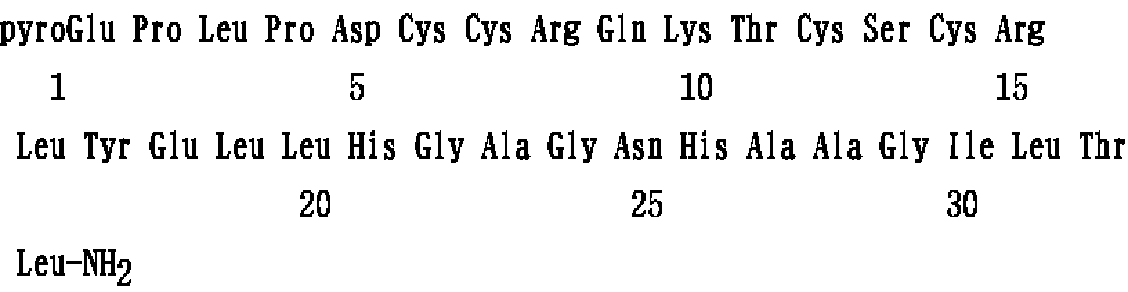JP2004534026A - オレキシン受容体アンタゴニストとしてのn−アロイルサイクリックアミン誘導体 - Google Patents
オレキシン受容体アンタゴニストとしてのn−アロイルサイクリックアミン誘導体 Download PDFInfo
- Publication number
- JP2004534026A JP2004534026A JP2002586935A JP2002586935A JP2004534026A JP 2004534026 A JP2004534026 A JP 2004534026A JP 2002586935 A JP2002586935 A JP 2002586935A JP 2002586935 A JP2002586935 A JP 2002586935A JP 2004534026 A JP2004534026 A JP 2004534026A
- Authority
- JP
- Japan
- Prior art keywords
- ethyl
- phenyl
- phenoxy
- methyl
- benzoylpiperidine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229940123730 Orexin receptor antagonist Drugs 0.000 title abstract description 5
- 150000001875 compounds Chemical class 0.000 claims description 112
- 238000000034 method Methods 0.000 claims description 30
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 28
- 150000003839 salts Chemical class 0.000 claims description 21
- 229910052760 oxygen Inorganic materials 0.000 claims description 20
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 20
- 125000000217 alkyl group Chemical group 0.000 claims description 15
- 229910052717 sulfur Inorganic materials 0.000 claims description 15
- 239000005557 antagonist Substances 0.000 claims description 14
- 201000010099 disease Diseases 0.000 claims description 14
- 208000035475 disorder Diseases 0.000 claims description 14
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 13
- 125000005842 heteroatom Chemical group 0.000 claims description 13
- 125000004076 pyridyl group Chemical group 0.000 claims description 12
- 238000011282 treatment Methods 0.000 claims description 11
- YXTROGRGRSPWKL-UHFFFAOYSA-N 1-benzoylpiperidine Chemical compound C=1C=CC=CC=1C(=O)N1CCCCC1 YXTROGRGRSPWKL-UHFFFAOYSA-N 0.000 claims description 10
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 claims description 10
- 125000003118 aryl group Chemical group 0.000 claims description 10
- 229910052736 halogen Inorganic materials 0.000 claims description 9
- 150000002367 halogens Chemical class 0.000 claims description 9
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 8
- 125000005843 halogen group Chemical group 0.000 claims description 8
- 125000003226 pyrazolyl group Chemical group 0.000 claims description 8
- 101000598921 Homo sapiens Orexin Proteins 0.000 claims description 7
- 125000001624 naphthyl group Chemical group 0.000 claims description 7
- 125000000335 thiazolyl group Chemical group 0.000 claims description 7
- 102000008834 Orexin receptor Human genes 0.000 claims description 6
- 125000000623 heterocyclic group Chemical group 0.000 claims description 6
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims description 6
- 125000001715 oxadiazolyl group Chemical group 0.000 claims description 6
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims description 5
- 125000002373 5 membered heterocyclic group Chemical group 0.000 claims description 5
- 125000004070 6 membered heterocyclic group Chemical group 0.000 claims description 5
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 claims description 5
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 claims description 5
- 239000001257 hydrogen Substances 0.000 claims description 5
- 229910052739 hydrogen Inorganic materials 0.000 claims description 5
- 239000008194 pharmaceutical composition Substances 0.000 claims description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 4
- 125000001072 heteroaryl group Chemical group 0.000 claims description 4
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 4
- 125000002950 monocyclic group Chemical group 0.000 claims description 4
- 239000001301 oxygen Substances 0.000 claims description 4
- 230000002265 prevention Effects 0.000 claims description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 4
- 125000001544 thienyl group Chemical group 0.000 claims description 4
- SKPIRXOPCLNKOI-UHFFFAOYSA-N (2-methyl-5-phenyl-1,3-thiazol-4-yl)-[2-(3-phenoxypropyl)piperidin-1-yl]methanone Chemical compound C=1C=CC=CC=1C=1SC(C)=NC=1C(=O)N1CCCCC1CCCOC1=CC=CC=C1 SKPIRXOPCLNKOI-UHFFFAOYSA-N 0.000 claims description 3
- UWXWBSPVNKFAON-UHFFFAOYSA-N (2-methyl-5-phenyl-1,3-thiazol-4-yl)-[2-(phenylmethoxymethyl)piperidin-1-yl]methanone Chemical compound C=1C=CC=CC=1C=1SC(C)=NC=1C(=O)N1CCCCC1COCC1=CC=CC=C1 UWXWBSPVNKFAON-UHFFFAOYSA-N 0.000 claims description 3
- PHXCUOPWSBXUHY-UHFFFAOYSA-N 1-phenyl-3-[1-(2-phenylbenzoyl)piperidin-2-yl]propan-1-one Chemical compound C=1C=CC=CC=1C(=O)CCC1CCCCN1C(=O)C1=CC=CC=C1C1=CC=CC=C1 PHXCUOPWSBXUHY-UHFFFAOYSA-N 0.000 claims description 3
- YPQWWATVWTXIAA-UHFFFAOYSA-N [2-(2-phenylmethoxyethyl)piperidin-1-yl]-(2-pyridin-2-ylphenyl)methanone Chemical compound C=1C=CC=C(C=2N=CC=CC=2)C=1C(=O)N1CCCCC1CCOCC1=CC=CC=C1 YPQWWATVWTXIAA-UHFFFAOYSA-N 0.000 claims description 3
- 125000002619 bicyclic group Chemical group 0.000 claims description 3
- 125000001399 1,2,3-triazolyl group Chemical group N1N=NC(=C1)* 0.000 claims description 2
- ZOOAMWIQMYJVRD-UHFFFAOYSA-N 1-(1-benzofuran-2-yl)-2-[1-(5-bromo-2-methoxybenzoyl)piperidin-2-yl]ethanone Chemical compound COC1=CC=C(Br)C=C1C(=O)N1C(CC(=O)C=2OC3=CC=CC=C3C=2)CCCC1 ZOOAMWIQMYJVRD-UHFFFAOYSA-N 0.000 claims description 2
- 125000001088 1-naphthoyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 claims description 2
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 claims description 2
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 claims description 2
- YXDHUAPPMMHNDY-AWEZNQCLSA-N [(2s)-2-[(5-bromopyrimidin-2-yl)oxymethyl]pyrrolidin-1-yl]-[2-(3-methyl-1,2,4-oxadiazol-5-yl)phenyl]methanone Chemical compound CC1=NOC(C=2C(=CC=CC=2)C(=O)N2[C@@H](CCC2)COC=2N=CC(Br)=CN=2)=N1 YXDHUAPPMMHNDY-AWEZNQCLSA-N 0.000 claims description 2
- AZXPPXBVDYFKGQ-UHFFFAOYSA-N [2-(2-phenylmethoxyethyl)piperidin-1-yl]-(2-phenylphenyl)methanone Chemical compound C=1C=CC=C(C=2C=CC=CC=2)C=1C(=O)N1CCCCC1CCOCC1=CC=CC=C1 AZXPPXBVDYFKGQ-UHFFFAOYSA-N 0.000 claims description 2
- KBQDDFVTPHOJAA-UHFFFAOYSA-N [2-[2-[(4-fluorophenyl)methoxy]ethyl]piperidin-1-yl]-(2-methyl-5-phenyl-1,3-thiazol-4-yl)methanone Chemical compound C=1C=CC=CC=1C=1SC(C)=NC=1C(=O)N1CCCCC1CCOCC1=CC=C(F)C=C1 KBQDDFVTPHOJAA-UHFFFAOYSA-N 0.000 claims description 2
- WJJMQSRREBMKSG-UHFFFAOYSA-N [2-[2-[(4-fluorophenyl)methoxy]ethyl]piperidin-1-yl]-(2-phenylphenyl)methanone Chemical compound C1=CC(F)=CC=C1COCCC1N(C(=O)C=2C(=CC=CC=2)C=2C=CC=CC=2)CCCC1 WJJMQSRREBMKSG-UHFFFAOYSA-N 0.000 claims description 2
- NRIHCWYGKMIOMA-UHFFFAOYSA-N [5-(4-fluorophenyl)-2-methyl-1,3-thiazol-4-yl]-[2-(2-pyridin-2-ylsulfanylethyl)piperidin-1-yl]methanone Chemical compound C=1C=C(F)C=CC=1C=1SC(C)=NC=1C(=O)N1CCCCC1CCSC1=CC=CC=N1 NRIHCWYGKMIOMA-UHFFFAOYSA-N 0.000 claims description 2
- 229910052799 carbon Inorganic materials 0.000 claims description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 2
- UEGVISJXLQVJPA-UHFFFAOYSA-N n-[3-[2-[2-(1-benzofuran-2-yl)-2-oxoethyl]piperidine-1-carbonyl]phenyl]acetamide Chemical compound CC(=O)NC1=CC=CC(C(=O)N2C(CCCC2)CC(=O)C=2OC3=CC=CC=C3C=2)=C1 UEGVISJXLQVJPA-UHFFFAOYSA-N 0.000 claims description 2
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 claims description 2
- 125000000738 acetamido group Chemical group [H]C([H])([H])C(=O)N([H])[*] 0.000 claims 1
- 125000001589 carboacyl group Chemical group 0.000 claims 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims 1
- 239000003814 drug Substances 0.000 abstract description 7
- 239000000203 mixture Substances 0.000 description 39
- 238000001819 mass spectrum Methods 0.000 description 37
- -1 quinolinyl cinnamide derivatives Chemical class 0.000 description 36
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 35
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 30
- 210000004027 cell Anatomy 0.000 description 29
- 102000005962 receptors Human genes 0.000 description 28
- 108020003175 receptors Proteins 0.000 description 28
- 239000008186 active pharmaceutical agent Substances 0.000 description 26
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 24
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 23
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 22
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 21
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 20
- 208000002193 Pain Diseases 0.000 description 19
- 239000000243 solution Substances 0.000 description 19
- 238000005160 1H NMR spectroscopy Methods 0.000 description 18
- 239000003921 oil Substances 0.000 description 17
- 235000019198 oils Nutrition 0.000 description 17
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 15
- 239000000741 silica gel Substances 0.000 description 13
- 229910002027 silica gel Inorganic materials 0.000 description 13
- 125000001424 substituent group Chemical group 0.000 description 13
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 11
- 239000003446 ligand Substances 0.000 description 11
- 239000011541 reaction mixture Substances 0.000 description 11
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 10
- 239000000872 buffer Substances 0.000 description 10
- 239000012442 inert solvent Substances 0.000 description 10
- DBABZHXKTCFAPX-UHFFFAOYSA-N probenecid Chemical compound CCCN(CCC)S(=O)(=O)C1=CC=C(C(O)=O)C=C1 DBABZHXKTCFAPX-UHFFFAOYSA-N 0.000 description 10
- 229960003081 probenecid Drugs 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- 229910052938 sodium sulfate Inorganic materials 0.000 description 10
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- 239000007832 Na2SO4 Substances 0.000 description 9
- 208000008589 Obesity Diseases 0.000 description 9
- 235000020824 obesity Nutrition 0.000 description 9
- 239000012044 organic layer Substances 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 206010012601 diabetes mellitus Diseases 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 238000012216 screening Methods 0.000 description 8
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 8
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 8
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 7
- 239000002253 acid Substances 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 7
- 208000019116 sleep disease Diseases 0.000 description 7
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 6
- 208000004454 Hyperalgesia Diseases 0.000 description 6
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 6
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 6
- 201000001880 Sexual dysfunction Diseases 0.000 description 6
- 239000000556 agonist Substances 0.000 description 6
- 239000012300 argon atmosphere Substances 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 108090000765 processed proteins & peptides Proteins 0.000 description 6
- 231100000872 sexual dysfunction Toxicity 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- 101500025902 Homo sapiens Orexin-A Proteins 0.000 description 5
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 5
- 102000002512 Orexin Human genes 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 125000002252 acyl group Chemical group 0.000 description 5
- 238000010828 elution Methods 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 108060005714 orexin Proteins 0.000 description 5
- OFNHNCAUVYOTPM-IIIOAANCSA-N orexin-a Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)CNC(=O)[C@H](C)NC(=O)CNC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H]1NC(=O)[C@H](CO)NC(=O)[C@@H]2CSSC[C@@H](C(=O)N[C@H](C(N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N2)[C@@H](C)O)=O)CSSC1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H]1NC(=O)CC1)C1=CNC=N1 OFNHNCAUVYOTPM-IIIOAANCSA-N 0.000 description 5
- 229920001184 polypeptide Polymers 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 229920006395 saturated elastomer Polymers 0.000 description 5
- 239000000377 silicon dioxide Substances 0.000 description 5
- 230000007958 sleep Effects 0.000 description 5
- 208000011580 syndromic disease Diseases 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- 208000020401 Depressive disease Diseases 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- 208000035154 Hyperesthesia Diseases 0.000 description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 4
- 208000014993 Pituitary disease Diseases 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 206010047700 Vomiting Diseases 0.000 description 4
- 150000003976 azacycloalkanes Chemical class 0.000 description 4
- 239000012267 brine Substances 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 230000002267 hypothalamic effect Effects 0.000 description 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 208000004296 neuralgia Diseases 0.000 description 4
- 208000015238 neurotic disease Diseases 0.000 description 4
- 208000017402 pituitary gland disease Diseases 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 208000019901 Anxiety disease Diseases 0.000 description 3
- 206010012289 Dementia Diseases 0.000 description 3
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 206010056438 Growth hormone deficiency Diseases 0.000 description 3
- 239000007821 HATU Substances 0.000 description 3
- 208000016988 Hemorrhagic Stroke Diseases 0.000 description 3
- 206010021067 Hypopituitarism Diseases 0.000 description 3
- 208000032382 Ischaemic stroke Diseases 0.000 description 3
- 208000019695 Migraine disease Diseases 0.000 description 3
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 3
- 201000005746 Pituitary adenoma Diseases 0.000 description 3
- 206010061538 Pituitary tumour benign Diseases 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 description 3
- 208000006011 Stroke Diseases 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 230000001919 adrenal effect Effects 0.000 description 3
- 239000000443 aerosol Substances 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 230000003444 anaesthetic effect Effects 0.000 description 3
- 230000036506 anxiety Effects 0.000 description 3
- 230000036528 appetite Effects 0.000 description 3
- 235000019789 appetite Nutrition 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000003125 aqueous solvent Substances 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000012230 colorless oil Substances 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 238000003113 dilution method Methods 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000002895 emetic Substances 0.000 description 3
- ZKQFHRVKCYFVCN-UHFFFAOYSA-N ethoxyethane;hexane Chemical compound CCOCC.CCCCCC ZKQFHRVKCYFVCN-UHFFFAOYSA-N 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 208000031424 hyperprolactinemia Diseases 0.000 description 3
- 206010022437 insomnia Diseases 0.000 description 3
- 208000020658 intracerebral hemorrhage Diseases 0.000 description 3
- 230000000302 ischemic effect Effects 0.000 description 3
- 206010027599 migraine Diseases 0.000 description 3
- 208000021310 pituitary gland adenoma Diseases 0.000 description 3
- 208000010916 pituitary tumor Diseases 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 239000002157 polynucleotide Substances 0.000 description 3
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- WRTMQOHKMFDUKX-UHFFFAOYSA-N triiodide Chemical compound I[I-]I WRTMQOHKMFDUKX-UHFFFAOYSA-N 0.000 description 3
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 3
- UHEPSJJJMTWUCP-DHDYTCSHSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-[(1r)-1-hydroxyethyl]oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol;sulfuric acid Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H]([C@@H](C)O)O2)N)[C@@H](N)C[C@H]1N UHEPSJJJMTWUCP-DHDYTCSHSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical compound C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 2
- 125000006516 2-(benzyloxy)ethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 2
- QJQFTDCEQKMEFU-UHFFFAOYSA-N 2-(phenylmethoxymethyl)piperidine Chemical compound C1CCCNC1COCC1=CC=CC=C1 QJQFTDCEQKMEFU-UHFFFAOYSA-N 0.000 description 2
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- MPJOJCZVGBOVOV-UHFFFAOYSA-N 2-phenylbenzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1C1=CC=CC=C1 MPJOJCZVGBOVOV-UHFFFAOYSA-N 0.000 description 2
- GRFNBEZIAWKNCO-UHFFFAOYSA-N 3-pyridinol Chemical compound OC1=CC=CN=C1 GRFNBEZIAWKNCO-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- 201000000736 Amenorrhea Diseases 0.000 description 2
- 206010001928 Amenorrhoea Diseases 0.000 description 2
- 206010002383 Angina Pectoris Diseases 0.000 description 2
- 208000006820 Arthralgia Diseases 0.000 description 2
- 208000008035 Back Pain Diseases 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 208000032841 Bulimia Diseases 0.000 description 2
- 206010006550 Bulimia nervosa Diseases 0.000 description 2
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 2
- 208000017164 Chronobiology disease Diseases 0.000 description 2
- 208000014311 Cushing syndrome Diseases 0.000 description 2
- 206010012218 Delirium Diseases 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- 206010013883 Dwarfism Diseases 0.000 description 2
- 108091006027 G proteins Proteins 0.000 description 2
- 102000030782 GTP binding Human genes 0.000 description 2
- 108091000058 GTP-Binding Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 206010019196 Head injury Diseases 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 206010062767 Hypophysitis Diseases 0.000 description 2
- 208000028482 Hypothalamic disease Diseases 0.000 description 2
- 208000025282 Hypothalamo-pituitary disease Diseases 0.000 description 2
- 102000004877 Insulin Human genes 0.000 description 2
- 108090001061 Insulin Proteins 0.000 description 2
- 208000001456 Jet Lag Syndrome Diseases 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 229930182816 L-glutamine Natural products 0.000 description 2
- 208000019693 Lung disease Diseases 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- 206010029333 Neurosis Diseases 0.000 description 2
- 208000021384 Obsessive-Compulsive disease Diseases 0.000 description 2
- 208000004983 Phantom Limb Diseases 0.000 description 2
- 206010056238 Phantom pain Diseases 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- 208000010067 Pituitary ACTH Hypersecretion Diseases 0.000 description 2
- 208000020627 Pituitary-dependent Cushing syndrome Diseases 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 206010036376 Postherpetic Neuralgia Diseases 0.000 description 2
- 208000004550 Postoperative Pain Diseases 0.000 description 2
- 208000010366 Postpoliomyelitis syndrome Diseases 0.000 description 2
- 206010036832 Prolactinoma Diseases 0.000 description 2
- 208000005793 Restless legs syndrome Diseases 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 208000032851 Subarachnoid Hemorrhage Diseases 0.000 description 2
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 208000005298 acute pain Diseases 0.000 description 2
- 239000004479 aerosol dispenser Substances 0.000 description 2
- 125000004414 alkyl thio group Chemical group 0.000 description 2
- 206010053552 allodynia Diseases 0.000 description 2
- 231100000540 amenorrhea Toxicity 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000001110 calcium chloride Substances 0.000 description 2
- 235000011148 calcium chloride Nutrition 0.000 description 2
- 229910001628 calcium chloride Inorganic materials 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- 208000024732 dysthymic disease Diseases 0.000 description 2
- 206010015037 epilepsy Diseases 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- UREBWPXBXRYXRJ-UHFFFAOYSA-N ethyl acetate;methanol Chemical compound OC.CCOC(C)=O UREBWPXBXRYXRJ-UHFFFAOYSA-N 0.000 description 2
- QVDYYQXUNAQSNI-UHFFFAOYSA-N ethyl acetate;pentane Chemical compound CCCCC.CCOC(C)=O QVDYYQXUNAQSNI-UHFFFAOYSA-N 0.000 description 2
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 238000012632 fluorescent imaging Methods 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 208000019622 heart disease Diseases 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L magnesium chloride Substances [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 2
- 201000003631 narcolepsy Diseases 0.000 description 2
- 210000000287 oocyte Anatomy 0.000 description 2
- 238000011017 operating method Methods 0.000 description 2
- 229940125636 orexin 1 receptor antagonist Drugs 0.000 description 2
- 125000002524 organometallic group Chemical group 0.000 description 2
- XSXHWVKGUXMUQE-UHFFFAOYSA-N osmium dioxide Inorganic materials O=[Os]=O XSXHWVKGUXMUQE-UHFFFAOYSA-N 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 230000001590 oxidative effect Effects 0.000 description 2
- 210000003635 pituitary gland Anatomy 0.000 description 2
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 201000009395 primary hyperaldosteronism Diseases 0.000 description 2
- 208000030153 prolactin-producing pituitary gland adenoma Diseases 0.000 description 2
- 239000003380 propellant Substances 0.000 description 2
- 230000001107 psychogenic effect Effects 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000005495 pyridazyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 2
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 2
- 201000000980 schizophrenia Diseases 0.000 description 2
- 150000003333 secondary alcohols Chemical class 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 208000012201 sexual and gender identity disease Diseases 0.000 description 2
- 208000015891 sexual disease Diseases 0.000 description 2
- 201000002859 sleep apnea Diseases 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- LTVQOFUGXMVESU-UHFFFAOYSA-N tert-butyl 2-(2-hydroxyethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCCC1CCO LTVQOFUGXMVESU-UHFFFAOYSA-N 0.000 description 2
- YSNHXIMXFKYGEZ-UHFFFAOYSA-N tert-butyl 2-(3-hydroxypropyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCCC1CCCO YSNHXIMXFKYGEZ-UHFFFAOYSA-N 0.000 description 2
- 125000001113 thiadiazolyl group Chemical group 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- 239000003039 volatile agent Substances 0.000 description 2
- 125000002861 (C1-C4) alkanoyl group Chemical group 0.000 description 1
- 125000004769 (C1-C4) alkylsulfonyl group Chemical group 0.000 description 1
- 125000004505 1,2,4-oxadiazol-5-yl group Chemical group O1N=CN=C1* 0.000 description 1
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- LUBJCRLGQSPQNN-UHFFFAOYSA-N 1-Phenylurea Chemical class NC(=O)NC1=CC=CC=C1 LUBJCRLGQSPQNN-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- HNXQSOOCEHVHEA-UHFFFAOYSA-N 2-(2-piperidin-2-ylethylsulfanyl)pyridine Chemical compound C=1C=CC=NC=1SCCC1CCCCN1 HNXQSOOCEHVHEA-UHFFFAOYSA-N 0.000 description 1
- CKAXJDBTNNEENW-UHFFFAOYSA-N 2-[1-[(2-methylpropan-2-yl)oxycarbonyl]piperidin-2-yl]acetic acid Chemical compound CC(C)(C)OC(=O)N1CCCCC1CC(O)=O CKAXJDBTNNEENW-UHFFFAOYSA-N 0.000 description 1
- XBSSEPJMJIXGJV-UHFFFAOYSA-N 2-pyridin-2-ylbenzoyl chloride;hydrochloride Chemical compound Cl.ClC(=O)C1=CC=CC=C1C1=CC=CC=N1 XBSSEPJMJIXGJV-UHFFFAOYSA-N 0.000 description 1
- WDNBURPWRNALGP-UHFFFAOYSA-N 3,4-Dichlorophenol Chemical compound OC1=CC=C(Cl)C(Cl)=C1 WDNBURPWRNALGP-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- URCTXVMRFKFRMP-UHFFFAOYSA-N 3-piperidin-2-ylpropan-1-ol Chemical compound OCCCC1CCCCN1 URCTXVMRFKFRMP-UHFFFAOYSA-N 0.000 description 1
- SFAHKRAPKBLVSV-UHFFFAOYSA-N 5-(4-fluorophenyl)-2-methyl-1,3-thiazole-4-carbonyl chloride Chemical compound S1C(C)=NC(C(Cl)=O)=C1C1=CC=C(F)C=C1 SFAHKRAPKBLVSV-UHFFFAOYSA-N 0.000 description 1
- SUDVHFWYPBRULL-QRPNPIFTSA-N 5-bromo-2-[[(2s)-pyrrolidin-2-yl]methoxy]pyrimidine;hydrochloride Chemical compound Cl.N1=CC(Br)=CN=C1OC[C@H]1NCCC1 SUDVHFWYPBRULL-QRPNPIFTSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- WKLZNTYMDOPBSE-UHFFFAOYSA-N 823218-99-1 Chemical compound CC1=CC(C)=CC(C)=C1C1=NOC2C1C1CCC2C1 WKLZNTYMDOPBSE-UHFFFAOYSA-N 0.000 description 1
- 206010000599 Acromegaly Diseases 0.000 description 1
- 206010001367 Adrenal insufficiency Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical class [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- 208000000103 Anorexia Nervosa Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 201000009586 Basophil Adenoma Diseases 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 208000020925 Bipolar disease Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 206010058019 Cancer Pain Diseases 0.000 description 1
- 206010007556 Cardiac failure acute Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 208000012661 Dyskinesia Diseases 0.000 description 1
- 208000030814 Eating disease Diseases 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 244000166102 Eucalyptus leucoxylon Species 0.000 description 1
- 235000004694 Eucalyptus leucoxylon Nutrition 0.000 description 1
- 208000019454 Feeding and Eating disease Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 201000004311 Gilles de la Tourette syndrome Diseases 0.000 description 1
- 208000002705 Glucose Intolerance Diseases 0.000 description 1
- 102000018997 Growth Hormone Human genes 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 208000013016 Hypoglycemia Diseases 0.000 description 1
- 206010058359 Hypogonadism Diseases 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 229940122355 Insulin sensitizer Drugs 0.000 description 1
- 208000007914 Labor Pain Diseases 0.000 description 1
- 208000035945 Labour pain Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 208000019022 Mood disease Diseases 0.000 description 1
- 206010028289 Muscle atrophy Diseases 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 229910003844 NSO2 Inorganic materials 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 102000028517 Neuropeptide receptor Human genes 0.000 description 1
- 108070000018 Neuropeptide receptor Proteins 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 108050000742 Orexin Receptor Proteins 0.000 description 1
- 229940121884 Orexin receptor agonist Drugs 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 206010033307 Overweight Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 208000036623 Severe mental retardation Diseases 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 208000000323 Tourette Syndrome Diseases 0.000 description 1
- 208000016620 Tourette disease Diseases 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 208000000921 Urge Urinary Incontinence Diseases 0.000 description 1
- 206010046543 Urinary incontinence Diseases 0.000 description 1
- 206010046555 Urinary retention Diseases 0.000 description 1
- 241000269370 Xenopus <genus> Species 0.000 description 1
- OEUNJUXUGHUEQZ-UHFFFAOYSA-N [2-(3-hydroxy-3-phenylpropyl)piperidin-1-yl]-(2-phenylphenyl)methanone Chemical compound C=1C=CC=CC=1C(O)CCC1CCCCN1C(=O)C1=CC=CC=C1C1=CC=CC=C1 OEUNJUXUGHUEQZ-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000017515 adrenocortical insufficiency Diseases 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 125000005278 alkyl sulfonyloxy group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 150000001408 amides Chemical group 0.000 description 1
- 150000001413 amino acids Chemical group 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000003579 anti-obesity Effects 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 125000003435 aroyl group Chemical group 0.000 description 1
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 1
- 125000005279 aryl sulfonyloxy group Chemical group 0.000 description 1
- 125000004421 aryl sulphonamide group Chemical group 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- WTEPWWCRWNCUNA-UHFFFAOYSA-M benzyl(triphenyl)phosphanium;bromide Chemical compound [Br-].C=1C=CC=CC=1[P+](C=1C=CC=CC=1)(C=1C=CC=CC=1)CC1=CC=CC=C1 WTEPWWCRWNCUNA-UHFFFAOYSA-M 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 208000028683 bipolar I disease Diseases 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- RAABOESOVLLHRU-UHFFFAOYSA-N diazene Chemical compound N=N RAABOESOVLLHRU-UHFFFAOYSA-N 0.000 description 1
- 229910000071 diazene Inorganic materials 0.000 description 1
- YSSSPARMOAYJTE-UHFFFAOYSA-N dibenzo-18-crown-6 Chemical compound O1CCOCCOC2=CC=CC=C2OCCOCCOC2=CC=CC=C21 YSSSPARMOAYJTE-UHFFFAOYSA-N 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 235000014632 disordered eating Nutrition 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 230000001339 gustatory effect Effects 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- USZLCYNVCCDPLQ-UHFFFAOYSA-N hydron;n-methoxymethanamine;chloride Chemical compound Cl.CNOC USZLCYNVCCDPLQ-UHFFFAOYSA-N 0.000 description 1
- 230000002375 hyperadrenal effect Effects 0.000 description 1
- 208000007357 hyperpituitarism Diseases 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- 230000036543 hypotension Effects 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 208000003532 hypothyroidism Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 208000002551 irritable bowel syndrome Diseases 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- FUJCRWPEOMXPAD-UHFFFAOYSA-N lithium oxide Chemical compound [Li+].[Li+].[O-2] FUJCRWPEOMXPAD-UHFFFAOYSA-N 0.000 description 1
- 229910001947 lithium oxide Inorganic materials 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 210000003574 melanophore Anatomy 0.000 description 1
- 230000003340 mental effect Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 230000020763 muscle atrophy Effects 0.000 description 1
- 201000000585 muscular atrophy Diseases 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- OQJBFFCUFALWQL-UHFFFAOYSA-N n-(piperidine-1-carbonylimino)piperidine-1-carboxamide Chemical compound C1CCCCN1C(=O)N=NC(=O)N1CCCCC1 OQJBFFCUFALWQL-UHFFFAOYSA-N 0.000 description 1
- METAARIXCOAZDH-UHFFFAOYSA-N n-cyclohexyl-1-(4-methylphenyl)methanimine Chemical compound C1=CC(C)=CC=C1C=NC1CCCCC1 METAARIXCOAZDH-UHFFFAOYSA-N 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-N naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-N 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 230000010807 negative regulation of binding Effects 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000003891 oxalate salts Chemical class 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- MUMZUERVLWJKNR-UHFFFAOYSA-N oxoplatinum Chemical compound [Pt]=O MUMZUERVLWJKNR-UHFFFAOYSA-N 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- 230000001898 pallidal effect Effects 0.000 description 1
- 230000000803 paradoxical effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 208000030062 persistent idiopathic facial pain Diseases 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- NHKJPPKXDNZFBJ-UHFFFAOYSA-N phenyllithium Chemical compound [Li]C1=CC=CC=C1 NHKJPPKXDNZFBJ-UHFFFAOYSA-N 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 230000001817 pituitary effect Effects 0.000 description 1
- 229910003446 platinum oxide Inorganic materials 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000009258 post-therapy Methods 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 201000009104 prediabetes syndrome Diseases 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- WHMDPDGBKYUEMW-UHFFFAOYSA-N pyridine-2-thiol Chemical compound SC1=CC=CC=N1 WHMDPDGBKYUEMW-UHFFFAOYSA-N 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical compound CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 230000037322 slow-wave sleep Effects 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000009518 sodium iodide Nutrition 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000002511 suppository base Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- BFFLLBPMZCIGRM-QMMMGPOBSA-N tert-butyl (2s)-2-(hydroxymethyl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC[C@H]1CO BFFLLBPMZCIGRM-QMMMGPOBSA-N 0.000 description 1
- ZAYSXLJZWWIAMZ-UHFFFAOYSA-N tert-butyl 2-(2-bromoethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCCC1CCBr ZAYSXLJZWWIAMZ-UHFFFAOYSA-N 0.000 description 1
- VPUHJQDNBOTMSI-UHFFFAOYSA-N tert-butyl 2-(2-oxoethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCCC1CC=O VPUHJQDNBOTMSI-UHFFFAOYSA-N 0.000 description 1
- KZTKOEGYXAIPQO-UHFFFAOYSA-N tert-butyl 2-(2-pyridin-2-ylsulfanylethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCCC1CCSC1=CC=CC=N1 KZTKOEGYXAIPQO-UHFFFAOYSA-N 0.000 description 1
- PZTAGFCBNDBBFZ-UHFFFAOYSA-N tert-butyl 2-(hydroxymethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCCC1CO PZTAGFCBNDBBFZ-UHFFFAOYSA-N 0.000 description 1
- LJTAMNKGFHZTDR-UHFFFAOYSA-N tert-butyl 2-(phenylmethoxymethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCCC1COCC1=CC=CC=C1 LJTAMNKGFHZTDR-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000759 toxicological effect Toxicity 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- VSUUUSJHTHXYEK-UHFFFAOYSA-N tributylphosphane triphenylphosphane Chemical compound C(CCC)P(CCCC)CCCC.C1(=CC=CC=C1)P(C1=CC=CC=C1)C1=CC=CC=C1 VSUUUSJHTHXYEK-UHFFFAOYSA-N 0.000 description 1
- WTVXIBRMWGUIMI-UHFFFAOYSA-N trifluoro($l^{1}-oxidanylsulfonyl)methane Chemical group [O]S(=O)(=O)C(F)(F)F WTVXIBRMWGUIMI-UHFFFAOYSA-N 0.000 description 1
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 206010046494 urge incontinence Diseases 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 208000009935 visceral pain Diseases 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D265/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one oxygen atom as the only ring hetero atoms
- C07D265/28—1,4-Oxazines; Hydrogenated 1,4-oxazines
- C07D265/30—1,4-Oxazines; Hydrogenated 1,4-oxazines not condensed with other rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/10—Drugs for disorders of the endocrine system of the posterior pituitary hormones, e.g. oxytocin, ADH
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Diabetes (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Endocrinology (AREA)
- Hematology (AREA)
- Reproductive Health (AREA)
- Obesity (AREA)
- Addiction (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Pain & Pain Management (AREA)
- Cardiology (AREA)
- Emergency Medicine (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Gynecology & Obstetrics (AREA)
- Pregnancy & Childbirth (AREA)
- Child & Adolescent Psychology (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Physical Education & Sports Medicine (AREA)
- Otolaryngology (AREA)
Abstract
Description
本発明は、N−アロイルサイクリックアミン誘導体および医薬としてのその使用に関する。
【0002】
多くの医薬的に重要な生物学的プロセスは、G蛋白および/または第2メッセンジャーを含むシグナルトランスダクション経路に関係する蛋白により媒介される。
ヒト7回膜貫通G蛋白結合神経ペプチド受容体、オレキシン−1(HFGAN72)をコードするポリペプチドおよびポリヌクレオチドが同定されており、EP−A−875565、EP−A−875566およびWO96/34877に開示されている。第2のヒトオレキシン受容体、オレキシン−2(HFGANP)をコードするポリペプチドおよびポリペプチドは同定されており、EP−A−893498に開示されている。
オレキシン−1受容体に関するリガンド、例えばオレキシン−A(Lig72A)であるポリペプチドをコードするポリペプチドおよびポリヌクレオチドは、EP−A−849361に開示されている。
【0003】
オレキシン受容体は、哺乳類宿主において見られ、限定するものではないが、鬱病;不安症;依存症;強迫性障害;情動性神経症/障害;抑うつ神経症/障害;不安神経症;気分変調性障害;行動障害;気分障害;性機能不全;精神性性機能不全;性的障害;性障害;統合失調症;躁うつ病;譫妄;痴呆;重症精神遅滞およびジスキネジー、例えばハンチントン病およびジル・ド・ラ・トゥレット症候群;生体リズムおよび日周期リズム障害;摂食障害、例えば拒食症、過食症、悪液質、および肥満症;糖尿病;食欲/味覚障害;嘔吐/悪心;喘息;癌;パーキンソン病;クッシング症候群/疾患;好塩基性腺腫;プロラクチノーマ;高プロラクチン血症;下垂体機能低下症;下垂体腫瘍/腺腫;視床下部の疾患;フレーリッヒ症候群;副腎下垂体疾患;下垂体疾患;下垂体腫瘍/腺腫;脳下垂体成長ホルモン;副腎下垂体機能低下;副腎下垂体機能亢進症;視床下部性性腺機能低下症;カルマン症候群(無臭覚症、嗅覚障害);機能性または心因性無月経;下垂体機能低下症;視床下部甲状腺不全;視床下部副腎機能障害;特発性高プロラクチン血症;成長ホルモン欠損症の視床下部障害;特発性成長ホルモン欠損症;小人症;巨人症;末端肥大症;神経疾患、神経痛および下肢静止不能症候群、心臓および肺疾患のような疾患に付随する睡眠障害;急性および鬱血性心不全;低血圧;高血圧;尿閉;骨粗鬆症;狭心症;心筋梗塞症;虚血性または出血性発作;クモ膜下出血;頭部傷害、例えば外傷性頭部傷害に付随するクモ膜下出血;潰瘍;アレルギー;良性前立腺肥大症;慢性腎不全;腎臓病;耐糖能異常;片頭痛;痛覚過敏;痛み;痛みに対する感受性の増強または強調、例えば痛覚過敏、灼熱痛および異痛症;急性の痛み;熱傷の痛み;異型顔面痛;神経痛;背痛;複合部分痛症候群IおよびII;関節痛;スポーツ外傷の痛み;感染症に関連する痛み、例えば、HIV、ポリオ後症候群、およびヘルペス後神経痛;幻肢痛;陣痛;癌痛;化学療法後痛;発作後痛;術後痛;神経痛;悪心および嘔吐;過敏性腸症候群を含む内臓痛、片頭痛および狭心症に付随する症状;膀胱失禁例えば、急迫性尿失禁;麻酔剤耐性または麻酔剤退薬症状;睡眠障害;睡眠時無呼吸;ナルコレプシー;不眠症;睡眠時異常行動;時差ぼけ症候群;および疾病分類学的本質、例えば脱抑制−痴呆−パーキンソン筋萎縮症候群を含む神経変性障害;淡蒼球橋黒質変性症、癲癇および発作性疾患を含む病状を含む多くの生物学的機能を引き起こしうる。
【0004】
実験により、リガンドオレキシン−Aの中枢投与(より詳細な説明は下記する)が、4時間の間、自由摂食ラットの食物摂取を刺激することが示されている。この増加は、ビヒクルを受けた対照ラットの約4倍であった。これらのデータは、オレキシン−Aが食欲の内因性レギュレーターであることを示唆している。したがって、その受容体のアンタゴニストは、肥満症および糖尿病の治療に有用であり得る(Cell, 1998, 92, 573-585を参照)。
【0005】
西洋化社会において、肥満症が有意に発生している。WHOの定義によると、39個の研究における対象の平均35%が過体重であり、さらに22%が臨床的肥満であった。米国におけるすべての医療費の5.7%が肥満症の結果であると推定されている。2型糖尿病の約85%は肥満であり、食餌療法および運動はすべての糖尿病で価値がある。西洋化した国の診断された糖尿病の発生率は、典型的には5%であり、同等の数が未診断であると推定される。両方の疾患の発生率は上昇しており、効果がないか、または心血管への影響を含む毒性の危険性を有しうる現在の治療の不適当性が示されている。スルホニル尿素またはインスリンでの糖尿病の治療は、低血糖を引き起こし、さらに、メトホルミンはGI副作用を引き起こしうる。疾患の長期の合併症を減少させることを示す、2型糖尿病のための薬物治療は存在しなかった。インスリン感作剤は、多くの糖尿病に有用であるが、抗肥満効果を有しない。
【0006】
また、ラット睡眠/EEG研究により、オレキシン−A、オレキシン受容体のアゴニストの中枢投与が、正常な睡眠期間の開始時に、大部分は、逆説睡眠および徐波睡眠2の減少を犠牲にして、食欲を投与量に関連して増加させることが示された。したがって、その受容体のアンタゴニストは、不眠症を含む睡眠障害の治療において有用であり得る。
【0007】
本発明は、ヒトオレキシン受容体、特にオレキシン−1受容体の非ペプチドアンタゴニストであるN−アロイルサイクリックアミン誘導体を提供する。特に、これらの化合物は、2型(非インスリン依存性)糖尿病患者において見られる肥満症を含む肥満症および/または睡眠障害および/または発作、特に虚血性または出血性発作の治療における使用の可能性があり、および/または催吐応答の阻止に有用であり、すなわち、悪心および嘔吐の治療に有用である。
【0008】
オレキシン受容体アンタゴニストとして、国際特許出願WO99/09024、WO99/58533、WO00/47577およびWO00/47580は、フェニル尿素誘導体を開示しており、WO00/47576はキノリニルシンナミド誘導体を開示している。WO01/96302は、N−アロイルサイクリックアミン誘導体を開示している。
【0009】
本発明により、式(I):
【化1】
[式中:
Yは、結合、酸素、(CH2)n基であり、ここに、nは1、2または3であり;
mは、1、2または3であり;
pは0または1であり;
Xは、O、S、C=O、SO2または−CH=CH−であり;
Ar1は、アリールまたはN、OおよびSから選択される4つまでのヘテロ原子を含有するモノもしくはビサイクリックヘテロアリール基であり;それらはいずれも置換されていてもよく;
Ar2は、フェニルまたはN、OおよびSから選択される3つまでのヘテロ原子を含有する5もしくは6員のヘテロサイクリル基であり、ここに、フェニルまたはヘテロサイクリル基は、R1およびさらなる別の置換基により置換されており;またはAr2は、置換されていてもよいビサイクリック芳香族またはN、OおよびSから選択される3つまでのヘテロ原子を含有するビサイクリックヘテロ芳香族基であり;
R1は、水素、置換されていてもよい(C1−4)アルコキシ、ハロ、シアノ、置換されていてもよい(C1−6)アルキル、置換されていてもよいフェニルまたはN、OおよびSから選択される4つまでのヘテロ原子を含有する置換されていてもよい5もしくは6員のヘテロサイクリック環である]
で示される化合物またはその医薬上許容される塩を提供する。
【0010】
好ましくは、Ar2は、フェニルまたはN、OおよびSから選択される3つまでのヘテロ原子を含有する5もしくは6員のヘテロサイクリル基であり、R1基は、アミドカルボニルの結合位置に隣接して位置する、すなわち、R1は、アミドカルボニル基のオルト位にあるAr2に結合する。
本明細書で用いられる場合、アミドカルボニル基なる用語は、式(I)の化合物において示すように−C(O)N−基を意味する。
【0011】
好ましくは、Yは、結合、酸素、またはnが1または2である(CH2)nである。
好ましくは、Xは、O、−CH=CH−またはC=Oである。
好ましくは、mは1または2である。
好ましくは、pは0である。
【0012】
別に、R1は、水素、置換されていてもよい(C1−4)アルコキシ、ハロ、置換されていてもよい(C1−6)アルキル、置換されていてもよいフェニルまたはN、OおよびSから選択される3つまでのヘテロ原子を含有する置換されていてもよい5もしくは6員のヘテロサイクリック環を意味する。
【0013】
好ましくは、R1は、置換されていてもよい(C1−4)アルコキシ、ハロ、置換されていてもよい(C1−6)アルキル、置換されていてもよいフェニルまたはN、OおよびSから選択される3つまでのヘテロ原子を含有する置換されていてもよい5もしくは6員のヘテロサイクリック環を意味する。
より好ましくは、R1は、トリフルオロメトキシ、メトキシ、エトキシ、アセトアミド、ハロ、または置換されていてもよいフェニル、ピリジル、ピリミジニル、ピラゾリルもしくはオキサジアゾリル基から選択される。
さらにより好ましくは、R1は、トリフルオロメトキシ、メトキシ、ハロまたは置換されていてもよいフェニル、ピリジル、ピラゾリルもしくはオキサジアゾリル基から選択される。
【0014】
好ましくは、Ar1は、アリールまたはN、OおよびSから選択される3つまでのヘテロ原子を含有するモノもしくはビサイクリックヘテロアリール基であり;それらはいずれも置換されていてもよい。
Ar1が置換されていてもよいアリールである場合、それは、好ましくは、フェニルまたはナフチルである。アリール基は、5個まで、好ましくは1、2または3個の任意の置換基を有する。
【0015】
Ar1がモノまたはビサイクリックヘテロアリールである場合、それは、例えばキノキサリニル、キナゾリニル、ピリドピラジニル、ベンゾキサゾリル、ベンゾチエニル、ベンズイミダゾリル、ナフチリジニル、ピリジニル、ピリミジニルまたはチアゾリルである。加えて、それは、キノリニル、イソキノリニル、ベンゾフラニル、ベンゾチアゾリルまたはインドリルであってもよい。さらに、それは、イミダゾリル、オキサゾリル、ピラジニル、ピリダジル、チエニル、フラニル、オキサジアゾリルまたはチアジアゾリルでありうる。好ましくは、Ar1は、フェニル、ナフチル、ピリジニルまたはベンゾフラニル、より好ましくはピリジニルまたはベンゾフラニルである。さらにより好ましくは、Ar1はピリジニルである。
【0016】
Ar2またはR1がN、OおよびSから選択される4つまでのヘテロ原子を含有する5または6員のヘテロサイクリル基である場合、それは、フラニル、チエニル、ピロリル、オキサゾリル、チアゾリル、イミダゾリル、オキサジアゾリル、チアジアゾリル、ピリジル、トリアゾリル、トリアジニル、ピリダジル、ピリミジニル、イソチアゾリル、イソキサゾリル、ピラジニルまたはピラゾリルであってもよい。また、R1は、ピペリジニル、ピペラジニル、モルホリニルおよびチオモルホリニルでありうる。加えて、それは、ピロリジルまたはテトラゾリルでありうる。
【0017】
Ar2が置換されていてもよいビサイクリック芳香族またはヘテロ芳香族基である場合、それは、イソキノリニル、キノキサリニル、ベンゾキサゾリル、キノリニル、ナフチリジニル、ベンゾフラニル、ベンズイミダゾリル、ベンゾチエニル、インドリル、ベンゾチアゾリル、キナゾリニルまたはベンゾキサゾリルから選択される。加えて、それは、ナフチル、ベンゾトリアゾリルまたはベンゾチアジアゾリルでありうる。
好ましくは、Ar2は、置換されていてもよいフェニル、ピリジル、チアゾリル、ピラゾリル、ナフチルまたは1、2、3−トリアゾリルを意味する。加えて、Ar2は、チエニルおよびベンゾキサゾリルを意味する。
【0018】
さらにより好ましくは、R1は、トリフルオロメトキシ基、メトキシ基、ヨウドまたは置換されていてもよいフェニル、ピリジル、ピラゾリルもしくはオキサジアゾリル基を意味する。
XがCOである場合、好ましくは、mは1であり、好ましくは、pは0である。
【0019】
Ar1、Ar2およびR1基に関する任意の置換基は、ハロゲン、ヒドロキシ、オキソ、シアノ、ニトロ、(C1−4)アルキル、(C1−4)アルコキシ、ハロ(C1−4)アルキル、ハロ(C1−4)アルコキシ、アリール(C1−4)アルコキシ、(C1−4)アルキルチオ、ヒドロキシ(C1−4)アルキル、(C1−4)アルコキシ(C1−4)アルキル、(C3−6)シクロアルキル(C1−4)アルコキシ、(C1−4)アルカノイル、(C1−4)アルコキシカルボニル、(C1−4)アルキルスルホニル、(C1−4)アルキルスルホニルオキシ、(C1−4)アルキルスルホニル(C1−4)アルキル、アリールスルホニル、アリールスルホニルオキシ、アリールスルホニル(C1−4)アルキル、(C1−4)アルキルスルホンアミド、(C1−4)アルキルアミド、(C1−4)アルキルスルホンアミド(C1−4)アルキル、(C1−4)アルキルアミド(C1−4)アルキル、アリールスルホンアミド、アリールカルボキサミド、アリールスルホンアミド(C1−4)アルキル、アリールカルボキサミド(C1−4)アルキル、アロイル、アロイル(C1−4)アルキルまたはアリール(C1−4)アルカノイル基;R3R4N−、R3OCO(CH2)r、R3CON(R4)(CH2)r、R3R4NCO(CH2)r、R3R4NSO2(CH2)rまたはR3SO2NR4(CH2)r基を含み、ここに、R3およびR4は、各々独立して、水素原子または(C1−4)アルキル基を意味するか、または適当なR3R4は、(C3−6)アザシクロアルカンまたは(C3−6)(2−オキソ)アザシクロアルカン環の一部を形成し、rは0または1〜4の整数を意味する。付加的な置換基は、(C1−4)アシル、アリール、アリール(C1−4)アルキル、(C1−4)アルキルアミノ(C1−4)アルキル、R3R4N(CH2)n−、R3R4N(CH2)nO−であり、ここに、nは1〜4の整数を意味する。加えて、置換基がR3R4N(CH2)n−またはR3R4N(CH2)nOである場合、R3は、基の(CH2)n部の少なくとも1つのCH2と一緒になって、(C3−6)アザシクロアルカンを形成し、R4は、水素、(C1−4)アルキル基を意味するか、またはそれらが結合している窒素と一緒になって、第1(C3−6)アザシクロアルカンに縮合された第2の(C3−6)アザシクロアルカンを形成する。
【0020】
Ar2に関する好ましい任意の置換基は、ハロゲン、シアノ、(C1−4)アルキル、(C1−4)アルカノイルである。付加的な好ましい任意の置換基は、ヒドロキシ(C1−4)アルキル、R3R4N(CH2)n−、R3R4N−またはR3R4N(CH2)nO−である。
Ar1に関する好ましい任意の置換基は、ハロゲン、シアノ、(C1−4)アルキル、ヒドロキシ(C1−4)アルキル、(C1−4)アシル、(C1−4)アルコキシ(C1−4)アルキル、R3R4NCO(CH2)r−、R3R4N(CH2)n−、R3R4N(CH2)nO−またはR3R4N−である。
R1に関する好ましい任意の置換基は、ハロゲン、シアノ、R3R4N−、R3R4N(CH2)n−およびR3R4N(CH2)nO−である。付加的な任意の置換基は、(C1−4)アルキルおよび(C1−4)アルキルアミドである。
【0021】
加えて、Ar1は、ハロゲン、シアノ、C1−4アルカノイルまたはC1−4アルキルスルホニル基により置換されていてもよいフェニル環により;あるいは、(C1−2)アルキルまたはR3R4N−基により置換されていてもよい5もしくは6員のヘテロサイクリック環により置換されていてもよく;ここに、R3およびR4は上記と同意義である。
Ar1およびAr2基において、別の置換基に対してオルト位に位置する置換基は、結合して縮合環を形成してもよい。
【0022】
本発明の代表的な化合物は:
2−(1−(2−フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(4−クロロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−トリフルオロメトキシ)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(4−フルオロ)フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(2−シアノ)フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(3−シアノ)フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(3−(2−フェニル)ピリジル)カルボニルピペリジン;
【0023】
2−(1−(2−(2−シアノ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(3−クロロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(3,4−ジクロロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(1−ピラゾリル))ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(3−ピリジル)オキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
【0024】
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(2−トリフルオロメトキシ)ベンゾイルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(1−ナフトイル)ピペリジン;
2−(1−(2−(3−シアノ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(3−シアノ)フェノキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
【0025】
E:Z−2−(1−(2−(3−フェニル)プロペニル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−2−(1−(2−フェノキシ)エチル)−ピロリジン;
1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−2−(1−(2−フェノキシ)エチル)−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
4−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−3−(1−(2−フェノキシ)エチル)−モルホリン;
3−(1−(2−(4−フルオロフェノキシ))エチル)−4−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)モルホリン;
2−(1−(2−フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピロリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−フェニル)ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
2−(1−(2−フェノキシ)エチル)−1−(2−(2−ピリジル))ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
2−(1−(2−フェノキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
2−(1−(2−フェノキシ)エチル)−1−(2−トリフルオロメトキシ)ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
【0026】
2−(1−(2−フェノキシ)エチル)−1−(1−ナフトイル)−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
3−(1−(2−フェノキシ)エチル)−4−(2−フェニル)ベンゾイルモルホリン;
2−(1−(2−フェノキシ)エチル)−1−(5−フルオロ−2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
1−(5−(3−メチル−1−フェニル)−1H−ピラゾリル)カルボニル−2−(1−(2−フェノキシ)エチル)ピペリジン;
1−(4−(2−メチル−5−フェニル)−2H−1,2,3−トリアゾリル)カルボニル−2−(1−(2−フェノキシ)エチル)ピペリジン;
1−(2−ヨウド)ベンゾイル−2−(1−(2−フェノキシ)エチル)ピペリジン;
またはそのいずれか1つの医薬上許容される塩から選択される。
【0027】
本発明のさらなる化合物は:
(R,S)−1−ベンゾフラン−2−イル−2−(1−{1−[5−(4−フルオロ−フェニル)−2−メチル−チアゾール−4−イル]−メタノイル}−ピペリジン−2−イル)−エタノン;
1−ベンゾフラン−2−イル−2−(1−{1−[4−(4−フルオロ−フェニル)−1−H−ピラゾール−3−イル]−メタノイル}ピペリジン−2−イル)−エタノン;
1−ベンゾフラン−2−イル−2−(1−{1−[4−(4−フルオロ−フェニル)−1−メチル−1H−ピラゾール−3−イル]−メタノイル}−ピペリジン−2−イル)−エタノン;
1−ベンゾフラン−2−イル−2−{1−[1−(5−ブロモ−2−メトキシ−フェニル)−メタノイル]−ピペリジン−2−イル}エタノン;
N−(3−{1−[2−(2−ベンゾフラン−2−イル−2−オキソ−エチル)−ピペリジン−1−イル]−メタノイル}−フェニル)−アセトアミド;
またそのいずれか1つの医薬上許容される塩から選択される。
【0028】
本発明の付加的な化合物は:
1−(2−ベンジルオキシメチル−ピペリジン−1−イル)−1−(2−メチル−5−フェニル−チアゾール−4−イル)−メタノン;
1−[2−(2−ベンジルオキシ−エチル)−ピペリジン−1−イル]−1−(2−ピリジン−2−イル−フェニル)−メタノン;
1−[2−(2−ベンジルオキシ−エチル)−ピペリジン−1−イル]−1−ビフェニル−2−イル−メタノン;
1−{2−[2−(4−フルオロ−ベンジルオキシ)−エチル]−ピペリジン−1−イル}−1−(2−メチル−5−フェニル−チアゾール−4−イル)−メタノン;
1−ビフェニル−2−イル−1−{2−[2−(4−フルオロ−ベンジルオキシ)−エチル]−ピペリジン−1−イル}メタノン;
1−(2−メチル−5−フェニル−チアゾール−4−イル)−1−[2−(3−フェノキシ−プロピル)−ピペリジン−1−イル]−メタノン;
1−[5−(4−フルオロ−フェニル)−2−メチル−チアゾール−4−イル]−1−{2−[2−(ピリジン−2−イルスルファニル)−エチル]−ピペリジン−1−イル}−メタノン;
3−[1−(1−ビフェニル−2−イル−メタノイル)−ピペリジン−2−イル]−1−フェニル−プロパン−1−オン;
1−[(S)−2−(5−ブロモ−ピリミジン−2−イルオキシメチル)−ピロリジン−1−イル]−1−[2−(3−メチル−[1,2,4]オキサジアゾール−5−イル)−フェニル]−メタノン;
またはそのいずれか1つの医薬上許容される塩から選択される。
【0029】
ハロゲン原子が式(I)で示される化合物に存在する場合、それは、フッ素、塩素、臭素またはヨウ素であってもよい。
本明細書で用いる場合、アリールなる用語は、5もしくは6員の芳香環、例えばフェニル、または少なくとも1つの環が芳香族、例えばナフチルである7〜8員のビサイクリック環系を意味する。
式(I)で示される化合物はアルキル基を含有する場合、単独であっても、または大きな基、例えばアルコキシまたはアルキルチオを形成する一部であっても、アルキル基は、直鎖、分枝鎖または環状、あるいはその組み合わせであってもよく、好ましくは、それはメチルまたはエチルである。
【0030】
式(I)で示される化合物は、RまたはSエナンチオマーとして存在し得ることは明らかであろう。本発明は、混合物を含むかかるすべての異性体をその範囲内に含む。付加的なキラル中心が式(I)で示される化合物中に存在する場合、本発明は、その混合物を含むすべての可能性あるジアステレオマーをその範囲内に含む。異なる異性体形態は、慣用的な方法により他から1つを分離するか、または分割することができ、あるいはいずれの所定の異性体は、慣用的な方法によるか、または立体特異的もしくは不斉合成により得ることができる。
【0031】
本発明は式(I)で示される化合物の医薬上許容される誘導体を含むことは理解できるだろう。それらは本発明の範囲内に含まれる。
本発明の特定の化合物は、実施例に記載されるものおよびその医薬上許容される誘導体を含む。
【0032】
本明細書で用いられる場合、「医薬上許容される誘導体」は、式(I)で示される化合物のいずれの医薬上許容される塩、エステルまたはかかるエステルの塩を含み、それらは患者にに投与した場合、式(I)で示される化合物またはその活性代謝物もしくは残留物を提供する能力(直接または間接的に)がある。
【0033】
医薬において用いられる場合、式(I)で示される化合物は医薬上許容されなければならないことは明らかであろう。適当な医薬上許容される塩は当業者には明らかであり、無機酸、例えば塩酸、臭化水素酸、硫酸、硝酸またはリン酸および有機酸、例えばコハク酸、マレイン酸、酢酸、フマル酸、クエン酸、酒石酸、安息香酸、p−トルエンスルホン酸、メタンスルホン酸またはナフタレンスルホン酸と形成される酸付加塩を含む。他の塩、例えば、シュウ酸塩は、例えば式(I)で示される化合物の分離に用いることができ、それらは本発明の範囲内に含まれる。また、式(I)で示される化合物の溶媒和物および水和物も本発明の範囲内に含まれる。
【0034】
式(I)で示されるある種の化合物は、1つまたはそれ以上の酸等価物と酸付加塩を形成することができる。本発明は、すべての可能性ある化学量論的形態および非化学量論的形態をその範囲内に含む。
式(I)で示される化合物は、医薬組成物中に用いることを目的とするので、好ましくは、それらは、各々、実質的に純粋な形態、例えば少なくとも60%の純度、より適当には少なくとも75%の純度、好ましくは少なくとも85%の純度、特に少なくとも98%の純度(%は重量%)で提供されることは、容易に理解できるだろう。
【0035】
本発明のさらなる特徴により、式(I)で示される化合物およびその塩の製造方法を提供する。以下のスキームは、本発明の化合物のいつくかの合成経路を詳細に記載する。
【0036】
スキーム1は、特に、XがOまたはSである式(I)で示される化合物に適用することができる:
【化2】
【0037】
適当な脱離基L1の例としては、ハロゲン、ヒドロキシ、OSO2Me、OSO2(4−トリル)が挙げられる。(V)と(VI)との反応は、好ましくは、N,N−ジメチルホルムアミドのような不活性溶媒中、トリエチルアミン、水素化ナトリウムまたはカリウムt−ブトキシドのような塩基の存在下で行われる。特に、XがOであり、pが0である場合、L1は、好ましくは、ヒドロキシであり、(V)と(VI)との反応は、ミツノブ条件下、すなわち、ジクロロメタンまたはテトラヒドロフランのような不活性溶媒中、トリフェニルホスフィントリブチルホスフィンのようなホスフィン試薬およびアゾジカルボン酸ジエチル、アゾジカルボン酸ジイソプロピルまたは1,1’−アゾジカルボニルジピペリジンのようなアゾジカルボニル試薬の存在下で行われる。
【0038】
適当な脱離基L2の例としては、ハロゲン、ヒドロキシ、OC(=O)アルキルおよびOC(=O)O−アルキルが挙げられる。(II)から(I)への変換は、ジクロロメタンのような不活性溶媒中、トリエチルアミンのような塩基の存在下で行うことができる。別法としてこの工程は、L2がヒドロキシである場合に行うことができ、この場合、(II)との反応を、ジクロロメタンのような不活性溶媒中、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩のようなジイミド剤および1−ヒドロキシベンゾトリアゾールのような活性化剤の存在下で行う。
【0039】
保護基Pの例としては、t−ブチルオキシカルボニル、トリフルオロアセチルおよびベンジルオキシカルボニルが挙げられる。脱保護条件は、それぞれ、酸(例えば、ジクロロメタン中のトリフルオロ酢酸)、塩基(例えば、水性メタノールのような溶媒中の水酸化ナトリウム)および不活性溶媒中の触媒加水分解(例えば、低級アルコールまたは酢酸エチル中の炭素担持パラジウムを用いる)である。
【0040】
式(V)および(VI)の化合物は文献で公知のものであるか、または公知の方法により調製することができる。
上記したスキームにおいて、官能基の相互変換;例えば、化合物(V)において、ある種のL1を別のL1に変換すること;または置換基を相互変換(残留物Xの相互変換を含む)することにより式(I)で示される一の化合物を式(I)で示される別の化合物に変換することも範囲に含む。
【0041】
R1が芳香族基である場合、式(VII)で示される化合物(式中、L3は脱離基、例えばハロゲン(好ましくは、ブロモもしくはヨウド)またはトリフルオロメチルスルホニルオキシであり、すべての他の基は上記と同意義である)を、試薬R1M(式中、Mは有機金属種、例えばB(OH)2またはトリアルキルスタンニルの残余物である)と反応させることによる、スキーム2に説明するような最終工程で置換基R1を誘導することができる。かかる工程は、1,2−ジメトキシエタンまたは1,4−ジオキサンのような不活性溶媒中、Pd(PPh3)4のような遷移金属触媒の存在下で行うことができる。
【0042】
【化3】
【0043】
Xが−CH=CH−を意味する式(I)で示される化合物は、スキーム3に示す経路により合成することができる。
【化4】
【0044】
(XI)および(XII)間の反応は、テトラヒドロフランのような不活性溶媒中、ブチルリチウムのような塩基の存在下で行うことができる。脱保護および最終カップリング工程は、スキーム1に記載の方法と類似の方法で行うことができる。
式(XI)および(XII)で示される化合物は、文献で公知のものであるか、または公知の方法により調製することができる。
【0045】
XがC=Oである式(I)で示される化合物は、式(XI)で示される化合物を、化合物T−(CH2)p−Ar1(式中、Tは有機金属種の残留物、例えばLi−またはBrMg−である)と、テトラヒドロフランのような不活性溶媒中で反応させ;ついで、得られた二級アルコールをデスマーチンペルヨウダイドのような酸化剤で、ジクロロメタンのような不活性溶媒中で酸化し;ついで、脱保護し、得られた二級アミンを、式(III)で示される化合物と上記した方法でカップリングさせることにより調製することができる。
【0046】
別法として、XがC=Oである式(I)で示される化合物は、式(XV):
【化5】
[式中、Y、mおよびAr2は式(I)の記載と同意義である]
で示される化合物を、上記した化合物T−(CH2)p−Ar1と、テトラヒドロフランのような不活性溶媒中で反応させ;ついで、得られた二級アルコールを、上記したデスマーチンペルヨウダイドのような酸化剤で酸化することにより調製することができる。式(XV)で示される化合物は文献で公知のものであるか、または公知の方法により調製することができる。
【0047】
【化6】
構造式(XVI)で示される化合物は文献で公知のものであるか、または公知の方法により合成することができる。
【0048】
式(I)で示される化合物は、単独で、または少なくとも2個、例えば5〜1000個、好ましくは10〜100個の式(I)で示される化合物を含む化合物ライブラリーとして調製することができる。化合物ライブラリーは、当業者に公知の方法により、コンビナトリアル「分割および混合(split and mix)」法により、または液相もしくは固相化学を用いる複合パラレル合成(multiple parallel synthesis)により調製することができる。
かくして、本発明のさらなる態様により、少なくとも2個の式(I)で示される化合物またはその医薬上許容される塩を含む化合物ライブラリーを提供する。
医薬上許容される塩は、慣用的には、適当な酸または酸誘導体と反応させることにより調製することができる。
【0049】
式(I)で示される化合物およびその医薬上許容される誘導体は、ヒトオレキシン受容体のアンタゴニストを必要とする疾患または障害、例えば肥満症および糖尿病;プロラクチノーマ;高プロラクチン血症;成長ホルモン欠損症の視床下部障害;特発性成長ホルモン欠損症;クッシング症候群/クッシング病;視床下部副腎機能障害;小人症;睡眠障害;睡眠時無呼吸;ナルコレプシー;不眠症;睡眠時異常行動;時差ぼけ症候群;神経疾患、神経痛および下肢静止不能症候群のような疾患に付随する睡眠障害;心臓および肺疾患;鬱病;不安症;依存症;強迫性障害;情動性神経症/障害;抑うつ神経症/障害;不安神経症;気分変調性障害;行動障害;気分障害;性機能不全;精神性性機能不全;性的障害;性障害;統合失調症;躁うつ病;譫妄;痴呆;過食症および下垂体機能低下症の治療に有用である。
【0050】
式(I)で示される化合物およびその医薬上許容される誘導体は、特に発作、特に虚血性または出血性発作の治療に有用である。また、式(I)で示される化合物およびその医薬上許容される誘導体は、催吐応答の阻止に有用である。
式(I)で示される化合物およびその医薬上許容される誘導体は、特に、2型糖尿病に付随する肥満症を含む肥満症、睡眠障害、発作および/または催吐応答、例えば悪心および嘔吐の治療に有用である。
【0051】
本発明に従って治療することができる他の疾患または障害は、生体リズムおよび日周期リズム障害;副腎下垂体疾患;下垂体疾患;下垂体腫瘍/腺腫;副腎下垂体機能低下;機能性または心因性無月経;副腎下垂体機能亢進症;片頭痛;痛覚過敏;痛み;痛みに対する感受性の増強または強調、例えば痛覚過敏、灼熱痛および異痛症;急性の痛み;熱傷の痛み;異型顔面痛;神経痛;背痛;複合部分痛症候群IおよびII;関節痛;スポーツ外傷の痛み;感染症に関連する痛み、例えばHIV、ポリオ後症候群およびヘルペス後神経痛;幻肢痛;陣痛;癌痛;化学療法後痛;発作後痛;術後痛;神経痛;および麻酔剤耐性または麻酔剤退薬症状を含む。
【0052】
また、本発明は、ヒトオレキシン受容体のアンタゴニストを必要とする疾患または障害の治療または予防方法であって、該治療または予防を必要とする対象に、有効量の式(I)で示される化合物またはその医薬上許容される誘導体を投与することを含む方法を提供する。
また、本発明は、ヒトオレキシン受容体のアンタゴニストを必要とする疾患または障害の治療または予防において用いるための、式(I)で示される化合物またはその医薬上許容される誘導体を提供する。
また、本発明は、ヒトオレキシン受容体のアンタゴニストを必要とする疾患または障害の治療または予防用の医薬の製造における式(I)で示される化合物またはその医薬上許容される誘導体の使用を提供する。
【0053】
治療において用いるために、本発明の化合物は、通常、医薬組成物として投与される。また、本発明は、式(I)で示される化合物またはその医薬上許容される誘導体および医薬上許容される担体を含んでなる医薬組成物を提供する。
式(I)で示される化合物またはその医薬上許容される誘導体は、いずれの慣用的な方法、例えば経口、非経口、バッカル、舌下、経鼻、直腸または経皮投与により投与することができ、医薬組成物はそれに応じて適応させる。
【0054】
経口で投与される場合に活性である式(I)で示される化合物またはその医薬上許容される誘導体は、液体または固体、例えばシロップ、懸濁液、エマルジョン、錠剤、カプセルまたはロゼンジとして処方することができる。
液体処方は、適当には、適当な液体担体(複数でも可)、例えば水性溶媒、例えば水、エタノールもしくはグリセリンまたは非水性溶媒、例えばポリエチレングリコールもしくは油中の活性成分の懸濁液または溶液で構成されるだろう。また、処方は、懸濁化剤、保存剤、フレーバーおよび/または着色剤を含有していてもよい。
錠剤の形態である組成物は、固体処方を調製するのに慣用的に用いられるいずれの適当な医薬担体(複数でも可)、例えばステアリン酸マグネシウム、スターチ、ラクトース、シュークロースおよびセルロースを用いて調製することができる。
【0055】
カプセルの形態である組成物は、慣用的なカプセル化法、例えば活性成分を含むペレットは、標準的な担体を用いて調製され、ついで、ハードゼラチンカプセル中に充填され;別法として、分散液または懸濁液は、いずれの適当な医薬担体(複数でも可)、例えば水性ガム、セルロース、シリケートまたは油を用いて調製することができ、ついで、分散液または懸濁液をソフトゼラチンカプセル中に充填する。
【0056】
典型的な非経口組成物は、適当な水性担体または非経口的に許容される油、例えばポリエチレングリコール、ポリビニルピロリドン、レシチン、ラッカセイ油またはゴマ油中の活性成分の溶液または懸濁液で構成される。別法として、溶液は凍結乾燥し、ついで、投与直前に適当な溶媒で復元することができる。
【0057】
経鼻投与用の組成物は、慣用的には、エアロゾル、滴剤、ゲルおおび粉末として処方することができる。エアロゾル処方は、典型的には、医薬上許容される水性または非水性溶媒中の活性成分の溶液または微細懸濁液を含み、通常、噴霧装置と一緒に使用するためのカートリッジまたは詰替品の形態をとることができる密封容器中の滅菌形態で単回または複数回量で提供される。別法として、密封容器は、単回投与経鼻吸入器のような使い捨て投薬装置または定量バルブを装着したエアロゾルディスペンサーであってもよい。投与形態がエアロゾルディスペンサーを含む場合、それは、圧縮ガス、例えば空気または有機噴射剤、例えばフルオロクロロ炭化水素またはヒドロフルオロカーボンであり得る噴射剤を含有するだろう。また、エアロゾル投与形態は、ポンプ噴霧器の形態をとることもできる。
【0058】
バッカルまたは舌下投与に適した組成物は、活性成分が、担体、例えば糖、アカシア、トラガカントまたはゼラチンおよびグリセリンと一緒に処方される、錠剤、ロゼンジ、トローチを含む。
直腸投与用の組成物は、慣用的には、ココアバターのような慣用的な坐剤基剤を含有する坐剤の形態である。
経皮投与に適した組成物は、軟膏、ゲルおよびパッチを含む。
好ましくは、組成物は錠剤、カプセルまたはアンプルのような単位投与形態である。
【0059】
上記した障害または疾患の治療または予防において用いるための、式(I)で示される化合物またはその医薬上許容される塩の投与量は、通常、治療される特定の障害または疾患、対象の体重および他の同様の因子により変化するだろう。しかしながら、原則として、適当な単位投与量は、0.05〜1000mg、より適当には0.05〜500mgであってもよい。単位投与量は、1日の総投与量が約0.01〜100mg/kgであるように、1日1回以上、例えば1日2または3回投与することができ;かかる治療は、数週間または数ヶ月に及んでもよい。医薬上許容される塩である場合、上記数量は、式(I)で示される親化合物として計算される。
上記した投与量範囲で式(I)で示される化合物を投与する場合、毒性効果は示されず/予想されない。
【0060】
ヒトオレキシン−Aは、下記アミノ酸配列を有する:
【0061】
オレキシン−Aは、オレキシン−1受容体のリガンド活性化を阻害する化合物に関するスクリーニング法において用いることができる。
一般的には、かかるスクリーニング法は、その表面上でオレキシン−1受容体を発現する適当な細胞を提供することを含む。かかる細胞は、哺乳類、酵母、ショウジョウバエ(Drosophila)またはイー・コリ(E. coli)からの細胞を含む。特に、オレキシン−1受容体をコードするポリヌクレオチドを用いて、細胞をトランスフェクトし、受容体を発現させる。ついで、発現した受容体を試験化合物およびオレキシン−1受容体リガンドと接触させて、機能的応答の阻害を観察する。一のかかるスクリーニング法は、WO92/01810に記載されているように、トランスフェクトされてオレキシン−1受容体を発現する黒色素胞の使用を含む。
【0062】
別のスクリーニング法は、オレキシン−1受容体をコードするRNAを、ゼノパス(Xenopus)卵母細胞中に導入して該受容体を一時的に発現することを含む。ついで、受容体卵母細胞を受容体リガンドおよび試験化合物と接触させ、ついで、リガンドによる受容体の活性化を阻害すると考えられる化合物に関してスクリーニングする場合に、シグナルの阻害を検出する。
【0063】
別の方法は、標識オレキシン−1受容体リガンドと、その表面に受容体を有する細胞との結合の阻害を測定することにより、受容体の活性化を阻害する化合物をスクリーニングすることを含む。該方法は、オレキシン−1受容体をコードするDNAで真核細胞をトランスフェクトし、細胞がその表面に受容体を発現し、オレキシン−1受容体リガンドの標識形態の存在下、細胞または細胞膜調製物を化合物と接触させることを含む。リガンドは、放射性標識を含んでいてもよい。受容体に結合した標識リガンドの量を、例えば、放射能を測定することにより測定する。
【0064】
さらなる別のスクリーニング法は、オレキシン−1受容体リガンドとオレキシン−1受容体との相互作用に影響を与えることにより、細胞内のカルシウムイオンまたは他のイオンの動員を阻害する試験化合物の高処理能力スクリーニングのためのFLIPR装置の使用を含む。
【0065】
本明細書に示した、限定するものではないが、特許および特許出願を含むすべての刊行物は、出典明示により本明細書に組み入れる。
【0066】
以下の実施例は、本発明の医薬上活性な化合物の製造法を説明するものである。記載D1〜D23は、本発明の化合物の中間体の製造法を説明するものである。
【0067】
実施例において、1H NMRは、特記しない限り、CDCl3中で250MHzで測定した。
本明細書で用いられる略号は:
MDCは二塩化メチレンを意味する。
THFはテトラヒドロフランを意味する。
HATUはO−(7−アザベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウムヘキサフルオロホスフェートを意味する。
DMFはジメチルホルムアミドを意味する。
【0068】
記載1(a):1−(t−ブチルオキシカルボニル)−2−(1−(2−(3,4−ジクロロ)フェノキシ)−エチル)ピペリジン
乾燥MDC(25ml)中の1−tert−ブトキシカルボニル−2−ピペリジンエタノール(1.50g、6.55mmol)、トリフェニルホスフィン(1.72g、6.56mmol)および3,4−ジクロロフェノール(1.07g、6.56mmol)の混合物を、氷浴で冷却した。乾燥MDC(7ml)中のアゾジカルボン酸ジエチル(1.03ml、1.14g、6.54mmol)を、アルゴン雰囲気下で撹拌しながら、0.5時間にわたって滴下した。反応混合物を室温で18時間撹拌し、ついで、減圧下で濃縮した。残渣をMDCで溶出するシリカゲル(100g)のカラムクロマトグラフィーにより精製した。所望の物質を含有するフラクションを合し、減圧下で濃縮した。残渣を1:1のエーテル−ヘキサン(40ml)中で溶解し、1Mの水酸化ナトリウム水溶液で洗浄した。有機層を除去し、乾燥(Na2SO4)し、濾過し、溶媒を減圧下で除去して、黄色油として標題化合物(1.31g、53%)を得た。
1H NMR δ: 1.39 (9H, s), 1.62 (6H, m), 1.83 (1H, m) 2.21 (1H, m), 2.79 (1H, m), 3.91 (2H, m), 4.01 (1H, m), 4.47 (1H, m) 6.72 (1H, dd, J = 9 Hz, 3 Hz), 6.96 (1H, d, J = 3 Hz), 7.30 (1H, d, J = 9 Hz)。
【0069】
以下の化合物を記載1(a)と類似の方法で調製した:
1(b):1−(t−ブチルオキシカルボニル)−2−(1−(2−フェノキシ)エチル)ピペリジン
1H NMR δ: 1.40 (9H, s), 1.63 (6H, m), 1.87 (1H, m), 2.22 (1H, m), 2.82 (1H, m), 3.95 (2H, m), 4.05 (1H, m), 4.47 (1H, m), 6.81 6.96 (3H, m), 7.20 7.31 (2H, m)。
【0070】
1(c):1−(t−ブチルオキシカルボニル)−2−(1−(2−(1−ナフチル)オキシ)エチル)ピペリジン
1H NMR δ: 1.34 (9H, s), 1.57 1.75 (6H, m), 2.05 (1H, m), 2.37 (1H, m), 2.89 (1H, m), 3.96 4.21 (3H, m), 4.60 (1H, m), 6.76 (1H, dd, J = 7, 1Hz), 7.26 7.53 (4H, m), 7.78 (1H, m), 8.27 (1H, m)。
【0071】
1(d):1−(t−ブチルオキシカルボニル)−2−(1−(2−(3−シアノ)フェノキシ)エチル)ピペリジン
1H NMR δ: 1.38 (9H, s), 1.62 (6H, m), 1.86 (1H, m), 2.25 (1H, m) 2.81 (1H, m), 3.99 (3H, m), 4.51 (1H, m), 7.10 (2H, m), 7.23 (1H, m), 7.36 (1H, m)。
【0072】
1(e):1−(t−ブチルオキシカルボニル)−2−(1−(2−(2−ピリジル)オキシ)エチル)ピペリジン
1H NMR δ: 1.39 (9H, s), 1.59 (6H, m), 1.88 (1H, m), 2.19 (1H, m), 2.80 (1H, m), 4.02 (1H, m), 4.29 (2H, m), 4.47 (1H, m), 6.72 (1H, m), 6.84 (1H, m), 7.55 (1H, m), 8.14 (1H, m)。
【0073】
1(f):1−(t−ブチルオキシカルボニル)−2−(1−(2−(4−フルオロ)フェノキシ)エチル)ピペリジン
1H NMR δ: 1.39 (9H, s), 1.62 (6H, m), 1.83 (1H, m), 2.22 (1H, m), 2.81 (1H, m), 3.89 (2H, m), 4.02 (1H, m), 4.47 (1H, m), 6.80 (2H, m) 6.95 (2H, m)。
【0074】
記載2(a):2−(1−(2−(3,4−ジクロロ)フェノキシ)エチル)ピペリジン
MDC(18ml)中の1−(t−ブチルオキシカルボニル)−2−(1−(2−(3,4−ジクロロ)フェノキシ)エチル)ピペリジン(1.31g、3.49mmol)およびトリフルオロ酢酸(3.5ml)の混合物を、室温で1時間撹拌した。反応混合物を減圧下で蒸発させて乾燥し、残渣を、1:1のエーテル−ヘキサン(30ml)および1NのHCl(30ml)間で分配した。水層を分離し、5NのNaOHでpH14に塩基性化し、MDC(2×20ml)で抽出した。合した有機洗浄液を乾燥(Na2SO4)し、濾過し、減圧下で蒸発させて、黄色油(0.80g、83%)得た。
質量スペクトル(API+):C13H17 35Cl2NOとして、計算値273、実測値274(MH+)。
1H NMR δ: 1.17 (1H, m), 1.39 (2H, m), 1.63 (3H, m), 1.82 (3H, m), 2.68 (2H, m), 3.07 (1H, m), 4.02 (2H, m), 6.75 (1H, dd, J = 9 Hz, 3Hz), 7.00 (1H, d, J = 3 Hz), 7.30 (1H, d, J = 9 Hz)。
【0075】
以下の化合物を記載2(a)と類似の方法で調製した:
2(b):2−(1−(2−フェノキシ)エチル)ピペリジン
質量スペクトル(API+):C13H19NOとして、計算値205、実測値MH+206。
【0076】
2(c):2−(1−(2−(1−ナフチル)オキシ)エチル)ピペリジン
質量スペクトル(API+):C17H21NOとして、計算値255、実測値MH+256。
【0077】
2(d):2−(1−(2−(3−ピリジル)オキシ)エチル)ピペリジン
質量スペクトル(API+):C12H18N2Oとして、計算値206、実測値207。
1H NMR δ: 1.16 (1H, m), 1.38 (2H, m), 1.63 (3H, m), 1.83 (3H, m), 2.69 (2H, m), 3.07 (1H, m), 4.10 (2H, m), 7.19 (2H, m) 8.18 (1H, m), 8.31 (1H, m)。
【0078】
2(e):2−(1−(2−(3−シアノ)フェノキシ)エチル)ピペリジン
質量スペクトル(API+):C14H18N2Oとして、計算値230、実測値231。
【0079】
2(f):2−(1−(2−(2−ピリジル)オキシ)エチル)ピペリジン
質量スペクトル(API+):C12H18N2Oとして、計算値206、実測値207。
1H NMR δ: 1.19 - 1.52 (4H, m), 1.64 (3H, m), 1.82 (2H, m), 2.65 (2H, m), 3.08 (1H, m), 4.36 (2H, m), 6.72 (1H, m), 6.83 (1H, m), 7.55 (1H, m), 8.12 (1H, m)。
【0080】
2(g):2−(1−(2−(4−フルオロ)フェノキシ)エチル)ピペリジン
質量スペクトル(API+):C13H18FNOとして、計算値223、実測値224。
1H NMR δ: 1.18 (1H, m), 1.39 (2H, m), 1.62 (3H, m), 1.81 (3H, m), 2.68 (2H, m), 3.07 (1H, m), 4.01 (2H, t, J = 6Hz), 6.83 (2H, m), 6.94 (2H, m)。
【0081】
2(h):2−(1−(2−(3−フェニル)プロペニル))ピペリジン(2:1のE:Z異性体混合物)
質量スペクトル(API+):C14H19Nとして、計算値201、実測値MH+202。
【0082】
記載3:1−(t−ブチルオキシカルボニル)−2−(1−(2−(3−ピリジル)オキシ)エチル)ピペリジン
乾燥DMF(55ml)中の1−tert−ブトキシカルボニル−2−ピペリジンエタノール(3.0g、13.2mmol)、トリフェニルホスフィン(3.45g、13.2mmol)および3−ヒドロキシピリジン(1.25g、13.2mmol)の混合物を、氷−メタノール浴で0℃に冷却した。アゾジカルボン酸ジエチル(2.1ml、2.30g、13.2mmol)を加え、反応混合物を室温でアルゴン雰囲気下で4時間撹拌した。ほとんどのDMFを減圧下で除去し、残渣をMDC(100ml)中に溶解し、水(3×100ml)で洗浄した。有機層を分離し、乾燥(Na2SO4)し、濾過し、減圧下で蒸発させて、緑色油(8.1g)を得、これをMDC中の0〜2%.880アンモニアで溶出するシリカゲルのクロマトグラフィー(約200g)により精製した。所望の物質を含有するフラクションを合し、減圧下で蒸発させて、褐色油(6.77g)を得た。この物質を、さらに、メタノール中の0〜2%.880アンモニアで溶出するプレパックされたSCXカラムを通して精製した。所望の物質を含有するフラクションを合し、減圧下で蒸発させて、褐色油として標題化合物(1.23g、30%)を得た。
質量スペクトル(API+):C17H26N2O3として、計算値306、実測値307。
1H NMR δ: 1.38 (9H, s), 1.62 (6H, m), 1.85 (1H, m), 2.27 (1H, m), 2.81 (1H, m), 3.99 (3H, m), 4.51 (1H, m), 7.17 (2H, m), 8.20 (1H, m), 8.29 (1H, m)。
【0083】
記載4:1−(t−ブチルオキシカルボニル)−2−(1−(2−(3−フェニル)プロペニル))ピペリジン(2:1のE:Z異性体混合物)
乾燥テトラヒドロフラン(60ml)中のベンジルトリフェニルホスホニウムブロマイド(10.3g、23.8mmol)の撹拌懸濁液に、アルゴン雰囲気下20℃で、ヘキサン(1.6M、11ml、17.3mmol)中のn−ブチルリチウムの溶液を0.5時間にわたって滴下した。得られた混合物を、20℃で0.5時間撹拌し、ついで、乾燥テトラヒドロフラン(40ml)中の2−(2−(1−(t−ブチルオキシカルボニル)ピペリジニル)アセトアルデヒド(2.61g、11.5mmol)の溶液を、0.1時間にわたって滴下した。得られた混合物を、20℃で18時間撹拌し、ついで、水(100ml)およびブライン(100ml)の混合物中に注いだ。得られた懸濁液を、ジクロロメタン(4×100ml)で抽出し、合した有機抽出物を乾燥(Na2SO4)し、減圧下で蒸発させて、準固体を得た。ジクロロメタンで溶出するシリカゲルのクロマトグラフィーに付して、無色の油として標題化合物(2.51g、73%)を得た。
1H NMR δ: 1.30および1.47 (9H, 2 x s), 1.50 1.70 (6H, m), 2.31 2.90 (3H, m), 3.96 (1H, s), 4.36 (1H, s), 5.64および6.15 (1H, 2 x m), 6.41および6.50 (1H, 2 x d, それぞれ、J = 16 HzおよびJ = 12 Hz), 7.13 7.38 (5H, m)。
【0084】
記載5:(R、S)−2−[(メトキシ−メチル−カルバモイル)−メチル]−ピペリジン−1−カルボン酸tert−ブチルエステル
DMF(20ml)中の2−カルボキシメチル−ピペリジン−1−カルボン酸tert−ブチルエステル(2.29g、10mmol)の溶液を、連続的に、N,N−ジイソプロピルエチルアミン(4.0ml)、HATU(3.8g、10mmol)およびO、N−ジメチル−ヒドロキシルアミン・HCl(0.98g、10mmol)で処理した。反応混合物をアルゴン雰囲気下室温で16時間撹拌した。揮発性物質を減圧下で除去し、残渣をクロマトグラフィー(シリカゲル、ジエチルエーテル)に付して、白色固体として標題化合物(2.60g、90%)を得た。
質量スペクトル(API+):C14H26N2O4として、計算値286、実測値187(MH+−tBOC)。
【0085】
記載6:(R,S)−2−(2−ベンゾフラン−2−イル−2−オキソ−エチル)−ピペリジン−1−カルボン酸tert−ブチルエステル
THF(40ml)中のベンゾフラン(0.95g、8.0mmol)の溶液に、アルゴン雰囲気下−40℃で、n−ブチルリチウム(ヘキサン中2.5M)(4.00ml、10.0mmol)を5分間にわたって滴下した。得られた混合物を15分間−40℃で撹拌し、ついで、THF(10ml)中の(R,S)−2−[(メトキシ−メチル−カルバモイル)−メチル]−ピペリジン−1−カルボン酸tert−ブチルエステル(2.30g、8.0mmol)を1分間にわたって加え、得られた溶液を20分間−40℃で撹拌した。混合物を飽和塩化アンモニウム(20ml)中に注ぎ、酢酸エチル(3×)で抽出した。合した有機物を乾燥(MgSO4)し、減圧下で溶媒を除去した。得られた残渣を、クロマトグラフィー(シリカゲル、MDC)に付して標題化合物(2.2g、84%)を得た。
1H NMR δ: 1.35 (9H, s), 1.44 (1H, m), 1.65 ( 5H, m), 2.94 (1H, dt, J = 3および13Hz), 3.17 (2H, m), 4.05 (1H, broad d), 4.89 (1H, m), 7.31 (1H, t, J = 8Hz), 7.48 (1H, m), 7.57 (2H, m), 7.72 (1H, d, J = 8Hz)。
【0086】
記載7:(R,S)−1−ベンゾフラン−2−イル−2−ピペリジン−2−イル−エタノン
MDC(20ml)中の(R,S)−2−(2−ベンゾフラン−2−イル−2−オキソ−エチル)−ピペリジン−1−カルボン酸tert−ブチルエステル(1.68g、4.9mmol)の撹拌溶液を、トリフルオロ酢酸(5ml)で処理した。混合物を50℃で1時間撹拌し、冷却し、揮発性物質を減圧下で除去した。残渣をMDC中に溶解し、飽和重炭酸ナトリウムで洗浄し、乾燥(MgSO4)し、溶媒を減圧下で除去して、標題化合物(1.20g、99%)を得た。
質量スペクトル(API+):C15H19NO2として、計算値243、実測値244(MH+)。
【0087】
記載8:2−(ベンジルオキシメチル)−1−(t−ブチルオキシカルボニル)−ピペリジン
水素化ナトリウム(1.05g、26mmol;60%の油中分散液)を、乾燥ジメチルホルムアミド(75ml)中の1−tert−ブトキシカルボニル−2−ピペリジンメタノール(5g、23mmol)および臭化ベンジル(2.8ml、24mmol)の撹拌混合物に、アルゴン雰囲気下0℃で、10分間にわたって滴下した。3時間後、反応混合物を水(700ml)中に注ぎ、酢酸エチル(2×200ml)で抽出した。合した有機物をブライン(2×200ml)で洗浄し、乾燥し、蒸発させた。酢酸エチル−ヘキサン混合物で溶出するシリカゲルのクロマトグラフィーに付して、固体として標題生成物(4.5g、63%)を得た。
質量スペクトル(API+):C18H27NO3として、計算値305、実測値206(MH+−tBoc)。
【0088】
記載9:2−(ベンジルオキシメチル)−ピペリジン
乾燥MDC(40ml)中の2−(ベンジルオキシメチル)−1−(t−ブチルオキシカルボニル)−ピペリジン(4.5g、14.8mmol)およびトリフルオロ酢酸(10ml)の混合物を、30℃で1時間撹拌し、冷却し、蒸発させた。残渣をMDCおよび1MのNaOH間で分配し、水相をMDCで抽出し、合した抽出物を乾燥し、蒸発させて、淡緑色油として標題生成物(2.9g、96%)を得た。
1H NMR δ: 1.00 - 1.80 (7H, m), 2.50 - 2.70 (1H, m), 2.70 - 2.85 (1H, m), 3.00 - 3.10 (1H, m), 3.27 - 3.36 (1H, m), 3.42 - 3.47 (1H, m), 4.51 (2H, s), 7.30 - 7.38 (5H, m)。
【0089】
記載10(a):2−(1−(2−(ベンジルオキシ)エチル))−1−(t−ブチルオキシカルボニル)−ピペリジン
1−t−ブチルオキシカルボニル−2−ピペリジンエタノール(0.3g、1.32mmol)および臭化ベンジル(0.17ml、1.3mmol)から、記載8の方法に従って、標題化合物(0.318g、76%)を得た。
質量スペクトル(API+):C19H29NO3として、計算値319、実測値220(MH+−tBoc)。
【0090】
以下の化合物を記載10(a)と同様の方法で調製した:
10(b):2−(1−(2−(4−フルオロベンジルオキシ)エチル))−1−(t−ブチルオキシカルボニル)−ピペリジン
質量スペクトル(API+):C19H28FNO3として、計算値337、実測値238(MH+−tBoc)。
【0091】
記載11(a):2−(1−(2−(ベンジルオキシ)エチル))ピペリジン
2−(1−(2−(ベンジルオキシ)エチル))−1−(t−ブチルオキシカルボニル)−ピペリジン(0.32g、1.0mmol)から、記載9の方法に従って、標題化合物(0.22g、99%)を得た。
質量スペクトル(API+):C14H21NOとして、計算値219、実測値220(MH+)。
【0092】
以下の化合物を記載11(a)と同様の方法で調製した:
11(b):2−(1−(2−(4−フルオロベンジルオキシ)エチル))ピペリジン
質量スペクトル(API+):C14H20FNOとして、計算値237、実測値238(MH+)。
【0093】
記載12:2−(3−ヒドロキシプロパン−1−イル)ピペリジン
エタノール(200ml)中の2−ピリジンプロパノール(15g、0.11mol)を、酸化プラチナ触媒(1.0g)で、水素雰囲気下50℃で、24時間水素化した。反応混合物をキーゼルゲル(kieselguhr)を通して濾過し、濾液を蒸発させて、油として標題生成物(16.7g、100%)を得た。
質量スペクトル(API+):C8H17NOとして、計算値143、実測値144。
【0094】
記載13:1−(t−ブチルオキシカルボニル)−2−(3−ヒドロキシプロパン−1−イル)ピペリジン
MDC(100ml)中の2−(3−ヒドロキシプロパン−1−イル)ピペリジン(16.7g、0.117mol)に、カルボン酸ジ−tert−ブチル(25.5g、0.117mol)、ついで、トリエチルアミン(18ml、0.13mol)を0℃で加えた。反応混合物を外界温度になるまで静置し、16時間撹拌した。得られた混合物をシリカゲルに注ぎ、MDCで溶出して、標題生成物(8g、29%)を得た。
質量スペクトル(API+):C13H25NO3として、計算値243、実測値244(MH+)。
【0095】
記載14:1−(t−ブチルオキシカルボニル)−2−(3−フェノキシ)プロピル)ピペリジン
1−(t−ブチルオキシカルボニル)−2−(3−ヒドロキシプロパン−1−イル)ピペリジン(5.15g、21.2mmol)およびフェノール(2.0g、21.2mmol)から、記載1の方法に従って、標題生成物(3.45g、51%)を得た。
質量スペクトル(API+):C19H29NO3として、計算値319、実測値220(MH+−tBoc)。
【0096】
記載15:2−(1−(3−フェノキシ)プロピル)ピペリジン
1−(t−ブチルオキシカルボニル)−2−(1−(3−フェノキシ)プロピル)ピペリジン(3.42g、10.7mmol)から、記載2(a)の方法に従って、標題化合物(1.74g、74%)を調製した。
質量スペクトル(API+):C14H21NOとして、計算値219、実測値220(MH+)。
【0097】
記載16:2−(2−ブロモエチル)−ピペリジン−1−カルボン酸tert−ブチルエステル
無水テトラヒドロフラン(100ml)中の1−tert−ブチルオキシカルボニル−2−ピペリジンエタノール(6g、0.026mol)およびトリフェニルホスフィン(11g、0.042mol)の混合物に、N−ブロモスクシニミド(7.5g、0.042mol)を0℃で滴下した。反応混合物を外界温度になるまで静置し、64時間撹拌し、ついで、低容量になるまで蒸発させ、シリカゲル上に注ぎ、30%のエーテル−石油エーテル(40〜60℃)で溶出して、油として標題生成物(7.8g、99%)を得た。
1H NMR δ: 1.3 - 1.8 (6H, m), 1.47 (9H, s), 1.90 - 1.94 (1H, m), 2.31 - 2.35 (1H, m), 2.70 - 2.80 (1H, m), 3.31 - 3.38 (2H m), 3.95 - 4.05 (1H, m), 4.38 - 4.40 (1H, m)。
【0098】
記載17:2−[2−(ピリジン−2−イルスルファニル)−エチル]−ピペリジン−1−カルボン酸tert−ブチルエステル
ジメチルホルムアミド(17ml)中の2−(2−ブロモエチル)−ピペリジン−1−カルボン酸tert−ブチルエステル(1.7g、5.8mmol)、2−メルカプトピリジン(0.71g、6.4mmol)、水酸化リチウム(0.15g、6.4mmol)およびヨウ化ナトリウム(1.92g、12.8mmol)の撹拌溶液を、外界温度で、18時間撹拌した。反応混合物を酢酸エチルで希釈し、水(×3)、ブラインで洗浄し、乾燥し、蒸発させた。酢酸エチル−ヘキサン混合物で溶出するシリカゲルのクロマトグラフィーに付して、標題生成物(0.45g、27%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C17H26N2O2Sとして、計算値322、実測値345(MNa+)。
【0099】
記載18:2−(2−ピペリジン−2−イル−エチルスルファニル)−ピリジン
2−[2−(ピリジン−2−イルスルファニル)−エチル]−ピペリジン−1−カルボン酸tert−ブチルエステル(0.44g、1.4mmol)から、記載9の方法に従って、標題化合物(0.35g、99%)を得た。
1H NMR δ: 1.05 - 1.20 (1H, m), 1.25 - 1.50 (2H, m), 1.50 - 1.60 (1H, m), 1.65 - 1.80 (5H, m), 2.40 - 2.60 (2H, m), 3.00 - 3.10 (1H, m), 3.15 - 3.25 (2H, m), 6.94 - 6.97 (1H, m), 7.14 - 7.18 (1H, m), 7.44 - 7.48 (1H, m), 8.40 - 8.41 (1H, m)。
【0100】
記載19:1−ビフェニル−2−イル−1−[2−(3−ヒドロキシ−プロピル)−ピペリジン−1−イル]−メタノン
MDC(100ml)中の記載12のアミンHBr塩(2.0g、8.9mmol)、ビフェニル−2−カルボニルクロライド(2.17g、10mmol)およびトリエチルアミン(2.02g、20mmol)の混合物を、外界温度で20時間撹拌し、飽和炭酸水素ナトリウム(200ml)で洗浄し、有機物を乾燥(Na2SO4)し、減圧下で蒸発させた。残渣を、ヘキサン中の10〜100%の酢酸エチルの勾配を用いるシリカゲルのクロマトグラフィーに付して、油として標題化合物油としてを得た。
質量スペクトルAPI+:C21H25NO2として、計算値323、実測値324(MH+)。
【0101】
記載20:3[1−(1−ビフェニル−2−イル−メタノイル)−ピペリジン−2−イル]−プロピオンアルデヒド
MDC(40ml)中の塩化オキサリル(1.4g、11mmol)の溶液に、アルゴン雰囲気下、−70℃で0.2時間にわたって、MDC(10ml)中のジメチルスルホキシド(1.9g、24mmol)の溶液を滴下した。混合物を−70℃で1時間撹拌し、ついで、MDC(10ml)中の記載D19のアルコール(3.28g、10mmol)の溶液を0.1時間にわたって滴下した。混合物を−70℃で1時間にわたって滴下し、ついで、トリエチルアミン(7.5ml、53.8mmol)を0.1時間にわたって滴下した。得られた混合物を外界温度に温まるまで静置し、1時間撹拌し、ついで、減圧下で蒸発させた。残渣を1:1のエーテル−ヘキサン(300ml)および水(100ml)間で分配し、有機層を水(4×100ml)で洗浄し、乾燥(Na2SO4)し、減圧下で蒸発させた。残渣をヘキサン中の10〜100%のジエチルエーテル勾配で溶出するシリカゲルのクロマトグラフィーに付して、無色の油として標題化合物(1.74g)を得た。
質量スペクトル(API+):C21H23NO2として、計算値321、実測値322(MH+)。
【0102】
記載21:1−ビフェニル−2−イル−1−[2−(3−ヒドロキシ−3−フェニル−プロピル)−ピペリジン−1−イル]−メタノン
シクロヘキサン/エーテル(1.2ml、2.16mmol)中の1.8Mのフェニルリチウムを、アルゴン雰囲気下、−70℃で、0.25時間にわたって、無水エーテル(25ml)中の3−[1−(1−ビフェニル−2−イル−メタノイル)−ピペリジン−2−イル]−プロピオンアルデヒド(D20)(0.6g、1.87mmol)の撹拌溶液に滴下した。−70℃で1時間、外界温度で3時間撹拌した後、水(70ml)を加え、混合物を酢酸エチル(2×50ml)で抽出した。合した有機物を乾燥(Na2SO4)し、減圧下で蒸発させて、黄色ガムとして標題化合物(0.7g、94%)を得た。
質量スペクトル(API+):C27H29NO2として、計算値399、実測値400(MH+)。
【0103】
記載22:(S)−2−(5−ブロモ−ピリミジン−2−イルオキシメチル)−ピロリジン−1−カルボン酸tert−ブチルエステル
2−クロロ−5−ブロモピリミジン(1.48g、7.6mmol)、(S)−1−(tert−ブトキシカルボニル)−2−ピロリジンメタノール(2.0g、9.9mmol)、ジベンゾ−18−クラウン−6(0.3g、0.83mmol)、ジイソプロピルアミン(3ml、17mmol)および水酸化カリウム(0.73g、13mmol)の混合物を、キシレン(40ml)で、130℃に3日間加熱した。ついで、反応混合物を蒸発させ、MDCおよび水間で分配した。有機層を分離し、ブラインで洗浄し、乾燥(Na2SO4)し、蒸発させた。残渣を酢酸エチル−ペンタン混合物で溶出するシリカゲルのクロマトグラフィーに付して標題生成物(0.573g;21%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C14H20 79BrN3O3として、計算値357、実測値380(MNa+)。
【0104】
記載23:5−ブロモ−2−((S)−1−ピロリジン−2−イルメトキシ)−ピリミジン塩酸塩
ジオキサン(4ml)中の4NのHClを含有する、メタノール(12ml)中の(S)−2−(5−ブロモ−ピリミジン−2−イルオキシメチル)−ピロリジン−1−カルボン酸tert−ブチルエステル(0.57g、1.6mmol)の溶液を、外界温度で18時間撹拌し、蒸発させて、減圧下で乾燥して、淡黄色固体として標題生成物(0.395g、96%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C9H12 79BrN3Oとして、計算値257、実測値258(MH+)。
【0105】
実施例1
ジクロロメタン(8ml)中の2−(1−(2−フェノキシ)エチル)ピペリジン(0.10g、0.49mmol)、トリエチルアミン(0.07ml、0.05g、0.50mmol)および2−ビフェニルカルボニルクロライド(0.10g、0.46mmol)の混合物を、20℃で1時間振盪し、ついで、飽和NaHCO3を加え、0.1時間振盪し続けた。有機層を分離し、ついで、直接プレパックされたシリカカートリッジに用いた。30〜100%の酢酸エチル−ヘキサンで溶出して、無色の油として2−(1−(2−フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン(0.137g、77%)を得た。
【0106】
以下の実施例の化合物を、適当なアミンおよび酸クロライドから、実施例1の説明と類似の方法を用いて調製した。
【表1】
【0107】
【表2】
【0108】
【表3】
【0109】
【表4】
【0110】
【表5】
【0111】
実施例32:1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−2−(1−(2−フェノキシ)エチル)−ピロリジン
ジクロロメタン(4ml)中の2−(1−(2−フェノキシ)エチル)ピロリジン(0.029g、0.15mmol)、トリエチルアミン(0.046g、0.45mmol)および4−(2−メチル−5−フェニル)チアゾリル)カルボニルクロライド(0.043g、0.18mmol)の混合物を、20℃で1時間振盪し、ついで、飽和NaHCO3水溶液を加え、0.1時間振盪し続けた。有機層を分離し、ついで、直接プレパックしたシリカカートリッジに適用した。10〜100%の酢酸エチル−ヘキサンで溶出して、黄褐色油として標題化合物(0.034g、58%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C23H24N2O2Sとして、計算値392、実測値393(MH+)。
1H NMR δ: 1.5-2.1 (6H, m), 2.46および2.72 (3H, 2 x s), 2.50および3.02 (1H, 2 x m), 3.21および3.62 (1H, 2 x m), 3.70および4.06 (2H, 2 x t, J = 5Hz), 3.90および4.40 (1H, 2 x m), 6.70-7.00 (3H, m), 7.2-7.6 (7H, m)。
【0112】
実施例33:1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−2−(1−(2−フェノキシ)エチル)−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン
ジクロロメタン(4ml)中の2−(1−(2−フェノキシ)エチル)−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン(0.033g、0.15mmol)、トリエチルアミン(0.046g、0.45mmol)および4−(2−メチル−5−フェニル)チアゾリル)カルボニルクロライド(0.043g、0.18mmol)の混合物を、20℃で1時間振盪し、ついで、飽和NaHCO3を加え、0.1時間振盪し続けた。有機層を分離し、ついで、直接プレパックされたシリカカートリッジに適用した。10〜100%の酢酸エチル−ヘキサンで溶出して、黄褐色油として標題化合物(0.055g、87%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C25H28N2O2Sとして、計算値420、実測値421(MH+)。
1H NMR δ: 1.10-2.20 (10H, m), 2.46および2.72 (3H, 2 x s), 2.65および2.90 (1H, 2 x m), 3.37および4.31 (1H, 2 x m), 3.6 - 3.9 (2H, m), 3.96および4.76 (1H, m), 6.70-7.00 (3H, m), 7.20-7.40 (5H, m), 7.50-7.60 (2H, m)。
【0113】
実施例34:4−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−3−(1−(2−フェノキシ)エチル)−モルホリン
ジクロロメタン(5ml)中の3−(1−(2−フェノキシ)エチル)モルホリン(0.027g、0.13mmol)、トリエチルアミン(0.030g、0.30mmol)および4−(2−メチル−5−フェニル)チアゾリル)カルボニルクロライド(0.033g、0.14mmol)の混合物を20℃で1時間振盪し、ついで、飽和NaHCO3水溶液を加え、0.1時間振盪し続けた。有機層を分離し、ついで、直接プレパックされたシリカカートリッジに適用した。10〜100%の酢酸エチル−ヘキサンで、ついで、2%のメタノール−酢酸エチルで溶出して、油として標題化合物(0.048g、95%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C23H24N2O3Sとして、計算値408、実測値409(MH+)。
【0114】
実施例35:3−(1−(2−(4−フルオロフェノキシ))エチル)−4−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)モルホリン
ジクロロメタン(5ml)中の3−(1−(2−(4−フルオロフェノキシ))エチル)モルホリン(0.027g、0.12mmol)、トリエチルアミン(0.030g、0.30mmol)および4−(2−メチル−5−フェニル)チアゾリル)カルボニルクロライド(0.029g、0.12mmol)の混合物を20℃で1時間振盪し、ついで、飽和NaHCO3水溶液を加え、0.1時間撹拌し続けた。有機層を分離し、ついで、直接プレパックされたシリカカートリッジに適用した。10〜100%の酢酸エチル−ヘキサンで、ついで、2%のメタノール−酢酸エチルで溶出して、油として標題化合物(0.039g、79%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C23H23FN2O3Sとして、計算値426、実測値427(MH+)。
【0115】
表2中の化合物を、適当なアミンおよび酸クロライドを用いて、実施例31〜35に記載の方法と類似の方法を用いて調製した。
【表6】
【0116】
【表7】
【0117】
実施例47:(R,S)−1−ベンゾフラン−2−イル−2−(1−{1−[5−(4−フルオロ−フェニル)−2−メチル−チアゾール−4−イル]−メタノイル}−ピペリジン−2−イル)−エタノン
5−(4−フルオロ−フェニル)−2−メチル−チアゾール−4−カルボン酸(0.079g、0.33mmol)および(R,S)−1−ベンゾフラン−2−イル−2−ピペリジン−2−イル−エタノン(0.081g、0.33mmol)から、記載5の方法と類似の方法に従って標題化合物(0.120g、79%)を調製した。
質量スペクトル(API+):C26H23FN2O3Sとして、計算値462、実測値463(MH+)。
【0118】
同様の方法により、実施例48〜51の化合物を調製した。
【表8】
【0119】
実施例52:1−(2−ベンジルオキシメチル−ピペリジン−1−イル)−1−(2−メチル−5−フェニル−チアゾール−4−イル)−メタノン
2−(ベンジルオキシメチル)−ピペリジン(0.020g、0.1mmol)および4−(2−メチル−5−フェニル)チアゾリル)カルボニルクロライド(0.026g、0.12mol)から、実施例32に記載のように標題化合物(0.005g、13%)を調製した。
質量スペクトル(エレクトロスプレーLC/MS):C24H26N2O2Sとして、計算値406、実測値407(MH+)。
【0120】
実施例53:1−[2−(2−ベンジルオキシ−エチル)−ピペリジン−1−イル]−1−(2−ピリジン−2−イル−フェニル)−メタノン
2−(1−(2−ベンジルオキシ)エチル))ピペリジン(0.025g、0.11mmol)および2−(ピリジン−2−イル)塩化ベンゾイル塩酸塩(0.030g、0.12mmol)から、実施例32に記載のように標題化合物(0.030g、67%)を調製した。
質量スペクトル(エレクトロスプレーLC/MS):C26H28N2O2として、計算値400、実測値401(MH+)。
【0121】
以下の実施例の化合物を、適当なアミンおよび酸を用いて上記した方法と類似の方法を用いて調製した。
【表9】
【0122】
実施例57:1−(2−メチル−5−フェニル−チアゾール−4−イル)−1−[2−(3−フェノキシ−プロピル)−ピペリジン−1−イル]−メタノン
2−(1−(3−フェノキシ)プロピル)ピペリジン(0.011g、0.05mmol)および4−(2−メチル−5−フェニル)チアゾリル)カルボニルクロライド(0.013g、0.06mmol)から、実施例35の方法に従って標題化合物(0.021g、98%)を得た。
C25H28N2O2Sとして、計算値420、質量スペクトル(API+):実測値421(MH+)。
【0123】
実施例58:1−[5−(4−フルオロ−フェニル)−2−メチル−チアゾール−4−イル]−1−{2−[2−(ピリジン−2−イルスルファニル)−エチル]−ピペリジン−1−イル}−メタノン
2−(2−ピペリジン−2−イル−エチルスルファニル)−ピリジン(0.116g、0.5mmol)および5−(4−フルオロフェニル)−2−メチルチアゾール−4−カルボニルクロライド(0.146g、0.57mmol)から、実施例32の方法に従って標題化合物(0.091g、40%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C23H24FN3OS2として、計算値441、実測値442(MH+)。
【0124】
実施例59:3−[1−(1−ビフェニル−2−イル−メタノイル)−ピペリジン−2−イル]−1−フェニル−プロパン−1−オン
デス−マーチンペルヨウダイド(0.85g、2mmol)を、MDC(20ml)中の記載D21のアルコール(0.7g、1.75mmol)の撹拌溶液に、0.16時間にわたって滴下した。1.16時間後、MDCを加え、混合物を飽和水素化ナトリウム:10%の硫酸ナトリウム溶液の2:1混合物(2×100ml)で洗浄した。有機物を乾燥(Na2SO4)し、減圧下で蒸発させて、残渣を、ヘキサン中の0〜30%酢酸エチルの勾配で溶出するシリカゲルのクロマトグラフィーに付して、無色のガムとして標題化合物(0.24g、34%)を得た。
質量スペクトルAPI+:C27H27NO2として、計算値397、実測値398(MH+)。
【0125】
実施例60:1−[(S)−2−(5−ブロモ−ピリミジン−2−イルオキシメチル)−ピロリジン−1−イル]−1−[2−(3−メチル−[1,2,4]オキサジアゾール−5−イル)−フェニル]−メタノン
ジメチルホルムアミド(1ml)中の5−ブロモ−2−((S)−1−ピロリジン−2−イルメトキシ)−ピリミジン塩酸塩(0.09g、0.3mmol)の溶液に、HATU(0.116g、0.3mmol)およびジイソプロピルエチルアミン(5ml)を加えた。外界温度で18時間後、反応混合物を蒸発させ、残渣を、酢酸エチル−ペンタン混合物で溶出するシリカゲルのクロマトグラフィーに付して、ガムとして標題化合物(0.065g、48%)を得た。
質量スペクトル(エレクトロスプレーLC/MS):C19H18 79BrN5O3として、計算値443、実測値444(MH+)、466(MNa+)。
【0126】
本発明は、本明細書に上記した特定および好ましい群のすべての組み合わせを範囲に含むことは理解できるだろう。
【0127】
オレキシン−1受容体アンタゴニスト活性の測定
式(I)で示される化合物のオレキシン−1受容体アンタゴニスト活性を、以下の実験方法に従って測定した。
【0128】
実験方法
ヒトオレキシン−1受容体を発現するCHO−DG44細胞を、2mMのL−グルタミン、GIBCO BRLからの0.4mg/mLのG418スルフェートおよびGibco BRLからの10%の熱不活性ウシ胎仔血清を含有する細胞培地(アール塩(Earl's salts)を含むMEM培地)中で増殖させた。SIGMAからの10μg/ウェルのポリ−L−リシンでプレコートされた、Costarからの96ウェルブラッククリアーボトム滅菌プレート中に、20,000細胞/100μl/ウェルで細胞を接種した。接種したプレートを5%のCO2中で、37℃で一晩インキュベートした。
【0129】
アゴニストを水:DMSO(1:1)中の1mMの貯蔵液として調製した。EC50値(最大応答の50%を生じるのに必要な濃度)を、プロベネシドを含有するタイロード緩衝液(Tyrode's buffer)(145mMのNaCl、10mMのグルコース、2.5mMのKCl、1.5mMのCaCl2、1.2mMのMgCl2および2.5mMのプロベネシドを含む10mMのHEPES;pH7.4)中で、11xのハーフログ単位希釈法(half log unit dilutions)(Biomek 2000, Beckman)を用いて評価した。アンタゴニストをDMSO(100%)中の10mMの貯蔵液として調製した。アンタゴニストのIC50値(アゴニスト応答の50%を阻害するのに必要な濃度)を、3.0nMのヒトオレキシン−Aに対して、10%DMSOおよびプロベネシドを含有するタイロード緩衝液中で、11xのハーフログ単位希釈法を用いて測定した。
【0130】
アッセイの日に、各々のウェルにプロベネシド(Sigma)およびFluo3AM(Texas Fluorescence Laboratories)を含有する50μlの細胞培地を加え(Quadra, Tomtec)、それぞれ、2.5mMおよび4μMの最終濃度を得た。96ウェルプレートを5%CO2中37℃で60分間インキュベートした。ついで、色素を含有するローディング溶液を吸引し、細胞をプロベネシドおよび0.1%のゼラチンを含有する150μlのタイロード緩衝液(4回)(Denley Cell Wash)で洗浄した。各々のウェルに残った緩衝液の容量は125μlであった。アンタゴニストまたは緩衝液(25μl)を加え(Quadra)、細胞プレートを穏やかに振盪し、5%のCO2中37℃で30分間インキュベートした。ついで、細胞プレートを、蛍光造影プレートリーダー(Fruorescent Imaging Plate Reader)(FLIPR, Molecular Devices)装置に移した。薬剤を添加する前に、細胞プレートの一の画像を取り(シグナル試験)、色素ローディング整合性を評価した。操作手順は、1秒間隔で取られた60個の画像、ついで、5秒間隔で取られたさらに24個の画像を用いた。20秒後(連続読み取りの間)、(FLIPRにより)アゴニストを加えた。各々のウェルから、ピーク蛍光を、アッセイ期間の全体にわたって測定し、1〜19個を含む読み取りの平均をこの図から引いた。蛍光のピーク増加を、化合物濃度に対してプロットし、4個のパラメーターロジスティック適合(parameter logistic fit)(BowenおよびJerman, TiPS, 1995, 16, 413-417により開示されている)を用いて、反復曲線適合し、濃度効果値を得た。アンタゴニストKb値を以下の等式を用いて計算した:
Kb=IC50/(1+([3/EC50])
[式中、EC50は、アッセイにおいて測定されたヒトオレキシン−Aの能力(nMで表す)であり、IC50はモルで表す]
【0131】
この方法に従って試験した実施例の化合物は、ヒトクローンオレキシン−1受容体で、7.0〜9.7の範囲のpKb値を有していた。
【0132】
式(I)で示される化合物のオレキシン−2受容体アンタゴニスト活性を、以下の実験方法に従って測定した。
【0133】
実験方法
ヒトオレキシン−2受容体を発現するCHO−DG44細胞を、2mMのL−グルタミン、GIBCO BRLからの0.4mg/mLのG418スルフェートおよびGibco BRLからの10%の熱不活性ウシ胎仔血清を含有する細胞培地(アール塩を含むMEM培地)中で増殖させた。SIGMAからの10μg/ウェルのポリ−L−リシンでプレコートされた、Costarからの96ウェルブラッククリアーボトム滅菌プレート中に、20,000細胞/100μl/ウェルで細胞を接種した。接種したプレートを5%のCO2中で、37℃で一晩インキュベートした。
【0134】
アゴニストを水:DMSO(1:1)中の1mMの貯蔵液として調製した。EC50値(最大応答の50%を生じるのに必要な濃度)を、プロベネシドを含有するタイロード緩衝液(145mMのNaCl、10mMのグルコース、2.5mMのKCl、1.5mMのCaCl2、1.2mMのMgCl2および2.5mMのプロベネシドを含む10mMのHEPES;pH7.4)中で、11xのハーフログ単位希釈法(Biomek 2000, Beckman)を用いて評価した。アンタゴニストをDMSO(100%)中の10mMの貯蔵液として調製した。アンタゴニストのIC50値(アゴニスト応答の50%を阻害するのに必要な濃度)を、10.0nMのヒトオレキシン−Aに対して、10%DMSOおよびプロベネシドを含有するタイロード緩衝液中で、11xのハーフログ単位希釈法を用いて測定した。
【0135】
アッセイの日に、各々のウェルにプロベネシド(Sigma)およびFluo3AM(Texas Fluorescence Laboratories)を含有する50μlの細胞培地を加え(Quadra, Tomtec)、それぞれ、2.5mMおよび4μMの最終濃度を得た。96ウェルプレートを5%CO2中37℃で60分間インキュベートした。ついで、色素を含有するローディング溶液を吸引し、細胞をプロベネシドおよび0.1%のゼラチンを含有する150μlのタイロード緩衝液(4回)(Denley Cell Wash)で洗浄した。各々のウェルに残った緩衝液の容量は125μlであった。アンタゴニストまたは緩衝液(25μl)を加え(Quadra)、細胞プレートを穏やかに振盪し、5%のCO2中37℃で30分間インキュベートした。ついで、細胞プレートを、蛍光造影プレートリーダー(Fruorescent Imaging Plate Reader)(FLIPR, Molecular Devices)装置に移した。薬剤を添加する前に、細胞プレートの一の画像を取り(シグナル試験)、色素ローディング整合性を評価した。操作手順は、1秒間隔で取られた60個の画像、ついで、5秒間隔で取られたさらに24個の画像を用いた。20秒後(連続読み取りの間)、(FLIPRにより)アゴニストを加えた。各々のウェルから、ピーク蛍光を、アッセイ期間の全体にわたって測定し、1〜19個を含む読み取りの平均をこの図から引いた。蛍光のピーク増加を、化合物濃度に対してプロットし、4個のパラメーターロジスティック適合(parameter logistic fit)(BowenおよびJerman, TiPS, 1995, 16, 413-417により開示されている)を用いて、反復曲線適合し、濃度効果値を得た。アンタゴニストKb値を以下の等式を用いて計算した:
Kb=IC50/(1+([3/EC50])
[式中、EC50は、アッセイにおいて測定されたヒトオレキシン−Aの能力(nMで表す)であり、IC50はモルで表す]
【0136】
記載および特許請求の範囲が一部を形成する出願は、いずれの後願に対しても優先権の基礎として用いることができる。かかる後願の特許請求の範囲は、本明細書に記載の特徴または特徴の組み合わせを指示することができる。これらは生成物、組成物、方法または使用の特許請求の範囲の形態であり得、本願の特許請求の範囲に限定されることなく、一例として含まれうる。
Claims (10)
- 式(I):
Yは、結合、酸素、(CH2)n基であり、ここに、nは1、2または3であり;
mは、1、2または3であり;
pは0または1であり;
Xは、O、S、C=O、SO2または−CH=CH−であり;
Ar1は、アリールまたはN、OおよびSから選択される4つまでのヘテロ原子を含有するモノもしくはビサイクリックヘテロアリール基であり;それらはいずれも置換されていてもよく;
Ar2は、フェニルまたはN、OおよびSから選択される3つまでのヘテロ原子を含有する5もしくは6員のヘテロサイクリル基であり、ここに、フェニルまたはヘテロサイクリル基は、R1およびさらなる別の置換基により置換されており;またはAr2は、置換されていてもよいビサイクリック芳香族またはN、OおよびSから選択される3つまでのヘテロ原子を含有するビサイクリックヘテロ芳香族基であり;
R1は、水素、置換されていてもよい(C1−4)アルコキシ、ハロ、シアノ、置換されていてもよい(C1−6)アルキル、置換されていてもよいフェニルまたはN、OおよびSから選択される4つまでのヘテロ原子を含有する置換されていてもよい5もしくは6員のヘテロサイクリック環である]
で示される化合物またはその医薬上許容される塩。 - Yが結合、酸素またはnが1または2である(CH2)nである請求項1記載の化合物。
- Ar2が、置換されていてもよいフェニル、ピリジル、チアゾリル、ピラゾリル、ナフチル、1、2、3−トリアゾリル、チエニルまたはベンゾキサゾリルである請求項1または2記載の化合物。
- R1がトリフルオロメトキシ基、メトキシ基、エトキシ基、アセトアミド、ハロまたは置換されていてもよいフェニル、ピリジル、ピラゾリル、ピリミジニル、ピラゾリルもしくはオキサジアゾリル基である請求項1〜3いずれか1項記載の化合物。
- Ar1が置換されていてもよいフェニル、ナフチル、ピリジニルまたはベンゾフラニルである請求項1〜4いずれか1項記載の化合物。
- Ar2がハロゲン、シアノ、(C1−4)アルキル、ヒドロキシ(C1−4)アルキル、R3R4(CH2)n、R3R4N、(C1−4)アルカノイルまたはR3R4N(CH2)nOにより置換されていてもよい請求項1〜5いずれか1項記載の化合物。
- 2−(1−(2−フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(4−クロロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−トリフルオロメトキシ)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(4−フルオロ)フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(2−シアノ)フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(3−シアノ)フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(3−(2−フェニル)ピリジル)カルボニルピペリジン;
2−(1−(2−(2−シアノ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(3−クロロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(3,4−ジクロロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−(1−ピラゾリル))ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−(4−フルオロ)フェノキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(3−ピリジル)オキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−(2−ピリジル)オキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(2−(2−ピリジル))ベンゾイルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(2−トリフルオロメトキシ)ベンゾイルピペリジン;
2−(1−(2−(1−ナフチル)オキシ)エチル)−1−(1−ナフトイル)ピペリジン;
2−(1−(2−(3−シアノ)フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピペリジン;
2−(1−(2−(3−シアノ)フェノキシ)エチル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
E:Z−2−(1−(2−(3−フェニル)プロペニル)−1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニルピペリジン;
1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−2−(1−(2−フェノキシ)エチル)−ピロリジン;
1−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−2−(1−(2−フェノキシ)エチル)−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
4−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)−3−(1−(2−フェノキシ)エチル)−モルホリン;
3−(1−(2−(4−フルオロフェノキシ))エチル)−4−(4−(2−メチル−5−フェニル)チアゾリル)カルボニル)モルホリン;
2−(1−(2−フェノキシ)エチル)−1−(2−フェニル)ベンゾイルピロリジン;
2−(1−(2−フェノキシ)エチル)−1−(2−フェニル)ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
2−(1−(2−フェノキシ)エチル)−1−(2−(2−ピリジル))ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
2−(1−(2−フェノキシ)エチル)−1−(2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
2−(1−(2−フェノキシ)エチル)−1−(2−トリフルオロメトキシ)ベンゾイル−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
2−(1−(2−フェノキシ)エチル)−1−(1−ナフトイル)−1H−2,3,4,5,6,7−ヘキサヒドロアゼピン;
3−(1−(2−フェノキシ)エチル)−4−(2−フェニル)ベンゾイルモルホリン;
2−(1−(2−フェノキシ)エチル)−1−(5−フルオロ−2−(5−(3−メチル)−1,2,4−オキサジアゾリル))ベンゾイルピペリジン;
1−(5−(3−メチル−1−フェニル)−1H−ピラゾリル)カルボニル−2−(1−(2−フェノキシ)エチル)ピペリジン;
1−(4−(2−メチル−5−フェニル)−2H−1,2,3−トリアゾリル)カルボニル−2−(1−(2−フェノキシ)エチル)ピペリジン;
1−(2−ヨウド)ベンゾイル−2−(1−(2−フェノキシ)エチル)ピペリジン;
(R,S)−1−ベンゾフラン−2−イル−2−(1−{1−[5−(4−フルオロ−フェニル)−2−メチル−チアゾール−4−イル]−メタノイル}−ピペリジン−2−イル)−エタノン;
1−ベンゾフラン−2−イル−2−(1−{1−[4−(4−フルオロ−フェニル)−1−H−ピラゾール−3−イル]−メタノイル}ピペリジン−2−イル)−エタノン;
1−ベンゾフラン−2−イル−2−(1−{1−[4−(4−フルオロ−フェニル)−1−メチル−1H−ピラゾール−3−イル]−メタノイル}−ピペリジン−2−イル)−エタノン;
1−ベンゾフラン−2−イル−2−{1−[1−(5−ブロモ−2−メトキシ−フェニル)−メタノイル]ピペリジン−2−イル}エタノン;
N−(3−{1−[2−(2−ベンゾフラン−2−イル−2−オキソ−エチル)−ピペリジン−1−イル]−メタノイル}−フェニル)−アセトアミド;
1−(2−ベンジルオキシメチル−ピペリジン−1−イル)−1−(2−メチル−5−フェニル−チアゾール−4−イル)−メタノン;
1−[2−(2−ベンジルオキシ−エチル)−ピペリジン−1−イル]−1−(2−ピリジン−2−イル−フェニル)−メタノン;
1−[2−(2−ベンジルオキシ−エチル)−ピペリジン−1−イル]−1−ビフェニル−2−イル−メタノン;
1−{2−[2−(4−フルオロ−ベンジルオキシ)−エチル]−ピペリジン−1−イル}−1−(2−メチル−5−フェニル−チアゾール−4−イル)−メタノン;
1−ビフェニル−2−イル−1−{2−[2−(4−フルオロ−ベンジルオキシ)−エチル]−ピペリジン−1−イル}メタノン;
1−(2−メチル−5−フェニル−チアゾール−4−イル)−1−[2−(3−フェノキシ−プロピル)−ピペリジン−1−イル]−メタノン;
1−[5−(4−フルオロ−フェニル)−2−メチル−チアゾール−4−イル]−1−{2−[2−(ピリジン−2−イルスルファニル)−エチル]−ピペリジン−1−イル}−メタノン;
3−[1−(1−ビフェニル−2−イル−メタノイル)−ピペリジン−2−イル]−1−フェニル−プロパン−1−オン;
1−[(S)−2−(5−ブロモ−ピリミジン−2−イルオキシメチル)−ピロリジン−1−イル]−1−[2−(3−メチル−[1,2,4]オキサジアゾール−5−イル)−フェニル]−メタノン;
から選択される化合物またはそのいずれか1つの医薬上許容される塩。 - 実施例1〜60のいずれか1つまたはその医薬上許容される誘導体から選択される化合物。
- 請求項1〜8いずれか1項記載の式(I)で示される化合物またはその医薬上許容される塩および医薬上許容される担体を含んでなる医薬組成物。
- ヒトオレキシン受容体のアンタゴニストを必要とする疾患または障害の治療または予防方法であって、該治療または予防方法を必要とする対象に、有効量の請求項1〜8いずれか1項記載の式(I)で示される化合物またはその医薬上許容される塩を投与することを含む方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0111183A GB0111183D0 (en) | 2001-05-05 | 2001-05-05 | Compounds |
| GB0130386A GB0130386D0 (en) | 2001-12-19 | 2001-12-19 | Compounds |
| PCT/EP2002/004874 WO2002089800A2 (en) | 2001-05-05 | 2002-05-03 | N-aroyl cyclic amine derivatives as orexin receptor antagonists |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004534026A true JP2004534026A (ja) | 2004-11-11 |
Family
ID=26246044
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002586935A Pending JP2004534026A (ja) | 2001-05-05 | 2002-05-03 | オレキシン受容体アンタゴニストとしてのn−アロイルサイクリックアミン誘導体 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20040192673A1 (ja) |
| EP (1) | EP1435955A2 (ja) |
| JP (1) | JP2004534026A (ja) |
| AU (1) | AU2002341123A1 (ja) |
| WO (1) | WO2002089800A2 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010511038A (ja) * | 2006-12-01 | 2010-04-08 | アクテリオン ファーマシューティカルズ リミテッド | オレキシン受容体阻害剤としての3−ヘテロアリール(アミノ又はアミド)−1−(ビフェニル又はフェニルチアゾリル)カルボニルピペリジン誘導体 |
| JP2010514751A (ja) * | 2006-12-28 | 2010-05-06 | アクテリオン ファーマシューティカルズ リミテッド | オレキシン受容体拮抗薬としての2−アザ−ビシクロ[3.1.0]ヘキサン誘導体 |
| JP2015506382A (ja) * | 2012-02-07 | 2015-03-02 | エオラス セラピューティクス, インコーポレイテッド | オレキシンレセプターアンタゴニストとしての置換プロリン/ピペリジン |
| WO2015087993A1 (ja) * | 2013-12-13 | 2015-06-18 | 大正製薬株式会社 | オキサゾリジン及びオキサジナン誘導体 |
| WO2015087853A1 (ja) * | 2013-12-13 | 2015-06-18 | 大正製薬株式会社 | オキサジナン化合物の結晶形及びその製造方法 |
Families Citing this family (81)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE383359T1 (de) * | 2001-05-05 | 2008-01-15 | Smithkline Beecham Plc | N-aroyl zyklische amine |
| ES2266549T3 (es) * | 2001-06-28 | 2007-03-01 | Smithkline Beecham Plc | Derivados de n-aroil-amina ciclicos como antagonistas del receptor de orexina. |
| GB0115862D0 (en) * | 2001-06-28 | 2001-08-22 | Smithkline Beecham Plc | Compounds |
| GB0124463D0 (en) * | 2001-10-11 | 2001-12-05 | Smithkline Beecham Plc | Compounds |
| GB0127145D0 (en) * | 2001-11-10 | 2002-01-02 | Smithkline Beecham | Compounds |
| GB0130335D0 (en) * | 2001-12-19 | 2002-02-06 | Smithkline Beecham Plc | Compounds |
| US7482366B2 (en) | 2001-12-21 | 2009-01-27 | X-Ceptor Therapeutics, Inc. | Modulators of LXR |
| CA2469435A1 (en) | 2001-12-21 | 2003-07-24 | X-Ceptor Therapeutics, Inc. | Modulators of lxr |
| RU2334735C2 (ru) | 2002-10-11 | 2008-09-27 | Актелион Фармасьютиклз Лтд. | Производные сульфониламиноуксусной кислоты и их применение в качестве антагонистов рецепторов орексина |
| GB0225944D0 (en) * | 2002-11-06 | 2002-12-11 | Glaxo Group Ltd | Novel compounds |
| US7772188B2 (en) | 2003-01-28 | 2010-08-10 | Ironwood Pharmaceuticals, Inc. | Methods and compositions for the treatment of gastrointestinal disorders |
| WO2004096780A1 (en) | 2003-04-28 | 2004-11-11 | Actelion Pharmaceuticals Ltd | Quinoxalinone-3- one derivatives as orexin receptor antagonists |
| HRP20150371T1 (hr) | 2004-03-01 | 2015-05-08 | Actelion Pharmaceuticals Ltd. | Supstituirani derivati 1,2,3,4-tetrahidroizokinolina |
| EP1734963A4 (en) | 2004-04-02 | 2008-06-18 | Merck & Co Inc | METHOD FOR TREATING PEOPLE WITH METABOLIC AND ANTHROPOMETRIC DISORDER |
| US7501395B2 (en) | 2005-04-25 | 2009-03-10 | Eisai R & D Management Co., Ltd. | Method of screening for antianxiety drugs |
| JP2009531447A (ja) * | 2006-03-29 | 2009-09-03 | メルク エンド カムパニー インコーポレーテッド | ジアゼパンオレキシン受容体アンタゴニスト |
| WO2007126934A2 (en) * | 2006-03-29 | 2007-11-08 | Merck & Co., Inc. | Amidoethylthioether orexin receptor antagonists |
| CA2657623A1 (en) | 2006-07-14 | 2008-01-17 | Merck & Co., Inc. | Bridged diazepan orexin receptor antagonists |
| WO2008038251A2 (en) * | 2006-09-29 | 2008-04-03 | Actelion Pharmaceuticals Ltd | 3-aza-bicyclo[3.1.0]hexane derivatives |
| PE20081229A1 (es) | 2006-12-01 | 2008-08-28 | Merck & Co Inc | Antagonistas de receptor de orexina de diazepam sustituido |
| CL2008000836A1 (es) * | 2007-03-26 | 2008-11-07 | Actelion Pharmaceuticals Ltd | Compuestos derivados de tiazolidina, antagonistas del receptor de orexina; composicion farmaceutica que los comprende; y su uso en el tratamiento de neurosis emocional, depresion grave, trastornos psicoticos, alzheimer, parkinson, dolor, entre otras. |
| JP2010527924A (ja) * | 2007-05-18 | 2010-08-19 | メルク・シャープ・エンド・ドーム・コーポレイション | オキソ架橋ジアゼパンオレキシン受容体アンタゴニスト |
| CN101679366B (zh) | 2007-05-23 | 2013-08-07 | 默沙东公司 | 吡啶基哌啶食欲素受体拮抗剂 |
| WO2008150364A1 (en) | 2007-05-23 | 2008-12-11 | Merck & Co., Inc. | Cyclopropyl pyrrolidine orexin receptor antagonists |
| US8969514B2 (en) | 2007-06-04 | 2015-03-03 | Synergy Pharmaceuticals, Inc. | Agonists of guanylate cyclase useful for the treatment of hypercholesterolemia, atherosclerosis, coronary heart disease, gallstone, obesity and other cardiovascular diseases |
| US7879802B2 (en) | 2007-06-04 | 2011-02-01 | Synergy Pharmaceuticals Inc. | Agonists of guanylate cyclase useful for the treatment of gastrointestinal disorders, inflammation, cancer and other disorders |
| NZ583487A (en) | 2007-07-27 | 2011-09-30 | Actelion Pharmaceuticals Ltd | 2-aza-bicyclo[3.3.0]octane derivatives |
| JP2010540429A (ja) * | 2007-09-24 | 2010-12-24 | アクテリオン ファーマシューティカルズ リミテッド | オレキシン受容体拮抗薬としてのピロリジン類及びピペリジン類 |
| WO2009104155A1 (en) | 2008-02-21 | 2009-08-27 | Actelion Pharmaceuticals Ltd | 2-aza-bicyclo[2.2.1]heptane derivatives |
| GB0806536D0 (en) * | 2008-04-10 | 2008-05-14 | Glaxo Group Ltd | Novel compounds |
| WO2009133522A1 (en) * | 2008-04-30 | 2009-11-05 | Actelion Pharmaceuticals Ltd | Piperidine and pyrrolidine compounds |
| AU2009256157B2 (en) | 2008-06-04 | 2014-12-18 | Bausch Health Ireland Limited | Agonists of guanylate cyclase useful for the treatment of gastrointestinal disorders, inflammation, cancer and other disorders |
| JP2011528375A (ja) | 2008-07-16 | 2011-11-17 | シナジー ファーマシューティカルズ インコーポレイテッド | 胃腸障害、炎症、癌、およびその他の障害の治療のために有用なグアニル酸シクラーゼのアゴニスト |
| EP2161266A1 (en) | 2008-08-22 | 2010-03-10 | EVOTEC Neurosciences GmbH | Benzofuran derivatives as orexin receptor antagonists |
| AU2009307913A1 (en) * | 2008-10-21 | 2010-04-29 | Merck Sharp & Dohme Corp. | 2,5-disubstituted piperidine orexin receptor antagonists |
| WO2010048013A1 (en) * | 2008-10-21 | 2010-04-29 | Merck Sharp & Dohme Corp. | 2,5-disubstituted morpholine orexin receptor antagonists |
| CA2739916A1 (en) * | 2008-10-21 | 2010-04-29 | Merck Sharp & Dohme Corp. | 2,5-disubstituted piperidine orexin receptor antagonists |
| EP2348846B1 (en) * | 2008-10-21 | 2013-08-28 | Merck Sharp & Dohme Corp. | Disubstituted azepan orexin receptor antagonists |
| MX2011004258A (es) | 2008-10-22 | 2011-06-01 | Merck Sharp & Dohme | Derivados de bencimidazol ciclicos novedosos utiles como agentes anti-diabeticos. |
| WO2010051206A1 (en) | 2008-10-31 | 2010-05-06 | Merck Sharp & Dohme Corp. | Novel cyclic benzimidazole derivatives useful anti-diabetic agents |
| UY32276A (es) | 2008-12-02 | 2010-05-31 | Glaxo Group Ltd | Derivados de n-{[1s,4s,6s)-3-(2-piridinilcarbonil)-3-azabiciclo[4.1.0]hept-4-il}metil}-2heteroarilamina y uso de los mismos |
| GB0823467D0 (en) | 2008-12-23 | 2009-01-28 | Glaxo Group Ltd | Novel Compounds |
| SG175026A1 (en) | 2009-04-24 | 2011-11-28 | Glaxo Group Ltd | 3 -azabicyclo [4.1.0] heptanes used as orexin antagonists |
| US20120149723A1 (en) | 2009-08-24 | 2012-06-14 | Romano Di Fabio | 5-methyl-piperidine derivatives as orexin receptor antagonists for the treatment of sleep disorder |
| US20120149711A1 (en) | 2009-08-24 | 2012-06-14 | Glaxo Group Limited | Piperidine derivatives used as orexin antagonists |
| DK2513085T3 (en) | 2009-11-18 | 2016-12-05 | Suven Life Sciences Ltd | Alfa4beta2 bicyclic compounds as nicotinic acetylcholine receptor ligands |
| DK2519514T3 (en) | 2009-12-29 | 2015-11-16 | Suven Life Sciences Ltd | Neuronal nicotinic alpha4beta2-acetylcholine receptor ligands |
| WO2011106273A1 (en) | 2010-02-25 | 2011-09-01 | Merck Sharp & Dohme Corp. | Novel cyclic benzimidazole derivatives useful anti-diabetic agents |
| WO2011138265A2 (en) | 2010-05-03 | 2011-11-10 | Evotec Ag | Indole and indazole derivatives as orexin receptor antagonists |
| WO2011138266A1 (en) | 2010-05-03 | 2011-11-10 | Evotec Ag | Indolizine and imidazopyridine derivatives as orexin receptor antagonists |
| US9616097B2 (en) | 2010-09-15 | 2017-04-11 | Synergy Pharmaceuticals, Inc. | Formulations of guanylate cyclase C agonists and methods of use |
| AR083501A1 (es) * | 2010-10-21 | 2013-02-27 | Bayer Cropscience Ag | 1-(heterociclo carbonil)piperidinas |
| WO2012089606A1 (en) | 2010-12-28 | 2012-07-05 | Glaxo Group Limited | Azabicyclo [4.1.0] hept - 4 - yl derivatives as human orexin receptor antagonists |
| WO2012089607A1 (en) | 2010-12-28 | 2012-07-05 | Glaxo Group Limited | Novel compounds with a 3a-azabicyclo [4.1.0] heptane core acting on orexin receptors |
| WO2012116145A1 (en) | 2011-02-25 | 2012-08-30 | Merck Sharp & Dohme Corp. | Novel cyclic azabenzimidazole derivatives useful as anti-diabetic agents |
| AR088352A1 (es) | 2011-10-19 | 2014-05-28 | Merck Sharp & Dohme | Antagonistas del receptor de 2-piridiloxi-4-nitrilo orexina |
| WO2013062857A1 (en) * | 2011-10-25 | 2013-05-02 | Merck Sharp & Dohme Corp. | Piperidinyl alkyne orexin receptor antagonists |
| DK2776430T3 (en) * | 2011-11-08 | 2016-05-09 | Actelion Pharmaceuticals Ltd | 2- (1,2,3-triazol-2-yl) benzamide and 3- (1,2,3-triazol-2-yl) PICOLINAMIDDERIVATER AS orexin receptor antagonists |
| US9440982B2 (en) | 2012-02-07 | 2016-09-13 | Eolas Therapeutics, Inc. | Substituted prolines/piperidines as orexin receptor antagonists |
| TWI510481B (zh) | 2012-06-04 | 2015-12-01 | Actelion Pharmaceuticals Ltd | 苯并咪唑脯胺酸衍生物 |
| WO2014022528A1 (en) | 2012-08-02 | 2014-02-06 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| MX2015004638A (es) | 2012-10-10 | 2015-07-14 | Actelion Pharmaceuticals Ltd | Antagonistas de receptores de orexina los cuales son derivados de [orto bi-(hetero-) aril]-[2-meta bi-(hetero-) aril)-pirrolidin-1-il]-metanona. |
| CA2898482A1 (en) | 2013-02-22 | 2014-08-28 | Linda L. Brockunier | Antidiabetic bicyclic compounds |
| JP2016510810A (ja) | 2013-03-12 | 2016-04-11 | アクテリオン ファーマシューティカルズ リミテッドActelion Pharmaceuticals Ltd | オレキシン受容体アンタゴニストとしてのアゼチジンアミド誘導体 |
| EP2970119B1 (en) | 2013-03-14 | 2021-11-03 | Merck Sharp & Dohme Corp. | Novel indole derivatives useful as anti-diabetic agents |
| AU2014235209B2 (en) | 2013-03-15 | 2018-06-14 | Bausch Health Ireland Limited | Guanylate cyclase receptor agonists combined with other drugs |
| JP2016514671A (ja) | 2013-03-15 | 2016-05-23 | シナジー ファーマシューティカルズ インコーポレイテッド | グアニル酸シクラーゼのアゴニストおよびその使用 |
| AU2014274812B2 (en) | 2013-06-05 | 2018-09-27 | Bausch Health Ireland Limited | Ultra-pure agonists of guanylate cyclase C, method of making and using same |
| WO2015051496A1 (en) | 2013-10-08 | 2015-04-16 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| UA119151C2 (uk) | 2013-12-03 | 2019-05-10 | Ідорсія Фармасьютікалз Лтд | КРИСТАЛІЧНА СОЛЬОВА ФОРМА (S)-(2-(6-ХЛОР-7-МЕТИЛ-1H-БЕНЗО[d]ІМІДАЗОЛ-2-ІЛ)-2-МЕТИЛПІРОЛІДИН-1-ІЛ)(5-МЕТОКСИ-2-(2H-1,2,3-ТРИАЗОЛ-2-ІЛ)ФЕНІЛ)МЕТАНОНУ ЯК АНТАГОНІСТ ОРЕКСИНОВОГО РЕЦЕПТОРА |
| HUE035731T2 (hu) | 2013-12-03 | 2018-05-28 | Idorsia Pharmaceuticals Ltd | (S)-(2-(6-klór-7-metil-1H-benzo[d]imidazol-2-il)-2-metilpirrolidin-1-il)(5-metoxi-2- (2H-l,2,3-triazol-2-il)fenil)metanon kristályos formája és alkalmazása orexin receptor antagonistaként |
| LT3077391T (lt) | 2013-12-04 | 2018-10-25 | Idorsia Pharmaceuticals Ltd | Benzimidazolo prolino darinių panaudojimas |
| AR101558A1 (es) | 2014-08-13 | 2016-12-28 | Eolas Therapeutics Inc | Difluoropirrolidinas como moduladores del receptor de orexina |
| AU2017217931B2 (en) | 2016-02-12 | 2020-10-22 | Astrazeneca Ab | Halo-substituted piperidines as orexin receptor modulators |
| EP3454857A1 (en) | 2016-05-10 | 2019-03-20 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for the treatment of autoimmune inflammatory diseases |
| WO2018106518A1 (en) | 2016-12-06 | 2018-06-14 | Merck Sharp & Dohme Corp. | Antidiabetic heterocyclic compounds |
| WO2018118670A1 (en) | 2016-12-20 | 2018-06-28 | Merck Sharp & Dohme Corp. | Antidiabetic spirochroman compounds |
| CN111315734B (zh) | 2017-09-01 | 2024-03-08 | 克罗诺斯治疗有限公司 | 作为食欲素受体拮抗剂的经取代的2-氮杂双环[3.1.1]庚烷和2-氮杂双环[3.2.1]辛烷衍生物 |
| WO2020007964A1 (en) | 2018-07-05 | 2020-01-09 | Idorsia Pharmaceuticals Ltd | 2-(2-azabicyclo[3.1.0]hexan-1-yl)-1h-benzimidazole derivatives |
| WO2020099511A1 (en) | 2018-11-14 | 2020-05-22 | Idorsia Pharmaceuticals Ltd | Benzimidazole-2-methyl-morpholine derivatives |
| WO2023218023A1 (en) | 2022-05-13 | 2023-11-16 | Idorsia Pharmaceuticals Ltd | Thiazoloaryl-methyl substituted cyclic hydrazine-n-carboxamide derivatives |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2796417A (en) * | 1952-04-03 | 1957-06-18 | American Cyanamid Co | Quinazolone compounds and methods of making the same |
| DE3641343A1 (de) * | 1986-12-03 | 1988-06-16 | Hoechst Ag | Carbamoylimidazol-derivate, verfahren zu ihrer herstellung und ihre verwendung als fungizide |
| AU758567B2 (en) * | 1998-06-08 | 2003-03-27 | Ajinomoto Co., Inc. | Benzamidine derivative |
| CN1245380C (zh) * | 1998-07-24 | 2006-03-15 | 帝人株式会社 | 邻氨基苯甲酸衍生物 |
| US6326379B1 (en) * | 1998-09-16 | 2001-12-04 | Bristol-Myers Squibb Co. | Fused pyridine inhibitors of cGMP phosphodiesterase |
| HUP0201020A3 (en) * | 1999-02-26 | 2003-04-28 | Bristol Myers Squibb Co | Novel sulfonamide compounds and uses thereof |
| US6638980B1 (en) * | 1999-05-24 | 2003-10-28 | Millennium Pharmaceuticals, Inc. | Inhibitors of factor Xa |
| MY125533A (en) * | 1999-12-06 | 2006-08-30 | Bristol Myers Squibb Co | Heterocyclic dihydropyrimidine compounds |
| WO2001044228A2 (fr) * | 1999-12-14 | 2001-06-21 | Sanofi-Synthelabo | Derives de quinazolinedione et phtalimide, leurs preparations et leurs applications en therapeutique |
| ID30204A (id) * | 1999-12-27 | 2001-11-15 | Japan Tobacco Inc | Senyawa-senyawa cincin terfusi dan penggunaannya sebagai obat |
| ATE293101T1 (de) * | 2000-06-16 | 2005-04-15 | Smithkline Beecham Plc | Piperidine zur verwendung als orexin rezeptor antagonisten |
| ATE383359T1 (de) * | 2001-05-05 | 2008-01-15 | Smithkline Beecham Plc | N-aroyl zyklische amine |
| GB0115862D0 (en) * | 2001-06-28 | 2001-08-22 | Smithkline Beecham Plc | Compounds |
| ES2266549T3 (es) * | 2001-06-28 | 2007-03-01 | Smithkline Beecham Plc | Derivados de n-aroil-amina ciclicos como antagonistas del receptor de orexina. |
| JP2006504695A (ja) * | 2002-09-18 | 2006-02-09 | グラクソ グループ リミテッド | オレキシン受容体アンタゴニストとしてのn−アロイル環状アミン |
-
2002
- 2002-05-03 JP JP2002586935A patent/JP2004534026A/ja active Pending
- 2002-05-03 WO PCT/EP2002/004874 patent/WO2002089800A2/en not_active Ceased
- 2002-05-03 EP EP02742938A patent/EP1435955A2/en not_active Withdrawn
- 2002-05-03 AU AU2002341123A patent/AU2002341123A1/en not_active Abandoned
- 2002-05-03 US US10/476,995 patent/US20040192673A1/en not_active Abandoned
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010511038A (ja) * | 2006-12-01 | 2010-04-08 | アクテリオン ファーマシューティカルズ リミテッド | オレキシン受容体阻害剤としての3−ヘテロアリール(アミノ又はアミド)−1−(ビフェニル又はフェニルチアゾリル)カルボニルピペリジン誘導体 |
| JP2010514751A (ja) * | 2006-12-28 | 2010-05-06 | アクテリオン ファーマシューティカルズ リミテッド | オレキシン受容体拮抗薬としての2−アザ−ビシクロ[3.1.0]ヘキサン誘導体 |
| JP2015506382A (ja) * | 2012-02-07 | 2015-03-02 | エオラス セラピューティクス, インコーポレイテッド | オレキシンレセプターアンタゴニストとしての置換プロリン/ピペリジン |
| WO2015087993A1 (ja) * | 2013-12-13 | 2015-06-18 | 大正製薬株式会社 | オキサゾリジン及びオキサジナン誘導体 |
| WO2015087853A1 (ja) * | 2013-12-13 | 2015-06-18 | 大正製薬株式会社 | オキサジナン化合物の結晶形及びその製造方法 |
| JP5907310B2 (ja) * | 2013-12-13 | 2016-04-26 | 大正製薬株式会社 | オキサジナン化合物の結晶形及びその製造方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20040192673A1 (en) | 2004-09-30 |
| AU2002341123A1 (en) | 2002-11-18 |
| WO2002089800A3 (en) | 2004-05-06 |
| WO2002089800A2 (en) | 2002-11-14 |
| EP1435955A2 (en) | 2004-07-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2004534026A (ja) | オレキシン受容体アンタゴニストとしてのn−アロイルサイクリックアミン誘導体 | |
| CA2450922C (en) | Piperidines for use as orexin receptor antagonists | |
| JP4309135B2 (ja) | N−アロイルサイクリックアミン | |
| JP4328615B2 (ja) | 化合物 | |
| US7405217B2 (en) | N-aroyl piperazine derivatives as orexin receptor antagonists | |
| US7365077B2 (en) | Piperazine bis-amide derivatives and their use as antagonists of the orexin receptor | |
| EP1539747B1 (en) | N-aroyl cyclic amines as orexin receptor antagonists | |
| JP4246490B2 (ja) | オレキシン受容体のアンタゴニストとしてのモルホリン誘導体 | |
| JP4399256B2 (ja) | オレキシン受容体アンタゴニストとしてのn−アロイル環状アミン誘導体 | |
| WO2003051873A1 (en) | Piperazine compounds and their phamaceutical use | |
| WO2004041816A1 (en) | Azacyclic compounds as orexin receptor antagonist | |
| WO2004041807A1 (en) | Novel compounds | |
| WO2003051871A1 (en) | N-aroyl cyclic amine derivatives and their use as orxin receptor antagonist |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041221 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20080827 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080902 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081202 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081209 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081225 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090108 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090202 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090209 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090302 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090407 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090707 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090714 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20091020 |