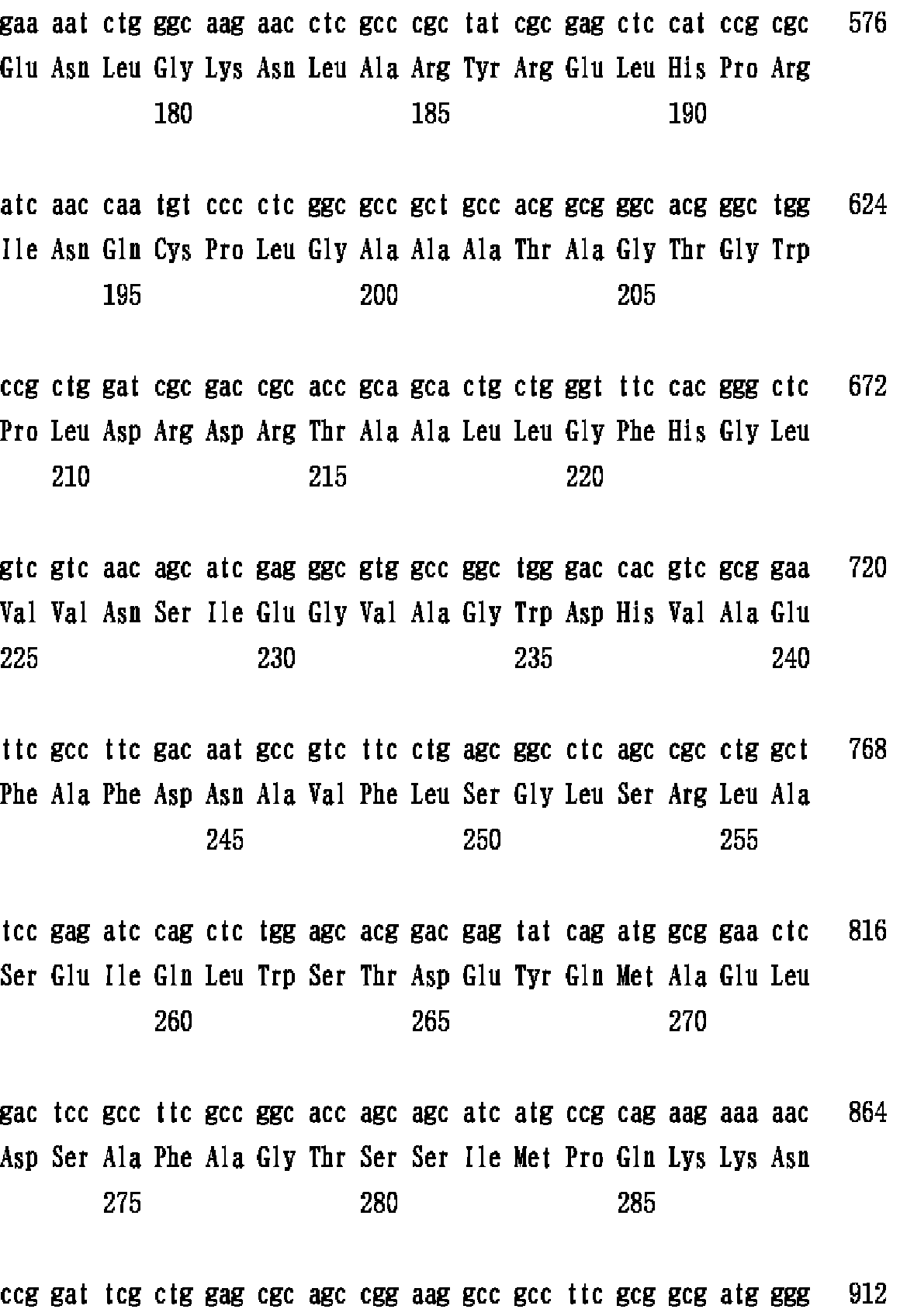JP2004242533A - 改変型エチレンジアミン−n,n’−ジコハク酸:エチレンジアミンリアーゼ - Google Patents
改変型エチレンジアミン−n,n’−ジコハク酸:エチレンジアミンリアーゼ Download PDFInfo
- Publication number
- JP2004242533A JP2004242533A JP2003033932A JP2003033932A JP2004242533A JP 2004242533 A JP2004242533 A JP 2004242533A JP 2003033932 A JP2003033932 A JP 2003033932A JP 2003033932 A JP2003033932 A JP 2003033932A JP 2004242533 A JP2004242533 A JP 2004242533A
- Authority
- JP
- Japan
- Prior art keywords
- base
- ethylenediamine
- seq
- amino acid
- substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 108090000856 Lyases Proteins 0.000 title claims abstract description 118
- VKZRWSNIWNFCIQ-UHFFFAOYSA-N 2-[2-(1,2-dicarboxyethylamino)ethylamino]butanedioic acid Chemical class OC(=O)CC(C(O)=O)NCCNC(C(O)=O)CC(O)=O VKZRWSNIWNFCIQ-UHFFFAOYSA-N 0.000 title claims abstract description 92
- 102000004317 Lyases Human genes 0.000 title claims abstract description 85
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 149
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 89
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 73
- 230000000694 effects Effects 0.000 claims abstract description 65
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 65
- 125000000539 amino acid group Chemical group 0.000 claims abstract description 13
- 108020004414 DNA Proteins 0.000 claims description 189
- 238000000034 method Methods 0.000 claims description 66
- 235000018102 proteins Nutrition 0.000 claims description 62
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 57
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 claims description 52
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical group NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 claims description 36
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical group O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 claims description 36
- 229940113082 thymine Drugs 0.000 claims description 26
- 239000013598 vector Substances 0.000 claims description 24
- 230000002068 genetic effect Effects 0.000 claims description 23
- 239000002253 acid Substances 0.000 claims description 22
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 claims description 22
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 claims description 21
- 235000013922 glutamic acid Nutrition 0.000 claims description 21
- 239000004220 glutamic acid Substances 0.000 claims description 21
- 229940104302 cytosine Drugs 0.000 claims description 18
- 239000002773 nucleotide Substances 0.000 claims description 18
- 125000003729 nucleotide group Chemical group 0.000 claims description 17
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 claims description 16
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 claims description 15
- 108020004511 Recombinant DNA Proteins 0.000 claims description 14
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 claims description 14
- 230000008569 process Effects 0.000 claims description 14
- 238000012258 culturing Methods 0.000 claims description 12
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 claims description 11
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 claims description 11
- 239000004474 valine Substances 0.000 claims description 11
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 11
- 229930024421 Adenine Natural products 0.000 claims description 10
- 229960000643 adenine Drugs 0.000 claims description 10
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 claims description 10
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 claims description 9
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 claims description 9
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 claims description 9
- 239000004473 Threonine Substances 0.000 claims description 9
- 239000001530 fumaric acid Substances 0.000 claims description 8
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 claims description 8
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 claims description 8
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 150000004985 diamines Chemical class 0.000 claims description 4
- 230000000295 complement effect Effects 0.000 claims description 3
- 239000007795 chemical reaction product Substances 0.000 claims description 2
- 241000589539 Brevundimonas diminuta Species 0.000 abstract description 4
- 239000002585 base Substances 0.000 description 108
- 239000012634 fragment Substances 0.000 description 47
- 108090000790 Enzymes Proteins 0.000 description 45
- 102000004190 Enzymes Human genes 0.000 description 44
- 229940088598 enzyme Drugs 0.000 description 44
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical class NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 39
- 210000004027 cell Anatomy 0.000 description 36
- 239000002609 medium Substances 0.000 description 36
- 108091008146 restriction endonucleases Proteins 0.000 description 36
- 239000013612 plasmid Substances 0.000 description 35
- 239000000243 solution Substances 0.000 description 32
- 241000588724 Escherichia coli Species 0.000 description 28
- 230000035772 mutation Effects 0.000 description 23
- 235000001014 amino acid Nutrition 0.000 description 22
- 229940024606 amino acid Drugs 0.000 description 21
- 150000001413 amino acids Chemical class 0.000 description 21
- 238000006243 chemical reaction Methods 0.000 description 18
- 238000003752 polymerase chain reaction Methods 0.000 description 17
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 17
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 16
- 238000006467 substitution reaction Methods 0.000 description 16
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 14
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 14
- 238000000605 extraction Methods 0.000 description 14
- 238000003776 cleavage reaction Methods 0.000 description 13
- 239000013604 expression vector Substances 0.000 description 13
- 244000005700 microbiome Species 0.000 description 13
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 12
- 239000000872 buffer Substances 0.000 description 12
- 235000002639 sodium chloride Nutrition 0.000 description 10
- 238000011282 treatment Methods 0.000 description 10
- 108010036781 Fumarate Hydratase Proteins 0.000 description 9
- 102100036160 Fumarate hydratase, mitochondrial Human genes 0.000 description 9
- OZDAOHVKBFBBMZ-UHFFFAOYSA-N 2-aminopentanedioic acid;hydrate Chemical compound O.OC(=O)C(N)CCC(O)=O OZDAOHVKBFBBMZ-UHFFFAOYSA-N 0.000 description 8
- 238000012869 ethanol precipitation Methods 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 102220073859 rs116135678 Human genes 0.000 description 8
- 102200107958 rs121912658 Human genes 0.000 description 8
- 230000007017 scission Effects 0.000 description 8
- 238000005119 centrifugation Methods 0.000 description 7
- 239000013611 chromosomal DNA Substances 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 238000010438 heat treatment Methods 0.000 description 7
- 102220328511 rs1555583424 Human genes 0.000 description 7
- 102220047852 rs199997425 Human genes 0.000 description 7
- 239000000523 sample Substances 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 239000008223 sterile water Substances 0.000 description 7
- 229920001817 Agar Polymers 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 241000894006 Bacteria Species 0.000 description 6
- 241000196324 Embryophyta Species 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 6
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 6
- 239000008272 agar Substances 0.000 description 6
- 239000011543 agarose gel Substances 0.000 description 6
- 238000000246 agarose gel electrophoresis Methods 0.000 description 6
- 238000006911 enzymatic reaction Methods 0.000 description 6
- 239000000284 extract Substances 0.000 description 6
- SEOVTRFCIGRIMH-UHFFFAOYSA-N indole-3-acetic acid Chemical compound C1=CC=C2C(CC(=O)O)=CNC2=C1 SEOVTRFCIGRIMH-UHFFFAOYSA-N 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 239000011535 reaction buffer Substances 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 5
- 238000004520 electroporation Methods 0.000 description 5
- 238000009396 hybridization Methods 0.000 description 5
- 230000000813 microbial effect Effects 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 239000013600 plasmid vector Substances 0.000 description 5
- 238000012216 screening Methods 0.000 description 5
- 108091028043 Nucleic acid sequence Proteins 0.000 description 4
- 229960000723 ampicillin Drugs 0.000 description 4
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 4
- 210000004102 animal cell Anatomy 0.000 description 4
- 229940041514 candida albicans extract Drugs 0.000 description 4
- 239000006285 cell suspension Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K potassium phosphate Substances [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 239000012138 yeast extract Substances 0.000 description 4
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 244000063299 Bacillus subtilis Species 0.000 description 3
- 235000014469 Bacillus subtilis Nutrition 0.000 description 3
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 101100364969 Dictyostelium discoideum scai gene Proteins 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 101100364971 Mus musculus Scai gene Proteins 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 239000007983 Tris buffer Substances 0.000 description 3
- 240000008042 Zea mays Species 0.000 description 3
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 3
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 3
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 3
- 238000000137 annealing Methods 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 210000000349 chromosome Anatomy 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 235000005822 corn Nutrition 0.000 description 3
- 238000012136 culture method Methods 0.000 description 3
- 230000009849 deactivation Effects 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 238000004925 denaturation Methods 0.000 description 3
- 230000036425 denaturation Effects 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 238000001962 electrophoresis Methods 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 239000003617 indole-3-acetic acid Substances 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 3
- 238000009630 liquid culture Methods 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 229960003390 magnesium sulfate Drugs 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 239000001630 malic acid Substances 0.000 description 3
- 235000011090 malic acid Nutrition 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 3
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 108010067770 Endopeptidase K Proteins 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 239000004677 Nylon Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- 108020005091 Replication Origin Proteins 0.000 description 2
- 238000005273 aeration Methods 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 238000013019 agitation Methods 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000037429 base substitution Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 2
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 2
- 235000019797 dipotassium phosphate Nutrition 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- PHTQWCKDNZKARW-UHFFFAOYSA-N isoamylol Chemical compound CC(C)CCO PHTQWCKDNZKARW-UHFFFAOYSA-N 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 238000001638 lipofection Methods 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- 229940099596 manganese sulfate Drugs 0.000 description 2
- 239000011702 manganese sulphate Substances 0.000 description 2
- 235000007079 manganese sulphate Nutrition 0.000 description 2
- SQQMAOCOWKFBNP-UHFFFAOYSA-L manganese(II) sulfate Chemical compound [Mn+2].[O-]S([O-])(=O)=O SQQMAOCOWKFBNP-UHFFFAOYSA-L 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 2
- 235000019796 monopotassium phosphate Nutrition 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 229920001778 nylon Polymers 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 150000002989 phenols Chemical class 0.000 description 2
- GNSKLFRGEWLPPA-UHFFFAOYSA-M potassium dihydrogen phosphate Chemical compound [K+].OP(O)([O-])=O GNSKLFRGEWLPPA-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- VKZRWSNIWNFCIQ-WDSKDSINSA-N (2s)-2-[2-[[(1s)-1,2-dicarboxyethyl]amino]ethylamino]butanedioic acid Chemical compound OC(=O)C[C@@H](C(O)=O)NCCN[C@H](C(O)=O)CC(O)=O VKZRWSNIWNFCIQ-WDSKDSINSA-N 0.000 description 1
- VZSRBBMJRBPUNF-UHFFFAOYSA-N 2-(2,3-dihydro-1H-inden-2-ylamino)-N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]pyrimidine-5-carboxamide Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C(=O)NCCC(N1CC2=C(CC1)NN=N2)=O VZSRBBMJRBPUNF-UHFFFAOYSA-N 0.000 description 1
- 241000589158 Agrobacterium Species 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- 239000004254 Ammonium phosphate Substances 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 241000061154 Brevundimonas sp. Species 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 108010059892 Cellulase Proteins 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 235000019750 Crude protein Nutrition 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 241001646716 Escherichia coli K-12 Species 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229910021578 Iron(III) chloride Inorganic materials 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- IOVCWXUNBOPUCH-UHFFFAOYSA-N Nitrous acid Chemical compound ON=O IOVCWXUNBOPUCH-UHFFFAOYSA-N 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 108020002230 Pancreatic Ribonuclease Proteins 0.000 description 1
- 102000005891 Pancreatic ribonuclease Human genes 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 108010059820 Polygalacturonase Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 239000007984 Tris EDTA buffer Substances 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000003905 agrochemical Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 239000012670 alkaline solution Substances 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 229910000148 ammonium phosphate Inorganic materials 0.000 description 1
- 235000019289 ammonium phosphates Nutrition 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 238000002306 biochemical method Methods 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 238000006065 biodegradation reaction Methods 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- SQKPPECKDHASCX-UHFFFAOYSA-N butylazanium tetrahydroxide Chemical compound [OH-].[OH-].[OH-].[OH-].CCCC[NH3+].CCCC[NH3+].CCCC[NH3+].CCCC[NH3+] SQKPPECKDHASCX-UHFFFAOYSA-N 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 229940106157 cellulase Drugs 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229910000365 copper sulfate Inorganic materials 0.000 description 1
- ARUVKPQLZAKDPS-UHFFFAOYSA-L copper(II) sulfate Chemical compound [Cu+2].[O-][S+2]([O-])([O-])[O-] ARUVKPQLZAKDPS-UHFFFAOYSA-L 0.000 description 1
- 239000012045 crude solution Substances 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- UFJPAQSLHAGEBL-RRKCRQDMSA-N dITP Chemical compound O1[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C[C@@H]1N1C(N=CNC2=O)=C2N=C1 UFJPAQSLHAGEBL-RRKCRQDMSA-N 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- MNNHAPBLZZVQHP-UHFFFAOYSA-N diammonium hydrogen phosphate Chemical compound [NH4+].[NH4+].OP([O-])([O-])=O MNNHAPBLZZVQHP-UHFFFAOYSA-N 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 108010093305 exopolygalacturonase Proteins 0.000 description 1
- 229940032296 ferric chloride Drugs 0.000 description 1
- 229940044631 ferric chloride hexahydrate Drugs 0.000 description 1
- 229940032950 ferric sulfate Drugs 0.000 description 1
- 239000011790 ferrous sulphate Substances 0.000 description 1
- 235000003891 ferrous sulphate Nutrition 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 238000005227 gel permeation chromatography Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 238000009776 industrial production Methods 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- RBTARNINKXHZNM-UHFFFAOYSA-K iron trichloride Chemical compound Cl[Fe](Cl)Cl RBTARNINKXHZNM-UHFFFAOYSA-K 0.000 description 1
- NQXWGWZJXJUMQB-UHFFFAOYSA-K iron trichloride hexahydrate Chemical compound O.O.O.O.O.O.[Cl-].Cl[Fe+]Cl NQXWGWZJXJUMQB-UHFFFAOYSA-K 0.000 description 1
- BAUYGSIQEAFULO-UHFFFAOYSA-L iron(2+) sulfate (anhydrous) Chemical compound [Fe+2].[O-]S([O-])(=O)=O BAUYGSIQEAFULO-UHFFFAOYSA-L 0.000 description 1
- RUTXIHLAWFEWGM-UHFFFAOYSA-H iron(3+) sulfate Chemical compound [Fe+3].[Fe+3].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O RUTXIHLAWFEWGM-UHFFFAOYSA-H 0.000 description 1
- 229910000359 iron(II) sulfate Inorganic materials 0.000 description 1
- 229910000360 iron(III) sulfate Inorganic materials 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- XIXADJRWDQXREU-UHFFFAOYSA-M lithium acetate Chemical compound [Li+].CC([O-])=O XIXADJRWDQXREU-UHFFFAOYSA-M 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 229960002337 magnesium chloride Drugs 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 229940050906 magnesium chloride hexahydrate Drugs 0.000 description 1
- DHRRIBDTHFBPNG-UHFFFAOYSA-L magnesium dichloride hexahydrate Chemical compound O.O.O.O.O.O.[Mg+2].[Cl-].[Cl-] DHRRIBDTHFBPNG-UHFFFAOYSA-L 0.000 description 1
- GVALZJMUIHGIMD-UHFFFAOYSA-H magnesium phosphate Chemical compound [Mg+2].[Mg+2].[Mg+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O GVALZJMUIHGIMD-UHFFFAOYSA-H 0.000 description 1
- 239000004137 magnesium phosphate Substances 0.000 description 1
- 229960002261 magnesium phosphate Drugs 0.000 description 1
- 229910000157 magnesium phosphate Inorganic materials 0.000 description 1
- 235000010994 magnesium phosphates Nutrition 0.000 description 1
- CDUFCUKTJFSWPL-UHFFFAOYSA-L manganese(II) sulfate tetrahydrate Chemical compound O.O.O.O.[Mn+2].[O-]S([O-])(=O)=O CDUFCUKTJFSWPL-UHFFFAOYSA-L 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 238000000164 protein isolation Methods 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 239000011833 salt mixture Substances 0.000 description 1
- 238000005185 salting out Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 239000012137 tryptone Substances 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000015099 wheat brans Nutrition 0.000 description 1
- NWONKYPBYAMBJT-UHFFFAOYSA-L zinc sulfate Chemical compound [Zn+2].[O-]S([O-])(=O)=O NWONKYPBYAMBJT-UHFFFAOYSA-L 0.000 description 1
- 229910000368 zinc sulfate Inorganic materials 0.000 description 1
- 229960001763 zinc sulfate Drugs 0.000 description 1
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Enzymes And Modification Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
【解決手段】Brevundimonas diminutaを由来とする、特定のアミノ酸配列から成るタンパク質、又は上記のアミノ酸配列において、1若しくは複数のアミノ酸残基が欠失、置換又は付加されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
【選択図】 なし
Description
【発明の属する技術分野】
本発明は新規なエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質、およびそれをコードする遺伝子DNAに関する。さらに該酵素の変異体として誘導されうる改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ、該改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼをコードする遺伝子DNA、該改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼをコードする遺伝子DNAを含む組換えDNA、該改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼをコードする遺伝子DNAを含む組換えDNAを含む形質転換体または形質導入体、およびそれら形質転換体または形質導入体を用いたジアミノアルキレン−N,N’−ジコハク酸の製造法に関する。
【0002】
【従来の技術】
ジアミノアルキレン−N,N’−ジコハク酸は、医農薬合成中間体として重要である一方、重金属を捕捉するという特異な性質を持つことから、自然界に放出された後に生分解を受けやすい可能性を持つ該化合物の光学活性体は、キレート剤や洗剤用ビルダーなどの用途が見込まれている。
【0003】
本出願人らは先に、微生物の触媒作用を利用してフマル酸あるいはマレイン酸と各種アミンから効率よく光学活性S,S−ジアミノアルキレン−N,N’−ジコハク酸を合成する新規な製造方法を提案している(特開平9−140390号、同9−289895号および同10−52292号公報記載)。さらには、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を単離同定し、遺伝子組換えの手法を用いることで、菌体の触媒活性の向上および菌体生産性の改善に成功している(特開平10−210984号公報記載)。
【0004】
ところで、一般的に微生物菌体内にはフマラーゼが存在することが広く知られている。フマラーゼは、フマル酸に水添加してリンゴ酸を生成する酵素である。従って、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有する微生物を用いてジアミノアルキレン−N,N’−ジコハク酸を製造しようとする場合、リンゴ酸等の副生物の生成を避けるために、微生物菌体内のフマラーゼを失活させる必要がある。これを解決する手段として、本出願人らは先に、微生物菌体をアルカリ水溶液中で処理することにより、菌体内フマラーゼ活性を低減できることを見出している(特開平11−196882号公報記載)。
【0005】
【発明が解決しようとする課題】
上記方法によるフマラーゼ失活処理においては、フマラーゼの失活速度は処理温度に依存するため、高温であればあるほど短時間での失活が可能となる。また、宿主微生物によってフマラーゼの安定性は異なるが、フマラーゼが失活しにくい微生物を用いた場合においても、より高温での失活処理が望まれる。したがって、本発明は、耐熱性を向上させたエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを提供することを目的とする。
【0006】
【課題を解決するための手段】
本発明者らは、上記課題を解決すべく鋭意検討を重ねた結果、新規に見出されたブレブンディモナス・ディミニュタ(Brevundimonas diminuta)MR−E001株由来であるエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼのアミノ酸配列において、少なくとも一つ以上のアミノ酸残基を天然アミノ酸のグループから選択される残基で置換することにより、該酵素の耐熱性が向上することを見出し、本発明を完成するに至った。すなわち、本願は以下の発明を提供するものである。
【0007】
(1) 配列番号1記載のアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(2) 配列番号1記載のアミノ酸配列において、1又は複数のアミノ酸残基が欠失、置換又は付加されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(3) 配列番号1記載のアミノ酸配列において、120番目のリジン残基、166番目のイソロイシン残基及び365番目のアラニン残基のうち少なくとも1つのアミノ酸残基が他のアミノ酸残基に置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(4) 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(5) 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がセリンに置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(6) 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がスレオニンに置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(7) 配列番号1記載のアミノ酸配列において、少なくとも365番目のアラニン残基がバリンに置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(8) 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がセリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(9) 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がスレオニンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(10) 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がセリンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
【0008】
(11) 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がスレオニンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(12) 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がセリンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(13) 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がスレオニンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
(14) (1)に記載されたタンパク質をコードする遺伝子DNA。
(15) 以下の(a)又は(b)の遺伝子DNA。
(a)配列番号2記載の塩基配列から成る遺伝子DNA。
(b)配列番号2記載の塩基配列又はその一部の配列からなるDNAと相補的な配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質をコードする遺伝子DNA
(16) (2)に記載されたタンパク質をコードする遺伝子DNA。
(17) 配列番号2記載の塩基配列において、1又は複数の塩基が欠失、置換又は付加された塩基配列から成る(16)記載の遺伝子DNA。
(18) (3)に記載されたタンパク質をコードする遺伝子DNA。
(19) 配列番号2記載の塩基配列において、358番目から360番目、496番目から498番目及び1093番目から1095番目の塩基のうち少なくとも1つの塩基が他の異なる塩基に置換された塩基配列から成る請求項18記載の遺伝子DNA。
(20) (4)に記載されたタンパク質をコードする遺伝子DNA。
【0009】
(21) 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAGに置換された塩基配列から成る(20)記載の遺伝子DNA。
(22) 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに置換された塩基配列から成る(20)記載の遺伝子DNA。
(23) (5)に記載されたタンパク質をコードする遺伝子DNA。
(24) 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)に置換された塩基配列から成る(23)記載の遺伝子DNA。
(25) 配列番号2記載の塩基配列において、497番目の塩基チミンがグアニンに置換された塩基配列から成る(23)記載の遺伝子DNA。
(26) (6)に記載されたタンパク質をコードする遺伝子DNA。
(27) 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)に置換された塩基配列から成る(26)記載の遺伝子DNA。
(28) 配列番号2記載の塩基配列において、497番目の塩基チミンがシトシンに置換された塩基配列から成る(26)記載の遺伝子DNA。
(29) (7)に記載されたタンパク質をコードする遺伝子DNA。
(30) 配列番号2記載の塩基配列において、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)に置換された塩基配列から成る(29)記載の遺伝子DNA。
【0010】
(31) 配列番号2記載の塩基配列において、1094番目の塩基シトシンがチミンに置換された塩基配列から成る(29)記載の遺伝子DNA。
(32) (8)に記載されたタンパク質をコードする遺伝子DNA。
(33) 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAG に、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る(32)記載の遺伝子DNA。
(34) 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがグアニンにそれぞれ置換された塩基配列から成る(32)記載の遺伝子DNA。
(35) (9)に記載されたタンパク質をコードする遺伝子DNA。
(36) 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAG に、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る(35)記載の遺伝子DNA。
(37) 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがシトシンにそれぞれ置換された塩基配列から成る(35)記載の遺伝子DNA。
(38) (10)に記載されたタンパク質をコードする遺伝子DNA。
(39) 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る(38)記載の遺伝子DNA。
(40) 配列番号2記載の塩基配列において、497番目の塩基チミンがグアニンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る(38)記載の遺伝子DNA。
【0011】
(41) (11)に記載されたタンパク質をコードする遺伝子DNA。
(42) 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る(41)記載の遺伝子DNA。
(43) 配列番号2記載の塩基配列において、497番目の塩基チミンがシトシンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る(41)記載の遺伝子DNA。
(44) (12)に記載されたタンパク質をコードする遺伝子DNA。
(45) 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAGに、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る(44)記載の遺伝子DNA。
(46) 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがグアニンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る(44)記載の遺伝子DNA。
(47) (13)に記載されたタンパク質をコードする遺伝子DNA。
(48) 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAGに、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る(47)記載の遺伝子DNA。
(49) 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがシトシンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る(47)記載の遺伝子DNA。
(50) (14)〜(49)記載の遺伝子DNAをベクターDNAに挿入した組換えDNA。
【0012】
(51) (50)記載の組換えDNAを含む形質転換体又は形質導入体。
(52) (51)記載の形質転換体又は形質導入体を培養し、得られる培養物からエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを採取することを特徴とするエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼの製造方法。
(53) フマル酸とジアミンとを、(51)記載の形質転換体又は形質導入体の存在下で反応させ、得られる反応産物からジアミノアルキレン−N,N’−ジコハク酸を採取することを特徴とするジアミノアルキレン−N,N’−ジコハク酸の製造方法。
【0013】
【発明の実施の形態】
以下、本発明について詳細に説明する。本発明におけるエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ(「EDDSase」ともいう)とは、フマル酸とエチレンジアミンからエチレンジアミン−N,N’−ジコハク酸を可逆的に生成する能力を持つ酵素を示すが、反応の条件によってはエチレンジアミン−N−モノコハク酸を生成することもある。さらに本酵素は、エチレンジアミン以外のジアミン類にも反応性を示し、対応するジアミノアルキレン−N,N’−ジコハク酸を生成する。また、生成するジアミノアルキレン−N,N’−ジコハク酸は、多くの場合光学活性体であるが、ラセミ体を生成する酵素もある。このような反応性を示す一群の酵素は、本出願人らにより自然界から分離同定された複数の属に属する細菌類に見出されており、これら細菌類は上記特開平9−140390号、同9−289895号および同10−52292号公報に記載されている。さらに、本出願人らは、特開平10−52292号公報記載のブレブンディモナス(Brevundimonas)sp. TN−3株よりエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を単離し、そのアミノ酸配列および遺伝子配列を初めて明らかにするとともに、該遺伝子産物の大量発現の可能性を有する形質転換体の作出に成功している(特開平10−210984号公報記載)。
【0014】
一方、近年の組換えDNA技術の進歩により、酵素の作用を実質的に変えることなく、その酵素の構成アミノ酸の1個以上を欠失、付加、削除、挿入、もしくは他のアミノ酸で置換した変異体を作製することが可能となっている。これら変異体は、置換、欠失、付加、削除、もしくは挿入されるアミノ酸残基の個所および置換されるアミノ酸の種類によっては、変異の導入されていない野生型酵素と比較して、有機溶媒耐性、耐熱性、耐酸性、耐アルカリ性、基質特異性、基質親和性などの性能が著しく向上することが知られている。これら性能の向上は、触媒としての酵素の安定化、反応工程の簡略化、反応収率の向上等を通じて、酵素反応を利用した工業的生産における生産コストの大幅な低減をもたらすことがある。従って、多くの酵素において様々な性能が向上した有用な改良酵素の創製が行われている。
【0015】
本明細書中、「野生型」とは、自然界より分離されてきた微生物に保持されていた酵素を構成するアミノ酸配列、および該酵素をコードする遺伝子の塩基配列が、意図的または非意図的に欠失、削除、挿入、もしくは他のアミノ酸あるいは塩基で置換されていないことを意味する。
【0016】
本出願人らは、更なる有用なエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを求めて、該酵素活性を保有する微生物のスクリーニングを行った。その結果、高い該酵素活性を持つブレブンディモナス・ディミニュタMR−E001株(以下MR−E001株ということがある)を単離するとともに、MR−E001株よりエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を取得した。さらに、該酵素のアミノ酸配列において少なくとも一つ以上のアミノ酸残基を天然アミノ酸のグループから選択される残基で置換することにより該酵素の耐熱性が向上することを見出し、本発明を完成するに至った。
【0017】
本発明の改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼは、例えば、次のようにして得ることができる。先ず、MR−E001株より、野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の取得を行う。遺伝子の取得には、如何なる公知の手段を用いてもよい。例えば、MR−E001株より調製した染色体DNAを鋳型としてPCR(Polymerase Chain Reaction)を行い、該遺伝子の一部を含むDNA断片を得る。PCRに用いるプライマーは、一般的には、該酵素を単離精製した後、アミノ酸分析を行い、得られたアミノ酸配列情報に基づいて設計したデジェネレイトプライマーを用いることができる。また、「目的とする該遺伝子の配列が既に知られている他生物種由来の該遺伝子の配列と相同性を有することが期待される」場合、あるいは「既に知られている他生物種由来の該遺伝子の配列と相同性を有する遺伝子の取得を目的とする」場合は、その既知の他生物種由来の該遺伝子によりコードされるアミノ酸配列情報よりデジェネレイトプライマーを設計し、利用することも可能である。かくして設計されたプライマーを用い、MR−E001株染色体DNAを鋳型としてPCRを行い、得られた増幅DNA産物を後に行うコロニーハイブリダイゼーションのプローブとして用いる。
【0018】
続いてDNAライブラリーの作製を行う。公知の方法、例えばSaito and Miuraらの方法(Biochem. Biophys. Acta, 72, 619(1963))に従って調製したMR−E001株染色体を適切な制限酵素により切断、または部分切断し、同制限酵素切断末端と連結可能な切断末端を生じさせることができる制限酵素で処理したベクターDNAに連結し、適切な微生物宿主の形質転換体または形質導入体を作製することにより、該染色体のDNAライブラリーを得る。形質転換体または形質導入体の宿主とする微生物は特に限定されるものではなく、例えば大腸菌を用いる場合、大腸菌K12株、JM109株、XL1−Blue株などを挙げることができる。形質転換体作製に用いるプラスミドDNAとしては、例えば大腸菌を宿主とする場合、大腸菌中での自律複製可能な領域を有しているpBR322、pUC18、pBluescript II SK(+)などが挙げられる。また、上記プラスミドベクターDNAに限定されることなく、それ以外のファージベクターDNAを用いて形質導入体を作製してもよい。
【0019】
ここで、遺伝子操作に関する工程における説明中、作製する組換えDNAを含む微生物は、プラスミドベクターDNAを用いた場合は形質転換体といい、ファージベクターDNAを用いた場合は形質導入体という。上記形質転換体及び形質導入体は、いずれも本発明に含まれる。以下、プラスミドベクターDNAを用いた形質転換体の場合を例として述べる。
【0020】
かくして得られた該染色体のDNAライブラリーに対し、上述のPCRによる増幅DNA産物をプローブとしてコロニーハイブリダイゼーションを行う。コロニーハイブリダイゼーションは通常行いうる方法でよく、例えば次のようにして行うことができる。すなわち、寒天培地上に生育した該染色体DNAライブラリー形質転換体をナイロンメンブレン上に写し取った後、溶菌させてDNAを固定化する。上述のPCRによる増幅DNA産物を、例えばDNA Labeling kit(ロシュ・ダイアグノスティックス社製)を用いて標識してプローブとした後、メンブレンに対してハイブリダイゼーションを行い、DNA Luminescent Detection kit(ロシュ・ダイアグノスティックス社製)などを用いて、陽性クローンの選択を行うことができる。得られた陽性クローンより定法に従ってプラスミドDNAを調製し、必要に応じてサブクローニングを行った後、挿入断片の塩基配列を決定する。塩基配列の決定方法は如何なる方法でもよく、通常、市販のキット等を用いたジデオキシ法(Methods in Enzymology, 101, 20−78, 1983)により決定することができる。このようにして、MR−E001株由来野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を取得し、また、そのアミノ酸配列および塩基配列を決定することができる。
【0021】
次いで、得られた野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼのアミノ酸配列において、少なくとも一つが他の天然アミノ酸残基で置換された改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを得るには、如何なる方法でもよく、通常公知の方法で行ない得る。すなわち、野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子DNAに対して、例えば、ハイドロキシルアミンや亜硝酸等の変異源となる薬剤を接触・作用させる方法、紫外線照射により変異を誘発する方法、PCRを用いてランダムに変異を導入する方法、市販のキットを利用して部位特異的な置換を生じさせる方法、遺伝子DNAを選択的に開裂し、次いで選択されたオリゴヌクレオチドを除去・付加し連結する方法等が挙げられる。
【0022】
上記処理のいずれかによって種々の変異を持つエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子DNAを得たのち、形質転換体を作製する。形質転換に用いることができるプラスミドベクターとしては、例えば、大腸菌を宿主とする場合、上記DNAライブラリー作製工程で挙げたプラスミドベクターを用いることもできるが、後のスクリーニング工程において、熱処理後のエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ残存活性を効率よく検出するため、発現効率の高い発現ベクター、例えばtrcプロモーターを有する発現ベクターpKK233−2(アマシャム社製)、あるいは後の実施例で示すpKK233−2の誘導体pFY529Vなどを用いることが好ましい。
【0023】
但し、本発明において使用するベクター及び宿主は、上記プラスミド及び大腸菌に限定されるものではない。例えば、ベクターとしてはプラスミドDNA、バクテリオファージDNA、レトロトランスポゾンDNA、人工染色体DNAなどが挙げられる。
【0024】
本発明のエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子DNAは、該遺伝子DNAが導入される宿主生物において発現されるように、遺伝子をベクターに組み込むことが必要である。そこで、本発明のベクターには、本発明の遺伝子DNAのほか、プロモーター、ターミネーター、エンハンサー、スプライシングシグナル、ポリA付加シグナル、選択マーカー、リボソーム結合配列(SD配列)等を連結することができる。なお、選択マーカーとしては、例えばジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子等が挙げられる。
【0025】
本発明の形質転換体は、本発明の組換えベクターを、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子が発現し得るように宿主中に導入することにより得ることができる。ここで、宿主としては、例えば、大腸菌、枯草菌等の細菌が挙げられる。また、酵母、動物細胞、昆虫細胞、植物細胞等を用いることもできる。
【0026】
大腸菌としては、例えばエッシェリヒア・コリ(Escherichia coli)等が挙げられ、枯草菌としては、例えばバチルス・ズブチリス(Bacillus subtilis)等が挙げられる。細菌への組換えベクターの導入方法としては、細菌にDNAを導入する方法であれば特に限定されるものではない。例えばカルシウムイオンを用いる方法、エレクトロポレーション法等が挙げられる。
【0027】
酵母を宿主とする場合は、例えばサッカロミセス・セレビシエ(Saccharomycescerevisiae)、シゾサッカロミセス・ポンベ(Schizosaccharomyces pombe)、ピヒア・パストリス(Pichia pastoris)等が用いられる。酵母への組換えベクターの導入方法としては、酵母にDNAを導入する方法であれば特に限定されず、例えばエレクトロポレーション法、スフェロプラスト法、酢酸リチウム法等が挙げられる。
【0028】
動物細胞を宿主とする場合は、サル細胞COS−7、Vero、CHO細胞、マウスL細胞、ラットGH3、ヒトFL細胞等が用いられる。動物細胞への組換えベクターの導入方法としては、例えばエレクトロポレーション法、リン酸カルシウム法、リポフェクション法等が挙げられる。
【0029】
昆虫細胞を宿主とする場合は、Sf9細胞、Sf21細胞等が用いられる。昆虫細胞への組換えベクターの導入方法としては、例えばリン酸カルシウム法、リポフェクション法、エレクトロポレーション法等が用いられる。
【0030】
植物細胞を宿主とする場合は、トウモロコシ、イネ、タバコ等が挙げられるが、これらに限定されるものではない。植物細胞への組換えベクターの導入方法としては、例えばアグロバクテリウム法、パーティクルガン法、PEG法、エレクトロポレーション法等が用いられる。
【0031】
上記の通り、種々のエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を含む組換えDNAを保有する形質転換体を得ることができる。
【0032】
宿主を大腸菌とした場合は、得られた形質転換体を寒天培地上で培養してコロニーを形成させた後、液体培養し、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを生産させる。得られた培養物を、例えば、40〜65℃の温度下、30分間の熱処理に供した後、残存エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を測定し、残存エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性の高い形質転換体を選択する。かくして得られた優良形質転換体の組換えDNAに挿入されているエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の塩基配列の決定は、例えば、ジデオキシ法により行なうことができる。
【0033】
配列番号2に本発明のエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子DNAの塩基配列を、配列番号1に本発明の遺伝子によりコードされるアミノ酸配列を例示する。
【0034】
また、酵素に耐熱性を付与する複数の異なる単変異置換を組み合わせ、多重変異体とすることにより、単変異体よりもさらに耐熱性の向上した変異酵素を創製できる可能性があることが知られている。多重変異体を作製する手段は如何なる方法でもよく、例えば、合成一本鎖オリゴヌクレオチドを用いて部位特異的な置換を生じさせる方法、複数の異なる単変異個所を含むDNA断片を制限酵素で切断して連結させる方法などが挙げられる。
【0035】
したがって、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼがその酵素活性を有する限り、配列番号1に示すアミノ酸配列において複数個、好ましくは1又は数個のアミノ酸に欠失、置換、付加等の変異が生じてもよい。例えば、配列番号1に示されるアミノ酸配列の1〜10個、好ましくは1〜5個のアミノ酸が欠失してもよく、配列番号1に示されるアミノ酸配列に1〜10個、好ましくは1〜5個のアミノ酸が付加してもよく、あるいは、配列番号1に示されるアミノ酸配列の1〜10個、好ましくは1〜5個のアミノ酸が他のアミノ酸に置換してもよい。
【0036】
本発明においては、特に、配列番号1に示すアミノ酸配列において120番目のLys、166番目のIle、365番目のAlaのうち少なくとも1つのアミノ酸が他のアミノ酸に置換したものが好ましい。上記3箇所のアミノ酸置換は、任意に組み合わせることができる。好ましい置換の態様を以下に示す。なお、以下の置換の態様において、数字は配列番号1に示すアミノ酸配列の位置の番号、番号の左のアルファベットは置換前のアミノ酸(1文字表記)、数字の右のアルファベットは置換後のアミノ酸(1文字表記)である。
K120E
I166S
I166T
A365V
(K120E, I166S)
(K120E, I166T)
(I166S, A365V)
(I166T, A365V)
(K120E, I166S, A365V)
(K120E, I166T, A365V)
【0037】
また、K120Eの置換を生じさせるときの塩基置換は以下の通りである。
120番目のLysに対応する配列番号2に示す塩基配列の位置は358番目から360番目であり、その塩基配列は「AAA」である。一方、グルタミン酸のコドンはGAA又はGAGであるため、本発明においては、AAAがGAA又はGAGとなるように塩基を置換させることができる。特に、358番目のAをGに置換すること(AAA→GAA)が好ましい。
【0038】
上記と同様にして、I166Sの置換を生じさせるときは、配列番号2に示す塩基配列において496番目から498番目の塩基ATCを、AGC、AGT、ACA、ACC、ACG又はACTに置換させることができる。特に、497番目のTをGに置換させること(ATC→AGC)が好ましい。I166Tの置換を生じさせるときは、配列番号2に示す塩基配列において496番目から498番目の塩基ATCを、ACA、ACC、ACG又はACTに置換させることができる。特に、497番目のTをCに置換させること(ATC→ACC)が好ましい。
【0039】
A365Vの置換を生じさせるときは、配列番号2に示す塩基配列において1093番目から1095番目の塩基GCCを、GTA、GTG、GTC又はGTTに置換することができる、特に、1094番目のCをTに置換すること(GCC→GTC)が好ましい。
【0040】
但し、本発明においては、置換後のアミノ酸は上記例に限定されるものではない。したがって、配列番号1に示すアミノ酸配列の120番目、166番目、365番目のアミノ酸のうち少なくとも1つのアミノ酸残基となるように、当該アミノ酸をコードするコドンの少なくとも1つの塩基を他の塩基に置換することができる。
【0041】
ここで、「エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性」とは、フマル酸及びジアミンとを反応させてジアミノアルキレン−N,N’−ジコハク酸を生成するための触媒活性を意味する。
【0042】
また、配列番号2記載の塩基配列又はその一部の配列からなるDNAと相補的な配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質をコードする遺伝子DNAも本発明の遺伝子DNAに含まれる。ストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成される条件をいう。例えば、相同性が高い核酸同士、すなわち80%以上、好ましくは90%以上の相同性を有するDNAであって、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質をコードするDNA同士がハイブリダイズし、それより相同性が低いDNA同士がハイブリダイズしない条件が挙げられる。より具体的には、ナトリウム濃度が300〜2000mM、好ましくは600〜900mMであり、温度が40〜75℃、好ましくは55〜65℃での条件をいう。
【0043】
一旦本発明の遺伝子の塩基配列が確定されると、その後は化学合成によって、又はクローニングされたDNAを鋳型としたPCRによって、あるいは該塩基配列を有するDNA断片をプローブとしてハイブリダイズさせることによって、本発明の遺伝子DNAを得ることができる。
【0044】
本発明において、耐熱性とは、野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼが失活する温度範囲においても酵素活性を保持することができる性質を意味し、45〜60℃、好ましくは50〜60℃である。50〜60℃の範囲内において、改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼは50℃のときの酵素活性と比較して60%の酵素活性を維持することができる。
【0045】
かくして得られた単変異あるいは多重変異が導入された改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を含む組換えプラスミドDNAを保有する形質転換体を用いて、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを製造することができる。また、上記形質転換体を用いて(例えば、大腸菌の形質転換体を用いて)、ジアミノアルキレン−N,N’−ジコハク酸を製造することもできる。
【0046】
エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを製造するには、上記形質転換体を培養し、その培養物から採取することにより得ることができる。「培養物」とは、培養上清、培養細胞若しくは培養菌体、又は細胞若しくは菌体の破砕物のいずれをも意味するものである。本発明の形質転換体を培養する方法は、宿主の培養に用いられる通常の方法に従って行われる。
【0047】
大腸菌や酵母菌等の微生物を宿主として得られた形質転換体を培養する培地は、微生物が資化し得る炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行うことができる培地であれば、天然培地、合成培地のいずれを用いてもよい。炭素源としては、グルコース、フラクトース、スクロース、デンプン等の炭水化物、酢酸、プロピオン酸等の有機酸、エタノール、プロパノール等のアルコール類が挙げられる。窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウム等の無機酸若しくは有機酸のアンモニウム塩又はその他の含窒素化合物のほか、ペプトン、肉エキス、コーンスティープリカー等が挙げられる。無機物としては、リン酸第一カリウム、リン酸第二カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸銅、炭酸カルシウム等が挙げられる。培養は、通常、振盪培養又は通気攪拌培養などの好気的条件下で行う。pHの調整は、無機又は有機酸、アルカリ溶液等を用いて行う。培養中は必要に応じてアンピシリンやテトラサイクリン等の抗生物質を培地に添加してもよい。
【0048】
プロモーターとして誘導性のプロモーターを用いた発現ベクターで形質転換した微生物を培養する場合は、必要に応じてインデューサーを培地に添加してもよい。例えば、イソプロピル−β−D−チオガラクトシド(IPTG)で誘導可能なプロモーターを有する発現ベクターで形質転換した微生物を培養するときには IPTG等を培地に添加することができる。また、インドール酢酸(IAA)で誘導可能なtrpプロモーターを用いた発現ベクターで形質転換した微生物を培養するときにはIAA等を培地に添加することができる。
【0049】
動物細胞を宿主として得られた形質転換体を培養する培地としては、一般に使用されているRPMI1640培地、DMEM培地又はこれらの培地に牛胎児血清等を添加した培地等が挙げられる。培養は、通常、5%CO2存在下、37℃で1〜30日行う。培養中は必要に応じてカナマイシン、ペニシリン等の抗生物質を培地に添加してもよい。
【0050】
培養後、本発明のタンパク質が菌体内又は細胞内に生産される場合には、超音波処理、凍結融解の繰り返し、ホモジナイザー処理などを施して菌体又は細胞を破砕することにより目的のタンパク質採取する。また、本発明のタンパク質が菌体外又は細胞外に生産される場合には、培養液をそのまま使用するか、遠心分離等により菌体又は細胞を除去する。その後、タンパク質の単離精製に用いられる一般的な生化学的方法、例えば硫酸アンモニウム沈殿、ゲルクロマトグラフィー、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー等を単独で又は適宜組み合わせて用いることにより、前記培養物中から本発明のタンパク質を単離精製することができる。
【0051】
形質転換体が植物細胞又は植物組織である場合は、培養は、通常の植物培養用培地、例えばMS基本培地、LS基本培地等を用いることにより行うことができる。培養方法は、通常の固体培養法、液体培養法のいずれをも採用することができる。
【0052】
培養物から本発明のタンパク質を精製するには、まず、セルラーゼ、ペクチナーゼ等の酵素を用いた細胞溶解処理、超音波破砕処理、磨砕処理等により細胞を破壊する。次いで、濾過又は遠心分離等を用いて不溶物を除去し、粗タンパク質溶液を得る。上記粗溶液から本発明のタンパク質を精製するには、塩析、各種クロマトグラフィー(例えばゲル濾過クロマトグラフィー、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー等)、SDSポリアクリルアミドゲル電気泳動等を単独で又は適宜組み合わせて実施する。
【0053】
ジアミノアルキレン−N,N’−ジコハク酸を製造するには、下記のようにして行なうことができる。大腸菌形質転換体を培養するには、通常の固体培養法で培養してもよいが、可能な限り液体培養法を採用して培養するのが好ましい。培養に用いる培地としては、例えば、酵母エキス、トリプトン、ポリペプトン、コーンスティープリカー、大豆若しくは小麦ふすまの浸出液等の1種以上の窒素源に、塩化ナトリウム、リン酸第一カリウム、リン酸第二カリウム、硫酸マグネシウム、塩化マグネシウム、塩化第二鉄、硫酸第二鉄若しくは硫酸マンガン等の無機塩類の1種以上を添加し、更に必要により糖質原料、ビタミン等を適宜添加したものが用いられる。なお、培地の初発pHは7〜9に調整するのが適当である。また、培養は、25〜42℃で6〜24時間、通気攪拌深部培養、振盪培養、静置培養等により実施するのが好ましい。
【0054】
培養終了後、得られた微生物菌体を集菌し、適当な緩衝液、例えば、50mMホウ酸緩衝液(pH9.0)で菌体を洗浄した後、同緩衝液に懸濁することにより菌体懸濁液を調製する。この菌体懸濁液を、例えば、40〜65℃の温度下、30分〜72時間熱処理することにより、フマラーゼ活性が消失し、かつエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有する菌体を調製することができる。かくして得られた菌体を、フマル酸あるいはマレイン酸と各種アミンを含む水溶液中に懸濁して反応させることにより、リンゴ酸等の副生物を含まない、光学活性S,S−ジアミノアルキレン−N,N’−ジコハク酸水溶液を製造することができる。
なお、ブレブンディモナス・ディミニュタ(Brevundimonas diminuta)MR−E001株の菌学的性質は下記表のとおりである。
【0055】
【表1】
【0056】
なお、ブレブンディモナス・ディミニュタ(Brevundimonas diminuta)MR−E001株は、独立行政法人産業技術総合研究所 特許生物寄託センター(茨城県つくば市東1丁目1番地1 中央第6)にFERM P−19203として2003年2月5日付けで寄託されている。
【0057】
【実施例】
以下、本発明を実施例によりさらに具体的に説明する。しかしながら、実施例は本発明の具体的な認識を得る一助とみなすべきものであり、本発明の範囲を何等限定するものではない。
【0058】
[実施例1] MR−E001株由来野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の取得
(1) MR−E001株染色体DNAの調製
MR−E001株を 100mlのEDDS培地 (0.2%エチレンジアミン−N,N’−ジコハク酸、0.2%グルコース、0.1%バクトイーストエキス、 0.05%ポリペプトン、0.1%硫酸マグネシウム・7水塩、25%(v/v)燐酸緩衝液(1M 、pH 7.0) 、0.5%(v/v) 金属塩混合物溶液(硫酸ナトリウム 56g、塩化マグネシウム・6水塩 8g 、塩化カルシウム0.8g 、硫酸マンガン・4水塩 0.6g 、塩化第二鉄・6水塩 0.12g、硫酸亜鉛 0.06g/100ml)中、30℃にて4日間振盪培養した後に集菌し、この菌体を Saline−EDTA溶液(0.1M EDTA、15M NaCl、pH 8.0) 4ml に懸濁し、リゾチーム 8mgを加えて37℃で1時間振盪した後凍結した。次に、10mlの Tris−SDS 液(1%SDS、0.1M NaCl 、0.1M Tris 、pH 9.0) を穏やかに振盪しながら加え、さらにプロテイナーゼK(メルク社製)(終濃度 1mg) を加え37℃で1時間振盪した。次に、等量のTE飽和フェノール(TE:10mM Tris 、1mM EDTA、pH 8.0)を加えて撹拌後遠心し、上層を採り2倍量のエタノールを加えた後ガラス棒でDNAを巻きとり、90% 、80% 、70% のエタノールで順次フェノールを取り除いた。次に、DNAを 3mlのTE緩衝液に溶解させ、リボヌクレアーゼ A溶液(100℃、15分間の熱処理済み)を 10mg/mlの終濃度となるように加え37℃で30分間振盪した。さらにプロテイナーゼ Kを加え37℃で30分間振盪した後、等量のTE飽和フェノールを加え遠心し、上層と下層に分離させ上層を採取した(以後この操作をフェノール抽出と呼ぶ)。フェノール抽出を2回繰り返した後、同量のクロロホルム (4%イソアミルアルコール含有)を加え同様の抽出操作を繰り返した(以後この操作をクロロホルム抽出と呼ぶ)。その後上層に2倍量のエタノールを加えガラス棒でDNAを巻き取り回収し、染色体DNA標品を得た。
【0059】
(2) プローブの調製
本出願人らは先に、ブレブンディモナス(Brevundimonas)sp. TN−3株よりエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の単離に成功し、そのアミノ酸配列および遺伝子配列を初めて明らかにしている(特開平10−210984号公報記載)。該公報において用いられたデジェネレイトプライマー、すなわち、配列番号3および配列番号4に示されるような配列を有する合成DNA(それぞれ、プライマー#1 および #2とする)を用い、工程(1)で得られたMR−E001株の染色体DNAを鋳型としてPCRを行った。
プライマー#1:ATGACICCIC AYAAYCCIGA YGC(配列番号3)
プライマー#2:CCDATYTGCAT YTTICCIGC RACIGAICCD ATYTC(配列番号4)
【0060】
すなわち、MR−E001株染色体DNA 1μl 、10倍濃度の反応緩衝液 10μl 、10mM dNTP 4μl 、プライマー#1および#2各々1μl(100pmol 濃度相当)、ExTaq (宝酒造社製)1μl を加えて100 μl とした。この溶液について、95℃、30秒間(デナチュレーション過程)、55℃、30秒間(アニーリング過程)、72℃、2分間(エクステンション過程)のインキュベーションを30サイクル行った。反応終了後、フェノール抽出およびクロロホルム抽出を行い、エタノール沈殿により増幅されたDNAを回収した。これを1.0%アガロースゲル電気泳動で分離後、MR−E001株のエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の一部をコードすると考えられる約300bpのDNA断片を得た。こうして得られたDNA断片をDIG DNA Labeling kit(ロシュ・ダイアグノスティックス社製)を用いて標識し、プローブとした。
【0061】
(3) DNAライブラリーの作製
MR−E001株染色体DNA 10μl に10倍濃度制限酵素反応用緩衝液5μl 、滅菌水33μl 、制限酵素 KpnI 2μl を加え、37℃にて16時間反応させた後エタノール沈殿によりDNAを回収した。アガロースゲル電気泳動を行い、6.5Kb から 5.5KbのDNA断片をゲルから切り出し、DNA PREP(ダイアトロン社製)を用いて回収した。このDNA断片をDNA Ligation Kit Ver.1(宝酒造社製)を用いて大腸菌ベクター pUC18のKpnI部位に挿入し、組換えDNAライブラリーを作製した。ライゲーションに用いた pUC18断片は次のように作製した。pUC18 保存液 2μl に対し、10倍濃度制限酵素用緩衝液5μl 、滅菌水40μl 、制限酵素 KpnI 3μl を加え、37℃で2時間反応後、フェノール抽出およびクロロホルム抽出を行い、エタノール沈殿させた後乾燥して50μl の滅菌水に溶解させた。さらにアルカリフォスファターゼ(宝酒造社製)1μl 、10倍濃度緩衝液10μl 、滅菌水39μl を加え65℃で反応後、フェノール抽出およびクロロホルム抽出を行い、エタノール沈殿後乾燥して滅菌水に溶解させた。
【0062】
(4) 大腸菌形質転換体の作製および組換えDNAの選別
大腸菌 JM109株をLB培地(1% バクトトリプトン、0.5%バクトイーストエキス、0.5% NaCl) 1mlに接種し37℃、5時間好気的に前培養し、この培養物 0.4mlを SOB培地 40ml(2%バクトトリプトン、0.5%バクトイーストエキス、10mM NaCl 、2.5mM KCl 、1mM MgSO4 、1mM MgCl2 ) に加え、18℃で20時間培養した。この培養物を遠心分離により集菌した後、冷TF溶液(20mM PIPES−KOH(pH 6.0) 、200mM KCl 、10mM CaCl2 、40mM MnCl2 ) を13ml加え、0℃で10分間放置した。その後、再度遠心し、上澄を除いた後、沈殿した大腸菌を冷TF溶液 3.2mlに懸濁し、0.22mlのジメチルスルフォキシドを加え0℃で10分間放置した。こうして作製したコンピテントセル 200μl に工程(3)で作製した組換えプラスミドDNAを含有する溶液(DNAライブラリー)を10μl 加え、0℃で30分放置後、42℃で30秒間ヒートショックを与え、0℃で2分間冷却後、SOC 培地(20mM グルコース、2%バクトトリプトン、0.5%バクトイーストエキス、10mM NaCl 、2.5mM KCl 、1mM MgSO4 、1mM MgCl2 )1ml を添加して37℃にて1時間振盪培養した。これを 200μl ずつLBAmp寒天培地(アンピシリン 100mg/L 、1.5%寒天を含有するLB培地)にまき、37℃で培養した。寒天培地上に生育した形質転換体コロニーについて、コロニーハイブリダイゼーション法によりエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を保有すると考えられる形質転換体を選別した。すなわち、寒天培地上に生育した形質転換体をナイロンメンブレン(バイオダイン A:日本ポール社製)上に移し、菌体を溶かしてDNAを固定した後、これを工程(2)で作製したプローブ(約300bp)で処理し、DIG Luminescent Detection Kit (ロシュ・ダイアグノスティックス社製)を用い、目的の組換えDNAを持つコロニーを選択した。
【0063】
(5) 組換えプラスミドの調製
工程(4) で選択した形質転換体を 100mlのLBAmp培地(アンピシリン 100mg/Lを含有するLB培地)にて37℃で一晩培養し、集菌後、Flexi Prep(アマシャムバイオサイエンス社製)を用いてプラスミドDNAを回収した。得られた組換えプラスミドDNAを pEDS9001と名付けた。
【0064】
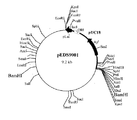
(6) 制限酵素地図の作製およびエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子領域の特定
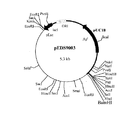
工程(5) で得られたプラスミド pEDS9001を数種の制限酵素を用いて切断し制限酵素地図を作製した(図1)。さらに、通常行われるようにサブクローニングを行った。すなわち、pEDS9001 を制限酵素 BamHIで切断した後アガロースゲル電気泳動を行い、約5.3KbのDNA断片をゲルから切り出し、DNA PREP(ダイアトロン社製)を用いて回収した。DNA Ligation Kit Ver.1(宝酒造社製)を用いて自己連結反応を行った後、大腸菌 JM109株を形質転換することにより、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を含むと考えられる約2.6Kb の断片が挿入されたプラスミド(pEDS9003)(図2)を得た。
【0065】
(7) 塩基配列の決定
工程(6) で特定された領域周辺の塩基配列を蛍光シーケンサ ALFII(アマシャムバイオサイエンス社製)を用いて決定した。その結果、配列番号1に示されるアミノ酸配列から成るオープンリーディングフレームをコードする塩基配列(配列番号2)が見い出された。
【0066】
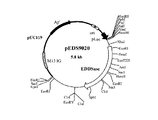
[実施例2] MR−E001株由来野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を導入した形質転換体の活性評価
実施例1の工程(6)で得られたエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を有する組換えプラスミドpEDS9003 2μl に対し、10倍濃度制限酵素用緩衝液2μl 、滅菌水15μl 、制限酵素 KpnI 1μl を添加し、37℃にて2時間反応させた。エタノール沈殿によりプラスミドDNAを回収し、乾燥後17μl の滅菌水、 2μl の10倍濃度制限酵素緩衝液、制限酵素 BamHI 1μlを添加して37℃にて2時間反応させた。この反応液からアガロースゲル電気泳動により約2.6Kb の断片を調製し、大腸菌ベクター pUC119 に挿入した。作製したライゲーション溶液を用いて大腸菌 JM109を形質転換して目的のプラスミドを得た。ここで作製したプラスミドを pEDS9020 (図3)と名付け、また形質転換体を JM109/ pEDS9020と名付けた。JM109/ pEDS9020 およびコントロールとしてJM109/ pEDS020(特開平10−210984号公報記載)を、それぞれLBAmp培地1mlに接種して37℃にて8時間振盪培養後、1mM isopropyl−β−thiogalactosideを含有する40mlのLBAmp培地で37℃、30時間培養した。得られた培養物を10mMリン酸ナトリウム緩衝液(pH 8.0)で洗浄後、2ml の同緩衝液に懸濁した。得られた菌体懸濁液の一部を342mMフマル酸と 171mMエチレンジアミンを含むpH 8.0の水溶液50ml に懸濁し30℃で反応させた。時間間隔を空けて反応混合液の一部を(0.1ml)を取り出し、0.42NのNaOH水溶液0.9ml中に加え反応を停止した。菌体を遠心分離により除いた後、HPLCを用いて生成したS,S−エチレンジアミン−N,N’−ジコハク酸を分析した(WAKOSIL5C8 (和光純薬社製)〔溶出液;10mM水酸化テトラ−n−ブチルアンモニウムと0.4mMCuSO4 を含む50mMリン酸;pH 2〕)。上記測定条件下において1分間に1μmolのS,S−エチレンジアミン−N,N’−ジコハク酸を生成させる酵素量を酵素単位(U)として、JM109/ pEDS9020 およびJM109/ pEDS020の菌体あたり(OD630あたり)の活性を求めたところ、それぞれ1.22 mU/ODml、0.89mU/ODmlであり、MR−E001株由来エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼが高い該酵素活性を有することが確認された。なお、pEDS9020は、独立行政法人産業技術総合研究所 特許生物寄託センター(茨城県つくば市東1丁目1番地1 中央第6)にFERM P−19202として、2003年2月5日付で寄託されている。
【0067】
[実施例3] 改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の取得
(1)野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子への変異導入
実施例2で得られたプラスミドpEDS9020をもとに、野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子へのランダム変異導入を行った。変異導入は、PCRにおけるヌクレオチドの誤取り込みによる塩基置換を利用した。エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子開始コドン領域を含むオリゴヌクレオチドED−01(配列番号5)と、該遺伝子終止コドンより約50bp下流領域を含むED−02(配列番号6)を変異誘発PCRのプライマーとし、以下のような組成のPCR反応液100μlを調製した。
プライマー:
ED−01:CGCCATGGCC CCGCATAACC CAGATGCCAC C(配列番号5)
(下線部分は制限酵素NcoI切断認識部位)
ED−02:AAACAAGCTT CGTCATGGCT ATCCCCTC(配列番号6)
(下線部分は制限酵素HindIII切断認識部位)
反応液組成:
鋳型DNA(上記工程で調製したpEDS9020) 1μl
10× PCR Buffer(GIBCO社製) 10μl
50mM MgCl2(GIBCO社製) 3μl
プライマーED−01 1μl
プライマーED−02 1μl
2.5mM dNTP 各々2μl
10mM dITP 2μl
10mM dBraUTP 2μl
滅菌水 71μl
Taq DNAポリメラーゼ(GIBCO社製) 1μl
【0068】
上記反応液に対し、94℃、30秒(デナチュレーション過程)、68℃、180秒(アニーリング過程・エクステンション過程)のインキュベーションを30サイクル行った。上記PCR終了後、反応液10μlを0.7%アガロースゲルにより電気泳動を行って、約1.5kbの増幅断片の検出を行った。また、耐熱性評価のコントロールとして用いるため、通常のPCRにて野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を増幅した。すなわち、以下のような組成のPCR反応液100μlを調製した。
鋳型DNA(pEDS9020) 1μl
10× Pyrobest Buffer(宝酒造社製) 10μl
プライマーED−01 1μl
プライマーED−02 1μl
5mM dNTP 各々2μl
滅菌水 78μl
PyrobestTM DNAポリメラーゼ(宝酒造社製) 1μl
【0069】
上記反応液に対し、94℃、30秒(デナチュレーション過程)、68℃、180秒(アニーリング過程・エクステンション過程)のインキュベーションを30サイクル行った。上記PCR終了後、反応液10μlを0.7%アガロースゲルにより電気泳動を行って、約1.5kbの増幅断片の検出を行った。
【0070】
プライマーED−01およびED−02中には、制限酵素NcoI切断認識部位および制限酵素HindIII切断認識部位がそれぞれ導入されており(プライマーED−01及びED−02の塩基配列の下線部分)、増幅DNA産物を両制限酵素で切断することにより、後述する発現ベクターpFY529VのNcoI部位−HindIII部位間に容易に挿入することが可能となる。
【0071】
(2)発現ベクターの構築
後述のスクリーニング工程において、熱処理後のエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ残存活性を効率よく検出するため、コピー数と発現効率の高い大腸菌発現ベクターpFY529Vを作製した(図4)。trcプロモーターを有する発現ベクターpKK233−2(アマシャム社製)5μlに制限酵素NaeI 1μl 、ScaI 1μl、10倍濃度制限酵素反応用緩衝液1μl、滅菌水2μlを加え、37℃にて12時間切断反応を行った。切断後、0.7%アガロースゲルにより電気泳動を行い、該プラスミドの複製開始点を含まないNaeI−ScaI断片(1.2kb)を切り出し、DNA PREP(ダイアトロン社製)を用いて、該DNA断片を含むTE溶液(10mM Tris、1mM EDTA、pH8.0)3μlを回収した。この操作と並行して、高コピー数ベクターであるpUC18 2μlに制限酵素PvuII 1μl 、ScaI 1μl、10倍濃度制限酵素反応用緩衝液1μl、滅菌水5μlを加え、37℃にて12時間切断反応を行った。切断後、0.7%アガロースゲルにより電気泳動を行い、該プラスミドの複製開始点を含むPvuII−ScaI断片(1.6kb)を切り出し、DNA PREP(ダイアトロン社製)を用いて、該DNA断片を含むTE 1μlを回収した。こうして得られた両DNA断片をDNA Ligation Kit Ver.1(宝酒造社製)により連結させた。pKK233−2由来NaeI−ScaI断片溶液3μl、pUC18由来PvuII−ScaI断片溶液1μl、キット中のA液16μl、キット中のB液4μlを混合し、16℃にて16時間連結反応を行った。連結反応後の反応液を用い、実施例1 (4)記載の方法により大腸菌JM109を形質転換した。得られた形質転換体コロニーより約10クローンをLBAmp培地1.5mlに接種し、37℃で12時間振盪培養した。培養後、この培養物を遠心分離により集菌した後、Flexi Prep(アマシャムバイオサイエンス社製)を用いることにより、プラスミドDNAを抽出した。得られたプラスミドDNAを制限酵素ScaIで切断後、0.7%アガロースゲルにより電気泳動を行い、pKK233−2由来NaeI−ScaI断片(1.2kb)とpUC18由来PvuII−ScaI断片(1.6kb)が正しく連結されているクローンを選んでpFY529Vと命名し、変異ライブラリーの発現ベクターとして用いた。
【0072】
(3)変異ライブラリーの作製
工程(1)のPCRで得られた変異導入エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を含む反応液を、常法に従ってエタノール沈殿により精製を行い、沈殿物を70μlの滅菌水に再懸濁した。10倍濃度制限酵素反応用緩衝液10μl、制限酵素NcoI 10μl、HindIII 10μlを加え、37℃にて12時間切断反応を行った。切断反応後、フェノール抽出およびクロロホルム抽出を行った後、エタノール沈殿を行い、沈殿物を100μlの滅菌水に再懸濁して変異DNA断片溶液とした。この操作と並行して、工程(2)で作製した発現ベクターpFY529V 3μlに、滅菌水67μl、10倍濃度制限酵素反応用緩衝液10μl、制限酵素NcoI 10μl、HindIII 10μlを加え、37℃にて12時間切断反応を行った。切断後、フェノール抽出およびクロロホルム抽出を行い、エタノール沈殿により精製した後、沈殿物を10μlの滅菌水に再懸濁して切断済みpFY529V溶液とした。変異DNA断片と発現ベクターpFY529Vの連結は、DNA Ligation Kit Ver.1(宝酒造社製)を用いて行った。上記の変異DNA断片溶液3μl、切断済みpFY529V溶液1μl、キット中のA液16μl、キット中のB液4μlを混合し、16℃にて16時間連結反応を行った。連結反応後の反応液を用いて、実施例1(工程(4))記載の方法により大腸菌JM109を形質転換し、種々の変異導入EDDSase遺伝子を保有する形質転換体を得た。また、以上と同様の操作を、工程(1)で増幅した野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を挿入断片として行った。得られた形質転換体コロニーよりプラスミドを抽出し、蛍光シークエンサーALF II(アマシャムバイオサイエンス社製)を用いて塩基配列を確認した結果、実施例1(工程(7))で決定した野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼの塩基配列(配列番号2)と同一であった{但し、プライマーED−01のNcoI部位導入による、4番目の塩基変化(A→G)は除く}。このプラスミドをpEDTrc9003と命名し、該プラスミドを含む大腸菌、すなわちJM109/ pEDTrc9003を、後述する(4)の耐熱性向上エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼのスクリーニング工程におけるコントロールとして用いた。なお、pEDTrc9003は、独立行政法人産業技術総合研究所 特許生物寄託センター(茨城県つくば市東1丁目1番地1 中央第6)にFERM P−19201として2003年2月5日付けで寄託されている。
【0073】
(4)耐熱性向上エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼのスクリーニング
工程(3)で得られた変異エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を含むJM109形質転換体およびコントロールとするJM109/ pEDTrc9003を、48穴マルチディッシュに1.5mlずつ分注したLBAmp培地にそれぞれ接種し、37℃にて12時間液体培養した。得られた培養物を、50℃の温度下、30分間の熱処理に供した後、実施例2記載の方法により、残存エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性の測定を行った。工程(3)で得られた形質転換体約10000株についてスクリーニングを行った結果、野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを保有するJM109/ pEDTrc9003がもはや完全にその活性を消失していたのに対し、該酵素活性が残存している株が4株得られた。
【0074】
(5)変異の同定
工程(4)で得られた4株の耐熱性向上候補株に含有される変異導入エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子について、どの部位にどのような変異が導入されたのかを確認すべく以下のように解析を行った。4株の耐熱性向上候補株に含まれる組換えプラスミドDNAを、Flexi Prep(アマシャムバイオサイエンス社製)を用いて精製し、得られた組換えプラスミドDNAをそれぞれpEDTrcI−2、pEDTrcI−23、pEDTrcJ−05、pEDTrcK−01と命名した。また、それぞれのプラスミドに含まれる変異酵素自体をI−2、I−23、J−05、K−01と命名した。これらの組換えプラスミドDNAに含まれる変異エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の塩基配列を、蛍光シークエンサーALF II(アマシャムバイオサイエンス社製)を用いて決定した。決定した各変異エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子の塩基配列と野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼの塩基配列(配列番号2)とを比較解析した結果、pEDTrcI−2では166番目のイソロイシン残基(ATC)がスレオニン(ACC)に、pEDTrcI−23では120番目のリジン残基(AAA)がグルタミン酸(GAA)に、pEDTrcJ−05では166番目のイソロイシン残基(ATC)がセリン(AGC)に、pEDTrcK−01では365番目のアラニン残基(GCC)がバリン(GTC)にそれぞれ置換されている単変異体であることが明らかになった[()内は、各々のアミノ酸をコードする塩基配列の変化を示す]。
【0075】
(6)単変異体の耐熱性評価
工程(5)で同定された4種類の単変異体エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ(I−2、I−23、J−05、K−01)の耐熱性をより詳細に調べた。単変異体エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを保有する大腸菌4株(JM109/pEDTrcI−2、JM109/pEDTrcI−23、JM109/pEDTrcJ−05、JM109/pEDTrcK−01)、および野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを保有する大腸菌JM109/pEDTrc9003を、LBAmp培地1.5mlに接種して30℃にて8時間振盪培養した後、それぞれの培養液を500ml容の三角フラスコに調製したLBAmp培地40mlに400μlずつ接種し、37℃にて12時間振盪培養した。得られた培養物より1.5mlを採取し、遠心分離により集菌した後、50mMホウ酸緩衝液(pH9.0)で洗浄した後、1.5mlの同緩衝液に懸濁することにより菌体懸濁液を調製した。この菌体懸濁液に対して超音波破砕を行い、粗酵素抽出液を得た。得られた粗酵素抽出液を40℃、45℃、50℃、55℃、60℃、65℃の各温度下、それぞれ30分間熱処理した後、直ちに4℃に冷却した。熱処理後、実施例2記載の方法により、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性の測定を行い、熱処理を行わずに4℃で保冷したものをそれぞれの相対活性値のコントロール(100%)として、残存相対活性を求めた。
【0076】
結果を図5に示す。図5において、縦軸は残存エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を、横軸は処理温度を示す。野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼは50℃で完全に該酵素活性が消失していたのに対し、単変異体I−2、I−23、J−05、K−01はそれぞれ50℃で75%、50℃で85%、60℃で12%、55℃で12%の残存相対活性を保持しており、野生型と比較してこれらの単変異体の耐熱性が向上していることが確認された。
【0077】
[実施例4] 多重変異体の作製と耐熱性評価
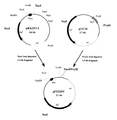
(1) 多重変異体の作製
実施例3で耐熱性の向上が確認された4種類の単変異体におけるアミノ酸残基の置換を組み合わせることにより、多重変異体を作製した。単変異体I−2、I−23、J−05、K−01の変異個所は、それぞれ166番目のイソロイシン残基、120番目のリジン残基、166番目のイソロイシン残基、366位のアラニン残基であり、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子DNA断片を制限酵素EcoT22I、AccI、ClaIで切断することにより、これらの変異個所を各々一つずつ含むDNA断片が得られる(図6)。切断した単変異体のDNA断片を、異なる単変異体由来の対応するDNA断片と置き換えて再連結することにより、二重変異あるいは三重変異を持つキメラ酵素遺伝子を作製した(図6)。例えば、二重変異体Ch−4の作製は、先ず、単変異体I−23をコードする遺伝子を含むpEDTrcI−23を制限酵素NcoIおよびAccIで切断し、切断の結果生じた短いほうのDNA断片(約0.5kb)をアガロースゲル電気泳動により切り出した。同時に、単変異体J−05をコードする遺伝子を含むpEDTrcJ−05を制限酵素NcoIおよびAccIで切断し、切断の結果生じた長いほうのDNA断片(約3.8kb、ベクター含む)をアガロースゲル電気泳動により切り出した。両DNA断片を、DNA PREP(ダイアトロン社製)を用いて回収し、DNA Ligation Kit Ver.1(宝酒造社製)を用いて連結した後、常法に従って大腸菌JM109を形質転換した。得られた形質転換体よりプラスミドを抽出し、制限酵素NcoIおよびAccIで切断した後、アガロースゲル電気泳動により正しく連結されていることを確認し、このプラスミドDNAをpEDTrcCh−4、キメラ酵素をCh−4と命名した。同様に、単変異体I−23由来NcoI−AccI断片(約0.5kb)と、単変異体I−2由来NcoI−AccI断片(約3.8kb、ベクター含む)を連結して得られるプラスミドDNAをpEDTrcCh−6、キメラ酵素をCh−6と命名した。同様な手法により、単変異体J−05由来NcoI−ClaI断片(約1kb)と、単変異体K−01由来NcoI−ClaI断片(約3.3kb、ベクター含む)を連結して得られるプラスミドDNAをpEDTrcCh−1、キメラ酵素をCh−1とし、単変異体I−2由来NcoI−ClaI断片(約1kb)と、単変異体K−01由来NcoI−ClaI断片(約3.3kb、ベクター含む)を連結して得られるプラスミドDNAをpEDTrcCh−2、キメラ酵素をCh−2とした。また、三重変異体についても、単変異体I−23由来NcoI−AccI断片(約0.5kb)と単変異体J−05由来AccI−ClaI断片(約0.5kb)および単変異体K−01由来NcoI−ClaI断片(約3.3kb、ベクター含む)を連結して得られるプラスミドDNAをpEDTrcCh−8、キメラ酵素をCh−8とし、単変異体I−23由来NcoI−AccI断片(約0.5kb)と単変異体I−2由来AccI−ClaI断片(約0.5kb)および単変異体K−01由来NcoI−ClaI断片(約3.3kb、ベクター含む)を連結して得られるプラスミドDNAをpEDTrcCh−10、キメラ酵素をCh−10とした。かくして得られたキメラ酵素の構造を図6に示す。
【0078】
(2) 多重変異体の耐熱性評価
工程(1)で作製した6種類の多重変異体エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ(Ch−4、Ch−6、Ch−1、Ch−2、Ch−8、Ch−10)の耐熱性を調べた。多重変異体エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを保有する大腸菌6株(JM109/ pEDTrcCh−4、JM109 /pEDTrcCh−6、JM109/pEDTrcCh−1、JM109/pEDTrcCh−2、JM109 /pEDTrcCh−8、JM109/ pEDTrcCh−10)、および野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを保有する大腸菌JM109/pEDTrc9003を、LBAmp培地1.5mlに接種して30℃にて8時間振盪培養した後、それぞれの培養液を500ml容の三角フラスコに調製したLBAmp培地40mlに400μlずつ接種し、37℃にて12時間振盪培養した。得られた培養物より1.5mlを採取し、遠心分離により集菌した後、50mMホウ酸緩衝液(pH9.0)で洗浄した後、1.5mlの同緩衝液に懸濁することにより菌体懸濁液を調製した。この菌体懸濁液に対して超音波破砕を行い、粗酵素抽出液を得た。得られた粗酵素抽出液を40℃、45℃、50℃、55℃、60℃、65℃の各温度下、それぞれ30分間熱処理した後、直ちに4℃に冷却した。熱処理後、実施例2記載の方法により、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性の測定を行い、熱処理を行わずに4℃で保冷したものをそれぞれの相対活性値のコントロールとして、残存相対活性を求めた。結果を図7に示す。図7において、縦軸は残存エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を、横軸は処理温度を示す。野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼは50℃で完全に該酵素活性が消失していたのに対し、多重変異体Ch−4、Ch−6、Ch−1、Ch−2、Ch−8、Ch−10はそれぞれ60℃で72%、55℃で89%、60℃で56%、55℃で25%、60℃で90%、55℃で97%の残存相対活性を保持しており、野生型および単変異体と比較してこれら多重変異体の耐熱性が向上していることが確認された。
【0079】
【発明の効果】
本発明により、ブレブンディモナス・ディミニュタ(Brevundimonas diminuta)MR−E001株由来野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼの塩基配列およびアミノ酸配列が提供される。また、野生型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼより誘導された改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼの塩基配列およびアミノ酸配列が提供される。さらには、野生型および改変型エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ遺伝子を含む組換えDNA、該組換えDNAを含む形質転換体または形質導入体、該形質転換体または形質導入体を用いたジアミノアルキレン−N,N’−ジコハク酸の製造法が提供される。本発明により、効率よくジアミノアルキレン−N,N’−ジコハク酸を製造することが可能となる。
【0080】
【配列表】
【0081】
【配列表フリーテキスト】
配列番号1:XaaはMet又は欠失を表す
配列番号3:合成DNA
配列番号4:合成DNA
配列番号5:合成DNA
配列番号6:合成DNA
【図面の簡単な説明】
【図1】プラスミドpEDS9001の制限酵素地図。
【図2】プラスミドpEDS9003の制限酵素地図。
【図3】プラスミドpEDS9020の制限酵素地図。
【図4】発現ベクターpFY529Vの構築図。
【図5】単変異体の耐熱性評価を示す図。
【図6】単変異体および多重変異体の構造を示す模式図。□はT497C(Ile166Thr)の変異を、△はA358G(Lys120Glu)の変異を、○はT497G(Ile166Ser)の変異を、◇はC1094T(Ala365Val)の変異をそれぞれ示す。
【図7】多重変異体の耐熱性評価を示す図。
Claims (53)
- 配列番号1記載のアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、1又は複数のアミノ酸残基が欠失、置換又は付加されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、120番目のリジン残基、166番目のイソロイシン残基及び365番目のアラニン残基のうち少なくとも1つのアミノ酸残基が他のアミノ酸残基に置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がセリンに置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がスレオニンに置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも365番目のアラニン残基がバリンに置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がセリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がスレオニンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がセリンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも166番目のイソロイシン残基がスレオニンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がセリンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 配列番号1記載のアミノ酸配列において、少なくとも120番目のリジン残基がグルタミン酸に、166番目のイソロイシン残基がスレオニンに、365番目のアラニン残基がバリンにそれぞれ置換されたアミノ酸配列から成り、且つ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質。
- 請求項1に記載されたタンパク質をコードする遺伝子DNA。
- 以下の(a)又は(b)の遺伝子DNA。
(a)配列番号2記載の塩基配列から成る遺伝子DNA。
(b)配列番号2記載の塩基配列又はその一部の配列からなるDNAと相補的な配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ、エチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼ活性を有するタンパク質をコードする遺伝子DNA - 請求項2に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、1又は複数の塩基が欠失、置換又は付加された塩基配列から成る請求項16記載の遺伝子DNA。
- 請求項3に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目から360番目、496番目から498番目及び1093番目から1095番目の塩基のうち少なくとも1つの塩基が他の異なる塩基に置換された塩基配列から成る請求項18記載の遺伝子DNA。
- 請求項4に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAGに置換された塩基配列から成る請求項20記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに置換された塩基配列から成る請求項20記載の遺伝子DNA。
- 請求項5に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)に置換された塩基配列から成る請求項23記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、497番目の塩基チミンがグアニンに置換された塩基配列から成る請求項23記載の遺伝子DNA。
- 請求項6に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)に置換された塩基配列から成る請求項26記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、497番目の塩基チミンがシトシンに置換された塩基配列から成る請求項26記載の遺伝子DNA。
- 請求項7に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)に置換された塩基配列から成る請求項29記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、1094番目の塩基シトシンがチミンに置換された塩基配列から成る請求項29記載の遺伝子DNA。
- 請求項8に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAG に、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る請求項32記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがグアニンにそれぞれ置換された塩基配列から成る請求項32記載の遺伝子DNA。
- 請求項9に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAG に、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る請求項35記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがシトシンにそれぞれ置換された塩基配列から成る請求項35記載の遺伝子DNA。
- 請求項10に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る請求項38記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、497番目の塩基チミンがグアニンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る請求項38記載の遺伝子DNA。
- 請求項11に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る請求項41記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、497番目の塩基チミンがシトシンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る請求項41記載の遺伝子DNA。
- 請求項12に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAGに、496番目から498番目の塩基ATCがAGC、AGT又はTCN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る請求項44記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがグアニンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る請求項44記載の遺伝子DNA。
- 請求項13に記載されたタンパク質をコードする遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目から360番目の塩基AAAがGAA又はGAGに、496番目から498番目の塩基ATCがACN(NはA、G、C又はTを表す。)に、1093番目から1095番目の塩基GCCがGTN(NはA、G、C又はTを表す。)にそれぞれ置換された塩基配列から成る請求項47記載の遺伝子DNA。
- 配列番号2記載の塩基配列において、358番目の塩基アデニンがグアニンに、497番目の塩基チミンがシトシンに、1094番目の塩基シトシンがチミンにそれぞれ置換された塩基配列から成る請求項47記載の遺伝子DNA。
- 請求項14〜49いずれか1項に記載の遺伝子DNAをベクターDNAに挿入した組換えDNA。
- 請求項50記載の組換えDNAを含む形質転換体又は形質導入体。
- 請求項51記載の形質転換体又は形質導入体を培養し、得られる培養物からエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼを採取することを特徴とするエチレンジアミン−N,N’−ジコハク酸:エチレンジアミンリアーゼの製造方法。
- フマル酸とジアミンとを、請求項51記載の形質転換体又は形質導入体の存在下で反応させ、得られる反応産物からジアミノアルキレン−N,N’−ジコハク酸を採取することを特徴とするジアミノアルキレン−N,N’−ジコハク酸の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003033932A JP4253195B2 (ja) | 2003-02-12 | 2003-02-12 | 改変型エチレンジアミン−n,n’−ジコハク酸:エチレンジアミンリアーゼ |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003033932A JP4253195B2 (ja) | 2003-02-12 | 2003-02-12 | 改変型エチレンジアミン−n,n’−ジコハク酸:エチレンジアミンリアーゼ |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2004242533A true JP2004242533A (ja) | 2004-09-02 |
| JP2004242533A5 JP2004242533A5 (ja) | 2006-03-30 |
| JP4253195B2 JP4253195B2 (ja) | 2009-04-08 |
Family
ID=33019768
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003033932A Expired - Fee Related JP4253195B2 (ja) | 2003-02-12 | 2003-02-12 | 改変型エチレンジアミン−n,n’−ジコハク酸:エチレンジアミンリアーゼ |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4253195B2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007037354A1 (ja) * | 2005-09-29 | 2007-04-05 | Nippon Shokubai Co., Ltd. | 新規耐酸性改変型s-ヒドロキシニトリルリアーゼ |
| WO2008041272A1 (en) * | 2006-09-29 | 2008-04-10 | Nippon Shokubai Co., Ltd. | Novel highly active modified type s-hydroxynitrile lyase |
| JP2020162539A (ja) * | 2019-03-29 | 2020-10-08 | 三井化学株式会社 | 死菌化微生物の製造方法、s,s−エチレンジアミン−n,n’−ジコハク酸又はその塩の製造方法及び菌体液 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4556568A1 (en) | 2023-11-17 | 2025-05-21 | Basf Se | Biocatalytical methods for producing ethylenediamine-n,n'-disuccinic acid |
-
2003
- 2003-02-12 JP JP2003033932A patent/JP4253195B2/ja not_active Expired - Fee Related
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007037354A1 (ja) * | 2005-09-29 | 2007-04-05 | Nippon Shokubai Co., Ltd. | 新規耐酸性改変型s-ヒドロキシニトリルリアーゼ |
| JP2007089513A (ja) * | 2005-09-29 | 2007-04-12 | Nippon Shokubai Co Ltd | 新規耐酸性改変型s−ヒドロキシニトリルリアーゼ |
| WO2008041272A1 (en) * | 2006-09-29 | 2008-04-10 | Nippon Shokubai Co., Ltd. | Novel highly active modified type s-hydroxynitrile lyase |
| JP2020162539A (ja) * | 2019-03-29 | 2020-10-08 | 三井化学株式会社 | 死菌化微生物の製造方法、s,s−エチレンジアミン−n,n’−ジコハク酸又はその塩の製造方法及び菌体液 |
| JP7362999B2 (ja) | 2019-03-29 | 2023-10-18 | 三井化学株式会社 | 死菌化微生物の製造方法、s,s-エチレンジアミン-n,n’-ジコハク酸又はその塩の製造方法及び菌体液 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP4253195B2 (ja) | 2009-04-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN100357431C (zh) | 新的赖氨酸脱羧酶基因以及生产l-赖氨酸的方法 | |
| US7803578B2 (en) | Heat-resistant nitrile hydratase | |
| CN110831959B (zh) | 新型多肽及使用其产生imp的方法 | |
| JP4561010B2 (ja) | D−ヒダントインハイドロラーゼをコードするdna、n−カルバミル−d−アミノ酸ハイドロラーゼをコードするdna、該遺伝子を含む組み換えdna、該組み換えdnaにより形質転換された細胞、該形質転換細胞を用いるタンパク質の製造方法、および、d−アミノ酸の製造方法 | |
| JP2020535787A (ja) | 新規なアデニロコハク酸シンテターゼ及びこれを用いたプリンヌクレオチドの製造方法 | |
| JP2001037494A (ja) | 変異型イソプロピルマレートシンターゼをコードするdna、l−ロイシン生産性微生物、および、l−ロイシンの製造法 | |
| JP2010284170A (ja) | 新規アルドラーゼおよび置換α−ケト酸の製造方法 | |
| JPWO1994003613A1 (ja) | 耐熱性の向上したデカルバミラーゼをコードするdnaおよびその用途 | |
| JP2001046067A (ja) | 好熱性バチルス属細菌由来のl−リジン生合成系遺伝子 | |
| KR102434925B1 (ko) | 3-메틸-2-옥소뷰타노에이트 하이드록시 메틸트랜스퍼라아제의 활성이 강화된 미생물, 및 이의 용도 | |
| US9212356B2 (en) | Modified ethylenediamine-N,N′-disuccinate:ethylenediamine lyase | |
| CN117098842A (zh) | 具有增强的3-甲基-2-氧代丁酸羟甲基转移酶活性的微生物及其用途 | |
| JP4253195B2 (ja) | 改変型エチレンジアミン−n,n’−ジコハク酸:エチレンジアミンリアーゼ | |
| JP4561009B2 (ja) | D−ヒダントインハイドロラーゼをコードするdna、n−カルバミル−d−アミノ酸ハイドロラーゼをコードするdna、該遺伝子を含む組み換えdna、該組み換えdnaにより形質転換された細胞、該形質転換細胞を用いるタンパク質の製造方法、および、d−アミノ酸の製造方法 | |
| JP2004215513A (ja) | 改良型ニトリルヒドラターゼ | |
| JP2004222538A (ja) | 改良型ニトリルヒドラターゼ | |
| JPWO2001071021A1 (ja) | 発酵法によるl−アミノ酸の製造方法 | |
| CN115175993A (zh) | 柠檬酸合酶活性减弱的新型修饰多肽及使用其生产l-氨基酸的方法 | |
| JP2003189863A (ja) | アスパラギン酸アミド並びにその誘導体の製造方法 | |
| JP2007189949A (ja) | 新規ヒダントイナーゼ及び光学活性アミノ酸誘導体の製造方法 | |
| CA3215115A1 (en) | Mutant spot protein and method for producing l-amino acids using same | |
| KR20240000168A (ko) | L-히스티딘 배출 단백질 및 이를 이용한 l-히스티딘 생산 방법 | |
| CN101300360A (zh) | 突变体扩环酶及其在β-内酰胺化合物生产中的用途 | |
| JPH04325086A (ja) | セラチア属に属する形質転換微生物及びそれを用いるビオチンの製造方法 | |
| JP2004242564A (ja) | メチロフィラス属細菌のベクター |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060209 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060209 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081014 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081211 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090113 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090123 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 4253195 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120130 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130130 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130130 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130130 Year of fee payment: 4 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130130 Year of fee payment: 4 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130130 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |