式(1)で示される化合物の式中、R1は水素原子、直鎖状、分岐状もしくは環状のアルキル基または置換もしくは無置換のアリール基を表わす。
R1で表される直鎖状、分岐状もしくは環状のアルキル基としては、例えばメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、シクロヘキシル基、n−ヘプチル基、n−オクチル基、n−デシル基、メンチル基、ウンデシル基、ドデシル基、トリデシル基、テトラデシル基、ペンタデシル基等の直鎖状、分枝鎖状もしくは環状の炭素数1〜15のアルキル基が挙げられる。
R1で表される置換もしくは無置換のアリール基としては、例えばフェニル基、ナフチル基等の無置換のアリール基およびこれらアリール基の芳香環の一つまたは二つ以上の水素原子が、例えば上記したアルキル基、例えばフッ素原子、塩素原子等のハロゲン原子、例えばメトキシ基、エトキシ基等のアルコキシ基、例えばフェニル基等のアリール基、例えばフェノキシ基等のアリールオキシ基、例えばメトキシカルボニル基等のアルコキシカルボニル基等の置換基で置換された、例えば4−メチルフェニル基、2,6−ジ(tert−ブチル)−4−メチルフェニル基、4−フェニルオキシフェニル基等が挙げられる。
式(1)の式中、R2およびR3は同一または相異なって、水素原子またはメチル基を表わす。R4は少なくとも一つの置換もしくは無置換のアリール基で置換された炭素数1〜2のアルキル基を表わす。
R4で表わされる、少なくとも一つの置換もしくは無置換のアリール基で置換された炭素数1〜2のアルキル基としては、上記した置換もしくは無置換のアリール基で少なくとも一つの水素原子が置換されたメチル基もしくはエチル基が例示され、具体例としては、例えばベンジル基、4−メトキシベンジル基、2,4−ジメトキシベンジル基、4−クロロベンジル基、4−ブロモベンジル基、2,6−ジクロロベンジル基、3−フェノキシベンジル基、4−フェニルベンジル基、ジフェニルメチル基、トリチル基、(4−メトキシフェニル)ジフェニルメチル基、ジ(4−メトキシフェニル)フェニルメチル基、トリ(4−メトキシフェニル)メチル基、2,3,5,6−テトラフルオロベンジル基、2,3,5,6−テトラフルオロ−4−メチルベンジル基、2,3,5,6−テトラフルオロ−4−メトキシメチルベンジル基等が挙げられる。
式(1)で示される化合物には、−CO2R1で示される基と−CH2OR4で示される基が、シクロプロパン環平面に対して、同じ側にあるシス体と反対側にあるトランス体が存在するが、本発明には、シス体もしくはトランス体のいずれか一方を用いてもよいし、それらの任意の割合の混合物を用いてもよい。また、式(1)で示される化合物は、不斉炭素原子を有しているため、光学異性体が存在するが、本発明には、いずれか一つの光学異性体を用いてもよいし、二つ以上の光学異性体の任意の割合の混合物を用いてもよい。
かかる式(1)で示される化合物は、例えば対応するオレフィン類とジアゾ酢酸エステル類とを、金属触媒の存在下に反応させる公知の方法(例えばTetrahedron,2001,57,6083−6088等)に準じた方法により製造することができる。
かかる式(1)で示される化合物としては、例えば2−(ベンジルオキシメチル)シクロプロパンカルボン酸、2−[(4−メトキシベンジルオキシ)メチル]シクロプロパンカルボン酸、2−[(2,4−ジメトキシベンジルオキシ)メチル]シクロプロパンカルボン酸、2−[(4−クロロベンジルオキシ)メチル]シクロプロパンカルボン酸、2−[(4−ブロモベンジルオキシ)メチル]シクロプロパンカルボン酸、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸、2−[(4−フェニルベンジルオキシ)メチル]シクロプロパンカルボン酸、2−[(ジフェニルメトキシ)メチル]シクロプロパンカルボン酸、2−(トリチルオキシメチル)シクロプロパンカルボン酸、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]シクロプロパンカルボン酸、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]シクロプロパンカルボン酸、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]シクロプロパンカルボン酸、
2−(ベンジルオキシメチル)シクロプロパンカルボン酸メチル、2−[(4−メトキシベンジルオキシ)メチル]シクロプロパンカルボン酸メチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]シクロプロパンカルボン酸メチル、2−[(4−クロロベンジルオキシ)メチル]シクロプロパンカルボン酸メチル、2−[(4−ブロモベンジルオキシ)メチル]シクロプロパンカルボン酸メチル、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸メチル、2−[(4−フェニルベンジルオキシ)メチル]シクロプロパンカルボン酸メチル、2−[(ジフェニルメトキシ)メチル]シクロプロパンカルボン酸メチル、2−(トリチルオキシメチル)シクロプロパンカルボン酸メチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]シクロプロパンカルボン酸メチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]シクロプロパンカルボン酸メチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]シクロプロパンカルボン酸メチル、
2−(ベンジルオキシメチル)シクロプロパンカルボン酸エチル、2−[(4−メトキシベンジルオキシ)メチル]シクロプロパンカルボン酸エチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]シクロプロパンカルボン酸エチル、2−[(4−クロロベンジルオキシ)メチル]シクロプロパンカルボン酸エチル、2−[(4−ブロモベンジルオキシ)メチル]シクロプロパンカルボン酸エチル、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸エチル、2−[(4−フェニルベンジルオキシ)メチル]シクロプロパンカルボン酸エチル、2−[(ジフェニルメトキシ)メチル]シクロプロパンカルボン酸エチル、2−(トリチルオキシメチル)シクロプロパンカルボン酸エチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]シクロプロパンカルボン酸エチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]シクロプロパンカルボン酸エチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]シクロプロパンカルボン酸エチル、
2−(ベンジルオキシメチル)シクロプロパンカルボン酸tert−ブチル、2−[(4−メトキシベンジルオキシ)メチル]シクロプロパンカルボン酸tert−ブチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]シクロプロパンカルボン酸tert−ブチル、2−[(4−クロロベンジルオキシ)メチル]シクロプロパンカルボン酸tert−ブチル、2−[(4−ブロモベンジルオキシ)メチル]シクロプロパンカルボン酸tert−ブチル、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸tert−ブチル、2−[(4−フェニルベンジルオキシ)メチル]シクロプロパンカルボン酸tert−ブチル、2−[(ジフェニルメトキシ)メチル]シクロプロパンカルボン酸tert−ブチル、2−(トリチルオキシメチル)シクロプロパンカルボン酸tert−ブチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]シクロプロパンカルボン酸tert−ブチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]シクロプロパンカルボン酸tert−ブチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]シクロプロパンカルボン酸tert−ブチル、
2−(ベンジルオキシメチル)シクロプロパンカルボン酸シクロヘキシル、2−[(4−メトキシベンジルオキシ)メチル]シクロプロパンカルボン酸シクロヘキシル、2−[(2,4−ジメトキシベンジルオキシ)メチル]シクロプロパンカルボン酸シクロヘキシル、2−[(4−クロロベンジルオキシ)メチル]シクロプロパンカルボン酸シクロヘキシル、2−[(4−ブロモベンジルオキシ)メチル]シクロプロパンカルボン酸シクロヘキシル、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸シクロヘキシル、2−[(4−フェニルベンジルオキシ)メチル]シクロプロパンカルボン酸シクロヘキシル、2−[(ジフェニルメトキシ)メチル]シクロプロパンカルボン酸シクロヘキシル、2−(トリチルオキシメチル)シクロプロパンカルボン酸シクロヘキシル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]シクロプロパンカルボン酸シクロヘキシル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]シクロプロパンカルボン酸シクロヘキシル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]シクロプロパンカルボン酸シクロヘキシル、
2−(ベンジルオキシメチル)シクロプロパンカルボン酸メンチル、2−[(4−メトキシベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(4−クロロベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(4−ブロモベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(4−フェニルベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(ジフェニルメトキシ)メチル]シクロプロパンカルボン酸メンチル、2−(トリチルオキシメチル)シクロプロパンカルボン酸メンチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]シクロプロパンカルボン酸メンチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]シクロプロパンカルボン酸メンチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]シクロプロパンカルボン酸メンチル、
2−(ベンジルオキシメチル)シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−メトキシベンジルオキシ)メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(2,4−ジメトキシベンジルオキシ)メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−クロロベンジルオキシ)メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−ブロモベンジルオキシ)メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−フェニルベンジルオキシ)メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(ジフェニルメトキシ)メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−(トリチルオキシメチル)シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、
2−(ベンジルオキシメチル)−3−メチルシクロプロパンカルボン酸、2−[(4−メトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸、2−[(4−ニトロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸、2−[(4−クロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸、2−[(4−ブロモベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸、2−[(2,6−ジクロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸、2−[(4−フェニルベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸、2−[(ジフェニルメトキシ)メチル]−3−メチルシクロプロパンカルボン酸、2−(トリチルオキシメチル)−3−メチルシクロプロパンカルボン酸、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3−メチルシクロプロパンカルボン酸、
2−(ベンジルオキシメチル)−3−メチルシクロプロパンカルボン酸メチル、2−[(4−メトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[(4−クロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[(4−ブロモベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[(4−フェニルベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[(ジフェニルメトキシ)メチル]−3−メチルシクロプロパンカルボン酸メチル、2−(トリチルオキシメチル)−3−メチルシクロプロパンカルボン酸メチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸メチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3−メチルシクロプロパンカルボン酸メチル、
2−(ベンジルオキシメチル)−3−メチルシクロプロパンカルボン酸エチル、2−[(4−メトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[(4−クロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[(4−ブロモベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[(4−フェニルベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[(ジフェニルメトキシ)メチル]−3−メチルシクロプロパンカルボン酸エチル、2−(トリチルオキシメチル)−3−メチルシクロプロパンカルボン酸エチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸エチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3−メチルシクロプロパンカルボン酸エチル、
2−(ベンジルオキシメチル)−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[(4−メトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[(4−クロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[(4−ブロモベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[(4−フェニルベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[(ジフェニルメトキシ)メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−(トリチルオキシメチル)−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3−メチルシクロプロパンカルボン酸tert−ブチル、
2−(ベンジルオキシメチル)−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−メトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−クロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−ブロモベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−フェニルベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[(ジフェニルメトキシ)メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−(トリチルオキシメチル)−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3−メチルシクロプロパンカルボン酸シクロヘキシル、
2−(ベンジルオキシメチル)−3−メチルシクロプロパンカルボン酸メンチル、2−[(4−メトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−[(4−クロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−[(4−ブロモベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(4−フェニルベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−[(ジフェニルメトキシ)メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−(トリチルオキシメチル)−3−メチルシクロプロパンカルボン酸メンチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸メンチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3−メチルシクロプロパンカルボン酸メンチル、
2−(ベンジルオキシメチル)−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−メトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−クロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−ブロモベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(2,6−ジクロロベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−フェニルベンジルオキシ)メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(ジフェニルメトキシ)メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−(トリチルオキシメチル)−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、
2−(ベンジルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸、2−[(4−メトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[(4−クロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[(4−ブロモベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[(2,6−ジクロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[(4−フェニルベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[(ジフェニルメトキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−(トリチルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸、
2−(ベンジルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[(4−メトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[(4−クロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[(4−ブロモベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[(4−フェニルベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[(ジフェニルメトキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−(トリチルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸メチル、
2−(ベンジルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[(4−メトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[(4−クロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[(4−ブロモベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[(4−フェニルベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[(ジフェニルメトキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−(トリチルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸エチル、
2−(ベンジルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[(4−メトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[(4−クロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[(4−ブロモベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[(4−フェニルベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[(ジフェニルメトキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−(トリチルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸tert−ブチル、
2−(ベンジルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−メトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−クロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−ブロモベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[(2,6−ジクロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[(4−フェニルベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[(ジフェニルメトキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−(トリチルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸シクロヘキシル、
2−(ベンジルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[(4−メトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[(4−クロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[(4−ブロモベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[(2,6−ジクロロベンジルオキシ)メチル]シクロプロパンカルボン酸メンチル、2−[(4−フェニルベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[(ジフェニルメトキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−(トリチルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸メンチル、
2−(ベンジルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−メトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(2,4−ジメトキシベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−クロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−ブロモベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(2,6−ジクロロベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(4−フェニルベンジルオキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[(ジフェニルメトキシ)メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−(トリチルオキシメチル)−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[(4−メトキシフェニル)ジフェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[ジ(4−メトキシフェニル)フェニルメトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、2−[[トリ(4−メトキシフェニル)メトキシ]メチル]−3,3−ジメチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]等が挙げられる。
遷移金属触媒としては、例えばルテニウム触媒、コバルト触媒、ロジウム触媒、ニッケル触媒、パラジウム触媒、白金触媒等の周期律表第8,9または10族金属触媒が挙げられる。かかる遷移金属触媒は、例えば活性炭、アルミナ、シリカ等の担体に担持された不均一系触媒であってもよいし、例えば種々の配位子が配位した均一系触媒であってもよい。
ルテニウム触媒としては、例えばルテニウム/アルミナ、ルテニウム/炭素、クロロトリス(トリフェニルホスフィン)ルテニウム等が挙げられ、コバルト触媒としては、例えばラネーコバルト等が挙げられる。ロジウム触媒としては、例えばロジウム/アルミナ、ロジウム/炭素、クロロトリス(トリフェニルホスフィン)ロジウム等が挙げられ、ニッケル触媒としては、例えばラネーニッケル、ニッケル/炭素、ニッケル/シリカ・アルミナ、テトラキス(トリフェニルホスフィン)ニッケル、ビス(シクロオクタジエン)ニッケル等が挙げられる。パラジウム触媒としては、例えばパラジウム/炭素、パラジウム/アルミナ、テトラキス(トリフェニルホスフィン)パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、水酸化パラジウム/炭素等が挙げられ、白金触媒としては、例えば白金/炭素、白金/アルミナ、テトラキス(トリフェニルホスフィン)白金、ビス(シクロオクタジエン)白金等が挙げられる。なかでも、ニッケル触媒、パラジウム触媒が好ましく、ラネーニッケル、パラジウム/炭素がより好ましい。
かかる遷移金属触媒は、市販品をそのまま用いてもよいし、公知の方法により調製したものを用いてもよい。
かかる遷移金属触媒の使用量は、式(1)で示される化合物に対して、通常0.01〜100モル%程度の範囲である。
水素供与体としては、例えば水素、ギ酸、ギ酸アンモニウム、シクロヘキセン、シクロヘキサジエン、イソプロピルアルコール等が挙げられ、中でも水素、ギ酸が好ましい。水素供与体はそのまま用いてもよいし、例えば後述する溶媒に溶解もしくは懸濁させて用いてもよい。また、かかる水素供与体は、それぞれ単独で用いてもよいし、混合して用いてもよい。
かかる水素供与体の使用量は、式(1)で示される化合物に対して、通常1モル倍以上であり、その上限は特に制限されない。
本反応は、通常遷移金属触媒、式(1)で示される化合物および水素供与体を接触、混合させることにより実施され、その混合順序は特に制限されない。また、反応は、常圧条件下で行なってもよいし、加圧条件下で行なってもよい。
本反応は、無溶媒で実施してもよいし、溶媒中で実施してもよい。溶媒としては、反応に不活性な溶媒であれば特に制限されず、例えばメタノール、エタノール、イソプロピルアルコール等のアルコール溶媒、トルエン、キシレン、メシチレン等の芳香族炭化水素溶媒、例えばジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタン等のハロゲン化炭化水素溶媒、例えばジエチルエーテル、ジイソプロピルエーテル、メチルtert−ブチルエーテル等のエーテル溶媒、水等の単独または混合溶媒が挙げられ、その使用量は、特に制限されない。
反応温度は、通常0℃〜100℃程度である。
遷移金属触媒として、不均一系触媒を用いた場合には、例えば反応液から、該触媒を濾別した後、濃縮処理することにより、目的とする式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物を取り出すことができる。また遷移金属触媒として、均一系触媒を用いた場合には、例えば反応液を蒸留処理することにより、式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物を取り出すことができる。取り出した式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物は、例えば蒸留、カラムクロマトグラフィー等の通常の精製手段により、さらに精製してもよい。
式(1)で示される化合物として、シス体とトランス体の混合物を用いた場合には、そのシス体/トランス体比が保持された式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物が得られ、また式(1)で示される化合物として、光学活性体を用いた場合には、その立体が保持された式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物の光学活性体が得られる。
かくして得られる式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物としては、例えば2−(ヒドロキシメチル)シクロプロパンカルボン酸、2−(ヒドロキシメチル)シクロプロパンカルボン酸メチル、2−(ヒドロキシメチル)シクロプロパンカルボン酸エチル、2−(ヒドロキシメチル)シクロプロパンカルボン酸tert−ブチル、2−(ヒドロキシメチル)シクロプロパンカルボン酸シクロヘキシル、2−(ヒドロキシメチル)シクロプロパンカルボン酸メンチル、2−(ヒドロキシメチル)シクロプロパンカルボン酸メチル、2−(ヒドロキシメチル)シクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、
2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸、2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸メチル、2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸エチル、2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸tert−ブチル、2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸メンチル、2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸メチル、2−ヒドロキシメチル−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、
2−ヒドロキシメチル−3,3−ジメチルシクロプロパンカルボン酸、2−ヒドロキシメチル−3,3−メチルシクロプロパンカルボン酸メチル、2−ヒドロキシメチル−3,3−メチルシクロプロパンカルボン酸エチル、2−ヒドロキシメチル−3,3−メチルシクロプロパンカルボン酸tert−ブチル、2−ヒドロキシメチル−3,3−メチルシクロプロパンカルボン酸シクロヘキシル、2−ヒドロキシメチル−3,3−メチルシクロプロパンカルボン酸メンチル、2−ヒドロキシメチル−3,3−メチルシクロプロパンカルボン酸メチル、2−ヒドロキシメチル−3,3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]等が挙げられる。
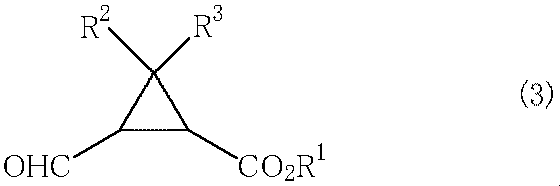
かくして得られる式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物は、さらに酸化剤と反応させることにより式(3)
(式中、R
1、R
2およびR
3は上記と同一の意味を表わす。)
で示される2−ホルミルシクロプロパンカルボン酸化合物を製造することができる。酸化剤としては特に限定されず、例えばSwern酸化(例えばTetrahedron,2001,57,6083−6088参照。)において用いる酸化剤やクロロクロム酸ピリジニウム(例えばTetrahedron:Asymmetry,1995,6,683−684参照。)を例示することができるが、特願2003−196277に記載の方法が好ましい酸化反応として例示される。
かかる好ましい酸化反応とは、ニトロキシラジカル誘導体の存在下に式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物と次亜ハロゲン酸塩、N−ハロスクシンイミド、トリクロロイソシアヌル酸およびヨウ素からなる群から選ばれる少なくとも一種の酸化剤との反応が挙げられる。
ニトロキシラジカル誘導体としては、例えば2,2,6,6−テトラメチルピペリジン−1−オキシル、4−アセトキシ−2,2,6,6−テトラメチルピペリジン−1−オキシル、4−プロピオニルオキシ−2,2,6,6−テトラメチルピペリジン−1−オキシル、4−ベンゾイルオキシ−2,2,6,6−テトラメチルピペリジン−1−オキシル、4−メトキシ−2,2,6,6−テトラメチルピペリジン−1−オキシル、4−エトキシ−2,2,6,6−テトラメチルピペリジン−1−オキシル、4−ベンジルオキシ−2,2,6,6−テトラメチルピペリジン−1−オキシル、4−アセトアミド−2,2,6,6−テトラメチルピペリジン−1−オキシル、4−オキソ−2,2,6,6−テトラメチルピペリジン−1−オキシル、2,2,5,5−テトラメチルピロリジン−1−オキシル等が挙げられる。
ニトロキシラジカル誘導体の使用量は特に限定されず、例えば当量でもよいが、好ましくは、式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物に対して当量より少ない触媒量でよく、例えば0.01〜10mol%程度でもよい。
本発明には、次亜ハロゲン酸塩、N−ハロスクシンイミド、トリクロロイソシアヌル酸およびヨウ素からなる群から選ばれる少なくとも一種の酸化剤(以下、酸化剤と略記する。)が用いられる。
次亜ハロゲン酸塩としては、例えば次亜塩素酸ナトリウム、次亜塩素酸カリウム、次亜塩素酸カルシウム、次亜臭素酸ナトリウム等の次亜ハロゲン酸のアルカリ金属塩またはアルカリ土類金属塩が挙げられる。N−ハロスクシンイミドとしては、例えばN−クロロスクシンイミド、N−ブロモスクシンイミド等が挙げられる。かかる酸化剤の中でも、次亜ハロゲン酸アルカリ金属塩が好ましく、中でも次亜塩素酸ナトリウムが特に好ましい。
かかる酸化剤は、それぞれ単独で用いてもよいし、混合して用いてもよい。また、そのまま用いてもよいし、例えば水溶液として用いてもよい。
かかる酸化剤の使用量は、式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物に対して、通常1〜5モル倍、好ましくは1.5〜4モル倍程度の範囲である。
本反応は、通常ニトロキシラジカル、式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物および酸化剤を、接触、混合させることにより実施され、その混合順序は特に制限されない。
本反応は、通常は反応系内のpHをpH6〜13、好ましくはpH6〜10、より好ましくはpH8〜10の範囲に保って行われる。反応系内のpHを制御するため、例えば、鉱酸、有機酸等の酸、炭酸塩、炭酸水素塩、アルカリ金属もしくはアルカリ土類金属の水酸化物、アルカリ金属もしくはアルカリ土類金属の炭酸塩等の塩基、リン酸塩またはリン酸水素塩等あるいは上記の酸、塩基、リン酸塩およびリン酸水素塩から選ばれる任意の混合物、あるいは上記のpH範囲を保つのに適当な緩衝液が用いられる。
ここで、鉱酸としては、例えば塩酸、硫酸、リン酸、ホウ酸等が挙げられ、有機酸としては、例えば酢酸、プロピオン酸、安息香酸、クエン酸、p−トルエンスルホン酸等が挙げられる。炭酸塩としては、例えば炭酸ナトリウム、炭酸カリウム等のアルカリ金属炭酸塩が挙げられ、炭酸水素塩としては、例えば炭酸水素ナトリウム、炭酸水素カリウム等のアルカリ金属炭酸水素塩が挙げられ、リン酸塩としては、例えばリン酸ナトリウム、リン酸カリウム等のアルカリ金属リン酸塩、リン酸水素二ナトリウム、リン酸二水素ナトリウム、リン酸水素二カリウム、リン酸二水素カリウム等のアルカリ金属リン酸水素塩が挙げられる。
好ましくは、炭酸水素塩(より好ましくは、例えば炭酸水素ナトリウム)あるいはリン酸水素塩(より好ましくは、例えばリン酸ニ水素カリウム、リン酸ニ水素ナトリウム等のアルカリ金属のリン酸ニ水素塩)が用いられる。
かかる酸、塩基、リン酸塩、リン酸水素塩等あるいはこれらの混合物は、そのまま用いてもよいし、例えば水溶液として用いてもよい。
酸、塩基、リン酸塩、リン酸水素塩等あるいはこれらの混合物は、反応系の水層のpHを前記のpH範囲に保つのに必要な量を適宜用いればよく、その添加方法としては特に限定されないが、逐次反応系内に加えたり一括して加えるなどの方法を適宜選択することができる。
本反応は、例えば式(2)で示される2−(ヒドロキシメチル)シクロプロパンカルボン酸化合物が液体である場合には、無溶媒で実施してもよいが、通常は溶媒の存在下で実施される。溶媒としては、反応に不活性な溶媒であれば特に制限されず、例えばトルエン、キシレン、メシチレン等の芳香族炭化水素系溶媒、例えばジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタン等のハロゲン化炭化水素系溶媒、例えばジエチルエーテル、ジイソプロピルエーテル、メチルtert−ブチルエーテル等のエーテル系溶媒、例えばメチルイソブチルケトン、メチルtert−ブチルケトン等のケトン系溶媒、水等の単独または混合溶媒が挙げられる。かかる溶媒の使用量は、特に制限されない。
また、溶媒として、例えば水と水に不溶の有機溶媒を用いたとき等の水と有機溶媒の二相系で反応を実施する場合は、相間移動触媒を反応系に共存させてもよい。相間移動触媒としては、例えばテトラ(n−ブチル)アンモニウムブロミド、テトラ(n−ブチル)アンモニウムクロリド、ベンジルトリエチルアンモニウムクロリド、テトラエチルアンモニウムクロリド等の第四級アンモニウムハロゲン化物等が挙げられる。
反応温度は、通常−5〜80℃であり、好ましくは0〜50℃程度の範囲である。
反応終了後、例えば反応液中に残存する酸化剤を、例えばチオ硫酸ナトリウム等の還元剤で分解処理した後、必要に応じて水および/または水に不溶の有機溶媒を加え、抽出処理することにより、目的とする式(3)で示される2−ホルミルシクロプロパンカルボン酸化合物を含む有機層が得られ、該有機層を濃縮処理することにより、式(3)で示される2−ホルミルシクロプロパンカルボン酸化合物を取り出すことができる。取り出した式(3)で示される2−ホルミルシクロプロパンカルボン酸化合物は、例えば蒸留、カラムクロマトグラフィー等の通常の精製手段により、さらに精製してもよい。
かくして得られる式(3)で示される2−ホルミルシクロプロパンカルボン酸化合物としては、例えば2−ホルミルシクロプロパンカルボン酸、2−ホルミルシクロプロパンカルボン酸メチル、2−ホルミルシクロプロパンカルボン酸エチル、2−ホルミルシクロプロパンカルボン酸tert−ブチル、2−ホルミルシクロプロパンカルボン酸シクロヘキシル、2−ホルミルシクロプロパンカルボン酸メンチル、2−ホルミルシクロプロパンカルボン酸メチル、2−ホルミルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、
2−ホルミル−3−メチルシクロプロパンカルボン酸、2−ホルミル−3−メチルシクロプロパンカルボン酸メチル、2−ホルミル−3−メチルシクロプロパンカルボン酸エチル、2−ホルミル−3−メチルシクロプロパンカルボン酸tert−ブチル、2−ホルミル−3−メチルシクロプロパンカルボン酸シクロヘキシル、2−ホルミル−3−メチルシクロプロパンカルボン酸メンチル、2−ホルミル−3−メチルシクロプロパンカルボン酸メチル、2−ホルミル−3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]、
2−ホルミル−3,3−ジメチルシクロプロパンカルボン酸、2−ホルミル−3,3−メチルシクロプロパンカルボン酸メチル、2−ホルミル−3,3−メチルシクロプロパンカルボン酸エチル、2−ホルミル−3,3−メチルシクロプロパンカルボン酸tert−ブチル、2−ホルミル−3,3−メチルシクロプロパンカルボン酸シクロヘキシル、2−ホルミル−3,3−メチルシクロプロパンカルボン酸メンチル、2−ホルミル−3,3−メチルシクロプロパンカルボン酸メチル、2−ホルミル−3,3−メチルシクロプロパンカルボン酸[2,6−ジ(tert−ブチル)−4−メチルフェニル]等が挙げられる。