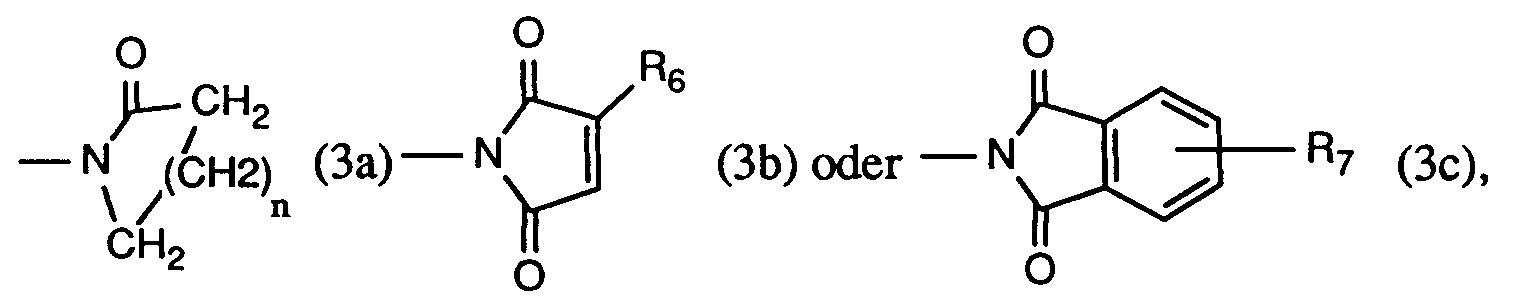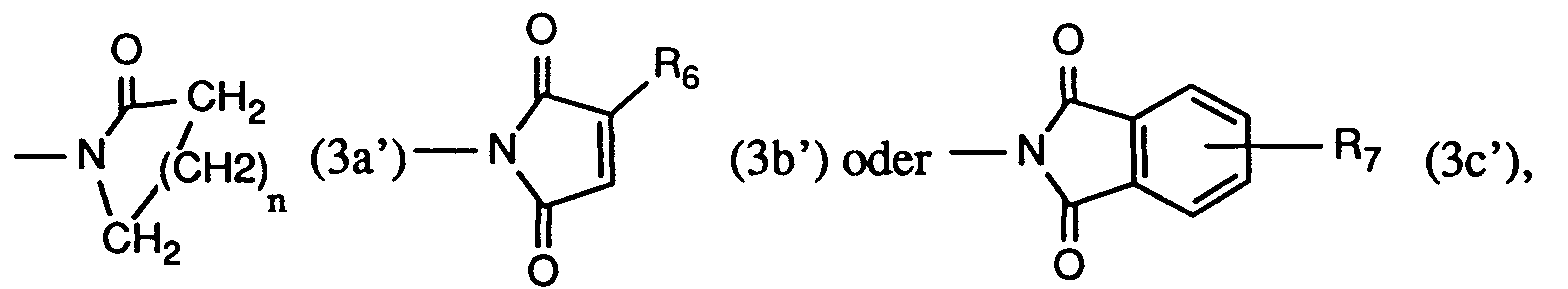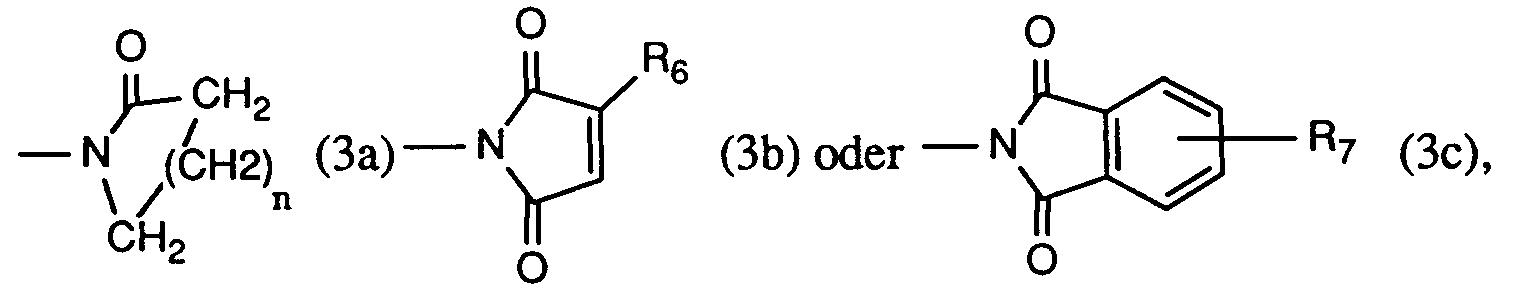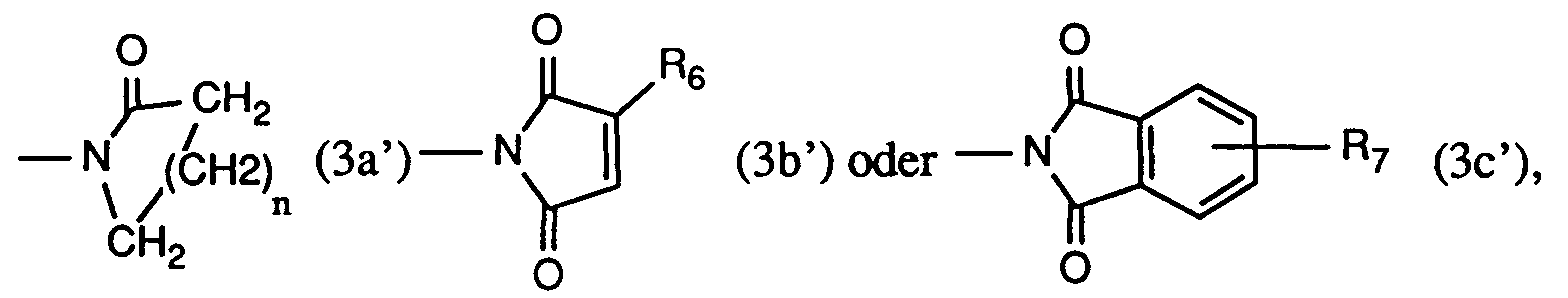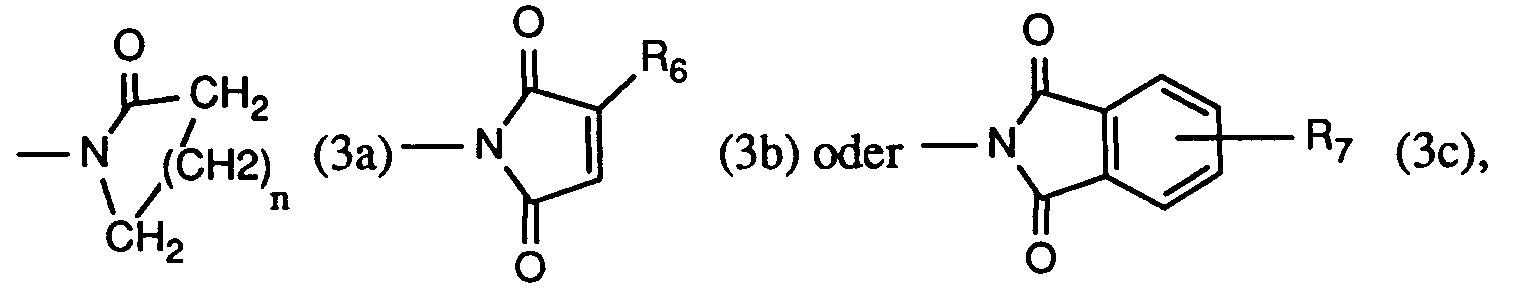EP0657577A1 - Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien - Google Patents
Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien Download PDFInfo
- Publication number
- EP0657577A1 EP0657577A1 EP94810674A EP94810674A EP0657577A1 EP 0657577 A1 EP0657577 A1 EP 0657577A1 EP 94810674 A EP94810674 A EP 94810674A EP 94810674 A EP94810674 A EP 94810674A EP 0657577 A1 EP0657577 A1 EP 0657577A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- alkyl
- hydrogen
- formula
- phenyl
- alkoxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
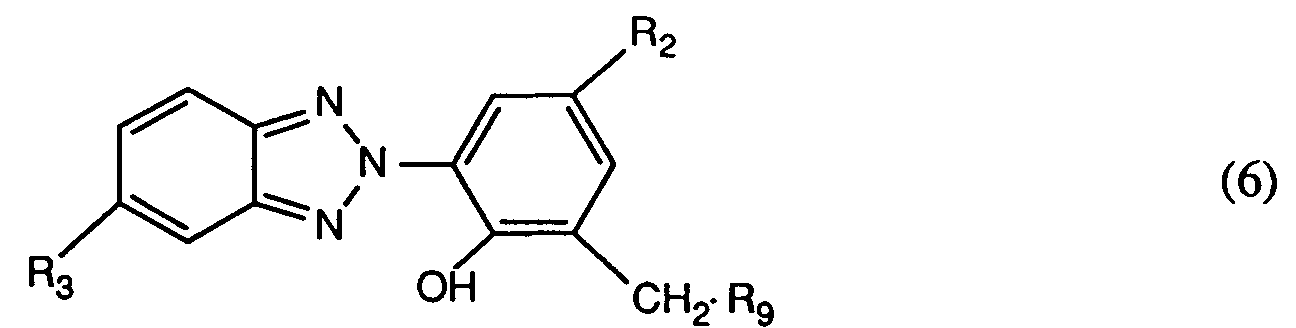
- 0 *Cc(cc(*)cc1-[n]2nc(cc(*)cc3)c3n2)c1O Chemical compound *Cc(cc(*)cc1-[n]2nc(cc(*)cc3)c3n2)c1O 0.000 description 8
- SECXISVLQFMRJM-UHFFFAOYSA-N CN(CCC1)C1=O Chemical compound CN(CCC1)C1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P1/00—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed
- D06P1/44—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders
- D06P1/64—General processes of dyeing or printing textiles, or general processes of dyeing leather, furs, or solid macromolecular substances in any form, classified according to the dyes, pigments, or auxiliary substances employed using insoluble pigments or auxiliary substances, e.g. binders using compositions containing low-molecular-weight organic compounds without sulfate or sulfonate groups
- D06P1/642—Compounds containing nitrogen
- D06P1/6426—Heterocyclic compounds
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06M—TREATMENT, NOT PROVIDED FOR ELSEWHERE IN CLASS D06, OF FIBRES, THREADS, YARNS, FABRICS, FEATHERS OR FIBROUS GOODS MADE FROM SUCH MATERIALS
- D06M13/00—Treating fibres, threads, yarns, fabrics or fibrous goods made from such materials, with non-macromolecular organic compounds; Such treatment combined with mechanical treatment
- D06M13/322—Treating fibres, threads, yarns, fabrics or fibrous goods made from such materials, with non-macromolecular organic compounds; Such treatment combined with mechanical treatment with compounds containing nitrogen
- D06M13/35—Heterocyclic compounds
- D06M13/352—Heterocyclic compounds having five-membered heterocyclic rings
Definitions
- the present invention relates to a process for the photochemical and thermal stabilization of undyed and dyed or printed polyester fiber materials.
- Undyed and dyed or printed polyester fiber materials are damaged under the influence of light and especially when exposed to heat.
- effective protection of undyed and dyed or printed fiber materials from UV radiation is essential.
- the present invention accordingly relates to a process for the photochemical and thermal stabilization of undyed and dyed or printed polyester fiber materials, which is characterized in that the fiber material is treated with at least one compound of the formula treated in what R1 the rest of the formula R2 and R'2 are each independently hydrogen, C1-C12-alkyl, C5-C7-cycloalkyl, (C1-C8-alkyl) -phenyl, phenyl, C7-C9-phenylalkyl or C1-C4-alkoxy, and R3 is hydrogen or halogen, R4 is hydrogen or C1-C4 alkyl, and R5 C1-C12-alkyl, C1-C6-monohalalkyl, C1-C6-dihaloalkyl, C1-C1-alkenyl, C1-C1-monohalogenalkenyl, C5-C7-cycloalkyl, phenyl, by C1-C4-alkyl
- Halogen is e.g. for fluorine, bromine and preferably chlorine.
- C1-C12 alkyl is e.g. Methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec. Butyl, tert. Butyl, n-pentyl, n-hexyl, n-octyl or n-decyl.
- C5-C7-cycloalkyl is e.g. Cyclopentyl, cyclohexyl or cycloheptyl.
- phenyl is e.g. Methylphenyl, ethylphenyl, tert. Butylphenyl or di-tert. Butylphenyl.
- C7-C9-phenylalkyl is e.g. Benzyl or phenethyl.
- C1-C4-alkoxy means methoxy, ethoxy, n-propoxy, isopropoxy, n-butoxy, isobutoxy, sec. Butoxy or tert. Butoxy.
- C1-C4-alkyl is methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec. Butyl or tert. Butyl.
- C1-C6 monohalalkyl is e.g. Chloromethyl, bromomethyl, 2-chloroethyl, 2-bromoethyl, 3-chloro-n-propyl or 4-chloro-n-butyl.
- C1-C6 dihaloalkyl is e.g. 1,2-dichloroethyl, 1,2-dibromoethyl or 2,3-dichloropropyl.
- C2-C4-alkenyl is, for example, vinyl, 2-propenyl or 2-butenyl.
- C2-C4 monohalogenalkenyl is e.g. 1-chloroethen-1-yl, or 1-bromoethen-1-yl.
- Phenyl-C1-C4-alkyl is e.g. Benzyl or phenethyl.
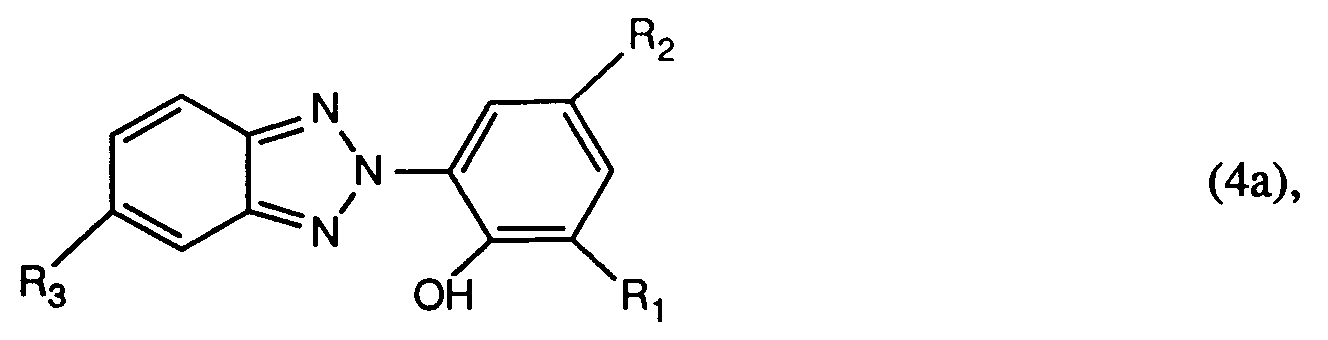
- R1, R2 and R3 have the meanings given under formula (1), in particular those compounds of the formula (4) are used in which R1 is the rest of the formula R2 is hydrogen, C1-C12-alkyl, C5-C7-cycloalkyl, (C1-C8-alkyl) -phenyl, phenyl, C7-C9-phenylalkyl or C1-C4-alkoxy, and R3 is hydrogen or halogen, R4 is hydrogen or C1-C4 alkyl, and R5 C1-C12 alkyl, C1-C6 monohalalkyl, C1-C6 dihaloalkyl, C1-C4 alkenyl, C1-C4 monohalogenalkenyl, C5-C7 cycloalkyl, phenyl or by C1-C4 alkyl, C1-C4- Alkoxy or halogen substituted pheny
- a method is particularly preferred which is characterized in that at least one compound of the formula (1) or (4) is used, in which R1 is a radical of the formula (2), R2 is hydrogen, C1-C4-alkyl, C5-C7-cycloalkyl, (C1-C4-alkyl) -phenyl, phenyl, benzyl or phenethyl, R'2 is hydrogen or C1-C4 alkyl, R3 is hydrogen, chlorine or bromine, R4 hydrogen, and R5 C1-C6-alkyl, C1-C4-chloroalkyl, C1-C4-dichloroalkyl, C1-C4-dibromoalkyl, C1-C4-alkenyl, C1-C4-chloroalkenyl, C1-C4-bromoalkenyl, C5-C7-cycloalkyl, phenyl , phenyl or benzyl substituted by C1
- a very particularly preferred process is characterized in that at least one compound of the formula used where R2 is hydrogen, methyl, ethyl, isopropyl, n-propyl, sec. Butyl, tert. Butyl, isobutyl or n-butyl, R3 is hydrogen or chlorine, and R8 methyl, ethyl, isopropyl, n-propyl, sec. Butyl, tert.
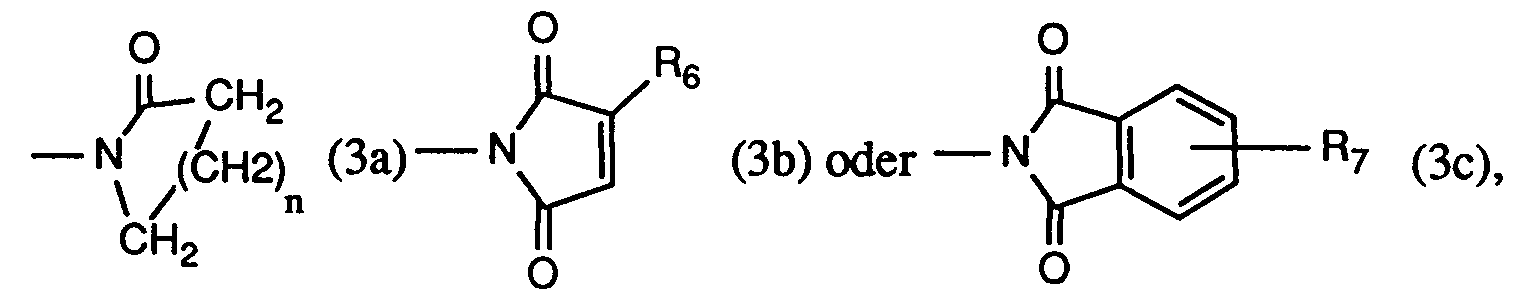
- Another very particularly preferred process is characterized in that at least one compound of the formula used where R2 is hydrogen, methyl, ethyl, isopropyl, n-propyl, sec. Butyl, tert. Butyl, isobutyl or n-butyl, R3 is hydrogen or chlorine, and R9 is a radical of formula (3a), (3b) or (3c), wherein n is the number 3, R6 is hydrogen or methyl, and R7 is hydrogen.
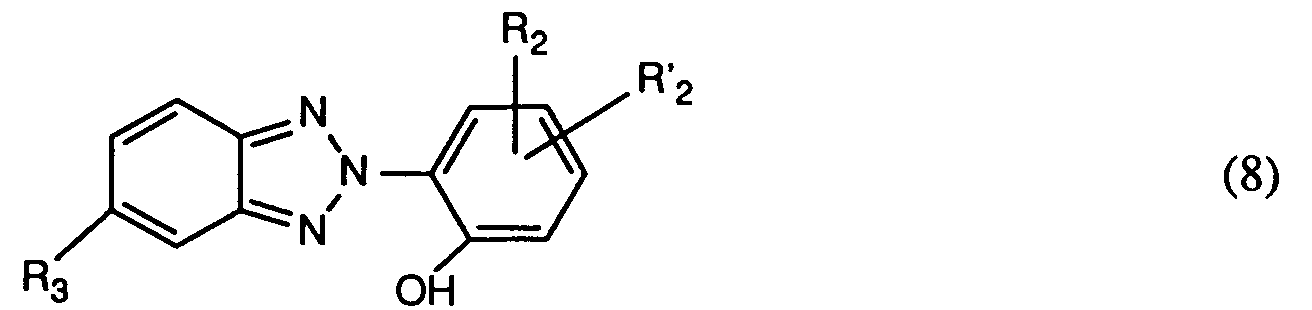
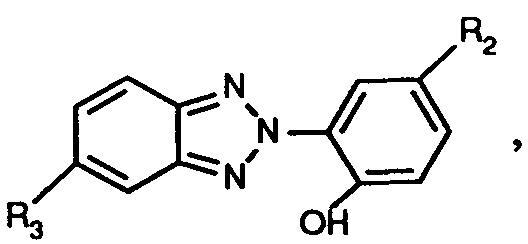
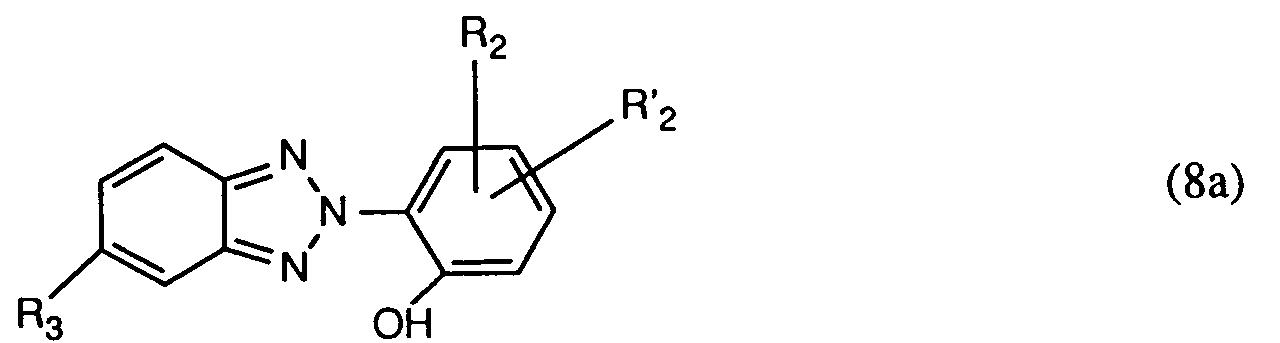
- Another particularly important process is characterized in that a mixture of at least one compound of the formula (1) and a compound of the formula used in which R2, R'2 and R3 have the meanings given under formula (1), in particular mixtures are suitable in which at least one compound of formula (1) is used together with a compound of formula (8), wherein R1, R2, R'2 and R3 have the meanings given above as preferred and particularly preferred to have.
- a very particularly important process is characterized in that a mixture of two compounds of the formula (1) is used.
- the compounds of formula (1) are partly New.
- the new compounds of formula (1a) represent a further subject of the invention.
- R1 the rest of the formula R2 and R'2 independently of one another are hydrogen, C1-C12-alkyl, C5-C7-cycloalkyl, (C1-C8-alkyl) -phenyl, phenyl, C7-C9-phenylalkyl or C1-C4-alkoxy
- R3 is hydrogen or halogen is is
- R4 is hydrogen or C1-C4 alkyl
- R5 C1-C12-alkyl, C2-C6-monohalalkyl, C1-C6-dihaloalkyl, C1-C4-alkenyl, C1-C1-monohalogenalkenyl, C5-C7-cycloalkyl, phenyl, by C1-C4-alkyl, C1-C4- Alkoxy or halogen substituted phenyl or phenyl-C1-C4-alkyl means or R4 and R5
- R1, R2 and R3 have the meanings given under formula (1a), in particular wherein R1 is the rest of the formula R2 is hydrogen, C1-C12-alkyl, C5-C7-cycloalkyl, (C1-C8-alkyl) -phenyl, phenyl, C7-C9-phenylalkyl or C1-C4-alkoxy, and R3 is hydrogen or halogen R4 is hydrogen or C1-C4 alkyl, and R5 C1-C12 alkyl, C1-C6 monohalalkyl, C1-C6 dihaloalkyl, C1-C4 alkenyl, C1-C4 monohalogenalkenyl, C5-C7 cycloalkyl, phenyl or by C1-C4 alkyl, C1-C4- Alkoxy or halogen substituted phenyl, or R4 and R5 together with the -N-CO radical connecting
- R1 is the rest of the formula (2a)
- R2 is hydrogen, C1-C4-alkyl, C5-C7-cycloalkyl, (C1-C4-alkyl) -phenyl, phenyl, benzyl or phenethyl
- R'2 is hydrogen or C1-C4 alkyl
- R3 is hydrogen, chlorine or bromine
- R4 hydrogen
- R5 C1-C6-alkyl
- R2 is hydrogen, methyl, ethyl, isopropyl, n-propyl, sec. Butyl, tert. Butyl, isobutyl or n-butyl
- R3 is hydrogen or chlorine
- R8 methyl, ethyl, isopropyl, n-propyl, sec. Butyl, tert. Butyl, isobutyl, n-butyl, phenyl, chlorophenyl, dichlorophenyl, 1,2-dichloroethyl, 1,2-dibromoethyl, cyclohexyl, 1-chlorovinyl or 1-bromovinyl.
- R2 is hydrogen, methyl, ethyl, isopropyl, n-propyl, sec. Butyl, tert. Butyl, isobutyl or n-butyl
- R3 is hydrogen or chlorine
- R9 is a radical of the formula (3a '), (3b') or (3c '), wherein n is the number 3
- R6 is hydrogen or methyl
- R7 is hydrogen.
- the compounds of formula (1) or (1a) are prepared by using a compound of formula wherein R2, R'2 and R3 have the meanings given under formula (1) or (1a), with one the rest of the formula introductory compound in which R4 and R5 have the meanings given under formula (2) or (2a).
- the reaction is carried out at a temperature between 0 and 100 ° C.
- the implementation takes place e.g. by homogenizing the compounds of formula (7) and the compound introducing the rest of formula (2) and adding them to concentrated sulfuric acid with stirring.
- the reaction mass is then discharged onto ice / water and isolated in a manner known per se.
- the present invention accordingly also relates to a process for the preparation of compounds of the formula (1a).
- Examples of compounds which introduce the rest of the formula (2) or (2a) are: N-hydroxymethylbenzamide, N-hydroxymethylacetamide, N-hydroxymethyl-4-chlorobenzamide, N-hydroxymethyl-2,4-dichlorobenzamide, N-hydroxymethylbutyric acid amide, N-hydroxymethyl-2,3-dichloropropionic acid amide, N-hydroxymethyl-2,3-dibromopropionic acid amide.
- the invention further relates to a process for the photochemical and thermal stabilization of undyed polyester fiber materials, which is characterized in that the fiber material is treated with a dyeing liquor which, in addition to a disperse dye, is a compound of the formula wherein R1 the rest of the formula R2 and R'2 are each independently hydrogen, C1-C12-alkyl, C5-C7-cycloalkyl, (C1-C8-alkyl) -phenyl, phenyl, C7-C9-phenylalkyl or C1-C4-alkoxy, and R3 is hydrogen or halogen, R4 is hydrogen or C1-C4 alkyl, and R5 C1-C12-alkyl, C1-C6-monohalalkyl, C1-C6-dihaloalkyl, C1-C1-alkenyl, C1-C1-monohalogenalkenyl, C5-C7-cycloalkyl, phenyl,
- the invention also relates to mixtures comprising at least one, in particular two or three, preferably two, compound (s) of the formula wherein R1 the rest of the formula R2 and R'2 are each independently hydrogen, C1-C12-alkyl, C5-C7-cycloalkyl, (C1-C8-alkyl) -phenyl, phenyl, C7-C9-phenylalkyl or C1-C4-alkoxy, and R3 is hydrogen or halogen, R4 is hydrogen or C1-C4 alkyl, and R5 C1-C12-alkyl, C1-C6-monohalalkyl, C1-C6-dihaloalkyl, C1-C1-alkenyl, C1-C1-monohalogenalkenyl, C5-C7-cycloalkyl, phenyl, by C1-C4-alkyl, C1-C4- Alkoxy or halogen substituted pheny
- the UV absorbers according to the invention are used in an amount of 0.01 to 5% by weight, preferably 0.1 to 3, and in particular 0.25 to 2% by weight of the weight of the fiber material.
- the ratio of the compounds of the formulas (1) or at least one compound of the formula (1) and one compound of the formula (8) can vary within wide limits; preferred is a ratio of two compounds of formula (1) or a compound of formula (1) and a compound of formula (8) from 1:10 to 10: 1; and the ratio of two compounds of formula (1) and one compound of formula (8) is preferably from 1:10:10, 10: 1: 10 to 10: 10: 1.
- the UV absorbers according to the invention are practically insoluble in water and are therefore applied in dispersed form. To do this, they are mixed with an appropriate dispersant e.g. ground to a fineness of ⁇ 1-2 ⁇ m using quartz balls and a high-speed mixer.
- an appropriate dispersant e.g. ground to a fineness of ⁇ 1-2 ⁇ m using quartz balls and a high-speed mixer.
- Dispersions which are only slightly soluble in water are suitable as dyes. They are therefore largely in the form of a fine dispersion in the dyeing liquor. They can belong to different classes of dyes, for example the acridone, azo, anthraquinone, coumarin, methine, perinone, naphthoquinone imine, quinophthalone, styryl or nitro dyes. Mixtures of disperse dyes can also be used according to the invention.
- polyester fiber material which can be dyed or printed and treated with the UV absorbers mentioned, there are e.g. Cellulose ester fibers, e.g. Cellulose-21 ⁇ 2-acetate fibers and triacetate fibers and especially linear polyester fibers, which may also be acid-modified, to be understood, e.g. can be obtained by condensation of terephthalic acid with ethylene glycol or of isophthalic acid or terephthalic acid with 1,4-bis (hydroxymethyl) cyclohexane, and also copolymers of terephthalic and isophthalic acid and ethylene glycol, or the incorporation of sulfoisophthalic acid.
- the linear polyester fiber material used almost exclusively in industry so far consists of terephthalic acid and ethylene glycol.
- the fiber materials can also be used as a blend with one another or with other fibers, e.g. Mixtures of polyacrylonitrile / polyester, polyamide / polyester, polyester / cotton, polyester / viscose and polyester / wool, and can be dyed or printed discontinuously or continuously by known methods.
- the textile material can be presented in various forms.
- Piece goods such as knitted or woven fabrics or yarn on cross-wound bobbins, warp beams, etc., are preferably used.
- the dyeings are carried out from an aqueous liquor using a continuous or batch process.
- the liquor ratio can be chosen in a wide range, e.g. 1: 4 to 1: 100, preferably 1: 6 to 1:50.
- the temperature at which dyeing is carried out is at least 50 ° C and usually it is not higher than 140 ° C. It is preferably in the range from 80 to 135 ° C.
- the dye liquors are used in addition to the dyes can optionally contain other auxiliaries, applied to the piece material by padding or slapping, for example, and developed by means of heat-setting or HT steaming processes.
- Linear polyester fibers and cellulose fibers are preferably dyed by the so-called high-temperature process in closed and pressure-resistant apparatus at temperatures> 100 ° C., preferably between 110 ° and 135 ° C. and, if appropriate, under pressure.
- Circulation devices such as cross-wound or tree dyeing machines, reel runners, nozzle or drum dyeing machines, muff dyeing machines, paddles or jiggers are suitable as closed vessels.
- foulards or paddles are used; the development is carried out by hot air in the stenter or in HT dampers.
- Cellulose-21 ⁇ 2-acetate fibers are preferably dyed at temperatures of 80-85 ° C.
- the UV absorbers according to the invention are used in the dyeing application, they are used in such a way that the fiber material is first treated with these compounds and then the dyeing is carried out, or preferably the fiber material is simultaneously treated with the UV absorber and the dye in the dye bath.
- the application of the UV absorber can also be applied subsequently to the finished color e.g. using pad application and heat setting in the stenter, e.g. at 190 to 230 ° C in a period of 30 seconds to 5 minutes.
- the dye liquors can also contain other additives, e.g. Dyeing aids, dispersants, diffusion accelerators, wool protection and wetting agents as well as defoamers.
- additives e.g. Dyeing aids, dispersants, diffusion accelerators, wool protection and wetting agents as well as defoamers.
- the dye baths can also contain mineral acids, e.g. Contain sulfuric acid or phosphoric acid, or expediently organic acids, for example aliphatic carboxylic acids such as formic acid, acetic acid, oxalic acid or citric acid and / or salts such as ammonium acetate, ammonium sulfate or sodium acetate.
- mineral acids e.g. Contain sulfuric acid or phosphoric acid
- organic acids for example aliphatic carboxylic acids such as formic acid, acetic acid, oxalic acid or citric acid and / or salts such as ammonium acetate, ammonium sulfate or sodium acetate.
- the acids are used primarily to adjust the pH of the liquors used according to the invention, which is between 4 and 5.
- the fiber material is preferably left in the bath at 40 to 80 ° C. for 5 minutes, that contains the dye, the UV absorber and optionally other additives and is adjusted to a pH of 4.5 to 5.5, increases the temperature within 10 to 20 minutes to 125 to 130 ° C. and treats for 15 to 90 minutes, preferably 30 minutes, further at this temperature.
- the dyeings are completed by cooling the dye liquor to 50 to 80 ° C., rinsing the dyeings with water and, if appropriate, cleaning in a conventional manner in an alkaline medium under reductive conditions. The dyeings are then rinsed again and dried.
- the UV absorbers according to the invention are added to the printing pastes in the form of their aqueous dispersions.
- the printing paste contains the corresponding UV absorber in amounts of 0.5 to 5%, preferably 1 to 2%, based on the weight of the fiber material to be printed.
- the amount of dyes added to the printing pastes depends on the desired shade; In general, amounts of 0.01 to 15, preferably 0.02 to 10 percent by weight, based on the textile material used, have proven successful.
- the printing pastes advantageously contain acid-stable thickeners, preferably of natural origin such as seed flour derivatives, in particular sodium alginate, alone or in a mixture with modified cellulose, in particular with preferably 20 to 25 percent by weight carboxymethyl cellulose.
- the print pastes can also contain acid donors such as butyrolactone or sodium hydrogen phosphate, preservatives, sequestering agents, emulsifiers, water-insoluble solvents, oxidizing agents or deaerating agents.
- Particularly suitable preservatives are formaldehyde-releasing agents, such as paraformaldehyde or trioxane, especially aqueous, approximately 30 to 40 percent by weight formaldehyde solutions, sequestering agents, for example sodium nitrilotriacetic acid, sodium ethylenediaminetetraacetic acid, especially sodium polymethaphosphate, especially sodium hexamethaphosphate, as Emulsifiers, especially adducts of an alkylene oxide and a fatty alcohol, in particular an adduct of oleyl alcohol and ethylene oxide, as water-insoluble solvents, high-boiling, saturated hydrocarbons, especially paraffins with a boiling range of about 160 to 210 ° C (so-called Lackbenzine), as an oxidizing agent, for example an aromatic nitro compound, especially an aromatic mono- or dinitrocarboxylic acid or sulfonic acid, which is optionally present as an alkylene oxide adduct, especially a nitrobenzen
- the printing paste is applied over the entire surface or in places directly to the fiber material, whereby printing machines of conventional design, e.g. Gravure printing, rotary screen printing and flat film printing machines are used.
- the fiber material is dried at temperatures up to 150 ° C., preferably 80 ° to 120 ° C.
- the fixation is then carried out by heat treating the material at temperatures of preferably 100 ° to 220 ° C.
- the heat treatment is generally carried out with superheated steam under atmospheric pressure.
- the fixation can take place for 20 seconds to 10 minutes, preferably 4 to 8 minutes.
- the prints are also finished in the usual way by rinsing with water and can, if appropriate, be carried out by additional cleaning in an alkaline medium under reductive conditions, e.g. be made with sodium dithionite. In the latter case, the printing stains are again rinsed, dewatered and dried.
- the printing paste is applied to paper and later transferred from the paper to the fiber material.
- the transfer print on the calender is preferably carried out at 210-240 ° C for 20 to 60 seconds.
- polyester fiber materials treated with the compounds of the formula (1) reduce the diffuse transmission of UV radiation through textiles made from polyester fibers and polyester fiber blended fabrics.
- the percentages relate to the weight.
- the amounts relate to pure substance in the case of dyes and UV absorbers.
- the temperatures are given in degrees Celsius.
- the fixed point of the connection is 198-200 ° C.
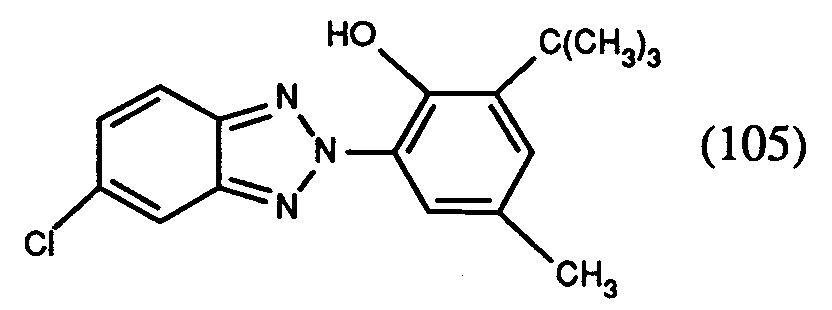
- Example 18 If, as in Example 18, 11.3 g of the compound of the formula (100) and 2.1 g of N-hydroxymethylbenzamide and 5.1 g of N-hydroxymethylchloroacetamide are homogenized and added to 55 ml of sulfuric acid (95-97%) within 25 minutes, the result is after drying 16.3 g of the mixture of the compounds of the formulas (102) and (103) in a ratio of 1: 3. The melting point of the mixture is 178 to 190 °.
- Example 18 5.6 g of the compound of formula (100) according to Example 1 are homogenized with 7.9 g of the compound of formula (105) and 6.8 g of N-hydroxymethylchloroacetamide and within 20 minutes to 55 ml of sulfuric acid (95 to 97%) admitted. Subsequently the procedure is as given in Example 18. After drying, 17.8 g of the mixture of the compounds of the formulas (103) and in a ratio of 1: 1. The melting point of the mixture is 168 to 176 °.
- 3 samples of 10 g each of a PES jersey are dyed in an HT dyeing machine, for example a ®Turbomat (company Mathis, Niederhasli) at a liquor ratio of 1:10.
- the liquors contain 2 g / l ammonium sulfate, 0.5 g / l of a dyeing aid, for example ®Univadin 3-flex and the dyes of the formulas (I) to (IV) in the following amounts: 0.035% of the dye of the formula 0.016% of the dye of the formula 0.02% of the dye of the formula and 0.016% of the dye of the formula
- fleet 1 contains no further additives
- fleet 2 additionally contains 0.75% of the compound of the formula
- fleet 3 additionally 0.75% of the compound of the formula added as 25% grinds.
- the liquors 1 to 3 are adjusted to pH 5 with dilute acetic acid and dispersed intensively.
- fleets and jersey pieces are placed in pressure bombs.
- the dyeing begins at 70 ° C., after 5 minutes the temperature is raised to 135 ° C. at a rate of 2 ° / minute, the mixture is left at 135 ° C. for 30 minutes and then allowed to cool to 60 ° C. the dyeing is then rinsed.
- This is followed by reductive post-cleaning at 70 ° C for 30 minutes with a solution containing 2 ml / liter of sodium hydroxide solution 36 ° Bè and 3g / liter of sodium dithionite. Then it is rinsed warm and cold and dried.
- Table 2 shows that the light fastness of the gray colorings is improved by the UV absorbers of the formulas (102) and (101).
- Table 3 shows that the lightfastness of the beige colorations is improved by the UV absorbers of the formulas (102) and (101).
- the trunk thickening corresponds to the following composition: 120 g of a starch ether thickener 480 g of a sodium alginate thickener 5 g sodium dihydrogen phosphate 5 g sodium chlorate 5 g of a printing aid (e.g. LYOPRINT AP®) 385 g of deionized water 1000 g trunk thickening
- the compounds of the formulas (102) and (101) are used as 25% finely dispersed grinding.
- the cleaned jersey pieces are printed on a printing table (company Zimmer, Klagenfurt, Austria).
- the swatches are then dried at 100 ° C for 10 minutes and then steamed with superheated steam at 180 ° C for 8 minutes. It is then rinsed with water and reductively cleaned at 70 ° C. for 30 minutes with a solution of 2 ml / liter sodium hydroxide solution 38 ° Bé and 3 g / liter sodium dithionite. Finally, it is rinsed well and dried at 80 ° C. The samples obtained are then checked for their light fastness.
- Table 5 shows that the lightfastness of the prints is improved by the UV absorbers of the formulas (102) and (101).
Landscapes
- Engineering & Computer Science (AREA)
- Textile Engineering (AREA)
- Coloring (AREA)
- Plural Heterocyclic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
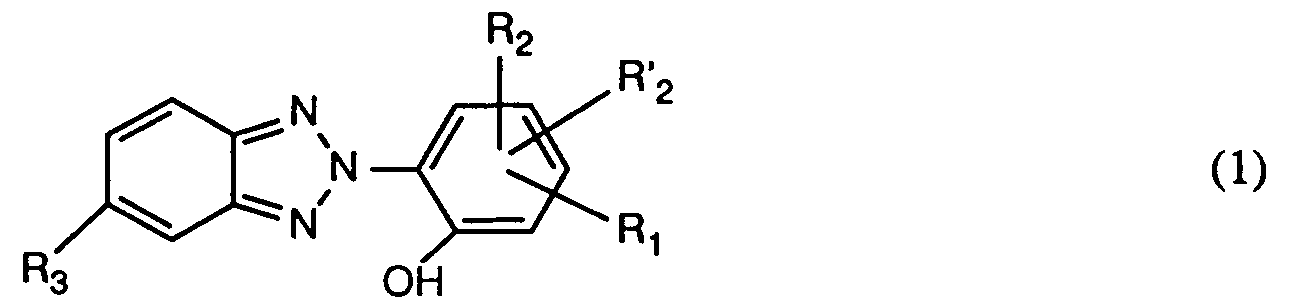
Mit dem Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien, welches dadurch gekennzeichnet ist, dass man das Fasermaterial mit mindestens einer Verbindung der Formel <IMAGE> behandelt, worin R1 der Rest der Formel <IMAGE> R2 und R'2 unabhängig voneinander je Wasserstoff, C1-C12-Alkyl, C5-C7-Cycloalkyl, (C1-C8-Alkyl)-phenyl, Phenyl, C7-C9-Phenylalkyl oder C1-C4-Alkoxy, und R3 Wasserstoff oder Halogen, ist, R4 Wasserstoff oder C1-C4-Alkyl, und R5 C1-C12-Alkyl, C1-C6-Monohalogenalkyl, C1-C6-Dihalogenalkyl, C1-C4-Alkenyl, C1-C4-Monohalogenalkenyl, C5-C7-Cycloalkyl, Phenyl, durch C1-C4-Alkyl, C1-C4-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C1-C4-alkyl bedeutet, oder R4 und R5 bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel <IMAGE> worin n die Zahl 1, 2, 3 oder 4, R6 Wasserstoff oder C1-C4-Alkyl, und R7 Wasserstoff, C1-C4-Alkyl, C1-C4-Alkoxy oder Halogen ist, werden lichtechte Färbungen erzielt.
Description
- Die vorliegende Erfindung betrifft ein Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien.
- Ungefärbte und gefärbte oder bedruckte Polyesterfasermaterialien werden unter Lichteinfluss und insbesondere bei gleichzeitiger Wärmeeinwirkung geschädigt. Für den Einsatz im Automotive-Sektor beispielsweise ist ein wirkungsvoller Schutz von ungefärbten und gefärbten oder bedruckten Fasermaterialien vor UV-Strahlung unerläßlich.
- Gegenstand der vorliegenden Erfindung ist demnach ein Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien, das dadurch gekennzeichnet ist, dass man das Fasermaterial mit mindestens einer Verbindung der Formel
behandelt, worin
R₁ der Rest der Formel
R₂ und R'₂ unabhängig voneinander je Wasserstoff, C₁-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy, und
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
worin
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist. - In den vorhergehenden Formeln nehmen die Substituenten folgende Bedeutungen an:
- Halogen steht z.B. für Fluor, Brom und vorzugsweise Chlor.
- C₁-C₁₂-Alkyl ist z.B. Methyl, Aethyl, n-Propyl, Isopropyl, n-Butyl, Isobutyl, sek. Butyl, tert. Butyl, n-Pentyl, n-Hexyl, n-Octyl oder n-Decyl.
- C₅-C₇-Cycloalkyl ist z.B. Cyclopentyl, Cyclohexyl oder Cycloheptyl.
- (C₁-C₈-Alkyl)phenyl ist z.B. Methylphenyl, Äthylphenyl, tert. Butylphenyl oder Di-tert. Butylphenyl.
- C₇-C₉-Phenylalkyl ist z.B. Benzyl oder Phenäthyl.
- C₁-C₄-Alkoxy bedeutet Methoxy, Aethoxy, n-Propoxy, Isopropoxy, n-Butoxy, Isobutoxy, sek. Butoxy oder tert. Butoxy.
- C₁-C₄-Alkyl ist Methyl, Aethyl, n-Propyl, Isopropyl, n-Butyl, Isobutyl, sek. Butyl oder tert. Butyl.
- C₁-C₆-Monohalogenalkyl ist z.B. Chlormethyl, Brommethyl, 2-Chloräthyl, 2-Bromäthyl, 3-Chlor-n-propyl oder 4-Chlor-n-butyl.
- C₁-C₆-Dihalogenalkyl ist z.B. 1,2-Dichloräthyl, 1,2-Dibromäthyl oder 2,3-Dichlorpropyl.
- C₂-C₄-Alkenyl ist z.B. Vinyl, 2-Propenyl oder 2-Butenyl.
- C₂-C₄-Monohalogenalkenyl ist z.B. 1-Chloräthen-1-yl, oder 1-Bromäthen-1-yl.
- Phenyl-C₁-C₄-alkyl ist z.B. Benzyl oder Phenäthyl.
- Bevorzugt werden in dem erfindungsgemässen Verfahren Verbindungen der Formel
verwendet, worin R₁, R₂ und R₃ die unter Formel (1) angegebenen Bedeutungen haben, insbesondere werden solche Verbindungen der Formel (4) verwendet, worin R₁ der Rest der Formel
R₂ Wasserstoff, C₁-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy, und
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl oder durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
worin
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist. - Besonders bevorzugt ist ein Verfahren, welches dadurch gekennzeichnet ist, dass man mindestens eine Verbindung der Formel (1) oder (4) verwendet, worin
R₁ ein Rest der Formel (2) ist,
R₂ Wasserstoff, C₁-C₄-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₄-Alkyl)-phenyl, Phenyl, Benzyl oder Phenäthyl,
R'₂ Wasserstoff oder C₁-C₄-Alkyl,
R₃ Wasserstoff, Chlor oder Brom,
R₄ Wasserstoff, und
R₅ C₁-C₆-Alkyl, C₁-C₄-Chloralkyl, C₁-C₄-Dichloralkyl, C₁-C₄-Dibromalkyl, C₁-C₄-Alkenyl, C₁-C₄-Chloralkenyl, C₁-C₄-Bromalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy, Chlor oder Brom substituiertes Phenyl oder Benzyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel (3a), (3b) oder (3c), worin
n die Zahl 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl oder Halogen ist.
Wird die Verbindung der Formel (4) verwendet, bedeutet R'₂ Wasserstoff. - Ein ganz besonders bevorzugtes Verfahren ist dadurch gekennzeichnet, dass man mindestens eine Verbindung der Formel
verwendet, worin
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₈ Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl, n-Butyl, Phenyl, Chorphenyl, Dichlorphenyl, 1,2-Dichloräthyl, 1,2-Dibromäthyl, Cyclohexyl, 1-Chlorvinyl oder 1-Bromvinyl ist. - Ein ebenfalls ganz besonders bevorzugtes Verfahren ist dadurch gekennzeichnet, dass man mindestens eine Verbindung der Formel
verwendet, worin
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₉ ein Rest der Formel (3a), (3b) oder (3c) ist, worin
n die Zahl 3,
R₆ Wasserstoff oder Methyl, und
R₇ Wasserstoff ist. - Ein wichtiges Verfahren ist dadurch gekennzeichnet, dass man mindestens eine Verbindung der Formel
verwendet, worin R₁, R₂, R'₂ und R₃ die unter Formel (1) angegebenen Bedeutungen haben, insbesondere, worin R₁, R₂, R'₂ und R₃, die für ein besonders bevorzugtes Verfahren angegebenen Bedeutungen haben. - Ein ebenfalls besonders wichtiges Verfahren ist dadurch gekennzeichnet, dass man eine Mischung aus mindestens einer Verbindung der Formel (1) und einer Verbindung der Formel
verwendet, worin R₂, R'₂ und R₃ die unter Formel (1) angegebenen Bedeutungen haben, insbesondere kommen Mischungen in Betracht, worin mindestens eine Verbindung der Formel (1) zusammen mit einer Verbindung der Formel (8) verwendet wird, worin R₁, R₂, R'₂ und R₃ die oben als bevorzugt und besonders bevorzugt angegebenen Bedeutungen haben. - Ein ganz besonders wichtiges Verfahren ist dadurch gekennzeichnet, dass man eine Mischung aus zwei Verbindungen der Formel (1) verwendet.
- In dem erfindungsgemässen Verfahren werden nicht nur einzelne Verbindungen der Formel (1) sondern auch Mischungen von Verbindungen der Formel (1) und Mischungen von Verbindungen der Formel (1) und mindestens einer Verbindung der Formel (8) verwendet. Bei den Mischungen handelt es sich in der Regel um 2 oder auch drei Verbindungen der Formel (1), vorzugsweise 2 Verbindungen der Formel (1), die in dem erfindungsgemässen Verfahren eingesetzt werden.
- Die Verbindungen der Formel (1) sind z.T. neu. Die neuen Verbindungen der Formel (1a) stellen einen weiteren Gegenstand der Erfindung dar.
- Die neuen Verbindungen entsprechen der Formel
worin
R₁ der Rest der Formel
R₂ und R'₂ unabhängig voneinander Wasserstoff, C₁-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy, und R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₂-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet,
oder R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
worin n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist, oder worin
R₁ den Rest der Formel -CH₂-N(R₄)-CO-CH₂-Cl bedeutet,
R₂ Wasserstoff, C₂-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy,
R₃ Wasserstoff oder Halogen, und
R₄ Wasserstoff oder C₁-C₄-Alkyl ist. - Bevorzugt sind Verbindungen der Formel
worin R₁, R₂ und R₃ die unter Formel (1a) angegebenen Bedeutungen haben, insbesondere worin R₁ der Rest der Formel
R₂ Wasserstoff, C₁-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy, und
R₃ Wasserstoff oder Halogen, ist
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl oder durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
worin
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist. - Besonders bevorzugt sind Verbindungen der Formeln (1a) und (4a), worin
R₁ der Rest der Formel (2a),
R₂ Wasserstoff, C₁-C₄-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₄-Alkyl)-phenyl, Phenyl, Benzyl oder Phenäthyl,
R'₂ Wasserstoff oder C₁-C₄-Alkyl,
R₃ Wasserstoff, Chlor oder Brom,
R₄ Wasserstoff, und
R₅ C₁-C₆-Alkyl, C₂-C₄-Chloralkyl, C₁-C₄-Dichloralkyl, C₂-C₄-Dibromalkyl, C₁-C₄-Alkenyl, C₁-C₄-Chloralkenyl, C₁-C₄-Bromalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy, Chlor oder Brom substituiertes Phenyl oder Benzyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel (3a'), (3b') oder (3c'), worin
n die Zahl 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl oder Halogen ist. - Ganz besonders bevorzugt sind Verbindungen der Formel
worin
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₈ Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl, n-Butyl, Phenyl, Chlorphenyl, Dichlorphenyl, 1,2-Dichloräthyl, 1,2-Dibromäthyl, Cyclohexyl, 1-Chlorvinyl oder 1-Bromvinyl ist. - Ebenfalls ganz besonders bevorzugt sind Verbindungen der Formel
worin
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₉ ein Rest der Formel (3a'), (3b') oder (3c') ist, worin
n die Zahl 3,
R₆ Wasserstoff oder Methyl, und
R₇ Wasserstoff ist. -
- Die Verbindungen der Formel (1) bzw. (1a) werden dadurch hergestellt, dass man eine Verbindung der Formel
worin R₂, R'₂ und R₃ die unter Formel (1) bzw. (1a) angegebenen Bedeutungen haben, mit einer den Rest der Formel
einführenden Verbindung, worin R₄ und R₅ die unter Formel (2) bzw. (2a) angegebenen Bedeutungen haben, umsetzt. - Die Umsetzung wird bei einer Temperatur zwischen 0 und 100°C vorgenommen. Die Umsetzung erfolgt z.B. dadurch, dass man die Verbindungen der Formel (7) und die den Rest der Formel (2) einführende Verbindung homogenisiert und zu konzentrierter Schwefelsäure unter Rühren zusetzt. Anschliessend wird die Reaktionsmasse auf Eis/Wasser ausgetragen und in an sich bekannter Weise isoliert.
- Gegenstand der vorliegenden Erfindung ist demnach auch ein Verfahren zur Herstellung von Verbindungen der Formel (1a).
- Verbindungen der Formel (8) bzw. (8a) und die den Rest der Formel (2) bzw. (2a) einführenden Verbindungen sind bekannt und können in Analogie zu bekannten Verfahren hergestellt werden.
-
- Als den Rest der Formel (2) bzw. (2a) einführende Verbindungen seien z.B. genannt:
N-Hydroxymethylbenzamid, N-Hydroxymethylacetamid, N-Hydroxymethyl-4-chlorbenzamid, N-Hydroxymethyl-2,4-dichlorbenzamid, N-Hydroxymethylbuttersäureamid, N-Hydroxymethyl-2,3-dichlorpropionsäureamid, N-Hydroxymethyl-2,3-dibrompropionsäureamid. - Gegenstand der Erfindung ist ferner ein Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten Polyesterfasermaterialien, welches dadurch gekennzeichnet ist, dass man das Fasermaterial mit einer Färbeflotte behandelt, die neben einem Dispersionsfarbstoff eine Verbindung der Formel
worin
R₁ der Rest der Formel
R₂ und R'₂ unabhängig voneinander je Wasserstoff, C₁-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy, und
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
worin
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist, enthält. - Ebenfalls Gegenstand der Erfindung sind Mischungen enthaltend mindestens eine, insbesondere zwei oder drei, vorzugsweise zwei, Verbindung(en) der Formel
worin
R₁ der Rest der Formel
R₂ und R'₂ unabhängig voneinander je Wasserstoff, C₁-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy, und
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
worin
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist, insbesondere Mischungen enthaltend ausser mindestens einer Verbindung der Formel (1) eine Verbindung der Formel
worin R₂, R'₂ und R₃ die angegebenen Bedeutungen haben. - Für die Mischungen der Verbindungen der Formel (1) bzw. für die Mischungen mindestens einer Verbindung der Formel (1) mit einer Verbindung der Formel (8) gelten die identischen Bevorzugungen wie oben für die Verbindungen der Formel (1) angegeben.
- Die erfindungsgemässen UV-Absorber werden in einer Menge von 0,01 bis 5 Gew.-%, vorzugsweise 0,1 bis 3, und insbesondere 0,25 bis 2 Gew.-% vom Gewicht des Fasermaterials eingesetzt.
- In den erfindungsgemässen Mischungen kann das Verhältnis der Verbindungen der Formeln (1) bzw. mindestens einer Verbindung der Formel (1) und einer Verbindung der Formel (8) in weiten Grenzen schwanken; bevorzugt ist ein Verhältnis von zwei Verbindungen der Formel (1) bzw. einer Verbindung der Formel (1) und einer Verbindung der Formel (8) von 1:10 bis 10:1; und das Verhältnis von zwei Verbindungen der Formel (1) und einer Verbindung der Formel (8) ist bevorzugt von 1:10:10, 10:1:10 bis 10:10:1.
- Die erfindungsgemässen UV-Absorber sind in Wasser praktisch unlöslich und werden daher in dispergierter Form appliziert. Dazu werden sie mit einem entsprechenden Dispergator z.B. mit Hilfe von Quarzkugeln und einem Schnellrührgerät auf eine Feinheit von <1-2 µm gemahlen.
- Als Dispergatoren für die UV-Absorber der Formel (1) kommen in Betracht:
- saure Ester oder deren Salze von Alkylenoxidaddukten, wie z.B. saure Ester oder deren Salze eines Polyadduktes von 4 bis 40 Mol Ethylenoxid an 1 Mol eines Phenols, oder Phosphorsäureester der Addukte von 6 bis 30 Mol Ethylenoxid an 1 Mol 4-Nonylphenol, 1 Mol Dinonylphenol oder besonders an 1 Mol von Verbindungen, die durch Anlagerung von 1 bis 3 Mol von Styrolen an 1 Mol Phenol hergestellt werden,
- Polystyrolsulfonate,
- Fettsäuretauride,
- alkylierte Diphenyloxid-mono- oder -di-sulfonate,
- Sulfonate von Polycarbonsäureestern,
- mit einer organischen Dicarbonsäure, oder einer anorganischen mehrbasischen Säure in einen sauren Ester übergeführte Anlagerungsprodukte von 1 bis 60, vorzugsweise 2 bis 30 Mol Ethylenoxid und/oder Propylenoxid an Fettamine, Fettamide, Fettsäuren oder Fettalkohole mit je 8 bis 22 Kohlenstoffatomen oder an drei- bis sechswertige Alkanole mit 3 bis 6 Kohlenstoffatomen,
- Ligninsulfonate, und ganz besonders
- Formaldehyd-Kondensationsprodukte wie z.B. Kondensationsprodukte von Ligninsulfonaten und/oder Phenol und Formaldehyd, Kondensationsprodukte von Formaldehyd mit aromatischen Sulfonsäuren, wie z. B. Kondensationsprodukte von Ditolylethersulfonaten und Formaldehyd, Kondensationsprodukte von Naphthalinsulfonsäure und/oder Naphthol- oder Naphthylaminsulfonsäuren mit Formaldehyd, Kondensationsprodukte von Phenolsulfonsäuren und/oder sulfoniertem Dihydroxydiphenylsulfon und Phenolen bzw. Kresolen mit Formaldehyd und/oder Harnstoff, sowie Kondensationsprodukte von Diphenyloxid-disulfonsäure-Derivaten mit Formaldehyd.
- Als Farbstoffe kommen in Wasser nur gering lösliche Dispersionsfarbstoffe in Betracht. Sie liegen deshalb in der Färbeflotte zum größten Teil in Form einer feinen Dispersion vor. Sie können verschiedenen Farbstoffklassen angehören, beispielsweise den Acridon-, Azo-, Anthrachinon-, Cumarin-, Methin-, Perinon-, Naphthochinonimin-, Chinophthalon-, Styryl-, oder Nitrofarbstoffen. Es können auch Mischungen von Dispersionsfarbstoffen erfindungsgemäss eingesetzt werden.
- Als Polyesterfasermaterial, das gefärbt oder bedruckt und mit den genannten UV-Absorbern behandelt werden kann, sind z.B. Celluloseesterfasern, wie z.B. Cellulose-2½-acetatfasern und -triacetatfasern und besonders lineare Polyesterfasern, die eventuell auch sauer modifiziert sind, zu verstehen, die z.B. durch Kondensation von Terephthalsäure mit Ethylenglykol oder von Isophthalsäure oder Terephthalsäure mit 1,4-Bis(hydroxymethyl)-cyclohexan erhalten werden, sowie Mischpolymere aus Terephthal- und Isophthalsäure und Ethylenglykol, oder der Einbau von Sulfoisophthalsäure. Das in der Industrie bisher fast ausschließlich eingesetzte lineare Polyesterfasermaterial besteht aus Terephthalsäure und Ethylenglykol.
- Die Fasermaterialien können auch als Mischgewebe untereinander oder mit anderen Fasern verwendet werden, wie z.B. Mischungen aus Polyacrylnitril/Polyester, Polyamid/Polyester, Polyester/Baumwolle, Polyester/Viskose und Polyester/Wolle, und nach bekannten Verfahren diskontinuierlich oder kontinuierlich gefärbt oder auch bedruckt werden.
- Das Textilmaterial kann in verschiedenen Aufmachungsformen vorliegen. Vorzugsweise kommt Stückware, wie Gewirke oder Gewebe oder auch Garn auf Kreuzspulen, Kettbäumen usw. in Betracht.
- Die Färbungen erfolgen aus wässriger Flotte nach einem kontinuierlichen oder diskontinuierlichen Verfahren. Beim diskontinuierlichen Verfahren kann das Flottenverhältnis in einem weiten Bereich gewählt werden, z.B. 1:4 bis 1:100, vorzugsweise 1:6 bis 1:50. Die Temperatur, bei der gefärbt wird, beträgt mindestens 50°C und in der Regel ist sie nicht höher als 140°C. Vorzugsweise liegt sie im Bereich von 80 bis 135°C.
- Bei kontinuierlichen Färbeverfahren werden die Färbeflotten, die neben den Farbstoffen gegebenenfalls weitere Hilfsmittel enthalten können, auf das Stückmaterial durch beispielsweise Foulardieren oder Pflatschen aufgebracht und mittels Thermofixier- oder HT-Dämpfprozessen entwickelt.
- Lineare Polyesterfasern und Cellulosefasern färbt man vorzugsweise nach dem sogenannten Hochtemperaturverfahren in geschlossenen und druckbeständigen Apparaten bei Temperaturen >100°C, bevorzugt zwischen 110° und 135°C und gegebenenfalls unter Druck. Als geschlossene Gefäße eignen sich beispielsweise Zirkulationsapparaturen wie Kreuzspul- oder Baumfärbeapparate, Haspelkufen, Düsen- oder Trommelfärbemaschinen, Muff-Färbeapparate, Paddeln oder Jigger.
- Zum kontinuierlichen Färben werden Foulard oder Pflatschwerke eingesetzt, die Entwicklung erfolgt durch Heissluft im Spannrahmen oder in HT-Dämpfern.
- Cellulose-2½-acetatfasern färbt man vorzugsweise bei Temperaturen von 80-85°C.
- Werden die erfindungsgemässen UV-Absorber in der Färbeapplikation eingesetzt, so erfolgt die Anwendung so, dass man das Fasermaterial zunächst mit diesen Verbindungen behandelt und anschliessend die Färbung durchführt oder vorzugsweise gleichzeitig das Fasermaterial mit dem UV-Absorber und dem Farbstoff im Färbebad behandelt. Die Applikation des UV-Absorbers kann jedoch auch nachträglich auf die fertig hergestellte Färbung z.B. mittels Foulardapplikation und Thermofixierung im Spannrahmen, z.B. bei 190 bis 230°C in einem Zeitraum von 30 Sekunden bis 5 Minuten erfolgen.
- Die Färbeflotten können auch weitere Zusätze, wie z.B. Färbereihilfsmittel, Dispergiermittel, Diffusionsbeschleuniger, Wollschutz- und Netzmittel sowie auch Entschäumer enthalten.
- Die Färbebäder können desweiteren Mineralsäuren, wie z.B. Schwefelsäure oder Phosphorsäure, oder zweckmässigerweise organische Säuren, zum Beispiel aliphatische Carbonsäuren wie Ameisensäure, Essigsäure, Oxalsäure oder Zitronensäure und/oder Salze wie Ammoniumacetat, Ammoniumsulfat oder Natriumacetat enthalten. Die Säuren dienen vor allem der Einstellung des pH-Wertes der erfindungsgemäss verwendeten Flotten, der zwischen 4 und 5 liegt.
- Vorzugsweise lässt man das Fasermaterial während 5 Minuten bei 40 bis 80°C im Bad, das den Farbstoff, den UV-Absorber und gegebenenfalls weitere Zusätze enthält und auf einen pH-Wert von 4,5 bis 5,5 eingestellt ist, vorlaufen, erhöht die Temperatur innerhalb von 10 bis 20 Minuten auf 125 bis 130°C und behandelt für 15 bis 90 Minuten, vorzugsweise 30 Minuten, bei dieser Temperatur weiter.
- Die Fertigstellung der Färbungen erfolgt durch Abkühlen der Färbeflotte auf 50 bis 80°C, Spülen der Färbungen mit Wasser und gegebenenfalls durch Reinigung auf übliche Weise im alkalischen Medium unter reduktiven Bedingungen. Die Färbungen werden dann wiederum gespült und getrocknet.
- Für die Herstellung von Drucken werden die erfindungsgemässen UV-Absorber in Form ihrer wässrigen Dispersionen den Druckpasten beigemischt. Die Druckpaste enthält dabei den entsprechenden UV-Absorber in Mengen von 0,5 bis 5 %, vorzugsweise 1 bis 2%, bezogen auf das Gewicht des zu bedruckenden Fasermaterials.
- Die Menge der Farbstoffe, die den Druckpasten zugesetzt werden, richtet sich nach der gewünschten Farbnuance; im allgemeinen haben sich Mengen von 0,01 bis 15, vorzugsweise 0,02 bis 10 Gewichtsprozent, bezogen auf das eingesetzte Textilmaterial, bewährt.
- Die Druckpasten enthalten neben den Farbstoffen und der wässrigen UV-Absorber-Dispersion zweckmässigerweise säurestabile Verdickungsmittel, vorzugsweise natürlicher Herkunft wie Kernmehlabkömmlinge, insbesondere Natriumalginat für sich allein oder im Gemisch mit modifizierter Cellulose, insbesondere mit vorzugsweise 20 bis 25 Gewichtsprozent Carboxymethylcellulose. Daneben können die Druckpasten noch Säurespender wie Butyrolacton oder Natriumhydrogenphosphat, Konservierungsmittel, Sequestriermittel, Emulgatoren, wasserunlösliche Lösungsmittel, Oxidationsmittel oder Entlüftungsmittel enthalten.
- In Betracht kommen als Konservierungsmittel vor allem Formaldehyd abgebende Mittel, wie z.B. Paraformaldehyd oder Trioxan, vor allem wässrige, etwa 30 bis 40-gewichtsprozentige Formaldehydlösungen, als Sequestriermittel z.B. nitrilotriessigsaures Natrium, ethylendiamintetraessigsaures Natrium, vor allem Natrium-Polymethaphosphat, insbesondere Natrium-Hexamethaphosphat, als Emulgatoren vor allem Addukte aus einem Alkylenoxid und einem Fettalkohol, insbesondere einem Addukt aus Oleylalkohol und Ethylenoxid, als wasserunlösliche Lösungsmittel hochsiedende, gesättigte Kohlenwasserstoffe, vor allem Paraffine mit einem Siedebereich von etwa 160 bis 210°C (sogenannte Lackbenzine), als Oxidationsmittel z.B. eine aromatische Nitroverbindung, vor allem eine aromatische Mono- oder Dinitrocarbonsäure oder -sulfonsäure, die gegebenenfalls als Alkylenoxidaddukt vorliegt, insbesondere eine Nitrobenzolsulfonsäure und als Entlüftungsmittel z.B. hochsiedende Lösungsmittel, vor allem Terpentinöle, höhere Alkohole, vorzugsweise C₈- bis C₁₀-Alkohole, Terpenalkohole oder Entlüftungsmittel auf Basis von Mineral- und/oder Silikonölen, insbesondere Handelsformulierungen aus etwa 15 bis 25 Gewichtsprozent eines Mineral- und Silikonölgemisches und etwa 75 bis 85 Gewichtsprozent eines C₈-Alkohols wie z.B. 2-Ethyl-n-hexanol.
- Beim Bedrucken der Fasermaterialien wird die Druckpaste ganzflächig oder stellenweise direkt auf das Fasermaterial aufgebracht, wobei zweckmässigerweise Druckmaschinen üblicher Bauart, z.B. Tiefdruck-, Rotationssiebdruck- und Flachfilmdruckmaschinen eingesetzt werden.
- Das Fasermaterial wird nach dem Bedrucken bei Temperaturen bis 150°C, vorzugsweise 80° bis 120°C getrocknet.
- Anschliessend erfolgt die Fixierung durch eine Wärmebehandlung des Materials bei Temperaturen von vorzugsweise 100° bis 220°C. Die Wärmebehandlung erfolgt im allgemeinen mit überhitztem Wasserdampf unter atmosphärischem Druck.
- Je nach Temperatur kann die Fixierung 20 Sekunden bis 10 Minuten, vorzugsweise 4 bis 8 Minuten erfolgen.
- Die Fertigstellung der Drucke erfolgt ebenfalls auf übliche Weise durch Spülen mit Wasser und kann gegebenenfalls durch zusätzliche Reinigung im alkalischen Medium unter reduktiven Bedingungen, z.B. mittels Natriumdithionit vorgenommen werden. Im letzteren Fall werden die Druckfärbungen wiederum gespült, entwässert und getrocknet.
- Beim Transferdruck wird die Druckpaste auf Papier aufgebracht und später vom Papier auf das Fasermaterial übertragen. Der Transferdruck auf dem Kalander erfolgt vorzugsweise bei 210 - 240°C während 20 bis 60 Sekunden.
- Mit dem erfindungsgemässen Verfahren lassen sich hochlichtechte und sublimationsbeständige Polyester-Färbungen und Drucke erzielen, die sich z.B. zur Autoausstattung sowie als Segelstoffe, Netze und Gurte, aber auch für sogenannte "outdoor"-Artikel, wie z.B. Sonnenschirme, Sonnenblenden und Markisen, eignen. Eine gezielte Vor- oder Nachbehandlung des Fasermaterials ist mit dem erfindungsgemässen Verfahren nicht erforderlich. Ferner wird mit Polyesterfasermaterialien, die mit den Verbindungen der Formel (1) behandelt sind, die Reduktion der diffusen Transmission von UV-Strahlung durch Textilien aus Polyesterfasern sowie Polyesterfaser-Mischgeweben erzielt.
- In den folgenden Herstellungsverfahren und Applikationsbeispielen beziehen sich die Prozentsätze auf das Gewicht. Die Mengen beziehen sich bei den Farbstoffen und bei den UV-Absorbern auf Reinsubstanz. Die Temperaturen sind in Celsiusgraden angegeben.
- 135 g der Verbindung der Formel
und 132 g N-Hydroxymethylbenzamid werden homogenisiert und innert 90 Minuten bei 0 - 5° zu 660 ml Schwefelsäure (95 - 97%-ig) unter Rühren zugegeben. Es wird 2 Stunden bei 0 - 5° ausreagieren gelassen. Die viskose, gelbe Lösung wird dann innert 20 Minuten auf 3000 g einer Eis/Wasser-Mischung von 0 - 5° ausgetragen. Die erhaltene hellgelbe Suspension wird 30 Minuten verrührt, abfiltriert und anschliessend mit Wasser neutral gewaschen. Nach dem Trocknen erhält man 206 g (96% der Theorie) der Verbindung der Formel - Wenn man wie in Beispiel 1 angegeben verfährt, jedoch als Benzotriazol eine Verbindung der Formel
worin R₂ und R₃ die in Tabelle 1 angegebenen Bedeutungen haben, und anstelle von N-Hydroxymethylbenzamid eine äquivalente Menge einer Verbindung der Formel
HO-CH₂-R , worin R die in der Tabelle 1 angegebene Bedeutung hat verwendet, so erhält man Verbindungen der Formel
worin R, R₁ und R₃, die in Tabelle 1 angegebenen Bedeutungen haben. -
- Der Festpunkt der Verbindung beträgt 198-200°C.
- 348,8 g der Verbindung der Formel (100) gemäss Beispiel 1 und 124,7g N-Hydroxymethylbenzamid sowie 104,7g N-Hydroxymethylchloracetamid werden homogenisiert und innert 90 Minuten bei 0 bis 5° zu 1700 ml Schwefelsäure (95-97%-ig) unter Rühren zugegeben. Anschliessend lässt man 10 Minuten bei 5° nachrühren, dann lässt man nachrühren während die Temperatur auf Raumtemperatur steigt. Nach 3 Stunden wird die gelbe Lösung auf ca. 6000g einer Eis/Wasser-Mischung ausgetragen, 90 Minuten verrührt, anschliessend abfiltriert und dann mit Wasser neutral gewaschen. Nach dem Trocknen erhält man 529 g (Ausbeute beträgt 98% der Theorie) der Mischung der Verbindungen der Formeln
und
im Verhältnis von 1:1. Der Schmelzpunkt des Gemisches beträgt 182 bis 199°. - Wenn man analog Beispiel 18 11,3g der Verbindung der Formel (100) sowie 2,1g N-Hydroxymethylbenzamid und 5,1g N-Hydroxymethylchloracetamid homogenisiert und innert 25 Minuten zu 55 ml Schwefelsäure (95-97%-ig) zusammengibt, erhält man nach dem Trocknen 16,3g der Mischung der Verbindungen der Formeln (102) und (103) im Verhältnis 1:3. Der Schmelzpunkt des Gemisches beträgt 178 bis 190°.
- Analog zu Beispiel 18 werden 11,3g der Verbindung der Formel (100) sowie 3,3g N-Hydroxymethylbenzamid und 2,7g N-Hydroxymethylchloracetamid homogenisiert und innert 25 Minuten zu 55 ml Schwefelsäure (95-97%-ig) zusammengegeben. Man erhält nach dem Trocknen 15,7g der Mischung der Verbindungen der Formeln (102), (103) und
im Verhältnis 4:4:2. Der Schmelzpunkt des Gemisches beträgt 170 bis 185°. - Analog zu Beispiel 18 werden 23,6g der Verbindung der Formel (100) sowie 4,1g N-Hydroxymethylbenzamid und 10,2g N-Hydroxymethylchloracetamid homogenisiert und innert 45 Minuten zu 110 ml Schwefelsäure (95-97%-ig) zugegeben. Nach beendeter Reaktion werden 8,3 g der Verbindung der Formel
zugegeben. Sobald diese gelöst ist, wird die gelbe Lösung auf 600g Eis/Wasser ausgetragen, 15 Minuten verrührt, abfiltriert und mit Wasser neutral gewaschen. Nach dem Trocknen erhält man 42,8g des Gemisches der Verbindungen der Formeln (102), (103) und (105) im Verhältnis 1:3:1. Der Schmelzpunkt des Gemisches beträgt 160 bis 181°. - 5,6 g der Verbindung der Formel (100) gemäss Beispiel 1 werden mit 7,9g der Verbindung der Formel (105) und 6,8g N-Hydroxymethylchloracetamid homogenisiert und innert 20 Minuten zu 55 ml Schwefelsäure (95 bis 97%-ig) zugegeben. Anschliessend wird wie in Beispiel 18 angegeben verfahren. Nach dem Trocknen erhält man 17,8g des Gemisches der Verbindungen der Formeln (103) und
im Verhältnis 1:1. Der Schmelzpunkt des Gemisches beträgt 168 bis 176°. - Es werden 3 Muster von je 10 g eines PES-Trikots in einem HT-Färbeapparat, z.B. einem ®Turbomat (Firma Mathis, Niederhasli) bei einem Flottenverhältnis von 1:10 gefärbt. Die Flotten enthalten 2g/l Ammoniumsulfat, 0,5 g/l eines Färbereihilfsmittels, z.B. ®Univadin 3-flex und die Farbstoffe der Formeln (I) bis (IV) in folgenden Mengen:
0,035% des Farbstoffs der Formel
0,016% des Farbstoffs der Formel
0,02% des Farbstoffes der Formel
und
0,016% des Farbstoffes der Formel -
- Zubereitung der Mahlung: 5 g der Wirksubstanz der UV-Absorber werden mit einer Lösung von 2,5 g des Triäthanolaminsalzes von Tristyrylphenylpolyäthylenglykolphosphorsäure und 12,5 ml Wasser unter Zuhilfenahme von 20 g Quarzkugeln (Durchmesser 1 mm) mit einem Rührwerk (1500 Umdrehungen/Minute) auf eine Feinheit von < 2 µm gemahlen und auf 25% mit Wasser eingestellt.
- Die Flotten 1 bis 3 werden mit verdünnter Essigsäure auf pH-Wert 5 eingestellt und intensiv dispergiert. Zum Färben gibt man Flotten und Trikotstücke in Druckbomben. Man beginnt bei 70° C zu färben, steigert nach 5 Minuten die Temperatur mit einer Aufheizrate von 2°/Minute auf 135°C, belässt 30 Minuten bei 135°C, lässt dann auf 60°C abkühlen spült dann die Färbung. Anschliessend folgt eine reduktive Nachreinigung bei 70°C während 30 Minuten mit einer Lösung, die 2 ml/Liter Natronlauge 36° Bè und 3g/Liter Natiumdithionit enthält. Dann wird warm und kalt gespült und getrocknet. Zur Ermittlung der Lichtechtheiten werden die Färbungen nach DIN 75.202 (FAKRA) und nach SAE J 1885 belichtet. Die Ergebnisse sind in Tabelle 2 aufgeführt.
Tabelle 2: Färbung (Flotte Nr.) Lichtechtheiten bewertet mit Graumassstab nach FAKRA 4 Perioden FAKRA 6 Perioden SAE 420 KJ SAE 600 KJ (1) ohne Zusatz 2-3 2 3-4 -3 (2) + Verbindung (102) 3-4 3 4 3-4 (3) + Verbindung (101) 3-4 3 4 3-4 - Tabelle 2 zeigt, dass die Lichtechtheiten der Graufärbungen durch die UV-Absorber der Formeln (102) und (101) verbessert wird.
- Es wird wie in den Beispielen 2 und 3 angegeben verfahren, wobei folgende Farbstoffkombination eingesetzt wird (Flotten 4 bis 6):
Farbstoff der Formel I: 0.37%
Farbstoff der Formel II 0,067%
Farbstoff der Formel III 0,010%
Farbstoff der Formel IV 0,013% - Die Zubereitungen der Verbindungen der Formel (102) und (101) werden den Flotten 5 und 6 zugesetzt. Wie in den Beispielen 2 und 3 angegeben, werden die Färbungen angefertigt, fertiggestellt und auf ihre Lichtechtheit geprüft. Die Ergebnisse sind in Tabelle 3 aufgeführt.
Tabelle 3: Färbung (Flotte Nr.) Lichtechtheiten bewertet mit Graumassstab nach FAKRA 4 Perioden FAKRA 6 Perioden SAE 420 KJ SAE 600 KJ (4) ohne Zusatz 2 1-2 2-3 1-2 (5) + Verbindung (102) 3-4 -3 3-4 2-3 (6) + Verbindung (101) 3-4 2-3 2-3 2+ - Tabelle 3 zeigt, dass die Lichtechtheiten der Beigefärbungen durch die UV-Absorber der Formeln (102) und (101) verbessert wird.
- Wie in den Beispiele 23 bis 26 angegeben, werden 3 Flotten für Graufärbungen (analog den Beispielen 23 und 24) und 3 Flotten für Beigefärbungen (analog den Beispielen 25 und 26) hergestellt, wobei zur Foulardierung die Flotten je 0,5 g/Liter eines Dispergiermittels, z.B. einen Nonylphenolpolyglykoläther mit 10 Äthylenoxideinheiten enthalten. Für die Graufärbungen sowie auch für die Beigefärbungen wird je eine Kontrollfärbung (ohne UV-Absorber), eine Färbung mit 28 g/Liter der Verbindung der Formel (102) als 25%-ige Mahlung und eine Färbung mit 28 g/Liter der Verbindung der Formel (101) als 25%-ige Mahlung hergestellt. Das Foulardieren wird mit einem Abquetscheffekt von 95% vorgenommen, dann wird sofort bei 110°C 3 Minuten getrocknet und bei 190°C 60 Minuten thermofixiert. Von den so erhaltenen Färbungen werden die Lichtechtheiten nach DIN 75.202 und SAE J 1885 angefertigt. Es werden die in Tabelle 4 angegebenen Ergebnisse erhalten.
Tabelle 4: Grau-Färbung (Flotte Nr.) Lichtechtheiten bewertet mit Graumassstab nach FAKRA 4 Perioden FAKRA 6 Perioden SAE 420 KJ SAE 600 KJ (7) ohne Zusatz 3 1-2 2-3 2-3 (8) + Verbindung (102) 4 3 -4 3-4 (9) + Verbindung (101) 4 3 4 3-4 Beige-Färbung (Flotte Nr.) (10) ohne Zusatz 2R 1 2-3R 2R (11) + Verbindung (102) 2-3 2 3 3 (12) + Verbindung (101) -3 2+ 2 2-3 - Aus den Lichtechtheitesnoten folgt, dass die Verbindungen der Formeln (102) und (101) auch unter Hitzefixierbedingungen entwickelt werden können.
- Zum Bedrucken von Polyester-Texturtrikot werden Druckpasten aus einer Stammverdickung, Farbstoffen und gegebenenfalls UV-Absorbern hergestellt. Die Stammverdickung entspricht folgender Zusammensetzung:
120 g eines Stärkeäther-Verdickers
480 g eines Natriumalginat-Verdickers
5 g Natriumdihydrogenphosphat
5 g Natriumchlorat
5 g eines Druckhilfsmittels (z.B. LYOPRINT AP®)
385 g deionisiertes Wasser
1000 g Stammverdickung - Die 3 Druckpasten 13, 14 und 15 werden aus den Komponenten A, B und C gemischt:
- A)
1,4 g des Farbstoffes der Formel (I)
0,9 g des Farbstoffes der Formel (II)
0,5 g des Farbstoffes der Formel (III)
1,3 g des Farbstoffes der Formel (IV) - B)
0 g UV-Absorber (Paste 13), oder
7,5 g der Verbindung der Formel (102) (Paste 14) oder
7,5 g der Verbindung der Formel (101) (Paste 15) und - C)
auf insgesamt 1000 g aufgefüllt mit Stammverdickung. - Die Verbindungen der Formeln (102) und (101) werden als 25%-ige feindispers Mahlung eingesetzt.
- Mit diesen Druckpasten werden die gereinigten Trikotstücke auf einem Drucktisch (Firma Zimmer, Klagenfurt, Österreich) bedruckt. Die Muster werden dann getrocknet bei 100°C während 10 Minuten und dann mit überhitztem Dampf bei 180°C während 8 Minuten gedämpft. Anschliessend wird mit Wasser gespült und bei 70°C während 30 Minuten mit einer Lösung aus 2 ml/Liter Natriumlauge 38°Bé und 3 g/Liter Natriumdithionit reduktiv gereinigt. Abschliessend wird gut gespült und bei 80°C getrocknet. Die erhaltenen Muster werden dann auf ihre Lichtechtheit geprüft.
Tabelle 5: Druckmuster (Paste Nr.) Lichtechtheiten in Δ E nach CIEL ab, D 65/10; DIN 6174 FAKRA 5 Perioden SAE 488 KJ (13) ohne Zusatz 4,61 4,81 (14) + Verbindung (102) 2,46 2,40 (15) + Verbindung (101) 1,95 2,31 - Tabelle 5 zeigt, dass die Lichtechtheiten der Drucke durch die UV-Absorber der Formeln (102) und (101) verbessert werden.
Claims (24)
- Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien, dadurch gekennzeichnet, dass man das Fasermaterial mit mindestens einer Verbindung der Formel
R₁ der Rest der Formel
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist. - Verfahren gemäss Anspruch 2, dadurch gekennzeichnet, dass man mindestens eine Verbindung der Formel (4) verwendet, worin R₁ der Rest der Formel
R₃ Wasserstoff oder Halogen, ist
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl oder durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist. - Verfahren gemäss einem der Ansprüche 1 und 2, dadurch gekennzeichnet, dass man mindestens eine Verbindung der Formel (1) oder (4) verwendet, worin
R₁ ein Rest der Formel (2) ist,
R₂ Wasserstoff, C₁-C₄-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₄-Alkyl)-phenyl, Phenyl, Benzyl oder Phenäthyl,
R'₂ Wasserstoff oder C₁-C₄-Alkyl,
R₃ Wasserstoff, Chlor oder Brom,
R₄ Wasserstoff, und
R₅ C₁-C₆-Alkyl, C₁-C₄-Chloralkyl, C₁-C₄-Dichloralkyl, C₁-C₄-Dibromalkyl, C₁-C₄-Alkenyl, C₁-C₄-Chloralkenyl, C₁-C₄-Bromalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy, Chlor oder Brom substituiertes Phenyl oder Benzyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel (3a), (3b) oder (3c), worin
n die Zahl 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl oder Halogen ist. - Verfahren gemäss einem der Ansprüche 1 bis 4, dadurch gekennzeichnet, dass man mindestens eine Verbindung der Formel
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₈ Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl, n-Butyl, Phenyl, Chlorphenyl, Dichlorphenyl, 1,2-Dichloräthyl, 1,2-Dibromäthyl, Cyclohexyl, 1-Chlorvinyl oder 1-Bromvinyl ist. - Verfahren gemäss einem der Ansprüche 1 und 2, dadurch gekennzeichnet, dass man mindestens eine Verbindung der Formel
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₉ ein Rest der Formel (3a), (3b) oder (3c) ist, worin
n die Zahl 3,
R₆ Wasserstoff oder Methyl, und
R₇ Wasserstoff ist. - Verfahren gemäss Anspruch 1, dadurch gekennzeichnet, dass man eine Mischung aus zwei Verbindungen der Formel (1) verwendet.
- Verfahren gemäss einem der Ansprüche 1 bis 9, dadurch gekennzeichnet, dass man die Verbindung der Formel (1) in einer Menge von 0,01 bis 5 Gew.-% des Fasermaterials verwendet.
- Verfahren gemäss einem der Ansprüche 1 bis 10, dadurch gekennzeichnet, dass man die Verbindung der Formel (1) in der Färbeapplikation direkt dem Färbebad oder der Foulardflotte zusetzt.
- Verfahren gemäss einem der Ansprüche 1 bis 10, dadurch gekennzeichnet, dass man die Verbindung der Formel (1) bei der Druckapplikation der Druckpaste beimischt.
- Verbindungen der Formel
R₁ der Rest der Formel
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₂-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet,
oder R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
R₆ Wasserstoff oder C₁-C₄-Alkyl, und R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist, oder worin
R₁ den Rest der Formel -CH₂-N(R₄)-CO-CH₂-Cl bedeutet,
R₂ Wasserstoff, C₂-C₁₂-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₈-Alkyl)-phenyl, Phenyl, C₇-C₉-Phenylalkyl oder C₁-C₄-Alkoxy,
R₃ Wasserstoff oder Halogen, und
R₄ Wasserstoff oder C₁-C₄-Alkyl ist. - Verbindungen gemäss Anspruch 14, worin R₁ der Rest der Formel
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl oder durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist. - Verbindungen gemäss einem der Ansprüche 13 und 14, worin
R₁ der Rest der Formel (2a),
R₂ Wasserstoff, C₁-C₄-Alkyl, C₅-C₇-Cycloalkyl, (C₁-C₄-Alkyl)-phenyl, Phenyl, Benzyl oder Phenäthyl,
R'₂ Wasserstoff oder C₁-C₄-Alkyl,
R₃ Wasserstoff, Chlor oder Brom,
R₄ Wasserstoff, und
R₅ C₁-C₆-Alkyl, C₂-C₄-Chloralkyl, C₁-C₄-Dichloralkyl, C₂-C₄-Dibromalkyl, C₁-C₄-Alkenyl, C₁-C₄-Chloralkenyl, C₁-C₄-Bromalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy, Chlor oder Brom substituiertes Phenyl oder Benzyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel (3a'), (3b') oder (3c'), worin
n die Zahl 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl oder Halogen ist. - Verbindungen gemäss einem der Ansprüche 13 bis 16, der Formel
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₈ Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl, n-Butyl, Phenyl, Chlorphenyl, Dichlorphenyl, 1,2-Dichloräthyl, 1,2-Dibromäthyl, Cyclohexyl, 1-Chlorvinyl oder 1-Bromvinyl ist. - Verbindungen gemäss einem der Ansprüche 13 bis 16, der Formel
R₂ Wasserstoff, Methyl, Äthyl, Isopropyl, n-Propyl, sek. Butyl, tert. Butyl, Isobutyl oder n-Butyl,
R₃ Wasserstoff oder Chlor, und
R₉ ein Rest der Formel (3a'), (3b') oder (3c') ist, worin
n die Zahl 3,
R₆ Wasserstoff oder Methyl, und
R₇ Wasserstoff ist. - Verfahren zur Herstellung von Verbindungen der Formel (1a) gemäss Anspruch 13, dadurch gekennzeichnet, dass man eine Verbindung der Formel
- Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten Polyesterfasermaterialien, dadurch gekennzeichnet, dass man das anfärbbare Fasermaterial mit einer Färbeflotte behandelt, die neben einem Dispersionsfarbstoff eine Verbindung der Formel
R₁ der Rest der Formel
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist, enthält. - Verwendung der in Anspruch 13 definierten Verbindungen zur fotochemischen Stabilisierung von anfärbbaren oder gefärbten oder bedruckten Polyesterfasermaterialien.
- Mischungen enthaltend mindestens eine Verbindung der Formel
R₁ der Rest der Formel
R₃ Wasserstoff oder Halogen, ist,
R₄ Wasserstoff oder C₁-C₄-Alkyl, und
R₅ C₁-C₁₂-Alkyl, C₁-C₆-Monohalogenalkyl, C₁-C₆-Dihalogenalkyl, C₁-C₄-Alkenyl, C₁-C₄-Monohalogenalkenyl, C₅-C₇-Cycloalkyl, Phenyl, durch C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen substituiertes Phenyl oder Phenyl-C₁-C₄-alkyl bedeutet, oder
R₄ und R₅ bilden zusammen mit dem sie verbindenden -N-CO-Rest einen Rest der Formel
n die Zahl 1, 2, 3 oder 4,
R₆ Wasserstoff oder C₁-C₄-Alkyl, und
R₇ Wasserstoff, C₁-C₄-Alkyl, C₁-C₄-Alkoxy oder Halogen ist.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH3628/93 | 1993-12-06 | ||
| CH362893 | 1993-12-06 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| EP0657577A1 true EP0657577A1 (de) | 1995-06-14 |
Family
ID=4260068
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP94810674A Withdrawn EP0657577A1 (de) | 1993-12-06 | 1994-11-29 | Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien |
Country Status (3)
| Country | Link |
|---|---|
| EP (1) | EP0657577A1 (de) |
| JP (1) | JPH07196631A (de) |
| CA (1) | CA2137212A1 (de) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999023151A1 (en) * | 1997-10-31 | 1999-05-14 | Minnesota Mining And Manufacturing Company | Amide functional ultraviolet light absorbers for polyurethanes and polyureas |
| US5994431A (en) * | 1996-05-03 | 1999-11-30 | 3M Innovative Properties Company | Amide functional ultraviolet light absorbers for polyolefins |
| WO2002077148A1 (en) * | 2001-03-27 | 2002-10-03 | Ciba Speciality Chemicals Holding Inc. | Fabric rinse composition containing a benztriazole uv absorber |
| DE102011082078A1 (de) * | 2011-09-02 | 2013-03-07 | Carl Stahl Gmbh & Co. Kg | Verfahren zum Bedrucken eines Gurtbands |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5308039B2 (ja) | 2007-02-20 | 2013-10-09 | 富士フイルム株式会社 | 紫外線吸収剤を含む高分子材料 |
| EP2135911B1 (de) | 2007-03-30 | 2014-05-28 | FUJIFILM Corporation | Ultraviolettstrahlenabsorbierende zusammensetzung |
| KR101569220B1 (ko) | 2007-08-16 | 2015-11-13 | 후지필름 가부시키가이샤 | 헤테로시클릭 화합물, 자외선 흡수제, 및 상기 자외선 흡수제를 포함하는 조성물 |
| JP5244437B2 (ja) | 2008-03-31 | 2013-07-24 | 富士フイルム株式会社 | 紫外線吸収剤組成物 |
| JP5250289B2 (ja) | 2008-03-31 | 2013-07-31 | 富士フイルム株式会社 | 紫外線吸収剤組成物 |
| JP2009270062A (ja) | 2008-05-09 | 2009-11-19 | Fujifilm Corp | 紫外線吸収剤組成物 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR1572761A (de) * | 1967-07-01 | 1969-06-27 | ||
| CH529877A (de) * | 1965-10-23 | 1972-10-31 | Gaf Corp | Verwendung von Naphtotriazolen als UV-Absorber für Textilfasern |
| EP0474595A1 (de) * | 1990-08-28 | 1992-03-11 | Ciba-Geigy Ag | Wässrige Dispersion schwerlöslicher UV-Absorber |
| EP0523006A1 (de) * | 1991-07-12 | 1993-01-13 | Ciba-Geigy Ag | Verfahren zum Bedrucken und photochemischen Stabilisieren von Polyesterfasermaterialien |
-
1994
- 1994-11-29 EP EP94810674A patent/EP0657577A1/de not_active Withdrawn
- 1994-12-02 CA CA 2137212 patent/CA2137212A1/en not_active Abandoned
- 1994-12-06 JP JP6302388A patent/JPH07196631A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH529877A (de) * | 1965-10-23 | 1972-10-31 | Gaf Corp | Verwendung von Naphtotriazolen als UV-Absorber für Textilfasern |
| FR1572761A (de) * | 1967-07-01 | 1969-06-27 | ||
| EP0474595A1 (de) * | 1990-08-28 | 1992-03-11 | Ciba-Geigy Ag | Wässrige Dispersion schwerlöslicher UV-Absorber |
| EP0523006A1 (de) * | 1991-07-12 | 1993-01-13 | Ciba-Geigy Ag | Verfahren zum Bedrucken und photochemischen Stabilisieren von Polyesterfasermaterialien |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5994431A (en) * | 1996-05-03 | 1999-11-30 | 3M Innovative Properties Company | Amide functional ultraviolet light absorbers for polyolefins |
| US6150440A (en) * | 1996-05-03 | 2000-11-21 | 3M Innovative Properties Company | UV light absorbing material comprising a carboxylic polymer and an amide compound, films, products, and methods of use |
| US6291586B2 (en) | 1996-05-03 | 2001-09-18 | 3M Innovative Properties Company | Amide functional ultraviolet light absorbers for polyurethanes and polyureas |
| WO1999023151A1 (en) * | 1997-10-31 | 1999-05-14 | Minnesota Mining And Manufacturing Company | Amide functional ultraviolet light absorbers for polyurethanes and polyureas |
| WO2002077148A1 (en) * | 2001-03-27 | 2002-10-03 | Ciba Speciality Chemicals Holding Inc. | Fabric rinse composition containing a benztriazole uv absorber |
| US7105479B2 (en) | 2001-03-27 | 2006-09-12 | Ciba Specialty Chemicals Corporation | Fabric rinse composition containing a benztriazole UV absorber |
| DE102011082078A1 (de) * | 2011-09-02 | 2013-03-07 | Carl Stahl Gmbh & Co. Kg | Verfahren zum Bedrucken eines Gurtbands |
Also Published As
| Publication number | Publication date |
|---|---|
| JPH07196631A (ja) | 1995-08-01 |
| CA2137212A1 (en) | 1995-06-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0557247B1 (de) | Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien | |
| EP0475905A1 (de) | Verfahren zum photochemischen Stabilisieren von Wolle | |
| DE2520527C3 (de) | Wäßrige Präparate von in Wasser unlöslichen bis schwerlöslichen Farbstoffen oder optischen Aufhellern sowie deren Herstellung und Verwendung | |
| EP0280654B1 (de) | Verfahren zur Verbesserung der fotochemischen Stabilität von Färbungen auf Polyesterfasermaterialien | |
| EP0613976B1 (de) | Verwendung von Acrylamidpolymeren als Faltenverhinderungsmittel | |
| CH666275A5 (de) | Acetylerythromycinstearat, verfahren zu dessen herstellung und dieses enthaltende arzneimittel. | |
| EP0584044B1 (de) | Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten Polyesterfasermaterialien | |
| EP0657577A1 (de) | Verfahren zur photochemischen und thermischen Stabilisierung von ungefärbten und gefärbten oder bedruckten Polyesterfasermaterialien | |
| EP0964096A2 (de) | Verfahren zur Verbesserung der photochemischen und thermischen Stabilität von Färbungen und Drucken auf Polyesterfasermaterialien | |
| DE2340045A1 (de) | Verfahren zum kontinuierlichen faerben und bedrucken von stueckwaren aus synthetischen polyamidfasern vorzugsweise in mischung mit cellulosefasern | |
| DE3035912C2 (de) | ||
| DE1290913B (de) | Verfahren zum Faerben von organischem Fasermaterial | |
| EP0354174A1 (de) | Stabile, wässrige Zusammensetzung zur Verbesserung der Lichtechtheit | |
| EP0279272B1 (de) | Mischungen von Monoazofarbstoffen | |
| EP0591108B1 (de) | Verfahren zum Färben von wollhaltigen Fasermaterialien | |
| CH682578A5 (de) | N-Alkylphthalimidgemisch. | |
| DE1099494B (de) | Verfahren zur Fertigstellung von Faerbungen, welche in saurem Bade auf stickstoffhaltigen Fasern mit im Bad loeslichen Farbstoffen, die mindestens ein bewegliches, mit den Fasern reaktionsfaehiges Halogenatom enthalten, hergestellt worden sind | |
| DE2148867C3 (de) | Verfahren zur kontinuierlichen Fixierung von Dispersionsfarbstoffen auf Polyester, Cellulosetriacetat, Cellulose-2 l/2-acetat und deren Mischungen | |
| DE1904919C2 (de) | 06.11.68 Schweiz 16521-68 Verfahren zum Färben und Bedrucken von Textilmaterial aus hydrophoben Polyestern | |
| EP0864687A2 (de) | Verfahren zur Verbesserung der photochemischen Stabilität von Färbungen und Drucken auf Polyesterfasern | |
| DE2512462C2 (de) | Verfahren zum bedrucken oder klotzfaerben von polyester, cellulose-triacetat, cellulose 2 1/2 acetat und deren mischungen | |
| CH672274A5 (de) | ||
| DE60223004T2 (de) | Schutz für reduktionsempfindliche farbstoffe | |
| DE1239266B (de) | Verfahren zum Faerben und bzw. oder Bedrucken von Textilgut | |
| EP0962586A1 (de) | Verfahren zur Verbesserung der photochemischen und thermischen Stabilität von Färbungen und Drucken auf Polyesterfasermaterialien |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE CH DE ES FR GB IT LI |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION IS DEEMED TO BE WITHDRAWN |
|
| 18D | Application deemed to be withdrawn |
Effective date: 19951215 |