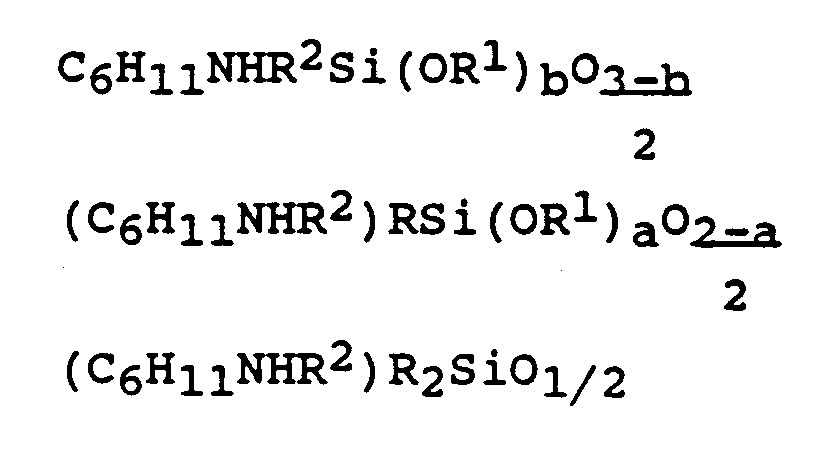EP0306935B1 - Verfahren zur Imprägnierung von organischen Fasern - Google Patents
Verfahren zur Imprägnierung von organischen Fasern Download PDFInfo
- Publication number
- EP0306935B1 EP0306935B1 EP88114668A EP88114668A EP0306935B1 EP 0306935 B1 EP0306935 B1 EP 0306935B1 EP 88114668 A EP88114668 A EP 88114668A EP 88114668 A EP88114668 A EP 88114668A EP 0306935 B1 EP0306935 B1 EP 0306935B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- bonded
- sic
- radicals
- organopolysiloxane
- silicon
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000000034 method Methods 0.000 title claims abstract description 28
- 229920001296 polysiloxane Polymers 0.000 claims abstract description 51
- 229910052710 silicon Inorganic materials 0.000 claims abstract description 29
- 239000010703 silicon Substances 0.000 claims abstract description 27
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims abstract description 24
- 239000004215 Carbon black (E152) Substances 0.000 claims abstract description 18
- 229930195733 hydrocarbon Natural products 0.000 claims abstract description 18
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 15
- 239000003054 catalyst Substances 0.000 claims abstract description 12
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 12
- 238000009833 condensation Methods 0.000 claims abstract description 10
- 230000005494 condensation Effects 0.000 claims abstract description 10
- 239000000835 fiber Substances 0.000 abstract description 18
- -1 hydrocarbon radicals Chemical class 0.000 description 51
- 150000003254 radicals Chemical class 0.000 description 25
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 24
- 239000000839 emulsion Substances 0.000 description 19
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 18
- 229920000742 Cotton Polymers 0.000 description 13
- 229910000077 silane Inorganic materials 0.000 description 13
- 239000004744 fabric Substances 0.000 description 12
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 239000000126 substance Substances 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 9
- 235000013870 dimethyl polysiloxane Nutrition 0.000 description 8
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 150000001412 amines Chemical class 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 7
- 239000001257 hydrogen Substances 0.000 description 7
- 229910052739 hydrogen Inorganic materials 0.000 description 7
- 238000012986 modification Methods 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 230000000052 comparative effect Effects 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 125000004432 carbon atom Chemical group C* 0.000 description 4
- 239000002270 dispersing agent Substances 0.000 description 4
- 238000004383 yellowing Methods 0.000 description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 102000011782 Keratins Human genes 0.000 description 3
- 108010076876 Keratins Proteins 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 125000004103 aminoalkyl group Chemical group 0.000 description 3
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 229910052799 carbon Chemical group 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- QQGRFMIMXPWKPM-UHFFFAOYSA-N 2,3,4-tributylphenol Chemical compound CCCCC1=CC=C(O)C(CCCC)=C1CCCC QQGRFMIMXPWKPM-UHFFFAOYSA-N 0.000 description 2
- HNUALPPJLMYHDK-UHFFFAOYSA-N C[CH]C Chemical compound C[CH]C HNUALPPJLMYHDK-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical class [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 2
- CIUQDSCDWFSTQR-UHFFFAOYSA-N [C]1=CC=CC=C1 Chemical compound [C]1=CC=CC=C1 CIUQDSCDWFSTQR-UHFFFAOYSA-N 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 239000004205 dimethyl polysiloxane Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 238000005470 impregnation Methods 0.000 description 2
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 150000003961 organosilicon compounds Chemical class 0.000 description 2
- 239000010695 polyglycol Substances 0.000 description 2
- 229920000151 polyglycol Polymers 0.000 description 2
- 150000004756 silanes Chemical class 0.000 description 2
- 238000005507 spraying Methods 0.000 description 2
- 239000004753 textile Substances 0.000 description 2
- 210000002268 wool Anatomy 0.000 description 2
- ONDPHDOFVYQSGI-UHFFFAOYSA-N zinc nitrate Chemical compound [Zn+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O ONDPHDOFVYQSGI-UHFFFAOYSA-N 0.000 description 2
- ODIGIKRIUKFKHP-UHFFFAOYSA-N (n-propan-2-yloxycarbonylanilino) acetate Chemical group CC(C)OC(=O)N(OC(C)=O)C1=CC=CC=C1 ODIGIKRIUKFKHP-UHFFFAOYSA-N 0.000 description 1
- IHEDBVUTTQXGSJ-UHFFFAOYSA-M 2-[bis(2-oxidoethyl)amino]ethanolate;titanium(4+);hydroxide Chemical compound [OH-].[Ti+4].[O-]CCN(CC[O-])CC[O-] IHEDBVUTTQXGSJ-UHFFFAOYSA-M 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- SLRMQYXOBQWXCR-UHFFFAOYSA-N 2154-56-5 Chemical compound [CH2]C1=CC=CC=C1 SLRMQYXOBQWXCR-UHFFFAOYSA-N 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 1
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 229920000297 Rayon Polymers 0.000 description 1
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 1
- 229920004482 WACKER® Polymers 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical class [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- YUDRVAHLXDBKSR-UHFFFAOYSA-N [CH]1CCCCC1 Chemical compound [CH]1CCCCC1 YUDRVAHLXDBKSR-UHFFFAOYSA-N 0.000 description 1
- UKLDJPRMSDWDSL-UHFFFAOYSA-L [dibutyl(dodecanoyloxy)stannyl] dodecanoate Chemical compound CCCCCCCCCCCC(=O)O[Sn](CCCC)(CCCC)OC(=O)CCCCCCCCCCC UKLDJPRMSDWDSL-UHFFFAOYSA-L 0.000 description 1
- WPNRZVONKRBZDU-UHFFFAOYSA-L [dodecanoyloxy(diethyl)stannyl] dodecanoate Chemical compound CC[Sn+2]CC.CCCCCCCCCCCC([O-])=O.CCCCCCCCCCCC([O-])=O WPNRZVONKRBZDU-UHFFFAOYSA-L 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000002877 alkyl aryl group Chemical group 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- NDKBVBUGCNGSJJ-UHFFFAOYSA-M benzyltrimethylammonium hydroxide Chemical compound [OH-].C[N+](C)(C)CC1=CC=CC=C1 NDKBVBUGCNGSJJ-UHFFFAOYSA-M 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 230000001680 brushing effect Effects 0.000 description 1
- MIGNWTQKRPNYLP-UHFFFAOYSA-N but-2-ene-2,3-diol urea Chemical compound NC(=O)N.OC(=C(C)O)C MIGNWTQKRPNYLP-UHFFFAOYSA-N 0.000 description 1
- 235000009120 camo Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 150000001734 carboxylic acid salts Chemical class 0.000 description 1
- 235000005607 chanvre indien Nutrition 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- WCRDXYSYPCEIAK-UHFFFAOYSA-N dibutylstannane Chemical compound CCCC[SnH2]CCCC WCRDXYSYPCEIAK-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- HGQSXVKHVMGQRG-UHFFFAOYSA-N dioctyltin Chemical compound CCCCCCCC[Sn]CCCCCCCC HGQSXVKHVMGQRG-UHFFFAOYSA-N 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004945 emulsification Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000009950 felting Methods 0.000 description 1
- 239000011487 hemp Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- WCYWZMWISLQXQU-UHFFFAOYSA-N methyl Chemical compound [CH3] WCYWZMWISLQXQU-UHFFFAOYSA-N 0.000 description 1
- GRVDJDISBSALJP-UHFFFAOYSA-N methyloxidanyl Chemical compound [O]C GRVDJDISBSALJP-UHFFFAOYSA-N 0.000 description 1
- 239000004745 nonwoven fabric Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 229920000191 poly(N-vinyl pyrrolidone) Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- 239000002964 rayon Substances 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 239000011701 zinc Chemical class 0.000 description 1
- 229910052725 zinc Chemical class 0.000 description 1
- CHJMFFKHPHCQIJ-UHFFFAOYSA-L zinc;octanoate Chemical compound [Zn+2].CCCCCCCC([O-])=O.CCCCCCCC([O-])=O CHJMFFKHPHCQIJ-UHFFFAOYSA-L 0.000 description 1
- 150000003755 zirconium compounds Chemical class 0.000 description 1
Classifications
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06M—TREATMENT, NOT PROVIDED FOR ELSEWHERE IN CLASS D06, OF FIBRES, THREADS, YARNS, FABRICS, FEATHERS OR FIBROUS GOODS MADE FROM SUCH MATERIALS
- D06M15/00—Treating fibres, threads, yarns, fabrics, or fibrous goods made from such materials, with macromolecular compounds; Such treatment combined with mechanical treatment
- D06M15/19—Treating fibres, threads, yarns, fabrics, or fibrous goods made from such materials, with macromolecular compounds; Such treatment combined with mechanical treatment with synthetic macromolecular compounds
- D06M15/37—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
- D06M15/643—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds containing silicon in the main chain
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06M—TREATMENT, NOT PROVIDED FOR ELSEWHERE IN CLASS D06, OF FIBRES, THREADS, YARNS, FABRICS, FEATHERS OR FIBROUS GOODS MADE FROM SUCH MATERIALS
- D06M15/00—Treating fibres, threads, yarns, fabrics, or fibrous goods made from such materials, with macromolecular compounds; Such treatment combined with mechanical treatment
- D06M15/19—Treating fibres, threads, yarns, fabrics, or fibrous goods made from such materials, with macromolecular compounds; Such treatment combined with mechanical treatment with synthetic macromolecular compounds
- D06M15/37—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
- D06M15/643—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds containing silicon in the main chain
- D06M15/6436—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds containing silicon in the main chain containing amino groups
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/31504—Composite [nonstructural laminate]
- Y10T428/31652—Of asbestos
- Y10T428/31663—As siloxane, silicone or silane
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T442/00—Fabric [woven, knitted, or nonwoven textile or cloth, etc.]
- Y10T442/20—Coated or impregnated woven, knit, or nonwoven fabric which is not [a] associated with another preformed layer or fiber layer or, [b] with respect to woven and knit, characterized, respectively, by a particular or differential weave or knit, wherein the coating or impregnation is neither a foamed material nor a free metal or alloy layer
- Y10T442/2762—Coated or impregnated natural fiber fabric [e.g., cotton, wool, silk, linen, etc.]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T442/00—Fabric [woven, knitted, or nonwoven textile or cloth, etc.]
- Y10T442/20—Coated or impregnated woven, knit, or nonwoven fabric which is not [a] associated with another preformed layer or fiber layer or, [b] with respect to woven and knit, characterized, respectively, by a particular or differential weave or knit, wherein the coating or impregnation is neither a foamed material nor a free metal or alloy layer
- Y10T442/2762—Coated or impregnated natural fiber fabric [e.g., cotton, wool, silk, linen, etc.]
- Y10T442/277—Coated or impregnated cellulosic fiber fabric
- Y10T442/2803—Polymeric coating or impregnation from a silane or siloxane not specified as lubricant or water repellent
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T442/00—Fabric [woven, knitted, or nonwoven textile or cloth, etc.]
- Y10T442/20—Coated or impregnated woven, knit, or nonwoven fabric which is not [a] associated with another preformed layer or fiber layer or, [b] with respect to woven and knit, characterized, respectively, by a particular or differential weave or knit, wherein the coating or impregnation is neither a foamed material nor a free metal or alloy layer
- Y10T442/2861—Coated or impregnated synthetic organic fiber fabric
- Y10T442/2877—Coated or impregnated polyvinyl alcohol fiber fabric
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T442/00—Fabric [woven, knitted, or nonwoven textile or cloth, etc.]
- Y10T442/20—Coated or impregnated woven, knit, or nonwoven fabric which is not [a] associated with another preformed layer or fiber layer or, [b] with respect to woven and knit, characterized, respectively, by a particular or differential weave or knit, wherein the coating or impregnation is neither a foamed material nor a free metal or alloy layer
- Y10T442/2861—Coated or impregnated synthetic organic fiber fabric
- Y10T442/291—Coated or impregnated polyolefin fiber fabric
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T442/00—Fabric [woven, knitted, or nonwoven textile or cloth, etc.]
- Y10T442/20—Coated or impregnated woven, knit, or nonwoven fabric which is not [a] associated with another preformed layer or fiber layer or, [b] with respect to woven and knit, characterized, respectively, by a particular or differential weave or knit, wherein the coating or impregnation is neither a foamed material nor a free metal or alloy layer
- Y10T442/2861—Coated or impregnated synthetic organic fiber fabric
- Y10T442/291—Coated or impregnated polyolefin fiber fabric
- Y10T442/2918—Polypropylene fiber fabric
Definitions
- the invention relates to a process for impregnating organic fibers with organopolysiloxane (1) which contains the condensable groups bonded directly to silicon and, in addition to diorganosiloxane units, in which the two SiC-bonded organic radicals are monovalent hydrocarbon radicals, at least two monovalent SiC- contains bound residues with basic nitrogen, characterized in that that at least some of the SiC-bound radicals with basic nitrogen consist of SiC-bound N-cyclohexylaminoalkyl radicals.
- SiC-bonded radicals with basic nitrogen are N-alkylaminoalkyl radicals or N- (aminoalkyl) aminoalkyl Residues, but not called N-cycloalkylaminoalkyl residues.
- all organic fibers in the form of threads, yarns, nonwovens, mats, strands, woven, knitted or knitted textiles can be impregnated, which previously could also be impregnated with organosilicon compounds.
- fibers which can be impregnated by the process according to the invention are thus those made of keratin, in particular wool, polyvinyl alcohol, copolymers of vinyl acetate, cotton, rayon, hemp, natural silk, polypropylene, polyethylene, polyester, polyurethane, polyamide, cellulose and mixtures from at least two such fibers.
- the fibers can be of natural or synthetic origin.
- the textiles can be in the form of fabric webs or items of clothing or parts of items of clothing.
- the shrinkage due to felting can be prevented by impregnation by the process according to the invention, especially if the keratin has been pretreated, rinsed and neutralized.
- the diorganosiloxane units in which the two SiC-bonded organic radicals are monovalent hydrocarbon radicals, are preferably those represented by the formula can be reproduced, where R is the same or different monovalent hydrocarbon radicals, R1 is hydrogen or carbon and hydrogen atom (s) and, if appropriate, an ether oxygen atom, radicals free of multiple bonds with 1 to 15 carbon atoms per radical and a is 0 or 1 is.
- radicals R preferably contain 1 to 18 carbon atoms per radical.
- radicals R are alkyl radicals, such as the methyl, ethyl, n-propyl and isopropyl radical and butyl, octyl, tetradecyl and octadecyl radicals; aliphatic hydrocarbon radicals with at least one double bond, such as the vinyl, allyl and butadienyl radical; cycloaliphatic hydrocarbon radicals, such as the cyclohexyl radical; aromatic hydrocarbon radicals such as the phenyl radical and naphthyl radicals; Alkaryl groups such as tolyl groups; and aralkyl radicals, such as the benzyl radical.
- at least 80% of the number of SiC-bonded hydrocarbon radicals in the organopolysiloxane (1) are preferably methyl radicals.
- hydrocarbon radicals R insofar as they represent hydrocarbon radicals free of multiple bonds with a maximum of 15 carbon atoms per radical, also apply in full to the hydrocarbon radicals R 1, the methyl, ethyl and isopropyl radicals being preferred.
- a a preferred example of a radical R 1 composed of carbon and hydrogen atoms and an ether oxygen is the rest of the formula CH3O (CH2) 2-.
- the organopolysiloxanes (1) preferably contain at least 100 diorganosiloxane units, in which the two SiC-bonded organic radicals are monovalent hydrocarbon radicals, per molecule.
- the SiC-bonded N-cyclohexylaminoalkyl radicals are present in monoorganosiloxane and / or diorganosiloxane and / or triorganosiloxane units, preferably by the formulas can be reproduced, where R, R1 and a have the meaning given above, R2 is the same or different, divalent hydrocarbon radicals and b is 0, 1 or 2.
- radical R 2 is that of the formula - (CH2) 3- particularly preferred.
- the SiC-bound N-cyclohexyl-3-aminopropyl radical is particularly preferred as the SiC-bound N-cyclohexylaminoalkyl radical.
- organopolysiloxane (1) which contains condensable groups bonded directly to silicon
- further monoorganosiloxane and / or diorganosiloxane and / or triorganosiloxane units which have a SiC-bonded radical with basic nitrogen are not excluded.
- They are preferably those of the formula wherein R, R1, R2, a and b have the meaning given above and R3 is hydrogen or the same or different alkyl or aminoalkyl or iminoalkyl radicals.
- alkyl radicals R3 are the methyl, ethyl, n-propyl and isopropyl radical as well as butyl, octyl, tetradecyl and octadecyl radicals.
- aminoalkyl radicals R3 are those of the formula H2N (CH2) 2- H2N (CH2) 2NH (CH2) 3- H2N (CH2) 3- (CH3) 2N (CH2) - H2N (CH2) 5- H (NHCH2CH2) 3- and n-C4H9NHCH2CH2NHCH2CH2-.
- the number of siloxane units with an SiC-bonded radical with basic nitrogen is preferably 0.4% to 6% of the number of diorganosiloxane units, in which the both SiC-bonded organic radicals are monovalent hydrocarbon radicals.
- a type of organopolysiloxane (1) can be used. However, a mixture of at least two different types of organopolysiloxane (1) can also be used.
- the organopolysiloxane (1) or a mixture of at least two different types of organopolysiloxane (1) has an average viscosity of preferably 100 to 10,000 mPa.s at 25 ° C, particularly preferably 1000 to 5000 mPa.s at 25 ° C.
- the organopolysiloxane contains (1) condensable groups bonded directly to silicon, it can, together with (2a) organopolysiloxane, which has at least 3 Si-bonded hydrogen atoms per molecule, and (3) optionally a catalyst for the condensation of bonds bonded directly to silicon , condensable groups are used.
- organopolysiloxane can also be used together with (2b) trialkoxy- or tetraalkoxysilane and (3) optionally catalyst for the condensation of condensable groups directly bonded to silicon.
- the organopolysiloxanes (1) can be prepared in a manner known per se for any of the organopolysiloxanes which contain monovalent SiC-bonded radicals containing basic nitrogen.
- organopolysiloxane (2a) with at least 3 Si-bonded hydrogen atoms per molecule which in connection with directly organopolysiloxane (1) having silicon-bonded groups capable of condensation can be used in the process according to the invention
- the silicon valences, other than saturated by hydrogen and siloxane oxygen atoms are preferably saturated by methyl, ethyl or phenyl radicals or a mixture of at least two such hydrocarbon radicals. It is further preferred that each silicon atom to which a hydrogen atom is bound also has one of the preferred hydrocarbon radicals mentioned above bound.
- Particularly preferred organopolysiloxanes (2a) with at least 3 Si-bonded hydrogen atoms per molecule are those of the formula (CH3) 3SiO (SiR 4th 2nd O) p Si (CH3) 3, wherein R4 is hydrogen or the methyl, ethyl or phenyl radical and p is an integer from 10 to 500, with the proviso that at most one hydrogen atom is bonded to a silicon atom and that the ratio of R 4th 2nd SiO units in which both R4 are hydrocarbon radicals to the units with Si-bonded hydrogen is 3: 1 to 1: 4.
- R4 also preferably denotes a methyl radical if it is not hydrogen.
- organopolysiloxane can also be used as organopolysiloxanes (2a) with at least 3 Si-bonded hydrogen atoms per molecule.
- the organopolysiloxane (2a) is preferably used in amounts of 0.01 to 0.20 parts by weight of Si-bonded hydrogen per 100 parts by weight of organopolysiloxane (1).
- the trialkoxy or tetraalkoxysilanes (2b) which can be used in the process according to the invention in connection with organopolysiloxane (1) having groups capable of condensation bonded directly to silicon are preferably those of the formula RSi (OR1) 3 or Si (OR1) 4 or partial hydrolyzates of trialkoxy or tetraalkoxysilanes with up to 10 silicon atoms per partial hydrolyzate, where R and R1 have the meaning given above.
- Trialkoxy- or tetraalkoxysilane (2b) is preferably used in amounts of 1 to 20 parts by weight per 100 parts by weight of organopolysiloxane (1).
- any catalysts for the condensation of condensable groups directly bonded to silicon can be used in the process according to the invention which have hitherto been used to promote the condensation of condensable groups directly bonded to silicon Groups could be used.
- Such catalysts are, in particular, carboxylic acid salts of tin or zinc, it being possible for hydrocarbon radicals to be bonded directly to tin, such as di-n-butyltin dilaurate, tin octoates, di-2-ethyltin dilaurate, di-n-butyltin di-2-ethylhexoate, di-2- ethylhexyltin di-2-ethylhexoate, dibutyl or dioctyltin diacylates, the acylate groups being derived in each case from alkanoic acids having 3 to 16 carbon atoms per acid, in which at least two of the valences of the carbon atom bonded to the carboxyl group are saturated by at least two carbon atoms other than that of the carboxy group , and zinc octoate.
- tin such as di-n-butyltin dilaurate, tin octo
- catalysts (3) are alkoxy titanates, such as butyl titanates and triethanolamine titanate, and zirconium compounds.
- catalysts (3) The same or different molecules of this type of catalyst can also be used as catalysts (3).
- the catalyst (3) is preferably used in amounts of 1 to 10 parts by weight per 100 parts by weight of organopolysiloxane (1).
- further substances such as can conventionally be used to impregnate organic fibers, can optionally be used in the process according to the invention.
- further substances in the terminal units are dimethylpolysiloxanes each having an Si-bonded hydroxyl group and having a viscosity of at most 10,000 mPa.s at 25 ° C, dimethylpolysiloxanes endblocked by trimethylsiloxy groups and having a viscosity of at most 10,000 mPa.s at 25 ° C and, especially if the fibers to be impregnated consist at least in part of cellulose or cotton, so-called "crease-free finishes", such as dimethyldihydroxyethylene urea (DMDHEU) in a mixture with zinc nitrate or magnesium chloride.
- DMDHEU dimethyldihydroxyethylene urea
- the substances used in the process according to the invention can be applied to the fiber to be impregnated in undiluted form or in the form of solutions in organic solvent or in the form of aqueous emulsions. If aqueous emulsions are used, these emulsions can in addition to water, dispersants and the above-mentioned substances to be dispersed, contain thickeners, such as poly-N-vinylpyrrolidone.
- the substances used in the process according to the invention are preferably applied in the form of aqueous emulsions to the fibers to be impregnated. Nonionic and cationogenic emulsifiers are preferred as dispersants in these dispersions. These emulsions can be prepared in a manner known for the emulsification of organopolysiloxanes.
- the substances used in the process according to the invention can be applied to the fibers to be impregnated in any suitable and well-known manner for the impregnation of fibers, e.g. B. by dipping, brushing, pouring, spraying, including spraying from aerosol packaging, rolling, padding or printing.
- the substances used in the process according to the invention are preferably applied in amounts such that the weight gain of the fiber by these substances, minus any diluents which may be used, is 1 to 20 percent by weight, based on the weight of the fiber.
- the crosslinking of the organosilicon compounds used in the process according to the invention which occurs when components (2a) or (2b) and optionally (3) are used, takes place at room temperature. You can by heating to z. B. accelerated 50 ° to 180 ° C.
- An emulsion as described in Example 1 under b) is prepared with a dimethylpolysiloxane which has a Si-bonded hydroxyl group and has a viscosity of 1010 mPa.s at 25 ° C. in the terminal units.
- a white cotton fabric with a weight of 180 g / cm2 is immersed in an emulsion E1, E2, E3 and E4, each containing 30 g / l of the emulsion, the preparation of which is described in Examples 1, 2, 3 and 4 , and the rest contains water.
- a white cotton fabric with a weight of 180 g / cm 2 is immersed in an emulsion VE1, VE2, VE3 and VE4, each containing 30 g / l of the emulsion, the preparation of which is described in comparative experiments 1, 2, 3 and 4 and contains the rest of water.
- the cotton fabrics are then squeezed to 74% liquid absorption.
- the cotton fabrics impregnated in this way are then heated to 150 ° C. for 10 minutes.
- the grip was rated equally well for the cotton fabrics impregnated with the emulsions E1, E2, E4, VE1 and VE2, but was rated better than for the cotton fabrics impregnated with the emulsions E3 and VE3 and much better rated as for the cotton fabric impregnated with the emulsion VE4.
- Table 2 Yellowing assessment white cotton fabric impregnated with emulsion E1 E2 E3 E4 VE1 VE2 VE3 VE4 without 1) Berger whiteness 76.1 76.3 76.5 76.8 74.7 74.5 71.5 76.6 76.5 1) non-impregnated white cotton fabric
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Textile Engineering (AREA)
- Treatments For Attaching Organic Compounds To Fibrous Goods (AREA)
- Silicon Polymers (AREA)
Description
- Aus US-A-4 098 701, ausgegeben 4. Juli 1978, P. M. Burrill et al., Dow Corning Limited und DE-A-35 03 457, offengelegt 7. August 1986, K. Huhn et al., Wacker Chemie GmbH ist es bereits bekannt, organische Fasern mit direkt an Silicium gebundene, kondensationsfähige Gruppen aufweisenden Organopolysiloxan, das zusätzlich zu Diorganosiloxaneinheiten, worin die beiden SiC-gebundenen, organischen Reste einwertige Kohlenwasserstoffreste sind, mindestens zwei einwertige SiC-gebundene Reste mit basischen Stickstoff enthält, Organopolysiloxan mit mindestens drei Si-gebundenen Wasserstoffatomen je Molekül und Katalysator für die Kondensation von direkt an Silicium gebundenen, kondensationsfähigen Gruppen zu imprägnieren.
- Es ist Aufgabe der Erfindung, ein Verfahren zur Imprägnierung von organischen Fasern bereitzustellen, das den Fasern angenehmen Griff verleiht, und bei dem die Vergilbung der organischen Fasern besonders gering ist.
- Gegenstand der Erfindung ist ein Verfahren zur Imprägnierung von organischen Fasern mit Organopolysiloxan (1), das das direkt an Silicium gebundene, kondensationsfähige Gruppen enthält und zusätzlich zu Diorganosiloxaneinheiten, worin die beiden SiC-gebundenen, organischen Reste einwertige Kohlenwasserstoffreste sind, mindestens zwei einwertige SiC-gebundene Reste mit basischem Stickstoff enthält, dadurch gekennzeichnet, daß mindestens ein Teil der SiC-gebundenen Reste mit basischem Stickstoff aus SiC-gebundenen N-Cyclohexylaminoalkyl-Resten besteht.
- In US-A-4 098 701 sowie in der DE-A-35 03 457 (entsprechend US Ser. No. 807007) sind als SiC-gebundene Reste mit basischem Stickstoff N-Alkylaminoalkyl-Reste, bzw. N-(Aminoalkyl)aminoalkyl-Reste, aber keine N-Cycloalkylaminoalkyl-Reste genannt.
- Nach dem erfindungsgemäßen Verfahren können alle organischen Fasern in Form von Fäden, Garnen, Vliesen, Matten, Strängen,gewebten, gewirkten oder gestrickten Textilien imprägniert werden, die auch bisher mit Organosiliciumverbindungen imprägniert werden konnten. Beispiele für Fasern, die nach dem erfindungsgemäßen Verfahren imprägniert werden können, sind somit solche aus Keratin, insbesondere Wolle, Polyvinylalkohol, Mischpolymere von Vinylacetat, Baumwolle, Rayon, Hanf, natürliche Seide, Polypropylen, Polyethylen, Polyester, Polyurethan, Polyamid, Cellulose und Gemische aus mindestens zwei solcher Fasern. Wie aus der vorstehenden Aufzählung ersichtlich, können die Fasern natürlicher oder synthetischer Herkunft sein. Die Textilien können in Form von Stoffbahnen oder Kleidungsstücken bzw. Teilen von Kleidungsstücken vorliegen.
- Bei Keratin, insbesondere Wolle, kann durch Imprägnierung nach dem erfindungsgemäßen Verfahren, vor allem, wenn das Keratin mit Chlor vorbehandelt, gespült und neutralisiert wurde, das Schrumpfen durch Verfilzen verhindert werden.
- Im Organopolysiloxan (1), das direkt am Silicium gebundene, kondensationsfähige Gruppen enthält, sind die Diorganosiloxaneinheiten, worin die beiden SiC-gebundenen, organischen Reste einwertige Kohlenwasserstoffreste sind, vorzugsweise solche, die durch die Formel
wiedergegeben werden können, wobei R gleiche oder verschiedene, einwertige Kohlenwasserstoffreste, R¹ Wasserstoff oder aus Kohlenstoff- und Wasserstoffatom(en) sowie gegebenenfalls einem Ethersauerstoffatom aufgebaute, von Mehrfachbindungen freie Reste mit 1 bis 15 Kohlenstoffatom(en) je Rest bedeutet und a 0 oder 1 ist. - Vorzugsweise enthalten die Reste R 1 bis 18 Kohlenstoffatom(e)je Rest. Beispiele für Reste R sind Alkylreste, wie der Methyl-, Ethyl-, n-Propyl- und Isopropylrest sowie Butyl-, Octyl-, Tetradecyl- und Octadecylreste; aliphatische Kohlenwasserstoffreste mit mindestens einer Doppelbindung, wie der Vinyl-, Allyl- und Butadienylrest; cycloaliphatische Kohlenwasserstoffreste, wie der Cyclohexylrest; aromatische Kohlenwasserstoffreste, wie der Phenylrest und Naphthylreste; Alkarylreste, wie Tolylreste; und Aralkylreste, wie der Benzylrest. Insbesondere wegen der leichteren Zugänglichkeit sind vorzugsweise mindestens 80 % der Anzahl der SiC-gebundenen Kohlenwasserstoffreste im Organopolysiloxan (1) Methylreste.
- Die Beispiele für Kohlenwasserstoffreste R, soweit sie von Mehrfachbindungen freie Kohlenwasserstoffreste mit höchstens 15 Kohlenstoffatomen je Rest darstellen, gelten im vollen Umfang auch für die Kohlenwasserstoffreste R¹, wobei die Methyl-, Ethyl- und Isopropylreste bevorzugt sind. Ein bevorzugtes Beispiel für einen aus Kohlenstoff- und Wasserstoffatomen sowie einem Ethersauerstoff aufgebauten Rest R¹ ist der Rest der Formel
CH₃O(CH₂)₂-.
- Vorzugsweise enthalten die Organopolysiloxane (1) mindestens 100 Diorganosiloxaneinheiten, worin die beiden SiC-gebundenen, organischen Reste einwertige Kohlenwasserstoffreste sind, je Molekül.
- Im Organopolysiloxan (1), das gegebenenfalls direkt an Silicium gebundene kondensationsfähige Gruppen enthält, liegen die SiC-gebunden N-Cyclohexylaminoalkyl-Reste in Monoorganosiloxan- und/oder Diorganosiloxan- und/oder Triorganosiloxaneinheiten vor, die vorzugsweise durch die Formeln
wiedergegeben werden können, wobei R, R¹ und a die oben dafür angegebene Bedeutung haben, R² gleiche oder verschiedene, zweiwertige Kohlenwasserstoffreste bedeutet und b 0, 1 oder 2 ist. -
- Besonders bevorzugt als SiC-gebundener N-Cyclohexylaminoalkyl-Rest ist der SiC-gebundene N-Cyclohexyl-3-aminopropyl-Rest.
- Im Organopolysiloxan (1), das direkt an Silicium gebundene, kondensationsfähige Gruppen enthält, sind weitere Monoorganosiloxan- und/oder Diorganosiloxan-und/oder Triorganosiloxaneinheiten, die einen SiC-gebundenen Rest mit basischem Stickstoff aufweisen, nicht ausgeschlossen. Vorzugsweise sind es solche der Formel
wobei R, R¹, R², a und b die oben dafür angegebene Bedeutung haben und R³ Wasserstoff oder gleiche oder verschiedene Alkyl- oder Aminoalkyl- bzw. Iminoalkylreste bedeutet. - Beispiele für Alkylreste R³ sind der Methyl-, Ethyl-, n-Propyl- und Isopropylrest sowie Butyl-, Octyl-, Tetradecyl- und Octadecylreste.
- Beispiele für Aminoalkylreste R³ sind solche der Formel
H₂N(CH₂)₂-
H₂N(CH₂)₂NH(CH₂)₃-
H₂N(CH₂)₃-
(CH₃)₂N(CH₂)-
H₂N(CH₂)₅-
H(NHCH₂CH₂)₃-
und
n-C₄H₉NHCH₂CH₂NHCH₂CH₂-.
- Vorzugsweise beträgt die Anzahl der Siloxaneinheiten mit einem SiC-gebundenen Rest mit basischem Stickstoff 0,4 % bis 6 % der Anzahl der Diorganosiloxaneinheiten, worin die beiden SiC-gebundenen, organischen Reste einwertige Kohlenwasserstoffreste sind.
- Es kann eine Art von Organopolysiloxan (1) eingesetzt werden. Es kann aber auch ein Gemisch aus mindestens zwei verschiedenen Arten von Organopolysiloxan (1) eingesetzt werden.
- Das Organopolysiloxan (1) oder ein Gemisch aus mindestens zwei verschiedenen Arten von Organopolysiloxan (1) hat eine durchschnittliche Viskosität von vorzugsweise 100 bis 10 000 mPa.s bei 25°C, besonders bevorzugt 1000 bis 5000 mPa.s bei 25°C.
- Enthält das Organopolysiloxan (1) direkt an Silicium gebundene, kondensationsfähige Gruppen, so kann es zusammen mit (2a) Organopolysiloxan, das mindestens 3 Si-gebundene Wasserstoffatome je Molekül aufweist, und (3) gegebenenfalls einem Katalysator für die Kondensation von direkt an Silicium gebundene, kondensationsfähige Gruppen eingesetzt werden. Ebenso kann solches Organopolysiloxan zusammen mit (2b) Trialkoxy- oder Tetraalkoxysilan und (3) gegebenenfalls Katalysator für die Kondensation von direkt an Silicium gebundene, kondensationsfähige Gruppen eingesetzt werden.
- Die Herstellung der Organopolysiloxane (1) kann in beliebiger für die Herstellung von Organopolysiloxanen, die einwertige SiC-gebundene Reste mit basischem Stickstoff enthalten, an sich bekannter Weise erfolgen.
- Im Organopolysiloxan (2a) mit mindestens 3 Si-gebundenen Wasserstoffatomen je Molekül, das in Verbindung mit direkt an Silicium gebundene, kondensationsfähige Gruppen aufweisendem Organopolysiloxan (1) bei dem erfindungsgemäßen Verfahren eingesetzt werden kann, sind die anders als durch Wasserstoff- und Siloxansauerstoffatome abgesättigten Siliciumvalenzen vorzugsweise durch Methyl-, Ethyl- oder Phenylreste oder ein Gemisch aus mindestens zwei solcher Kohlenwasserstoffreste abgesättigt. Weiterhin ist bevorzugt, daß an jedes Siliciumatom, an das ein Wasserstoffatom gebunden ist, auch einer der vorstehend genannten bevorzugten Kohlenwasserstoffreste gebunden ist.
- Besonders bevorzugt als Organopolysiloxane (2a) mit mindestens 3 Si-gebundenen Wasserstoffatomen je Molekül sind solche der Formel
(CH₃)₃SiO(SiR
worin R⁴ Wasserstoff oder den Methyl-, Ethyl- oder Phenylrest und p eine ganze Zahl im Wert von 10 bis 500 bedeutet, mit der Maßgabe, daß an ein Siliciumatom höchstens ein Wasserstoffatom gebunden ist und daß das Verhältnis von R - Auch als Organopolysiloxane (2a) mit mindestens 3 Si-gebundenen Wasserstoffatomen je Molekül können gleiche oder verschiedene Moleküle dieser Organopolysiloxanart eingesetzt werden.
- Vorzugsweise wird das Organopolysiloxan (2a) in Mengen von 0,01 bis 0,20 Gewichtsteilen Si-gebundenen Wasserstoffs je 100 Gewichtsteile Organopolysiloxan (1) eingesetzt.
- Als Trialkoxy- oder Tetraalkoxysilane (2b), die in Verbindung mit direkt an Silicium gebundene, kondensationsfähige Gruppen aufweisendem Organopolysiloxan (1) bei dem erfindungsgemäßen Verfahren eingesetzt werden können, werden vorzugsweise solche der Formel
RSi(OR¹)₃
oder
Si(OR¹)₄
oder Teilhydrolysate von Trialkoxy- oder Tetraalkoxysilanen mit bis zu 10 Siliciumatomen je Teilhydrolysat eingesetzt, wobei R und R¹ die oben dafür angegebene Bedeutung haben. - Vorzugsweise wird Trialkoxy- oder Tetraalkoxysilan (2b) in Mengen von 1 bis 20 Gewichtsteilen je 100 Gewichtsteile Organopolysiloxan (1) eingesetzt.
- Als Katalysatoren (3) für die Kondensation von direkt an Silicium gebundenen, kondensationsfähigen Gruppen können bei dem erfindungsgemäßen Verfahren beliebige Katalysatoren für die Kondensation von direkt an Silicium gebundenen, kondensationsfähigen Gruppen eingesetzt werden, die bisher zur Förderung der Kondensation von direkt an Silicium gebundenen, kondensationsfähigen Gruppen eingesetzt werden konnten. Beispiele für solche Katalysatoren sind insbesondere Carbonsäuresalze von Zinn oder Zink, wobei an Zinn Kohlenwasserstoffreste direkt gebunden sein können, wie Di-n-butylzinndilaurat, Zinnoctoate, Di-2-ethylzinndilaurat, Di-n-butylzinndi-2-ethylhexoat, Di-2-ethylhexylzinndi-2-ethylhexoat, Dibutyl- oder Dioctylzinndiacylate, wobei sich die Acylatgruppen jeweils von Alkansäuren mit 3 bis 16 Kohlenstoffatomen je Säure ableiten, bei denen mindestens zwei der Valenzen des an die Carboxylgruppe gebundenen Kohlenstoffatoms durch mindestens zwei andere Kohlenstoffatome als dasjenige der Carboxygruppe abgesättigt sind, und Zinkoctoate.
- Weitere Beispiele für Katalysatoren (3) sind Alkoxytitanate, wie Butyltitanate und Triethanolamintitanat, sowie Zirkoniumverbindungen.
- Auch als Katalysatoren (3) können gleiche oder verschiedene Moleküle dieser Katalysatorart eingesetzt werden.
- Vorzugsweise wird der Katalysator (3) in Mengen von 1 bis 10 Gewichtsteilen je 100 Gewichtsteile Organopolysiloxan (1) eingesetzt.
- Zusätzlich zu den bisher genannten Stoffen (1), (2a), (2b), und (3) können bei dem erfindungsgemäßen Verfahren gegebenenfalls weitere Stoffe, wie sie zur Imprägnierung von organischen Fasern herkömmlicherweise mitverwendet werden können, mitverwendet werden. Beispiele für derartige weitere Stoffe sind in den endständigen Einheiten je eine Si-gebundene Hydroxylgruppe aufweisende Dimethylpolysiloxane mit einer Viskosität von höchstens 10 000 mPa.s bei 25°C, durch Trimethylsiloxygruppen endblockerte Dimethylpolysiloxane mit einer Viskisität von höchstens 10 000 mPa.s bei 25°C und, vor allem, wenn die zu imprägnierenden Fasern mindestens zum Teil aus Cellulose oder Baumwolle bestehen, sogenannte "Knitterfrei-Ausrüstungen", wie Dimethyldihydroxyethylenharnstoff (DMDHEU) im Gemisch mit Zinknitrat oder Magnesiumchlorid.
- Die bei dem erfindungsgemäßen Verfahren eingesetzten Stoffe können in unverdünnter Form oder in Form von Lösungen in organischem Lösungsmittel oder in Form wäßriger Emulsionen auf die zu imprägnierende Faser aufgetragen werden. Werden dabei wäßrige Emulsionen eingesetzt, so können diese Emulsionen zusätzlich zu Wasser, Dispergiermittel und den oben genannten, zu dispergierenden Stoffen Verdickungsmittel, wie Poly-N-vinylpyrrolidon, enthalten. Vorzugsweise werden die bei dem erfindungsgemäßen Verfahren eingesetzten Stoffe in Form wäßriger Emulsionen auf die zu imprägnierenden Fasern aufgetragen. Als Dispergiermittel in diesen Dispersionen sind nichtionogene und kationogene Emulgatoren bevorzugt. Die Herstellung dieser Emulsionen kann in für die Emulgierung von Organopolysiloxanen bekannter Weise erfolgen.
- Das Auftragen der bei dem erfindungsgemäßen Verfahren verwendeten Stoffe auf die zu imprägnierenden Fasern kann in beliebiger für die Imprägnierung von Fasern geeigneter und vielfach bekannter Weise erfolgen, z. B. durch Tauchen, Streichen, Gießen, Sprühen, einschließlich Sprühen aus Aerosolverpackung, Aufwalzen, Klotzen oder Drucken.
- Vorzugsweise werden die bei dem erfingungsgemäßen Verfahren verwendeten Stoffe in solchen Mengen aufgetragen, daß die Gewichtszunahme der Faser durch diese Stoffe, abzüglich der dabei gegebenenfalls mitverwendeten Verdünnungsmittel, 1 bis 20 Gewichtsprozent, bezogen auf das Gewicht der Faser, beträgt.
- Die bei Mitverwendung der Bestandteile (2a) bzw. (2b) und ggf. (3) eintretende Vernetzung der bei dem erfindungsgemäßen Verfahren eingesetzten Organosiliciumverbindungen auf der Faser erfolgt bei Raumtemperatur. Sie kann durch Erwärmen auf z. B. 50° bis 180°C beschleunigt werden.
- In den folgenden Teilen der Beschreibung beziehen sich alle Angaben von Teilen und Prozentsätzen auf das Gewicht, soweit nichts anderes angegeben ist.
-
- a) Ein Gemisch aus 4,5 Teilen des Silans der Formel
C₆H₁₁NH(CH₂)₃SiCH₃(OCH₃)₂
und 150 Teilen einer Mischung von cyclischen Dimethylpolysiloxanen mit 3 bis 10 Siloxaneinheiten je Molekül und 0,03 Teilen einer 40-%-igen Lösung von Benzyltrimethylammoniumhydroxid in Methanol wird unter Stickstoff und Rühren 4 Stunden auf 80°C erwärmt. Dann wird das quarternäre Ammoniumhydroxid durch 60 Minuten Erwärmen auf 150°C bei 13 hPa (abs.) unwirksam gemacht und gleichzeitig das Organopolysiloxan von unter diesen Bedingungen siedende Bestandteilen befreit. Das so erhaltene Organopolysiloxan enthält als direkt an Silicium gebundene, kondensationsfähige Gruppen Methoxygruppen und zusätzlich zu Dimethylsiloxaneinheiten Diorganosiloxaneinheiten mit einem SiC-gebundenen N-Cyclohexyl-3-aminopropyl-Rest. Es hat eine Viskosität von 1200 mPa.s bei 25°C und eine Aminzahl (= Anzahl der ml 1-n-HCl, die zum Neutralisieren von 1g Substanz erforderlich sind) von 0,15. - b) 35 Teile des Organopolysiloxans, dessen Herstellung vorstehend unter a) beschrieben wurde, werden unter Verwendung von 4 Teilen Polyglykolether, der durch Umsetzung von Tributylphenol (1 Mol) mit Ethylenoxyd (13 Mol) hergestellt wurde, als Dispergiermittel in 61 Teilen Wasser emulgiert.
-
- a) Die in Beispiel 1 unter a) beschriebene Arbeitsweise wird wiederholt mit der Abänderung, daß anstelle von 4,5 Teilen des Silans der Formel
C₆H₁₁NH(CH₂)₃SiCH₃(OCH₃)₂
9 Teile dieses Silans verwendet werden. Das so erhaltene Organopolysiloxan enthält als direkt an Silicium gebundene, kondensationsfähige Gruppen Methoxygruppen und zusätzlich zu Dimethylsiloxaneinheiten Diorganosiloxaneinheiten mit einem SiC-gebundenen N-Cyclohexyl-3-aminopropyl-Rest. Es hat eine Viskosität 1150 mPa.s bei 25°C und eine Aminzahl von 0,29. - b) Mit dem Organopolysiloxan, dessen Herstellung vorstehend unter a) beschrieben wurde, wird eine Emulsion wie im Beispiel 1 unter b) beschrieben, hergestellt.
-
- a) Die in Beispiel 1 unter a) beschriebene Arbeitsweise wird wiederholt mit den Abänderungen, daß anstelle von 4,5 Teilen des Silans der Formel
C₆H₁₁NH(CH₂)₃SiCH₃(OCH₃)₂
10 Teile dieses Silans und anstelle von 150 Teilen der Mischung von cyclischen Dimethylpolysiloxanen mit 3 bis 10 Siloxaneinheiten je Molekül 90 Teile dieser Mischung von cyclischen Dimethylpolysiloxanen verwendet werden. Das so erhaltene Organopolysiloxan enthält als direkt an Silicium gebundene, kondensationsfähige Gruppen Methoxygruppen und zusätzlich zu Dimethylsiloxaneinheiten Diorganosiloxaneinheiten mit einem SiC-gebundenen N-Cyclohexylaminopropyl-Rest. Es hat eine Viskosität von 830 mPa.s bei 25°C und eine Aminzahl von 0,62. - b) 35 Teile des Organopolysiloxans, dessen Herstellung vorstehend unter a) beschrieben wurde, wird unter Verwendung von 6 Teilen Polyglykolether, der durch Umsetzung von Tributylphenol (1 Mol) mit Ethylenoxid (8 Mol) hergestellt wurde, als Dispergiermittel in 61 Teilen Wasser emulgiert.
-
- a) Die in Beispiel 1 unter a) beschriebene Arbeitsweise wird wiederholt mit der Abänderung, daß anstelle von 4,5 Teilen des Silans der Formel
C₆H₁₁NH(CH₂)₃SiCH₃(OCH₃)₂
4,7 Teile des Silans der Formel
C₆H₁₁NH(CH₂)₃Si(OCH₃)₃
verwendet werden. Das so erhaltene Organopolysiloxan enthält als direkt an Silicium gebundene, kondensationsfähige Gruppen Methoxygruppen und zusätzlich zu Dimethylsiloxaneinheiten Monoorganosiloxaneinheiten mit einem SiC-gebundenen N-Cyclohexyl-3-aminopropyl-Rest. Es hat eine Viskosität von 1220 mPa.s bei 25°C und eine Aminzahl von 0,14. - b) Mit dem Organopolysiloxan, dessen Herstellung vorstehend unter a) beschrieben wurde, wird eine Emulsion wie im Beispiel 1 unter b) beschrieben, hergestellt.
-
- a) Die in Beispiel 1 unter a) beschriebene Arbeitsweise wird wiederholt mit der Abänderung, daß anstelle von 4,5 Teilen des Silans der Formel
C₆H₁₁NH(CH₂)₃SiCH₃(OCH₃)₂
2 Teile des Silans der Formel
NH₂(CH₂)₂NH(CH₂)₃SiCH₃(OCH₃)₂
verwendet werden. Das so erhaltene Organopolysiloxan enthält als direkt an Silicium gebundene, kondensationsfähige Gruppen Methoxygruppen und zusätzlich zu Dimethylsiloxaneinheiten Diorganosiloxaneinheiten mit einem SiC-gebundenen N-(2-Aminoethyl)-3-aminopropyl-Rest. Es hat eine Viskosität von 1050 m Pa.s bei 25°C und eine Aminzahl von 0,14. - b) Mit dem Organopolysiloxan, dessen Herstellung vorstehend unter a) beschrieben wurde, wird eine Emulsion, wie im Beispiel 1 unter b) beschrieben, hergestellt.
-
- a) Die im Beispiel 1 unter a) beschriebene Arbeitsweise wird wiederholt mit der Abänderung, daß anstelle von 4,5 Teilen des Silans der Formel
C₆H₁₁NH(CH₂)₃SiCH₃(OCH₃)₂
4,3 Teile des Silans der Formel
NH₂(CH₂)₂NH(CH₂)₃SiCH₃(OCH₃)₂
verwendet wird. Das so erhaltene Organopolysiloxan enthält als direkt an Silicium gebundene, kondensationfähige gruppen Methoxygruppen und zusätzlich zu Dimethylsiloxaneinheiten Diorganosiloxaneinheiten mit einem SiC-gebundenen N-(2-Aminoethyl)-3-aminopropyl-Rest. Es hat eine Viskosität von 1020 mPa.s bei 25°C und eine Aminzahl von 0,27. - b) Mit dem Organopolysiloxan, dessen Herstellung vorstehend unter a) beschrieben wurde, wird eine Emulsion wie im Beispiel 1 unter b) beschrieben, hergestellt.
-
- a) Die im Beispiel 1 unter a) beschriebene Arbeitsweise wird wiederholt mit den Abänderungen, daß anstelle von 4,5 Teilen des Silans der Formel
C₆H₁₁NH(CH₂)₃SiCH₃(OCH₃)₂
4,8 Teile des Silans der Formel
NH₂(CH₂)₂NH(CH₂)₃SiCH₃(OCH₃)₂
und anstelle von 150 Teilen der Mischung von cyclischen Dimethylpolysiloxan mit 3 bis 10 Siloxaneinheiten je Molekül 100 Teile dieser Mischung von cyclischen Dimethylpolysiloxanen verwendet werden. Das so erhaltene Organopolysiloxan enthält als direkt an Silicium gebundene, kondensationsfähige Gruppen Methoxygruppen und zusätzlich zu Dimethylsiloxaneinheiten Diorganosiloxaneinheiten mit einem SiC-gebundenen N-(2-Aminoethyl)-3-aminopropyl-Rest. Es hat eine Viskosität von 960 m Pa.s bei 25°C und eine Aminzahl von 0,60. - b) Mit dem Organopolysiloxan, dessen Herstellung vorstehend unter a) beschrieben wurde, wird eine Emulsion, wie im Beispiel 1 unter b) beschrieben, hergestellt.
- Mit einem in den endständigen Einheiten je eine Si-gebundenen Hydroxylgruppe aufweisenden Dimethylpolysiloxan, das eine Viskosität von 1010 mPa.s bei 25°C besitzt, wird eine Emulsion, wie im Beispiel 1 unter b) beschrieben, hergestellt.
- Je ein weißes Baumwollgewebe mit einem Gewicht von 180g/cm² wird jeweils in eine Emulsion E1, E2, E3 bzw. E4 getaucht, die jeweils 30 g/l der Emulsion, deren Herstellung in den Beispielen 1, 2, 3 bzw. 4 beschrieben ist, und als Rest Wasser enthält. Ebenso wird je ein weißes Baumwollgewebe mit einem Gewicht von 180g/cm² jeweils in eine Emulsions VE1, VE2, VE3 bzw. VE4 getaucht, die jeweils 30 g/l der Emulsion, deren Herstellung in den Vergleichsversuchen 1, 2, 3 bzw. 4 beschrieben ist, und als Rest Wasser enthält. Die Baumwollgewebe werden dann jeweils auf 74 % Flüssigkeitsaufnahme abgequetscht. Die so imprägnierten Baumwollgewebe werden anschließend 10 Minuten auf 150°C erwärmt.
- Bei den so erhaltenen imprägnierten Baumwollgeweben wird der Griff und die Vergilbung bewertet (vgl. Tabelle 1 und 2).
- E1= E2= E4= VE1= VE2> E3= VE3>>VE4
- Der Griff wurde für die mit den Emulsionen E1, E2, E4, VE1 und VE2 imprägnierten Baumwollgewebe gleich gut bewertet, wurde aber besser bewertet als für die mit den Emulsionen E3 und VE3 imprägnierten Baumwollgewebe und sehr viel besser bewertet als für das mit der Emulsion VE4 imprägnierte Baumwollgewebe.
Tabelle 2 Beurteilung der Vergilbung weißes Baumwollgewebe imprägniert mit Emulsion E1 E2 E3 E4 VE1 VE2 VE3 VE4 ohne1) Weißgrad nach Berger 76,1 76,3 76,5 76,8 74,7 74,5 71,5 76,6 76,5 1) nicht imprägniertes weißes Baumwollgewebe - Die Bestimmung des Weißgrades ist in A. Berger, Die Farbe, Band 8, 1959, Seite 187-202 beschrieben. Für das nicht imprägnierte, weiße Baumwollgewebe wurde ein Wert von 76,5 ermittelt. Niedrigere Werte als 76,5 kennzeichnen eine Vergilbung des Gewebes, höhere Werte ein weißeres Gewebe.
Claims (6)
- Verfahren zur Imprägnierung von organischen Fasern mit Organopolysiloxan (1), das direkt an Silicium gebundene, kondensationsfähige Gruppen enthält und zusätzlich zu Diorganosiloxaneinheiten, worin die beiden SiC-gebundenen, organischen Reste einwertige Kohlenwasserstoffreste sind, mindestens zwei einwertige SiC-gebundene Reste mit basischem Stickstoff enthält, dadurch gekennzeichnet, daß mindestens ein Teil der SiC-gebundenen Reste mit basischem Stickstoff aus SiC-gebundenen N-Cyclohexylaminoalkyl-Resten besteht.
- Verfahren nach Anspruch 1,
dadurch gekennzeichnet, daß die SiC-gebundenen N-Cyclohexylaminoalkyl-Reste in Monoorganosiloxan- und/oder Diorganosiloxan- und/oder Triorganosiloxaneinheiten vorliegen. - Verfahren nach Anspruch 1 oder 2,
dadurch gekennzeichnet, daß der SiC-gebundene N-Cyclohexylaminoalkyl-Rest ein Sic-gebundener N-Cyclohexyl-3-aminopropyl-Rest ist. - Verfahren nach Anspruch 1, 2 oder 3,
dadurch gekennzeichnet, daß direkt an Silicium gebundene, kondensationsfähige Gruppen aufweisendes Organopolysiloxan (1) gemäß Anspruch 1,2 oder 3 zusammen mit Organopolysiloxan (2a) mit mindestens 3 Si-gebundenen Wasserstoffatomen je Molekül eingesetzt wird. - Verfahren nach Anspruch 1,2 oder 3,
dadurch gekennzeichnet, daß direkt an Silicium gebundene, kondensationsfähige Gruppen aufweisendes Organopolysiloxan (1) gemäß Anspruch 1,2 oder 3 zusammen mit Trialkoxy- oder Tetraalkoxysilan (2b) eingesetzt wird. - Verfahren nach Anspruch 4 oder 5,
dadurch gekennzeichnet, daß Katalysatoren (3) für die Kondensation von direkt an Silicium gebundene, kondensationsfähige Gruppen mitverwendet wird.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AT88114668T ATE78531T1 (de) | 1987-09-10 | 1988-09-08 | Verfahren zur impraegnierung von organischen fasern. |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19873730413 DE3730413A1 (de) | 1987-09-10 | 1987-09-10 | Verfahren zur impraegnierung von organischen fasern |
| DE3730413 | 1987-09-10 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP0306935A2 EP0306935A2 (de) | 1989-03-15 |
| EP0306935A3 EP0306935A3 (en) | 1989-12-27 |
| EP0306935B1 true EP0306935B1 (de) | 1992-07-22 |
Family
ID=6335714
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP88114668A Expired - Lifetime EP0306935B1 (de) | 1987-09-10 | 1988-09-08 | Verfahren zur Imprägnierung von organischen Fasern |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US4874662A (de) |
| EP (1) | EP0306935B1 (de) |
| JP (1) | JPH0197279A (de) |
| KR (1) | KR950003854B1 (de) |
| AT (1) | ATE78531T1 (de) |
| AU (1) | AU609875B2 (de) |
| DE (2) | DE3730413A1 (de) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2649061B2 (ja) * | 1988-05-26 | 1997-09-03 | 東レ・ダウコーニング・シリコーン株式会社 | 繊維用処理剤 |
| GB9002715D0 (en) * | 1990-02-07 | 1990-04-04 | Dow Corning | Method of treating fibrous materials |
| US5182173A (en) * | 1990-05-07 | 1993-01-26 | Rogers Corporation | Coated particles and method for making same |
| US5292575A (en) * | 1990-08-21 | 1994-03-08 | Aerospatiale Societe Nationale Industrielle | Sheet material for constructing high performance thermal screens |
| DE4117864A1 (de) * | 1991-05-31 | 1992-12-03 | Pfersee Chem Fab | Waessrige dispersionen von polysiloxanen |
| DE4132647A1 (de) * | 1991-10-01 | 1993-04-08 | Pfersee Chem Fab | Waessrige dispersionen von stickstoffhaltigen polysiloxanen |
| DE4133358A1 (de) * | 1991-10-09 | 1993-04-15 | Pfersee Chem Fab | Waessrige zusammensetzungen mit stickstoffhaltigen polysiloxanen |
| DE4318794A1 (de) * | 1993-06-07 | 1994-12-08 | Pfersee Chem Fab | Substituierte 1.3.5-Triazin-Einheiten enthaltende Organopolysiloxane |
| JPH07119043A (ja) * | 1993-10-27 | 1995-05-09 | Toray Dow Corning Silicone Co Ltd | 繊維の吸尽処理方法 |
| DE4424914A1 (de) * | 1994-07-14 | 1996-01-18 | Wacker Chemie Gmbh | Aminofunktionelle Organopolysiloxane |
| US6712121B2 (en) | 2001-10-12 | 2004-03-30 | Kimberly-Clark Worldwide, Inc. | Antimicrobially-treated fabrics |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5229207B2 (de) * | 1973-05-10 | 1977-08-01 | ||
| GB1570983A (en) * | 1976-06-26 | 1980-07-09 | Dow Corning Ltd | Process for treating fibres |
| JPS5638609A (en) * | 1979-09-05 | 1981-04-13 | Toshiba Corp | Monitoring method for plant |
| US4247592A (en) * | 1980-03-12 | 1981-01-27 | Dow Corning Corporation | Method for treating synthetic textiles with aminoalkyl-containing polydiorganosiloxanes |
| JPS5952403B2 (ja) * | 1983-07-11 | 1984-12-19 | 旭光学工業株式会社 | マクロ撮影可能なズ−ムレンズ鏡筒 |
| DE3343575A1 (de) * | 1983-12-01 | 1985-10-03 | Wacker-Chemie GmbH, 8000 München | Verfahren zur herstellung von waessrigen emulsionen |
| US4639321A (en) * | 1985-01-22 | 1987-01-27 | The Procter And Gamble Company | Liquid detergent compositions containing organo-functional polysiloxanes |
| DE3503457A1 (de) * | 1985-02-01 | 1986-08-07 | Wacker-Chemie GmbH, 8000 München | Verfahren zur impraegnierung von organischen fasern |
-
1987
- 1987-09-10 DE DE19873730413 patent/DE3730413A1/de not_active Withdrawn
-
1988
- 1988-08-26 US US07/240,040 patent/US4874662A/en not_active Expired - Lifetime
- 1988-09-08 KR KR1019880011594A patent/KR950003854B1/ko not_active Expired - Fee Related
- 1988-09-08 DE DE8888114668T patent/DE3872993D1/de not_active Expired - Lifetime
- 1988-09-08 AT AT88114668T patent/ATE78531T1/de not_active IP Right Cessation
- 1988-09-08 JP JP63223684A patent/JPH0197279A/ja active Granted
- 1988-09-08 EP EP88114668A patent/EP0306935B1/de not_active Expired - Lifetime
- 1988-09-09 AU AU22037/88A patent/AU609875B2/en not_active Ceased
Also Published As
| Publication number | Publication date |
|---|---|
| JPH0197279A (ja) | 1989-04-14 |
| ATE78531T1 (de) | 1992-08-15 |
| DE3730413A1 (de) | 1989-03-30 |
| KR890005341A (ko) | 1989-05-13 |
| JPH0137515B2 (de) | 1989-08-08 |
| EP0306935A2 (de) | 1989-03-15 |
| AU2203788A (en) | 1989-03-16 |
| EP0306935A3 (en) | 1989-12-27 |
| US4874662A (en) | 1989-10-17 |
| DE3872993D1 (de) | 1992-08-27 |
| AU609875B2 (en) | 1991-05-09 |
| KR950003854B1 (ko) | 1995-04-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0057937B1 (de) | Verfahren zur Imprägnierung von organischen Fasern | |
| DE2359966A1 (de) | Verfahren zur wasserabweisenden ausruestung von fasermaterialien aller art | |
| EP0306935B1 (de) | Verfahren zur Imprägnierung von organischen Fasern | |
| DE2621460A1 (de) | Organosiloxanzubereitung | |
| DE2459936C3 (de) | Verfahren zur Verbesserung der Elastizität von Synthesefasern | |
| DE2726108C2 (de) | Verfahren zur Herstellung einer wäßrigen Zubereitung zum Schrumpffestmachen von Wolle | |
| DE1273099B (de) | UEberzugs- und Impraegniermittel zum Hydrophobieren von Oberflaechen | |
| DE3343575A1 (de) | Verfahren zur herstellung von waessrigen emulsionen | |
| DE1178397B (de) | Verfahren zum Hydrophobieren von Fasergut | |
| DE2615078C2 (de) | Verfahren zur Behandlung von organischen Fasern und dabei verwendete Organopolysiloxanzusammensetzungen | |
| EP0621115A1 (de) | Verfahren zum Imprägnieren von Holz | |
| DE2942786C2 (de) | ||
| EP0190672B1 (de) | Verfahren zur Imprägnierung von organischen Fasern | |
| DE3332997A1 (de) | Verfahren zur impraegnierung von textilien aus organischen fasern | |
| CH663214A5 (de) | Verfahren zur herstellung organofunktioneller organopolysiloxane. | |
| DE1086668B (de) | Verfahren zur Herstellung von plueschartiger Wirkware | |
| DE2365977A1 (de) | Organopolysiloxanzusammensetzung | |
| WO2001023394A1 (de) | Amidogruppen aufweisende organosiliciumverbindungen | |
| DE3247825A1 (de) | Organopolysiloxane mit sic-gebundenen oxyalkyleneinheiten, verfahren zu ihrer herstellung und eine verwendung dieser organopolysiloxane | |
| DE2823118A1 (de) | Verfahren zur herstellung von sic-gebundene vinylgruppen enthaltenden organopolysiloxanharzen | |
| EP0039783A2 (de) | Verfahren zum Dimensionsstabilisieren von flächenförmigen Textilmaterialien | |
| DE1273097B (de) | Verfahren zur Verbesserung der Oberflaecheneigenschaften von anorganischen Fuellstoffen fuer Kunststoffe | |
| DE3113365A1 (de) | Waessrige beschichtungsmasse | |
| DE1469331C (de) | Ausrüsten von Geweben | |
| EP0554863A1 (de) | Verfahren zum Imprägnieren von organischen Fasern |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19880908 |
|
| AK | Designated contracting states |
Kind code of ref document: A2 Designated state(s): AT BE CH DE FR GB IT LI NL |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): AT BE CH DE FR GB IT LI NL |
|
| 17Q | First examination report despatched |
Effective date: 19910917 |
|
| RAP1 | Party data changed (applicant data changed or rights of an application transferred) |
Owner name: WACKER-CHEMIE GMBH |
|
| ITF | It: translation for a ep patent filed | ||
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE CH DE FR GB IT LI NL |
|
| REF | Corresponds to: |
Ref document number: 78531 Country of ref document: AT Date of ref document: 19920815 Kind code of ref document: T |
|
| REF | Corresponds to: |
Ref document number: 3872993 Country of ref document: DE Date of ref document: 19920827 |
|
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) | ||
| ET | Fr: translation filed | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19960814 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19960820 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 19960821 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19960823 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 19960827 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 19960828 Year of fee payment: 9 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970908 Ref country code: AT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970908 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970930 Ref country code: FR Free format text: THE PATENT HAS BEEN ANNULLED BY A DECISION OF A NATIONAL AUTHORITY Effective date: 19970930 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970930 Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19970930 |
|
| BERE | Be: lapsed |
Owner name: WACKER-CHEMIE G.M.B.H. Effective date: 19970930 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980401 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 19970908 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee |
Effective date: 19980401 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 20010820 Year of fee payment: 14 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030401 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES;WARNING: LAPSES OF ITALIAN PATENTS WITH EFFECTIVE DATE BEFORE 2007 MAY HAVE OCCURRED AT ANY TIME BEFORE 2007. THE CORRECT EFFECTIVE DATE MAY BE DIFFERENT FROM THE ONE RECORDED. Effective date: 20050908 |