DE69918170T2 - Beschichtungszusammensetzung mit modifiziertem carbamat-funktionellem acrylbindemittel - Google Patents
Beschichtungszusammensetzung mit modifiziertem carbamat-funktionellem acrylbindemittel Download PDFInfo
- Publication number
- DE69918170T2 DE69918170T2 DE69918170T DE69918170T DE69918170T2 DE 69918170 T2 DE69918170 T2 DE 69918170T2 DE 69918170 T DE69918170 T DE 69918170T DE 69918170 T DE69918170 T DE 69918170T DE 69918170 T2 DE69918170 T2 DE 69918170T2
- Authority
- DE
- Germany
- Prior art keywords
- carbamate
- group
- groups
- acrylic resin
- coating composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000008199 coating composition Substances 0.000 title claims description 38
- 239000011230 binding agent Substances 0.000 title description 3
- 150000004657 carbamic acid derivatives Chemical class 0.000 title 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 58
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 claims description 46
- 238000000034 method Methods 0.000 claims description 40
- 229920000178 Acrylic resin Polymers 0.000 claims description 37
- 239000004925 Acrylic resin Substances 0.000 claims description 37
- 238000006243 chemical reaction Methods 0.000 claims description 35
- -1 alkyl carbamate Chemical compound 0.000 claims description 29
- 150000001875 compounds Chemical class 0.000 claims description 26
- 239000000203 mixture Substances 0.000 claims description 26
- XSQUKJJJFZCRTK-UHFFFAOYSA-N urea group Chemical group NC(=O)N XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 claims description 25
- 239000004971 Cross linker Substances 0.000 claims description 24
- 229920003180 amino resin Polymers 0.000 claims description 23
- 239000000178 monomer Substances 0.000 claims description 23
- 238000000576 coating method Methods 0.000 claims description 22
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 claims description 14
- 239000012948 isocyanate Substances 0.000 claims description 14
- 238000006116 polymerization reaction Methods 0.000 claims description 14
- 239000011248 coating agent Substances 0.000 claims description 13
- 125000002947 alkylene group Chemical group 0.000 claims description 12
- 150000002513 isocyanates Chemical class 0.000 claims description 11
- 125000000217 alkyl group Chemical group 0.000 claims description 10
- 229920000877 Melamine resin Polymers 0.000 claims description 9
- 150000005676 cyclic carbonates Chemical group 0.000 claims description 8
- 239000000126 substance Substances 0.000 claims description 8
- 150000001735 carboxylic acids Chemical class 0.000 claims description 7
- 238000005809 transesterification reaction Methods 0.000 claims description 7
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 claims description 6
- 229910021529 ammonia Inorganic materials 0.000 claims description 6
- 125000002993 cycloalkylene group Chemical group 0.000 claims description 6
- GTCAXTIRRLKXRU-UHFFFAOYSA-N methyl carbamate Chemical compound COC(N)=O GTCAXTIRRLKXRU-UHFFFAOYSA-N 0.000 claims description 6
- 239000000758 substrate Substances 0.000 claims description 6
- 238000001321 HNCO Methods 0.000 claims description 5
- OWIKHYCFFJSOEH-UHFFFAOYSA-N Isocyanic acid Chemical compound N=C=O OWIKHYCFFJSOEH-UHFFFAOYSA-N 0.000 claims description 5
- 125000000732 arylene group Chemical group 0.000 claims description 5
- OHJMTUPIZMNBFR-UHFFFAOYSA-N biuret Chemical group NC(=O)NC(N)=O OHJMTUPIZMNBFR-UHFFFAOYSA-N 0.000 claims description 4
- AVWRKZWQTYIKIY-UHFFFAOYSA-N urea-1-carboxylic acid Chemical group NC(=O)NC(O)=O AVWRKZWQTYIKIY-UHFFFAOYSA-N 0.000 claims description 4
- BSBQJOWZSCCENI-UHFFFAOYSA-N 3-hydroxypropyl carbamate Chemical compound NC(=O)OCCCO BSBQJOWZSCCENI-UHFFFAOYSA-N 0.000 claims description 3
- 150000008065 acid anhydrides Chemical class 0.000 claims description 3
- 150000008064 anhydrides Chemical class 0.000 claims description 3
- OZDFMZUKOBBNHM-UHFFFAOYSA-N 2-ethylhexyl carbamate Chemical compound CCCCC(CC)COC(N)=O OZDFMZUKOBBNHM-UHFFFAOYSA-N 0.000 claims description 2
- BTDQXGUEVVTAMD-UHFFFAOYSA-N 2-hydroxyethyl carbamate Chemical compound NC(=O)OCCO BTDQXGUEVVTAMD-UHFFFAOYSA-N 0.000 claims description 2
- SKKTUOZKZKCGTB-UHFFFAOYSA-N butyl carbamate Chemical compound CCCCOC(N)=O SKKTUOZKZKCGTB-UHFFFAOYSA-N 0.000 claims description 2
- VPKDCDLSJZCGKE-UHFFFAOYSA-N carbodiimide group Chemical group N=C=N VPKDCDLSJZCGKE-UHFFFAOYSA-N 0.000 claims description 2
- 239000011247 coating layer Substances 0.000 claims description 2
- AUELWJRRASQDKI-UHFFFAOYSA-N cyclohexyl carbamate Chemical compound NC(=O)OC1CCCCC1 AUELWJRRASQDKI-UHFFFAOYSA-N 0.000 claims description 2
- 125000000623 heterocyclic group Chemical group 0.000 claims description 2
- YNTOKMNHRPSGFU-UHFFFAOYSA-N n-Propyl carbamate Chemical compound CCCOC(N)=O YNTOKMNHRPSGFU-UHFFFAOYSA-N 0.000 claims description 2
- HNHVTXYLRVGMHD-UHFFFAOYSA-N n-butyl isocyanate Chemical compound CCCCN=C=O HNHVTXYLRVGMHD-UHFFFAOYSA-N 0.000 claims description 2
- BSCCSDNZEIHXOK-UHFFFAOYSA-N phenyl carbamate Chemical compound NC(=O)OC1=CC=CC=C1 BSCCSDNZEIHXOK-UHFFFAOYSA-N 0.000 claims description 2
- OVPLZYJGTGDFNB-UHFFFAOYSA-N propan-2-yl carbamate Chemical compound CC(C)OC(N)=O OVPLZYJGTGDFNB-UHFFFAOYSA-N 0.000 claims description 2
- 150000001348 alkyl chlorides Chemical class 0.000 claims 1
- 150000001350 alkyl halides Chemical class 0.000 claims 1
- 239000002184 metal Substances 0.000 claims 1
- 229920000058 polyacrylate Polymers 0.000 description 21
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 15
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical class OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 14
- 229920005989 resin Polymers 0.000 description 14
- 239000011347 resin Substances 0.000 description 14
- 239000002253 acid Chemical group 0.000 description 13
- 239000003054 catalyst Substances 0.000 description 13
- 238000001723 curing Methods 0.000 description 13
- 239000002904 solvent Substances 0.000 description 11
- 230000007613 environmental effect Effects 0.000 description 10
- 238000005886 esterification reaction Methods 0.000 description 10
- 230000015572 biosynthetic process Effects 0.000 description 9
- 229920000642 polymer Polymers 0.000 description 9
- 125000004432 carbon atom Chemical group C* 0.000 description 8
- 239000002131 composite material Substances 0.000 description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 8
- 235000013877 carbamide Nutrition 0.000 description 7
- 230000032050 esterification Effects 0.000 description 7
- 239000003973 paint Substances 0.000 description 7
- 239000011541 reaction mixture Substances 0.000 description 7
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 239000004202 carbamide Substances 0.000 description 6
- 230000000052 comparative effect Effects 0.000 description 5
- 238000005530 etching Methods 0.000 description 5
- VOZRXNHHFUQHIL-UHFFFAOYSA-N glycidyl methacrylate Chemical compound CC(=C)C(=O)OCC1CO1 VOZRXNHHFUQHIL-UHFFFAOYSA-N 0.000 description 5
- IQPQWNKOIGAROB-UHFFFAOYSA-N isocyanate group Chemical group [N-]=C=O IQPQWNKOIGAROB-UHFFFAOYSA-N 0.000 description 5
- 150000002924 oxiranes Chemical group 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 4
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 150000004820 halides Chemical class 0.000 description 4
- 150000002596 lactones Chemical class 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- LLHKCFNBLRBOGN-UHFFFAOYSA-N propylene glycol methyl ether acetate Chemical compound COCC(C)OC(C)=O LLHKCFNBLRBOGN-UHFFFAOYSA-N 0.000 description 4
- 239000000376 reactant Substances 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- GOXQRTZXKQZDDN-UHFFFAOYSA-N 2-Ethylhexyl acrylate Chemical compound CCCCC(CC)COC(=O)C=C GOXQRTZXKQZDDN-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- UKLDJPRMSDWDSL-UHFFFAOYSA-L [dibutyl(dodecanoyloxy)stannyl] dodecanoate Chemical compound CCCCCCCCCCCC(=O)O[Sn](CCCC)(CCCC)OC(=O)CCCCCCCCCCC UKLDJPRMSDWDSL-UHFFFAOYSA-L 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- KQWGXHWJMSMDJJ-UHFFFAOYSA-N cyclohexyl isocyanate Chemical compound O=C=NC1CCCCC1 KQWGXHWJMSMDJJ-UHFFFAOYSA-N 0.000 description 3
- 239000012975 dibutyltin dilaurate Substances 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 150000002734 metacrylic acid derivatives Chemical class 0.000 description 3
- 125000000466 oxiranyl group Chemical group 0.000 description 3
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- ARXJGSRGQADJSQ-UHFFFAOYSA-N 1-methoxypropan-2-ol Chemical compound COCC(C)O ARXJGSRGQADJSQ-UHFFFAOYSA-N 0.000 description 2
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 2
- HGINCPLSRVDWNT-UHFFFAOYSA-N Acrolein Chemical compound C=CC=O HGINCPLSRVDWNT-UHFFFAOYSA-N 0.000 description 2
- SOGAXMICEFXMKE-UHFFFAOYSA-N Butylmethacrylate Chemical compound CCCCOC(=O)C(C)=C SOGAXMICEFXMKE-UHFFFAOYSA-N 0.000 description 2
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Chemical compound CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 2
- 239000004640 Melamine resin Substances 0.000 description 2
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 2
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 2
- 229920001807 Urea-formaldehyde Polymers 0.000 description 2
- 230000001133 acceleration Effects 0.000 description 2
- WDJHALXBUFZDSR-UHFFFAOYSA-N acetoacetic acid Chemical group CC(=O)CC(O)=O WDJHALXBUFZDSR-UHFFFAOYSA-N 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- GZCGUPFRVQAUEE-SLPGGIOYSA-N aldehydo-D-glucose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O GZCGUPFRVQAUEE-SLPGGIOYSA-N 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 125000005907 alkyl ester group Chemical group 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229940072049 amyl acetate Drugs 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- VSKFADHADUWCCL-UHFFFAOYSA-N carbamoperoxoic acid Chemical compound NC(=O)OO VSKFADHADUWCCL-UHFFFAOYSA-N 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- KBLWLMPSVYBVDK-UHFFFAOYSA-N cyclohexyl prop-2-enoate Chemical compound C=CC(=O)OC1CCCCC1 KBLWLMPSVYBVDK-UHFFFAOYSA-N 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 125000004185 ester group Chemical group 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- 239000004922 lacquer Substances 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- 150000007974 melamines Chemical class 0.000 description 2
- 238000010422 painting Methods 0.000 description 2
- 239000000049 pigment Substances 0.000 description 2
- 239000004848 polyfunctional curative Substances 0.000 description 2
- 239000005056 polyisocyanate Substances 0.000 description 2
- 229920001228 polyisocyanate Polymers 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 229910000077 silane Inorganic materials 0.000 description 2
- ISXSCDLOGDJUNJ-UHFFFAOYSA-N tert-butyl prop-2-enoate Chemical compound CC(C)(C)OC(=O)C=C ISXSCDLOGDJUNJ-UHFFFAOYSA-N 0.000 description 2
- 238000005979 thermal decomposition reaction Methods 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- 230000000007 visual effect Effects 0.000 description 2
- 229920002818 (Hydroxyethyl)methacrylate Polymers 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- ZVEMLYIXBCTVOF-UHFFFAOYSA-N 1-(2-isocyanatopropan-2-yl)-3-prop-1-en-2-ylbenzene Chemical class CC(=C)C1=CC=CC(C(C)(C)N=C=O)=C1 ZVEMLYIXBCTVOF-UHFFFAOYSA-N 0.000 description 1
- UDJZTGMLYITLIQ-UHFFFAOYSA-N 1-ethenylpyrrolidine Chemical compound C=CN1CCCC1 UDJZTGMLYITLIQ-UHFFFAOYSA-N 0.000 description 1
- DYQFCTCUULUMTQ-UHFFFAOYSA-N 1-isocyanatooctane Chemical compound CCCCCCCCN=C=O DYQFCTCUULUMTQ-UHFFFAOYSA-N 0.000 description 1
- OQURWGJAWSLGQG-UHFFFAOYSA-N 1-isocyanatopropane Chemical compound CCCN=C=O OQURWGJAWSLGQG-UHFFFAOYSA-N 0.000 description 1
- QBDAFARLDLCWAT-UHFFFAOYSA-N 2,3-dihydropyran-6-one Chemical compound O=C1OCCC=C1 QBDAFARLDLCWAT-UHFFFAOYSA-N 0.000 description 1
- CFTDUTRNVMVVSA-UHFFFAOYSA-N 2,6,8,8-tetramethylnon-2-enoic acid Chemical class CC(C)(C)CC(C)CCC=C(C)C(O)=O CFTDUTRNVMVVSA-UHFFFAOYSA-N 0.000 description 1
- STMDPCBYJCIZOD-UHFFFAOYSA-N 2-(2,4-dinitroanilino)-4-methylpentanoic acid Chemical compound CC(C)CC(C(O)=O)NC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O STMDPCBYJCIZOD-UHFFFAOYSA-N 0.000 description 1
- XSCRXCDDATUDLB-UHFFFAOYSA-N 2-(2-methylpropoxymethyl)prop-2-enamide Chemical group CC(C)COCC(=C)C(N)=O XSCRXCDDATUDLB-UHFFFAOYSA-N 0.000 description 1
- JAHNSTQSQJOJLO-UHFFFAOYSA-N 2-(3-fluorophenyl)-1h-imidazole Chemical compound FC1=CC=CC(C=2NC=CN=2)=C1 JAHNSTQSQJOJLO-UHFFFAOYSA-N 0.000 description 1
- NQBXSWAWVZHKBZ-UHFFFAOYSA-N 2-butoxyethyl acetate Chemical compound CCCCOCCOC(C)=O NQBXSWAWVZHKBZ-UHFFFAOYSA-N 0.000 description 1
- WBIQQQGBSDOWNP-UHFFFAOYSA-N 2-dodecylbenzenesulfonic acid Chemical compound CCCCCCCCCCCCC1=CC=CC=C1S(O)(=O)=O WBIQQQGBSDOWNP-UHFFFAOYSA-N 0.000 description 1
- WDQMWEYDKDCEHT-UHFFFAOYSA-N 2-ethylhexyl 2-methylprop-2-enoate Chemical compound CCCCC(CC)COC(=O)C(C)=C WDQMWEYDKDCEHT-UHFFFAOYSA-N 0.000 description 1
- IEVADDDOVGMCSI-UHFFFAOYSA-N 2-hydroxybutyl 2-methylprop-2-enoate Chemical compound CCC(O)COC(=O)C(C)=C IEVADDDOVGMCSI-UHFFFAOYSA-N 0.000 description 1
- OMIGHNLMNHATMP-UHFFFAOYSA-N 2-hydroxyethyl prop-2-enoate Chemical compound OCCOC(=O)C=C OMIGHNLMNHATMP-UHFFFAOYSA-N 0.000 description 1
- RUMACXVDVNRZJZ-UHFFFAOYSA-N 2-methylpropyl 2-methylprop-2-enoate Chemical compound CC(C)COC(=O)C(C)=C RUMACXVDVNRZJZ-UHFFFAOYSA-N 0.000 description 1
- CFVWNXQPGQOHRJ-UHFFFAOYSA-N 2-methylpropyl prop-2-enoate Chemical compound CC(C)COC(=O)C=C CFVWNXQPGQOHRJ-UHFFFAOYSA-N 0.000 description 1
- KGIGUEBEKRSTEW-UHFFFAOYSA-N 2-vinylpyridine Chemical compound C=CC1=CC=CC=N1 KGIGUEBEKRSTEW-UHFFFAOYSA-N 0.000 description 1
- DXIJHCSGLOHNES-UHFFFAOYSA-N 3,3-dimethylbut-1-enylbenzene Chemical compound CC(C)(C)C=CC1=CC=CC=C1 DXIJHCSGLOHNES-UHFFFAOYSA-N 0.000 description 1
- FIXKCCRANLATRP-UHFFFAOYSA-N 3,5,5-trimethylhexyl prop-2-enoate Chemical class CC(C)(C)CC(C)CCOC(=O)C=C FIXKCCRANLATRP-UHFFFAOYSA-N 0.000 description 1
- GNSFRPWPOGYVLO-UHFFFAOYSA-N 3-hydroxypropyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCCO GNSFRPWPOGYVLO-UHFFFAOYSA-N 0.000 description 1
- QZPSOSOOLFHYRR-UHFFFAOYSA-N 3-hydroxypropyl prop-2-enoate Chemical compound OCCCOC(=O)C=C QZPSOSOOLFHYRR-UHFFFAOYSA-N 0.000 description 1
- ULYIFEQRRINMJQ-UHFFFAOYSA-N 3-methylbutyl 2-methylprop-2-enoate Chemical compound CC(C)CCOC(=O)C(C)=C ULYIFEQRRINMJQ-UHFFFAOYSA-N 0.000 description 1
- ZVYGIPWYVVJFRW-UHFFFAOYSA-N 3-methylbutyl prop-2-enoate Chemical compound CC(C)CCOC(=O)C=C ZVYGIPWYVVJFRW-UHFFFAOYSA-N 0.000 description 1
- KFDVPJUYSDEJTH-UHFFFAOYSA-N 4-ethenylpyridine Chemical compound C=CC1=CC=NC=C1 KFDVPJUYSDEJTH-UHFFFAOYSA-N 0.000 description 1
- NDWUBGAGUCISDV-UHFFFAOYSA-N 4-hydroxybutyl prop-2-enoate Chemical compound OCCCCOC(=O)C=C NDWUBGAGUCISDV-UHFFFAOYSA-N 0.000 description 1
- COCLLEMEIJQBAG-UHFFFAOYSA-N 8-methylnonyl 2-methylprop-2-enoate Chemical compound CC(C)CCCCCCCOC(=O)C(C)=C COCLLEMEIJQBAG-UHFFFAOYSA-N 0.000 description 1
- LVGFPWDANALGOY-UHFFFAOYSA-N 8-methylnonyl prop-2-enoate Chemical compound CC(C)CCCCCCCOC(=O)C=C LVGFPWDANALGOY-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical group [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- JIGUQPWFLRLWPJ-UHFFFAOYSA-N Ethyl acrylate Chemical compound CCOC(=O)C=C JIGUQPWFLRLWPJ-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- WOBHKFSMXKNTIM-UHFFFAOYSA-N Hydroxyethyl methacrylate Chemical compound CC(=C)C(=O)OCCO WOBHKFSMXKNTIM-UHFFFAOYSA-N 0.000 description 1
- 239000005058 Isophorone diisocyanate Substances 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- STNJBCKSHOAVAJ-UHFFFAOYSA-N Methacrolein Chemical compound CC(=C)C=O STNJBCKSHOAVAJ-UHFFFAOYSA-N 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- GYCMBHHDWRMZGG-UHFFFAOYSA-N Methylacrylonitrile Chemical compound CC(=C)C#N GYCMBHHDWRMZGG-UHFFFAOYSA-N 0.000 description 1
- VGGLHLAESQEWCR-UHFFFAOYSA-N N-(hydroxymethyl)urea Chemical compound NC(=O)NCO VGGLHLAESQEWCR-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- AWMVMTVKBNGEAK-UHFFFAOYSA-N Styrene oxide Chemical compound C1OC1C1=CC=CC=C1 AWMVMTVKBNGEAK-UHFFFAOYSA-N 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical class [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- ISKQADXMHQSTHK-UHFFFAOYSA-N [4-(aminomethyl)phenyl]methanamine Chemical compound NCC1=CC=C(CN)C=C1 ISKQADXMHQSTHK-UHFFFAOYSA-N 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 239000003377 acid catalyst Substances 0.000 description 1
- 125000005396 acrylic acid ester group Chemical group 0.000 description 1
- 229920006397 acrylic thermoplastic Polymers 0.000 description 1
- 239000002318 adhesion promoter Substances 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 150000007824 aliphatic compounds Chemical group 0.000 description 1
- 125000004466 alkoxycarbonylamino group Chemical group 0.000 description 1
- 229920000180 alkyd Polymers 0.000 description 1
- XYLMUPLGERFSHI-UHFFFAOYSA-N alpha-Methylstyrene Chemical compound CC(=C)C1=CC=CC=C1 XYLMUPLGERFSHI-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- SMZOGRDCAXLAAR-UHFFFAOYSA-N aluminium isopropoxide Chemical compound [Al+3].CC(C)[O-].CC(C)[O-].CC(C)[O-] SMZOGRDCAXLAAR-UHFFFAOYSA-N 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- PGMYKACGEOXYJE-UHFFFAOYSA-N anhydrous amyl acetate Natural products CCCCCOC(C)=O PGMYKACGEOXYJE-UHFFFAOYSA-N 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 239000003849 aromatic solvent Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- CQEYYJKEWSMYFG-UHFFFAOYSA-N butyl acrylate Chemical compound CCCCOC(=O)C=C CQEYYJKEWSMYFG-UHFFFAOYSA-N 0.000 description 1
- UTOVMEACOLCUCK-PLNGDYQASA-N butyl maleate Chemical compound CCCCOC(=O)\C=C/C(O)=O UTOVMEACOLCUCK-PLNGDYQASA-N 0.000 description 1
- DVECBJCOGJRVPX-UHFFFAOYSA-N butyryl chloride Chemical compound CCCC(Cl)=O DVECBJCOGJRVPX-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- NDWWLJQHOLSEHX-UHFFFAOYSA-L calcium;octanoate Chemical compound [Ca+2].CCCCCCCC([O-])=O.CCCCCCCC([O-])=O NDWWLJQHOLSEHX-UHFFFAOYSA-L 0.000 description 1
- 125000005587 carbonate group Chemical group 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 238000007334 copolymerization reaction Methods 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- LDHQCZJRKDOVOX-NSCUHMNNSA-N crotonic acid Chemical compound C\C=C\C(O)=O LDHQCZJRKDOVOX-NSCUHMNNSA-N 0.000 description 1
- 150000003983 crown ethers Chemical class 0.000 description 1
- 238000007766 curtain coating Methods 0.000 description 1
- OIWOHHBRDFKZNC-UHFFFAOYSA-N cyclohexyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OC1CCCCC1 OIWOHHBRDFKZNC-UHFFFAOYSA-N 0.000 description 1
- GTBGXKPAKVYEKJ-UHFFFAOYSA-N decyl 2-methylprop-2-enoate Chemical compound CCCCCCCCCCOC(=O)C(C)=C GTBGXKPAKVYEKJ-UHFFFAOYSA-N 0.000 description 1
- FWLDHHJLVGRRHD-UHFFFAOYSA-N decyl prop-2-enoate Chemical compound CCCCCCCCCCOC(=O)C=C FWLDHHJLVGRRHD-UHFFFAOYSA-N 0.000 description 1
- 210000003298 dental enamel Anatomy 0.000 description 1
- JGFBRKRYDCGYKD-UHFFFAOYSA-N dibutyl(oxo)tin Chemical compound CCCC[Sn](=O)CCCC JGFBRKRYDCGYKD-UHFFFAOYSA-N 0.000 description 1
- ZXDVQYBUEVYUCG-UHFFFAOYSA-N dibutyltin(2+);methanolate Chemical compound CCCC[Sn](OC)(OC)CCCC ZXDVQYBUEVYUCG-UHFFFAOYSA-N 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- PYBNTRWJKQJDRE-UHFFFAOYSA-L dodecanoate;tin(2+) Chemical compound [Sn+2].CCCCCCCCCCCC([O-])=O.CCCCCCCCCCCC([O-])=O PYBNTRWJKQJDRE-UHFFFAOYSA-L 0.000 description 1
- GMSCBRSQMRDRCD-UHFFFAOYSA-N dodecyl 2-methylprop-2-enoate Chemical compound CCCCCCCCCCCCOC(=O)C(C)=C GMSCBRSQMRDRCD-UHFFFAOYSA-N 0.000 description 1
- 229940060296 dodecylbenzenesulfonic acid Drugs 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- RJUVPCYAOBNZAX-VOTSOKGWSA-N ethyl (e)-3-(dimethylamino)-2-methylprop-2-enoate Chemical compound CCOC(=O)C(\C)=C\N(C)C RJUVPCYAOBNZAX-VOTSOKGWSA-N 0.000 description 1
- DUVOZUPPHBRJJO-UHFFFAOYSA-N ethyl 2-isocyanatoacetate Chemical compound CCOC(=O)CN=C=O DUVOZUPPHBRJJO-UHFFFAOYSA-N 0.000 description 1
- SUPCQIBBMFXVTL-UHFFFAOYSA-N ethyl 2-methylprop-2-enoate Chemical compound CCOC(=O)C(C)=C SUPCQIBBMFXVTL-UHFFFAOYSA-N 0.000 description 1
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- SLGWESQGEUXWJQ-UHFFFAOYSA-N formaldehyde;phenol Chemical class O=C.OC1=CC=CC=C1 SLGWESQGEUXWJQ-UHFFFAOYSA-N 0.000 description 1
- VANNPISTIUFMLH-UHFFFAOYSA-N glutaric anhydride Chemical compound O=C1CCCC(=O)O1 VANNPISTIUFMLH-UHFFFAOYSA-N 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-M heptanoate Chemical compound CCCCCCC([O-])=O MNWFXJYAOYHMED-UHFFFAOYSA-M 0.000 description 1
- LNCPIMCVTKXXOY-UHFFFAOYSA-N hexyl 2-methylprop-2-enoate Chemical compound CCCCCCOC(=O)C(C)=C LNCPIMCVTKXXOY-UHFFFAOYSA-N 0.000 description 1
- LNMQRPPRQDGUDR-UHFFFAOYSA-N hexyl prop-2-enoate Chemical compound CCCCCCOC(=O)C=C LNMQRPPRQDGUDR-UHFFFAOYSA-N 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- LDHQCZJRKDOVOX-IHWYPQMZSA-N isocrotonic acid Chemical compound C\C=C/C(O)=O LDHQCZJRKDOVOX-IHWYPQMZSA-N 0.000 description 1
- NIMLQBUJDJZYEJ-UHFFFAOYSA-N isophorone diisocyanate Chemical compound CC1(C)CC(N=C=O)CC(C)(CN=C=O)C1 NIMLQBUJDJZYEJ-UHFFFAOYSA-N 0.000 description 1
- 150000002576 ketones Chemical group 0.000 description 1
- PBOSTUDLECTMNL-UHFFFAOYSA-N lauryl acrylate Chemical compound CCCCCCCCCCCCOC(=O)C=C PBOSTUDLECTMNL-UHFFFAOYSA-N 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 1
- KKHUSADXXDNRPW-UHFFFAOYSA-N malonic anhydride Chemical compound O=C1CC(=O)O1 KKHUSADXXDNRPW-UHFFFAOYSA-N 0.000 description 1
- RBQRWNWVPQDTJJ-UHFFFAOYSA-N methacryloyloxyethyl isocyanate Chemical compound CC(=C)C(=O)OCCN=C=O RBQRWNWVPQDTJJ-UHFFFAOYSA-N 0.000 description 1
- LVHBHZANLOWSRM-UHFFFAOYSA-N methylenebutanedioic acid Natural products OC(=O)CC(=C)C(O)=O LVHBHZANLOWSRM-UHFFFAOYSA-N 0.000 description 1
- 239000010445 mica Substances 0.000 description 1
- 229910052618 mica group Inorganic materials 0.000 description 1
- 150000002762 monocarboxylic acid derivatives Chemical class 0.000 description 1
- 239000012860 organic pigment Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- RPQRDASANLAFCM-UHFFFAOYSA-N oxiran-2-ylmethyl prop-2-enoate Chemical compound C=CC(=O)OCC1CO1 RPQRDASANLAFCM-UHFFFAOYSA-N 0.000 description 1
- GYDSPAVLTMAXHT-UHFFFAOYSA-N pentyl 2-methylprop-2-enoate Chemical compound CCCCCOC(=O)C(C)=C GYDSPAVLTMAXHT-UHFFFAOYSA-N 0.000 description 1
- ULDDEWDFUNBUCM-UHFFFAOYSA-N pentyl prop-2-enoate Chemical compound CCCCCOC(=O)C=C ULDDEWDFUNBUCM-UHFFFAOYSA-N 0.000 description 1
- PNJWIWWMYCMZRO-UHFFFAOYSA-N pent‐4‐en‐2‐one Natural products CC(=O)CC=C PNJWIWWMYCMZRO-UHFFFAOYSA-N 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- CMPQUABWPXYYSH-UHFFFAOYSA-N phenyl phosphate Chemical compound OP(O)(=O)OC1=CC=CC=C1 CMPQUABWPXYYSH-UHFFFAOYSA-N 0.000 description 1
- 239000003495 polar organic solvent Substances 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 230000000379 polymerizing effect Effects 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- BAVIDSCVXNQEBA-UHFFFAOYSA-N prop-2-enoyl prop-2-eneperoxoate Chemical class C=CC(=O)OOC(=O)C=C BAVIDSCVXNQEBA-UHFFFAOYSA-N 0.000 description 1
- FBCQUCJYYPMKRO-UHFFFAOYSA-N prop-2-enyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCC=C FBCQUCJYYPMKRO-UHFFFAOYSA-N 0.000 description 1
- HJWLCRVIBGQPNF-UHFFFAOYSA-N prop-2-enylbenzene Chemical compound C=CCC1=CC=CC=C1 HJWLCRVIBGQPNF-UHFFFAOYSA-N 0.000 description 1
- BOQSSGDQNWEFSX-UHFFFAOYSA-N propan-2-yl 2-methylprop-2-enoate Chemical compound CC(C)OC(=O)C(C)=C BOQSSGDQNWEFSX-UHFFFAOYSA-N 0.000 description 1
- LYBIZMNPXTXVMV-UHFFFAOYSA-N propan-2-yl prop-2-enoate Chemical compound CC(C)OC(=O)C=C LYBIZMNPXTXVMV-UHFFFAOYSA-N 0.000 description 1
- RZWZRACFZGVKFM-UHFFFAOYSA-N propanoyl chloride Chemical compound CCC(Cl)=O RZWZRACFZGVKFM-UHFFFAOYSA-N 0.000 description 1
- NHARPDSAXCBDDR-UHFFFAOYSA-N propyl 2-methylprop-2-enoate Chemical compound CCCOC(=O)C(C)=C NHARPDSAXCBDDR-UHFFFAOYSA-N 0.000 description 1
- QQKDTTWZXHEGAQ-UHFFFAOYSA-N propyl carbonochloridate Chemical compound CCCOC(Cl)=O QQKDTTWZXHEGAQ-UHFFFAOYSA-N 0.000 description 1
- PNXMTCDJUBJHQJ-UHFFFAOYSA-N propyl prop-2-enoate Chemical compound CCCOC(=O)C=C PNXMTCDJUBJHQJ-UHFFFAOYSA-N 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000006798 ring closing metathesis reaction Methods 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- 150000003839 salts Chemical group 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- SJMYWORNLPSJQO-UHFFFAOYSA-N tert-butyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OC(C)(C)C SJMYWORNLPSJQO-UHFFFAOYSA-N 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 125000001302 tertiary amino group Chemical group 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- DDFYFBUWEBINLX-UHFFFAOYSA-M tetramethylammonium bromide Chemical compound [Br-].C[N+](C)(C)C DDFYFBUWEBINLX-UHFFFAOYSA-M 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 229920001187 thermosetting polymer Polymers 0.000 description 1
- 239000004416 thermosoftening plastic Substances 0.000 description 1
- 150000003606 tin compounds Chemical class 0.000 description 1
- KSBAEPSJVUENNK-UHFFFAOYSA-L tin(ii) 2-ethylhexanoate Chemical compound [Sn+2].CCCCC(CC)C([O-])=O.CCCCC(CC)C([O-])=O KSBAEPSJVUENNK-UHFFFAOYSA-L 0.000 description 1
- LDHQCZJRKDOVOX-UHFFFAOYSA-N trans-crotonic acid Natural products CC=CC(O)=O LDHQCZJRKDOVOX-UHFFFAOYSA-N 0.000 description 1
- STCOOQWBFONSKY-UHFFFAOYSA-N tributyl phosphate Chemical compound CCCCOP(=O)(OCCCC)OCCCC STCOOQWBFONSKY-UHFFFAOYSA-N 0.000 description 1
- 239000002966 varnish Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- 150000003752 zinc compounds Chemical class 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F8/00—Chemical modification by after-treatment
- C08F8/30—Introducing nitrogen atoms or nitrogen-containing groups
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09D—COATING COMPOSITIONS, e.g. PAINTS, VARNISHES OR LACQUERS; FILLING PASTES; CHEMICAL PAINT OR INK REMOVERS; INKS; CORRECTING FLUIDS; WOODSTAINS; PASTES OR SOLIDS FOR COLOURING OR PRINTING; USE OF MATERIALS THEREFOR
- C09D133/00—Coating compositions based on homopolymers or copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by only one carboxyl radical, or of salts, anhydrides, esters, amides, imides, or nitriles thereof; Coating compositions based on derivatives of such polymers
- C09D133/04—Homopolymers or copolymers of esters
- C09D133/06—Homopolymers or copolymers of esters of esters containing only carbon, hydrogen and oxygen, the oxygen atom being present only as part of the carboxyl radical
- C09D133/062—Copolymers with monomers not covered by C09D133/06
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L61/00—Compositions of condensation polymers of aldehydes or ketones; Compositions of derivatives of such polymers
- C08L61/20—Condensation polymers of aldehydes or ketones with only compounds containing hydrogen attached to nitrogen
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/31504—Composite [nonstructural laminate]
- Y10T428/31551—Of polyamidoester [polyurethane, polyisocyanate, polycarbamate, etc.]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/31504—Composite [nonstructural laminate]
- Y10T428/31551—Of polyamidoester [polyurethane, polyisocyanate, polycarbamate, etc.]
- Y10T428/31605—Next to free metal
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/31504—Composite [nonstructural laminate]
- Y10T428/31678—Of metal
- Y10T428/31688—Next to aldehyde or ketone condensation product
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/31504—Composite [nonstructural laminate]
- Y10T428/31678—Of metal
- Y10T428/31692—Next to addition polymer from unsaturated monomers
- Y10T428/31699—Ester, halide or nitrile of addition polymer
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/31504—Composite [nonstructural laminate]
- Y10T428/31855—Of addition polymer from unsaturated monomers
- Y10T428/31935—Ester, halide or nitrile of addition polymer
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/31504—Composite [nonstructural laminate]
- Y10T428/31942—Of aldehyde or ketone condensation product
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- General Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Wood Science & Technology (AREA)
- Paints Or Removers (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Phenolic Resins Or Amino Resins (AREA)
- Application Of Or Painting With Fluid Materials (AREA)
Description
- Die vorliegende Erfindung betrifft härtbare Beschichtungszusammensetzungen, insbesondere Zusammensetzungen für Hochglanz-Decklacke, insbesondere für Klarlacke von Farblack-Klarlack-Verbundbeschichtungen.
- Härtbare bzw. warmhärtbare Beschichtungszusammensetzungen sind auf dem Gebiet der Beschichtungen weit verbreitet, insbesondere für Decklacke im Bereich der Autolackierung und der technischen Lackierung. Basislack-Klarlack-Verbundbeschichtungen sind Decklacke, die außergewöhnliche Glanz-, Farbtiefe- und Abbildungsschärfewerte oder Metallic-Spezialeffekte bieten. In der Automobilindustrie wird von Basislack-Klarlack-Verbundbeschichtungen für Autokarosseriebleche ausgiebig Gebrauch gemacht. Damit der gewünschte visuelle Effekt auch erzielt wird, müssen einschichtige Decklacke und die Klarlacke von Farblack-Klarlack-Verbundbeschichtungen jedoch eine sehr hohe Klarheit und einen sehr hohen Glanz aufweisen. Bei derartigen Lacken ist zur Erzielung des gewünschten hohen Glanzes und der gewünschten hohen Abbildungsschärfe (DOI) ein geringes Maß an visuellen Fehlstellen an der Oberfläche des Überzugs erforderlich.
- Da Fehler in den für diese Überzüge erforderlichen glatten, glänzenden Oberflächen so augenfällig sind, sind sie besonders anfällig gegenüber der sogenannten Umweltätzung, einer Art von Bewitterungsdegradation, die sich in Form von Flecken auf dem oder im Finish der Lackierung bemerkbar macht, die sich häufig nicht wegreiben lassen. Es hat sich als schwierig erwiesen, eine Vorhersage darüber zu treffen, wie groß die Beständigkeit einer Hochglanzlackierung oder einer Farblack-Klarlack-Verbundbeschichtung gegen Umweltätzung sein wird. Viele Beschichtungszusammensetzungen, die bei Verwendung in Außenanstrichfarben für ihre Standfestigkeit und/oder Witterungsbeständigkeit bekannt sind, wie z.B. feststoffreiche Einbrennlacke, in denen ein hydroxyfunktionelles Acrylpolymer mit einem Melamin-Formaldehyd-Harz vernetzt wird, liefern bei Verwendung in Hochglanzlacken, wie z.B. dem Klarlack einer Farblack-Klarlack-Verbundbeschichtung, nicht den gewünschten Grad an Beständigkeit gegen Umweltätzung. Während die von Aminoplastharz-Vernetzern, wie dem Melamin-Formaldehyd-Harz, mit hydroxyfunktionellen Harzen gebildeten Etherbindungen vom Standpunkt der Beständigkeit gegenüber Umweltätzung nicht wünschenswert sind, sind Aminoplastvernetzer aus anderen Gründen wünschenswert, beispielsweise da sie feststoffreiche Überzüge mit hervorragendem Aussehen liefern, die unter moderaten Bedingungen aushärten.
- In letzter Zeit hat sich gezeigt, daß Autolackzusammensetzungen auf Basis von carbamatfunktionellen Acrylharzen gegenüber Schäden durch Umweltätzung beständiger sind. Härtbare Beschichtungszusammensetzungen, in denen carbamatfunktionelle Acrylharze zum Einsatz kommen, werden beispielsweise in den US-Patentschriften 5,356,699, 5,474,811, 5,552,497, 5,559,195, 5,605,965, 5,639,554, 5,639,828 und 5,726,246 beschrieben. Carbamatgruppen können bei moderaten Temperaturen mit Melamin-Formaldehyd-Harzen oder anderen Aminoplastharzen vernetzt werden. Diese Beschichtungszusammensetzungen nutzen somit viele der Vorteile von Aminoplastharzen, bilden aber gleichzeitig Überzüge, die gegenüber Degradation durch Umweltätzung beständig sind.
- So werden beispielsweise in der US-PS 5,356,669 Verfahren zur Herstellung eines Acrylpolymers mit Carbamatfunktionalität beschrieben. Bei einem vorgeschlagenen Verfahren setzt man eine Acrylverbindung mit cyclischer Carbonatfunktionalität mit Ammoniak zu der Carbamatgruppe bzw. den Carbamatgruppen um. Man kann auch ein carbonatfunktionelles Monomer in ein carbamatfunktionelles Monomer umwandeln und dieses wiederum bei der Polymerisation des carbamatfunktionellen Acrylpolymers verwenden. Diese Syntheserouten zur Ausbildung der Carbamtfunktionalität weisen Vorteile auf. Nachteilig ist bei der Synthese unter Öffnung des Carbonatrings, daß bei der Reaktion auch eine Hydroxylgruppe entsteht, die dann mit einem Aminoplastvernetzer (wie in den herkömmlichen Einbrennzusammensetzungen) unter Ausbildung unerwünschter Etherbindungen reagieren kann.
- Andere zur Herstellung eines carbamatfunktionellen Acrylpolymers vorgeschlagene Methoden führen bzw. führen potentiell zu einem Acrylpolymer, das neben der gewünschten Carbamatfunktionalität auch Hydroxylfunktionalität aufweist. In der US-PS 5,553,497 wird ein Verfahren zur Umesterung einer hydroxyfunktionellen Acrylverbindung mit einer Carbamatverbindung zur Herstellung eines carbamatfunktionellen Acrylpolymers beschrieben. Auch in diesem Fall kann das Acrylpolymer wieder neben den Carbamatgruppen Hydroxylgruppen aufweisen, da zu erwarten ist, daß ein Teil der Hydroxylgruppen nicht umgesetzt bleibt. Bei einer anderen Synthese wird in der US-PS 5,552,497 durch gleichzeitige Polymerisation von hydroxyfunktionellem Acrylmonomer und Veresterung mit einem Alkylcarbamat, wie Methylcarbamat, ein carbamatfunktionelles Acrylpolymer hergestellt. Durch die gleichzeitige Polymerisation und Veresterung werden mit der Unverträglichkeit von carbamatgruppenhaltigem Monomer in der Polymerisationsmischung und der unerwünschten Molekulargewichtszunahme bei der Umesterung eines vorher hergestellten hydroxyfunktionellen Acrylpolymers verbundene Probleme vermieden. Das Acrylpolymer kann jedoch Hydroxylgruppen aufweisen, wenn die Veresterungsreaktion nicht vollständig ist. Bei einer weiteren Methode zur Ausbildung von Carbamatfunktionalität setzt man eine Hydroxylgruppe mit HNCO, das durch thermische Zersetzung von Harnstoff erzeugt wird, um, wie in der US-PS 5,605,965 beschrieben. Wenn weniger als eine stöchiometrische Menge des HNCO abreagiert, bleibt am Acrylpolymer Hydroxylfunktionalität zurück.
- Alle gerade beschriebenen Methoden kommen zwar zur Herstellung von Acrylpolymeren mit Carbamatgruppen in Betracht, jedoch können restliche Hydroxylgruppen mit Aminoplastvernetzern unerwünschte Etherbindungen ergeben. Es wäre daher wünschenswert, die Hydroxylfunktionalität gegenüber dem Aminoplastvernetzer reaktionsunfähig zu machen, so daß bei der Härtung des Acrylharzes nur die Carbamatgruppen Vernetzungen ausbilden, wodurch die Beständigkeit des gehärteten Überzugs gegenüber Umweltätzung maximiert wird.
- Kurze Darstellung der Erfindung
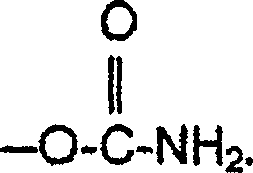
- Gegenstand der vorliegenden Erfindung ist ein Verfahren zur Herstellung eines prim.-carbamatfunktionellen Acrylpolymers für eine härtbare Beschichtungszusammensetzung, bei dem man alle Hydroxylgruppen eines Acrylharzes mit Hydroxylgruppen und primären Carbamatgruppen in neue Gruppen umwandelt, welche bei der Härtung einer das umgewandelte Acrylharz und einen Aminoplastvernetzer enthaltenden Beschichtungszusammensetzung nicht mit dem Aminoplastvernetzer reagieren. Durch die Umwandlung der Hydroxylgruppen wird die Reaktion der Hydroxylgruppen mit den Aminoplastvernetzern unter Ausbildung von Etherbindungen bei der Härtung des Überzugs verhindert. Somit ist die Aussage, daß die Gruppen aus der Umwandlung nicht mit dem Aminoplastvernetzer reagieren, so zu verstehen, daß die Gruppen unter den Bedingungen, unter denen die Reaktion mit Carbamatgruppen erfolgt, gegenüber dem Aminoplastvernetzer unreaktiv sind. Im Rahmen der vorliegenden Erfindung bezieht sich der Begriff "primäre Carbamatgruppe" auf eine Gruppe der Struktur
- Gegenstand der Erfindung ist ferner eine nach dem erfindungsgemäßen Verfahren hergestellte Beschichtungszusammensetzung und ein Gegenstand mit einem Substrat, auf dem sich ein gehärteter Überzug, der sich von einer erfindungsgemäßen Beschichtungszusammensetzung ableitet, befindet.
- Nähere Beschreibung
- Bei dem erfindungsgemäßen Verfahren wandelt man in einem ersten Schritt die Hydroxylgruppen eines Acrylharzes mit Hydroxylgruppen und primären Carbamatgruppen in neue, gegenüber einem Aminoplastvernetzer unreaktive Gruppen um, insbesondere durch Umsetzung der Hydroxylgruppen mit einer Verbindung dafür; vereinigt in einem zweiten Schritt das Acrylharz mit den neuen Gruppen mit mindestens einem Aminoplastvernetzer, wobei man eine Beschichtungszusammensetzung erhält; und bringt die Beschichtungszusammensetzung auf ein Substrat auf und härtet die aufgebrachte Überzugsschicht weitgehend ohne Ausbildung von Etherbindungen.
- Das Acrylharz mit Hydroxylgruppen und primären Carbamatgruppen kann auf einer Reihe von Wegen hergestellt werden. Bei einem Verfahren zur Einführung von primärer Carbamatfunktionalität in ein Acrylpolymer setzt man zur Ausbildung der Carbamatgruppen eine Acrylverbindung mit cyclischer Carbonatfunktionalität mit Ammoniak um. Acrylpolymere mit cyclischer Carbonatfunktionalität sind an sich bekannt und werden beispielsweise in der US-PS 2,979,514 beschrieben. Bei der Ringöffnungsreaktion bildet sich auch eine Hydroxylgruppe in beta-Stellung zur primären Carbamatgruppe.
- Man kann auch auf ähnliche Art und Weise ein carbonatfunktionelles Monomer in ein beta-hydroxy-prim.-carbamatfunktionelles Monomer umwandeln und dieses dann bei der Polymerisation des Acrylharzes mit Hydroxylgruppen und primären Carbamatgruppen verwenden. Außerdem kann man durch Umsetzung eines Monomers mit einer Oxirangruppe (bwz. Epoxidgruppe) mit CO2 Carbonatfunktionalität erhalten. Hierbei arbeitet man bei einem beliebigen Druck von Normaldruck bis zu überkritischen CO2-Drücken, vorzugsweise jedoch unter erhöhtem Druck (z.B. 60-150 psi). Die Reaktionstemperatur beträgt hierbei vorzugsweise 60-150°C. Als Katalysatoren eignen sich u.a. alle Katalysatoren, die einen Oxiranring aktivieren, wie z.B. ein tertiäres Amin oder quartäre Salze (z.B. Tetramethylammoniumbromid), Kombinationen von komplexen Organozinnhalogeniden und Alkylphosphoniumhalogeniden (z.B. (CH3)3SnI, Bu3SnI, Bu4PI und (CH3)4PI), Kaliumsalze (z.B. K2CO3, KI), vorzugsweise in Kombination mit Kronenethern, Zinnoctoat, Calciumoctoat und dergleichen. Danach kann man die cyclische Carbonatgruppe wie oben beschrieben in eine Carbamatgruppe überführen. Wie im Fall eines carbonatfunktionellen Monomers kann die Umwandlung einer Oxirangruppe in eine Carbamatgruppe vor, während oder nach der Polymerisationsreaktion durchgeführt werden. Beispiele für geeignete oxiranfunktionelle Monomere sind Glycidylacrylat, Glycidylmethacrylat und Allylglycidylether. Ungesättigte Bindungen können ebenfalls in Carbamatgruppen überführt werden, indem man sie zunächst durch Umsetzung mit Peroxid in eine Epoxidgruppe, dann mit CO2 in ein cyclisches Carbonat und dann mit Ammoniak oder einem primären Amin in das Carbamat überführt. Aufgrund der Reaktionsfreudigkeit der ethylenischen Ungesättigtheit der reaktiven Monomere sollte die Synthese der Carbamatfunktionalität nach der Polymerisation durch geführt werden. Beispielsweise kann man eine ungesättigte Bindung in das Acrylpolymer einführen, indem man bei der Polymerisation Allylmethacrylat mitverwendet oder die Ungesättigtheit in das gebildete Acrylpolymer einführt, wie z.B. durch Umsetzung von Hydroxylgruppen des Polymers mit Isocyanatoethylmethacrylat.
- Bei einem anderen Verfahren kann man eine hydroxyfunktionelle Acrylverbindung mit einer primären Alkylcarbamatverbindung zu einem prim.-carbamatfunktionellen Acrylpolymer umestern. Wenn nicht alle Hydroxylgruppen verestert werden, weist das Acrylpolymer auch Hydroxylgruppen auf. Zwar kann man durch Verwendung eines Überschusses der veresternden Carbamatverbindung in der Regel die Veresterungsreaktion bis zu vollständigem Umsatz treiben, aber die Verwendung von überschüssiger Carbamatverbindung könnte zu unerwünschten Nebenreaktionen führen und/oder die Entfernung des restlichen Überschusses der Carbamatverbindung nach Vervollständigung der Veresterung erforderlich machen. Daher verwendet man vorzugsweise keinen Überschuß an Carbamatverbindung, sondern läßt lieber einen Teil der Hydroxylgruppen zurück. Als Beispiele für primäre Alkylcarbamate, die für die Umesterung geeignet sind, sind u.a. Methylcarbamat, Ethylcarbamat, Propylcarbamat, Isopropylcarbamat, Butylcarbamat, 2-Ethylhexylcarbamat, Cyclohexylcarbamat, Phenylcarbamat, Hydroxypropylcarbamat, Hydroxyethylcarbamat usw. Die Umesterung kann mit einem Katalysator, wie beispielsweise metallorganischen Komplexen einschließlich Zinnverbindungen, wie Dibutylzinnoxid, Dibutylzinndilaurat, Dibutylzinndiacetat und Dibutylzinndimethoxid, Aluminiumverbindungen, wie Aluminiumisopropoxid, Zinkverbindungen und Titanaten, und stark sauren Katalysatoren, durchgeführt werden. Die Menge eines solchen Veresterungskatalysators kann im Bereich von etwa 0,05 bis etwa 5 Gewichtsprozent, bezogen auf das Gewicht der Reaktanten, liegen. In der Regel liegt der Veresterungskatalysator in einer Menge von etwa 0,1 bis etwa 1 Gew.-%, bezogen auf die Reaktanten, vor.
- In der US-PS 5,552,497 wird ein anderes Verfahren zur Herstellung eines Acrylharzes mit Hydroxylgruppen und primären Carbamatgruppen beschrieben. Die Polymerisation des Acrylpolymers wird mit einem hydroxyfunktionellen Monomer durchgeführt. Gleichzeitig wird die Hydroxylgruppe dieses Monomers durch Mitverwendung eines Alkylcarbamats, wie eines der oben beschriebenen, in der Reaktionsmischung verestert. Bei dem Versuch, die Reaktion bis zum vollständigen Umsatz zu treiben, ergeben sich die gleichen Probleme, wie sie bereits für das gerade beschriebene Verfahren mit sequentieller Polymerisation und Veresterung diskutiert worden sind. Das resultierende Polymer enthält Hydroxylgruppen, wenn die Veresterung der Hydroxylgruppen nicht vollständig ist, und zwar unabhängig davon, ob dies auf einen stöchiometrischen Überschuß an Hydroxylgruppen oder auf die Reaktionsbedingungen zurückzuführen ist. Wiederum kann man einen Umesterungskatalysator in Anteilen von etwa 0,05 bis etwa 5 Gewichtsprozent und vorzugsweise von etwa 0,1 bis etwa 1 Gew.-%, bezogen auf die Reaktanten (bei denen es sich in diesem Fall um die Monomere handelt), verwendet werden. Der Umesterungskatalysator kann zu Beginn der Umsetzung in einem Guß zugegeben werden, wird aber vorzugsweise in zwei Portionen aufgeteilt, von denen die eine zu Beginn der Umsetzung und die andere nach Abschluß der Polymerisationsreaktion zugegeben wird.
- Ein weiteres Beispiel für ein Verfahren zur Ausbildung von primärer Carbamatfunktionalität ist die Umsetzung einer Hydroxylgruppe mit HNCO, das durch thermische Zersetzung von Harnstoff erzeugt wird, wie in der US-PS 5,605,965 beschrieben. Wenn weniger als eine stöchiometrische Menge des HNCO abreagiert oder die Umsetzung nicht bis zum vollständigen Umsatz durchgeführt wird, bleibt am Acrylpolymer Hydroxylfunktionalität zurück.
- Das Acrylharz hat vorzugsweise ein Molekulargewicht von 500 bis 1.000.000 und besonders bevorzugt von 1500 bis 50.000. Unter "Molekulargewicht" ist im Rahmen der vorliegenden Erfindung das zahlenmittlere Molekulargewicht zu verstehen, das nach der GPC-Methode unter Verwendung eines Polystyrol-Standards bestimmt werden kann. Die eine primäre Carbamatgruppe tragende Monomereinheit kann etwa 10 bis etwa 90 Gewichtsprozent des Acrylharzes ausmachen und macht vorzugsweise etwa 40 bis etwa 60 Gewichtsprozent des Acrylharzes aus.
- Bei allen Verfahren, bei denen das Acrylharz mit Hydroxylgruppen und primären Carbamatgruppen aus einem hydroxyfunktionellen Acrylharz hergestellt wird, kann man das hydroxyfunktionelle Acrylharz durch Verwendung eines hydroxyfunktionellen ethylenisch ungesättigten Monomers bei der Polymerisation des Acrylharzes herstellen. Beispiele für brauchbare hydroxyfunktionelle ethylenisch ungesättigte Monomere sind Hydroxyethylmethacrylat, Hydroxyethylacrylat, Hydroxypropylacrylat, Hydroxypropylmethacrylat, Hydroxybutylacrylat, Hydroxybutylmethacrylat, das Produkt der Umsetzung von Methacrylsäure mit Styroloxid usw. Bevorzugte Hydroxylmonomere sind Methacrylsäure- oder Acrylsäureester, in denen es sich bei dem die Hydroxylgruppe tragenden Alkoholteil der Verbindung um eine lineare oder verzweigte Hydroxyalkylgruppierung mit 1 bis etwa 8 Kohlenstoffatomen handelt.
- Das die Hydroxylgruppe, Carbamatgruppe, Epoxidgruppe, nicht polymerisierende Ungesättigtheit oder Carbonatgruppe tragende Monomer kann mit einem oder mehreren ethylenisch ungesättigten Monomeren polymerisiert werden. Derartige Monomere für die Copolymerisation sind an sich bekannt. Als Beispiele seien im einzelnen genannt: Alkylester von Acryl- oder Methacrylsäure, z.B. Methylmethacrylat, Ethylacrylat, Ethylmethacrylat, Propylacrylat, Propylmethacrylat, Isopropylacrylat, Isopropylmethacrylat, Butylacrylat, Butylmethacrylat, Isobutylacrylat, Isobutylmethacrylat, t-Butylacrylat, t-Butylmethacrylat, Amylacrylat, Amylmethacrylat, Isoamylacrylat, Isoamylmethacrylat, Hexylacrylat, Hexylmethacrylat, 2-Ethylhexylacrylat, Decylacrylat, Decylmethacrylat, Isodecylacrylat, Isodecylmethacrylat, Dodecylacrylat, Dodecylmethacrylat, Cyclohexylacrylat, Cyclohexylmethacrylat , substituierte Cyclohexylacrylate und -methacrylate, 3,5,5-Trimethylhexylacrylat, 3,5,5-Trimethylhexylmethacrylat, die entsprechenden, Maleinsäure-, Fumarsäure-, Crotonsäure-, Isocrotonsäure-, Vinylessigsäure- und Itaconsäureester und dergleichen sowie Vinylmonomere, wie ungesättigtes m-Tetramethylxylolisocyanat, Styrol, t-Butylstyrol, alpha-Methylstyrol, Vinyltoluol und dergleichen. Beispiele für andere brauchbare polymerisierbare Comonomere sind Alkoxyethylacrylate und -methacrylate, Acryloxyacrylate und -methacrylate, ethylenisch ungesättigte Carbonsäuren, wie Acrylsäure, Methacrylsäure, Itaconsäure, Crotonsäure, Maleinsäure und Fumarsäure, ethylenisch ungesättigte tertiäre Aminoverbindungen, wie N,N'-Dimethylaminoethylmethacrylat, 2-Vinylpyridin, 4-Vinylpyridin und Vinylpyrrolidin, und Verbindungen wie Acrylnitril, Methacrylnitril, Acrolein und Methacrolein. In der Regel werden Kombinationen davon verwendet.
- Bei dem erfindungsgemäßen Verfahren wandelt man in einem Schritt die Hydroxylgruppen eines Acrylharzes mit Hydroxylgruppen und primären Carbamatgruppen in neue Gruppen um, vorzugsweise durch Umsetzung mit einer Substanz, die die Hydroxylgruppen in eine neue Gruppierung umwandelt, die bei der Härtung der Beschichtungszusammensetzung nicht mit dem Aminoplastvernetzer reagiert. Durch die Vermeidung von Etherbindungen, die durch Reaktion von Aminoplastvernetzern mit Hydroxylgruppen gebildet werden könnten, wird die Beständigkeit des gehärteten Überzugs gegenüber Umweltätzung verbessert. Außerdem wird im Fall von beta-Hydroxycarbamaten durch die Entfernung der beta-Hydroxylgruppe die Stabilität des Acrylharzes verbessert, da beta-Hydroxycarbamatgruppen unter bestimmten Bedingungen Ringschlußreaktionen eingehen können. Der Ringschluß könnte womöglich die vollständige Aushärtung der Beschichtungszusammensetzung verhindern.
- Zur Umwandlung der Hydroxylgruppen in neue Gruppen kann man eine Reihe verschiedener Substanzen mit den Hydroxylgruppen des Acrylharzes mit Hydroxylgruppen und primären Carbamatgruppen umsetzen. Vorzugsweise wird die Substanz unter monofunktionellen Isocyanaten, Säureanhydriden difunktioneller Carbonsäuren, Säureanhydriden monofunktioneller Carbonsäuren, monofunktionellen Carbonsäuren, Alkylhalogeniden einschließlich Alkylchloriden und Kombinationen davon ausgewählt.
- Die monofunktionellen Isocyanate können aromatisch, arylaliphatisch oder aliphatisch sein. Vorzugsweise enthält die monofunktionelle Isocyanatsubstanz eine monofunktionelle Isocyanatverbindung, bei der es sich um eine aliphatische Verbindung einschließlich cycloaliphatischer Verbindungen handelt. Die monofunktionelle Isocyanatverbindung kann andere, bei der Reaktion inerte Gruppen, wie Estergruppen oder Säuregruppen, enthalten. Beispiele für geeignete monofunktionelle Isocyanatverbindungen sind Butylisocyanat, Propylisocyanat, Octylisocyanat, Cyclohexylisocyanat, Isocyanatoessigsäurealkylester, wie Isocyanatoessigsäureethylester, und Kombinationen davon.
- Bei Umsetzung der Hydroxylgruppen mit einem Säureanhydrid einer Monocarbonsäure oder einer Dicarbonsäure ist nicht zu erwarten, daß die verbleibende Säuregruppe bei der Härtungstemperatur für die Reaktion der Carbamatgruppen mit dem Aminoplastvernetzer in beträchtlichem Maße mit dem Aminoplastvernetzer reagiert. In jedem Fall würde die Reaktion nicht zu einer Ethergruppe führen. Beispiele für geeignete Anhydridverbindungen sind Essigsäureanhydrid, Maleinsäureanhydrid, Malonsäureanhydrid, Glutarsäureanhydrid und Kombinationen davon.
- Die Hydroxylgruppen des Acrylharzes mit Hydroxylgruppen und primären Carbamatgruppen können auch mit monofunktionellen Säuren in einer Veresterungsreaktion umgesetzt werden. Beispiele für geeignete monofunktionelle Säuren sind Essigsäure, Buttersäure, Octansäure, Neosäuren (von denen viele im Handel von Exxon erhältlich sind) und Kombinationen davon. Die Hydroxylgruppen können auch mit Säurehalogeniden, vorzugsweise Säurechloriden, umgesetzt werden, wobei die Hydroxylgruppe verestert wird. Beispiele für geeignete Säurehalogenide sind Acetylchlorid, Propionylchlorid, Butyrylchlorid usw.
- Bei einem anderen Verfahren zur Umwandlung der Hydroxylgruppen in neue Gruppen, die bei der Härtung der Beschichtungszusammensetzung mit dem Aminoplastvernetzer keine Etherbindung bilden, kann man das Acrylharz mit Hydroxylgruppen und primären Carbamatgruppen mit einem Halogenameisensäurealkylester, insbesondere einem Chlorameisensäurealkylester, umsetzen. Dabei bildet sich eine Estergruppe sowie HCl als Nebenprodukt. Beispiele für geeignete Halogenameisensäurealkylester sind Chlorameisensäureethylester, Chlorameisensäurepropylester und Kombinationen davon.
- In einem weiteren Schritt des erfindungsgemäßen Verfahrens wird das Acrylharzreaktionsprodukt, das primäre Carbamatgruppen und aus der Umwandlung der Hydroxylgruppen hervorgegangene neue Gruppen enthält, mit mindestens einem Aminoplastvernetzer vereinigt, wobei man eine Beschichtungszusammensetzung erhält. Der Aminoplastvernetzer weist durchschnittlich mindestens zwei gegenüber dem Acrylharz reaktive Gruppen auf. Aminoplastvernetzer, unter denen hier auch Phenol-Formaldehyd-Addukte zu verstehen sind, sind durch aktive Methylol- oder Methylalkoxygruppen gekennzeichnet. Beispiele für bevorzugte Härterverbindungen sind Melamin-Formaldehyd-Harz (einschließlich monomerem oder polymerem Melaminharz und teil- oder vollalkyliertem Melaminharz), Harnstoffharze (z.B. Methylolharnstoffe, wie Harnstoff-Formaldehyd-Harz, Alkoxyharnstoffe, wie butyliertes Harnstoff-Formaldehyd-Harz) und Harze mit einpolymerisierten Isobutoxymethylacrylamidgruppen. Bei dem Härter kann es sich um Kombinationen davon handeln. Kombinationen von Tris(alkoxycarbonylamino)triazin wie mit einem Melamin-Formaldehyd-Harz und/oder einem blockierten Isocyanathärter sind ebenfalls geeignet und wünschenswert.
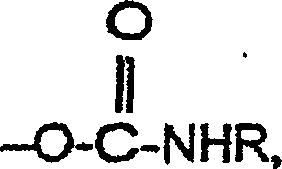
- Die Beschichtungszusammensetzung kann auch noch andere Substanzen mit Carbamat- oder Harnstoffgruppen enthalten. Erstens kann die Beschichtungszusammensetzung eine Komponente (a) mit mindestens einer Carbamatgruppe oder Harnstoffgruppe und einer Lacton- oder Hydroxycarbonsäuregruppierung enthalten. Im Rahmen der vorliegenden Erfindung bezieht sich der Begriff "Carbamatgruppe" auf eine Gruppe der Struktur worin R für H oder Alkyl steht. Vorzugsweise steht R für H oder Alkyl mit 1 bis etwa 4 Kohlenstoffatomen und besonders bevorzugt für H (primäres Carbamat). Im Rahmen der vorliegenden Erfindung bezieht sich der Begriff "endständige Harnstoffgruppe" auf eine Gruppe der Struktur worin R' und R'' jeweils unabhängig voneinander für H oder Alkyl stehen oder gemeinsam eine heterocyclische Ringstruktur bilden. Vorzugsweise stehen R' und R'' jeweils unabhängig voneinander für H oder Alkyl mit 1 bis etwa 4 Kohlenstoffatomen oder bilden gemeinsam eine Ethylenbrücke, und besonders bevorzugt stehen R' und R'' jeweils unabhängig voneinander für H. Die erfindungsgemäße endständige Harnstoffgruppe unterscheidet sich von Harnstoff-Brückengruppen, für die R'' von Alkyl verschieden wäre.
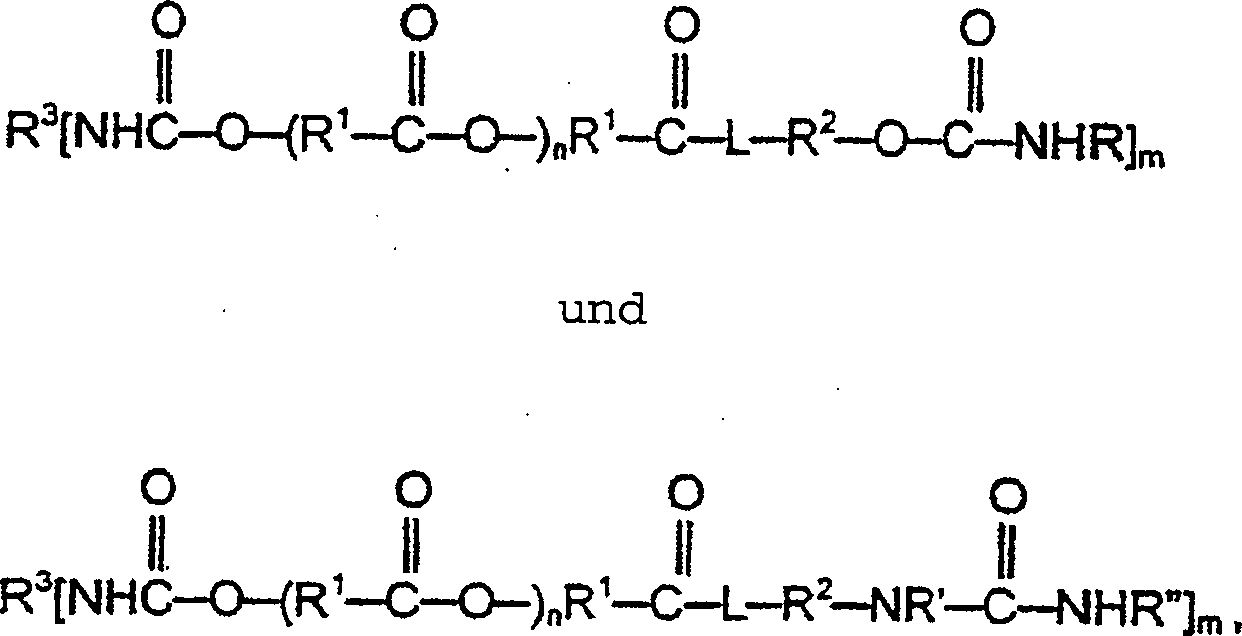
- Bevorzugte Verbindungen (a) können durch die Strukturen wiedergegeben werden, wobei R, R' und R'' die oben angegebene Bedeutung besitzen; R1 für Alkylen oder Arylalkylen, vorzugsweise Alkylen und insbesondere Alkylen mit 5 bis 10 Kohlenstoffatomen steht; R2 für gegebenenfalls substituiertes Alkylen, vorzugsweise mit etwa 2 bis etwa 4 Kohlenstoffatomen, steht; R3 für Alkylen (einschließlich Cycloalkylen), Alkylarylen, Arylen oder eine Struktur mit einem Cyanursäurering, einer Urethangruppe, einer Harnstoffgruppe, einer Carbodiimidgruppe, einer Biuretstruktur oder einer Allophanatgruppe, vorzugsweise Alkylen (einschließlich Cycloalkylen) oder eine Struktur mit einem Cyanursäurering, steht; n für 0 bis etwa 10, vorzugsweise 0 bis etwa 5, steht; m für 2 bis etwa 6, vorzugsweise 2 oder 3, steht; und L für O, NH oder NR4, worin R4 Alkyl, vorzugsweise Alkyl mit 1 bis etwa 6 Kohlenstoffatomen, bedeutet, steht.
- Die Verbindung (a) kann man nach einem Verfahren herstellen, bei dem man ein Lacton oder eine Hydroxycarbonsäure mit einer Verbindung mit einer Carbamatgruppe oder Harnstoffgruppe oder einer in eine Carbamatgruppe oder Harnstoffgruppe überführbaren Gruppe und, einer gegenüber dem Lacton bzw. der Hydroxycarbonsäure reaktiven Gruppe umsetzt. Im Fall einer in eine Carbamat- oder Harnstoffgruppe überführbare Gruppe kann die Überführung der Gruppe in die Carbamat- oder Harnstoffgruppe während oder nach der Umsetzung mit dem Lacton oder der Hydroxycarbonsäure erfolgen. Bei dem Verfahren zur Herstellung von Verbindung (a) kann man in einem weiteren Schritt ein hydroxyfunktionelles Produkt aus dem ersten Schritt mit einer Verbindung mit mindestens zwei Isocyanatgruppen umsetzen.
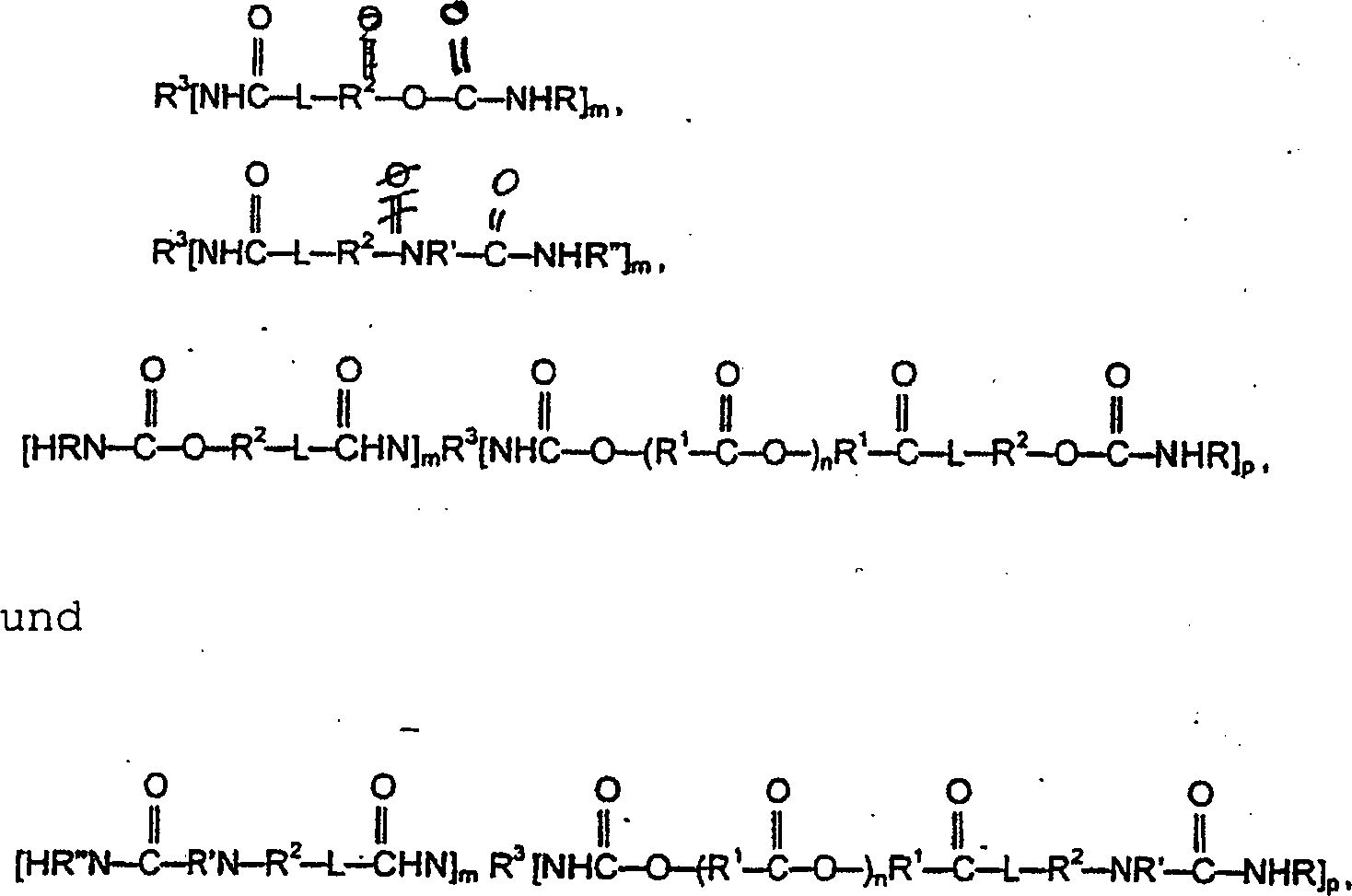
- Die Beschichtungszusammensetzung kann eine Komponente (b) mit mindestens einer erfindungsgemäßen Carbamatgruppe oder endständigen Harnstoffgruppe und mindestens zwei Brückengruppen, bei denen es sich um Urethan oder Harnstoff handelt, enthalten. Bevorzugte Verbindungen (b) können durch eine der Strukturen wiedergegeben werden, wobei R, R', R'', R2, R3, L und m die oben angegebene Bedeutung besitzen; p für 1 bis 5, vorzugsweise 1 oder 2, steht und m+p gleich 2 bis 6, vorzugsweise etwa 3, ist. Vorzugsweise steht R3 für Alkylen (einschließlich Cycloalkylen), Alkylarylen, Arylen oder eine Struktur mit einem Cyanursäurering.
- Die Verbindung (b) kann nach einem Verfahren hergestellt werden, bei dem man ein Polyisocyanat (b)(2) mit einer Verbindung (b)(1) mit einer Carbamatgruppe oder endständigen Harnstoffgruppe oder einer in eine Carbamatgruppe oder endständige Harnstoffgruppe überführbaren Gruppe sowie einer gegenüber Isocyanatfunktionalitäten reaktiven Gruppe umsetzt. Im Fall einer in Carbamat oder endständigen Harnstoff überführbaren Gruppe kann die Überführung in die Carbamatgruppe oder endständige Harnstoffgruppe zur Bildung der zweiten Komponente gleichzeitig mit oder nach der Umsetzung mit dem Polyisocyanat erfolgen.
- Schließlich kann die Beschichtungszusammensetzung eine Komponente (c) mit mindestens zwei unter Carbamatgruppen, endständigen Harnstoffgruppen oder Kombinationen davon ausgewählten Gruppen und mindestens vier Urethan- oder Harnstoff-Brückengruppen enthalten. Bevorzugte Verbindungen (c) können durch eine der Strukturen wiedergegeben werden, wobei R, R', R'', R2, L und m die oben angegebene Bedeutung besitzen; R5 und R6 jeweils unabhängig voneinander für Alkylen (einschließlich Cycloalkylen), vorzugsweise mit 1 bis etwa 18 Kohlenstoffatomen, besonders bevorzugt mit etwa 5 bis etwa 12 Kohlenstoffatomen, Alkylarylen oder Arylen stehen oder R6 für eine Struktur mit einem Cyanursäurering, einer Biuretstruktur oder einer Allophanatgruppe steht.
- Die Verbindung (c) kann nach einer Synthese hergestellt werden, bei der man eine Verbindung (c)(1) mit einer Carbamatgruppe oder endständigen Harnstoffgruppe oder einer in eine Carbamatgruppe oder endständige Harnstoffgruppe überführbaren Gruppe sowie einer Isocyanatgruppe mit einer Verbindung (c)(2) mit mindestens zwei gegenüber Isocyanatfunktionalitäten reaktiven Gruppen umsetzt. Wenn die Verbindung (c)(1) eine in eine Carbamatgruppe oder endständige Harnstoffgruppe überführbare Gruppe enthält, kann die Überführung in Carbamat- oder Harnstoffgruppe zur Bildung der Komponente (c) gleichzeitig mit oder nach Abschluß der Umsetzung mit der Verbindung mit mindestens zwei gegenüber Isocyanatfunktionalitäten reaktiven Gruppen erfolgen. Weitere Einzelheiten zu den Komponenten (a), (b) und (c) werden in der am 2. November 1998 eingereichten US-Patentanmeldung 09/184,195 beschrieben.
- In der Beschichtungszusammensetzung kann man gegebenenfalls ein Lösungsmittel mitverwenden. Zwar kann die Beschichtungszusammensetzung beispielsweise in Form eines weitgehend festen Pulvers oder einer Dispersion eingesetzt werden, jedoch ist es häufig wünschenswert, daß die Zusammensetzung in weitgehend flüssigem Zustand vorliegt, was man durch den Einsatz eines Lösungsmittels erreichen kann. Im allgemeinen kann es sich bei dem Lösungsmittel um ein beliebiges organisches Lösungsmittel und/oder Wasser handeln. Nach einer bevorzugten Ausführungsform handelt es sich bei dem Lösungsmittel um ein polares organisches Lösungsmittel. Besonders bevorzugt handelt es sich bei dem Lösungsmittel um ein polares aliphatisches Lösungsmittel oder ein polares aromatisches Lösungsmittel. Noch weiter bevorzugt handelt es sich bei dem Lösungsmittel um ein Keton, einen Ester, ein Acetat, ein aprotisches Amid, ein aprotisches Sulfoxid, ein aprotisches Amin oder eine Kombination aus beliebigen dieser Lösungsmittel. Als Lösungsmittel eignen sich beispielsweise Methylethylketon, Methylisobutylketon, m-Amylacetat, Ethylenglykolbutyletheracetat, Propylenglykolmonomethyletheracetat, Xylol, N-Methylpyrrolidon, Mischungen aromatischer Kohlenwasserstoffe und Gemische davon. Nach einer anderen bevorzugten Ausführungsform handelt es sich bei dem Lösungsmittel um Wasser oder ein Gemisch aus Wasser mit geringen Mengen an Cosolventien.
- Nach einer bevorzugten Ausführungsform liegt das Lösungsmittel in der Beschichtungszusammensetzung in einer Menge von etwa 0,01 Gewichtsprozent bis etwa 99 Gewichtsprozent, vorzugsweise von etwa 10 Gewichtsprozent bis etwa 60 Gewichtsprozent und besonders bevorzugt von etwa 30 Gewichtsprozent bis etwa 50 Gewichtsprozent vor.
- Die bei der Ausübung der Erfindung verwendete Beschichtungszusammensetzung kann zur Beschleunigung der Härtungsreaktion einen Katalysator enthalten. Bei Verwendung von Aminoplastverbindungen, insbesondere von monomeren Melaminen, kann man beispielsweise zur Beschleunigung der Härtungsreaktion einen stark sauren Katalysator einsetzen. Zu derartigen Katalysatoren, die an sich gut bekannt sind, gehören beispielsweise p-Toluolsulfonsäure, Dinonylnaphthalindisulfonsäure, Dodecylbenzolsulfonsäure, saures Phenylphosphat, Maleinsäuremonobutylester, Butylphosphat und Hydroxyphosphatester. Stark saure Katalysatoren sind häufig blockiert, z.B. mit einem Amin. Andere Katalysatoren, die sich zur Verwendung in der erfindungsgemäßen Zusammensetzung eignen, sind u.a. Lewis-Säuren, Zinksalze und Zinnsalze.
- In die Beschichtungszusammensetzung können auch zusätzliche Reagentien eingearbeitet werden, beispielsweise Tenside, Füllstoffe, Stabilisatoren, Netzmittel, Dispergiermittel, Haftvermittler, UV-Absorber, HALS-Verbindungen usw. Zwar sind derartige Additive an sich gut bekannt, jedoch muß man die Einsatzmenge genau bemessen, damit die Beschichtungseigenschaften nicht beeinträchtigt werden.
- Die erfindungsgemäße Beschichtungszusammensetzung wird vorzugsweise in einem Hochglanzlack und/oder als Klarlack einer Farblack-Klarlack-Verbundbeschichtung verwendet. Unter Hochglanzlacken sind im Rahmen der vorliegenden Erfindung Lacke mit einem 20°-Glanz (ASTM D523-89) oder einem DOI (ASTM E430-91) von mindestens 80 zu verstehen.
- Bei Verwendung der erfindungsgemäßen Beschichtungszusammensetzung als pigmentierter Hochglanzlack kann man als Pigment beliebige organische oder anorganische Verbindungen oder farbige Materialien, Füllstoffe, metallische oder andere anorganische plättchenförmige Materialien, wie z.B. Glimmer- oder Aluminiumplättchen, und andere Materialien dieser Art, die gemäß dem Stand der Technik in derartigen Beschichtungen normalerweise mitverwendet werden, verwenden. Pigmente und andere unlösliche teilchenförmige Verbindungen, wie z.B. Füllstoffe, werden in der Zusammensetzung für gewöhnlich in einer Menge von 1% bis 100%, bezogen auf das Feststoffgesamtgewicht der Bindemittelkomponenten, verwendet (d.h. das Pigment-Bindemittel-Verhältnis beträgt 0,1 bis 1).
- Bei Verwendung der erfindungsgemäßen Beschichtungszusammensetzung als Klarlack einer Farblack-Klarlack-Verbundbeschichtung kann man eine beliebige aus einer ganzen Reihe von Typen pigmentierter Basislackzusammensetzungen verwenden, welche an sich gut bekannt sind und hier nicht näher erläutert zu werden brauchen. Als Polymere, die sich bekanntlich zur Verwendung in Basislackzusammensetzungen eignen, seien Acrylverbindungen, Vinylverbindungen, Polyurethane, Polycarbonate, Polyester, Alkyde und Polysiloxane genannt. Zu den bevorzugten Polymeren gehören Acrylverbindungen und Polyurethane. Nach einer bevorzugten Ausführungsform der Erfindung enthält die Basislackzusammensetzung auch ein carbamatfunktionelles Acrylpolymer. Basislackpolymere können thermoplastisch sein, sind aber vorzugsweise vernetzbar und enthalten somit einen oder mehrere Typen vernetzbarer funktioneller Gruppen. Als Beispiele für derartige Gruppen seien Hydroxyl-, Isocyanat-, Amino-, Epoxid-, Acrylat-, Vinyl-, Silan- und Acetoacetatgruppen genannt. Diese Gruppen können so maskiert bzw. blockiert sein, daß sie erst unter den gewünschten Härtungsbedingungen, im allgemeinen bei erhöhten Temperaturen, entblockt werden und für die Vernetzungsreaktion zur Verfügung stehen. Als vernetzbare funktionelle Gruppen eignen sich u.a. Hydroxyl-, Epoxid-, Säure-, Anhydrid-, Silan- und Acetoacetatgruppen. Zu den bevorzugten vernetzbaren funktionellen Gruppen gehören Hydroxy- und Aminofunktionalitäten.
- Basislackpolymere können selbstvernetzend sein oder einen separaten Vernetzer erfordern, welcher gegenüber den funktionellen Gruppen des Polymers reaktiv ist. Enthält das Polymer beispielsweise Hydroxyfunktionalitäten, so kann es sich bei dem Vernetzer um ein Aminoplastharz, Isocyanat und blockierte Isocyanate (einschließlich Isocyanuraten) sowie säure- oder anhydridfunktionelle Vernetzer handeln.
- Die Beschichtungszusammensetzungen können nach einer Reihe von an sich wohlbekannten Methoden auf den Gegenstand aufgebracht werden. Dazu gehören u.a. Spritz-, Tauch-, Walzen-, Vorhangbeschichtung und dergleichen. Für Autokarosseriebleche ist die Spritzbeschichtung bevorzugt.
- Die hier beschriebenen Beschichtungszusammensetzungen werden vorzugsweise Bedingungen unterworfen, bei denen die Lackschichten aushärten. Zwar kommen verschiedene Härtungsmethoden in Betracht, jedoch ist die Warmhärtung bevorzugt. Dazu setzt man den lackierten Gegenstand im allgemeinen erhöhten Temperaturen aus, die hauptsächlich von Strahlungswärmequellen geliefert werden. Die Härtungstemperaturen variieren dabei je nach den jeweiligen in den Vernetzern verwendeten Blockierungsgruppen, liegen jedoch im allgemeinen im Bereich zwischen 90°C und 180°C. Die ersten erfindungsgemäßen Verbindungen sind schon bei verhältnismäßig niedrigen Härtungstemperaturen härtbar. So liegt die Härtungstemperatur für ein blockiertes, sauer katalysiertes System nach einer bevorzugten Ausführungsform vorzugsweise zwischen 115°C und 150°C und besonders bevorzugt zwischen 115°C und 140°C. Für ein unblockiertes, sauer katalysiertes System liegt die Härtungstemperatur vorzugsweise zwischen 80°C und 100°C. Die Härtungszeit variiert je nach den jeweils eingesetzten Komponenten und physikalischen Parametern, wie z.B. der Dicke der Schichten. Typische Härtungszeiten liegen jedoch im Bereich von 15 bis 60 Minuten, für blockierte, sauer katalysierte Systeme bevorzugt bei 15-25 Minuten und für unblockierte, sauer katalysierte Systeme vorzugsweise bei 10-20 Minuten.
- Die Erfindung wird nun anhand der folgenden Beispiele näher erläutert. Alle Teileangaben beziehen sich auf das Gewicht, sofern nicht anders vermerkt.
- BEISPIELE Vergleichsbeispiel A
- Eine Mischung von 824,5 Gewichtsteilen des cyclischen Carbonats von Glycidylmethacrylat (hergestellt durch Umsetzung von Glycidylmethacrylat mit Kohlendioxid unter Druck), 762,6 Gewichtsteilen 2-Ethylhexylacrylat und 129,8 Gewichtsteilen VAZO® 67 (von Dupont erhältlich) wurde über einen Zeitraum von 4 Stunden zu 995,3 Teilen refluxierendem Propylenglykolmonomethyletheracetat gegeben. Danach wurde eine Mischung von 76,4 Gewichtsteilen Propylenglykolmonomethyletheracetat und 24,3 Gewichtsteilen VAZO® 67 zugegeben. Dann wurde die Reaktionsmischung auf Raumtemperatur abgekühlt und mit 850,1 Gewichtsteilen Methanol versetzt. Danach wurde Ammoniakgas in die Reaktionsmischung geleitet, bis die Hydroxycarbamatbildung abgeschlossen war. Dann wurden überschüssiges Ammoniak und Methanol unter Vakuum abdestilliert. Der letztendliche nichtflüchtige Anteil für dieses Harz betrug 60 Gew.-%.
- Beispiel 1
- Eine Mischung von 1164 Gewichtsteilen des Harzes aus Vergleichsbeispiel A und 0,4 Gewichtsteilen Dibutylzinndilaurat wurde unter Inertatmosphäre auf 47°C erhitzt. Dann wurden 226 Gewichtsteile Cyclohexylisocyanat zugegeben. Nach Beendigung der Isocyanatzugabe wurde die Temperatur der Reaktionsmischung langsam auf 100°C erhöht. Nach Beedingung der Reaktion wurden 206,8 Gewichtsteile Propylenglykolmonomethyletheracetat und 10 Gewichtsteile n-Butanol zugegeben. Der letztendliche nichtflüchtige Anteil für dieses Harz betrug 60,1 Gew.-%.
- Vergleichsbeispiel B
- Eine Mischung von 549,6 Gewichtsteilen des cyclischen Carbonats von Glycidylmethacrylat (hergestellt durch Umsetzung von Glycidylmethacrylat mit Kohlendioxid unter Druck), 339,5 Gewichtsteilen 2-Ethylhexylacrylat, 322,5 Gewichtsteilen Styrol, 93,4 Gewichtsteilen 2-Ethylhexylmethacrylat, 342,9 Gewichtsteilen Methylmethacrylat und 131,7 Gewichtsteilen VAZO® 67 (von Dupont erhältlich) wurde über einen Zeitraum von 4 Stunden zu 995,3 Teilen refluxierendem Propylenglykolmonomethyletheracetat gegeben. Danach wurde eine Mischung von 77,6 Gewichtsteilen Propylenglykolmonomethyletheracetat und 24,7 Gewichtsteilen VAZO® 67 zugegeben. Dann wurde die Reaktionsmischung auf Raumtemperatur abgekühlt und mit 863 Gewichtsteilen Methanol versetzt. Danach wurde Ammoniakgas in die Reaktionsmischung geleitet, bis die Hydroxycarbamatbildung abgeschlossen war. Dann wurden überschüssiges Ammoniak und Methanol unter Vakuum abdestilliert. Der letztendliche nichtflüchtige Anteil für dieses Harz betrug 56,7 Gew.-%.
- Beispiel 2
- Eine Mischung von 1350 Gewichtsteilen des Harzes aus Vergleichsbeispiel B und 0,4 Gewichtsteilen Dibutyl zinndilaurat wurde unter Inertatmosphäre auf 65°C erhitzt. Dann wurden 156,3 Gewichtsteile Cyclohexylisocyanat zugegeben. Nach Beendigung der Isocyanatzugabe wurde die Temperatur der Reaktionsmischung langsam auf 100°C erhöht. Nach Beedingung der Reaktion wurden 20 Gewichtsteile Propylenglykolmonomethyletheracetat und 10 Gewichtsteile n-Butanol zugegeben. Der letztendliche nichtflüchtige Anteil für dieses Harz betrug 62,8 Gew.-%.
- Herstellung eines Additivharzes
- Zur Herstellung eines Additivharzes für die Beurteilung der Beschichtungszusammensetzung werden 51,7 Gewichtsteile Hydroxypropylcarbamat und 48,3 Gewichtsteile Isophorondiisocyanat in einem Gemisch aus Propylenglykolmonomethyletheracetat und Amylacetat im Gewichtsverhältnis 50:50 mit Dibtulyzinndilaurat als Katalysator nach der Verfahrensweise gemäß US-PS 5,373,069 (ohne den Reaktanten 2-Ethyl-1,3-hexandiol) miteinander zur Reaktion gebracht. Das Endprodukt hat einen nichtflüchtigen Anteil von 65,4 Gew.-%.
- Beurteilung der Beschichtungszusammensetzung
- Gemäß den Angaben in der folgenden Tabelle wurden Klarlackzusammensetzungen mit den Harzen gemäß den Beispielen 1 und 2 und den Vergleichsbeispielen A und B hergestellt. Zur Beurteilung der Klarlackzusammensetzungen wurden grundierte Bleche mit einem schwarzen Basislack und dann naß-in-naß mit einer der Klarlackzusammensetzungen versehen. Die lackierten Bleche wurden durch 30 Minuten Brennen bei 120°C gehärtet. Die gehärteten Klarlackfilme waren etwa 1,8 bis 2,0 Millizoll (45,7 bis 50,8 μm) dick. Die lackierten Bleche wurden einer 14 Wochen dauernden Freibewitterungsprüfung in einem Umweltätzungsprüfprogramm in Jacksonville, FL, USA, unterzogen. Das Ausmaß der Umweltätzung wurde auf einer Skala von 1 bis 10 bewertet, wobei 1 keine oder nur geringe Filmschäden und 10 starke Filmschäden bedeutet.
- Die Erfindung wurde anhand von bevorzugten Ausführungsformen näher erläutert.
Claims (18)
- Verfahren, bei dem man: (a) ein Acrylharz mit Hydroxylgruppen und primären Carbamatgruppen bereitstellt, (b) die Hydroxylgruppen des Acrylharzes in neue Gruppen umwandelt, (c) das Acrylharz aus Schritt (b) mit den neuen Gruppen mit mindestens einem Aminoplastvernetzer vereinigt, wobei man eine Beschichtungszusammensetzung erhält, und (d) die Beschichtungszusammensetzung auf ein Substrat aufbringt und die aufgebrachte Überzugsschicht härtet, wobei man auf dem Substrat einen gehärteten Überzug erhält; bei dem die in Schritt (b) gebildeten neuen Gruppen bei der Härtung gemäß Schritt (d) nicht mit dem Aminoplastvernetzer reagieren.
- Verfahren nach Anspruch 1, bei dem das in Schritt (a) bereitgestellte Acrylharz durch Umsetzung eines Acrylharzes mit cyclischer Carbonatfunktionalität mit Ammoniak hergestellt wird.
- Verfahren nach Anspruch 1, bei dem das in Schritt (a) bereitgestellte Acrylharz durch eine Polymerisationsreaktion unter Verwendung eines ⎕-hydroxycarbamatfunktionellen Monomers hergestellt wird.
- Verfahren nach Anspruch 1, bei dem das in Schritt (a) bereitgestellte Acrylharz durch Umesterung eines hydroxyfunktionellen Acrylharzes mit einer Alkylcarbamatverbindung hergestellt wird.
- Verfahren nach Anspruch 4, bei dem die Alkylcarbamatverbindung aus der Gruppe bestehend aus Methylcarbamat, Ethylcarbamat, Propylcarbamat, Isopropylcarbamat, Butylcarbamat, 2-Ethylhexylcarbamat, Cyclohexylcarbamat, Phenylcarbamat, Hydroxypropylcarbamat und Hydroxyethylcarbamat ausgewählt wird.
- Verfahren nach Anspruch 1, bei dem das in Schritt (a) bereitgestellte Acrylharz durch eine Polymerisationsreaktion unter Verwendung eines Monomers mit einer Hydroxylgruppe und gleichzeitige Umesterung der Hydroxylgruppe mit einem Alkylcarbamat hergestellt wird.
- Verfahren nach Anspruch 1, bei dem das in Schritt (a) bereitgestellte Acrylharz durch Umsetzung eines hydroxyfunktionellen Acrylharzes mit HNCO hergestellt wird.
- Verfahren nach Anspruch 1, bei dem man Schritt (b) durchführt, indem man das Acrylharz mit einer Substanz aus der Gruppe bestehend aus monofunktionellen Isocyanaten, Säureanhydriden difunktioneller Carbonsäuren, Säureanhydriden monofunktioneller Carbonsäuren, monofunktionellen Carbonsäuren, Alkylhalogeniden, Alkylchloriden und Kombinationen davon umsetzt.
- Verfahren nach Anspruch 8, bei dem die Substanz ein monofunktionelles Isocyanat umfaßt.
- Verfahren nach Anspruch 8, bei dem die Substanz Butylisocyanat umfaßt.
- Verfahren nach Anspruch 1, bei dem es sich bei dem Aminoplastvernetzer gemäß Schritt (c) um ein Melamin-Formaldehyd-Harz handelt.
- Verfahren nach Anspruch 1, bei dem die Beschichtungszusammensetzung gemäß Schritt (c) ferner eine Verbindung aus der Gruppe bestehend aus Verbindungen mit den Strukturen und Mischungen davon enthält, wobei R für H oder Alkyl steht; R' und R'' jeweils unabhängig voneinander für H oder Alkyl stehen oder gemeinsam eine heterocyclische Ringstruktur bilden; R2 für Alkylen oder substituiertes Alkylen steht; R1, R3, R5 und R6 unabhängig voneinander für Alkylen, Cycloalkylen oder Arylalkylen stehen oder R3, R5 und R6 unabhängig voneinander für Arylen oder eine Struktur mit einem Cyanursäurering, einer Urethangruppe, einer Harnstoffgruppe, einer Carbodiimidgruppe, einer Biuretstruktur oder einer Allophanatgruppe stehen; n für 0 bis etwa 10 steht; m für 2 bis etwa 6 steht und L für O, NH oder NR4, worin R4 Alkyl bedeutet, steht; p für 1 bis 5 steht und m + p gleich 2 bis 6 ist; R5 und R6 jeweils unabhängig voneinander für Alkylen, Cycloalkylen, Alkylarylen oder Arylen stehen oder R6 für eine Struktur mit einem Cyanursäurering, einer Biuretstruktur oder einer Allophanatgruppe steht.
- Verfahren nach Anspruch 1, bei dem das Substrat gemäß Schritt (d) aus der Gruppe bestehend aus Metall- und Kunststoffsubstraten ausgewählt wird.
- Verfahren nach Anspruch 1, bei dem es sich bei der Beschichtungszusammensetzung gemäß Schritt (c) um eine Decklackzusammensetzung handelt.
- Verfahren nach Anspruch 1, bei dem es sich bei der Beschichtungszusammensetzung gemäß Schritt (c) um eine Klarlackzusammensetzung handelt.
- Verfahren nach Anspruch 1, bei dem es sich bei dem gehärteten Überzug gemäß Schritt (d) um einen Hochglanzüberzug handelt.
- Nach dem Verfahren gemäß Anspruch 1 hergestellter Überzug.
- Beschichtungszusammensetzung, enthaltend: (a) ein Acrylharz mit primären Carbamatgruppen und mindestens einer anderen Art von Gruppen, welche durch Umwandlung von Hydroxylgruppen gebildet worden ist, und (b) einen Aminoplastvernetzer; bei der die neuen Gruppen unter Bedingungen zur Umsetzung der primären Carbamatgruppen mit dem Aminoplastvernetzer nicht mit dem Aminoplastvernetzer reagieren.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US198472 | 1998-11-24 | ||
| US09/198,472 US6106951A (en) | 1998-11-24 | 1998-11-24 | Curable coating compositions containing carmamate-functional compounds |
| PCT/US1999/025881 WO2000031195A1 (en) | 1998-11-24 | 1999-11-03 | Coating compositions containing modified carbamate-functional polyacrylic binders |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918170D1 DE69918170D1 (de) | 2004-07-22 |
| DE69918170T2 true DE69918170T2 (de) | 2005-07-07 |
Family
ID=22733527
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69918170T Expired - Lifetime DE69918170T2 (de) | 1998-11-24 | 1999-11-03 | Beschichtungszusammensetzung mit modifiziertem carbamat-funktionellem acrylbindemittel |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US6106951A (de) |
| EP (1) | EP1141149B1 (de) |
| JP (1) | JP2002530508A (de) |
| AU (1) | AU1465100A (de) |
| BR (1) | BR9914106B1 (de) |
| CA (1) | CA2345746C (de) |
| DE (1) | DE69918170T2 (de) |
| ES (1) | ES2224754T3 (de) |
| WO (1) | WO2000031195A1 (de) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6512069B1 (en) | 1999-09-30 | 2003-01-28 | Basf Corporation | Durable refinish coating |
| US6639016B2 (en) * | 2000-12-31 | 2003-10-28 | Basf Corporation | Method of making a graft polymer |
| US6838530B2 (en) * | 2001-11-29 | 2005-01-04 | Basf Corporation | Method of preparing various multifunctional materials using limited starting reactants |
| US6825286B2 (en) * | 2001-11-29 | 2004-11-30 | Basf Corporation | Method for determining the water solubility or water dispersibility of waterborne beta-hydroxy primary carbamate functional graft materials |
| US7122605B2 (en) * | 2001-11-29 | 2006-10-17 | Basf Corporation | Method for selective graft polymerization |
| US6812300B2 (en) * | 2001-11-29 | 2004-11-02 | Basf Corporation | Method for making multifunctional materials |
| DE10246139A1 (de) * | 2002-10-01 | 2004-04-15 | Basf Ag | Alkylglycidolcarbonate als Co-Tenside |
| DE10305119B4 (de) * | 2003-02-07 | 2007-02-22 | Basf Coatings Ag | Beschichtungsstoffe, Verfahren zu ihrer Herstellung und ihre Verwendung |
| US6939592B2 (en) * | 2003-05-08 | 2005-09-06 | Ppg Industries Ohio, Inc. | Carbamated polyols, and compositions and methods using the same |
| US20050032978A1 (en) * | 2003-08-06 | 2005-02-10 | O'dwyer James B. | Etherified carbamate functional copolymers of isobutylene type monomers, and their use in curable compositions |
| DE102005033622A1 (de) * | 2005-07-19 | 2007-01-25 | Basf Coatings Ag | Laterale Carbamatgruppen und mit aktinischer Strahlung aktivierbare Gruppen enthaltende Copolymerisate, Verfahren zu ihrer Herstellung und ihre Verwendung |
| MX2009005610A (es) * | 2007-02-13 | 2009-06-08 | Basf Corp | Sistema de revestimiento para lograr excelente adhesion a mvss. |
| US20110097482A1 (en) * | 2009-10-27 | 2011-04-28 | Basf Coatings Ag | Compact coating system and process |
| WO2021078492A1 (en) | 2019-10-23 | 2021-04-29 | Evonik Operations Gmbh | Process for preparing glycerol carbonate (meth)acrylate |
| CN110894273A (zh) * | 2019-12-05 | 2020-03-20 | 江苏长顺高分子材料研究院有限公司 | 贮存稳定性好的三聚氰胺醛基粘合树脂及其制备方法 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5356669A (en) * | 1992-10-23 | 1994-10-18 | Basf Corporation | Composite color-plus-clear coating utilizing carbamate-functional polymer composition in the clearcoat |
| US5552497A (en) * | 1994-12-29 | 1996-09-03 | Basf Corporation | Method of preparing carbamate-functional polymer |
| US5922475A (en) * | 1997-04-29 | 1999-07-13 | Ppg Industries Ohio, Inc. | Color-plus-clear composite coating compositions containing alkylolated or etherified carbanate functional polymers |
-
1998
- 1998-11-24 US US09/198,472 patent/US6106951A/en not_active Expired - Lifetime
-
1999
- 1999-11-03 JP JP2000584012A patent/JP2002530508A/ja active Pending
- 1999-11-03 AU AU14651/00A patent/AU1465100A/en not_active Abandoned
- 1999-11-03 WO PCT/US1999/025881 patent/WO2000031195A1/en not_active Ceased
- 1999-11-03 DE DE69918170T patent/DE69918170T2/de not_active Expired - Lifetime
- 1999-11-03 CA CA002345746A patent/CA2345746C/en not_active Expired - Fee Related
- 1999-11-03 ES ES99972664T patent/ES2224754T3/es not_active Expired - Lifetime
- 1999-11-03 EP EP99972664A patent/EP1141149B1/de not_active Expired - Lifetime
- 1999-11-03 BR BRPI9914106-0A patent/BR9914106B1/pt not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| US6106951A (en) | 2000-08-22 |
| WO2000031195A1 (en) | 2000-06-02 |
| EP1141149A1 (de) | 2001-10-10 |
| EP1141149B1 (de) | 2004-06-16 |
| BR9914106A (pt) | 2001-10-16 |
| CA2345746C (en) | 2007-09-25 |
| JP2002530508A (ja) | 2002-09-17 |
| ES2224754T3 (es) | 2005-03-01 |
| AU1465100A (en) | 2000-06-13 |
| BR9914106B1 (pt) | 2009-08-11 |
| CA2345746A1 (en) | 2000-06-02 |
| DE69918170D1 (de) | 2004-07-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69904641T2 (de) | Härtbare beschichtungszusammensetzungen die carbamatfunktionelle verbindungen enthalten | |
| DE69814302T2 (de) | Zweifach wärmehärtbare Zusammensetzungen mit hohem Feststoffgehalt | |
| DE69604804T2 (de) | Beschichtungszusammensetzungen enthaltend acrylpolymere mit carbamatgruppen | |
| DE69411221T2 (de) | Tri-Carbamat-funktionelle Vernetzer | |
| DE60009523T2 (de) | Carbamatfunktionelle harze mit verbesserter adhäsion, verfahren zu deren herstellung und verfahren zur verbesserung der zwischenhaftung | |
| DE69610805T2 (de) | Umwelteinflüsse ätzresistente wässrige Beschichtungszusammensetzung | |
| DE69532744T2 (de) | Polyurethan mit Carbamatseitengruppen, Verfahren zu seiner Herstellung und Beschichtungszusammensetzung | |
| DE69904638T2 (de) | Härtbare beschichtungszusammensetzungen die carbamatfunktionelle verbindungen enthalten | |
| DE69918170T2 (de) | Beschichtungszusammensetzung mit modifiziertem carbamat-funktionellem acrylbindemittel | |
| DE69617157T2 (de) | Härtbare Zusammensetzungen für Beschichtungen | |
| DE69506834T2 (de) | Carbamatharz und Zusätze enthaltende vernetzbare Beschichtungszusammensetzungen | |
| DE60220090T2 (de) | Klarlack | |
| DE69603678T2 (de) | Härtbare Beschichtungszusammensetzungen | |
| DE69905927T2 (de) | Härtbare beschichtungszusammensetzungen die carbamatfunktionelle verbindungen enthalten | |
| DE60038628T2 (de) | Härtbare beschichtungszusammensetzungen, die carbamatfunktionelle reaktive additive enthalten | |
| EP0705853A2 (de) | Copolymerisate mit cyclischen oder polycyclischen Monomeren mit einer speziellen Isomerenverteilung und deren Einsatz in Beschichtungsmittel | |
| DE69417532T2 (de) | Kettenverlängerte Isocyanurate zur Verwendung als Härtungsmittel in Beschichtungszusammensetzungen | |
| DE60217403T2 (de) | Verfahren zur herstellung von beschichtungsmassen mit reduziertem gehalt an flüchtigen organischen substanzen | |
| DE69804313T2 (de) | Filmbildende zusammensetzung | |
| DE60207751T2 (de) | Wasser- und organisch-lösliche carbamatmaterialien | |
| EP1362074B1 (de) | Karbamatfunktionelle polymere und oligomere | |
| DE69730032T2 (de) | Carbamatfunktionelle polyesters und diese enthaltende beschichtungsmischungen | |
| EP1590385B1 (de) | Beschichtungsstoffe, verfahren zu ihrer herstellung und ihre verwendung | |
| US6391968B1 (en) | Curable coating compositions containing carbamate functional polymers and carbamate functional reactive additives | |
| DE69925835T2 (de) | Verfahren zur verbesserung des aussehens von farbigen und durchsichtigen verbundbeschichtungen und solche zusammensetzungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |