-
TECHNISCHES GEBIET DER
ERFINDUNG
-
Die
vorliegende Erfindung betrifft neue Chitosan enthaltende flüssige Zusammensetzungen,
ihre Herstellungsverfahren und ihre Verwendungsverfahren. Insbesondere
betrifft die Erfindung eine Chitosan enthaltende flüssige Suspensionszusammensetzung,
die beständig
bleibt und als ein Zusatzstoff z. B. in Wasser oder Flüssigkeiten
auf Wasserbasis brauchbar ist.
-
HINTERGRUND
DER ERFINDUNG
-
Wir
leben in einer Gesellschaft, die von der äußeren Gesamterscheinung der
Person und ihrer Gewichtsabnahme besessen ist. Trotz dieser Verbohrheit
bestätigen
medizinische Berichte, daß 68%
aller Amerikaner übergewichtig
sind und 33% von jenen, die das Alter von 20 überschritten haben, klinisch
adipös
sind. Dies sind 64 Millionen übergewichtige
Erwachsene nur alleine in den Vereinigten Staaten. Über die
offensichtlichen kosmetischen Überlegungen
hinaus ist die Fettleibigkeit eine der führenden Ursachen von Herzkrankheiten,
Hochdruck, Schlaganfall und Zuckerkrankheit und eine beitragende
Krebsursache. Die Größe des Marktes
für Produkte
der Gewichtskontrolle wird auf über
$ 100 Milliarden pro Jahr weltweit geschätzt und steigt ständig. Es
besteht zweifellos ein Bedarf für
ein wirksames, sicheres und schmackhaftes Gewichtseinschränkungsprodukt,
um diesem wachsenden Problem Einhalt zu gebieten.
-
Die ärztliche
Seite hat lange die Vorteile einer Diät mit hohem Faser- und niedrigem
Fettgehalt verkündet.
In diesem Zusammenhang wurde Chitosan beträchtliche Aufmerksamkeit entgegengebracht,
da es angewandt werden kann, um Fett in der Nahrung zu binden und
eine unverdauliche Masse zu bilden, die das Fett unabsorbiert das
Verdauungssystem einer Person passieren und geradewegs aus dem Körper austreten
läßt. Chitosan
(das ist (1→4)
2-Amino-2-deoxy-β-D-glucosamin,
auch als Polyglucosamin bekannt) ist eine mit Wasser mischbare biopolymere
Verbindung, die teilweise oder vollständig deacetyliertes Chitin
umfaßt.
Chitin ist ein celluloseartiges Polymer, das in Pilzwandungen und
den Hautskeletten von Gliederfüßern einschließlich Insekten,
Krabben, Garnelen und Hum mern anwesend ist. Chitosan kann das bis
zu bis zu 4- bis 6-fache seines Gewichts an Ölen, Fetten und giftigen Substanzen
binden (Nauss et al., Lipids, 18(10), 714–719 (1983)). Diese Fähigkeit
des Chitosans beruht darauf, daß es
positiv geladene Aminogruppen besitzt, die negativ geladene Fettsäuren (die
Baublöcke
des Fetts) und Gallensäuren
(bei der Cholesterinbildung benutzt) binden.
-
Die
außergewöhnlichen
Eigenschaften des Chitosans sind verantwortlich für seinen
Einsatz als ein Zusatzstoff oder als Hauptbestandteil bei zahlreichen
Anwendungen auf den Gebieten der Nahrungsmittel, Gesundheit, Kosmetik,
Landwirtschaft, Abwasserbehandlung sowie in anderen Industrien.
In der Nahrungsmittel- und Gesundheitsindustrie ist Chitosan gegenwärtig unter
mehreren Handelsnamen in Tablettenform erhältlich. Auch werden gegenwärtig Tabletten
vertrieben, die Chitosan kombiniert mit Ascorbinsäure enthalten.
Ascorbinsäure
wirkt in Synergie mit Chitosan, um Fettabsorptionseigenschaften
zu schaffen, die weit über
die von Chitosan alleine hinausgehen. Chitosantabletten sind jedoch
voluminös,
müssen
in grossen Mengen genommen werden, haben einen unangenehmen Geschmack
und können
andere bemerkenswerte Nebenwirkungen haben. Somit besteht ein aktueller
Bedarf an einem Produkt, das eine Gewichtskontrolle schafft und
leicht anzuwenden ist, insbesondere im Vergleich mit Chitosan enthaltenden
Kapseln.
-
US-Patent
5,736,532 betrifft eine Fettabsorptions- und Cholesterinreduktionsformulierung,
die Chitosan und Nicotinsäure
enthält,
und beschreibt die Verwendung dieser Formulierung zur Reduzierung
von Cholesterin. Das Patent beschreibt, daß die Formulierung Chitosan
und Nicotinsäure
enthalten muß und
zusätzlich eine
oder mehrere andere wasserlösliche
Vitaminsäuren,
wie Ascorbinsäure,
Folsäure
usw. enthalten kann. Das Patent beschreibt die Formulierung des
Gemisches als ein Pulver, das dann zu Tabletten geformt oder in Gelatinekapseln
verpackt wird. Natürlich
sind diese Tabletten und Kapseln so unbequem einzunehmen wie es Chitosantabletten
sind. Es ist auch gut bekannt, daß orale Nicotinsäure (Niacin)
für sich
selbst in hohen Dosen eingenommen die Wirkung hat, Serumcholesterin-
und Triglyceridgehalte zu reduzieren. Niacin kann jedoch in therapeutischen
Dosen mehrere Nebenwirkungen haben, darunter Erröten, Hautausschlag, Leberprobleme, Aktivierung
peptischer Geschwüre,
Gicht, Verschlechterung der Diabeteskontrolle sowie andere (siehe "Niacin zur Cholesterinabsenkung" bei http://www.heartinfo.
com/niacin.html 6/7/99).
-
Gewisse
Patente beschreiben u. a. Chitosan, das in einer flüssigen Formulierung
sein kann. Die diesbezüglichen
US-Patente 5,453,282 und 5,654,001 beschreiben jeweils eine flüssige Chitosanformulierung,
die Ascorbinsäure
(siehe z. B. Tabelle 8, die eine Formulierung mit Fruchtsaft (210
g/l), Zucker (100 g/l), Ascorbinsäure (1 g/l), Essenz (1 g/l)
und Chitosan (20 g/l)) enthält,
die zur Behandlung von Fettleibigkeit eingesetzt werden kann. Die
flüssige
Chitosanformulierung dieser Patente hat jedoch eine ungewisse Haltbarkeit,
da die Flüssigkeit
hohe Zuckermengen und kein Konservierungsmittel enthält. Außerdem machen
die Patente keine Angaben, wie das Chitosan in der Flüssigkeit
in Lösung
zu bringen ist (d. h. das Gewichtsverhältnis von Chitosan zu Ascorbinsäure in Tabelle
8 ist 20 : 1, und es sind in dem Patent keine Anweisungen bezüglich der speziellen
Mischung zwecks Auflösung
des Chitosans in der Flüssigkeit
angegeben), was bedeutet, daß das Chitosan
in der beschriebenen flüssigen
Zusammensetzung wahrscheinlich in Flocken- oder Pulverform verbleibt.
-
In ähnlicher
Weise beansprucht US-Patent 4,223,023 ein "Verfahren zur Reduzierung der Lipidabsorption
in Säugern,
bei dem man dem Säuger
eine Chitosanmenge oral verabreicht, die zur wesentlichen Verringerung
der Lipidabsorption wirksam ist" (Anspruch
1). Beispiel 6 dieses Patents bezieht sich auf ein Chitosanpulvergemisch
zur oralen Verabreichung, das Chitosan (80 g), Lactose (10 g), Sucrose
(9,9 g) und Geschmacksstoff enthält.
Das Pulvergemisch muß als
Suspension in Wasser oder anderer Flüssigkeit verabreicht werden.
Das Patent gibt jedoch keine Anweisung, wieviel Flüssigkeit
dem Pulver zuzusetzen ist, noch irgendeine Anweisung bezüglich der
Löslichmachung
des Chitosans in der Flüssigkeit.
Alle übrigen
Beispiele dieses Patents betreffen Formulierungen, in denen das
Chitosan in dem Gemisch mit Backfett oder Fettsäure kombiniert ist. Diese Kombination
wird in einer kurzen Zeitdauer die Ausfällung des Chitosans in der
Zusammensetzung verursachen.
-
Zum
Vergleich beschreiben die US-Patente 4,202,881, 4,363,801, 4,474,769
und 4,512,968 sowie die internationale PCT-Anmeldung WO 98/32335
(a) die Behandlung von Chitosan mit Säure, (b) die Löslichmachung
des Chitosans in Wasser durch Behandlung mit Säure und/oder (c) flüssige Chitosanformulierungen. So
beansprucht US-Patent 4,202,881 ein Verfahren zum Waschen und Konditionieren
von Haar, bei dem man dem Haar eine wässrige Lösung, Emulsion oder ein Gel
zusetzt, enthaltend ein "wasserlösliches
Chitosansalz, das durch Umsetzung von Chitosan... mit einer ausreichenden
Säuremenge
gebildet wurde, um die in dem Chitosan vorliegenden freien Aminogruppen
zu neutralisieren und sein wasserlösliches Salz zu bilden" (Anspruch 1). Spalte
2, Zeilen 23–43
beschreibt, daß Aminogruppen
im Chitosan mit Säuren
(insbesondere mit Essigsäure,
Ameisensäure
und Milchsäure)
neutralisiert werden können,
um wasserlösliche
Salze zu bilden. Das Patent beschreibt jedoch nicht das Verfahren,
durch das eine Chitosan enthaltende Lösung, Emulsion oder Gel erhalten
werden kann, ohne daß das
wasserlösliche
Salz eines Chitosans dem Haarkonditioniermittel und/oder Haar-Shampoo
zugesetzt wird.
-
US-Patent
4,512,968 beansprucht eine Chitosan enthaltende Zusammensetzung
(einschließlich
eines flüssigen
Mundspülmittels)
zur Reduzierung von Zahnkaries (Anspruch 1). Beispiel 4 beschreibt
eine wässrige Mundspülformulierung,
und Beispiel 6 beschreibt ein flüssiges
orales Erfrischungsmittel. Spalte 2, Zeilen 37–47 beschreibt, daß Chitosan
zunächst
in anorganischen schwachen Säuren
gelöst
wird, um es wasserlöslich
zu machen. Das Patent beschreibt jedoch nicht das Verfahren, durch
das eine Chitosan enthaltende Zusammensetzung erhalten werden kann,
ohne daß in
die Formulierung andere Bestandteile eingebracht werden, die den
Charakter der Zusammensetzung beeinflussen (z. B. Ethylalkohol,
Natriumlaurylsulfonat, Natrium-α-olefinsulfonat,
Natriumlauroylsarcosinat und/oder Glycerin oder andere Mittel).
-
Demgegenüber beansprucht
US-Patent 4,474,769 eine Chitosanformulierung als ein Empfängnisverhütungsmittel.
Spalte 2, Zeilen 44–53,
beschreibt, daß Chitosan
zunächst
in schwachen Säuren
(insbesondere Essigsäure,
Ameisensäure
und Milchsäure)
gelöst
wird. Die Chitosanmenge kann in dem Bereich von 10 ppm bis 5% liegen,
und die zur Auflösung
des Chitosans eingesetzte Menge des sauren Materials kann von 5
ppm bis 10% reichen.
-
US-Patent
4,363,801 beansprucht ein "Verfahren
zur Behandlung von Hyperbilirubinämie, bei dem man dem befallenen
Patienten eine Menge lösliches
Chitosan oral verabreicht, die wirksam ist, um die Bilirubinmenge
in dem Blut wesentlich zu verringern" (Anspruch 1). Spalte 3, Zeilen 11–18 beschreibt,
daß Chitosan zunächst in
schwachen Säuren
(insbesondere Essigsäure,
Ameisensäure
und Zitronensäure)
gelöst
wird, um ein Chitosansalz zu bilden. Das Chitosansalz wird vorzugsweise
gebildet durch Auflösen
von Chitosan in der schwachen Säure,
Rühren
der Lösung
(z. B. in einem Mischer), Gefriertrocknen der Lösung und Pulverisieren der
durch Gefriertrocknung erzeugten Chitosansalze zu einem feingemahlenen
Pulver. Das gemahlene Pulver wird dann zur Gebrauchsfertigstellung
mit einer Wasserlösung
oder einem anderen Getränk
gemischt.
-
In ähnlicher
Weise beansprucht die internationale PCT-Anmeldung WO 98/32335 eine
Chitosanlösung zur
Behandlung von Keimblattpflanzen. Der die Seiten 15 und 16 überbrückende Absatz
beschreibt die Herstellung einer wässrigen Chitosanacetatlösung, die
eine genügend
lange Haltbarkeit zeigt, so daß sie
in einem Labor verpackt und zum Feldeinsatz transportiert werden
kann. Diese Lösung
erhält
man durch kräftiges
Rühren
von Chitosanflocken in Wasser bei einer Temperatur von 60°C, Zusatz
von Essigsäure
bei fortgesetzter Rührung
und erhöhter
Temperatur zwecks Auflösung
des Chitosans, Filtration der Lösung,
Verdünnung
mit Wasser und Verpackung der Lösung.
-
Somit
beschreibt dieses Schrifttum höchstens
eine Flüssigkeitszusammensetzung,
die durch Behandlung von Chitosan mit Säure erzeugt wird. Es ist nicht
klar, ob diese Präparate
alle Chitosan in löslicher
Form enthalten und/oder irgendeine Beständigkeit zeigen. Wichtiger
ist, da bestimmte von diesen Präparaten
andere, für
besondere Anwendungsfälle
spezifische Bestandteile enthalten, daß es nicht klar ist, ob diese
Präparate bei
einer Lebensweise zur Gewichtsbehandlung für den menschlichen Verbrauch
geeignet sind, geschweige denn für
den menschlichen Verzehr akzeptabel sind.
-
Schließlich betrifft
die internationale PCT-Anmeldung WO 98/34625 sogenanntes "mikrokristallines Chitosan", das zur Reduzierung
der Absorption von Lipiden eingesetzt werden kann. Das mikrokristalline
Chitosan liegt wahlweise in der Form einer gelartigen Dispersion
oder eines Pulvers vor. Das mikrokristalline Chitosan wird anscheinend
durch ein Verfahren hergestellt, das die Aggregation von Glucosamin-Makromolekülen aus
einer Chitosanlösung
in einer Säure
durch Einführung
einer alkalischen Lösung
beinhaltet (nämlich
wie beschrieben in der internationalen PCT-Anmeldung 91/00298).
Es ist jedoch aus der Beschreibung nicht genau klar, welches die
Eigenschaften des Gels (z. B. Steifheit usw.) sein sollen und welche
anderen Bestandteile wahlweise in der Dispersion vorliegen können oder
für die
Dispersion benötigt
werden.
-
In
jüngerer
Zeit wurde eine extrahierte und hoch-raffinierte flüssige Form
von Polyglucosamin für
den Verkauf verfügbar,
z. B. FTF Liquid Chitosan (vertrieben von verschiedenen Internet-Verkäufern, darunter
Discover Nutrition unter http://www.discovernutrition.com (Februar
1999), auch unter dem Namen Madeira Liquid PolyGlucosamine beschrieben,
das von Madeira, Inc. unter http://madeira.com (Februar 1999))vertrieben
wird. Diese flüssige
Form enthält
gereinigtes flüssiges
Polyglucosamin (das ist löslichgemachtes
Polyglucosamin), bei dem viele der üblichen Chitosanbestandteile
entfernt sind und das in genauen Mengen (z. B. einer exakten Anzahl
von Tropfen) in eine andere Flüssigkeit
eingemessen werden muß,
um eine gänzlich
flüssige
Chitosan-Dosierlösung
zu bilden. Das Produkt selbst ist eine klare Lösung. Die Mischbarkeit des
flüssigen
Chitosans in einer anderen Flüssigkeit
bedeutet, daß es
keine deutliche Formänderung
der Chitosan enthaltenden Lösung
gibt verglichen mit der Lösung,
die kein Chitosan enthält.
Dies verursacht Unsicherheit beim Verbraucher, ob das im Verbrauch
befindliche Getränk
tatsächlich
eine Chitosan enthaltende Lösung
ist, und es ist denkbar, daß dies
zu einer Überdosierung
führen
könnte
(z. B. wenn das Chitosan mehr als 1 × der Lösung zugesetzt wird). Außerdem versagt
das Fehlen einer Formänderung
der Lösung
dem Verbraucher jegliches klare Gefühl einer Befriedigung, daß eine Chitosan
enthaltende Gewichtsbehandlungslösung
getrunken wird. Natürlich
ist oft bei einer Gewichtsbehandlungsdiät die Wahrnehmung, daß etwas
getan wird und als Folge dieses Tuns eine Wirkung beobachtet wird,
der Schlüssel
dafür,
ein günstiges
Ergebnis zu erzielen.
-
Nach ähnlichen
Leitlinien vermarktet Collaborative Laboratories einen Polyelektrolyten
aus Ascorbinsäure
und Polyglucosamin (d. h. Ascorbyl Glucoseamine®, vermarktet
unter http://www.collabo.com (Februar 1999)). Dieser Polyelektrolyt
ist nicht als wirksam zur Verhinderung der Fettabsorption beschrieben
(obgleich eine erhebliche Anzahl seiner Eigenschaften beschrieben
ist). Falls jedoch der Polyelektrolyt benutzt werden kann (z. B.
bei einer Gewichtsbehandlungsdiät),
leidet er an den gleichen Problemen wie sie für löslich gemachtes Chitosan beschrieben
sind. Das Polyglucosamin ist nämlich
eine Flüssigkeit,
die wasserlöslich
ist.
-
Demgemäß schafft
die vorliegende Erfindung neue Chitosan enthaltende flüssige Zusammensetzungen
sowie Verfahren zu ihrer Herstellung und Verwendung. Die Chitosan
enthaltenden Zusammensetzungen der Erfindung sind schmackhaft und
können
eingesetzt werden u. a. bei einem Gewichtsbehandlungsprogramm. Insbesondere
schafft die Erfindung erwünschtermassen
eine Chitosan enthaltende flüssige
Suspensionszusammensetzung, die beständig ist und als ein Zusatzstoff
z. B. in Wasser oder Flüssigkeiten
auf Wasserbasis einsetzbar ist. Diese und andere Ziele und Vorteile
der vorliegenden Erfindung sowie weitere Erfindungsmerkmale werden
aus der hier gegebenen Erfindungsbeschreibung deutlich.
-
KURZER ABRISS DER ERFINDUNG
-
Die
vorliegende Erfindung schafft u. a. neue flüssige Chitosan enthaltende
Zusammensetzungen, ihre Herstellungsverfahren und ihre Verwendungsverfahren.
Insbesondere schafft die Erfindung eine Chitosan enthaltende flüssige Suspensionszusammensetzung,
die beständig
bleibt und als ein Zusatzstoff z. B. in Wasser oder Flüssigkeiten
auf Wasserbasis einsetzbar ist.
-
DETAILLIERTE BESCHREIBUNG
DER BEVORZUGTEN AUSFÜHRUNGSFORMEN
-
Die
vorliegende Erfindung bezieht sich auf neue flüssige Chitosan enthaltende
Zusammensetzungen, ihre Herstellungsverfahren und ihre Verwendungsverfahren.
Insbesondere schafft die Erfindung beständige, Chitosan enthaltende,
flüssige
Suspensionszusammensetzungen. Die Erfindung schafft ferner ein Verfahren zur
Herstellung der beständigen
Chitosan enthaltenden flüssigen
Suspensionszusammensetzungen. Die Erfindung schafft ferner Verfahren
zur Verwendung der beständigen,
Chitosan enthaltenden, flüssigen
Suspensionszusammensetzungen, z. B. in einem Gewichtsbehandlungsprogramm.
-
Die
vorliegende Erfindung betrifft demgemäß Produkte (insbesondere sogenannte "Gewichtsbehandlungsprodukte", die unten definiert
sind), die hier durch verschiedene Namen beschrieben werden, z.
B. "Chitosan enthaltende
Zusammensetzungen der Erfindung", "flüssige, Chitosan
enthaltende Zusammensetzungen", "Chitosansuspensionen", "flüssige Chitosansuspensionszusammensetzungen" usw., und die insbesondere
durch die Eigennamen "Kytabsorbe® " und "X-Fat®" bezeichnet sind.
Eine besonders bevorzugte Formulierung der Erfindung ist die in
Beispiel 5 Beschriebene, die vermittels der eingesetzten Säure, des
verwendeten Geschmacksstoffs usw. weiter modifiziert werden kann.
Somit macht die Erfindung Chitosan in einer verflüssigten
Form verfügbar,
die erwünschtermassen
eine verbesserte Schmackhaftigkeit, Wirksamkeit und Bequemlichkeit
der Verwendung zeigt (z. B. im Vergleich zu Tablettenformulierungen
und flüssigen
Formulierungen). Es gibt bestimmte Verbesserungen, die durch die
erfindungsgemäßen Produkte
erreicht werden und ihnen Vorzüge
gegenüber
anderen verfügbaren
Chitosanprodukten verleihen. Z. B. sind die flüssigen Chitosan enthaltenden
Zusammensetzungen der Erfindung bevorzugt, weil (1) die Produkte
die Fettabsorption einschränken,
was in optimaler Weise in einer Gewichtsbehandlung resultiert, (2)
die Produkte leicht zu verwenden sind (z. B. wird einfach etwa eine
halbe Unze des flüssigen
Produkts in ein Getränk
gegossen (oder "wie es
ist" verzehrt) und
vor, während
oder nach der Mahlzeit getrunken, und der Fettabsorptionsprozess
beginnt), (3) die Produkte hauptsächlich von natürlichen
Bestandteilen abgeleitet sind und wahlweise keine Anregungsmittel
enthalten (z. B. Koffein oder andere Mittel, die in bestimmten anderen
Gewichtsabnahme fördernden Formulierungen
enthalten sind), (4) die Produkte ausreichend schmackhaft sind,
um den Patienten zum Verzehr zu ermuntern, und (5) die Produkte
in optimaler Weise eine Langzeitbeständigkeit (d. h. Haltbarkeit)
zeigen. Ferner sind die Chitosan enthaltenden Zusammensetzungen
der Erfindung dadurch günstig,
daß sie
erwünschtermassen
nicht den widerlichen Fischgeschmack und Meerestiergeruch haben,
der Chitosan eigentümlich
ist.
-
Flüssige, Chitosan enthaltende
Zusammensetzungen
-
Die
neuen flüssigen
Chitosan enthaltenden Zusammensetzungen sind beständige, flüssige Suspensionszusammensetzungen
und erwünschtermassen
bei handelsüblichen
und industriellen Anwendungen sowie Konsumentengebrauch beständig. Insbesondere
schafft die vorliegende Erfindung eine beständige flüssige Suspensionszusammensetzung,
die im wesentlichen aus Chitosan, einer Nichtfettsäure oder
ihrem Salz und Wasser oder wässriger
Lösung
besteht, wobei jeder Bestandteil in der Zusammensetzung in einer
stabilisierenden Menge vorliegt, die ausreicht, die Bildung einer
beständigen
flüssigen
Suspension zu bewirken, und wobei die Zusammensetzung einen pH von
2 bis 4,2 hat.
-
Die
hier benutzte Bezeichnung "beständige flüssige Suspension" bezieht sich – wenn nichts
anderes angegeben ist – auf
eine Chitosan enthaltende, flüssige
Suspension, die nach vorzugsweise wenigstens etwa 12 Monaten, gewünschtenfalls
nach wenigstens etwa 5 Jahren und optimal nach wenigstens etwa 20
Jahren der Aufbewahrung bei optimal etwa 25°C fließfähig bleibt und wenig oder keine
Abscheidung hat. Die Chitosan enthaltenden, flüssigen Suspensionen der Erfindung
sind auch erwünschtermassen
beständig
(d. h. sie bleiben fließfähig und
bilden wenig oder keine Abscheidung), nachdem sie auf einer Temperatur
von etwa 0°C
bis etwa 100°C,
insbesondere auf einer Temperatur von etwa 10°C bis etwa 50°C über einen
Zeitraum gehalten wurden, der sich über vorzugsweise wenigstens
etwa 12 Monate, erwünschtermassen
wenigstens etwa 5 Jahre und optimal wenigstens etwa 20 Jahre erstreckt.
Vorzugsweise ist die beständige
flüssige
Suspension nach der Erfindung unbegrenzt oder fast unbegrenzt beständig. Es
ist ferner nach der Erfindung erwünscht, daß die Chitosan enthaltenden
Zusammensetzungen, die keine Suspensionen sind, eine Beständigkeit
haben, wie sie für
die flüssigen
Suspensionszusammensetzungen beschrieben wurde.
-
Eine "Suspension", wie sie hier beschrieben
ist, ist ein zweiphasiges System, in dem eine Phase (die dispergierte
Phase, auch die diskontinuierliche oder innere Phase genannt) als
Teilchen oder Tröpfchen
in einer zweiten flüssigen
Phase (auch die äußere Phase,
kontinuierliche Phase oder das dispergierende Medium genannt) verteilt
ist, d. h. Feststoff/Flüssigkeit
oder Flüssigkeit/Flüssigkeit
(z. B. Emulsionen).
-
Somit
ist erfindungsgemäß die Suspension
irgendein Chitosan enthaltendes System, in dem kleine feste oder
flüssige
Teilchen mehr oder weniger gleichmäßig in einem flüssigen Medium
dispergiert sind. Die Suspension ist optimalerweise eine Flüssig/Flüssig-Suspension.
Eine besonders bevorzugte Suspension der Erfindung hat eine gleichmässige Dispergierung
der Teilchen in der Flüssigkeit.
Die dispergierten Teilchen sind von solcher Größe, daß sie sich nicht schnell in
dem Behälter
absetzen. Optimalerweise ist die Oberfläche der Teilchen um soviel
größer als
ihr Volumen, daß die
Teilchen nicht dazu neigen, sich unter der Schwerkraft abzusetzen
(d. h. sie tendieren weder dazu, abzusinken noch aufzuschwimmen).
Falls irgendeine geringe (d. h. nicht bedeutende) Sedimentation
in der Suspension der Erfindung eintritt, bildet das Sediment vorzugsweise keinen
harten Kuchen, sondern es kann gewünschtenfalls mit geringer Mühe wieder
dispergiert werden.
-
Eine
Suspension gemäß der Erfindung
ist vorzugsweise eine kolloidale Suspension mit einer Teilchengröße in dem
Bereich von etwa 1–10
Nanometer (10–100
Angström)
bis zu der Größe, bei
der die Teilchen in einem optischen Mikroskop (d. i. Lichtmikroskop)
sichtbar sind (etwa 0,5 bis 5 Mikrometer) (Aldridge, "Einige Bemerkungen
zu kolloidalen Suspensionen",
erhältlich
unter http://www5.onramp.net/-jaldr/colloids.html (März 1999)).
Wegen ihrer kleinen Größe erfahren
kolloidale Dispersionen eine geringe oder keine Sedimentation oder
Aufrahmung – die
Brown'sche Bewegung
hält die
dispersen Teilchen in Suspension (Schott, "Kolloidale Dispersionen", Remington: The
Science and Practice of Pharmacy, 19. Aufl., Mack Publishing Co.:
Easton, Pennsylvania (1995)). Eine Suspension der Erfindung ist
erwünschtermassen
auch eine Grobdispersion, in der die Teilchengröße 0,5 Mikrometer überschreitet
und vorzugsweise in dem Bereich von etwa 0,1 bis etwa 150 Mikrometer,
wahlweise von etwa 50 bis etwa 100 Mikrometer liegt. Demgemäß reicht
die Teilchengröße der erfindungsgemäßen Suspension
wahlweise von etwa 1 Nanometer bis etwa 150 Mikrometer, aber am
meisten erwünscht
ist eine Teilchengröße, die
man von einem Kolloid erwartet.
-
Der
Tyndalleffekt kann dazu dienen, eine kolloidale Suspension von einer
echten Lösung
in den Fällen zu
unterscheiden, bei denen ein Lichtstrahl durch das Material geschickt
werden kann (Aldridge, "Einige Bemerkungen
zu kolloidalen Suspensionen",
erhältlich
unter http: //www5.onramp.net/-jaldr/colloids.html (März 1999)).
Bei einer echten Lösung
geht das Licht relativ ungehindert durch das Material und ist von
der Seite nicht sichtbar. Bei einer kolloidalen Suspension sind
die Kolloidteilchen ausreichend groß, um das Licht erheblich zu
streuen und den Strahl von der Seite sichtbar zu machen. Echte Lösungen unterscheiden
sich dadurch von Kolloiden, daß die
dispergierten Mittel in echten Lösungen
(d. i. das Gelöste)
typischerweise Atome, Ionen oder ziemlich kleine Moleküle sind.
Wie zuvor erwähnt,
kann eine Chitosan enthaltende Zusammensetzung nach der Erfindung
eine Suspension (d. h. einschließlich einer kolloidalen Suspension)
oder eine Lösung
(d. h. eine echte Lösung)
sein. Es ist jedoch erwünscht,
daß eine
Chitosan enthaltende Zusammensetzung der Erfindung einen Tyndalleffekt
zeigt, so daß die
in der Zusammensetzung vorliegenden Teilchen das Licht streuen.
-
Demgemäß schafft
die vorliegende Erfindung eine beständige flüssige Suspensionszusammensetzung
(oder eine Chitosan enthaltende Zusammensetzung, die keine Suspension
ist), die Chitosan, eine Nichtfettsäure oder ihr Salz und Wasser
oder wässrige
Lösung
umfassen, im wesentlichen daraus bestehen oder daraus bestehen kann,
wobei jeder Bestandteil der Zusammensetzung in einer stabilisierenden
Menge vorliegt, die ausreicht, um die Bildung einer beständigen flüssigen Suspension
zu bewirken. Erwünschtermassen ist
das Chitosan in dieser Zusammensetzung in einer Menge von etwa 2,5%
bis etwa 4,0% (Masse/Volumen) der Zusammensetzung anwesend, und
die Nichtfettsäure
oder ihr Salz ist in einer Menge von etwa 2,5% bis etwa 4,0% (Masse/Volumen)
der Zusammensetzung anwesend. Eine solche Suspension, die wie hier
beschrieben hergestellt wurde (und die andere Bestandteile enthalten
kann) ist durch den Eigentümernamen "Kytabsorbe® " bezeichnet. Vorzugsweise
ist diese Zusammensetzung schmackhaft. Optimal hat diese Zusammensetzung
einen pH von etwa 3,6 bis etwa 4,2, vorzugsweise einen pH von etwa
3,8. Diese Zusammensetzung hat erwünschtermassen auch eine Viskosität von etwa
0,12 bis 0,39 Pa·s
(etwa 120 bis etwa 390 Centipoise), insbesondere eine Viskosität von etwa
0,2 bis 0,3 Pa·s
(etwa 200 bis 300 Centipoise) und insbesondere eine Viskosität von etwa
0,24 Pa·s
(etwa 240 Centipoise) (Drehviskosität). Wie in den folgenden Beispielen
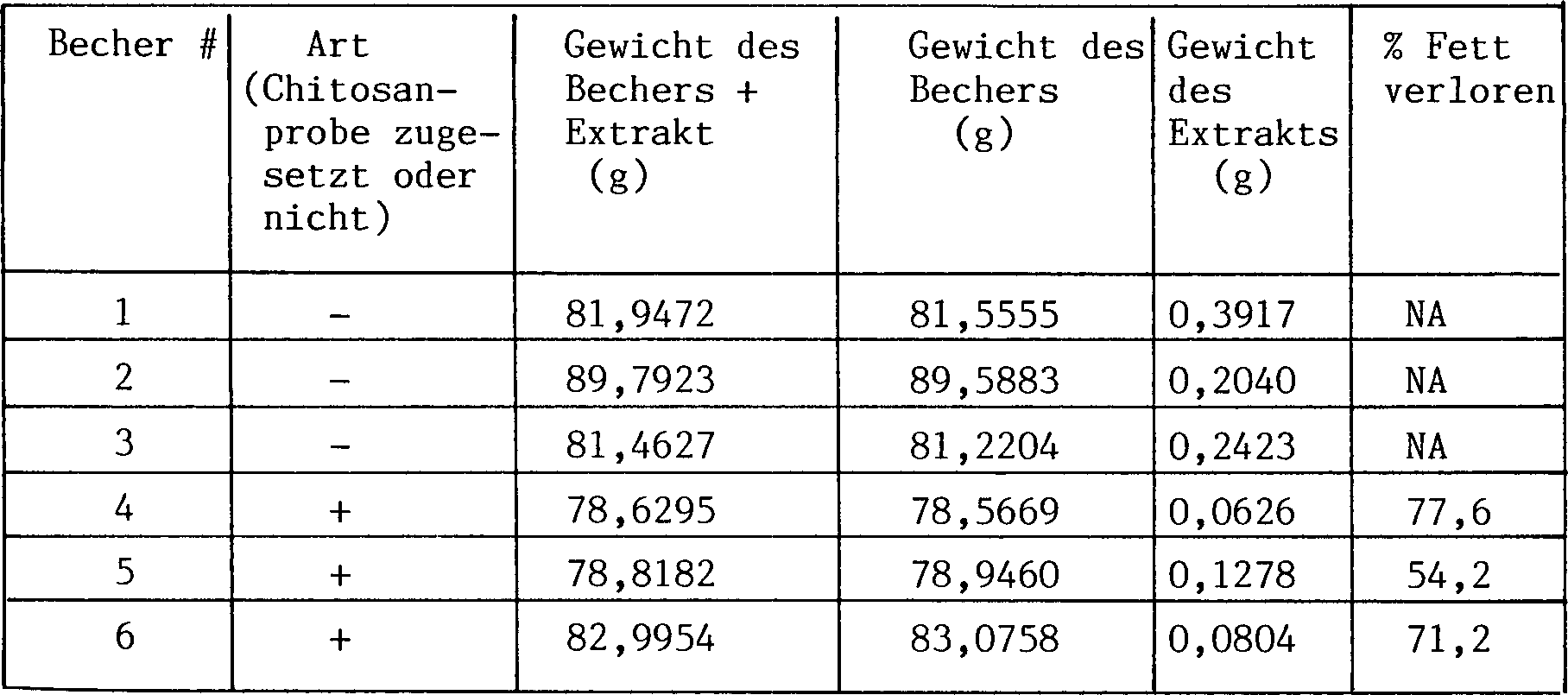
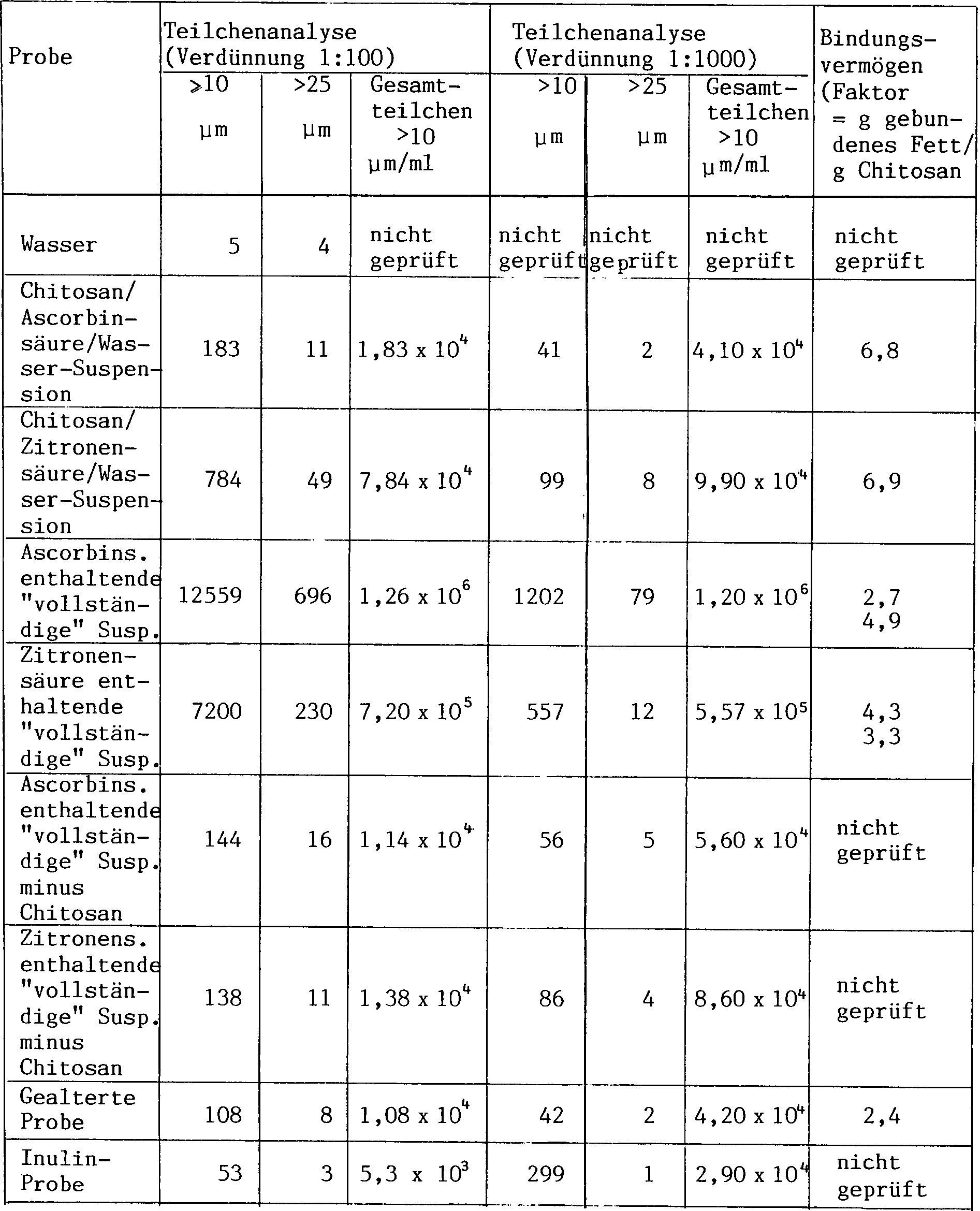
(insbesondere Bei spiel 13) beschrieben ist, bindet eine Zusammensetzung
gemäß der Erfindung
(d. h. eine im wesentlichen aus Chitosan, Wasser oder wässriger
Lösung
und Nichtfettsäure
bestehende Zusammensetzung) vorzugsweise wenigstens etwa 3 Gramm
Fett je Gramm Chitosan, erwünschtermassen
etwa 3 bis etwa 12 Gramm Fett je Gramm Chitosan und wahlweise etwa
6 bis etwa 7 Gramm Fett je Gramm Chitosan. Diese Bereiche sind jedoch
nur beispielhaft für
das Fettbindungsvermögen
von Chitosanformulierungen, das bei Einsatz spezieller Fette und
bei speziellen Bedingungen beobachtet wurde. Es ist wahrscheinlich,
daß noch
höheres
Bindungsvermögen
(d. i. die Fähigkeit
zur Bindung von Fett, freien Fettsäuren, Cholesterin, anderen
Sterinen als Cholesterin und Gallensäuren) bei optimierten Bedingungen
und unter Benutzung besonderer Mittel (z. B. besonderer Fette, freier
Fettsäuren
usw.) erreicht würde.
-
Erfindungsgemäß kann die
Chitosan enthaltende Zusammensetzung vorzugsweise andere wahlfreie Bestandteile
enthalten, z. B. diätetische
Faser. Somit kann die vorliegende Erfindung auch eine beständige, flüssige Suspensionszusammensetzung
schaffen, die umfaßt
(d. h. besteht aus oder besteht im wesentlichen aus): (a) Chitosan,
eine Nichtfettsäure
oder ihr Salz und Wasser oder wässrige
Lösung,
wobei jeder Bestandteil in der Zusammensetzung in einer stabilisierenden
Menge vorliegt, die ausreicht, um die Bildung einer beständigen flüssigen Suspension
zu bewirken, und (b) diätetische
Faser. Wahlweise ist die diätetische
Faser Inulin. Erwünschtermassen
ist das Chitosan in dieser Zusammensetzung in einer Menge von etwa
2,5% bis etwa 4,0% (Masse/Volumen) der Zusammensetzung anwesend,
die Nichtfettsäure
oder ihr Salz ist in einer Menge von etwa 2,5% bis etwa 4,0% (Masse/Volumen)
der Zusammensetzung anwesend, und die diätetische Faser ist in einer
Menge von etwa 2,0% bis etwa 10,0% (Volumen/Volumen) der Zusammensetzung
anwesend. Vorzugsweise ist diese Zusammensetzung geschmacklich akzeptabel.
Diese Zusammensetzung hat optimal einen pH von etwa 3,6 bis etwa
4,2, vorzugsweise einen pH von etwa 3,8. Diese Zusammensetzung hat auch
erwünschtermassen
eine Viskosität
von etwa 0,12 bis 0,39 Pa·s
(etwa 120 bis etwa 390 Centipoise), insbesondere eine Viskosität von etwa
0,2 bis 0,3 Pa·s
(etwa 200 bis 300 Centipoise) und insbesondere eine Viskosität von etwa
0,24 Pa·s
(etwa 240 Centipoise)(Drehviskosität).
-
Außerdem kann
die Zusammensetzung insbesondere noch weitere wahlfreie Bestandteile
aufweisen, um eine beständige
flüssige
Suspensionszusammensetzung zu schaffen, die vorzugsweise im wesentlichen besteht
aus: (a) Chitosan, einer Nichtfettsäure oder ihrem Salz und Wasser
oder wässriger
Lösung,
wobei jeder Bestandteil in der Zusammensetzung in einer stabilisierenden
Menge vorliegt, die ausreicht, um die Bildung einer beständigen flüssigen Suspension
zu bewirken, und (b) diätetischer
Faser, Konservierungsmittel und Geschmacksstoff.
-
Somit
schafft die vorliegende Erfindung in optimaler Weise eine beständige flüssige Suspensionszusammensetzung,
die erwünschtermassen
im wesentlichen besteht aus
- (a) Chitosan, einer
Nichtfettsäure
oder ihrem Salz und Wasser oder wässriger Lösung, wobei jeder Bestandteil
in der Zusammensetzung in einer stabilisierenden Menge vorliegt,
die ausreicht, um die Bildung einer beständigen flüssigen Suspension zu bewirken,
und
- (b) diätetischer
Faser, Konservierungsmittel und Geschmacksstoff, wobei das Chitosan
in einer Menge von etwa 2,5% bis etwa 4,0% (Masse/Volumen) vorliegt,
die
Nichtfettsäure
oder ihr Salz in einer Menge von etwa 2,5% bis etwa 4,0% (Masse/Volumen)
vorliegt,
die diätetische
Faser in einer Menge von etwa 2,0% bis etwa 10,0% (Volumen/Volumen)
vorliegt,
das Konservierungsmittel in einer Menge von etwa
2,5% bis etwa 4,0% (Masse/Volumen) vorliegt und
der Geschmacksstoff
in einer Menge von etwa 2,0% bis etwa 4,0% (Masse/Volumen) der Zusammensetzung
vorliegt.
-
Vorzugsweise
ist diese Zusammensetzung wohlschmeckend. Optimalerweise hat diese
Zusammensetzung einen pH von etwa 3,6 bis etwa 4,2, vorzugsweise
einen pH von etwa 3,8. Auch ist es erwünscht, daß die Zusammensetzung eine
Viskosität
hat von etwa 0,12 bis 0,39 Pa·s
(etwa 120 bis etwa 390 Centipoise), insbesondere eine Viskosität von etwa
0,2 bis 0,3 Pa·s
(etwa 200 bis 300 Centipoise) und insbesondere eine Viskosität von etwa
0,24 Pa·s
(etwa 240 Centipoise) (Rotationsviskosität). Wie in den folgenden Beispielen (insbesondere
Beispiel 13) beschrieben ist, bindet eine erfindungsgemäße Zusammensetzung
(d. h. eine Zusammen setzung bestehend im wesentlichen aus Chitosan,
Wasser oder wässriger
Lösung,
einer Nichtfettsäure
oder ihrem Salz, diätetischer
Faser, Konservierungsmittel und Geschmacksstoff) vorzugsweise wenigstens etwa
2 Gramm Fett je Gramm Chitosan, erwünschtermassen etwa 2 bis etwa
10 Gramm Fett je Gramm Chitosan und wahlweise etwa 2 bis etwa 5
Gramm Fett je Gramm Chitosan. Diese Bereiche sind jedoch nur beispielhaft
für das
Fettbindungsvermögen
der Chitosanformulierungen, die bei Einsatz besonderer Fette und
unter besonderen Bedingungen beobachtet wurde. Es ist wahrscheinlich,
daß noch
höheres
Bindungsvermögen (d.
h. Vermögen
der Bindung von Fett, freien Fettsäuren, Cholesterin, anderen
Sterinen als Cholesterin und Gallensäuren) bei optimierten Bedingungen
und bei Verwendung besonderer Mittel (z. B. besonderer Fette, freier
Fettsäuren
usw.) erreicht werden würde.
-
Wenn
die Zusammensetzung der Erfindung die in Beispiel 5 angegebene besondere
Formulierung hat, ist sie unter dem Markennamen "X-Fat®" bekannt.
-
Andere
Eigenschaften einer Chitosan enthaltenden Zusammensetzung der Erfindung
beinhalten, daß die
Zusammensetzung klar (das bedeutet nicht opak) ist. Das Chitosan
bleibt in Suspension.
-
Wesentliche Bestandteile
der flüssigen,
Chitosan enthaltenden Zusammensetzung
-
Chitosan
kann in den Zusammensetzungen der Erfindung wahlweise aus irgendeiner
möglichen
Quelle erhalten werden, z. B. aus Pilzwandungen und Hautskeletten
von Gliederfüssern
einschließlich,
jedoch nicht beschränkt
auf Insekten, Krabben, Garnelen und Hummern und durch alkalische
N-Deacetylierung von Chitin. Chitosan kann auch vorzugsweise direkt
von kommerziellen Lieferanten bezogen werden, z. B. Chitosan SC 143
und Chitosan SC 243 ist erhältlich
von Natural Biopolymer Inc., Raymond, WA (Produkt-Kode 27130123, Gattungsname "Chitosan"), oder von einem
anderen kommerziellen Verkäufer.
Chitosan kann gewünschtenfalls
in der Form von Chitosan zur Verwendung kommen oder in irgendeiner
anderen geeigneten Form, z. B. Chitin, Chitosansalz (wie etwa Chitosanlactatsalz).
Somit umfaßt
ein "Chitosan" erfindungsgemäß Chitosan
an sich (d. h. das durch N-Deacetylierung von Chitin erhaltene Produkt)
sowie Chitin, aber er wünschtermassen ist
es in der Form von Chitosan an sich. Eine bevorzugte Chitosanquelle
nach der Erfindung ist die aus Garnelen.
-
Vorzugsweise
ist das in der Erfindung benutzte Chitosan zu wenigstens etwa 75%
deacetyliert, insbesondere sogar zu wenigstens etwa 90% und optimal
zu wenigstens etwa 95% deacetyliert. Chitosan von pharmazeutischer
Qualität
ist im allgemeinen zu zwischen etwa 90 und 95% deacetyliert und
kann das 10- bis 12-fache seines Gewichts an Fett absorbieren, während Chitosan
von Ernährungsqualität zu zwischen
etwa 75 und 80% deacetyliert ist und das etwa 6- bis 8-fache seines
Gewichtes an Fett absorbieren kann. Wenn die Viskosität oder Deacetylierung
eines Chitosanpräparats
zunimmt, nimmt typischerweise seine Wirkung auf die Fettverdaulichkeit
zu (Deuchi et al., Biosci. Biotechnol. Biochem., 59(5), 781–5 (1995)).
So wird für
eine größere Fettabsorption
ein erhöhter
Deacetylierungsgrad bevorzugt. Vorzugsweise hat das zur Herstellung
der Zusammensetzungen der Erfindung benutzte Chitosan eine Viskosität von etwa
40 mPas bis etwa 100 mPas, noch erwünschter etwa 50 bis etwa 80
mPas. Typischerweise hat das zur Herstellung der Zusammensetzungen
der Erfindung eingesetzte Chitosan ein mittleres Molekulargewicht
von etwa 30.000 bis etwa 300.000 Dalton und ein bevorzugtes mittleres
Molekulargewicht von etwa 100.000 bis etwa 200.000 Dalton. Die mittlere Teilchengröße des Chitosans
kann erwünschtermassen
z. B. unter Benutzung der Siebanalyse bestimmt werden. Auf diese
Weise passieren die Teilchen typischerweise die Industriesiebmaschen
40–50
(300–425 μm) und werden
von Industriesiebmaschen 60–100
(150–250 μm) zurückgehalten,
wobei sie eine mittlere Größe von etwa
80 Maschen (etwa 180 μm)
haben, d. h. 7/1000 eines Zolls entsprechen. Es besteht jedoch natürlich eine
Teilchengrössenverteilung.
Im allgemeinen wird es jedoch bevorzugt, daß das Chitosan-"Mahlgut" feiner als das ist,
das typischerweise z. B. zur Befüllung
von Kapseln dient.
-
Das
in den Chitosan enthaltenden Zusammensetzungen der Erfindung vorliegende
Chitosan macht optimalerweise etwa 2,5% bis etwa 4,0% (Masse/Volumen)
der flüssigen,
Chitosan enthaltenden Zusammensetzung der Erfindung aus, noch erwünschter
etwa 3,0% bis etwa 3,5% (Masse/Volumen) und insbesondere etwa 3,25%
(Masse/Volumen).
-
Das
Chitosan kann dem Präparat
in der Form von Chitosanflocken (z. B. "grob", "zu Flocken" oder "fein" gemahlen), Chitosanpulver
oder löslich
gemachtem Chitosan zugesetzt werden. Während Chitosanflocken und Chitosanpulver
im Handel erhältlich
sind, kann man löslich
gemachtes Chitosan wunschgemäß aus Chitosanflocken
und Chitosanpulver dadurch erhalten, daß man das Chitosan zunächst mit
einer geeigneten Nichtfettsäure
oder einem geeigneten Nichtfettsäuresalz
als Löslichmachungsmittel
löslich
macht.
-
Geeignete
Nichtfettsäuren
oder -säuresalze
umfassen erfindungsgemäß, sind
aber nicht beschränkt auf
organische Nichtfettsäuren
oder -säuresalze
mit 1 bis 10 Kohlenstoffatomen, vorzugsweise 2 bis 7 Kohlenstoffatomen,
wie Essigsäure,
Adipinsäure,
Zitronensäure,
Ameisensäure,
Milchsäure, Äpfelsäure und
andere geeignete Nichtfettsäuren
oder -säuresalze,
die geeignet sind, Chitosan zu dispergieren, ohne die Eigenschaften
der flüssigen,
Chitosan enthaltenden Zusammensetzung nachteilig zu beeinflussen.
Im allgemeinen liegt solch ein saures Salz oder die Nichtfettsäure in der
Chitosan enthaltenden Zusammensetzung in einer Menge vor, die von
etwa 2,5% bis etwa 4,0% (Masse/Volumen) der flüssigen Chitosan enthaltenden
Zusammensetzung der Erfindung und noch erwünschter von etwa 3,0% bis etwa
3,5% (Masse/Volumen) reicht und insbesondere etwa 3,25% (Masse/Volumen)
beträgt.
Vorzugsweise liegt die Nichtfettsäure oder das Säuresalz
in der flüssigen,
Chitosan enthaltenden Zusammensetzung in einem Massenverhältnis mit
Chitosan von 1 : 10 bis 10 : 1 und optimal in einem Massenverhältnis mit
Chitosan von 1 : 2 bis 5 : 1 vor.
-
Eine
besonders bevorzugte Nichtfettsäure
oder ein -säuresalz
zum Einsatz in den flüssigen
Chitosan enthaltenden Zusammensetzungen der Erfindung ist eine Vitaminsäure, wie
Ascorbinsäure,
Folsäure,
Pantothensäure,
Biotin usw.. Besonders bevorzugt für den Einsatz in der Erfindung
sind Ascorbinsäure,
Ascorbat oder ein Salz der Ascorbinsäure. Ascorbinsäure, (d.
h. Vitamin C) ist zu erhalten von Natural Biopolymer (Hebei, China),
Roche Laboratories (La Jolla, CA) oder von anderen kommerziellen
Verkäufern.
Die in der Formulierung vorliegende Ascorbinsäure macht optimal etwa 2,5%
bis etwa 4,0% (Masse/Volumen) der flüssigen, Chitosan enthaltenden
Zusammensetzung der Erfindung aus, noch erwünschter etwa 3,0% bis etwa
3,5% (Masse/Volumen) und insbesondere etwa 3,25 (Masse/Volumen).
Erwünschtermassen
liegt Ascorbinsäure
in der flüssigen, Chitosan
enthaltenden Zusammensetzung in einem Massenverhältnis mit Chitosan von etwa
1 : 10 bis etwa 10 : 1 und optimal einem Massenverhältnis von
etwa 1 : 1 vor Ascorbinsäure
wird besonders für den
Einsatz in der Erfindung bevorzugt, da Ascorbinsäure oder Ascorbatformulierungen
gezeigt haben, daß sie
die Wirksamkeit von Chitosan steigern (siehe z. B. Kanauchi et al.,
Biosci. Biotechnol Biochem., 59(5), 786–90 (1995); Bugamelli et al.,
Arch. Pharm. (Weinheim), 331(4), 133–8 (1998); Deuchi et al., Biosci.
Biotechnol. Biochem. 59(7), 1211–6 (1995)).
-
Chitosan,
das in geeigneter Weise mit einer Nichtfettsäure und/oder -säuresalz
dispergiert ist, wird vorzugsweise passend durch Mischen mit Wasser
(z. B. belüftetem,
mit Sauerstoff beladenem, destilliertem, entionisiertem Wasser,
Quellwasser oder anderem) oder einer Lösung überwiegend auf Wasserbasis
(d. h. einer "wässrigen
Lösung" oder einer Lösung von
Wasser, die wahlweise andere Bestandteile enthält) auf eine gewünschte Konzentration
formuliert. Das Wasser ist wunschgemäß Quellwasser, insbesondere
Quellwasser, das von einem geeigneten Händler bezogen wurde. Es kann
irgendeine geeignete Wasserquelle benutzt werden, sofern das Wasser
einen gewünschten
Sterilitätsgrad
besitzt, das sind Grade, die für
menschlichen Verzehr sicher sind, insbesondere Grade, die nicht
nachweisbar sind.
-
Die
erfindungsgemäß verwendete
Menge an Wasser oder wässriger
Lösung
hängt von
der gewünschten
Konzentration des Chitosans und anderer Bestandteile ab, liegt aber
typischerweise in dem Bereich des etwa 10- bis 50-fachen, insbesondere des etwa
20- bis 40-fachen und noch mehr erwünscht des etwa 30-fachen der
Chitosanmenge (Gewicht/Gewicht oder Volumen/Volumen), die in der
flüssigen,
Chitosan enthaltenden Zusammensetzung vorliegt. Optimalerweise resultiert
dieses Gemisch erfindungsgemäß zu einer
Zusammensetzung oder einer Flüssigkeit,
in der Chitosanflocken, -pulver oder -flüssigkeit ultrasubmikroskopisch
unter Schaffung einer Suspensionszusammensetzung suspendiert sind,
wie oben definiert ist. Erwünschtermassen
ist eine solche Suspensionszusammensetzung beständig. Das Chitosan bleibt erwünschtermassen
ohne Ausfällung
wenigstens ein Jahr, wahrscheinlich bis zu 5 Jahre und gut möglich bis
zu 30 Jahre optimal bei Temperaturen von unter etwa 30°F bis 210°F (etwa –1,1°C bis 98,9°C) auf Seehöhe in Suspension.
Erfindungsgemäß ist das
Chitosan in Suspension (das ist im Gegensatz zum ausgefällten Zustand),
wenn es eine klare und lichtdurchlässige Flüssigkeit ist.
-
Die
flüssigen,
Chitosan enthaltenden Zusammensetzungen der Erfindung enthalten
erwünschtermassen
auch eine Diätfaserquelle.
Durch die Gattungsbezeichnung "Diätfaser" wird erfindungsgemäß eine andere Faser
als Chitosan oder ein von Chitin abgeleitetes Produkt bezeichnet,
das für
menschlichen Verzehr geeignet ist (d. h. für den menschlichen Körper nicht
gesundheitsschädlich
ist) und durch endogene Darmenzyme nicht verdaut wird. Eine bevorzugte
Diätfaser
nach der Erfindung ist Inulin, das ein bevorzugter Nährstoff
für die
Lactobacilli im Darm ist und das Gleichgewicht zuträglicher
Bakterien in dem Darm verbessert (Wang et al., J. Appl. Bacteriol.,
75(4), 373–380
(1993)) und ferner krebsverhindernde Eigenschaften hat (Spiller,
Dietary Fiber in Health and Nutrition, Boca Raton, FL: CRC Press
(1994); Reddy et al., Carcinogenesis, 18(7), 1371–1374 (1997)).
Die Zugabe von Diätfaser
in den Zusammensetzungen der Erfindung ist auch insofern erwünscht, als
diese Diätfaser
dazu neigt, füllend
zu wirken, und in diesem Sinne eine positive Wirkung auf eine Gewichtskontrolldiät haben
würde.
-
Die
in die Zusammensetzungen der Erfindung eingebrachte Diätfaser wird
optimalerweise in löslicher, d.
h. flüssiger
Form, vorzugsweise in der Form eines flüssigen Extrakts zugesetzt.
In einem solchen Extrakt sind wahlweise auch andere Bestandteile
anwesend, jedoch beträgt
die in dem Extrakt vorliegende Gesamtfasermenge vorzugsweise etwa
40% bis etwa 99%, erwünschtermassen
etwa 60% bis etwa 75% des gesamten Extraktes. Diese Diätfaser (d.
h. ein Diätfaserextrakt
oder eine lösliche
Lösung)
liegt in einer Chitosan enthaltenden Zusammensetzung der Erfindung
gewünschtenfalls
in einer Menge vor, die von etwa 2,0 bis etwa 10,0 Vol.-% der flüssigen,
Chitosan enthaltenden Zusammensetzung der Erfindung, noch erwünschter
von etwa 4,0 bis etwa 8,0 Vol.-% und insbesondere etwa 6,2 Vol.-%
beträgt.
Demgemäß kann bei
Einsatz eines solchen Extraktes oder einer solchen löslichen
Lösung
die gesamte, in der Chitosanzusammensetzung der Erfindung vorliegende
Diätfaser
im Bereich von etwa 0,8 bis etwa 9,9% der flüssigen, Chitosan enthaltenden
Zusammensetzung der Erfindung liegen.
-
GAVEDIET®-SP,
das von Colibree Company, Inc. (Aspen, Colorado) hergestellt wird,
kann in dieser Eigenschaft als Quelle für Fructooligosaccharide (FOS)
oder Inulin aus der Pflanze Blue Agave benutzt werden. GAVEDIET®-SP
von Colibree ist ein lösliches
Diätfaser/Inulin,
das man durch den physikalischen Prozess der Extraktion und Reinigung
des Saftes der Blauen Agavenpflanze erhält. Das Produkt ist ein kristalliner,
geschmacksneutraler, schwach süsser
Sirup. Inulin/FOS ist verwendbar z. B. als Bestandteil in einem
fettarmen und/oder an Cholesterin armen Nahrungsmittel als Fettersatz
(z. B. in Öl-,
Fett- und Butterersatzstoffen und zur Verbesserung des Mundgefühls), als
Kaloriensenker bei der Nahrungsmittelherstellung, als Füll- und
Texturierungsmittel usw.. Inulin oder FOS ist in einer Chitosan
enthaltenden Zusammensetzung der Erfindung in einer Menge anwesend
im Bereich von etwa 2,0 bis etwa 10,0 Vol.-% der flüssigen,
Chitosan enthaltenden Zusammensetzung der Erfindung, noch erwünschter
von etwa 4,0 bis etwa 8,0 Vol.-% und insbesondere etwa 6,2 Vol.-%.
-
Nach
Wunsch können
jedoch andere Quellen für
FOS und/oder Inulin bei der vorliegenden Erfindung zur Anwendung
kommen, insbesondere Oligosaccharide mit einer langen mittleren
Kettenlänge
und verstärkten
Fett-Nachahmereigenschaften.
Beispielsweise kann Zichorie von Orafti (Belgien) oder Suiker Unie
(Breda, Niederlande) erhalten werden, oder Jerusalem-Artichoke kann von
IFP (International Flavours and Fragrances, Cayton, NJ) erhalten
werden. Vorzugsweise kann man auch Neosugar (das ist ein synthetisches
FOS) von Meiji Seika Kaisha (Japan) oder Dahlia von California Natural
Products (Santa Barbara, CA) erhalten. Wahlweise kann man auch medizinisches
Inulin, das aus Jerusalem Artichoke, Zichorie und Dahlia Dahlia
abstammt, von Sigma, Aldrich (St. Louis, MO) erhalten.
-
Der
in dieser Erfindung verwendete Geschmacksstoff kann irgendein Geschmack
sein, z. B. Preiselbeere, Weintraube, Orange, Himbeere, Banane,
Limette, Zitrone, Kirsche, Pampelmuse, Apfel, Birne, Tee, Cola sowie
irgendein anderer Geschmacksstoff, ist aber erwünschtermassen ein wohlschmeckender
Geschmacksstoff, der eine Haltbarkeit hat und bei längerer Aufbewahrung
nicht auskristallisiert oder aus der Zusammensetzung ausfällt. In
einigen Fällen
ist der Geschmacksstoff vorzugsweise ein Fleisch-, Gefügel- oder Fischgeschmacksstoff.
Insbesondere kann ein Preiselbeergeschmack (z. B. "Natural SN038222" von International
Flavours and Fragrances, Dayton, NJ) in einer flüssigen, Chitosan enthaltenden
Zusammensetzung nach der Erfindung zur Anwendung kommen.
-
Die
zugesetzte Geschmacksstoffmenge kann mit dem eingesetzten Geschmacksstoff
variieren. Der Geschmacksstoff macht jedoch wunschgemäß etwa 2,0
bis etwa 4,0 Vol.-%, noch erwünschter
etwa 3,0 bis etwa 3,5 Vol.-% und insbesondere etwa 3,25 Vol.-% der
flüssigen,
Chitosan enthaltenden Zusammensetzung der Erfindung aus.
-
Vorzugsweise
werden den flüssigen
Chitosan enthaltenden Zusammensetzungen nach der Erfindung Konservierungsmittel
zugesetzt. Es kann irgendein geeignetes Konservierungsmittel eingesetzt
werden, solange es nicht andere erwünschte Eigenschaften der Chitosan
enthaltenden Zusammensetzungen unwirksam macht. Bevorzugte Konservierungsmittel
umfassen, sind aber nicht beschränkt
auf Natriumbenzoat und Kaliumsorbat, die von irgendeinem kommerziellen
Lieferanten bezogen werden können.
Es ist erwünscht,
daß diese
Konservierungsmittel von hoher Reinheit sind. Vorzugsweise bezieht
man diese Konservierungsmittel von Spectrum Quality Products, Inc.
(Gardena, CA, Katalog Nummern 51146 bzw. P1408) oder von Sigma-Aldrich (St.
Louis, MO, Katalog Nummern B3420 bzw. S7420). Andere geeignete Konservierungsmittel
sind Alkohol (von etwa 15 bis etwa 20%), Benzoesäure (etwa 0,1%) Methylparaben
(von etwa 0,025% bis etwa 0,2%), Propylparaben (von etwa 0,025%
bis etwa 0,2%) und Sorbinsäure
(etwa 0,1%).
-
Natriumbenzoat
und Kaliumsorbat (oder andere geeignete Konservierungsmittel) sind
in einer flüssigen,
Chitosan enthaltenden Zusammensetzung der Erfindung in Mengen einzusetzen,
die im Bereich von etwa 0,01 bis etwa 1,0 Gew.-% (Masse/Volumen,
wie g/l), erwünschter
etwa 0,05 bis etwa 0,5 Gew.-% (Masse/Volumen) und insbesondere etwa
0,1 Gew.-% (Masse/Volumen) der flüssigen, Chitosan enthaltenden
Zusammensetzung der Erfindung liegen.
-
Wahlweise
können
den flüssigen
chitosanhaltigen Zusammensetzungen der Erfindung auch Süssungsmittel
zugesetzt werden, z. B. Süssungsmittel,
wie natürliche
Zucker (z. B. Glucose, Sucrose, Fructose) und synthetische Zucker
(z. B. Aspartam, usw.). Eine bevorzugte Geschmacksstoffquelle nach
der Erfindung ist GAVESWEET®-SP von dem Hersteller
Colibree Company, Inc. (Aspen, Colorado), das als ein Ausgangsstoff
für Pure
Agave Nectar, einem Agavensirup von hohem Fructosegehalt eingesetzt
werden kann. GAVESWEET®-SP von Colibree ist ein
rein natürlicher
Fructosesirup. Man erhält
ihn durch das physikalische Verfahren der Extraktion und Reinigung
von in der Blauen Agavenpflanze natürlich vorkommendem Inulin mit
nachfolgendem enzymatischem Hydrolyseverfahren. Das Produkt ist
ein kristalliner, geschmacksneutraler sehr süsser Sirup.
-
Andere
Süssungsmittel
können
gewünschtenfalls
jedoch ebenfalls in der vorliegenden Erfindung zur Anwendung kommen,
insbesondere andere natürliche
Fructose-Süssungsmittel
(insbesondere jene, die nicht einen so hohen Raffinatfructosegehalt
haben, der nach Hinweisen einen Kupfermangel verschlimmert und mit durch
hohe Triglyceridgehalte charakterisierter Herzerkrankung in Verbindung
ist) und insbesondere Süssungsmittel
mit einer langen Haltbarkeit und die bei verlängerter Aufbewahrung nicht
aus der Zusammensetzung auskristallisieren oder ausfallen. Andere
bevorzugte natürliche
Süssungsmittel,
die in der Erfindung eingesetzt werden können, umfassen, sind aber nicht
beschränkt
auf: Bienenhonig (Dutch Gold Honey, Lancaster, PA), Organischer
Bienenhonig (verschiedene Lieferanten), Gerstenmalzsirupe (Briess
Industries New York, NY), entionisierter Fruchtsaft (Daystar-Robinson,
Lake Success, New York), Fruitrim-Flüssigkeit
(Adept Solutions), Fruitrim-Pulver (Adept Solutions Capitola, CA),
Braun-Reissirupe (California Natural Products, Santa Barbara, CA),
organischer brauner Reissirup (California Natural Products), Hafersirup
(T & A Gourmet),
Roh- oder Turbinadozucker (C & H
Zucker, La Palma, CA), Sucanat (Wholesome Foods Palm Bay, FL), organisches Sucanat
(Wholesome Foods Palm Bay, FL), organischer Zucker (Wholesome Foods
Palm Bay, FL) und eingedampfter Zuckerrohrsaft (Florida Crystals
Palm Beach, FL), Ki-Sweet (Kiwifrucht-Süssungsmittel, vermarktet über das
Internet).
-
Die
Chitosan enthaltenden Präparate
der Erfindung können
gewünschtenfalls
andere natürliche
und künstliche
Verbindungen enthalten, wie sie für eine besondere Anwendung
geeignet sind, z. B. andere Träger, Stabilisatoren,
Konservierungsmittel, aktive Mittel, Geschmacks- und Geruchsstoffe
usw., sofern diese anderen Verbindungen nicht die erwünschten
Eigenschaften der flüssigen,
chitosanhaltigen Zusammensetzungen unwirksam machen. Für den erfindungsgemäßen Zusatz
sind besonders bevorzugt Vitamine, insbesondere fettlösliche Vitamine,
und insbesondere die Vitamine A, B, D, E und K.
-
Verfahren zur Herstellung
der flüssigen,
Chitosan enthaltenden Zusammensetzungen
-
X-Fat® und
die anderen Produkte der Erfindung in Bezug auf Chitosan enthaltende
Zusammensetzungen werden wahlweise hergestellt nach einem gesetzlich
geschützten
Verfahren, wie hier beschrieben ist, das in optimaler Weise eine
beständige
Zusammensetzung von langer Haltbarkeit liefert, etwa eine Lösung, und insbesondere
vorzugsweise eine beständige
Suspension ergibt.
-
Die
flüssigen,
Chitosan enthaltenden Zusammensetzungen der Erfindung, das sind
die beständigen Chitosan-Suspensionszusammensetzungen
erhält
man gewünschtenfalls
dadurch, daß man
das Chitosan in der Weise präpariert,
daß eine
Suspension erhalten wird. Dies unterscheidet sich von dem einfachen
Zugeben des Chitosans zu einem Gemisch. Die Reihenfolge, in der
die Zugabe erfolgt, und die Einrichtung, durch die die Zugabe durchgeführt wird,
sind wichtig. Das Verfahren wird gewünschtenfalls bei Raumtemperatur
durchgeführt,
obgleich andere Temperaturen wahlweise ebenfalls angewandt werden
können.
-
Nach
der Erfindung wird insbesondere vorzugsweise das Chitosan zuerst
in einer kleinen Menge wässriger
Lösung
(z. B. Wasser) "befeuchtet". Vorzugsweise verwendet
man etwa 0,25 bis etwa 1,0 ml Wasser je Gramm Chitosan. Das Chitosan
wird in einer präzisen
Art und Weise zugesetzt, vorzugsweise durch langsames Einmischen
des Chitosans in einen Wirbel, der durch die hochtourige Rührung der
Flüssigkeit
geschaffen wurde. Wenn nicht durch Zugabe in einen Wirbel, dann
wird die Flüssigkeit
gewünschtenfalls
in einer Weise gerührt,
um zu verhindern, daß das
Chitosan an dem Boden der Flüssigkeit
einen unlöslichen
Klumpen bildet. Für
das Mischen des Chitosans sind die Kräfte in der Flüssigkeit
am meisten erwünscht,
wenn ein Wirbel (im Gegensatz zu anderen Rühreinrichtungen) zur Anwendung
kommt.
-
Im
Anschluß an
die erste Zugabe des Chitosans läßt man den
Wirbel sich legen, jedoch wird mit langsamer Rührung des Gemisches begonnen,
bevor er gänzlich
aufgehört
hat. Diese langsame Rührung
erfolgt vorzugs weise in entgegengesetzter Richtung zu der des Wirbels.
Diese Rührung
erfolgt am besten mit einer Einrichtung (insbesondere einem Kunststoffgerät), das
eine große
Berührungsfläche mit
dem Gemisch hat, z. B. erfolgt eine optimale Mischung mit einer
Kunststoffschaufel in einem handelsüblichen Wannenmischer. Die entgegengesetzte
Rührung
erfolgt in milder Weise bis sich das Chitosan gleichmäßig dispergiert
hat, optimal etwa 10 Minuten bis 2 Stunden, erwünschtermassen etwa 10 Minuten
bis etwa 45 Minuten.
-
Gewünschtenfalls
wird dann Säure
(nämlich
wie hier beschrieben) der Chitosanzusammensetzung zugesetzt. Die
Säure wird
langsam zugegeben, und die Rührung
der Zusammensetzung wird vorzugsweise während dieser Zugabe mäßig beibehalten,
bis die Säure
dispergiert ist. Optimalerweise wird die schwache Rührung des
Gemisches etwa 10 Minuten bis 2 Stunden, gewünschtenfalls etwa 10 Minuten
bis etwa 1 Stunde fortgesetzt. Vorzugsweise erfolgt diese Rührung mit
einem Gerät
(insbesondere einem Kunststoffgerät) mit einer großen Oberfläche, z.
B. einer Schaufel. Das Gemisch ist dick. Bei fortgesetzter mäßiger Rührung nimmt die
dicke Flüssigkeit
eine goldene Farbe an. Das Gemisch hat in dieser Stufe einen pH
von 2 bis 4,2, optimal von etwa 3,9.
-
Die
Chitosan-Säure-Zusammensetzung
ist wahlweise eine erfindungsgemässe,
beständige,
Chitosan enthaltende Suspensionszusammensetzung. Die Chitosan-Säure-Zusammensetzung
kann vorzugsweise "wie
sie ist" eingesetzt
werden. Alternativ kann die Chitosan-Säure-Zusammensetzung mit Zugabe
anderer bevorzugter Bestandteile (z. B. diätetischer Faser, Konservierungsmittel
und/oder Geschmacksstoff wie oben beschrieben) eingesetzt werden,
um noch andere bevorzugte, stabile, Chitosan enthaltende Suspensionszusammensetzungen
nach der Erfindung zu bilden.
-
Somit
schafft die vorliegende Erfindung ein Verfahren zur Herstellung
einer Chitosan enthaltenden Zusammensetzung der Erfindung, bei dem
das Verfahren vorzugsweise umfaßt:
- (a) Erhalten von festem Chitosan,
- (b) Befeuchten des Chitosans mit Wasser oder wässriger
Lösung,
und
- (c) Mischen einer Nichtfettsäure
oder eines Nichtfettsäuresalzes
mit dem Chitosan und dem Wasser oder der wässrigen Lösung, um die Zusammensetzung
zu erhalten.
-
Wenn
die Chitosanzusammensetzung Chitosan, Wasser oder wässrige Lösung, eine
Nichtfettsäure und
Diätfaser
aufweist (z. B. im wesentlichen daraus besteht), schafft die vorliegende
Erfindung ein Verfahren zur Herstellung dieser Zusammensetzung,
bei dem das Verfahren wunschgemäß umfaßt:
- (a) Erhalten von festem Chitosan,
- (b) Befeuchten des Chitosans mit Wasser oder wässriger
Lösung,
und
- (c) Mischen einer Nichtfettsäure
oder eines Nichtfettsäuresalzes
mit dem Chitosan und dem Wasser oder der wässrigen Lösung, um ein Chitosan-Säure-Gemisch
zu erhalten,
- (d) Zusetzen von Wasser oder wässriger Lösung in einem getrennten Behälter,
- (e) Einmischen von Diätfaser
in dem genannten getrennten Behälter,
und
- (f) Mischen des Chitosan-Säure-Gemisches
mit dem Inhalt des getrennten Behälters, um die Zusammensetzung
zu erhalten.
-
Bei
einer bevorzugten Ausführungsform
der Erfindung wird die Chitosan enthaltende Zusammensetzung nach
der hier beschriebenen Methode mit Chitosan, Wasser oder wässriger
Lösung,
Nichtfettsäure,
Diätfaser,
Konservierungsmittel und Geschmacksstoff formuliert, um eine geschützte Chitosan
enthaltende Formulierung (das ist Kytabsorbe®) herzustellen.
Wenn die Formulierung die in Beispiel 5 aufgeführten besonderen Bestandteile
hat, ist diese unter dem Eigennamen X-Fat bekannt. Es wird jedoch
erwartet, daß diese
Formulierung nach der hier gegebenen Lehre leicht modifiziert wird,
um andere beständige
Chitosan enthaltende Suspensionszusammensetzungen herzustellen.
Bei Zugabe gewisser Geschmacksstoffe können in die Formulierungen
Teilchen eingeführt
werden, z. B. durch Fruchtfleisch und dergl.. Diese Teilchen sind
nicht als Sediment der Chitosan enthaltenden Suspensionen anzusehen
(und können
von Sediment unterschieden werden), sondern werden passender für sich als
Geschmacksstoff betrachtet. Diese Geschmacksstoffteilchen beeinträchtigen
wunschgemäß die Langzeitbeständigkeit
der Chitosan enthaltenden Suspensionszusammensetzung nicht.
-
Demgemäß ist es
zur Zugabe anderer Bestandteile zu der Chitosan-Säure-Suspensionszusammensetzung
erwünscht,
daß diese
Bestandteile in einem separaten Behälter mit Wasser (oder wässriger
Lösung) gemischt und
dann der Chitosan-Säure-Suspension
zugesetzt werden. In Fällen,
wo nur Konservierungsmittel zuzusetzen sind, werden diese in einer
getrennten Wanne gut gemischt und vorzugsweise dann bei inniger Mischung
dem Chitosan enthaltenden Säure-Suspensionsgemisch
zugesetzt. Die Menge Wasser oder wässrige Lösung, die in der zweiten Wanne
eingesetzt wird, ist optimalerweise kleiner als oder etwa gleich
der Menge Wasser oder wässriger
Lösung,
die zu Beginn in der Chitosan-Säure-Suspensionszusammensetzung
eingesetzt wurde.
-
Geschmacksstoff
und/oder Diätfaser
werden der Chitosan-Säure-Suspensionszusammensetzung vorzugsweise
in Anwesenheit oder Abwesenheit des Konservierungsmittelzusatzes
zugesetzt, wie oben beschrieben wurde. Wenn Konservierungsmittel
zugegen ist, wird es gewünschtenfalls
zuerst in einer separaten Wanne gemischt, wie zuvor beschrieben
wurde.
-
Wenn
Diätfaser
oder Geschmacksstoff zuzusetzen ist, wird wahlweise bevorzugt Diätfaser oder
Geschmacksstoff der das Konservierungsmittel enthaltenden zweiten
Wanne (bei kräftiger
Mischung) zugesetzt, und der Inhalt der zweiten Wanne wird bei kräftiger Mischung
dem Inhalt der ersten Wanne zugesetzt. Wenn Diätfaser oder Geschmacksstoff
in Abwesenheit von Konservierungsmitteln zugesetzt wird, wird Diätfaser oder Geschmacksstoff
gewünschtenfalls
zuerst mit Wasser (oder wässriger
Lösung)
in einer separaten Wanne gemischt (nämlich mit einer Menge Wasser
oder wässriger
Lösung,
die kleiner als oder gleich der der ersten Wanne zugesetzten Menge
ist), und nach inniger Mischung wird der Inhalt der zweiten Wanne
sanft und gründlich mit
dem Inhalt der ersten Wanne gemischt. Wenn Diätfaser und Geschmacksstoff
zugesetzt werden (d. h. in Anwesenheit oder Abwesenheit von Konservierungsmittel),
wird optimalerweise der Geschmacksstoff dem Gemisch in der zweiten
Wanne zuletzt zugesetzt. Der Geschmacksstoff wird gewünschtenfalls
vor seiner Zugabe filtriert, um irgendwelche anwesenden Teile zu
reduzieren.
-
Wenn
keine Konservierungsmittel eingesetzt werden, können Diätfaser und/oder Geschmacksstoff
alternativ einfach der Wanne zugesetzt werden, die die Chitosan-Säure-Suspension
enthält.
Wenn Konservierungsmittel verwendet werden, können diese (sobald gelöst) gewünschtenfalls
ebenso aus der zweiten Wanne der die Chitosan-Säure-Suspension enthaltenden
Wanne zugegeben werden, und dann kann Diätfaser und/oder Geschmacksstoff
der gleichen Wanne zugesetzt werden.
-
Die
vorliegende Erfindung schafft somit ferner ein Verfahren zur Herstellung
einer erfindungsgemäßen Zusammensetzung
(d. h. einer Zusammensetzung, die Chitosan, Wasser oder wässrige Lösung, Nichtfettsäure, Diätfaser,
Geschmacksstoff und Konservierungsmittel enthält), bei dem man erwünschterweise
- (a) sich festes Chitosan verschafft,
- (b) das Chitosan mit Wasser oder wässriger Lösung anfeuchtet,
- (c) eine Nichtfettsäure
oder ein Nichtfettsäuresalz
mit dem Chitosan und dem Wasser oder der wässrigen Lösung mischt, um ein Chitosan-Säure-Gemisch zu erhalten,
- (d) in einem separaten Behälter
Wasser oder wässrige
Lösung
zugibt,
- (e) in dem separaten Behälter
Konservierungsmittel zumischt,
- (f) in dem separaten Behälter
diätetische
Faser zumischt,
- (g) in dem separaten Behälter
Geschmacksstoff zumischt und
- (h) den Inhalt des separaten Behälters mit dem Chitosan-Säure-Gemisch
mischt, um die Zusammensetzung zu erhalten.
-
Es
gibt ein alternatives Verfahren, bei dem man vorzugsweise
- (a) sich festes Chitosan verschafft,
- (b) das Chitosan mit Wasser oder wässriger Lösung anfeuchtet,
- (c) Nichtfettsäure
oder Nichtfettsäuresalz
mit dem Chitosan und dem Wasser oder der wässrigen Lösung mischt, um ein Chitosan-Säure-Gemisch
zu erhalten,
- (d) in einem separaten Behälter
Wasser oder wässrige
Lösung
zugibt,
- (e) in dem separaten Behälter
Konservierungsmittel zumischt,
- (f) den Inhalt des separaten Behälters mit dem Chitosan-Säure-Gemisch
mischt, um ein Chitosan-Säure-Konservierungsmittel-Gemisch
zu erhalten,
- (g) diätetische
Faser mit dem Chitosan-Säure-Konservierungsmittel-Gemisch mischt und
- (h) Geschmacksstoff mit dem Chitosan-Säure-Konservierungsmittel-Gemisch mischt, um
die Zusammensetzung zu erhalten.
-
Der
pH der durch die vorhergehenden Verfahren erhaltenen unveränderten
Produkte ist 2 bis 4,2, vorzugsweise etwa 3,9. Das in dieser Stufe
erhaltene Gemisch wird wahlweise durch einen Trichter in separate Verpackungen
gepumpt oder in anderer Weise verpackt.
-
Bei
diesem Verfahren der Erfindung wird der Geschmacksstoff vorzugsweise
der Suspensionszusammensetzung zugesetzt, nachdem die Konservierungsmittel
(z. B. Natriumbenzoat, Kaliumsorbat) zugesetzt und gelöst wurden.
Wenn der Geschmacksstoff vor den Konservierungsmitteln und der Diätfaser zugesetzt wird,
ist es möglich,
daß sich
die Konservierungsmittel nicht gänzlich
auflösen.
-
Charakterisierung der
flüssigen,
Chitosan enthaltenden Zusammensetzungen
-
Die
flüssigen,
Chitosan enthaltenden Zusammensetzungen der Erfindung können durch
ihre Bestandteile charakterisiert und bestätigt werden, z. B. Gesamtfett/gesättigtes
Fett oder Fähigkeit,
Gesamtfett/gesättigtes
Fett (z. B. durch Extraktion) zu binden, gesättigtes Fett Cholesterin oder
die Fähigkeit,
Cholesterin (z. B. durch Gaschromatographie) zu binden, Gesamtkohlenhydrat
(z. B. durch Berechnung), Diätfaser,
lösliche
Faser, Zucker (z. B. FOS, D-Fructose, D-Glucose), Protein (z. B.
durch Lowry-Prüfung),
Vitamin C (z. B. durch Titration), Natrium (z. B. durch Auftragsvergabe
an eine Firma, die den Natriumgehalt misst), Chitosan (z. B. durch
Stickstoffbestimmung nach Kjeldahl) und Inulin.
-
Die
Chitosan enthaltende Zusammensetzung kann ferner untersucht werden
auf Gesamtfeststoffe (z. B. H2O), pH, Leitfähigkeit,
Geschmack, Farbe, Dispergierbarkeit in Wasser, aerobe Gesamtplattenzahl,
Hefe- und Schimmelpilzzahl, Bacillus-cereus-Zahl, Coliform-Gesamtzahl
in 1 Gramm, Staphylococcus-aureus-Zahl in 1 Gramm und Salmonella-Zahl
in 25 Gramm sowie auf andere Faktoren.
-
Auch
kann das Lipidbindungsvermögen
der flüssigen,
Chitosan enthaltenden Zusammensetzungen geprüft werden, wobei man eine Lipid-Polysaccharid-Standardlösung benutzt
und durch Titration ein Produkt der Erfindung (z. B. "X-Fat"-Produkt) zusetzt.
Der Verlust an Lipid-Polysaccharid kann instrumentell gemessen werden,
z. B. unter Benutzung eines kinetischen chromogenen Lipidanalysators.
-
Andere
Kennzeichnungsmittel sind in den folgenden Beispielen aufgeführt und
den Fachleuten bekannt.
-
Verwendung der Chitosan
enthaltenden flüssigen
Zusammmensetzungen der Erfindung bei einer Lebensweise zur Gewichtsbehandlung
-
Die
Produkte der Erfindung enthalten alle Chitosan, das bei der Gewichtsreduktion
und/oder Gewichtssteuerung verwendet werden kann auf der Basis,
daß die
Produkte verhindern, daß Fett
in dem Magen und Verdauungstrakt abgebaut wird, bevor es in das
Kreislaufsystem gelangt. Mit anderen Worten verbindet sich Chitosan
mit Fett, macht es unverdaulich und verhindert seinen Eintritt in
den Blutstrom. Das Fett wird auf dem natürlichen Wege von dem Körper ausgeschieden.
Diese Fettausscheidung ergibt im Gegensatz zur Fettabsorption eine "fettfreie" oder "fettreduzierte" Diät, wenn
die Produkte der Erfindung wie hier beschrieben eingesetzt werden.
Eine fettfreie Diät
und eine fettreduzierte Diät
können
(1) die Gewichtszunahme wesentlich reduzieren (wenn nicht gänzlich stoppen),
(2) wesentlich zum Gewichtsverlust beitragen und/oder (3) das Halten
des Gewichts wesentlich erleichtern.
-
Vorzugsweise
werden somit die Chitosan enthaltenden Zusammensetzungen (insbesondere
die beständige
Suspension) der Erfindung bei einer Gewichtsbehandlungsdiät verwendet.
Eine "Gewichtsbehandlungsdiät" in der hier benutzten
Bedeutung meint ein Programm für
die Begünstigung
des Gewichtsverlustes, die Begünstigung
des Haltens des Gewichts und/oder die Verhinderung einer Gewichtszunahme.
Ebenso umfaßt
eine "Gewichtsbehandlungszusammensetzung" eine Chitosan enthaltende
Zusammensetzung nach der Erfindung, die zur Anwendung kommt für die Gewichtsabnahme
(das ist zur Hilfe, mit der Zeit das Gewicht der Person zu verringern),
für das
Halten des Gewichts (das ist zur Hilfe, das Gewicht einer Person
mit der Zeit zu halten) und/oder zur Verhinderung der Gewichtszunahme
(um zu verhindern, daß der
sporadische Verzehr einer Mahlzeit mit hohem Fett- und hohem Kaloriengehalt
zu einer Gewichtszunahme führt).
Eine Gewichtsbehandlungszusammensetzung enthält eine "wirksame Bindungsmenge Chitosan", das ist eine Chitosanmenge, wie
sie hier beschrieben ist, die wirksam ist, Fett, freie Fettsäuren, Cholesterin,
andere Sterine als Cholesterin und/oder Gallensäuren zu binden, und die in
einer Gewichtsbehandlung resultiert, wenn sie in einem Gewichtsbehandlungsprogramm
nach der Erfindung zur Anwendung kommt. Ein "Programm" bedeutet eine Handlungsweise (das ist
der Verzehr einer Gewichtsbehandlungszusammensetzung gemäß der Erfindung), die über eine
Zeitdauer wiederholt wird, z. B. gewünschtenfalls mindestens für einen
Zeitraum von etwa einer Woche bis vorzugsweise höchstens etwa der Lebensdauer
einer Person. Die Wiederholung innerhalb eines Programms variiert
optimalerweise je nach dem, ob die Gewichtsbehandlungszusammensetzung
zur Förderung
der Gewichtsabnahme, Förderung
der Aufrechterhaltung des Gewichts und/oder Verhinderung der Gewichtszunahme
dient.
-
Bei
Anwendung zur Förderung
der Gewichtsabnahme zum Beispiel wird die Gewichtsbehandlungszusammensetzung
vorzugsweise auf wenigstens täglicher
Basis (wie unten näher
beschrieben) für
eine Zeitdauer verzehrt, die optimal von etwa einer Woche bis vorzugsweise
höchstens
etwa ein Jahr reicht. Wenn sie zur Förderung des Haltens des Gewichts
dient, wird die Gewichtsbehandlungszusammensetzung vorzugsweise höchstens
zweimal täglich
(wie unten näher
beschrieben) über
einen Zeitraum verzehrt, der optimalerweise von etwa einer Woche
bis vorzugsweise höchstens
etwa einem Jahr reicht. Zur Verhinderung der Gewichtszunahme wird
die Gewichtsbehandlungszusammensetzung vorzugsweise "nach Bedarf" (wie unten näher beschrieben) über einen
Zeitraum verzehrt, der optimalerweise von etwa einer Woche bis etwa
höchstens
der Lebenszeit einer Person reicht.
-
Die
Chitosan enthaltenden Zusammensetzungen der Erfindung (oder ihre
Variationen) können
bei irgendeinem aufnehmbaren Getränk zum Einsatz kommen, z. B.
Wasser, Eistee, Fruchtgetränke,
Sodawässer, Colas,
Diätgetränke und
Arzneitränke, "Gesundheitsgetränke", Magen-Darm-Reinigungssysteme
und dergl.. Beim Einsatz in dieser Weise können die Chitosan enthaltenden
Zusammensetzungen (z. B. als Teil eines anderen Getränks anwesend)
in der Konsistenz weiter verändert
werden, z. B. durch Gefrieren zur Bildung eines "Eis am Stiel" oder von Schlammeis, durch Mischen
in einem Mischer mit Eisstückchen
zur Bildung eines gleichmäßigen kalten
Getränks
mit einer Konsistenz wie ein Milchmischgetränk und dergl.. Ebenso können Chitosanhaltige
Zusammensetzungen der Erfindung (oder ihre Variationen) "wie sie sind" zur Anwendung kommen,
z. B. einfach durch Trinken der Zusammensetzungen oder nach Zusatz
als Komponente zu einer anderen flüssigen oder halbflüssigen Formulierung
nicht zum Trinken, sondern z. B. zum Aufbringen auf die Oberfläche eines
anderen Nahrungsmittels, wie etwa einer Tunke, eines Toppings, einer
Soße,
einer Garnierung o. a., wo das andere Nahrungsmittel ein fettfreies
Nahrungsmittel ist, z. B. Frucht, Samen, Nuß und/oder Gemüse, das
als Teil einer Mahlzeit mit einem Fett und/oder Cholesterin enthaltenden
Nahrungsmittel zu essen ist. Z. B. können die Chitosan enthaltenden
Zu sammensetzungen mit anderen fettfreien Geschmacksbestandteilen
(z. B. Essig, Vinaigrette) gemischt und für den Verzehr auf die Oberfläche fester
Nahrungsmittel gegossen oder gesprüht werden. Alternativ können die
Frucht, Saat, Nuß und/oder
Gemüse,
die Chitosan enthaltenden Zusammensetzungen und die andere flüssige oder
halbflüssige
Formulierung zusammengemischt werden, z. B. um eine Suppe, Paprikasoße, Salsa,
Topping oder ein ähnliches
anderes Produkt herzustellen. Bei sorgfältiger Wahl anderer Bestandteile
und bei Auswahl eines fettfreien Fleisches, Fisches oder Geflügels kann
es möglich
sein, die Chitosan enthaltenden Zusammensetzungen als Bratensaft,
Topping, Soße
usw. für Fleisch,
Fisch und/oder Geflügel
anzuwenden, das als Teil einer Mahlzeit mit einem Fett und/oder
Cholesterin enthaltenden Nahrungsmittel gegessen werden soll.
-
Ferner
können
die bevorzugten Zusammensetzungen als fettfreie halbfeste Formulierung,
z. B. fettfreier Pudding, Jell-O, Gelatine oder Tofu, vorformuliert
oder erst vor dem Verzehr zugesetzt werden. Die Steifheit dieser
Formulierungen kann sich jedoch bei Zugabe der erfindungsgemäßen Produkte ändern.
-
Chitosan
hat sich im Verkauf in Tablettenform schon bewährt und wird zur Gewichtsabnahme/Gewichtskontrolle
in verschiedenen Geschäften
vertrieben. Daher ist schon eine große Datenquelle verfügbar, die seine
Sicherheit und Wirksamkeit für
diesen Zweck nahelegt. Die Nebenwirkungen des Chitosans, die berichtet
wurden, scheinen geringfügig
zu sein (z. B. Blähungen,
Verringerung der Vitaminaufnahme, usw.). Ebenso wurden zum menschlichen
Verzehr Essigsäure,
Milchsäure
und Ascorbinsäure
sicher zur Anwendung gebracht. Personen mit Schellfischallergien
jedoch, schwangere oder stillende Frauen, Personen unter 18 Jahren und
Personen mit Einnahme fettlöslicher
Medikamente oder deren Aufnahme durch den Verzehr Chitosan enthaltender
Produkte der Erfindung anderweitig beeinträchtigt würde, sollten X-Fat® oder
ein anderes Chitosan enthaltendes Produkt der Erfindung nicht nehmen.
Personen, die die vorliegenden Chitosanprodukte der Erfindung länger nehmen,
sollten vorzugsweise Vitaminzusätze
mit hohem Gehalt an fettlöslichen
Vitaminen (insbesondere Vitaminen A, B, D, E und K) täglich zum
Frühstück oder
zu einer anderen geeigneten Zeit nehmen. Optimalerweise wird die
Fettaufnahme überwacht,
um sicherzustellen, daß täglich die
angemessenen empfohlenen Gramm Fett verzehrt werden (die von dem
Körper
tatsächlich
umgewandelt werden). Die medizinische Überwachung wird für jeden
empfohlen, der mit einer Gewichtsabnahme- oder Gewichtsaufrechterhaltungsdiät befaßt ist.
Die Anwendung der Chitosan enthaltenden Produkte der Erfindung wird
somit im allgemeinen bei den Personen bevorzugt, die nicht einen
zuvor bestehenden Gesundheitszustand haben, der den Einsatz der
Chitosan enthaltenden Zusammensetzungen der Erfindung beeinflussen
würde.
-
Während X-Fat® (und
andere flüssige
chitosanhaltige Zusammensetzungen der Erfindung) die Eigenschaft
hat, die Fettabsorption zu modifizieren, wird die Kalorienaufnahme
sonst nicht gesteuert. Während
somit die flüssigen
Chitosan enthaltenden Zusammensetzungen der Erfindung (einschließlich X-Fat®)
bei alleiniger Verwendung die Gewichtsabnahme, die Verhinderung
der Gewichtszunahme und/oder das Halten des Gewichts erleichtern,
erhält
man schnellere und/oder erwünschtere
Ergebnisse optimal, wenn die Chitosan enthaltenden Zusammensetzungen
der Erfindung in Verbindung mit einer Kalorien-gesteuerten Diät, vorzugsweise
unter Belastung angewendet werden.
-
Das
Produkt sollte ferner vor, während
oder nach einer Mahlzeit eingenommen werden, d. h. insbesondere
einer Mahlzeit, die einen Bestandteil enthält, der aus Fett, freien Fettsäuren, Cholesterin,
anderen Sterinen als Cholesterin und Gallensäuren bestehenden Gruppe ausgewählt ist.
Nach der Erfindung kann eine "Mahlzeit" irgendein von einer
Person verzehrtes Nahrungsmittel sein einschließlich, jedoch nicht beschränkt auf
die Verzehrgänge,
die als "Frühstück", "Mittag", "Abendessen" und "Imbiss" bekannt sind. Unter "vor" ist eine Zeitspanne
zu verstehen, die von etwa 10 Sekunden bis gewünschtenfalls nicht mehr als
etwa 30 Minuten vor dem Verzehr der Mahlzeit reicht. Unter "gleichzeitig mit" ist etwa oder angenähert etwa
die gleiche Zeit wie der Verzehr der Mahlzeit zu verstehen. Unter "nach" ist eine Zeitspanne
zu verstehen, die von etwa 10 Sekunden bis gewünschtenfalls nicht mehr als
etwa 30 Minuten nach Verzehr der Mahlzeit reicht. Nach der Erfindung wird
das Produkt optimalerweise nicht vor, während oder nach einer Mahlzeit
eingenommen, die eine fettfreie oder fettreduzierte Mahlzeit ist,
wenn die Mahlzeit nicht wesentliche Mengen Cholesterin und/oder
Gallensäuren
enthält.
Unter "wesentlichen
Mengen" ist eine
Menge Cholesterin und/oder Gallensäure zu verstehen, die typischerweise
in einer medi zinisch empfohlenen Diät für eine Person, die den Verzehr
von Cholesterin und/oder Gallensäuren
unter Kontrolle halten muß,
nicht akzeptabel wäre.
-
Es
ist ferner nach der Erfindung erwünscht, daß die Leute die Anwendung des
Produkts für
mindestens eine Zeitdauer von zwei Wochen im Anschluß an einen
Gewichtsverlust von zehn Prozent des Ausgangsgewichts unterbrechen,
wenn dieser Gewichtsverlust innerhalb eines Monats eintreten sollte.
Ferner wird es bevorzugt, daß eine
Person mit einem routinemäßigen Verzehr
der flüssigen,
Chitosan enthaltenden Zusammensetzung der Erfindung auch jeden Tag
etwa 8 Glas Wasser einnimmt.
-
Die
hier beschriebene bevorzugte Dosierung (siehe z. B. Beispiel 5)
ist die einer Aufnahme der flüssigen,
Chitosan enthaltenden Zusammensetzungen (jede etwa 0,5 g Chitosan
enthaltend), die gewünschtenfalls nicht
mehr als zweimal an einem Tag zu nehmen sind.
-
Demgemäß schafft
die vorliegende Erfindung ein Verfahren zur Anwendung einer Chitosan-Zusammensetzung
nach der Erfindung bei einem Programm der Gewichtsbehandlung eines
Patienten, bei dem der Verzehr der Zusammensetzung durch den Patienten
erwünschtermassen
vor, gleichzeitig mit oder nach einer Mahlzeit erfolgt. Optimalerweise
enthält
die Mahlzeit einen Bestandteil aus der Gruppe, die aus Fett, freien Fettsäuren, Cholesterin,
anderen Sterinen als Cholesterin und Gallensäuren besteht. Die vorliegende
Erfindung schafft ferner ein verbessertes Verfahren der Gewichtsbehandlung,
wobei die Verbesserung erwünschtermassen
die Aufnahme der Zusammensetzung der Erfindung durch den Patienten
vor, während
oder nach einer Mahlzeit umfaßt.
-
Andere erläuternde
Verwendungen der flüssigen,
Chitosan enthaltenden Zusammensetzungen
-
Wie
hier weiter beschrieben wird, können
die flüssigen,
Chitosan enthaltenden Zusammensetzungen der Erfindung aufgrund der
einzigartigen Eigenschaften des Chitosans bei sehr verschiedenen
Anwendungsfällen
außer
der Gewichtsabnahme/Gewichtsaufrechterhaltung eingesetzt werden.
Dieses Beispiel beschreibt nur ein paar Wege, durch die die Präparate der
Erfindung oder Variationen dieser Zusammensetzungen angewendet werden
können.
Natürlich
sind andere Mittel verfügbar
und für
die offenkundig, die mit den Eigenschaften von Chitosan vertraut
sind.
-
Neben
einem positiven Effekt auf Gewichtsabnahme, Verhinderung der Gewichtszunahme
und Gewichtskontrolle sind andere positive Effekte evident, die
von Personen beobachtet wurden, die regelmäßig Chitosan enthaltende Produkte
genommen haben, z. B. Steuerung des Blutdrucks, verbesserte Cholesteringehalte
(d. h. unterstützte
HDL-Cholesterinwerte, verringerte LDL-Cholesterinwerte), Förderung
der Wundheilung, antibakterielle Wirkungen, Anticandida-Wirkungen,
antivirale Effekte, Antacid-Aktivität, Hemmung
der Bildung von Plaque/Reduktion des Zahnzerfalls, schnellere Knochenwiederherstellung,
verbesserte Calciumabsorption und verringerte Harnsäuregehalte
(Hennen, Chitosan, Pleasant Grove, UT: Woodland Publishing, Inc. (1996)).
Während
die Chitosan enthaltenden Zusammensetzungen der Erfindung in zweiter
Linie eine bestimmte Krankheit heilen oder verhindern können, sollen
sie nach der hier gegebenen Beschreibung primär zur Gewichtsabnahme, Verhinderung
der Gewichtszunahme und/oder zum Halten des Gewichts beitragen. Die
Chitosan enthaltenden Zusammensetzungen tun dies dadurch, daß sie bei
der Steuerung der Fettabsorption helfen und dadurch den Gewichtsverlust
und die Verhinderung oder Reduktion der Gewichtszunahme unterstützen. Die
Zusammensetzungen der Erfindung können jedoch auch wie weiter
unten beschrieben verwendet werden.
-
Die
Chitosan enthaltenden Zusammensetzungen können bei einem Programm zur
Cholesterinbehandlung eines Patienten als Cholesterinbehandlungszusammensetzungen
in einer Weise eingesetzt werden, die der Verwendung der Zusammensetzung
bei einem Gewichtsbehandlungsprogramm analog ist, bei dem der Patient
die Zusammensetzung vor, während
oder nach einer Mahlzeit einnimmt. Wie hier benutzt bedeutet "Cholesterinbehandlungsprogramm" ein Programm zur
Förderung
der Cholesterinabsenkung, zur Förderung der
Cholesterineinhaltung und/oder der Verhinderung der Cholesterinzunahme.
Eine Cholesterinbehandlungszusammensetzung stellt eine "wirksame Bindungsmenge
Chitosan" dar, d.
h. eine Chitosanmenge wie hier beschrieben, die zur Bindung von
Cholesterin, anderen Sterinen als Cholesterin und/oder Gallensäuren wirksam ist
und eine Cholesterinbehandlung zur Folge hat, wenn sie in einem
Cholesterinbehandlungspro gramm der Erfindung appliziert wird. Ein "Programm" ist wie zuvor definiert
und wird gewünschtenfalls
wie für
das Gewichtsbehandlungsprogramm beschrieben durchgeführt. Das
Cholesterinbehandlungsprogramm kann insbesondere zur Anwendung kommen,
wenn eine Person eine Mahlzeit verzehrt, die einen Bestandteil enthält, der aus
der aus Cholesterin, anderen Sterinen als Cholesterin und Gallensäuren bestehenden
Gruppe ausgewählt ist.
-
Die
Chitosan enthaltenden Zusammensetzungen der Erfindung (oder ihre
Variationen) können
gewünschtenfalls
als orales Mundwasser angewandt werden, z. B. in der Form eines
feinen Sprühnebels
oder der traditionelleren "Swish-and-spit"-Formulierung. Die
Verwendung der Zusammensetzungen in dieser Art kann die Verhinderung
der Plaque-Bildung und der Halitosis dadurch unterstützen, daß die Entfernung
gewisser Verbindungen erleichtert wird, bevor sie zu Plaque und
schlechtem Mundgeruch beitragen. Die Zusammensetzungen können auch
die Heilung von Mundverletzungen, z. B. Krebswunden und Gesichtsherpes
dadurch unterstützen,
daß Verbindungen
von und aus diesen Wunden entfernt werden.
-
Die
Reinigungseigenschaften des Chitosans erlauben ferner, daß Chitosan
enthaltende Zusammensetzungen der Erfindung (oder ihre Variationen)
vorzugsweise für
Badbehandlungen von Wunden und/oder Verbrennungen und/oder anderen
Verletzungsarten (vorzugsweise einer äußeren Verletzung) angewandt
werden können,
ferner als Zusatzstoffe für örtliche
Behandlungen hierfür,
solange das Chitosan nicht andere günstige/therapeutische Verbindungen
in der Formulierung unwirksam macht.
-
Auf
derselben Linie können
wahlweise Chitosan enthaltende Zusammensetzungen der Erfindung (oder
ihre Variationen) für
zahlreiche tierärztliche
Anwendungen zum Einsatz kommen, wo ihre Reinigungseigenschaften
sich als therapeutisch erweisen würden, z. B. als tierärztliches
Haustier-Entwurmungsmittel
oder bei der Reinigung irgendeiner Art von Ungezieferbefall, Wunde,
Verbrennung oder Verletzung. Der in der Zusammensetzung benutzte
Geschmacksstoff ist gewünschtenfalls
einer, der für
das Tier schmackhaft ist, z. B. Fleisch- oder Fischgeschmack.
-
Die
Chitosan enthaltenden Zusammensetzungen der Erfindung (oder ihre
Variationen) können
vorzugsweise auch bei verschiedenen persönlichen Reinigungsvorgängen eingesetzt
werden, z. B. Formulierungen zur Entfernung von Kosmetika oder zur
Hautreinigung, Haarwaschmittel oder Haarklärmittel oder sogenannte Haar-,
Haut- oder Nagel-"Leave-In"-Produkte, um Ansammlung
von Rückständen auf
dem Haarbalg, der Haut oder den Nägeln zu verhindern, die zur Öligkeit
oder Fettigkeit beitragen können.
Bei der Anwendung dieser Eigenschaft kann es erwünscht sein (ist aber wahlfrei),
den Geschmacksbestandteil z. B. durch einen Duftstoff zu ersetzen,
wie er bekannt und im Handel erhältlich
ist.
-
Die
Chitosan enthaltenden Zusammensetzungen der Erfindung (oder ihre
Variationen) können
ebenso erwünschtermassen
bei verschiedenen allgemeinen Reinigungsprodukten zur Anwendung
kommen, z. B. Reinigungsmitteln, Seifen oder Waschmitteln für Wäsche, Teppiche,
Geschirrseife, Geschirrspüler,
Autowäschen, Polsterwaren,
Leder/Vinyl und dergl. sowie in jedem allgemeinen Haushaltsreinigungsmittel,
z. B. Glasreiniger, Fußbodenreiniger
und/oder Wachs, allgemeinem Reinigungsmittel, Küchen- und Badezimmerreiniger
und vielen anderen. Bei dieser Verwendung kann es erwünscht sein,
daß die
Chitosan enthaltenden Zusammensetzungen der Erfindung kein Süssungsmittel
und/oder Geschmacksmittel enthalten.
-
Insbesondere
umfassen die Chitosan enthaltenden Zusammensetzungen gemäß der Erfindung
vorzugsweise insbesondere ferner einen Arzneitrank, ein Getränk, einen
Sprühnebel
zur Mundreinigung, Badbehandlungsmittel für Wunden und/oder Verbrennungen,
flüssige
kosmetische Reiniger, tiermedizinische Lösungen u. a..
-
BEISPIELE
-
Die
folgenden Beispiele erläutern
die vorliegende Erfindung weiter, sollten aber natürlich in
keiner Weise als ihren Umfang begrenzend ausgelegt werden.
-
Beispiel 1
-
Dieses
Beispiel beschreibt die Herstellung einer flüssigen, Chitosan enthaltenden
Zusammensetzung, die z. B. als ein Lipidbinder benutzt werden kann.
Optimalerweise wird diese Zusammensetzung als ein Systementgifter
benutzt (das ist eine Zusammensetzung, die Fett und andere unerwünschte aufgenommene
Bestandteile bindet). Tabelle
1: Chitosan enthaltende Zusammensetzung
| Menge | Bestandteil |
| 5,0
Gramm | Chitosan-Flocken
oder -pulver oder -salz |
| 2,5
Gramm | Zitronensäure und/oder
anderes Säuresalt
oder Pulver |
| 5,0
Unzen (147,9 ml) | Flüssigkeit
(z. B. Wasser oder wässrige
Lösung) |
| 50
Gran (3,24 g) | Aspartam |
| 25
ml | Minzextrakt |
| 25
ml | Zitronenextrakt |
| 25
ml | Orangenextrakt |
| 50
ml | Farbstoff
und Konservierungsmittel |
-
In
Tabelle 1 können
die Mengen und Arten der Geschmacksstoffextrakte (z. B. Minze, Zitrone,
Orange) und das Süssungsmittel
variiert oder weggelassen werden je nach dem gewünschten Geschmack und Geruch der
resultierenden Zusammensetzung. Desgl. ist die Menge und Einbringung
von Farbstoff und Konservierungsmittel wahlfrei.
-
Die
Zusammensetzung erhält
man, indem man die Chitosan-Flocken, -pulver oder -salz in Mischung mit
dem Säurepulver
oder -salz in einen Meßbecher
bringt, 5 Unzen (147,9 ml) Flüssigkeit
zusetzt, kurz 10 bis 20 Sekunden rührt, das Gemisch bis zu etwa
10 Minuten oder bis sich das gesamte Chitosan gelöst hat,
absitzen läßt. Bei
diesem Verfahren dispergieren sich das Chitosan und die Zitronensäure als
ultramikroskopische Teilchen, die in der Zusammensetzung suspendiert
sind. An dieser Stufe können
andere Bestandteile zugesetzt werden, die Geschmack, Aussehen, Geruch
oder andere Eigenschaften des Chitosan enthaltenden Gemisches beeinflussen.
Wie in Tabelle 1 angeführt,
kann z. B. ein Süssungsmittel,
wie Aspartam zusammen mit verschiedenen Geschmacksstoffextrakten
der Chitosan enthaltenden Zusammensetzung zugesetzt oder mit dieser
vorgemischt werden. Dann wird das Gemisch geschüttelt oder gerührt, bis
es gleichmäßig suspendiert
ist. Eine Gefrierkühlung
der Chitosan enthaltenden Zusammensetzung ist wahlfrei, und die
Zusammensetzung kann zur zukünftigen
Verwendung aufbewahrt werden.
-
Die
Chitosan enthaltende Zusammensetzung kann so benutzt werden, daß man eine
Unze (29,6 ml) des Gemisches der Tabelle 1 zusammen mit anderen
für den
menschlichen (oder säugetierischen)
Verzehr vorgesehenen Flüssigkeiten
oder Zusammensetzungen in Behälter
der Größe von ein Liter
oder Quart (946,4 ml) gießt
und gut mischt. Vorzugsweise enthalten die Flüssigkeiten oder Zusammensetzungen
keine fettige Gallensäure
oder -verbindung. Die Zusammensetzung der Tabelle 1 liefert so fünf Applikationen
von je einer Unze (29,6 ml), die gebrauchsfertig sind.
-
Beispiel 2
-
Dieses
Beispiel beschreibt die Herstellung einer flüssigen, Chitosan enthaltenden
Zusammensetzung, die z. B. als ein Lipidbinder und/oder Systementgifter
eingesetzt werden kann. Die Zusammensetzung zeigt optimalerweise
günstige
Wirkungen auf die Virilität
oder die Virilitätsreizwahrnehmung
einer Person im Anschluß an
den Verzehr der Zusammensetzung. Tabelle
2: Chitosan enthaltende Zusammensetzung
| Menge | Bestandteil |
| 5,0
Gramm | Chitosan-Flocken
oder -pulver |
| 2,5
Gramm | Milchsäure und/oder
anderes aufnehmbares Salz/Pulver |
| 5,0
Unzen (147,9 ml) | Flüssigkeit
(z. B. Wasser oder wässrige
Lösung) |
| 2,0
Gramm | Salz
von Rhodiola Rosea |
| 25
ml | Vanille-Extrakt |
| 25
ml | Minze-Extrakt |
| 25ml | Zitronen-Extrakt |
| 25
ml | Orangen-Extrakt |
| wahlweise | Farbstoff
und Konservierungsmittel |
-
In
Tabelle 2 können
die Mengen und Arten der Geschmacksstoffextrakte (z. B. Minze, Zitrone,
Orange) variiert oder weggelassen werden je nach dem gewünschten
Geschmack und Geruch der resultierenden Zusammensetzung. Desgl.
ist die Menge und Einbringung von Farbstoffen und Konservierungsmittel
wahlfrei.
-
Die
Zusammensetzung erhält
man, indem man die Chitosan-Flocken, -pulver oder -salz in Mischung mit
dem Säurepulver
oder -salz in einen Meßbecher
bringt, 5 Unzen (147,9 ml) Flüssigkeit
zusetzt, kurz 10 bis 20 Sekunden rührt, das Gemisch bis zu etwa
10 Minuten oder bis sich das gesamte Chitosan gelöst hat,
absitzen läßt. Bei
diesem Verfahren dispergieren sich das Chitosan und die Zitronensäure als
ultramikroskopische Teilchen, die in der Zusammensetzung suspendiert
sind. An dieser Stufe können
andere Bestandteile zugesetzt werden, die Geschmack, Aussehen, Geruch
oder andere Eigenschaften des Chitosan enthaltenden Gemisches beeinflussen.
Wie in Tabelle 2 angeführt,
kann Rhodiola-Rosea-Salz
zusammen mit verschiedenen Geschmacksstoffextrakten der Chitosan
enthaltenden Zusammensetzung zugesetzt werden oder mit dieser vorgemischt
werden. Dann wird das Gemisch geschüttelt oder gerührt, bis
es gleichmässig
suspendiert ist. Eine Gefrierkühlung
der Chitosan enthaltenden Zusammensetzung wird bevorzugt (ist aber
nicht erforderlich), und die Zusammensetzung kann zur zukünftigen
Verwendung aufbewahrt werden.
-
Die
Chitosan enthaltende Zusammensetzung kann so verwendet werden, daß man eine
Unze (29,6 ml) des Gemisches der Tabelle 2 zusammen mit anderen
für den
menschlichen (oder säugetierischen)
Verzehr vorgesehenen Flüssigkeiten
oder Zusammensetzungen in Behälter
von Liter- oder Quartgröße (946,4
ml) gießt
und gut mischt. Vorzugsweise enthalten die Flüssigkeiten oder Zusammensetzungen
keine fettige Gallensäure
oder -verbindung. Die Zusammensetzung der Tabelle 2 liefert so fünf Applikationen
von je einer Unze (29,6 ml), die gebrauchsfertig sind.
-
Die
Getränkemischungen
dieses und des vorhergehenden Beispiels können wahlweise modifiziert werden,
um weitere Mittel zu enthalten, darunter ohne Beschränkung andere
natürliche
oder künstliche
Nichtfettverbindungen, -elemente oder -säuren, wie Dehydroepiandrosteron
(DHEA) oder oligomeres Proanthocyanidin (OPC), usw..
-
Beispiel 3
-
Dieses
Beispiel beschreibt die Herstellung einer flüssigen, Chitosan enthaltenden
Zusammensetzung, die bei Verbrennungen/Wunden zur örtlichen
Anwendung kommen kann. Tabelle
3: Chitosan enthaltende Zusammensetzung
| Menge | Bestandteil |
| 30
Gramm | Chitosan |
| 45
Gramm | Milchsäuresalz
(oder anderes Säuresalz,
wie Essigsäuresalz) |
| 5 Unzen
(147,9 ml) | Destilliertes
oder filtriertes Wasser |
| 50
ml | Löslicher
milder Gelextrakt |
| wahlweise | Farbstoff
und Konservierungsmittel |
-
In
Tabelle 3 können
die Mengen und die Arten des Farbstoffs und des Konservierungsmittels
variiert oder weggelassen werden.
-
Man
erhält
die Zusammensetzung dadurch, daß man
die Chitosan-Flocken im Gemisch mit dem Säuresalz in einen Meßbecher
gibt, 5 Unzen (147,9 ml) Flüssigkeit
zusetzt, kurz 30 Sekunden rührt,
das Gemisch absitzen läßt, bis
sich das gesamte Chitosan gelöst
hat. Bei dieser Methode werden das Chitosan und das Säuresalz
als in der Zusammensetzung suspendierte, ultramikroskopische Teilchen
dispergiert.
-
In
dieser Stufe können
andere Bestandteile zugesetzt werden, die das Aussehen oder andere
Eigenschaften des Chitosan enthaltenden Gemisches beeinflussen.
Wie in Tabelle 3 ausgeführt,
kann z. B. ein mildes lösliches
Gel der Chitosan enthaltenden Zusammensetzung zugesetzt oder mit
dieser vorgemischt werden (nämlich
um die Anwendung zu erleichtern).
-
Wahlweise
können
auch andere therapeutische Mittel in dem Gel anwesend sein. Das
Gemisch wird dann gerührt,
bis es gleichmäßig gemischt
ist.
-
Die
Chitosan enthaltende Zusammensetzung kann zur zukünftigen
Verwendung aufbewahrt werden.
-
Beispiel 4
-
Dieses
Beispiel beschreibt die Herstellung einer flüssigen, Chitosan enthaltenden
Zusammensetzung, die z. B. bei der Gewichtsabnahme sowie bei anderen
Anwendungen, z. B. bei tierärztlichen
Anwendungen, wie etwa der Tierentwurmung, eingesetzt werden kann. Tabelle
4: Chitosan enthaltende Zusammensetzung
| Menge | Bestandteil |
| 20
Gramm | Chitosan |
| 12
Gramm | Ameisensäuresalz/Zitronensäurepulver/salz |
| 5 Unzen
(147,9 ml) | Destilliertes
oder filtriertes Wasser |
| 50
ml | Fleischextrakt
oder -geschmacksstoff (kein Fett enthaltend) |
| 50
ml | Hühnchenextrakt
oder -geschmacksstoff (kein Fett enthaltend) |
| 50
ml | Farbstoff |
| wahlweise | Konservierungsmittel |
-
In
Tabelle 4 können
die Menge und Art des Farbstoffs und Konservierungsmittels
variiert oder weggelassen werden. Ebenso können die Menge und Art der
Extrakte und Geschmacksstoffe variiert werden.
-
Die
Zusammensetzung erhält
man dadurch, daß man
das Chitosan im Gemisch mit dem Säurepulver/-salz in einen Meßbecher
bringt, fünf
Unzen (147,9 ml) Flüssigkeit
zusetzt, kurz 30 Sekunden rührt,
das Gemisch absitzen läßt, bis
sich alles Chitosan gelöst
hat. Bei dieser Methode werden das Chitosan und das Säuresalz
als in der Zusammensetzung suspendierte ultramikroskopische Teilchen
dispergiert.
-
In
dieser Stufe können
andere Bestandteile zugesetzt werden, die Geschmack, Geruch oder
andere Eigenschaften des Chitosan enthaltenden Gemisches beeinflussen.
Wie in Tabelle 4 aufgeführt,
können
beispielsweise Extrakte oder Geschmackmittel der Chitosan enthaltenden
Zusammensetzung zugesetzt oder mit dieser vorgemischt werden (nämlich um
die Schmackhaftigkeit zu erhöhen).
Dann wird das Gemisch gerührt, bis
es gleichmäßig gemischt
ist. Die Chitosan enthaltende Zusammensetzung kann zur zukünftigen
Verwendung aufbewahrt werden.
-
Beispiel 5
-
Herstellung einer flüssigen,
Chitosan enthaltenden Zusammensetzung
-
Etwa
30 Unzen (etwa 887,2 ml) einer Chitosan enthaltenden Suspensionszusammensetzung
("X-Fat") kann unter Benutzung
der folgenden Formulierung hergestellt und z. B. in Päckchen von
60 × 0,5
Unzen (14,8 ml) oder andere Päckchen
zweckmäßiger Größe verpackt
werden:
-
Tabelle
5: Formulierung der Chitosanzusammensetzung (etwa 30 Flüssigkeitsunzen)
-
Dies
kann z. B. wie folgt auf eine handelsübliche Faßgröße von etwa 80 Litern vergrößert werden:
-
Tabelle
6: Formulierung der Chitosanzusammensetzung (etwa 80 Liter)
-
Die
gesamte Vermischung der Bestandteile zu einer Chitosan enthaltenden
Zusammensetzung erfolgt bei Raumtemperatur. Man erhält die Formulierung
durch langsames Einmischen des Chitosans in einen Wirbel, der durch
die hochtourige Rührung
von in einem Faß ("Faß A") vorliegenden Quellwasser
(z. B. 16 Unzen (473,2 ml) für
eine Formulierung von 30 Unzen (887,2 ml) geschaffen wurde. Das
Gemisch wird mit einem Kunststoff-Schaufelrührer schwach entgegengesetzt
gerührt,
bis sich das Chitosan gleichmässig
dispergiert hat. Dies erfordert im allgemeinen weniger als eine
Stunde. Dann wird Ascorbinsäure
langsam zugesetzt und schwach gerührt, bis sie dispergiert ist.
Dies bildet ein viskoses Material, das am besten mit einer Schaufel gerührt wird.
Die dicke Flüssigkeit
nimmt bei fortdauernder schwacher Rührung eine goldene Farbe an
(d. h. im allgemeinen in weniger als einer Stunde). Typischerweise
hat das Gemisch in dieser Stufe einen sauren pH (z. B. zwischen
etwa 2 und etwa 4, typischerweise etwa 3,9).
-
Quellwasser
(z. B. 11 Unzen (325,3 ml) für
eine Formulierung von 30 Unzen (887,2 ml) wird in ein getrenntes
Faß ("Faß B") gegeben. Die Konservierungsmittel
werden dem Faß B
zugesetzt und es wird gut gerührt.
Dann wird der Inhalt des Fasses B dem Faß A zugesetzt, und die Flüssigkeit
wird bei schwacher Rührung gemischt.
Dann wird das Inulin zugesetzt, und die Reaktionsmasse wird schwach
und völlig
gemischt. Der Preiselbeer geschmacksstoff wird durch ein Filter zugesetzt
(oder erst filtriert und dann zugesetzt) und völlig eingemischt. Der pH des
nach diesem Verfahren erhaltenen unveränderten Produkts ist sauer
(z. B. zwischen etwa 2 und etwa 4, typischerweise etwa 3,9). Das
Gemisch kann in dieser Stufe wahlweise durch einen Trichter in separate
Päckchen
gepumpt werden.
-
Es
ist für
diesen Prozess wichtig, daß der
Preiselbeergeschmacksstoff zugesetzt wird, nachdem die Konservierungsmittel
(Natriumbenzoat, Kaliumsorbat) in Lösung gegangen sind. Wenn der
Preiselbeergeschmacksstoff vor den Konservierungsmitteln und dem
Inulin zugesetzt wird, gehen die später zugesetzten Konservierungsmittel
nicht in Lösung.
Dieses Verfahren kann in gleicher Weise mit anderen Säuren als
Ascorbinsäure
und mit anderer Diätfaser
oder unter Weglassung der Diätfaser
durchgeführt
werden. Desgleichen kann der Geschmacksstoff variiert werden.
-
Beispiel 6
-
Feststellung von Bestandteilen
der Chitosan enthaltenden Proben
-
Diese
Studien wurden durchgeführt,
um verschiedene Eigenschaften von nach Beispiel 5 hergestellten
Chitosansuspensionsproben zu erfassen.
-
Für diese
Untersuchungen wurden alle Analysen von Gibraltar Laboratories,
Inc., Fairfield NJ durchgeführt,
einem biologischen Forschungs- und
Ausführungsprüfdienstleistungsunternehmen,
das die Prüfung biologischer
Proben nach bewährter
Forschungspraxis durchführt.
Die Ergebnisse dieser Prüfungen
für drei erfindungsgemäß synthetisch
hergestellte separate Chitosan-Trinkproben sind unten in Tabelle
7 aufgeführt.
-
Tabelle
7: Zusammenfassung chemischer Analysen von drei Chitosan enthaltenden
Proben
-
Das
Protein konnte durch Standard-Stickstoffanalysen nach Kjeldahl wegen
Störung
durch Chitosan nicht bestimmt werden. Stattdessen wurde die Proteinbestimmungsmethode
nach Bradford benutzt. Bei Benutzung des Lowry-Tests, der nach zwei Methoden probiert
wurde, traten in ähnlicher
Weise Störungen
auf. Ähnliche
Ergebnisse wie in Tabelle 7 dargestellt erhielt man bei anderen
Probenanalysen.
-
Beispiel 7
-
Festellung der mikrobiellen
Konzentration in Chitosanzusammensetzungen
-
Diese
Studien wurden durchgeführt,
um die aerobe Plattenzahl von zwei nach Beispiel 5 hergestellten separaten
Chitosanflüssigkeitsproben
sowie die Anwesenheit/Abwesenheit spezifischer USP-Indikatororganismen
zu bestimmen.
-
Für diese
Studien wurde der USP-Mikrobengrenztest durchgeführt, bei dem 10 ml der Probe
zu 90 ml der GBL-STAT-Nährlösung (Trypticase
Soy Broth mit 4% Tween 20, 0,5% Lecithin und 1% Lactose) zugesetzt wurden.
Das Gefäß wurde
geschüttelt,
um eine Suspension 1 : 10 (Anreicherung) zu ergeben. Geeignete aliquote
Teile wurden mit GBL-STAT-Agar (Trypticase Soy Agar mit 4% Tween
20 und 0,5% Lecithin) auf Keinzahlen (30 bis 35°C/48 bis 72 Stunden) plattiert.
Die obige 10 ml Anreicherung wurde dann bei 30 bis 35°C 48 bis
72 Stunden bebrütet
und zu selektiven und differentiellen Medien (30 bis 35°C/24 bis
48 Stunden) subkultiviert, wie in USP angegeben ist.
-
Die
Ergebnisse dieser Tests bestätigen,
daß die
Chitosansuspensionsproben jeweils eine Keimzahl von weniger als
etwa 10 cfu/ml und eine Schimmelpilz/Hefezahl von weniger als etwa
10 cfu/ml beherbergten. Escherichia coli und Salmonella sp. wurden
in den 10 ml Anreicherung nicht bestimmt. Bei der Prüfung wurden Pseudomonas
aeruginosa und Staphylococcus aereus ebenfalls nicht bestimmt. Ähnliche
Ergebnisse erhielt man aus anderen Probenanalysen.
-
Ähnliche
Ergebnisse erhielt man bei Untersuchungen, die gemäß einer
Methodologie USP 23 durchgeführt
wurden. Die Medien für
diese Methode sind wie folgt: U.S. Patent modifizierte Lactose-Nährlösung (MLB)
A32; U.S. Patent modifizierte Trypticase-Soja-Nährlösung (MTSB) Al; GBL-STAT-Nährlösung A2.TSB A5;
Selenit-Cystein-Nährlösung (SCB)
A57*; Tetrathionat-Nährlösung (TB)
A74; GBL-STAT-Agar A32; Sabouraud-Dextrose-Agar (SDA) L67; Mannitsalz-Agar (MSA)
K140; MacConkey-Agar (MAC) A9; Cetrimid-Agar (CET) K68; Xylose-Lysin-Sesoxyeholat-Agar
(XLD) A29; und BGA A64.
-
Die
Abkürzungen
der Medien sind: MLB (das ist Lactose-Nährlösung mit 4% Tween 20 und 0,5%
Lecithin); MTSB (das ist Trypticas-Soja-Nährlösung (TSB) mit 4% Tween 20
und 0,5% Lecithin); GBL-STAT-Nährlösung (das
ist TSB mit 4% Tween 20 und 0,5% Lecithin); TSB (das ist Sojabohnen-Casein-Aufschlußnährlösung); SDA
(das ist Sabouraud-Dextrose-Agar) und STAT-Agar (das ist TSA mit
4% Tween 20 und 0,5% Lecithin).
-
Die
Methodologie USP23 wurde wie folgt durchgeführt:
- 1.
Es wurde eine Verdünnung
1 : 10 des Testmaterials in MTSB (25 ml Testmaterial + 225 ml MTSB)
hergestellt. Die Testmaterial-Nährlösung-Verdünnung wurde
aseptisch in vier Portionen von 15 ml in sterilen Prüfröhrchen unterteilt.
- 2. Eine Verdünnung
1 : 10 des Testmaterials in MLB (25 ml Testmaterial + 225 ml MLB)
wurde ebenfalls hergestellt. Die Verdünnung aus Testmaterial und
Nährlösung wurde
aseptisch in zwei Portionen von 15 ml in sterilen Prüfröhrchen unterteilt.
- 3. Die Indikatororganismenkulturen, die 24 +/- 8 Stunden bei
30 bis 35°C
in TSB gezüchtet
worden waren, wurden in steriler physiologischer Salzlösung 1 :
10.000 (104) verdünnt (Candida albicans und Aspergillus niger
wurden 1 : 100 (102) verdünnt). Ein
ml jedes Organismus wurde in die 15 ml-Portionen des Testmaterials
aus den Stufen 1 und 2 separat eingeimpft und gemischt. Die MTSB-Röhrchen (Stufe
1) wurden separat mit Pseudomonas aeruginosa, Staphylococcus aureus,
Candida albicans und A. niger beimpft. Die MLB-Röhrchen (Stufe 2) wurden separat
mit Salmonella choleroaesuis und Escherichia coli beimpft.
- 4. Um zu bestätigen,
daß die
Test-Nährmedien
das Wachstum der oben in Stufe 3 gezüchteten Indikator-Organismen
fördern
können,
wurde ein ml jedes Organismus, der wie in Stufe 3 verdünnt wurde,
separat in 15 ml MTSB und MLB (Kontrollen) eingeimpft. Die MTSB-Kontrollröhrchen wurden
separat mit Pseudomonas aeruginosa, Staphylococcus aureus, Candida
albicans und A. niger beimpft. Die MLB-Kontrollröhrchen wurden separat mit Salmonella
choleroaesuis und Escherichia coli beimpft.
- 5. Die Anzahl der in das Testmaterial und in die Kontrollproben
eingeimpfien Organismen wurde durch zehnfache serielle Verdünnungen
(10–1 bis
10–3)
in GBL-STAT-Nährlösung (TSB
mit 4% Tween 20 und 0,5% Lecithin) bestimmt. Vier Platten wurden
von jeder Verdünnung
mit TSA (Bakterien) und SDA (Pilze) gemacht. Die Platten wurden
48 bis 72 Stunden bei 30 bis 35°C
(Bakterien) oder 5 bis 7 Tage (Pilze) bei 20 bis 25°C inkubiert,
und die koloniebildenden Einheiten wurden auf einem Quebec-Dunkelfeld-Koloniezähler ausgezählt.
- 6. 15 ml-Portionen des beimpften MTSB-Testmaterials aus Stufe
3 (mit Ausnahme von Candida albicans und A. niger) und 15 ml-Portionen
der beimpften MTSB-Kontrollnährlösungen aus
Stufe 4 wurden dann 48 bis 72 Stunden bei 30 bis 35°C (Bakterien)
oder 5 bis 7 Tage bei 20 bis 25°C
(Pilze) inkubiert.
- 7. 15 ml-Portionen des beimpften MLB-Testmaterials aus Stufe
3 und die 15 ml-Portionen der beimpften MLB-Kontrollnährlösungen aus
Stufe 4 wurden dann 24 +/- 8 Stunden bei 30 bis 35°C inkubiert.
Nach Inkubation von 24 +/- 8 Stunden bei 30 bis 35°C wurde ein
ml der Anreicherung (MTSB und MLB, nur Salmonella choleroaesuis)
in 10 ml SCB übertragen,
und 1 ml der Anreicherung wurde in 10 ml TB übertragen. Die MLB, SCB und
TB wurden dann 12 bis 24 Stunden bei 30 bis 35°C inkubiert.
- 8. Die Anreicherungen aus den Stufen 6 und 7 wurden dann auf
Gesamttrübung
beobachtet, und eine Öse voll
der Nährlösung wurde
dann auf ausgewählte
Medien aufgestrichen, um das Wachstum der angegebenen Organismen
zu bestätigen.
-
Beim
Studium nach der Methodik nach USP 23 wurde Hemmung bemerkt. Die
Hemmung wurde bemerkt, wenn kleine Zahlen der oben angegebenen Organismen
absichtlich in das Chitosanpräparat
eingeimpft wurden. Die Inter pretation dieses Ergebnisses war, daß das Präparat selbst
oder die Bestandteile des mikrobiellen USP23-Grenztests für die Anwesenheit
der geringen Anzahl von Organismen toxisch waren. Es ist bekannt,
daß die
USP-Subkulturbestandteile Fluid-Tetrathionat-Nährlösung und Selenit-Cystin-Nährlösung für kleine
Organismenzahlen toxisch sind und infolgedessen war die festgestellte
Hemmung nicht überraschend. Sollten
möglicherweise
irgendwelche Mikroorganismen in irgendeiner erfindungsgemäß hergestellten
Zusammensetzung anwesend sein, ist der Gehalt so niedrig, daß er unwesentlich
ist. Die mit dem mikrobiellen USP-Grenztest erhaltenen Ergebnisse
zeigen die Abwesenheit der obigen Organismen.
-
Im
Schluß bestätigen die
Daten die Abwesenheit von Pathogenen und die geringen Zahlen, falls überhaupt,
wenn Mikroorganismen in den erfindungsgemäß hergestellten Chitosanzusammensetzungen
anwesend sind. Diese Ergebnisse bestätigen, daß die Chitosan enthaltenden
Zusammensetzungen der Erfindung im wesentlichen steril sind.
-
Beispiel 8
-
Feststellung der Wirkung
der Lagerung auf die flüssigen,
Chitosan enthaltenden Zusammensetzungen
-
Dieses
Beispiel gibt die Wirkung der Lagerung auf die nach Beispiel 5 hergestellten,
Chitosan enthaltenden Proben an, d. h. ob die Proben sich eine längere Zeit
halten, ohne mikrobielles Wachstum zu zeigen.
-
Für diese
Untersuchungen wurden Proben benutzt, die (1) ungefroren wenigstens
ein Jahr ("Probe
A") gehalten wurden,
(2) gefroren wenigstens ein Jahr ("Probe B") gehalten wurden oder (3) vor kurzem
hergestellt wurden ("Probe
C"). 25 ml Probe
wurden zu 225 ml GBL-STAT-Nährlösung (Trypticase-Soja-Nährlösung mit 4%
Tween 20, 0,5% Lecithin und 1% Lactose) zugesetzt. Der Behälter wurde
geschüttelt,
um eine Verdünnung 1
: 10 (Anreicherung) zu ergeben. Geeignete aliquote Teile wurden
mit GBL-STAT-Agar (Trypticase-Soja-Agar mit 4% Tween 20 und 0,5%
Lecithin) auf Bakterienzahlen (48 bis 72 Stunden bei 30 bis 35°C) und mit
Sabouraud-Dextrose-Agar (SDA) auf Schimmelpilz/Hefezahlen (7 Tage
bei 20 bis 25°C)
plattiert. Die obige Anreicherung wurde dann 48 bis 72 Stunden bei
30 bis 35°C
inkubiert und zu selektiven und differentiellen Medien (24 bis 48
Stunden bei 30 bis 35°C)
subkultiviert, wie in USP angegeben ist.
-
25
ml der Proben wurden durch ein steriles Membranfilter von 0,2 Mikron
filtriert und dreimal mit 100 ml 0,1%-igem Pepton-Wasser gewaschen.
Das Filter wurde auf m-Endo-Agar ausgestrichen. Die Platten wurden
24 bis 32 Stunden bei 30 bis 35°C
inkubiert und auf typische Coliform-Morphologie (das sind Kolonien
mit einem metallischen Glanz) beobachtet.
-
Tabelle
8: Ergebnisse des mikrobiellen USP-Grenzpräparationstests
-
Diese
Ergebnisse bestätigen,
daß die
Produkte der Erfindung bei langer Lagerung sogar bei fehlender Tiefkühlung beständig sind.
-
Beispiel 9
-
Feststellung der Viskosität und des
pH der flüssigen,
Chitosan enthaltenden Zusammensetzungen
-
Dieses
Beispiel gibt eine Feststellung der Viskosität und des pH der flüssigen Chitosan
enthaltenden Proben der Erfindung an.
-
Nach
Beispiel 5 hergestellte repräsentative
Chitosanproben wurden hinsichtlich der Viskosität (das ist Drehviskosität unter
Benutzung eines Brookfield-Viskosimeters) und pH (das ist pH-Messer)
bewertet. Die mittlere Viskosität
wurde zu 0,24 Pa·s
(241,50 Centipoise)(3 Proben) bei einer oberen und unteren Normgrenze
von 0,39 bzw. 0,12 Pa·s
(390 bzw. 120 Centipoise) bestimmt. Der mittlere pH wurde zu 3,8
bestimmt.
-
Beispiel 10
-
Feststellung des Fettbindungsvermögens in
vitro der flüssigen,
Chitosan enthaltenden Zusammensetzungen
-
Dieses
Beispiel gibt eine Bestimmung des Fettbindungsvermögens der
nach Beispiel 5 hergestellten flüssigen,
Chitosan enthaltenden Proben der Erfindung an.
-
Für diese
Studien wurden 15 ml geschmolzener Eiscreme in Bechergläser gegeben.
Einigen der Bechergläser
wurden 30 ml Wasser zugesetzt. In den anderen wurden 7,5 ml einer
Chitosanprobe und 22,5 ml Wasser zugesetzt. Die entstandenen Gemische
wurden zentrifugiert. Das mit der Chitosan enthaltenden Probe behandelte
Material ergab nach der Zentrifugierung eine klare Lösung, wobei
das Fett an der Oberseite der Lösung
blieb. Das unbehandelte Material ergab eine trübe Lösung. Aliquote Teile von 20
ml aus dem Überstehenden
(d. h. der geklärten
Lösung
aus der mit Chitosan behandelten Probe und der trüben Lösung aus
der unbehandelten Probe) wurden dann nach den Bedingungen extrahiert,
wie sie für
die Fettbestimmung in Eiscreme in dem Associate Official Analytical
Chemists Manual angegeben sind. Die resultierenden Extrakte wurden
eingedampft, und die Menge des gewonnenen Fettes wurde bestimmt. Tabelle
9: Ergebnisse der Fettreduktionsprüfung
- NA
- nicht anwendbar
-
-
Diese
Ergebnisse bestätigen,
daß das
Verfahren benutzt werden kann, um die Höhe der Fettabsorption durch
die Chitosan enthaltende Zusammensetzung der Erfindung zu zeigen.
-
Beispiel 11
-
Einsatz der flüssigen,
Chitosan enthaltenden Zusammensetzungen bei einer Lebensweise zur
Gewichtsabnahme und/oder zum Gewichtshalten
-
Dieses
Beispiel gibt die Art und Weise an, wie die flüssigen, Chitosan enthaltenden
Zusammensetzungen routinemäßig eingesetzt
werden können,
um Gewichtszunahme zu verhindern, eine Gewichtsabnahme herbeizuführen und/oder
zum Halten eines bevorzugten Gewichtes beizutragen.
-
Die
Verwendung der flüssigen,
Chitosan enthaltenden Zusammensetzungen (z. B. wie in Beispiel 5 beschrieben)
ist im allgemeinen wie folgt. Vor einer der zwei Haupttagesmahlzeiten
einer Person (z. B. typischerweise Mittag- oder Abendessen) werden
etwa 0,5 Unzen (14,8 ml) des flüssigen
Produkts (d. h. etwa 14 Tropfen) in wenigstens etwa 2 Unzen (59,2
ml) Wasser eingemischt. Die Zusammensetzung wird vorzugsweise mit
Wasser gemischt, da das Chitosan enthaltende Produkt beinahe unmittelbar
beginnt, sich mit einem in der Flüssigkeit anwesenden Fett (oder
vielleicht anderen großen
komplexen Molekülen)
zu verbinden, was einen negativen Einfluß auf das Erscheinungsbild
des Getränks
haben könnte.
Die Zusammensetzung kann jedoch mit einem anderen Getränk gemischt
werden, soweit Getränke
mit Milch, Sahne oder Fetten vermieden werden und vorzugsweise solange
das Getränk
fettfrei ist.
-
Anschließend an
die Vermischung wird das Getränk
verzehrt. Die Aufnahme des Chitosans als Flüssigkeit (das ist im Gegensatz
zu einer Tablette) mit anschließendem
Verzehr von noch weiterer Flüssigkeit
hat den zusätzlichen
Vorteil der Tendenz, den Magen zu füllen, was auch helfen könnte, die
Nahrungsaufnahme zu verringern.
-
Typischerweise
wird ein "kalkiger" Nachgeschmack empfunden.
Dies zeigt wahrscheinlich an, daß das flüssige, Chitosan enthaltende
Produkt begonnen hat, Fett (z. B. Rückstände auf der Zunge und im Mund)
zu sammeln. Es wird empfohlen, z. B. um die Verdauung und die Empfindung
zu fördern,
daß auf
den Verzehr des Produktes der Verzehr eines weiteren Glases Wasser
folgt.
-
Im
Anschluß an
die Aufnahme des Chitosan enthaltenden Produkts kann die Person
eine Mahlzeit in üblicher
Weise zu sich nehmen. Die Einnahme des Chitosan enthaltenden Produkts
kann dann vor der anderen großen
Tagesmahlzeit wiederholt werden.
-
Beispiel 12
-
Verwendung der flüssigen,
Chitosan enthaltenden Zusammensetzungen – doppelte klinische Blindstudie
-
Dieses
Beispiel beschreibt klinische Studien zur Bestätigung der Wirkung einer Chitosan
enthaltenden Zusammensetzung der Erfindung (z. B. wie in Beispiel
5 beschrieben hergestellt) auf die Fettabsorption.
-
Diese
Studie ist doppel-blind, zufallsverteilt und umfaßt einen
Crossover, um die Wirkung der Chitosan enthaltenden Zusammensetzungen
auf Änderungen
bei Lipid- und Lipoprotein- und Serum-Triglyceridgehalten nach dem
Essen einer normierten fetthaltigen Mahlzeit (bestehend aus einer
halben Schale (118,3 ml) Vanille- oder Schokoladeneiscreme von Haagen
Daz) bei normalen Personen zu bestimmen.
-
Die
Studie umfaßte
vorzugsweise zwanzig Patienten, männlich oder weiblich, zwischen
21 und 60 Jahre alt. Es werden Personen ausgewählt, die keine dokumentierte
Hypertriglyceridämievergangenheit
haben und die wenigstens in den letzten vier Wochen nicht auf eine
fettarme Diät
(≤ 30% Fett, ≤ 300 mg Cholesterin)
gesetzt waren. Für
die Aufnahme in die klinische Studie ist es ferner nötig, daß die Person
normale Nüchtern-Plasmatriglyceride < 250 mg/dl und Nüchtern-Plasmagesamtcholesterin > 220 mg/dl hat, in
den vier Wochen vor der Bestimmung der qualifizierenden Lipidgehalte
keine lipidsenkenden Arzneimittel genommen hat, innerhaln von zwei
Wochen vor der Studie keine der verbotenen Hormontherapiebehandlungen
(Östrogendosen > 0,03 mg), immunosuppressive
Mittel und chronische Verabreichung von Corticosteroiden (ausgenommen örtlich oder
inhaliert) erhalten hat, keine aktive Leberkrankheit hat (d. h.
Anstiege von AST oder ALT sind kleiner als oder gleich dem 1,5-fachen
normalen Bereich), ein Serum-Kreatinin von weniger als oder gleich
1,2 mg/dl hat und ein CPK hat, das kleiner als oder gleich dem zweifachen
normalen Bereich ist.
-
Alle
folgenden Kriterien schließen
eine Person von der Teilnahme an der klinischen Studie aus: Eine akute
Myokardinfarcierung oder ein cerebrovaskulärer Insult innerhalb von 3
Monaten, eine Bypass-Operation der Koronararterie oder PTCA innerhalb
der vergangenen 3 Monate, ein instabiler kardiovasculärer Zustand (instabile
Angina, Herzmuskelversagen, NYHA 3. oder 4. Grades), eine Geschichte
einer klinisch signifikanten Magen-Darm-Krankheit innerhalb der
vergangenen 3 Monate, eine Leberkrankheitsvergangenheit oder eine Vergangenheit
der Gallenwegserkrankung ohne eine operative Gallenblasenentfernung,
bekannte Diabetes des Typs I oder II oder Nüchtern-Glucose > 140 mg/dl, eine Malignität außer bei
kutanen Plattenepithelkarzinomen oder Basalzellenkarzinomen, ein
Körpermassenindex > 37 kg/m2,
die Person ist in einer oralen Antikoagulantienbehandlung oder hat
eine abnormale Prothrombinzeit, aktive Psychosen, ein unbehandelter
Schilddrüsenmangelzustand
(> die obere normale
Grenze für
TSH), eine Vergangenheit des chronischen oder akuten Drogen- oder
Alkoholmissbrauchs während
der letzten 6 Monate, eine Schellfisch- oder Jodallergie, abnormale
Cholesterin- (> 220 mg/dl) oder Triglyceridwerte
(> 250 mg/dl), Einnahme
fettlöslicher
Medikamente, eine mögliche
Schwangerschaft in den nächsten
6 Monaten.
-
Der
Test nach dem Essen verläuft
mit den folgenden Stufen. Blut wird für den ersten Lipidtest (0 Stunden
nach der Mahlzeit) und für
Laborsicherheitstests abgenommen. Die Person verzehrt innerhalb
von 30 Minuten von dieser 0 Uhr-Blutabnahme die fetthaltige Normalmahlzeit.
Unmittelbar nach der Mahlzeit verzehrt die Person die Chitosan enthaltende
Zusammensetzung der Erfindung gemischt mit 2 Unzen Wasser und darauffolgend
weitere 6 Unzen Wasser. 4 bis 4 1/2 Stunden nach der Mahlzeit wird
Blut für
Lipidtest abgenommen. Die Blutproben werden nach verschiedenen Test
analysiert, z. B. Chemie (wie Natrium, Kalium, Calcium, Glucose,
BUN, Creatinin, Gesamtprotein, Alkaliphosphat, gamma-GT, SGOT (AST),
SGPT (ALT), Albumin, Gesamtbilirubin, Harnsäure und CPK), Urinchemie (wie
etwa Aussehen des Urins, Urin-pH, spezifisches Gewicht, Urinprotein,
Uringlucose, Urinketone, Urinbilirubin, rote Blutkörperchen
im Urin, weisse Blutkörperchen im
Urin und Schattierungen), Hämatologie
(wie weisse Blutkörperchen,
rote Blutkörperchen,
Hämoglobin,
Hämatokrit,
Blutplättchenzahl,
Monocyten, Eosinophile, Basophile, Neutrophile und Lymphocyten)
und andere Tests (wie Insulin, TSH-Screening, Serum-β-hCG).
-
Doppelblind
willkürlich
ausgewählte
Patenten werden eine Woche mit der Chitosan enthaltenden Zusammensetzung
behandelt und die andere Woche mit dem Placebo.
-
Auf
Basis der bestätigten
Eigenschaften des Chitosans sollten diese Studien die Wirksamkeit
der Chitosanzusammensetzungen der Erfindung bei der Hemmung der
Fettabsorption bestätigen.
-
Beispiel 13
-
Erfassung der Fettbindung
und Teilchenanalyse
-
Dieses
Beispiel bringt eine Erfassung der Fettbindung und Teilchenanalyse
für eine
erfindungsgemäß hergestellte
Chitosansuspension.
-
Eine
Chitosan/Säure/Wasser-Suspension
wurde im wesentlichen wie in Beispiel 5 für die Herstellung von "Faß A" beschrieben hergestellt,
wobei weiteres Wasser zugesetzt wurde, um das Volumen aufzufüllen. Das
Chitosan/Säure/Wasser
enthielt nämlich
3% (Masse/Volumen) Chitosan und etwa 3% (Masse/Volumen) Säure und
(abgesehen von Wasser) keine weiteren Bestandteile. Die zur Bildung
der Chitosan/Säure/Wasser-Suspension
verwendete Säure
war Ascorbinsäure
oder Zitronensäure.
-
Eine
säurehaltige "vollständige" Suspension wurde
im wesentlichen wie in Beispiel 5 für die Bildung der vollständigen Formulierung
(d. h. einschließlich
anderer Mittel neben dem Chitosan und der Säure) beschrieben hergestellt.
Die zur Bildung der säurehaltigen "vollständigen" Suspension verwendete
Säure war
Ascorbinsäure
oder Zitronensäure.
-
Eine
säurehaltige "vollständige" Suspension ohne
Chitosan wurde im wesentlichen wie in Beispiel 5 für die Bildung
der vollständigen
Formulierung (d. h. einschließlich
anderer Mittel neben Chitosan und Säure) beschrieben hergestellt,
wobei abweichend Chitosan in der Formulierung weggelassen wurde
und die Volumendifferenz (falls überhaupt
vorhanden) mit Wasser abgeglichen wurde. Die zur Bildung der säurehaltigen "vollständigen" Suspension ohne
Chitosan verwendete Säure
war Ascorbinsäure
oder Zitronensäure.
-
Eine
gealterte Probe wurde im wesentlichen wie zur Herstellung der Chitosan/Säure/Wasser-Suspension
unter Benutzung von Zitronensäure
beschrieben hergestellt. Die Probe wurde etwa 5 Monate bei etwa Raumtemperatur
gehalten und dann etwa 5 Monate bei etwa 4°C gelagert.
-
Ferner
wurde eine Kontrollprobe untersucht, die Inulin nur in demselben
Prozentsatz wie dem in Beispiel 5 beschriebenen enthielt.
-
Die
Fettbindung wurde wie folgt untersucht. 15 ml der geprüften Probe
wurden zu 5 g extra reinem Olivenöl und 10 ml 0,01 N Chlorwasserstoffsäure zugesetzt.
Es wurde 2 Stunden bei etwa 22°C
auf einem Burrell-Gelenkschüttler geschüttelt. Das
Gemisch wurde mit NaOH auf pH 7,4 gebracht und wie oben beschrieben erneut
30 Minuten geschüttelt.
Dann wurden die Röhrchen
20 Minuten bei 20°C
in einer Sorvall-Zentrifuge RC2B bei 10.000 UpM zentrifugiert. Das überstehende Öl wurde
abgesaugt und gewogen.
-
Die
Teilchenanalyse wurde wie folgt durchgeführt. Die Untersuchung erfolgte
auf einem Teilchengrößenanalysator
Modell 3000A Hyac Royco. Die Proben wurden zur Bewässerung
mit sterilem Wasser 1 : 100 und 1 : 1000 verdünnt. 5 ml-Proben wurden in
dem Gerät
getestet, und die Menge der Teilchen, die größer als 25 und größer als
10 Mikron waren, wurden durch Laserlichtverdunkelung gemessen.
-
Die
Ergebnisse dieser Untersuchungen sind in Tabelle 10 berichtet.
-
Tabelle
10: Fettbindung und Teilchenanalyse
-
Wie
aus dieser Tabelle ersichtlich ist, enthielten alle Chitosan/Säure/Wasser-Suspensionen
Teilchen mit einer Größe von mehr
als 10 μm.
-
Zum
Vergleich war dies bei einer "Wasser"-Kontrollprobe nicht
der Fall. Die Menge Teilchen, die man bei einer mit Ascorbinsäure hergestellten
Chitosan/Säure/Wasser-Suspension
erhielt, schien grob äquivalent der,
die man bei einer mit Zitronensäure
hergestellten Suspension erhielt. Die Ascorbinsäure enthaltende und Zitronensäure enthaltende
Chitosan/Säure/Wasser-Suspension
zeigte ein ähnliches
Vermögen
zur Fettbindung – etwa
6,8 bis 6,9 Gramm Fett sind je Gramm in der Suspension anwesendem
Chitosan gebunden.
-
Die
säurehaltige "vollständige" Suspension, die
mit Ascorbinsäure
oder Zitronensäure
gebildet wurde, zeigt eine höhere
Teilchenzahl und ähnlichen
Bereich der Bindungskapazität
wie die vergleichbaren Chitosan/Säure/Wasser-Suspensionen. Wenn
jedoch die "vollständige" Formel ohne das
Chitosan zusammengestellt wird, fällt die Teilchenzahl auf den
Wert, den Chitosan in den vergleichbaren Chitosan/Säure/Wasser-Suspensionen ergab.
Dies bedeutet, daß die
Chitosan-Teilchenbildung (Teilchensuspension) sogar höher ist
bei Einsatz in der "vollständigen" Formel unter den
Bedingungen des vorliegenden Versuchs, und läßt vermuten, daß die gemessenen
Teilchen jene der in dem Versuch nicht bestimmten, zusätzlichen
Bestandteile sind.
-
Da
das Protokoll für
alle Proben gleich war, erfolgte keine Optimierung, um maximale
Bindungswirksamkeit zu zeigen. Es wurde demonstriert, daß die Art
des Diätfetts
die durch Chitosan auf die Lipidabsorption ausgeübte Wirkung beeinflußt, wie
z. B. in Ikeda et al., J. Nutr. 119(110), 1383–7 (1989) beschrieben wurde. Demgemäß sind die
Ergebnisse in Tabelle 10 nur beispielhaft für das Fettbindungsvermögen der
Chitosanformulierungen der Erfindung, und sie zeigen nicht das volle
Potential der Formulierungen. Es ist gänzlich möglich, daß noch höhere Bindungskapazitäten erreichbar
wären bei
Einsatz besonderer Fette, freier Fettsäuren, Cholesterin, anderen
Sterinen als Cholesterin, Gallensäuren und dergl..
-
Die "gealterte" Formel ergab zu
den Chitosan/Säure/Wasser-Suspensionen
vergleichbare Teilchenergebnisse. Dies zeigt, daß die vorliegende Methode der
Bildung einer Chitosansuspension reproduzierbar ist.
-
Beispiel 14
-
Beurteilung der suspendierten
Teilchen der gelagerten Probe
-
Dieses
Beispiel beschreibt die kolloidalen Eigenschaften einer aufbewahrten
Probe der Chitosansuspension.
-
Die
Probe der Chitosansuspension war die in Beispiel 13 beschriebene "gealterte" Probe. Die visuelle Prüfung der
Flüssigkeit
zeigte einen profunden Tyndalleffekt. Die Flüssigkeit zeigte Brownsche Bewegung
der Teilchen ohne irgendein Absetzen der Teilchen. Dies bestätigt die
Beständigkeit
der Suspension im Verlaufe der Zeit.
-
Während diese
Erfindung mit Betonung einer bevorzugten Ausführungsform beschrieben wurde,
ist es für
die Fachleute klar, daß Veränderungen
bei der bevorzugten Zusammensetzung und der Methode vorgenommen
werden können
und daß es
beabsichtigt ist, die Erfindung in anderer Weise als hier speziell
beschrieben praktisch auszuführen.
Demgemäß umfaßt diese
Erfindung alle Modifizierungen, die von dem Erfindungsumfang umfaßt sind,
wie er durch die folgenden Ansprüche
definiert ist.