DE69909794T2 - Verwendung eines dipeptids für wiederherstellungsprozesse - Google Patents
Verwendung eines dipeptids für wiederherstellungsprozesse Download PDFInfo
- Publication number
- DE69909794T2 DE69909794T2 DE69909794T DE69909794T DE69909794T2 DE 69909794 T2 DE69909794 T2 DE 69909794T2 DE 69909794 T DE69909794 T DE 69909794T DE 69909794 T DE69909794 T DE 69909794T DE 69909794 T2 DE69909794 T2 DE 69909794T2
- Authority
- DE
- Germany
- Prior art keywords
- dipeptide
- lys
- glu
- use according
- animals
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000000034 method Methods 0.000 title abstract description 24
- 230000008569 process Effects 0.000 title description 10
- 238000011084 recovery Methods 0.000 title description 5
- 108010016626 Dipeptides Proteins 0.000 claims abstract description 73
- UGTZHPSKYRIGRJ-YUMQZZPRSA-N Lys-Glu Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(O)=O)CCC(O)=O UGTZHPSKYRIGRJ-YUMQZZPRSA-N 0.000 claims abstract description 64
- 238000002360 preparation method Methods 0.000 claims abstract description 24
- 239000003814 drug Substances 0.000 claims abstract description 20
- 238000011282 treatment Methods 0.000 claims abstract description 19
- 229940079593 drug Drugs 0.000 claims abstract description 16
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 15
- 150000003839 salts Chemical class 0.000 claims abstract description 11
- 208000027418 Wounds and injury Diseases 0.000 claims description 26
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 11
- 239000000126 substance Substances 0.000 claims description 11
- 201000010099 disease Diseases 0.000 claims description 8
- 230000006378 damage Effects 0.000 claims description 7
- 208000035965 Postoperative Complications Diseases 0.000 claims description 6
- 230000037396 body weight Effects 0.000 claims description 6
- 208000014674 injury Diseases 0.000 claims description 6
- 230000000638 stimulation Effects 0.000 claims description 6
- 208000027866 inflammatory disease Diseases 0.000 claims description 5
- 208000019180 nutritional disease Diseases 0.000 claims description 5
- 230000017423 tissue regeneration Effects 0.000 claims description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 3
- 125000003178 carboxy group Chemical class [H]OC(*)=O 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 238000011321 prophylaxis Methods 0.000 claims description 3
- 239000011734 sodium Substances 0.000 claims description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 claims description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical class [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical class C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 claims description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical class [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 claims description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical class [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims description 2
- 208000034493 Mucous membrane disease Diseases 0.000 claims description 2
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 claims description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical class [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims description 2
- 125000003277 amino group Chemical group 0.000 claims description 2
- 239000011575 calcium Chemical class 0.000 claims description 2
- 229910052791 calcium Inorganic materials 0.000 claims description 2
- 229910052744 lithium Inorganic materials 0.000 claims description 2
- 239000011777 magnesium Chemical class 0.000 claims description 2
- 229910052749 magnesium Inorganic materials 0.000 claims description 2
- 150000002892 organic cations Chemical class 0.000 claims description 2
- 230000000191 radiation effect Effects 0.000 claims description 2
- 208000017520 skin disease Diseases 0.000 claims description 2
- 229910052708 sodium Inorganic materials 0.000 claims description 2
- ZMANZCXQSJIPKH-UHFFFAOYSA-O triethylammonium ion Chemical compound CC[NH+](CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-O 0.000 claims description 2
- 229910052725 zinc Inorganic materials 0.000 claims description 2
- 239000011701 zinc Chemical class 0.000 claims description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical class [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 claims 1
- 239000011591 potassium Chemical class 0.000 claims 1
- 229910052700 potassium Inorganic materials 0.000 claims 1
- 230000000699 topical effect Effects 0.000 claims 1
- 230000008439 repair process Effects 0.000 abstract description 14
- 238000011069 regeneration method Methods 0.000 abstract description 9
- 230000001225 therapeutic effect Effects 0.000 abstract description 9
- 230000008929 regeneration Effects 0.000 abstract description 8
- 230000004936 stimulating effect Effects 0.000 abstract description 7
- 238000002347 injection Methods 0.000 abstract description 6
- 239000007924 injection Substances 0.000 abstract description 6
- 229960002989 glutamic acid Drugs 0.000 abstract description 4
- 230000000069 prophylactic effect Effects 0.000 abstract description 4
- 241001465754 Metazoa Species 0.000 description 43
- 210000004027 cell Anatomy 0.000 description 23
- 206010052428 Wound Diseases 0.000 description 20
- 241000700159 Rattus Species 0.000 description 19
- 210000001519 tissue Anatomy 0.000 description 18
- 230000000694 effects Effects 0.000 description 16
- 210000001198 duodenum Anatomy 0.000 description 14
- 210000004185 liver Anatomy 0.000 description 11
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 10
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- 210000004379 membrane Anatomy 0.000 description 9
- 239000012528 membrane Substances 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 102000003992 Peroxidases Human genes 0.000 description 8
- 229960002685 biotin Drugs 0.000 description 8
- 239000011616 biotin Substances 0.000 description 8
- 230000004054 inflammatory process Effects 0.000 description 8
- 108040007629 peroxidase activity proteins Proteins 0.000 description 8
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 210000004907 gland Anatomy 0.000 description 7
- 230000035876 healing Effects 0.000 description 7
- 230000001338 necrotic effect Effects 0.000 description 7
- OTNVGWMVOULBFZ-UHFFFAOYSA-N sodium;hydrochloride Chemical compound [Na].Cl OTNVGWMVOULBFZ-UHFFFAOYSA-N 0.000 description 7
- 206010061218 Inflammation Diseases 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 210000002950 fibroblast Anatomy 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 230000035755 proliferation Effects 0.000 description 6
- 230000005855 radiation Effects 0.000 description 6
- 210000004872 soft tissue Anatomy 0.000 description 6
- 108050006400 Cyclin Proteins 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- 241000283973 Oryctolagus cuniculus Species 0.000 description 5
- 102000009339 Proliferating Cell Nuclear Antigen Human genes 0.000 description 5
- 208000008117 Salivary Gland Calculi Diseases 0.000 description 5
- 206010039394 Salivary gland calculus Diseases 0.000 description 5
- 210000003630 histaminocyte Anatomy 0.000 description 5
- 210000003701 histiocyte Anatomy 0.000 description 5
- 230000000968 intestinal effect Effects 0.000 description 5
- 238000011835 investigation Methods 0.000 description 5
- 230000000394 mitotic effect Effects 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 229940076279 serotonin Drugs 0.000 description 5
- 201000009789 sialolithiasis Diseases 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- 208000002193 Pain Diseases 0.000 description 4
- 230000018199 S phase Effects 0.000 description 4
- 230000002354 daily effect Effects 0.000 description 4
- 238000007918 intramuscular administration Methods 0.000 description 4
- 210000000265 leukocyte Anatomy 0.000 description 4
- 229910052751 metal Inorganic materials 0.000 description 4
- 239000002184 metal Substances 0.000 description 4
- 230000036407 pain Effects 0.000 description 4
- 238000012753 partial hepatectomy Methods 0.000 description 4
- 210000003079 salivary gland Anatomy 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 102000013563 Acid Phosphatase Human genes 0.000 description 3
- 108010051457 Acid Phosphatase Proteins 0.000 description 3
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 3
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 230000006399 behavior Effects 0.000 description 3
- 230000022131 cell cycle Effects 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 238000001647 drug administration Methods 0.000 description 3
- 230000003203 everyday effect Effects 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 210000003494 hepatocyte Anatomy 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 230000008595 infiltration Effects 0.000 description 3
- 238000001764 infiltration Methods 0.000 description 3
- 239000010410 layer Substances 0.000 description 3
- 230000004807 localization Effects 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 230000000877 morphologic effect Effects 0.000 description 3
- 230000017074 necrotic cell death Effects 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 3
- 230000002062 proliferating effect Effects 0.000 description 3
- 229950003937 tolonium Drugs 0.000 description 3
- HNONEKILPDHFOL-UHFFFAOYSA-M tolonium chloride Chemical compound [Cl-].C1=C(C)C(N)=CC2=[S+]C3=CC(N(C)C)=CC=C3N=C21 HNONEKILPDHFOL-UHFFFAOYSA-M 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- GZCWLCBFPRFLKL-UHFFFAOYSA-N 1-prop-2-ynoxypropan-2-ol Chemical compound CC(O)COCC#C GZCWLCBFPRFLKL-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 238000012752 Hepatectomy Methods 0.000 description 2
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 206010030113 Oedema Diseases 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- 208000033809 Suppuration Diseases 0.000 description 2
- 230000001133 acceleration Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000002421 anti-septic effect Effects 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 210000000748 cardiovascular system Anatomy 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 230000019522 cellular metabolic process Effects 0.000 description 2
- 230000007665 chronic toxicity Effects 0.000 description 2
- 231100000160 chronic toxicity Toxicity 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 239000000306 component Substances 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 230000004590 drinking behavior Effects 0.000 description 2
- 230000020595 eating behavior Effects 0.000 description 2
- 210000003890 endocrine cell Anatomy 0.000 description 2
- 210000002322 enterochromaffin cell Anatomy 0.000 description 2
- 210000001842 enterocyte Anatomy 0.000 description 2
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 230000002519 immonomodulatory effect Effects 0.000 description 2
- 210000004347 intestinal mucosa Anatomy 0.000 description 2
- 210000005229 liver cell Anatomy 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 239000006210 lotion Substances 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 230000011278 mitosis Effects 0.000 description 2
- 238000013425 morphometry Methods 0.000 description 2
- 210000000214 mouth Anatomy 0.000 description 2
- 238000010606 normalization Methods 0.000 description 2
- 231100000915 pathological change Toxicity 0.000 description 2
- 230000036285 pathological change Effects 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 230000002980 postoperative effect Effects 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 230000036573 scar formation Effects 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000011272 standard treatment Methods 0.000 description 2
- 231100000456 subacute toxicity Toxicity 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 210000000689 upper leg Anatomy 0.000 description 2
- 210000005167 vascular cell Anatomy 0.000 description 2
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical group C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 1
- BUHVIAUBTBOHAG-FOYDDCNASA-N (2r,3r,4s,5r)-2-[6-[[2-(3,5-dimethoxyphenyl)-2-(2-methylphenyl)ethyl]amino]purin-9-yl]-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound COC1=CC(OC)=CC(C(CNC=2C=3N=CN(C=3N=CN=2)[C@H]2[C@@H]([C@H](O)[C@@H](CO)O2)O)C=2C(=CC=CC=2)C)=C1 BUHVIAUBTBOHAG-FOYDDCNASA-N 0.000 description 1
- ATCFYQUZTYQTJN-AXDSSHIGSA-N (2s)-2-amino-4-benzylpentanedioic acid Chemical compound OC(=O)[C@@H](N)CC(C(O)=O)CC1=CC=CC=C1 ATCFYQUZTYQTJN-AXDSSHIGSA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 101100008049 Caenorhabditis elegans cut-5 gene Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 206010007882 Cellulitis Diseases 0.000 description 1
- 241000700112 Chinchilla Species 0.000 description 1
- 208000032544 Cicatrix Diseases 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000018832 Cytochromes Human genes 0.000 description 1
- 108010052832 Cytochromes Proteins 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 101000981685 Homo sapiens Protein Lines homolog 1 Proteins 0.000 description 1
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 108010065920 Insulin Lispro Proteins 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- AIXUQKMMBQJZCU-IUCAKERBSA-N Lys-Pro Chemical compound NCCCC[C@H](N)C(=O)N1CCC[C@H]1C(O)=O AIXUQKMMBQJZCU-IUCAKERBSA-N 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 102000003792 Metallothionein Human genes 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 101150008755 PCNA gene Proteins 0.000 description 1
- 206010034038 Parotitis Diseases 0.000 description 1
- 208000020584 Polyploidy Diseases 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 102100024087 Protein Lines homolog 1 Human genes 0.000 description 1
- 208000019155 Radiation injury Diseases 0.000 description 1
- 206010039424 Salivary hypersecretion Diseases 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- COQLPRJCUIATTQ-UHFFFAOYSA-N Uranyl acetate Chemical compound O.O.O=[U]=O.CC(O)=O.CC(O)=O COQLPRJCUIATTQ-UHFFFAOYSA-N 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- -1 ZnOH 2 Chemical compound 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 210000004100 adrenal gland Anatomy 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 210000000709 aorta Anatomy 0.000 description 1
- 235000019789 appetite Nutrition 0.000 description 1
- 230000036528 appetite Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000000035 biogenic effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- HOQPTLCRWVZIQZ-UHFFFAOYSA-H bis[[2-(5-hydroxy-4,7-dioxo-1,3,2$l^{2}-dioxaplumbepan-5-yl)acetyl]oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HOQPTLCRWVZIQZ-UHFFFAOYSA-H 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- KIZFHUJKFSNWKO-UHFFFAOYSA-M calcium monohydroxide Chemical compound [Ca]O KIZFHUJKFSNWKO-UHFFFAOYSA-M 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 150000001767 cationic compounds Chemical class 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000001447 compensatory effect Effects 0.000 description 1
- 230000000093 cytochemical effect Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 238000000586 desensitisation Methods 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 201000006549 dyspepsia Diseases 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000001827 electrotherapy Methods 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 210000000750 endocrine system Anatomy 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 210000003989 endothelium vascular Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 210000003054 facial bone Anatomy 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 230000000762 glandular Effects 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 244000144993 groups of animals Species 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000002390 hyperplastic effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 229910001411 inorganic cation Inorganic materials 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 230000005865 ionizing radiation Effects 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 230000000622 irritating effect Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 230000008752 local inflammatory process Effects 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 210000003141 lower extremity Anatomy 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 210000000350 mc(t) Anatomy 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- XBCXJKGHPABGSD-UHFFFAOYSA-N methyluracil Natural products CN1C=CC(=O)NC1=O XBCXJKGHPABGSD-UHFFFAOYSA-N 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 238000007491 morphometric analysis Methods 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 229940105631 nembutal Drugs 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 208000030212 nutrition disease Diseases 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- WEXRUCMBJFQVBZ-UHFFFAOYSA-N pentobarbital Chemical compound CCCC(C)C1(CC)C(=O)NC(=O)NC1=O WEXRUCMBJFQVBZ-UHFFFAOYSA-N 0.000 description 1
- 239000005426 pharmaceutical component Substances 0.000 description 1
- 238000000554 physical therapy Methods 0.000 description 1
- 210000001850 polyploid cell Anatomy 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 210000003660 reticulum Anatomy 0.000 description 1
- 208000026451 salivation Diseases 0.000 description 1
- 231100000241 scar Toxicity 0.000 description 1
- 230000037387 scars Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 235000000891 standard diet Nutrition 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 210000004003 subcutaneous fat Anatomy 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 1
- 231100000816 toxic dose Toxicity 0.000 description 1
- 231100000820 toxicity test Toxicity 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 210000001364 upper extremity Anatomy 0.000 description 1
- 230000002477 vacuolizing effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/05—Dipeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Dermatology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Treatments For Attaching Organic Compounds To Fibrous Goods (AREA)
- Bending Of Plates, Rods, And Pipes (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Description
- Beschreibung im Bereich der Erfindung
- Die Erfindung liegt im Bereich der Pharmakologie, d. h. pharmazeutische Mittel, die Peptide enthalten und ihre Zusammensetzungen, die eine prophylaktische und/oder therapeutische Anwendung in der Medizin als Stimulatoren der Geweberegeneration bei eitrig-entzündlichen Krankheiten und nachoperativen Komplikationen, Ernährungskrankheiten, Erkrankungen und Verletzungen der Haut und Mukosa Membran, Schädigungen durch Strahlung, thermische und chemische Faktoren, begleitet von Störungen des Reparaturprozesses.
- Die Erfindung betrifft die Anwendung des Dipeptids L-lysyl-L-glutaminsäure (L-Lys-L-Glu) als Arznei, das die Reparaturprozesse bei Personen, die dieses benötigen, stimuliert.
- Hintergrund der Erfindung
- Als Arzneimittel die in ihrer Anwendung zu dem Erfindungsgemäßen am stärksten analog sind, gibt es eine Gruppe von Präparaten, die Stoffwechselprozesse stimulieren: Derivate von Pyrimidin (Methyliracil, Pentoxyl) und biogene Präparaten (Actovegin, Solcoseryl) (1).
- Die Nachteile des Methyluracils bestehen in kutanen, allergischen Reaktionen (urticaria eruption), manchmal treten Kopfschmerzen und Schwindel auf. Die Oralverabreichung von Pentoxyl kann Dyspepsie aufgrund der irritierenden Wirkung des Arzneimittels hervorrufen. Der Nachteil von Actovegin und Solcoseryl besteht in der kleine Mengen an wirksamen Substanzen in den Arzneimitteln, einer verlängerten Behandlung und einer begrenzten Anwendung in Bezug auf das Stadium der Wunde, genauso wie eine niedrige Wirksamkeit bei der Behandlung von eitrigen Wunden. Diese Arzneimittel produzieren einen deutlich stimulierenden Effekt auf die Leukopoese.
- Das Dipeptid L-Lys-L-Glu ist als Komponente bei der Peptidsynthese bekannt (2).
- Es ist allgemein bekannt, dass L-Lys-L-Glu Dipeptid eine immunmodulierende Wirkung aufzeigt, (3) und WO 9503067. Diese Aktivität des Dipeptids charakterisiert allerdings nur seine immunbiologische Wirkung, dies ist aber keine offensichtliche und miteinander verbundene Manifestierung der Eigenschaften des Dipeptids, Reparaturprozesses zu stimulieren und spezifiziert keine Indikation der klinischen Anwendung. Die unten dargestellten Beispiele für das Dipeptid L-Lys-L-Glu in seiner stimulierenden Wirkung auf die Reparaturprozesse bestätigen objektiv die Abwesenheit einer Korrelation zwischen den bekannten und den beanspruchten Eigenschaften.
EP 0 165 492 offenbart die Verwendung von Lys-Pro Dipeptid für eine verbesserte Heilung bei Verletzungen. - Offenbarung der Erfindung
- Die beanspruchte Erfindung richtet sich auf die Lösung des Problems des Erhalts einer von einem Peptid stammenden Substanz, die in der Lage ist, Reparaturprozesse zu stimulieren.
- Erfindungsgemäß wird die Verwendung von L-Lys-L-Glutaminsäure Dipeptid (L-Lys-L-Glu) zur Herstellung eines Peptidpräparates zur Prophylaxe und/oder Behandlung von Erkrankungen, die eine Stimulation der Geweberegeneration benötigen, vorgeschlagen, wobei die Erkrankung zu der folgenden Gruppe gehört: eitrig-entzündliche Krankheiten und nachoperative Komplikationen, Ernährungskrankheiten, Haut- und Schleimhautkrankheiten und -verletzungen; Bestrahlungsnachwirkungen, chemische und thermische Faktoren.
- Das Dipeptid wird durch ein klassisches Verfahren zur Peptidsynthese in Lösung erhalten (4). Bisher unbekannte Eigenschaften des L-Lys-L-Glu Dipeptids in der Stimulation von Reparaturprozessen wurden experimentiell gefunden.
- Erfindungsgemäß besteht das pharmazeutische Peptidpräparat aus einem pharmazeutischen annehmbaren Träger und einer wirksamen Menge von L-Lys-L-Glu oder einem seiner Salze.
- Erfindungsgemäß kann das pharmazeutische Peptidpräparat Salze der Aminogruppe (Acetat, Hydrochlorid, Oxalat) oder der Carboxylgruppen (Salze der Metalle Natrium, Kalzium, Lithium, Zink, Magnesium oder andere organische und anorganische Kationen, z. B. Ammonium, Triethylammonium) enthalten.
- Der Ausdruck „pharmazeutisches Peptidpräparat", wie er hier verwendet wird, bedeutet die Verwendung des Dipeptids in irgendeiner Arzneiform, die eine therapeutische Wirkung bei der Behandlung von Erkrankungen, die eine Stimulation der Geweberegeneration benötigen, aufzeigt.
- Der Ausdruck „wirksame Menge", wie er hier verwendet wird, bedeutet die Anwendung einer Menge an wirksamer Grundsubstanz, die in Übereinstimmung mit den quantitativen Indizes der Aktivität und Toxizität, sowie dem zur Verfügung stehenden Wissen, in seiner Arzneiform wirksam ist. Um pharmazeutische Zusammensetzungen, die erfindungsgemäß verwendet werden können, zu erhalten, wird das vorgeschlagene Dipeptid oder dessen pharmazeutisch annehmbaren Derivate als aktiver Inhaltsstoff und ein pharmazeutischer Träger gemäß anerkannten pharmakologischen Verfahren zur Formulierung vermischt.
- Der Träger kann verschiedene Formen aufzeigen, diese hängen von der Arzneiform des Präparats ab, wie es für die Verabreichung vorgesehen ist, z. B. paranteral, oral, intranasal oder lokal (z. B. als Verabreichungen oder Salben).
- Alle bekannten pharmazeutischen Komponenten können zur Herstellung der Zusammensetzungen in bevorzugten Dosen zu oralen oder lokalen Anwendung verwendet werden.
- Zur parenteralen (intranasalen) Verabreichung umfasst der Träger üblicherweise steriles Wasser, obwohl auch andere Inhaltsstoffe, die zur Stabilität oder zur Aufrechterhaltung der Sterilität beitragen, verwendet werden können.
- Erfindungsgemäß ist das Dipeptid bei Verabreichung von Dosen von 0,01 bis 100 μg/kg Körpergewicht wirksam, obwohl auch geringere (höhere) Dosen unter Berücksichtigung der Schwere und dem Auftreten der Erkrankung verwendet werden können.
- Das pharmazeutische Peptidpräparat wird zur parenteralen, intranasalen, oralen und lokalen Verabreichung vorgeschlagen. Die Erfindung ist geeignet zur Verwendung bei Menschen und Tieren, die eine solche Stimulation benötigen.
- Die Stimulation der Regenerationsprozesse durch Verabreichung des Arzneimittels, das als aktive Substanz das Dipeptid L-lysil-L-Glutaminsäure (L-Lys-L-Glu) oder dessen chemische Modifikation in Form eines Salzes oder andere Derivate enthält, wird aufgezeigt durch Aktivierung des Zellstoffwechsels und des regulierenden Effekts auf die Prozesse der Proliferation und Differenzierung der Zellen in verschiedenen Geweben. Das Verfahren ist zur prophylaktischen und therapeutischen Anwendung geeignet, wobei das Objekt, das dieses braucht, Dosen von 0,01 bis 100 μg/kg mindestens einmal am Tag über einen Zeitraum, der notwendig ist, um eine therapeutische Wirkung zu erzielen, wie 10 bis 40 Tage unter Berücksichtigung der Ausbildung und Schwere der Erkrankung, erhält.
- Die Verwendung des Dipeptids schließt die Herstellung der Präparate zur Prophylaxe und Behandlung von Erkrankungen, bei der eine Stimulation der Geweberegeneration notwendig ist, ein; eitrig-entzündliche Prozesse und postoperative Komplikationen, Ernährungsstörungen, Haut und Schleimhauterkrankungen und Verletzungen, Bestrahlungsnachwirkungen, thermische und chemische Faktoren, begleitet von Verschiebungen der Reparaturprozesse.
- Industrielle Anwendbarkeit
- Die Erfindung wird mit Hilfe von Beispielen zur Synthese des Dipeptids der Formel L-lysil-L-Glutaminsäure (L-Lys-L-Glu) (Beispiel 1), Tests zur Toxizität und biologischen Aktivität des Dipeptids (Beispiele 2, 3, 4 und 5) und Beispiele der Ergebnisse der klinischen Anwendung des Dipeptids, das deren pharmazeutische Eigenschaften aufzeigt und die Möglichkeit des Erzielens einer therapeutischen Wirkung bestätigt, dargestellt (Beispiele 6, 7, 8). Bezug wird auch auf die Abbildungen genommen.
- KURZE BESCHREIBUNG DER ABBILDUNGEN
-
1A zeigt PCNA positive Kerne proliferierender Zellen im Wachstumsbereich des Duodenums. Avidin-Biotin-Peroxidase Verfahren, × 100. Bestrahltes Tier. -
1B zeigt PCNA positive Kerne proliferierender Zellen im Wachstumsbereich des Duodenums. Avidin-Biotin-Peroxidase Verfahren, × 100. Bestrahlte Tiere + L-Lys-Glu Dipeptid. -
2A zeigt Serotonin immunpositive Zellen in der mukosalen Membran des Duodenums. Streptavidin-Biotin-Peroxidase Verfahren × 100. Bestrahlte Tiere. -
2B zeigt Serotonin immunpositive Zellen in der mukosalen Membran des Duodenums. Streptavidin-Biotin-Peroxidase Verfahren × 100. Bestrahlte Tiere + L-Lys-L-Glu Dipeptid. -
3A zeigt Metallotionein immunpositive Zellen in der mukosalen Membran des Duodenums (histotopografische Lokalisierung der MLT-positiven Zellen. Streptavidin-Biotin-Peroxidase Verfahren, × 100. Bestrahlte Tiere. -
3B zeigt Metallotionein immunpositive Zellen in der mukosalen Membran des Duodenums (histotopografische Lokalisierung der MLT-positiven Zellen. Streptavidin-Biotin-Peroxidase Verfahren, × 100. Bestrahlte Tiere + L-Lys-L-Glu Dipeptide. -
4A zeigt Mastzellen in der mukosalen Membran des Duodenums. Selektive Färbung mit Toluidin blau, pH 0,5-×100. Bestrahlte Tiere. -
4 B zeigt Mastzellen in der mukosalen Membran des Duodenums. Selektive Färbung mit Toluidin blau, pH 0,5-×100. Bestrahlte Tiere +L-Lys-L-Glu Dipeptide. - Beispiel 1. Synthese von L-Lys-L-Glu Dipeptid
- 1. Nα,Nε-Dibenzyloxycarbonyl-L-lysyl-γ-benzyl-Glutaminsäure (I)
- 0,154 g (0,65 mmol) γ-Benzyl-Glutaminsäure wurden in 3 ml Dimethylformamid suspendiert und 0,091 ml (0,65 mmol) Triethylamine wurden unter Rühren hinzugefügt, anschließend wurden 0,300 g (0,59 mmol) N-Oxysuccinimidether des Nα,Nε Dibenzyloxycarbonyl-L-lysyls hinzugegeben. Die Reaktionsmischung wurde innerhalb von 12 Stunden bei Raumtemperatur umgesetzt. Anschließend wurde das Lösungsmittel im Vakuum unter 40°C abgezogen und 10 ml H2SO4 zu dem Rest gegeben. Das Produkt wurde zweimal mit Ethylacetat (30 × 2) extrahiert. Die organische Schicht wurde mit H2SO4 und Wasser bis zur Neutralreaktion gewaschen und über Na2SO4 getrocknet. Lösungsmittel-Destillation wurde unter Vakuum bei 40°C durchgeführt und der Rest wurde in 1–2 ml Ethylazetat gelöst. Das Produkt wurde mit Hexan ausgefällt und im System Ethylazetat/Hexan rekristallisiert. Das Produkt wurde filtriert und unter Vakuum über P2O5 getrocknet. Die Ausbeute war 0,0330 g (88%). Der Koeffizient Rf war 0,81 (Benzol : Azeton 1 : 1, Silufol).
- 2. L-lysyl-L-Glutaminsäure
- Geschütztes Dipeptid (1) (0,330 g) wurde in 10 mg Methanol gelöst, es wurden 3 ml Wasser hinzugegeben und über Kohlenstoff / Palladium hydriert. Eine Kontrolle wurde mit Dünnschichtchromatographie durchgeführt. Nach Beendigung der Hydratisierung wurde der Katalysator abfiltriert, und der Rest wurde in einer minimalen Menge Wasser gelöst und mit Methanol präzipitiert. Das Produkt wurde filtriert, mit Ethanol gewaschen und unter Vakuum über P2O5 getrocknet. Die Ausbeute war 0,110 g (85 %). Die Schmelztemperatur war 194 bis 196°C. (α) γ20 = +20,0° (c = 3,0; H2O). Rf = 0,54 (Azeton: Wasser 1 : 3, „Merk"). Elektrophorese: EGly = 1,96; Ehis = 0,98 (1400 Volt, 45 min., 2% Essigsäure, „Watmann 3MM".
- Um die entsprechenden Salze der Carboxylgruppen zu erhalten, wurden dem freien Dipeptid entsprechende Mengen einer wässrigen Lösung des Hydroxids des entsprechenden Metalls hinzugefügt (NaOH, KOH, ZnOH2, LiOH, CaOH2, NH4OH). Um das Triethylammonium Salz zu erhalten, wurde das gleiche Verfahren mit Triethylamin als Base durchgeführt.
- Beispiel 2. Untersuchung zur Toxizität von L-Lys-L-Glu Dipeptid
- Die Untersuchung zur allgemeinen toxischen Wirkung des Dipeptids L-Lys-L-Glu wurde gemäß den „Regeln zur präklinischen Bestimmung der Sicherheit von pharmakologischen Substanzen (GLP)" durchgeführt.
- Der Zweck der Studie besteht in der Identifikation von tolerierbaren toxischen Dosen des Arzneimittels, Bestimmung des Stadiums und des Charakters der pathologischen Veränderungen in verschiedenen Organen und Systemen des Organismus und Bestimmung der Korrelation zwischen toxischer Wirkung in bezug auf die Dosis und die Dauer der Arzneiverabreichung.
- Die Bestimmung der akuten Toxizität des Dipeptids L-Lys-L-Glu wurde gemäß Kerber durchgeführt. Die Studie wurde bei 66 weißen männlichen Inzuchtmäusen mit einem Körpergewicht von 20–23 g durchgeführt, diese wurden unter Standardbehandlung gehalten und mit einer Standardernährung in Käfigen aufbewahrt. Die Tiere wurden zufällig in sechs gleiche Gruppen a' 11 Mäuse unterteilt. Die Tiere wurden einer einzelnen intramuskulären Verabreichung des Arzneimittels, 0,25 ml in Dosen von 1 mg/kg, 2 mg/kg, 3 mg/kg, 4 mg/kg, 5 mg/kg, ausgesetzt, dies war mehrere Tausendfach über der empfohlenen therapeutischen Dosis bei einem klinischen Versuch. Die Kontrolltiere wurden mit einer Natriumchloridlösung gleicher Menge behandelt.
- Nach 72 Stunden und nach 14 Tagen verstarb keines der Tiere irgendeiner Gruppe. Keine Veränderung im allgemeinen Zustand, Verhalten, Bewegungsaktivität, Haar- oder Hautintegument oder physiologischen Ausscheidungen.
- Somit zeigt das L-Lys-L-Glu Dipeptid in Dosen, die die für klinische Tests empfohlene Dosis mehrere Tausendfach überschreitet, keine toxischen Wirkungen auf, dies deutet auf eine breite therapeutische Anwendbarkeit des Arzneimittels.
- Die Untersuchung der subakuten Toxizität des L-Lys-L-Glu Dipeptids wurde an 60 weißen Inzuchtratten mit einem Körpergewicht von 150 bis 250 g durchgeführt. Die Tiere der Experimentalgruppen wurden täglich einer einzelnen intramuskulären Verabreichung des Arzneimittels für 90 Tage in Dosen von 1 mg/kg, 0,3 mg/kg, 3 mg/kg in 0,5 ml Natriumchloridlösung ausgesetzt. Den Tieren der Kontrollgruppen wurde Natriumchloridlösung in gleicher Menge verabreicht.
- Während des gesamten Untersuchungszeitraums wurden die Tiere täglich kontrolliert. Das Verhalten der Tiere wurde aufgezeichnet, genauso wie das Freß- und Trinkverhalten, der Zustand der Haare und mukosalen Oberflächen. Die Tiere wurden wöchentlich gewogen. Die morphologische Zusammensetzung und die Eigenschaften des peripheren Bluts wurden vor und am 30sten, 60sten und 90sten Tag der Arzneiverabreichung untersucht. Biochemische und Koagulationsindizes des Bluts wurden nach Beendigung des Experiments bestimmt.
- Die chronische Toxizität des erfindungsgemäßen L-Lys-L-Glu Dipeptids wurde bei Langzeitverabreichung an Ratten mit einem Körpergewicht von 150 bis 250 g untersucht. Die Tiere der Experimentalgruppen wurden täglich einer intramuskulären Gabe oder Substanz in Dosen von 1 mg/kg, 0,3 mg/kg, 3 mg/kg in 0,5 ml Natriumchloridlösung über 6 Monate ausgesetzt. Das Verhalten der Tiere, genauso wie das Ess- und Trinkverhalten, der Zustand der Haare und der mukosalen Oberflächen wurde beobachtet. Die Tiere wurden in den ersten drei Monaten des Experiments täglich gewogen und anschließend einmal im Monat. Drei Monate nach Beginn der Gabe und nach Beendigung des Experiments wurden hematologische und biochemische Untersuchungen durchgeführt. Die Funktionen des cardiovasculären Systems, Leber, Pancreas, Niere und Nebenniere wurden untersucht. Nach Beendigung der Arzneimittelverabreichung wurden einige Tiere pathomorphologischen Untersuchungen unterworfen, mit dem Ziel verschiedene Bereiche des Gehirns und des Rückenmarks, Herz, Aorta, Lunge, Leber, Endokrin- und Immunsystem zu untersuchen.
- Die Bestimmung des allgemeinen Zustandes des Tieres, der morphologischen und biochemischen Indizes des peripheren Bluts, des morphologischen Zustands der intrinsi schen Organe, des cardiovaskulären und Atmungssystems, der Leber und Nierenfunktion zeigte keine pathologischen Veränderungen des Organismus.
- Die Untersuchung der subakuten und chronischen Toxizität des L-Lys-L-Glu Dipeptids zeigte die Abwesenheit von Nebeneffekten der Langzeitgabe des Arzneimittels in Dosen, die die therapeutische 100 bis 1000fach überschritt.
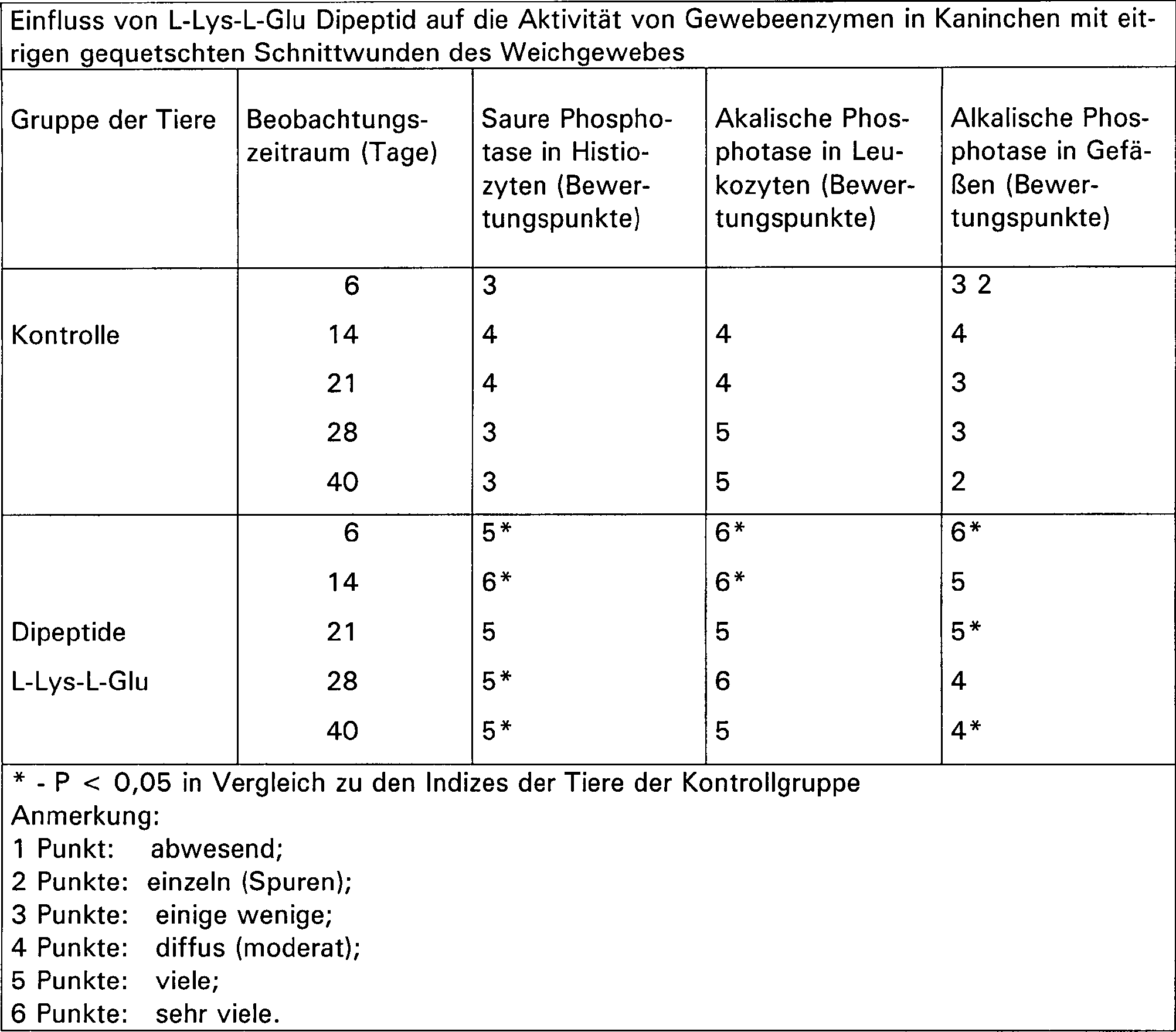
- Beispiel 3. Einfluss des L-Lys-L-Glu Dipeptids auf die Heilung von eitrigen gequetschten Schnittwunden des Weichgewebes
- Die Wirksamkeit des L-Lys-L-Glu Dipeptids wurde an einem Modell von eitrigen gequetschten Schnittwunden in Weichgeweben an Oberschenkeln bei „Chinchilla" Kaninchen beiderlei Geschlechts mit ein Körpergewicht von 2 bis 3 kg untersucht. Die Kaninchen wurden in dem Bereich des Weichgewebes der Oberschenkel rasiert mit einem anschließenden Schnitt von 5 cm Länge und 2 cm Tiefe. Das Weichgewebe (Muskel, subkutanes Fett) wurde mit Kocher's Pinzetten gequetscht und mit der pathogenen Mischung: Staphylococcus aureus, Stamm 186, infiziert. Anschließend wurde die Wunde vernäht. Nach 72 Stunden wurde die Naht geöffnet, und die Wunde wurde mit 3% Wasserstoffperoxidlösung behandelt.
- Den Tieren der Experimentalgruppe wurde intramuskulär jeden Tag für fünf Tage mit dem Dipeptid L-Lys-L-Glu in einer einzelnen Dosis von 1 μg pro Injektion injiziert. Den Kontrollkaninchen wurde Natriumchloridlösung gemäß dem gleichen Schema injiziert. Beim Behandlungsverfahren wurden die Wunden mit einem antiseptischen Arzneimittel zur externen Anwendung behandelt.
- Die Bestimmung der Wirksamkeit des L-Lys-L-Glu Dipeptids in dem Fortschreiten der Regression des Entzündungsprozesses bezog sich auf die Abstoßung der Kruste und der Entfernung von pyonekrotischer Masse aus der Wunde, dem Auftreten von granulärem Gewebe in der Wunde und dem Beginn der Epithelbildung an den Ecken. Mit dem Ziel, objektive Kriterien für das Fortschreiten des Heilungsprozesses zu identifizieren, wurden Indizes analysiert, die halbquantitative Eigenschaften verschiedener zellulärer Elemente und Strukturen des granulären Gewebes an den Tagen 6, 14, 21, 28 und 40 wiedergeben. Weiterhin wurde die Aktivität der Gewebeenzyme bestimmt (5, 6, 7).
- Als Ergebnis der Untersuchung wurde festgestellt, dass die Tiere aller Gruppen in der ersten Phase der Entzündung am 6. Tag eine ausgeweitete Nekrose in dem umgebenen Gewebe mit einem dünnen Rand an granulärem Gewebe mit diffusen frischen Fibroblasten und einzelnen Histiozyten aufzeigten. In der Phase der Proliferation waren schmale Foci einer Nekrose umringt von einer breiten Schicht granulären Gewebes mit Auftreten von Gefäßen und Lymphozyten. Die Menge an Histiozyten nahm zu, und die Makrophagen bildeten Kluster in den nekrotischen Bereichen. Die Fibroblasten waren gestreckt und hatten dünne Nuclei. Besonders verstärkt waren Prozesse der zellulären Aktivierung bei den Tieren der Experimentalgruppe (Tabelle 1). In der Phase der Narbenbildung zeigten diese Tiere Foci von Nekrose umgeben mit einer Schicht granulären Gewebes mit reifen Fibroblasten. Zwischen den Fibroblasten wurde eine Schicht von kollagenen Fasern gefunden. Interstitielle Substanzen, die sich innerhalb der nekrotischen Bereiche befanden, enthielten Prekollagen Fasern, Fibroblasten, Histiozyten, dies legt einen Resorptionsprozess und einen Austausch des nekrotischen Gewebes mit frischem granulären Gewebe nahe.
- Ein hervortretendes Merkmal der Antwort des Gewebes auf die Verabreichung von L-Lys-L-Glu Dipeptid bestand in der hohen Aktivität der sauren Phosphatase in Histiozyten zum Zeitpunkt der Proliferation (14–28 Tage). In neuen Foci von Leukozyten Infiltrationen, genauso wie im vaskulären Endothel wurde eine starke Aktivität der alkalischen Phosphatase beobachtet. In der Narbenbildungsphase wurde ein hoher Gehalt an saurer Phosphatase in Histiozyten und von alkalischer Phosphatase in Leukozyten und Gefäßen festgestellt (Tabelle 2).
- Die beobachteten Veränderungen beweisen eine Intensivierung des Zellstoffwechsels in Geweben, das Fördern eines schnellen Säuberns der Wundenoberfläche von nekrotischem Gewebe mit anschließender Epithelbildung in der Wunde (Tabelle 3).
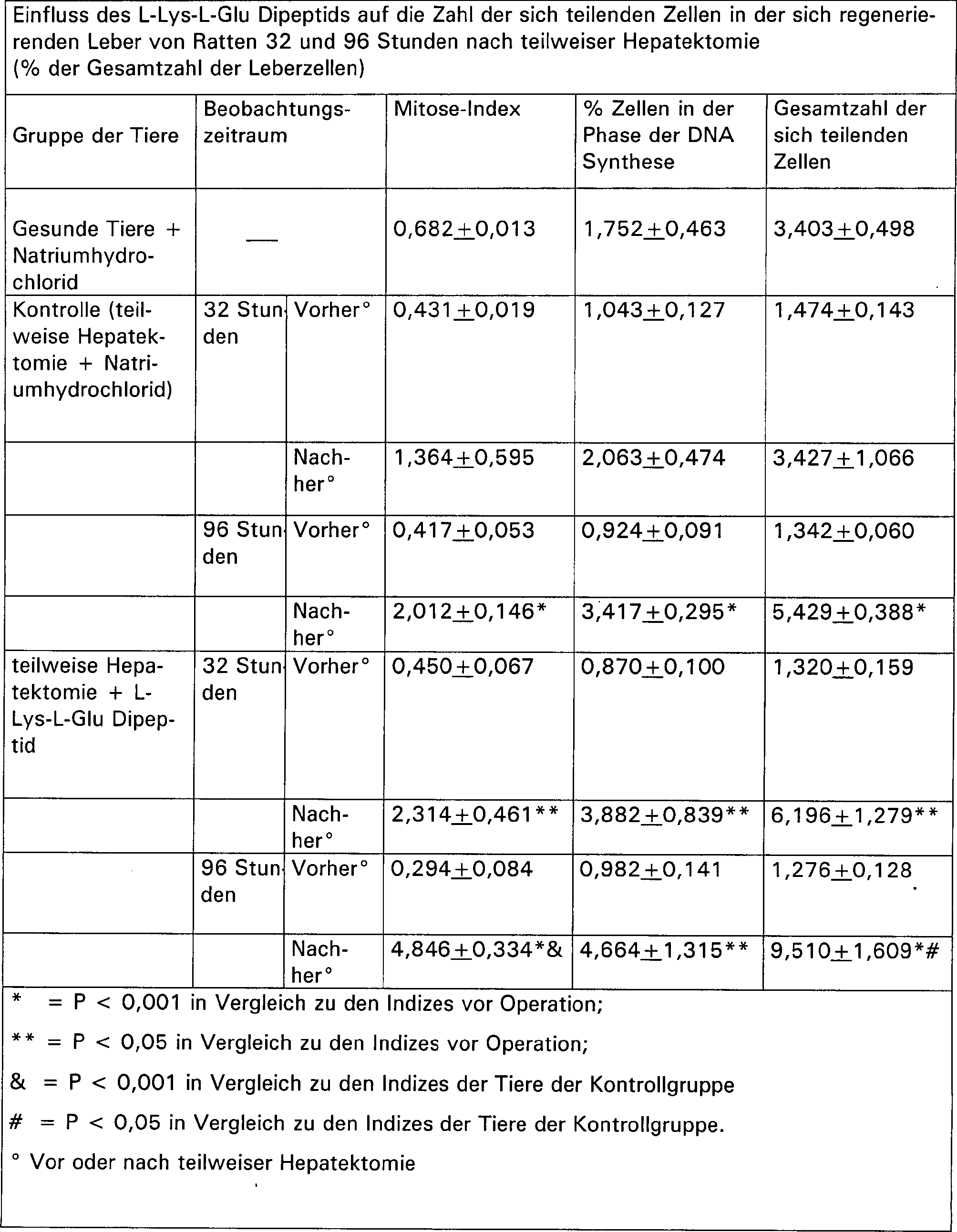
- Beispiel 4. Einfluss des L-Lys-L-Glu Dipeptids auf die kompensatorische Regenerierung der Leber nach teilweiser Hepatektomie
- Die Untersuchung wurde bei 26 weißen männlichen Inzuchtratten mit einem Gewicht von 150 bis 200 g durchgeführt. Die Tiere wurden in die folgenden drei Gruppen unterteilt:
- 1. Gruppe: gesunde Tiere
- 2. Gruppe: Kontrolle (Ratten, die einer teilweisen Hepatektomie unterzogen wurden, wobei 2/3 der Leber entfernt wurde)
- 3. Gruppe: Ratten, die der Operation unterzogen wurden und anschließend (2 und 24 Stunden nach der Operation) wurden zwei subkutane Injektionen des L-Lys-L-Glu Dipeptids (0,1 μg pro Ratte) durchgeführt.
- Gleichzeitig wurden die Tiere der ersten und zweiten Gruppe mit dem gleichen Volumen Natriumhydrochlorid injiziert. Die entfernte Leber wurde in Formalin fixiert. Die operierten Ratten wurden mit Hilfe von Ether 32 bzw. 96 Stunden nach der Operation getötet. Die Ratten der Kontrollgruppe wurden zur gleichen Zeit getötet. Deren Leber wurde in Formalin fixiert. Durch Nachfärben der Präparate mit Hematoxilin-Eosin wurde der mitotische Index in den Leberzellen definiert, genauso wie die Menge an polyploiden Zellen in der S-Phase des Zellzyklus (die Menge an sich teilenden Zellen).
- Die Untersuchung der Mitose-Aktivität der sich regenerierenden Leberzellen 32 Stunden nach teilweise Hepatektomie zeigte, dass die Zahl der Mitosen und der Zellen in der S-Phase des Zellzyklus zweifach größer war als in der Leber der gesunden Tiere. Dieser Unterschied ist im Falle der Injektion von Natriumhydrochlorid nicht deutlich, während die Zunahme der Mitosen, der DNA synthetisierenden Zellen und der Gesamtmenge an sich teilenden Zellen nach Gabe des L-Lys-L-Glu Dipeptids deutlich war.
- Die Untersuchung der Leberpräparationen 96 Stunden nach Hepatektomie bewies, dass sowohl Ratten, denen Natriumhydrochlorid als auch solche denen L-Lys-L-Glu Dipeptid injiziert wurde, eine deutliche Intensivierung der Mitose-Aktivität der Hepatozyten aufzeigt. Ein Vergleich der Daten der dritten und der zweiten Gruppe zeigte, dass die Ratten, denen L-Lys-L-Glu Dipeptid injiziert wurde, eine doppelt so große Zahl an Mitosen aufwies als die Ratten, denen Natriumhydrochlorid injiziert wurde. Die Zahl der Zellen in der S-Phase jedes Zellzyklus bei der dritten Gruppe von Ratten unterschied sich nicht signifikant von der Zahl der Hepatozyten in der S-Phase der zweiten Gruppe, obwohl insgesamt die Zahl der sich teilenden Zellen 96 Stunden nach Hepatektomie in der regenerierten Leber der mit L-Lys-L-Glu Dipeptide injizierten Ratten 75% größer war als bei den Ratten, denen Natriumhydrochlorid injiziert wurde (Tabelle 4).
- Somit konnte gezeigt werden, dass Ratten, denen L-Lys-L-Glu Dipeptide injiziert wurde, 96 Stunden nach teilweiser Hepatektomie eine Intensivierung der Mitose-Aktivität der Hepatozyten aufzeigte, dies zeigt die Beschleunigung der reparativen Prozesse der Leber.
- Beispiel 5. Einfluss des L-Lys-L-Glu Dipeptids auf die Regeneration von intestinaler mukoser Membran nach Verletzung durch Bestrahlung
- Die Untersuchung wurde an 24 Monate alten weißen männlichen Ratten der Wistar Linie durchgeführt, Gewicht 90 bis 100 g. Die folgenden drei Gruppen von Tieren wurden untersucht:
- 1. Gruppe: gesunde Tiere
- 2. Gruppe: Kontrolle (bestrahlte Tiere)
- 3. Gruppe: bestrahlte Tiere, denen L-Lys-L-Glu Dipeptid injiziert wurde.
- Eine einzelne γ Bestrahlung von sechs Gy, die das „Syndrom des intestinalen Tod" induziert, wurde mit einem Kobaltapparat „GUB 20000" mit einer Dosiskapazität von 200 rad/min, durchgeführt.
- L-Lys-L-Glu Dipeptid wurde 24 Stunden nach Bestrahlung intraperitoneal über 5 Tage mit 0,5 μg in 0,5 ml Natriumhydrochlorid injiziert. Die Tiere der ersten und zweiten Gruppen erhielten Natriumhydrochlorid gemäß dem gleichen Schema.
- Die Untersuchung der Wirkung des L-Lys-L-Glu Dipeptids wurde im proximalen Bereich des Duodenums der bestrahlten Tiere durchgeführt.
- Die Tiere wurden unter Nembutal-Narkose (50 mg/kg) am achten Tag nach Bestrahlung getötet (Beginn der Regeneration des Reparaturzeitraums). Teile des Duodenums wurden gemäß Karnovsky für 24 Stunden fixiert für die Elektronenmikroskopie.
- Die ultrastrukturelle Untersuchung wurde mit dem JEM-100S Mikroskop (JEOL, Japan) mit ultradünnen mikroskopischen Schnitten, hergestellt mit dem LKB-7A Ultra-Mikrotom (LKB, Schweden), durchgeführt, diese wurden mit Uranylacetat und Bleicitrat gefärbt.
- Mastzellen wurden selektiv mit 1% Lösung Toluidin blau (Fluka) in 0,5 M HCl mit einem pH von 0,5 gefärbt (8,9). Um die Proliferationsaktivität der Zellen zu untersuchen, wurden Maus monoklonale Antikörper gegen das nukleäre Zell-Proliferations Antigen (PCNA), 1 : 50 verdünnt (Klon PC 10, Calbiochem, USA) und Avidin-Biotin Peroxidase zum Aufzeigen der Mausimmunoglobuline (Vectastain, USA) verwendet. Serotonin positive Zellen wurden dargestellt mit Hilfe des polyklonalen Kaninchenantikörpers gegen Serotonin (unverdünnt) und Streptavidin-Biotin-Peroxidase Kit (Bio-Genex, USA). Um MTL positive Zellen aufzuzeigen, wurden Kaninchen Antikörper gegen Metallthioneine verwendet (1 : 2000).
- Die immunhistochemische Identifizierung der Antigene auf histologischen Schnitten wurde gemäß den Bedingungen für Immunperoxidaseverfahren gemacht (10,11).
- Die quantitative Untersuchung wurde mit Hilfe des Systems zur Computeranalyse von mikroskopischen Bildern IMSTAR (Imstar, Frankreich) und der lizenzierten Anwendungsverfahren Morphostar-2 und Colquat-2 durchgeführt gemäß den allgemeinen Prinzipien der Stereologie in der Morphometrie (12, 13). Für jedes Tier wurde die Berechnung der entsprechenden Strukturen in 10 verschiedenen Untersuchungsbereichen bei drei Schnitten des untersuchten Organs durchgeführt. Der Mitose-Index (Imit) und der Index der proliferierenden Fähigkeit (Ipcna) der Duodenumzellen wurde in 10 bis 15 Standardabschnitten mit Gesamtmengen von nicht weniger als 1000 Nuclei von Enterozyten definiert. Der Testbereich zum Auffinden von Serotonin-positiven- und Mastzellen deckte nicht weniger als 3 mm2 ab. MTL positive Zellen wurden in 100 Duodenum Krypten gezählt.
- Nach Ionenbestrahlung war am Tag 8 eine teilweise, in manchen Fällen sogar totale, Wiederherstellung der Ultrastruktur der Enterozyten zu beobachten, es traten allerdings nach wie vor hyperplastische („geschwollene") Mitochondrien, Ödeme des endoplasmatischen Retikulums und fokale Vakuolisierung des Zytoplasmas auf, die endokrinen Zellen schauten zu diesem Zeitpunkt im Prinzip unverändert aus.
- Quantitative Veränderungen im Duodenum am B. Tag nach Total γ-Bestrahlung mit 6 Gy des Darms zeigten die folgenden spezifischen Merkmale: IPCNA in den intestinalen Krypten stieg auf 46,5%, während der Mitose-Index bis auf 4,2% stieg (Tabelle 5). Diese Daten bestätigen, dass die Wiederherstellung des Mukosaepithels in den überlebenden Tieren sehr schnell vor sich ging, während der Pool an Gefäßzellen im intestinalen Epithel zu diesem Zeitraum in einem Stadium der Hyperregenerierung war (
1a ). - Histologische Untersuchung der Präparate, die mit Hematoxilin und Eosin gefärbt wurden, bestätigen ebenfalls den Beginn der Normalisierungsprozesse des Epithelaufbaus. Die Ergebnisse der Computeranalyse zeigten allerdings, dass die zahlenmäßige Dichte der Enterochromaffinn Zellen (
2a ) und MTL-positiven Zellen (3a ) noch nicht die Niveaus der Indizes gesunder Tiere aufzeigte (MTL-positiv = Metallothionein-positiv). - Die Menge an Mastzellen der mukosalen Grundplatte der bestrahlten Tiere war um das 10fache verringert (
4a ), dies bestätigt die starke Bestrahlungssensitivität der Mastzellen vom mukosalen Typ gegenüber ionisierender Strahlung, genauso wie die sehr langsame Wiederherstellung ihrer Zahl, selbst wenn sie subletalen Dosen ausgesetzt sind. - Es ist bemerkenswert, dass die Injektion des L-Lys-L-Glu Dipeptids die Strukturen des zytoplasmatischen Retikulums und die des Plattenkomplexes der endokrinen Zellen des Duodenums aktiver macht, dies zeigt die stimulierende Wirkung auf die Syntheseprozesse und die Hormonsekretion.
- Gemäß den Ergebnissen der morphometrischen Analyse tritt in den Krypten der Gedärme der bestrahlten Tiere nach Injektion von L-Lys-L-Glu Dipeptid eine bemerkenswerte Beschleunigung des Wiederherstellungsverfahrens auf (
1b ). Der PCNA-Index geht auf 49,8%, während der Mitose-Index sich auf 4,7% erhöht (Tabelle 5). Die quantitative Dichte der Enterochromaffinn Zellen stellte sich praktisch auf die der gesunden Tiere ein. Es bestand eine Tendenz der Erhöhung der Zahl und Intensität von immungefärbten MTL positiven Zellen an der Kryptenbasis (3b ). - Die Verwendung von L-Lys-L-Glu Dipeptid intensiviert das Proliferationspotential von Gefäßzellen des Darms und stärkt die morphofunktionelle Regeneration der intestinellen Mukosa nach allgemeiner γ-Bestrahlung mit einer Dosis von 6 Gy.
- Somit zeigt die Experimentalstudie, dass L-Lys-L-Glu Dipeptid nicht toxisch ist, dass es Stoffwechselprozesse und die Proliferationsaktivität von Zellen in irgendeinem Gewebe aktiviert, um so deren Wiederherstellung zu verbessern.
- Die Eigenschaften des L-Lys-L-Glu Dipeptids, die sich während der experimentellen pre-klinischen Untersuchung darstellten, erlauben eine prophylaktische und/oder therapeutische Verwendung als Stimulans zur Gewebewiederherstellung bei eitrigen entzündlichen Erkrankungen, postoperativen Komplikationen, Ernährungskrankheiten, Haut und Mukosa Verletzungen und Erkrankungen, Bestrahlung, thermischen und chemischen Nachwirkungen, begleitet von Reparaturprozesszuständen.
- Die Beispiele der klinischen Studien des beanspruchten Dipeptids, wie sie unten gezeigt sind, zeigen dessen pharmakologische Eigenschaften und bestätigt dessen Patentfähigkeit.
- Beispiel 6. Wirksamkeit der Verwendung des L-Lys-L-Glu Dipetids zur Behandlung bei der Entzündung der Speicheldrüsen und Sialolithiasis
- 45 Patienten wurden untersucht. Von diesen hatten 27 Personen eine Entzündung der Speicheldrüse, 4 davon hatten Parotitis. 18 Personen litten an Sialolithiasis der Unterkieferdrüsen. Das Durchschnittsalter der Patienten war 35–40. Alle Patienten mit der Sialolithiasis hatten entfernte Steine. 30 Patienten (15 von diesen hatten eine Entzündung der Speicheldrüse, die anderen 15 hatten Sialolithiasis) wurden einer täglichen intramuskulären Injektion von L-Lys-L-Glu Dipeptid von 1 μg über 5 Tagen unterworfen.
- Die Patienten der Kontrollgruppe wurden einer Standardbehandlung unterworfen: antibakterielle, Desensibilisierungstherapie, Joddimexidverbände, physische Therapie (Ultraschall, 5–10% Kaliumjodidelektrotherapie des Drüsenbereichs), lokale Behandlung (Waschen der Drüsen mit einer antiseptischen Lösung und Antibiotika).
- Die Patienten, die eine Sialolithiasis aufzeigten und mit L-Lys-L-Gludipeptid behandelt wurden, zeigten keinen Auswurf von Eiter aus den Drüsengängen, im postoperativen Zeitraum heilte die Wunde in der Mundhöhle beim ersten Verheilen ohne irgendwelche Nachwirkungen. Ein Schwellen und eine Infiltration des Weichgewebes und der mukosalen Membran der Mundhöhle war am 3.–4. Tag nach der Operation abgeklungen. Die Größe der Drüse nahm deutlich ab, und die Schmerzen verschwanden.
- Die Patienten, die eine Entzündung der Speicheldrüsen hatten und die mit L-Lys-L-Glu Dipeptid behandelt wurden, hatten am 4.–5. Tag nach Behandlung keine Schmerzen in der Drüse mehr und der Auswurf an Eiter aus den Drüsengängen stoppte, die Speichelbildung nahm zu, die Schwellung und die Infiltration des Weichgewebes verschwand; beim Abtasten war die Größe der Drüse deutlich verringert, und sie wurde schmerzfrei. Der Allgemeinzustand der Patienten verbesserte sich. Die Laborwerte normalisierten sich ebenfalls.
- Somit half die Verwendung von L-Lys-L-Glu Dipeptid bei der Reduktion der Zahl der Entzündungen, beschleunigte die Regeneration bei Wunden und verkürzte den Behandlungszeitraum.
- Beispiel 7. Wirksamkeit von L-Lys-L-Glu Dipeptid bei der Behandlung von eitrigen Entzündungserkrankungen verschiedener Lokalisation
- L-Lys-L-Glu Dipeptid wurde bei der komplexen Behandlung von 15 Patienten, die Fleischwunden mit verzögerter Granulierung in oberen und unteren Extremitäten hatten und 19 Patienten, die Phlegmone im Kiefer und Gesichtsknochenbereich hatten, verwendet. 1 μg der Präparation wurde jeden Tag für 10 Tage intramuskulär injiziert. Die Wirksamkeit der Behandlung wurde in ihrer Dynamik gemäß den Veränderungen der Aktivität der Wundenzyme und dem Zeitraum der Heilung untersucht.
- Es wurde gefunden, dass L-Lys-L-Glu Dipeptid sich als am wirksamsten bei Patienten mit geringer Aktivität der eiweißspaltenden Wundenzyme im ersten und zweiten Stadium des Wundheilungsprozesses herausstellte, mit nekrotischem Zytogramm und langsamer Heilung. L-Lys-L-Glu Dipeptid erhöht die Aktivität der Wundfermente in der ersten Phase des Heilungsprozesses, verursachte eine Adaption der Restrukturierung in der Wunde und fördert die Synthese der sauren Phosphatasen in Histozyten, der alkalischen Phosphatasen in Leukozyten und Zytochrom C in Makrophagen und verstärkt die Reparaturprozesse. Das Injizieren des Dipeptids hilft einer beschleunigten Reinigung der Wunde von nekrotischen Geweben und Heilen der Wunde aufgrund der Makrophagen, Fibroblasten und Leukozytenaktivierung im Entzündungsfokus.
- L-Lys-L-Glu Dipeptid-Behandlung führte zu einer schnelleren Abwicklung des lokalen Entzündungsprozesses, Verbesserung des allgemeinen Zustandes des Patienten und der Kürzung des Behandlungszeitraums.
- Beispiel 8. Wirksamkeit der Verwendung des L-Lys-L-Glu Dipeptids bei Krebspatienten mit postoperativen Komplikationen
- L-Lys-L-Glu Dipeptid wurde bei der komplexen Behandlung von 9 Patienten mit verzögert granulierenden Wunden nach operativer Behandlung bei Lungenkrebs des zweiten bis dritten Stadiums und Magenkrebs im zweiten bis dritten Stadium verwendet. Im pre-operativen Zeitraum wurden die Patienten einer Gesamtbestrahlungstherapie unterworfen, unter Verwendung von großen Bereichen der Komplexkonfiguration eines linearen Elektronenbeschleunigers (dessen Leistung ist 4,3 Mev) und einer Gamma-Therapievorrichtung „Rokus-M" im Bremsmodus. In bestimmten Fällen war eine Komponente der kombinierten Therapie eine Chemotherapie.
- Beginnend mit dem 3. Tag nach der Operation wurde 1 μg L-Lys-L-Glu Dipeptid über 10 Tage intramuskulär injiziert.
- Es stellte sich heraus, dass die Verwendung dieses Präparats die Ödeme und Schmerzen im Wundbereich reduzierten und sowohl die Entfernung von nekrotischem Gewebe aus der Wunde als auch die Bildung postoperativer Narben beschleunigte. Während des Injektionszeitraums wurden die folgenden Faktoren beobachtet: Normalisierung der Temperatur, Verbesserung des Appetits und schnellere Gewichtszunahme.
- Die Verwendung des L-Lys-L-Glu Dipeptids als Teil der komplexen Therapie bei Krebspatienten stimuliert somit die Reparaturprozesse in den Geweben, fördert die Verbesserung des Allgemeinzustandes des Patienten und reduziert die Behandlungszeit.
- Die klinische Anwendung von L-Lysyl-L-Glutaminsäure (L-Lys-L-Glu) wird durch die durch experimentelle Untersuchungen erhaltenen Daten bestätigt, dies zeigt, dass das Präparat ein wirksames Arzneimittel gegenüber Störungen des Reparaturprozesses ist.
- REFERENZEN
-
- 1. M. Mashkovsky Medicinal Substances. Zweiteilig, Moskau: Medizin 1993, Teil 2, S. 161–191.
- 2. SERVA-Katalog.-Heidelberg, 1987/88. -PE 1-PE40.
- 3. Patent der Russischen Föderation N 2080120 „Medicinal substances possessing immune-modulating activity". BIN 15.27.05.97
- 4. H. -D. Yakubke, X. Eshkait. Aminoacids, peptides, proteins: Transl. from German./Moscow, Mir, 1985. -456 p.
- 5. V. Balin, D. Madai, D. Tsvigailo. Local Treatment of purulent surgical skin and subcutaneous fat diseases in the conditions of regulated activity of wound enzymes. /St. Petersburg, 1996.-37 p.
- 6. V. Kolodin, 0. Kuznetsov Quantitative cytochemical revealing of enzymes in the cess culture after the Rowse virus infecting//Vopr. Oncol. (Problems in Oncology).-1975.-Vo1.21, N 9.P.65–71.
- 7. M. Berston Histochemistry of Enzymes. -Moscow, Mir, 1965.-454 p.
- 8. Enerback L., Miller H. R. P., Mayrhofer G. Methods for the identification and characterization of mast cells by light microscopy//Mast cell differentiation and heterogenity/Eds. A. D. Beifus et al. Raven Press, New York, 1986.-P.405-416.
- 9. Stead R. H., Dixon M. F., Bramwell N. H. Mast cells are closely apposed to nerves in the human gastrointestinal mucosa//Gastroenterology.-1987.-Vol 87.-P. 575–585
- 10. Polack G., van Norden S. Introduction into immunocytochemistry: modern methods and problems: Transl. from English. -Moscow, Mir, 1987.-74 p.
- 11. Kvetnoy I., Yuzhakov V. Staining endocrine tissue and elements of APUD-system//Microscopic technique: Manual/Eds. D. Sarkisov, Y. Perov.-Moscow, Medicine, 1966.-P.375–418.
- 12. G. Avtandilov. Medical morphometry. Manual. Moscow, 1990.-384 p.
- 13. Weibel E. R., Kistler G. S., Scherle W. F. Practical stereological methods for mophometric cytology//J. Cell Biol.-1966. – Vol 30. -P.23-38.
- DATENBLATT
- Patentinhaber: Obschestvo s Ogranichennoi Otvetstvennostiju "Klinika Instituta Bioregulyatsii i Gerontologii, pr. Dinoamo, 3, St. Petersburg 197110/RU
Vertreter: GRAMM, LINS & PARTNER GbR Freundallee 13, D-30173 Hannover
Aktenzeichen: 99928267.6-2107
Veröffentlichungsnummer: 1 089 753
Bezeichnung der Erfindung: USE OF A DIPEPTIDE FOR STIMULATING REPAIR PROCESS
Aktenzeichen des DPMA für das Europäische Patent: 699 09 794.0-08
Claims (6)
- Verwendung des Dipeptids L-Lysyl-L-Glutaminsäure (L-Lys-L-Glu) für die Herstellung einer Peptidzubereitung für die Prophylaxe und/oder Behandlung von Krankheiten, die die Stimulation einer Geweberegeneration erfordern, wobei die Krankheit zu der folgenden Gruppe gehört: eitrig-entzündliche Krankheiten und nachoperative Komplikationen, Ernährungskrankheiten, Haut- und Schleimhautkrankheiten und -verletzungen; Bestrahlungsnachwirkungen, chemische und thermische Faktoren.
- Verwendung nach Anspruch 1, wobei die Peptidzubereitung aus einem pharmazeutisch zulässigen Träger und einer wirksamen Menge L-Lys-L-Glu oder eines seiner Salze besteht.
- Verwendung nach Anspruch 1 oder 2, wobei das Peptid angeboten wird als Dipeptid, welches Salze der Aminogruppe enthält, insbesondere Acetat, Hydrochlorid, Oxalat.
- Verwendung nach einem der Ansprüche 1 bis 3, wobei das Peptid angeboten wird als Dipeptid, welches Salze von Carboxylgruppen enthält, insbesondere Salze von Natrium, Kalium, Lithium, Kalzium, Zink, Magnesium oder organischen und nicht-organische Kationen, insbesondere Ammonium, Triethylammonium.
- Verwendung nach einem der Ansprüche 1 bis 4, wobei die Peptidzubereitung als Medikament für parenterale, intranasale oder orale Verabreichung oder lokale Applikation angeboten wird.
- Verwendung nach einem der Ansprüche 1 bis 5, wobei die Dosiseinheit des Dipeptids oder seines Salzes auf 0,01 bis 100 μg je kg Körpergewicht eines Patienten eingestellt ist.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU98111342/14A RU2139085C1 (ru) | 1998-06-23 | 1998-06-23 | Средство, стимулирующее репаративные процессы, и способ его применения |
| RU98111342 | 1998-06-23 | ||
| PCT/RU1999/000188 WO1999066948A2 (en) | 1998-06-23 | 1999-05-27 | Use of a dipeptide for stimulating repair processes |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69909794D1 DE69909794D1 (de) | 2003-08-28 |
| DE69909794T2 true DE69909794T2 (de) | 2004-06-09 |
Family
ID=20207251
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69909794T Expired - Lifetime DE69909794T2 (de) | 1998-06-23 | 1999-05-27 | Verwendung eines dipeptids für wiederherstellungsprozesse |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US6642201B1 (de) |
| EP (1) | EP1089753B1 (de) |
| JP (1) | JP4489946B2 (de) |
| AT (1) | ATE245434T1 (de) |
| AU (1) | AU776693B2 (de) |
| CA (1) | CA2335362C (de) |
| CH (1) | CH692477A5 (de) |
| DE (1) | DE69909794T2 (de) |
| IL (2) | IL140412A0 (de) |
| RU (1) | RU2139085C1 (de) |
| WO (1) | WO1999066948A2 (de) |
Families Citing this family (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8680059B2 (en) | 1998-05-20 | 2014-03-25 | Biotempt B.V. | Oligopeptide acetate and formulations thereof |
| US20030220258A1 (en) | 2001-12-21 | 2003-11-27 | Robbert Benner | Treatment of ischemic events |
| EP1138692A1 (de) | 2000-03-29 | 2001-10-04 | Erasmus Universiteit Rotterdam | Fragmente des menschlichen Choriongonadotropins als Immunoregulatoren |
| RU2161974C1 (ru) * | 2000-01-20 | 2001-01-20 | Общество с ограниченной ответственностью "Клиника Института биорегуляции и геронтологии" | Лечебно-профилактическое средство для ухода за кожей (варианты) |
| US7358330B2 (en) | 2001-03-29 | 2008-04-15 | Biotempt B.V. | Immunoregulatory compositions |
| USRE43279E1 (en) | 2000-03-29 | 2012-03-27 | Biotemp B.V. | Compositions capable of reducing elevated blood urea concentration |
| EP1300418A1 (de) * | 2001-10-04 | 2003-04-09 | Erasmus Universiteit Rotterdam | Genregulation durch Oligopeptide |
| RU2196990C2 (ru) * | 2000-04-24 | 2003-01-20 | Красноярская государственная медицинская академия | Способ воспроизведения воспалительно-инфекционного процесса на крысах |
| RU2177801C1 (ru) * | 2001-01-25 | 2002-01-10 | Санкт-Петербургская Общественная Организация "Санкт-Петербургский Институт Биорегуляции И Геронтологии Сзо Рамн" | Средство, ингибирующее ангиогенез при заболеваниях органа зрения |
| US7786084B2 (en) | 2001-12-21 | 2010-08-31 | Biotempt B.V. | Treatment of burns |
| US20080318871A1 (en) * | 2001-12-21 | 2008-12-25 | Khan Nisar A | Treatment of neurological disorders |
| RU2211046C1 (ru) * | 2002-01-08 | 2003-08-27 | Цепелев Виктор Львович | Средство, стимулирующее пролиферацию фибробластов |
| RU2214269C1 (ru) * | 2002-03-07 | 2003-10-20 | Курский государственный медицинский университет | Способ стимуляции физиологической и репаративной регенерации печени |
| RU2221456C1 (ru) * | 2003-03-11 | 2004-01-20 | Общество с ограниченной ответственностью "Арсентех" | Биологически активное вещество, биологически активная добавка к пище, фармацевтический препарат, биологически активная добавка для кормления животных, ветеринарный препарат, удобрение, активатор микробиологических процессов, пероральное питание, парфюмерно-косметическое средство, гигиеническое средство, молочный продукт, кондитерское изделие, хлебобулочное изделие, масло-жировой продукт, соус, алкогольный напиток, безалкогольный напиток, рыбный продукт, мясной продукт, макаронные изделия, жевательная резинка, пиво |
| US7517529B2 (en) * | 2003-04-08 | 2009-04-14 | Biotempt B.V. | Treatment of type I diabetes |
| US20090191105A1 (en) * | 2004-08-30 | 2009-07-30 | Kazuhiro Tanahashi | Fractionation Apparatus |
| RU2278676C1 (ru) * | 2004-12-14 | 2006-06-27 | Александр Борисович Смолянинов | Способ лечения больных язвенной болезнью, сочетаемой с сахарным диабетом |
| RU2286794C1 (ru) * | 2005-04-27 | 2006-11-10 | Государственное образовательное учреждение высшего профессионального образования Курский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию | Средство для стимуляции репаративной регенерации печени и коррекции иммунной реактивности при экспериментальных токсических гепатопатиях |
| CN101217971B (zh) * | 2005-07-05 | 2011-11-09 | 比奥滕普特公司 | 肿瘤的治疗 |
| RU2288474C1 (ru) * | 2005-12-28 | 2006-11-27 | Федеральное государственное учреждение науки "Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека" (ФГУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора) | Способ определения токсического действия оральной мукозальной интерферонотерапии |
| EP1864692A1 (de) | 2006-06-07 | 2007-12-12 | Biotempt B.V. | Verwendung von peptiden zum Schutz von Strahlenschäden |
| RU2309758C1 (ru) * | 2006-04-20 | 2007-11-10 | Георгий Михайлович Элбакидзе | Способ и средство патогенетической терапии заболеваний посредством тканеспецифического регулирования митохондриальных процессов в печени (варианты) |
| RU2301071C1 (ru) * | 2006-06-22 | 2007-06-20 | Общество С Ограниченной Ответственностью "Сиа Пептайдс" | Гепатопротекторное средство и способ его получения |
| JP5715962B2 (ja) * | 2009-01-30 | 2015-05-13 | バイヤースドルフ・アクチエンゲゼルシヤフトBeiersdorf Aktiengesellschaft | コラーゲン、キトサン、グリコシルアミノグリカンおよび細胞増殖促進ペプチドおよび/または細胞複合体よりなる、化粧品または皮膚科学的調製物 |
| WO2012048298A2 (en) | 2010-10-08 | 2012-04-12 | Caridianbct, Inc. | Methods and systems of growing and harvesting cells in a hollow fiber bioreactor system with control conditions |
| RU2496511C1 (ru) * | 2012-04-20 | 2013-10-27 | Замертон Холдингс Лимитед | Фармацевтическая композиция, средство (варианты) и способ профилактики и лечения артрита, остеоартроза и остеохондроза позвоночника (варианты) |
| RU2517213C2 (ru) * | 2012-08-03 | 2014-05-27 | Татьяна Георгиевна Емельянова | Средство пептидной структуры, обладающее противовоспалительным, антибактериальным, ранозаживляющим, регенеративным, анальгетическим, противоожоговым действием и лекарственные формы на его основе |
| RU2521973C1 (ru) * | 2013-08-23 | 2014-07-10 | Замертон Холдингс Лимитед | Средства для профилактики и лечения заболеваний суставов и способы их применения |
| JP6612227B2 (ja) | 2013-11-16 | 2019-11-27 | テルモ ビーシーティー、インコーポレーテッド | バイオリアクターにおける細胞増殖 |
| EP3122866B1 (de) | 2014-03-25 | 2019-11-20 | Terumo BCT, Inc. | Passives ersetzen von medien |
| EA025549B1 (ru) | 2014-09-09 | 2017-01-30 | Замертон Холдингс Лимитед | Композиция и средства для профилактики и лечения заболеваний суставов и позвоночника и способы их применения |
| US20160090569A1 (en) | 2014-09-26 | 2016-03-31 | Terumo Bct, Inc. | Scheduled Feed |
| WO2017004592A1 (en) | 2015-07-02 | 2017-01-05 | Terumo Bct, Inc. | Cell growth with mechanical stimuli |
| US11965175B2 (en) | 2016-05-25 | 2024-04-23 | Terumo Bct, Inc. | Cell expansion |
| US11685883B2 (en) | 2016-06-07 | 2023-06-27 | Terumo Bct, Inc. | Methods and systems for coating a cell growth surface |
| US11104874B2 (en) | 2016-06-07 | 2021-08-31 | Terumo Bct, Inc. | Coating a bioreactor |
| RU2627669C1 (ru) * | 2016-07-20 | 2017-08-09 | федеральное государственное бюджетное научное учреждение "Федеральный центр токсикологической, радиационной и биологической безопасности" (ФГБНУ "ФЦТРБ-ВНИВИ") | Способ получения продуктов метаболизма бифидобактерий для лечения комбинированного радиационно-термического поражения организма и способ лечения комбинированного радиационно-термического поражения организма |
| US11624046B2 (en) | 2017-03-31 | 2023-04-11 | Terumo Bct, Inc. | Cell expansion |
| JP7393945B2 (ja) | 2017-03-31 | 2023-12-07 | テルモ ビーシーティー、インコーポレーテッド | 細胞増殖 |
| US12234441B2 (en) | 2017-03-31 | 2025-02-25 | Terumo Bct, Inc. | Cell expansion |
| CN113004370B (zh) * | 2021-02-09 | 2022-06-17 | 宁波绿之健药业有限公司 | 一种具有缓解高尿酸血症和调节肠道菌群的二肽及其应用 |
| WO2022204315A1 (en) | 2021-03-23 | 2022-09-29 | Terumo Bct, Inc. | Cell capture and expansion |
| US12209689B2 (en) | 2022-02-28 | 2025-01-28 | Terumo Kabushiki Kaisha | Multiple-tube pinch valve assembly |
| USD1099116S1 (en) | 2022-09-01 | 2025-10-21 | Terumo Bct, Inc. | Display screen or portion thereof with a graphical user interface for displaying cell culture process steps and measurements of an associated bioreactor device |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DD248961A1 (de) | 1984-05-22 | 1987-08-26 | Akad Wissenschaften Ddr | Verfahren zur herstellung wundheilungsfoerdernder praeparationen |
| WO1995003067A1 (en) * | 1993-07-21 | 1995-02-02 | Khavinson Vladimir Khatskelevi | Pharmaceutical with immunomodulating activity |
| RU2080120C1 (ru) * | 1994-07-19 | 1997-05-27 | Совместное русско-американское акционерное общество закрытого типа "Неофарм" | Средство, обладающее иммуномодулирующей активностью |
| RU2110275C1 (ru) * | 1994-09-09 | 1998-05-10 | Дейгин Владислав Исакович | Способ получения пептида, обладающего анаболической активностью, стимулирующего увеличение массы тела, развитие эпидермального слоя и роста волосяного покрова |
-
1998
- 1998-06-23 RU RU98111342/14A patent/RU2139085C1/ru active
-
1999
- 1999-05-27 JP JP2000555634A patent/JP4489946B2/ja not_active Expired - Fee Related
- 1999-05-27 CH CH00366/00A patent/CH692477A5/de not_active IP Right Cessation
- 1999-05-27 DE DE69909794T patent/DE69909794T2/de not_active Expired - Lifetime
- 1999-05-27 IL IL14041299A patent/IL140412A0/xx active IP Right Grant
- 1999-05-27 AT AT99928267T patent/ATE245434T1/de active
- 1999-05-27 EP EP99928267A patent/EP1089753B1/de not_active Expired - Lifetime
- 1999-05-27 CA CA2335362A patent/CA2335362C/en not_active Expired - Fee Related
- 1999-05-27 WO PCT/RU1999/000188 patent/WO1999066948A2/en not_active Ceased
- 1999-05-27 AU AU45369/99A patent/AU776693B2/en not_active Ceased
- 1999-05-27 US US09/720,519 patent/US6642201B1/en not_active Expired - Fee Related
-
2000
- 2000-12-19 IL IL140412A patent/IL140412A/en not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| CH692477A5 (de) | 2002-07-15 |
| IL140412A0 (en) | 2002-02-10 |
| ATE245434T1 (de) | 2003-08-15 |
| RU2139085C1 (ru) | 1999-10-10 |
| US6642201B1 (en) | 2003-11-04 |
| CA2335362C (en) | 2012-11-20 |
| AU776693B2 (en) | 2004-09-16 |
| IL140412A (en) | 2007-06-17 |
| JP2002518459A (ja) | 2002-06-25 |
| EP1089753B1 (de) | 2003-07-23 |
| DE69909794D1 (de) | 2003-08-28 |
| WO1999066948A3 (en) | 2000-03-23 |
| AU4536999A (en) | 2000-01-10 |
| CA2335362A1 (en) | 1999-12-29 |
| WO1999066948A2 (en) | 1999-12-29 |
| JP4489946B2 (ja) | 2010-06-23 |
| EP1089753A2 (de) | 2001-04-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69909794T2 (de) | Verwendung eines dipeptids für wiederherstellungsprozesse | |
| DE69020573T2 (de) | Verfahren zur wachstumshemmung von stammzellen. | |
| EP0065747B1 (de) | Nonapeptid zur Behandlung von Suchtmittelentzugserscheinungen | |
| DE69434121T2 (de) | Pharmazeutische zusammensetzung zur immunverstärkenden therapie | |
| DE60213407T2 (de) | Zusammensetzungen zur hemmung der angiogenese | |
| DE69414904T2 (de) | Silikat-Polymer enthaltende pharmazeutische Zusammensetzungen | |
| DE60112431T2 (de) | Verwendung von biguanidederivaten zur herstellung eines vernarbungsfördernden medikaments | |
| DE69807710T2 (de) | Verwendung von Latenz Assoziierten Peptiden in der Herstellung eines Medikaments zur Verbesserung der Wundheilung. | |
| EP0240829A2 (de) | Cancerostatisches Mittel | |
| DE60038106T3 (de) | Anthelmintische zusammensetzungen | |
| DE69024053T2 (de) | Behandlung zur ermässigung von ödem und muskelschäden. | |
| EP1283047B1 (de) | Methode zur herstellung einer bioaktiven substanz aus blutserum | |
| DE2748399A1 (de) | Antimikrobielles mittel zur oertlichen anwendung | |
| EP0493662B1 (de) | Verwendung von Superoxiddismutasen für die Herstellung von Arzneimitteln zur Prophylaxe und/oder Behandlung von Organversagen bei Risikopatienten mit Polytrauma als Unfallfolge | |
| DE69914957T2 (de) | Nicht-festes topisch anzuwendendes arzneimittel enthaltend glyzerol und alchemilla vulgaris extrakt | |
| DE69220050T2 (de) | Verfahren zur inhibierung der fibrose | |
| CH621334A5 (de) | ||
| DE10228680A1 (de) | Grundlage für transdermale Formulierungen (PTF) | |
| DE4300969A1 (de) | ||
| DE3707532C2 (de) | Verwendung einer Kombination von Extr. Gingko biloba oder mindestens einem Gingkolid und Acetylsalicylsäure oder DL-Lysin-mono-acetylsalicylat oder Diflunisal zur Behandlung von Verbrennungen, Verbrühungen, Strahlenschäden und Erfrierungen | |
| DE2432393B2 (de) | Arzneipräparat zur Behandlung von bösartigen Neubildungen | |
| CH671516A5 (de) | ||
| DE69900336T2 (de) | Pentoxifyllin und antizytokin enthaltende pharmazeutische zusammensetzungen | |
| DE2221281C3 (de) | Pharmazeutische Zubereitungen mit entzündungshemmender und analgetischer Wirkung | |
| DE2228187A1 (de) | Arzneimittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |