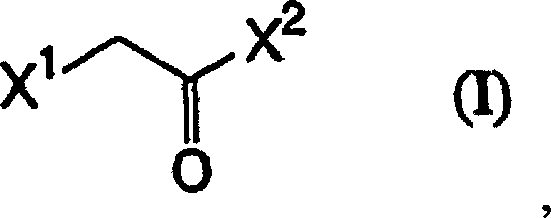-
Die vorliegende Erfindung betrifft
ein Verfahren zur rationellen Herstellung von N-Glycyltyrosin, einschließlich N-Glycyl-L-tyrosin
Dihydrat, welches eines der Dipeptide ist, die als Bestandteil von
Infusionen nützlich
sind. Die Erfindung betrifft auch ein Verfahren zur Herstellung
von N-Glycyl-L-tyrosin Dihydrat mit einer spezifischen Kristallstruktur.
-
Aminosäuren und Dipeptide davon sind üblicherweise
als Bestandteile von Infusionen verwendet worden. N-Glycyl-L-tyrosin
ist ein Derivat, das zu dem Zweck hergestellt wurde, die Löslichkeit
des sehr schlecht wasserlöslichen
L-Tyrosins zu verbessern.
-
Ein Verfahren zur Herstellung von
N-Glycyl-L-tyrosin ist in Berichte der Deutschen Chemischen Gesellschaft,
S. 2486 (1904) offengelegt. In dem Verfahren wird L-Tyrosin mit
1,1 Äquivalenten
Chloracetylchlorid und einer wässrigen
Natriumhydroxidlösung
umgesetzt, wobei N-Chloracetyl-L-tyrosin gewonnen wird, welches
dann mit wässrigem
Ammoniak zur Reaktion gebracht wird, um N-Glycyl-L-tyrosin herzustellen.
Dieses Verfahren ergibt N-Chloracetyl-Ltyrosin, welches ein Zwischenprodukt
in der Synthese von N-Glycyl-L-tyrosin ist, in 50 %iger Ausbeute.
Die obige Literaturstelle legt auch ein Verfahren offen, in dem
L-Tyrosinethylester mit 1,0 Äquivalenten
Chloracetylchlorid zur Reaktion gebracht wird, wobei der N-Chloracetyl-L-tyrosinethylester
gebildet wird, welcher dann hydrolysiert wird, um N-Chloracetyl-L-tyrosin
herzustellen. In diesem Verfahren beträgt die Gesamtausbeute von N-Chloracetyl-L-tyrosin
91%, bezogen auf den L-Tyrosinethylester, und bezogen auf L-Tyrosin
77%, da die Ausbeute in dem Umwandlungsschritt in den Ethylester
von L-Tyrosin 85% beträgt.
Das Verfahren zur Herstellung von N-Glycyl-L-tyrosin über den
L-Tyrosinethylester ist deshalb hinsichtlich der Ausbeute vorteilhafter
als das Verfahren, in dem L-Tyrosin direkt chloracetyliert wird.
Angewandt auf die Herstellung im industriellen Maßstab jedoch,
ist das ersterwähnte
Verfahren, das die Schritte der Veresterung und der Hydrolyse erfordert,
unwirtschaftlich verglichen mit dem letzteren Verfahren, das eine
geringere Anzahl an Schritten erfordert.
-
Ein anderes Verfahren zur Herstellung
von N-Halogenacetyl-L-tyrosin durch direkte Halogenacetylierung
von L-Tyrosin ist in Journal of Organic Chemistry, 18, 127 (1953)
und ibid., 18, 1546 (1953) offengelegt. In diesem Verfahren wird
N-Halogenacetyl-L-tyrosin durch eine Umsetzung von L-Tyrosin mit
1–2 Äquivalenten Chloracetylchlorid
in Ethylacetat unter Erhitzen unter Rückfluss hergestellt. Diese
Umsetzung muss unter harten Bedingungen durchgeführt werden. Ferner beträgt die Ausbeute
des Reaktionsprodukts 59% und deshalb ist das Verfahren hinsichtlich
des Nutzeffekts nicht zufriedenstellend.
-
Ein Verfahren zur Herstellung von
N-Chloracetylglutamin ist in EP-A-0678501 offengelegt. Die Synthese
von Di- und Polypeptiden ist in Zh. Obshch. Khim. Vol. 37, No 8:
1761–1764
(1967) beschrieben.
-
Die Kristallstruktur von N-Glycyl-L-tyrosin
Dihydrat ist in Crystal Structure Communication, 1, 301 (1972) offengelegt.
-
Unter diesen Umständen ist zur Herstellung von
N-Glycyltyrosin unter Verwendung von N-Halogenacetyltyrosin als Zwischenprodukt
ein Ein-Schritt-Verfahren zur Herstellung von N-Halogenacetyltyrosin aus Tyrosin in
hohen Ausbeuten gewünscht.
-
Eine Aufgabe der vorliegenden Erfindung
ist, N-Halogenacetyltyrosin rationell herzustellen und N-Glycyltyrosin
durch Ammonolyse von N-Halogenacetyltyrosin unter Verwendung von
Ammoniak, gegebenenfalls in Gegenwart von anorganischen Salzen,
rationell herzustellen. Eine andere Aufgabe der Erfindung ist, ein Verfahren
zur Herstellung von zur Verwendung als Bestandteil von Arzneimitteln
geeignetem N-Glycyl-L-tyrosin Dihydrat mit spezifischen Kristallstrukturen,
zur Verfügung
zu stellen.
-
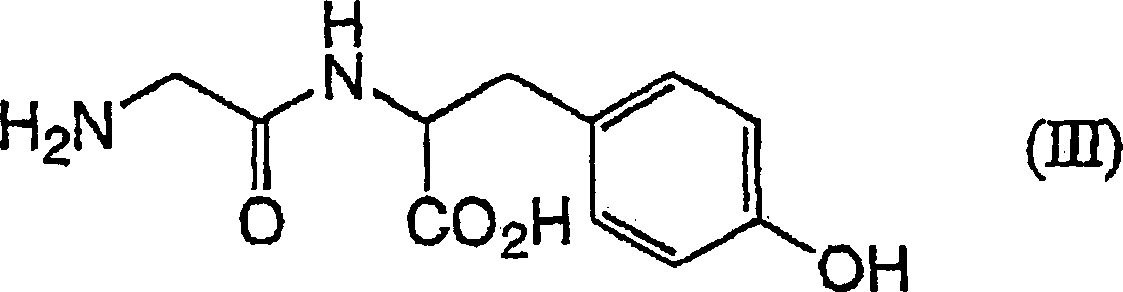
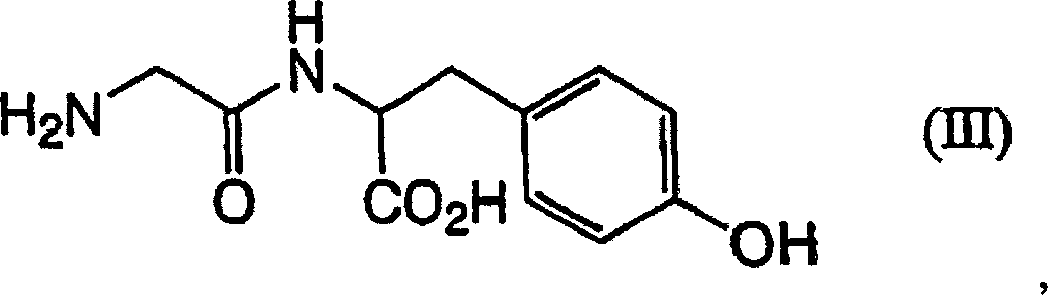
Die vorliegende Endung betrifft ein
Verfahren zur Herstellung von N-Glycyltyrosin der Formel (III):
oder eines Salzes oder Solvats
davon, umfassend gleichzeitiges Zutropfen von 2 oder mehr Äquivalenten
eines Halogenacetylhalogenids der Formel (I):
(wobei X
1 und
X
2, welche gleich oder unterschiedlich sein
können,
jeweils Chlor-, Brom- oder Iodatome darstellen) und einer wässrigen
Lösung
einer anorganischen Base in Gegenwart oder Abwesenheit eines organischen
Lösungsmittels
zu einer wässrigen
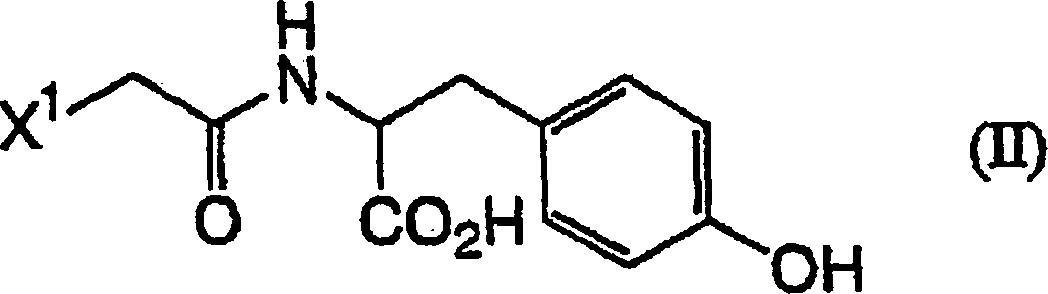
Suspension von Tyrosin oder eines Salzes davon, wobei N-Halogenacetyltyrosin
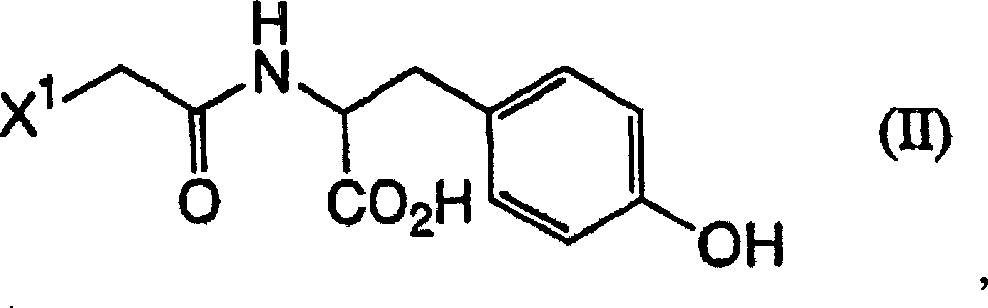
der Formel (II) gebildet wird:
(wobei X
1 die
oben angegebene Bedeutung hat) (Halogenacetylierung) und Umsetzen
des resultierenden N-Halogenacetyltyrosins mit einem Ammoniumion.
-
In diesem Verfahren werden die Reaktionstemperatur
und der pH-Wert des Reaktionsgemischs in dem Schritt der Halogenacetylierung
von Tyrosin vorzugsweise bei –20
bis 30°C,
beziehungsweise bei pH 8 bis 14, gehalten.
-
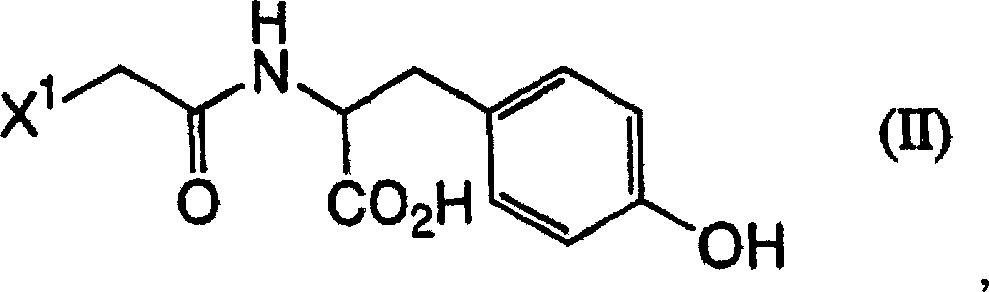
Die Erfindung betrifft ein Verfahren
zur Herstellung von N-Halogenacetyltyrosin der obigen Formel (II) oder
eines Salzes oder Solvats davon, umfassend gleichzeitiges Zutropfen
von 2 oder mehr Äquivalenten
eines Halogenacetylhalogenids der obigen Formel (I) und einer wässrigen
Lösung
einer anorganischen Base in Gegenwart oder Abwesenheit eines organischen
Lösungsmittels
zu einer wässrigen
Suspension von Tyrosin oder eines Salzes davon.
-
In diesem Verfahren werden die Reaktionstemperatur
und der pH-Wert des Reaktionsgemischs vorzugsweise bei –20 bis
30°C, beziehungsweise
bei pH 8 bis 14, gehalten.
-
Die Erfindung betrifft auch ein Verfahren
zur Herstellung von N-Glycyl-L-tyrosin Dihydrat mit einer Kristallstruktur,
die bei der Röntgen-Pulverdiffraktometrie,
innerhalb der experimen tellen Fehlergrenzen, folgendes Beugungsmuster
des Beugungswinkels 2 θ° und die
in Klammern angegebene relative Beugungsintensität % I/I0 ergibt:
7,96 (22), 15,20 (26), 15,86 (16), 18,92 (26), 19,96 (14), 21,16
(54), 21,52 (24), 23,08 (17), 23,84 (100), 26,44 (17), 27,08 (22),
28,88 (20), 31,64 (20), 33,72 (9), 35,28 (11). Das Verfahren ist
charakterisiert durch Umfassen von:
-
- (a) Herstellen eines Dihydrats mit dem oben
beschriebenen Verfahren und
- (b) Kristallisieren des Dihydrats aus einem Wasser-Ethanol-Lösunsmittelgemisch
mit einem Ethanolgehalt von 10–99
Vol.-%
-
(obige Kristallstruktur wird nachstehend
als Kristallstruktur A bezeichnet).
-
N-Glycyl-L-tyrosin Dihydrat mit einer
Kristallstruktur, die bei der Röntgen-Pulverdiffraktometrie,
innerhalb der experimentellen Fehlergrenzen, folgendes Beugungsmuster
des Beugungswinkels 2 θ° und die
in Klammern angegebene relative Beugungsintensität % I/I0 ergibt:
7,36 (16), 9,48 (17), 10,12 (23), 11,24 (100), 13,80 (14), 14,72
(19), 15,32 (58), 22,16 (59), 22,56 (37), 23,08 (56), 25,56 (31),
26,84 (28), 28,76 (39), 29,72 (38), 33,12 (22), 34,16 (23),
-
wird als Kristallstruktur B bezeichnet.
-
Tyrosin, das zur Herstellung von
N-Glycyltyrosin verwendet werden soll, kann in irgendeiner von D-, L-
oder D,L-Form vorliegen. Um N-Glycyl-L-tyrosin zu gewinnen, welches
ein als Bestandteil von Infusionen nützliches Dipeptid ist, wird
L-Tyrosin verwendet. Tyrosin kann als solches oder in der Form eines
Salzes verwendet werden. Bevorzugte Salze schließen ein Dinatriumsalz und ein
Monohydrochlorid ein.
-
Bevorzugte organische Lösungsmittel
für die
Herstellung von N-Halogenacetyltyrosin sind aromatische Kohlenwasserstoffe,
halogenierte Kohlenwasserstoffe, Fettsäureester, cyclische oder acyclische Ether-Verbindungen,
Ketone und Gemische davon. Bevorzugte anorganische Basen, die zusammen
mit einem Halogenacetylhalogenid zugetropft werden sollen, sind
Lithiumhydroxid, Natriumhydroxid, Kaliumhydroxid und Gemische davon.
Das Halogenacetylhalogenid wird bei der Umsetzung in einer Menge
von 2 oder mehr, vorzugsweise 2 bis 6, Äquivalenten, bezogen auf Tyrosin,
verwendet. Die Reaktionstemperatur liegt vorzugsweise bei –20 bis
30°C, stärker bevorzugt
bei –10
bis 10°C.
Das Reaktionsgemisch wird vorzugsweise bei pH 8 bis 14 gehalten,
stärker
bevorzugt bei pH 11 bis 13.
-
Chloracetylchlorid ist eines der
bevorzugten Halogenacetylhalogenide.
-
Die Halogenacetylierung von Tyrosin
wird in Gegenwart oder Abwesenheit eines organischen Lösungsmittels
durchgeführt.
Als organisches Lösungsmittel
können
aromatische Kohlenwasserstoffe (z. B. Benzol, Toluol und Xylol),
halogenierte Kohlenwasserstoffe (z. B. Chloroform, Methylenchlorid
und 1,2-Dichlorethan), Fettsäureester
(z. B. Ethylacetat und Isopropylacetat), cyclische oder acyclische
Etherverbindungen (z. B. Tetrahydrofuran und Diethylether) und Ketone
(z. B. Aceton und Ethylmethylketon) alleine oder in Kombination
verwendet werden, in einer Menge von vorzugsweise dem 0,5 bis 30fachen,
stärker
bevorzugt dem 0,5 bis 5fachen, der Menge an Tyrosin (Gewicht/Gewicht).
Wasser wird als Lösungsmittel
in einer Menge von vorzugsweise dem 1 bis 30fachen, stärker bevorzugt
dem 3 bis 5 fachen, der Menge an Tyrosin (Gewicht/Gewicht) verwendet.
Die Umsetzung wird vorzugsweise bei einer Temperatur von –20 bis
30°C, stärker bevorzugt bei –10 bis
10°C, und
vorzugsweise bei einem pH-Wert von 8 bis 14, stärker bevorzugt bei 11 bis 13,
durchgeführt.
Nach Vollendung der Umsetzung wird der pH-Wert der Wasserschicht
vorzugsweise auf unter 3 eingestellt, stärker bevorzugt auf 1 bis 2,
um Kristallisation zu bewirken. Die resultierenden Kristalle werden
durch Filtration isoliert, wodurch N-Halogenacetyltyrosin in hohen
Ausbeuten gewonnen wird. Dieses Verfahren ist darin vorteilhafter
gegenüber
den vorhergehenden Verfahren, dass N-Halogenacetyltyrosin in einem
Schritt aus Tyrosin in hohen Ausbeuten hergestellt werden kann.
Es erübrigt
sich zu sagen, dass im Reaktionsprodukt die optische Reinheit des
als Ausgangssubstanz verwendeten Tyrosins erhalten bleibt.
-
Die Herstellung von N-Glycyltyrosin
aus N-Halogenacetyltyrosin kann gemäß den in Berichte der Deutschen
Chemischen Gesellschaft, S. 2486 (1904) und Journal of Organic Chemistry,
18, 127 (1953) beschriebenen Methoden durchgeführt werden.
-
Quellen für Ammoniumionen, die für die Ammonolyse
nützlich
sind, schließen
wässrigen
Ammoniak, Ammoniak, Ammoniumhydrogencarbonat, Ammoniumcarbonat,
etc. ein, welche vorzugsweise in einer Menge von 10 bis 100, stärker bevorzugt
20 bis 100, Äquivalenten
verwendet werden.
-
Die durch das obige Verfahren hergestellten
gewünschten
Verbindungen können
mit üblicherweise
in der präparativen
organischen Chemie verwendeten Reinigungsverfahren gereinigt werden,
zum Beispiel Umkristallisation, Chromatographie oder Behandlung
mit Harz. Nicht nur freies N-Glycyltyrosin oder N-Halogenacetyltyrosin,
sondern auch N-Glycyltyrosin oder N-Halogenacetyltyrosin in der
Form eines Salzes oder Solvats, wie ein Hydrat, können durch übliche Verfahren
in der präparativen
organischen Chemie gewonnen werden. Kristallisation aus einem Wasser-Ethanol-Lösungsmittelgemisch
(Ethanolgehalt: 10–99
Vol.-%, vorzugsweise 15–50
Vol.-%) in der vorzugsweise 8 bis 30fachen, stärker bevorzugt 9 bis 15fachen,
Gewichtsmenge der Menge an N-Glycyl-L-tyrosin, vorzugsweise bei
0 bis 5°C
für vorzugsweise
eine Minute bis 100 Stunden, ergibt mit hoher Reproduzierbarkeit
N-Glycyl-L-tyrosin Dihydrat mit einer Kristallstruktur (Kristallstruktur
A), die spezifische Spektren in Kristallstrukturanalysen wie IR,
Röntgen-Pulverdiffraktometrie
und TG-DTA (thermogravimetrische und Differentialthermoanalyse)
zeigt. Kristallisation aus Wasser in der vorzugsweise 5 bis 30fachen,
stärker
bevorzugt 5 bis 10fachen, Gewichtsmenge der Menge an N-Glycyl-L-tyrosin, bei vorzugsweise
0 bis 5°C
für vorzugsweise
mehr als 20, stärker
bevorzugt 20 bis 100 Stunden, ergibt mit hoher Reproduzierbarkeit
N-Glycyl-L-tyrosin Dihydrat mit einer Kristallstruktur (Kristallstruktur
B), die spezifische Spektren, verschieden von jenen bei der Verwendung
eines Wasser-Ethanol-Lösungsmittelgemischs
beobachteten, in Kristallstrukturanalysen wie IR, Röntgen-Pulverdiffraktometrie
und TG-DTA (thermogravimetrische und Differentialthermoanalyse)
zeigt.
-
Bestimmte Ausführungsformen der Endung werden
in den folgenden Beispielen und dem Referenzbeispiel veranschaulicht.
-
Beispiel 1
-
Herstellung
von N-Chloracetyl-L-tyrosin
-
L-Tyrosin (600 g, 3,31 mol) wurde
in einem Gemisch aus 1200 ml destilliertem Wasser, 900 ml einer 4N
wässrigen
Natriumhydroxidlösung
und 600 ml Toluol suspendiert und die Suspension auf –5 bis 0°C abgekühlt. Zu
dieser Suspension wurden gleichzeitig ein Gemisch aus 792 ml (9,93
mol) Chloracetylchlorid und 792 ml Toluol und eine 10N wässrige Natrium hydroxidlösung zugetropft,
wobei das Reaktionsgemisch bei einem pH-Wert von 12 bis 12,6 und
einer Temperatur unter 5°C
gehalten wurde. Nachdem die Zugabe vollendet war, wurde das resultierende
Gemisch mit konzentrierter Salzsäure
auf pH 8,5 eingestellt, gefolgt von der Abtrennung der Wasserschicht.
Die Überführung von
N-Chloracetyl-L-tyrosin in die Wasserschicht betrug 92,6%. Die Wasserschicht
wurde mit konzentrierter Salzsäure
auf pH 1,5 eingestellt und die ausgefallenen Kristalle wurden durch
Filtration isoliert und dann in 600 ml destilliertem Wasser suspendiert.
Die Suspension wurde eisgekühlt
und die ausgefallenen Kristalle durch Filtration isoliert, was 707
g (2,74 mol, 82,8%) der gewünschten Verbindung
ergab.
Schmelzpunkt: 154°C
(Zersetzung)
Elementaranalyse:
Gef.: C 51,27, H 4,74,
N 5,39%
Ber. für
C11H1
2ClNO4: C 51,27, H 4,69, N 5,44%
IR-Absorptionsspektrum
(KBr, cm–1):
3290, 1707, 1659, 1556, 1516, 1452, 1231, 1105 1H-NMR-Spektrum
(DMSO-d6, δ ppm): 2.80 (dd, J = 8.6, 3.9Hz,
1H), 2.95 (dd, J = 5.0, 13.9Hz, 1H), 4.06 (s, 2H), 4.37 (ddd, J
= 5.0, 8.2, 8.3Hz, 1H), 6.65 (d, J = 8.4Hz, 2H), 6.99 (d, J = 8.4Hz,
2H), 8.40 (d, J = 7.9Hz, 1H), 9.21 (br, 1H)
-
Referenzbeispiel 1
-
Vergleich der Menge (ausgedrückt in Äquivalenten)
an Chloracetylchlorid bei der Herstellung von N-Chloracetyl-L-tyrosin
-
L-Tyrosin (10 g, 55,2 mmol) wurde
in einem Gemisch aus 15 ml einer 4N wässrigen Natriumhydroxidlösung und
10 ml Toluol suspendiert und die Suspension auf –5 bis 0°C abgekühlt. Zu dieser Suspension wurden
gleichzeitig ein 1 : 1-Gemisch aus Chloracetylchlorid und Toluol
und eine 4N wässrige
Natriumhydroxidlösung
zugetropft, wobei das Reaktionsgemisch bei einem pH-Wert von 12
bis 12,5 und einer Temperatur unter 5°C gehalten wurde. Nachdem die
Zugabe vollendet war, wurde die Wasserschicht abgetrennt und die Überführung von
N-Chloracetyl-L-tyrosin
in die Wasserschicht gemessen. Das Ergebnis wird in der folgenden
Tabelle gezeigt.
-
-
Beispiel 2
-
Herstellung von N-Glycyl-L-tyrosin
Dihydrat und Herstellung von Kristallen davon mit Kristallstruktur
A
-
Ammoniumhydrogencarbonat (1289 g)
wurde in einem Gemisch aus 4000 ml 28%igem wässrigem Ammoniak und 1000 ml
destilliertem Wasser bei 35°C
gelöst.
Zu der Lösung
wurden 700 g (2,72 mol) N-Chloracetyl-L-tyrosin und 700 ml destilliertes
Wasser zugegeben, gefolgt von Rühren
bei 40°C
für 5 Stunden.
Das Reaktionsgemisch wurde unter vermindertem Druck eingeengt, um überschüssigen Ammoniak
zu entfernen, und dann bei 45°C
mit konzentrierter Salzsäure
auf pH 5,5 eingestellt, gefolgt von allmählichem Abkühlen. Nachdem Kristalle ausgefallen
waren, wurde das Gemisch eisgekühlt
und die Kristalle durch Filtration isoliert, was 600 g (489 g bezogen
auf die wasserfreie Substanz, 2,05 mol, 75,4%) rohe Kristalle von
N-Glycyl-L-tyrosin ergab.
-
Die gewonnenen rohen Kristalle (589
g, 480 g bezogen auf die wasserfreie Substanz, 2,01 mol) wurden
in 9600 ml destilliertem Wasser bei 40°C gelöst. Die Lösung wurde durch eine Säule mit
einem schwach basischen Harz (WA-30 OH, 960 ml) geleitet und die
Fraktionen, die die gewünschte
Verbindung enthielten, wurden gesammelt. Die vereinigte wässrige Lösung wurde
unter vermindertem Druck auf 2667 ml eingeengt und 1333 ml Ethanol
dazu zugegeben, gefolgt von Umkristallisation. Die resultierenden
Kristalle wurden unter vermindertem Druck getrocknet, was 482 g
(1,76 mol, 87,5%) der gewünschten
Verbindung ergab.
Schmelzpunkt: 277°C (Zersetzung)
Elementaranalyse:
Gef.:
C 48,27, H 6,51, N 10,21%
Ber. für C11H1
4N2O4·2H2O: C 48,17, H 6,61, N 10,21%
IR-Absorptionsspektrum
(KBr, cm–1):
3361, 1668, 1537, 1458, 1421, 1389, 1240, 1148, 1115 1H-NMR-Spektrum
(DMSO-d6, δ ppm): 2.75 (dd, J = 7.4, 13.6Hz,
1H), 2.96 (dd, J = 4.3, 13.6Hz, 1H), 3.29 (d, J = 16.4Hz, 1H), 3.43
(d, J = 16.4Hz, 1H), 4.22 (m, 1H), 6.63 (d, J = 7.3Hz, 2H), 6.96
(d, J = 7.7Hz, 2H), 8.21 (m, 1 H)
Röntgen-Pulverdiffraktometrie
[Beugungswinkel 2 θ°, relative
Intensität
% I/I0 (in Klammern angegeben)]: 7,96 (22),
15,20 (26), 15,86 (16), 18,92 (26), 19,96 (14), 21,16 (54), 21,52
(24), 23,08 (17), 23,84 (100), 26,44 (17), 27,08 (22), 28,88 (20),
31,64 (20), 33,72 (9), 35,28 (11)
-
Beispiel 3
-
Herstellung von Kristallen
von N-Glycyl-L-tyrosin Dihydrat mit Kristallstruktur B
-
N-Glycyl-L-tyrosin Dihydrat (118,5
g, 100,0 g bezogen auf die wasserfreie Substanz, 0,432 mol), gewonnen
in Beispiel 2, wurde in 600 ml destilliertem Wasser bei 25°C suspendiert,
gefolgt von Kristallisation bei 5°C
für 46
Stunden. Die resultierenden Kristalle wurden unter vermindertem
Druck getrocknet, was 106,4 g (0,388 mol, 89,8%) der gewünschten
Verbindung ergab.
Schmelzpunkt: 277°C (Zersetzung)
IR-Absorptionsspektrum
(KBr, cm 1): 3327, 1653, 1545, 1516, 1462,
1445, 1414, 1379, 1253, 1107
Röntgen-Pulverdiffraktometrie
[Beugungswinkel 2 θ°, relative
Intensität
% I/I0 (in Klammern angegeben)]: 7,36 (16),
9,48 (17), 10,12 (23), 11,24 (100), 13,80 (14), 14,72 (19), 15,32
(58), 22,16 (59), 22,56 (37), 23,08 (56), 25,56 (31), 26,84 (28),
28,76 (39), 29,72 (38), 33,12 (22), 34,16 (23)