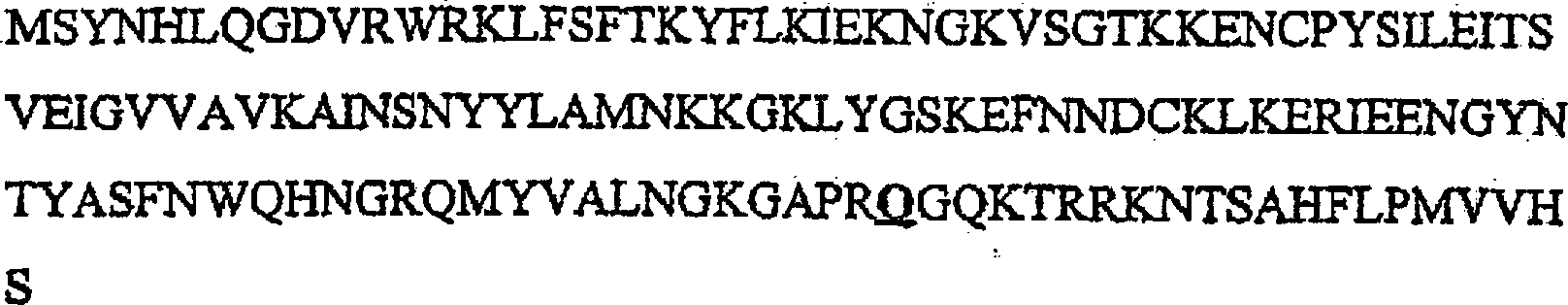-
Gebiet der
Erfindung
-
Diese Erfindung betrifft neu identifizierte
Polynucleotide, Polypeptide, die von derartigen Polynucleotiden
codiert werden, die Verwendung derartiger Polynucleotide und Polypeptide
sowie die Herstellung derartiger Polynucleotide und Polypeptide.
Genauer gesagt, sind die Polypeptide der vorliegenden Erfindung
Mutanten des Keratinocyten-Wachstumsfaktors, manchmal nachstehend
als „KGF-2" bezeichnet und auch
früher
als Fibroblasten-Wachstumsfaktor-12 (FGF-12) bekannt. Die Erfindung
betrifft auch die Hemmung der Wirkung derartiger Polypeptide. Diese
Erfindung betrifft ferner die therapeutische Verwendung von KGF-2-Mutanten zur Förderung
oder Beschleunigung der Wundheilung. Diese Erfindung betrifft neue
Mutantenformen von KGF-2, die erhöhte Aktivität, erhöhte Stabilität, höheren Ertrag
oder bessere Löslichkeit
zeigen. Zusätzlich
betrifft diese Erfindung ein Verfahren zur Reinigung der KGF-2-Mutanten.
-
Hintergrund
der Erfindung
-
Die Familie der Fibroblasten-Wachstumsfaktoren
entstammt der großen
Familie der Wachstumsfaktoren, die am Wachstum und der Regeneration
von weichem Gewebe beteiligt ist. Derzeit schließt sie mehrere Mitglieder ein,
die einen variierenden Homologiegrad auf Proteinebene teilen und
die mit einer Ausnahme ein ähnlich
breites mitogenes Spektrum aufzuweisen scheinen, d. h. sie fördern die
Proliferation einer Reihe von Zellen mesodermalen und neuroektodermalen
Ursprungs und/oder fördern
die Angiogenese.
-
Das Expressionsmuster verschiedener
Mitglieder der Familie ist sehr unterschiedlich, und reicht von äußerst begrenzter
Expression einiger Entwicklungsstadien bis zu einer ziem lich ubiquitären Expression
in einer Reihe von Geweben und Organen. Alle Mitglieder scheinen
Heparin und Heparinsulfatprotoglycane und Glycosaminoglycane zu
binden und sich stark in der extrazellulären Matrix zu konzentrieren.
KGF wurde ursprünglich
als Mitglied der FGF-Familie durch Sequenzhomologie oder Reinigung
und Clonierung des Faktors identifiziert. Der Keratinocyten-Wachstumsfaktor
(KGF) wurde als Mitogen für
eine gezüchtete
Maus-Keratinocytenlinie isoliert (Rubin, J. S. et al., Proc. Natl.
Acad Sci USA 86: 802–806
(1989)). Im Gegensatz zu den anderen Mitgliedern der FGF-Familie übt er wenig
Aktivität
auf Mesenchym-abstammende Zellen aus, aber er stimuliert das Wachstum
von Epithelzellen. Das Gen des Keratinocyten-Wachstumsfaktors codiert
ein Polypeptid mit 194 Aminosäuren
(Finch, P. W. et al., Science 245: 752–755 (1989)). Die N-terminalen
64 Aminosäuren
sind einzigartig, aber der Rest des Proteins besitzt etwa 30% Homologie
zu bFGF. KGF ist das unterschiedlichste Mitglied der FGF-Famile.
Das Molekül
besitzt eine hydrophobe Signalsequenz und wird effizient sekretiert.
Posttranslationale Modifikationen schließen die Spaltung der Signalsequenz
und die N-verbundene Glycosylierung an einer Stelle ein, was zu
einem Protein mit 28 kDa führt.
Der Keratinocyten-Wachstumsfaktor wird von Fibroblasten produziert,
die von der Haut und der fötalen
Lunge stammen (Rubin et al. (1989)). Man fand heraus, dass die Keratinocyten-Wachstumsfaktor-mRNA
in den Nieren, im Darm und Ileum von Erwachsenen, jedoch nicht im
Gehirn oder in der Lunge exprimiert wird (Finch, P. W. et al. Science
245: 752–755 (1989)).
KGF zeigt konservierte Bereiche innerhalb der FGF-Proteinfamilie.
KGF bindet mit hoher Affinität
an den FGF-2-Rezeptor.
-
Eine gehemmte Wundheilung ist eine
wesentliche Quelle der Morbidität
und kann zu solchen Komplikationen wie Deshiszenz, anastomotischen
Zusammenbruch und nicht heilenden Wunden führen. Beim normalen Individuum
erfolgt die Wundheilung ohne Komplikationen. Dagegen ist die beeinträchtigte
Wundheilung mit verschiedenen Erkrankungen wie Diabetes, Infektionen,
Immunsuppression, Adipositas und Mangelernährung assoziiert (Cruse, P.
J und Foord, R., Arch. Surg. 107: 206 (1973); Schrock T. R. et al.,
Ann. Surg. 177: 513 (1973); Poole, G. U., Jr., Surgery. 97: 631
(1985); Irvin, G. L. et al., Am. Surg. 51: 418 (1985)).
-
Wundheilung ist das Ergebnis komplexer
Interaktionen und biologischer Prozesse. Bei der normalen Wundheilung
wurden drei Phasen beschrieben: akute inflammatorische Phase, Synthese
der extrazellulären Matrix
sowie Collagensynthese und Remodellierung (Peacock, E. E., Jr.,
Wound Repair, 2. Ausgabe, WB Saunders, Philadelphia (1984)). Der
Vorgang bein haltet die Interaktion der Keratinocyten, Fibroblasten
und inflammatorischen Zellen an der Wundstelle.
-
Die Geweberegeneration scheint von
spezifischen Peptidfaktoren gesteuert zu werden, die die Migration
und Proliferation der am Reparaturvorgang beteiligten Zellen regulieren
(Barrett, T. B. et al, Proc. Natl. Acad. Sci. USA 81: 6772–6774 (1985);
Collins, T. et al., Nature 316: 748–750 (1985)). Somit können Wachstumsfaktoren
vielversprechende Therapeutika bei der Behandlung von Wunden, Verbrennungen
und anderen Hautstörungen
sein (Rifkin, D. B. und Moscatelli, J. Cell. Biol. 109: 1–6 (1989);
Sporn, M. B. et al., J. Cell. Biol. 105: 1039–1045 (1987); Pierce, G. F.
et al., J. Cell. Biochem. 45; 319–326 (1991)). Die Sequenz des
Heilungsprozesses wird während
einer akuten inflammatorischen Phase mit der Ablagerung von provisorischem
Gewebe initiiert. Darauf folgt die Reepithelialisierung, Collagensynthese
und Ablagerung, Fibroblastenvermehrung und Neovaskularisation, von
denen alle letztendlich die Remodellierungsphase definieren (Clark,
R. A. F., J. Am. Acad. Dermatol. 13: 701 (1985)). Diese Ereignisse
werden von Wachstumsfaktoren und Cytokinen beeinflusst, die von
inflammatorischen Zellen oder von den an den Wundrändern lokalisierten
Zellen sekretiert werden (Assoian, R. K. et al., Nature (Load.)
309: 804 (1984); Nemeth, G. G. et al., „Growth Factors and Their Role
in Wound and Fracture Healing, „ Growth Factors and Other
Aspects of Wound Healing in Biological and Clinical Implications,
New York (1988), S. 1–17).
-
Mehrere Polypeptidurchstumsfaktoren,
einschließlich
des Keratinocyten-Wachstumsfaktors (KGF) (Antioniades, H. et al.,
Proc. Natl. Acad. Sci. USA 88: 565 (1991)), dem Thrombocyten-Wachstumsfaktors (PDGF)
(Antioniades, H. el al., Proc. Natl. Acad. Sci. USA 88: 565 (1991);
Staiano-Coico, L. et al., Jour. Exp. Med 178: 865–878 (1993)),
dem basischen Fibroblasten-Wachstumsfaktors (bFGF) (Golden, M. A.
et al., J Clin. Invest. 87: 406 (1991)), des sauren Fibroblasten-Wachstumsfaktors
(aFGF) (Mellin, T. N. et al., J Invest. Dermatol. 104: 850–855 (1995)),
des epidermalen Wachstumsfaktors (EGF) (Whitby, D. J. und Ferguson,
W. J., Dev. Biol. 147: 207 (1991)), des transformierenden Wachstumsfaktors
a (TGF-α)
(Gartner, M. H. et al., Surg. Forum 42: 643 (1991); Todd, R. et
al., Am. J. Pathol. 138; 1307 (1991)), des transformierenden Wachstumsfaktors β (TGF-β) (Wong,
D. T. W. et al., Am. J. Pathol. 143: 622 (1987)), des Neu-Differentzierungsfaktors (rNDF)
(Danilenko, D. M. et al., J Clin. Invest, 95; 842–851 (1995)),
des insulinartigen Wachstumsfaktors I (IGF-1) und des insulinartigen
Wachstumsfaktors Π (IGF-Π) (Cromack,
D. T. et al., J. Surg. Res. 42: 622 (1987)) wurden identifiziert,
an der Wundheilung beteiligt zu sein.
-
Es wurde berichtet, dass rKGF-1 in
der Haut die epidermalen Keratinocyten, die Keratinocyten in den Haarfollikeln
und den Talgdrüsen
stimuliert (Pierce, G. F. et al., J. Exp. Med. 179: 831–840 (1994)).
-
Zusammenfassung
der Erfindung
-
Hier werden Nucleinsäuremoleküle aufgeführt, die
ein Polynucleotid umfassen, das den Keratinocyten-Wachstumsfaktor
(KGF-2) codiert, der die in 1 [SEQ
ID NR: 2] dargestellte Aminosäuresequenz
besitzt, oder die Aminosäuresequenz,
die von dem in einem bakteriellen Wirt als ATCC-Hinterlegungsnummer 75977
am 16. Dezember 1994 hinterlegten cDNA-Clou codiert wird. Die durch
Sequenzieren des hinterlegten KGF-2-Clons bestimmte Nucleotidsequenz,
die in 1 [SEQ ID NR:
1] dargestellt ist, enthält
einen offenen Leserahmen, der ein Polypeptid mit 208 Aminosäureresten,
einschließlich
eines Initiationscodons bei den Positionen 1–3 mit einer vorhergesagten
Leader-Sequenz von etwa 35 oder 36 Aminosäureresten und einem abgeleiteten
Molekulargewicht von etwa 23,4 kDa codiert. Die Aminosäuresequenz
des reifen KGF-2 ist in 1 dargestellt;
Aminosäurereste
etwa 36 oder 37 bis 208 [SEQ ID NR: 2].
-
Das Polypeptid, das von derartigen
Nucleinsäuren
codiert wird, wurde vermutlich als Mitglied der FGF-Familie identifiziert.
Genauer gesagt, wurde das Polypeptid vermutlich als KGF-2 aufgrund
der Aminosäuresequenzhomologie
mit anderen Mitgliedern der FGF-Familie identifiziert.
-
Nach einem Aspekt der vorliegenden
Erfindung werden neuartige Mutanten der KGF-2-Polypeptide bereitgestellt, die biologisch
aktiv und diagnostisch oder therapeutisch nützlich sind.
-
Die Polypeptide der vorliegenden
Erfindung sind menschlichen Ursprungs.
-
Nach einem weiteren Aspekt der vorliegenden
Erfindung werden Nucleinsäuremoleküle, die
menschliche KGF-2 Mutanten codieren, einschließlich mRNAs, DNAs, cDNAs und
genomische DNA bereitgestellt, die biologisch aktiv sind und diagnostisch
oder therapeutisch nützlich
sind.
-
Nach einem weiteren Aspekt der vorliegenden
Erfindung wird ein Verfahren zur Herstellung eines derartigen Polypeptids
durch rekombinante Verfahren unter Verwendung rekombinanter Vektoren
wie Clonierungs- und Expressionsplasmide bereitgestellt, die als
Rea genzien in dem rekombinanten Verfahren der Proteine der KGF-2-Mutanten
nützlich
sind sowie rekombinante prokaryontische und/oder eukaryontische
Wirtszellen, die die menschlichen Nucleinsäuresequenzen der KGF-2-Mutanten
umfassen.
-
Nach einem noch weiteren Aspekt der
vorliegenden Erfindung wird ein Verfahren zur Nutzung eines derartigen
Polypeptids oder eines derartigen Polynucleotids bereitgestellt,
das ein derartiges Polypeptid für therapeutische
Zwecke codiert, beispielsweise, um die Proliferation der Epithelzellen
und basalen Keratinocyten für
Wundheilungszwecke zu stimulieren und um die Haarfollikelproduktion
und die Heilung von Hautwunden zu stimulieren. KGF-2 kann klinisch
bei der Stimulation der Wundheilung, einschließlich Operationswunden, Schnittwunden,
tiefe Wunden, die eine Schädigung
der Dermis und Epidermis beinhalten, Wunden des Augengewebes, Wunden
des Dentalgewebes, Wunden der Mundhöhle, diabetische Geschwüre, Hautgeschwüre, Cubitusgeschwüre, arterielle
Geschwüre,
Venenstaugeschwüre,
Verbrennungen, die auf Hitzeexposition oder Chemikalien zurückzuführen sind,
und anderen abnormen Zustände
der Wundheilung wie Urämie, Mangelernährung, Vitaminmangel
und Komplikationen, die mit einer systemischen Behandlung mit Steroiden, Strahlentherapie
und antineoplastischen Medikamenten und Antimetaboliten assoziiert
sind, nützlich
sein. KGF-2 kann verwendet werden, um den Wiederaufbau der Haut
nach Hautverlust zu fördern.
-
KGF-2 kann verwendet werden, um die
Haftung von Hauttransplantaten an ein Wundbett zu erhöhen und
die Reepithelialisierung aus dem Wundbett zu stimulieren. Folgende
sind Transplantatarten, bei denen KGF-2 verwendet werden könnte, um
die Haftung von Hauttransplantaten an ein Wundbett zu erhöhen: Autotransplantate,
künstliche
Haut, Allotransplantate, autodermale Transplantate, autoepidermale
Transplantate, avaculäre
Transplantate, Blair-Brown-Transplantate, Knochentransplantat, brephoplastische
Transplantate, Cutistransplantat, verzögertes Transplantat, Hauttransplantat,
Epidermistransplantat, Fascia-Transplantat, Vollhauttransplantat,
heterologes Transplantat, Xenotransplantat, homologes Transplantat,
hyperplastisches Transplantat, lamelläres Transplantat, Maschentransplantat,
Schleimhauttransplantat, Ollier-Thiersch-Transplantat, Omentum-Plastik,
Streifenplastik, Stiel-Transplantat, Spalthauttransplantat, dickes
Spalthaut-Transplantat. KGF-2 kann verwendet werden, um die Hautfestigkeit
zu fördern
und das Erscheinungsbild gealterter Haut zu verbessern.
-
Man glaubt, dass KGF-2 auch Änderungen
bei der Hepatocytenproliferation und der Epithelzellenproliferation
in der Lunge, Brust, Pankreas, Magen, Dünndarm und Dickdarm hervorruft.
KGF-2 kann die Proliferation von Epithelzellen wie Sebocyten, Haarfollikel,
Hepatocyten, Typ-II-Pneumocyten, Mucin-produzierenden Gobletzellen
und anderen Epithelzellen und ihre in Haut, Lunge, Leber und dem
Gastrointestinaltrakt enthaltenen Vorläufer fördern. KGF-2 kann die Proliferation
von Endothelzellen, Keratinocyten und basalen Keratinocyten fördern.
-
KGF-2 kann auch verwendet werden,
um die Nebenwirkungen der Toxizität auf den Darm zu reduzieren,
die auf Strahlung, Chemotherapiebehandlungen und Virusinfektionen
zurückzuführen sind.
KGF-2 kann auch eine kryoprotektive Wirkung auf die Dünndarmschleimhaut
haben. KGF-2 kann auch die Heilung von Mucositis (Mundgeschwüren) fördern, die
auf Chemotherapie und Virusinfektionen zurückzuführen sind.
-
KGF-2 kann ferner zur vollständigen Regenerierung
der Haut bei Voll- und Teilhautdefekten, einschließlich Verbrennungen
(d. h. die Repopulation von Haarfollikeln, Schweißdrüsen und
Talgdrüsen)
und der Behandlung anderer Hautdefekte wie Psoriasis verwendet werden.
KGF-2 kann verwendet werden, um Epidermolysis bullosa, einen Defekt
bei der Haftung der Epidermis an die darunter liegende Dermis, zu
behandeln, die zu häufigen,
offenen und schmerzhaften Blasen führt, indem die Reepithelialisierung
dieser Läsionen beschleunigt
wird. KGF-2 kann auch verwendet werden, um Magen- und Zwölffinderdarmgeschwüre zu behandeln
und die schnellere Heilung durch Narbenbildung der Schleimhaut und
Regeneration der Drüsenschleimhaut
und Zwölffingerdarmschleimhaut
zu unterstützen.
Entzündliche
Darmerkrankungen wie Morbus Crohn oder Colitis ulcerosa sind Krankheiten,
die zur Zerstörung
der Schleimhautoberfläche
des Dünndarms bzw.
des Dickdarms führen.
Somit könnte
KGF-2 verwendet werden, um die Erzeugung einer neuen Schleimhautoberfläche zu fördern, um
die schnellere Heilung zu unterstützen und um das Fortschreiten
der entzündlichen
Darmerkrankungen zu verhindern. Man erwartet, dass die KGF-2-Behandlung
einen wesentlichen Effekt auf die Schleimhautproduktion im Gastrointestinaltrakt
hat und verwendet werden könnte,
um die Darmschleimhaut vor verletzenden Substanzen zu schützen, die
aufgenommen werden oder auf einen chirurgischen Eingriff folgen.
KGF-2 kann verwendet werden, um Krankheiten zu behandeln, die mit
der Unterexpression von KGF-2 assoziiert sind.
-
Außerdem kann KGF-2 verwendet
werden, um Lungenschäden
aufgrund verschiedener pathologischer Zustände zu verhindern und zu heilen.
Ein Wachstumsfaktor wie KGF-2, der die Proliferation und Differenzierung
stimulieren und die Reparatur der Alveolen und des Bronchienepithels
fördern
könnte,
kann verwendet werden, um akute oder chronische Lungenschäden zu verhindern
oder zu behandeln. Beispielsweise könnte ein Emphysem, das zu einem
progressiven Alveolenverlust und Verletzungen beim Einatmen führt, d. h.
die auf das Einatmen von Rauch und Verbrennungen zurückzuführen sind,
was die Nekrose des Bronchienepithels und Alveolen verursacht, effektiv
mit KGF-2 behandelt werden. KGF-2 kann auch verwendet werden, um
bei Frühgeburten
die Proliferation und Differenzierung von Typ-II-Pneumonocyten zu
stimulieren, die helfen können,
Krankheiten wie hyaline Membranerkrankungen wie das Atemnotsyndrom
des Neugeborenen und bronchopulmonäre Displasie zu behandeln oder
zu verhindern.
-
KGF-2 könnte die Proliferation und
Differenzierung von Hepatocyten stimulieren und könnte somit
verwendet werden, um Lebererkrankungen und Pathologien wie fulminantes,
durch Zirrhose verursachtes, Leberversagen, durch virale Hepatitis
und toxische Substanzen (d. h. Acetaminophen, Tetrachlorkohlenstoff
und andere aus dem Fachgebiet bekannte Toxine) verursachte Leberschäden zu lindern
oder zu behandeln.
-
Zusätzlich könnte KGF-2 auch verwendet werden,
um den Ausbruch von Diabetes mellitus zu behandeln oder zu verhindern.
Bei Patienten mit neu diagnostiziertem Diabetes Typ I und Typ II,
bei dem noch etwas Funktion der Inselzellen übrig bleibt, könnte KGF-2
verwendet werden, um die Funktion der Inselzellen zu erhalten, um
die permanente Manifestation der Krankheit zu lindern, zu verzögern oder
zu verhindern. KGF-2 könnte
auch als Hilfsmittel bei der Transplantation von Inselzellen verwendet
werden, um die Inselzellfunktion zu verbessern oder zu fördern.
-
Ferner werden hier mimetische Peptide
von KGF-2 beschrieben, die als therapeutische Peptide verwendet
werden können.
Mimetische KGF-2-Peptide sind kurze Peptide, die die biologische
Aktivität
des KGF-2-Proteins nachahmen, indem sie an die verwandten Rezeptoren
von KGF-2 binden und sie aktivieren. Mimetische KGF-2-Peptide können auch
an die verwandten Rezeptoren von KGF-2 binden und sie hemmen.
-
Außerdem können Antagonisten gegen derartige
Polypeptide verwendet werden, um die Wirkung derartiger Polypeptide
zu hemmen, beispielsweise, um die Narbenbildung während des
Wundheilungsprozesses zu reduzieren und die Tumorproliferation,
diabetische Retinopathie, rheumatoide Arthritis, Osteoarthritis
und Tumorwachstum zu verhindern und/oder zu behandeln. KGF-2-Antagonisten
können
auch verwendet werden, um Krankheiten zu behandeln, die mit der Überexpression
von KGF-2 assoziiert sind.
-
Diagnostische Tests können zum
Nachweis von Krankheiten oder der Anfälligkeit für Krankheiten verwendet werden,
die mit Mutationen in der KGF-2-Nucleinsäuresequenz oder Überexpression
der Polypeptide zusammenhängen,
die von derartigen Sequenzen codiert werden. Derartige Polypeptide
oder Polynucleotide, die derartige Polypeptide codieren, können für in vitro-Zwecke
verwendet werden, die mit wissenschaftlicher Forschung, DNA-Synthese
und der Herstellung von DNA-Vektoren zusammenhängen.
-
Somit stellt ein erfindungsgemäßer Aspekt
eine Mutante des KGF-2-Polypeptids bereit, ausgewählt aus
der Gruppe, bestehend aus:
- (a) einer N-terminalen
Deletionsmutante von KGF-2, wobei die Mutante aus der Aminosäuresequenz
Ala (63) bis Ser (208) der SEQ ID NR: 2 oder aus der Aminosäuresequenz
Ala (63) bis Ser (208) des Proteins besteht, das durch die in dem
Plasmid ATCC 75977 enthaltene cDNA codiert ist, und wobei die Mutante
ein N-terminales Methionin enthält;
- (b) einem Polypeptid, das eine Aminosäuresequenz besitzt, die mindestens
90%, 95%, 97% oder 99% mit der Aminosäuresequenz der KGF-2 Mutante
nach (a) identisch ist;
- (c) einem Polypeptid nach (a), wobei das Polypeptid mindestens
eine Aminosäuresubstitution
hat, ausgewählt
aus der Gruppe, bestehend aus Arg(194)Glu, Arg(194)Gln, Lys(191)Glu,
Lys(191)Gln, Arg(188)Glu und Lys(183)Glu.
-
Die erfindungsgemäße Mutante kann ein Polynucleotid
sein, das unter stringenten Hybridisierungsbedingungen mit einem
vorstehenden Polynucleotid nach (a) hybridisiert. Dieses hybridisierende
Polynucleotid hybridisiert nicht unter stringenten Hybridisierungsbedingungen
mit einem Polynucleotid, das eine Nucleotidsequenz besitzt, die
nur aus A-Resten oder nur aus T-Resten besteht.
-
Das Polynucleotid kann die Aminosäuresequenz
eines Epitop-tragenden Anteils eines KGF-2 codieren, der eine vorstehende
Aminosäuresequenz
nach (a), (b) oder (c) besitzt.
-
Nach einem weiteren Aspekt der vorliegenden
Erfindung werden neuartige Varianten der KGF-2-Mutanten beschrieben.
Diese können
durch Deletion oder Austausch von einer oder mehreren Aminosäuren der KGF-2-Mutanten
hergestellt werden. Natürliche
Mutationen werden als allele Variation bezeichnet.
-
Allele Variationen können still
sein (keine Änderung
beim codierten Polypeptid) oder sie können die Aminosäuresequenz
verändert
haben. Man kann Protein-Engineering-Verfahren einsetzen, um zu versuchen, die
Merkmale des nativen KGF-2 zu verbessern oder zu ändern. Man
kann aus dem Fachgebiet bekannte rekombinante DNA-Technologie verwenden, um
neuartige Polypeptide zu erzeugen. Muteine und Deletionsmutationen
können
z. B. eine erhöhte
Aktivität
oder erhöhte
Stabilität
zeigen. Zusätzlich
könnten
sie für
einen größeren Ertrag
gereinigt werden und sie könnten
zumindest unter bestimmten Reinigungs- und Lagerbedingungen bessere
Löslichkeit
zeigen.
-
Diese und andere Aspekte der vorliegenden
Erfindung sollten für
den Fachmann aufgrund der hier beschriebenen Ausführungen
offensichtlich sein.
-
Kurze Beschreibung
der Figuren
-
Die folgenden Zeichnungen veranschaulichen
die erfindungsgemäßen Ausführungsformen
und sollen nicht den Umfang der Erfindung, wie durch die Patentansprüche umfasst,
begrenzen.
-
Die 1A–1C stellen die cDNA und
die entsprechende abgeleitete Aminosäuresequenz des Polypeptids
der vorliegenden Erfindung dar. Die ersten 35 oder 36 Aminosäurereste
sind die vermeintliche Leadersequenz (unterstrichen). Für die Aminosäuren werden
die Standardabkürzungen
mit einem Buchstaben verwendet. Ungenauigkeiten beim Sequenzieren
sind ein weitverbreitetes Problem beim Versuch, Polynucleotidsequenzen
zu bestimmen. Die Sequenzierung erfolgte unter Verwendung eines
automatischen 373-DNA-Sequenziergeräts (Applied Biosystems, Inc.).
Es wird ein Sequenziergenauigkeit von mehr als 97% Genauigkeit vorhergesagt.
[SEQ ID NR: 1]
-
Die 2A–2D sind eine Darstellung
eines Aminosäuresequenzvergleichs
des Polypeptids der vorliegenden Erfindung mit anderen Fibroblasten-Wachstumsfaktoren.
[SEQ ID NR: 13–22]
-
Die 3A–3D zeigen die Gesamtlänge der
mRNA und die Aminosäuresequenz
für das
KGF-2-Gen. [SEQ ID NR: 23 und 24]
-
Die 4A–4E zeigen eine Analyse der
KGF-2-Aminosäuresequenz.
Alpha-, Beta-, „Turn"- und „Coil"-Bereiche; Hydrophilie
und Hydrophobizität;
Amphipathische Bereiche; flexible Bereiche; Antigen-Index und Oberflächenwahrscheinlichkeit
werden dargestellt. In der „Antigenindex-Jameson-Wolf"-Graphik entsprechen
die Aminosäurereste
41-109 aus 1 den dargestellten
hoch antigenen Bereichen des KGF-2-Proteins. Hydrophobe Bereiche
(Hopp-Woods-Plot) liegen unter der medianen Linie (negative Werte),
während
man die hydrophilen Bereiche (Kyte-Doolittle-Plot) über der
medianen Linie (positive Werte, z. B. Aminosäurereste 41-109) findet. Der
Plot erstreckt sich über
den gesamten ORF mit 208 Aminosäuren.
-
5 zeigt
die Beurteilung von KGF-2 bezüglich
des Wundverschlusses bei diabetischen Mäusen. Die Wunden wurden unmittelbar
nach der Verletzung und täglich
an 5 aufeinanderfolgenden Tagen und an Tag 8 gemessen. Der prozentuale
Wundverschluss wurde unter Verwendung der folgenden Formel berechnet: [Fläche an Tag
1 ]-[Fläche
an Tag 8]/[Fläche
an Tag 1]. Die statistische Analyse erfolgte unter Verwendung eines
urgepaarten t-Tests (Mittelwert +/– SEM, n = 5).
-
6 zeigt
die Beurteilung von KGF-2 bezüglich
des Wundverschlusses bei nicht diabetischen Mäusen. Die Wunden wurden unmittelbar
nach der Verletzung und täglich
an 5 aufeinanderfolgenden Tagen und an Tag 8 gemessen. Der prozentuale
Wundverschluss wurde unter Verwendung der folgenden Formel berechnet:
[Fläche
an Tag 1 ]-[Fläche
an Tag 8]/[Fläche
an Tag 1]. Die statistische Analyse erfolgte unter Verwendung eines
urgepaarten t-Tests
(Mittelwert +/– SEM,
n = 5).
-
7 zeigt
den Zeitverlauf beim Wundverschluss bei diabetischen Mäusen. Die
Wundflächen
wurden unmittelbar nach der Verletzung und täglich an 5 aufeinanderfolgenden
Tagen und an Tag 8 gemessen. Die Werte sind als Gesamtfläche (mm2) dargestellt. Die statistische Analyse
erfolgte unter Verwendung eines urgepaarten t-Tests (Mittelwert
+/– SEM,
n = 5).
-
8 zeigt
den Zeitverlauf beim Wundverschluss bei nicht diabetischen Mäusen. Die
Wundbereiche wurden unmittelbar nach der Verletzung und täglich an
5 aufeinanderfolgenden Tagen und an Tag 8 gemessen. Die Werte sind
als Gesamtfläche
(mm2) dargestellt. Die statistische Analyse
erfolgte unter Verwendung eines urgepaarten t-Tests (Mittelwert
+/– SEM,
n = 5).
-
9 zeigt
eine histopathologische Beurteilung von KGF-2 bei diabetischen Mäusen. Die
Punkteverteilung erfolgte durch einen blinden Beobachter. Die statistische
Analyse erfolgte unter Verwendung eines urgepaarten t-Tests (Mittelwert
+/– SEM,
n = 5).
-
10 zeigt
eine histopathologische Beurteilung von KGF-2 bei nicht diabetischen
Mäusen.
Die Punkteverteilung erfolgte durch einen blinden Beobachter. Die
statistische Analyse erfolgte unter Verwendung eines urgepaarten
t-Tests (Mittelwert +/– SEM,
n = 5).
-
11 zeigt
die Wirkung des Keratinocyten-Wachstums bei diabetischen Mäusen. Die
Punkteverteilung erfolgte durch einen blinden Beobachter. Die statistische
Analyse erfolgte unter Verwendung eines urgepaarten t-Tests (Mittelwert
+/– SEM,
n = 5).
-
12 zeigt
die Wirkung des Keratinocyten-Wachstums bei nicht diabetischen Mäusen. Die
Punkteverteilung erfolgte durch einen blinden Beobachter. Die statistische
Analyse erfolgte unter Verwendung eines urgepaarten t-Tests (Mittelwert
+/– SEM,
n = 5).
-
13 zeigt
die Wirkung der Hautproliferation bei diabetischen Mäusen. Die
Punkteverteilung erfolgte durch einen blinden Beobachter. Die statistische
Analyse erfolgte unter Verwendung eines urgepaarten t-Tests (Mittelwert
+/– SEM,
n = 5).
-
14 zeigt
die Wirkung der Hautproliferation bei nicht diabetischen Mäusen. Die
Punkteverteilung erfolgte durch einen blinden Beobachter. Die statistische
Analyse erfolgte unter Verwendung eines urgepaarten t-Tests (Mittelwert
+/– SEM,
n = 5).
-
15 zeigt
die DNA-Sequenz und das vom pQE60-Cys37-Konstrukt exprimierte Protein.
Das exprimierte KGF-2-Protein enthält die Sequenz von Cystein
an Position 37 bis Serin an Position 208 mit einem 6X(His)-Tag,
der an den N-Terminus des Proteins gebunden ist.
-
16 zeigt
die Wirkung von Methylprednisolon auf die Wundheilung bei Ratten.
Männlichen
erwachsenen SD-Ratten (n = 5) wurde am Tag der Verletzung 5 mg Methylprednisolon
injiziert. Den Tieren wurden mit einer Stanze Hautwunden (8 mm)
beigebracht, und sie wurden täglich
an 5 aufeinanderfolgenden Tagen mit Pufferlösung oder KGF-2-Lösung in
50 μl Pufferlösung behandelt.
Die Wunden wurden täglich
an den Tagen 1–5
und an Tag 8 mit einem kalibrierten Jameson-Tastzirkel ausgemessen.
Die Werte sind die an Tag 8 durchgeführten Messungen. (Mittelwert
+/– SEM)
-
17 zeigt
die Wirkung von KGF-2 auf den Wundverschluss. Männlichen erwachsenen SD-Ratten (n
= 5) wurden mit einer Stanze Hautwunden (8 mm) beigebracht, und
sie erhielten am Tag der Verletzung 5 mg Methylprednisolon. Die
Tiere wurden täglich
an 5 aufeinanderfolgenden Tagen, beginnend am Tag der Verletzung,
mit Pufferlösung
oder KGF-2-Lösung in
50 μl Pufferlösung behandelt.
Die Messungen erfolgten täglich an
5 aufeinanderfolgenden Tagen und an Tag B. Der Wundverschluss wurde
mittels folgender Formel berechnet: [Fläche an Tag 8]-[Fläche an Tag
1]/[Fläche
an Tag 1]. Es wurde ermittelt, dass die Fläche an Tag 1 64 mm2 betrug – die Fläche, die
von der Hautstanze erzeugt wurde. Die statisti sche Analyse erfolgte
unter Verwendung eines urgepaarten t-Tests (Mittelwert +/– SEM, n
= 5).
-
18 zeigt
den Zeitverlauf der Wundheilung im Glucokortikoid-gehemmten Wundheilungsmodell. Männlichen
erwachsenen SD-Ratten (n = 5) wurden mit einer Stanze Hautwunden
(8 mm) an Tag 1 beigebracht, und sie wurden täglich an 5 aufeinanderfolgenden
Tagen mit einer Pufferlösung
oder KGF-2-Lösung
in 50 μl
behandelt. Die Tiere erhielten am Tag der Verletzung 5 mg Methylprednisolon.
Die Wunden wurden täglich
an 5 aufeinanderfolgenden Tagen, beginnend am Tag der Verletzung,
und an Tag 8 mit einem kalibrierten Jameson-Tastzirkel ausgemessen.
Die statistische Analyse erfolgte unter Verwendung eines urgepaarten t-Tests
(Mittelwert +/– SEM,
n = 5).
-
19(A) zeigt
die Wirkung von KGF-2 auf die Wundfläche im Ratten-Wundheilungsmodell
ohne Methylprednisolon an Tag 5 nach der Verletzung. Männlichen
erwachsenen SD-Ratten (n = 5) wurden mit einer Stanze Hautwunden
(8 mm) an Tag 1 beigebracht, und sie wurden täglich entweder mit einer Pufferlösung oder mit
KGF-2-Lösung
in einer 50 μl-Lösung am
Tag der Verletzung und danach an 5 aufeinanderfolgenden Tagen behandelt.
Die Wunden wurden täglich
unter Verwendung eines kalibrierten Jämeson-Tastzirkels ausgemessen.
Die statistische Analyse erfolgte unter Verwendung eines urgepaarten
t-Tests (Mittelwert +/– SEM).
(B) Die Beurteilung von PDGF-BB und KGF-2 in männlichen erwachsenen SD-Ratten (n = 6). Allen
Ratten wurden 8 mm große
Wunden am Rücken
beigebracht und sie erhielten Methylprednisolon (MP) (17 mg/kg),
um die Wundheilung zu hemmen. Die Wunden wurden täglich mit
Puffer oder verschiedenen Konzentrationen von PDGF-BB und KGF-2
behandelt. Die Wunden wurden an den Tagen 2, 4, 6, 8 und 10 unter
Verwendung eines kalibrierten Jameson-Tastzirkels ausgemessen. Die
statistische Analyse erfolgte unter Verwendung eines urgepaarten
t-Tests (Mittelwert +/– SEM).
*Im Vergleich mit Puffer. **PDGF-BB 1 μg gg. KGF-2/E3 1 μg.
-
20 zeigt
die Wirkung von KGF-2 auf den Wunderabstand im Glucocortikoid-gehemmten
Wundheilungsmodell. Männlichen
erwachsenen SD-Ratten (n = 5) wurden mit einer Stanze Hautwunden
(8 mm) beigebracht, und sie erhielten am Tag der Verletzung 17 mg/kg
Methylprednisolon. Die Tiere wurden täglich an 5 aufeinanderfolgenden
Tagen und an Tag 8 mit einer Pufferlösung oder mit KGF-2-Lösung in
50 μl Pufferlösung behandelt.
Der Wunderabstand wurde unter dem Lichtmikroskop mit einem kalibrierten
Mikrometer gemes sen. Die statistische Analyse erfolgte unter Verwendung
eines ungepaarten t-Tests (Mittelwert +/– SEM).
-
21(A) zeigt
die Stimulation der normalen primären epidermalen Keratinocytenproliferation
durch KGF-2. (B) zeigt die Stimulation der normalen primären epidermalen
Keratinocytenproliferation durch KGF-2Δ33. (C) zeigt die Stimulation
der normalen primären
epidermalen Keratinocytenproliferation durch KGF-2Δ28. Menschliche
normale primäre
epidermale Keratinocyten wurden drei Tage mit verschiedenen Konzentrationen
KGF-2, KGF-2Δ33
oder KOF-2Δ28
inkubiert. Bei allen drei Experimenten wurde 16 Std. alamarBlue
zugegeben und die Intensität
der roten Farbe, die durch die Zellen aus alamarBlue umgewandelt
wurde, wurde mittels der Differenz zwischen O.D. 570 nm und O.D.
600 nm gemessen. Für
jedes KGF-2 Protein wurde eine Positivkontrolle mit Keratinocyten-Komplett-Wachstumsmedium
(KGM) und eine Negativkontrolle mit Keratinocyten-Basalmedium (KBM)
auf derselben Testplatte eingeschlossen.
-
22(A) zeigt
die Stimulation des Thymidineinbaus durch KGF-2 und FGF7 in mit
FGFR1b und FGFR2 transfizierten Baf3-Zellen. Die Wirkungen von KGF-2
(rechte Graphik) und FGF7 (linke Graphik) auf die Proliferation
von mit FGFRiiib (unausgefüllter
Kreis) oder FGFR2iiib/KGFR (ausgefüllter Kreis) transfizierten
Baf3-Zellen wurden untersucht. Die Y-Achse stellt die Menge des
[3H]-Thymidineinbaus (cpm) in die DNA der Baf3-Zellen dar. Die X-Achse
stellt die Endkonzentration von KGF-2 oder FGF7 dar, die dem Gewebekulturmedium
zugegeben wurden. (B) zeigt die Stimulation des Thymidineinbaus
durch KGF-2Δ33
in mit FGFR2iiib transfizierten Baf3-Zellen.
-
(C) zeigt die Stimulation des Thymidineinbaus
durch KGF-2 (weißer
Balken), KGF-2Δ33
(schwarzer Balken) und KGF-2Δ28
(grauer Balken) in mit FGFR2iiib transfizierten Baf3-Zellen.
-
23 zeigt
die DNA- und Proteinsequenz für
das E.coli-optimierte KGF-2 mit der gesamten Länge.
-
Die 24A und B zeigen die DNA- und Proteinsequenzen
für das
E.coli-optimierte reife KGF-2.
-
25 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
36 bis 208 von KGF-2 umfasst.
-
26 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
63 bis 208 von KGF-2 umfasst.
-
27 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
77 bis 208 von KGF-2 umfasst.
-
28 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
93 bis 208 von KGF-2 umfasst.
-
29 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
104 bis 208 von KGF-2 umfasst.
-
30 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
123 bis 208 von KGF-2 umfasst.
-
31 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
138 bis 208 von KGF-2 umfasst.
-
32 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
36 bis 153 von KGF-2 umfasst.
-
33 zeigt
die DNA- und die davon codierte Proteinsequenz für das KGF-2-Deletionskonstrukt,
das die Aminosäuren
63 bis 153 von KGF-2 umfasst.
-
34 zeigt
die DNA-Sequenz für
das Konstrukt der KGF-2-Cystein-37-bis-Serin-Mutante.
-
35 zeigt
die DNA-Sequenz für
das Konstrukt der KGF-2-Cystein-37/Cystein-106-bis-Serin- Mutante.
-
36 zeigt
die Beurteilung der Effekte von KGF-2Δ33 auf die Wundheilung bei männlichen
SD-Ratten (n = 5). Den Tieren wurden 6 mm große Wunden am Rücken beigebracht,
und sie wurden mit verschiedenen Pufferkonzentrationen oder KGF-2Δ33 an 4 aufeinanderfolgenden
Tagen behandelt. Die Wunden wurden unter Verwendung eines kalibrierten
Jameson-Tastzirkels ausgemessen. Die statistische Analyse erfolgte
unter Verwendung eines urgepaarten t-Tests (Mittelwert +/– SEM).
* Im Vergleich mit Puffer
-
37 zeigt
die Wirkung von KGF-2Δ33
auf die Wundheilung bei normalen Ratten. Männlichen SD-Ratten, 250–300 g,
(n = 5) wurden 6 mm große
Vollhautwunden durch am Rücken
beigebracht. Die Wunden wurden mit einem Tastzirkel ausgemessen
und 4 Tage, beginnend am Tag des chirurgischen Eingriffs mit, verschiedenen
KGF-2Δ33-Konzentrationen
und Puffer behandelt. Am letzten Tag wurden die Wunden geerntet.
Die statistische Analyse erfolgte unter Verwendung eines urgepaarten
t-Tests. *Wert wird mit der „Keine Behandlung"-Kontrolle verglichen. t Wert wird mit
Pufferkontrolle verglichen.
-
38 zeigt
die Wirkung von KGF-2Δ33
auf die Bruchfestigkeit bei Schnittwunden. Männlichen erwachsenen SD-Ratten
(n = 10) wurden an Tag 1 2,5 cm große Vollhautschnittwunden beigebracht,
und sie wurden nach der Verletzung mit einer Anwendung von entweder
Puffer oder KGF-2 (Delta 33) (1, 4 und 10 μg) intraincisional behandelt.
Die Tiere wurden an Tag 5 getötet
und 0,5 cm große
Proben der Wunde wurden für die
routinemäßige Histologie
und Bruchfestigkeitsanalyse herausgeschnitten. Der biomechanische
Test erfolgte unter Verwendung eines Instron-Hauttensiometers, wobei
eine Kraft über
die Wunde hinweg aufgewandt wurde. Die Bruchfestigkeit wurde als
die größte Kraft
definiert, die von jeder Wunde vor dem Reißen ausgehalten wurde. Die
statistische Analyse erfolgte unter Verwendung eines ungepaarten
t-Tests (Mittelwert +/– SE).
-
39 zeigt
die Wirkung von KGF-2 (Delta 33) auf die Epidermisdicke in Schnittwunden.
Männlichen erwachsenen
SD-Ratten (n = 10) wurden an Tag 1 2,5 cm-Vollhautschnittwunden
beigebracht, und sie wurden nach der Verletzung mit einer Anwendung
von entweder Puffer oder KGF-2 (Delta 33) (1, 4 und 10 μg) intraincisional
behandelt. Die Tiere wurden an Tag 5 getötet und 0,5 cm große Proben
der Wunde wurden für
die routinemäßige Histologie
und Bruchfestigkeitsanalyse herausgeschnitten. Die Epidermisdicke
wurde ermittelt, indem man den Mittelwert aus 6 Messungen nahm,
die um die Wundstelle herum durchgeführt wurden. Die Messungen wurden
von einem blinden Beobachter auf Masson-Trichrom-gefärbten Abschnitten
unter dem Lichtmikroskop unter Verwendung eines kalibrierten Linsenmikrometers
durchgeführt.
Die statistische Analyse erfolgte unter Verwendung eines ungepaarten
t-Tests (Mittelwert +/– SE).
-
40 zeigt
die Wirkung von KGF-2 (Delta 33) auf die Epidermisdicke nach einer
einzigen intradermalen Injektion. Männliche erwachsene SD-Ratten
(n = 18) erhielten 6 intradermale Injektionen entweder mit Puffer
oder mit KGF-2 in einer Konzentration von 1 und 4 μg in 50 μl an Tag
0. Die Tiere wurden 24 und 48 Stunden nach der Injektion getötet. Die
Epidermisdicke wurde aus der granulären Schicht bis zum unteren Ende
der Basalschicht gemessen. Es wurden etwa 20 Messungen entlang der
Injektionsstelle durchgeführt und
die mittlere Dicke quantifiziert. Die Messungen wurden unter Verwendung
eines kalibrierten Linsenmikrometers auf Masson-Trichrom-gefärbten Abschnitten
unter dem Lichtmikroskop bestimmt. Die statistische Analyse erfolgte
unter Verwendung eines ungepaarten t-Tests (Mittelwert +/– SE).
-
41 zeigt
die Wirkung von KGF-2 (Delta 33) auf die BrdU-Punktebewertung. Männliche
erwachsene SD-Ratten (n = 18) erhielten 6 intradermale Injektionen
entweder mit Placebo oder mit KGF-2 in einer Konzentration von 1
und 4 μg
in 50 μl
an Tag 0. Die Tiere wurden 24 und 48 Stunden nach der Injektion
getötet. Den
Tieren wurde zwei Stunden bevor sie getötet wurden 5-2'-Bromdesoxyuridin
(100 mg/kg ip) injiziert. Die Punkteverteilung erfolgte durch einen
blinden Beobachter unter dem Lichtmikroskop unter Verwendung des folgenden
Punktesystems: 0–3
keine bis minimal BrdU-markierte Zellen; 4–6 leichte Markierung; 7–10 stark markierte
Zellen. Die statistische Analyse erfolgte unter Verwendung eines
ungepaarten t-Tests (Mittelwert +/– SE).
-
42 zeigt
die anti-inflammatorische Wirkung von KGF-2 auf ein PAF-induziertes
Pfotenödem.
-
43 zeigt
die anti-inflammatorische Wirkung von KGF-2Δ33 auf ein PAF-induziertes Ödem der
Pfote bei Lewis-Ratten.
-
44 zeigt
die Wirkung von KGF-2Δ33
auf das Überleben
von Ganzkörper-bestrahlten
Balb/c-Mäusen.
Männliche
Balb/c-Mäuse
(n = 5), 22,1 g, wurden mit 519 RADS bestrahlt. Die Tiere wurden
2 Tage vor der Bestrahlung und danach täglich 7 Tage mit Puffer oder
KGF-2 (1 & 5
mg/kg, s. q.) behandelt.
-
45 zeigt
die Wirkung von KGF-2Δ33
auf das Körpergewicht
der bestrahlten Mäuse.
Männlichen Balb/c-Mäusen (n
= 5) mit einem Gewicht von 22,1 g wurde 2 Tage vor der Bestrahlung
mit 519 Rad/min entweder Puffer oder KGF-2Δ33 (1,5 mg/kg) injiziert. Die
Tiere wurden täglich
gewogen und nach der Bestrahlung wurde ihnen die Injektion 7 Tage
eine Injektion verabreicht.
-
46 zeigt
die Wirkung von KGF-2Δ33
auf die Überlebensrate
von Ganzkörperbestrahlten Balb/c-Mäusen. Männliche
Balb/c-Mäuse
(n = 7), 22,1 g, wurden mit 519 RADS bestrahlt. Die Tiere wurden
2 Tage vor der Bestrahlung und danach täglich 7 Tage mit Puffer oder
KGF-2 (1 und 5 mg/kg, s. q.) behandelt.
-
47 zeigt
die Wirkung von KGF-2Δ33
auf die Wundheilung in einem Glucocortikoid-gehemmten Rattenmodell.
-
48 zeigt
die Wirkung von KGF-2Δ33
auf die Zellproliferation, wie sie unter Verwendung der BrdU-Markierung
bestimmt wurde.
-
49 zeigt
die Wirkung von KGF-2-Δ33
auf den an anastomotischen Operationsstellen im Rattendarm lokalisierten
Collagengehalt.
-
Detaillierte
Beschreibung
-
In Verbindung mit der vorliegenden
Erfindung wird eine isolierte Nucleinsäure (Polynucleotid) offenbart,
die das Polypeptid codiert, das die abgeleitete Aminosäuresequenz
von 1 (SEQ ID NR: 2)
besitzt, oder das das Polypeptid codiert, das von der cDNA des am
16. Dezember 1994 bei der American Type Culture Collection, 12301
Park Lawn Drive, Rockville, Maryland 20852, als ATCC-Hinterlegungsnummer
75977 hinterlegten Clons codiert wird.
-
Nucleinsäuremoleküle
-
Wenn nicht anders angegeben, wurden
alle hier durch Sequenzierung eines DNA-Moleküls bestimmten Nucleotidsequenzen
unter Verwendung eines automatischen DNA-Sequenziergeräts (wie
das Model 373 von Applied Biosystems, Inc.) bestimmt, und alle Aminosäuresequenzen
von Polypeptiden, die von hier bestimmten DNA-Molekülen codiert
werden, wurden durch Translation einer wie vorstehend bestimmten DNA-Sequenz
vorhergesagt. Deshalb kann, wie aus dem Fachgebiet für jede DNA-Sequenz,
die durch diesen automatisierten Ansatz bestimmt wurde, bekannt
ist, jede hier bestimmte Nucleotidsequenz einige Fehler enthalten.
Die mittels Automatisierung bestimmten Nucleotidsequenzen sind typischerweise
mindestens etwa 90% identisch, noch typischer mindestens etwa 95%
bis mindestens etwa 99,9% mit der tatsächlichen Nucleotidsequenz des
sequenzierten DNA-Moleküls
identisch. Die tatsächliche
Sequenz kann präziser
durch andere Ansätze,
einschließlich
manuelle DNA-Sequenzierverfahren,
die sehr gut aus dem Fachgebiet bekannt sind, bestimmt werden. Wie
ebenfalls aus dem Fachgebiet bekannt ist, verursacht eine einzelne
Insertion oder Deletion in einer ermittelten Nucleotidsequenz im
Vergleich zur tatsächlichen
Sequenz eine Verschiebung des Leserahmens bei der Translation der
Nucleotidsequenz, so dass sich, beginnend an der Stelle einer derartigen Insertion
oder Deletion, die vorhergesagte Aminosäuresequenz, die von einer ermittelten
Nucleotidsequenz codiert wird, vollkommen von der Aminosäuresequenz
unterscheidet, die tatsächlich
von dem sequenzierten DNA-Molekül
codiert wird.
-
Wenn nicht anders angegeben, wird
jede hier aufgeführte „Nucleotidsequenz" als Desoxyribonucleotidsequenz
(abgekürzt
A, G, C und T) dargestellt. Jedoch ist mit einer „Nucleotidsequenz" eines Nucleinsäuremoleküls oder
Polynucleotids für
ein DNA-Molekül oder
Polynucleotid, eine Desoxyribonucleotidsequenz gemeint und für ein RNA-Molekül oder Polynucleotid,
die entsprechende Ribonucleotidsequenz (A, G, C und U) gemeint,
bei der jedes Thymidindesoxyribonucleotid (T) in der bestimmten
Desoxyribonucleotidsequenz durch das Ribonucleotid Uridin (U) ersetzt
ist. Beispielsweise soll die Bezugnahme auf ein RNA-Molekül, das die
Sequenz von SEQ ID NR: 1 besitzt, die unter Verwendung der Desoxyribonucleotidabkürzungen
aufgeführt
ist, anzeigen, dass ein RNA-Molekül, das eine Sequenz besitzt,
bei der jedes Desoxyribonucleotid A, G oder C der SEQ ID NR: 1 durch
das entsprechende Ribonucleotide A, G oder C ersetzt wurde und jedes
Desoxyribonucleotid T durch ein Ribonucleotid U ersetzt wurde.
-
Mit „isoliertem/isolierten" Nucleinsäuremolekül(en) ist
ein Nucleinsäuremolekül, DNA oder
RNA gemeint, das/die aus seiner/ihrer nativen Umgebung entfernt
wurde(n). Beispielsweise werden rekombinante, in einem Vektor enthaltene
DNA-Moleküle,
als isoliert für
die Zwecke der vorliegenden Erfindung betrachtet. Weitere Beispiele
für isolierte
DNA-Moleküle
schließen
rekombinante, in heterologen Wirtszellen gehaltene DNA-Moleküle oder
gereinigte (teilweise oder wesentlich) DNA-Moleküle in Lösungen ein. Isolierte RNA-Moleküle schließen in vivo-
oder in vitro-RNA-Transkripte der DNA-Moleküle der vorliegenden Erfindung
ein. Isolierte Nucleinsäuremoleküle nach
der vorliegenden Erfindung schließen ferner solche Moleküle ein,
die synthetisch hergestellt werden.
-
Isolierte Nucleinsäuremoleküle der vorliegenden
Erfindung schließen
DNA-Moleküle
ein, die eine Sequenz umfassen, die sich im wesentlichen von denjenigen
unterscheidet, die vorstehend beschrieben wurden, die jedoch aufgrund
der Degenerierung des genetischen Codes noch KGF-2-Mutanten einschließen.
-
Natürlich ist der genetische Code
im Fachgebiet gut bekannt. Deshalb wäre es für den Fachmann Routine, die
vorstehend beschriebenen degenerierten Varianten zu erzeugen.
-
Ein Polynucleotid, das ein KGF-2-Polypeptid
codiert, kann man aus einer menschlichen Prostata und einer fötalen Lunge
erhalten. Ein Fragment der cDNA, die das Polypeptid codiert, wurde
zuerst aus einer von einer normalen menschlichen Prostata abstammenden
Genbank isoliert. Der offene Leserahmen, der das Protein mit der
gesamten Länge
codiert, wurde anschließend
aus einer zufallsgeprimten menschlichen fötalen Lungen-cDNA-Genbank isoliert.
Sie ist strukturell mit der FGF-Familie verwandt. Sie enthält einen
offenen Leserahmen, der ein Protein mit 208 Aminosäureresten
codiert, dessen erste 35 bis 36 Aminosäurereste die vermeintliche
Leader-Sequenz sind, so dass das reife Protein 173 oder 172 Aminosäuren um fasst.
Das Protein zeigt den höchsten
Homologiegrad zum menschlichen Keratinocyten-Wachstumsfaktor mit 45% Identität und 82% Ähnlichkeit über eine
Länge von
206 Aminosäuren.
Es ist auch wichtig, dass man herausfand, dass Sequenzen, die innerhalb
der FGF-Familie konserviert sind, im Protein der vorliegenden Erfindung
konserviert sind.
-
Zusätzlich zeigten Ergebnisse von
ineinandergesetzter PCR von KGF-2-cDNA aus Genbanken, dass es potenzielle
alternative gespleißte
KGF-2-Formen gab. Insbesondere bei der Verwendung von Primern, die den
N-Terminus des offenen Leserahmens von KGF-2 flankieren, wurden
PCR-Produkte mit 0,2 kb und 0,4 kb aus verschiedenen cDNA-Genbanken
erhalten. Eine 0,2 kb-Größe war das
erwartete Produkt für
KGF-2, während
die 0,4 kb-Größe auf eine
alternativ gespleißte
KGF-2-Form zurückgeführt werden
kann. Das 0,4 kb-Produkt wurde in Genbanken aus Magenkrebs, Hoden
von Erwachsenen, Duodenum und Pankreas beobachtet.
-
Das Polynucleotid der vorliegenden
Erfindung kann in Form von RNA oder in Form von DNA sein, wobei
die DNA cDNA, genomische DNA und synthetische DNA einschließt. Die
DNA kann doppelsträngig
oder einzelsträngig
sein und wenn die DNA einzelsträngig
ist, kann sie der codierende Strang oder der nicht codierende (Antisense-)
Strang sein. Die codierende Sequenz, die den entsprechenden Teil
des reifen Polypeptids codiert, kann mit der in 1 (SEQ ID NR: 1) dargestellten entsprechenden
codierenden Sequenz identisch sein oder mit derjenigen des hinterlegten
Clons oder sie kann eine unterschiedliche codierende Sequenz sein, deren
codierende Sequenz als Folge der Redundanz oder Degenerierung des
genetischen Codes, den gleichen entsprechenden Teil des reifen Polypeptids
codiert wie die DNA von 1 (SEQ
ID NR: 1) oder die hinterlegte cDNA.
-
Das Polynucleotid, das die Polypeptide
der KGF-2-Mutanten codiert, kann einschließen: nur die codierende Sequenz
für die
Polypeptidmutanten; die codierende Sequenz für die Polypeptidmutanten und
zusätzliche
codierende Sequenzen wie Leader- oder sekretorische Sequenz oder
eine Proproteinsequenz; die codierende Sequenz für die Polypeptidmutanten (und
fakultativ zusätzliche
codierende Sequenzen) und nicht codierende Sequenzen wie Intron- oder nicht codierende
Sequenzen 5' und/oder
3' der codierende
Sequenz für die
Polypeptidmutanten. Zusätzlich
wurde eine mRNA mit der gesamten Länge erhalten, die nicht translatierte 5'- und 3'-Bereiche des Gens
enthält
(3).
-
Dem Fachmann ist bewusst, dass aufgrund
der Möglichkeiten
der vorstehend diskutierten Fehler beim Sequenzieren sowie der Variabilität der Spaltungsstellen
für Leader
in ver schiedenen bekannten Proteinen das tatsächliche von der hinterlegten
cDNA codierte KGF-2-Polypeptid
etwa 208 Aminosäuren
umfasst, jedoch irgendwo im Rahmen von 200–220 Aminosäuren liegen kann, und die tatsächliche
Leader-Sequenz dieses Protein besitzt etwa 35 oder 36 Aminosäuren, kann
aber auch im Bereich von etwa 30 bis 40 Aminosäuren liegen.
-
Somit umfasst der Begriff „Polynucleotid,
das ein Polypeptid codiert" ein
Polynucleotid, das nur die codierende Sequenz für das Polypeptid sowie ein
Polypeptid umfasst, das zusätzliche
codierende und/oder nicht codierende Sequenzen umfasst.
-
Die vorliegende Patentanmeldung beschreibt
ferner Varianten der hier vorstehend beschriebenen Polynucleotide,
die Varianten der KGF-2-Polypeptidmutanten umfassen, die entsprechende
Teile der abgeleiteten Aminosäuresequenz
von 1 (SEQ ID NR: 2)
oder das von der cDNA des hinterlegten Clons codierte Polypeptid
besitzen. Die Variante des Polypeptids kann eine natürlich vorkommende
allele Variante des Polynucleotids sein oder eine nicht natürlich auftretende
Variante des Polynucleotids.
-
Somit beschreibt die vorliegende
Patentanmeldung Polynucleotide, die die entsprechenden Teile des vorhergesagten
reifen Polypeptids codieren, wie in 1 (SEQ
ID NR: 2) dargestellt, oder das gleiche vorhergesagte reife Polypeptid,
das von der cDNA des hinterlegten Clons sowie von Varianten derartiger
Polynucleotide codiert wird.
-
Derartige Nucleotidvarianten schließen Deletionsvarianten,
Substitutionsvarianten und Additions- oder Insertionsvarianten ein.
-
Die vorliegende Patentanmeldung beschreibt
auch Polypeptide, die mimetische KGF-2-Peptide codieren, die als therapeutische
Peptide verwendet werden können.
Mimetische KGF-2-Peptide
sind kurze Peptide, die die biologische Aktivität des KGF-2-Proteins nachahmen,
indem sie an die verwandten Rezeptoren von KGF-2 binden und sie
aktivieren. Mimetische KGF-2-Peptide können auch an die verwandten
Rezeptoren von KGF-2 binden und sie inaktivieren. KGF-2-Rezeptoren
schließen
ein, sind aber nicht begrenzt auf FGR2iiib und FGFR1iiib. Derartige
mimetische KGF-2-Peptide werden aus Verfahren wie Phagen-Display
oder kombinatorische Chemie erhalten, sind aber nicht darauf begrenzt.
Beispielsweise das Verfahren, das von Wrighton et al. Science 273:
458–463
(1996) offenbart wird, um mimetische KGF-2-Peptide zu erzeugen.
-
Wie hier vorstehend angegeben, können die
Polynucleotide eine codierende Sequenz besitzen, die eine natürlich auftretende
allele Variante der codierenden, in 1 (SEQ
ID NR: 1) dargestellten Sequenz oder die codierende Sequenz des
hinterlegten Clons ist. Wie aus dem Fachgebiet bekannt, ist eine
allele Variante eine andere Form einer Polypeptidsequenz, die eine
Substitution, eine Deletion oder Addition von einem oder mehreren
Nucleotide besitzen kann, die die Funktion des codierten Polypeptids
nicht wesentlich ändern.
-
Die vorliegende Erfindung schließt auch
Polynucleotide ein, wobei die codierende Sequenz für die Polypeptidmutanten
im selben Leserahmen mit einer Polynucleotidsequenz fusioniert werden
kann, die bei der Expression und Sekretion eines Polypeptids aus
einer Wirtszelle unterstützen
kann, beispielsweise eine Leadersequenz, die als sekretorische Sequenz
zur Transportkontrolle eines Polypeptids aus der Zelle fungiert. Das
Polypeptid, das eine Leadersequenz besitzt, ist ein Präprotein
und die Leader-Sequenz kann von der Wirtszelle gespalten werden,
um die reife Form des Polypeptids zu bilden. Die Polynucleotide
können
auch ein Proprotein codieren, das das reife Protein plus zusätzliche
5 ` Aminosäurereste ausmacht. Ein reifes
Protein mit einer Prosequenz ist ein Proprotein und ist eine inaktive
Form des Proteins. Sobald die Prosequenz gespalten wird, bleibt
ein aktives reifes Protein übrig.
-
Somit kann beispielsweise das Polynucleotid
der vorliegenden Erfindung ein reifes Protein oder ein Protein mit
einer Prosequenz oder ein Protein codieren, das sowohl eine Prosequenz
als auch eine Präsequenz
besitzt (Leader-Sequenz).
-
Die Polynucleotide der vorliegenden
Erfindung können
auch die codierende Sequenz im Leserahmen mit einer Markersequenz
fusioniert haben, die die Reinigung des Polynucleotids der vorliegenden
Erfindung zulässt.
Die Markersequenz kann ein Hexahistidin-Tag sein, der von einem
pQE-9-Vektor geliefert wird, um die Reinigung des reifen Polypeptids,
das mit einer Markersequenz fusioniert ist, im Falle eines bakteriellen
Wirtes bereitzustellen, oder die Markersequenz kann beispielsweise
ein Hämagglutinin
(HA)-Tag bei Verwendung eines Sängerwirtes
z. B. COS-7-Zellen sein. Der HA-Tag entspricht einem Epitop, das
vom Influenza Hämagglutininprotein
stammt (Wilson, I. et al. Cell 37: 767 (1984)).
-
Der Begriff „Gen" bezeichnet das DNA-Segment, das an
der Herstellung einer Polypeptidkette beteiligt ist; es schließt Bereiche,
die dem codierenden Bereich (Leader und Trailer vorangehen und darauf
folgen, sowie dazwischenliegende Sequenzen (Introns) zwischen den
einzelnen codierenden Segmenten (Exons) ein.
-
Fragmente mit dem Gen mit der gesamten
Länge der
vorliegenden Erfindung können
als Hybridisierungssonde für
eine cDNA-Genbank verwendet werden, um die cDNA mit der gesamten
Länge zu
isolieren und um andere cDNAs zu isolieren, die eine hohe Sequenzähnlichkeit
mit dem Gen oder eine ähnliche
biologische Aktivität
besitzen. Die Sonden dieser Art be sitzen mindesten 30 Basen und
können
beispielsweise 50 oder mehr Basen besitzen. Die Sonde kann auch
verwendet werden, um einen cDNA-Clon, der einem Transkript mit der
gesamten Länge
entspricht, und einen genomischen Clon oder Clone zu identifizieren,
die das vollständige
Gen einschließlich
regulatorischer oder Promotorbereiche, Exons und Introns enthalten.
Ein Beispiel einer Durchmusterung umfasst die Isolierung des codierenden
Genbereichs unter Verwendung der bekannten DNA-Sequenz, um eine
Oligonucleotidsonde zu synthetisieren. Markierte Oligonucleotide
mit einer Sequenz, die komplementär zum Gen der vorliegenden
Erfindung sind, werden verwendet, um eine Genbank mit menschlicher
cDNA, genomischer DNA oder cDNA zu durchmustern, um zu bestimmen,
mit welchen Mitgliedern der Genbank die Sonde hybridisiert.
-
Die vorliegende Patentanmeldung offenbart,
wie man Nucleinsäuremoleküle isoliert
oder bereitstellt, die ein Polynucleotid mit einer Nucleotidsequenz
umfassen, die mindestens 90% identisch ist und besonders bevorzugt
mindestens 95%, 96%, 97%, 98% oder 99% identisch ist mit (a) einer
Nucleotidsequenz, die das KGF-2-Polypeptid mit der gesamten Länge codiert,
das die vollständige
Aminosäuresequenz
in 1 (SEQ ID NR: 2),
einschließlich
der vorausgesagten Leader-Sequenz umfasst; (b) einer Nucleotidsequenz,
die das reife KGF-2-Polypeptid
(Polypeptid mit der gesamten Länge,
wobei der Leader entfernt wurde) codiert, das die Aminosäuresequenz
an den Positionen bei etwa 36 oder 37 bis 208 in 1 (SEQ ID NR: 2) besitzt; (c) einer Nucleotidsequenz,
die das KGF-2-Polypeptid mit der gesamten Länge codiert, das die vollständige Aminosäuresequenz
einschließlich
des Leaders besitzt, die von dem cDNA-Clon codiert wird, der in
der ATCC-Hinterlegungsnr. 75977 enthalten ist; (d) einer Nucleotidsequenz,
die das reife KGF-2-Polypeptid codiert, das die Aminosäuresequenz
besitzt, die von dem cDNA-Clon codiert wird, der in der ATCC-Hinterlegungsnr.
75977 enthalten ist; (e) einer Nucleotidsequenz, die irgendeines
der KGF-2-Analoga oder die nachstehend beschriebenen Deletionsmutanten
codiert oder (f) einer Nucleotidsequenz, die zu irgendeiner der
Nucleotidsequenzen in (a), (b), (c), (d), oder (e) komplementär ist.
-
Mit einem Polypeptid, das eine Nucleotidsequenz
besitzt, die beispielsweise mindestens 95% mit einer Referenznucleotidsequenz „identisch" ist, die ein KGF-2-Polypeptid
codiert, ist gemeint, dass die Nucleotidsequenz des Polynucleotids
mit dem Referenzsystem identisch ist, außer, dass die Polynucleotidsequenz
jeweils pro 100 Nucleotide der Referenznucleotidsequenz, die das
KGF-2-Polypeptid codiert, bis zu fünf Punktmutationen einschließen kann.
Mit anderen Worten, um ein Polynucleotid zu erhalten, das eine Nucleotidsequenz besitzt,
die mindestens 95% mit einer Referenznucleotidsequenz identisch
ist, können
bis zu 5% der Nucleotide in der Referenzsequenz deletiert oder mit
einem anderen Nucleotid ersetzt werden oder eine Anzahl von bis
zu 5% der Gesamtnucleotide in der Referenzsequenz kann in die Referenzsequenz
eingebaut werden. Diese Mutationen der Referenzsequenz können an
den terminalen 5'-
oder 3'-Positionen
der Referenznucleotidsequenz oder irgendwo zwischen den terminalen
Positionen auftreten, die entweder einzeln unter den Nucleotiden
in der Referenzsequenz oder in einer oder mehreren aufeinander folgenden
Gruppen innerhalb der Referenzsequenz verteilt sind.
-
In der Praxis kann unter Verwendung
bekannter Computerprogramme wie das Bestfit-Programm (Wisconsin Sequence Analysis
Package, Version 8 für
Unix, Genetics Computer Group, University Research Park, 575 Science
Drive, Madison, WI 53711) auf herkömmliche Weise bestimmt werden,
ob irgendein bestimmtes Nucleinsäuremolekül mindestens
90%, 95%, 96%, 97%, 98% oder 99% mit beispielsweise der in 1 dargestellten Nucleotidsequenz
oder mit der Nucleotidsequenz des hinterlegten cDNA-Clops identisch
ist. Beim Bestfit-Programm werden die lokalen Homologiealgorithmen
von Smith und Waterman, Advances in Applied Mathematics 2: 482–489 (1981)
verwendet, um das beste Homologiesegment zwischen zwei Sequenzen
zu finden. Bei der Verwendung von Bestfit oder irgendeinem anderen
Programm zur Sequenzausrichtung, um zu bestimmen, ob eine bestimmt
Sequenz beispielsweise 95% mit einer Referenzsequenz nach der vorliegenden Erfindung
identisch ist, werden die Parameter natürlich so eingestellt, dass
die prozentuale Identität über die gesamte
Länge der
Referenznucleotidsequenz berechnet wird und dass Lücken bei
der Homologie von bis zu 5% der Gesamtzahl der Nucleotide in der
Referenz zugelassen werden.
-
Die vorliegende Patentanmeldung offenbart
somit Nucleinsäuremoleküle, die
mindestens 90%, 95%, 96%, 97%, 98% oder 99% mit der in 1 [SEQ ID NR: 1] dargestellten
Nucleinsäure
oder der Nucleinsäuresequenz
des hinterlegten Clons identisch sind, unabhängig davon, ob sie ein Polypeptid
mit KGF-2-Aktivität codieren.
Das liegt daran, dass sogar wenn ein bestimmtes Nucleinsäuremolekül ein Polypeptid
ohne KGF-2-Aktivität
codiert, ein Fachmann noch wüsste,
wie er das Nucleinsäuremolekül verwenden
soll, beispielsweise als Hybridisierungssonde oder als Polymerasekettenreaktions
(PCR)-Primer. Die Verwendung dieser Nucleinsäuremoleküle, die ein Polypeptid ohne
KGF-2-Aktivität
codieren, schließt
u. A. ein (1) die Isolierung des KGF-2-Gens oder alleler Varianten
davon in einer cDNA-Genbank, (2) in-situ-Hybridisierung (z. B. „FISH") mit chromosomalen
Ausstrichen in der Metaphase, um den genauen chromosomalen Ort des KGF-2-Gens
bereitzustellen, wie in Verma et al., Human Chromosomes. A Manual
of Basic Techniques, Pergamon Press, New York (1988) beschrieben;
und die Northern-Blot-Analyse zum Nachweis der KGF-2-mRNA-Expression
in spezifischen Geweben.
-
Die vorliegende Patentanmeldung offenbart
insbesondere Nucleinsäuremoleküle, die
mindestens 90%, 95%, 96%, 97%, 98% oder 99% mit der in 1 [SEQ ID NR: 1] dargestellten
Nucleinsäure
oder der Nucleinsäuresequenz
des hinterlegten Clons identisch sind, die tatsächlich ein Polypeptid mit KGF-2-Proteinaktivität codieren.
-
Mit „einem Polypeptid mit KGF-2-Aktivität" sind Polypeptide
gemeint, die eine Aktivität
zeigen, die einer Aktivität
des erfindungsgemäßen Wildtyp-KGF-2-Proteins
oder einer Aktivität ähnelt, die
gegenüber
derjenigen des Wildtyp-KGF-2-Proteins (entweder das Protein mit
der gesamten Länge
oder vorzugsweise das reife Protein) verstärkt ist, wie es in einem bestimmten
biologischen Test gemessen wird, jedoch nicht unbedingt mit ihr
identisch ist.
-
Tests der KGF-2-Aktivität werden
beispielsweise nachstehend in den Beispielen 10 und 11 offenbart. Diese
Tests können
verwendet werden, um die KGF-2-Aktivität von teilweise gereinigtem
oder gereinigtem rekombinantem Protein zu messen.
-
KGF-2 stimuliert die Proliferation
der epidermalen Keratinocyten, jedoch nicht Mesenchymzellen wie Fibroblasten.
Somit schließt „ein Polypeptid
mit KGF-2-Proteinaktivität" Polypeptide ein,
die in dem in Beispiel 10 aufgeführten
Keratinocytenproliferationstest KGF-2-Aktivität zeigen, und an die Rezeptor-Isoformen
1-iiib und 2-iiib (Beispiel 11) binden. Obwohl der Aktivitätsgrad nicht
mit demjenigen des KGF-2-Proteins identisch sein muss, zeigt „ein Polypeptid
mit KGF-2-Proteinaktivität" vorzugsweise eine
im wesentlichen ähnliche
Aktivität
im Vergleich zum KGF-2-Protein (d. h. das Kandidaten-Polypeptid
zeigt relativ zum Referenz-KGF-2-Protein höhere Aktivität oder nicht
mehr als etwa zehnfach weniger und vorzugsweise nicht mehr als zweifach
weniger Aktivität).
-
Natürlich wird der Fachmann aufgrund
der Degenerierung des genetischen Code sofort erkennen, dass eine
große
Anzahl der Nucleinsäuremoleküle, die
eine Sequenz besitzen, die mindestens 90%, 95%, 96%, 97%, 98% oder
99% mit der Nucleinsäuresequenz
des hinterlegten Clons oder der in 1 [SEQ
ID NR: 1 ] dargestellten Nucleinsäure identisch ist, ein Polypeptid „mit KGF-2-Proteinaktivität" codiert. Tatsächlich ist, da
die degenerierten Varianten dieser Nucleotidsequenzen alle dasselbe
Polypeptid codieren, dem Fachmann klar ohne, dass er der vorstehend
beschriebenen Vergleichstest durchführt. Im Fachgebiet erkennt
man ferner, dass eine bemerkenswerte Anzahl derartiger Nucleinsäuremoleküle, die
keine degenerierten Varianten sind, auch ein Polypeptid mit KGF-2-Proteinaktivität codieren.
Das liegt daran, dass der Fachmann sich vollkommen der Aminosäuresubstituitionen
bewusst ist, die entweder weniger wahrscheinlich oder unwahrscheinlich
die Proteinfunktion signifikant beeinflussen (z. B. Ersetzen einer
aliphatischen Aminosäure
durch eine zweite aliphatische Aininosäure).
-
Bei Bowie, J. U. et al., "Deciphering the Message
in Protein Sequences: Tolerance to Amino Acid Substitutions," Science 247: 1306–1310 (1990)
werden beispielsweise Anleitungen bereitgestellt, wie man phänotypisch
stille Aminosäuresubstitutionen
herstellt, wobei die Autoren angeben, dass es zwei Hauptansätze zur Untersuchung
der Toleranz der zu ändernden
Aminosäuresequenz
gibt. Das erste Verfahren beruht auf dem Evolutionsprozess, bei
dem Mutationen entweder durch natürliche Selektion angenommen
oder abgelehnt werden. Beim zweiten Ansatz werden gentechnische
Verfahren verwendet, um einen Austausch der Aminosäuren an
spezifischen Positionen eines clonierten Gens und Selektionen oder
Durchmusterungen einzuführen,
um Sequenzen zu identifizieren, die die Funktionalität erhalten.
Wie die Autoren angeben, haben diese Studien offenbart, dass die
Proteine erstaunlich tolerant gegenüber Aminosäuresubstitutionen sind. Die
Autoren geben ferner an, welche Aminosäurenaustausche wahrscheinlich
an einer bestimmten Proteinposition erlaubt sind. Beispielsweise
erfordern die am meisten verdeckten Aminosäuren unpolare Seitenketten,
während im
allgemeinen wenige Merkmale von Oberflächenseitenketten konserviert
sind. Andere derartige phänotypisch
stille Substitutionen werden bei Bowie, J. U. et al., vorstehend
und den hier zitierten Referenzen beschrieben.
-
Es werden ebenfalls Polynucleotide
offenbart, die mit den hier vorstehend beschriebenen Sequenzen hybridisieren,
wenn mindestens 70%, vorzugsweise mindestens 90% und besonders bevorzugt
mindestens 95% und am meisten bevorzugt 96%, 97%, 98%, 99% Identität zwischen
den Sequenzen vorliegen.
-
Zudem werden Polynucleotide offenbart,
die unter stringenten Bedingungen mit den hier vorstehend beschriebenen
Polynucleotiden hybridisieren. Wie hier verwendet, bedeutet der
Begriff „stringente
Bedingungen", dass
die Hybridisierung nur auftritt, wenn mindestens 95% und vorzugsweise
mindestens 97% Identität zwischen
den Sequenzen vorliegt. Die Polynucleotide, die mit den hier vorstehend
beschriebenen Polynucleotiden hybridisieren, codieren vorzugsweise
Polypeptide, die entweder im wesentlichen dieselbe biologische Funktion
oder Aktivität
wie das reife Polypeptid beibehalten, das von den cDNAs von 1 (SEQ ID NR: 1) oder der/den
hinterlegten cDNA(s) codiert wird.
-
Ein Beispiel „stringenter Hybridisierungsbedingungen" schließt die Inkubation über Nacht
bei 42°C
in einer Lösung
ein, umfassend: 50% Formamid, 5 × SSC (150 mM NaCl, 15 mM Trinatriumcitrat),
50 mM Natriumphosphat (pH 7,6), 5 × Denhardt-Lösung, 10%
Dextransulfat und 20 μg/ml
denaturierte, gescherte Heringssperma DNA, gefolgt von einem Waschen
der Filter in 0,1 × SSC
bei etwa 65°C.
-
Alternativ kann das Polynucleotid
mindestens 20 Basen, vorzugsweise 30 Basen und besonders bevorzugt
mindesten 50 Basen besitzen, die mit einem Polynucleotid der vorliegenden
Erfindung hybridisieren und das damit eine Identität aufweist,
wie hier vorstehend beschrieben, und das die Aktivität beibehalten
kann oder nicht. Beispielsweise können derartige Nucleotide als
Sonden für
das Polynucleotid von SEQ ID NR: 1 verwendet werden, beispielsweise
zur Gewinnung des Polynucleotids oder als diagnostische Sonde oder
als PCR-Primer.
-
Natürlich sind Polynucleotide,
die mit einem größeren Anteil
des Referenzpolynucleotids hybridisieren (z. B. dem hinterlegten
cDNA-Clon), beispielsweise mit einem Anteil mit einer Länge von
50–750
nt oder sogar der Gesamtlänge
des Referenzpolynucleotids gemäß der vorliegenden
Erfindung ebenfalls als Sonden nützlich,
so wie die Polynucleotide, die den meisten, wenn nicht allen, Nucleotidsequenzen
der hinterlegten cDNA oder der in 1 [SEQ
ID NR: 1] dargestellten Nucleotidsequenz entsprechen. Mit einem
Anteil eines Polynucleotids „mit
einer Länge
von mindestens 20 nt" sind
beispielsweise 20 oder mehr aufeinander folgende Nucleotide von
der Nucleotidsequenz des Referenzpolynucleotids (z. B. der hinterlegten
cDNA oder der in 1 [SEQ
ID NR: 1] dargestellten Nucleotidsequenz gemeint. Wie angegeben,
sind derartige Anteile diagnostisch entweder als Sonde nach den
herkömmlichen
DNA-Hybridisierungsverfahren oder als Primer zur Amplifikation einer
Zielsequenz durch die Polymerasekettenreaktion (PCR) nützlich,
wie beispielsweise bei Molecular Cloning, A Laboratory Manual, 2.
Ausgabe, herausgegeben von Sambrook, J., Fritsch, E. F. und Maniatis,
T., (1989), Cold Spring Harbor Laboratory Press, beschrieben, wobei
die gesamte Offenbarung hier durch Bezugnahme einbezogen ist.
-
Da ein KGF-2-cDNA-Clon hinterlegt
wurde und seine ermittelte Nucleotidsequenz in 1 [SEQ ID NR: 1 ] bereitgestellt wurde,
wäre die
Erzeugung von Polynucleotiden, die mit einem Teil des KGF-2-cDNA-Moleküls hybridisieren,
für den
Fachmann Routine. Beispiels weise könnte die Restriktionsendnucleasepaltung oder
das Scheren des KGF-2-cDNA-Clons durch Ultraschall leicht verwendet
werden, um DNA-Anteile mit verschiedenen Größen zu erzeugen, die Polynucleotide
sind, die mit einem Anteil des KGF-2-cDNA-Moleküls hybridisieren. Alternativ
könnten
die hybridisierenden Polynucleotide der vorliegenden Erfindung synthetisch nach
bekannten Verfahren erzeugt werden. Natürlich wäre ein Polynucleotid, das nur
mit einer Poly-A-Sequenz (wie den terminalem 3'-Poly(A)-Schwanz der in 1 [SEQ ID NR: 1 ] dargestellten KGF-2-cDNA)
oder mit einem komplementären
Abschnitt von T- (oder
U-) Resten nicht in ein erfindungsgemäßes Polynucleotid eingeschlossen,
das verwendet wird, um mit einem Teil einer erfindungsgemäßen Nucleinsäure zu hybridisieren,
da ein derartiges Polynucleotid an jedes Nucleinsäuremolekül hybridisieren
würde,
das einen Poly (A)-Abschnitt
oder ein Komplement davon enthält
(z. B. praktisch jeder doppelsträngige
cDNA-Clon).
-
Es werden isolierte Nucleinsäuremoleküle beschrieben,
die Polypeptide codieren, die die folgenden Aminosäurereste
in
1 (SEQ ID NR: 2)
umfassen, die die hier genannten Erfinder als Antigenbereiche des KGF-2-Proteins
ermittelt haben:
-
Es gibt auch zwei zusätzliche
kürzere
vorhergesagte Antigenbereiche, Gln74-Arg78 und Gln170-Gln175. Die
Verfahren zur Erzeugung derartiger Epitop-tragender Anteile von
KGF-2 werden nachstehend detailliert beschrieben.
-
Die Hinterlegung(en), auf die hier
Bezug genommen wird, werden nach den Bedingungen des Budapester
Vertrags über
die internationale Anerkennung der Hinterlegung von Mikroorganismen
für Zwecke
des Patentverfahrens aufrechterhalten. Diese Hinterlegungen werden
nur aus praktischen Gründen
für den
Fachmann bereitgestellt und sind keine Zulassung, dass eine Hinterlegung
nach 35 U. S. C. § 112
erforderlich ist. Die Sequenz der Polynucleotide, die in den hinterlegten
Materialien enthalten sind, sowie die Aminosäuresequenz der dadurch codierten
Polypeptide werden hier unter Bezugnahme einbezogen und sind im
Falle eines Konflikts mit irgendeiner Sequenzbeschreibung hier kontrollierend.
Es kann eine Lizenz erforderlich sein, um die hinterlegten Materialien
herzustellen, zu verwenden oder zu verkaufen und es wird hiermit
keine derartige Lizenz ausgestellt.
-
KGF-2-Polypeptide und
Fragmente
-
Die vorliegende Erfindung betrifft
eine Mutante des KGF-2-Polypeptids, ausgewählt aus der Gruppe, bestehend
aus:
- (a) einer N-terminalen Deletionsmutante
von KGF-2, wobei die Mutante aus der Aminosäuresequenz Ala (63) – Ser (208)
der SEQ ID NR: 2 oder aus der Aminosäuresequenz Ala (63) – Ser (208)
des Proteins besteht, das durch die in dem Plasmid ATCC 75977 enthaltene
cDNA codiert ist, und wobei die Mutante ein N-terminales Methionin
enthält;
- (b) einem Polypeptid, das eine Aminosäuresequenz aufweist, die mindestens
90%, 95%, 97% oder 99% mit der Aminosäuresequenz der KGF-2 Mutante
nach (a) identisch ist;
- (c) einem Polypeptid nach (a), wobei das Polypeptid mindestens
eine Aminosäuresubstitution
hat, ausgewählt
aus der Gruppe bestehend aus Arg(194)Glu, Arg(194)Gln, Lys(191)Glu,
Lys(191)Gln, Arg(188)Glu und Lys(183)Glu.
-
Einem Fachmann ist bewusst, dass
aufgrund der vorstehend diskutierten Möglichkeiten von Fehlern beim
Sequenzieren sowie der Variabilität der Spaltungsstellen für Leader
in verschiedenen bekannten Proteinen das tatsächliche von der hinterlegten
cDNA codierte KGF-2-Polypeptid
etwa 208 Aminosäuren
umfasst, jedoch auch irgendwo im Bereich von 200–220 Aminosäuren liegen kann und die tatsächliche
Leader-Sequenz dieses Proteins etwa 35 oder 36 Aminosäuren beträgt, jedoch
auch irgendwo im Bereich von 30 bis etwa 40 Aminosäuren liegen
kann.
-
Die Begriffe „Fragment", „Derivat" und „Analogon" bei Bezugnahme auf
das Polypeptid von 1 (SEQ
ID NR: 2) oder das von der hinterlegten cDNA bedeuteten ein Polypeptid,
das im wesentlichen dieselbe biologische Funktion oder Aktivität wie ein
derartiges Polypeptid beibehält.
Somit schließt
ein Analogon ein Proprotein ein, das durch Spaltung des Proproteinanteils
aktiviert werden kann, um ein aktives reifes Polypeptid herzustellen.
-
Das Polypeptid der vorliegenden Erfindung
kann ein rekombinantes Polypeptid, ein natürliches Polypeptid oder ein
synthetisches Polypeptid sein, vorzugsweise ein rekombinantes Polypeptid.
-
Das Fragment, das Derivat oder das
Analogon des Polypeptids von 1 (SEQ
ID NR: 2) oder das von der hinterlegten cDNA kann eines sein, bei
dem (i) ein oder mehrere Aminosäurereste
mit einem konservierten oder nicht konservierten Aminosäurerest
(vorzugsweise einem konservierten Aminosäurerest) ausgetauscht werden
und derartige ausgetauschte Aminosäurereste können oder können nicht durch den genetischen
Code codiert werden oder bei dem (ii) ein oder mehrere Aminosäurereste
eine Substituentengruppe einschließen oder eines, bei der (iii)
das reife Polypeptid mit einer anderen Verbindung fusioniert ist,
wie eine Verbindung, um die Halbwertszeit des Polypeptids (beispielsweise
Polyethylenglycol) zu erhöhen
oder eines bei der (iv) die Aminosäuren mit dem reifen Polypeptid
fusioniert ist, wie ein Leader oder eine sekretorische Sequenz oder
eine Sequenz, die zur Reinigung des reifen Polypeptids oder einer
Proproteinsequenz eingesetzt wird. Man erwartet, dass derartige
Fragmente, Derivate und Analoga aufgrund der hier gemachten Ausführungen
im Anwendungsbereich des Fachmanns liegen.
-
Die Begriffe „Peptid" und „Oligopeptid" werden als Synonyme
betrachtet (wie allgemein anerkannt wird) und jeder Begriff kann,
so wie der Zusammenhang es erfordert, austauschbar verwendet werden,
um eine Kette von mindestens zwei Aminosäuren anzugeben, die durch Peptidbindungen
verbunden sind. Das Wort „Polypeptid" wird hier für Ketten
verwendet, die mehr als zehn Aminosäurereste enthalten. Alle Oligopeptid-
und Polypeptidformeln oder Sequenzen hier werden von links nach
rechts und in die Richtung von Aminoterminus zum Carboxyterminus
geschrieben.
-
Im Fachgebiet wird anerkannt, dass
einige Aminosäuresequenzen
des KGF-2-Polypeptids ohne signifikanten Effekt auf die Struktur
oder die Funktion des Proteins variiert werden können. Wenn derartige Unterschiede
in der Sequenz bedacht werden, sollte man sich daran erinnern, dass
es kritische Bereiche auf dem Protein gibt, die die Aktivität bestimmen.
Im allgemeinen ist es möglich,
Reste zu ersetzen, die die tertiäre Struktur
bilden, vorausgesetzt, dass Reste, die eine ähnliche Funktion ausüben, verwendet
werden. In anderen Fällen
kann die Art des Restes völlig
unwichtig sein, wenn die Änderung
an einem unkritischen Bereich des Proteins auftritt.
-
Somit schließt die Erfindung ferner Variationen
von Mutanten der KGF-2-Polypeptide ein, die eine wesentliche KGF-2-Polypeptid-Aktivität zeigen
oder die Bereiche des KGF-2-Proteins wie die nachstehend diskutierten
Proteinanteile einschließen.
Derartige Mutationen schließen
Deletionen, Insertionen, Inversionen, Wiederholungssequenzen und
Typsubstitutionen ein (beispielsweise die Substitution eines hydrophilen
Rests mit einem anderen, jedoch in der Regel nicht einen stark hydrophilen
mit einem stark hydrophoben). Kleine Änderungen oder derartige „neutrale" Aminosäuresubstitutionen
haben im allgemeinen wenig Wirkung auf die Aktivität.
-
Die Substitution untereinander mit
den aliphatischen Aminosäuren
Ala, Val, Leu und Ile, die Substitution der Hydroxylreste Ser und
Thr, die Substitution der sauren Reste Asp und Glu, die Substitution
zwischen den Amidresten Asn und Gln, der Austausch der basischen
Reste Lys und Arg und der Austausch zwischen den aromatischen Resten
Phe, Tyr wird typischerweise als konservative Substitutionen angesehen.
-
Wie vorstehend detailliert angegeben,
kann man weitere Anleitungen darüber,
welche Aminosäuresubstitutionen
wahrscheinlich phänotypisch
still sind (d. h. wahrscheinlich keine signifikante zerstörerische Wirkung
auf eine Funktion haben) bei Bowie, J. U. et al., "Deciphering the Message
in Protein Sequences: Tolerance to Amino Acid Substitutions," Science 247: 1306–1310 (1990)
finden.
-
Die vorliegende Patentanmeldung beschreibt
mimetische Peptide von KGF-2-Mutanten, die als therapeutische Peptide
verwendet werden können.
Mimetische Mutanten der KGF-2-Peptide
sind kurze Peptide, die die biologische Aktivität der KGF-2-Mutanten nachahmen,
indem sie an die verwandten Rezeptoren von KGF-2 binden und sie
aktivieren. Mimetische Mutanten der KGF-2-Peptide können auch
an die verwandten Rezeptoren von KGF-2 binden und sie hemmen. KGF-2-Rezeptoren
schließen
ein, sind aber nicht begrenzt auf FGFR2iiib und FGFR1iiib. Derartige
mimetische KGF-2-Peptide werden aus Verfahren wie Phagen-Display oder kombinatorischer
Chemie erhalten, sind aber nicht darauf begrenzt. Beispielsweise
kann das Verfahren, das von Wrighton et al. Science 273: 458–463 (1996)
offenbart wird, verwendet werden, um mimetische Mutanten der KGF-2-Peptide
zu erzeugen.
-
Die erfindungsgemäßen Polypeptide und Polynucleotide
werden vorzugsweise in einer isolierten Form bereitgestellt und
werden vorzugsweise bis zur Homogenität gereinigt.
-
Die Polypeptide der vorliegenden
Erfindung liegen vorzugsweise in einer isolierten Form vor. Mit „isoliertem
Polypeptid" ist
ein Polypeptid gemeint, das aus seiner nativen Umgebung entfernt
wurde. Somit wird ein Polypeptid, das in einer rekombinanten Wirtszelle
produziert wurde und/oder enthalten ist, als isoliert für die Zwecke
der vorliegenden Erfindung betrachtet. Es sind auch Polypeptide
gemeint, die teilweise oder wesentlich aus einer rekombinanten Wirtszelle
oder einer nativen Quelle gereinigt wurden.
-
Wie vorstehend beschrieben, betrifft
die vorliegende Erfindung auch Polypeptide, die eine Aminosäuresequenz
besitzen, die mindestens 90%, 95%, 97% oder 99% mit der Aminosäuresequenz
einer N-terminalen KGF-2-Mutante identisch ist, wobei die Mutante
aus der Aminosäuresequenz
Ala (63) – Ser
(208) der SEQ ID NR: 2 oder aus der Aminosäuresequenz Ala (63) – Ser (208)
des Proteins besteht, das von der in dem Plasmid ATCC 75977 enthaltenen
cDNA codiert wird.
-
Wie aus dem Fachgebiet bekannt, wird
die „Ähnlichkeit" zwischen zwei Polypeptiden
bestimmt, indem die Aminosäuresequenz
und ihre konservierten Aminosäuresubstituenten
eines Polypeptids mit der Sequenz eines zweiten Polypeptids verglichen
wird.
-
Mit „%-Ähnlichkeit" für
zwei Polypeptide ist eine Ähnlichkeitstrefferquote
gemeint, die durch Vergleich der Aminosäuresequenzen der beiden Polypeptide
unter Verwendung des Bestfit-Programms (Wisconsin Sequence Analysis
Package, Version 8 für
Unix, Genetics Computer Group, University Research Park, 575 Science
Drive, Madison, WI 53711) und der Standardeinstellungen zur Ähnlichkeitsbestimmung
erzeugt wird. Beim Bestfit-Programm werden die lokalen Homologiealgorithmen
von Smith und Waterman (Advances in Applied Mathematics 2: 482–489, 1981)
verwendet, um das beste Ähnlichkeitssegment
zwischen zwei Segmenten zu finden.
-
Mit einem Polypeptid, das eine Aminosäuresequenz
besitzt, die beispielsweise mindestens 95% „identisch" mit einer Referenzaminosäuresequenz
eines KGF-2-Polypeptids ist, ist gemeint, dass die Aminosäuresequenz
des Polypeptids mit der Referenzsequenz identisch ist, außer, dass
die Polypeptidsequenz jeweils pro 100 Aminosäuren der Referenzaminosäuresequenz
bis zu fünf Änderungen
der Aminosäuren
eines KGF-2-Polypeptids einschließen kann. Mit anderen Worten,
um ein Polynucleotid zu erhalten, das eine Aminosäuresequenz
besitzt, die mindestens 95% mit einer Referenzaminosäuresequenz
identisch ist, können
bis zu 5% der Aminosäurereste
in der Referenzsequenz deletiert oder durch eine andere Aminosäure ersetzt
werden oder mehrere Aminosäuren
von bis zu 5% der Gesamtaminosäurereste
in der Referenzsequenz können in
die Referenzsequenz eingebaut werden. Diese Änderungen der Referenzsequenz
kann an der amino- oder carboxyterminalen Position der Referenzaminosäuresequenz
oder irgendwo zwischen den terminalen Positionen auftreten, die
entweder einzeln zwischen den Resten in der Referenz oder in einer
oder mehreren aufeinander folgenden Gruppen innerhalb der Referenzsequenz
verteilt sind.
-
In der Praxis kann unter Verwendung
bekannter Computerprogramme wie das Bestfit-Programm (Wisconsin Sequence Analysis
Package, Version 8 für
Unix, Genetics Computer Group, University Research Park, 575 Science
Drive, Madison, WI 53711) auf herkömmliche Weise bestimmt werden,
ob irgendein bestimmtes Polypeptid mindestens 90%, 95%, 96%, 97%,
98% oder 99% mit beispielsweise der in 1 [SEQ ID NR: 2] dargestellten Amino säuresequenz
oder mit der vom hinterlegten cDNA-Clons codierten Aminosäuresequenz identisch
ist. Bei der Verwendung von Bestfit oder irgendeinem anderen Programm
zur Ausrichtung von Sequenzen, um zu bestimmen, ob eine bestimmt
Sequenz beispielsweise 95% identisch mit einer Referenzsequenz nach
der vorliegenden Erfindung ist, werden die Parameter natürlich so
eingestellt, dass die prozentuale Identität über die gesamte Länge der
Referenzaminosäuresequenz
berechnet wird und dass Lücken
bei der Homologie von bis zu 5% der Gesamtzahl der Aminosäurereste
in der Referenz zugelassen werden.
-
Wie nachstehend detailliert beschrieben,
können
die Polypeptide der vorliegenden Erfindung verwendet werden, um
polyclonale und monoclonale Antikörper zu erzeugen, die bei diagnostischen
Tests zum Nachweis der KGF-2-Proteinexpression, wie nachstehend
beschrieben, nützlich
sind oder sie können
als Agonisten und Antagonisten verwendet, die die KGF-2-Proteinfunktion erhöhen oder
hemmen können.
Ferner können derartige
Polypeptide im Zweihybridsystem der Hefe verwendet werden, um die
KGF-2-Protein-bindenden Proteine zu „fangen", die ebenfalls Kandidaten-Agonisten
und Antagonisten nach der vorliegenden Erfindung sind. Das Zweihybridsystem
der Hefe wird bei Fields und Song, Nature 340: 245–246 (1989)
beschrieben.
-
Dem Fachmann ist bewusst, dass Mutanten
der KGF-2-Polypeptide der vorliegenden Erfindung mit Teilen der
konstanten Domäne
von Immunglobulinen (IgG) kombiniert werden können, was zu chimeren Polypeptiden
führt.
Diese Fusionsproteine erleichtern die Reinigung und zeigen eine
erhöhte
Halbwertszeit in vivo. Das wurde z. B. für chimere Proteine gezeigt,
die aus den ersten beiden Domänen
des menschlichen CD4-Polypeptids und verschiedenen Domänen der
konstanten Regionen der schweren oder leichten Ketten der Säugerimmunglobuline
bestehen (EPA 394,827; Traunecker et al., Nature 331: 84–86 (1988)).
Fusionsproteine, die eine Disulfid-verbundene dimere Struktur aufgrund
des IgG-Anteils besitzen, können
auch effizienter bei der Bindung und Neutralisierung anderer Moleküle sein
als monomere KGF-2-Proteine
oder Proteinfragmente allein (Fountoulakis et al., J Biochem 270:
3958–3964
(1995)).
-
Es werden auch neuartige Varianten
der KGF-2-Mutanten beschrieben. Diese können hergestellt werden, indem
eine oder mehrere Aminosäuren
der KGF-2-Mutanten deletiert oder ersetzt werden. Natürliche Mutationen
werden als allele Variationen bezeichnet. Allele Variationen können still
sein (keine Änderung
im codierten Polypeptid) oder können
eine geänderte
Aminosäuresequenz
besitzen.
-
Um zu versuchen die Merkmale der
KGF-2-Mutante zu verbessern oder zu ändern, können Protein-Engineering-Verfahren
eingesetzt werden. Man kann rekombinante, dem Fachmann bekannte
DNA-Technologie verwenden, um neuartige Polypeptide zu erzeugen.
Muteine und Deletionen können
z. B. erhöhte
Aktivität
oder erhöhte
Stabilität
zeigen. Zusätzlich
könnten
sie mit einem höheren
Ertrag gereinigt werden und zumindest unter bestimmten Reinigungsbedingungen
und Lagerbedingungen eine bessere Löslichkeit zeigen. Nachstehend
sind Beispiele von Mutationen aufgeführt, die konstruiert werden
können.
-
Aminoterminale
und carboxyterminal Deletionen
-
Verschiedene Mitglieder der FGF-Familie
wurden unter Verwendung rekombinanter DNA-Technologie modifiziert.
Positiv geladene Moleküle
wurden sowohl im aFGF als auch bFGF ersetzt oder deletiert, die
für die Heparinbindung
wichtig sind. Die modifizierten Moleküle führten zu einer reduzierten
Heparin-bindenden Aktivität.
Demnach ist bekannt, dass die Menge an modifiziertem Molekül, das von
Heparin in einem Patienten komplexiert wird, reduziert würde, wobei
die Wirksamkeit erhöht
würde,
je mehr FGF den geeigneten Rezeptor erreichen würde. (
EP 0 298 723 ).
-
Natives KGF-2 ist im wässrigen
Zustand relativ instabil und es erfährt einen chemischen und physikalischen
Abbau, der zum Verlust von biologischer Aktivität während der Verarbeitung und
Lagerung führt.
Natives KGF-2 neigt auch dazu, in wässriger Lösung bei erhöhten Temperaturen
zu aggregieren und es wird unter sauren Bedingungen inaktiv.
-
Um ein oder mehrere Merkmale des
nativen KGF-2 zu verbessern oder zu ändern, können Protein-Engineering-Verfahren
verwendet werden. Ron et al., J. Biol. Chem., 268(4): 2984–2988 (1993)
berichtete über modifizierte
KGF-2-Proteine, die eine Heparin-bindende Aktivität besaßen, auch
wenn die 3, 8, oder 27 aminoterminalen Aminosäurereste fehlten. Die Deletion
von 3 und 8 Aminosäuren
besaß volle
Aktivität.
Mehr Deletionen von KGF-2 wurden in PCT/IB95/00971 beschrieben.
Die Deletion von carboxyterminalen Aminosäuren kann die Proteinaktivität erhöhen. Ein
Beispiel ist Interferon gamma, das bis zu zehnmal höhere Aktivität durch
Deletion von zehn Aminosäureresten
aus dem Carboxyterminus des Proteins zeigt (Döbeli et al., J. of Biotechnology
7: 199–216
(1988)). Somit ist ein erfindungsgemäßer Aspekt, die Polypeptidanaloga
von KGF-2 und die Nucleotidsequenzen derartiger Analoga von KGF-2
und Nucleotidsequenzen bereitzustellen, die derartige Analoga codieren,
die eine erhöhte
Stabilität
(z. B. bei Exposition gegenüber
einem typischen pH-Wert, Wärmebedingungen
oder anderen Lagerbedingungen) im Verhältnis zum nativen KGF-2-Polypeptid
zeigen.
-
Die erfindungsgemäßen nativen KGF-2-Polypeptide
sind nachstehend dargestellt (die Nummerierung beginnt mit der ersten
Aminosäure
im Protein (Met)):
Ser(46)-Ser(208)
Pro(47)-Ser(208)
Glu
(48)-Ser(208)
Ala (49)-Ser(208)
Thr(50)-Ser(208)
Asn(51)-Ser(208)
Ser(52)-Ser(208)
Ser(53)-Ser(208)
Ser(54)-Ser(208)
Ser(55)-Ser(208)
Ser(56)-Ser(208)
Phe
(57)-Ser(208)
Ser(59)-Ser(208)
Ser(62)-Ser(208)
Ala(63)-Ser(208)
Gly(64)-Ser(208)
Arg(65)-Ser(208)
Val(57)-Ser(208)
Ser(69)-Ser(208)
Val(77)-Ser(208)
-
Die Erfindung schließt die N-terminalen
Deletionen Ala (63) – Ser
(208) (KGF-2Δ28)
und Ser (69) – Ser
(208) (KGF-2Δ33)
ein. Weitere bevorzugte N-terminale und C-terminale Deletionsmutanten
werden in den Beispielen 13 und 16 (c) der Beschreibung beschrieben
und schließen
ein:
Pro (47) – Ser
(208) und Val (77) – Ser
(208)
-
In die vorliegende Erfindung sind
Deletionsmutanten, ebenfalls eingeschlossen, die Aminosäuren besitzen,
die sowohl am N-Terminus als auch am C-Terminus deletiert sind.
Diese Kombinationen können
unter Verwendung rekombinanter, dem Fachmann bekannter Verfahren
gemacht werden.
-
In der vorliegenden Patentanmeldung
werden N-terminale Deletionsmutanten beschrieben. Derartige Mutanten
schließen
diejenigen ein, die die in 1 (SEQ
ID NR: 2) dargestellten Aminosäuresequenz
zeigen, außer
eine Deletion mit mindestens den ersten 38 N-terminalen Aminosäureresten
(d. h. eine Deletion von mindestens Met (1) – Gln (38)), jedoch nicht mehr
als die ersten 147 N-terminalen Aminosäurereste von 1 (SEQ ID NR: 2). Alternativ schließt die Deletion
mindestens die ersten 38 N-terminalen Aminosäurereste (d. h. eine Deletion
von mindestens Met (1) – Gln
(38)), jedoch nicht mehr als die ersten 137 N-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2)
ein. Alternativ schließt
die Deletion mindestens die ersten 46 N-terminalen Aminosäurereste,
jedoch nicht mehr als die ersten 137 N-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2)
ein. Alternativ schließt
die Deletion mindestens die ersten 62 N-terminalen Aminosäurereste,
jedoch nicht mehr als die ersten 137 N-terminalen Aminosäurereste von 1 (SEQ ID NR: 2) ein. Alternativ schließt die Deletion
die mindestens ersten 68 N-terminalen Aminosäurereste, jedoch nicht mehr
als die ersten 137 N-terminalen Aminosäurereste von 1 (SEQ ID NR: 2) ein. Alternativ schließt die Deletion
mindestens die ersten 76 N-terminalen Aminosäurereste, jedoch nicht mehr
als die ersten 137 N-terminalen Aminosäurereste von 1 (SEQ ID NR: 2) ein. Alternativ schließt die Deletion
mindestens die ersten 92 N-terminalen Aminosäurereste, jedoch nicht mehr
als die ersten 137 N-terminalen Aminosäurereste von 1 (SEQ ID NR: 2) ein. Alternativ schließt die Deletion
mindestens die ersten 103 N-terminalen Aminosäurereste, jedoch nicht mehr als
die ersten 137 N-terminalen Aminosäurereste von 1 (SEQ ID NR: 2) ein. Alternativ schließt die Deletion mindestens
die ersten 122 N-terminalen Aminosäurereste, jedoch nicht mehr
als die ersten 137 N-terminalen Aminosäurereste von 1 (SEQ ID NR: 2) ein.
-
Zusätzlich zu den Bereichen der
vorstehend beschriebenen N-terminalen Deletionsmutanten werden in
der vorliegenden Patentanmeldung auch alle Kombinationen der vorstehend
beschriebenen Bereiche beschrieben, z. B. Deletionen mit mindestens
den ersten 62 N-terminalen Aminosäureresten, jedoch nicht mehr als
den ersten 68 N-terminalen Aminosäureresten von
-
1 (SEQ
ID NR: 2); Deletionen mit mindestens den ersten 62 N-terminalen
Aminosäureresten,
jedoch nicht mehr als die ersten 76 N-terminalen Aminosäureresten
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den ersten 62 N-terminalen Aminosäureresten,
jedoch nicht mehr als den ersten 92 N-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den ersten 62 N-terminalen Aminosäureresten,
jedoch nicht mehr als den ersten 103 N-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2); Deletionen
mit mindestens den ersten 68 N-terminalen Aminosäureresten, jedoch nicht mehr
als den ersten 76 N-terminalen Aminosäureresten von 1 (SEQ ID NR: 2); Deletionen mit mindestens
den ersten 68 N-terminalen Aminosäureresten, jedoch nicht mehr
als den ersten 92 N-terminalen Aminosäureresten von 1 (SEQ ID NR: 2); Deletionen mit mindestens
den ersten 68 N-terminalen
Aminosäureresten,
jedoch nicht mehr als den ersten 103 N-terminalen Aminosäureresten
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den ersten 46 N-terminalen Aminosäureresten,
jedoch nicht mehr als den ersten 62 N-terminalen Aminosäureresten
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den ersten 46 N-terminalen Aminosäurereste,
jedoch nicht mehr als den ersten 68 N-terminalen Aminosäureresten
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den ersten 46 N-terminalen Aminosäurereste,
jedoch nicht mehr als den ersten 76 N-terminalen Aminosäureresten
von 1 (SEQ ID NR: 2);
etc. etc. etc.
-
In der vorliegenden Patentanmeldung
werden auch C-terminale Deletionsmutanten beschrieben. Vorzugsweise
ist der N-terminale Aminosäurerest
der C-terminalen Deletionsmutauten Aminosäurerest 1 (Met), 36 (Thr) oder
37 (Cys) von 1 (SEQ
ID NR: 2). Derartige Mutanten schließen diejenigen ein, die die
in 1 (SEQ ID NR: 2)
dargestellte Aminosäuresequenz
umfassen, außer
eine Deletion mit mindestens dem letzten C-terminalen Aminosäurerest
(Ser (208)), jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste (d.
h. eine Deletion der Aminosäurereste
Glu (154) – Ser
(208) von 1 (SEQ ID
NR: 2). Alternativ schließt die
Deletion mindestens den letzten C-terminalen Aminosäurerest
ein, jedoch nicht mehr als die letzen 65 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2).
Alternativ schließt
die Deletion mindestens die letzten 10 C-terminalen Aminosäurereste
ein, jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste von 1 (SEQ ID NR: 2). Alternativ
schließt
die Deletion mindestens die letzten 20 C-terminalen Aminosäurereste
ein, jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2).
Alternativ schließt
die Deletion mindestens die letzten 30 C-terminalen Aminosäure reste
ein, jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2).
Alternativ schließt
die Deletion mindestens die letzten 40 C-terminalen Aminosäurereste
ein, jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste
von 1 (SEQ II) NR:
2). Alternativ schließt
die Deletion mindestens die letzten 50 C-terminalen Aminosäurereste
ein, jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2).
-
Zusätzlich zu dem Bereichen der
vorstehend beschriebenen C-terminalen Deletionsmutanten werden in
der vorliegenden Patentanmeldung auch alle Kombinationen der vorstehend
beschriebenen Bereiche beschrieben, z. B. Deletionen mit mindestens
dem letzten C-terminalen Aminosäurerest,
jedoch nicht mehr als die letzten 10 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens dem letzten C-terminalen Aminosäurerest,
jedoch nicht mehr als die letzten 20 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens dem C-terminalen Aminosäurerest,
jedoch nicht mehr als die letzten 30 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens dem C-terminalen Aminosäurerest,
jedoch nicht mehr als die letzten 40 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den letzten 10 C-terminalen Aminosäureresten,
jedoch nicht mehr als die letzten 20 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den letzten 10 C-terminalen Aminosäureresten,
jedoch nicht mehr als die letzten 30 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den letzten 10 C-terminalen Aminosäureresten,
jedoch nicht mehr als die letzten 40 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
Deletionen mit mindestens den letzten 20 C-terminalen Aminosäureresten,
jedoch nicht mehr als die letzten 30 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2);
etc. etc. etc.
-
In der vorliegenden Patentanmeldung
werden auch Deletionsmutanten beschrieben, bei denen Aminosäurereste
sowohl aus den N-terminalen als auch aus den C-terminalen Resten
deletiert wurden. Derartige Mutanten schließen alle Kombinationen von
N-terminalen Deletionsmutanten und vorstehend beschriebenen C-terminalen
Deletionsmutanten ein. Derartige Mutanten schließen diejenigen ein, die die
in 1 (SEQ ID NR: 2)
dargestellten Aminosäuresequenz
umfassen, außer
eine Deletion mit mindestens den ersten 46 N-terminalen Aminosäureresten,
jedoch nicht mehr als die ersten 137 N-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2)
und eine Deletion mit mindestens dem letzten C-terminalen Aminosäurerest,
jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2).
Alternativ kann die Deletion mindestens die ersten 62, 68, 76, 92,
103 oder 122 N-terminalen
Aminosäurereste,
jedoch nicht mehr als die ersten 137 N-terminalen Aminosäurereste
von 1 (SEQ ID NR: 2)
und eine Deletion mit mindestens 10, 20, 30, 40 oder 50 C-terminalen Aminosäureresten,
jedoch nicht mehr als die letzen 55 C-terminalen Aminosäurereste
von 1, einschließen.
-
Ferner werden alle Kombinationen
der vorstehend beschriebenen Bereiche beschrieben.
-
Substitution
der Aminosäuren
-
Ein weiterer Aspekt der vorliegenden
Erfindung schließt
auch die Substitution von Aminosäuren
ein. Nativer reifer KGF-2 enthält
44 geladene Reste, von denen 32 eine positive Ladung tragen. Abhängig vom
Ort derartiger Reste in der dreidimensionalen Struktur des Proteins
kann die Substitution von einem oder mehreren dieser geclusterten
Reste mit Aminosäuren,
die eine negative Ladung oder eine neutrale Ladung tragen, die elektrostatischen
Wechselwirkungen angrenzender Reste ändern und kann nützlich sein,
um eine höhere Stabilität und geringere
Aggregation des Proteins zu erreichen. Die Aggregation von Proteinen
kann nicht nur zu einem Aktivitätsverlust
führen,
sondern auch bei der Herstellung pharmazeutischer Formulierungen
problematisch sein, da sie immunogen sein können (Pinckard et al., Clin.
Exp. Immunol. 2: 331–340
(1967), Robbins et al., Diabetes 36: 838–845 (1987), Cleland et al.,
Crit. Rev. Therapeutic Drug Carrier Systems 10: 307–377 (1993)).
Zur Reduzierung der Ladungsabstoßung sollte jede Modifikation
in der Tertiärstruktur
des Proteinmoleküls
auf ein Minimum in Betracht gezogen werden. Somit sind Substitutionen
von geladenen Aminosäuren mit
einer anderen Ladung und mit neutralen oder negativ geladenen Aminosäuren von
speziellem Interesse. Das letztere führt zu Proteinen mit einer
verminderten positiven Ladung, um die Merkmale von KGF-2 zu verbessern.
Derartige Verbesserungen schließen
erhöhte
Stabilität
und die geringere Aggregation des Analogons im Vergleich zum nativen
KGF-2-Protein ein.
-
Der Austausch von Aminosäuren kann
auch die Selektivität
der Bindung an Zelloberflächenrezeptoren verändern Ostade
et al., Nature 361: 266–268
(1993) beschrieb bestimmte TNF-alpha-Mutationen, die an nur einen
der beiden bekannten Rezeptoren zur selektiven Bindung von TNF-alpha
führte.
-
KGF-2-Moleküle können eine oder mehrere Aminosäuresubstitutionen,
Deletionen oder Additionen entweder aufgrund natürlicher Mutation oder menschlicher
Manipulation einschließen.
Beispiele von einigen bevorzugten Mutationen sind:
-
-
Beispielsweise ist mit der Bezeichnung
Ala (49) Gln gemeint, dass das Ala an Position 49 von 1 (SEQ ID NR: 2) durch
Gln ersetzt ist.
-
Die Änderungen sind vorzugsweise
von unbedeutender Natur wie konservative Aminosäuresubstitutionen, die die
Faltung oder die Aktivität
des Proteins nicht wesentlich beeinflussen. Dem Fachmann bekannte Beispiele
konservativer Aminosäuresubstitutionen
sind nachstehend aufgeführt:
| Aromatisch: | Phenylalanin
Tryptophan Tyrosin |
| Hydrophob: | Leucin
Isoleucin Valin |
| Polar: | Glutamin
Asparagin |
| Basisch: | Arginin
Lysin Histidin |
| Sauer: | Asparaginsäure Glutaminsäure |
| Klein: | Alanin
Serin Threonin Methionin Glycin |
-
Natürlich hängt die Anzahl der Aminosäuresubstitutionen,
die ein Fachmann durchführen
würde,
von vielen Faktoren ab, einschließlich denjenigen, die vorstehend
beschrieben wurden. Im allgemeinen beträgt die Anzahl der Substitutionen
für jedes
gegebene KGF-2-Polypeptid nicht mehr als 50, 40, 30, 20, 10, 5 oder
3, abhängig
von der Zielsetzung. Beispielweise werden mehrere Substitutionen,
die im C-Terminus von KGF-2 zur Verbesserung der Stabilität durchgeführt werden,
vorstehend und in Beispiel 22 beschrieben.
-
Für
die Funktion wesentliche Aminosäuren
in KGF-2 können
durch Verfahren, die aus dem Fachgebiet gut bekannt sind, wie zielgerichtete
Mutagenese oder Alanin-Scanning-Mutagenese (Cunningham und Wells, Science
244: 1081–1085
(1989)) identifiziert werden. Das letztere Verfahren führt einzelne
Alaninmutationen an jedem Rest im Molekül ein. Die sich ergebenden
Molekülmutanten
werden dann auf biologische Aktivität wie Rezeptorbindung oder
in vitro- und in vivo-Proliferationsaktivität getestet. (Vgl. z. B. Beispiele
10 und 11). Stellen, die für
die Liganden-Rezeptorbindung wichtig sind, können auch durch Strukturanalyse
wie Kristallisation, magnetische Kernresonanz oder Photoaffinitätsmarkierung
bestimmt werden. (Vgl. beispielsweise: Smith et al., J. Mol. Biol.
224: 899–904
(1992) und de Vos et al. Science, 255: 306–312 (1992).)
-
Die Substitution von Serin mit Cystein
kann an den Aminosäurepositionen
106 und 150 erfolgen. Eine ungerade Anzahl von Cysteinen bedeutet,
dass mindestens ein Cysteinrest für intermolekulare Quervernetzungen
oder Bindungen verfügbar
ist, die bewirken, dass das Pro tein eine unerwünschte Tertiärstruktur
annimmt. Neuartige KGF-2-Proteine, bei denen ein oder mehrere Cysteine
durch Serin oder z. B. Alanin ersetzt wurden, werden im allgemeinen
mit einem höheren
Ertrag von löslichem,
korrekt gefalteten Protein gereinigt. Obwohl es nicht erwiesen ist,
glaubt man, dass der Cysteinrest an Position 106 für die Funktion
wichtig ist. Der Cysteinrest ist unter all den anderen FGF-Familienmitgliedern
hoch konserviert.
-
Ein weiterer Aspekt der vorliegenden
Erfindung sind Fusionen von KGF-2 mit anderen Proteinen oder Fragmenten
davon, wie Fusionen oder Hybride mit anderen FGF-Proteinen, z. B.
KGF (FGF-7), bFGF, aFGF, FGF-5, FGF-6 etc. Über ein derartiges Hybrid wurde
für KGF
(FGF-7) berichtet. In der veröffentlichten
PCT-Anmeldung Nr. 90/08771 wurde ein chimeres Protein hergestellt,
das aus den ersten 40 Aminosäureresten
von KGF und dem C-terminalen
Anteil von aFGF besteht. Über
das Chimär
wurde berichtet, das es Keratinocyten wie KGF anvisiert, ihm jedoch
die Empfindlichkeit gegenüber
Heparin fehlte, ein Merkmal von aFGF, jedoch nicht von KGF. Die
Fusionen mit Teilen der konstanten Domäne von Immunglobulinen (IgG)
zeigen oft eine erhöhte
Halbwertszeit in vivo. Das wurde z. B. für chimere Proteine gezeigt,
die aus den ersten beiden Domänen
des menschlichen CD4-Polypeptids mit verschiedenen Domänen der
konstanten Bereiche der schweren oder leichten Ketten der Säuger-Immunglobuline
bestehen (Europäische
Patentanmeldung, Publikation Nr. 394 827, Traunecker et al., Nature
331, 84–86
(1988)). Fusionsproteine, die eine mit Disulfidenverbundene dimere
Struktur besitzen, können
auch bei der Bindung von ausschließlich monomeren Molekülen effizienter sein.
(Fountoulakis et al., J. of Biochemistry, 270: 3958–3964, (1995)).
-
Antigene/Hydrophile Teile
von KGF-2
-
Wie in 4A–4E gezeigt, gibt es 4 sehr
hydrophile Hauptbereiche im KGF-2-Protein. Die Aminosäurereste
Gly41–Asn
71, Lys91–Ser
109, Asn 135–Tyr
164 und Asn 181–Ala
199 [SEQ ID NR: 25–28].
Es gibt zwei zusätzliche
kürzere
vorhergesagte antigene Bereiche Gln 74–Arg 78 und Gln 170–Gln 175.
Man weiß, dass
die hydrophilen Teile hauptsächlich
an der Außenseite
(Oberfläche)
von Proteinen liegen und deshalb für Antikörper verfügbar sind, die diese Bereiche
erkennen. Diese Bereiche sind auch wahrscheinlich an der Bindung
von KGF-2 an seine(n) Rezeptoren) beteiligt. Synthetische Peptide,
die von diesen Bereichen stammen, können mit der Bindung von KGF-2
an seine(n) Rezeptoren) interferieren und des halb die Funktion des
Proteins blockieren. Synthetische Peptide aus den hydrophilen Teilen
des Proteins können
auch agonistisch sein, d. h. die Funktion von KGF-2 nachahmen.
-
Chemische
Modifikationen
-
Mutanten der KGF-Polypeptide können weiter
modifiziert werden, damit sie zusätzliche chemische Einheiten
zu enthalten, die normalerweise nicht Teil des Proteins sind. Diese
derivatisierten Einheiten können die
Löslichkeit,
die biologische Halbwertszeit oder die Absorption des Proteins verbessern.
Die Einheiten können
auch alle wünschenswerten
Nebenwirkungen des Proteins oder dergleichen reduzieren oder eliminieren. Einen Überblick über jene
Einheiten kann man bei REMINGTON'S
PHARMACEUTICAL SCIENCES, 18. Ausg., Mack Publishing Co., Easton,
PA (1990) finden. Polyethylenglycol (PEG) ist eine solche chemische
Einheit, die zur Herstellung therapeutischer Proteine verwendet
wurde. Es wurde gezeigt, dass die Bindung von PEG an Proteine gegen
Proteolyse schützt
Sada et al., J. Fermentation Bioengineering 71: 137–139 (1991). Für die Bindung
bestimmter PEG-Einheiten stehen verschiedene Verfahren zur Verfügung. Für einen Überblick vgl.
Abuchowski et al., in Enzymes as Drugs. (Holcerberg und Roberts,
Herausg.) S. 367–383
(1981). In vielen veröffentlichten
Patenten werden die Derivate von PEG und die Verfahren beschreiben,
wie sie hergestellt werden, z. B. Ono et al. U.S.-Patent Nr. 5,342,940;
Nitecki et al. U.S.-Patent Nr. 5,089,261; Delgado et al. U.S.-Patent
Nr. 5,349,052. Im allgemeinen sind die PEG-Moleküle mit dem Protein über eine
reaktive Gruppe verbunden, die auf dem Protein zu finden ist. Für diese
Bindung sind unter anderem die Aminogruppen z. B. auf Lysinen oder
dem Aminoterminus des Proteins praktisch.
-
Vektoren und
Wirtszellen
-
Die vorliegende Erfindung betrifft
auch Vektoren, die die isolierten DNA-Moleküle der vorliegenden Erfindung
einschließen,
Wirtszellen, die gentechnisch mit den rekombinanten Vektoren hergestellt
werden und die Herstellung von Mutanten der KGF-2-Polypeptide oder
Fragmenten davon durch rekombinante Verfahren.
-
Fragmente oder Teile der Polypeptide
der vorliegenden Erfindung können
zur Herstellung der entsprechenden Polypeptide mit der gesamten
Länge durch
Peptidsynthese verwendet werden; deshalb können die Fragmente als Zwischenprodukte
zur Herstellung der Polypeptide mit der gesamten Länge verwendet
werden. Fragmente oder Teile der Polypeptide der vorliegenden Erfindung
können
verwendet werden, um Polypeptide der vorliegenden Erfindung mit
der gesamten Länge
zu synthetisieren. Die vorliegende Erfindung betrifft auch Vektoren,
die Polynucleotide der vorliegenden Erfindung einschließen, Wirtszellen,
die gentechnisch mit den erfindungsgemäßen rekombinanten Vektoren
hergestellt werden, und die Herstellung erfindungsgemäßer Polypeptide
durch rekombinante Verfahren.
-
Die Wirtszellen werden gentechnisch
(transduziert oder transformiert oder transfiziert) mit den erfindungsgemäßen Vektoren
hergestellt, die beispielsweise ein Clonierungsvektor oder ein Expressionsvektor sein
können.
Der Vektor kann beispielsweise in Form eines Plasmids, eines Viruspartikel,
eines Phagen etc. vorliegen. Die gentechnisch hergestellten Wirtszellen
können
in herkömmlichen
Nährmedien
gezüchtet
werden, die für
die Aktivierung von Promotoren, die Auswahl von Transformanten oder
Amplifikation der KGF-2-Gene passend modifiziert werden. Die Kulturbedingungen
wie Temperatur, pH-Wert und dergleichen sind diejenigen, die früher mit
der für
die Selektion ausgewählten
Wirtszelle verwendet wurden und sind für den Fachmann offensichtlich.
-
Die Polynucleotide der vorliegenden
Erfindung können
zur Herstellung von Polypeptiden durch rekombinante Verfahren verwendet
werden. Somit kann das Polynucleotid in irgendeinen aus einer Reihe
von Expressionsvektoren zur Expression eines Polypeptids eingebaut
werden. Derartige Vektoren schließen chromosomale, nicht chromosomale
und synthetische DNA-Sequenzen, z. B. Derivate von SV40, bakterielle
Plasmide; Phagen-DNA; Baculovirus, Hefeplasmide; Vektoren, die von
Kombinationen von Plasmiden und Phagen-DNA stammen, Virus-DNA wie
Vaccinia, Adenovirus, Geflügelpocken-Virus
und Pseudotollwut ein. Jedoch kann jeder andere Vektor verwendet
werden, solange er replizierbar und im Wirt überlebensfähig ist.
-
Die geeignete DNA-Sequenz kann in
den Vektor durch eine Reihe von Verfahren eingebaut werden. Im allgemeinen
wird die DNA in (eine) geeignete Restriktionsendunucleaseschnittstelle(n)
mittels aus dem Fachgebiet bekannter Verfahren eingebaut. Man glaubt,
dass derartige und andere Verfahren und sonstiges im Anwendungsbereich
des Fachmanns liegen.
-
Die DNA im Expressionsvektor ist
funktional mit geeigneten Expressionskorttrollsequenzen (Promotor)
verbunden, um die cDNA-Synthese zu lenken. Als repräsentative
Beispiele derartiger Promotoren kann man erwähnen: LTR- oder SV40-Promotor,
der E. coli lac- oder
trp-Promotor, der Lambda-Phagen-PL-Promotor
und andere Promotoren, von denen bekannt ist, dass sie die Genexpression
in prokaryontischen oder eukaryontischen Zellen oder deren Viren
kontrollieren. Der Expressionsvektor enthält auch eine ribosomale Bindestelle
zur Translationsinitiation und einen Transkriptionsterminator. Der
Vektor kann auch geeignete Sequenzen zur Amplifikationsexpression
enthalten.
-
Zusätzlich enthalten die Expressionsvektoren
vorzugsweise ein oder mehrere Selektionsmarkergene, wie Dihydrofolatreduktase
oder Neomycin-Resistenz für
eukaryontische Zellkultur oder ein derartiges wie Tetracyclin- oder
Ampicillin-Resistenz, um ein phänotypisches
Merkmal zur Selektion transformierter Wirtszellen in E. coli bereitzustellen.
-
Der Vektor, der die geeignete DNA-Sequenz,
wie hier vorstehend beschrieben, sowie einen geeigneten Promotor
oder Kontrollsequenz enthält,
kann zur Tranformation eines geeigneten Wirts verwendet werden, damit
der Wirt das Protein exprimieren kann.
-
Als repräsentative Beispiele geeigneter
Wirte kann man erwähnen:
Bakterienzellen wie E. coli, Streptomyces, Salmonella typhimurium;
Pilzzellen wie Hefe; Insektenzellen wie Drosophila S2 und Spodoptera
Sf9; tierische Zellen wie CHO, COS oder Bowes-Melanom; Adenoviren;
Pflanzenzellen etc. Man glaubt, dass die Auswahl eines geeigneten
Wirtes aufgrund der hier gemachten Ausführungen im Anwendungsbereich
des Fachmanns liegt.
-
Genauer gesagt, schließt die vorliegende
Erfindung auch rekombinante Konstrukte ein, die eine oder mehrere
Sequenzen umfasst, wie ausführlich
vorstehend beschrieben. Die Konstrukte umfassen einen Vektor wie
ein Plasmid oder einen Virusvektor, in den eine erfindungsgemäße Sequenz
in Vorwärts-
oder Rückwärtsorientierung
eingebaut wurde. In einem bevorzugten Aspekt dieser Ausführungsform
umfasst das Konstrukt ferner regulatorische Sequenzen, einschließlich beispielsweise
einen Promotor, der funktional mit der Sequenz verbunden ist. Dem
Fachmann sind sehr viele geeignete Vektoren bekannt, und sie sind
im Handel erhältlich. Die
folgenden Vektoren werden anhand von Beispielen bereitgestellt:
Bakteriell:
pQE70, pQE60, pQE-9 Qiagen), pBS, pD1O, Phagescript, psiX174, pBluescript
SK, pbsks, pNH8A, pNH16a, pNH18A, pNH46A (Stratagene); ptrc99a,
pKK223-3, pKK233-3, pDR540, pRIT5 (Pharmacia); Eukaryontisch: pWLNEO,
pSV2CAT, pOG44, pXT1, pSG (Stratagene), pSVK3, pBPV, pMSG, pSVL
(Pharmacia). Jedoch kann jedes andere Plasmid oder jeder andere
Vektor verwendet werden, so lange sie im Wirt replizierbar und lebensfähig sind.
-
Promotorbereiche können aus
jedem gewünschten
Gen unter Verwendung von CAT (Chloramphenicoltransferase)-Vektoren
oder anderen Vektoren mit Selektionsmarkern ausgewählt werden.
Zwei geeignete Vektoren sind pKK232-8 und pCM7. Besonders zu nennende
bakterielle Promotoren schließen
lacI, lacZ, T3, T7, gpt, lambda PR, PL und trp ein. Eukaryontische Promotoren
schließen
den unmittelbaren frühen
CMV-Promotor, HSV-Thymidinkinase, den frühen und späten SV40-Promotor, LTRs aus
einem Retrovirus und Maus-Metallothionein-I
ein. Die Auswahl des geeigneten Vektors liegt gut im Anwendungsbereich
des Fachmanns.
-
In einer weiteren Ausführungsform
betrifft die vorliegende Erfindung Wirtszellen, die die vorstehend beschriebenen
Konstrukte enthalten. Die Wirtszelle kann eine höhere eukaryontische Zelle wie
eine Säugerzelle
oder eine niedrigere eukaryontische Zelle wie eine Hefezelle sein,
oder die Wirtszelle kann eine prokaryontische Zelle wie eine Bakterienzelle
sein. Die Einführung
des Konstrukts in die Wirtszelle kann durch Calciumphosphat-Transfektion,
DEAE-Dextran-vermittelte Transfektion oder Elektroporation (Davis,
L. et al., Basic Methods in Molecular Biology (1986)) erfolgen.
-
Die Konstrukte in Wirtszellen können auf
herkömmliche
Weise verwendet werden, um das Genprodukt herzustellen, das von
der rekombinanten Sequenz codiert wird. Alternativ können die
erfindungsgemäßen Polypeptide
synthetisch durch herkömmliche
Peptidsynthisiergeräte
hergestellt werden.
-
Reife Proteine können in Säugerzellen, Hefe, Bakterien
oder anderen Zellen unter der Kontrolle von geeigneten Promotoren
exprimiert werden. Es können
auch zellfreie Translationssysteme verwendet werden, um derartige
Proteine zu produzieren, indem RNAs verwendet werden, die von den
DNA-Konstrukten der vorliegenden Erfindung stammen. Geeignete Clonierungs-
und Expressionsvektoren zur Verwendung mit prokaryontischen und
eukaryontischen Wirten werden von Sambrook et al., Molecular Cloning:
A Laboratory Manual 2. Ausgabe, Cold Spring Harbor, N. Y. (1989)
beschrieben, dessen Offenbarung hier durch Bezugnahme eingebracht
wird.
-
Die Transkription der DNA, die die
Polypeptide der vorliegenden Erfindung durch höhere Eukaryonten codiert, wird
durch den Einbau einer Verstärkersequenz
in den Vektor erhöht.
Verstärkerelemente
sind cis-agierende DNA-Elemente, gewöhnlich von mit 10 bis 300 bp,
die auf einen Promotor wirken, um seine Transkription zu erhöhen. Beispiele
schließen
das SV-40-Verstärkerelemet
auf der späten
Seite des Replikationsursprungs von by 100 bis 270, ein Verstärkerelement
des frühen
Cytomegalovirus-Promotors, das Polyoma-Verstärkerelement auf der späten Seite
des Replikationsursprungs und das Adenovirus-Verstärkerelement ein.
-
Zur Sekretion des translatierten
Proteins in das Lumen des endoplasmatischen Retikulums in den periplasmatischen
Raum oder in die extrazelluläre
Umgebung, können
geeignete Sekretionssignale in das exprimierte Polypeptid eingebaut
werden. Die Signale können
endogen zum Polypeptid sein oder sie können heterologe Signale sein.
-
Das Polypeptid kann in einer modifizierten
Form, wie ein Fusionsprotein, exprimiert werden und kann nicht nur
Sekretionssignale einschließen,
sondern auch zusätzliche
heterologe funktionale Bereiche. Beispielsweise kann dem N-Terminus
des Polypeptids ein Bereich mit zusätzlichen Aminosäuren, insbesondere geladene
Aminosäuren
hinzugefügt
werden, um die Stabilität
und Persistenz während
der Reinigung oder während
der anschließenden
Handhabung und Lagerung in der Wirtszelle zu verbessern. Dem Polypeptid können auch
Peptideinheiten hinzugefügt
werden, um die Reinigung zu erleichtern. Derartige Bereiche können vor
der endgültigen
Herstellung des Polypeptids entfernt werden. Die Zugabe von Peptideinheiten
zu Polypeptiden, um die Sekretion oder Exkretion zu erzeugen, um
die Stabilität
zu verbessern und, um unter anderem die Reinigung zu erleichtern,
sind aus Fachgebiet bekannte und routinemäßige Verfahren. Ein bevorzugtes
Fusionsprotein umfasst einen heterologen Bereich aus Immunglobulin,
der nützlich
ist, um Rezeptoren zu solubilisieren. Beispielsweise offenbart EP-A-O
464 533 (Kanadisches Gegenstück
2045869) Fusionsproteine, die verschiedene Anteile der konstanten
Region von Immunglobulinmolekülen
zusammen mit einem anderen menschlichen Protein oder einem Teil
davon umfasst. In vielen Fällen
ist der Fc-Anteil im Fusionsprotein ausgesprochen vorteilhaft zur
Verwendung bei der Therapie und der Diagnose und führt somit
beispielsweise zu verbesserten pharmakokinetischen Eigenschaften
(EP-A 0232 262). Andererseits wäre
es für
einige Verwendungszwecke wünschenswert,
wenn man den Fc-Teil deletieren könnte, nachdem das Fusionsprotein
in der vorteilhaften beschriebenen Weise exprimiert, nachgewiesen
und gereinigt wurde. Das ist der Fall, wenn sich der Fc-Anteil als
Hindernis zur Verwendung bei der Therapie und der Diagnose erweist,
beispielsweise, wenn das Fusionsprotein als Antigen für Immunisierungen
verwendet werden soll. Bei der Entdeckung von Medikamenten wurden
beispielsweise menschliche Proteine wie shIL5- mit Fc-Anteilen zum
Zweck von Durchmusterungstests mit hohem Durchsatz fusioniert, um
Antagonisten von hIL-5 zu identifizieren. Vgl. D. Bennett et al., Journal
of Mole cular Recognition, Bd. 8, 52–58 (1995) und K. Johanson
et al., The Journal of Biological Chemistry, Bd. 270, No. 16, S.
9459–9471
(1995).
-
Im allgemeinen schließen rekombinante
Expressionsvektoren Replikationsursprünge und Selektionsmarker, die
die Transformation der Wirtszelle zulassen, z. B. das Ampicillin-Resistenzgen von
E. coli und das S. cerevisiae-TRP 1-Gen und einen Promotor ein,
der von einem hoch exprimiertem Gen stammt, um die Transkription
einer stromabwärts
liegenden Struktursequenz zu lenken. Derartige Promotoren können von
Operons stammen, die unter anderem glycolytische Enzyme wie 3-Phosphoglycerinkinase
(PGK), α-Faktor,
saure Phosphatase oder Hitzeschockproteine codieren. Die heterologe
Struktursequenz wird in der geeigneten Phase mit Initiations- und
Terminationssequenzen der Translation und vorzugsweise einer Leader-Sequenz
zusammengefügt,
die die Sekretion des translatierten Proteins in den periplasmatischen
Raum oder in das extrazelluläre
Medium lenkt. Fakultativ kann die heterologe Sequenz ein Fusionsprotein
einschließlich
eines N-terminalen Identifikationspeptids codieren, das die gewünschten
Merkmale verleiht, z. B. Stabilisierung oder vereinfachte Reinigung
des exprimierten rekombinanten Produkts.
-
Nützliche
Expressionsvektoren zur Verwendung in Bakterien werden durch den
Einbau einer strukturellen DNA-Sequenz konstruiert, die ein gewünschtes
Protein zusammen mit den geeigneten Initiations- und Terminationssignalen
der Translation in der funktionalen Lesephase mit einem funktionellen
Promotor codieren. Der Vektor umfasst einen oder mehrere phänotypische
Selektionsmarker und einen Replikationsursprung, um die Erhaltung
des Vektors sicherzustellen und, um wenn gewünscht, die Amplifikation im
Wirt bereitzustellen. Geeignete prokaryontische Wirte für die Transformation
schließen
E. coli, Bacillus subtilis, Salmonella typhimurium und verschiedene
Spezies in der Gattung Pseudomonas, Streptomyces und Staphylococcus
ein, obwohl auch andere als Mittel der Wahl verwendet werden können.
-
Als repräsentatives, jedoch nicht begrenzendes
Beispiel, können
nützliche
Expressionsvektoren zur Verwendung in Bakterien einen Selektionsmarker
und einen bakteriellen Replikationsursprung umfassen, der von im
Handel erhältlichen
Plasmiden stammt, die genetische Elemente des sehr gut bekannten
Clonierungsvektors pBR322 (ATCC 37017) umfassen. Derartige im Handel
erhältliche
Vektoren schließen
beispielsweise pKK223-3 (Pharmacia Fine Chemicals, Uppsala, Schweden)
und GEM1 (Promega Biotec, Madison, WI, USA) ein. Diese pBR322-„Rückgrad"-Abschnitte sind
mit einem geeigneten Promotor und der zu exprimierenden Struktursequenz
kombiniert.
-
Nach der Transformation eines geeigneten
Wirtsstammes und dem Wachstum bis zu einer geeigneten Zelldichte,
wird der ausgewählte
Promotor durch geeignete Mittel (z. B. Temperaturverschiebung oder
chemische Induktion induziert und die Zellen werden für eine zusätzlichen
Zeitraum gezüchtet.
-
Die Zellen werden typischerweise
durch Zentrifugation geerntet, durch physikalische oder chemische Mittel
zerstört
und der sich daraus ergebende Rohextrakt für eine weitere Reinigung zurückbehalten.
-
Die die bei der Expression von Proteinen
verwendeten mikrobiellen Zellen können durch jedes praktische
Verfahren, einschließlich
einem Einfrier-Auftau-Zyklus, Ultraschall, mechanische Zerstörung oder
Verwendung von zelllysierenden Agentien aufgebrochen werden, wobei
derartige Verfahren dem Fachmann gut bekannt sind.
-
Verschiedene Säugerzellkultursysteme können auch
verwendet werden, um das rekombinante Protein zu exprimieren. Beispiele
von Säugerexpressionssystemen
schließen
die von Gluzman, Cell 23: 175 (1981) beschrieben COS-7-Linien von
Affennierenfibroblasten und andere Zelllinien ein, die einen kompatiblen
Vektor exprimieren können,
beispielsweise die C127-, 3T3-, CHO-, HeLa- und BHK-Zelllinen. Säuger-Expressionsvektoren
umfassen einen Replikationsursprung, einen geeigneten Promotor und
Verstärker
und auch jede notwendige ribosomale Bindestelle, Polyadenylierungsstelle,
Spender- und Empfängerstellen
beim Spleißen, Transkriptionsterminationssequenzen
und nicht transkribierte flankierende 5'-Sequenzen. Die DNA-Sequenzen, die von
dem SV40-Spleißvorgang
stammen, und die Polyadenylierungsstellen können verwendet werden, um die
erforderlichen nicht transkribierten genetischen Elemente bereitzustellen.
-
Das KGF-2-Polypeptid kann aus rekombinanten
Zellkulturen durch Verfahren wie Ammoniumsulfat- oder Ethanolfällung, Säureextraktion,
Anionen- oder Kationenaustauschchromatographie, Phosphocellulose-Chromatographie,
hydrophobe Interaktionschromatographie, Affinitätschromatographie, Hydroxyapatit-Chromatographie
und Lektinchromatographie gewonnen und gereinigt werden. Es können gegebenenfalls Schritte
zur Proteinfaltung durchgeführt
werden, um Konfiguration des reifen Proteins zu vollenden. Schließlich kann
die Hochleistungsflüssigkeits-Chromatographie
(HPLC) für
die letzten Reinigungsschritte verwendet werden.
-
Die Polypeptide der vorliegenden
Erfindung können
ein natürlich
gereinigtes Produkt sein oder ein Produkt aus chemisch synthetischen
Verfahren oder durch rekombinante Verfah ren aus einem prokaryontischen
oder eukaryontischen Wirt hergestellt werden (beispielsweise durch
Bakterien-, Hefe-, höhere
Pflanzen-, Insekten- und Säugerzellen
in Kultur). Abhängig
vom verwendeten Wirt, der bei einem rekombinanten Verfahren verwendet
wird, können
die Polypeptide der vorliegenden Erfindung glykosyliert sein oder
können nicht
glykosyliert sein. Erfindungsgemäße Polypeptide
können
auch einen Methioninrest am Anfang einschließen.
-
Diagnostische und therapeutische
Anwendungen von KGF-2
-
Wie in dem nachstehenden Abschnitt
verwendet, soll sich „KGF-2" auf die hier beschriebenen
reifen KGF-2-Formen und Formen mit der gesamten Länge von
KGF-2 und auf die hier beschriebenen KGF-2-Analoga, Derivate und
Mutationen beziehen. Diese Erfindung betrifft auch die Verwendung
des KGF-2-Gens als Teil eines diagnostischen Tests zum Nachweis
von Krankheiten oder der Anfälligkeit
für Krankheiten,
die im Zusammenhang mit dem Vorhandensein von Mutationen in den
KGF-2-Nucleotidsequenzen stehen.
-
Individuen, die Mutationen im KGF-2-Gen
tragen, können
auf der DNA-Ebene durch eine Reihe von Verfahren entdeckt werden.
Nucleinsäuren
für die
Diagnose können
aus den Zellen eines Patienten, wie aus Blut, Urin, Speichel, Gewebebiopsie
und Autopsiematerial erhalten werden. Die genomische DNA kann direkt zum
Nachweis verwendet werden oder kann enzymatisch unter Verwendung
von PCR vor der Analyse amplifiziert werden (Saiki et al., Nature
324: 163–166
(1986)). RNA oder cDNA kann ebenfalls für denselben Zweck verwendet
werden. Als Beispiel können
PCR-Primer verwendet werden, die zu den KGF-2 codierenden Nucleinsäuren komplementär sind,
um KGF-2-Mutationen zu identifizieren und zu analysieren. Beispielsweise können Deletionen
und Insertionen durch eine Änderung
der Größe des amplifizierten
Produkts im Vergleich zum normalen Genotyp nachgewiesen werden.
Punktmutationen können
durch Hybridisierung von amplifizierter DNA mit radiomarkierter
KGF-2-RNA oder alternativ mit radiomarkierten KGF-2-Antisense-DNA-Sequenzen
identifiziert werden. Perfekt übereinstimmende
Sequenzen können
von fehlgepaarten Duplexen durch RNase-A-Spaltung oder durch Unterschiede
in der Schmelztemperatur unterschiedenen werden.
-
Auf DNA-Sequenzunterschieden basierende
genetisches Tests können
durch Nachweis der Änderung bei
der elektrophoretischen Mobilität
von DNA-Fragmenten in Gelen mit oder ohne denaturierenden Agentien erreicht
werden. Kleine Sequenzdeletionen und Insertionen können durch
hoch auflösende
Gelelektrophorese sichtbar gemacht werden. DNA-Fragmente mit verschiedenen
Sequenzen können
auf denaturierenden Formamid-Gradientengelen unterschieden werden,
bei denen die Mobilitäten
von verschiedenen DNA-Fragmenten im Gel an verschiedenen Positionen
nach ihrem spezifischen Schmelz- oder partiellen Schmelztemperaturen
verzögert
werden (vgl. z. B. Myers et al., Science, 230: 1242 (1985)).
-
Sequenzänderungen an spezifischen Orten
können
auch durch Nuclease-Schutz-Tests wie RNase- und S1-Schutz oder dem
chemischen Spaltungsverfahren gezeigt werden (z. B. Cotton et al.,
PNAS, USA, 85: 4397–4401
(1985)).
-
Somit kann der Nachweis einer spezifischen
DNA-Sequenz durch Verfahren wie Hybridisierung, RNase-Schutz, chemische
Spaltung, direkte DNA-Sequenzierung oder die Verwendung von Restriktionsenzymen erreicht
werden (z. B. Restriktionsfragmentlängenpolymorphismus (RFLP))
und Southern-Blot der genomischen DNA.
-
Zusätzlich zur herkömmlicheren
Gelelektrophorese und DNA-Sequenzierung können Mutationen auch durch
die in situ-Analyse nachgewiesen werden.
-
Die vorliegende Erfindung beschreibt
auch einen diagnostischen Test zum Nachweis von veränderten KGF-2-Proteinspiegeln
in verschiedenen Geweben, da eine Überexpression der Proteine
im Vergleich zu normalen Kontrollgewebeproben das Vorhandensein
einer Krankheit oder die Anfälligkeit
für eine
Krankheit, beispielsweise einen Tumor nachweisen kann. Tests, die
verwendet werden, um KGF-2-Proteinspiegel in einer Probe nachzuweisen,
stammen von einem Wirt, der dem Fachmann gut bekannt ist, und schließen Radioimmuntests,
kompetitive Bindungstests, Western-Blot-Analyse, ELISA-Tests und
den „Sandwich"-Test ein. Ein ELISA-Test (Coligan, et
al., Current Protocols in Immunology, 1(2), Kapitel 6, (1991)) umfasst
zuerst die Herstellung eines für
KGF-2-Antigen spezifischen Antikörpers
vorzugsweise eines monoclonalen Antikörpers. Zusätzlich wird ein Reporterantikörper gegen
den monoclonalen Antikörper
hergestellt. An den Reporterantikörper ist ein nachweisbares
Reagenz wie Radioaktivität
oder Fluoreszenz oder in diesem Beispiel ein Meerrettich-Peroxidase-Enzym
gebunden. Dem Wirt wird eine Probe entnommen und auf einem festen
Träger
z. B. einer Polystryolschale, inkubiert, die die Proteine in der
Probe bindet. Alle freien Proteinbindungsstellen auf der Schale
werden dann durch Inkubation mit einem unspezifischen Protein wie
Rinderserumalbumin abgedeckt. Dann binden die monoclonalen Antikörper an
alle auf der Polystryolschale gebundenen KGF-2-Proteine. Alle ungebundenen
monoclonalen Antikörper
werden mit Puffer ausgewaschen. Der an die Meerrettich-Peroxidase
-gebundene Reporterantikörper
wird nun in eine Schale gegeben, was zur Bindung des Reporterantikörpers an
jeden an KGF-2 gebundenen monoclonalen Antikörper führt. Ungebundener Reporterantikörper wird
dann ausgewaschen. Die Peroxidasesubstrate werden dann in die Schale
gegeben und die Menge der sich entwickelnden Farbe in einem gegebenen
Zeitraum ist ein Maß für die KGF-2-Proteinmenge,
die in einem gegebenen Volumen der Patientenprobe beim Vergleich
mit einer Standardkurve vorliegt.
-
Ein Kompetitionstest kann verwendet
werden, wobei die für
KGF-2 spezifischen Antikörper
an einen festen Träger
gebunden sind und markiertes KGF-2 und eine Probe, die vom Wirt
stammt, auf den festen Träger übertragen
werden und die z. B. durch flüssige
Szinillationschromatographie nachgewiesene Menge der Markierung
mit einer Menge von KGF-2 kann in der Probe korreliert werden.
-
Ein „Sandwich"-Test ähnelt einem ELISA-Test. In
einem „Sandwich"-Test wird KGF-2 auf einen festen Träger übertragen
und bindet an den an einen festen Träger gebundenen Antikörper. Ein
zweiter Antikörper wird
dann an KGF-2 gebunden. Ein dritter Antikörper, der markiert ist und
für den
zweiten Antikörper
spezifisch ist, wird dann auf den festen Träger übertragen und bindet an den
zweiten Antikörper
und eine Menge kann dann quantifiziert werden.
-
Die Polypeptide, ihre Fragmente und
andere Derivate oder Analoga davon oder Zellen, die sie exprimieren,
können
als Immunogen verwendet werden, die damit Antikörper produzieren. Diese Antikörper können beispielsweise
polyclonale oder monoclonale Antikörper sein. Die vorliegende
Erfindung schließt
auch chimere, Einzelketten- und humanisierte Antikörper sowie
Fab-Fragmente oder das Produkt einer Fab-Expressionsgenbank ein.
Es können
verschiedene aus dem Fachgebiet bekannte Verfahren zur Herstellung
derartiger Antikörper
und Fragmente verwendet werden.
-
Antikörper, die gegen die Polypeptide
erzeugt werden, die einer Sequenz der vorliegenden Erfindung entsprechen,
können
durch direkte Injektion der Polypeptide in ein Lebewesen oder durch
Verabreichung der Polypeptide an ein Lebewesen, vorzugsweise nicht
menschlich, erhalten werden. Der so erhaltene Antikörper bindet
dann die Polypeptide selbst. Auf diese Weise kann sogar eine Sequenz,
die nur ein Fragment der Polypeptide codiert, verwendet werden,
um Antikörper
zu erzeugen, die die ganzen nativen Polypeptide binden. Derartige
Antikörper
können
dann verwendet werden, um das Polypeptid aus dem Gewebe zu isolieren,
das das Polypeptid exprimiert.
-
Zur Herstellung monoclonaler Antikörper kann
jedes Verfahren verwendet werden, das Antikörper bereitstellt, die von
kontinuierlichen Zelllinienkulturen produziert werden. Beispiele
schließen
das Hybridomverfahren (Kohler & Milstein,
Nature, 256: 495–497
(1975)), das Triomverfahren, das menschliche B-Zell-Hybridomverfahren
(Kozbor, et al., Immunology Today 4: 72 (1983)) und das EBV-Hybridomverfahren
ein, um menschliche monoclonale Antikörper herzustellen (Cole, et
al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc.,
S. 77–96
(1985)).
-
Die für die Herstellung von Einzelketten-Antikörpern beschriebenen
Verfahren (U.S. Patent 4,946,778) können übernommen werden, um Einzelketten-Antikörper für erfindungsgemäße immunogene
Polypeptidprodukte herzustellen. Es können auch transgene Mäuse verwendet
werden, um humanisierte Antikörper
für die erfindungsgemäßen immunogenen
Polypeptidprodukte zu exprimieren.
-
Die Polypeptide der vorliegenden
Erfindung können
zur Herstellung eines Arzneimittels zur Stimulation des Wachstums
neuer Blutgefäße oder
der Angiogenese verwendet werden. Insbesondere können die Polypeptide der vorliegenden
Erfindung das Keratinocyten-Zellwachstum und die Proliferation stimulieren.
Demnach stellt die vorliegende Erfindung ein Verfahren zur Nutzung
eines derartigen Polypeptids oder Polynucleotids bereit, das ein
derartiges Polypeptid zur Herstellung eines Arzneimittels für therapeutische
Zwecke codiert, beispielsweise, um die Proliferation der Epithelzellen
und basalen Keratinocyten für
Wundheilungszwecke zu stimulieren und um die Haarfollikelproduktion
und die Heilung von Hautwunden zu stimulieren.
-
Wie vorstehend angemerkt, können die
Polypeptide der vorliegenden Erfindung zur Herstellung eines Arzneimittels
zur Heilung von Hautwunden durch Stimulation der Epithelzellproliferation
verwendet werden.
-
Diese Wunden können oberflächlicher Natur sein oder können tief
sein und die Schädigung
der Dermis und der Epidermis der Haut beinhalten. Somit stellt die
vorliegenden Erfindung ein Verfahren zur Herstellung eines Arzneimittels
bereit, das konzipiert wurde, die Wundheilung zu fördern.
-
Bei dem Individuum, dem KGF-2 verabreicht
wird, können
Wunden mit normaler Geschwindigkeit heilen oder die Heilung beeinträchtigt sein.
Bei Verabreichung an ein Individuum, das keine Beeinträchtigung
der Heilung hat, wird KGF-2 verabreicht, um den normalen Heilungsprozess
zu beschleunigen. Bei Verabreichung an ein Individuum, das eine
Beein trächtigung
der Heilung hat, wird KGF-2 verabreicht, um die Heilung von Wunden
zu erleichtern, die ansonsten langsam oder überhaupt nicht heilen würden. Wie
nachstehend angemerkt, können
viele Leiden und Erkrankungen zu einer Hemmung der Heilung führen. Diese
Leiden und Erkrankungen schließen
Diabetes (z. B. Diabetes mellitus Typ II), die Behandlung mit sowohl
Steroiden als auch anderen pharmakologischen Agentien und die ischämische Blockade
oder Verletzungen ein. Steroide, von denen gezeigt wurde, dass sie
die Wundheilung hemmen, schließen
Cortison, Hydrocortison, Dexamethason und Methylprednisolon ein.
-
Es wurde auch gezeigt, dass nicht
steroide Verbindungen, z. B. Octreotidacetat, ebenfalls die Wundheilung
hemmen. Waddell, B. et al., Am. Surg. 63: 446–449 (1997). Man glaubt, dass
die vorliegende Erfindung die Wundheilung bei Individuuen fördert, die
sich einer Behandlung mit derartigen nicht Steroiden Agentien unterziehen.
-
Es wurde gezeigt, dass zahlreiche
von Wachstumsfaktoren die Wundheilung bei Individuen fördert, deren
Heilung beeinträchtigt
ist. Vgl. z. B. Steed, D. et al., J. Am. Coll. Surg. 183: 61–64 (1996);
Richard, J. et al., Diabetes Care 18: 64–69 (1995); Steed, D., J. Vasc.
Surg. 21: 71–78
(1995); Kelley, S. et al., Proc. Soc. Exp. Biol. 194: 320–326 (1990).
Diese Wachstumsfaktoren schließen
den Wachstumshormon-freisetzenden Faktor, den Thrombocyten-Wachstumsfaktor und
den basischen Wachstumsfaktor ein. Somit umfasst die vorliegende
Verbindung auch die Verabreichung von KGF-2 in Verbindung mit einem
oder mehreren zusätzlichen Wachstumsfaktoren
oder einem anderen Mittel, das die Wundheilung fördert. Die vorliegende Erfindung
stellt auch die Verwendung von Polypeptiden der vorliegenden Erfindung
zur Herstellung eines Arzneimittels zur Förderung der Heilung von anastomotischen
und anderen durch chirurgische Eingriffe verursachten Wunden bei
Individuen bereit, bei denen Wunden sowohl mit einer normalen Geschwindigkeit
heilen als auch eine Beeinträchtigung
der Heilung haben. Das Arzneimittel kann für die Verabreichung einer wirksamen
Menge an KGF-2 an ein Individuum vor, nach und/oder während eines
anastomotischen oder anderen chirurgischen Eingriffs konzipiert
werden. Anastomose ist die Verbindung zweier röhrenartiger Strukturen, so
wie das beispielsweise bei der Entfernung des mittleren Darmabschnitts
erfolgt und die Verbindung der verbleibenden Anteile miteinander
erfolgt, um den Intestinaltrakt wieder herzustellen. Im Gegensatz
zur Heilung der Haut, ist der Heilungsvorgang von anastomotischen
Wunden im allgemeinen nicht sichtbar. Ferner erfolgt die Wundheilung
wenigstens im Gastrointestinaltrakt schnell ohne Komplikationen;
jedoch erfordern Komplikationen oft die Korrektur durch zusätzliche
chirurgische Eingriffe. Thornton, F. und Barbul, A., Surg. Clin.
North Am. 77: 549–573 (1997).
-
Wie in den Beispielen 21 und 28 gezeigt,
verursacht die Behandlung mit KGF-2 eine wesentliche Verringerung
der peritonealen Insuffizienz und der anastomotischen Konstriktion,
die auf eine Anastomose des Darms folgt. Man glaubt, dass KGF-2
diese Ergebnisse verursacht, indem der Heilungsprozess so die Wahrscheinlichkeit
von auftretenden Komplikationen verringert, die auf derartige Verfahren
folgen.
-
Somit stellt die vorliegende Erfindung
auch die Verwendung von Polypeptiden der vorliegenden Erfindung
zur Herstellung eines Arzneimittels zur Beschleunigung der Heilung
von anastomotischen und anderen, durch chirurgische Eingriffe verursachten
Wunden bei Individuen bereit, bei denen Wunden mit einer normalen Geschwindigkeit
heilen oder die eine Beeinträchtigung
der Heilung haben.
-
Die Polypeptide der vorliegenden
Erfindung können
auch verwendet werden, um ein Arzneimittel zur Stimulation der Zelldifferenzierung,
beispielsweise Muskelzellen, Zellen, die das Nervengewebe ausmachen, Prostatazellen
und Lungenzellen herzustellen.
-
KGF-2 kann bei der Stimulation der
Wundheilung von Wunden klinisch nützlich sein, einschließlich Operationswunden,
Schnittwunden, tiefe Wunden, die eine Schädigung der Dermis und Epidermis
beinhalten, Wunden des Augengewebes, Wunden des Dentalgewebes, Wunden
der Mundhöhle,
diabetische Geschwüre, Hautgeschwüre, Cubitusgeschwüre, arterielle
Geschwüre,
Venenstaugeschwüre,
Verbrennungen, die auf Hitzeexposition oder Chemikalien zurückzufahren
sind, in normalen Individuen und denjenigen einschließen, die Zuständen unterliegen,
die eine abnorme Wundheilung induzieren wie Urämie, Mangelernährung, Vitaminmangel,
Adipositas, Infektionen, Immunsuppression und Komplikationen, die
mit systemischer Behandlung mit Steroiden, Strahlentherapie und
antineoplastischen Medikamenten und Antimetaboliten assoziiert sind.
KGF-2 ist auch für
die Förderung
der Wundheilung nützlich,
die mit Ischämie
und ischämischer
Verletzung assoziiert ist, z. B. chronischer venöser Beingeschwüre, die
von einer Hemmung des Rückflusses
des venösen
Blutkreislaufs und/oder Insuffizienz verursacht werden.
-
KGF-2 kann auch verwendet werden,
um den Wiederaufbau der Haut nach Hautverlust zu fördern. Zusätzlich kann
KGF-2 verwendet werden, um die Zugfestigkeit der Epidermis und die
Epidermisdicke zu erhöhen.
-
KGF-2 kann verwendet werden, um die
Haftung von Hauttransplantaten an ein Wundbett zu erhöhen und
die Reepithelialisierung aus dem Wundbett zu stimulieren. Folgende
sind Transplantatarten, bei denen KGF-2 verwendet werden könnte, um
die Anheftung an ein Wundbett zu erhöhen: Autotransplantate, künstliche
Haut, Allotransplantate, autodermale Transplantate, autoepidermale
Transplantate, avaculäre
Transplantate, Blair-Brown-Transplantate, Knochentransplantat, brephoplastische
Transplantate, Cutistransplantat, verzögertes Transplantat, Hauttransplantat,
Epidermistransplantat, Fascia-Transplantat, Vollhauttransplantat,
heterologes Transplantat, Xenotransplantat, homologes Transplantat,
hyperplastisches Transplantat, lamelläres Transplantat, Maschentransplantat,
Schleimhauttransplantat, Ollier-Thiersch-Transplantat,
Omentum-Plastik, Streifenplastik, Stiel-Transplantat, Spalthauttransplantat,
dickes Spalthaut-Transplantat. KGF-2 kann verwendet werden, um die
Hautfestigkeit zu fördern
und das Erscheinungsbild gealterter Haut zu verbessern.
-
Man glaubt, dass KGF-2 auch Änderungen
bei der Hepatocytenproliferation und der Epithelzellproliferation
in der Lunge, Brust, Pankreas, Magen, Dünndarm und Dickdarm hervorruft.
KGF-2 kann die Proliferation von Epithelzellen wie Sebocyten, Haarfollikel,
Hepatocyten, Typ-II-Pneumocyten, Mucin-produzierenden Gobletzellen
und anderen Epithelzellen und ihre in Haut, Lunge, Leber und dem
Gastrointestinaltrakt enthaltenen Vorläufer fördern. Somit könnte KGF-2
die Proliferation und Differenzierung von Hepatocyten stimulieren und
könnte
somit verwendet werden, um Lebererkrankungen und Pathologien wie
fulminantes, durch Zirrhose verursachtes Leberversagen, durch virale
Hepatitis und toxische Substanzen verursachte Leberschäden (d.
h. Acetaminophen, Tetrachloridkohlenstoff und andere aus dem Fachgebiet
bekannte Hepatoxine) zu lindern oder zu behandeln. KGF-2 kann auch
verwendet werden, um die Leberregeneration zu stimulieren oder zu
fördern.
-
KGF-2 kann auch verwendet werden,
um die Nebenwirkungen der Toxizität auf die Eingeweide zu reduzieren,
die auf die Behandlung von Virusinfektionen, Strahlentherapie, Chemotherapie
oder andere Behandlungen zurückzuführen sind.
KGF-2 kann auch eine cryoprotektive Wirkung auf die Dünndarmschleimhaut
haben. KGF-2 kann auch prophylaktisch oder therapeutisch verwendet
werden, um Mucositis zu verhindern oder zu mildern und um die Heilung
von Mucositis (z. B. Mund-, Speiseröhren-, Darm-, rektale und anale
Geschwüre)
zu stimulieren, die auf Chemotherapie, andere Agentien und Virusinfektionen
zurückzuführen sind.
Somit stellt die vorliegende Erfindung auch die Verwendung von Polypeptiden
der vorliegenden Erfindung zur Herstellung eines Arzneimittels zur
Vermeidung oder Behandlung von Erkrankungen oder pathologischen
Ereignissen der Schleimhaut, einschließlich Colitis ulcerosa, Morbus
Crohn und anderen Krankheiten bereit, bei denen die Schleimhaut
geschädigt
wird. Die vorliegende Erfindung stellt auf ähnliche Weise ein Verfahren
zur Herstellung eines Arzneimittels zur Vermeidung oder Behandlung
von Mucositis des Mundes (einschließlich Odynophagie, die mit
Schleimhautverletzungen im Pharynx und Hypopharynx assoziiert ist),
der Speiseröhre, des
Magens, des Colons und rektaler Mucositis bereit, unabhängig vom
Mittel oder der Modalität,
die diese Schädigung
verursacht.
-
KGF-2 kann die Proliferation von
Endothelzellen, Keratinocyten und basalen Keratinocyten fördern. Somit
stellt die vorliegende Erfindung auch ein in vitro-Verfahren zur
Stimulation der Proliferation derartiger Zelltypen bereit, das das
Inkontaktbringen der Zellen mit einer wirksamen Menge der Mutanten
des KGF-2-Polypeptids der vorliegenden Erfindung beinhaltet. Zudem
betrifft die vorliegende Erfindung auch die Verwendung von Polypeptiden
der vorliegenden Erfindung zur Herstellung eines Arzneimittels zur
Stimulation der Proliferation von Endothelzellen, Keratinocyten
oder basalen Keratinocyten. Die vorliegende Erfindung stellt ferner die
Verwendung von Polypeptiden der vorliegenden Erfindung zur Herstellung
eines Arzneimittels zur Förderung
der urothelialen Heilung bereit, umfassend die Verabreichung einer
wirksamen Menge von KGF-2 an ein Individuum. Somit stellt die vorliegende
Erfindung auch ein Verfahren zur Herstellung eines Arzneimittels
zur Beschleunigung der Heilung oder der Behandlung einer Reihe von
Pathologien bereit, die die Urothelzellen betreffen (d. h. Zellen,
die den Harntrakt auskleiden). Gewebeschichten, die derartige Zellen
umfassen, können
durch viele Mechanismen, einschließlich Katheterisierung, Operation
oder bakterielle Infektion (d. h. eine Infektion durch einen Erreger,
der eine sexuell übertragbare
Krankheit wie Gonorrhö verursacht)
beschädigt werden.
-
Die vorliegende Erfindung umfasst
auch die Verwendung von Polypeptiden der vorliegenden Erfindung
zur Herstellung eines Arzneimittels zur Förderung der Gewebeheilung im
weiblichen Genitaltrakt. Gewebeschäden im weiblichen Genitaltrakt
können
durch eine Vielzahl von Zuständen,
einschließlich
Candida trichmoniasis-Infektionen, Garderella-, Gonorrhea-, Chlamydien-,
Mycoplasmen-Infektionen und andere sexuell übertragbare Krankheiten verursacht
werden.
-
Wie in den Beispielen 10, 18 und
19 gezeigt, stimuliert KGF-2 die Proliferation der epidermalen Keratinocyten
und erhöht
die Epidermisdicke. Somit können
die Polypeptide der vorliegenden Erfindung zur Herstellung eines
Arzneimittels zur Verwendung bei der vollstän digen Regenerierung der Haut
bei Voll- und Teilhautdefekten, einschließlich Verbrennungen (d. h.
die Repopulation von Haarfollikeln, Schweißdrüsen und Talgdrüsen) und
zur Behandlung anderer Hautdefekte wie Psoriasis verwendet werden.
-
KGF-2 kann zur Behandlung von Epidermolysis
bullosa, ein Defekt bei der Anheftung der Epidermis an die darunterliegende
Dermis, verwendet werden, der zu häufigen, offenen und schmerzhaften
Blasen durch die Beschleunigung der Reepithelialisierung dieser
Läsionen
führt.
KGF-2 kann auch verwendet werden, um Magen- und Zwölffingerdarmgeschwüre zu behandeln
und um zu helfen, die Schleimhaut schneller zu heilen und die die
Drüsenschleimhaut
zu regenerieren. Entzündliche
Darmerkrankungen wie Morbus Crohn oder Colitis ulcerosa sind Krankheiten,
die zur Zerstörung
der Schleimhautoberfläche
des Dünndarms
bzw. des Dickdarms führen.
Somit könnte
KGF-2 verwendet werden, um die Erzeugung einer neuen Schleimhautoberfläche zu fördern, um
die schnellere Heilung zu unterstützen und um das Fortschreiten
der entzündlichen
Darmerkrankungen zu verhindern oder abzuschwächen. Man erwartet, dass die
KGF-2-Behandlung eine signifikante Wirkung auf die Schleimhautproduktion
im Gastrointestinaltrakt hat und verwendet werden könnte, um
die Darmschleimhaut vor verletzenden Substanzen zu schützen, die
aufgenommen werden oder auf einen chirurgischen Eingriff folgen.
Wie vorstehend angemerkt, kann KGF-2 auch verwendet werden, um die
Heilung der Darm- oder Colonanastomose zu fördern. KGF-2 kann ferner verwendet
werden, um Krankheiten zu behandeln, die mit der Unterexpression
von KGF-2 assoziiert sind.
-
Außerdem kann KGF-2 verwendet
werden, um Lungenschäden
aufgrund verschiedener pathologischer Zustände zu verhindern und zu heilen.
Als Wachstumsfaktor könnte
KGF-2 die Proliferation und Differenzierung stimulieren und die
Reparatur der Alveolen und des Bronchienepithels fördern, um
akute oder chronische Lungenschäden
zu verhindern, abzuschwächen
oder zu behandeln. Beispielsweise könnte ein Emphysem, das zu einem
progressiven Alveolenverlust und Verletzungen beim Einatmen führt, d.
h. die auf das Einatmen von Rauch und Verbrennungen zurückzuführen sind,
was die Nekrose des Bronchienepithels und Alveolen verursacht, effektiv
unter Verwendung von KGF-2 behandelt werden. KGF-2 könnte auch
verwendet werden, um bei Frühgeburten
die Proliferation und Differenzierung von Typ-II-Pneumonocyten zu stimulieren, die helfen
können,
Krankheiten wie hyaline Membranerkrankungen wie das Atemnotsyndrom
des Neugeborenen und bronchopulmonäre Displasie zu behandeln.
-
Die drei Ursachen des akuten Nierenversagens
sind prärenal
(z. B. Herzversagen), intrinsisch (z. B. Nephrotoxizität, die durch
chemotherapeutische Agentien verursacht wird) und postrenal (z.
B. die Obstruktion des Harntraktes), die zu einem Zelltod der Nierentubuli,
Obstruktion des tubulären
Lumens und dem Rückfluss von
Filtrat in die Glomeruli führt
(Über-sichtartikel von
Thadhani et al., N. Engl. J. Med. 334: 1448–1460 (1996)). Wachstumsfaktoren
wie der Insulin-ähnliche
Wachstumsfaktor I, das osteogene Protein-1, der Hepatocytenwachstumsfaktor
und der epidermale Wachstumsfaktor haben das Potential für die Verbesserung
der Nierenerkrankung in Tiermodellen gezeigt. Taub et al., Cytokine
5: 175–179
(1993); Vukicevic et al. J. Am. Soc. Nephrol. 7: 1867 (1996). KGF-2
kann die Proliferation und Differenzierung der Nierenzellen stimulieren
und könnte
somit verwendet werden, um Nierenerkrankungen und Pathologien wie
akutes oder chronisches Nierenversagen und das Endstadium einer
Nierenerkrankung zu lindern oder zu behandeln.
-
KGF-2 könnte die Proliferation und
Differenzierung von Brustgewebe stimulieren und könnte deshalb verwendet
werden, um die Heilung von Verletzungen des Brustgewebes aufgrund
eines chirurgischen Eingriffes, Trauma oder Krebs zu fördern.
-
Zusätzlich könnte KGF-2 verwendet werden,
um den Ausbruch von Diabetes mellitus zu behandeln oder zu vermeiden.
KGF-2 könnte
bei Patienten mit neu diagnostiziertem Diabetes Typ I und II, bei
dem noch etwas Zellfunktion vorhanden ist, verwendet werden, um
die Funktion der Inselzellen zu erhalten, so dass die dauerhafte
Manifestation der Krankheit gelindert, verzögert oder vermieden wird. KGF-2
könnte
auch als Hilfsmittel bei der Inselzellentransplantation verwendet
werden, um die Funktion der Inselzellen zu verbessern oder zu fördern.
-
Ferner könnte die antiflammatorische
Eigenschaft von KGF-2 für
die Behandlung von akuten oder chronischen Erkrankungen nützlich sein,
bei denen die Entzündung
eine Schlüsselpathogenese
der Erkrankung ist, einschließlich,
jedoch nicht begrenzt auf Psoriasis, Ekzem, Dermatitis und/oder
Arthritis. Somit stellt die vorliegende Erfindung bei einem Individuum
die Verwendung der Polypeptide der vorliegenden Erfindung zur Herstellung
eines Arzneimittels zur Vermeidung oder Abschwächung der Entzündung und
Erkrankungen bereit, die eine Entzündung beinhalten.
-
KGF-2 kann verwendet werden, um die
Schädigung
von Gehirngewebe aufgrund einer Verletzung durch Trauma, eines chirurgischen
Eingriffes oder Chemikalien zu heilen oder zu lindern.
-
Zusätzlich könnte, da KGF-2 die Epidermisdicke
erhöht,
das Protein verwendet werden, um alternde Haut zu verbessern, die
Faltenbildung der Haut zu reduzieren und die Narbenbildung nach
einem chirurgischen Eingriff zu reduzieren. Die Narbenbildung von
Wundgeweben beinhaltet oft die Hyperproliferation von Hautfibroblasten.
Wie in Beispiel 10 angemerkt, wird die Fibroblastenproliferation
nicht von KGF-2 stimuliert. Deshalb scheint KGF-2 für epidermale
Keratinocyten mitogenspezifisch zu sein und induziert die Wundheilung mit
minimaler Narbenbildung. Somit stellt die vorliegende Erfindung
die Verwendung der Polypeptide der vorliegenden Erfindung zur Herstellung
eines Arzneimittels zur Förderung
der Heilung von Wunden mit minimaler Narbenbildung bereit. KGF-2
kann vor, während
und/oder nach dem Prozess, der die Wunde erzeugt (z. B. kosmetische
Operation, zufälliges
oder absichtliches Gewebetrauma, verursacht durch einen scharfen
Gegenstand), verabreicht werden.
-
Wie vorstehend angemerkt, stimuliert
KGF-2 auch die Proliferation von Keratinocyten und Haarfollikeln
und kann deshalb verwendet werden, um das Haarwachstum bei schütter werdendem
Haar und bei Haartransplantationspatienten zu fördern. Somit stellt die vorliegende
Erfindung ferner die Verwendung der Polypeptide der vorliegenden
Erfindung zur Herstellung eines Arzneimittels zur Förderung
der Produktion von Haarfollikeln bereit. Die vorliegende Erfindung
stellt auch die Verwendung der Polypeptide der vorliegenden Erfindung
zur Herstellung eines Arzneimittels zum Schutz eines Individuums
vor ionisierender Strahlung, Chemotherapie oder Behandlung mit antiviralen
Agentien bereit. Die vorliegende Erfindung stellt ferner die Verwendung
der Polypeptide der vorliegenden Erfindung zur Herstellung eines
Arzneimittels zur Behandlung von Gewebeschäden bereit, die auf die Exposition
mit ionisierender Strahlung, chemotherapeutischen Agentien oder
antiviralen Agentien zurückzuführen sind.
Ein Individuum kann einer ionisierenden Strahlung aus einer Vielzahl
von Gründen,
einschließlich
therapeutischer Zwecke (z. B. für
die Behandlung von hyperproliferativen Störungen), als Folge einer zufälligen Freisetzung
eines radioaktiven Isotops in die Umgebung oder während nicht
invasiver medizinischer diagnostischer Verfahren (z. B. Röntgenstrahlen)
ausgesetzt sein. Ferner ist eine wesentliche Anzahl von Personen
radioaktivem Radon an ihren Arbeitsplätzen und Zuhause ausgesetzt.
Diese ständige
Langzeitexposition in der Umwelt wurde verwendet, um eine Einschätzung der
Lebenserwartung zu erstellen. Johnson, W. und Kearfott, K., Health
Phys. 73: 312–319
(1997). Wie in Beispiel 23 gezeigt, erhöhen die Proteine der vorliegenden
Erfindung das Überleben
von Tieren, die Strahlung ausgesetzt sind. Somit kann KGF-2 verwendet
werden, um die Überlebensraten
von Individuen zu erhöhen, die
an strahleninduzierten Verletzungen leiden, um Individuen vor sublethalen
Strahlungsdosen zu schützen
und das therapeutische Verhältnis
der Bestrahlung bei der Behandlung von Erkrankungen wie hyperproliferative
Störungen
zu erhöhen.
-
KGF-2 kann auch verwendet werden,
um Individuen vor Strahlungsdosen, Chemotherapeutika oder antiviralen
Agentien zu schützen,
die normalerweise nicht toleriert werden würden. Bei dieser Verwendungsweise,
oder wie anderweitig hier beschrieben, kann KGF-2 vor, nach und/oder
während
der Strahlentherapie/Exposition, Chemotherapie oder Behandlung mit
antiviralen Agentien verabreicht werden. Hohe Strahlungsdosen und
Chemotherapeutika können
insbesondere bei der Behandlung eines Individuums nützlich sein,
das ein fortgeschrittenes Stadium eines Leidens wie eine hyperproliferative
Störung
aufweist.
-
In einem anderen Aspekt stellt die
vorliegende Erfindung die Verwendung der Polypeptide der vorliegenden
Erfindung zur Herstellung eines Arzneimittels zur Vermeidung oder
Behandlung von Erkrankungen wie strahleninduzierte und gastrointestinale
Verletzungen, Mucositis, Darmfibrose, Proktitis, strahleninduzierte Lungenfibrose,
strahleninduzierte Pneumonitis, strahleninduzierte Pleuraretraktion,
strahleninduziertes hämopoetisches
Syndrom, strahleninduzierte Myelotoxizität bereit.
-
KGF-2 kann alleine oder in Verbindung
mit einem oder mehreren zusätzlichen
Agentien verwendet werden, die einen Schutz vor Strahlung oder anderen
Agentien verleihen. Es wurde gezeigt, dass eine Anzahl von Cytokinen
(z. B. IL-1, TNF, IL-6, IL-12) einen derartigen Schutz verleihen.
Ygl. z. B., Neta, R. et al., J. Exp. Med. 173: 1177 (1991). Zusätzlich wurde
gezeigt, dass IL-11 die Schleimhautzellen des Dünndarms nach kombinierter Strahlung
und Chemotherapie, Du, X. X. et al., Blood 83: 33 (1994) sowie strahleninduzierter
Verletzung des Thoraxes schützt.
Redlich, C. A. et al., J. Immun. 157: 1705–1710 (1996). Man hat auch
gezeigt, dass mehrere Wachstumsfaktoren einen Schutz vor Strahlenexposition
verleihen, z. B. der Fibroblasten-Wachstumsfaktor und der transformierende
Wachstumsfaktor beta-3. Ding, I. et al., Acta Oncol. 36: 337–340 (1997); Potten,
C. et al., Br. J. Cancer 75: 1454–1459 (1997).
-
Wie hier verwendet, ist mit „Individuum" ein Tier, vorzugsweise
ein Säuger
(wie Menschenaffen, Kühe, Pferde,
Schweine, Eber, Schafe, Nagetiere, Ziegen, Hunde, Katzen, Hühner, Affen,
Kaninchen, Frettchen, Wale und Delfine) und besonders bevorzugt
ein Mensch gemeint.
-
Die Signalsequenz von KGF-2, die
die Aminosäuren
1 bis 35 oder 36 codiert, kann verwendet werden, um sekretierte
Proteine im allgemeinen durch Hybridisierung und/oder computergestützten Suchalgorithmen zu
identifizieren.
-
Die Nucleotidsequenz von KGF-2 könnte verwendet
werden, um 5'-Sequenzen
durch Hybridisierung zu isolieren. Plasmide, die das KGF-2-Gen unter
der Kontrolle seiner nativen Promotor-/Verstärkersequenzen umfassen, könnten dann
in in-vitro-Studien verwendet werden, die auf die Identifizierung
von endogenen zellulären
und viralen Transaktivatoren des KGF-2-Gens abzielen.
-
Das KGF-2-Protein kann auch als Positivkontrolle
bei Experimenten verwendet werden, die so konzipiert sind, dass
Peptidomimetika identifiziert werden, die auf den KGF-2-Rezeptor
wirken.
-
Die vorliegende Patentanmeldung beschreibt
ein Verfahren zur Nutzung derartiger Polypeptide oder Polynucleotide,
die derartige Polypeptide für
in vitro-Zwecke codieren, die mit wissenschaftlicher Forschung, DNA-Synthese,
Herstellung von DNA-Vektoren zusammenhängen sowie für Bereitstellungszwecke
von Diagnostika und Therapeutika zur Behandlung von Krankheiten
beim Menschen.
-
Fragmente des KGF-2-Gens mit der
gesamten Länge
können
als Hybridisierungssonde für
eine cDNA-Genbank verwendet werden, um KGF-2-Gene mit der gesamten
Länge zu
isolieren und um andere Gene zu isolieren, die eine hohe Sequenzähnlichkeit
mit diesen Genen oder eine ähnliche
biologische Aktivität
aufweisen. Sonden dieser An besitzen mindestens 20 Basen. Vorzugsweise
besitzen die Sonden jedoch mindestens 30 Basen und besitzen im allgemeinen
nicht mehr als 50 Basen, auch wenn sie eine größere Anzahl von Basen besitzen
können.
Die Sonde kann auch verwendet werden, um einen cDNA-Clon zu identifizieren,
der einem Transkript mit der gesamten Länge und einem genomischen Clon
oder Clonen entspricht, die das vollständige KGF-2-Gen, einschließlich regulatorischer
und Promotorbereiche, Exons und Introns enthalten. Ein Beispiel
einer Durchmusterung umfasst die Isolierung des codierenden Bereichs
des KGF-2-Gens unter Verwendung der bekannten DNA-Sequenz, um eine
Oligonucleotidsonde zu synthetisieren. Markierte Oligonucleotide,
die eine Sequenz besitzen, die zu derjenigen des Gens der vorliegenden
Erfindung komplementär sind,
werden verwendet, um eine Genbank mit menschlicher cDNA, genomischer
DNA oder cDNA zu durchmustern, um zu bestimmen, mit welchen Mitgliedern
der Genbank die Sonde hybridisiert.
-
Die vorliegende Patentanmeldung beschreibt
auch ein Verfahren zur Identifizierung des Rezeptors für das KGF-2-Peptid.
Das Gen, das den Rezeptor codiert, kann durch zahlreiche aus dem
Fachgebiet bekannte Verfahren identifiziert werden, beispielsweise
Liganden-Panning und FACS-Sortieren (Coligan et al., Current Protocols
in Immun., 1(2), Kapitel 5 (1991)). Vorzugsweise wird die Expressionsclonierung
verwendet, wobei polyadenylierte RNA aus einer Zelle hergestellt
wird, die auf die Polypeptide reagiert, und eine cDNA-Genbank, die
aus dieser RNA erzeugt wurde, wird in Pools aufgeteilt und verwendet,
um COS-Zellen oder
andere Zellen zu transfizieren, die nicht auf die Polypeptide reagieren.
Transfizierte Zellen, die auf Glasobjektträgern gezüchtet werden, werden den markierten
Polypeptiden ausgesetzt. Die Polypeptide können durch eine Reihe von Mitteln,
einschließlich
Jodierung oder Einschluss der Erkennungsstelle für eine zielspezifische Proteinkinase
markiert werden. Nach der Fixierung und Inkubation werden die Objektträger einer
autoradiographischen Analyse unterzogen. Positive Pools werden identifiziert
und Unterpools hergestellt und unter Verwendung eines itinerativen
Subpooling-Verfahrens und eines erneuten Durchmusterungsvorganges
erneut transfiziert, wobei man schließlich einen Einzelclon gewinnt,
der den vermeintlichen Rezeptor codiert.
-
Als alternativen Ansatz zur Rezeptoridentifizierung
können
die Polypeptide mittels Photoaffinität mit Zellmembran- oder Extraktpräperationen
verbunden werden, die das Rezeptormolekül exprimieren. Quervernetztes
Material wird durch PAGE-Analyse aufgelöst und einem Röntgenfilm
ausgesetzt. Der markierte Komplex, der die Rezeptoren der Polypeptide
enthält,
kann ausgeschnitten, in Peptidfragmente aufgelöst und einer Proteinmikrosequenzierung
unterzogen werden. Die aus der Mikrosequenzierung erhaltene Aminosäuresequenz
würde verwendet
werden, um eine Reihe von degenerierten Oligonucleotidsonden zu
konstruieren, um eine cDNA-Genbank zur Identifizierung der Gene
zu durchmustern, die die vermeintlichen Rezeptoren codieren.
-
Diese Patentanmeldung beschreibt
außerdem
ein Verfahren zur Durchmusterung von Verbindungen, um diejenigen
zu identifizieren, die die Wirkung von KGF-2 beinträchtigen
oder die Funktion von KGF-2 blockieren. Ein Beispiel eines derartigen
Tests umfasst die Kombination einer Säuger-Keratinocytenzelle, der
zu durchmusternden Verbindung und 3[H]-Tymidin unter Zellkulturbedingungen,
bei denen die Keratinocytenzelle normalerweise proliferiert. Man
kann in Abwesenheit der zu durchmusternden Verbindung einen Kontrolltest durchführen und
mit der Menge der Keratinocyten-Proliferation in Gegenwart der zu
bestim menden Verbindung vergleichen, wenn die Verbindung die Proliferation
der Keratinocyten stimuliert.
-
Um nach Antagonisten zu durchmustern,
kann derselbe Test in Gegenwart von KGF-2 hergestellt werden und
die Fähigkeit
der Verbindung, die Keratinocytenproliferation zu verhindern, wird
gemessen und es wird eine Bestimmung der Antagonistenfähigkeit
durchgeführt.
Die Menge der Kerationocytenzell-Proliferation wird durch Flüssigkeitsszintillations-Chromatographie gemessen,
die den Einbau von 3[H]-Tymidin misst.
-
In einem anderen Verfahren würde man
eine Säugerzellen-
oder eine Membranpräparation,
die den KGF-2-Rezeptor exprimieren, mit markiertem KGF-2 in Gegenwart
der Verbindung inkubieren. Die Fähigkeit der
Verbindung, diese Wechselwirkung zu verstärken oder zu blockieren könnte dann
gemessen werden. Alternativ würde
man die Reaktion eines bekannten zweiten Botenstoffes messen, die
auf die Wechselwirkung von KGF-2 folgt, und der Rezeptor würde in Gegenwart
oder Abwesenheit der Verbindung gemessen und verglichen werden.
Derartige zweite Botenstoffsysteme schließen ein, sind aber nicht begrenzt
auf cAMP Guanylatcyclase, Innenkanäle oder Phosphoinositidhydrolyse.
-
Beispiele potenzieller KGF-2-Antagonisten
schließen
einen Antikörper
oder in einigen Fällen
ein Oligonucleotid ein, das an das Polypeptid bindet. Alternativ
kann ein potenzieller KGF-2-Antagonist eine Mutantenform von KGF-2
sein, die an KGF-2-Rezeptoren bindet, jedoch wird kein zweiter Botenstoff
gewonnen, und deshalb wird die Wirkung von KGF-2 wirksam blockiert.
-
Ein weiterer potenzieller KGF-2-Antagonist
ist ein Antisense-Konstrukt, das unter Verwendung der Antisense-Technologie
hergestellt wird. Die Antisense-Technologie kann verwendet werden,
um die Genexpression durch Dreifachhelixbildung oder Antisense-DNA
oder RNA zu kontrollieren, dessen beide Verfahren auf die Bindung
eines Polynucleotids an DNA oder RNA basieren. Beispielsweise wird
der codierende 5'-Anteil
der Polynucleotidsequenz, der das reife Polypeptid der vorliegenden
Erfindung codiert, verwendet, um ein Antisense-RNA-Oligonucleotid mit einer Länge von
etwa 10 bis 40 Basenpaaren zu konstruieren. Es wird ein DNA-Oligonucleotid
konstruiert, das komplementär
zu einem Bereich des Gens sein soll, der an der Transkription beteiligt
ist (Dreifachhelix – vgl.
Lee et al., Nucl. Acids Res. 6: 3073 (1979); Cooney et al., Science
241: 456 (1988) und Dervan et al., Science 251: 1360 (1991)), und
dabei wird die Transkription und die Herstellung von KGF-2 verhindert.
Das Antisense-RNA-Oligonucleotid hybridisiert mit der cDNA in vivo
und blockiert die Transla tion des cDNA-Moleküls in das KGF-2-Polypeptid
(Antisense – Okano,
J., Neurochem. 56: 560 (1991); Oligodeoxynucleotides as Antisense
Inhibitors of Gene Expression, CRC Press, Boca Raton, FL (1988)).
Die vorstehend beschriebenen Oligonucleotide können auch in Zellen eingebracht
werden, so dass die Antisense-RNA oder DNA in vivo exprimiert werden
kann, um die KGF-2-Produktion zu hemmen.
-
Potenzielle KGF-2-Antagonisten schließen kleine
Moleküle
ein, die an die Bindungsstelle des KGF-2-Rezeptors binden und sie
besetzen, um dabei den Rezeptor für KGF-2 unzugänglich machen,
so dass die normale biologische Aktivität verhindert wird. Beispiele
kleiner Moleküle
schließen
ein, sind aber nicht begrenzt auf kleine Peptide oder peptidartige
Moleküle.
-
Die KGF-2-Antagonisten können verwendet
werden, um die Induktion des Wachstums neuer Blutgefäße oder
die Angiogenese in Tumoren zu verhindern. Die Angiogenese, die von
KGF-2 stimuliert wird, trägt ebenfalls
zu mehreren Pathologien bei, einschließlich diabetischer Retinopathie
und Hemmung des Wachstums von pathologischem Geweben wie bei der
rheumatoiden Arthritis, die auch von den Antagonisten der vorliegenden
Erfindung behandelt werden können.
-
KGF-2-Antagonisten können auch
verwendet werden, um Glomerulonephritis zu behandeln, die durch die
deutliche Proliferation von glomerulären Epithelzellen charakterisiert
wird, die eine zelluläre
Masse bilden, die den Bowman'schen
Raum ausfüllen.
-
Die Antagonisten können auch
verwendet werden, um die Überproduktion
des Narbengewebes bei Keloidbildung nach einem chirurgischen Eingriff,
Fibrose nach einem Myocardinfakt oder fibrotische Läsionen, die
mit Lungenfibrose assoziiert sind, und Restenose zu hemmen. KGF-2-Antagonisten
können
auch verwendet werden, um andere durch KGF-2 stimulierte, proliferative
Erkrankungen einschließlich
Krebs und Karposi-Sarkom zu behandeln.
-
KGF-2-Antagonisten können auch
verwendet werden, um Keratitis zu behandeln, die eine chronische Infiltration
der tiefen Schichten der Cornea mit uvealer Entzündung ist, die durch eine Proliferation
der Epithelzellen charakterisiert ist.
-
Die Antagonisten können in
einer Zusammensetzung mit einem pharmazeutisch verträglichen
Träger, wie
z. B. nachstehend beschrieben, verwendet werden. Die hier beschriebenen
Polypeptide, Agonisten und Antagonisten können in Kombination mit einem
geeigneten pharmazeutischen Träger
verwendet werden, um ein Arzneimittel zu umfassen. Derartige Zusammensetzung
umfassen eine therapeutisch wirksame Menge des Polypeptids, Agonisten oder
Antagonisten und einen pharmazeutisch verträglichen Träger oder Excipienten. Ein derartiger
Träger
schließt,
ist aber nicht begrenzt auf Salzlösung, gepufferte Salzlösung, Dextrose, Wasser,
Glycerin, Ethanol und Kombinationen davon. Die Formulierung sollte
der Verabreichungsart angepasst sein.
-
Die Erfindung stellt auch eine pharmazeutische
Verpackung oder einen Kit bereit, die/der einen oder mehrere Behälter umfasst,
die mit einem oder mehreren Bestandteilen des erfindungsgemäßen Arzneimittels gefüllt sind.
Derartige Behältern
kann ein Beipackzettel in der von einer Behörde vorgeschriebenen Form beiliegen,
der die Herstellung, die Verwendung oder den Verkauf der Arzneimittel
oder der biologischen Produkte regelt, wobei der Beipackzettel die
Genehmigung durch die Behörde,
die Herstellung, die Verwendung oder den Verkauf für die Verabreichung
am Menschen wiederspiegelt. Zusätzlich
können
die Polypeptide, Agonisten und Antagonisten der vorliegenden Erfindung
in Verbindung mit anderen Therapeutika verwendet werden.
-
Die Polypeptide der vorliegenden
Erfindung können
in Verbindung mit einem oder mehreren pharmazeutisch verträglichen
Excipienten verabreicht werden. Es klar, dass die tägliche Dosis
der Arzneimittel der vorliegenden Erfindung bei Verabreichung an
einen menschlichen Patienten von dem anwesenden Arzt im Rahmen einer
vernünftigen
medizinischen Beurteilung entschieden wird. Das spezifische, therapeutisch
wirksame Dosierungsniveau für
jeden bestimmten Patienten hängt
von einer Reihe von Faktoren ab, einschließlich der Art und dem Grad
der Reaktion, der erreicht werden soll; der verwendeten spezifischen
Verbindung eines anderen Mittels, wenn es eines gibt; Alter, Körpergewicht,
allgemeiner Gesundheitszustand, Geschlecht und Ernährung des
Patienten; Verabreichungszeitraum, Verabreichungsweg und Ausscheidungsrate
der Zusammensetzung; Behandlungsdauer; Medikamente (wie Chemotherapeutika),
die in Kombination oder zusammen mit der spezifischen Zusammensetzung
verwendet werden und ähnliche
Faktoren, die im medizinischen Fachgebiet gut bekannt sind. Geeignete,
aus dem Fachgebiet bekannte Formulierungen kann man bei Remington's Pharmaceutical
Sciences (neueste Ausgabe), Mack Publishing Company, Easton, PA
finden. Die in der Therapie zu verwendenden Zusammensetzungen, die
die Polypeptide der vorliegenden Erfindung umfassen, werden auf
eine Weise formuliert und dosiert, die mit der guten medizinischen
Praxis vereinbar ist, wobei der klinische Zustand des einzelnen
Patienten (insbesondere die Nebenwirkungen der Behandlung mit KGF-2
alleine), der Ort, an den die KGF-2-Zusammensetzung gelangt, das Verabreichungsverfahren,
der Verabreichungszeitplan und andere dem Arzt bekannte Faktoren
in Betracht gezogen werden. Die „wirksame Menge" von KGF-2 für die Zwecke
hier (einschließlich
einer KGF-2-wirksamen Menge) wird durch derartige Überlegungen
bestimmt.
-
Die Arzneimittel können auf
eine bequeme Weise wie durch orale, topische, intravenöse, intraperitoneale,
intramuskuläre,
intraartikuläre,
subkutane, intranasale oder intradermale Wege verabreicht werden.
Die Arzneimittel werden in einer Menge verabreicht, die für die Behandlung
und/oder Prophylaxe der spezifischen Indikation wirksam ist. In
den meisten Fällen
liegt die Dosierung im Bereich von 1 μg/kg bis etwa 50 mg/kg Körpergewicht
täglich,
wobei die Verabreichungswege, Symptome etcberücksichtigt werden. In dem spezifischen Fall
des topischen Verabreichungswegs werden die Dosierungen vorzugsweise
von etwa 0,01 μg
bis 9 mg pro cm2 verabreicht.
-
Als allgemeiner Vorschlag liegt die
pharmazeutisch wirksame KGF-2-Gesamtmenge, die parenteral besonders
pro bevorzugter Dosierung verabreicht wird, im Bereich von etwa
1 μg/kg/Tag
bis etwa 100 mg/kg/Tag des Körpergewichtes
des Patienten, obwohl dies, wie vorstehend angemerkt, dem therapeutischen Ermessen
unterliegt. Wenn KGF-2 kontinuierlich verabreicht wird, wird er
typischerweise mit einer Dosisrate von etwa 1 μg/kg/Stunde bis etwa 50 μg/kg/Stunde
entweder mittels 1–4
Injektion pro Tag oder durch ständige subkutane
Infusionen beispielsweise unter Verwendung einer Minipumpe verabreicht.
Eine intravenöse
Lösung
im Beutel oder eine Lösung
in der Flasche kann ebenfalls verwendet werden.
-
Der KGF-2-Behandlungsverlauf, um
das fibrinolytische System zu beeinflussen, erscheint optimal, wenn
er länger
als ein bestimmtes Minimum an Tagen fortgesetzt wird; 7 Tage im
Fall von Mäusen.
Die Länge der
benötigten
Behandlung, um Änderungen
zu beobachten, und das Intervall, das auf die Behandlungen, für Reaktionen
folgt, die auftreten sollen, scheinen abhängig vom gewünschten
Effekt zu variieren.
-
KGF-2 wird auch von Selbstfreisetzungssystemen
geeignet verabreicht. Geeignete Beispiele der Selbstfreisetzungszusammensetzungen
schließen
semipermeable Polymermatizes in Form von geformten Artikeln z. B.
Filmen oder Mikrokapseln ein. Selbstfreisetzungs-Matrizes schließen Polyactide
(U.S. Pat. Nr. 3,773,919,
EP 58,481 ),
Copolymere der L-Glutaminsäure
und Gamma-Ethyl-L-Glutamat (U. Sidman et al., Biopolymers 22: 547–556 (1983)),
Poly-(2-hydroxyethylmethacrylat)
(R. Langer et al., J. Biomed. Mater. Res. 15: 167–277 (1981)
und R. Langer, Chem. Tech. 12: 98–105 (1982)), Ethylenvinylacetat
(R. Langer et al., Id.) oder Poly-D-(-)-3-hydroxybuttersäure (
EP 133,988 ) ein. Selbst freisetzende
KGF-2-Zusammenset zungen schließen auch
in Liposomen eingeschlossenen KGF-2 ein. Liposomen, die KGF-2 enthalten,
werden durch per se bekannte Verfahren hergestellt:
DE 3,218,121 ; Epstein, et al., Proc.
Natl. Acad. Sci. USA 82: 3688–3692
(1985); Hwang et al., Proc. Natl. Acad. Sci. USA 77: 4030–4034 (1980);
EP 52,322 ;
EP 36,676 ;
EP
88,046 ;
EP 143,949 ;
EP 142,641 , Japanische Patentanmeldung
83-118008; U.S. Pat. Nr. 4,485,045 und 4,544,545 und
EP 102,324 . Normalerweise sind Liposomen
von der kleinen (etwa 200–800
Angström)
unilamellaren An, bei der der Lipidgehalt größer als etwa 30 Mol-% Cholesterin
ist, wobei die gewählte
Proportion für
die optimale KGF-2-Therapie eingestellt wird.
-
Für
die parenterale Verabreichung wird in einer Ausführungsform KGF-2 im allgemeinen
durch Mischen des gewünschten
Reinheitsgrades in einer injizierbaren Form als Einheitsdosis (Lösung, Suspension oder
Emulsion) mit einem pharmazeutisch verträglichen Träger gemischt, d. h. einen,
der für
die Empfänger bei
den verwendeten Dosierungen und Konzentrationen nicht toxisch ist
und mit den anderen Bestandteilen der Formulierung kompatibel ist.
Beispielsweise schließt
die Formulierung vorzugsweise keine oxidierenden Agentien und andere
Bestandteile ein, von denen bekannt ist, dass sie schädlich für Polypeptide
sind.
-
Im allgemeinen werden die Formulierungen
hergestellt, indem das KGF-2 einheitlich und nahe mit flüssigen oder
fein verteilten festen Trägern
oder beiden in Kontakt gebracht wird. Dann wird das Produkt gegebenenfalls
in die gewünschte
Formulierung geformt. Vorzugsweise ist der Träger ein parenteraler Träger, besonders
bevorzugt eine Lösung,
die mit dem Blut des Empfängers
isotonisch ist. Beispiele derartiger Trägervehikel schließen Wasser,
Salzlösung,
Ringer-Lösung
und Dextroselösung
ein. Nicht wässrige
Vehikel wie fixierte Öle
und Ethyloleat sowie Liposomen sind hier ebenfalls nützlich.
Geeignete Formulierungen kann man in Remingtons Pharmaceutical Sciences
(neueste Ausgabe), Mack Publishing Company, Easton, PA finden.
-
Der Träger enthält geeigneterweise kleinere
Mengen an Zusatzstoffen wie Substanzen, die die Isotonie und chemische
Stabilität
erhöhen.
Derartige Materialien sind für
die Empfänger
bei den verwendeten Dosierungen und Konzentrationen nicht toxisch
und schließen
Puffer wie Phosphat, Citrat, Succinat, Essigsäure und andere organische Säuren und
ihre Salze, Antioxidantien wie Ascorbinsäure; Polypeptide mit niedrigem Molekulargewicht
(weniger als etwa zehn Reste), z. B. Polyarginin oder Tripeptide;
Proteine wie Serumalbumin, Gelatine oder Immunglobuline; hydrophile
Polymere wie Polyvinylpyrrolidon; Aminosäuren wie Glycin, Glutaminsäure, Asparaginsäure oder
Arginin; Monosaccharide, Disaccharide und andere Kohlenstoffe einschließlich Cellulose
oder deren Derivate, Glucose, Mannose oder Dextrine; Chelatbildner
wie EDTA; Zuckeralkohole wie Mannit oder Sorbit; Gegenionen wie
Natrium und/oder nicht ionische grenzflächenaktive Mittel wie Polysorbate,
Poloxamere oder PEG ein.
-
KGF-2 wird typischerweise in solchen
Vehikeln bei einer Konzentration von etwa 0,01 μg/ml bis 100 mg/ml, vorzugsweise
0,01 μg/ml
bis 10 mg/ml bei einem pH-Wert von etwa 3 bis 8 formuliert. Es ist
klar, dass die Verwendung von bestimmten der vorstehenden Excipienten,
Träger
oder Stabilisatoren zur Bildung von KGF-2-Salzen führt.
-
KGF-2, der für die therapeutische Verabreichung
verwendet werden soll, muss steril sein. Die Sterilität wird leicht
durch Sterilfiltrationsmembranen erreicht (z. B. 0,2 Micron-Membranen). Therapeutische
KGF-2-Zusammensetzungen werden im allgemeinen in einen Behälter gegeben,
der eine sterile Zugangsöffnung
besitzt, beispielsweise eine intravenöse Lösung im Beutel oder in einer
Phiole mit einem Verschluss, der von einer hypodermischen Injektionsnadel
durchstochen werden kann.
-
KGF-2 wird normalerweise in Einheits-
oder Mehrfachdosierungsbehältern,
beispielsweise in versiegelten Ampullen oder Phiolen, als wässrige Lösung oder
als lyophilisierte Formulierung zur Rekonstitution gelagert. Als
Beispiel einer lyophilisierten Formulierung werden 10 ml-Phiolen
mit 5 ml sterilfiltrierter 1%-iger (Gew./Vol.) wässriger KGF-2-Lösung gefüllt und
das sich ergebende Gemisch wird lyophilisiert. Die Infusionslösung wird
durch Rekonstitution von lyophilisiertem KGF-2 unter Verwendung
von bakteriostatischem Wasser für
Injektionen hergestellt.
-
Die Dosierung muss auch auf eine
patientenspezifische Weise eingestellt werden, um eine zuvor bestimmte
Konzentration einer KGF-2-Aktivität, wie beispielsweise durch
das RIA-Verfahren bestimmt, im Blut bereitzustellen. Somit kann
die Patientendosierung eingestellt werden, um reguläre, durchgehende
Blutspiegel, wie durch RIA gemessen, in der Größenordnung von 50 bis 1000
ng/ml, vorzugsweise 150 bis 500 ng/ml zu erreichen.
-
Die erfindungsgemäßen Arzneimittel können oral,
rektal, parenteral, intracisternal, intradermal, intravaginal, intraperitoneal,
topisch (durch Pulver, Salben, Gele, Creams, Tropfen oder transdermale
Pflaster), bucal oder als Mund- oder Nasenspray verabreicht werden.
Mit „pharmazeutisch
verträglichem
Träger" ist ein nicht toxischer
fester, halbfester oder flüssiger
Füllstoff,
Verdünnungsmittel,
Kapselmaterial oder ein Formulierungshilfsmittel jeder Art gemeint.
Der Begriff „parenteral", wie hier verwendet,
bezieht sich auf Verabreichungsweisen, die intravenöse, intramuskuläre, intraperitoneale,
intrasternale, subkutane und intra zellulläre Injektion und Infusion einschließen. Die
KGF-2-Polypeptide, Agonisten und Antagonisten, die Polypeptide sind,
können
auch durch Expression derartiger Polypeptide in vivo verwendet werden,
was häufig
als „Gentherapie" bezeichnet wird.
-
Somit können beispielsweise Zellen
aus einem Patienten mit einem Polynucleotid (DNA oder RNA), das
ein Polypeptid ex vivo codiert, gentechnisch hergestellt werden,
wobei die gentechnisch hergestellten Zellen einem Patienten bereitgestellt
werden, damit er mit dem Polypeptid behandelt wird. Derartige Verfahren sind
aus dem Fachgebiet gut bekannt. Beispielsweise können Zellen mittels aus dem
Fachgebiet gut bekannter Verfahren unter Verwendung eines RNA-enthaltenden
Retroviruspartikels, das ein Polypeptid der vorliegenden Erfindung
codiert, gentechnisch hergestellt werden.
-
Auf ähnliche Weise können die
Zellen in vivo gentechnisch zur Expression eines Polypeptids in
vivo beispielsweise durch aus dem Fachgebiet bekannte Verfahren
hergestellt werden. Wie aus dem Fachgebiet bekannt, kann eine Produzentenzelle
zur Herstellung eines RNA-enthaltenden Retroviruspartikels, das
ein Polypeptid der vorliegenden Erfindung codiert, einem Patienten
zur gentechnischen Herstellung von Zellen ex vivo und Expression
des Polypeptids in vivo verabreicht werden. Diese und andere Verfahren
zur Verabreichung eines Polypeptids der vorliegenden Erfindung durch
derartige Verfahren sollten für
den Fachmann aufgrund der Ausführungen
der vorliegenden Erfindung offensichtlich sein. Beispielsweise kann
das Expressionsvehikel zur gentechnischen Herstellung von Zellen
ein anderes als ein Retrovirus sein, beispielsweise ein Adenovirus,
der verwendet werden kann, um Zellen gentechnisch in vivo nach Kombination
mit einem geeigneten Transportvehikel herzustellen. Beispiele anderer
Transportvehikel schließen
ein auf HSV-basierendes Vektorsystem, Adenoassoziierte Virusvektoren
und inerte Vehikel beispielsweise Dextran-beschichtete Ferritpartikel ein.
-
Retroviren, von denen die hier vorstehend
erwähnten
Plasmidvektoren abstammen können,
schließen ein,
sind jedoch nicht begrenzt auf das Moloney-Maus-Leukämie-Virus,
Milznekrosevirus, Retroviren wie das Rous-Sarkom-Virus, Harvey-Sarkom-Virus,
Vogel-Leukämie-Virus,
Gibbon-Leukämie-Virus,
menschliches Immunschwäche-Virus,
Adenovirus, myoproliferatives Sarkomvirus und Mammatumor-Virus.
In einer Ausführungsform
stammt der retrovirale Plasmidvektor vom Moloney-Maus-Leukämie-Virus
ab.
-
Der Vektor schließt einen oder mehrere Promotoren
ein. Geeignete Vektoren, die verwendet werden können, schließen ein,
sind jedoch nicht begrenzt auf die retroviralen LTRs, die SV40-Promotoren
und den bei Miller et al., Biotechniques Bd. 7 Nr. 9: 980–990 (1989)
beschriebenen menschlichen Cytomegalovirus (CMV)-Promotor oder jeden
anderen Promotor (z. B. zelluläre
Promotoren wie zelluläre
eukaryontische Promotoren einschließlich, jedoch nicht begrenzt
auf die Histon-, Pol III- und β-Aktin-Promotoren).
Andere Viruspromotoren, die verwendet werden können, schließen ein,
sind jedoch nicht begrenzt auf Adenovirus-Promotoren, Tymidinkinase
(TK)-Promotoren und B19-Parvovirus-Promotoren. Die Auswahl eines
geeigneten Promotors ist für
den Fachmann aufgrund der hier enthaltenen Ausführungen offensichtlich.
-
Die Nucleotidsequenz, die das Polypeptid
der vorliegenden Erfindung codiert, ist unter der Kontrolle eines
geeigneten Promotors. Geeignete Promotoren, die verwendet werden
können,
schließen
ein, sind jedoch nicht begrenzt auf Adenovirus-Promotoren wie den
späten
Hauptpromotor des Adenovirus oder heterologe Promotoren wie den
Cytomegalovirus (CMV)-Promotor, den Respiratory-sycytial-Virus (RSV)-Promotor; induzierbare
Promotoren wie den MMT-Promotor, den Metallothioninpromotor; Hitzeschockpromotoren;
den Albuminpromotor; den ApoAI-Promotor; menschliche Globin-Promotoren;
Virusthymidinkinase-Promotoren wie
den Herpes-Simplex-Tymidinkinase-Promotor; retrovirale LTRs (einschließlich die
modifizierten hier vorstehend beschriebenen LTRs); den β-Aktin-Promotor
und menschliche Wachstumshormonpromotoren. Der Promotor kann auch
der native Promotor sein, der die Gene kontrolliert, die das Polypeptid
codieren.
-
Der retrovirale Plasmidvektor wird
verwendet, um Verpackungszelllinien zur Erzeugung von Produzentenzelllinien
zu transduzieren. Beispiele von Verpackungszelllinien, die transfiziert
werden können,
schließen ein,
sind jedoch nicht begrenzt auf die PE501-, PA317-, Ψ-2-; Ψ-AM-, PA12-,
T19-14X-, VT-19-17-H2-, ΨCRE-, ΨCRIP-, GP
+ E-86, GP + envAm12-und
DAN-Zellinien, wie bei Miller, Human Gene Therapy 1 : 5–14 (1990) beschrieben,
was hier durch Bezugnahme in seiner Gesamtheit eingebracht wurde.
Der Vektor kann die Verpackungszelllinien mittels jeden aus dem
Fachgebiet bekannten Mittels transduzieren. Derartige Mittel schließen ein,
sind jedoch nicht begrenzt auf Elektropoaration, die Verwendung
von Liposomen und CaPO4-Präzipitation.
In einer Ausführungsform
kann der Plasmidvektor in ein Liposom verkapselt werden oder an
ein Lipid gekoppelt werden und dann einem Wirt verabreicht werden.
-
Die Produzentenzelllinie erzeugt
infektiöse
retrovirale Viruspartikel, die die Nucleinsäuresequenz(en) einschließen, die
die Polypeptide codieren. Derartige retrovirale Partikel werden
dann verwendet, um eukaryontische Zellen entweder in vitro oder
in vivo zu transduzieren. Die transduzierten eukaryontischen Zellen
exprimieren dann die Nucleinsäuresequenz(en),
die das Polypeptid codieren. Eukaryontische Zellen, die transduziert
werden können,
schließen
ein, sind jedoch nicht begrenzt auf embryonale Stammzellen, embryonale Karzinomzellen
sowie hämatopoetische
Stammzellen, Hepatocyten, Fibroblasten, Myoblasten, Keratinocyten, Endothelzellen
und Bronchienepithelzellen.
-
Chromosomentests
-
Die in der vorliegenden Erfindung
beschriebenen Sequenzen sind auch für die Identifizierung von Chromosomen
wertvoll. Die Sequenz wird spezifisch anvisiert und kann mit einer
bestimmten Stelle auf einem einzelnen menschlichen Chromosom hybridisieren.
Außerdem
gibt es einen derzeitigen Bedarf, bestimmte Stellen auf den Chromosomen
zu identifizieren. Es stehen derzeit wenige chromosomenmarkierende
Reagenzien zur Markierung chromosomaler Orte zur Verfügung, die
auf tatsächlichen
Sequenzdaten (Wiederholungspolymorphismen) basieren. Die Karierung
von DNAs auf Chromosomen nach der vorliegenden Erfindung ist ein
wichtiger erster Schritt bei der Korrelation solcher Sequenzen mit
Genen, die mit Krankheiten assoziiert sind.
-
Kurz gesagt, können Sequenzen auf Chromosomen
kartiert werden, indem PCR-Primer (vorzugsweise 15–25 bp)
aus der cDNA hergestellt werden. Die Computeranalyse des nicht translatierten
3'-Bereichs wird verwendet,
um schnell Primer auszuwählen,
die nicht mehr als ein Exon in der genomischen DNA umspannen, wodurch
der Amplifikationsvorgang verkompliziert wird. Diese Primer werden
dann zur PCR-Durchmusterung der somatischen Zellhybride verwendet,
die einzelne menschliche Chromosomen enthalten. Nur diejenigen Hybride,
die das menschliche Gen enthalten, das dem Primer entspricht, werden
ein amplifiziertes Fragment ergeben.
-
Die PCR-Kartierung somatischer Zellhybride
ist ein schnelles Verfahren zur Zuordnung einer bestimmten DNA zu
einem bestimmten Chromosom. Unter Verwendung der vorliegenden Erfindung
mit denselben Oligonucleotidprimern kann eine Sublokalisierung mit
Fragmentfeldern aus spezifischen Chromosomen oder Pools großer genomischer
Clone auf analoge An erreicht werden. Andere Kartierungsstrategien,
die einfach verwendet werden können,
um das Chromosom zu kartieren, schließen in situ-Hybridisierung,
vorheriges Durch mustern mit markierten durchflusscytometrisch sortierten
Chromosomen und Vorselektion durch Hybridisierung ein, um chromosomenspezifische
cDNA-Genbanken zu konstruieren.
-
Die Fluoreszenz-in-situ-Hybridisierung
(FISH) eines c-DNA-Clons mit einem Chromosomenausstrich in der Metaphase
kann verwendet werden, um einen präzisen chromosomalen Ort in
einem Schritt bereitzustellen. Dieses Verfahren kann mit einer DNA
verwendet werden, die nur 50 oder 60 Basen umfasst. Für einen Übersichtsartikel
dieses Verfahrens vgl. Verma et al., Human Chromosomes: a Manual
of Basic Techniques, Pergamon Press, New York (1988).
-
Sobald eine Sequenz auf einem präzisen Chromosomenort
kartiert wurde, kann die physikalische Position der Sequenz auf
dem Chromosom mit genetischen Kartierungsdaten korreliert werden.
Derartige Daten findet man beispielsweise bei V. McKusick, Mendelian
Inheritance in Man (erhältlich
online über
die Medizinische Welch-Bibliothek der John Hopkins University).
Die Beziehung zwischen Genen und Krankheiten, die auf demselben
Chromosomenbereich kartiert wurden, werden dann über Verwandtschaftsanalyse
(gemeinsame Vererbung von physikalisch benachbarten Genen) identifiziert.
-
Dann ist es notwendig, die Unterschiede
in der cDNA oder der Genomsequenz zwischen betroffenen und nicht
betroffenen Individuen zu bestimmen. Wenn eine Mutation in allen
oder manchen der betroffenen Individuen, aber nicht bei irgendeinem
normalen Individuum beobachtet wird, dann ist die Mutation wahrscheinlich
die Krankheitsursache.
-
Mit der derzeitigen Auflösung der
physikalischen Kartierungs- und genetischen Kartierungsverfahren könnte eine
cDNA, die präzise
auf einem chromosomalen Bereich lokalisiert ist, der mit der Krankheit
assoziiert ist, eines von zwischen 50 und 500 potenziellen verursachenden
Genen sein. (Das setzt eine Auflösung
der Kartierung von 1 Megabase und einem Gen pro 20 kb voraus).
-
Die vorliegende Erfindung wird ferner
unter Bezugnahme auf die folgenden Beispiele beschrieben; jedoch
soll klar sein, dass die vorliegende Erfindung nicht auf derartige
Beispiele begrenzt ist. Alle Teile oder Mengen, wenn nicht anders
spezifiziert, sind pro Gewicht.
-
Um das Verständnis der folgenden Beispiele
zu erleichtern, werden bestimmte häufig auftretende Verfahren
und/oder Begriffe beschrieben.
-
„Plasmide" werden durch ein kleines p bezeichnet,
dem Großbuchstaben
und/oder Zahlen vorhergehen oder folgen. Die hier verwendeten Ausgangsplasmide
sind entweder im Handel erhältlich, öffentlich
auf einer uneingeschränkten
Basis erhältlich
oder können
aus zur Verfügung
stehenden Plasmiden nach den veröffentlichten
Verfahren konstruiert werden. Zusätzlich sind äquivalente
Plasmide zu den beschriebenen aus dem Fachgebiet bekannt und sind
für den
Fachmann offensichtlich.
-
Die „Spaltung" von DNA bezieht sich auf die katalytische
Spaltung der DNA mit einem Restriktionsenzym, das nur auf bestimmte
Sequenzen in der DNA wirkt. Die verschiedenen hier verwendeten Restriktionsenzyme
sind im Handel erhältlich
und ihre Reaktionsbedingungen, Cofaktoren und andere Anforderungen
werden so verwendet, wie es dem Fachmann bekannt wäre. Für analytische
Zwecke wird typischerweise 1 μg Plasmid
oder DNA-Fragment mit etwa 2 Einheiten Enzym in etwa 20 μl Pufferlösung verwendet.
Für den
Zweck der DNA-Fragment-Isolierung
zur Plasmidkonstruktion werden typischerweise 5 bis 50 μg DNA mit
20 bis 250 Enzymeinheiten in einem größeren Volumen gespalten. Geeignete
Puffer und Substratmengen für
besondere Restriktionsenzyme werden vom Hersteller spezifiziert.
Die Inkubationszeiten von etwa 1 Stunde bei 37°C werden üblicherweise verwendet, aber
können
nach den Anweisungen des Herstellers variieren. Nach der Spaltung
wird der Restriktionsansatz direkt auf einem Polyacrylamidgel einer
Elektrophorese unterzogen, um das gewünschte Fragment zu isolieren.
-
Die Größentrennung der gespaltenen
Fragmente erfolgt unter Verwendung von 8 Prozent Polyacrylamid,
beschrieben von Goeddel, D., et al., Nucleic Acids Res., 8: 4057
(1980).
-
„Oligonucleotide" bezieht sich entweder
auf ein einzelsträngiges
Polydesoxynucleotid oder zwei komplementäre Polydesoxynucleotidstränge, die
chemisch synthetisiert werden können.
Derartige synthetische Oligonucleotide besitzen kein 5'-Phosphat und ligieren
somit nicht mit einem anderen Oligonucleotid ohne Zugabe von Phosphat
mit ATP in Gegenwart einer Kinase. Ein synthetisches Oligonucleotide
ligiert mit einem Fragment, das nicht phosphorylisiert wurde.
-
„Ligierung" bezieht sich auf den Vorgang der Bildung
von Phosphodiesterbindungen zwischen zwei doppelsträngigen Nucleinsäurefragmenten
(Maniatis, T., et al., vorstehend, S. 146). Wenn nicht anderweitig bereitgestellt,
kann die Ligierung unter Verwendung bekannter Puffer und Bedingungen
mit 10 Einheiten T4-DNA-Ligase („Ligase") pro 0,5 μg ungefähr äquimolarer Mengen von zu ligierenden
DNA-Fragmenten erfolgen.
-
Eine Zelle wurde durch exogene DNA „transformiert", wenn derartige
exogene DNA in die Zellmembran eingeführt wurde. Die exogene DNA
kann oder kann nicht intergrierte (covalent gebundene) interchromosomale
DNA sein, die das Genom der Zelle ausmacht. Bei Prokaryonten und
Hefe kann die exogene DNA beispielsweise auf einem episomalen Element
wie einem Plasmid gehalten werden. Was eukaryontische Zellen anbelangt,
ist eine stabil transformierte oder transfizierte Zelle eine, bei
der die exogene DNA in das Chromosom integriert wurde, so dass sie
von Tochterzellen durch Chromosomenreplikation vererbt wurde. Diese
Fähigkeit
wird durch die Fähigkeit
der eukaryontischen Zellen gezeigt, Zelllinien oder Clone zu etablieren,
die eine Population von Tochterzellen umfassen, die die exogene
DNA enthalten. Ein Beispiel der Transformation wird bei Graham,
F. & Van der
Eb, A., Virology 52: 456–457
(1973) dargestellt.
-
„Transduktion" oder „transduziert" bezieht sich auf
einen Vorgang, bei dem die Zellen Fremd-DNA aufnehmen und diese
Fremd-DNA in ihr Chromosom integrieren. Die Transduktion kann beispielsweise
durch Transfektion erfolgen, die sich auf verschiedene Verfahren
bezieht, bei der die Zellen DNA aufnehmen oder Infektion, bei der
Viren verwendet werden, um DNA in Zellen zu übertragen.
-
Beispiel 1
-
Bakterielle Expression
und Reinigung von KGF-2
-
Die DNA-Sequenz, die KGF-2, ATCC
# 75977, codiert, wird zuerst unter Verwendung von PCR-Oligonucleotidprimern
amplifiziert, die den 5'-
und 3'-Sequenzenden
der prozessierten KGF-2-cDNA (einschließlich der Signalpeptidsequenz)
entsprechen. Der 5'-Oligonucleotidprimer
besitzt die Sequenz 5'CCCCACATGTGGAAATGGATACTGACACATTGTGCC3' (SEQ ID Nr. 3),
enthält
eine Afl III-Restriktionsenzyrrischnittstelle, einschließlich und
gefolgt von 30 Nucleotiden der KGF-2-codierenden Sequenz, beginnend vom
angenommenen Initiationscodon. Die 3'-Sequenz 5'CCCAAGCTTCCACAAACGTTGCCTTCCTCTATGAG3' (SEQ m Nr. 4) enthält Komplementärsequenzen
zur HindIII-Schnittstelle und auf sie folgen 26 Nucleotide von KGF-2. Die Restriktionsenzymschnittstellen
sind mit den Restriktionsenzynischnittstellen auf dem bakteriellen
Expressionsvektor pQE-60 (Qiagen, Inc. Chatsworths, CA) kompatibel.
pQE-60 codiert eine Antibiotikaresistenz (AMpr),
einen bakteriellen Replikationsursprung (ori), einen IPTG-regulierbaren
Promotoroperator (P/O), eine ribosomale Bindestelle (RBS), einen 6-His-Tag und Restriktionsenzymschnittstellen.
pQE-60 wird dann mit NcoI und HindIII gespalten.
-
Die amplifizierten Sequenzen werden
in pQE-60 ligiert und werden im Leserahmen eingebaut. Das Ligierungsgemisch
wird dann verwendet, um den E. coli-Stamm M15/rep 4 (Qiagen, Inc.)
mittels des bei Sambrook, J., et al., Molecular Cloning: A Laboratory
Manual, Cold Spring Harbor Laboratory Press, (1989) beschriebenen
Verfahrens zu transformieren. M15/rep4 enthält multiple Kopien des Plasmids
pREP4, das den lacI-Repressor exprimiert und auch die Kanmycinresitenz
(Kanr verleiht. Die Transformanten werden
aufgrund ihrer Fähigkeit,
auf LB-Platten zu wachsen, identifiziert und Ampicillin/Kanmycin-resistente
Kolonien werden ausgewählt.
Die Plasmid-DNA wird isoliert und durch Restriktionsanalyse bestätigt. Die
Clone, die die gewünschten
Konstrukte enthalten, werden über
Nacht (Ü/N)
in Flüssigkultur
in sowohl mit Amp (100 μg/ml)
und Kan (25 μg/ml)
ergänztem
LB-Medium gezüchtet.
Die Ü/N-Kultur
wird verwendet, um eine große
Kultur in einem Verhältnis
von 1 : 100 bis 1 : 250 anzuimpfen. Die Zellen werden bis zu einer
optischen Dichte 600 (O. D.600) zwischen
0,4 und 0,6 gezüchtet.
Dann wird IPTG („Isopropyl-B-D-thiogalaktopyranosid") bis zu einer Endkonzentration
von 1 mM zugegeben. IPTG induziert durch Inaktivierung des lacI-Repressors, indem
der P/O geräumt
wird, was zu einer erhöhten
Genexpression führt.
Die Zellen werden zusätzliche
3 bis 4 Stunden gezüchtet.
Die Zellen werden dann durch Zentrifugation geerntet. Das Zellpellet
wird in der chaotropen Substanz Guanidin HCl (6 Molar) solubilisiert.
Nach der Klärung
wird solubilisiertes KGF-2 aus dieser Lösung durch Chromatographie
auf einer Heparin-Affinitätssäule unter
Bedingungen gereinigt, die eine feste Bindung der Proteine zulassen
(Hochuli, E., et al., J. Chromatography 411: 177–184 (1984)). KGF-2 (75% rein)
wird von der Säule
durch Hochsalzpuffer eluiert.
-
Beispiel 2
-
Bakterielle Expression
und Reinigung einer verkürzten
Version von KGF-2
-
Die DNA-Sequenz, die KGF-2, ATCC
# 75977, codiert, wird zuerst unter Verwendung von PCR-Oligonucleotidprimern
amplifiziert, die den 5'-
und 3'-Sequenzen
der verkürzten
Version des KGF-2-Polypeptids entsprechen. Die verkürzte Version
umfasst das Polypeptid minus der 36 Aminosäuresignalsequenz, wobei ein Methionin-
und Alaninrest genau vor dem Cysteinrest hinzugefügt werden,
der die Aminosäure
37 der Proteins mit der gesamten Länge umfasst. Der 5'-Oligonucleotidprimer
besitzt die Sequenz 5'CATGCCATGGCGTGCCAAGCCCTTGGTCAGGACATG3' (SEQ ID Nr. 5),
enthält
eine NcoI-Restriktionsenzymschnittstelle, einschließlich und
gefolgt von 24 Nucleotiden der KGF-2 codierenden Sequenz einschließt und darauf
folgt. Die 3'-Sequenz
5'CCCAAGCTTCCACAAACGTTGCCTTCCTCTATGAG3' (SEQ ID Nr. 6) enthält Komplementärsequenzen
zur HindIII-Schnittstelle und auf sie folgen 26 Nucleotide des KGF-2-Gens. Die Restriktionsenzymschnittstellen
sind mit den Restriktionsenzymschnittstellen auf dem bakteriellen
Expressionsvektor pQE-60 (Qiagen, Inc. Chatsworths, CA) kompatibel.
pQE-60 codiert eine Antibiotikaresistenz (AMpr),
einen bakteriellen Replikationsursprung (ori), einen IPTG-regulierbaren
Promotoroperator (P/O), eine ribosomale Bindestelle (RBS), einen
6-His-Tag und Restriktionsenzymschnittstellen. pQE-60 wird dann
mit NcoI und Hind-III
gespalten. Die amplifizierten Sequenzen werden in pQE-60 ligiert
und werden im Leserahmen eingebaut. Das Ligierungsgemisch wird dann
verwendet, um den E. coli-Stamm M15/rep 4 (Qiagen, Inc.) mittels des
bei Sambrook, J., et al., Molecular Cloning: A Laboratory Manual
Cold Spring Harbor Laboratory Press, (1989) beschriebenen Verfahrens
zu transformieren. M15/rep4 enthält
multiple Kopien des Plasmids pREP4, das den lacI-Repressor exprimiert
und auch die Kanmycinresistenz (Kanr verleiht.
Die Transformanten werden aufgrund ihrer Fähigkeit, auf LB-Platten zu
wachsen, identifiziert und Ampicillin/Kanmycin-resistente Kolonien werden
ausgewählt.
Die Plasmid-DNA wird isoliert und durch Restriktionsanalyse bestätigt. Die
Clone, die die gewünschten
Konstrukte enthalten, werden über
Nacht (Ü/N)
in Flüssigkultur
in sowohl mit Amp (100 μg/ml) und
Kan (25 μg/ml)
ergänztem
LB-Medium gezüchtet.
Die Ü/N-Ku1tur
wird verwendet, um eine große
Kultur in einem Verhältnis
von 1 : 100 bis 1 : 250 anzuimpfen. Die Zellen werden bis zu einer
optischen Dichte 600 (O.D.600) zwischen
0,4 und 0,6 gezüchtet.
Dann wird IPTG („Isopropyl-β-D-thiogalaktopyranosid") bis zu einer Endkonzentration
von 1 mM zugegeben. IPTG induziert durch Inaktivierung des lacI-Repressors,
indem der P/O geräumt
wird, was zu einer erhöhten
Genexpression führt.
Die Zellen werden zusätzliche
3 bis 4 Stunden gezüchtet.
Die Zellen werden dann durch Zentrifugation geerntet. Das Zellpellet
wird in der chaotropen Substanz Guanidin HCl (6 Molar) solubilisiert.
Nach der Klärung
wird solubilisiertes KGF-2 aus dieser Lösung durch Chromatographie
auf einer Heparin-Affinitätssäule unter
Bedingungen gereinigt, die eine feste Bindung der Proteine zulassen
(Hochuli, E. et al., J. Chromatography 411: 177–184 (1984)). Das KGF-2-Protein
wird von der Säule
durch Hochsalzpuffer eluiert.
-
Beispiel 3
-
Clonierung und Expression
von KGF-2 unter Verwendung des Baculovirus-Expressionssystems
-
Die DNA-Sequenz, die das KGF-2-Protein
mit der gesamten Länge,
ATCC # 75977, codiert, wird unter Verwendung von PCR-Oligonucleotidprimern
amplifiziert, die den 5'-
und 3'-Sequenzen
des Gens entsprechen:
-
Der 5'-Primer besitzt die Sequenz 5'GCGGGATCCGCCATCATGTGGAAATGG-ATACTCAC3' (SEQ ID Nr. 7) und
enthält
eine BamHI-Restriktionsenzymschnittstelle (fettgedruckt), gefolgt
von 6 Nucleotiden, die einem effizienten Signal zur Initiation der
Translation in eukaryontischen Zellen ähnelt (Kozak, M., J. Mol. Biol., 196:
947–950
(1987)) und genau dahinter die ersten 17 Nucleotide des KGF-2-Gens
(das Initiationscodon zur Translation „ATG" ist unterstrichen).
-
Der 3'-Primer besitzt die Sequenz 5'GCGCGGTACCACAAACGTTGCC-TTCCT3'(SEQ ID Nr. 8) und enthält die Schnittstelle
für die
Restriktionsendonuclease Asp718 und 19 Nucleotide, die zur nicht
translatierten 3'-Sequenz
des KGF-2-Gens komplementär
sind. Die amplifizierten Sequenzen werden aus einem 1%-igen Agarosegel
unter Verwendung eines im Handel erhältlichen Kits von Qiagen, Inc.,
Chatsworths, CA isoliert. Das Fragment wird dann mit den Endonucleasen
BamHI und Asp718 gespalten und dann wiederum auf einem 1%-igen Agarosegel
gereinigt. Dieses Fragment wird als F2 bezeichnet.
-
Der Vektor pA2 (Modifikation des
pVL941-Vektors, nachstehend diskutiert) wird zur Expression des KGF-2-Proteins
unter Verwendung des Baculovirus-Expressionssystems verwendet (für eine Übersicht
vgl.: Summers, M. D. & Smith,
G. E., A manual of methods for baculovirus vectors and insect cell
culture procedures, Texas Agricultural Experimental Station Bulletin
Nr. 1555 (1987)). Dieser Expressionsvektor enthält den starken Polyhedrinpromotor
des Autographa californica Kernpolyeder Virus (AcMNPV), gefolgt
von den Erkennungsschnittstellen für die Restriktionsendonucleasen
BamHI und Asp718. Die Polyadenylierungsstelle des Simian-Virus (SV)
40 wird für
eine effiziente Polyadenylierung verwendet. Zur leichten Selektion
der rekombinanten Viren wird das Beta-Galaktosidase Gen aus E. coli
in derselben Orientierung wie der Polyhedrinpromotor eingebaut,
gefolgt von dem Polyade nylierungssignal des Polyhedringens. Die
Polyhedrinsequenzen werden auf beiden Seiten von Virussequenzen
zur zellvermittelten homologen Rekombination der cotransfizierten Virus-Wildtyp-DNA flankiert.
Viele andere Baculovirusvektoren wie pAc373, pVL941 und pAc1M1 könnten anstatt
pRG1 verwendet werden (Luckow, V. A. & Summers, M. D, Virology, 170: 31–39).
-
Das Plasmid wird mit den Restriktionsenzymen
BamHI und Asp718 gespalten. Die DNA wird dann aus einem 1%-igen
Agarosegel unter Verwendung des im Handel erhältlichen Kits (Qiagen, Inc.,
Chatsworths, CA) isoliert. Diese Vektor DNA wird als V2 bezeichnet.
-
Das Fragment F2 und das Plasmid V2
wird mit T4-DNA-Ligase ligiert. E. coli-HB101-Zellen werden dann transformiert und
die Bakterien identifiziert, die das Plasmid (pBacKGF-2) mit dem KGF-2-Gen
enthielten, indem eine PCR mit beiden Clonierungsoligonucleotiden
verwendet wurde. Die Sequenz der clonierten Fragments wird durch
DNA-Sequenzierung bestätigt.
-
5 μg
Plasmid pBacKGF-2 werden zusammen mit 1,0 μg eines im Handel erhältlichen
linearisierten Baculovirus („BaculoGoldTM Baculovirus DNA", Pharmingen, San Diego, CA) unter Verwendung
des Lipofektionsverfahrens transfiziert (Felgner, et al., Proc.
Natl. Acad. Sci. USA, 84: 7413–7417
(1987)).
-
1 μg
BaculoGoldTM Virus-DNA und 5 μg Plasmid
pBacKGF-2 werden in einer sterilen Vertiefung einer Mikrotiterplatte
gemischt, die 50 μl
serumfreies Grace-Medium (Life Technologies Inc. Gaithersburg, MD)
enthält.
Anschließend
werden 10 μl
Lipofektin plus 90 μl
Grace-Medium zugegeben, gemischt und 15 Minuten bei Raumtemperatur
inkubiert. Dann wird das Transfektionsgemisch tropfenweise den Sf9-Insektenzellen
(ATCC CRL 1711) zugegeben, die in einer 35 mm-Gewebekulturplatte
mit 1 ml Grace-Medium ohne Serum angesetzt werden. Die Platte wird
hin- und hergeschwenkt, um die neu hinzugefügte Lösung zu mischen. Die Platte
wird dann 5 Stunden bei 27°C
inkubiert. Nach 5 Stunden wird die Transfektionslösung von
der Platte entfernt und 1 ml Grace-Insektenmedium, ergänzt mit
10%-igem fötalem Kälberserum
wird zugegeben. Die Platte wird in einen Inkubator zurückgegeben
und die Züchtung
bei 27°C
vier Tage fortgesetzt.
-
Nach vier Tagen wird der Überstand
gesammelt und ein Plaquetest wird auf ähnliche Weise durchgeführt, wie
bei Summers und Smith (vorstehend) beschrieben. Als Modifikation
wird ein Agarosegel mit „Blue Gal" (Life Technologies
Inc., Gaithersburg, MD) verwendet, das eine einfache Isolierung
der blaugefärbten Plaques
zulässt.
(Eine detaillierte Beschreibung eines „Plaquetests" findet man auch
im Benutzerleitfaden für Insektenzellkultur
und Baculovirologie, vertrieben von Life Technologies Inc., Gaithersburg,
Seiten 9–10).
-
Vier Tage nach der Reihenverdünnung werden
die Viren den Zellen zugegeben und blau gefärbte Plaques werden mit der
Spitze einer Eppendorfpipette aufgenommen. Der Agar, der die rekombinanten
Viren enthält,
wird dann in einem Eppendorfröhrchen
resuspendiert, das 200 μl
Grace-Medium enthält.
Der Agar wird durch kurze Zentrifugation entfernt und der Überstand,
der das rekombinante Baculovirus enthält, wird verwendet, um die
in 35 mm-Schalen
angesetzten Sf9-Zellen zu infizieren. Vier Tage später werden
die Überstände dieser
Kulturschalen geerntet und dann bei 4°C gelagert.
-
Sf9-Zellen werden in mit 10% hitzeinaktiviertem
FBS ergänztem
Grace-Medium gezüchtet.
Die Zellen werden mit dem rekombinanten Baculovirus V-KGF-2 mit
einer Multiplizität
der Infektion (MOI von 2 infiziert. Sechs Stunden später wird
das Medium entfernt und durch SF900-II-Medium ohne Methionin und
Cystein (Life Technologies, Inc. Gaithersburg) ersetzt. 42 Stunden
später
werden 5 uCi 35S-Methionin und 5 uCi 3SS-Cystein zugegeben. Die Zellen werden
16 Stunden weiter inkubiert, bevor sie mittels Zentrifugation geerntet
werden und die markierten Proteine werden durch SDS-PAGE und Autoradiographie
sichtbar gemacht.
-
Beispiel 4
-
Die meisten der für die vorübergehende Expression der KGF-2-Protein-Gensequenz
in Säugerzellen verwendeten
Vektoren sollten den SV40-Replikationsursprung tragen. Das lässt die
Replikation des Vektors mit hohen Kopiezahlen in Zellen zu (z. B.
COS-Zellen), die das T-Antigen exprimieren, das für die Initiation
der viralen DNA-Synthese erforderlich ist. Jede andere Säugerzelllinie
kann ebenfalls für
diesen Zweck verwendet werden.
-
Ein typischer Säuger-Expressionsvektor enthält das Promotorelement,
das die Initiation der mRNA-Transkription vermittelt, die Protein-codierende
Sequenz und Signale, die für
die Termination der Transkription und Polyadenylierung des Transkripts
erforderlich sind. Zusätzliche
Elemente schließen
Verstärkerelemente,
Kozak-Sequenzen und dazwischenliegenden Sequenzen ein, die von Spender-
und Empfängerstellen
für das
Spleißen
von RNA flankiert werden. Hoch effiziente Transkription kann mit
den frühen
und späten Promotoren
aus SV40, den langen terminalen Wiederholungssequenzen (LTRs) aus
Retroviren, z. B. RSV, HTLVI, HIVI und dem frühen Promotor des Cytomegalovirus
(CMV) erreicht werden. Jedoch können
zelluläre Signale
ebenfalls verwendet werden (z. B. menschlicher Aktinpromotor). Geeignete
Expressionsvektoren zur Verwendung bei der praktischen Umsetzung
der vorliegenden Erfindung schließen beispielsweise Vektoren wie
pSVL und pMSG (Pharmacia, Uppsala, Schweden), pRSVcat (ATCC 37152),
pSV2dhfr (ATCC 37146) und pBC12MI (ATCC 67109) ein. Säugerwirtszellen,
die verwendet werden könnten,
schließen
menschliche Hela-, 283-, H9- und Jurkat-Zellen, Maus-NIH3T3- und
C127-Zellen, Cos 1-, Cos 7- und CV1-, Zellen der Meerkatze, Wachtel-QC1-3-Zellen,
Maus-L-Zellen und chinesische Hamster-Ovarienzellen ein.
-
Alternativ kann das Gen in stabilen
Zelllinien exprimiert werden, die in ein Chromosom integriertes
Gen enthalten. Die gemeinsame Transfektion mit einem Selektionsmarker
wie dhfr, gpt, Neomycin, Hygromycin lässt die Identifizierung und
Isolierung der transfizierten Zellen zu.
-
Das transfizierte Gen kann auch amplifiziert
werden, um große
Mengen des codierten Proteins zu exprimieren. DHFR (Dihydrofolatreduktase)
ist ein nützlicher
Marker, um Zelllinien zu entwickeln, die mehrere hundert oder sogar
mehrere tausend Kopien des Gens von Interesse tragen. Ein anderer
nützlicher
Selektionsmarker ist die Enzyrriglutaminsynthase (GS) (Murphy et
al., Biochem J. 227: 277–279
(1991); Bebbington et al., Bio/Technology 10: 169– 175 (1992)).
Unter Verwendung dieser Marker werden die Säugerzellen in Selektionsmedium
gezüchtet
und die Zellen mit der größten Resistenz
werden ausgewählt.
Diese Zelllinien enthalten das/die amplifizierte(n), in ein Chromosom
integrierte(n) Gen(e). Chinesische Hamster-Ovarienzellen werden häufig für die Produktion
von Proteinen verwendet.
-
Die Expressionsvektoren pC1 und pC4
enthalten den starken Promotor (LTR) des Rous-Sarkom-Virus (Cullen et al., Molecular
and Cellular Biology, 438–447
(März,
1985)) plus ein Fragment des CMV-Verstärkerelements (Boshart et al.,
Cell 41: 521–530
(1985)). Mehrfachclonierungsstellen z. B. mit den Restriktionsenzymschnittstellen
BamHI, XbaI und Asp718 erleichtern die Clonierung des Gens von Interesse.
Die Vektoren enthalten zusätzlich
das 3'-Intron, das Polyadenylierungs-
und Terminationssignal des Ratten-Präproinsulingens.
-
A. Expression von rekombinantem
KGF-2 in COS-Zellen
-
Das Expressionsplasmid KGF-2-HA stammte
von einem Vektor pcDNAI/Amp (Invitrogen), enthaltend: 1) SV40-Replikationsursprung,
2) Ampicillin-Resistenzgen, 3) E. coli-Replikationsursprung, 4) CMV-Promotor, gefolgt
von einem Polylinkerbereich, einem SV40-Intron und einer Polyadylierungsstelle.
Der HA-Tag entspricht einem Epitop, das vom Influenza-Hämagglutininprotein
stammt, wie zuvor beschrieben (Wilson, I., et al. Cell 37: 767,
(1984)). Das Anbringen des HA-Tags am Zielprotein lässt einen
leichten Nachweis des rekombinanten Proteins mit einem Antikörper zu,
der das HA-Epitop erkennt. Ein DNA-Fragment, das den gesamten KGF-2-Vorläufer-HA-Tag
codiert, wird im Leserahmen mit dem HA-Tag fusioniert, so dass die rekombinante Proteinexpression
vom CMV-Promotor gelenkt wird.
-
Die Strategie zur Plasmidkonstruktion
wird wie folgt beschrieben:
-
Die DNA-Sequenz, die KGF-2, ATCC
# 75977, codiert, wird mittels PCR unter Verwendung zweier Primer
konstruiert: Der 5'-Primer
5'TAACGAGGATCCGCCATCATGTGGAAATGGATACTGACAC3' (SEQ ID Nr. 9) enthält eine
BamHI-Schnittstelle, gefolgt von 22 Nucleotiden der KGF-2- codierenden
Sequenz, beginnend vom Initiationscodon; die 3'-Sequenz
5'TAAGCACTCGAGTGAGTGTACCACCATTGGAAGAAATG3' (SEQ ID Nr. 10)
enthält
Komplementärsequenzen
zu einer XhoI-Schnittstelle, einem HA-Tag und die letzten 26 Nucleotide
der KGF-2-codierenden Sequenz (das Stoppcodon nicht eingeschlossen).
Deshalb enthält
das PCR-Produkt eine BamHI-Schnittstelle, eine KGF-2 codierende
Sequenz, gefolgt von einer XhoI-Schnittstelle, einen HA-Tag, der
im Leserahmen fusioniert ist und ein Translationsstoppcodon neben
dem HA-Tag. Das PCR-amplifizierte DNA-Fragment und der Vektor, pcDNA-3'HA, werden mit dem
BamHI- und XhoI-Restriktionsenzym gespalten
und ligiert, was zu pcDNA-3'HA-KGF-2
führt.
Das Ligierungsgemisch wird im E. coli-Stamm XL1-Blue (Stratagene
Cloning Systems, La Jolla, CA) transformiert. Die transformierte
Kultur wird auf Ampicillin-Mediumplatten plattiert und resistente
Kolonien werden ausgewählt.
Die Plasmid-DNA wurde aus Transformanten isoliert und durch PCR
und Restriktionsanlyse auf das Vorhandensein des richtigen Fragments
untersucht. Zur Expression des rekombinanten KGF-2 wurden COS-Zellen
mit dem Expressionsvektor mittels des DEAE-DEXTRAN-Verfahrens transfiziert
(Sambrook, J., et al., Molecular Cloning: A Laboratory Manual, Cold Spring
Harbor Laboratory Press (1989)). Die Expression des KGF-2-HA-Proteins
wurde durch Radiomarkierung und das Immunpräzipitationsverfahren nachgewiesen
(Harlow, E. & Lane,
D., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory
Press, (1988)). Die Zellen wurden 8 Stunden mit 35S-Cystein
zwei Tage nach der Infektion markiert. Die Kulturmedien wurden dann
gesammelt, und die Zellen wurden mit Detergenz (RIPA-Puffer (150
mM NaCl, 1% NP-40,
0,1% SDS, 1% NP-40, 0,5% DOC, 50 mM Tris, pH 7,5) lysiert (Wilson, I.,
et al., vorstehend 37: 767 (1984)). Sowohl das Zelllysat als auch
das Kulturmedium wurden mit HA-spezifischem monoclonalen Antikörper präzipitiert.
Die präzipitierten
Proteine wurden auf 15% SDS-PAGE-Gelen analysiert.
-
B: Expression und Reinigung
des menschlichen KGF-2-Proteins unter Verwendung des CHO-Expressionssystems
-
Der Vektor pC1 wird für die Expression
des KGF-2-Proteins verwendet. Das Plasmid pC1 ist ein Derivat des
Plasmids pSV2-dhfr [ATCC Hinterlegungsnr. 37146]. Beide Plasmide
enthalten das Maus-DHFR-Gen unter der Kontrolle des frühen Promotors
von SV40. Chinesische Hamster-Ovarienzellen oder andere Zellen, denen
Dihydrofolataktivität
fehlt, die mit diesen Plasmiden transfiziert werden, können ausgewählt werden,
indem die Zellen in einem Selektionsmedium (Alpha minus MEM, Life
Techologies), ergänzt
mit dem Chemotherapeutikum Methotrexat, gezüchtet werden. Die Amplifikation
der DHFR-Gene in Zellen, die gegenüber Methotrexat (MTX) resistent
sind, wurde gut dokumentiert (vgl. z. B. Alt, F. W., Kellems, R.
M., Bertino, J. R. und Schimke, R. T., 1978, J. Biol. Chem. 253:
1357–1370,
Hamlin, J. L. und Ma, C. 1990, Biochem. et Biophys. Acta, 1097:
107–143,
Page, M. J. und Sydenham, M. A. 1991, Biotechnology Bd. 9: 64–68). Die
Zellen, die in ansteigenden MTX-Konzentrationen gezüchtet werden,
entwickeln eine Resistenz gegenüber
dem Medikament, indem sie das Zielenzym DHFR als Folge der Amplifikation
des DHFR-Gen überproduzieren.
Wenn ein zweites Gen an das DHFR-Gen gebunden ist, wird es gewöhnlich gemeinsam
amplifiziert und überexprimiert. Es
ist Stand der Technik, Zelllinien zu entwickeln, die mehr als 1.000
Kopien der Gene tragen. Folglich enthalten die Zelllinien bei Methotrexatentzug
das amplifizierte, in das/die Chromosomen) integrierte Gen.
-
Plasmid pC1 enthält zur Expression des Gens
von Interesse einen starken Promotor der langen terminalen Wiederholungssequenzen
(LTR) des Rous-Sarkom-Virus (Cullen, et al., Molecular and Cellular
Biology, März,
1985: 438–4470)
plus ein Fragment, das aus dem Ver stärkerelement des unmittelbaren
frühen
Gens des menschlichen Cytomegalovirus (CMV) isoliert wurde (Boshart
et al., Cell 41: 521–530,
1985). Stromabwärts
des Promotors befinden sich die folgenden einzelnen Restriktionsenzymschnittstellen,
die die Integration der Gene zulassen: BamHI, PvuII und NruI. Hinter
diesen Clonierungsstellen enthält
das Plasmid in allen drei Leserahmen Translationsstoppcodons, gefolgt
von dem 3'-Intron
und der Polyadenylierungsstelle des Ratten-Präproinsulingens. Es können auch
andere effiziente Promotoren für
die Expression verwendet werden z. B. der menschliche β-Actin-Promotor,
die frühen
oder späten
Promotoren von SV40 oder die langen terminalen Wiederholungssequenzen
aus anderen Retroviren, z. B. HIV und HTLVI. Für die Polyadenylierung der
mRNA können
auch andere Signale, z. B. aus den menschlichen Wachstumshormon-
oder Globingenen verwendet werden.
-
Stabile Zelllinien, die ein Gen von
Interesse in das Chromosom integriert haben, können auch bei der gemeinsamen
Transfektion mit einem Selektionsmarker wie gpt, G418 oder Hygromycin
ausgewählt
werden. Es ist von Vorteil, zuerst mehr als einem Selektionsmarker
z. B. G418 plus Methotrexat zu verwenden.
-
Das Plasmid pC1 wird mit dem Restriktionsenzym
BamHI gespalten und dann unter Verwendung von Kälberdarm Phosphatase mit aus
dem Fachgebiet bekannten Verfahren dephosphoryliert. Der Vektor
wird dann aus einem 1%-igen Agarosegel isoliert.
-
Die DNA-Sequenz, die KGF-2, ATCC
Nr. 75977, codiert, wird unter Verwendung von PCR-Oligonucleotidprimern
amplifiziert, die den 5'-
und 3'-Sequenzen
des Gens entsprechen.
-
Der 5'-Oligonucleotidprimer besitzt die Sequenz 5'TAACGAGGATCCGCCATCATGTGGAAATGGATACTACAC3' (SEQ ID Nr. 9),
die die unterstrichene BamHI-Schnittstelle enthält, gefolgt von 21 Basen von
KGF-2-Sequenz von 1 (SEQ
ID NR: 1). Das 5'-Ende des
amplifizierten Fragments, das das menschliche KGF-2 codiert, stellt,
eingebaut in einen Expressionsvektor, wie vorstehend beschrieben,
ein effizientes Signalpeptid bereit. Ein effizientes Signal zur
Initiation der Translation in eukaryontischen Zellen, wie bei Kozak,
M., J. Mol. Biol., 196: 947–950
(1987) beschrieben, ist geeignet im Vektoranteil des Konstrukts
lokalisiert.
-
Der 3'-Primer besitzt die Sequenz 5'TAAGCAGGATCCTGAGTGTACCACCATTGGAAGAAATG3' (SEQ ID Nr. 10),
die die BamHI-Schnittstelle enthält,
gefolgt von Nucleotiden, die zu den letzten 26 Nucleotiden der in 1 (SEQ ID NR: 1) dargestellten KGF-2-codierenden
Sequenz komplementär
sind, wobei das Stoppcodon nicht eingeschlossen ist.
-
Die amplifizierten Fragmente werden
aus einem 1%-igen Agarosegel, wie vorstehend beschrieben, isoliert
und dann mit der Endonuclease BamHI gespalten und dann wiederum
auf einem 1%-igen Agarosegel gereinigt.
-
Das isolierte Fragment und der dephosphorylierte
Vektor werden dann mit T4-DNA-Ligase
ligiert. E. coli-HB101-Zellen werden dann transformiert und die
Bakterien identifiziert, die das Plasmid pC1 enthielten. Die Sequenz
und Orientierung des eingebauten Gens wird durch DNA-Sequenzierung
bestätigt.
-
Transfektion
von CHO-DHFR-Zellen
-
Chinesische Hamster-Ovarienzellen,
denen ein aktives DHFR-Enzym fehlt, werden zur Transfektion verwendet.
5 μg des
Expressionsplasmids C1 werden zusammen mit 0,5 μg Plasmid pSVneo unter Verwendung
des Lipofektionsverfahrens (Felgner et al., vorstehend) transfiziert.
Das Plasmid pSVneo enthält
einen dominanten Selektionsmarker, das Gen neo von Tn5, das ein
Enzym codiert, das die Resistenz gegenüber einer Antibiotikagruppe
einschließlich
G418 verleiht. Die Zellen werden in mit 1 mg/ml G418 ergänztem Alpha-minus-MEM angesetzt. Nach
2 Tagen werden die Zellen mit Trypsin versetzt und auf Hybridom-Clonierungsplatten
(Greiner, Deutschland) angesetzt und 10–14 Tage gezüchtet. Nach
diesem Zeitraum werden Einzelclone mit Trypsin versetzt und unter
Verwendung von verschiedenen Methotrexatkonzentrationen (25 nM, 50
nM, 100 nM, 200 nM, 400 nM) in Petrischalen mit 6 Vertiefungen angesetzt.
Die Clone, die bei den höchsten Methotrexatkonzentrationen
wachsen, werden dann in neue Schalen mit 6 Vertiefungen überführt, die
noch höhere
Methotrexatkonzentrationen (500 nM, 1 μM, 2 μM, 5 μM) enthalten. Dasselbe Verfahren
wird wiederholt, bis die Clone bei einer Konzentration von 100 μM wachsen.
-
Die Expression des gewünschten
Genprodukts wird durch Western-Blot-Analyse und SDS-PAGE analysiert.
-
Beispiel 5
-
Transkription und Translation
von rekombinantem KGF-2 in vitro
-
Ein PCR-Produkt stammt von der clonierten
cDNA in dem pA2-Vektor ab, der für
die Expression der Insektenzellen von KGF-2 verwendet wurde.
-
Die für diese PCR verwendeten Primer
waren: 5'ATTAACCCTCACTAAAGGGAGGCCATGTGGAAATGGATACTGACACATTGTGTGCC3' (SEQ ID Nr. 11) und
5'CCCAAGCTTCCACAAACGTTGCCTTCCTCTATGAG3'(SEQ ID Nr. 12).
-
Der erste Primer enthält die Sequenz
eines T3-Promotors 5' zum
ATG-Initiationscodon. Der zweite Primer ist zum 3'-Ende des offenen
Leserahmens von KGF-2 komplementär
und codiert das reverse Komplement eines Stoppcodons.
-
Das sich ergebende PCR-Produkt wird
unter Verwendung eines im Handel erhältlichen Kits von Qiagen gereinigt.
0,5 μg dieser
DNA wird als Matrize für
eine in-vitro-Transkriptions-Translationreaktion
verwendet. Die Reaktion wird mit einem im Handel erhältlichen
Kit von Promega unter dem Namen TNT durchgeführt. Der Test wird wie bei
der Anleitung für
den Kit unter Verwendung von radioaktiv markiertem Methionin als
Substrat durchgeführt,
ausgenommen, dass nur die Hälfte
der angegebenen Volumina der Reagenzien verwendet werden und dass
man die Reaktion bei 33°C
1,5 Stunden weiterlaufen lässt.
-
5 μl
der Reaktion werden elektrophoretisch auf einem denaturierenden
10 bis 15%-igen Polyacrylamidgel getrennt. Das Gel wird 30 Minuten
in einem Gemisch von Wasser : Methanol : Essigsäure bei jeweils 6 : 3 : 1 Volumina
fixiert. Das Gel wird dann unter Hitze und Vakuum getrocknet und
dann 16 Stunden auf einem Röntgenfilm
exponiert. Der Film wird entwickelt, wobei er das Vorhandensein
einer radioaktiven Proteinbande zeigt, die der Größe des konzeptionell
translatierten KGF-2 entspricht, was sehr nahe legt, dass die clonierte cDNA
für KGF-2
einen offenen Leserahmen enthält,
der ein Protein der erwarteten Größe codiert.
-
Beispiel 6
-
Expression über Gentherapie
-
Von einem Probanden werden durch
Hautbiopsie Fibroblasten erhalten. Das sich ergebende Gewebe wird
in ein Gewebekulturmedium gegeben und in kleine Teile geteilt. Kleine
Gewebestücke
werden auf eine feuchte Oberfläche
eines Gewebekulturkolbens gegeben, etwa zehn Stücke in jeden Kolben. Der Kolben
wird umgedreht, fest verschlossen und bei Raumtemperatur über Nacht
stehen gelassen. Nach 24 Stunden bei Raumtemperatur wird der Kolben
umgedreht und die Gewebestücke
bleiben am Kolbenboden kleben und frisches Medium (z. B. Ham-F12-Medium
mit 10% FBS, Penicillin und Streptomycin) wird zugegeben. Dies wird dann
etwa eine Woche bei 37°C
inkubiert. Zu diesem Zeitpunkt wird frisches Medium zugegeben und
dann alle paar Tage gewechselt. Nach zwei zusätzlichen Wochen in Kultur ergibt
sich eine Fibroblasten-Einzelschicht. Die Einzelschicht wird mit
Trypsin versetzt und in größere Kolben
abgemessen.
-
pMV-7 (Kirschmeier, P. T. et al.,
DNA, 7: 219–25
(1988)), flankiert von den langen terminalen Wiederholungssequenzen
des Moloney-Maus-Sarkom-Virus, wird mit EcoRI und HindIII gespalten
und anschließend mit
Kälberdarm-Phosphatase
behandelt. Der lineare Vektor wird auf Agarosegel fraktioniert und
unter Verwendung von Glassperlen gereinigt.
-
Die cDNA, die ein Polypeptid der
vorliegenden Erfindung codiert, wird unter Verwendung von PCR-Primern
amplifiziert, die den 5'-
bzw. 3'-Sequenzenden
entsprechen. Der 5'-Primer enthält eine
EcoRI-Schnittstelle, und der 3'-Primer
schließt
ferner eine HindIII-Schnittstelle
ein. Gleiche Mengen des linearen Rückgrads des Moloney-Maus-Sarkom-Virus
und das amplifizierte EcoRI- und HindIII-Fragmente werden in Gegenwart
von T4-DNA-Ligase zusammengegeben. Das sich ergebende Gemisch wird
unter Bedingungen gehalten, die für die Ligierung der beiden
Fragmente geeignet sind. Das Ligierungsgemisch wird verwendet, um
die Bakterien HB101 zu transformieren, die dann auf Agar-enthaltendes
Kanamycin zum Zweck der Bestätigung,
dass das Gen von Interesse richtig eingebaut wurde, ausplattiert.
-
Die amphotropischen pA317- oder GP
+ am12-Verpackungszellen werden in Zellkultur bis zur konfluenten
Dichte in Dulbecco's
modifiziertem Eagles-Medium (DMEM) mit 10% Kälberserum (CS), Penicillin
und Streptomycin gezüchtet.
Der MSV-Vektor, der das Gen enthält,
wird dann den Medien zugegeben und die Verpackungszellen werden
mit dem Vektor transduziert. Die Verpackungszellen produzieren jetzt
infektiöse
Viruspartikel, die das Gen enthalten (die Verpackungszellen werden
nun als Produzentenzellen bezeichnet).
-
Den Produzentenzellen wird frisches
Medium zugegeben und anschließend
wird das Medium von einer 10 cm-Platte mit konfluenten Produzentenzellen
geerntet. Das verbrauchte Medium, das die infektiösen Viruspartikel
enthält,
wird durch einen Millipore-Filter filtriert, um zerstörte Produzentenzellen
zu entfernen, und dieses Medium wird dann verwendet, um Fibroblastenzellen
zu infizieren. Das Medium wird von einer subkonfluenten Fibroblastenplatte
entfernt und schnell mit dem Medium aus den Produzentenzellen ersetzt.
Dieses Medium wird entfernt und mit frischem Medium ersetzt. Wenn
der Virustiter hoch ist, dann sind tatsächlich alle Fibroblasten infiziert
und es ist keine Selektion erforderlich. Wenn der Titer sehr niedrig
ist, dann ist es notwendig, einen retroviralen Vektor zu verwenden,
der einen Selektionsmarker wie neo oder his besitzt.
-
Die gentechnisch hergestellten Fibroblasten
werden dann entweder allein oder nachdem sie bis zur Konfluenz auf
Cytodex-3-Mikroträgerkügelchen
gezüchtet
wurden, in den Wirt injiziert. Die Fibroblasten produzieren nun
das Proteinprodukt.
-
Beispiel 7
-
KGF-2 stimulierte Wundheilung
im diabetischen Mausmodell
-
Um zu zeigen, dass der Keratinocyten-Wachstumfaktor-2
(KGF-2) auch den Heilungsprozess beschleunigen würde, wurde das Wundheilungsmodell
der genetisch diabetischen Maus verwendet. Das Vollhaut-Wundheilungsmodell
in der db+/db+-Maus ist ein gut charakterisiertes, klinisch relevantes
und reproduzierbares Modell der gehemmten Wundheilung. Die Heilung
der diabetischen Wunde hängt
von der Erzeugung von Granulationsgewebe und der Reepthelialisierung
und nicht so sehr von der Kontraktion ab (Gartner, M. H. et al.,
J. Surg. Res. 52: 389(1992); Greenhalgh D. G. et al., Am. J. Pathol.:
136: 1235 (1990)).
-
Die diabetischen Tiere besitzen viele
der charakteristischen Merkmale, die bei Diabetes mellitus Typ II
beobachtet werden. Homozygote (db+/db+)-Mäuse sind im Vergleich zu ihren
normalen, heterozygoten (db+/+m)-Wurfgeschwister adipösen. Diabetische
(db+/db+)-Mausmutanten besitzen eine einzelne autosomale rezessive
Mutation auf Chromosom 4 (db+). (Coleman et al., Proc. Natl. Acad.
Sci USA 77: 283–293
(1982)). Die Tiere zeigen Polyphagie, Polydipsie und Polyurie. Diabetische
(db+/db+)-Mausmutanten besitzen einen erhöhten Blutzucker, erhöhte oder
normale Insulinspiegel und eine unterdrückte zellvermittelte Immunität (Mandel
et al., J. Immunol. 120: 1375 (1978); Debray-Sachs, M. et al., Clin.
Exp. Immunol. 51 (1): 1–7
(1983); Leitner et al., Am. J. of Pathol. 114: 46–55 (1985)).
Bei diesen Tieren wurden periphere Neuropathie, Myocardkomplikationen
und mikrovaskuläre
Läsionen,
Verdickung der Basalmembran und glomeruläre Filtrationsabnormalitäten beschrieben
(Norido, F. et al., Exp. Neurol. 83(2): 221–232 (1984); Robertson et al.,
Diabetes 29(1): 60–67
(1980); Giacomelli et al., Lab Invest. 40(4): 460–473 (1979);
Coleman, D. L., Diabetes 31 (Suppl): 1–6 (1982)). Diese homozygoten
diabetischen Mäuse
entwickeln analog zum menschlichen Diabetes Typ II gegenüber Insulin
resistente Hyperglykämie
(Mandel et al., J. Immunol. 120: 1375–1377 (1978)).
-
Die bei diesen Tieren beobachteten
Merkmale legen nahe, dass die bei diesem Modell beobachtete Heilung
der Heilung beim menschlichen Diabetes ähneln kann (Greenhalgh, et
al., Am. J. of Pathol. 136: 1235–1246 (1990)). Die Ergebnisse
dieser Studie zeigten, dass KGF-2
eine starke stimulatorische Wirkung auf die Heilung von Vollhautwunden
bei diabetischen und nicht diabetischen heterozygoten Wurfgeschwistern
besitzt. Es wurden deutliche Wirkungen auf die Reepithelialisierung
und auf einen Anstieg bei den Collagenfibrillen, dem Granulationsgewebe
innerhalb der Dermis bei KGF-2 behandelten Tieren beobachtet. Die
exogene Anwendung von Wachstumsfaktoren kann die Bildung von Granulationsgewebe
durch Ziehen von inflammatorischen Zellen in die Wunde beschleunigen.
-
Tiere
-
In dieser Studie wurden genetisch
diabetische weibliche C57BL/KsJ (db+/db+)-Mäuse und ihre nicht diabetischen
(db+/+m) heterozygoten Wurfgeschwister verwendet (Jackson Laboratories).
Die Tiere wurden im Alter von 6 Wochen gekauft und waren zu Beginn
der Studie 8 Wochen alt. Die Tiere wurden einzeln gehalten und erhielten
Futter und Wasser ad libitum. Alle Manipulationen erfolgten unter
Verwendung aseptischer Verfahren. Die Experimente wurden nach den
Vorschriften und Richtlinien von Human Genome Sciences, Inc. Institutional
Animal Care and Use Committee und den Richtlinien für die Sorgfalt
und Verwendung von Labortieren durchgeführt.
-
KGF-2
-
Der für die Wundheilungsstudien verwendete
rekombinante menschliche KGF-2 wurde überexprimiert und aus pQE60-Cys37,
einem E. coli-Expressionsvektorsystem (pQE-9, Qiagen) gereinigt.
Das aus diesem Konstrukt exprimierte Protein ist das KGF-2 aus Cystein
an Position 37 bis Serin an Position 208 mit einem 6X(His)-Tag,
der an den N-Terminus des Proteins (SEQ ID NR: 29–30) (15) gebunden ist. Fraktionen,
die mehr als 95% reines rekombinantes Material enthielten, wurden
für das
Experiment verwendet. Der Keratinocyten-Wachstumsfaktor-2 wurde in einem Vehikel
formuliert, das 100 mM Tris, 8,0 und 600 mM NaCl enthielt. Die Endkonzentrationen
betrugen 80 μg/ml
und 8 μg/ml
Stammlösung.
Die Verdünnungen
wurden aus der Stammlösung
unter Verwendung desselben Vehikels durchgeführt.
-
Durch chirurgischen Eingriff
erzeugte Verletzung
-
Die Vorschrift zur Erzeugung von
Verletzungen erfolgte nach früher
berichteten Verfahren (Tsuboi., R. und Rifkin, D. B., J. Exp. Med.
172: 245–251
(1990)). Kurz gesagt, wurden die Tiere am Tag der Verletzung mit einer
intraperitonealen Avertininjektion (0,01 mg/ml), 2,2,2-Tribromethanol und
2-Methyl-2-butanol, aufgelöst in
deionisiertem Wasser, betäubt.
Der Rückenbereich
des Tieres wurde rasiert und die Haut mit 70%-iger Ethanollösung und
Jod gewaschen. Die chirurgische Eingriffsfläche wurde vor der Verletzung
mit steriler Gaze getrocknet. Dann wurde eine 8 mm-Vollhautwunde
unter Verwendung einer Keyes-Gewebestanze erzeugt. Unmittelbar nach
der Verletzung wurde die umgebende Haut sanft gestreckt, damit keine
Wundexpansion erfolgt. Die Wunden wurden für die Dauer des Experiments
offengelassen. Die Anwendung der Behandlung erfolgte 5 aufeinanderfolgende
Tage topisch, beginnend am Tag der Verletzung. Vor der Behandlung
wurden die Wunden sanft mit steriler Salzlösung und Gazeschwämmen gereinigt.
-
Die Wunden wurden visuell untersucht
und in einem festen Abstand am Tag des chirurgischen Eingriffs und
danach in zwei Tagesintervallen photographiert. Der Wundverschluss
wurde durch tägliche
Messung an den Tagen 1–5
und an Tag 8 bestimmt. Die Wunden wurden horizontal und vertikal
unter Verwendung eines Jameson-Tastzirkels gemessen. Die Wunden
wurden als verheilt betrachtet, wenn das Granulationsgewebe nicht
länger
sichtbar war und die Wunde von einem kontinuierlichem Epithel bedeckt
war.
-
KGF-2 wurde unter Verwendung von
zwei unterschiedlichen KGF-2-Dosen verabreicht, eine 8 Tage bei
4 μg pro
Wunde pro Tag und die zweite 8 Tage bei 40 μg pro Wunde pro Tag in 50 μl Vehikel.
Die Vehikel-Kontrollgruppen erhielten 50 μl Vehikellösung.
-
Die Tiere wurden an Tag 8 mit einer
intraperitonealen Natriumpentobarbitalinjektion (300 mg/kg) getötet. Die
Wunden und die umgebende Haut wurden für die Histologie und die Immunhistochemie
geerntet. Gewebeproben wurden zur weiteren Verarbeitung in 10% neutral
gepuffertem Formalin in Gewebecassetten zwischen Biopsieschwämmchen gegeben.
-
Versuchskonzept
-
Drei Gruppen von jeweils 10 Tieren
(5 diabetische und 5 nicht diabetische Kontrollen) wurden ausgewertet:
1) Vehikel-Placobokontrolle, 2) KGF-2 4 μg/Tag und 3) KGF-2 40 μg/Tag. Diese
Studie wurde wie folgt konzipiert:
-
-
Messung der Wundfläche und
des Wundverschlusses
-
Der Wundverschluss wurde analysiert,
indem der Bereich in der vertikalen und horizontalen Achse gemessen
wurde und die Gesamtquadratfläche
der Wunde erhalten wurde. Die Kontraktion wurde dann geschätzt, indem
die Unterschiede zwischen der Anfangswundfläche (Tag 0) und derjenigen
nach der Behandlung (Tag 8) ermittelt wurden. Die Wundfläche an Tag
1 betrug 64 mm2 – die entsprechende Größe der Hautstanze.
Die Berechnungen wurden unter Verwendung der folgenden Formel durchgeführt:
[Offene
Fläche
an Tag 8]–[Offene
Fläche
an Tag 1]/[Offene Fläche
an Tag 1].
-
Histologie
-
Proben wurden in 10% gepuffertem
Formalin fixiert und in Parffin eingebettete Blocks wurden senkrecht
zur Wundoberfläche
(5 μm) in
Abschnitte unterteilt und unter Verwendung eines Reichert-Jung Mikrotoms geschnitten.
Die Routine-Hämatoxylin-Eosin
(H & E)-Färbung erfolgte
auf Querschnitten zweigeteilter Wunden. Die histologische Untersuchung
der Wunden wurde verwendet, um zu beurteilen, ob der Heilungsprozess und
das morphologische Erscheinungsbild der reparierten Haut durch Behandlung
mit KGF-2 geändert
wurde. Diese Beurteilung schloss die Bestätigung des Vorhandenseins von
Zellakkumulierung, inflammatorischer Zellen, Kapillaren, Fibroblasten,
Reepithelialisierung und die Epidermisreife ein (Greenhalgh, D.
G. et al., Am. J. Pathol. 136: 1235 (1990)) (Tabelle 1). Ein kalibriertes
Linsenmikrometer wurde von einem blinden Beobachter verwendet.
-
Immunhistochemie
-
Reepithelialisierung
-
Gewebeabschnitte wurde immunhistochemisch
mit einem polyclonalen anti-humanen Kaninchen-Keratinantikörper unter
Verwendung eines ABC-Elite-Nachweissystems gefärbt. Die menschliche Haut wurde
als positive Gewebekontrolle verwendet, während nicht-immunes IgG als
Negativkontrolle verwendet wurde. Das Keratinocytenwachstum wurde
durch Beurteilung des Reepithelialisierungsausmaßes der Wunde unter Verwendung
eines kalibrierten Linsenmikrometers beurteilt.
-
Zellproliferationsmarker
-
Das proliferierende Zellkernantigen/Cyclin
(PCNA) in Hautproben wurde unter Verwendung des anti-PCNA-Antikörpers (1
: 50) mit einem ABC-Elite-Nachweissystem gezeigt. Dickdarmkrebs
des Menschen diente als positive Gewebekontrolle und menschliches
Gehirngewebe wurde als negative Gewebekontrolle verwendet. Jede
Probe schloss einen Abschnitt ein, wobei der primären Antikörper weggelassen
wurde und durch nicht immunen Maus-IgG ersetzt wurde. Die Bewertung
dieser Abschnitte basierte auf dem Proliferationsausmaß auf einer
Skala von 0–8,
wobei der untere Bereich der Skala geringe Proliferation und der
obere Bereich starke Proliferation wiederspiegelte.
-
Statistische Analyse
-
Die experimentelle Daten wurden unter
Verwendung eines ungepaarten t-Tests analysiert. Ein p-Wert von < 0,05 wurde als
signifikant betrachtet. Die Daten wurden als Mittelwert +/– SEM ausgedrückt.
-
Ergebnisse
-
Wirkung von KGF-2 auf
den Wundverschluss
-
Diabetische Mäuse zeigten im Vergleich zu
heterozygoten normalen Mäusen
eine beeinträchtigte
Heilung. Die Dosis von 4 μg
KGF-2 pro Stelle schien die maximale Reaktion bei diabetischen und
nicht-diabetischen Tieren zu erzeugen (5, 6).
Diese Ergebnisse waren im Vergleich zu den Puffer-Kontrollgruppen
statistisch signifikant (p = 0,002 und p < 0,0001). Die Behandlung mit KGF-2
führte
zu einem endgültigen
durchschnittlichen Wundverschluss von 60,6% in der Gruppe, die 4 μg/Tag erhielt
und 34,5% in der 40 μg/Tag-Gruppe.
Die Wunden in der Puffer-Kontrollgruppe wiesen nur 3,8% Wundverschluss
an Tag 8 auf. Wiederholte Messungen der Wunden an den Tagen 2–5 nach
der Verletzung und an Tag 8, die an den db+/db+-Mäusen durchgeführt wurden,
die mit KGF-2 behandelt wurden, zeigten eine signifikante Verbesserung
in der Gesamtwundfläche
(mm2) an Tag 3 nach der Verletzung im Vergleich
zur Puffer-Kontrollgruppe. Diese Verbesserung hielt an und am Ende
des Experiments wurden statistisch signifikante Ergebnisse beobachtet
(7). Tiere in den db/+m-Gruppen,
die KGF-2 erhielten, zeigten ebenfalls eine höhere Reduzierung der Wundfläche im Vergleich zu
den Puffer-Kontrollgruppen bei wiederholten Messungen (8). Diese Ergebnisse bestätigten eine
höhere
Wundverschlussrate bei den KGF-2 behandelten Tieren.
-
Auswirkung von KGF-2 auf
die histologische Bewertung
-
Die histopathologische Bewertung
von KGF-2 im diabetischen (db+/db+)-Modell an Tag 8 zeigte eine statistisch
signifikante Verbesserung (p < 0,0001)
bei der Bewertung der Wunde im Vergleich zur Pufferkontrolle. Die
pharmakologischen Effekte, die sowohl bei den 4 μg- als auch den 40 μg-Dosen von
KGF-2 beobachtet wurden, unterschieden sich nicht signifikant voneinander.
Die Pufferkontrollgruppe zeigte eine minimale Zellakkumulation ohne
Granulationsgewebe oder Epithelmigration während die 4 μg- und 40 μg-Dosen von KGF-2
(p < 0,0001 bzw.
p = 0,06) eine Epithelbedeckung der Wunde, Granulationsgewebebildung
und Fibroblasten und Collagenablagerung zeigten (9).
-
Die histopathologische Beurteilung
der Hautwunden erfolgte auf Hämatoxylin-Eosingefärbten Proben. Die
Punktebewertungskriterien schlossen eine Skala von 1–12 ein,
wobei eine Punktebewertung von eins die minimale Zellakkumulation
mit wenig bis keiner Granulation repräsentierte und eine Punktebewertung
von 12 das übermäßige Vorhandensein
von Fibroblasten, Collagenablagerung und neues Epithel, das die
Wunden bedeckte, repräsentierte
(Tabelle 1).
-
-
Die Beurteilung der nicht diabetischen
Wurfgeschwister nach beiden KGF-2-Dosen zeigte für alle ausgewerteten Messungen
keine signifikante Aktivität
im Vergleich zur Puffer-Kontrollgruppe
(10). Die Puffer-Kontrollgruppe
zeigte unreifes Granulationsgewebe, inflammatorische Zellen und
Kapillaren. Die mittlere Punktebewertung war höher als bei der diabetischen
Gruppe, was die beeinträchtigte
Wundheilung bei den diabetischen (db+/db+)-Mäusen
zeigte.
-
Auswirkung von KGF-2 auf
die Reepithelialisierung
-
Die Cytokeratin-Immunfärbung wurde
verwendet, um das Ausmaß der
Reepithelialisierung zu bestimmen. Die Punkteverteilung erfolgte
basierend auf dem Grad des Wundverschlusses auf einer Skala von
0 (kein Wundverschluss) bis 8 (vollständiger Wundverschluss). Bei
den Gruppen, die 4 μg/Tag
erhielten, gab es im Vergleich zur Puffer-Kontrollgruppe eine statistisch
signifikante Verbesserung p < 0,0001
(11). In dieser Gruppe
wurden Keratinocyten beobachtet, die sich in der neu gebildeten
Epidermis lokalisierten, die die Wunde bedeckte. Beide KGF-2-Dosen
zeigten auch in verschiedenen Stadien mitotische Figuren. Die Beurteilung der
nicht diabetischen Gruppen bei beiden Dosen von KGF-2 verbesserte
auch signifikant die Beurteilung der Reepithelialisierung (p = 0,006
bzw. 0,01) (12).
-
Auswirkung von KGF-2 auf
die Zellproliferation
-
Die proliferierende Zellkern-Antigen-Färbung zeigte
sowohl bei den 4 μg-
als auch bei den 40 μg-Gruppen
eine signifikante Proliferation (13).
Die nicht diabetische Gruppe zeigte ähnliche Ergebnisse, da beide Gruppen,
die beide Dosen von KGF-2 erhielten, eine höhere signifikante Punktezahl
im Vergleich zur Puffer-Kontrollgruppe zeigten (14). Die Epidermisproliferation wurde
insbesondere auf der Basalschicht der Epidermis beobachtet. Zusätzlich wurden
dicht gepackte PCNA-markierte Zellen in der Dermis, insbesondere in
den Haarfollikeln, beobachtet.
-
Schlussfolgerung
-
Die Ergebnisse zeigen, dass KGF-2
das Wachstum der primären
epidermalen Keratinocyten spezifisch stimuliert. Zusätzlich zeigen
diese Experimente, dass topisch angewendetes rekombinantes menschliches
KGF-2 die Heilungsrate von Vollhautschnittwunden bei diabetischen
Mäusen
merklich beschleunigt. Die histologische Beurteilung zeigt, dass
KGF-2 die Keratinocytenproliferation mit der Epidermisverdickung
induziert. Diese Proliferation ist in der Basalschicht der Epidermis
lokalisiert, wie durch das proliferierende Zellkern-Antigen (PCNA)
gezeigt wird. Auf Dermisebene bauten die Collagenablagerungen, die
Fibroblastenproliferation und die Neovaskularisation die normale
Architektur der Haut wieder auf.
-
Die hohe Dichte der PCNA-markierten
Zellen bei KGF2-behandelten Tieren im Gegensatz zur Puffer-Kontrollgruppe,
die weniger PCNA-markierte Zellen besaß, zeigt die Stimula tion der
Keratinocyten auf der dermal-epidermalen Ebene, Fibroblasten und
Haarfollikel. In diesem Experiment wurde Verbesserung des Heilungsprozesses
durch KGF-2 stetig beobachtet. Dieser Effekt war bei den ausgewerteten
Parametern (prozentuale Reepithelialisierung und Wundverschluss)
statistisch signifikant. Die PCNA-markierten Keratinocyten wurden
im wesentlichen hauptsächlich
an der unteren Basalebene der Epidermis beobachtet. Die Dermis zeigte
normalisiertes Gewebe mit Fibroblasten, Collagen und Granulationsgewebe.
-
Die bei den nicht diabetischen Tieren
beobachtete Aktivität
zeigt, basierend auf täglichen
Messungen, dass KGF-2 eine signifikante pharmakologische Reaktion
beim prozentualen Wundverschluss an Tag 8 sowie während des
Experimentverlaufs aufwies. Obwohl die histopathologische Beurteilung
sich nicht wesentlich im Vergleich zur Pufferkontrolle unterschied
zeigten das Keratinocytenwachstum und die PCNA-Punktebewertung signifikante
Effekte.
-
Zusammenfassend zeigen diese Ergebnisse,
dass KGF-2 eine signifikante Aktivität sowohl bei den gehemmten
als auch den normalen Schnittwundenmodellen bei Verwendung des db+/db+-Mausmodells
zeigt und deshalb bei der Behandlung von Wunden einschließlich Operationswunden,
diabetischen Geschwüren, Venenstaugeschwüren, Verbrennungen
und anderen Hauterkrankungen nützlich
sein kann.
-
Experiment 8
-
KGF-2-vermittelte Wundheilung
im steroidgehemmten Rattenmodell
-
Die Hemmung der Wundheilung durch
Steroide wurde gut in verschiedenen in vitro- und in vivo-Systemen gezeigt. (Wahl,
S. M. Glucocorticoids and Wound healing. In Anti-Inflammatory Steroid
Action: Basic and Clinical Aspects. 280–302 (1989); Wahl, S. M. et
al., J. Immunol 115: 476–481
(1975); Werb, Z. et al., J. Exp. Med. 147: 1684–1694 (1978)). Glucocorticoide
verzögern
die Wundheilung durch Hemmung der Angiogenese, wobei die Gefäßpermeabilität (Ebert,
R. H., et al., An. Intern. Med. 37: 701–705 (1952)), die Fibroblastenproliferation
und die Collagensynthese herabgesetzt wird (Beck, L. S. et al.,
Growth Factors. 5: 295–304 (1991);
Haynes, B. F., et al., J. Clin. Invest. 61: 703–797 (1978)) und eine vorübergehende
Reduzierung der zirkulierenden Monocyten erzeugt wird (Haynes, B.
F., et al., J. Clin. Invest. 61: 703–797 (1978); Wahl, S. M. Glucocorticoids
and wound healing. In Anti-inflammatory Steroid Action: Basic and
Clinical Aspects. Academic Press. New York. S. 280–302 (1989)).
Die systemische Verabreichung von Steroiden bei beeinträchtigter Wundheilung
ist ein gut etabliertes Phänomen
bei Ratten (Beck, L. S. et al., Growth Factors 5: 295304 (1991); Haynes,
B. F., et al., J. Clin. Invest. 61: 703–797 (1978); Wahl, S. M. Glucocorticoids
and Wound healing. In Anti-Inflammatory Steroid Action: Basic and
Clinical Aspects. Academic Press. New York. S. 280–302 (1989); Pierce,
G. F., et al., Proc. Natl. Acad. Sci. USA. 86: 2229–2233 (1989)).
-
Um zu zeigen, dass KGF-2 den Heilungsprozess
beschleunigen würde,
wurden die Wirkungen von multiplen topischen Anwendungen von KGF-2
bei Vollhautschnittwunden bei Ratten beurteilt, bei denen die Heilung
durch die systemische Anwendung von Methyprednisolon gehemmt ist.
In-vitro-Studien zeigten, dass KGF-2 das Wachstum der primären epidermalen
Keratinocyten spezifisch stimuliert. Dieses Beispiel zeigt, dass
das topisch angewandte rekombinante menschliche KGF-2 die Heilungsrate
von Vollhautschnittwunden bei Ratten beschleunigt, indem die Wundlücke mit
einem kalibrierten Jameson-Tastzirkel und durch Histomorphometrie
und Immunhistochemie gemessen wird. Die histologische Beurteilung
zeigt, dass KGF-2 die Reepithelialisierung und folglich die Wundreparatur
beschleunigt.
-
Tiere
-
In diesem Beispiel wurden junge ausgewachsene
Sprague-Dawley-Ratten mit einem Gewicht von 250–300 g (Charles River Laboratories)
verwendet. Die Tiere wurden im Alter von 8 Wochen gekauft und waren
zu Beginn der Studie 9 Wochen alt. Die Heilungsreaktion der Ratten
wurde durch die systemische Verabreichung von Methylprednisolon
(17 mg/kg/Ratte intramuskulär)
zum Zeitpunkt der Verletzung gehemmt. Die Tiere wurden einzeln gehalten
und erhielten Futter und Wasser ad libitum. Alle Manipulationen
erfolgten unter Verwendung aseptischer Verfahren. Diese Studie wurde
nach den Vorschriften und Richtlinien von Human Genome Sciences,
Inc. Institutional Animal Care und Use Committee und den Richtlinien
für die
Sorgfalt und Verwendung von Labortieren durchgeführt.
-
KGF-2
-
Rekombinantes menschliches KGF-2
wurde überexprimiert
und aus pQE60-Cys37, einem E. coli-Expressionsvektorsystem (pQE-9,
Qiagen), gereinigt. Das aus diesem Konstrukt exprimierte Protein
ist das KGF-2 von Cystein an Position 37 bis Serin an Position 208
mit einem 6X(His)-Tag, der an den N-Terminus des Proteins (SEQ ID
NR: 29–30)
(15) gebunden ist.
Für das
Experiment wurden Fraktionen verwendet, die mehr als 95% reines
rekombinantes Material enthielten. KGF-2 wurde in einem Vehikel
formuliert, das 1X PBS enthielt. Die Endkonzentrationen betrugen
20 μg/ml
und 80 μg/ml
Stammlösung.
Die Verdünnungen
wurden aus der Stammlösung
unter Verwendung desselben Vehikels hergestellt.
-
KGF-2Δ28 wurde überexprimiert und aus einem
E. coli-Expressionsvektorsystem gereinigt. Für das Experiment wurden Fraktionen
verwendet, die mehr als 95% reines rekombinantes Material enthielten.
KGF-2 wurde in einem Vehikel formuliert, das 1X PBS enthielt. Die
Endkonzentrationen betrugen 20 μg/ml
und 80 μg/ml
Stammlösung.
Die Verdünnungen
wurden aus der Stammlösung
unter Verwendung desselben Vehikels hergestellt.
-
Durch chirurgischen Eingriff
erzeugte Verletzung
-
Die Vorschrift zur Erzeugung von
Verletzungen wurde nach dem vorstehenden Beispiel 7 befolgt. Am Tag
der Verletzung die Tiere mit einer intramuskulären Ketamininjektion (50 mg/kg)
und Xylazin (5 mg/kg) betäubt.
Der Rückenbereich
des Tieres wurde rasiert und die Haut mit 70%-iger Ethanol- und
Jodlösung
gewaschen. Die chirurgische Eingriffsfläche wurde mit steriler Gaze
vor der Verletzung getrocknet. Dann wurde unter Verwendung einer
Keyes-Gewebestanze eine 8 mm Vollhautwunde erzeugt. Die Wunden wurden
für die Dauer
des Experiments offengelassen. Die Anwendung der Testmaterialen
erfolgte einmal am Tag topisch an 7 aufeinanderfolgenden Tagen,
beginnend am Tag der Verletzung und nach der Verabreichung von Methypredniloson.
Vor der Behandlung wurden die Wunden sanft mit steriler Salzlösung und
Gazeschwämmen
gereinigt.
-
Die Wunden wurden visuell untersucht
und in einem konstanten Abstand am Tag der Verletzung und am Ende
der Behandlung photographiert. Der Wundverschluss wurde durch tägliche Messung
an den Tagen 1–5
und an Tag 8 bestimmt. Die Wunden wurden horizontal und vertikal
unter Verwendung eines Jameson-Tastzirkels gemessen. Die Wunden
wurden als verheilt betrachtet, wenn das Granulationsgewebe nicht länger sichtbar
war und die Wunde von einem kontinuierlichen Epithel bedeckt war.
-
Eine Dosis-Antwort wurde 5 Tage unter
Verwendung von zwei unterschiedlichen KGF-2-Dosierungen, eine bei 1 μg pro Wunde
pro Tag und die zweite bei 4 μg
pro Wunde pro Tag, in 50 μl
Vehikel durchgeführt.
Die Vehikel-Kontrollgruppen erhielten 50 μl 1X PBS.
-
Die Tiere wurden an Tag 8 mit einer
intraperitonealen Natriumpentobarbitalinjektion (300 mg/kg) getötet. Die
Wunden und die umgebende Haut wurden dann für die Histologie und die Immunhistochemie
geerntet. Gewebeproben wurden zur weiteren Verarbeitung in 10% neutral
gepuffertes Formalin in Gewebecassetten zwischen Biopsieschwämmchen gegeben.
-
Versuchskonzept
-
Vier Gruppen von jeweils 10 Tieren
(5 mit Methylprednisolon und 5 ohne Glucocorticoid) wurden ausgewertet:
1) Unbehandelte Gruppe, 2) Vehikel-Placobokontrolle, 3) KGF-2 1 μg/Tag und
4) KGF-2 4 μg/Tag. Diese
Studie wurde wie folgt konzipiert:
-
-
Messung der Wundfläche und
des Wundverschlusses
-
Der Wundverschluss wurde analysiert,
indem der Bereich in der vertikalen und horizontalen Achse gemessen
wurde und die Gesamtquadratfläche
der Wunde erhalten wurde. Die Kontraktion wurde dann geschätzt, indem
die Unterschiede zwischen der Anfangswundfläche (Tag 0) und derjenigen
nach der Behandlung (Tag 8) ermittelt wurden. Die Wundfläche an Tag
1 betrug 64 mm2 – die entsprechende Größe der Hautstanze.
Die Berechnungen wurden unter Verwendung der folgenden Formel durchgeführt:
[Offene
Fläche
an Tag 8]–[Offene
Fläche
an Tag 1]/[Offene Fläche
an Tag 1].
-
Histologie
-
Proben wurden in 10% gepuffertem
Formalin fixiert und in Parffin eingebettete Blocks wurden senkrecht
zur Wundoberfläche
(5 μm) in
Abschnitte eingeteilt und unter Verwendung eines Olympus-Mikrotoms
geschnitten. Die Routine-Hämatoxylin-Eosin
(H & E)-Färbung erfolgte
auf den Querschnitten zweigeteilter Wunden. Die histologische Untersuchung
der Wunden erlaubte uns zu beurteilen, ob der Heilungsprozess und
das morphologische Erscheinungsbild der reparierten Haut durch Behandlung
mit KGF-2 verbessert wurde. Von einem blinden Beobachter wurde ein
kalibriertes Linsenmikrometer verwendet, um den Abstand der Wundlücke zu bestimmen.
-
Statistische Analyse
-
Die experimentellen Daten wurden
unter Verwendung eines ungepaarten t-Tests analysiert. Ein p-Wert von < 0,05 wurde als
signifikant betrachtet. Die Daten wurden als Mittelwert +/– SEM ausgedrückt.
-
Ergebnisse
-
Ein Vergleich des Wundverschlusses
der unbehandelten Kontrollgruppen mit und ohne Methylprednisolon
zeigt, dass die Methylprednisolon behandelten Ratten eine signifikante
Hemmung der Wundheilung 8 Tage nach der Verletzung im Vergleich
zu normalen Ratten aufwiesen. Die Gesamtwundfläche betrug 58,4 mm2 bei
der Methylprednisolon-injizierten Gruppe und 22,4 mm2 bei
der Gruppe, die kein Glucocorticoid erhielt (16).
-
Auswirkungen von KGF-2
auf den Wundverschluss
-
Die systemische Verabreichung von
Methylpredinsolon bei Ratten zum Zeitpunkt der Verletzung verzögerte den
Wundverschluss (p = 0,002) normaler Ratten. Die Messungen des Wundverschlusses
der Methypredniloson-gehemmten Gruppen am Ende des Experiments an
Tag 8 zeigten, dass der Wundverschluss mit KGF-2 (1 μg p = 0,002 & 4 μg p = 0,005)
im Vergleich zur unbehandelten Gruppe statistisch signifikant größer war
(16). Der prozentuale
Wundverschluss betrug 60,2% bei der Gruppe, die 1 μg KGF-2 (p
= 0,002) erhielt, und 73% bei der Gruppe, die 4 μg KGF-2 (p = 0,0008) erhielt.
Dagegen betrug der Wundverschluss der unbehandelten Gruppe 12,5%
und derjenige der Vehikel-Placebogruppe betrug 28,6% ( 17).
-
Die Längsanalyse des Wundverschlusses
bei den Glucocorticoid-Gruppen von Tag 1 bis Tag 8 zeigt bei beiden
KGF-2-Dosierungen in den behandelten Gruppen eine signifikante Reduzierung
der Wundgröße von Tag
3 bis 8 nach der Verletzung (18).
-
Die Ergebnisse zeigen, dass die mit
4 μg KGF-2
behandelte Gruppe einen statistisch signifikanten (p = 0,05) beschleunigten
Wundverschluss im Vergleich zur unbehandelten Gruppe aufwies (19A). Obwohl es schwierig
ist, die Fähigkeit
eines Proteins oder anderer Verbindungen zu beurteilen, die Wundheilung
in einem normalen Tier zu beschleunigen (aufgrund der schnellen
Erholung), konnte trotzdem gezeigt werden, dass KGF-2 die Wundheilung
in diesem Modell beschleunigt.
-
Histopathologische Beurteilung
von KGF-2-behandelten Wunden
-
Die Histomorphometrie der Wundlücke zeigte
eine Reduzierung im Wundabstand der KGF-2-behandelten Gruppe. Die
für die
unbehandelte Gruppe beobachtete Wundlücke betrug S336μ während die
mit 1 μg KGF-2
behandelte Gruppe eine Reduzierung der Wundlücke bis 2972μ aufwies
und die Gruppe, die mit 4 μg KGF-2
(p = 0,04) behandelt wurde, wies eine Reduzierung der Lücke bis
zu 3086μ auf.
(20)
-
Auswirkungen von KGF-2Δ28 bei der
Wundheilung
-
Die Bewertung von KGF-2Δ28 und PDGF-BB
bei der Wundheilung beim Methylprednisolon-gehemmten Rattenmodell
wurde ebenfalls untersucht. Das Experiment wurde genauso wie vorstehend
beim KGF-2-Protein durchgeführt,
außer,
dass das KGF-2Δ28-Protein
keinen His-Tag besaß und
die Wundheilung an den Tagen 2, 4, 6, 8 und 10 gemessen wurde. Das
Puffervehikel für
die Proteine war für
alles außer
der „E2"-Präparation
des KGF-2 mit der gesamten Länge
40 mM NaOAc und 150 mM NaCl, pH 6,5. Das Puffervehikel für die „E2"-KGF-2- Präparation war 20 mM NaOAc und
400 mM NaCl, pH 6,4.
-
Die in 19B dargestellten Ergebnisse zeigen,
dass KGF-2Δ28
einen statistisch signifikant beschleunigten Wundverschluss im Vergleich
zur unbehandelten Gruppe aufweist und die Wirkungen von Methylprednisolon
auf die Wundheilung umkehrte.
-
Schlussfolgerungen
-
Dieses Beispiel zeigt, dass KGF-2
die Wirkungen von Methylprednisolon auf die Wundheilung umkehrte.
Die exogene Anwendung von Wachstumsfaktoren kann die Granulationsgewebebildung
beschleunigen, indem inflammatorische Zellen in die Wunde gezogen
werden. Eine ähnliche
Aktivität
wurde ebenfalls bei Tieren beobachtet, die kein Methylprednisolon
erhielten, was zeigte, dass basierend auf täglichen Messungen KGF-2 eine
signifikante pharmakologische Reaktion beim prozentualen Wundverschluss
an Tag 5 aufwies. Es wurde gezeigt, dass das Glucocorticoid-gehemmte
Wundheilungsmodell bei Ratten ein geeignetes und reproduzierbares
Modell zur Messung der Wirksamkeit von KGF-2 und anderen Verbindungen
auf dem Gebiet der Wundheilung ist.
-
Zusammengefasst zeigen die Ergebnisse,
dass KGF-2 sowohl im Glucocorticoid-gehemmten als auch in normalen
Schnittwundenmodellen eine signifikante Aktivität zeigt. Deshalb kann KGF-2
bei der Stimulation der Wundheilung einschließlich Operationswunden, diabetischen
Geschwüren,
Venenstaugeschwüren,
Verbrennungen und andere abnorme Wundheilungszustände wie
Urämie,
Mangelernährung,
Vitaminmangel und systemische Behandlung mit Steroiden und antineoplastischen
Medikamenten klinisch nützlich
sein.
-
Beispiel 9
-
Verteilung der KGF-2-mRNA-Expression
im Gewebe
-
Die Northern-Blot-Analyse wird durchgeführt, um
den Expressionsgrad des Gens, das das KGF-2-Protein in menschlichen
Geweben codiert, unter Verwendung von Verfahren zu untersuchen,
die unter anderem von Sambrook et. al., vorstehend zitiert, beschrieben
werden. Eine Sonde, die dem gesamten offenen Leserahmen von KGF-2
der vorliegenden Erfindung (SEQ ID NR: 1) entspricht, wurde durch
PCR erhalten und wurde mit 32P unter Verwendung
des rediprimeTM-DNA-Markierungssystems (Amersham
Life Science) nach den Anweisungen des Herstellers markiert. Nach
der Markierung wurde die Sonde unter Verwendung einer CHROMA SPIN-100TM-Säule
(Clontech Laboratories, Inc.) nach der Vorschriftsnummer PT1200-1
des Herstellers gereinigt. Die gereinigte Sonde wurde dann verwendet,
um verschiedene menschliche Gewebe für die Expression des KGF-2-codierenden
Gens zu untersuchen.
-
Mehrfache Gewebe-Northern (MTN)-Blots,
die Poly-A-RNA aus verschiedenen menschlichen Geweben (H) oder menschlichen
Immunsystemgeweben (IM) enthielten, wurden aus Clontech erhalten
und wurden mit einer markierten Sonde unter Verwendung der Express-HybTM-Hybridisierungslösung (Clontech)
nach der Vorschriftsnummer PT1190-1 des Herstellers untersucht.
Nach der Hybridisierung und dem Waschen wurden die Blots befestigt
und auf einem Film bei –70°C über Nacht
exponiert und die Filme nach Standarduerfahren entwickelt.
-
In den meisten menschlichen Geweben
wurde eine Haupt-mRNA-Spezies von etwa 4,2 kb beobachtet. Die KGF-2-mRNA
war relativ häufig
im Herz, Pankreas, in der Plazenta und im Eierstock vorhanden. Eine kleinere
mRNA-Spezies von etwa 5,2 kb wurde ebenfalls ubiquitär beobachtet.
Die Identität
dieser 5,2 kb-mRNA-Spezies war nicht klar. Es ist möglich, dass
das 5,2 kb-Transkript eine alternativ gespleißte Form von KGF-2 oder ein
drittes Mitglied der KGF-Familie codiert. Die KGF-2-cDNA war 4,1
kb, was mit der Größe der mRNA
von 4,2 kb übereinstimmt.
-
Beispiel 10
-
Keratinocyten-Proliferationstests
-
Hautkeratinocyten sind Zellen in
der Epidermis der Haut. Das Wachstum und die Verbreitung der Keratinocyten
in der Haut ist ein wichtiger Vorgang bei der Wundheilung. Ein Keratinocyten-Proliferationstest
ist deshalb ein wertvoller Indikator der Proteinaktivitäten bei
der Stimulation des Keratinocytenwachstums und folglich der Wundheilung.
-
Es ist jedoch schwierig, Keratinocyten
in vitro zu züchten.
Es existieren wenige Keratinocytezelllinien. Diese Zelllinie besitzen
verschiedene zelluläre
und genetische Defekte. Um Komplikationen dieses Tests durch zelluläre Defekte
wie den Verlust von Hauptwachstumsfaktorenrezeptoren oder die Abhängigkeit
von Hauptwachstumsfaktoren für
das Wachstum zu vermeiden, werden primäre Hautkeratinocyten für diesen
Test ausgewählt.
Diese primären
Keratinocyten erhält
man von Clonetics, Inc. (San Diego, CA).
-
Keratinocytenproliferationstest
mit alamarBlue
-
alamarBlue ist eine verwendbare blaue
Farbe, die bei Zugabe zum Kulturmedium von den Mitochondrien verstoffwechselt
wird. Die Farbe schlägt
dann in Gewebekulturüberständen auf
rot um. Die Mengen an roter Farbe können direkt durch Ablesen des
Unterschieds in der optischen Dichte zwischen 570 nm und 600 nm
quantifiziert werden. Dieses Ablesen spiegelt die zellulären Aktivitäten und
die Zellzahl wider.
-
Normale primäre Hautkeratinocyten (CC-0255,
NHEK-Neo vereinigt) werden von Clonetics, Inc gekauft. Diese Zellen
sind Passage 2. Die Keratinocyten werden in Keratinocyten-Komplett-Wachstumsmedium (CC-3001,
KGM; Cloneties, Inc.) gezüchtet,
bis sie 80% Konfluenz erreichen. Die Zellen werden nach der Spezifikation
des Herstellers mit Trypsin versetzt. Kurz gesagt, werden die Zellen
zweimal mit ausgewogener Hank-Salzlösung gewaschen. Den Zellen
werden etwa 3–5
min 2–3
ml Trypsin bei Raumtemperatur zugegeben. Es wurde eine Trypsin neutralisierende
Lösung
zugegeben und die Zellen wurden gesammelt. Die Zellen werden 5 min
bei Raumtemperatur bei 600 × g
zentrifugiert und in neue Kolben bei 3.000 Zellen pro Quadratzentimenter
unter Verwendung von vorgewärmtem
Medium plattiert.
-
Für
den Proliferationstest 1.000–2.000
Keratinocytes pro Vertiefung der Corning-Platten mit flachem Boden
und 96 Vertiefungen in Komplettmedium außer die äußersten Reihen ausplattieren.
Die äußeren Vertiefungen
mit 200 μl
sterilem Wasser auffüllen.
Das hilft, die Temperatur- und Feuchtigkeitsschwankungen der Vertiefungen
auf ein Minimum zu halten. Die Zellen bei 37°C über Nacht mit 5% CO2 züchten.
Zellen zweimal mit Keratinocyten-Basalmedium (CC-3101, KBM, Clonetics,
Inc.) waschen und jeder Vertiefung 100 μl KBM zugeben. 24 Stunden inkubieren.
Wachstumsfaktoren in KBM in Reihenverdünnung verdünnen und jeder Vertiefung 100 μl zugeben.
KGM als Positivkontrolle und KBM als Negativkontrolle verwenden.
Für jeden
Konzentrationspunkt werden sechs Vertiefungen verwendet. Zwei bis
drei Tage inkubieren. Am Ende der Inkubation die Zellen einmal mit
KBM waschen und 100 μl
KBM mit im Medium vorgemischtes 10 Vol.-% alamarBlue zugeben. 6
bis 16 Stunden inkubieren, bis die Farbe des Mediums bei der KGM-Positivkontrolle
rot wird. O.D. 570 nm minus O.D. 600 nm messen, indem die Platten
direkt in das Plattenlesegerät
gesetzt werden.
-
Ergebnisse
-
Stimulation der Keratinocytenproliferation
durch KGF-2
-
Um zu zeigen, dass KGF-2 (d. h. beginnend
bei Aminosäure
Cys37, wie in den Beispielen 7 und 8 vorstehend beschrieben) und
die N-terminalen Deletionsmutanten KGF-2Δ33 und KGF-2Δ28 bei der Stimulation des epidermalen
Keratinocytenwachstums aktiv waren, wurden normale primäre menschliche
epidermale Keratinocyten mit dem E. coli exprimierten und gereinigten
KGF-2-Protein (Chargennummer E3)(SEQ ID NR: 2), KGF-2Δ33 (Chargennummer
E 1) und KGF-2Δ28
(Chargennummer E2) inkubiert. Das KGF-2-Protein stimulierte das
Wachstum der epidermalen Keratinocyten mit einem EC50 von etwa 5
ng/ml, der demjenigen von FGF7/KGF-1 (21A) entspricht. Dagegen stimulierten
andere FGF's wie
FGF-1 und FGF-2 das Wachstum der primären Keratinocyten nicht. Der
EC50 für
KGF-2Δ33
betrug 0,2 ng/ml und derjenige für
KGF-2Δ28
2 ng/ml (Vgl. 21B und C). Somit schien KGF-2 bei der Stimulation
der Proliferation der primären
epidermalen Keratinocyten genauso wirksam wie FGF7/KGF zu sein.
Jedoch ist KGF-2Δ33
bei der Stimulation der Proliferation der Keratinocyten wirksamer
als der in den Beispielen 7 und 8 vorstehend beschriebene „Cys (37)" KGF-2 und KGF-2Δ28.
-
Die Vernarbung von Wundgewebe geht
einher mit der Hyperproliferation von Hautfibroblasten. Um zu bestimmen,
ob die stimulatorischen Effekte von KGF-2 für Keratinocyten spezifisch
waren, jedoch nicht für
Fibroblasten, wurden Maus-Balb.c.3T3-Fibroblasten und menschliche
Fibroblasten der Lunge getestet. Keine der Fibroblastenarten reagierte
auf KGF-2 in den Proliferationstests. Deshalb schien KGF-2 ein Mitogen
zu sein, das für
epidermale Keratinocyten, aber nicht für Mesenchymzellen wie Fibroblasten
spezifisch ist. Das legte nahe, dass die Wahrscheinlichkeit gering
war, dass KGF-2 die Vernarbung der Wundgewebe verursacht.
-
Beispiel 11
-
A. Mitogene Effekte von
KGF-2 auf mit spezifischen FGF-Rezeptoren transfizierte Zellen
-
Um zu bestimmen, welche FGF-Rezeptorisoform(en)
die proliferierenden KGF-2-Effekte vermitteln/vermittelt, wurden
die Auswirkungen von KGF-2 auf Zellen, die die spezifi schen FGF-Rezeptorisoformen exprimieren,
nach dem von Santos-Ocampo et al., J. Biol. Chem. 271: 1726–1731 (1996)
beschriebenen Verfahren getestet. Es war bekannt, dass FGF7/KGF
die Mitogenese von Epithelzellen induziert, indem es an die FGFR2iiib-Form
bindet und sowie spezifisch aktiviert (Miki et al. Science 251:
72–75
(1991)). Deshalb wurden die proliferativen Effekte von KGF-2 in
Mitogense-Tests unter Verwendung von Zellen getestet, die eine der folgenden
FGF-Rezeptorisoformen exprimierten: FGFR1iiib, FGFR2iiib, FGFR3iiib
und FGFR4.
-
Mitogenese-Test von FGF-Rezeptoren
exprimierenden Zellen
-
Der Thymidin-Einbau von BaF3-Zellen,
die spezifische FGF-Rezeptoren exprimieren, erfolgte wie bei Santos-Ocampo
et al., J. Biol. Chem. 271: 1726–1731 (1996) beschrieben. Kurz
gesagt, wurden die BaF3-Zellen, die spezifische FGF-Rezeptoren exprimieren,
in Dulbeco's modifiziertem
Eagle-Medium, 10% neonatalem Rinderserum und L-Glutamin gewaschen
und resuspendiert. Es wurden etwa 22.500 Zellen pro Vertiefung in eine
Testplatte mit 96 Vertiefungen in Medium plattiert, das 2 μg/ml Heparin
enthielt. Die Testreagenzien wurden jeder Vertiefung in einem Gesamtvolumen
von 200 μl
pro Vertiefung zugegeben. Die Zellen wurden 2 Tage bei 37°C inkubiert.
Jeder Vertiefung wurde dann 1 uCi 3H-Thymidin
in einem Volumen von 50 μl
zugegeben. Die Zellen wurden nach 4–5 Stunden durch Filtration
durch Glasfaserpapier geerntet. Das eingebaute 3H-Thymidin
wurde auf einem Wallac-Beta-Plattenscintillationszähler gezählt.
-
Ergebnisse
-
Die Ergebnisse zeigten, dass das
KGF-2-Protein (Thr(36)–Ser(208)
von 1 )(SEQ ID NR:
2), mit einem N-terminalen hinzugefügten Met) die Proliferation
der Baf3-Zellen, die den KGF-Rezeptor, FGFR2iiib-Isoform, exprimieren,
stark stimulierten, wie durch den Einbau von H3-Thymidin
gezeigt (22A). Im wesentlichen
wurde ein leichter stimulatorischer Effekt von KGF-2 auf die Proliferation
von Baf3-Zellen beobachtet, die das FGFR1iiib-Isoform exprimieren. KGF-2 hatte keine
Wirkung auf Zellen, die die FGFR3iiib oder die FGFR4-Formen des
Rezeptors exprimieren.
-
FGF7/KGF stimulierte die Proliferation
von Zellen, die den KGF-Rezeptor exprimieren. Der Unterschied zwischen
KGF-2 und FGF7/KGF war faszinierend. In Kontrollexperimenten stimulierte
aFGF seine Rezeptoren, FGFR1iiib und iiic und bFGF stimulierten
seinen Rezep tor FGFR2iiic. Somit legten diese Ergebnisse nahe, dass
KGF-2 an die FGFR2iiib-Isoform bindet und die Mitogenese stimuliert.
Im Gegensatz zu FGF7/KGF bindet KGF-2 auch die FGFR1iiib-Isoform
und stimuliert die Mitogenese.
-
B. Mitogene Effekte von
KGF-2Δ33
auf Zellen, die mit spezifischen FGF Rezeptoren transfiziert wurden
-
Wie vorstehend gezeigt, binden sowohl
FGFs oder KGF-1 als auch -2 an den FGF2iiib-Rezeptor (FGFR2iiib) und aktivieren
ihn. Die proliferativen Effekte von KGF-2Δ33 bei Mitogenese-Tests wurden
unter Verwendung von Zellen getestet, die eine der folgenden FGF-Rezeptortsoformen
exprimiertem: FGFR2iiib oder FGFR2iiic (die 2iiic Rezeptor-transfizierten
Zellen sind als Negativkontrolle eingeschlossen).
-
Die Experimente wurden wie vorstehend
in Teil A dieses Beispiels durchgeführt. Kurz gesagt, wurden BaF3-Zellen
in RPMI, enthaltend 10% Kälberserum
(BCS – nicht
fötales
Serum), 10% conditioniertes Medium aus WEHI3-Zellen (gezüchtet in
RPMI, enthaltend 5% BCS), 50 nM β-Mercaptoethanol,
L-Glu (2% einer 100X Stammlösung)
und Pen/Strep (1% einer 100X Stammlösung) gezüchtet.
-
Für
den Test wurden BaF3-Zellen zweimal in RPMI-Medium, enthaltend 10%
BCS und 1 μg/ml
Heparin, gespült.
Die BaF3-Zellen (22.000/Vertiefung) wurden in eine Platte mit 96
Vertiefungen in 150 μl
RPMI-Medium, enthaltend 10% BCS und 1 μg/ml Heparin, plattiert. Saurer
FGF, basischer FGF, KGF-1 (HG15400) oder KGF-2-Proteins (HG03400,
03401, 03410 oder 03411) wurden bei Konzentrationen von etwa 0 bis
10 nM zugegeben. Die Zellen wurden 48 Stunden in einem Endvolumen
von 200 μl
bei 37°C
inkubiert. Alle Tests wurden in dreifacher Ausführung durchgeführt. Jeder
Vertiefung wurde 4 Stunden bei 37°C
mit Tritium versetztes Thymidin (0,5 μCi) zugegeben, und die Zellen
wurden durch Filtration über
einen Glasfaserfilter geerntet. Die Gesamtmenge der eingebauten
Radioaktivität
wurde dann durch flüssige
Szintilationszählung
bestimmt. Die folgenden Positivkontrollen wurden verwendet: basischer
FGF und saurer FGF für
FGFR2iiic-Zellen; saurer FGF und KGF-1 für FGFR2iiib-Zellen. Die folgenden
Negativkontrollen wurden verwendet: Basalmedium (RPMI-Medium, enthaltend
10% BCS und 1 μg/ml
Heparin).
-
Ergebnisse
-
Die Ergebnisse zeigten, dass KGF-2
(Thr(36)–Ser(208)
mit einem N-terminalen hinzugefügten
Met), KGF-2Δ33
und KGF-2Δ28-Proteine
die Proliferation der BaF3-Zellen, die den KGF-Rezeptor, FGFR2iiib-Isoform,
exprimieren, stark stimulierten, wie durch Einbau von 3H-Thymidin
gezeigt(22A–C). Die KGF-2-Proteine hatten
keine Wirkung auf Zellen, die die FGFR2iiic-Formen des Rezeptors
exprimieren. Diese Ergebnisse legten nahe, dass KGF-2-Proteine an
die FGFR2iiib-Isoform binden und die Mitogenese stimulieren. Außerdem scheint
es, dass KGF-2Δ33
die Proliferation der BaF3-Zellen besser als KGF-2 (Thr(36)– Ser(208))
stimulieren konnte.
-
Beispiel 12
-
A. Konstruktion von E.
coli-optimiertem KGF-2 mit der gesamten Länge
-
Um den Expressionsgrad von KGF-2
mit der gesamten Länge
in einem E. coli-Expressionssystem zu erhöhen, wurden die Codons des
aminoterminalen Genanteils für
häufig
verwendete E. coli-Codons optimiert. Für die Synthese des optimieren
KGF-2-Bereichs wurde eine Reihe von sechs Oligonucleotiden synthetisiert: Nummer
1–6 (Sequenzen
nachstehend aufgeführt).
Diese sich überlappenden
Oligos wurden in einer PCR-Reaktion für sieben Runden bei den folgenden
Bedingungen verwendet:
-
-
Es wurde eine zweite PCR-Reaktion
angesetzt, wobei 1 μl
der ersten PCR-Reaktion mit dem synthetischen KGF-2-Primer 6 als
3'-Primer und dem
synthetischen KGF-2-BamHI als 5'-Primer
unter Verwendung derselben Bedingungen für 25 Zyklen verwendet wurde,
wie vorstehend beschrieben. Das durch diese Endreaktion produzierte
Produkt wurde mit AvaII und BamHI gespalten. Das KGF-2-Konstrukt
von Beispiel 1 wurde mit AvaII und HindIII gespalten und das Fragment
wurde isoliert. Diese beiden Fragmente wurden in den mit BamHI und
HindIII gespaltenen pQE-9 in einer Ligierung mit drei Fragmenten
cloniert.
-
Die für die Konstruktion des optimierten
KGF-2 1/208 verwendeten Primer:
-
-
Der sich ergebende Clon ist in 23 (SEQ ID NR: 38 und 39)
dargestellt.
-
B. Konstruktion von E.
coli-optimiertem reifem KGF-2
-
Um die Expressionsspiegel von KGF-2
in einem E. coli-Expressionssystem weiter zu erhöhen, wurden die Codons des
aminoterminalen Genanteils für
häufig
verwendete E. coli- Codons
optimiert. Zur Übereinstimmung
mit der reifen Form von KGF-1 wurde eine verkürzte Form von KGF-2, beginnend
bei Threonin 36, konstruiert. Als Matrize wurde synthetischer E.
coli-KGF-2 aus Beispiel 12 A in einer PCR-Reaktion unter Verwendung
von BspHI-5'-KGF-2 als 5'-Primer (Sequenz
nachstehend angeführt)
und HindIII-3'-KGF-2
als 3'-Primer (Sequenz
nachstehend angeführt)
verwendet. Die Amplifikation erfolgte unter Verwendung von Standardbedingungen,
wie vorstehend in Beispiel 12A für
25 Zyklen angegeben. Das sich ergebende Produkt wurde mit BspHI
und HindIII gespalten und in den mit NcoI und HindIII gespaltenen
E. coli-Expressionsvektor pQE60 cloniert.
-
-
Der sich ergebende Clon ist in 24A (SEQ ID NR: 42 und
43) dargestellt.
-
C. Konstruktion eines
alternativen E. coli-optimierten reifen KGF-2
-
Um die Expressionsspiegel der reifen
Form von KGF-2 in einem E. coli-Expressionssystem weiter zu erhöhen, wurden
die Codons von 53 Aminosäuren
am aminoterminalen Anteil des E. coli-optimierten Gens in alternative,
häufig
verwendete E. coli-Codons geändert.
Für die
Synthese des optimieren KGF-2-Bereichs wurde eine Reihe von sechs
Oligonucleotiden synthetisiert: Nummern 18062, 18061, 18058, 18064,
18059 und 18063 (Sequenzen nachstehend aufgeführt). Diese sich überlappenden
Oligos wurden in einer PCR-Reaktion für sieben Runden bei den folgenden
Bedingungen verwendet:
-
-
Nach sieben Syntheserunden wurden
diesem gesamten Bereich 5'-Primer
dieser Region, 18169, und ein 3'-Primer,
18060, zu einer PCR-Reaktion hinzugefügt, die 1 μl von der An fangsreaktion der
sechs Oligonucleotide enthielt. Dieses Produkt wurde 30 Runden unter
Verwendung der folgenden Bedingungen amplifiziert:
-
-
Es wurde eine zweite PCR-Reaktion
angesetzt, um den 3'-Bereich
des Gens unter Verwendung der Primer 18066 und 18065 unter denselben
Bedingungen, wie vorstehend beschrieben, für 25 Runden zu amplifizieren.
Die sich ergebenden Produkte wurden auf einem Agarosegel aufgetrennt.
Die das Produkt enthaltenden Gelstücke wurden in 10 mM Tris, 1
mM EDTA, pH 7,5 verdünnt.
Ein μl eines
jeden verdünnten
Stücks wurde
in einer zusätzlichen
PCR-Reaktion unter Verwendung des Primers 18169 als 5'-Primer und des Primer 18065
als 3'-Primer verwendet.
Das Produkt wurde für
25 Zyklen unter Verwendung derselben Bedingungen wie vorstehend
amplifiziert. Das von dieser Endreaktion produzierte Produkt wurde
mit EcoRI und HindIII gespalten und in pQE60 cloniert, der ebenfalls
mit EcoRI und HindIII gespalten wurde (nun pQE6).
-
Sequenzen
der synthetischen 5'-Primer
-
Die Sequenz des synthetischen KGF-2-Gens
und dessen entsprechende Aminosäure
ist in 24B (SEQ ID
NR: 54 und 55) dargestellt.
-
Beispiel 13
-
Konstruktion der KGF-2-Deletionsmutanten
-
Die Deletionsmutanten wurden aus
dem 5'-Terminus
und dem 3'-Terminus
des KGF-2-Gensunter
Verwendung des optimierten KGF-2-Konstrukts aus Beispiel 12 A als
Matrize konstruiert. Die Deletionen wurden basierend auf Genbereichen
ausgewählt,
die die Expression in E. coli negativ beeinflussen könnten. Für die 5'-Deletion wurden
die nachstehend aufgeführten
Primer als 5'-Primer
verwendet. Diese Primer enthalten die angegebene Restriktionsschnittstelle
und ein ATG, um das Initiatormethionin zu codieren. Der KGF-2 (FGF-12)-208-Aminosäure-3'-HindIII-Primer wurde
als 3'-Primer verwendet.
Die PCR-Amplifikation für
25 Runden erfolgte unter Verwendung von Standardbedingungen, wie
in Beispiel 12 aufgeführt.
Die Produkte für
die KGF-2 36aa/208aa-Deletionsmutanten wurden mit BspHI für die 5'-Schnittstelle und
mit HindIII für
die 3'-Schnittstelle
gespalten und in pQE60 cloniert, das mit BspHI und HindIII gespalten
wurde. Alle anderen Produkte wurden mit NcoI für das 5'-Restriktionsenzym und mit HindIII für die 3'-Schnittstelle gespalten
und in den pQE60 cloniert, der mit NcoI und HindIII gespalten wurde.
Für KGF-2
(FGF-12) wurde 36aa/153aa und 128aa-3'-HindIII wurde als 3'-Primer mit FGF-12-36aa/208aa als 5'-Primer verwendet.
Für FGF-12-62aa/153aa
wurde 128aa-3'-HindIII
als 3'-Primer mit
FGF-12-62aa/208aa als 5'-Primer verwendet. Die
Nomenklatur der sich ergebenden Clone gibt die erste und letzte
Aminosäure
des Polypeptids an, das sich aus der Deletion ergibt. Beispielsweise
gibt KGF-2– 36aa/153aa
an, dass die erste Aminosäure
der Deletionsmutante die Aminosäure
36 ist und die letzte Aminosäure
ist Aminosäure
153 von KGF-2. Ferner besitzt, wie in den 25-33 angegeben,
jede Mutante ein daran hinzugefügtes
N-terminales Met.
-
Sequenzen
der Deletionsprimer:
-
Die Sequenzen für die sich daraus ergebenden
Deletionsmutanten werden in den 25-33 [SEQ m NR: 65–82] aufgeführt.
-
Beispiel 14
-
Konstruktion der KGF-2-Cysteinmutanten
-
Die Konstruktion der C-37-Mutationsprimer
5457-5'-BspHI und
5258-173aaa-3' HindIII
wurde verwendet, um die KGF-2 (FGF-12)-Matrize aus Beispiel 12 A
zu amplifizieren. Der Primer 5457-5'BspHI ändert Cystein 37 in ein Serin.
Die Amplifikation erfolgte für
25 Zyklen unter Verwendung der Standardbedingungen, die vorstehend
in Beispiel 12 A umrissen wurden. Das sich ergebende Produkt wurde
mit BspHI und HindIII gespalten und in den mit BspHI und HindIII
gespaltenen E. coli-Expressionsvektor pQE60 cloniert. (34) [SEQ ID NR: 83].
-
Für
die Mutation von Cystein 106 in Serin wurden zwei PCR-Reaktionen
zur zielgerichteten Oligonucleotidmutagenese dieses Cysteins angesetzt.
In einer Reaktion wurde 5453-BspHI
als 5'-Primer verwendet, und
5455 wurde als 3'-Primer
in der Reaktion verwendet. In einer zweiten Reaktion wurde 5456
als 5'-Primer und
5258 HindIII als der 3'-Primer
verwendet. Die Reaktionen wurden 25 Runden unter Standardbedingungen amplifiziert,
wie in Beispiel 12 aufgeführt.
Ein Mikroliter aus jeder dieser PCR-Reaktionen wurde als Matrize
in einer nachfolgenden Reaktion unter Verwendung von 5453 BspHI
als 5'-Primer und
5258 HindIII als 3'-Primer verwendet.
Die Amplifikation für
25 Runden erfolgte unter Standardbedingungen, wie in Beispiel 12
aufgeführt. Das
sich ergebende Produkt wurde mit BspHI und HindIII gespalten und
in den mit NcoI und HindIII gespaltenen E. coli-Expressionsvektor
pQE60 cloniert.
-
Es waren zwei PCR-Reaktionen erforderlich,
um die C-37/C-106-Mutante herzustellen. Die Primer 5457-BspH1 und
5455 wurden verwendet, um den 5'-Bereich
der Mutante zu erzeugen, die Cystein 37 bis zur Serinsubstitution
enthielt, und Primer 5456 und 5258-HindIII wurden verwendet, um
den 3'-Bereich der
Mutante zu erzeugen, die Cystein 106 bis zur Serinsubstitution enthielt.
In der zweiten Reaktion wurde der 5457-BspHI-Primer als 5'-Primer verwendet
und 5258-HindIII als 3'-Primer
verwendet, um die C-37/C-106-Mutante zu erzeugen, wobei 1 μl aus jeder
der Anfangsreaktionen zusammen als Matrize verwendet wurden. Dieses PCR-Produkt
wurde mit BspHI und HindIII gespalten und in den mit NcoI und HindIII
gespaltenen pQE60 cloniert. Der sich ergebende Clon ist in 35 (SEQ ID NR: 84) dargestellt.
-
Sequenzen
der Cysteinmutantenprimer:
-
Beispiel 15
-
Herstellung und Reinigung
von KGF-2 (FGF-12)
-
Die DNA-Sequenz, die das in Beispiel
12 B beschriebene optimierte reife Protein codiert (d. h. die Aminosäuren T36
bis 5208 von KGF-2), wurde in das Plasmid pQE-9 (Qiagen) cloniert.
E. coli (M15/rep4;Qiagen) wurden bis zur stationären Phase über Nacht bei 37°C in LB gezüchtet, enthaltend
100 μg/ml
Ampicillin und 25 μg/ml
Kanamycin. Diese Kultur wurde verwendet, um frisches LB-Medium,
enthaltend 100 μg/ml
Ampicillin und 25 μg/ml
Kanamycin bei einer Verdünnung
von 1 : 50 anzuimpfen. Die Zellen wurden bei 37°C bis zu einer O.D.595 von
0,7 gezüchtet,
und durch Zugabe von Isopropyl-1-thio-β-D-galactopyranoside (IPTG)
bis zu einer Endkonzentration von 1 mM induziert. Nach 3–4 Stunden
wurden die Zellen durch Zentrifugation geerntet und in einem Puffer
resuspendiert, der 60 mM NaPO4 und 360 mM
NaCl in einem Verhältnis
von 5 Volumina Puffer: 1 Volumen Zellpaste enthielt.
-
Nach der Zertrümmerung in einem Mautin-Gaulin-Homogenisator
wurde der Extrakt auf einen pH-Wert von 8,0 durch Zugabe von NaOH
eingestellt und durch Zentrifugation geklärt. Der geklärte lösliche Extrakt
wurde auf eine Poros-HS-50-Säule
aufgetragen (2,0 × 10,0
cm; PerSeptive Biosystems, Inc.) und die gebundenen Proteine wurden
schrittweise mit 50 mM NaPO4 pH 8,0, enthaltend
0,5 M, 1,0 M und 1,5 M NaCl, eluiert. KGF-2 eluierte in der 1,5
M-Salzfraktion,
die dann fünffach
mit 50 mM NaPO4 pH 6,5 bis zu einer Endkonzentration
von 300 mM verdünnt
wurde. Diese KGF-2 enthaltende Fraktion wurde dann nacheinander über eine
Poros-HQ-20-Säule
(2,0 × 7,0
cm; PerSeptive Biosystems, Inc.) aufgetragen und dann an eine Poros CM-20-Säule (2,0 × 9,0 cm;
PerSeptive Biosystems, Inc.) gebunden. KGF-2 (FGF-12) enthaltende Fraktionen, die
bei etwa 500 mM bis etwa 750 mM NaCl eluierten, wurden vereinigt,
verdünnt
und wiederum auf eine CM-20-Säule
zur Konzentration aufgetragen. Schließlich wurde das Protein auf
einer Gelfiltrationssäule
(S-75; Pharmacia) in 40 nM NaOAC pH6,5; 150 mM NaCl (Charge E-5)
aufgetragen. Alternativ ließ man
die Gelfiltrationssäule
in Phosphat-gepufferter Salzlösung
(PBS, Charge E-4) laufen. KGF-2 enthaltende Fraktionen wurden vereinigt
und die Proteinkonzentration wurde durch den Bio-Rad-Protein-Test bestimmt.
Mittels SDS-PAGE beurteilte man die Proteine als > 90% rein. Schließlich fand
man heraus, das die durch den Limulus-Amöbocyten-Lysattest (Cape Cod
Associates) bestimmten Endotoxinspiegel ≤ 1 Eu/mg betrugen. Die auf diese
Weise hergestellten Proteine konnten Heparin binden, was ein Kennzeichen
der Mitglieder FGF-Familie ist.
-
Beispiel 16
-
A. Konstruktion der N-terminalen
Deletionsmutante KGF-2Δ33
-
Um den Expressionsgrad von KGF-2
in E. coli zu erhöhen
und um die Löslichkeits-
und Stabilitätseigenschaften
von E. coli exprimiertem KGF-2 zu erhöhen, wurde eine Deletionsvariante
KGF-2Δ33
(KGF-2 aa 69-208) erzeugt, bei der die ersten 68 Aminosäuren des
vorprozessierten KGF-2 entfernt wurden. Der Grund zur Erzeugung
dieser Deletionsvariante basierte auf den folgenden Beobachtungen.
Erstens enthält
reifes KGF-2 (KGF-2-aa 69-208) eine ungerade Anzahl (drei) an Cysteinresten,
die zu einer Aggregation aufgrund von intramolekularen Disulfidbrückenbildung
führen
kann. Die KGF-Δ33-Deletionsvariante
enthält
nur zwei Cysteinreste, die das Potential für die intramolekulare Disulfidbrückenbildung
und nachfolgende Aggregation verringern. Eine Verringerung der Aggregation
sollte zu einer Erhöhung
im Ertrag des aktiven KGF-2-Proteins führen. Zweitens wurde bei der
KGF-Δ33-Deletionsvariante
ein Poly-Serin-Abschnitt entfernt, der im KGF-1 nicht vorhanden
ist und der für
die Aktivität
nicht wichtig zu sein scheint, aber die Expression des Proteins
in E. coli behindern kann. Somit kann die Entfernung des Poly-Serin-Abschnitts
die Expressionsspiegel des aktiven KGF-2-Proteins erhöhen. Drittens
führt die
Expression von KGF-Δ33
in E. coli zu einer natürlichen
Spaltung von KGF-2 zwischen den Resten 68 und 69. Somit nimmt man
an, dass KGF-Δ33
effizient prozessiert wird und in E. coli stabil ist.
-
Konstruktion von KGF-Δ33 in pQE6
-
Um eine Polymerasekettenreaktion
gelenkte Amplifikation und Subclonierung von KGF-2Δ33 in den E.
coli Expressionsvektor, pQE6, zuzulassen, wurden zwei Oligonucleotidprimer
(5952 und 19138) komplementär
zum gewünschten
Bereich von KGF-2 mit der folgenden Basensequenz synthetisiert.
-
-
Im Falle des N-terminalen Primers
(5952) wurde eine AflIII-Restriktionsschnittstelle eingebaut, während im
Falle des C-terminalen Primers (19138) eine HindIII-Restriktionsschnittstelle
eingebaut wurde. Der Primer 5952 enthält auch eine ATG-Sequenz neben
und im Leserahmen mit dem KGF-2-codierenden Bereich, um die Translation
des clonierten Fragments in E. coli zuzulassen, während der
Primer 19138 zwei Stoppcodons (vorzugsweise in E. coli verwendet)
neben und im Leserahmen mit dem KGF-2-codierenden Bereich enthält, der
die richtige Translationstermination in E. coli sicherstellt.
-
Die Polymerasekettenreaktion erfolgte,
indem dem Fachmann gut bekannte Standardbedingungen und die Nucleotidsequenz
für das
reife KGF-2 (aa 36-208) (konstruiert in Beispiel 12C) als Matrize
verwendet wurden. Das sich ergebende Amplikon wurde einer Restriktionsspaltung
mit AflIII und HindIII unterzogen und in den mit NcoI/HindIII gespaltenen
Proteinexpressionsvektor pQE6 subcloniert.
-
Konstruktion von KGF-2Δ33 in pHE1
-
Um die Polymerasekettenreaktion gelenkte
Amplifikation und Subclonierung von KGF-2Δ33
in den E. coli Expressionsvektor, pHE1, zuzulassen, wurden zwei
Oligonucleotidprimer (6153 und 6150) komplementär zum gewünschten Bereich von KGF-2 mit
der folgenden Basensequenz synthetisiert.
-
-
Im Falle des N-terminalen Primers
(6153) wurde eine NdeI-Restriktionsschnittstelle eingebaut, während im
Falle des C-terminalen Primers (6150) eine Asp718-Restriktionsschnittstelle
eingebaut wurde. Der Primer 6153 enthält auch eine ATG-Sequenz neben
und im Leserahmen mit dem KGF-2 codierenden Bereich, um die Translation
des clonierten Fragments in E. coli zuzulassen, während der
Primer 6150 zwei Stoppcodons (vorzugsweise in E. coli verwendet)
neben und im Leserahmen mit dem KGF-2-codierenden Bereich enthält, der
die richtige Translationstermination in E. coli sicherstellt.
-
Die Polymerasekettenreaktion erfolgte,
indem dem Fachmann gut bekannte Standardbedingungen und die Nucleotidsequenz
für das
reife KGF-2 (aa 36-208) (konstruiert in Beispiel 12C) als Matrize
verwendet wurden. Das sich ergebende Amplikon wurde einer Restriktionsspaltung
mit NdeI und Asp718 unterzogen und in den mit NdeI/Asp718 gespaltenen
Proteinexpressionsvektor pHE1 subcloniert.
-
Nucleotidsequenz
von KGF2 Δ33
-
-
Aminosäuresequenz
von KGF 1533:
-
B. Konstruktion eines
optimierten KGF-2Δ33
-
Um den Expressionsgrad von KGF-2Δ33 in E.
coli zu erhöhen,
wurden die Codons des vollständigen Gens
optimiert, damit sie mit denjenigen übereinstimmen, die am häufigsten
in E. coli verwendet werden. Da die Matrize, die zur Erzeugung von
KGF-2Δ33
verwendet wurde, innerhalb des N-terminalen Bereiches Codon-optimiert
wurde, war für
die C-terminalen Aminosäuren
(84–208)
eine Optimierung erforderlich.
-
Zuerst wurden die Aminosäuren 172–208 Codon-optimiert,
um KGF-2Δ33(s172–208) zu
erzeugen. Dies wurde durch eine Strategie mit sich überlappender
PCR erreicht. Die Oligonucleotide PM07 und PM08 (entsprechen den
Aminosäuren
172–208)
wurden vereinigt und zusammen angelagert, indem sie auf 70°C erhitzt
wurden und man sie auf 37°C
abkühlen
ließ.
Die angelagerten Oligonucleotide wurden dann als Matrize für eine Standard
PCR-Reaktion verwendet, die von den Primern PM09 und PM10 gelenkt
wurde. In einer getrennten PCR-Reaktion,
die dem Fachmann gut bekannte Standardbedingungen folgte und unter
Verwendung von KGF-2Δ33
als Matrize wurden die Oligonucleotide PM05 (das mit der PstI-Schnittstelle
innerhalb des codierenden Bereiches von KGF-2 überlappt) und PM11 verwendet,
um den KGF-2-Bereich zu amplifizieren, der den Aminosäuren 84–172 entspricht.
In einer dritten PCR-Reaktion wurden das Produkt der ersten PCR-Reaktion
(entspricht den Codon optimierten Aminosäuren 172–208) und dem Produkt der zweiten
PCR-Reaktion (entspricht den nicht optimierten Aminosäuren 84–172) vereinigt
und als Matrize für
eine Standard PCR-Reaktion verwendet, die von den Primern PM05 und
PM10 gelenkt wurde. Das sich ergebende Amplikon wurde mit PstI/HindIII
gespalten und in den mit PstI/HindIII gespaltenen pQE6KGF2Δ33 subcloniert,
wobei der entsprechende nicht optimierte Bereich effektiv ersetzt
wurde und pQE6KGF2Δ33(s172–208) erzeugt
wurde.
-
Um die Codon-Optimierung von KGF-2
zu vervollständigen,
wurde ein synthetisches Gencodon unter Verwendung von sich überlappenden
Oligonucleotiden erzeugt, das für
den KGF-2-Bereich optimiert wurde, der den Aminosäuren 84–172 entspricht.
Zuerst wurden vier Oligonucleotide (PM31, PM32, PM33 und PM34) vereinigt,
und sieben Zyklen der folgenden PCR wurden durchgeführt: 94°C, 30 sec,
46,5°C,
30 sec und 72°C, 30
sec.
-
Eine zweite PCR-Reaktion, die von
den Primern PM35 und PM36 gelenkt wurde, wurde dann unter Befolgung
von Standardverfahren durchgeführt,
wobei 1 μl
der ersten PCR-Reaktion
als Matrize verwendet wurden. Das sich ergebende optimierte Genfragment
wurde dann mit PstI/SalI gespalten und in den mit PstI/SalI gespaltenen
pQE6KGF2Δ33s
(s172–208)
subcloniert, um ein vollständig
optimiertes KGF-2-codierendes Gen, pQE6KGF2Δ33s, zu erzeugen.
-
Um einen alternativen E. coli-Proteinexpressionsvektor
zu erzeugen, wurde KGF2Δ33s
mittels PCR unter Verwendung der Primer PM102 und PM130 auf pQE6KGF2Δ33s amplifiziert.
Das sich ergebende Amplikon wurde mit NdeI und EcoRV gespalten und
in den mit NdeI und Asp718 gespaltenen (mit stumpfen Enden versehenen)
pHE1-Expressionsvektor subcloniert, um pHE1Δ33s zu erzeugen.
-
Die bei der Konstruktion des Codon-pptimierten
KGF2Δ33s
verwendeten Oligonucleotidsequenzen:
-
-
-
-
Aminosäuresequenz
von KGF2Δ33(s172–208):
-
C. Konstruktion der N-terminalen
Deletionsmutante KGF-2Δ4
-
Um den Expressionsgrad von KGF-2
in E. coli zu erhöhen
und die Löslichkeits-
und Stabilitätseigenschaften
von E. coli-exprimiertem KGF-2 zu erhöhen, wurde eine Deletionsvariante
KGF-2Δ4
(Äminosäuren 39–208) erzeugt,
bei der die ersten 38 Aminosäuren,
einschließlich
des Cysteins an Position 37, des vorprozessierten KGF-2 entfernt
wurden. Da das sich ergebende KGF-2-Deletionsmolekül eine gerade
Anzahl von Cysteinen enthält,
sollten Probleme aufgrund von Aggregation verringert werden, die
durch intramolekulare Disulfidbrückenbildung
verursacht werden, was zu einem erhöhten Expressionsgrad des aktiven
Proteins führt.
-
Um eine Polymerasekettenreaktions
gelenkte Amplifikation und Subclonierung von KGF-2Δ4 in den E.
coli-Proteinexpressionsvektor, pQE6, zuzulassen, wurden zwei Oligonucleotidprimer
(PM61 und 19138) mit der folgenden Basensequenz synthetisiert.
-
-
Im Falle des N-terminalen Primers
(PM61) wurde eine NcoI-Restriktionsschnittstelle eingebaut, während im
Falle des C-terminalen Primers (19138) eine HindIII-Restriktionsschnittstelle
eingebaut wurde. PM61 enthält
auch eine ATG-Sequenz neben und im Leserahmen mit dem KGF-2-codierenden
Bereich, um die Translation des clonierten Fragments in E. coli
zuzulassen, während
19138 ein Stoppcodon (vorzugsweise in E. coli verwendet) neben und
im Leserahmen mit dem KGF-2 codierenden Bereich enthält, der
die richtige Translationstermination in E. coli sicherstellt.
-
Die Polymerasekettenreaktion erfolgte,
indem dem Fachmann gut bekannte Standardbedingungen und die Nucleotidsequenz
für das
reife KGF-2 (aa 36-208) (konstruiert in Beispiel 12C) als Matrize
verwendet wurden. Das sich ergebende Amplikon wurde einer Restriktionsspaltung
mit NcoI und HindIII unterzogen und in den mit NcoI/HindIII gespaltenen
Proteinexpressionsvektor pQE6 subcloniert.
-
Nacleotidsequenz
von KGF2Δ4:
-
Aminosäuresequenz
von KGF2Δ4:
-
Beispiel 17
-
KGF-2Δ33-stimulierte Wundheilung bei
normalen Ratten
-
Um zu zeigen, dass KGF-2Δ33 den Wundheilungsprozess
beschleunigen würde,
wurde die Wundheilung von Schnittwunden unter Verwendung des folgenden
Modells untersucht. Spague-Dawley-Ratten (n = 5) wurde mit einer
Keyes-Hautstanze eine 6 mm-Schnittwunde am Rücken beigebracht. Die Wunden
werden offen gelassen und 4 Tage, beginnend am Tag der Verletzung,
topisch mit verschiedenen KGF-2Δ33-Konzentrationen
(in 40 mM NaOAc und 150 mM NaCl, pH 6,5 Puffer) und Puffer (40 mM
NaOAc and 150 mM NaCl, pH 6,5) behandelt. Die Wunden werden täglich unter
Verwendung eines kalibrierten Jameson-Tastzirkels gemessen. Die Wundgröße wird
in Quadratmillimetern ausgedrückt.
Am letzten Tag wurden die Wunden gemessen und für die weitere Analyse geerntet.
Die statistische Analyse erfolgte unter Verwendung eines urgepaarten
t-Tests (Mittelwert +/– SE).
Die Bewertungsparameter schließen
den prozentualen Wundverschluss, die histologischen Punktebewertung
(1–3 minimale
Zellakkumulation, keine Granulation; 4–6 unreife Granulation, inflammatorischen
Zellen, Kapillare; 7–9
Granulationsgewebe, Zellen, Fibroblasten, neues Epithel; 10–12 reife Dermis
mit Fibroblasten, Collagen, Epithel), Reepithelialisierung und Immunhistochemie
ein.
-
Am dritten Tag nach der Verletzung
zeigte die Behandlung mit KGF-2Δ33
eine Abnahme der Wundgröße (30,4
mm2 bei 4 μg, p = 0,006, 33,6 mm2 bei 1 μg,
p = 0,0007) im Vergleich zur Pufferkontrolle von 38,9 mm2. An Tag 4 nach der Verletzung zeigte die
Behandlung mit KGF-2Δ33
eine Abnahme der Wundgröße (27,2 mm2 bei 0,1 μg
p = 0,02, 27,9 mm2 bei 0,4 μg p = 0,04)
im Vergleich zur Pufferkontrolle von 33,8 mm2.
An Tag 5 nach der Verletzung zeigte die Behandlung mit KGF-2Δ33 eine Abnahme
der Wundgröße (18,1
mm2 bei 0,4 μg p = 0,02) im Vergleich zur
Pufferkontrolle von 25,1 mm2. Vgl. 36.
-
Nach der Ernte der Wunden an Tag
5 wurden zusätzliche
Parameter ausgewertet. KGF-2Δ33 zeigte eine
Zunahme beim prozentualen Wundverschluss bei 0,4 μg (71,2%,
p = 0,02) im Vergleich zur Pufferkontrolle 60,2%. Die Verabreichung
von KGF-2Δ33
führt auch
zu einer Verbesserung der histologischen Punktbewertung bei 1 μg und 4 μg (8,4 bei
1 μg p =
0,005, 8,5 bei 4 μg
p = 0,04) relativ zur Pufferkontrolle von 6,4. Die Reepithelialisierung
wurde auch bei 1 und 4 μg
KGF-2Δ33
(1389 um bei 1 μg
p = 0,007, 1220 um bei 4 μg
p = 0,02) relativ zur Pufferkontrolle von 923 um verbessert. Vgl. 37.
-
Diese Studie zeigt, dass die tägliche Behandlung
mit KGF-2Δ33
die Wundheilungsrate bei normalen Tieren beschleunigt, wie durch
die Abnahme der Nettowundfläche
gezeigt. Zusätzlich
zeigt die histologische Bewertung der Wundenproben und die Beurteilung
der Reepithelialisierung, dass KGF-2Δ33 die Heilungsrate in diesem
normalen Rattenmodell verbessert.
-
Beispiel 18
-
Auswirkungen von KGF-2Δ33 auf die
Zugfestigkeit und Epidermisdicke bei normalen Ratten
-
Um zu zeigen, dass KGF-2Δ33 die Zugfestigkeit
und die Epidermisdicke von Wunden erhöht, wurde das folgende Experiment
durchgeführt.
-
Auf dem Rücken von männlichen Sprague-Dawley-Ratten
(n = 8 oder 9) wird eine 2,5 cm-Mittellinien-Vollhautschnittwunde
erzeugt. Der Hautschnitt wird unter Verwendung von 3 Metallklammern
im gleichem Abstand geschlossen. Der Puffer (40 mM NaOAc und 150
mM NaCl, pH 6,5) oder KGF-2Δ33
(in 40 mM NaOAc und 150 mM NaCl, pH 6,5 Puffer) wurden zum Zeitpunkt
der Verletzung topisch auf die Wunde aufgetragen. Vier Wundstreifen
mit einer Breite von 0,5 cm werden am Tag 5 herausgeschnitten. Die
Proben werden für
die Studie der Bruchfestigkeit unter Verwendung eines InstronTM-Hauttensiometers, die Hydroxyprolinbestimmung und
histopathologische Beurteilung verwendet. Die Bruchfestigkeit wurde
als die größte Kraft
definiert, die von jeder Wunde vor dem Reißen ausgehalten wurde. Die
statistische Analyse erfolgte unter Verwendung eines ungepaarten
t-Tests (Mittelwert +/– SE).
-
Bei einem Schnittwundenmodell der
Rattenhaut zeigte das topisch aufgetragene KGF-2Δ33 einen statistisch signifikanten
Anstieg bei der Bruchfestigkeit, Zugfestigkeit und der Eperdermisdicke
als Folge einer einzelnen intraincisionalen Anwendung nach der Verletzung.
In einer Studie war die Bruchfestigkeit von KGF-2-behandelten Wunden
bei 1, 4 und 10 μg
im Vergleich zu den Pufferkontrollen (107,3 g bei 1 μg p = 0,0006,
126,4 g bei 4 μg
p < 0,0001, 123,8
g bei 10 μg
p < 0,0001) signifikant
höher.
Vgl. 38.
-
Die Epidermisdicke wurde unter dem
Lichtmikroskop auf Masson-Trichom-Abschnitten bestimmt. KGF-2Δ33 behandelte
Wunden zeigten im Gegensatz zur Pufferkontrolle von 54,8 u eine
erhöhte
Epidermisverdickung (60,5 μ bei
1 μg, 66,51 μ bei 4 μg p = 0,01,
59,6 μ bei
10 μg).
Vgl. 39.
-
Diese Studie zeigt, dass eine einzelne
intraincisionale Anwendung von KGF-2 den Wundheilungsprozess verbessert
und beschleunigt, was durch einen Anstieg bei der Bruchfestigkeit
und der Epidermisdicke von incisionalen Wunden charakterisiert ist.
-
Beispiel 19
-
Auswirkungen von KGF-2Δ33 auf normale
Rattenhaut
-
Um die Auswirkung von KGF-2Δ33 auf normale
Rattenhaut nach einer intradermalen Injektion zu bestimmen, wurde
folgendes Experiment durchgeführt.
-
Männliche
erwachsene SD-Ratten (n = 3) erhielten sechs intradermale Injektionen
entweder mit Placebo oder KGF-2Δ33
(in 40 mM NaOAc und 150 mM NaCl, pH 6,5 Puffer) in einer Konzentration
von 1 und 4 μg
in 50 μl
an Tag 0. Den Tieren wurde 5–2'-Bromdesoxyuridin (BrdU)(100 mg/kg i.
p.) zwei Stunden vor der Tötung
nach 24 und 48 Stunden injiziert. Die Epidermisdicke wurde von der
granulären
Schicht bis zum Boden der Basalschicht gemessen. Entlang der Injektionsstelle
wurden etwa 20 Messungen durchgeführt und die mittlere Dicke
quantifiziert. Die Messungen wurden unter Verwendung eines kalibrierten
Mikrometers auf Masson-Trichom-gefärbten Abschnitten unter dem
Lichtmikroskop bestimmt. Die BrdU-Punktebewertung erfolgte unter
dem Lichtmikroskop durch zwei blinde Beobachter unter Verwendung
des folgenden Punktebewertungssystems: 0–3 keine bis minimal markierte
Zellen; 4–6
leichte Markierung; 7–10
stark markierte Zellen. Die Tiere wurden 24 und 48 Stunden nach
der Injektion getötet.
Die statistische Analyse erfolgte unter Verwendung eines ungepaarten
t-Tests (Mittelwert +/– SE).
-
Mit KGF-2Δ33 behandelte Haut zeigte nach
24 Stunden eine erhöhte
epidermale Verdickung (32,2 μ bei
1 μg p < 0,001, 35,4 μ bei 4 μg p < 0,0001) im Gegensatz
zur Pufferkontrolle von 27,1 μ.
Nach 48 Stunden zeigte mit KGF-2Δ33
behandelte Haut eine erhöhte
epidermale Verdickung (34,0 μ bei
1 μg p =
0,0003, 42,4 μ bei
4 μg p < 0,0001) im Gegensatz
zur Pufferkontrolle von 27,8 μ.
Vgl. 40. Mit KGF-2Δ33 behandelte Haut
zeigte auch eine erhöhte BrdU-Immunfärbung nach
48 Stunden (4,73 bei 1 μg
p = 0,07, 6,85 bei 4 μg
p < 0,0001) im
Gegensatz zur Pufferkontrolle von 3,33. Vgl. 41.
-
Diese Studien zeigen, dass eine intradermale
Injektion von KGF-2 die epidermale Verdickung erhöht und beschleunigt.
Somit gäbe
es bei KGF-2 Anwendungen zur Vermeidung oder Linderung von Falten,
Verbesserung der Hautalterung und Verringerung der Narbenbildung
oder Verbesserung der Heilung von kosmetischen Operationen. Zusätzlich kann
KGF-2 prophylaktisch verwendet werden, um orale Mucosistis (Mundgeschwüre), Darmentzündungen
als Reaktion auf Chemotherapie oder andere Agentien zu verhindern
oder zu reduzieren.
-
Beispiel 20
-
Anti-inflammatorischer
Effekt von KGF-2 beim PAF-induzierten Pfotenödem
-
Um den anti-inflammatorischen Effekt
von KGF-2 zu zeigen, wurde das folgende Experiment unter Verwendung
des PAF-induzieren Pfotenödem-Modells
durchgeführt.
-
Gruppen mit vier Lewis-Ratten (190–210 g)
wurde subkutan in die Sohle der rechten hinteren Pfote 120 μl Lösung, die
2,5 nM PAF enthielt, zusammen mit folgenden Reagenzien injiziert:
125 μg Ckb-10(B5),
24 μg LPS,
73 μg KGF-2
(Thr (36) – Ser
(208) von 1 (SEQ ID
NR: 2) mit einem N-terminalen Met) oder kein Protein. Der linken
hinteren Pfote wurde dieselbe Menge Puffer verabreicht, um sie als
Parallelkontrolle zu verwenden. Das Pfotenvolumen wurde unmittelbar
vor oder 30 und 90 Minuten nach der PAF-Injektion unter Verwendung
eines Plethysmographie-Systems quantifiziert. Die prozentuale (%) Änderung
des Pfotenvolumens wurde berechnet.
-
Testreagenzien
im Experiment Nr. 1 und Nr. 2
-
Wie in 42 gezeigt, führten, wie erwartet, die nur
mit PAF injizierten rechten hinteren Pfoten zu einem signifikanten
Anstieg beim Pfotenvolumen (75 oder 100% für Experiment Nr. 1 bzw. Nr.
2) 0,5 Stunden nach der Injektion; während die linken hinteren Pfoten,
die Puffer erhielten, oder die rechten hinteren Pfoten, die nur
LPS oder SEB erhielten, wenig Anzeichen eines Ödems zeigten (Daten nicht gezeigt).
Jedoch gab es, wenn KGF-2 zusammen mit PAF lokal verabreicht wurde,
eine wesentliche Verringerung (25 bzw. 50% für Experiment Nr. 1 bzw. Nr.
2) beim Pfotenvolumen im Vergleich zu Pfoten, die nur mit PAF provoziert
wurden. Die Verringerung der Pfotenödeme wurde nicht bei Tieren
beobachtet, die PAF zusammen mit Ckb-10 (ein anderes Protein), LPS
oder SEB (zwei inflammatorische Mediatoren) erhielten. Diese Ergebnisse
legen nahe, dass der anti-inflammatorische Effekt von KGF-2 spezifisch
ist und nicht aufgrund einer unspezifischen Art des Proteins erfolgt.
-
Auswirkungen von KGF-2Δ33 auf das
PAF-induzierte Pfotenödem
bei Ratten
-
Indem die vorstehend beschriebenen
Experimente mit KGF-2Δ33
befolgt wurden, um die biologischen Aktivitäten zur Stimulation der Keratinocytenproliferation
in vitro und dessen in-vivo-Effekt auf die Wundheilung zu bestätigen, wurde
KGF-2Δ33
ferner beim PAF-induzierten
Pfotenödem
bei Ratten beurteilt. Gruppen mit vier Lewis-Ratten (190–210 mg)
wurde subkutan in die Sohle der rechten hinteren Pfote 120 μl Lösung, die
2,5 nM PAF enthielt, zusammen mit 210 μg KGF-2Δ33 oder Albumin injiziert. Den
linken hinteren Pfoten wurde dieselbe Menge Puffer, Albumin oder
KGF-2Δ33
verabreicht, um sie als Paralellkontrolle zu verwenden. Das Pfotenvolumen
wurde in verschiedenen Intervallen nach der PAF-Injektion unter
Verwendung eines Plethysmographie-Systems quantifiziert. Die prozentuale
(%) Änderung
des Pfotenvolumens wurde berechnet.
-
Wie in 43 dargestellt, zeigten, wie erwartet,
die nur mit PAF und Albumin injizierten rechten hinteren Pfoten
einen signifikanten Anstieg (75%) beim Pfotenvolumen 0,5 Stunden
nach der Injektion; während
die linken hinteren Pfoten, die Puffer, Albumin oder nur KGF-2Δ33 erhielten,
wenig Anzeichen eines Ödems
zeigten. Jedoch gab es, wenn KGF-2Δ33 zusammen mit PAF lokal verabreicht
wurde, eine wesentliche Verringerung (durchschnittlich 20%) beim
Pfotenvolumen im Vergleich mit Pfoten, die während des gesamten Experiments,
das innnerhalb von 4 Stunden beendet wurde, nur mit PAF provoziert
wurden. Diese Ergebnisse bestätigen
die anti-inflammatorische Eigenschaft von KGF-2Δ33.
-
-
Somit ist KGF-2Δ33 zur Behandlung von akuten
oder chronischen Erkrankungen nützlich,
bei denen die Entzündung
eine Schlüsselpathogenese
der Krankheiten einschließlich,
jedoch nicht begrenzt auf Psoriasis, Ekzeme, Dermatitis und/oder
Arthritis ist.
-
Beispiel 21
-
Auswirkungen von KGF-2Δ33 auf das
End-zu-End-Darm-Anastomos- Rattenmodell
-
Dieses Beispiel zeigt, dass KGF-2Δ33 die Rate
der Darmreparatur in einem Darm- oder Colon-Anastomose-Modell bei
Wistar oder Sprague-Dawley-Ratten erhöht.
-
Die Verwendung der Ratte bei experimenteller
Anastomose ist ein gut charakterisiertes, relevantes und reproduzierbares
Modell der Wundheilung nach einem chirurgischen Eingriff. Dieses
Modell kann auch erweitert werden, um die Auswirkungen der chronischen
Steroidbehandlung oder die Effekte verschiedener chemotherapeutischer
Therapieschemata auf die Qualität
und Rate der Wundheilung nach einem chirurgischen Eingriff im Colon
oder Dünndarm
auszuweiten (Mastboom W. J. B. et al. Br. J. Surg. 78: 54–56 (1991),
Salm R. et al. J Surg. Oncol. 47: 5–11, (1991), Weiber S. et al.
Eur. Surg. Res. 26: 173–178
(1994)). Die Heilung von Anastomose ähnelt der Wundheilung irgendwo
sonst im Körper.
Die frühen
Phasen der Heilung werden durch akute Entzündung, gefolgt von Fibroblastenproliferation
und Collagensynthese charakterisiert. Collagen wird allmählich modelliert
und die Wunde wird gefestigt, sobald das neue Collagen synthetisiert
wird. (Koruda M. J. und Rolandelli, R. H. J. Surg. Res. 48: 504–515 (1990).
Die meisten postoperativen Komplikationen wie Anastomoseinsuffizienz
treten während
der ersten paar Tage nach dem chirurgischen Eingriff auf – eine Zeitspanne,
während
der die Stärke
des Colons hauptsächlich
durch die Fähigkeit
des Wundrandes, Suturen zu halten, gesichert wird. Es wurde berichtet,
dass die Kapazität
des GI-Trakts, Nähte
zu halten, um 80% während
der ersten postoperativen Tage abnimmt. (Hogstrom H und Haglund
U. Acta Chir Scand 151: 533–535
(1985), Jonsson K, et al. Am J. Surg. 145: 800–803 (1983)).
-
Männliche
erwachsene SD-Ratten (n = 5) wurden mit einer Kombination von Ketamin
(50 mg/kg) und Xylazin (5 mg/kg) intramuskulär narkotisiert. Die Bauchhöhle wurde
mit einem 4 cm langen Mittellinienschnitt geöffnet. Ein 1 cm breites Segment
des linken Colons wurde 3 cm proximal zur peritonealen Reflektion
reseziert, wobei die Randgefäße erhalten
wurden. Eine Einzelschicht End-zu-End Anastomose wurde mit 8–10 unterbrochenen
5–0 invertierten
Vicryl-Suturen durchgeführt,
um die intestinale Kontinuität
wiederherzustellen. Die Anastomose wurde dann topisch über eine
Spritze entweder mit Puffer oder KGF-2Δ33 bei Konzentrationen von 1
und 4 μg
behandelt. Die Schnittwunde wurde mit 0–3 durchgehender Seidensutur
für die
Muskelschicht und mit Operationsklammern für die Haut geschlossen. Die
Behandlungen erfolgten dann danach täglich und bestanden aus Puffer
oder KGF-2Δ33
und 1 und 5 mg/kg sc. Am Tag des chirurgischen Eingriffs und täglich danach
wurde gewogen. Die Tiere wurden 24 Stunden nach der letzten Behandlung
(Tag 5) getötet.
Die Tiere wurden narkotisiert und erhielten Bariumklistiere und
wurden in einem konstanten Abstand geröngt. Die radiologische Analyse
nach der intracolonalen Verabreichung durch 2 blinde Beobachter
zeigte, dass die KGF-2Δ33-behandelte
Gruppen 1) einen verringerten Austritt von Barium an der Stelle
des chirurgischen Eingriffs aufwiesen, 2) ein geringerer Einschnürungsgrad
an der Stelle des chirurgischen Eingriffs und 3) eine Erhöhung fäkaler Pellets
distal zur chirurgischen Eingriffsstelle aufwiesen.
-
Colon-Anastomose
Radiologische
Analyse
-
Beispiel 22
-
Konstruktion der carboxyterminalen
Mutationen in KGF-2
-
Der Carboxyterminus von KGF-2 ist
hoch geladen. Die Dichte dieser geladenen Reste kann die Stabilität und folglich
die Löslichkeit
des Proteins beeinflussen. Um Muteine zu produzieren, die das Protein
in Lösung
stabilisieren könnten,
wurden eine Reihe von Mutationen in diesem Genbereich durchgeführt.
-
Um die Punktmutationen 194 R/E, 194
R/Q, 191 K/E, 191 K/Q, 188 R/E, 188 R/Q zu erzeugen, wurde der 5952-KGFΔ33-5'-AflIII-5'-Primer mit den angegeben
3'-Primern, die
die geeigneten Punktmutationen für KGF-2
enthalten, in PCR-Reaktionen unter Verwendung von dem Fachmann gut
bekannter Standardbedingungen mit KGF2Δ33 als Matrize verwendet. Die
sich ergebenden Produkte wurden mit AflIII und HindIII gespalten
und in den mit NcoI und HindIII gespaltenen E. coli-Expressionsvektor,
pQE60, cloniert.
-
KGF2Δ33,194 R/E-Konstruktions
-
Die folgenden Primer wurden verwendet:
-
-
KGF2Δ33,194 R/E
Nucleotidsequenz:
-
KGF2Δ33,194 R/E
Aminosäuresequenz:
-
KGF2Δ33,194 R/Q Konstruktion:
-
Die folgenden Primer wurden verwendet:
-
-
KGF2 Δ33,194 R/Q
Nucleotidsequenz:
-
KGF2 Δ33,194 R/Q
Aminosäuresequenz:
-
KGF2Δ33,191 K/E Konstruktion:
-
Die folgenden Primer wurden verwendet:
-
-
KGF2Δ33,19l K/E
Nucleotidsequenz:
-
KGF2Δ33,191 K/E
Aminosäuresequenz:
-
KGF2 Δ33,191 K/Q Konstruktion:
-
Die folgenden Primer wurden verwendet:
-
-
KGF2 Δ33,191 K/Q
Nueleatidsequenz:
-
KGF2 Δ33,191 K/Q
Aminasäuresequenz:
-
KGF2Δ33, 188R/E Konstruktion:
-
Die folgenden Primer wurden verwendet:
-
-
KGPF2Δ33, 188R/E
Nucleotidsequenz:
-
KGF233,
188R/E Aminosäuresequenz:
-
KTF2Δ33, 188 R/Q Konstruktion:
-
Die folgenden Primer wurden verwendet:
-
-
-
KGF2Δ33, 188 R/Q
Nucleotidsequenz:
-
KGF2Δ33, 188 R/Q
Aminosäuresequenz:
-
KGF2Δ33, 183K/E- Konstruktion
-
Für
die Mutation 183K/E wurden zwei PCR-Reaktionen für die zielgerichtete Oligonucleotidmutagenese
für dieses
Lysin angesetzt. In einer Reaktion wurde 5952-KGFΔ33-5'-AflIII als 5'-Primer verwendet und KGF-2-183aa-K-bis-E-Antisense
wurde als 3'-Primer
in der Reaktion verwendet. In einer zweiten Reaktion wurde KGF-2-183aa-K-bis-E-Antisense
als 5 '-Primer verwendet
und KGF2-3'HindII-TAA-Stop
wurde als 3 '-Primer
verwendet. KGF2Δ33
wurde als Matrize für
diese Reaktionen verwendet. Die Reaktionen wurden unter Verwendung
von dem Fachmann gut bekannten Standardbedingungen amplifiziert.
Ein Mikroliter jeder dieser PCR-Reaktionen wurde als Matrize in
einer nachfolgenden Reaktion unter Verwendung von 5453-BsphI als
5'-Primer und 5258-HindIII
als 3'-Primer verwendet.
Die Amplifikation erfolgte unter Verwendung dem Fachmann gut bekannter
Standardbedingungen. Das sich ergebende Produkt wurde mit AflIII
und HindIII gespalten und in den mit NcoI und HindIII gespaltenen
E. coli-Expressionsvektor, pQE60, cloniert.
-
Die folgenden Primer wurden verwendet:
-
-
KGF2 Δ33, 183K/E
Nucleotidsequenz
-
-
KGF2 Δ33, 183K/E
Aminosäuresequenz
-
Beispiel 23
-
Wirkung von KGF-2 auf
das Überleben
nach einer Gesamtkörperbestrahlung
bei Balb/c-Mäusen
-
Ionisierende Strahlung wird häufig verwendet,
um viele Malignitäten,
einschließlich
Lungen- und Brustkrebs, Lymphome und Beckentumoren zu behandeln
(Ward, W. F. et al., CRC Handbook of Animal Models of Pulmonary
Disease, CRC Press, S. 165–195
(1989)). Jedoch begrenzt die strahleninduzierte Verletzung (Lunge,
Darm etc.) die Intesität
und den Erfolg der Strahlentherapie (Morgan, G. W. et al., Int.
J. Radfiat. Oncol. Biol. Phys. 31: 361 (1995)). Die Magenschleimhaut
besitzt einen schnellen Zellzyklus und ist besonders senstiv gegenüber cytotoxischen
Agentien (Potten, C. S., et al., In: Cytotoxic Insult to Tissue,
Churchill Livingstone, S. 105–152
(1983)). Einige Manifestationen der Strahlenschäden des Darms schließen akute
Proktitis, Darmfibrose, Striktur oder Fistelbildung ein (Anseline,
D. F. et al., Ann. Surg. 194: 716–724 (1981)). Eine Behandlung, die
die normalen Strukturen vor der Strahlung schützt, ohne die Sensitivität des Tumors
gegenüber
Strahlung zu ändern,
wäre beim
Management dieser Erkrankungen nützlich.
Ungeachtet der bestrahlten Fläche
ist die Strahlendosis durch die Strahlensensitivität des normalen
Gewebes begrenzt. Komplikationen nach einer Ganzkörper- oder
Teilkörperbestrahlung
schließen
Pneumonitis, Fibrose, gastrointestinale Verletzungen und Knochenmarkserkrankungen
ein.
-
Mehrere Cytikine einschließlich IL-1,
TNF, IL-6, IL-12 haben eine Schutzwirkung gegenüber Strahlen nach einer GKB
gezeigt (Neta, R. et al., J. Exp. Med. 173: 1177 (1991)). Man hat
gezeigt, dass IL-11 die Zellen der Dünndarmschleimhaut nach kombinierter
Strahlungs- und Chemotherapie (Du, X. X. et al., Blood 83: 33 (1994))
und strahleninduzierter Verletzung des Thorax schützt (Redlich,
C. A. et al., The Journal of lmmunology 157: 1705–1710 (1996)).
-
Tiere
-
Alle Experimente wurden unter Verwendung
von BALB/c-Mäusen
durchgeführt.
Die Tiere wurden im Alter von 6 Wochen gekauft und waren zu Beginn
der Studie 7 Wochen alt. Alle Manipulationen erfolgten unter Verwendung
aseptischer Verfahren. Diese Studie wurde nach den von Human Genome
Sciences, Inc. Institutional Animal Care and Use Committee aufgeführten Richtlinien
durchgeführt,
das die Experimentiervorschrift überprüfte und
genehmigte.
-
KGF-2
-
Das Protein besteht aus einem menschlichen
Protein mit 141 Aminosäuren,
das als KGF-2Δ33
bezeichnet wird. Dieses Protein ist eine verkürzte Isoform von KGF-2, der
die ersten 33 aminoterminalen Reste des reifen Proteins fehlen.
Das Gen, das dieses Protein codiert, wurde in einen E. coli-Expressionsvektor
cloniert. Für
das Experiment wurden Fraktionen verwendet, die mehr als 95% reines
rekombinantes Material enthielten. KGF-2 wurde in einem Vehikel
formuliert, das 40 mM Na Acetat + 150 mM NaCl, pH 6,5 enthielt.
Verdünnungen
wurden aus einer Stammlösung
unter Verwendung desselben Vehikels hergestellt.
-
Ganzkörperbestrahlung
und Versuchskonzept
-
Mäuse
wurden mit 519 RADS (5,19 Gy) unter Verwendung eines 68-Mark-I-Shepherd-Cäsium-Bestrahlungsgeräts bestrahlt.
KGF-2Δ33
wurde täglich
subkutan, beginnend 2 Tage vor der Bestrahlung und weiterhin 7 Tage
nach der Bestrahlung verabreicht. Alle Mäuse wurden täglich gewogen.
Die Mäusegruppen
wurden randomisiert, damit sie eine von drei Behandlungen erhalten:
Die Ganzkörperbestrahlung
(GKB) plus Puffer, GKB plus KGF-2Δ33
(1 mg/kg sq), GKB plus KGF-2Δ33
(5 mg/kg sq). Es wurden zwei unabhängige Experimente durchgeführt.
-
Ergebnisse
-
Zwei Studien wurden unter Verwendung
bestrahlter Tiere durchgeführt.
In der ersten Studie wurden die Tiere mit 519 RADS (5,19 Gy) bestrahlt.
Die Tiere wurden zwei Tage vor der Bestrahlung und danach täglich 7
Tage mit Puffer oder KGF-2Δ33
bei 1 & 5 mg/kg,
s. q. behandelt. An Tag 25 nach der Gesamtkörperbestrahlung überlebten
1/5 der Tiere in der Puffergruppe. Dagegen bestanden die KGF-2-behandelten
Gruppen aus 5/5 Tiere a 1 mg/kg und 4/5 à 5 mg/kg (44).
-
Zusätzlich zeigten KGF-2 behandelte
Tiere eine 0,9%-ige und 5,3%-ige Gewichtszunahme an Tag 20 nach
der GKB. Dagegen wies die Puffer-behandelte Gruppe einen 4,2%-igen Gewichtsverlust
an Tag 20 auf. Die normalen, unbestrahlten Kontrolltiere im passenden
Alter zeigten eine 6,7%-ige Gewichtszunahme im selben Zeitraum (45).
-
Die Tiere in der zweiten Studie wurden
ebenfalls mit 519 RADS (5,19 Gy) bestrahlt. Diese Tiere wurden zwei
Tage vor der Bestrahlung und danach täglich 7 Tage mit Puffer oder
KGF-2Δ33
bei 1 & 5 mg/kg,
s. q. behandelt. An Tag 15 nach der Gesamtkörperbestrahlung waren alle
Tiere in der Puffergruppe tot. Mit KGF-2 bei 1 mg/kg ergab sich
eine 30%-ige Überlebensrate
und bei 5 mg/kg eine 60%-ige Überlebensrate.
An Tag 25 nach der GKB zeigte die 1 mg/kg-Gruppe eine 20%-ige Überlebensrate
und die 5 mg/kg eine 50%-ige Überlebensrate
(46).
-
Schlussfolgerungen
-
Zusammengefasst zeigen diese Ergebnisse,
dass KGF-2 eine schützende
Wirkung nach einer GKB besitzt. Die Fähigkeit von KGF-2 die Überlebensrate
von Tieren zu erhöhen,
die einer GKB unterzogen wurden, legt nahe, dass es bei strahlungsinduzierten
Verletzungen auch nützlich
wäre und
dass bei der Behandlung von Malignitäten das therapeutische Verhältnis der
Bestrahlung erhöht
wird.
-
Beispiel 24
-
Bewertung von KGF-2 im
TPA-Modell der Hautentzündung
bei Mäusen
-
Um zu zeigen, dass KGF-2 die Progression
von Kontaktdermatitis abschwächen
würde,
wird ein Tetradecanoylphorbolacetat (TPA-) induziertes kutanes Entzündungsmodell
verwendet. Die Verwendung von weiblichen BALB/c- und männlichen
Swiss-Webster-Mäusen
bei der experimentellen Hautentzündung
sind gut charakterisierte, relevante und reproduzierbare Modelle
der Kontaktdermatitis. Man hat gezeigt, dass diese Mäusestämme eine
inflammatorische Langzeitreaktion nach der topischen Anwendung von
TPA entwickeln, die lokale Hämodynamik,
Gefäßpermeabilität und lokale
Leukocytenwanderung umfasst, und diese pathologi schen Veränderungen ähneln denjenigen
der menschlichen Dermatitis (Rao et al., 1993 Inflammation 17(6): 723;
Rao et al. 1994, J. Kipid Mediators Cell Signalling 10: 213).
-
Die Mäusegruppen erhalten intraperitoneal,
subkutan oder intravenös
entweder Vehikel oder KGF-2 60 min nach der topischen Anwendung
von TPA (4 μg/Ohr),
wobei 10 μl
jeweils an der inneren und äußeren Oberfläche des
Ohres als Lösung
in Aceton (200 μg/ml)
angewandt wird. Die Kontrollgruppe erhält 20 μl Aceton als topische Anwendung.
Vier Stunden nach der TPA-Anwendung wurde die Zunahme der Ohrendicke
gemessen und die Ohren werden für
die Histologie abgeschnitten. Um die Gefäßpermeabilität als Reaktion
auf TPA zu bestimmen, wird den Mäusen
intravenös über die
Schwanzvene Evans-Blau (300 mg/kg) zu ausgewählten Zeitpunkten nach der
topischen Anwendung von TPA injiziert, und die Mäuse werden 15 min danach getötet. Die
Ohren werden abgeschnitten und entfernt und dann in Dimethylformamid
extrahiert und zentrifugiert. Die Absorptionswerte werden spektrometrisch
bei 590 nm gemessen.
-
Beispiel 25
-
Auswirkung von KGF-2Δ33 auf die
Wundheilung
-
Die biologischen Wirkungen von KGF-2Δ33 in der
Haut wurden basierend auf den anfänglichen in vitro-Daten untersucht,
die die Kapazität
von KGF-2 zeigen, die primären
menschlichen Keratinocyten sowie Maus-pro-B-BaF3-Zellen zu stimulieren,
die mit dem FGFR-Isoform 2iiib transfiziert wurden. Es wurden erste Experimente
durchgeführt,
um die biologischen Wirkungen von KGF-2Δ33 nach der intradermalen Verabreichung
zu zeigen. Nach den intradermalen Studien wurde KGF-2Δ33 in einer
Reihe von Wundheilungsmodellen (einschließlich Vollhautwunden mittels
einer Biopsiestanze und Schnittwunden) untersucht, um dessen Potential
als Wundheilungsmittel zu bestimmen.
-
Wirkung von KGF-2Δ33 in einem
Glucocoricoid-gehemmten Rattenmodell der Wundheilung
-
Gehemmte Wundheilung ist ein wichtiges
klinisches Problem, das mit einer Reihe von pathologischen Zuständen wie
Diabetes assoziiert ist und eine Komplikation der systemischen Verabreichung
von Steroiden oder Antimetaboliten ist. Es ist bekannt, dass die
Behandlung mit systemischen Glucocorticoiden die Wundheilung bei
Menschen und in Tiermodellen der Gewebereparatur beeinträchtigt.
Nach der Glucocorticoidverabreichung wurde eine Abnahme der zirkulierenden
Monocytenspiegel und eine Hemmung der Procollagensynthese beobachtet.
Die Entzündungsphase
der Heilung und die Matrixsynthese sind deshalb wichtige Faktoren,
die am komplexen Prozess der Gewebereparatur beteiligt sind. In
der vorliegenden Studie wurden die Wirkungen mehrfacher topischer
Anwendungen von KGF-2 bei Vollhautschnittwunden bei Ratten beurteilt,
bei denen die Heilung durch die systemische Verabreichung von Methyprednisolon
beeinträchtigt
wurde.
-
Sprague-Dawley-Ratten (n = 5/Behandlungsgruppe)
wurden 8 mm große
Wunden am Rücken
beigebracht und sie erhielten Methylprednisolon (17 mg/kg, i. m.),
um die Heilung zu hemmen. Die Wunden wurden täglich topisch mit Puffer oder
KGF-2 bei einer Dosierung von 0,1, 0,5 und 1,5 μg in einem Volumen von 50 μl behandelt.
Die Wunden wurden an den Tagen 2, 4, 6 und 8 unter Verwendung eines
kalibrierten Jameson-Tastzirkels ausgemessen. An Tag 6 (Daten nicht
gezeigt) und Tag 8 (47)
zeigten die KGF-2-behandelten Gruppen eine statistisch signifikante
Verringerung des Wundverschlusses im Vergleich zur Pufferkontrolle.
-
Wirkung von KGF-2Δ33 auf die
Wundheilung in einem diabetischen Mausmodell
-
Genetisch homozygoten diabetischen
weiblichen (db+/db+)-Mäusen,
6 Wochen alt (n = 6), mit einem Gewicht von 30–35 g wurden am Rücken Vollhautwunden
mit einer 6 mm-Biopsiestanze
beigebracht. Die Wunden wurden offen gelassen und täglich mit
Placebo oder KGF-2 bei 0,1, 0,5 und 1,5 μg behandelt. Der Wundverschluss
wurde unter Verwendung eines Jameson-Tastzirkels ermittelt. Die
Tiere wurden an Tag 10 getötet,
und die Wunden wurden für
die Histologie geerntet.
-
KGF-2 zeigte eine signifikante Verbesserung
beim prozentualen Wundverschluss bei 0,1 μg (p = 0,02) im Vergleich Placebo
oder der unbehandelten Gruppe. Die Verabreichung von KGF-2 führte auch
zu einer Verbesserung der histologischen Punktebewertung bei 0,1 μg (p = 0,03)
im Vergleich zu Placebo oder der unbehandelten Gruppe (p = 0,01)
und 1,5 μg
(p = 0,05) im Vergleich zur unbehandelten Gruppe.
-
Schlussfolgerungen
-
Basierend auf den vorstehend dargestellten
Ergebnissen zeigt KGF-2 signifikante Aktivität bei gehemmten Bedingungen
wie der Glucocorticoid-Verabreichung und Diabetes. Deshalb kann
KGF-2 bei der Stimulation der Wundheilung nach einem chirurgischen
Eingriff, chronischen Geschwüren
bei Patienten mit Diabetes oder schlechter Durchblutung (z. B. Veneninsuffizienz
und Venengeschwüre),
Verbrennungen und anderen abnormen Wundheilungszuständen wie
Urämie,
Mangelernährung,
Vitaminmangel und systematische Behandlung mit Steroiden und antineoplastischen
Medikamenten klinisch nützlich
sein.
-
Beispiel 26
-
Wirkungen von KGF-2Δ33 auf die
Mundschleimhaut
-
Cytotoxische Agentien, die klinisch
verwendet werden, haben die unglückliche
Wirkung, an manchen Orten wie der Mundschleimhaut die Proliferation
des normalen Epithels zu hemmen, was zu lebensbedrohlichen Störungen der
Schleimhautbarriere führt.
Wir haben Studien durchgeführt,
um die Wirksamkeit von KGF-2 in diesem klinischen Bereich zu untersuchen.
Die Daten unterstützen
eine therapeutische Wirkung von KGF-2 in den Mucositis-Modellen.
-
Wirkungen von KGF-2Δ33 auf die
Hamster-Mundschleimhaut
-
Wir versuchten zu bestimmen, ob KGF-2
die Proliferation des normalen Schleimhautepithels induziert. Die
Wirkung von KGF-2 in der Mundschleimhaut wurde bei syrischen Goldhamstern
beurteilt. Die Wangentasche des Hamsters wurde täglich mit Puffer oder KGF-2Δ33 (bei 0,1, 1 und 10 μg/Wange)
behandelt, der topisch auf die betäubten Hamsterbacken in einem
Volumen von 100 μl
pro Wange aufgetragen wurde. Die Verbindung hatte mit der Wange
mindestens 60 Sekunden Kontakt und wurde daraufhin geschluckt. Nach
siebentägiger
Behandlung wurde den Tieren BrdU injiziert und sie wurden wie vorstehend
beschrieben getötet.
Die proliferierenden Zellen wurden unter Verwendung eines anti-BrdU-Antikörpers markiert. 48 zeigt, dass es einen
signifikanten Anstieg bei der BrdU-Markierung (Zellproliferation)
gab, wenn die Tiere mit 1 μg
und 10 μg KGF-2Δ33 (im Vergleich
zur Pufferbehandlung) behandelt wurden.
-
Die topische Behandlung mit KGF-2
induzierte die Proliferation normaler Schleimhautepithelzellen. Basierend
auf diesen Ergebnissen kann KGF-2 bei der Vermeidung von Mundschleimhautentzündung klinisch nützlich sein,
die durch chemotherapeutische Agentien (oder anderen Therapieschemata
im Bezug auf toxische Arzneimittel), Strahlentherapie oder irgendeinem
kombinierten chemotherapeutischen Strahlungstherapieschema verursacht
wurde. Zusätzlich
kann KGF-2 als Therapeutikum nützlich
sein, indem es die Schwere der Mundschleimhautschädigung als
Folge toxischer Agentien (Chemotherapie) oder Radiotherapie verringert.
-
Beispiel 27
-
Die Auswirkung von KGF-2Δ33 auf die
ischämische
Wundheilung bei Ratten
-
Das Ziel der Experimente, die in
diesem Beispiel präsentiert
werden, bestand darin, die Wirksamkeit von KGF-2 bei der Wundheilung
unter Verwendnug eines ischämischen
Wundheilungsmodells zu ermitteln.
-
Die Blutzufuhr von lokal begrenzter
Haut wurde teilweise durch Herstellung eines zufälligen einzelnen myokutanen
Vollhaut-Pediculuslappens (3 × 4
cm) unterbrochen. An der lokalen Hautstelle wurde eine Vollhautwunde
erzeugt, die aus dem myokutanen Lappen besteht. 60 erwachsene Sprague-Dawley-Ratten
wurden verwendet und zufällig
in Behandlungs-KGF-2Δ33- und Placebo-Gruppen
für diese
Studie (5 Tiere/Gruppe/Zeitpunkt) eingeteilt. Die Wunden wurden
jeweils an Tag 1, 3, 5, 7, 10 und nach der Verletzung geerntet.
-
Die Bruchfestigkeit der Wunde zeigte
keinen signifikanten Unterschied zwischen KGF-2 und den Puffer-behandelten Gruppen
zu frühen
Zeitpunkten bis Tag 10 und 15 nach der Verletzung.
-
Die Ergebnisse zeigen, dass KGF-2
die Bruchfestigkeit bei ischämischen
Wunden 10 Tage nach der Verletzung signifikant verbesserte. Diese
Ergebnisse legen auch nahe, dass Ischämie den Heilungsvorgang bei
beiden Gruppen im Vergleich zu den zuvor erhaltenen Daten verzögert, die
bei den Studien der normalen Wundheilung erhalten wurden.
-
Dieses myokutane Lappen-Modell stellt
Daten und Informationen in einer ischämischen Situation bereit, die
auf einen Venenrückfluss
zurückzuführen ist.
Diese Ergebnisse legen nahe, dass KGF-2 bei der Behandlung von chronischen
Venenbeingeschwüren
verwendet werden könnte,
die durch eine Einschränkung des
Venenrückflusses
und/oder Insuffizienzverursacht wird.
-
Beispiel 28
-
Beurteilung von KGF-2
bei der Heilung von Darm Anastomose bei Ratten
-
Die Ergebnisse des vorliegenden Experiments
zeigen, dass KGF-2Δ33
die Rate der Darmreparatur in einem Darm- oder Colon-Anastomose-Modell
bei Wistar oder Sprague-Dawley-Ratten
erhöht.
Zusätzlich
kann dieses Modell verwendet werden, um zu zeigen, dass KGF-2 und
seine Isoformen die Fähigkeit,
der Gastroinstinal- oder Darmwand Nähte zu binden, erhöhen.
-
Die Verwendung der Ratte bei experimenteller
Anastomose ist ein gut charkterisiertes, relevantes und reproduzierbares
Modell der Wundheilung nach einem chirurgischen Eingriff. Dieses
Modell kann auch erweitert werden, um die Auswirkungen der chronischen
Steroidbehandlung oder die Effekte verschiedener chemotherapeutischer
Therapieschemata auf die Qualität
und Rate der Wundheilung nach einem chirurgischen Eingriff im Colon
oder Dünndarm
auszuweiten (Mastboom W. J. B. et al. Br. J. Surg. 78: 54–56 (1991),
Salm R. et al. J Surg. Oncol. 47: 5–11, (1991), Weiber S. et al.
Eur. Surg. Res. 26: 173–178
(1994)). Die Heilung von Anastomose ähnelt der Wundheilung irgendwo
sonst im Körper.
Die frühen
Phasen der Heilung werden durch akute Entzündung, gefolgt von Fibroblastenproliferation
und Collagensynthese charakterisiert. Collagen wird allmählich modelliert
und die Wunde wird gefestigt, sobald das neue Collagen synthetisiert
wird. (Koruda M. J. und Rolandelli, R. H. J. Surg. Res. 48: 504–515 (1990).
Die meisten postoperativen Komplikationen wie Anastomoseinsuffizienz
treten während
der ersten paar Tage nach dem chirurgischen Eingriff auf – eine Zeitspanne,
während
der die Stärke
des Colons hauptsächlich
durch die Fähigkeit
des Wundrandes, Suturen zu halten, gesichert wird. Es wurde berichtet,
dass die Kapazität
des GI-Trakts, Nähte
zu halten, um 80% während
der ersten postoperativen Tage abnimmt.
-
(Hogstrom H und Haglund U. Acta Chir
Scand 151: 533–535
(1985), Jonsson K, et al. Am J. Surg. 145: 800–803 (1983)).
-
Die Ratten wurden mit einer Kombination
von Ketamin (50 mg/kg) und Xylazin (5 mg/kg) intramuskulär narkotisiert.
Die Bauchhöhle
wurde mit einem 4 cm langen Mittellinienschnitt geöffnet. Ein
1 cm breites Segment des linken Colons wurde 3 cm proximal zur peritonealen
Reflektion reseziert, wobei die Randgefäße erhalten wurden. Eine Einzelschicht
End-zu-End Anastomose wurde mit 8–10 unterbrochenen 5–0 invertierten Vicryl-Suturen
durchgeführt,
um die intestinale Kontinuität
wiederherzustellen. Die Schnittwunde wurde mit 0–3 durchgehender Seidensutur
für die
Muskelschicht und mit Operationsklammern für die Haut geschlossen. Jedes
Tier erhielt eine tägliche
klinische Bewertung, bestehend aus dem individuellen Körpergewicht,
Körpertemperatur
und Nahrungsmuster.
-
Die KGF-2Δ33- und Placebobehandlung wurden
täglich
sk, topisch, ip, im, intragastrisch oder intracoloal unmittelbar
nach dem chirurgischen Eingriff durchgeführt und wurden danach bis zum
Tag der Tötung,
Tag 7, fortgesetzt. Es gab eine unbehandelte Kontrolle, eine Placebogruppe
und KGF-2Δ33-Gruppen.
Zwei Stunden vor der Tötung
wurde den Tieren 100 mg/kg BrdU i. p. injiziert. Die Tiere wurden
24 nach der letzten Behandlung (Tag 5) getötet. Ein Mittellinienschnitt
wurde auf der anterioren Bauchwand durchgeführt und ein 1 cm langes Colonsegment,
einschließlich
der Anstomose wurde entfernt. Es wurde ein drittes Segment an der Stelle
des chirurgischen Eingriffs für
die Gesamtkollagenanalyse entnommen.
-
In einer Reihe von zwei Experimenten
wurden erwachsene männliche
SD-Ratten (n = 6) betäubt
und erhielten eine Einzelschicht-End-zu-End Anastomose des distalen
Darms mit 8– 10
unterbrochenen invertierten 6–0
Prolen-Suturen. Die anastomostische Stelle wurden dann topisch mit
einer Spritze entweder mit Puffer oder KGF-2Δ33 bei Konzentrationen von 1
und 4 μg
behandelt. Die Tiere wurden dann täglich entweder mit Puffer oder
KGF-2Δ33
bei Konzentrationen von 1 mg/kg oder 5 mg/kg ip. behandelt. Die
Tiere wurden an Tag 5 getötet
und das Colon herausgeschnitten und in flüssigem Stickstoff schockgefroren,
liophilisiert und einer Collagenbestimmungen unterzogen. Die Collagenkonzentration
wird als μg
Collagen/mg Trockengewicht Gewebe ausgedrückt. Die statistische Analyse
erfolgte unter Verwendung eines ungepaarten t-Tests. Mittelwert +/– SEM. An
Tag 5 wurden die Ratten narkotisiert und erhielten ein Barium-Klistier,
gefolgt von eine radiologische Analyse. Die radiologische Beurteilung
des Barium-Klistiers der linken End-zu-End Colon-Anatomose aus zwei
Experimenten zeigte eine konsistente Reduzierung bei der peritonealen
Insuffizienz bei KGF-2-be handelten Tieren bei 1 und 5 mg/kg. Diese
Daten sind in der nachstehenden Tabelle gezeigt. Zusätzlich wurde die
Bruchfestigkeit an der Stelle des chirurgischen Eingriffs unter
Verwendung eines Tensitometers untersucht. Es wurden keine signifikanten
Unterschiede zwischen den KGF-2Δ33-
und Puffergruppen beobachtet. Wie in 49 gezeigt,
wurden signifikante Anstiege beim Collagengehalt an der Stelle des
chirurgischen Eingriffs sowohl bei 1 mg/kg KGF-2Δ33 (p = 0,02) als auch bei 5
mg/kg (p = 0,004) relativ zu den Pufferkontrollen gezeigt.
-
Tabelle
Colon-Anastomose
Radialogische
Analyse
-
Männliche
erwachsene SD-Ratten (n = 5) wurden mit einer Kombination von Ketamin
(50 mg/kg) und Xylazin (5 mg/kg) intramuskulär narkotisiert. Die Bauchhöhle wurde
mit einem 4 cm langen Mittellinienschnitt geöffnet. Ein 1 cm breites Segment
des linken Colons wurde 3 cm proximal zur peritonealen Reflektion
reseziert, wobei die Randgefäße erhalten
wurden. Eine Einzelschicht End-zu-End Anastomose wurde mit 8–10 unterbrochenen
5– 0 invertierten
Vicryl-Suturen durchgeführt,
um die intestinale Kontinuität
wiederherzustellen. Die Anastomose wurde dann topisch über eine
Spritze entweder mit Puffer oder KGF-2Δ33 bei Konzentrationen von 1
und 4 μg
behandelt. Die Schnittwunde wurde mit 0–3 durchgehender Seidensutur
für die
Muskelschicht und mit Operationsklammern für die Haut geschlossen. Die
Behandlungen erfolgten dann danach täglich und bestanden aus Puffer
oder KGF-2Δ33
und 1 und 5 mg/kg sc. Am Tag des chirurgischen Eingriffs und täglich danach
wurde gewogen. Die Tiere wurden 24 Stunden nach der letzten Behandlung
(Tag 5) getötet.
Die Tiere wurden narkotisiert und erhielten Bartumklistiere und
wurden in einem konstanten Abstand geröngt. Die Anastomose wurde dann
für die
histopathologische und biomechanische Analyse herausgeschnitten.
-
Beispiel 29
-
Bewertung KGF-2 in einem
Modell der Darmentzündung
-
KGF-2 ist ein Protein, das die Keratinocytnproliferation
in vitro induziert und in einer Reihe von Wundheilungsmodellen in
vivo aktiv ist. Der Zweck dieser Studie bestand darin, zu bestimmen,
ob KGF-2 in einem Modell der Maus-Colitis wirksam ist, die durch
ad libitum Exposition gegenüber
Natriumdextransulfat im Trinkwasser induziert wurde.
-
6 bis 8 Wochen alte weibliche Swiss-Webster-Mäuse (20–25 g, Charles
River, Raleigh, NC) wurden in einem Modell der Darmentzündung verwendet,
die mit einer 4%-igen Natriumdextransulfat-Lösung induziert wurde (DSS,
36.000–44.000
MW, American International Chemistry, Natick, MA), das eine Woche
ad libitum verabreicht wurde. KGF-2 wurde mittels täglicher
parenteraler Verabreichung (n = 10) gegeben. Drei Parameter wurden
verwendet, um die Wirksamkeit zu bestimmen: 1) Klinische Punktebewertung,
basierend auf der Bewertung des Stuhls; 2) histologische Punktebewertung,
basierend auf der Bewertung des Colons und 3) Gewichtsänderung.
Die klinische Punktebewertung bestand aus zwei Teilen, wobei insgesamt
eine maximale Punktzahl von vier erreicht wird. Die Stuhlbeschaffenheit
wurde bewertet als: 0 = fest; 1 = locker; 2 = Diarrhö. Blut im
Stuhl wurde auch auf einer Skala von 0 bis 2 mit 0 = kein Blut;
1 = okkultes Blut und 2 = starke rektale Blutung bewertet. Eine
mittlere Punktebewertung über
3 zeigte eine mögliche
Lethalität
und eine Erkrankung an, die über
ihr behandelbares Stadium fortgeschritten war. Die klinische Punktebewertung
erfolgte an Tag 0, 4, 5, 6 und 7. Um eine histologische Punktebewertung
zu erhalten, wurden Stücke
des aufsteigenden, transversen und absteigenden Colons mittels Verblindung,
basierend aucf einer Punktebewertung der Entzündung (0–3) und einer cryptischen Punktebewertung
(0–4)
ausgewertet. Das Körpergewicht
wurde täglich
gemessen. Die Daten werden als Mittewert + SEM ausgedrückt. Ein
ungepaarter t-Test nach Student wurde verwendet, um signifikante
Unterschiede im Vergleich zur Krankheitskontrolle zu bestimmen (*
p < 0,05; ** p < 0,01; *** p < 0,001).
-
Wenn DSS-behandelten Mäusen eine
tägliche
intraperitoneale (IP) KGF-2-Injektion bei einer Dosis von 1, 5 oder
10 mg/kg 7 Tage verabreicht wurde, reduzierte KGF-2 die klinische
Punktebewertung signifikant um 28, 38 bzw. 50 Prozent. Die histologische
Bewertung glich nahezu der dosisabhängigen Hemmung der klinischen
Punktebewertung, wobei die 1, 5 und 10 mg/kg-Dosis die histologische
Punktebewertung um signifikante 26, 48 und 51 Prozent reduzierte.
KGF-2 reduzierte auch signifikant den mit DSS-induzierter Colitis
assoziierten Gewichtsverlust.
-
In einer zweiten Studie wurde ein
Vergleich der relativen Wirksamkeit von KGF-2Δ33 (10 mg/kg) bei täglicher
IP- oder subkutaner Gabe (SC) durchgeführt. Am Ende des Experiments
an Tag 7 wiesen die IP-injizierten Tiere eine signifikante 34%-ige
Reduzierung in der klinischen Punktebewertung auf, während KGF-2 injizierte
SC zu einer signifikanten 46%-igen
Reduzierung führten.
Basierend auf der Messung der klinischen Punktebewertung und dem
Körpergewicht
ist die SC-Verabreichung von KGF-2 mindestens so wirksam wie die
IP-Verabreichung.
-
Es ist klar, dass die Erfindung anders
umgesetzt werden kann als im Besonderen in der vorstehenden Beschreibung
und den Beispielen beschrieben.
-
Es sind zahlreiche Modifikationen
und Variationen im Lichte der vorstehenden Ausführungen möglich und deshalb kann im Rahmen
der im Anhang befindlichen Patentansprüche die Erfindung anders umgesetzt werden,
als im Besonderen beschrieben.