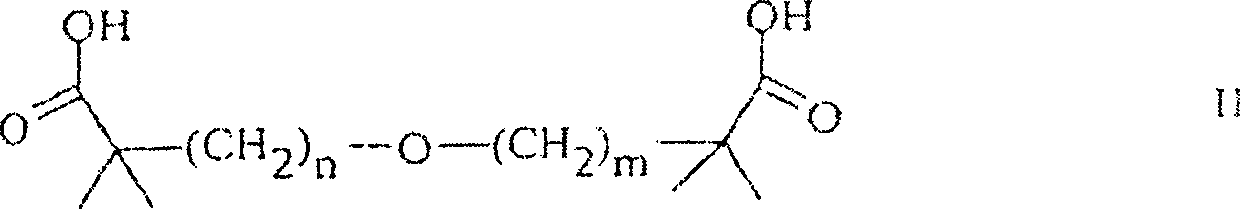DE60107559T2 - Kombination von carboxyalkylethern mit antihypertensiva und pharmazeutische verwendung - Google Patents
Kombination von carboxyalkylethern mit antihypertensiva und pharmazeutische verwendung Download PDFInfo
- Publication number
- DE60107559T2 DE60107559T2 DE60107559T DE60107559T DE60107559T2 DE 60107559 T2 DE60107559 T2 DE 60107559T2 DE 60107559 T DE60107559 T DE 60107559T DE 60107559 T DE60107559 T DE 60107559T DE 60107559 T2 DE60107559 T2 DE 60107559T2
- Authority
- DE
- Germany
- Prior art keywords
- pharmaceutically acceptable
- antihypertensive
- treatment
- pharmaceutical composition
- blocker
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 150000002170 ethers Chemical class 0.000 title 1
- 239000002220 antihypertensive agent Substances 0.000 claims description 62
- 150000003839 salts Chemical class 0.000 claims description 59
- 238000011282 treatment Methods 0.000 claims description 56
- 229940030600 antihypertensive agent Drugs 0.000 claims description 50
- 150000001875 compounds Chemical class 0.000 claims description 39
- 230000003276 anti-hypertensive effect Effects 0.000 claims description 36
- -1 carboxyalkyl ether Chemical compound 0.000 claims description 35
- 206010020772 Hypertension Diseases 0.000 claims description 31
- 239000002253 acid Substances 0.000 claims description 31
- JSDRRTOADPPCHY-HSQYWUDLSA-N quinapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC=CC=C2C1)C(O)=O)CC1=CC=CC=C1 JSDRRTOADPPCHY-HSQYWUDLSA-N 0.000 claims description 31
- 229960001455 quinapril Drugs 0.000 claims description 31
- 239000008194 pharmaceutical composition Substances 0.000 claims description 27
- 241000124008 Mammalia Species 0.000 claims description 24
- 229960000528 amlodipine Drugs 0.000 claims description 22
- 239000000203 mixture Substances 0.000 claims description 21
- 239000003814 drug Substances 0.000 claims description 19
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 claims description 19
- 201000001320 Atherosclerosis Diseases 0.000 claims description 17
- 230000000694 effects Effects 0.000 claims description 17
- 206010002383 Angina Pectoris Diseases 0.000 claims description 15
- 230000000747 cardiac effect Effects 0.000 claims description 12
- 229940127291 Calcium channel antagonist Drugs 0.000 claims description 11
- 229940127088 antihypertensive drug Drugs 0.000 claims description 11
- 239000000480 calcium channel blocker Substances 0.000 claims description 11
- 239000005541 ACE inhibitor Substances 0.000 claims description 10
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 claims description 10
- 239000003937 drug carrier Substances 0.000 claims description 10
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 8
- 208000024172 Cardiovascular disease Diseases 0.000 claims description 8
- 239000002160 alpha blocker Substances 0.000 claims description 8
- 239000002876 beta blocker Substances 0.000 claims description 8
- 229910052799 carbon Inorganic materials 0.000 claims description 8
- 239000002934 diuretic Substances 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 125000006727 (C1-C6) alkenyl group Chemical group 0.000 claims description 6
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 6
- 239000002333 angiotensin II receptor antagonist Substances 0.000 claims description 6
- 229940097320 beta blocking agent Drugs 0.000 claims description 6
- 239000003085 diluting agent Substances 0.000 claims description 6
- 230000001225 therapeutic effect Effects 0.000 claims description 6
- 125000000217 alkyl group Chemical group 0.000 claims description 5
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims description 5
- 210000004351 coronary vessel Anatomy 0.000 claims description 4
- 239000002552 dosage form Substances 0.000 claims description 4
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 4
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 4
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 claims description 4
- 208000019553 vascular disease Diseases 0.000 claims description 4
- 125000000304 alkynyl group Chemical group 0.000 claims description 3
- 125000002837 carbocyclic group Chemical group 0.000 claims description 3
- 230000002526 effect on cardiovascular system Effects 0.000 claims description 3
- IBBLRJGOOANPTQ-JKVLGAQCSA-N quinapril hydrochloride Chemical compound Cl.C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC=CC=C2C1)C(O)=O)CC1=CC=CC=C1 IBBLRJGOOANPTQ-JKVLGAQCSA-N 0.000 claims description 3
- 150000003536 tetrazoles Chemical class 0.000 claims description 3
- 125000003342 alkenyl group Chemical group 0.000 claims description 2
- 238000002360 preparation method Methods 0.000 claims description 2
- 229960003042 quinapril hydrochloride Drugs 0.000 claims description 2
- 208000037260 Atherosclerotic Plaque Diseases 0.000 claims 6
- UVSDAPVYVXZPDP-UHFFFAOYSA-N calcium;6-(5-carboxy-5-methylhexoxy)-2,2-dimethylhexanoic acid Chemical compound [Ca].OC(=O)C(C)(C)CCCCOCCCCC(C)(C)C(O)=O UVSDAPVYVXZPDP-UHFFFAOYSA-N 0.000 claims 6
- HTIQEAQVCYTUBX-UHFFFAOYSA-N amlodipine Chemical compound CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl HTIQEAQVCYTUBX-UHFFFAOYSA-N 0.000 claims 5
- 229940126317 angiotensin II receptor antagonist Drugs 0.000 claims 5
- 230000001882 diuretic effect Effects 0.000 claims 5
- 125000004432 carbon atom Chemical group C* 0.000 claims 2
- 125000001475 halogen functional group Chemical group 0.000 claims 2
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims 2
- 125000005741 alkyl alkenyl group Chemical group 0.000 claims 1
- 210000001715 carotid artery Anatomy 0.000 claims 1
- 230000002093 peripheral effect Effects 0.000 claims 1
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 27
- NLFBCYMMUAKCPC-KQQUZDAGSA-N ethyl (e)-3-[3-amino-2-cyano-1-[(e)-3-ethoxy-3-oxoprop-1-enyl]sulfanyl-3-oxoprop-1-enyl]sulfanylprop-2-enoate Chemical compound CCOC(=O)\C=C\SC(=C(C#N)C(N)=O)S\C=C\C(=O)OCC NLFBCYMMUAKCPC-KQQUZDAGSA-N 0.000 description 25
- ZPBWCRDSRKPIDG-UHFFFAOYSA-N amlodipine benzenesulfonate Chemical compound OS(=O)(=O)C1=CC=CC=C1.CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl ZPBWCRDSRKPIDG-UHFFFAOYSA-N 0.000 description 20
- 230000036772 blood pressure Effects 0.000 description 18
- 238000012360 testing method Methods 0.000 description 15
- 208000031226 Hyperlipidaemia Diseases 0.000 description 14
- 238000011125 single therapy Methods 0.000 description 14
- 235000012000 cholesterol Nutrition 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 9
- 208000029078 coronary artery disease Diseases 0.000 description 9
- 239000012458 free base Substances 0.000 description 9
- 208000010125 myocardial infarction Diseases 0.000 description 9
- 239000003981 vehicle Substances 0.000 description 9
- 108010007622 LDL Lipoproteins Proteins 0.000 description 8
- 102000007330 LDL Lipoproteins Human genes 0.000 description 8
- 241000700159 Rattus Species 0.000 description 8
- 201000010099 disease Diseases 0.000 description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- 238000002604 ultrasonography Methods 0.000 description 8
- 108010010234 HDL Lipoproteins Proteins 0.000 description 7
- 102000015779 HDL Lipoproteins Human genes 0.000 description 7
- 238000003556 assay Methods 0.000 description 7
- 235000005911 diet Nutrition 0.000 description 7
- 230000037213 diet Effects 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 150000002632 lipids Chemical class 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 238000000034 method Methods 0.000 description 7
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 238000004364 calculation method Methods 0.000 description 6
- 238000002586 coronary angiography Methods 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 241000282412 Homo Species 0.000 description 5
- 208000006011 Stroke Diseases 0.000 description 5
- 230000007211 cardiovascular event Effects 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 241000894007 species Species 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- SNIOPGDIGTZGOP-UHFFFAOYSA-N Nitroglycerin Chemical compound [O-][N+](=O)OCC(O[N+]([O-])=O)CO[N+]([O-])=O SNIOPGDIGTZGOP-UHFFFAOYSA-N 0.000 description 4
- 239000000006 Nitroglycerin Substances 0.000 description 4
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 4
- 125000002091 cationic group Chemical group 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 229960003711 glyceryl trinitrate Drugs 0.000 description 4
- 238000011835 investigation Methods 0.000 description 4
- 230000003902 lesion Effects 0.000 description 4
- QKAYGRBHBMRHEC-UHFFFAOYSA-N n-[5-amino-4-[6-(aminomethyl)-3,4,5-trihydroxyoxan-2-yl]oxy-2-[3,5-dihydroxy-6-(hydroxymethyl)-4-[(2,2,2-trifluoroacetyl)amino]oxan-2-yl]oxy-3-hydroxycyclohexyl]pentadecanamide Chemical compound OC1C(OC2C(C(NC(=O)C(F)(F)F)C(O)C(CO)O2)O)C(NC(=O)CCCCCCCCCCCCCC)CC(N)C1OC1OC(CN)C(O)C(O)C1O QKAYGRBHBMRHEC-UHFFFAOYSA-N 0.000 description 4
- 230000010412 perfusion Effects 0.000 description 4
- 239000000902 placebo Substances 0.000 description 4
- 229940068196 placebo Drugs 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- CABVTRNMFUVUDM-VRHQGPGLSA-N (3S)-3-hydroxy-3-methylglutaryl-CoA Chemical compound O[C@@H]1[C@H](OP(O)(O)=O)[C@@H](COP(O)(=O)OP(O)(=O)OCC(C)(C)[C@@H](O)C(=O)NCCC(=O)NCCSC(=O)C[C@@](O)(CC(O)=O)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 CABVTRNMFUVUDM-VRHQGPGLSA-N 0.000 description 3
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 206010019280 Heart failures Diseases 0.000 description 3
- 238000008214 LDL Cholesterol Methods 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 229910002651 NO3 Inorganic materials 0.000 description 3
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 3
- 208000002193 Pain Diseases 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000002648 combination therapy Methods 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 3
- 229940124549 vasodilator Drugs 0.000 description 3
- 239000003071 vasodilator agent Substances 0.000 description 3
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 239000002080 C09CA02 - Eprosartan Substances 0.000 description 2
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 2
- 0 CCNC(C)(*)C(C)C1CC(C)C*C1 Chemical compound CCNC(C)(*)C(C)C1CC(C)C*C1 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical class [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 208000006029 Cardiomegaly Diseases 0.000 description 2
- 208000014882 Carotid artery disease Diseases 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 108010061435 Enalapril Proteins 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 208000031481 Pathologic Constriction Diseases 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-L Phosphate ion(2-) Chemical compound OP([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-L 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 206010042434 Sudden death Diseases 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 108010062497 VLDL Lipoproteins Proteins 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 229940124308 alpha-adrenoreceptor antagonist Drugs 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229960004005 amlodipine besylate Drugs 0.000 description 2
- 229950010351 amosulalol Drugs 0.000 description 2
- LVEXHFZHOIWIIP-UHFFFAOYSA-N amosulalol Chemical compound COC1=CC=CC=C1OCCNCC(O)C1=CC=C(C)C(S(N)(=O)=O)=C1 LVEXHFZHOIWIIP-UHFFFAOYSA-N 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 230000003257 anti-anginal effect Effects 0.000 description 2
- 239000003529 anticholesteremic agent Substances 0.000 description 2
- 229940127226 anticholesterol agent Drugs 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 229950010731 arotinolol Drugs 0.000 description 2
- BHIAIPWSVYSKJS-UHFFFAOYSA-N arotinolol Chemical compound S1C(SCC(O)CNC(C)(C)C)=NC(C=2SC(=CC=2)C(N)=O)=C1 BHIAIPWSVYSKJS-UHFFFAOYSA-N 0.000 description 2
- 230000003143 atherosclerotic effect Effects 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- UPABQMWFWCMOFV-UHFFFAOYSA-N benethamine Chemical compound C=1C=CC=CC=1CNCCC1=CC=CC=C1 UPABQMWFWCMOFV-UHFFFAOYSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 2
- 229960001231 choline Drugs 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 239000006184 cosolvent Substances 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 230000035487 diastolic blood pressure Effects 0.000 description 2
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 2
- 229940043237 diethanolamine Drugs 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 2
- 229940030606 diuretics Drugs 0.000 description 2
- 239000000890 drug combination Substances 0.000 description 2
- 238000002651 drug therapy Methods 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 208000019622 heart disease Diseases 0.000 description 2
- 238000002657 hormone replacement therapy Methods 0.000 description 2
- 229960002003 hydrochlorothiazide Drugs 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 230000000302 ischemic effect Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 230000002107 myocardial effect Effects 0.000 description 2
- 235000019371 penicillin G benzathine Nutrition 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 229960005141 piperazine Drugs 0.000 description 2
- 229920000136 polysorbate Polymers 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000009097 single-agent therapy Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 208000037804 stenosis Diseases 0.000 description 2
- 230000036262 stenosis Effects 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000008719 thickening Effects 0.000 description 2
- 229960000281 trometamol Drugs 0.000 description 2
- HMJIYCCIJYRONP-UHFFFAOYSA-N (+-)-Isradipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)C)C1C1=CC=CC2=NON=C12 HMJIYCCIJYRONP-UHFFFAOYSA-N 0.000 description 1
- QKIVRALZQSUWHH-SFYZADRCSA-N (1s,2r)-2-[[2-(hydroxyamino)-2-oxoethyl]-methylcarbamoyl]cyclohexane-1-carboxylic acid Chemical compound ONC(=O)CN(C)C(=O)[C@@H]1CCCC[C@@H]1C(O)=O QKIVRALZQSUWHH-SFYZADRCSA-N 0.000 description 1
- GKYIONYOYVKKQI-MPGHIAIKSA-N (2s)-2-[[(2s,3r)-2-(benzoylsulfanylmethyl)-3-phenylbutanoyl]amino]propanoic acid Chemical compound C([C@H](C(=O)N[C@@H](C)C(O)=O)[C@@H](C)C=1C=CC=CC=1)SC(=O)C1=CC=CC=C1 GKYIONYOYVKKQI-MPGHIAIKSA-N 0.000 description 1
- LPUDGHQMOAHMMF-JBACZVJFSA-N (2s)-2-[[[(2s)-6-amino-2-(methanesulfonamido)hexanoyl]amino]methyl]-3-[1-[[(1s)-1-carboxy-2-(4-hydroxyphenyl)ethyl]carbamoyl]cyclopentyl]propanoic acid Chemical compound N([C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C(=O)C1(C[C@@H](CNC(=O)[C@H](CCCCN)NS(=O)(=O)C)C(O)=O)CCCC1 LPUDGHQMOAHMMF-JBACZVJFSA-N 0.000 description 1
- BIDNLKIUORFRQP-XYGFDPSESA-N (2s,4s)-4-cyclohexyl-1-[2-[[(1s)-2-methyl-1-propanoyloxypropoxy]-(4-phenylbutyl)phosphoryl]acetyl]pyrrolidine-2-carboxylic acid Chemical compound C([P@@](=O)(O[C@H](OC(=O)CC)C(C)C)CC(=O)N1[C@@H](C[C@H](C1)C1CCCCC1)C(O)=O)CCCC1=CC=CC=C1 BIDNLKIUORFRQP-XYGFDPSESA-N 0.000 description 1
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 1
- KJTLQQUUPVSXIM-ZCFIWIBFSA-N (R)-mevalonic acid Chemical compound OCC[C@](O)(C)CC(O)=O KJTLQQUUPVSXIM-ZCFIWIBFSA-N 0.000 description 1
- SGUAFYQXFOLMHL-ACJLOTCBSA-N (R,R)-labetalol Chemical compound C([C@@H](C)NC[C@H](O)C=1C=C(C(O)=CC=1)C(N)=O)CC1=CC=CC=C1 SGUAFYQXFOLMHL-ACJLOTCBSA-N 0.000 description 1
- UUUHXMGGBIUAPW-UHFFFAOYSA-N 1-[1-[2-[[5-amino-2-[[1-[5-(diaminomethylideneamino)-2-[[1-[3-(1h-indol-3-yl)-2-[(5-oxopyrrolidine-2-carbonyl)amino]propanoyl]pyrrolidine-2-carbonyl]amino]pentanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-methylpentanoyl]pyrrolidine-2-carbon Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(C(C)CC)NC(=O)C(CCC(N)=O)NC(=O)C1CCCN1C(=O)C(CCCN=C(N)N)NC(=O)C1CCCN1C(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C1CCC(=O)N1 UUUHXMGGBIUAPW-UHFFFAOYSA-N 0.000 description 1
- JQSAYKKFZOSZGJ-UHFFFAOYSA-N 1-[bis(4-fluorophenyl)methyl]-4-[(2,3,4-trimethoxyphenyl)methyl]piperazine Chemical compound COC1=C(OC)C(OC)=CC=C1CN1CCN(C(C=2C=CC(F)=CC=2)C=2C=CC(F)=CC=2)CC1 JQSAYKKFZOSZGJ-UHFFFAOYSA-N 0.000 description 1
- SGUAFYQXFOLMHL-UHFFFAOYSA-N 2-hydroxy-5-{1-hydroxy-2-[(4-phenylbutan-2-yl)amino]ethyl}benzamide Chemical compound C=1C=C(O)C(C(N)=O)=CC=1C(O)CNC(C)CCC1=CC=CC=C1 SGUAFYQXFOLMHL-UHFFFAOYSA-N 0.000 description 1
- JXZZEXZZKAWDSP-UHFFFAOYSA-N 3-(2-(4-Benzamidopiperid-1-yl)ethyl)indole Chemical compound C1CN(CCC=2C3=CC=CC=C3NC=2)CCC1NC(=O)C1=CC=CC=C1 JXZZEXZZKAWDSP-UHFFFAOYSA-N 0.000 description 1
- UIAGMCDKSXEBJQ-IBGZPJMESA-N 3-o-(2-methoxyethyl) 5-o-propan-2-yl (4s)-2,6-dimethyl-4-(3-nitrophenyl)-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound COCCOC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)C)[C@H]1C1=CC=CC([N+]([O-])=O)=C1 UIAGMCDKSXEBJQ-IBGZPJMESA-N 0.000 description 1
- UYNVMODNBIQBMV-UHFFFAOYSA-N 4-[1-hydroxy-2-[4-(phenylmethyl)-1-piperidinyl]propyl]phenol Chemical compound C1CC(CC=2C=CC=CC=2)CCN1C(C)C(O)C1=CC=C(O)C=C1 UYNVMODNBIQBMV-UHFFFAOYSA-N 0.000 description 1
- LTSOENFXCPOCHG-GQCTYLIASA-N 4-chloro-6-[[(e)-3-oxobut-1-enyl]amino]-1-n-prop-2-enylbenzene-1,3-disulfonamide Chemical compound CC(=O)\C=C\NC1=CC(Cl)=C(S(N)(=O)=O)C=C1S(=O)(=O)NCC=C LTSOENFXCPOCHG-GQCTYLIASA-N 0.000 description 1
- LBXHRAWDUMTPSE-AOOOYVTPSA-N 4-chloro-N-[(2S,6R)-2,6-dimethyl-1-piperidinyl]-3-sulfamoylbenzamide Chemical compound C[C@H]1CCC[C@@H](C)N1NC(=O)C1=CC=C(Cl)C(S(N)(=O)=O)=C1 LBXHRAWDUMTPSE-AOOOYVTPSA-N 0.000 description 1
- BNNMDMGPZUOOOE-UHFFFAOYSA-N 4-methylbenzenesulfonic acid Chemical class CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1 BNNMDMGPZUOOOE-UHFFFAOYSA-N 0.000 description 1
- RZTAMFZIAATZDJ-HNNXBMFYSA-N 5-o-ethyl 3-o-methyl (4s)-4-(2,3-dichlorophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OC)[C@@H]1C1=CC=CC(Cl)=C1Cl RZTAMFZIAATZDJ-HNNXBMFYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 102100030988 Angiotensin-converting enzyme Human genes 0.000 description 1
- 101150102415 Apob gene Proteins 0.000 description 1
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 1
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 1
- 238000012935 Averaging Methods 0.000 description 1
- 239000004135 Bone phosphate Substances 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 239000002083 C09CA01 - Losartan Substances 0.000 description 1
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 206010071200 Carbohydrate intolerance Diseases 0.000 description 1
- 208000020446 Cardiac disease Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- JOATXPAWOHTVSZ-UHFFFAOYSA-N Celiprolol Chemical compound CCN(CC)C(=O)NC1=CC=C(OCC(O)CNC(C)(C)C)C(C(C)=O)=C1 JOATXPAWOHTVSZ-UHFFFAOYSA-N 0.000 description 1
- 108091006146 Channels Proteins 0.000 description 1
- 206010008479 Chest Pain Diseases 0.000 description 1
- NENBAISIHCWPKP-UHFFFAOYSA-N Clofenamide Chemical compound NS(=O)(=O)C1=CC=C(Cl)C(S(N)(=O)=O)=C1 NENBAISIHCWPKP-UHFFFAOYSA-N 0.000 description 1
- 206010010904 Convulsion Diseases 0.000 description 1
- KJTLQQUUPVSXIM-UHFFFAOYSA-N DL-mevalonic acid Natural products OCCC(O)(C)CC(O)=O KJTLQQUUPVSXIM-UHFFFAOYSA-N 0.000 description 1
- 208000032928 Dyslipidaemia Diseases 0.000 description 1
- 108010066671 Enalaprilat Proteins 0.000 description 1
- YARKMNAWFIMDKV-UHFFFAOYSA-N Epanolol Chemical compound C=1C=CC=C(C#N)C=1OCC(O)CNCCNC(=O)CC1=CC=C(O)C=C1 YARKMNAWFIMDKV-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010023302 HDL Cholesterol Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical group [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 108010028554 LDL Cholesterol Proteins 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 208000017170 Lipid metabolism disease Diseases 0.000 description 1
- 108010033266 Lipoprotein(a) Proteins 0.000 description 1
- 102000057248 Lipoprotein(a) Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- UWWDHYUMIORJTA-HSQYWUDLSA-N Moexipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC(OC)=C(OC)C=C2C1)C(O)=O)CC1=CC=CC=C1 UWWDHYUMIORJTA-HSQYWUDLSA-N 0.000 description 1
- KBAFPSLPKGSANY-UHFFFAOYSA-N Naftidrofuryl Chemical compound C=1C=CC2=CC=CC=C2C=1CC(C(=O)OCCN(CC)CC)CC1CCCO1 KBAFPSLPKGSANY-UHFFFAOYSA-N 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- CWRVKFFCRWGWCS-UHFFFAOYSA-N Pentrazole Chemical compound C1CCCCC2=NN=NN21 CWRVKFFCRWGWCS-UHFFFAOYSA-N 0.000 description 1
- 108090000882 Peptidyl-Dipeptidase A Proteins 0.000 description 1
- 208000018262 Peripheral vascular disease Diseases 0.000 description 1
- CYLWJCABXYDINA-UHFFFAOYSA-N Polythiazide Polymers ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)N(C)C(CSCC(F)(F)F)NC2=C1 CYLWJCABXYDINA-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 244000000231 Sesamum indicum Species 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- DDNCQMVWWZOMLN-IRLDBZIGSA-N Vinpocetine Chemical compound C1=CC=C2C(CCN3CCC4)=C5[C@@H]3[C@]4(CC)C=C(C(=O)OCC)N5C2=C1 DDNCQMVWWZOMLN-IRLDBZIGSA-N 0.000 description 1
- BLGXFZZNTVWLAY-CCZXDCJGSA-N Yohimbine Natural products C1=CC=C2C(CCN3C[C@@H]4CC[C@@H](O)[C@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-CCZXDCJGSA-N 0.000 description 1
- 229940077422 accupril Drugs 0.000 description 1
- 229960002122 acebutolol Drugs 0.000 description 1
- GOEMGAFJFRBGGG-UHFFFAOYSA-N acebutolol Chemical compound CCCC(=O)NC1=CC=C(OCC(O)CNC(C)C)C(C(C)=O)=C1 GOEMGAFJFRBGGG-UHFFFAOYSA-N 0.000 description 1
- KTUFKADDDORSSI-UHFFFAOYSA-N acebutolol hydrochloride Chemical compound Cl.CCCC(=O)NC1=CC=C(OCC(O)CNC(C)C)C(C(C)=O)=C1 KTUFKADDDORSSI-UHFFFAOYSA-N 0.000 description 1
- 229960003830 acebutolol hydrochloride Drugs 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- PAZJSJFMUHDSTF-UHFFFAOYSA-N alprenolol Chemical compound CC(C)NCC(O)COC1=CC=CC=C1CC=C PAZJSJFMUHDSTF-UHFFFAOYSA-N 0.000 description 1
- 229960002213 alprenolol Drugs 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 229950007019 ambuside Drugs 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000002399 angioplasty Methods 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 239000003524 antilipemic agent Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 230000004872 arterial blood pressure Effects 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 229960005370 atorvastatin Drugs 0.000 description 1
- 229960004374 befunolol Drugs 0.000 description 1
- ZPQPDBIHYCBNIG-UHFFFAOYSA-N befunolol Chemical compound CC(C)NCC(O)COC1=CC=CC2=C1OC(C(C)=O)=C2 ZPQPDBIHYCBNIG-UHFFFAOYSA-N 0.000 description 1
- FYJJXENSONZJRG-UHFFFAOYSA-N bencyclane Chemical compound C=1C=CC=CC=1CC1(OCCCN(C)C)CCCCCC1 FYJJXENSONZJRG-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- WWIWLTSSHDKOKO-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1.OS(=O)(=O)C1=CC=CC=C1 WWIWLTSSHDKOKO-UHFFFAOYSA-N 0.000 description 1
- KKBIUAUSZKGNOA-HNAYVOBHSA-N benzyl (2s)-2-[[(2s)-2-(acetylsulfanylmethyl)-3-(1,3-benzodioxol-5-yl)propanoyl]amino]propanoate Chemical compound O=C([C@@H](NC(=O)[C@@H](CSC(C)=O)CC=1C=C2OCOC2=CC=1)C)OCC1=CC=CC=C1 KKBIUAUSZKGNOA-HNAYVOBHSA-N 0.000 description 1
- IVBOFTGCTWVBLF-GOSISDBHSA-N benzyl 2-[[(2s)-2-(acetylsulfanylmethyl)-3-(1,3-benzodioxol-5-yl)propanoyl]amino]acetate Chemical compound O=C([C@H](CC=1C=C2OCOC2=CC=1)CSC(=O)C)NCC(=O)OCC1=CC=CC=C1 IVBOFTGCTWVBLF-GOSISDBHSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- BLGXFZZNTVWLAY-UHFFFAOYSA-N beta-Yohimbin Natural products C1=CC=C2C(CCN3CC4CCC(O)C(C4CC33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-UHFFFAOYSA-N 0.000 description 1
- 229960003588 bevantolol Drugs 0.000 description 1
- HXLAFSUPPDYFEO-UHFFFAOYSA-N bevantolol Chemical compound C1=C(OC)C(OC)=CC=C1CCNCC(O)COC1=CC=CC(C)=C1 HXLAFSUPPDYFEO-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- DDPMGIMJSRUULN-UHFFFAOYSA-N buphedrone Chemical compound CCC(NC)C(=O)C1=CC=CC=C1 DDPMGIMJSRUULN-UHFFFAOYSA-N 0.000 description 1
- HQIRNZOQPUAHHV-UHFFFAOYSA-N bupranolol Chemical compound CC1=CC=C(Cl)C(OCC(O)CNC(C)(C)C)=C1 HQIRNZOQPUAHHV-UHFFFAOYSA-N 0.000 description 1
- 229960000330 bupranolol Drugs 0.000 description 1
- HZIYHIRJHYIRQO-UHFFFAOYSA-N butazolamide Chemical compound CCCC(=O)NC1=NN=C(S(N)(=O)=O)S1 HZIYHIRJHYIRQO-UHFFFAOYSA-N 0.000 description 1
- 229950000426 butazolamide Drugs 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229960000830 captopril Drugs 0.000 description 1
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 208000037876 carotid Atherosclerosis Diseases 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 229960002320 celiprolol Drugs 0.000 description 1
- IHJCXVZDYSXXFT-UHFFFAOYSA-N chloraminophenamide Chemical compound NC1=CC(Cl)=C(S(N)(=O)=O)C=C1S(N)(=O)=O IHJCXVZDYSXXFT-UHFFFAOYSA-N 0.000 description 1
- 229960002155 chlorothiazide Drugs 0.000 description 1
- 229960002883 clofenamide Drugs 0.000 description 1
- 229960004070 clopamide Drugs 0.000 description 1
- XYCMOTOFHFTUIU-UHFFFAOYSA-N cloranolol Chemical compound CC(C)(C)NCC(O)COC1=CC(Cl)=CC=C1Cl XYCMOTOFHFTUIU-UHFFFAOYSA-N 0.000 description 1
- 229960004893 cloranolol Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000007887 coronary angioplasty Methods 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 229950007942 dilevalol Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 229960000873 enalapril Drugs 0.000 description 1
- GBXSMTUPTTWBMN-XIRDDKMYSA-N enalapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 GBXSMTUPTTWBMN-XIRDDKMYSA-N 0.000 description 1
- OYFJQPXVCSSHAI-QFPUQLAESA-N enalapril maleate Chemical compound OC(=O)\C=C/C(O)=O.C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 OYFJQPXVCSSHAI-QFPUQLAESA-N 0.000 description 1
- 229960000309 enalapril maleate Drugs 0.000 description 1
- 229960002680 enalaprilat Drugs 0.000 description 1
- MZYVOFLIPYDBGD-MLZQUWKJSA-N enalaprilat dihydrate Chemical compound O.O.C([C@H](N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)C(O)=O)CC1=CC=CC=C1 MZYVOFLIPYDBGD-MLZQUWKJSA-N 0.000 description 1
- 229960002711 epanolol Drugs 0.000 description 1
- 229960004563 eprosartan Drugs 0.000 description 1
- OROAFUQRIXKEMV-LDADJPATSA-N eprosartan Chemical compound C=1C=C(C(O)=O)C=CC=1CN1C(CCCC)=NC=C1\C=C(C(O)=O)/CC1=CC=CS1 OROAFUQRIXKEMV-LDADJPATSA-N 0.000 description 1
- 229960000573 eprosartan mesylate Drugs 0.000 description 1
- DJSLTDBPKHORNY-XMMWENQYSA-N eprosartan methanesulfonate Chemical compound CS(O)(=O)=O.C=1C=C(C(O)=O)C=CC=1CN1C(CCCC)=NC=C1\C=C(C(O)=O)/CC1=CC=CS1 DJSLTDBPKHORNY-XMMWENQYSA-N 0.000 description 1
- SLFUXNFVAANERW-UHFFFAOYSA-N ethyl hexanoate;potassium Chemical compound [K].CCCCCC(=O)OCC SLFUXNFVAANERW-UHFFFAOYSA-N 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 229950005203 fasidotril Drugs 0.000 description 1
- 229960002435 fasudil Drugs 0.000 description 1
- NGOGFTYYXHNFQH-UHFFFAOYSA-N fasudil Chemical compound C=1C=CC2=CN=CC=C2C=1S(=O)(=O)N1CCCNCC1 NGOGFTYYXHNFQH-UHFFFAOYSA-N 0.000 description 1
- 229960003580 felodipine Drugs 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 229960002490 fosinopril Drugs 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 238000007446 glucose tolerance test Methods 0.000 description 1
- 230000036449 good health Effects 0.000 description 1
- 244000144993 groups of animals Species 0.000 description 1
- 230000003760 hair shine Effects 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 230000001631 hypertensive effect Effects 0.000 description 1
- 229950010375 idrapril Drugs 0.000 description 1
- 229960003998 ifenprodil Drugs 0.000 description 1
- 229960001195 imidapril Drugs 0.000 description 1
- KLZWOWYOHUKJIG-BPUTZDHNSA-N imidapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1C(N(C)C[C@H]1C(O)=O)=O)CC1=CC=CC=C1 KLZWOWYOHUKJIG-BPUTZDHNSA-N 0.000 description 1
- 229960002056 indoramin Drugs 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- MOYKHGMNXAOIAT-JGWLITMVSA-N isosorbide dinitrate Chemical compound [O-][N+](=O)O[C@H]1CO[C@@H]2[C@H](O[N+](=O)[O-])CO[C@@H]21 MOYKHGMNXAOIAT-JGWLITMVSA-N 0.000 description 1
- 229960000201 isosorbide dinitrate Drugs 0.000 description 1
- YWXYYJSYQOXTPL-SLPGGIOYSA-N isosorbide mononitrate Chemical compound [O-][N+](=O)O[C@@H]1CO[C@@H]2[C@@H](O)CO[C@@H]21 YWXYYJSYQOXTPL-SLPGGIOYSA-N 0.000 description 1
- 229960003827 isosorbide mononitrate Drugs 0.000 description 1
- 229960004427 isradipine Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229950007692 lomerizine Drugs 0.000 description 1
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical compound CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 description 1
- 229960004773 losartan Drugs 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 229960003194 meglumine Drugs 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- AXLHVTKGDPVANO-UHFFFAOYSA-N methyl 2-amino-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoate Chemical compound COC(=O)C(N)CNC(=O)OC(C)(C)C AXLHVTKGDPVANO-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 229960005170 moexipril Drugs 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- 229960004501 nadoxolol Drugs 0.000 description 1
- UPZVYDSBLFNMLK-UHFFFAOYSA-N nadoxolol Chemical compound C1=CC=C2C(OCC(O)CC(/N)=N/O)=CC=CC2=C1 UPZVYDSBLFNMLK-UHFFFAOYSA-N 0.000 description 1
- 229960001132 naftidrofuryl Drugs 0.000 description 1
- 229960001597 nifedipine Drugs 0.000 description 1
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 1
- 229960000715 nimodipine Drugs 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 229940036132 norvasc Drugs 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 238000003305 oral gavage Methods 0.000 description 1
- 229940097258 other antihypertensives in atc Drugs 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229960002582 perindopril Drugs 0.000 description 1
- IPVQLZZIHOAWMC-QXKUPLGCSA-N perindopril Chemical compound C1CCC[C@H]2C[C@@H](C(O)=O)N(C(=O)[C@H](C)N[C@@H](CCC)C(=O)OCC)[C@H]21 IPVQLZZIHOAWMC-QXKUPLGCSA-N 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229960005483 polythiazide Drugs 0.000 description 1
- 229920000046 polythiazide Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- BDAWXSQJJCIFIK-UHFFFAOYSA-N potassium methoxide Chemical compound [K+].[O-]C BDAWXSQJJCIFIK-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- FLSLEGPOVLMJMN-YSSFQJQWSA-N quinaprilat Chemical compound C([C@H](N[C@@H](C)C(=O)N1[C@@H](CC2=CC=CC=C2C1)C(O)=O)C(O)=O)CC1=CC=CC=C1 FLSLEGPOVLMJMN-YSSFQJQWSA-N 0.000 description 1
- 229960003401 ramipril Drugs 0.000 description 1
- HDACQVRGBOVJII-JBDAPHQKSA-N ramipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 HDACQVRGBOVJII-JBDAPHQKSA-N 0.000 description 1
- 238000009790 rate-determining step (RDS) Methods 0.000 description 1
- 239000003087 receptor blocking agent Substances 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229950001780 sampatrilat Drugs 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 235000021003 saturated fats Nutrition 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 230000000391 smoking effect Effects 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 229960002909 spirapril Drugs 0.000 description 1
- 108700035424 spirapril Proteins 0.000 description 1
- HRWCVUIFMSZDJS-SZMVWBNQSA-N spirapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2(C1)SCCS2)C(O)=O)CC1=CC=CC=C1 HRWCVUIFMSZDJS-SZMVWBNQSA-N 0.000 description 1
- 229950006297 spiraprilat Drugs 0.000 description 1
- 108700006892 spiraprilat Proteins 0.000 description 1
- FMMDBLMCSDRUPA-BPUTZDHNSA-N spiraprilat Chemical compound C([C@H](N[C@@H](C)C(=O)N1[C@@H](CC2(C1)SCCS2)C(O)=O)C(O)=O)CC1=CC=CC=C1 FMMDBLMCSDRUPA-BPUTZDHNSA-N 0.000 description 1
- 238000011699 spontaneously hypertensive rat Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000035488 systolic blood pressure Effects 0.000 description 1
- 229960004084 temocapril Drugs 0.000 description 1
- FIQOFIRCTOWDOW-BJLQDIEVSA-N temocapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H]1C(N(CC(O)=O)C[C@H](SC1)C=1SC=CC=1)=O)CC1=CC=CC=C1 FIQOFIRCTOWDOW-BJLQDIEVSA-N 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 125000003831 tetrazolyl group Chemical class 0.000 description 1
- JQSHEDRVRBSFCZ-YWZLYKJASA-N tinofedrine Chemical compound N([C@@H](C)[C@H](O)C=1C=CC=CC=1)CC=C(C1=CSC=C1)C=1C=CSC=1 JQSHEDRVRBSFCZ-YWZLYKJASA-N 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- JIVZKJJQOZQXQB-UHFFFAOYSA-N tolazoline Chemical compound C=1C=CC=CC=1CC1=NCCN1 JIVZKJJQOZQXQB-UHFFFAOYSA-N 0.000 description 1
- 229960002312 tolazoline Drugs 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- 235000021076 total caloric intake Nutrition 0.000 description 1
- 239000006211 transdermal dosage form Substances 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 229960002906 trimazosin Drugs 0.000 description 1
- YNZXWQJZEDLQEG-UHFFFAOYSA-N trimazosin Chemical compound N1=C2C(OC)=C(OC)C(OC)=CC2=C(N)N=C1N1CCN(C(=O)OCC(C)(C)O)CC1 YNZXWQJZEDLQEG-UHFFFAOYSA-N 0.000 description 1
- 235000021081 unsaturated fats Nutrition 0.000 description 1
- ACWBQPMHZXGDFX-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=NN1 ACWBQPMHZXGDFX-QFIPXVFZSA-N 0.000 description 1
- 229960004699 valsartan Drugs 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 229960000744 vinpocetine Drugs 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- BLGXFZZNTVWLAY-SCYLSFHTSA-N yohimbine Chemical compound C1=CC=C2C(CCN3C[C@@H]4CC[C@H](O)[C@@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-SCYLSFHTSA-N 0.000 description 1
- 229960000317 yohimbine Drugs 0.000 description 1
- AADVZSXPNRLYLV-UHFFFAOYSA-N yohimbine carboxylic acid Natural products C1=CC=C2C(CCN3CC4CCC(C(C4CC33)C(O)=O)O)=C3NC2=C1 AADVZSXPNRLYLV-UHFFFAOYSA-N 0.000 description 1
- 229960002769 zofenopril Drugs 0.000 description 1
- IAIDUHCBNLFXEF-MNEFBYGVSA-N zofenopril Chemical compound C([C@@H](C)C(=O)N1[C@@H](C[C@@H](C1)SC=1C=CC=CC=1)C(O)=O)SC(=O)C1=CC=CC=C1 IAIDUHCBNLFXEF-MNEFBYGVSA-N 0.000 description 1
- 229950001300 zofenoprilat Drugs 0.000 description 1
- UQWLOWFDKAFKAP-WXHSDQCUSA-N zofenoprilat Chemical compound C1[C@@H](C(O)=O)N(C(=O)[C@@H](CS)C)C[C@H]1SC1=CC=CC=C1 UQWLOWFDKAFKAP-WXHSDQCUSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/194—Carboxylic acids, e.g. valproic acid having two or more carboxyl groups, e.g. succinic, maleic or phthalic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4422—1,4-Dihydropyridines, e.g. nifedipine, nicardipine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/72—Signal processing specially adapted for physiological signals or for diagnostic purposes
- A61B5/7271—Specific aspects of physiological measurement analysis
- A61B5/7275—Determining trends in physiological measurement data; Predicting development of a medical condition based on physiological measurements, e.g. determining a risk factor
Landscapes
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
- Gebiet der Erfindung
- Diese Erfindung bezieht sich auf eine Kombination eines Antihypertonikums, das dafür bekannt ist, eine Verringerung des Blutdruckes hervorzurufen, und eines Carboxyalkylethers, eine Verbindung, die die Steigerung des High-Density-Lipoprotein (HDL)-Cholesterins hervorruft. Die Kombination ist zur Behandlung vaskulärer Erkrankungen und zur Vorbeugung von kongestiver Herzinsuffizienz nützlich. Die Carboxyalkylether können ebenso allein zur Behandlung von Bluthockdruck verwendet werden.
- Hintergrund der Erfindung
- Verschiedene klinische Studien haben bestätigt, daß die Verringerung bestimmter Formen von Cholesterin bei einem Säuger ein effektiver Weg zur Behandlung und Vorbeugung von Herzanfällen, plötzlichem Tod und Angina ist, sowohl bei Patienten, die höhere Niveaus an zirkulierendem Cholesterin als normal aufweisen, ebenso wie bei denen, die normale Niveaus an Cholesterin aufweisen. Die Verringerung von Low-Density-Lipoprotein (LDL), die schlechte Form von Cholesterin, ist nunmehr eines der primären Ziele der Ärzte die Patienten behandeln, die Herz-Kreislauf-Erkrankungen haben, wie koronarer Herzerkrankung, Atherosklerose, Myocardinfarkt, Schlaganfall, Hirnschlag und selbst Restenose, die der Ballonangioplastie folgt, oder bei denen ein hohes Risiko besteht, daß sie diese entwickeln. Viele Ärzte verwenden derzeit Cholesterin-senkende Mittel in reiner Form als eine prophylaktische Behandlung bei gesunden Patienten, deren Cholesterinniveaus normal sind, wodurch sie vor der Entwicklung von Herz-Kreislauf-Erkrankungen geschützt werden.
- Die am verbreitetsten verwendeten Cholesterinsenkungsmittel sind die Statine, die Verbindungen sind, die das Enzym 3-Hydroxy-3-methylglutaryl-Coenzym-A-(HMG-CoA)-Reduktase, das Enzym, daß für die Katalyse der Umwandlung von HMG-CoA zu Mevalonat verantwortlich ist, hemmt, was ein früher und geschwindigkeitsbestimmender Schritt im Cholesterin-Biosynthese-Stoffwechsel ist. Atorvastatin und Simvastatin sind weit verbreitet verwendete Statine.
- Es gibt verschiedene Formen von zirkulierendem Blutcholesterin, die natürlich bei Säugern vorkommen. Einige Formen werden als „schlechtes" Cholesterin betrachtet, während andere Formen als „gutes" Cholesterin betrachtet werden, und für eine gute Gesundheit wichtig sind. Die guten Formen von Cholesterin sind als HDL bestätigt worden. Ein schlechtes Cholesterin ist LDL. Eine andere Form von LDL-Cholesterin, die primäre schlechte Form, ist eine modifizierte Form von LDL, die Lipoprotein (a), oder „Lp(a)" genannt wird. Es wird angenommen, daß hohe Niveaus an Lp(a) schädlich sind und zu Herz-Kreislauf-Erkrankungen führen, und dies einer der Hauptrisikofaktoren ist, der zum Tode aufgrund einer Herzerkrankung führt. Es ist gezeigt worden, daß Carboxyalkylether HDL steigern und LDL und Lp(a) verringern. Typische Carboxyalkylether werden in U. S. Patent 5,648,387 beschrieben, hierin durch Verweis aufgenommen.
- Andere Hauptrisikofaktoren für die Entwicklung einer Herz-Kreislauf-Erkrankung und plötzlichen Tod umfassen Hypertension und Angina pectoris. Hypertension ist erhöhter Blutdruck. Es sind zahlreiche Antihypertonika bekannt und werden üblicherweise verwendet, um den Blutdruck zu senken. Solche Mittel umfassen Calciumkanalblocker, ACE-Hemmer, A-II-Antagonisten, Diuretika, Beta-Rezeptorenblocker, Vasodilatoren und Alpha-Rezeptorenblocker. Diese Mittel werden ebenso verbreitet verwendet, um Angina pectoris zu behandeln, die ein einschnürender Schmerz im Brustkorb ist, der oftmals vom Präkordium zur linken Schulter und am linken Arm herunter strahlt. Angina pectoris wird oftmals durch Ischämie am Herzen hervorgerufen und wird üblicherweise durch Koronarerkrankung hervorgerufen.
- Da vaskuläre Krankheiten wie koronare Herzkrankung, Schlaganfall und sogar periphäre vaskuläre Erkrankung, eine führende Todesursache und Invaliditätsursache in der ganzen Welt bleiben, besteht nach wie vor der Bedarf nach der Entwicklung neuer und verbesserter Behandlungen, ebenso wie nach Mitteln, die tatsächlich die Bildung dieser Erkrankungen verhindern.
- Wir haben nunmehr entdeckt, daß die Behandlung und Vorbeugung vaskulärer Erkrankungen mit überraschenden Ergebnissen durch die Verabreichung einer Kombination eines Antihypertonikums mit einem Carboxyalkylether bewirkt werden kann. Die Carboxyalkylether kön nen ebenso allein als Antihypertonika und zur Behandlung von Schlaganfall verwendet werden.
- Zusammenfassung der Erfindung
- Diese Erfindung liefert eine pharmazeutische Zusammensetzung, die aus einer wirksamen Menge eines Antihypertonikums und einer wirksamen Menge Carboxyalkylether besteht. Genauer gesagt ist die Erfindung eine Kombination aus einem Antihypertonikum mit einem Carboxyalkylether der Formel I worin n und m unabhängig ganze Zahlen von 2 bis 9 sind;
- R1, R2, R3 und R4 unabhängig C1-C6-Alkyl, C1-C6-Alkenyl, C2-C6-Alkinyl sind, und R1 und R2 zusammen mit dem Kohlenstoff, an den sie gebunden sind, und R3 und R4 zusammen mit dem Kohlenstoff, an den sie gebunden sind, einen carbocyclischen Ring mit 3 bis 6 Kohlenstoffen vervollständigen können;
- Y1 und Y2 unabhängig COOH, CHO, Tetrazol und COOR5 sind, worin R5 für C1-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl steht; worin die Alkyl-, Alkenyl- und Alkinylgruppen mit einer oder zwei Gruppen, die aus Halogen, Hydroxy, C1-C6-Alkoxy und Phenyl ausgewählt sind, substituiert sein können, oder ein pharmazeutisch verträgliches Salz davon.
- Bevorzugte Verbindungen, die in dieser Erfindung eingesetzt werden können, haben die obige Formel, worin n und m dieselben ganzen Zahlen sind und worin R1, R2, R3 und R4 jeweils Alkyl sind.
- Ferner sind Verbindungen bevorzugt, in denen Y1 und Y2 unabhängig COOH oder COOR5 sind, worin R5 Alkyl ist.
-
- Eine besonders bevorzugte Verbindung hat die Formel III
- Die Kombinationen dieser Erfindung können ebenso pharmazeutisch verträgliche Salze der Säuren von Formel 1 einsetzen. Das Monocalciumsalz der Verbindung der Formel III ist als CI-1027 bekannt und wird derzeit klinisch zur Behandlung von Dyslipidämie ausgewertet.
- Die Carboxyalkylether der Formeln I, II und III sind zur Einzeltherapiebehandlung von Hypertension geeignet. Die Verwendung eines Carboxyalkylethers zur Herstellung eines Medikaments zur Behandlung von Hypertension bei einem Säuger wird daher als eine weitere Ausführungsform dieser Erfindung bereitgestellt.
- Die Carboxyalkylether können ebenso mit einem anderen Antihypertonikum zur Kombinationstherapie kombiniert werden. Es kann irgendein Antihypertonikum in den Kombinationen dieser Erfindung eingesetzt werden. In einer bevorzugten Ausführungsform ist das Antihypertonikum ein Hemmer für ein Angiotensin-umwandelndes Enzym (ACE-Hemmer) oder ein Calciumkanalblocker.
- Die ACE-Hemmer, die in den Zusammensetzungen dieser Erfindung verwendet werden könne, sind in der Technik allgemein bekannt, und es werden routinemäßig verschiedene für die klinische Behandlung von Hypertension verwendet. Zum Beispiel werden Captopril und dessen Analoga in US Patent 5,238,924 und 4,258,027 beschrieben. Enalapril, Enalaprilat und eng verwandte Analoga werden in US Patent 4,374,829, 4,472,380 und 4,264,611 beschrieben. Moexipril, Quinapril, Quinaprilat und verwandte Analoga werden in US Patent 4,743,450 und 4,344,949 beschrieben. Ramipril und dessen Analoga werden in US Patent 4,587,258 und 5,061,722 beschrieben. Alle der vorstehenden Patente sind hierin durch Verweis auf deren Lehre typischer ACE-Hemmer, die in Kombination mit einem erfindungsgemäßen Carboxyalkylether genutzt werden können, aufgenommen. Andere ACE-Hemmer, die genutzt werden können, umfassen Fosinopril, Fasidotril, Glycopril, Idrapril, Imidapril, Mixanpril, Perindopril, Spirapril, Spiraprilat, Temocapril, Trundolapril, Zofenopril, Zofenoprilat, Utilapril und Sampatrilat.
- Eine andere Klasse für Antihypertonika, die in den Kombinationen dieser Erfindung verwendet werden können, sind Calciumkanalblocker. Zahlreiche Calciumkanalblocker sind bekannt und viele werden routinemäßig klinisch verwendet. Typische Kanalblocker umfassen Amlodipin (
US 5,155,120 ), Micardipin (US 3,985,758 ), Nifedipin (US 3,485,847 ), Isradipin (US 4,466,972 ), Felodipin (US 4,264,611 ) und zahlreiche andere, wie in WO 99/11260 beschrieben. Alle Verweise auf Patente und Veröffentlichungen sind hierin durch Verweis aufgenommen. - Eine andere Klasse Antihypertonika wird Angiotensin-II-Rezeptorantagonisten (A-II-Antagonisten) genannt, und typische Beispiele umfassen Cardesartan (
US 5,196,444 ), Eprosartan (US 5,185,351 ), Losartan und Valsartan (sieheUS 5,399,578 ). - Andere Antihypertonika, die in den Kombinationen dieser Erfindung verwendbar sind, sind Beta-Rezeptorenblocker (β-Blocker) wie Acebutolol, Alprenolol, Amosulalol, Arotinolol, Befunolol, Bevantolol, Amosulalol, Labetolol, Buprandolol, Celiprolol, Cloranolol, Dilevalol, Epanolol, Nadoxolol, Perbutolol und dergleichen.
- Dem ähnlich sind Alpha-Rezeptorenblocker (α-Blocker) allgemein bekannte Antihypertonika und können erfindungsgemäß verwendet werden. Typische α-Blocker umfassen Arotinolol, Fenspirid, Indoramin, Tolazolin, Trimazosin und Yohimbin. Alle dieser α-Blocker sind allgemein bekannte und verbreitet verwendete Antihypertonika.
- Eine andere Klasse Antihypertonika sind Vasodilatoren wie Bencyclan, Citicolin, Fasudil, Ifenprodil, Lomerizin, Nafronyl, Nimodipin, Tinofedrin und Vinpocetin. Alle Vasodilator-Antihypertonika können in dieser Erfindung verwendet werden.
- Diuretika werden ebenso verbreitet als Antihypertonika verwendet. Diese umfassen Mittel wie Chlorthiazid, Hydrochlorthiazid, Polythiazid, Ambusid, Butazolamid, Chloraminophenamid, Clofenamid und Clopamid.
- Alles was zur Praktizierung dieser Erfindung erforderlich ist, ist die Kombination eines Antihypertonikums mit einem Carboxyalkylether, oder auf der anderen Seite die Verwendung eines Antihypertonikums in Kombination mit einem Carboxyalkylether bei der Behandlung von Herz-Kreislauf-Erkrankungen wie Atherosklerose, Hypertension, und zur Vorbeugung oder Vermeidung eines Herz-Kreislauf-Vorfalles wie einem Herzinfarkt.
- Durch die Erfindung wird ebenso die Verwendung einer antihypertensiven Menge einer Verbindung der Formel I zur Herstellung eines Medikaments zur Behandlung von Hypertension bei einem Patienten, der einer solchen Behandlung bedarf, bereitgestellt. Eine bevorzugte Verwendung umfaßt die Verwendung einer Verbindung der Formel II oder III, und am stärksten bevorzugt die Verendung von CI-1027. Die Erfindung liefert ebenso die Verwendung einer wirksamen Menge einer Verbindung der Formel I, und bevorzugt einer Verbindung der Formel II oder III, und stärker bevorzugt von CI-1027, zur Herstellung eines Medikaments zur Vorbeugung von Schlaganfällen bei Säugern.
- Ausführliche Beschreibung der Erfindung
- Wir haben entdeckt, daß die Kombination eines Antihypertonikums wie Qhinapril oder Amlodipin mit einem Carboxyalkylether wie CI-1027 eine überraschend wirksame Zusammensetzung zur Behandlung vaskulärer Erkrankungen bei Säugern liefert. Wie oben angemerkt, sind die „Carboxyalkylether" wie hierin verwendet, Verbindungen wie die, die in US Patent 5,648,387, hiermit durch Verweis aufgenommen, beschrieben werden. Die Verbindungen können die freie Säure, eine Salzform oder das Tetrazolyl- oder Aldehydanalogon sein. Diese Verbindungen können so wie sie sind zur Behandlung von Hypertension gemäß dieser Erfindung verwendet werden. Sie können ebenso in Kombination mit anderen Antihypertonika verwendet werden.
- Die andere wirksame Komponente der Kombinationen dieser Erfindung ist ein Antihypertonikum. Es kann irgendein Antihypertonikum verwendet werden. Alles was erforderlich ist, ist, daß ein solches Mittel den Blutdruck bei einem Säuger effektiv senkt.
- Die Zusammensetzungen dieser Erfindung werden ein Antihypertonikum und einen Carboxyalkylether in einem Gewichtsverhältnis von etwa 0,01 : 1 bis etwa 1.000 : 1, und typischerweise etwa 1 : 1 bis etwa 0,5 : 1, und idealerweise von etwa 1 : 1 bis etwa 0,03 : 1 enthalten. Eine typische Zusammensetzung wird zum Beispiel 20 mg Quinaprilhydrochlorid und etwa 600 mg CI-1027 aufweisen. Alles was erforderlich ist, ist, daß die Mengen jeder Komponente verwendet werden, die die Verschlechterung des Herz-Kreislaufs, wie Kammererweiterung, Hypertension und Herzversagen, hemmen oder aufheben.
- Es wird zu erkennen sein, daß bestimmte der obigen Antihypertonika, zum Beispiel CI-1027, Quinapril und Amlodipin, entweder freie Carbonsäure oder eine freie Amingruppe als Teil der chemischen Struktur enthalten. Ferner enthalten bestimmte Antihypertonika innerhalb des Umfangs der Erfindung wirksame Einheiten, die im Gleichgewicht mit verschiedenen Formen existieren. Daher umfaßt diese Erfindung pharmazeutisch verträgliche Salze dieser Carbonsäuren oder Amingruppen. Der Ausdruck „pharmazeutisch verträgliche Salze" umfaßt sowohl pharmazeutisch verträgliche Säureadditionssalze als auch pharmazeutisch verträgliche kationische Salze. Der Ausdruck „pharmazeutisch verträgliche kationische Salze" soll Salze definieren wie Alkalimetallsalze, (zum Beispiel Natrium und Kalium), Erdalkalimetallsalze (z. B. Calcium und Magnesium), Aluminiumsalze, Ammoniumsalze und Salze mit organischen Aminen wie Benzathin(N,N'-Dibenzylethylendiamin), Cholin, Diethanolamin, Ethylendiamin, Meglumin(N-Methylglucamin), Benethamin(N-Benzylphenethylamin), Diethylamin, Piperazin, Tromethamin(2-Amino-2-hydroxymethyl-1,3-propandiol) und Procain, ist aber nicht darauf beschränkt. Der Ausdruck „pharmazeutisch verträgliche Säureadditionssalze" soll Salze definieren wie Hydrochlorid-, Hydrobromid-, Sulfat-, Hydrogensulfat-, Phosphat-, Hydrogenphosphat-, Dihydrogenphosphat-, Acetat-, Succinat-, Citrat-, Methansulfonat(Mesylat), Benzensulfonsäure-(Besylat) und p-Toluenesulfonat-(Tosylat) Salze, ist aber nicht darauf beschränkt.
- Die pharmazeutisch verträglichen kationischen Salze der Verbindungen, die freie Carbonsäuregruppen enthalten, können ohne weiteres durch die Umsetzung der freien Säureform der Verbindung mit einer geeigneten Base, für gewöhnlich einem Äquivalent, in einem Co-Lösungsmittel hergestellt werden.
- Typische Basen sind Natriumhydroxid, Natriummethoxid, Natriumethoxid, Natriumhydrid, Kaliummethoxid, Magnesiumhydroxid, Calciumhydroxid, Benzathin, Cholin, Diethanolamin, Piperazin und Tromethamin. Das Salz wird durch Konzentration zur Trockne oder durch Zugabe eines Nicht-Lösungsmittels isoliert. In vielen Fällen werden die Salze bevorzugt durch Mischen einer Lösung der Säure mit einer Lösung aus einem anderen Salz des Kations (Natrium- oder Kaliumethylhexanoat, Magnesiumoleat) hergestellt, wobei ein Lösungsmittel (z. B., Ethylacetat) eingesetzt wird, aus dem das gewünschte kationische Salz ausfällt, oder wird auf andere Weise durch Konzentration und/oder Zugabe eines Nicht-Lösungsmittels isoliert.
- Die pharmazeutisch verträglichen Säureadditionssalze der Verbindungen, die freie Amingruppen enthalten, können ohne weiteres durch die Umsetzung der freien Baseform des Amins mit der entsprechenden Säure hergestellt werden. Wenn das Salz von einer einbasigen Säure (z. B. das Hydrochlorid, das Hydrobromid, das p-Toluensulfonat, das Benzensulfonat, das Acetat), der Wasserstofform einer zweibasigen Säure (z. B. das Hydrogensulfat, das Succinat), oder der Dihydrogenform einer dreibasigen Säure (z. B. das Dihydrogenphosphat, das Citrat) ist, wird zumindest ein Moläquivalent, und üblicherweise ein molarer Überschuß, der Säure eingesetzt. Wenn jedoch Salze wie das Sulfat, das Hemisuccinat, das Hydrogenphosphat oder das Phosphat gewünscht werden, werden im allgemeinen die geeigneten und exakten chemischen Äquivalente an Säure verwendet. Die freie Base und die Säure werden für gewöhnlich in einem Co-Lösungsmittel kombiniert, aus dem das gewünschte Salz ausfällt, oder es kann auf andere Weise durch Konzentration und/oder Zugabe eines Nicht-Lösungsmittels isoliert werden.
- Überdies können die Carboxyalkylether und die pharmazeutisch verträglichen Säureadditionssalze davon als Hydrate oder Solvate auftreten. Ferner können die antihypertensiven Verbindungen der vorliegenden Erfindung und die pharmazeutisch verträglichen Salze solcher Verbindungen auch als Hydrate oder Solvate auftreten. Die Hydrate und Solvate liegen ebenso im Umfang der Erfindung.
- Die pharmazeutischen Zusammensetzungen und die Verwendungen dieser Erfindung sind alle an die therapeutische Verwendung als Mittel zur Vorbeugung und Behandlung von Atherosklerose, Angina pectoris und einen Zustand, der durch das Auftreten sowohl von Hypertension als auch von Hyperlipidämie bei Säugern, insbesondere Menschen, charakterisiert ist, angepaßt. Da diese Krankheiten ferner eng mit der Entwicklung von Herzkrankheit und unerwarteten Herzzuständen im Zusammenhang stehen, sind diese Kombinationen und Verfahren aufgrund ihrer Wirkung als Mittel gegen Atherosklerose, Mittel gegen Angina pectoris, Antihypertonika und Antihyperlipidämiemittel bei der Behandlung des Herzrisikos bei Personen mit einem Risiko zur Entwicklung unerwarteter Herzzustände und bei Personen mit einem Risiko, daß sie unter unerwarteten Herzanfällen leiden, nützlich.
- Die Ausdrücke „Person", „Patient" und „Säuger" werden abwechselnd verwendet und bedeuten Tiere wie Menschen, Hunde, Katzen, Pferde, Rinder und Schafe.
- Die Nützlichkeit der Zusammensetzungen der vorliegenden Erfindung als medizinische Mittel bei der Behandlung von Atherosklerose und Herzanfällen bei Säugern (z. B. Menschen) wird durch die Wirkung der Verbindungen dieser Erfindung in herkömmlichen Assays und in einem klinischen Protokoll, wie den nachstehend beschriebenen, demonstriert.
- Beispiel 1
- Die antihypertensiven Wirkungen der Carboxyalkyletherverbindung der Formel III (CI-1027), allein und in Kombination mit einem Antihypertonikum wie Quinapril (CI-906), wurden an Ratten, gemäß dem folgenden Protokoll bewertet.
- Männliche spontan hypertensive Ratten (SHR, 15 bis 20 Wochen alt, Charles River Laboratories, Wilmington, Massachusetts) wurden mit Daueraortakathetern und Radiotransmittern (Data Sciences International, Saint Paul, Minnesota) präpariert. Die Radiotransmitter lieferten eine kontinuierliche Messung der Aortablutdruck-Wellenform. Aus der Aortablutdruck-Wellenform lieferte ein Ponemah (Gould Instruments Inc, Valley View, Ohio) Computer den mittleren Arterienblutdruck (MABD) und Herzgeschwindigkeitswerte kontinuierlich als Ein-Minuten-Durchschnitte. Die Ein-Minuten-Daten wurden dann bei 15-Minuten-Intervallen, unter Verwendung von Excel (Microsoft Corporation, Redmond, Washington) Tabellenkal kulationen, zusammengefaßt. Die Tiere konnten nach Belieben Futter und Wasser zusichnehmen. Damit sie sich nach dem chirurgischen Eingriff erhohlen konnten, wurde den Ratten wenigstens 7 Tage nichts verabreicht. Vordosierte Blutdrücke bei Tag 0 wurden durch Mittelung von acht 15-Minuten-MABD-Messungen, die 2 h vor der Dosierung vorgenommen wurden, erhalten. Um die maximale Empfindlichkeit auf die Behandlung (Tage 0, 12, 16, 19 und 22) zu erhalten, wurden die 15-Minuten-MABD-Messungen in dem Intervall zwischen 2 und 4 h Vordosierung gemittelt.
- Die Testverbindungen wurden in eine Trägersubstanz gegeben, die 96 % Wasser, 3 % Carbomethocellulose (Sigma Chemical, Saint Louis, Missouri) und 1 % Tween 88 (Polyoxyethylensorbitanmonooleat, Sigma Chemical) enthält. Die CI-1027- und Quinapril-Einzeltherapie wurde 8:30 am Morgen täglich durch orale Sondenfütterung in einem Volumen von 2 ml/kg verabreicht. Die Kombination von CI-1027 und Quinapril wurde in einer einzelnen Sondenfütterung in einem Volumen von 2 ml/kg verabreicht. Die Experimentgestaltung wird in Tabelle 1 unten dargestellt.
- Das Experiment wurde über 22 Tage an 4 Gruppen von Tieren durchgeführt. Gruppe I diente als eine Kontrolle und bekam 2 ml/kg/Tag der Trägersubstanz für 22 aufeinanderfolgende Tage. Der Gruppe II, die zur Bestimmung der antihypertensiven Antwort auf die Quinapril-Einzeltherapie verwendet wurde, wurde die Trägersubstanz die ersten 12 bis 13 aufeinanderfolgenden Tage gegeben. Dann am Tag 13 bis 14 wurde Quinapril in einer Dosis von 0,3 mg/kg/Tag für 3 bis 4 aufeinanderfolgende Tage zugegeben; dann wurde die Dosis auf 1 mg/kg/Tag für die nächsten 3 Tage erhöht, und an den letzten 3 Tagen wurden 3 mg/kg/Tag verabreicht. Um die Antwort auf die CI-1027-Einzeltherapie zu bestimmen bekamen die Gruppen III und IV eine 12-Tage-Behandlung mit CI-1027-Einzeltherapie bei Dosen von 30 bzw. 100 mg/kg/Tag. Um die antihypertensive Antwort auf die Kombinationstherapie zu bestimmen, wurde zu der laufenden CI-1027-Behandlung (Tag 13 bis 14) unter Verwendung des ansteigenden Dosisprotokolls, das für Gruppe II (Quinapril-Einzeltherapie) beschrieben wurde, Quinapril zugegeben.
- Unter den 4 Behandlungsgruppen lag der Vordosen-Grundlinen-MABD im Bereich von 141 bis 149 mmHg. Über die 22 Tage lag der maximale MABD im Bereich von 140 mmHg bis 145 mmHg bei den Trägersubstanz-Kontrollratten der Gruppe I, was ein Anzeichen dafür ist, daß die Trägersubstanz allein keine Wirkung auf den Blutdruck hatte. Die 12-Tage-CI-1027-Einzeltherapie bei 30 mg/kg/Tag (Gruppe III) senkte den maximalen MABD signifikant auf 131 ab (Tag 0 gegen Tag 12, p < 0,05). Der MABD bei Ratten, die mit 100 mg/kg/Tag (Gruppe IV) behandelt wurden, glich dem der 30-mg/kg/Tag-Dosis. Daher demonstrierte die CI-1027-Einzeltherapie mäßige antihypertensive Wirkung.
- Die Quinapril-Einzeltherapie wurde der Gruppe III unter Verwendung eines ansteigenden Dosierprotokolls von 3 Tagen jeweils bei 0,3, 1 und 3 mg/kg/Tag gegeben. Unter Verwendung eines ansteigenden Dosierprotokolls senkte die 9 Tage-Quinapril-Einzeltherapie den MABD auf 117 mmHg (Tag 22). Quinapril bei 3 mg/kg/Tag ergab eine antihypertensive Antwort, die nahe der maximalen lag, da die Antwort nur 5 mmHg größer war als die, die bei 0,3 mg/kg/Tag aufgezeichnet wurde.
- Die Ergebnisse der Gruppen III und IV zeigen an, daß eine mehrtägige Quinaprilbehandlung, wenn diese der laufenden CI-1027-Behandlung zugeführt wird, die antihypertensive Antwort enorm steigert. Die MABD-Werte bei kombinationsbehandelten Ratten waren viel geringer als die der entsprechenden Quinapril-Einzeltherapiegruppe. Ratten, die 3 Tage mit der Kombination aus Quinapril bei 1 m/kg/Tag und CI-1027 bei 30 und 100 mg/kg/Tag behandelt wurden, hatten MABD-Werte (Tag 19) von 104 bzw. 111 mmHg.
- Der Unterschied des MABD erreichte mit der CI-1027-Kombination bei 30 mg/kg/Tag statistische Signifikanz. Nach einer 3-Tage-Behandlung bei der höchsten Quinaprildosis (3 mg/kg/Tag) führte die Quinapril-CI-1027-Kombination zu MABD-Werten, die unter 100 mmHg (p < 0,05 gegen Quinapril-Einzeltherapie) lagen.
- Die Daten aus dem vorstehenden Experiment werden in Tabelle 2 gezeigt.
- Beispiel 2
- Es wurde dem allgemeinen Verfahren aus Beispiel 1 gefolgt, um die antihypertensive Wirkung des Carboxyalkylethers CI-1027 allein und in Kombination mit dem Calciumkanalblocker Amlodipin zu bewerten.
- Männliche SHR (15 bis 20 Wochen alt, Charles River Laboratories) wurden mit Daueraortakathetern und Radiotransmittern für die kontinuierliche Messung des artieriellen Blutdruckes und der Herzgeschwindigkeit präpariert. Die Tiere konnten nach Belieben Futter und Wasser zu sich nehmen. Vor der Dosierung konnten sich alle Ratten wenigstens 7 Tage lang von dem chirurgischen Eingriff erholen.
- Das Experiment wurde über 22 Tage an 3 Gruppen von SHR durchgeführt. Gruppe I diente als eine Kontrolle und bekam 2 ml/kg/Tag der Trägersubstanz (die gleiche wie in Beispiel 1) für 22 aufeinanderfolgende Tage. Der Gruppe II, die zur Bestimmung der antihypertensiven Antwort auf die Amlodipin-Einzeltherapie verwendet wurde, wurde die Trägersubstanz die ersten 13 aufeinanderfolgenden Tage gegeben. Dann am Tag 14 wurde Amlodipin in einer Dosis von 0,3 mg/kg/Tag für 3 aufeinanderfolgende Tage zugegeben. Die Dosis wurde dann auf 1 mg/kg/Tag für die nächsten 3 Tage erhöht, und an den letzten 3 Tagen wurden 3 mg/kg/Tag verabreicht. Um die Antwort auf die CI-1027-Einzeltherapie zu bestimmen, bekam die Gruppen III eine 13-Tage-Behandlung mit CI-1027-Einzeltherapie bei einer Dosis von 30 mg/kg/Tag. Die antihypertensive Antwort auf die Kombinationstherapie wurde bestimmt, indem zu der laufenden CI-1027-Behandlung am Tag 14 Amlodipin zugegeben wurde. Die Experimentgestaltung/Dosierung wird in Tabelle 3 gezeigt.
- Die Medikamente wurden in einer Trägersubstanz suspendiert oder gelöst, die 96 % Wasser, 3 % Carboxymethocellulose und 1 % Tween 88 enthält. Die Verbindungen wurden 9 Uhr morgens täglich durch orale Sondenfütterung in einem Volumen von 2 ml/kg verabreicht. Die Kombination von CI-1027 und Amlodipin wurde als eine einzelne Sondenfütterung in einem Volumen von 2 ml/kg verabreicht.
- Die Ergebnisse des Experiments werden in Tabelle 4 dargestellt. Unter den 3 Behandlungsgruppen lag der Vordosen-Grundlinen-MABD im Bereich von 131 bis 134 mmHg. Über die 22 Tage blieb der maximale MABD konstant (136 bis 141 mmHg) bei den Trägersubstanz-Kontrollratten der Gruppe I. Die erste Hälfte des Experiments demonstrierte, daß die CI-1027-Einzeltherapie den Blutdruck bei den SHR senkte. Am Tag 13 betrug der MABD 120 mmHg bei den CI-1027-behandelten SHR, während die beiden Trägersubstanz-Gruppen MABD-Werte von 138 und 144 mmHg hatten.
- Die antihypertensive Schwellendosis für die Amlodipin-Einzeltherapie (Gruppe II) betrug 1 mg/kg/Tag, und 3 mg/kg/Tag senkte den MABD auf 114 mmHg. Die Zugabe von Amlodipin zu der laufenden CI-1027-Behandlung (Gruppe III) führte zu einer antihypertensiven Antwort, die größer war als die, die mit einem der beiden Mittel allein erhalten wurde. Zum Beispiel hatten SHR, die 3 Tage mit der Kombination von Amlodipin bei 3 mg/kg/Tag und CI-1027 bei 30 mg/kg/Tag (Tag 22) behandelt wurden, einen MABD von nur 96 mmHg, im Vergleich zu 114 mmHg für die Amlodipin-Einzeltherapie. Diese Ergebnisse bestätigen, daß die Kombination von Amlodipin mit CI-1027 für eine sehr effektive Kontrolle des Blutdruckes bei hypertensiven Säugern sorgt.
- Beispiel 3
- Die Wirkung der Verbindung der Formel III und eines Antihypertonikums, allein und in Kombination, auf die Behandlung von Atherosklerose und Herz-Kreislauf-Erkrankung Diese Studie ist eine voraussichtliche willkürlich angeordnete Bewertung der Wirkung einer Kombination der Verbindung der Formel III (Verbindung III) oder eines pharmazeutisch verträglichen Salzes hiervon und eines Antihypertonikums wie Amlodipin auf die Progression/Regression einer Koronar- und Halsschlagader-Krankheit und das Risiko zu Herzversagen. Die Studie wird dazu verwendet zu zeigen, daß eine Kombination der Verbindung der Formel III oder eines pharmazeutisch verträglichen Säureadditionssalzes und eines Antihypertonikums wie Amlodipinbesylat bei der Verlangsamung oder Hemmung der Progression oder der Herbeiführung der Regression einer existierenden Koronararterienkrankheit (KAK) wirksam ist, wie durch die Veränderungen in der Koronarangiographie oder dem Karotisultraschall, bei Patienten mit der bestehenden Krankheit bewiesen.
- Diese Studie ist eine angiographische Dokumentation der Koronararterienerkrankung, die als ein doppelter, Placebo-kontrollierter Blindversuch von weniger als 500 Patienten und bevorzugt von etwa 780 bis etwa 1.200 Patienten durchgeführt wurde. Besonders bevorzugt werden etwa 1.200 Patienten in dieser Studie untersucht. Die Patienten werden nach Erfüllung bestimmter Eintrittskriterien, die unten dargelegt werden, für die Studie zugelassen.
- Eintrittskriterien: Patienten, die für den Eintritt in diesen Versuch akzeptiert werden, müssen bestimmte Kriterien erfüllen. Demnach muß der Patient ein Erwachsener, entweder männlich oder weiblich, 18 bis 80 Jahre alt, sein, dessen Koronarangiographie klinisch nachgewiesen ist. Die Patienten werden bei der nachfolgenden Bewertung durch quantitative Koronarangiographie (QKA) die angiographische Gegenwart einer signifikanten Herdläsion von 30 % bis 50 % in wenigstens einem Segment (Nicht-PTKA, Nicht-Bypass-operiert oder Nicht-MI-Gefäß) aufweisen, die man wahrscheinlich über die nächsten 3 Jahre nicht behandeln muß. Es ist erforderlich, daß die zu analysierenden Segmente sich nicht gegenseitig beeinflussen. Da perkutane transluminale Koronarangioplastik (PTKA) die Segmente durch die Einführung eines Ballonkatheters beeinflußt, sind Nicht-PTKA-Segmente für die Analyse erforderlich. Es ist ebenso erforderlich, daß die zu analysierenden Segmente nicht unter einem thrombotischen Ereignis gelitten haben, wie einem Myokardinfarkt (MI). Daher sind Nicht-MI-Gefäße erforderlich. Segmente, die analysiert werden, umfassen: linker Haupt-, proximaler, mittlerer und distaler linker vorderer abwärtsführender, erster und zweiter diagonaler Ramus, proximaler und distaler linker Zirkumflex, erste oder größträumig abgestumpfte, randständige, proximale, mittlere und distale rechte Koronararterie. Die Patienten werden zum Zeitpunkt des qualifizierenden Angiogramms oder innerhalb von 3 Monaten vor der Aufnahme des qualifizierenden Angiogramms eine Ejektionsfraktion von mehr als 30 % aufweisen, bestimmt durch Einführung eines Katheters oder radionuklide Ventrikulographie oder ECHO-Kardiogramm, vorrausgesetzt, es hat kein beeinflussendes Ereignis, wie ein thrombotisches Ereignis, oder ein Verfahren wie die PTKA stattgefunden.
- Im allgemeinen wird die Studie aufgrund der Anzahl an Patienten und der physikalischen Einschränkungen irgendwelcher Einrichtung an mehreren Stellen durchgeführt. Am Anfang der Studie unterziehen sich die Patienten einer quantitativen Koronarangiographie, ebenso wie einer B-Mode-Karotis-Ultraschallaufnahme und einer Einschätzung der Dehnbarkeit der Karotis, in den dafür vorgesehenen Testzentren. Dies schafft Ausgangswerte für jeden Patienten. Sind sie erst einmal in den Test eingetreten, werden den Patienten die Verbindung der Formel III (600 mg) und ein Placebo oder ein Antihypertonikum (die Dosis hängt von dem verwendeten Mittel ab; im allgemeinen werden jedoch zuerst 40 mg verwendet) und ein Placebo oder Verbindung III (600 mg) und ein Antihypertonikum (40 mg) willkürlich verabreicht. Es wird für einen Fachmann zu erkennen sein, daß die freie Base-Form oder andere Salzformen der Verbindung III oder die freie Base-Form oder andere Salzformen des Antihypertonikums in dieser Erfindung verwendet werden können. Die Berechnung der Dosierungsmenge dieser oder anderer Formen des Antihypertonikums und der Verbindung III kann leicht durch Einhaltung eines einfachen Verhältnisses bezogen auf die Molekulargewichte der einbezogen Spezies erreicht werden. Die Menge der Verbindung III kann je nach Bedarf variiert werden. Im allgemeinen wird ein Patient mit 600 mg beginnen, und die Menge wird auf mindestens 200 mg herunter titriert, wie durch einen Arzt bestimmt. Die Menge des Antihypertonikums wird ähnlich von 40 mg herunter titriert, wenn dies so vom Arzt bestimmt wird, um für den Patienten das Beste zu erreichen. Die Patienten werden für einen Zeitraum von 1 bis 3 Jahren beobachtet, im allgemeinen sind 3 Jahre bevorzugt. Die B-Mode-Karotis-Ultraschalleinschätzung der Karotisatherosklerose und der Dehnbarkeit werden bei regelmäßigen Intervallen über die Studie hinweg durchgeführt.
- Im allgemeinen sind 6monatige Intervalle geeignet. Typischerweise wird diese Einschätzung unter Verwendung von B-Mode-Ultraschallausrüstung durchgeführt. Ein Fachmann kann jedoch andere Verfahren zur Durchführung dieser Einschätzung verwenden. Die Koronarangiographie wird am Ende des 1- bis 3jährigen Behandlungszeitraumes durchgeführt. Die Anfangs- und Nachbehandlungsangiogramme und die dazwischen liegenden Karotis-B-Mode-Ultraschallbilder werden hinsichtlich neuer Läsionen oder dem Fortschreiten bestehender atherosklerotischer Läsionen bewertet. Die arteriellen Dehnbarkeitsmessungen werden hinsichtlich Veränderungen vom Anfang und über den 6monatigen Bewertungszeitraum eingeschätzt.
- Das primäre Ziel dieser Studie ist es aufzuzeigen, daß die Kombination von Carboxyalkylether oder eines pharmazeutisch verträglichen Säureadditionssalzes und eines Antihypertonikums das Fortschreiten atherosklerotischer Läsionen verringert, wie durch quantitative Koronarangiographie (QKA) bei Patienten mit klinischer Koronarerkrankung gemessen. Die QKA mißt die Öffnung des Hohlraumes der gemessenen Arterien.
- Der primäre Endpunkt der Studie ist die Veränderung des durchschnittlichen Hauptsegmentdurchmessers des Koronararterienbaumes. Daher wird der Durchmesser eines Arteriensegmentes an verschiedenen Stellen entlang der Länge des Segmentes gemessen. Der durchschnittliche Durchmesser dieses Segmentes wird dann bestimmt. Nachdem der durchschnittliche Segmentdurchmesser vieler Segmente bestimmt worden ist, wird der Durchschnitt aller Segmentdurchschnitte bestimmt, um den durchschnittlichen Segmentmitteldurchmesser zu erhalten. Der mittlere Segmentdurchmesser der Patienten, die ein Antihypertonikum und Verbindung III oder ein pharmazeutisch verträgliches Säureadditionssalz einnehmen, wird langsamer fallen, wird vollständig gehalten, oder bei ihnen wird es eine Erhöhung des mittleren Segmentdurchmessers geben.
- Diese Ergebnisse stellen das verlangsamte Fortschreiten von Atherosklerose, keine Veränderung des Fortschreitens von Atherosklerose bzw. Regression von Atherosklerose dar.
- Das sekundäre Ziel dieser Studie ist, daß die Kombination von Carboxyalkylether oder eines pharmazeutisch verträglichen Säureadditionssalzes und eines Antihypertonikums die Geschwindigkeit des Fortschreitens von Atherosklerose in der Karotis verringert, wie durch die Neigung der maximalen intimal-medial Verdickungsmessungen gemessen, die über 12 separate Wandsegmente (Mittel Max) als eine Funktion der Zeit gemittelt wurden, mehr als es Verbindung III oder ein pharmazeutisch verträgliches Säureadditionssalz oder ein Antihypertonikum allein tut. Die intimal-medial Verdickung von Patienten, die ein Antihypertonikum und Verbindung III oder ein pharmazeutisch verträgliches Salz hiervon einnehmen, wird sich langsamer erhöhen, wird aufhören zu wachsen, oder wird zurückgehen. Diese Ergebnisse stellen ein verlangsamtes Fortschreiten von Atherosklerose, beibehaltenes Fortschreiten von Atherosklerose bzw. Rückgang von Atherosklerose dar. Ferner können diese Ergebnisse dazu verwendet werden, die Dosierbestimmungen zu erleichtern.
- Die Nützlichkeit der Verbindungen der vorliegenden Erfindung als Medikamente bei der Behandlung von Angina pectoris bei Säugern (z. B., Menschen) wird durch die Wirkung der Verbindungen dieser Erfindung in herkömmlichen Assays und dem klinischen Protokoll, das nachstehend beschrieben wird, demonstriert.
- Beispiel 4
- Die Wirkung der Verbindung der Formel III und eines Antihypertonikums allein und in Kombination auf die Behandlung von Angina.
- Diese Studie ist eine willkürliche, doppelte Parallelarm-Studie, um die Wirksamkeit der Verbindung III oder eines pharmazeutisch verträglichen Säureadditionssalzes hiervon und eines Antihypertonikums, verabreicht in Kombination, bei der Behandlung von symptomatischer Angina zu zeigen.
- Eintrittskriterien: Die Patienten sind Männer oder Frauen zwischen 18 und 80 mit typischen Schmerzen im Brustkorn, die mit einem der folgenden objektiven Beweise für kardiale Ischämie im Zusammenhang stehen: (1) Belastungstest-Segmentbewertung von etwa einem Millimeter oder mehr aus dem EKG; (2) positiver Tretmühlenbelastungstest; (3) neue Wandbewegungsabnormalität beim Ultraschall; oder (4) Koronarangiogramm mit einer signifikanten qualitativen Stenose. Im allgemeinen wird eine Stenose von 30 % bis 50 % als signifikant betrachtet.
- Jeder Patient wird für etwa 10 bis 32 Wochen bewertet. Zumindest 10 Wochen sind im allgemeinen erforderlich, um die Studie zu vollenden. Es werden ausreichend Patienten in dieser Untersuchung verwendet, um sicher zu stellen, daß etwa 200 bis 800 Patienten und bevorzugt etwa 400 Patienten bewertet werden, um die Studie zu vollenden. Die Patienten werden während einer 4-wöchigen Einlaufphase mit den Eingangskriterien, die nachstehend aufgezeigt werden, auf die Dehnbarkeit untersucht. Nachdem die Versuchskriterien erfüllt waren, wurden die Patienten von ihrer derzeitigen antianginalen Medikation ausgewaschen und an ein lange wirkendes Nitrat wie Nitroglycerin, Isosorbid-5-mononitrat oder Isosorbiddinitrat gewöhnt. Der Ausdruck „ausgewaschen", sofern er in Verbindung mit diesem Versuch verwendet wird, bedeutet den Abzug von der derzeitigen antianginalen Medikation, so daß im wesentlichen die gesamte Medikation aus dem Körper des Patienten eliminiert worden ist. Ein Zeitraum von 8 Wochen ist sowohl als Auswaschzeitraum als auch für die Errichtung einer stabilen Dosis des Nitrats bei dem Patienten möglich. Patienten, die ein oder zwei Anginaanfälle pro Woche haben, während sie auf einer stabilen Dosis des lange wirkenden Nitrats sind, dürfen im allgemeinen mit der Auswaschphase aussetzen. Nachdem die Patienten an die Nitrate gewöhnt wurden, treten die Patienten in die Randomisationsphase ein, vorausgesetzt, die Patienten haben weiterhin entweder ein oder zwei Anginaanfälle pro Woche. In der Randomisationsphase werden die Patienten willkürlich in einem der vier Arme der Studie, die nachstehend angegeben werden, untergebracht. Nach der Auswaschphase werden die Patienten gemäß den Vorschriften der Eintrittskriterien einem 24stündigen ambulanten Elektrokardiogramm (EKG) wie Holter-Monitoring, körperlicher Belastungstest wie einer Tretmühle, und Bewertung der Myokardperfusion unter Verwendung der Photonenemissionstomographie(PET-)-Scanning unterzogen, um Ausgangswerte für jeden Patienten zu schaffen. Bei der Durchführung eines Belastungstestes können die Geschwindigkeit der Tretmühle und der Gradient der Tretmühle durch einen Techniker kontrolliert werden. Die Geschwindigkeit der Tretmühle und der Winkel des Gradienten werden im allgemeinen während des Testes erhöht. Die Zeitintervalle zwischen jeder Geschwindigkeits- und Gradientenerhöhung werden im allgemeinen unter Verwendung eines modifizierten Bruce-Protokolls bestimmt.
- Nachdem die Ausgangswertermittlungen abgeschlossen sind, werden die Patienten in einen der folgenden vier Arme der Studie eingeführt: (1) Placebo; (2) ein Antihypertonikum (etwa 2,5 mg bis etwa 50 mg); (3) Verbindung III (etwa 150 mg bis etwa 900 mg); oder (4) eine Kombination aus den obigen Dosierungen von Verbindung III und einem Antihypertonikum zusammen. Die Patienten werden dann 2 bis 24 Wochen beobachtet. Ein Fachmann wird erkennen, daß die freie Baseform oder andere Salzformen von Verbindung III oder die freie Baseform oder andere Salzformen des Antihypertonikums in dieser Erfindung verwendet werden können. Die Berechnung der Dosierungsmenge für diese anderen Formen Antihypertonikum und der Verbindung III kann leicht durch Einhaltung eines einfachen Verhältnisses, bezogen auf die Molekulargewichte der einbezogen Spezies, erreicht werden.
- Nachdem der Beobachtungszeitraum beendet ist, werden die Patienten den folgenden Untersuchungen unterzogen: (1) 24stündiges ambulantes EKG, wie Holter-Monitoring; (2) körperlicher Belastungstest (z. B. eine Tretmühle unter Verwendung des Bruce-Protokolls), und (3) Bewertung der Myokardperfusion unter Verwendung von PET-Scanning. Die Patienten führen ein Tagebuch über schmerzhafte ischämische Ereignisse und den Nitroglycerinkonsum. Es ist im allgemeinen erforderlich, daß die Anzahl der Anginaanfälle, die der Patient während des Tests erleidet, genau aufgezeichnet wird. Da ein Patient im allgemeinen Nitroglycerin einnimmt, um den Schmerz eines Anginaanfalles zu lindern, liefert die Anzahl der Male, die der Patient Nitroglycerin einnimmt, eine vernünftige genaue Aufzeichnung der Anzahl der Anginaanfälle.
- Um die Wirksamkeit und die Dosierung der Medikamentenkombination dieser Erfindung zu demonstrieren, wird die Person, die den Test durchführt, den Patienten unter Verwendung des beschriebenen Tests bewerten. Eine erfolgreiche Behandlung wird weniger Fälle von ischämischen Ereignissen ergeben, wie durch EKG aufgezeichnet, wird es dem Patienten ermöglichen, sich auf der Tretmühle länger zu belasten oder bei einem höheren Intensitätsniveau, oder sich auf der Tretmühle ohne Schmerzen zu belasten, oder wird eine bessere Perfusion oder weniger Perfusionsdefekte bei der PET ergeben.
- Die Nützlichkeit der Verbindungen der vorliegenden Erfindung als Medikamente bei der Behandlung von Hypertension und Hyperlipidämie bei Säugern (z. B. Menschen), die an einer Kombination aus Hypertension und Hyperlipidämie leiden, wird durch die Wirkung der Verbindungen der Erfindung in herkömmlichen Assays und dem klinischen Protokoll, das nachstehend beschrieben wird, demonstriert.
- Beispiel 5
- Wirkungen von Carboxyalkylether und eines Antihypertonikums allein und in Kombination bei der Behandlung von Patienten, die sowohl Hypertension als auch Hyperlipidämie haben Diese Studie ist eine willkürliche, doppelte Parallelarm-Studie, um die Wirksamkeit von Carboxyalkylether oder eines pharmazeutisch verträglichen Säureadditionssalzes hiervon und eines Antihypertonikums, verabreicht in Kombination, bei der Kontrolle sowohl von Hypertension als auch Hyperlipidämie bei Patienten, die wenig, mäßige oder schwere Hypertension und Hyperlipidämie haben, zu zeigen.
- Jeder Patient wird für etwa 10 bis 20 Wochen bewertet und bevorzugt für 14 Wochen. Es werden ausreichend Patienten in dieser Untersuchung verwendet, um sicher zu stellen, daß etwa 400 bis 800 Patienten bewertet werden, um die Studie zu vollenden.
- Eintrittskriterien: Die Patienten sind männliche oder weibliche Erwachsene zwischen 18 und 80 Jahren mit sowohl Hyperlipidämie als auch Hypertension. Die Gegenwart von Hyperlipidämie wird durch die Bewertung des LDL-Cholesterin-Niveaus des Patienten, bezogen auf bestimmte positive Risikofaktoren, nachgewiesen. Wenn der Patient keine koronare Herzerkrankung (KHE) hat und weniger als zwei positive Risikofaktoren zeigt, dann hat das der Patient Hyperlipidämie, die eine Medikamententherapie erforderlich macht, wenn das LDL des Patienten ≥ 190 mg/dl beträgt. Hat der Patient keine KHE und zeigt zwei oder mehr positive Risikofaktoren, dann hat der Patient Hyperlipidämie, die eine Medikamententherapie erforderlich macht, wenn das LDL des Patienten ≥ 160 mg/dl beträgt. Hat der Patient KHE, dann hat der Patient Hyperlipidämie wenn das LDL des Patienten ≥ 130 mg/dl beträgt.
- Positive Risikofaktoren umfassen: (1) Männer über 45, (2) Frauen über 55, wobei die Frau keiner Hormonersatztherapie (HET) unterzogen wird, (3) Familiengeschichte einer frühzeitigen kardiovaskulären Erkrankung, (4) der Patient ist Kettenraucher, (5) der Patient hat Diabetes, (6) ein HDL von weniger als 45 mg/dl, und (7) der Patient hat Hypertension. Ein HDL von > 60 mg/dl wird als ein negativer Risikofaktor angesehen und wird einen der oben genannten positiven Risikofaktoren aufwiegen.
- Die Gegenwart von Hypertension wird durch einen diastolischen Blutdruck (BD) im Sitzen von > 90 mmHg oder einen systolischen BD im Sitzen von > 140 mmHg nachgewiesen. Alle Blutdrücke werden im allgemeinen als Mittel von drei Messungen, die in 5 Minuten-Abständen genommen wurden, bestimmt.
- Die Patienten werden hinsichtlich der Einhaltung der Eintrittskriterien, die oben angegeben werden, untersucht. Nachdem alle Untersuchungskriterien erfüllt sind, werden die Patienten von ihrer derzeitigen antihypertensiven und Lipid-verringernden Medikation ausgewaschen und werden auf die NCEP ATP II Schritt 1-Diät gesetzt. Die NCEP ATP II (Erwachsenen-Behandlungsgremium, 2. Revision) Schritt 1-Diät gibt die Menge gesättigter und ungesättigter Fette an, die als ein Teil der gesamten Kalorieneinnahme konsumiert werden kann. Der Ausdruck „ausgewaschen", wo dieser in Verbindung mit dieser Untersuchung verwendet wird, bedeutet den Abzug der derzeitigen antihypertensiven und Lipid-verringernden Medikation, so daß im wesentlichen die gesamte Medikation aus dem Körper des Patienten eliminiert wird. Kürzlich diagnostizierte Patienten bleiben im allgemeinen unbehandelt, bis der Test beginnt. Diese Patienten werden ebenso auf die NCEP Schritt 1-Diät gesetzt. Nach der 4-wöchigen Auswäsche und der Diäteingewöhnungszeit, werden die Patienten den folgenden Grunduntersuchungen unterzogen: (1) Blutdruck und (2) Nüchternlipidaufnahme. Die Nüchternlipidaufnahme bestimmt die Grundlipidniveaus im nüchternen Zustand eines Patienten.
- Im allgemeinen nimmt der Patient für 12 Stunden keine Nahrung zu sich, wobei innerhalb dieses Zeitraumes die Lipidniveaus gemessen werden.
- Nachdem die Grunduntersuchungen durchgeführt sind, beginnen die Patienten mit einem der folgenden: (1) einer festen Dosis von Verbindung III, im allgemeinen etwa 150 bis 900 mg; (2) einer festen Dosis eines Antihypertonikums, im allgemeinen etwa 2,5 mg bis etwa 50 mg; oder (3) einer Kombination aus den obigen Dosen von Verbindung III und eines Antihypertonikums zusammen. Ein Fachmann wird erkennen, daß die freie Baseform oder andere Salzformen von Verbindung III oder die freie Baseform oder andere Salzformen des Antihypertonikums in dieser Erfindung verwendet werden können. Die Berechnung der Dosierungsmenge für diese anderen Formen des Antihypertonikums und der Verbindung III kann leicht durch Einhaltung eines einfachen Verhältnisses, bezogen auf die Molekulargewichte der einbezogen Spezies, erreicht werden. Die Patienten bleiben wenigstens 6 Wochen und im allgemeinen für nicht mehr als 8 Wochen bei dieser Dosierung. Die Patienten kehren am Ende der 6 bis 8 Wochen ins Testzentrum zurück, so daß die Grundbewertungen wiederholt werden können. Der Blutdruck des Patienten am Ende der Studie wird mit dem Blutdruck des Patienten bei Eintritt verglichen. Die Lipidaufnahme mißt das Gesamt-Cholesterin, LDL-Cholesterin, HDL-Cholesterin, Triglyceride, apoB, Lipoprotein sehr geringer Dichte (VLDL) und andere Komponenten des Lipidprofils des Patienten. Verbesserungen der erhaltenen Werte nach der Behandlung, bezogen auf die Vorbehandlung, zeigen die Nützlichkeit der Medikamentenkombination an.
- Die Nützlichkeit der Verbindungen der vorliegenden Erfindung als Medikamente bei der Behandlung von kardialem Risiko bei Säugern (z. B. Menschen) mit einem Risiko zu einem nachteiligen Herzereignis, wird durch die Wirkung der Verbindungen der Erfindung in herkömmlichen Assays und dem klinischen Protokoll, das nachstehend beschrieben wird, demonstriert.
- Beispiel 6
- Wirkungen von Carboxyalkylether und eines Antihypertonikums allein und in Kombination bei Patienten, die für kommende kardiovaskuläre Ereignisse gefährdet sind
- Diese Studie ist eine willkürliche, doppelte Parallelarm-Studie, um die Wirksamkeit von Carboxyalkylether oder eines pharmazeutisch verträglichen Säureadditionssalzes hiervon und eines Antihypertonikums, verabreicht in Kombination, bei der Verringerung des gesamten berechneten Risikos von kommenden Ereignissen bei Patienten, die für kommende kardiovaskuläre Ereignisse gefährdet sind. Dieses Risiko wird unter Verwendung der Framingham Risiko-Gleichung berechnet. Ein Patient wird als für ein kommendes kardiovaskuläres Ereignis gefährdet betrachtet, wenn der Patient mehr als eine Standardabweichung über dem Mittel ist, wie durch die Framingham-Risiko-Gleichung berechnet. Die Studie wird zur Bewertung der Wirksamkeit einer festen Kombination aus Carboxyalkylether oder einem pharmazeutisch verträglichen Säureadditionssalz und einem Antihypertonikum bei der Kontrolle des kardiovaskulären Risikos durch die Kontrolle sowohl der Hypertension als auch der Hyperlipidämie bei Patienten, die sowohl geringe bis mäßige Hypertension als auch Hyperlipidämie zeigen, verwendet.
- Jeder Patient wird für etwa 10 bis 20 Wochen bewertet und bevorzugt für 14 Wochen. Es werden ausreichend Patienten in dieser Untersuchung verwendet, um sicher zu stellen, daß etwa 400 bis 800 Patienten bewertet werden, um die Studie zu vollenden.
- Eintrittskriterien: Die Patienten in der Studie sind männliche oder weibliche erwachsene Patienten zwischen 18 und 80 Jahren mit einem Ausgangsrisiko von 5 Jahren, wobei das Risiko über dem Mittel des Alters und des Geschlechts der Patienten liegt, wie durch die Framingham-Herz-Studie definiert, die eine laufende Prospektivstudie erwachsener Männer und Frauen ist, die bestimmte Risikofaktoren zeigen, die die Entwicklung einer koronaren Herzerkrankung vorhersagen. Das Alter, das Geschlecht, der systolische und diastolische Blutdruck, die Rauchgewohnheit, Gegenwart oder Abwesenheit von Kohlenhydratunverträglichkeit, Gegenwart oder Abwesenheit von Linksherzhypertrophie, Serumcholesterin und ein HDL von mehr als einer Standardabweichung über der Norm für die Framingham-Population werden alle dadurch bewertet, indem bestimmt wird, ob ein Patient für ein nachteiliges Herzereignis gefährdet ist. Die Werte für die Risikofaktoren werden in die Framingham-Risiko-Gleichung eingesetzt und berechnet, um zu bestimmten, ob ein Patient für ein kommendes kardiovaskuläres Ereignis gefährdet ist.
- Die Patienten werden hinsichtlich der Einhaltung der Eintrittskriterien, die oben angegeben werden, untersucht. Nachdem alle Untersuchungskriterien erfüllt sind, werden die Patienten von ihrer derzeitigen antihypertensiven und Lipid-verringernden Medikation ausgewaschen, die die Ergebnisse der Aufnahme beeinflussen könnten. Die Patienten werden dann auf die NCEP ATP II Schritt 1-Diät gesetzt, wie oben beschrieben wird. Kürzlich diagnostizierte Patienten bleiben im allgemeinen unbehandelt, bis der Test beginnt. Diese Patienten werden ebenso auf die NCEP Schritt 1-Diät gesetzt. Nach der 4-wöchigen Auswäsche und der Diäteingewöhnungszeit, werden die Patienten den folgenden Anfangsuntersuchungen unterzogen: (1) Blutdruck, (2) Fasten; (3) Lipidaufnahme; (4) Glukosetoleranztest; (5) EKG und (6) Herzultraschall. Diese Tests werden unter Verwendung von Standardverfahren, die einem Fachmann allgemein bekannt sind, durchgeführt. Das EKG und der Herzultraschall werden im allgemeinen verwendet, um die Gegenwart oder Abwesenheit von Linksherzhypertrophie zu messen.
- Nachdem die Grunduntersuchungen durchgeführt sind, beginnen die Patienten mit einem der folgenden: (1) einer festen Dosis von Verbindung III (etwa 150 bis 900 mg); (2) einer festen Dosis Quinapril (etwa 2,5 mg bis etwa 50 mg); oder (3) einer Kombination aus den obigen Dosen von Verbindung III und des Quinaprils. Die Patienten werden auf diesen Dosen gehalten und sollen nach 6 bis 8 Wochen wieder kommen, so daß die Ausgangsbewertungen wiederholt werden können. Zu diesem Zeitpunkt werden die neuen Werte in die Framingham-Risiko-Gleichung eingesetzt, um zu bestimmen, ob der Patient weniger oder stärker für ein kommendes kardiokaskuläres Ereignis gefährdet ist oder ob es keine Änderung gibt.
- Die obigen Assays, die die Wirkungen der Verbindung III oder eines pharmazeutisch verträglichen Säureadditionssalzes hiervon und Quinapril oder eines pharmazeutisch verträglichen Salzes hiervon bei der Behandlung von Angina pectoris, Atherosklerose, Hypertension und Hyperlipidämie zusammen, und der Behandlung von kardialem Risiko, demonstrieren, liefern ebenso ein Mittel, bei dem die Aktivitäten der Verbindungen dieser Erfindung unter sich und mit den Wirkungen anderer bekannter Verbindungen verglichen werden können. Die Ergebnisse dieser Vergleiche sind für die Bestimmung der Dosierungsniveaus bei Säugern, insbesondere bei Menschen, zur Behandlung solcher Krankheiten verwendbar.
- Die folgenden Dosiermengen und andere Dosiermengen, die anderswo in dieser Beschreibung und in den anhängenden Ansprüchen angegeben werden, sind für einen durchschnittlichen menschlichen Patienten mit einem Gewicht von 65 kg bis etwa 70 kg. Die zu verabreichenden Dosen sind die Mengen, die den Blutdruck eines Säugers wirksam senken, was eine antihypertensive Wirkung ist. Der Arzt wird ohne weiteres in der Lage sein, die Dosiermenge, die für einen Patienten, dessen Gewicht außerhalb des 65 bis 70 kg-Bereiches fallt, basierend auf der medikalen Geschichte des Patienten und der Gegenwart von Erkrankungen, zum Beispiel Diabetes, bei dem Patienten, zu bestimmen.
- Alle Dosen, die hierin und in den anhängenden Ansprüchen angegeben werden, sind tägliche Dosen.
- Im allgemeinen wird der Carboxyalkylether gemäß dieser Erfindung im allgemeinen in einer Dosierung von etwa 150 mg bis etwa 1.000 mg verabreicht. Bevorzugt wird Verbindung III in einer Dosierung von etwa 600 mg verabreicht. Ein Fachmann wird erkennen, daß die freie Baseform oder andere Salzformen von Verbindung III in dieser Erfindung verwendet werden können. Die Berechnung der Dosierungsmenge für diese anderen Formen oder freien Basenform oder anderen Salzformen der Verbindung III kann leicht durch Einhaltung eines einfachen Verhältnisses, bezogen auf die Molekulargewichte der einbezogen Spezies, erreicht werden.
- Im allgemeinen werden die obigen Antihypertonika gemäß dieser Erfindung in den folgenden Dosiermengen verabreicht:
- Quinapril, im allgemeinen etwa 1,0 mg bis etwa 80 mg und bevorzugt etwa 10 mg bis etwa 40 mg;
- Amlodipine-Besylat, im allgemeinen etwa 2,5 mg bis etwa 40 mg und bevorzugt etwa 2,5 mg bis etwa 10 mg;
- Enalapril-Maleat, im allgemeinen etwa 2,0 mg bis etwa 50 mg und bevorzugt etwa 2,5 mg bis etwa 20 mg;
- Eprosartan-Mesylat, im allgemeinen etwa 100 mg bis etwa 800 mg und bevorzugt etwa 200 mg bis etwa 400 mg;
- Acebutolol-Hydrochlorid, im allgemeinen etwa 100 mg bis etwa 800 mg und bevorzugt etwa 200 mg bis etwa 400 mg; und
- Hydrochlorthiazid, im allgemeinen etwa 2,5 mg bis etwa 160 mg und bevorzugt etwa 10 mg bis etwa 80 mg.
- Ein Fachmann wird erkennen, daß die freie Säureform oder andere Salzformen der obigen Antihypertonika in dieser Erfindung verwendet werden können. Die Berechnung der Dosierungsmenge für diese anderen Formen oder freien Säureform oder anderen Salzformen solcher Antihypertonika kann leicht durch Einhaltung eines einfachen Verhältnisses, bezogen auf die Molekulargewichte der einbezogen Spezies, erreicht werden.
- Die Verbindungen der vorliegenden Erfindung werden im allgemeinen in Form einer pharmazeutischen Zusammensetzung verabreicht, die zumindest eine der Verbindungen diesen Erfindung zusammen mit einem pharmazeutisch verträglichen Träger oder einem Verdünnungsmittel umfassen. Daher können die Verbindungen dieser Erfindung entweder einzeln oder zusammen in irgendeiner herkömmlichen oralen, parenteralen oder transdermalen Dosierungsform verabreicht werden.
- Für die orale Verabreichung kann eine pharmazeutische Zusammensetzung die Form von Lösungen, Suspensionen, Tabletten, Pillen, Kapseln, Pulvern und dergleichen annehmen. Tabletten, die verschiedene Trägerstoffe wie Natriumzitrat, Calciumcarbonat und Calciumphosphat enthalten, werden mit verschiedenen Desintegrationsmitteln wie Stärke und bevorzugt Kartoffel- oder Tapiokastärke und bestimmten Komplexsilikaten, zusammen mit Bindemitteln wie Polyvinylpyrrolidon, Saccharose, Gelatine und Akazie eingesetzt. Zusätzlich sind Schmiermittel wie Magnesiumstearat, Natriumlaurylsulfat und Talk oftmals für Tablettierungszwecke nützlich. Feste Zusammensetzungen von einem ähnlichen Typ werden ebenso als Füllstoffe in weichen und harten gefüllten Gelatinekapseln eingesetzt; bevorzugte Materialien in diesem Zusammenhang umfassen ebenso Laktose oder Milchzucker, ebenso wie Polyethylenglykole mit hohem Molekulargewicht. Wenn wässerige Suspensionen und/oder Elixire für die orale Verabreichung gewünscht werden, können die Verbindungen dieser Erfindung mit verschiedenen Süßungsmitteln, Geschmacksmitteln, Färbemitteln, Emulgatoren und/oder Suspendiermitteln, ebenso wie Verdünnungsmitteln wie Wasser, Ethanol, Propylenglykol, Glycerin und verschiedenen ähnlichen Kombinationen hiervon kombiniert werden.
- Die Kombinationen dieser Erfindung können ebenso in einer Formulierung mit kontrollierter Freisetzung verabreicht werden, wie in einer Formulierung mit langsamer oder schneller Freisetzung. Solche Formulierungen mit kontrollierter Freisetzung der Kombination dieser Erfindung können unter Verwendung von Verfahren, die dem Fachmann bekannt sind, hergestellt werden. Das Verfahren zur Verabreichung wird durch den behandelnden Arzt oder eine andere fachkundige Person nach einer Bewertung des Zustandes und der Erfordernisse des Patienten bestimmt. Die allgemein bevorzugte Formulierung aus Quinapril ist Accupril® (Quinapril, Warner-Lambert Company) wie in US-Patent 4,743,450, das hierin durch Verweis aufgenommen ist, beschrieben. Ein bevorzugter Calcium-Kanal-Blocker ist Amlodipine, bevorzugt Norvasc® (Pfizer, Inc.).
- Für parenterale Verabreichungszwecke können Lösungen in Sesam- oder Erdnußöl oder in wässerigem Propylenglykol eingesetzt werden, ebenso wie sterile wässerige Lösungen aus den entsprechenden wasserlöslichen Salzen. Solche wässerigen Lösungen können wenn not wendig geeigneterweise gepuffert und das flüssige Verdünnungsmittel zuerst mit ausreichend Salzlösung oder Glucose isotonisch gemacht werden. Diese wässerigen Lösungen sind insbesondere für intravenöse, intramuskuläre, subkutane und intraperitoneale Injektionszwecke geeignet. In diesem Zusammenhang sind alle eingesetzten sterilen wässerigen Medien ohne weiteres durch Standard-Techniken, die einem Fachmann allgemein bekannt sind, erhältlich.
- Verfahren zur Herstellung verschiedener pharmazeutischer Zusammensetzungen mit einer bestimmten Menge an Wirkstoff sind dem Fachmann bekannt oder werden im Lichte dieser Offenbarung ersichtlich. Für Beispiele, siehe Remingtons Pharmaceutical Sciences, Mack Publishing Company, Easter, Pennsylvania., 15. Auflage Edition (1995).
- Die erfindungsgemäßen pharmazeutischen Zusammensetzungen können 0,1 bis 95 % der Verbindungen) dieser Erfindung enthalten, bevorzugt 1 % bis 70 %. In jedem Fall wird die zu verabreichende Zusammensetzung oder Formulierung eine gewisse Menge einer erfindungsgemäßen Verbindung/von Verbindungen enthalten, die zur Behandlung des Zustandes oder der Erkrankung des zu behandelnden Patienten wirksam ist.
- Da sich die vorliegende Erfindung auf die Behandlung von Krankheiten und Zuständen in Kombination von Wirkstoffen bezieht, die separat verabreicht werden können, bezieht sich die Erfindung ebenso auf die Kombination separater pharmazeutischer Zusammensetzungen in Kitform. Das Kit umfaßt zwei separate pharmazeutische Zusammensetzungen: einen Carboxyalkylether oder ein pharmazeutisch verträgliches Säureadditionssalz hiervon und ein Antihypertonikum oder ein pharmazeutisch verträgliches Salz hiervon. Das Kit umfaßt Behälter, die die separaten Zusammensetzungen enthalten, wie eine geteilte Flasche oder eine geteilte Folieschachtel; die separaten Zusammensetzungen können jedoch ebenso in einem einzelnen nicht geteilten Behälter enthalten sein. Typischerweise umfaßt das Kit Anweisungen für die Verabreichung der separaten Komponenten, um synergistische Ergebnisse zu erhalten. Die Kitform ist insbesondere vorteilhaft, wenn die separaten Komponenten bevorzugt in verschiedenen Dosierformen verabreicht werden (z. B. oral und parenteral), bei verschiedenen Dosierintervallen verabreicht werden, oder wenn die Titrierung der einzelnen Komponenten durch den verschreibenden Arzt gewünscht wird.
- Es sollte selbstverständlich sein, daß die Erfindung nicht auf die besonderen Ausführungsformen, die hierin beschrieben werden, beschränkt ist, sondern das verschiedene Änderungen und Modifikationen vorgenommen werden können, ohne vom Sinn und Umfang dieses neuen Konzeptes, wie es durch die folgenden Ansprüche definiert wird, abzuweichen.
Claims (32)
- Pharmazeutische Zusammensetzung umfassend: a. Eine Menge eines Carboxyalkylethers oder eines pharmazeutisch verträglichen Säureadditionssalzes davon; b. eine Menge eines Antihypertonikums oder eines pharmazeutisch verträglichen Salzes davon; und c. einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel worin genanntes Antihypertonikum ausgewählt ist aus: einem Calciumkanalblocker, einem ACE-Hemmer, einem α-Blocker, einem β-Blocker, einem Diuretikum oder einem Angiotensin-II-Rezeptor-Antagonisten.
- Pharmazeutische Zusammensetzung nach Anspruch 1, worin genanntes Antihypertonikum Amlodipin oder Quinapril oder pharmazeutisch verträgliche Salze davon darstellt.
- Pharmazeutische Zusammensetzung nach Anspruch 1 oder 2 umfassend eine Verbindung der Formel I worin n und m unabhängig ganze Zahlen von 2 bis 9 darstellen; R1, R2, R3 und R4 unabhängig C1-C6-Alkyl, C1-C6-Alkenyl, C2-C6-Alkynyl darstellen und R1 und R2 zusammen mit dem Kohlenstoff, an den sie gebunden sind, und R3 und R4 zusammen mit dem Kohlenstoff, an den sie gebunden sind, einen carbocyclischen Ring mit von 3 bis 6 Kohlenstoffatomen vervollständigen können; und Y1 und Y2 unabhängig COOH, CHO, Tetrazol und COOR5 darstellen, worin R5 für C1-C6-Alkyl, C1-C6-Alkenyl oder C2-C6-Alkynyl steht, worin die Alkyl-, Alkenyl- und Alkynyl-Gruppen mit einer oder zwei Gruppe(n), die aus Halo, Hydroxy, C1-C6-Alkoxy und Phenyl ausgewählt sind, substituiert werden können; oder ein pharmazeutisch verträgliches Salz davon.
- Pharmazeutische Zusammensetzung nach Anspruch 3 umfassend Quinapril-Hydrochlorid und 6,6'-Oxybis(2,2-dimethylhexansäure)-Monocalcium.
- Erste pharmazeutische Zusammensetzung zur Verwendung mit einer zweiten pharmazeutischen Zusammensetzung zum Erlangen einer antihypertonen und/oder einer kardiovaskulären Wirkung in einem Säuger, der an Hypertonie leidet oder bei dem ein Risiko für eine kardiovaskuläre Erkrankung besteht, welche Wirkungen größer als die Summe der antihypertonen Wirkungen sind, die durch Verabreichung genannter erster und zweiter pharmazeutischer Zusammensetzungen getrennt erreicht werden und welche zweite pharmazeutische Zusammensetzung eine Menge eines Carboxyalkylethers oder eines pharmazeutisch verträglichen Salzes davon und einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel umfasst, wobei genannte erste pharmazeutische Zusammensetzung eine Menge eines Antihypertonikums oder eines pharmazeutisch verträglichen Salzes davon und einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel umfasst, worin genanntes Antihypertonikum aus einem Calciumkanalblocker, einem ACE-Hemmer, einem α-Blocker, einem β-Blocker, einem Diuretikum oder einem Angiotensin-II-Rezeptor-Antagonisten ausgewählt ist.
- Zusammensetzung nach Anspruch 5, worin genanntes Antihypertonikum Amlodipin oder Quinapril darstellt.
- Zusammensetzung nach Anspruch 6, worin genannte zweite pharmazeutische Zusammensetzung 6,6'-Oxybis(2,2-dimethylhexansäure)-Monocalcium umfasst.
- Erste pharmazeutische Zusammensetzung zur Verwendung mit einer zweiten pharmazeutischen Zusammensetzung zum Erlangen einer antihypertonen Wirkung in einem Säuger, der an Hypertonie leidet, welche Wirkungen größer als die Summe der antihypertonen Wirkungen sind, die durch Verabreichung genannter erster und zweiter pharmazeutischer Zusammensetzungen getrennt erreicht werden und welche zweite pharmazeutische Zusammensetzung eine Menge eines Antihypertonikums oder eines pharmazeutisch verträglichen Salzes davon und einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel umfasst, wobei genannte erste pharmazeutische Zusammensetzung eine Menge einer Verbindung der Formel II umfasst worin n und m jeweils eine ganze Zahl darstellen, die aus 2, 3, 4 oder 5, oder einem pharmazeutisch verträglichen Salz davon und einem pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel ausgewählt ist; und worin genanntes Antihypertonikum aus einem Calciumkanalblocker, einem ACE-Hemmer, einem α-Blocker, einem β-Blocker, einem Diuretikum oder einem Angiotensin-II-Rezeptor-Antagonisten ausgewählt ist.
- Zusammensetzung nach Anspruch 8, worin genanntes Antihypertonikum Amlodipin oder Quinapril darstellt.
- Zusammensetzung nach Anspruch 9 umfassend 6,6'-Oxybis(2,2-dimethylhexansäure)-Monocalcium.
- Erste pharmazeutische Zusammensetzung zur Verwendung mit einer zweiten pharmazeutischen Zusammensetzung zur Behandlung des kardialen Risikos in einem Säuger, bei dem ein Risiko für das Erleiden eines unerwünschten kardialen Ereignisses besteht, welche Wirkung größer als die Summe der Wirkungen des kardialen Risikomanagements ist, die durch Verabreichung genannter erster und zweiter pharmazeutischer Zusammensetzungen getrennt erreicht werden und welche zweite pharmazeutische Zusammensetzung eine Menge eines Antihypertonikums oder eines pharmazeutisch verträglichen Salzes davon und einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel umfasst, wobei genannte erste pharmazeutische Zusammensetzung eine Menge eines Carboxyalkylethers eines pharmazeutisch verträglichen Säureadditionssalzes davon und einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel umfasst, worin genanntes Antihypertonikum aus einem Calciumkanalblocker, einem ACE-Hemmer, einem α-Blocker, einem β-Blocker, einem Diuretikum oder einem Angiotensin-II-Rezeptor-Antagonisten ausgewählt ist.
- Zusammensetzung nach Anspruch 11, worin genanntes Antihypertonikum Amlodipin oder Quinapril darstellt.
- Zusammensetzung nach Anspruch 12 umfassend 6,6'-Oxybis(2,2-dimethylhexansäure)-Monocalcium.
- Kit zum Erlangen einer therapeutischen Wirkung in einem Säuger, umfassend: a. Eine Menge eines Carboxyalkylethers oder eines pharmazeutisch verträglichen Säureadditionssalzes davon und einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel in einer ersten Einheitsdosierungsform; b. eine Menge eines Antihypertonikums oder eines pharmazeutisch verträglichen Salzes davon und einen pharmazeutisch verträglichen Träger oder ein pharmazeutisch verträgliches Verdünnungsmittel in einer zweiten Einheitsdosierungsform; und c. Behältnismittel zum Halten der genannten ersten und zweiten Dosierungsformen, worin genanntes Antihypertonikum aus einem Calciumkanalblocker, einem ACE-Hemmer, einem α-Blocker, einem β-Blocker, einem Diuretikum oder einem Angiotensin-II-Rezeptor-Antagonisten ausgewählt ist.
- Kit nach Anspruch 14, worin genanntes Antihypertonikum Amlodipin oder Quinapril darstellt.
- Kit nach Anspruch 15 umfassend einen Carboxyalkylether der Formel I.
- Kit nach Anspruch 16, das 6,6'-Oxybis(2,2-dimethylhexansäure)-Monocalcium verwendet.
- Kit nach Anspruch 14, worin genannte therapeutische Wirkung die Behandlung der Hypertonie darstellt.
- Kit nach Anspruch 14, worin genannte therapeutische Wirkung die Behandlung von Angina pectoris darstellt.
- Kit nach Anspruch 14, worin genannte therapeutische Wirkung die Behandlung des kardialen Risikos darstellt.
- Kit nach Anspruch 14, worin genannte therapeutische Wirkung die Behandlung von Atherosklerose darstellt.
- Kit nach Anspruch 21, worin genannte Behandlung der Atherosklerose die Progression atherosklerotischer Plaques verlangsamt.
- Kit nach Anspruch 22, worin genannte Progression atherosklerotischer Plaques in Koronararterien verlangsamt wird.
- Kit nach Anspruch 22, worin genannte Progression atherosklerotischer Plaques in den Karotisarterien verlangsamt wird.
- Kit nach Anspruch 22, worin genannte Progression atherosklerotischer Plaques im peripheren arteriellen System verlangsamt wird.
- Kit nach Anspruch 21, worin genannte Behandlung der Atherosklerose zur Regression atherosklerotischer Plaques führt.
- Kit nach Anspruch 26, worin genannte Regression atherosklerotischer Plaques in Koronararterien auftritt.
- Verwendung einer wirksamen Menge einer Zusammensetzung nach Anspruch 1 zur Herstellung eines Arzneimittels zur Behandlung einer Gefäßerkrankung in einem Säuger.
- Verwendung einer antihyperton wirkenden Menge einer Verbindung der Formel I worin n und m unabhängig ganze Zahlen von 2 bis 9 darstellen; R1, R2, R3 und R4 unabhängig C1-C6-Alkyl, C1-C6-Alkenyl, C2-C6-Alkynyl darstellen, und R1 und R2 zusammen mit dem Kohlenstoff, an den sie gebunden sind, und R3 und R4 zusammen mit dem Kohlenstoff, an den sie gebunden sind, einen carbocyclischen Ring mit von 3 bis 6 Kohlenstoffatomen vervollständigen können; Y1 und Y2 unabhängig COOH, CHO, Tetrazol und COOR4 darstellen, worin R5 C1-C6-Alkyl, C1-C6-Alkenyl, C2-C6-Alkynyl darstellt; und worin die Alkyl-, Alkenyl- und Alkynyl-Gruppen mit einer oder zwei Gruppe(n), die aus Halo, Hydroxy, C1-C6-Alkoxy und Phenyl ausgewählt sind, substituiert werden können; oder ein pharmazeutisch verträgliches Salz davon zur Herstellung eines Arzneimittels zur Behandlung der Hypertonie in einem Säuger.
- Verwendung einer antihyperton wirkenden Menge von 6,6'-Oxybis(2,2-dimethylhexansäure)-Monocalcium zur Herstellung eines Arzneimittels zur Behandlung der Hypertonie in einem Säuger.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US19985500P | 2000-04-26 | 2000-04-26 | |
| US199855P | 2000-04-26 | ||
| US24228000P | 2000-10-20 | 2000-10-20 | |
| US242280P | 2000-10-20 | ||
| PCT/US2001/009088 WO2001080847A2 (en) | 2000-04-26 | 2001-03-22 | Combination of carboxyalkylethers with antihypertensives and pharmaceutical use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE60107559D1 DE60107559D1 (de) | 2005-01-05 |
| DE60107559T2 true DE60107559T2 (de) | 2005-04-14 |
Family
ID=26895229
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE60107559T Expired - Fee Related DE60107559T2 (de) | 2000-04-26 | 2001-03-22 | Kombination von carboxyalkylethern mit antihypertensiva und pharmazeutische verwendung |
Country Status (34)
| Country | Link |
|---|---|
| EP (1) | EP1280522B1 (de) |
| JP (1) | JP2003531170A (de) |
| KR (1) | KR20020091245A (de) |
| CN (1) | CN1426299A (de) |
| AP (1) | AP2002002665A0 (de) |
| AR (1) | AR031104A1 (de) |
| AT (1) | ATE283691T1 (de) |
| AU (1) | AU2001247658A1 (de) |
| BG (1) | BG107264A (de) |
| BR (1) | BR0110234A (de) |
| CA (1) | CA2405559A1 (de) |
| CZ (1) | CZ20023459A3 (de) |
| DE (1) | DE60107559T2 (de) |
| DO (1) | DOP2001000150A (de) |
| EA (1) | EA005245B1 (de) |
| EE (1) | EE200200611A (de) |
| ES (1) | ES2231470T3 (de) |
| HR (1) | HRP20020936A2 (de) |
| HU (1) | HUP0300403A3 (de) |
| IL (1) | IL152474A0 (de) |
| IS (1) | IS6570A (de) |
| MA (1) | MA26894A1 (de) |
| MX (1) | MXPA02009662A (de) |
| NO (1) | NO20025135L (de) |
| NZ (1) | NZ521713A (de) |
| OA (1) | OA12252A (de) |
| PA (1) | PA8516001A1 (de) |
| PE (1) | PE20011308A1 (de) |
| PL (1) | PL357906A1 (de) |
| PT (1) | PT1280522E (de) |
| SK (1) | SK15132002A3 (de) |
| SV (1) | SV2002000367A (de) |
| TN (1) | TNSN01061A1 (de) |
| WO (1) | WO2001080847A2 (de) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102008026033A1 (de) * | 2008-05-30 | 2009-12-10 | Voith Patent Gmbh | Hydrodynamische Maschine und Antriebsstrang |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SI1045691T1 (en) * | 1997-12-12 | 2005-04-30 | Warner-Lambert Company Llc | Statin-carboxyalkylether combinations |
| UA101326C2 (en) * | 2007-06-21 | 2013-03-25 | Актимис Фармасьютикалз, Инк. | Amine salts of crth2 antagonist |
| SI23149A (sl) * | 2009-09-21 | 2011-03-31 | Silverstone Pharma | Nove benzatinske soli ACE inhibitorjev, postopek za njihovo pripravo in njihova uporaba za zdravljenje kardiovaskularnih bolezni |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5298497A (en) * | 1990-05-15 | 1994-03-29 | E. R. Squibb & Sons, Inc. | Method for preventing onset of hypertension employing a cholesterol lowering drug |
| US5648387A (en) * | 1995-03-24 | 1997-07-15 | Warner-Lambert Company | Carboxyalkylethers, formulations, and treatment of vascular diseases |
| NZ503982A (en) * | 1997-12-12 | 2002-03-28 | Warner Lambert Co | Statin-carboxyalkylether combinations useful for treating vascular disorders and diabetes mellitus |
-
2001
- 2001-03-22 PL PL01357906A patent/PL357906A1/xx not_active Application Discontinuation
- 2001-03-22 SK SK1513-2002A patent/SK15132002A3/sk not_active Application Discontinuation
- 2001-03-22 NZ NZ521713A patent/NZ521713A/en unknown
- 2001-03-22 CA CA002405559A patent/CA2405559A1/en not_active Abandoned
- 2001-03-22 MX MXPA02009662A patent/MXPA02009662A/es unknown
- 2001-03-22 AP APAP/P/2002/002665A patent/AP2002002665A0/en unknown
- 2001-03-22 EE EEP200200611A patent/EE200200611A/xx unknown
- 2001-03-22 AT AT01920625T patent/ATE283691T1/de not_active IP Right Cessation
- 2001-03-22 JP JP2001577946A patent/JP2003531170A/ja active Pending
- 2001-03-22 AU AU2001247658A patent/AU2001247658A1/en not_active Abandoned
- 2001-03-22 CN CN01808632A patent/CN1426299A/zh active Pending
- 2001-03-22 EP EP01920625A patent/EP1280522B1/de not_active Expired - Lifetime
- 2001-03-22 OA OA1200200325A patent/OA12252A/en unknown
- 2001-03-22 KR KR1020027014357A patent/KR20020091245A/ko not_active Withdrawn
- 2001-03-22 ES ES01920625T patent/ES2231470T3/es not_active Expired - Lifetime
- 2001-03-22 PT PT01920625T patent/PT1280522E/pt unknown
- 2001-03-22 CZ CZ20023459A patent/CZ20023459A3/cs unknown
- 2001-03-22 BR BR0110234-6A patent/BR0110234A/pt not_active IP Right Cessation
- 2001-03-22 HU HU0300403A patent/HUP0300403A3/hu unknown
- 2001-03-22 DE DE60107559T patent/DE60107559T2/de not_active Expired - Fee Related
- 2001-03-22 WO PCT/US2001/009088 patent/WO2001080847A2/en active IP Right Grant
- 2001-03-22 IL IL15247401A patent/IL152474A0/xx unknown
- 2001-03-22 EA EA200200953A patent/EA005245B1/ru not_active IP Right Cessation
- 2001-04-05 SV SV2001000367A patent/SV2002000367A/es not_active Application Discontinuation
- 2001-04-19 TN TNTNSN01061A patent/TNSN01061A1/en unknown
- 2001-04-23 PA PA20018516001A patent/PA8516001A1/es unknown
- 2001-04-24 DO DO2001000150A patent/DOP2001000150A/es unknown
- 2001-04-24 PE PE2001000363A patent/PE20011308A1/es not_active Application Discontinuation
- 2001-04-25 AR ARP010101902A patent/AR031104A1/es unknown
-
2002
- 2002-09-27 IS IS6570A patent/IS6570A/is unknown
- 2002-10-17 MA MA26872A patent/MA26894A1/fr unknown
- 2002-10-25 NO NO20025135A patent/NO20025135L/no not_active Application Discontinuation
- 2002-11-12 BG BG107264A patent/BG107264A/xx unknown
- 2002-11-26 HR HRP20020936 patent/HRP20020936A2/hr not_active Application Discontinuation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102008026033A1 (de) * | 2008-05-30 | 2009-12-10 | Voith Patent Gmbh | Hydrodynamische Maschine und Antriebsstrang |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69828413T2 (de) | Kombinationstherapie, enthaltend atorvastatin und bluddrucksenkendes mittel | |
| DE69826683T2 (de) | Therapeutische zusammensetzungen, enthaltend amlopidin und atorvastatin | |
| DE60035581T2 (de) | Salz von amlodipin und atorvastatin | |
| DE69828442T2 (de) | Kombinationspräparate enthaltend statin und karboxyalkyläther | |
| DE3390114T1 (de) | Verbesserte analgetische und antiinflammatorische, Ibuprofen enthaltende Zubereitungen und Verfahren zu ihrer Herstellung | |
| RU2145220C1 (ru) | Способ замедления прогрессирования атеросклероза коронарных артерий с помощью правастатина | |
| DE60107559T2 (de) | Kombination von carboxyalkylethern mit antihypertensiva und pharmazeutische verwendung | |
| US8557835B2 (en) | Statin-carboxyalkylether combinations | |
| DE60124400T2 (de) | Verwendung eines betablockers zur behandlung von atherosklerose | |
| US20020103252A1 (en) | Statin-carboxyalkylether combinations | |
| US20030225123A1 (en) | Antihypertensive agents and use | |
| HUP0100349A2 (hu) | Antihyperlipidaemicus statin-Lp (a) inhibitort tartalmazó gyógyszerkészítmények | |
| US20040092574A1 (en) | Statin-Lp(a) inhibitor combinations | |
| ZA200208131B (en) | Antihypertensive agents and use. | |
| MXPA00002085A (en) | Combination therapy comprising amlodipine and a statin compound | |
| EP1481962A1 (de) | Neuer cholesterinspiegelsenkender Karboxyalkylether |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |