DE60026146T2 - Verwendung von Dapoxetin, A selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Disfunktion - Google Patents
Verwendung von Dapoxetin, A selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Disfunktion Download PDFInfo
- Publication number
- DE60026146T2 DE60026146T2 DE60026146T DE60026146T DE60026146T2 DE 60026146 T2 DE60026146 T2 DE 60026146T2 DE 60026146 T DE60026146 T DE 60026146T DE 60026146 T DE60026146 T DE 60026146T DE 60026146 T2 DE60026146 T2 DE 60026146T2
- Authority
- DE
- Germany
- Prior art keywords
- dapoxetine
- medicament
- use according
- sexual
- treatment
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Description
- Die Erfindung betrifft Verwendungen einer therapeutisch wirksamen Menge von Dapoxetin, das ein selektiver Serotoninwiederaufnahme-Inhibitor mit schnellem Wirkungseintritt ist, oder von einem pharmazeutisch verträglichen Salz davon je nach Bedarf kurz vor einer sexuellen Aktivität zur Vorbeugung, Behandlung oder Handhabung von sexueller Funktionsstörung in Säugetieren, insbesondere von vorzeitigem Samenerguß bei Männern.
- Eine normale Erektion tritt als ein Ergebnis eines koordinierten Gefäßereignisses im Penis auf, welches üblicherweise nervös ausgelöst wird und Gefäßerweiterung und Relaxation der glatten Muskulatur im Penis und in den ihn versorgenden arteriellen Gefäßen umfaßt. Der arterielle Einstrom verursacht eine Vergrößerung der Substanz der Corpora cavernosa. Der venöse Ausstrom wird durch diese Vergrößerung zurückgehalten, was aufrecht erhaltene hohe Blutdrücke im Penis ermöglicht, die normalerweise ausreichend sind, um die Steifheit zu bewirken. Auch die Muskeln in dem Perineum wirken unterstützend bei der Erzeugung und Aufrechterhaltung der penilen Steifheit. Eine Erektion kann auch zentral im Nervensystem durch sexuelle Gedanken oder die Phantasie induziert werden und wird üblicherweise lokal durch Reflexmechanismen verstärkt. Die erektilen Mechanismen bei Frauen sind für die Klitoris im wesentlichen gleich. Allerdings tritt bei Männern typischerweise mit einem Orgasmus die Ejakulation auf.
- Jedoch ist der vorzeitige Samenerguß eine der häufigsten sexuellen Beschwerden. Es wird geschätzt, daß davon bis zu 30 bis 40% der Männer betroffen sind, d.h. ungefähr 36 Millionen männliche Amerikaner (Derogatis, L. R., Med. Aspects Hum. Sexuality, 14: 1168–76 (1980), Frank E., et al., Engl. J. Med., 299: 111–115 (1978), Schein, M., et al., Fam. Pract. Res. J., 7(3): 122–134 (1988)). Vorzeitiger Samenerguß bedeutet andauernde oder wiederkehrende Ejakulation bei minimaler vorheriger sexueller Stimulation bei oder kurz nach der Penetration und bevor die Person es wünscht. Ein solcher früher als gewünscht eintretender Erguß ist häufig enttäuschend und kann zu anderen sexuellen Funktionsstörungen führen, einschließlich erektiler Probleme, weiblicher Anorgasmie, geringem sexuellen Verlangen und sexuelle Abneigung (Rust J., et al., Br. J. Psychiat., 152: 629–631 (1988)). Für die Behandlung von vorzeitigem Samenerguß wird die Verhaltenstherapie als Goldstandard angesehen, wie z. B. die Wartemethode nach Seman, die Warte-Drück-Technik nach Masters und Johnson oder das Stop-Start-Verfahren nach Kaplan (Seftel, A. D., Altohob, S. E., „Premature Ejaculation", Diagnosis and Management of Male Sexual Dysfunction, herausgegeben von J. J. Mulcahy, New York, NY, Igaku-Shoin, (1997) Kapitel 11, Seiten 196–203). Obwohl diese Verfahren harmlos, gewöhnlich schmerzfrei und mit Quoten von 60 bis 95% erfolgreich sind (Seftel, Hawton, K., et al., Behav. Res. Ther., 24–377 (1986)), erfordern sie die Kooperation des Partners und die Verbesserung ist kurzlebig (Bancroft, J. and Colse L., Brit. Med. J., 1: 1575 (1976) und De Amicus, L. A., et al., Arch. Sex. Behav., 14: 467 (1985)).
- Der vorzeitige Samenerguß hat selten eine physische Ursache, allerdings können eine Entzündung der Prostatadrüse oder Störungen des Nervensystems eine Rolle spielen. Die Behandlung kann bestimmte selektive Serotoninwiederaufnahme-Inhibitoren einschließen, wie z. B. Fluoxetin, Paroxetin oder Sertralin (Merck Manual of Medical Information auf 421–422, Home Edition, Merck Research Laboratories (1997)), siehe auch US-Patente mit den Nummern 5,597,826 (Setralin), 5,276,042 (Paroxetin) und 5,151,448 (Fluoxetin). Obwohl die Ejakulationslatenz durch psychologische und/oder kognitive Mechanismen beeinflußt wird, spielen auch somatische Faktoren eine Rolle (Althof, S. E., Psychiatr. Clin. N. Amer., 18(1): 85–94 (1995), Rowland D. L. et al., J. Sex. Marital. Ther., 19: 189 (1993)). Die Ejakulation wird teilweise durch einen nervösen Reflex vermittelt, der durch ein sensorisches Signal an den Penis stimuliert wird, und endet in Kontraktionen der glatten und gestreiften Muskulatur, die zu einer seminalen Entleerung und Austreibung führen. Segraves stellte die Hypothese auf, daß eine erhöhte serotoninerge Aktivierung mit einer Orgasmushemmung einhergehen könnte (Arch. Gen. Psychiatry., 46: 275–284 (1989)) und berichtet, daß der Samenerguß durch Alpha-Rezeptoraktivierung vermittelt zu sein scheint, vermutlich auf einer peripheren Ebene, wobei cholinerge Fasern eine modulatorische Rolle spielen. Die Einbeziehung des serotoninergen Systems bei der Ejakulation könnte auf der Ebene des Gehirns oder des Rückenmarks erfolgen.
- Von mehreren Psychopharmaka wurde berichtet, daß sie die Nebenwirkung der Hemmung des Samenergusses haben. Daher wurde als eine Alternative zur Verhaltenstherapie die orale pharmazeutische Therapie des vorzeitigen Samenergusses unter Verwendung von trizyklischen Antidepressiva oder bestimmter selektiver Serotoninwiederaufnahme-Inhibitorarzneimittel untersucht (siehe z. B. Merck Manual of Medical Information auf 421–422, Home Edition, Merck Research Laboratories (1997). Von Open-Label- und kontrollierten Studien wurde berichtet, daß diese Verbindungen die intravaginale Ejakulationslatenz bei Patienten mit vorzeitigem Samenerguß wirksam erhöhen, während Nebenwirkungen vermieden werden.
- Z. B. offenbart das US-Patent Nr. 5,672,612 amorphe Paroxetinhydrochlorid-Ethanol-Zusammensetzungen für die Verwendung als ein therapeutisches Mittel für den vorzeitigen Samenerguß. Diese Referenz berichtet auch, daß die sexuelle Funktionsstörung, die typischerweise mit Antidepressiva einhergeht, einschließlich verzögerter und vollständig ausbleibender Ejakulation, Gegenstand einer Anzahl von Fallberichten, Studien und Artikeln war. Siehe z. B. Depression, 2: 233–240 (1994/1995), J. Clin. Psychiatry, 54: 209–212 (1993), J. Clin. Psychopharmacol., 3: 76–79 (1983). SSRI-Antidepressiva scheinen eine sichere Behandlungsoption für Patienten mit vorzeitigem Samenerguß zu sein, insbesondere bei den Fällen, in denen eine psychologische Behandlung scheiterte, obwohl andere angstlösende Arzneimittel, wie z. B. Chlordiazepoxid (LIBRIUM®) und Diazepam (VALIUM®) für die Behandlung von vorzeitigem Samenerguß nicht geeignet sind. Siehe auch Clin. Neuropharmacology, 20(5): 466–471 (1997) (Behandlung von vorzeitigem Samenerguß mit Fluoxetin) und Clin. Neuropharmacology, 20(3): 210–214 (Mianserin zur Behandlung von durch SSRIs induzierter sexueller Funktionsstörung).
- Das US-Patent Nr. 5,151,448 offenbart die chronische Verabreichung von Fluoxetin, vorzugsweise oral, in einer Menge in dem Bereich von etwa 5 mg bis etwa 80 mg pro Tag, vorzugsweise von etwa 20 mg pro Tag, zur Behandlung von vorzeitigem Samenerguß. Die Zusammensetzungen werden über einen Zeitraum von wenigstens etwa 3 Monaten verabreicht, vorzugsweise über wenigstens etwa 6 Monate. In einigen Fällen wird Fluoxetin solange chronisch verabreicht, wie der Patient sexuelle aktiv bleibt.
- Das US-Patent Nr. 5,276,042 offenbart die chronische Verabreichung von Paroxetin, vorzugsweise oral, in einer Menge in dem Bereich von etwa 3 mg bis etwa 30 mg pro Tag, vorzugsweise von etwa 10 mg pro Tag, zur Behandlung von vorzeitigem Samenerguß. Die Zusammensetzungen werden über einen Zeitraum von wenigstens etwa 3 Monaten verabreicht, vorzugsweise über wenigstens etwa 6 Monate. In einigen Fällen wird Paroxetin solange chronisch verabreicht, wie der Patient sexuell aktiv bleibt.
- Das US-Patent Nr. 5,597,826 offenbart die Verabreichung von Sertralin und einem Agonisten oder Antagonisten des Serotonin-1-(5-HT1)-Rezeptors und die Verwendung solcher Zusammensetzungen zur Behandlung oder Vorbeugung eines Zustands, der aus einer langen Liste von Erkrankungen ausgewählt ist, einschließlich der sexuellen Funktionsstörung, wie z. B. vorzeitiger Samenerguß. Es wird offenbart, daß diese Zusammensetzungen täglich zu verabreichen sind, z. B. ein- bis viermal täglich.
- McMahon berichtet, daß 37 potente Männer mit vorzeitigem Samenerguß mit 50 mg Sertralin und Placebo oral in einer kontrollierten, randomisierten Einzelblind-Crossover-Studie behandelt wurden. Die chronische Open-Label-Behandlung wurde bei 29 Patienten fortgesetzt, die eine Steigerung der Ejakulationslatenz über die Niveaus vor der Behandlung mit aktivem Arzneimittel erreichten. McMahon, J. Urology, 159(6): 1935–1938 (1998). McMahon schloß daraus, daß Sertralin eine geeignete und gut akzeptierte orale Behandlung des vorzeitigen Samenergusses nach ein bis zwei Wochen zu sein scheint, wobei mehrere Patienten diese Kontrolle nach der chronischen Behandlung über einige Monate halten können.
- Die US-Patente Nr. 5,770,606 und 5,624,677 offenbaren eine psychogene Impotenz oder erektile Funktionsstörung, die bei Patienten feststellbar ist und ohne wesentliche ungewünschte Nebenwirkungen behandelt werden kann durch die sublinguale Verabreichung von Apomorphin-Dosierungsformen zur Aufrechterhaltung einer Plasmakonzentration von nicht mehr als etwa 5,5 Nanogramm pro ml.
- Es wurde berichtet, daß bestimmte selektive Serotoninwiederaufnahme-Inhibitoren für verschiedene Indikationen geeignet sind. Z. B. offenbart das US-Patent Nr. 5,135,947 1-Phenyl-3-Naphtalenyloxypropanamine und Verfahren zur Verwendung derselben zur Behandlung einer Vielzahl von Funktionsstörungen, die mit verminderter Neurotransmission von Serotonin in Säugetieren verbunden waren, einschließlich Fettsucht, Depression, Alkoholismus, Schmerz, Gedächtnisverlust, Angst, Rauchen und dergleichen.
- Die oben besprochenen Referenzen beschäftigen sich primär mit der chronischen Verabreichung von therapeutischen Mitteln zur Behandlung von vorzeitigem Samenerguß, aber sie diskutieren nicht eine bedarfsabhängige Verabreichung. Wie oben besprochen wurde, kann die Behandlung von vorzeitigem Samenerguß die Verabreichung von bestimmten selektiven Serotoninwiederaufnahme-Inhibitoren einschließen, wie z. B. Fluoxetin, Paroxetin oder Sertralin, um den Samenerguß zu verzögern. Diese Arzneistofftyp wirkt, indem die Menge an Serotonin im Körper erhöht wird, und kann täglich verabreicht werden (Merck Manual of Medical Information auf 421–422, Home Edition, Merck Research Laboratories (1997)).
- Kürzlich berichteten Paick et al., daß die Eigentherapie mit Sertralintabletten durch chronische Verabreichung gefolgt von bedarfsabhängiger Verabreichung am Tag des Verkehrs untersucht wurde. Paick, J. S. et al., J. Urology, 159(S5): 241 (Juni, 1998). Diese Studie wurde mit 24 Männern über 6 Wochen durchgeführt und die Autoren berichteten, daß bei der Behandlung von vorzeitigem Samenerguß über 2 Wochen Dosierungen von 50 mg verabreicht wurden, gefolgt von der Eigentherapie mit 50 mg oder 100 mg an Sertralin je nach Bedarf um 17 h. Die Autoren schlossen hieraus, daß diese Therapie möglicherweise genauso attraktiv sein könnte, wie die Eigeninjektions-Therapie bei der Behandlung von erektiler Funktionsstörung.
- McMahon und Touma, J. Urol., 161. 1826–1839 (1999) zeigten bei 26 Patienten, die unter vorzeitigem Samenerguß litten, daß die prn-Dosierung mit 20 mg Paroxetin-Tabletten 3–4 Stunden vor dem Verkehr zu einer statistisch signifikanten Erhöhung der Ejakulationslatenz in der zweiten und bis zur vierten Woche der Paroxetin-Behandlung führte, jedoch nicht in der ersten Woche, was darauf hinweist, daß 1–2 Wochen „Initialdosierungen" an Paroxetin erforderlich ist. Die Häufigkeit des Verkehrs wurde bereits nach 3 Wochen der prn-Paroxetin-Therapie signifikant erhöht.
- In einer nachfolgenden Druckschrift zeigten McMahon und Touma, International J. Impotence Research, 11, 241–246 (1999), daß 20 mg prn-Paroxetin die Ejakulationslatenz bei lediglich 42% ihrer Patienten verbesserten, und es wurde berichtet, daß die Erhöhung er Ejakulationslatenz erst nach vier Wochen der Behandlung statistisch signifikant war, was wiederum darauf hinweist, daß es einen Bedarf nach „Initialdosierungen" von Paroxetin gibt. Außerdem gingen bei 37% der Patienten, die anfangs eine Verbesserung der Ejakulationslatenz unter kontinuierlicher Dosierung von Paroxetin zeigten, anschließend diese Vorteile verloren, nachdem sie zu der prn-Dosierung wechselten. Gleichermaßen zeigten Salem, et al., J. Urol., 163 (S4), 197 (2000), daß 100% der Patienten, die anfangs eine Verbesserung der Ejakulationslatenz unter kontinuierlicher Dosierung von Fluoxetin zeigten, anschließend diesen Vorteil verloren, nachdem sie zu der prn-Dosierung wechselten.
- Die angemessene Behandlung von vorzeitigem Samenerguß umfaßt nicht nur die Hemmung der frühen Ejakulation, sondern auch die Gewährleistung, daß der Patient über eine verbesserte Kontrolle über die zeitliche Steuerung des Samenergusses verfügt. Die zur Verfügung stehenden Optionen zur Behandlung von vorzeitigem Samenerguß erfordern üblicherweise auch tägliche Dosierungen, um die geeigneten Plasmaniveaus zu erhalten. Die tägliche oder chronische Verwendung von konventionellen SSRIs und verwandten Verbindungen für eine solche Therapie kann zu nachteiligen Wirkungen führen, die bei hoher oder kontinuierlicher Dosierung solcher Verbindungen zu erwarten sind. Außerdem ist die chronische oder tägliche Verabreichung von konventionellen SSRIs eine für den Patienten lästige Anforderung. Darüber hinaus ist die Latenzzeit vom Zeitpunkt der Dosierung bis zum Einlassen auf eine sexuelle Aktivität, die mit konventionellen SSRIs verbunden ist, eine weitere Hürde, mit der der Patient zurechtkommen muß. Schließlich ist es auch lästig, den Vorteil eines Arzneimittels nicht mit einer einzelnen oder der ersten Verabreichung des Arzneimittels zu erfahren. Es ist daher gewünscht, eine Verbindung und ein Verfahren zur Therapie einer sexuellen Funktionsstörung zu finden, insbesondere, um eine verbesserte Kontrolle über die zeitliche Steuerung einer Ejakulation bereitzustellen. Insbesondere ist es gewünscht, den vorteilhaften therapeutischen Effekt der Vorbeugung, der Behandlung oder der Handhabung einer sexuellen Funktionsstörung zu erreichen, während nachteilige Wirkungen, die mit den gegenwärtigen Verabreichungsprotokollen von Therapien von sexueller Funktionsstörung verbunden sind, reduziert oder vermieden werden. Insbesondere ist es wünschenswert, dauerhaft die maximale therapeutische Wirkung innerhalb eines angenehmen Zeitrahmens nach der Verabreichung einer Arzneimitteltherapie, unmittelbar bis 4 Stunden vorher bedarfsabhängig zu erreichen, um es dem Patienten zu ermöglichen, die Arzneimitteltherapie mit der zeitlichen Planung des Verkehrs nach einer einzelnen oder der ersten Dosierung zu koordinieren.
- Die Erfindung umfaßt Verwendungen, die eine bedarfsabhängige Dosierung anwenden, die auch als pro-re-nata-Dosierung bekannt ist (hier als „prn-Dosierung" bezeichnet), für die Therapie zur Vorbeugung, Behandlung und Handhabung von sexueller Funktionsstörung. Ohne durch diese theoretische Überlegung gebunden sein zu wollen, wird angenommen, daß diese Verwendungen eine Therapie liefern, indem wenigstens eines unter folgendem erreicht wird: Erhöhung der Wirkung von Monoaminen im Säugetier, Erhöhung von Serotonin im Säugetier oder Hemmung oder Vermeidung der Wiederaufnahme von Serotonin in die Nervenenden im Säugetier. Die prn-Dosierung reduziert und/oder verhindert nachteilige Wirkungen, die mit der chronischen Therapie eines therapeutischen Mittels auftreten können. Daher umfassen die Verwendungen zur Vorbeugung, Behandlung oder Handhabung von sexueller Funktionsstörung gemäß der Erfindung die Verabreichung einer therapeutisch wirksamen Menge des wirksamen Mittels an einen Patienten, der dieser Therapie bedarf, unmittelbar vor bis etwa 12 Stunden vor der zu erwartenden sexuellen Aktivität des Patienten. Vorzugsweise wird eine therapeutisch wirksame Menge des wirksamen Mittels einem Patienten, der dieser Therapie bedarf, ummittelbar vor bis etwa 10 Stunden vor der zu erwartenden sexuellen Aktivität des Patienten verabreicht, vorzugsweise unmittelbar bis etwa 8 Stunden vor der zu erwartenden sexuellen Aktivität des Patienten, und besonders bevorzugt unmittelbar vor bis etwa 4 Stunden vor der zu erwartenden sexuellen Aktivität des Patienten. Außerdem kann eine therapeutisch wirksame Menge des wirksamen Mittels einem Patienten, der einer solchen Therapie bedarf, unmittelbar vor der zu erwartenden sexuellen Aktivität des Patienten verabreicht werden. Demzufolge beseitigt die vorliegende Erfindung die Notwendigkeit der chronischen oder täglichen Verabreichung des wirksamen Mittels vor der zu erwartenden sexuellen Aktivität.
- Typischerweise ist der Patient ein Säugetier, wie z. B. ein Hund, ein Pferd, eine Ratte, eine Maus oder ein Mensch, aber insbesondere ist der Patient ein Mensch. Bei einer bevorzugten Ausführungsform ist der Mensch männlich mit oder ohne dem Risiko einer sexuellen Funktionsstörung, wie z. B. dem vorzeitigen Samenerguß.
- Gemäß einem Aspekt der vorliegenden Erfindung wird die Verwendung von Dapoxetin, das ein selektiver Serotoninwiederaufnahme-Inhibitor mit schnellem Wirkungseintritt ist, oder einem pharmazeutisch verträglichen Salz davon zur Herstellung eines Arzneimittels für die Behandlung oder die Handhabung von sexueller Funktionsstörung bei einem Säugetier bereitgestellt, wobei das Arzneimittel für die bedarfsabhängige Verabreichung angepaßt ist.
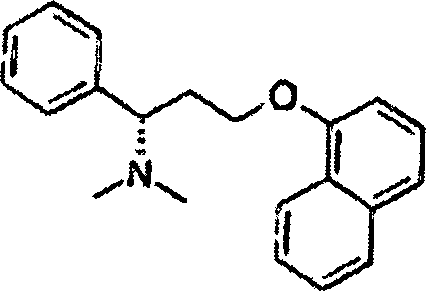
- Gemäß eines weiteren Aspekts der vorliegenden Erfindung wird die Verwendung von Dapoxetin oder einem pharmazeutisch verträglichen Salz davon für die Herstellung eines Arzneimittels zur Behandlung oder Handhabung von vorzeitigem Samenerguß bei einem männlichen Menschen bereitgestellt, wobei das Arzneimittel bedarfsabhängig verabreicht wird in einer Verabreichungsform, die etwa 0,01 mg bis etwa 200 mg an Dapoxetin oder eines pharmazeutisch verträglichen Salzes davon pro Verabreichung liefert und für die Verabreichung unmittelbar vor bis etwa 8 Stunden vor einer sexuellen Aktivität angepaßt ist. Dapoxetin ist ein Beispiel für einen selektiven Serotoninwiederaufnahme-Inhibitor mit schnellem Wirkungseintritt. Hierin wird der Begriff „Dapoxetin" zur Bezeichnung der Verbindung der folgenden Formel verwendet, die auch als (S)-(+)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyloxy)-Propanamin oder als (S)-(+)-N,N-Dimethyl-α-[2-(1-Naphtalenyloxy)-Ethyl-Bezolmethanamin bezeichnet wird. Dem Fachmann ist klar, daß Dapoxetin als die freie Base oder als ein pharmazeutisch verträgliches Salz davon, wie z. B. das HCl-Salz, verabreicht werden kann.
- Die Erfindung umfaßt vorzugsweise die Behandlung, Vorbeugung und/oder Handhabung von solchen Erkrankungen, indem eine einzelne Dosierungseinheitsform, die Dapoxetin oder ein pharmazeutisch verträgliches Salz davon enthält, verwendet wird. Das Dapoxetin oder ein pharmazeutisch verträgliches Salz davon ist auch in Kombination mit einem zusätzlichen therapeutischen Mittel, wie z. B. einem konventionellen selektiven Serotoninwiederaufnahme-Inhibitor (der Begriff „SSRI" wird hierin zur Bezeichnung eines selektiven Serotoninwiederaufnahme-Inhibitors verwendet) verwendbar für die Behandlung, Vorbeugung oder Handhabung einer sexuellen Funktionsstörung, wie z. B. dem vorzeitigen Samenerguß. Die Erfindung umfaßt die Verwendung von Dapoxetin bei der Herstellung eines Arzneimittels zur Behandlung, Vorbeugung und/oder Handhabung einer sexuellen Funktionsstörung und der Symptome davon.
- Die vorliegende Erfindung stellt eine Verbesserung der Flexibilität der zeitlichen Planung im Hinblick darauf bereit, wann die therapeutisch wirksame Menge des selektiven Serotoninwiederaufnahme-Inhibitors mit schneller Wirkung in Bezug auf die Erwartung einer sexuellen Aktivität des Patienten genommen wird, und stellt daher eine Verbesserung des Dosierungsplans dar.
- Die vorliegende Erfindung liefert auch einen unerwarteten Vorzug der prn-Dosierung mit Dapoxetin gegenüber entweder der prn-Dosierung oder der kontinuierlichen Dosierung mit SSRIs ohne schnellen Wirkungseintritt, wie z. B. Paroxetin, Fluoxetin und Sertralin, dadurch, daß die Verbesserung der Ejakulationslatenz durch die prn-Dosierung mit Dapoxetin nach der allerersten Dosierung oder einzigen Dosierung auftritt.
- Die vorliegende Erfindung zeigt eine Verbesserung auch im Hinblick auf die Fähigkeit von prn-dosiertem Dapoxetin, den gesamten Bereich von PE-Patienten zu behandeln, wie z. B. solche, die sich selbst für schwere Patienten (siehe Tabellen 13a und 13b) oder moderate Patienten (siehe Tabellen 14a und 14b) halten, und Patienten, die eine Ejakulationslatenzgrundlinie von weniger als einer Minute (siehe Tabellen 10a und 10b) oder weniger als zwei Minuten (siehe Tabellen 11a und 11b) haben. Dapoxetin erhöhte ebenso die Ejakulationslatenz bei Patienten mit Grundlinienlatenzen, die größer als eine oder gleich einer Minute sind (siehe Tabellen 16a und 16b) oder größer als oder gleich 2 Minuten (siehe Tabellen 15a und 15b). Die zuletzt genannten Daten sind der Grund dafür, daß die Verabreichung eines SSRI mit schnellem Wirkungseintritt für einen Mann von Vorteil wäre, der nicht per se unter vorzeitigem Samenerguß leidet, aber dennoch den Samenerguß verlängern möchte. Die vorliegende Erfindung liefert einen weiteren Vorteil, indem sie die Verabreichung einer therapeutisch wirksamen Dosis von Dapoxetin ermöglicht, ohne daß dadurch eine Akkumulation des Arzneistoffs verursacht wird, wenn es auf einer täglichen Basis verabreicht wird, da der Arzneistoff eine kurze Halbwertszeit aufweist.
-
1 zeigt einen schnellen Wirkungseintritt bis zum Erreichen des Plasmakonzentrations-Peaks, gefolgt von dem schnellen Metabolismus (d.h. kurze Halbwertszeit), bei 20 Freiwilligen, die eine Dosis von 40 mg Dapoxetin zum Zeitpunkt 0 am 14. Tag einer täglichen Dosierung genommen hatten. -
2 stellt die Veränderung der Ejakulationslatenz in Minuten gegen die Zeit nach der Dosierung eines Placebos, von 20 mg Dapoxetin und 40 mg Dapoxetin dar. - Die vorliegende Erfindung stellt eine Verbesserung der allgemeinen Therapie im Bezug auf die gegenwärtig zur Verfügung stehenden Behandlungsverfahren für sexuelle Funktionsstörungen dar.
- Gemäß der vorliegenden Erfindung wird ein Herstellungsartikel verwendet, der ein Verpackungsmaterial und ein pharmazeutisches Mittel, das in diesem Verpackungsmaterial enthalten ist, umfaßt, wobei das pharmazeutische Mittel für die Behandlung von vorzeitigem Samenerguß bei einem männlichen Menschen wirksam ist, und wobei das Verpackungsmaterial ein Etikett umfaßt, das angibt, daß das pharmazeutische Mittel für die Behandlung von vorzeitigem Samenerguß bei einem männlichen Menschen verwendet werden kann, und wobei das pharmazeutische Mittel einen selektiven Serotoninwiederaufnahme-Inhibitor mit schnellem Wirkungseintritt umfaßt, der Dapoxetin oder ein pharmazeutisch verträgliches Salz davon ist.
- Die Erfindung umfaßt Verwendungen für die Vorbeugung, Behandlung oder die Handhabung von sexuellen Funktionsstörungen bei einem Säugetier, das der Therapie bedarf, indem bedarfsabhängig eine therapeutisch wirksame Menge an Dapoxetin oder einem pharmazeutisch verträglichen Salz davon verabreicht wird. Dapoxetin wird einem Säugetier beispielsweise verabreicht, um die Wirkung von Monoaminen zu erhöhen, die Wirkungen von Serotonin zu erhöhen oder zu verstärken und/oder die Wiederaufnahme von Serotonin in die Nervenenden zu hemmen oder zu vermeiden. Insbesondere umfaßt die Erfindung Verwendungen der bedarfsabhängigen Verabreichung einer therapeutisch wirksamen Menge an Dapoxetin oder einem pharmazeutisch verträglichen Salz davon an einen Menschen, der einer Therapie bedarf, um eine(r) sexuelle(n) Funktionsstörung vorzubeugen, zu behandeln oder zu handhaben. Die Erfindung wird unten noch ausführlicher besprochen.
- Die vorliegende Erfindung betrifft die Verwendung von Dapoxetin, insbesondere von (a) (±)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyloxy)-Propanamin oder einem pharmazeutisch verträglichen Salz davon, (b) (S)-(+)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyolxy)-Propanamin (Dapoxetin) oder einem pharmazeutisch verträglichen Salz davon und (c) (R)-(–)-N,N-Dimethyl-1-Phenyl-3-(1- Naphtalenyloxy)-Propanamin oder einem pharmazeutisch verträglichen Salz davon, sowie von aktiven Metaboliten davon. Insbesondere umfassen die aktiven Metaboliten, ohne Beschränkung hierauf, Monodesmethyldapoxetin und Di-Desmethyldapoxetin. Typischerweise wird die verabreichte Verbindung nur eine dieser altemativen Formen umfassen, kann aber auch mehr als eine in verschiedenen Mengen enthaften.
- Die Begriffe „Me", „Et", „Pr", „EtOAc", „THF" und „DMF" werden hier zur Bezeichnung von jeweils Methyl, Ethyl, Propyl, Ethylacetat, Tetrahydrofuran und Diemethylformamid verwendet.
- Der Begriff „sexuelle Aktivität" wird hier zur Bezeichnung einer Aktivität verwendet, die eine sexuelle Erregung umfaßt, bei der der Patient es sich wünscht, eine sexuelle Funktionsstörung zu vermeiden, wie z. B. einen vorzeitigen Samenerguß. Beispiele für sexuelle Aktivität sind Verkehr, Masturbation, Geschlechtsverkehr und dergleichen. Geschlechtsverkehr ist bevorzugt.
- Der Begriff „sexuelle Erregung" bezeichnet hier die Blutwallung eines Geschlechtsorgans. Beispiele für Geschlechtsorgane sind der Penis und die Klitoris.
- Der Begriff „Blutwallung" bezeichnet hier eine Erhöhung des Blutflusses zu einem Geschlechtsorgan.
- Der Begriff „Verkehr" bezeichnet hier die physische Stimulierung zwischen Individuen, die die Genitalien von wenigstens einer Person einbezieht, wie z. B. das Einführen.
- Der Begriff „Einführen" bezeichnet die Einführung oder die Phase des Eingeführtseins des Penis in eine Körperöffnung. Ein Beispiel einer Körperöffnung ist die Vagina.
- Der Begriff „ein selektiver Serotoninwiederaufnahme-Inhibitor mit schnellem Wirkungseintritt" bezeichnet hier einen Arzneistoff mit einem pharmakokinetischen Profil, bei dem Tmax durchweg weniger als etwa 4 Stunden beträgt. Bei alternativen Ausführungsformen bezeichnet „ein selektiver Serotoninwiederaufnahme-Inhibitor mit schnellem Wirkungseintritt" einen Arzneistoff mit einem pharamkokinetischen Profil, bei dem Tmax durchweg weniger als etwa 3 Stunden oder durchweg weniger als etwa 2 Stunden beträgt. Dapoxetin ist ein Beispiel eines selektiven Serotoninwiederaufnahme-Inhibitors mit schnellem Wirkungseintritt.
- Der Begriff „ein kurz wirkender selektiver Serotoninwiederaufnahme-Inhibitor" bezeichnet einen Arzneistoff mit einem pharmakokinetischen Profil, bei dem T1/2 weniger als etwa 20 Stunden beträgt. Bei alternativen Ausführungsformen bezeichnet „ein kurz wirkender selektiver Serotoninwiederaufnahme-Inhibitor" einen Arzneistoff mit einem pharmakokinetischen Profil, bei dem T1/2 weniger als etwa 13 Stunden oder weniger als etwa 7 Stunden beträgt.
- Der Begriff „racemisch" bedeutet hierin ein Gemisch des (R)- und des (S)-Enantiomers einer Verbindung, wobei die (R)- und (S)-Enantiomere in einem Verhältnis von ungefähr 1:1 vorliegen.
- Der Begriff „im wesentlichen frei von seinem (R)-Stereoisomer" bedeutet hier z. B., daß die Verbindung einen signifikant größeren Anteil an Dapoxetin im Bezug auf dessen (R)-Stereoisomer enthält. Bei einer bevorzugten Ausführungsform der vorliegenden Erfindung enthält die Verbindung wenigstens etwa 90 Gew.-% an Dapoxetin und etwa 10 Gew.-% oder weniger an dessen (R)-Stereoisomer. Bei einer bevorzugteren Ausführungsform der vorliegenden Erfindung wird der Begriff „im wesentlichen frei von dessen (R)-Stereoisomer" in der Bedeutung verwendet, daß die Verbindung wenigstens etwa 95 Gew.-% an Dapoxetin und etwa 5 Gew.-% oder weniger an dessen (R)-Stereoisomer enthält. Bei einer am meisten bevorzugten Ausführungsform bedeutet der Begriff „im wesentlichen frei von dessen (R)-Stereoisomer", daß die Verbindung wenigstens etwa 99 Gew.-% an Dapoxetin und etwa 1% oder weniger an dessen (R)-Stereoisomer enthält. Bei einer insbesondere am meisten bevorzugten Ausführungsform bedeutet der Begriff „im wesentlichen frei an dessen (R)-Stereoisomer", daß die Verbindung nahezu 100 Gew.-% an Dapoxetin enthält.
- Der Begriff „im wesentlichen frei von dessen (S)-Stereoisomer" bedeutet z. B., daß die Verbindung einen signifikant größeren Anteil an (R)-(–)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyloxy)-Propanamin in Bezug auf dessen (S)-Stereoisomer enthält. Bei einer bevorzugten Ausführungsform der vorliegenden Erfindung enthält die Verbindung wenigstens etwa 90 Gew.-% an (R)-(–)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyloxy)-Propanamin und etwa 10 Gew.-% oder weniger an dessen (S)-Stereoisomer. In einer noch bevorzugteren Ausführungsform der vorliegenden Erfindung bedeutet der Begriff „im wesentlichen frei von dessen (S)-Stereoisomer", daß die Verbindung wenigstens etwa 95 Gew.-% an (R)-(–)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyloxy)-Propanamin enthält und etwa 5 Gew.-% oder weniger an dessen (S)-Stereoisomer. Bei einer am meisten bevorzugten Ausführungsform bedeutet der Begriff „im wesentlichen frei von dessen (S)-Stereoisomer", daß die Verbindung wenigstens etwa 99 Gew.-% an (R)-(–)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyolxy)-Propanamin und etwa 1% oder weniger an dessen (S)-Stereoisomer enthält. Bei einer insbesondere am meisten bevorzugten Ausführungsform bedeutet der Begriff „im wesentlichen frei von dessen (S)-Stereoisomer", daß die Verbindung nahezu 100 Gew.-% an (R)-(–)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyloxy)-Propanamin enthält.
- Dapoxetin und dessen pharmazeutisch verträgliche Salze können einfach nach Verfahren hergestellt werden, die dem Fachmann gut bekannt sind. Siehe z. B. US-Patent Nr. 5,135,947, erteilt am 4. August 1992. Siehe außerdem für die Herstellung verschiedener geeigneter Intermediate des Dapoxetin das US-Patent Nr. 5,292,962, erteilt am 8. März 1994.
- Bei einer Ausführungsform der vorliegenden Erfindung kann Dapoxetin oder ein pharmazeutisch verträgliches Salz davon an ein Tier verabreicht werden in Verbindung mit einer Verbindung, die in der Lage ist, die Wirkung von Monoaminen oder Serotonin in dem Säugetier zu erhöhen oder zu verstärken, und daß für die Verwendung bei der vorliegenden Erfindung geeignet ist. Bevorzugte monoaminerhöhende Verbindungen umfassen, jedoch nicht ausschließlich, Amitriptylin (ELAVILTM und VANATRIPTM), Amitriptylin und Chlordiazepoxid (LIMBITROLTM), Amitriptylin und Perphenazin (ETRAFONTM und TRIAVILTM), Amoxapin (ASENDINTM), Clomipramin (ANAFRANILTM), Citalopram (CELEXATM), Dapoxetin, Desipramin (NORPRAMINTM und PERTOFRANTM), Doxepin (ADAPINTM, SINEQUANTM, XEPINTM und ZONALONTM), Duloxetin, Fluoxetin (PROZACTM), Fluvoxamin (LUVOXTM), Imipramin (JANIMINETM, TOFRANILTM und TOFRANIL-PMTM), Isocarboxazid (MARPLANTM), Mirtazapin (REMERONTM), Nortriptylin (PAMELORTM), Papoxetin (PAXILTM), Phenelzin (NARDILTM), Protriptylin (VIVACTILTM), Nefazodon (SERZONETM), Selegilin (ALZENETM, CARBEX, DEPRENYLTM und ELDEPRYLTM), Sertralin (ZOLOFTTM), Tranylcypromin (PARNATETM), Trazadon (DESYRELTM), Trimipramin (SURMONTILTM) und Venlafaxin (EFFEXORTM).
- Es sollte außerdem für alle Ausführungsformen hierin zur Kenntnis genommen werden, daß auch die Kombinationstherapie durch separate Verabreichung der Verbindungen der Erfindung und eines zusätzlichen therapeutischen Mittels, wie z. B. ein oder mehrere Arzneistoffe (z. B. Yohimbin) für eine zweite, andere sexuelle Funktionsstörung, umfaßt ist.
- Die verschiedenen oben aufgezählten Verbindungen mit einem Handelsnamen sind allgemein im Handel erhältlich. Die übrigen Verbindungen können vom Fachmann auf dem Gebiet der Pharmazie leicht hergestellt oder erhalten werden. Z. B. ist der Durchschnittsfachmann in der Lage Dapoxetin oder ein pharmazeutisch verträgliches Salz davon zu synthetisieren, so wie Metaboliten oder die optisch reinen Stereoisomere oder Salze davon, um sie bei den Verbindungen und Verfahren gemäß der Erfindung zu verwenden, wie z. B. indem man den Lehren des US-Patents Nr. 5,135,947 folgt. Siehe auch W. J. Wheeler, et al., „A Chiral Synthesis of Dapoxetine Hydrochloride, a Serotonin Re-uptake Inhibitor, and its 14C Isotopomer", J. Labeled Compounds Radiopharmaceuticals, 31(4): 305–315 (1992).
- Die Begriffe „Zusammensetzung(en)", „wirksame(s) Mittel" und „Verbindung(en)" umfassen hier jeweils (eine): (a) Zusammensetzung(en), um die Wirkung von Monoaminen zu erhöhen, (b) Zusammensetzung(en), um Serotonin im Säugetier zu erhöhen, (c) Zusammensetzung(en), die die Wiederaufnahme von Serotonin in die Nervenenden des Säugetieres hemmen oder verhindern, und (d) Serotonin-selektive(r) Wiederaufnahme-Inhibitor(en) oder ein pharmazeutisch verträgliches Salz davon. Die Begriffe „Zusammensetzung(en)", „wirksame(s) Mittel" und „Verbindung(en)" umfassen auch ein optisch reines Isomer oder ein pharmazeutisch verträgliches Salz davon sowie einen wirksamen Metaboliten oder ein pharmazeutisch verträgliches Salz von einer/den oben genannten Verbindung(en).
- Der Begriff „zusätzliche(s) therapeutische(s) Mittel" bezeichnet hier die Verwendung von Verbindungen, die zusätzlich verwendet werden können zu der Verbindung, zur Vorbeugung, Behandlung oder Handhabung einer sexuellen Funktionsstörung bei einem therapiebedürftigen Patienten. Z. B. kann zusätzlich zu einer hier besprochenen Verbindung gemäß der Erfindung Yohimbin oder Stickstoffoxid zur Therapie von erektiler Funktionsstörung verwendet werden. Weitere geeignete zusätzliche therapeutische Mittel umfassen, jedoch nicht ausschließlich, Eicosanoide, wie z. B. Alprostadil, und Phosphodiesterase-Inhibitoren, wie z. B. Sildenafilcitrat (VIGARA®) und IC 351.
- Der Begriff „pharmazeutisch verträgliches Salz" bezeichnet hierin Salze der hier offenbarten Verbindungen, die für lebende Organismen im wesentlichen nicht toxisch sind. Die typischen pharmazeutisch verträglichen Salze umfassen die Salze, die durch eine Umsetzung der Verbindungen der vorliegenden Erfindung mit einem/einer pharmazeutisch verträglichen Mineral- oder organischen Säure umgesetzt werden. Solche Salze sind als Säureadditionssalze bekannt. Die pharmazeutisch verträglichen Salze umfassen auch Verbindungen, die formuliert wurden, um eine Tmax von weniger als etwa 4 Stunden aufzuweisen.
- Die Säuren, die üblicherweise eingesetzt werden, um Säureadditionssalze auszubilden, sind anorganische Säuren, wie z. B. Salzsäure, Bromwasserstoffsäure, Jodwasserstoffsäure, Schwefelsäure, Phosphorsäure und dergleichen und organische Säuren, wie z. B. p-Toluolsulfon-, Methansulfonsäure, Oxalsäure, p-Bromphenylsulfonsäure, Kohlensäure, Bernsteinsäure, Zitronensäure, Benzoesäure, Essigsäure und dergleichen. Beispiele solcher pharmazeutisch verträglicher Salze sind das Sulfat, Pyrosulfat, Bisulfat, Sulfat, Bisulfit, Phosphat, Monohydrogenphosphat, Dihydrogenphosphat, Metaphosphat, Pyrophosphat, Bromid, Jodid, Acetat, Propionat, Decanoat, Caprylat, Acrylat, Format, Hydrochlorid, Dihydrochlorid, Isobutyrat, Caproat, Heptanoat, Propionat, Oxalat, Malonat, Succinat, Suberat, Sebacat, Fumarat, Maleat, Butin-1,4-dioat, Hexin-1,6-Dioat, Benzoat, Chlorbenzoat, Methylbenzoat, Hydroxybenzoat, Methoxybenzoat, Phthalat, Xylensulfonat, Phenylacetat, Phenylpropionat, Phenylbutyrat, Citrat, Lactat, α-Hydroxybutyrat, Glycolat, Tartrat, Methansulfonat, Propansulfonat, Naphtalen-1-Sulfonat, Naphtalen-2-Sulfonat, Mandelat und dergleichen. Bevorzugte pharmazeutisch verträgliche Säureadditionssalze sind diejenigen, die mit Mineralsäuren, wie z. B. Salzsäure und Bromwasserstoffsäure gebildet werden, und diejenigen, die mit organischen Säuren, wie z. B. Maleinsäure und Methansulfonsäure gebildet wurden.
- Es sollte zur Kenntnis genommen werden, daß das jeweilige Gegenion, das einen Teil eines jeden Salzes gemäß dieser Erfindung bildet, normalerweise von unbedenklicher Natur ist, solange das Salz als Ganzes pharmakologisch verträglich ist und solange das Gegenion nicht zu unerwünschten Qualitäten des Salzes als Ganzem beiträgt. Des weiteren wird davon ausgegangen, daß die obigen Salze Hydrate bilden können oder in einer im wesentlichen wasserfreien Form vorliegen können.
- Die pharmazeutischen Verbindungen, die gemäß der vorliegenden Erfindung verwendet werden, und die, wo erforderlich, steril sind, umfassen jede der oben aufgeführten Verbindungen oder ein pharmazeutisch verträgliches Salz davon als den Wirkstoff. Die Verbindungen können auch einen pharmazeutisch verträglichen Träger oder Arzneistoffträger umfassen und wahlweise weitere therapeutische Bestandteile.
- Die Verbindungen für die Verwendung bei der vorliegenden Erfindung können geeignete Arzneistoffträger oder Träger umfassen, wie z. B. Stärken, Zucker, mikrokristalline Zellulose, Streckmittel, Granuliermittel, Schmiermittel, Bindemittel, Zersetzungsmittel und dergleichen. Beispiele solcher Arzneistoffträger umfassen Wasser, Salzlösung, Ringer-Lösung, Dextroselösung, Hank-Lösung und andere wäßrige physiologisch ausgeglichene Salzlösungen. Nicht wäßrige Träger, wie z. B. fette Öle, Sesamöl, Ethyloleat oder Triglyceride können ebenso verwendet werden. Weitere geeignete Formulierungen umfassen Suspensionen, die viskositätsverstärkende Mittel enthalten, wie z. B. Natriumcarboxymethylzellulose, Sorbitol oder Dextran. Die Arzneiträgerstoffe können auch kleinere Mengen an Zusatzstoffen enthalten, wie z. B. Substanzen, die die Isotonizität und die chemische Stabilität verbessern. Beispiele von Puffern umfassen Phosphatpuffer, Bicarbonatpuffer und Tris-Puffer, während die Beispiele für Konservierungsstoffe Thimerosal, o-Cresol, Formalin und Benzylalkohol umfassen. Die Standardformulierungen können entweder flüssige, injizierbare Substanzen oder Feststoffe sein, die in einer geeigneten Flüssigkeit als eine Suspension oder Lösung zur Injektion aufgenommen werden können. Bei einer nicht-flüssigen Formulierung kann der Arzneistoffträger daher Dextrose, Human-Serum-Albumin, Konservierungsstoffe etc. umfassen, wozu steriles Wasser oder Salzlösung vor der Verabreichung zugegeben werden kann.
- Die Verabreichungsformen umfassen Tabletten, Pastillen, Dispersionen, Suspensionen, Lösungen, Kapseln, Dragees, Kapseln aus Stärkemasse, Patch-Pflaster, Gel-Kapseln, Sirupe, Elixiere, Gele, Puder, Magmas, Lutschpastillen, Salben, Cremes, Pasten, Pflaster, Lotionen, Discs, Suppositorien, Nasen- oder Mundsprays, Aerosole und dergleichen.
- Tabletten und Kapseln stellen die vorteilhafteste orale Dosierungseinheitsform dar, da sie leicht zu verabreichen sind, wobei in diesem Fall feste pharmazeutische Träger eingesetzt werden. Falls gewünscht können die Tabletten nach wäßrigen oder nicht-wäßrigen Standardverfahren beschichtet werden.
- Zusätzlich zu den üblichen oben aufgeführten Dosierungsformen können die Verbindungen gemäß der vorliegenden Erfindung zur Erleichterung der bedarfsabhängigen Verabreichung auch über kontrollierte Freisetzungsmittel oder Zuführungsvorrichtungen, die dem Durchschnittsfachmann wohl bekannt sind, verabreicht werden, wie z. B. diejenigen, die in den US-Patenten mit den Num mern: 3,845,770, 3,916,899, 3,536,809, 3,598,123, 4,008,719, 5,674,533, 5,059,595, 5,591,767, 5,120,548, 5,073,543, 5,639,476, 5,354,556 und 5,733,566 beschrieben werden.
- Diese pharmazeutischen Zusammensetzungen können verwendet werden, um eine langsame oder kontrollierte Freisetzung von einem oder mehreren der Wirkstoffe darin zu liefern, wobei z. B. Hydropropylmethylzellulose oder andere Polymermatrices, Gele, permeable Membranen, osmotische Systeme, Multilayer-Beschichtungen, Mikropartikel, Liposome, Mikrosphären oder dergleichen oder eine Kombination davon verwendet werden, um das gewünschte Freisetzungsprofil mit verschiedenen Anteilen zu liefern. Die geeigneten Formulierungen zur kontrollierten Freisetzung, die dem Fachmann bekannt sind, einschließlich derjenigen, die hier beschrieben sind, können leicht für die Anwendung bei den pharmazeutischen Verbindungen und Verfahren gemäß der Erfindung ausgewählt werden. Demzufolge sind einzelne Dosierungseinheitsformen, die für die orale Verabreichung geeignet sind, wie z. B. Tabletten, Kapseln, Gel-Kapseln, Dragees und dergleichen, die für die kontrollierte Freisetzung angepaßt sind, von der vorliegenden Erfindung umfaßt. Der Begriff „Formulierung(en) für die kontrollierte Freisetzung" bedeutet hier eine Formulierung, die so angepaßt ist, daß sie eine ausgedehnte Freisetzung des/der Wirkstoffs/Wirkstoffe während der Notwendigkeit der Therapie liefert. Beispielsweise könnte eine Formulierung zur kontrollierten Freisetzung gemäß der Erfindung den Wirkstoff/die Wirkstoffe über einen Zeitraum von 2 bis 8 Stunden freisetzen, ohne daß hierdurch die Erfindung beschränkt werden soll.
- Alle pharmazeutischen Produkte zur kontrollierten Freisetzung haben ein gemeinsames Ziel der Verbesserung der Arzneistofftherapie gegenüber der, die durch deren nicht-kontrollierte Gegenstücke erreicht wird. Idealerweise ist die Verwendung einer optimal gestalteten Zubereitung für die kontrollierte Freisetzung für die medizinische Behandlung gemäß der Erfindung gekennzeichnet durch ein Minimum an Arzneistoffsubstanz, das eingesetzt wird, um die Bedingung während des Therapiebedarfs zu heilen oder zu kontrollieren. Die Vorteile von Formulierungen zur kontrollierten Freisetzung gemäß der Erfindung können umfassen: 1) Die Aktivität des Arzneistoffs, die auf die Dauer des Therapiebedarfs ausgedehnt wird, 2) die Verringerung des Plasmakonzentrations-Peaks des Wirkstoffs/der Wirkstoffe und 3) eine verbesserte Patientencompliance.
- Die meisten Formulierungen zur kontrollierten Freisetzung sind so ausgestaltet, daß sie anfänglich eine Arzneistoffmenge freisetzen, die unverzüglich zu dem gewünschten therapeutischen Effekt führt, und daß sie abgestuft und kontinuierlich weitere Arzneistoffmengen freisetzen, um dieses Niveau des therapeutischen Effekts über einen hinreichenden Zeitraum zu halten, um die bedarfsabhängige Therapie zu liefern. Um dieses konstante Niveau an Arzneistoff im Körper während des Therapiebedarfs aufrecht zu erhalten, muß der Arzneistoff von der Dosierungsform in einer Rate freigesetzt werden, die die Menge an Arzneistoff ersetzen wird, die metabolisiert und aus dem Körper ausgeschieden wird. Der Arzneistoff muß auch in einer hinreichenden Rate freigesetzt werden, um die Absorption in den Blutstrom während des Therapiebedarfs zu erleichtern.
- Die kontrollierte Freisetzung eines Wirkstoffs kann durch verschiedene Induktoren stimuliert werden, z. B. pH-Wert, Temperatur, Enzyme, Wasser oder andere physiologische Bedingungen oder Verbindungen. Der Begriff „Komponente für die kontrollierte Freisetzung" bedeutet hier eine Verbindung oder Verbindungen, einschließlich, jedoch ohne Beschränkung hierauf, Polymere, Polymermatrices, Gele, permeable Membranen, Liposome, Mikrosphären oder dergleichen oder eine Kombination davon, die die kontrollierte Freisetzung des Wirkstoffs je nach Therapiebedarf erleichtert.
- Es ist außerdem klar, daß die Verbindungen für die Verwendung gemäß der vorliegenden Erfindung als schnell zerfallende oder sich schnell auflösende pharmazeutische Dosierungsformen verabreicht werden können, die von einem Fachmann leicht hergestellt werden können. Solche Formulierungen sind z. B. für menschliche Patienten nützlich, die Schwierigkeiten mit dem Schlucken von herkömmlichen Tabletten oder Kapseln haben und sind ebenso nützlich für die sublinguale und bukkale Verabreichung von Arzneistoffen.
- Beispielsweise sind gefriergetrocknete oder lyophylisierte Dosierungsformen im allgemeinen bekannt dafür, daß sie sich im Mund schnell auflösen oder zerfallen. Diese Formen bestehen aus einer porösen Matrix eines in Wasser löslichen oder in Wasser dispergierbaren Trägermaterials, das mit einer Einheitsdosis der wirksamen Verbindung imprägniert ist. Diese Dosierungsformen werden hergestellt, indem zunächst die aktive Verbindung zu einer Lösung zugegeben wird, die das Trägermaterial und ein geeignetes Lösungsmittel, typischerweise Wasser, enthält. Die hieraus hervorgehende Zusammensetzung wird dann einem Gefriertrocknungsverfahren unterworfen, wobei das Lösungsmittel unter einem hohen Vakuum sublimiert.
- Darüber hinaus beschreibt das US-Patent Nr. 4,866,046, erteilt am 12. September 1989 z. B. eine Aspirintablette, die sich innerhalb von 2 bis 60 Sekunden schnell in der Mundöffnung, vorzugsweise sublingual, auflöst. Diese Tablette liefert eine schnelle Absorption von Aspirin aus dem Speichel in den Blutstrom. Die Sublingual-Tablette wird hergestellt, indem ein Gemisch von Stärke (10% Feuchtigkeit), Acetylsalicylsäure, Geschmacksstoff und Süßstoff in ein Rohstück gepreßt wird. Die Rohstücke werden dann gemahlen (Maschenzahl ist 14–16) und wieder in Tabletten gepreßt. Wegen seiner solubilisierenden und geschmacksneutralisierenden Wirkungen kann mit dem Aspirin auch eine Aminosäure verwendet werden.
- Das US-Patent Nr. 5,082,667, erteilt am 21. Januar 1992, diskutiert eine Tablettenverreibungsdosierung, die sich schnell in der bukkalen Höhle löst. Diese Form umfaßt ein poröses, zementierendes Netzwerk eines wasserlöslichen, aber ethanolunlöslichen Kohlenwasserstoffs, der diskrete Partikel der wirksamen Verbindung enthält, die mit einer Triglycerid-Beschichtung beschichtet wurden. Die diskreten Partikel werden hergestellt, indem der Wirkstoff in geschmolzenem Trigly cerid suspendiert wird. Die diskreten Partikel werden mit dem Kohlenwasserstoff und einem temporären Flüssigkeitsbindemittel unter Ausbildung einer feuchten Masse vermischt. Die Masse wird dann in eine Tablette geformt und unter Ausbildung der Tablettenverreibung getrocknet. Allerdings ist dieses Tablettenverreibungsverfahren auf wirksame Verbindungen beschränkt, die auf die Schmelztemperatur des Triglycerids nicht empfindlich reagieren.
- Die pharmazeutischen Zusammensetzungen zur Verwendung gemäß der vorliegenden Erfindung können nach beliebigen pharmazeutischen Verfahren hergestellt werden, jedoch schließen alle Verfahren die Stufe ein, in der der Wirkstoff mit dem Trägerstoff in Verbindung gebracht wird, der aus einem oder mehreren notwendigen Bestandteilen gebildet wird. Üblicherweise wird die Zusammensetzung hergestellt, indem man den Wirkstoff mit flüssigen Trägern oder fein verteilten Feststoffträgern oder beidem gleichmäßig und gründlich vermischt und, falls notwendig, dann das Produkt in die gewünschte Erscheinungsform formt.
- Beispielsweise kann eine Tablette durch Kompression oder Formung hergestellt werden, wahlweise mit einem oder mehreren Hilfsbestandteilen. Komprimierte Tabletten können hergestellt werden, indem der Wirkstoff in einer frei fließenden Form, wie z. B. einem Pulver oder als Granulat in einer geeigneten Maschine gepreßt wird, wahlweise vermischt mit einem Bindemittel, einem Schmiermittel, einem inerten Verdünnungsmittel, einem oberflächenaktiven Mittel oder einem Dispersionsmittel. Geformte Tabletten können hergestellt werden, indem ein Gemisch der pulverisierten Verbindung, befeuchtet mit einem inerten flüssigen Verdünnungsmittel, in einer geeigneten Maschine geformt wird.
- Die Verabreichung dieser Zusammensetzungen gemäß der vorliegenden Erfindung kann entweder gleichzeitig oder aufeinanderfolgend erfolgen, z. B. kann ein selektiver Serotoninwiederaufnahme-Inhibitor oder ein pharmazeutisch verträgliches Salz davon als eine Kombination (eine einzelne Dosierungseinheit) verabreicht werden oder gleichzeitig, jedoch separat mit einem oder mehreren zusätzlichen therapeutischen Mitteln, wie z. B. einem oder mehreren Arzneistoffen für erektive Funktionsstörung oder geringe Libido, zur Vorbeugung, Behandlung oder Handhabung von sexueller Funktionsstörung. Die Verbindungen der Erfindung können auch durch aufeinanderfolgende Verabreichung von einer der oben besprochenen Verbindungen und von einem oder mehreren zusätzlichen therapeutischen Mitteln, die für die Vorbeugung, Behandlung oder Handhabung einer sexuellen Funktionsstörung geeignet sind, in jeder möglichen Reihenfolge bereitgestellt werden. Die bei jedem dieser Verfahren verabreichten Zusammensetzungen können gleichzeitig, aufeinanderfolgend oder in jeder Kombination von gleichzeitig und/oder aufeinanderfolgend vorliegen.
- Die Begriffe „bedarfsabhängig", „je nach Bedarf", „prn" und „prn-Dosierung" bedeuten hier, daß man eine therapeutisch wirksame Menge eines selektiven Serotoninwiederaufnahme-Inhibitors mit schnellem Wirkungseintritt gemäß der Erfindung in einem geeigneten Zeitintervall verabreicht, um ein verbessertes therapeutisches Profil zu liefern, d.h. eine verbesserte Therapie bei der Vorbeugung, Behandlung oder Handhabung von sexueller Funktionsstörung, während Initialdosierungen, chronische Verabreichung und/oder Überdosierung vermieden werden. Der Begriff „therapeutisch wirksame Menge" steht hier für die Menge eines selektiven Serotoninwiederaufnahme-Inhibitors mit schnellem Wirkungseintritt oder eines pharmazeutisch verträglichen Salzes davon, die eine therapeutisch vorteilhafte Wirkung bei der Behandlung, Vorbeugung oder Handhabung einer oder mehrerer sexueller Funktionsstörungen oder der Symptome der einen oder mehreren sexuellen Funktionsstörungen liefert. Der Begriff „sexuelle Funktionsstörung" umfaßt hier, jedoch nicht ausschließlich, vorzeitigen Samenerguß, verzögerten Samenerguß (männlich), Orgasmushemmung (weiblich), geringes sexuelles Verlangen, sexuelle Abneigung, Dyspareunie und Vaginismus. Insbesondere bedeutet sexuelle Funktionsstörung vorzeitiger Samenerguß. Der Begriff „vorzeitiger Samenerguß" bedeutet hier eine intravaginale Ejakulationslatenz von weniger als 2 Minuten, die bei mehr als 50% des Verkehrs über wenigstens die letzten 6 Monate auftrat. Der Begriff wird auch in Übereinstimmung mit DSM IV in der Bedeutung verwendet: (1) Andauernde oder wiederkehrende Ejakulation mit minimaler vorheriger sexueller Stimulierung bei oder kurz nach der Penetration und bevor die Person es wünscht, wobei Faktoren zu berücksichtigen sind, die die Dauer der Erregungsphase beeinträchtigen, wie z. B. das Alter, ein neuer Sexualpartner oder eine neue Situation und kürzliche Häufigkeit der sexuellen Aktivität, (2) die Störung verursacht ausgeprägte Verzweiflung oder zwischenmenschliche Schwierigkeiten, und (3) der vorzeitige Samenerguß ist nicht ausschließlich bedingt durch die unmittelbaren Wirkungen einer Substanz (z. B. Entzug von Opiaten).
- Eine Ausführungsform der vorliegenden Erfindung besteht in der prn-Dosierung eines selektiven Serotoninwiederaufnahme-Inhibitors mit schnellem Wirkungseintritt oder eines pharmazeutisch verträglichen Salzes davon kurz vor der sexuellen Aktivität. Eine bevorzugte Verwendung umfaßt die prn-Dosierung eines selektiven Serotoninwiederaufnahme-Inhibitors mit schnellem Wirkungseintritt von unmittelbar vor bis zu etwa 12 Stunden vor der sexuellen Aktivität. Eine bevorzugtere Verwendung umfaßt die prn-Dosierung unmittelbar vor bis zu etwa 10 Stunden vor der sexuellen Aktivität. Eine noch bevorzugtere Verwendung umfaßt die prn-Dosierung unmittelbar vor bis zu etwa 8 Stunden vor der sexuellen Aktivität. Eine insbesondere bevorzugte Ausführungsform umfaßt eine prn-Dosierung unmittelbar vor bis etwa 4 Stunden vor der sexuellen Aktivität.
- Dem Fachmann sind geeignete Zeitintervalle für die hier besprochenen Dosierungszwecke wohl bekannt, die von anderen therapeutischen Zusammensetzungen, die von dem Patienten eingenommen werden, abhängig sein können. Beispielsweise könnte ein geeignetes Zeitintervall, ohne hierauf beschränkt zu sein, etwa 1 bis 4 Stunden vor dem Therapiebedarf sein, jedoch nicht mehr als einmal pro Tag.
- Die Menge einer Dosierung an Dapoxetin oder eines pharmazeutisch verträglichen Salzes davon bei der prn-Dosierung ist eine Menge, die für die Handhabung einer Störung oder Bedingung geeignet ist. Die Menge wird je nach Schwere der Bedingung, die zu behandeln ist, und je nach Verabreichungsweg variieren. Die Dosierung und die Dosierungshäufigkeit werden auch in Abhängigkeit von Alter, Körpergewicht und Reaktion des individuellen Patienten variieren. Ein geeigneter Dosierungsbereich kann von einem Fachmann leicht bestimmt werden. Im allgemeinen liegt die Gesamtdosierung für einen selektiven Serotoninwiederaufnahme-Inhibitor mit schnellem Wirkungseintritt oder eines pharmazeutisch verträglichen Salzes davon für die hier beschriebenen Bedingungen in dem Bereich von etwa 0,001 mg bis etwa 350 mg, vorzugsweise von etwa 0,01 mg bis etwa 200 mg, noch bevorzugter von etwa 0,01 mg bis etwa 120 mg und besonders bevorzugt von etwa 1 mg bis etwa 80 mg, je nach Bedarf verabreicht in einer einzelnen oder in aufgeteilten Dosierungen. Diese Dosierungen sind je nach Bedarf des Patienten vorzugsweise für die Eigenverabreichung angepaßt.
- Des weiteren wird empfohlen, daß Patienten, die über 65 Jahre alt sind, und diejenigen mit beeinträchtigter Nieren- oder Leberfunktion anfänglich niedrige Dosierungen erthalten und daß sie dann auf der Grundlage ihrer individuellen Reaktion(en) oder ihres/ihrer Blutspiegel(s) eingestellt werden. Es wird für den Fachmann erkennbar sein, daß es in einigen Fällen erforderlich sein kann, Dosierungen außerhalb dieser Bereiche anzuwenden. Darüber hinaus wird darauf hingewiesen, daß der Krankenhausart oder der behandelnde Arzt weiß, wie und wann die Therapie in Verbindung mit individuellen Patientenreaktionen einzustellen, zu unterbrechen oder abzubrechen ist.
- Die Wirksamkeit einer bei der vorliegenden Erfindung angewendeten prn-Dosierung kann auf verschiedene Weisen untersucht werden. Beispielsweise könnte ein Fachmann Reaktionen mit und ohne Verabreichung einer prn-Dosis an Dapoxetin oder eines pharmazeutisch verträglichen Salzes davon (innerhalb eines mit der Pharmakokinetik von Dapoxetin zu vereinbarenden Zeitraums) vergleichen. Die zum Vergleichen geeigneten Reaktionen umfassen z. B. die Bestimmung der Latenz von dem Beginn der sexuellen Aktivität bis zum Zeitpunkt des Samenergusses mit einem Chronometer, indem die Anzahl der Beckenstöße, die mit dem Verkehr einhergehen, bestimmt werden, wobei gezählt wird, wie oft der Samenerguß vor der Penetration erfolgt oder durch das Stellen einer Frage oder einer Reihe von Fragen an die Patienten.
- Die Wirksamkeit eines prn-Dosierungsverfahrens mit Dapoxetin oder einem pharmazeutisch verträglichen Salz davon kann z. B. wie folgt bestimmt werden. Eine in vivo-Untersuchung von menschlichen Patienten kann durchgeführt werden durch eine randomisierte, Placebo-kontrollierte Doppelblind-Studie auf Unbedenklichkeit und Wirksamkeit an 2 bis 15 Stellen. Um 128 evaluierbare Patienten sicherzustellen, können ungefähr 168 Patienten auf eine oder vier Behandlungen zufällig verteilt werden: Placebo, 20 mg oder 40 mg Dapoxetin. Die Studie kann einen Auswahlbesuch umfassen, eine Einführungsperiode von vier Wochen oder weniger, in der wenigstens viermal Verkehr versucht wurde, und eine Behandlungsperiode von vier Wochen oder weniger, in der wenigstens viermal Verkehr versucht wurde. Die Patienten sollten gesunde Männer im Alter von wenigstens 18 Jahren sein mit einer Diagnose von vorzeitigem Samenerguss.
- Die Patienten sollten angewiesen werden, die Studienmedikation (eine Dosis ist 2 Tabletten von entweder Placebo, 10 mg oder 20 mg Dapoxetin) innerhalb von 1–3 Stunden von erwarteter sexueller Aktivität einzunehmen. Die Studienmedikation wird nicht öfter als 1 Mal pro Tag eingenommen. Die Patienten können zum Zeitpunkt der Einschreibung in einem Verhältnis von 1:1:1 für Placebo und die zwei Dosierungen an Dapoxetin eingeteilt werden. Die Wirksamkeit von Dapoxetin oder eines pharmazeutisch verträglichen Salzes davon kann bestimmt werden durch Vergleich der mit einer Stoppuhr durch den Partner aufgezeichneten und in einem Ereignisprotokoll eingetragenen Ejakulationslatenzen.
- Der vom Patienten erfahrene Vorteil eines prn-Dosierungsverfahrens mit Dapoxetin oder einem pharmazeutisch verträglichen Salz davon kann beispielsweise bestimmt werden durch das Stellen einer allgemeinen Frage zur Zufriedenheit, wie z. B.:
„Wie würden Sie die folgende Stellungnahme vervollständigen?
Die neue Medikationsflasche, die ich bei meinem vorherigen Besuch erhalten habe, machte mein Problem mit vorzeitigem Samenerguß:
_viel besser
_besser
_etwas besser
_gleich
_etwas schlechter
_schlechter
_viel schlechter" - Außerdem kann der von dem Patienten erfahrene Vorteil des prn-Dosierungsverfahrens mit Dapoxetin oder einem pharmazeutisch verträglichen Salz davon z. B. bestimmt werden durch die Verwendung eines psychometrischen Lebensqualitätsinstruments, wie z. B. eines Fragebogens zum vorzeitigen Samenerguß (PEQ).
- Die Patienten sollten gesunde Männer im Alter von wenigstens 18 Jahren und mit einer Diagnose von vorzeitigem Samenerguss, definiert durch DSM IV, sein. Die Patienten, die den Auswahlkriterien entsprechen, können eine medizinische Vorgeschichte bereitstellen und bei der Auswahl psychosexuell und physisch untersucht werden. Die Wirksamkeit von Dapoxetin oder von einem pharmazeutisch verträglichen Salz davon kann bestimmt werden durch den Vergleich der mit einer Stoppuhr vom Partner aufgezeichneten und in einem Ereignisprotokoll vermerkten Ejakulationslatenzen. Die Unbedenklichkeit kann durch während der Studie gesammelte klinische Laboranalysen, Vitalzeichen und Berichte über nachteilige Erfahrungen bestimmt werden. Beim Abschlußbesuch kann eine physische Untersuchung, einschließlich einer Röntgenuntersuchung des Brustbereichs und eines EKG durchgeführt werden.
- Jeder Patient sollte den folgenden Kriterien entsprechen, vorzeitiger Samenerguß, wie in DSM IV definiert oder intravaginale Ejakulationslatenz über 2 Minuten, die bei über 50% des Verkehrs über wenigstens die vorherigen sechs Monate auftrat, wie es von sowohl dem Patienten als auch dem Partner/Ehepartner bemerkt wurde. Die Kriterien für den vorzeitigen Samenerguß sollten die folgenden sein: (1) Andauernde oder wiederkehrende Ejakulation mit minimaler vorheriger sexueller Stimulierung bei oder kurz nach der Penetration und bevor die Person es wünscht. Der Krankenhausarzt muß Faktoren berücksichtigen, die die Dauer der Erregungsphase beeinträchtigen können, wie z. B. Alter, neuer Sexualpartner oder neue Situation und kürzliche Häufigkeit der sexuellen Aktivität, (2) die Störung verursacht ausgeprägte Verzweiflung oder zwischenmenschliche Schwierigkeiten und (3) der vorzeitige Samenerguß ist nicht ausschließlich bedingt durch die unmittelbaren Wirkungen einer Substanz (z. B. Entzug von Opiaten). Die Patienten bei dieser Studie sollten heterosexuelle Männer im Alter von wenigstens 18 Jahren in einer stabilen, monogamen, sexuellen Beziehung über wenigstens 6 Monate sein. Der Patient und der Partner/Ehepartner sollten einverstanden sein, wenigstens viermal vaginalen Verkehr zwischen dem Besuch 1 und dem Besuch 2 zu versuchen (was nicht länger als eine Zeit von vier Wochen sein kann) und viermal vaginalen Verkehr zwischen Besuch 2 und Besuch 3, Besuch 3 und Besuch 4 und Besuch 4 und Besuch 5 (was nie eine Zeit von mehr als vier Wochen sein kann). Der Patient und der Partner sollten in der Lage sein, das Protokoll zu verstehen und zu befolgen, und beide haben das ihnen zur Kenntnis gebrachte Einverständnisformular verstanden und unterzeichnet. Falls der Partner/Ehepartner fähig ist, Kinder zu gebähren (d.h. nicht im Stadium nach der Menopause oder nicht operativ steril) und der Patient nicht steril ist, sollten der Patient und/oder der Partner eine annehmbare Form der Geburtenkontrolle (Kondom oder orale Kontrazeptiva) verwenden. Der Patient und der Partner sollten damit einverstanden sein, die gleiche Art der Geburtenkontrolle während der Studie anzuwenden. Die Patienten, auf die eines der folgenden Krierien zutrifft, sollten von der Studie ausgeschlossen werden, jede klinisch signifikante Abnormalität, eine vorliegende oder in der Vorgeschichte aufgetretene Herz- oder Gefäßerkrankung, Bluthochdruck, Leber-, Nieren-, Lungen-, neurologische oder endokrinologische Erkrankungen, ein signifikant unnormales EKG bei der Auswahl, eine Vorgeschichte mit Alkohol-/Drogenmißbrauch in den vorherigen 6 Monaten, der durchschnittliche Konsum von mehr als 2 Drinks pro Tag, das Vorliegen einer schweren psychischen Erkrankung (z. B. Schizophrenie, Depression), gleichzeitige erektile Funktionsstörung, Urethritis, chronischer Prostatitus, Beckenoperation oder Trauma/Verletzung des Rückenmarks, positive Testergebnisse auf Hepatitis B-Oberflächen-Antigen (HbsAg), HCV oder humanes Immunschwäche-Virus (HIV), hat eine bekannte Überempfindlichkeit auf Dapoxetin oder andere SSRIs, hat innerhalb der letzten 30 Tage einen anderen für die experimentelle Forschung freigegebenen Arzneistoff erhalten, möchte mit dem Untersuchenden nicht voll kooperieren oder ist dazu nicht in der Lage, nimmt die Arzneistoffe Gua nethidin oder Reserpin gegen hohen Blutdruck oder es liegt ein Nachweis irgendeiner medizinischen Kondition vor, die den vorzeitigen Samenerguß beeinträchtigen würde, wie z. B. Patienten, die eine der Medikationen nehmen, die unten in Tabelle 1 mit den angegebenen Zeiträumen für das Auswaschen aufgeführt sind.
- Zum Zeitpunkt der Einschreibung können die Patienten in einem Verhältnis von 1:1:1 auf Placebo und zwei Dosierungen von Dapoxetin aufgeteilt werden. Sowohl der Untersuchende als auch der Patient sollten von der Zuordnung des zu untersuchenden Arzneistoffs keine Kenntnis haben können.
- Die Vitalzeichenbestimmungen umfassen den Blutdruck, die Herzfrequenz, die Atmung und die Körpertemperatur, und diese können bei der Auswahl bestimmt werden und bei den Besuchen 2, 3, 4 und 5. Die Messungen des Blutdrucks und der Herzfrequenz können mit dem Patienten liegend oder sitzend durchgeführt werden. Die orale Körpertemperatur (Grad Fahrenheit) kann als Bestandteil jeder der oben spezifizierten Vitalzeichenmessungen gemessen werden. Die Laboranalyse von Standardtests kann bei der Auswahl und bei den Besuchen 2, 3, 4 und 5 durchgeführt werden. Bei Besuch 1 können den Patienten Ereignisprotokolle und Stoppuhren gegeben werden, um die Zeit zu bestimmen, wenn die Untersuchungsmedikation genommen wird, sobald Verkehr erwartet wird und die Ejakulationslatenz definiert als die Zeit von der Einführung bis zur Ejakulation. Die Patienten und der Partner können jedes Ereignis in das Ereignisprotokoll eintragen. Bei den Besuchen 1, 2, 3, 4 und 5 sollten am Untersuchungsort die Befragungen durchgeführt werden.
- Bei Besuch 2 können den Patienten 6 Dosierungen des Untersuchungsarzneistoffs gegeben werden (d.h. 12 Kapseln). Die Patienten sollten sich die Untersuchungsmedikation innerhalb von 1–3 Stunden vor der erwarteten sexuellen Aktivität selbst verabreichen. Der Untersuchungsarzneistoff sollte nicht mehr als einmal pro Tag genommen werden. Die Dosierung kann von dem Patienten in seinem Ereignisprotokoll festgehalten werden. Die Dosierungsangaben in dem Ereignisprotokoll des Patienten können mit der bei Besuch 3 verbliebenen Arzneistoffmenge verglichen werden.
- Die Patienten dürfen innerhalb der angegebenen Auswaschzeiträume keine der Medikationen einnehmen, die in der Tabelle im Abschnitt mit den Ausschlußkriterien aufgeführt sind. Die Patienten sollten keine neuen Medikationen nehmen (d.h. Medikationen, mit denen 30 Tage vor dem Studienstart begonnen wurde oder zu einem Zeitpunkt während der Studie) oder sie sollten die Einnahme jeder Medikation während des Verlaufs dieser Studie abbrechen. Die Verwendung aller Medikationen (freiverkäufliche, verschreibungspflichtige und pflanzliche) kann auf der begleitenden Medikationsseite des Formulars für den Fallbereicht notiert werden. Zwischen den absoluten Werten der mit Placebo behandelten gegen jede der mit Dapoxetin behandelten Gruppen können Vergleiche angestellt werden.
- Von den Patienten kann gefordert werden, daß sie zu wenigstens 4 Anlässen über eine maximale Zeitperiode von vier Wochen während der Einführungsphase Verkehr versuchen. Nach vier Verkehrsversuchen sollten die Patienten für den Besuch 2 wiederkommen. Es sollten die Ereignisprotokolle eingesammelt werden, die allgemeine Zufriedenheit des Patienten/Partners aufgezeichnet werden und die Befragung zur Lebensqualität durchgeführt werden. Der Patient sollte zu einem von 18 Dosierungsplänen für Placebo oder Dapoxetin (20 oder 40 mg prn) zufällig zugeteilt werden. Nach 4–6 Verkehrsversuchen über einen maximalen Zeitraum von vier Wochen sollte der Patient für den Besuch 3 wiederkommen. Es sollten die Ereignisprotokolle eingesammelt werden, die allgemeine Zufriedenheit des Patienten/Partners aufgezeichnet werden und der Fragebogen zur Lebensqualität durchgeführt werden. Dann sollte die nächste Dosierung von Placebo oder Dapoxetin verteilt werden. Nach 4–6 Verkehrsversuchen über einen maximalen Zeitraum von 4 Wochen sollte der Patient für Besuch 4 wiederkommen. Dieses Muster kann solange durchgeführt werden, bis der Patient Placebo und beide Dosierungen an Dapoxetin erhalten hat.
- Die Messungen der „Ejakulationslatenz" und „die Anzahl der Stöße vor dem Samenerguß" sollten als der Durchschnitt der 4–6 in den Ereignisprotokollen aufgezeichneten Ereignisse für diesen Behandlungszeitraum vermerkt werden. Die Patienten, die vor der Einführung ejakulierten sollten für sowohl „Ejakulationslatenz" als auch „Anzahl der Stöße vor der Ejakulation" eine Null vermerken. „Die Maße der Befriedigungswerte von Patient und Partner (allgemeiner Eindruck)" und „der Fragebogen für Patient und Partner zur Lebensqualität im Hinblick auf die Ejakulation (oder die Sexualität)" für jeden Behandlungszeitraum sollten auf dem Wert basieren, der bei dem Besuch aufgenommen wurde, der jedem Behandlungszeitraum unmittelbar folgte.
- Die Kapseln oder Tabletten können so präpariert sein, daß sie Placebo, 10 mg oder 20 mg Dapoxetin enthalten. Zwei Kapseln oder zwei Tabletten sollten 1–3 Stunden vor einer erwarteten sexuellen Aktivität von einem Patienten eingenommen werden. Weitere geeignete orale Formulierungen für die vorliegende Erfindung sind in den Tabellen 2, 3, 4, 5, 6 und 7 aufgeführt.
- Der Wirkstoff (Dapoxetin oder ein pharmazeutisch verträgliches Salz davon) kann gesiebt werden und mit den aufgeführten Arzneistoffträgern vermischt werden. Das Gemisch kann in einer zweiteiligen Hartgelatine-Kapsel geeigneter Größe unter Einsatz der auf dem Gebiet wohl bekannten geeigneten Maschinen und Verfahren gefüllt werden. Siehe Remington's Pharmaceutical Sciences, 16. oder 18. Auflagen. Andere Dosierungen können herstellt werden, indem das Füllgewicht verändert wird und, falls erforderlich, die Kapselgröße so verändert wird, daß sie passend ist.
- Der Wirkstoff (Dapoxetin oder ein pharmazeutisch verträgliches Salz davon) kann durch ein geeignetes Sieb gesiebt werden und mit dem Arzneistoffträger vermischt werden, bis sich eine gleichmäßige Mischung ausbildet. Die trockene Mischung kann gescreent werden und mit dem Magnesiumstearat vermischt werden. Das hieraus hervorgehende Pulvergemisch kann dann in Tabletten von gewünschter Form und Größe gepreßt werden. Tabletten anderer Stärken können hergestellt werden, indem das Verhältnis des Wirkstoffs zu dem/den Arzneistoffträger(n) verändert wird oder indem das Tablettengewicht modifiziert wird.
- Der Wirkstoff (Dapoxetin oder ein pharmazeutisch verträgliches Salz davon) kann durch ein geeignetes Sieb gesiebt werden und mit der Lactose vermischt werden, bis sich eine gleichmäßige Mischung ausbildet. Es werden geeignete Volumina an Wasser zugegeben und die Puder werden granuliert. Nach dem Trocknen werden die Granula dann gescreent und mit den verbleibenden Arzneistoffträgern vermischt. Die hieraus hervorgehenden Granula werden dann in Tabletten der gewünschten Form gepreßt. Tabletten anderer Stärken können hergestellt werden, indem das Verhältnis von Wirkstoff zu dem/der Arzneistoffträger(n) oder der Kompressionsdruck verändert wird.
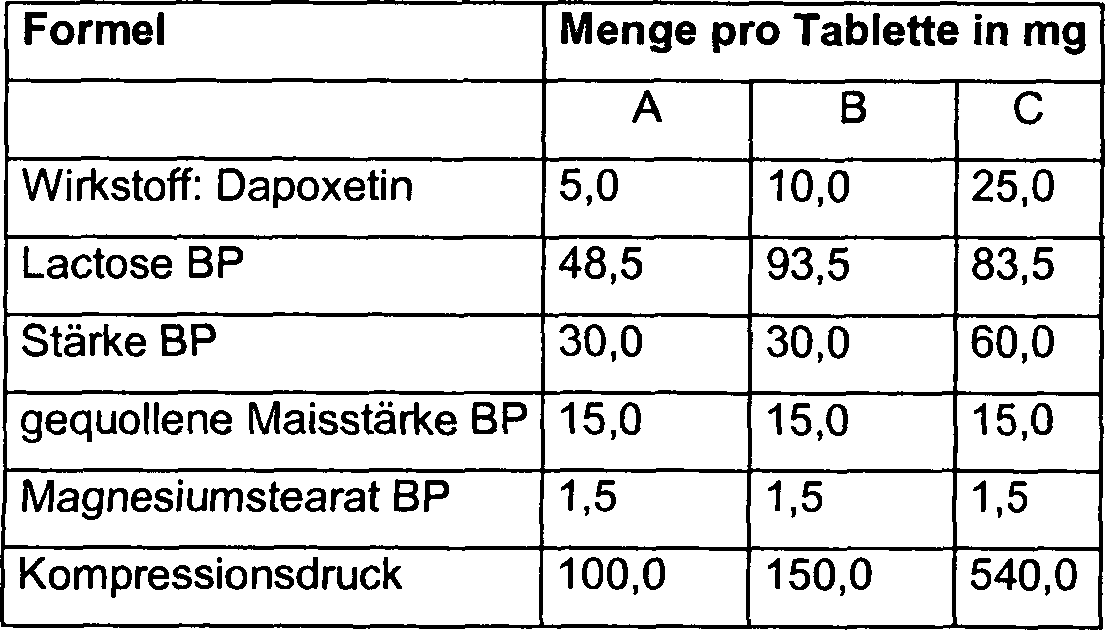
- Der Wirkstoff (Dapoxetin oder ein pharmazeutisch verträgliches Salz davon) kann durch ein geeignetes Sieb gesiebt werden und mit Lactose, Stärke und gequollener Maisstärke vermischt, bis sich ein gleichmäßiges Gemisch ausbildet. Es werden geeignete Volumina an Wasser zugegeben und die Pulver werden granuliert. Nach dem Trocknen werden die Granula dann gescreent und mit den übrigen Arzneistoffträgern vermischt. Die hieraus hervorgehenden Granula werden dann in Tabletten der gewünschten Form gepreßt. Tabletten anderer Stärken können hergestellt werden, indem das Verhältnis von Wirkstoff zu Arzneistoffträger(n) oder der Kompressionsdruck verändert wird.
- Der Wirkstoff (R)-(–)-N,N-Dimethyl-1-Phenyl-3-(1-Naphtalenyloxy)-Propanamin kann durch ein geeignetes Sieb gesiebt werden und mit Lactose, Stärke und gequollener Maisstärke vermischt werden, bis sich ein gleichmäßiges Gemisch ausbildet. Es werden geeignete Volumina an Wasser zugegeben und die Pulver granuliert. Nach dem Trocknen werden die Granula gescreent und mit den verbleibenden Arzneistoffträgern vermischt. Die hieraus hervorgehenden Granula werden dann in Tabletten der gewünschten Form gepreßt. Tabletten anderer Stärken können hergestellt werden, indem das Verhältnis von Wirkstoff zu dem/den Arzneistoffträger(n) oder der Kompressionsdruck geändert wird. Tabelle 7 Zusammensetzung von Kapseln mit Placebo, 10 mg Dapoxetin, 20 mg Dapoxetin und 30 mg Dapoxetin
- * Die Mengen an Dapoxetin-HCl sind zu den korrespondierenden Stärken (10 mg, 20 mg und 30 mg) der freien Base, Dapoxetin, äquivalent.
- Tabelle 7 stellt eine zusätzliche Formulierung für das Placebo und die Kapseln mit 10 mg, 20 mg und 30 mg Dapoxetin bereit. Dapoxetin-HCl wird mit den in Tabelle 7 aufgeführten Arzneistoffträgern unter Bedingungen und unter Anwendung von Verfahren gemischt, die dem Fachmann wohl bekannt sind. Das Gemisch wird dann in Hartgelatine-Kapseln geeigneter Größe gefüllt, wobei auf dem Gebiet gut bekannte Maschinen und Verfahren zur Anwendung kommen.
- Der die Untersuchung Durchführende kann dem Patienten bei jedem Besuch 12 Kapseln des Arzneistoffs der Studie geben, beginnend mit Besuch 2 und endend mit Besuch 4. 12 Kapseln sollten für das Ziel von 4 Verkehrsversuche (8 Kapseln) plus 2 geplante, jedoch abgebrochene Versuche (4 „Extra"-Kapseln) eine ausreichende Versorgung darstellen. Bei jedem nachfolgenden Versuch sollten die Patienten die nicht verwendete Studienmedikation aus dem vorherigen Behandlungszeitraum zurückgeben, und ihnen können die nächsten 12 Kapseln (die eine von den vorherigen Studienzeiträumen abweichende Dosierung enthalten) an Studienarzneistoff gegeben werden. Dem Patienten sollte ein Maximum von einer Dosis (2 Kapseln) pro Tag erlaubt werden. Die Arzneistoffverabreichung sollte von dem Patienten in seinem Ereignisprotokoll aufgezeichnet werden. Der Untersuchende sollte eine Ausgabe- und eine Inventarsaufzeichnung aller Untersuchungsartikel während der Studie aufrecht erhalten und sollte die Menge an zurückgegebener Studienmedikation bei diesen Besuchen mit der Arzneistoffverabreichungsaufzeichnung im Ereignisprotokoll des Patienten vergleichen. Am Ende der Studie sollten sämtliche nicht verwendeten Untersuchungsartikel zum Sponsor zurückgegeben werden.
- Nach dem ersten Behandlungszeitraum kann man den Patienten zu einer anderen Dosierung der Studienmedizin (Placebo, 20 mg oder 40 mg Dapoxetin) herüberwechseln lassen. Nach dem zweiten Behandlungszeitraum kann man den Patienten zu der letzten Studienmedizin wechseln lassen (Placebo, 20 mg oder 40 mg Dapoxetin).
- Um ein Säugetier mit einer wirksamen Dosierung an Dapoxetin gemäß den Verfahren der vorliegenden Erfindung zu versorgen, kann jeder geeignete Verabreichungsweg eingesetzt werden. Z. B. können die folgenden Formen der Verabreichung eingesetzt werden, oral, rektal, parenteral, epicutan, transdermal, subcutan, intramuskulär, intranasal, sublingual, bukkal, intradural, intraokular, intrarespiratorisch oder durch nasale Inhalation und dergleichen. Zum Zwecke der Erleichterung der Verabreichung ist die orale Verabreichung im allgemeinen bevorzugt, insbesondere wo durch Selbsttherapie durch das Säugetier verabreicht wird.
- Die Begriffe „Studienarzneistoff" oder „Studienmedizin" bezeichnen hier entweder die Placebodosis, die Dosis von 20 mg Dapoxetin oder die Dosis von 40 mg Dapoxetin.
- In den Tabellen 8a und 8b werden die Ergebnisse einer Interimsanalyse einer randomisierten Doppelblind-3-Wege-Crossover-Evaluierung von 2 prn-Dosierungen an Dapoxetin (20 mg und 40 mg) bei der Behandlung von vorzeitigem Samenerguß (im folgenden als „PE" bezeichnet) offenbart. Jeder Patient ist dazu bestimmt, jeweils 4 bis 6 Verabreichungen von jeder der 3 Studiendosierungen in einer zufälligen Reihenfolge über 3 Zeiträume von nicht mehr als 4 Wochen zu erhalten. Die Interimsanalyse der Daten wurde nach Vollendung des ersten Behandlungszeitraums durchgeführt.
- Die Studie umfaßte 155 Männer im Alter von 19 bis 60 Jahren, die PE zeigten, wie es in DSM IV definiert ist. Alle Patienten waren in eine stabile, monogame sexuelle Beziehung von wenigstens 6 Monaten Dauer eingebunden und berichteten eine Vorgeschichte von intravaginaler Ejakulationslatenz (im folgenden als „EL" bezeichnet) von weniger als 2 Minuten bei mehr als der Hälfte ihrer Verkehrserfahrungen. Eine Vorgeschichte mit signifikanter kardiovaskulärer Erkrankung oder psychischen Störungen, unkontrolliertem Bluthochdruck, erektiler Funktionsstörung und Mißbrauch von Substanzen waren Ausschlußkriterien.
- Während eines Einführungszeitraums (maximal 4 Wochen) wurden die Patienten gebeten, die Ejakulationslatenz minimal 4 Mal aufzuzeichnen. Die Latenz ist definiert als die Zeitspanne, die durch den Partner des Patienten mit einer Stoppuhr von der vaginalen Einführung bis zum Samenerguß gemessen wird. Bei Vollendung der Einführungsperiode wurden die Patienten zufällig zu Behandlungen mit entweder 20 mg oder 40 mg Dapoxetin oder Placebo zugeteilt. Die Studienmedikation sollte 1 bis 3 Stunden vor einem geplanten Verkehrsereignis eingenommen werden. Die Zeit zu der der Studienarzneistoff eingenommen wurde und die Zeit des Verkehrs wurden in einem Ereignisprotokoll aufgezeichnet. Die Patienten wurden angewiesen, über die 4 Wochen Behandlungszeit wenigstens 4 Mal einen Anlauf zum Verkehr zu unternehmen und wurden mit einer hinreichenden Versorgung an Medikation für insgesamt 6 Verkehrsversuche versehen. Das Ergebnis jedes Versuchs (Einführungserfolg und EL) wurde in dem Ereignisprotokoll aufgezeichnet und von dem Patienten und seinem Partner abgezeichnet. Die Patienten kehrten, nachdem 4 bis 6 Verkehrsversuche abgeschlossen waren, für einen Nachbesuch in die Untersuchungsklinik zurück. Bei den Besuchen 4, 5 und 6 wurden die Patienten gebeten, die Fragen zur allgemeinen Zufriedenheit zu beantworten und den PEQ zu vervollständigen.
- Von den 155 zufällig aufgeteilten Patienten vollendeten 145 den Behandlungszeitraum. 54 Patienten wurden zufällig der Placebogruppe zugeteilt, während 56 und 45 jeweils 20 mg oder 40 mg Dapoxetin erhielten. Obwohl die Patienten zu den Behandlungssequenzen in Blocks von 6 zufällig zugeteilt wurden, war das Ungleichgewicht im Hinblick auf die Anzahl der Patienten, die zu jeder Gruppe zufällig zugeteilt wurden, eine Folge der zufälligen Verteilung der Zuteilung von 40 mg zu späteren Allokationen innerhalb der Blocks. Die Intent-to-Treat-Population umfaßte 143 Patienten, von denen jeweils Basislinien- und Folgedaten für die Analyse vorlagen. Die Analyse der EL wurde bei den 138 Patienten durchgeführt, die Latenzdaten auf der Basislinie aufwiesen und wenigstens ein Ereignis nach der Medikation. Der Prozentsatz der Patienten mit genügend Daten, um in die Analyse der EL eingeschlossen zu werden, war bei der Gruppe mit 40 mg kleiner als in jeder der anderen beiden Gruppen. Diese Abweichung mag der geringeren Größe der Gruppe mit 40 mg zuzuschreiben sein, so daß jeder Patient einen größeren Prozentsatz an dem Ganzen repräsentiert, anstatt eine Funktion der verabreichten Dosis zu sein.
- Die Patienten über alle drei Gruppen hinweg versuchten im Durchschnitt 4,4 Mal den Verkehr im Anschluß an die Einnahme des Studienarzneistoffs. Die mittlere Ejakulationslatenz auf der Basislinie (der Durchschnitt aller aufgezeichneter EL während der Einführungsperiode von 4 Wochen) war in der Placebogruppe 18 Sekunden länger als in jeder der Dapoxetingruppen. Ein im Bezug auf EL evaluierbarer Patient war einer, der sowohl einen Basislinien- als auch einen Folge-Latenzwert aufwies. Es ist bemerkenswert, daß 22,5%, 16,0% und 13,5% der im Hinblick auf EL evaluierbaren Patienten in den Gruppen mit Placebo, 20 mg Dapoxetin und 40 mg Dapoxetin jeweils eine mittlere Basislinien-EL von über 2 Minuten aufwiesen, mit einigen, die mittlere Werte in der Höhe von 7 Minuten aufzeichneten.
-
- * NA bedeutet „nicht anwendbar".
- ** LS bedeutet „Kleinste Fehlerquadrate" und ist der Mittelwert mit Einstellung auf die Unterschiede in Basislinie und Probenumfang.
- Wie oben in Tabelle 8b zusammengefasst ist, erhöhte sich die mittlere Ejakulationslatenz für alle Verkehrsereignisse, die der Einnahme von Dapoxetin folgten, um eine Minute sowohl für die Behandlungsgruppe mit 20 mg als auch für die mit 40 mg Dapoxetin, während sich die EL in der Placebogruppe lediglich um 24 Sekunden erhöhte. Wenn die Daten auf den Probenumfang und die Basislinienabweichungen zwischen den Behandlungen eingestellt werden, betragen die LS-Mittel 1,74 Minuten für das Placebo, 2,41 für die Behandlung mit 20 mg Dapoxetin und 2,52 für die Behandlung mit 40 mg Dapoxetin. Der Prozentsatz der Patienten, die eine Erhöhung der EL von wenigstens einer Minute erreichten, war in der Dapoxetingruppe mit 20 mg (22%) und bei der mit 40 mg (24%) größer als bei der Placebogruppe (14%).
- Für den Fachmann werden aus der voranstehenden Beschreibung zusätzlich zu den hier aufgezeigten und beschriebenen Modifikationen verschiedene Modifikationen der Erfindung offensichtlich sein. Solche Modifikationen sollen auch in den Schutzumfang der anhängenden Ansprüche fallen. Es wird angenommen, daß die obige Offenbarung all die Informationen umfaßt, die wesentlich sind, um den Fachmann in die Lage zu versetzen, die beanspruchte Erfindung auszuführen.
- In den folgenden Tabellen werden die Ergebnisse einer Abschlußanalyse einer randomisierten Doppelblind-3-Wege-Crossover-Evaluierung von 2 prn-Dosierungen an Dapoxetin (20 mg und 40 mg) bei der Behandlung von vorzeitigem Samenerguß offenbart. Die Abschlußanalysen der Daten wurden im Anschluß an die Vollendung aller drei Behandlungszeiträume durchgeführt.
- Die Tabelle 12 deckt auf, daß Dapoxetin vorzeitigen Samenerguß mit der ersten, einem Patienten verabreichten Dosis wirksam und unerwartet behandeln kann. Es ist daher keine Einführungsphase erforderlich, um vorzeitigen Samenerguß mit Dapoxetin zu behandeln und um eine wirksame prn-Dosierung zu liefern. Tabelle 12 Nach Verabreichung einer Einzeldosis festgestellte Ejakulationslatenz
- * p-Wert für die kombinierten Dapoxetindosierungen gegen Placebo = 0,038
Claims (19)
- Verwendung von Dapoxetin oder eines pharmazeutisch verträglichen Salzes davon für die Herstellung eines Medikaments zur Behandlung oder Handhabung von sexueller Funktionsstörung in einem Säuger, wobei das Medikament bedarfsabhängig zu verabreichen ist.
- Verwendung nach Anspruch 1, wobei der Säuger ein männlicher Mensch ist.
- Verwendung nach einem der Ansprüche 1 oder 2, wobei die sexuelle Funktionsstörung aus der Gruppe ausgewählt ist, bestehend aus vorzeitigem Samenerguß, verzögertem Samenerguß, geringem sexuellem Verlangen, sexueller Abneigung oder Orgasmusstörung.
- Verwendung nach Anspruch 3, wobei die sexuelle Funktionsstörung vorzeitiger Samenerguß ist.
- Verwendung nach einem der Ansprüche 1 bis 4, wobei das Medikament unmittelbar vor bis zu etwa 12 Stunden vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach einem der Ansprüche 1 bis 4, wobei das Medikament unmittelbar vor bis zu etwa 8 Stunden vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach einem der Ansprüche 1 bis 4, wobei das Medikament unmittelbar vor bis zu etwa 4 Stunden vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach einem der Ansprüche 1 bis 4, wobei das Medikament unmittelbar vor bis zu etwa 3 Stunden vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach einem der Ansprüche 1 bis 4, wobei das Medikament unmittelbar vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach einem der Ansprüche 1 bis 9, wobei das Medikament in einer Verabreichungsform vorliegt, die von etwa 0,001 mg bis etwa 350 mg des Dapoxetin pro Verabreichung liefert.
- Verwendung nach einem der Ansprüche 1 bis 9, wobei das Medikament in einer Verabreichungsform vorliegt, die von etwa 0,01 mg bis etwa 200 mg des Dapoxetin pro Verabreichung liefert.
- Verwendung nach einem der Ansprüche 1 bis 9, wobei das Medikament in einer Verabreichungsform vorliegt, die von etwa 0,1 mg bis etwa 120 mg des Dapoxetin pro Verabreichung liefert.
- Verwendung nach einem der Ansprüche 1 bis 9, wobei das Medikament in einer Verabreichungsform für eine orale Verabreichung vorliegt.
- Verwendung nach Anspruch 13, wobei das Medikament eine orale feste Verabreichungsform ist.
- Verwendung von Dapoxetin oder eines pharmazeutisch verträglichen Salzes davon für die Herstellung eines Medikaments für die Behandlung oder Handhabung von vorzeitigem Samenerguß in einem männlichen Menschen, wobei das Medikament in einer Verabreichungsform vorliegt, welche etwa 0,01 mg bis etwa 200 mg Dapoxetin oder eines pharmazeutisch verträglichen Salzes davon pro Verabreichung liefert und unmittelbar vor bis zu etwa 8 Stunden vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach Anspruch 15, wobei das Medikament unmittelbar vor bis zu etwa 4 Stunden vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach Anspruch 15, wobei das Medikament unmittelbar vor bis zu etwa 3 Stunden vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach Anspruch 15, wobei das Medikament unmittelbar vor einer sexuellen Aktivität zu verabreichen ist.
- Verwendung nach einem der Ansprüche 1 bis 18, wobei das Medikament weiterhin eine therapeutisch wirksame Menge eines zusätzlichen therapeutischen Mittels für die Behandlung oder Handhabung einer zweiten, anderen sexuellen Funktionsstörung enthält.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15243599P | 1999-09-03 | 1999-09-03 | |
| US152435P | 1999-09-03 | ||
| PCT/US2000/020788 WO2001017521A1 (en) | 1999-09-03 | 2000-08-22 | Methods of using rapid-onset selective serotonin reuptake inhibitors for treating sexual dysfunction |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE60026146D1 DE60026146D1 (de) | 2006-04-27 |
| DE60026146T2 true DE60026146T2 (de) | 2006-08-17 |
Family
ID=22542905
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE60026146T Expired - Lifetime DE60026146T2 (de) | 1999-09-03 | 2000-08-22 | Verwendung von Dapoxetin, A selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Disfunktion |
| DE122009000036C Active DE122009000036I2 (de) | 1999-09-03 | 2000-08-22 | Verwendung von Dapoxetin, ein selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Dysfunktion |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE122009000036C Active DE122009000036I2 (de) | 1999-09-03 | 2000-08-22 | Verwendung von Dapoxetin, ein selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Dysfunktion |
Country Status (34)
| Country | Link |
|---|---|
| US (4) | US7718705B1 (de) |
| EP (3) | EP1889614A3 (de) |
| JP (1) | JP3194734B2 (de) |
| KR (1) | KR100719977B1 (de) |
| CN (1) | CN1222283C (de) |
| AT (1) | ATE318135T1 (de) |
| AU (1) | AU762934B2 (de) |
| BE (1) | BE2012C040I2 (de) |
| BG (1) | BG65677B1 (de) |
| BR (1) | BR0014166A (de) |
| CA (1) | CA2383785C (de) |
| CY (1) | CY2012028I2 (de) |
| CZ (1) | CZ299712B6 (de) |
| DE (2) | DE60026146T2 (de) |
| DK (1) | DK1225881T3 (de) |
| EA (1) | EA004101B1 (de) |
| EE (1) | EE05315B1 (de) |
| ES (2) | ES2393582T3 (de) |
| FR (1) | FR12C0052I2 (de) |
| HK (2) | HK1047545B (de) |
| HR (1) | HRP20020189A2 (de) |
| HU (1) | HU229150B1 (de) |
| IL (2) | IL148159A0 (de) |
| LU (1) | LU92204I2 (de) |
| MX (1) | MXPA02001811A (de) |
| MY (1) | MY125490A (de) |
| NO (2) | NO330562B1 (de) |
| NZ (1) | NZ517038A (de) |
| PL (1) | PL211402B1 (de) |
| SI (1) | SI1225881T1 (de) |
| TW (3) | TW200524582A (de) |
| UA (1) | UA75580C2 (de) |
| WO (1) | WO2001017521A1 (de) |
| ZA (1) | ZA200201407B (de) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6403597B1 (en) | 1997-10-28 | 2002-06-11 | Vivus, Inc. | Administration of phosphodiesterase inhibitors for the treatment of premature ejaculation |
| DE60026146T2 (de) * | 1999-09-03 | 2006-08-17 | Apbi Holdings, Llc | Verwendung von Dapoxetin, A selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Disfunktion |
| ES2265495T3 (es) | 2001-03-16 | 2007-02-16 | Dmi Biosciences, Inc. | Uso de tramadol para el retardo de la eyaculacion. |
| WO2002079152A1 (en) | 2001-03-29 | 2002-10-10 | Bristol-Myers Squibb Company | Cyclopropylindole derivatives as selective serotonin reuptake inhibitors |
| CA2410966C (en) * | 2002-11-01 | 2005-11-22 | Craig J. Hudson | Sexual desire and performance enhancement with protein-bound tryptophan |
| AU2003903597A0 (en) * | 2003-07-11 | 2003-07-24 | Jakov Vaisman | Treatment of premature ejaculation |
| GB0318706D0 (en) * | 2003-08-08 | 2003-09-10 | Pfizer Ltd | Selective serotonin reuptake inhibitors in the treatment of disease |
| DE102009015702A1 (de) | 2009-03-31 | 2010-10-07 | Ratiopharm Gmbh | Tabletten enthaltend Dapoxetin und Trockenverarbeitungsverfahren zu deren Herstellung |
| DE102009058321A1 (de) | 2009-12-15 | 2011-06-16 | Ratiopharm Gmbh | Schmelztablette, enthaltend Dapoxetin |
| EP2591773A4 (de) | 2010-07-06 | 2014-11-26 | Navipharm Co Ltd | Zeitverzögert freigesetzte pharmazeutische zusammensetzung mit dapoxetin zur oralen verabreichung |
| RU2463033C2 (ru) * | 2010-08-06 | 2012-10-10 | Василий Федорович Пятин | Способ лечения преждевременной эякуляции |
| CN103100085A (zh) * | 2011-11-09 | 2013-05-15 | 上海兰蒂斯生物医药科技有限公司 | 一种药物组合物 |
| CN103130660B (zh) * | 2011-11-25 | 2014-09-17 | 厦门福满药业有限公司 | 一类达泊西汀的酸式盐及其晶体,以及晶体的制备方法 |
| WO2014042416A1 (ko) * | 2012-09-13 | 2014-03-20 | 주식회사 씨티씨바이오 | 다폭세틴 유리염기를 함유하는 경구용 조성물 |
| KR101432905B1 (ko) | 2012-12-11 | 2014-08-21 | 가톨릭대학교 산학협력단 | 다폭세틴을 유효성분으로 포함하는 유전적 통증 치료용 약학 조성물 |
| US20160101093A1 (en) * | 2013-05-21 | 2016-04-14 | Jason B. Wynberg | Methods for the treatment of premature ejaculation |
| CN103735525B (zh) * | 2014-02-12 | 2015-05-06 | 江苏仁寿药业有限公司 | 一种达泊西汀片剂及制备方法 |
| US20180071269A1 (en) | 2015-08-12 | 2018-03-15 | Tianxin Wang | Therapeutical methods, formulations and nutraceutical formulations |
| CN106659755A (zh) * | 2014-08-12 | 2017-05-10 | 王天欣 | 一种处理哺乳动物性功能障碍的方法、药品及药品配方 |
| WO2018102233A1 (en) * | 2016-11-30 | 2018-06-07 | Wang tian xin | Therapeutical methods, formulations and nutraceutical formulations |
| TR201620151A2 (en) | 2016-12-30 | 2018-07-23 | Sanovel Ilac Sanayi Ve Ticaret Anonim Sirketi | ORAL PHARMACEUTICAL COMPOSITIONS CONTAINING TADALAFIL AND DAPOXETIN |
| CN113143879A (zh) * | 2021-05-07 | 2021-07-23 | 苏州康恒研新药物技术有限公司 | 一种盐酸达泊西汀缓释片的制备方法 |
| CN113181127A (zh) * | 2021-05-07 | 2021-07-30 | 苏州康恒研新药物技术有限公司 | 一种盐酸达泊西汀微丸片的制备方法 |
Family Cites Families (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3536809A (en) | 1969-02-17 | 1970-10-27 | Alza Corp | Medication method |
| US3598123A (en) | 1969-04-01 | 1971-08-10 | Alza Corp | Bandage for administering drugs |
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US3916899A (en) | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| US4194009A (en) * | 1974-01-10 | 1980-03-18 | Eli Lilly And Company | Aryloxyphenylpropylamines for obtaining a psychotropic effect |
| US4018895A (en) * | 1974-01-10 | 1977-04-19 | Eli Lilly And Company | Aryloxyphenylpropylamines in treating depression |
| US4314081A (en) * | 1974-01-10 | 1982-02-02 | Eli Lilly And Company | Arloxyphenylpropylamines |
| US4008719A (en) | 1976-02-02 | 1977-02-22 | Alza Corporation | Osmotic system having laminar arrangement for programming delivery of active agent |
| US4207343A (en) * | 1978-06-22 | 1980-06-10 | Eli Lilly And Company | 1-Phenyl-3-(substituted phenoxy)propylamines |
| US4329356A (en) * | 1980-10-31 | 1982-05-11 | Eli Lilly And Company | Treatment of hypertension with fluoxetine and l-5-hydroxytryptophane |
| IE58110B1 (en) | 1984-10-30 | 1993-07-14 | Elan Corp Plc | Controlled release powder and process for its preparation |
| US5135947A (en) | 1987-04-09 | 1992-08-04 | Eli Lilly And Company | 1-phenyl-3-naphthalenyloxypropanamines and their use as selective serotonin reuptake inhibitors |
| US4866046A (en) | 1988-05-31 | 1989-09-12 | Top Laboratories, Inc. | Low-dosage sublingual aspirin |
| US5082667A (en) | 1988-06-07 | 1992-01-21 | Abbott Laboratories | Solid pharmaceutical dosage in tablet triturate form and method of producing same |
| US5073543A (en) | 1988-07-21 | 1991-12-17 | G. D. Searle & Co. | Controlled release formulations of trophic factors in ganglioside-lipsome vehicle |
| US5114976A (en) | 1989-01-06 | 1992-05-19 | Norden Michael J | Method for treating certain psychiatric disorders and certain psychiatric symptoms |
| IT1229203B (it) | 1989-03-22 | 1991-07-25 | Bioresearch Spa | Impiego di acido 5 metiltetraidrofolico, di acido 5 formiltetraidrofolico e dei loro sali farmaceuticamente accettabili per la preparazione di composizioni farmaceutiche in forma a rilascio controllato attive nella terapia dei disturbi mentali organici e composizioni farmaceutiche relative. |
| US4940731A (en) | 1989-08-30 | 1990-07-10 | Pfizer Inc. | Method of treating premature ejaculation using sertraline |
| US5120548A (en) | 1989-11-07 | 1992-06-09 | Merck & Co., Inc. | Swelling modulated polymeric drug delivery device |
| US5733566A (en) | 1990-05-15 | 1998-03-31 | Alkermes Controlled Therapeutics Inc. Ii | Controlled release of antiparasitic agents in animals |
| US5589511A (en) | 1990-08-13 | 1996-12-31 | Sepracor Inc. | Method for treating migraine headaches using optically pure S(+) fluoxetine |
| US5151448A (en) * | 1991-07-12 | 1992-09-29 | Crenshaw Roger T | Method for treating premature ejaculation |
| US5151488A (en) * | 1991-11-12 | 1992-09-29 | The Mead Corporation | Liquid crystal polymers containing a repeating bisoxazole structure |
| US5580578A (en) | 1992-01-27 | 1996-12-03 | Euro-Celtique, S.A. | Controlled release formulations coated with aqueous dispersions of acrylic polymers |
| US5248699A (en) | 1992-08-13 | 1993-09-28 | Pfizer Inc. | Sertraline polymorph |
| US5292962A (en) | 1992-12-11 | 1994-03-08 | Eli Lilly And Company | Intermediates to 1-phenyl-3-naphthalenyloxy-propanamines |
| US5591767A (en) | 1993-01-25 | 1997-01-07 | Pharmetrix Corporation | Liquid reservoir transdermal patch for the administration of ketorolac |
| ZA93694B (en) * | 1993-02-01 | 1993-06-03 | Lilly Co Eli | Pharmaceutical treatments. |
| US5276042A (en) * | 1993-04-16 | 1994-01-04 | Crenshaw Roger T | Treatment of premature ejaculation |
| IT1264965B1 (it) | 1993-11-12 | 1996-10-17 | Giorgio Cavallini | Uso di alfa 1-bloccanti nel trattamento della eiaculazione precoce |
| AU703608B2 (en) | 1994-04-22 | 1999-03-25 | Pentech Pharmaceuticals, Inc. | Dosage forms and method for ameliorating male erectile dysfunction |
| CA2134038C (en) | 1994-06-16 | 1997-06-03 | David Taiwai Wong | Potentiation of drug response |
| IT1270594B (it) | 1994-07-07 | 1997-05-07 | Recordati Chem Pharm | Composizione farmaceutica a rilascio controllato di moguisteina in sospensione liquida |
| US5457121A (en) | 1994-09-02 | 1995-10-10 | Eli Lilly And Company | Cis-hexahydro-5-(1,2,3,4-tetrahydro-2-naphthalenyl)pyrrolo<3,4-c>pyrroles as inhibitors of serotonin reuptake |
| US5597826A (en) | 1994-09-14 | 1997-01-28 | Pfizer Inc. | Compositions containing sertraline and a 5-HT1D receptor agonist or antagonist |
| ZA958725B (en) | 1994-10-20 | 1997-04-16 | Lilly Co Eli | Treatment of disorders with duloxetine |
| EP0714663A3 (de) | 1994-11-28 | 1997-01-15 | Lilly Co Eli | Potenzierung von Wirkstoffresponz durch Serotonin 1A Rezeptor Antagonisten |
| US5627196A (en) | 1995-01-17 | 1997-05-06 | Eli Lilly And Company | Compounds having effects on serotonin-related systems |
| US5576321A (en) | 1995-01-17 | 1996-11-19 | Eli Lilly And Company | Compounds having effects on serotonin-related systems |
| US5789402A (en) | 1995-01-17 | 1998-08-04 | Eli Lilly Company | Compounds having effects on serotonin-related systems |
| US5614523A (en) | 1995-01-17 | 1997-03-25 | Eli Lilly And Company | Compounds having effects on serotonin-related systems |
| AU4918796A (en) | 1995-02-10 | 1996-08-27 | Eli Lilly And Company | Methods of treating or preventing psychiatric disorders |
| US5624677A (en) | 1995-06-13 | 1997-04-29 | Pentech Pharmaceuticals, Inc. | Controlled release of drugs delivered by sublingual or buccal administration |
| CA2233541C (en) | 1995-10-13 | 2002-04-30 | Neurosearch A/S | 8-azabicyclo[3.2.1]oct-2-ene derivatives, their preparation and use |
| US5758911A (en) * | 1996-02-07 | 1998-06-02 | Northrop Grumman Corporation | Linear motion wind driven power plant |
| US5897864A (en) | 1996-05-23 | 1999-04-27 | Cohen; Alan J. | Method for treating sexual dysfunction disorders with compositions containing ginkgo biloba |
| US5846982A (en) | 1996-06-14 | 1998-12-08 | Eli Lilly And Company | Inhibition of serotonin reuptake |
| US5912256A (en) | 1996-06-20 | 1999-06-15 | Eli Lilly And Company | Compounds having effects on serotonin-related systems |
| US5830500A (en) * | 1996-07-22 | 1998-11-03 | Pentech Pharmaceuticals, Inc. | Low dose fluoxetine tablet |
| US6638948B1 (en) | 1996-09-09 | 2003-10-28 | Pentech Pharmaceuticals, Inc. | Amorphous paroxetine composition |
| US5672612A (en) | 1996-09-09 | 1997-09-30 | Pentech Pharmaceuticals, Inc. | Amorphous paroxetine composition |
| US5910319A (en) | 1997-05-29 | 1999-06-08 | Eli Lilly And Company | Fluoxetine enteric pellets and methods for their preparation and use |
| US6517866B1 (en) | 1997-07-01 | 2003-02-11 | Pfizer Inc. | Sertraline salts and sustained-release dosage forms of sertraline |
| HUP0301787A3 (en) | 1997-07-01 | 2005-04-28 | Pfizer Prod Inc | Delayed-release dosage forms of sertraline |
| EP0980241B1 (de) | 1997-07-01 | 2003-12-17 | Pfizer Products Inc. | In gelatine eingekapselte sertarline dosierungsformen |
| FR2765483B1 (fr) * | 1997-07-04 | 2000-02-04 | Philippe Gorny | Medicament destine a traiter les dysfonctions erectiles |
| US5922341A (en) | 1997-10-28 | 1999-07-13 | Vivus, Incorporated | Local administration of pharmacologically active agents to treat premature ejaculation |
| US6037360A (en) | 1997-10-28 | 2000-03-14 | Vivus, Incorporated | Administration of 5-HT3 receptor antagonists to treat premature ejaculation |
| US6228864B1 (en) | 1997-10-28 | 2001-05-08 | Vivus, Inc. | Administration of 5-HT receptor agonists and antagonists, to treat premature ejaculation |
| UA66370C2 (en) * | 1997-12-16 | 2004-05-17 | Lilly Co Eli | Arylpiperazines having activity to setotonin 1 receptors |
| PA8469101A1 (es) | 1998-04-09 | 2000-09-29 | Pfizer Prod Inc | Ligandos azabiciclicos de receptores 5ht1 |
| US6303627B1 (en) | 1998-06-19 | 2001-10-16 | Eli Lilly And Company | Inhibitors of serotonin reuptake |
| JP2002518331A (ja) | 1998-06-19 | 2002-06-25 | イーライ・リリー・アンド・カンパニー | セロトニン再取り込みの阻害 |
| FR2781671A1 (fr) | 1998-07-28 | 2000-02-04 | Synthelabo | Compositions pharmaceutiques contenant un inhibiteur de la recapture de la serotonine et leur application en therapeutique |
| US6150376A (en) | 1998-08-05 | 2000-11-21 | Georgetown University | Bi- and tri-cyclic aza compounds and their uses |
| OA11662A (en) | 1998-10-13 | 2004-12-08 | Pfizer Prod Inc | Sertraline oral concentrate. |
| WO2000067729A1 (en) * | 1999-05-06 | 2000-11-16 | Pentech Pharmaceuticals, Inc. | Regimen and kit for amelioration of premature ejaculation |
| US20010003120A1 (en) * | 1999-05-14 | 2001-06-07 | M. D. Robert Hines | Method for treating erectile dysfunction |
| DE60026146T2 (de) * | 1999-09-03 | 2006-08-17 | Apbi Holdings, Llc | Verwendung von Dapoxetin, A selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Disfunktion |
-
2000
- 2000-08-22 DE DE60026146T patent/DE60026146T2/de not_active Expired - Lifetime
- 2000-08-22 DK DK00957264T patent/DK1225881T3/da active
- 2000-08-22 AT AT00957264T patent/ATE318135T1/de active
- 2000-08-22 BR BR0014166-6A patent/BR0014166A/pt not_active Application Discontinuation
- 2000-08-22 UA UA2002031755A patent/UA75580C2/uk unknown
- 2000-08-22 CA CA002383785A patent/CA2383785C/en not_active Expired - Lifetime
- 2000-08-22 EP EP07023209A patent/EP1889614A3/de not_active Withdrawn
- 2000-08-22 WO PCT/US2000/020788 patent/WO2001017521A1/en active IP Right Grant
- 2000-08-22 NZ NZ517038A patent/NZ517038A/xx not_active IP Right Cessation
- 2000-08-22 ES ES06002333T patent/ES2393582T3/es not_active Expired - Lifetime
- 2000-08-22 IL IL14815900A patent/IL148159A0/xx unknown
- 2000-08-22 EE EEP200200107A patent/EE05315B1/xx active Protection Beyond IP Right Term
- 2000-08-22 EP EP00957264A patent/EP1225881B1/de not_active Expired - Lifetime
- 2000-08-22 CN CNB008153132A patent/CN1222283C/zh not_active Ceased
- 2000-08-22 CZ CZ20020784A patent/CZ299712B6/cs not_active IP Right Cessation
- 2000-08-22 DE DE122009000036C patent/DE122009000036I2/de active Active
- 2000-08-22 EA EA200200324A patent/EA004101B1/ru not_active IP Right Cessation
- 2000-08-22 KR KR1020027002870A patent/KR100719977B1/ko active IP Right Review Request
- 2000-08-22 US US10/049,427 patent/US7718705B1/en not_active Expired - Lifetime
- 2000-08-22 SI SI200030828T patent/SI1225881T1/sl unknown
- 2000-08-22 AU AU68911/00A patent/AU762934B2/en not_active Expired
- 2000-08-22 MX MXPA02001811A patent/MXPA02001811A/es active IP Right Grant
- 2000-08-22 PL PL364924A patent/PL211402B1/pl unknown
- 2000-08-22 EP EP06002333A patent/EP1671628B1/de not_active Expired - Lifetime
- 2000-08-22 ES ES00957264T patent/ES2256032T3/es not_active Expired - Lifetime
- 2000-08-22 BG BG106461A patent/BG65677B1/bg unknown
- 2000-08-22 HU HU0202687A patent/HU229150B1/hu active Protection Beyond IP Right Term
- 2000-08-25 TW TW094107594A patent/TW200524582A/zh unknown
- 2000-08-25 TW TW098145182A patent/TWI367751B/zh not_active IP Right Cessation
- 2000-08-25 TW TW089117155A patent/TWI312678B/zh not_active IP Right Cessation
- 2000-08-29 JP JP2000259000A patent/JP3194734B2/ja not_active Expired - Lifetime
- 2000-08-29 MY MYPI20003983A patent/MY125490A/en unknown
-
2002
- 2002-02-14 IL IL148159A patent/IL148159A/en active IP Right Grant
- 2002-02-19 ZA ZA200201407A patent/ZA200201407B/en unknown
- 2002-02-28 HR HR20020189A patent/HRP20020189A2/hr not_active Application Discontinuation
- 2002-03-01 NO NO20021035A patent/NO330562B1/no not_active IP Right Cessation
- 2002-12-16 HK HK02109124.8A patent/HK1047545B/zh unknown
-
2004
- 2004-11-24 US US10/996,587 patent/US20050261377A1/en not_active Abandoned
- 2004-11-24 US US10/996,757 patent/US20050215617A1/en not_active Abandoned
-
2006
- 2006-11-30 HK HK06113173.6A patent/HK1091418A1/xx unknown
-
2012
- 2012-08-29 FR FR12C0052C patent/FR12C0052I2/fr active Active
- 2012-09-11 NO NO2012015C patent/NO2012015I2/no unknown
- 2012-10-11 BE BE2012C040C patent/BE2012C040I2/fr unknown
- 2012-10-23 CY CY2012028C patent/CY2012028I2/el unknown
-
2013
- 2013-05-23 LU LU92204C patent/LU92204I2/fr unknown
-
2014
- 2014-04-10 US US14/250,198 patent/US20140221497A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE60026146T2 (de) | Verwendung von Dapoxetin, A selektiver Serotonin Aufnahme Inhibitor mit schnellem Wirkungseintritt, zur Behandlung von sexueller Disfunktion | |
| DE60022021T2 (de) | Zubereitungen enthaltend Apomorphin und Sildenafil und ihre Verwendung zur Behandlung von erektiler Dysfunktion | |
| CA2184077C (en) | Nasal and ocular administration of ketamine to manage pain and for detoxification | |
| US6376550B1 (en) | Pharmaceutical compositions containing tramadol for migraine | |
| MXPA96003633A (en) | Use of ketamine and device for the nasal and eye administration of ketamine for the management of pain and for detoxification | |
| JPH06508836A (ja) | 光学的に純粋なr(+)オンダンセトロンを使用する嘔吐、吐き気および他の障害の治療のための方法および組成物 | |
| DE69835288T2 (de) | Kombinationstherapie zur modulation der humanen sexualreaktion | |
| EP1154795A1 (de) | Verfahren zur behandlung und diagnose des restless leg syndroms und dementsprechende vorrichtungen | |
| KR20030077538A (ko) | 항우울제-유도된 성기능 장애를 아포모르핀을 사용하여치료하는 방법 | |
| NO309965B1 (no) | Oralt farmasøytisk antihostepreparat | |
| JP4640888B2 (ja) | 神経精神性疾患用ニコチンアンタゴニスト | |
| JPH06509073A (ja) | 光学的に純粋なs(−)オンダンセトロンを使用する嘔吐、吐き気および他の障害の治療のための方法および組成物 | |
| EA003557B1 (ru) | Схема обезболивания | |
| WO2002056869A2 (en) | Method for treating sexual disorders | |
| CZ20022320A3 (cs) | Kombinace účinných látek a její použití pro výrobu farmaceutického prostředku | |
| JP2010159285A6 (ja) | 神経精神性疾患用ニコチンアンタゴニスト | |
| JP2010159285A (ja) | 神経精神性疾患用ニコチンアンタゴニスト |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| V448 | Application of spc |
Free format text: PRODUCT NAME: DAPOXETIN IN ALLEM DEM SCHUTZ DES GRUNDPATENTS UNTERLIEGENDEN FORMEN; REGISTRATION NO/DATE: 71669.00.00, 71670.00.00; 20090423 Spc suppl protection certif: 12 2009 000 036 Filing date: 20090714 Free format text: PRODUCT NAME: DAPOXETIN IN ALLEN DEM SCHUTZ DES GRUNDPATENTS UNTERLIEGENDEN FORMEN; REGISTRATION NO/DATE: 71669.00.00, 71670.00.00; 20090423 Spc suppl protection certif: 12 2009 000 036 Filing date: 20090714 |
|
| V484 | Delivery of the decision of grant |
Free format text: PRODUCT NAME: DAPOXETINHYDROCHLORID; REGISTRATION NO/DATE: 71669.00.00, 71670.00.00; 20090423 Spc suppl protection certif: 12 2009 000 036 Filing date: 20090714 |
|
| V457 | Spc granted |
Free format text: PRODUCT NAME: DAPOXETINHYDROCHLORID; REGISTRATION NO/DATE: 71669.00.00, 71670.00.00; 20090423 Spc suppl protection certif: 12 2009 000 036 Filing date: 20090714 |