-
Gegenstand der Erfindung ist die
Verwendung von strahlenhärtbaren
Beschichtungsmassen auf Basis von strahlungshärtenden Organopolysiloxanen
mit (Meth)acrylsäureestergruppen
zur Herstellung abhäsiver Beschichtungen,
welche zur photoinduzierten Härtung
Photoinitiatoren vom Typ Hydroxyalkylphenon enthalten.
-
Abhäsive Beschichtungsmassen (Trennmittel)
werden in grösserem
Umfang zur Beschichtung insbesondere von flächigen Materialien verwendet,
um die Adhäsionsneigung
von adhärierenden
Produkten gegenüber
diesen Oberflächen
zu verringern.
-
Abhäsive Beschichtungsmassen werden
beispielsweise zur Beschichtung von Papieren oder Folien verwendet,
welche als Träger
für selbstklebende
Etiketten dienen sollen. Die mit einem Haftkleber versehenen Etiketten
haften auf der beschichteten Oberfläche noch in genügendem Maße, um die
Handhabung der die Klebeetiketten aufweisenden Trägerfolien
zu ermöglichen.
Die Haftung der Klebeetiketten auf den Trägerfolien muss so hoch sein,
dass bei der maschinellen Applikation von Etiketten, z.B. auf Gebinde,
beim Lauf der mit den Etiketten versehenen Trägerfolien über Umlenkwalzen kein vorzeitiges
Ablösen
erfolgt. Andererseits müssen
jedoch die Etiketten von der beschichteten Trägerfolie abziehbar sein, ohne
dass ihre Klebkraft für
die spätere
Verwendung wesentlich beeinträchtigt
wird. Dazu ist eine besonders gute Aushärtung der Silicontrennschicht
erforderlich, da ansonsten Siliconbestandteile auf die Kleberoberfläche übergehen
können
und die Klebkraft reduzieren.
-
Weitere Anwendungsmöglichkeiten
für abhäsive Beschichtungsmassen
sind Verpackungspapiere, die insbesondere zur Verpackung von klebrigen
Gütern
dienen. Derartige abhäsive
Papiere oder Folien werden beispielsweise zum Verpacken von Lebensmitteln
oder zum Verpacken technischer Produkte, wie z.B. Bitumen, verwendet.
-
Eine weitere Anwendung von abhäsiven Beschichtungsmassen
besteht in der Herstellung von Haftverschlüssen, wie z.B. bei sogenannten
Höschenwindeln.
Ist die Abhäsivität zu hoch,
d.h. der Trennwert zu niedrig, bleibt die Windel nicht zuverlässig geschlossen.
Ist die Abhäsivität zu niedrig
und damit der Trennwert zu hoch, lässt sich der Verschluss nicht
mehr ohne Zerreißen
der Windel öffnen.
-
Die Darstellung von Organosiloxanen
mit (Meth)acrylatmodifizierten organischen Gruppen, die über Si-O-
und/oder über
Si-C-Bindungen an die Siloxaneinheit gebunden sind, ist in zahlreichen
Patentschriften beschrieben. Stellvertretend werden zum Stand der
Technik die folgenden Patent- und Offenlegungsschriften genannt.
-
Organopolysiloxane, bei denen die
(meth)acrylathaltigen organischen Gruppen über eine Si-O-C-Bindung mit
dem Polysiloxangerüst
verbunden sind, sind in der
DE-C-27
47 233 und der
DE-C-29
48 708 beschrieben.
-
Organopolysiloxane, bei denen die
acrylesterhaltigen organischen Gruppen über Si-C-Bindungen mit dem
Polysiloxangerüst
verbunden sind, können
z.B. dadurch hergestellt werden, dass man an ein Wasserstoffsiloxan
Allylglycidether oder ein anderes geeignetes Epoxid mit einer olefinischen
Doppelbindung addiert und nach der Anlagerung das Epoxid mit Acrylsäure unter Öffnung des
Epoxidringes verestert. Diese Verfahrensweise ist in der
DE-C-38 20 294 beschrieben.
-
Eine weitere Möglichkeit der Herstellung (meth)acrylatmodifizierter
Polysiloxane mit Si-C-Verknüpfung der
modifizierenden Gruppe(n) besteht darin, dass man an ein Wasserstoffsiloxan
einen Alkohol mit einer olefinischen Doppelbindung, z. B. Allylalkohol,
in Gegenwart eines Platinkatalysators, addiert und dann die OH-Gruppe
dieses Alkohols mit Acrylsäure
oder einem Gemisch von Acrylsäure
und anderen gegebenenfalls gesättigten
Säuren
umsetzt. Diese Verfahrensweise ist z. B. in der
DE-C-38 10 140 beschrieben.
-
Des Weiteren ist es möglich, jeweils
mehrere (Meth)acrylatgruppen pro Verbindungsglied an das Siloxangerüst zu binden.
Um eine möglichst
gute Vernetzung, das heißt,
eine möglichst
hohe Anzahl an reaktiven Gruppen, bei gleichzeitig so geringer Modifizierungsdichte
am Siloxangerüst
wie möglich
zu erzielen, ist es wünschenswert,
mehr als eine (Meth)acrylatgruppe je Verbrückungsglied anzubinden. Solche
Verfahren sind z.B. in der
US
6 211 322 beschrieben.
-
Beispiele der genannten Organosiliciumverbindungen
sind z.B. von der Firma Goldschmidt/Deutschland unter der Produktbezeichnung
TEGO® RC,
von Shin Etsu/Japan unter der Bezeichnung X-8010 und von Rhodia/Frankreich
unter der Bezeichnung UV Poly 100 und RCA 110 verfügbar.
-
Zur Herstellung der genannten Beschichtungen
wird üblicherweise
eine Mischung aus mehreren der genannten Organosiliciumverbindungen
(und eines oder mehrerer Photoinitiatoren) auf flächige Träger aus Kunststoff,
Metallen oder Papier aufgebracht und bahnförmig von Rolle zu Rolle bei
hohen Anlagengeschwindigkeiten von mehreren hundert Metern pro Minute
durch eine UV-Anlage geführt
und gehärtet.
-
Im Gegensatz zu den genannten Organosiliziumverbindungen
sind eine Vielzahl von rein organischen Verbindungen, d.h, ohne
Si lyl- oder Siloxaneinheit, bekannt, die zur radikalischen Polymerisation
befähigte Doppelbindungen
enthalten und durch UV-Strahlung
nach Zusatz bekannter Photoinitiatoren aushärten. Diese Beschichtungsmassen
werden z.B. für
Druckfarben und zur Herstellung von Lackbindemitteln oder für die Beschichtung
von Kunststoff-, Papier-, Holz- und Metalloberflächen eingesetzt.
-
Allen genannten Organosiliciumverbindungen
und organischen Verbindungen ist gemeinsam, dass sie durch UV-Strahlung
nach Zusatz von Photoinitiatoren in einer radikalischen Polymerisation
in kürzester
Zeit aushärten.
Eine Übersicht über geeignete
Photoinitiatoren ist in "J.P.
Fouassier, Polymerization photoinitiators: Exited state process
and kinetic aspects, Progress in Organic Coating, 18 (1990) 229–252", in "J.P. Fouassier, Photochemical
reactivity of UV radical photoinitiators of polymerisation: A general
discussion, Recent Res. Devel. Photochem. & Photobiol., 4(2000):51–74", in "D. Ruhlmann et al,
Relations structure-proprietes dans les photoamorceurs de polymerisation-2. Derives de Phenyl
Acetophenone, Eur. Polym. J. Vol. 28, No. 3, pp. 287–292, 1992" und "K.K. Dietliker, Chemistry & Technology of
UV & EB Formulation
for Coatings, Inks & Paints,
Volume 3, Sita Technology Ltd, UK" gegeben. In der
DE-A-27 22 264 werden Hydroxyalkylphenone
und ihre Verwendung als Photoinitiatoren beschrieben.
-
Diese Literaturstellen benennen Photoinitiatoren,
unter anderem auch Photoinitiatoren vom Typ Hydroxyalkylphenon und
bewerten ihre Reaktivität
in den genannten organischen Verbindungen. Die Wirksamkeit von Photoinitiatoren
ist von einer Vielzahl Faktoren abhängig, die im Wesentlichen auch
von der photoreaktiven Gruppe und der Konzentration dieser Gruppe
im Photoinitiatormolekül,
also vom Verhältnis
des Molgewichtes der reaktiven Gruppe zum Gesamtmolgewicht, abhängen. Auch
das Molgewicht der radikalischen Spaltprodukte und damit des Photoinitiatormoleküls selbst,
ist für
die Wirksamkeit wichtig. Diese Zusammen hänge sind insbesondere für Photoinitiatoren
vom Typ Hydroxyalkylphenon Stand der Technik.
-
Photoinitiatoren müssen in
der Beschichtungsmasse außerdem
löslich
sein, um eine ausreichende Wirksamkeit bei der UV-Härtung zu
erreichen. Durch die sehr hydrophobe Matrix der genannten Organosiliciumverbindungen
ist im Gegensatz zu den organischen Verbindungen die Verwendung
von sehr vielen bekannten Photoinitiatoren nicht möglich, da
sie sich nicht in der Siliconmatrix verträglich lösen lassen. Besonders geeignete
Photoinitiatoren für
die genannten Organosiliciumverbindungen sind daher solche, die
flüssig
oder leicht schmelzbar sind und sich in der Siliconmatrix verträglich mischen.
-
Zur Verbesserung der Löslichkeit
mit den genannten Organosiliciumverbindungen werden z.B. in WO-A-97/49768,
US 5 776 658 ,
US 4 391 963 und
EP-B-0 088 842 mit Silylresten,
insbesondere auch polymeren Silylresten, modifizierte Photoinitiatoren,
z.B. vom Hydroxyketon-, Aminoketon-, Benzoinether-, Benzophenonoder
Thioxanton-Typ, vorgeschlagen. Auch in den Patenten
US 4 356 265 ,
US 4 534 838 und
EP-B-0 162 572 sind die unterschiedlichsten
mit Organopolysiloxanresten versehenen Photoinitiatorstrukturen
beschrieben. Diese Verbindungen sind beispielsweise vom Dialkoxyacetophenon
abgeleitet und weisen eine erhöhte
Siliconlöslichkeit
auf.
US 4 507 187 offenbart
Diketophotoinitiatoren mit Silylgruppen als in Silikonpolymeren
gut lösliche
Photoinitiatoren. Polymere Photoinitiatoren mit Siloxanresten sind
in
US 4 587 276 beschrieben.
A. Kolar et al berichten in J.M.S. Pure Appl. Chem. A31(3) (1994),
305–318 über reaktive
silylderivierte Hydroxyalkylphenon Photoinitiatoren. In der
EP-A-1 072 326 werden
siloxanmodifizierte Photoinitiatoren mit oberflächenaktiven Eigenschaften beschrieben,
die ebenfalls Derivate des Hydroxyalkylphenon sind.
-
Die genannten Literaturstellen beschäftigen sich
mit der Lösung
des Problems der Löslichkeit
von Photoinitiatoren in den genannten Organosiliciumverbindungen.
Die Löslichkeit
wird durch die Anbindung von teilweise polymeren Siloxanresten an
die photoreaktive Gruppe erreicht. Diese Lösung hat zum Nachteil, dass die
Konzentration der photoreaktiven Gruppe durch das hohe Molgewicht
des Silyl- oder Siloxanrestes in dem Maße erniedrigt wird, in dem
die Löslichkeit
mit den genannten Organosiliciumverbindungen steigt. Solche Photoinitiatoren
müssen
zum Ausgleich der verringerten Konzentration der photoreaktiven
Gruppe den genannten Organosiliciumverbindungen mit erhöhter Einsatzkonzentration
zugemischt werden. Die zur Anbindung der Silyl- oder Siloxanreste nötigen Verfahrensschritte stellen
außerdem
einen zusätzlichen
kostenerhöhenden
Verfahrensschritt dar.
-
Es bestand daher ein Bedarf für die genannten
Organosiliciumverbindungen einen einfach zugänglichen, leicht mischbaren
und verträglichen
Photoinitiator zu finden, der trotzdem mit einer hohen Konzentration an
photoreaktiven Gruppen ausgestattet ist.
-
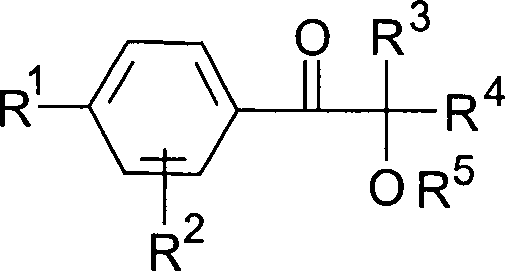
Überraschenderweise
wurde gefunden, dass Photoinitiatoren vom Typ Hydroxyalkylphenon
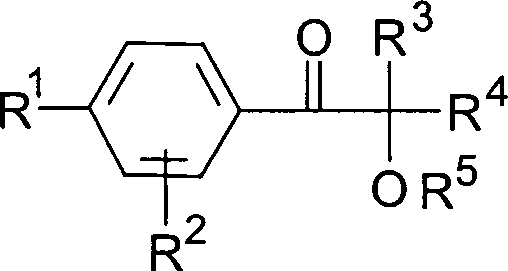
der allgemeinen Formel
worin
R
1 ein
linearer oder verzweigter Alkylrest mit 3 bis 18 C-Atomen, vorzugsweise
4 bis 12 C-Atomen,
R
2 ein Alkylrest
mit 1 bis 4 C-Atomen, vorzugsweise Wasserstoff,
R
3,
R
4 Alkylreste mit 1 bis 6 C-Atomen, die
auch zu einem 5- oder 6-gliedrigen Kohlenstoffring verknüpft sein können oder
einer dieser Reste auch Wasserstoff sein kann, und
R
5 ein Alkyl- oder Alkanoylrest, vorzugsweise
Wasserstoff ist,
in für
die genannten Organosiliciumverbindungen besonders geeignete Photoinitiatoren
darstellen.
-
Diese Photoinitiatoren sind an sich
bekannt, haben sich jedoch als Photoinitiatoren für die genannten organischen
Beschichtungsmassen nicht durchsetzen können, da durch die Reste R1 und R2 die Konzentration der
photoreaktiven Gruppe deutlich reduziert wird und somit die Reaktivität gegenüber Verbindungen
mit R1, R2 gleich
Wasserstoff reduziert ist. Dementsprechend sind nur Verbindungen
mit R1, R2, R5 gleich Wasserstoff und R3,
R4 gleich Methyl (z.B. Darocur® 1173
der Ciba Additives) oder R1, R2,
R5 gleich Wasserstoff und R3,
R4 gleich Cyclohexyl (z.B. Irgacur® 184
der Ciba Additives) für
die Verwendung in den genannten organischen Beschichtungsmassen
verbreitet. Analoge Verbindungen mit R1 gleich
linearem oder verzweigtem Alkylrest mit C3 bis
C18 sind in durch die um bis zu 80 % verringerte
Konzentration der photoreaktiven Gruppe in organischen Beschichtungsmassen
deutlich weniger reaktiv.
-
Bei der Verwendung der dieser Photoinitiatoren
in Organosiliciumverbindungen wurde jedoch überraschenderweise eine deutlich
verbesserte Reaktivität
gefunden, ohne die Nachteile der mit Siloxanketten verknüpften Photoinitiatoren
gemäß
EP-A-1 072 326 .
-
Ein Gegenstand der vorliegenden Erfindung
ist daher die Verwendung strahlenhärtbarer Beschichtungsmassen,
enthaltend mindestens ein strahlungshärtbares Organopolysiloxan mit
(Meth)acrylsäureestergruppen
und einen Photoinitiator, welche dadurch gekennzeichnet sind, dass
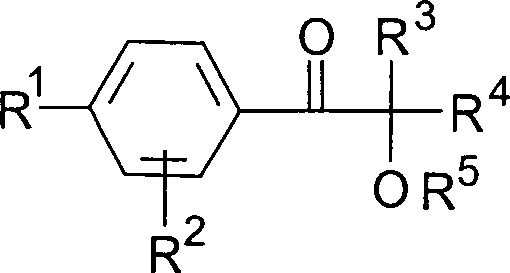
als Photoinitiator mindestens eine Verbindung der allgemeinen Formel
mitverwendet wird, worin
R
1 ein linearer oder verzweigter Alkylrest
mit 3 bis 18 C-Atomen, vorzugsweise 4 bis 12 C-Atomen,
R
2 ein Alkylrest mit 1 bis 4 C-Atomen, vorzugsweise
Wasserstoff,
R
3, R
4 Alkylreste
mit 1 bis 6 C-Atomen, die auch zu einem 5- oder 6-gliedrigen Kohlenstoffring
verknüpft
sein können
oder einer dieser Reste auch Wasserstoff sein kann, und
R
5 ein Alkyl- oder Alkanoylrest, vorzugsweise
Wasserstoff bedeuten,
zur Herstellung abhäsiver Lacke, abhäsiver Überzüge, abhäsiver Beschichtungen.
-
Weitere Gegenstände der Erfindung sind durch
die Ansprüche
gekennzeichnet.
-
Die Photoinitiatoren können allein
oder als Mischung miteinander, gegebenenfalls mit anderen nicht erfindungsgemäßen Photoinitiatoren
und/oder Photosensibilisatoren, in Anteilen von vorzugsweise 0,01
bis 10 Gew.-%, insbesondere von 0,1 bis 5 Gew.-%, bezogen auf das
Gewicht der acrylatfunktionellen Organopolysiloxane, mitverwendet
werden.
-
Vorteile bei der UV-Härtung der
genannten organomodifizierten Polysiloxane und der erfindungsgemäß mitverwendeten
Photoinitiatoren gegenüber
beispielsweise den an Siloxanketten chemisch gebundenen Hydroxyalkylphenonen
gemäß
EP-A-1 072 326 sind:
- – Sehr
geringe Zugabe der erfindungsgemäßen Photoinitiatoren
möglich;
- – Aushärtung der
Produkte auf Trägermaterial
mit deutlich erhöhter
Geschwindigkeit;
- – bessere
Durchhärtung
der erhaltenen abhäsiven
Beschichtungen und damit einen geringeren Anteil an potentiell migrierfähigen Siliconbestandteilen,
die auf den Kleber übergehen
und die Klebereigenschaften verschlechtern können;
- – Veränderungen
der Abhäsivität ausgehärteter Produkte
bei der Lagerung, erkennbar durch den Anstieg der Trennwerte, sind
nicht oder nur in vernachlässigbarem
Umfang gegeben.
-
Die erfindungsgemäßen härtbaren Mischungen können als
strahlenhärtende
Lacke, Überzüge, Beschichtungsmassen
oder als Additive in solchen Systemen verwendet werden. Sie können in üblicher
Weise mit anderen Härtungsinitiatoren,
Photosensibilisatoren, Stabilisatoren, Antioxidationsmitteln, Füllstoffen,
Pigmenten, anderen an sich bekannten Acrylatsystemen und weiteren üblichen
Zusatzstoffen compoundiert werden. Stabilisatoren und Antioxidationsmittel
sind insbesondere solche, die Sauerstoff fangen oder Peroxyde zersetzen
können
wie z.B. Phosphite, insbesondere Trialkylphosphite. Sie können dreidimensional
durch freie Radikale vernetzt werden und härten unter Einfluss energiereicher
Strahlung wie UV-Licht, innerhalb kürzester Zeit zu mechanisch
und chemisch widerstandsfähigen
Schichten aus.
-
Beispiele:
-
Nachfolgende Beispiele sollen zur
Verdeutlichung der Erfindung dienen, sie stellen jedoch keinerlei Einschränkung dar.
-
Anwendungstechnische Überprüfung:
-
Zur Überprüfung der anwendungstechnischen
Eigenschaften der härtbaren
Mischungen werden die erfindungsgemäßen Mischungen sowie die nicht
erfindungsgemäßen Vergleichsbeispiele
nach Zugabe des jeweiligen Photoinitiators auf flächige Träger (orientierte
Polypropylenfolie) aufgetragen und durch Einwirkung von UV-Licht
einer dem Stand der Technik entsprechenden Mitteldruckquecksilberdampflampe
mit einer UV-Leistung von 50 W/cm unter Stickstoffinertisierung
mit kontrolliertem Restsauerstoffgehalt von < 50 ppm bei der Bahngeschwindigkeit
vom 200 m/min gehärtet.
Die Auftragsmenge beträgt
in jedem Fall ca. 1 g/m2.
-
Trennwert:
-
Für
die Ermittlung der Trennwerte wird ein 25 mm breites Klebeband,
dass mit einem Kautschukleber beschichtet ist und als TESA® 7476
im Handel von der Firma Beiersdorf erhältlich ist verwendet.
-
Zur Messung der Abhäsivität werden
diese Klebebänder
auf den Untergrund aufgewalzt und anschließend bei 40 °C unter einem
Gewicht von 70 g/cm2 gelagert. Nach 24 Stunden
wird die Kraft gemessen, die benötigt
wird, um das jeweilige Klebeband mit einer Geschwindigkeit von 30
cm/min unter einem Schälwinkel von
180 ° vom
Untergrund abzuziehen. Diese Kraft wird als Trennkraft oder Trennwert
bezeichnet. Die allgemeine Testprozedur entspricht im wesentlichen
der Testmethode Nr. 10 der "Federation
Internationale des Fabricants et Transformateurs D'Adhésifs et
Thermocollants sur Papier et autres Supports" (FINAT).
-
Loop-Test:
-
Der Loop-Test dient zur schnellen
Ermittlung des Härtungsgrades
einer Trennbeschichtung. Hierzu wird ein etwa 20 cm langer Streifen
des Klebebandes TESA® 4154 der Firma Beiersdorf
3 mal auf den Untergrund aufgewalzt und sofort wieder von Hand abgezogen.
Dann wird durch Zusammenlegen der Enden des Klebebandes eine Schlaufe
gebildet, so dass die Klebeflächen
beider Enden auf etwa einem Zentimeter Strecke Kontakt haben. Dann
werden die Enden wieder von Hand auseinandergezogen, wobei die Kontaktfläche gleichmäßig zur
Mitte des Klebebandes wandern sollte. Im Falle einer Kontamination
mit schlecht ausgehärtetem
Trennmaterial ist die Klebkraft des Klebebandes nicht mehr ausreichend,
um die Kontaktfläche
beim Auseinanderziehen der Enden zusammenzuhalten. In diesem Falle
gilt der Test als nicht bestanden.
-
Restklebkraft:
-
Die Bestimmung der Restklebkraft
erfolgt weitestgehend gemäß der FINAT
Testvorschrift Nr. 11. Hierzu wird das Klebeband TESA® 7475
der Firma Beiersdorf auf den Untergrund gewalzt und anschließend bei 40 °C unter einem
Gewicht von 70 g/cm2 gelagert. Nach 24 Stunden
wird das Klebeband vom Trennsubstrat getrennt und auf einen definierten
Untergrund (Stahlplatte, Glasplatte, Folie) aufgewalzt. Nach einer
Minute wird die Kraft gemessen, die benötigt wird, um das Klebeband
mit einer Geschwindigkeit von 30 cm/min unter einem Schälwinkel
von 180 ° vom
Untergrund abzuziehen. Der so gemessene Wert wird durch den Wert
geteilt, den ein unbehandeltes Klebeband unter ansonsten gleichen
Testbedingungen ergibt. Das Ergebnis wird als Restklebkraft bezeichnet
und in der Regel in Prozent angegeben. Werte über 80 % gelten dem Fachmann als
ausreichend und sprechen für
eine gute Aushärtung.
-
Strahlenhärtende Organosiliziumverbindungen:
-
Als strahlenhärtende Organosiliziumverbindungen
werden Produkte der Firma Goldschmidt, die unter der Bezeichnung
TEGO
® RC
erhältlich
sind, eingesetzt. Das Produkt TEGO
® RC
902 (gemäß
US-6 211 322 ) hat in der
gehärteten
Beschichtung eine sehr gute abhäsive
Wirkung gegen klebende Substanzen. Der Gehalt an zur Polymerisation
befähigten
Doppelbindungen ist sehr gering. TEGO
® RC
902 wird zur Verbesserung der Haftung zum Untergrund mit TEGO
® RC
711 (gemäß
DE-A-38 20 294 )
abgemischt. TEGO
® RC 711 hat einen höheren Gehalt
an zur Polymerisation befähigten
Doppelbindungen und somit, wenn für sich allein beschichtet,
in der gehärteten
Beschichtung auch eine geringere Abhäsivität gegen klebende Substanzen.
Als Beispiel der genannten strahlenhärtenden Organosiliziumverbindungen
wird eine Mischung aus RC 902/RC 711 im Verhältnis 70 : 30 hergestellt und
mit Photoinitiator gemäß Beispiel
vermischt.
-
Verwendete Photoinitiatoren:
-
Die erfindungsgemäß mitverwendeten Photoinitiatoren
sowie die Vergleichsbeispiele enthalten als photoreaktive Gruppe
das Molekülteil
-
Photoinitiator Nr. 3
mit R1, R2 = H;
R3 , R4 = CH3;
R5 = H
und
kann daher als Referenz für
den Anteil der photoreaktiven Gruppe im Photoinitiator angesehen
werden. Dieser Anteil kann demnach durch das Verhältnis (Molgewicht
Photoinitiator Nr. 3 mal Anzahl an reaktiven Gruppen im Molekül) geteilt
durch (Molgewicht des betrachteten Photoinitiators) ausgedrückt werden.
-
Photoinitiatoren stellen einen hohen
Kostenfaktor dar. Hohe Zugaben an Photoinitiator kann zudem die
Trenneigenschaften negativ beeinflussen. Daher soll der Photoinitiator
bei möglichst
geringen Konzentrationen zugegeben werden. In der Praxis haben sich
Mengen von ca. 2 Gew.-% Photoinitiator Nr. 3, bezogen auf härtbares
Polymer, bewährt.
Die Beurteilung der anwendungstechnischen Eigenschaften in den Beispielen orientieren
sich also an dieser Einsatzmenge.
-
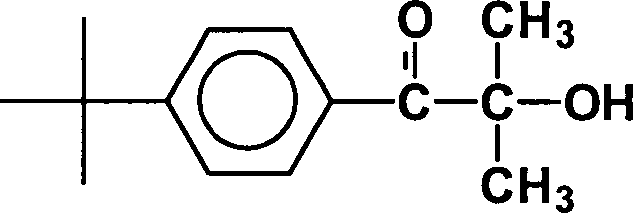
Photoinitiator Nr. 1:
-
Erfindungsgemäßer Photoinitiator
R
1 =
tert. Butyl;
R
2 = H;
R
3 , R
4 = CH
3;
R
5 = H
mit
einem Molgewicht von 220 g/Mol; Anteil photoreaktive Gruppe: 0,75.
-
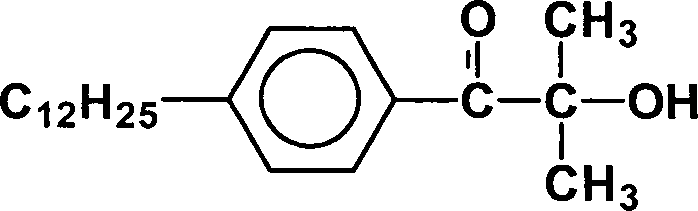
Photoinitiator Nr. 2: Erfindungsgemäßer Photoinitiator
mit
R
1 =
C
12H
25 R
2 = H;
R
3, R
= CH
3;
R
5 =
H
und einem mittlerem Molgewicht von 330 g/Mol.
-
Der Alkylrest R1 hat
herstellungsbedingt eine Homologenverteilung von C9H19 bis C15H31 mit einem Maximum bei C12H25. Die Alkylreste sind jeweils eine Mischung
aus linearem und verzweigtem Alkyl; Anteil photoreaktive Gruppe:
0,5.
-
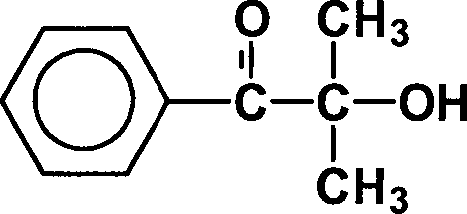
Photoinitiator Nr. 3:
-
Nicht erfindungsgemäßer Photoinitiator
mitR
1 ,
R
2 = H;
R
3,
R
4 = CH
3;
R
5 = H
als Basis-Vergleich.
-
Die Verbindung ist als Handelsprodukt
der Firma Ciba Additives unter der Bezeichnung Darocur® 1173 verfügbar. Dieser
Photoinitiator hat ein Molgewicht von 164,2 g/Mol; Anteil photoreaktive
Gruppe definitionsbedingt 1.
-
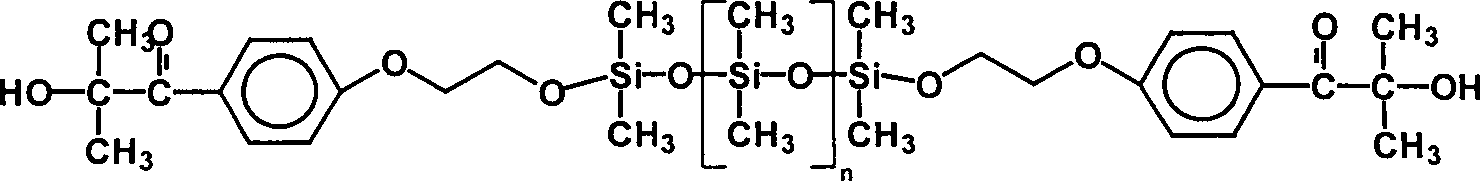
Photoinitiator Nr. 4:
-
Nicht erfindungsgemäßer Photoinitiator
gemäß
EP-A-1 072 326
mit
R
2 =
H;
R
3 , R
4 =
CH3 ;
R
5 = H
n im Mittel = 7
und
einem mittleren Molgewicht von etwa 1.100 g/Mol; Anteil photoreaktive
Gruppe: 0,3
-
Versuchsserie 1:
-
In dieser Versuchsserie wurde die
Zugabemenge der jeweiligen Photoinitiatoren so berechnet, dass die
Konzentration an photoreaktiver Gruppe in den strahlenhärtenden
Organosiliziumverbindungen in allen Beispielen gleich ist.
-
-
Anwendungstechnische Prüfung der
Versuchsserie 1:
-
Aus diesen Beispielen ist ersichtlich,
dass bei gleicher Konzentration der photoreaktiven Gruppe die erfindungsgemäßen Photoinitiatoren
gegenüber
dem Vergleich eine deutlich bessere Härtung der Siliconmasse ermöglichen.
-
Versuchsserie 2:
-
In dieser Versuchsserie wurde die
Zugabemenge der jeweiligen Photoinitiatoren auf jeweils 2 Gewichtsprozent
festgelegt. Dadurch ergeben sich unterschiedliche Konzentrationen
an photoreaktiver Gruppe in den strahlenhärtenden Organosiliziumverbindungen.
-
-
Anwendungstechnische
Prüfung
der Versuchsserie 2:
-
Aus diesen Beispielen wird überraschenderweise
deutlich, dass bei gleicher Einwaage des jeweiligen Photoinitiators
(also unterschiedlicher Konzentration der photoreaktiven Gruppe)
die erfindungsgemäßen Photoinitiatoren
gegenüber
dem Vergleich Photoinitiator Nr. 3 weiterhin eine deutlich bessere
Härtung
der Siliconmasse ermöglichen
und gegenüber
dem Vergleich Photoinitiator Nr. 5 sogar eine noch bessere Härtung ermöglichen.