-
QUERVERWEIS
-
Diese Anmeldung beansprucht die Priorität der vorläufigen US-Anmeldung Ser. Nr. 61/582, 155, eingereicht am 30. Dezember 2011, die durch Bezugnahme in ihrer Gesamtheit aufgenommen wird.
-
HINTERGRUND DER ERFINDUNG
-
Diabetes mellitus, oft einfach als Diabetes bezeichnet, ist eine Gruppe von Stoffwechselerkrankungen, in denen eine Person einen hohen Blutzuckerspiegel hat, entweder weil der Körper nicht genügend Insulin produziert, oder weil Zellen nicht auf das Insulin, das produziert wird reagieren. Diese hohe Blutzuckerwerte produzieren die klassischen Symptome der Polyurie (häufiges Wasserlassen), Polydipsie (vermehrter Durst) und Polyphagie (gesteigerter Hunger).
-
Es gibt drei Haupttypen von Diabetes. Typ-1-Diabetes resultiert aus dem körpereigenen Versagen, Insulin zu produzieren, und nötigt gegenwärtig die Person Insulin zu spritzen. Typ-1-Diabetes wird auch als Insulin-abhängiger Diabetes mellitus, kurz IDDM, und juveniler Diabetes bezeichnet. Typ-2-Diabetes resultiert aus Insulinresistenz, ein Zustand, in dem die Zellen das Insulin nicht richtig zu nutzen, manchmal mit einem absoluten Insulinmangel kombiniert. Typ 2 Diabetes ist früher als nicht-Insulin-abhängiger Diabetes mellitus und Altersdiabetes bezeichnet worden. Gestationsdiabetes ist wenn schwangere Frauen, die noch nie zuvor Diabetes hatten, einen hohen Blutzuckerspiegel während der Schwangerschaft haben. Schwangerschafts-Diabetes kann der Entwicklung von Typ-2-Diabetes vorausgehen.
-
Weitere Formen von Diabetes mellitus sind kongenitaler Diabetes, der zurückzuführen ist auf genetische Defekte der Insulinsekretion, zystische Fibrose im Zusammenhang mit Diabetes, Steroiddiabetes, der durch hohe Dosen von Glukokortikoiden hervorgerufen wird, und verschiedene Formen von monogenetischem Diabetes.
-
Das wichtigste Ziel bei der Behandlung von Diabetes ist, jede Erhöhung des Blutzuckers (Glukose) zu minimieren ohne ungewöhnlich niedrige Blutzuckerspiegel hervorzurufen.
-
ZUSAMMENFASSUNG DER ERFINDUNG
-
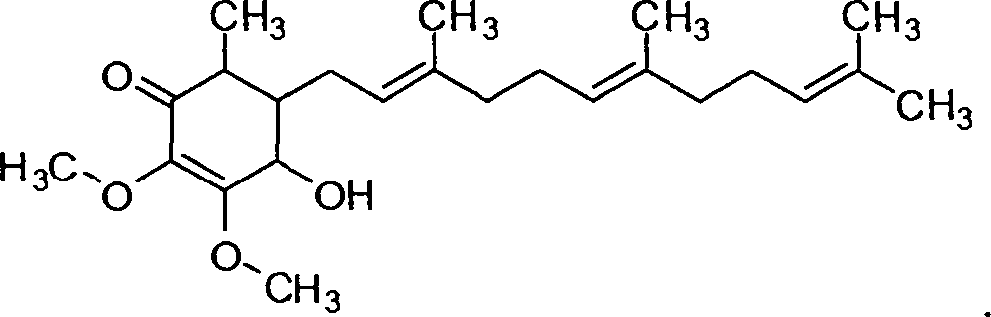
Ein hier vorgestellter Aspekt betrifft ein Verfahren zur Behandlung von Diabetes umfassend das Verabreichen an ein Lebewesen eine therapeutisch wirksamen Menge einer Cyclohexenon Verbindung mit der Struktur:
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl;
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
Ein weiterer hier vorgestellter Aspekt betrifft ein Verfahren zum Verhindern eines Anstiegs des Blutzuckerlevels in einem Lebewesen, umfassend Verabreichung an das Lebewesen, das von einer Krankheit resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose betroffen ist und Hilfe benötigt, einer therapeutisch wirksamen Menge einer Cyclohexenon Verbindung mit der Struktur
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl;
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7 , C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
Ein weiterer hier vorgestellter Aspekt betrifft ein Verfahren zum Verhindern eines Anstiegs des Blutzuckerlevels in einem Lebewesen, umfassend Verabreichung an das Lebewesen, das von einer Krankheit resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose betroffen ist und Hilfe benötigt, einer therapeutisch wirksamen Menge einer Cyclohexenon Verbindung mit der Struktur
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl;
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
Ein weiterer hier vorgestellter Aspekt betrifft ein Verfahren zum Behandlung von oder Verminderung des Risikos von einer Krankheit resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose umfassend Verabreichung an das Lebewesen, das von der Krankheit betroffen ist und Hilfe benötigt, einer therapeutisch wirksamen Menge einer Cyclohexenon Verbindung mit der Struktur
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl;
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7 , C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
Aufnahme durch Referenz
-
Alle Veröffentlichungen, Patente und Patentanmeldungen, die in dieser Beschreibung erwähnt werden, werden hiermit durch Bezugnahme in demselben Umfang aufgenommen, als ob jede einzelne Veröffentlichung oder Patentanmeldung spezifisch und individuell durch Bezugnahme aufgenommen würde.
-
DETAILLIERTE BESCHREIBUNG DER ERFINDUNG
-
Diabetes mellitus ist eine chronische Erkrankung, die außer in ganz bestimmten Situationen schwer zu heilen ist. Das Management konzentriert sich auf das so normal wie möglich halten des Blutzuckerspiegel (”Euglycämie”), ohne Hypoglykämie hervorzurufen. Dies kann in der Regel mit Diät, Bewegung und Einsatz geeigneter Medikamente (Insulin bei Typ-1-Diabetes, orale Medikamente sowie ggf. Insulin bei Typ-2-Diabetes) erreicht werden.
-
Typ-1-Diabetes wird in der Regel mit einer Kombination von regelmäßigen und NPH-Insulin oder synthetischen Insulinanaloga behandelt. Wenn Insulin bei Typ-2-Diabetes eingesetzt wird, wird in der Regel zunächst eine lang wirkende Formulierung gegeben, während die orale Medikamentation weiter geht. Die Insulindosen werden dann bis zur Wirksamkeit erhöht. Die erfindungsgemäßen Cyclohexenonverbindungen sind in einigen Ausführungsformen aus Extrakten natürlicher Produkte und rufen weniger Komplikationen und/oder Nebenwirkungen hervor. Einige Ausführungsformen, die hierin bereitgestellt werden, betreffen Verfahren zur Behandlung von Diabetes durch Verabreichung einer hier bereitgestellten Cyclohexenonverbindung an ein Lebewesen (z. B. einen Menschen). Die Cyclohexenonverbindungen haben einen therapeutischen Nutzen für ein Lebewesen, das aufgrund von Diabetes behandelt wird (siehe Beispiele 1–7).
-
In einigen Ausführungsformen werden Verfahren zur Behandlung von Diabetes bereitgestellt umfassend das Verabreichen an ein Lebewesen einer therapeutisch wirksamen Menge einer Verbindung mit der Struktur:
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7 , C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
In einigen Ausführungsformen verhindern die Verfahren eine Erhöhung des Blutzuckerspiegels bei einem Patienten. In einigen Ausführungsformen verhindert die Cyclohexenonverbindung eine Erhöhung des Blutzuckerspiegels bei einem Patienten. In einigen Ausführungsformen ist der Diabetes Typ-1-Diabetes, Typ-2-Diabetes oder Schwangerschaftsdiabetes. In einigen Ausführungsformen ist das Lebewesen ein Mensch. Siehe Beispiele 2–8.
-
In einigen Ausführungsformen wird die Cyclohexenonverbindung, mit der Struktur
synthetisch oder semi-synthetisch hergestellt ausgehend von einem geeignetem Material. In anderen Ausführungsformen wird die Cyclohexenonverbindung hergestellt durch Fermentation oder ähnliches. Beispielsweise wird die Verbindung 1 (welche auch als Antroquinonol
TM oder „Antroq” bekannt ist) oder Verbindung 3, in einigen Fällen hergestellt aus 4-hydroxy-2,3-dimethoxy-6-methylcyclohexa-2,5-dienone. Die nicht-limitierenden beispielhaften Verbindungen sind im Folgenden gezeigt:
-
In anderen Ausführungsformen wird die Cyclohexenonverbindung mit der Struktur
isoliert aus organischen Lösungsmittel-Extrakten von Antrodia camphorata. In einigen Ausführungsformen ist das organische Lösungsmittel ausgewählt aus Alkoholen (wie z. B. Methanol, Ethanol oder Propanol), Estern (wie z. B. Methylacetat, Ethylacetat), Alkanen (wie z. B. Pentan, Hexan, Heptan) und halogenierten Alkane (wie z. B. Chlormethan, Chlorethan, Chloroform, Methylenchlorid). Beispielsweise wurden die beispielhaften Verbindungen 1–7 aus organischen Lösungsmittel-Extrakten isoliert. In bestimmten Ausführungsformen ist das organische Lösungsmittel Alkohol. In bestimmten Ausführungsformen ist der Lösungsmittelalkohol Ethanol. In bestimmten Ausführungsformen wird die Cyclohexenonverbindung aus wässrigen Extrakten von Antrodia camphorata isoliert.
-
In einigen Ausführungsformen ist R Wasserstoff, C(=O)C
3H
8, C(=O)C
2H
5 oder C(=O)CH
3. In einigen Ausführungsformen ist R
1 Wasserstoff oder Methyl. In einigen Ausführungsformen ist R
2 Wasserstoff, Methyl, Ethyl, Propyl, Butyl, Pentyl oder Hexyl. In einigen Ausführungsformen ist R
3 Wasserstoff, Methyl, Ethyl, Propyl, Butyl, Pentyl oder Hexyl. In einigen Ausführungsformen ist R
4 ein Halogen, NH
2, NHCH
3. N(CH
3)
2, OCH
3, OC
2H
5, C(=O)CH
3, C(=O)C
2H
5, C(=O)OCH
3, C(=O)OC
2H
5, C(=O)NHCH
3, C(=O)NHC
2H
5, C(=O)NH
2, OC(=O)CH
3, OC(=O)C
2H
5, OC(=O)OCH
3, OC(=O)OC
2H
5, OC(=O)NHCH
3, OC(=O)NHC
2H
5 oder OC(=O)NH
2. In einigen Ausführungsformen ist R
4 C
2H
5C(CH
3)
2OH, C
2H
5C(CH
3)
2OCH
3, CH
2COOH, C
2H
5COOH, CH
2OH, C
2H
5OH, CH
2Ph, C
2H
5Ph, CH
2CH=C(CH
3)(CHO), CH
2CH=C(CH
3)(C(=O)CH
3), 5- oder 6-gliedriges Lacton, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl. In bestimmten Ausführungsformen ist R
4 CH
2CH=C(CH
3)
2. In einigen Ausführungsformen ist die Verbindung
-
In einigen Ausführungsformen werden Verfahren bereitgestellt zum Verhindern eines Anstiegs des Blutzuckerlevels in einem Lebewesen, umfassend Verabreichung an das Lebewesen, das von einer Krankheit resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose betroffen ist und Hilfe benötigt, einer therapeutisch wirksamen Menge einer Verbindung mit der Struktur
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl;
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
In einigen Ausführungsformen ist die Erkrankung resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose Diabetes oder eine diabetische Komplikation ist umfassend diabetischen Azidose, diabetisches Xanthom, diabetische Amyotrophie, diabetische Ketose, diabetisches Koma, diabetische Magenbeschwerden, diabetische Gangrän, diabetische Geschwüre, diabetische Diarrhoe, diabetische Mikroangiopathie, diabetische Gebärmutter Sklerose, diabetische Kardiomyopathie, diabetische Neuropathie, diabetische Nephropathie, diabetische Bulla, diabetische Katarakt, diabetische Dermopathie, diabetische Sklerodermie, diabetische Retinopathie, Nekrobiose lipoidica diabeticorum oder diabetische Durchblutungsstörungen. In einigen Ausführungsformen ist die Erkrankung resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose Typ 1, Typ 2 oder Schwangerschaftsdiabetes oder eine Komplikation derselben ist. In einigen Ausführungsformen ist das Lebewesen ein Mensch.
-
Gestörte Glukosetoleranz oder Glucose-Intoleranz ist ein vordiabetischer Zustand der Hyperglykämie, der mit Insulinresistenz und einem erhöhten Risiko von Herz-Kreislauf-Erkrankung assoziiert ist. IGT kann Typ-2-Diabetes mellitus viele Jahre vorausgehen. IGT ist auch ein Risikofaktor für die Mortalität.
-
Hyperglykämie oder hoher Blutzucker ist ein Zustand, in dem eine übermäßige Menge an Glukose im Blutplasma zirkuliert.
-
In einigen Ausführungsformen wird ein Verfahren bereitgestellt zur Behandlung von oder Verminderung des Risikos von einer Krankheit resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose umfassend Verabreichung an das Lebewesen, das von der Krankheit betroffen ist und Hilfe benötigt, einer therapeutisch wirksamen Menge einer Verbindung mit der Struktur
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl;
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
In einigen Ausführungsformen ist die Erkrankung resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose Diabetes oder eine diabetische Komplikation ist umfassend diabetischen Azidose, diabetisches Xanthom, diabetische Amyotrophie, diabetische Ketose, diabetisches Koma, diabetische Magenbeschwerden, diabetische Gangrän, diabetische Geschwüre, diabetische Diarrhoe, diabetische Mikroangiopathie, diabetische Gebärmutter Sklerose, diabetische Kardiomyopathie, diabetische Neuropathie, diabetische Nephropathie, diabetische Bulla, diabetische Katarakt, diabetische Dermopathie, diabetische Sklerodermie, diabetische Retinopathie, Nekrobiose lipoidica diabeticorum oder diabetische Durchblutungsstörungen. In einigen Ausführungsformen ist die Erkrankung resultierend aus Hyperglykämie oder Glukoseintoleranz oder abnormale Glucose Typ 1, Typ 2 oder Schwangerschaftsdiabetes oder eine Komplikation derselben ist. In einigen Ausführungsformen verhindert die Cyclohexenonverbindung einen Anstieg des Blutzuckerlevels in einem Lebewesen. In einigen Ausführungsformen ist das Lebewesen ein Mensch.
-
In einigen Ausführungsformen, besitzen die hier bereitgestellten Cyclohexenonverbindungen die therapeutischen Wirkungen den Blutzuckerspiegel eines Lebewesens zu senken. Siehe Beispiele 2.
-
Pharmazeutische und Medizinische Terminologie
-
Sofern nicht anders angegeben, sollen die folgenden Begriffe, die in dieser Anmeldung einschließlich der Beschreibung und der Ansprüche verwendet werden, wie folgend definiert. Es muss berücksichtigt werden, dass die Ausdrücke „ein” und „der, die, das”, wie sie in der Beschreibung und in den Ansprüchen verwendet werden, im Singular den Plural beinhalten außer der Kontext spricht klar dagegen. Sofern nicht anders angegeben, werden bekannte Methoden wie Massenspektroskopie, NMR, HPLC, der Proteinchemie, der Biochemie, rekombinante DNA Techniken und der Pharmakologie eingesetzt. In dieser Anmeldung meint die Verwendung von „oder” oder „und” „und/oder” sofern nicht anders angegeben. Zudem ist die Verwendung des Ausdrucks „beinhalten” sowie anderer Formen dieses Begriffs z. B. „beinhaltet” und „beinhaltetet” nicht einschränkend. Die verwendeten Überschriften sind nur zur besseren Orientierung keinesfalls jedoch zur Einschränkung des Erfindungsgegenstands gedacht.
-
Eine „Alkyl” Gruppe bezieht sich auf eine aliphatische Hydrokarbon Gruppe. Die Alkylgruppe kann eine gesättigter Alkylgruppe sein (das heißt, dass sie keine Kohlenstoff-Kohlenstoff Doppelbindungen oder Tripelbindungen aufweist) oder die Alkylgruppe kann eine ungesättigte Alkylgruppe sein (das heißt, dass sie wenigstens eine Kohlenstoff-Kohlenstoff Doppelbindungen oder Tripelbindungen aufweist). Die Alkylgruppe ob gesättigt oder ungesättigt kann verzweigt oder unverzweigt sein.
-
Die „Alkyl” Gruppe kann 1 bis 12 Kohlenstoffatome haben (wann immer ein nummerischer Bereich wie ”1 bis 12” hier erscheint so bezieht er sich auf jede ganze Zahl in diesem Bereich, z. B. „1 bis 12 Kohlenstoffatome” meint eine Kohlenstoffgruppe, die aus 1 Kohlenstoffatom, 2 Kohlenstoffatomen, 3 Kohlenstoffatomen usw. bis zu und einschließlich 12 Kohlenstoffatomen besteht, obwohl die gegebene Definition auch das Auftreten des Begriff „Alkyl” bei dem kein numerischer Bereich angegeben ist, umfasst). Die Alkylgruppe der beschriebenen Verbindungen kann als „C1-C8 Alkyl” oder ähnlich bezeichnet werden. Beispielsweise zeigt „C1-C8 Alkyl” an, dass es ein, zwei, drei, vier, fünf, sechs, sieben oder acht Kohlenstoffatome in der Alkylkette gibt. In einem Aspekt ist das Alkyl ausgewählt aus der Gruppe bestehend aus Methyl, Ethyl, Propyl, Iso-Propyl, n-Butyl, Iso-Butyl, Sec-Butyl und t-Butyl. Typische Alkylgruppen beinhalten sind aber nicht beschränkt auf Methyl, Ethyl, Propyl, Isopropyl, Butyl, Isobutyl, Secbutyl, tertiäres Butyl, Pentyl, Neopentyl, Hexyl, Allyl, But-2-enyl, But-3-enyl, Cyclopropylmethyl, Cyclobutylmethyl, Cyclopentylmethyl, Cyclohexylnethyl und ähnliche. In einem Aspekt ist das Alkyl ein C1-C8 Alkyl.
-
Der Begriff „Alkylen” bezeichnet ein divalentes Alkylradikal. Jede der oben genannten monovalenten Alkylgruppen kann mittels Abstraktion eines zweiten Wasserstoffatoms aus dem Alkyl ein Alkylen sein. In einem Aspekt ist das Alkylen ein C1-C12 Alkylen. In einem anderen Aspekt ist das Alkylen ein C1-C8 Alkyl. Typische Alkylengruppen beinhalten sind aber nicht beschränkt auf -CH2-, -CH(CH3)-, -C(CH3)2-, -CH2CH2-, -CH2CH(CH3)-, -CH2C(CH3)2, -CH2CH2CH2-, -CH2CH2CH2CH2 und ähnliche.
-
Der Begriff „Aryl” bezieht sich wie hierin verwendet auf einen aromatischen Ring, wobei jedes der Atome, die den Ring formen, ein Kohlenstoffatom ist. Arylgruppen sind optional substituiert. In einem Aspekt ist das Aryl ein Phenyl oder ein Naphtalenyl, in einem Aspekt ist das Aryl ein Phenyl. In einem Aspekt ist das Aryl ein C6-C10 Aryl. Abhängig von der Struktur kann die Arylgruppe ein Monoradikal oder ein Diradikal (also eine Arylengruppe) sein. In einem Aspekt ist das Arlyen ein C6-C19 Arylen. Beispielhafte Arylene beinhalten sind aber nicht beschränkt auf Phenyl-1,2-ene, Phenyl-1,3-ene und Phenyl-1,4-ene.
-
Der Begriff „aromatisch” bezeichnet einen planaren Ring mit delokalizierten π-Elektronen umfassend 4n + 2π Elektronen, wobei n eine ganze Zahl ist. Aromatische Ringe könne aus fünf, sechs, sieben, acht, neun, zehn oder mehr als zehn Atomen aufgebaut sein. Aromate sind optional substituiert. Der Begriff „aromatisch” beinhaltet beides carbozyklisches Aryl-(„Aryl”, e. g. Phenyl) und heterozyklische Aryl-(oder „Heteroaryl” oder „heteroaromatisch”)gruppen (e. g. Pyridine). Der Begriff beinhaltet monozyklische und polyzyklische fusionierte-Ringe (also Ringe, die benachbarte Kohlenstoffatome teilen).
-
Der Begriff „Halo”, oder alternativ, „Halogen” oder „Halid” meint Fluor, Chlor, Brom, oder Iod.
-
Der Begriff „Lacton” bezeichnet zyklische Ester, die als Kondensationsprodukt einer Alkoholgruppe -OH und einer Carbonsäuregruppe -COOH im gleichen Molekül angesehen werden können. Es ist charakterisiert durch einen geschlossenen Ring, der aus zwei oder mehr Kohlenstoffatomen und einem einzelnen Sauerstoffatom besteht, mit einer Ketongruppe =O in einem der Kohlenstoffatome neben dem anderen Sauerstoffatom.
-
Der Begriff „Heterozyklus” oder „heterozyklisch” bezieht sich auf heteroaromatische Ringe (auch als Heteroaryle bekannt) und heterozyklische Alkylringe (auch bekannt als heteroalizyklische Gruppen) beinhaltend ein bis vier Heteroatome in einem (der) Ring(e), wobei jedes Heteroatom in den Ring(en) ausgewählt ist aus O, S und N und wobei jede heterozyklische Gruppe zwischen 4 und 10 Atome in ihrem Ringsystem hat und mit der Maßgabe, dass der jeweilige Ring nicht zwei benachbarte O oder S Atome aufweist. Nichtaromatische heterozyklische Gruppen (auch bekannt als heterozyklische Alkyle) beinhalten Gruppen, die nur 3 Atome in ihrem Ringsystem haben, aber aromatisch heterozyklische Gruppen müssen mindestens 5 Atome in ihrem Ringsystem haben. Die heterozyklischen Gruppen beinhalten benzo-fusionierte Ringsysteme. Ein Beispiel einer heterozyklischen Gruppe mit 3 Mitgliedern ist Aziridinyl. Ein Beispiel einer heterozyklischen Gruppe mit 4 Mitgliedern ist Azetidinyl. Ein Beispiel einer heterozyklischen Gruppe mit 5 Mitgliedern ist Thiazolyl. Ein Beispiel einer heterozyklischen Gruppe mit 6 Mitgliedern ist Pyridyl und ein Beispiel einer heterozyklischen Gruppe mit 10 Mitgliedern ist Quinolinyl. Bespiele von nicht-aromatischen heterozyklischen Gruppen sind Pyrrolidinyl, Tetrahydrofuranyl, Dihydrofuranyl, Tetrahydrothienyl, Oxazolidinonyl, Tetrahydropyranyl, Dihydropyranyl, Tetrahydrothiopyranyl, Piperidinyl, Morpholinyl, Thiomorpholinyl, Thioxanyl, Piperazinyl, Aziridinyl, Azetidinyl, Oxetanyl, Thietanyl, Homopiperidinyl, Oxepanyl, Thiepanyl, Oxazepinyl, Diazepinyl, Thiazepinyl, 1,2,3,6-Tetrahydropyridinyl, Pyrrolin-2-yl, Pyrrolin-3-yl, Indolinyl, 2H-Pyranyl, 4H-Pyranyl, Dioxanyl, 1,3-Dioxolanyl, Pyrazolinyl, Dithianyl, Dithiolanyl, Dihydropyranyl, Dihydrothienyl, Dihydrofuranyl, Pyrazolidinyl, Imidazolinyl, Imidazolidinyl, 3-Azabicyclo[3.1.0]hexanyl, 3-Azabicyclo[4.1.0]heptanyl, 3H-Indolyl und Quinolizinyl. Beispiele von aromatischen heterozyklischen Gruppen sind Pyridinyl, Imidazolyl, Pyrimidinyl, Pyrazolyl, Thazolyl, Pyrazinyl, Tetrazolyl, Furyl, Thienyl, Isoxazolyl, Thiazolyl, Oxazolyl, Isothiazolyl, Pyrrolyl, Quinolinyl, Isoquinolinyl, Indolyl, Benzimidazolyl, Benzofuranyl, Cinolinyl, Indazolyl, Indolizinyl, Phthalazinyl, Pyridazinyl, Triazinyl, Isoindolyl, Pteridinyl, Purinyl, Oxadiazolyl, Thiadiazolyl, Furazanyl, Benzofurazanyl, Benzothiophenyl, Benzothiazolyl, Benzoxazolyl, Quinazolinyl, Quinoxalinyl, Naphthyridinyl, und Furopyridinyl. Diese Gruppen können C-verbunden oder N-verbunden sein, wenn dies möglich ist. Beispielsweise kann eine Gruppe die von Pyrrol stammt Pyrrol-1-yl (N-verbunden) oder Pyrrol-2-yl (C-verbunden) sein. Zudem kann eine Gruppe die von Imidazol stammt Imidazol-1-yl oder Imidazol-3-yl (beide N verbunden) oder Imidazol-2-yl, Imidazol-4-yl oder Imidazol-5-yl (alle C-verbunden) sein. Die heterozyklischen Gruppen können benzo-fusionierte Ringsysteme beinhalten. Nicht-aromatische Heterozyklen können mit einem oder zwei Oxogruppen (=O), wie Pyrrolidin-2-on, substituiert sein.
-
Der Begriff „Alkenyl” wie hierin verwendet meint einen geraden, verzweigten oder zyklischen (in diesem Fall könnte es auch als „Cykloalkenyl” bezeichnet werden) Kohlenwasserstoff umfassend 2-10 Kohlenstoffatome und umfassend mindestens eine Kohlenstoff-Kohlenstoff Doppelbindung entstanden durch die Entfernung von zwei Wasserstoffatomen. In einigen Ausführungsformen sind die Alkenylgruppen optional substituiert. Beispielhafte Beispiele von Alkenyl beinhalten sind aber nicht beschränkt auf Ethenyl, 2-Propenyl, 2-Methyl-2-Propenyl, 3-Butenyl, 4-Pentenyl, 5-Hexenyl, 2-Heptenyl, 2-Methyl-1-Heptenyl und 3-Cecenyl.
-
Der Begriff „Alkinyl” wie hierin verwendet meint einen geraden, verzweigten oder zyklischen (in diesem Fall könnte es auch als „Cykloalkenyl” bezeichnet werden) Kohlenwasserstoff umfassend 2-10 Kohlenstoffatome und umfassend mindestens eine Kohlenstoff-Kohlenstoff Dreifachbindung entstanden durch die Entfernung von vier Wasserstoffatomen. In einigen Ausführungsformen ist die Alkinylgruppe abhängig von der Struktur ein Monoradikal oder ein Diradikal (also eine Alkinylengruppe). In einigen Ausführungsformen sind die Alkinylgruppen optional substituiert. Beispielhafte Beispiele von Alkinyl beinhalten sind aber nicht beschränkt auf Ethinyl, Propinyl, Butiryl, Pentinyl, Hexinyl, Heptinyl und ähnliche.
-
Der Begriff „Alkoxy” wie hierin verwendet meint eine Alkylgruppe, wie hierin definiert, angehängt an die molekulare Hauptgruppe durch ein Sauerstoffatom. Beispielhafte Beispiele einer Alkoxygruppe beinhalten sind aber nicht beschränkt auf Methoxy, Ethoxy, Propoxy, 2-Propoxy, Butoxy, Tert-Butoxy, Pentyloxy und Hexyloxy.
-
Der Begriff „Cykloalkyl” wie hierin verwendet meint ein monozyklisches oder polyzyklisches Radikal, das nur Kohlenstoff und Wasserstoff enthält und beinhaltet solche, die gesättigt, teilweise gesättigt und komplett ungesättigt sind. Cykloalkylgruppen beinhalten Gruppen, die 3 bis 10 Ringatome haben. Repräsentative Beispiele von Cyklogruppen beinhalten sind aber nicht beschränkt auf folgende Gruppen:
-
In einigen Ausführungsformen, abhängig von der Struktur, ist eine Cykloalkylgruppe monoradikal oder diradikal (beispielsweise eine Cycloalkylengruppe).
-
Die Begriffe „Haloalkyl”, „Haloalkenyl”, „Haloalkinyl” und „Haloalkoxy” wie hierin verwendet beinhalten Alkyl-, Alkenyl-, Alkinyl- und Alkoxystrukturen, in denen mindestens ein Wasserstoffatom durch ein Halogenatom ersetzt wurde. In bestimmten Ausführungsformen, in denen zwei oder mehr Wasserstoffatome mit Halogenatomen ersetzt wurden, sind die Halogenatome gleich. In anderen Ausführungsformen, in denen zwei oder mehr Wasserstoffatome mit Halogenatomen ersetzt wurden, sind die Halogenatome nicht alle gleich. Die Begriffe „Fluoralkyl” und Fluoralkoxy” beinhaltet Haloalkyl- bzw. Haloalkoxygruppen, in denen Fluor das Halogen ist. In bestimmten Ausführungsformen sind die Haloalkyle optional substituiert.
-
Der Begriff „Glucosyl” wie hier verwendet beinhaltet D- oder L-förmige Glucosylgruppen, in denen die Glucosylgruppe durch eine Hydroxylgruppe oder den Glucosering gebunden ist.
-
Der Begriff „akzeptabel” bezogen auf eine Formulierung, Zusammensetzung oder Inhaltsstoff wie hier verwendet meint, dass es keinen anhaltendenden negativen Effekt auf die generelle Gesundheit des Behandelten gibt.
-
Antrodia ist ein Pilzgenus der Familie Meripilaceae. Antrodia Spezies haben Fruchtkörper, die typischerweise flach oder ausgebreitet auf der Wachstumsebene liegen, mit dem Hymenium nach außen exponiert. Die Ecken können so gedreht sein, dass sie schmale Taschen bilden. Die meisten Spezies sind in den temperierten und borealen Wäldern anzutreffen und rufen Holzfäule hervor. Einige der Spezies in diesem Genus haben medizinische Eigenschaften und sind in Taiwan als traditionelle Medizin verwendet worden.
-
Der Begriff „Träger” wie hierin verwendet bezeichnet relativ ungiftige chemische Verbindungen oder Agenzien, die die Aufnahme einer Verbindung in Zellen oder Gewebe vereinfachen.
-
Der Begriff „Co-Administration” oder ähnliches wie hier verwendet bezieht sich auf die Verabreichung der ausgewählten therapeutischen Mittel an einen ausgewählten Patienten und sind beabsichtigt die Behandlungsverfahren, in denen die Mittel durch die gleiche oder eine andere Route oder zur selben oder zu einer anderen Zeit verabreicht werden, zu beinhalten.
-
Der Begriff „Verdünnungsmittel” bezieht sich auf chemische Verbindungen, die verwendet wurden um die Verbindungen, um die es geht, vor der Verabreichung zu verdünnen. Verdünnungsmittel können auch verwendet werden um die Verbindungen zu stabilisieren, da sie eine stabilere Umgebung bereitstellen können. Salze gelöst in Pufferlösungen (die auch eine pH Kontrolle oder Aufrechterhaltung bewirken können) werden im Stand der Technik als Verdünnungsmittel verwendet, inklusive, aber nicht limitiert auf phosphatgepufferte Kochsalzlösung.
-
Der Begriff „effektive Menge” oder „therapeutisch effektive Menge” wie hier verwendet bezieht sich auf eine Menge eines zu verabreichenden Wirkstoffs oder einer Verbindung, die ausreicht um in einem gewissen Umfang ein oder mehrere Symptome der Krankheit oder des Zustands, die behandelt werden, zu lindern. Das Ergebnis kann eine Minderung und/oder eine Abschwächung der Anzeichen, Symptome oder Gründe der Krankheit sein oder jede andere gewollte Änderung eine biologischen Systems. Beispielsweise ist eine „effektive Menge” für therapeutische Anwendungen die Menge der Zusammensetzung umfassend eine Verbindung wie hier offenbart, die nötig ist um einen klinisch signifikanten Rückgang der Krankheitssymptome zu erreichen. Eine für ein Individuum geeignete „effektive” Menge kann durch Techniken wie einer Studie mit ansteigender Dosis bestimmt werden.
-
Der Begriff „steigern” wie hier verwendet bezieht sich auf das Erhöhen oder Verlängern eines gewünschtes Effekt entweder in Potenz oder in Dauer. Daher bezieht sich der Begriff „steigern” in Hinblick auf das Steigern des Effekts von therapeutischen Wirkstoffen auf die Fähigkeit des Erhöhens oder Verlängerns entweder eines gewünschtes Effekts in Potenz oder in Dauer eines anderen therapeutischen Wirkstoffs auf ein System. Eine „Menge, die steigerungs-effektiv” ist bezieht sich auf eine Menge die ausreicht, um den Effekt eines andere therapeutischen Wirkstoffs in einem gewünschten System zu steigern.
-
Ein „Metabolit” einer Verbindung wie hier offenbart ist ein Derivat dieser Verbindung, das entsteht, wenn die Verbindung umgewandelt wird. Der Begriff ”aktiver Metabolit” bezieht sich auf ein biologisch aktives Derivat einer Verbindung, das entsteht wenn die Verbindung umgewandelt wird. Der Begriff „umgewandelt” wie hier verwendet, bezieht sich auf die Summe der Vorgänge (beinhaltet, ist aber nicht limitiert auf Hydrolyse Reaktionen und Reaktionen, die von Enzymen katalysiert werden) durch die eine bestimmte Substanz durch einen Organismus verändert wird. Daher können Enzyme spezifische strukturelle Änderungen einer Verbindung produzieren. Beispielsweise katalysiert Cytochrom P450 eine Vielfalt von Oxidations- und Reduktionsreaktionen während Uridin Diphosphat Glucuronyltransferase den Transfer eines aktivierten Glukonsäuremoleküls auf aromatische Alkohole, aliphatische Alkohole, Carbonsäuren, Amine und freie Sulphydryl-Gruppen katalysiert. Metabolite der Verbindungen, die hier offenbart werden, sind optional identifizierbar durch Verabreichung der Verbindung an einen Wirt und Analyse von Gewebeproben des Wirts oder durch Inkubation von Verbindungen mit Leberzellen in vitro und Analyse der resultierenden Verbindungen.
-
Der Begriff „pharmazeutische Kombination” wie hier verwendet bezieht sich auf ein Produkt, das aus mischen oder kombinieren von mehr als einem aktiven Inhaltsstoff resultiert und beinhaltet beides feststehende und nicht feststehende Kombinationen von aktiven Inhaltsstoffen. Der Begriff ”feststehende Kombination” bezieht sich darauf, dass die aktiven Inhaltsstoffe beispielsweise eine Verbindung (d. h. eine Cyclohexenonverbindung wie hier offenbart) und einen Co-Wirkstoff beide einem Patienten in Form einer einzelnen Einheit oder Dosis gleichzeitig verabreicht werden. Der Begriff ”nicht-feststehende Kombination” bezieht sich darauf, dass die aktiven Inhaltsstoffe beispielsweise eine Verbindung (also eine Cyclohexenon Verbindung wie hier offenbart) und einen Co-Wirkstoff beide einem Patienten in Form von verschiedenen Einheiten verabreicht werden entweder gleichzeitig, zeitgleich oder sequenziell mit keinen spezifischen Zeiträumen, die dazwischen liegen müssen, wobei eine solche Verabreichung ein effektives Level der beiden Verbindungen im Körper des Patienten bereitstellt. Dies trifft auch auf eine Cocktailtherapie, also die Verabreichung von drei oder mehr aktiven Inhaltsstoffen zu.
-
Der Begriff „pharmazeutische Zusammensetzung” bezeichnet eine Mischung einer Verbindung (d. h. einer Cyclohexenon Verbindung wie hier offenbart) mit anderen chemischen Komponenten, wie Trägern, Stabilisiern, Verdünnern, Dispergierhilfen, Suspendierhilfen, Verdickern und/oder Exzipienten. Die pharmazeutische Zusammensetzung erleichtert die Verabreichung der Verbindung an einen Organismus. Viele Techniken der Verabreichung einer Verbindung existieren im Stand der Technik, sie beinhaltenden sind aber nicht beschränkt auf: intravenös, oral, als Aerosol, parenteral, ophthalmisch, pulmonal und topisch.
-
Der Begriff „Lebewesen” oder „Patient” schließt Säugetiere ein. Beispiele von Säugetieren beinhalten, sind aber nicht limitiert auf alle Mitglieder der Säugetierklasse: Menschen, nicht menschlichen Primaten wie Schimpansen und andere Menschenaffen und Affen Spezies, landwirtschaftliche Nutztiere wie Rindvieh, Pferde, Schafe, Ziegen, Schweine, Haustiere wie Hasen, Hunde und Katzen, Labortiere wie Nagetiere wie Ratten, Mäuse und Meerscheinchen. In einer Ausführungsform ist das Säugetier ein Mensch.
-
Die Begriffe „behandeln” und „Behandlung” wie hier verwendet beinhalten das Lindern, Abklingen oder Verbessern wenigstens der Symptome einer Krankheiten oder eines Zustands, das Vorbeugen (auch das Reduzieren des Risikos) weiterer Symptome, stoppen der Krankheit oder des Zustandes, beispielsweise durch anhalten der Entwicklung der Krankheit oder des Zustandes, erleichtern der Krankheit oder des Zustandes, bewirken des Zurückgehens der Krankheit oder des Zustandes, erleichtern eines Zustands, der durch eine Krankheit oder einen Zustand hervorgerufen wird oder stoppen der Symptome einer Krankheit oder des Zustandes entweder prophylaktisch oder therapeutisch.
-
Routen der Verabreichung
-
Geeignete Routen der Verabreichung beinhalten, sind aber nicht limitiert auf oral, intravenös, rektal, als Aerosol, parenteral, ophthalmisch, pulmonal, transmukosal, transdermal, vaginal, durch die Ohren, durch die Nase und topisch. Überdies beinhaltet die parenterale Zuführung beispielswese intramuskuläre, subkutane, intravenöse, intramedullare Injektionen und intrathekale, direkt intraventrikulare, intraperitoneale, intralympathische und intranasale Injektionen.
-
In bestimmten Ausführungsformen wird eine Verbindung, wie sie hierin beschrieben wird, als Depot Formulierung oder als Formulierungen, die eine anhaltende Freisetzung ermöglicht, lokal und nicht systemisch verabreicht, beispielsweise durch Injektion der Verbindung direkt in ein Organ. In bestimmten Ausführungsformen werden Formulierungen, deren Wirkung lange anhält durch Implantation verabreicht (beispielsweise subkutan oder intramuskulär) oder durch intramuskuläre Injektion. Außerdem wird das Medikament in anderen Ausführungsformen in einem System für den gezielten Wirkstofftransport verabreicht, beispielsweise in einem Liposom, welches mit einem organspezifischen Antikörper beschichtet ist. In einer solchen Ausführungsform werden die Liposomen auf das Organ ausgerichtet und nur von diesem aufgenommen. In noch anderen Ausführungsformen wird die Verbindung, wie sie hier beschrieben wird, als Formulierung mit rascher Freisetzung bereitgestellt. In noch anderen Ausführungsformen wird die Verbindung, die hier beschrieben wird topisch verabreicht.
-
In einigen Ausführungsformen wird die Cyclohexenonverbindung oder ein pharmazeutisch akzeptables Salz, ein Metabolit, Solvat oder Prodrug derselben durch Injektion verabreicht. In einigen Ausführungsformen wird die Cyclohexenon Verbindung oder ein pharmazeutisch akzeptables Salz, ein Metabolit, Solvat oder Prodrug derselben oral verabreicht.
-
In einigen Ausführungsformen werden pharmazeutische Zusammensetzungen bereitgestellt umfassend einen therapeutisch wirksame Menge eines Verbindung mit der Struktur:
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8alkyl,
R
1, R
2 und R
3 jeweils Wasserstoff, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5-oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
m = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung
und ein pharmazeutisch akzeptabler Exzipient.
-
In einigen Ausführungsformen haben die Cyclohexenonverbindungen der pharmazeutische Zusammensetzungen die Struktur:
worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8alkyl,
R
1, R
2 und R
3 jeweils Wasserstoff, Methyl oder (CH
2)
m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7, C(=O)OR
5, C(O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
m = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung.
-
In einigen Ausführungsformen ist R Wasserstoff, C(=O)C3H8, C(=O)C2H5 oder C(=O)CH3. In einigen Ausführungsformen ist R1 Wasserstoff oder Methyl. In einigen Ausführungsformen ist R2 Wasserstoff, Methyl, Ethyl, Propyl, Butyl, Pentyl oder Hexyl. In einigen Ausführungsformen ist R3 Wasserstoff, Methyl, Ethyl, Propyl, Butyl, Pentyl oder Hexyl. In einigen Ausführungsformen ist R4 ein Halogen, NH2, NHCH3. N(CH3)2, OCH3, OC2H5, C(=O)CH3, C(=O)C2H5, C(=O)OCH3, C(=O)OC2H5, C(=O)NHCH3, C(=O)NHC2H5, C(=O)NH2, OC(=O)CH3, OC(=O)C2H5, OC(=O)OCH3, OC(=O)OC2H5, OC(=O)NHCH3, OC(=O)NHC2H5 oder OC(=O)NH2. In einigen Ausführungsformen ist R4 C2H5C(CH3)2OH, C2H5C(CH3)2OCH3, CH2COOH, C2H5COOH, CH2OH, C2H5OH, CH2Ph, C2H5Ph, CH2CH=C(CH3)(CHO), CH2CH=C(CH3)(C(=O)CH3), 5- oder 6-gliedriges Lacton, C2-C8 Alkenyl, C2-C8 Alkinyl, Aryl und Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C2-C8 Alkenyl, C2-C8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR5R6, OR5, OC(=O)R7, C(=O)OR5, C(=O)R5, C(=O)NR5R6, C1-C8 Alkyl, C2-C8 Alkenyl, C2-C8 Alkinyl, C3-C8 Cycloalkyl und C1-C8 Haloalkyl.
-
In einigen Ausführungsformen ist die Verbindung ausgewählt aus der Gruppen bestehend aus
-
In bestimmten Ausführungsformen ist die Verbindung ausgewählt aus der Gruppen bestehend aus
-
In einigen Ausführungsformen, ist die hier beschriebene Verbindung in eine pharmazeutische Zusammensetzung formuliert. In bestimmten Ausführungsformen, werden pharmazeutische Zusammensetzungen in einer konventionellen Weise formuliert unter Verwendung von ein oder mehreren physiologisch akzeptablen Trägern enthaltend Exzipienten und Hilfsstoffe, die die Verarbeitung der aktiven Verbindung zu Formulierungen, die pharmazeutisch genutzt werden können, vereinfachen. Die richtige Formulierung ist abhängig von der gewählten Verabreichungsroute. Jede pharmazeutisch akzeptable Technik, jeder Träger und Exzipient, die in diesen Referenzen beschrieben werden sind geeignet um die pharmazeutische Zusammensetzung zu formulieren Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa. 1975; Liberman, H. A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N. Y., 1980; and Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins 1999).
-
Hier werden pharmazeutische Zusammensetzungen bereitgestellt umfassend eine Verbindung (d. h. eine Cyclohexenonverbindung wie hier beschrieben) und einen pharmazeutisch akzeptables Lösungsmittel(n) Exzipient(en) oder Träger. In bestimmten Ausführungsformen werden die Verbindungen, die hier beschrieben werden als pharmazeutische Zusammensetzung, in denen eine Verbindung (d. h. eine Cyclohexenonverbindung wie hier beschrieben) mit anderen aktiven Inhaltsstoffen vermischt ist, als Kombinationstherapie verabreicht. Alle Kombinationen von aktiven wie sie in den Kombinationstherapien weiter unten und durchgehend in der Beschreibung erwähnt werden sind eingeschlossen. In spezifischen Ausführungsformen beinhaltet die pharmazeutische Zusammensetzung ein oder mehrere Verbindungen (d. h. eine Cyclohexenonverbindung wie hier beschrieben).
-
Eine pharmazeutische Zusammensetzung bezieht sich auf eine Mischung einer Verbindung (d. h eine Cyclohexenonverbindung wie hier beschrieben) mit anderen chemischen Komponenten wie Trägern, Stabilizierern, Verdünnern, Dispergierhilfen, Suspensionshilfen, Verdickern und/oder Exzipienten. In bestimmten Ausführungsformen erleichtert die pharmazeutische Zusammensetzung die Verabreichung der Verbindung an einen Organismus. In einigen Ausführungsformen, in denen die Behandlungsverfahren oder Verwendungsverfahren wie hier beschrieben angewandt werden, werden therapeutisch effektive Mengen von Verbindungen (d. h. einer Cyclohexenonverbindung wie hier beschrieben) in pharmazeutischen Zusammensetzung an ein Säugetier, das eine Krankheit oder einen Zustand hat, der behandelt werden soll, verabreicht. In bestimmten Ausführungsformen ist das Säugetier ein Mensch. In bestimmten Ausführungsformen variieren die therapeutisch effektiven Mengen abhängig von der Schwere der Krankheit, dem Alter, dein relativen Gesundheitszustand, der Potenz der verwendeten Verbindung und anderen Faktoren. Die beschriebenen Verbindungen werden einzeln oder in Kombination mit einem oder mehreren therapeutischen Wirkstoffen als Komponenten in Mischungen verwendet.
-
In einer Ausführungsform, wird eine Verbindung (d. h. eine Cyclohexenonverbindung wie hier beschrieben) in einer wässrigen Lösung formuliert. In bestimmten Ausführungsformen ist die wässrige Lösung beispielsweise ausgewählt aus einem physiologisch kompatiblem Puffer wie Hanklösung, Ringerlösung oder physiologischer salziger Puffer. In anderen Ausführungsformen, wird eine Verbindung (d. h. eine Cyclohexenonverbindung wie hier beschrieben) formuliert für die transmukosale Verabreichung. In bestimmten Ausführungsformen beinhaltet die transmukosale Verabreichung Eindringungsmittel, die der Basiere, welche es zu überwinden gilt, angemessen sind. In noch weiteren Ausführungsformen, in denen die Verbindungen wie sie hier beschreiben werden formuliert sind für andere parenterale Injektionen, beinhalten die angemessenen Formulierungen wässrige oder nicht-wässrige Lösungen. In bestimmten Ausführungsformen beinhalten solche Lösungen physiologisch kompatible Puffer und/oder Exzipienten.
-
In einer weiteren Ausführungsform, werden Verbindungen, wie sie hier beschrieben sind, für eine orale Verabreichung formuliert. Verbindungen, wie sie hier beschrieben werden, beinhalten eine Verbindung (d. h. eine Cyclohexenonverbindungen wie hier beschrieben) und werden formuliert indem die aktiven Verbindungen kombiniert werden beispielsweise mit pharmazeutisch akzeptablen Trägern oder Exzipienten. In verschiedenen Ausführungsformen, die hier beschreiben werden, sind die Verbindungen formuliert in oraler Dosierform, die beispielsweise Tabletten, Puder, Pillen, Dragees, Kapseln, Flüssigkeiten, Gele, Sirup, Elixiere, Breie, Suspensionen und ähnliches beinhalten.
-
In bestimmten Ausführungsformen, werden pharmazeutische Zubereitungen für die orale Anwendung gewonnen durch mischen von einem oder mehreren festen Exzipienten mit einer oder mehrerer der Verbindungen, wie sie hier beschrieben werden, optionales zermahlen der resultierenden Mischung und weiterverarbeiten – falls gewünscht – der Mischung von Granulat nachdem geeignete Hilfsstoffe zugefügt wurden zu Tabletten oder Dragee Kernen. Geeinigte Exzipienten sind insbesondere Füller wie Zucker inklusive Laktose, Sucrose, Manitol oder Sorbitol, Zellulosezubereitungen wie beispielsweise Maisstärke, Weizenstärke, Reisstärke, Kartoffelstärke, Gelatine, Gummi, Tragacanth, Methylzellulose, mikrokristalline Zellulose, Hydroxypropylmethylcellulose, Natriumcarboxylmethylcellulose und andere wie Polyvinylpyrrolidone (PVP oder Povidone) oder Calcium Phosphat. In bestimmten Ausführungsformen werden optional Disintegrieragentien hinzugefügt. Disintegrieragentien beinhalten beispielsweise querverbundenes Croscarmellose Natrium, Polyvinylpyrrolindone, Agar oder Alginsäure oder deren Salze wie Natriumalginat.
-
In einer Ausführungsform werden Dosierformate wie Dragee Kerne und Tabletten mit einem oder mehreren geeigneten Überzügen bereitgestellt. In bestimmten Ausführungsformen werden konzentrierte Zuckerlösungen zum Überziehen der Dosierformate verwendet. Die Zuckerlösungen enthalten optional weiterte Komponenten beispielsweise Gummi Arabicum, Talk, Polyvinylpyrrolidone, Carbopolgel, Polyethylene Glykol und/oder Titandioxid, Lacklösungen und geeignete organische Lösungsmittel oder Lösungsmittelmischungen. Farbstoffe und/oder Pigmente werden optional zum Überzug hinzugefügt für Identifikationszwecke. Zudem werden die Farbstoffe und Pigmente optional dazu verwendet um verschiedene Kombinationen von Dosen der aktiven Verbindungen zu kennzeichnen.
-
In bestimmten Ausführungsformen werden therapeutisch effektive Mengen von mindestens einer der Verbindungen, die hier beschrieben sind, in andere orale Dosierformen formuliert. Orale Dosierformen beinhalten Einpresskapseln aus Gelatine sowie flachdichtende Kapseln aus Gelatine und einem Plastizierer wie Glycerol oder Sorbitol. In bestimmten Ausführungsformen beinhalten Einpresskapseln die aktiven Inhaltsstoffe in einer Mischung mit einem oder mehreren Füllern. Füller sind beispielsweise Lactosebinder wie Stärke und/oder Schmiermittel wie Talk oder Magnesiumstearat und optional Stabilisierer. In anderen Ausführungsformen enthalten weiche Kapseln einen oder mehrere aktive Verbindungen, die in einer geeigneten Flüssigkeit gelöst oder suspendiert sind. Geeignete Flüssigkeiten sind beispielsweise ein oder mehrere fettige Öle, flüssiges Paraffin oder flüssiges Polyethylene Glycol. Zudem werden Stabilisierer optional hinzugefügt.
-
In anderen Ausführungsformen, werden therapeutisch effektive Mengen wenigstens einer der Verbindungen, die hier beschreiben werden, formuliert für eine bukkale oder sublinguale Verabreichung wie beispielsweise Tablette, Lutschtabletten oder Gele. In noch anderen Ausführungsformen werden die Verbindungen wie hier beschrieben formuliert für eine parentale Injektion beinhalten Formulierungen geeignet für Bolus Injektionen oder kontinuierliche Infusionen. In bestimmten Ausführungsformen werden Formulierungen für Injektionen präsentiert in Einheits-Dosierformaten (z. B. in Ampullen) oder in multi-Dosier Container. Konservierungsmittel werden optional zu den Injektionsformulierungen hinzugefügt. In noch anderen Ausführungsformen werden die pharmazeutischen Zubereitungen einer Verbindung (d. h. einer Cyclohexenonverbindung wie hier beschrieben) formuliert in Form geeignete für parenterale Injektion in einer steilen Suspension, Lösung oder Emulsion in öligen oder sterilen Vehikeln. Parenterale Injektionsformulierungen enthalten optional Formulierungsagenzien wie Suspensions-, Stabilisierungs- und/oder Dispersionsagenzien. In bestimmten Ausführungsformen beinhalten pharmazeutische Formulierungen für parenterale Verabreichung wässrige Lösungen die aktiven Verbindung in wasserlöslicher Form. In zusätzlichen Ausführungsformen werden Suspensionen der aktiven Verbindungen zubereitet als geeignete ölige Injektionssuspensionen. Geeignete lipophile Lösungsmittel oder Vehikel zur Verwendung in den pharmazeutischen Zubereitungen, die hier beschrieben sind, beinhalten beispielsweise fettige Öle wie Sesamöl oder synthetische Fettsäureester wie Ethyloleat oder Triglyceride oder Liposomen. In bestimmten Ausführungsformen beinhalten die wässrigen Injektionensuspensionen Substanzen, die die Viskosität der Suspension erhöhen wie Natriumcarboxylmethycellulose, Sorbitol oder Dextran. Optional, beinhalten die Suspensionen geeignete Stabilisierer oder Agenzien, die die Löslichkeit der Verbindungen erhöhen um die Zubereitung von hochkonzentrierten Lösungen zu ermöglichen. Alternativ ist in anderen Ausführungsformen der aktive Inhaltsstoff in Puderform zur Konstitution mit einem geeigneten Vehikel z. B. sterilem pyrogen-freiem Wasser vor der Verwendung.
-
In einem Aspekt werden die Verbindungen (d. h. die Cyclohexenonverbindungen wie hier beschrieben) als Lösungen für parenterale Injektionen wie hier beschrieben oder im Stand der Technik bekannt zubereitet und verabreicht wie beschrieben in
US 4,031,893 ,
5,358,489 ;
5,540,664 ;
5,665,071 ,
5,695,472 und
WO/2005/087297 (die alle durch Verweis hierin einbezogen werden). Generell enthalten alle automatischen Injektoren ein Lösungsvolumen, das eine Verbindung (d. h. die Cyclohexenonverbindungen wie hier beschrieben), die injiziert werden soll, beinhaltet. Generell beinhalten automatische Injektoren ein Reservoir zur Aufbewahrung der Lösung, welches sich in fluider Kommunikation mit einer Nadel zur Verabreichung des Arzneimittels befindet sowie einen Mechanismus zum automatischen aufstellen der Nadel, zum einführen der Nadel in einen Pateinten und zur Verabreichung der Dosis in den Patienten. Beispielshafte Injektoren stellen ca. 0,3 ml, 0,6 ml, 1,0 ml oder andere geeignete Lösungsvolumen mit einer Konzentration von 0,5 mg bis 50 mg einer Verbindung (d. h. die Cyclohexenonverbindungen wie hier beschrieben) pro 1 ml der Lösung zur Verfügung. Jeder Injektor ist nur fähig eine Dosis der Verbindung zu verabreichen.
-
In noch anderen Ausführungsformen werden die Verbindungen (also die Cyclohexenonverbindungen wie hier beschrieben) topisch verabreicht. Die Verbindungen, die hier beschrieben sind, werden als verschiedene topisch verabreichbare Zusammensetzungen formuliert wie Lösungen, Suspensionen, Lotionen, Gels, Pasten, medizinische Stäbe, Balsam, Cremes oder Salben. Solche pharmazeutischen Zusammensetzungen enthalten optional Lösungsmittel, Stabilisierer, Spannkraft erhöhende Mittel, Puffer und Konservierungsmittel.
-
In noch anderen Ausführungsformen werden die Verbindungen (d. h. die Cyclohexenonverbindungen wie hier beschrieben) für eine transdermale Verabreichung formuliert. In spezifischen Ausführungsformen verwenden transdermale Formulierungen transdermale Verabreichungsvorrichtungen und transdermale Verabreichungspflaster und können lipophile Emulsionen oder gepufferte, wässrige Lösungen sein, gelöst in und/oder dispergierte in einem Polymer oder Klebstoff. In verschiedenen Ausführungsformen werden solche Pflaster konstruiert für eine kontinuierliche, pulsatile oder Verabreichung bei Bedarf des pharmazeutischen Wirkstoffs. In zusätzlichen Ausführungsformen wird die transdermale Verabreichung einer Verbindungen (d. h. einer Cyclohexenonverbindung wie hier beschrieben) verwirklicht durch Verwendung iontophoretischer Pflaster und ähnliches. In bestimmten Ausführungsformen stellen transdermale Pflaster eine kontrollierte Abgabe einer Verbindungen (d. h. einer Cyclohexenonverbindung wie hier beschrieben) bereit. In bestimmten Ausführungsformen wird die Absorptionsrate verlangsamt durch Verwendung einer Membran, die die Rate kontrolliert, oder durch einfangen der Verbindung in einer Polymermatrix oder einem Gel. In alternativen Ausführungsformen werden Absorptionsenhancer verwendet um die Absorption zu steigern. Absorptionsenhancer oder -träger beinhalten absorbierbare pharmazeutisch akzeptable Lösungsmittel, die die Passage durch die Haut unterstützen. Beispielsweise ist in einer Ausführungsform die transdermale Vorrichtung in der Form eines Pflasters umfassend eine Rückschicht, ein Reservoir, das die Verbindung optional mit Trägern enthält, optional eine Barriere, die die Rate kontrolliert um die Verbindung über eine langer Zeitperiode in einer kontrollierten und vorher bestimmten Rate an die Haut des Wirts zu verabreichen und Mittel um die Vorrichtung an der Haut anzubringen.
-
Die transdermalen Dosierungsformen, die hier beschrieben werden, können mit verschiedensten Vorrichtungen, die im Stand der Technik beschrieben sind, verabreicht werden. Beispielsweise sind solche Vorrichtungen offenbart in
U.S. Pat. No. 3,598,122 ,
3,598,123 ,
3,710,795 ,
3,731,683 ,
3,742,951 ,
3,814,097 ,
3,921,636 ,
3,972,995 ,
3,993,072 ,
3,993,073 ,
3,996,934 ,
4,031,894 ,
4,060,084 ,
4,069,307 ,
4,077,407 ,
4,201,211 ,
4,230,105 ,
4,292,299 ,
4,292,303 ,
5,336,168 ,
5,665,378 ,
5,837,280 ,
5,869,090 ,
6,923,983 ,
6,929,801 und
6,946,144 sind jedoch nicht limitiert auf diese.
-
Die transdermalen Dosierungsformen, die hier beschrieben werden, können bestimmte pharmazeutisch akzeptable Exzipienten enthalten, die normalerweise im Stand der Technik eingesetzt werden. In einer Ausführungsform beinhalten die transdermalen Formulierungen, die hier beschrieben sind, mindestens drei Verbindungen; (1) eine Formulierung einer Verbindung (d. h. einer Cyclohexenon Verbindung wie hier beschrieben); (2) einen Penetrationsenhancer; und (3) einen wässrigen Hilfsstoff. Zusätzlich, können transdermale Formulierungen zusätzliche Komponenten enthalten wie, aber nicht beschränkt auf, Gelierhilfen, Cremes und Salbenbasen und ähnliches, In einiges Ausführungsformen, beinhalten die transdermalen Formulierungen ferner ein gewebtes oder nicht gewebtes Trägermaterial um die Absorption zu verstärken und die Entfernung der transdermalen Formulierung von der Haut zu verhindern. In anderen Ausführungsformen halten die transdermalen Formulierungen, die hier beschrieben sind, einen gesättigten oder super gesättigten Zustand aufrecht um die Diffusion in die Haut zu fördern.
-
In anderen Ausführungsformen werden die Verbindungen (d. h. eine Cyclohexenon Verbindung wie hier beschrieben) für eine Verabreichung mittels Inhalation formuliert. Verschiedene Formen geeignet für eine Verabreichung mittels Inhalation beinhalten sind aber nicht beschränkt auf Aerosole, Nebel und Puder. Pharmazeutische Zusammensetzungen einer Verbindung (d. h. einer Cyclohexenon Verbindung wie hier beschrieben) werden zweckmäßig angeboten in Form eines Aerosolsprays in unter Druck stehenden Behältern oder in einem Vernebler, unter Verwendung eines geeigneten Treibmittels (beispielsweise Dichlorodifluoromethan, Trichlorofluoromethan, Dichlorotetrafluoroethan, Kohlenstoffdioxid oder anderer geeigneter Gase). In spezifischen Ausführungsformen wird die Dosiereinheit eines unter Druck stehenden Aerosols festgestellt durch bereitstellen eines Ventils um eine gemessen Menge abzugeben. In bestimmten Ausführungsformen werden Kapseln und Patronen aus beispielsweise Gelatine zur Verwendung in einem Inhalator oder einem Insufflator formuliert, die einen Pudermix der Verbindung und eine geeignete Puderbasis wie Laktose oder Stärke beinhalten.
-
Intranasale Formulierungen sind im Stand der Technik bekannt und werden beispielsweise in
U.S. Pat. No. 4,476,116 ,
5,116,817 und
6,391,452 beschrieben, die alle durch Verweis hierin aufgenommen werden. Formulierungen, die eine Verbindung (d. h. eine Cyclohexenon Verbindung wie hier beschrieben) beinhalten und hergestellt werden nach diesen oder anderen Verfahren, die im Stand der Technik bekannt sind, werden als Lösungen in Kochsalzlösung hergestellt unter Verwendung von Benzylalkohol oder anderen geeigneten Konservierungsmitteln, Fluorkohlenstoffen und/oder anderen Lösungs- oder Dispersionsmitteln, die im Stand er Technik bekannt sind. Vergleiche beispielsweise
Ansel, H. C. et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6. Ausgabe. (1995). Vorzugsweise werden diese Zusammensetzungen und Formulierungen hergestellt mit geeigneten nicht toxischen pharmazeutisch akzeptablen Inhaltsstoffen. Diese Inhaltsstoffe sind auffindbar in Quellen wie
REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, 21. Auflage, 2005. Die Wahl von geeigneten Trägern ist abhängig von der genauen Natur der gewünschten nasalen Dosierungsform, beispielsweise Lösungen, Suspensionen, Salben oder Gele. Nasale Dosierungsformen enthalten generell größere Mengen Wasser zusätzlich zum aktiven Inhaltsstoff. Kleinere Mengen an anderen Inhaltsstoffen wie pH Regulierern, Emulgatoren oder Dispergierhilfen, Konservierungsmitteln, Tensiden, Gellierungsmitteln oder Puffer und anderen Stabilisierungs- und Lösungsmitteln können auch vorhanden sein. Vorzugsweise sollte die nasale Dosierungsform isotonisch mit den nasalen Sekreten sein.
-
Für die Verabreichung durch Inhalation können die Verbindungen, die hier beschrieben sind in der Form eines Aerosol eines Nebels oder eines Puder vorliegen. Pharmazeutischen Zusammensetzungen wie hier beschrieben werden zweckmäßiger Weise in Form eines Aerosolsprays in unter Druck stehenden Behältern oder einem Vernebler angeboten unter Verwendung eines geeigneten Treibmittels beispielsweise Dichlorodifluoromethan, Trichlorofluoromethan, Dichlorotetrafluoroethan, Kohlenstoffdioxid oder anderer geeigneter Gase. Im Fall eines unter Druck stehenden Aerosols kann die Dosiereinheit festgestellt durch bereitstellen eines Ventils um eine gemessen Menge abzugeben. Kapsel und Patronen aus beispielsweise Gelatine zur Verwendung in einem Inhalator oder einem Insufflator formuliert die einen Pudermix der Verbindung und eine geeignete Puderbases wie Laktose oder Stärke beinhalten.
-
In noch anderen Ausführungsformen werden die Verbindungen (d. h. die Cyclohexenon Verbindungen wie hier beschrieben) formuliert als rektale Zusammensetzungen wie Klistiere, rektale Gele, rektale Schäume, rektale Aerosole, Gelees, gelierte Gelees oder Retentionseinläufe beinhaltend übliche Geleebasen wie Cocoa Butter oder andere Glyzeride und synthetische Polymere wie Polyvinylpyrrolidon, PEG, und ähnliches. In Geleeformen der Verbindungen schmilzt ein Wachs mit einer niedriger Schmelztemperatur wie, aber nicht beschränkt auf, Fettsäureglyzeride optional in Kombination mit Cocoa Butter zuerst.
-
In bestimmten Ausführungsformen werden pharmazeutischen Zusammensetzungen in jeder üblichen Weise formuliert unter Verwendung eines oder mehreren physiologisch akzeptabler Träger umfassend Exzipienten und Hilfsstoffe, die die Umwandlung der aktiven Verbindung zu Zusammensetzungen, die pharmazeutisch nutzbar sind, zu vereinfachen. Eine richtige Formulierung hängt von der gewählten Verabreichungsroute ab. Alle pharmazeutisch akzeptablen Techniken, Träger oder Exzipienten werden optional als geeignet verwendet und wie Stand der Technik verstanden. Pharmazeutischen Verbindungen umfassend eine Verbindung (d. h. eine Cyclohexenon Verbindung wie hier beschrieben) können in der üblichen Weise hergestellt werden beispielsweise durch übliches mischen, lösen, granulieren, Dragee-machen, schweben, emulgieren, einkapseln, einfangen oder verdichten.
-
Pharmazeutischen Zusammensetzungen beinhalten wenigstens einen pharmazeutisch akzeptablem Träger, Verdünnungsmittel oder Exzipienten und wenigstens eine Verbindung (d. h. eine Cyclohexenon Verbindung wie hier beschrieben) hier beschrieben als aktiver Inhaltsstoff. Der aktive Inhaltstoff liegt in seiner säurefreien oder basenfreien Form oder in einer pharmazeutisch akzeptablen Salzform vor. Zusätzlich umfassen die Verfahren und pharmazeutischen Verbindungen, die hier beschrieben werden, die Verwendung von kristallinen Formen (auch als Polymorphe bekannt) und die aktiven Metaboliten dieser Verbindungen, die den gleichen Aktivitätstyp haben. Alle Tautomere der hier beschriebenen Verbindungen sind vom Umfang der präsentierten Verbindungen umfasst. Zusätzlich beinhalten die beschriebenen Verbindungen unsolvatisierte und solvatisierte Formen mit pharmazeutisch akzeptablen Lösungsmitteln wie Wasser, Ethanol und ähnlichen. Zusätzlich kann die pharmazeutische Zusammensetzung optional andere medizinische oder pharmazeutische Wirkstoffen, Träger, Hilfsmittel wie Konservierungs-, Stabilisierungs-. Benetzungs- oder Emulgationsagentien, Lösungspromotoren, Salze zur Regulation des osmotischen Drucks, Puffer und/oder andere therapeutisch wertvolle Substanzen enthalten.
-
Verfahren zur Herstellung der Zusammensetzungen umfassend die hier beschriebenen Verbindungen beinhalten das Formulieren der Verbindungen mit einem oder mehreren inerten, pharmazeutisch akzeptablen Exzipienten oder Trägern um einen Feststoff, einen Semifeststoff oder eine Flüssigkeit zu formen. Feste Zusammensetzungen beinhalten, sind aber nicht beschränkt auf, Puder, Tabletten, dispergierbare Granulate, Kapseln, Taschen und Gelees. Flüssige Zusammensetzungen beinhalten Flüssigkeiten, in denen eine Verbindung gelöst ist, Emulsionen umfassend eine Verbindung oder eine Lösung beinhaltend Liposomen, Mizellen oder Nanopartikel umfassend eine Verbindung wie hier offenbart. Semifeste Zusammensetzungen beinhalten, sind aber nicht beschränkt auf Gele, Suspensionen und Cremes. Die Form der pharmazeutischen Zusammensetzungen, die hier beschrieben sind, beinhaltet flüssige Lösungen oder Suspensionen, feste Formen geeignet zur Lösung oder Suspension in einer Flüssigkeit vor der Verwendung oder Emulsionen. Diese Zusammensetzungen können optional kleiner Mengen an nichttoxischen Hilfsstoffen wie Benetzungs- oder Emulgationsagentien, pH Pufferagentien und so weiter enthalten.
-
In einigen Ausführungsformen nehmen pharmazeutische Zusammensetzungen umfassend wenigsten eine Verbindung (d. h. eine Cyclohexenon Verbindung wie hier beschrieben) zur Erläuterung die Form einer Flüssigkeit, in der die Wirkstoffe in Lösung oder in Suspension oder in beidem vorliegen, an. Typischerweise liegt, wenn die Zusammensetzung als Lösung oder Suspension verabreicht wird eine erster Teil des Wirkstoffs in Lösung und ein zweiter Teil des Wirkstoffs partikelförmig vor, in Suspension in einer flüssigen Matrix. In einigen Ausführungsformen beinhaltet eine flüssige Zusammensetzung eine Gelformulierung. In anderen Ausführungsformen ist die flüssige Zusammensetzung wässrig.
-
In einigen Ausführungsformen beinhalten pharmazeutische wässrige Suspensionen einen oder mehrere Polymere als Suspensionsagentien. Polymere beinhalten Wasser lösliche Polymere wie quervernetztes Carboxyl enthaltendes Polymer. Bestimmte pharmazeutische Zusammensetzungen, die hier beschrieben werden, beinhalten ein mucoadhäsives Polymer ausgewählt aus z. B. Carboxymethylcellulos, Carbomer (Acrylsäure Polymer), Poly(methylmethacrylat), Polyacrylamide, Polycarbophil, Acrylsäure/Butyl acrylate Copolymer, Natriumalginat und Dextran.
-
Pharmazeutische Zusammensetzungen beinhalten optional zudem Lösungsmittel um die Löslichkeit einer Verbindung (d. h. einer Cyclohexenon Verbindung wie hier beschrieben) zu unterstützen. Der Begriff Lösungsmittel beinhaltet generell Wirkstoffe, die in einer Mizellen haltigen Lösung resultieren oder in einer wahren Lösung des Wirkstoffs. Bestimmte akzeptable nicht ionische Tenside beispielsweise Polysorbat 80 sind nützlich als Lösungsmittel genauso wie ophthalmisch akzeptables Glycerin und Polyglycole z. B. Polyethylene Glycol 400 und Glycolether.
-
Außerdem enthalten pharmazeutische Zusammensetzungen optional ein oder mehrere pH Regulierungsagentien oder Pufferagentien beinhaltend Säuren wie Essigsäure, Borsäure, Zitronensäure, Milchsäure, phosphorhaltige Säure und Hydrochlorsäure, Basen wie Natriumhydroxid, Natriumphosphat, Natriumborat, Natriumcitrat, Natriumazetat, Natriumlaktat und Tris-hydroxymethylaminomethan; sowie Puffer wie Citrat/Dextrose, Natriumbicarbonat und Ammoniumchlorid. Solche Säuren, Basen und Puffer sind in Mengen enthalten, die nötig sind, um den pH der Zusammensetzung in einen akzeptablen Bereich zu halten.
-
Außerdem enthalten pharmazeutische Zusammensetzungen optional ein oder mehrere Salze in Mengen, die notwendig sind um die Osmolarität der Zusammensetzung in einen akzeptablem Bereich zu bringen. Solche Salze beinhalten die, die Natrium, Kalium oder Ammonium Kationen und Chlorid, Citrat, Ascorbat, Borat, Phosphat, Bicarbonat, Sulfat, Thiosulfat oder Bisulfit Anionen haben. Geeignete Salze beinhalten Natriumchlorid, Klaiumchlorid, Natriumthiosulfat, Natriumbisulfit und Ammoniumsulfat.
-
Andere pharmazeutische Zusammensetzungen enthalten optional ein oder mehrere Konservierungsmittel um mikrobielle Aktivität zu verhindern. Geeignete Konservierungsmittel beinhalten Quecksilber-enthaltenden Substanzen wie Merfen und Thiomersal, stabilisiertes Chlordioxid und quaternäre Ammoniumverbindungen wie Benzalkoniumchlorid, Cetyltrimethylammoniumbromid und Cetylpyridiniumchlorid.
-
Andere pharmazeutische Zusammensetzungen beinhalten optional ein oder mehrere Tenside um die physikalische Stabilität zu erhöhen oder für andere Zwecke. Geeignete nicht ionische Tenside beinhalten Polyoxyethylenfettsäureglyceride und pflanzliche die z. B. Polyoxyethylen (60) hydriertes Rizinusöl; und Polyoxyethylenalkylether und Alkylphenylether, z. B. Octoxynol 10, Octoxynol 40.
-
Noch andere pharmazeutische Zusammensetzungen können ein oder mehrere Antioxidantien enthalten, um die chemische Stabilität falls nötig zu erhöhen. Geeignete Antioxidantien beinhalten beispielsweise Ascorbinsäure und Natriummetabisulfit.
-
In bestimmten Ausführungsformen werde pharmazeutische wässrige Suspensionen in einzelnen Dosen in Behälter, die nicht wiederverschließbar sind, verpackt. Alternativ, werden Behälter, die mehrere Dosen umfassen und wiederverschließbar sind, verwendet. In diesem Fall wird die Zusammensetzung typischerweise ein Konservierungsmittel enthalten.
-
In alternativen Ausführungsformen werden andere Verabreichungssysteme für hydrophobe pharmazeutische Verbindung verwendet. Liposomen und Emulsion sind Beispiele für Verabreichungsvehikel oder Träger. In bestimmten Ausführungsformen werden auch organische Lösungsmittel wie N-methylpyrrolidone verwendet. In zusätzlichen Ausführungsformen werden die hier beschriebenen Verbindungen unter Verwendung eines Systems, das eine anhaltende Freisetzung erlaubt, verabreicht wie semipermeable Matrizen aus festen hydrophoben Polymeren, die das therapeutische Agens umfassen. Verschiedene Materialen, die eine anhaltende Freisetzung erlauben, sind hier nützlich. In einer Ausführungsform setzten Kapseln, die eine anhaltende Freisetzung erlauben, die Verbindung für einige Stunden bis zu 24 Stunden frei. Abhängig von der chemischen Natur und der biologischen Stabilität des therapeutischen Wirkstoffs können zusätzliche Strategien zur Proteinstabilisierung verwendet werden.
-
In bestimmten Ausführungsformen, beinhalten die hier beschriebenen Formulierungen einen oder mehrere Antioxidantien, Metalchelatbildner, Thiol enthaltenden Komponenten und/oder allgemeine Stabilisierungsagenzien. Beispiele für derartige Stabilisierungsagenzien beinhalten sind aber nicht beschränkt auf a) ungefähr 0.5% bis ungefähr 2% Masse/Volumen Glycerin, (b) ungefähr 0.1% bis ungefähr 1% Masse/Volumen Methionin, (c) ungefähr 0.1% bis ungefähr 2% Masse/Volumen Monothioglycerin, (d) ungefähr 1 mM bis ungefähr 10 mM EDTA, (e) ungefähr 0.01% bis ungefähr 2% Masse/Volumen Ascorbinsäure, (f) 0 0.003% bis ungefähr 0.02% Masse/Volumen Polysorbat 80, (g) 0.001% bis ungefähr 0.05% Masse/Volumen. Polysorbate 20, (h) Arginin, (i) Heparin, (j) Dextransulfat, (k) Cyclodextrin, (1) Pentosan Polysulfat und andere Heparinoide (m) divalente Kationen wie Magnesium und Zinc; oder (n) Kombinationen derselben.
-
Kombinationsbehandlungen
-
Generell müssen die hier beschriebenen Verbindungen und in Ausführungsformen, in denen eine Kombinationstherapie verwendet wird, andere Wirkstoffe nicht in derselben pharmazeutischen Zusammensetzung verabreicht werden und in einigen Ausführungsformen werden sie aufgrund verschiedener physikalischer und chemischer Eigenschaften über verschiedene Routen verabreicht. In einigen Ausführungsformen wird die erste Verabreichung nach etablierten Protokollen durchgeführt und anschließend werden die Dosis, die Art der Verabreichung und die Zeit der Verabreichung aufgrund der beobachteten Effekte von einem fachmännischen Kliniker verändert.
-
In einigen Ausführungsformen variieren die therapeutisch effektiven Dosen, wenn die Medikamente in Behandlungskombinationen verwendet werden. Kombinationsbehandlungen schließen zudem periodische Behandlungen, die zu verschiedenen Zeitpunkten beginnen und enden können, ein, um das klinische Management des Patienten zu unterstützen. In hier beschriebene Kombinationstherapien kann die Dosis der co-verabreichten Verbindung abhängig von der Art des verwendeten Co-medikaments, des speziellen verwendeten Medikaments, der Krankheit, Störung oder des Zustand, der behandelt wird, variieren.
-
Es versteht sich, dass in einigen Ausführungsformen die Dosierungsanleitung zum Behandeln, vorbeugen oder verbessern des Zustands, wegen dem Erleichterung gewünscht wird, abhängig von einer Reihe von Faktoren modifiziert wird. Diese Faktoren beinhalten die Störung, an der das Lebewesen leidet, sowie das Alter, das Gewicht, das Geschlecht, die Ernährung und den medizinische Zustand des Lebewesens. Daher variiert die tatsächlich verwendete Dosierungsanleitung in einigen Ausführungsformen erheblich und weichen daher von der hier beschriebenen Dosierungsanleitung ab.
-
Kombinationen von Verbindungen (d. h. der hier beschriebenen Cyclohexenon Verbindungen) mit anderen mit anderen therapeutischen Diabetesmitteln sollen abgedeckt werden. In einigen Ausführungsformen schließen Beispiele von therapeutischen Diabetesmittel die folgenden ein, sind aber nicht beschränkt auf diese: Insulin Sensibilisatoren (z. B. Biguanide, wie Metformin (Glucophage), Thiazolidindione, wie Pioglitazon (Actos)); Secretagogues (z. B. Sulfonylharnstoffe wie Tolbutamid (Orinase), Acetohexamid (Dymelor), Tolazamid (Tolinase), Chlorpropamid (Diabinese), Glipizide (Glucotrol), Glibenclamid (Diabeta, Micronase, Glynase), Glimepirid (Amaryl), Sekretagoga Gliclazide (Diamicron) und Nicht-Sulfonylharnstoff wie Meglitinide Repaglinid (Prandin), Nateglinide (Starlix)); Alpha-Glucosidase-Inhibitoren wie Miglitol (Glyset) und Acarbose (Precose/Glucobay); Injectable Inkretinmimetika wie Glucagon-like Peptid-Analoga wie Exenatide, Exendin-4, Liraglutide und Taspoglutide, Magen-hemmenden Peptid-Analoga, wie N-AcGIP, GIP (Lys37) PAL, N-AcGIP (Lys37), PAL (Pro3) GIP, GLP-1 und dergleichen, andere ähnliche Peptid-Analoga wie Vildagliptin (Galvus), Vildagliptin (Galvus), Saxagliptin (Onglyza) und Linagliptin (Tradjenta) und Amylin-Analoga (z. B. Pramlintide).
-
In einigen Ausführungsformen werden Kombinationen von (d. h. der hier beschriebenen Cyclohexenon Verbindungen) mit dem folgenden Typ 1 und/oder Typ-2-Diabetes Therapeutika verwendet um Diabetes zu behandeln: -NN1250/Insulin Degludec; Dapagliflozin; Aleglitazar; DiaPep277; GAD-alum/rhGAD65; Otelixizumab; MGA031/hOKT3γ1/teplizumab (A1a-A1a); Arxxant und dergleichen.
-
Die Kombinationen der Cyclohexenonverbindungen und anderen Diabetes-Therapeutika wie hierin beschriebenen umfassen in einigen Ausführungen zusätzliche Therapien und Behandlungsmethoden mit anderen Wirkstoffen. Solche zusätzlichen Therapien und Behandlungsmethoden können in einigen Ausführungen andere Diabetes-Therapien beinhalten. Alternativ beinhalten in anderen Ausführungsformen zusätzliche Therapien und Behandlungsformen andere Wirkstoffe, die verwendet werden um adjungierte Zustände zu behandeln, die mit Diabetes einhergehen oder Nebenwirkungen von Wirkstoffen in Kombinationstherapien behandeln. In weiteren Ausführungsformen werden Adjuvantien oder Enhancer mit einer hier beschriebenen Kombinationstherapie verabreicht.
-
In einigen Ausführungsformen werden Mittel zur Behandlung von Diabetes bereitgestellt umfassend eine therapeutisch wirksame Menge einer Verbindung mit der Struktur:
35 worin X und Y Sauerstoff, NR
5 oder Schwefel sind;
R ist Wasserstoff oder C(=O)C
1-C
8Alkyl;
R
1, R
2 und R
3 jeweils ein Wasserstoffatom, Methyl oder (CH
2)m-CH
3 ist;
R
4 ist NR
5R
6, OR
5, OC(=O)R
7, C(=O)oR
5, C(=O)R
5, C(=O)NR
5R
6, Halogen, 5- oder 6-gliedriges Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl, Glucosyl, wobei das 5- oder 6-gliedrige Lacton, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, Aryl und Glucosyl optional substituiert sind mit einem oder mehreren Substituenten ausgewählt aus NR
5R
6, OR
5, OC(=O)R
7 , C(=O)OR
5, C(=O)R
5, C(=O)NR
5R
6, C
1-C
8 Alkyl, C
2-C
8 Alkenyl, C
2-C
8 Alkinyl, C
3-C
8 Cycloalkyl und C
1-C
8 Haloalkyl;
R
5 und R
6 jeweils ein Wasserstoffatom oder ein C
1-C
8 Alkyl ist;
R
7 C
1-C
8 Alkyl, OR
5 oder NR
5R
6 ist;
M = 1–12; und
n = 1–12; oder eine pharmazeutisch akzeptables Salz, ein Metabolit, ein Solvat oder ein Prodrug der Verbindung und einem oder mehrere therapeutische Diabetesagenzien.
-
Beispiele
-
Herstellung der beispielhaften Cyclohexenon Verbindung
-
Einhundert Gramm Myzellen, Fruchtkörper oder eine Mischung von beiden von Antrodia camphorata wurden in eine Flasche gefüllt. Eine geeignete Menge an Wasser und Alkohol (70–100% Alkohol in Lösung) wurden in die Flasche hinzugefügt und bei 20–25°C für mindestens 1 Stunde gerührt. Die Lösung wurde durch einen Filter mit einer 0,45 μm Membran gefiltert und das Filtrat wurde als Extrakt gesammelt.
-
Das Filtrat von Antrodia camphorata wurde einer High Performance Liquid Chromatographie (HPLC) Analyse unterzogen. The Auftrennung wurde auf einer RP18 Säule durchgeführt, die mobile Phase bestand aus Methanol (A) und 0,3% Essigsäure (B) mit Gradientenbedingungen von 0–10 min 95%–20% B, 10–20 min in 20%–10% B, 20–35 min in 10%–10% B, 35–40 min in 10%–95% B bei einer Fließrate von 1 ml/min. Der Säulenausfluss wurde mit einem UV-Detektor überwacht.
-
Die Fraktionen, die zwischen 21,2 und 21,4 min gesammelt wurde, wurde gesammelt und konzertiert um Verbindung 5 zu ergeben ein Produkt in Form einer blassgelben Flüssigkeit. Analyse von Verbindung 5 ergab, dass es sich um 4-Hydroxy-5-(11-hydroxy-3,7,11-trimethyldodeca-2,6-dienyl)-2,3-dimethoxy-6-methylcyclohex-2-enon handelt mit einem Molekulargewicht von 408 (Molekulare Formel: C24 H40O5). 1H-NMR (CDCl3) δ (ppm) = 1.21, 1.36, 1.67, 1.71, 1.75, 1.94, 2.03, 2.07, 2.22, 2.25, 3.68, 4.05, 5.71 and 5.56. 13C-NMR (CDC13) δ (ppm): 12.31, 16.1, 16.12, 17.67, 25.67, 26.44, 26.74, 27.00, 30.10, 40.27, 43.34, 59.22, 60.59, 71.8, 120.97, 123.84, 124.30, 131.32, 134.61, 135.92, 138.05, 160.45, und 197.11.
-
-
Verbindung 5: 4-hydroxy-5-(11-hydroxy-3,7,11-trimethyldodeca-2,6-dienyl)-2,3-dimethoxy-6-methylcyclohex-2-enon
-
Die Fraktionen, die zwischen 23,7 und 24 min gesammelt wurde, wurde gesammelt und konzertiert um Verbindung 7 zu ergeben ein Produkt in Form einer blassgelben Flüssigkeit. Analyse von Verbindung 7 ergab, dass es sich um 4-Hydroxy-2,3-dimethoxy-5-(11-methoxy-3,7,11-trimethyldodeca-2,6-dienyl)-6-methylcyclohex-2-enon handelt mit einem Molekulargewicht von 422 (C25H42O5). 1H-NMR (CDCl3) δ (ppm) = 1.21, 1.36, 1.71, 1.75, 1.94, 2.03, 2.07, 2.22, 2.25, 3.24, 3.68, 4.05, 5.12, 5.50, und 5.61. 13C-NMR (CDCl3) δ (ppm): 12.31, 16.1, 16.12, 17.67, 24.44, 26.44, 26.74, 27.00, 37.81, 39.81, 40.27, 43.34, 49.00, 59.22, 60.59, 120.97, 123.84, 124.30, 135.92, 138.05, 160.45 und 197.12.
-
-
Verbindung 7 4-Hydroxy-2,3-dimethoxy-5-(11-methoxy-3,7,11-trimethyldodeca-2,6-dienyl)-6-methylcyclohex-2-enon
-
Die Fraktionen, die zwischen 25 und 30 min gesammelt wurde, wurde gesammelt und konzertiert um 4-Hydroxy-2,3-dimethoxy-6-methyl-5-(3,7,11-trimethyldodeca-2,6,10-trienyl)cyclohex-2-enon (Verbindung 1) zu ergeben, ein Produkt von blassgelb-bräunlicher Farbe. Die Analyse von Verbindung 1 ergab die molekulare Formel C24H38O4, ein molekulares Gewicht von 390 mit einem Schmelzpunkt von 48 bis 52°C. NMR Spektra ergaben, dass 1H-NMR (CDCl3) δ (ppm) = 1.51, 1.67, 1.71, 1.75, 1.94, 2.03, 2.07, 2.22, 2.25, 3.68, 4.05, 5.07, und 5.14; 13C-NMR (CDCl3) δ (ppm) = 12.31, 16.1, 16.12, 17.67, 25.67, 26.44, 26.74, 27.00, 39.71, 39.81, 40.27, 43.34, 59.22, 60.59, 120.97, 123.84, 124.30, 131.32, 135.35, 135.92, 138.05, 160.45, und 197.12.
-
-
Verbindung 1 4-Hydroxy-2,3-dimethoxy-6-methyl-5-(3,7,11-trimethyldodeca-2,6,10-trtenyl)cyclohex-2-enon
-
Verbindung 6 ein Metabolit von Verbindung 1 wurde erhalten aus Urinproben von Ratten, die mit Verbindung 1 in einer Tierstudie gefüttert worden waren. Es wurde bestimmt, dass es sich bei Verbindung 6 um 4-Hydroxy-2,3-dimethoxy-6-methyl-5-(3-methyl-2-hexenoic acid)cyclohex-2-enon handelt mit einem molekularen Gewicht von 312 (C,6H24O6). Verbindung 4 wurde bestimmt als 3,4-Dihydroxy-2-methoxy-6-methyl-5-(3,7,11-trimethyldodeca-2,6,10-trienyl)cyclohex-2-enon (molekularen Gewicht von 376, C23H36O4), und wurde erhalten, wenn Verbindung 1 Verhältnissen über 40°C für mehr als 6 Stunden ausgesetzt war.
-
-
Alternativ können die beispielhaften Verbindungen ausgehend von 4-Hydroxy-2,3-dimethoxy-6-methylcyclohexa-2,5-dienon oder ähnlichem hergestellt werden.
-
Genauso werden andere Cyclohexenon Verbindungen mit der Struktur
aus Antrodia camphorata isoliert oder synthetisch oder semi-synthetisch aus geeigneten Ausgangsmaterialien hergestellt. Ein normaler Fachmann würde auf Anhieb geeignete Bedingungen für eine derartige Synthese verwenden.
-
Beispiel 2
-
Die Behandlung durch STZ induzierten Diabetes in Ratten
-
Die Auswirkungen von der beispielhaften Cyclohexenonverbindung 1 bei der Behandlung eines Lebewesens, das an Diabetes leidet, wurden in einem Sprague-Dawley Ratten-Modell über einen Zeitraum von vier Wochen untersucht. Das Beispiel beschreibt die Ergebnisse solcher Experimente.
-
In-vivo-Modelle.
-
Ein Ratten Modell von Diabetes wurde durch niedrig dosierte Streptozotocin (STZ, 60 mg/kg) Injektion in SD-Ratten etabliert. Ratten der gleichen Charge, die mit normalem Futter (NRC) gefüttert wurden, dienten als Kontrolle (n = 4).
-
Gruppen der Studie
-
- Gruppe A: Diabetes ohne Behandlung Gruppe, n = 6; Gruppe B: Aope + STZ + Verbindung 1, n = 4. Die Kontrollgruppe zeigte ca. 100 mg/dl durchschnittlichen Blutzucker vor den Mahlzeiten.
-
Ratten der Gruppe A zeigten etwa 400–500 mg/dl Blutzucker im Durchschnitt. Die Ratten in der Gruppe A zeigten auch typische Diabetes Symptome wie viel Glukose im Urin und häufiges Wasserlassen. Ratten der Gruppe B (Behandlungsgruppe) haben folgende Blutzucker Daten vor den Mahlzeiten:
| ID Nummer | Blutzuckerlevel der 4. Woche | Blutzuckerlevel der 2. Woche |
| 1 | 147 mg/dl | 421 mg/dl |
| 2 | 149 mg/dl | 330 mg/dl |
| 3 | 89 mg/dl | 261 mg/dl |
| 4 | 388 mg/dl | 484 mg/dl |
-
Darüber hinaus zeigten die Ratten in der Gruppe B verringerte Diabetes Symptome: weniger Glukose im Urin, weniger Urin und Gewichtsverlust.
-
Beispiel 3
-
Effekte der Verbindung 1 auf die Blutzuckerkontrolle bei Patienten mit Typ-1-Diabetes
-
Das Ziel der Studie ist es, zu beurteilen, ob die Verbindung 1 einen Effekt auf die Verringerung des Risikos für oder auf die Behandlung von Typ-1-Diabetes hat. Insbesondere ob Verbindung 1 hilft den Blutzucker zu senken; ob Verbindung 1 das Auftreten von Typ-1-Diabetes reduziert.
Studien Typ: Interventional
Studiendesign:
Auswahl: randomisiert;
Klassifizierungsendpunkt: Sicherheit/Wirksamkeitsstudie
Interventionsmodell: Parallel Assignment
Maskierung: Doppelblind (Patient, Pfleger, Forscher)
-
Hauptzielkriterien:
-
- Um eine Abnahme der postprandialen Glucagonfreisetzung wie beurteilt nach Glucagon Fläche unter der Kurve (AUC) für 3 Stunden während 4 Stunden Mahlzeit Toleranz-Tests zu demonstrieren.
- Zeitrahmen: Primärer Zielparameter werden nach 16 Wochen Behandlung aufgenommen werden. Ausgewiesene als Sicherheitsrisiko: Ja
- Um eine Abnahme der postprandialen Glucagonfreisetzung wie beurteilt nach Glucagon Fläche unter der Kurve (AUC) für 3 Stunden während 4 Stunden Mahlzeit Toleranz-Tests zu demonstrieren.
-
Die sekundären Endpunkte:
-
- Sekundäre Ziele: 1. Eine 0,3%ige Abnahme der HbA1c bei Patienten mit Typ-1-Diabetes nach 16 Wochen der Behandlung mit Verbindung 1 zu demonstriere 2. Eine Änderungen in der Gesamt-, Basal- und Bolusinsulinmenge während der Behandlung mit auf Verbindung 1 zu bewerten. Zeitrahmen: Sekundäre Zielparameter werden nach 16 Wochen der Behandlung aufgenommen werden. Ausgewiesene als Sicherheitsrisiko: Ja
-
Kriterien bei Patienten mit Diabetes
-
- Altersbegrenzung für die Studie: 18 Jahre bis 70 Jahre (150 Probanden)
- Geschlechter Berechtigt für Studie: Beide
- Nimmt gesunde Freiwillige: Nein
-
Kriterien
-
Aufnahmekriterien
-
- Schriftliche Einwilligung vor allen studienbezogenen Tätigkeiten
- Männlich oder weiblich im Alter von 18 bis 70 Jahre
- Diabetes mellitus Typ 1 Dauer > 1 Jahr
- Behandlung mit MDI oder CSII-Therapie für mindestens 3 Monate vor der Screening-Besuch; stabile Insulindosis für den letzten 1 Monat
- Keine Verwendung von Pramlintide, Saxagliptin, Metformin oder Sitagliptin für 1 Monat vor der Aufnahme
- A1c 7,5–10%
- Die Bereitschaft, regelmäßig mindestens 2–4 Blutzuckermessungen pro Tag durchzuführen
- BMI < 35 kg/m2
- Die Fähigkeit und die Bereitschaft dem Protokoll zu folgen einschließlich der täglichen oralen Dosis der Studienmedikation oder Placebo und wochenlanges CGM tragen
- Bereitschaft Telefon und Arztbesuche zu absolvieren
- Fähigkeit Englisch zu sprechen, zu lesen und zu schreiben
-
Ausschlusskriterien:
-
- Die Verwendung von oralen, inhalativen oder vorgemischtem Insulin
- Schwanger oder die Absicht im Laufe der Studie schwanger zu werden, keine Verwendung von adäquaten Verhütungsmethoden
- Schwere unerklärliche Hypoglykämie, die eine Notfallbehandlung in den letzten 3 Monaten erforderte
- Die Verwendung von systemischen oder inhalativen Kortikosteroiden
- Geschichte der Hämoglobinopathien
- Diagnose der Anämie
- Post-Nierentransplantation, derzeit in Dialysebehandlung, Kreatinin > 2,0 mg/dl oder eine berechnete Kreatinin-Clearance von < 50 ml/min
- Fortgeschrittene Retinopathie benötigen Laserverfahren oder Vitrektomie
- Geschichte der Pankreatitis
- Umfangreiche Hautveränderungen/Krankheiten, die das Tragen eines Sensors auf normaler Haut verhindern
- Bekannte Allergie gegen Klebstoffe
- Bekannte Allergie gegen Studienmedikation
- Teilnahme an einer anderen klinischen Studie Protokoll innerhalb von 30 Tagen vor der Aufnahme
jede andere Bedingung, die vom Forscher festgestellt wurde, die den Pateinten ungeeignet macht für die Studie, die Eignung des Patienten für die Studie beeinträchtigt oder die informierte Einwilligung beeinträchtigt.
-
| Arme |
Zugeschriebene Intervention |
| Verbindung 1 : Experimentell
Intervention: Medikament: Verbindung 1 |
Medikament: Verbindung 1. Dosierungsform jeweils 100 mg Tablette. Es wird während der Studie eine Kapsel am Tag genommen |
| Zuckerpille: Placebovergleich
Intervention: Medikament: Zuckerpille |
Medikament: Zuckerpille: 100 mg Tablette einmal am Tag |
-
Die Studie liefert Ergebnisse von Patienten, die Verbindung 1 zur Typ-1-Diabetes-Behandlung. Diese Ergebnisse sind klinisch signifikant.
-
Beispiel 4 Wirksamkeit und Sicherheit der Verbindung 1 bei erwachsenen Probanden mit Typ-2-Diabetes mellitus
-
Das Ziel dieser Studie ist es, die Sicherheit und Wirksamkeit der verschiedenen Dosierungen von Verbindung 1, einmal täglich (QD), bei Patienten mit Typ-2-Diabetes mellitus zu bewerten.
Studie Typ: Interventional
Studiendesign:
Auswahl: randomisiert
Klassifizierungsendpunkt Sicherheit/Wirksamkeitsstudie
Interventions Modell: Parallel Assignment
Maskierung: Doppelblind (Patient, Pfleger, Forscherk, Endpunktbeurteiler)
-
Hauptzielkriterien:
-
- Veränderung das Ausgangswert von glykosyliertem Hämoglobin
- Zeitrahmen: Woche 12 oder Endbesuch Ausgewiesene als Sicherheitsrisiko: Nein
-
Die sekundären Endpunkte:
-
- Veränderung gegenüber dem Ausgangswert von glykosylierten Hämoglobin.
- Zeitrahmen: 4 und 8 Wochen oder Endbesuch; Ausgewiesen als Sicherheitsrisiko: Nein
- Veränderung gegenüber dem Ausgangswert von Blutzucker bei fasten
- Zeitrahmen: Wochen 1, 2, 4, 8 und 12 oder Endbesuch; Ausgewiesen als Sicherheitsrisiko: Nein
- Veränderung vom Ausgangswert des Körpergewichts.
- Zeitrahmen: Wochen 4, 8 und 12 oder Endbesuch; Ausgewiesen als Sicherheitsrisiko: Nein
- Anzahl der Patienten mit Erhöhung der Alanin-Aminotransferase um das mehr als das Dreifache der oberen Grenze des Normalen während der Behandlung.
- Zeitrahmen: Woche 12 oder Endbesuch; Ausgewiesen als Sicherheitsrisiko: Nein
- Plasma-Konzentrationen der Verbindung Ansatz mit Weinger Stickproben aus der Bevölkerung
- Time Frame Woche 12 oder Final besuchen; Ausgewiesen als Sicherheitsrisiko: Nein
-
Kriterien bei Patienten mit Diabetes
-
- Altersbegrenzung für die Studie: 18 Jahre bis 80 Jahre (300 Probanden)
- Geschlechter Berechtigt für Studie: Beide
- Aufnahme von gesunden Freiwilligen: Nein
-
Kriterien
-
Aufnahmekriterien
-
- Historische Diagnose eines Typ-2-Diabetes mellitus ohne die chronische Anwendung von Antidiabetika-Therapie und eine 8 wöchige Historie der Ernährung und Bewegung.
- Historische Diagnose eines Typ-2-Diabetes mellitus mit einer stabilen Dosis von Metformin als Mono-Therapie für mindestens 3 Monate vor dem Screening.
- Glykosyliertes Hämoglobin zwischen 7,5% und 10,0%, inklusive.
- Die C-Peptid-Konzentration ist gefastet größer als oder gleich 0,8 ng pro ml
- Jedes andere chronische Medikament, das für mindestens 4 Wochen vor Screening stabil war.
- Der Body Mass Index bei Screening ist größer oder gleich 23 kg/m2 und weniger als 45 kg/m2.
- Fähig und bereit die eigenen Blutzuckerwerte mit einem Heim-Glukose-Monitor zu überwachen.
- Frauen im gebärfähigen Alter, die sexuell aktiv sind, müssen sich verpflichten, Empfängnisverhütung zu verwenden, und können weder schwanger noch stillenden sein beginnend bei Screening und während der gesamten Dauer der Studie.
- Eine Einhaltung der single-blind Studienmedikamentegabe während der Run-in-Phase von mindestens 75% und nicht mehr als 125% basierend auf Tabletten, die vom Studienpersonal gezählt wurden.
-
Ausschlusskriterien:
-
- Der systolische Blutdruck ist größer als 160 mm Hg oder diastolischer Blutdruck größer als 100 mm Hg bei wiederholten Messungen.
- Jede Geschichte von Blasenkrebs oder eine Krebshistorie mit Remission in den 5 Jahren vor der Screening (eine Geschichte von Basalzellkarzinom oder Stage 1 Plattenepithelkarzinom der Haut ist erlaubt).
- Glykosyliertes Hämoglobin weniger als 7,5% und größer als 10,0%.
- Creatinphosphokinase ist größer als oder gleich dem 5-fachen der Obergrenze des Normalwertes beim Screening.
- Hämoglobin weniger als oder gleich 12 g pro dl bei Männern und weniger als oder gleich 10 g pro dl bei Frauen.
- Alanin-Aminotransferase und Aspartat-Aminotransferase sind größer als oder gleich dem 2,5fachen der Obergrenze des Normalwertes.
- Gesamtbilirubin größer als oder gleich dem 1,5-fachen der oberen Grenze des Normalen beim Screening.
- Serumtriglyceridkonzentration größer oder gleich 400 mg pro dl.
- Glomeruläre Filtrationsrate kleiner als oder gleich 60 ml pro Minute geschätzt mit der Änderung der Diät in Renal Disease Gleichung oder der Cockroft-Gault-Gleichung.
- Abnormales Schilddrüsen-stimulierendes Hormon, definiert durch Zentrallabor Normwerte.
- Positive Testergebnisse für Hepatitis-B-Oberflächen-Antigen- oder Hepatitis-C-Antikörper.
- Urin-Albumin zu Kreatinin-Verhältnis größer oder gleich 1000 μg pro mg beim Screening.
- Geschichte der mikroskopischen oder makroskopischen Hämaturie.
- Zwei aufeinanderfolgende unerklärliche positive dip-stick Urinanalysen und größer oder gleich 3 rote Blutkörperchen pro High-Power-Bereich an zwei aufeinander folgenden Messungen.
- Geschichte der Laser-Behandlung für proliferative diabetische Retinopathie innerhalb von 6 Monaten vor dem Screening.
- Diabetische Gastroparese, von der der Ermittler der Meinung ist, sie sei mittelschwer oder schwer und beeinträchtigt somit Absorption der Studienmedikation.
- Der Patient hat New York Heart Association Klasse III oder IV Herzinsuffizienz.
- Hatte koronare Angioplastie, koronare Stentimplantation, koronare Bypass-Operation, Herzinfarkt, instabile Angina pectoris, klinisch signifikanten Abweichungen im Elektrokardiogramm, Apoplexie oder eine transitorische ischämische Attacke innerhalb von 6 Monaten vor oder am Screening.
- Geschichte einer Hämoglobinopathie die die Bestimmung des glykosylierten Hämoglobins beeinflussen können.
- Erhielt eine Behandlung mit Probucol innerhalb von 1 Jahr vor Randomisierung.
- Hat gespendet oder Blutprodukte erhalten innerhalb von 12 Wochen vor dem Screening.
- Erhielt eine Behandlung für mehr als 7 Tage innerhalb von 8 Wochen vor der Randomisierung oder muss ein nichterlaubtest Medikament, ein verschreibungspflichtiges Medikamente, eine pflanzliche Behandlung oder ein freiverkäufliches Medikament nehmen bzw. muss es weiter nehmen, das bei der Auswertung der Studie stören können, einschließlich:
oral oder systemisch injiziert Glukokortikoiden
Rezept oder freiverkäuföiche Gewichtsverlustmedikamente
Peroxisomproliferator-aktivierte Rezeptor-Agonisten einschließlich Fibrinsäurederivaten
Niacin
Ezetemibe
Gallensäure-Bindemittel
Warfarin
Phenytoin
Jede Änderung von Lipid-senkenden Medikamenten (Veränderung der Dosierung oder der Medikamente)
Chronisch mit Insulin behandelt.
-
Erhielt eine Studienmedikament innerhalb von 4 Wochen vor Screening.
-
Geschichte der Infektion mit Hepatitis B, Hepatitis C oder humanen Immundefizienz-Virus.
-
Überempfindlichkeit gegenüber Verbindung 1 oder deren Bestandteilen.
-
Geschichte von Drogenmissbrauch oder einer Vorgeschichte von Alkoholmissbrauch innerhalb von 2 Jahren vor dem Screening.
-
Jede andere körperliche oder psychiatrische Krankheit oder Bedingung, die sich in den Augen des Forschers auf die Lebenserwartung auswirken oder es schwierig machen kann, den Patienten erfolgreich zu managen und ihm wie es das Protokoll vorzieht zu folgen
| Arme | Ausgewählte Intervention |
| Verbindung 1 50 mg QD: Experimental
Intervention: Medikament: Verbindung 1 | Medikament: Verbindung 1
Verbindung 1 50 mg Tablette, oral einmal täglich und Pioglitazon Tabletten, die wie der Placebo aussehen, oral einmal täglich für bis zu 12 Wochen |
| Verbindung 1 1000 mg QD: Experimental
Intervention: Medikament: Verbindung 1 | Medikament: Verbindung 1
Verbindung 1 100 mg Tablette, oral einmal täglich und Pioglitazon Tabletten, die wie der Placebo aussehen, oral einmal täglich für bis zu 12 Wochen |
| Verbindung 1 200 mg QD: Experimental
Intervention: Medikament: Verbindung 1 | Medikament: Verbindung 1
Verbindung 1 200 mg Tablette, oral einmal täglich und Pioglitazon Tabletten, die wie der Placebo aussehen, oral einmal täglich für bis zu 12 Wochen |
| Pioglitazon 30 mg QD: Aktiver vergleich
Intervention: Medikament: Pioglitazon | Medikament: Pioglitazon
Pioglitazon 30 mg Tablette, oral einmal täglich und Tabletten, die wie der Placebo von Verbindung 1 aussehen, oral einmal täglich für bis zu 12 Wochen |
| Placebo: Placebo Vergleich
Intervention: Medikament: Placebo | Medikament: Placebo
Tabletten, die wie der Placebo von Verbindung 1 aussehen, und Tabletten, die wie der Placebo von Pioglitazon aussehen oral einmal täglich und für bis zu 12 Wochen |
-
Die Studie liefert Ergebnisse von Patienten, die Verbindung 1 nehmen für Typ-2-Diabetes-Behandlung. Diese Ergebnisse sind klinisch signifikant.
-
Beispiel 5
-
Parenterale Formulierungen
-
Um eine parenterale pharmazeutische Zusammensetzungen für die Verabreichung mittels Injektion zuzubereiten, werden 100 mg einer hier beschriebenen Verbindung oder ihres Salzes in DMSO verdünnt und mit 10 ml 0,9% steriler Kochsalzlösung gemischt. Die Mischung wird in eine Dosierungsformt integriert, die für die Verabreichung mittels Injektion geeignet ist.
-
Beispiel 6 Orale Formulierung
-
Um eine pharmazeutische Zusammensetzungen für die orale Verabreichung zuzubereiten, wurden 100 mg einer beispielhaften Verbindung 1 mit 100 mg Maisöl gemischt. Die Mischung wurde in eine orale Dosiereinheit einer Kapsel integriert, welche für die orale Verabreichung geeignet ist.
-
In einigen Fällen wurden 100 mg einer hier beschriebenen Verbindung mit 750 mg Stärke gemischt. Die Mischung wurde in eine orale Dosiereinheit, wie eine harte Gelatinkapsel, integriert, welche für die orale Verabreichung geeignet ist.
-
Bespiel 7
-
Sublinguale (harte Lutschtablette) Formulierung
-
Um eine pharmazeutische Zusammensetzungen für eine buccale Verabreichung zuzubereiten, werden 100 mg einer hier beschriebenen Verbindung mit 420 g gemischtem puderförmigen Zucker, 1,6 ml leichten Maissirup, 2,4 ml destilliertem Wasser und 0,42 Mintextrakt gemischt. Die Mischung wird vorwichtige vermengt und in eine Form gegossen um eine Lutschtablette zu formen, die für eine buccale Verabreichung geeignet ist.
-
Beispiel 8 Inhalationszusammensetzungen
-
Um eine pharmazeutische Zusammensetzungen für Verabreichung durch Inhalation zuzubereiten werden 20 mg einer hier beschriebenen Verbindung mit 50 mg wasserfreien Zitronensäure und 100 ml 0,9% Natriumchloridlösung gemischt. Die Mischung wird in eine Inhalationsverabreichungseinheit, wie einen Vernebler, eingebracht, die für die Verabreichung mittels Inhalation geeignet ist.
-
Während bevorzugten Ausführungsformen der vorliegenden Erfindung hier gezeigt und beschrieben wurden, ist für den Fachmann ersichtlich, dass solche Ausführungsformen nur beispielhaft aufgeführt werden. Verschiedenste Variationen, Änderungen und Substitutionen werden dem Fachmann einfallen, ohne dass er vom Erfindungsgedanken abweicht. Es versteht sich, dass verschiedene Alternativen zu den Ausführungsformen der Erfindung, die hier beschrieben sind, in der Anwendung der Erfindung verwendet werden können. Es ist intendiert, dass die folgenden Ansprüche den Umfang der Erfindung festlegen und dass Methoden und Strukturen innerhalb dieses Umfangs und ihre Äquivalente von diesem umfasst sind.
-
ZITATE ENTHALTEN IN DER BESCHREIBUNG
-
Diese Liste der vom Anmelder aufgeführten Dokumente wurde automatisiert erzeugt und ist ausschließlich zur besseren Information des Lesers aufgenommen. Die Liste ist nicht Bestandteil der deutschen Patent- bzw. Gebrauchsmusteranmeldung. Das DPMA übernimmt keinerlei Haftung für etwaige Fehler oder Auslassungen.
-
Zitierte Patentliteratur
-
- US 4031893 [0070]
- US 5358489 [0070]
- US 5540664 [0070]
- US 5665071 [0070]
- US 5695472 [0070]
- WO 2005/087297 [0070]
- US 3598122 [0073]
- US 3598123 [0073]
- US 3710795 [0073]
- US 3731683 [0073]
- US 3742951 [0073]
- US 3814097 [0073]
- US 3921636 [0073]
- US 3972995 [0073]
- US 3993072 [0073]
- US 3993073 [0073]
- US 3996934 [0073]
- US 4031894 [0073]
- US 4060084 [0073]
- US 4069307 [0073]
- US 4077407 [0073]
- US 4201211 [0073]
- US 4230105 [0073]
- US 4292299 [0073]
- US 4292303 [0073]
- US 5336168 [0073]
- US 5665378 [0073]
- US 5837280 [0073]
- US 5869090 [0073]
- US 6923983 [0073]
- US 6929801 [0073]
- US 6946144 [0073]
- US 4476116 [0076]
- US 5116817 [0076]
- US 6391452 [0076]
-
Zitierte Nicht-Patentliteratur
-
- Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995) [0061]
- Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa. 1975 [0061]
- Liberman, H. A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N. Y., 1980 [0061]
- Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins 1999) [0061]
- Ansel, H. C. et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 6. Ausgabe. (1995) [0076]
- REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, 21. Auflage, 2005 [0076]