CN1671663A - 截短侧耳素 - Google Patents
截短侧耳素 Download PDFInfo
- Publication number
- CN1671663A CN1671663A CNA038176432A CN03817643A CN1671663A CN 1671663 A CN1671663 A CN 1671663A CN A038176432 A CNA038176432 A CN A038176432A CN 03817643 A CN03817643 A CN 03817643A CN 1671663 A CN1671663 A CN 1671663A
- Authority
- CN
- China
- Prior art keywords
- boc
- valyl
- compound
- piperidin
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/45—Non condensed piperidines, e.g. piperocaine having oxo groups directly attached to the heterocyclic ring, e.g. cycloheximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/10—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/12—Oxygen or sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/20—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/54—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/56—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/56—Nitrogen atoms
- C07D211/58—Nitrogen atoms attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/68—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D211/72—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D223/00—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom
- C07D223/02—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom not condensed with other rings
- C07D223/06—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom not condensed with other rings with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D493/00—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system
- C07D493/02—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system in which the condensed system contains two hetero rings
- C07D493/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Hydrogenated Pyridines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
式(I)化合物及其作为抗微生物剂的用途,其中R1和R1’是氢或氘,R2、R3和R4是氢或氘,R5是氨基酸的残基,X是S或N-ALK,式(II)是哌啶基或四氢吡啶基,ALK是(C1-4)烷基,并且R6是氢、羟基或(C2-12)酰氧基。
Description
本发明涉及具有药物活性例如抗菌活性的截短侧耳素。
一方面,本发明提供了式I化合物:
其中
R1和R1’是氢或氘,
R2、R3和R4是氢或氘,
R5是氨基酸的残基,例如缬氨酰或组氨酰基残基,
X是S或N-ALK,是哌啶基或四氢吡啶基,
ALK是(C1-4)烷基,例如甲基,并且
另一方面,本发明提供了式I化合物,其中
R1、R1’、R2、R3和R4是氢,
R5是氨基酸的残基,例如缬氨酰或组氨酰基残基,
X是S,是哌啶基或四氢吡啶基,并且
R6是羟基。
另一方面,本发明提供了式I化合物,其中
R1、R1’、R2、R3和R4是氢,
R5是氨基酸的残基,例如缬氨酰或组氨酰基,
ALK是(C1-4)烷基,例如甲基,并且
R6是羟基。
另一方面,本发明提供了选自下列的式I化合物:
-14-O-[4-羟基-N-缬氨酰-哌啶-3-基]-硫基乙酰基木替灵(mutilin),诸如14-O-[4-羟基-N-(R)-缬氨酰-哌啶-3-基]-硫基乙酰基木替灵,例如呈盐酸盐的形式,
-14-O-[3-羟基-N-缬氨酰-哌啶-4-基]-硫基乙酰基木替灵,诸如14-O-[3-羟基-N-(R)-缬氨酰-哌啶-4-基]-硫基乙酰基木替灵,例如呈盐酸盐的形式,
-14-O-[3-羟基-N-组氨酰基-哌啶-4-基]-硫基乙酰基木替灵,诸如14-O-[3-羟基-N-(R)-组氨酰基-哌啶-4-基]-硫基乙酰基木替灵,例如呈二盐酸盐的形式,
-14-O-[3-羟基-N-缬氨酰-哌啶-4-基]-甲基氨基乙酰基木替灵,诸如14-O-[3-羟基-N-(R)-缬氨酰-哌啶-4-基]-甲基氨基乙酰基木替灵,例如呈二盐酸盐的形式,
-14-O-[4-羟基-N-缬氨酰-哌啶-3-基]-甲基氨基乙酰基木替灵,诸如14-O-[4-羟基-N-(R)-缬氨酰-哌啶-3-基]-甲基氨基乙酰基木替灵,例如呈二盐酸盐的形式,
-14-O-[N-缬氨酰-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵,诸如14-O-[N-(R)-缬氨酰-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵和-14-O-[N-缬氨酰-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵,诸如14-O-[N-(R)-缬氨酰-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵。
式I化合物可以通过从其中的官能团例如氨基被保护的式I化合物中除去保护基来制备。因此,该化合物可用作式I化合物的制备过程中的中间体,或者可具有药物活性。
另一方面,本发明提供了式II化合物:
其中
R1和R1’是氢或氘,
R2、R3和R4是氢或氘,
R7是保护基,例如BOC,或者是其中的氨基被保护的氨基酸的残基,例如N-BOC保护的缬氨酰或组氨酰基,
X是S或N-ALK,是哌啶基或四氢吡啶基,
ALK是(C1-4)烷基,例如甲基,并且
R8是氢、羟基或(C2-12)酰氧基,例如(C2-6)烷基羰基氧基,例如-O-CO-CH3,条件是:如果是哌啶基且X是S,则R8不是氢。
本文所用的BOC是叔丁氧基羰基。
另一方面,本发明提供了式II化合物,其中
R1、R1’、R2、R3和R4是氢,
R7是叔丁氧基羰基或其中将氨基用叔丁氧基羰基进行了保护的氨基酸的残基,例如N-BOC保护的缬氨酰或组氨酰基,
X是S或N-ALK,是哌啶基或四氢吡啶基,
ALK是(C1-4)烷基,例如甲基,并且
R8是氢、羟基或乙酰氧基,
条件是:如果是哌啶基且X是S,则R8不是氢。
保护基包括例如如果需要的话可选择性除去的保护基,并且包括化学中、例如截短侧耳素或木替灵化学中的常规保护基,优选BOC,例如该BOC可以例如通过用HCl的乙醚溶液进行处理来除去。
另一方面,本发明提供了选自下列的式II化合物:
-14-O-[N-BOC-4-羟基-哌啶-3-基]-硫基乙酰基木替灵、
-14-O-[N-BOC-3-羟基-哌啶-4-基]-硫基乙酰基木替灵、
-14-O-[4-羟基-N-BOC-哌啶-3-基]-甲基氨基乙酰基木替灵、
-14-O-[3-羟基-N-BOC-哌啶-4-基]-甲基氨基乙酰基木替灵,
-14-O-[N-BOC-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵,诸如
14-O-[N-BOC-1,4,5,6-四氢吡啶-4(R*)-基]-硫基乙酰基木替灵和
14-O-[N-BOC-1,4,5,6-四氢吡啶-4(S*)-基]-硫基乙酰基木替灵,
-14-O-[4-羟基-N-(N-BOC-缬氨酰)-哌啶-3-基]-硫基乙酰基木替灵,诸如
14-O-[4-羟基-N-(N-BOC-(R)-缬氨酰)-哌啶-3-基]-硫基乙酰基木替灵,例如呈盐酸盐的形式,
-14-O-[3-羟基-N-(N-BOC-缬氨酰)-哌啶-4-基]-硫基乙酰基木替灵,诸如14-O-[3-羟基-N-(N-BOC-(R)-缬氨酰)-哌啶-4-基]-硫基乙酰基木替灵,例如呈盐酸盐的形式,
-14-O-[4-乙酰氧基-N-(N-BOC-缬氨酰)-哌啶-3-基]-硫基乙酰基木替灵,诸如14-O-[4-乙酰氧基-N-(N-BOC-(R)-缬氨酰)-哌啶-3-基]-硫基乙酰基木替灵,例如呈盐酸盐的形式,
-14-O-[3-乙酰氧基-N-(N-BOC-缬氨酰)-哌啶-4-基]-硫基乙酰基木替灵,诸如14-O-[3-乙酰氧基-N-(N-BOC-(R)-缬氨酰)-哌啶-4-基]-硫基乙酰基木替灵,例如呈盐酸盐的形式,
-14-O-[3-羟基-N-(N-BOC-组氨酰基)-哌啶-4-基]-硫基乙酰基木替灵,诸如14-O-[3-羟基-N-(N-BOC-(R)-组氨酰基-哌啶-4-基)-硫基乙酰基木替灵,例如呈二盐酸盐的形式,
-14-O-[3-羟基-N-(N-BOC)-缬氨酰-哌啶-4-基]-甲基氨基乙酰基木替灵,诸如14-O-[3-羟基-N-(N-BOC)-(R)-缬氨酰-哌啶-4-基]-甲基氨基乙酰基木替灵,例如呈二盐酸盐的形式,
-14-O-[4-羟基-N-(N-BOC)-缬氨酰-哌啶-3-基]-甲基氨基乙酰基木替灵,诸如14-O-[4-羟基-N-(N-BOC)-(R)-缬氨酰-哌啶-3-基]-甲基氨基乙酰基木替灵,例如呈二盐酸盐的形式,
-14-O-[N-(N-BOC-缬氨酰)-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵,诸如14-O-[N-(N-BOC-(R)-缬氨酰)-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵,
-14-O-[N-(N-BOC-缬氨酰)-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵,诸如14-O-[N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵。
在式I或式II化合物中,基团X可连接到哌啶或四氢吡啶环的除1位之外的任何位置上,例如可以在2、3、4、5或6位上,优选在3或4位上。在式I或式II化合物中,基团R6或基团R8可以分别在哌啶或四氢吡啶环的除1位之外的任何位置上,例如在2、3、4、5或6位上,优选在3或4位上。当在2或6位上时,R8优选是烷基,例如(C1-20)烷基。在优选的式I或式II化合物中,基团X在3位或4位上,R6或基团R8分别在3或4位上。
在式I或式II化合物中,所有的单一取代基均是优选的取代基,例如彼此独立的是所定义的取代基。
本发明所用的“(N-保护的)氨基酸的残基”是指在式I或式II化合物中将所述的(保护的)氨基酸的羰基连接到下式基团的氮上并且,所述氨基酸官能团的-OH基团是缺失的,即,环的N被氨基酸的羧基所酰化。优选(N-保护的)-氨基酸的残基是(N-保护的)-α-氨基酸、例如天然存在的α-氨基酸的残基,例如(N-保护的)-缬氨酰或(N-保护的)-组氨酰基,优选(N-保护的)-R-缬氨酰。
本发明提供的化合物、例如式I或式II化合物在下文中称为“本发明的化合物”。本发明的化合物包括任何形式例如游离形式、盐形式、溶剂化物形式以及盐和溶剂化物形式的化合物。式II化合物是式I化合物的制备过程中的有用中间体。然后,式II化合物也可以表现出例如与式I化合物相类似的药物活性。
另一方面,本发明提供了盐形式的式I或式II化合物。
所述的盐优选包括可药用盐,尽管例如为了制剂/分离/纯化目的也包括不可药用的盐。
本发明的化合物的盐包括酸加成盐。酸加成盐包括式I或式II化合物与酸形成的盐,例如富马酸氢盐、富马酸盐、奈1,5-磺酸盐、盐酸盐、氘氯酸盐;例如盐酸盐或氘氯酸盐,优选盐酸盐。可将本发明的化合物转化成盐形式的相应化合物;反之亦然。可将游离形式或盐形式并且呈溶剂化物形式的本发明化合物转化成非溶剂化物形式的游离形式或盐形式的相应化合物;反之亦然。
本发明的化合物可以以纯异构体或其混合物、例如旋光异构体、非对映异构体、顺/反构象异构体的形式存在。本发明的化合物可例如含有不对称碳原子,并因此可以以对映体或非对映异构体及其混合物、例如消旋体的形式存在。任何不对称的碳原子、例如R6和X连接于其上的不对称碳原子可以以(R)-、(S)-或(R,S)-构型、优选以(R)-或(S)-构型存在。例如,在式I或式II化合物中,经由基团X连接到哌啶环的基团可以是(R)-或(S)-构型或其混合物的形式。例如氨基酸残基、例如酰化哌啶环的氮原子的缬氨酰或组氨酰基残基的胺基团可以是(S)-构型、(R)-构型或其混合物的形式。异构体混合物可在适当时例如按照常规方法进行分离以得到纯异构体。本发明包括任何异构体形式和任何异构体混合物形式的本发明的化合物。在互变异构体存在的情况下,本发明还包括式I或式II的互变异构体。优选本发明的化合物的木替灵环中的构型与天然木替灵中的构型相同。
异构体混合物可以根据需要例如按照类似于常规方法的方法进行分离,以得到纯异构体。
另一方面,本发明提供了制备式I或式II化合物的方法,该方法包括以下步骤:
a)将式III或式III’化合物
其中Prot是保护基,例如BOC,X′是-SH或-NH-ALK,并且R6、R8和ALK如上所定义,
与22-O-甲苯磺酰基-截短侧耳素和t-But-OK反应以得到式II化合物,其中R7是保护基,例如BOC,其它残基如上所定义,
b)将步骤a)中得到的化合物中的哌啶环的氮基团例如通过用HCl的乙醚溶液进行脱保护以得到式I化合物,其中R5是氢,其它残基如上所定义,
c)将步骤b)中得到的化合物与氨基被保护的例如用BOC-保护的氨基酸例如缬氨酸或组氨酸反应以得到式II化合物,其中R7是保护的氨基酸、例如保护的缬氨酸或组氨酸,优选BOC-保护的缬氨酸或组氨酸的残基,其它残基如上所定义,
d)将步骤c)中得到的化合物的氨基酸残基的氨基进行脱保护以得到式I化合物,其中R5是氨基酸的残基,例如缬氨酰或组氨酰基;例如呈盐的形式,例如盐酸盐的形式,
e)任选地将氘引入到步骤d)中得到的式I化合物中以得到如下式I化合物,其中R2、R3和R4是氘,R1、R’1和R5如上所定义,
B1)如果四氢吡啶基是1,2,3,6-四氢吡啶基,
a)将下式化合物
其中Prot′是保护基或者是保护的氨基酸的残基,例如,其中保护的氨基酸的残基如上所定义,并且Prot″是保护基,例如-CO-CH3,
在DBU的存在下反应以得到式V化合物
其中Prot′和Prot″如上所定义,
b)将保护基Prot″从式V化合物中除去以得到式VI化合物
其中Prot′如上所定义,
c)将式VI化合物中的羟基与甲磺酰氯反应并将得到的甲磺酸酯与硫代截短侧耳素或HN-烷基-截短侧耳素反应得到式II化合物,其中是1,2,3,6-四氢吡啶基,其它残基如上所定义,然后
d)如果Prot′是保护基的话,除去保护基Prot′以得到式I化合物,其中是1,2,3,6-四氢吡啶基,R5是氢且其它残基如上所定义;或者,如果Prot′是保护的氨基酸的残基的话,从保护的氨基酸的残基上除去保护基得到式I化合物,其中是1,2,3,6-四氢吡啶基,R5是氨基酸的残基且其它残基如上所定义;
B2)如果四氢吡啶基是1,4,5,6-四氢吡啶基,
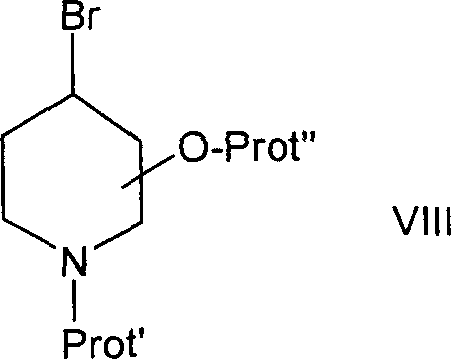
a)将式VII化合物
其中X′和Prot′如上所定义,
与22-O-甲苯磺酰基截短侧耳素在正丁基锂的存在下反应以得到式II化合物,其中是1,4,5,6-四氢吡啶基,R7是Prot′,其中Prot′如上所定义且其它残基如上所定义,然后
b)如果Prot′是保护基的话,除去保护基Prot′以得到式I化合物,其中是1,4,5,6-四氢吡啶基,R7是氢且其它残基如上所定义;或者,如果Prot′是保护的氨基酸的残基的话,从保护的氨基酸的残基上除去保护基得到式I化合物,其中是1,4,5,6-四氢吡啶基,R5是氨基酸的残基且其它残基如上所定义。
在本发明另一个优选的方面中,式II化合物以及例如按照本发明的步骤b)至f)得到的式I化合物,其中是哌啶基,X是S且R6是氢,
可以通过如下方法来制备:将式IV化合物
与硫代截短侧耳素和Al2O3反应得到式II化合物的混合物,其中R7是保护基,例如BOC,并且其中,在该混合物的一种化合物中,羟基在3位上,并且硫代截短侧耳素的硫基团在哌啶环的4位上,在该混合物的另一种化合物中,羟基在4位上,并且硫代截短侧耳素的硫基团在哌啶环的3位上。可以将该区域异构体混合物
-相分离以得到纯净的式II化合物,将所述的纯净的式II化合物按照本发明的步骤b)至f)进一步处理以得到纯净的式I化合物;或
-将式II化合物的区域异构体混合物按照本发明的步骤b)至f)进一步处理以得到式I化合物的相应区域异构体的混合物,将该混合物相分离以得到纯净的式I化合物。
区域异构体的分离可以在适当时例如通过色谱法进行。
如果在本发明的步骤A)c)中以(R)-形式例如(R)-缬氨酸、(R)-组氨酸的形式使用氨基酸,则得到其中连接到哌啶环的氮原子上的(保护的)氧基酸基团的胺基团是(R)-构型的式I或II化合物;并且,如果在本发明的步骤A)c)中以(S)-形式例如(S)-缬氨酸、(S)-组氨酸的形式使用氨基酸,则得到其中连接到哌啶环的氮原子上的(保护的)氨基酸基团的胺基团是(S)-构型的式I或II化合物。
制备过程中的保护基包括适当的保护基,例如用于有机化学、例如截短侧耳素或木替灵化学的保护基,例如常规保护基诸如BOC或-CO-CH3。
如需要,可以例如按照常规方法或者按照本文所述的方法将式I或式II化合物、例如呈盐形式的化合物中的氢原子用氘原子代替,例如通过用氘氯酸(DCl)在适当的溶剂(体系)中处理式I或式II化合物,然后分离出式I或式II化合物、例如盐形式的化合物,其中例如在R2、R3和R4的含义中的氢原子被氘原子代替。其中的R1和R’1是氘的式I或式II化合物的制备可以在适当时例如按照常规方法、例如通过用氘处理下式化合物来进行:
其中携带R1和R’1(它们都是氢)的碳原子一起形成双键,其中R2、R3和R4是氢(它们是已知化合物),从而得到式IX化合物,其中R1和R’1是氘且R2、R3和R4是氢;然后将式IX化合物(其中R1和R’1是氘且R2、R3和R4是氢)在适当时例如按照常规方法进一步反应以得到式I或式II化合物,其中R1和R’1是氘且R2、R3和R4是氢。R是在化学反应中不受氘加成影响的残基,例如-CO-CH2OH。
在式I化合物的制备中,中间体包括式III、III′、IV、V、VI、VII、VIII或IX的化合物,它们是已知的或者可以按照常规方法来得到。本文所述的任何化合物均可以按照例如类似于常规方法的方法或者按照本文所述的方法进行制备。
本发明的化合物、包括例如式I化合物,表现出药理活性,因此可用作药物。式II化合物是式I化合物的制备过程中的有用中间体,然而它也可以具有例如类似于式I化合物的药理活性。
例如,按照国家临床实验室标准委员会(NCCLS)1997,文档号M7-A4Vol.17,No.2:“Methods for dilution Antimicrobial Susceptibility Testsfor Bacteria that Grow Aerobically-第4版,Approved Standard”中的描述,在体外琼脂稀释试验或微量稀释试验中,以及例如在小鼠的全身性感染的体内试验中证实,本发明的活性化合物(例如以及式II化合物)表现出抗微生物活性,例如抗革兰氏阳性菌和革兰氏阴性菌的抗菌活性,例如抗革兰氏阴性菌如大肠杆菌,以及抗革兰氏阳性菌如金黄色酿脓葡萄球菌以及酿脓链球菌和肺炎链球菌、支原体、衣原体、螺杆菌属和专性厌氧菌,例如脆弱拟杆菌(Bacteroides fragilis)的活性。本发明的活性化合物显示出出人意料的总活性谱。
另一方面,本发明提供了用作药物、优选用作抗微生物的药物诸如抗生素的式I化合物或者式II化合物。
对于药物应用,本发明的化合物包括一种或多种、优选一种本发明的化合物,例如本发明的两种或多种化合物的组合。
在另一方面,本发明提供了本发明的化合物、例如式I或式II化合物在制备用于治疗由微生物引起的疾病的药物、例如药物组合物中的用途,所述疾病是例如由细菌例如金黄色酿脓葡萄球菌、酿脓链球菌、肺炎链球菌、支原体、衣原体,例如沙眼衣原体、肺炎衣原体、专性厌氧菌,例如包括例如肺炎链球菌的耐青霉素或多重耐药的菌株;例如包括例如屎肠球菌的万古霉素耐药性菌株;例如包括例如金黄色酿脓葡萄球菌的甲氧苯青霉素的耐药性菌株,和螺杆菌属、例如幽门螺旋杆菌引起的疾病。
另一方面,本发明提供了用于制备治疗微生物引起的疾病的药物的本发明的化合物或本发明的药物组合物。
另一方面,本发明还提供了治疗微生物引起的疾病的方法,该方法包括给需要所述治疗的个体施用有效量的本发明的化合物、例如式I或式II化合物,例如以药物组合物的形式。
治疗包括治疗和预防。
对于微生物引起的疾病的治疗,合适的剂量当然取决于例如所用的本发明化合物的化学性质和药动学数据、宿主、给药方式以及所治疗的病症的性质和严重程度。然而,一般情况下,为了在较大的哺乳动物例如人中获得令人满意的结果,推荐的日剂量为约0.1-3g、例如0.00125g/kg至0.0375g/kg本发明的化合物,活性化合物可例如以分开的剂量每天给药最高达4次。
本发明的化合物可通过任何常规的途径给药,例如肠道给药,例如包括鼻、颊、直肠、口服给药;胃肠外给药,例如包括静脉内、肌肉内、皮下给药;或局部给药,例如包括经皮给药、鼻内给药、气管内给药,例如以包衣或未包衣的片剂、胶囊、可注射溶液或混悬液的形式,例如以安瓿、小药瓶的形式,以霜剂、凝胶、糊剂、吸入粉末、泡沫剂、酊剂、唇膏剂、滴剂、喷雾剂的形式,或以栓剂的形式,例如以类似于大环内酯例如克拉霉素和阿奇霉素的形式给药。
本发明的化合物可以以下列形式给药:可药用盐的形式,例如酸加成盐或金属盐的形式;或游离形式;任选地以溶剂化物的形式。盐形式的本发明的化合物表现出与游离形式、任选的溶剂化物的形式的本发明的化合物相同程度的活性。
根据本发明,本发明的化合物可单独用于药物治疗或者与一种或多种其它药物活性剂相组合。所述的其它药物活性剂包括例如其它抗生素。所述的组合包括固定组合,其中两种或多种药物活性剂是在同一制剂中;药盒,其中两种或多种药物活性成分是在不同的制剂中并在同一包装中销售,例如,带有给药的说明;以及自由组合,其中,药物活性成分分别包装,但给出了用于同时或顺序给药的说明。
另一方面,本发明提供了一种药物组合物,其包含游离或可药用盐形式例如和/或溶剂化物形式的本发明化合物、例如式I化合物或例如式II化合物;以及至少一种药用赋形剂、例如载体或稀释剂,例如包括填充剂、粘合剂、崩解剂、流动调节剂、润滑剂、糖和甜味剂、芳香剂、防腐剂、稳定剂、润湿剂和/或乳化剂、增溶剂、用于调节渗透压的盐和/或缓冲剂。
另一方面,本发明提供了本发明的药物组合物,其还包含另一种药用活性剂。
所述的药物组合物可以按照例如类似于常规方法的方法例如通过混合、造粒、包衣、溶解或冷冻干燥过程来生产。
单位剂型可含有例如约0.5mg至约1500mg,诸如1mg至约500mg,例如1mg至约100mg活性成分。
本发明的化合物还适宜用作兽药,例如用作兽药活性化合物,例如用于预防和治疗动物例如家禽、猪和牛中的微生物疾病例如细菌性疾病;和例如用于稀释人工授精用液体以及卵浸泡技术。
另一方面,本发明提供了用作兽药的式I或式II化合物。
另一方面,本发明还提供了用于制备用作兽药的兽药组合物的式I或式II化合物。
另一方面,本发明提供了预防和治疗微生物疾病例如细菌性疾病的兽医方法,该方法包括给需要所述治疗的个体施用有效量的式I或式II化合物,例如以兽药组合物的形式。
对于本发明活性化合物作为兽药的应用,剂量当然取决于动物的大小和年龄以及所需的疗效;例如,对于预防性治疗,可在较长的时间内例如1-3周内施用较低剂量。在饮用水中的优选剂量为0.0125-0.05g/ml,特别是0.0125-0.025g/ml;在饲料中,剂量为20-400g/公吨,优选为20-200g/公吨。优选将本发明的活性化合物作为兽药在饮用水中对母鸡给药,在饲料中对猪给药,对牛以例如口服或胃肠外给药用制剂的形式口服给药或胃肠外给药。
另一方面,本发明提供了式I化合物:
其中
R1P2和R`1P2是氢或氘,
R2P2、R3P2和R4P2是氢或氘,并且
R5P2是氢或氨基酸的残基。
另一方面,本发明提供了式I化合物:
其中
R1P3和R`1P3是氢或氘,
R2P3、R3P3和R4P3是氢或氘,
R5P3是氢或氨基酸的残基,
X是S或N-ALK,
虚线之一是化学键且另一个不是化学键;或者虚线之一是连接到哌啶环的2、3、4、5或6位上的基团-Oac且另一个虚线不是化学键,
ALK是(C1-4)烷基,例如甲基,并且
Ac是氢或(C2-12)酰基,例如基团-CO-CH3,
条件是:如果X是S且虚线之一是基团OAc且另一个虚线不是化学键,则Ac不是氢。
在以下实施例中,所有温度都是摄氏度(℃),并且未校正。
使用下列缩写词:
BOC 叔丁基氧基羰基
DBU 1,8-二氮杂双环[5.4.0]十一碳-7-烯(1,5-5)
Diast. 非对映异构体的混合物
EDC N-(3-二甲基氨基丙基)-N-乙基碳二亚胺
EE 乙酸乙酯
EtOH 乙醇
EX 实施例
HOBT 羟基苯并三唑
RT 室温
THF 四氢呋喃
TBAF 氟化四丁铵
t-But-OK 叔丁醇钾
1H-NMR数据在CDCl3中确定,如果没有特别指明的话。
缬氨酰和N-BOC-缬氨酰是下式的基团
组氨酰基和N-BOC-组氨酰基是下式的基团
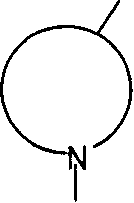
N-BOC-3,4-环氧-哌啶是下式的基团
截短侧耳素是下式的化合物
以下基团
是缺少基团-CO-CH2OH的式截短侧耳素的基团
硫代截短侧耳素是下式化合物
HN-烷基-截短侧耳素是下式化合物
实施例1
14-O-[N-BOC-4-羟基-哌啶-3-基]-硫基乙酰基木替灵和14-O-[N-BOC-3-羟基-哌啶-4-基]-硫基乙酰基木替灵
将40g用THF润湿的(中性)活化Al2O3用1.576g硫代截短侧耳素的5ml THF溶液处理,然后向得到的混合物中加入0.398g溶于3ml THF的N-BOC-3,4-环氧-哌啶。从得到的混合物中滤出Al2O3,从得到的滤液中蒸除溶剂,然后将包含14-O-[N-BOC-4-羟基-哌啶-3-基]-硫基乙酰基木替灵和14-O-[N-Boc-3-羟基-哌啶-4-基]-硫基乙酰基木替灵的混合物的蒸发残余物进行色谱分离。得到14-O-[N-BOC-3-羟基-哌啶-4-基]-硫基乙酰基木替灵和14-O-[N-BOC-4-羟基-哌啶-3-基]-硫基乙酰基木替灵。
14-O-[N-BOC-3-羟基-哌啶-4-基]-硫基乙酰基木替灵还可以通过以下方法得到:将0.466g N-BOC-3-羟基-4-巯基哌啶的10ml THF溶液与0.224gt-But-OK的20ml THF溶液反应,向得到的混合物中加入1.064g 22-O-甲苯磺酰基截短侧耳素的5ml THF溶液,向得到的混合物中滴加1ml 2-丁酮,在RT下搅拌然后进行色谱纯化。
实施例2
14-O-[4-羟基-N-(N-BOC-缬氨酰-哌啶-3-基]-硫基乙酰基木替灵
将1.5mmol溶于5ml CH2Cl2的14-O-[4-羟基-哌啶-3-基]-硫基乙酰基木替灵用1.5mmol HOBT、1mmol(R)-BOC-缬氨酸和1.5mmol EDC处理并在RT下搅拌。从得到的混合物中蒸发溶剂,将得到的蒸发残余物与EE相混合,然后将得到的混合物用0.1N HCl和饱和NaHCO3水溶液萃取。将得到的有机相干燥然后蒸发溶剂。得到14-O-[4-羟基-N-(N-BOC-(R)-缬氨酰-哌啶-3-基-硫基乙酰基木替灵。
实施例3
14-O-[4-羟基-N-(R)-缬氨酰]-哌啶-3-基]-硫基乙酰基木替灵
将1mmol 14-O-[4-羟基-N-(N-BOC-(R)-缬氨酰-哌啶-3-基-硫基乙酰基木替灵的5至8ml CH2Cl2溶液用1至2ml HCl的乙醚溶液处理,然后将得到的混合物在RT下搅拌,沉淀出盐酸盐形式的14-O-[4-羟基-N-(R)-缬氨酰)-哌啶-3-基]-硫基乙酰基木替灵,然后通过过滤分离。
实施例4
14-O-[N-(N-BOC-缬氨酰)-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵
a)3-甲磺酰基氧基-N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶
将0.894g溶于10ml CH2Cl2的N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶-3-醇用0.844g 4-二甲基氨基吡啶和0.31g甲磺酰氯处理并搅拌约24小时,然后将得到的混合物用0.1N HCl和CH2Cl2处理,将得到的有机相用H2O和NaHCO3水溶液洗涤,蒸发溶剂并将蒸发残余物干燥。得到3-甲磺酰基氧基-N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶。1H-NMR(CDCl3):6.1-5.85(m,2H,HIV,HV),4.5(m,1H,NHCHCO),3.7(s,3H,CH3SO2),1.2-0.9(m,6H,(CH3H3)2。
b)14-O-[N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替
灵
将0.235g溶于5ml THF的t-But-OK用硫代截短侧耳素的10ml THF溶液处理,然后向得到的混合物中滴加0.789g 3-甲磺酰基氧基-N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶的10ml THF溶液。将得到的混合物加热至90°并在RT下搅拌。将得到的混合物用稀HCl处理,将得到的有机相洗涤并蒸发溶剂。得到14-O-[N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵。
实施例5
14-O-[N-BOC-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵
将2.72ml二异丙基胺的40ml THF溶液周12ml正丁基锂(1.6M的己烷溶液)在-40°下处理,然后将得到的混合物搅拌,加热至-10°,然后滴加3.44g N-BOC-1,2,5,6-四氢吡啶的20ml THF溶液。向得到的混合物中加入22-O-甲苯磺酰基截短侧耳素的10ml THF溶液和1ml 2-丁酮,然后将得到的混合物在RT下搅拌。将得到的包含14-O-[N-BOC-1,4,5,6-四氢吡啶-4(R*)-基]-硫基乙酰基-木替灵(化合物A)和14-O-[N-BOC-1,4,5,6-四氢吡啶-4(S*)-基]-硫基乙酰基木替灵(化合物B)的混合物进行色谱法,得到纯化合物A和纯化合物B。
实施例6
14-O-[N-(N-BOC-缬氨酰)-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵
将4.53ml二异丙基胺的30ml THF溶液用正丁基锂(1.6M的正己烷溶液)在-40℃下处理。将得到的混合物搅拌,加热至-10℃,然后加入5.02g 3,4-环硫-N(N-BOC-(R)-缬氨酰)-哌啶的30ml THF溶液。将得到的混合物在-10℃下搅拌约3小时,然后加入22-O-甲苯磺酰基截短侧耳素在20ml THF和5ml 2-丁酮中的溶液并将得到的混合物在RT下搅拌。将得到的混合物进行萃取后处理和色谱分离。得到14-O-[N-(N-BOC-(R)-缬氨酰)-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵。
按照与前述实施例相类似的方式,但使用适当的原料来制备下式化合物
其中X、REX和R1EX如下表1中所示。如果以盐的形式得到化合物,则在第6栏中指出。所得到的化合物(任选地以盐的形式)的1H-NMR也在表1中列出。
表1
原料的制备
实施例A-硫代截短侧耳素
a)异硫脲鎓盐形式的硫代截短侧耳素
将106.4g 22-O-甲苯磺酰基截短侧耳素、15.2g硫脲和250ml丙酮的混合物回流约1.5小时,冷却,然后从得到的混合物中蒸发溶剂并将蒸发残余物真空干燥。得到异硫脲鎓盐形式的硫代截短侧耳素。1H-NMR:9.82,8.42(2xb,2H,NH2),7.78,7.2(2xd,4H,芳香H甲苯磺酰基,J=15.8Hz)
a)硫代截短侧耳素
将24.4g溶于40ml无水EtOH的异硫脲鎓盐形式的硫代截短侧耳素用70ml H2O稀释并加热至90℃。将得到的混合物用7.6g亚硫酸氢钠的35mlH2O溶液处理,然后向得到的混合物中加入200ml CH2Cl2。将得到的混合物在90℃下加热约1.5小时并冷却。形成两相并进行分离,将得到的有机相洗涤,干燥,蒸发溶剂,然后将蒸发残余物通过硅胶过滤。得到硫代截短侧耳素。
1H-NMR:6.48(dd,1H,H19,J19,20顺=11Hz,J19,20反=16.5Hz),5.75(d,1H,H14,J13,14=8.5Hz),5.38(dd,1H,H20,J20,20=1.5Hz),5.2(dd,1H,H20反),3.38(dd,1H,H11,J11,OH=10.4Hz,J11,10=6.6Hz),ABX-系统:VA=3.21,VB=3.18,VX=1.9(H22,J22,sH=8.2Hz,JAB=15.1Hz,JAX=8.2Hz),2.35(quint.1H,H10,J10,17=8.2Hz),2.28,2.2(2H,HH2α,2β,J2α,2β=15.5Hz,J2α,1α=J2α,1β=5.5Hz),2.19(dd,1H,H13,J13,13=16Hz,J13,14=8.5Hz),2.12(b,1H,H4),1.9(t,1H,SH,J22,sH=8.2Hz),1.79,176(2xq,1H,H8equ.,J7,8equ=3.01Hz,J8,8=14.5Hz),1.67(m,2H,H1,H6),1.57,1.53(2xm,1H、H7ax),1.45(s,3H,(CH3)15),1.39,1.36(2xq,1H,H7q,J7,7=7.23Hz),1.33(d,1H,H13′),1.18(s,3H,(CH3)18),1.12(dd,1H,H8ax,J7,8ax=1.14Hz),0.89(d,3H,(CH3)17,J10,17=6.54Hz),0.74(d,3H,(CH3)16,J6,16=6.5Hz)。1H-NMR(d6-DMSO):2.85(s,1H,SH)。
实施例B-N-BOC-3,4-环氧-哌啶
a)N-BOC-1,2,5,6-四氢吡啶
向1.66g 1,2,5,6-四氢吡啶的25ml CH2Cl2溶液中加入2.02g N-甲基吗啉,然后将得到的混合物用4.36g(BOC)2O的30ml CH2Cl2溶液处理并将得到的混合物在RT下搅拌约36小时。得到N-BOC-1,2,5,6-四氢吡啶。
1H-NMR:5.82(m,1H,HIV),5.64(m,1H,HIII),3.86(b,2H,HII),3.47(t,2H,HVI),2.12(b,1H,HV),1.46(m,9H,(CH3)3)。
b)N-BOC-3,4-环氧-哌啶
向3.29g N-BOC-1,2,5,6-四氢吡啶的25ml CH2Cl2溶液中加入6.2g氯过苯甲酸的50ml CH2Cl2悬浮液,然后将得到的混合物在RT下搅拌约12小时。将得到的混合物用饱和NaHCO3水溶液和0.5m Na2SsO3水溶液萃取,然后将得到的有机相洗涤,干燥并蒸发溶剂。得到N-BOC-3,4-环氧-哌啶。
1H-NMR:3.9,3.65,3.45,3.1(4xm,4H,HII,HVI),3.28,3.2(2xm,2H,HIII,HIV),2.05,1.9(2xm,2H,HV),1.45(s,9H,(CH3)3)。
实施例C-N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶-3-醇
a)N-(N-BOC-缬氨酰-1,2,5,6-四氢吡啶
将1.245g四氢吡啶的50ml CH2Cl2溶液用1.5mmol/mmol四氢吡啶的HOBT溶液、2.17g N-BOC-(R)-缬氨酸和1.5mmol/mmol四氢吡啶的EDC溶液处理并将得到的混合物在RT下搅拌。从得到的混合物中蒸发溶剂,将得到的蒸发残余物与EE混合并将得到的混合物用0.1N HCl和饱和NaHCO3水溶液萃取。将得到的有机相干燥并蒸发溶剂。得到N-(N-BOC-(R)-缬氨酰-1,2,5,6-四氢吡啶。
b)3,4-环氧-N-(N-BOC-缬氨酰-1,2,5,6-四氢吡啶
向2.82g N-(N-BOC-(R)-缬氨酰-1,2,5,6-四氢吡啶的75ml CH2Cl2溶液中缓慢加入3.44g间氯过苯甲酸的50ml CH2Cl2溶液并将得到的混合物搅拌过夜。将得到的混合物用NaHCO3水溶液和0.5m Na2S2O3水溶液萃取,将得到的各相分离,然后从得到的有机相中真空蒸发溶剂。得到3,4-环氧-N-(N-BOC-(R)-缬氨酰-1,2,5,6-四氢吡啶。1H-NMR:旋转异构体:5.3(m,1H,NHCHCO),4.4(m,1H,NHCHCO),4.3,4.1,4.0(3dd,1H,HIII,J=15.6Hz),3.88,3.78,3.65(3xd,1H,HIV,J=15.6Hz),3.6,3.45,3.3(3xm,4H,HII、HVI),1.45(b,9H(CH3)3),1.0-0.85(m,6H,CH(CH3)2)。
c)溴-N-(N-BOC-缬氨酰)-哌啶-3-醇
将0.5g Ph3PBr2的10ml CH2Cl2溶液用0.289g 3,4-环氧-N-(N-BOC-(R)-缬氨酰-1,2,5,6-四氢吡啶的10ml CH2Cl2溶液处理。将得到的混合物倒入冰/NaHCO3的混合物中,然后将各相分离,洗涤,干燥并蒸发溶剂。得到4(R*)-溴-N-(N-BOC-(R)-缬氨酰)-哌啶-3(R*)-醇(化合物A)和4(S*)-溴-N-(N-BOC-(R)-缬氨酰)-哌啶-3(S*)-醇(化合物B)的混合物,然后通过色谱法分离。
化合物A:1H-NMR:旋转异构体:5.2(m,1H,NHCHCO),4.3(t,1H,NHCHCO,J=6.5Hz),4.25(m,1H,HIV),3.88(m,1H,HIII),2.4,1.85(2xm,2H,HV),1.43(b,9H(CH3)3),0.98,0.92(2xd,6H,CH(CH3)2,J=7Hz)。
化合物B:1H-NMR:旋转异构体:5.25(d,1H,NHCHCO,J=6.7Hz),4.45(m,1H,NHCHCO),4.15(m,1H,HIV),3.75(m,1H,HIII),2.55,2.3(2xm,2H,HV),1.9(m,1H,CH(CH3)2),1.42(b,9H(CH3)3),0.9(m,6H,CH(CH3)2)。
d)3-乙酰氧基-4-溴-N-(N-BOC-缬氨酰)-哌啶
将0.57g溶于吡啶的溴-N-(N-BOC-缬氨酰)-哌啶-3-醇用0.4ml乙酸酐处理,将得到的混合物搅拌,得到3(R*)-乙酰氧基-4(R*)-溴-N-(N-BOC-(R)-缬氨酰)-哌啶(化合物A)和3(S*)-乙酰氧基-4(S*)-溴-N-(N-BOC-(R)-缬氨酰)-哌啶(化合物B)的混合物,然后通过色谱法分离。
化会物A:1H-NMR(d6-DMSO,350K):6.4(b,1H,NHCHCO),4.73(dt,1H,NHCHCO,J=3.9Hz,J=7.7Hz),4.38(dt,1H,HIII,J=4.4Hz,J=8.8Hz),4.18(m,1H,NHCHCO),4.05,3.8,3.35(3m,4H,HII,HVI),2.3(s,3H,OCOCH3),1.38(s,9H(CH3)3),0.85(d,6H,CH(CH3)2,J=7Hz)。
化合物B:1H-NMR(d6-DMSO,350K):6.5(b,1H,NHCHCO),4.72(dt,1H,HIV,J=4.0Hz,J=7.7Hz),4.38(dt,1H,HIII,J=4.4Hz,J=8.6Hz),4.2(m,1H,NHCHCO),4.11,3.78,3.3(3m,4H,HII,HVI),2.3(s,3H,OCOCH3),1.37(s,9H,(CH3)3),0.85(d,6H,CH(CH3)2,J=7Hz)。
e)3-乙酰氧基-N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶
将1.684g溶于4ml甲苯的3-乙酰氧基-4-溴-N-(N-BOC-缬氨酰)-哌啶用4ml DBU在密封管中处理并加热至90℃。将得到的混合物用EE处理,用HCl溶液萃取,洗涤,然后从得到的有机相中蒸发溶剂中。得到3-乙酰氧基-N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶。
1H-NMR:旋转异构体/Diast:5.95,5.85,5.25,5.15(4xm,2H,HIV,HV),4.51,4.4(2xdd,1H,NHCHCO,J=5.2Hz,J=9Hz),4.45,4.15(2xd,1H,HVI,J=15.2Hz),3.4,3.2(2xdd,1H,HVI,J=3.5Hz),2.02,2.0,1.95(3xs,3H,OCOCH3),1.35(s,9H,(CH3)3),0.85(m,6H,CH(CH3)2)。
f)N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶-3-醇
将0.254g溶于5ml EtOH的3-乙酰氧基-N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶用2N NaOH的乙醇溶液在冰冷却下处理。向得到的混合物中加入乙酸以中和反应混合物,然后蒸发溶剂。将得到的蒸发残余物与CHCl3相混合,将得到的混合物用NaCl溶液洗涤,将有机相干燥并蒸发溶剂。得到N-(N-BOC-(R)-缬氨酰)-1,2,3,6-四氢吡啶-3-醇。1H-NMR:5.9(m,2H,HIV,HV)、4.51,4.45(2xdd,1H,NHCHCO,J=5.2Hz,J=9.0Hz),1.4(b,9H,(CH3)3),0.9(m,6H,CH(CH3)2)。
实施例D-甲基氨基乙酰基木替灵
将13.33g 22-O-甲苯磺酰基截短侧耳素的350ml EtOH溶液用5mlCH3NH2(33%的EtOH溶液)处理,将得到的混合物回流约30小时,然后从得到的混合物中蒸发溶剂。将蒸发残余物用EE处理并将得到的混合物用0.1N HCl萃取。将得到的水相用NaHCO3处理并用EE萃取。将得到的有机相干燥并蒸发溶剂。得到甲基氨基乙酰基木替灵。1H-NMR:AB-体系:VA=3.32,VB=3.22(2H,H22,J22,NCH3=15Hz),2.42(s,3H,CH3NH)。
实施例E
N-BOC-1,2,5,6-四氢吡啶
将1.66g 1,2,5,6-四氢吡啶的25ml CH2Cl2溶液用2.02g N-甲基-吗啉处理。向得到的混合物中加入4.36g(BOC)2O的30ml CH2Cl2溶液并将得到的混合物反应约36小时。将得到的混合物进行水萃取,将有机相干燥并蒸发。得到N-BOC-1,2,5,6-四氢吡啶。1H-NMR:5.82(m,1H,HIV),5.64(m,1H,HIII),3.86(b,2H,HII),3.47(t,2H,HVI),2.12(b,1H,HV),1.46(m,9H,(CH3)3)。
实施例F
3,4-环硫-N(N-BOC-缬氨酰)-哌啶
将2.91g KSCN的3ml H2O溶液加入到5.96g 3,4-环氧-N-(N-BOC-缬氨酰-1,2,5,6-四氢吡啶在10ml无水乙醇中的混合物中并将得到的混合物在RT下搅拌72小时。将得到的混合物进行水萃取,将得到的有机相蒸发溶剂,然后将蒸发残余物进行色谱法。得到3,4-环硫-N(N-BOC-(R)-缬氨酰)-哌啶。熔点:69.71°。
Claims (10)
2、权利要求1所述的化合物,该化合物选自:
14-O-[4-羟基-N-缬氨酰-哌啶-3-基]-硫基乙酰基木替灵,
14-O-[3-羟基-N-缬氨酰-哌啶-4-基]-硫基乙酰基木替灵,
14-O-[3-羟基-N-组氨酰基-哌啶-4-基]-硫基乙酰基木替灵,
14-O-[3-羟基-N-缬氨酰-哌啶-4-基]-甲基氨基乙酰基木替灵,
14-O-[4-羟基-N-缬氨酰-哌啶-3-基]-甲基氨基乙酰基木替灵,
14-O-[N-缬氨酰-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵和
14-O-[N-缬氨酰-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵。
4、权利要求3所述的化合物,该化合物选自:
14-O-[N-BOC-4-羟基-哌啶-3-基]-硫基乙酰基木替灵、
14-O-[N-BOC-3-羟基-哌啶-4-基]-硫基乙酰基木替灵、
14-O-[4-羟基-N-BOC-哌啶-3-基]-甲基氨基乙酰基木替灵、
14-O-[3-羟基-N-BOC-哌啶-4-基]-甲基氨基乙酰基木替灵,
14-O-[N-BOC-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵,
14-O-[4-羟基-N-(N-BOC-缬氨酰)-哌啶-3-基]-硫基乙酰基木替灵,
14-O-[3-羟基-N-(N-BOC-缬氨酰)-哌啶-4-基]-硫基乙酰基木替灵,
14-O-[4-乙酰氧基-N-(N-BOC-缬氨酰)-哌啶-3-基]-硫基乙酰基木替灵,
14-O-[3-乙酰氧基-N-(N-BOC-缬氨酰)-哌啶-4-基]-硫基乙酰基木替灵,
14-O-[3-羟基-N-(N-BOC-组氨酰基)-哌啶-4-基]-硫基乙酰基木替灵,
14-O-[3-羟基-N-(N-BOC)-缬氨酰-哌啶-4-基]-甲基氨基乙酰基木替灵,
14-O-[4-羟基-N-(N-BOC)-缬氨酰-哌啶-3-基]-甲基氨基乙酰基木替灵,
14-O-[N-(N-BOC-缬氨酰)-1,4,5,6-四氢吡啶-4-基]-硫基乙酰基木替灵,
14-O-[N-(N-BOC-缬氨酰)-1,2,3,6-四氢吡啶-3-基]-硫基乙酰基木替灵。
5、盐形式的权利要求1至4中任一项所述的化合物。
6、用作药物的权利要求1至5中任一项所述的化合物。
7、药物组合物,其包含权利要求1至5中任一项所述的化合物和至少一种药用赋形剂。
8、权利要求7所述的药物组合物,其还包含另一种药物活性剂。
9、权利要求1至5中任一项所述的化合物或权利要求7或8所述的药物组合物在制备用于治疗微生物引起的疾病的药物中的应用。
10、治疗微生物引起的疾病的方法,该方法包括给需要所述治疗的个体施用有效量的权利要求1至5中任一项所述的化合物或权利要求7或8中任一项所述的药物组合物。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0217149.4 | 2002-07-24 | ||
| GB0217149A GB0217149D0 (en) | 2002-07-24 | 2002-07-24 | Organic compounds |
| GB0217305A GB0217305D0 (en) | 2002-07-25 | 2002-07-25 | Organic compounds |
| GB0217305.2 | 2002-07-25 | ||
| PCT/EP2003/003215 WO2003082260A2 (en) | 2002-03-28 | 2003-03-27 | Tuberculosis treatment using pleuromutilin derivatives |
| EPPCT/EP03/03215 | 2003-03-27 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1671663A true CN1671663A (zh) | 2005-09-21 |
| CN100355729C CN100355729C (zh) | 2007-12-19 |
Family
ID=34702496
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB038176432A Expired - Lifetime CN100355729C (zh) | 2002-07-24 | 2003-07-23 | 截短侧耳素 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US7612103B2 (zh) |
| EP (1) | EP1534678B1 (zh) |
| JP (1) | JP4611020B2 (zh) |
| CN (1) | CN100355729C (zh) |
| AT (1) | ATE377001T1 (zh) |
| AU (1) | AU2003257493A1 (zh) |
| BR (1) | BRPI0312882B8 (zh) |
| DE (1) | DE60317208T2 (zh) |
| ES (1) | ES2295657T3 (zh) |
| MX (1) | MXPA05000984A (zh) |
| PL (1) | PL373460A1 (zh) |
| RU (1) | RU2005105576A (zh) |
| SI (1) | SI1534678T1 (zh) |
| WO (1) | WO2004011431A1 (zh) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101319234B (zh) * | 2008-07-04 | 2011-02-16 | 江苏赛奥生化有限公司 | 截短侧耳素的发酵方法 |
| CN102143944A (zh) * | 2008-09-02 | 2011-08-03 | 纳布里瓦治疗股份公司 | 有机化合物 |
| CN103265487A (zh) * | 2013-06-05 | 2013-08-28 | 北京理工大学 | 截短侧耳素扩环衍生物及其制备方法和用途 |
| CN103319437A (zh) * | 2013-06-20 | 2013-09-25 | 中国农业科学院兰州畜牧与兽药研究所 | 具有噻二唑骨架的截短侧耳素类衍生物及其制备方法、应用 |
| CN103709093A (zh) * | 2012-09-28 | 2014-04-09 | 山东亨利医药科技有限责任公司 | 含有并环的截短侧耳素类抗生素 |
| CN105111117A (zh) * | 2010-05-26 | 2015-12-02 | 纳布里瓦治疗股份公司 | 制备截短侧耳素的工艺 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PE20020676A1 (es) * | 2000-09-13 | 2002-08-27 | Biochemie Gmbh | Compuestos de mutilina como antibacterianos |
| GB0308114D0 (en) * | 2003-04-08 | 2003-05-14 | Glaxo Group Ltd | Novel compounds |
| US7875630B2 (en) * | 2003-09-03 | 2011-01-25 | Glaxo Group Limited | Process salts compositions and use |
| GB0504314D0 (en) * | 2005-03-02 | 2005-04-06 | Glaxo Group Ltd | Novel polymorph |
| US20080171766A1 (en) * | 2005-03-10 | 2008-07-17 | Smithkline Beecham Corporation | Novel Method |
| GB0515995D0 (en) * | 2005-08-03 | 2005-09-07 | Sandoz Ag | Organic compounds |
| WO2007037518A1 (ja) * | 2005-09-29 | 2007-04-05 | Dainippon Sumitomo Pharma Co., Ltd. | ムチリン誘導体及びそれを含有する医薬組成物 |
| EP1808431A1 (en) * | 2006-01-16 | 2007-07-18 | Nabriva Therapeutics Forschungs GmbH | Mutilin derivatives and their use as pharmaceutical |
| EP2023721A2 (en) * | 2006-06-05 | 2009-02-18 | Auspex Pharmaceuticals Inc. | Preparation and utility of substituted erythromycin analogs |
| EP1908750A1 (en) * | 2006-10-05 | 2008-04-09 | Nabriva Therapeutics Forschungs GmbH | Process for the preparation of pleuromutilins |
| EP1972618A1 (en) * | 2007-03-20 | 2008-09-24 | Nabriva Therapeutics AG | Pleuromutilin derivatives for the treatment of diseases mediated by microbes |
| US8222407B2 (en) * | 2007-05-24 | 2012-07-17 | Kyorin Pharmaceutical Co., Ltd. | Mutilin derivative having heterocyclic aromatic ring carboxylic acid structure in substituent at 14-position |
| CN101324384A (zh) * | 2008-07-25 | 2008-12-17 | 李华玉 | 在第一类吸收式热泵上增加相邻高温供热端的方法 |
| US20100184987A1 (en) * | 2008-11-13 | 2010-07-22 | Teva Pharmaceutical Industries Ltd. | Preparation of Retapamulin via its Pleuromutilin-thiol precursor |
| CN103204787B (zh) * | 2012-01-17 | 2014-10-01 | 北京艾百诺科技有限公司 | 含有取代方酸的乙酸妙林酯及其应用 |
| CN103265442B (zh) * | 2013-06-05 | 2017-02-08 | 北京理工大学 | 一类新型截短侧耳素衍生物及其制备方法和抗肿瘤用途 |
| TWI762573B (zh) | 2017-02-10 | 2022-05-01 | 奧地利商納畢瓦治療有限責任公司 | 截短側耳素之純化 |
| CN117024367B (zh) * | 2023-08-10 | 2024-03-12 | 西华大学 | 哌嗪连接的噁唑烷酮截短侧耳素衍生物和应用及其药物组合物 |
| CN116768813B (zh) * | 2023-08-18 | 2023-10-20 | 西华大学 | 截短侧耳素衍生物和应用及其药物组合物 |
| CN120607472B (zh) * | 2025-08-06 | 2025-10-17 | 重庆市畜牧科学院 | 一种截短侧耳素衍生物及其制备方法和应用 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UY25225A1 (es) * | 1997-10-29 | 2000-12-29 | Smithkline Beecham Plc | Derivados de pleuromutilina utiles como agentes antimicrobianos |
| GB9918037D0 (en) | 1999-07-30 | 1999-09-29 | Biochemie Gmbh | Organic compounds |
| WO2001074788A1 (en) * | 2000-04-04 | 2001-10-11 | Smithkline Beecham Plc | 2-hydroxy-mutilin carbamate derivatives for antibacterial use |
| GB0018951D0 (en) | 2000-08-03 | 2000-09-20 | Smithkline Beecham Plc | Novel compounds |
| PE20020676A1 (es) | 2000-09-13 | 2002-08-27 | Biochemie Gmbh | Compuestos de mutilina como antibacterianos |
-
2003
- 2003-07-23 DE DE60317208T patent/DE60317208T2/de not_active Expired - Lifetime
- 2003-07-23 AU AU2003257493A patent/AU2003257493A1/en not_active Abandoned
- 2003-07-23 JP JP2004523769A patent/JP4611020B2/ja not_active Expired - Lifetime
- 2003-07-23 SI SI200331105T patent/SI1534678T1/sl unknown
- 2003-07-23 MX MXPA05000984A patent/MXPA05000984A/es unknown
- 2003-07-23 BR BRPI0312882A patent/BRPI0312882B8/pt not_active IP Right Cessation
- 2003-07-23 US US10/521,926 patent/US7612103B2/en not_active Expired - Lifetime
- 2003-07-23 EP EP03771076A patent/EP1534678B1/en not_active Expired - Lifetime
- 2003-07-23 AT AT03771076T patent/ATE377001T1/de active
- 2003-07-23 PL PL03373460A patent/PL373460A1/xx not_active Application Discontinuation
- 2003-07-23 CN CNB038176432A patent/CN100355729C/zh not_active Expired - Lifetime
- 2003-07-23 RU RU2005105576/04A patent/RU2005105576A/ru not_active Application Discontinuation
- 2003-07-23 WO PCT/EP2003/008059 patent/WO2004011431A1/en not_active Ceased
- 2003-07-23 ES ES03771076T patent/ES2295657T3/es not_active Expired - Lifetime
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101319234B (zh) * | 2008-07-04 | 2011-02-16 | 江苏赛奥生化有限公司 | 截短侧耳素的发酵方法 |
| CN102143944A (zh) * | 2008-09-02 | 2011-08-03 | 纳布里瓦治疗股份公司 | 有机化合物 |
| CN105503675A (zh) * | 2008-09-02 | 2016-04-20 | 纳布里瓦治疗股份公司 | 有机化合物 |
| CN105111117A (zh) * | 2010-05-26 | 2015-12-02 | 纳布里瓦治疗股份公司 | 制备截短侧耳素的工艺 |
| CN103709093A (zh) * | 2012-09-28 | 2014-04-09 | 山东亨利医药科技有限责任公司 | 含有并环的截短侧耳素类抗生素 |
| CN103709093B (zh) * | 2012-09-28 | 2016-06-08 | 山东亨利医药科技有限责任公司 | 含有并环的截短侧耳素类抗生素 |
| CN103265487A (zh) * | 2013-06-05 | 2013-08-28 | 北京理工大学 | 截短侧耳素扩环衍生物及其制备方法和用途 |
| CN103319437A (zh) * | 2013-06-20 | 2013-09-25 | 中国农业科学院兰州畜牧与兽药研究所 | 具有噻二唑骨架的截短侧耳素类衍生物及其制备方法、应用 |
| CN103319437B (zh) * | 2013-06-20 | 2016-05-04 | 中国农业科学院兰州畜牧与兽药研究所 | 具有噻二唑骨架的截短侧耳素类衍生物及其制备方法、应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2004011431A1 (en) | 2004-02-05 |
| BRPI0312882B8 (pt) | 2021-05-25 |
| JP4611020B2 (ja) | 2011-01-12 |
| CN100355729C (zh) | 2007-12-19 |
| MXPA05000984A (es) | 2005-09-12 |
| HK1079191A1 (zh) | 2006-03-31 |
| DE60317208T2 (de) | 2008-08-07 |
| JP2006502124A (ja) | 2006-01-19 |
| ATE377001T1 (de) | 2007-11-15 |
| PL373460A1 (en) | 2005-08-22 |
| US20050250811A1 (en) | 2005-11-10 |
| SI1534678T1 (sl) | 2008-06-30 |
| RU2005105576A (ru) | 2005-10-10 |
| BR0312882A (pt) | 2005-06-28 |
| ES2295657T3 (es) | 2008-04-16 |
| BRPI0312882B1 (pt) | 2019-04-09 |
| AU2003257493A1 (en) | 2004-02-16 |
| EP1534678A1 (en) | 2005-06-01 |
| US7612103B2 (en) | 2009-11-03 |
| EP1534678B1 (en) | 2007-10-31 |
| DE60317208D1 (de) | 2007-12-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1671663A (zh) | 截短侧耳素 | |
| CN1182116C (zh) | 姆替林衍生物及其在制备作为抗菌剂的药物中的用途 | |
| CN1309711C (zh) | 3-酰氨基-1,2-苯并异噁唑衍生物、其制备方法及应用 | |
| CN1287487A (zh) | 氨基苯氧基乙酸衍生物和含有它们的药用组合物 | |
| CN1688544A (zh) | 作为蕈毒碱受体拮抗剂的含氟代和磺酰氨基的3,6-二取代的氮杂双环(3.1.0)己烷衍生物 | |
| CN1642535A (zh) | 使用截短侧耳素衍生物治疗肺结核 | |
| CN1422269A (zh) | 1h-咪唑并吡啶衍生物 | |
| CN1301972C (zh) | 作为毒覃碱拮抗剂的哌啶化合物 | |
| CN1288134C (zh) | 抗菌剂木替灵 | |
| CN1062729A (zh) | 可用作血管紧张肽转化酶抑制剂的含氨基和硝基的三环新化合物 | |
| CN1229335C (zh) | 莫维诺林衍生物 | |
| CN1922138A (zh) | 芳氧基烷基氨基甲酸酯类衍生物,它们的制备方法与治疗用途 | |
| CN1173951C (zh) | 取代1,3-二芳基-2-吡啶-2-基-3-(吡啶-2-基氨基)-丙醇衍生物、其制备方法、含有它们的药物组合物及其应用 | |
| CN1113064C (zh) | 顺式取代氨基环丙烷衍生物 | |
| CN1165295C (zh) | 倍他司汀的控释组合物 | |
| HK1040706A1 (zh) | Fkbp抑制剂 | |
| CN1126738C (zh) | 苯甲酰胺衍生物及含有它们的药物 | |
| CN1688307A (zh) | 4-氨基哌啶衍生物,它们的制备方法和它们作为药物的用途 | |
| CN1308532A (zh) | 分枝杆菌抑制剂 | |
| CN1202819C (zh) | 眼压降低剂 | |
| CN1809542A (zh) | 具有天冬氨酸蛋白酶抑制活性的大环化合物和其药学用途 | |
| CN1466573A (zh) | 5-苯基苄胺化合物、其制备方法以及其合成中间体 | |
| CN1148349C (zh) | N-取代-N′-取代脲衍生物及其用作TNF-α生成抑制剂的用途 | |
| HK1079506B (zh) | 抗菌剂木替灵 | |
| CN1218946C (zh) | 异奎宁环衍生物及其制备方法以及含有该化合物的药物组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| ASS | Succession or assignment of patent right |
Owner name: NABRIVA THERAPEUTICS FORSCHUNG Free format text: FORMER OWNER: SANDOZ AG Effective date: 20141217 |
|
| C41 | Transfer of patent application or patent right or utility model | ||
| TR01 | Transfer of patent right |
Effective date of registration: 20141217 Address after: Austria Vienna Patentee after: NABRIVA THERAPEUTICS AG Address before: Basel, Switzerland Patentee before: Sandoz AG |
|
| CX01 | Expiry of patent term | ||
| CX01 | Expiry of patent term |
Granted publication date: 20071219 |