CN1289371A - 对还原条件敏感的转染化合物,含有它们的药物组合物及其应用 - Google Patents
对还原条件敏感的转染化合物,含有它们的药物组合物及其应用 Download PDFInfo
- Publication number
- CN1289371A CN1289371A CN99802464A CN99802464A CN1289371A CN 1289371 A CN1289371 A CN 1289371A CN 99802464 A CN99802464 A CN 99802464A CN 99802464 A CN99802464 A CN 99802464A CN 1289371 A CN1289371 A CN 1289371A
- Authority
- CN
- China
- Prior art keywords
- nucleic acid
- transfering reagent
- transfering
- cell
- reagent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6901—Conjugates being cells, cell fragments, viruses, ghosts, red blood cells or viral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/51—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/60—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton with the carbon atom of at least one of the carboxyl groups bound to nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06008—Dipeptides with the first amino acid being neutral
- C07K5/06017—Dipeptides with the first amino acid being neutral and aliphatic
- C07K5/06026—Dipeptides with the first amino acid being neutral and aliphatic the side chain containing 0 or 1 carbon atom, i.e. Gly or Ala
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biochemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Biophysics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Microbiology (AREA)
- Virology (AREA)
- Hematology (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
本发明涉及在细胞中转移核酸用的新试剂。更具体地,这种试剂的特征在于它含有一个或多个对还原条件敏感的二硫桥。本发明还涉及含有这样一种试剂的组合物,以及它们在不同类型细胞中体外、体内或离体转移目的核酸的应用。
Description
本发明涉及用于向细胞中转移核酸的新试剂。更具体地,这种转移试剂特征是含有一个或多个对还原性条件敏感的二硫桥。这种新试剂可用于在体外、体内或离体在不同类型的细胞中转移目的核酸。
随着生物技术的发展,在细胞中有效转移核酸日益变得必不可少。例如为了生产重组蛋白,或在实验室对基因表达调控、基因克隆的研究,或任何其他牵涉DNA的操作,都可能涉及体外细胞中的核酸转移。再例如在产生转基因动物、实现免疫接种、研究标记或治疗方法中,也可能涉及在体内细胞中的核酸转移。在骨髓移植方法、免疫治疗方法或涉及在从器官取出的细胞中转移基因以便随后回输的其他方法中,也可能涉及在离体细胞中的转移核酸。
为了改善细胞中的核酸转移,迄今研制的不同合成载体结构差异相当大,这反映在以下的现象:它们的效率因所寻求的应用和针对的细胞类型而不同。这种效率主要取决于它们的结构。
在直到现在已研制的合成载体中,阳离子脂类占重要位置。这些载体由与核酸作用的阳离子极性部分、和能够保护生成的复合物不受外部环境影响的疏水脂部分构成。作为实例可以列举单阳离子脂类(DOTMA:Lipofectin)、脂多胺,特别是双十八烷基氨基甘氨酰基精胺(DOGS)或棕榈酰基磷脂酰乙醇胺的5-羧基精胺基酰胺(DPPES),在专利申请EP 394 111中描述过它的制备方法,或在专利申请WO96/17823与WO97/18185(作为参考文献列于本文)列出的阳离子脂类。
许多研究工作清楚地表明,阳离子脂类具有能够促进转染的性质。但是,今天还有必要研制具有新结构的阳离子脂类,以便带来一些其它的有利性质。例如,存在对更适合通过膜屏障的阳离子脂类的需求。事实上,许多障碍影响转染的实际效率,其中有核酸越过生物膜和渗入细胞腔室的困难(“Cellular and Molecular Barriers to Gene Transferby a Cationic Lipid”,Zabner,J.和Al.,J.Biol.Chem.,1995年,第32期,第18997-19007页)。这正是本发明提出要解决的技术难点。
因此,本发明涉及新的核酸转移试剂,该试剂包括至少一个能够以非共价方式与核酸结合的阳离子亲水区域,和至少一个亲脂区域,这些区域彼此通过所谓的“间隔臂”连接起来,还包含至少一个二硫桥,其位于还原后可引起亲脂区域部分降解的位置,或位于还原后可引起所述转移试剂对称时一分为二的位置。
这些转移试剂能够通过阳离子亲水部分有效地与核酸复合,这种相互作用强烈地压紧所述核酸,而亲脂区域通过给形成的微粒包裹脂质膜使这种离子相互作用变得对外界环境不敏感。
但是,除了这些载体化所要求的性质之外,本发明的转移试剂具有极有利的去污剂性质,在还原性细胞介质中,因存在一个或多个二硫桥,产生多胺化烷基链类型的分子,这些分子是膜的去稳定剂。事实上,二硫桥在氧化性介质中能够构成稳定的共价键,而在还原性介质中被打断,如下述示意图:
X-S-S-Y→X-SH+HS-Y
这类结构见于例如在某些具有半胱氨酸的蛋白质中,并对这些蛋白质的三维结构作出贡献,因此对生物活性作出贡献。另外,二硫桥已经被引入某些设计的蛋白质中,特别是免疫毒素中,以便将靶向结构域与活性结构域连接起来。
关于“还原性介质”,在本发明中应该理解是自然的还原性介质,例如细胞内的介质,特别是细胞质,尤其是内体。代表这些自然条件的人工还原性介质例如是含0.1-20%二硫苏糖醇(DTT)的介质。
相反地,关于氧化性介质”应该理解是与大气氧接触的任何介质,这些介质不含有还原剂,特别是是细胞外介质。有代表性的氧化介质例如由150mM氯化钠的等渗溶液或由含5%葡萄糖的溶液构成。
申请人非常意外地证明,可以核酸转移的合成载体中、特别是阳离子脂类型的载体中引入一个或多个二硫桥,而不会影响该试剂在非还原性介质中结合核酸的能力。申请人还证实,保持了这些试剂的核酸转移性质,甚至还得到改善。另外,生成的复合物在还原性介质中、特别是在细胞中降解,这样能够产生去污剂分子,因此使得更大量的核酸可接触细胞转录机器。
在本发明中,关于“去污剂”应该理解是具有插入生物膜中并使它们去稳定化性质的任何两亲分子。这是出于去污剂两亲分子通过插入磷脂双层并溶解脂类和蛋白质而破坏这些膜的能力(La Cellule,Vigot和Decaire编,1998年,第581-583页)。
本发明转移试剂的另一个优点还在于其固有毒性低。事实上,由于这些转移试剂在细胞中在对还原性条件敏感的二硫键处降解,所以不会出现由通常转移载体产生的毒性作用。此外,膜通过性的改善使得可以使用较低剂量的核酸/转移试剂复合物,由此产生毒性方面的有利结果。
最后,申请人还证明了,当转移试剂具有足够的亲脂性,并且它们的用量也适当时,转移性质可获得显著的改善。更具体地,已证明增加这些转移试剂的亲脂性,或加入类固醇衍生物链的一个主要好处是诱导一种改善的血清抗性。
本发明的转移试剂可以有两类结构,而对它们的技术效果没有影响。在第一种情况下,这种结构可以用下述方式表达:
阳离子亲水区域-间隔臂-亲脂区域
在这样一种结构中,一个或多个二硫桥定位在亲脂区域中,以便它们被还原时产生去污剂两亲分子。
第二类结构可以表达如下:
阳离子亲水区域-间隔臂-亲脂区域
|
阳离子亲水区域-间隔臂-亲脂区域
在这种情况下,一个或多个二硫桥位于其还原引起转移试剂的两个对称部分分离的位置,即在两个间隔臂之间。
在本发明中,关于“阳离子亲水部分”应该理解是在生理pH的条件下,即pH为5-8的条件下,总电荷是正的并具有核酸结合性质的任何亲水分子。这种结合具体讲是非共价键类型的结合,例如像离子相互作用。优选地,在本发明转移试剂中存在的阳离子亲水区域是多胺或多氨基胍。
根据一种有利的实施方式,阳离子亲水区域满足下述通式:
式中,m是大于或等于2的整数,l是大于或等于1的整数,m可以在两个胺所含碳的不同组合之间变化。优选地,m是2-6,其中包括2和6在内,l是1-5,其中包括1和5在内。更优选地,多胺区域用精胺代表。
式中R1、R2、R3各自代表氢原子或-(CH2)q-NRR′基团,q可以在1、2、3、4、5和6中改变,在不同的基团R1、R2和R3之间可独立改变,R和R′各自代表氢原子或-(CH2)q-NH2,q如前面所定义,m和n各自是0-6之间的整数,当n大于1时,m可以取不同的值,R3在上述通式中可代表不同的意义。
在本发明转移试剂中存在的亲脂区域由至少一个脂肪脂族链和一个或多个其他脂族链构成,后者为一个或多个类固醇衍生物、天然或合成的脂类,或选择性地一种它们的组合,优选地能够生成层状或六角相。这些结构的特征在于层或管之间的距离,这取决于脂肪脂族链的长度或脂类的极性部分。
术语“脂肪脂族链”在本发明中表示支链或直链的、有10-22个碳原子的、选择性地饱和和/或含氟的烃基链。优选地,该烃基链有12-22个碳原子。更具体地可以列举C12、C13、C14、C16、C18、C19脂族基团等,尤其是基团(CH2)11CH3、(CH2)12CH3、(CH2)13CH3和(CH2)17CH3。
当亲脂区域含有类固醇衍生物时,其优选地选自胆固醇、胆酸或胆甾烯基胺。
在一种优选实施方式中,亲脂区域含至少两个脂肪脂族链。更优选地,亲脂区域含两个或三个脂肪脂族链。
根据本发明另一种有利的实施方案,亲脂部分由一个脂肪脂族链和一个类固醇衍生物组成。
当本发明的转移试剂具有对称结构时,该分子的每个对称部分含有至少一个脂肪脂族链。
阳离子亲水区域和亲脂区域彼此可以通过所谓的“间隔臂”连接起来。间隔臂可以非限制性地描述为含有可水解官能团的酸或胺基团,这些基团是本技术领域的技术人员知道的。优选地,所谓的间隔臂区域含有脂族链或芳族链。优选地,间隔臂区域例如可以选自酰胺、氨基甲酸酯、酯、醚或芳族环。
本发明的转移试剂含有一个或多个二硫桥。本技术领域的技术人员根据转移试剂的结构与所寻求的性质可以决定这些桥键数目。有利地,转移试剂含有一个或两个二硫桥,优选地一个二硫桥。在转移试剂中,一个或多个二硫键可以处在不同的地方。其位置取决于桥键数和转移试剂的结构。
根据第一种实施方式,二硫桥定位于其还原可引起亲脂区域部分降解的位置,降解后在细胞周围产生了一种去污剂两亲分子。当亲脂区域有多个脂族链时,这种部分降解可能尤其相当于丧失一个脂族链,或当亲脂区域有一个类固醇衍生链时,相当于类固醇衍生链的丧失。关于脂肪脂族链的丧失,应该理解是或者该链完全丧失,或者部分丧失,余下部分这时对于构成脂肪链来说太短(长度小于10个碳原子)。这样一种断裂破坏了复合物的完整性,该复合物然后逐渐地降解,放出离解的元件,其中至少一个是去污剂两亲分子。这种复合物降解可通过显微镜或采用电泳法很容易检测。
根据另一种实施方案,二硫桥定位在对称结构转移试剂的两个间隔臂之间,其结果是其还原引起所述转移试剂分成两部分。
本发明优选的转移试剂含有:
-作为阳离子亲脂区域的多胺或多氨基胍,
-作为亲脂区域的至少两个脂肪脂族链,或至少一个类固醇的衍生链和一个脂肪脂族链,和
-二硫桥,其还原导致一个脂肪脂族链丧失,或当转移试剂含有一个类固醇衍生链时丧失一个类固醇衍生链。
特别有利地,本发明转移试剂含有一个多胺区域、三个脂族链-其中至少两个是脂肪脂族链、一个二硫桥,在还原性介质中,该二硫桥导致一个脂族链丧失。
另一种特别有利的转移试剂含有一个多胺区域、一个脂肪脂族链和一个类固醇的衍生链和一个二硫桥,而二硫桥在还原性介质中导致类固醇的衍生链丧失。
另一种特别有利的转移试剂是由两个对称的脂肪多胺和一个二硫桥构成,该二硫桥在还原性介质中导致分成两部分。
在实施例中说明乐这样一些转移试剂。作为非限制性的实例列出下述化合物:
-NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys[S-S-(CH2)4CH3]-N[(CH2)17CH3]2:
-NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys[S-S-(CH2)11CH3]-N[(CH2)17CH3]2:
-NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys[S-S-Cholestérol]-NH(CH2)17CH3:
本发明另一个目的涉及一种含有一种如前面定义的转移试剂和至少一种核酸的组合物。优选地,转移试剂和核酸的量是这样的,转移试剂正电荷与核酸负电荷的比为0.1-50。本领域的技术人员根据使用的转移试剂、核酸和待转染细胞类型很容易调整这个比例。有利地,这个比例是每微克核酸为3-12纳摩尔本发明转移试剂,优选地是每微克核酸为3-9纳摩尔转移试剂。
关于本发明中的“核酸:应该理解是脱氧核糖核酸或核糖核酸。可能涉及自然或人工的序列,特别是基因组DNA(gDNA)、互补DNA(cDNA)、信使RNA(mRNA)、转移RNA(tRNA)、核糖体RNA(rRNA)、杂合序列或合成或半-合成序列、修饰或未修饰的寡核苷酸。这些核酸可以来自人、动物、植物、细菌、病毒等。采用本技术领域的技术人员已知的任何技术,特别是采用文库筛选、化学合成,或采用混合方法,其中包括化学修饰或酶修饰采用筛选文库所得到的序列,可以得到这些核酸。这些核酸可以采用化学方法进行修饰,即可以涉及假核酸(PNA)、用各种化学键(例如硫代磷酸酯或甲基膦酸酯)修饰的寡核苷酸,或官能化的寡核苷酸,即与一种或多种具有不同特性的分子偶联的寡核苷酸。更具体低涉及脱氧核糖核酸,它们可以是单链或双链脱氧核糖核酸,以及短的寡核苷酸或更长的序列。具体地,这些核酸有利地是由质粒、载体、附加体、表达盒等组成。这些脱氧核糖核酸可以带有治疗意义的基因、转录或复制调控序列、修饰或未修饰的反义序列、与其他细胞组分结合的区域等。
优选地,核酸含有一个表达盒,该盒由在靶细胞中有活性的一个或多个启动子和转录终止子控制下的一个或多个有治疗意义的基因构成。
在本发明中,关于“有治疗意义的基因”尤其应该理解为任何具有治疗作用的蛋白质产品的编码基因。如此编码的蛋白质产品可以是一种蛋白质、肽等。这种蛋白质产品对靶细胞可以是同源的(即当靶细胞不存在任何病理性问题时,在该细胞中正常表达的产品)。在这种情况下,蛋白质的表达例如能够克服在该细胞中表达不充分或因修饰失活或低活性的蛋白质的表达,或超量表达所述蛋白质。治疗基因还可以编码细胞蛋白质的突变体,其稳定性提高、活性改变等。蛋白质产品对靶细胞还可以是异源的。在这种情况下,表达的蛋白质例如可以补足或提供在该细胞中缺失的活性,使它们能够抵抗疾病,或刺激免疫应答。
在本发明有治疗意义的产品中,更具体地可列举酶、血液衍生物、激素、淋巴因子[白介素、干扰素、TNF等(FR92/03120)]、生长因子、神经递质或它们的前体或合成酶、营养因子(BDNF、CNTF、NGF、IGF、GMF、aFGF、bFGF、NT3、NT5、HARP/多效因子等)、肌营养不良蛋白或小肌营养不良蛋白(minidystrophine)(FR91/11947),与先天性粘液稠厚症相关的CFTR蛋白质、肿瘤抑制基因[p53,Rb,Rapl A,DCC,k-rev等(FR93/04745)]、凝血相关因子的编码基因(因子Ⅶ、Ⅷ、Ⅸ)、参与DNA修复的基因、自杀基因(胸腺嘧啶核苷激酶、胞嘧啶脱胺酶)、血红蛋白基因或其他转运蛋白的基因、参与脂质代谢的蛋白:选自载脂蛋白A-Ⅰ、A-Ⅱ、A-Ⅳ、B、C-Ⅰ、C-Ⅱ、C-Ⅲ、D、E、F、G、H、J和apo(a)的载脂蛋白类的相应基因、代谢酶如像脂蛋白脂酶、肝脂酶、卵磷脂胆固醇酰基转移酶、7-α-胆固醇羟化酶、磷脂酸磷酸酶,或脂质转移蛋白如胆固醇酯转移蛋白和磷酯转移蛋白、HDL结合蛋白质或例如选自LDL受体、乳靡微粒-遗余物受体和清除剂受体等的受体。
有治疗意义的核酸还可以是这样一种基因或一种反义序列,它们在靶细胞中的表达能够控制基因表达或细胞mRNA的转录。根据专利EP 140308中描述的技术,这样的序列例如可以在靶细胞中转录成细胞mRNA的互补RNA,并因此阻断它们转译成蛋白质。治疗基因还含有核酶编码序列,这些核酶能够选择性地破坏靶RNA(EP 321 201)。
如前面所指出的,核酸还可以含有一个或多个编码抗原性肽的基因,这种肽在人体或动物中能够造成免疫应答。在这种特定实施方式中,本发明因此使得有可能制备用于人体或动物的疫苗或进行免疫治疗,尤其是用于抗微生物、病毒或癌。具体地涉及对E-B病毒、HIV病毒、乙型肝炎病毒(EP 185 573)、伪狂犬病病毒、“合包体形成病毒”或其他病毒特异的、或对肿瘤特异的抗原性肽(EP 259 212)。
优选地,核酸还含有能够使有治疗意义的基因和/或抗原肽编码基因在细胞或所希望的器官中表达的序列。可以涉及天然负责所考虑的基因表达的序列,只要这些序列在感染的细胞中能够起作用。还涉及不同来源的序列(负责其他的蛋白质的表达,或甚至是合成的)。具体地,可以涉及真核细胞或病毒基因的启动子序列。例如,可以涉及来自人们希望感染的细胞基因组的启动子序列。同样地,可以涉及来自病毒基因组的启动子序列。为此,例如可以列举基因E1A、MLP、CMV、RSV等的启动子。另外,这些表达序列可以通过加入活化序列、调节序列等进行修饰。也可以涉及可诱导的或可抑制的启动子。
另外,核酸还可以特别在有治疗意义的基因上游含有指导合成的治疗产品至靶细胞分泌通道中的信号序列。这种信号序列可以是治疗产品的天然信号序列,但也可以涉任何其他功能性信号序列或人工信号序列。核酸还可以含有将合成的治疗产品引导向特定的细胞室的信号序列。
本发明的组合物还可以含有能够与转移试剂/核酸复合物结合并能够改善其转染能力的添加剂。在这种选择中,本发明的组合物可以含有一种或多种中性脂作为添加剂。这样一些组合物是特别有利的,当转移试剂正电荷与核酸负电荷的比很低时尤其如此。事实上,已表明加一种中性脂能够改善核脂颗粒的生成,还通过使膜失稳定有利于细胞穿透。
更优选地,在本发明范围内使用的中性脂是具有两个脂肪链的脂类。
特别有利地,使用在生理条件下为两性离子或无离子电荷的天然或合成脂类。更具体地,它们可以选自二油酰基磷脂酰乙醇胺(DOPE)、油酰基棕榈酰基磷脂酰乙醇胺(POPE)、二硬脂酰基-、二棕榈酰基-、二胆甾烯基-、二肉豆蔻酰基-磷脂酰乙醇胺以及它们的1-3次N-甲基化衍生物、磷脂酰基甘油、糖基二酰基甘油、脑苷脂(具体如半乳糖脑苷脂)、鞘脂(具体如鞘磷脂),或脱唾液酸神经节苷脂(具体如脱唾液酸GM1和GM2)。这些不同的脂类采用本技术领域的技术人员熟知的方法用合成方法,或者从器官(例如脑)或蛋提取的方法得到。具体地,采用有机溶剂的方法可以提取天然脂类(也可参见Lehninger Biochemistry)。
最近,申请人已证明,使用干预或非直接地干预所述核酸缩合的化合物作为添加剂,也是特别有利的,如在专利申请WO96/25508中列举的化合物。在以脂多胺为主要成分的转染组合物中,这样一种化合物的存在,能够大大降低这种转移试剂的量,在毒理学方面由此获得有益结果,对所述组合物的转染活性不会带来任何损害。关于干预核酸缩合的化合物,应该定义为直接或非直接地压紧核酸的化合物。更确切地,这种化合物或者直接作用于待转染核酸,或者所用于直接参与核酸缩合作用的其它化合物。优选地,直接作用于核酸。具体地,预致密(precompactant)剂可以是任何多阳离子物,例如聚赖氨酸。根据一种优选实施方式,干预核酸缩合作用的这种预致密剂完全或部分地从鱼精蛋白、组蛋白、核仁蛋白和/或它们的衍生物得到。这样一种预致密剂还可以全部或部分地由肽基元(KTPKKAKKP)和/或(ATPAKKAA)构成,基元数可以是2-10。在本发明化合物结构中,这些基元可以连续地或不连续地重复。因此它们可以通过生物化学性质的连接(例如一个或多个氨基酸)隔开,或通过化学性质的连接隔开。
优选地,本发明的组合物含有每核酸当量为0.01-20当量的添加剂(重量/重量),更优选地是0.5-5。
本发明的组合物还可以使用一种或多种靶向元件,这些元件能够将核酸复合物引导向细胞表面的受体或配体。作为实例,本发明的组合物可以含有一种或多种抗细胞表面分子的抗体,或膜受体的一种或多种配体如胰岛素、转铁蛋白、叶酸或任何其他的生长因子、细胞因子或维生素。有利地,该组合物可以使用修饰或未修饰的凝集素,以便靶向于细胞表面或邻近细胞外基质上的特定多糖。还可以使用具有RGD基元的蛋白质、含有串联RGD基元的环状或非环状的肽、以及聚赖氨酸肽。最近,还报道了一些天然或合成的配体肽,它们尤其对一些特定细胞具有选择性并能够提高这些细胞中的内在化效率(Bary等人,天然药物(naturemedicine),1996年,第2期,第299-305页)。这些靶向试剂一般与所研究的阳离子转染剂偶联。
在如上述定义的任何组合物中,本发明还包括如上所定义平含有一种或多种已知用于转染核酸的其他转染剂的组合物。具体地,可以列举在专利EP 394 111中或在专利申请WO96/17823或WO97 18185(以参考文献列于本文中)中描述的产品。
本发明另一个目的还涉及如上述定义的转移试剂在向细胞中转移核酸中的应用。
含有本发明转移试剂的组合物经配制可以采用局部、皮肤、口、直肠、阴道、肠胃外、鼻内、静脉内、肌肉内、皮下、眼内、皮内、气管内、腹膜内等方式用药。优选地,本发明的药物组合物含有下述药学上可接受的赋形剂,该赋形剂适用于注射剂,尤其是用于在所希望器官中直接注射的注射剂,或适于用局部方式(皮肤和/或粘膜上)用药。特别涉及等渗的无菌溶液,或干的尤其是冻干的组合物,这些组合物可根据情况加入无菌水或生理盐水配制成注射溶液。注射使用的核酸剂量以及用药次数可以根据不同的参数而变化,特别是根据用药方式、涉及的疾病、待表达基因或所进行治疗的时间长短。更具体地对于用药方式,可以在组织或循环通路中直接注射,或者处理培养细胞接着采用注射或移植方法将它们再植入。
本发明还涉及在细胞中转移核酸的方法,该方法包括下述步骤:
(1)让核酸与如前面定义的转移试剂进行接触,以便生成核酸/转移试剂复合物,
(2)让细胞与(1)中生成的复合物接触。
在含有一种或多种其他转移试剂和/或一种或多种添加剂的组合物的情况下,步骤(1)之前有不同转染剂的接触步骤和/或转染剂与一种或多种添加剂的接触步骤。
一种含有微胶粒状的或六角层状相的本发明转染剂的溶液,另一种含有待转染核酸的溶液,将这两种溶液以逐体积(volumeàvolume)进行混合,可生成本发明转染剂/核酸的复合物。在几秒钟内生成了这些复合物。根据加入核酸的脂的量,它们可以带负电荷、正电荷或为中性(Pitard等人,Proc.Natl.Acad.Sci.USA,第94卷,第14412-14417页,1997年12月)。这些复合物的尺寸是直径50-300纳米(采用光的准-弹性散射与采用透射电子显微镜测定)。另外,这些复合物的形态随电荷比R(阳离子脂类带的正电荷与核酸带的负电荷之比)而改变。带负电荷的复合物被核酸分子包围。相反地,带正电荷的复合物在其表面有阳离子的脂类。至于中性复合物,它们是胶体状不稳定复合物。因此,申请人证明,加入足量的非离子表面活性剂可以使这些复合物稳定。优选的非离子表面活性剂具体是poloxamers、聚氧化乙烯醇、聚氧乙烯壬基苯基醚或具有树状苄基聚醚端的PEG(聚乙二醇)。
细胞与复合物的接触可以通过细胞与所述复合物一起培养(体外或离体使用),或给生物体注入复合物(体内使用)来实现。优选地,106个细胞例如在0.01-1000微克核酸存在下进行培养。体内用药时,可以使用的核酸剂量为0.01-10毫克。
在初级细胞中或在已建的细胞系中转移核酸使用本发明的转移试剂是特别有意义的。这可以涉及成纤维细胞、肌肉细胞、神经细胞(神经元、星形细胞、神经胶质细胞)、肝细胞、生血细胞(淋巴细胞,CD34、树状细胞等)、上皮细胞等,它们呈已分化形式或多潜能形式(前体)。
本发明因此提供了一种特别有利的治疗疾病的方法,该方法包括在体内、体外或离体使用与本发明的化合物结合的一种能够缓和所述疾病的核酸。更具体地,这种方法可用于因蛋白质或核酸产品不足或缺乏而引起的疾病。使用的核酸可编码该蛋白质产品或含有所述核酸产品。
除了前面的因素外,本发明还包括由下述实施例和附图得出的其他特点和优点,这些实施例和附图应该认为是说明本发明而不是限制其保护范围。具体地,申请人非限制性地提出各种操作方案,以及可用于制备本发明转移试剂的反应中间体。当然,本技术领域的技术人员在这些方案或中间体的启示下能够找到类似的方法或中间体用于制备这些同样的化合物。
附图
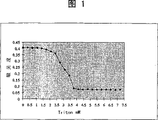
图1:表示用Triton X-100对脂质体EPC/EPA(10∶1)溶解情况的曲线,使用分光光度计测定溶液烛度得出该溶解曲线。横坐标为添加Triton X-100的量,以mM表示。纵坐标表示含有脂质体的溶液的吸光度。
图2:表示用化合物(Ⅶ)对脂质体EPC/EPA(10∶1)溶解情况的曲线,使用分光光度计测定溶液烛度得出该溶解曲线。横坐标为添加化合物(Ⅶ)的量,以mM表示。纵坐标表示含有脂质体的溶液的吸光度。
图3:在没有血清的情况下,在细胞HepG2中化合物(Ⅶ)的转染活性,用化学式H2N(CH2)3NH(CH2)4NH(CH2)3NHCH2COGly[(CH2)17CH3]2阳离子脂类作参比转移试剂(在本申请下文中称之REF)进行比较。
图4:在有或没有血清存在下,在细胞HepG2和HeLa中化合物(Ⅰ)和化合物(Ⅳ)的转染活性,用参比REF阳离子脂类进行比较。
图5:该矩形图表示在没有辅助脂质或在辅助脂质DOPE或胆固醇存在下,在HeLa细胞中化合物(Ⅰ)的体外转移活性。纵轴表示每孔中荧光素酶的表达,以pg表示。横轴表示化合物(Ⅰ)/DNA比,以纳摩尔/微克DNA表示。
图6:该矩形图表示在没有辅助脂质或在辅助脂质DOPE或胆固醇存在下,在HeLa细胞中化合物(Ⅳ)的体外转移活性。纵轴表示每孔中荧光素酶的表达,以pg表示。横轴表示化合物(Ⅳ)/DNA比,以纳摩尔/微克DNA表示。
图7:在有或没有血清的情况下,在细胞HepG2中化合物(Ⅱ)的转染活性,用参比REF阳离子脂类进行比较。
图8:该矩形图表示在没有辅助脂质或在辅助脂质DOPE或胆固醇存在下,在HeLa细胞中化合物(Ⅱ)的体外转移活性。纵轴表示每孔中荧光素酶的表达,以pg表示。横轴表示化合物(Ⅰ)/DNA比,以纳摩尔/微克DNA表示。
图9:在有或没有血清的情况下,在细胞HepG2和HeLa中化合物(Ⅴ)的转染活性,用参比REF阳离子脂类进行比较。
实施例
实施例1:本发明转移试剂的化学合成
A、材料
-三乙胺、N-乙基二异丙基胺、双十八烷基胺、Nα,Nα′-二Boc胱氨酸和BOP试剂在市场上可购到的。
-戊胺、十八烷胺、戊硫醇、十二烷硫醇、十八烷硫醇和硫代胆固醇同样可购到。
-在实验室中,根据在专利申请WO97/18185和Byk G.,Frederic M,和Scherman D.,在“四面体通讯”(Tetrahedron Letters)(1997)38,第3219-3222页发表的文章中所述操作方式,已合成出BocNH(CH2)3NBoc(CH2)4NBoc(CH2)3NBocCH2CO2H。
B方法
a)光谱分析
用Brucker 250和400MHz光谱仪记录了质子NMR谱(核磁共振)。
b)色谱技术
HPLC分析(高效液相色谱)使用HITACHI装置,它配置了AS-2000A自动取样器、L-6200A泵、220纳米的UV L 4000检测器和D 2500计算机积分仪。使用的柱是APPLIED BIOSYSTEMS销售的柱,用不锈钢制成,长为3厘米,直径为4.6毫米。流动相是水和补加三氟乙酸的乙腈,固定相是Aquapore butyl,7微米。流量是1-4毫升/分。
薄层色谱(TLC)使用涂有硅胶的20×20铝板。
c)制备性HPLC纯化
-使用的装置是一套梯度方式的液相色谱装置,能进行U.V.检测。这种制备性流水线组成如下:
泵A:GILSON 305型,配置50 SC头。
泵B:GILSON 303型,配置50 SC头。
注射泵:GILSON 303型,配置25 SC头。
压力组件:GILSON 806型。
混合器:GILSON 811型,配置23毫升头。
UV检测器:配置制备池的GILSON 119型,调节到220纳米。
馏分收集器:GILSON 202型,配置21号架。
积分仪:SHIMADZU C-R6A型。
柱:VYDAC公司销售的214TP 1022型C4柱(10毫米),不锈钢制,长为25厘米,直径为2.2厘米。
用注射泵以15毫升/分的流量将待纯化的产品溶液装入柱中。流动相是水和乙腈。
C.化学合成
a)用二硫桥构建可还原的具有脂肪链的转移试剂
步骤2
步骤3
用下述非限制性实施例来说明这些转移试剂:
化合物(Ⅰ):R1=(CH2)4CH3;R2=(CH2)17CH3;R3=(CH2)17CH3[制备例3.1]
化合物(Ⅱ):R1=(CH2)17CH3;R2=(CH2)17CH3;R3=H[制备例3.2]
化合物(Ⅲ):R1=(CH2)11CH3;R2=(CH2)17CH3;R3=H[制备例3.3]
化合物(Ⅳ):R1=(CH2)11CH3;R2=(CH2)17CH3;R3=(CH2)17CH3[制备例3.4]
化合物(Ⅴ):R1=胆甾烯基;R2=(CH2)17CH3;R3=H[制备例3.5]
步骤1
·制备例1.1:NHBocCys[S-S-(CH2)4CH3]-OH
将Nα,Nα′-二-Boc胱氨酸(6.81毫摩尔)溶于二甲基甲酰胺(20毫升)中。往该溶液添加三乙胺(58.1毫摩尔),然后加1-戊硫醇(6.81毫摩尔)。将混合物在室温下搅拌2小时。蒸去三乙胺,然后将浓缩物加到0.5M硫酸钾溶液(300毫升)中。沉淀出的产物每次用100毫升氯仿提取3次。将有机相合并,用无水硫酸镁干燥,然后再蒸去氯仿。干提取物用乙醚(100毫升)溶解,然后每次用50毫升饱和碳酸钠(NaHCO3)溶液提取3次。合并水相,加0.5M KHSO4溶液(350毫升)中和直到pH=3。沉淀的产物每次用100毫升氯仿提取3次。将有机相合并,再每次用50毫升饱和氯化钠溶液洗涤2次,然后用无水硫酸镁干燥。用旋转蒸发仪蒸去氯仿。得到的产物在硅胶柱上用氯仿/甲醇混合物(体积比9/1)洗脱。
得到2.31毫摩尔产品,即产率为34%。
TLC Rf=0.63(CH3/MeOH,9∶1)。
·制备例1.2:NHBocCys[S-S-(CH2)17CH3]-OH
将Nα,Nα′-二-Boc胱氨酸(6.81毫摩尔)溶于二甲基甲酰胺(20毫升)中。往该溶液添加三乙胺(58.1毫摩尔),然后加1-十八烷硫醇(6.81毫摩尔)。将混合物在40℃下搅拌2小时。用旋转蒸发器蒸去三乙胺,然后将浓缩物加到0.5M硫酸氢钾溶液(300毫升)中。沉淀出的产物每次用100毫升氯仿提取3次。将有机相合并,用无水硫酸镁干燥,然后再蒸去氯仿。干提取物用乙醚(100毫升)溶解,然后每次用50毫升饱和NaHCO3溶液洗涤3次。乙醚相每次用100毫升0.5M KHSO4溶液搅拌酸化2次,再每次用50毫升饱和氯化钠溶液洗涤2次。乙醚相用无水硫酸镁干燥,然后用旋转蒸发器蒸发至干。得到的粗产物在石油醚中结晶。
得到1.36毫摩尔产品,即产率为20%。
TLC Rf=0.67(CH3/MeOH,9∶1),HPLC:Rt=17.80分。
·制备例1.3:NHBocCys[S-S-胆甾醇]-OH
该合成与制备例1.2相同,但是使用硫代胆甾醇。
得到的产率为58%。
TLC:Rf=0.59(CH3/MeOH,9∶1),HPLC:Rt=19.16分。
·制备例1.4:NHBocCys[S-S-(CH2)11CH3]-OH
该合成与制备例1.2相同,但是在室温下使用1-十二烷硫醇。
得到的产率为40%。
TLC:Rf=0.69(CH3/MeOH,9∶1),HPLC:Rt=13.23分。
步骤2
·制备例2.1:NHBocCys[S-S-(CH2)4CH3]-N[(CH2)17CH3]2
将1.1得到的产品(1.15毫摩尔)溶解于二氯甲烷(10毫升)中,加入N-乙基二异丙基胺(2.86毫摩尔)、双十八烷胺(1.15毫摩尔)和BOP(1.27毫摩尔)。
将该混合物搅拌2小时,接着进行TLC和HPLC。
用旋转蒸发器蒸去二氯甲烷。将“粗产物”溶解于氯仿(100毫升),然后相继地进行如下洗涤:每次用50毫升0.5MKHSO4洗涤3次,然后每次用50毫升饱和NaHCO3溶液洗涤3次,最后用50毫升饱和NaCl溶液洗涤2次。有机相用无水硫酸镁干燥,然后用旋转蒸发器蒸去氯仿。得到的产率为64%。
TLC:Rf=0.90(CH3/MeOH,9∶1),HPLC:Rt=25.96分。
·制备例2.2:NHBocCys[S-S-(CH2)17CH3]-NH(CH2)17CH3
该合成与制备例2.1相同,但是使用在制备例1.2中得到的产品作为起始反应物。
得到的产率为97%。
TLC:Rf=0.89(CH3/MeOH,9∶1),HPLC:Rt=24.84分。
·制备例2.3:NHBocCys[S-S-(CH2)11CH3]-NH(CH2)17CH3
该合成与制备例2.1相同,但是使用在制备1.4中得到的产品作为起始反应物。
得到的产率为86%。
TLC:Rf=0.90(CH3/MeOH,9∶1),HPLC:Rt=22.22分。
·制备例2.4:NHBocCys[S-S-(CH2)11CH3]-N[(CH2)17CH3]2
该合成与制备2.1相同,但是使用双十八烷胺和在制备1.4中得到的产品作为起始反应物。
得到的产率为85%。
TLC:Rf=0.90(CH3/MeOH,9∶1)。
·制备例2.5:NHBocCys[S-S-胆甾醇]-NH(CH2)17CH3
该合成与制备2.1相同,但是使用十八烷胺和在制备1.3中得到的产品作为起始反应物。
得到的产率为90%。
TLC:Rf=0.88(CH3/MeOH,9∶1),HPLC:Rt=26.98分。
步骤3
·制备例3.1[化合物(Ⅰ)]:NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys[S-S-(CH2)4CH3]-N[(CH2)17CH3]2
将三氟乙酸(10毫升)加到制备例2.1的产品中。将该介质搅拌1.5小时,用HPLC跟踪BOC的分解。蒸去三氟乙酸,为赶掉微量三氟乙酸,每次用5毫升乙醚蒸发3次。
将干提取物溶于10毫升二氯甲烷中,然后加N-乙基二异丙胺(3.34毫摩尔)、BocNH(CH2)3NBocNH(CH2)4NBoc(CH2)3NBocCH2CO2H(0.644毫摩尔)和BOP(0.708毫摩尔)。将该混合物搅拌2小时,用TLC和HPLC跟踪反应。
用旋转蒸发器蒸去二氯甲烷。粗产物溶于氯仿(100毫升)中,然后相继地进行如下洗涤:每次用50毫升0.5MKHSO4洗涤3次,然后每次用50毫升饱和NaHCO3溶液洗涤3次,最后用50毫升饱和NaCl溶液洗涤2次。有机相用无水硫酸镁干燥,然后用旋转蒸发器蒸去氯仿。
将三氟乙酸(10毫升)加到干提取物中。将该介质搅拌1.5小时,用HPLC跟踪BOC的分解。蒸去三氟乙酸,为赶掉微量三氟乙酸,每次用5毫升乙醚蒸发3次。
得到的粗产物用制备HPLC进行纯化。收集目标馏分并冻干。
得到0.081毫摩尔成盐产品,即产率为11%。
HPLC:Rt=17.79分。
1HNMR谱(400MHz,(CD3)2SO,δ,以ppm表示):0.90(mt,9H:两个十八烷基氨基的CH3和戊基二硫基的CH3);1.15-1.50(mt,64H:两个十八烷基氨基之一的15个CH2-另一个十八烷基氨基的15个CH2和戊基二硫基的2CH2);1.47(mt,2H:两个十八烷基氨基之一的1CH2);1.55-1.75(mt,4H:两个十八烷基氨基之一的1CH2和戊基二硫基的1CH2);1.65(mf,4H:丁基中心的2CH2);1.85-2.05(mt,4H:两个丙基中心的CH2);2.70-2.85(mt,1H:半胱氨酸CH2S的1H);2.78(mt,2H:戊基二硫基的SCH2);2.85-3.50(mt,丁基的2NCH2-两个丙基的2NCH2-半胱氨酸CH2S的另一个H和两个十八烷基氨基的NCH2);3.80(宽s,2H:甘氨酰基氨基的NCH2CON);5.07(mt,1H:半胱氨酸的CONCHCON);9.05(d,J=8Hz,1H:半胱氨酸的CONH);7.95-8.85和8.90-9.15(分别为2mf和展宽的mf:相应于NH和NH2的H)。
MH+=969
制备例3.2[化合物(Ⅱ)]:NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys[S-S-(CH2)17CH3]-NH(CH2)17CH3
该方法与制备例3.1中描述的方法相同,但是用制备例2.2得到的产品。
得到产率为31%成盐产品。
HPLC:Rt=15.63分。
1HNMR谱(400MHz,(CD3)2SO,δ,以ppm表示):0.89(t,J=7.5Hz,6H:十八烷基氨基的CH3和十八烷基二硫基的CH3);1.15-1.45(mt,60H:十八烷基氨基的15CH2和十八烷基二硫基的15CH2);1.42(mt,十八烷基氨基CH2中的1CH2);1.55-1.70(mt,2H:十八烷基二硫基CH2中1CH2);1.66(mf,4H:丁基中心的2CH2);1.85-2.05(mt,4H:两个丙基中心的CH2);2.76(t,J=7.5Hz,2H:十八烷基二硫基的SCH2);2.85-3.10(mt,14H:丁基的2NCH2-两个丙基的2NCH2-十八烷基氨基NCH2的1H和半胱氨酸CH2S的1H);3.10(dd,J=13.5和6Hz,1H:半胱氨酸CH2S另一个H);3.18(mt,1H:十八烷基氨基NCH2的另一个H);3.82(非常限制的AB,2H:甘氨酰基氨基的NCH2CON);4.60(mt,1H:半胱氨酸的CONCHCON);8.27(t,J=5.5Hz,1H:十八烷基氨基的CONH);8.90(d,J=8Hz,1H:半胱氨酸的CONH);7.95-8.82和9.07(3个mf:相应于NH和NH2的H)。
MH+=899
制备例3.3[化合物(Ⅲ)]:NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys-[S-S-(CH2)11CH3]-NH(CH2)17CH3
该方法与制备例3.1中描述的方法相同,但是用制备例2.3得到的产品。
得到产率为26.5%成盐产品。
HPLC:Rt=12.36分。
1HNMR谱(400MHz,(CD3)2SO,δ,以ppm表示):0.90(t,J=7.5Hz,6H:十八烷基氨基的CH3和十二烷基二硫基的CH3);1.15-1.50(mt,48H:十八烷基氨基的15CH2和十二烷基二硫基的9CH2);1.43(mt,十八烷基氨基CH2的1CH2);1.55-1.70(mt,2H:十八烷基二硫基的1CH2);1.65(mf,4H:丁基中心的2CH2);1.85-2.05(mt,4H:两个丙基中心CH2);2.76(t,J=7.5Hz,2H:十二烷基二硫基的SCH2);2.80-3.05(mt,14H:丁基的2NCH2-两个丙基的2NCH2-十八烷基氨基NCH2的1H和半胱氨酸CH2S的1H);3.11(dd,J=13.5和6Hz,1H:半胱氨酸CH2S另一个H);3.17(mt,1H:十八烷基氨基NCH2另一个H);3.83(限制的AB,2H:甘氨酰基氨基的NCH2CON);4.60(mt,1H:半胱氨酸的CONCHCON);8.25(t,J=5.5Hz,1H:十八烷基氨基的CONH);8.99(d,J=8Hz,1H:半胱氨酸的CONH);7.96-8.84和9.09(3个mf:相应于NH和NH2的H)。
MH+=815
制备例3.4[化合物(Ⅳ)]:NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys-[S-S-(CH2)11CH3]-N[(CH2)17CH3]2
将制备例2.4得到的产品用于与制备例3.1相同的合成中。
得到产率为39%成盐产品。
HPLC:Rt=19.75分。
1HNMR谱(400MHz,(CD3)2SO,δ,以ppm表示):0.87(t,J=7.5Hz,9H:两个十八烷基氨基的CH3和十二烷基二硫基的CH3);1.15-1.50(mt,78H:两个十八烷基氨基的15CH2-另一个十八烷基氨基的15CH2和十二烷基二硫基的9CH2);1.47(mt,2H:两个十八烷基氨基之一的1CH2);1.50-1.70(mt,4H:两个十八烷基之一的1CH2和十二烷基二硫基的1CH2);1.68(mf,4H:丁基中心的2CH2);1.85-2.10(mt,4H:两个丙基中心的CH2);2.77(t,J=7.5Hz,2H:十二烷基二硫基的SCH2);2.80(mt,1H:半胱氨酸的CH2S的1H);2.70-3.50(mt:丁基的2NCH2-两个丙基的2NCH2-半胱氨酸CH2S另一个H和两个十八烷基氨基的NCH2);3.80(宽s,2H:甘氨酰基氨基的NCH2CON);5.05(mt,1H:半胱氨酸的CONCHCON);9.07(d,J=8Hz,1H:半胱氨酸的CONH);7.75-8.20和8.65-9.25(2个展宽的mf:相应于NH和NH2的H)。
MH+=1067
制备例3.5[化合物(Ⅴ)]:NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys-[S-S-胆甾醇]-NH(CH2)17CH3
将制备例2.5得到的产品用于与制备例3.1相同的合成中,BOC的最后分解除外,这种分解使用下述的混合物:10毫升TFA、0,5毫升水、0,5毫升苯硫基甲烷和0.75克苯酚。
得到产率为5.6%成盐产品。
HPLC:Rt=16.59分。
1HNMR谱(400MHz,(CD3)2SOd6,温度383K,δ,以ppm表示):0.74和1.05(2s,每个3H:胆甾烯基18位的CH3和19位的CH3);0.80-0.95(mt:相应于十八烷基氨基CH3和胆甾烯基26位CH3-27位CH3和21位CH3的H);1.77(mt:相应于丁基中心2CH2的4H);1.85-2.10(mt:相应于两个丙基中心的CH2的4H);2.90-3.25(mt:相应于丁基2NCH2-两个丙基的2NCH2-半胱氨酸CH2S和十八烷基氨基的NCH2的16H);3.63(限制的AB,2H:甘氨酰基氨基的NCH2CON);4.61(mt,1H:半胱氨酸的CONCHCON);5.39(mt,1H:胆甾烯基6位的CH);7.69(mt,1H:十八烷基氨基的CONH);8.25(mf,1H:半胱氨酸的CONH)。对于胆甾烯基和十八烷基氨基的所有其他质子,相应的信号在0.60-3.00ppm之间。
MH+=1015
b)用二硫桥构建可一分为二的对称转移试剂
这些分子的一般结构如下:
多胺-间隔臂-脂
|
S
|
S
|
多胺-间隔臂-脂
它们以下述方式构建:
用下列非限制性的实施例说明这些转移试剂:
化合物(Ⅵ):R1=(CH2)17CH3;R2=H
步骤1
·制备例1:[NHBoc-CH(CH2)17CH3]CH2-S-]2
将Nα,Nα′-二-Boc胱氨酸(0.57毫摩尔)溶于氯仿(15毫升)中,再加入N-乙基二异丙基胺(5.67毫摩尔)、十八烷基胺(0.10毫摩尔)和BOP(1.24毫摩尔)。
该混合物搅拌2小时,采用TLC和HPLC跟踪。
用旋转蒸发器蒸去氯仿。“粗产物”溶于乙酸乙酯(100毫升),然后相继地进行如下洗涤:每次用50毫升0.5M KHSO4洗涤3次,然后每次用50毫升饱和NaHCO3溶液洗涤3次,最后每次用50毫升饱和NaCl溶液洗涤2次。有机相用无水硫酸镁干燥,再用旋转蒸发器蒸去乙酸乙酯。
得到0.346毫摩尔产品,即产率69%。
TLC:Rf=0.94(CHCl3/MeOH,9∶1)。
步骤2
·制备例2[化合物(Ⅵ)]:[NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCyNH(CH2)17CH3]2
将三氟乙酸(5毫升)加到由制备例1得到的产品中。将混合物搅拌1.5小时,采用HPLC跟踪BOC的分解。蒸去三氟乙酸,为了赶掉微量三氟乙酸,每次用5毫升乙醚蒸发3次。干提取物溶于二氯甲烷(25毫升)中,然后加N-乙基二异丙基胺(3.44毫摩尔)、BocNH(CH2)3NBoc(CH2)4NBoc(CH2)3NBocCH2CO2H(0.697毫摩尔)和BOP(0.86毫摩尔)。将混合物搅拌2小时,采用TLC和HPLC跟踪该反应。
用旋转蒸发器蒸去二氯甲烷。将“粗产物”溶于乙酸乙酯(100毫升),然后相继地进行如下洗涤:每次用50毫升0.5M KHSO4洗涤3次,然后每次用50毫升饱和NaHCO3溶液洗涤3次,最后每次用50毫升饱和NaCl溶液洗涤2次。有机相用无水硫酸镁干燥,再用旋转蒸发器蒸去乙酸乙酯。
TLC:Rf=0.90(CHCl3/MeOH,9∶1),HPLC:Rt=26.10分。
将三氟乙酸(5毫升)加到干提取物中。将混合物搅拌1.5小时,采用HPLC跟踪BOC的分解。蒸去三氟乙酸,为了赶掉微量三氟乙酸,每次用5毫升乙醚蒸发3次。
得到的粗产品采用制备性HPLC进行纯化。收集目标馏分并冻干。
得到0.099毫摩尔成盐产品,即产率为28.5%。
HPLC:Rt=10.55分。
1HNMR谱(400MHz,(CD3)2SO,δ,以ppm表示):0.91(t,J=7.5Hz,6H:两个十八烷基氨基的CH3);1.10-1.40(mt,60H:两个十八烷基氨基之一的15CH2和另一个十八烷基氨基的15CH2);1.43(mt,4H:两个十八烷基氨基的1CH2);1.64(mf,8H:两个丁基中心2CH2);1.85-2.10(mt,8H:四个丙基中心的CH2);2.80-3.15(mt,32H:两个丁基的2NCH2-四个丙基的2NCH2-两个十八烷基氨基的NCH2和两个半胱氨酸的CH2S);3.84(mf,4H:两个甘氨酰基氨基的NCH2CON);4.60(mt,2H:两个半胱氨酸的CONCHCON);8.27(mf,2H:两个十八烷基氨基CONH);8.95(mf,2H:两个半胱氨酸的CONH);7.97-8.87和9.15(3个mf:相应于NH和NH2的H)。
MH+=1227。
实施例2:本发明转移试剂净化作用的评价
这个实施例的目的是证明本发明的转移试剂具有去污剂性质,即它们能够溶解膜。
为此,使用了代表生物膜的体外模型,即脂质体EPC/EPA(卵的磷脂酰胆碱/卵的磷脂酸,10∶1)。与生物膜完全一样,这些脂质体的壁是由双层磷脂构成,因此它们具有可比较的性能。
这些脂质体的制备方法如下:将不同的组分在氯仿中制成溶液,然后采用旋转蒸发器蒸去所述的氯仿。得到的脂薄膜再分散在水中,然后采用声处理和加热处理生成脂质体。
采用分光光度法测定浊度,可评价添加到脂质体中的产品的去污剂作用。
作为参比,用Triton X-100进行了第一个试验,Triton X-100是人们熟知的市售去污剂。正如图1曲线所表明的,达到了脂质体的完全溶解(100%溶解作用)。
第二个试验产品是一种两亲分子,该分子含有通过间隔臂与有18个碳原子的脂肪链连接的多胺(化合物(Ⅶ))。因此涉及还原本发明化合物(Ⅱ)二硫桥所得到的分子。图2的曲线表明将这种两亲分子加到脂质体中时所得到的结果:观察到了部分溶解作用,与Triton X-100相比相当于约30%溶解作用。
最后,用参比REF阳离子脂,即化合物(Ⅱ)的类似物但不含二硫桥,进行了同样的试验。观察到脂质体膜没有任何溶解。
结论:本实施例表明,本发明的转移试剂在还原介质中能够产生具有去污剂作用-即能够溶解膜-的两亲分子。这种性质是极有利的,因为本发明的转移试剂能够更大量地更容易地接近核酸,直到细胞室,这样就能够改善转染效率(正如下面转染实施例所表明的)。
实施例3:本发明的产品用于遗传物质的体外转染
不论二硫桥插入转移试剂结构中的情况如何,这些试验都说明了本发明转移试剂能够有效地转染体外细胞。
A.使用的遗传物质
使用的质粒在专利WO97/10343中作过描述。这种结构pCOR-pXL2774包括在人巨细胞病毒非常早熟基因[hCMV-IE]的启动子控制下的荧光素酶编码基因。
核酸溶液在生理盐水(0.15M NaCl)中稀释到20微克/毫升。
B.细胞转染剂溶液(临时制备)
将本发明中描述的产品在水中制成溶液,浓度为40-160微摩尔,并与DNA溶液逐体积混合。最后盐浓度是75毫摩尔。
C.转染
将细胞在24孔(2厘米2/孔)微培养板中在适当的条件下培养,当它们处于指数生长期及50-70%汇合时进行转染。
这些细胞每次用0.5毫升无血清蛋白的介质洗涤两次,接着在无血清的培养基中(在没有血清的情况下转染)或者在完全培养基中(在有血清的情况下转染)继续生长。往细胞中加入0.05毫升细胞转染剂混合物(0.5微克DNA/孔)(3孔/载体-DNA条件)。在无血清转染细胞时,在转染后2小时后,生长培养基中补充适量的血清。
根据Promega试剂盒的使用说明(荧光素酶试验系统),通过测定荧光素酶的表达,在转染后48小时评价转染效率。通过测定细胞溶胞产物中的蛋白质浓度,估算细胞转染剂混合物的毒性。
D.结果
a)通过还原二硫桥可一分为二的对称转移试剂:化合物(Ⅵ)(图3)
为转染细胞系HepG2,作为DNA载体使用本发明描述的这种产品,与参比REF阳离子脂类(在专利申请WO97/18185中作为化合物(6)描述的)进行比较。
对于这种类型的细胞,化合物(Ⅵ)毒性与参比REF阳离子脂类处于相同的数量级:在没有血清的情况下进行转染,阳离子脂类剂量为160μM时,HepG2细胞的存活率为80%。
阳离子脂类/微克DNA之比为4-8纳摩尔时,可获得最大的转染效率。对于HepG2细胞的转染,使用化合物(Ⅵ)达到的转基因表达高于使用参比REF阳离子脂类达到的转基因表达(4倍)。
b)转移试剂:脂部分由两个C18烷基链和一个通过二硫桥连接的第三种烷基链组成:化合物(Ⅰ)和(Ⅳ)
对于HeLa细胞和HepG2细胞,本发明描述的这两种产品直到阳离子脂类剂量为160μM都没有显著的毒性。
与使用参比REF的阳离子脂类得到的转基因表达相比,在C5[化合物(Ⅰ)]中引入第三个脂链在没有血清蛋白质的情况下得到的转染结果具有相同的数量级。相反地,在同样的转染条件下,如果第三个脂链是在C12[化合物(Ⅳ)]中,对于HeLa细胞,转基因表达增加约2倍,对于HepG2细胞,转基因表达增加约9倍(参见图4)。
此外,在血清蛋白质存在下的转染试验中,证明了通过加入第三个烷基链,阳离子脂类亲脂性增加的重要意义。在这种情况下,事实上血清蛋白质的存在没有任何显著的抑制作用,这样,可从中选择体内转染的侯选者。
图5和6以矩形图表示化合物(Ⅰ)和(Ⅳ)的转染效率。
c)转移试剂:脂部分由两个C18烷基链组成,其中一个烷基链通过二硫桥连接:化合物(Ⅱ)
对于HepG2细胞(阳离子脂类剂量为160μM),本发明描述的这种产品在所用的剂量下都没有显著的毒性。
对于没有血清蛋白质情况下的转染,转基因表达水平比参比REF的阳离子脂类的高达3倍(参见图7)。
此外,在血清蛋白质存在下,转染有明显改善(达4倍)。因此,非常惊奇地注意到,没有因血清存在而有任何抑制作用。
图8以矩形图表示化合物(Ⅱ)的转染效率。
d)转移试剂:脂部分含有一个通过二硫桥连接的类固醇衍生链:化合物(Ⅴ)(图9)
对于HeLa细胞和HepG2细胞(阳离子脂类剂量为160μM),本发明描述的这种化合物在所用的剂量下都没有显著的毒性。
胆固醇代替烷基链的连接使转基因表达非常显著地增加,此外,在这种情况下,在血清存在下未观察到任何抑制作用,这样使这种产品很有希望用于体内转染。
结论:在表中和图3-9中以矩形图表示的结果证明:
-在阳离子脂类型转移试剂中引入一个或多个二硫桥不影响这些DNA转染剂的体外能力,而相反地可导致转染效率的提高,
-本发明的转移试剂在使用的剂量下没有毒性,
-最后,本发明转移试剂亲脂性增加至少能够部分地克服因血清而引起的转染抑制作用。
Claims (27)
1、一种核酸转移试剂,其含有至少一个能够以非-共价键方式与核酸结合的阳离子亲水区域,和至少一个亲脂区域,这些区域彼此通过一个“间隔臂”连接起来,还含有至少一个二硫桥,其处于还原后引起亲脂区域部分降解的位置,或处于还原后引起转移试剂为对称时所述转移试剂一分为二的位置。
2、根据权利要求1所述的转移试剂,其特征在于阳离子亲水区域是多胺或多氨基胍。
3、根据权利要求1所述的转移试剂,其特征在于亲脂区域由至少一个脂肪脂族链和一个或多个脂族链、一个或多个类固醇衍生物、自然或合成的脂,和/或选择性地它们的组合构成。
4、根据权利要求3所述的转移试剂,其特征在于亲脂区域由至少两个脂肪脂族链构成。
5、根据权利要求3所述的转移试剂,其特征在于亲脂区域由一个脂肪脂族链和一个类固醇衍生物构成。
6、根据权利要求3所述的转移试剂,其特征在于脂肪脂族链是10-22碳原子的直链或支链烃基,其选择性地为饱和的和/或含氟的。
7、根据权利要求3所述的转移试剂,其特征在于类固醇衍生物选自胆甾醇、胆酸和胆甾烯基胺。
8、根据权利要求1所述的转移试剂,其特征在于所谓“间隔臂”选自酰胺、氨基甲酸酯、酯、醚基团和/或芳环。
9、根据权利要求1所述的转移试剂,其特征在于它含有一个或多个二硫桥。
10、根据权利要求1所述的转移试剂,其特征在于它含有二硫桥,其位于还原后可引起脂肪脂族链丧失的位置。
11、根据权利要求1所述的转移试剂,其特征在于它含有二硫桥,其位于还原后可引起亲脂区域中存在的类固醇衍生链丧失的位置。
12、根据权利要求1所述的转移试剂,其特征在于它选自如下:NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys[S-S-(CH2)4CH3]-N[(CH2)17CH3]2 (Ⅰ)NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys[S-S-(CH2)17CH3]-NH(CH2)17CH3 (Ⅱ)NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys-[S-S-(CH2)11CH3]-NH(CH2)17CH3 (Ⅲ)NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys-[S-S-(CH2)11CH3]-N[(CH2)17CH3]2(Ⅳ)NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCys-[S-S-胆甾醇]-NH(CH2)17CH3 (Ⅴ)[NH2(CH2)3NH(CH2)4NH(CH2)3NHCH2COCyNH(CH2)17CH3]2(Ⅵ)。
13、组合物,其特征在于它含有如权利要求1-12中限定的转移试剂和至少一种核酸。
14、根据权利要求13所述的组合物,其特征在于核酸是脱氧核糖核酸或核糖核酸。
15、根据权利要求13所述的组合物,其特征在于核酸是化学方法修饰的核酸。
16、根据权利要求13所述的组合物,其特征在于核酸是反义核酸。
17、根据权利要求13所述的组合物,其特征在于核酸含有有治疗意义的基因。
18、根据权利要求13-17中任一项所述的组合物,其特征在于它还含有由一种或多种中性脂类构成的添加剂,这些脂选自合成的或天然的、在生理条件下为两性的或没有离子电荷的脂类。
19、根据权利要求18所述的组合物,其特征在于一种或多种中性脂类是胆甾醇或下述类型的具有两个脂肪链的脂类:二油酰基磷脂酰乙醇胺(DOPE)、油酰基棕榈酰基磷脂酰乙醇胺(POPE)、二硬脂酰基-、二棕榈酰基-、二胆甾烯基-、二肉豆蔻酰基-磷脂酰乙醇胺以及它们的1-3次N-甲基化衍生物、磷脂酰基甘油、糖基二酰基甘油、脑苷脂(具体如半乳糖脑苷脂)、鞘脂(具体如鞘磷脂),或脱唾液酸神经节苷脂(具体如脱唾液酸GM1和GM2)。
20、根据权利要求13所述的组合物,其特征在于它还含有一种添加剂,其添加剂是或含有全部或部分地由组蛋白、核仁素和/或鱼精蛋白衍生的化合物,或所述的化合物全部或部分地由连续或非连续重复的肽基元(KTPKKAKKP)和/或(ATPAKKAA)组成,基元数是2-10。
21、根据权利要求13所述的组合物,其特征在于它还结合有转移试剂的靶向元件。
22、根据权利要求21所述的组合物,其特征在于所述的靶向元件选自抗细胞表面分子的抗体,膜受体的配位体如胰岛素、转铁蛋白、叶酸或任何其他的生长因子、细胞因子或维生素,修饰或未修饰的凝集素,具有RGD基元的蛋白质,含有串联RGD基元的环状或非环状的肽,聚赖氨酸肽以及天然或合成的配体肽。
23、根据权利要求13所述的组合物,其特征在于它还含有至少一种poloxamer,聚氧乙烯醇、聚氧乙烯壬基苯基醚或具有树状苄基聚醚端的聚乙二醇类型的非离子表面活性剂。
24、如根据权利要求1-12限定的转移试剂在细胞中转移核酸的用途。
25、向细胞中核酸转移的方法,其特征在于该方法包括下述步骤:
(1)让核酸与如权利要求1-12限定的转移试剂接触,以生成核酸/转移试剂复合物,如果必要,让该转染剂与一种或多种用于核酸转染的其他已知的试剂和/或与一种或多种添加剂预先进行接触,
(2)让细胞与(1)生成的复合物接触。
26、上述权利要求中限定的组合物的制备方法,其特征在于让核酸与如权利要求1-12限定的转移试剂接触,以生成核酸/转移试剂复合物,如果必要,让该转染剂与一种或多种用于核酸转染的其他已知的试剂和/或与一种或多种添加剂预先进行接触。
27、疾病的治疗方法,该方法包括在体内、离体或在体外给予上述权利要求中限定的组合物。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR9801065A FR2774394B1 (fr) | 1998-01-30 | 1998-01-30 | Composes transfectants sensibles aux conditions reductrices, compositions pharmaceutiques les contenant, et leurs applications |
| FR98/01065 | 1998-01-30 | ||
| US7702698P | 1998-03-06 | 1998-03-06 | |
| US60/077,026 | 1998-03-06 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1289371A true CN1289371A (zh) | 2001-03-28 |
Family
ID=26234096
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN99802464A Pending CN1289371A (zh) | 1998-01-30 | 1999-01-28 | 对还原条件敏感的转染化合物,含有它们的药物组合物及其应用 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US6521252B1 (zh) |
| EP (1) | EP1049793B1 (zh) |
| JP (1) | JP2002501762A (zh) |
| KR (1) | KR20010081924A (zh) |
| CN (1) | CN1289371A (zh) |
| AT (1) | ATE306556T1 (zh) |
| AU (1) | AU759197B2 (zh) |
| BR (1) | BR9907269A (zh) |
| CA (1) | CA2318512C (zh) |
| DE (1) | DE69927669T2 (zh) |
| HU (1) | HUP0101393A3 (zh) |
| IL (1) | IL137247A0 (zh) |
| NO (1) | NO20003880D0 (zh) |
| WO (1) | WO1999038821A2 (zh) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6169078B1 (en) * | 1998-05-12 | 2001-01-02 | University Of Florida | Materials and methods for the intracellular delivery of substances |
| US6379698B1 (en) * | 1999-04-06 | 2002-04-30 | Isis Pharmaceuticals, Inc. | Fusogenic lipids and vesicles |
| AU9418501A (en) * | 2000-10-04 | 2002-04-15 | Kyowa Hakko Kogyo Kk | Method of coating fine particle with lipid film |
| WO2009036368A2 (en) * | 2007-09-14 | 2009-03-19 | Nitto Denko Corporation | Drug carriers |
| FR2921369B1 (fr) * | 2007-09-25 | 2014-07-11 | Pf Medicament | Nouveau procede de preparation de derives (poly) aminoalkylaminoacetamide d'epipodophyllotoxine,utiles pour leurs applications en therapeutique comme agent anticancereux. |
| GB0720486D0 (en) * | 2007-10-19 | 2007-11-28 | Univ Edinburgh | Cationic lipids |
| EP3995489A3 (en) * | 2013-02-28 | 2022-07-20 | Tufts University | Disulfide compounds for delivery of pharmaceutical agents |
| US11433128B2 (en) * | 2017-04-07 | 2022-09-06 | Tianxin Wang | Cell surface anchoring antigen conjugates to treat cancer |
| CN111918668A (zh) * | 2018-02-16 | 2020-11-10 | 王天欣 | 治疗肿瘤细胞和癌症的方法和药剂 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2645866B1 (fr) | 1989-04-17 | 1991-07-05 | Centre Nat Rech Scient | Nouvelles lipopolyamines, leur preparation et leur emploi |
| EP0537299A1 (en) | 1990-03-29 | 1993-04-21 | Gilead Sciences, Inc. | Oligonucleotide-transport agent disulfide conjugates |
| US5283185A (en) * | 1991-08-28 | 1994-02-01 | University Of Tennessee Research Corporation | Method for delivering nucleic acids into cells |
| US5837533A (en) * | 1994-09-28 | 1998-11-17 | American Home Products Corporation | Complexes comprising a nucleic acid bound to a cationic polyamine having an endosome disruption agent |
| FR2727679B1 (fr) | 1994-12-05 | 1997-01-03 | Rhone Poulenc Rorer Sa | Nouveaux agents de transfection et leurs applications pharmaceutiques |
| FR2730637B1 (fr) * | 1995-02-17 | 1997-03-28 | Rhone Poulenc Rorer Sa | Composition pharmaceutique contenant des acides nucleiques, et ses utilisations |
| KR19990022597A (ko) | 1995-06-07 | 1999-03-25 | 다니엘 엘. 캐시앙, 헨리 엘. 노르호프 | 티오양이온성 지질, 제약조성물 및 그 사용 방법 |
| FR2741066B1 (fr) * | 1995-11-14 | 1997-12-12 | Rhone Poulenc Rorer Sa | Nouveaux agents de transfection et leurs applications pharmaceutiques |
| US5942634A (en) * | 1997-05-09 | 1999-08-24 | Genzyme Corporation | Cationic amphiphiles for cell transfections |
| EP0945138A1 (en) | 1997-12-04 | 1999-09-29 | Université Louis Pasteur de Strasbourg | Transfection particles |
| US6169078B1 (en) | 1998-05-12 | 2001-01-02 | University Of Florida | Materials and methods for the intracellular delivery of substances |
-
1999
- 1999-01-28 HU HU0101393A patent/HUP0101393A3/hu unknown
- 1999-01-28 EP EP99901639A patent/EP1049793B1/fr not_active Expired - Lifetime
- 1999-01-28 IL IL13724799A patent/IL137247A0/xx unknown
- 1999-01-28 DE DE69927669T patent/DE69927669T2/de not_active Expired - Lifetime
- 1999-01-28 CN CN99802464A patent/CN1289371A/zh active Pending
- 1999-01-28 JP JP2000530060A patent/JP2002501762A/ja active Pending
- 1999-01-28 WO PCT/FR1999/000162 patent/WO1999038821A2/fr not_active Application Discontinuation
- 1999-01-28 AT AT99901639T patent/ATE306556T1/de not_active IP Right Cessation
- 1999-01-28 KR KR1020007008257A patent/KR20010081924A/ko not_active Application Discontinuation
- 1999-01-28 CA CA002318512A patent/CA2318512C/fr not_active Expired - Fee Related
- 1999-01-28 BR BR9907269-6A patent/BR9907269A/pt not_active IP Right Cessation
-
2000
- 2000-07-04 AU AU43843/00A patent/AU759197B2/en not_active Ceased
- 2000-07-06 US US09/610,727 patent/US6521252B1/en not_active Expired - Fee Related
- 2000-07-28 NO NO20003880A patent/NO20003880D0/no not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| JP2002501762A (ja) | 2002-01-22 |
| KR20010081924A (ko) | 2001-08-29 |
| WO1999038821A2 (fr) | 1999-08-05 |
| BR9907269A (pt) | 2001-04-03 |
| EP1049793B1 (fr) | 2005-10-12 |
| AU759197B2 (en) | 2003-04-10 |
| US6521252B1 (en) | 2003-02-18 |
| DE69927669D1 (de) | 2006-02-23 |
| IL137247A0 (en) | 2001-07-24 |
| CA2318512C (fr) | 2009-10-13 |
| EP1049793A2 (fr) | 2000-11-08 |
| ATE306556T1 (de) | 2005-10-15 |
| DE69927669T2 (de) | 2006-07-20 |
| HUP0101393A3 (en) | 2004-10-28 |
| AU4384300A (en) | 2001-04-05 |
| HUP0101393A1 (hu) | 2001-08-28 |
| WO1999038821A3 (fr) | 1999-09-23 |
| NO20003880L (no) | 2000-07-28 |
| NO20003880D0 (no) | 2000-07-28 |
| CA2318512A1 (fr) | 1999-08-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1082043C (zh) | 新的阳离子类脂及其应用 | |
| CN1131208C (zh) | 化合物、它们的制备及其在细胞中核酸转移的应用 | |
| CN1254234C (zh) | 质粒dna(lipogenestm)和含细胞核定位信号/促融合肽缀合物的治疗剂包封到定向脂质体复合体中 | |
| CN1284523C (zh) | 由脂质膜被覆微粒的方法 | |
| CN1433478A (zh) | 用于基因治疗的新的胶体合成载体 | |
| CN1434870A (zh) | 病毒核心蛋白-阳离子脂质-核酸-递送复合物 | |
| CN1906308A (zh) | 小干扰rna的细胞转染制剂、相关组合物以及制备和使用方法 | |
| CN100351259C (zh) | 含硫的磷脂衍生物 | |
| CN1271992C (zh) | 作为遗传物质转移系统的阳离子病毒体 | |
| FR2759382A1 (fr) | Nouveaux composes et compositions les contenant utilisables pour le transfert d'au moins une substance therapeutiquement active, notamment un polynucleotide, dans une cellule cible et utilisation en therapie genique | |
| CN1882693A (zh) | 聚乙二醇修饰的脂质化合物及其应用 | |
| CN1263730C (zh) | 用于胞内释放药理活性化合物的用作阳离子脂质的l-肉碱或烷酰基l-肉碱的酯 | |
| CN1268186A (zh) | 重组诱发剂寡核碱基校正肝细胞遗传损害的体内应用 | |
| CN1849069A (zh) | 用于端粒酶抑制的改性寡核苷酸 | |
| HUT77171A (hu) | Lipopoliaminok mint transzfekciós ágensek, és ezeket tartalmazó gyógyászati készítmények | |
| CN1193978A (zh) | 肽基化合物和它们作为金属蛋白酶抑制剂的医疗用途 | |
| CN1617710A (zh) | 递送核酸的脂质体组合物 | |
| CN1180697A (zh) | 用于基因治疗的阳离子类脂 | |
| CN1289371A (zh) | 对还原条件敏感的转染化合物,含有它们的药物组合物及其应用 | |
| JP2001500162A (ja) | 少なくとも1種の治療上有効な物質、特にポリヌクレオチド、を標的細胞に導入するための新規脂質複合体および遺伝子治療における使用 | |
| CN1561199A (zh) | 含有包含极性和非极性部分的类脂的药物组合物 | |
| CN1867580A (zh) | 被甘油衍生物修饰的化合物 | |
| CN1863559A (zh) | 化合物 | |
| CN1452617A (zh) | 酸敏感化合物、其制备方法和用途 | |
| CN1259134A (zh) | 新型的核酸阳离子转染剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| AD01 | Patent right deemed abandoned | ||
| C20 | Patent right or utility model deemed to be abandoned or is abandoned |