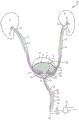用于产生负压以增强肾功能的系统、套件和方法
相关申请的交叉引用
本申请要求优先于2017年8月25日提交的美国专利申请号15/687064文件,美国专利申请号15/687064文件是2017年1月20日提交的美国专利申请号15/411884文件的部分延续案,美国专利申请号15/411884文件是2016年7月20日提交的美国专利申请号15/214955文件的部分延续案,美国专利申请号15/214955文件要求2016年2月25日提交的美国临时申请号62/300025文件、2016年1月14日提交的美国临时申请号62/278721文件、2015年11月30日提交的美国临时申请号62/260966文件和2015年7月20日提交的美国临时申请号62/194585文件的权益,其中每一项的全文均通过引用并入本文。
此外,本申请要求优先于2017年8月25日提交的美国专利申请号15/687083文件,美国专利申请号15/687083文件是2017年1月20日提交的美国专利申请号15/411884文件的部分延续案,美国专利申请号15/411884文件是2016年7月20日提交的美国专利申请号15/214955文件的部分延续案,美国专利申请号15/214955文件要求2016年2月25日提交的美国临时申请号62/300025文件、2016年1月14日提交的美国临时申请号62/278721文件、2015年11月30日提交的美国临时申请号62/260966文件和2015年7月20日提交的美国临时申请号62/194585文件的权益,其中每一项的全文均通过引用并入本文。
此外,本申请要求优先于2018年1月18日提交的美国专利申请号15/745823文件,美国专利申请号15/745823文件是2016年7月20日提交的文件PCT/US2016/043101的美国国家阶段,文件PCT/US2016/043101要求2016年2月25日提交的美国临时申请号62/300025文件、2016年1月14日提交的美国临时申请号62/278721文件、2015年11月30日提交的美国临时申请号62/260966文件和2015年7月20日提交的美国临时申请号62/194585文件的权益,其中每一项的全文均通过引用并入本文。
此外,本申请要求2017年4月25日提交的美国临时申请号62/489789文件和62/489831文件的优先权。
背景技术
技术领域
本发明涉及用于治疗各种疾病状态下肾功能受损的方法和装置,尤其涉及用于从患者体内除去液体(例如尿液)的方法,该方法例如使用通过膀胱导管施加负压的输尿管支架和/或输尿管导管与膀胱导管的组合。
背景技术
肾或泌尿系统包括一对肾和一尿道,每个肾通过输尿管与膀胱相连,尿道用于从膀胱中排出肾所产生的液体或尿液。肾对人体具有多种重要功能,例如过滤血液以排除尿液形式的废物。肾还调节电解质(例如钠、钾和钙)和代谢物、血液量、血压、血液pH值、液体量、红细胞生成和骨代谢。充分了解肾的解剖结构和生理状况有助于理解改变血流动力学的其他液体过多条件对其功能的影响。
在正常解剖中,两个肾位于腹腔腹膜后。肾是豆状的包膜器官。尿液是由肾的功能单位肾单位形成的,然后流经一个称为集尿管的会聚小管的系统。集尿管汇合在一起形成肾小盏,然后形成肾大盏,这些肾盏最终在肾凹部(肾盂)附近汇合。肾盂的主要功能是引导尿液流向输尿管。尿液从肾盂流入输尿管,输尿管是一种将尿液从肾输送到膀胱的管状结构。肾的外层称为皮质,是一种坚硬的纤维包膜。肾的内部称为髓质。髓质结构呈金字塔状排列。
每个肾由大约一百万个肾单位组成。每个肾单位包括肾小球、鲍曼囊和小管。小管包括近曲小管、亨氏环、远曲小管和集尿管。肾的皮质层中的肾单位相比于髓质中的肾单位具有不同的解剖结构。主要区别是亨氏环的长度。髓质肾单位含有更长的亨氏环,它在正常情况下比皮质肾单位能更大程度地调节水和钠的重吸收。
肾小球是肾单位的起点,负责对血液的最初过滤。输入小动脉将血液输送到肾小球毛细血管,在那里静水压将水和溶质推入鲍曼囊。净过滤压力表示为输入小动脉中的静水压减去鲍曼空间中的静水压减去输出小动脉中的渗透压。
净过滤压力=静水压(输入小动脉)-静水压(鲍曼空间)-渗透压(输出小动脉) (方程1)
由方程1确定的净过滤压力的大小决定了在鲍曼空间中形成并输送到小管中的超滤液的量。剩余的血液通过输出小动脉流出肾小球。正常肾小球过滤或将超滤液输送到小管中的速率约为90ml/min/1.73m2。
肾小球具有三层过滤结构,包括血管内皮细胞、肾小球基膜和足细胞。通常情况下,像白蛋白和红细胞这样的大蛋白不会被过滤到鲍曼空间中。然而,肾小球压力升高和系膜扩张导致基膜的表面积改变以及足细胞之间有更大的孔,从而允许更大的蛋白质进入鲍曼空间。
在鲍曼空间中收集的超滤液首先被输送到近曲小管。水和溶质在小管中的重吸收和分泌是由主动运输通道和被动压力梯度共同完成的。近曲小管通常会重吸收大部分的氯化钠和水,以及几乎所有被肾小球过滤后的葡萄糖和氨基酸。亨氏环有两个用于将废物浓缩到尿液中的组成部分。下降段高度透水,能重吸收大部分剩余的水。上升段重吸收剩余氯化钠的25%,从而产生浓缩的尿液,例如尿素和肌酐。远曲小管通常会重吸收一小部分氯化钠,并且渗透梯度为水的流动创造了条件。
在正常条件下,净过滤压力约为14mmHg。静脉充血的影响可能是净过滤压力显著降低,降至约4mmHg。参见Jessup M.,The cardiorenal syndrome:Do we need a changeof strategy or a change of tactics?,JACC 53(7):597-600,2009(以下简称为“Jessup”)。第二过滤阶段发生在近端小管。尿液的分泌和吸收主要发生在髓质肾单位的小管中。钠从小管向组织间隙的主动运输引发了这一过程。然而,静水压力主导着溶质和水的净交换。在正常情况下,认为75%的钠被重吸收回淋巴或静脉循环。然而,肾由于被包裹,它对静脉和淋巴充血引起的静水压变化很敏感。在静脉充血期间,钠和水的滞留量可能超过85%,从而使肾充血进一步持续。参见Verbrugge et al.,The kidney in congestiveheart failure:Are natriuresis,sodium,and diruetucs really the good,the badand the ugly?European Journal of Heart Failure 2014:16,133-42(以下简称为“Verbrugge”)。
静脉充血可导致肾前性急性肾损伤(AKI)。肾前性AKI是由于肾灌注减少(或血流减少)所致。许多临床医生关注的是由于休克导致的肾血流入量不足。然而,也有证据表明,由于静脉充血导致的器官血流出量不足可能是一种临床上重要的持续性损伤。参见DammanK,Importance of venous congestion for worsening renal function in advanceddecompensated heart failure,JACC 17:589-96,2009(以下简称为“Damman”)。
肾前性AKI发生在需要重症监护入院的各种诊治中。最突出的入院原因是败血症和急性失代偿性心力衰竭(ADHF)。其他入院原因包括心血管手术、普通手术、肝硬化、外伤、烧伤和胰腺炎。虽然这些疾病状态的表现形式存在广泛的临床变异性,但其共同点是中心静脉压升高。在ADHF的情况下,由心力衰竭引起的中心静脉压升高导致肺水肿,继而呼吸困难又导致入院。在败血症的情况下,中心静脉压升高主要是由于积极的液体复苏。无论最初的损伤是低血容量引起的低灌注还是钠和液体的滞留,持续性损伤都是静脉充血,导致灌注不足。
高血压是另一种被广泛确认的状态,它会在肾的主动和被动运输系统中产生干扰。高血压直接影响输入小动脉压,并导致肾小球内的净过滤压成比例增加。增加的滤过分数也会增加小管周围的毛细血管压力,从而刺激钠和水的重吸收。参见Verbrugge。
因为肾是一个被包裹的器官,所以它对髓质锥体中的压力变化很敏感。肾静脉压升高会造成充血,导致间质压升高。间质压升高对肾小球和小管都会施加作用力。参见Verbrugge。在肾小球中,间质压升高直接对抗过滤。升高的压力增加了间质液,从而增加了肾髓质中的间质液和小管周围毛细血管中的静水压。在这两种情况下都可能导致缺氧,从而导致细胞损伤和进一步丧失灌注。最终结果是钠和水的重吸收进一步加剧,从而产生负反馈。参见Verbrugge,133-42。液体过多,特别是腹腔积液与许多疾病和病症有关,包括腹腔内压升高、腹腔综合征和急性肾衰竭。可以通过肾脏替代治疗来解决液体过多的问题。参见Peters,C.D.,Short and Long-Term Effects of the Angiotensin II ReceptorBloeker Irbesartanon Intradialytic Central Hemodynamics:A Randomized Double-Blind Placebo-Controlled One-Year Intervention Trial(the SAFIR Study),PLoSONE(2015)10(6):e0126882.doi:10.1371/joumal.pone.0126882(以下简称为“Peters”)。然而,这种临床策略并不能改善心肾综合征患者的肾功能。参见Bart B,Ultrafiltrationin decompensated heart failure with cardiorenal syndrome,NEJM 2012;367:2296-2304(以下简称为“Bart”)。
考虑到这种液体滞留的问题,需要用于促进从患者体内排出液体(例如尿液)的系统和方法,尤其是用于增加从肾排出的液体的数量和质量的系统和方法。
发明概述
在一些实施例中提供了一种用于从患者体内排出液体(例如尿液)的方法,该方法包括:将输尿管支架或输尿管导管部署在患者的输尿管中,以维持患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在患者的膀胱中,其中该膀胱导管包括定位在患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向膀胱导管的近端施加负压,以在患者的一部分尿路中产生负压,从而从患者体内排出液体。
在一些实施例中提供了一种用于从患者体内排出液体的系统,该系统包括:输尿管支架或输尿管导管,用于维持患者的至少一个肾与膀胱之间液体流动的通畅性;膀胱导管,其包括用于从患者的膀胱中排出液体的排液腔;以及与排液腔的远端呈液体连通的泵,该泵包括控制器,该控制器被配置成致动所述泵以向所述导管的近端施加负压,从而在患者的一部分尿路中产生负压,以从患者体内排出液体。
在一些实施例中提供了一种用于从患者体内排出液体的套件,该套件包括:输尿管支架或输尿管导管,其包括排液通道,用于促进液体从输尿管和/或肾经由输尿管支架的排液通道流向患者的膀胱;以及包括控制器的泵,其被配置成在患者的输尿管、肾或膀胱中的至少一个中产生负压,以通过部署在所述患者膀胱中的导管的排液腔抽吸尿液。
在一些实施例中提供了一种套件,其包括:多个一次性膀胱导管,每个膀胱导管包括具有近端的排液腔部、定位在患者膀胱中的远端以及在其间延伸的侧壁;以及保持部,其从排液腔部的一部分远端径向向外延伸,并被配置成延伸至一部署位置,在该部署位置保持部的直径大于排液腔部的直径;膀胱导管的部署说明;以及用于将膀胱导管的近端连接至泵并用于操作该泵以通过膀胱导管的排液腔抽吸尿液的指令。
在一些实施例中介绍了一种用于保持肾功能的方法,该方法通过施加负压来降低髓质区小管内的间质压,以促进尿液的排出,并预防静脉充血引起的肾髓质中肾单位的缺氧,该方法包括:将输尿管支架或输尿管导管部署在患者的输尿管中,以维持患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在患者的膀胱中,其中该膀胱导管包括定位在患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向膀胱导管的近端施加负压,以在预定时间内在患者的一部分尿路中产生负压,从而从患者体内排出液体。
现在将在以下条款中描述本发明的非限制性实施例、方面或实施方式:
条款1:一种用于从患者体内排出液体的方法,该方法包括:将输尿管支架或输尿管导管部署在患者的输尿管中,以维持该患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在所述患者的所述膀胱中,其中该膀胱导管包括定位在所述患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向所述膀胱导管的所述近端施加负压,以在所述患者的一部分尿路中产生负压,从而从所述患者体内排出液体。
条款2:如条款1所述的方法,还包括将第二输尿管支架或第二输尿管导管部署在所述患者的第二输尿管中,以维持所述患者的第二肾与所述膀胱之间液体流动的通畅性。
条款3:如条款1或2中任一项所述的方法,其中所述输尿管导管包括:具有近端的排液腔部、定位在所述患者的输尿管、肾盂或肾中的至少一个中的远端以及在其间延伸的侧壁;以及保持部,其从所述排液腔部的一部分所述远端径向向外延伸,并被配置成延伸至一部署位置,在该部署位置所述保持部的直径大于所述排液腔部的直径。
条款4:如条款1或2中任一项所述的方法,其中所述输尿管导管包括管,该管限定排液腔并包括螺旋状保持部,该螺旋状保持部包括螺旋形装置,该螺旋形装置具有多个排液口且在展开时具有多个线圈。
条款5:如条款4所述的方法,其中所述输尿管导管的部署包括在所述患者的输尿管、肾盂或肾中的至少一个中的液体收集位置处扩展所述螺旋状保持部,以接收来自所述肾的尿液或液体。
条款6:如条款1或2中任一项所述的方法,其中所述输尿管导管包括:排液腔,其包括近端部和远端部,所述远端部定位在患者的邻近所述肾盂的一部分输尿管、肾盂或肾中的至少一个中,所述远端部包括螺旋状保持部,所述螺旋状保持部包括:至少一具有第一直径的第一线圈;至少一具有第二直径的第二线圈,且所述第一直径小于所述第二直径;以及在所述排液腔的所述远端部的所述螺旋状保持部的侧壁上的一个或多个穿孔,以允许液体流入所述排液腔,其中所述排液腔的所述近端部没有或基本上没有穿孔;在一些实施方式中,所述第二线圈比所述第一线圈更接近所述排液腔的所述远端部的端部;在一些实施方式中,所述第二线圈比所述第一线圈更接近所述排液腔的所述近端部的端部。
条款7:如条款1或2中任一项所述的方法,其中所述输尿管支架包括细长体,该细长体包括近端、远端、纵轴以及沿所述纵轴从所述近端向所述远端延伸的至少一个排液通道,以维持所述患者的肾与膀胱之间液体流动的通畅性。
条款8:如条款7所述的方法,其中所述输尿管支架还包括在所述近端或所述远端中的至少一个上的尾纤线圈或环。
条款9:如条款7所述的方法,其中所述输尿管支架的主体还包括在其侧壁上的至少一个穿孔。
条款10:如条款7所述的方法,其中所述输尿管支架的主体在其侧壁上没有或基本上没有穿孔。
条款11:如条款7所述的方法,其中所述至少一个排液通道沿着其至少一纵向部是部分开放的。
条款12:如条款7所述的方法,其中所述至少一个排液通道沿着其至少一纵向部是闭合的。
条款13:如条款7所述的方法,其中所述至少一个排液通道沿着其所述纵向部是闭合的。
条款14:如条款7所述的方法,其中所述输尿管支架可径向压缩。
条款15:如条款7所述的方法,其中所述输尿管支架可径向压缩,以使所述至少一个排液通道变窄。
条款16:如条款7所述的方法,其中所述细长体包括沿着所述细长体的纵轴的至少一个外翅片。
条款17:如权利要求7所述的方法,其中所述细长体包括一至四个排液通道。
条款18:如条款1或2中任一项所述的方法,其中所述输尿管支架包括:细长体,其包括近端、远端、纵轴、外表面和内表面,其中所述内表面限定可变形孔,该可变形孔沿所述纵轴从所述近端延伸到所述远端;其中所述可变形孔包括:(a)默认取向,其包括限定纵向开放通道的开放孔;以及(b)第二取向,其包括闭合孔或至少基本闭合的孔,该孔沿所述细长体的所述纵轴限定纵向基本闭合的排液通道,其中在径向压缩力施加到所述细长体的至少一部分外表面上时,所述可变形孔可从所述默认取向移动到所述第二取向;在一些实施例中,至少有两个翅片从所述细长体的所述外表面径向伸出。
条款19:如权利要求18所述的方法,其中在所述可变形孔从所述默认取向移动到所述第二取向时,所述输尿管支架的所述排液通道的直径减小,其中所述直径可减小至经由所述可变形孔的尿流量不再减少时为止。
条款20:如条款19所述的方法,其中当所述可变形孔从所述默认取向移动到所述第二取向时,所述直径减小高达约40%。
条款21:如条款18所述的方法,其中所述细长体还包括至少两个翅片,这些翅片包含基于肖氏硬度标度的软至中软的柔性材料,并且其中所述细长体包含基于肖氏硬度标度的中硬至硬的柔性材料。
条款22:如条款21所述的方法,其中所述至少两个翅片的硬度为约15A至约40A,并且所述细长体的硬度为约80A至约90A。
条款23:如条款18所述的方法,其中所述细长体还包括至少两个翅片,并且所述细长体包含基于肖氏硬度标度的中软至中硬的柔性材料。
条款24:如条款23所述的方法,其中所述至少两个翅片和所述细长体的硬度为约40A至约70A。
条款25:如条款18所述的方法,其中所述细长体还包括至少两个翅片,并且所述细长体包含基于肖氏硬度标度的中硬至硬的柔性材料。
条款26:如条款25所述的方法,其中所述至少两个翅片和所述细长体的硬度为约85A至约90A。
条款27:如条款18至26中任一项所述的方法,其中所述默认取向和所述第二取向除了支持液体流经所述可变形孔之外,还支持液体围绕所述支架的外表面流动。
条款28:如条款18所述的方法,其中所述至少两个翅片从所述近端纵向延伸至所述远端。
条款29:如条款18至28中任一项所述的方法,其中所述细长体的所述外表面的直径约为0.036英寸。
条款30:如条款18至29中任一项所述的方法,其中所述细长体的所述内表面的直径约为0.024英寸。
条款31:如条款21所述的方法,其中所述至少两个翅片中的每一个具有距所述纵轴约0.040英寸的尖端。
条款32:如条款18至31中任一项所述的方法,其中所述径向压缩力由正常输尿管生理系统、异常输尿管生理系统或施加任何外力中的至少一种方式来提供。
条款33:如条款21所述的方法,其中所述翅片的数量为两个或三个。
条款34:如条款1所述的方法,其中所述输尿管支架特意适应动态的输尿管环境,所述输尿管支架包括:细长体,其包括近端、远端、纵轴、外表面和内表面,其中所述内表面限定可变形孔,该可变形孔沿所述纵轴从所述近端延伸到所述远端;其中所述可变形孔包括:(a)默认取向,其包括限定纵向开放通道的开放孔;以及(b)第二取向,其包括限定纵向基本闭合通道的至少基本闭合的孔,其中在径向压缩力施加到所述细长体的至少一部分外表面上时,所述可变形孔可从所述默认取向移动到所述第二取向,其中在所述可变形孔从所述默认取向移动到所述第二取向时,所述细长体的所述内表面的直径减小,其中所述直径可减小至经由所述可变形孔的尿流量不再减少时为止。
条款35:如条款34所述的方法,其中当所述可变形孔从所述默认取向移动到所述第二取向时,所述直径减小高达约40%。
条款36:如条款34或35中任一项所述的方法,其中所述细长体包含基于肖氏硬度标度的中硬至硬的柔性材料。
条款37:如条款36所述的方法,其中所述细长体的硬度为约80A至约90A。
条款38:如条款36所述的方法,其中所述细长体的硬度为约85A至约90A。
条款39:如条款34或36中任一项所述的方法,其中所述细长体包含基于肖氏硬度标度的中软至中硬的柔性材料。
条款40:如条款39所述的方法,其中所述细长体的硬度为约40A至约70A。
条款41:如条款34所述的方法,其中所述默认取向和所述第二取向除了支持液体流经所述可变形孔之外,还支持液体围绕所述支架的外表面流动。
条款42:如条款1至41中任一项所述的方法,其中所述膀胱导管包括:具有近端的排液腔部、定位在患者膀胱中的远端以及在其间延伸的侧壁;以及保持部,其从所述排液腔部的一部分所述远端径向向外延伸,并被配置成延伸至一部署位置,在该部署位置所述保持部的直径大于所述排液腔部的直径。
条款43:如条款1或42中任一项所述的方法,其中所述膀胱导管包括管,该管限定排液腔并包括螺旋状保持部,该螺旋状保持部包括螺旋形装置,该螺旋形装置具有多个排液口且在展开时具有多个线圈。
条款44:如条款43所述的方法,其中所述膀胱导管的部署包括在所述患者膀胱中的液体收集位置处扩展所述螺旋状保持部,以接收通过所述输尿管和/或输尿管支架进入所述膀胱的尿液。
条款45:如条款1至44中任一项所述的方法,其中将所述输尿管支架或输尿管导管部署在所述患者体内并保持至少24小时。
条款46:如条款1至45中任一项所述的方法,其中将所述输尿管支架或输尿管导管部署在所述患者体内并保持至少30天或更长时间。
条款47:如条款1至46中任一项所述的方法,其中所述膀胱导管比所述输尿管支架或输尿管导管更频繁地被更换。
条款48:如条款1至47中任一项所述的方法,其中对于单个输尿管支架或输尿管导管,在所述留置时间内依次放置和取出多个膀胱导管。
条款49:如条款2所述的方法,其中对于单套输尿管支架或输尿管导管,在所述留置时间内放置和取出多个膀胱导管。
条款50:如条款1-49中任一项所述的方法,其中泌尿科医生或其他医生将所述输尿管支架或输尿管导管放置在所述患者体内。
条款51:如条款1至49中任一项所述的方法,其中医生、护士、护理人员或患者在家中或在任何医疗环境中将所述膀胱导管放置在所述患者体内。
条款52:如条款1至51中任一项所述的方法,其中在预定数量的晚上,每晚施加负压,并且在每晚施加负压之前可选地更换所述膀胱导管。
条款53:如条款1-52中任一项所述的方法,其中从所述患者体内除去过多的液体,并将其作为与慢性水肿、高血压、慢性肾病和/或急性心力衰竭相关的系统性液体体积管理的治疗方法之一。
条款54:根据条款53所述的方法,还包括:定期测量所述患者的体重;如果测得的重量小于预定阈值,则停止对所述尿路施加负压。
条款55:如条款54所述的方法,其中所述预定阈值是所述患者的干体重。
条款56:一种用于从患者体内排出液体的系统,该系统包括:输尿管支架或输尿管导管,用于维持所述患者的至少一个肾与膀胱之间液体流动的通畅性;膀胱导管,其包括用于从所述患者的所述膀胱中排出液体的排液腔;以及与所述排液腔的远端呈液体连通的泵,该泵包括控制器,该控制器被配置成致动所述泵以向所述导管的所述近端施加负压,从而在所述患者的至少一部分所述尿路中产生负压,以从所述患者体内排出液体。
条款57:如条款56所述的系统,还包括与所述患者相关联的一个或多个生理传感器,所述生理传感器被配置成向所述控制器提供代表至少一个身体参数的信息。
条款58:如条款57所述的系统,其中所述一个或多个生理传感器包括与体外血液系统相关联的分析物和/或电容传感器,且所述体外血液系统与所述患者相关联。
条款59:如条款56所述的系统,其中在停止施加所述负压之前,所述控制器还被配置成至少部分地基于所述至少一个身体参数的测量值来调整所述泵的运行参数。
条款60:如条款59所述的系统,其中基于所述至少一个身体参数的测量值来调整所述泵的运行参数包括当识别出所述至少一个身体参数的值的下降趋势时降低所施加的负压。
条款61:如条款56至60中任一项所述的系统,其中所述泵的灵敏度约为10mmHg或更低。
条款62:如条款56至61中任一项所述的系统,其中所述控制器被配置成使所述泵交替地提供负压与正压。
条款63:如条款62所述的系统,其中所提供的所述负压为约0.1mmHg至约150mmHg,并且其中所提供的所述正压为约5mmHg至约20mmHg。
条款64:如条款56所述的系统,其中在液体复苏程序期间向所述患者提供过量的液体。
条款65:一种用于从患者体内排出液体的套件,该套件包括:输尿管支架或输尿管导管,其包括排液通道,用于促进液体从所述输尿管和/或肾经由所述输尿管支架或输尿管导管的所述排液通道流向所述患者的所述膀胱;以及包括控制器的泵,其被配置成在所述患者的所述输尿管、肾或膀胱中的至少一个中产生负压,以通过部署在所述患者膀胱中的导管的排液腔抽吸液体。
条款66:如条款65所述的套件,还包括膀胱导管。
条款67:如条款66所述的套件,还包括对以下内容的说明:插入输尿管支架、膀胱导管,以及操作所述泵以通过部署在所述患者膀胱中的导管的排液腔抽吸尿液。
条款68:一套件,包括:多个一次性膀胱导管,每个膀胱导管包括具有近端的排液腔部、定位在患者膀胱中的远端以及在其间延伸的侧壁;以及保持部,其从所述排液腔部的一部分所述远端径向向外延伸,并被配置成延伸至一部署位置,在该部署位置所述保持部的直径大于所述排液腔部的直径;所述膀胱导管的部署说明;以及用于将所述膀胱导管的所述近端连接至泵并用于操作该泵以通过所述膀胱导管的所述排液腔抽吸液体的指令。
条款69:一种用于保持肾功能的方法,该方法通过施加负压来降低髓质区小管内的间质压,以促进尿液的排出,并预防静脉充血引起的所述肾的所述髓质中肾单位的缺氧,该方法包括:将输尿管支架或输尿管导管部署在患者的输尿管或肾中,以维持该患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在所述患者的所述膀胱中,其中该膀胱导管包括定位在所述患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向所述膀胱导管的所述近端施加负压,以在预定时间内在所述患者的一部分所述尿路中产生负压,从而从所述患者的所述尿路中排出液体。
附图说明
通过以下描述和所附条款并参考附图,本发明的这些和其他特征和特点、相关结构元件的操作方法和功能以及部件与制造经济性的结合将变得更加显而易见,所有这些均形成本说明书的一部分,其中相同的附图标记指示各个附图中相应的部件。然而,应当明确理解,附图仅用于说明和描述,并不旨在限定本发明。
通过结合附图所进行的以下详细描述,进一步的特征、其他实施例和优点将变得显而易见,在这些附图中:
图1A是根据本发明的一实施例得到的系统留置部的示意图,该系统留置部包括部署在患者的尿路中的输尿管支架和膀胱导管;
图2是根据本发明的一实施例得到的系统留置部的示意图,该系统留置部包括部署在患者的尿路中的输尿管导管和膀胱导管;
图3是根据PCT专利申请公开号WO 2017/019974文件中的图1得到的现有技术可变形输尿管支架的一实施例的二维视图,其中左图示出支架的未压缩状态,右图示出支架的压缩状态;
图4是根据美国专利申请公开号2002/0183853 A1文件中的图4得到的现有技术输尿管支架的一实施例的透视图;
图5是根据美国专利申请公开号2002/0183853 A1文件中的图5得到的现有技术输尿管支架的一实施例的透视图;以及
图6是根据美国专利申请公开号2002/0183853 A1文件中的图7得到的现有技术输尿管支架的一实施例的透视图。
图7是根据本发明的一实施例得到的系统留置部的另一实施例的示意图,该系统留置部包括部署在患者的尿路中的输尿管导管和膀胱导管;
图8A是根据本发明的一实施例得到的示例性导管的透视图;
图8B是图8A中导管的前视图;
图9A是根据本发明的一实施例得到的导管保持部的一实施例的示意图;
图9B是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图9C是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图9D是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图9E是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图10是根据本发明的一实施例得到的导管的另一实施例的前视图;
图10A是根据本发明的一实施例得到的图10中由圆圈10A包围的导管保持部的透视图;
图10B是根据本发明的一实施例得到的图10A中保持部的前视图;
图10C是根据本发明的一实施例得到的图10A中保持部的后视图;
图10D是根据本发明的一实施例得到的图10A中保持部的俯视图;
图10E是根据本发明的一实施例得到的图10A中沿着线30E-30E截取的保持部的剖视图;
图11是根据本发明的一实施例得到的处于约束或线性位置的导管的保持部的示意图;
图12是根据本发明的一实施例得到的处于约束或线性位置的导管的保持部的另一实施例的示意图;
图13是根据本发明的一实施例得到的处于约束或线性位置的输尿管导管的保持部的另一实施例的示意图;
图14是根据本发明的一实施例得到的处于约束或线性位置的导管的保持部的另一实施例的示意图;
图15A示出根据本发明的一实施例得到的流经一示例性导管的开口的液体流量百分比随位置的变化情况;
图15B示出根据本发明的一实施例得到的流经另一示例性导管的开口的液体流量百分比随位置的变化情况;
图15C示出根据本发明的一实施例得到的流经另一示例性导管的开口的液体流量百分比随位置的变化情况;
图16是根据本发明的一实施例得到的导管保持部的示意图,其示出用于计算液体流动系数以进行传质平衡评估的工位;
图17是根据本发明的另一实施例得到的部署在患者的尿路中的系统留置部的示意图;
图18A是根据本发明的一实施例得到的导管保持部的侧立面图;
图18B是沿图18A中线B-B截取的图18A中导管保持部的剖视图;
图18C是沿图18A中线C-C截取的图18A中导管保持部的俯视图;
图19是根据本发明的一实施例得到的另一导管的保持部的侧立面图;
图20是根据本发明的一实施例得到的另一导管的保持部的侧立面图;
图21是根据本发明的一实施例得到的另一导管的保持部的侧立面图;
图22A是根据本发明的一实施例得到的另一输尿管导管的保持部的透视图;
图22B是沿图22A中线B-B截取的图22A中导管保持部的俯视图;
图23A是根据本发明的一实施例得到的另一导管的保持部的透视图;
图23B是沿图23A中线B-B截取的图23A中导管保持部的俯视图;
图24是根据本发明的一实施例得到的另一导管的保持部的透视图;
图25是根据本发明的一实施例得到的另一导管的保持部的侧立面图;
图26是根据本发明的一实施例得到的另一导管的保持部的侧立面图;
图27是根据本发明的一实施例得到的另一导管的保持部的横截面侧视图;
图28A是根据本发明的一实施例得到的另一导管的保持部的透视图;
图28B是图28A中导管保持部的俯视图;
图29A是根据本发明的一实施例得到的另一导管的保持部的透视图;
图29B是图29A中导管保持部的俯视图;
图30是根据本发明的一实施例得到的另一导管的保持部的透视图;
图31是图30中导管保持部的俯视图;
图32A是根据本发明的一实施例得到的另一导管的保持部的透视图;
图32B是图32A中导管保持部的俯视图;
图33是根据本发明的一实施例得到的另一导管的保持部的横截面侧立面图;
图34是根据本发明的一实施例得到的另一导管的保持部的横截面侧立面图;
图35A是根据本发明的一实施例得到的另一导管的保持部的透视图;
图35B是沿图35A中线B-B截取的图35A中导管保持部的横截面侧立面图;
图36中的侧立面图示出根据本发明的一实施例得到的导管周围护套的剖视图,该护套处于收缩状态以插入到患者的输尿管中。
图37A是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图37B是沿图37A中线B-B截取的图37A中一部分保持部的剖视示意图;
图38A是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图38B是沿图38A中线B-B截取的图5A中保持部的一部分剖视图的示意图;
图39是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图40是根据本发明的一实施例得到的导管保持部的另一实施例的横截面示意图;
图41是根据本发明的一实施例得到的导管保持部的另一实施例的示意图;
图42A中的流程图示出根据本发明的一实施例得到的系统的插入和部署的过程;
图42B中的流程图示出使用根据本发明的一实施例得到的系统施加负压的过程;
图43是肾单位和周围脉管系统的示意图,其示出了毛细管床和曲小管的位置。
图44是根据本发明的一实施例得到的用于将负压引入到患者尿路中的系统的示意图;
图45A是根据本发明的一实施例得到的用于图44中系统的泵的平面图;
图45B是图45A中泵的侧立面图;
图46是用于评估猪模型中的负压疗法的实验装置的示意图;
图47示出使用图21中实验装置进行测试得到的肌酐清除率;
图48A是经负压疗法治疗的充血肾脏的肾组织的低倍显微照片;
图48B是图48A中肾组织的高倍显微照片;
图48C是充血且未经治疗肾脏(例如对照肾脏)的肾组织的低倍显微照片;
图48D是图23C中肾组织的高倍显微照片;
图49中的流程图示出根据本发明的一实施例得到的用于降低患者的肌酐和/或蛋白质水平的过程;
图50中的流程图示出根据本发明的一实施例得到的用于治疗液体复苏患者的过程;以及
图51示出使用本文所述的实验方法在猪身上进行试验得到的血清白蛋白相对于基线的变化情况。
具体实施方式
如本文所用,除非上下文另有明确说明,否则单数形式的“一”、“一个”和“该”包括复数指示物。
如本文所用,术语“右”、“左”、“顶”及其派生词应与本发明在附图中的取向相关。术语“近端”是指导管装置的由用户操纵或接触的部分和/或留置导管的最靠近尿路进入部位的部分。术语“远端”是指导管装置的被配置成插入到患者体内的相对端和/或导管装置的插入到患者尿路最远处的部分。然而,应当理解,本发明可以采取各种替代的取向,因此这些术语不应被视为具有限制性。另外,应当理解,除非明确相反地指出,否则本发明可以采取各种替代变型和阶段顺序。还应理解,附图中示出的以及以下说明书中描述的特定设备和过程是实施例。因此,与本文公开的实施方式有关的特定尺寸和其他物理特性不应被视为具有限制性。
为了本说明书的目的,除非另有说明,否则在本说明书和权利要求书中使用的表示成分数量、反应条件、尺寸、物理特性等的所有数字在所有情况下均应理解为被术语“约”修饰。除非相反地指出,否则以下说明书和所附权利要求书中列出的数值参数是可以随根据本发明得到的期望特性而变化的近似值。
尽管用于设定本发明的广泛范围的数值范围和参数是近似值,但在具体实施例中给出的数值尽可能地精确。但是,任何数值本身都包含一定的误差,这些误差必然是由在其各自的测试测量中的标准偏差引起的。
此外,应理解,本文列举的任何数值范围旨在包括其中包含的所有子范围。例如,“1至10”的范围旨在包括在所列举的最小值1与所列举的最大值10之间(含最小值1和最大值10)的任何和所有子范围,也就是说,从最小值等于或大于1开始并且以最大值等于或小于10截止的所有子范围,以及其间的所有子范围,例如,1至6.3,或5.5至10,或2.7至6.1。
如本文所用,术语“通信”是指接收或发送一个或多个信号、消息、命令或其他类型的数据。对于一个单元或组件与另一单元或组件通信,是指一个单元或组件能够直接或间接地从另一单元或组件接收数据和/或向另一单元或组件发送数据。这可以指本质上可以是有线和/或无线的直接或间接连接。另外,即使可以在第一与第二单元或组件之间对所发送的数据进行修改、处理、路由等,两个单元或组件也可以相互通信。例如,即使第一单元被动地接收数据并且不主动地向第二单元发送数据,第一单元也可以与第二单元通信。作为另一实施例,如果中间单元处理来自一个单元的数据并将处理后的数据发送给第二单元,则第一单元可以与第二单元通信。人们将意识到,许多其他安排也是可能的。
如本文所用,“维持患者的肾与膀胱之间液体流动的通畅性”是指建立、增强或维持液体(如尿液)从肾通过输尿管、输尿管支架和/或输尿管导管向膀胱的流动。如本文所用,“液体”是指来自尿路的尿液和任何其他液体。
液体滞留和静脉充血是发展为晚期肾病的主要问题。钠摄入过多再加上排泄相对减少会导致等渗体积膨胀和次级室受累。在一些实施例中,本发明总体上涉及用于促进从患者的膀胱、输尿管和/或肾排出尿液或废物的装置和方法。在一些实施例中,本发明总体上涉及用于在患者的膀胱、输尿管和/或肾中产生负压的系统和方法。尽管不希望受到任何理论的约束,但是认为在某些情况下对膀胱、输尿管和/或肾施加负压可以抵消髓质肾小管对钠和水的重吸收。抵消钠和水的重吸收可增加产尿量,降低全身钠量,并改善红细胞的生成。由于髓内压是由钠驱动的,因而体积过大,因此有针对性地清除过量的钠可以维持体积损失。去除体积可恢复髓腔止血。正常产尿量为1.48-1.96升/天(或1-1.4毫升/分钟)。
液体滞留和静脉充血也是肾前急性肾损伤(AKI)进展中的主要问题。具体地,AKI可能与灌注损失或流经肾的血流量有关。因此,在一些实施例中,本发明有助于改善肾血流动力学并增加排尿量,以缓解或减少静脉充血。此外,预计治疗和/或抑制AKI可积极影响和/或减少其他疾病的发生,例如减少或抑制NYHA III级和/或IV级心力衰竭患者的肾功能恶化。对不同程度心力衰竭的分类可参见The Criteria Committee of the New YorkHeart Association,(1994),Nomenclature and Criteria for Diagnosis of Diseases of the Heart and Great Vessels,(9th ed.),Boston:Little,Brown&Co.pp.253-256,其公开内容的全文通过引用并入本文。减少或抑制AKI发作和/或长期减少灌注也可以是治疗4期和/或5期慢性肾病的方法。有关慢性肾病的进展可参见国家肾脏基金会K/DOQIClinical Practice Guidelines for Chronic Kidney Disease:Evaluation,Classification and Stratification.Am.J.Kidney Dis.39:S1-S266,2002(Suppl.1),其公开内容的全文通过引用并入本文。
参见图1、2、7、17、27和44,尿路包括患者的右肾2和左肾4。如上所述,肾2、4负责血液过滤和通过尿液从体内清除废物化合物。由右肾2和左肾4产生的尿液通过小管(即右输尿管6和左输尿管8)排入患者的膀胱10中。例如,尿液可以通过输尿管壁的蠕动以及重力而流经输尿管6、8。输尿管6、8通过输尿管口或开口16进入膀胱10。膀胱10是一种柔性且基本中空的结构,其适于收集尿液直到尿液从体内排出。膀胱10可从空位(由参考线E表示)过渡到满位(由参考线F表示)。当膀胱处于空位E时,膀胱上壁70可位于膀胱导管56、116的远端136的外围72的附近和/或与之一致。通常,当膀胱10达到基本满的状态时,允许尿液通过位于膀胱10下部的尿道括约肌或开口18从膀胱10排至尿道12。膀胱10可通过收缩对施加在膀胱10的三角区14上的应力和压力作出响应,该三角区是指在输尿管开口16与尿道开口18之间延伸的三角区。三角区14对应力和压力敏感,使得当膀胱10开始充盈时,三角区14上的压力增加。当超过三角区14的阈值压力时,膀胱10开始收缩,以将收集的尿液通过尿道12排出。
在一些实施例中,如图1、2、7、17、27和44所示的方法和系统50、100用于从患者体内排出液体(例如尿液),所述方法包括:将输尿管支架52、54(如图1所示)或输尿管导管112、114(如图2、7、17、27和44所示)部署在患者的输尿管6、8中,以保持患者的肾2、4与膀胱10之间液体流动的通畅性;将膀胱导管56、116部署在所述患者的所述膀胱10中,其中该膀胱导管56、116包括定位在所述患者膀胱10中的远端136、具有近端117的排液腔部140以及在其间延伸的侧壁119;以及向所述膀胱导管56、116的所述近端117施加负压,以在所述患者的一部分尿路中产生负压,从而从所述患者体内排出液体。在一些实施例中,所述方法还包括将第二输尿管支架或第二输尿管导管部署在所述患者的第二输尿管或肾中,以维持所述患者的第二肾与所述膀胱之间液体流动的通畅性。本文详细描述了本发明的示例性输尿管支架或输尿管导管的具体特征。
出于至少三个原因,将负压输送到患者的肾区具有许多解剖学上的挑战。首先,泌尿系统是由易变形的高柔顺组织构成的。医学教科书通常将膀胱描述成一种厚厚的肌肉结构,无论膀胱内的尿量如何,它都可以保持固定的形状。然而,膀胱实际上是一种软的可变形结构。膀胱会收缩以适应膀胱内的尿量。空的膀胱更像是放了气的乳胶气球而非像球状物。此外,膀胱内部的粘膜衬里柔软,容易受到刺激和损伤。最好避免将泌尿系统组织吸入导管的孔口,以保持有足够的液体流经该孔口,并避免对周围组织造成损伤。
其次,输尿管是一种小的管状结构,可以扩张和收缩以将尿液从肾盂输送到膀胱。这种输送有两种方式:蠕动活动和开放系统中的压力梯度。在蠕动活动中,尿液部分被推到收缩波的前面,收缩波几乎完全使管腔消失。波形始于肾盂区,沿输尿管传播,并止于膀胱。这样的完全闭合中断了液体的流动,可以防止在没有帮助的情况下在膀胱内输送的负压到达肾盂。尿流量大时可能存在第二种输送方式,即通过经由大开口输尿管的压力梯度来输送。肾盂中的压差不是由上尿路平滑肌的收缩引起的,而是由尿液流动产生的,因此其反映了动脉血压。参见Kiil F.,“Urinary Flow and Ureteral Peristalsis”in:Lutzeyer W.,Melchior H.(eds)Urodynamics.Springer,Berlin,Heidelberg(pp.57-70)(1973)。
第三,肾盂至少像膀胱一样柔软。肾盂的薄壁可以扩张,以容纳数倍于正常体积的液体,例如在肾积水患者体内出现的状况。
尽管不希望受到任何理论的约束,但是认为肾盂和膀胱的组织可以足够柔软以在负压输送期间被向内拉动,以在某种程度上与用于输送负压的工具的形状和体积相适应。这样,用于保持三维空隙体积(该三维空隙体积可将负压输送到至少一个肾盏)的三维形状被认为有助于将负压输送到肾单位。另外,考虑到组织的柔性,需要保护这些组织免受通向工具腔的开口的影响。本文讨论的导管可用于输送负压、正压,或可用于环境压力下或其任何组合条件下。
输尿管导管实施例:
图2、7、17、27和44示出了系统100的实施例,该系统100包括定位在患者尿路内的输尿管导管112、114。例如,输尿管导管112、114的远端120、121可以被配置成部署在患者输尿管2、4中的至少一个中,肾6、8的肾盂20、21区,或者肾6、8。
在一些实施例中,在美国专利号9744331文件、美国专利申请公开号US 2017/0021128 A1文件、美国专利申请号15/687064文件和美国专利申请号15/687083文件中公开了合适的输尿管导管,它们各自通过引用并入本文。
在一些实施例中,系统100可包括两个分开的输尿管导管,例如布置在右肾2的肾盂20中或其附近的第一导管112以及布置在左肾4的肾盂21中或其附近的第二导管114。导管112、114可以在其整个长度上是分开的,或者可以通过夹子、环、夹具或其他类型的连接机构(例如连接器)保持彼此靠近,以便于放置或移除导管112、114。如图2、7、17、27和44所示,每个导管112、114的近端113、115位于膀胱10内,或位于靠近膀胱10的输尿管近端,以将液体或尿液排入膀胱。在一些实施例中,导管112、114可以在膀胱内合并或连接在一起,以形成可向膀胱10中排液的单个排液腔。
在其他实施例中,导管112、114可被插入或封闭在沿其一些部分或区段布置的另一导管、管或护套内,以便于将导管112、114插入到患者体内和从患者体内收回。例如,膀胱导管116可与输尿管导管112、114插入到同一导丝上和/或沿同一导丝插入。
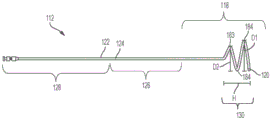
参见图2、7、8A和8B,示例性输尿管导管112可包括至少一个细长体或管122,其内部限定或包括一个或多个排液通道或管腔,例如排液腔124。管122的尺寸可以为约1Fr至约9Fr(法国导管刻度)。在一些实施例中,管122的外径可以为约0.33mm至约3mm,内径可以为约0.165mm至约2.39mm。在一实施例中,管122为6Fr,且其外径为2.0±0.1mm。取决于患者的年龄(例如儿童或成人)和性别,管122的长度可以为约30cm至约120cm。
管122可以由柔性和/或可变形的材料形成,以便将管122推进和/或定位在膀胱10和输尿管6、8中(如图2、7所示)。导管材料应具有足够的韧性和柔性,以避免或减少对肾盂和输尿管的刺激,但也应具有足够的刚性,以当肾盂或尿道的其他部分对管122的外部施加压力时,或者当肾盂和/或输尿管在产生负压期间被吸引抵靠在管122上时,管122不会塌陷。例如,管122或排液腔可以至少部分地由一种或多种材料形成,所述一种或多种材料包括铜、银、金、镍钛合金、不锈钢、钛和/或聚合物,所述聚合物例如是指生物相容性聚合物、聚氨酯、聚氯乙烯、聚四氟乙烯(PTFE)、乳胶、涂硅乳胶、硅、硅树脂、聚乙交酯或聚乙醇酸(PGA)、聚丙交酯(PLA)、聚(丙交酯-共-乙交酯)、聚羟基烷酸酯、聚己内酯和/或聚富马酸丙烯酯。在一实施例中,管122由热塑性聚氨酯形成。管1222还可以包括或浸渍有铜、银、金、镍钛合金、不锈钢和钛中的一种或多种物质。在一些实施例中,管1222浸渍有可通过荧光成像法看到的材料或由该材料形成。例如,形成管1222的生物相容性聚合物可以浸渍有硫酸钡或类似的不透射线材料。这样,管1222的结构和位置对于荧光检查是可见的。
导管112的至少一部分或全部(例如管122)可以涂覆有亲水涂层,以方便插入和/或移除,以及/或者增强舒适度。在一些实施例中,涂层是疏水和/或润滑涂层。例如,合适的涂层可以包括可从Koninklijke DSM N.V.获得的
亲水涂层或包含聚电解质的亲水涂层,例如在美国专利号8512795文件中公开的专利,该专利通过引用并入本文。
在一些实施例中,例如如图8B所示,管122可包括:远端部118(例如,定位在输尿管6、8和肾盂20、21中的管122的一部分);中间部126(例如,管122的一部分,其被配置成从远端部通过输尿管开口16延伸到患者的膀胱10和尿道12中);以及近端部128(例如,管122的延伸到膀胱中的一部分)。在一实施例中,管122的近端部128和中间部126的组合长度约为54±2cm。在一些实施例中,管122终止于膀胱110中。在这种情况下,液体从输尿管导管112、114的近端排出,并从体内被引导通过附加的留置膀胱导管。
示例性输尿管保持部:
本文公开的任何保持部均可由与上述排液腔相同的材料形成,并且可与排液腔整合为一体,或者保持部可由不同的材料形成(例如上文讨论的排液腔材料),并与排液腔连接。例如,保持部可由诸如聚合物的任何上述材料形成,例如聚氨酯、柔性聚氯乙烯、聚四氟乙烯(PTFE)、胶乳、硅树脂、硅、聚乙交酯或聚乙醇酸(PGA)、聚丙交酯(PLA)、聚(丙交酯-共-乙交酯)、聚羟基烷酸酯、聚己内酯和/或聚富马酸丙烯酯。
继续参见图2、8A和8B,输尿管导管112的远端部118包括保持部130,其用于将导管112的远端120保持在靠近肾2、4的肾盂20、21或在其内部的期望液体收集位置。在一些实施例中,保持部130被配置成具有柔性和可弯曲,以允许将保持部130定位在输尿管和/或肾盂中。期望保持部130可充分弯曲,以吸收施加在导管112上的力并防止这种力传递到输尿管。例如,如果将保持部130沿近端方向P(如图9A所示)拉向患者的膀胱,则保持部130可以足够柔韧以开始展开或拉直,从而可以将其拉过输尿管。类似地,当可将保持部130重新插入肾盂或输尿管内的其他合适区域时,可使其偏向于返回其部署的构造。
在一些实施例中,保持部130与管122成为一体。在这种情况下,可以通过对导管体122施加弯曲或卷曲作用来形成保持部130,该导管体122的尺寸和形状被设计成将导管保持在期望的液体收集位置。合适的弯头或线圈可以包括尾纤线圈、旋转线圈和/或螺旋线圈。例如,保持部130可包括一个或多个径向和纵向延伸的螺旋线圈,其被配置成接触导管112并被动地将导管112保持在输尿管6、8内且靠近肾盂20、21或位于肾盂20、21内。在其他实施例中,保持部130由导管体122的径向张开或渐缩的部分形成。例如,保持部130还可包括液体收集部,如图4A和4B所示,例如锥形或漏斗形的内表面186。在其他实施例中,保持部130可包括连接至导管体或管122并从导管体或管122延伸的单独元件。
保持部130还可包括一个或多个穿孔部分,例如排液孔或口132(例如,如图9A-9E、10A和10E所示)。排液口可位于例如管122的开放远端120、121处。在其他实施例中,穿孔部分和/或排液口132沿着导管的管122的远端部118的侧壁布置。排液口或孔可用于协助液体收集。在其他实施例中,保持部130仅是一种保持结构,并且液体收集和/或施加负压是通过在导管的管122上其他位置处的结构来实施的。在一些实施例中,排液孔、口或穿孔被定位成使得来自膀胱的组织不直接与孔、口或穿孔接触。
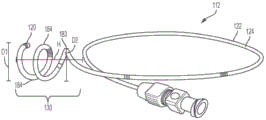
现在参见图8A、8B和9A-9E,其中示出了示例性的保持部130,其包括多个螺旋线圈,例如一个或多个全线圈184和一个或多个半线圈或部分线圈183。保持部130能够通过多个螺旋线圈在收缩位置与展开位置之间移动。例如,可以将大致笔直的导丝穿过保持部130,以将保持部130保持在大致笔直的收缩位置。当导丝被移除时,保持部130可以过渡到其卷曲的构造。在一些实施例中,线圈183、184从管122的远端部118径向地和纵向地延伸。具体参见图8A和8B,在示例性实施方式中,保持部130包括两个全线圈184和一个半线圈183。由D1线示出的全线圈184的外径可约为18±2mm。半线圈183的直径D2可约为14mm。卷曲的保持部130的高度H约为16±2mm。
保持部130还可包括一个或多个排液孔132(例如,如图9A-9E、10A和10E所示),该排液孔132被配置成将液体吸入到导管的管122的内部。在一些实施例中,保持部130可包括六个排液孔以及位于保持部的远端尖部120处的附加孔。每个排液孔132的直径(例如,如图9A-9E、10A和10E所示)可以为约0.7mm至0.9mm,并且优选为约0.83±0.01mm。相邻排液孔132之间的距离,特别是当线圈被拉直时排液孔132之间的线性距离可约为22.5±2.5mm。
如图9A-9E所示,在另一示例性实施方式中,排液腔的靠近保持部130的远端部118限定了笔直或弯曲的中轴L。在一些实施例中,保持部130的至少半线圈或第一线圈183和全线圈或第二线圈184围绕保持部130的轴线A延伸。在第一线圈183起始或开始的点处,管122被弯曲到其与中轴L所成角度α为约15度至约75度,优选为约45度。如图9A和9B所示,在插入体内之前,轴线A可以与纵向中轴L共同延伸。在其他实施例中,如图9C-9E所示,在插入体内之前,轴线A相对于中心纵轴L延伸并弯曲或成角度,例如角度β。
在一些实施例中,多个线圈184可具有相同的内径和/或外径D和高度H2。在这种情况下,线圈184的外径D1可以为10mm至30mm。线圈184之间的高度H2可为约3mm至10mm。
在其他实施例中,保持部130被配置成插入在肾盂的锥形部中。例如,线圈184的外径D1可以朝向管122的远端120增加,从而形成具有锥形或部分锥形构造的螺旋结构。例如,锥形螺旋部的远端或最大外径D1为约10mm至约30mm,其对应于肾盂的尺寸。保持部130的高度H2为约10mm至约30mm。
在一些实施例中,线圈184的外径D1和/或高度H2可以以规则或不规则的方式变化。例如,线圈的外径D1或线圈之间的高度H2可以增加或减少一定的量(例如,相邻线圈184之间为约10%至约25%)。例如,对于具有三个线圈的保持部130(例如,如图9A和9B所示),最近端线圈或第一线圈183的外径D3可以为约6mm至18mm,中间线圈或第二线圈185的外径D2可以为约8mm至约24mm,并且最远端或第三线圈187的外径D1可以为约10mm至约30mm。
保持部130还可包括排液口132或孔,该排液口或孔设置在保持部130上或附近的导管的管122的侧壁上或穿过导管的管122的侧壁,以允许尿液废物从导管的管122的外部流向导管122的内部。排液口132的位置和尺寸可以根据期望的流速和保持部的构造而变化。排液口132的直径可以为约0.005mm至约1.0mm。排液口132的间距可以为约1.5mm至约5mm。可以以任何布置方式(例如线性或偏移)将排液口132间隔开。在一些实施例中,排液口132可以是非圆形的,并且其表面积可以为约0.00002mm2至0.79mm2。
在一些实施例中,如图9A所示,排液口132位于导管的管122的侧壁的整个外围,以增加可被吸入排液腔124中的液体的量(如图2、9A和9B所示)。在其他实施例中,如图9B-9E所示,排液口132可以仅或基本上仅布置在线圈184的径向向内的侧面上,以防止排液口132堵塞或阻塞,并且线圈的向外的侧面可以没有或基本上没有排液口132。例如,当在输尿管和/或肾盂中产生负压时,输尿管和/或肾脏的粘膜组织可被吸引抵靠在保持部130上,并且可堵塞保持部130的外周上的一些排液口132。当这些组织接触保持部130的外周时,位于保持结构的径内向侧上的排液口132将不会被明显堵塞。此外,可以减小或减轻由于挤压或接触排液口132而对组织造成损伤的风险。
参见图9C和9D,其中示出了具有包括多个线圈的保持部130的输尿管导管112的其他实施例。如图9C所示,保持部130包括围绕轴线A延伸的三个线圈184。轴线A是从排液腔181的靠近保持部130的部分的中心纵轴L延伸的弧线。可以选择使保持部130的曲率对应于包括聚宝盆形的腔的肾盂的曲率。
如图9D所示,在另一示例性实施方式中,保持部130可包括两个围绕斜轴A延伸的线圈184。斜轴A从中心纵轴L成一角度延伸,并且相对于大体上垂直于排液腔部中轴L的轴线成一角度,如角度β所示。角度β可以为约15度至约75度(例如,相对于导管112的排液腔部中心纵轴L为约105度至约165度)。
图9E示出了输尿管导管112的另一实施例。保持部包括三个绕轴线A延伸的螺旋线圈184。轴线A相对于水平面成一角度,如角度β所示。如前述实施例所述,角度β可以为约15度至约75度(例如,相对于导管112的排液腔部中心纵轴L为约105度至约165度)。
在一些实施例中,如图10-10E所示,保持部1230与管1222成为一体。在其他实施例中,保持部1230可包括连接至管或排液腔1224并从管或排液腔1224延伸的单独管状件。
在一些实施例中,保持部包括多个径向延伸的线圈。线圈被配置成漏斗形,从而形成漏斗支架。线圈漏斗支架的一些实施例在图2、7和8A-10E中示出。
在一些实施例中,漏斗支架的至少一个侧壁至少包括具有第一直径的第一线圈和具有第二直径的第二线圈,其中第一直径小于第二直径,其中第一线圈的侧壁的一部分与第二线圈的相邻侧壁的一部分之间的最大距离为约0mm至约10mm。在一些实施例中,第一线圈的第一直径为约1mm至约10mm,第二线圈的第二直径为约5mm至约25mm。在一些实施例中,线圈的直径向排液腔的远端增加,使得螺旋结构具有锥形或部分锥形的构造。在一些实施方式中,所述第二线圈比所述第一线圈更接近所述排液腔的所述远端部的端部。在一些实施方式中,所述第二线圈比所述第一线圈更接近所述排液腔的所述近端部的端部。
在一些实施例中,漏斗支架的至少一个侧壁包括内向侧和外向侧,内向侧包括至少一个允许液体流入排液腔的开口,外向侧没有或基本上没有开口,如下所述。在一些实施例中,至少一个开口的面积为约0.002mm2至约100mm2。
在一些实施例中,第一线圈包括侧壁,该侧壁包括径向向内的侧面和径向向外的侧面,第一线圈的径向向内的侧面包括至少一个允许液体流入排液腔的开口。
在一些实施例中,第一线圈包括侧壁,该侧壁包括径向向内的侧面和径向向外的侧面,第一线圈的径向向内的侧面包括至少两个允许液体流入排液腔的开口。
在一些实施例中,第一线圈包括侧壁,该侧壁包括径向向内的侧面和径向向外的侧面,第一线圈的径向向外的侧面没有或基本上没有一个或多个开口。
在一些实施例中,第一线圈包括侧壁,该侧壁包括径向向内的侧面和径向向外的侧面,第一线圈的径向向内的侧面包括至少一个允许液体流入排液腔的开口,并且径向向外的侧面没有或基本上没有一个或多个开口。
现在参见图10-10E,在一些实施例中,远端部1218包括开放的远端1220,用于将液体吸入排液腔1224。输尿管导管1212的远端部1218还包括保持部1230,用于将排液腔或管1222的远端部1218保持在输尿管和/或肾中。在一些实施例中,保持部包括多个径向延伸的线圈1280、1282、1284。保持部1230可以是柔性的和可弯曲的,以允许将保持部1230定位在输尿管、肾盂和/或肾中。例如,期望保持部1230可充分弯曲,以吸收施加在导管1212上的力并防止这种力传递到输尿管。此外,如果将保持部1230沿近端方向P(如图9A-9E所示)拉向患者的膀胱10,则保持部1230可以足够柔韧以开始展开或拉直,从而可以将其拉过输尿管6、8。在一些实施例中,保持部1230与管1222成为一体。在其他实施例中,保持部1230可包括连接至管或排液腔1224并从管或排液腔1224延伸的单独管状件。在一些实施例中,导管1212包括位于保持部1230近端的管1222上的不透射线带1234(如图29所示)。在导管1212的部署过程中,通过荧光成像法可以看到不透射线带1234。特别地,用户可以通过荧光检查法来监测带1234穿过尿路的行进情况,以确定保持部1230何时在肾盂中并准备好展开。
在一些实施例中,保持部1230包括在管1222的侧壁中的穿孔、排液口或开口1232。如本文所述,开口1232的位置和尺寸可以根据每个开口的期望体积流速和保持部1230的尺寸限制而变化。在一些实施例中,开口1232的直径为约0.05mm至约2.5mm,并且面积为约0.002mm2至5.00mm2。开口1232可以定位成在管1222的侧壁上沿所需的任何方向延伸,例如纵向和/或轴向。在一些实施例中,开口1232之间的间隔可以为约1.5mm至约15mm。液体通过一个或多个穿孔、排液口或开口1232进入排液腔1234。理想地,开口1232被定位成使得当对排液腔1224施加负压时,开口1232不被输尿管6、8或肾的组织堵塞。例如,如本文所述,开口1234可定位在保持部1230的线圈或其他结构的内部上,以避免堵塞开口1232。在一些实施例中,管1222的中间部1226和近端部1228可以没有或基本上没有穿孔、端口或开口,以避免沿着管1222的那些部分的开口被堵塞。在一些实施例中,基本上没有穿孔或开口的部1226、1228包括比管1222的其他部分少得多的开口。例如,远端部1218的开口1232的总面积可以大于或基本上大于管1222的近端部1226和/或远端部1228的开口的总面积。
在一些实施例中,开口1232的尺寸和间隔被确定,以改善通过保持部1230的液体流动。特别地,本发明人发现,当向导管1212的排液腔1224施加负压时,大部分液体通过最近端的穿孔或开口1232吸入到排液腔1224中。为了改善流动动力学,从而也可通过管1222的更远端开口和/或开放远端1220接收液体,可以向保持部1230的远端提供更大尺寸或更多数量的开口。例如,位于保持部1230的近端附近的一段长度的管1222上的开口1232的总面积可以小于位于管1222的开放远端1220附近的一段相近长度的管1222上的开口1232的总面积。特别地,可能期望产生通过排液腔1224的流量分布,其中小于90%且优选小于70%并且更优选小于55%的液体流经位于保持部1230的近端附近的单个或少量开口1232抽吸到排液腔1224中。
在许多实施例中,开口1232通常呈圆形,虽然它也可以呈三角形、椭圆形、正方形、菱形以及任何其他开口形状。此外,如本领域普通技术人员所理解,随着管1222在未卷曲或伸长位置与卷曲或展开位置之间转换,开口1232的形状可发生变化。要注意的是,尽管开口1232的形状可以变化(例如,孔口在一个位置可以是圆形的,而在另一位置可以稍微伸长),但是开口1232在伸长或未卷曲位置的面积基本接近于其在展开或卷曲位置的面积。
在一些实施例中,由管1222限定的排液腔1224包括:远端部1218(例如,定位在输尿管6、8和肾盂20、21中的管1222的一部分)(如图7和7A所示);中间部1226(例如,管1222的一部分,其被配置成从远端部通过输尿管开口16延伸到患者的膀胱10和尿道12中)(如图7和7A所示);以及近端部1228(例如,管1222的一部分从尿道12延伸到外部液体收集容器和/或泵2000)。在一实施例中,管1222的近端部1228和中间部1226的组合长度约为54±2cm。在一些实施例中,管1222的中间部1226和近端部1228包括在管1222的侧壁上的距离标记1236(如图10所示),该距离标记可以在导管1212的展开期间用于确定管1222插入患者的尿路中有多远。
如图7和10-14所示,示例性输尿管导管1212包括至少一个细长体或管1222,其内部限定或包括一个或多个排液通道或管腔,例如排液腔1224。管1222的尺寸可以为约1Fr至约9Fr(法国导管刻度)。在一些实施例中,管1222的外径可以为约0.33mm至约3.0mm,内径可以为约0.165mm至约2.39mm。在一实施例中,管1222为6Fr,且其外径为2.0±0.1mm。取决于患者的年龄(例如儿童或成人)和性别,管1222的长度可以为约30cm至约120cm。
管1222可以由柔性和/或可变形的材料形成,以便将管1222推进和/或定位在膀胱10和输尿管6、8中(如图7所示)。例如,管1222可以由包括生物相容性聚合物、聚氯乙烯、诸如
的聚四氟乙烯(PTFE)、涂硅乳胶或硅在内的材料形成。在一实施例中,管1222由热塑性聚氨酯形成。
螺旋线圈保持部
参见图10A-10E,示例性保持部1230包括螺旋线圈1280、1282、1284。在一些实施例中,保持部1230包括第一或半线圈1280和两个全线圈,例如第二线圈1282和第三线圈1284。如图10A-10D所示,在一些实施例中,第一线圈包括围绕保持部1230的曲线中轴A从0度延伸到180度的半线圈。在一些实施例中,如图所示,曲线中轴A基本笔直,并且与管1222的曲线中轴共同延伸。在其他实施例中,保持部1230的曲线中轴A可以弯曲,以使保持部1230具有聚宝盆形状。第一线圈1280的直径D1可以为约1mm至20mm,并且优选为约8mm至10mm。第二线圈1282可以是沿着保持部1230从180度延伸至540度的全线圈,其直径D2为约5mm至50mm,优选为约10mm至20mm,并且更优选为约14±2mm。第三线圈1284可以是在540度与900度之间延伸的全线圈,其直径D3为5mm至60mm,优选为约10mm至30mm,更优选为约18±2mm。在其他实施例中,多个线圈1282、1284可具有相同的内径和/或外径。例如,全线圈1282、1284的外径可各自为约18±2mm。
在一些实施例中,保持部1230的总高度H1为约10mm至约30mm,并且优选为约18±2mm。线圈1284之间,即第一线圈1280的管1222的侧壁与第二线圈1282的管122的相邻侧壁之间的间隙的高度H2小于3.0mm,优选为约0.25mm至2.5mm,更优选为约0.5mm至2.0mm。
保持部1230还可以包括最远端弯曲部1290。例如,保持部1230的最远端部1290(包括管1222的开放远端1220)可以相对于第三线圈1284的曲率向内弯曲。例如,最远端部1290的曲线中轴X1(如图10D所示)可以从管1222的远端1220向保持部1230的曲线中轴A延伸。
保持部1230能够在收缩位置与展开位置之间移动,在收缩位置,保持部1230是笔直的以便能插入到患者的尿路中,在展开位置,保持部1230包括螺旋线圈1280、1282、1284。通常,管1222自然地偏向于卷曲的构造。例如,可以将未卷曲的或基本笔直的导丝穿过保持部1230,以将保持部1230保持在其笔直的收缩位置,例如如图11-14所示。当导丝被移除时,保持部1230自然地过渡到其卷曲的位置。
在一些实施例中,开口1232仅或基本上仅布置在线圈1280、1282、1284的径向向内的侧面1286上,以防止开口1232堵塞或阻塞。线圈1280、1282、1284的径向向外的侧面1288可以基本上没有开口1232。在类似的实施例中,在保持部1230的内向侧1286上的开口1232的总面积可以基本上大于在保持部1230的径向向外的侧面1288上的开口1232的总面积。因此,当在输尿管和/或肾盂中产生负压时,输尿管和/或肾脏的粘膜组织可被吸引抵靠在保持部1230上,并且可堵塞保持部1230的外周上的一些开口1232。然而,当这些组织接触保持部1230的外周时,位于保持部1230的径内向侧1286上的开口1232不会被明显堵塞。因此,可以减小或消除由于挤压或接触排出开口1232而对组织造成损伤的风险。
孔或开口分布实施例
在一些实施例中,第一线圈1280可以没有或基本上没有开口。例如,第一线圈1280上的开口的总面积可以小于或基本上小于全线圈1282、1284的开口的总面积。在图11-14中示出了可以用于卷曲的保持部(例如如图10A-10E所示的卷曲的保持部1230)的开口或开口1332的各种布置的实施例。如图11-14所示,保持部处于其未卷曲或笔直位置,如在将导丝穿过排液腔时所发生的那样。
图11示出了示例性保持部1330。为了更清楚地描述保持部1330的开口的定位,保持部1330在本文中被描述为分为多个部分或穿孔部分,例如最近端或第一部分1310、第二部分1312、第三部分1314、第四部分1316、第五部分1318和最远端或第六部分1320。本领域普通技术人员将理解,如果需要,可以包括附加部分。如本文所用,“截面”是指管1322在保持部1330内的离散长度。在一些实施例中,这些部分的长度相等。在其他实施例中,某些部分可以具有相同的长度,而其他部分可以具有不同的长度。在其他实施例中,每个部分具有不同的长度。例如,这些部分的长度L1-L6可以为约5mm至约35mm,并且优选为约5mm至15mm。
在一些实施例中,每个部分包括一个或多个开口。在一些实施例中,每个部分均包括单个开口1332。在其他实施例中,第一部分1310包括单个开口1332,而其他部分包括多个开口1332。在其他实施例中,不同的部分包括一个或多个开口1332,且每个开口具有不同的形状或不同的总面积。
在一些实施例中,例如图10A-10E中所示的保持部1230,从保持部1230的0度延伸至约180度的第一或半线圈1280可以没有或基本上没有开口。第二线圈1282可以包括在约180度与360度之间延伸的第一部分1310。第二线圈1282还可包括第二部分1312和第三部分1314,其位于保持部1230的约360度与540度之间。第三线圈1284可包括第四部分1316和第五部分1318,其位于保持部1230的约540度与900度之间。
在一些实施例中,开口1332的尺寸可以使得第一部分1310的开口总面积小于相邻的第二部分1312的开口总面积。以类似的方式,如果保持部1330还包括第三部分1314,则第三部分1314的开口总面积可大于第一部分1310或第二部分1312的开口总面积。第四部分1316、第五部分1318和第六部分1320的开口总面积和/或开口数量也可以逐渐增加,以改善液体通过管1222的流动。
如图11所示,管的保持部1230包括五个部分1310、1312、1314、1316、1318,每个部分包括单个开口1332、1334、1336、1338、1340。保持部1230还包括第六部分1320,其包括管1222的开放远端1220。在本实施例中,第一部分1310的开口1232具有最小的总面积。例如,第一部分的开口1332的总面积可以为约0.002mm2至约2.5mm2,或为约0.01mm2至1.0mm2,或为约0.1mm2至0.5mm2。在一实施例中,开口1332距导管的远端1220约55mm,直径为0.48mm,面积为0.18mm2。在该实施例中,第二部分1312的开口1334的总面积大于第一部分1310的开口1232的总面积,并且尺寸范围可以为约0.01mm2至1.0mm2。第三开口1336、第四开口1338和第五开口1350的尺寸范围也可以为约0.01mm2至1.0mm2。在一实施例中,开口1334距导管1220的远端约45mm,直径为约0.58mm,面积为约0.27mm2。第三开口1336可以距导管1220的远端约35mm,并且直径为约0.66mm。第四开口1338可以距远端1220约25mm,并且直径为约0.76mm。第五开口1340可以距导管的远端1220约15mm,并且直径为约0.889mm。在一些实施例中,管1222的开放远端1220的开口最大,其面积为约0.5mm2至约5.0mm2或更大。在一实施例中,开放远端1220的直径为约0.97mm,面积为约0.74mm2。
如本文所述,开口1332、1334、1336、1338、1340的位置和尺寸可被设置成使得当对导管1212的排液腔1224施加负压时,液体流经第一开口1332时的体积流速更接近地其流经更远端部分的开口时的体积流速。如上所述,如果每个开口的面积相同,那么,当对排液腔1224施加负压时,液体流经第一开口1332的最近端时的体积流速将大大地大于液体流经更靠近保持部1330的远端1220的开口1334时的体积流速。尽管不希望受到任何理论的约束,但认为当施加负压时,排液腔1224的内部与排液腔1224的外部之间的压力差在最近端开口的区域中更大,并且在朝向管的远端移动的每个开口处减小。例如,可以选择开口1332、1334、1336、1338、1340的尺寸和位置,以使流入第二部分1312的开口1334的液体的体积流速为流入第一部分1310的开口1332的液体的体积流速的至少约30%。在其他实施例中,流入最近端或第一部分1310的液体的体积流速小于流经排液腔1224的近端部的液体的总体积流速的约60%。在其他实施例中,当对排液腔的近端施加例如约-45mmHg的负压时,液体流入两个最近端部分(例如,第一部分1310和第二部分1312)的开口1332、1334时的体积流速可以小于液体流经排液腔1224的近端部时的体积流速的约90%。
如本领域普通技术人员所理解,可以以多种不同的方式直接测量或计算包括多个开口或穿孔的导管或管的体积流速和分布。如本文所用,“体积流速”是指在每个开口的下游和附近实际测得的体积流速,或者是使用下述的“计算体积流速”方法得到的体积流速。
例如,随时间推移的分散液体体积的实际测量值可用于确定液体通过每个开口1332、1334、1336、1338、1340时的体积流速。在一示例性实验布置中,包括单独腔室的多腔室容器(其尺寸可允许其容纳保持部1330的部分1310、1312、1314、1316、1318、1320)可被密封并包围在保持部1330的周围。每个开口1332、1334、1336、1338、1340可以密封在这些腔室之一中。当施加负压时,可以测量从各个腔室通过每个开口1332、1334、1336、1338、1340吸入到管3222中的液体量,以确定随时间推移吸入到每个开口中的液体量。由负压泵系统在管3222中收集的液体体积的累积量将等于吸入到每个开口1332、1334、1336、1338、1340中的液体的总和。
或者,可以使用模拟流经管状体的液体的流动的方程来对流经不同开口1332、1334、1336、1338、1340的液体的体积流速进行数学计算。例如,可以基于传质壳平衡评估来计算流经开口1332、1334、1336、1338、1340并进入排液腔1224的液体的体积流速,如下面结合数学实施例和图15A-15C所详细描述的那样。下面还结合图15A-15C详细描述了用于导出质量平衡方程和计算开口1332、1334、1336、1338、1340之间的流量分布或体积流速的步骤。
在图12中示出了具有开口2332、2334、2336、2338、2340的另一示例性保持部2230。如图12所示,保持部2230包括许多较小的穿孔或开口2332、2334、2336、2338、2340。开口2332、2334、2336、2338、2340中的每个可以具有基本相同的横截面积。如图12所示,保持部2330包括如上所述的六个部分2310、2312、2314、2316、2318、2320,其中每个部分包括多个开口2332、2334、2336、2338、2340。在图12所示的实施例中,每个部分的开口2332、2334、2336、2338、2340的数目朝向管1222的远端1220增加,使得每个部分中的开口1332的总面积与近端相邻部分相比有所增加。
如图12所示,第一部分2310的开口2332沿着第一虚线V1布置,该第一虚线V1基本平行于保持部2230的曲线中轴X1。第二部分2312、第三部分2314、第四部分2316和第五部分2318的开口2334、2336、2338、2340分别以逐渐增加的行数定位在管2222的侧壁上,使得这些部分的开口2334、2336、2338、2340也围绕管2222的圆周排列。例如,第二部分2312的一些开口2334被定位成使得围绕管2222的侧壁圆周延伸的第二虚线V2接触到多个开口2334的至少一部分。例如,第二部分2312可包括两排或更多排穿孔或开口2334,其中每个开口2334具有相等的横截面积。此外,在一些实施例中,第二部分2312的至少一行可以沿着第三虚线V3对齐,该虚线V3平行于管2222的曲线中轴X1,但不与第一虚线V1共同延伸。以类似的方式,第三部分2314可包括五排穿孔或开口2336,其中每个开口2336具有相等的横截面积;第四部分2316可包括七排穿孔或开口2338;第五部分2318可包括九排穿孔或开口2340。如先前实施例所述,第六部分2320包括单个开口,即管2222的开放远端2220。在图12的实施例中,每个开口具有相同的面积,但是如果需要,一个或多个开口的面积也可以不同。
在图13中示出了具有开口3332、3334、3336、3338、3340的另一示例性保持部3230。图13的保持部3230包括多个尺寸相近的穿孔或开口3332、3334、3336、3338、3340。如先前实施例所述,保持部3230可以分成六个部分3310、3312、3314、3316、3318、3320,每个部分包括至少一个开口。最近端或第一部分3310包括一个开口3332。第二部分3312包括沿虚线V2对齐的两个开口3334,虚线V2围绕管3222的侧壁的圆周延伸。第三部分3314包括一组位于虚拟三角形的顶点处的三个开口3336。第四部分3316包括一组位于虚拟正方形的角处的四个开口3338。第五部分3318包括十个开口3340,其在管3222的侧壁上定位成菱形。如先前实施例所述,第六部分3320包括单个开口,即管3220的开放远端3222。每个开口的面积可以为约0.001mm2至约2.5mm2。
在图14中示出了具有开口4332、4334、4336、4338、4340的另一示例性保持部4230。保持部4330的开口4332、4334、4336、4338、4340具有不同的形状和尺寸。例如,第一部分4310包括单个圆形开口4332。第二部分4312具有圆形开口4334,该圆形开口4334的横截面积大于第一部分4310的开口4332。第三部分4314包括三个三角形的开口4336。第四部分4316包括大的圆形开口4338。第五部分4318包括菱形开口4340。如先前实施例所述,第六部分4320包括管4222的开放远端4220。图14示出了每个部分中不同形状的开口的布置的一个实施例。应当理解,可以独立地选择每个部分中每个开口的形状,例如第一部分4310可以具有一个或多个菱形开口或其他形状的开口。每个开口的面积可以为约0.001mm2至约2.5mm2。
实施例
体积流速和流量分布百分比的计算
在描述了用于输尿管导管1212的保持部的开口的各种布置之后,现在将详细描述用于确定通过导管的计算流量分布百分比和计算体积流速的方法。图16示出了具有侧壁开口的示例性导管的示意图,其示出了在如图16所示的以下计算中使用的管或排液腔的部分的位置。计算流量分布百分比是指流经排液腔近端部的总液体的百分比,该液体通过保持部的不同开口或部分进入排液腔。计算体积流速是指单位时间通过排液腔的不同部分或保持部的开口的液体流量。例如,排液腔近端部的体积流速是指流经导管的总液体的流动速率。开口时的体积流速是指单位时间通过开口进入排液腔的液体的体积。在下面的表3-5中,流量描述为排液腔近端部的总液体流量或总体积流速的百分比。例如,流量分布为100%的开口意味着进入排液腔的所有液体都流经了该开口。流量分布为0%的开口将表明排液腔中的液体均未通过该开口进入排液腔。
这些体积流速计算用于确定和模拟流经图7和10-10E中所示的输尿管导管1212的保持部1230的液体的流动。此外,这些计算表明,调整开口面积和开口沿保持部的线性分布会影响流经不同开口的液体的分布。例如,减小最近端开口的面积可减小通过最近端开口吸入到导管中的液体的比例,并增大吸入到保持部更远端开口中的液体的比例。
对于以下计算,使用的参数为管长86cm、内径0.97mm、端孔内径0.97mm。尿的密度为1.03g/mL,在37℃下的摩擦系数μ为8.02×10-3Pa·S(8.02×10-3kg/s·m)。通过实验测量确定,通过导管的尿液体积流速为2.7ml/min(Q总)。
通过体积质量平衡方程确定计算体积流速,其中通过保持部的五个部分的所有穿孔或开口1232的体积流量(此处称为体积流量Q2至Q6)与通过开放远端1220的体积流量(此处称为体积流量Q1)的总和等于从距离最后一个近端开口10cm至60cm的管1222的近端流出的总体积流量(Q总),如方程2所示。
Q总=Q1+Q2+Q3+Q4+Q5+Q6 (方程2)
每个部分的修正损耗系数(K’)基于导管模型内的三种损耗系数,即:入口损失系数,其考虑了在管道入口(例如,管道1222的开口和开放远端)处产生的压力损失;摩擦损失系数,其考虑了由于液体与管壁之间的摩擦而产生的压力损失;以及流结损失系数,其考虑了由于两个汇流相互作用而产生的压力损失。
入口损失系数取决于孔口或开口的形状。例如,锥形或喷嘴形的孔口将增加进入排液腔1224的流速。类似地,锐边孔口的流动特性与边缘不太明确的孔口不同。为了进行以下计算,假设开口1232是侧孔开口,并且管1222的开放远端1220是锐边开口。认为每个开口的横截面积在整个管侧壁上都是恒定的。
摩擦损失系数近似于由于液体与管1222的相邻内壁之间的摩擦引起的压力损失。摩擦损失是根据以下方程确定的:
流结损失系数是从90度分支角处的合流损失系数导出的。损失系数的值来自Miller DS,Internal Flow Systems,1990中的图表13.10和13.11,其通过引用并入本文。这些图表使用进孔口面积(在图表中称为A1)与管道横截面积(在图表中称为A3)的比率以及进孔口体积流速(在图表中称为Q1)与得到的组合管道体积流速(在图表中称为Q3)的比率。例如,对于开口面积与排液腔面积之间的面积比为0.6,将使用以下的流结损失系数(K13和K23)。
为了计算总歧管损失系数(K),有必要将模型分为所谓的“参考站”,并逐步研究和平衡两条路径的压力和流量分布(例如,通过开口的流量和通过管的排液腔的流量),以到达从远端尖部到最近的“站”的每个站。在图38中示出了用于该计算的不同站的图形表示。例如,最远的“站”A是管122的远端开放端1220。第二站A’是管122的侧壁上最远端开口(例如,图31-34中第五部分1318的一个或多个开口)。下一站B用于流经刚好靠近A’开口的排液腔1224。
为了计算通过管1222的开放远端(路径1)进入的液体在站A(远端开口)与站B之间的损失,修正损失系数(K’)等于:
K′=入口损失+摩擦损失+流结损失 (方程4.1)
类似地,到站B的第二路径经过保持部1330的第五部分1318的开口1334(如图11-14所示)。路径2的修正损失计算如下:
K′=入口损失+流结损失(方程5.1)
路径1和路径2的修正损失系数必须相等,以确保体积流速(Q1和Q2)反映站B处歧管内的平衡分布。调整体积流速,直到两条路径的修正损失系数相等。体积流速可以调整,因为它们代表总体积流速(Q’总)的一小部分,且Q’总在这个分步解算过程中假设为单位。在使两个修正损失系数等同后,可以继续使到达站C的两条路径(图11-14中的第四部分1316)等同。
以方程5.1和5.2所示的类似方式计算在站B(流经第五部分1318中的排液腔)与站C(流经第四部分1316中的排液腔)之间的损失系数。例如,对于路径1(站B至站C),第四部分1316的开口的修正损失系数(K’)定义为:
K′=到站B的损失+摩擦损失+流结损失 (方程6.1)
K′C=K′B+K2-3×(Q1+Q2)2+K2-4×(Q1+Q2+Q3)2 (方程6.2)
对于路径2(站B至站C),基于第四部分1316的开口的流通面积的修正损失系数(K’)定义为:
K′=入口损失+流结损失 (方程7.1)
与之前的站一样,路径1和路径2的修正损失系数必须相等,以确保体积流速(Q1、Q2和Q3)反映歧管内直至站C处的平衡分布。在使两个修正损失系数等同后,可以继续使到达站D、站E和站F的两条路径等同。如图所示,分步解算过程在每个站点进行,直至计算出最终站点(本例中为站F)的修正损失系数。然后,可以使用通过实验测量确定的实际Q总(通过排液腔近端部时的体积流速)来计算歧管的总损失系数(K)。
然后,可以将通过分步处理计算出的分数体积流速乘以实际总体积流速(Q总),以确定通过每个开口1232(如图10-10E所示)和开放远端1220的流量。
实施例
下文提供了用于计算体积流速的实施例,如表3-5和图15A-15C中所示。
实施例1
实施例1示出了具有不同尺寸的开口的保持构件管的液体流量的分布,其对应于图11中所示的保持构件1330的实施方式。如表3所示,最近端开口(Q6)的直径为0.48mm,管侧壁上的最远端开口(Q5)的直径为0.88mm,并且管的开放远端(Q6)的直径为0.97mm。每个开口都呈圆形。
流量分布百分比和计算体积流速确定如下。
通过管的远端到站B的路径(路径1)
通过侧壁开口至站B的路径(路径2)
从站B到站C的路径(路径1+路径2)
通过侧壁开口至站C的路径(路径3)
从站C到站D的路径(路径1与路径2+路径3)
通过侧壁开口至站D的路径(路径4)
从站D到站E的路径(路径1+路径2+路径3+路径4)
通过侧壁开口至站E的路径(路径5)
从站E到站F的路径(路径1-5)
通过侧壁开口至站F的路径(路径6)
为了计算每个“站”或开口的流量分布,将计算出的K’值乘以实际总体积流速(Q总),以确定通过每个穿孔和远端孔的流量。或者,计算结果可以表示为总流量的百分比或流量分布,如表3所示。如表3和图15C所示,通过最近端开口(Q6)的流量分布的百分比(流量分布%)为56.1%。通过两个最近端开口(Q6和Q5)的流量为84.6%。
表3
如实施例1所示,从管的保持部的近端区至远端区的穿孔直径的增加使得在整个保持部上的流量分布得更均匀。
实施例2
在实施例2中,每个开口都具有相同的直径和面积。如表4和图15A所示,在这种情况下,通过最近端开口的流量分布占通过管的总流量的86.2%。通过第二个开口的流量分布为11.9%。因此,在该实施例中,经计算,流经排液腔的液体的98.1%通过两个最近端开口进入该腔。与实施例1相比,实施例2增加了通过管的近端的流量。因此,实施例1提供了较宽的流量分布,其中更大百分比的液体通过除了最近端开口之外的开口进入排液腔。这样,可以通过多个开口更有效地收集液体,从而减少液体储量并改善通过肾盂和/或肾的负压分布。
表4:
实施例3
实施例2还说明了具有相同直径的开口的流量分布。但是,如表5所示,开口相互靠得更近(10mm相对于22mm)。如表5和图15B所示,通过排液腔的液体的80.9%经由最近端开口(Q6)进入排液腔。排液腔中的96.3%的液体经由两个最近端开口(Q5和Q6)进入排液腔。
表5
现在大体上参见图17-41,更具体地参见图17,其中示出了定位在患者尿路内的两个示例性输尿管导管5000、5001。输尿管5000、5001包括:排液腔5002、5003,用于从患者的肾脏2、4和肾盂20、21中的至少一个中或与肾盂20、21相邻的输尿管6、8中排出液体,例如尿液。排液腔5002、5003包括远端部5004、5005,远端部5004、5005被配置成定位在患者的肾脏2、4和肾盂20、21中和/或邻近肾盂20、21的输尿管6、8和近端部5006、5007中,且液体5008通过近端部5006、5007排到患者的膀胱10中或体外。
在一些实施例中,远端部5004、5005包括开放远端5010、5011,用于将液体吸入排液腔5002、5003。输尿管导管5000、5001的远端部5004、5005还包括保持部5012、5013,用于将排液腔或管5002、5003的远端部5004、5005保持在输尿管和/或肾中。保持部5012、5013可以是柔性的和/或可弯曲的,以允许将保持部5012、5013定位在输尿管、肾盂和/或肾中。例如,期望保持部5012、5013可充分弯曲,以吸收施加在导管5000、5001上的力并防止这种力传递到输尿管。此外,如果将保持部5012、5013沿近端方向P(如图17所示)拉向患者的膀胱10,则保持部5012、5013可以足够柔韧以开始展开、拉直或折叠,从而可以将其拉过输尿管6、8。
在一些实施例中,保持部包括漏斗支架。漏斗支架包括至少一个侧壁。漏斗支架的至少一个侧壁包括第一直径和第二直径,且第一直径小于第二直径。漏斗支架的第二直径比第一直径更靠近排液腔的远端部的端部。
排液腔或排液管的近端部没有或基本上没有开口。尽管不希望受到任何理论的约束,但认为当在排液腔近端部的近端施加负压时,在排液腔或排液管的近端部中的开口可能是不想要的,因为这样的开口可能减小输尿管导管远端部的负压,从而减少从肾和肾盂中抽出或流出的液体或尿液。理想的是,导管堵塞输尿管和/或肾不会阻止液体从输尿管和/或肾流出。而且,尽管不希望受到任何理论的约束,但认为当在排液腔近端部的近端施加负压时,输尿管组织可沿排液腔的近端部吸到开口上或吸入到开口中,这可能刺激组织。
根据本发明,输尿管导管的一些实施例包括包含漏斗支架的保持部,如图2和7-10E、17-41所示。如图2和7-10E所示,漏斗支架由一圈管子形成。在图17-41中示出了漏斗支架的其他实施例。下文将详细讨论根据本发明的每个漏斗支架。
现在参见图18A-C,在一些实施例中示出了输尿管导管的远端部5004,通常标示为5000。远端部5004包括保持部5012,该保持部5012包括漏斗支架5014。漏斗支架5014包括至少一个侧壁5016。漏斗支架5014的至少一个侧壁5016包括第一(外)直径D4和第二(外)直径D5,且第一外径D4小于第二外径D5。漏斗支架5014的第二外径D5比第一外径D4更靠近排液腔5002的远端部5004的远端5010。在一些实施例中,第一外径D4可以为约0.33mm至4mm(约1Fr至约12Fr(法国导管刻度)),或约2.0±0.1mm。在一些实施例中,第二外径D5大于第一外径D4,并且可以为约1mm至约60mm,或约10mm至30mm,或约18±2mm。
在一些实施例中,漏斗支架5014的至少一个侧壁5016还可包括第三直径D7(如图18B所示),且第三直径D7小于第二外径D5。漏斗支架5014的第三直径D7比第二直径D5更靠近排液腔5002的远端部5004的远端5010。下文将就唇部更详细地讨论第三直径D7。在一些实施例中,第三直径D7可以为约0.99mm至约59mm,或约5mm至约25mm。
漏斗支架5014的至少一个侧壁5016包括第一(内)直径D6。第一内径D6比第三直径D7更靠近漏斗支架5014的近端5017。第一内径D6小于第三直径D7。在一些实施例中,第一内径D6为约0.05mm至3.9mm,或约1.25±0.75mm。
在一些实施例中,沿着保持部5012的中轴5018的侧壁5016的总高度H5可以为约1mm至约25mm。在一些实施例中,例如,如果侧壁具有起伏边缘或圆形边缘(例如,如图24所示),则侧壁的高度H5可以在侧壁的不同部分变化。在一些实施例中,如果需要,波动范围可以为约0.01mm至约5mm或更大。
在一些实施例中,如图2、7-10E和17-41所示,漏斗支架5014可通常呈锥形。在一些实施例中,在漏斗支架5014的近端5017附近的外壁5022和与漏斗支架5014的基部5024相邻的排液腔5002之间的角度5020可以为约100度至约180度,或者约100度至约160度,或者约120度至约130度。角度5020可以在围绕漏斗支架5014的圆周的不同位置处变化,例如如图22A所示,其中角度5020为约140度至约180度。
在一些实施例中,至少一个侧壁5016的远端5010的边缘或唇部5026可以呈圆形、正方形或任何所需形状。由边缘5026限定的形状例如可以是圆形(如图18C和23B所示)、椭圆形(如图22B所示)、叶片形(如图28B、29B和31所示)、正方形、矩形或任何所需形状。
现在参见图28A-31,其中示出了漏斗支架5300,其中至少一个侧壁5302包括沿着侧壁5302的长度L7的多个叶片形纵向褶子5304。如图所示,褶子5304的数量可以为2至约20,或约6。在该实施例中,褶子5304可以由一种或多种柔性材料形成,例如硅树脂、聚合物、固体材料、织物或渗透性网,以提供所需的叶片形。褶子5304可具有大体上圆形的形状,如剖视图51B所示。漏斗支架5300的远端5306处的每个褶子5304的深度D10可以相同或变化,并且可以为约0.5mm至约5mm。
现在参见图29A和29B,一个或多个褶子5304可包括至少一个纵向支撑构件5308。纵向支撑构件5308可跨越漏斗支架5300的长度L7的全部或一部分。纵向支撑构件5308可以由柔性但部分刚性的材料形成,例如温敏形状记忆材料,例如镍钛合金。根据需要,纵向支撑构件5308的厚度可以为约0.01mm至约1mm。在一些实施例中,镍钛合金框架可以用诸如硅的合适防水材料覆盖,以形成锥形部或漏斗。在这种情况下,允许液体沿漏斗支架5300的内表面5310向下流动并进入排液腔5312。在其他实施例中,褶子5304由各种刚性或部分刚性的片材或材料形成,这些材料被弯曲或模制以形成漏斗形保持部。
现在参见图30和31,褶子5402的远端或边缘5400可包括至少一个边缘支撑构件5404。边缘支撑构件5404可跨越漏斗支架5408的远边缘5400的整个圆周5406或圆周5406的一个或多个部分。边缘支撑构件5404可以由柔性但部分刚性的材料形成,例如温敏形状记忆材料,例如镍钛合金。根据需要,边缘支撑构件5404的厚度可以为约0.01mm至约1mm。
在一些实施例中,如图18A-C所示,排液腔5002(或漏斗支架5014)的远端5010可具有朝向漏斗支架5014的中心的内向唇部5026,其厚度例如为约0.01mm至约1mm,以抑制对肾组织的刺激。因此,漏斗支架5014可包括小于第二直径D5的第三直径D7,第三直径D7比第二直径D5更靠近排液腔5002的远端部5004的端部5010。唇部5026的外表面5028可以呈圆形、正方形边缘或任何所需形状。唇部5026可有助于为肾盂和肾内部组织提供额外的支撑。
现在参见图24,在一些实施例中,可以形成至少一个侧壁5204的远端5202的边缘5200。例如,边缘5200可包括多个通常呈圆形的边缘5206或扇贝形部,例如约4至约20个或更多个圆形边缘。圆形边缘5206可提供比笔直边缘更大的表面积,以帮助支撑肾盂或肾的组织并抑制堵塞。边缘5200可以具有所需的任何形状,但是优选没有或基本上没有锐边,以避免损伤组织。
在一些实施例中,如图18A-C和22A-23B所示,漏斗支架5014包括与排液腔5002的远端部5004相邻的基部5024。基部5024包括至少一个内部开口5030,该内部开口与排液腔5002的近端部5006的排液腔5002的内腔5032对准,以允许液体流入排液腔5002的近端部5006的内腔5032。在一些实施例中,开口5030的横截面呈圆形,尽管形状可以不同,例如椭球体、三角形、正方形等。
在一些实施例中,如图22A-23B所示,漏斗支架5014的中轴5018相对于排液腔5002的近端部5006的中轴5034偏移。从漏斗支架5014的中轴5018相对于近端部5006的中轴5034的偏移距离X可以为约0.1mm至约5mm。
底部5024的至少一个内部开口5030的直径D8(例如,如图18C和23B所示)为约0.05mm至4mm。在一些实施例中,基部5024的内部开口5030的直径D8约等于排液腔的相邻近端部5006的第一内径D6。
在一些实施例中,漏斗支架5014的至少一个侧壁5016的高度H5与漏斗支架5014的至少一个侧壁5016的第二外径D5的比率为约1∶25至约5∶1。
在一些实施例中,基部5024的至少一个内部开口5030的直径D8为约0.05mm至约4mm,漏斗支架5014的至少一个侧壁5016的高度H5为约1mm至约25mm,漏斗支架5014的第二外径D5为约5mm至约25mm。
在一些实施例中,漏斗支架5014的至少一个侧壁5016的厚度T1(例如,如图18B所示)可以为约0.01mm至约1.9mm,或约0.5mm至约1mm。厚度T1可以在整个至少一个侧壁5016上大致均匀,或者可以根据需要变化。例如,至少一个侧壁5016的厚度T1在排液腔5002的远端部5004的远端5010附近可以小于或大于漏斗支架5014的基部5024处的厚度。
现在参见图18A-21,沿着至少一个侧壁5016的长度,侧壁5016可以是直的(如图18A和20所示)、凸的(如图19所示)、凹的(如图21所示)或其任何组合。如图19和21所示,侧壁5016的曲率可以由点Q的曲率半径R近似得出,使得以Q为中心的圆与曲线相交并且具有与曲线相同的斜率和曲率。在一些实施例中,曲率半径为约2mm至约12mm。在一些实施例中,漏斗支架5014的形状通常呈半球形,如图19所示。
在一些实施例中,漏斗支架5014的至少一个侧壁5016由气囊5100形成,例如如图35A、35B、38A和38B所示。气囊5100可以呈能够提供漏斗支撑的任何形状,以抑制输尿管、肾盂和/或肾其余部分的堵塞。如图35A和35B所示,气囊5100呈漏斗形。在插入气囊后,可以通过气口5102添加气体或空气来对其充气,或者在将其移除前通过气口5102去除气体或空气来使其放气。一个或多个气口5102可以简单地与气囊5100的内部5104邻接,例如,气囊5100可以与内部5106相邻,或者包围排液腔5002的近端部5006的相邻部分的外部5108。气囊5100的侧壁5110的直径D9可以为约1mm至约3mm,并且可以沿其长度变化,使得侧壁具有均匀的直径,且朝向远端5112逐渐变细,或朝向漏斗支架5116的近端5114逐渐变细。漏斗支架5116的远端5112的外径D10可以为约5mm至约25mm。
在一些实施例中,漏斗支架5014的至少一个侧壁5016沿着至少一个侧壁5016的高度H5是连续的,例如如图18A、19、20和21所示。在一些实施例中,漏斗支架5014的至少一个侧壁5016包括固体壁,例如侧壁5016在与一侧的液体(例如尿液)接触24小时后不能渗透过侧壁。
在一些实施例中,漏斗支架的至少一个侧壁沿至少一个侧壁的高度或主体是不连续的。如本文所用,“不连续”是指至少一个侧壁包括至少一个开口,用于允许液体或尿液例如通过重力或负压而经其流入排液腔。在一些实施例中,开口可以是穿过侧壁的常规开口,或者是网材内的开口,或者是渗透性织物内的开口。根据需要,开口的横截面形状可以呈圆形或非圆形,例如矩形、正方形、三角形、多边形、椭球体。在一些实施例中,“开口”是指包括螺旋管或导出管在内的导管的保持部中的相邻线圈之间的间隙。
如本文所用,“开口”或“孔”是指从侧壁的外侧到内侧或从侧壁的内侧到外侧穿过侧壁的连续的空隙空间或通道。在一些实施例中,至少一个或多个开口中的每一个可以具有相同或不同的面积,并且该面积可以为约0.002mm2至约100mm2,或约0.002mm2至约10mm2。如本文所用,开口的“面积”或“表面积”或“横截面积”是指由开口周界限定的最小或极小平面面积。例如,如果开口是圆形的,且在侧壁外侧的直径约为0.36mm(面积为0.1mm2),但在侧壁内或侧壁的相对侧上的某个点处的直径仅为0.05mm(面积为0.002mm2),则“面积”将为0.002mm,因为这是流经侧壁上的开口的最小或极小平面面积。如果开口是正方形或长方形,则“面积”是长度乘以平面区域的宽度。对于任何其他形状,可以通过本领域技术人员熟知的常规数学计算来确定“面积”。例如,通过拟合形状以填充开口的平面区域,并计算每种形状的面积且将每种形状的面积相加,从而得到不规则形状的开口的“面积”。
在一些实施例中,至少一部分侧壁包括至少一个(一个或多个)开口。通常,开口的中轴可以大体上垂直于侧壁的平面外表面,或者开口可以相对于侧壁的平面外表面成角度。开口的孔的尺寸可以在其整个深度上是均匀的,或者宽度可以沿深度变化,且从侧壁的外表面贯通到侧壁的内表面的开口的宽度可以增加、减小或交替。
现在参见图9A-9E、10A、10E、11-14、27、32A、32B、33和34,在一些实施例中,至少一部分侧壁包括至少一个(一个或多个)开口。开口可以沿着侧壁定位在任何位置。例如,开口可以均匀地定位在整个侧壁上,或定位在侧壁的特定区域中,例如更靠近侧壁的远端或更靠近侧壁的近端,或者沿着侧壁的长度或周长进行垂直、水平或随机分组。尽管不希望受任何理论的约束,但认为当在排液腔近端部的近端施加负压时,漏斗支架近端部中与输尿管、肾盂和/或其他肾组织直接相邻的开口可能是不可取的,因为这样的开口可能会减小输尿管导管远端的负压,从而减少从肾和肾盂中吸出或流出的液体或尿液,也可能会刺激组织。
根据需要,开口的数量可以在1至1000或更多之间变化。例如,在图27中示出了六个开口(每侧三个)。如上所述,在一些实施例中,至少一个或多个开口中的每一个可具有可以相同或不同的面积,并且该面积可以为约0.002mm2至约50mm2或约0.002mm2至约10mm2。
在一些实施例中,如图27所示,开口5500可定位成更靠近侧壁5504的远端5502。在一些实施例中,一个或多个开口朝着远端5502定位在侧壁的远端半部5506中。在一些实施例中,开口5500围绕远端半部5506的圆周均匀地分布,或者甚至更靠近侧壁5504的远端5502。
相反,如图32B所示,开口5600位于内侧壁5604的近端5602附近,并且不直接接触组织,因为在开口5600与组织之间存在外侧壁5606。或者或另外,根据需要,一个或多个开口5600可以定位在内侧壁的远端附近。可以通过将内侧壁5604的外侧5610连接至外侧壁5606的内侧5612的一个或多个支架5608或脊将内侧壁5604和外侧壁5606连接起来。
在一些实施例中,例如如图25和26所示,漏斗支架5702、5802的至少一个侧壁5700、5800包括网5704、5804。网5704、5804包括穿过其中的多个开口5706、5806,以允许液体流入排液腔5708、5808。在一些实施例中,开口的最大面积可以小于约100mm2,或小于约1mm2,或约0.002mm2至约1mm2,或约0.002mm2至约0.05mm2。网5704、5804可以由任何合适的金属或聚合材料形成,如上文所述。
在一些实施例中,漏斗支架还包括在漏斗支架的远端上方的覆盖物部。该覆盖物部可以形成为漏斗支架的整体部分或连接至漏斗支架的远端。例如,如图26所示,漏斗支架5802包括覆盖物部5810,该覆盖物部跨过漏斗支架5802的远端5812且从漏斗支架5802的远端5812伸出。覆盖物部5810可具有任何期望的形状,例如平形、凸形、凹形、波浪形及其组合。覆盖物部5810可以由如上所述的网或任何聚合固体材料形成覆盖物部5810可有助于支撑肾区中的柔韧组织,以促进尿液的生成。
在一些实施例中,漏斗支架包括多孔材料,例如如图39和40所示。下文将详细讨论图39和40以及合适的多孔材料。简而言之,在图39和40中,多孔材料本身就是漏斗支架。在图39中,漏斗支架是多孔材料制成的楔形物。在图40中,多孔材料呈漏斗形。在一些实施例中,例如如图33所示,多孔材料5900位于侧壁5904的内部5902内。在一些实施例中,例如如图34所示,漏斗支架6000包括多孔衬垫6002,该多孔衬垫6002靠近侧壁6006的内部6004。例如,多孔衬垫6002的厚度T2可以为约0.5mm至约12.5mm。多孔材料内的开口的面积可以为约0.002mm2至约100mm2或更小。
现在参见图37A和37B,例如,输尿管导管112的保持部130包括导管的管122,导管的管122具有加宽和/或渐细的远端部,该远端部在一些实施例中被配置成位于患者的肾盂和/或肾中。例如,保持部130可以是漏斗形的结构,其包括外表面185和内表面186,外表面185被配置成抵靠输尿管和/或肾壁,内表面186被配置成将液体导向导管112的排液腔124。保持部130可包括与排液腔124的远端相邻且具有第一直径D1的近端188以及具有第二直径D2的远端190,而且当保持部130处于部署位置时第二直径D2大于第一直径D1。在一些实施例中,保持部130可以从折叠或压缩位置过渡到展开位置。例如,保持部130可以径向向外偏移,使得当保持部130前进到其液体收集位置时,保持部130(例如漏斗部分)径向向外扩展到展开状态。
输尿管导管112的保持部130可以由能够从折叠状态过渡到展开状态的各种合适的材料制成。在一实施例中,保持部130包括由温敏形状记忆材料(例如镍钛合金)形成的尖齿件或细长体的框架。在一些实施例中,镍钛合金框架可以用诸如硅的合适防水材料覆盖,以形成锥形部或漏斗。在这种情况下,允许液体沿保持部130的内表面186向下流动并进入排液腔124。在其他实施例中,如图37A和37B所示,保持部130由各种刚性或部分刚性的片材或材料形成,这些材料被弯曲或模制以形成漏斗形保持部。
在一些实施例中,输尿管导管112的保持部可包括一个或多个机械刺激装置191,用于刺激输尿管和肾盂的相邻组织中的神经和肌肉纤维。例如,机械刺激装置191可包括线性或环形致动器,这些线性或环形致动器嵌入或安装在导管的管122的侧壁的一些部分附近并且被配置成发出低水平的振动。在一些实施例中,可以对输尿管和/或肾盂的一些部分提供机械刺激,以补充或改变通过施加负压获得的疗效。尽管不希望受到理论的约束,但认为这种刺激通过例如刺激神经和/或激活与输尿管和/或肾盂相关的蠕动肌的方式影响相邻组织。刺激神经和激活肌肉可能引起周围组织和器官中的压力梯度或压力水平的变化,这可能有助于或在某些情况下增强负压治疗的疗效。
参见图38A和38B,根据另一实施例,输尿管导管312的保持部330包括导管的管322,导管的管322具有形成在螺旋结构332中的远端部318和位于螺旋结构332附近的可充气元件或气囊350,以在肾盂和/或液体收集位置提供额外的保留度。气囊350可以充气到足以将气囊保持在肾盂或输尿管中的压力,但又足够低,以避免膨胀或损坏这些结构。本领域技术人员已知合适的充气压力,并且可以通过反复试验来轻易确定。如先前实施例所述,可通过弯曲导管的管322来形成一个或多个线圈334,从而获得螺旋结构332。线圈334可以具有如上所述的恒定或可变的直径和高度。导管的管322还包括设置在导管的管322的侧壁上的多个排液口336,以允许尿液被吸入导管的管322的排液腔324中,并从体内引导通过排液腔324,例如在线圈334的向内和/或向外的侧面上。
如图38B所示,可充气元件或气囊350可包括环形气囊状结构,该结构具有例如大体上心形的横截面且包括限定腔353的表面或覆盖物352。腔353与充气腔354呈液体连通,且充气腔354平行于由导管的管322限定的排液腔324延伸。气囊350可配置成插入肾盂的锥形部中并充气,使得其外表面356接触并靠在输尿管和/或肾盂的内表面上。可充气元件或气囊350可包括朝着导管的管322纵向和径向向内延伸的渐缩内表面358。内表面358可被配置成将尿液导向导管的管322以将其抽吸到排液腔324中。内表面358也可定位成防止液体积聚在输尿管中,例如围绕在可充气元件或气囊350的周围。理想的是,可充气的保持部或气囊350的尺寸设置成适合布置在肾盂内,并且其直径可以为约10mm至约30mm。
参见图39和40,在一些实施例中示出了包括输尿管导管412的组件400,且输尿管导管412包括保持部410。保持部410由附接到导管的管422的远端421上的多孔和/或海绵状材料形成。多孔材料可被配置成引导和/或吸收尿液并将尿液引向导管的管422的排液腔424。如图40所示,保持部410可以是多孔楔形结构,其被配置成插入和保持在患者的肾盂中。多孔材料包括多个孔和/或通道。例如通过重力或当通过导管412产生负压时,液体可以通过通道和孔被吸入。例如,液体可以通过孔和/或通道进入楔形保持部410,并通过例如毛细血管作用、蠕动或由于孔和/或通道中负压的产生而被引向排液腔424的远端开口420。在其他实施例中,如图40所示,保持部410包括由多孔海绵状材料形成的中空漏斗结构。如箭头A所示,液体沿漏斗结构的内表面426向下进入由导管的管422限定的排液腔424。此外,液体可以通过侧壁428的多孔海绵状材料中的孔和通道进入保持部410的漏斗结构。例如,合适的多孔材料可包括开孔聚氨酯泡沫,例如聚氨酯醚。合适的多孔材料还可包括机织或非机织层的叠层,其包含例如聚氨酯、硅树脂、聚乙烯醇、棉或聚酯,并具有或不具有抗菌添加剂,例如银,且具有或不具有用于改变材料性能的添加剂,例如水凝胶、水胶体、丙烯酸或硅树脂。
参见图41,根据另一实施例,输尿管导管512的保持部500包括扩张式笼530。扩张式笼530包括一个或多个纵向和径向延伸的空心管522。例如,管522可以由诸如镍钛合金的弹性形状记忆材料形成。笼530被配置成从用于插入患者尿路的收缩状态过渡到用于在患者输尿管和/或肾脏中定位的展开状态。空心管522包括多个排液口534,所述排液口534可以定位在管上,例如定位在其径向向内的侧面上。端口534被配置成允许液体流过或被吸通过端口534并进入相应的管522。液体通过空心管522排入由输尿管导管512的导管体526限定的排液腔524。例如,液体可以沿着图41中的箭头532指示的路径流动。在一些实施例中,当在肾盂、肾和/或输尿管中产生负压时,输尿管壁和/或肾盂的一些部分可被吸引到空心管522的朝外的表面上。排液口534被定位和配置成在对输尿管和/或肾施加负压时不会被输尿管结构明显堵塞。
在一些实施例中,可以使用穿过尿道并进入膀胱的导管将包括漏斗支架的输尿管导管在患者的尿路中(更具体地,在肾盂区/肾中)展开。漏斗支架6100处于折叠状态(如图36所示),并套在输尿管护套6102中。为了展开输尿管导管,医务人员会将膀胱镜插入尿道,以便为工具进入膀胱提供通道。输尿管口将被可视化,将通过膀胱镜和输尿管插入导丝,直到导丝的尖端到达肾盂。膀胱镜可能会被移除,“推管”将通过导丝被送入肾盂。当“推管”停留在适当位置以充当部署护套时,导丝将被移除。输尿管导管将插入穿过推管/护套,一旦导管尖端延伸超出推管/护套的端部,导管尖端将被致动。漏斗支架将呈放射状扩展,以位于部署位置。
输尿管支架实施例:
现在参见图1,在一些实施例中,所述输尿管支架52、54包括细长体,该细长体包括近端62、远端58、纵轴以及沿所述纵轴从所述近端向所述远端延伸的至少一个排液通道,以维持所述患者的肾与膀胱之间液体流动的通畅性。在一些实施例中,所述输尿管支架还包括在所述近端或所述远端中的至少一个上的尾纤线圈或环。在一些实施例中,所述输尿管支架的主体还包括在其侧壁上的至少一个穿孔。在一些实施例中,所述输尿管支架的主体在其侧壁上没有或基本上没有穿孔。
在目前的系统和方法中可以使用的输尿管支架52、54的一些实施例包括CONTOUR
TM输尿管支架、CONTOUR VL
TM输尿管支架、POLARIS
TM Loop输尿管支架、POLARIS
TM Ultra输尿管支架、PERCUFLEX
TM输尿管支架、PERCUFLEX
TM Plus输尿管支架、STRETCH
TM VL Flexima输尿管支架,其中的每种都可以从马萨诸塞州的Boston Scientific Corporation ofNatick公司购得。参见“Ureteral Stent Portfolio”,Boston Scientific公司的出版物(2010年7月),其通过引用并入本文。CONTOUR
TM和CONTOUR VL
TM输尿管支架由柔软的Percuflex
TM材料制成,该材料在体温下会变软,并可供365天的留置。远端和近端上的可变长度线圈允许一个支架适合各种输尿管长度。固定长度支架可以为6F至8F,其长度为20cm至30cm;可变长度支架可以为4.8F至7F,其长度为22cm至30cm。合适的输尿管支架的其他实施例包括
输尿管支架、
输尿管支架、
双尾纤输尿管支架和FLUORO-4
TM硅树脂输尿管支架,其中的每种都可以从新泽西州的Murray Hill的C.R.Bard公司购得。参见“Ureteral Stents”,http://www.bardmedical.com/products/kidney-stone-management/ureteral-stents/(2018年1月21日),其通过引用并入本文。
根据需要,可以将支架52、54部署在患者的一个或两个肾或肾区(肾盂或与肾盂相邻的输尿管)中。通常,将具有镍钛合金丝的支架插入尿道和膀胱直至肾,然后将镍钛合金丝从支架中取出,从而使支架呈现出展开的构型。上述许多支架在远端具有平面环58、60(将部署在肾中),并且一些支架在支架近端也具有部署在膀胱中的平面环62、64。当移除镍钛合金丝时,支架在远端和/或近端呈现出预应力平面环形状。为了移除支架,可插入镍钛合金丝以拉直支架,然后将支架从输尿管和尿道中抽出。
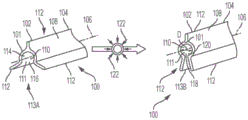
合适的输尿管支架52、54的其他实施例在PCT专利申请公开号WO 2017/019974文件中公开,其通过引用并入本文。在一些实施例中,例如如在WO 2017/019974文件中的图1-7和本文中的图3(与WO 2017/019974文件中的图1相同)所示,输尿管支架100可以包括:细长体101,其包括近端102、远端104、纵轴106、外表面108和内表面110,其中所述内表面110限定可变形孔111,该可变形孔111沿所述纵轴106从所述近端102延伸到所述远端104;以及至少两个从细长体101的外表面108径向伸出的翅片112;其中所述可变形孔111包括:(a)默认取向113A(如图59中左侧所示),其包括限定了纵向开放通道116的开放孔114;以及(b)第二取向113B(如图59中右侧所示),其包括至少基本闭合的孔118或闭合孔,该孔沿所述细长体101的所述纵轴106限定纵向基本闭合的排液通道120,其中所述可变形孔111在径向压缩力122施加到所述细长体101的至少一部分外表面108上时可从所述默认取向113A移动到所述第二取向113B。
在一些实施例中,如图3所示,所述输尿管支架100的所述排液通道120的直径D在所述可变形孔111从所述默认取向113A移动到所述第二取向113B时减小,其中所述直径可减小至经由所述可变形孔111的尿流量不再减少时为止。在一些实施例中,当可变形孔111从默认取向113A移动到第二取向113B时,直径D减小多达约40%。在一些实施例中,默认取向113A上的直径D可以为约0.75mm至约5.5mm,或者为约1.3mm或约1.4mm。在一些实施例中,默认取向113B上的直径D可以为约0.75mm至约4mm,或者为约.9mm或约1.4mm。
在一些实施例中,一个或多个翅片112包含基于肖氏硬度标度的软至中软的柔性材料。在一些实施例中,细长体101包含基于肖氏硬度标度的中硬至硬的柔性材料。在一些实施例中,一个或多个翅片的硬度为约15A至约40A。在一些实施例中,细长体101的硬度为约80A至约90A。在一些实施例中,一个或多个翅片112和细长体101包含基于肖氏硬度标度的中软至中硬的柔性材料,例如,其硬度为约40A至约70A。
在一些实施例中,一个或多个翅片112和细长体101包含基于肖氏硬度标度的中硬至硬的柔性材料,例如,其硬度为约85A至约90A。
在一些实施例中,除了通过可变形孔111之外,默认取向113A和第二取向113B还支持液体或尿液围绕支架100的外表面108流动。
在一些实施例中,一个或多个翅片112从近端102纵向延伸至远端104。在一些实施例中,支架具有两个、三个或四个翅片。
在一些实施例中,细长体的外表面108在默认取向113A上的外径为约08mm至约6mm或约3mm。在一些实施例中,细长体的外表面108在第二取向113B上的外径为约0.5mm至约4.5mm或约1mm。在一些实施例中,一个或多个翅片的宽度或尖端的范围从约0.25mm至约1.5mm,或约1mm,其从细长体的外表面108沿大致垂直于纵轴的方向伸出。
在一些实施例中,通过正常输尿管生理机能、异常输尿管生理机能或施加任何外力中的至少一种来提供径向压缩力。在一些实施例中,输尿管支架100特意适应动态的输尿管环境,且输尿管支架100包括:细长体101,其包括近端102、远端104、纵轴106、外表面108和内表面110,其中所述内表面110限定可变形孔111,该可变形孔111沿所述纵轴106从所述近端102延伸到所述远端104;其中所述可变形孔111包括:(a)默认取向113A,其包括限定纵向开放通道116的开放孔114;以及(b)第二取向113B,其包括限定纵向基本闭合通道120的至少基本闭合的孔118,其中当径向压缩力122施加到所述细长体101的至少一部分外表面108上时,所述可变形孔可从所述默认取向113A移动到所述第二取向113B,其中所述细长体101的所述内表面110的直径D在所述可变形孔111从所述默认取向113A移动到所述第二取向113B时减小,其中所述直径可减小至经由所述可变形孔111的液体流量不再减少时为止。在一些实施例中,当可变形孔111从默认取向113A移动到第二取向113B时,直径D减小多达约40%。
合适的输尿管支架的其他实施例在US专利申请公开号US 2002/0183853 A1文件中公开,其通过引用并入本文。在一些实施例中,例如如US 2002/0183853 A1文件中的图4、5和7以及在本文中的图4-6所示(与US 2002/0183853 A1文件中的图1、4、5和7相同),输尿管支架包括细长体10,该细长体10包括近端12、远端14(未示出)、纵轴15以及至少一个排液通道(例如,图4中的26、28、30,图5中的32、34、36和38,以及图6中的48),且该排液通道沿纵轴15从近端12延伸到远端14,以保持患者的肾与膀胱之间液体流动的通畅性。在一些实施例中,所述至少一个排液通道沿着其至少一纵向部是部分开放的。在一些实施例中,所述至少一个排液通道沿着其至少一纵向部是闭合的。在一些实施例中,所述至少一个排液通道沿着其纵向长度是闭合的。在一些实施例中,输尿管支架可径向压缩。在一些实施例中,输尿管支架可径向压缩,以使至少一个排液通道变窄。在一些实施例中,细长体10包括沿着细长体10的纵轴15的至少一个外翅片40。在一些实施例中,细长体包括一至四个排液通道。排液通道的直径可以与上述相同。
产生负压的系统
本发明提供了一种用于从患者的尿路中排出液体的系统,该系统包括:输尿管支架或输尿管导管,用于维持所述患者的至少一个肾与膀胱之间液体流动的通畅性;膀胱导管,其包括用于从患者的膀胱中排出液体的排液腔;以及与排液腔的远端呈液体连通的泵,该泵包括控制器,该控制器被配置成致动所述泵以向所述导管的近端施加负压,从而在患者的一部分尿路中产生负压,以从患者的尿路中排出液体。
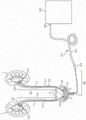
参见图7,其中示出了用于在患者的尿路中产生负压以增强肾灌注的示例性系统1100。系统1100包括一个或两个输尿管导管1212(或如图1所示的替代性输尿管支架),其连接至用于产生负压的液体泵2000。更具体地,患者的尿路包括患者的右肾2和左肾4。肾2、4负责血液过滤和通过尿液从体内清除废物化合物。由右肾2和左肾4产生的尿液通过小管(即右输尿管6和左输尿管8)排入患者的膀胱10中,这些小管在肾盂20、21与肾相连。尿液可以通过输尿管壁的蠕动以及重力而流经输尿管6、8。输尿管6、8通过输尿管口或开口16进入膀胱10。膀胱10是一种柔性且基本中空的结构,其适于收集尿液直到尿液从体内排出。膀胱10可从空位(由参考线E表示)过渡到满位(由参考线F表示)。通常,当膀胱10达到基本满的状态时,允许液体或尿液通过位于膀胱10下部的尿道括约肌或开口18从膀胱10排至尿道12。膀胱10可通过收缩对施加在膀胱10的三角区14上的应力和压力作出响应,该三角区是指在输尿管开口16与尿道开口18之间延伸的三角区。三角区14对应力和压力敏感,使得当膀胱10开始充盈时,三角区14上的压力增加。当超过三角区14的阈值压力时,膀胱10开始收缩,以将收集的尿液通过尿道12排出。
如图7和7A所示,输尿管导管的远端部部署在靠近肾2、4的肾盂20、21中。一个或多个导管1212的近端部进入膀胱。膀胱导管的近端部连接至负压源,例如液体泵2000。可以基于所使用的泵2000的类型来选择连接器的形状和尺寸。在某些实施例中,连接器可以制成独特的结构,以使它只能连接至特定的泵类型,这被认为可安全地用于在患者的膀胱、输尿管或肾中产生负压。在其他实施例中,如本文所述,连接器可以是适于附接至各种不同类型的液体泵的更通用构造。系统1100仅是用于产生负压的负压系统的一个实施例,其可与本文公开的膀胱导管一起使用。
现在参见图1、2、7、7A、17,在一些实施例中,系统100包括膀胱导管116。输尿管导管112、114的远端120、121可以直接排入膀胱,并且液体可以通过膀胱导管116并可选地沿着膀胱导管的管的侧面排出。
示例性膀胱导管
本文公开的任何输尿管导管均可用作在本方法和系统中有用的膀胱导管。在一些实施例中,膀胱导管116包括可展开的密封件和/或锚136,用于锚定、保持和/或被动固定尿液收集组件100的留置部,以及在一些实施例中用于防止在使用期间过早和/或草率地移除组装部件。锚136被配置成位于患者膀胱10的下壁附近(如图1、2、7、7A、17所示),以阻止患者移动和/或施加在留置导管112、114、116上的力传导到输尿管。膀胱导管116的内部限定了排液腔140,所述排液腔140被配置成将尿液从膀胱10输送至外部尿液收集容器712(如图44所示)。在一些实施例中,膀胱导管116的管尺寸可以为约8Fr至约24Fr。在一些实施例中,膀胱导管116的外管径可以为约2.7mm至约8mm。在一些实施例中,膀胱导管116的内径可以为约2.16mm至约10mm。膀胱导管116可以具有不同的长度,以适应性别和/或患者尺寸的解剖学差异。例如,女性的平均尿道长度仅为几英寸,因此管138的长度可以相当短。男性的平均尿道长度因阴茎而较长,并且可以是可变的。如果多余的导管不会增加导管116的无菌部分的操作难度和/或抗污染难度,则女性可以使用带有较长导管138的膀胱导管116。在一些实施例中,膀胱导管116的无菌和留置部可以为约1英寸至3英寸(对于女性)至约20英寸(对于男性)。包括无菌和非无菌部分的膀胱导管116的总长度可以为一英尺至几英尺。
导管的管138可包括一个或多个排液口142,所述排液口142被配置成位于膀胱10中以将尿液吸入排液腔140。例如,从输尿管导管112、114流入患者膀胱10中的液体或尿液通过端口142和排液腔140从膀胱10排出。可使排液腔140内呈负压,以协助液体收集。
具体参见图2,可展开的密封件和/或锚136布置在膀胱导管116的远端148处或其附近。可展开的锚136被配置成在通过尿道12和尿道开口18插入膀胱10的收缩状态与展开状态之间过渡。锚136被配置成在膀胱10的下部和/或紧靠尿道开口18处展开并安装在其附近。例如,锚136可以定位在尿道开口18附近,以增强对膀胱10的负压抽吸,或者部分地、实质上或全部地密封膀胱10,以确保将膀胱10中的尿液引导通过排液腔140并防止泄漏到尿道12中。对于包括8Fr至24Fr细长管138的膀胱导管116,锚136在展开状态下的直径可以为约10mm至约100mm。
示例性膀胱锚结构
本文公开的任何输尿管导管均可用作在本方法和系统中有用的膀胱导管。例如,膀胱导管可包括作为膀胱锚的网,如图1和2所示。在另一实施例中,膀胱导管116可包括作为膀胱锚的线圈,如图7所示。在另一实施例中,膀胱导管116可包括作为膀胱锚的网状漏斗,如图7A所示。在另一实施例中,膀胱导管116可包括作为膀胱锚的漏斗,如图17所示。
参见图41,在膀胱导管的另一实施例中,扩张式笼可以将膀胱导管锚定在膀胱中。扩张式笼包括从膀胱导管的导管体纵向和径向向外延伸的多个柔性构件或尖齿,其在一些实施例中可类似于上文中对图41中输尿管导管的保持部所作的那些讨论。这些构件可以由合适的弹性和形状记忆材料(例如镍钛合金)形成。在部署位置,这些构件或尖齿具有足够的曲率,以限定球形或椭球形的中心腔。笼被附接到导管体或管的开放远端,以允许进入由导管体或管限定的排液腔。所述笼的尺寸使其适于定位在所述膀胱的下部内,并且可以将直径和长度限定为1.0cm至2.3cm,优选为约1.9cm(0.75in)。
在一些实施例中,所述笼还包括在所述笼的远端部上的屏蔽件或覆盖物,以防止或减小由于与所述笼或所述构件接触而使组织(即所述膀胱的远端壁)被卡住或挤压的可能性。更具体地,当膀胱收缩时,膀胱的内远端壁与笼的远端侧接触。覆盖物可防止组织被挤压或卡住,可减少患者不适,并在使用过程中保护设备。所述覆盖物可至少部分地由多孔和/或渗透性的生物相容性材料(例如编织的聚合物网)形成。在一些实施例中,覆盖物包围了所有或基本上所有的腔。在一些实施例中,覆盖物仅覆盖笼210的远端2/3、远端一半或远端第三部分或任何量。
笼和覆盖物可从收缩位置过渡,在收缩位置中,该构件围绕中心部和/或围绕膀胱导管116紧密地收缩在一起,以允许通过导管或护套插入到部署位置。例如,在由形状记忆材料构成笼的情况下,当笼被加热到足够的温度(例如37℃的体温)时,该笼可以被配置成过渡到展开位置。在展开位置,笼的直径D优选比尿道口宽,并且防止患者移动通过输尿管导管112、114传导到输尿管。构件212或尖齿的开口布置不会阻塞或堵塞膀胱导管216的远端开口248和/或排液口,使得更容易进行导管112、114的操作。
膀胱导管通过例如限定液体流动路径的柔性管166连接至真空源,例如泵组件710。
示例性液体传感器:
再次参见图1,在一些实施例中,组件100还包括传感器174,该传感器174用于监测从输尿管6、8和/或膀胱10收集的液体或尿液的身体参数或液体特性。如本文结合图44所讨论的,从传感器174获得的信息可以传输到中央数据采集模块或处理器,并且可以例如用于控制外部设备(例如泵710)的运行(如图44所示)。传感器174可以与导管112、114、116中的一个或多个形成为一体,例如,嵌入导管体或管的壁中,并且与排液腔124、140呈液体连通。在其他实施例中,一个或多个传感器174可以定位在液体收集容器712中(如图44所示)或外部装置(如泵710)的内部电路中。
可与尿液收集组件100一起使用的示例传感器174可包括以下传感器类型中的一种或多种。例如,导管组件100可以包括对尿液的电导率进行采样的电导传感器或电极。人尿的正常电导率为约5-10mS/m。尿液的电导率超出预期范围可能表明患者正在经历生理问题,需要进一步治疗或分析。导管组件100还可以包括用于测量通过导管112、114、116的尿液流速的流量计。流速可以用来确定从人体内排出的液体总量。导管112、114、116还可包括用于测量尿液温度的温度计。尿液温度可以用来配合电导传感器。尿液温度也可用于监测目的,因为尿温超出生理正常范围可指示某些生理状况。在一些实施例中,传感器174可以是尿液分析物传感器,其被配置成测量尿液中肌酐和/或蛋白质的浓度。例如,各种电导率传感器和光学光谱传感器可用于测定尿液中的分析物浓度。基于变色试剂测试条的传感器也可用于此目的。
系统的插入方法:
在描述了包括输尿管导管和/或输尿管支架和膀胱导管的系统100之后,现在将详细讨论插入和部署输尿管支架或输尿管导管和膀胱导管的方法的一些实施例。
参见图42A,其中示出了用于将系统定位在患者体内和(可选地)用于在患者尿路(例如膀胱、输尿管和/或肾)中产生负压的步骤的实施例。如框610所示,医疗专业人员或护理人员将柔性或刚性膀胱镜插入患者的尿道并进入膀胱,以使输尿管口或开口可视化。一旦获得合适的可视化效果,如612框所示,即可将导丝穿过尿道、膀胱、输尿管开口、输尿管,并到达所需的液体收集位置,如肾的肾盂。一旦导丝被推进到所需的液体收集位置,即可将本发明的输尿管支架或输尿管导管(其实施例已在上文中详细讨论)从导丝上方插入到液体收集位置,如框614所示。在一些实施例中,输尿管支架或输尿管导管的位置可以通过荧光检查法来确定,如框616所示。如框618所示,一旦确定了输尿管支架或输尿管导管的远端的位置,即可展开输尿管导管的保持部。例如,可以从导管上移除导丝,从而允许远端和/或保持部过渡到展开位置。在一些实施例中,导管的展开的远端部并不完全堵塞输尿管和/或肾盂,使得尿液可以从导管外流动并通过输尿管进入膀胱。由于移动导管可对尿路组织施加力,所以避免输尿管完全堵塞可避免对输尿管侧壁施加力而造成损伤。
在输尿管支架或输尿管导管就位并展开后,可以使用与本文所述相同的插入和定位方法,将同一导丝用于将第二输尿管支架或第二输尿管导管定位在另一输尿管和/或肾中。例如,膀胱镜可用于获得膀胱中另一输尿管开口的可视化效果,并且导丝可通过可视化的输尿管开口前行至另一输尿管中的液体收集位置。第二输尿管支架或第二输尿管导管可以与导丝并排,并以本文所述的方式展开。或者,膀胱镜和导丝可以从人体内移除。膀胱镜可以通过第一个输尿管导管重新插入膀胱。以上述方式使用膀胱镜,以获得输尿管开口的可视化,并协助将第二导丝推进至第二输尿管和/或肾,以定位第二输尿管支架或第二输尿管导管。在一些实施例中,一旦输尿管支架或导管就位,即可移除导丝和膀胱镜。在其他实施例中,膀胱镜和/或导丝可以留在膀胱内,以协助放置膀胱导管。
一旦输尿管导管就位,如框620所示,医疗专业人员、护理人员或患者即可通过患者的尿道将处于折叠或收缩状态的膀胱导管的远端插入膀胱。如上所述,膀胱导管可以是如上所述的本发明的膀胱导管。一旦插入膀胱,如框622所示,即可将连接至膀胱导管和/或与膀胱导管相关联的锚扩展在部署位置。在一些实施例中,膀胱导管通过尿道插入膀胱,而无需使用导丝和/或膀胱镜。在其他实施例中,膀胱导管被插入到用于定位输尿管支架或导管的同一导丝上。
在一些实施例中,输尿管支架或输尿管导管被展开并在患者体内停留至少24小时或更长时间。在一些实施例中,输尿管支架或输尿管导管被展开并在患者体内停留至少30天或更长时间。在一些实施例中,可以定期更换输尿管支架或输尿管导管,例如每周或每月更换一次,以延长治疗时间。
在一些实施例中,膀胱导管比输尿管支架或输尿管导管更经常地被更换。在一些实施例中,对于单个输尿管支架或输尿管导管,在留置期间内依次放置和移除多个膀胱导管。例如,医生、护士、护理人员或患者可以在家中或任何医疗机构中将膀胱导管放置在患者体内。根据需要,可以将多个膀胱导管成套地提供给医疗专业人员、患者或护理人员,同时也可选地提供放置、更换以及可选的将膀胱导管与负压源连接或排液至容器的说明。在一些实施例中,在预定数量的晚上(例如1至30个晚上或更多),每晚施加负压。可选地,可以在每晚施加负压之前更换膀胱导管。
在一些实施例中,尿液可以通过重力或蠕动从尿道排出。在其他实施例中,在膀胱导管中产生负压,以便于排尿。尽管不希望受任何理论的约束,但认为施加到膀胱导管近端的一部分负压被传输到输尿管、肾盂或肾的其他部分,以便于从肾中排出液体或尿液。
参见图42B,其中示出了使用该系统在输尿管和/或肾脏中产生负压的步骤。如框624所示,在正确定位输尿管支架的留置部或输尿管导管和膀胱导管以及展开任何锚定/保持结构(如果存在)之后,将膀胱导管的外部近端连接至液体收集器或泵组件。例如,膀胱导管可连接至泵,以在患者膀胱、肾盂和/或肾处产生负压。
一旦膀胱导管和泵组件连接,即可通过膀胱导管的排液腔向肾盂和/或肾和/或膀胱施加负压,如框626所示。负压旨在抵消充血介导的间质静水压,该间质静水压是由于腹腔内压升高以及随之而来的或升高的肾静脉压或肾淋巴压引起的。因此,所施加的负压能够增加通过髓质小管的滤液流量,并减少水和钠的重吸收。
由于所施加的负压,如框628所示,尿液通过膀胱导管的排液腔被吸入其远端的排液口处的膀胱导管中,并被吸入液体收集容器中进行处理。当尿液被吸到收集容器时,在框630处,设置在液体收集系统中的可选传感器可以提供关于尿液的许多测量值,这些测量值可用于评估身体参数,例如收集的尿液量以及关于患者的身体状况和产生的尿液成分的信息。在一些实施例中,如框632所示,由与泵和/或另一患者监测设备相关联的处理器处理传感器获得的信息,并且在框634通过相关联的反馈设备的视觉显示器向用户显示。
示例性液体收集系统:
在描述了用于将这样的系统定位在患者体内的示例性系统和方法之后,参见图44,现在将描述用于使患者的膀胱、输尿管、肾盂和/或肾产生负压的系统700。系统700可包括输尿管支架和/或输尿管导管、膀胱导管或上述系统100。如图44示,系统100的膀胱导管116连接至一个或多个液体收集容器712,用于收集从膀胱抽出的尿液。连接至膀胱导管116的液体收集容器712可以与外部液体泵710呈液体连通,以通过膀胱导管116和/或输尿管导管112、114在膀胱、输尿管和/或肾中产生负压。如本文所述,可以提供这种负压,以克服间质压并在肾或肾单位中形成尿液。在一些实施例中,液体收集容器712与泵710之间的连接可以包括液体锁或液体屏障,以防止在偶然的治疗性或非治疗性压力变化的情况下空气进入膀胱、肾盂或肾。例如,液体容器的流入和流出端口可以定位在容器中的液位以下。由此,防止空气通过液体容器712的流入或流出端口进入医疗管或导管。如前所述,在液体收集容器712与泵710之间延伸的管的外部部分可包括一个或多个过滤器,以防止尿液和/或微粒进入泵710。
如图44所示,系统700还包括控制器714,例如微处理器,其电耦合到泵710并且具有计算机可读存储器716或与计算机可读存储器716相关联。在一些实施例中,存储器716包括指令,该指令在被执行时使控制器714从位于组件100的一些部分上的或与之相关联的传感器174接收信息。可以基于来自传感器174的信息来确定关于患者状况的信息。来自传感器174的信息也可以用于确定和执行泵710的操作参数。
在一些实施例中,控制器714并入与泵710通信的单独的远程电子设备中,例如专用电子设备、计算机、平板电脑或智能电话。或者,控制器714可以包括在泵710中,并且例如可以控制用于手动操作泵710的用户界面以及诸如从传感器174接收和处理信息的系统功能。
控制器714被配置成从一个或多个传感器174接收信息并且将该信息存储在相关联的计算机可读存储器716中。例如,控制器714可以被配置成以预定速率(例如每秒一次)从传感器174接收信息,并基于所接收的信息来确定电导。在一些实施例中,用于计算电导的算法还可包括其他传感器测量值,例如尿液温度,以获得更稳健的电导率测定。
控制器714还可被配置成计算患者的体格统计或诊断指标,用以表明患者状况随时间的变化情况。例如,系统700可以被配置成确定排出的钠总量。排出的钠总量可以例如基于一段时间内的流速与电导率的组合。
继续参见图19,系统700还可包括用于向用户提供信息的反馈设备720,例如视觉显示器或音频系统。在一些实施例中,反馈装置720可以与泵710形成为一体。或者,反馈设备720可以是单独的专用或多用途电子设备,例如计算机、手提电脑、平板电脑、智能电话或其他手持电子设备。反馈设备720被配置成从控制器714接收所计算或确定的测量值,并且通过反馈设备720将所接收的信息呈现给用户。例如,反馈设备720可以被配置成显示施加到尿路的当前负压(以mmHg为单位)。在其他实施例中,反馈设备720被配置成显示尿液的当前流速、温度、尿液的当前电导率(以mS/m为单位)、在该过程中产生的总尿量、在该过程中排出的总钠量、其他身体参数或其任何组合。
在一些实施例中,反馈设备720还包括允许用户控制泵710的操作的用户界面模块或组件。例如,用户可以通过用户界面启动或关闭泵710。用户还可以调节泵710施加的压力,从而以更大量或更高速率排出钠和液体。
可选地,反馈设备720和/或泵710还包括数据发送器722,用于将信息从设备720和/或泵710发送到其他电子设备或计算机网络。数据发送器722可以利用短程或远程数据通信协议。短程数据传输协议的一实施例是远程数据传输网络包括例如Wi-Fi或蜂窝网络。数据发送器722可以将信息发送给患者的医生或护理人员,以将患者的当前状况告知医生或护理人员。替代地或另外地,信息例如可以从数据发送器722发送到现有的数据库或信息存储位置,以将记录的信息例如包括在患者的电子健康记录(EHR)中。
继续参见图44,在一些实施例中,除了尿液传感器174之外,系统700还可包括一个或多个患者监测传感器724。患者监测传感器724可以包括侵入性和非侵入性传感器,用于测量关于患者的身体参数信息,例如,如上文详细讨论的尿液成分、血液成分(例如,血细胞比容比、分析物浓度、蛋白质浓度、肌酐浓度)和/或血流量(例如,血压、血流速率)。血细胞比容是红细胞体积与血液总体积之比。正常血细胞比容为约25%至40%,优选为约35%和40%(例如,红细胞的体积百分比为35%至40%,血浆的体积百分比为60%至65%)。
非侵入性患者监测传感器724可以包括脉搏血氧传感器、血压传感器、心率传感器和呼吸传感器(例如,二氧化碳传感器)。侵入性患者监测传感器724可以包括侵入性血压传感器、葡萄糖传感器、血流速率传感器、血红蛋白传感器、血细胞比容传感器、蛋白质传感器、肌酐传感器和其他传感器。在另外的实施例中,传感器可以与体外血液系统或电路相关联,并且被配置成测量在体外系统的管道中流动的血液的参数。例如,分析物传感器(例如电容传感器或光学光谱传感器)可与体外血液系统的管道相关联,以测量患者血液通过管道时的参数值。患者监测传感器724可以与泵710和/或控制器714进行有线或无线通信。
在一些实施例中,控制器714被配置成使泵710基于从尿液分析物传感器174和/或患者监测传感器724(例如血液监测传感器)获得的信息为患者提供治疗。例如,可以基于患者的血液血细胞比容比、血液蛋白浓度、肌酐浓度、排尿量、尿蛋白浓度(例如白蛋白)和其他参数的变化来调整泵710的操作参数。例如,控制器714可以被配置成从患者监测传感器724和/或分析物传感器174接收关于患者的血液血细胞比容比或肌酐浓度的信息。控制器714可以被配置成基于血液和/或尿液测量来调整泵710的操作参数。在其他实施例中,可以从定期由患者体内获得的血样中测量血细胞比容比。测试结果可以被手动或自动地提供给控制器714,以进行处理和分析。
如本文所述,可以将患者的血细胞比容测量值与一般人群的预定阈值或临床上可接受的值进行比较。通常,女性的血细胞比容水平低于男性。在其他实施例中,可以将测得的血细胞比容值与在外科手术前获得的患者基线值进行比较。当测得的血细胞比容值增加到可接受的范围内时,可以关闭泵710,从而停止向输尿管或肾施加负压。以类似的方式,可以基于所测量的参数值来调整负压的强度。例如,随着患者的测量参数开始接近可接受的范围,可以降低施加在输尿管和肾上的负压强度。相反,如果识别出不期望的趋势(例如,血细胞比容值、排尿率和/或肌酐清除率下降),则可以增加负压强度,以产生积极的生理结果。例如,泵710可以被配置成首先提供低水平的负压(例如,在约0.1mmHg与10mmHg之间)。在观察到患者的肌酐水平呈阳性趋势之前,负压可能会逐渐增加。然而,泵710提供的负压通常不会超过约50mmHg。
参见图45A和45B,其中示出了与该系统一起使用的示例性泵710。在一些实施例中,泵710是一种微型泵,其被配置成从导管112、114(例如,如图1所示)中抽吸液体,且其灵敏度或精度为约10mmHg或更小。理想地,泵710能够在长时间内(例如,每天约8小时至约24小时,持续一(1)天至约30天或更长时间)提供0.05ml/min至3ml/min的尿流量。以0.2ml/min的流量计,预计系统700每天收集约300mL尿液。泵710可被配置成向患者的膀胱提供负压,该负压的范围为约0.1mmHg至约150mmHg,或约0.1mmHg至约50mmHg,或约5mmHg至约20mmHg(泵710处的表压)。例如,由Langer公司制造的微型泵(型号BT100-2J)可与本发明的系统700一起使用。隔膜泵以及其他类型的商用泵也可用于此目的。蠕动泵也可与系统700一起使用。在其他实施例中,活塞泵、真空瓶或手动真空源可用于提供负压。在其他实施例中,该系统可以通过真空调节器连接至壁面抽吸源(如医院中可用的壁面抽吸源),以将负压降低至治疗上适当的水平。
在一些实施例中,至少一部分泵组件可位于患者的尿路内,例如膀胱内。例如,泵组件可以包括泵模块和耦合至泵模块的控制模块,且控制模块被配置成引导泵模块的运动。泵模块、控制模块或电源中的至少一个(一个或多个)可位于患者的尿路内。泵模块可以包括至少一个泵元件,该泵元件位于液体流动通道内,以通过该通道抽吸液体。在2017年8月25日提交的题为“一种用于促进尿液从尿路中排出的留置泵(Indwelling Pump forFacilitating Removal of Urine from the Urinary Tract)”的美国专利申请号62/550259文件中公开了合适的泵组件、系统和使用方法的一些实施例,其公开内容的全文通过引用并入本文。
在一些实施例中,泵710被配置成可长期使用,因此泵710能够保持长时间的精确抽吸,例如每天约8小时至约24小时,或1天至约30天或更长时间,且膀胱导管的更换时间除外。此外,在一些实施例中,泵710被配置成手动操作,并且它在这种情况下包括允许用户设置期望吸入值的控制面板718。泵710还可包括控制器或处理器,其可以是用于操作系统700的相同控制器,或者可以是专用于操作泵710的单独处理器。在任一情况下,处理器被配置成既接收用于手动操作泵的指令,又根据预定的操作参数自动操作泵710。替代地或另外地,泵710的操作可以由处理器基于从与导管相关联的多个传感器接收到的反馈来控制。
在一些实施例中,处理器被配置成使泵710间歇地运行。例如,泵710可以被配置成发射负压脉冲,随后是不提供负压的时段。在其它实施例中,泵710可被配置成交替地提供负压和正压,以产生交替的冲洗和泵送效果。例如,可以提供约0.1mmHg至20mmHg(优选约5mmHg至20mmHg)的正压,然后提供约0.1mmHg至50mmHg的负压。
图49示出了使用本文所述的设备和系统从患者体内除去过多液体的步骤。如图49所示,该治疗方法包括在患者的输尿管和/或肾内部署输尿管支架或尿路导管(如输尿管导管),以使尿液从输尿管和/或肾流出,如框910所示。可以放置导管,以避免堵塞输尿管和/或肾。在一些实施例中,支架或导管的液体收集部可位于患者肾脏的肾盂中。在一些实施例中,输尿管支架或输尿管导管可放置在患者的每个肾中。在其他实施例中,尿液收集导管可放置在膀胱或输尿管中,如框911所示。在一些实施例中,输尿管导管包括本文所述的任何保持部中的一个或多个。例如,输尿管导管可以包括限定排液腔的管,所述排液腔包括螺旋状保持部和多个排液口。在其它实施例中,导管可包括漏斗形的液体收集和保持部或尾纤线圈。或者,可以部署具有例如尾纤线圈的输尿管支架。
如框912所示,该方法还包括通过膀胱导管对膀胱、输尿管和/或肾中的至少一个施加负压,以诱导或促进肾中液体或尿液的产生,并从患者体内提取出液体或尿液。理想的是,施加足够时间的负压,以使患者的血肌酐水平降低达临床上显著的水平。
可以持续施加负压达预定的时间段。例如,可以指示用户在外科手术期间或根据患者的生理特征选择的时间段内操作泵。在其他实施例中,可以监测病人的状况,以确定何时提供了足够的治疗。例如,如框914所示,该方法还可包括监测患者,以确定何时停止对患者的膀胱、输尿管和/或肾施加负压。在一些实施例中测量患者的血细胞比容水平。例如,可使用患者监测设备来定期获取血细胞比容值。在其他实施例中,可以定期抽取血样,以直接测量血细胞比容。在一些实施例中,还可以监测通过膀胱导管从体内排出的尿液的浓度和/或体积,以确定肾产生尿液的速率。以类似的方式,可以监测排尿量,以确定患者的蛋白浓度和/或肌酐清除率。尿液中肌酐和蛋白质浓度的降低可能表明稀释过度和/或肾功能低下。可以将测量值与预定阈值进行比较,以评估负压疗法是否在改善患者的状况,并且应该对其进行修改或将其中止。例如,如本文所述,患者血细胞比容的期望范围可以在25%至40%之间。在其他实施例中,如本文所述,可以测量患者体重并将其与干体重进行比较。患者体重测量值的变化表明正在从体内排出液体。因此,恢复到干体重表示血液稀释已得到适当的控制,患者没有被过度稀释。
如框916所示,当确定为阳性结果时,用户可以使泵停止提供负压治疗。以类似的方式,可以监测患者的血液参数,以评估施加到患者肾脏的负压的有效性。例如,可以将电容传感器或分析物传感器布置成与体外血液管理系统的管道呈液体连通。该传感器可用于测量代表血液蛋白、氧气、肌酐和/或血细胞比容水平的信息。可以连续或周期性地测量所需的血液参数值,并将其与各种阈值或临床上可接受的值进行比较。负压可能会继续施加到患者的膀胱、肾脏或输尿管上,直到测量的参数值在临床上可接受的范围内。如框916所示,一旦测量值不在阈值或临床上可接受的范围内,即可停止施加负压。
在一些实施例中,提供了一种用于从患者体内去除过多液体的方法,以用于与慢性水肿、高血压、慢性肾病和/或急性心力衰竭相关的系统性液体体积管理。根据本发明的另一方面,提供了一种通过从患者体内去除过多液体来为正在接受液体复苏程序治疗(例如冠状动脉搭桥术)的患者去除过多液体的方法。在液体复苏过程中,通过适当的液体输送过程(如静脉滴注)将诸如生理盐水和/或淀粉溶液之类的溶液被引入患者的血液中。例如,在一些外科手术过程中,可以为患者提供量为每日正常摄入量的5至10倍的液体。可以提供液体置换或液体复苏,以补充因出汗、出血、脱水和类似过程而流失的液体。可在进行冠状动脉搭桥术等外科手术的情况下提供液体复苏,以帮助将患者的液体平衡和血压维持在适当的水平。急性肾损伤(AKI)是冠状动脉搭桥术的已知并发症。AKI与住院时间延长以及发病率和死亡率增加相关,即使对于没有发展为肾衰竭的患者也是如此。参见Kim等人,Relationship between a perioperative intravenous fluid administrationstrategy and acute kidney injury following off-pump coronary artery bypasssurgery:an observational study,Critical Care 19:350(1995)。将液体引入血液还会降低血细胞比容水平,这已被证明会进一步增加死亡率和发病率。研究还表明,向患者体内注入生理盐水可能会降低肾功能和/或抑制自然液体管理过程。因此,适当监测和控制肾功能可改善预后,特别是可减少AKI的术后病例。
图50示出了一种用于治疗患者以除去其体内过多液体的方法。如框1010所示,该方法包括在患者的输尿管和/或肾脏中部署输尿管支架或输尿管导管,以使输尿管和/或肾脏的堵塞不会阻止尿液从输尿管和/或肾脏流出。例如,输尿管支架的远端或导管的液体收集部可以定位在肾盂中。在其他实施例中,导管可以在肾脏或输尿管中展开。导管可包括本文所述的一个或多个输尿管导管。例如,输尿管导管可以包括限定排液腔的管,所述排液腔包括螺旋状保持部和多个排液口。在其他实施例中,导管可包括尾纤线圈。
如框1012所示,膀胱导管可以部署在患者的膀胱中。例如,膀胱导管可以被定位成至少部分地密封尿道口,以防止尿液从体内通过尿道。例如,膀胱导管可以包括用于将导管的远端保持在膀胱中的锚。如本文所述,线圈和螺旋、漏斗等的其他布置可用于使膀胱导管适当定位。膀胱导管可以配置成收集在放置输尿管导管之前进入患者膀胱的液体,以及在治疗期间从输尿管、输尿管支架和/或输尿管导管收集的液体。膀胱导管还可收集流经输尿管导管的液体收集部并进入膀胱的尿液。在一些实施例中,输尿管导管的近端部可以定位在膀胱导管的排液腔中。以类似的方式,可以使用用于定位输尿管导管的相同导丝将膀胱导管推进到膀胱中。在一些实施例中,可以通过膀胱导管的排液腔向膀胱提供负压。在其他实施例中,负压可以仅施加到膀胱导管上。在这种情况下,输尿管导管通过重力进入膀胱。
如框1014所示,在输尿管支架和/或输尿管导管和膀胱导管被部署好之后,通过膀胱导管对膀胱、输尿管和/或肾脏施加负压。例如,可以施加足够长时间的负压,以抽取出尿液,该尿液包括在液体复苏过程中提供给患者的一部分液体。如本文所述,可以通过连接到膀胱导管的近端或端口的外部泵来提供负压。根据患者的治疗要求,泵可以连续或定期运行。在某些情况下,泵可能会交替提供负压和正压。
可以持续施加负压达预定的时间段。例如,可以指示用户在外科手术期间或根据患者的生理特征选择的时间段内操作泵。在其他实施例中,可以监测患者的状况,以确定何时已经从患者体内抽取出了足够量的液体。例如,如框1016所示,可以收集从体内排出的液体,并且可以监测所获得的液体的总体积。在这种情况下,泵可以继续运行,直到从输尿管和/或膀胱导管收集了预定的液体体积。预定的液体体积可以例如基于外科手术之前和期间提供给患者的液体体积。如框1018所示,当收集的总液体体积超过预定的液体体积时,停止向膀胱、输尿管和/或肾脏施加负压。
在其他实施例中,可以基于测量的患者的生理参数(例如测量的肌酐清除率、血肌酐水平或血细胞比容比)确定泵的运行。例如,如框1020所示,可以通过与导管和/或泵相关联的一个或多个传感器来分析从患者体内收集的尿液。传感器可以是电容传感器、分析物传感器、光学传感器或配置成测量尿液分析物浓度的类似设备。以类似的方式,如框1022所示,可以基于从上文讨论的患者监测传感器获得的信息来分析患者的血肌酐或血细胞比容水平。例如,可以将电容传感器放置在现有的体外血液系统中。可以分析由电容传感器获得的信息,以确定患者的血细胞比容比。可以将测得的血细胞比容比与某些预期或治疗上可接受的值进行比较。泵可继续向患者的输尿管和/或肾脏施加负压,直到获得的测量值在治疗上可接受的范围内。一旦获得治疗上可接受的值,即可停止施加负压,如框1018所示。
在其他实施例中,如框2024所示,可以测量患者体重,以评估通过所使用的负压疗法是否从患者体内去除了液体。例如,可以将患者的测得体重(包括在液体复苏过程中引入的液体)与患者的干体重进行比较。如本文所用,干体重定义为当患者未被过度稀释时测得的正常体重。例如,不具有以下一种或多种症状且呼吸舒适的患者可能没有过多的液体:血压升高,头晕或抽筋,腿、脚、手臂、手或眼睛周围肿胀。当患者没有这些症状时测量的体重可以是干体重。可以定期测量患者的体重,直到测得的体重接近干体重为止。当测得的重量接近(例如,体重与干体重的差值为干体重的5%至10%)时,如框1018所示,可以停止施加负压。
上述使用本发明系统的治疗细节可用于治疗可受益于尿液或液体的输出或排出增加的多种病症。例如,本发明提供了一种用于保持肾功能的方法,该方法通过施加负压来降低髓质区小管内的间质压,以促进尿液的排出,并预防静脉充血引起的肾髓质中肾单位的缺氧。所述方法包括:将输尿管支架或输尿管导管部署在患者的输尿管或肾中,以维持该患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在所述患者的所述膀胱中,其中该膀胱导管包括定位在所述患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向所述导管的所述近端施加负压,以在预定时间内在所述患者的一部分所述尿路中产生负压,从而从所述患者的所述尿路中排出液体。
在另一实施例中提供了一种用于治疗由于静脉充血引起的急性肾损伤的方法。所述方法包括:将输尿管支架或输尿管导管部署在患者的输尿管或肾中,以维持该患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在所述患者的所述膀胱中,其中该膀胱导管包括定位在所述患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向所述导管的所述近端施加负压,以在预定时间内在所述患者的一部分所述尿路中产生负压,从而从所述患者的所述尿路中排出液体,由此减少肾静脉充血,以治疗急性肾损伤。
在另一实施例中提供了一种通过减少肾脏的静脉充血来治疗纽约心脏协会(NYHA)的III级和/或IV级心力衰竭的方法。所述方法包括:将输尿管支架或输尿管导管部署在患者的输尿管或肾中,以维持该患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在所述患者的所述膀胱中,其中该膀胱导管包括定位在所述患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向所述导管的所述近端施加负压,以在预定时间内在所述患者的一部分所述尿路中产生负压,从而从所述患者的所述尿路中排出液体,以治疗NYHA III级和/或IV级心力衰竭中的液量超负荷。
在另一实施例中提供了一种通过减少肾脏中的静脉充血来治疗4期和/或5期慢性肾病的方法。所述方法包括:将输尿管支架或输尿管导管部署在患者的输尿管或肾中,以维持该患者的肾与膀胱之间液体流动的通畅性;将膀胱导管部署在所述患者的所述膀胱中,其中该膀胱导管包括定位在所述患者膀胱中的远端、具有近端的排液腔部以及在其间延伸的侧壁;以及向所述导管的所述近端施加负压,以在所述患者的一部分所述尿道中引起负压,从而从所述患者的所述尿路中排出液体,由此减少肾脏的静脉充血。
在一些实施例中提供了一种用于从患者的尿路内排出液体的套件。该套件包括:输尿管支架或输尿管导管,其包括排液通道,用于促进液体从所述输尿管和/或肾经由所述输尿管支架或输尿管导管的所述排液通道流向所述患者的所述膀胱;以及包括控制器的泵,其被配置成在患者的输尿管、肾或膀胱中的至少一个中产生负压,以通过部署在所述患者膀胱中的导管的排液腔抽吸尿液。在一些实施例中,该套件还包括至少一个膀胱导管。在某些实施例中,该套件还包含以下一项或多项说明:插入/展开输尿管支架和/或输尿管导管,插入/展开膀胱导管,并操作泵以通过部署在患者膀胱中的膀胱导管的排液腔抽吸尿液。
在一些实施例中,另一套件包括:多个一次性膀胱导管,每个膀胱导管包括具有近端的排液腔部、定位在患者膀胱中的远端以及在其间延伸的侧壁;以及保持部,其从排液腔部的一部分远端径向向外延伸,并被配置成延伸至一部署位置,在该部署位置保持部的直径大于排液腔部的直径;所述膀胱导管的插入/展开说明;以及用于将膀胱导管的近端连接至泵并用于操作该泵以通过膀胱导管的排液腔抽吸尿液(例如,对膀胱导管的近端施加负压)的指令。
使用输尿管导管产生负压的实验实施例:
为了评估负压疗法对肾脏中肾充血的作用,使农场猪的肾盂内产生负压。这些研究的目的是证明在肾充血的猪模型中向肾盂输送负压是否会显著增加排尿量。在实施例1中,通常在栓子切除术或支气管镜检查应用中使用的儿科Fogarty导管在猪模型中仅用于证明引起肾盂负压的原理。不建议在临床环境中在人体内使用Fogarty导管,以避免对尿路组织的损伤。在实施例2中使用了输尿管导管112,其在图2A和2B中示出,并包括用于将导管的远端部安装或保持在肾盂或肾中的螺旋保持部。
实施例1
方法
以四头农场猪800为研究对象,评估负压疗法对肾脏中肾充血的影响。如图21所示,将儿科Fogarty导管812、814插入四头猪800的每个肾802、804的肾盂区820、821。通过将可充气气囊充气至足以密封肾盂并将气囊保持在肾盂内位置的尺寸,将导管812、814在肾盂区内展开。导管812、814从肾盂802、804延伸穿过膀胱810和尿道816,并延伸至猪体外的液体收集容器。
在15分钟的时间内采集两只动物的排尿量数据,以建立排尿量和排尿率的基线。分别测量右肾802和左肾804的排尿量,发现两者差异很大。同时还测定了肌酐清除率值。
通过在肾静脉流出口正上方使用充气气囊导管850部分地堵塞下腔静脉(IVC),在动物800的右肾802和左肾804中引起肾充血(例如,肾静脉中的充血或血流量减少)。采用压力传感器测量IVC压力。正常的1VC压力为1-4mmHg。通过将导管850的气囊膨胀到IVC直径的大约四分之三,将1VC压力升高至15-25mmHg。将气囊充气至IVC直径的大约四分之三会导致排尿量减少50%至85%。完全闭塞引起的IVC压力超过28mmHg,并与排尿量减少至少95%有关。
每只动物800的一个肾未经治疗,并且用作对照(“对照肾802”)。从对照肾延伸的输尿管导管812连接到液体收集容器819,用于确定液体水平。每只动物的一个肾(“治疗肾804”)通过连接到输尿管导管814的负压源(例如,治疗泵818与设计用于更精确地控制低负压值的调节器组合)接受负压治疗。泵818是来自Cole-Parmer Instrument公司的AirCadet真空泵(型号:EW-07530-85)。泵818与调节器串联。该调节器是由AirtrolComponents公司生产的V-800系列微型精密真空调节器-1/8NPT端口(型号V-800-10-W/K)。
根据以下方案,泵818被致动,以在治疗肾的肾盂820、821内引起负压。首先,研究了正常状态下负压的影响(例如,未使IVC囊充气)。分别施加四种不同的压力水平(-2、-10、-15和-20mmHg)持续达15分钟,测定尿液产生率和肌酐清除率。在调节器上控制和确定压力水平。在-20mmHg治疗后,将IVC囊充气以增加15-20mmHg的压力。施加相同的四个负压水平。获得了充血对照肾802和治疗肾804的排尿率和肌酐清除率。通过部分堵塞IVC 90分钟使动物800充血。在90分钟的充血期内,治疗时间为60分钟。
采集排尿量和肌酐清除率数据后,对一只动物的肾脏进行大体检查,然后将其固定在10%中性福尔马林缓冲液中。大体检查后,获取组织切片,进行检查,并拍摄切片的放大图像。使用直立的Olympus BX41光学显微镜检查切片,并使用Olympus DP25数码相机拍摄图像。具体地,在低放大倍率(初始放大倍率的20倍)和高放大倍率(初始放大倍率的100倍)下获得采样组织的显微图像。对获得的图像进行组织学评价。评估的目的是从组织学角度检查组织,并定性表征获得的样本的充血和肾小管变性。
还对获得的肾组织玻片进行了表面映射分析。具体地,将样本染色并进行分析,以评估治疗肾和未治疗肾的小管大小的差异。图像处理技术计算了染色图像中具有不同颜色的像素的数量和/或相对百分比。计算的测量数据用于确定不同解剖结构的体积。
结果
排尿量和肌酐清除率
排尿率变化很大。在研究过程中观察到了三种排尿率的变化来源。个体间和血流动力学的可变性是本领域已知的可变性的预期来源。在本文讨论的实验中,根据被认为是以前未知的信息和信念,确定了排尿量变化的第三种来源,即对侧个体内排尿量的变化。
一个肾的基线排尿率为0.79ml/min,另一个肾的基线排尿率为1.07ml/min(例如,相差26%)。排尿率是从每只动物的排尿率计算出的平均值。
当通过使IVC囊充气而引起充血时,治疗肾的排尿量从0.79ml/min降至0.12ml/min(基线的15.2%)。相比之下,充血期间对照肾的排尿率从1.07ml/min降至0.09ml/min(基线的84%)。基于排尿率,根据以下方程计算出治疗肾相比于对照肾的排尿量的相对增加:
(治疗治疗肾/基线治疗肾)/(治疗对照肾/基线对照肾)=相对增加(0.12ml/min/0.79ml/min)/(0.09ml/min/1.07ml/min)
=180.6%
因此,与对照肾相比,治疗肾的排尿率相对增加了180.6%。这一结果表明,与治疗侧相比,对照一方由充血导致的产尿量下降的幅度更大。将结果显示为排尿量的相对百分比差异,以适应肾脏之间排尿量的差异。
图22示出了其中一只动物的基线、充血和治疗部位的肌酐清除率测量结果。
大体检查和组织学评价
根据对对照肾(右肾)和治疗肾(左肾)的大体检查,确定对照肾呈均匀的深红棕色,这意味着与治疗肾相比对照肾充血更多。对放大后的切片图像所作的定性评估也表明,对照肾的充血程度较治疗肾增加。具体地,如表1所示,与对照肾相比,治疗肾表现出较低程度的充血和肾小管变性。使用以下定性量表来评估所获得的载玻片。
充血
肾小管变性
表1
列表结果
如表1所示,治疗肾(左肾)仅表现为轻度的充血和肾小管变性。相反,对照肾(右肾)表现出中度的充血和肾小管变性。这些结果是通过分析下面讨论的载玻片获得的。
图48A和48B是动物的左肾(经负压治疗)的低放大倍率和高放大倍率显微照片。根据组织学检查,如箭头所示,确定了皮质髓质交界处的血管轻度充血。如图48B所示,已识别出具有透明管型的单个小管(由星号标识)。
图48C和48D是对照肾(右肾)的低分辨率和高分辨率显微照片。根据组织学检查,如图48C中的箭头所示,确定了皮质髓质交界处的血管中度充血。如图48D所示,组织样本中存在几个具有透明管型的小管(如图中星号所示)。大量透明管型的存在是缺氧的证据。
表面映射分析提供了以下结果。经测定,治疗肾在Bowman腔中的液体量大1.5倍,在肾小管腔中的液体量大2倍。Bowman腔和肾小管腔中液体量的增加与排尿量的增加相对应。另外,测定出治疗肾的毛细血管血容量比对照肾少5倍。治疗肾中的体积增加似乎是由于以下原因造成的:(1)与对照组相比,单个毛细血管的尺寸减小;(2)与对照肾相比,治疗肾中无可见红细胞的毛细血管数量增加,这是治疗器官中充血减少的一个指标。
总结
这些结果表明,与治疗肾相比,对照肾有更多的充血和更多的腔内透明管型,这些透明管型代表了富含蛋白质的腔内物质。因此,治疗肾表现出较低程度的肾功能丧失。尽管不希望受到理论的约束,但认为随着肾脏出现严重的充血,器官的低氧血症随之而来。低氧血症干扰器官内的氧化磷酸化作用(例如,ATP产生)。ATP的损失和/或ATP产量的下降会抑制蛋白质的主动转运,从而导致腔内蛋白质的含量增加,其表现为透明管型。腔内透明管型肾小管的数量与肾功能丧失的程度相关。因此,被治疗的左肾中小管数量的减少被认为具有生理学意义。尽管不希望受到理论的约束,但认为这些结果表明,通过对插入肾盂的输尿管导管施加负压以促进尿液排出,可以预防或抑制对肾脏的损害。
实施例2
方法
将四(4)头农场猪(A、B、C、D)镇静并麻醉。在整个实验过程中对每头猪的生命体征进行监测,并在研究的每个30分钟阶段结束时测量心输出量。输尿管导管(例如,如图2A和2B所示的输尿管导管112)分别在每头猪的肾脏的肾盂区中展开。展开的导管是外径为2.0±0.1mm的6Fr导管。该导管的长度为54±2cm,且不包括远端保持部。保持部的长度为16±2mm。如图2A和2B中的导管112所示,保持部包括两个全线圈和一个近端半线圈。全线圈的外径为18±2mm,如图2A和2B中的线D1所示。半线圈的直径D2约为14mm。输尿管导管的保持部包括六个排液口,外加在导管远端的一个开口。每个排液口的直径为0.83±0.01mm。相邻排液口132之间的距离,特别是当线圈被拉直时排液口132之间的线性距离为22.5±2.5mm。
输尿管导管的位置是从猪的肾盂延伸,穿过膀胱和尿道,并延伸到每头猪的外部液体收集容器。放置好输尿管导管后,将用于测量IVC压力的压力传感器放置在IVC中远离肾静脉的位置。使一种由纽约州Hopkinton市的NuMED公司制造的充气式气囊导管(特别是
经皮气囊导管(直径30mm,长5cm))在IVC中靠近肾静脉处扩张。然后,将热稀释导管(特别是由加利福尼亚州Irvine市的Edwards Lifesciences公司制造的Swan-Ganz热稀释肺动脉导管)放置在肺动脉中,以测量心输出量。
最初,在30分钟内测量基线排尿量,并采集血液和尿液样本进行生化分析。在30分钟的基线期之后,对气囊导管进行充气,以将IVC压力从1-4mmHg的基线压力增加到大约20mmHg(±5mmHg)的升高的充血压力。然后采集30分钟的充血基线数据,并进行相应的血液和尿液分析。
在充血期结束时,维持较高的IVC充血压力,并为猪A和猪C进行负压利尿治疗。具体地,使用泵通过输尿管导管对猪A和猪C施加-25mmHg的负压来进行治疗。与前面讨论的实施例一样,该泵是来自Cole-Parmer Instrument公司的Air Cadet真空泵(型号:EW-07530-85)。泵与调节器串联。该调节器是由Airtrol Components公司生产的V-800系列微型精密真空调节器-1/8NPT端口(型号V-800-10-W/K)。在提供治疗的同时,观察猪120分钟。在治疗期间,每30分钟收集一次血液和尿液。两头猪(B、D)作为充血对照(例如,未通过输尿管导管对肾盂施加负压),这意味着这两头猪(B、D)未接受负压利尿治疗。
在120分钟治疗期间采集排尿量和肌酐清除率数据,之后处死动物,并对每只动物的肾脏进行大体检查。大体检查后,获取组织切片,进行检查,并拍摄切片的放大图像。
结果
在基线、充血和治疗期间采集的测量数据见表2。具体地,在每个时间段均获得排尿量、血清肌酐和尿肌酐的测量值。这些值可用于计算肌酐清除率,如下所示:
另外,从在每个时间段获得的血清样本中测量与中性粒细胞明胶酶相关的脂蛋白(NGAL)值,从在每个时间段获得的尿液样本中测量肾脏损伤分子1(KIM-1)值。表2还列出了通过回顾获得的组织学切片而确定的定性组织学发现。
表2
数据是原始值(基线百分比)
*未测量
**与苯肾上腺素混淆
动物A:该动物重50.6kg,基线排尿率为3.01ml/min,基线血肌酐为0.8mg/dl,测得的CrCl为261ml/min。值得注意的是,与其他所研究的动物相比,这些测量值除血清肌酐外都异常高。充血与排尿率(0.06ml/min)下降98%和CrCl(1.0ml/min)下降超过99%有关。通过输尿管导管施加负压进行的治疗与尿量和CrCl分别为基线值的17%和12%相关,也与分别为充血值的9倍和大于10倍相关。NGAL水平在整个实验过程中都发生了变化,其范围从充血时基线值的68%到治疗90分钟后基线值的258%。最终值为基线值的130%。在最后三个采集期,在基线评估后的前两个30分钟窗口中,在分别增加到基线值的68倍、52倍和63倍之前,KIM-1水平分别为基线值的6倍和4倍。2小时血清肌酐为1.3mg/dl。组织学检查显示,通过毛细管腔内的血容量测量得到的总充血水平为2.4%。组织学检查还发现一些小管有腔内透明管型和某种程度的小管上皮变性,这一发现与细胞损伤相一致。
动物B:该动物重50.2kg,基线排尿率为2.62ml/min,测得的CrCl为172ml/min(也高于预期)。充血与排尿率(0.5ml/min)下降80%和CrCl(30ml/min)下降83%有关。在充血50分钟时(充血基线期后20分钟),动物的平均动脉压和呼吸频率突然下降,然后出现心动过速。麻醉师施用了一剂苯肾上腺素(75mg),以避免心源性休克。当麻醉过程中血压降至安全水平以下时,可以使用苯肾上腺素进行静脉注射。但是,由于该实验正在测试充血对肾脏生理的影响,因此施用苯肾上腺素会混淆实验的其余部分。
动物C:该动物重39.8kg,基线排尿率为0.47ml/min,基线血肌酐为3.2mg/dl,测得的CrCl为5.4ml/min。充血与排尿率(0.12ml/min)下降75%和CrCl(1.6ml/min)下降79%有关。结果表明,基线NGAL水平大于正常上限(ULN)的5倍。通过输尿管导管对肾盂施加负压治疗与排尿量正常化(基线的101%)和CrCl(18.2ml/min)改善341%相关。NGAL水平在整个实验过程中都发生了变化,其范围从充血时基线值的84%到治疗30至90分钟时基线值的47%至84%。最终值为基线值的115%。KIM-1水平在充血的前30分钟内从基线值下降了40%,然后在其余的30分钟窗口内分别增加到基线值的8.7倍、6.7倍、6.6倍和8倍。2小时时的血清肌酐水平为3.1mg/dl。组织学检查显示,通过毛细管腔内的血容量测量得到的总充血水平为0.9%。小管在组织学上正常。
动物D:该动物重38.2kg,基线排尿量为0.98ml/min,基线血肌酐为1.0mg/dl,测得的CrCl为46.8ml/min。充血与排尿率(0.24ml/min)下降75%和CrCl(16.2ml/min)下降65%有关。持续的充血与尿量减少66%至91%和CrCl减少89%至71%有关。NGAL的水平在整个实验过程中都发生了变化,其范围从充血期间基线值的127%到最终值为基线值的209%。在最后三个30分钟期间,在基线评估后的前两个30分钟窗口中,在增加到基线值的190倍、219倍和201倍之前,KIM-1水平保持在基线值的1倍至2倍之间。2小时血清肌酐水平为1.7mg/dl。组织学检查显示,总的充血水平比在治疗动物(A、C)的组织样本中观察到的高2.44倍,而平均毛细血管大小比在两只治疗动物中的任一只中所观察到的大2.33倍。组织学评估还发现一些小管有腔内透明管型和小管上皮变性,表明存在实质性细胞损伤。
总结
尽管不希望受到理论的约束,但认为采集到的数据支持以下假设:静脉充血对肾功能产生生理上的显著影响。特别地,观察到肾静脉压升高在几秒钟内使排尿量减少了75%至98%。就伤害的程度和持续时间而言,小管损伤的生物标志物升高与组织学损伤之间的相关性与所产生的静脉充血程度一致。
这些数据似乎也支持以下假设:静脉充血通过改变间质压来降低髓质肾单位的过滤梯度。这种变化似乎直接导致了髓质肾单位内的缺氧和细胞损伤。虽然这个模型没有模拟AKI的临床情况,但它确实提供了对机械性持续损伤的认识。
这些数据似乎也支持以下假设:在静脉充血模型中,通过输尿管导管对肾盂施加负压可以增加排尿量。特别地,负压治疗与排尿量和肌酐清除率的增加有关,这将在临床上具有重要意义。还观察到了在生理学上有意义的髓质毛细血管体积的减小和小管损伤的生物标志物的小幅度升高。因此,似乎通过增加排尿率和降低髓质肾单位内的间质压,负压疗法可以直接减轻充血。尽管不希望受到理论的约束,但可以得出结论,通过减少充血,负压疗法可减少在静脉充血介导的AKI中的缺氧及其在肾脏内的下游效应。
实验结果似乎支持以下假设:无论是压力大小还是持续时间,充血程度都与观察到的细胞损伤程度有关。具体地,观察到尿量减少程度与组织学损伤之间有关联。例如,排尿量减少了98%的治疗猪A所遭受的损伤要大于排尿液减少了75%的治疗猪C。不出所料,对照猪D在两个半小时内在没有治疗的情况下排尿量减少了75%,表现出最大的组织学损伤。这些发现与人类数据大体上一致,表明随着静脉充血的增加,AKI发病的风险增大。参见例如Legrand,M.等人,Association between systemic hemodynamics and septic acutekidney injury in critically ill patients:a retrospective observationalstudy.Critical Care 17:R278-86,2013。
实施例3
方法
为了评估负压疗法对血液稀释的作用,采用输尿管导管使农场猪的肾盂内产生负压。这些研究的目的是探明在液体复苏的猪模型中,向肾盂输送负压是否会显著增加排尿量。
用氯胺酮、咪达唑仑、异氟烷和异丙酚对两头猪进行镇静和麻醉。用本文所述的输尿管导管和负压疗法治疗一只动物(#6543)。另一只接受Foley型膀胱导管,作为对照(#6566)。放置好输尿管导管后,将动物转移到吊索上并进行24小时监测。
在24小时的随访期间,在两只动物中不断注入生理盐水(125mL/h)以引起液体过多。以15分钟的增量连续24小时测量排尿量。以4小时的增量采集血液和尿液样本。如图21所示,设置治疗泵818,以使用-45mmHg(+/-2mmHg)的压力在两个肾的肾盂820、821(图21所示)内产生负压。
结果
两只动物在24小时内均接受了7L的生理盐水。治疗动物产生了4.22L的尿液,而对照动物产生了2.11L的尿液。在24小时结束时,对照动物保留了7L给药中的4.94L,而治疗动物保留了7L给药中的2.81L。图26示出了血清白蛋白的变化。在24小时内,治疗动物的血清白蛋白浓度下降了6%,而对照动物的血清白蛋白浓度下降了29%。
总结
尽管不希望受到理论的约束,但认为采集到的数据支持以下假设:液体过多对肾功能产生临床上显著的影响,并因此引起血液稀释。特别地,观察到即使健康的肾脏也不能有效地去除大量的静脉注射生理盐水。由此产生的液体积聚导致血液稀释。这些数据似乎也支持以下假设:使用输尿管导管进行负压利尿治疗对液体过多的动物可以增加排尿量,改善净液体平衡,并减少液体复苏对血液稀释发展的影响。
已经参考各种实施例描述了本发明的前述实施例和实施方式。其他人在阅读和理解了前述实施例之后会想到进行修改和变更。因此,前述实施例不应被解释为限制本发明。