CN109923104B - 稳定的聚(咪唑鎓)氢氧化物 - Google Patents
稳定的聚(咪唑鎓)氢氧化物 Download PDFInfo
- Publication number
- CN109923104B CN109923104B CN201780056571.9A CN201780056571A CN109923104B CN 109923104 B CN109923104 B CN 109923104B CN 201780056571 A CN201780056571 A CN 201780056571A CN 109923104 B CN109923104 B CN 109923104B
- Authority
- CN
- China
- Prior art keywords
- group
- polymer
- alkyl
- heteroalkyl
- perfluoroalkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/64—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms, e.g. histidine
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G12/00—Condensation polymers of aldehydes or ketones with only compounds containing hydrogen attached to nitrogen
- C08G12/02—Condensation polymers of aldehydes or ketones with only compounds containing hydrogen attached to nitrogen of aldehydes
- C08G12/04—Condensation polymers of aldehydes or ketones with only compounds containing hydrogen attached to nitrogen of aldehydes with acyclic or carbocyclic compounds
- C08G12/06—Amines
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/06—Polycondensates having nitrogen-containing heterocyclic rings in the main chain of the macromolecule
- C08G73/0605—Polycondensates containing five-membered rings, not condensed with other rings, with nitrogen atoms as the only ring hetero atoms
- C08G73/0616—Polycondensates containing five-membered rings, not condensed with other rings, with nitrogen atoms as the only ring hetero atoms with only two nitrogen atoms in the ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Oncology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Communicable Diseases (AREA)
- Polymers & Plastics (AREA)
- Macromolecular Compounds Obtained By Forming Nitrogen-Containing Linkages In General (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Detergent Compositions (AREA)
- Preventing Corrosion Or Incrustation Of Metals (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Fuel Cell (AREA)
- Inert Electrodes (AREA)
Abstract
本发明提供咪唑鎓聚合物,其在聚合物链中的咪唑部分的4‑位具有空间位阻。空间保护的N‑甲基化咪唑鎓聚合物在高温下例如在100℃和更高的温度下在浓苛性碱溶液中表现出氢氧化物稳定性。
Description
相关申请的交叉引用
本申请要求2016年7月29日提交的第62/368,667号美国临时申请的权益,其公开内容通过引用整体并入本文。
背景
用于能量转换装置,如碱性氢燃料电池、碱性水电解槽和氧化还原液流电池的高稳定性阳离子膜和离聚物的制造对于它们的长期功能是至关重要的。尽管已经开发了许多用于在这样的装置中进行测试的材料,但是已经证明当经受长时间暴露于碱性溶液时,没有阳离子膜具有良好的抗降解性。
阳离子聚电解质具有的阳离子基团或者作为侧链官能团或者是主链不可缺少的。电中性可以通过溶剂化时存在的通常可移动的阴离子实现。近年来,对具有氢氧化物抗衡离子的阳离子聚合物的研究已经得到重视。然而,有机基聚合物阳离子易受到氢氧根离子的亲核攻击,这可以破坏阴离子交换能力和氢氧根离子电导性。为了增加阳离子聚合物在高碱性介质中的稳定性已经研究了许多阳离子头基。例如,具有二茂钴阳离子的聚合物已描述于Gu,S.等的Sci.Rep.2015,5,11668(通过引用整体并入本文)中,并且表现出优异的稳定性。Marino,M.G.;Kreuer,K.D.的ChemSusChem 2015,8,513(通过引用整体并入本文)已经描述了有机铵阳离子的稳定性,其中脂族铵一般比芳香族铵阳离子更稳定。在Pham,T.H.等,J.Am.Chem.Soc.2017,139,2888(通过引用整体并入本文)中描述了在80℃下在1MKOD/D2O中稳定1800小时的N-螺环季铵紫罗烯。在Noonan,K.J.T.等,J.Am.Chem.Soc.2012,134,18161(通过引用整体并入本文)中描述了一种鏻阳离子—四(二烷基氨基)鏻,其在80℃下在1M KOH中稳定长达22天。Zha,Y.等,J.Am.Chem.Soc.2012,134,4493中描述了基于金属阳离子的阴离子交换聚合物膜,其显示出良好的碱稳定性和对甲醇的耐受性。然而,尽管有这些进步,但在高温下在高浓度苛性碱溶液中(例如10M KOH,100℃)稳定的阳离子聚合物已被证明是难以找到的。
已显示苯并咪唑鎓和咪唑鎓小分子模型化合物的稳定性与阳离子部分附近的空间位阻的程度相关。例如,如果均三甲苯在1,3-二甲基苯并咪唑鎓的2-位取代(MeB,方案1),则该小分子在80℃下在3M氢氧化物中具有436小时的半衰期,相比1,3-二甲基-2-苯基苯并咪唑鎓(HB,方案1),其在相同的溶液中具有<10分钟的半衰期。
方案1.HB和MeB的化学结构,其中X-代表抗衡阴离子。
已经显示在苯并咪唑鎓环的C2位附近具有空间位阻的二烷基化聚(苯并咪唑鎓)相对于其更加“空间开放”的类似物表现出大幅改善的稳定性。参见,例如,Thomas,O.D.等,J.Am.Chem.Soc.2012,134,10753;Wang,J.等,S.ACS Macro Lett.2014,3,444;Wright,A.G等,Angew.Chem.Int.Ed.2016,55,4818;Wright,A.G.等,S.Energy Environ.Sci.2016,9,2130;Thomas,O.D.等,S.Polym.Chem.2011,2,1641;和Henkensmeier,D.等,Macromol.Mater.Eng.2011,296,899;它们中的每一篇都通过引用整体并入本文。Wright,A.G.等,Energy Environ.Sci.2016,9,2130(其通过引用整体并入本文)描述了由大体积的均三甲苯基保护的苯并咪唑鎓基聚合物在80℃下在1M氢氧化物溶液中长时间稳定,但在高浓度苛性碱、热条件下降解快得多;例如,在80℃下浸入5M NaOH中1周后观察到60%的降解。
因此,需要具有良好的耐氢氧化物降解性的阳离子膜。本发明的公开内容旨在满足这些需求并提供另外的优点。
概述
提供本概述以简化的形式介绍一系列构思,这些构思将在下面的详述中进一步描述。该概述不旨在确认所要求保护的主题的关键特征,也不旨在用于帮助确定所要求保护的主题范围。
一方面,本发明的公开内容的特征在于包含式(I)的重复单元的聚合物:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15选自亚烷基、全氟亚烷基、亚杂烷基、亚芳基、亚芳烷基和亚杂芳基,各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16选自化学键、亚芳基和亚杂芳基,其中所述亚芳基和亚杂芳基各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8、R9、R12和R13各自独立地选自氢、烷基、全氟烷基和杂烷基。
另一方面,本发明的公开内容的特征在于包含式(II)的重复单元的聚合物:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8和R12各自独立地选自氢、烷基、全氟烷基和杂烷基。
又一方面,本发明的公开内容的特征在于包含式(III-A)的重复单元的聚合物:
在一些实施方案中,包含式(III-A)的重复单元的聚合物还包含式(III-B)的重复单元:
在一些实施方案中,包含式(III-A)和/或(III-B)的重复单元的聚合物还包含式(III-C)的重复单元:
其中R1d和R4d中的一个不存在,而剩余的R1d或R4d是甲基;不存在的R1d或R4d所连接的咪唑基是中性的。
又一方面,本发明的公开内容的特征在于包含式(IV-A)、(IV-B)和(IV-C)的重复单元的无规聚合物:
其中,
R1a和R2a中的一个不存在,而剩余的R1a或R2a选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R4a和R5a中的一个不存在,而剩余的R4a或R5a选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R1b、R2b、R4b和R5b中的一个不存在,并且不存在的R1b、R2b、R4b或R5b所连接的咪唑基是中性的,而R1b、R2b、R4b和R5b中的其余三个各自独立地选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R1c、R2c、R4c和R5c各自独立地选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R3a、R6a、R3b、R6b、R3c和R6c各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R7a、R10a、R11a、R14a、R7b、R10b、R11b、R14b、R7c、R10c、R11c和R14c各自独立地选自烷基、全氟烷基和杂烷基;和
R8a、R12a、R8b、R12b、R8c和R12c各自独立地选自氢、烷基、全氟烷基和杂烷基;
其中所述聚合物包括m摩尔%的式(IV-A)的重复单元、n摩尔%的式(IV-B)的重复单元和p摩尔%的式(IV-C)的重复单元,和
m为0摩尔%至60摩尔%,
n+p为40摩尔%至100摩尔%,和
m+n+p=100%。
另一方面,本发明的公开内容的特征在于一种离子膜,其包含任何上述聚合物。本发明的公开内容的特征还在于包含任何上述聚合物的离聚物。离聚物可以掺入燃料电池、电解槽或其他电化学装置的催化剂层中。
附图说明
当结合附图时,由于通过参考以下详细描述,本发明的公开内容的前述方面和许多伴随的优点变得更好理解,因此其将变得更加容易理解,其中:
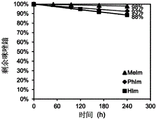
图1A是显示咪唑鎓小分子(例如,HIm、MeIm和PhIm)的实施方案的剩余咪唑鎓的百分比随时间变化的图,咪唑鎓小分子浓度为0.02M,暴露于在80℃下含有70wt%CD3OD的3MNaOD的D2O溶液,如由1H NMR谱确定的。
图1B是在80℃下含有70wt%CD3OD的3M NaOD的D2O溶液中以0.02M的浓度溶解的铵、苯并咪唑鎓和咪唑鎓的实施方案的半衰期(t1/2)的图。
图1C是显示小分子(MeIm)的实施方案在80℃下在3M NaOD中在不同CD3OD:D2Owt%浓度(c)下随时间降解的程度的图。
图1D是显示小分子(MeIm)的实施方案在80℃下在3M NaOD中在不同CD3OD:D2Owt%浓度下在240小时之后的降解程度的图。
图1E显示了铵、苯并咪唑鎓和咪唑鎓的实施方案的化学结构。
图2A是显示本发明公开的聚合物的实施方案(例如,聚(亚芳基-咪唑鎓)HMT-PMPI)的合成的方案,其中,在步骤a和b中,通过溴化均三甲基苯甲醛以产生9(a,72%),接着将9与1,4-苯二硼酸进行Suzuki-Miyaura偶联得到10(b,58%)来制备化合物10。在步骤c和d中,在过量乙酸铵存在下,单体10与双苯偶酰(bisbenzil)的微波缩聚反应得到聚(亚芳基-咪唑)HMT-PPI(c,98%),其被去质子化,然后甲基化以制备碘化物形式的聚(亚芳基-咪唑鎓)HMT-PMPI(d,95%)。
图2B是包含本发明公开的聚合物(HMT-PMPI)的实施方案的圆形浇铸膜的照片。
图2C是从图2B的膜切下的片的照片。
图2D是本发明公开的聚合物的实施方案的化学结构。
图3显示了本发明公开的聚合物的实施方案,具体是在将含HMT-PMPI的膜浸渍于100℃下的不同浓度的KOH(水溶液)中168小时后,在DMSO-d6中氯化物形式的HMT-PMPI的1H NMR谱。HMT-PMPI没有发生化学降解。
图4A显示了咪唑鎓小分子的实施方案的密度泛函理论(DFT)-计算的反应曲线。沿去甲基化路径或开环路径优化了三种咪唑鎓氢氧化物的试剂、过渡态(TS)、中间态(IS)和产物(P)的自由能(ΔG),这三种咪唑鎓氢氧化物具有C2位置邻位的氢-、甲基-或苯基基团(HIm、MeIm和PhIm分别作为试剂)。使用水作为溶剂并在298.15K下优化。
图4B是咪唑鎓小分子(碘化物形式的MeIm,具有热椭圆体,含共结晶的H2O(氢未示出))的实施方案的单晶X射线衍射(XRD)结构,以50%概率水平显示。
图5A显示咪唑鎓小分子(HIm)的实施方案的降解产物(例如,去甲基化降解产物)的实施方案的结构。
图5B显示咪唑鎓小分子(MeIm)的实施方案的降解产物(例如,去甲基化降解产物)的实施方案的结构。
图5C显示咪唑鎓小分子(PhIm)的实施方案的降解产物(例如,去甲基化降解产物)的实施方案的结构。
图6显示本发明公开的聚合物的实施方案的1H NMR谱(膜在不同浓度的KOH水溶液中在80℃下浸没168小时后,溶解在DMSO-d6中的氯化物形式的HMT-PMPI),其中在这些苛刻的条件下,没有发生明显的聚合物的化学降解。
图7显示出模型咪唑鎓氢氧化物的实施方案的去甲基化过渡态的化学结构。使用B3LYP DFT计算在298.15K下在水中优化氢氧化物形式的HIm、MeIm和PhIm的去甲基化降解反应(TSSN2)的过渡态。标记了去甲基化碳到氮和羟基氧二者的距离(以计)。
图8显示小分子咪唑鎓氢氧化物的实施方案的开环降解的第一过渡态的化学结构。使用B3LYP DFT计算在298.15K下在水中优化HIm、MeIm和PhIm的开环反应(TSC2)的过渡态。标记了咪唑鎓的C2位置到羟基氧原子的距离(以计)和氢氧化物与空间保护基团之间的距离。
图9显示小分子咪唑鎓化合物的实施方案的溶液二面角。具体地,使用B3LYP DFT计算在298.15K下在水中优化显示的HIm、MeIm和PhIm的结构。标记了从C2位置到相邻空间保护基团的最近原子的距离(以计)和咪唑鎓平面与C2位置的苯基取代基之间的二面角。
图10是本发明公开的聚合物(HMT-PMPI)的实施方案的极化和相关功率密度数据的图,具体是基于寿命起初(BOL)HMT-PMPI的AEMFC,在阳极/阴极处为0.5/0.5mg Pt·cm-2和总膜厚度为20μm。测试条件为80℃,0.25/0.5slpm H2/O2,零背压(backpressure)。
发明详述
本文提供了咪唑鎓聚合物,其在聚合链中的咪唑部分的4-位具有空间位阻。空间保护的N-甲基化咪唑鎓聚合物在高温下,如在100℃和更高的温度下,在浓苛性碱溶液中表现出氢氧化物稳定性。
定义
在本说明书的各个位置,公开的化合物的取代基是成组或成范围公开的。具体意图是,公开内容包括这样的组和范围的成员的每个单一子组合。例如,术语“C1-6烷基”具体旨在单独地公开甲基、乙基、C3烷基、C4烷基、C5烷基和C6烷基。
进一步的意图是,公开的化合物是稳定的。如本文所用,“稳定的”是指化合物足够稳固以经受从反应混合物分离至有用纯度。
还应理解,为清楚起见,在分开的实施方案的上下文中描述的公开的某些特征也可以在单个实施方案中以组合方式提供。相反地,为简洁起见,在单个实施方案的上下文中描述的公开的各个特征也可以分开提供或以任何合适的子组合提供。
“任选取代的”基团可以指例如可被另外的官能团取代或未被另外的官能团取代的官能团。例如,当基团未被取代时,可以称其为基团名称,例如烷基或芳基。当基团被另外的官能团取代时,可以更通常地称其为取代烷基或取代芳基。
如本文所用,术语“取代的”或“取代”是指用除H以外的取代基取代氢原子。例如,“N取代的哌啶-4-基”是指用非氢取代基例如烷基取代来自哌啶基的NH的H原子。
如本文所用,术语“烷基”是指直链或支链烃基。在一些实施方案中,烷基具有1至10个碳原子(例如,1至8个碳原子、1至6个碳原子、1至3个碳原子、1或2个碳原子或1个碳原子)。代表性的烷基包括甲基、乙基、丙基(例如,正丙基、异丙基)、丁基(例如,正丁基、仲丁基和叔丁基)、戊基(例如,正戊基、叔戊基、新戊基、异戊基、戊-2-基、戊-3-基)和己基(例如,正己基和异构体)基团。
如本文所用,术语“亚烷基”是指连接烷基。
如本文所用,术语“环烷基”是指非芳族碳环,包括环化的烷基、烯基和炔基。环烷基可包括单环或多环(例如,具有2、3或4个稠环)环体系,包括螺环。在一些实施方案中,环烷基可具有3至约20个碳原子、3至约14个碳原子、3至约10个碳原子或3至7个碳原子。环烷基可进一步具有0、1、2或3个双键和/或0、1或2个三键。环烷基的定义中还包括具有一个或多个与环烷基环稠合(即,与其具有共用键)的芳环的部分,例如戊烷、戊烯、己烷等的苯并衍生物。具有一个或多个稠合芳环的环烷基可以通过芳族或非芳族部分连接。环烷基的一个或多个成环碳原子可被氧化,例如,具有氧代或硫代(sulfido)取代基。示例环烷基包括环丙基、环丁基、环戊基、环己基、环庚基、环戊烯基、环己烯基、环己二烯基、环庚三烯基、降冰片基(norbomyl)、降蒎烷基(norpinyl)、降莰基(norcamyl)、金刚烷基等。
如本文所用,术语“亚环烷基”是指连接环烷基。
如本文所用,术语“全氟烷基”是指直链或支链氟碳链。在一些实施方案中,全氟烷基具有1至10个碳原子(例如,1至8个碳原子、1至6个碳原子、1至3个碳原子、1或2个碳原子或1个碳原子)。代表性的烷基包括三氟甲基、五氟乙基等。
如本文所用,术语“全氟亚烷基”是指连接全氟烷基。
如本文所用,术语“杂烷基”是指直链或支链烷基,并且其中一个或多个碳原子被选自O、N或S的杂原子取代。在一些实施方案中,杂烷基烷基具有1至10个碳原子(例如,1至8个碳原子、1至6个碳原子、1至3个碳原子、1或2个碳原子或1个碳原子)。
如本文所用,术语“亚杂烷基”是指连接杂烷基。
如本文所用,术语“烷氧基”是指与氧原子键合的如本文所述的烷基或环烷基。在一些实施方案中,烷氧基具有1至10个碳原子(例如,1至8个碳原子、1至6个碳原子、1至3个碳原子、1或2个碳原子或1个碳原子)。代表性的烷氧基包括甲氧基、乙氧基、丙氧基和异丙氧基。
如本文所用,术语“全氟烷氧基”是指与氧原子键合的如本文所述的全氟烷基或环状全氟烷基。在一些实施方案中,全氟烷氧基具有1至10个碳原子(例如,1至8个碳原子、1至6个碳原子、1至3个碳原子、1或2个碳原子或1个碳原子)。代表性的全氟烷氧基包括三氟甲氧基、五氟乙氧基等。
如本文所用,术语“芳基”是指具有6至10个碳原子的芳族烃基。代表性的芳基包括苯基。在一些实施方案中,术语“芳基”包括单环或多环(例如,具有2、3或4个稠环)芳烃,例如苯基、萘基、蒽基、菲基、茚满基和茚基。
如本文所用,术语“亚芳基”是指连接芳基。
如本文所用,术语“芳烷基”是指如具有如本文所定义的芳基的本文所定义的烷基或环烷基,其一个烷基氢原子被取代。代表性的芳烷基是苄基。
如本文所用,术语“亚芳烷基”是指连接芳烷基。
如本文所用,术语“杂芳基”是指含有1-4个选自O、S和N的杂原子的5至10元芳族单环或双环。代表性的5-或6-元芳族单环基团包括吡啶、嘧啶、哒嗪、呋喃、噻吩、噻唑、噁唑和异噁唑。代表性的9-或10-元芳族双环基团包括苯并呋喃、苯并噻吩、吲哚、吡喃吡咯(pyranopyrrole)、苯并吡喃、喹啉、苯并环己基和萘啶。
如本文所用,术语“亚杂芳基”是指连接杂芳基。
如本文所用,术语“卤素”或“卤代”是指氟、氯、溴和碘基团。
如本文所用,当咪唑鎓带正电荷时,例如,如下所示,
应理解,所示结构包括可位于两个位置之一的双键,且因此正电荷位于两个咪唑鎓氮原子之一上:
如本文所用,术语“大体积基团”是指通过具有至少与甲基一样大的尺寸提供空间体积的基团。
如本文所用,术语“共聚物”是指作为两种或更多种不同单体聚合的结果的聚合物。每种结构单元的数量和性质可以在共聚物中分开控制。除非另外明确说明,否则结构单元可以以纯无规、交替无规、规则交替、规整嵌段或无规嵌段构型布置。例如,纯无规构型可以是:x-x-y-z-x-y-y-z-y-z-z-z…或y-z-x-y-z-y-z-x-x…,交替无规构型可以是:x-y-x-z-y-x-y-z-y-x-z…,并且规则交替构型可以是:x-y-z-x-y-z-x-y-z…。规整嵌段构型(即嵌段共聚物)具有以下通用构型:…x-x-x-y-y-y-z-z-z-x-x-x…,而无规嵌段构型具有通用构型:…x-x-x-z-z-x-x-y-y-y-y-z-z-z-x-x-z-z-z-…。
如本文所用,术语“无规共聚物”是具有两种或更多种结构单元的不受控制的混合物的共聚物。结构单元在整个聚合物骨架(或主链)中的分布可以是结构单元的统计分布或接近统计分布。在一些实施方案中,一种或多种结构单元的分布是有利的。
如本文所用,术语聚合物的“结构单元”是指聚合物中的原子或原子组,包括链的一部分连同其侧链原子或原子组,如果有的话。结构单元可以指重复单元。结构单元也可以指聚合物链上的端基。例如,聚乙二醇的结构单元可以是对应于重复单元的-CH2CH2O-,或对应于端基的-CH2CH2OH。
如本文所用,术语“重复单元”对应于最小的结构单元,其重复构成规整的大分子(或低聚物分子或嵌段)。
如本文所用,术语“端基”是指与聚合物链仅有一个连接的结构单元,位于聚合物的末端。例如,一旦单体单元聚合,端基就可以衍生自聚合物末端的单体单元。作为另一个实例,端基可以是用于合成聚合物的链转移剂或引发剂的一部分。
如本文所用,术语聚合物的“末端”是指位于聚合物骨架末端的聚合物结构单元。
如本文所用,术语“阳离子”是指在生理条件下带正电荷或可电离成带正电荷的部分的部分。阳离子部分的实例包括,例如,氨基、铵、吡啶鎓、亚氨基、锍、季鏻基(phosphonium)等。
如本文所用,术语“阴离子”是指在生理条件下带负电荷的或可电离成带负电荷的部分的官能团。阴离子基团的实例包括羧酸根、硫酸根、磺酸根、磷酸根等。
如本文所用,“甲基化程度”(dm)是指例如本发明公开的聚合物的实施方案的N-甲基化的百分比。因此,如果聚合物的咪唑部分中的所有成环氮原子都被甲基化,则甲基化程度为100%。如果聚合物的咪唑部分中一半的成环氮原子被甲基化,则甲基化程度为50%。
如本文所用,术语“基本由……组成(consisting essentially of)”或“基本上由……组成(consists essentially of)”是指包含其基本组成组分以及其它组分的组合物,条件是其它组分不实质影响组合物的基本特征。通常,基本由某些组分组成的组合物将包含大于或等于95wt%的那些组分或大于或等于99wt%的那些组分。
除非另外定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的含义相同的含义。尽管与本文描述的方法和材料类似或等同的方法和材料可以用于本发明公开内容的实践或测试,但是下面仍描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入。在冲突的情况下,将以本说明书,包括定义为准。另外,材料、方法和实施例仅是说明性的,而无意作为限制性的。
聚合物
本发明的公开内容的特征在于一种聚合物,其包含式(I)的重复单元(或基本由其组成或由其组成):
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基(即,具有R1或R2中的一个的咪唑基,但非另一个)是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基(即,具有R4或R5中的一个的咪唑基,但非另一个)是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15选自亚烷基、全氟亚烷基、亚杂烷基、亚芳基、亚芳烷基和亚杂芳基,各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16选自化学键、亚芳基和亚杂芳基,其中所述亚芳基和亚杂芳基各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8、R9、R12和R13各自独立地选自氢(H)、烷基、全氟烷基和杂烷基。
在一些实施方案中,包含式(I)的重复单元(或基本上由其组成或由其组成)的聚合物包含式(I-A)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基(即,具有R1或R2中的一个的咪唑基,但非另一个)是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基(即,具有R4或R5中的一个的咪唑基,但非另一个)是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15选自亚烷基、全氟亚烷基、亚杂烷基、亚芳基、亚芳烷基和亚杂芳基,各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16选自化学键、亚芳基和亚杂芳基,其中所述亚芳基和亚杂芳基各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8、R9、R12和R13各自独立地选自氢(H)、烷基、全氟烷基和杂烷基。
在一些实施方案中,包含式(I)的重复单元(或基本上由其组成或由其组成)的聚合物包含式(I-B)的重复单元,或者包含式(I-A)的重复单元(多个重复单元)的聚合物还包含式(I-B)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基(即,具有R1或R2中的一个的咪唑基,但非另一个)是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基(即,具有R4或R5中的一个的咪唑基,但非另一个)是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15选自亚烷基、全氟亚烷基、亚杂烷基、亚芳基、亚芳烷基和亚杂芳基,各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16选自化学键、亚芳基和亚杂芳基,其中所述亚芳基和亚杂芳基各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8、R9、R12和R13各自独立地选自氢(H)、烷基、全氟烷基和杂烷基。
在一些实施方案中,包含式(I)的重复单元(或基本上由其组成或由其组成)的聚合物包含式(I-C)的重复单元,或者包含式(I-A)和/或式(I-B)的重复单元(多个重复单元)的聚合物还包含式(I-C)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1和R2所连接的咪唑基(即,具有R1或R2中的一个的咪唑基,但非另一个)是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基(即,具有R4或R5中的一个的咪唑基,但非另一个)是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15选自亚烷基、全氟亚烷基、亚杂烷基、亚芳基、亚芳烷基和亚杂芳基,各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16选自化学键、亚芳基和亚杂芳基,其中所述亚芳基和亚杂芳基各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8、R9、R12和R13各自独立地选自氢(H)、烷基、全氟烷基和杂烷基。
在一些实施方案中,包含式(I)的重复单元(或基本上由其组成或由其组成)的聚合物包含式(I-D)的重复单元,或者包含式(I-A)、式(I-B)和/或式(I-C)的重复单元(多个重复单元)的聚合物还包含式(I-D)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基(即,具有R1或R2中的一个的咪唑基,但非另一个)是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基(即,具有R4或R5中的一个的咪唑基,但非另一个)是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15选自亚烷基、全氟亚烷基、亚杂烷基、亚芳基、亚芳烷基和亚杂芳基,各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16选自化学键、亚芳基和亚杂芳基,其中所述亚芳基和亚杂芳基各自任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8、R9、R12和R13各自独立地选自氢(H)、烷基、全氟烷基和杂烷基。
式(I)的聚合物可具有式(I-A)、(I-B)、(I-C)和/或(I-D)的重复单元的混合物。例如,聚合物可包含式(I-A)、(I-B)、(I-C)和(I-D)的重复单元;式(I-A)、(I-B)和(I-C)的重复单元;式(I-A)、(I-B)和(I-D)的重复单元;式(I-A)、(I-C)和(I-D)的重复单元;式(I-B)、(I-C)、(I-D)的重复单元;式(I-A)和(I-B)的重复单元;式(I-A)和(I-C)的重复单元;式(I-A)和(I-D)的重复单元;式(I-B)和(I-C)的重复单元;式(I-B)和(I-D)的重复单元;式(I-C)和(I-D)的重复单元;式(I-A)的重复单元;式(I-B)的重复单元;式(I-C)的重复单元;或式(I-D)的重复单元。
在任何上述包含式(I)的重复单元(或基本上由其组成或由其组成)或包含式(I-A)、(I-B)、(I-C)和/或(I-D)的重复单元(多种重复单元)的聚合物的实施方案中,R1、R2、R4和R5可各自独立地选自不存在、烷基、全氟烷基、杂烷基和芳基;条件是:R1和R2中的至少一个选自烷基、全氟烷基、杂烷基和芳基;并且R4和R5中的至少一个选自烷基、全氟烷基、杂烷基和芳基。例如,R1、R2、R4和R5可各自独立地选自不存在、烷基、全氟烷基和杂烷基;条件是:R1和R2中的至少一个选自烷基、全氟烷基和杂烷基;并且R4和R5中的至少一个选自烷基、全氟烷基和杂烷基。在一些实施方案中,R1、R2、R4和R5各自独立地选自不存在、甲基和三氟甲基;条件是:R1和R2中的至少一个选自甲基和三氟甲基;R4和R5中的至少一个选自甲基和三氟甲基。
在任何上述包含式(I)的重复单元(或基本上由其组成或由其组成)或包含式(I-A)、(I-B)、(I-C)和/或(I-D)的重复单元(多种重复单元)的聚合物的实施方案中,R3和R6可各自独立地为芳基。例如,R3和R6可各自独立地为苯基。在一些实施方案中,R3和R6各自独立地为乙基或甲基。在一些实施方案中,R3和R6各自独立地为甲基。
在任何上述包含式(I)的重复单元(或基本上由其组成或由其组成)或包含式(I-A)、(I-B)、(I-C)和/或(I-D)的重复单元(多种重复单元)的聚合物的实施方案中,R15和R16可各自独立地选自亚芳基和亚杂芳基,各自任选地被1、2、3或4个独立地选自烷基和卤素的取代基取代。例如,R15和R16可各自独立地为亚芳基,任选地被1、2、3或4个独立地选自烷基和卤素的取代基取代。例如,R15和R16各自可以是亚苯基,任选地被1、2、3或4个独立地选自烷基和卤素的取代基取代。在一些实施方案中,R15和R16各自为亚苯基。
在任何上述包含式(I)的重复单元(或基本上由其组成或由其组成)或包含式(I-A)、(I-B)、(I-C)和/或(I-D)的重复单元(多种重复单元)的聚合物的实施方案中,R7、R10、R11和R14可各自独立地为烷基。例如,R7、R10、R11和R14可各自独立地为甲基或乙基。例如,R7、R10、R11和R14可各自独立地为甲基。
在任何上述包含式(I)的重复单元(或基本上由其组成或由其组成)或包含式(I-A)、(I-B)、(I-C)和/或(I-D)的重复单元(多种重复单元)的聚合物的实施方案中,该聚合物可包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、醋酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,聚合物包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,聚合物包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,聚合物包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,聚合物包含一个或多个阴离子X-,其选自碘离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,聚合物包含一个或多个氢氧根,其中所述一个或多个氢氧根抵消聚合物中的一个或多个正电荷。
本发明的公开内容还提供包含式(II)的重复单元(或基本上由其组成或由其组成)的聚合物:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基(即,具有R1或R2中的一个的咪唑基,但非另一个)是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基(即,具有R4或R5中的一个的咪唑基,但非另一个)是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R7、R10、R11和R14各自独立地选自烷基、全氟烷基和杂烷基;和
R8和R12各自独立地选自氢(H)、烷基、全氟烷基和杂烷基。
在一些实施方案中,对于上述包含式(II)的重复单元(或基本上由其组成或由其组成)的聚合物,R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基和杂烷基;条件是:R1和R2中的至少一个选自烷基、全氟烷基和杂烷基;并且R4和R5中的至少一个选自烷基、全氟烷基和杂烷基。例如,R1、R2、R4和R5可各自独立地选自不存在、甲基和三氟甲基;条件是:R1和R2中的至少一个选自甲基和三氟甲基,并且R4和R5中的至少一个选自甲基和三氟甲基。
在一些实施方案中,对于任何上述包含式(II)的重复单元(或基本上由其组成或由其组成)的聚合物的实施方案,R3和R6各自独立地为芳基。例如,R3和R6可各自独立地为苯基。在一些实施方案中,R3和R6各自独立地为甲基或乙基。在一些实施方案中,R3和R6各自独立地为甲基。
在一些实施方案中,对于任何上述包含式(II)的重复单元(或基本上由其组成或由其组成)的聚合物的实施方案,R7、R8、R10、R11、R12和R14各自独立地为烷基。例如,R7、R8、R10、R11、R12和R14各自独立地为甲基或乙基。例如,R7、R8、R10、R11、R12和R14各自独立地为甲基。
在一些实施方案中,对于任何上述包含式(II)的重复单元(或基本上由其组成或由其组成)的聚合物的实施方案,该聚合物包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、醋酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。例如,所述一个或多个阴离子X-可以选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,一个或多个阴离子X-选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,聚合物包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,聚合物包括一个或多个阴离子X-,其选自碘离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,所述聚合物包含一个或多个氢氧根,其中所述一个或多个氢氧根抵消聚合物中的一个或多个正电荷。
本发明的公开内容进一步提供包含式(III-A)的重复单元的聚合物:
在一些实施方案中,包含式(III-A)的重复单元的聚合物还包含式(III-B)的重复单元:
在一些实施方案中,包含式(III-A)的重复单元或包含式(III-A)和(III-B)的重复单元的聚合物还包含式(III-C)的重复单元:
其中R1d和R4d中的一个不存在,并且剩余的R1d或R4d是甲基;且不存在的R1d或R4d所连接的咪唑基(即,其中其R1d或R4d中的一个不存在的咪唑基)是中性的。
在一些实施方案中,对于任何上述包含式(III-A)、式(III-B)和/或式(III-C)的重复单元(或基本上由其组成或由其组成)的聚合物,该聚合物包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、醋酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,一个或多个阴离子X-选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。例如,一种或多种阴离子X-可选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,一个或多个阴离子X-选自碘离子、溴离子、氯离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,一个或多个阴离子X-选自碘离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。例如,对于任何上述包含式(III-A)、式(III-B)和/或式(III-C)的重复单元的聚合物,所述聚合物可包含一个或多个氢氧根阴离子,其中所述一个或多个氢氧根阴离子抵消聚合物中的一个或多个正电荷。
本发明的公开内容进一步提供包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物:
其中,
R1a和R2a中的一个不存在,并且剩余的R1a或R2a选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R4a和R5a中的一个不存在,并且剩余的R4a或R5a选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R1b、R2b、R4b和R5b中的一个不存在,并且不存在的R1b、R2b、R4b或R5b所连接的咪唑基(即,其中其R1b、R2b、R4b或R5b中的一个不存在的咪唑基)是中性的,而R1b、R2b、R4b和R5b中的其余三个各自独立地选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R1c、R2c、R4c和R5c各自独立地选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R3a、R6a、R3b、R6b、R3c和R6c各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R7a、R10a、R11a、R14a、R7b、R10b、R11b、R14b、R7c、R10c、R11c和R14c各自独立地选自烷基、全氟烷基和杂烷基;和
R8a、R12a、R8b、R12b、R8c和R12c各自独立地选自氢(H)、烷基、全氟烷基和杂烷基;
其中聚合物包含m摩尔%的式(IV-A)的重复单元、n摩尔%的式(IV-B)的重复单元和p摩尔%的式(IV-C)的重复单元,和
m为0摩尔%至60摩尔%,
n+p为40摩尔%至100摩尔%,和
m+n+p=100%。
在一些实施方案中,对于包含上述式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,R1a和R2a中的一个不存在,且剩余的R1a或R2a选自甲基和三氟甲基;并且R4a和R5a中的一个不存在,且剩余的R4a或R5a选自甲基和三氟甲基。
在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,R1b、R2b、R4b和R5b中的一个不存在,并且不存在的R1b、R2b、R4b或R5b所连接的咪唑基(即,其中其R1b、R2b、R4b或R5b中的一个不存在的咪唑基)是中性的,而R1b、R2b、R4b和R5b中的其余三个各自独立地选自烷基、全氟烷基和杂烷基。在一些实施方案中,R1b、R2b、R4b和R5b中的一个不存在,并且不存在的R1b、R2b、R4b或R5b所连接的咪唑基(即,其中其R1b、R2b、R4b或R5b中的一个不存在的咪唑基)是中性的,而R1b、R2b、R4b和R5b中的其余三个各自独立地选自甲基和三氟甲基。
在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,R1c、R2c、R4c和R5c各自独立地选自烷基、全氟烷基和杂烷基。例如,R1c、R2c、R4c和R5c可各自独立地选自甲基和三氟甲基。在一些实施方案中,R1c、R2c、R4c和R5c各自独立地为甲基或乙基。在一些实施方案中,R1c、R2c、R4c和R5c各自为甲基。
在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,R3a、R6a、R3b、R6b、R3c和R6c各自独立地为芳基。例如,R3a、R6a、R3b、R6b、R3c和R6c可各自独立地为苯基。
在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,R7a、R10a、R11a、R14a、R7b、R10b、R11b、R14b、R7c、R10c、R11c和R14c各自独立地为烷基。例如,R7a、R10a、R11a、R14a、R7b、R10b、R11b、R14b、R7c、R10c、R11c和R14c可各自独立地为甲基或乙基。例如,R7a、R10a、R11a、R14a、R7b、R10b、R11b、R14b、R7c、R10c、R11c和R14c可各自独立地为甲基。
在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,R8a、R12a、R8b、R12b、R8c和R12c各自独立地为烷基。例如,R8a、R12a、R8b、R12b、R8c和R12c可各自独立地为甲基或乙基。例如,R8a、R12a、R8b、R12b、R8c和R12c可各自独立地为甲基。
在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,n和p每个都超过0%。
在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元(或基本上由其组成或由其组成)的无规聚合物,所述聚合物包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、乙酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。例如,所述一个或多个阴离子X-可选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。例如,一个或多个阴离子X-可选自碘离子、溴离子、氯离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。作为另外的实例,一个或多个阴离子X-可选自碘离子、氢氧根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。在一些实施方案中,对于任何上述包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元的无规聚合物,所述聚合物包含一个或多个氢氧根阴离子,其中所述一个或多个氢氧根阴离子抵消聚合物中的一个或多个正电荷。
在一些实施方案中,本发明的公开内容的特征在于包含上述聚合物的任何实施方案的离子膜。
在某些实施方案中,本发明的公开内容的特征在于包含上述聚合物的任何实施方案的离聚物。离聚物可以掺入燃料电池、电解槽或其他电化学装置的催化剂层中。
在下面的实施例1中提供了本发明公开的咪唑鎓聚合物的实施例。咪唑鎓聚合物在高温下在浓苛性碱溶液中表现出显著的氢氧化物稳定性。
实施例
实施例1.N-甲基化咪唑鎓聚合物的合成与表征
下面提供空间保护的N-甲基化咪唑鎓聚合物,其在100℃下在浓苛性碱溶液中表现出氢氧化物稳定性。
试剂和仪器
除非另有注明,否则化学品均购自Sigma Aldrich或Combi-Blocks,Inc.,并且是试剂级或ACS级。冰醋酸和碘化钾购自Caledon Laboratories Ltd.。乙醇(无水)购自Commercial Alcohols。氢氧化钾购自Macron Fine Chemicals。二甲基亚砜(光谱级)、碳酸钾、氯化钾、碳酸氢钠和己烷购自ACP Chemicals Inc.。二氯甲烷(稳定化的)、连二亚硫酸钠、丙酮和甲醇购自Fisher Scientific。氯仿和氢氧化钠购自BDH。四(三苯基膦)钯(99%)购自Strem Chemicals。二甲基亚砜-d6(99.9%-D)、二氯甲烷-d2(99.9%-D),甲醇-d4(99.8%-D)购自Cambridge Isotope Laboratories,Inc.。2,6-二溴苯甲醛(3)是根据Luliński,S.;Serwatowski,J.J.Org.Chem.2003,68,5384(其通过引用整体并入本文)制备的;1,4-双(苯基乙炔基)苯是根据Sonogashira,K.;Tohda,Y.;Hagihara,N.TetrahedronLett.1975,16,4467(其通过引用整体并入本文)制备的;并且1,4-双(苯甲酰基羰基)苯(双苯偶酰)是根据Yusubov,M.S.;Filimonov,V.D.Synthesis 1991,131(其通过引用整体并入本文)制备的。在Top Spin 2.1下,在400或500MHz Bruker AVANCE III上运行IconNMR,获得核磁共振(NMR)谱。DMSO-d6、CD2Cl2和CD3OD的残留1H NMR溶剂峰分别设定为2.50ppm、5.32ppm和3.31ppm。CD2Cl2和CD3OD的残留13C NMR溶剂峰分别设定为54.00ppm和49.00ppm。
2,4,5-三苯基-1H-咪唑(2)的合成
向500mL双颈圆底烧瓶中加入苯偶酰(12.6g,60mmol)、苯甲醛(6.3g,59mmol)、乙酸铵(45g,580mmol)、乙酸(60mL)和乙醇(300mL)。将反应混合物加热至回流持续18小时。然后将反应混合物冷却至室温,并通过过滤收集固体。在乙醇中重结晶后,得到2(12.0g,69%),为白色晶体。1H NMR(400MHz,DMSO-d6,ppm)δ:12.70(s,1H),8.10(d,J=7.2Hz,2H),7.67–7.07(m,13H)。13C NMR(100MHz,DMSO-d6,ppm)δ:145.47,130.34,128.65,128.44,128.21,127.74,127.06,126.49,125.17。C21H17N2 +的HRMS(m/z):[M+H]+计算值为297.1386;实测值为297.1389。
1,3-二甲基-2,4,5-三苯基-1H-咪唑鎓(HIm)碘化物的合成
在200mL圆底烧瓶中加入粉末状氢氧化钾(1.78g,32mmol),然后加入二甲基亚砜(60mL)。将混合物在室温下封口搅拌30分钟。然后将2(5.00g,16.9mmol)的二甲基亚砜(60mL)溶液加到碱性溶液并在室温下搅拌45分钟。然后加入碘甲烷(1.12mL,18.0mmol)并搅拌45分钟。然后将混合物倒入含有氢氧化钾(4.0g)的水(800mL)中。将所得沉淀物溶于乙醚中,收集有机物并用水、盐水和水洗涤。然后将有机相用硫酸镁干燥,过滤,并在50℃下使用动态真空蒸发,得到单甲基化咪唑,为白色粉末(4.62g,88%)。仅将部分该粉末(2.00g,6.44mmol)进一步甲基化,将其移入50mL圆底烧瓶中并溶解在二氯甲烷(15mL)中。加入碘甲烷(1.6mL,26mmol),并将封口的混合物在30℃下搅拌18小时。然后使用动态真空在40℃下蒸发溶剂。将得到的固体在温热的乙醚中研磨,并在100℃下真空干燥,得到碘化物形式的HIm(2.23g,77%),为灰白色粉末(总收率68%)。1H NMR(500MHz,DMSO-d6,ppm)δ:7.98–7.92(m,2H),7.84–7.75(m,3H),7.54–7.45(m,10H),3.54(s,6H)。13C NMR(125MHz,DMSO-d6,ppm)δ:144.08,132.48,131.25,130.80,130.66,130.07,129.53,129.02,125.53,121.90,34.51。C23H21N2 +的HRMS(m/z):[M]+计算值为325.1699;实测值为325.1708。
2-均三甲苯基-4,5-二苯基-1H-咪唑(4)的合成
在50mL双颈圆底烧瓶中加入苯偶酰(2.1g,10mmol)、均三甲基苯甲醛(1.48mL,10.0mmol)、乙酸铵(1.70g,22.1mmol)和磷酸二氢钠(0.52g,4.3mmol)。然后将反应混合物在130℃下搅拌1小时(通过TLC监测反应)。完成后,将混合物冷却至室温并加入甲醇。过滤混合物以除去不溶物,并减压蒸发滤液。将粗产物用水和己烷洗涤。将固体在乙腈中重结晶两次,并在80℃下真空干燥,得到4(1.2g,36%),为棉状纤维。1H NMR(400MHz,CD3OD,ppm)δ:7.48(d,J=7.3Hz,4H),7.38–7.21(m,6H),6.98(s,2H),2.32(s,3H),2.22(s,6H)。13C NMR(100MHz,CD3OD,ppm)δ:147.41,140.32,139.56,129.53,129.10,129.07,128.26,21.29,20.20。C24H23N2 +的HRMS(m/z):[M+H]+计算值为339.1856;实测值为339.1862。
2-均三甲苯基-1,3-二甲基-4,5-二苯基-1H-咪唑鎓(MeIm)碘化物的合成
将粉末状氢氧化钾(0.1122g,2.00mmol)加到25mL圆底烧瓶中。加入二甲基亚砜(5mL)并将混合物剧烈搅拌30分钟。在另外的容器中,将4(0.338g,1.0mmol)溶解在二甲基亚砜(5mL)中。然后将4的溶液加到碱性溶液中,并将混合物在室温下封闭搅拌1小时。加入碘甲烷(65μL,1.04mmol)并将混合物搅拌1小时。将混合物倒入含氢氧化钾(0.2g)的搅拌的水(80mL)溶液中。加入乙醚(30mL)并搅拌直至两层都透明。倾析出有机层,并用另外的乙醚(2×15mL)重复相同的过程。将合并的有机层用水、盐水、水洗涤。然后将有机相用硫酸镁干燥,过滤,并在动态真空下蒸发。将二氯甲烷(5mL)加到产物中并搅拌直至完全溶解。加入碘甲烷(260μL,4.2mmol),将混合物在30℃下搅拌18小时。通过动态真空蒸发溶剂,并加入乙醚(20mL)。通过过滤收集固体,用乙醚洗涤,并在80℃下真空干燥,得到碘化物形式的MeIm(0.31g,63%),为灰白色薄片。1H NMR(400MHz,CD3OD,ppm)δ:7.57–7.43(m,10H),7.26(s,2H),3.53(s,6H),2.44(s,3H),2.24(s,6H)。13C NMR(100MHz,CD3OD,ppm)δ:145.19,140.51,133.92,132.09,131.56,130.61,130.25,126.67,34.02,21.46,19.51。C26H27N2 +的HRMS(m/z):[M]+计算值为367.2169;实测值为367.2173。
2-(2,6-二溴苯基)-4,5-二苯基-1H-咪唑(6)的合成。
在1L双颈圆底烧瓶中加入苯偶酰(10.05g,48mmol)、2,6-二溴苯甲醛(13.2g,50mmol)、乙酸铵(38.5g,500mmol)、乙酸(50mL)和乙醇(400mL)。将反应混合物加热至回流持续18小时。然后将反应冷却至室温并倒入水中。将沉淀物在乙醇/水(250mL:150mL)中重结晶,得到6(18.8g,86%),为白色晶体。1H NMR(400MHz,CD3OD,ppm)δ:7.76(d,J=8.1Hz,2H),7.59–7.41(m,4H),7.40–7.21(m,7H)。13C NMR(100MHz,CD3OD,ppm)δ:144.48,133.91,132.08,131.59,128.17,127.74,125.68。C21H15Br2N2 +的HRMS(m/z):[M+H]+计算值为452.9597;实测值为452.9603。
2-(2,6-二溴苯基)-1-甲基-4,5-二苯基-1H-咪唑(7)的合成。
向有塞圆底烧瓶中加入氢氧化钾(0.4062g,7.24mmol)和二甲基亚砜(24mL)。将混合物在室温下搅拌30分钟。然后加入化合物6(0.90g,2.0mmol)以及另外的二甲基亚砜(4.0mL)。将该混合物在室温下搅拌45分钟。加入碘甲烷(160μL,2.6mmol),并将混合物在室温下再搅拌45分钟。将反应缓慢倒入水中。通过过滤收集沉淀物并真空干燥,得到7(0.8581g,92%),为白色粉末。1H NMR(500MHz,DMSO-d6,ppm)δ:7.87(d,J=8.1Hz,2H),7.59–7.49(m,3H),7.49–7.39(m,5H),7.21(t,J=7.6Hz,2H),7.14(t,J=7.3Hz,1H),3.17(s,3H)。13C NMR(125MHz,DMSO-d6,ppm)δ:144.95,136.14,134.50,133.15,133.03,131.94,130.63,130.35,129.26,128.92,128.81,128.10,126.23,126.01,125.81,31.13。C22H17Br2N2 +的HRMS(m/z):[M+H]+计算值为466.9753;实测值为466.9756。
2-([1,1':3',1″-三联苯]-2'-基)-1-甲基-4,5-二苯基-1H-咪唑(8)的合成
在250mL圆底烧瓶中加入7(4.0002g,8.54mmol)、苯硼酸(3.1225g,25.6mmol)、1,4-二噁烷(120mL)和2M K2CO3(水溶液)(40mL)。将混合物用氩气鼓泡5分钟,然后加入四(三苯基膦)钯(0)(104mg,0.090mmol)。将混合物加热至104℃并保持18小时。将所得混合物用空气鼓泡15分钟直至溶液变黑,并在搅拌下将混合物冷却至室温。加入乙酸乙酯,并将有机相用水和盐水洗涤。用硫酸镁干燥后,在动态真空下蒸发溶剂。将所得物质溶于二氯甲烷中,并用二氯甲烷和乙酸乙酯将其冲洗通过硅藻土/二氧化硅(celite/silica)。蒸发滤液,并用己烷洗涤固体。将固体用乙酸乙酯/己烷重结晶两次,用己烷洗涤,并在100℃下真空干燥,得到8(1.44g,36%),为白色粉末。1H NMR(500MHz,DMSO-d6,ppm)δ:7.76–7.68(m,1H),7.59(d,J=7.7Hz,2H),7.46–7.39(m,3H),7.36–7.25(m,6H),7.25–7.18(m,3H),7.19–7.13(m,2H),7.10(t,J=7.4Hz,2H),7.07–7.02(m,1H),6.99(dd,J=7.4,2.0Hz,2H),2.60(s,3H)。13C NMR(125MHz,DMSO-d6,ppm)δ:144.50,143.19,140.41,135.76,134.90,130.74,130.31,130.02,129.03,128.99,128.60,128.57,128.16,127.95,127.87,126.97,125.89,125.81,30.91。C34H27N2 +的HRMS(m/z):[M+H]+计算值为463.2169;实测值为463.2176。
2-([1,1':3',1″-三联苯]-2'-基)-1,3-二甲基-4,5-二苯基-1H-咪唑鎓(PhIm)碘
化物的合成
在25mL圆底烧瓶中加入8(0.8009g,1.73mmol)和二氯甲烷(8.0mL)。完全溶解后,加入碘甲烷(0.54mL,8.67mmol),并将封口的混合物在30℃下加热18小时。在40℃下在动态真空下除去溶剂,并将得到的固体用乙醚洗涤。在80℃下真空干燥固体,得到碘化物形式的PhIm(0.94g,90%),为灰白色粉末。1H NMR(500MHz,DMSO-d6,ppm)δ:8.07(t,J=7.8Hz,1H),7.89(d,J=7.8Hz,2H),7.59–7.49(m,6H),7.49–7.39(m,6H),7.33–7.24(m,4H),7.11–7.03(m,4H),3.04(s,6H)。13C NMR(125MHz,DMSO-d6,ppm)δ:144.15,143.38,138.05,133.97,131.63,130.41,130.32,129.95,129.11,129.09,128.59,128.26,124.41,118.30,33.63。C35H29N2 +的HRMS(m/z):[M]+计算值为477.2325;实测值为477.2334。
下面的方案2总结了制备HIm、MeIm和PhIm的反应。第一反应是在过量的乙酸铵存在下醛与苯偶酰缩合,以得到咪唑衍生物(36-86%)。2和4的去质子化和甲基化分别产生HIm(68%)和MeIm(63%)。6的部分甲基化产生7(92%),使7与苯基硼酸发生Suzuki-Miyaura偶联以产生8(36%)。8的甲基化产生模型化合物PhIm(90%)。
方案2.用于制备咪唑鎓小分子化合物HIm、MeIm和PhIm的合成路线。
3-溴-2,4,6-三甲基苯甲醛(9)的合成
将均三甲基苯甲醛(14.8g,0.10mol)溶解在200mL冰醋酸中。然后另外加入60mL含溴(16.0g,0.10mol)的冰醋酸溶液,并将所得混合物在50℃下搅拌2小时。然后将溶液缓慢倒入1.5L搅拌的蒸馏水中并搅拌2小时。过滤沉淀物并用水洗涤两次。将粗产物在乙醇/水(140mL:60mL)中重结晶两次。收集晶体并在60℃下真空干燥过夜,得到9(16.4g,72%),为白色粉末。1H NMR(400MHz,CD3OD,ppm)δ:10.48(s,1H),7.08(s,1H),2.64(s,3H),2.47(s,3H),2.41(s,3H)。13C NMR(100MHz,CD3OD,ppm)δ:194.88,144.80,141.11,140.65,133.86,132.80,127.96,24.78,20.10,19.90。C10H12BrO+的HRMS(m/z):[M+H]+计算值为227.0066;实测值为227.0056。
2,2″,4,4″,6,6″-六甲基对三联苯-3,3″-二甲醛(dicarbaldehyde)(10)的合成
在带有搅拌棒和冷凝器的氩气吹扫的100mL圆底烧瓶中加入9(2.26g,10mmol)、1,4-苯二硼酸(0.83g,5mmol)、1,4-二噁烷(50mL)、2M K2CO3(16mL)和季铵氯化物(aliquat)336(1滴)。将混合物用氩气鼓泡20分钟并加入四(三苯基膦)钯(0)(0.02g,0.2mol%)。在氩气下回流22小时后,将溶液冷却至80℃并倒入搅拌的55℃乙醇(80mL)-水(100mL)溶液中。将混合物缓慢冷却至室温,并过滤所得沉淀物。通过快速柱色谱法使用氯仿作为洗脱剂纯化固体。将收集的固体在80℃下真空干燥,得到10(5.15g,58%),为白色粉末。1H NMR(400MHz,CD2Cl2,ppm)δ:10.63(d,J=1.0Hz,2H),7.19(s,4H),7.07(s,2H),2.60(s,6H),2.34(s,3H),2.32(s,3H),2.09(s,3H),2.07(s,3H)。13C NMR(100MHz,CD2Cl2,ppm)δ:194.34,142.57,142.54,141.75,140.23,140.21,139.48,139.45,139.43,131.67,131.47,131.46,130.17,21.88,21.82,20.88,20.86,17.80,17.77。C26H27O2 +的HRMS(m/z):[M+H]+计算值为371.2006;实测值为371.2006。
聚合物合成
使用改进的一般化微波辅助聚合方法,例如如在Chauveau,E.等,Polymer 2008,49,5209和Chauveau,E.等,Polymer 2014,55,6435(其各自整体并入本文)中所描述的制备HMT-PPI(参见图2A)。具体地,将二苯偶酰(0.34g,1.0mmol)、10(0.37g,1.0mmol)、乙酸铵(1.54g,20.0mmol)、冰醋酸(3.0mL)和1,4-二噁烷(9.0mL)加至高压玻璃反应器中,并在120℃下微波照射35分钟。一旦反应混合物冷却至室温,就将其倒入氯仿中以沉淀聚合物。收集聚合物并将其破碎成较小的片。将固体溶解在二甲基亚砜中并再沉淀到氯仿中。将收集的固体用丙酮和水洗涤,并在80℃下真空干燥,得到HMT-PPI(0.66g,98%),为浅黄色纤维状物。1H NMR(400MHz,DMSO-d6,ppm)δ:7.68–7.54(m,4H),7.34(s,4H),7.21(s,4H),7.16–7.04(m,4H),7.00–6.82(m,4H),2.21(s,6H),2.12–1.73(m,12H)。HMT-PPI的1H NMR谱是通过加热具有两滴40wt%NaOD(D2O中)的DMSO-d6中的HMT-PPI直至完全溶解获得的。
聚合物官能化
向带有搅拌棒和玻璃塞的50mL圆底烧瓶中加入HMT-PPI(0.336g,0.5mmol)、5MKOH水溶液(0.3mL)和二甲基亚砜(8mL)。将混合物在空气中加热至70℃。加入另外的二甲基亚砜(2mL),然后在70℃下加入5M KOH水溶液(0.2mL)。30分钟后,将混合物冷却至室温。在剧烈搅拌溶液的同时,快速加入碘甲烷(68μL,1.1mmol)并搅拌30分钟,产生沉淀。将混合物倒入150mL搅拌的水中,并且收集固体并用水洗涤。在室温下将固体在150mL含有碘化钾(0.5g)的水中搅拌2小时。收集固体并用水洗涤两次。将固体在80℃下真空干燥。然后将聚合物转移至带有搅拌棒和玻璃塞的25mL圆底烧瓶中,然后加入二氯甲烷(10mL)以溶解部分甲基化的聚合物。加入过量的碘甲烷(200μL,3.2mmol),并将混合物加热至30℃,保持20小时。减压蒸发溶剂,并将聚合物在80℃下真空干燥,得到碘化物形式的HMT-PMPI(参见图2A)(0.47g,95%),为硬的淡黄色纤维状固体。GPC分析,Mn=49,900g mol-1,Mw=66,900g mol-1,Mw/Mn=1.39。1H NMR(400MHz,DMSO-d6,ppm)δ:7.67(s,4H),7.58–7.22(m,16H),3.55(d,J=12.7Hz,12H),2.25(s,6H),2.15(s,6H),1.93(s,6H)。HMT-PMPI的1H NMR谱是在浇铸(casting)和用水洗涤后获得的。
尺寸排阻色谱
通过使用Water HPLC HR 5、HR 4和HR 3柱以HPLC级DMF(含有0.10M LiBr)作为洗脱剂获得尺寸排阻色谱分析。聚苯乙烯样品购自Waters Associates Inc.,并用作校准标准。
浇铸步骤
将碘化物形式的HMT-PMPI聚合物溶解在5mL热的二甲基亚砜中,过滤至平的培养皿中,并使其在86℃下在空气中缓慢干燥至少24小时。在离子交换步骤之前,将膜从玻璃上剥离并转移至去离子水中至少24小时。用这种方法制备的膜是透明、黄色的,且厚度为约25微米。
溶液降解测试
用降解试验评价HIm、MeIm、PhIm和四甲基铵(TMA)的稳定性,描述于Wright,A.G.等,Angew.Chem.Int.Ed.2016,55,4818(通过引用整体并入本文)中。通过将模型化合物(碘化物形式)溶解在3M NaOD的CD3OD/D2O(CD3OD/D2O质量比7:3,除非另有说明)溶液中制备模型化合物的溶液(0.02M)。CD3OD在此用作试剂和产品的良好溶剂,因此使NMR谱分析能够进行。将混合物在封闭的PTFE小瓶中加热至80℃,持续多达240小时。在特定时间,提取样品用于1H NMR谱分析。
使用公式1量化MeIm和PhIm的降解:
对于PhIm,xt是相对于表示为yt的在时间t时8.10-6.70ppm的总芳族区域的积分,7.73-7.66ppm区域(代表去甲基化PhIm降解产物的1H)的积分值(x0和y0分别是0h时的xt和yt)。对于MeIm,xt是相对于表示为yt的在时间t时7.70-6.90ppm的总芳族区域的积分,6.98-6.94ppm区域(代表去甲基化MeIm降解产物的2H)的积分值。n表示y区域的相对质子比与x区域的相对质子比之比(即,对于PhIm和MeIm,n分别为和)。
使用公式2量化HIm的降解:
其中,wt是相对于表示为zt的在时间t时8.11-7.02ppm的总芳族区域的积分,7.92-7.83ppm区域(代表起始材料HIm的2H)的积分值(w0和z0分别是0h时的wt和zt)。
使用公式3量化苄基三甲基铵(BTMA)的降解:
其中,xt是相对于表示为yt的在时间t时7.65-7.18ppm的总芳族区域的积分,7.65-7.45ppm区域(代表起始材料BTMA的5H)的积分值(x0和y0分别是0h时的xt和yt)。
使用公式4量化十六烷基三甲基铵(CTAB)的降解:
其中,xt是相对于设定为3H在时间t时0.88-0.77ppm的积分,3.38-3.32ppm区域(代表起始材料HIm的2H)的积分值(x0为在0h时的xt)。
使用公式5量化四甲基铵(TMA)的降解:
其中M0是3.28-3.24ppm区域的积分值(表示起始材料TMA的12H),M1是3.24-3.20ppm区域的积分值(表示氘交换的起始材料TMA的2H)。N0是2.20-2.17ppm区域的积分值(表示降解产物三甲胺的9H),N1是2.17-2.15ppm区域的积分值(表示氘交换的降解产物三甲胺的2H)。
在前面提到的240小时降解测试后,将溶液冷却至室温。然后使用以下方法分离有机降解产物:将混合物倒入烧杯中,用水将任何剩余的溶液冲洗出至烧杯中。将混合物用稀盐酸水溶液酸化至pH为中性。加入乙醚,并将有机层用水洗涤三次,用硫酸镁干燥,过滤,并使用动态真空在40℃下蒸发。然后通过质谱分析所得残余物。对于MeIm的不同CD3OD:D2O降解测试,适当调整1H NMR积分区域以适应由溶剂变化导致的相对峰位移。
粉末降解测试
对于化合物MeIm,在3、5、7和10M NaOD/D2O中进行降解测试。将模型化合物(0.02M)分散在PTFE容器内的碱溶液中,然后在80℃的烘箱中加热240小时。然后,过滤样品,用4mL D2O洗涤并直接溶解在CD3OD中进行1H NMR谱分析。使用MestReNova中存在的“全自动(多项式拟合)(Full Auto(Polynomial Fit))”函数对所有谱进行基线校正。
膜降解测试
最初,通过将膜浸入1M NaCl水溶液中48小时(中途用新鲜的1M NaCl交换溶液),然后用去离子水洗涤48小时,进行多次新鲜交换,将HMT-PMPI膜从铸态(as-cast)碘化物形式转化为氯化物形式。然后将膜在80℃、90℃和100℃下在封闭的玻璃容器中分别经受1、2、5、7和10M NaOH水溶液7天。然后通过如前所述重复1M NaCl水溶液浸泡(48小时)和水洗(48小时)将膜交换回氯化物形式。干燥膜后,将它们溶解在DMSO-d6中用于1H NMR谱分析。
离子导电性
最初,将HMT-PMPI的膜片在室温下在1M NaOH水溶液中浸泡48小时(中途进行一次新鲜交换),然后用去离子水洗涤超过48小时,在室温下在空气中进行多次新鲜交换。使用两点探针通过电化学阻抗谱在面内方向上测量膜的混合氢氧化物/碳酸氢盐/碳酸盐离子电阻。通过相同的方式而不是通过浸泡在1M NaCl水溶液中获得其氯化物形式的HMT-PMPI。具体地,在室温下和在水中使用Solartron SI 1260阻抗/增益相位分析仪在100-107Hz的频率范围内施加交流(AC)电势。膜电荷转移电阻(R),由标准Randles电路与测量的奈奎斯特图的最佳拟合确定,用于根据公式6计算离子电导率(σ):
其中l是两个电极之间的距离,而A是膜的横截面积。
吸水率
如先前的离子导电性部分所述,将膜交换成混合的氢氧化物/碳酸氢盐/碳酸盐形式和氯化物形式。然后将水合膜从去离子水溶液中取出,在Kimwipes之间按压以除去表面上的任何过量的水,并立即称重(Ww)。然后将湿膜在40℃下真空干燥直至获得恒定的干重(Wd)。使用公式7计算三个样品的吸水率(Wu),并使用标准偏差作为误差。
机械强度
使用标准ASTM D638-4切割机将膜冲切成杠铃形状。在环境条件下在单柱系统(Instron 3344系列)上使用5mm min-1的十字头速度(crosshead speed)测量膜的机械性能。测定的拉伸强度和断裂伸长率是对三个样品取的平均值。报告的误差是标准偏差。
DFT计算
在Gaussian G09下使用B3LYP密度泛函理论(DFT)运行沿HIm、MeIm和PhIm的降解路径的结构,如例如在Frisch,M.J.等,Gaussian~09Revision D.01(GaussianInc.Wallingford CT,2009)中所述,其通过引用整体并入本文。G09中实现的极化连续模型(PCM)使用积分方程形式(IEFPCM),以水为溶剂(ε=78.36)。所有结构均使用6-31G(d)基组进行预优化,并用6-311++G(2d,2p)基组细化,收敛准则严格且无对称性。将试剂、中间体(IS)和产物(P)优化至最小能量。使用Berny算法优化过渡态(TS),其具有一个假想的频率,并通过计算内禀反应坐标(IRC)确认。进行298.15K的频率分析以获得反应自由能(ΔG)和反应自由活化能给出关于试剂自由能的总和的值:咪唑鎓阳离子+2OH-用于开环反应,和咪唑鎓阳离子+OH-用于去甲基化反应。支持信息包括试剂的坐标和沿着降解反应路径的所有确定的过渡态结构。
单晶X射线衍射(XRD)
在配备有APEX II CCD面积检测器的Bruker Smart仪器上收集X射线数据,该面积检测器固定在距离晶体5.0cm的距离处,并且Cu Kα精细聚焦密封管以1.5kW(50kV,30mA)运行,用石墨单色器过滤。在环境条件下收集数据。所有衍射数据均使用Bruker Apex II软件套件处理。用直接方法(SIR92)解析结构,并使用ShelXle进行随后的细化,如例如Hübschle,C.B.等,B.J.Appl.Crystallogr.2011,44,1281中所述,其通过引用整体并入本文。MeIm以碘化物形式从水中结晶。
掺入AEMFC
通过将5wt%碘化物形式的HMT-PMPI在MeOH中的分散体滴加到快速搅拌的Pt/C催化剂在水-甲醇溶液中的浆液中形成催化剂油墨。在最终的催化剂油墨中,溶剂比为3:1的MeOH:H2O,固体占1wt%,并且离聚物占固体的15wt%,余量为Pt/C电催化剂。使用市售的10wt%Pt/C作为均聚物直接膜沉积电池的电催化剂。通过超声喷雾涂布机(Sono-TekExactacoat SC)将催化剂油墨涂布至加热的基材(70℃,Sigracet 24BC气体扩散层)上至0.5mg Pt/cm2的负载量,以形成气体扩散电极(GDE)。为了形成直接膜沉积(DMD)型燃料电池,以与Vierrath,S.等,Power Sources,2016,326,170-175中描述的类似方法(该文献通过引用整体并入本文),将2.5wt%碘化物形式的HMT-PMPI的MeOH溶液喷雾到GDE上至按重量计10μm的厚度(即,当构造时总膜厚度为20μm)。这些FC结构的深入比较(in-depthcomparison)可见于Klingele,M.等,Electrochem.Comm.,2016,70,65-68中,其通过引用并入本文。将所有组分在6M KOH中浸泡24至48小时。
作为AEMFC运行
向得到的DMD加衬垫以确保GDL的20-30%的压缩,并在燃料电池硬件中压缩至3.4N·m(30in·lbs)以形成AEMFC。采用具有加热加湿器和电路中断系统的测试站,用于连续测量膜/离聚物电阻(iR)(Teledyne Medusa RD 890CL,Scribner Associates)。将FC加热至给定温度并通过单个缓慢电流斜坡调节以保持0.4-0.5V直至实现稳定电位。
AEMFC的电化学分析
使用公式8,由膜厚度-L(cm)、膜的横截面积-A(cm2)和在欧姆区域中测量的膜/离聚物电阻确定膜的原位氢氧根电导率(σOH-):
误差分析考虑iR数据和膜厚度两者。这是我们组中的标准方法,保守并且与标准参考膜,例如在Skalski,T.J.G.;Britton,B.;Peckham,T.J.;Holdcroft,S.J.Am.Chem.Soc.,2015,137,12223-12226和Adamski,M.等,Angew.Chem.Intl.Ed.,2017,56(其各自整体并入本文)中所述的诸如Nafion 211和212一致。
稳定性和降解特性
对在苛性碱溶液中的降解程度进行定量,并确定三种咪唑鎓阳离子的降解路径,所述三种咪唑鎓阳离子具有连接至C2-苯基的邻位氢(HIm)、甲基(MeIm)和苯基(PhIm)基团(化学结构示于图1E中)。如上所述,通过中间体化合物1-8合成这些模型化合物。图1A中示出了在80℃下作为时间函数的在3M NaOD/CD3OD/D2O(7:3wt.CD3OD:D2O)中剩余的每种模型化合物的百分比。在80℃下240小时后,在溶液中分别剩余88%、98%和93%的HIm、MeIm和PhIm。根据1H NMR谱和质谱,MeIm和PhIm阳离子通过N-甲基的去甲基化分解(图5B和5C)。HIm的降解路径更复杂,观察到归因于开环的另外的产物(图5A)。通过将降解速率拟合为指数函数,表示伪一级降解,计算化合物的半衰期(t1/2)。为了比较,还在相同的条件下对各种叔烷基铵阳离子和苯并咪唑鎓阳离子(参见Wright,A.G.等,S.Angew.Chem.Int.Ed.2016,55,4818,其通过引用整体并入本文)进行评估(图1B)。这些模型化合物中最稳定的是MeIm,其表现出>5000h的t1/2,远高于基准叔烷基铵TMA和BTMA阳离子(2069h和180h)和苯并咪唑鎓阳离子MeB和PhB(436h和3240h)。
观察到降解速率取决于D2O中CD3OD的重量分数(χCD3OD),如图1C和1D所示。减少氘代甲醇的量导致MeIm的降解速率降低。不希望受理论限制,据信甲醇通常用于“水性”降解实验,因为它是试剂和产物的溶剂,因此使得NMR谱分析能够进行。然而,在水性降解研究中使用甲醇是误导性的,因为甲醇可能改变降解路径。因此,将MeIm在3、5、7和10M NaOD的水溶液中在80℃和100℃下加热240小时。通过NMR谱未观察到降解(<1%实验误差)。
由于发现MeIm在高浓度苛性碱溶液中表现出最高的稳定性,因此将聚(亚芳基-咪唑鎓)HMT-PMPI设计为包含相同的邻甲基结构,如图2A所示。通过二醛10与双苯偶酰的微波辅助缩聚反应制备聚合物骨架聚(亚芳基-咪唑)HMT-PPI。随后的去质子化和烷基化产生期望的甲基保护的聚(亚芳基-咪唑鎓)(HMT-PMPI),其具有67kg mol-1Mw和1.39PDI,其由DMSO浇铸成韧性、柔性、透明的黄色膜(图2B和2C),具有43.5±1.4MPa的拉伸强度和44.3±9.6%的断裂伸长率。在将膜转化为其氢氧化物形式后,HMT-PMPI具有2.61meq g-1的离子交换容量(IEC)。在其完全水合状态下,它在25℃下表现出14mS cm-1的空气平衡离子电导率和82±5wt%的吸水率,后者代表每离子对18H2O。聚电解质膜的空气平衡的OH-形式在25℃下不溶于水,但在80℃以上缓慢溶解于纯水。如先前针对HMT-PMBI所示,通过降低IEC可使聚合物不可溶。参见,例如,Wright,A.G.Holdcroft,S.ACS Macro Lett.2014,3,444;Wright,A.G.等,Energy Environ.Sci.2016,9,2130;和Thomas,O.D.等;Polym.Chem.2011,2,1641;和Weissbach,等,T.;Wright,A.G.;Peckham,T.J.;Alavijeh,A.S.;Pan,V.;Kjeang,E.;Holdcroft,S.Chem.Mater.2016,28,8060.21.Li,N.;Leng。
聚合物在80℃下不溶于pH13以上的碱性溶液。AEM对苛性碱溶液的稳定性通常通过在高温下将其浸入氢氧化物水溶液中持续长时间进行测量。由于实验的不均一性,该过程通常导致非一级降解速率,其中降解在实验开始时快速发生(在约100小时内)。当将HMT-PMPI的薄膜(25μm)浸入1、2、5、7和10M KOH水溶液中,加热至80、90和100℃持续7天(168h)时,通过1H NMR谱未观察到聚合物降解,例如,如图3和6所示。就可计算寿命的幅度而言,HMT-PMPI在100℃下在10M KOH水溶液中表现出半衰期>5000小时。
为了解释所研究的化学结构之间的稳定性差异,根据Long,H.;Pivovar,B.J.Phys.Chem.C 2014,118,9880(通过引用整体并入本文)报道的方案,使用密度泛函理论(DFT)确定沿两种降解路径的状态的自由能:去甲基化和开环(图4A)。计算的通过去甲基化的降解的自由能HIm(27.1kcal mol-1),MeIm(26.9kcal mol-1)和Phmm(27.3kcal mol-1)非常相似(结构见图7),这表明邻甲基空间保护基团对去甲基化速率没有影响。相比之下,开环降解的第一过渡态的自由能(结构参见图8)从14.6kcal mol-1(HIm)增加至27.7kcal mol-1(MeIm),和增加至30.2kcal mol-1(PhIm),其涉及在C2位置加成OH-以形成ISC2。降解机理取决于TSSN2和TSC2之间的活化自由能差。例如,HIm的TSC2比低12.5kcal mol-1,表明通过开环的降解是降解路径。相反,MeIm和PhIm的都大于表明去甲基化是主要降解机制。降解机制的变化是对C2位置空间保护的结果,与实验数据吻合良好。另外,MeIm和PhIm的计算的结构揭示,咪唑鎓平面和C2连接的苯基之间的二面角比观察到的HIm的所述二面角更大(图9);二面角从HIm的59°增加到MeIm的79°、到Phm的69°。二面角似乎与分子稳定性有关。尽管证明了HIm在该工作中测试的三种模型化合物的最低稳定性,但是HIm表现出相对于文献中报道的其它2-苯基咪唑鎓的高稳定性(在3M NaOD中在80℃下t1/2 1370h)。发现1,3-二甲基-2-苯基咪唑鎓(具有57°的二面角)在1MNaOH的更温和的碱性条件下在80℃下表现出107小时的t1/2。参见Price,S.C.,Williams,K.S.;Beyer,F.L.ACS Macro Lett.2014,3,160,其通过引用整体并入本文。在80℃下在2MKOH水溶液中168小时后,3-乙基-1-甲基-2-苯基咪唑鎓降解26%。参见Lin,B.;Dong,H.;Li,Y.;Si,Z.;Gu,F.;Yan,F.Chem.Mater.2013,25,1858,其通过引用整体并入本文。因此,证实稳定性的改善归因于HIm的4,5-二苯基取代基。另外,MeIm的单晶XRD结构以其碘化物形式(图4B)揭示了固态二面角之一为90°,使得位于C2位置侧面的甲基作为有效的C2保护基团。HMT-PMPI具有与C2位置邻近的相同的空间位阻基团和均三甲苯基团,预期其相对于咪唑鎓基团具有90°角,这解释了在腐蚀性的苛性碱条件下该阴离子交换聚合物的稳定性。
OH-的水合水平对阳离子基团的稳定性具有关键影响,表明当前使用的用于测定阳离子基团的碱稳定性的水基碱性非原位法可能低估了在燃料电池应用的特定情况下阳离子的稳定性,但此断言不适用于其他应用,例如碱性膜电解槽、金属-空气电池或电渗析,其中保持阳离子膜暴露于苛性碱液体。在80℃下运行的0.5/0.5mg Pt·cm-2和膜厚度为20μm的碱性交换膜燃料电池(AEMFC)在电流密度为1.8A·cm-2、零背压下获得818mW的功率密度(图10)。阳极/阴极的条件是0.5/0.25slpm H2/O2和70%/100%RH。这是在零背压下在AEMFC中实现的最高功率密度之一。此外,由高频电阻估算的原位氢氧根电导率为280±80mS·cm,其比非原位电导率测量值大一个数量级。由于膜的过度膨胀及其在这些温度下的部分溶解,在总运行10小时的时间内AEMFC的性能降低,这与在100℃下溶于水中的完全甲基化的HMT-PMPI的观察结果一致。
尽管已经说明和描述了说明性实施方案,但应当理解,在不脱离本发明的公开内容的精神和范围的情况下,可以在其中进行各种改变。
Claims (51)
1.一种包含式(I)的重复单元的聚合物:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地为甲基;和
R8、R9、R12和R13各自独立地选自氢、烷基、全氟烷基和杂烷基。
2.权利要求1所述的聚合物,其中所述聚合物包含式(I-A)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基是中性的;
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地为甲基;和
R8、R9、R12和R13各自独立地选自氢、烷基、全氟烷基和杂烷基。
3.权利要求1所述的聚合物,其中所述聚合物包含式(I-B)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地为甲基;和
R8、R9、R12和R13各自独立地选自氢、烷基、全氟烷基和杂烷基。
4.权利要求1所述的聚合物,其中所述聚合物包含式(I-C)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1和R2所连接的咪唑基是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地为甲基;和
R8、R9、R12和R13各自独立地选自氢、烷基、全氟烷基和杂烷基。
5.权利要求1所述的聚合物,其中所述聚合物包含式(I-D)的重复单元:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R15为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R16为亚芳基,任选地被1、2、3或4个取代基取代,所述取代基独立地选自烷基、全氟烷基、杂烷基和卤素;
R7、R10、R11和R14各自独立地为甲基;和
R8、R9、R12和R13各自独立地选自氢、烷基、全氟烷基和杂烷基。
6.权利要求1至5中任一项所述的聚合物,其中R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基和芳基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基和芳基;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基和芳基。
7.权利要求1至5中任一项所述的聚合物,其中R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基和杂烷基;条件是
R1和R2中的至少一个选自烷基、全氟烷基和杂烷基;和
R4和R5中的至少一个选自烷基、全氟烷基和杂烷基。
8.权利要求1至5中任一项所述的聚合物,其中R1、R2、R4和R5各自独立地选自不存在、甲基和三氟甲基;条件是
R1和R2中的至少一个选自甲基和三氟甲基;和
R4和R5中的至少一个选自甲基和三氟甲基。
9.权利要求1所述的聚合物,其中R3和R6各自独立地为芳基。
10.权利要求1所述的聚合物,其中R3和R6各自独立地为苯基。
11.权利要求1所述的聚合物,其中R3和R6各自独立地为甲基。
12.权利要求1所述的聚合物,其中R15和R16各自独立地为亚芳基,任选地被1、2、3或4个独立地选自烷基和卤素的取代基取代。
13.权利要求1所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、乙酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
14.权利要求1所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
15.权利要求1所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
16.一种包含式(II)的重复单元的聚合物:
其中:
R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基、杂烷基、芳基和芳烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基,
当R1和R2中的一个不存在时,不存在的R1或R2所连接的咪唑基是中性的;和
R4和R5中的至少一个选自烷基、全氟烷基、杂烷基、芳基和芳烷基;和
当R4和R5中的一个不存在时,不存在的R4或R5所连接的咪唑基是中性的;
R3和R6各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R7、R10、R11和R14各自独立地为甲基;和
R8和R12各自独立地选自氢、烷基、全氟烷基和杂烷基。
17.权利要求16所述的聚合物,其中R1、R2、R4和R5各自独立地选自不存在、烷基、全氟烷基和杂烷基;
条件是
R1和R2中的至少一个选自烷基、全氟烷基和杂烷基;和
R4和R5中的至少一个选自烷基、全氟烷基和杂烷基。
18.权利要求16所述的聚合物,其中R1、R2、R4和R5各自独立地选自不存在、甲基和三氟甲基;
条件是:
R1和R2中的至少一个选自甲基和三氟甲基,并且
R4和R5中的至少一个选自甲基和三氟甲基。
19.权利要求16至18中任一项所述的聚合物,其中R3和R6各自独立地为芳基。
20.权利要求16至18中任一项所述的聚合物,其中R3和R6各自独立地为苯基。
21.权利要求16至18中任一项所述的聚合物,其中R3和R6各自独立地为甲基。
22.权利要求16至18中任一项所述的聚合物,其中R8和R12各自独立地为烷基。
23.权利要求16至18中任一项所述的聚合物,其中R8和R12各自独立地为甲基。
24.权利要求16至18中任一项所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、乙酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
25.权利要求16至18中任一项所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
26.权利要求16至18中任一项所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
30.权利要求27或28所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、乙酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
31.权利要求27或28所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
32.权利要求27或28所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
33.权利要求27或28所述的聚合物,还包含一个或多个氢氧根阴离子,其中所述一个或多个氢氧根阴离子抵消聚合物中的一个或多个正电荷。
34.一种包含式(IV-A)、式(IV-B)和式(IV-C)的重复单元的无规聚合物:
(IV-C)
其中,
R1a和R2a中的一个不存在,而剩余的R1a或R2a选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R4a和R5a中的一个不存在,而剩余的R4a或R5a选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R1b、R2b、R4b和R5b中的一个不存在,并且不存在的R1b、R2b、R4b或R5b所连接的咪唑基是中性的,而R1b、R2b、R4b和R5b中的其余三个各自独立地选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R1c、R2c、R4c和R5c各自独立地选自烷基、全氟烷基、杂烷基、芳基和芳烷基;
R3a、R6a、R3b、R6b、R3c和R6c各自独立地选自烷基、全氟烷基、杂烷基、芳基、芳烷基和杂芳基;
R7a、R10a、R11a、R14a、R7b、R10b、R11b、R14b、R7c、R10c、R11c和R14c各自独立地为甲基;和
R8a、R12a、R8b、R12b、R8c和R12c各自独立地选自氢、烷基、全氟烷基和杂烷基;
其中所述聚合物包含m摩尔%的式(IV-A)的重复单元、n摩尔%的式(IV-B)的重复单元和p摩尔%的式(IV-C)的重复单元,和
m为0摩尔%至60摩尔%,
n+p为40摩尔%至100摩尔%,和
m+n+p=100%。
35.权利要求34所述的聚合物,其中R1a和R2a中的一个不存在,而剩余的R1a或R2a选自甲基和三氟甲基;并且R4a和R5a中的一个不存在,而剩余的R4a或R5a选自甲基和三氟甲基。
36.权利要求34或权利要求35所述的聚合物,其中R1b、R2b、R4b和R5b中的一个不存在,并且不存在的R1b、R2b、R4b或R5b所连接的咪唑基是中性的,而R1b、R2b、R4b和R5b中的其余三个各自独立地选自烷基、全氟烷基和杂烷基。
37.权利要求34或权利要求35所述的聚合物,其中R1b、R2b、R4b和R5b中的一个不存在,并且不存在的R1b、R2b、R4b或R5b所连接的咪唑基是中性的,而R1b、R2b、R4b和R5b中的其余三个各自独立地选自甲基和三氟甲基。
38.权利要求34或权利要求35所述的聚合物,其中R1c、R2c、R4c和R5c各自独立地选自烷基、全氟烷基和杂烷基。
39.权利要求34或权利要求35所述的聚合物,其中R1c、R2c、R4c和R5c各自独立地选自甲基和三氟甲基。
40.权利要求34或权利要求35所述的聚合物,其中R1c、R2c、R4c和R5c各自为甲基。
41.权利要求34或权利要求35所述的聚合物,其中R3a、R6a、R3b、R6b、R3c和R6c各自独立地为芳基。
42.权利要求34或权利要求35所述的聚合物,其中R3a、R6a、R3b、R6b、R3c和R6c各自独立地为苯基。
43.权利要求34或权利要求35所述的聚合物,其中R8a、R12a、R8b、R12b、R8c和R12c各自独立地为烷基。
44.权利要求34或权利要求35所述的聚合物,其中R8a、R12a、R8b、R12b、R8c和R12c各自独立地为甲基。
45.权利要求34或权利要求35所述的聚合物,其中n和p各自大于0%。
46.权利要求34或权利要求35所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、三碘离子、氢氧根、碳酸根、碳酸氢根、氰根、乙酸根、硝酸根、硫酸根、磷酸根、三氟甲磺酸根、甲苯磺酸根、四(3,5-双(三氟甲基)苯基)硼酸根、双(三氟甲烷)磺酰胺根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
47.权利要求34或权利要求35所述的聚合物,还包含一个或多个阴离子X-,其选自碘离子、溴离子、氯离子、氟离子、氢氧根、碳酸根、碳酸氢根及其任意组合,其中所述一个或多个阴离子X-抵消聚合物中的一个或多个正电荷。
48.权利要求34或权利要求35所述的聚合物,还包含一个或多个氢氧根阴离子,其中所述一个或多个氢氧根阴离子抵消聚合物中的一个或多个正电荷。
49.一种离子膜,其包含权利要求1、16、27或34所述的聚合物。
50.一种离聚物,其包含权利要求1、16、27或34所述的聚合物。
51.权利要求50所述的离聚物,其掺入燃料电池、电解槽或其它电化学装置的催化剂层中。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662368667P | 2016-07-29 | 2016-07-29 | |
| US62/368667 | 2016-07-29 | ||
| PCT/US2017/044554 WO2018023097A1 (en) | 2016-07-29 | 2017-07-29 | Stable ply(imidazolium) hydroxides |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN109923104A CN109923104A (zh) | 2019-06-21 |
| CN109923104B true CN109923104B (zh) | 2022-12-06 |
Family
ID=61017214
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780056571.9A Active CN109923104B (zh) | 2016-07-29 | 2017-07-29 | 稳定的聚(咪唑鎓)氢氧化物 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US11299464B2 (zh) |
| EP (1) | EP3490976B1 (zh) |
| JP (1) | JP7010500B2 (zh) |
| CN (1) | CN109923104B (zh) |
| AU (1) | AU2017301884B2 (zh) |
| CA (1) | CA3032388A1 (zh) |
| DK (1) | DK3490976T3 (zh) |
| ES (1) | ES2952539T3 (zh) |
| FI (1) | FI3490976T3 (zh) |
| HR (1) | HRP20230899T1 (zh) |
| HU (1) | HUE062710T2 (zh) |
| LT (1) | LT3490976T (zh) |
| PL (1) | PL3490976T3 (zh) |
| PT (1) | PT3490976T (zh) |
| WO (1) | WO2018023097A1 (zh) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6917999B2 (ja) * | 2016-01-08 | 2021-08-11 | サイモン フレーザー ユニバーシティー | ポリ(フェニレン)及びベンゾイミダゾリウムヒドロキシドのための保護基としてのm−テルフェニル |
| CN109863227B (zh) * | 2016-08-04 | 2023-01-10 | 西蒙弗雷泽大学 | 氢氧化物稳定的聚苯并咪唑鎓和聚咪唑鎓膜和离聚物的交联 |
| CN111848520B (zh) * | 2020-08-10 | 2022-02-22 | 中国科学院长春应用化学研究所 | 一种咪唑鎓盐单体及其制备方法和聚合物电解质材料及其制备方法和应用 |
| AU2022236306A1 (en) * | 2021-03-19 | 2023-10-12 | Ionomr Innovations, Inc. | Antiviral and antimicrobial coatings and methods thereof |
| CN115109235B (zh) * | 2022-07-18 | 2023-07-04 | 烟台九目化学股份有限公司 | 一种咪唑型基团功能化的聚合物及其制备方法和应用 |
| CN115181250B (zh) * | 2022-08-10 | 2023-07-04 | 烟台九目化学股份有限公司 | 一种侧链咪唑功能化的聚合物及其制备方法和应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013149328A1 (en) * | 2012-04-04 | 2013-10-10 | Simon Fraser University | Anion-conducting polymer |
| WO2015157848A1 (en) * | 2014-04-15 | 2015-10-22 | Simon Fraser University | Hydroxide-stable ionenes |
| CN105175455A (zh) * | 2015-09-05 | 2015-12-23 | 四川大学 | 咪唑鎓为阳离子的水溶性联吡啶-钌类光敏剂及其在染料敏化太阳能电池中的应用 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL267363A (zh) | 1960-07-23 | |||
| KR100411465B1 (ko) | 2001-10-26 | 2003-12-18 | 한국과학기술연구원 | 폴리페닐렌을 갖는 플로렌계 화합물, 그 중합체 및 이들을포함하는 el 소자 |
| US7301002B1 (en) | 2003-10-14 | 2007-11-27 | Sandia Corporation | Sulfonated polyphenylene polymers |
| JP4565879B2 (ja) | 2004-04-19 | 2010-10-20 | ルネサスエレクトロニクス株式会社 | 半導体装置 |
| KR100612873B1 (ko) | 2004-11-20 | 2006-08-14 | 삼성에스디아이 주식회사 | 금속 촉매와 전극의 제조방법 |
| JP2009087687A (ja) | 2007-09-28 | 2009-04-23 | Sanyo Chem Ind Ltd | ガス電極 |
| WO2009134227A1 (en) | 2008-05-02 | 2009-11-05 | Energy Materials Corporation | Pol yarylene polymers resulting from diels-alder reaction |
| US8110636B1 (en) | 2009-04-17 | 2012-02-07 | Sandia Corporation | Multi-block sulfonated poly(phenylene) copolymer proton exchange membranes |
| WO2011046661A1 (en) * | 2009-07-24 | 2011-04-21 | The Regents Of The University Of Colorado, A Body Corporate | Imidazolium-based room-temperature ionic liquids, polymers monomers and membranes incorporating same |
| JP2012128142A (ja) | 2010-12-15 | 2012-07-05 | Konica Minolta Business Technologies Inc | トナーの製造方法およびトナー |
| US9263524B2 (en) | 2011-04-05 | 2016-02-16 | The Board Of Trustees Of The Leland Stanford Junior University | Semiconductor materials, apparatuses and methods |
| KR101293196B1 (ko) | 2011-04-11 | 2013-08-05 | 한국과학기술연구원 | 폴리벤즈이미다졸리움 및 폴리벤즈이미다졸리움 기반 고체 전해질 |
| WO2014012188A1 (en) | 2012-07-20 | 2014-01-23 | Zhongwei Chen | Highly ion-conductive nano-engineered porous electrolytic composite membrane for alkaline electrochemical energy systems |
| EP3125884B1 (en) | 2014-04-04 | 2019-11-06 | The Regents of the University of Michigan | Small molecule inhibitors of mcl-1 and uses thereof |
| KR20150122535A (ko) | 2014-04-23 | 2015-11-02 | 한국과학기술연구원 | 디벤질화 폴리벤지이미다졸계 고분자 및 그 제조 방법 |
| CA2933312C (en) | 2015-02-23 | 2017-02-07 | Nigel Andrew Shaw | A device for enhancing and/or maintaining a penile erection |
-
2017
- 2017-07-29 AU AU2017301884A patent/AU2017301884B2/en active Active
- 2017-07-29 JP JP2019504901A patent/JP7010500B2/ja active Active
- 2017-07-29 US US16/321,414 patent/US11299464B2/en active Active
- 2017-07-29 CN CN201780056571.9A patent/CN109923104B/zh active Active
- 2017-07-29 HR HRP20230899TT patent/HRP20230899T1/hr unknown
- 2017-07-29 HU HUE17835398A patent/HUE062710T2/hu unknown
- 2017-07-29 DK DK17835398.3T patent/DK3490976T3/da active
- 2017-07-29 WO PCT/US2017/044554 patent/WO2018023097A1/en unknown
- 2017-07-29 FI FIEP17835398.3T patent/FI3490976T3/fi active
- 2017-07-29 PL PL17835398.3T patent/PL3490976T3/pl unknown
- 2017-07-29 PT PT178353983T patent/PT3490976T/pt unknown
- 2017-07-29 LT LTEPPCT/US2017/044554T patent/LT3490976T/lt unknown
- 2017-07-29 CA CA3032388A patent/CA3032388A1/en active Pending
- 2017-07-29 ES ES17835398T patent/ES2952539T3/es active Active
- 2017-07-29 EP EP17835398.3A patent/EP3490976B1/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013149328A1 (en) * | 2012-04-04 | 2013-10-10 | Simon Fraser University | Anion-conducting polymer |
| WO2015157848A1 (en) * | 2014-04-15 | 2015-10-22 | Simon Fraser University | Hydroxide-stable ionenes |
| CN105175455A (zh) * | 2015-09-05 | 2015-12-23 | 四川大学 | 咪唑鎓为阳离子的水溶性联吡啶-钌类光敏剂及其在染料敏化太阳能电池中的应用 |
Non-Patent Citations (3)
| Title |
|---|
| Hexamethyl-p -terphenyl poly(benzimidazolium):a universal hydroxide-conducting polymer for energy conversion devices;Andrew G. Wright 等;《Energy & Environmental Science》;20160525;第9卷;全文 * |
| Hydroxide Degradation Pathways for Imidazolium Cations:A DFT Study;Hai Long等;《The Journal of Physical Chemistry》;20141231;摘要 * |
| Hydroxide-Stable Ionenes;Andrew G.Wright 等;《ACS Macro Letters》;20141231;第3卷;摘要,第9887页结论部分 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3490976B1 (en) | 2023-06-07 |
| US11299464B2 (en) | 2022-04-12 |
| US20190382353A1 (en) | 2019-12-19 |
| HRP20230899T1 (hr) | 2023-11-24 |
| DK3490976T3 (da) | 2023-08-21 |
| PL3490976T3 (pl) | 2023-11-20 |
| LT3490976T (lt) | 2023-09-25 |
| CN109923104A (zh) | 2019-06-21 |
| PT3490976T (pt) | 2023-08-08 |
| JP7010500B2 (ja) | 2022-01-26 |
| WO2018023097A8 (en) | 2018-05-24 |
| HUE062710T2 (hu) | 2023-11-28 |
| WO2018023097A1 (en) | 2018-02-01 |
| EP3490976A4 (en) | 2020-04-01 |
| CA3032388A1 (en) | 2018-02-01 |
| AU2017301884A1 (en) | 2019-02-14 |
| AU2017301884B2 (en) | 2021-06-24 |
| FI3490976T3 (fi) | 2023-08-21 |
| EP3490976A1 (en) | 2019-06-05 |
| ES2952539T3 (es) | 2023-11-02 |
| JP2019532116A (ja) | 2019-11-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN109923104B (zh) | 稳定的聚(咪唑鎓)氢氧化物 | |
| Dang et al. | A comparative study of anion-exchange membranes tethered with different hetero-cycloaliphatic quaternary ammonium hydroxides | |
| JP7001284B2 (ja) | 水酸化物安定性のポリベンズイミダゾリウム及びポリイミダゾリウムの膜及びイオノマーの架橋 | |
| Dang et al. | Alkali-stable and highly anion conducting poly (phenylene oxide) s carrying quaternary piperidinium cations | |
| CN108358767B (zh) | 含五苯甲基苯双氟单体、制备方法及其在聚芳醚酮功能膜中的应用 | |
| Wang et al. | Alkaline stability of poly (phenylene oxide) based anion exchange membranes containing imidazolium cations | |
| Jiang et al. | Imidazolium structural isomer pyrazolium: a better alkali-stable anion conductor for anion exchange membranes | |
| JP6917999B2 (ja) | ポリ(フェニレン)及びベンゾイミダゾリウムヒドロキシドのための保護基としてのm−テルフェニル | |
| CN117003969A (zh) | 亚苯基聚合物、方法及其用途 | |
| Molavian et al. | A new sulfonated poly (ether sulfone) hybrid with low humidity dependence for high‐temperature proton exchange membrane fuel cell applications | |
| Wang et al. | Ionic liquids as green reaction media for synthesis of poly (aryl ether ketone) s | |
| KR20150122535A (ko) | 디벤질화 폴리벤지이미다졸계 고분자 및 그 제조 방법 | |
| Boström et al. | Alkali-stable polybenzimidazole anion exchange membranes tethered with N, N-dimethylpiperidinium cations for dilute aqueous KOH fed water electrolyzers | |
| Marestin et al. | Synthesis of sulfonate ester and sulfonic acid-containing poly (arylene perfluorocyclobutane) s (PFCB) by direct copolymerization of a sulfonate ester-containing precursor | |
| Krishnan et al. | A functional monomer to synthesize sulfonated poly (ether ether ketone) with sulfonic acid group in the pendant side chain | |
| JP2005171087A (ja) | プロトン伝導性電解質及び燃料電池 | |
| KR101785303B1 (ko) | 디벤질화 폴리벤지이미다졸계 고분자 및 그 제조 방법 | |
| JP2005239833A (ja) | スルホン酸基を有するポリアリーレンおよびそれからなるプロトン伝導膜ならびにスルホン酸基を有するポリアリーレンの製造方法 | |
| Li | Poly (arylene imidazolium) s: Towards stable hydroxide ion exchange membranes | |
| WO2006135114A1 (ja) | オキソカーボン分子を含む電解質及びその用途 | |
| CA3212249A1 (en) | Long-term anion-conducting compound, its preparation and its use in electrochemistry | |
| JP2014098086A (ja) | ポリメタフェニレンおよびその用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |