CN109640645B - 用于治疗疾病的遗传修饰的细胞、组织和器官 - Google Patents
用于治疗疾病的遗传修饰的细胞、组织和器官 Download PDFInfo
- Publication number
- CN109640645B CN109640645B CN201780049966.6A CN201780049966A CN109640645B CN 109640645 B CN109640645 B CN 109640645B CN 201780049966 A CN201780049966 A CN 201780049966A CN 109640645 B CN109640645 B CN 109640645B
- Authority
- CN
- China
- Prior art keywords
- cells
- genetically modified
- cell
- human
- hla
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0278—Humanized animals, e.g. knockin
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0008—Antigens related to auto-immune diseases; Preparations to induce self-tolerance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70539—MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/8509—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/15—Animals comprising multiple alterations of the genome, by transgenesis or homologous recombination, e.g. obtained by cross-breeding
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/106—Primate
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/108—Swine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/02—Animal zootechnically ameliorated
- A01K2267/025—Animal producing cells or organs for transplantation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/8509—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic
- C12N2015/8518—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic expressing industrially exogenous proteins, e.g. for pharmaceutical use, human insulin, blood factors, immunoglobulins, pseudoparticles
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/10—Plasmid DNA
- C12N2800/106—Plasmid DNA for vertebrates
- C12N2800/107—Plasmid DNA for vertebrates for mammalian
Abstract
本文公开了用于治疗或预防疾病的遗传修饰的细胞、组织和器官。还公开了制备所述遗传修饰的细胞和非人动物的方法。所述遗传修饰可包括被转录为在3’非翻译区中包含缺失的人白细胞抗原G(HLA‑G)mRNA的核酸,或包含针对在猪细胞中表达进行了密码子优化的CD47基因的核酸。
Description
交叉引用
本申请要求2016年6月14日提交的第62/350,048号美国临时申请的权益,该美国临时申请通过引用以其整体并入本文。
背景技术
在接受者如人类中,可用于移植的器官、组织或细胞存在短缺。将器官、组织或细胞异种移植或同种异体移植入人类有可能满足这一需要并每年帮助成千上万人。基于与人类的解剖和生理相似性,可选择非人动物作为器官供体。此外,异种移植不仅涉及人类,还涉及兽医应用。
然而,未经修饰的野生型非人动物组织可被接受者(诸如人类) 通过免疫系统排斥。据认为,排斥反应至少部分地通过组织与抗体结合和细胞介导的免疫引起,从而导致移植物损失。例如,猪移植物可被由适应性免疫细胞介导的细胞机制所排斥。
援引并入
本文的所有出版物、专利和专利申请均通过引用而并入本文,其程度犹如特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。在本文的术语与并入的参考文献中的术语发生冲突的情况下,以本文的术语为准。
发明内容
在第一方面,本文公开了遗传修饰的非人动物,其包含与SEQ ID NO:359或SEQ IDNO:502至少95%相同的外源核酸序列。
在所述第一方面的一些实施方案中,所述外源核酸与SEQ ID NO: 359或SEQ IDNO:502至少96%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359或SEQ ID NO:502至少97%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359或SEQ ID NO:502至少98%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359或SEQ ID NO: 502至少99%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359 或SEQ ID NO:502 100%相同。
在第二方面,本文公开了遗传修饰的非人动物,其包含被转录为具有修饰的3’非翻译区的人白细胞抗原G(HLA-G)mRNA的外源核酸。
在所述第二方面的一些实施方案中,所述修饰的3’非翻译区包含一个或多个缺失。在一些实施方案中,与未修饰的HLA-G mRNA相比,所述修饰的3’非翻译区增加所述mRNA的稳定性。在一些实施方案中,所述HLA-G是HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6 或HLA-G7。在一些实施方案中,所述HLA-G是HLA-G1。在一些实施方案中,所述HLA-G是HLA-G2。
在所述第一或第二方面的一些实施方案中,所述遗传修饰的非人动物的至少一种细胞表达HLA-G蛋白质。在一些实施方案中,所述 HLA-G蛋白质是HLA-G1。
所述第一或第二方面的一些实施方案进一步包含编码β-2-微球蛋白(B2M)蛋白质的第二外源核酸。在一些实施方案中,所述B2M蛋白质是人B2M蛋白质。
在第三方面,本文公开了遗传修饰的非人动物,其包含与SEQ ID NO:240至少75%相同的外源核酸序列。
在所述第三方面的一些实施方案中,所述外源核酸序列与SEQ ID NO:240至少80%相同。在一些实施方案中,所述外源核酸序列与SEQ ID NO:240至少85%相同。在一些实施方案中,所述外源核酸序列与SEQ ID NO:240至少90%相同。在一些实施方案中,所述外源核酸序列与SEQ ID NO:240至少95%相同。在一些实施方案中,所述外源核酸序列与SEQ ID NO:240相同。
在所述第三方面的一些实施方案中,所述遗传修饰的非人动物的至少一种细胞表达人CD47蛋白质。
所述第三方面的一些实施方案进一步包含被转录为具有修饰的3’非翻译区的人白细胞抗原G(HLA-G)mRNA的第二外源核酸序列。在一些实施方案中,所述修饰的3’非翻译区包含一个或多个缺失。在一些实施方案中,与未修饰的HLA-G mRNA相比,所述修饰的3’非翻译区增加所述mRNA的稳定性。在一些实施方案中,所述HLA-G是HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7。在一些实施方案中,所述HLA-G是HLA-G1。在一些实施方案中,所述HLA-G 是HLA-G2。
在所述第三方面的一些实施方案中,所述第二外源核酸序列与 SEQ ID NO:359或SEQ ID NO:502至少95%、96%、97%、98%、99%或100%相同。
在所述第一、第二或第三方面的一些实施方案中,所述外源核酸序列与组成型活性内源启动子可操作地连接。
在所述第一、第二或第三方面的一些实施方案中,所述外源核酸序列插入到所述遗传修饰的非人动物的基因组中ROSA 26基因位点处。
在所述第一、第二或第三方面的一些实施方案中,所述外源核酸序列插入到所述遗传修饰的非人动物的基因组中有效降低糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)、β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)、 C-X-C基序趋化因子10(CXCL10)、MHC I类多肽相关序列A(MICA)、 MHC I类多肽相关序列B(MICB)、抗原加工相关转运体1(TAP1)、含有CARD结构域的NOD样受体家族成员5(NLRC5)或其组合的表达的位点处,所述降低表达是与没有所述外源核酸序列的相同物种的动物或所述外源核酸插入到不同位点上的相同物种的动物相比。
在所述第一、第二或第三方面的一些实施方案中,所述外源核酸序列插入到所述遗传修饰的非人动物的基因组中有效降低糖蛋白半乳糖基转移酶α1,3(GGTA1)的表达的位点处。
在所述第一、第二或第三方面的一些实施方案中,所述遗传修饰的非人动物进一步包含选自下组的一种或多种基因中的基因组破坏:糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)、β1,4N-乙酰基氨基半乳糖基转移酶 (B4GALNT2)、C-X-C基序趋化因子10(CXCL10)、MHC I类多肽相关序列A(MICA)、MHC I类多肽相关序列B(MICB)、抗原加工相关转运体1(TAP1)、含有CARD结构域的NOD样受体家族成员5 (NLRC5)及其任意组合。
在所述第一、第二或第三方面的一些实施方案中,所述遗传修饰的非人动物进一步包含选自下组的一种或多种基因中的基因组破坏:MHC I特异性增强体的组分、MHC I结合肽的转运体、自然杀伤细胞(NK) 族2D配体、CXC趋化因子受体(CXCR)3配体、MHC II反式激活因子(CIITA)、C3、不在人类中表达的内源基因及其任意组合。一些实施方案包括MHC I特异性增强体的组分的基因组破坏,其中所述MHC I 特异性增强体的组分是含有CARD结构域的NOD样受体家族成员5 (NLRC5)。一些实施方案包括MHC I结合肽的转运体的基因组破坏,其中所述转运体是抗原加工相关转运体1(TAP1)。一些实施方案包括 C3的基因组破坏。一些实施方案包括NK族2D配体的基因组破坏,其中所述NK族2D配体是MHC I类多肽相关序列A(MICA)或MHC I 类多肽相关序列B(MICB)。一些实施方案包括不在人类中表达的内源基因的基因组破坏,其中所述不在人类中表达的内源基因是糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)或β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)。一些实施方案包括CXCR3配体的基因组破坏,其中所述CXCR3配体是 C-X-C基序趋化因子10(CXCL10)。
在一些实施方案中,与没有所述基因组破坏的相同物种的动物相比,所述基因组破坏降低被破坏的基因的表达。
在一些实施方案中,与没有所述基因组破坏的相同物种的动物相比,所述基因组破坏降低来自被破坏的基因的蛋白质表达。
所述第一、第二或第三方面的一些实施方案进一步包括编码感染性细胞蛋白47(ICP47)的另外的外源核酸序列。
在所述第一、第二或第三方面的一些实施方案中,所述遗传修饰的非人动物是劳亚兽(Laurasiatheria)总目的成员。
在所述第一、第二或第三方面的一些实施方案中,所述遗传修饰的非人动物是有蹄类动物。
在所述第一、第二或第三方面的一些实施方案中,所述遗传修饰的非人动物是猪。
在所述第一、第二或第三方面的一些实施方案中,所述遗传修饰的非人动物是非人灵长类动物。
在所述第一、第二或第三方面的一些实施方案中,所述遗传修饰的非人动物是胎儿。
本文还公开了从所述第一、第二或第三方面的任何实施方案的遗传修饰的非人动物分离的细胞。在一些实施方案中,所述细胞是胰岛细胞。在一些实施方案中,所述细胞是干细胞。
本文还公开了从所述第一、第二或第三方面的任何实施方案的遗传修饰的非人动物分离的组织。在一些实施方案中,所述组织是实体器官移植物。在一些实施方案中,所述组织是肝的全部或一部分。在一些实施方案中,所述组织是肾的全部或一部分。
在第四方面,本文公开了非人细胞,其包含与SEQ ID NO:359或 SEQ ID NO:502至少95%相同的外源核酸序列。
在所述第四方面的一些实施方案中,所述外源核酸与SEQ ID NO: 359或SEQ IDNO:502至少96%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359或SEQ ID NO:502至少97%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359或SEQ ID NO:502至少98%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359或SEQ ID NO: 502至少90%相同。在一些实施方案中,所述外源核酸与SEQ ID NO:359 或SEQ ID NO:502 100%相同。
在所述第四方面的一些实施方案中,所述非人细胞在细胞表面上表达人白细胞抗原G1(HLA-G1)。
在第五方面,本文公开了非人细胞,其包含被转录为具有修饰的 3’非翻译区的人白细胞抗原G(HLA-G)mRNA的外源核酸。
在所述第五方面的一些实施方案中,所述修饰的3’非翻译区包含一个或多个缺失。在一些实施方案中,与未修饰的HLA-G mRNA相比,所述修饰的3’非翻译区增加所述mRNA的稳定性。
在所述第五方面的一些实施方案中,所述HLA-G是HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7。在一些实施方案中,所述HLA-G是HLA-G1。在一些实施方案中,所述HLA-G 是HLA-G2。
在所述第四或第五方面的一些实施方案中,所述非人细胞进一步包含编码β-2-微球蛋白(B2M)蛋白质的第二外源核酸。在一些实施方案中,所述B2M蛋白质是人B2M蛋白质。
在第六方面,本文公开了非人细胞,其包含与SEQ ID NO:240至少75%相同的外源核酸。
在所述第六方面的一些实施方案中,所述外源核酸序列与SEQ ID NO:240至少80%相同。
在一些实施方案中,所述外源核酸序列与SEQ ID NO:240至少 85%相同。在一些实施方案中,所述外源核酸序列与SEQ ID NO:240至少90%相同。在一些实施方案中,所述外源核酸序列与SEQ ID NO:240 至少95%相同。在一些实施方案中,所述外源核酸序列与SEQ ID NO:240 100%相同。
在所述第六方面的一些实施方案中,至少一种非人细胞表达人 CD47蛋白质。
在所述第六方面的一些实施方案中,所述非人细胞进一步包含被转录为具有修饰的3’非翻译区的人白细胞抗原G(HLA-G)mRNA的第二外源核酸序列。在一些实施方案中,所述修饰的3’非翻译区包含一个或多个缺失。在一些实施方案中,与未修饰的HLA-G mRNA相比,所述修饰的3’非翻译区增加所述mRNA的稳定性。在一些实施方案中,所述 HLA-G是HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6 或HLA-G7。在一些实施方案中,所述HLA-G是HLA-G1。在一些实施方案中,所述HLA-G是HLA-G2。在一些实施方案中,所述第二外源核酸序列与SEQ ID NO:359或SEQ ID NO:502至少95%、96%、97%、 98%、99%或100%相同。
在所述第四、第五或第六方面的一些实施方案中,所述外源核酸序列与组成型活性内源启动子可操作地连接。
在所述第四、第五或第六方面的一些实施方案中,所述外源核酸序列插入到所述非人细胞的基因组中ROSA 26基因位点处。
在所述第四、第五或第六方面的一些实施方案中,所述外源核酸序列插入到所述非人细胞的基因组中有效降低糖蛋白半乳糖基转移酶α1,3 (GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)、β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)、C-X-C基序趋化因子10(CXCL10)、MHC I类多肽相关序列A(MICA)、MHC I类多肽相关序列B(MICB)、抗原加工相关转运体1(TAP1)、含有CARD结构域的NOD样受体家族成员5(NLRC5)或其组合的表达的位点处,所述降低表达是与没有所述外源核酸序列的相同物种的细胞或其中所述外源核酸插入到不同位点上的相同物种的细胞相比。
在所述第四、第五或第六方面的一些实施方案中,所述外源核酸序列插入到所述非人细胞的基因组中降低糖蛋白半乳糖基转移酶α1,3 (GGTA1)的表达的位点处。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞进一步包含选自下组的一种或多种基因中的基因组破坏:糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)、β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)、C-X-C 基序趋化因子10(CXCL10)、MHC I类多肽相关序列A(MICA)、MHC I类多肽相关序列B(MICB)、抗原加工相关转运体1(TAP1)、含有 CARD结构域的NOD样受体家族成员5(NLRC5)及其任意组合。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞进一步包含选自下组的一种或多种基因中的基因组破坏:MHC I特异性增强体的组分、MHC I结合肽的转运体、自然杀伤细胞(NK)族2D配体、 CXC趋化因子受体(CXCR)3配体、MHC II反式激活因子(CIITA)、 C3、不在人类中表达的内源基因及其任意组合。在一些实施方案中,所述非人细胞包含MHC I特异性增强体的组分的基因组破坏,其中所述 MHC I特异性增强体的组分是含有CARD结构域的NOD样受体家族成员5(NLRC5)。在一些实施方案中,所述非人细胞包含MHC I结合肽的转运体的基因组破坏,其中所述转运体是抗原加工相关转运体1 (TAP1)。
在一些实施方案中,所述非人细胞包含C3的基因组破坏。
在一些实施方案中,所述非人细胞包含NK族2D配体的基因组破坏,其中所述NK族2D配体是MHC I类多肽相关序列A(MICA)或 MHC I类多肽相关序列B(MICB)。
在一些实施方案中,所述非人细胞包含不在人类中表达的内源基因的基因组破坏,其中所述不在人类中表达的内源基因是糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)或β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)。在一些实施方案中,所述非人细胞包含CXCR3配体的基因组破坏,其中所述CXCR3配体是C-X-C基序趋化因子10(CXCL10)。在一些实施方案中,与来自相同物种的没有所述基因组破坏的细胞相比,所述基因组破坏降低被破坏的基因的表达。
在一些实施方案中,与来自相同物种的没有所述基因组破坏的细胞相比,所述基因组破坏降低来自被破坏的基因的蛋白质表达。
所述第四、第五或第六方面的一些实施方案进一步包括编码感染性细胞蛋白47(ICP47)的另外的外源核酸序列。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞是劳亚兽总目细胞。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞是有蹄类动物细胞。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞是猪细胞。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞是非人灵长类动物细胞。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞是胎儿细胞。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞是干细胞。
在所述第四、第五或第六方面的一些实施方案中,所述非人细胞是胰岛细胞。
本文还公开了包含所述第四、第五或第六方面的任何实施方案的非人细胞的实体器官移植物。
本文还公开了包含所述第四、第五或第六方面的任何实施方案的非人细胞的胚胎。
在第七方面,本文公开了方法,其包括向受试者提供至少一种所述第四、第五或第六方面的任何实施方案的非人细胞。在一些实施方案中,所述至少一种非人细胞是实体器官移植物。在一些实施方案中,所述至少一种非人细胞是干细胞移植物。在一些实施方案中,所述至少一种非人细胞是胰岛细胞移植物。
所述第七方面的一些实施方案包括向所述受试者提供耐受性疫苗。在一些实施方案中,在向所述受试者提供至少一种非人细胞之前、同时或之后提供所述耐受性疫苗。在一些实施方案中,所述耐受性疫苗包含凋亡细胞。在一些实施方案中,所述耐受性疫苗包含来自与向所述受试者提供的所述至少一种非人细胞相同物种的细胞。在一些实施方案中,所述耐受性疫苗包含与向所述受试者提供的所述至少一种非人细胞在遗传上相同的细胞。
所述第七方面的一些实施方案包括向所述受试者提供抗CD40抗体。在一些实施方案中,在向所述受试者提供至少一种非人细胞之前、同时或之后提供所述抗CD40抗体。在一些实施方案中,所述抗CD40 抗体与氨基酸序列SEQ ID NO:487内的表位特异性结合。在一些实施方案中,所述抗CD40抗体与氨基酸序列SEQ ID NO:488内的表位特异性结合。
在第八方面,本文公开了用于异种移植的系统,该系统包括:a) 至少一种从所述第一、第二或第三方面的任何实施方案的遗传修饰的非人动物中分离的细胞;以及b)耐受性疫苗、抗CD40抗体或其组合。在一些实施方案中,所述至少一种细胞包含胰岛细胞、干细胞或其组合。在一些实施方案中,所述至少一种细胞是实体器官移植物。在一些实施方案中,所述至少一种细胞是肝的全部或一部分。在一些实施方案中,所述至少一种细胞是肾的全部或一部分。
所述第八方面的一些实施方案包括所述耐受性疫苗。在一些实施方案中,所述耐受性疫苗包含凋亡细胞。在一些实施方案中,所述耐受性疫苗包含来自与所述至少一种细胞相同物种的细胞。在一些实施方案中,所述耐受性疫苗包含与所述至少一种细胞在遗传上相同的细胞。
所述第八方面的一些实施方案包括或进一步包括所述抗CD40抗体。在一些实施方案中,所述抗CD40抗体与氨基酸序列SEQ ID NO:487 内的表位特异性结合。在一些实施方案中,所述抗CD40抗体与氨基酸序列SEQ ID NO:488内的表位特异性结合。
在第九方面,本文公开了用于异种移植的系统,该系统包括:a) 至少一种根据权利要求58-108中任一项所述的非人细胞;以及b)耐受性疫苗、抗CD40抗体或其组合。在一些实施方案中,所述至少一种细胞包含胰岛细胞、干细胞或其组合。在一些实施方案中,所述至少一种细胞是实体器官移植物。在一些实施方案中,所述至少一种细胞是肝的全部或一部分。在一些实施方案中,所述至少一种细胞是肾的全部或一部分。
所述第九方面的一些实施方案包括所述耐受性疫苗。在一些实施方案中,所述耐受性疫苗包含凋亡细胞。在一些实施方案中,所述耐受性疫苗包含来自与所述至少一种细胞相同物种的细胞。在一些实施方案中,所述耐受性疫苗包含与所述至少一种细胞在遗传上相同的细胞。
所述第九方面的一些实施方案包括或进一步包括所述抗CD40抗体。在一些实施方案中,所述抗CD40抗体与氨基酸序列SEQ ID NO:487 内的表位特异性结合。在一些实施方案中,所述抗CD40抗体与氨基酸序列SEQ ID NO:488内的表位特异性结合。
本文提供了方法,其包括向个体提供至少一种工程化的细胞;其中所述工程化的细胞包含导致所述个体对所述至少一种工程化细胞的免疫应答的抑制的至少两种基因组修饰,所述抑制是和与非工程化的对应细胞接触的个体的免疫应答相比,如通过以下方面所测量的:选自T细胞、 B细胞、单核细胞、巨噬细胞、自然杀伤(NK)细胞、树突细胞及其组合的至少一种内源细胞的降低的效应子功能;和/或选自包括但不限于 CD4+调节性T细胞、CD8+调节性T细胞、CD8+天然抑制细胞、Tr1细胞、调节性B细胞、B10细胞、骨髓衍生的抑制细胞及其任意组合的组的至少一种内源细胞的增加的免疫细胞调节。在一些情况下,所述至少一种工程化细胞可以是实体器官移植物。在其他情况下,至少一种工程化细胞可以是干细胞移植物。在一些情况下,至少一种工程化细胞可以是胰岛细胞移植物。个体可以对至少一种工程化细胞耐受化。在一些情况下,耐受化(tolerization)可以在可以向个体提供至少一种工程化细胞之前、期间或之后发生。
在一些情况下,可以通过施用疫苗促进耐受化。在一些情况下,耐受化可以是至少一种工程化细胞的施用。在一些情况下,耐受化可以是疫苗的施用和至少一种工程化细胞的施用。疫苗可包含凋亡细胞。疫苗还可包含活细胞。在一些情况下,降低的效应子功能可以选自响应于暴露于所述至少一种工程化细胞的降低的增殖;降低的细胞因子表达、降低的细胞溶解效应分子表达、降低的持久性、缺失、无反应性诱导、增加的免疫细胞调节及其任意组合。
本文公开了还可以向个体施用至少一个另外的治疗步骤。在一些情况下,至少一个另外的治疗步骤可以是免疫抑制疗法。免疫抑制疗法可选自抗CD40抗体、抗CD20抗体、抗IL6受体抗体、C51H79NO13(雷帕霉素)、可溶性肿瘤坏死因子受体(sTNFR)、C66H99N23O17S2(compstatin) 及其任意组合。个体可能不会对主要组织相容性复合物(MHC)敏感。所述抗CD40抗体可以是拮抗性抗体。所述抗CD40抗体可以是与氨基酸序列 EPPTACREKQYLINSQCCSLCQPGQKLVSDCTEFTETECLPCGESEFLD TWNRETHCHQHKYCDPNLGLRVQQKGTSETDTICTCEEGWHCTSEA CESCV(SEQ ID NO:487)内的表位特异性结合的抗CD40抗体。所述抗CD40抗体可以是与氨基酸序列 EKQYLINSQCCSLCQPGQKLVSDCTEFTETECL(SEQ ID NO:488)内的表位特异性结合的抗CD40抗体。所述抗CD40抗体可以是Fab’抗 CD40L单克隆抗体片段CDP7657。所述抗CD-40抗体可以是FcR工程化的、Fc沉默的抗CD40L单克隆结构域抗体。在一些情况下,个体可以对主要组织相容性复合物(MHC)敏感。MHC可以是人白细胞抗原 (HLA)。如通过对群体反应性抗体(PRA)筛选分析的正响应所确定的,个体可以对主要组织相容性复合物(MHC)敏感。
在一些情况下,个体可以具有0.1%至100%的计算的群体反应性抗体(cPRA)评分。在一些情况下,降低的效应子功能可以是选自T细胞、 B细胞、单核细胞、巨噬细胞、自然杀伤(NK)细胞、树突细胞及其任意组合的至少两种内源细胞类型的降低的效应子功能。基因组修饰可以是基因破坏、缺失、无反应性诱导、增加的免疫细胞调节或其组合。基因可以选自C-X-C基序趋化因子10(CXCL10)、抗原加工相关转运体1 (TAP1)、含有CARD结构域的NOD样受体家族成员5(NLRC5)及其任意组合。在一些情况下,至少一种工程化细胞是异种移植物。
本文公开的可以是包含至少两个编码靶向寡核苷酸的序列的工程化的多核酸;其中所述靶向寡核苷酸包含与前间区序列邻近基序(PAM) 序列相邻的至少一个非人基因组序列的互补序列。在一些情况下,靶向寡核苷酸可以是指导RNA(gRNA)。gRNA可以包含选自GGTA1、Gal2-2、 NLRC5及其任意组合的基因的互补序列。在一些情况下,gRNA可包含 GGTA1和/或Gal2的互补序列。gRNA可包含NLRC5和Gal2的互补序列。在一些情况下,靶向寡核苷酸可以与所述基因的第一外显子结合。非人基因组可以是劳亚兽总目动物或可以来自非人灵长类动物。劳亚兽总目动物可以是有蹄类动物。在一些情况下,有蹄类动物可以是猪。PAM序列可以是5’-NGG-3’(SEQ ID NO:265)。
在一些情况下,指导RNA可包含至少一种修饰。修饰可选自5’腺苷酸、5’鸟苷-三磷酸帽、5’N7-甲基鸟苷-三磷酸帽、5’-三磷酸帽、3’磷酸、3’硫代磷酸、5’-磷酸、5’硫代磷酸、顺式-Syn胸苷二聚体、三聚体、C12间隔区、C3间隔区、C6间隔区、d间隔区(dSpacer)、PC间隔区、 r间隔区(rSpacer)、间隔区18、间隔区9、3’-3’修饰、5’-5’修饰、脱碱基(abasic)、吖啶、偶氮苯、生物素、生物素BB、生物素TEG、胆固醇TEG、脱硫生物素TEG、DNP TEG、DNP-X、DOTA、dT-生物素、双生物素、PC生物素、补骨脂素C2、补骨脂素C6、TINA、3’DABCYL、黑洞猝灭剂1、黑洞猝灭剂2、DABCYL SE、dT-DABCYL、IRDye QC-1、 QSY-21、QSY-35、QSY-7、QSY-9、羧基接头、硫醇接头、2’脱氧核糖核苷类似物嘌呤、2’脱氧核糖核苷类似物嘧啶、核糖核苷类似物、2’-O- 甲基核糖核苷类似物、糖修饰的类似物、摆动(wobble)/通用碱基、荧光染料标记、2’-氟代RNA、2’O-甲基RNA、甲基膦酸酯、磷酸二酯DNA、磷酸二酯RNA、硫代磷酸酯DNA、硫代磷酸酯RNA、UNA、假尿苷-5’- 三磷酸、5-甲基胞苷-5’-三磷酸及其任意组合。
本文公开的可以是用于异种移植的移植物,该移植物包含SEQ ID NO:261的至少一个基因组破坏。
本文公开的可以是用于异种移植的移植物,该移植物包含SEQ ID NO:262的至少一个基因组破坏。
在一些情况下,用于异种移植的移植物可以进一步包含至少一种转基因。转基因可以是内源性的。转基因可以是工程化的。转基因可以编码人白细胞抗原(HLA)。HLA可以是HLA-G。转基因可以是CD47。
本文提供了一种遗传修饰的动物,其在选自下组的两种或更多种基因中具有基因组破坏:MHC I特异性增强体的组分、MHC I结合肽的转运体、自然杀伤细胞(NK)族2D配体、CXC趋化因子受体(CXCR) 3配体、MHC II反式激活因子(CIITA)、C3、不在人类中表达的内源基因及其任意组合,其中所述遗传修饰的动物与非遗传修饰的对应动物相比具有所述基因的降低的表达。在一些情况下,遗传修饰的动物可以是劳亚兽总目的成员,其中所述劳亚兽总目的成员是有蹄类动物。有蹄类动物可以是猪。
在一些情况下,在遗传修饰的动物中可以不存在所述两种或更多种基因的蛋白质表达。在一些情况下,蛋白质表达的降低使所述两种或更多种基因的功能失活。在一些情况下,遗传修饰的动物可以具有三种或更多种基因的降低的蛋白质表达。遗传修饰的动物可以具有MHC I特异性增强体的组分的降低的蛋白质表达,其中MHC I特异性增强体的组分可以是含有CARD结构域的NOD样受体家族成员5(NLRC5)。遗传修饰的动物可以包含MHC I结合肽转运体的降低的蛋白质表达,其中转运体可以是抗原加工相关转运体1(TAP1)。
在一些情况下,遗传修饰的动物可以具有C3的降低的蛋白质表达。在一些情况下,蛋白质表达的降低可以使两种或更多种基因的功能失活。在一些情况下,蛋白质表达降低的NK族2D配体可以是MHC I类多肽相关序列A(MICA)或MHC I类多肽相关序列B(MICB)。在一些情况下,蛋白质表达降低的内源基因可能不在人类中表达,其中所述可能不在人类中表达的内源基因可以是糖蛋白半乳糖基转移酶α1,3 (GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH) 或β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)。
在本文所述的一些遗传修饰的动物中,至少两种基因组破坏导致 CXCR3配体的蛋白质表达降低,所述CXCR3配体可以是C-X-C基序趋化因子10(CXCL10)。
本文提供了至少一种遗传修饰的动物,其进一步包含编码至少一种蛋白质或其功能片段的一种或多种外源转基因,其中所述至少一种蛋白质选自MHC I形成阻抑因子、补体激活调节因子、NK细胞的抑制性配体、B7家族成员、CD47、丝氨酸蛋白酶抑制剂、半乳凝素及其任意组合。
在一些情况下,所述至少一种蛋白质可以是至少一种人蛋白质。编码MHC I形成阻抑因子的一种或多种外源转基因可以是感染性细胞蛋白47(ICP47)。在一些情况下,编码补体激活调节因子的一种或多种外源转基因可以是分化群46(CD46)、分化群55(CD55)或分化群59 (CD59)。在一些情况下,编码NK细胞的抑制性配体的一种或多种外源转基因可以是白细胞抗原E(HLA-E)、人白细胞抗原G(HLA-G)或β-2-微球蛋白(B2M)。在其他情况下,一种或多种外源转基因编码HLA-G,其中HLA-G可以是HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7。在一些情况下,HLA-G可以是HLA-G1。
在本文提供的一些遗传修饰的动物中,提供了编码B7家族成员的一种或多种外源转基因,其中B7家族成员可以是程序性死亡配体。程序性死亡配体可以是程序性死亡配体1(PD-L1)或程序性死亡配体2 (PD-L2)。在一些情况下,一种或多种外源转基因可以编码PD-L1和 PD-L2两者。在一些情况下,一种或多种外源转基因可以编码丝氨酸蛋白酶抑制剂,其中所述丝氨酸蛋白酶抑制剂可以是丝氨酸蛋白酶抑制剂 9(Spi9)。在一些情况下,一种或多种外源转基因可以编码半乳凝素,其中所述半乳凝素可以是半乳凝素-9。在一些情况下,可以将一种或多种外源转基因插入到普遍存在的启动子附近。普遍存在的启动子可以是Rosa26启动子。
在一些情况下,可以将一种或多种外源转基因插入到靶基因的启动子附近、所述靶基因内或前间区序列邻近基序(PAM)序列附近。在一些情况下,可以使用CRISPR/Cas系统来降低两种或更多种基因的蛋白质表达。
本文提供了一种遗传修饰的动物,其在选自下组的至少一种基因中具有基因组破坏:MHC I特异性增强体的组分、MHC I结合肽的转运体、自然杀伤细胞(NK)族2D配体、CXC趋化因子受体(CXCR)3 配体、MHC II反式激活因子(CIITA)、C3、不在人类中表达的内源基因及其任意组合,其中所述遗传修饰的动物与非遗传修饰的对应动物相比具有所述基因的降低的表达,并且所述遗传修饰的动物在出生后存活至少22天。在一些情况下,遗传修饰的动物在出生后可以存活至少23 天、30天、35天、50天、70天、100天、150天、200天、250天、300天、350天或400天。
附图说明
本发明的新颖特征在所附的权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述以及附图,将会获得对本发明的特征和优点的更好的理解,在这些附图中:
图1示出了以使用缺乏MHC I类功能性表达的遗传修饰的细胞和器官移植物为中心的免疫治疗策略。当遗传修饰的细胞和器官的移植与拮抗性抗CD40抗体的瞬时使用相组合时,对于防止移植物排斥反应所需的维持免疫抑制的需要逐渐减少(或细胞和器官异种移植物的移植以及干细胞衍生的细胞同种异体移植物和异种移植物的移植的适用性逐渐增加),并且当在抗CD40抗体掩蔽下与包含凋亡供体细胞的耐受性疫苗的施用相组合时减少更多。
图2示出了一种制备遗传修饰的猪胰岛细胞和耐受性疫苗的策略。产生了猪的两个克隆群体。至少GGTA1敲除的一个群体可用于产生耐受性疫苗。至少GGTA1和MHC I基因(例如,NRLC5)敲除的猪的另一个克隆群体可用于细胞、组织和/或器官供体。
图3示出了阳性疫苗和耐受性疫苗(也称为阴性疫苗)的使用。
图4示出了在瞬时免疫抑制的掩蔽下,通过输注用于对疫苗接种耐受的凋亡供体脾细胞来延长受试者中异种移植物的存活的示例性方法。
图5示出了在不存在异种移植接受者的长期和广泛免疫抑制的情况下防止接受者中异种移植物的排斥反应或延长异种移植物的存活的示例性方法。该示例性方法包括并整合了三个组分:i)αGal、 MHC I类、补体C3和CXCL10的表达缺乏和/或降低以及具有HLA-G转基因表达的基因工程胰岛;ii)αGal、Neu5Gc和Sda/CAD的表达缺乏和/或降低以及具有或不具有人CD47、人PD-L1、人PD-L2的 HLA-G转基因表达的基因工程供体凋亡和非凋亡单核细胞(例如脾细胞)(例如,基因工程疫苗);以及iii)对包括拮抗性抗CD40mAb、抗CD20mAb、雷帕霉素的瞬时免疫抑制以及包括compstatin(例如, compstatin衍生物APL-2)、抗IL-6受体mAb和可溶性TNF受体的瞬时抗炎治疗的施用。
图6示出了在猪到食蟹猴胰岛异种移植中用于预防移植排斥反应的示例性方案。IE:胰岛等同物;sTNFR:可溶性TNF受体(例如,依那西普);α-IL-6R:抗白介素6受体;Tx’d:移植的。
图7A-图7E示出了用于克隆靶向GGTA1的px330-Gal2-1质粒的策略。图7A示出了用于制备靶向GGTA1的指导RNA的克隆策略和寡核苷酸(按出现顺序分别为SEQ ID NO:266-267)。图7B示出了 px330质粒(SEQ ID NO:268)上的插入位点。图7C示出了显示克隆和验证策略的流程图。图7D示出了克隆位点(SEQ ID NO:270)和测序引物(按出现顺序分别为SEQID NO:269和271)。图7E示出了测序结果(按出现顺序分别为SEQ ID NO:272-274)。
图8A-图8E示出了用于克隆靶向CMAH的px330-CM1F质粒的策略。图8A示出了用于制备靶向CMAH1的指导RNA的克隆策略和寡核苷酸(按出现顺序分别为SEQ ID NO:275和276)。图8B示出了px330质粒(SEQ ID NO:277)上的插入位点。图8C示出了显示克隆和验证策略的流程图。图8D示出了克隆位点(SEQ ID NO:279) 和测序引物(按出现顺序分别为SEQID NO:278和280)。图8E示出了测序结果(按出现顺序分别为SEQ ID NO:281-283)。
图9A-图9E示出了用于克隆靶向NLRC5的px330-NL1_第一质粒的策略。图9A示出了用于制备靶向NLRC5的指导RNA的克隆策略和寡核苷酸(按出现顺序分别为SEQ ID NO:284和285)。图9B示出了px330质粒(SEQ ID NO:286)上的插入位点。图9C示出了显示克隆和验证策略的流程图。图9D示出了克隆位点(SEQ ID NO:288) 和测序引物(按出现顺序分别为SEQ ID NO:287和289)。图9E示出了测序结果(按出现顺序分别为SEQ ID NO:290-292)。
图10A-图10E示出了用于克隆靶向C3的px330/C3-5质粒的策略。图10A示出了用于制备靶向C3的指导RNA的克隆策略和寡核苷酸(按出现顺序分别为SEQ ID NO:293和294)。图10B示出了px330 质粒(SEQ ID NO:295)上的插入位点。图10C示出了显示克隆和验证策略的流程图。图10D示出了克隆位点(SEQ ID NO:297)和测序引物(按出现顺序分别为SEQID NO:296和298)。图10E示出了测序结果(按出现顺序分别为SEQ ID NO:299-301)。
图11A-图11E示出了用于克隆靶向B4GALNT2的px330/B41_ 第二质粒的策略。图11A示出了用于制备靶向B4GALNT2的指导 RNA的克隆策略和寡核苷酸(按出现顺序分别为SEQ ID NO:302和 303)。图11B示出了px330质粒(SEQ ID NO:304)上的插入位点。图11C示出了显示克隆和验证策略的流程图。图11D示出了克隆位点(SEQ ID NO:306)和测序引物(按出现顺序分别为SEQ ID NO:305 和307)。图11E示出了测序结果(按出现顺序分别为SEQID NO: 308-310)。
图12示出了在实施例2中测序的Rosa26基因座的图谱。
图13A-图13E示出了用于克隆靶向Rosa26的px330/Rosa外显子1质粒的策略。图13A示出了用于制备靶向Rosa26的指导RNA 的克隆策略和寡核苷酸(按出现顺序分别为SEQID NO:311-312)。图 13B示出了px330质粒(SEQ ID NO:313)上的插入位点。图13C示出了显示克隆和验证策略的流程图。图13D示出了克隆位点(SEQ ID NO:315)和测序引物(按出现顺序分别为SEQ ID NO:314和316)。图13E示出了测序结果(按出现顺序分别为SEQ ID NO:317-319)。
图14A示出了HLA-G的基因组序列的图谱。图14B示出了 HLA-G的cDNA序列的图谱。
图15示出了用pSpCas9(BB)-2A-GFP转染的猪胎儿成纤维细胞的示例性显微镜视图。
图16示出了通过揭示染色体1上位置的特异性探针与GGTA1 基因的荧光原位杂交(FISH)。
图17A-图17B示出了具有cas9/sgRNA介导的GGTA1/NLCR5 破坏的细胞的表型选择的实例。图17A示出了不表达α-半乳糖苷酶的遗传修饰的细胞。图17B示出了表达α-半乳糖苷酶并用同工凝集素 B4(IB)连接的亚铁珠标记的非遗传修饰的细胞。
图18A-图18B示出了从经受GGTA1(相比于野猪品种混合的染色体1,Sscrofa10.2NCBI,参考序列:NC_010443.4)靶区域的PCR 扩增的两窝单独幼崽(妊娠1:图18A,或妊娠2:图18B)的胎儿细胞中分离的DNA的测序,且所得扩增子在1%琼脂糖凝胶上进行分离。还通过使用来自每个反应的单独正向引物的Sanger测序分析扩增子。在图18A中,显示了来自妊娠1胎儿的胎儿1-7(分别为SEQ ID NO: 322-328)与参考和靶基因序列(分别为SEQ ID NO:320-321)比对的结果。胎儿1、2、4、5、6和7在GGTA1的靶位点后截短6个核苷酸。胎儿3在切割位点后截短17个核苷酸,然后是2,511(668-3179)个核苷酸缺失,然后是单碱基置换。来自包含来自靶基因的两个拷贝的等位基因的单一测序实验的截短、缺失和置换仅可表明发生了基因修饰,而不揭示每个等位基因的确切序列。从该分析来看,所有7个胎儿似乎都具有GGTA1的单个等位基因修饰。在图18B中,显示了来自妊娠2胎儿DNA样品的胎儿1-5(分别为SEQ ID NO:331-335)与参考和靶基因序列(分别为SEQ ID NO:329-330)比对的结果。胎儿1、3、 4和5从GGTA1基因靶位点截短3个核苷酸。胎儿2在Sanger测序中具有变异性,表明DNA突变的复杂变异性或较差的样品质量。然而,胎儿DNA模板质量足以用来进行如上所述的GGTA1基因筛选实验。
图19A-图19B示出了从经受NLRC5(共有序列)靶区域的PCR 扩增的两窝单独幼崽(妊娠1:图19A,或妊娠2:图19B)的胎儿细胞中分离的DNA的测序,且所得扩增子在1%琼脂糖凝胶上进行分离。还通过使用来自每个反应的单独正向引物的Sanger测序分析扩增子。在图19A中,显示了来自妊娠1的胎儿1、3、5、6和7(分别为 SEQ ID NO:338-342)与参考和靶基因序列(分别为SEQ ID NO:338-342) 比对的结果。NLRC5靶位点的序列分析不能显示一致的比对,表明了测序反应中未知的复杂性或使Sanger测序反应和分析复杂化的NLRC5等位基因之间不同的DNA修饰。在图19B中,显示了来自妊娠2的胎儿 1-5(分别为SEQ ID NO:345-349)与参考和靶基因序列(分别为SEQ ID NO:343-344)比对的结果。胎儿1-5的NLRC5基因扩增子全部在NLRC5 基因切割位点的下游截短120个核苷酸。
图20A-图20B示出了来自从后肢活检物中分离的胎儿DNA(野生型(WT)和1-7(图20A:妊娠1)或1-5(图20B:妊娠2))的数据。通过PCR扩增靶基因,并在1%琼脂糖凝胶上分离PCR产物,并通过荧光DNA染色剂将PCR产物可视化。存在于WT泳道中的扩增子条带代表未修饰的DNA序列。扩增子大小的增大或减小分别表明扩增子内的插入或缺失。一个样品中等位基因之间DNA修饰的变化可使条带看上去更分散。妊娠1(图20A)产生7个胎儿,而妊娠 2(图20B)产生5个胎儿,分别在第45天和第43天收获。图20A 的胎儿1、3和4中NLRC5凝胶(底部凝胶)中条带的缺乏表明,对靶区域的修饰已经破坏了DNA扩增引物的结合。图20A中GGTA 1中所有条带的存在(顶部凝胶)表明,DNA质量足以在NLRC5靶向 PCR反应中产生DNA扩增子。妊娠1的胎儿1、2、4和5(图20A) 具有比WT更大的GGTA 1扩增子,表明在靶区域内有插入。在妊娠 1的胎儿3(图20A)中,GGTA 1扩增子比WT对照迁移更快,表明在靶区域内有缺失。在妊娠1的胎儿6和7(图20A)中,NLRC5扩增子比WT迁移更快,表明在靶区域内有缺失。与WT对照相比,胎儿1-5(图20B)的GGTA1扩增子难以通过大小来解释并且是分散的。与野生型对照相比,胎儿1-5(图20B)的NLRC5扩增子的大小和密度均匀。
图21A-图21E示出了来自两窝单独猪幼崽的表型分析(图21A、图21B、图21C:妊娠1,或图21D-图21E:妊娠2)。在第45天(妊娠1)或第43天(妊娠2)收获胎儿,并处理胎儿才用于DNA和培养细胞分离。将组织碎片和细胞铺在培养基中2天,以使胎儿细胞附着并生长。从培养板移出野生型细胞(未经遗传修饰的胎儿细胞)和来自妊娠1和2的胎儿细胞,并将该细胞用与Alexa fluor 488偶联的 IB4凝集素或与FITC偶联的抗猪MHC I类抗体进行标记。流式细胞分析显示为描绘测试细胞的标记强度的直方图。WT细胞的直方图包含在每幅中,以强调每组胎儿细胞总体强度的降低。在妊娠1(图21A) 中存在αGal和MHC I类标记的降低,表示为峰强度的降低。在妊娠 2(图21B)中,与WT胎儿细胞相比,胎儿1和3具有αgal标记的较大降低和MHC 1类标记的显著降低。
图22A-图22C示出了与来自遗传克隆的野生型胎儿细胞相比,来自胎儿3(妊娠1)的细胞中MHC I类表达降低的影响。测量人CD8+ 细胞和CD4T细胞对猪对照成纤维细胞和NLRC5敲除胎儿细胞的增殖响应。图22A.在评估增殖之前,细胞被门控为CD4或CD8。图22B.与对照未修饰猪成纤维细胞相比,在通过猪胎儿GGTA1/NLRC5敲除细胞的治疗刺激后,CD8T细胞增殖降低。当以1:1的比例用猪胎儿 GGTA1/NLRC5敲除细胞处理人类响应物时,观察到CD8T细胞增殖几乎降低55%。野生型胎儿细胞在人CD8T细胞中引发17.2%的增殖,而来自胎儿3(妊娠1)的MHC I类缺乏的细胞仅诱导7.6%的增殖。图22C.与未修饰的胎儿细胞相比,在1:5和1:10比例下的CD8T细胞增殖响应中未观察到差异。在研究的所有比例下,在响应于NLRC5 敲除的CD4T细胞增殖和对照未修饰猪胎儿细胞中未观察到改变。
图23示出了使用CRISPR/Cas技术产生的GGTA1/NLRC5敲除仔猪的活产。
图24A-图24C示出了实施例6中产生的仔猪的基因型的DNA凝胶分析。图24A示出了实施例6中第一PCR实验的结果。图24B示出了实施例6中第二PCR实验的结果。图24C示出了实施例6中第三PCR 实验的结果。
图25A示出了仔猪#1的NLRC5基因的部分的测序数据和序列判定(SEQ ID NO:350)。图25B示出了仔猪#2的NLRC5基因的部分的测序数据和序列判定(SEQ ID NO:351)。图25C示出了仔猪#4的NLRC5 基因的部分的测序数据和序列判定(SEQ ID NO:352)。图25D示出了仔猪#5的NLRC5基因的部分的测序数据和序列判定(SEQ ID NO:353)。图25E示出了仔猪#6的NLRC5基因的部分的测序数据和序列判定(SEQ ID NO:354)。图25F示出了仔猪#7的NLRC5基因的部分的测序数据和序列判定(SEQ ID NO:355)。
图26A示出了实施例8中Rosa26的左臂(SEQ ID NO:356)。图 26B示出了实施例8中用于同源重组的构建体的DNA凝胶分析。图26C 示出了基于实施例8中的成对读取分析的扩增子的共有序列(SEQ ID NO:357)。图26D(SEQ ID NO:358)、图26E(SEQ ID NO:359)和图26F(SEQ ID NO:360)示出了实施例8中用于在Rosa26基因座处插入 HLA-G1的同源性指导的重组构建体。
图27A示出了在实施例8中产生的含有靶向Rosa26的寡核苷酸的正确px330质粒的序列(SEQ ID NO:362)和测序引物(按出现顺序分别为SEQ ID NO:361和363)。图27B示出了在实施例8中构建的含有靶向Rosa26的寡核苷酸的px330质粒的测序结果。按出现顺序分别公开了SEQ ID NO:364-366。图27C示出了在实施例8中构建的含有靶向 Rosa26的寡核苷酸的px330质粒的限制性消化。
图28示出了在实施例8中使用的GalMet质粒的图谱和寡核苷酸 (按出现顺序分别为SEQ ID NO:367-368)。
图29示出了体外转录的gRNA的体外Cas9介导的切割反应。泳道1:未切割的猪Rosa26(2000bp)。泳道2:猪Rosa26的设计gRNA 指导的Cas9切割;泳道3:未切割的猪GGTA1;泳道4:GGTA1模板的设计gRNA指导的Cas9切割。
图30示出了通过流式细胞术分选在实施例8中产生的遗传修饰的细胞。
图31示出了实施例9中产生的用于CD47与GGTA1基因座的同源重组的构建体(SEQID NO:369)。
图32示出了实施例9中GGTA1基因座的右臂(图32A;SEQ ID NO:370)和左臂(图32B;SEQ ID NO:371)的序列。
图33A、图33B和图33C示出了实施例9中未染色的细胞的分选。
图34A、图34B和图34C示出了实施例9中px330染色的细胞的分选。
图35A、图35B和图35C示出了实施例9中IB4染色的细胞的分选。
图36A、图36B和图36C示出了实施例9中CD47/IB4染色的细胞的分选。
图37A、图37B和图37C示出了实施例9中分选的IB4染色的细胞、CD47/IB4染色的细胞。
图38A、图38B和图38C示出了实施例9中分选的CD47/IB4染色的细胞。
图39示出了用于选择单细胞和活细胞以供分析的门控策略。观察总CD3+细胞,在该群体中针对实验参数选择CD4+和CD8+细胞并进行计数。
图40A和图40B显示,A.当在与用PHA刺激的相同细胞相同的培养条件下时,象限2中未刺激的细胞显示出不显著的扩充。B.PHA刺激在淋巴细胞样品中诱导20.7%(CD3)、24.7%(CD4)、18.4%(CD8) 和21%(CD20)增殖,表明在该测定中可能有最大量的刺激。
图41示出了共培养测定的流式细胞术结果,其中CD8+T细胞以 100:1、50:1、10:1或1:1的稀释度添加至附着的野生型或基因工程猪成纤维细胞的培养物中。野生型细胞在50:1、10:1和1:1的比例下刺激T 细胞增殖。遗传修饰的(GM)细胞#3和#4显示在100:1、50:1和10:1 的比例下在刺激T细胞方面几乎没有效果,表明T细胞增殖响应完全消除。
图42示出了共培养测定的流式细胞术结果,其中CD4+T细胞以 100:1、50:1、10:1和1:1的稀释度添加至附着的野生型或基因工程猪成纤维细胞的培养物中。GM细胞#3和#4显示在100:1、50:1和10:1的比例下在刺激T细胞方面几乎没有效果,表明T细胞增殖响应完全消除。
图43示出了共培养测定的流式细胞术结果,其中CD3+T细胞(总 CD 4和CD8)以100:1、50:1、10:1和1:1的稀释度添加至附着的野生型或基因工程猪成纤维细胞的培养物中。GM细胞#3和#4显示在100:1、 50:1和10:1的比例下在刺激T细胞方面几乎没有效果,表明T细胞增殖响应完全消除。
图44示出了与野生型细胞相比,当与GGTA1/NLRC5敲除细胞一起温育时,B细胞增殖抑制约50%。
图45示出了共培养测定的流式细胞术结果,其中通过将人淋巴细胞与野生型或GM细胞一起温育,然后引入布雷菲德菌素A以阻断内吞作用而导致4种细胞因子在内体中的细胞内积累来测量细胞因子。细胞的固定和透化允许细胞内测量细胞因子的积累。在CD8T细胞群体中,在100:1比例下未观察到IL2刺激,在100:1比例下观察到CD107a、穿孔蛋白和粒酶的适度减少。在100:1和10:1比例下,穿孔蛋白和粒酶B 双阳性细胞受到显著抑制。
图46示出了在T细胞与FC之比=10:1时,人淋巴细胞与野生型或遗传修饰的猪成纤维细胞的共培养测定的流式细胞术结果。在CD8T 细胞群体中,在10:1的比例下IL2受到刺激,因此在具有遗传修饰的猪细胞的培养中减少约40%。CD107a表达降低约25%。穿孔蛋白表达降低约40%,而粒酶在该温育比例下不受影响。
图47示出了在T细胞与FC之比=10:1时,人淋巴细胞与野生型或遗传修饰的猪成纤维细胞的共培养测定的流式细胞术结果。在CD3 细胞内,CD107a减少约50%。与遗传修饰的细胞一起温育后,穿孔蛋白和粒酶B也减少,并且在与从象限2退回的双阳性细胞进行比较时反映出来。
图48示出了在T细胞与FC之比=10:1时,人淋巴细胞与野生型或遗传修饰的猪成纤维细胞的共培养测定的流式细胞术结果。CD4+T 细胞在GM细胞的存在下较少被激活以产生细胞因子。IL2表达降低了 40%。CD107a减少了大约50%。穿孔蛋白和粒酶B分别减少约50%和 30%。
图49示出了在T细胞与FC之比=10:1时,人淋巴细胞与野生型或遗传修饰的猪成纤维细胞的共培养测定的流式细胞术结果。在CD3 细胞中,当淋巴细胞与GM猪成纤维细胞以10:1的比例一起培养时,IFNγ的表达显著降低。在具有野生型细胞的培养中,TNFα表达低,但在具有GM细胞的培养中降低。在该实验中,与野生型细胞相比,当与GM 细胞一起温育时,粒酶B也显著减少。
图50示出了在T细胞与FC之比=10:1时,人淋巴细胞与野生型或遗传修饰的猪成纤维细胞的共培养测定的流式细胞术结果。在CD4 细胞中,当淋巴细胞与GM猪成纤维细胞以10:1的比例一起培养时,IFNγ的表达显著降低。在具有野生型细胞的培养中,TNFα表达低,但在具有GM细胞的培养中降低。在该实验中,与野生型细胞相比,当与GM 细胞一起温育时,粒酶B也显著减少。
图51示出了在T细胞与FC之比=10:1时,人淋巴细胞与野生型或遗传修饰的猪成纤维细胞的共培养测定的流式细胞术结果。在CD8 细胞中,当淋巴细胞与GM猪成纤维细胞以10:1的比例一起培养时,IFNγ的表达显著降低。在具有野生型细胞的培养中,TNFα表达低,但在具有GM细胞的培养中降低。在该实验中,与野生型细胞相比,当与GM 细胞一起温育时,粒酶B也显著减少。
图52示出了在T细胞与FC之比=10:1时,人淋巴细胞与野生型或遗传修饰的猪成纤维细胞的共培养测定的流式细胞术结果。已显示在细胞上不存在MHC I类表达时,NK细胞(CD56+)被激活。IFNγ(y 轴)和粒酶B(x轴)在与野生型细胞的共培养中表达,但在与GGTA1/NLRC5敲除细胞共培养时显著降低。与野生型细胞相比,GM 细胞未观察到表达或TNFα表达的变化。
图53示出了与野生型猪成纤维细胞一起温育的人PBMC具有正常背景百分比(11%)的表达IL10的CD4阳性T细胞。分别标记为#3和 #4的GGTA1/NLRC5敲除细胞(13.3%和20.2%)对IL10表达具有轻微影响。表达针对在猪中表达而优化的人激发HLAG1蛋白质的猪成纤维细胞诱导60.7%的人CD4+T细胞产生IL10。
图54显示,可溶性HLA-G(100ng/ml)在具有野生型猪胰岛的培养物中阻断CD8+、CD8-和PBMC的增殖。Q1和Q2分别显示增殖 (CFSE lo)和非增殖(CFSE hi)级分。
图55示出了用于分析CD3、CD4或CD8群体的细胞因子的流式细胞术门控策略,以及与遗传修饰的猪成纤维细胞(表达HLAG1)、野生型或野生型加PT85抗体一起培养的人T细胞的效应功能分子分析。
图56示出了与野生型猪成纤维细胞、具有PT85抗体的野生型猪成纤维细胞或表达HLAG1的猪成纤维细胞共培养的CD4群体的流式细胞分析数据。采用阻断PT85或表达HLAG1的细胞,在10:1和1:1比例的MLR培养下,观察到细胞因子水平(IL-2)和效应分子分泌的大幅降低。使用PT85阻断抗体确定观察到的免疫抑制作用有多少是由于 NLRC5敲除(MHC 1类无效)或GGTA1敲除引起的。在存在正常野生型α-Gal表面表达的情况下,PT85抗体模拟NLRC5敲低的作用。细胞表面上的HLAG1蛋白质表达对CD4+和CD8+T细胞细胞因子的产生以及效应子功能具有明显的抑制作用。
图57示出了与野生型猪成纤维细胞、具有PT85抗体的野生型猪成纤维细胞或表达HLAG1的猪成纤维细胞共培养的CD8群体的流式细胞分析数据。采用阻断PT85或表达HLAG1的细胞,在10:1和1:1比例的MLR培养下,观察到细胞因子水平(IL-2)和效应分子分泌的大幅降低。使用PT85阻断抗体确定观察到的免疫抑制作用有多少是由于 NLRC5敲除(MHC 1类无效)或GGTA1敲除引起的。在CD8群体内存在正常野生型α-Gal表面表达的情况下,PT85抗体模拟NLRC5敲低的作用。细胞表面上的HLAG1蛋白质表达对CD4+和CD8+T细胞细胞因子的产生以及效应子功能具有明显的抑制作用。细胞表面上的HLAG1 蛋白质表达对CD4+和CD8+T细胞细胞因子的产生以及效应子功能具有明显的抑制作用。
图58示出了与野生型猪成纤维细胞、具有PT85抗体的野生型猪成纤维细胞或表达HLAG1的猪成纤维细胞共培养的CD4群体的流式细胞分析数据。采用阻断PT85或表达HLAG1的细胞,在10:1和1:1比例的MLR培养下,观察到细胞因子水平(TNF-a、IFN-g)和效应分子分泌的大幅降低。使用PT85阻断抗体确定观察到的免疫抑制作用有多少是由于NLRC5敲除(MHC 1类无效)或GGTA1敲除引起的。在存在正常野生型α-Gal表面表达的情况下,PT85抗体模拟NLRC5敲低的作用。细胞表面上的HLAG1蛋白质表达对CD4+和CD8+T细胞细胞因子的产生以及效应子功能具有明显的抑制作用。
图59示出了与野生型猪成纤维细胞、具有PT85抗体的野生型猪成纤维细胞或表达HLAG1的猪成纤维细胞共培养的CD8群体的流式细胞分析数据。采用阻断PT85或表达HLAG1的细胞,在10:1和1:1比例的MLR培养下,观察到细胞因子水平(TNF-a、IFN-g)和效应分子分泌的大幅降低。使用PT85阻断抗体确定观察到的免疫抑制作用有多少是由于NLRC5敲除(MHC 1类无效)或GGTA1敲除引起的。在存在正常野生型α-Gal表面表达的情况下,PT85抗体模拟NLRC5敲低的作用。细胞表面上的HLAG1蛋白质表达对CD4+和CD8+T细胞细胞因子的产生以及效应子功能具有明显的抑制作用。
图60示出了用于细胞增殖/CFSE低群体分析的流动门控方案。
图61A和图61B示出了A.未刺激的细胞或B.PHA刺激的细胞(阳性对照或最大稀释)中CD3、CD4或CD8群体的细胞增殖(CFSE稀释) 实验的流式细胞分析。
图62显示,在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体(Ab)处理的猪成纤维细胞刺激后,T细胞增殖降低。当在10:1和1:1比例下用SLA-I 阻断PT-85抗体或HLA-G表达处理人类响应物时,观察到T细胞(CD3) 增殖的大幅降低。与未修饰的/野生型猪成纤维细胞相比,在100:1和50:1 比例下,在T细胞增殖响应方面未见太大差异。
图63显示,在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后,T细胞增殖降低。当在10:1和1:1比例下用SLA-I阻断 PT-85抗体或HLA-G表达处理人类响应物时,观察到T细胞(CD4)增殖的大幅降低。与未修饰的/野生型猪成纤维细胞相比,在100:1和50:1 比例下,在T细胞增殖响应方面未见太大差异。
图64示出了在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后降低的T细胞增殖。当在10:1和1:1比例下用SLA-I阻断 PT-85抗体或HLA-G表达处理人类响应物时,观察到T细胞(CD8)增殖的大幅降低。与未修饰的/野生型猪成纤维细胞相比,在100:1和50:1 比例下,在T细胞增殖响应方面未见太大差异。
图65示出了在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后降低的T细胞增殖。通过用PT-85阻断SLA-I或HLA-G 表达,B细胞增殖没有大幅降低。
图66显示,IFNγ主要由自然杀伤(NK)和自然杀伤T(NKT) 细胞产生,作为先天免疫应答的一部分。DKO#3和#4是分别制备的遗传上和表型上的GGTA1/NLRC5敲除细胞。在抗原特异性免疫发展后, IFNγ也由CD4Th1和CD8细胞毒性T淋巴细胞(CTL)效应T细胞产生。
图67示出了与人免疫细胞和对照培养的遗传修饰的细胞中的 GMC-SF产生。双敲除(DKO)细胞不能刺激GM-CSF产生。HLAG1 的表达显著降低。DKO#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。
图68示出了与人免疫细胞培养的遗传修饰的细胞中的IL-17A表达。DKO和HLAG1转基因细胞都不能诱导人PBMC的促炎应答。
图69示出了与人免疫细胞培养的遗传修饰的猪细胞中的CXXXC 趋化分子(Fractalkine)表达。尽管以对数标度表示,但HLAG1表达仍然是T细胞活化和CXXXC趋化分子产生的重要抑制物。
图70示出了与人免疫细胞培养的遗传修饰的猪细胞中的TNFα表达。
图71示出了与人免疫细胞培养的遗传修饰的猪细胞中的IL-6产生。
图72示出了与人免疫细胞培养的遗传修饰的猪细胞中的IL-4产生。
图73示出了与人免疫细胞培养的遗传修饰的猪细胞中的MIP1α产生。
图74示出了与人免疫细胞培养的遗传修饰的猪细胞中的MIP1β产生。
图75显示,在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后,T细胞增殖降低。当在10:1和1:1比例下用SLA-I阻断 PT-85抗体或HLA-G表达处理人类响应物时,观察到T细胞(CD3)增殖的大幅降低。与未修饰的/野生型猪成纤维细胞相比,在100:1和50:1 比例下,在T细胞增殖响应方面未见太大差异。
图76显示,在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后,T细胞增殖降低。当在10:1和1:1比例下用SLA-I阻断 PT-85抗体或HLA-G表达处理人类响应物时,观察到T细胞(CD4)增殖的大幅降低。与未修饰的/野生型猪成纤维细胞相比,在100:1和50:1 比例下,在T细胞增殖响应方面未见太大差异。
图77示出了在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后降低的T细胞增殖。当在10:1和1:1比例下用SLA-I阻断 PT-85抗体或HLA-G表达处理人类响应物时,观察到T细胞(CD8)增殖的大幅降低。与未修饰的/野生型猪成纤维细胞相比,在100:1和50:1 比例下,在T细胞增殖响应方面未见太大差异。
图78示出了在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后降低的T细胞增殖。通过用PT-85阻断SLA-I或HLA-G 表达,B细胞增殖没有大幅降低。
图79示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的 IFNγ表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图79B)(而不是人供体#1;图79A)进行,因此包括匹配的未刺激的和野生型细胞对照。
图80示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的 GM-CSFγ表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图80B)(而不是人供体#1;图80A)进行,因此包括匹配的未刺激的和野生型细胞对照。
图81示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的IL-2 表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。
图82示出了来自两个供体(图80A和图80B)的人混合淋巴细胞和猪遗传修饰的细胞共培养后的IL-17表达。双敲除(DKO)#3和#4 是分别制备的遗传上和表型上的GGTA1/NLRC5敲除细胞。DKO和 HLA-G1转基因细胞都不能诱导人PBMC的促炎应答。
图83示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的 CXXXC趋化分子表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图83B)(而不是人供体#1;图83A)进行,因此包括匹配的未刺激的和野生型细胞对照。尽管以对数标度表示,但HLA-G1表达仍然是T细胞活化和CXXXC趋化分子产生的重要抑制物。
图84示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的 TNFα表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图84B)(而不是人供体#1;图84A)进行,因此包括匹配的未刺激的和野生型细胞对照。
图85示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的IL-6 表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图85B)(而不是人供体#1;图85A)进行,因此包括匹配的未刺激的和野生型细胞对照。
图86示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的IL-4 表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图86B)(而不是人供体#1;图86A)进行,因此包括匹配的未刺激的和野生型细胞对照。
图87示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的 MIP-1α表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图87B)(而不是人供体#1;图87A)进行,因此包括匹配的未刺激的和野生型细胞对照。
图88示出了人混合淋巴细胞和猪遗传修饰的细胞共培养后的 MIP-1β表达。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。HLA-G1转基因细胞在单独的实验中与人供体#2(图88B)(而不是人供体#1;图88A)进行,因此包括匹配的未刺激的和野生型细胞对照。
图89示出了PX333载体内的CRISPR/Cas构建体。
图90示出了使用以下构建体的原代猪成纤维细胞的转染示意图: GGTA1-10/B4GALNT2(条件2)、NLRC5-6/B4GALNT2(条件3)、 GGTA1-10/B4GALNT2和NLRC5-6/B4GALNT2(条件4)、条件1(野生型):仅细胞。
图91示出了使用磁珠分选的遗传修饰的选择。
图92示出了使用SLA I+/IB4+(右上)、SLAI+/IB4–(右下)、 SLA I-/IB4+(左上)和SLA I-/IB4(左下)的细胞分选(Cell Sort) 的遗传修饰的选择。
图93示出了条件2的流式细胞分析:GGTA1-10/B4GALNT2。
图94示出了条件3的流式细胞分析:NLRC5-6/B4GALNT2。
图95示出了条件4的流式细胞分析:GGTA1-10/B4GALNT2+ NLRC5-6/B4GALNT2。
图96示出了条件2的流式细胞分析:GGTA1-10/B4GALNT2分选后。对每个群体进行分选以证实在分选后获得了正确的群体,并且没有来自其他门(gate)的交叉样品。
图97示出了条件3的流式细胞分析:NLRC5-6/B4GALNT2。对每个群体进行分选以证实在分选后获得了正确的群体,并且没有来自其他门的交叉样品。
图98示出了条件4的流式细胞分析:GGTA1-10/B4GALNT2+ NLRC5-6/B4GALNT2。对每个群体进行分选以证实在分选后获得了正确的群体,并且没有来自其他门的交叉样品。
图99A和图99B示出了以下的IB4凝集素的流式细胞分析:A.与野生型或PFF1培养的未染色的野生型、未染色的所有细胞、野生型阴性和条件#2Gal阴性级分。B.与野生型或PFF1培养的条件#4Gal阴性级分、野生型阳性、条件#2Gal阳性级分、条件#3Gal阳性级分或条件#4Gal 阳性级分的侧向散射与正向散射。
图100显示条件1(野生型)、2、3和4(分别从左至右)遗传修饰的细胞的流式细胞定量。
图101A和图101B示出了以下的IB4凝集素的流式细胞分析:A. 与野生型或PFF1培养的未染色的野生型、未染色的所有细胞、野生型阴性和条件#2Gal阴性级分。B.与野生型或PFF1培养的条件#4Gal阴性级分、野生型阳性、条件#2Gal阳性级分、条件#3Gal阳性级分或条件 #4Gal阳性级分的侧向散射与正向散射。
图102示出了以下的SLA1(FITC)的流式细胞定量:A.条件3 细胞,和B.条件4细胞。
图103A和图103B示出了以下的共聚焦显微术:A.野生型猪细胞和遗传修饰的条件2、3和4细胞的成像结果。B.产生成像的载玻片。
图104示出了条件和条件4细胞系的NLRC5测序的测序结果。按出现顺序分别公开了SEQ ID NO:372-376。
图105示出了GG1、Gal2-1、Gal 2-2、Gal 2-3、Gal 2-4、Gal 2-5、 GGTA1-10、GGTA1-11、GGTA1-16、NL1、NLRC5-6、NLRC5-7、NLRC5-8 的PCR寡核苷酸和靶序列(第二列)的表格。在第2列按出现顺序分别公开了SEQ ID NO:377-404。在第4列按出现顺序分别公开了SEQ ID NO:405-413。在第6列按出现顺序分别公开了SEQ ID NO:414-422。
图106示出了CM1F、CM2RS、CM3RS、CM4RS的PCR寡核苷酸和靶序列(第二列)的表格。在第2列按出现顺序分别公开了SEQ ID NO:423-430。在第4列按出现顺序分别公开了SEQID NO:431-434。在第6列按出现顺序分别公开了SEQ ID NO:435-437。
图107A和图107B示出了以下的表格:A.用于B41、C3-9_1、 C3-9_2、C3-5_1、C3-5_2、C3-15RS_1、C3-15RS_2的gRNA的靶序列。在第2列按出现顺序分别公开了SEQ ID NO:438-447。B.缺失筛选引物序列及其各自针对Gal 1的靶序列。在第2列按出现顺序分别公开了SEQ ID NO:448-453。
图108示出了Gal2-2(B4GALNT2)载体和克隆策略的概述。公开了该载体的一部分的核苷酸序列(SEQ ID NO:454),以及两个寡核苷酸:Gal2-2_正向(SEQ ID NO:455)和Gal2-2_反向(SEQ ID NO:456)。
图109示出了基于图113的载体和克隆策略正确插入后的预期 Gal2-2(B4GALNT2)克隆序列(上图)。按出现顺序分别公开了SEQ ID NO:457-459。在下图中,构建的质粒(SEQID NO:462)的测序结果与预期的序列(SEQ ID NO:460-461)进行比对。
图110A和图110B。A.示出了GGTA1基因(SEQ ID NO:464)内的Gal2-1(B4GALNT2)靶位点和两个寡核苷酸(Gal2-1_筛选_正向_1, SEQ ID NO:463;和Gal2-1_筛选_反向_1,SEQID NO:465)。B.示出了 Gal2-1_筛选_1引物组、在凝胶上观察到的Gal2-1_筛选引物组PCR产物和303bp的预期扩增子大小。在预期扩增子大小产物处观察到的强单条带进行序列验证,并显示包括筛选所需的Gal2-1靶切割位点。
图111A和图111B。A.示出了CMAH基因(SEQ ID NO:467)内的CM1F靶位点和两个寡核苷酸(CM1F-1_筛选_正向_1,SEQ ID NO: 466;和CM1F-1_筛选_反向_1,SEQ ID NO:468)。B.示出了预期扩增子大小为309bp的CM1F_筛选_1引物组、在凝胶上观察到的CM1F_筛选引物组PCR产物。在预期扩增子大小处观察到强条带;在~600bp处也观察到微弱的条带。对大约300bp的产物进行序列验证,并显示包括筛选所需的靶切割位点。
图112A和图112B。A.示出了NLRC5基因(SEQ ID NO:470)内的NL1_第一靶位点和两个寡核苷酸(NLR amp2正向,SEQ ID NO:469;和NLR amp2反向,SEQ ID NO:471)。B.示出了预期扩增子大小为217bp 的NLR amp 2引物组、在凝胶上观察到的NLR amp 2引物组PCR产物、在预期扩增子大小处观察到的强单条带。对产物进行序列验证,并显示包括筛选所需的NL1_第一靶切割位点。
图113A至图113I代表Gal2-2和NLRC5基因的外显子1基因组修饰。A.示出了针对Gal的筛选引物的位置。B.使用Gal2-2筛选1引物的Gal2-2PCR筛选。C.Gal2-2的序列结果。按出现顺序分别公开了SEQ ID NO:472-478。D.使用GGTA1-10,11筛选引物的GGTA1-10PCR筛选。 E.LRC5-6筛选引物位置。F.NLRC5-6组A(NLRC5-678筛选引物)。 G.来自组A的NLRC5-6序列结果。按出现顺序分别公开了SEQ ID NO: 479-486。H.NLRC5-6组B(NLRC5-678正向和NLR第一筛选2反向筛选引物)。I.NLRC5-6组C(NLRC5-678正向和NLR第一筛选2反向筛选引物)。
图114A-图114C示出了使用CRISPR/Cas技术生成的 GGTA1/NLRC5敲除/HLA-G1敲入仔猪的活产。
图115示出了确认HLA-G1插入ROSA基因位点中的测序结果。公开了SEQ ID NO:499。
图116示出了确认在实施例8中正确构建了用于在Rosa26基因座处插入HLA-G1的同源性指导的重组构建体的序列结果。公开了SEQ ID NO:500。
图117示出了对应于Rosa26基因座的左臂序列,该序列可用于构建用于将HLA-G1或另一序列插入Rosa26基因座中的同源性靶向载体。公开了SEQ ID NO:501。
图118示出了修饰的HLA-G编码序列的序列,该序列可用于构建用于将HLA-G1插入遗传基因座如Rosa26基因座中的同源性靶向载体。公开了SEQ ID NO:502。
图119示出了对应于Rosa26基因座的右臂序列,该序列可用于构建用于将HLA-G1或另一序列插入Rosa26基因座中的同源性靶向载体。公开了SEQ ID NO:503。
具体实施方式
以下描述和实例详细阐述了本发明的实施方案。应当理解,本发明不限于本文所述的特定实施方案,并因此可以变化。本领域技术人员将意识到,本发明存在许多变化和修改,这些变化和修改均包含在本发明的范围内。
可以通过调节免疫应答的方法(包括本文所述的那些方法)防止移植物排斥。例如,本文所述的在或不在免疫抑制药物最小化使用的情况下防止移植排斥反应或延长到移植排斥反应的时间的一种方法,可以例如在遗传上改变动物,例如,供体非人动物。随后,可收获改变的动物(例如,供体非人动物)的细胞、器官和/或组织并将其用于同种异体移植或异种移植。或者,可从动物例如人或非人动物(包括但不限于原代细胞)提取细胞,或者细胞可以是先前提取的动物细胞,例如细胞系。这些细胞可用于产生遗传改变的细胞。
可通过慢性免疫抑制防止移植排斥反应(例如,T细胞介导的移植排斥反应)。然而,免疫抑制是昂贵的,且与严重副作用的风险相关。为了规避对于慢性免疫抑制的需要,开发了多方面的T细胞靶向的排斥反应预防法(图1),其:
i)利用缺乏MHC I类功能性表达的遗传修饰的移植物,从而干扰具有直接特异性的CD8+T细胞的活化,并妨碍这些CD8+T细胞的细胞毒性效应子功能,
ii)使用包含拮抗性抗CD40mAb的诱导免疫治疗(并消耗抗CD20 mAb和mTOR抑制剂)干扰B细胞(和其他APC)介导的抗供体T 细胞的引发和记忆产生,和/或
iii)经由外周移植输注凋亡供体细胞疫苗耗尽具有间接特异性的抗供体T细胞。
本文描述了遗传修饰的非人动物(诸如非人灵长类动物或为劳亚兽总目成员的遗传修饰的动物,例如有蹄类动物),和从该动物分离的器官、组织或细胞,耐受性疫苗,以及用于通过移植从非人动物分离的器官、组织或细胞治疗或预防有需要的接受者的疾病的方法。从非人动物(诸如非人灵长类动物或为劳亚兽总目成员的遗传修饰的动物,例如有蹄类动物)分离的器官、组织或细胞可移植到来自相同物种(同种异体移植)或不同物种(异种移植)的有需要的接受者中。可用耐受性疫苗和/或一种或多种免疫调节剂(例如,抗体)使接受者耐受。在涉及异种移植的实施方案中,接受者可以是人类。可治疗的合适疾病为接受者的器官、组织或细胞有缺陷或损伤的(例如,心脏、肺、肝、血管、皮肤或胰岛细胞),且接受者可通过移植从非人动物分离的器官/组织或细胞而进行治疗的任何疾病。
人白细胞抗原G(HLA-G)HLA-G可以是强效的免疫抑制性的致耐受性分子。因此,在一个方面,本文公开了包含编码HLA-G蛋白质的外源核酸序列的遗传修饰的非人动物和细胞。该遗传修饰的非人动物和细胞还可以包含一种或多种另外的遗传修饰,如本文公开的任何遗传修饰(例如,敲入、敲除、基因破坏等)。
定义
如本文所用的,关于参考数值的术语“约”及其语法等同语可包括该数值自身和该数值正或负10%的值的范围。例如,量“约10”包括 10和从9到11的任何量。例如,关于参考数值的术语“约”还可包括该数值正或负10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的值的范围。
如本文所用的,术语“非人动物”及其语法等同语包括除人类之外的所有动物物种,包括非人哺乳动物,该动物可以是天然动物或遗传修饰的非人动物。非人哺乳动物包括,有蹄类动物,诸如偶蹄类动物(例如,猪、西貒、河马、骆驼、大羊驼、鼷鹿(鼠鹿)、鹿、长颈鹿、叉角羚、羚羊、羊(包括绵羊、山羊等)或牛),或者奇蹄类动物(例如,马、貘和犀牛),非人灵长类动物(例如,猴或黑猩猩),犬科动物(例如,狗)或猫。非人动物可以是劳亚兽总目的成员。劳亚兽总目可包括如Waddell等人,Towards Resolving the InterordinalRelationships of Placental Mammals.Systematic Biology 48(1):1–5 (1999)中所述的一组哺乳动物。劳亚兽总目的成员可包括真盲缺目 (Eulipotyphla)(刺猬、鼩鼱和鼹鼠)、奇蹄目(Perissodactyla)(犀牛、马和貘)、食肉目(Carnivora)(食肉动物)、鲸偶蹄目(Cetartiodactyla) (偶蹄目动物和鲸目动物)、翼手目(Chiroptera)(蝙蝠)和鳞甲目(Pholidota)(鲮鲤)。劳亚兽总目的成员可以是本文所述的有蹄类动物,例如奇蹄类动物或偶蹄类动物。有蹄类动物可以是猪。成员可以是食肉目的成员,诸如猫或狗。在一些情况下,劳亚兽总目的成员可以是猪。
如本文所用的,术语“猪”及其语法等同语可指属于偶蹄类动物的猪科(Suidae)中的猪属(Sus)的动物。例如,猪可以是野猪、家猪、小型猪、野猪(Sus scrofa)、家猪(Susscrofa domesticus)或同系繁殖猪。
如本文所用的,术语“转基因”及其语法等同语可指可被转入生物体中的基因或遗传物质。例如,转基因可以是含有引入生物体中的基因的DNA的片段或区段。该基因或遗传物质可以来自不同的物种。该基因或遗传物质可以是合成的。当转基因转入生物体中时,该生物体随后可被称为转基因生物体。转基因可在转基因生物体中保持其产生RNA或多肽(例如,蛋白质)的能力。转基因可包含编码蛋白质或其片段(例如,功能片段)的多核苷酸。转基因的多核苷酸可以是外源多核苷酸。蛋白质的片段(例如,功能片段)可包含该蛋白质的氨基酸序列的至少或至少约5%、10%、20%、30%、40%、50%、60%、 70%、80%、90%、95%或99%。蛋白质的片段可以是蛋白质的功能片段。蛋白质的功能片段可保留蛋白质的部分或全部功能。
术语“外源核酸序列”可以指源自细胞或动物外部的转移到细胞或动物中的基因或遗传物质。外源核酸序列可以通过合成产生。外源核酸序列可以来自不同物种,或相同物种的不同成员。外源核酸序列可以是内源核酸序列的另一个拷贝。
如本文所用的,术语“遗传修饰”及其语法等同语可指核酸(例如,位于生物体基因组内的核酸)的一个或多个改变。例如,遗传修饰可指基因的改变、添加和/或缺失。遗传修饰的细胞还可指具有添加、缺失和/或改变的基因的细胞。遗传修饰的细胞可来自遗传修饰的非人动物。来自遗传修饰的非人动物的遗传修饰的细胞可以是从这样的遗传修饰的非人动物中分离的细胞。来自遗传修饰的非人动物的遗传修饰的细胞可以是源自这样的遗传修饰的非人动物的细胞。
术语“基因敲除”或“敲除”可以指降低被“敲除”的基因的表达的任何遗传修饰。降低的表达可包括不表达。该遗传修饰可以包括基因组破坏。
如本文所用的,术语“胰岛”或“胰岛细胞”及其语法等同语可指存在于生物体的胰腺中的内分泌(例如,产生激素的)细胞。例如,胰岛细胞可包括不同类型的细胞,包括但不限于胰腺α细胞、胰腺β细胞、胰腺δ细胞、胰腺F细胞和/或胰腺ε细胞。胰岛细胞还可指一组细胞、细胞簇等。
如本文所用的,术语“状况”及其语法等同语可指疾病、事件或健康状态的变化。
如本文所用的,术语“糖尿病”及其语法等同语可指特征在于长时间高血糖水平的疾病。例如,如本文所用的,术语“糖尿病”及其语法等同语可指糖尿病的所有或任何类型,包括但不限于1型糖尿病、 2型糖尿病、囊性纤维化相关糖尿病、外科手术糖尿病、妊娠期糖尿病和线粒体糖尿病。在一些情况下,糖尿病可以是遗传性糖尿病的形式。
如本文所用的,术语“表型”及其语法等同语可指生物体的可观察特征或特点的综合,诸如其形态学、发育、生物化学或生理性质、物候学、行为和行为的结果。根据上下文,术语“表型”有时可指群体的可观察特征或特点的综合。
如本文所用的,术语“破坏”及其语法等同语可指改变基因的过程,例如,通过删除、插入、突变、重排或其任意组合。例如,可通过敲除破坏基因。破坏基因可以是部分降低或完全抑制该基因的表达 (例如,mRNA和/或蛋白质表达)。破坏还可包括抑制技术,诸如shRNA、siRNA、微小RNA、显性失活或抑制基因或蛋白质的功能性或表达的任何其他方式。
如本文所用的,术语“基因编辑”及其语法等同语可指从基因组插入、替换或去除一个或多个核苷酸的基因工程化。例如,可使用核酸酶(例如,天然存在的核酸酶或人工工程化的核酸酶)进行基因编辑。
如本文所用的,术语“移植排斥反应”及其语法等同语可指器官移植接受者的免疫应答对移植材料(例如,细胞、组织和/或器官)发生足以损害或破坏移植材料的功能的反应的一个或多个过程。
如本文所用的,术语“超急性排斥反应”及其语法等同语可指在移植后前24小时内发生或开始的移植材料或组织的排斥反应。例如,超急性排斥反应可包括但不限于“急性体液性排斥反应”和“抗体介导的排斥反应”。
如本文所用的,术语“阴性疫苗”、“耐受性疫苗”及其语法等同语可互换使用。如果在适当免疫治疗的掩蔽下使用,则耐受性疫苗可使接受者对移植物耐受或有助于接受者对移植物的耐受化。这可帮助防止移植排斥反应。
如本文所用的,术语“接受者”、“受试者”及其语法等同语可互换使用。接受者或受试者可以是人类或非人动物。接受者或受试者可以是将接受、正在接受或已经接受了移植物、耐受性疫苗和/或本申请中公开的其他组合物的人类或非人动物。接受者或受试者还可能需要移植物、耐受性疫苗和/或本申请中公开的其他组合物。在一些情况下,接受者可以是将接受、正在接受或已经接受了移植物的人类或非人动物。
在全文中公开的一些数值被表述为,例如,“X为至少或至少约 100;或200[或任何数值]。”该数值包括该数目本身和下列所有:
i)X为至少100;
ii)X为至少200;
iii)X为至少约100;以及
iv)X为至少约200。
在全文中公开的数值涉及所有这些不同组合。除非另有明确相反指示,否则所有公开的数值均应以此方式进行解释,无论该数值是指施用治疗剂还是指天、月、年、重量、剂量等。
在全文中公开的范围有时被表述为,例如,“X在或在约第1天至第2天;或第2天至第3天[或任何数值范围]施用。”该范围包括该数值本身(例如,该范围的端点)和下列所有:
i)X在第1天与第2天之间施用;
ii)X在第2天与第3天之间施用;
iii)X在约第1天与第2天之间施用;
iv)X在约第2天与第3天之间施用;
v)X在第1天与约第2天之间施用;
vi)X在第2天与约第3天之间施用;
vii)X在约第1天与约第2天之间施用;以及
viii)X在约第2天与约第3天之间施用。
在全文中公开的范围涉及所有这些不同组合。除非另有明确相反指示,否则所有公开的范围均应以此方式进行解释,无论该范围是指施用治疗剂还是指天、月、年、重量、剂量等。
如本文所用的,术语“和/或”和“其任意组合”及其语法等同语可互换使用。这些术语可表达,具体考虑到任意组合。仅为了说明目的,下列短语“A、B和/或C”或“A、B、C或其任意组合”可指“单独A;单独B;单独C;A和B;B和C;A和C;以及A、B和C”。
除非上下文具体指分离性使用,否则术语“或”可以结合性或分离性使用。
I.遗传修饰的非人动物
本文提供了可成为用于移植的细胞、组织和/或器官的供体的遗传修饰的非人动物。遗传修饰的非人动物可以是任何期望的物种。例如,本文所述的遗传修饰的非人动物可以是遗传修饰的非人哺乳动物。遗传修饰的非人哺乳动物可以是遗传修饰的有蹄类动物,包括遗传修饰的偶蹄类动物(例如,猪、西貒、河马、骆驼、大羊驼、鼷鹿(鼠鹿)、鹿、长颈鹿、叉角羚、羚羊、山羚羊(包括绵羊、山羊等)或牛),或遗传修饰的奇蹄类动物(例如,马、貘和犀牛),遗传修饰的非人灵长类动物(例如,猴或黑猩猩),或遗传修饰的犬科动物(例如,狗)。遗传修饰的非人动物可以是劳亚兽总目的成员。遗传修饰的非人动物可以是非人灵长类动物,例如,猴或黑猩猩。如果非人动物为猪,则该猪可以是至少或至少约1、5、50、100或300磅,例如,该猪可为或约为5磅至50磅;25磅至100磅;或75磅至300磅。在一些情况下,非人动物为产仔至少一次的猪。
遗传修饰的非人动物可为任何年龄。例如,遗传修饰的非人动物可为胎儿;为或为约1天至1个月龄;为或为约1个月至3个月龄;为或为约3个月至6个月龄;为或为约6个月至9个月龄;为或为约 9个月龄至1岁;为或为约1岁至2岁。遗传修饰的非人动物可以是非人胎儿动物、围产期非人动物、新生儿非人动物、断奶前非人动物、青年非人动物或成年非人动物。
遗传修饰的非人动物在出生后可以存活至少一段时间。例如,遗传修饰的非人动物在出生后可以存活至少1天、2天、3天、1周、2周、 3周、1个月、2个月、4个月、8个月、1年、2年、5年或10年。多个遗传修饰的动物(例如猪)可以在一窝中出生。一窝遗传修饰的动物可以具有至少30%、50%、60%、80%或90%的存活率,例如,一窝中在出生后存活的动物数除以一窝中的动物总数。
与非遗传修饰的对应动物相比,遗传修饰的非人动物可具有一种或多种基因的降低的表达。基因表达的降低可以由基因的一个或多个等位基因上的突变引起。例如,遗传修饰的动物可以包含基因的两个或更多个等位基因上的突变。在一些情况下,这样的遗传修饰的动物可以是二倍体动物。
与非遗传修饰的对应动物相比,遗传修饰的非人动物可具有一种或多种基因的降低的表达。与非遗传修饰的对应动物相比,遗传修饰的非人动物可具有两种或更多种基因的降低的表达。遗传修饰的动物可以具有在选自下组的至少一种基因中的基因组破坏:MHCI特异性增强体的组分、MHC I结合肽的转运体、自然杀伤细胞(NK)族2D配体、CXC 趋化因子受体(CXCR)3配体、MHC II反式激活因子(CIITA)、C3、不在人类中表达的内源基因及其任意组合。
在一些情况下,与非遗传修饰的对应动物相比,遗传修饰的动物具有降低的基因表达。在一些情况下,遗传修饰的动物在出生后存活至少22天。在其他情况下,遗传修饰的动物在出生后可以存活至少或至少约23至30、25至35、35至45、45至55、55至65、65至75、75至 85、85至95、95至105、105至115、115至225、225至235、235至 245、245至255、255至265、265至275、275至285、285至295、295 至305、305至315、315至325、325至335、335至345、345至355、 355至365、365至375、375至385、385至395或395至400天。
非遗传修饰的对应动物可以是与遗传修饰的动物基本上相同但在基因组中没有遗传修饰的动物。例如,非遗传修饰的对应动物可以是与遗传修饰的动物相同物种的野生型动物。
遗传修饰的非人动物可提供用于移植到有需要的接受者或受试者中的细胞、组织或器官。有需要的接受者或受试者可以是已知或怀疑具有状况的接受者或受试者。该状况可通过本文公开的方法和组合物进行治疗、预防、减少、消除或增强。接受者可对移植的细胞、组织或器官表现出低免疫应答或不表现出免疫应答。移植的细胞、组织或器官可不被接受者(例如,人类或另一种动物)的CD8+T细胞、 NK细胞或CD4+T细胞识别。表达降低的基因可包括MHC分子、 MHC分子表达调节因子和在供体非人动物和接受者(例如,人类或另一种动物)之间差异性表达的基因。降低的表达可以是一种或多种基因的mRNA表达或蛋白质表达。例如,降低的表达可以是一种或多种基因的蛋白质表达。降低的表达还可包括不表达。例如,具有基因的降低的表达的动物、细胞、组织或器官可不具有该基因的表达(例如,mRNA和/或蛋白质表达)。基因的表达降低可使基因的功能失活。在一些情况下,当遗传修饰的动物中基因的表达降低时,该遗传修饰的动物中不存在该基因的表达。
与非遗传修饰的对应动物相比,遗传修饰的非人动物可具有一种或多种MHC分子的降低的表达。例如,非人动物可以是有蹄类动物,例如猪,其一种或多种猪白细胞抗原(SLA)I类和/或SLA II类分子的表达降低。
与非遗传修饰的对应动物相比,遗传修饰的非人动物可具有调节主要组织相容性复合物(MHC)分子(例如,MHC I分子和/或MHC II分子)的任何基因的降低的表达。降低这类基因的表达可导致MHC 分子(例如,MHC I分子和/或MHC II分子)的降低的表达和/或功能。在一些情况下,在非人动物中表达降低的一种或多种基因可包括下列一种或多种:MHC I特异性增强体的组分、MHC I结合肽的转运体、自然杀伤细胞族2D配体、CXC化学受体(CXCR)3配体、补体成分3(C3)和主要组织相容性复合物II反式激活因子(CIITA)。在一些情况下,MHC I特异性增强体的组分可以是NLRC5。在一些情况下,MHC I特异性增强体的组分还可包括调节因子X(RFX)(例如,RFX1)、核转录因子Y(NFY)和cAMP应答元件结合蛋白(CREB)。在一些情况下,MHC I结合肽的转运体可以是抗原加工相关转运体1 (TAP1)。在一些情况下,自然杀伤细胞(NK)族2D配体可包括 MICA和MICB。例如,遗传修饰的非人动物可具有下列基因中的一种或多种的降低的表达:含有CARD结构域的NOD样受体家族成员 5(NLRC5)、抗原加工相关转运体1(TAP1)、C-X-C基序趋化因子 10(CXCL10)、MHC I类多肽相关序列A(MICA)、MHC I类多肽相关序列B(MICB)、补体成分3(C3)和CIITA。遗传修饰的动物可具有下列基因中的一种或多种的降低的表达:MHC I特异性增强体的组分(例如,NLRC5)、MHC I结合肽的转运体(TAP1)和C3。
与非遗传修饰的对应动物相比,遗传修饰的非人动物可具有在非人动物与从非人动物接受细胞、组织或器官的接受者之间以不同水平表达的一种或多种基因的降低的表达。例如,所述一种或多种基因可在人类中比在非人动物中以更低水平表达。在一些情况下,所述一种或多种基因可以是非人动物的内源基因。在一些情况下,该内源基因是不在另一物种中表达的基因。例如,非人动物的内源基因可以是不在人类中表达的基因。例如,在一些情况下,所述一种或多种基因的同源物(例如,直系同源物)不存在于人类中。在另一个实例中,所述一种或多种基因的同源物(例如,直系同源物)可存在于人类中但不表达。
在一些情况下,非人动物可以是猪,而接受者可以是人类。在这些情况下,所述一种或多种基因可以是在猪中表达但不在人类中表达的任何基因。例如,所述一种或多种基因可包括糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)和β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)。遗传修饰的非人动物可具有B4GALNT2、GGTA1或CMAH的降低的表达,其中该降低表达是与非遗传修饰的对应动物相比。遗传修饰的非人动物可具有B4GALNT2和GGTA1的降低的表达,其中该降低表达是与非遗传修饰的对应动物相比。遗传修饰的非人动物可具有 B4GALNT2和CMAH的降低的表达,其中该降低表达是与非遗传修饰的对应动物相比。遗传修饰的非人动物可具有B4GALNT2、GGTA1和CMAH的降低的表达,其中该降低表达是与非遗传修饰的对应动物相比。
与非遗传修饰的对应动物相比,遗传修饰的非人动物可具有本文公开的任何基因中的一种或多种的降低的表达,这些基因包括 NLRC5、TAP1、CXCL10、MICA、MICB、C3、CIITA、GGTA1、CMAH 和B4GALNT2。
遗传修饰的非人动物可包含表达降低(例如,基因表达降低) 的一种或多种基因。表达降低的一种或多种基因包括但不限于:含有 CARD结构域的NOD样受体家族成员5(NLRC5)、抗原加工相关转运体1(TAP1)、糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)、C-X-C基序趋化因子10(CXCL10)、MHC I类多肽相关序列A(MICA)、MHC I类多肽相关序列B(MICB)、II类主要组织相容性复合物反式激活因子 (CIITA)、β-1,4-N-乙酰基氨基半乳糖基转移酶2(B4GALNT2)、补体成分3(C3)和/或其任意组合。
遗传修饰的非人动物可包含表达被破坏的1、2、3、4、5、6、 7、8、9、10、11、12、13、14、15、16、17、18、19、20种或更多种基因。为了说明目的,且不限制本领域技术人员可想象的多种不同组合,遗传修饰的非人动物可具有单独的被破坏的NLRC5和TAP1。遗传修饰的非人动物还可具有被破坏的NLRC5和TAP1两者。除了被破坏的下列GGTA1、CMAH、CXCL10、MICA、MICB、B4GALNT2 或CIITA基因中的一种或多种之外,遗传修饰的非人动物还可具有被破坏的NLRC5和TAP1;例如“NLRC5、TAP1和GGTA1”或“NLRC5、 TAP1和CMAH”可被破坏。遗传修饰的非人动物还可具有被破坏的 NLRC5、TAP1、GGTA1和CMAH。或者,遗传修饰的非人动物还可具有被破坏的NLRC5、TAP1、GGTA1、B4GALNT2和CMAH。在一些情况下,遗传修饰的非人动物可具有被破坏的C3和GGTA1。在一些情况下,遗传修饰的非人动物可具有NLRC5、C3、GGTA1、B4GALNT2、CMAH和CXCL10的降低的表达。在一些情况下,遗传修饰的非人动物可具有TAP1、C3、GGTA1、B4GALNT2、CMAH 和CXCL10的降低的表达。在一些情况下,遗传修饰的非人动物可具有NLRC5、TAP1、C3、GGTA1、B4GALNT2、CMAH和CXCL10 的降低的表达。B4GALNT2基因可以是Gal2-2或Gal 2-1。
在移植的人类细胞上缺乏MHC I类表达可导致自然杀伤(NK) 细胞被动激活(Ohlen等人,1989)。缺乏MHC I类表达可能是由于 NLRC5、TAP1或B2M基因缺失。可通过人类MHC 1类基因HLA-E (其可刺激NK细胞上的抑制性受体CD94/NKG2A)的表达来克服 NK细胞的细胞毒性,从而防止细胞杀伤(Weiss等人,2009;Lilienfeld 等人,2007;Sasaki等人,1999)。HLA-E基因的成功表达可能取决于人B2M(β2微球蛋白)基因和同源肽的共表达(Weiss等人,2009; Lilienfeld等人,2007;Sasaki等人,1999;Pascasova等人,1999)。干细胞DNA中的核酸酶介导的断裂可允许一种或多种基因经由同源性定向修复而插入。连续的HLA-E和hB2M基因可整合到核酸酶介导的DNA断裂的区域中,从而防止在插入转基因时靶基因(例如NLRC5) 的表达。
基因的表达水平可降低到多种不同程度。例如,一种或多种基因的表达可降低或降低约100%。在一些情况下,一种或多种基因的表达可降低或降低约正常表达的99%、95%、90%、85%、80%、75%、 70%、65%、60%、55%或50%,例如,与非修饰对照的表达相比。在一些情况下,一种或多种基因的表达可降低正常表达的至少或至少约99%至90%;89%至80%;79%至70%;69%至60%;59%至50%,例如,与非修饰对照的表达相比。例如,一种或多种基因的表达可降低正常表达的至少或至少约90%或者至少或至少约90%至99%。
可通过任何已知的方法测量表达,诸如定量PCR(qPCR),包括但不限于PCR、实时PCR(例如,Sybr-green)和/或热PCR。在一些情况下,可通过检测基因的转录物水平来测量一种或多种基因的表达。例如,可通过Northern印迹法、核酸酶保护分析(例如,RNA 酶保护分析)、逆转录PCR、定量PCR(例如,实时PCR,如实时定量逆转录PCR)、原位杂交(例如,荧光原位杂交(FISH))、斑点印迹分析、差别显示、基因表达的连续分析、消减式杂交、微阵列、纳米序列(nanostring)和/或测序(例如,下一代测序)来测量一种或多种基因的表达。在一些情况下,可通过检测由基因编码的蛋白质的水平来测量一种或多种基因的表达。例如,可通过蛋白质免疫染色、蛋白免疫沉淀、电泳(例如,SDS-PAGE)、Western印迹法、二喹啉甲酸测定法、分光光度法、质谱分析法、酶测定(例如,酶联免疫吸附测定)、免疫组织化学、流式细胞术和/或免疫细胞化学来测量一种或多种基因的表达。还可通过显微术测量一种或多种基因的表达。显微术可以是光学、电子或扫描探针显微术。光学显微术可包括使用亮视野、倾斜照明、交叉偏振光、色散染色、暗视野、相差、差异干涉对比、干涉反射显微术、荧光(例如,对颗粒例如细胞进行免疫染色时)、共聚焦、单平面照明显微术、光片荧光显微术、去卷积或连续时间编码放大显微术。还可通过如本文所述的用于测试表达的任何方法检测MHCI分子的表达。
被破坏的基因
具有本文所述的被破坏的基因的不同组合的细胞、器官和/或组织可导致细胞、器官和/或组织在移植到接受者中时更不易受到排斥反应。例如,发明人已经发现,破坏(例如,降低表达)某些基因(诸如NLRC5、TAP1、GGTA1、B4GALNT2、CMAH、CXCL10、MICA、 MICB、C3和/或CIITA)可提高移植物存活的可能性。在一些情况下,破坏至少两种基因。例如,可以破坏GGTA1-10和Gal2-2。在一些情况下,可以破坏GGTA1-10、Gal2-2和NLRC5-6。在其他情况下,可以破坏NLRC5-6和Gal2-2。
在一些情况下,破坏不仅限于这些基因。考虑本申请中基因的遗传同源物(例如,基因的任何哺乳动物形式)均包含在内。例如,被破坏的基因可表现出与本文公开的基因(例如,NLRC5、TAP1、 GGTA1、B4GALNT2、CMAH、CXCL10、MICA、MICB、C3和/或 CIITA)的某种同一性和/或同源性。因此,考虑可破坏表现出至少或至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、 99%或100%同源性(在核酸或蛋白质水平)的基因,例如,表现出至少或至少约50%至60%;60%至70%;70%至80%;80%至90%;或90%至99%同源性的基因。还考虑可破坏表现出至少或至少约50%、 55%、60%、65%、70%、75%、80%、85%、90%、99%或100%同一性(在核酸或蛋白质水平)的基因,例如,表现出至少或至少约50%至60%;60%至70%;70%至80%;80%至90%;或90%至99%同一性的基因。一些遗传同源物是本领域已知的,然而在一些情况下,同源物是未知的。然而,可通过使用可公开获得的数据库如NCBI BLAST比较核酸(DNA或RNA)序列或蛋白质序列,找到哺乳动物之间的同源基因。示例性基因的基因组序列、cDNA和蛋白质序列示于表1中。
基因抑制还可通过多种方式进行。例如,可通过敲除、改变基因的启动子和/或通过施用干扰RNA(敲低)来降低基因表达。这可在生物体水平或在组织、器官和/或细胞水平进行。如果在非人动物、细胞、组织和/或器官中敲低一种或多种基因,则可通过施用RNA干扰试剂(例如,siRNA、shRNA或微小RNA)来减少所述一种或多种基因。例如,可将可表达shRNA的核酸稳定地转染入细胞以敲低表达。此外,可将可表达shRNA的核酸插入到非人动物的基因组中,从而在非人动物中敲低基因。
破坏方法还可以包括过表达显性失活蛋白质。该方法可导致功能野生型基因的功能整体降低。另外,表达显性失活基因可导致类似于敲除和/或敲低的表型的表型。
在一些情况下,可在一个或多个基因中插入或产生(例如,通过核苷酸替换)终止密码子,这可导致非功能转录物或蛋白质(有时称为敲除)。例如,如果在一个或多个基因的中间产生终止密码子,则所产生的转录和/或蛋白质可被截短,并且可以是非功能性的。然而,在一些情况下,截短可导致活性(部分或过度活性的)蛋白质。在一些情况下,如果蛋白质是过度活性的,则这可导致显性失活蛋白质,例如,破坏野生型蛋白质活性的突变多肽。
该显性失活蛋白可在任何启动子控制下的核酸中表达。例如,启动子可以是普遍存在的启动子。启动子还可以是诱导型启动子、组织特异性启动子和/或发育特异性启动子。
然后,可将编码显性失活蛋白质的核酸插入到细胞或非人动物中。可使用任何已知的方法。例如,可使用稳定转染。此外,编码显性失活蛋白质的核酸可插入到非人动物的基因组中。
可使用本领域已知的任何方法敲除非人动物中的一种或多种基因。例如,敲除一种或多种基因可包括从非人动物的基因组中删除一种或多种基因。敲除还可包括从非人动物中去除全部或部分基因序列。还考虑,敲除可包括用一个或多个核苷酸替换非人动物基因组中的全部或部分基因。敲除一种或多种基因还可以包括在一种或多种基因中插入序列,从而破坏所述一种或多种基因的表达。例如,插入序列可在一种或多种基因的中间产生终止密码子。插入序列还可移动所述一种或多种基因的开放阅读框。在一些情况下,敲除可以在基因的第一外显子中进行。在其他情况下,敲除可以在基因的第二外显子中进行。
敲除可在非人动物的任何细胞、器官和/或组织中进行。例如,敲除可以是全身敲除,例如,一种或多种基因的表达在非人动物的所有细胞中均降低。敲除还可对非人动物的一种或多种细胞、组织和/ 或器官具有特异性。这可通过条件性基因敲除来实现,其中一种或多种基因的表达在一种或多种器官、组织或细胞类型中选择性降低。可通过Cre-lox系统进行条件性基因敲除,其中cre在细胞、组织和/或器官特异性启动子的控制下进行表达。例如,可在一种或多种组织或器官中敲除一种或多种基因(或可降低表达),其中所述一种或多种组织或器官可包括脑、肺、肝、心脏、脾、胰腺、小肠、大肠、骨骼肌、平滑肌、皮肤、骨骼、脂肪组织、毛发、甲状腺、气管、胆囊、肾、输尿管、膀胱、主动脉、静脉、食道、隔膜、胃、直肠、肾上腺、支气管、耳、眼、视网膜、生殖器、下丘脑、喉、鼻、舌、脊髓或输尿管、子宫、卵巢、睾丸和/或其任意组合。还可在一种类型的细胞中敲除一种或多种基因(或可降低表达),其中一种或多种类型的细胞包括毛细胞、角质形成细胞、促性腺激素细胞、促肾上腺皮质激素细胞、促甲状腺素细胞、生长激素细胞、泌乳细胞、嗜铬细胞、滤泡旁细胞、球细胞、黑素细胞、痣细胞、梅克尔细胞、成牙本质细胞、成牙骨质细胞、角膜细胞、视网膜muller细胞、视网膜色素上皮细胞、神经元、神经胶质细胞(例如,少突胶质细胞、星形胶质细胞)、室管膜细胞、松果体细胞、肺细胞(例如,I型肺细胞和II型肺细胞)、克拉拉细胞、杯形细胞、G细胞、D细胞、肠嗜铬细胞样细胞、胃主细胞、壁细胞、凹细胞、K细胞、D细胞、I细胞、杯形细胞、帕内特细胞、肠上皮细胞、微皱褶细胞、肝细胞、肝星状细胞(例如,来自中胚层的枯否细胞)、胆囊细胞、泡心细胞、胰腺星状细胞、胰腺α细胞、胰腺β细胞、胰腺δ细胞、胰腺F细胞、胰腺ε细胞、甲状腺 (例如,滤泡细胞)、甲状旁腺(例如,甲状旁腺主细胞)、嗜酸细胞、尿道上皮细胞、成骨细胞、骨细胞、成软骨细胞、软骨细胞、成纤维细胞、纤维细胞、成肌细胞、肌细胞、肌卫星细胞、腱细胞、心肌细胞、成脂肪细胞、脂肪细胞、cajal间质细胞、成血管细胞、内皮细胞、系膜细胞(例如,肾小球内系膜细胞和肾小球外系膜细胞)、肾小球旁细胞、致密斑细胞、基质细胞、间质细胞、端细胞简单上皮细胞、足细胞、肾近端小管刷状缘细胞、支持细胞、莱迪希细胞、颗粒细胞、胚栓细胞、生殖细胞、精子、卵子、淋巴细胞、骨髓细胞、内皮祖细胞、内皮干细胞、成血管细胞、中成血管细胞、周细胞壁细胞和/或其任意组合。
条件性基因敲除可以是诱导型的,例如通过使用四环素诱导型启动子、发育特异性启动子。这可允许在任何时间或在特定时间消除或抑制基因/蛋白质的表达。例如,在四环素诱导型启动子的情况下,可在出生后的任何时间给予非人动物四环素。如果非人动物是在子宫中发育的生命,则可通过在妊娠期间给予母亲四环素来诱导启动子。如果非人动物在卵中发育,则可通过注射四环素或在四环素中孵化来诱导启动子。一旦将四环素给予非人动物,四环素将导致cre的表达,这随后将导致感兴趣的基因的切除。
cre/lox系统还可处于发育特异性启动子的控制之下。例如,一些启动子在出生后,甚至在青春期开始后开启。这些启动子可用于控制cre表达,因此可用于发育特异性敲除。
还考虑,可将敲除技术的任意组合进行组合。例如,组织特异性敲除可与诱导技术组合,产生组织特异性诱导型敲除。此外,其他系统如发育特异性启动子可与组织特异性启动子和/或诱导型敲除组合使用。
在一些情况下,基因编辑可用于设计敲除。例如,可使用核酸酶进行基因编辑,该核酸酶包括CRISPR相关蛋白(Cas蛋白,例如Cas9)、锌指核酸酶(ZFN)、转录激活因子样效应物核酸酶(TALEN)和大范围核酸酶。核酸酶可以是天然存在的核酸酶、遗传修饰的核酸酶和/或重组核酸酶。例如,CRISPR/Cas系统可适合作为基因编辑系统。
还考虑,可敲除非人动物的一种或多种基因的少于全部的等位基因。例如,在二倍体非人动物中,考虑敲除两个等位基因中的一个。这可导致基因的表达降低和蛋白质水平降低。与两个等位基因均起作用(例如,不敲除和/或敲低)时相比;总降低的表达可以是小于或小于约99%、95%、90%、85%、80%、75%、70%、65%、60%、55%、 50%、45%、40%、35%、30%、25%或20%;例如,是或是约99%至 90%;90%至80%;80%至70%;70%至60%;60%至50%;50%至 40%;40%至30%或30%至20%。此外,蛋白质水平的总降低可与总表达的降低相同。与两个等位基因均起作用(例如,不敲除和/或敲低) 时相比;蛋白质水平的总降低可以是约或小于约99%、95%、90%、 80%、70%、60%、50%、40%、30%或20%,例如,是或是约99%至 90%;90%至80%;80%至70%;70%至60%;60%至50%;50%至 40%;40%至30%或30%至20%。然而,还考虑可敲除非人动物中的一种或多种基因的所有等位基因。
可通过基因分型验证一种或多种基因的敲除。用于基因分型的方法可包括测序、限制性片段长度多态性鉴定(RFLPI)、随机扩增多态性检测(RAPD)、扩增片段长度多态性检测(AFLPD)、PCR(例如,长片段PCR或分段PCR)、等位基因特异性寡核苷酸(ASO)探针,以及与DNA微阵列或珠子杂交。例如,可通过测序进行基因分型。在一些情况下,测序可以是高保真测序。测序方法可包括 Maxam-Gilbert测序、链终止法(例如Sanger测序)、鸟枪法测序和桥式PCR。在一些情况下,可通过下一代测序进行基因分型。下一代测序的方法可包括大规模平行标记测序、菌落测序、焦磷酸测序(例如, 454Life Sciences开发的焦磷酸测序)、单分子实时测序(例如,Pacific Biosciences)、离子半导体测序(例如,Ion Torrent半导体测序)、合成测序(例如,Illumina的Solexa测序)、连接法测序(例如,Applied Biosystems的SOLiD测序)、DNA纳米球测序和heliscope单分子测序。在一些情况下,本文的非人动物的基因分型可包括全基因组测序分析。在一些情况下,可通过对一部分基因或全部基因进行测序(例如,下一代测序)来验证动物中基因的敲除。例如,可通过全部NLRC5 的下一代测序验证猪中NLRC5基因的敲除。可使用例如正向引物 5’-gctgtggcatatggcagttc-3’(SEQ IDNo.1)和反向引物 5’-tccatgtataagtctttta-3’(SEQ ID No.2)或正向引物 5’-ggcaatgccagatcctcaac-3’(SEQ ID No.3)和反向引物 5’-tgtctgatgtctttctcatg-3’(SEQID No.4)进行NLRC5的下一代测序。
表1.示例性破坏基因的基因组序列、cDNA和蛋白质*
*表1的序列可在表18中找到。
转基因
转基因或外源核酸序列可用于以比没有转基因的情况下更高的水平过表达内源基因。此外,外源核酸序列可用于表达外源基因。转基因还可包括其他类型的基因,例如,显性失活基因。
蛋白质X的转基因可指包含编码蛋白质X的外源核酸序列的转基因。如本文所用,在一些情况下,编码蛋白质X的转基因可以是编码蛋白质X的100%或约100%的氨基酸序列的转基因。在一些情况下,编码蛋白质X的转基因可编码蛋白质X的全部或部分氨基酸序列。例如,转基因可编码蛋白质X的至少或至少约99%、95%、90%、 80%、70%、60%、50%、40%、30%、20%、10%或5%,例如为或为约99%至90%;90%至80%;80%至70%;70%至60%;或60%至50%的氨基酸序列。转基因的表达可最终产生功能蛋白质,例如,部分或全功能蛋白质。如上所讨论的,如果部分序列被表达,则在一些情况下最终的结果可以为非功能蛋白质或显性失活蛋白质。非功能蛋白质或显性失活蛋白质还可与功能(内源或外源)蛋白质竞争。转基因还可编码RNA(例如,mRNA、shRNA、siRNA或微小RNA)。在一些情况下,当转基因编码mRNA时,该mRNA转而可被翻译成多肽(例如蛋白质)。因此,考虑转基因可编码蛋白质。在一些情况下,转基因可编码蛋白质或蛋白质的一部分。此外,与野生型多肽相比,蛋白质可具有一种或多种突变(例如,缺失、插入、氨基酸置换或重排)。蛋白质可以是天然多肽或人工多肽(例如,重组多肽)。转基因可编码由两种或更多种多肽形成的融合蛋白。
当转基因或外源核酸序列基于天然存在的mRNA(例如,通常在另一物种中发现的mRNA)编码mRNA时,该mRNA可以在5’或3’非翻译区中包含一个或多个修饰。该一个或多个修饰可包含一个或多个插入、一个或多个缺失或一个或多个核苷酸变化或其组合。该一个或多个修饰可以增加该mRNA的稳定性。该一个或多个修饰可以去除miRNA 分子(如可以抑制翻译或刺激mRNA降解的miRNA分子)的结合位点。例如,可以修饰编码HLA-G蛋白质的mRNA以去除miR148家族miRNA 的结合位点。去除该结合位点可以增加mRNA稳定性。
可以以产生转基因产物的方式将转基因置于生物体、细胞、组织或器官中。例如,本文公开了包含一种或多种转基因的非人动物。一种或多种转基因可与如本文所述的一种或多种破坏相组合。转基因可并入细胞中。例如,转基因可并入生物体的生殖细胞系中。当插入细胞中时,转基因可以是互补DNA(cDNA)区段(其为信使RNA (mRNA)的拷贝),或位于其基因组DNA原始区域(含有或不含有内含子)的基因本身。
转基因可包含编码物种的蛋白质并在不同物种的动物中表达该蛋白质的多核苷酸。例如,转基因可包含编码人蛋白质的多核苷酸。这样的多核苷酸可用于在非人动物(例如猪)中表达人蛋白质(例如CD47)。在一些情况下,该多核苷酸可以是合成的,例如,在序列和/或化学特征方面不同于任何天然多核苷酸。
可以优化编码物种X的蛋白质的多核苷酸以在物种Y的动物中表达该蛋白质。可能存在密码子使用偏倚(例如,编码DNA中同义密码子的出现频率的差异)。密码子可以是编码多肽链中的特定氨基酸残基或用于终止翻译(终止密码子)的一系列核苷酸(例如,一系列3个核苷酸)。不同的物种可能在DNA密码子中具有不同的偏好。在一些情况下,优化的多核苷酸可以编码具有物种Y的密码子的物种X的蛋白质,使得与编码物种X的蛋白质的天然基因相比,该多核苷酸可以在物种Y中更有效地表达该蛋白质。在一些情况下,优化的多核苷酸在物种Y中可以比编码相同的蛋白质的物种X的天然基因至少5%、10%、20%、40%、 80%、90%、1.5倍、2倍、5倍或10倍更有效地表达蛋白质。
人白细胞抗原G(HLA-G)
HLA-G可以是强效的免疫抑制性的致耐受性分子。人胎儿中的 HLA-G表达可以使得人胎儿能够躲避母体免疫应答。迄今为止,尚未报道刺激功能和对同种异体HLA-G的应答。HLA-G可以是非经典的HLA I类分子。它可以在其遗传多样性、表达、结构和功能上与经典MHC I 类分子不同。HLA-G的特征可能在于低等位基因多态性。HLA-G的表达可限于滋养层细胞、成体胸腺髓质和干细胞。然而,可以在诸如癌症、多发性硬化、炎性疾病或病毒感染的病理状况中诱导HLA-G新表达。
已经鉴定了7种HLA-G同种型。不同的同种型可以是选择性剪接的产物。其中4个(HLA-G1至-G4)可以是膜结合的,且3个(HLA-G5 至-G7)可以是可溶性同种型。HLA-G1和HLA-G5同种型呈现由3个球状结构域(α1-α3)重链形成的经典HLA I类分子的典型结构,其与β-2-微球蛋白(B2M)和九肽非共价结合。截短的同种型缺少1或2个结构域,但它们都含有α1结构域,并且它们都是不含B2M的同种型。
HLA-G可通过直接结合抑制性受体,例如ILT2/CD85j/LILRB1、 ILT4/CD85d/LILRB2或KIR2DL4/CD158d,发挥免疫抑制功能。
ILT2可由B细胞、一些T细胞、一些NK细胞和单核细胞/树突细胞表达。ILT4可以是骨髓特异性的,并且其表达可以限于单核细胞/树突细胞。KIR2DL4可以是HLA-G的特异性受体。它可以由NK细胞的CD56 亮子集表达。ILT2和ILT4受体可通过α3结构域和B2M结合大范围的经典HLA分子。然而,HLA-G可以是它们的最高亲和力配体。
ILT2-HLA-G相互作用可以介导对以下方面的抑制,例如:i)NK 和抗原特异性CD8+T细胞溶细胞功能,ii)CD4+T细胞的同种异体增殖响应,以及iii)树突细胞的成熟和功能。ILT2-HLA-G相互作用可以在体外和体内阻碍幼稚和记忆B细胞两者的功能。在B细胞活化的T 细胞依赖性和非依赖性模型中,HLA-G可以抑制B细胞增殖、分化和Ig分泌。在调节B细胞Ab分泌方面,HLA-G可以充当负B细胞调节剂。 HLA-G还可以诱导调节性T细胞的分化,然后该T细胞可以抑制可能参与同种异体移植物的耐受性的同种异体反应本身。
肿瘤细胞对HLA-G的表达可以实现避免宿主T淋巴细胞和NK细胞介导的免疫监视。因此,恶性肿瘤细胞对HLA-G的表达可通过抑制肿瘤浸润性NK细胞、细胞毒性T淋巴细胞(CTL)和抗原呈递细胞(APC) 的活性来预防肿瘤免疫根除。
HLA-G结构变异,特别是其单体/多聚体状态及其与B2M的结合,可在HLA-G的生物学功能、其调节及其与抑制性受体ILT2和ILT4的相互作用中发挥作用。
相比于单体结构,ILT2和ILT4抑制性受体可能具有对HLA-G多聚体的更高的亲和力。HLA-G1和HLA-G5(HLA-G1/5)可通过α1结构域内位置42上的独特的半胱氨酸残基(Cys42-Cys42)之间的二硫键形成二聚体。B2M相关HLA-G1的二聚体可以以比单体更高的亲和力结合ILT2和ILT4。二聚体的亲和力的这种增加可能是由于暴露α3结构域的ILT2和ILT4结合位点的倾斜取向,使得它更容易被受体接近。ILT2 和ILT4均可以以F195和Y197残基的水平结合HLA-Gα3结构域。
ILT2和ILT4差异性地与它们的HLA-G同种型结合。ILT2仅可识别B2M相关的HLA-G结构,而ILT4可识别B2M缔合的和无B2M的 HLA-G重链。已经在细胞表面和表达HLA-G的细胞的培养上清液中检测到无B2M的重链。此外,无B2M的HLA-G重链可以是人绒毛滋养层细胞产生的主要结构。(无B2M)α1-α3结构(HLA-G2和G-6同种型) 的存在显示在人心脏移植接受者的循环中,并且可能与更好的同种异体移植物接受性相关。α1-α3结构仅可与ILT4结合,而不与ILT2结合。然而,α1-α3二聚体(通过位置42中的两个游离半胱氨酸之间的二硫键实现的α1-α3单体的二聚化)在同种异体鼠皮肤移植模型中可以是体内致耐受性的。(α1-α3)x2合成分子可以抑制不表达ILT4的肿瘤细胞系的增殖。这可能表明存在尚未知的HLA-G受体。
因此,在一个方面,本文公开了包含编码HLA-G蛋白质的外源核酸序列的遗传修饰的非人动物和细胞。该遗传修饰的非人动物和细胞还可以包含一种或多种另外的遗传修饰,如本文公开的任何遗传修饰(例如,敲入、敲除、基因破坏等)。例如,该遗传修饰的非人动物和细胞也可包含编码B2M蛋白质的另一种外源核酸序列。
非人动物可包含含有一种或多种多核苷酸插入片段的一种或多种转基因。该多核苷酸插入片段可编码一种或多种蛋白质或其功能片段。例如,非人遗传修饰的动物可包含编码一种或多种蛋白质或其功能片段的一种或多种外源核酸序列。在一些情况下,非人动物可包含一种或多种转基因,该转基因含有编码可降低MHC分子(例如,MHC I分子和/或MHCII分子)的表达和/或功能的蛋白质的一种或多种多核苷酸插入片段。一种或多种转基因可包含编码MHC I形成阻抑因子、补体激活调节因子、NK细胞的抑制性配体、B7家族成员、CD47、丝氨酸蛋白酶抑制剂、半乳凝素和/或其任何片段的一种或多种多核苷酸插入片段。在一些情况下,MHC I形成阻抑因子可以是感染性细胞蛋白47(ICP47)。在一些情况下,补体激活调节因子可包括分化群 46(CD46)、分化群55(CD55)和分化群59(CD59)。在一些情况下,NK细胞的抑制性配体可包括白细胞抗原E(HLA-E)、人白细胞抗原G(HLA-G)和β-2-微球蛋白(B2M)。NK细胞的抑制性配体可以是HLA-G的同种型,例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、 HLA-G5、HLA-G6或HLA-G7。例如,NK细胞的抑制性配体可以是 HLA-G1。HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、 HLA-G5、HLA-G6或HLA-G7)的转基因可指包含编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或 HLA-G7)的核苷酸序列的转基因。如本文所用,在一些情况下,编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、 HLA-G6或HLA-G7)的转基因可以是编码HLA-G(例如,HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)的100%或约100%的氨基酸序列的转基因。在其他情况下,编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或 HLA-G7)的转基因可以是编码HLA-G(例如,HLA-G1、HLA-G2、 HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)的全部或部分序列的转基因。例如,转基因可编码HLA-G(例如,HLA-G1、HLA-G2、 HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)的至少或至少约99%、95%、90%、80%、70%、60%或50%的氨基酸序列。例如,转基因可编码90%的HLA-G氨基酸序列。转基因可包含编码功能性 (例如,部分或全功能)HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、 HLA-G4、HLA-G5、HLA-G6或HLA-G7)的多核苷酸。在一些情况下,一种或多种转基因可包含编码ICP47、CD46、CD55、CD59、HLA-E、 HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、 HLA-G6或HLA-G7)和B2M中的一种或多种的多核苷酸插入片段。 HLA-G基因组DNA序列可具有8个外显子,通过这些外显子,选择性剪接产生7个同种型。HLA-G1同种型可排除外显子7。HLA-G2 同种型可排除外显子3和7。由于跨膜结构域表达的丧失,内含子2 或内含子4的翻译可产生分泌型同种型。HLA-G的基因组序列和 cDNA的图谱示于图14A-14B中。在一些情况下,B7家族成员可包括CD80、CD86、程序性死亡配体1(PD-L1)、程序性死亡配体2 (PD-L2)、CD275、CD276、含V-set域的T细胞激活抑制因子1 (VTCN1)、血小板受体Gi24、天然细胞毒性触发受体3配体1(NR3L1) 和HERV-H LTR-相关2(HHLA2)。例如,B7家族成员可以是PD-L1 或PD-L2。在一些情况下,丝氨酸蛋白酶抑制剂可以是丝氨酸蛋白酶抑制剂9(Spi9)。在一些情况下,半乳凝素可包括半乳凝素-1、半乳凝素-2、半乳凝素-3、半乳凝素-4、半乳凝素-5、半乳凝素-6、半乳凝素-7、半乳凝素-8、半乳凝素-9、半乳凝素-10、半乳凝素-11、半乳凝素-12、半乳凝素-13、半乳凝素-14和半乳凝素-15。例如,半乳凝素可以是半乳凝素-9。
遗传修饰的非人动物可具有本文公开的一种或多种基因和一种或多种转基因的降低的表达。在一些情况下,遗传修饰的非人动物可具有NLRC5、TAP1、CXCL10、MICA、MICB、C3、CIITA、GGTA1、 CMAH和B4GALNT2中的一种或多种的降低的表达,以及包含编码 ICP47、CD46、CD55、CD59、HLA-E、HLA-G(例如,HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、 PD-L1、PD-L2、CD47、Spi9和半乳凝素-9中的一种或多种的一种或多种多核苷酸插入片段的一种或多种转基因。在一些情况下,遗传修饰的非人动物可具有GGTA1、CMAH和B4GALNT2的降低的表达,以及编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、CD47(例如,人CD47)、PD-L1(例如,人PD-L1)和PD-L2(例如,人PD-L2)的外源多核苷酸。在一些情况下,遗传修饰的非人动物可具有GGTA1、CMAH和B4GALNT2 的降低的表达,以及编码HLA-E、CD47(例如,人CD47)、PD-L1 (例如,人PD-L1)和PD-L2(例如,人PD-L2)的外源多核苷酸。在一些情况下,遗传修饰的非人动物可具有NLRC5、C3、CXC10、 GGTA1、CMAH和B4GALNT2的降低的表达,以及编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或 HLA-G7)、CD47(例如,人CD47)、PD-L1(例如,人PD-L1)和PD-L2(例如,人PD-L2)的外源多核苷酸。在一些情况下,遗传修饰的非人动物可具有TAP1、C3、CXC10、GGTA1、CMAH和 B4GALNT2的降低的表达,以及编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、CD47(例如,人CD47)、PD-L1(例如,人PD-L1)和PD-L2(例如,人PD-L2) 的外源多核苷酸。在一些情况下,遗传修饰的非人动物可具有NLRC5、 C3、CXC10、GGTA1、CMAH和B4GALNT2的降低的表达,以及编码HLA-E、CD47(例如,人CD47)、PD-L1(例如,人PD-L1)和 PD-L2(例如,人PD-L2)的外源多核苷酸。在一些情况下,遗传修饰的非人动物可具有TAP1、C3、CXC10、GGTA1、CMAH和 B4GALNT2的降低的表达,以及编码HLA-E的外源多核苷酸。在一些情况下,遗传修饰的非人动物可具有GGTA1的降低的表达,以及包含编码HLA-E的一种或多种多核苷酸插入片段的转基因。在一些情况下,遗传修饰的非人动物可具有GGTA1的降低的表达,以及包含编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、 HLA-G6或HLA-G7)的一种或多种多核苷酸插入片段的转基因。在一些情况下,遗传修饰的非人动物可包含含有一种或多种多核苷酸插入片段的转基因,该插入片段编码插入到Rosa26启动子,例如,猪 Rosa26启动子附近的HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、 HLA-G4、HLA-G5、HLA-G6或HLA-G7)。在一些情况下,遗传修饰的非人动物可具有NLRC5、C3、GGTA1、CMAH和B4GALNT2 的降低的表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1、Spi9、PD-L1、PD-L2、CD47和半乳凝素-9。在一些情况下,遗传修饰的非人动物可具有TAP1、C3、 GGTA1、CMAH和B4GALNT2的降低的表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1、Spi9、PD-L1、PD-L2、CD47和半乳凝素-9。在一些情况下,遗传修饰的非人动物可具有NLRC5、TAP1、C3、GGTA1、CMAH和B4GALNT2 的降低的表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1、Spi9、PD-L1、PD-L2、CD47和半乳凝素-9。在一些情况下,遗传修饰的非人动物可具有NLRC5、C3、 GGTA1和CXCL10的降低的蛋白质表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1或HLA-E。在一些情况下,遗传修饰的非人动物可具有TAP1、C3、GGTA1和 CXCL10的降低的蛋白质表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1或HLA-E。在一些情况下,遗传修饰的非人动物可具有NLRC5、TAP1、C3、GGTA1 和CXCL10的降低的蛋白质表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1或HLA-E。在一些情况下,由本文的转基因编码的CD47、PD-L1和PD-L2可以是人 CD47、人PD-L1和人PD-L2。
遗传修饰的非人动物可包含插入动物基因组的基因座中的转基因。在一些情况下,转基因可插入到靶基因的启动子附近或插入靶基因内。在一些情况下,转基因的插入可降低靶基因的表达。靶基因可以是本文公开的表达降低的基因。例如,转基因可插入到NLRC5、 TAP1、CXCL10、MICA、MICB、C3、CIITA、GGTA1、CMAH和 B4GALNT2中的一种或多种的启动子附近或插入NLRC5、TAP1、 CXCL10、MICA、MICB、C3、CIITA、GGTA1、CMAH和B4GALNT2 中的一种或多种内。在一些情况下,转基因可插入到GGTA1的启动子附近或插入GGTA1内。在一些情况下,转基因(例如CD47转基因) 可以插入到启动子附近,该启动子允许转基因在某些类型的细胞中选择性表达。例如,CD47转基因可以插入到允许CD47转基因在血细胞和脾细胞中选择性表达的启动子附近。一种这样的启动子可以是GGTA1 启动子。
例如,非人动物可包含一种或多种转基因(例如外源核酸序列),该转基因含有感染性细胞蛋白47(ICP47)、分化群46(CD46)、分化群55(CD55)、分化群59(CD59)、HLA-E、HLA-G(例如,HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、 Spi9、PD-L1、PD-L2、CD47、半乳凝素-9、其任意功能片段或其任意组合中的一种或多种多核苷酸插入片段。编码ICP47、CD46、CD55、 CD59、HLA-E、HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)或B2M的多核苷酸可编码ICP47、 CD46、CD55、CD59、HLA-E、HLA-G(例如,HLA-G1、HLA-G2、 HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、Spi9、 PD-L1、PD-L2、CD47或半乳凝素-9人蛋白质中的一种或多种。非人动物可包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、 16、17、18、19、20种或更多种转基因。例如,非人动物可包含含有 ICP47、CD46、CD55、CD59、HLA-E、HLA-G(例如,HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、 Spi9、PD-L1、PD-L2、CD47、半乳凝素-9、其任意功能片段或其任意组合的一种或多种转基因。非人动物还可包含编码ICP47的单个转基因。非人动物有时可包含编码CD59的单个转基因。非人动物有时可包含编码HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、 HLA-G5、HLA-G6或HLA-G7)的单个转基因。非人动物有时可包含编码HLA-E的单个转基因。非人动物有时可包含编码B2M的单个转基因。非人动物还可包含两种或更多种转基因,其中该两种或更多种转基因为ICP47、CD46、CD55、CD59和/或其任意组合。例如,两种或更多种转基因可包括CD59和CD46,或CD59和CD55。非人动物还可包含三种或更多种转基因,其中所述三种或更多种转基因可包括ICP47、CD46、CD55、CD59或其任意组合。例如,三种或更多种转基因可包括CD59、CD46和CD55。非人动物还可包含四种或更多种转基因,其中所述四种或更多种转基因可包括ICP47、CD46、CD55 和CD59。非人动物可包含含有ICP47、CD46、CD55和CD59的四种或更多种转基因。
可使用转基因和基因破坏的组合。非人动物可包含一种或多种降低的基因和一种或多种转基因。例如,一种或多种表达降低的基因可包括NLRC5、TAP1、GGTA1、B4GALNT2、CMAH、CXCL10、 MICA、MICB、C3、CIITA和/或其任意组合中的任一种,并且一种或多种转基因可包括ICP47、CD46、CD55、CD59、其任意功能片段和/或其任意组合。例如,仅仅为了说明各种组合,一种或多种表达被破坏的基因可包括NLRC5,并且一种或多种转基因包括ICP47。一种或多种表达被破坏的基因还可包括TAP1,并且一种或多种转基因包括ICP47。一种或多种表达被破坏的基因还可包括NLRC5和TAP1,并且一种或多种转基因包括ICP47。一种或多种表达被破坏的基因还可包括NLRC5、TAP1和GGTA1,并且一种或多种转基因包括ICP47。一种或多种表达被破坏的基因还可包括NLRC5、TAP1、B4GALNT2 和CMAH,并且一种或多种转基因包括ICP47。一种或多种表达被破坏的基因还可包括NLRC5、TAP1、GGTA1、B4GALNT2和CMAH,并且一种或多种转基因包括ICP47。一种或多种表达被破坏的基因还可包括NLRC5,并且一种或多种转基因包括CD59。一种或多种表达被破坏的基因还可包括TAP1,并且一种或多种转基因包括CD59。一种或多种表达被破坏的基因还可包括NLRC5和TAP1,并且一种或多种转基因包括CD59。一种或多种表达被破坏的基因还可包括NLRC5、 TAP1和GGTA1,并且一种或多种转基因包括CD59。一种或多种表达被破坏的基因还可包括NLRC5、TAP1、B4GALNT2和CMAH,并且一种或多种转基因包括CD59。一种或多种表达被破坏的基因还可包括NLRC5、TAP1、GGTA1、B4GALNT2和CMAH,并且一种或多种转基因包括CD59。
在一些情况下,基因的第一外显子被遗传修饰。例如,可以被遗传修饰的基因的一个或多个第一外显子可以是选自NLRC5、TAP1、 GGTA1、B4GALNT2、CMAH、CXCL10、MICA、MICB、C3、CIITA 及其任意组合的基因。例如,图112A示出了靶向NLCR5基因的第一外显子的指导RNA。在其他情况下,靶向基因的第二外显子。例如,图 105、图106和图107示出了用于生成靶向第一和第二外显子的指导RNA 的引物对的相关序列以及用于通过测序确定遗传修饰的引物序列。
可以使用且特别考虑的转基因可包括表现出与本文所公开的基因,例如,ICP47、CD46、CD55、CD59、HLA-E、HLA-G(例如, HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、 B2M、Spi9、PD-L1、PD-L2、CD47、半乳凝素-9、其任意功能片段和/或其任意组合的某种同一性和/或同源性的那些基因。因此,考虑到,如果基因表现出至少或至少约60%、70%、80%、90%、95%、 98%或99%的同源性,例如,至少或至少约99%至90%;90%至80%; 80%至70%;70%至60%的同源性(在核酸或蛋白质水平),则该基因可用作转基因。还考虑到,表现出至少或至少约60%、65%、70%、 75%、80%、85%、90%、95%、98%或99%的同一性,例如,至少或至少约99%至90%;90%至80%;80%至70%;70%至60%的同一性 (在核酸或蛋白质水平)的基因可用作转基因。
非人动物还可包含1、2、3、4、5、6、7、8、9、10、11、12、 13、14、15、16、17、18、19、20种或更多种显性失活转基因。显性失活转基因的表达可抑制显性失活转基因的野生型对应物的表达和/ 或功能。因此,例如,包含显性失活转基因X的非人动物可具有与包含表达降低的X基因的不同非人动物相似的表型。一种或多种显性失活转基因可以是显性失活NLRC5、显性失活TAP1、显性失活GGTA1、显性失活CMAH、显性失活B4GALNT2、显性失活CXCL10、显性失活MICA、显性失活MICB、显性失活CIITA、显性失活C3或其任意组合。
还提供了包含一种或多种转基因的非人动物,该转基因编码一种或多种可抑制基因表达例如可敲低基因的核酸。抑制基因表达的 RNA可包括但不限于shRNA、siRNA、RNAi和微小RNA。例如,可给予非人动物siRNA、RNAi和/或微小RNA以抑制基因表达。此外,非人动物可包含编码shRNA的一种或多种转基因。shRNA可以对特定基因具有特异性。例如,shRNA可以对本申请中所述的任何基因(包括但不限于NLRC5、TAP1、GGTA1、B4GALNT2、CMAH、CXCL10、MICA、MICB、B4GALNT2、CIITA、C3和/或其任意组合)具有特异性。
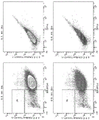
当移植到受试者时,与来自非遗传修饰的对应动物的细胞、组织或器官相比,来自遗传修饰的非人动物的细胞、组织或器官可在受试者中触发较低的免疫应答(例如,移植排斥反应)。在一些情况下,该免疫应答可包括T细胞(例如,CD8+T细胞和/或CD4+T细胞) 和NK细胞的活化、增殖和细胞毒性。因此,可通过将本文公开的遗传修饰的细胞与NK细胞、T细胞(例如,CD8+T细胞或CD4+T细胞)共培养并测试NK细胞或T细胞的活化、增殖和细胞毒性来测量该遗传修饰的细胞的表型。在一些情况下,由遗传修饰的细胞诱导的 T细胞或NK细胞活化、增殖和细胞毒性可以比非遗传修饰的细胞诱导的更低。在一些情况下,可通过酶联免疫斑点(ELISPOT)测定来测量本文的遗传修饰的细胞的表型。
一种或多种转基因可来自不同的物种。例如,一种或多种转基因可包括人基因、小鼠基因、大鼠基因、猪基因、牛基因、狗基因、猫基因、猴基因、黑猩猩基因或其任意组合。例如,转基因可来自人类,从而具有人基因序列。一种或多种转基因可包括人基因。在一些情况下,一种或多种转基因不是腺病毒基因。
转基因可以以随机或位点特异性方式插入非人动物的基因组中。例如,转基因可插入非人动物基因组中的随机基因座中。如果插入基因组中的任何位置,则这些转基因可以是全功能性的。例如,转基因可编码其自身的启动子,或者可插入处于内源启动子控制下的位置中。或者,转基因可插入基因中,如基因的内含子或基因的外显子、启动子或非编码区中。转基因可以整合到基因的第一外显子中。
有时,转基因的多于一个拷贝可插入基因组中的多于一个随机基因座中。例如,多个拷贝可插入基因组中的随机基因座中。与转基因随机插入一次时相比,这可导致整体表达增加。或者,转基因的一个拷贝可插入基因中,而转基因的另一个拷贝可插入不同的基因中。转基因可被靶向,以使其可插入非人动物基因组中的特定基因座。
转基因的表达可受一种或多种启动子控制。启动子可以是普遍存在的组织特异性启动子或诱导型启动子。被插入到启动子附近的转基因的表达可进行调控。例如,如果转基因插入到普遍存在的启动子附近或周围,则该转基因将会在非人动物的所有细胞中表达。一些普遍存在的启动子可以是CAGGS启动子、hCMV启动子、PGK启动子、 SV40启动子或Rosa26启动子。
启动子可以是内源的或外源的。例如,一种或多种转基因可插入到内源或外源Rosa26启动子附近。此外,启动子可以对非人动物具有特异性。例如,一种或多种转基因可插入到猪Rosa26启动子附近。
组织特异性启动子(其可以是与细胞特异性启动子同义的)可用来控制表达的位置。例如,一种或多种转基因可插入到组织特异性启动子附近。组织特异性启动子可以是FABP启动子、Lck启动子、 CamKII启动子、CD19启动子、角蛋白启动子、白蛋白启动子、aP2启动子、胰岛素启动子、MCK启动子、MyHC启动子、WAP启动子或Col2A启动子。例如,启动子可以是胰腺特异性启动子,例如胰岛素启动子。
也可以使用诱导型启动子。可以通过添加或去除诱导剂,在需要时开启和关闭这些诱导型启动子。考虑到,诱导型启动子可以是 Lac、tac、trc、trp、araBAD、phoA、recA、proU、cst-1、tetA、cadA、 nar、PL、cspA、T7、VHB、Mx和/或Trex。
本文所述的非人动物或细胞可包含编码胰岛素的转基因。编码胰岛素的转基因可以是人基因、小鼠基因、大鼠基因、猪基因、牛基因、狗基因、猫基因、猴基因、黑猩猩基因或任何其他哺乳动物基因。例如,编码胰岛素的转基因可以是人基因。编码胰岛素的转基因还可以是嵌合基因,例如部分人基因。
可通过检测转基因的转录物水平来测量转基因的表达。例如,可通过Northern印迹法、核酸酶保护分析(例如,RNA酶保护分析)、逆转录PCR、定量PCR(例如,实时PCR如实时定量逆转录PCR)、原位杂交(例如,荧光原位杂交(FISH))、斑点印迹分析、差别显示、基因表达的连续分析、消减式杂交、微阵列、纳米序列和/或测序(例如,下一代测序)来测量转基因的表达。在一些情况下,可通过检测由基因编码的蛋白质来测量转基因的表达。例如,可通过蛋白质免疫染色、蛋白免疫沉淀、电泳(例如,SDS-PAGE)、Western印迹法、二喹啉甲酸测定法、分光光度法、质谱分析法、酶测定(例如,酶联免疫吸附测定)、免疫组织化学、流式细胞术和/或免疫细胞化学来测量一种或多种基因的表达。在一些情况下,可通过显微术来测量转基因的表达。该显微术可以是光学、电子或扫描探针显微术。在一些情况下,光学显微术包括使用亮视野、倾斜照明、交叉偏振光、色散染色、暗视野、相差、差异干涉对比、干涉反射显微术、荧光(例如,对颗粒例如细胞进行免疫染色时)、共聚焦、单平面照明显微术、光片荧光显微术、去卷积或连续时间编码放大显微术。
可通过基因分型来验证转基因的插入。用于基因分型的方法可包括测序、限制性片段长度多态性鉴定(RFLPI)、随机扩增多态性检测(RAPD)、扩增片段长度多态性检测(AFLPD)、PCR(例如,长片段PCR或分段PCR)、等位基因特异性寡核苷酸(ASO)探针,以及与DNA微阵列或珠子杂交。在一些情况下,可通过测序进行基因分型。在一些情况下,测序可以是高保真测序。测序方法可包括 Maxam-Gilbert测序、链终止法(例如,Sanger测序)、鸟枪法测序和桥式PCR。在一些情况下,可通过下一代测序进行基因分型。下一代测序的方法可包括大规模平行标记测序、菌落测序、焦磷酸测序(例如,454Life Sciences开发的焦磷酸测序)、单分子实时测序(例如, Pacific Biosciences)、离子半导体测序(例如,IonTorrent半导体测序)、合成测序(例如,Illumina的Solexa测序)、连接法测序(例如,Applied Biosystems的SOLiD测序)、DNA纳米球测序和heliscope单分子测序。在一些情况下,本文的非人动物的基因分型可包括全基因组测序分析。
在一些情况下,可通过对一部分转基因或全部转基因进行测序 (例如,下一代测序)来验证动物中转基因的插入。例如,可通过例如使用正向引物5’-cgcctagagaagaggctgtg-3’(SEQ ID No.35)和反向引物5’-ctgctgtggctgtggtgtag-3’(SEQID No.36)对Rosa外显子1至 4进行下一代测序,来验证转基因在猪的Rosa26启动子附近的插入。
表2.示例性转基因的cDNA序列*
| SEQ ID No. | 基因 | 登录号 |
| 37 | CD46 | NM_213888 |
| 38 | CD55 | AF228059.1 |
| 39 | CD59 | AF020302 |
| 40 | ICP47 | EU445532.1 |
| 41 | HLA-G1 | NM_002127.5 |
| 42 | HLA-E | NM_005516.5 |
| 43 | 人β-2-微球蛋白 | NM_004048.2 |
| 44 | 人PD-L1 | NM_001267706.1 |
| 45 | 人PD-L2 | NM_025239.3 |
| 46 | 人Spi9 | NM_004155.5 |
| 47 | 人CD47 | NM_001777.3 |
| 48 | 人半乳凝素-9 | NM_009587.2 |
*表2的序列可在表18中找到。
表3.由示例性转基因编码的蛋白质的序列*
| SEQ ID No. | 蛋白质 | 登录号 |
| 49 | CD46 | NP_999053.1 |
| 50 | CD55 | AAG14412.1 |
| 51 | CD59 | AAC67231.1 |
| 52 | ICP47 | ACA28836.1 |
| 53 | HLA-G1 | NP_002118.1 |
| 54 | HLA-E | NP_005507.3 |
| 55 | 人β-2-微球蛋白 | NP_004039.1 |
| 56 | 人PD-L1 | NP_001254635.1 |
| 57 | 人PD-L2 | NP_079515.2 |
| 58 | 人Spi9 | NP_004146.1 |
| 59 | 人CD47 | NP_001768.1 |
| 60 | 人半乳凝素-9 | NP_033665.1 |
*表3的序列可在表18中找到。
非人动物群体
本文提供了单个非人动物并且还提供了非人动物群体。非人动物群体可以是遗传上相同的。非人动物群体还可以是表型相同的。非人动物群体可以是表型和遗传上都相同的。
本文进一步提供了可被遗传修饰的非人动物群体。例如,群体可包含如本文所公开的至少或至少约2、5、10、50、100或200个非人动物。群体的非人动物可具有相同的表型。例如,群体的非人动物可以是克隆。非人动物群体可具有相同的物理特征。具有相同表型的群体的非人动物可包含相同的转基因。具有相同表型的群体的非人动物还可包含表达降低的相同基因。具有相同表型的群体的非人动物还可包含表达降低的相同基因并包含相同的转基因。非人动物群体可包含至少或至少约2、5、10、50、100或200个具有相同表型的非人动物。例如,任何特定幼崽群的表型可具有相同的表型(例如,在一个实例中,1至约20个非人动物中的任何个数)。群体的非人动物可以是具有相同表型的猪。
群体的非人动物可具有相同的基因型。例如,群体中非人动物染色体中的所有核酸序列可以是相同的。具有相同基因型的群体的非人动物可包含相同的转基因。具有相同基因型的群体的非人动物还可包含表达降低的相同基因。具有相同基因型的群体的非人动物还可包含表达降低的相同基因并包含相同的转基因。非人动物群体可包含至少或至少约2、5、50、100或200个具有相同基因型的非人动物。群体的非人动物可以是具有相同基因型的猪。
来自具有相同基因型和/或表型的两个或更多个非人动物的细胞可用于耐受性疫苗中。在一些情况下,本文公开的耐受性疫苗可包含来自具有相同基因型和/或表型的两个或更多个非人动物(例如,猪) 的多个细胞(例如,遗传修饰的细胞)。用于使接受者对移植物免疫耐受的方法可包括向接受者施用包含来自具有相同基因型或表型的两个或更多个非人动物的多个细胞(例如,遗传修饰的细胞)的耐受性疫苗。
来自具有相同基因型和/或表型的两个或更多个非人动物的细胞可用于移植中。在一些情况下,移植物(例如,异种移植物或同种异体移植物)可包含来自具有相同基因型和/或表型的两个或更多个非人动物的多个细胞。在本文所述方法(例如,用于治疗有需要的受试者的疾病的方法)的实施方案中,可包括移植来自具有相同基因型和 /或表型的两个或更多个非人动物的多个细胞(例如,遗传修饰的细胞)。
可使用本领域已知的任何方法产生非人动物群体。在一些情况下,可通过繁殖产生非人动物群体。例如,同系繁殖可用于产生表型或遗传上相同的非人动物或非人动物群体。可以使用同系繁殖,例如,兄弟姐妹与兄弟姐妹,或父母与子女,或孙子女与祖父母,或曾孙子女与曾祖父母。连续轮的同系繁殖可最终产生表型或遗传上相同的非人动物。例如,至少或至少约2、3、4、5、10、20、30、40或50代的同系繁殖可产生表型和/或遗传上相同的非人动物。认为,在10-20 代的同系繁殖后,非人动物的遗传构成为至少99%纯。由于非人动物可以没有相同的双胞胎,因此连续同系繁殖可产生基本上为同基因的或接近同基因的非人动物。
可使用具有相同基因型的非人动物进行繁殖。例如,非人动物具有表达降低的相同基因并且/或者携带相同的转基因。还可使用具有不同基因型的非人动物进行繁殖。可使用遗传修饰的非人动物和非遗传修饰的非人动物,例如,遗传修饰的雌猪和野生型雄猪,或遗传修饰的雄猪和野生型雌猪进行繁殖。所有这些繁殖组合均可用于产生期望的非人动物。
还可通过克隆产生遗传修饰的非人动物的群体。例如,遗传修饰的非人动物细胞的群体可以以无性方式产生遗传或表型上相同的个体非人动物的类似群体。可通过各种方法,如孪生(twinning)(例如,从胚胎中分裂出一个或多个细胞并使其生长成新的胚胎)、体细胞核移植或人工授精进行克隆。在整个公开内容中提供了这些方法的更多细节。
II.遗传修饰的细胞
本文公开了可用于治疗或预防疾病的一种或多种遗传修饰的细胞。这些遗传修饰的细胞可来自遗传修饰的非人动物。例如,可对如上文公开的遗传修饰的非人动物进行处理,以便分离一个或多个细胞从而产生分离的遗传修饰的细胞。这些分离的细胞在一些情况下还可以是进一步遗传修饰的细胞。然而,可使用修饰的或非修饰的人类或非人动物细胞对细胞进行离体(例如,在动物外部)修饰。例如,可在培养物中对细胞(包括人类和非人动物细胞)进行修饰。还考虑到,遗传修饰的细胞可用于产生本文所述的遗传修饰的非人动物。在一些情况下,可从遗传修饰的动物中分离遗传修饰的细胞。在一些情况下,遗传修饰的细胞可衍生自来自非遗传修饰的动物的细胞。可通过本领域已知的方法,包括原代细胞分离和培养的方法进行细胞的分离。特别地考虑,遗传修饰的细胞并非提取自人类。
因此,可应用于遗传修饰的非人动物的任何方法,包括如本文全文所述的各种制备方法也可应用于本文。例如,所有被破坏的基因和过表达的转基因都可应用于制备本文所用的遗传修饰的细胞。此外,用于测试本文全文所述遗传修饰的非人动物中基因的基因型和表达的任何方法均可用于测试细胞的遗传修饰。
遗传修饰的细胞可来自劳亚兽总目的成员或非人灵长类动物。可从劳亚兽总目成员或非人灵长类动物分离这样的遗传修饰的细胞。或者,这样的遗传修饰的细胞可源自劳亚兽总目的成员或非人灵长类动物。例如,可以例如使用细胞培养或遗传修饰方法从分离自劳亚兽总目成员或非人灵长类动物的细胞制备遗传修饰的细胞。
可对遗传修饰的细胞,例如来自遗传修饰的动物的细胞或离体制备的细胞,进行分析和分选。在一些情况下,可通过流式细胞术,例如荧光激活细胞分选,对遗传修饰的细胞进行分析和分选。例如,可使用流式细胞术,基于识别由转基因编码的多肽的标记(例如,荧光标记)对表达转基因的遗传修饰的细胞进行检测并将该遗传修饰的细胞从其他细胞中纯化。
在一些情况下,遗传修饰的细胞可以减少、抑制或消除免疫应答。例如,遗传修饰可以降低细胞效应子功能、减少增殖、降低持久性和/ 或降低细胞溶解效应分子如免疫细胞中的粒酶B和CD107α的表达。免疫细胞可以是单核细胞和/或巨噬细胞。在一些情况下,T细胞衍生的细胞因子,如IFN-g,可以经由IFN-γ的分泌激活巨噬细胞。在一些情况下,T细胞活化受到抑制并且可能导致巨噬细胞也被抑制。
可使用干细胞,包括非人动物干细胞和人类干细胞。干细胞不具备产生活的人类的能力。例如,干细胞可以不可逆地分化,使得它们不能产生活的人类。干细胞可以是多能的,但注意到干细胞不能产生活的人类。
如上文在关于遗传修饰的非人动物的部分所讨论的,遗传修饰的细胞可包含表达降低的一种或多种基因。如上文所公开的用于遗传修饰的非人动物的相同基因可被破坏。例如,遗传修饰的细胞包含表达被破坏例如降低的一种或多种基因,其中所述一种或多种基因包括 NLRC5、TAP1、GGTA1、B4GALNT2、CMAH、CXCL10、MICA、 MICB、C3、CIITA和/或其任意组合。此外,遗传修饰的细胞可包含含有一种或多种多核苷酸插入片段的一种或多种转基因。例如,遗传修饰的细胞可包含一种或多种转基因,该转基因含有ICP47、CD46、 CD55、CD59、HLA-E、HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、 HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、Spi9、PD-L1、PD-L2、 CD47、半乳凝素-9、其任意功能片段或其任意组合中的一种或多种多核苷酸插入片段。遗传修饰的细胞可包含一种或多种降低的基因和一种或多种转基因。例如,一种或多种表达降低的基因可包括NLRC5、 TAP1、GGTA1、B4GALNT2、CMAH、CXCL10、MICA、MICB、 CIITA和/或其任意组合中的任一种,并且一种或多种转基因可包括 ICP47、CD46、CD55、CD 59、HLA-E、HLA-G(例如,HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、 Spi9、PD-L1、PD-L2、CD47、半乳凝素-9、其任意功能片段和/或其任意组合。在一些情况下,遗传修饰的细胞可具有NLRC5、C3、GGTA1、 CMAH和B4GALNT2的降低的表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1、Spi9、PD-L1、 PD-L2、CD47和半乳凝素-9。在一些情况下,遗传修饰的细胞可具有 TAP1、C3、GGTA1、CMAH和B4GALNT2的降低的表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括 HLA-G1、Spi9、PD-L1、PD-L2、CD47和半乳凝素-9。在一些情况下,遗传修饰的细胞可具有NLRC5、TAP1、C3、GGTA1、CMAH和 B4GALNT2的降低的表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-G1、Spi9、PD-L1、PD-L2、CD47和半乳凝素-9。在一些情况下,由本文的转基因编码的CD47、 PD-L1和PD-L2可以是人CD47、人PD-L1和人PD0-L2。在一些情况下,遗传修饰的细胞可在其表面上包覆有CD47。可通过使细胞表面生物素化,然后将该生物素化的细胞与链霉亲和素-CD47嵌合蛋白一起温育来实现细胞表面上CD47的包覆。包覆的CD47可以是人 CD47。
如上文在关于遗传修饰的非人动物的部分所讨论的,遗传修饰的细胞可包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、 15、16、17、18、19、20种或更多种被破坏的基因。遗传修饰的细胞还可包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、 16、17、18、19、20种或更多种转基因。
如上文详细讨论的,遗传修饰的细胞,例如猪细胞,还可包含显性失活转基因和/或表达一种或多种敲低基因的转基因。同样如上文所讨论的,转基因的表达可受一种或多种启动子控制。
遗传修饰的细胞可以是来自组织或器官的一种或多种细胞,该组织或器官包括脑、肺、肝、心脏、脾、胰腺、小肠、大肠、骨骼肌、平滑肌、皮肤、骨骼、脂肪组织、毛发、甲状腺、气管、胆囊、肾、输尿管、膀胱、主动脉、静脉、食道、隔膜、胃、直肠、肾上腺、支气管、耳、眼、视网膜、生殖器、下丘脑、喉、鼻、舌、脊髓或输尿管、子宫、卵巢和睾丸。例如,遗传修饰的细胞,例如猪细胞,可来自脑、心脏、肝、皮肤、肠、肺、肾、眼、小肠或胰腺。在一些情况下,遗传修饰的细胞可来自胰腺。更具体地,胰腺细胞可以是胰岛细胞。此外,一种或多种细胞可以是胰腺α细胞、胰腺β细胞、胰腺δ细胞、胰腺F细胞(例如PP细胞)或胰腺ε细胞。例如,遗传修饰的细胞可以是胰腺β细胞。本文公开的组织或器官可包含一种或多种遗传修饰的细胞。组织或器官可来自本申请中所描述的一种或多种遗传修饰的动物,例如,胰腺组织如胰岛来自一种或多种遗传修饰的猪。
遗传修饰的细胞,例如猪细胞,可包括一种或多种类型的细胞,其中所述一种或多种类型的细胞包括毛细胞、角质形成细胞、促性腺激素细胞、促肾上腺皮质激素细胞、促甲状腺素细胞、生长激素细胞、泌乳细胞、嗜铬细胞、滤泡旁细胞、球细胞、黑素细胞、痣细胞、梅克尔细胞、成牙本质细胞、成牙骨质细胞、角膜细胞、视网膜Muller 细胞、视网膜色素上皮细胞、神经元、神经胶质细胞(例如,少突胶质细胞、星形胶质细胞)、室管膜细胞、松果体细胞、肺细胞(例如, I型肺细胞和II型肺细胞)、克拉拉细胞、杯形细胞、G细胞、D细胞、 ECL细胞、胃主细胞、壁细胞、凹细胞、K细胞、D细胞、I细胞、杯形细胞、帕内特细胞、肠上皮细胞、微皱褶细胞、肝细胞、肝星状细胞(例如,来自中胚层的枯否细胞)、胆囊细胞、泡心细胞、胰腺星状细胞、胰腺α细胞、胰腺β细胞、胰腺δ细胞、胰腺F细胞(例如,PP细胞)、胰腺ε细胞、甲状腺(例如,滤泡细胞)、甲状旁腺(例如,甲状旁腺主细胞)、嗜酸细胞、尿道上皮细胞、成骨细胞、骨细胞、成软骨细胞、软骨细胞、成纤维细胞、纤维细胞、成肌细胞、肌细胞、肌卫星细胞、腱细胞、心肌细胞、成脂肪细胞、脂肪细胞、cajal 间质细胞、成血管细胞、内皮细胞、系膜细胞(例如,肾小球内系膜细胞和肾小球外系膜细胞)、肾小球旁细胞、致密斑细胞、基质细胞、间质细胞、端细胞简单上皮细胞、足细胞、肾近端小管刷状缘细胞、支持细胞、莱迪希细胞、颗粒细胞、胚栓细胞、生殖细胞、精子、卵子、淋巴细胞、骨髓细胞、内皮祖细胞、内皮干细胞、成血管细胞、中成血管细胞和周细胞壁细胞。遗传修饰的细胞可以潜在地为用于细胞治疗的任何细胞。例如,细胞治疗可以是针对疾病如糖尿病的胰腺β细胞补充或替换。
遗传修饰的细胞,例如猪细胞,可来自(例如,提取自)非人动物。一种或多种细胞可来自成熟的成年非人动物。然而,一种或多种细胞可来自胎儿或新生儿组织。
根据疾病,一种或多种细胞可来自已经生长到足够大小从而可用作成年供体,例如胰岛细胞供体的转基因非人动物。在一些情况下,非人动物可以经过了断奶年龄。例如,非人动物可以为至少或至少约六个月龄。在一些情况下,非人动物可以为至少或至少约18个月龄。在一些情况下,非人动物存活至达到繁殖年龄。例如,用于异种移植的胰岛可来自新生儿(例如,3-7天龄)或断奶前(例如,14至21 天龄)供体猪。一种或多种遗传修饰的细胞,例如猪细胞,可以是培养的细胞。例如,培养的细胞可来自野生型细胞或来自遗传修饰的细胞(如本文所述)。此外,培养的细胞可以是原代细胞。原代细胞可进行提取并例如在液氮中或在-20℃至-80℃下进行冷冻。还可通过已知的方法使培养的细胞永生化,并且可以将该细胞,例如在液氮中或在-20℃至-80℃下进行冷冻和储存。
与移植野生型非遗传修饰的细胞时相比,如本文所述的遗传修饰的细胞,例如猪细胞,可具有更低的排斥反应风险。
本文公开了包含ICP47、CD46、CD55、CD59、HLA-E、HLA-G (例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6 或HLA-G7)、B2M、Spi9、PD-L1、PD-L2、CD47、半乳凝素-9、其任意功能片段或其任意组合的多核苷酸序列的载体。这些载体可插入细胞的基因组中(通过转染、转化、病毒递送或任何其他已知的方法)。这些载体可编码ICP47、CD46、CD55、CD59、HLA-E、HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或 HLA-G7)、B2M、Spi9、PD-L1、PD-L2、CD47和/或半乳凝素-9蛋白质或其功能片段。
考虑的载体包括但不限于质粒载体、人造/小染色体、转座子和病毒载体。本文进一步公开了包含RNA的分离的或合成的核酸,其中该RNA由表2中的任何序列编码。RNA还可编码表现出与表2中的任何序列至少或至少约50%、60%、70%、80%、90%、95%、99%或100%同源性的任何序列。RNA还可编码表现出与表2中的任何序列至少或至少约50%、60%、70%、80%、90%、95%、99%或100%同一性的任何序列。
RNA可以是单链指导RNA。本公开内容还提供了包含表1中任何序列的分离的或合成的核酸。RNA还可提供表现出与表1中的任何序列至少或至少约50%、60%、70%、80%、90%、95%、99%或100%同源性的分离的或合成的核酸。RNA还可提供表现出与表1中的任何序列至少或至少约50%、60%、70%、80%、90%、95%、99%或100%同一性的分离的或合成的核酸。
指导RNA序列可用于靶向非人动物基因组中的一个或多个基因。例如,指导RNA序列可靶向非人动物基因组中的单个基因。在一些情况下,指导RNA序列可靶向非人动物基因组中一个或多个基因中的每一个的一个或多个靶位点。
遗传修饰的细胞还可以是白细胞、淋巴细胞、B淋巴细胞或任何其他细胞如胰岛细胞、胰岛β细胞或肝细胞。可通过本文公开的任何方法,例如通过ECDI固定来固定这些细胞或使这些细胞凋亡。
遗传修饰的细胞可衍生(例如,获取)自非人胎儿动物、围产期非人动物、新生儿非人动物、断奶前非人动物、青年非人动物、成年非人动物或其任意组合。在一些情况下,遗传修饰的非人动物细胞可衍生自胚胎组织,例如胚胎胰腺组织。例如,遗传修饰的细胞可衍生(例如,获取)自胚胎第42天(E42)的胚胎猪胰腺组织。
术语“胎儿动物”及其语法等同语可指动物的任何未出生子代。术语“围产期动物”及其语法等同语可指出生前或出生后不久的动物。例如,围产期可从妊娠第20周至第28周开始,并在出生后1至4周结束。术语“新生儿动物”及其语法等同语可指任何新出生的动物。例如,新生儿动物可以是一个月内出生的动物。术语“断奶前非人动物”及其语法等同语可指脱离母乳之前的任何动物。
遗传修饰的非人动物细胞可被配制成药物组合物。例如,遗传修饰的非人动物细胞可与药学上可接受的赋形剂相组合。可以使用的赋形剂为盐水。药物组合物可用于治疗需要移植的患者。
遗传修饰的细胞可具有任何基因的降低的表达和/或本文所公开的任何转基因。可通过使用与本文针对获得遗传修饰的动物所述的相同的方法来进行细胞的遗传修饰。在一些情况下,制备源自非人动物的遗传修饰的细胞的方法可包括降低一种或多种基因的表达和/或插入一种或多种转基因。可使用本申请所述的任何方法,例如基因编辑,进行基因表达的降低和/或转基因插入。
衍生自干细胞的遗传修饰的细胞
遗传修饰的细胞可以是干细胞。这些遗传修饰的干细胞可用于制备潜在无限供应的细胞,通过本文所公开的方法这些细胞随后可被加工成固定的或凋亡的细胞。如上文所讨论的,干细胞不能产生活的人类。
来自人类多能干细胞的数亿个产胰岛素的葡萄糖反应性胰腺β细胞的产生为糖尿病的细胞移植治疗提供了前所未有的细胞来源 (Pagliuca等人,2014)。正在开发用于糖尿病和其他疾病的细胞移植治疗的其他人类干细胞(胚胎、多能、胎盘、诱导多能干细胞等)衍生的细胞来源。
这些干细胞衍生的细胞移植物容易产生排斥反应。排斥反应可由CD8+T细胞介导。在1型糖尿病接受者中,人类干细胞衍生的功能性β细胞容易产生排斥反应和自身免疫复发。两者均被认为由 CD8+T细胞介导。
为了干扰这些同种反应性和自身反应性CD8+T细胞的活化和效应子功能,已建立的基因修饰分子方法,包括CRISP/Cas9基因靶向,可用于使人类干细胞中的NLRC5、TAP1和/或B2M基因突变,以达到防止干细胞衍生的、部分或完全分化的细胞移植物中功能性 MHC I类的细胞表面表达的目的。因此,移植缺乏MHC I类功能性表达的人类干细胞衍生的细胞移植物可使对为防止排斥反应和自身免疫复发所需的免疫抑制的需求最小化。
然而,在移植的人类细胞上缺乏MHC I类表达将可能导致自然杀伤(NK)细胞被动激活(Ohlen等人,1989)。可通过人类MHC 1类基因HLA-E(其刺激NK细胞上的抑制性受体CD94/NKG2A)的表达来克服NK细胞的细胞毒性,从而防止细胞杀伤(Weiss等人,2009;Lilienfeld等人,2007;Sasaki等人,1999)。HLA-E基因的成功表达取决于人B2M(β2微球蛋白)基因和同源肽的共表达(Weiss等人,2009; Lilienfeld等人,2007;Sasaki等人,1999;Pascasova等人,1999)。干细胞DNA中的核酸酶介导的断裂允许一种或多种基因经由同源性定向修复而插入。连续的HLA-E和hB2M基因可整合到核酸酶介导的 DNA断裂的区域中,从而防止在插入转基因时靶基因(例如,NLRC5) 的表达。
为了进一步使对缺乏MHC I类功能性表达的干细胞衍生的细胞移植物的接受者中维持免疫抑制的需要最小化(如果不消除),还可用本文公开的耐受性凋亡供体细胞治疗这些移植物的接受者。
用于产生产胰岛素的胰腺β细胞的方法(Pagliuca等人,2014) 可潜在地应用于非人类(例如,猪)原代分离多能胚胎干细胞或干细胞样细胞(Goncalves等人,2014;Hall等人V.2008)。然而,这些产胰岛素的胰腺β细胞的接受者可能具有威胁移植成功的主动免疫应答。为了克服抗体介导的和CD8+T细胞的免疫攻击,可在原代非人类多能胚胎干细胞或干细胞样细胞的分离之前对供体动物进行遗传修饰,以防止如整个申请中所公开的GGTA1、CMAH、B4GalNT2或MHC I 类相关基因的表达。从遗传修饰的动物中分离的多能胚胎干细胞或干细胞样细胞随后可分化成数百万产胰岛素的胰腺β细胞。
在一些情况下,异种干细胞衍生的细胞移植可能是期望的。例如,人类胚胎干细胞的使用对接受者而言可能在伦理上受到反对。因此,人类接受者可能对接受衍生自非人源胚胎干细胞的细胞移植物感觉更舒服。
非人类干细胞可包括猪干细胞。这些干细胞可衍生自野生型猪或基因工程猪。如果衍生自野生型猪,最好可在干细胞阶段进行使用已建立的基因修饰分子方法(包括CRISP/Cas9基因靶向)的基因工程。基因工程可以是靶向破坏表达的NLRC5、TAP1和/或B2M基因,以防止MHC I类的功能性表达。破坏移植物中的基因如NLRC5、TAP1 和B2M可造成MHCI类在移植细胞上包括在胰岛β细胞上功能性表达的缺失,从而干扰自身反应性CD8+T细胞的移植后激活。因此,这可以保护移植物,例如,被移植的胰岛β细胞,免受自身反应性 CD8+T细胞的溶细胞效应子功能的影响。
然而,由于干细胞的基因工程可改变其分化潜力,因此一种方法可以是从基因工程猪(包括NLRC5、TAP1和/或B2M基因的表达已被破坏的那些猪)产生干细胞系。
来自经遗传修饰以同样防止GGTA1、CMAH、B4GalNT2基因的表达或来自经修饰以表达编码如整个申请中所公开的补体调节蛋白CD46、CD55或CD59的转基因的猪的干细胞的生成,可进一步改善产胰岛素的胰腺β细胞或其他细胞治疗产品的治疗用途。同样地,与本文所述的相同的策略可用于全文描述的其他方法和组合物。
如同在缺乏MHC I类功能性表达的人类干细胞衍生的细胞移植物的接受者中一样,通过采用耐受性凋亡供体细胞的外周移植治疗可进一步使对猪干细胞衍生的移植物的接受者中维持免疫抑制的需要最小化。
III.耐受性疫苗
传统上,疫苗用于赋予宿主免疫力。例如,在皮肤下注射具有佐剂的灭活病毒可产生对活性和/或恶性种类病毒的暂时或永久免疫力。这可被称为阳性疫苗(图3)。然而,静脉内注射的灭活细胞(例如,来自供体或与供体在遗传上不同的动物的细胞)可导致供体细胞或具有相似细胞标志物的细胞的耐受性。这可被称为耐受性疫苗(也称为阴性疫苗) (图3)。可在无佐剂的情况下注射无活性细胞。或者,可在有佐剂的情况下注射无活性细胞。这些耐受性疫苗通过使接受者耐受并防止排斥反应,从而在移植例如在异种移植中可以是有利的。可在不使用免疫抑制治疗的情况下赋予接受者耐受性。然而,在一些情况下,其他免疫抑制治疗与耐受性疫苗组合可降低移植排斥反应。
图4示出了延长被移植的移植物(例如,异种移植物)在受试者(例如,人或非人灵长类动物)中的存活的示例性方法,其中在瞬时免疫抑制的掩蔽下输注(例如,静脉内输注)来自供体的凋亡细胞用于使接种疫苗耐受。供体可提供用于移植的异种移植物(例如,胰岛)以及作为耐受性疫苗的细胞(例如,脾细胞)。耐受性疫苗细胞可以是凋亡细胞(例如,通过ECDI固定)并在移植之前(例如,第一疫苗,在移植前第7天)和之后(例如,加强疫苗,在移植后第1 天)施用于接受者。耐受性疫苗可提供延长被移植的移植物(例如,胰岛)的存活时间的瞬时免疫抑制。
耐受性疫苗可包含以下类型的细胞中的一种或多种:i)凋亡细胞,其包括单一GGTA1表达降低或GGTA1和CMAH表达降低,或者 GGTA1、CMAH和B4GALNT2表达降低的基因型相同的细胞。这可使对来自与凋亡细胞疫苗供体动物基因型相同的动物,或来自已经历了另外的遗传修饰(例如,NLRC5、TAP1、MICA、MICB、CXCL10、 C3、CIITA基因的抑制或包含ICP47、CD46、CD55、HLA-E、HLA-G (例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、CD59或其任意功能片段中的两种或更多种多核苷酸插入片段的转基因的表达)但与衍生出凋亡细胞疫苗的供体动物基因型相似的动物的器官、组织、细胞和细胞系移植物(例如异种移植物)的细胞介导的免疫力和细胞依赖性抗体介导的免疫力最小化或消除;ii)凋亡干细胞(例如,胚胎、多能、胎盘、诱导多能等)衍生的供体细胞(例如,白细胞、淋巴细胞、T淋巴细胞、B淋巴细胞、红细胞、移植细胞或任何其他供体细胞),其用于使对来自与凋亡细胞疫苗供体动物基因型相同的动物,或来自已经历了另外的遗传修饰 (例如,NLRC5、TAP1、MICA、MICB、CXCL10、C3、CIITA基因的抑制或包含ICP47、CD46、CD55、HLA-E、HLA-G(例如,HLA-G1、 HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M、 CD59或其任意功能片段中的两种或更多种多核苷酸插入片段的转基因的表达)但与衍生出凋亡干细胞衍生细胞疫苗的供体动物基因型相似的动物的器官、组织、细胞和细胞系移植物(例如异种移植物)的细胞介导的免疫力和细胞依赖性抗体介导的免疫力最小化或消除;iii) 凋亡干细胞(例如,胚胎、多能、胎盘、诱导多能等)衍生的供体细胞(白细胞、淋巴细胞、T淋巴细胞、B淋巴细胞、红细胞、移植细胞如功能性胰岛β细胞,或任何其他供体细胞),其用于使对与人类干细胞系基因型相同的器官、组织、细胞和细胞移植物(例如同种异体移植物),或对衍生自已经历了遗传修饰(例如,NLRC5、TAP1、 MICA、MICB、CXCL10、C3、CIITA基因的抑制)但在其他方面与凋亡人类干细胞衍生的供体细胞疫苗基因型相似的相同干细胞系的移植物(例如同种异体移植物)的细胞介导的免疫力和细胞依赖性抗体介导的免疫力最小化或消除;iv)凋亡供体细胞,其中通过UV照射、γ照射或不涉及ECDI存在下的温育的其他方法使这些细胞凋亡。在一些情况下,可向有需要的受试者施用,例如输注(在一些情况下重复输注)耐受性疫苗细胞。可通过破坏(例如,降低表达)来自细胞的一种或多种基因产生耐受性疫苗。例如,如整个申请中所述的遗传修饰的细胞可用于制备耐受性疫苗。例如,细胞可具有可被破坏(例如,降低的表达)的一种或多种基因,包括糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白 (CMAH)、B4GALNT2和/或其任意组合。例如,细胞可仅具有被破坏的GGTA1,或仅具有被破坏的CMAH,或仅具有被破坏的B4GALNT2。细胞还可具有被破坏的GGTA1和CMAH,被破坏的 GGTA1和B4GALNT2,或被破坏的CMAH和B4GALNT2。细胞可具有被破坏的GGTA1、CMAH和B4GALNT2。在一些情况下,被破坏的基因不包括GGTA1。细胞还可表达NLRC5(内源或外源),而 GGTA1和/或CMAH被破坏。细胞还可具有被破坏的C3。
可用包含额外表达的例如如整个申请中所述的一种或多种转基因的细胞产生耐受性疫苗。例如,耐受性疫苗可包括含有一种或多种转基因的细胞,所述一种或多种转基因包含感染性细胞蛋白47 (ICP47)、分化群46(CD46)、分化群55(CD55)、分化群59(CD59)、HLA-E、HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、 HLA-G5、HLA-G6或HLA-G7)、B2M、PD-L1、PD-L2、CD47、其任意功能片段或其任意组合中的一种或多种多核苷酸插入片段。在一些情况下,耐受性疫苗可包含遗传修饰的细胞,该遗传修饰的细胞具有GGTA1、CMAH和B4GALNT2的降低的蛋白质表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括 HLA-G1、PD-L1、PD-L2和CD47。在一些情况下,耐受性疫苗可包含遗传修饰的细胞,该遗传修饰的细胞具有GGTA1、CMAH和 B4GALNT2的降低的蛋白质表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括HLA-E、PD-L1、PD-L2和CD47。在一些情况下,耐受性疫苗可包含表面上包覆有CD47的细胞。可通过使细胞表面生物素化,然后将这些生物素化的细胞与链霉亲和素-CD47嵌合蛋白一起温育来实现细胞表面上CD47的包覆。例如,耐受性疫苗可包含表面上包覆有CD47的细胞,其中该细胞具有GGTA1、CMAH和B4GALNT2的降低的蛋白质表达,以及含有编码蛋白质或其功能片段的多核苷酸的转基因,其中该蛋白质包括 HLA-G1、PD-L1和PD-L2。CD47包覆的细胞可以是非凋亡细胞。或者,CD47包覆的细胞可以是凋亡细胞。
在一些情况下,耐受化可包括施用遗传修饰的移植物。移植物可以是细胞、组织、器官或其组合。在一些情况下,免疫抑制与疫苗或耐受性移植物结合。在一些情况下,移植物上HLA-G1的表达和移植物的 MHC或HLA I类缺乏可能具有独立于疫苗施用的致耐受性活性。
当在受试者中施用时,耐受性疫苗的细胞可具有循环半衰期。耐受性疫苗的细胞可具有至少或至少约0.1、0.5、1、2、3、4、5、6、 7、8、9、10、12、18、24、36、48、60或72小时的循环半衰期。例如,耐受性疫苗的循环半衰期可以为或为约0.1至0.5;0.5至1.0;1.0 至2.0;1.0至3.0;1.0至4.0;1.0至5.0;5至10;10至15;15至 24;24至36;36至48;48至60;或60至72小时。可对耐受性疫苗中的细胞进行处理以增加其循环半衰期。这样的处理可包括用蛋白质例如CD47包覆细胞。经处理以增加其循环半衰期的细胞可以是非凋亡细胞。经处理以增加其循环半衰期的细胞可以是凋亡细胞。或者,可对耐受性疫苗中的细胞进行遗传修饰(例如,在其基因组中插入转基因如CD47)以增加其循环半衰期。经遗传修饰以增加其循环半衰期的细胞可以是非凋亡细胞。经遗传修饰以增加其循环半衰期的细胞可以是凋亡细胞。
耐受性疫苗可具有一种或多种被破坏的基因(例如,降低的表达)和一种或多种转基因。可以使用如本文所述的任何基因和/或转基因。
包含一种或多种被破坏的基因(例如,降低的表达)的细胞可用作耐受性疫苗或可以是耐受性疫苗的一部分。换句话说,包含一种或多种被破坏的基因的细胞可以是耐受性疫苗或可被制成耐受性疫苗。
耐受性疫苗可具有与移植中使用的细胞、器官和/或组织相同的基因型和/或表型。有时,耐受性疫苗和移植物的基因型和/或表型是不同的。用于移植接受者的耐受性疫苗可包含来自被移植的移植物供体的细胞。用于移植接受者的耐受性疫苗可包含在遗传和/或表型上与被移植的移植物不同的细胞。在一些情况下,用于移植接受者的耐受性疫苗可包含来自被移植的移植物供体的细胞和在遗传和/或表型上与被移植的移植物不同的细胞。与被移植的移植物在遗传和/或表型上不同的细胞可来自被移植的移植物供体的相同物种的动物。
用于耐受性疫苗的细胞的来源可来自人类或非人动物。
如整个申请中所公开的细胞可制成耐受性疫苗。例如,耐受性疫苗可由本文公开的一种或多种移植的细胞制成。或者,耐受性疫苗可由不同于任何移植细胞的一种或多种细胞制成。例如,制成耐受性疫苗的细胞可与任何移植细胞在基因型和/或表型上不同。然而,在一些情况下,耐受性疫苗将表达NLRC5(内源或外源)。耐受性疫苗可促进移植中细胞、器官和/或组织的存活。耐受性疫苗可衍生自与供体细胞、器官和/或组织在基因型上相同或相似的非人动物。例如,耐受性疫苗可以是衍生自与供体猪细胞、器官和/或组织在基因型上相同或相似的猪(例如,凋亡猪细胞)的细胞。随后,供体细胞、器官和/ 或组织可用于同种异体移植物或异种移植物。在一些情况下,用于耐受性疫苗的细胞可来自具有降低表达的GGTA1、CMAH和B4GalNT2,并具有编码HLA-G(或HLA-E)、人CD47、人PD-L1和人PD-L2的转基因的遗传修饰的动物(例如,猪)。可通过对用于耐受性疫苗细胞的动物(例如,猪)进行进一步遗传修饰来生成移植供体动物。例如,可通过破坏上述用于耐受性疫苗细胞的动物中的另外的基因(例如,NLRC5(或TAP1)、C3和CXCL10)来生成移植供体动物(图5)。
耐受性疫苗可包含非人动物细胞(例如,非人哺乳动物细胞)。例如,非人动物细胞可来自猪、猫、牛、鹿、狗、白鼬、印度野牛、山羊、马、小鼠、欧洲盘羊、骡、兔、大鼠、绵羊或灵长类动物。具体地,非人动物细胞可以是猪细胞。耐受性疫苗还可包含遗传修饰的非人动物细胞。例如,遗传修饰的非人动物细胞可以是死细胞(例如凋亡细胞)。耐受性疫苗还可包含本文公开的任何遗传修饰的细胞。处理细胞以制备耐受性疫苗
耐受性疫苗可包含用化学品处理的细胞。在一些情况下,处理可诱导细胞凋亡。不受理论的束缚,凋亡细胞可被宿主抗原呈递细胞 (例如,在脾中)摄取,并以非免疫原方式呈递给宿主免疫细胞(例如,T细胞),从而导致诱导免疫细胞(例如,T细胞)中的无反应性。
耐受性疫苗可包含凋亡细胞和非凋亡细胞。耐受性疫苗中的凋亡细胞可与耐受性疫苗中的非凋亡细胞在遗传上相同。或者,耐受性疫苗中的凋亡细胞可与耐受性疫苗中的非凋亡细胞在遗传上不同。耐受性疫苗可包含固定细胞和非固定细胞。耐受性疫苗中的固定细胞可与耐受性疫苗中的非固定细胞在遗传上相同。或者,耐受性疫苗中的固定细胞可与耐受性疫苗中的非固定细胞在遗传上不同。在一些情况下,固定细胞可以是1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(ECDI) 固定的细胞。
可使用化学品例如ECDI来固定耐受性疫苗中的细胞。固定可使细胞凋亡。本文公开的耐受性疫苗、细胞、试剂盒和方法可包括 ECDI和/或ECDI处理。例如,耐受性疫苗可以是用1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(ECDI)处理的细胞,例如,如本文公开的遗传修饰的细胞。换句话说,可用ECDI处理如全文所述的遗传修饰的细胞以产生耐受性疫苗。然后可在移植中使用耐受性疫苗以促进被移植的细胞、器官和/或组织的存活。还考虑,ECDI衍生物、官能化ECDI 和/或取代的ECDI也可用于处理用于耐受性疫苗的细胞。在一些情况下,可用任何合适的碳二亚胺衍生物,例如,ECDI、N,N’-二异丙基碳二亚胺(DIC)、N,N’-二环己基碳二亚胺(DCC)和本领域技术人员了解的其他碳二亚胺衍生物来处理用于耐受性疫苗的细胞。
还可用不涉及在ECDI存在下温育的方法,例如,其他化学品或照射如UV照射或γ照射使用于耐受性疫苗的细胞凋亡。
ECDI可化学交联游离的胺和羧基基团,并可有效诱导例如来自产生耐受性疫苗和供体非人动物的动物的细胞、器官和/或组织中的凋亡。换句话说,相同的遗传修饰的动物可产生耐受性疫苗和用于移植的细胞、组织和/或器官。例如,可用ECDI处理如本文所公开的遗传修饰的细胞。这种ECDI固定可导致耐受性疫苗的产生。
可用于制备耐受性疫苗的遗传修饰的细胞可衍生自:脾(包括脾B细胞)、肝、外周血(包括外周血B细胞)、淋巴结、胸腺、骨髓或其任意组合。例如,细胞可以是脾细胞,例如猪脾细胞。在一些情况下,细胞可以离体扩增。在一些情况下,细胞可衍生自胎儿、围产期、新生儿、断奶前和/或青年非人动物。在一些情况下,细胞可衍生自非人动物的胚胎。
耐受性疫苗中的细胞还可包含两种或更多种被破坏的(例如,降低的表达)基因,其中两种或更多种被破坏的基因可以是糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)、HLA-E、HLA-G(例如,HLA-G1、HLA-G2、 HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7)、B2M和 B4GALNT2、其任意功能片段或其任意组合。在一些情况下,两种或更多种被破坏的基因不包括GGTA1。如上文所述,破坏可以是基因表达的敲除或抑制。可通过基因编辑,例如,通过使用CRISPR/Cas 系统来进行敲除。或者,可通过敲低,例如,使用RNA干扰、shRNA、一种或多种显性失活转基因来进行基因表达的抑制。在一些情况下,细胞可进一步包含如本文所公开的一种或多种转基因。例如,一种或多种转基因可以是CD46、CD55、CD59或其任意组合。
耐受性疫苗中的细胞还可衍生自一种或多种供体非人动物。在一些情况下,细胞可衍生自相同的供体非人动物。细胞可衍生自一种或多种接受者非人动物。在一些情况下,细胞可衍生自两种或更多种非人动物(例如,猪)。
耐受性疫苗可包含或包含约0.001至约5.0,例如,包含或包含约0.001至1.0个内毒素单位/kg预期接受者体重。例如,耐受性疫苗可包含或包含约0.01至5.0、0.01至4.5、0.01至4.0、0.01至3.5、 0.01至3.0、0.01至2.5、0.01至2.0、0.01至1.5、0.01至1.0、0.01至0.9、0.01至0.8、0.01至0.7、0.01至0.6、0.01至0.5、0.01至0.4、 0.01至0.3、0.01至0.2或0.01至0.1个内毒素单位/kg预期接受者体重。
耐受性疫苗可包含或包含约1至100个聚集体/μl。例如,耐受性疫苗可包含或包含约1至5、1至10或1至20个聚集体/μl。耐受性疫苗可包含至少或至少约1、5、10、20、50或100个聚集体。
当约50,000个冻结至解冻的人外周血单核细胞与约160,000个细胞的耐受性疫苗(例如,猪细胞)一起温育时,耐受性疫苗可引发或引发约0.001pg/ml至10.0pg/ml,例如,引发或引发约0.001pg/ml 至1.0pg/ml IL-1β的释放。例如,当约50,000个冻结至解冻的人外周血单核细胞与约160,000个细胞的耐受性疫苗(例如,猪细胞)一起温育时,耐受性疫苗引发或引发约0.001至10.0、0.001至5.0、0.001 至1.0、0.001至0.8、0.001至0.2或0.001至0.1pg/ml IL-1β的释放。当约50,000个冻结至解冻的人外周血单核细胞与约160,000个细胞的耐受性疫苗(例如,猪细胞)一起温育时,耐受性疫苗可引发或引发约0.001至2.0pg/ml,例如,引发或引发约0.001至0.2pg/ml IL-6的释放。例如,当约50,000个冻结至解冻的人外周血单核细胞与约 160,000个细胞的耐受性疫苗(例如,猪细胞)一起温育时,耐受性疫苗可引发或引发约0.001至2.0;0.001至1.0、0.001至0.5或0.001 至0.1pg/ml IL-6的释放。
耐受性疫苗在37℃下温育释放后4小时之后或约4小时之后可包含多于或多于约60%,例如,多于或多于约85%的膜联蛋白V阳性凋亡细胞。例如,耐受性疫苗在37℃下温育释放后约4小时之后包含多于60%、70%、80%、90%或99%的膜联蛋白V阳性凋亡细胞。
耐受性疫苗可包含或包含约0.01%至10%,例如,包含或包含约0.01%至2%的坏死细胞。例如,耐受性疫苗包含或包含约0.01%至10%、0.01%至7.5%、0.01%至5%、0.01%至2.5%或0.01%至1%的坏死细胞。
在施用供体细胞之前、期间和/或之后施用包含经ECDI处理的细胞、器官和/或组织的耐受性疫苗可诱导接受者(例如,人类或非人动物)中对细胞、器官和/或组织的耐受性。可通过静脉内输注来施用经ECDI处理的细胞。
由输注包含经ECDI处理的脾细胞的耐受性疫苗所诱导的耐受性可能依赖于完整的程序性死亡1受体程序性死亡配体1信号传导途径与CD4+CD25+Foxp3+调节T细胞之间的协同效应。
不仅可通过ECDI固定,而且可通过其他方法将耐受性疫苗中的细胞制成凋亡细胞(例如,耐受性疫苗)。例如,可通过使遗传修饰的细胞暴露于紫外线照射,而使如全文所公开的任何遗传修饰的细胞,例如,非人动物细胞或人类细胞(包括干细胞)凋亡。还可通过使遗传修饰的细胞暴露于γ照射而使该细胞凋亡。还考虑不涉及ECDI 的其他方法,例如,通过EtOH固定。
耐受性疫苗中的细胞,例如,经ECDI处理的细胞、抗原偶联细胞和/或表位偶联细胞,可包括供体细胞(例如,来自被移植的移植物的供体的细胞)。耐受性疫苗中的细胞,例如,经ECDI处理的细胞、抗原偶联细胞和/或表位偶联细胞,可包括接受者细胞(例如,来自被移植的移植物的接受者的细胞)。耐受性疫苗中的细胞,例如,经ECDI处理的细胞、抗原偶联细胞和/或表位偶联细胞,可包括第三方(例如,既不是供体也不是接受者)细胞。在一些情况下,第三方细胞来自与接受者和/或供体相同物种的非人动物。在其他情况下,第三方细胞来自与接受者和/或供体不同物种的非人动物。
可在一种或多种抗原和/或表位存在的情况下进行细胞的ECDI 处理。经ECDI处理的细胞可包括供体、接受者和/或第三方细胞。同样,抗原和/或表位可包括供体、接受者和/或第三方抗原和/或表位。在一些情况下,供体细胞与接受者抗原和/或表位偶联(例如,ECDI 诱导的偶联)。例如,利用ECDI使衍生自基因工程化的基因型相同的供体细胞(例如,猪细胞)的可溶性供体抗原与接受者外周血单核细胞偶联,并经由静脉内输注施用ECDI偶联的细胞。
在一些情况下,接受者细胞与供体抗原和/或表位偶联(例如, ECDI诱导的偶联)。在一些情况下,接受者细胞与第三方抗原和/或表位偶联(例如,ECDI诱导的偶联)。在一些情况下,供体细胞与接受者抗原和/或表位偶联(例如,ECDI诱导的偶联)。在一些情况下,供体细胞与第三方抗原和/或表位偶联(例如,ECDI诱导的偶联)。在一些情况下,第三方细胞与供体抗原和/或表位偶联(例如,ECDI 诱导的偶联)。在一些情况下,第三方细胞与接受者抗原和/或表位偶联(例如,ECDI诱导的偶联)。例如,利用ECDI使衍生自基因工程化的基因型相同的供体细胞(例如,猪细胞)的可溶性供体抗原与聚苯乙烯纳米颗粒偶联,并经由静脉内输注施用ECDI偶联的细胞。
可通过与细胞表面一种或多种以下分子进行偶联来进一步优化这些耐受性细胞疫苗中任一种的致耐受性效力:IFN-g、NF-kB抑制剂(如姜黄色素、雷公藤甲素、Bay-117085)、维生素D3、siCD40、原卟啉钴、胰岛素B9-23或改变宿主抗原呈递细胞和宿主淋巴细胞功能的其他免疫调节分子。
这些凋亡细胞疫苗还可由供体细胞来补充,该供体细胞被工程化以在其引发供体反应性细胞的凋亡性死亡的表面分子(如FasL、 PD-L1、半乳凝素-9、CD8α)上展示。
本文公开的耐受性疫苗可增加移植物(例如,异种移植物或同种异体移植物)在接受者中存活的持续时间。本文公开的耐受性疫苗还可减少或消除对移植后免疫抑制的需要。异种移植物或同种异体移植物可以是器官、组织、细胞或细胞系。异种移植物和耐受性疫苗还可来自不同的物种。或者,异种移植物和耐受性疫苗可来自相同的物种。例如,异种移植物和耐受性疫苗可来自基本上在遗传上相同的个体(例如,相同的个体)。
在一些情况下,耐受性疫苗或阴性疫苗可在施用耐受性或阴性疫苗的受试者中产生协同效应。在其他情况下,耐受性或阴性疫苗可在施用耐受性或阴性疫苗的受试者中产生拮抗效应。
经ECDI固定的细胞可配制成药物组合物。例如,经ECDI固定的细胞可与药学上可接受的赋形剂相组合。可以使用的赋形剂为盐水。可以使用的赋形剂为磷酸盐缓冲盐水(PBS)。药物组合物随后可用于治疗需要移植的患者。
IV.获得遗传修饰的非人动物的方法
为了获得如上所述的遗传修饰的非人动物,可以使用各种技术。本文公开了产生遗传修饰的动物的一些实例。应当理解,本文公开的方法仅为实例,并不意在以任何方式进行限制。
基因破坏
可通过上述任何方法进行基因破坏,例如通过敲除、敲低、RNA 干扰、显性失活等进行。在上文关于遗传修饰的非人动物的部分中公开了这些方法的详细描述。
CRISPR/Cas系统
本文所述的方法可利用CRISPR/Cas系统。例如,可使用 CRISPR/Cas系统,例如,II型CRISPR/Cas系统,产生双链断裂(DSB)。本文公开的方法中所使用的Cas酶可以是催化DNA裂解的Cas9。来源于酿脓链球菌(Streptococcus pyogenes)的Cas9或任何密切相关的Cas9的酶促作用可在靶位点序列处产生双链断裂,该靶位点序列与指导序列的20个核苷酸杂交,并且具有位于该靶序列的20个核苷酸之后的前间区序列邻近基序(PAM)。
载体可以与编码CRISPR酶如Cas蛋白的酶编码序列可操作地连接。可在本文中使用的Cas蛋白包括1类和2类。Cas蛋白的非限制性实例包括Cas1、Cas1B、Cas2、Cas3、Cas4、Cas5、Cas5d、Cas5t、 Cas5h、Cas5a、Cas6、Cas7、Cas8、Cas9(也被称为Csn1或Csx12)、Cas10、Csy1、Csy2、Csy3、Csy4、Cse1、Cse2、Cse3、Cse4、Cse5e、 Csc1、Csc2、Csa5、Csn1、Csn2、Csm1、Csm2、Csm3、Csm4、Csm5、 Csm6、Cmr1、Cmr3、Cmr4、Cmr5、Cmr6、Csb1、Csb2、Csb3、Csx17、 Csx14、Csx10、Csx16、CsaX、Csx3、Csx1、Csx1S、Csf1、Csf2、 CsO、Csf4、Csd1、Csd2、Cst1、Cst2、Csh1、Csh2、Csa1、Csa2、 Csa3、Csa4、Csa5、C2c1、C2c2、C2c3、Cpf1、CARF、DinG、其同源物或其修饰型。未修饰的CRISPR酶可具有DNA裂解活性,如Cas9。 CRISPR酶可引导靶序列处,如靶序列内和/或靶序列的互补序列内一条链或两条链的裂解。例如,CRISPR酶可引导在距离靶序列的第一个或最后一个核苷酸约1、2、3、4、5、6、7、8、9、10、15、20、 25、50、100、200、500个或更多个碱基对内一条链或两条链的裂解。可以使用编码CRISPR酶的载体,该CRISPR酶相对于相应的野生型酶而发生突变,使得突变的CRISPR酶缺乏裂解含有靶序列的靶多核苷酸的一条链或两条链的能力。
Cas9可以指与野生型示例性Cas9多肽(例如来自酿脓链球菌(S. pyogenes)的Cas9)具有至少或至少约50%、60%、70%、80%、90%、 91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性和/或序列同源性的多肽。Cas9可以指与野生型示例性Cas9多肽 (例如来自酿脓链球菌)具有至多或至多约50%、60%、70%、80%、 90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性和/或序列同源性的多肽。Cas9可以指Cas9蛋白的野生型或修饰的形式,其可以包含诸如缺失、插入、置换、变异、突变、融合、嵌合或其任意组合的氨基酸改变。
酿脓链球菌Cas9(SpCas9)可用作基因组工程的CRISPR内切核酸酶。但可以使用其他的类似物。在一些情况下,可以使用不同的内切核酸酶来靶向某些基因组靶标。在一些情况下,可以使用具有非NGG PAM序列的合成的SpCas9衍生的变体。另外,已经鉴定了来自多种物种的其他Cas9直系同源物,并且这些“非SpCas9”可以结合也可以用于本发明的多种PAM序列。例如,相对大尺寸的SpCas9(大约4kb编码序列)可导致携带SpCas9cDNA的质粒可能不能在细胞中有效表达。相反,金黄色葡萄球菌(Staphylococcus aureus)Cas9(SaCas9)的编码序列比SpCas9短大约1千碱基,从而可能使其在细胞中有效表达。与 SpCas9类似,SaCas9内切核酸酶能够在哺乳动物细胞(体外)和小鼠 (体内)中修饰靶基因。在一些情况下,Cas蛋白可以靶向不同的PAM 序列。在一些情况下,靶基因如NLRC5可以与例如Cas9PAM、5'-NGG 相邻。在其他情况下,其他Cas9直系同源物可能具有不同的PAM要求。例如,也可以在诸如NLRC5等靶基因附近发现其他PAM,如嗜热链球菌(S.thermophilus)(CRISPR1的5’-NNAGAA和CRISPR3的5’-NGGNG) 和奈瑟氏脑膜炎双球菌(Neisseria meningiditis)(5’-NNNNGATT)的PAM。本发明的转基因可以插入任何Cas或Cas衍生的蛋白质的任何PAM序列附近。在一些情况下,PAM可以在基因组中的每8到12个碱基对或约每8到12个碱基对中找到。PAM可以在基因组中的每1至15个碱基对中找到。PAM也可以在基因组中的每5到20个碱基对中找到。在一些情况下,PAM可以在基因组中的每5、6、7、8、9、10、11、12、13、 14、15、16、17、18、19、20个或更多个碱基对中找到。PAM可以在基因组中的每5-100个碱基对中或之间找到。
例如,对于酿脓链球菌系统,靶基因序列可以在5’-NGG PAM之前(即,5’侧),并且20-nt指导RNA序列可以与相反的链进行碱基配对以介导邻近PAM的Cas9切割。在一些情况下,相邻切口可以为或可以约为PAM上游的3个碱基对。在一些情况下,相邻切口可以为或可以约为PAM上游的10个碱基对。在一些情况下,相邻切口可以为或可以约为PAM上游的0-20个碱基对。例如,相邻切口可以在PAM上游的 1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、 19、20、21、22、23、24、25、26、27、28、29或30个碱基对旁边。相邻切口也可以在PAM下游1至30个碱基对。
酿脓链球菌Cas9的替代物可包括在哺乳动物细胞中显示切割活性的来自Cpf1家族的RNA引导的内切核酸酶。与Cas9核酸酶不同,Cpf1 介导的DNA切割的结果是具有短的3’突出端的双链断裂。Cpf1的交错切割模式可能开启定向基因转移的可能性,类似于传统的限制酶克隆,这可以提高基因编辑的效率。与上述Cas9变体和直系同源物一样,Cpf1 也可以扩展可以被CRISPR靶向至富含AT的区域或富含AT的基因组的位点的数目,这些基因组缺乏SpCas9所偏爱的NGG PAM位点。
可以使用编码包含一个或多个核定位序列(NLS)的CRISPR 酶的载体。例如,可以使用或使用约1、2、3、4、5、6、7、8、9、 10个NLS。CRISPR酶可包含在氨基末端或其附近的NLS,在羧基末端或其附近的约或多于约1、2、3、4、5、6、7、8、9、10个NLS,或这些的任何组合(例如,在氨基末端的一个或多个NLS和在羧基末端的一个或多个NLS)。当存在多于一个NLS时,每一个可独立于其他NLS而被选择,使得单个NLS可存在于多于一个拷贝中并且/ 或者与一个或多个其他NLS组合存在于一个或多个拷贝中。
所述方法中所使用的CRISPR酶可包含至多6个NLS。当最接近NLS的氨基酸位于沿着多肽链距离N末端或C末端的约50个氨基酸内时,例如,位于1、2、3、4、5、10、15、20、25、30、40或50 个氨基酸内时,将NLS视为位于N末端或C末端附近。
指导RNA
如本文所用的,术语“指导RNA”及其语法等同语可指可对靶 DNA具有特异性并且可与Cas蛋白形成复合物的RNA。RNA/Cas复合物可协助将Cas蛋白“指导”至靶DNA。
本文公开的方法还可包括向细胞或胚胎中引入至少一种指导 RNA或核酸,例如,编码至少一种指导RNA的DNA。指导RNA可与RNA指导的内切核酸酶相互作用以将该内切核酸酶引导至特定的靶位点,在该位点处,指导RNA的5’端与染色体序列中的特异性前间区序列碱基配对。
指导RNA可包含两种RNA,例如,CRISPR RNA(crRNA)和反式激活crRNA(tracrRNA)。指导RNA有时可包括通过crRNA和 tracrRNA的一部分(例如,功能部分)融合而形成的单链RNA或单指导RNA(sgRNA)。指导RNA还可以是包含crRNA和tracrRNA的双重RNA。此外,crRNA可与靶DNA杂交。
如上文所讨论的,指导RNA可以是表达产物。例如,编码指导 RNA的DNA可以是包含编码指导RNA的序列的载体。可通过用包含编码指导RNA的序列和启动子的分离的指导RNA或质粒DNA转染细胞或生物体,将指导RNA转移到细胞或生物体中。指导RNA还可以以其他方式,如使用病毒介导的基因递送,而转移到细胞或生物体中。
可以分离指导RNA。例如,可以以分离的RNA的形式将指导 RNA转染到细胞或生物体中。可通过使用本领域已知的任何体外转录系统的体外转录来制备指导RNA。可以以分离的RNA的形式而不是以包含指导RNA编码序列的质粒形式将指导RNA转移到细胞中。
指导RNA可包含三个区域:可与染色体序列中的靶位点互补、位于5’端的第一区域,可形成茎环结构的第二内部区域,以及可以是单链的第三3’区域。每个指导RNA的第一区域也可以是不同的,使得每个指导RNA将融合蛋白指导至特定的靶位点。此外,在所有指导RNA中,每个指导RNA的第二和第三区域可以是相同的。
指导RNA的第一区域可与染色体序列中靶位点处的序列互补,使得指导RNA的第一区域可与该靶位点发生碱基配对。在一些情况下,指导RNA的第一区域可包含或包含约10个核苷酸至25个核苷酸(即10nt至25nt;或约10nt至约25nt;或10nt至约25nt;或约10nt至25nt)或更多个核苷酸。例如,指导RNA的第一区域与染色体序列中的靶位点之间的碱基配对区域可以为或可以约为10、11、 12、13、14、15、16、17、18、19、20、22、23、24、25个或更多个核苷酸的长度。有时,指导RNA的第一区域可以为或可以约为19、 20或21个核苷酸的长度。
指导RNA还可包含形成二级结构的第二区域。例如,由指导 RNA形成的二级结构可包括茎(或发夹)和环。环和茎的长度可以变化。例如,环可以在约3至10个核苷酸长度的范围内,而茎可以在约6至20个碱基对长度的范围内。茎可包含一个或多个1至10个或约10个核苷酸的凸起。第二区域的总长度可以在或在约16至60 个核苷酸长度的范围内。例如,环可以为或可以约为4个核苷酸的长度,而茎可以为或可以约为12个碱基对的长度。
指导RNA还可包含可以基本上是单链、位于3’端的第三区域。例如,第三区域有时不与感兴趣的细胞中的任何染色体序列互补,并且有时不与指导RNA的其余部分互补。此外,第三区域的长度可以变化。第三区域可以为多于或多于约4个核苷酸的长度。例如,第三区域的长度可以在或在约5至60个核苷酸长度的范围内。
指导RNA可以靶向基因靶标的任何外显子或内含子。在一些情况下,指导RNA可以靶向基因的外显子1或2,在其他情况下;指导RNA 可以靶向基因的外显子3或4。组合物可以包含全部靶向相同的外显子的多个指导RNA,或者在一些情况下,包含可以靶向不同的外显子的多个指导RNA。可以靶向基因的外显子和内含子。
指导RNA可以靶向20个核苷酸或约20个核苷酸的核酸序列。靶核酸可少于或少于约20个核苷酸。靶核酸的长度可以为至少或至少约5、 10、15、16、17、18、19、20、21、22、23、24、25、30个或1-100之间的任何数目的核苷酸。靶核酸的长度可以为至多或至多约5、10、15、 16、17、18、19、20、21、22、23、24、25、30、40、50个或1-100之间的任何数目的核苷酸。靶核酸序列可以是紧邻PAM的第一核苷酸的 5’的20个碱基或约20个碱基。指导RNA可以靶向核酸序列。靶核酸可以为至少或至少约1-10、1-20、1-30、1-40、1-50、1-60、1-70、1-80、 1-90或1-100个。
指导核酸,例如指导RNA,可以指可以与另一种核酸,例如细胞基因组中的靶核酸或前间区杂交的核酸。指导核酸可以是RNA。指导核酸可以是DNA。可以将指导核酸编程或设计为与核酸序列位点特异性地结合。指导核酸可包含一条多核苷酸链,并且可被称为单指导核酸。指导核酸可包含两条多核苷酸链,并且可被称为双指导核酸。指导RNA 可作为RNA分子而引入细胞或胚胎中。例如,RNA分子可在体外转录并且/或者可以化学合成。可从合成的DNA分子,例如,基因片段转录RNA。然后指导RNA可作为RNA分子引入细胞或胚胎中。指导RNA也可以以非RNA核酸分子,例如DNA分子的形式引入细胞或胚胎中。例如,编码指导RNA的DNA可以与启动子控制序列可操作地连接,以用于在感兴趣的细胞或胚胎中表达指导RNA。 RNA编码序列可以与被RNA聚合酶III(Pol III)识别的启动子序列可操作地连接。可用于表达指导RNA的质粒载体包括但不限于px330 载体和px333载体(图11和图89)。在一些情况下,质粒载体(例如, px333载体)可包含至少两个编码指导RNA的DNA序列。例如,可以使用px333载体来引入GGTA1-10和Gal2-2,或GGTA1-10、Gal2-2 和NLRC5-6。在其他情况下,可以用px333载体引入NLRC5-6和Gal2-2。
编码指导RNA的DNA序列也可以是载体的一部分。此外,载体可包含另外的表达控制序列(例如,增强子序列、Kozak序列、多聚腺苷化序列、转录终止序列等)、选择性标记序列(例如,抗生素抗性基因)、复制起点等。编码指导RNA的DNA分子还可以是线性的。编码指导RNA的DNA分子还可以是环状的。
当编码RNA指导的内切核酸酶和指导RNA的DNA序列被引入细胞中时,每种DNA序列可以是不同分子的一部分(例如,含有 RNA指导的内切核酸酶编码序列的一个载体和含有指导RNA编码序列的第二载体),或者两者可以是相同分子的一部分(例如,含有RNA 指导的内切核酸酶和指导RNA两者的编码(和调控)序列的一个载体)。
指导RNA可靶向猪或猪细胞中的基因。在一些情况下,指导 RNA可靶向猪NLRC5基因,例如,表4所列的序列。在一些情况下,指导RNA可被设计用于靶向猪NLRC5、GGTA1或CMAH基因。用于制备指导RNA的示例性寡核苷酸在表5中列出。在一些情况下,引入至少两个指导RNA。至少两个指导RNA可各自靶向两个基因。例如,在一些情况下,第一指导RNA可以靶向GGTA1而第二指导RNA可以靶向Gal2-2。在一些情况下,第一指导RNA可以靶向NLRC5而第二指导RNA可以靶向Gal2-2。在其他情况下,第一指导RNA可以靶向 GGTA1-10而第二指导RNA可以靶向Gal2-2。
指导核酸可包含一个或多个修饰,以便为核酸提供新的或增强的特征。指导核酸可包含核酸亲和标签。指导核酸可包含合成的核苷酸、合成的核苷酸类似物、核苷酸衍生物和/或修饰的核苷酸。
在一些情况下,gRNA可包含修饰。可以在gRNA的任何位置进行修饰。可以对单个gRNA进行多于一种修饰。可以在修饰后对gRNA 进行质量控制。在一些情况下,质量控制可包括PAGE、HPLC、MS或其任意组合。
gRNA的修饰可以是置换、插入、缺失、化学修饰、物理修饰、稳定化、纯化或其任意组合。
gRNA也可以通过5’腺苷酸、5’鸟苷-三磷酸帽、5’N7-甲基鸟苷- 三磷酸帽、5’-三磷酸帽、3’磷酸、3’硫代磷酸、5’-磷酸、5’硫代磷酸、顺式-Syn胸苷二聚体、三聚体、C12间隔区、C3间隔区、C6间隔区、d 间隔区、PC间隔区、r间隔区、间隔区18、间隔区9、3’-3’修饰、5’-5’修饰、脱碱基、吖啶、偶氮苯、生物素、生物素BB、生物素TEG、胆固醇TEG、脱硫生物素TEG、DNP TEG、DNP-X、DOTA、dT-生物素、双生物素、PC生物素、补骨脂素C2、补骨脂素C6、TINA、3’DABCYL、黑洞猝灭剂1、黑洞猝灭剂2、DABCYL SE、dT-DABCYL、IRDye QC-1、 QSY-21、QSY-35、QSY-7、QSY-9、羧基接头、硫醇接头、2’脱氧核糖核苷类似物嘌呤、2’脱氧核糖核苷类似物嘧啶、核糖核苷类似物、2’-O- 甲基核糖核苷类似物、糖修饰的类似物、摆动/通用碱基、荧光染料标记、 2’-氟代RNA、2’O-甲基RNA、甲基膦酸酯、磷酸二酯DNA、磷酸二酯 RNA、硫代磷酸酯DNA、硫代磷酸酯RNA、UNA、假尿苷-5’-三磷酸、 5-甲基胞苷-5’-三磷酸或其任意组合进行修饰。
在一些情况下,修饰是永久性的。在其他情况下,修饰是暂时性的。在一些情况下,对gRNA进行多种修饰。gRNA修饰可以改变核苷酸的物理化学性质,如它们的构象、极性、疏水性、化学反应性、碱基配对相互作用或其任意组合。
修饰也可以是硫代磷酸酯替代物。在一些情况下,天然磷酸二酯键可能易被细胞核酸酶快速降解,并且使用硫代磷酸酯(PS)键替代物对核苷酸间连接的修饰可以对细胞降解引起的水解更稳定。修饰可以增加gRNA的稳定性。修饰还可以增强生物活性。在一些情况下,硫代磷酸酯增强的RNA gRNA可以抑制RNA酶A、RNA酶T1、小牛血清核酸酶或其任意组合。这些性质可允许PS-RNA gRNA在体内或体外非常可能暴露于核酸酶的应用中使用。例如,可以在gRNA的5’-或3’-端的最后3-5个核苷酸之间引入硫代磷酸酯(PS)键,这可以抑制外切核酸酶降解。在一些情况下,可以在整个gRNA中添加硫代磷酸酯键以减少内切核酸酶的攻击。
表4.将被指导RNA靶向的NLRC5基因的示例性序列
| SEQ ID No. | 序列(5’-3’) |
| 61 | ggggaggaagaacttcacct |
| 62 | gtaggacgaccctctgtgtg |
| 63 | gaccctctgtgtggggtctg |
| 64 | ggctcggttccattgcaaga |
| 65 | gctcggttccattgcaagat |
| 66 | ggttccattgcaagatgggc |
| 67 | gtcccctcctgagtgtcgaa |
| 68 | gcctcaggtacagatcaaaa |
| 69 | ggacctgggtgccaggaacg |
| 70 | gtacccagagtcagatcacc |
| 71 | gtacccagagtcagatcacc |
| 72 | gtgcccttcgacactcagga |
| 73 | gtgcccttcgacactcagga |
| 74 | gtgcccttcgacactcagga |
| 75 | gggggccccaaggcagaaga |
| 76 | ggcagtcttccagtacctgg |
表5.用于制备指导RNA构建体的示例性寡核苷酸
同源重组
同源重组也可用于如本文所公开的任何相关的遗传修饰。同源重组可允许内源基因中的位点特异性修饰,因此可将新型修饰工程化至基因组中。例如,同源重组(基因转变和经典的链断裂/重新连接) 在DNA分子之间转移遗传序列信息的能力可以致使进行靶向同源重组,并且可成为基因工程和基因操作中强有力的方法。
可通过许多方法来鉴定已经历同源重组的细胞。例如,选择方法可以,例如,通过人抗gal抗体来检测针对细胞的免疫应答的不存在。选择方法还可包括评估暴露于细胞或组织时人血液中的凝血水平。经由抗生素抗性的选择可用于筛选。
获得转基因非人动物
随机插入
本文所述方法的一种或多种转基因可随机插入细胞基因组中的任何基因座中。当插入基因组中的任何位置时,这些转基因都可以是功能性的。例如,转基因可编码其自身的启动子,或者可插入处于内源启动子控制下的位置中。或者,转基因可插入基因中,如基因的内含子或基因的外显子、启动子或非编码区中。转基因可以整合到基因的第一外显子中。
编码转基因序列的DNA可随机插入细胞的染色体中。随机整合可由本领域技术人员已知的将DNA引入细胞中的任何方法产生。这可以包括但不限于电穿孔,声孔效应,基因枪的使用,脂质转染,磷酸钙转染,树枝状大分子的使用,显微注射,包括腺病毒、AAV和逆转录病毒载体在内的病毒载体的使用,和/或II族核酶。
编码转基因的DNA还可设计成包含报告基因,以便可经由报告基因的活化来检测转基因或其表达产物的存在。可以使用本领域已知的任何报告基因,如上文公开的那些。通过在细胞培养物中选择那些报告基因被激活的细胞,可选择含有转基因的细胞。
可经由电穿孔将编码转基因的DNA引入细胞中(图90)。还可经由脂质转染、感染或转化将DNA引入细胞中。电穿孔和/或脂质转染可用于转染成纤维细胞。
可通过表达测定法,例如qPCR,或通过测量RNA水平来验证转基因的表达。表达水平还可指示拷贝数。例如,如果表达水平非常高,则这可指示转基因的多于一个拷贝整合到基因组中。或者,高表达可指示转基因整合到高转录区域中,例如,高度表达的启动子附近。还可通过测量蛋白质水平,如通过Western印迹法来验证表达。
位点特异性插入
以本文公开的任何方法插入一种或多种转基因可以是位点特异性的。例如,一种或多种转基因可插入到启动子附近,例如,Rosa26 启动子附近或接近Rosa26启动子。
可通过将DNA引入细胞中而产生细胞靶向基因座的修饰,其中该DNA与该靶基因座具有同源性。DNA可包含标记基因,从而允许对包含整合的构建体的细胞进行选择。靶载体中的同源DNA可与靶基因座上的染色体DNA进行重组。标记基因可通过同源DNA序列、 3’重组臂和5’重组臂而位于两侧。
多种酶可催化外来DNA向宿主基因组中的插入。例如,位点特异性重组酶可簇集成具有不同生物化学性质的两个蛋白家族,即酪氨酸重组酶(其中DNA与酪氨酸残基共价连接)和丝氨酸重组酶(其中共价连接发生在丝氨酸残基处)。在一些情况下,重组酶可包括Cre, fC31整合酶(衍生自链霉菌噬菌体fC31的丝氨酸重组酶)或细菌噬菌体衍生的位点特异性重组酶(包括Flpλ整合酶、细菌噬菌体HK022 重组酶、细菌噬菌体R4整合酶和噬菌体TP901-1整合酶)。
表达控制序列也可用于构建体中。例如,表达控制序列可包含在很多种细胞类型中表达的组成型启动子。例如,合适的强组成型启动子和/或增强子是来自DNA病毒(例如,SV40、多瘤病毒、腺病毒、腺相关病毒、痘病毒、CMV、HSV等)或来自逆转录病毒LTR的表达控制序列。也可使用组织特异性启动子并且其可用于引导向特定细胞谱系的表达。虽然使用Rosa26基因启动子进行下文实施例中所讨论的实验,但可以使用能够引导基因表达的其他Rosa26相关启动子得到相似的结果,这对本领域技术人员而言将是显而易见的。因此,本文的描述并不意在限制,而是公开许多可能实例中的一种。在一些情况下,可以使用较短的Rosa26 5’上游序列,其仍可实现相同程度的表达。同样有用的是Rosa26启动子的微小DNA序列变体,如点突变、部分缺失或化学修饰。
Rosa26启动子可在哺乳动物中表达。例如,还可使用与猪 Rosa26基因的5’侧翼序列相似的序列,包括但不限于其他物种(例如,人、牛、小鼠、绵羊、山羊、兔和大鼠)的Rosa26同源物的启动子。Rosa26基因在不同的哺乳动物物种中可以是充分保守的,并且也可使用其他哺乳动物Rosa26启动子。
CRISPR/Cas系统可用于进行位点特异性插入。例如,可通过 CRISPR/Cas在基因组的插入位点上制作切口,以促进转基因在插入位点处的插入。
本文所述的方法可以利用可用于允许DNA或RNA构建体进入宿主细胞中的技术,包括但不限于磷酸钙/DNA共沉淀、DNA向细胞核中的显微注射、电穿孔、细菌原生质体与完整细胞融合、转染、脂质转染、感染、粒子轰击、精子介导的基因转移或本领域技术人员已知的任何其他技术。
本文公开的某些方面可以利用载体。可以使用任何质粒和载体,只要它们在选择的宿主中是可复制的并具有活力。可将本领域已知的载体和可商购的载体(及其变体或衍生物)工程化为包含用于该方法的一个或多个重组位点。可以使用的载体包括但不限于真核表达载体,如pFastBac、pFastBacHT、pFastBacDUAL、pSFV和pTet-Splice (Invitrogen)、pEUK-C1、pPUR、pMAM、pMAMneo、pBI101、pBI121、 pDR2、pCMVEBNA、和pYACneo(Clontech)、pSVK3、pSVL、pMSG、 pCH110和pKK232-8(Pharmacia,Inc.)、p3’SS、pXT1、pSG5、pPbac、pMbac、pMClneo、和pOG44(Stratagene,Inc.)和pYES2、pAC360、 pBlueBa-cHis A、B和C、pVL1392、pBlueBac111、pCDM8、pcDNA1、 pZeoSV、pcDNA3、pREP4、pCEP4和pEBVHis(Invitrogen,Corp.) 及其变体或衍生物。
这些载体可用于表达基因,例如转基因,或感兴趣的基因的一部分。可通过使用已知的方法如基于限制酶的技术插入基因的一部分或基因。
使用细胞核移植获得相似的遗传修饰的非人动物
获得遗传修饰的非人动物的替代方法可以是通过细胞核移植。获得遗传修饰的非人动物的方法可包括:a)产生具有一种或多种基因的降低的表达并且/或者包含本文公开的外源多核苷酸的细胞;b)提供第二细胞并将来自a)的所得细胞的细胞核转移到第二细胞以产生胚胎;c)使胚胎生长成遗传修饰的非人动物。该方法中的细胞可以是去核细胞。可使用任何方法,例如,本文所述或本领域已知的基因破坏和/或插入来制备a)中的细胞。
该方法可用于获得本文公开的相似的遗传修饰的非人动物。例如,获得遗传修饰的非人动物的方法可包括:a)产生NLRC5、TAP1 和/或C3的表达降低的细胞;b)提供第二细胞并将来自a)的所得细胞的细胞核转移到第二细胞以产生胚胎;以及c)使胚胎生长成遗传修饰的非人动物。该方法中的细胞可以是去核细胞。
在该方法中使用的细胞可来自如本文所述的任何公开的遗传修饰的细胞。例如,被破坏的基因不限于NRLC5、TAP1和/或C3。可在本文的整个公开内容中找到基因破坏和转基因的其他组合。例如,方法可包括:提供来自本文公开的任何非人动物的第一细胞;提供第二细胞;将a)中的第一细胞的细胞核转移到b)中的第二细胞;从c) 中的产物产生胚胎;以及使该胚胎生长成遗传修饰的非人动物。
在本文公开的方法中,a)中的细胞可以是合子。该合子可通过以下步骤形成:接合i)野生型非人动物的精子和野生型非人动物的卵子;ii)野生型非人动物的精子和遗传修饰的非人动物的卵子;iii)遗传修饰的非人动物的精子和野生型非人动物的卵子;和/或iv)遗传修饰的非人动物的精子和遗传修饰的非人动物的卵子。非人动物可以是猪。
可通过在基因组所需位置处产生断裂来破坏本文公开的方法中 a)中的细胞中的一种或多种基因。例如,断裂可以是双链断裂(DSB)。可使用核酸酶,包括Cas(例如Cas9)、ZFN、TALEN和大范围核酸酶来产生DSB。核酸酶可以是天然存在或经修饰的核酸酶。编码核酸酶的核酸可被递送到细胞,在该细胞中核酸酶得以表达。可将Cas9 和靶向细胞中的基因的指导RNA递送至细胞。在一些情况下,可将编码Cas9的mRNA分子和指导RNA注入细胞中。在一些情况下,可将编码Cas9的质粒和编码指导RNA的不同质粒递送到细胞中(例如,通过感染)。在一些情况下,可将编码Cas9和指导RNA两者的质粒递送到细胞中(例如,通过感染)。
如上所述,在DSB之后,可通过DNA修复机制,如同源重组 (HR)和/或非同源末端连接(NHEJ)破坏一种或多种基因。一种方法可包括将一种或多种转基因插入a)中的细胞的基因组中。一种或多种转基因可包含ICP47、CD46、CD55、CD59、HLA-E、HLA-G(例如,HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6或 HLA-G7)、B2M、其任意功能片段和/或其任意组合。
本文提供的方法可包括插入一种或多种转基因,其中所述一种或多种转基因可以是本文公开的任何非人动物或遗传修饰的细胞中的任何转基因。
本文还公开了使用来自遗传修饰的非人动物的细胞获得非人动物的方法。细胞可来自本文公开的任何遗传修饰的非人动物。方法可包括:a)提供来自遗传修饰的非人动物的细胞;b)提供细胞;c)将a) 中细胞的细胞核转移到b)中的细胞;c)从c)中的产物产生胚胎;以及 d)使该胚胎生长成遗传修饰的非人动物。该方法中的细胞可以是去核细胞。
此外,所述方法中的a)中的细胞可以是来自遗传修饰的非人动物的任何细胞。例如,本文公开的方法中的a)中的细胞可以是体细胞,如成纤维细胞或胎儿成纤维细胞。
所述方法中的去核细胞可以是来自生物体的任何细胞。例如,去核细胞为猪细胞。去核细胞可以是卵子,例如,去核的未受精的卵子。
可使用本领域已知的任何合适的技术来获得本文公开的遗传修饰的非人动物。例如,这些技术包括但不限于显微注射(例如,前核的显微注射)、精子介导的基因转移、卵细胞或合子的电穿孔和/或细胞核移植。
获得相似的遗传修饰的非人动物的方法可包括:a)破坏细胞中的一种或多种基因;b)使用a)中所得的细胞产生胚胎;以及c)使胚胎生长成遗传修饰的非人动物。
本文公开的方法中的a)中的细胞可以是体细胞。对体细胞的类型或来源没有限制。例如,体细胞可来自猪或来自培养的细胞系或任何其他活细胞。细胞还可以是真皮细胞、神经细胞、卵丘细胞、输卵管上皮细胞、成纤维细胞(例如,胎儿成纤维细胞)或肝细胞。本文公开的方法中的a)中的细胞可来自野生型非人动物、遗传修饰的非人动物或遗传修饰的细胞。此外,b)中的细胞可以是去核卵子(例如,去核的未受精的卵子)。
还可通过已知的方法进行去核。例如,可将中期II期卵母细胞置于任选含有或含有约7-10微克/毫升细胞松弛素B的HECM中,以用于立即去核,或可将该卵母细胞置于合适的培养基(例如,胚胎培养基如CRla加10%发情期牛血清)中,再随后进行去核(例如,在不多于24小时或16-18小时之后去核)。还可使用微量移液管移取极体和附近的细胞质以显微手术方式完成去核。然后可对卵母细胞进行筛选以鉴定已经成功去核的卵母细胞。筛选卵母细胞的一种方式可以是在合适的保持培养基中用3-10微克/毫升或约3-10微克/毫升33342 Hoechst染料对卵母细胞进行染色,然后在紫外线照射下观察卵母细胞少于10秒。然后可将已经成功去核的卵母细胞置于合适的培养基,例如,CRlaa加10%血清中。还可对卵母细胞的处理进行优化以用于核移植。
可将本文产生的胚胎转移到代孕的非人动物(例如,猪)中以产生子代(例如,仔猪)。例如,胚胎可在发情期之后的当天或第1 天,例如,在全身麻醉下的中线剖腹手术之后转移到接受者母猪的输卵管中。可以例如通过超声来诊断妊娠。可在距离转移28天或约28天之后诊断妊娠。然后可通过超声检查以2周或约2周的间隔检查妊娠。所有显微注射的子代(例如,仔猪)都可通过自然分娩而出生。可以记录妊娠和分娩的信息(例如,妊娠时间、妊娠率、子代数目、存活率等)。可使用本申请中描述的任何方法如测序(例如,下一代测序)来测量子代的基因型和表型。测序也可以是Zas 258测序,如图 109和图110A所示。测序产物也可以通过扩增产物的电泳来验证,图 110B。例如,CM1F测序显示在图111A中,而电泳产物显示在图111B 中。
培养的细胞可立即用于核移植(例如,体细胞核移植)、胚胎移植和/或诱导妊娠,从而允许稳定遗传修饰衍生的胚胎产生子代(例如仔猪)。这样的方法可减少时间和成本,例如,可导致遗传修饰的细胞无法产生活的和/或健康仔猪的数月昂贵的细胞筛选。
可使用胚胎生长和转移工业中所使用的标准程序进行胚胎生长和转移。例如,可以使用代孕母体。例如,还可通过使用培养箱使胚胎在培养中生长并转移。在一些情况下,可将胚胎移植到动物,例如代孕动物中,以建立妊娠。
可能期望复制或生成具有本文公开的相同基因型和/或表型的多个遗传修饰的非人动物。例如,可通过繁殖(例如,选择性繁殖) 来复制遗传修饰的非人动物。可通过核移植(例如,体细胞核移植) 或向细胞(例如,卵母细胞、精子、合子或胚胎干细胞)中引入DNA 来复制遗传修饰的非人动物。这些方法可重复多次以复制或生成多个本文公开的遗传修饰的非人动物。在一些情况下,可从妊娠的遗传修饰的非人动物的胎儿分离细胞。所分离的细胞(例如,胎儿细胞)可用于生成多个与妊娠动物相似或相同的遗传修饰的非人动物。例如,所分离的胎儿细胞可通过核移植(例如,体细胞核移植)提供用于生成遗传修饰的动物的供体核。
V.使用方法
可从如本文所述的非人动物中提取细胞、器官和/或组织。细胞、器官和/或组织可经离体遗传改变并相应地被使用。这些细胞、器官和 /或组织可用于基于细胞的治疗。这些细胞、器官和/或组织可用于治疗或预防接受者(例如,人或非人动物)的疾病。出人意料地,如本文所述的遗传修饰可帮助防止排斥反应。此外,细胞、器官和/或组织可制成耐受性疫苗,以同样帮助免疫系统对移植耐受。此外,耐受性疫苗可调节免疫系统,包括消除自身免疫应答。
本文公开了用于治疗有需要的受试者的疾病的方法,该方法可包括:向受试者施用耐受性疫苗;向受试者施用抑制T细胞活化的药剂;以及将遗传修饰的细胞移植到受试者中。抑制T细胞活化的药剂可以是抗体。该抗体可以是本文公开的抗CD40抗体。该抗CD40抗体可以是拮抗抗体。该抗CD40抗体可以是与氨基酸序列 EPPTACREKQYLINSQCCSLCQPGQKLVSDCTEFTETECLPCGESEFLD TWNRETHCHQHKYCDPNLGLRVQQKGTSETDTICTCEEGWHCTSEA CESCV(SEQ ID NO:487)内的表位特异性结合的抗体。该抗CD40抗体可以是与氨基酸序列 EKQYLINSQCCSLCQPGQKLVSDCTEFTETECL(SEQ ID NO:488)内的表位特异性结合的抗体。该抗CD40抗体可以是Fab’抗CD40L单克隆抗体片段CDP7657。该抗CD40抗体可以是FcR工程化的、Fc沉默的抗CD40L单克隆结构域抗体。移植到受试者中的细胞可以是整个申请中描述的任何遗传修饰的细胞。移植到受试者中的组织或器官可包含一种或多种遗传修饰的细胞。在一些情况下,所述方法可进一步包括施用本申请中所述的一种或多种免疫抑制剂,如进一步包括向接受者提供B细胞消耗性抗体、mTOR抑制剂、TNF-α抑制剂、IL-6抑制剂、氮芥烷化剂(例如,环磷酰胺)和补体C3或C5抑制剂中的一种或多种。
本文还公开了用于治疗疾病的方法,该方法包括将一种或多种细胞移植到有需要的受试者中。所述一种或多种细胞可以是本文公开的任何遗传修饰的细胞。在一些情况下,该方法可包括将包含所述一种或多种细胞(例如,遗传修饰的细胞)的组织或器官移植到有需要的受试者中。
本文描述了治疗或预防接受者(例如,人或非人动物)的疾病的方法,该方法包括将衍生自包含表达降低的一种或多种基因的遗传修饰的非人动物的一种或多种细胞(包括器官和/或组织)移植到接受者(例如,人或非人动物)中。一种或多种细胞可衍生自如全文所述的遗传修饰的非人动物。
本文公开的方法可用于治疗或预防疾病,包括但不限于糖尿病、心血管疾病、肺疾病、肝脏疾病、皮肤疾病或神经障碍。例如,该方法可用于治疗或预防帕金森病或阿尔茨海默病。该方法还可用于治疗或预防糖尿病,包括1型糖尿病、2型糖尿病、囊性纤维化相关糖尿病、外科手术糖尿病、妊娠期糖尿病、线粒体糖尿病或其组合。在一些情况下,该方法可用于治疗或预防遗传性糖尿病或遗传性糖尿病的形式。此外,该方法可用于治疗或预防1型糖尿病。该方法还可用于治疗或预防2型糖尿病。该方法可用于治疗或预防前驱糖尿病。
例如,当治疗糖尿病时,可用ECDI固定遗传修饰的脾细胞并将该脾细胞给予接受者。此外,可将遗传修饰的胰岛细胞移植到相同的接受者中以产生胰岛素。遗传修饰的脾细胞和胰岛细胞可以是遗传上相同的,并且还可衍生自相同的遗传修饰的非人动物。
本文提供的包括i)用于施用于有需要的受试者以治疗受试者的状况的遗传修饰的细胞、组织或器官;ii)用于使受试者对移植物免疫耐受的耐受性疫苗,其中该耐受性疫苗包含遗传修饰的细胞、组织或器官;iii)用于抑制受试者中的T细胞活化、B细胞活化、树突细胞活化或其组合的一种或多种药剂;或iv)其任意组合。
本文提供的还包括用于施用于有需要的受试者以治疗受试者的状况的遗传修饰的细胞、组织或器官。受试者可通过耐受性疫苗的使用成为或变得对遗传修饰的细胞、组织或器官耐受。此外,可向受试者施用抑制T细胞活化、B细胞活化、树突细胞活化或其组合的一种或多种药剂。
移植
本文公开的方法可包括移植。移植可以是自体移植、同种异体移植、异种移植或任何其他移植。例如,移植可以是异种移植。移植还可以是同种异体移植。
如本文所用的“异种移植”及其语法等同语可包括涉及将细胞、组织或器官移植、植入或输注到接受者中的任何程序,其中接受者和供体是不同的物种。本文所述的细胞、器官和/或组织的移植可用于向人体中的异种移植。异种移植包括但不限于血管化异种移植、部分血管化异种移植、非血管化异种移植、异种敷料(xenodressings)、异种绷带(xenobandages)和纳米结构。
如本文所用的“同种异体移植”及其语法等同语可包括涉及将细胞、组织或器官移植、植入或输注到接受者中的任何程序,其中接受者和供体是相同的物种。本文所述的细胞、器官和/或组织的移植可用于向人体中的同种异体移植。同种异体移植包括但不限于血管化同种异体移植、部分血管化同种异体移植、非血管化同种异体移植、同种异体敷料(allodressings)、同种异体绷带(allobandages)和同种异体结构。
治疗(例如,如本文所公开的任何治疗)后,移植排斥反应与将一种或多种野生型细胞移植到接受者中相比可得到改善。例如,移植排斥反应可以是超急性排斥反应。移植排斥反应还可以是急性排斥反应。其他类型的排斥反应可包括慢性排斥反应。移植排斥反应还可以是细胞介导的排斥反应或T细胞介导的排斥反应。移植排斥反应还可以是自然杀伤细胞介导的排斥反应。
在一些情况下,受试者对主要组织相容性复合物(MHC)或人白细胞抗原(HLA)敏感。例如,受试者可以在群体反应性抗体(PRA) 筛选上具有阳性结果。在一些情况下,受试者可具有0.1%至100%的经计算的PRA(cPRA)评分。cPRA评分可以为或可以约为0.1%至10%、 5%至30%、10%至50%、20%至80%、40%至90%、50%至100%。在一些情况下,PRA筛选呈阳性的受试者可以移植本发明的遗传修饰的细胞。
在一些情况下,受试者可通过单抗原珠(SAB)测试对其PRA水平进行定量。SAB测试可以鉴别受试者具有针对其的抗体的MHC或 HLA。
如本文所用的“改善”及其语法等同语可意指本领域技术人员所认识到的任何改善。例如,改善移植可意指减轻超急性排斥反应,其可包括不良作用或症状的减少、减轻或削弱。
本公开内容描述了治疗或预防糖尿病或前驱糖尿病的方法。例如,该方法包括但不限于向接受者或有需要的接受者施用来自本文所述的供体非人动物的一种或多种胰岛细胞。该方法可以是移植,或在一些情况下是异种移植。供体动物可以是非人动物。接受者可以是灵长类动物,例如,非人灵长类动物,包括但不限于猴。接受者可以是人,并且在一些情况下,是患有糖尿病或前驱糖尿病的人。在一些情况下,可使用例如,如Diabetes Care2015;38:1016–1029(其通过引用而整体并入本文)中所述的算法来确定是否可用移植来治疗患有糖尿病或前驱糖尿病的患者。
所述方法还可包括异种移植的方法,其中将本文提供的转基因细胞、组织和/或器官,例如,胰腺组织或细胞移植到灵长类动物例如人中,并且在移植后,该灵长类动物需要较少的免疫抑制治疗或不需要免疫抑制治疗。需要较少的免疫抑制治疗或不需要免疫抑制治疗包括但不限于,免疫抑制药物/药剂的剂量与其他方法所需的剂量相比减少(或完全消除);免疫抑制药物/药剂类型的数目与其他方法所需的数目相比减少(或完全消除);免疫抑制治疗的持续时间与其他方法所需的持续时间相比减少(或完全消除);和/或维持免疫抑制与其他方法所需的相比减少(或完全消除)。
本文公开的方法可用于治疗或预防接受者(例如,人或非人动物)的疾病。接受者可以是任何非人动物或人。例如,接受者可以是哺乳动物。接受者的其他实例包括但不限于灵长类动物,例如,猴、黑猩猩、狒狒(bamboo)或人。如果接受者是人,则接受者可以是有需要的人。本文所述的方法还可用于非灵长类非人接受者,例如,接受者可以是宠物动物,包括但不限于狗、猫、马、狼、兔、白鼬、沙鼠、仓鼠、南美洲栗鼠、褐鼠、豚鼠、金丝雀、长尾鹦鹉或鹦鹉。如果接受者是宠物动物,则宠物动物可以是有需要的宠物动物。例如,接受者可以是有需要的狗或有需要的猫。
移植可以是本领域已知的任何移植。移植物可被移植到接受者的各个部位。部位可包括但不限于肝囊下空间、脾囊下空间、肾囊下空间、网膜、网膜囊、胃或肠粘膜下层、小肠血管节段、静脉囊、睾丸、脑、脾或角膜。例如,移植可以是囊下移植。移植还可以是肌内移植。移植可以是门静脉内移植。
移植可以是来自人或非人动物的一种或多种细胞、组织和/或器官的移植。例如,组织和/或器官可以是,或者一种或多种细胞可来自脑、心脏、肺、眼、胃、胰腺、肾、肝、肠、子宫、膀胱、皮肤、毛发、指甲、耳、腺体、鼻、嘴、嘴唇、脾、牙龈、牙齿、舌头、唾液腺、扁桃体、咽、食管、大肠、小肠、直肠、肛门、甲状腺、胸腺、骨骼、软骨、肌腱、韧带、肾上囊、骨骼肌、平滑肌、血管、血液、脊髓、气管、输尿管、尿道、下丘脑、垂体、幽门、肾上腺、卵巢、输卵管、子宫、阴道、乳腺、睾丸、精囊、阴茎、淋巴、淋巴结或淋巴管。一种或多种细胞还可来自脑、心脏、肝、皮肤、肠、肺、肾、眼、小肠或胰腺。所述一种或多种细胞来自胰腺、肾、眼、肝、小肠、肺或心脏。所述一种或多种细胞可来自胰腺。所述一种或多种细胞可以是胰岛细胞,例如,胰腺β细胞。此外,所述一种或多种细胞可以是胰岛细胞和/或细胞簇等,包括但不限于胰腺α细胞、胰腺β细胞、胰腺δ细胞、胰腺F细胞(例如,PP细胞)或胰腺ε细胞。在一个实例中,所述一种或多种细胞可以是胰腺α细胞。在另一个实例中,所述一种或多种细胞可以是胰腺β细胞。
如上文所讨论的,遗传修饰的非人动物可用于异种移植物(例如,细胞、组织和/或器官)捐献。仅出于说明性目的,遗传修饰的非人动物例如猪可用作胰腺组织,包括但不限于胰岛和/或胰岛细胞的供体。胰腺组织或衍生自这种组织的细胞可包括胰岛细胞或胰岛或胰岛细胞簇。例如,细胞可以是可被移植的胰岛。更具体地,细胞可以是胰腺β细胞。细胞还可以是产胰岛素的细胞。或者,细胞可以是胰岛样细胞。胰岛细胞簇可包含α、β、δ、PP或ε细胞中的任一种或多种。将通过本文的方法和组合物治疗的疾病可以是糖尿病。可移植的移植物可以是胰岛和/或来自胰岛的细胞。对转基因动物的修饰可以是对胰岛或来自胰岛的细胞的修饰。在一些情况下,胰岛或来自胰岛的细胞可以是猪的。在一些情况下,来自胰岛的细胞包括胰腺β细胞。
供体非人动物可处于任何发育阶段,包括但不限于胚胎期、胎儿期、新生儿期、幼崽期和成年期。例如,可从成年非人动物分离供体细胞胰岛细胞。还可从胎儿或新生儿非人动物分离供体细胞,例如胰岛细胞。供体非人动物可以为10、9、8、7、6、5、4、3、2或1 岁以下的年龄。例如,可从6岁以下年龄的非人动物分离胰岛细胞。还可从3岁以下年龄的非人动物分离胰岛细胞。供体可以是非人动物,并且可以为或可以约为0(包括胎儿)至2、2至4、4至6、6至8、或8至10岁的任何年龄。非人动物可以大于或大于约10岁。供体细胞还可来自人。
可从不同年龄的非人动物中分离胰岛细胞。例如,可从或从约新生儿至2岁的非人动物中分离胰岛细胞。还可从或从约胎儿至2岁的非人动物中分离胰岛细胞。可从或从约6个月龄至2岁的非人动物中分离胰岛细胞。还可从或从约7个月龄至1岁的非人动物中分离胰岛细胞。可从或从约2-3岁的非人动物中分离胰岛细胞。在一些情况下,非人动物可以小于0岁(例如,胎儿或胚胎)。在一些情况下,新生儿胰岛可比成年胰岛更加有活力和一致,可以更好地抵抗氧化应激,可以表现出显著的生长潜能(可能来自新生的胰岛干细胞亚群),从而使得它们可具有在移植并移入移植部位之后进行增殖的能力。
就治疗糖尿病而言,新生儿胰岛可能具有这样的缺点:可能花费最长或最长约4-6周以达到足够的成熟,以便它们产生显著水平的胰岛素,但这一缺点可通过在足以使新生儿胰岛成熟的时间段用外源胰岛素治疗来克服。在异种移植物移植中,可以通过测量易于与任何接受者内源性c-肽区分开的供体特异性c-肽水平来确定新生胰岛的存活和功能性移入。
如上文所讨论的,可分离成年细胞。例如,可分离成年非人动物胰岛,例如成年猪细胞。然后可在移植前将胰岛培养1-3天或约1-3 天,以便耗尽污染外分泌组织的制备物。在治疗之前,可对胰岛进行计数,并通过双荧光钙黄绿素-AM和碘化丙锭染色来评估活力。胰岛细胞活力>75%可被使用。然而,细胞活力大于或大于约40%、50%、 60%、70%、80%、90%、95%、99%均可被使用。例如,可使用表现出或表现出约40%至50%、50%至60%、60%至70%、70%至80%、 80%至90%、90%至95%或90%至100%的活力的细胞。此外,纯度可以大于或大于约80%胰岛/整个组织。纯度还可以为至少或至少约 40%、50%、60%、70%、80%、90%、95%或99%胰岛/整个组织。例如,纯度可以为或可以约为40%至50%;50%至60%;60%至70%; 70%至80%;80%至90%;90%至100%;90%至95%,或95%至100%。
可在治疗前在体外确定胰岛的功能特性,包括活力和通过动态外周灌流所评估的葡萄糖刺激的胰岛素分泌(Balamurugan,2006)。例如,可在体外培养非人动物胰岛细胞,例如转基因猪胰岛细胞,以使其扩增、成熟和/或纯化,从而使它们适于移植。
还可通过切碎的胰腺的标准胶原酶消化来分离胰岛细胞。例如,使用无菌技术,可利用组织解离酶(被配制用于胰腺快速解离和健康、完整和功能性朗格汉斯岛的最大回收的纯化酶的混合物,其中这些酶的靶底物没有得到全部鉴定,但被推测为胶原和非胶原蛋白,这些靶底物包括胰腺腺泡组织的细胞间基质)(1.5mg/ml)使腺体扩张,修剪多余脂肪、血管和结缔组织,将腺体切碎,并在37℃、120rpm下在振荡水浴中消化15分钟。可使用与组织解离酶混合的利诺卡因来实现消化,以避免消化期间的细胞损伤。消化后,细胞可穿过无菌的 50mm至1000mm筛孔,例如,100mm、200mm、300mm、400mm、 500mm、600mm、700mm、800mm、900mm或1000mm筛孔,进入无菌烧杯中。此外,第二消化过程可用于任何未消化的组织。
还可从成年猪胰腺分离胰岛(Brandhorst等人,1999)。从合适来源猪取出胰腺,去除外周胰腺组织,将胰腺分为脾叶和十二指肠叶 /连接叶,对各个叶的导管进行插管,并用组织解离酶使叶扩张。将胰腺叶置于Ricordi室中,将温度逐渐升高到28至32℃,并借助酶活性和机械力使胰腺叶解离。使用连续密度梯度使释放的胰岛与腺泡和导管组织分开。将纯化的胰岛培养2至7天或约2至7天,进行表征,并释放满足所有规格的胰岛产物用于移植(Korbutt等人,2009)。
移植之前、之后和/或期间的供体细胞、器官和/或组织可以是功能性的。例如,移植的细胞、器官和/或组织可以在移植后至少或至少约1、5、10、20、30天是功能性的。移植的细胞、器官和/或组织可以在移植后至少或至少约1、2、3、4、5、6、7、8、9、10、11或12 个月是功能性的。移植的细胞、器官和/或组织可以在移植后至少或至少约1、2、3、4、5、6、7、8、9、10、15、20、25或30年是功能性的。在一些情况下,移植的细胞、器官和/或组织可以在最长接受者整个寿命中是功能性的。这可指示移植是成功的。这还可指示移植的细胞、组织和/或器官没有排斥反应。
此外,移植的细胞、器官和/或组织可以发挥其正常预期操作的 100%的功能。移植的细胞、器官和/或组织还可以发挥其正常预期操作的至少或至少约50%、60%、65%、70%、75%、80%、85%、90%、 95%、99%或100%的功能,例如,发挥或发挥约50%至60%、60%至 70%、70%至80%、80%至90%、90%至100%的功能。在某些情况下,移植的细胞、器官和/或组织可以发挥其正常预期操作的大于100%的功能(当与美国医学协会所确定的正常功能非移植细胞、器官或组织相比时)。例如,移植的细胞、器官和/或组织可以发挥其正常预期操作的110%、120%、130%、140%、150%、175%、200%或更大的功能或约110%、120%、130%、140%、150%、175%、200%或更大的功能,例如,发挥或发挥约100%至125%、125%至150%、150%至 175%、175%至200%的功能。
在某些情况下,移植的细胞可以至少或至少约1天是功能性的。移植的细胞还可以至少或至少约7天是功能性的。移植的细胞可以至少或至少约14天是功能性的。移植的细胞可以至少或至少约21天是功能性的。移植的细胞可以至少或至少约28天是功能性的。移植的细胞可以至少或至少约60天是功能性的。
成功移植的另一指示可以是接受者不需要免疫抑制治疗的天数。例如,在本文提供的治疗(例如,移植)之后,接受者可以至少或至少约1、5、10、100、365、500、800、1000、2000、4000天或更多天不需要免疫抑制治疗。这可指示移植是成功的。这还可指示移植的细胞、组织和/或器官没有排斥反应。
在一些情况下,接受者可以至少或至少约1天不需要免疫抑制治疗。接受者还可以至少或至少约7天不需要免疫抑制治疗。接受者可以至少或至少约14天不需要免疫抑制治疗。接受者可以至少或至少约21天不需要免疫抑制治疗。接受者可以至少或至少约28天不需要免疫抑制治疗。接受者可以至少或至少约60天不需要免疫抑制治疗。此外,接受者可以至少或至少约1、2、3、4、5、6、7、8、9、 10、15、20、30、40或50年,例如,至少或至少约1至2、2至3、 3至4、4至5、1至5、5至10、10至15、15至20、20至25、25 至50年不需要免疫抑制治疗。
成功移植的另一指示可以是接受者需要减少的免疫抑制治疗的天数。例如,在本文提供的治疗之后,接受者可以至少或至少约1、5、 10、50、100、200、300、365、400、500天,例如,至少或至少约1 至30、30至120、120至365、365至500天需要减少的免疫抑制治疗。这可指示移植是成功的。这还可指示移植的细胞、组织和/或器官没有排斥反应或具有最小的排斥反应。
例如,接受者可以至少或至少约1天需要减少的免疫抑制治疗。接受者还可以至少7天需要减少的免疫抑制治疗。接受者可以至少或至少约14天需要减少的免疫抑制治疗。接受者可以至少或至少约21 天需要减少的免疫抑制治疗。接受者可以至少或至少约28天需要减少的免疫抑制治疗。接受者可以至少或至少约60天需要减少的免疫抑制治疗。此外,接受者可以至少或至少约1、2、3、4、5、6、7、8、 9、10、15、20、30、40或50年,例如,至少或至少约1至2、2至 3、3至4、4至5、1至5、5至10、10至15、15至20、20至25、 25至50年需要减少的免疫抑制治疗。
如本文所用的“减少的”及其语法等同语可指与将一种或多种野生型细胞移植到接受者中时所需的免疫抑制治疗相比的更少的免疫抑制治疗。
供体(例如,移植的移植物和/或耐受性疫苗中的细胞的供体) 可以是哺乳动物。同种异体移植物的供体可以是未修饰的人类细胞、组织和/或器官,包括但不限于多能干细胞。异种移植物的供体可以是来自非人动物如哺乳动物的任何细胞、组织和/或器官。在一些情况下,哺乳动物可以是猪。
本文的方法可进一步包括通过将一种或多种供体细胞移植到免疫耐受的接受者(例如,人或非人动物)来治疗疾病。
实施例
实施例1:生成表达指导RNA的质粒以用于破坏猪中的GGTA1、 CMAH、NLRC5、B4GALNT2和/或C3基因
遗传修饰的猪将提供在接受者中诱导低免疫排斥反应或不诱导免疫排斥反应的移植物,和/或作为在接受者中增强免疫耐受的耐受性疫苗的细胞。与非遗传修饰的对应动物相比,这样的猪将具有调控 MHC分子(例如,MHC I分子和/或MHC II分子)的任何基因的降低的表达。降低此类基因的表达将导致MHC分子的表达和/或功能降低。这些基因将是以下的一种或多种:MHC I特异性增强体的组分、 MHC I结合肽的转运体、自然杀伤细胞族2D配体、CXCR 3配体、 C3和CIITA。此外或可替代地,这样的猪将具有在人类中不表达的内源基因(例如,CMAH、GGTA1和/或B4GALNT2)的降低的蛋白质表达。例如,所述猪将具有以下一种或多种基因的降低的蛋白质表达: NLRC5、TAP1、C3、CXCL10、MICA、MICB、CIITA、CMAH、GGTA1 和/或B4GALNT2。在一些情况下,猪将具有NLRC5、C3、CXCL10、 CMAH、GGTA1和/或B4GALNT2的降低的蛋白质表达。
该实施例示出了生成用于使用CRISPR/cas9系统破坏猪中的 GGTA1、CMAH、NLRC5、B4GALNT2和/或C3基因的质粒的示例性方法。使用px330载体生成质粒,该质粒同时表达Cas9DNA内切核酸酶和指导RNA。
从Addgene获得细菌穿刺培养物形式的px330-U6-Chimeric_BB-CBh-hSpCas9(#42230)质粒。将该穿刺培养物划线到具有氨苄青霉素的预热LB琼脂板上,并在37℃下温育过夜。第二天,选择单菌落并将其接种到具有氨苄青霉素的液体LB中过夜培养(5mL用于小提(mini-prep),或80-100mL用于大提 (maxi-prep))。根据制造商的说明书,使用Qiagen试剂盒进行小提。在无核酸酶的水中洗脱质粒,并将贮备液储存在-20℃下。为了靶向 GGTA1、CMAH、NLRC5、C3和B4GALNT2而设计的寡核苷酸在表 6中示出。这些寡核苷酸由IDT合成。图7A-7E、图8A-8E、图9A-9E、图10A-10E和图11A-11E示出了用于克隆靶向GGTA1(即, px330/Gal2-1)(图7A-7E)、CMAH(即,px330/CM1F)(图8A-8E)、 NLRC5(即,px330/NL1_第一)(图9A-9E)、C3(即,px330/C3-5) (图10A-10E)和B4GALNT2(即,px330/B41_第二)(图11A-11E) 的质粒的克隆策略。通过使用表7所示的测序引物进行测序以及通过如图109所示进行测序来验证所构建的px330质粒。将寡核苷酸重悬于100μM无核酸酶的水中,并储存在-20℃的冰箱中。
载体消化:在含有5μg px330贮备液、5μL 10X FastDigest反应缓冲液、35μL无核酸酶的水和5μL FastDigest BbsI酶(切割位点: GAAGAC)的反应溶液中消化px330载体。将反应溶液在37℃下温育15分钟,在65℃下热灭活15分钟。为了使载体去磷酸化,加入 0.2μL(2U;1U/1pmol DNA末端)CIP,并将所得混合物在37℃下温育60分钟。使用Qiagen PCRCleanup试剂盒纯化线性化的质粒,并将该质粒用无核酸酶的水洗脱并储存在-20℃下直到使用。
寡核苷酸退火和磷酸化:通过混合1μL 100uM正向寡核苷酸、 1μL 100uM反向寡核苷酸、1μL 10X T4连接酶缓冲液、6μL无核酸酶的水、1μL多核苷酸激酶(PNK)来制备溶液。将所得溶液在运行以下程序的热循环仪上进行温育:37℃下30分钟,95℃下5分钟,以0.1℃/秒降至25℃。
连接反应:通过将退火的寡核苷酸(用无核酸酶的水1:250稀释),2μL稀释的退火寡核苷酸、100ng线性化/去磷酸化的px330载体、5μL 10X T4连接酶缓冲液、使终体积达到50μL的无核酸酶的水和2.5μL T4DNA连接酶混合来制备溶液。将溶液在室温下温育4 小时,然后在65℃下热灭活10分钟。
转化:在转化前,将TOP10大肠杆菌(E.coli)小瓶从-80℃冰箱中取出并在冰上解冻15分钟。将2μL的连接反应产物加入细胞中并通过轻弹该管进行混合。将管在冰上温育5分钟,在42℃水浴中热休克30秒,并在热休克后再放回冰上2分钟。将50μL转化的细胞铺到具有氨苄青霉素的LB琼脂板上并用移液管端头涂布。将板在 37℃下温育过夜。
针对正确插入的寡核苷酸的菌落PCR筛选:从板中选择3x菌落,并在板的底部标记为1-3。通过混合15μL 10X标准Taq反应缓冲液、3μL 10mM dNTP混合物、0.5μL 100uMpx330-F1引物(表7 中的SEQ ID No.161)、0.5μL 100uM px330-R1引物(表7中的SEQ IDNo.162)、130μL无核酸酶的水和1μL标准Taq聚合酶来制备用于PCR反应的主混合物。将主混合物短暂涡旋,然后将50μL等分至标记为1-3的3x PCR管中。使移液管端头轻触到琼脂板上的菌落#1 中,然后在PCR管#1中上下吹吸。每个菌落都使用新的端头以重复进行每个菌落的筛选。将管放置在热循环仪中以运行以下程序:95℃下5min,95℃下30秒,52℃下30秒,68℃下30秒,循环步骤2-4 进行30个循环,68℃下5min,保持在4℃直到使用。使用Qiagen PCRCleanup试剂盒并遵照制造商的方案进行PCR清理。在无核酸酶的水中洗脱产物。
制备测序样品:通过混合120ng PCR产物、6.4pmol px330-F1 引物(1μL的6.4μM贮备液)和使终体积达到12μL的无核酸酶的水来制备溶液。获得序列数据后,鉴定出正确的序列插入片段。制备具有正确插入片段的菌落甘油贮备液。在菌落PCR期间标记有#1-3 的LB琼脂板上,通过用移液管端头轻触并喷入培养基的管中将正确插入的菌落接种到具有氨苄青霉素的5mL LB培养基中。液体培养物生长直到OD达到1.0至1.4。将500μL细菌培养物加入冷冻管中的 500μL无菌50%甘油中,并立即置于干冰上直到转移至-80℃冰箱中。
表6.用于制备靶向GGTA1、CMAH、NLRC5、C3、GG1和 B4GALNT2的指导RNA构建体的示例性寡核苷酸
表7.用于px330质粒的示例性测序引物
实施例2:生成表达靶向猪中Rosa26基因座的指导RNA的质粒
具有MHC缺陷的猪将提供在接受者中诱导低免疫排斥反应或不诱导免疫排斥反应的移植物。抑制MHC功能的外源蛋白质将在猪中表达以引起MHC缺陷。我们在该项目中更深远的另一目标是在将引导一种或多种蛋白质普遍表达的普遍存在的启动子的控制下插入编码所述一种或多种蛋白质的一种或多种外源多核苷酸。该实施例示出了生成表达靶向一种这样的普遍存在的启动子即Rosa26的指导RNA的质粒。Rosa26启动子将引导Rosa26基因座上的基因的普遍表达。因此,通过在Rosa26基因座处插入编码外源蛋白质的转基因来生成转基因猪,使得基因产物将在猪的所有细胞中表达。将使用表达靶向Rosa26的指导RNA的质粒来促进转基因向Rosa26基因座中的插入。该实施例示出了生成用于使用CRISPR/cas9系统靶向猪中 Rosa26基因座的质粒的示例性方法。使用px330载体生成质粒,该质粒用于同时表达Cas9DNA内切核酸酶和指导RNA。
对Rosa26进行测序:
为了设计靶向猪中Rosa26基因座的指导RNA,对猪中的Rosa26 进行测序以提供准确的序列信息。
引物设计:用来生成引物的Rosa26参考序列取自Kong等人, Rosa26LocusSupports Tissue-Specific Promoter Driving Transgene Expression Specificallyin Pig.PLoS ONE 2014;9(9):e107945,Li等人, Rosa26-targeted swine models forstable gene over-expression and Cre-mediated lineage tracing.Cell Research2014;24(4):501-504,和Li 等人,Identification and cloning of the porcineROSA26promoter and its role in transgenesis.Transplantation Technology 2014:2(1)。然后通过检索猪基因组数据库(NCBI)并通过使用Ensembl Genome Browser来扩展参考序列。将碱基序列分成四个1218个碱基对区域以便于引物设计。使用Integrated DNATechnologies的PrimerQuest工具设计引物,然后使用标准核苷酸BLAST检索野猪(Susscrofa)参考基因组序列,以检查特异性。引物长度限制在200-250个碱基对。使用针对1000nM 引物浓度和Taq DNA聚合酶试剂盒的New England Tm计算器计算引物退火温度。
PCR:用标准Taq缓冲液(New England Biolabs)使用Taq DNA 聚合酶进行PCR。用于PCR的DNA模板提取自从克隆猪中分离的细胞。PCR条件为30个以下的循环:95℃下30秒;50℃下30秒,51℃下30秒,52℃下30秒,53℃下30秒,54℃下30秒,55℃下30 秒;以及68℃下30秒的延伸步骤。使用QIAquick PCR纯化试剂盒 (Qiagen)纯化PCR产物。用于测序的引物在表8中列出。
表8:用于对Rosa26进行测序的示例性PCR引物
测序分析:使用SnapGene软件比对DNA序列。从明尼苏达大学生物基因组学中心收到DNA序列结果后,将结果上传到SnapGene 软件中,并通过软件进行比对以进行分析。通过参考色谱图确定碱基对置换、缺失和插入,并通过比较使用不同引物扩增的DNA片段的序列进行确认。当完成了所有的编辑和确认时,通过用比对的序列替换原始的亲本DNA序列(SEQID NO:224,图12所示的图谱)而制得所得新DNA亲本序列。Rosa26序列与参考Rosa26序列不同。例如,在位置223、420、3927、4029和4066处存在碱基对置换,并且在位置2692和2693之间存在碱基对缺失。核苷酸置换和缺失使得该序列是独特的(图12)。因此,测序数据提供了用于设计靶向Rosa26 基因座的指导RNA的更准确的序列信息。
生成表达靶向Rosa26的指导RNA的质粒
通过IDT设计并合成靶向Rosa26的寡核苷酸。指导RNA的序列在表9中示出。使用实施例1中所述的方法生成表达靶向Rosa26 的指导RNA的px330质粒。图13A-13E示出了用于克隆靶向Rosa 26 (即,px330/ROSA外显子1)的质粒的克隆策略。通过使用表7所示的测序引物进行测序来验证所构建的px330质粒。
表9.用于制备靶向Rosa26的指导RNA构建体的示例性寡核苷酸
实施例3:生成同时表达两种指导RNA的质粒
同时表达两种指导RNA的替代载体(例如,px333)也将用于表达靶向单个基因的两个区域的指导RNA。通过CRISPR/Cas9系统靶向单个基因的两个区域将导致当DNA被修复在一起时两个切割位点之间的整个基因的去除。与仅靶向基因中的一个基因座相比,靶向两个区域将增加产生双等位基因敲除的可能性,从而导致更好的分选、更多的双等位基因缺失,以及产生具有阴性基因型的猪的总体上更高的可能性。
与用于px330质粒的寡核苷酸相比,在px333质粒构建中使用的寡核苷酸对将含有更高的G含量、更低的A含量和尽可能多的GGGG 四联体。GGTA1靶标将跨越几乎整个GGTA1基因,这将会从基因组中去除整个基因。此外,利用该策略靶向多个位点将会在插入转基因时使用,这是我们在该项目中更深远的另一目标。
实施例4:分离、培养并转染猪胎儿成纤维细胞以用于获得遗传修饰的猪
为了使用表达靶向基因的指导RNA的px330质粒生成遗传修饰的猪,将px330质粒转染到猪胎儿成纤维细胞中。转染的成纤维细胞将表达导致一种或多种靶基因的破坏的指导RNA。所得到的成纤维细胞用于,例如,通过体细胞核移植获得遗传修饰的猪。该实施例示出了猪胎儿成纤维细胞的分离和培养以及用px330质粒对成纤维细胞的转染。
细胞培养
用于生成遗传修饰的猪的胎儿成纤维细胞系包括:Karoline胎儿(衍生自雌猪供体P1101,其在胰岛分离后提供高胰岛产量)、Marie Louise胎儿(衍生自雌猪供体P1102,其在胰岛分离后提供高胰岛产量)、屠宰场猪#41(雄性;在天然胰腺中显示出大量的胰岛(通过非常高的双硫腙(DTZ)评分评估))、屠宰场猪#53(在天然胰腺中显示出大量的胰岛(通过高双硫腙(DTZ)评分评估))。
将从这些猪的每只中取出的肌肉和皮肤组织样品剖开并培养以生长出成纤维细胞。然后收获细胞并将该细胞用于体细胞核移植 (SCNT)以产生克隆。在第30天收获多个胎儿(可达8只)。将胎儿分别剖开并将其铺在150mm培养皿上以生长出胎儿成纤维细胞。在整个培养过程中,使胎儿细胞系保持分开,并在每个管或培养容器上用胎儿编号进行标记。当汇合时,收获细胞并将该细胞在具有10% DMSO的FBS中以约100万个细胞/mL进行冷冻以进行液氮冷冻储存。
培养基制备:将5mL Glutamax、5mL青霉素/链霉素和25mL HI-FBS(对于标准5%FBS培养基;对于分选的细胞使用10%FBS) 加入DMEM、高葡萄糖、无谷氨酰胺、无酚红的500mL瓶中。用于离心(spinning down)所有胎儿成纤维细胞的离心机设置为0.4rcf(1600rpm)、4℃下5分钟。通过在水浴中快速升温至37℃,使细胞从液氮储存中解冻。将解冻的细胞快速转移到约25mL的新鲜预热的培养基(足以充分稀释DMSO)中。然后将细胞离心,去除上清液,并将细胞重悬于1-5mL新鲜培养基中用于计数或铺板。用预热的培养基每3-4天对细胞换一次培养基,并在细胞90-100%汇合时,使用 TrypLE Express解离试剂进行传代。
收获贴壁的成纤维细胞:从细胞中吸出培养基。加入DPBS以洗涤细胞。将预热(37℃)的TrypLE Express试剂加入细胞中。使用最小量的试剂将细胞覆盖薄薄的一层。将细胞在37℃下温育10分钟。将一定体积的含有FBS的培养基加入TrypLE细胞悬浮液以中和酶。上下吹吸细胞悬浮液以从培养物表面移走所有细胞。将细胞悬浮液转移至在冰上的15mL或50mL锥形管中。在显微镜下检查板/烧瓶以确保所有细胞都被收集。有时培养基洗涤有助于收集留下的细胞。将细胞离心,然后用新鲜培养基重悬(1-5mL,用于计数)。如果进行计数,通过将20μL细胞悬浮液加入80μL 0.2%台盼蓝来制备细胞悬浮液的1:5稀释液。通过上下吹吸使悬浮液混匀。将12-14μL的稀释液加入血细胞计数器中以对4个角落进行计数。将数目进行平均。例如,针对每个角落的计数20、24、22、22产生平均值22。该数目乘以稀释因子5,得到110x 104个细胞/mL。通过将十进位向左移动两位,将该数目调整至106,即1.10x 106个细胞/mL。最后,将该数目乘以从原始样品取出的mL数以获得细胞总数。
胎儿成纤维细胞的转染
该实验在于转染胎儿成纤维细胞。转染的胎儿成纤维细胞用于使用体细胞核移植技术生成遗传修饰的动物。
用于转染的GFP质粒(pSpCas9(BB)-2A-GFP)是px330质粒的精确拷贝,不同之处在于GFP质粒含有GFP表达区域。
GFP转染的对照细胞:使用来自Invitrogen的Neon转染系统进行转染。试剂盒有10μL和100μL端头规格。在实验前一天或两天,根据实验的规模和期望的细胞数目和密度将细胞铺在合适的培养容器中。在转染当天达到约80%的汇合。
在实验当天,在生物工作台(biohood)中设置Neon模块和移液管架。将Neon管置于移液管架中,并将3mL的缓冲液E(Neon 试剂盒)加入Neon管中。将模块打开并调节至所需的设置(对于胎儿猪成纤维细胞:1300V、30ms、1脉冲)。使用TrypLE收获细胞并对细胞进行计数以确定实验设置。将需要量的细胞转移到新管,并将剩余的细胞重新铺板。计数后将细胞离心,并重悬于PBS中进行洗涤。将细胞离心并根据表10的细胞数目和端头规格将细胞重悬于缓冲液 R(Neon试剂盒)中。
将根据表10的适量的DNA加入细胞悬浮液中并通过上下吹吸进行混合。将Neon端头从试剂盒装到Neon移液管,以将一定体积的细胞悬浮液吸入Neon端头中。将移液管置于移液管架中的Neon 管中,使得Neon端头浸没在缓冲液E中。在模块界面上按下START 键,直到出现“完成(complete)”信息。将移液管从移液管架上移出,以将细胞悬浮液喷入根据表10的合适大小的孔中的一定体积的没有抗生素的预热培养基中。
重复上述步骤直到用完整个细胞悬浮液。每2次转染更换一次 Neon端头,并且每10次转染更换一次Neon管。将细胞在37℃下温育24小时,然后用含有抗生素的正常培养基更换培养基。将所得细胞培养约5天以允许Cas9裂解,基因敲除后表面蛋白质的完全回收,以及分选前的适当细胞分裂。用GFP质粒转染的细胞在图15中示出。
实施例5:与GGTA1基因的荧光原位杂交(FISH)
在细胞中使用FISH来验证CRISPR/cas9的基因破坏。该实施例示出了使用荧光原位杂交(FISH)检测GGTA1基因的示例性方法。此处的方法用于验证GGTA1基因在来自动物(例如,具有GGTA1 敲除的动物)的细胞中的存在或不存在。
FISH探针的制备:使用Invitrogen PureLink试剂盒从RP-44猪 BAC克隆(RP44-324B21)提取GGTA1DNA。使用Orange-552dUTP (Enzo Life Science),通过切口平移反应(切口平移试剂盒-Abbott Molecular)来标记DNA。通过1%TBE凝胶上的电泳来检查切口平移片段的大小。使标记的DNA在COT-1DNA、鲑精DNA、乙酸钠和95%乙醇中沉淀,然后干燥并重悬于50%甲酰胺杂交缓冲液中。
FISH探针的杂交:使探针/杂交缓冲液混合物和来自猪成纤维细胞(15AS27)的细胞遗传学载玻片变性。将探针施加到载玻片上,并将载玻片在湿室中、在37℃下杂交24小时。
FISH检测、可视化和图像捕获:杂交后,将FISH载玻片在2xSSC 溶液中、在72℃下洗涤15秒,并用DAPI染色剂复染。在具有DAPI 和FITC滤波片组件的Olympus BX61显微镜工作站(Applied Spectral Imaging,Vista,CA)上将荧光信号可视化。使用基于干涉仪的CCD冷却相机(ASI)和FISHView ASI软件捕获FISH图像。FISH图像在图16中示出。
实施例6:具有Cas9/指导RNA介导的GGTA1敲除的细胞的表型选择
通过标记GGTA1基因产物来验证Cas9/指导RNA系统对 GGTA1基因的破坏。GGTA1敲除将用作敲除实验中表型分选的标记。 GGTA1基因编码在猪细胞表面上发现的糖蛋白,如果敲除该基因,将导致细胞表面上不存在该糖蛋白。用于分选GGTA1阴性细胞的凝集素是同工凝集素GS-IB4生物素-XX偶联物,其选择性结合末端α-D- 半乳糖基残基,如由GGTA1基因产生的糖蛋白。
用表达靶向GGTA1的指导RNA的px330质粒(在实施例1中生成的)转染猪胎儿成纤维细胞。
为了选择转染后的阴性细胞,使细胞生长约5天以回收其表面蛋白质。然后收获细胞,并用IB4凝集素标记细胞。然后用DynaBeads 生物素-粘合剂包覆细胞,DynaBeads生物素-粘合剂是2.8微米超磁珠,具有链霉亲和素尾部,该尾部与生物素偶联的凝集素在细胞表面上非常紧密地结合。当放置在磁体中时,表面上结合有凝集素/珠子的“阳性”细胞粘附在管的侧壁,而“阴性”细胞不结合任何珠子并保持漂浮在悬浮液中以易于分离。
详细来说,使用TrypLE方案从板上收获细胞并将细胞收集到单个管中。将细胞离心,并重悬于1mL的分选培养基(DMEM,无补充物)中进行计数。如果少于1000万个细胞,则将细胞离心并弃去上清液。在单独的管中,将5μL的IB4凝集素(1μg/μL)稀释到1mL 的分选培养基(终浓度5μg/mL)中。用1mL的稀释凝集素使细胞沉淀物重悬。将细胞悬浮液在冰上温育约15-20分钟,其中每隔几分钟轻轻晃动。
生物素珠子在温育过程中得以制备。将一瓶珠子涡旋30秒。将 20μL珠子/1M细胞加入在15mL锥形管中的5mL分选培养基中。将管涡旋,置于DynaMag-15磁体中并静置3分钟。去除培养基。加入1mL的新鲜分选培养基,并将管涡旋以洗涤珠子。将洗过的珠子置于冰上直到使用。
细胞温育后,用分选培养基使细胞悬浮液体积达到15mL以稀释凝集素。将细胞离心并用1mL洗过的生物素珠子重悬。将悬浮液在冰上在振荡培养箱中以125rpm温育30分钟。将细胞悬浮液从振荡培养箱中取出并进行检查。可能会观察到小的聚集体。
将5mL分选培养基加入细胞悬浮液中,并将管在DynaMag-15 中放置3分钟。收集第一部分“阴性”细胞并将细胞转移到新的15mL 锥形管中。加入另外5mL分选培养基以洗涤仍在磁体上的“阳性”管。将磁体倒置数次以再次将细胞悬浮液混合。将管静置3分钟以分离细胞。然后取出第二“阴性”部分并将其与第一部分组合。将10mL分选培养基加入“阳性”管中。将管从磁体中取出,并置于冰浴中直到准备使用。
将“阴性”部分的管置于磁体上以提供二次分离并去除可能与第一管交叉的任何与珠子结合的细胞。将管保持在磁体上3分钟。用移液管将细胞从磁体中移出并转移到新的15mL锥形管中。使原始的“阳性”管与双重分选的“阴性”管平衡,并将这些管中的细胞离心。“阳性”的沉淀物呈现暗锈红色。“阴性”沉淀物不可见或呈现白色。
将每种沉淀物重悬于1mL新鲜培养基(10%FBS)中,并铺在 24孔板上的隔开的孔中。在显微镜下检查这些孔,并在必要时稀释至更多的孔。在37℃下培养细胞。遗传修饰的细胞,即未标记的细胞是被磁体阴性选择的细胞(图17A)。非遗传修饰的细胞,即标记的细胞在细胞表面上累积了含铁珠子(图17B)。
实施例7. GGTA1/NLRC5敲除猪的生成和表征
该实施例示出了用于生成敲除猪的示例性方法。敲除猪可具有以下基因中的两种或更多种的降低的蛋白质表达:NLRC5、TAP1、 C3、CXCL10、MICA、MICB、CIITA、CMAH、GGTA1和/或B4GALNT2。这样的敲除猪中的其中一种是使用CRISPR/cas9系统得到的 GGTA1/CMAH/NLRC5敲除猪。该猪为移植提供胰岛。具有被破坏的 GGTA1/CMAH/NLRC5的猪胰岛具有MHC I类缺陷,并在移植到接受者时将诱导低免疫排斥反应或不诱导免疫排斥反应。
胎儿成纤维细胞的转染
将实施例1中生成的、表达靶向GGTA1、CMAH和NLRC5 的指导RNA的px330质粒转染到猪胎儿成纤维细胞中。在含有5-10%血清、谷氨酰胺和青霉素/链霉素的DMEM中培养猪胎儿成纤维细胞。根据制造商的说明书,使用Lipofectamine 3000系统(Life Technologies,Grand Island,NY),用表达靶向GGTA1、CMAH或NLRC5基因的 Cas9和sgRNA的两种或三种质粒共转染成纤维细胞。
GGTA1KO细胞的反选择
转染后4天,收获转染的细胞,并将该细胞用同工凝集素B4(IB4) -生物素进行标记。用生物素偶联的IB4标记表达αGal的细胞,并在磁场中通过链霉亲和素包被的Dynabeads(Life Technologies)来吸取该细胞(图91)。从上清液中选出αGal缺乏的细胞。通过显微镜检查细胞。分选后不含或含非常少的结合珠子的细胞被鉴定为阴性细胞。CRISPR/Cas9靶向的GGTA1和NLRC5基因的DNA测序分析
使用Qiagen DNeasy小提试剂盒提取来自IB4反选择细胞和克隆猪胎儿的基因组DNA。用如表11所示的GGTA1和NLRC5特异性引物对进行PCR。使用DNA聚合酶、dNTPack(NewEngland Biolabs),并且用于GGTA1的PCR条件是基于对于这些引物理想的退火和解链温度。将PCR产物在1%琼脂糖凝胶上进行分离,通过Qiagen凝胶提取试剂盒进行纯化,并用Sanger方法(DNA Sequencing Core Facility, University of Minnesota)进行测序,其中特异性测序引物在表7中示出。
表11.用于从遗传修饰的细胞和动物扩增基因组DNA的示例性PCR引物
体细胞核移植(SCNT)
如Whitworth等人,Biology of Reproduction 91(3):78,1–13, (2014)所述进行SCNT。使用体外成熟卵母细胞(DeSoto Biosciences Inc.,St.Seymour,TN)进行SCNT。通过用移液管在0.1%透明质酸酶中吸取而从卵母细胞中去除卵丘细胞。只有具有正常形态和可见极体的卵母细胞才被选择用于SCNT。将卵母细胞在含有5μg/mL双苯酰亚胺和7.5μg/mL细胞松弛素B的操作培养基(含5%FBS的无Ca 的NCSU-23)中温育15min。通过去除第一极体加中期II板使卵母细胞去核。将单个细胞注射到各个去核卵母细胞中,融合,并通过在280mM甘露醇、0.1mM CaCl2和0.05mM MgCl2中施加两个180V的 DC脉冲50μsec(BTX细胞电穿孔仪,Harvard Apparatus,Hollison, MA,USA)来同时激活细胞。将激活的胚胎放回具有0.4%牛血清白蛋白(BSA)的NCSU-23培养基中,并在38.5℃、5%CO2下在湿润气氛中培养少于1小时,并转移到代孕猪中。
使用胚胎产生遗传修饰的猪
将用于转移到代孕猪的胚胎加入装有胚胎转移培养基的有盖培养皿中。还使用用于细胞冷冻保存的0.25ml无菌吸管。在25-35℃下进行胚胎的抽吸。
按照以下顺序进行胚胎的抽吸:介质层-空气层-介质层-空气层- 胚层-空气层-介质层-空气层-介质层。当使用经EO气体灭菌的吸管时,在胚胎抽吸之前,通过重复抽吸并分配用于胚胎移植的培养基1-3次来洗涤吸管内部。抽吸后,吸管的顶端用塑料盖密封。为了保持该抽吸且密封的吸管无菌,将塑料移液管(Falcon,2ml)切割成比吸管略大的尺寸,放入其中,并用石蜡膜密封。使用便携式培养箱维持密封吸管的温度直到使用之前不久。
准备胚胎和发情期同步化的代孕母体。将通过代孕母体的剖腹手术暴露卵巢从而进行胚胎的转移。麻醉后,将腹部的中线切开以暴露子宫、卵巢、输卵管和伞部。将吸管抽吸的胚胎从便携式培养箱中无菌取出,并插入输卵管入口中。将所插入的吸管移动到壶腹-峡交界区。在插入程序后,使用剪刀在对面的含空气层切割吸管。将1cc 注射器安装到切割端,并注入大约0.3cc的空气以将胚胎和培养基从吸管释放到输卵管中。此时,将0.2ml黄色端头的顶端5mm切掉,并使用该切掉的顶端来连接注射器和吸管。
胚胎转移后,将暴露的子宫、卵巢、输卵管和伞部放入腹腔中,并使用可吸收的缝合材料封闭腹部筋膜。然后,用Betadine清洗手术部位,并用抗生素和抗炎镇痛药物进行治疗。对移植有胚胎的代孕母体进行妊娠试验,然后诱导成功妊娠的非人动物进行分娩。
妊娠和胎儿
获得两窝猪胎儿(7只来自妊娠1,5只来自妊娠2)。在第45 天(妊娠1)或第43天(妊娠2)收获胎儿,并对胎儿进行DNA和培养细胞分离。将组织碎片和细胞铺在培养基中2天,以使胎儿细胞附着并生长。从培养板移出野生型细胞(未经遗传修饰的胎儿细胞) 和来自妊娠1或妊娠2的胎儿细胞,并将该细胞用与alexa fluor 488 偶联的IB4凝集素或与FITC偶联的抗猪MHC I类抗体进行标记。进行流式细胞分析,并且数据示于图21A-图21C:妊娠1,或图21D- 图21E:妊娠2中。每组均包含WT细胞的直方图,以突出显示每组胎儿细胞总体强度的降低。特别感兴趣的是妊娠1中αGal和MHC I 类标记的减少,其指示峰值强度的降低。与WT胎儿细胞相比,在妊娠2中,胎儿1和胎儿3具有αgal标记的大幅减少和MHC 1类标记的显著降低。
胎儿的基因型
使来自胎儿细胞的DNA经受GGTA1(与野猪品种混合染色体 1,Sscrofa10.2NCBI参考序列:NC_010443.4相比)或NLRC5(共有序列)靶区域的PCR扩增,并将所得扩增子在1%琼脂糖凝胶上进行分离(图18A、图18B、图19A和图19B)。通过仅使用来自每个反应的正向引物进行Sanger测序来分析扩增子。结果显示为妊娠1 胎儿1、2、4、5、6和7在GGTA1靶位点后截短6个核苷酸。胎儿 3在切割位点后截短17个核苷酸,然后是2,511(668-3179)个核苷酸缺失,然后是单碱基置换。包含来自靶基因的两个拷贝的等位基因的单测序实验的截短、缺失和置换只能表明发生了基因修饰,但不能揭示每个等位基因的确切序列。从这一分析来看,所有7个胎儿似乎都含有单个等位基因修饰。来自妊娠1的胎儿的NLRC5靶位点的序列分析不能显示一致的比对,表明了测序反应中未知的复杂性或使 Sanger测序反应和分析复杂化的NLRC5等位基因之间不同的DNA 修饰。妊娠2胎儿DNA样品1、3、4和5从GGTA1基因靶位点截短3个核苷酸。胎儿2在Sanger测序中具有变异性,表明DNA突变的复杂变异性或较差的样品质量。然而,胎儿DNA模板质量足以用来进行上述GGTA1基因筛选实验。NLRC5基因扩增子均在NLRC5 基因切割位点的下游截短120个核苷酸。
从后肢活检物中分离胎儿DNA(来自野生型(WT)对照,胎儿1-7来自妊娠1),并通过PCR扩增靶基因NLRC5和GGTA。将 PCR产物在1%琼脂糖凝胶上进行分离,并通过荧光DNA染色进行可视化。WT泳道中的扩增子条带表示未修饰的DNA序列。扩增子大小的增大或减小分别表明扩增子内的插入或缺失。一个样品中等位基因之间DNA修饰的变化可使条带看上去更分散。通过1%琼脂糖凝胶可能解析DNA修饰中的微小变化。结果在图20A-图20B中示出。NLRC5凝胶(妊娠1的胎儿1、3和4;图20A底部)中条带的缺乏表明,对靶区域的修饰破坏了DNA扩增引物的结合。GGTA1靶向实验中所有条带的存在表明,DNA质量足以在NLRC5靶向PCR反应中生成DNA扩增子。妊娠1的胎儿1、2、4和5(图20A,顶部) 具有较大的GGTA1扩增子,表明了在靶区域内的插入。对于妊娠1 的胎儿3(图20A,顶部),GGTA1扩增子比WT对照迁移得更快,表明了在靶区域内的缺失。对于妊娠1的胎儿6和7(图20A,底部), NLRC5扩增子比WT迁移得更快,表明了在靶区域内的缺失。与WT 对照相比,妊娠2的胎儿1-5(图20B,顶部)GGTA1扩增子难以通过大小来解释并且是分散的。与野生型对照相比,胎儿1-5(图 20B ,底部)NLRC5扩增子的大小和密度均匀。
鉴于αGal和MHC 1类流式细胞术标记的表型结果的变化, GGTA1和NLRC5基因中的双等位基因突变存在相当大的变化。该观察结果得到了琼脂糖凝胶中的条带大小差异、截短的基因产物和测序变化的支持(图18A-图18B、图19A-图19B、图20A-图20B和图21A- 图21E)。将进行单个等位基因的克隆以完全破译序列修饰。然而,胎儿的表型、DNA测序和功能分析支持在胎儿猪中产生了双等位基因的GGTA1和NLRC5基因修饰。
基因敲除对人免疫细胞增殖的影响
接下来,利用来自妊娠1的胎儿3的细胞,进行共培养测定以评估降低的MHC I类表达对人免疫细胞增殖的影响。
混合淋巴细胞反应(MLR)
在平底96孔板中进行共培养。使用0.3-0.9×105个细胞/孔的用羧基荧光素琥珀酰亚胺酯(CFSE)(2.5μM/ml)标记的人PBMC作为响应物。使用0.1-0.3×105个细胞/孔的野生型或猪成纤维细胞(来自野生型猪或GGTA1/NLRC5敲除胎儿)作为刺激物,其中刺激物-响应物比例为1:1、1:5和1:10。在所有MLR测定中进行MLR共培养4 天。在另一个平行实验中,用植物血凝素(PHA)(2ug/ml)刺激总 PBMC细胞作为阳性对照。
将培养的细胞洗涤并用抗CD3抗体、抗CD4抗体和抗CD8抗体染色,然后进行甲醛固定并洗涤。使用BD FACS Canto II流式细胞仪来评估相比于未修饰的猪成纤维细胞,CD8+和CD4+T细胞响应于来自GGTA1/NLRC5敲除胎儿的成纤维细胞的增殖能力。使用FACS diva/Flow Jo软件(Tri star,San Diego,CA,USA)分析数据,并在预先门控的CD8T细胞和CD4T细胞上确定CFSE暗/低的百分比。
人CD8+细胞和CD4+T细胞对野生型和GGTA1/NLRC5敲除胎儿细胞的增殖响应在图22A-图22C中示出。在评估增殖之前,细胞被门控为CD4+或CD8+(图22A)。与野生型胎儿细胞相比,用具有 GGTA1/NLRC5敲除成纤维细胞的胎儿细胞刺激处理后,CD8T细胞增殖降低。当以1:1的比例用GGTA1/NLRC5敲除胎儿细胞处理人类响应物时,观察到几乎55%的CD8+T细胞增殖降低(图22B)。野生型胎儿细胞在人CD8+T细胞中引发17.2%的增殖,而来自胎儿3(妊娠1)的GGTA1/NLRC5敲除胎儿细胞仅诱导7.6%的增殖(图22B)。在1:5和1:10比例下的CD8+T细胞增殖响应与野生型胎儿细胞相比没有观察到差异(图22B)。与野生型胎儿细胞相比,没有观察到响应于GGTA1/NLRC5敲除的CD4+T细胞增殖的变化(图22C)。
活仔猪的分娩
以上获得的一个妊娠被允许完成妊娠。在足月时通过剖腹产分娩7 只活仔猪(图23)。取耳剪片(clipping)和尾部皮肤样品,并分析以供筛选GGTA1和NLRC5基因处或附近的突变。仔猪的基因型通过PCR 确定。使用不同引物对进行三次PCR实验以确认仔猪的基因型。
第一次PCR实验:使用来自仔猪#6和#7的样品进行PCR。仔猪 #6的NLR扩增产生一个强条带,而#7在凝胶上运行时产生一些条带(图 24A)。从每只仔猪中凝胶提取最强的条带,从而产生足够的DNA用于测序。仔猪#6的PCR产物在预测的PCR产物处显示出强条带。仔猪#7 的PCR产物在与预测的PCR产物不同的大小处显示出条带。结果表明,仔猪#6是单等位基因突变体,而仔猪#7是NLRC5基因位点处的双等位基因突变体。用于GGTA1基因分型的引物组是:Gal amp 1正向: gagcagagctcactagaacttg(SEQ ID NO:153),以及Gal amp1反向:AAGAGACAAGCCTCAGACTAAAC(SEQ ID NO:154)(644bp扩增子)。用于NLRC5基因分型的引物组是:NL1_第一_筛选正向: ctgctctgcaaacactcaga(SEQ ID NO:155),以及NLRC5-678反向:gtggtcttgcccatgcc(SEQ ID NO:156)(630bp扩增子)。
第二次PCR实验:使用来自仔猪#5、#6和#7的样品进行PCR。只测试了NLRC5基因。进行与第一次PCR实验相同的PCR扩增。仔猪 #5和#6的PCR产物在预期大小处显示出条带(图24B)。仔猪#5的PCR 产物显示出第二个微弱条带(图24B)。仔猪#7的PCR产物像上述第一次PCR实验中一样显示出一些条带。这些结果表明,NLRC5基因在这些仔猪的仔猪#5、#6和#7中具有单等位基因和双等位基因突变。
第三次PCR实验:使用来自仔猪#1、#2、#4、#5、#6和#7的样品进行PCR。用于GGTA1基因分型的引物组是表11中的SEQ ID NO. 193和194(303bp扩增子)。用于NLRC5基因分型的引物组是表11中的SEQ ID NO.197和198(217bp扩增子)。用于仔猪#1和#2的NLRC5 基因扩增不像其余的仔猪那样强,并且产生更微弱的条带(图24C)。仔猪#5产生比其余仔猪更模糊的条带(图24C)。GGTA1筛选产生了一致的条带。NLRC5基因扩增产物在本实验中较小且不同,并且在仔猪#1 和#2、#4和#5、#6和#7中产生了不同的产物,表明存在导致MHC 1类表达丧失的不同突变。
通过测序对仔猪进行基因分型
通过测序确定仔猪的基因型。如图25A-图25F所示,仔猪#1、#2、 #4、#5、#6和#7在NLRC5基因上具有一个或多个突变。
实施例8.用于获得遗传修饰的猪的GGTA1/NLRC5敲除/HLA-G1敲入细胞的生成和表征。
当移植到接受者(例如,灵长类动物,如人)时增强猪异种移植物存活的一种策略是同时抑制Galα-(1,3)Gal抗原(Gal抗原)和SLA1 的水平,同时,在没有SLA1的情况下抑制移植物激活的自然杀伤细胞 (NK细胞)增殖。为此,使用CRISPR-Cas9介导的基因编辑技术生成具有GGTA1敲除(以抑制Gal抗原)、NLRC5敲除(与抑制SLA1)和 HLA-G1敲入(以抑制NK细胞增殖)的细胞。
为了获得HLA-G1的最佳表达,将HLA-G1cDNA整合到猪Rosa26 的第一外显子中。如上文实施例2中所述测定Rosa26的外显子1的准确序列。我们首先确认了Rosa26上切割位点的5’和3’序列的1000bp DNA 序列。切割位点上游的1000bp被设计为左同源臂,而下游1000bp被指定为右同源臂。左同源臂的序列由Li等人(Li P.等人,Identification andcloning of the porcine Rosa26promoter and its role in transgenesis.Transplantation Technology 2014,doi:10.7243/2053-6623-2-1)修改(图 26A),后来通过使用序列特异性引物扩增来证实。设计针对右同源臂(包括外显子1和切割位点)的引物,并基于使用Long Amp(NEB)在数据库中可获得的序列扩增1000bp产物。以下是用于扩增左和右同源臂的引物:左Rosa26正向:gcagccatctgagataggaaccctgaaaacgagagg(SEQ ID NO:157),左Rosa26反向:acagcctcttctctaggcggcccc(SEQ ID NO:158);右Rosa26正向:cgcctagagaagaggctgtg(SEQ ID NO:263)以及右Rosa26 反向:actcccataaaggtattg(SEQID NO:264)。
通过进行下一代测序验证臂的序列。根据制造商的说明,在长范围PCR(Qiagen,USA)后获得来自猪的Rosa26基因的扩增子。扩增产物用0.8%琼脂糖凝胶运行(图26B,泳道:分子量标准参照物:1kb DNA梯;1和2个Rosa26扩增子一式两份运行)。使用凝胶提取试剂盒 (Invitrogen,USA)按照制造商的说明从凝胶上洗脱扩增的片段。洗脱的片段通过纳米滴进行定量并进行下一代测序。基于成对读取分析的扩增子的共有序列显示在图26C中。用于在Rosa26基因座处插入HLA-G1 的同源性指导的重组构建体显示在图26D、图26E和图26F以及图117- 图119中。
含有针对Rosa26基因座的HLAG1的同源性指导片段的生成
使用Gibson装配技术在Rosa26基因座处插入HLA-G1,这允许在单管等温反应中成功装配多个DNA片段,而不管片段长度或末端相容性如何。Gibson装配主混合物具有用于在单一反应缓冲液中行使的三种不同的酶活性:外切核酸酶产生单链3’突出端,这促进了在一端(重叠区域)共享互补性的片段的退火;DNA聚合酶补平在每个退火片段内的缺口;而DNA连接酶在装配的DNA中密封切口。
进行PCR以生成同源的左臂和右臂(与HLA-G1序列具有适当的碱基重叠)。将化学合成的用于HLA-G1的gBLOCK以10ng/mL的浓度重悬于无核酸酶的水中。由于HLA-G1大到足以进一步增加50bp作为重叠标记,我们使用左臂和右臂为HL-G1添加额外的50bp重叠。我们在片段1(用于同源性指导的修复(HDR)的左臂)的反向引物和片段 2(HDR的右臂)的正向引物中添加了50bp重叠。因此,左臂和右臂的长度为1050bp。
左臂片段的反应设定如下:将2μL DNA(浓度298ng/ml)、1μL 正向引物(GLF)(10μM)、1μL反向引物(GLR)(10μM)和21μL 的无核酸酶的水(NFW)混合。将混合物添加至HighYield PCR EcoDry Premix(从Clontech获得)中。进行PCR。预测的扩增子大小为1050bp。Tm为61.5℃。PCR产物在琼脂糖凝胶上产生多个条带。从琼脂糖凝胶中洗脱1050bp条带用于装配并更好地表示图像。
右臂片段的反应设定如下:将10μL的10x长范围缓冲液、1μL 的dNTP、2μL的DNA(浓度298ng/ml)、1μL正向引物(10μM)、1μL 反向引物(10μM)、2μL的长范围Amp与无核酸酶的水混合,使总体积为50μL。Tm为67℃。预期的扩增子大小为987bp。
中间片段(HLA-G1)的反应设定如下:将10μL的10x缓冲液、 1μL的dNTP、1μL或2μL的gBlock浓度)、1μL正向引物(10μM)、 1μL反向引物(10μM)、2μL的长范围Amp与无核酸酶的水混合,使总体积为50μL。Tm为67℃。
按照Quick Gel Extraction试剂盒(Invitrogen)的说明从琼脂糖凝胶中纯化左、右和中臂。使用纳米滴分光光度计测量所有片段的浓度。23.5ng/μL、30ng/μL和28.3ng/μL是从1.2%琼脂糖凝胶中洗脱的左、中和右片段的浓度。按照Gibson装配的说明,在0.2ml的 PCR管中将2μL的每个片段与10μL的GA主混合物(NEB)和4μL 的无核酸酶的水混合,使终体积达20μL,并在热循环仪上在50℃下温育一小时。
然后使用Long Amp(NEB),用左臂的正向引物和右臂的反向引物对2μL的装配产物进行长范围PCR。长范围PCR的反应设定如下:将10μL的5x长范围缓冲液、1μL的dNTP(100μM;NEB)、2μL的扩增的gblock HLA-G1、1μL正向引物(10μM)、1μL反向引物(10μM) 与无核酸酶的水混合,达到终体积50μL。进行PCR,且预期的扩增子大小约为3000bp。
设计和克隆gRNA以靶向猪Rosa26外显子1的外显子1、GGTA1 和NLRC5(用于SLA1敲除)。
使用http://zifit.partners.org/ZiFiT/CSquare9Nuclease.aspx设计用于制备gRNA的特异性寡核苷酸,该gRNA在猪ROSA26外显子1的外显子1中、紧邻GGTA1的第一密码子处或NLRC5中形成切口。HLA-G1 的cDNA序列在表2中示出,而HLA-G的基因组序列如SEQ ID:No.191 所示。HLA-G的基因组序列和cDNA的图谱在图14A-图14B中示出。
简而言之,合成寡核苷酸,并将其重悬于相应量的无核酸酶的水中以达到各100μM的浓度。在0.2μL的管中,将1μL的每种寡核苷酸 (正向和反向)与1μL的10xT4多核苷酸激酶反应缓冲液、0.5μL T4 多核苷酸激酶和6.5μL dH2O混合,构成10μL的总体积。将具有反应溶液的管置于热循环仪中。运行以下程序以进行正向和反向寡核苷酸的适当退火:37°℃下30分钟;95°℃下5分钟;以0.1℃/秒的速度斜降至 25℃。以1:100稀释退火的寡核苷酸。
使用质粒pX330-U6-Chimeric_BB-CBh-hSpCas9(Addgene)克隆退火的寡核苷酸,以生成用于CRISPR相关的Cas9核酸酶系统的gRNA。将1微克的质粒pX330用BbsI(NewEngland Biolabs,Ipswich,MA)在 37℃下使用快速消化缓冲液消化15分钟,然后保持15分钟以灭活BbsI。然后添加0.2μL的小牛肠碱性磷酸酶(CIP)并温育1小时,以避免经消化的载体的自连接。使用Plasmid Extraction mini-prep试剂盒(Qiagen) 纯化经消化的pX330。将消化的载体与300μL的PB缓冲液混合,然后添加至该试剂盒的纯化柱中,然后以8000rpm离心1min。除去流出液,用PE缓冲液(含有无水乙醇)洗涤柱,最后用50μL的EB缓冲液洗脱。将1.3μL(50ng)经消化的px330载体与1.0μL稀释的寡核苷酸、5μL 10X T4连接酶缓冲液和2.5μL T4DNA连接酶混合,最后通过添加39.9 μL无核酸酶的水使体积达到50μL。不向反应混合物中添加任何寡核苷酸进行阴性对照。然后将连接酶在65℃下灭活5分钟,之后按照制造商的方案,在TOP10感受态细胞(Invitrogen)中进行转化。对DNA克隆是进行测序。
图27A、图27B和图27C显示了与gRNA并列的px330载体中 Rosa26寡核苷酸连接的证据。正确克隆的序列在图27A中示出,而构建的质粒的RNC1_E02_008测序结果在图27B中示出。
还进行了连接产物的限制性消化以验证连接的成功。使用两种限制酶(BsbI和AgeI)消化经纯化的连接产物。由于寡核苷酸在Bsbl位点连接,BsbI位点在带有寡核苷酸的px300载体中被破坏(图27C,泳道1:完整载体;泳道2:具有破坏的BsbI位点的连接载体)。
体外转录(IVT)和体外Cas9介导的靶DNA切割
为了检查为Rosa26、GGTA1和NLRC5位点设计的gRNA的切割潜能,使用Guide-itTMsgRNA体外转录和筛选系统按照制造商的方案进行指导RNA的体外转录。还检查了指导RNA的相应切割潜能。使用 GalMet寡核苷酸(正向:acaccggagaaaataatgaatgtcaag(SEQ IDNO:367);反向:aaaacttgacattcattattttctccg(SEQ ID NO:368))进行用于GGTA1 的gRNA的切割(图28)。Gal(Met)靶向GGTA1cDNA转录物的第一个甲硫氨酸,而不是启动子区域外的任何其他调节甲基基团。
A:用于gRNA的靶标(约2000kb)的扩增。
根据试剂盒的说明,使用特异性引物扩增含有用于Rosa26、 GGTA1和NLRC5的gRNA的靶序列的约2kb长的扩增子。将猪DNA 和引物与无核酸酶的水混合至总体积为25μL。随后将该混合物与干 PCR混合物混合。Rosa26、GGTA1和NLRC5的反应的Tm分别为61.5℃、 60℃和63℃。使用Purlink;Quick Gel Extraction试剂盒(Invitrogen)从琼脂糖凝胶洗脱所有扩增子。
B:体外转录
从IDT获得化学合成的DNA模板和通用gRNA序列,该DNA模板含有在T7启动子控制下的经设计的sgRNA编码序列。使用试剂盒中提供的d Guide-it支架模板通过PCR扩增该模板。
Rosa26、NLRC5和GGTA1的IVT模板如下:Rosa26: gccgcctctaatacgactcactatagggccgccggggccgcctagagagttttagagctagaaatagca (SEQ ID NO:233);NLRC5: gccgcctctaatacgactcactatagggccggcctcagaccccacacagaggttttagagctagaaatagca (SEQ ID NO:234);GGTA1: gcggcctctaatacgactcactataggggagaaaataatgaatgtcaagttttagagctagaaatagca (SEQ ID NO:235)。
将具有1μl上述模板的5μl Guide-it支架模板(在试剂盒中提供) 以10μM的浓度混合,并用无RNA酶的水稀释至终体积为25μl。通过温和移液将溶液混合。将全部25μl混合物加入到一管High Yield PCR EcoDry Premix中。使用以下程序进行热循环:95℃下1min;33个循环(95℃下30sec、68℃下1min,68℃下1min)。
将得到的PCR产物在1.8%琼脂糖凝胶上电泳。对于三种IVT模板中的每一种,获得约140bp的单一条带。然后通过试剂盒提供的 NucleoSpin凝胶纯化这些条带。
然后如下进行体外转录:将100ng的PCR产物与Guide-it体外转录缓冲液和Guide-it T7聚合酶混合物混合。通过添加无核酸酶的水使终体积为20μL,并在42℃下温育1小时。
C:体外转录的sgRNA的纯化和定量
(1)将2μl的无RNA酶的DNA酶I添加至整个20μl的体外转录反应中,并在37℃下温育0.5小时。
(2)向反应混合物中添加无RNA酶的水至终体积为100μl。
(3)将100μl用10mM Tris,pH 8.0、1mM EDTA饱和的苯酚:氯仿:异戊醇(25:24:1)添加至步骤(2)的经稀释的反应混合物中并充分涡旋。
(4)将溶液在室温下以12,000rpm离心2min。将上清液转移到新管中,向其中添加等体积的氯仿。
(5)将溶液充分涡旋,然后在室温下以12,000rpm离心2min。
(6)将上清液转移到新管中,添加1/10体积的3M乙酸钠和等体积的异丙醇,并充分涡旋。
(7)将步骤(6)的溶液在室温下温育5min,然后在室温下以 15,000rpm离心5min。
(8)小心地除去上清液。将沉淀物用80%乙醇冲洗并在室温下以 15,000rpm离心5min。
(9)将沉淀物风干约15min,并重悬于20μl的无RNA酶的水中,并使用纳米滴检查浓度。
D:具有Rosa26、NLRC5和GGTA1的纯化gRNA的2kb模板(部分A)的Cas9介导的切割
(1)建立含有上述sgRNA(对靶标具有特异性)和扩增的实验模板(每个基因长约2kb;Rosa26、NLRC5(NL1)和GGTA1,含有靶序列)的切割反应。
(2)将实验切割模板(总共100ng)与实验sgRNA样品(来自以上总共20ng)、1μL的Guide-it重组Cas9核酸酶、1μL的10X Cas9 反应缓冲液、1μL的10X BSA混合,并用无核酸酶的水使终体积为10μL。将混合物在37℃下温育1小时。通过在70℃下温育溶液10min来终止反应。在1%琼脂糖凝胶上与阴性对照(100ng未切割的2kb对照片段)一起分析整个10μl反应(图29)。
电穿孔和流动分选
将冷冻保存的细胞以每个培养皿1x 106个细胞的密度接种到10%完全DEMEM培养基中。在接种细胞后,每24小时更换培养基,并使培养皿达到汇合(>70%)。然后使用PBS、TRYPLE Express收获细胞,然后重悬于100μL的由Neon系统提供的R缓冲液中以供电穿孔。将1.5 μg的含有gRNA的px330质粒(用于Rosa26、GGTA1或NLRC5)添加至1.5ml管中并通过轻轻敲打混合。然后在100μL管中以1300V×30 ms×1脉冲进行电穿孔。将细胞接种在15%完全DMEM培养基中,并在每12小时之后监测。电穿孔12小时后,可见细胞附着的迹象。
用px330U6-gRNA(met,GGTA1)、px330U6-gRNA(Rosa26)和 px330U6-gRNA(NLRC5)对猪胎儿成纤维细胞进行电穿孔;在转染后第5天使用1xPBS-/-和Triple Express收获具有Rosa26同源左臂和右臂的Gibson装配的HLA-G1的扩增子(设计用于在猪Rosa26基因座处插入)。
我们在三个不同的管中转染,并从每个培养皿中回收约1X 106个细胞。用100μL流动缓冲液(PBS-1%BSA)中的1μg IB4-APC (Biolegend)、1μg抗猪SLA1-FITC(NovusBiologicals)、5μL抗 HLA-G1-PE对这些细胞进行染色,并在4℃下黑暗中温育30min。阴性未染色的对照也保持在4℃下,并且如染色的细胞那样进行所有处理。另外,我们制作了单染色管:IB4-APC和SLA1-FITC,用于相应荧光染料的阳性对照。之后,将猪成纤维细胞在微量离心机中以2000rpm旋转 5min以除去额外的抗体。接下来,将细胞再次重悬于流动缓冲液(100 μL)中并通过带有过滤器(BD)的流动管。染色后,我们小心地盖住所有的管,以避免在前往流动分选设施(CCRB,University of Minnesota) 时受到污染的可能性。根据流动分选核心设施的说明,收集介质是2.5%完全DMEM(Pen-Step、Glutamax和FBS)。分选结果在图30中示出。活仔猪的分娩
图114A-图114C显示了GGTA1/NLRC5敲除/HLA-G1敲入仔猪的活产图片。
通过测序进行基因分型
进行下一代测序以确认HLA-G1序列向ROSA位点中的正确插入。对取自活仔猪的皮肤样品进行测序。ROSA位点中的HLA-G1敲入的确认序列示于图115中(SEQ ID NO:499)。
实施例9.用于获得遗传修饰的猪的GGTA1敲除/CD47敲入细胞的生成和表征。
当移植到接受者(例如,灵长类动物,如人)时增强猪异种移植物存活的一种策略是同时抑制Galα-(1,3)Gal抗原(Gal抗原)和SLA1 的水平,并抑制巨噬细胞的活化。为此,使用CRISPR-Cas9介导的基因编辑技术生成具有GGTA1敲除(以抑制Gal抗原)和人CD47敲入(以抑制巨噬细胞活化)的细胞。
使用与实施例26中所述类似的方法生成GGTA1敲除/CD47敲入细胞。用Gibson装配的GGTA1-CD47基因杂合体转染GGTA1靶向gRNA 载体,在该载体中,GGTA1特异性gRNA(在外显子1中具有结合位点) 被克隆到px330中的U6启动子下。在GGTA1-CD47基因杂合体中,CD47 基因被夹在GGTA1的1000bp同源臂(切割位点的5’侧和3’侧)之间。
用GGTA1基因座的左臂和右臂装配CD47cDNA。
用于装配的引物是:CD47装配右正向引物:ttgagcctgtgcatcgcagcgt (SEQ IDNO:236);CD47装配右反向引物: ctacttttaatgcaagctggtgacttggctgataactagg(SEQ IDNO:237);CD47装配左正向引物:aaattaaggtagaacgcactccttagcgctcgt(SEQ ID NO:238);CD47 装配左反向引物:attttgggcttccatgttggtgacaaaacaaggg(SEQ ID NO:239)。
包含左臂、CD47编码序列和右臂的所得装配构建体的序列示于图 31中(左臂和右臂以下划线表示)。CD47序列针对猪密码子使用进行了优化,并且是合成制备且装配的。该序列不是源自人细胞。它被设计用于在猪中以正确的氨基酸谱表达。CD47序列(表12)针对猪密码子使用进行了优化,并且是合成制备且装配的。
表12.用于在猪中表达的合成的CD47
CD47基因针对具有与GGTA1基因同源的左臂和右臂的GGTA1 基因切割位点。GGTA1基因在成年胰岛中无活性,但在成年猪的血细胞和脾细胞中开启了启动子。因此,(从GGTA1位点)表达CD47的猪将是很好的疫苗供体。
通过测序确认装配。装配的左臂和右臂的序列在图32中示出。
通过细胞分选检查细胞的表型。通过IB4-APC染色检测Gal抗原。用CD47-Brilliant Violet 421-A检测CD47。细胞分选结果显示在图33A- 图33C(未染色的)、图34A-图34C(px330)、图35A-图35C(IB4) 和图36A-图36C(CD47/IB4)中。对具有GGTA1敲除的细胞和具有 CD47敲入/GGTA1敲除的细胞进行分选和纯化以进行体细胞核移植。分选的细胞的细胞分选结果显示在图37A-图37C(IB4)和图38A-图38C (CD47/IB4)中。
实施例10:MHC I类缺乏的猪成纤维细胞(成纤维细胞)对人淋巴细胞免疫激活的影响
A.增殖(CFSE):SLA-I/Gal-2敲除
确定异种移植的人免疫应答的一种策略可以是将遗传修饰的 MHC I类缺乏的猪成纤维细胞与人PBMC共培养。在平底96孔板中进行混合淋巴细胞反应共培养。使用1-2×105个细胞/孔/200ul的人CFSE 标记的(2.5μM/ml)PBMC作为响应物。使用1000至1×105个细胞/孔 (有或没有SLA-I/Gal-2敲除)的猪成纤维细胞作为刺激物,其中刺激物-响应物比例为100:1、50:1、10:1和1:10。MLR共培养进行24小时以用于细胞因子(Il-2、TNF-α和IFN-g)效应分子(穿孔蛋白、粒酶B LAMP-1/CD107a)表达以及T和B细胞增殖的5-6天的测量。图39和图55示出了用于分析增殖数据的门控策略。一个人供体的结果显示在图40和图41-图44中。另外的供体的结果显示在图56至图59中。
B.增殖(CFSE):NLRC5-6/Gal-2-2构建体:SLA-I/Gal-2敲低; NLRC5-6/Gal-2构建体和GGTA1-1/Gal2-2构建体SLA-I/Gal-2敲低。
人PBMC:用CFSE预标记,与以下细胞培养:对照:猪成纤维细胞:野生型;条件#3MLF细胞,具有NLRC5-6/Gal-2-2构建体: SLA-I/Gal-2敲低;条件#4MLF细胞,具有NLRC5-6/Gal-2构建体和 GGTA1-1/Gal2-2构建体SLA-I/Gal-2敲低;培养细胞密度:MLF细胞=4x104个细胞/ml;人PBMC=1x106个细胞/ml;MLR培养的细胞密度:在96孔平底板中2x105至1.4x105个细胞/200ul/孔,一式两份或一式三份(表13)。
表13.测试板配置
C.胞内细胞因子染色
在一个平行实验(表14)中,分别使用和不使用PHA(2ug/ml) 刺激总PBMC细胞作为阳性和未刺激的对照。洗涤培养的细胞并用抗 CD3、抗CD4和抗CD8染色,然后进行甲醛固定和洗涤,并用抗穿孔蛋白、粒酶B、IL-2、TNF-α和IFN-g进行细胞内染色(图45至图52)。使用BD FACS Canto II flow评估相比于未修饰的猪成纤维细胞,CD8和 CD4T细胞响应于SLA-I敲除猪成纤维细胞(F3)的增殖能力。使用FACS diva/Flow Jo软件(Tri star,San Diego,CA,USA)分析数据,并在预先门控的CD8T细胞和CD4T细胞上确定CFSE暗/低的百分比。
表14.ICCS实验配置
实施例11:用于包括PT85抗体的混合细胞培养物的方法。
在平底96孔板中进行混合淋巴细胞反应共培养。使用1-2×105个细胞/孔/200ul的人CFSE标记的(2.5μM/ml)PBMC作为响应物。使用2000至1×105个细胞/孔(有或没有PT85抗体/阻断抗体,10ug/ml) 的野生型或HLA-G转导的猪成纤维细胞作为刺激物,其中刺激物-响应物比例为100:1、50:1、10:1和1:10。MLR共培养进行24小时以用于细胞因子(Il-2、TNF-a和IFN-g)效应物分子(Perforin、粒酶B LAMP-1/CD107a)表达以及T和B细胞增殖的5-6天测量。在另一个平行实验中,分别使用和不使用PHA(2ug/ml)刺激总PBMC细胞作为阳性和未刺激的对照。洗涤培养的细胞并用抗CD3、抗CD4和抗CD8 染色,然后进行甲醛固定和洗涤,并用抗穿孔蛋白、粒酶B、IL-2、TNF-a 和IFN-g进行细胞内染色。使用BD FACS Canto IIflow评估相比于未修饰的猪成纤维细胞,CD8和CD4T细胞响应于SLA-I敲除猪成纤维细胞(F3)的增殖能力。使用FACS diva/Flow Jo软件(Tri star,San Diego,CA, USA)分析数据(表15)。
表15:流式细胞术实验配置
实施例12:阻断MHC 1类分子/TCR相互作用PT-85抗体
在平底96孔板中进行混合淋巴细胞反应共培养。使用1-2×105个细胞/孔/200ul的人CFSE标记的(2.5μM/ml)PBMC作为响应物。使用2000至1×105个细胞/孔的猪成纤维细胞(有或没有PT85的SLA阻断,10ug/ml)或HLA-G转导的猪成纤维细胞/MLF细胞作为刺激物,刺激物-响应物比例为100:1、50:1、10:1和1:10(图53和图54)。MLR 共培养进行24小时以用于细胞因子(Il-2、TNF-a和IFN-g)效应分子 (穿孔蛋白、粒酶B LAMP-1/CD107a)表达以及T和B细胞增殖的5-6 天测量。在另一个平行实验中,分别使用和不使用PHA(2ug/ml)刺激总PBMC细胞作为阳性和未刺激的对照。洗涤培养的细胞并用抗CD3、抗CD4和抗CD8染色,然后进行甲醛固定和洗涤,并用抗穿孔蛋白、粒酶B、IL-2、TNF-a和IFN-g进行细胞内染色(图66至图74和图79 至图86)。使用BD FACS Canto II flow评估相比于未修饰的猪成纤维细胞,CD8和CD4T细胞响应于SLA-I敲除猪成纤维细胞(F3)的增殖能力(图61至图65和图75至图78)。使用FACS diva/Flow Jo软件(Tri star, San Diego,CA,USA)分析数据,并在预先门控的CD8T细胞和CD4T 细胞上确定CFSE暗/低的百分比,图61至图65。用于分析数据的门控策略在图60中示出。
实施例13:测试表达HLA-G转基因的猪细胞以抑制人T细胞增殖响应。
在人PBMC与FC的比例分别为10:1的情况下,与对照未修饰的猪成纤维细胞/野生型相比,用PT-85阻断抗体处理的猪成纤维细胞刺激后,T细胞增殖降低。当在10:1和1:1比例下用SLA-I阻断PT-85抗体或HLA-G表达处理人类响应物时,观察到T细胞(CD3/CD4/CD8)增殖的大幅降低。与未修饰的/野生型猪成纤维细胞相比,在100:1和50:1 比例下,在T细胞增殖响应方面未见太大差异。通过用PT-85阻断SLA-I 或HLA-G表达,B细胞增殖没有大幅降低。
实施例14:通过Luminex人细胞因子组(HSTCMAG-28SK人高灵敏度T细胞)测量混合淋巴细胞测定后的分泌细胞因子谱。
为了确定混合淋巴细胞对猪遗传修饰的细胞的细胞因子谱,进行共培养测定,其中收集来自第24天的混合细胞培养物和对照的上清液并进行luminex测定。按照制造商的方案,取出一份上清液,并且对于每种细胞因子与luminex珠子一起温育、洗涤,并在工厂维护的luminex 仪器上测量。双敲除(DKO)#3和#4是分别制备的遗传上和表型上的 GGTA1/NLRC5敲除细胞。HLAG1转基因细胞在单独的实验中进行,因此包括匹配的未刺激的和野生型细胞对照。
实施例15:GGTA1-10、Gal2-2和NLRC5-6的基因组修饰
原代猪细胞用以下物质转染:GGTA1-10/Gal2-2(条件2)、 NLRC5-6/Gal2-2(条件3)、GGTA1-10/Gal2-2和NLRC5-6/Gal2-2(条件4)或条件1:仅细胞(图90)。通过磁珠分选对阴性细胞的珠子选择使用对末端α-D-半乳糖基残基(诸如GGTA1的产物)具有选择性的 IB4凝集素进行(图91)。5天后进行第一次珠子选择,然后在第8天进行第二次珠子选择。在转染后7天,使用来自MN大学的分选机进行阴性细胞的细胞分选选择。用IB4凝集素Alexa Fluor467和SLA I FITC对细胞进行染色,并通过流式细胞术进行分析(图92至图102)。培养物的共聚焦显微镜检查显示在图103A中。另外的数据显示测序确认的电泳,显示在图113A至图113I中。
表16.用于px333质粒的示例性测序引物
表17.将被指导RNA靶向的NLRC5和/或B4GALNT2基因的第一外显子的示例性序列。
实施例16:用于获得劳亚兽总目的遗传修饰的动物的HLA-G敲入细胞的生成和表征
可以使用CRISPR/Cas9介导的基因编辑技术生成具有HLA-G敲入的劳亚兽总目的动物细胞。HLA-G的敲入可包括HLA-G1、HLA-G2、 HLA-G3、HLA-G4、HLA-G5、HLA-G6或HLA-G7。可将HLA-G插入靶基因座处。例如,可以将HLA-G插入劳亚兽总目动物的Rosa26基因座中。或者,可以将HLA-G插入另一个靶基因座,如糖蛋白半乳糖基转移酶α1,3(GGTA1)、推定的胞苷一磷酸-N-乙酰神经氨酸羟化酶样蛋白(CMAH)、β1,4N-乙酰基氨基半乳糖基转移酶(B4GALNT2)、C-X-C 基序趋化因子10(CXCL10)、MHC I类多肽相关序列A(MICA)、MHC I类多肽相关序列B(MICB)、抗原加工相关转运体1(TAP1)、含有 CARD结构域的NOD样受体家族成员5(NLRC5)。针对另一个基因的 HLA-G编码序列的敲入可以破坏或敲除该基因。
基本如以上实施例2中所述,对用于HLA-G插入的靶区域进行测序。如实施例2中所述,使用准确的序列信息来设计靶区域特异性的指导RNA。使用实施例1和实施例2中描述的方法生成表达靶区域特异性的指导RNA的质粒,如px330。或者,可以如实施例3中所述生成同时表达两种靶区域特异性的指导RNA的质粒,如px333。
如实施例8中所述,确认处于靶基因座切割位点上游(5’)和下游(3’)1000bp的DNA序列。左同源臂被指定为切割位点上游1000bp,右同源臂被指定为切割位点下游1000bp。如实施例8中对Rosa26基因座处的HLA-G1插入所述,生成含有HLA-G的同源性指导片段并在靶基因座处插入HLA-G。使用的HLA-G序列可以转录为mRNA,其在5’和/或3’非翻译区中具有修饰。这样的修饰可以增加mRNA稳定性。
劳亚兽总目动物的细胞可以具有与HLA-G敲入相组合的基因敲除。例如,可以敲除GGTA1和/或NLRC5,并且可以敲入HLA-G。因此,可以使用与实施例8中描述的方法类似的方法生成劳亚兽总目的 GGTA1/NLRC5敲除/HLA-G敲入动物。如上所述,HLA-G编码序列的敲入可以破坏或敲除另一个基因(例如GGTA1和/或NLRC5)。
劳亚兽总目的动物可包括有蹄类动物,诸如偶蹄类动物(例如,猪、西貒、河马、骆驼、大羊驼、鼷鹿(鼠鹿)、鹿、长颈鹿、叉角羚、羚羊、羊(包括绵羊、山羊等)或牛),或者奇蹄类动物(例如,马、貘和犀牛),非人灵长类动物(例如,猴或黑猩猩),犬科动物(例如,狗) 或猫。劳亚兽总目的成员可包括真盲缺目(Eulipotyphla)(刺猬、鼩鼱和鼹鼠)、奇蹄目(Perissodactyla)(犀牛、马和貘)、食肉目(Carnivora) (食肉动物,如猫、狗和熊)、鲸偶蹄目(Cetartiodactyla)(偶蹄目动物和鲸目动物)、翼手目(Chiroptera)(蝙蝠)和鳞甲目(Pholidota)(鲮鲤)。
表18.SEQ ID NO:5-60的序列
尽管本文已经示出并描述了一些实施方案,但这样的实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域技术人员现将想到许多变化、改变和替代。应当理解,本文所述的本发明实施方案的各种替代方案将用于实施本发明。
Claims (30)
1.一种产生遗传修饰的非人哺乳动物的方法,其中所述遗传修饰的非人哺乳动物包含与SEQ ID NO: 359或SEQ ID NO: 502至少95%相同的外源核酸序列。
2.根据权利要求1所述的方法,其中所述外源核酸序列与SEQ ID NO: 359或SEQ IDNO: 502至少96%相同。
3.根据权利要求1所述的方法,其中所述外源核酸序列与SEQ ID NO: 359或SEQ IDNO: 502至少99%相同。
4.根据权利要求1所述的方法,其中所述外源核酸与SEQ ID NO: 359 100%相同。
5.根据权利要求1所述的方法,其中所述外源核酸与SEQ ID NO: 502 100%相同。
6.根据权利要求1所述的方法,其中所述遗传修饰的非人哺乳动物进一步包含编码β-2-微球蛋白(B2M)蛋白质的外源核酸序列。
7.根据权利要求1所述的方法,其中所述遗传修饰的非人哺乳动物进一步包含编码β-2-微球蛋白(B2M)蛋白质的外源核酸序列,其中所述B2M蛋白质与由所述外源核酸序列编码的蛋白质融合。
8.根据权利要求1所述的方法,其中所述非人哺乳动物为猪。
9.根据权利要求1所述的方法,其中所述外源核酸序列插入到所述遗传修饰的非人哺乳动物的基因组中有效降低糖蛋白半乳糖基转移酶α1,3(GGTA1)和含有CARD结构域的NOD样受体家族成员5(NLRC5)中的至少一个或其组合的表达的位点处,所述降低表达是与没有所述外源核酸序列的相同物种的动物或所述外源核酸插入到不同位点上的相同物种的动物相比。
10.根据权利要求1所述的方法,其中所述遗传修饰的非人哺乳动物为劳亚兽总目的成员。
11.一种遗传修饰的非人细胞、组织或者器官,其包含与SEQ ID NO: 359或SEQ ID NO:502至少95%相同的外源核酸序列,其中所述外源核酸序列插入到所述遗传修饰的非人细胞、组织或者器官的基因组中有效降低糖蛋白半乳糖基转移酶α1,3(GGTA1)和含有CARD结构域的NOD样受体家族成员5(NLRC5)中的至少一个的表达的位点处,其中所述遗传修饰的非人细胞、组织或者器官不能发育成动物个体。
12.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述外源核酸序列与SEQ ID NO: 359或SEQ ID NO: 502至少96%相同。
13.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述外源核酸序列与SEQ ID NO: 359或SEQ ID NO: 502至少99%相同。
14.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述外源核酸序列与SEQ ID NO: 359 100%相同。
15.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述外源核酸序列与SEQ ID NO: 502 100%相同。
16.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其进一步包含编码β-2-微球蛋白(B2M)蛋白质的外源核酸序列。
17.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其进一步包含编码β-2-微球蛋白(B2M)蛋白质的外源核酸序列,其中所述B2M蛋白质与由所述外源核酸序列编码的蛋白质融合。
18.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述遗传修饰的非人细胞是胰岛细胞。
19.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述遗传修饰的非人细胞是干细胞。
20.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述遗传修饰的非人组织为实体器官移植物。
21.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述遗传修饰的非人组织是肝的全部或一部分。
22.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述遗传修饰的非人组织是肾的全部或一部分。
23.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述遗传修饰的非人细胞、组织或者器官分别是猪细胞、组织或者器官。
24.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官,其中所述遗传修饰的非人细胞、组织或者器官分别是劳亚兽总目的成员的细胞、组织或者器官。
25.根据权利要求11所述的遗传修饰的非人细胞、组织或者器官在制备用于受试者中的异种移植或同种异体移植的移植物中的用途。
26.一种制备遗传修饰的猪的方法,包括:
a) 获得猪胎儿成纤维细胞;
b) 使用CRISPR/Cas通过(i)在所述猪胎儿成纤维细胞中破坏编码GGTA1的基因和(ii)在包含所述被破坏的编码GGTA1的基因的猪胎儿成纤维细胞中插入与SEQ ID NO: 359或SEQ ID NO: 502至少95%相同的外源核酸序列,从而遗传修饰所述猪胎儿成纤维细胞;
c) 将所述遗传修饰的猪胎儿成纤维细胞的核转移至猪去核卵母细胞以生成胚胎;以及
d) 将所述胚胎转移入代孕猪中,并且使所述转移的胚胎在所述代孕猪中生长为遗传修饰的猪。
27.根据权利要求26所述的方法,其中所述外源核酸序列与SEQ ID NO: 359或SEQ IDNO: 502至少96%相同。
28.根据权利要求26所述的方法,其中所述外源核酸序列与SEQ ID NO: 359或SEQ IDNO: 502至少99%相同。
29.根据权利要求26所述的方法,其中所述外源核酸序列与SEQ ID NO: 359 100%相同。
30.根据权利要求26所述的方法,其中所述外源核酸序列与SEQ ID NO: 502 100%相同。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202111165647.6A CN114176043B (zh) | 2016-06-14 | 2017-06-14 | 用于治疗疾病的遗传修饰的细胞、组织和器官 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662350048P | 2016-06-14 | 2016-06-14 | |
| US62/350,048 | 2016-06-14 | ||
| PCT/US2017/037566 WO2017218714A1 (en) | 2016-06-14 | 2017-06-14 | Genetically modified cells, tissues, and organs for treating disease |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111165647.6A Division CN114176043B (zh) | 2016-06-14 | 2017-06-14 | 用于治疗疾病的遗传修饰的细胞、组织和器官 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN109640645A CN109640645A (zh) | 2019-04-16 |
| CN109640645B true CN109640645B (zh) | 2021-10-15 |
Family
ID=60663278
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780049966.6A Active CN109640645B (zh) | 2016-06-14 | 2017-06-14 | 用于治疗疾病的遗传修饰的细胞、组织和器官 |
| CN202111165647.6A Active CN114176043B (zh) | 2016-06-14 | 2017-06-14 | 用于治疗疾病的遗传修饰的细胞、组织和器官 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111165647.6A Active CN114176043B (zh) | 2016-06-14 | 2017-06-14 | 用于治疗疾病的遗传修饰的细胞、组织和器官 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20190335726A1 (zh) |
| EP (1) | EP3468356A4 (zh) |
| JP (3) | JP2019517803A (zh) |
| KR (2) | KR20190017985A (zh) |
| CN (2) | CN109640645B (zh) |
| AU (1) | AU2017285224B2 (zh) |
| CA (1) | CA3027428A1 (zh) |
| WO (1) | WO2017218714A1 (zh) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9950282B2 (en) | 2012-03-15 | 2018-04-24 | Flodesign Sonics, Inc. | Electronic configuration and control for acoustic standing wave generation |
| US10967298B2 (en) | 2012-03-15 | 2021-04-06 | Flodesign Sonics, Inc. | Driver and control for variable impedence load |
| US9458450B2 (en) | 2012-03-15 | 2016-10-04 | Flodesign Sonics, Inc. | Acoustophoretic separation technology using multi-dimensional standing waves |
| US10704021B2 (en) | 2012-03-15 | 2020-07-07 | Flodesign Sonics, Inc. | Acoustic perfusion devices |
| MX2016003615A (es) | 2013-09-24 | 2016-10-26 | Giner Inc | Sistema para tratamiento con gas de un implante de celulas. |
| EP3092049A1 (en) | 2014-01-08 | 2016-11-16 | Flodesign Sonics Inc. | Acoustophoresis device with dual acoustophoretic chamber |
| KR102656470B1 (ko) | 2014-12-10 | 2024-04-09 | 리전츠 오브 더 유니버스티 오브 미네소타 | 질환을 치료하기 위한 유전적으로 변형된 세포, 조직 및 장기 |
| US11377651B2 (en) | 2016-10-19 | 2022-07-05 | Flodesign Sonics, Inc. | Cell therapy processes utilizing acoustophoresis |
| US11708572B2 (en) | 2015-04-29 | 2023-07-25 | Flodesign Sonics, Inc. | Acoustic cell separation techniques and processes |
| US11420136B2 (en) | 2016-10-19 | 2022-08-23 | Flodesign Sonics, Inc. | Affinity cell extraction by acoustics |
| US11021699B2 (en) | 2015-04-29 | 2021-06-01 | FioDesign Sonics, Inc. | Separation using angled acoustic waves |
| US11474085B2 (en) | 2015-07-28 | 2022-10-18 | Flodesign Sonics, Inc. | Expanded bed affinity selection |
| US11459540B2 (en) | 2015-07-28 | 2022-10-04 | Flodesign Sonics, Inc. | Expanded bed affinity selection |
| US11214789B2 (en) | 2016-05-03 | 2022-01-04 | Flodesign Sonics, Inc. | Concentration and washing of particles with acoustics |
| US11085035B2 (en) | 2016-05-03 | 2021-08-10 | Flodesign Sonics, Inc. | Therapeutic cell washing, concentration, and separation utilizing acoustophoresis |
| WO2018093956A1 (en) | 2016-11-15 | 2018-05-24 | Giner, Inc. | Percutaneous gas diffusion device suitable for use with a subcutaneous implant |
| WO2018204867A1 (en) | 2017-05-04 | 2018-11-08 | Giner, Inc. | Robust, implantable gas delivery device and methods, systems and devices including same |
| BR112020009889A2 (pt) | 2017-12-14 | 2020-11-03 | Flodesign Sonics, Inc. | acionador e controlador de transdutor acústico |
| EP3866815B1 (en) * | 2018-10-19 | 2024-05-01 | Regents Of The University Of Minnesota | Transplant tolerance induction with carbodiimide treated tolerizing vaccine |
| EP3760718A1 (en) * | 2019-07-04 | 2021-01-06 | Medizinische Hochschule Hannover | Tissue for use as allogeneic or xenogeneic transplant and method for its production |
| CN111264469B (zh) * | 2020-02-27 | 2022-03-25 | 西安交通大学医学院第一附属医院 | 一种基因免疫诱导的甲状腺相关性眼病动物模型的构建方法及雷帕霉素类药物的应用 |
| US20230123863A1 (en) * | 2020-06-30 | 2023-04-20 | National Yang-Ming University | A glia cell and neuron co-culture system and method |
| CN111500693B (zh) * | 2020-07-02 | 2020-09-22 | 中南大学 | 检测巨噬细胞中rfx1表达水平的试剂在制备巨噬细胞分型检测制剂中的应用 |
| KR20240043783A (ko) * | 2021-08-06 | 2024-04-03 | 럿거스, 더 스테이트 유니버시티 오브 뉴 저지 | 유전자 변형 세포의 제조 방법 |
| WO2023019226A1 (en) * | 2021-08-11 | 2023-02-16 | Sana Biotechnology, Inc. | Genetically modified cells for allogeneic cell therapy |
| CN114958768B (zh) * | 2022-06-02 | 2023-03-24 | 健颐生物科技发展(山东)有限公司 | Fgf10旁分泌通用型人成纤维细胞制剂的制备方法 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6156306A (en) * | 1994-08-17 | 2000-12-05 | Albert Einstein College Of Medicine Of Yeshiva University | Pancreatic β-cells for allogeneic transplantation without immunosuppression |
| CN1407851A (zh) * | 1999-11-19 | 2003-04-02 | 韩国生命工学研究院 | 一种改进的通过体细胞核转移制备猪克隆胚胎的方法 |
| CN1486365A (zh) * | 2000-11-17 | 2004-03-31 | 异种(人类)免疫球蛋白在克隆转基因有蹄类动物中的表达 | |
| CN104046593A (zh) * | 2013-03-14 | 2014-09-17 | 浙江大学 | 一种低免疫原性的人细胞及其制备方法 |
| CN104789592A (zh) * | 2015-03-19 | 2015-07-22 | 中国食品药品检定研究院 | 一种制备α-1,3GT基因敲除的非人哺乳动物的方法及应用 |
| CN105612176A (zh) * | 2012-07-31 | 2016-05-25 | 伊斯凯普治疗有限公司 | Hla g修饰的细胞及方法 |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5770201A (en) * | 1994-12-23 | 1998-06-23 | Rijsuniversiteit Te Leiden | HA-2 antigenic peptide |
| CA2227584A1 (en) * | 1995-08-04 | 1997-02-20 | The General Hospital Corporation | Transgenic swine and swine cells having human hla genes |
| EP0892643B2 (en) * | 1996-03-20 | 2009-09-02 | Bristol-Myers Squibb Company | Methods for inhibiting an immune response by blocking the gp39/cd40 and ctla4/cd28/b7 pathways and compositions for use therewith |
| FR2760023B1 (fr) * | 1997-02-21 | 2004-05-07 | Commissariat Energie Atomique | Cellules eucaryotes exprimant a leur surface au moins une isoforme d'hla-g et leurs applications |
| IL148508A0 (en) * | 1999-09-13 | 2002-09-12 | Univ Massachusetts | Cloning pigs using donor cells of nuclei from differentiated cells and production of pluripotent porcine |
| IL157332A0 (en) * | 2001-02-14 | 2004-02-19 | Multipotent adult stem cells, sources thereof, methods of obtaining and maintaining same, methods of differentiation thereof, methods of use thereof and cells derived thereof | |
| AU2002357110A1 (en) * | 2001-12-07 | 2003-07-09 | The Ohio State University Research Foundation | Apoptotic ebv-transformed lymphocytes, a therapeutic agent for post-transplant lymphoproliferative disorder |
| EP1530970A1 (en) * | 2003-11-13 | 2005-05-18 | Medizinische Hochschule Hannover | Composition and method for inducing immune tolerance towards cell, tissue and/or organ transplants |
| KR20090068646A (ko) * | 2007-12-24 | 2009-06-29 | (주)엠젠 | Hla-g 유전자 및 daf 유전자를 발현하는 형질전환복제 돼지 및 그의 제조 방법 |
| KR20100022684A (ko) * | 2008-08-20 | 2010-03-03 | (주)엠젠 | 세 개의 유전자를 발현하는 복합형질전환 복제 돼지 및 그의 제조 방법 |
| WO2010037408A1 (en) * | 2008-09-30 | 2010-04-08 | Curevac Gmbh | Composition comprising a complexed (m)rna and a naked mrna for providing or enhancing an immunostimulatory response in a mammal and uses thereof |
| EP2184297A1 (en) * | 2008-11-07 | 2010-05-12 | Hla-G Technologies | HLA-G polypeptides and pharmaceutical uses thereof |
| EP2184070A1 (en) * | 2008-11-07 | 2010-05-12 | Hla-G Technologies | HLA-G proteins and pharmaceutical uses thereof |
| CA2745376A1 (en) * | 2008-12-01 | 2010-06-10 | Lifespan Extension Llc | Methods and compositions for altering health, wellbeing, and lifespan |
| WO2011019385A1 (en) * | 2009-08-11 | 2011-02-17 | Sangamo Biosciences, Inc. | Organisms homozygous for targeted modification |
| EP2464219B1 (en) * | 2009-08-14 | 2019-10-23 | Revivicor, Inc. | Multi-transgenic pigs for diabetes treatment |
| US8734786B2 (en) * | 2009-09-16 | 2014-05-27 | Northwestern University | Use of ECDI-fixed cell tolerance as a method for preventing allograft rejection |
| WO2012009337A2 (en) * | 2010-07-12 | 2012-01-19 | Dana-Farber Cancer Institute, Inc. | Nlrc5 as a target to intervene mhc class 1-mediated immune responses |
| US20140045915A1 (en) * | 2010-08-31 | 2014-02-13 | The General Hospital Corporation | Cancer-related biological materials in microvesicles |
| WO2012072096A1 (en) * | 2010-12-03 | 2012-06-07 | Biontech Ag | Method for cellular rna expression |
| CN104774871A (zh) * | 2011-02-14 | 2015-07-15 | 雷维维科公司 | 用于血管化异种移植物及其衍生物的异种移植的遗传修饰的猪 |
| MX363013B (es) * | 2011-02-25 | 2019-03-04 | Recombinetics Inc | Animales genéticamente modificados y métodos para su obtención. |
| CN102911270A (zh) * | 2011-08-05 | 2013-02-06 | 浙江大学 | 一种抑制移植器官慢性排斥反应的抗体的制备及纯化方法 |
| SI2830662T1 (sl) * | 2012-03-29 | 2019-01-31 | The Trustees Of Columbia University In The City Of New York | Postopki zdravljenja motenj izgube las |
| WO2013188358A1 (en) * | 2012-06-12 | 2013-12-19 | The General Hospital Corporation | Miniature swine transgenic for one or more coagulation factors |
| US20140115728A1 (en) * | 2012-10-24 | 2014-04-24 | A. Joseph Tector | Double knockout (gt/cmah-ko) pigs, organs and tissues |
| UY35468A (es) * | 2013-03-16 | 2014-10-31 | Novartis Ag | Tratamiento de cáncer utilizando un receptor quimérico de antígeno anti-cd19 |
| AU2014356400A1 (en) * | 2013-11-28 | 2016-06-02 | Horizon Discovery Limited | Somatic haploid human cell line |
| CA2949710A1 (en) * | 2014-05-30 | 2015-12-03 | The Board Of Trustees Of The Leland Stanford Junior University | Compositions and methods to treat latent viral infections |
| DK3161128T3 (en) * | 2014-06-26 | 2018-11-05 | Regeneron Pharma | METHODS AND COMPOSITIONS FOR TARGETED GENTICAL MODIFICATIONS AND PROCEDURES FOR USE THEREOF |
| CN105586389A (zh) * | 2014-10-21 | 2016-05-18 | 天津华大基因科技有限公司 | 试剂盒及其在检测遗传性骨病基因中的用途 |
| KR102659529B1 (ko) * | 2014-10-22 | 2024-04-23 | 인디애나 유니버시티 리서치 앤드 테크놀로지 코퍼레이션 | 이종이식에 적합한 삼중 트랜스제닉 돼지 |
| KR102656470B1 (ko) * | 2014-12-10 | 2024-04-09 | 리전츠 오브 더 유니버스티 오브 미네소타 | 질환을 치료하기 위한 유전적으로 변형된 세포, 조직 및 장기 |
-
2017
- 2017-06-14 CN CN201780049966.6A patent/CN109640645B/zh active Active
- 2017-06-14 CA CA3027428A patent/CA3027428A1/en active Pending
- 2017-06-14 CN CN202111165647.6A patent/CN114176043B/zh active Active
- 2017-06-14 WO PCT/US2017/037566 patent/WO2017218714A1/en unknown
- 2017-06-14 KR KR1020197001275A patent/KR20190017985A/ko not_active IP Right Cessation
- 2017-06-14 KR KR1020237022996A patent/KR20230110373A/ko not_active Application Discontinuation
- 2017-06-14 US US16/312,052 patent/US20190335726A1/en not_active Abandoned
- 2017-06-14 JP JP2018565376A patent/JP2019517803A/ja active Pending
- 2017-06-14 AU AU2017285224A patent/AU2017285224B2/en active Active
- 2017-06-14 EP EP17814052.1A patent/EP3468356A4/en active Pending
-
2021
- 2021-12-27 JP JP2021212142A patent/JP2022031487A/ja active Pending
-
2022
- 2022-08-15 JP JP2022129299A patent/JP2022160703A/ja active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6156306A (en) * | 1994-08-17 | 2000-12-05 | Albert Einstein College Of Medicine Of Yeshiva University | Pancreatic β-cells for allogeneic transplantation without immunosuppression |
| CN1407851A (zh) * | 1999-11-19 | 2003-04-02 | 韩国生命工学研究院 | 一种改进的通过体细胞核转移制备猪克隆胚胎的方法 |
| CN1486365A (zh) * | 2000-11-17 | 2004-03-31 | 异种(人类)免疫球蛋白在克隆转基因有蹄类动物中的表达 | |
| CN105612176A (zh) * | 2012-07-31 | 2016-05-25 | 伊斯凯普治疗有限公司 | Hla g修饰的细胞及方法 |
| CN104046593A (zh) * | 2013-03-14 | 2014-09-17 | 浙江大学 | 一种低免疫原性的人细胞及其制备方法 |
| CN104789592A (zh) * | 2015-03-19 | 2015-07-22 | 中国食品药品检定研究院 | 一种制备α-1,3GT基因敲除的非人哺乳动物的方法及应用 |
Non-Patent Citations (1)
| Title |
|---|
| "Suppression of human macrophage-mediated cytotoxicity by transgenic swine endothelial cell expression of HLA-G";Emilio L.Esquivel 等;《Transplant Immunology》;20150103;第32卷(第2期);第109-115页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN109640645A (zh) | 2019-04-16 |
| CN114176043B (zh) | 2024-04-23 |
| JP2022160703A (ja) | 2022-10-19 |
| CN114176043A (zh) | 2022-03-15 |
| CA3027428A1 (en) | 2017-12-21 |
| EP3468356A4 (en) | 2020-02-26 |
| US20190335726A1 (en) | 2019-11-07 |
| WO2017218714A1 (en) | 2017-12-21 |
| KR20190017985A (ko) | 2019-02-20 |
| AU2017285224B2 (en) | 2023-05-18 |
| AU2017285224A1 (en) | 2019-01-17 |
| KR20230110373A (ko) | 2023-07-21 |
| JP2022031487A (ja) | 2022-02-18 |
| JP2019517803A (ja) | 2019-06-27 |
| EP3468356A1 (en) | 2019-04-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN109640645B (zh) | 用于治疗疾病的遗传修饰的细胞、组织和器官 | |
| US20220104467A1 (en) | Genetically modified cells, tissues, and organs for treating disease | |
| JP6928604B2 (ja) | 万能性細胞のゲノム改変 | |
| US20080003560A1 (en) | Tailor-made pluripotent stem cell and use of the same | |
| Denning et al. | New frontiers in gene targeting and cloning: success, application and challenges in domestic animals and human embryonic stem cells | |
| JP2021530999A (ja) | 免疫改変多能性幹細胞由来のキメラ抗原受容体t細胞 | |
| KR20180091821A (ko) | 유전적 상보성에 의한 인간화 car t-세포 및 혈소판의 조작방법 | |
| CN111182921A (zh) | 用于治疗肾疾病的免疫豁免的生物活性肾细胞 | |
| JP2022043344A (ja) | 多能性細胞に関連する方法 | |
| JP2018522553A (ja) | ヒト化骨格筋 | |
| CN113423411A (zh) | 用碳二亚胺处理的耐受性疫苗诱导移植物耐受 | |
| US20220061279A1 (en) | Genetically modified cells, tissues, and organs for treating disease | |
| JP2003509028A (ja) | 核移植技術を用いた免疫適合性を有する細胞及び組織を産生する方法 | |
| EP4112720A1 (en) | Genetically modified megakaryocyte, modified platelet, and methods respectively for producing said genetically modified megakaryocyte and said modified platelet | |
| Sper et al. | Allogeneic and xenogeneic lymphoid reconstitution in a RAG2−/− IL2RGy/− severe combined immunodeficient pig: A preclinical model for intrauterine hematopoietic transplantation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |