JP2018522553A - ヒト化骨格筋 - Google Patents
ヒト化骨格筋 Download PDFInfo
- Publication number
- JP2018522553A JP2018522553A JP2017568279A JP2017568279A JP2018522553A JP 2018522553 A JP2018522553 A JP 2018522553A JP 2017568279 A JP2017568279 A JP 2017568279A JP 2017568279 A JP2017568279 A JP 2017568279A JP 2018522553 A JP2018522553 A JP 2018522553A
- Authority
- JP
- Japan
- Prior art keywords
- myod
- mrf4
- myf5
- human
- combination
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0276—Knockout animals
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0271—Chimeric animals, e.g. comprising exogenous cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0603—Embryonic cells ; Embryoid bodies
- C12N5/0604—Whole embryos; Culture medium therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0658—Skeletal muscle cells, e.g. myocytes, myotubes, myoblasts
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/15—Animals comprising multiple alterations of the genome, by transgenesis or homologous recombination, e.g. obtained by cross-breeding
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/108—Swine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/02—Animal zootechnically ameliorated
- A01K2267/025—Animal producing cells or organs for transplantation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/34—Muscles; Smooth muscle cells; Heart; Cardiac stem cells; Myoblasts; Myocytes; Cardiomyocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2517/00—Cells related to new breeds of animals
- C12N2517/02—Cells from transgenic animals
Abstract
Description
本願は、その優先権の恩典が本願で主張され、その全体が参照により本明細書に組み入れられる2015年6月30日出願の米国仮特許出願第62/187,027号の優先権の恩典を主張する。
筋疾患、例えば筋ジストロフィーは、よく知られており、命にかかわるものである。さらに、多くの筋肉の状態、例えば萎縮およびサルコペニアが、加齢に伴って生じる。骨格筋は高い再生能を有しているが、この能力は、最終的には、疾患および加齢により消失する。末期筋疾患に対する処置は現時点で存在せず、老齢者における転倒の50パーセントは死を招いている。
遺伝子編集技術を用いて、MYF5/MYOD/MRF4ヌルのブタ胚を作製した。MYF5/MYOD/MRF4に対する多遺伝子編集の実施により、多能性を有するブタ細胞を用いて筋肉と共に、および非ヒト動物においてヒト幹細胞と共に再増殖され、ヒト化骨格筋を生成する、寛容なニッチが形成される。
以下の定義は、本明細書および特許請求の範囲の明確かつ一貫性のある理解を提供するために含まれている。本明細書で使用される場合、列挙されている用語は以下の意味を有する。本明細書で使用される他の用語およびフレーズはすべて、当業者が理解しているであろうそれらの通常の意味を有する。そのような通常の意味は、技術辞書、例えばHawley's Condensed Chemical Dictionary 14th Edition, by R.J. Lewis, John Wiley & Sons, New York, N.Y., 2001を参照することによって知ることができる。
ヒト化された大型動物モデルは、再生医療のリソースであり、個人向けヒト化ブタモデルのプラットフォームとして機能するであろう。このストラテジーは、現在の臨床実務のパラダイムを慢性筋骨格疾患および移植用に変換するであろう。ブタ骨格筋の除去は、大型動物モデルにおいてヒト化骨格筋を作製することを目指しているという理由だけでなく、免疫拒絶を回避する新規のアプローチであり、外来器官作製ストラテジーに広く適用可能であるという理由から、唯一の存在である。
筋肉は、運動を助け、身体の動作を助ける。異なるタイプの筋肉は、異なる役割を有する。筋肉に影響を及ぼし得る問題は多く存在する。筋肉障害は、衰弱、疼痛または麻痺さえも引き起こし得る。
MYF5/MYOD/MRF4を変異させ、骨格筋系統欠損ブタ胚(MYF5/MYOD/MRF4ヌルブタ胚;詳細については実施例2を参照のこと)を作製した。具体的に、E18およびE24で収集した胚は、筋節にデスミンが存在しなかったが、心臓のデスミンは保存されていた。さらに、GFP標識ブタ割球をヌル胚盤胞に注射することによるブタ:ブタ補完が、PCR、組織学および免疫組織学的アプローチを用いて実証された。これらの補完された胚において、GFPは、デスミンと共に体節に共局在化された(E24)。MYF5/MYOD/MRF4の多遺伝子編集を行うことで、多能性を有するブタ幹細胞を用いて筋肉と共に増殖され、野生型ブタ骨格筋を生成する寛容なニッチが作製された。MYF5/MYOD/MRF4を欠くこの遺伝子編集ブタモデルは、その変異桑実胚または胚盤胞にヒト幹細胞を送達した後にヒト化骨格筋を生成するために使用されるであろう。
材料および方法
雌性ブタ:家畜用母体雌性ブタ(8〜12月齢)を、胚移植用レシピエントとして使用し、承認されたIACUCプロトコルの下で予定されている妊娠および分娩において通常の家畜用ブタとして世話および維持する。
Myod、Myf5、Mrf4およびMyogを含むMyodファミリーの発見は、骨格筋形成の調節メカニズムを理解するための土台を提供する(6〜8)。
ブタにおけるMYF5/MYOD/MRF4(MYF6としても公知)の役割を試験するため、各コード配列を、ブタ線維芽細胞においてその遺伝子に隣接する2つのTALEN対を用いて除去した(図3)。
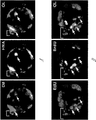
MYF5/MYOD/MRF4ヌル胚をE18.0で収集し、分析した(図4Aおよび4B)。このヌル体では、Wt胚と比較して、筋節発生が損なわれ、デスミンは存在しない。これに対して、心臓デスミンはこのヌル体において保存されており、このことはこの遺伝子編集の特異性を示している。マウスおよびブタにおける結果は、同様の表現型を反映しており、変異胚が骨格筋を欠いていることから、MYF5/MYOD/MRF4の機能がマウスとブタの間で保存されているという考えを支持している。これらのデータは、2つ以上の細胞型でヒト化されるであろうキメラ器官の成長を支持するためにブタゲノムに複数の変異を導入できることを示している。
SCNTを用いてブタMYF5/MYOD/MRF4ヌル胚盤胞を作製し、これにGFP標識ブタ割球を注入した(検証済みのブタES細胞が入手可能でなかったため、この実験では割球を使用した)。得られたキメラを、偽妊娠雌性ブタに移植し、E20で試験した。肝臓および卵黄嚢がGFP陽性であったことにより、補完の実現性が実証された。加えて、PCR分析により、ブタMYF5/MYOD/MRF4ヌル胚盤胞の約10%が、GFP標識されていた。これらのデータは、このブタ変異宿主におけるブタ:ブタ補完の実現性を支持している。
ヒト・ブタキメラの作製を実証するさらなるデータを提供する。ヒト臍帯血幹細胞(hUCBSC)およびhiPSCの能力を、ブタ胚盤胞に導入され胚発生に参加するそれらの能力について試験した。ブタ単為生殖性胚盤胞を、卵母細胞の電気刺激を用いて作製した(そしてこれらは妊娠中期を超えて生きられない)。活性化から6日後、9〜12の色素標識されたhUCBSCまたはhiPSCを卵割腔に注射した。胚盤胞を2日間培養下で回復させ、その後に画像化した(図5)。標識hUCBSCおよびhiPSCが、ブタ胚盤胞の90%の内部細胞塊において観察された(それぞれ、図5Aおよび5B)。ヒト核抗原特異的抗体(HNA)を用いた免疫組織化学によるDil分布の比較は、HNA抗体が、注射されたヒト幹細胞を検出することを明らかにした(図5A、矢印)。EdU標識hiPSCを注射された胚盤胞をBrdUで1時間さらにパルスし、その後に増殖性細胞の検出のために収集した。EdUによる二重染色は、注射されたヒト幹細胞が注射から48時間後も増殖し続けていることを明らかにした(図5B、矢印)。これらの結果は、ブタ胚盤胞のICMへのヒト幹細胞の導入、および子宮への移植の準備におけるキメラ胚盤胞の孵化段階への発生の進行を実証している。
材料および方法
TALENの設計および作製
候補TALEN標的DNA配列およびRVD配列は、オンラインツール「TAL EFFECTOR NUCLEOTIDE TARGETER 2.0」を用いて特定した。次いで、TALEN DNAトランスフェクションまたはインビトロTALEN mRNA転写のためのプラスミドを、最終目標ベクターとしてRCIscript-GOLDYTALEN(Addgene ID 38143)を用いるGolden Gate Assemblyプロトコル(Carlson 2012)にしたがい構築した。QIAPREP SPIN MINIPREPキット(Qiagen)を用いて調製した構築したRCIscriptベクターを、以前に示された(Carlson, 2009)ようにmMESSAGE mMACHINE(登録商標)T3キット(Ambion)を用いるインビトロTALEN mRNA転写におけるテンプレートとして使用するために、SacIにより直鎖状にした。得られたmRNAを、MEGACLEAR REACTION CLEANUPキット(Applied Biosciences)またはRNeasyキット(Qiagen)を用いる精製の前にDNAse処理した。
ブタ線維芽細胞は、(示されているように)摂氏37または30度、5%CO2下、10%ウシ胎仔血清、100 I.U./mLペニシリンおよびストレプトマイシン、2mM L-グルタミンおよび10mM Hepesを補充したDMEM中で維持した。Neon Transfectionシステム(Life Technologies)を使用して、TALENおよびHDRオリゴを送達した。70〜100%コンフルエンスの低継代OssabawまたはLandraceブタ線維芽細胞を、1:2に分割し、次の日に70〜80%コンフルエンスで収集した。約600,000細胞を、mRNA TALENおよびHDRオリゴを含む"R"Buffer(Life Technologies)中に再懸濁し、100μLチップ内で以下のパラメータを用いて電気穿孔した:入力電圧:1800V;パルス幅:20ms;パルス数:1。関心対象の特定の遺伝子につき0.1〜4 ugのTALEN mRNAおよび0.1〜0.4 nmolのHDRオリゴを各トランスフェクションに含めた。トランスフェクトされた細胞を摂氏30度で2〜3日間培養し、その後に遺伝子編集効率について分析し、コロニー形成のためにプレーティングした。
トランスフェクションの2または3日後に、50〜250個の細胞を10cmディッシュに播種し、個々のコロニーが約5mm径に達するまで培養した。8 mLのTrypLEおよびDMEM培地の1:4(vol/vol)混合物(Life Technologies)を添加し、コロニーを吸引し、48ウェルディッシュおよびレプリカの96ウェルディッシュのウェルに移し、同一条件下で培養した。凍結保存のためおよび遺伝子タイピング用のサンプル調製のために、コンフルエンスに達したコロニーを収集した。
第3および10日のトランスフェクト細胞集団を、6ウェルディッシュのウェルから回収し、10〜30%を、200μg/mlプロテイナーゼKを直前に補充した50μlの1X PCR適合溶解緩衝液:10mM Tris-Cl pH 8.0、2mM EDTA、0.45% Tryton X-100(vol/vol)、0.45% Tween-20(vol/vol)に再懸濁させた。その溶解産物を、サーマルサイクラーで以下のプログラムを用いて処理した:55℃で60分間、95℃で15分間。
意図する部位に隣接するPCRを、AccuStart(商標)Taq DNA Polymerase HiFi(Quanta Biosciences)および1μlの細胞溶解産物を製造元の推奨にしたがい用いて行った。集団内の変異頻度を、上記のように10μlのPCR産物を用いて製造元の推奨にしたがうSURVEYOR MUTATION DETECTION Kit(Transgenomic)により分析した。SURVEYOR反応物を、10% TBEポリアクリルアミドゲル上で分離し、臭化エチジウム染色によって可視化した。バンドの濃度測定を、ImageJを用いて行い、SURVEYOR反応物の変異率を、(Guschin et al. 2010)に記載されるようにして計算した。個々のコロニーを、ssMYODにおけるHDR対立遺伝子についてはプライマーssMYOD NJ F2とssMYOD NJ R2を、ssMYF5におけるHDR対立遺伝子についてはssMYF5 NJ F1とssMYF5 NJ R1を、ssMYF6におけるHDR対立遺伝子についてはssMYF6 NJ F1とssMYF6 NJ R1を用いてHDR対立遺伝子の存在についてスクリーンした。得られたPCR増幅産物をHindIIIで消化することによって、PCR産物を制限酵素断片長多型分析(RFLP)に供し、対立遺伝子の一方、両方が切断されたかまたはいずれも切断されなかったか、したがってHDR対立遺伝子を含んでいたかどうかを決定した。生成物を、アガロースゲル上で分離した。
ヒト遺伝子:MYOD ENSG00000129152
フレームシフトKO対立遺伝子:ssMYODのエクソン1にフレームシフトおよび未成熟停止コドンを導入する
TALEN:
ssMYOD 1.2(5’から3’に向かって)
左側:
右側:
ssMYOD 1.2 HDRオリゴ
下線=MYOD 1.2切断部位の右側から52bpの相同領域
太字=MYOD 1.2切断部位の左側から33bpの相同領域
斜体=挿入された塩基
下線=HindIII部位
大文字=未成熟終止コドン
ssMYOD NJ F2からssMYOD NJ R2までの全長
スクリーニングプライマー:
これはHDRが生じたときに予想されるPCR産物である:
これは野生型対立遺伝子の予想されるPCR産物である:
ヒト遺伝子:MYF5 ENSG00000111049
フレームシフトKO対立遺伝子:ssMYF5のエクソン1にフレームシフトおよび未成熟停止コドンを導入する
TALEN:
ssMYF5 1.1(5’から3’に向かって)
左側:
右側:
ssMYF5 1.1 HDRオリゴ
下線=MYF5 1.1切断部位の右側から42bpの相同領域
太字=MYF5 1.1切断部位の左側から43bpの相同領域
斜体=挿入された塩基
下線=HindIII部位
大文字=未成熟終止コドン
ssMYF5 NJ F1からssMYF5 NJ R1までの全長:
スクリーニングプライマー:
これはHDRが生じたときに予想されるPCR産物である:
これは野生型対立遺伝子の予想されるPCR産物である:
ヒト遺伝子:MYF6 ENSG00000111046
フレームシフトKO対立遺伝子:ssMYF6のエクソン1にフレームシフトおよび未成熟停止コドンを導入する
TALEN:
ssMYF6 1.2(5’から3’に向かって)
左側:
右側:
ssMYF6 1.2 HDRオリゴ
下線=MYF6 1.2切断部位の右側から32bpの相同領域
太字=MYF6 1.2切断部位の左側から54bpの相同領域
斜体=挿入された塩基
下線=HindIII部位
大文字=未成熟終止コドン
ssMYF6 NJ F1からssMYF6 NJ R1までの全長:
スクリーニングプライマー:
これはHDRが生じたときに予想されるPCR産物である:
これは野生型対立遺伝子の予想されるPCR産物である:
Claims (14)
- 非ヒト動物細胞または胚盤胞が、機能的なMYF5タンパク質、MYODタンパク質、MRF4タンパク質またはそれらの組み合わせを欠くよう、そのゲノムが、MYF5遺伝子、MYOD遺伝子、MRF4遺伝子またはそれらの組み合わせの両方の対立遺伝子に変異を有する、非ヒト動物細胞、桑実胚または胚盤胞。
- 変異が、MYF5遺伝子、MYOD遺伝子および/またはMRF4遺伝子の欠失である、請求項1記載の非ヒト動物細胞、桑実胚または胚盤胞。
- ブタ、ウシ、ウマまたはヤギである、請求項1または2記載の非ヒト動物細胞、桑実胚または胚盤胞。
- ヒトMYF5、MYODおよび/またはMRF4を発現し、非ヒト動物MYF、MYODおよび/またはMRF4の発現を欠く、キメラ非ヒト動物、桑実胚または胚盤胞。
- 前記非ヒト動物が、ヒト化骨格筋細胞および/または組織を生成する、請求項4記載のキメラ非ヒト動物。
- 外因性ブタMYF5、MYOD、MRF4またはそれらの組み合わせを発現し、内因性ブタMYF5、MYOD、MRF4またはそれらの組み合わせの発現を欠く、キメラブタ(ブタ・ブタキメラ)。
- 非ヒト動物が、ブタ、ウシ、ウマまたはヤギである、請求項4または5記載のキメラ非ヒト動物。
- ヒトMYF5遺伝子、MYOD遺伝子、MRF4遺伝子またはそれらの組み合わせを発現するキメラ非ヒト動物を作製するための方法であって、以下の工程を含む、方法:
(a)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである非ヒト動物細胞を作製する工程であって、ブタMYF5遺伝子、MYOD遺伝子、MRF4遺伝子またはそれらの組み合わせの両方のコピーが、非ヒト動物内での機能的なMYF5タンパク質、MYODタンパク質、MRF4タンパク質またはそれらの組み合わせの生成を妨げる変異を有する、工程;
(b)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである(a)の非ヒト動物細胞由来の核を除核非ヒト卵母細胞に融合し、該卵母細胞を活性化させて、MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである非ヒト胚盤胞を形成するよう分裂させることを含む体細胞核移植によって、MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである非ヒト桑実胚または胚盤胞を作製する工程;
(c)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである(b)の非ヒト桑実胚または胚盤胞にヒト幹細胞を導入する工程;および
(d)偽妊娠代理非ヒト動物に(c)由来の桑実胚または胚盤胞を移植して、ヒトMYF5、MYOD、MRF4またはそれらの組み合わせを発現するキメラ非ヒト動物を作製する工程。 - 外因性MYF5遺伝子、MYOD遺伝子、MRF4遺伝子またはそれらの組み合わせを発現するキメラブタを作製するための方法であって、以下の工程を含む、方法:
(a)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルであるブタ細胞を作製する工程であって、内因性ブタMYF5遺伝子、MYOD遺伝子、MRF4遺伝子またはそれらの組み合わせの遺伝子の両方のコピーが、機能的な内因性ブタMYF5タンパク質、MYODタンパク質、MRF4タンパク質またはそれらの組み合わせの生成を妨げる変異を有する、工程;
(b)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである(a)のブタ細胞由来の核を除核ブタ卵母細胞に融合し、該卵母細胞を活性化させて、MYF5、MYOD、MRF4またはそれらの組み合わせがヌルであるブタ胚盤胞を形成するよう分裂させることを含む体細胞核移植によって、MYF5、MYOD、MRF4またはそれらの組み合わせがヌルであるブタ胚盤胞を作製する工程;
(c)ブタMYF5、MYOD、MRF4またはそれらの組み合わせがヌルである(b)の胚盤胞にブタ幹細胞を導入する工程;および
(d)偽妊娠代理ブタに(c)由来の胚盤胞を移植して、外因性ブタMYF5、MYOD、MRF4またはそれらの組み合わせを発現するキメラブタを作製する工程。 - 非ヒト動物においてヒトおよび/またはヒト化骨格筋細胞を生成する方法であって、以下の工程を含む、方法:
(a)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである非ヒト動物細胞を作製する工程であって、非ヒト動物MYF5遺伝子、MYOD遺伝子、MRF4遺伝子またはそれらの組み合わせの両方の対立遺伝子が、機能的なMYF5タンパク質、MYODタンパク質、MRF4タンパク質またはそれらの組み合わせの生成を妨げる変異を有する、工程;
(b)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである(a)の非ヒト動物細胞由来の核を除核非ヒト卵母細胞に融合し、該卵母細胞を活性化させて、MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである非ヒト胚盤胞を形成するよう分裂させることを含む体細胞核移植によって、MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである非ヒト動物胚盤胞または桑実胚を作製する工程;
(c)MYF5、MYOD、MRF4またはそれらの組み合わせがヌルである(b)の非ヒト胚盤胞または桑実胚にヒトドナー幹細胞を導入する工程;および
(d)偽妊娠代理非ヒト動物に(c)由来の胚盤胞または桑実胚を移植して、ヒトまたはヒト化骨格筋細胞を発現する非ヒト動物を作製する工程。 - 非ヒト動物が、ブタ、ウシ、ウマまたはヤギである、請求項8または10記載の方法。
- ヒトドナー幹細胞が、組織特異的幹細胞、多能性幹細胞、分化多能性成体幹細胞、人工多能性幹細胞または臍帯血幹細胞(UCBSC)である、請求項8または10記載の方法。
- 前記人工多能性細胞が、線維芽細胞から形成される、請求項8または10記載の方法。
- 請求項8〜13のいずれか一項記載の方法によって作製される非ヒト動物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562187027P | 2015-06-30 | 2015-06-30 | |
| US62/187,027 | 2015-06-30 | ||
| PCT/US2016/040378 WO2017004367A1 (en) | 2015-06-30 | 2016-06-30 | Humanized skeletal muscle |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018522553A true JP2018522553A (ja) | 2018-08-16 |
| JP2018522553A5 JP2018522553A5 (ja) | 2019-08-08 |
Family
ID=57609173
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017568279A Pending JP2018522553A (ja) | 2015-06-30 | 2016-06-30 | ヒト化骨格筋 |
Country Status (10)
| Country | Link |
|---|---|
| US (2) | US10874092B2 (ja) |
| EP (1) | EP3316898A4 (ja) |
| JP (1) | JP2018522553A (ja) |
| CN (1) | CN108135943A (ja) |
| AU (1) | AU2016288196A1 (ja) |
| BR (1) | BR112017028619A2 (ja) |
| CA (1) | CA2991053A1 (ja) |
| MX (1) | MX2018000273A (ja) |
| RU (1) | RU2018103093A (ja) |
| WO (1) | WO2017004367A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10874092B2 (en) | 2015-06-30 | 2020-12-29 | Regents Of The University Of Minnesota | Humanized skeletal muscle |
| US10897880B2 (en) | 2015-06-30 | 2021-01-26 | Regents Of The University Of Minnesota | Humanized heart muscle |
| US11673928B2 (en) | 2015-03-03 | 2023-06-13 | Regents Of The University Of Minnesota | Genetically modified pig cells with an inactivated Etv2 gene |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111808820A (zh) * | 2020-06-01 | 2020-10-23 | 贵州省种畜禽种质测定中心 | 基于CRISPRCAS9技术构建MyoD1基因敲除的MDBK细胞系的方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010515737A (ja) * | 2007-01-11 | 2010-05-13 | ユニバーシティー オブ ピッツバーグ − オブ ザ コモンウェルス システム オブ ハイヤー エデュケーション | 尿路病状の処置のための筋由来細胞ならびにその作製および使用の方法 |
| JP2014533491A (ja) * | 2011-11-18 | 2014-12-15 | 国立大学法人京都大学 | 多能性幹細胞から骨格筋細胞への分化誘導方法 |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5994619A (en) * | 1996-04-01 | 1999-11-30 | University Of Massachusetts, A Public Institution Of Higher Education Of The Commonwealth Of Massachusetts, As Represented By Its Amherst Campus | Production of chimeric bovine or porcine animals using cultured inner cell mass cells |
| WO2003034818A1 (fr) | 2001-10-24 | 2003-05-01 | Chugai Seiyaku Kabushiki Kaisha | Animal non humain a srgf genetiquement modifie |
| US20040133931A1 (en) | 2003-01-08 | 2004-07-08 | Gavin William G. | Method and system for fusion and activation following nuclear transfer in reconstructed embryos |
| WO2003081990A2 (en) | 2002-03-22 | 2003-10-09 | St. Jude Children's Research Hospital | Improved method for generating genetically modified animals |
| WO2004004447A2 (en) * | 2002-07-03 | 2004-01-15 | Merck & Co., Inc. | Agouti-related protein deficient cells, non-human transgenic animals and methods of selecting compounds which regulate energy metabolism |
| GB2398784B (en) * | 2003-02-26 | 2005-07-27 | Babraham Inst | Removal and modification of the immunoglobulin constant region gene cluster of a non-human mammal |
| US20060008451A1 (en) * | 2004-07-06 | 2006-01-12 | Michigan State University | In vivo methods for effecting tissue specific differentiation of embryonic stem cells |
| WO2008089482A1 (en) | 2007-01-20 | 2008-07-24 | Boehringer Ingelheim International Gmbh | C-reactive protein (crp) knockout mouse |
| JPWO2008102602A1 (ja) | 2007-02-22 | 2010-05-27 | 国立大学法人 東京大学 | Blastocystcomplementationを利用した臓器再生法 |
| WO2009104794A1 (ja) | 2008-02-22 | 2009-08-27 | 国立大学法人 東京大学 | 遺伝子改変による致死性表現型を持つ動物の繁殖用ファウンダー動物作製法 |
| GB2475656B (en) * | 2008-08-22 | 2013-04-24 | Univ Tokyo | Organ regeneration method utilizing ips cell and blastocyst complementation |
| WO2010108126A2 (en) | 2009-03-19 | 2010-09-23 | Fate Therapeutics, Inc. | Reprogramming compositions and methods of using the same |
| MX363013B (es) * | 2011-02-25 | 2019-03-04 | Recombinetics Inc | Animales genéticamente modificados y métodos para su obtención. |
| CA2834375C (en) | 2011-04-27 | 2020-07-14 | Amyris, Inc. | Methods for genomic modification |
| RU2631807C2 (ru) | 2011-06-02 | 2017-09-26 | Президент Энд Феллоуз Ов Харвард Колледж | Способы и применение систем культуры ткани ex vivo |
| IL221187A (en) | 2012-07-30 | 2017-01-31 | Adom Advanced Optical Tech Ltd | A system to perform optical tomography in two 2D beams |
| US20140115728A1 (en) * | 2012-10-24 | 2014-04-24 | A. Joseph Tector | Double knockout (gt/cmah-ko) pigs, organs and tissues |
| AR100216A1 (es) | 2014-04-28 | 2016-09-21 | Recombinetics Inc | Edición de genes multiplexados |
| BR112017018932A2 (pt) | 2015-03-03 | 2018-07-31 | Univ Minnesota | etv2 e usos do mesmo |
| JP2018523999A (ja) | 2015-06-30 | 2018-08-30 | リージェンツ オブ ザ ユニバーシティ オブ ミネソタ | ヒト化心筋 |
| CA2991053A1 (en) | 2015-06-30 | 2017-01-05 | Regents Of The University Of Minnesota | Humanized skeletal muscle |
| CN108697067A (zh) * | 2015-10-27 | 2018-10-23 | 明尼苏达大学评议会 | 嵌合胚胎-辅助的器官制备的组合物和方法 |
| CN108125943A (zh) | 2018-01-17 | 2018-06-08 | 云南省第二人民医院 | 前胡醇当归脂作为制备抗动脉粥样硬化药物的应用 |
-
2016
- 2016-06-30 CA CA2991053A patent/CA2991053A1/en not_active Abandoned
- 2016-06-30 CN CN201680049673.3A patent/CN108135943A/zh active Pending
- 2016-06-30 AU AU2016288196A patent/AU2016288196A1/en not_active Abandoned
- 2016-06-30 EP EP16818785.4A patent/EP3316898A4/en active Pending
- 2016-06-30 US US15/739,042 patent/US10874092B2/en active Active
- 2016-06-30 MX MX2018000273A patent/MX2018000273A/es unknown
- 2016-06-30 BR BR112017028619A patent/BR112017028619A2/pt not_active Application Discontinuation
- 2016-06-30 JP JP2017568279A patent/JP2018522553A/ja active Pending
- 2016-06-30 WO PCT/US2016/040378 patent/WO2017004367A1/en active Application Filing
- 2016-06-30 RU RU2018103093A patent/RU2018103093A/ru not_active Application Discontinuation
-
2020
- 2020-11-19 US US16/952,807 patent/US20210161110A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010515737A (ja) * | 2007-01-11 | 2010-05-13 | ユニバーシティー オブ ピッツバーグ − オブ ザ コモンウェルス システム オブ ハイヤー エデュケーション | 尿路病状の処置のための筋由来細胞ならびにその作製および使用の方法 |
| JP2014533491A (ja) * | 2011-11-18 | 2014-12-15 | 国立大学法人京都大学 | 多能性幹細胞から骨格筋細胞への分化誘導方法 |
Non-Patent Citations (4)
| Title |
|---|
| DEVELOPMENT, vol. 111, JPN6020012875, 1991, pages 1097 - 1107, ISSN: 0004380364 * |
| DEVELOPMENTAL BIOLOGY, vol. 219, JPN6020012871, 2000, pages 287 - 298, ISSN: 0004380362 * |
| NATURE, vol. 431, JPN6020012877, 2004, pages 466 - 471, ISSN: 0004380361 * |
| PNAS, vol. 110, no. 12, JPN6020012873, 2013, pages 4557 - 4562, ISSN: 0004380363 * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11673928B2 (en) | 2015-03-03 | 2023-06-13 | Regents Of The University Of Minnesota | Genetically modified pig cells with an inactivated Etv2 gene |
| US10874092B2 (en) | 2015-06-30 | 2020-12-29 | Regents Of The University Of Minnesota | Humanized skeletal muscle |
| US10897880B2 (en) | 2015-06-30 | 2021-01-26 | Regents Of The University Of Minnesota | Humanized heart muscle |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2018103093A (ru) | 2019-07-31 |
| US20210161110A1 (en) | 2021-06-03 |
| US20180177166A1 (en) | 2018-06-28 |
| EP3316898A4 (en) | 2019-02-27 |
| EP3316898A1 (en) | 2018-05-09 |
| CN108135943A (zh) | 2018-06-08 |
| BR112017028619A2 (pt) | 2018-09-04 |
| MX2018000273A (es) | 2018-03-08 |
| WO2017004367A1 (en) | 2017-01-05 |
| US10874092B2 (en) | 2020-12-29 |
| CA2991053A1 (en) | 2017-01-05 |
| AU2016288196A1 (en) | 2018-02-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200017882A1 (en) | Engineering of humanized car t-cell and platelets by genetic complementation | |
| US20210161110A1 (en) | Humanized skeletal muscle | |
| BR122023023211A2 (pt) | Método de fazer edições de genes multiplex em uma célula de vertebrado ou de embrião primário não-humano | |
| MX2015000074A (es) | Animales geneticamente modificados y metodos para hacer los mismos. | |
| JP2019502400A (ja) | キメラ胚補助臓器作製用の組成物及び方法 | |
| US20230365638A1 (en) | Etv2 and uses thereof | |
| US20210169054A1 (en) | Humanized heart muscle | |
| Kim et al. | Generation of genome-edited dogs by somatic cell nuclear transfer | |
| US20210037797A1 (en) | Inducible disease models methods of making them and use in tissue complementation | |
| JP2019505218A (ja) | 遺伝子相補によるヒト化腎臓の操作 | |
| Suvá et al. | MSTN-edited born calves obtained by precision breeding, using CRISPR/Cas9 and SCNT | |
| JP2023554545A (ja) | 改変ミオスタチン遺伝子を有するトランスジェニック動物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180216 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181114 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190628 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190628 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20200325 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200406 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20201109 |