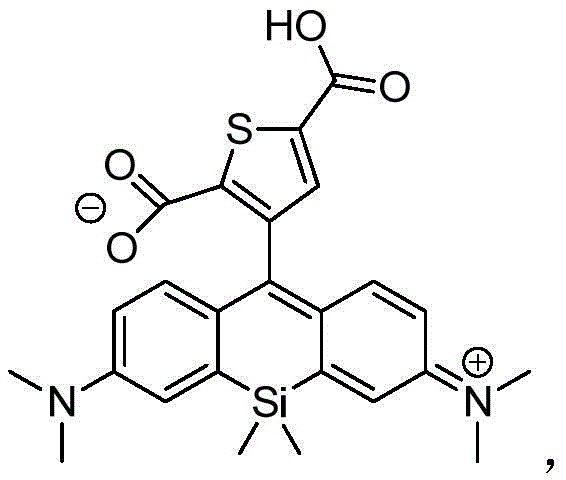
CN105073761B - 用于体外和体内成像和检测的取代的硅杂蒽阳离子红至近红外荧光染料 - Google Patents
用于体外和体内成像和检测的取代的硅杂蒽阳离子红至近红外荧光染料 Download PDFInfo
- Publication number
- CN105073761B CN105073761B CN201480016182.XA CN201480016182A CN105073761B CN 105073761 B CN105073761 B CN 105073761B CN 201480016182 A CN201480016182 A CN 201480016182A CN 105073761 B CN105073761 B CN 105073761B
- Authority
- CN
- China
- Prior art keywords
- compound
- group
- alkyl
- imaging
- substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/0019—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules
- A61K49/0021—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules the fluorescent group being a small organic molecule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/005—Fluorescence in vivo characterised by the carrier molecule carrying the fluorescent agent
- A61K49/0052—Small organic molecules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/005—Fluorescence in vivo characterised by the carrier molecule carrying the fluorescent agent
- A61K49/0054—Macromolecular compounds, i.e. oligomers, polymers, dendrimers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0803—Compounds with Si-C or Si-Si linkages
- C07F7/081—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te
- C07F7/0812—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te comprising a heterocyclic ring
- C07F7/0816—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te comprising a heterocyclic ring said ring comprising Si as a ring atom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B11/00—Diaryl- or thriarylmethane dyes
- C09B11/28—Pyronines ; Xanthon, thioxanthon, selenoxanthan, telluroxanthon dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/008—Dyes containing a substituent, which contains a silicium atom
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/0019—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- General Physics & Mathematics (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Zoology (AREA)
- Food Science & Technology (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Peptides Or Proteins (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Saccharide Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明提供了一类荧光化合物。所述化合物是取代的硅杂蒽阳离子化合物,其可以化学连接至一个以上的生物分子,诸如蛋白质、核酸和治疗性小分子。所述化合物可以用于在各种医疗、生物和诊断应用中成像。所述染料在各种体外、体内和离体成像应用中是特别有用的。
Description
与相关申请的交叉引用
本申请要求2013年3月15日提交的美国临时申请序列号61/794,188的利益,所述临时申请以其整体通过引用并入本文。
技术领域
本申请涉及使用荧光染料(荧光色素)的组合物和方法。组合物通常包含硅杂蒽阳离子(silaxanthenium)荧光染料,其能够用于各种医疗、诊断和生物应用。荧光染料使在体外、离体和体内成像应用中进行荧光检测成为可能。
背景技术
光学成像和检测方法提供了优于其他成像和检测方法的多个优点。组织、器官或整个对象的成像通常使用红和近红外(NIR)范围(600-1200nm)的光,以最大化组织穿透,并且最小化来自诸如血红蛋白和水的自然生物吸收剂的吸收以及生物分子的自发荧光。光学成像可以提供高灵敏度,不需要将检测对象或实验室人员暴露于电离辐射,能够允许同时使用多个可区分的探针(可能在分子成像中非常重要),并且提供了高的时间和空间分辨率,其在功能性成像、检测、诊断应用、显微术、血细胞计数、组织成像以及体内和体外成像中非常重要。
在荧光成像或检测中,将过滤的光或具有限定带宽的激光用作激发光源。激发光从身体组织或诸如显微镜载片、细胞或多孔板的其他分析样品中穿过,并且当激发光遇到报告分子(例如,对比剂、增敏剂、荧光染料或成像探针)时,光被吸收。报告分子然后发光,或者将激发信号或能量转移至其他能够发光的分子,该报告分子或其他能够发光的分子发射的光与激发光具有可检测的不同性质。产生的发射光然后能够用于构建图像或者定量样品中报告子的量。大多数光学成像技术依赖于将有机和无机荧光染料(荧光染料)用作报告分子。
荧光染料或荧光染料是普遍已知的,并且通过诸如荧光显微术、荧光免疫分析法和流式细胞术的过程用于各种生物和非生物材料的荧光标记和检测。用荧光染料标记这样的材料的典型方法是通过染料分子上的适当基团和要标记的材料上的相容基团之间成键的方式构建荧光复合体。以此方法,诸如细胞、组织、氨基酸、蛋白质、抗体、药物、激素、核苷酸、核酸、脂质和多糖等的材料可以被化学标记并且检测或定量,或者可以用作能够与目标物质特异性结合的荧光探针并且通过荧光检测方法检测。明亮的荧光染料以极高的灵敏度允许被连接材料的检测或定位。
已经出现使用荧光染料的光学成像,其作为一种强大的成像模式,具有在体内和体外均优于其他模式的显著优点。在远红至近红外(NIR)区域(630-900nm)内发荧光的染料是体内成像必需的,这是由于这些波长的光相对于波长更长或更短的光经过组织的优秀穿透性,波长更长或更短的光会被水和血红蛋白所吸收。NIR染料也在远在组织自发荧光的通常范围之外吸收和发射,使得它们极其适合组织和细胞的体外成像。
多年来,吲哚菁染料一直是用于体内NIR荧光成像的染料的主导种类,而且吲哚菁绿(分子量775Da)是已知最佳的批准用于人的诊断应用的NIR染料的一种。此外,已经开发出用于生物偶联和成像应用的具有各种诸如羧酸的连接官能性的吲哚菁的多种衍生变体。然而,当前的在NIR区域发荧光的分子构造,包括吲哚菁族,趋向于体积大(>750Da)并且水中溶解性差,需要并入诸如多个磺酸基团的增溶基团。于是,所得染料显示出非常低的细胞膜通透性,限制了它们对于靶向细胞内结构的应用。
对于开发新颖的、远红至NIR荧光的、较小并且细胞膜高度可通透的荧光团,从而将体外和体内NIR成像的范围扩展至细胞内目标的范围,有着不断增长的需求。用于这个目的的理想的荧光团应该体积小(<750Da)、具有良好的水溶性、具有远红至NIR范围的吸收和发射分布以及高消光系数和量子产率、对于活体细胞的膜高度可通透、并且通过关键取代基的变化具有可调的光学性质。
尽管如此,对于能够用于各种医疗、诊断和生物应用的新染料,有着持续的需求。对于在体外、离体和体内应用中运作良好的染料有着需求。
发明概述
本发明描述了基于硅杂蒽阳离子核心的荧光化合物(荧光染料),该荧光化合物通过使用选择的取代基可以有效地红移,从而落入能够用于体内和体外的成像和检测应用的远红和NIR光谱范围内。在一个实施方式中,本发明提供了一族荧光的9-取代-3,6-二氨基-10-硅杂蒽阳离子荧光染料,其具有红至近红外吸收和发射波长。在某些实施方式中,本发明的荧光染料具有低分子量(小于约750Da)、展现出显著的细胞通透性、以及具有能够由选择的取代基或相对于硅杂蒽阳离子核心的取代基定位/取向来调整的光学性质。
在一个实施方式中,本发明提供了一种由式I或其盐表示的化合物:
其中,变量如下面的详细描述所定义。
在另一个实施方式中,本发明提供了由下式及其盐表示的荧光的硅杂蒽阳离子荧光染料:
其中R1、R2、R3、R4、R5、L、W1、W2、X、Y和Z更详细的描述如下。在一个实施方式中,W1或W2包含脂肪族或芳香族碳环或杂环组成部分。在另一个实施方式中,X、Y或Z包含杂原子,例如N、O、S或Si。在另一个实施方式中,由R1、R2、R3、R4、R5、L、W1、W2、X、Y或Z表示的取代基,通过例如引起光学吸收或发射波长的位移、或者提高量子产率或光稳定性,改善9-硅杂蒽阳离子核心的光学性质。在其他实施方式中,本发明提供了细胞膜可通透的化合物。
在某些实施方式中,化合物具有小于750道尔顿的分子量。在其他实施方式中,化合物具有从约400至750道尔顿的分子量。在其他实施方式中,化合物具有小于500道尔顿的分子量。
在某些实施方式中,化合物具有在从约500nm至1100nm范围内的吸收和发射波长。在其他实施方式中,化合物具有在从约600nm至850nm范围内的吸收和发射波长。在其他实施方式中,化合物在远红至近红外区域内是荧光的。
在某些实施方式中,化合物是由下式或其盐表示的荧光生物分子:
其中;X、Y和Z独立地是O、S、N、Si、C或(C=C)。L是连接基团,其可选择的具有官能性基团或反应性基团,诸如羧酸盐、羧基烷基、马来酰亚胺、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸盐、-NH2、-OH、-SH、-SO3H、羧基、-COCl、-(CO)O(CO)R7、-CONHNH2、乙酰氧基甲酯、取代的和未取代的N-羟基琥珀酰亚胺基酯、取代的和未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基或氟或苯酚酯、叠氮、-NCS、-CHO、叠氮、-COCH2I、亚磷酰胺、邻苯二甲酰胺或马来酰亚胺,其中R7选自由H、烷基和芳基所组成的组;
BM是生物分子,其中荧光生物分子包含至少一个BM。
R1、R2、R3和R4独立地是H、甲基、乙基、烷基、或环烷基、芳基、取代的芳基、杂芳基、或杂环(如吗啉)、炔基、羧基烷基、氨基烷基、卤代烷基、叠氮基烷基、酰胺、氨基酸或肽;
R5不存在或是H、C1-20烷基、羧基、羧基烷基、磺酸盐、磺酰胺、卤素、羟基、氨基、酰胺、硝基、氰基、O-烷基、S-烷基、甲硅烷基、O-甲硅烷基、甲基、乙基、异丙基、羧基烷基、卤代烷基、烷基巯基、三氟甲基、酰肼;并且
W1和W2独立地不存在或者是包含脂肪族碳、氮、氧、硫或硅的、与R2和R3或R4和R5形成四元至九元环的环状基团,其可选择地进一步含有取代基。在另一个实施方式中,化合物包括生物分子(BM),其中BM是细胞、蛋白质或核酸。
在某些实施方式中,本发明提供了一种体外成像方法,该方法包括:(a)将样品与本发明的试剂相接触;(b)使所述试剂与生物目标结合;(c)可选择地去除未结合的试剂;以及(d)检测由所述试剂发射的信号,从而判定所述试剂是否已经被生物目标激活或者已经与生物目标结合。在其他实施方式中,样品是生物样品。在其他实施方式中,由荧光染料发射的光学信号由例如荧光显微镜、流式细胞计数器或其他适当的检测设备检测。
在某些实施方式中,本发明提供了一种离体成像方法,该方法包括:(a)将样品与本发明的试剂相接触;(b)使所述试剂与生物目标结合;(c)可选择地去除未结合的试剂;以及(d)检测由所述试剂发射的信号,从而判定所述试剂是否已经被生物目标激活或者已经与生物目标结合。在其他实施方式中,样品是生物样品。
在某些实施方式中,本发明提供了一种体内成像方法,该方法包括:(a)向对象给予本发明的试剂;(b)使试剂在对象体内分布;以及(c)检测由试剂发射的信号。
在另一个实施方式中,本发明提供了一种体内光学成像方法,其中该方法包括(a)向例如动物或人的对象给予本发明的荧光染料或其缀合体;(b)使荧光染料或其缀合物在对象体内分布、与生物目标接触、相互作用或者结合于生物目标;(c)将对象暴露于具有可以被荧光染料吸收的波长的光下;以及(d)检测由荧光染料发射的光学信号,例如使用内窥镜、导管、断层扫描成像系统、荧光显微镜或反射成像系统、手持光学成像系统、术中系统或显微镜。
在某些实施方式中,本发明的成像方法允许由化合物发射的信号用于构建图像。在其他实施方式中,图像是断层扫描图像。在其他实施方式中,步骤(a)-(c)按预定时间间隔重复,从而允许随时间地评估发射的信号。在其他实施方式中,使用内窥镜、导管、断层扫描系统、手持光学成像系统或者术中显微镜进行光照和检测步骤。
在某些实施方式中,其中在步骤(a)中,当向对象给予或对诸如生物或化学样品的样品应用两种以上信号性质可相互区分的成像或检测剂时,至少一种成像或检测剂是本发明的化合物。在其他实施方式中,本发明的化合物与一种以上本文中描述的或本领域已知的成像或检测剂一起,在用于在单一样品或对象中成像或检测多个目标的多重试验中使用。
在某些实施方式中,本发明提供了用于在诸如生物样品的样品中检测或定量分析物的方法。在其他实施方式中,检测方法是均相试验。在其他实施方式中,方法是非均相试验(heterogeneous assay)。在其他实施方式中,方法是时间分辨的荧光或发光试验。在另一个实施方式中,方法是信号放大试验,诸如酪胺信号放大试验。
在某些实施方式中,本发明的材料和方法用作高通量筛选试验的一部分。在其他实施方式中,本发明的材料和方法用作高含量筛选试验的一部分。
在某些实施方式中,本公开的方法能够用于检测、监控或诊断疾病或生物状况,例如骨疾病、癌症、心血管疾病、皮肤疾病、环境性疾病、免疫疾病、传染病、炎症、遗传疾病、代谢疾病、神经变性疾病、眼病和呼吸疾病。能够在诸如细胞、组织、活检或诸如动物或人的活体对象的生物样品中,检测、监控或诊断这些疾病或生物状况。
在某些实施方式中,用本文中描述的荧光染料化合物标记细胞,并给予对象标记的细胞。由荧光染料化合物发生的信号能够用于监控细胞的转运和定位,或者用于评估细胞疗法的有效性。
附图说明
图1图示出本发明的硅杂蒽阳离子荧光染料化合物的细胞摄入。图1A是在流式细胞术研究中比较未标记的细胞、花菁染料和硅杂蒽阳离子化合物之间的平均荧光的图表。硅杂蒽阳离子系化合物具有大于花菁系化合物的细胞荧光。图1B图示出硅杂蒽阳离子化合物和花菁染料的细胞摄入的荧光显微图像。细胞也与作为细胞摄入的对照的线粒体染料一起培养。结合的图像表明硅杂蒽阳离子化合物具有大于电中性花菁染料的细胞摄入。
图2图示出肽缀合的、内部淬灭的、可激活的硅杂蒽阳离子荧光染料化合物的吸收和荧光。图2A图示出淬灭的硅杂蒽阳离子化合物的激活示意图。肽的酶切去除分离硅杂蒽阳离子荧光团,足以消除淬灭并释放荧光。图2B图示出淬灭的和激活的硅杂蒽阳离子荧光化合物的比较吸收和荧光。基于肽的切割,激活的硅杂蒽阳离子化合物具有远大于淬灭的相对物的吸收和荧光。
图3图示出使用硅杂蒽阳离子荧光化合物(化合物34)的小鼠中荧光位点的断层扫描图像。图3图示出从给予硅杂蒽阳离子化合物后1分钟至3小时的小鼠的断层扫描图像。
图4图示出葡萄糖缀合的硅杂蒽阳离子化合物与商品化的荧光葡萄糖分子相比的细胞摄入的荧光显微图像和流式细胞术定量。
图5图示出硝基咪唑缀合的硅杂蒽阳离子化合物69在HeLa细胞中的摄入和定位。
图6A描绘了由可酶切的肽序列分隔开的硅杂蒽阳离子荧光染料内部淬灭对(化合物78),当酶切时的荧光激活。图6B示出用于酶活性的淬灭的和激活的基于硅杂蒽阳离子的探针的吸收和发射光谱。
图7展示了在静脉注射后,本发明的荧光染料化合物的FMT2500断层扫描体内成像系统(PerkinElmer,Waltham,MA)的断层扫描图像。
图8图示出通过流式细胞术和荧光显微术,两个异构的具有不同波长分布的9-噻吩基硅杂蒽阳离子化合物在4T1细胞内的细胞摄入和清洗(washout)。
图9A示出可激活的噻吩基化合物91的蛋白酶激活。图9B示出通过流式细胞术和荧光显微术,几种酶可激活的硅杂蒽阳离子化合物92、93和91在活体细胞中的摄入和激活。图9C示出通过FMT断层扫描成像,化合物92在活体小鼠中的体内激活和生物分布。
具体实施方式
本发明提供了一族硅杂蒽阳离子荧光染料化合物(染料),其吸收和/或发射具有在从约500nm至约1100nm的范围内,更优选为在从约600nm至约900nm的范围内的波长的光。在某些实施方式中,染料吸收和/或发射具有在从约600nm至约850nm、从约650nm至约900nm或从约650nm至约850nm的范围内的波长的光。荧光化合物或其特定缀合物或衍生物是细胞膜可通透的,能够缀合于其他分子或生物分子,并且在各种体外和体内成像应用中是特别有用的。
一般地,本发明的荧光染料能由式W1-(SX)Ar-W2及其盐表示,其中SX表示3,6-二氨基-10-硅杂蒽阳离子核心(core),Ar表示在SX核心的9-位的取代的芳基或杂芳基基团,并且W1和W2各自独立地为不存在或者分别表示环绕SX核心的3-氨基取代基和6-氨基取代基的相同或不同的碳环或杂环基团。一个显著特征是取代基Ar、W1和W2如何影响SX核心的光学性质。在以下部分中,统一汇总了说明书、实施例和附带的权利要求书中采用的特定术语。
I.定义
应当依照本说明书的其他部分阅读此处列出的定义,并且由本领域技术人员来理解。除非另有定义,本文中使用的所有技术和科学术语都与本发明所属领域普通技术人员普遍理解的意义相同。
“化学连接”意指通过原子之间的吸引力连接,所述吸引力强得足以使结合的聚集体作为一个单位起作用。这包括但不限于化学键诸如共价键,非共价键诸如离子键、金属键和桥键,疏水相互作用,氢键和范德华相互作用。这也包括交联或掩蔽(caging)。
术语“烷基”是本领域公知的,并包括饱和的脂族基团,包括直链烷基基团、支链烷基基团、环烷基(脂环族)基团、烷基取代的环烷基基团和环烷基取代的烷基基团。在某些实施方式中,直链或支链烷基在其骨架中具有30个以下的碳原子(如,直链为C1-C30,支链为C3-C30),并且可任选地为约20个以下。同样地,环烷基在其环结构中具有从约3至约10个碳原子,并且可任选地在环结构中具有约5、6或7个碳原子。术语“烷基”也包括卤代烷基。
此外,术语“烷基”包括“取代的烷基”,其指代在烃类骨架的一个以上的碳上具有替代氢的取代基的烷基组成部分。这样的取代基可以包括例如羟基、羰基(诸如羧基、烷氧基羰基、甲酰基或酰基)、硫羰基(诸如硫酯、硫乙酸酯或硫甲酸酯)、烷氧基、磷酰基、膦酸酯、亚膦酸酯、氨基、氨酰基、脒、亚氨基、氰基、硝基、叠氮基、巯基、烷基硫基、硫酸酯、磺酸酯、氨磺酰基、磺酰胺基、磺酰基、杂环基、芳烷基或芳香族或杂芳族组成部分。本领域技术人员应该理解,如果适当的话,在烃链上取代的组成部分本身可以被取代。例如,取代的烷基的取代基,可以包括取代和未取代形式的氨基、叠氮基、亚氨基、氨酰基、磷酰基(包括膦酸酯和亚膦酸酯)、磺酰基(包括硫酸酯、磺酰胺基、氨磺酰基和磺酸酯)和甲硅烷基,以及醚、烷基硫基、羰基(包括酮、醛、羧酸盐和酯)、-CN等。以下描述了示例性的取代的烷基。环烷基可以被烷基、烯基、烷氧基、烷基硫基、氨基烷基、羰基取代的烷基、-CN等进一步取代。在某些实施方式中,烷基是未取代的。在某些实施方式中,烷基是未取代的直链或支链烷基基团。
术语“卤代烷基”指代上面定义的烷基基团,除了一个以上的氢原子被卤素所替代。
术语“亚烷基”指代未取代的直链或支链烷基基团的双自由基。
术语“芳烷基”和“烷芳基”是本领域公知的,并且指代由芳基基团(如芳香族或杂芳族基团)取代的烷基基团。
术语“烯基”和“炔基”是本领域公知的,并且指代不饱和脂肪族基团,与上面描述的烷基长度类似并可以被取代,但是分别包含至少一个双键或三键。
术语“杂原子”是本领域公知的,并且指代除碳和氢外任意元素的原子。示意性的杂原子包括硼、氮、氧、磷、硫和硒。
术语“芳基”在本领域中是公知的,并且是指五元、六元和七元单环芳香族基团,其可以包括零至四个杂原子,例如苯、吡咯、呋喃、噻吩、咪唑、噁唑、噻唑、三唑、吡唑、吡啶、吡嗪、哒嗪和嘧啶等。在环结构中具有杂原子的那些芳基也可以称为“杂芳基”或“杂芳族”。芳香环可以在一个以上环位置处被如上所述的那些取代基取代,例如卤素、叠氮化物、烷基、芳烷基、烯基、炔基、环烷基、羟基、烷氧基、氨基、硝基、巯基、亚氨基、氨酰基、膦酸酯、亚膦酸酯、羰基、羧基、甲硅烷基、醚、烷基硫基、磺酰基、磺酰胺基、氨磺酰、酮、醛、酯、杂环基、芳香族或杂芳族组成部分、-CF3或-CN等。术语“芳基”还包括具有两个以上环状环的多环状环系统,其中两个以上碳为两个相邻环所共有(所述环是“稠合环”),其中所述环中的至少一个是芳香族的,其他的环状环可以是例如环烷基、环烯基、环炔基、芳基和/或杂环基。
术语“杂环基”、“杂环基团”或“杂环组成部分”是本领域公知的,并且指代三元至约十元的环状结构,可任选地指代三元至约7元的环状结构,其环状结构包括一至四个杂原子。杂环也可以是多环。杂环基团包括,例如噻吩、噻蒽、呋喃、吡喃、异苯并呋喃、苯并吡喃、氧杂蒽、苯酚氧杂蒽、吡咯、咪唑、吡唑、异噻唑、异噁唑、吡啶、吡嗪、嘧啶、哒嗪、吲哚嗪、异吲哚、吲哚、吲唑、嘌呤、喹嗪、异喹啉、喹啉、酞嗪、萘啶、喹喔啉、喹唑啉、噌啉、蝶啶、咔唑、咔啉、菲啶、吖啶、嘧啶、菲咯啉、吩嗪、吩吡嗪、吩噻嗪、呋咱、吩噁嗪、吡咯烷、四氢呋喃(oxolane)、四氢硫杂茂(thiolane)、噁唑、哌啶、哌嗪、吗啉、内酯、内酰胺诸如氮杂环丁酮和吡咯烷酮、磺内酰胺、磺内酯等。杂环的环可任选地在一个或多个位置处被如上所述的那些取代基取代,例如卤素、烷基、芳烷基、烯基、炔基、环烷基、羟基、氨基、硝基、巯基、亚氨基、氨酰基、膦酸酯、亚膦酸酯、羰基、羧基、甲硅烷基、醚、烷基硫基、磺酰基、酮、醛、酯、杂环基、芳香族或杂芳族组成部分、-CF3或-CN等。
术语“多环”、“多环基团”或“多环组成部分”是本领域公知的,并且指代其中两个以上碳为两个相邻环所共有的两个以上的环(如环烷基、环烯基、环炔基、芳基和/或杂环),如所述环是“稠合环”。通过不相邻的原子结合的环术语称为“桥接”环。多环的每个环可以被如上所述的那些取代基取代,例如卤素、烷基、芳烷基、烯基、炔基、环烷基、羟基、氨基、硝基、巯基、亚氨基、氨酰基、膦酸酯、亚膦酸酯、羰基、羧基、甲硅烷基、醚、烷基硫基、磺酰基、酮、醛、酯、杂环基、芳香族或杂芳族组成部分、-CF3或-CN等。
术语“硝基”是本领域公知的,并且指代-NO2;术语“卤素”是本领域公知的,并且指代-F、-Cl、Br或-I;术语“巯基”是本领域公知的,并且指代-SH;术语“羟基”指代-OH;以及术语“磺酰基”是本领域公知的,并且指代-SO2 -。“卤化物”指代卤素的对应阴离子,并且“类卤化物”具有如Cotton和Wilkinson所著“Advanced Inorganic Chemistry”中阐述的定义。
术语“胺”和“氨基”是本领域公知的,并且指代未取代和取代的胺两者,如可以由下列通式表示的组成部分:
其中R50、R51、R52和R53各自独立地表示氢、烷基、烯基、-(CH2)m-R61,或者R50和R51与它们附连的N原子合在一起完成在环结构中具有4至8个原子的杂环;R61表示芳基、环烷基、环烯基、杂环或多环;并且m是0或1至8范围内的整数。在某些实施方式中,R50或R51中只有一个可以是羰基,例如R50、R51和氮一起不形成酰亚胺。在其他实施方式中,R50和R51(以及可选择的R52)各自独立地表示氢、烷基、烯基或-(CH2)m-R61。因此,术语“烷基胺”包括具有接附于其上的取代的或未取代的烷基的如上所述的氨基基团,即R50和R51的至少一个是烷基基团。
术语“酰胺基”是本领域公知的,并且指代可以由下列通式表示的组成部分:
其中R50如以上定义,并且R54代表氢、烷基、烯基或-(CH2)m-R61,其中m和R61如以上定义。
术语“胺基”是本领域公知的氨基取代的羰基,并且包括可以由下列通式表示的组成部分:
其中R50和R51如以上定义。在本发明的酰胺的某些实施方式中,将不包括可能不稳定的酰亚胺。
术语“烷基硫基”指代具有接附于其上的硫自由基的如上所述的烷基基团。在某些实施方式中,“烷基硫基”组成部分由-S-烷基、-S-烯基、-S-炔基和-S-(CH2)m-R61中的一个表示,其中m和R61如以上定义。代表性的烷基硫基基团包括甲硫基、乙硫基等。
术语“羰基”是本领域公知的,并且包括可以由下列通式表示的组成部分:
其中X50是键或者表示氧或硫,并且R55和R56表示氢、烷基、烯基、-(CH2)m-R61或药学上可接受的盐,R56表示氢、烷基、烯基或-(CH2)m-R61,其中m和R61如以上定义。当X50是氧并且R55或R56不是氢时,该式表示“酯”。当X50是氧,并且R55如以上定义时,本文中将该组成部分指称为羧基基团,并且特别地,当R55是氢时,该式表示“羧酸”。当X50是氧,并且R56是氢时,该式代表“甲酸酯”。一般来说,当上式的氧原子被硫替代时,该式表示“硫代羰基”基团。当X50是硫并且R55或R56不是氢时,该式表示“硫酯”。当X50是硫并且R55是氢时,该式表示“硫代羧酸”。当X50是硫并且R56是氢时,该式表示“硫代甲酸酯”。另一方面,当X50是键,并且R55不是氢时,上式表示“酮”基团。当X50是键,并且R55是氢时,上式表示“醛”基团。
术语“烷氧基”或“烷氧”是本领域公知的,并且指代具有接附于其上的氧的如以上定义的烷基。代表性的烷氧基基团包括甲氧基、乙氧基、丙氧基、叔丁氧基等。“醚”是由氧共价连接的两个烃类。因此,使烷基成为酯的烷基的取代基是或类似于烷氧基,诸如可以由-O-烷基、-O-烯基、-O-炔基、-O-(CH2)m-R61的一个表示,其中m和R61如以上所述。
术语“磺酸盐”是本领域公知的,并且指代可以由下列通式表示的组成部分:
其中R57是电子对、氢、烷基、环烷基或芳基。
术语“硫酸盐”是本领域公知的,并且包括可以由下列通式表示的组成部分:
其中R57如以上定义。
术语“磺酰氨基”是本领域公知的,并且包括可以由下列通式表示的组成部分:
其中R50和R56如以上定义。
术语“氨磺酰基”是本领域公知的,并且指代可以由下列通式表示的组成部分:
其中R50和R51如以上定义。
术语“磺酰基”是本领域公知的,并且指代可以由下列通式表示的组成部分:
其中R58是下列之一:氢、烷基、烯基、炔基、环烷基、杂环基、芳基或杂芳基。
术语“亚砜基”是本领域公知的,并且指代可以由下列通式表示的组成部分:
其中R58如以上定义。
术语“磷酰基”是本领域公知的,并且一般地可以由下式表示:
其中Q50表示S或O,并且R59表示氢、低级烷基或芳基。当用于取代例如烷基时,磷酰烷基的磷酰基基团可以由下列通式表示:
其中Q50和R59各自独立地定义如上,并且Q51表示O、S或N。当Q50为S时,磷酰基组成部分是“硫代磷酸酯”。
术语“亚磷酰胺”是本领域公知的,并且可以由下列通式表示:
其中Q51、R50、R51和R59如以上定义。
术语“次磷酰胺”是本领域公知的,并且可以由下列通式表示:
其中Q51、R50、R51和R59如以上定义,并且R60表示低级烷基或芳基。
可以对烯基和炔基基团进行类似的取代,以生成例如氨基烯基、氨基炔基、酰胺基烯基、酰胺基炔基、亚氨基烯基、亚氨基炔基、硫代烯基、硫代炔基、羰基取代的烯基或炔基。
各个表达式的定义,如烷基、m、n等,当其在任意结构中出现多于一次时,意味着其独立于相同结构中的其他定义。
应该理解,“取代”或“被...取代”包括隐含的条件,即这种取代与取代的原子和取代基的允许价态相一致,并且取代产生了稳定的化合物,如其不自发地进行诸如通过重排、环化、排除或其他反应而变形。
术语“取代的”也意欲包括有机化合物的所有可允许的取代基。示例性的取代基包括,例如卤素、叠氮化物、烷基、芳烷基、烯基、炔基、环烷基、羟基、烷氧基、氨基、硝基、巯基、亚氨基、氨酰基、膦酸酯、亚膦酸酯、羰基、羧基、甲硅烷基、醚、烷基硫基、磺酰基、磺酰胺基、氨磺酰、酮、醛、酯、杂环基、芳香族或杂芳族组成部分、-CF3和-CN等。在更广泛的方面,可允许的取代基包括有机化合物的非环状的和环状的、分枝的和未分枝的、碳环的和杂环的、芳香的和非芳香的取代基。例如,示意性的取代基包括本文中上面描述的那些。可允许的取代基对于适当的有机化合物可以是一个以上,并且可以是相同的或不同的。取代基本身也可以进一步被一个以上的上述取代基取代。为了本发明的目的,诸如氮的杂原子可以含有氢取代基和/或本文中描述的满足杂原子价态的任意有机化合物可允许的取代基。本发明不意味着以任何方式通过有机化合物可允许的取代基来限制。
术语“生理上可接受的载体”指代一种以上本发明的化合物在其中分散、溶解、悬浮、混合,并且在生理上可耐受的载体,即可以给予于对象的身体、身体中或身体上而没有过度不适或刺激或毒性的载体。
在整个说明书中,当以具有、包括或包含特定组分描述组合物时,也意指该组合物基本上由所述组分构成、或者由所述组分构成。类似地,当以具有、包括或包含特定步骤描述过程时,该过程也可以基本上由所述处理步骤组成,或者由所述步骤组成。而且应该理解,只要本发明是可进行的,步骤的次序或者进行特定操作的次序不重要。另外,两个以上步骤或动作可以同时进行。
II.本发明的硅杂蒽阳离子化合物
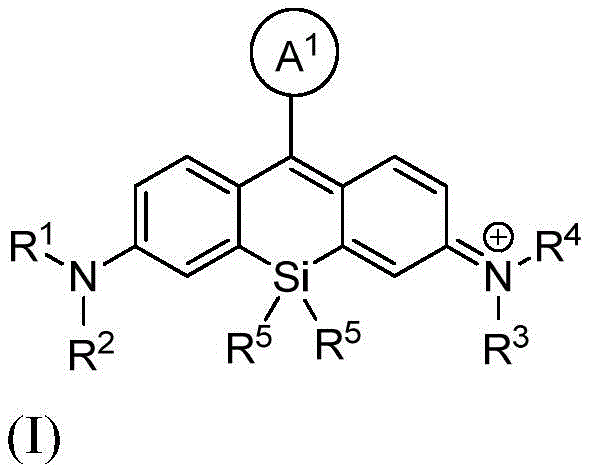
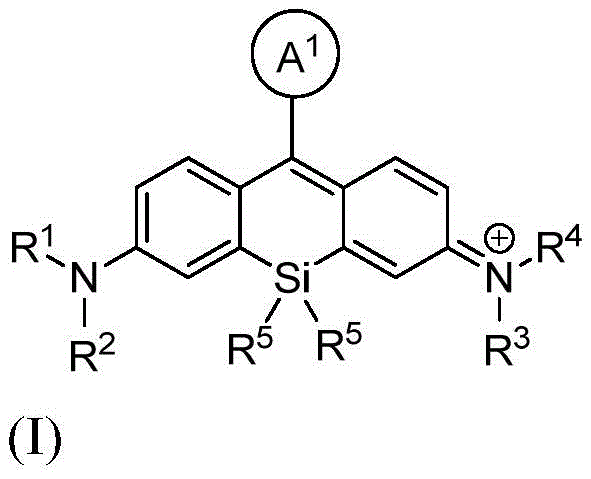
本发明的一个方面提供了一种由式I或其盐表示的化合物:
其中:
A1是苯基或五至六元杂环,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2、-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)、X1和亚烷基-X1所组成的组;
X1在每次出现时独立地表示马来酰亚胺、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯酚酯、氟代苯酚酯、叠氮、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R1和R2各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R1和R2与接附于它们的氮原子合并在一起形成单环状或双环状环;
R3和R4各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R3和R4与接附于它们的氮原子合并在一起形成单环状或双环状环;
R5在每次出现时独立地表示C1-6烷基;
R6在每次出现时独立地表示氢或烷基;
R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H、亚烷基-C(O)N(R6)2、亚烷基-(可选择地取代的杂环基)、可选择地取代的杂环基、亚烷基-(可选择地取代的杂芳基)、或者羟基亚烷基-(可选择地取代的杂环基);并且
R8在每次出现时独立地表示氢、烷基或芳基。
在一些实施例中,在式(I)中描述的变量能够如下定义:
A1是苯基或五至六元杂芳基,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2、-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)、X1和亚烷基-X1所组成的组;
X1在每次出现时独立地表示酯、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯基酯、氟代苯基酯、炔烃、叠氮、酰肼、烷氧基胺、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R1和R2各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R1和R2与接附于它们的氮原子合并在一起形成单环状或双环状环;
R3和R4各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R3和R4与接附于它们的氮原子合并在一起形成单环状或双环状环;
R5在每次出现时独立地表示可选择地带有官能团的C1-6烷基、酯、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯基酯、氟代苯基酯、炔烃、叠氮、酰肼、烷氧基胺、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R6在每次出现时独立地表示氢或烷基;
R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H、亚烷基-C(O)N(R6)2、亚烷基-(可选择地取代的杂环基)、可选择地取代的杂环基、亚烷基-(可选择地取代的杂芳基)、或者羟基亚烷基-(可选择地取代的杂环基);并且
R8在每次出现时独立地表示氢、烷基或芳基。
在某些实施例中,化合物还包含具有-1的电荷的平衡离子。示例性的具有-1的电荷的平衡离子包括例如卤素(如Cl-、Br-或I-)和RCO2 -,其中R是烷基、芳基和芳烷基等。
在某些实施例中,A1是可选择地由1个、2个或3个取代基取代的五至六元杂环,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2和-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)所组成的组。在某些实施例中,A1是苯硫基、呋喃基或者吡啶基,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2和-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)所组成的组。在某些实施例中,A1是可选择地由1个、2个或3个取代基取代的苯基,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2和-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)所组成的组。
在某些实施例中,R1和R2各自独立地表示氢或烷基;或者R1和R2与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环。
在某些实施例中,R3和R4各自独立地表示氢或烷基;或者R3和R4与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环。
在某些实施例中,R5是甲基。在某些实施例中,R6是氢。在某些实施例中,R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H或者亚烷基-C(O)N(R6)2。在某些实施例中,R7还可以包括羟基亚烷基-(可选择地取代的杂芳基)、亚烷基-(可选择地取代的苯基)和羟基亚烷基-(可选择地取代的苯基)。
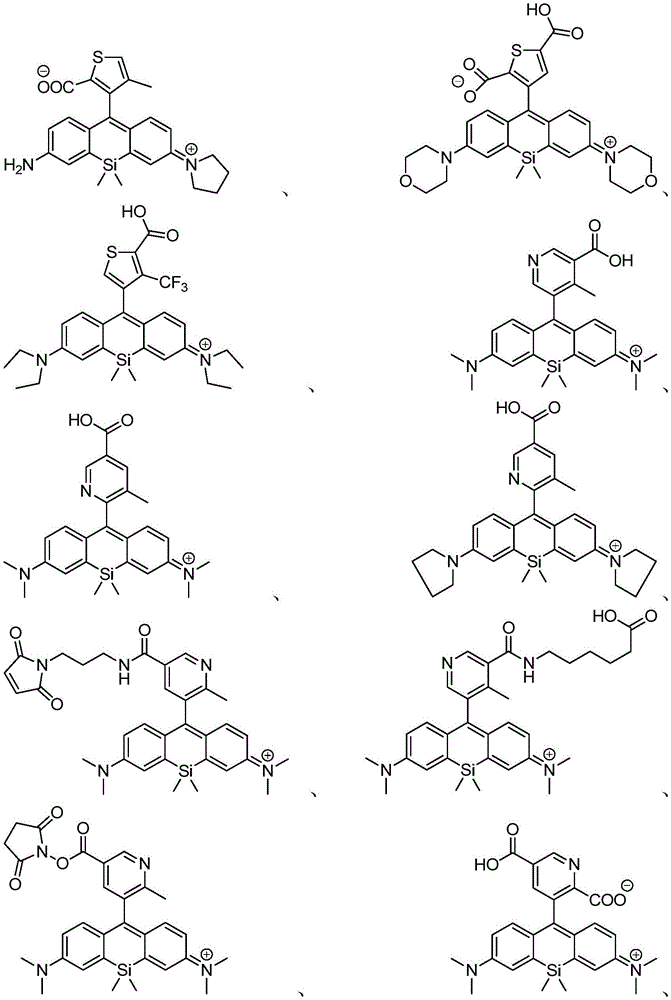
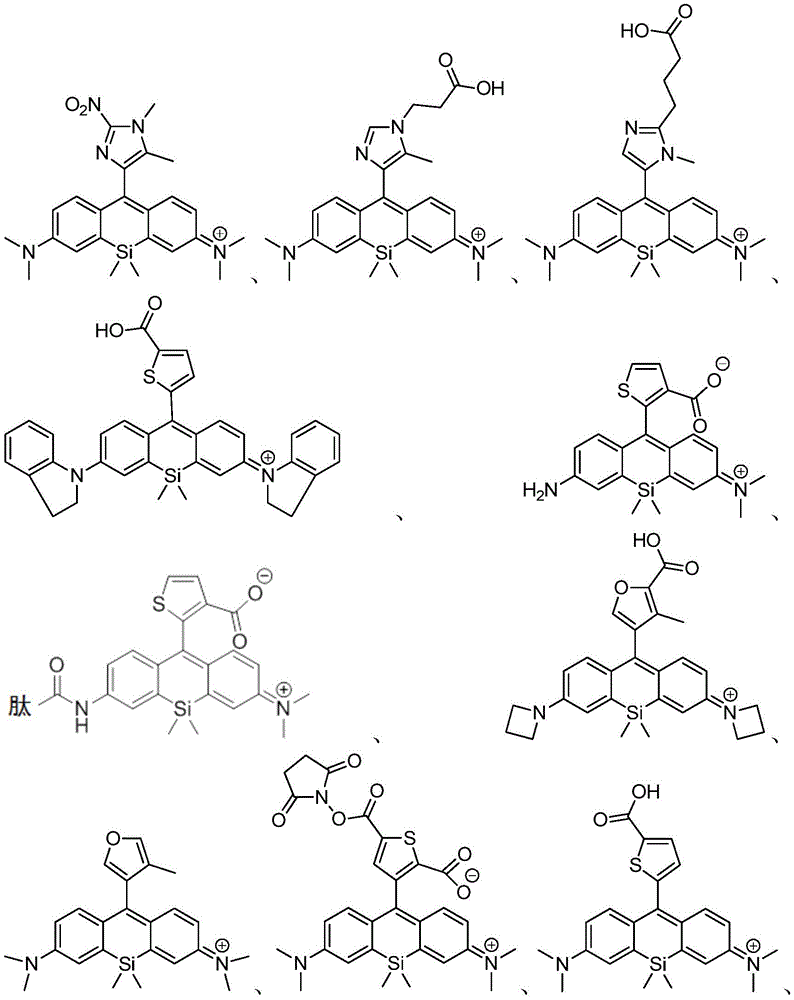
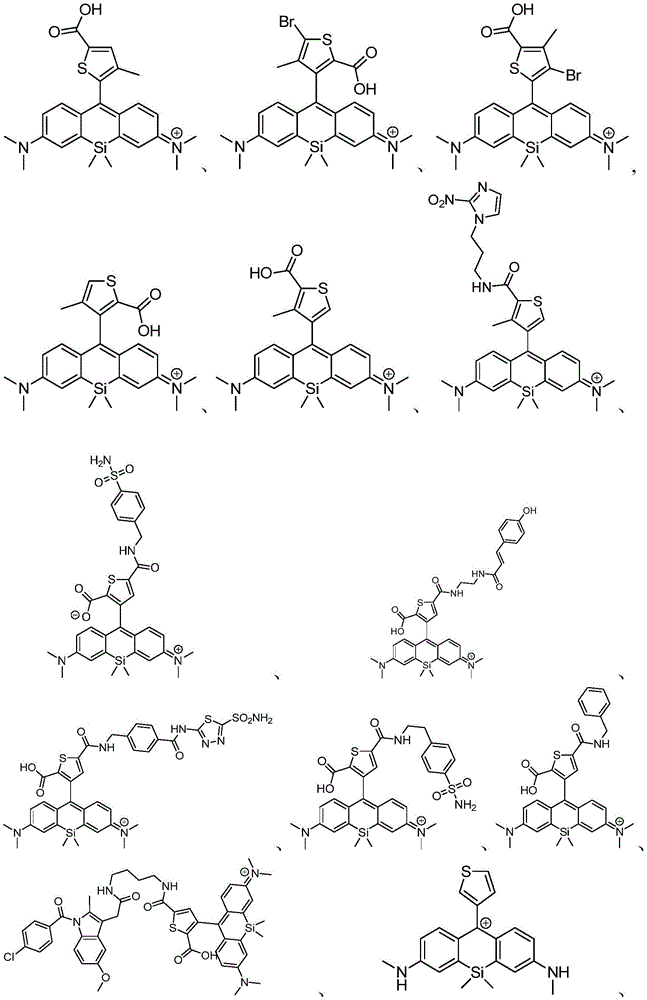
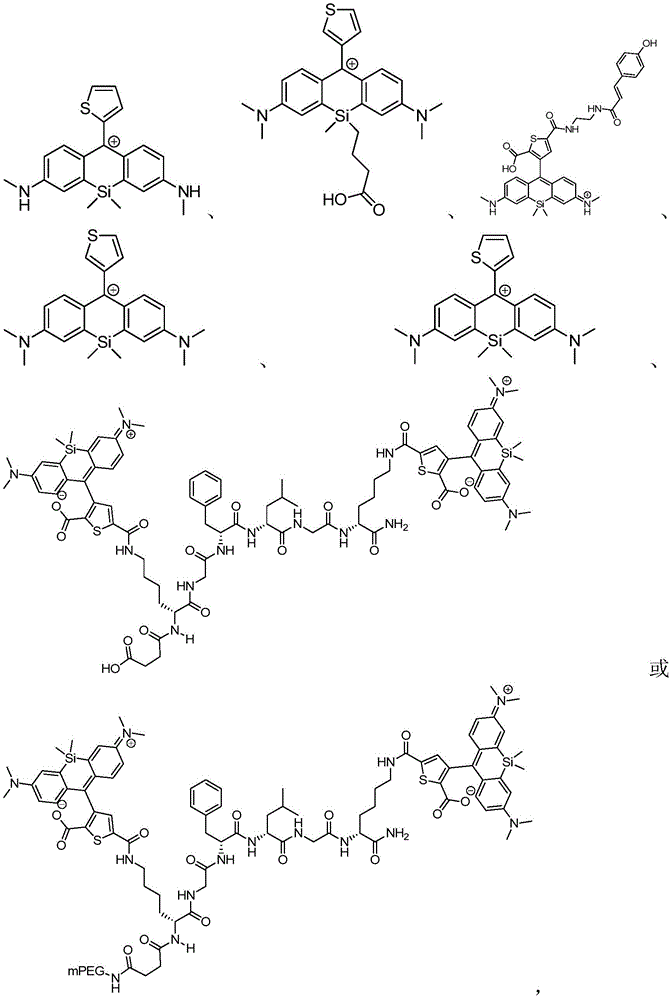
在某些实施例中,化合物是本文的表1或表2中给出的化合物或其药学上可接受的盐。
在某些实施例中,化合物具有在从约500nm至约1100nm范围内的吸收和发射波长。在某些实施例中,化合物具有在从约500nm至约600nm范围内的吸收和发射波长。
本发明的一个方面提供了一种由式I-A或其盐表示的化合物:
其中:
A1是苯基或五至六元杂环,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2、-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)、X1和亚烷基-X1所组成的组;
X1在每次出现时独立地表示马来酰亚胺、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯酚酯、氟代苯酚酯、叠氮、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R1和R2各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R1和R2与接附于它们的氮原子合并在一起形成单环状或双环状环;
R3和R4各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R3和R4与接附于它们的氮原子合并在一起形成单环状或双环状环;
R5在每次出现时独立地表示C1-6烷基;
R6在每次出现时独立地表示氢或烷基;
R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H、亚烷基-C(O)N(R6)2、亚烷基-(可选择地取代的杂环基)、可选择地取代的杂环基、亚烷基-(可选择地取代的杂芳基)、或者羟基亚烷基-(可选择地取代的杂环基);并且
R8在每次出现时独立地表示氢、烷基或芳基。
在某些实施例中,化合物还包含具有-1的电荷的平衡离子。示例性的具有-1的电荷的平衡离子包括例如卤素(如Cl-、Br-或I-)和RCO2 -,其中R是烷基、芳基和芳烷基等。
本发明的另一个方面提供了由下列通式表示的化合物:
W1-(SX)Ar-W2
其中SX表示3,6-二氨基-10-硅杂蒽阳离子核心(包含碳编号):
W1和W2独立地为不存在,或者包含连接至SX核心上的3-氨基取代基和6-氨基取代基的相同或不同的碳环或杂环基团,其中W1或W2的存在或缺失能够改变荧光染料的光学性质。Ar表示在SX核心的9位的取代的或未取代的芳基或杂芳基取代基,其中芳基或杂芳基基团的种类(nature)、取向和取代基能够改变SX核心的光学性质。
在本发明的一些实施例中,Ar由苯基、吡啶、呋喃、噻吩、咪唑、吡咯、噁唑、异噁唑、苯并噁唑、噻唑、异噻唑、苯并噻唑、嘧啶、哒嗪、三唑表示。在某些实施例中,Ar是未取代的噻吩,如在噻吩环的2或3位接附于核心。
在本发明的一些实施例中,W1或W2独立地为不存在,或者与SX的3-氨基取代基和6-氨基取代基一起形成由氮杂环丙烷、氮杂环丁烷、吡咯烷、吡唑烷、哌啶、哌嗪、噁唑烷、吗啉或硫代吗啉表示的杂环状环。
在一些实施例中,接附于SX核心的Si原子的取代基可以各自独立地选自可选择地带有官能团的C1-6烷基、酯、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯基酯、氟代苯基酯、炔烃、叠氮、酰肼、烷氧基胺、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺。例如,取代基可以各自独立地选自未取代的C1-6烷基(如CH3)和由羧基(CO2H)取代的C1-6烷基。
本发明的另一个方面提供了由下列通用结构及其盐表示的化合物:
其中:
L不存在或者是连接物组成部分,该连接物组成部分可选择地带有官能性基团或反应性基团,诸如羧酸盐、羧基烷基、马来酰亚胺、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸盐、-NH2、-OH、-SH、-SO3H、羧基、-COCl、-(CO)O(CO)R7、-CONHNH2、乙酰氧基甲酯、取代的和未取代的N-羟基琥珀酰亚胺基酯、取代的和未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基或氟或苯酚酯、叠氮、-NCS、-CHO、叠氮、-COCH2I、亚磷酰胺、邻苯二甲酰胺或马来酰亚胺,其中R7选自由H、烷基和芳基所组成的组;
BM是生物分子,其中荧光生物分子包含至少一个BM。
R1、R2、R3和R4独立地是H、甲基、乙基、烷基、或环烷基、芳基、取代的芳基、杂芳基、或杂环(如吗啉)、炔基、羧基烷基、氨基烷基、卤代烷基、叠氮基烷基、酰胺、氨基酸或肽;
R5不存在或是H、C1-20烷基、羧基、羧基烷基、磺酸盐、磺酰胺、卤素、羟基、氨基、酰胺、硝基、氰基、O-烷基、S-烷基、甲硅烷基、O-甲硅烷基、甲基、乙基、异丙基、羧基烷基、卤代烷基、烷基巯基、三氟甲基、酰肼;并且
W1和W2独立地不存在或者是包含脂肪族碳、氮、氧、硫或硅的、与R2和R3或R4和R5形成四元至九元环的环状基团,其可选择地进一步含有取代基。
X、Y和Z独立地是O、S、N、Si、C或(C=C)。
应该理解,X、Y和Z的每一个如果能够带有附加的取代基的话,可以带有附加的取代基包括但不限于H、C1-20烷基、卤素、硝基、O-烷基、S-烷基。
本发明的一个实施例包括恰好一个X、Y或Z,在X、Y或Z的其他两个是C的同时,该X、Y或Z为N、O或S原子,从而使接附于硅杂蒽阳离子核心的9-位的基团Ar表示吡咯基、噻吩基、呋喃基或带有附加的取代基的基团。在另一个实施例中,位于X、Y或Z的杂原子的位置改变所得到的荧光染料化合物的吸收和发射波长。在一个实施例中,杂原子的并入使荧光染料化合物的吸收和发射波长红移约5至35nm。在另一个实施例中,荧光染料化合物的吸收和发射波长红移约10至25nm。此类型的荧光染料化合物能够由下列式表示:
其中R1、R2、R3、R4、R5、L、W1、W2如本文中定义,并且R6是H、C1-20烷基、烷基芳基、芳基、烯基、炔基或L。
在另一个实施例中,与在Y或Z位置并入S并且其他两个位置为C相比,通过在X位置并入S并且其他两个位置为C,荧光染料化合物的波长红移约15-20nm。通过改变杂原子的位置而不改变染料的实验式在吸收中带来的这个出乎意料的变化,允许了本发明的荧光染料的荧光波长的调节,例如与检测滤镜组更好地匹配以及更容易地允许与非常类似的组合物的多个荧光团的多重化(multiplex)。
在另一个实施例中,恰好一个X、Y或Z是氮(N)原子(诸如N、O、S或Si),同时其他两个表示为一个C和一个(C=C),从而使接附于硅杂蒽阳离子核心的9-位的基团Ar表示吡啶基团。此类型的荧光染料化合物能够由下列式表示:
其中R1、R2、R3、R4、R5、L、W1、W2如本文中定义。
在其他实施例中,选择X、Y和Z使得硅杂蒽阳离子核心的9-位芳基基团为可选择地带有R5和L的噁唑、异噁唑、苯并噁唑、噻唑、异噻唑、苯并噻唑、嘧啶、哒嗪、三唑基团。
在其他实施例中,L包含选自由-NH2、-OH、-SH、-SO3H、羧基、-COCl、-(CO)O(CO)R7、-CONHNH2、乙酰氧基甲酯、取代的和未取代的N-羟基琥珀酰亚胺基酯、取代的和未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基或氟代或苯酚酯、叠氮、-NCS、-CHO、叠氮、-COCH2I、亚磷酰胺、邻苯二甲酰胺和马来酰亚胺所组成的组中的官能团,其中R7选自由H、烷基和芳基所组成的组。
在另一个实施例中,9-硅杂蒽阳离子核心的1、2、4、5、7或8位可以是被例如烷基、卤素、磺酸盐、硝基、氰基、O-烷基、S-烷基、氨基、羧酸、羧酸酯、酰胺、磺酰胺或羟基基团独立地取代的。
应该理解,W1和W2可以相同或不同。例如,R1-W1-R2和R3-W2-R4可以选自由下列组成的组:
其中R8是H、C1-C20烷基、烷基芳基、芳基、烯基、炔基并且L是可选择地带有诸如羧酸盐、羧基烷基、马来酰亚胺、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸盐的官能性基团或反应性基团的连接物组成部分,该连接物组成部分能够缀合至分子、生物分子、纳米颗粒等。在碳环或杂环状环上并入一个以上非氢取代基,能够用于调节所得染料的吸收和发射光谱。
一般来说,本发明的荧光染料化合物能够以4,4'-亚甲基双(3-溴苯胺)衍生物的形式合成。10-硅杂蒽(silaxanthene)的合成的一些实例在Fu et al.“A design conceptof long-wavelength fluorescent analogs of rhodamine dyes:replacement ofoxygen with silicon atom”,Chem.Comm.2008,1780-1782和Nagano,et al.“Evolutionof Group 14 Rhodamines as Platforms for Near-Infrared Fluorescence ProbesUtilizing Photoinduced Electron Transfer”,ACS Chem.Biol.2011,6,600-608中有描述。首先,例如1-(3-溴苯基)吡咯烷的N,N-二取代3-溴苯胺与甲醛缩合,以形成能够通过硅胶柱色谱法纯化的双-(3-溴苯胺)化合物。接下来,溴原子与丁基锂反应,随后以二氯二甲基硅烷处理以形成10-硅杂蒽核心。然后在三乙基碳酸氢铵的存在下,用过量氯醌氧化10-硅杂蒽以形成10-硅杂蒽酮(silaxanthone),该10-硅杂蒽酮能与诸如锂(2,5-二羧酸噻吩-3-基)锂的芳基锂试剂反应,该(2,5-二羧酸噻吩-3-基)锂可以通过将2,5-二羧酸噻吩与3当量的丁基锂反应而原位生成,随后通过酸后处理(workup)产生如下所述的取代的3,6-氨基-9-芳基-10-硅杂蒽阳离子荧光染料化合物:
在本发明的某些实施例中,硅杂蒽阳离子荧光染料化合物是非对称的。这样的非对称杂蒽阳离子化合物可以如下合成。例如N,N-二烯丙基-3-溴苯胺的一个N,N-二取代-3-溴苯胺,通过在含有ZnCl2的盐酸中加热,与一当量的例如3-甲基噻吩-2-甲醛的醛反应。第二个诸如N,N-二甲基-3-溴苯胺的N,N-二取代-3-溴苯胺的加成跟随第一缩合进行,以产生能够通过硅胶柱色谱法纯化的非对称双-(3-溴苯胺)中间体。然后该非对称中间体在-78℃下在THF中与丁基锂反应,随后进行二氯二甲基硅烷的加成和氯醌的氧化,以产生如下所述的非对称9-芳基-10-硅杂蒽阳离子荧光染料化合物。
在本发明的其他实施例中,非对称荧光染料化合物具有一个未取代的3,6-二氨基-10-硅杂蒽阳离子核心的氮取代基,即只带有氢。这样的非对称荧光染料化合物能够在诸如N,N'-二甲基巴比妥酸(NDMBA)的烯丙基清除剂的存在下,通过非对称N,N-二烯丙基-10-硅杂蒽荧光染料的钯催化脱烯丙基化合成。N,N-二烯丙基-10-硅杂蒽以与N,N-二烯丙基氧杂蒽阳离子荧光染料化合物相同的方式制备,但是最终使用氯醌的氧化步骤在烯丙基去保护之后进行,如下所述。
本发明的另一个方面,如果胺基取代基中的一个是具有能够由酶或例如Z-Leu-Arg的蛋白酶切割的氨基酸或肽序列的非荧光酰胺的形式,则非对称硅杂蒽阳离子是荧光的。使用诸如组织蛋白酶B、K、L、S或V的酶对非荧光酰胺的切割会释放出游离胺,其会造成荧光硅杂蒽阳离子荧光染料的释放。在其他胺基和杂蒽阳离子核心的9-位的例如3-甲基噻吩-2-基的取代基能够使激活的荧光染料化合物相对于在9-位不包含杂芳基基团的化合物红移。这样的荧光硅杂蒽阳离子探针的合成和酶激活描述如下:
在某些实施例中,化合物包含本文的表1中给出的化合物或其盐。应当理解,出于提供电中性组合物的需要,可以存在平衡离子(例如诸如Cl-的卤素)。例如,表1中图示出的化合物13显示+1的电荷,并且因此应该理解为存在诸如Cl-的平衡离子以提供电中性组合物。
表1
在某些优选的实施例中,化合物包含表2中给出的化合物或其盐。应当理解,出于提供电中性组合物的需要,可以存在平衡离子(例如诸如Cl-的卤素)。例如,表2中图示出的化合物65显示+1的电荷,并且因此应该理解为存在诸如Cl-的平衡离子以提供电中性组合物。
表2
本发明的另一个方面提供了一种缀合化合物,该缀合化合物通过生物分子与本文中描述的化合物诸如式I的化合物反应而形成。
本发明的另一个方面提供了一种缀合化合物,该缀合化合物是由-L-BM定义的1个、2个或3个基团取代式I的化合物;其中L是键或连接物,-BM是生物分子的自由基,并且式I由以下或其盐表示:
其中:
A1是苯基或五至六元杂芳基,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2、-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)、X1和亚烷基-X1所组成的组;
X1在每次出现时独立地表示马来酰亚胺、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯酚酯、氟代苯酚酯、叠氮、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R1和R2各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R1和R2与接附于它们的氮原子合并在一起形成单环状或双环状环;
R3和R4各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R3和R4与接附于它们的氮原子合并在一起形成单环状或双环状环;
R5在每次出现时独立地表示C1-6烷基;
R6在每次出现时独立地表示氢或烷基;
R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H、亚烷基-C(O)N(R6)2、亚烷基-(可选择地取代的杂环基)、可选择地取代的杂环基、亚烷基-(可选择地取代的杂芳基)、或者羟基亚烷基-(可选择地取代的杂环基);
R8在每次出现时独立地表示氢、烷基或芳基。
在一些实施例中,在式(I)中描述的可变量能够如下定义:
A1是苯基或五至六元杂环,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基独立地选自由烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2、-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)、X1和亚烷基-X1所组成的组;
X1在每次出现时独立地表示酯、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯基酯、氟代苯基酯、炔烃、叠氮、酰肼、烷氧基胺、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R1和R2各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R1和R2与接附于它们的氮原子合并在一起形成单环状或双环状环;
R3和R4各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R3和R4与接附于它们的氮原子合并在一起形成单环状或双环状环;
R5在每次出现时独立地表示可选择地带有官能团的C1-6烷基、酯、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯基酯、氟代苯基酯、炔烃、叠氮、酰肼、烷氧基胺、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R6在每次出现时独立地表示氢或烷基;
R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H、亚烷基-C(O)N(R6)2、亚烷基-(可选择地取代的杂环基)、可选择地取代的杂环基、亚烷基-(可选择地取代的杂芳基)、或者羟基亚烷基-(可选择地取代的杂环基);并且
R8在每次出现时独立地表示氢、烷基或芳基。
在某些实施例中,化合物还包含具有-1的电荷的平衡离子。示例性的具有-1的电荷的平衡离子包括例如卤素(如Cl-、Br-或I-)和RCO2 -,其中R是烷基、芳基和芳烷基等。
在某些实施例中,R1和R2各自独立地表示氢或烷基;或者R1和R2与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环。
在某些实施例中,R3和R4各自独立地表示氢或烷基;或者R3和R4与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环。
在某些实施例中,R5是甲基。在某些实施例中,R6是氢。在某些实施例中,R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H或者亚烷基-C(O)N(R6)2。
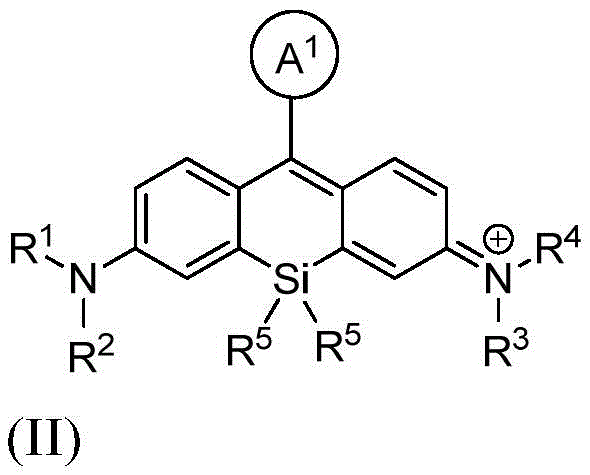
本发明的另一个方面提供了一种由式II或其盐表示的缀合物化合物:
其中:
A1是苯基或五至六元杂环,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基选自由-C(O)-ψ、-C(O)N(R6)-ψ、亚烷基-C(O)-ψ、亚烷基-C(O)N(R6)-ψ、-N(R6)C(O)-ψ、亚烷基-C(O)-ψ、亚烷基-N(R6)C(O)-ψ、烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2和-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)所组成的组;
ψ是生物分子的自由基;
R1和R2各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R1和R2与接附于它们的氮原子合并在一起形成单环状或双环状环;
R3和R4各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R3和R4与接附于它们的氮原子合并在一起形成单环状或双环状环;
R5在每次出现时独立地表示C1-6烷基;
R6在每次出现时独立地表示氢或烷基;以及
R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H、亚烷基-C(O)N(R6)2、亚烷基-(可选择地取代的杂环基)、可选择地取代的杂环基、亚烷基-(可选择地取代的杂芳基)、或者羟基亚烷基-(可选择地取代的杂环基)。
在一些实施例中,在式(II)中描述的可变量能够如下定义:
A1是苯基或五至六元杂芳基,其中每个是可选择地由1个、2个或3个取代基取代的,所述取代基选自由-C(O)-ψ、-C(O)N(R6)-ψ、亚烷基-C(O)-ψ、亚烷基-C(O)N(R6)-ψ、-N(R6)C(O)-ψ、亚烷基-C(O)-ψ、亚烷基-N(R6)C(O)-ψ、烷基、卤代烷基、卤素、羟基、烷氧基、-CO2H、-CO2 -、-CO2-(可选择地取代的杂环烷基)、-C(O)N(R6)(R7)、-N(R6)C(O)(R7)、亚烷基-(可选择地取代的杂环基)、硝基、亚烷基-O-亚烷基-CO2H、亚烷基-O-亚烷基-CO2 -、-SO2-N(R6)-亚烷基-CO2H、-SO2-N(R6)-亚烷基-CO2 -、-N(R6)-SO2-亚烷基-CO2H、-N(R6)-SO2-亚烷基-CO2 -、-SO2-N(R6)-(可选择地取代的杂环烷基)、-SO2-N(R6)2和-SO2-N(R6)-亚烷基-(可选择地取代的杂环基)所组成的组;
ψ是生物分子的自由基;
R1和R2各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R1和R2与接附于它们的氮原子合并在一起形成单环状或双环状环;
R3和R4各自独立地表示氢、烷基、环烷基、杂环烷基、或者-C(O)N(R6)(可选择地取代的烷基);或者R3和R4与接附于它们的氮原子合并在一起形成单环状或双环状环;
R5在每次出现时独立地表示可选择地带有官能团的C1-6烷基、酯、琥珀酰亚胺基酯、羧胺、炔丙基、叠氮基烷基、异硫氰酸酯、-NH2、-OH、-SH、-SO3H、羧基、-C(O)Cl、-(CO)O(CO)R8、-CON(H)NH2、乙酰氧基甲基酯、取代的或未取代的N-羟基琥珀酰亚胺基酯、取代的或未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基苯基酯、氟代苯基酯、炔烃、叠氮、酰肼、烷氧基胺、-NCS、-CHO、-COCH2I、亚磷酰胺、邻苯二甲酰胺、或者马来酰亚胺;
R6在每次出现时独立地表示氢或烷基;以及
R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H、亚烷基-C(O)N(R6)2、亚烷基-(可选择地取代的杂环基)、可选择地取代的杂环基、亚烷基-(可选择地取代的杂芳基)、或者羟基亚烷基-(可选择地取代的杂环基)。
在某些实施例中,化合物还包含具有-1的电荷的平衡离子。示例性的具有-1的电荷的平衡离子包括例如卤素(如Cl-、Br-或I-)和RCO2 -,其中R是烷基、芳基和芳烷基等。
在某些实施例中,R1和R2各自独立地表示氢或烷基;或者R1和R2与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环。
在某些实施例中,R3和R4各自独立地表示氢或烷基;或者R3和R4与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环。
在某些实施例中,R5是甲基。在某些实施例中,R6是氢。在某些实施例中,R7在每次出现时独立地表示氢、烷基、亚烷基-CO2H或者亚烷基-C(O)N(R6)2。
在某些实施例中,生物分子是多肽、核酸或细胞。
本发明的另一个方面包含肽、蛋白质或具有蛋白水解的或酶解的剪切键的肽、蛋白质或其他生物分子,并且两个以上本发明的荧光染料化合物化学连接至该肽、蛋白质或生物分子,从而显著地淬灭它们的荧光。当酶的通过例如酶解切割肽、蛋白质或生物分子的剪切键的动作进行时,荧光染料化合物被分离,并且药剂试剂在由适当波长和频率的电磁辐射激活时发射荧光信号。在本文中使用的术语“淬灭的”应该理解为意指部分或完全降低来自荧光团的荧光信号的过程。例如,来自本发明的荧光染料化合物的荧光信号能够通过极为贴近第一荧光染料地放置第二荧光染料或者通过极为贴近第一荧光团地放置如淬灭剂的非荧光淬灭发色团分子,被分子间地或分子内地降低。药剂试剂通过例如肽、蛋白质或生物分子的蛋白水解的或酶解的剪切键的酶解切割而去淬灭(或激活)。在一些实施例中,一个以上本发明的荧光染料化合物通过接附于3,6-二氨基-10-硅杂蒽阳离子核心的9-位的环状组成部分(如式(I)或(II)中的A1)连接至生物分子(如肽)。参见如文本中描述的化合物90-93。
在某些实施例中,本发明的荧光染料化合物可以具有非常低的固有荧光(量子产率),但是保持在电磁光谱的远红至NIR区域的高吸收。意欲包含的是,这样的荧光染料化合物可以在极为贴近另一个在邻近吸收波长的波长处发射荧光的荧光化合物时用作淬灭剂化合物。例如,如果荧光化合物和淬灭剂化合物由肽、蛋白质或生物分子的酶解剪切键分隔开,所述剪切键被特定酶或蛋白酶识别并切割,这样的包含本发明的一个荧光化合物和补充的具有低固有荧光的淬灭剂化合物的化合物可以被激活。还意欲包含的是,分子内淬灭的荧光染料和本发明的淬灭剂化合物也可以通过诸如借助或不借助酶的氧化或还原的化学方式激活。
在某些实施例中,本发明的化合物能够通过L化学连接至生物学分子或生物分子(BM)。例如由于生物分子与目标之间的相互作用,例如通过受体-配体相互作用、酶-底物相互作用或抗体-抗原相互作用等,所得荧光染料-生物分子缀合体可以具有与目标的高结合亲和性。通式[W1-(SX)Ar-W2]-L-BM这样的化学连接的化合物可以由以下表示:
其中,R1、R2、R3、R4、R5、L、W1、W2、X、Y和Z如本文中定义,并且BM是生物分子。前述结构是示例性的,并且应该理解,生物分子(BM)能够通过任意一个以上鉴定为R1、R2、R3、R4、R5、L、W1、W2、X、Y和Z的基团,直接地化学连接或通过连接物L化学连接至这样的化合物。
本发明的另一个实施例是9-噻吩基-3,6-二氨基-10-硅杂蒽阳离子或其盐,其在两个氨基基团(诸如甲基、乙基或羧基基团)和噻吩基基团(诸如甲基和羧酸盐)上具有可选择的取代基。硅原子在10位的并入造成相对于10-氧杂氧杂蒽(oxaxanthene)染料的大约100nm的红移,并且在9位的取代基以及3-和6-氨基基团能够通过移动吸收或发射波长或通过增加量子产率来进一步改善染料的光学性质。取代基的各种组合能够用于为特定目的(如为匹配显微镜的滤镜组或为增加总体亮度)“调节”染料的性质。另外,能够例如通过连接至噻吩基基团,向染料并入用于连接至目标配体或生物分子的功能性柄(handle)。已经合成的第一类染料中的两个代表性分子是3,6-双-(二甲基氨基)-9-(3-甲基-5-羧基-噻吩-2-基)-10,10-二甲基-10-硅杂蒽-9-阳离子和3,6-双-(二乙基氨基)-9-(2-羧基-3-甲基-噻吩-4-基)-10,10-二甲基-10-硅杂蒽阳离子或其盐。此类分子的意想不到的发现是噻吩基基团在杂蒽阳离子核心的接附位置对于最大吸收波长具有剧烈的影响。例如,当噻吩基基团以噻吩基基团的2位或5位接附至杂蒽阳离子核心时,最大吸收的波长相对于以3位或4位接附,红移了20-25nm。其他取代基也对光学性质有影响,例如接近硅杂蒽阳离子核心的甲基取代基给量子产率带来8倍的增加。已经合成了一系列的六个9-噻吩基-10-硅杂蒽阳离子染料,显示了光学性质的区别。
本发明的一个实施例包含在3位和6位的氨基上具有碳环、杂环或双环取代基以形成例如氮杂环丙烷、氮杂环丁烷、吡咯烷、吡唑烷、哌啶、哌嗪、噁唑烷、吗啉或硫代吗啉的9-取代-3,6-二氨基-10-硅杂蒽-9-阳离子核心。这样的环状取代基能够改变染料的光学性质或溶解度性质。例如,环状吡咯基团给染料带来比仅带有一个甲基取代基的等同染料更高的量子产率。关于另一个实例,在包括水的一些溶剂中的溶解度性质由吗啉取代基增强。环状氨基取代基也可以是稠合至第二环或通过硅杂蒽阳离子的2、4、5或7位稠合至染料的硅杂蒽阳离子核心的多环。多环状构造可以改变染料性质,诸如吸收和发射波长及量子产率。染料相对于3位和6位的氮上的环状基团可以是对称的或非对称的,或者一个氮可以不具有环状基团。已经合成的示例性的N-环状硅杂蒽阳离子荧光染料化合物是3,6-双-(吡咯烷-1-基)-9-(2-甲基-4-羧基苯基)-10,10-二甲基-10-硅杂蒽-9-阳离子及其盐,和3,6-双-(吡咯烷-1-基)-9-(3-甲基-5-羧基-噻吩-2-基)-10,10-二甲基-10-硅杂蒽-9-阳离子及其盐。
本发明还提供了合成关键中间体(10-硅杂蒽酮)的方法,该方法通过去除困难的纯化步骤和减少文献中使用的合成氧杂蒽酮的反应时间,大大提高了产率和时间。该新的流程允许了从双-3-溴苯胺直接合成10-硅杂蒽酮,而不需要分离派若宁(pyronine)中间体。
在本发明的另一个方面,如果胺基取代基中的一个能够具有例如酶切割的氨基酸或肽序列的非荧光酰胺的形式,则也可以使化合物成为荧光的。非荧光酰胺的切割会释放能成为荧光的游离氨基。为保证激活的荧光团向远红/NIR区域(大于约635nm)的红移,选择了位于其他氨基和在杂蒽阳离子核心的9-位的取代基。
在本发明的某些实施例中,荧光染料化合物或其缀合体是细胞膜高度可通透的。在其他实施例中,由流式细胞术量化,化合物或缀合体比吸收和发射可比较的波长的常用吲哚菁染料十倍、百倍或千倍地更可通透。在其他实施例中,荧光染料化合物或其缀合体是能够在诸如线粒体或细胞核的细胞内的特定区域定位的,并且能够通过荧光显微术成像。在其他实施例中,荧光染料化合物或其缀合体结合于特定细胞内标志物、受体或蛋白质。在其他实施例中,化合物或缀合物向细胞内标志物、受体或蛋白质的成像结合是例如癌症或缺氧的细胞的疾病或状态的指示。在其他实施例中,本发明的荧光染料化合物能够用于在体外或体内直接标记细胞,或者通过共价或非共价接附至目标配体、小分子、药物、酶抑制剂、生物分子、肽、碳水化合物、蛋白质、抗体、胶束或纳米颗粒来修饰并且用于标记成像蛋白质、受体、细胞、组织或用于活体动物中。另外,出于成像的目的,本发明能够与许多现有荧光成像装置一起使用,包括但不限于诸如IVIS或FMT的体内成像设备、荧光显微镜、流式细胞计数器和细胞分类器、以及荧光读板仪。
在本发明的一些方面,本发明的荧光染料化合物是P-糖蛋白(P-gp)的底物。在其他方面,化合物用于在活体细胞中体外评估P-gp活性。在其他方面,化合物用于在活体细胞中评估P-gp活性被诸如药物的其它分子的抑制。在其他方面,化合物用于在活体动物中成像P-gp抑制,例如通过在抑制剂或可以与P-gp相互作用的药物的存在或缺失下,成像化合物在诸如小鼠或大鼠的动物的脑中的积累。P-gp在血脑屏障的抑制会导致为P-gp底物的荧光染料化合物在脑中的更高的积累。可以通过荧光分子断层扫描术(FMT)成像,检测和量化脑积累的改变。
在本发明的另一个方面,荧光染料化合物化学连接至诸如磺酰胺的分子,该磺酰胺例如结合于诸如碳酸酐酶II的细胞内酶或蛋白质、或者结合于诸如碳酸酐酶IX的分子外或膜结合酶或蛋白质的苯磺酰胺或乙酰唑胺。在本发明的另一个方面,荧光染料化合物化学连接至例如吲哚美辛(indomethacin)的药物。在本发明的另一个方面,连接有药物的荧光染料化合物用于成像诸如环氧酶-2(COX-2)的药物目标。在本发明的进一步方面,成像的药物目标是细胞内的。在一些方面,目标的荧光染料化合物能够用于成像特定的分子结构或区域,诸如细胞核、细胞质、线粒体、细胞膜、核周区域、溶酶体或其他结构,尤其是但不限于诸如显微术、超分辨率显微术、共聚焦显微术或成像流式细胞术的应用。在其他方面,诸如细胞核、线粒体、细胞膜、溶酶体、受体或诸如碳酸酐酶或环氧酶-2的酶、DNA、RNA或其他结构的特定细胞内蛋白质、目标、结构或生物标志物的靶向,是作为整体的细胞的荧光标记,用于体外或体内的显微术、流式细胞术、细胞计数、细胞分选或细胞示踪的应用。
与它们的细胞可通透性和用于缀合至目标配体、肽、蛋白质、抗体或其他生物分子的柄相接合,本发明的荧光染料化合物提供了使用传统的红至近红外染料难以达到的细胞内目标的体内成像。在本发明的一些方面,荧光染料化合物的整体分子量低,取决于取代基,从约400至约750Da,并且优选为从400至600Da。相对于诸如吲哚菁染料的其他近红外荧光染料的更小的尺寸,由于对于生物分子的自然功能有着更少的位阻影响,其对于诸如肽、蛋白质、碳水化合物、核酸或抗体的生物分子的标记有着显著的优势,允许了更好的成像剂。
W1、W2、SX和/或Ar可选择地可以包括能够形成共价键和/或与生物分子的化学键的连接物组成部分。这样的连接物组成部分可以包括能够与不同化合物上的官能团化学反应以形成共价键的反应性基团,或者能够与不同化合物上的反应性基团化学反应以形成共价键的官能团。这样的反应性基团可以包括,例如亲电子试剂和亲核试剂,其能够通过暴露于对应的官能团来形成共价键,该对应的官能团分别为亲核试剂和亲电子试剂。可任选地,反应性基团是光活化基团,并且仅在用适宜波长的光照射后成为化学活化的。本发明的化合物和要连接的生物分子之间的反应能够使得反应性基团的一个以上原子合并至新的连接键中,该新的连接键将本发明的化合物接附于缀合物质。
本文中意欲包含的生物分子包括但不限于蛋白质(例如酶、激素、抗体和其抗原结合片段、以及单链抗体)、肽、氨基酸、糖蛋白、细胞受体的配体、多糖、碳水化合物、核酸(例如DNA和RNA)、核苷、核苷酸、核酸适体、肽基核酸、细胞受体、酶底物、酶辅助因子、生物素、激素、神经递质、生长因子、细胞因子、淋巴因子、凝集素、选择素、脂质、脂质聚集体(例如胶束或囊泡)和毒素。能够使用其他生物分子,诸如参与靶向和递送的那些生物分子,诸如叶酸介导靶向(Leamon和Low,Drug Discovery Today,6:44-51,2001)、转铁蛋白、维生素、碳水化合物和靶向内化受体的配体,包括但不限于去唾液酸蛋白受体、生长激素抑制素、神经生长因子、催产素、铃蟾素、降血钙素、抗利尿激素、血管紧张素II、心房利尿钠肽、胰岛素、胰高血糖素、催乳素、促性腺激素、各种阿片类和尿激酶型纤溶酶原激活因子。意欲包含的还有膜、跨膜和核易位信号序列,其能够衍生自包括但不限于病毒和细菌的多种来源。生物分子也可以包括有机分子、聚合物、树形分子、细胞(例如哺乳动物细胞、非哺乳动物细胞、植物细胞、昆虫细胞、胚胎细胞)、细菌、噬菌体、病毒、微生物、颗粒、微粒或纳米颗粒。生物分子也可以包括治疗药物分子,包括但不限于光疗分子或化疗分子。生物分子的其他实例包括但不限于连接至接附于化合物67-83、87和90-93的3,6-二氨基-10-硅杂蒽阳离子核心的9-位(如式(I)或(II)中的A1)的环的组成部分。
本发明的荧光染料化合物能够用于构建一种以上下列类型的成像剂或探针:分子探针、可激活探针、酶激活探针、基于量子点的成像探针、基于纳米粒子的成像探针、靶向生物分子的探针、波长位移信标、多色探针、具有与目标的高结合亲和性的探针、非特异性成像探针、基于细胞的探针、双模态试剂、光学/CT双模态试剂(如物理或化学结合于CT试剂的光学试剂)、光学/MR双模态试剂(如物理或化学结合于MR试剂的光学试剂)、光学/原子核双模态试剂(如物理或化学结合于放射性原子或与放射性原子在一起的光学试剂)和/或其任意组合。
包括化学连接的生物分子的本发明的化合物与未化学连接至生物分子的化合物相比,可以具有增强的荧光。在某些实施方式中,与未连接的化合物相比,荧光增强了约10%、约25%或约50%。化学连接至本发明的化合物的生物分子可以在体内、离体和/或体外改变或增强分子的积累、生物分布、排除(elimination)、靶向、结合和/或识别。
一个以上的生物分子可以通过多价键或包含多个反应性官能团的连接物化学连接至荧光染料,以形成结构(SX)-((L)v(BM)r)t的生物相容的荧光分子,其中L是连接物或间隔物(spacer)或多价间隔物或连接物,BM是生物分子,SX如前文定义,并且t=1-6,v=1-500以及r=1-500。当v大于1时,(L)v表示多个相同的连接物或不同连接物的组合。
本发明的化合物的适当的连接物组成部分的实例在先前的文献中已有描述(参见,美国专利申请2002/0064794(2002);美国专利号6,086,737;美国专利号6,048,982;美国专利号6,747,159;以及美国专利号6,448,008)。
应该理解,多于一个本发明的荧光染料化合物能够化学连接至单一生物分子。这样的结构的实例可以表示为:SXu-BM,其中u=1-500,并且SX和BM如以上定义。
也意欲包括公开的化合物的盐,并且包括碱和酸加成的盐两者。本发明的化合物可以具有一个以上酸性足够的质子,其能够与合适的有机或无机碱反应以形成碱加成的盐。碱加成的盐包括衍生自无机碱的盐,诸如铵或碱金属或碱土金属氢氧化物、碳酸盐、碳酸氢盐等,以及衍生自有机碱的盐,诸如醇盐、烷基酰胺、烷基和芳基胺等。因此,用于制备本发明的盐的碱包括氢氧化钠、氢氧化钾、氢氧化铵、碳酸钾等。
本发明的化合物具有碱性足够的基团,诸如能够与有机或无机酸反应以形成酸加成的盐的胺基。通常采用的将含有碱性基团的化合物形成酸加成盐的酸是无机酸,诸如盐酸、氢溴酸、氢碘酸、硫酸、磷酸等,以及有机酸,诸如对甲基苯磺酸、甲磺酸、草酸、对溴代苯磺酸、碳酸、琥珀酸、柠檬酸、苯甲酸、乙酸等。这样的盐的实例包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、乙酸盐、丙酸盐、癸酸盐、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、己酸盐、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、丁炔-1,4-二酸盐、己炔-1,6-二酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、磺酸盐、二甲苯磺酸盐、苯乙酸盐、苯丙酸盐、苯丁酸盐、柠檬酸盐、乳酸盐、γ-羟基丁酸盐、乙醇酸盐、酒石酸盐、甲磺酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、扁桃酸盐等。
在其他实施方式中,T1选自由-NH2、-OH、-SH、-SO3H、羧基、-COCl、-(CO)O(CO)R13、-CONHNH2、取代的和未取代的N-羟基琥珀酰亚胺基酯、取代的和未取代的N-羟基磺酸琥珀酰亚胺基酯、硝基或氟代苯酚酯、叠氮、-NCS、-CHO、叠氮、-COCH2I、亚磷酰胺、邻苯二甲酰胺和马来酰亚胺所组成的组,其中R13选自由H、烷基和芳基所组成的组。
当本发明的化合物在本文中通过指示SX环和胺基取代基中双键位置的结构图示时,应该理解,该结构也包含任意的共振结构,例如,如下图所示:
其中,在每个上述结构中,关于SX核心的取代基如本文中定义。
在另一个方面,本发明提供了下列结构通式的化合物:
其中R1、R2、R3、R4、W1和W2如以上定义。
在某些实施例中,W1和W2独立地不存在或者选自包含脂肪族碳、氮、氧、硫或硅的与R1和R2或R3和R4一起形成三元至九元环的基团,其可选择地在环状环上进一步含有取代基。
本发明的另一个方面提供了下列化合物:
化合物能够用生物分子或细胞如下标记。带有如本文中描述的反应性官能团的本发明的化合物(荧光染料)与一种以上各种浓度的生物分子在从约4℃至约37℃的温度下培养从约5分钟至24小时以上。在培养之后,可以使用本领域技术人员已知的方法,诸如例如色谱法或超滤法,去除游离的荧光染料或未化学连接至生物分子的荧光染料。
在培养之后,可以离心细胞从而生成上清液从其中除去的细胞聚合体。可以在培养基或生理盐水中重新悬浮细胞,从而洗脱残留物、未结合的或游离的荧光染料。可以重复数次。以此方式,可以通过直接缀合至内部或外部细胞分子,或者通过向各种细胞内结构的非特异性细胞摄取来标记细胞,各种细胞内结构包括但不限于胞质液、胞内体、细胞核、高尔基体和其他细胞内的细胞器。
公开的化合物和/或组合物可以包装成试剂盒,该试剂盒可以可选择的包括使用化合物的说明书。非限定性实施例包括:包含例如用于体内和/或体外应用的粉末或冻干形式的组合物以及包括重构的说明、剂量信息和储存信息的使用说明的试剂盒。试剂盒可以可选择的包含处于即可使用的液体形式的组合物、或者需要进一步与溶液混合以给予的组合物的容器,诸如用于重构粉末形式的药水瓶、用于注射的注射器、定制IV递送系统、吸入器等。这样的容器可以包含单个或多个对象剂量。另外,试剂盒可以包含辅助组合物的体内或体外检测的组件,例如专用内窥镜、滤光器。
本文中公开的包括那些化学连接至生物分子的化合物能够制剂成适宜向例如动物或人类对象的对象给予的药物组合物。因此,剂型包括化合物与适于所需的给予形式和/或剂量的生理上可接受的载体。生理上可接受的载体可以包括水、盐水,并且还可以包括诸如缓冲剂的药剂试剂,以及其他药剂试剂,诸如用于药物剂型中的相容的防腐剂。优选的载体是流体,优选为液体,更优选为水性溶液;然而,固体剂型、局部剂型、吸入剂型、眼用剂型和经皮剂型的载体也意欲包含在本发明的范围中。
另外,药物组合物可以在生理上可接受的载体中包括一种以上稳定剂。适合用于这样的组合物中的稳定剂的实例包括例如低分子量碳水化合物,例如诸如山梨醇的直线型多元醇,以及甘油。也可以使用其他低分子量碳水化合物,诸如肌醇。
希望的是,本发明的化合物能够口服或非肠道给予。对于非肠道给予,化合物可以静脉内给予、肌肉内给予、皮肤给予、经皮给予、皮下给予、直肠给予、鼻部给予、阴道给予及眼部给予。因此,化合物可以处于如固体片剂、胶囊、丸剂、包括冻干粉的粉末、胶体悬浮剂、微球、脂质体颗粒、悬浮剂、乳化剂、溶剂、包括水凝胶的凝胶、糊剂、药膏、乳膏、硬膏、灌洗液、灌服剂、渗透递送装置、栓剂、灌肠剂、注射剂、植入物、喷剂或气雾剂。药物组合物可以根据传统药学实践来制剂(参见,例如Remington:The Science and Practice ofPharmacy,20th edition,2000,ed.A.R.Germaro,Lippincott Williams&Wilkins,Philadelphia,以及Encyclopedia of Pharmaceutical Technology,eds.J.Swarbrickand J.C.Boylan,1988-1999,Marcel Dekker,New York)。
III.本发明的荧光染料化合物的应用
本发明的化合物可以用于各种体内和体外应用。这些应用在以下部分中讨论。
(a)体内应用
本发明提供了新颖的荧光化合物,该荧光化合物可以用于各种成像应用,例如光学成像应用。关于光学成像技术的综述,参见如Alfano et al.,Ann.NY Acad.Sci.820:248-270,1997;Weissleder,Nature Biotechnology 19,316-317(2001);Ntziachristoset al.,Eur.Radiol.13:195-208(2003);Graves et al.,Curr.Mol.Med.4:419-430(2004);Citrin et al.,Expert Rev.Anticancer Ther.4:857-864(2004);Ntziachristos,Ann.Rev.Biomed.Eng.8:1-33(2006);Koo et al.,Cell Oncol.28:127-139(2006);以及Rao et al.,Curr.Opin.Biotechnol.18:17-25(2007)。
本发明的实践中有用的成像系统通常包括三个基本组件:(1)用于激发本发明的荧光染料化合物的合适的光源,(2)用于从用于诱导荧光染料激发的光分离或区分发射的光的系统,以及(3)检测系统。此检测系统可以是手持的或者整合于其他有用的成像仪器,诸如内窥镜、导管、术中显微镜和/或观察镜。
优选地,光源提供单色(或大体上单色)光。光源可以是适当过滤的白光,即源自宽带光源的带通光。例如,源自150瓦卤素灯的光可以穿过适合的带通滤光器,该带通滤光器是可从Omega Optical(Brattleboro,VT)商购的。取决于系统,光源可以是激光。参见,如Boas et al.,Proc.Natl.Acad.Sci.USA 91:4887-4891,1994;Ntziachristos et al.,Proc.Natl.Acad.Sci.USA 97:2767-2772,2000;以及Alexander,J.Clin.LaserMed.Surg.9:416-418,1991。可以在例如在Imaging Diagnostic Systems,Inc.,Plantation,FL以及各种其他来源找到用于成像的激光的信息。高通或带通滤光器可以用于从激发光分离光学发射。适合的高通或带通滤光器是可从Omega Optical,Burlington,VT商购的。
一般来说,光检测系统可以视为包括光采集/图像形成组件和光检测/图像记录组件。尽管光检查系统可以是整合了两个组件的单一集成设备,但是单独讨论光采集/图像形成组件和光检测/图像记录组件。
一个特别有用的光采集/图像形成组件是内窥镜。可以在本发明的实践中应用已经用于多组织和器官的体内光学成像的内窥镜设备和技术,所述多组织和器官包括腹膜(Gahlen et al.,J.Photochem.Photobiol.B 52:131-135,1999)、卵巢癌(Major et al.,Gynecol.Oncol.66:122-132,1997)、结肠和直肠(Mycek et al.,Gastrointest.Endosc.48:390-394,1998;和Stepp et al.,Endoscopy 30:379-386,1998)、胆管(Izuishi et al.,Hepatogastroenterology 46:804-807,1999)、胃(Abe etal.,Endoscopy32:281-286,2000)、膀胱(Kriegmair et al.,Urol.Int.63:27-31,1999;和Riedl et al.,J.Endourol.13:755-759,1999)、肺(Hirsch et al.,Clin Cancer Res 7:5-220,2001)、脑(Ward,J.Laser Appl.10:224-228,1998)、食道、以及头颈区域。
其他类型的光采集组件是基于导管的装置,包括光纤设备。这样的设备特别适合于血管内成像。参见,例如Tearney et al.,Science 276:2037-2039,1997;和Circulation94:3013,1996。
还有其他成像技术能够与本发明的荧光染料化合物共同使用,包括相控阵技术(Boas et al.,Proc.Natl.Acad.Sci.USA 91:4887-4891,1994;Chance,Ann.NYAcad.Sci.838:29-45,1998)、光学断层扫描术(Cheng et al.,Optics Express 3:118-123,1998;和Siegel et al.,Optics Express 4:287-298,1999)、活体显微术(Dellian etal.,Br.J.Cancer82:1513-1518,2000;Monsky et al,Cancer Res.59:4129-4135,1999;和Fukumura et al.,Cell 94:715-725,1998)、共聚焦成像(Korlach et al.,Proc.Natl.Acad.Sci.USA 96:8461-8466,1999;Rajadhyaksha et al.,J.Invest.Dermatol.104:946-952,1995;和Gonzalez et al.,J.Med.30:337-356,1999)以及荧光分子断层扫描术(FMT)(Nziachristos et al.,Nature Medicine 8:757-760,2002;美国专利号6,615,063、PCT申请号WO 03/102558、和PCT US/03/07579)。类似地,荧光染料化合物可以用于各种成像系统,例如[1]Imaging Systems:100Series,200Series(Xenogen,Alameda,CA),[2]SPECTRUM and LUMINA(Xenogen,Alameda,CA),[3]theor the eXplore OptixTM(GE Healthcare,United Kingdom),[4]MaestroTMand NuanceTM-2Systems(CRi,Woburn,MA),[5]Image Station In-Vivo FX fromCarestream Molecular Imaging,Rochester,NY(formerly Kodak Molecular ImagingSystems),[6]OV100,IV100(Olympus Corporation,Japan),[7]Cellvizio Mauna KeaTechnologies,France)[8]NanoSPECT/CT or HiSPECT(Bioscan,Washington,DC),[9]or LILATM(Imaging Diagnostic Systems,Plantation,FL),[10]DYNOTTM(NIRxMedical Technologies,Glen Head,NY)以及[11]NightOWL Imaging Systems byBerthold Technologies,Germany.
各种光检测/图像记录组件,如电荷藕合器件(CCD)系统或感光胶片可以用于这样的系统。光检测/图像记录的选择取决于包括使用的光收集/图像形成组件的类型在内的因素。然而,应该理解,选择合适的组件、将它们组装成光学成像系统、以及系统的操作是本领域的普通技术。
光学成像和测量技术包括但不限于荧光成像、发光成像、内窥镜术、荧光内窥镜术、光学相干断层扫描术、透射成像、时间分辨透射成像、共聚焦成像、非线性显微术、光声成像、声光成像、光谱术、反射光谱术、活体成像、双光子成像、干涉测量术、相干干涉测量术、扩散光学断层扫描术和荧光分子断层扫描术。
希望的是,注射的荧光染料化合物能够偶联至或合并于例如颗粒的固相支持物内。因此,应该理解,荧光染料化合物能够偶联至具有磁性性质的金属氧化物纳米颗粒,从而产生还能发出荧光的颗粒。由此,产生的颗粒还能够使用本领域已知的技术,用于MRI成像。关于MRI技术的综述,参见Westbrook,Handbook of MRI Technique,2nd Edition,1999,Blackwell Science。可能的是,例如,通过荧光分子断层扫描术和通过磁共振成像获得的图像可以彼此配准或融合,从而提供关于成像物体的附加信息。另外,多模态成像系统(即,组合的光学和MR成像系统)可以用于生产组合的光学MR图像。
另外,本发明的组合物和方法能够与其他成像组合物和方法组合使用。例如,本发明的荧光染料化合物可以通过光学成像流程单独地或与其他传统成像模式诸如X-射线、计算机断层扫描(CT)、MR成像、超声、正电子发射断层扫描(PET)和单光子计算机断层扫描(SPECT)组合地对感兴趣的区域进行成像。例如,本发明的组合物和方法可以与CT或MR成像组合使用,以通过例如与由另一种成像模式产生的图像配准的方法,同时获得解剖学和分子信息两者。本发明的组合物和方法也可以与X-射线、CT、PET、超声、SPECT、MR以及其他光学造影剂组合使用,或者可替代地,本发明的荧光染料化合物还可以包括成像剂诸如碘、钆原子和放射性同位素,其可以通过使用CT、PET、SPECT和MR成像模式与光学成像的组合来检测。
体内光学成像的示例性的方法包括如下步骤:(a)向对象,例如人或动物给予本发明的荧光化合物;(b)给予足够的时间,使荧光染料化合物在对象体内分布或者与生物目标接触或相互作用;(c)将对象暴露于例如具有可以被荧光染料化合物吸收的波长的光的电磁辐射下;并且(d)检测由荧光染料化合物发射的光学信号。
应该理解,对象可以是脊椎动物,例如包括人的哺乳动物。动物也可以是无脊椎动物(如秀丽隐杆线虫、果蝇或其他模式研究生物等)。生物目标可以包括但不限于细胞、细胞培养物、组织、组织切片、器官、器官切片、细胞离心样品、蛋白质、核酸、碳水化合物或脂质等。
包括例如步骤(a)-(d)的前述步骤可以按预定时间间隔重复,从而允许在对象体内随时间地评估荧光化合物的发射信号。可以使用平面成像系统、内窥镜、导管、断层扫描系统、手持光学成像系统、护目镜或者术中显微镜来进行光照和检测步骤(相应为步骤(c)和(d))。由荧光染料化合物发射的信号能够用于构建图像,例如断层扫描图。
在这些步骤之前或当中,检测系统可以环绕对象(例如,动物或人)或在对象周围布置,以检测对象发射的光学和/或其他信号(如,MR、原子核、X-射线)。发射的光学和/或其他信号可以进行处理以构建图像,例如断层扫描或平面图像。另外,处理的信号可以单独显示为图像或者显示为融合(组合的)图像。
另外,可以实行同时选择性地检测并成像一个以上成像剂的体内成像方法。例如,在这样的方法中,在上述步骤(a)中,向对象同时或依次给予两种以上信号性质可相互区分的成像剂,其中至少一种成像剂包含本发明的荧光染料化合物。多个试剂的使用允许了多个生物过程、功能或目标的记录。
本发明还以向对象给予标记细胞的体内成像方法为特征。细胞可以在体外用荧光染料化合物标记。细胞可以直接源自对象或者来自其他来源(如来自其他对象、细胞培养物等)。荧光染料化合物可以与细胞混合,从而有效地标记细胞,并且在步骤(a)中向对象给予所得细胞。然后步骤(b)-(d)如以上描述地随后进行。此方法可以用于监控特定细胞类型的转运和定位,包括T细胞、肿瘤细胞、免疫细胞和干细胞,以及其他细胞类型。特别地,此方法可以用于监控基于细胞的疗法。
应该理解,荧光染料化合物的剂型、给予模式的选择、向对象给予该染料化合物的剂量、以及荧光染料化合物的给予和暴露于光(以及如果在情况下适当的话,还有其他形式的电磁辐射)之间的时间,在本领域技术人员的水平之内。
本发明的方法能够用于判定标记的数量,包括随时间的追踪荧光染料化合物在对象体内的定位,或者随时间的评估荧光染料化合物在对象体内的新陈代谢和/或排泄的变化或改变。方法也能够用于通过成像由疗法调节的分子事件和生物通道,跟踪用于某些疾病的疗法,包括但不限于判定有效性、优化时机、优化剂量水平(包括个体病人或试验对象)、以及疗法的组合的协同效果。
本发明的方法和组合物也能够用于帮助内科医生或外科医生鉴定和表征诸如关节炎、癌症以及特别是结肠息肉、或者脆弱的或不稳定的斑块的疾病区域;用于区分患病的组织和正常组织,诸如检测如脑手术中使用普通操作显微镜难以检测的肿瘤边缘;用于帮助决定治疗或手术干预,例如通过判定病变是癌性的并应该去除还是非癌性的并保持不变;或者用于疾病的手术分期中,如术中淋巴结分期、前哨淋巴结定位;或者用于评估术中出血;或者用于描绘肿瘤边缘。
本发明的方法和组合物也可以用于检测、表征和/或判定疾病尤其是早期疾病的定位、疾病的严重性或疾病相关症状、疾病分期和/或监控疾病。发射信号的存在、缺失或水平可以表明疾病的状态。本发明的方法和组合物也可以用于监控和/或指导诸如手术程序的各种治疗干预,以及监控包括基于细胞的疗法的药物疗法。本发明的方法也可以用于疾病或疾病症状的预后。
关于前述的各种疾病或疾病症状,可以检测或监控(治疗之前、当中或之后)的疾病或疾病症状的实例包括,例如炎症(如由例如风湿性关节炎的关节炎导致的炎症)、癌症(如结直肠癌、卵巢癌、肺癌、乳腺癌、前列腺癌、宫颈癌、睾丸癌、皮肤癌、脑癌、胃肠道癌、胰腺癌、肝癌、肾癌、膀胱癌、胃癌、白血病、口腔癌、食道癌、骨癌),心血管疾病(如血管的动脉粥样硬化和炎症性症状、局部缺血、中风、血栓、弥散性静脉内凝血),皮肤疾病(如卡波西氏肉瘤、牛皮癣、过敏性皮炎),眼部疾病(如黄斑变性、糖尿病性视网膜病变),感染疾病(如细菌、病毒、真菌和寄生虫感染,包括获得性免疫缺陷综合症、疟疾、查加斯病、血吸虫病),免疫疾病(如自身免疫紊乱、淋巴瘤、多发性硬化、风湿性关节炎、糖尿病、红斑狼疮、重症肌无力、格雷夫斯病),中枢神经系统疾病(如神经变性疾病,诸如帕金森氏病、阿尔茨海默氏病、亨廷顿氏病、肌萎缩性脊髓侧索硬化症、朊病毒病),遗传疾病,代谢疾病、环境性疾病(如铅、水银和放射性中毒、皮肤癌),骨骼相关疾病(如骨质疏松、原发性和转移性骨肿瘤、骨关节炎),神经变性疾病,以及手术相关并发症(诸如移植排斥、器官排斥、伤口愈合的改变、纤维变性、或者其他与手术植入物相关的并发症)。
因此,本发明的方法和组合物可以用于例如判定肿瘤细胞的存在和/或定位、炎症的存在和/或定位,包括例如在动脉粥样硬化或关节炎中的活化巨噬细胞的存在、血管疾病的存在和/或定位,包括在冠状动脉和外周动脉中有急性栓塞的风险的区域(即易损斑块)、扩张动脉瘤的区域、颈动脉中的不稳定斑块以及缺血区。本发明公开的方法可以用于例如鉴定和评估细胞凋亡、坏死、缺氧和血管再生。可任选地,公开的方法也可以用于通过例如在用治疗化合物或疗法治疗之前和之后对对象进行成像,并且比较对应的图像,来评估治疗化合物或疗法在特定分子目标上的效果。
(b)体外应用
另外,可以理解,荧光染料化合物能够用于各种体外试验,例如结合实验、分析物的检测、荧光共振能量转移(FRET)试验、时间分辨荧光试验、信号放大试验诸如酪胺信号放大试验、均相试验诸如发光氧通道免疫试验(luminescent oxygen channelingimmunoassay)、高通量筛选、高含量筛选、流式细胞术、细胞检测(裂解的或活体)、显微术和体外成像实验。应该理解,前面部分中讨论的成像技术也可以应用于体外成像实验。
示例性的体外成像方法包括:(a)将包含本发明的荧光染料化合物的探针与样品接触;(b)使荧光染料化合物(i)被生物目标激活,和/或(ii)与生物目标结合;(c)可选择地,去除未激活及未结合的荧光染料化合物;(d)将样品暴露于具有可以被荧光染料化合物吸收的波长的例如光的电磁辐射下;并且(e)检测由荧光染料化合物发射的信号,从而判定探针是否已经被生物目标激活或者已经被生物目标结合。
还应该理解,本发明的荧光染料化合物能够与诸如荧光素(fluorescein)、若丹明(rhodamine)、花菁、硼-二吡咯亚甲基或噁嗪的其他类型的荧光染料化合物一起或平行使用,并且本发明的荧光染料的独有的化学、物理和光学性质使其尤其适合多重的荧光试验,该多重的荧光试验包括同时使用一种以上来自其他类型荧光染料化合物的荧光染料。
样品可以是包含例如原代细胞(primary cell)、细胞培养物、或组织、病毒、分析物、蛋白质、免疫球蛋白、碳水化合物、酶、脂质、细胞因子、组蛋白、修饰的组蛋白、DNA、修饰的DNA或其他生物分子的液体或固体样品。生物目标可以是例如细胞、细胞的聚集体、组织或组织样品、结构(超细胞级别(例如骨或组织)或亚细胞级别(例如线粒体或细胞核)两者)、以及细胞成分,例如蛋白质(例如酶或结构蛋白)、脂质、核酸或多糖。也考虑到样品可以在如水体样品、土壤样品、食物样品或生物或非生物来源的其他样品中缺失活体或完整细胞时,包含特定细胞或生物实体的存在的标志物,诸如蛋白质、肽、病毒、DNA、RNA、脂质、碳水化合物等。
还意欲包含的是,本发明的荧光染料化合物可以用于检测非生物材料或来自生物或非生物来源的样品中的非生物来源的材料。实例包括诸如爆炸物、毒素、武器、肥料、药物、重金属、微量金属、金属阳离子、工业废弃物或其他分析物的材料的检测。
荧光染料化合物可以用于各种体外配体结合试验,诸如当合并入磁颗粒时,可以用于基于磁检测的试验(参见美国专利号6,046,585和6,275,031、美国专利号5,445,970;美国专利号4,219,335,Chemla,et.al.(2000)Proc Natl Acad.Sci USA 97,14268-72)。它们也可以用于基于磁共振的配体结合试验,诸如在美国专利号5,164,297和Perez etal.Nature Biotechnol.2002,20(8):816-20中描述的那些。荧光染料化合物也可以用于细胞分选和计数应用。
荧光染料化合物也可以在基于核酸的试验中作为报告基团使用。例如,荧光染料化合物可以偶联至例如DNA或RNA的核酸、改性核酸、PNA、分子信标、或者其他核酸结合分子(例如小干扰RNA或siRNA),从而在杂交实验中使用,例如原位杂交试验、测序反应、扩增反应,例如实时聚合酶链反应扩增反应。例如,对于依据核酸杂交原理在样品中检测单链的核酸(即mRNA、cDNA或变性的双链DNA),本发明的荧光染料化合物化学连接至单链核酸(探针),并与可选择的固定于固相支持物上的、怀疑包含一种以上单链核酸(目标核酸)的样品相接触。探针与样品在允许探针杂交至样品中的目标核酸的条件下培养,以形成双链(duplex)。可以通过冲洗去除未结合的探针,并且可以检测结合的探针,其中探针中的荧光染料化合物发射的荧光的存在或水平是样品中目标核酸的存在或含量的指标。
荧光染料化合物也可以用于基于荧光共振能量转移(FRET)的试验,或者时间分辨的FRET(TR-FRET)试验,或者与淬灭剂分子协同使用。当荧光染料化合物极为贴近FRET的适当的受体或供体例如诸如铕的金属螯合物或者另一荧光染料时,可以发生从其他供体分子向荧光染料化合物或从荧光染料化合物至其他受体分子的能量转移。通过酶的结合、积累或作用等改变荧光染料化合物至其他供体或受体分子的邻近,会改变FRET或TR-FRET的有效性。这样的改变能够被测量并且用于量化酶的结合、积累或作用。
在本发明的另一个方面,本发明的荧光染料化合物能够用于检测金属或金属阳离子的存在、缺失、数量、或数量的变化。适合的金属螯合基团能够接附至荧光染料化合物,并且当结合或释放诸如铜、锌、钙、铅、镉、汞、铁、钴、镁、铬或其他金属的目标金属时能够观察到的荧光染料化合物的荧光的变化。
荧光染料化合物对于分析物的检测和量化是特别有用的。在检测试验期间,可选择的与如时间分辨的荧光测量中的瞬时分辨一起,由化合物发射的信号用于判定化合物是否已被生物目标激活或者结合于生物目标,或者用于判定样品中分析物的存在、缺失或数量。
一个方面,化合物的信号由于酶的存在而被放大,其中该酶结合于或邻近生物目标,并且其中该酶的活性导致荧光化合物向目标、分析物或周边区域的积累或结合。酶的实例是能够结合于诸如抗体的其他分子的辣根过氧化物酶,并且其能够作用于缀合至例如酪胺或4-羟基肉桂酰胺的荧光染料化合物,以标识荧光染料化合物与非常接近酶的分子的放大积累和结合。
在本发明的一个方面,荧光染料化合物能够作为用于判定分析物的存在或数量的均相试验中的组分使用,该分析物包括(a)包含能够由适合波长的入射光激发的单线态氧增敏剂(供体)的分析物特异性结合配偶体,以及(b)包含单线态氧敏感组成部分和一种以上荧光或发光组成部分的第二分析物特异性结合配偶体,该一种以上荧光或发光组成部分包括在单线态氧的存在下回发光的本发明的化合物。
在本发明的另一个方面,荧光染料化合物能够用于显微镜下或流式细胞计数器中或成像流式细胞计数器中的单个细胞的分析或成像。
在本发明的另一个方面,荧光染料化合物能够用于显微镜下或其他适合的成像装置中的完整组织的样品或类似样品中的细胞群的分析或成像。
在本发明的另一个方面,荧光染料化合物能够用于高通量筛选试验中的多个样品的依次的分析或成像。这样的试验可以在例如96孔板或384孔板或1536孔板中进行。
荧光染料化合物还能够在多重试验、高含量筛选试验或高含量分析试验中,与适合的成像或分析装置一起,作为一个样品或成组样品中的多个生物标志物、目标或分析物的分析中的一个组分或多个组分使用。在单一样品中的两个、三个、四个、五个或六个以上不同目标或标志物能够用单体探针一起量化或成像,以在分析中提供样品的状态的高含量示值读数(readout)。
(c)离体应用
另外,可以理解,荧光染料化合物也可以用于各种例如结合实验的离体试验,以及离体成像实验。应该理解,前面部分中讨论的成像技术也可以应用于离体成像实验。
示例性的离体成像方法包括:(a)将包含本发明的荧光染料化合物的探针与样品接触;(b)使荧光染料化合物(i)被生物目标激活,和/或(ii)与生物目标结合;(c)可选择地,去除未激活及未结合的荧光染料化合物;(d)将样品暴露于具有可以被荧光染料化合物吸收的波长的例如光的电磁辐射下;并且(e)检测由荧光染料化合物发射的信号,从而判定探针是否已经被生物目标激活或者已经被生物目标结合。
样品可以是包含例如原代细胞、细胞培养物或组织的液体或固体样品。生物目标可以是例如细胞、细胞的聚集体、组织或组织样品、结构(超细胞级别(例如骨器官或组织)或亚细胞级别(例如线粒体或细胞核)两者)、以及细胞成分,例如蛋白质(例如酶或结构蛋白)、脂质、核酸或多糖。
实施例
通过参考下列实例,经大概描述的本发明将会更容易地理解,其中下列实例的包括仅出于说明本发明的特定方面和实施方式的目的,并且无意限制本发明。
以下进一步描述可以用于制备本发明的化合物的代表性材料和方法。所有化学品和溶剂(试剂级)以其商购时的状态使用,一般没有进一步纯化。分析和制备HPLC方法包括:
流动相:乙腈,25mM三乙铵乙酸酯。
流动相:乙腈,25mM三乙铵乙酸酯。
流动相:乙腈,25mM三乙铵乙酸酯。
实施例1-化合物22(3,6-双(二甲基氨基)-9-(2-羧基-4-甲基-噻吩-5-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物)的合成
根据下列方案合成化合物22:
向化合物N,N-二甲基-3-溴苯胺(10.0g,50.0mmol)的AcOH(250mL)溶液中加入12.16mL 37%的甲醛水溶液(4.5g,150.0mmol),并且在60℃搅拌混合物115分钟。在冷却至室温后,通过真空移除一部分乙酸。然后,用饱和NaHCO3(aq.)和NaOH(aq.)中和反应混合物,并且用CH2Cl2提取。有机层用浓盐溶液(brine)冲洗,在Na2SO4下干燥并且蒸发至干燥。通过快速色谱(硅胶)纯化残留物,以产生纯的4,4'-亚甲基双(3-溴-N,N-二甲基苯胺)(5.24g,12.7mmol,产率51%)。
向用氮气清洗的烧瓶中加入4,4'-亚甲基双(3-溴-N,N-二甲基苯胺)(1000mg,2.42mmol)和无水THF(25mL)。将溶液冷却至-78℃,加入1.4M仲丁基锂(s-BuLi)(3.46mL,4.84mmol),并且搅拌混合物30分钟。在相同的温度下,缓慢加入溶于无水THF(25mL)中的Me2SiCl2(324μL,2.62mmol),并且将混合物温至室温,然后搅拌1小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。然后向混合的有机层中与1M三乙基碳酸氢铵(3mL)一起加入氯醌(1750mg,7.05mmol),并且搅拌混合物过夜。蒸发溶剂,并且通过快速色谱(硅胶)纯化残留物,以产生纯的3,6-双(二甲基氨基)-10,10-二甲基-10-硅杂蒽酮(425mg,1.3mmol,产率54%)。
在用氮气清洗的烧瓶中,将3,6-双(二甲基氨基)-10,10-二甲基-10-硅杂蒽酮(50.0mg,0.16mmol)溶解于无水THF(10mL)。将溶液冷却至-78℃。在相同的温度下,向烧瓶中加入4-甲基-5-溴-2-噻吩甲酸(136mg,0.81mmol)和无水THF(5mL),加入1M仲丁基锂(1.16mL,1.62mmol),并且搅拌混合物30分钟。缓慢加入锂化溶液,并且将混合物温至室温,然后搅拌2小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥,并且蒸发溶剂。粗混合物通过HPLC纯化,以产生纯的3,6-双(二甲基氨基)-9-(2-羧基-4-甲基-噻吩-5-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物22(9.7mg,0.022mmol,产率14%)。
实施例2-化合物65(3,6-双(二甲基氨基)-9-(2-羧基-噻吩-5-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物)的合成
在用氮气清洗的烧瓶中,将3,6-双(二甲基氨基)-10,10-二甲基-10-硅杂蒽酮(50.0mg,0.16mmol)溶解于无水THF(10mL)。将溶液冷却至-78℃。在相同的温度下,向烧瓶中加入叔丁基4-溴-3-甲基-2-噻吩甲酸(136mg,0.81mmol)和无水THF(5mL),加入1M仲丁基锂(1.16mL,1.62mmol),并且搅拌混合物30分钟。缓慢加入锂化溶液,并且将混合物温至室温,然后搅拌2小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥,并且蒸发溶剂。粗混合物通过HPLC纯化,以产生纯的3,6-双(二甲基氨基)-9-(2-羧基-噻吩-5-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物65(9.7mg,0.022mmol,产率14%)。
实施例3-化合物18(3,6-双(二甲基氨基)-9-(2-羧基-3-甲基-噻吩-4-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物)的合成
在用氮气清洗的烧瓶中,将3,6-双(二甲基氨基)-10,10-二甲基-10-硅杂蒽酮(50.0mg,0.16mmol)溶解于无水THF(10mL)。将溶液冷却至-78℃。在相同的温度下,向烧瓶中加入3-甲基-4-溴-2-噻吩甲酸(136mg,0.81mmol)和无水THF(5mL),加入1M仲丁基锂(1.16mL,1.62mmol),并且搅拌混合物30分钟。缓慢加入锂化溶液,并且将混合物温至室温,然后搅拌2小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥,并且蒸发溶剂。粗混合物通过HPLC纯化,以产生纯的3,6-双(二甲基氨基)-9-(2-羧基-3-甲基-噻吩-4-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物18(9.7mg,0.022mmol,产率14%)。
实施例4-化合物#17(2,6-双(二甲基氨基)-9-(2-羧基-4-甲基-噻吩-3-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物)IV的合成
如以下方案中所描述,制备化合物17:
在用氮气清洗的烧瓶中,将3,6-双(二甲基氨基)-10,10-二甲基-10-硅杂蒽酮(50.0mg,0.16mmol)溶解于无水THF(10mL)。将溶液冷却至-78℃。在相同的温度下,向烧瓶中加入叔丁基4-溴-3-苯甲酸甲酯(136mg,0.81mmol)和无水THF(5mL),加入1M仲丁基锂(1.16mL,1.62mmol),并且搅拌混合物30分钟。缓慢加入锂化溶液,并且将混合物温至室温,然后搅拌2小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥,并且蒸发溶剂。粗混合物通过HPLC纯化,以产生纯的3,6-双(二甲基氨基)-9-(2-羧基-4-甲基-噻吩-3-基)-10,10-二甲基-10-硅杂蒽阳离子氯化物17(9.7mg,0.022mmol,产率14%)。
实施例5-化合物44(2,6-双(吡咯烷-1-基)-9-(2-甲基-4-羧基苯基)-10,10-二甲基-10-硅杂蒽阳离子)的合成
向化合物1-(3-溴苯基)-吡咯烷(10.0g,44mmol)的AcOH(250mL)溶液中加入12.16mL 37%的甲醛水溶液(4.5g,150.0mmol),并且在60℃搅拌混合物115分钟。在冷却至室温后,通过真空移除一部分乙酸。然后,用饱和NaHCO3(aq.)和NaOH(aq.)中和反应混合物,并且用CH2Cl2提取。有机层用浓盐溶液(brine)冲洗,在Na2SO4下干燥并且蒸发至干燥。通过快速色谱(硅胶)纯化残留物,以产生纯的双(2-溴-4-(吡咯烷-1-基)苯基)甲烷(5.1g,11mmol,产率50%)。
向用氮气清洗的烧瓶中加入双(2-溴-4-(吡咯烷-1-基)苯基)甲烷(1000mg,2.42mmol)和无水THF(25mL)。将溶液冷却至-78℃,加入1.4M仲丁基锂(s-BuLi)(3.46mL,4.84mmol),并且搅拌混合物30分钟。在相同的温度下,缓慢加入溶于无水THF(25mL)中的Me2SiCl2(3.24μL,2.62mmol),并且将混合物温至室温,然后搅拌1小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥并蒸发。将残留物溶于CH2Cl2(10mL),随后与1M三乙基碳酸氢铵(2.5mL,2.5mmol)一起加入氯醌(1250mg,5.0mmol),并且在室温下搅拌混合物过夜。蒸发溶剂,并且通过快速色谱(硅胶)纯化残留物,以产生纯的3,6-双(吡咯烷-1-基)-10,10-二甲基-10-硅杂蒽酮。
在用氮气清洗的烧瓶中,将2,6-双(吡咯烷-1-基)-10,10-二甲基-10-硅杂蒽酮(50.0mg,0.162mmol)溶解于无水THF(10mL)。将溶液冷却至-78℃。在相同的温度下,向烧瓶中加入叔丁基4-溴-3-苯甲酸甲酯(136mg,0.81mmol)和无水THF(5mL),加入1M仲丁基锂(0.58mL,0.81mmol),并且搅拌混合物30分钟。缓慢加入锂化溶液,并且将混合物温至室温,然后搅拌2小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥,并且蒸发溶剂。粗混合物通过HPLC纯化,以产生溶于TFA(1mL)的纯的残留物。通过真空移除TFA,以产生3,6-双(吡咯烷-1-基)-9-(2-甲基-4-羧基苯基)-10,10-二甲基-10-硅杂蒽阳离子44(9.7mg,0.022mmol,产率14%)。
实施例6-化合物74(3,6-双-(哌啶-1-基)-9-(2-甲基-4-羧基苯基)-10,10-二甲基-10-硅杂蒽阳离子)的合成
向化合物1-(3-溴苯基)-哌啶(10.0g,50.0mmol)的AcOH(250mL)溶液中加入12.16mL 37%的甲醛水溶液(4.5g,150.0mmol),并且在60℃搅拌混合物115分钟。在冷却至室温后,通过真空移除一部分乙酸。然后,用饱和NaHCO3(aq.)和NaOH(aq.)中和反应混合物,并且用CH2Cl2提取。有机层用浓盐溶液(brine)冲洗,在Na2SO4下干燥并且蒸发至干燥。通过快速色谱(硅胶)纯化残留物,以产生双(2-溴-4-(哌啶-1-基)苯基)甲烷(5.24g,12.7mmol,产率51%)。
向用氮气清洗的烧瓶中加入双(2-溴-4-(哌啶-1-基)苯基)甲烷(1.0g,2.2mmol)和无水THF(25mL)。将溶液冷却至-78℃,加入1.4M仲丁基锂(s-BuLi)(3.46mL,4.84mmol),并且搅拌混合物30分钟。在相同的温度下,缓慢加入溶于无水THF(25mL)中的Me2SiCl2(3.24μL,2.62mmol),并且将混合物温至室温,然后搅拌1小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥并蒸发。将残留物溶于CH2Cl2(10mL),随后与加入氯醌(600mg,2.4mmol)。再次蒸发掉溶剂。通过快速色谱(硅胶)纯化残留物,以产生纯的3,6-双(吡咯烷-1-基)-10,10-二甲基-10-硅杂蒽-9-阳离子氯化物(340mg,产率40%)。
在用氮气清洗的烧瓶中,将3,6-双(吡咯烷-1-基)-10,10-二甲基-10-硅杂蒽-9-阳离子氯化物(50.0mg,0.125mmol)溶解于无水THF(10mL)。将溶液冷却至-78℃。在相同的温度下,向烧瓶中加入叔丁基4-溴-3-苯甲酸甲酯(136mg,0.81mmol)和无水THF(5mL),加入1M仲丁基锂(0.58mL,0.81mmol),并且搅拌混合物30分钟。缓慢加入锂化溶液,并且将混合物温至室温,然后搅拌2小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥,并且蒸发溶剂。粗混合物通过HPLC纯化,以产生溶于TFA(1mL)的纯的残留物。通过真空移除TFA,以产生3,6-双(哌啶-1-基)-9-(2-甲基-4-羧基苯基)-10,10-二甲基-10-硅杂蒽阳离子74(11.2mg,产率16%)。
实施例7-化合物45(3,6-双(吗啉基)-9-(2-甲基-4-羧基苯基)-10,10-二甲基-10-硅杂蒽阳离子)的合成
向化合物1-(3-溴苯基)-吗啉(10.0g,41.0mmol)的AcOH(250mL)溶液中加入12.16mL 37%的甲醛水溶液(4.5g,150.0mmol),并且在60℃搅拌混合物115分钟。在冷却至室温后,通过真空移除一部分乙酸。然后,用饱和NaHCO3(aq.)和NaOH(aq.)中和反应混合物,并且用CH2Cl2提取。有机层用浓盐溶液(brine)冲洗,在Na2SO4下干燥并且蒸发至干燥。通过快速色谱(硅胶)纯化残留物,以产生双(2-溴-4-吗啉基苯基)甲烷(5.1g,产率50%)。
向用氮气清洗的烧瓶中加入双(2-溴-4-吗啉基苯基)甲烷(1.0g,2.2mmol)和无水THF(25mL)。将溶液冷却至-78℃,加入1.4M仲丁基锂(s-BuLi)(3.46mL,4.84mmol),并且搅拌混合物30分钟。在相同的温度下,缓慢加入溶于无水THF(25mL)中的Me2SiCl2(3.24μL,2.62mmol),并且将混合物温至室温,然后搅拌1小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥并蒸发。将残留物溶于CH2Cl2(10mL),随后与加入氯醌(600mg,2.4mmol)。再次蒸发掉溶剂。通过快速色谱(硅胶)纯化残留物,以产生纯的3,6-双(吡咯烷-1-基)-10,10-二甲基-10-硅杂蒽-9-阳离子氯化物(340mg,产率40%)。
在用氮气清洗的烧瓶中,将3,6-双(吡咯烷-1-基)-10,10-二甲基-10-硅杂蒽-9-阳离子氯化物(50.0mg,0.125mmol)溶解于无水THF(10mL)。将溶液冷却至-78℃。在相同的温度下,向烧瓶中加入叔丁基4-溴-3-苯甲酸甲酯(136mg,0.81mmol)和无水THF(5mL),加入1M仲丁基锂(0.58mL,0.81mmol),并且搅拌混合物30分钟。缓慢加入锂化溶液,并且将混合物温至室温,然后搅拌2小时。通过加入2N HCl阻断反应,并且在室温下搅拌混合物10分钟。加入饱和NaHCO3,并且用CH2Cl2提取其全部。有机层在Na2SO4下干燥,并且蒸发溶剂。粗混合物通过HPLC纯化,以产生溶于TFA(1mL)的纯的残留物。通过真空移除TFA,以产生3,6-双(吗啉基)-9-(2-甲基-4-羧基苯基)-10,10-二甲基-10-硅杂蒽阳离子45(11.2mg,产率16%)。
实施例8.9-取代的10-硅杂蒽阳离子荧光染料的光学性质上的示例性的取代基效应:
此实施例示出光学性质(吸收和发射最大波长以及相对亮度)。相对亮度通过当被最大吸收的波长激发时荧光染料的溶液在1cm正方形吸收池中的荧光强度除以相同样品在最大吸收的波长下的吸收度定义。示出的三个在式II的X位具有S原子的样品相对于三个在Y或Z位具有S原子的样品,红移了约20nm。用甲基、溴或羧基取代基对噻吩基取代基进一步的衍生化显示了28倍范围的相对亮度:
图1说明了在将9-噻吩基SX化合物的硫原子从式I的Z位(化合物17)移动至X位并添加溴取代基(化合物66)时观察到的23nm的红移。该位移足以允许在使用这两个化合物在两个不同波长的多重成像,例如在四通道FMT断层扫描体内成像系统或多通道荧光显微镜上。
实施例9.一些示例性硅杂蒽阳离子荧光染料化合物的性质:
此实施例在表3中总结了一些示例性硅杂蒽阳离子(SX)荧光染料相对于细胞不可通透的花菁染料(磺化Cy5类似物)CY1的吸收和发射特性。在1cm正方形吸收池中的1X PBS中测量吸收和发射特性。如实施例8中测量相对荧光(亮度),并且以化合物CY1的相对荧光作标准化。
表3
实施例10.硅杂蒽阳离子荧光染料化合物与生物分子(葡萄糖胺)的缀合
将化合物44(1mg,1.9μmol)溶于100μL DMF中,并且加入HATU(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧杂六氟磷酸盐,0.75mg,2.0μmol)和0.3μL(2.1μmol)的三乙胺。在室温下10分钟后,加入D-葡萄糖胺盐酸盐(1mg,4.7μmol),并且使溶液在室温下反应2小时。通过HPLC纯化葡萄糖胺缀合的荧光染料化合物67。
实施例11.硅杂蒽阳离子荧光染料化合物与硝基咪唑的缀合
将化合物18(1mg,2.1μmol)溶于100μL DMF中,并且加入HATU(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧杂六氟磷酸盐,0.83mg,2.2μmol)和0.33μL(2.3μmol)的三乙胺。在室温下10分钟后,加入1-(3-氨基丙基)-2-硝基咪唑(1mg,5.9μmol),并且使溶液在室温下反应2小时。通过HPLC纯化2-硝基咪唑缀合的荧光染料化合物69。
实施例12.硅杂蒽阳离子荧光染料化合物与抗体的缀合
此实施例说明了硅杂蒽阳离子荧光染料的反应性N-羟基琥珀酰亚胺基酯的合成,及其随后对于荧光标记由抗体构成的生物分子的应用。为了生成氨基反应性琥珀酰亚胺基酯64,将化合物21(1mg,2.1μmol)溶于50μL DMF中,并且与1μL N-甲基吗啉一起加入二琥珀酰亚胺基碳酸酯(1mg,4μmol)。使反应在室温下进行30分钟,然后通过加入1500μL醚沉淀产物,并且通过离心分离并倾析出醚,随后在真空下干燥。
为了标记抗体,将1mg化合物64(1.75μmol)溶于100μL DMSO中。然后将5μL此溶液加入1mL1XPBS中浓度为1mg/mL的抗体。加入50μL 1M碳酸氢钠,并且在室温下旋转溶液1小时。通过使用从BioRad获得的10DG色谱柱的排阻色谱纯化标记的抗体。
实施例13.硅杂蒽阳离子荧光染料化合物的细胞摄入
此实施例通过流式细胞术说明细胞摄入。HT-29细胞与0.5μM的CY1、CY2(光学吸收和发射波长类似的常用花菁染料)或75在室温下一起培养5分钟。在离心机中旋转细胞,然后在1XPBS中重新悬浮用于通过使用装配有固态660nm(60mW)红色激光和712/21nm带通滤光片的BD LSR II流式细胞计数器(BD Biosciences,Rockville,MD)的流式细胞术的分析。在与两种花菁染料CY1和CY2一起培养的细胞中量化到非常低的数量的荧光信号,2倍和4倍的未标记细胞的背景,然而硅杂蒽阳离子染料75的信号为140倍的背景细胞。在减去来自未标记细胞的背景后,75具有分别为CY1和CY2的多于155倍和51倍的荧光。定量数据在下面的图2中与代表的直方图一起示出。
实施例14.两个硅杂蒽阳离子化合物的荧光显微术以及与Mitotracker Green的共定位
此实施例说明了硅杂蒽阳离子染料在HT-29细胞内的摄入和细胞内定位。HT-29细胞与0.25μm的75、76或非磺化的花菁染料CY3一起培养1小时,并且与0.25μm的线粒体标志物Mitotracker Green一起培养30分钟。冲洗细胞并且通过共聚焦显微术离心涂片分析,如图3中所示。染料的荧光以蓝色在第一列中示出,Mitotracker以绿色在中间列中示出,两者的重叠在第三列中示出。两种SX染料有效地穿透细胞并且与Mitotracker共定位。非磺化的中性花菁染料CY3在这些条件下没有有效地穿透细胞。
实施例15.生物分子缀合的SX化合物的细胞摄入
此实施例说明了生物分子(葡萄糖胺)缀合的SX化合物——化合物67在KB细胞中的细胞摄入。在使用适合两种不同的荧光染料的滤光片组通过荧光显微术和流式细胞术的细胞分析前,KB细胞在培养基中培养2小时,然后与30μM的化合物67培养30分钟。作为对照组,细胞也与同样为30μM的商用荧光葡萄糖胺衍生物2-NBDG培养。图4示出荧光显微术(细胞核染色的DAPI为蓝色,化合物67为红色并且2-NBDG为绿色)和流式细胞术的结果。两种荧光葡萄糖胺衍生物被细胞吸收,然而,如直方图、由流式细胞术量化的所示,对于化合物67展示出检测器饱和,同时商用衍生物2-NBDG处于仪器和滤光片组的正常分析范围。这个意想不到的检测器饱和是来自细胞中的化合物67的荧光信号数量非常大的指示,并且是本发明的SX化合物的优秀的细胞可通透性质的说明。
实施例16.硝基咪唑缀合的SX化合物的细胞摄入
此实施例示出硝基咪唑缀合的SX化合物——化合物69在HeLa细胞中的摄入和定位。将HeLa细胞接种于384孔板中(5000个细胞/孔)并且在培养箱中保存过夜。移除培养基,并且加入无血清的培养基中的0.25μM的化合物69。培养细胞60分钟,然后将培养基与完全培养基(full medium)交换,并且将细胞在Operetta成像系统(非共聚焦,20倍高NA)上分别使用620-640nm和650-760nm的激发和发射滤光片成像。在图5中,细胞核染色的DAPI以蓝色示出,同时化合物69荧光以红色示出。
实施例17.肽缀合的内部淬灭的可激活的硅杂蒽阳离子荧光染料化合物
图6A描绘了由可酶切的肽序列(化合物78)分隔开的硅杂蒽阳离子荧光染料内部淬灭对,当酶切时的荧光激活。通过使用HATU和三乙胺,将两个羧酸染料缀合至肽序列中的赖氨酸侧链氨基,合成化合物78。通过HPLC纯化淬灭的探针。分别使用Cary 50紫外-可见分光光度计(Varian)和Cary Eclipse荧光分光光度计测量的淬灭的(虚线)和激活的(在1XPBS中以胰凝乳蛋白酶切割,实线)荧光染料的吸收度和荧光,在图6B中示出。当分隔两个荧光染料化合物的肽序列被酶切割时,荧光信号强度剧烈地增加。
实施例18.硅杂蒽阳离子荧光染料化合物44的体内成像
图7展示了在向活体小鼠静脉注射化合物44后,本发明的荧光染料化合物的FMT2500断层扫描体内成像系统(PerkinElmer,Waltham,MA)的断层扫描图像。向两只SKH-1E雌性小鼠(9周大)注射了2nmol的化合物44。在1、15、30和45分钟及1、2和3小时拍摄小鼠整个身体的断层扫描图像。随着非靶向的化合物在3小时洗出,能够看到荧光染料化合物在心脏区域的快速积累,随后较慢的向身体的其他区域积累,代表了用于体内成像的窗口。
实施例19.碳酸酐靶向硅杂蒽阳离子化合物73的合成
将化合物20(0.5mg,1.0μmol)溶于100μL DMF中,并且加入HATU(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧杂六氟磷酸盐,0.83mg,2.2μmol)和0.33μL(2.3μmol)的N-甲基吗啉。在室温下30分钟后,加入4-(氨基甲基)苯磺酰胺(1mg,5.4μmol),并且使溶液在室温下反应2小时。通过HPLC纯化2-硝基咪唑缀合的荧光染料化合物73。
实施例20.4-羟基肉桂酰胺衍生化的硅杂蒽阳离子化合物74的合成
将化合物20(0.5mg,1.0μmol)溶于100μL DMF中,并且加入HATU(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧杂六氟磷酸盐,0.83mg,2.2μmol)和0.33μL(2.3μmol)的N-甲基吗啉。在室温下30分钟后,加入N-(2-氨基乙基)-4-羟基肉桂酰胺(1mg,5μmol),并且使溶液在室温下反应2小时。通过HPLC纯化2-硝基咪唑缀合的荧光染料化合物74。
实施例21.乙酰唑胺缀合的硅杂蒽阳离子化合物75的合成
将化合物20(0.5mg,1.0μmol)溶于100μL DMF中,并且加入HATU(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧杂六氟磷酸盐,0.83mg,2.2μmol)和0.33μL(2.3μmol)的N-甲基吗啉。在室温下30分钟后,加入4-(氨基甲基)-N-(5-氨磺酰-1,3,4-噻二唑-2-基)苯甲酰胺(1.5mg,4.8μmol),并且使溶液在室温下反应2小时。通过HPLC纯化2-硝基咪唑缀合的荧光染料化合物75。
实施例22.(4-氨基乙基)苯磺酰胺衍生化的硅杂蒽阳离子化合物76的合成
将化合物20(0.5mg,1.0μmol)溶于100μL DMF中,并且加入HATU(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧杂六氟磷酸盐,0.83mg,2.2μmol)和0.33μL(2.3μmol)的N-甲基吗啉。在室温下30分钟后,加入4-(氨基乙基)苯磺酰胺(1mg,5.0μmol),并且使溶液在室温下反应2小时。通过HPLC纯化2-硝基咪唑缀合的荧光染料化合物76。
实施例23.吲哚美辛缀合的(COX-2靶向的)硅杂蒽阳离子化合物78的合成
将化合物20(0.5mg,1.0μmol)溶于100μL DMF中,并且加入HATU(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧杂六氟磷酸盐,0.83mg,2.2μmol)和0.33μL(2.3μmol)的N-甲基吗啉。在室温下30分钟后,加入(4-氨基丁基)吲哚美辛甲酰胺(2mg,4.7μmol),并且使溶液在室温下反应2小时。通过HPLC纯化2-硝基咪唑缀合的荧光染料化合物78。
实施例24.两种具有相同实验式但是波长特性不同的9-噻吩基硅杂蒽荧光染料通过显微术和流式细胞术的细胞摄入
使用前面描述的方法,合成两种异构的噻吩基Si-Rho染料88和89。具有相同的分子量和分子式的两种异构的化合物,具有652nm和668nm(88)以及667nm和681nm(89)的吸收和发射最大值。对于细胞摄入和洗出,通过使用两组不同的滤光片组的流式细胞术以及荧光显微术分析化合物。0.5mil细胞/mL培养基的胰蛋白酶EDTA分离的4T1与1uM 88或89一起在37℃下培养30分钟。用1x PBS冲洗细胞,并且通过使用705/70nm发射滤光片的流式细胞术对88进行分析,并且通过使用712/21nm发射滤光片的荧光显微术对89进行分析。观察到两种染料的显著摄入,并且在1.5小时后,通过流式细胞术量化到仍然保留了大约三分之一的染料(图8)。
实施例25.几种可激活的SX衍生物的体外和体内表征
图9A示出可激活的噻吩基化合物91(通过胰凝乳蛋白酶)在37℃下在1X PBS中的4小时的代表性蛋白酶激活。观察到荧光强度的22倍的增加。图9B通过流式细胞术和荧光显微术,示出化合物92、93和91在活体细胞中的摄入和激活。胰蛋白酶EDTA分离的4T1在6孔组织培养板中以0.5mil细胞/2mL培养基接种,与1或5uM的92、93或91在37℃下培养21小时。用1x PBS冲洗细胞,分离、并且通过FC和FLM(Cy5滤光片)分析。图9C由通过FMT断层扫描成像,示出化合物92在活体小鼠中的体内激活和生物分布。在成像前大约1周,胰蛋白酶EDTA分离的4T1细胞以1.5mil/位点植入。以4nmol眼球后注射92,并且在5小时和24小时通过FMT成像。在肿瘤、肝脏和肠中体内检测到淬灭的硅杂蒽阳离子试剂的激活,展示了可激活的硅杂蒽阳离子化合物用于定量体内成像的能力。
通过引用并入
本文中引用的所有出版物、专利和专利申请,以其全部内容通过引用明确地并入本文,并且为所有目的,其引入程度与如同将每份出版物、专利或专利申请单独引入的程度相同。
等同
本发明可以体现为其他特定形式而不背离其精神和本质特征。因此,上述实施例在所有方面视为说明性的,而不是对本文描述的发明的限制。因此,本发明的范围由随附的权利要求书而不是由前面的描述指明,并且意图将进入权利要求书的意义和等同范围之内的所有变化涵盖在其中。
Claims (52)
1.一种化合物,该化合物由式I或其盐表示:
其中:
A1是由1个、2个或3个取代基未取代的或取代的噻吩基、呋喃基或吡啶基,所述取代基独立地选自由C1-20烷基、C1-20卤代烷基、卤素、羟基、C1-20烷氧基、-CO2H、-CO2 -和-CO2-(未取代的或取代的C3-10杂环烷基)所组成的组;
R1和R2各自独立地表示氢或C1-20烷基;或者R1和R2与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环;
R3和R4各自独立地表示氢或C1-20烷基;或者R3和R4与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环;
R5表示甲基;
其中,所述取代的C3-10杂环烷基在一个或多个位置上被羰基取代。
5.根据权利要求1至4的任意一项所述的化合物,其中所述化合物具有在从500nm至1100nm的范围内的吸收和发射波长。
6.根据权利要求1至4的任意一项所述的化合物,其中所述化合物具有在从500nm至600nm的范围内的吸收和发射波长。
7.一种缀合化合物,该缀合化合物通过生物分子与权利要求1至6的任意一项所述的化合物反应而形成。
8.一种缀合化合物,该缀合化合物是用由-L-BM定义的1个、2个或3个基团取代式I的化合物;其中L是键或连接物,-BM是生物分子的自由基,并且式I由以下或其盐表示:
其中:
A1是由1个、2个或3个取代基未取代的或取代的噻吩基、呋喃基或吡啶基,所述取代基独立地选自由C1-20烷基、C1-20卤代烷基、卤素、羟基、C1-20烷氧基、-CO2H、-CO2 -和-CO2-(未取代的或取代的C3-10杂环烷基)所组成的组;
R1和R2各自独立地表示氢或C1-20烷基;或者R1和R2与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环;
R3和R4各自独立地表示氢或C1-20烷基;或者R3和R4与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环;
R5表示甲基;
其中,所述取代的C3-10杂环烷基在一个或多个位置上被羰基取代。
9.一种化合物,该化合物由式II或其盐表示:
其中:
A1是由1个、2个或3个取代基未取代的或取代的噻吩基、呋喃基或吡啶基,所述取代基选自由-C(O)-ψ、C1-20烷基、C1-20卤代烷基、卤素、羟基、C1-20烷氧基、-CO2H、-CO2 -和-CO2-(未取代的或取代的C3-10杂环烷基)所组成的组;
ψ是生物分子的自由基;
R1和R2各自独立地表示氢或C1-20烷基;或者R1和R2与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环;
R3和R4各自独立地表示氢或C1-20烷基;或者R3和R4与接附于它们的氮原子合并在一起形成四元至六元饱和杂环状环;
R5表示甲基;
其中,所述取代的C3-10杂环烷基在一个或多个位置上被羰基取代。
10.根据权利要求7至9的任意一项所述的化合物,其中所述生物分子是蛋白质、肽、氨基酸、脂质、碳水化合物、核苷、核苷酸、维生素、核酸或细胞。
11.根据权利要求10所述的化合物,其中所述蛋白质是糖蛋白和/或所述碳水化合物是多糖。
12.一种化合物,该化合物由式III或其盐表示:
其中:
X、Y和Z独立地是O、S、N、Si、或C;
L不存在或者是连接物组成部分,该连接物组成部分被官能性基团或反应性基团未取代或取代,所述基团选自羧酸盐、C1-20羧基烷基、-NH2、-OH、-SH、-SO3H、羧基、和-COCl所组成的组;
R1是氢或甲基;
R2、R3和R4独立地是H、C1-20烷基、C3-10环烷基、C1-20卤代烷基或C1-20叠氮基烷基;
R5不存在或是H、C1-20烷基、羧基、C1-20羧基烷基、磺酸盐、卤素、羟基、氨基、C1-20卤代烷基;并且
W1和W2独立地不存在或者是包含脂肪族碳或氮的、与R1和R2或R3和R4形成四元至九元环的环状基团。
13.根据权利要求12所述的化合物,其中所述化合物是细胞膜可通透的。
14.根据权利要求12所述的化合物,其中所述化合物具有小于750道尔顿的分子量。
15.根据权利要求12所述的化合物,其中所述化合物具有从400Da至750Da的分子量。
16.根据权利要求12所述的化合物,其中所述化合物具有小于500道尔顿的分子量。
17.根据权利要求12所述的化合物,其中所述化合物具有在从500nm至1100nm的范围内的吸收和发射波长。
18.根据权利要求12所述的化合物,其中所述化合物具有在从500nm至600nm的范围内的吸收和发射波长。
19.根据权利要求12至18的任意一项所述的化合物,其中所述化合物在远红至近红外区域内是荧光的。
20.一种荧光生物分子,该荧光生物分子由式IV或其盐表示:
其中;
X、Y和Z独立地是O、S、N、Si、或C;
L是连接基团,其被官能性基团或反应性基团未取代或取代,所述基团选自羧酸盐、C1-20羧基烷基、-NH2、-OH、-SH、-SO3H、羧基、和-COCl所组成的组;
BM是生物分子,
R1为氢或甲基;
R2、R3和R4独立地是H、C1-20烷基、C3-10环烷基、C1-20卤代烷基或C1-20叠氮基烷基;
R5不存在或是H、C1-20烷基、羧基、C1-20羧基烷基、磺酸盐、卤素、羟基、氨基、C1-20卤代烷基;并且
W1和W2独立地不存在或者是包含脂肪族碳或氮的、与R1和R2或R3和R4形成四元至九元环的环状基团。
21.根据权利要求20所述的荧光生物分子,其中所述BM是蛋白质、糖蛋白、肽、氨基酸、脂质、多糖、碳水化合物、核苷、核苷酸、维生素、核酸或细胞。
22.根据权利要求21所述的荧光生物分子,其中所述蛋白质是糖蛋白和/或所述碳水化合物是多糖。
23.一种药物组合物,该药物组合物包含权利要求1至9的任意一项所述的化合物和药学上可接受的赋形剂。
24.一种药物组合物,该药物组合物包含权利要求10至19的任意一项所述的化合物或者权利要求20或21所述的荧光生物分子和药学上可接受的赋形剂。
25.权利要求1至19的任意一项所述的化合物在制备用于体内成像的试剂中的应用,其中所述试剂用于包括下列步骤的方法:
(a)向对象给予所述化合物;
(b)使所述化合物在所述对象体内分布;以及
(c)检测由所述化合物发射的信号。
26.权利要求1至19的任意一项所述的化合物在制备用于体内光学成像的试剂中的应用,其中所述试剂用于包括下列步骤的方法:
(a)向对象给予所述化合物;
(b)使所述化合物在所述对象体内分布;
(c)将所述对象暴露于具有可以被所述化合物吸收的波长的光下;以及
(d)检测由所述化合物发射的信号。
27.权利要求1至19的任意一项所述的化合物在制备用于体外成像的试剂中的应用,其中所述试剂用于包括下列步骤的方法:
(a)将所述化合物与样品相接触;
(b)使所述化合物与生物目标结合;以及
(c)检测由所述化合物发射的信号。
28.根据权利要求27所述的应用,其中所述样品是生物样品。
29.权利要求1至19的任意一项所述的化合物在制备用于离体成像的试剂中的应用,其中所述试剂用于包括下列步骤的方法:
(a)将所述化合物与样品相接触;
(b)使所述化合物与生物目标结合;以及
(c)检测由所述化合物发射的信号。
30.根据权利要求29所述的应用,其中所述样品是生物样品。
31.根据权利要求25至27和29的任意一项所述的应用,其中由所述化合物发射的所述信号用于构建图像。
32.根据权利要求31所述的应用,其中所述图像是断层扫描图像。
33.根据权利要求25至27和29的任意一项所述的应用,由所述化合物发射的所述信号指示所述化合物的激活和/或者结合于生物目标,或者用于判定样品中分析物的存在、缺失或数量。
34.根据权利要求27或29所述的应用,其中所述信号由于酶的存在而被放大,其中所述酶结合于或邻近所述生物目标,并且其中所述酶的活性导致所述荧光化合物向所述目标、分析物或周边区域的积累或结合。
35.根据权利要求25至27和29的任意一项所述的应用,其中所述化合物经历向适合的受体或来自适合的供体的荧光共振能量转移。
36.根据权利要求25至27和29的任意一项所述的应用,其中所述方法还包括提供:
a)包含能够被适合波长的入射光激发的单线态氧增敏剂的分析物特异性结合配偶体,以及
b)包含单线态氧敏感组成部分和所述化合物的第二分析物特异性结合配偶体,
其中所述第二分析物特异性结合配偶体在单线态氧的存在下发射光,从而判定分析物的存在或数量。
37.根据权利要求27或29所述的应用,其中所述检测步骤允许了细胞的分析或成像。
38.根据权利要求37所述的应用,其中所述细胞是细胞群或完整组织的部分,并且使用显微镜、流式细胞计数器或成像流式细胞计数器进行所述分析或成像。
39.根据权利要求27或29所述的应用,其中重复所述检测步骤以依次成像多个样品。
40.根据权利要求27或29所述的应用,其中所述检测步骤在多重试验、高含量筛选试验或高含量分析试验中,允许了在一个样品或成组样品中的多个生物标志物、目标或分析物的分析。
41.根据权利要求25所述的应用,其中步骤(a)至(c)按预定时间间隔重复,从而允许在所述对象体内随时间地评估所述发射的信号。
42.根据权利要求26、27和29的任意一项所述的应用,其中步骤(a)至(d)按预定时间间隔重复,从而允许在所述对象体内随时间地评估所述发射的信号。
43.根据权利要求25或26所述的应用,其中所述对象是动物或人。
44.根据权利要求25至27和29的任意一项所述的应用,其中在步骤(a)中,向对象给予信号性质可相互区分的两种以上成像探针,其中至少一种成像探针是硅杂蒽阳离子化合物。
45.根据权利要求25至27和29的任意一项所述的应用,其中使用内窥镜、导管、断层成像系统、手持光学成像系统或者术中显微镜进行权利要求25、27或29中的步骤(c)或者权利要求26中的步骤(d)。
46.根据权利要求26所述的应用,其中使用内窥镜、导管、断层成像系统、手持光学成像系统或者术中显微镜进行步骤(c)和步骤(d)。
47.根据权利要求25至27和29的任意一项所述的应用,其中所述发射信号的存在、缺失或水平表明疾病的状态。
48.根据权利要求25至27和29的任意一项所述的应用,其中所述方法用于检测和/或监控疾病。
49.根据权利要求48所述的应用,其中所述疾病选自由骨疾病、癌症、心血管疾病、动脉粥样硬化、再狭窄、心肌缺血、心肌再灌注损伤、环境性疾病、皮肤疾病、免疫疾病、遗传疾病、传染病、炎症、代谢疾病、神经变性疾病、眼病和呼吸疾病所组成的组。
50.根据权利要求25至27和29的任意一项所述的应用,其中,在步骤(a)中,向所述对象给予用所述硅杂蒽阳离子化合物标记的细胞。
51.根据权利要求50所述的应用,其中由所述硅杂蒽阳离子化合物发射的所述信号用于监控细胞的转运和定位。
52.权利要求1至19的任意一项所述的化合物在生产用于治疗对象疾病的药物中的应用,其中所述治疗包括向对象系统地或局部地给予所述化合物,其中所述化合物包含定位于疾病区域并且传递有效剂量辐射的放射性标记物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361794188P | 2013-03-15 | 2013-03-15 | |
| US61/794,188 | 2013-03-15 | ||
| PCT/US2014/029350 WO2014144793A1 (en) | 2013-03-15 | 2014-03-14 | Substituted silaxanthenium red to near-infrared fluorochromes for in vitro and in vivo imaging and detection |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN105073761A CN105073761A (zh) | 2015-11-18 |
| CN105073761B true CN105073761B (zh) | 2020-10-20 |
Family
ID=50721890
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201480016182.XA Active CN105073761B (zh) | 2013-03-15 | 2014-03-14 | 用于体外和体内成像和检测的取代的硅杂蒽阳离子红至近红外荧光染料 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9649389B2 (zh) |
| EP (1) | EP2970342B1 (zh) |
| JP (1) | JP6606487B2 (zh) |
| CN (1) | CN105073761B (zh) |
| AU (1) | AU2014228504C1 (zh) |
| CA (1) | CA2901379C (zh) |
| WO (1) | WO2014144793A1 (zh) |
Families Citing this family (57)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007028037A1 (en) | 2005-09-02 | 2007-03-08 | Visen Medical, Inc. | Biocompatible n, n-disubstituted sulfonamide-containing fluorescent dye labels |
| US9913917B2 (en) | 2005-12-22 | 2018-03-13 | Visen Medical, Inc. | Biocompatible fluorescent metal oxide nanoparticles |
| DK2244741T3 (en) | 2008-01-18 | 2015-05-26 | Visen Medical Inc | Fluorescent imaging agents |
| JP6122840B2 (ja) | 2011-05-09 | 2017-04-26 | ビセン メディカル, インコーポレイテッド | 炭酸脱水酵素標的化剤およびそれの使用方法 |
| CN105073761B (zh) | 2013-03-15 | 2020-10-20 | 文森医学公司 | 用于体外和体内成像和检测的取代的硅杂蒽阳离子红至近红外荧光染料 |
| AU2014228808C1 (en) | 2013-03-15 | 2018-12-20 | Visen Medical, Inc. | 4,4-disubstituted cyclohexyl bridged heptamethine cyanine dyes and uses thereof |
| US9765220B2 (en) | 2013-08-22 | 2017-09-19 | Sony Corporation | Water soluble fluorescent or colored dyes and methods for their use |
| JP6462587B2 (ja) * | 2013-12-04 | 2019-01-30 | 国立大学法人 東京大学 | 近赤外線消光団 |
| CA2944476C (en) * | 2014-04-01 | 2021-06-15 | Howard Hughes Medical Institute | Azetidine-substituted fluorescent compounds |
| JP6806694B2 (ja) | 2015-02-26 | 2021-01-06 | ソニー株式会社 | 共役基を含む水溶性蛍光染料または有色染料 |
| JP6898301B2 (ja) * | 2015-07-28 | 2021-07-07 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニアThe Regents Of The University Of California | 長波長電圧感受性色素 |
| JP2017149806A (ja) * | 2016-02-22 | 2017-08-31 | 富士フイルム株式会社 | 着色組成物、インクジェット用インク、及び捺染方法 |
| US20170240951A1 (en) * | 2016-02-24 | 2017-08-24 | Saudi Arabian Oil Company | Detecting Xanthan Gum |
| RU2762328C2 (ru) | 2016-04-01 | 2021-12-17 | Сони Корпорейшн | Ультраяркие димерные или полимерные красители |
| JP7145079B2 (ja) | 2016-04-01 | 2022-09-30 | ソニーグループ株式会社 | 剛性のスペーシング基を有する超明色ダイマーまたはポリマー染料 |
| KR20180133890A (ko) | 2016-04-06 | 2018-12-17 | 소니 주식회사 | 스페이싱 링커 그룹을 포함하는 초고명도 이량체성 또는 중합체성 염료 |
| US20190137396A1 (en) * | 2016-04-28 | 2019-05-09 | National University Corporation Nagoya University | Fluorescent probe, method for detecting fluorescence, and method for using fluorescent probe |
| WO2017197014A2 (en) | 2016-05-10 | 2017-11-16 | Sony Corporation | Compositions comprising a polymeric dye and a cyclodextrin and uses thereof |
| JP7527537B2 (ja) * | 2016-05-10 | 2024-08-05 | ソニーグループ株式会社 | ペプチド骨格を有する超明色ポリマー染料 |
| US11685835B2 (en) | 2016-05-11 | 2023-06-27 | Sony Corporation | Ultra bright dimeric or polymeric dyes |
| US11377563B2 (en) | 2016-06-06 | 2022-07-05 | Sony Corporation | Ionic polymers comprising fluorescent or colored reporter groups |
| KR20190021340A (ko) * | 2016-06-22 | 2019-03-05 | 후지필름 와코 준야꾸 가부시키가이샤 | 규소 함유 복소환식 화합물 및 소광제 |
| JP7312929B2 (ja) | 2016-07-29 | 2023-07-24 | ソニーグループ株式会社 | 超明色二量体またはポリマー色素およびその調製のための方法 |
| CN110402097A (zh) * | 2016-12-07 | 2019-11-01 | 普罗根尼蒂公司 | 胃肠道检测方法、装置和系统 |
| JP7008339B2 (ja) * | 2017-02-17 | 2022-01-25 | 国立大学法人 東京大学 | ペプチダーゼ活性検出用赤色蛍光プローブ |
| WO2019071153A1 (en) | 2017-10-05 | 2019-04-11 | Sony Corporation | PROGRAMMABLE DENDRITIC MEDICINES |
| CN111315415A (zh) | 2017-10-05 | 2020-06-19 | 索尼公司 | 可编程的聚合药物 |
| CN111836645A (zh) | 2017-11-16 | 2020-10-27 | 索尼公司 | 可编程的聚合药物 |
| EP4616912A3 (en) | 2018-01-12 | 2025-11-19 | Sony Group Corporation | Phosphoalkyl ribose polymers comprising biologically active compounds |
| JP7515785B2 (ja) | 2018-01-12 | 2024-07-16 | ソニーグループ株式会社 | 生物学的に活性な化合物を含むホスホアルキルポリマー |
| US12076407B2 (en) | 2018-01-12 | 2024-09-03 | Sony Group Corporation | Polymers with rigid spacing groups comprising biologically active compounds |
| US11874280B2 (en) | 2018-03-19 | 2024-01-16 | Sony Group Corporation | Use of divalent metals for enhancement of fluorescent signals |
| WO2019182766A1 (en) | 2018-03-21 | 2019-09-26 | Sony Corporation | Polymeric tandem dyes with linker groups |
| EP3793618A4 (en) | 2018-05-18 | 2022-03-02 | Singular Genomics Systems, Inc. | DETECTABLE COMPOUNDS CONTAINING SILICON |
| KR102228538B1 (ko) * | 2018-06-01 | 2021-03-15 | 주식회사 엘지화학 | 염료 화합물 및 포토폴리머 조성물 |
| EP3814366A1 (en) | 2018-06-27 | 2021-05-05 | Sony Corporation | Polymeric dyes with linker groups comprising deoxyribose |
| KR20210043584A (ko) * | 2018-08-10 | 2021-04-21 | 라이프 테크놀로지스 코포레이션 | 규소로 치환된 로다민 염료 및 염료 접합체 |
| WO2020056046A1 (en) * | 2018-09-11 | 2020-03-19 | Oregon Health & Science University | Near-infrared nerve-sparing benzo[c]phenoxazine fluorophores |
| KR102283067B1 (ko) * | 2019-07-18 | 2021-07-28 | 아주대학교산학협력단 | 미토콘드리아를 표적으로 하는 신규한 근적외선 형광 프로브 및 이를 포함하는 종양 진단 및 치료 겸용 조성물 |
| EP3861074A2 (en) | 2019-09-26 | 2021-08-11 | Sony Group Corporation | Polymeric tandem dyes with linker groups |
| WO2021092035A1 (en) | 2019-11-07 | 2021-05-14 | Singular Genomics Systems, Inc. | Silicon containing detectable compounds and uses thereof |
| WO2021116037A1 (en) * | 2019-12-09 | 2021-06-17 | F. Hoffmann-La Roche Ag | Dicationic fluorescent dyes |
| JP7481122B2 (ja) * | 2020-02-03 | 2024-05-10 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 蛍光色素及びその利用 |
| US20240132725A1 (en) | 2020-12-07 | 2024-04-25 | Sony Group Corporation | Spacing linker group design for brightness enhancement in dimeric or polymeric dyes |
| CN113045599B (zh) * | 2021-03-17 | 2022-04-19 | 山西大学 | 一种高对比度区分癌细胞/组织的方法及荧光探针的制备 |
| JP7748474B2 (ja) * | 2021-04-01 | 2025-10-02 | アグフア-ゲヴエルト,ナームローゼ・フエンノートシヤツプ | Nir吸収カプセル |
| WO2022241418A1 (en) * | 2021-05-10 | 2022-11-17 | University Of Virginia Patent Foundation | Phosphinate ester-containing dyes having tunable properties and methods of making the same |
| CN113563298B (zh) * | 2021-07-20 | 2023-07-28 | 北京大学 | 一类含水溶性取代基罗丹明荧光染料其制备方法和应用 |
| JP7787670B2 (ja) * | 2021-08-31 | 2025-12-17 | 富士フイルム株式会社 | 化合物及びこれを用いた標識生体物質 |
| CN113801145B (zh) * | 2021-10-12 | 2022-06-07 | 南京大学 | 一种激活型近红外小分子荧光探针及其制备方法与应用 |
| CN114869227B (zh) * | 2022-04-02 | 2025-09-05 | 北京信息科技大学 | 一种可穿戴式微型活体流式图像细胞仪 |
| CN115322205B (zh) * | 2022-04-06 | 2025-09-26 | 大连理工大学 | 一类近红外二区荧光染料及制备方法与抗肿瘤应用 |
| CN119095889A (zh) * | 2022-11-04 | 2024-12-06 | 株式会社Lg化学 | 全息图记录介质、其制备方法及包括其的光学元件 |
| WO2024096360A1 (ko) * | 2022-11-04 | 2024-05-10 | 주식회사 엘지화학 | 포토폴리머 조성물, 홀로그램 기록 매체, 이의 제조 방법 및 이를 포함하는 광학 소자 |
| CN119095890A (zh) | 2022-11-04 | 2024-12-06 | 株式会社Lg化学 | 全息图记录介质和包括其的光学元件 |
| US12359068B2 (en) | 2023-02-10 | 2025-07-15 | Singular Genomics Systems, Inc. | Rhodamine fluorescent compounds and production methods thereof |
| EP4674845A1 (en) * | 2023-04-28 | 2026-01-07 | SFC Co., Ltd. | Novel compound and use thereof |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100361999C (zh) * | 2006-03-03 | 2008-01-16 | 大连理工大学 | 含硅元素的阳离子发色团及其衍生物 |
| WO2012083064A1 (en) * | 2010-12-16 | 2012-06-21 | Southern Illinois University Carbondale | Silaanthracene as a red and near infrared sensor and a method to manufacture such a sensor |
| WO2012111818A1 (ja) * | 2011-02-18 | 2012-08-23 | 国立大学法人 東京大学 | 蛍光プローブ |
| WO2013029650A1 (en) * | 2011-08-26 | 2013-03-07 | Ecole Polytechnique Federale De Lausanne (Epfl) | Cell permeable, fluorescent dye |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4219335A (en) | 1978-09-18 | 1980-08-26 | E. I. Du Pont De Nemours And Company | Immunochemical testing using tagged reagents |
| US6086737A (en) | 1984-03-29 | 2000-07-11 | Li-Cor, Inc. | Sequencing near infrared and infrared fluorescence labeled DNA for detecting using laser diodes and suitable labels therefor |
| US6048982A (en) | 1986-04-18 | 2000-04-11 | Carnegie Mellon University | Cyanine dyes as labeling reagents for detection of biological and other materials by luminescence methods |
| US5164297A (en) | 1990-05-03 | 1992-11-17 | Advanced Magnetics Inc. | Solvent mediated relaxation assay system |
| US5445970A (en) | 1992-03-20 | 1995-08-29 | Abbott Laboratories | Magnetically assisted binding assays using magnetically labeled binding members |
| AU5085793A (en) | 1992-09-04 | 1994-03-29 | General Hospital Corporation, The | Biocompatible polymers containing diagnostic or therapeutic moieties |
| DE4445065A1 (de) | 1994-12-07 | 1996-06-13 | Diagnostikforschung Inst | Verfahren zur In-vivo-Diagnostik mittels NIR-Strahlung |
| IT1276833B1 (it) | 1995-10-09 | 1997-11-03 | Sorin Biomedica Cardio Spa | Coloranti fluorescenti della famiglia della solfo benz e indocianina |
| DE19717904A1 (de) | 1997-04-23 | 1998-10-29 | Diagnostikforschung Inst | Säurelabile und enzymatisch spaltbare Farbstoffkonstrukte zur Diagnostik mit Nahinfrarotlicht und zur Therapie |
| US6046585A (en) | 1997-11-21 | 2000-04-04 | Quantum Design, Inc. | Method and apparatus for making quantitative measurements of localized accumulations of target particles having magnetic particles bound thereto |
| US6592847B1 (en) | 1998-05-14 | 2003-07-15 | The General Hospital Corporation | Intramolecularly-quenched near infrared flourescent probes |
| US6083486A (en) | 1998-05-14 | 2000-07-04 | The General Hospital Corporation | Intramolecularly-quenched near infrared fluorescent probes |
| CA2335359C (en) | 1999-04-23 | 2007-07-17 | Molecular Probes, Inc. | Xanthene dyes and their application as luminescence quenching compounds |
| EP1065250B1 (en) | 1999-07-02 | 2004-12-08 | Visen Medical, Inc. | New fluorescent cyanine labels containing a sulfamido linker arm |
| ATE352586T2 (de) | 2000-09-29 | 2007-02-15 | Molecular Probes Inc | Modifizierte carbocyaninfarbstoffe und deren konjugate |
| WO2002038190A2 (en) | 2000-10-27 | 2002-05-16 | Beth Israel Deaconess Medical Center | Non-isotopic detection of osteoblastic activity in vivo using modified bisphosphonates |
| US6615063B1 (en) | 2000-11-27 | 2003-09-02 | The General Hospital Corporation | Fluorescence-mediated molecular tomography |
| EP1209205A1 (en) | 2000-11-28 | 2002-05-29 | Innosense S.r.l. | Improved process and method for the preparation of asymetric monofunctionalised indocyanine labelling reagents and obtained compounds |
| EP1221465A1 (en) | 2001-01-03 | 2002-07-10 | Innosense S.r.l. | Symmetric, monofunctionalised polymethine dyes labelling reagents |
| US20030044353A1 (en) | 2001-01-05 | 2003-03-06 | Ralph Weissleder | Activatable imaging probes |
| AU2003207438A1 (en) | 2002-01-02 | 2003-07-24 | Visen Medical, Inc. | Amine functionalized superparamagnetic nanoparticles for the synthesis of bioconjugates and uses therefor |
| WO2003061711A2 (en) | 2002-01-16 | 2003-07-31 | Visen Medical, Inc. | Chromophore probes for optical imaging |
| WO2003079015A1 (en) | 2002-03-11 | 2003-09-25 | Visen Medical, Inc. | Optical imaging probes |
| EP2410315B1 (en) | 2002-06-04 | 2020-04-01 | Visen Medical, Inc. | Imaging volumes with arbitrary geometries in contact and non-contact tomography |
| JP4713343B2 (ja) * | 2003-09-05 | 2011-06-29 | 哲雄 長野 | 蛍光プローブ |
| US20060239916A1 (en) | 2005-01-07 | 2006-10-26 | Kai Licha | Use of cyanine dyes for the diagnosis of proliferative diseases |
| ES2612738T3 (es) | 2005-09-02 | 2017-05-18 | Visen Medical, Inc. | Agentes de formación de imágenes fluorescentes biocompatibles |
| EP1934202B1 (en) | 2005-09-02 | 2019-01-09 | Visen Medical, Inc. | Nicotinic acid and picolinic acid derived near-infrared fluorophores |
| WO2007028037A1 (en) | 2005-09-02 | 2007-03-08 | Visen Medical, Inc. | Biocompatible n, n-disubstituted sulfonamide-containing fluorescent dye labels |
| US9913917B2 (en) | 2005-12-22 | 2018-03-13 | Visen Medical, Inc. | Biocompatible fluorescent metal oxide nanoparticles |
| WO2007109364A2 (en) | 2006-03-20 | 2007-09-27 | The General Hospital Corporation | Intramolecularly quenched fluorochrome conjugates and methods of use |
| JP5643514B2 (ja) | 2007-02-09 | 2014-12-17 | ビセン メディカル, インコーポレイテッド | ポリシクロ染料およびその使用 |
| WO2008109832A2 (en) | 2007-03-08 | 2008-09-12 | Visen Medical, Inc. | Viable near-infrared fluorochrome labeled cells and methods of making and using same |
| DK2244741T3 (en) | 2008-01-18 | 2015-05-26 | Visen Medical Inc | Fluorescent imaging agents |
| JP5586485B2 (ja) | 2008-03-14 | 2014-09-10 | ビセン メディカル, インコーポレイテッド | インテグリン標的化剤およびそれらを用いるinvivoおよびinvitroでの画像化方法 |
| US8864821B2 (en) | 2008-11-26 | 2014-10-21 | Visen Medical, Inc. | Methods and compositions for identifying subjects at risk of developing stent thrombosis |
| JP5526124B2 (ja) * | 2009-04-30 | 2014-06-18 | 国立大学法人 東京大学 | 近赤外蛍光化合物 |
| US9180209B2 (en) | 2011-02-28 | 2015-11-10 | The Board Of Trustees Of The Leland Stanford Junior University | Non-peptidic quenched fluorescent imaging probes |
| JP6122840B2 (ja) | 2011-05-09 | 2017-04-26 | ビセン メディカル, インコーポレイテッド | 炭酸脱水酵素標的化剤およびそれの使用方法 |
| EP2885006B1 (en) | 2012-08-15 | 2018-08-08 | VisEn Medical, Inc. | Prostate specific antigen agents and methods of using same for prostate cancer imaging |
| WO2014152298A1 (en) * | 2013-03-15 | 2014-09-25 | Promega Corporation | New silicon and germanium dyes for use in genetic identity |
| CN105073761B (zh) | 2013-03-15 | 2020-10-20 | 文森医学公司 | 用于体外和体内成像和检测的取代的硅杂蒽阳离子红至近红外荧光染料 |
| AU2014228808C1 (en) | 2013-03-15 | 2018-12-20 | Visen Medical, Inc. | 4,4-disubstituted cyclohexyl bridged heptamethine cyanine dyes and uses thereof |
-
2014
- 2014-03-14 CN CN201480016182.XA patent/CN105073761B/zh active Active
- 2014-03-14 EP EP14723931.3A patent/EP2970342B1/en active Active
- 2014-03-14 CA CA2901379A patent/CA2901379C/en active Active
- 2014-03-14 AU AU2014228504A patent/AU2014228504C1/en active Active
- 2014-03-14 WO PCT/US2014/029350 patent/WO2014144793A1/en not_active Ceased
- 2014-03-14 JP JP2016503068A patent/JP6606487B2/ja active Active
- 2014-03-17 US US14/215,979 patent/US9649389B2/en active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100361999C (zh) * | 2006-03-03 | 2008-01-16 | 大连理工大学 | 含硅元素的阳离子发色团及其衍生物 |
| WO2012083064A1 (en) * | 2010-12-16 | 2012-06-21 | Southern Illinois University Carbondale | Silaanthracene as a red and near infrared sensor and a method to manufacture such a sensor |
| WO2012111818A1 (ja) * | 2011-02-18 | 2012-08-23 | 国立大学法人 東京大学 | 蛍光プローブ |
| WO2013029650A1 (en) * | 2011-08-26 | 2013-03-07 | Ecole Polytechnique Federale De Lausanne (Epfl) | Cell permeable, fluorescent dye |
Non-Patent Citations (6)
| Title |
|---|
| Design Strategy for a Near-Infrared Fluorescence Probe for Matrix Metalloproteinase Utilizing Highly Cell Permeable Boron Dipyrromethene;Takuya Myochin et al.;《Journal of the American Chemical Society》;20120725;第134卷;摘要,Figure2a、5a * |
| Development of an Si-Rhodamine-Based Far-Red to Near-Infrared Fluorescence Probe Selective for Hypochlorous Acid and Its Applications for Biological Imaging;Yuichiro Koide et al;《Journal of the American Chemical Society》;20110328;第133卷;参见第5680页摘要及Figure 1 * |
| Evolution of Group 14 Rhodamines as Platforms for Near-Infrared Fluorescence Probes Utilizing Photoinduced Electron Transfer;Yuichiro Koide et al.;《ACS Chemical Biology》;20110304;第6卷;摘要,Figure1、2、4、6 * |
| Ting Wang et al..Spirolactonized Si-rhodamine: a novel NIR fluorophore utilized as a platform to construct Si-rhodamine-based probes.《Chem. Commun.》.2012,第48卷 * |
| Yu Kushida et al..Red fluorescent scaffold for highly sensitive protease activity probes.《Bioorganic & Medicinal Chemistry Letters》.2012,第22卷 * |
| Yuichiro Koide et al..Development of NIR Fluorescent Dyes Based on Si−rhodamine for in Vivo Imaging.《Journal of the American Chemical Society》.2012,第134卷 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US9649389B2 (en) | 2017-05-16 |
| WO2014144793A1 (en) | 2014-09-18 |
| AU2014228504B2 (en) | 2019-04-11 |
| JP2016521254A (ja) | 2016-07-21 |
| US20140314677A1 (en) | 2014-10-23 |
| CN105073761A (zh) | 2015-11-18 |
| EP2970342B1 (en) | 2024-01-24 |
| AU2014228504C1 (en) | 2019-10-03 |
| CA2901379C (en) | 2023-05-16 |
| EP2970342A1 (en) | 2016-01-20 |
| CA2901379A1 (en) | 2014-09-18 |
| AU2014228504A1 (en) | 2015-08-27 |
| JP6606487B2 (ja) | 2019-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN105073761B (zh) | 用于体外和体内成像和检测的取代的硅杂蒽阳离子红至近红外荧光染料 | |
| US20240393330A1 (en) | 4,4-disubstituted cyclohexyl bridged heptamethine cyanine dyes and uses thereof | |
| JP5643514B2 (ja) | ポリシクロ染料およびその使用 | |
| US11549017B2 (en) | NIR to SWIR fluorescent compounds for imaging and detection |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |