CN104981541B - 具有改进特性的经修饰的卷曲螺旋型蛋白 - Google Patents
具有改进特性的经修饰的卷曲螺旋型蛋白 Download PDFInfo
- Publication number
- CN104981541B CN104981541B CN201380072637.5A CN201380072637A CN104981541B CN 104981541 B CN104981541 B CN 104981541B CN 201380072637 A CN201380072637 A CN 201380072637A CN 104981541 B CN104981541 B CN 104981541B
- Authority
- CN
- China
- Prior art keywords
- protein
- modified
- antigen
- seq
- imx313
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000623 proteins and genes Proteins 0.000 title claims abstract description 244
- 102000004169 proteins and genes Human genes 0.000 title claims abstract description 229
- 230000001976 improved effect Effects 0.000 title description 29
- 239000000427 antigen Substances 0.000 claims abstract description 119
- 102000036639 antigens Human genes 0.000 claims abstract description 119
- 108091007433 antigens Proteins 0.000 claims abstract description 119
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 92
- 102000035118 modified proteins Human genes 0.000 claims abstract description 50
- 108091005573 modified proteins Proteins 0.000 claims abstract description 50
- 230000005847 immunogenicity Effects 0.000 claims abstract description 45
- 102000014914 Carrier Proteins Human genes 0.000 claims abstract description 36
- 108010078791 Carrier Proteins Proteins 0.000 claims abstract description 35
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 claims abstract description 31
- 229960002897 heparin Drugs 0.000 claims abstract description 31
- 229920000669 heparin Polymers 0.000 claims abstract description 31
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 31
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 30
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 30
- 230000001965 increasing effect Effects 0.000 claims abstract description 15
- 229920000642 polymer Polymers 0.000 claims abstract description 5
- 108010061100 Nucleoproteins Proteins 0.000 claims description 108
- 102000011931 Nucleoproteins Human genes 0.000 claims description 106
- 102000037865 fusion proteins Human genes 0.000 claims description 58
- 108020001507 fusion proteins Proteins 0.000 claims description 58
- 239000003446 ligand Substances 0.000 claims description 48
- 102000002689 Toll-like receptor Human genes 0.000 claims description 38
- 108020000411 Toll-like receptor Proteins 0.000 claims description 38
- 238000000034 method Methods 0.000 claims description 23
- 239000000203 mixture Substances 0.000 claims description 18
- 230000002163 immunogen Effects 0.000 claims description 17
- 230000003834 intracellular effect Effects 0.000 claims description 17
- 206010022000 influenza Diseases 0.000 claims description 13
- 229960005486 vaccine Drugs 0.000 claims description 11
- 241000191967 Staphylococcus aureus Species 0.000 claims description 5
- 238000002360 preparation method Methods 0.000 claims description 4
- NMJREATYWWNIKX-UHFFFAOYSA-N GnRH Chemical compound C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CC(C)C)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 NMJREATYWWNIKX-UHFFFAOYSA-N 0.000 claims description 3
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 claims description 3
- 230000009385 viral infection Effects 0.000 claims description 2
- 208000015181 infectious disease Diseases 0.000 claims 2
- 206010041925 Staphylococcal infections Diseases 0.000 claims 1
- 230000002265 prevention Effects 0.000 claims 1
- 241000712461 unidentified influenza virus Species 0.000 claims 1
- 150000001413 amino acids Chemical class 0.000 abstract description 29
- 239000004475 Arginine Substances 0.000 abstract description 10
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 abstract description 10
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 abstract description 7
- 239000004472 Lysine Substances 0.000 abstract description 7
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 abstract description 6
- 235000018102 proteins Nutrition 0.000 description 221
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 64
- 230000004044 response Effects 0.000 description 61
- 239000013612 plasmid Substances 0.000 description 56
- 241000699670 Mus sp. Species 0.000 description 49
- 239000011780 sodium chloride Substances 0.000 description 32
- 230000003053 immunization Effects 0.000 description 27
- 238000002649 immunization Methods 0.000 description 26
- 102000004196 processed proteins & peptides Human genes 0.000 description 26
- 235000001014 amino acid Nutrition 0.000 description 25
- 108020004414 DNA Proteins 0.000 description 24
- 238000002965 ELISA Methods 0.000 description 24
- 108091034117 Oligonucleotide Proteins 0.000 description 24
- 239000002671 adjuvant Substances 0.000 description 23
- 210000004027 cell Anatomy 0.000 description 23
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 23
- 230000004927 fusion Effects 0.000 description 21
- 229940046168 CpG oligodeoxynucleotide Drugs 0.000 description 18
- 230000027455 binding Effects 0.000 description 18
- 239000000872 buffer Substances 0.000 description 18
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 18
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 17
- 230000005867 T cell response Effects 0.000 description 17
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 17
- 229920002684 Sepharose Polymers 0.000 description 16
- 239000000499 gel Substances 0.000 description 15
- 210000001744 T-lymphocyte Anatomy 0.000 description 14
- 230000028993 immune response Effects 0.000 description 14
- 239000000047 product Substances 0.000 description 14
- 239000013598 vector Substances 0.000 description 14
- 230000000694 effects Effects 0.000 description 13
- 238000000746 purification Methods 0.000 description 13
- 230000004048 modification Effects 0.000 description 12
- 238000012986 modification Methods 0.000 description 12
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 11
- 235000009697 arginine Nutrition 0.000 description 11
- 238000002523 gelfiltration Methods 0.000 description 11
- 230000014509 gene expression Effects 0.000 description 11
- 150000003839 salts Chemical class 0.000 description 11
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 10
- 108010076504 Protein Sorting Signals Proteins 0.000 description 10
- 230000005875 antibody response Effects 0.000 description 10
- 239000013604 expression vector Substances 0.000 description 10
- 239000006228 supernatant Substances 0.000 description 10
- 229920000936 Agarose Polymers 0.000 description 9
- 108091036414 Polyinosinic:polycytidylic acid Proteins 0.000 description 9
- 230000001580 bacterial effect Effects 0.000 description 9
- 239000012634 fragment Substances 0.000 description 9
- 230000028327 secretion Effects 0.000 description 9
- 210000002966 serum Anatomy 0.000 description 9
- 102100037084 C4b-binding protein alpha chain Human genes 0.000 description 8
- 101710159767 C4b-binding protein alpha chain Proteins 0.000 description 8
- 101000831496 Homo sapiens Toll-like receptor 3 Proteins 0.000 description 8
- 102000008235 Toll-Like Receptor 9 Human genes 0.000 description 8
- 108010060818 Toll-Like Receptor 9 Proteins 0.000 description 8
- 102100024324 Toll-like receptor 3 Human genes 0.000 description 8
- 230000035772 mutation Effects 0.000 description 8
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 7
- 108020004705 Codon Proteins 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 7
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 7
- 238000005119 centrifugation Methods 0.000 description 7
- 239000002773 nucleotide Substances 0.000 description 7
- 125000003729 nucleotide group Chemical group 0.000 description 7
- 229940115272 polyinosinic:polycytidylic acid Drugs 0.000 description 7
- 239000013615 primer Substances 0.000 description 7
- 230000003248 secreting effect Effects 0.000 description 7
- 239000001488 sodium phosphate Substances 0.000 description 7
- 229910000162 sodium phosphate Inorganic materials 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 238000000527 sonication Methods 0.000 description 7
- 230000003393 splenic effect Effects 0.000 description 7
- 210000004988 splenocyte Anatomy 0.000 description 7
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 7
- 238000005406 washing Methods 0.000 description 7
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 description 6
- 108091026890 Coding region Proteins 0.000 description 6
- 241000588724 Escherichia coli Species 0.000 description 6
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 6
- 238000010162 Tukey test Methods 0.000 description 6
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 6
- 238000000246 agarose gel electrophoresis Methods 0.000 description 6
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 6
- 230000005012 migration Effects 0.000 description 6
- 238000013508 migration Methods 0.000 description 6
- 238000006384 oligomerization reaction Methods 0.000 description 6
- 238000001543 one-way ANOVA Methods 0.000 description 6
- 239000008188 pellet Substances 0.000 description 6
- 108010006464 Hemolysin Proteins Proteins 0.000 description 5
- 108091005804 Peptidases Proteins 0.000 description 5
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 5
- 239000007983 Tris buffer Substances 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000000875 corresponding effect Effects 0.000 description 5
- 238000010828 elution Methods 0.000 description 5
- 230000006872 improvement Effects 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 108010011110 polyarginine Proteins 0.000 description 5
- 230000011664 signaling Effects 0.000 description 5
- 210000000952 spleen Anatomy 0.000 description 5
- 230000000638 stimulation Effects 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 5
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- 102100021935 C-C motif chemokine 26 Human genes 0.000 description 4
- 102000053602 DNA Human genes 0.000 description 4
- 239000003155 DNA primer Substances 0.000 description 4
- 241000606768 Haemophilus influenzae Species 0.000 description 4
- 101000897493 Homo sapiens C-C motif chemokine 26 Proteins 0.000 description 4
- 101150118742 NP gene Proteins 0.000 description 4
- 102000035195 Peptidases Human genes 0.000 description 4
- 239000004365 Protease Substances 0.000 description 4
- 239000008049 TAE buffer Substances 0.000 description 4
- HGEVZDLYZYVYHD-UHFFFAOYSA-N acetic acid;2-amino-2-(hydroxymethyl)propane-1,3-diol;2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetic acid Chemical compound CC(O)=O.OCC(N)(CO)CO.OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O HGEVZDLYZYVYHD-UHFFFAOYSA-N 0.000 description 4
- 238000001042 affinity chromatography Methods 0.000 description 4
- 210000003719 b-lymphocyte Anatomy 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 230000009918 complex formation Effects 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 239000006166 lysate Substances 0.000 description 4
- 239000000178 monomer Substances 0.000 description 4
- VQWNELVFHZRFIB-UHFFFAOYSA-N odn 1826 Chemical compound O=C1NC(=O)C(C)=CN1C(O1)CC(O)C1COP(O)(=O)OC1CC(N2C(NC(=O)C(C)=C2)=O)OC1COP(O)(=O)OC1CC(N2C3=C(C(NC(N)=N3)=O)N=C2)OC1COP(O)(=O)OC1CC(N2C(N=C(N)C=C2)=O)OC1COP(O)(=O)OC1CC(N2C3=NC=NC(N)=C3N=C2)OC1COP(O)(=O)OC1CC(N2C3=C(C(NC(N)=N3)=O)N=C2)OC1COP(O)(=O)OC1CC(N2C(NC(=O)C(C)=C2)=O)OC1COP(O)(=O)OC1CC(N2C(N=C(N)C=C2)=O)OC1COP(O)(=O)OC1CC(N2C(N=C(N)C=C2)=O)OC1COP(O)(=O)OC1CC(N2C(NC(=O)C(C)=C2)=O)OC1COP(O)(=O)OC(C(O1)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=O)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(O)=O)CC1N1C=C(C)C(=O)NC1=O VQWNELVFHZRFIB-UHFFFAOYSA-N 0.000 description 4
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 4
- 239000013603 viral vector Substances 0.000 description 4
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 3
- 241000271566 Aves Species 0.000 description 3
- 238000011725 BALB/c mouse Methods 0.000 description 3
- 108010041986 DNA Vaccines Proteins 0.000 description 3
- 238000011238 DNA vaccination Methods 0.000 description 3
- 229940021995 DNA vaccine Drugs 0.000 description 3
- 241000287828 Gallus gallus Species 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 101710154606 Hemagglutinin Proteins 0.000 description 3
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000588655 Moraxella catarrhalis Species 0.000 description 3
- 241000588650 Neisseria meningitidis Species 0.000 description 3
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 3
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 3
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 3
- 101710176177 Protein A56 Proteins 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108020004682 Single-Stranded DNA Proteins 0.000 description 3
- 101000582398 Staphylococcus aureus Replication initiation protein Proteins 0.000 description 3
- 108700005078 Synthetic Genes Proteins 0.000 description 3
- 101800001690 Transmembrane protein gp41 Proteins 0.000 description 3
- 241000607447 Yersinia enterocolitica Species 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000004202 carbamide Substances 0.000 description 3
- 230000036755 cellular response Effects 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 238000003501 co-culture Methods 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 239000012228 culture supernatant Substances 0.000 description 3
- 210000004443 dendritic cell Anatomy 0.000 description 3
- 238000002337 electrophoretic mobility shift assay Methods 0.000 description 3
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 239000003228 hemolysin Substances 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 229960003971 influenza vaccine Drugs 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 230000021633 leukocyte mediated immunity Effects 0.000 description 3
- 238000011068 loading method Methods 0.000 description 3
- 229910052759 nickel Inorganic materials 0.000 description 3
- 229920000724 poly(L-arginine) polymer Polymers 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 229940098232 yersinia enterocolitica Drugs 0.000 description 3
- PAHHYDSPOXDASW-VGWMRTNUSA-N (2s)-6-amino-2-[[(2s)-6-amino-2-[[(2s)-1-[(2s)-2-amino-3-hydroxypropanoyl]pyrrolidine-2-carbonyl]amino]hexanoyl]amino]hexanoic acid Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CO PAHHYDSPOXDASW-VGWMRTNUSA-N 0.000 description 2
- OXEUETBFKVCRNP-UHFFFAOYSA-N 9-ethyl-3-carbazolamine Chemical compound NC1=CC=C2N(CC)C3=CC=CC=C3C2=C1 OXEUETBFKVCRNP-UHFFFAOYSA-N 0.000 description 2
- 241000606660 Bartonella Species 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 241000223935 Cryptosporidium Species 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 241001115402 Ebolavirus Species 0.000 description 2
- 238000011510 Elispot assay Methods 0.000 description 2
- 206010015150 Erythema Diseases 0.000 description 2
- 208000031886 HIV Infections Diseases 0.000 description 2
- 241000630665 Hada Species 0.000 description 2
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 2
- 241000713340 Human immunodeficiency virus 2 Species 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 101000878457 Macrocallista nimbosa FMRFamide Proteins 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 239000000020 Nitrocellulose Substances 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- 241000725643 Respiratory syncytial virus Species 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 108010088160 Staphylococcal Protein A Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 230000024932 T cell mediated immunity Effects 0.000 description 2
- 102100035824 Unconventional myosin-Ig Human genes 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 150000001484 arginines Chemical class 0.000 description 2
- 229960002685 biotin Drugs 0.000 description 2
- 235000020958 biotin Nutrition 0.000 description 2
- 239000011616 biotin Substances 0.000 description 2
- 238000005341 cation exchange Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 210000001163 endosome Anatomy 0.000 description 2
- 231100000321 erythema Toxicity 0.000 description 2
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 2
- 229960005542 ethidium bromide Drugs 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 229940047650 haemophilus influenzae Drugs 0.000 description 2
- 239000000185 hemagglutinin Substances 0.000 description 2
- 230000028996 humoral immune response Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 238000005342 ion exchange Methods 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 230000002794 monomerizing effect Effects 0.000 description 2
- 229920001220 nitrocellulos Polymers 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 108010015840 seryl-prolyl-lysyl-lysine Proteins 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- YYGNTYWPHWGJRM-AAJYLUCBSA-N squalene Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CC\C=C(/C)CC\C=C(/C)CCC=C(C)C YYGNTYWPHWGJRM-AAJYLUCBSA-N 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 1
- 101800001890 Atrial natriuretic peptide Proteins 0.000 description 1
- 241001518086 Bartonella henselae Species 0.000 description 1
- 101000971127 Bartonella henselae Autotransporter adhesin BadA Proteins 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 1
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- 102000003670 Carboxypeptidase B Human genes 0.000 description 1
- 108090000087 Carboxypeptidase B Proteins 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 102100023755 Coiled-coil domain-containing protein 192 Human genes 0.000 description 1
- 101150069153 Cp15 gene Proteins 0.000 description 1
- 108091029430 CpG site Proteins 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 102100035102 E3 ubiquitin-protein ligase MYCBP2 Human genes 0.000 description 1
- 102000018389 Exopeptidases Human genes 0.000 description 1
- 108010091443 Exopeptidases Proteins 0.000 description 1
- 101710133291 Hemagglutinin-neuraminidase Proteins 0.000 description 1
- 101000978235 Homo sapiens Coiled-coil domain-containing protein 192 Proteins 0.000 description 1
- 101000754919 Homo sapiens Ribosomal oxygenase 2 Proteins 0.000 description 1
- 101000800483 Homo sapiens Toll-like receptor 8 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 102000003960 Ligases Human genes 0.000 description 1
- 108090000364 Ligases Proteins 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 108010061306 Lipoprotein Receptors Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 101100481581 Mus musculus Tlr13 gene Proteins 0.000 description 1
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 1
- 102000010168 Myeloid Differentiation Factor 88 Human genes 0.000 description 1
- 108010077432 Myeloid Differentiation Factor 88 Proteins 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000010359 Newcastle Disease Diseases 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 108020002230 Pancreatic Ribonuclease Proteins 0.000 description 1
- 102000005891 Pancreatic ribonuclease Human genes 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 101710194807 Protective antigen Proteins 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 102000002278 Ribosomal Proteins Human genes 0.000 description 1
- 108010000605 Ribosomal Proteins Proteins 0.000 description 1
- 102100022092 Ribosomal oxygenase 2 Human genes 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000012506 Sephacryl® Substances 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 108700034501 Staphylococcus aureus auR Proteins 0.000 description 1
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 1
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 1
- 102000008230 Toll-like receptor 3 Human genes 0.000 description 1
- 108010060885 Toll-like receptor 3 Proteins 0.000 description 1
- 102100033110 Toll-like receptor 8 Human genes 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 241000282485 Vulpes vulpes Species 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 229940092524 bartonella henselae Drugs 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000003114 blood coagulation factor Substances 0.000 description 1
- 238000005277 cation exchange chromatography Methods 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000011210 chromatographic step Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 210000004087 cornea Anatomy 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 108091008039 hormone receptors Proteins 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 239000012160 loading buffer Substances 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 210000004898 n-terminal fragment Anatomy 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 229940046166 oligodeoxynucleotide Drugs 0.000 description 1
- 229940092253 ovalbumin Drugs 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 239000012466 permeate Substances 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- -1 polymerases Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-M sodium bicarbonate Substances [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 230000036964 tight binding Effects 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
- C07K14/4703—Inhibitors; Suppressors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0006—Contraceptive vaccins; Vaccines against sex hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/002—Protozoa antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/04—Mycobacterium, e.g. Mycobacterium tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/085—Staphylococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/385—Haptens or antigens, bound to carriers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/305—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Micrococcaceae (F)
- C07K14/31—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Micrococcaceae (F) from Staphylococcus (G)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/62—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier
- A61K2039/627—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier characterised by the linker
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/64—Medicinal preparations containing antigens or antibodies characterised by the architecture of the carrier-antigen complex, e.g. repetition of carrier-antigen units
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/40—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/73—Fusion polypeptide containing domain for protein-protein interaction containing coiled-coiled motif (leucine zippers)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Virology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Communicable Diseases (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Pulmonology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Reproductive Health (AREA)
- Wood Science & Technology (AREA)
- Toxicology (AREA)
- Oncology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Analytical Chemistry (AREA)
Abstract
本发明涉及一种经修饰的蛋白,其包含具有卷曲螺旋结构域的蛋白和具有如SEQ ID NO:1所示序列:ZXBBBBZ的肽,所述肽连接到卷曲螺旋结构域,其中:·Z是任意氨基酸或是缺失的;·X是任意氨基酸;·B是精氨酸(R)或赖氨酸(K)。所述经修饰的蛋白具体而言是一种抗原或与抗原相连的载体蛋白。这种经修饰的蛋白对带负电荷的聚合体(如核酸或肝素)具有增加的亲和性,并显示出增加的免疫原性。
Description
本发明涉及含有卷曲螺旋(coiled coil)结构域的重组抗原或与含有卷曲螺旋的蛋白融合的抗原,其中所述卷曲螺旋是经修饰的。该修饰改进了所述抗原的免疫原性。同时,其改进了它们结合带负电荷的聚合物(如核酸,包括DNA和RNA)以及结合肝素的能力。
背景技术
卷曲螺旋是蛋白质中的一种结构基序,其中α-螺旋如绳线般卷曲在一起。卷曲螺旋结构域在天然蛋白中含量丰富(1,2),并且可能是自然界中对蛋白进行寡聚化的最普遍的方式。卷曲螺旋由相互缠绕成超螺旋的两个或更多α-螺旋组成,所述超螺旋是一种简单但多用的蛋白折叠(3)。典型的卷曲螺旋一级序列是重复的,由称为“七肽(heptad)”的七残基重复序列构成。
许多卷曲螺旋型蛋白与重要的生物学功能有关。此处重点关注的是那些抗原中或载体蛋白中发现的卷曲螺旋。
抗原中发现的卷曲螺旋的例子包括但不限于:
i)在OCA家族(其中OCA意指低聚的卷曲螺旋附着)中发现的二聚的卷曲螺旋:例子有NadA,一种脑膜炎奈瑟氏球菌(Neisseria meningitidis)保护性抗原(4);来自小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)的YadA(5);来自粘膜炎莫拉氏菌(Moraxellacatarrhalis)的UspA2(6);来自汉氏巴尔通氏体(Bartonella henselae)的BadA(7)和来自流感嗜血杆菌(Haemophilus influenza)的HadA(8)。
ii)在流感血凝素HA2蛋白中(除其他以外)发现的三聚的卷曲螺旋(9)、呼吸道合胞体病毒的F糖蛋白(10)、HIV-1(11)和HIV-2(12)的gp41糖蛋白、和埃博拉病毒的gp1,2(13)。
iii)在新城病NH(血凝素-神经氨酸酶)糖蛋白和其他副黏液病毒(14,以及其中的参考文献)中发现的四聚的卷曲螺旋。载体蛋白具体用于改进抗原的免疫原性。含有卷曲螺旋的载体蛋白此前已有描述,尤其是来源于COMP(15)的五聚体和同样形成五聚体的人工序列(34),以及来源于哺乳动物C4bp寡聚化结构域(如鼠类结构域IMX108(16),或鸟类C4bp寡聚化结构域(16,WO 2005/077976和WO 2007/062819))的五聚体。称为IMX313(WO 2007/062819)的杂聚的(hybrid)鸟类寡聚化结构域在此处用作实例。
现有技术
在现有技术中,卷曲螺旋一直是大量研究的主题以理解什么决定它们的寡聚化状态以及它们的螺旋的相关取向(orientation)(平行的或反平行的)(35)。但是,一直缺乏通过修饰抗原的卷曲螺旋从而改进其免疫原性的研究。现有技术关注组群中有两个值得注意的例子涉及到了疫苗产业中,出于免疫接种的考虑,其需要纯化两种包含卷曲螺旋的分开的抗原(10,36,37);但两组均未修饰抗原中的卷曲螺旋。
在现有技术中已经显示,一些特定的肽改进缺乏卷曲螺旋的单体蛋白的结合特性。已经显示,当多聚精氨酸尾部与重组蛋白融合时,其更易于通过离子交换层析法进行纯化(17,18)。在此前的使用中,在通过酶方法纯化后将额外的精氨酸移除(17,18),或者将其留在原处并用于酶固定化和/或重折叠(19,20)。将短如六个连续精氨酸的肽用于将单体酶固定化于肝素-Sepharose柱上,防止单体通过基质结合而聚集并允许的酶的再次使用(19,20)。Fuchs和Raines已经显示了9个氨基酸的多聚精氨酸标签能用于将单体酶(RNase A)固定在多种支持物上,如玻璃和硅土树脂(22)。
已经公开了其他的核酸结合肽,如基序SPKK(其在1980年代鉴定为DNA结合基序)以及含有基序SPKK的肽,能够结合双链DNA(21)。然而,未证明对RNA或单链DNA的结合,并且Suzuki的数据强有力地表明对单链DNA的结合是不会发生的,因为只有双螺旋分子中存在小沟。
其他已显示结合DNA的肽包括乙型肝炎核心抗原的鱼精蛋白样结构域(38),其含有肽序列SPRRRRS,用于本申请的一些例子中。
然而,一些多聚精氨酸尾部非常易被蛋白酶切割,尤其是丝氨酸蛋白酶,并且它们在常规用途中已经被多聚组氨酸标签所替代,二者均用于纯化和固定化目的(45)。
另外在现有技术中,已经将肽与单体蛋白融合以改进它们的免疫原性。Shibagaki及同事已显示蛋白转导结构域(protein transduction domains,PTDs)能用于改进体外树突细胞(DCs)的转导,并显示当转导的DCs再次注入动物时,得到了抗原的改进的免疫原性(43)。此外,Shimada及同事已经显示无论是直接注入表达所述蛋白的肿瘤时还是皮内注射时(41),多聚精氨酸肽都能改进其融合的蛋白,卵清蛋白的免疫原性(42)。
最为纯化的抗原是弱免疫原性的。已使用佐剂来增加它们的免疫原性。先前已经证明使用C4bp蛋白的含有卷曲螺旋的小结构域以增加抗原的免疫原性:
·WO 2007/062819描述了一种复合物,其包含作为第一组分的鸟类C4bp结构域和作为第二组分的抗原,所述组分以融合蛋白的形式存在或非共价地结合。这种复合物在施用于生物体时显示了抗原的增加的免疫原性。
·WO 2011/045612描述了含有来自鸡的C4bp蛋白的片段的融合蛋白,以及分枝杆菌抗原85A。所述杂合蛋白不仅在如啮齿类的动物中且在灵长类中都改进了85A免疫原性。
此外,为了改进固定化的方法,通过TLR受体诱导信号传输也是非常重要的,但其至少与能限制这种信号传输同样重要。Toll样受体(TLRs)是一类在天然免疫系统中起重要作用的蛋白。一旦微生物破坏了生物体的物理屏障,它们就被TLRs所识别。微生物被识别的特征包括病毒的双链RNA、细菌的未甲基化的CpG位点、和某些其他RNA和DNA分子。
在这种核酸中存在实质利害关系,因为它们是一类Toll样受体(下文称为TLRs)的配体,尤其是TLR3、TLR7、TLR8、TLR9和TLR13的配体(23及其中的参考文献)。这些有时被归类为“细胞内Toll样受体”,但至少TLR3也在一些细胞表面存在(24)。TLR7和TLR9定位在细胞内区室(尤其是内质网和内体(endosome))中,并且已经清楚地显示对于TLR9和TLR7而言,受体的切割对于MyD88的激活是必需的,通过所述激活受体的配体进行信号传输(25,26)。因为这种切割仅在内吞溶酶体(endolysosomes)中发生,其可能是一种进化适应,以避免来自自身核酸的不适当的信号传输。
TLR3通过多种上皮细胞表达,包括气道、子宫、角膜、阴道、子宫颈、胆和肠的上皮细胞,并且这些细胞表现出在其细胞表面表达TLR3(24)。因此,可能并不令人惊讶的是,对聚I:C的施用与一些不良反应有关(26)。在那项研究中,采用了以3毫克/克的剂量的重复施用。如果小鼠平均重量为约35g,则重复施用100mg的剂量能诱导这些反应。在此处所述的免疫接种中我们仅需2.5μg的多聚I:C/剂。
通过这些受体(尤其是TLR3受体)来限制信号传输的重要性是剂量依赖性的。因而核配体紧密结合到抗原的优势是必不可少的。因此,紧密结合的细胞内TLR配体相对于那些结合较不紧密的制剂是高度优选的。因此,本领域技术人员寻求能够有效结合TLR配体的抗原组合物,以使其在抗原到达细胞内(所述抗原在此处引发免疫响应)之前不与抗原分离,其目的在于减少由于配体与别处的TLR受体结合所介导的潜在不良作用。
发明内容
本发明涉及包含卷曲螺旋结构域的蛋白,所述卷曲螺旋结构域通过带正电荷的肽与卷曲螺旋结构域的连接而被修饰。经修饰的卷曲螺旋型蛋白具有改进的免疫原性和同时具有针对带负电荷的聚合物(例如肝素和核酸)的改进的结合特性。所有卷曲螺旋蛋白都是重组的,并且修饰是通过将短肽序列与卷曲螺旋的端点融合而得到的。在此处的例子中,所述修饰是通过遗传工程技术进行的,但也存在获得经修饰的卷曲螺旋的其他方法,如肽合成。
带正电荷的肽优选包括精氨酸,但也能替代地包括赖氨酸,或二者的组合。这种肽是短的,其包含七个氨基酸或更少,尤其是5、6或7个氨基酸。一种或多种肽可用于卷曲螺旋的每条链。
形成的连接直接地(或是经过包含一个或多个不影响卷曲螺旋结构域、带正电荷的肽及其组合的技术效果的氨基酸的接头肽)连到卷曲螺旋结构域。接头可以含有任何氨基酸,但优选的接头含有甘氨酸、丝氨酸或脯氨酸,或其组合。
在一组例子中,经修饰的蛋白是来源于鸡C4bp蛋白的载体蛋白IMX313。
本发明还涉及包含经修饰的卷曲螺旋载体蛋白与抗原融合的融合蛋白。
本发明还涉及包含经修饰的卷曲螺旋结构域的经修饰的抗原。
本发明还涉及免疫原性的组合物,其包含经修饰的融合蛋白或经修饰的抗原、以及针对细胞内TLRs的核酸配体。
本发明还涉及携带本发明经修饰的蛋白的支持物,与支持物的连接是通过连接到卷曲螺旋结构域的肽形成的。支持物肝素能用于体外或体内。用于使用肝素以改进带正电荷的蛋白免疫原性的方法是熟知的(47,及其中的参考文献)。
本申请还涉及经修饰的抗原的用途或如上所述的经修饰的融合蛋白或免疫原性组合物的用途,其用于在患者中诱导免疫响应。
根据本申请的经修饰的卷曲螺旋型蛋白(其中带正电荷的肽连接到经修饰的蛋白的卷曲螺旋结构域)与相应的非修饰蛋白相比表现出优势,并且特别是:
-更好地结合带负电荷的层析柱,如阳离子交换层析柱SP FF,并且尤其是肝素-Sepharose(琼脂糖)柱;
-更好地结合核酸;
-在载体蛋白和抗原的情况中,抗原的增加的免疫原性,所述抗原是这些经修饰的卷曲螺旋型蛋白,或者抗原的增加的免疫原性,所述抗原与所述经修饰的载体蛋白有关。
发明详述
在详细描述本发明之前,应理解的是,本发明并不限于具体示例的方法,并且当然可以进行变化。具体而言,本发明涉及经修饰的具有卷曲螺旋结构域的抗原,并且不限于具体的载体蛋白或具体的含有卷曲螺旋的抗原。
此处引用的所有出版物、专利和专利申请,无论其在上文还是下文,均在此通过提述以其整体并入。然而,此处提及的出版物是出于描述和公开出版物中所报道的及可与本发明相关使用的试验方案、试剂及载体的目的而引用的。
并且,除非另有指明,本发明的实施采用的是本领域技术之内的常规蛋白纯化及分子生物学技术。这些技术是本领域技术人员所熟知的,并且在文献中进行了充分解释。在本发明说明书所附的权利要求中以及连续的说明书中,除了在上下文根据语言表达或必要指示而另有需要的地方以外,词语“包含”“含有”“涉及”或“包括”或变型如“包含(comprises)”、“包含(comprising)”、“含有(containing)”、“涉及的(involved)”、“包括(includes)”、“包括(including)”用于含括的意思,即在本发明实施方案中指明所述特征的存在,但并不排除其他特征的存在或添加。
对下列术语进行限定以更好地理解本发明:
“卷曲螺旋型蛋白”,也称为“含有卷曲螺旋的蛋白”或“具有卷曲螺旋结构域的蛋白”指的是包含卷曲螺旋基序的蛋白,即至少两个α-螺旋链相互缠绕成超螺旋。几种含有这种卷曲螺旋的蛋白已在文献中报道。根据本发明,优选的卷曲螺旋型蛋白是抗原和载体蛋白。
“载体蛋白”通常指的是这样的蛋白,抗原缀合或融合到所述蛋白上,并由此所述抗原被赋予更强的免疫原性。该术语在此处具体用于携带抗原的蛋白的含义中。所述蛋白的功能是增加其缀合或融合的所述抗原的免疫原性。融合具有创造同质(homogenous)产物的优势。更正式地讲,“缀合”能描述为遗传性的:将编码促免疫原性标签或载体蛋白的DNA剪接到编码抗原的DNA。虽然有传统的、化学缀合方法,但人们并不总能精准控制抗原在哪些位置连接到蛋白。在这种形式中,载体蛋白的这种亚类也称为“促免疫原性标签”或甚至“佐剂(16)”或“遗传佐剂”。
根据本发明,“经修饰的蛋白”指的是具有与野生型序列相比经过修饰的序列的蛋白,其添加了根据本发明的带正电荷的肽或被其部分取代。未经修饰的蛋白和本发明经修饰的蛋白之间的区别在于所述带正电荷的肽连接到卷曲螺旋结构域,或是进行添加或是部分取代。本领域技术人员理解,本发明经修饰的蛋白是重组蛋白,或是自然中不存在的嵌合体。包含卷曲螺旋结构域以及在别处经修饰但未在带电荷的肽结构域中进行修饰的带电荷的肽结构域的天然蛋白不是本发明的一部分。
本发明涉及经修饰的蛋白,其包含:(i)具有卷曲螺旋结构域的蛋白和(ii)至少一个连接到所述卷曲螺旋结构域的带正电荷的肽,所述带正电荷的肽具有序列ZXBBBBZ(SEQID NO:1),其中:
·Z是任意氨基酸或是缺失的;
·X是任意氨基酸;
·B是精氨酸(R)或赖氨酸(K)。
当需要保护所述肽对抗外切蛋白酶如羧肽酶B的破坏时,所述肽的最后一个氨基酸可既不是精氨酸也不是赖氨酸残基。
当本发明的经修饰的蛋白包含多于一个带正电荷的SEQ ID NO:1的肽时,所述肽优选为融合在一起以形成一个单个带正电荷的肽,其为式(ZXBBBBZ)n的SEQ ID NO:1的重复序列,其中n是1或更大的整数,多达至少6,具体是1、2、3、4、5或6,优选为2。
在另一个实施方案中,可通过一个或多个如下文定义的接头来分离2、3、4、5或6个肽。
在本发明优选的实施方案中,所述肽具有选自下组的序列:序列SPRRRRS(SEQ IDNO:2)、GRRRR(SEQ ID NO:3)、SPKKKK(SEQ ID NO:4)、GKKKK(SEQ ID NO:5)和GRRRRRS(SEQID NO:36),特别是对于七聚的卷曲螺旋。具体对于三聚的卷曲螺旋,优选的是两个带正电荷的肽的融合,更优选的是具有选自下组的序列:序列SPRRRRRRRRRS(SEQ ID NO:37)、第一肽SPRRRR(SEQ ID NO:38)与第二肽RRRRRS(SEQ ID NO:39)以及GRRRRRRRRRRS(SEQ ID NO:40)的组合、第一肽GRRRRR(SEQ ID NO:41)和肽RRRRRS(SEQ ID NO:39)的组合。
所述肽可在C末端或在N末端与卷曲螺旋融合。肽与蛋白的融合能用接头或不用接头来进行,所述接头是连接肽与蛋白的短肽序列。接头可以含有任何氨基酸,但优选的接头含有甘氨酸、丝氨酸或脯氨酸,或其组合。
在具体的实施方案中,缺失了所述蛋白C末端的几个氨基酸,并用一份或多份的肽ZXBBBBZ来替代。
在本发明优选的方面,所述肽在其C末端最端点连接到卷曲螺旋。
在本发明的一个方面,经修饰的蛋白具有载体蛋白的功能,尤其是充当抗原的载体。
在发明优选的方面,经修饰的蛋白是来源于鸡的载体C4-结合蛋白,称为IMX313,其包含七聚的卷曲螺旋,在专利申请WO 2007/062819中有描述。
根据本发明的具体的经修饰的蛋白是蛋白IMX313,其中肽GRRRR(SEQ ID NO:3)与IMX313的卷曲螺旋结构域连接。
根据本发明的具体的经修饰的蛋白是蛋白IMX313,其中肽SPKKKK(SEQ ID NO:4)与IMX313的卷曲螺旋结构域连接。
根据本发明的具体的经修饰的蛋白是蛋白IMX313,其中肽GKKKK(SEQ ID NO:5)与IMX313的卷曲螺旋结构域连接。
根据本发明优选的具体经修饰的蛋白是蛋白IMX313,其中肽SPRRRRS(SEQ ID NO:2)与IMX313的卷曲螺旋结构域连接。
IMX313、IMX313T和IMX313P的氨基酸序列如下文所示(*代表终止密码子):
IMX313:KKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQGLSKE*(SEQID NO:6)
IMX313T:KKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQSPRRRRS*(SEQ ID NO:7)
IMX313P:KKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVEGRRRRRS*(SEQID NO:42)。
在优选的实施方案中,具有载体蛋白功能的蛋白是IMX313P(SEQ ID NO:42)。包含IMX313P(SEQ ID NO:42)序列的蛋白本身也是本发明的一个目标,其单独存在或与一个或多个带正电荷的肽以及抗原或另一个蛋白融合。
在最优选的实施方案中,IMX313P(SEQ ID NO:42)的卷曲螺旋结构域与两个带正电荷的SEQ ID NO:1的肽的融合物连接,更优选的是序列SPRRRRRRRRRS(SEQ ID NO:37)的肽或序列GRRRRRRRRRRS(SEQ ID NO:40)的肽。
在本发明的另一个方面,经修饰的蛋白不是载体蛋白,而是抗原。所述寡聚抗原具体选自下组:
‐流感血凝素HA蛋白,
‐F呼吸道合胞体病毒的F糖蛋白,
‐HIV-1的gp41糖蛋白,
‐HIV-2的gp41糖蛋白,
‐埃博拉病毒的gp1,2,
‐来自脑膜炎奈瑟氏球菌的NadA,
‐来自小肠结肠炎耶尔森氏菌的YadA,
‐来自粘膜炎莫拉氏菌的UspA2,
‐来自汉氏巴尔通氏体的BadA,和
‐来自流感嗜血杆菌(Haemophilus influenza)的HadA。
本发明还涉及经修饰的载体蛋白和抗原之间的连结。已显示载体蛋白(IMX313)和抗原的这种连结增加所述抗原的免疫原性(参见专利申请WO 2007/062819)。用经修饰的载体蛋白,免疫原性的增加甚至比用未经修饰的IMX313蛋白更好。
具体而言,与抗原连结的经修饰的载体蛋白是具有序列SEQ ID NO:42的IMX313P。
在一个供选择的方案中,两种连结的组分是非共价地互相连结的。在优选的选择方案中,两种连结的组分是化学偶联的,并且是融合蛋白的形式。本领域技术人员知晓如何连结两个肽组分,以达到生产融合蛋白的目的。
本发明具体涉及融合蛋白,其包含具有经修饰的卷曲螺旋的载体蛋白以及一种或多种抗原。
在本发明的一个优选的方面,将以下抗原之一与经修饰的蛋白IMX313T或IMX313P融合:
i)金黄色葡萄球菌蛋白A蛋白,如所述(27,44)进行突变,或金黄色葡萄球菌蛋白溶血素α,或金黄色葡萄球菌蛋白ClfB或金黄色葡萄球菌蛋白分选酶A;
ii)85A,一种由结核分枝杆菌分泌的蛋白(28);
iii)自身抗原GnRH;
iv)隐孢子虫抗原Cp15;
v)流感核蛋白。
根据本发明具体的融合蛋白是蛋白IMX313P(SEQ ID NO:42),其中肽GRRRRRS(SEQID NO:36)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与金黄色葡萄球菌蛋白A蛋白融合。
根据本发明另一个具体的融合蛋白是蛋白IMX313P(SEQ ID NO:42),其中肽GRRRRRS(SEQ ID NO:36)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与蛋白85A融合。
根据本发明另一个具体的融合蛋白是蛋白IMX313(SEQ ID NO:6),其中肽SPKKKK(SEQ ID NO:4)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与金黄色葡萄球菌蛋白A蛋白融合。
根据本发明另一个具体的融合蛋白是蛋白IMX313(SEQ ID NO:6),其中肽SPKKKK(SEQ ID NO:4)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与蛋白85A融合。
根据本发明另一个具体的融合蛋白是蛋白IMX313(SEQ ID NO:6),其中肽GKKKK(SEQ ID NO:5)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与金黄色葡萄球菌蛋白A蛋白融合。
根据本发明另一个具体的融合蛋白是蛋白IMX313(SEQ ID NO:6),其中肽GKKKK(SEQ ID NO:5)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与蛋白85A融合。
根据本发明另一个具体的融合蛋白是蛋白IMX108T(SEQ ID NO:64),其中肽SPRRRRS(SEQ ID NO:2)与蛋白IMX108(SEQ ID NO:63)的卷曲螺旋结构域融合。
根据本发明优选的具体的经修饰的蛋白是蛋白IMX313(SEQ ID NO:6),其中肽SPRRRRS(SEQ ID NO:2)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与金黄色葡萄球菌蛋白A蛋白融合。
根据本发明另一个优选的具体的经修饰的蛋白是蛋白IMX313(SEQ ID NO:6),其中肽SPRRRRS(SEQ ID NO:2)连接到IMX313的卷曲螺旋,并且经修饰的蛋白与蛋白85A融合。
如上述例子显示,这两个模型抗原用于证明卷曲螺旋的修饰改进了它们的免疫原性。B和T细胞响应都得到了改进。此外,经修饰的卷曲螺旋在作为蛋白或作为核酸施用时免疫原性更强。
本发明还涉及免疫原性组合物,其包含如上述经修饰的卷曲螺旋型蛋白或如上述的融合蛋白、以及针对细胞内TLRs的核酸配体。这些针对TLRs的核酸配体优先与经修饰的载体蛋白进行复合。有利的是,虽然相应的未经修饰的载体蛋白不能显著结合这些针对TLRs的核酸配体,但所述核酸配体结合经修饰的蛋白。
本发明还涉及免疫原性组合物,其包含如上述的经修饰的卷曲螺旋型蛋白,或如上述的融合蛋白,以及肝素。肝素优先地与经修饰的载体蛋白复合。有利的是,虽然相应的未经修饰的载体蛋白不能显著结合肝素,但肝素结合经修饰的蛋白。
本发明还涉及携带经修饰的蛋白的固体支持物,其中所述蛋白结合于具有肽ZXBBBBZ的支持物。确实,肽中电荷的丰富程度足以强力结合经修饰的蛋白于表面。
本发明还涉及用于增加含卷曲螺旋结构域的蛋白对于支持物的结合能力的方法,包括将至少一个肽ZXBBBBZ连接到所述卷曲螺旋结构域,其中:
·Z是任意氨基酸或是缺失的;
·X是任意氨基酸;
·B是精氨酸(R)或赖氨酸(K)。
具体而言,所述支持物是层析柱。用带正电荷的肽作为亲和力标签,所有可溶的经修饰的卷曲螺旋蛋白都能结合到这种柱上。操作者能修改通用序列ZXBBBBZ的肽中精氨酸残基的数目以加强或减少结合。或者操作者可以修改通用序列ZXBBBBZ的肽的数目以加强结合。寡聚体中蛋白链的数目越小,应当使用的肽的数目或肽中精氨酸的数目越大。因而,例如用三聚的卷曲螺旋,优选地应当使用每条链中9个或更多的精氨酸,以确保在肝素-琼脂糖上类似的纯化。
本发明还涉及用于增加包含卷曲螺旋结构域的载体蛋白或抗原的免疫原性的方法,包括将至少一个肽ZXBBBBZ连接到所述蛋白的卷曲螺旋结构域,其中:
·Z是任意氨基酸或是缺失的;
·X是任意氨基酸;
·B是精氨酸(R)或赖氨酸(K)。
本发明还涉及增加抗原免疫原性的方法,包括:
·如上述制备经修饰的载体蛋白;和
·将所述抗原连接到所述经修饰的载体蛋白,以及连接到对于细胞内TLRs的核酸配体或肝素。
本发明具体涉及用于增加抗原Th1免疫原性的方法,其特征为如下文所例示的非常高的IgG2a/IgG1比率,所述方法包括:
·如上所述制备经修饰的载体蛋白;和
·将所述抗原连接到所述经修饰的载体蛋白,以及连接到对于细胞内TLRs的核酸配体或肝素。
本发明还涉及根据本发明的经修饰的抗原,或根据本发明的融合蛋白,其用作疫苗。
本发明还涉及用于在有需要的患者中诱导免疫响应的方法,包括对患者施用包含融合蛋白的疫苗组合物,所述融合蛋白包含经修饰的载体蛋白和抗原。
本发明还涉及用于在有需要的患者中诱导免疫响应的方法,包括对患者施用包含免疫原性组合物的疫苗组合物,所述免疫原性组合物包含经修饰的蛋白和对于细胞内TLRs的核酸配体或肝素。
本发明还涉及编码如上述经修饰的蛋白和融合蛋白的核酸分子。
此外,本发明涉及包含至少一个如上述核酸分子的疫苗组合物。包含核酸分子的疫苗组合物是本领域技术人员所熟知的,并且在专利申请WO2008/122817中有具体描述,该申请在此通过提述并入。
这些核酸分子本身可以使用,或者也可以应用于病毒载体中,所述病毒载体在专利申请WO2008/122817中也有描述。已经修饰了一些病毒载体以产生核酸,所述核酸能结合到病毒载体中编码的经修饰的抗原。对病毒载体进行修饰以产生核酸的方法在WO2007/100908中公开,在此通过提述并入。
本发明还涉及用于纯化如上述经修饰的卷曲螺旋型蛋白的方法,包括如下连续步骤:
·用所述经修饰的蛋白加载肝素-琼脂糖层析柱,
·和用高于500mM的盐浓度洗脱所述蛋白。
附图说明
图1:在Hi Trap肝素HP柱上纯化的IMX313T的层析图。肝素-琼脂糖柱将污染物(峰A和B)与基本纯化的IMX313T蛋白(峰C)清楚地分离。虚线显示用于洗脱经修饰的蛋白的盐梯度。
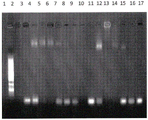
图2:TLR 9配体和IMX497蛋白(PAm-IMX313T)–琼脂糖凝胶电泳(TAE缓冲液中0.8%)。当用溴化乙锭对凝胶染色时,寡核苷酸在凝胶中所迁移到的位置在紫外线下是可观察的。
图3:TLR7和TLR3配体和IMX497蛋白(PAm-IMX313T)–琼脂糖凝胶电泳(TAE缓冲液中0.8%)。
图4:TLR7配体和IMX495(Pam)、IMX494(PAm-IMX313)和IMX497(PAm-IMX313T)蛋白–琼脂糖凝胶电泳(TAE缓冲液中0.8%)。
图5:将多组雌性BALB/C小鼠(n=5)用首先配制于CFA中然后配制于IFA中的PAm、PAm-IMX313、PAm-IMX313T或PAm以14天为间隔皮下免疫两次。首次免疫后28天,用ELISA确定血清中PAm-特异性的IgG效价,在所述ELISA中用Pam涂覆平板。结果以405nm+SEM处测量的样品OD来表示。不同组的平均值之间的显著差异通过单因素ANOVA然后是Tukey’s多重比较检验来确定。<0.05的p值被认为是统计学上显著的,并且用不同的*表示,而***代表p<0.001且**代表p<0.01。
图6:总T细胞群中的IFN-γ表达水平。肌内免疫的小鼠中85A特异性的细胞介导的免疫响应。将多组BALB/c雌性小鼠(n=5)用表达85A、85A-IR14、85A-TL18、85A-IMX313或85A-IMX313T的质粒以14天为间隔免疫两次。最后一次免疫2周后,处死小鼠并纯化脾T细胞。将细胞与重组的85A蛋白共培养。不同组平均值之间的显著差异通过单因素ANOVA然后是Tukey’s多重比较检验来确定。<0.05的p值被认为是统计学上显著的。共培养物上清中的IFN-γ响应以分泌IFN-γ的细胞/百万细胞来表示。
图7:CD8+T细胞群中的IFN-γ表达水平。肌内免疫的小鼠中85A特异性的细胞介导的免疫响应。将多组BALB/c雌性小鼠(n=5)用表达85A、85A-IR14、85A-TL18、85A-IMX313或85A-IMX313T的质粒以14天为间隔免疫两次。最后一次免疫2周后,处死小鼠并纯化脾CD8+T细胞。将细胞与85A肽p11共培养。不同组平均值之间的显著差异通过单因素ANOVA然后是Tukey’s多重比较检验来确定。<0.05的p值被认为是统计学上显著的。共培养物上清中的IFN-γ响应以分泌IFN-γ的细胞/百万细胞来表示。
图8:CD4+T细胞群中的IFN-γ表达水平。肌内免疫的小鼠中85A特异性的细胞介导的免疫响应。将多组BALB/c雌性小鼠(n=5)用表达85A、85A-IR14、85A-TL18、85A-IMX313或85A-IMX313T的质粒以14天为间隔免疫两次。最后一次免疫后2周,处死小鼠并纯化脾CD4+T细胞。将细胞与85A肽p15共培养。不同组平均值之间的显著差异通过单因素ANOVA然后是Tukey’s多重比较检验来确定。<0.05的p值被认为是统计学上显著的。共培养物上清中的IFN-γ响应以分泌IFN-γ的细胞/百万细胞来表示。
图9:将多组BALB/c雌性小鼠(n=5)用85A-IMX313质粒、85A-IMX313T质粒和较短的序列85A-IR14和85A-TL18以14天为间隔肌内免疫两次。首次免疫后28天,用85A特异性的ELISA确定血清中85A特异性的IgG水平。结果以405nm+SEM处测量的样品OD来表示。不同组平均值之间的显著差异通过单因素ANOVA然后是Tukey’s多重比较检验来确定。<0.05的p值被认为是统计学上显著的。NS意为不显著;显著性的值以星号显示:***(p<0.001)、**(p<0.01)、*(p<0.05)。
图10:亲本质粒pcDNA3NP的图谱。如实施例中所述构建的这种质粒及其衍生物用于DNA疫苗接种。
图11:响应于免疫而分泌IFN-γ的总T细胞的比较,所述免疫是用编码NP或融合于IMX313的NP的质粒进行的。
图12:响应于免疫而分泌IFN-γ的CD8和CD4T细胞的比较,所述免疫是用编码NP的质粒或编码融合于IMX313的NP的质粒进行的。
图13:对于重组NP的IgG抗体响应的比较,其由编码NP或融合于IMX313的NP的DNA质粒诱导。
图14:对于重组NP的IgG抗体亚类响应的比较,其由编码NP或融合于IMX313的NP的DNA质粒诱导。
图15:对于质粒的总T细胞响应的比较,所述质粒编码NP、单体NP(NP-M)、融合于IMX313的单体NP(NP-M-IMX313)和融合于IMX313T的单体NP(NP-M-IMX313T)。
图16:对于质粒的CD8+和CD4+T细胞响应的比较,所述质粒编码NP、单体NP(NP-M)、融合于IMX313的单体NP(NP-M-IMX313)和融合于IMX313T的单体NP(NP-M-IMX313T)。
图17:对于质粒的IgG抗体响应(其通过ELISA用重组NP测量)的比较,所述质粒编码NP、单体NP(NP-M)、融合于IMX313的单体NP和融合于IMX313T的单体NP。
图18:对于质粒的IgG抗体亚类响应(其用重组NP测量)的比较,所述质粒编码NP、单体NP(NP-M)、融合于IMX313的单体NP和融合于IMX313T的单体NP。
图19:多种NP融合蛋白的分泌的影响,所述NP融合蛋白由tPA信号肽分泌。通过比较NP、分泌的NP(tPA-NP)、分泌的单体NP(tPA-NP-M)、分泌的融合于IMX313的NP(tPA-NP-IMX313)、分泌的融合于IMX313的单体NP、和分泌的融合于IMX313T的单体NP(tPA-NP-M-IMX313T)的IFNγELISpots而测量总T细胞。
图20:分泌对于CD8+和CD4+对多种NP融合蛋白的响应的影响,所述CD8+和CD4+由tPA信号肽分泌,其通过比较NP、分泌的NP(tPA-NP)、分泌的单体NP(tPA-NP-M)、分泌的融合于IMX313的NP(tPA-NP-IMX313)、分泌的融合于IMX313的单体NP、和分泌的融合于IMX313T的单体NP(tPA-NP-M-IMX313T)的IFNγELISpots测量。
图21:对于多种NP融合蛋白的IgG响应的分泌的影响,所述IgG由tPA信号肽分泌,其通过比较NP、分泌的NP(tPA-NP)、分泌的单体NP(tPA-NP-M)、分泌的融合于IMX313的NP(tPA-NP-IMX313)、分泌的融合于IMX313的单体NP、和分泌的融合于IMX313T的单体NP(tPA-NP-M-IMX313T)的ELISA测量。
图22:分泌对于IgG亚类对多种NP融合蛋白的响应的影响,所述IgG亚类由tPA信号肽分泌,其通过比较NP、分泌的NP(tPA-NP)、分泌的单体NP(tPA-NP-M)、分泌的融合于IMX313的NP(tPA-NP-IMX313)、分泌的融合于IMX313的单体NP、和分泌的融合于IMX313T的单体NP(tPA-NP-M-IMX313T)的ELISA测量。
图23:本图显示了IMX743蛋白强力结合DNA寡核苷酸ODN1826,而IMX744仅弱结合同一寡核苷酸。在TAE缓冲液中以0.8%进行了琼脂糖凝胶电泳。当用溴化乙锭将凝胶染色时,寡核苷酸在凝胶中所迁移到的位置在紫外线下是可观察的。如凝胶上方表格所述制备了TLR9配体ODN1826和IMX744及IMX743蛋白的不同组合,并通过琼脂糖凝胶电泳分析了复合物形成。复合物形成是可以清楚检测到的,因为复合物迁移得比未经复合的配体慢得多。随着蛋白浓度的降低,观察到的复合物变得更加弥散,并且未结合的TLR配体的条带变得可见。凝胶显示,IMX743(比较泳道6与12)的凝胶迁移是可再现的,但显示IMX744(泳道3-5)在凝胶中产生的迁移几乎察觉不到。
实施例
1.IMX313、IMX313T和IMX313P蛋白的产生
IMX313是通过在基于T7的表达载体中用标准方法克隆这种寡聚化结构域而产生的。PCR产物在N末端含有NdeI位点,并含有与第二个终止密码子重叠的HindIII位点。所述核苷酸序列为:
SEQ ID NO:8:
CATATGTCAAAGAAGCAAGGTGATGCTGATGTGTGCGGAGAGGTTGCTTATATTCAGAGCGTCGTCTCCGATTGCCACGTGCCTACAGCGGAACTGCGTACTCTGCTGGAAATACGAAAACTCTTCCTGGAGATTCAAAAACTGAAGGTGGAATTGCAAGGACTGAGCAAGGAGTAATAAGCTT
这个基因编码如下的蛋白序列(SEQ ID NO:9):
MSKKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQGLSKE**
星号代表终止密码子。如质谱分析所确定的,第2位的丝氨酸使得起始甲硫氨酸能够被完全去除。
IMX313在大肠杆菌菌株C43(DE3)中表达。经转化的细胞在Terrific Broth培养基中于37℃生长至OD600约为0.6,然后在1mM的浓度用IPTG诱导表达,并使培养物在37℃生长过夜。将获得的细菌在含50mM磷酸钠pH 7.4的缓冲液中通过声处理裂解,并以18,000rpm在4℃离心30分钟。在可溶级分中发现了IMX313蛋白。
通过如下用带正电荷的肽(SPRRRRS)替代IMX313最后五个的C末端氨基酸(GLSKE)而产生IMX313T:通过在要取代的氨基酸(GLSKE)紧接的前方进行定点突变产生PstI限制性酶切位点(CTGCAG:编码氨基酸亮氨酸和谷氨酰胺)。这使得IMX313的最后五个氨基酸能被任何由两条互补寡核苷酸编码的氨基酸所取代并在终止密码子紧接着的下游连接到HindIII位点以及PstI位点,其中所述两条互补寡核苷酸可以是已退火的。
当在PstI和Hind III位点之间进行退火和克隆时,如下的磷酸化的寡核苷酸以LQSPRRRRS**(SEQ ID NO:11,其中*代表终止密码子)替代了编码LQGLSKE**(SEQ ID NO:10)的序列:
SEQ ID NO:12:5’GTCTCCGCGTCGCCGTCGCTCCTAATA 3’和
SEQ ID NO:13:5’AGCTTATTAGGAGCGACGGCGACGCGGAGACTGCA 3’
编码IMX313T的核苷酸序列如下所示(SEQ ID NO:14):
atgtcaaagaagcaaggtgatgctgatgtgtgcggagaggttgcttatattcagagcgtcgtctccgattgccacgtgcctacagcggaactgcgtactctgctggaaatacgaaaactcttcctggagattcaaaaactgaaggtggaactgcagtctccgcgtcgccgtcgctcctaataa
IMX313T也在大肠杆菌菌株C43(DE3)中表达。经转化的细胞在Terrific Broth培养基中于37℃生长至OD600约为0.6,然后通过添加IPTG至1mM来诱导表达,并使培养物在37℃生长过夜。将获得的细菌在含50mM磷酸钠pH 7.4的缓冲液中通过声处理裂解,并以18,000rpm在4℃离心30分钟。在可溶级分中也发现了IMX313T蛋白。IMX313P通过用如下寡核苷酸使表达IMX313T的质粒突变而构建:
IMX205:5’GGAGATTCAAAAACTGAAGGTGGAAGGTCGCCGTCGCCGTCGCTCC 3’(SEQ ID NO:43)和
IMX139:5’GGGCGATCGGTGCGGGCCTCTTCGC 3’(SEQ ID NO:44)。
通过Geiser(29)的方法将PCR产物插入到表达IMX313T蛋白的T7载体中。
编码IMX313P的核苷酸序列如下所示(SEQ ID NO:45):
ATGTCAAAGAAGCAAGGTGATGCTGATGTGTGCGGAGAGGTTGCTTATATTCAGAGCGTCGTCTCCGATTGCCACGTGCCTACAGCGGAACTGCGTACTCTGCTGGAAATACGAAAACTCTTCCTGGAGATTCAAAAACTGAAGGTGGAAGGTCGCCGTCGCCGTCGCTCCTAA
以与IMX313T蛋白相同的方式纯化产生IMX313P蛋白,只是裂解缓冲液还含有1MNaCl。将经澄清的细菌裂解液在80℃加热20分钟并通过18,000rpm在4℃离心30分钟使其再次澄清。
2.与IMX313类似,IMX313P和IMX313T是七聚的
在Hi Trap SP FF 5ml柱上纯化的蛋白IMX313T,所述柱用50mM、pH 7.4的磷酸钠来平衡。以0-1M NaCl梯度洗脱蛋白。汇集含有蛋白IMX313T的级分,相对1x PBS进行渗析,并施加于Hi Load 26/60Superdex 75pg柱,所述柱用1x PBS进行平衡。IMX313T(Ve 170ml)的洗脱体积与IMX313(Ve 162ml)的非常相似。
在肝素-琼脂糖柱上纯化蛋白IMX313P。首先将蛋白相对Tris-HCl pH8.0和150mMNaCl的溶液进行渗析,然后将其加载到柱上。然后用Tris-HCl pH8.0和2M NaCl冲洗(develop)该柱。汇集洗脱的IMX313P蛋白级分,相对含500mM NaCl的PBS进行渗析,并施加于Hi Load 26/60Superdex 75pg柱,所述柱用含500mM NaCl的1x PBS进行平衡。其洗脱体积与IMX313T的没有区别。
为了证明SDS-PAGE凝胶上的七聚体形成,在自然、变性和还原的条件下分析纯化的IMX313T和IMX313P蛋白。在没有还原剂时,IMX313T和IMX313P寡聚化,如同IMX313一样,并且均以比它们的单体大得多的分子量进行迁移。
3.带正电荷的短肽与IMX313的融合物促进蛋白纯化
随后将如上所述纯化的IMX313T蛋白加载到HiTrap Heparin HP 5ml柱上,所述柱在由10mM Tris-HCl和150mM NaCl组成的pH 7.5缓冲液中。用同一缓冲液中盐梯度:15柱体积的2M NaCl进行结合的蛋白的洗脱。带正电荷的IMX313T蛋白结合到肝素柱并用约1MNaCl洗脱。在分开的柱运行中,其显示IMX313不结合到肝素-琼脂糖柱,但在贯穿级分(flowthrough fraction)中发现了它。
肝素琼脂糖是一种亲和层析柱。其广泛用于纯化血清蛋白,包括凝血因子、脂酶、脂蛋白和激素受体,并且还成功地用于纯化生长因子。肝素的多阴离子结构(其作为DNA和RNA类似物)已使多类与DNA或RNA相互作用的蛋白能被纯化,所述蛋白包括聚合酶、连接酶、激酶、和核糖体蛋白。
我们在此显示,通过带正电荷的肽(例如多聚精氨酸尾部)的融合对卷曲螺旋进行的修饰赋予了结合带负电荷的肝素琼脂糖柱的有用能力,这极大简化了纯化过程。
这是预料不到的,因为当Stempfer等(19,20)用6个精氨酸残基与酶的融合物来将酶固定在肝素-琼脂糖上时,所述酶能用仅0.35M NaCl从柱上洗脱。在这个盐浓度处,细胞提取物中的其他蛋白也会洗脱,如实施例4所示,并且对于能够洗脱绝大多数蛋白存在明显的优势,所述蛋白伴以盐浓度如低于500mM NaCl结合到柱上,然后用甚至更高的盐浓度以基本纯的形式洗脱经修饰的卷曲螺旋融合蛋白。这允许进行不连续梯度(step gradient)或分批纯化。因此肝素-琼脂糖柱能用作亲和柱用于与IMX313T融合的蛋白,以及如此处所述方法修饰的其他卷曲螺旋。
与阳离子交换柱(如Hi Trap SP FF)相比,肝素-琼脂糖柱更加有用,因为其对经修饰的卷曲螺旋更有特异性。在我们的研究中,从阳离子交换柱(Hi Trap SP FF;pH7.4)洗脱的蛋白IMX313T不是完全纯的。当把这种经SP FF和S75纯化的蛋白加载到肝素-琼脂糖柱(HiTrap Heparin HP)上时,在穿透物(flow through)中除去了痕量污染物,并且用洗脱的IMX313T蛋白具有>98%的纯度,这显示对于通过添加肽SPRRRRS修饰的卷曲螺旋来说肝素柱比SP FF更有特异性,尽管所述蛋白以类似的NaCl浓度从两种柱上洗脱。
4.用于经修饰的卷曲螺旋的肝素琼脂糖亲和柱
如实施例1中所述生产IMX313。在对含有10mM Tris-HCl、150mM NaCl的pH7.5缓冲液中的细菌裂解物进行声处理后,得到可溶级分,并于Sorvall SS34转子中以18,000rpm在4℃离心30分钟。
将含有融合蛋白的上清加载到Hi Trap肝素HP柱上,所述柱是用150mM NaCl和10mM Tris-HCl pH7.5平衡的。用同一缓冲液中的盐梯度:2M NaCl进行洗脱。在穿透物中或以低的盐浓度去除了几乎所有污染物;并且随后用约1M NaCl在仅单个层析步骤中洗脱的IMX313T蛋白具有非常高的纯度(约95%)。通过凝胶过滤的进一步纯化提供了基本纯的蛋白。结果在图1中呈现。
5.其他带正电荷的短肽与IMX313融合
对IMX313T进行了三种其他修饰,以比较不同的接头(甘氨酸对比丝氨酸和脯氨酸)或比较精氨酸与赖氨酸。通过以如下寡核苷酸扩增来对表达IMX313T的质粒进行突变:
IMX206:5’GGAGATTCAAAAACTGAAGGTGGAAGGTCGCCGTCGCCGTTAATAAGCTTGATCCGGC3’(SEQ ID NO:46)或
IMX207:5’CTGAAGGTGGAATCTCCGaaaaagaaaaagTAATAAGCTTGATCCGGCTG 3’(SEQ IDNO:47)或
IMX208:GGAGATTCAAAAACTGAAGGTGGAAGGTAAAAAGAAAAAGTAATAAGCTTGATCCGGC 3’(SEQ ID NO:48)和
IMX139:5’GGGCGATCGGTGCGGGCCTCTTCGC 3’(SEQ ID NO:49)
并且通过Geiser(29)的方法将PCR产物插入到表达IMX313T蛋白的T7载体中。
得到的质粒(称为pIMX427、pIMX428和pIMX429)编码如下蛋白:
IMX427:MSKKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVEGRRRR*(SEQID NO50)
IMX428:MSKKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVESPKKKK*(SEQID NO51)
IMX429:MSKKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVEGKKKK*(SEQID NO52)
将这些如IMX313P那样进行纯化,然后在5ml肝素-琼脂糖柱上测试它们的行为与IMX313T和IMX313P进行比较。
| Ve(ml) | NaCl(mM) | C末端 | pI | |
| IMX428 | 34.4 | 786 | SPKKKK | 8.88 |
| IMX429 | 37.38 | 817 | GKKKK | 8.88 |
| IMX313T | 41.18 | 901 | SPRRRRS | 9.18 |
| IMX427 | 44.24 | 968 | GRRRR | 9.02 |
| IMX313P | 48.38 | 1058 | GRRRRRS | 9.41 |
条件如下所示:上样缓冲液20mM Tris pH 7.5150mM NaCl。然后用第二缓冲液进行梯度洗脱。所述第二缓冲液是20mM Tris pH 7.5和2M NaCl。
这些结果可以与Fromm和同事的实验进行比较,后者显示了从肝素琼脂糖以820mM的NaCl浓度洗脱的7个精氨酸的肽,以及以640mM NaCl浓度洗脱的7个赖氨酸的肽。显然,带正电荷的肽与卷曲螺旋的融合改进了它们对肝素的结合。
5.抗原Pam的生产和纯化,以及融合蛋白PAm-IMX313和PAm-IMX313T的生产和纯化
为了生产抗原Pam与IMX313的融合物,用下列寡核苷酸从质粒pEZZ18(AmershamPharmacia)扩增了来自金黄色葡萄球菌开放阅读框的蛋白A:
SEQ ID NO:15-IMX1078:5’CTTTAAGAAGGAGATATACATATGgctgatgcgcaacaaaataac3’和
SEQ ID NO:16-IMX1079:5’CCGCACACatcagcatcaccttgcttttttggtgcttgagcatcatttagc 3’
并将~233bp碱基对的PCR产物通过Geiser(29)的方法插入到表达IMX313蛋白的T7载体中。然后用如下寡核苷酸对蛋白A开放阅读框进行突变:
SEQ ID NO:17-IMX1080:5’cttcaacaaagaAAaaAaGaAcgccttctatg 3’和
SEQ ID NO:18-IMX1081:5’gcgctttggcttggagccgcttttaagctttgg 3’
从而引入如Kim等(27)所述的突变,产生表达载体pIMX494,所述表达载体具有如下的表达盒(SEQ ID NO:19):
atggctgatgcgcaacaaaataacttcaacaaaggaaaaaagaacgccttctatgaaatcttgaatatgcctaacttaaacgaagaacaacgcaatggtttcatccaaagcttaaaagcggctccaagccaaagcgctaaccttttagcagaagctaaaaagctaaatgatgctcaagcaccaaaaaagcaaggtgatgctgatgtgtgcggagaggttgcttatattcagagcgtcgtctccgattgccacgtgcctacagcggaactgcgtactctgctggaaatacgaaaactcttcctggagattcaaaaactgaaggtggaattgcaataataa
其编码如下蛋白(SEQ ID NO:20):
MADAQQNNFNKGKKNAFYEILNMPNLNEEQRNGFIQSLKAAPSQSANLLAEAKKLNDAQAPKKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQ**
应当注意,这个版本的IMX313缺少了55个氨基酸版本中的最后5个氨基酸(GLSKE),以促进对所计划的免疫接种的解释(interpretation)。当用IPTG诱导时,IMX494融合蛋白(PAm-IMX313)在C43(DE3)菌株中表达。在pH 7的20mM Tris-HCl中通过声处理裂解细胞沉淀,并以18,000rpm在4℃离心15分钟。在沉淀中发现了融合蛋白,然后在由50mMTris-HCl、3M尿素pH 7.4组成的缓冲液中将其进行声处理,并再次以18,000rpm进行离心。这一次,融合蛋白存在于上清中,将其加载到Hi Trap Q FF 5ml柱上,并用1M NaCl梯度来冲洗该柱。
汇集含有IMX494蛋白的级分相对PBS进行渗析,并在Hi Load 26/60Superdex 75柱上通过凝胶过滤进一步纯化。
为了生产未与载体蛋白融合的抗原Pam,用如下寡核苷酸将IMX313编码序列从载体pIMX494删除:
SEQ ID NO:21-IMX12795’gcagccggatcaagcttattattttggtgcttgagcatc 3’和SEQID NO:22-T7正向:5’TAATACGACTCACTATAGGG 3’。将PCR产物插入(27)到产生质粒pIMX495的亲本载体中。
用1mM IPTG诱导C43(DE3)菌株中pIMX495的500ml培养物并生长过夜。在50mM磷酸钠、pH 7.4的缓冲液中通过声处理裂解收获的细菌,并在Sorvall SS34转子中以18,000rpm在4℃离心15分钟。在上清中发现了蛋白IMX495(没有其N末端甲硫氨酸的PAm),并在76℃加热所述上清15分钟然后第二次以18k离心15分钟,从而将其纯化。再一次在上清中发现了IMX495,将其相对50mM MES、pH6的缓冲液进行渗析。将上清加载到Hi Trap SP FF 5ml柱上并用NaCl梯度进行洗脱。最终,通过在Hi prep 26/60Sephacryl(聚丙烯酰胺葡聚糖)S-100HR柱上于PBS中凝胶过滤而精制IMX495蛋白。
为了产生编码融合蛋白PAm-IMX313T的载体pIMX497,通过对编码最后两个氨基酸亮氨酸和谷氨酰胺的序列进行同义突变(从TTGCAA变为CTGCAG),然后在新生成的与终止密码子重叠的Pst I位点和Hind III位点之间克隆如下寡核苷酸,从而修饰载体pIMX494:
SEQ ID NO:23-5’GTCTCCGCGTCGCCGTCGCTCCTAATA 3’和
SEQ ID NO:24-5’AGCTTATTAGGAGCGACGGCGACGCGGAGACTGCA 3’
将IMX313的C末端从LQ**变为LQSPRRRRS**(SEQ ID NO:11)。
然后使编码的蛋白IMX497在C43(DE3)菌株中表达,并通过在50mM pH 7.4的磷酸钠溶液中裂解细菌沉淀并以18k rpm离心来对其进行纯化。在沉淀中发现了融合蛋白,并在50mM磷酸钠、8M尿素、pH 7.4的溶液中通过声处理将其重悬。进一步离心后,将上清相对50mM磷酸钠pH 7.4的溶液进行渗析,并将渗析液进行离心。将上清加热至75℃15分钟,然后再次离心。在用至2M的NaCl梯度冲洗的Hi Trap SP FF柱上纯化上清,并汇集含有IMX497融合蛋白的级分,再次相对PBS进行渗析,并在Hi Load 26/60superdex 75柱上通过凝胶过滤来精制。
7.细胞内TLR配体的结合
为了检测这些蛋白是否结合细胞内TLR配体,进行了电泳迁移率变动测定法(EMSAs)。
制备了细胞内TLR配体和IMX497蛋白(PAm-IMX313T)的不同组合,并通过琼脂糖凝胶电泳分析了复合物的形成。
所用的TLR配体如下:
-对于TLR3:多聚I:C(poly I:C)是多聚肌苷酸与多聚胞苷酸杂交的多核苷酸双链体(duplex),是双链RNA的类似物。每条链链长为20个核苷酸。
-对于TLR7:一种称为ssRNA40的寡核苷酸,其具有序列5’GsCsCsCsGsUsCsUsGsUsUsGsUsGsUsGsAsCsUsC 3’,其中“s”代表硫代磷酸酯键(SEQ ID NO:25);
-TLR9:称为ODN1826的寡核苷酸,其具有序列5’tccatgacgttcctgacgtt 3’(SEQID NO:26)。
对于TLR9配体,结果在图2中呈现。从左至右为:
泳道1:低分子量阶梯(NEB);
泳道2:蛋白IMX497(1mg/ml);
泳道3:FITC CpG ODN(Eurogentec)10μM;
泳道4:蛋白IMX497(1mg/ml)&FITC CpG ODN 10μM;
泳道5:蛋白IMX497(0.5mg/ml)&FITC CpG ODN 10μM;
泳道6:蛋白IMX497(0.25mg/ml)&FITC CpG ODN 10μM;
泳道7:蛋白IMX497(0.125mg/ml)&FITC CpG ODN 10μM。
复合物生成可以明显检测到,因为复合物迁移得比未复合的配体慢得多,因而在凝胶上“迁移”了配体。随着蛋白浓度的降低,观察到的复合物变得更加弥散,并且未结合TLR配体的条带变得可见(其与作为对照的仅含TLR配体的样品迁移了相同的距离)。
蛋白IMX497与TLR7和TLR3配体的组合在图3中显示;这些核酸也形成复合物,其通过EMSAs可以容易地检测到。
图3的图例(TLR7配体或TLR3配体+IMX497):
泳道1:低质量阶梯(NEB);
泳道2:蛋白IMX497(1mg/ml);
泳道3:FITC ssRNA(Eurogentec)10μM;
泳道4:蛋白IMX497(1.5mg/ml)/FITC ssRNA 10μM;
泳道5:蛋白IMX497(1mg/ml)/FITC ssRNA 10μM;
泳道6:蛋白IMX497(0.5mg/ml)/FITC ssRNA 10μM;
泳道7:蛋白IMX497(0.25mg/ml)/FITC ssRNA 10μM;
泳道8:蛋白IMX497(0.125mg/ml)/FITC ssRNA 10μM;
泳道9:FITC ssRNA 10μM;
泳道10:阴性对照;
泳道11:Poly(I:C)(R&D TOCRIS Bioscience)0.5mg/ml;
泳道12:蛋白IMX497(1.5mg/ml)/Poly(I:C)0.5mg/ml;
泳道13:蛋白IMX497(1mg/ml)/Poly(I:C)0.5mg/ml;
泳道14:蛋白IMX497(1mg/ml)/Poly(I:C)0.25mg/ml;
泳道15:蛋白IMX497(0.5mg/ml)/Poly(I:C)0.5mg/ml;
泳道16:蛋白IMX497(0.5mg/ml)/Poly(I:C)0.25mg/ml
泳道17:蛋白IMX497(0.25mg/ml)/Poly(I:C)0.5mg/ml
我们还测试了IMX494(PAm-IMX313)和IMX495(PAm)是否也能以CpG寡核苷酸(TLR9配体)产生这种凝胶迁移。结果如图4所示。
图4的图例:
泳道1:低分子量阶梯(NEB);
泳道2:蛋白IMX497(1mg/ml);
泳道3:蛋白IMX494(1mg/ml)
泳道4:蛋白IMX495(1mg/ml)
泳道5:FITC CpG ODN(Eurogentec)10μM;
泳道6:蛋白IMX497(1.5mg/ml)&FITC CpG ODN 10μM;
泳道7:蛋白IMX497(1mg/ml)&FITC CpG ODN 10μM;
泳道8:蛋白IMX497(0.5mg/ml)&FITC CpG ODN 10μM;
泳道9:蛋白IMX497(0.25mg/ml)&FITC CpG ODN 10μM;
泳道10:蛋白IMX494(1mg/ml)&FITC CpG ODN 10μM;
泳道11:蛋白IMX494(0.5mg/ml)&FITC CpG ODN 10μM;
泳道12:蛋白IMX494(0.25mg/ml)&FITC CpG ODN 10μM;
泳道13:蛋白IMX495(1mg/ml)&FITC CpG ODN 10μM;
泳道14:蛋白IMX495(0.5mg/ml)&FITC CpG ODN 10μM;
泳道15:蛋白IMX495(0.25mg/ml)&FITC CpG ODN 10μM
图4中的凝胶显示IMX497的凝胶迁移是可再次发生的,但IMX495(泳道13-15)未产生可检测的凝胶迁移,并且对于IMX494(泳道10-12)所观察到的凝胶迁移几乎是检测不到的,并且比对于IMX497所观察到的那些要弱得多。
IMX494和IMX497之间的差异是IMX497中存在序列SPRRRRS,其与该蛋白的卷曲螺旋C末端融合。
结论:没有该肽时,融合蛋白IMX313和抗原PAM不能结合针对TLR受体的核酸配体。
8.与IMX313T相关的抗原免疫原性
随后,对小鼠进行免疫接种以检测PAm(无论单独的还是与IMX313或IMX313T融合的,以及与或不与细胞内TLR配体制成制剂)的免疫原性。与完全或不完全弗氏佐剂(CFA/IFA)配制在一起的PAm用作对照。
为此,将雌性BALB/C小鼠用的PAm、PAm-IMX313、PAm-IMX313T或首先配制于CFA中然后于IFA中的PAm以14天为间隔皮下免疫两次,其中所述免疫是以每次注射每种蛋白2纳摩尔进行的。首次免疫后28天,用ELISA检测血清中PAm特异性的IgG效价,所述ELISA中平板用PAm涂覆。结果以405nm+SEM处测得的样品OD来表示。不同组的平均值之间的显著差异通过单因素ANOVA然后是Tukey’s多重比较检验来确定。<0.05的p值被认为是统计学上显著的,并且用不同的*表示,而***代表p<0.001且**代表p<0.01。
结果在图5中显示。单独用PAm免疫的小鼠其血清中没有抗PAM IgG抗体或是具有极低水平的抗PAM IgG抗体。另一方面,用PAm-IMX313或PAm-IMX313T免疫的小鼠显示出高水平的全身PAm特异性IgG抗体响应。然而,PAm-IMX313T免疫的小鼠具有比PAm-IMX313免疫的小鼠显著更高的(p<0.001)IgG抗体响应。用PAm+CFA/IFA作为佐剂得到了与PAm-IMX313T类似的响应。
这显示添加肽SPRRRRS给予抗原相比于亲本序列IMX313显著改进的免疫原性。当把抗原PAm与细胞内TLR配体配制在一起时(无论是单链DNA或RNA还是双链RNA),其免疫原性有了大幅改进,并且在配制前将抗原与IMX313融合时观察到了类似的改进。然而,很明显在与TLR配体配制在一起之前,将抗原与IMX313T融合时观察到了最佳结果。
在此将结果制成表格,并显示于如下图表中。
表1:针对PAm的IgG终点稀释效价
| PAm | PAm-IMX313 | PAm-IMX313T | |
| 无佐剂 | 0 | 800 | 1600 |
| 与Poly I:C | 100 | 3200 | 12800 |
| 与ODN CpG | 100 | 3200 | 6400 |
| 与ssRNA | 0 | 2400 | 6400 |
| 与CFA/IFA | 1600 | - | - |
一个有趣的问题是,这些改进是否改变了针对抗原获得的免疫响应的类型,所述抗原在本例中是PAm。Th1或Th2响应是否是有选择地得到了改进?为了回答这个问题,我们IgG1响应和IgG2a响应进行了比较,因为IgG1效价代表了Th2型响应,而IgG2a代表了Th1型响应。结果在表2中呈现。
很明显,PAm自身能诱导几乎同等的Th1和Th2响应,但其与弗氏佐剂一起的制剂发生了巨大的改变,其Th2响应(IgG1)此时占据了主导。PAm与IMX313的融合物显示,Th1和Th2响应都增加了,并且这种类型的响应中没有显著的偏移(shift)。用IMX313T,其Th1响应(IgG2a)开始占据主导,但其效果显著程度比用弗氏佐剂低很多,并且是反向的。免疫学家一致认为,Th1响应是比Th2响应更为优选的。
对此进一步分析,我们测试了伴随有细胞内TLR配体的制剂是否能用于将免疫系统重定向于产生Th1或Th2响应。用IgG抗体同种型数据来评估Th响应的类型,其中IgG2a或IgG1抗体占据主导分别表示Th1-或Th2-样响应。Th1-样响应具有非常高的IgG2a/IgG1比率,从而使得组平均值也高。IgG2a/IgG1比率被用作指示因子,来指示是Th1主导的(IgG2a>IgG1)、Th2主导的(IgG1>IgG2a)、还是Th1/Th2混合的(Th0,IgG1=IgG2a)响应。
结果在如下表2中显示:
非常明显,PAm-IMX313T与TLR配体在一起的制剂增加了Th1响应占据主导的趋势,对三种配体的每一种都是这样;TLR3配体多聚I:C的效果最为显著,与TLR9配体几乎差不多显著。
9.T细胞响应
为了确定用带正电荷的肽对IMX313卷曲螺旋进行的修饰是否也能改进T细胞响应,我们使用分枝杆菌抗原85A作为模型,因为已经显示IMX313在小鼠和猴中改进T细胞对于这种抗原的响应(28)。通过首先对来自Spencer等人所述pSG2-85A-IMX313载体的85A-IMX313编码序列进行亚克隆(28)到Gateway质粒pENTR4-LP中,从而制得了一系列表达抗原85A(单独的、或是与IMX313T或两种截短版本的IMX313(仅含有其14个或18个氨基酸)融合的)的重组质粒。在这种pENTR4骨架中,或是删除或是修饰IMX313从而制得了衍生物。
IMX313变体的氨基酸序列如下所示:
IR14 IRKLFLEIQKLKVE*(SEQ ID NO:27)
TL18 TLLEIRKLFLEIQKLKVE*(SEQ ID NO:28)
IMX313 KKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQGLSKE*(SEQID NO:6)
IMX313T KKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQSPRRRRS*(SEQ ID NO:7)
选择了IMX313的14聚体和18聚体片段,因为它们在37℃(并且甚至在42℃)保持着七聚化,并应当因此在DNA免疫接种后表达时形成七聚的融合蛋白。按照如下方法来对IMX313进行修饰:
用正向引物IMX043和IMX044以及反向引物IMX045来扩增IMX313的片段,并用这种PCR产物(29)在亲本质粒中替换IMX313。
IMX043:5’gaagcccgacctgcaacgtggatccATACGAAAACTCTTCCTGGAGA 3’(SEQ IDNO:29)
IMX044:5’gaagcccgacctgcaacgtggatccACTCTGCTGGAAATACGA 3’(SEQ ID NO:30)
IMX045:5’agggccctctagatgcatgctcgagcggccgcttattaTTCCACCTTCAGTTTTTG 3’(SEQ ID NO:31)
用引物IMX037和IMX047和作为模板的亲本质粒来删除IMX313编码序列;然后将所得的PCR产物用于(29)替代IMX313序列。
IMX037:5’cagaatagaatgacacctactcag 3’(SEQ ID NO:32)
IMX047:5’GAAGCCCGACCTGCAACGTTAATAAgcggccgctcgagcatg 3’(SEQ ID NO:33)
为了制得5A-IMX313T,用如下的寡核苷酸从质粒pIMX497扩增IMX313T;然后将PCR产物插入(29)到亲本质粒中:
IMX1030:5’GTGCCTACAGAGGACGTGAAAATGCTGCTGGAAATACGAAAACTCTTCCTGG 3’(SEQID NO:34)
IMX046:5’AgggccctctagatgcatgctcgagcggccgcttattaGGAGCGACGGCGACGCGGAGA3’(SEQ ID NO:35)
然后将这五种质粒(编码85A、85A-IR14、85A-TL18、85A-IMX313和85A-IMX313T)用于DNA免疫接种。
用所述五种质粒的每一种在第0和14天,用每次注射25μg的量对五组BALB/c小鼠进行肌内免疫。在第28天,通过ELISPOTs、用脾细胞来测量对抗原特异性T细胞响应的诱导。分离自经免疫的小鼠的经纯化的脾CD4+、CD8+和总T细胞与重组的85A蛋白(Clinibiosciences)或购自Eurogentec的p11或p15(26)肽共培养。
ELISPOT测定法:用IFN-γmAb(15μg/ml;MABTECH,Stockholm)涂覆平底的96-孔硝化纤维平板(Millititer;Millipore),并在4℃温育过夜。用PBS洗涤后,用10%胎牛血清在37℃封闭平板1小时。用终浓度为2μg/ml(CD8表位p11、CD4表位p15或85A蛋白)的相关肽在用15μg/ml抗人IFN-γ涂覆的IPVH-膜上刺激2x106细胞/孔,并温育20小时。温育后,用PBS彻底洗涤平板以去除细胞,并向每个孔添加IFN-γmAb(1μg/ml的生物素,MABTECH)。在37℃温育2小时后,洗涤平板并用链霉亲和素-HRP(1μg/ml;MABTECH)在室温显色(develop)1小时。洗涤后,加入底物(3-氨基-9-乙基咔唑(Sigma))并温育15分钟。进一步洗涤后,在显微镜下对红斑进行计数。
分离自85A-IMX313、85A-IR14或85A-TL18或85A-IMX313T免疫的小鼠的经纯化的脾CD4+T、CD8+T和总T细胞显示出比85A免疫的小鼠显著更高的IFNγ响应,并且证实了IMX313和其他经修饰的序列增加T细胞响应的能力。进一步地,来自接种85A-IMX313T的小鼠的脾CD4+、CD8+和总T细胞产生了比任何其他经免疫的组显著更多的IFNγ(p<0.001)(图6、7、8)。
CD8+T细胞展示出与CD4+T细胞相比不同的细胞因子概貌;所观察到的占据主导的产生细胞因子的群体是产生IFN-γ的CD8+T细胞(图7和8)。
值得注意的是,当IMX313被IMX313T替换时,CD4+和CD8+抗原特异性的T细胞响应都增强了。
总之,T细胞对抗原85A的响应(其通过IMX313而得到改进)通过使用IMX313T代替而得到了进一步的改进。
10.DNA疫苗接种诱导的B细胞响应
通过ELISAs测量了用DNA疫苗免疫的小鼠血清中针对抗原85A的抗体效价(图9)。
用85A-IMX313质粒、85A-IMX313T质粒和较短版本的IMX313(IR14和TL18)免疫的小鼠产生了比用表达85A的质粒免疫的那些显著更高的抗原特异性的总IgG效价(图9)。用85A-IMX313T免疫的组显示出最高的IgG响应(p<0.001)。用85A单独免疫的小鼠其血清中具有非常低的抗85A IgG抗体水平。
当把DNA用于免疫接种时还观察到,当加入较短的带正电荷的肽SPRRRRS时,免疫响应被重新定向至Th1。我们在ELISAs中测量了对85A蛋白具有特异性的IgG同种型(表3)。在BALB/c小鼠中,IgG2a同种型与Th1型免疫响应有关,而IgG1同种型与Th2型免疫响应有关。
值得注意,对IMX313或是IMX313T的使用导致了向T辅助型(Th1)相关抗原特异性IgGs的偏移,其中与单独抗原85A相比IgG2a的水平显著提升而IgG1的水平降低(表3),并且这些结果组成了Th1极化的直接证据;这些结果与细胞免疫响应所观察到的结果一致。
表3.将多组雌性BALB/C小鼠(n=5)用表达85A-IMX313、85A-IMX313T、较短的IMX313序列85A-IR14和85A-TL18、和单独85A的质粒以14天为间隔肌内免疫两次。首次免疫后28天,用85A特异性的ELISA确定血清中85A特异性的IgG1和IgG2a水平。结果以405nm+SEM处测得的样品OD来表示。当我们如上分析相同的数据以对这些同种型数据进行分类时,我们发现:
表3:
| IgG2a/IgG1比率 | TH响应 | |
| 85A | 0.8 | Th2 |
| 85A-IR14 | 1.6 | Th1 |
| 85A-TL18 | 1.47 | Th1 |
| 85A-IMX313 | 1.73 | Th1 |
| 85A-IMX313T | 2.57 | Th1 |
显然,所有版本的IMX313都倾向于优先地增大Th1响应,并且IMX313T版本的效果是最显著的,所述IMX313T具有较短的带正电荷的肽与卷曲螺旋的融合。
11.具体的融合蛋白IMX313T+来自流感的核蛋白(NP)抗原的用途
对于DNA疫苗接种,亲本质粒pcDNA3-NP(如图10所示)如下面实例中所述进行修饰。
11.1将IMX313插入NP编码质粒
用寡核苷酸引物IMX12895’caatgcagaggagtacgacaatggatccaagaagcaaggtgatgctgatg 3’(SEQ ID NO:53)和IMX12905’GTAGAAACAAGGGTATTTTTCTTtattactccttgctcagtccttgc 3’(SEQ ID NO:54)从pIMX494质粒扩增IMX313编码序列,并如Geiser(29)所述将其插入到质粒pcDNA3-NP中。
11.2插入tPA信号肽
用寡核苷酸IMX13055’cactgagtgacatcaaaatcatgGATGCAATGAAGAGAGGGC 3’(SEQID NO:55)和IMX13065’cgtaagaccgtttggtgccttggctagctcttctgaatcgggcatggatttcc3’(SEQ ID NO:56)从pSG2-85A(28)载体扩增tPA信号肽,并如Geiser(29)所述将其与NP编码序列的N末端一起插入到多个质粒中。
11.3产生NP的两点突变以使其成为称为单体
用寡核苷酸引物IMX12875’ccattctgccgcatttgCagatctaagag 3’(SEQ ID NO:57)和IMX12885’CAAAAGGGAGATTTGCCTGTACTGAGAAC 3’(SEQ ID NO:58)来扩增NP基因的内部片段,并将所得的PCR产物插入到编码NP的质粒中,如Geiser所述。因为两种寡核苷酸与NP基因的配对都不完美,因此PCR产物的插入产生了两个点突变。在NP基因中,IMX1287引物产生了突变E339A(GAA至GCA),而IMX1288引物产生了突变R416A(AGA至GCA)。
11.4插入IMX313T
用寡核苷酸引物IMX1289(SEQ ID NO:53)和IMX051 5’GTAGAAACAAGGGTATTTTTCTTtattaggagcgacggcgacgc 3’(SEQ ID NO:59)从质粒pIMX497扩增IMX313T编码序列,并如Geiser所述将其插入到多种衍生自pcDNA3-NP的质粒。
11.5用根据本发明的核酸进行DNA免疫
11.5.1试验方案
将五组雌性BALB/C小鼠(n=5)用多种质粒DNA、以14天为间隔以每次注射每种质粒20g的量肌内免疫两次。在第28天测量免疫响应,以确定对多种修饰的影响:+/-IMX313或IMX313T;+/-tPA信号肽;+/-单体化的突变。
通过ELISPOTs,在第28天用脾细胞测量抗原特异性的T细胞响应。分离自经免疫的小鼠的经纯化的CD4+、CD8+和总T脾细胞与购自Eurogentec的NP A流感肽(氨基酸366-374)共培养。
ELISPOT测定法:用IFN-γmAb(15μg/ml;MABTECH,Stockholm)涂覆平底的96-孔硝化纤维平板(Millititer;Millipore),并在4℃温育过夜。用PBS洗涤后,用10%胎牛血清在37℃封闭平板1小时。用终浓度为2μg/ml(NP A流感肽)的相关肽在用15μg/ml抗人IFN-γ涂覆的IPVH-膜上刺激2x106细胞/孔,并温育20小时。温育后,用PBS彻底洗涤平板以去除细胞,并向每个孔添加IFN-γmAb(1μg/ml的生物素,MABTECH)。在37℃温育2小时后,洗涤平板并用链霉亲和素-HRP(1μg/ml;MABTECH)在室温显色(develop)1小时。洗涤后,加入底物(3-氨基-9-乙基咔唑(Sigma))并温育15分钟。进一步洗涤后,在显微镜下对红斑进行计数。
为了研究体液免疫响应,我们通过ELISAs地特异性针对总IgG以及分别地针对IgG1和IgG2a评估了抗体水平,以评估Th1和Th2BALB/c小鼠的相对比例,所述小鼠以Th2型免疫响应典型地响应于流感疫苗,所述Th2型免疫响应与IgG1抗体的刺激是相关的。然而,在病毒感染中存活的小鼠血清中存在的主要的抗体同种型是IgG2a,其在Th1型免疫响应期间被刺激而成(32)。对IgG2a抗体的刺激与流感疫苗效力增加是相关的。
对于ELISAs,将抗原在0.1M碳酸钠/碳酸氢钠(pH 9.6)溶液中稀释至稀释至5mg/ml的浓度,然后用其涂覆MaxiSorb平板(Nunc-Immulon,Denmark)的孔。将两倍连续稀释的测试血清添加到孔中,在洗涤后,用与辣根过氧化物酶偶联的抗小鼠IgG、或抗小鼠的IgG1或抗小鼠的IgG2a(Sigma)来检测被结合的抗体。在添加邻苯二胺(Sigma)和H2O2后,确定490nm处的吸光度;用1M硫酸来终止反应。
数据在图11-14中显示。
11.5.2.在预备实验中,我们测试了由编码NP或融合于IMX313的NP的DNA疫苗诱导的针对NP的总T细胞响应。从用NP-IMX313免疫的小鼠分离的总T细胞显示出比那些用NP免疫的小鼠显著更高的IFN-γ响应,并证实了IMX313增加T细胞响应的能力。
图11显示,将亲本NP抗原基因与IMX313基因融合,改进了针对NP的T细胞响应。
11.5.3.为了确定ELISPOTs中检测到的IFN-γ是否是由CD4或CD8T细胞产生的,我们纯化了来自免疫小鼠的脾CD4+和CD8+T细胞,并将其与流感ANP肽共培养。在用NP-IMX313免疫的组中,来自CD8+T细胞的IFN-γ产量检测到了显著增加。产生IFN-γ的抗原特异性CD8+细胞的百分比比相应的CD4+T细胞群体更高(图12)。
图12显示,将NP抗原基因与IMX313基因融合,同时改进了针对NP抗原的CD4+和CD8+响应。
11.5.4.然后,我们测试了在免疫后以及末次免疫后14天时针对NP的抗体响应,在血清测量了NP特异性的IgGAb响应。NP对照小鼠和给予了NP-IMX313的小鼠显示出中等的NP特异性IgG Abs(图13),其比用NP-IMX313免疫的组更高。
图13显示,将NP基因与IMX313基因融合,改进了针对NP抗原的IgG抗体响应。
11.5.5.还测试了血清中NP特异性IgG1和IgG2a抗体(分别代表Balb/C小鼠中的Th2和Th1型响应)的存在情况。检测了用NP-IMX313免疫的小鼠血清中NP特异性的IgG1和IgG2a抗体同种型;然而来自单独给予NP的小鼠的血清样品仅显示出低水平的IgG1和IgG2aAb(图14)。
图14显示了针对NP抗原而诱导的抗体的亚类分布。与IMX313的融合对于IgG2A响应的改进比IgG1响应更多,将针对NP的偏向Th2的响应转变为针对NP-IMX313的偏向Th1的响应。
11.6产生重组NP-M-IMX313T蛋白
用针对大肠杆菌(Escherichia coli)中的表达而优化后的密码子合成了编码NP-M-IMX313T蛋白的合成基因。将这种合成基因克隆到基于T7的表达载体pIMX04(这是来自Invitrogen的载体pRsetC,其中f1起点已被质粒pSC101的par基因座所替代)中。在一些标准培养基(LB,Studier’s自动诱导培养基)中诱导表达,并将过表达的蛋白首先如Ye(30)所述进行纯化,然后如Tarus(31)所述进行澄清和离子交换步骤,但在最后一步中如上文所述通过肝素琼脂糖上的亲和层析来纯化融合蛋白。
11.7.将重组蛋白NP-M-IMX313T如下用于免疫:
将多组雌性BALB/C小鼠(n=5)用多组蛋白制备物(伴随或不伴随TLR配体制剂)、以14天为间隔用每次注射2纳摩尔蛋白的量肌内免疫两次。在第28天用脾细胞测量免疫响应,以确定抗原特异性的T细胞响应(通过ELISPOTs测量)。通过ELISAs、用NP作为抗原测量了免疫前和第28天的抗体响应。
结果:
图15显示,NP的单体化轻度地改进了其免疫原性,其免疫原性通过与IMX313基因的融合而进一步得到改进,但最大的改进是通过将单体NP与IMX313T基因融合而获得的。
图16显示,对于CD4+和CD8+响应的分析,观察到了与图6中相同的排序:NP的单体化轻度地改进了其免疫原性;其免疫原性通过与IMX313基因的融合而进一步得到改进,但最大的改进是通过将单体NP与IMX313T基因融合而获得的。
图17显示,对于B细胞响应观察到了与图6和7中的T细胞(CD4+和CD8+)响应相同的排序。用IMX313T具有比用IMX313更高的针对NP的总IgG响应。
图18显示了针对单体NP抗原而诱导的抗体的亚类分布。正如与NP一样,与IMX313基因的融合增大了IgG2A响应超过了IgG1响应,将针对NP的偏向Th2的响应转变为针对NP-IMX313的偏向Th1的响应。具体感兴趣的是,这种从Th2到Th1偏向的逆转是通过与IMX313T而非与IMX313的融合来放大的。IgG2a抗体在流感疫苗的表达与对抗致命性流感挑战的病毒清除和保护增加是有关联的。对于疫苗效力而言,如通过ELISA所测的,对两种抗体同种型的诱导的增加是比仅有中和反应更好的(32)相关作用。
11.8NP抗原的分泌改进其免疫原性
制得了一系列含有组织型纤维蛋白溶酶原激活物(tPA)分泌信号序列的NP NDA疫苗构建体:tPA-NP、tPA-NP-M、tPA-NP-M-IMX313和tPA-NP-M-IMX313T。分析了tPA与NP融合物对于来自免疫动物的体液和细胞免疫响应的效果。
用含有构建体的tPA免疫的小鼠比那些用NP免疫的小鼠显示出显著更高的IFN-γ响应,并证实了IMX313T和单体化突变增加T细胞响应的能力。
图19显示,对NP抗原的强制分泌改进了其免疫原性(NP对比tPA-NP),无论其是否是单体的(tPA-NP对比tPA-NP-M)。然而,与IMX313的融合显示了使用NP的单体版本比使用未经修饰的抗原(tPA-NP-IMX313对比tPA-NP-M-IMX313)具有更强的免疫原性。并且用IMX313T替换IMX313,进一步改进了NP的免疫原性(tPA-NP-M-IMX313对比tPA-NP-M-IMX313T)。
图20显示了针对不同分泌版本的NP的CD8+和CD4+响应。观察到了与图19中相同的排序,并且当添加IMX313时,将抗原单体化的效用再次是显著的。如在前述的图中,当使用IMX313T而非IMX313时,观察到了最大的免疫响应。
图21显示了针对抗原NP的总IgG响应,并得到了与图20相同的对于T细胞响应的结论:当使用IMX313T时观察到了最大的免疫响应,但分泌(NP对比tPA-NP)和单体化(tPA-NP-IMX313对比tPA-NP-M-IMX313)也有着重要的作用。
用NP单独免疫的小鼠其血清中不具有抗NP IgG抗体或仅具有低水平的抗NP IgG抗体(图21)。另一方面,用NP-M-IMX313、tPA-NP-M-IMX313、NP-M-IMX313T或tPA-NP-M-IMX313T免疫的小鼠则显示出高水平的全身NP特异性IgG抗体响应。然而,用tPA-NP-M-IMX313T免疫的小鼠与所有组的免疫小鼠相比具有显著更高的(p<0.001)IgG抗体响应。这显示所有修饰(单体化突变、tPA和IMX313T)的组合给予了抗原相对于亲本序列或其他组合显著改进的免疫原性。
图22显示对针对NP的B细胞响应的亚类分析,并说明了单独用NP的初始Th2偏向被IMX313和被IMX313T逆转。当分泌物对其自身的作用很小时(NP对比tPA-NP),单体化(tPA-NP-IMX313对比tPA-NP-M-IMX313)以及随后用IMX313T替代IMX313(tPA-NP-M-IMX313对比tPA-NP-M-IMX313T)都对于改进的Th1(IgG2a)对比Th2(IgG1)响应具有贡献。
非常重要的是,tPA-NP-M-IMX313T自身几乎相等地改进Th1和Th2响应。NP与IMX313的融合显示Th1和Th2响应都增加了,并且相应类型没有显著的偏移。但对于IMX313T和单体化突变,Th1响应(IgG2a)开始占据主导。免疫学家的共识是:Th1响应相对于Th2响应是优选的(图22)。
11.9IMX313T在经过分泌途径时不被蛋白酶降解
通过用含IMX313T的质粒进行DNA免疫所获得的结果强有力地证明了分子的尾部在经过分泌途径时未被蛋白酶切割,在所述途径中蛋白酶是丰富的。为了更直接地测试这个问题,将用于体内表达NP-M-IMX313T的质粒用来进行了CHO K1细胞的转染。转染如(33)所述进行。
18至24小时后,通过离心回收被转染的细胞的上清,并将其过滤,然后加载到肝素琼脂糖柱上,如上文所述。
观察到了小的“峰C”,其在SDS-PAGE和Western印迹上被证明含有蛋白NP-M-IMX313T。
12.对三聚的卷曲螺旋的修饰
为了确定对三聚的卷曲螺旋的修饰是否能改进抗原的免疫原性,用合成的编码流感血凝素的三聚卷曲螺旋的HA2基因构建了两种质粒。
第一种质粒是pIMX743,其中HA2卷曲螺旋通过肽:SPRRRRRRRRRS(SEQ ID NO:37)的融合而被修饰。
将如下Nde I至HindIII限制性酶切片段克隆到T7表达载体中:
CATATGCGGGGTTCTCATCATCATCATCATCATCATCATGGTAGTGGTTATGCAGCCGATCAGAAAAGCACGCAAAATGCGATTAACGGCATTACCAACAAAGTCAATTCTGTGATCGAAAAGATGAATATCCAGTTTACTGCTGTAGGCAAAGAGTTCAACAAACTGGAGAAACGCATGGAAAACCTGAACAAGAAAGTGGATGATGGGTTTCTGGATATTTGGACCTATAACGCGGAATTACTTGTGCTCTTAGAAAACGAACGGACATTGGACTTCCATGATTCGAACGTCAAGAACCTGTATGAGAAAGTGAAAAGCCAGCTGAAGAACAATGCCTCACCACGTCGCCGTCGTCGCCGTCGCCGTCGCAGTTAATAAGCTT(SEQ ID NO:60)
编码的蛋白序列为:
MRGSHHHHHHHHGSGYAADQKSTQNAINGITNKVNSVIEKMNIQFTAVGKEFNKLEKRMENLNKKVDDGFLDIWTYNAELLVLLENERTLDFHDSNVKNLYEKVKSQLKNNASPRRRRRRRRRS**(SEQ ID NO:61)
通过用寡核苷酸引物IMX203:5’GTTAGCAGCCGGATCAAGCTTATTAGGCATTGTTCTTCAGCTGGC 3’(SEQ ID NO:62)和T7F删除肽以扩增HA2插入物(其随后被插入到亲本质粒中),从而产生了对照质粒pIMX744。
其核苷酸序列为:
CATATGCGGGGTTCTCATCATCATCATCATCATGGTAGTGGTTATGCAGCCGATCAGAAAAGCACGCAAAATGCGATTAACGGCATTACCAACAAAGTCAATTCTGTGATCGAAAAGATGAATATCCAGTTTACTGCTGTAGGCAAAGAGTTCAACAAACTGGAGAAACGCATGGAAAACCTGAACAAGAAAGTGGATGATGGGTTTCTGGATATTTGGACCTATAACGCGGAATTACTTGTGCTCTTAGAAAACGAACGGACATTGGACTTCCATGATTCGAACGTCAAGAACCTGTATGAGAAAGTGAAAAGCCAGCTGAAGAACAATGCCTAATAAGCTT(SEQ ID NO:63)
而编码的蛋白序列为:
MRGSHHHHHHGSGYAADQKSTQNAINGITNKVNSVIEKMNIQFTAVGKEFNKLEKRMENLNKKVDDGFLDIWTYNAELLVLLENERTLDFHDSNVKNLYEKVKSQLKNNA**(SEQ ID NO:64)
随后两种蛋白均首先在IMAC亲和柱上然后在肝素琼脂糖柱上进行纯化。以比IMX744蛋白更高的盐(NaCl)浓度洗脱IMX743蛋白:以1.4M(sic)的盐浓度洗脱IMX743蛋白,而以600mM的盐浓度洗脱IMX744蛋白。
随后将两种蛋白均用于免疫4组5-6周龄的雌性BALB/c小鼠,所述免疫在第0天和第14天以每次注射20μg的量进行。收集血清和脾用于第21天的ELISAs和ELISPOTs。两组接受在佐剂Addavax中的蛋白,而另两组则在无佐剂情况下进行免疫。将蛋白IMX744用作ELISA抗原,并也用于刺激脾细胞。
结果在下表4中显示:
结果清楚地显示,无论是否使用佐剂,带正电荷的肽(SEQ ID NO:37)(其仅在IMX743蛋白中存在)都使IMX743蛋白比其他方面完全相同的蛋白IMX744的免疫原性更强。此外,对佐剂的使用进一步改进了含抗原的卷曲螺旋的免疫原性。
13.鼠类C4bp寡聚化结构域IMX108的修饰
如参考文献16中所述对融合蛋白DsbA-IMX108的卷曲螺旋进行修饰,以确定其是否也获得了IMX313所得到改进的特性。为了修饰它,用寡核苷酸IMX212:5’GGAGCGACGGCGACGCGGAGActggagctgtagtagttcaacctcc 3’(SEQ ID NO:65)和T7F扩增DsbA-IMX108基因,并将其插入(29)表达IMX313T的质粒,代替IMX313。通过离子交换层析、然后在肝素-琼脂糖柱上纯化蛋白,其结合肝素-琼脂糖柱,而亲本构建体DsbA-IMX108则不结合。
亲本IMX108序列(SEQ ID NO:66)在此IMX108T序列(SEQ ID NO:67)进行比对;
IMX108:EASEDLKPALTGNKTMQYVPNSHDVKMALEIYKLTLEVELLQLQIQKEKHTEAH*
IMX108T:EASEDLKPALTGNKTMQYVPNSHDVKMALEIYKLTLEVELLQLQSPRRRRS*
经修饰的IMX108蛋白对于免疫家禽是有用的,此处应当避免使用经修饰的IMX313融合蛋白的潜在自身免疫作用(16)。其他哺乳动物C4bp寡聚化结构域(在参考文献16和WO2007/062819中列出)也可以如此处所述进行修饰用于此目的。
14.包含葡萄球菌溶血素α的N末端和IMX313蛋白的融合蛋白
为了证明与经修饰的IMX313蛋白的融合能改进葡萄球菌毒素溶血素α(Hla)的N末端结构域的免疫原性,从Newman菌株的基因组DNA对截短的溶血素基因进行扩增,并克隆到T7表达载体中。所用的寡核苷酸为:
IMX056:5’GTTTAACTTTAAGAAGGAGATATAcatatggcagattctgatattaatattaaaaccgg3’(SEQ ID NO:68)和
IMX057:5’GTTAGCAGCCGGATCAAGCTTATTAatcgattttatatctttctgaagaacgatctgtc3’(SEQ ID NO:69)。
为了将成熟毒素N末端63个氨基酸与经修饰的IMX313蛋白融合,用如下引物来扩增IMX313T:
来自IMX313T表达质粒的IMX110:5’AGAACGAAAGGTACCATTGCTGGATCCAAGAAGCAAGGTGATGCT 3’(SEQ ID NO:70)和IMX139:5’GGGCGATCGGTGCGGGCCTCTTCGC 3’(SEQ ID NO:44),并用PCR产物进一步截短Hla毒素基因,而将氨基酸63与经修饰的IMX313基因融合。得到的质粒表达融合蛋白,称为Hla63-IMX313T,其具有如下的蛋白结构:
ADSDINIKTGTTDIGSNTTVKTGDLVTYDKENGMHKKVFYSFIDDKNHNKKLLVIRTKGTIAGSKKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQSPRRRRS(SEQ ID NO:71),并且由如下的核苷酸序列编码:
ATGGCAGATTCTGATATTAATATTAAAACCGGTACTACAGATATTGGAAGCAATACTACAGTAAAAACAGGTGATTTAGTCACTTATGATAAAGAAAATGGCATGCACAAAAAAGTATTTTATAGTTTTATCGATGATAAAAATCATAATAAAAAACTGCTAGTTATTAGAACGAAAGGTACCATTGCTGGATCCAAGAAGCAAGGTGATGCTGATGTGTGCGGAGAGGTTGCTTATATTCAGAGCGTCGTCTCCGATTGCCACGTGCCTACAGCGGAACTGCGTACTCTGCTGGAAATACGAAAACTCTTCCTGGAGATTCAAAAACTGAAGGTGGAACTGCAGTCTCCGCGTCGCCGTCGCTCCTAA(SEQID NO:72)。
为了产生这种蛋白,用1mM IPTG诱导C43(DE3)菌株的500ml培养物并生长过夜。用声处理裂解所得的细菌,并将不可溶的蛋白悬浮在pH 7.5、50m MTris、150mM NaCl和6M脲的溶液(缓冲液A)中。将其加载到Hi-Trap SP FF柱上,并用含1M NaCl的缓冲液A洗脱。将部分纯化的蛋白相对pH 7.5、50m MTris、150mM NaCl的缓冲液进行渗析,并加载到肝素琼脂糖柱上,用NaCl梯度(pH 7.5、50mM Tris、1M NaCl)将其从柱上洗脱。将洗脱的蛋白相对PBS进行渗析,并进一步通过凝胶过滤进行纯化。
通过克隆C末端His标签对N末端片段(缺少IMX313T)进行修饰,并通过IMACNickel亲和层析和凝胶过滤将其纯化。
然后将两种纯化的蛋白(存在或不存在佐剂)用于免疫小鼠。
用5毫摩尔的Hla63蛋白或IMX313T与相同抗原的融合物在第0和14天对四组每组5只5-6周龄的雌性BALB/C小鼠进行免疫。在第28天,收集血清和脾用于ELISAs和ELISPOTs。将蛋白63Hla 6His用作ELISA抗原,并且也用于刺激脾细胞。
结果在表5中显示:
结果清楚地显示,无论是否使用佐剂,当与IMX313T蛋白融合时溶血素α(HLA)的N末端免疫原性都更强。
15.与修饰的IMX313蛋白融合的全长葡萄球菌蛋白A
为了检测IMX313T和IMX313P是否能改进全长葡萄球菌蛋白A抗原(SpA)的免疫原性,将编码5个同源结构域的合成基因(经如参考文献44中所述突变)作为Nde I-Hind III片段克隆到T7表达载体中。其核酸序列如下:
CATATGGCGCAACACGATGAAGCTCAAGCGAATGCATTCTACCAGGTTCTGAACATGCCGAATTTGAATGCGGACCAACGTAATGGCTTTATTCAATCCCTGAAGGACGCACCGTCCCAAAGCGCAAACGTTCTGGGTGAAGCGCAAAAACTGAATGATAGCCAGGCCCCGAAAGCCGATGCCCAGCAGAACAAGTTCAATAAGGATCAGGCCTCTGCGTTCTATGAGATTTTGAATATGCCGAACTTGAATGAGGAGCAACGCAACGGCTTTATCCAAAGCCTGAAAGATGCACCAAGCCAAAGCACGAACGTCCTGGGTGAGGCAAAGAAACTGAACGAGAGCCAGGCGCCGAAAGCGGACAACAATTTCAATAAAGAGCAAGCGAACGCCTTTTACGAAATTCTGAATATGCCTAACCTGAACGAAGAACAACGTAACGGCTTCATCCAGAGCTTGAAGGACGCGCCGTCGCAAAGCGCGAATCTGCTGGCCGAGGCGAAAAAGCTGAATGAGAGCCAAGCGCCGAAGGCGGACAATAAGTTTAACAAAGAACAGGCGAACGCATTCTATGAAATCCTGCATCTGCCGAATCTGAATGAAGAACAGCGCAATGGTTTTATCCAGAGCCTGAAGGATGCGCCAAGCCAGAGCGCAAACCTGTTGGCTGAGGCCAAGAAGCTGAACGATGCGCAGGCTCCGAAAGCTGACAACAAATTCAACAAAGAGCAGGCCAACGCTTTTTACGAGATTCTGCACTTGCCGAACCTGACCGAAGAACAGCGTAATGGTTTCATCCAGTCTCTGAAAGACGCACCGAGCGTGAGCAAAGAGATTCTGGCAGAGGCGAAGAAGTTGAACGACGCGCAGGCACCGAAAGGATCCCATCACCACCACCATCACTAATAAGCTT(SEQ ID NO:73)
而编码的蛋白序列为:
MAQHDEAQANAFYQVLNMPNLNADQRNGFIQSLKDAPSQSANVLGEAQKLNDSQAPKADAQQNKFNKDQASAFYEILNMPNLNEEQRNGFIQSLKDAPSQSTNVLGEAKKLNESQAPKADNNFNKEQANAFYEILNMPNLNEEQRNGFIQSLKDAPSQSANLLAEAKKLNESQAPKADNKFNKEQANAFYEILHLPNLNEEQRNGFIQSLKDAPSQSANLLAEAKKLNDAQAPKADNKFNKEQANAFYEILHLPNLTEEQRNGFIQSLKDAPSVSKEILAEAKKLNDAQAPKGSHHHHHH*(SEQ ID NO:74)
为了将抗原与IMX313T和IMX313P蛋白融合,用编码313蛋白的BamH I-Hind III片段替代编码C末端His标签的BamH I-Hind III片段。
按照如下步骤纯化蛋白:在细菌株BLR中产生SpA-6His,并在缓冲液A(1xPBS、1MNaCl、20mM咪唑、1mM PMSF)中裂解细菌沉淀,将细菌裂解物加热至75℃,15分钟,然后通过离心使其澄清,随后将其加载到IMAC Nickel亲和柱上。用缓冲液B(1xPBS、500mM咪唑)中的咪唑梯度洗脱蛋白。通过凝胶过滤进一步纯化蛋白。
SpA-IMX313T和SpA-IMX313P也在BLR菌株中表达,并将细菌裂解液加热至75℃,15分钟,并通过离心使其澄清。然后在SP离子交换柱上、并随后在肝素琼脂糖柱上纯化两种蛋白。
在第0和第14天将这三种蛋白用于免疫6组5-6周龄的Balb/c雌性小鼠。每种蛋白(伴随或不伴随佐剂AddaVax)每次免疫使用5毫摩尔。在第28天,收集血清和脾,用于ELISAs和ELISPOTs。将SpA-6His蛋白用作ELISA抗原,并且也用于刺激脾细胞。
结果在下表6中显示。与IMX313T或P融合的抗原SpA的免疫原性明显比未融合的抗原更强,而IMX313P版本的免疫原性比IMX313T版本稍强。
表6
16.ClfB与经修饰的IMX313蛋白的融合蛋白
为了改进葡萄球菌抗原ClfB的免疫原性,用如下寡核苷酸来扩增N2N3结构域:
IMX239:5’CATCATCATCATCATCACggtGCTGAACCGGTAGTAAATGCTGCTGATGCTAAAGG 3’(SEQ ID NO:75)和
IMX240:5’ccccaaggggttatgctagttaATTTACTGCTGAATCACCATCagcacttccaccacc3’(SEQ ID NO:76),并将带有N末端His标签的PCR产物克隆到T7表达载体中(27)。
N2N3片段的核苷酸序列为:
ATGCGGGGTTCTCATCATCATCATCATCATCATCATGGTgctgaaccggtagtaaatgctgctgatgctaaaggtacaaatgtaaatgataaagttacggcaagtaatttcaagttagaaaagactacatttgaccctaatcaaagtggtaacacatttatggcggcaaattttacagtgacagataaagtgaaatcaggggattattttacagcgaagttaccagatagtttaactggtaatggagacgtggattattctaattcaaataatacgatgccaattgcagacattaaaagtacgaatggcgatgttgtagctaaagcaacatatgatatcttgactaagacgtatacatttgtctttacagattatgtaaataataaagaaaatattaacggacaattttcattacctttatttacagaccgagcaaaggcacctaaatcaggaacatatgatgcgaatattaatattgcggatgaaatgtttaataataaaattacttataactatagttcgccaattgcaggaattgataaaccaaatggcgcgaacatttcttctcaaattattggtgtagatacagcttcaggtcaaaacacatacaagcaaacagtatttgttaaccctaagcaacgagttttaggtaatacgtgggtgtatattaaaggctaccaagataaaatcgaagaaagtagcggtaaagtaagtgctacagatacaaaactgagaatttttgaagtgaatgatacatctaaattatcagatagctactatgcagatccaaatgactctaaccttaaagaagtaacagaccaatttaaaaatagaatctattatgagcatccaaatgtagctagtattaaatttggtgatattactaaaacatatgtagtattagtagaagggcattacgacaatacaggtaagaacttaaaaactcaggttattcaagaaaatgttgatcctgtaacaaatagagactacagtattttcggttggaataatgagaatgttgtacgttatggtggtggaagtgctgatggtgattcagcagtaaattaa(SEQ ID NO:77),且蛋白序列为:
MRGSHHHHHHHHGAEPVVNAADAKGTNVNDKVTASNFKLEKTTFDPNQSGNTFMAANFTVTDKVKSGDYFTAKLPDSLTGNGDVDYSNSNNTMPIADIKSTNGDVVAKATYDILTKTYTFVFTDYVNNKENINGQFSLPLFTDRAKAPKSGTYDANINIADEMFNNKITYNYSSPIAGIDKPNGANISSQIIGVDTASGQNTYKQTVFVNPKQRVLGNTWVYIKGYQDKIEESSGKVSATDTKLRIFEVNDTSKLSDSYYADPNDSNLKEVTDQFKNRIYYEHPNVASIKFGDITKTYVVLVEGHYDNTGKNLKTQVIQENVDPVTNRDYSIFGWNNENVVRYGGGSADGDSAVN*(SEQ ID NO:78)
随后,用如下寡核苷酸扩增IMX313T和IMX313P结构域:
IMX248:5’gctgatggtgattcagcagtaaatggatccaagaagcaaggtgatgctgatg 3’(SEQID NO79)和IMX139并将C末端克隆到N3结构域。通过如下步骤使未经修饰的N2N3结构域以及融合蛋白N2N3-IMX313T和IMX313P表达:
用1mM IPTG诱导C43(DE3)菌株的500ml培养物,并且在过夜诱导后,在缓冲液A(1xPBS、1M NaCl、20mM咪唑、1mM PMSF)中裂解细菌沉淀,然后通过离心使其澄清,随后将其加载到IMAC Nickel亲和柱上。用缓冲液B(1xPBS、500mM咪唑)中的咪唑梯度洗脱蛋白。通过凝胶过滤进一步纯化蛋白。通过亲和层析在肝素-琼脂糖上进一步纯化融合蛋白,然后是Sephacryl S-300HR凝胶过滤,而未融合的蛋白在S-75凝胶过滤柱上通过凝胶过滤进一步纯化。
17.分选酶和经修饰的IMX313蛋白的融合蛋白
为了改进葡萄球菌蛋白酶(称为分选酶A,或SrtA)的免疫原性,将灭活的版本克隆到如下的IMX313、IMX313T和IMX313P的框架中:用如下寡核苷酸从Newman株基因组DNA扩增野生型分选酶A基因:
IMX0055’GTTTAACTTTAAGAAGGAGATATACATatgCAAGCTAAACCTCAAATTCC 3’(SEQ IDNO80)和
IMX12755’GTTAGCAGCCGGATCAAGCTTATTATTTGACTTCTGTAGCTACAA 3’(SEQ IDNO81),并将其克隆到T7表达载体中。然后用寡核苷酸IMX215:5’GATAAACAATTAACATTAATTACTTCTGATGATTACAATGAAAAGACAGGCG 3’(SEQ ID NO:82)将活性位点半胱氨酸残基突变为丝氨酸。
然后用寡核苷酸IMX006:5’TTGTAGCTACAGAAGTCAAAAAGAAGCAAGGTGATGCTGATG 3’(SEQ ID NO:83)和IMX139:5’GGGCGATCGGTGCGGGCCTCTTCGC 3’(SEQ ID NO:44)从其IMX313、313T和313P基因各自的表达载体扩增上述基因,并符合读框地插入灭活的蛋白酶基因(29)。
通过SP柱上、然后在肝素琼脂糖柱上的离子交换来纯化IMX313T和IMX313P融合蛋白。
18.CP15DNA免疫
为了确定除了通过使用IMX313本身所获得的改进以外,经修饰的IMX313蛋白是否能进一步改进隐孢子虫抗原CP15的免疫原性,将设计用于在大肠杆菌中表达Cp15、Cp15-IMX313和IMX313T的三种质粒用于制备pcDNA3载体,作为DNA疫苗。用于从T7表达载体(所述载体用于将pcDNA3插入tPA信号肽的下游)扩增三种基因的引物如下:
IMX092:5’ggaaatccatgcccgattcagaaga GCGCGTGTTCTGATCAAAGAGAAGC 3’(SEQID NO:84)和
IMX093:5’gccagtgtgatggatggcggtagttattgctcagcggtgg 3’(SEQ ID NO:85)。
将三种PCR产物分别插入到pcDNA3载体中,所述载体包含N末端tPA信号肽。
三种编码序列为:
对于Cp15:
ATGGATGCAATGAAGAGAGGGCTCTGCTGTGTGCTGCTGCTGTGTGGAGCAGTCTTCGTTTCGCCCAGCCAggaaatccatgcccgattcagaagaGCGCGTGTTCTGATCAAAGAGAAGCAGAATATGGGCAATCTCAAAAGCTGTTGTTCCTTTGCTGACGAACACTCATTGACCAGCACTCAACTGGTTGTAGGAAATGGCTCTGGTGCCTCTGAAACCGCAAGCAATCATCCACAGGAAGAAGTGAACGACATTAACACGTTTAACGTGAAACTGATCATGCAAGATCGCTCCAAACTGGATTGTGAGGTCGTCTTTGACAGTACCAGCATCAGTCTGAGTGGTGATGGCAAATGCCGCAATATCGCGTTAGACGAGATTCACCAGCTTCTGTATTCGAAGGAGGAATTAAGCCGTGTGGAATCTTCAGCTGGGATTTCCGATAGCGATAACTGCGTAGCCATTCACCTGAAAGAATCGGGTAACTGCATTCCGTTGTTCTTCAACAATTCGCAGGATAAAGAACGCTTTGTGGCAACAGCGAATAAGTTCAAACCGAACTTTAACCATCATCACCATCATCATTAA(SEQ IDNO:86)
对于Cp15-IMX313:
ATGGATGCAATGAAGAGAGGGCTCTGCTGTGTGCTGCTGCTGTGTGGAGCAGTCTTCGTTTCGCCCAGCCAggaaatccatgcccgattcagaagaGCGCGTGTTCTGATCAAAGAGAAGCAGAATATGGGCAATCTCAAAAGCTGTTGTTCCTTTGCTGACGAACACTCATTGACCAGCACTCAACTGGTTGTAGGAAATGGCTCTGGTGCCTCTGAAACCGCAAGCAATCATCCACAGGAAGAAGTGAACGACATTAACACGTTTAACGTGAAACTGATCATGCAAGATCGCTCCAAACTGGATTGTGAGGTCGTCTTTGACAGTACCAGCATCAGTCTGAGTGGTGATGGCAAATGCCGCAATATCGCGTTAGACGAGATTCACCAGCTTCTGTATTCGAAGGAGGAATTAAGCCGTGTGGAATCTTCAGCTGGGATTTCCGATAGCGATAACTGCGTAGCCATTCACCTGAAAGAATCGGGTAACTGCATTCCGTTGTTCTTCAACAATTCGCAGGATAAAGAACGCTTTGTGGCAACAGCGAATAAGTTCAAACCGAACTTTAACGGATCCAAGAAGCAAGGTGATGCTGATGTGTGCGGAGAGGTTGCTTATATTCAGAGCGTCGTCTCCGATTGCCACGTGCCTACAGCGGAACTGCGTACTCTGCTGGAAATACGAAAACTCTTCCTGGAGATTCAAAAACTGAAGGTGCACCATCACCATTAA(SEQ ID NO:87)
对于CP15-IMX313T:
ATGGATGCAATGAAGAGAGGGCTCTGCTGTGTGCTGCTGCTGTGTGGAGCAGTCTTCGTTTCGCCCAGCCAggaaatccatgcccgattcagaagaGCGCGTGTTCTGATCAAAGAGAAGCAGAATATGGGCAATCTCAAAAGCTGTTGTTCCTTTGCTGACGAACACTCATTGACCAGCACTCAACTGGTTGTAGGAAATGGCTCTGGTGCCTCTGAAACCGCAAGCAATCATCCACAGGAAGAAGTGAACGACATTAACACGTTTAACGTGAAACTGATCATGCAAGATCGCTCCAAACTGGATTGTGAGGTCGTCTTTGACAGTACCAGCATCAGTCTGAGTGGTGATGGCAAATGCCGCAATATCGCGTTAGACGAGATTCACCAGCTTCTGTATTCGAAGGAGGAATTAAGCCGTGTGGAATCTTCAGCTGGGATTTCCGATAGCGATAACTGCGTAGCCATTCACCTGAAAGAATCGGGTAACTGCATTCCGTTGTTCTTCAACAATTCGCAGGATAAAGAACGCTTTGTGGCAACAGCGAATAAGTTCAAACCGAACTTTAACGGATCCAAGAAGCAAGGTGATGCTGATGTGTGCGGAGAGGTTGCTTATATTCAGAGCGTCGTCTCCGATTGCCACGTGCCTACAGCGGAACTGCGTACTCTGCTGGAAATACGAAAACTCTTCCTGGAGATTCAAAAACTGAAGGTGGAACTGCAGTCTCCGCGTCGCCGTCGCTCCTAA(SEQ ID NO:88)
将没有插入物的pcDNA3载体用作对照质粒。这四种质粒用于在第0和第14天免疫四组5-6周龄的Balb/c雌性小鼠。每次免疫每种质粒进行25微克的肌内注射。在第28天,收集血清和脾用于ELISAs和ELISPOTs。纯化自大肠杆菌的Cp15-6His蛋白被用作ELISA抗原,并且也用于刺激脾细胞。
ELISAs和ELISPOTs的结果在表7中显示,如下。
这些结果显示IMX313同时改进了针对Cp15抗原的抗体效价和干扰素γ响应,但这些响应通过IMX313T(而不是IMX313)的使用得到了进一步改进。
19.用自身抗原和修饰的IMX313蛋白融合物:GnRH-IMX313T的免疫
为了进一步改进由自身抗原GnRH在与IMX313融合时诱导的抗体响应,制备了蛋白GnRH-IMX313T。其蛋白编码序列如下:
ATGGAACATTGGAGCTATGGCCTGCGTCCGGGCGGATCCAAGAAGCAAGGTGATGCTGATGTGTGCGGAGAGGTTGCTTATATTCAGAGCGTCGTCTCCGATTGCCACGTGCCTACAGCGGAACTGCGTACTCTGCTGGAAATACGAAAACTCTTCCTGGAGATTCAAAAACTGAAGGTGGAACTGCAGTCTCCGCGTCGCCGTCGCTCCTAATAA(SEQID NO:89),并且蛋白序列为:
MEHWSYGLRPGGSKKQGDADVCGEVAYIQSVVSDCHVPTAELRTLLEIRKLFLEIQKLKVELQSPRRRRS**(SEQ ID NO:90)
20.佐剂与经修饰的IMX313蛋白和抗原的协同作用
为了确定通过使用经修饰的IMX313蛋白而获得的改进的免疫原性是否能通过使用经典佐剂以及甚至使用两种佐剂而进一步改进,配制了如下蛋白:PAm、PAm-IMX313和PAm-IMX313T(如上述实施例6来制备),如下表“佐剂”栏中所示。然后用配制的蛋白在第0和14天免疫7组5-6周龄的Balb/c雌性小鼠。每次免疫每种蛋白(伴随或不伴随佐剂AddaVax,以及伴随或不伴随TLR配体多聚I:C)使用5毫摩尔。在这7组中,TLR配体多聚I:C首先与蛋白PAm-IMX313T配制在一起,然后与佐剂AddaVax配制在一起。
在第28天,收集血清和脾用于ELISAs和ELISPOTs。用PAm蛋白作为ELISA抗原,并且也用于刺激脾细胞。
将结果制成如下表格(表8)。
很明显,将佐剂与修饰的IMX313蛋白一起使用具有优势,并且通过使用第二种佐剂,多聚I:C,能够进一步改进免疫原性。
参考文献
1)Odgren PR,Harvie LW Jr,Fey EG.1996.Phylogenetic occurrence ofcoiled coil proteins:implications for tissue structure in metazoan via coiledcoil tissue matrix.Proteins24:467-484.
2)Rose A,Schraegle SJ,Stahlberg EA,Meier I.2005.Coiled-coil proteincomposition of 22proteomes--differences and common themes in subcellularinfrastructure and traffic control.BMC Evol Biol.5:66.
3)Burkhard P,Stetefeld J,Strelkov SV.2001.Coiled coils:a highlyversatile protein folding motif.Trends Cell Biol.11:82-88.
4)Tavano R,Capecchi B,Montanari P,Franzoso S,Marin O,Sztukowska M,Cecchini P,Segat D,Scarselli M,Aricò B,Papini E.2011.Mapping of the NeisseriameningitidisNadA cell-binding site:relevance of predicted{alpha}-helices inthe NH2-terminal and dimericcoiled-coil regions.J Bacteriol.193:107-115.
5)El Tahir Y,&Skurnik M.2001.YadA,the multifaceted Yersiniaadhesin.Int.J.Med.Microbiol.291:209-218.
6)Cotter SE,Surana NK,St.Geme III JW.2005.Trimericautotransporters:adistinct subfamily of autotransporter proteins.Trends Microbiol.13:199-205.
7)Szczesny P,Linke D,Ursinus A,K,Schwarz H,Riess TM,Kempf VA,Lupas AN,Martin J,Zeth K.2008.Structure of the head of the BartonellaadhesinBadA.PLoSPathog.4:e1000119.
8)Serruto D,Spadafina T,Scarselli M,Bambini S,Comanducci M,S,Kilian M,Veiga E,Cossart P,Oggioni MR,Savino S,Ferlenghi I,Taddei AR,RappuoliR,Pizza M,Masignani V,AricòB.2009.HadA is an atypical new multifunctionaltrimeric coiled-coil adhesin of Haemophilusinfluenzaebiogroupaegyptius,whichpromotes entry into host cells.Cell Microbiol.11:1044-1063.
9)Chen J,Wharton SA,Weissenhorn W,Calder LJ,Hughson FM,Skehel JJ,Wiley DC.1995.A soluble domain of the membrane-anchoring chain of influenzavirushemagglutinin(HA2)folds in Escherichia coli into the low-pH-inducedconformation.ProcNatlAcadSci U S A.92:12205-12209.
10)Swanson KA,Settembre EC,Shaw CA,Dey AK,Rappuoli R,Mandl CW,Dormitzer PR,Carfi A.2011.Structural basis for immunization with postfusionrespiratory syncytial virus fusion F glycoprotein(RSV F)to elicit highneutralizing antibody titers.ProcNatlAcadSci U S A.108:9619-9624.
11)Tan K,Liu J,Wang J,Shen S,Lu M.1997.Atomic structure of athermostable subdomain of HIV-1 gp41.ProcNatlAcadSci U S A.94:12303-12308.
12)Chen YH,Christiansen A,G,Dierich MP.1995.HIV-2transmembraneprotein gp36 like HIV-1 gp41 binds to human lymphocytes and monocytes.AIDS9:1193-1194.
13)Lee JE,Fusco ML,Hessell AJ,Oswald WB,Burton DR,SaphireEO.2008.Structure of the Ebola virus glycoprotein bound to an antibody from ahuman survivor.Nature454:177-182.
14)Yuan P,Swanson KA,Leser GP,Paterson RG,Lamb RA,JardetzkyTS.2011.Structure of the Newcastle disease virus hemagglutinin-neuraminidase(HN)ectodomain reveals a four-helix bundle stalk.ProcNatlAcadSci U S A.108:14920-14925.
15)Chambers RS,Johnston SA.(2003)High-level generation of polyclonalantibodies bygeneticimmunization.Nat Biotechnol.21:1088-1092.
16)Ogun SA,Dumon-Seignovert L,Marchand JB,Holder AA,Hill F.2008.Theoligomerization domain of C4-binding protein(C4bp)acts as an adjuvant,and thefusion protein comprised of the 19-kilodalton merozoite surface protein 1fused with the murine C4bp domain protects mice against malaria.InfectImmun.76:2817-3823.
17)Sassenfeld HM&Brewer SJ.1984.A polypeptide fusion designed for thepurification of recombinant proteins.Biotechnology.2:76-81.
18)Smith JC,Derbyshire RB,Cook E,Dunthorne L,Viney J,Brewer SJ,Sassenfeld HM,Bell LD.1984.Chemical synthesis and cloning of a poly(arginine)-coding gene fragment designed to aid polypeptidepurification.Gene.32:321-327.
19)Stempfer G,B,Rudolph R.1996.Improved refolding ofan immobilized fusion protein.Nat Biotechnol.14:329-334.
20)Stempfer G,B,Kopetzki E,Rudolph R.1996.A fusionprotein designed for noncovalent immobilization:stability,enzymatic activity,and use in an enzyme reactor.Nat Biotechnol.14:481-484.
21)Suzuki M.1989.SPKK,a new nucleic acid-binding unit of proteinfound in histone.EMBO J.8:797-804.
22)Fuchs SM&Raines RT.2005.Polyarginine as a multifunctional fusiontag.Protein Science14:1538-1544.
23)Blasius AL&Beutler B.2010.Intracellular Toll-likeReceptors.Immunity32:305-315.
24)Akira S,Uematsu S,Takeuchi O.2006.Pathogen recognition and innateimmunity.Cell124:783-801.
25)Ewald SE,Lee BL,Lau L,Wickliffe KE,Shi GP,Chapman HA,BartonGM.2008.The ectodomain of Toll-like receptor 9 is cleaved to generate afunctional receptor.Nature 456:658-662.
26)Mendlowski B,Field AK,Tytell AA,Hilleman MR.1975.Safety assessmentof polyI:C in NZB/NZW mice.ProcSocExpBiol Med.148:476-483.
27)Kim HK,Cheng AG,Kim HY,Missiakas DM,Schneewind O.2010.Nontoxigenicprotein A vaccine for methicillin-resistant Staphylococcus aureus infectionsin mice.J Exp Med.207:1863-1870.
28)Spencer AJ,Hill F,Honeycutt JD,Cottingham MG,Bregu M,Rollier CS,Furze J,Draper SJ,KC,Gilbert SC,Wyllie DH,.2012.Fusion of theMycobacterium tuberculosis antigen 85A to an oligomerization domain enhancesits immunogenicity in both mice and non-human primates.PLoS One7:e33555.
29)Geiser M,Cèbe R;Drewello D,Schmitz R.2001.Integration of PCRfragments at any specific site within cloning vectors without the use ofrestriction enzymes and DNA ligase.Biotechniques31:88-92.
30)Ye Q,Krug RM,Tao YJ.(2006)The mechanism by which influenza A virusnucleoprotein forms oligomers and binds RNA.Nature.444:1078-1082.
31)Tarus B,Bakowiez O,Chenavas S,Duchemin L,Estrozi LF,Bourdieu C,Lejal N,Bernard J,Moudjou M,Chevalier C,Delmas B,Ruigrok RW,Di Primo C,Slama-Schwok A.(2012)Oligomerization paths of the nucleoprotein of influenza Avirus.Biochimie.94:776-785.
32)Huber VC,McKeon RM,Brackin MN,Miller L,Keating R,Brown SA,MakarovaN,Perez DR,MacDonald GH,McCullers JA.2006 Distinct Contributions of Vaccine-Induced Immunoglobulin G1(IgG1)and IgG2a Antibodies to Protective Immunityagainst Influenza.CLINICAL AND VACCINE IMMUNOLOGY13:981–990.
33)Krammer F,Pontiller J,Tauer C,Palmberger D,Maccani A,Baumann M,Grabherr R.(2010)Evaluation of the influenza A replicon for transientexpression of recombinant proteins in mammalian cells.PLoS One.5:e13265.
34)Yang Y,Ringler P,Müller SA,Burkhard P.(2012)Optimizing therefolding conditions of self-assembling polypeptide nanoparticles that serveas repetitive antigen display systems.J Struct Biol.177:168-176.
35)Parry DA,Fraser RD,Squire JM.(2008)Fifty years of coiled-coils andalpha-helical bundles:a close relationship between sequence and structure.JStruct Biol.163:258-269.
36)Bommakanti G,Citron MP,Hepler RW,Callahan C,Heidecker GJ,Najar TA,Lu X,Joyce JG,Shiver JW,Casimiro DR,terMeulen J,Liang X,Varadarajan R.(2010)Design of an HA2-based Escherichia coli expressed influenza immunogen thatprotects mice from pathogenic challenge.ProcNatlAcadSci US A.107:13701-13706.
37)Bommakanti G,Lu X,Citron MP,Najar TA,Heidecker GJ,terMeulen J,Varadarajan R,Liang X.(2012)Design of Escherichia coli-expressed stalk domainimmunogens of H1N1 hemagglutinin that protect mice from lethal challenge.JVirol.86:13434-13444.
38)Birnbaum F,Nassal M.(1990)Hepatitis B virus nucleocapsid assembly:primary structure requirements in the core protein.J Virol.64:3319-3330.
39)Mulcahy ME,Geoghegan JA,Monk IR,O'Keeffe KM,Walsh EJ,Foster TJ,McLoughlin RM.(2012)Nasal colonisation by Staphylococcus aureus depends uponclumping factor B binding to the squamous epithelial cell envelope proteinloricrin.PLoSPathog.8(12):e1003092.
40)Shibagaki N,Okamoto T,Mitsui H,Inozume T,Kanzaki M,Shimada S.(2010)Novel immunotherapeutic approaches to skin cancer treatments usingprotein transduction technology.J Dermatol Sci.61:153-161.
41)Mitsui H,Okamoto T,Kanzaki M,Inozume T,Shibagaki N,Shimada S.(2010)Intradermal injections of polyarginine-containing immunogenic antigenspreferentially elicit Tc1 and Th1 activation and antitumour immunity.Br JDermatol.162:29-41
42)Mitsui H,Inozume T,Kitamura R,Shibagaki N,Shimada S.(2006)Polyarginine-mediated protein delivery to dendritic cells presents antigenmore efficiently onto MHC class I and class II and elicits superior antitumorimmunity.J Invest Dermatol.126:1804-1812.
43)Shibagaki N,Udey MC.(2002)Dendritic cells transduced with proteinantigens induce cytotoxic lymphocytes and elicit antitumor immunity.JImmunol.168:2393-2401.
44)O'Seaghdha M,van Schooten CJ,Kerrigan SW,Emsley J,Silverman GJ,CoxD,Lenting PJ,Foster TJ.(2006)Staphylococcus aureus protein A binding to vonWillebrand factor A1domain is mediated by conserved IgG binding regions.FEBSJ.273:4831-4841.
45)Arnau J,Lauritzen C,Petersen GE,Pedersen J.(2006)Currentstrategies for the use of affinity tags and tag removal for the purificationof recombinant proteins.Protein ExprPurif.48:1-13.
46)Fromm JR,Hileman RE,Caldwell EE,Weiler JM,Linhardt RJ.(1995)Differences in the interaction of heparin with arginine and lysine and theimportance of these basic amino acids in the binding of heparin to acidicfibroblast growth factor.ArchBiochemBiophys.323:279-287.
47)Chudasama SL,Espinasse B,Hwang F,Qi R,Joglekar M,Afonina G,WiesnerMR,Welsby IJ,Ortel TL,Arepally GM.(2010)Heparin modifies the immunogenicityof positively charged proteins.Blood.116:6046-6053.
专利参考文献
WO 2007/062819
WO 2007/100908
WO 2011/045612
WO 2008/122817
Claims (20)
1.一种经修饰的蛋白,其包含:
(i) 具有卷曲螺旋结构域的蛋白和至少一个直接连接到所述卷曲螺旋结构域的带正电荷的肽,其中所述经修饰的蛋白如SEQ ID NO: 42 (IMX313P)或SEQ ID NO: 7(IMX313T)中所示。
2.权利要求1的经修饰的蛋白,其中所述具有卷曲螺旋结构域的蛋白是抗原。
3.一种融合蛋白,其包含根据权利要求1的经修饰的蛋白和一个或多个抗原。
4.权利要求3的融合蛋白,其中所述抗原选自下组:来自金黄色葡萄球菌(Staphylococcus aureus)的蛋白A、分枝杆菌抗原85A和流感核蛋白抗原。
5.权利要求3的融合蛋白,其中其包含与权利要求1限定的经修饰的蛋白融合的一个或多个葡萄球菌抗原。
6.权利要求5的融合蛋白,其中所述一个或多个葡萄球菌抗原选自下组:SpA、Hla、ClfB和分选酶A。
7.权利要求3的融合蛋白,其中其包含与权利要求1限定的经修饰的蛋白融合的一个或多个流感抗原。
8.权利要求7的融合蛋白,其中所述流感抗原是流感核蛋白。
9.权利要求3的融合蛋白,其中其包含与权利要求1限定的经修饰的蛋白融合的一个或多个自身抗原。
10.权利要求9的融合蛋白,其中所述自身抗原是GnRH。
11.一种免疫原性组合物,其包含根据权利要求1或2的经修饰的蛋白和对于细胞内TLRs的核酸配体,或包含根据权利要求3-10中任一项的融合蛋白和对于细胞内TLRs的核酸配体。
12.一种用于增加包含卷曲螺旋结构域的载体蛋白或抗原的免疫原性的方法,包括将至少一个带正电荷的肽直接连接到所述蛋白的卷曲螺旋结构域以形成经修饰的蛋白,其中
所述经修饰的蛋白如SEQ ID NO: 42 (IMX313P)或SEQ ID NO: 7 (IMX313T)中所示。
13.一种用于增加抗原的免疫原性的方法,所述方法包括:
•根据权利要求12的方法制备经修饰的载体蛋白;和
•将所述抗原连接到所述经修饰的载体蛋白,以及连接到带负电荷的聚合物。
14.权利要求13的方法,其中所述抗原的免疫原性是Th1免疫原性。
15.权利要求13的方法,其中所述带负电荷的聚合物是对于细胞内TLRs的核酸配体或肝素。
16.权利要求1或2的经修饰的蛋白,或根据权利要求3-10中任一项的融合蛋白,或根据权利要求11的免疫原性组合物的用途,其特征在于它们用于制备疫苗。
17.根据权利要求16的用途,其特征在于所述疫苗用于治疗和预防感染。
18.根据权利要求17的用途,其中所述感染是葡萄球菌感染或流感病毒感染。
19.编码根据权利要求1或2的经修饰的蛋白的核酸分子,或编码根据权利要求3-10任一项的融合蛋白的核酸分子。
20.一种疫苗组合物,其包含至少一种根据权利要求19的核酸分子。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12306560.9 | 2012-12-11 | ||
| EP12306560 | 2012-12-11 | ||
| US201361802836P | 2013-03-18 | 2013-03-18 | |
| US61/802,836 | 2013-03-18 | ||
| PCT/EP2013/076289 WO2014090905A1 (en) | 2012-12-11 | 2013-12-11 | Modified coiled coil type proteins having improved properties |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN104981541A CN104981541A (zh) | 2015-10-14 |
| CN104981541B true CN104981541B (zh) | 2022-06-28 |
Family
ID=47458800
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201380072637.5A Active CN104981541B (zh) | 2012-12-11 | 2013-12-11 | 具有改进特性的经修饰的卷曲螺旋型蛋白 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US9388225B2 (zh) |
| EP (1) | EP2931896B1 (zh) |
| JP (1) | JP6518193B2 (zh) |
| KR (1) | KR102237130B1 (zh) |
| CN (1) | CN104981541B (zh) |
| AU (1) | AU2013357367B2 (zh) |
| BR (1) | BR112015013387B8 (zh) |
| CA (1) | CA2893120C (zh) |
| MX (1) | MX363443B (zh) |
| PL (1) | PL2931896T3 (zh) |
| RU (1) | RU2677799C2 (zh) |
| WO (1) | WO2014090905A1 (zh) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2014234363B2 (en) * | 2013-03-18 | 2018-02-15 | Osivax Sas | Influenza nucleoprotein vaccines |
| US10111948B2 (en) | 2014-04-25 | 2018-10-30 | Tria Bioscience Corp. | Synthetic hapten carrier compositions and methods |
| RU2732013C1 (ru) * | 2019-12-11 | 2020-09-10 | Федеральное бюджетное учреждение науки "Государственный научный центр прикладной микробиологии и биотехнологии" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ) | Способ сенсибилизации планшета для иммуноферментного анализа нерастворимыми белковыми антигенами |
| KR102613348B1 (ko) * | 2020-01-07 | 2023-12-13 | 에이치케이이노엔 주식회사 | 알부민 및 코일드코일 형성 도메인이 연결된 융합단백질, 및 이를 이용한 이중 표적 결합체 |
| KR20240051209A (ko) | 2021-08-24 | 2024-04-19 | 오시벡스 | 면역원성 조성물 및 이의 용도 |
| WO2023117742A1 (en) | 2021-12-22 | 2023-06-29 | Osivax | Vaccine compositions and their use |
| WO2023180394A1 (en) | 2022-03-22 | 2023-09-28 | Osivax | Mrna vaccine compositions and their use |
| NL2031833B1 (en) | 2022-05-11 | 2023-11-17 | Univ Leiden | Immunotherapeutic compositions and adjuvants |
| CN115779079A (zh) * | 2022-10-01 | 2023-03-14 | 中国人民解放军军事科学院军事医学研究院 | 一种可增强与佐剂协同免疫效力的电荷调控型抗原蛋白 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU9222598A (en) * | 1997-09-04 | 1999-03-22 | Stanford University | Reversible immobilization of arginine-tagged moieties on a silicate surface |
| ES2269371T3 (es) * | 2000-04-07 | 2007-04-01 | University Of Leeds | Proteinas de fusion con el antigeno de la nucleocapsida de la hepatitis b. |
| US7270921B2 (en) * | 2002-02-08 | 2007-09-18 | Kabushiki Kaisha Toshiba | Pattern writing and forming method |
| JP2006522021A (ja) * | 2003-02-03 | 2006-09-28 | パロ アルト インスティチュート オブ モレキュラー メディシン | 殺細胞分子およびその使用方法 |
| ES2505695T3 (es) * | 2003-07-31 | 2014-10-10 | Novartis Vaccines And Diagnostics, Inc. | Composiciones inmunógenas para Streptococcus pyogenes |
| WO2005077976A2 (en) | 2004-02-13 | 2005-08-25 | Avidis Sa | Coiled-coil domains from c4b-binding protein |
| JP5186689B2 (ja) * | 2005-11-10 | 2013-04-17 | 国立大学法人広島大学 | 酸化ケイ素含有物質に結合するタンパク質を介したタンパク質の固定化方法および固定化剤 |
| EP1795540A1 (en) * | 2005-11-30 | 2007-06-13 | Imaxio | Multimeric complexes of antigens and an adjuvant |
| US7879602B2 (en) | 2006-02-28 | 2011-02-01 | Vaxart, Inc. | Chimeric adenoviral vectors |
| GB0706912D0 (en) | 2007-04-10 | 2007-05-16 | Isis Innovation | Novel viral vaccines |
| EP2060586A1 (en) * | 2007-11-14 | 2009-05-20 | PharmaSurgics in Sweden AB | New synthetic arginine substituted peptides and their use |
| GB0918154D0 (en) | 2009-10-16 | 2009-12-02 | Isis Innovation | Mycobacterial vaccines |
| AU2014234363B2 (en) * | 2013-03-18 | 2018-02-15 | Osivax Sas | Influenza nucleoprotein vaccines |
-
2013
- 2013-12-11 CA CA2893120A patent/CA2893120C/en active Active
- 2013-12-11 CN CN201380072637.5A patent/CN104981541B/zh active Active
- 2013-12-11 PL PL13802415T patent/PL2931896T3/pl unknown
- 2013-12-11 RU RU2015126105A patent/RU2677799C2/ru active
- 2013-12-11 JP JP2015547006A patent/JP6518193B2/ja active Active
- 2013-12-11 AU AU2013357367A patent/AU2013357367B2/en active Active
- 2013-12-11 KR KR1020157018233A patent/KR102237130B1/ko active IP Right Grant
- 2013-12-11 WO PCT/EP2013/076289 patent/WO2014090905A1/en active Application Filing
- 2013-12-11 BR BR112015013387A patent/BR112015013387B8/pt active IP Right Grant
- 2013-12-11 MX MX2015007421A patent/MX363443B/es unknown
- 2013-12-11 EP EP13802415.3A patent/EP2931896B1/en active Active
-
2014
- 2014-12-15 US US14/570,133 patent/US9388225B2/en active Active
Non-Patent Citations (2)
| Title |
|---|
| Pathway for Polyarginine Entry into Mammalian Cells;Stephen M. Fuchs等;《Biochemistry》;20041231;第43卷;2438-2444 * |
| Polyarginine-Mediated Protein Delivery to Dendritic Cells Presents Antigen More Efficiently onto MHC Class I and Class II and Elicits Superior Antitumor Immunity;Hiroshi Mitsui等;《Journal of Investigative Dermatology》;20060427;第126卷;1804-1812 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN104981541A (zh) | 2015-10-14 |
| AU2013357367A1 (en) | 2015-06-11 |
| KR102237130B1 (ko) | 2021-04-08 |
| BR112015013387B1 (pt) | 2022-12-20 |
| EP2931896A1 (en) | 2015-10-21 |
| JP6518193B2 (ja) | 2019-05-22 |
| RU2677799C2 (ru) | 2019-01-21 |
| AU2013357367B2 (en) | 2019-10-24 |
| EP2931896B1 (en) | 2019-01-16 |
| MX363443B (es) | 2019-03-21 |
| BR112015013387B8 (pt) | 2023-01-10 |
| US20150093406A1 (en) | 2015-04-02 |
| KR20150094697A (ko) | 2015-08-19 |
| BR112015013387A2 (pt) | 2017-11-14 |
| WO2014090905A1 (en) | 2014-06-19 |
| MX2015007421A (es) | 2015-12-07 |
| JP2016501266A (ja) | 2016-01-18 |
| US9388225B2 (en) | 2016-07-12 |
| RU2015126105A (ru) | 2017-01-18 |
| CA2893120A1 (en) | 2014-06-19 |
| CA2893120C (en) | 2022-03-15 |
| PL2931896T3 (pl) | 2019-07-31 |
| WO2014090905A8 (en) | 2014-08-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN104981541B (zh) | 具有改进特性的经修饰的卷曲螺旋型蛋白 | |
| CN112088014A (zh) | 自组装纳米结构疫苗 | |
| KR20180131584A (ko) | 안정화된 용해성 융합-전 rsv f 단백질 | |
| KR20110088526A (ko) | 구제역 백신 조성물 및 이의 제조 방법 | |
| CA2901888C (en) | Influenza nucleoprotein vaccines | |
| CN104755619B (zh) | 用于预防猪水肿病的疫苗 | |
| CN114127101A (zh) | 用于治疗或预防呼吸道感染的亚单位疫苗 | |
| US9328149B2 (en) | Mutated and bacteriophage T4 nanoparticle arrayed F1-V immunogens from Yersinia pestis as next generation plague vaccines | |
| AU2021269320A1 (en) | Pneumococcal vaccine combining selected alpha helical domains and proline rich domains of pneumococcal surface protein a | |
| US20160000901A1 (en) | Compositions and Methods for the Production of Virus-Like Particles | |
| WO2016184425A1 (zh) | 截短的轮状病毒vp4蛋白及其用途 | |
| CN111548395A (zh) | 一种口蹄疫病毒二价多表位重组病毒样颗粒及其应用 | |
| KR20070058457A (ko) | 면역원성 복합체, 이의 제조 방법 및 이의 약제학적조성물에서의 용도 | |
| CN114699521B (zh) | 基于金属硫蛋白家族的免疫佐剂及其应用 | |
| DK2931896T3 (en) | MODIFIED COILED COIL TYPE WITH IMPROVED PROPERTIES | |
| Kamzina et al. | Virus-like particles presenting conformational epitopes as a promising vaccine platform | |
| Abidin | Murine polyomavirus VLPs as a platform for cytotoxic T cell epitope-based influenza vaccine candidates |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| TA01 | Transfer of patent application right |
Effective date of registration: 20180129 Address after: Paris France Applicant after: Ossie Huaco J company Address before: Paris France Applicant before: IMAXIO |
|
| TA01 | Transfer of patent application right | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |