CN103890167A - 自多潜能干细胞有效诱导定形内胚层 - Google Patents
自多潜能干细胞有效诱导定形内胚层 Download PDFInfo
- Publication number
- CN103890167A CN103890167A CN201280040881.9A CN201280040881A CN103890167A CN 103890167 A CN103890167 A CN 103890167A CN 201280040881 A CN201280040881 A CN 201280040881A CN 103890167 A CN103890167 A CN 103890167A
- Authority
- CN
- China
- Prior art keywords
- cell
- chir
- concentration
- stem cell
- activin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0676—Pancreatic cells
- C12N5/0678—Stem cells; Progenitor cells; Precursor cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0603—Embryonic cells ; Embryoid bodies
- C12N5/0606—Pluripotent embryonic cells, e.g. embryonic stem cells [ES]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0676—Pancreatic cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0696—Artificially induced pluripotent stem cells, e.g. iPS
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/10—Growth factors
- C12N2501/115—Basic fibroblast growth factor (bFGF, FGF-2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/10—Growth factors
- C12N2501/16—Activin; Inhibin; Mullerian inhibiting substance
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/40—Regulators of development
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2506/00—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells
- C12N2506/02—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells from embryonic cells
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical & Material Sciences (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Developmental Biology & Embryology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Reproductive Health (AREA)
- Gynecology & Obstetrics (AREA)
- Transplantation (AREA)
- Diabetes (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Hematology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Veterinary Medicine (AREA)
- Obesity (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Materials For Medical Uses (AREA)
Abstract
本发明涉及使多潜能干细胞分化为原条细胞群的方法,以逐步方式用于进一步成熟为定形内胚层。
Description
发明领域
本发明涉及使多潜能干细胞分化为原条细胞群的方法,以逐步方式用于进一步成熟为定形内胚层。
发明背景
胰岛的移植对改进1型糖尿病的治疗有着巨大前景,但是缺乏可利用的供体胰岛是需要解决的一个障碍。多潜能干细胞原则上可以产生无限数量的移植用β细胞,但迄今没有找到产生全功能β细胞的可靠方案。前肠衍生器官:胰、肺、甲状腺、肝、食道和胃起源于定形内胚层(DE),其为原肠胚形成期间形成的三个胚层之一。DE的诱导是自内胚层衍生组织向分化细胞类型(例如产生胰岛素的胰β细胞)形成的第一个关键步骤。已针对小鼠和人这二者报告了由多潜能胚胎干(ES)细胞形成DE细胞,载于例如WO2005/116073、WO2005/063971和US 2006/0148081。由DE细胞产生胰内胚层(PE)细胞对于产生用于治疗糖尿病的产生胰岛素的β细胞而言是必要的。
已知胚胎中的DE形成经过原条(PS)形成(中内胚层中间体)的中间步骤,所述原条具有形成中胚层或者DE的潜力。在细胞水平上,所有发育过程最终都由不同的信号转导途径的协同作用来控制。这其中,Wnt信号转导对于协调整个发育过程中发生的复杂细胞行为而言是必不可少。Wnt信号转导控制细胞增殖、干细胞维护和细胞命运的决定以及有组织的细胞运动和组织极性的建立。它还在人类癌症中被频繁地解除控制并且涉及退行性疾病。作为治疗干预的潜在靶标,它因此给干细胞生物学和再生医学领域带来新的希望。
通过与或不与Wnt组合使用激活素A/Nodal,已经描述了DE的诱导。具体地讲,先前已经报道了Wnt受体配体Wnt3a当在5天AA-介导的DE诱导的第1天期间(24 h)与激活素A (AA)孵育时,即,使用常规D'Amour方案(Kroon等人2008, Nat Biotech, 2006),促进有效的DE形成。
将各Wnt蛋白按其可指定的特定活性分类的试图,已经形成了将Wnt分为“标准的(canonical)”或“非标准的(non-canonical)”的细分类,其根据前者(而非后者)的诱导β-连环蛋白/TCF信号转导的能力。
CHIR是一种糖原合酶激酶3 β (Gsk3b)抑制剂和使小鼠胚胎干细胞维持在多潜能状态的限定组织培养基的一种已知成分(Ying等人Nature 453, 519-523)。Gsk3b具有多个靶标,但主要是已知能调节β-连环蛋白的降解和/或核转移。使用其它糖原合酶激酶3 β (Gsk3b)抑制剂例如BIO和Wnt3a,已经描述了稳定的β-连环蛋白在自人胚胎干细胞(hESC)向PS形成中的作用。然而CHIR是迄今为止所报道的最具选择性的Gsk3b-抑制剂。
AA和CHIR的共孵育降低了DE形成的稳定性,导致有效性较差和稳健性较差的方案。本发明涉及与用常规诱导方案获取DE (D’Amour方案,描述于Kroon等人,2008)相比,在AA-介导的定形内胚层诱导之前利用限定浓度范围的CHIR而无AA来处理多潜能干细胞。这种先暴露给CHIR、再暴露给AA的序贯暴露是必不可少的并且反映了依次的PS形成(由CHIR诱导),然后是通过AA的更有效和快速的DE形成。本发明涉及首先对PS、然后对DE的不连续的和依次的诱导控制,导致总体更有效,具有较早的SOX17表达峰和稳健的DE方案。用Wnt3a处理不能重现CHIR的这些效应。
附图描述
D0: 在任何处理之前的未分化细胞
Ctrl: 无Chir处理D1。细胞在起始期间留在RPMI中,然后经过AA D2替换和从D3开始的AA +血清替换(B27)。
’Am: 无Chir处理,按照Kroon等人, Nat. Biotech., 2008的方案(1天激活素A 100 ng/ml + Wnt 25ng/ml,2天激活素A100 ng/ml + 0.2% FBS)
D1: Chir添加之后1天
D2-4: AA添加之后1-3天
所有基因表达图都以Log10值表示。
图1显示CHIR DE方案的命名法和概述。在下列7种不同的多潜能干细胞系中已经证实了该方案:SA121、SA181、SA461、SA167 (人ESC)和chIPS2、chIPS3、chIPS4 (人iPSC)。
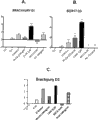
图2显示,与未经处理的细胞相比,在hES SA121 (图2A)和chIPS4 (图2B)中在CHIR处理之后24小时(D1)的PS标记Brachyury (T)、MIXL1、EOMES和Goosecoid (GSC)的转录表达。还用ICC证实了T蛋白水平(图2C)。与未分化的细胞相比,24小时CHIR处理之后,T fold诱导跨越500-100000 (n > 60)。柱条显示相对于未分化的细胞D0的Log10值。
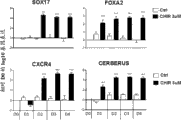
图3显示与未用CHIR预处理的细胞相比,用激活素A (AA)替代CHIR之后1天的DE标记(SOX17、CXCR4、FOXA2、CER)的基因表达。在hESC SA121 (图3A)和iPSC chIPS4 (图3B)两者中都显示出表达。柱条显示相对于未分化的细胞D0的Log10值。
图4显示单用CHIR (3μM)、BIO (0.5uM)、Wnt3a (200ng/ml)或者AA (100ng/ml)处理24小时(D1)、然后是2天AA处理(D3)的hESC SA121 (4A-B)和iPSC chIPS4 (4C)细胞。另外,分析了D’Amour (方案描述于Kroon等人,2008)。分析了Brachyury和SOX17的表达。前24小时用AA或BIO处理的hES细胞直到第3天无存活。
图5显示与D’Amour相比,在CHIR诱导之后DE标记SOX17、FOXA2和CXCR4 (图5A-C)和OCT4 (图5E)的基因表达水平,以及在chIPS4细胞中定量测定的SOX17/OCT4的ICC蛋白水平(图5D, F)。对OCT4和SOX17呈阳性染色的细胞的相应的% (D1-3)也示于表2中。使用这两个方案任一个,使用先前已公布的PE分化方案(Ameri等人2010),使chIPS/SA121 DE细胞进一步分化为胰内胚层(PE)。使用对于PDX1蛋白水平的ICC,在PE诱导7天后分析细胞。平行地,对于chIPS4细胞(图5G)和SA121细胞(图5H)两者,从细胞中采集mRNA并通过实时PCR分析PDX1表达。在这两种细胞系中重复2次实验(图5G, H)。
图6显示仅用RPMI、AA和Wnt3a或者CHIR D1处理、接着用AA或者用AA和Wnt3a D2和AA D3的组合(图6A)处理的hES SA121 (图6A)或chIPS4 (图6C)中的SOX17 D3的基因表达。细胞还用CHIR D1和AA D2 (“CHIR”)、D’Amour或者CHIR加上D’Amour处理,并分析SOX17表达(图6B)和形态学(图6C)。
图7显示在24小时(D1)之后和在随后的AA处理2天(D3)之后在浓度为1-7uM之间滴定CHIR并分析。CHIR 0.5-1uM和CHIR 7uM D3无存活。在SA121 (图7A)和chIPS细胞(图7C)中,在24小时处理之后分析Brachyury表达。在SA121 (图7B)和chIPS细胞(图7D)中D3分析SOX17表达。
图8显示在CHIR预处理之后或在D’Amour方案之后,在mTeSR系统中的SOX17 D3基因表达(图8)。
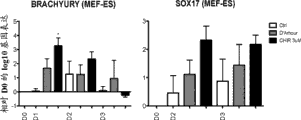
图9显示当在MEF饲养细胞上培养时,标记Brachyury和SOX17在D0、D2和D3的基因表达水平。
发明概述
本发明还涉及用于使干细胞分化为定形内胚层的方法,包括以下步骤:
a. 在包含至少2 μM CHIR的培养基中孵育干细胞的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
b. 在包含激活素A的培养基中孵育干细胞的第二后续步骤。
本发明涉及更快和更明显的SOX17表达峰和分化人类多潜能干细胞以获得定形内胚层的更稳健的方法。
发明描述
本发明涉及用于使干细胞分化为定形内胚层的方法,包括以下步骤:在包含至少2 μM CHIR的培养基中孵育多潜能干细胞,和随后在包含激活素A (AA)的培养基中孵育这些细胞。
本发明人已经发现单用CHIR 24小时然后再添加AA,在这24小时期间诱导PS标记(例如Brachyury、Mixl1、Eomes和Goosecoid (GSC))的显著和剂量依赖性的上调。
本发明人惊奇地发现,当与无CHIR预孵育的培养相比或当与常规D'Amour方案(Novocell, Nature Biotec 2006, 2008)相比时,在用AA的后续孵育以诱导DE期间,经SOX17表达测定的DE诱导在更早时间点达到峰值并具有更高倍数的变化。本发明人惊奇地发现本发明的方法更有效并显示出比其它已知的DE诱导方案更快的Sox17 mRNA表达的诱导。
CHIR-介导的效应在其他培养系统(在小鼠胚胎饲养(MEF)细胞上的mTeSR培养基和常规ES培养基)和跨越不同的细胞系(SA121、SA181、SA461、SA167、chIPS2、chIPS3、chIPS4)两者中都已重现,证明所述效应不依赖于细胞系或DEF培养基培养系统。人胚胎干细胞可源自单个卵裂球而不破坏胚胎(Klimanskaya等人2006;Chung等人2008;Geens等人2009)。细胞系chIPS2、chIPS3、chIPS4是iPS细胞系。
本发明人发现当添加AA之后,CHIR促进高的细胞密度。在PS诱导中CHIR的剂量依赖性将会允许当启动AA处理时未来可能的前-图式发育(pre-patterning)影响的优化。随后所添加因子的顺序减少了被平行激活的信号转导途径的数量。使可能影响效率的因子数量最小化将会提高稳健性和重现性。
本发明人惊奇地发现,就SOX17表达的有效峰和稳健性而言,当与BIO或Wnt3a相比时,CHIR-起始步骤对于DE诱导而言是独特的和优越的。
在简单的RPMI-1640培养基中,使来自可扩展的多潜能培养物的人胚胎干细胞(hESC)和人诱导的多潜能干细胞(iPSC)经历24小时CHIR (2-7 μM)处理。然后将培养基更换为含有AA的RPMI-1640培养基,DE诱导开始,其中2天之后SOX17 mRNA表达达到峰值,3-4天之后SOX17蛋白表达达到峰值。低于2 μM浓度的CHIR导致Brachyury的延迟诱导至明显较低的水平,随后AA刺激,在72小时之后DE不被诱导。在CHIR浓度低于1.5 μM时PS的形成被延迟,因此当添加AA时不能进一步发展为DE。本发明人惊奇地发现,浓度范围大于或等于2 μM的CHIR达24小时,对于随后通过AA的DE诱导而言是重要的。
本发明人已经惊奇地发现CHIR-起始步骤导致AA对SOX17的明显快速的诱导,1天之后就已达到峰值,相比之下,仅用AA则在3-4天之后才见峰值。用CHIR接着用AA的序贯孵育对于DE形成达到有利水平而言是必不可少的。
本发明的实施方案:
1. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
c. 在包含至少2 μM CHIR的培养基中孵育干细胞的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
d. 在包含激活素A的培养基中孵育干细胞的第二后续步骤。
2. 实施方案1的方法,其中所述培养基是RPMI-1640。
3. 前述实施方案中任一个的方法,其中所述干细胞是胚胎干细胞或诱导的多潜能干细胞。
4. 前述实施方案中任一个的方法,其中所述干细胞是胚胎干细胞。
5. 实施方案3的方法,其中所述干细胞是人胚胎干细胞。
6. 实施方案3的方法,其中所述干细胞是诱导的多潜能干细胞。
7. 前述实施方案中任一个的方法,其中CHIR的浓度为至少大约2.5 μM,或至少3 μM,例如范围在大约2-20uM,例如范围在大约3.1-15 μM,或例如范围在大约3.5-7 μM,或例如范围在大约3.5-6 μM,或例如范围在大约3.5-5 μM。
8. 实施方案7的方法,其中CHIR的浓度为至少大约2 μM。
9. 实施方案7的方法,其中CHIR的浓度为至少大约2.5 μM。
10. 实施方案7的方法,其中CHIR的浓度为至少大约3 μM。
11. 实施方案7的方法,其中CHIR的浓度为至少大约3.1 μM。
12. 实施方案7的方法,其中CHIR的浓度为至少大约3.2 μM。
13. 实施方案7的方法,其中CHIR的浓度为至少大约3.3 μM。
14. 实施方案7的方法,其中CHIR的浓度为至少大约3.4 μM。
15. 实施方案7的方法,其中CHIR的浓度为至少大约3.5 μM。
16. 实施方案7的方法,其中CHIR的浓度范围为大约2-7 μM。
17. 实施方案7的方法,其中CHIR的浓度范围为大约3-7 μM。
18. 实施方案7的方法,其中CHIR的浓度范围为大约3.1-7 μM。
19. 实施方案7的方法,其中CHIR的浓度范围为大约3.2-7 μM。
20. 实施方案7的方法,其中CHIR的浓度范围为大约3.3-7 μM。
21. 实施方案7的方法,其中CHIR的浓度范围为大约3.4-7 μM。
22. 实施方案7的方法,其中CHIR的浓度范围为大约3.5-7 μM。
23. 实施方案7的方法,其中CHIR的浓度为2.5 μM。
24. 实施方案7的方法,其中CHIR的浓度为3 μM。
25. 实施方案7的方法,其中CHIR的浓度为3.1 μM。
26. 实施方案7的方法,其中CHIR的浓度为3.2 μM。
27. 实施方案7的方法,其中CHIR的浓度为3.3 μM。
28. 实施方案7的方法,其中CHIR的浓度为3.4 μM。
29. 实施方案7的方法,其中CHIR的浓度为3.5 μM。
30. 实施方案7的方法,其中CHIR的浓度为3.6 μM。
31. 实施方案7的方法,其中CHIR的浓度为3.7 μM。
32. 实施方案7的方法,其中CHIR的浓度为3.8 μM。
33. 实施方案7的方法,其中CHIR的浓度为3.9 μM。
34. 实施方案7的方法,其中CHIR的浓度为大约4 μM。
35. 实施方案7的方法,其中CHIR的浓度为大约4.5 μM。
36. 实施方案7的方法,其中CHIR的浓度为大约5 μM。
37. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为至少12小时。
38. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为至少24小时。
39. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为至少48小时。
40. 实施方案37的方法,其中所述与CHIR的孵育为介于24和48小时之间。
41. 实施方案37的方法,其中所述与CHIR的孵育为24小时。
42. 实施方案37的方法,其中所述与CHIR的孵育为48小时。
43. 前述实施方案中任一个的方法,其中激活素A的浓度为至少大约100ng/ml,例如范围为大约1-5000 ng/ml,例如范围为大约1-1000 ng/ml,例如范围为大约10-500 ng/ml或例如范围为大约1-200 ng/ml。
44. 实施方案43的方法,其中激活素A的浓度范围为大约1-200ng/ml。
45. 实施方案43的方法,其中激活素A的浓度范围为大约20-200ng/ml。
46. 实施方案43的方法,其中激活素A的浓度范围为大约30-200ng/ml。
47. 实施方案43的方法,其中激活素A的浓度为至少25ng/ml。
48. 实施方案43的方法,其中激活素A的浓度为大约140ng/ml。
49. 实施方案43的方法,其中激活素A的浓度为大约120ng/ml。
50. 实施方案43的方法,其中激活素A的浓度为大约100ng/ml。
51. 实施方案43的方法,其中激活素A的浓度为大约80ng/ml。
52. 实施方案43的方法,其中激活素A的浓度为大约60ng/ml。
53. 实施方案43的方法,其中激活素A的浓度为大约40ng/ml。
54. 前述实施方案中任一个的方法,其中所述与激活素A的孵育范围为12小时至5天,例如至少12小时,例如至少24小时或至少48小时,或例如3-4天。
55. 实施方案54的方法,其中所述与激活素A的孵育为至少12小时。
56. 实施方案54的方法,其中所述与激活素A的孵育为24小时。
57. 实施方案54的方法,其中所述与激活素A的孵育为48小时。
58. 实施方案54的方法,其中所述与激活素A的孵育为72小时。
59. 实施方案54的方法,其中所述与激活素A的孵育为48至72小时。
60. 实施方案54的方法,其中所述与激活素A的孵育为3-4天。
61. 前述实施方案中任一个的方法,其中内胚层细胞是得自所述定形内胚层细胞。
62. 实施方案61的方法,其中所述内胚层细胞是肝内胚层细胞、胰内胚层细胞、肠内胚层细胞和/或肺内胚层细胞。
63. 实施方案62的方法,其中所述内胚层细胞是肝内胚层细胞。
64. 实施方案62的方法,其中所述内胚层细胞是胰内胚层细胞。
65. 通过实施方案1-64的方法可获取的定形内胚层细胞。
66. 通过实施方案1-64的方法可获取的内胚层细胞。
67. 实施方案66的肝内胚层细胞、胰内胚层细胞、肠内胚层细胞和/肺内胚层细胞。
68. 实施方案66的内胚层细胞,其中所述细胞是肝内胚层细胞。
69. 实施方案66的内胚层细胞,其中所述细胞是胰内胚层细胞。
70. 实施方案1-64的方法,其中β-连环蛋白被CHIR-诱导的Gsk3b抑制而活化。
71. CHIR的用途,其中在培养基中的CHIR的浓度为至少2μM CHIR,例如范围为3.1-15 μM,或例如3.1-7 μM,或例如3.5-15 uM,或例如
72. 在培养基中浓度为至少3.1uM的CHIR在自胚胎干细胞诱导原条细胞中的用途。
73. 浓度范围为3.1-7uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
74. 浓度范围为3.5-7uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
75. 浓度为3.5 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
76. 浓度为4 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
77. 浓度为4.5 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
78. 浓度为5 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
79. 实施方案71-78的用途,其中所述原条表达一种或多种以下标记:Brachyury或Mixl1。
80. 实施方案71-78的用途,其中所述定形内胚层表达一种或多种以下标记:Sox17。
本发明的更多实施方案:
81. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
a. 在包含至少2 μM CHIR的培养基中孵育干细胞的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
b. 在包含至少25ng/ml激活素A的培养基中孵育干细胞的第二后续步骤。
82. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
a. 在包含至少2 μM CHIR的培养基中孵育干细胞的至少12小时的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
c. 在包含至少25ng/ml激活素A的培养基中孵育干细胞的至少12小时的第二后续步骤。
83. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
b. 在包含至少2 μM CHIR的培养基中孵育干细胞的至少24小时的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
d. 在包含至少25ng/ml激活素A的培养基中孵育干细胞的至少24小时的第二后续步骤。
84. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
a. 在包含至少3.1 μM CHIR的培养基中孵育干细胞的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
b. 在包含至少25ng/ml激活素A的培养基中孵育干细胞的第二后续步骤。
85. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
a. 在包含至少3.5 μM CHIR的培养基中孵育干细胞的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
b. 在包含至少25ng/ml激活素A的培养基中孵育干细胞的第二后续步骤。
86. 前述实施方案中任一个的方法,其中所述干细胞是胚胎干细胞或诱导的多潜能干细胞。
87. 实施方案86的方法,其中所述干细胞是人胚胎干细胞。
88. 实施方案86的方法,其中所述干细胞是诱导的多潜能干细胞。
89. 前述实施方案中任一个的方法,其中CHIR的浓度为至少大约2,至少大约2.5uM,至少大约3uM,至少大约3.1 μM,例如范围为大约3.1-15 μM,或例如大约3.5-7 μM,或例如大约3.5-6 μM,或例如大约3.5-5 μM。
90. 前述实施方案中任一个的方法,其中CHIR的浓度为至少大约3.1 μM。
91. 前述实施方案中任一个的方法,其中CHIR的浓度为至少大约3.2 μM。
92. 前述实施方案中任一个的方法,其中CHIR的浓度为至少大约3.3 μM。
93. 前述实施方案中任一个的方法,其中CHIR的浓度为至少大约3.4 μM。
94. 前述实施方案中任一个的方法,其中CHIR的浓度为至少大约3.5 μM。
95. 前述实施方案中任一个的方法,其中CHIR的浓度范围为大约3.1-7 μM。
96. 前述实施方案中任一个的方法,其中CHIR的浓度范围为大约3.2-7 μM。
97. 前述实施方案中任一个的方法,其中CHIR的浓度范围为大约3.3-7 μM。
98. 前述实施方案中任一个的方法,其中CHIR的浓度范围为大约3.4-7 μM。
99. 前述实施方案中任一个的方法,其中CHIR的浓度范围为大约3.5-7 μM。
100. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为至少24小时。
101. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为至少48小时。
102. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为介于24和48小时之间。
103. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为24小时。
104. 前述实施方案中任一个的方法,其中所述与CHIR的孵育为48小时。
105. 前述实施方案中任一个的方法,其中激活素A的浓度范围为大约25-200ng/ml。
106. 前述实施方案中任一个的方法,其中激活素A的浓度范围为大约30-200ng/ml。
107. 前述实施方案中任一个的方法,其中激活素A的浓度为大约100ng/ml。
108. 前述实施方案中任一个的方法,其中激活素A的浓度为大约80ng/ml。
109. 前述实施方案中任一个的方法,其中激活素A的浓度为大约60ng/ml。
110. 前述实施方案中任一个的方法,其中激活素A的浓度为大约40ng/ml。
111. 前述实施方案中任一个的方法,其中激活素A的浓度为至少大约110ng/ml。
112. 前述实施方案中任一个的方法,其中所述与激活素A的孵育范围为12小时至5天,例如至少12小时,例如至少24小时或至少48小时,或例如3-4天。
113. 前述实施方案中任一个的方法,其中所述与激活素A的孵育为至少大约24小时。
114. 前述实施方案中任一个的方法,其中所述与激活素A的孵育为大约24小时。
115. 前述实施方案中任一个的方法,其中所述与激活素A的孵育为大约48小时。
116. 前述实施方案中任一个的方法,其中所述与激活素A的孵育为大约72小时。
117. 前述实施方案中任一个的方法,其中所述与激活素A的孵育为大约48至约72小时。
118. 前述实施方案中任一个的方法,其中所述与激活素A的孵育为大约3-4天。
119. 前述实施方案中任一个的方法,其中内胚层细胞得自所述定形内胚层细胞。
120. 实施方案119的方法,其中所述内胚层细胞是肝内胚层细胞、胰内胚层细胞、肠内胚层细胞和/或肺内胚层细胞。
121. 实施方案120的方法,其中所述内胚层细胞是肝内胚层细胞。
122. 实施方案120的方法,其中所述内胚层细胞是胰内胚层细胞。
123. 通过实施方案81-122的方法可获取的定形内胚层细胞。
124. 通过实施方案81-122的方法可获取的内胚层细胞。
125. 实施方案124的肝内胚层细胞、胰内胚层细胞、肠内胚层细胞和/肺内胚层细胞。
126. 实施方案124的内胚层细胞,其中所述细胞是肝内胚层细胞。
127. 实施方案124的内胚层细胞,其中所述细胞是胰内胚层细胞。
128. 实施方案81-122的方法,其中β-连环蛋白被CHIR-诱导的Gsk3b抑制而活化。
129. 特定浓度的CHIR在自干细胞诱导原条细胞中的用途。
130. 特定浓度的CHIR在自干细胞诱导定形内胚层细胞中的用途。
131. 实施方案129-130的用途,其中培养基中的CHIR浓度为至少2 μM CHIR。
132. 实施方案129-131的用途,其中培养基中的CHIR浓度为至少2μM CHIR,例如范围为2-7 μM,例如3 μM或例如4 μM。
133. 浓度范围为2-7 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
134. 浓度范围为3-7 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
135. 浓度范围为3.5-7 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
在一个实施方案中,通过本发明的方法可获取的胰内分泌细胞是产生胰岛素的细胞,任选与朝着产生胰高血糖素、生长抑素、胰多肽和/或生长素释放肽的细胞分化的细胞在一起。如本文所用,“产生胰岛素的细胞”是指产生和贮存或分泌可检测量的胰岛素的细胞。“产生胰岛素的细胞”可以是单一细胞或细胞集合。
在另一个实施方案中,包含胰细胞的细胞群得自体细胞群。在某些方面,所述体细胞群已经诱导而去分化,成为胚胎-样干(ES,例如多潜能)细胞。这样的去分化细胞也称为诱导的多潜能干细胞(IPS)。
在另一个实施方案中,包含胰细胞的细胞群得自胚胎干(ES,例如多潜能)细胞。在某些方面,包含胰细胞的细胞群是多潜能细胞,例如ES样-细胞。
在另一个实施方案中,包含胰细胞的细胞群是胚胎分化的干(ES或多潜能的)细胞。分化发生在胚状体中和/或在单层细胞培养中或其组合中。
在另一个实施方案中,所述细胞群是干细胞群。在某些方面,所述细胞群是分化为胰内分泌谱系的干细胞群。
干细胞是未分化的细胞,其定义为在单细胞水平上既能够自我更新,又能够分化以产生子代细胞,包括自我更新的祖细胞、非自我更新的祖细胞和终末分化的细胞。干细胞还可按以下能力来表征:在体外分化为来自多个胚层(内胚层、中胚层和外胚层)的多个细胞谱系的功能细胞的能力,以及在移植之后产生多个胚层的组织的能力,和在注入胚泡中之后充分促进大部分(如果不是所有的话)组织的能力。
按其发育潜力,将干细胞分为:(1)全能干细胞,是指能够产生所有胚胎的和胚胎外的细胞类型;(2)多潜能(pluripotent)干细胞,是指能够产生所有胚细胞类型;(3)多能(multi-potent)干细胞,是指能够产生细胞谱系亚型,但都在特定的组织、器官或生理系统内(例如,造血干细胞(HSC)可产生子代,其包括HSC (自我更新的)、血细胞限制性寡能祖细胞和作为血液正常组分的所有细胞类型和要素(例如,血小板));(4)寡能干细胞,是指能够产生比多能干细胞更受限制的细胞谱系亚型;和(5)单能干细胞,是指能够产生单一的细胞谱系(例如生精干细胞)。
用于自干细胞获取胰细胞的方案例如但不限于以下文献中描述的方案:D'Amour, K. A.等人(2006), Nat Biotechnol 24, 1392-401;Jiang, J.等人(2007), Stem Cells 25, 1940-53;和Kroon, E.等人(2008), Nat Biotechnol 26, 443 - 452。
自体细胞或经诱导去分化为多潜能细胞例如ES样-细胞的体细胞获取胰细胞的方案例如但不限于以下文献中描述的方案:Aoi, T.等人(2008), Science 321(no. 5889), 699 - 702;D'Amour, K. A.等人(2006), Nat Biotechnol 24, 1392-401;Jiang, J.等人(2007), 干细胞 25, 1940-53;Kroon, E.等人(2008), Nat Biotechnol 26, 443 - 452;Takahashi, K.等人(2007), Cell 131, 861-72;Takahashi, K.和Yamanaka, S. (2006), Cell 126, 663-76;和Wernig, M.等人(2007), Nature 448, 318-24。
如本文所用的“使分化”或“分化”是指细胞从未分化状态向分化状态、从未成熟状态向较成熟状态或从未成熟状态向成熟状态发展的过程。例如,早期未分化的胚胎胰细胞能够增殖和表达特征性标记,例如Pdx1、Nkx6.1和Ptf1a。成熟或分化的胰细胞不增殖,但分泌高水平的胰内分泌激素或消化酶。例如完全分化的β细胞在响应葡萄糖时分泌高水平的胰岛素。当细胞失去未分化细胞标记或获得分化细胞标记时,细胞相互作用和成熟的变化发生。失去或获得单个标记可表明细胞已“成熟或完全分化”。术语“分化因子”是指加入胰腺细胞以增强其向成熟内分泌细胞(还包含产生胰岛素的β细胞)分化的化合物。示例性的分化因子包括肝细胞生长因子、角化细胞生长因子、毒蜥外泌肽-4、基本成纤维细胞生长因子、胰岛素样生长因子-1、神经生长因子、表皮生长因子、血小板衍生生长因子和胰高血糖素样肽1。在某些方面,细胞的分化包括在含有一种或多种分化因子的培养基中培养细胞。
如本文所用,“人多潜能干细胞”(hPS)是指可源自任何来源并且在合适条件下能够产生作为所有3个胚层(内胚层、中胚层和外胚层)的衍生物的不同细胞类型的人的子代的细胞。hPS细胞可具有在8-12周龄SCID小鼠中形成畸胎瘤的能力和/或在组织培养中形成所有3胚层的可鉴定的细胞的能力。人多潜能干细胞的定义中包括不同类型的胚细胞,其包括人胚泡衍生的干(hBS)细胞(在30篇文献中通常称为人胚胎干(hES)细胞),(参见例如Thomson等人(1998), Heins等人. (2004),以及诱导的多潜能干细胞(参见例如Yu等人, (2007) Science 318:5858);Takahashi等人, (2007) Cell 131(5):861)。本文所述的各种方法和其它实施方案可能需要或利用来自各种来源的hPS细胞。例如,适用的hPS细胞可得自发育中的胚胎。此外或备选地,合适的hPS细胞可得自已建立的细胞系和/或人诱导的多潜能干(hiPS)细胞。
如本文所用的“hiPS细胞”是指人诱导的多潜能干细胞。
如本文所用,术语“胚泡-衍生的干细胞”命名为BS细胞,人形式称为“hBS细胞”。在文献中,所述细胞通常称为胚胎干细胞,更具体地讲是人胚胎干细胞(hESC)。因此,用于本发明的多潜能干细胞可以是自胚泡制备的胚胎干细胞,如例如WO 03/055992和WO 2007/042225所述,或是市售的hBS细胞或细胞系。然而,进一步设想的是任何人多潜能干细胞都可用于本发明,包括分化的成年细胞,这可通过例如用某些转录因子例如OCT4、SOX2、NANOG和LIN28 (公开于Yu等人, 2007, Takahashi等人,2007和Yu等人,2009)处理成年细胞,将其重新编程为多潜能细胞。
如本文所用“饲养细胞”意指单独使用或组合使用的支持细胞类型。所述细胞类型还可以是人或其它物种来源。饲养细胞可来源的组织包括胚胎、胎儿、新生儿、青少年或成人的组织,并且进一步包括源自皮肤的组织,包括包皮、脐带(umbilical chord)、肌肉、肺、上皮、胎盘、输卵管、腺体、基质或乳腺。饲养细胞可源自以下细胞类型:人成纤维细胞、纤维细胞、肌细胞、角质细胞、内皮细胞和上皮细胞。可用于得到饲养细胞的具体细胞类型的实例包括胚胎成纤维细胞、胚胎外内胚层细胞、胚胎外中胚层细胞、胎儿成纤维细胞和/或纤维细胞、胎儿肌肉细胞、胎儿皮肤细胞、胎儿肺细胞、胎儿内皮细胞、胎儿上皮细胞、脐带间充质细胞、胎盘成纤维细胞和/或纤维细胞、胎盘内皮细胞。
如本文所用,术语“MEF细胞”意指小鼠胚胎成纤维细胞。
如本文所用,“CHIR”、“Chir”或“Chir99021”是专利US6417185覆盖下的已获专利权的市售糖原合酶激酶3 β (Gsk3b)抑制剂,并由以下文献描述:Goff, D. A.等人(2002) Inhibitors of glycogen synthase kinase 3。
本发明的实施方案:
136. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
a. 在包含至少2 μM CHIR的培养基中孵育干细胞;和
b. 随后在包含激活素A的培养基中孵育干细胞。
137. 实施方案136的方法,其中在所述与CHIR的孵育期间激活素A不存在。
138. 实施方案136-137的方法,其中所述培养基是RPMI-1640。
139. 实施方案136-138中任一个的方法,其中所述干细胞是胚胎干细胞。
140. 实施方案136-139中任一个的方法,其中CHIR的浓度为至少2 μM,例如范围为2-7 μM,或例如3 μM或例如4 μM。
141. 实施方案136-140中任一个的方法,其中所述与CHIR的孵育为至少12小时,例如24小时。
142. 实施方案136-141中任一个的方法,其中所述与激活素A的孵育范围为12小时至5天,例如至少12小时,例如至少24小时或至少48小时,或例如3-4天。
143. 实施方案136-142中任一个的方法,其中特定的内胚层细胞得自所述定形内胚层细胞。
144. 实施方案143的方法,其中所述特定的内胚层细胞是胰内胚层细胞。
145. 通过实施方案136-144的方法可获取的定形内胚层细胞。
146. 通过实施方案136-145的方法可获取的特定内胚层细胞。
147. 特定浓度的CHIR在自干细胞诱导原条细胞中的用途。
148. 特定浓度的CHIR在自干细胞诱导定形内胚层细胞中的用途。
149. 实施方案147-148的用途,其中培养基中的CHIR浓度为至少2 μM CHIR。
150. 实施方案147-148的用途,其中培养基中的CHIR浓度为至少2μM CHIR,例如范围为2-7 μM,例如3 μM或例如4 μM。
151. 浓度范围为2-7 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
152. 浓度范围为3-7 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
153. 浓度范围为3.5-7 uM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
本文引用的所有参考文献,包括出版物、专利申请和专利,通过引用以其整体结合到本文中,并至如同每篇参考文献各自和明确地指明通过引用予以结合和作为整体在本文中阐明(至法律所允许的最大程度)的相同程度。
所有标题和小标题在本文仅用于方便目的,不应视为以任何方式限制本发明。
本文给出的任何和所有实施例或示例性语言(例如,“例如”)的使用,仅意指更好地说明本发明,不得视为对本发明范围的限制,除非另有说明。本说明书中的语言不应视为指示对本发明的实践必不可少的任何非权利要求的要素。
尽管本文已经说明和描述了本发明的某些特征,但是许多修改、替代、变动和等同方案对于本领域技术人员而言是将会发生的。因此,可以理解,所附权利要求书意图覆盖所有这样的修改和变动,如同落入本发明的真实精神之内。
缩略语
AA:激活素A
D’Am:D’Amour方案(Kroon等人, 2008)
DE:定形内胚层
bFGF:基础成纤维细胞生长因子(FGF2)
Gsk3b:糖原合酶激酶3 β
hBSC:人胚泡-衍生的干细胞
hESC:人胚胎干细胞
hIPSC:人诱导的多潜能细胞
hPSC:人多潜能干细胞
KO-SR:剔除血清替换
RNA:核糖核酸
PCR:聚合酶链式反应
PS:原条
SOX17:SRY (性别决定区Y)-box 17
T:Brachyury。
实施例
实施例1 –人ES/iPS细胞的体外培养
在两种不同的无饲养细胞(DEF, mTeSR)培养系统和一种饲养细胞依赖的(MEF-ES)培养系统中证实了DE方案。
DEF hESC/iPS培养系统
在6-96孔板中,在含有30 ng/ml bFGF (Invitrogen)和10 ng/ml Noggin (Peprotech)的DEF培养基(Cellartis)中,使人胚胎干(hES)细胞SA121和chIPS4 (Cellartis)生长在人纤连蛋白(Sigma)上。细胞是用Rock抑制剂Y-27632 (Calbiochem)传代的单细胞并以40000细胞/cm2的密度接种,用于实验。在传代之后4天开始实验。
mTeSR培养系统
根据培养系统方案,使hES细胞(SA121)在mTeSR1培养基(Cell Signaling Techologies)中从饲养细胞(MEF)成簇传代至Matrigel (BD Biosciences),并进一步用Dispase (BD Biosciences)传代。一旦各簇开始彼此接触,开始DE。
MEF-ES
在hES培养基(KO-DMEM、PEST、Glutamax、NEAA、2-巯基乙醇、KO血清替换、10ng/ml bFGF)中,将hES细胞(SA121)在包被明胶并预接种MEF的板上传代。在80%汇合时开始DE。
实施例2 – CHIR DE方案
将汇合的培养物在RPMI1640 (Invitrogen)中洗涤一次,然后在RPMI中用0.5-7μM CHIR99021 (Stemgent) 24小时预处理。根据实验设置,对照细胞置于RPMI中未经处理,D’Amour细胞置于RPMI中或者用AA (Peprotech) + Wnt3a (R&D Systems)处理(不经预处理)。
24小时之后,预处理的和对照细胞用RPMI洗涤一次,然后添加含100 ng/ml AA的RPMI。D’Amour细胞也用100ng/ml AA处理,但用0.2% FBS替代B27。24小时之后,将2% B27 (Invitrogen)添加到AA培养基中2-3天。根据已公布的方案,对照细胞用B27处理以防细胞死亡,D’Amour细胞用2% FBS处理。每天更换培养基。
当细胞进一步分化为PE时,在T75细胞培养瓶中应用DE方案,并在DE培养4天后以200K的密度在DE培养基中重接种。按照已公布方案(Ameri等人2010),1天之后,将细胞洗涤一次,然后添加PE培养基(RPMI1640+12% KOSR+64ng/ml bFGF)。
CHIR定形内胚层方案的概述可见图1。已在下列7种不同的细胞系中证实了该方案:SA121、SA181、SA461、SA167 (hESC)和chIPS2、chIPS3、chIPS4 (hiPSC)。
表1. CHIR DE细胞培养方案。
第1天:将细胞在预保温的(37℃) RPMI中小心洗涤,然后开始分化。将第1天培养基预混合(CHIR 3μM在预保温的RPMI + PEST中)并轻轻添加到细胞培养物中。按照板的格式调整体积。
第2天:将细胞在预保温的(37℃) RPMI中小心洗涤,然后更换培养基。将第2天培养基预混合(100ng/ml激活素A在预保温的RPMI + 0.1%PEST中)并轻轻添加到细胞培养物中。
第3天:将第3&4天培养基预混合(100ng/ml激活素A和2% B27在预保温的RPMI + 0.1%PEST中)并轻轻添加到细胞培养物中。
第4天:收获DE或者重新接种,用于进一步分化。每天在显微镜下检查细胞。
实施例3
RNA提取和定量实时PCR
在24小时预处理之后(D1)、AA处理1天之后(D2)和AA+B27处理1-2天之后(D3-4),采集RNA样品。总RNA用Rneasy Plus Mini试剂盒(Qiagen)提取,然后使用StepOnePLus系统(Applied Biosystems)进行定量实时PCR。
ICC染色程序
将细胞在PBS+/+中洗涤并在4%甲醛中固定30 min (10%福尔马林, VWR)。然后将细胞在PBS中再洗涤3次并留在PBS (4℃)中,直到染色。固定的细胞用PBS洗涤一次,然后用含0.5% Triton X-100的PBS渗透6min,在PBS中洗涤并用TNB缓冲液(0.1M Tris-HCL pH 7.5、0.15M NaCl、0.5%封闭试剂(Perkin Elmer))封闭30min。在RT或4℃ O/N,在0.1% TritonX-100 + PBS中加入第一抗体(山羊-抗SOX17 (AF1924, RnD Systems);山羊-抗Brachyury (AF2085, RnD Systems);小鼠-抗OCT4 (sc5279, SantaCruz Biotechnology);山羊-抗PDX1 (AB47383, Abcam))过1小时。在PBS中充分洗涤步骤之后,在室温下加入第二抗体以及在0.1% Triton X-100 + PBS中的DAPI过45min,在PBS中充分洗涤并留在PBS中,直到图像记录。
实施例4
速度和效率
将在DEF培养基中的未分化的SA121 hES和chIPS4 iPS细胞(D0)在不含CHIR的RPMI中 (Ctrl D1)培养,或者用含CHIR的RPMI处理24小时(CHIR D1)。然后洗涤细胞,确保没有CHIR,然后这两种情况都用1d AA处理(Ctrl和CHIR d2)。1d CHIR处理之后,与未经预处理的细胞相比,PS标记例如Brachyury (T)、MIXL1、EOMES和GSC被高度上调(图2A-C)。与未分化的细胞(d0)相比,24小时CHIR处理之后T fold诱导跨越500-100000。还用ICC证实了T蛋白水平(图2C)。
AA添加之后1天(D2),与未预处理的细胞相比,尽管这两种情况都添加了AA (图3A,B),共同指示DE形成的标记例如SOX17、CXCR4、FOXA2和CER也被高度上调,与未分化的细胞(D0, n>60)相比,CHIR预处理之后的Sox17-fold诱导跨越10000-3500000。T和SOX17两者的效率水平是高度稳健的(n > 60)并用IHC和SOX17定量测定而证实(图2C和表2)。CHIR预处理步骤导致在AA处理之后SOX17的明显快速诱导。当AA诱导之前细胞经历CHIR 24小时时,SOX17表达在AA处理1天之后就已达到峰值。在含AA的培养基中的未用CHIR预处理的细胞(ctrl)在Sox17诱导中未显示出相同的速度或效率。
在24小时处理(D1)之后,CHIR对于诱导PS标记具有直接能力并导致当添加AA(D2)时,对AA诱导DE而言具有明显更高的能力。一旦加入AA,Brachyury被极大地抑制,表明细胞正以高度逐步顺序分化。
表2. 在未分化的hES SA121/chIPS4细胞中OCT4和SOX17蛋白的ICC定量测定
表2显示按照D’Amour (如Kroon等人2008所描述的方案)的DE诱导的D1-3和用3uM CHIR处理细胞(CHIR D1),然后添加激活素A (CHIR D2-3)。
实施例5
CHIR特异性
将hES SA121和ChIPS4细胞单用CHIR (3μM)、BIO (0.5uM)、Wnt3a (200ng/ml)或者AA (100ng/ml)处理24小时,然后添加AA,显示出CHIR特异性(d1)。另外,平行测试了D’Amour (如Kroon等人2008所述的方案)。
CHIR处理在24小时之后明显地上调了Brachyury表达(图4A,C)。AA添加之后(D2),Brachyury被降低,而SOX17被上调(图4B)。用AA或BIO处理的hES细胞直到d3无存活。
数据清楚表明,与用生长因子例如AA和Wnt3a的预处理相比,在CHIR处理之后PS的转变(Brachyury的上调)和DE的诱导(SOX17的上调)都被加速并且高得多。细胞用另一种小分子Gsk3b抑制剂(BIO)预处理,未引起相同效果,并且所述细胞直到d3无存活。与CHIR处理相比,用Wnt3a或BIO替代CHIR的处理延迟了Brachyury (PS)响应(D2上调) (数据未显示)。此外,这些物质以显著更低的效率诱导Brachyury和SOX17两者的基因表达,并且用AA或BIO处理的细胞直到d3无存活。该方案也大大优于先前已公布的D’Amour方案。
实施例6
CHIR与D’Amour方案(DE和PE诱导)
按照Kroon等人2008,将未分化的ChIPS4细胞(d0)用CHIR (3uM)预处理24小时或者直接暴露于AA (100ng/ml)和Wnta3a (25ng/ml)。然后洗涤细胞并加入AA过1-4天。详细设置参见表1。
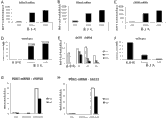
与D’Amour相比,在CHIR预处理之后,CHIR处理在上调T (mRNA D1)和SOX17 (mRNA, ICC D3)两者中是优越的(图5和表2)。另外,依照在D’Amour处理期间具有更高程度细胞死亡的形态学可见这些方案之间的最显著差异。为了进一步加强该结果,由此对SOX17蛋白表达进行定量测定。用CHIR-方案或者D’Amour-方案处理的chIPS4细胞经过固定并使用SOX17-特异性ab染色,关于SOX17-阳性细胞的总量和百分率对图像进行量化。如图6D所示,发现91.5%的CHIR-处理的细胞对于SOX17呈阳性,而仅77.6%的D’Amour-处理的细胞显示出SOX17阳性染色d3。另外,CHIR预处理的细胞的总量比经D’Amour处理之后所见的数量高25%。
还使用qPCR和qICC两者,在chIPS4细胞中分析了OCT4表达的减少。数据清楚地表明,CHIR-方案更充分地在mRNA和蛋白两者的水平上减少OCT4表达(图5E, F)。
为了进一步比较CHIR-方案和D’Amour方案的效率,使用这两个方案中任一个分化为DE的chIPS4细胞,通过使用先前已公布的PE分化方案(Ameri等人2010)被进一步向胰内胚层(PE)分化。PE分化诱导之后7天,将细胞固定并使用PDX1特异性抗体通过ICC进行分析。结果显示在D’Amour-处理的细胞中非常少的PDX1-染色,而在CHIR预处理的细胞中染色明显(数据未显示)。平行地,从细胞中采集mRNA并通过实时PCR分析PDX1表达。与ICC结果相一致,在D’Amour-处理的细胞中几乎没发现PDX1 mRNA表达,而在CHIR-分化细胞中却见到明显表达(图5G)。在这两种细胞系中重复2次实验(图5G,H)。
实施例7
时间安排
用RPMI (ctrl)、CHIR 3uM、CHIR 3uM+AA 100ng/ml或者100ng/ml AA + 25ng/ml Wnt3a (D’Amour)对细胞预处理1天,然后添加AA +/- Wnt3a (25ng/ml) d2和AA d3 (表3)。将B27加入Ctrl和CHIR d3和将FBS加入D’Amour d2-3。
表3:用于DE诱导的方案
数据显示CHIR处理之后Wnt3a不存在,对SOX17诱导无负面影响(图6A, C)。然而,CHIR处理之后AA的排除维持了Brachyury表达(数据未显示)和限制了向DE的进一步发展。
预处理期间添加AA加上CHIR不显示附加效应,但方案的稳定性却受到负面影响,在实验之间对于DE诱导而言具有高差异性。当在预处理期间组合CHIR和AA时也常见对细胞存活D1的负面影响(参见细胞形态学D1, 图6D)。与用CHIR预处理的细胞相比,添加CHIR加上D’Amour D1也显示出减少的SOX17表达D2(图6B)。
在向DE分化的第一天期间,CHIR预处理替代对Wnt3a和AA两者的需要并且也具有稳定效果,产生更稳健的方案。
CHIR和外源AA可能具有相反效应,其降低了总效率和/或分别靶向不同的细胞群,导致在细胞培养内更高水平的异质性并增加了实验之间的差异性。这表明将AA添加到培养基之前的PS诱导/转变是增加方案有效性和稳健性的重要而创新的步骤。
实施例8
剂量依赖性
在24小时CHIR处理之后(D1)和随后AA处理2天之后(D3),以1-7uM之间的浓度滴定Chir并进行分析。CHIR 0.5-1uM和CHIR 7uM d3无存活。
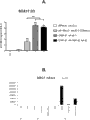
1. 在24小时处理之后,在CHIR 3uM中明显可见Brachyury诱导,而在CHIR 1uM中则不可见(图7A,C)。
2. 在AA处理之后2天,在CHIR 1uM中Brachyury表达的下调被延迟(图7A),而Sox17表达明显降低(7B,D)。
数据表明PS形成在Chir浓度低于1uM时被延迟,当添加AA时不能进一步向DE发展。
实施例9
在其它细胞培养系统中CHIR预处理之后的DE诱导
在其它无hESC饲养细胞培养系统例如mTeSR (图8A表4)和在生长在MEF饲养细胞上的hESC中(图9),CHIR预处理之后对OCT4下调和T/SOX17上调D3的效果也优于D’Amour方案。
表4. 在mTeSR系统中的Oct4和Sox17表达
参考文献
Ameri, J., A. Stahlberg等人(2010). FGF2 specifies hESC-derived definitive endoderm into foregut/midgut cell lineages in a concentration-independent manner (FGF2以浓度非依赖性方式指定hESC-衍生的定形内胚层到前肠/中肠细胞谱系). Stem Cells 28(1): 45-56.
Chung等人(2008). Human embryonic stem cells lines generated without embryo destruction (无胚胎破坏的人胚胎干细胞系的产生). Cell Stem Cells 2.
Geens等人(2009). Human embryonic stem cell lines derived from single blastomeres of two 4-cell stage embryos (源自2个4-细胞期胚胎的单个卵裂球的人胚胎干细胞系). Human reproduction.
Hanna, J., A. W. Cheng等人(2010). Human embryonic stem cells with biological and epigenetic characteristics similar to those of mouse ESCs (生物学和表观遗传学特征类似于小鼠ESC的人胚胎干细胞). Proc Natl Acad Sci U S A 107(20): 9222-9227.
Jiang, J., M. Au,等人(2007). Generation of insulin-producing islet-like clusters from human embryonic stem cells (来自人胚胎干细胞的产生胰岛素的胰岛-样聚簇的产生). Stem Cells 25(8): 1940-1953.
Klimanskaya等人(2006). Human embryonic stem cell lines derived from single blastomeres (源自单个卵裂球的人胚胎干细胞系). Nature Letters.
Kroon, E., L. A. Martinson,等人(2008). Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-? secreting cells in vivo. (源自人胚胎干细胞的胰内胚层在体内产生葡萄糖-响应性胰岛素-?‐分泌细胞) Nat Biotechnol 26(4): 443-452.
Mazumdar, J., W. T. O'Brien,等人(2010). O2 regulates stem cells through Wnt/beta-?‐catenin signalling (O2通过Wnt/β-?‐连环蛋白信号转导而调节干细胞). Nat Cell Biol 12(10): 1007-1013.
Sato, N., L. Meijer,等人(2004). Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signalling by a pharmacological GSK‐3-specific inhibitor(通过药理学的GSK 3-特异性抑制剂激活Wnt信号转导,维持人和小鼠胚胎干细胞的多潜能性). Nat Med 10(1): 55-63.
Wagner, R. T., X. Xu,等人(2010). Canonical Wnt/beta-?‐Catenin Regulation of Liver Receptor Homolog-1 (Lrh-1) Mediates Pluripotency Gene Expression (肝受体同源物-1 (Lrh‐1)的标准的Wnt/β-?‐连环蛋白调节介导多潜能性基因表达)." Stem Cells.
Yang, J., A. L. van Oosten,等人(2010). Stat3 Activation is limiting for reprogramming to ground state pluripotency (Stat3活化限制了基态多潜能性的重新编程). Cell Stem Cells 7(3): 319-328.
Claims (15)
1. 用于使干细胞分化为定形内胚层的方法,包括以下步骤:
c. 在包含至少2 μM CHIR的培养基中孵育干细胞的第一起始步骤,其中在所述起始步骤期间激活素A不存在;和
d. 在包含激活素A的培养基中孵育干细胞的第二后续步骤。
2. 权利要求1的方法,其中所述培养基是RPMI-1640。
3. 权利要求1或2的方法,其中所述干细胞是胚胎干细胞或诱导的多潜能干细胞。
4. 前述权利要求中任一项的方法,其中CHIR的浓度为至少大约2.5 μM,或至少大约3.1 μM,例如范围在大约2.5-15μM,例如范围在大约3.1-15 μM,或例如范围在大约3.1-7 μM,或例如范围在大约3.5-7 μM,或例如范围在大约3.5-6 μM,或例如大约3.5-5 μM。
5. 前述权利要求中任一项的方法,其中CHIR的浓度为至少大约3.1 μM。
6. 前述权利要求中任一项的方法,其中CHIR的浓度为至少大约3.5 μM。
7. 前述权利要求中任一项的方法,其中所述与CHIR的孵育为至少24小时。
8. 前述权利要求中任一项的方法,其中所述与激活素A的孵育为至少24小时。
9. 前述权利要求中任一项的方法,其中所述与激活素A的孵育为48至72小时。
10. 前述权利要求中任一项的方法,其中内胚层细胞得自所述定形内胚层细胞。
11. 权利要求10的方法,其中所述内胚层细胞是胰内胚层细胞。
12. 通过权利要求1-11的方法可获取的胰内胚层细胞。
13. 在培养基中以下CHIR浓度的CHIR的用途:至少2 μM,至少3 μM,例如范围在大约2-15 μM,例如大约3-15 μM,例如大约3.1-15 μM,或例如大约3.1-7 μM,或例如大约3.5-15 uM,或例如大约3.5-7 μM。
14. 在培养基中浓度为至少2 μM的CHIR在自胚胎干细胞诱导原条细胞中的用途。
15. 浓度范围为3.5-7 μM的CHIR在自胚胎干细胞诱导定形内胚层细胞中的用途。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201810066827.0A CN108220224A (zh) | 2011-06-21 | 2012-06-21 | 自多潜能干细胞有效诱导定形内胚层 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP11170713 | 2011-06-21 | ||
| EP11170713.9 | 2011-06-21 | ||
| US201161501351P | 2011-06-27 | 2011-06-27 | |
| US61/501351 | 2011-06-27 | ||
| PCT/EP2012/062013 WO2012175633A1 (en) | 2011-06-21 | 2012-06-21 | Efficient induction of definitive endoderm from pluripotent stem cells |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201810066827.0A Division CN108220224A (zh) | 2011-06-21 | 2012-06-21 | 自多潜能干细胞有效诱导定形内胚层 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103890167A true CN103890167A (zh) | 2014-06-25 |
Family
ID=47422055
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201280040881.9A Pending CN103890167A (zh) | 2011-06-21 | 2012-06-21 | 自多潜能干细胞有效诱导定形内胚层 |
| CN201810066827.0A Pending CN108220224A (zh) | 2011-06-21 | 2012-06-21 | 自多潜能干细胞有效诱导定形内胚层 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201810066827.0A Pending CN108220224A (zh) | 2011-06-21 | 2012-06-21 | 自多潜能干细胞有效诱导定形内胚层 |
Country Status (6)
| Country | Link |
|---|---|
| US (3) | US20140234963A1 (zh) |
| EP (1) | EP2723852B1 (zh) |
| JP (1) | JP6312591B2 (zh) |
| CN (2) | CN103890167A (zh) |
| ES (1) | ES2902650T3 (zh) |
| WO (1) | WO2012175633A1 (zh) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103890167A (zh) | 2011-06-21 | 2014-06-25 | 诺沃—诺迪斯克有限公司 | 自多潜能干细胞有效诱导定形内胚层 |
| US20150247123A1 (en) | 2012-09-03 | 2015-09-03 | Novo Nordisk A/S | Generation of pancreatic endoderm from Pluripotent Stem cells using small molecules |
| GB201317869D0 (en) * | 2013-10-09 | 2013-11-20 | Cambridge Entpr Ltd | In vitro production of foregut stem cells |
| WO2017144695A1 (en) | 2016-02-24 | 2017-08-31 | Novo Nordisk A/S | Generation of functional beta cells from human pluripotent stem cell-derived endocrine progenitors |
| WO2019051281A1 (en) * | 2017-09-07 | 2019-03-14 | StemoniX Inc. | EFFECTIVE DIFFERENTIATION OF HUMAN STEM CELLS IN DEFINITIVE ENDODERM |
| RU2020111055A (ru) | 2017-09-11 | 2021-09-17 | Ново Нордиск А/С | Обогащение клетками, совместно экспрессирующими nkx6.1 и c-пептид, полученными in vitro из стволовых клеток |
| CA3110932A1 (en) | 2018-08-30 | 2020-03-05 | Novo Nordisk A/S | Generation of functional beta cells from human pluripotent stem cell-derived endocrine progenitors |
| EP3953451A1 (en) | 2019-04-08 | 2022-02-16 | Novo Nordisk A/S | Generation of pancreatic endoderm from stem cell derived definitive endoderm |
| JP2023503302A (ja) | 2019-11-22 | 2023-01-27 | ノヴォ ノルディスク アー/エス | スピン凝集した神経系マイクロスフェアおよびその応用 |
| WO2022043518A1 (en) | 2020-08-28 | 2022-03-03 | Novo Nordisk A/S | Method for screening in vitro population of stem cell derived beta like cells and novel markers thereof |
| WO2024008810A1 (en) | 2022-07-06 | 2024-01-11 | Novo Nordisk A/S | Differentiation of stem cells to pancreatic endocrine cells |
| WO2024151541A1 (en) | 2023-01-09 | 2024-07-18 | Sana Biotechnology, Inc. | Type-1 diabetes autoimmune mouse |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009027654A1 (en) * | 2007-08-24 | 2009-03-05 | University Court Of The University Of Edinburgh | Regionalised endoderm cells and uses thereof |
| US20090298178A1 (en) * | 2008-06-03 | 2009-12-03 | D Amour Kevin Allen | Growth factors for production of definitive endoderm |
| WO2009154606A1 (en) * | 2008-06-03 | 2009-12-23 | Cythera, Inc. | Growth factors for production of definitive endoderm |
| CN101684454A (zh) * | 2008-09-25 | 2010-03-31 | 中国科学院上海生命科学研究院 | 一种定型内胚层细胞的制备和分离方法 |
Family Cites Families (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5523226A (en) * | 1993-05-14 | 1996-06-04 | Biotechnology Research And Development Corp. | Transgenic swine compositions and methods |
| JP4533534B2 (ja) | 1998-06-19 | 2010-09-01 | ノバルティス バクシンズ アンド ダイアグノスティックス,インコーポレーテッド | グリコーゲンシンターゼキナーゼ3のインヒビター |
| EP1393066A4 (en) | 2001-05-15 | 2006-01-25 | Rappaport Family Inst For Res | INSULIN-PRODUCING CELLS DERIVED FROM HUMAN EMBRYONAL STEM CELLS |
| GB2415432B (en) | 2001-12-07 | 2006-09-06 | Geron Corp | Islet cells from human embryonic stem cells |
| EP1461421A2 (en) | 2001-12-28 | 2004-09-29 | Cellartis AB | A method for the establishment of a pluripotent human blastocyst-derived stem cell line |
| US7625753B2 (en) | 2003-12-23 | 2009-12-01 | Cythera, Inc. | Expansion of definitive endoderm cells |
| DK1709159T3 (da) | 2003-12-23 | 2019-07-29 | Viacyte Inc | Definitiv endoderm |
| KR101278421B1 (ko) | 2004-04-27 | 2013-07-15 | 비아싸이트, 인크. | Pdx1 발현 내배엽 |
| CA2624728A1 (en) | 2005-10-07 | 2007-04-19 | Cellartis Ab | A method for obtaining a xeno-free hbs cell line |
| EP2650360B1 (en) | 2006-03-02 | 2019-07-24 | Viacyte, Inc. | Endocrine precursor cells, pancreatic hormone-expressing cells and methods of production |
| GB0615327D0 (en) | 2006-03-30 | 2006-09-13 | Univ Edinburgh | Culture medium containing kinase inhibitors and uses thereof |
| US8741643B2 (en) * | 2006-04-28 | 2014-06-03 | Lifescan, Inc. | Differentiation of pluripotent stem cells to definitive endoderm lineage |
| AU2007244675A1 (en) | 2006-04-28 | 2007-11-08 | Lifescan, Inc. | Differentiation of human embryonic stem cells |
| WO2007143193A1 (en) | 2006-06-02 | 2007-12-13 | University Of Georgia Research Foundation, Inc. | Pancreatic and liver endoderm cells and tissue by differentiation of definitive endoderm cells obtained from human embryonic stems |
| EP2126045A4 (en) * | 2007-01-30 | 2010-05-26 | Univ Georgia | EARLY MESODERM CELLS, STABLE POPULATION OF MESENDODERM CELLS WITH THE ABILITY TO GENERATE ENDODERM AND MESODERM CELL LINES AND MULTIPOTENTIAL MIGRATION CELLS |
| WO2008133904A1 (en) | 2007-04-23 | 2008-11-06 | Stowers Institute For Medical Research | Methods and compositions for stem cell self-renewal |
| US9080145B2 (en) * | 2007-07-01 | 2015-07-14 | Lifescan Corporation | Single pluripotent stem cell culture |
| CA2693156C (en) | 2007-07-18 | 2018-03-06 | Alireza Rezania | Differentiation of human embryonic stem cells |
| WO2009013254A1 (en) | 2007-07-20 | 2009-01-29 | Cellartis Ab | A novel population of hepatocytes derived via definitive endoderm (de-hep) from human blastocysts stem cells |
| KR101592180B1 (ko) | 2007-07-31 | 2016-02-05 | 라이프스캔, 인코포레이티드 | 인간 영양 세포를 이용한 만능 줄기 세포 분화 |
| RU2473685C2 (ru) | 2007-07-31 | 2013-01-27 | Лайфскен, Инк. | Дифференцировка человеческих эмбриональных стволовых клеток |
| US8623648B2 (en) * | 2008-04-24 | 2014-01-07 | Janssen Biotech, Inc. | Treatment of pluripotent cells |
| US7939322B2 (en) | 2008-04-24 | 2011-05-10 | Centocor Ortho Biotech Inc. | Cells expressing pluripotency markers and expressing markers characteristic of the definitive endoderm |
| CA2723820A1 (en) | 2008-05-09 | 2009-11-12 | Vistagen Therapeutics, Inc. | Pancreatic endocrine progenitor cells derived from pluripotent stem cells |
| AU2009267167A1 (en) | 2008-06-30 | 2010-01-07 | Centocor Ortho Biotech Inc. | Differentiation of pluripotent stem cells |
| JP5734183B2 (ja) | 2008-06-30 | 2015-06-17 | ヤンセン バイオテツク,インコーポレーテツド | 多能性幹細胞の分化 |
| US20100028307A1 (en) | 2008-07-31 | 2010-02-04 | O'neil John J | Pluripotent stem cell differentiation |
| US8278105B2 (en) * | 2008-09-09 | 2012-10-02 | University Of Southern California | Induction, propagation and isolation of liver progenitor cells |
| CN102272291B (zh) | 2008-10-31 | 2018-01-16 | 詹森生物科技公司 | 人胚胎干细胞向胰腺内分泌谱系的分化 |
| RU2528861C2 (ru) | 2008-10-31 | 2014-09-20 | Сентокор Орто Байотек Инк. | Дифференцирование человеческих эмбриональных стволовых клеток в линию панкреатических эндокринных клеток |
| EP2356227B1 (en) | 2008-11-14 | 2018-03-28 | Viacyte, Inc. | Encapsulation of pancreatic cells derived from human pluripotent stem cells |
| WO2010091241A2 (en) | 2009-02-06 | 2010-08-12 | President And Fellows Of Harvard College | Compositions and methods for promoting the generation of definitive endoderm |
| WO2010124142A2 (en) | 2009-04-22 | 2010-10-28 | Cythera, Inc. | Cell compositions derived from dedifferentiated reprogrammed cells |
| US20100303775A1 (en) | 2009-05-27 | 2010-12-02 | The Salk Institute For Biological Studies | Generation of Genetically Corrected Disease-free Induced Pluripotent Stem Cells |
| GB2485112B (en) * | 2009-07-20 | 2014-02-26 | Janssen Biotech Inc | Differentiation of human embryonic stem cells |
| WO2011011300A2 (en) | 2009-07-20 | 2011-01-27 | Centocor Ortho Biotech Inc. | Differentiation of human embryonic stem cells |
| RU2701335C2 (ru) | 2009-12-23 | 2019-09-25 | Янссен Байотек, Инк. | Способ получения популяции панкреатических эндокринных клеток, соэкспрессирующих nkx6.1 и инсулин, и способ лечения диабета |
| ES2633648T3 (es) | 2009-12-23 | 2017-09-22 | Janssen Biotech, Inc. | Diferenciación de células madre embrionarias humanas |
| WO2011081222A1 (ja) | 2009-12-29 | 2011-07-07 | 武田薬品工業株式会社 | 膵ホルモン産生細胞の製造法 |
| CA2791476C (en) | 2010-03-01 | 2020-06-30 | Janssen Biotech, Inc. | Methods for purifying cells derived from pluripotent stem cells |
| WO2011140441A2 (en) | 2010-05-06 | 2011-11-10 | Children's Hospital Medical Center | Methods and systems for converting precursor cells into intestinal tissues through directed differentiation |
| RU2663339C1 (ru) | 2010-05-12 | 2018-08-03 | Янссен Байотек, Инк. | Дифференцирование эмбриональных стволовых клеток человека |
| US9085757B2 (en) | 2010-06-17 | 2015-07-21 | Regents Of The University Of Minnesota | Production of insulin producing cells |
| WO2012021698A2 (en) | 2010-08-12 | 2012-02-16 | Janssen Biotech, Inc. | Treatment of diabetes with pancreatic endocrine precursor cells |
| PL2611910T3 (pl) | 2010-08-31 | 2018-06-29 | Janssen Biotech, Inc | Różnicowanie ludzkich embrionalnych komórek macierzystych |
| CN103221536B (zh) | 2010-08-31 | 2016-08-31 | 詹森生物科技公司 | 人胚胎干细胞的分化 |
| US9062292B2 (en) | 2010-09-13 | 2015-06-23 | Enzo Life Sciences Inc. | Mutant T7 polymerases |
| WO2012070014A2 (en) | 2010-11-26 | 2012-05-31 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd. | Identification of novel cell surface markers for pancreatic progenitor cells and definite endodermal cells |
| AU2010365057B2 (en) | 2010-12-08 | 2016-12-22 | Viacyte, Inc. | Agents and methods for inhibiting human pluripotent stem cell growth |
| US9404087B2 (en) | 2010-12-15 | 2016-08-02 | Kadimastem Ltd. | Insulin producing cells derived from pluripotent stem cells |
| CN103890167A (zh) | 2011-06-21 | 2014-06-25 | 诺沃—诺迪斯克有限公司 | 自多潜能干细胞有效诱导定形内胚层 |
-
2012
- 2012-06-21 CN CN201280040881.9A patent/CN103890167A/zh active Pending
- 2012-06-21 ES ES12735227T patent/ES2902650T3/es active Active
- 2012-06-21 JP JP2014516354A patent/JP6312591B2/ja active Active
- 2012-06-21 WO PCT/EP2012/062013 patent/WO2012175633A1/en active Application Filing
- 2012-06-21 US US14/127,296 patent/US20140234963A1/en not_active Abandoned
- 2012-06-21 EP EP12735227.6A patent/EP2723852B1/en active Active
- 2012-06-21 CN CN201810066827.0A patent/CN108220224A/zh active Pending
-
2017
- 2017-09-15 US US15/705,705 patent/US10487313B2/en active Active
-
2019
- 2019-11-25 US US16/694,040 patent/US20200190477A1/en not_active Abandoned
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009027654A1 (en) * | 2007-08-24 | 2009-03-05 | University Court Of The University Of Edinburgh | Regionalised endoderm cells and uses thereof |
| US20090298178A1 (en) * | 2008-06-03 | 2009-12-03 | D Amour Kevin Allen | Growth factors for production of definitive endoderm |
| WO2009154606A1 (en) * | 2008-06-03 | 2009-12-23 | Cythera, Inc. | Growth factors for production of definitive endoderm |
| CN101684454A (zh) * | 2008-09-25 | 2010-03-31 | 中国科学院上海生命科学研究院 | 一种定型内胚层细胞的制备和分离方法 |
Non-Patent Citations (1)
| Title |
|---|
| 孙彦洵 等: "利用胚胎干细胞分化的拟胚体研究小鼠早期胚胎发育过程", 《生物技术通讯》 * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2012175633A1 (en) | 2012-12-27 |
| US10487313B2 (en) | 2019-11-26 |
| US20140234963A1 (en) | 2014-08-21 |
| CN108220224A (zh) | 2018-06-29 |
| JP6312591B2 (ja) | 2018-04-18 |
| US20200190477A1 (en) | 2020-06-18 |
| US20180002668A1 (en) | 2018-01-04 |
| JP2014519832A (ja) | 2014-08-21 |
| EP2723852B1 (en) | 2021-11-17 |
| EP2723852A1 (en) | 2014-04-30 |
| ES2902650T3 (es) | 2022-03-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10487313B2 (en) | Efficient induction of definitive endoderm from pluripotent stem cells | |
| CN102083965B (zh) | 多潜能细胞 | |
| RU2650813C2 (ru) | Использование лигандов эпинефрина для дифференцирования клеток панкреатической эндодермы | |
| RU2668814C2 (ru) | Способы продуцирования клеток дефинитивной энтодермы и панкреатической энтодермы | |
| JP6449829B2 (ja) | ヒト胚性幹細胞の分化 | |
| RU2668798C2 (ru) | Способы in vitro пошаговой дифференцировки полюрипотентных клеток | |
| CN105793414B (zh) | 前肠干细胞的活体外生产 | |
| CN101952415B (zh) | 人胚胎干细胞的分化 | |
| US8278105B2 (en) | Induction, propagation and isolation of liver progenitor cells | |
| WO2014165663A1 (en) | Methods and compositions for culturing endoderm progenitor cells in suspension | |
| CN101861386A (zh) | 人胚胎干细胞的分化 | |
| KR20100061455A (ko) | 인간 영양 세포를 이용한 만능 줄기 세포 분화 | |
| KR102403165B1 (ko) | 만능성 줄기 세포의 장의 중장 내배엽 세포로의 분화 | |
| CN113151147B (zh) | 功能性肝实质细胞及其制备方法 | |
| WO2024047188A1 (en) | Extraembryonic mesoderm cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C53 | Correction of patent of invention or patent application | ||
| CB02 | Change of applicant information |
Address after: Denmark bagsvaerd Applicant after: Novo Nordisk AS Applicant after: CELLECTIS S.A. Address before: Denmark bagsvaerd Applicant before: Novo Nordisk AS Applicant before: Cellartis AB |
|
| COR | Change of bibliographic data |
Free format text: CORRECT: ADDRESS; FROM: Free format text: CORRECT: APPLICANT; FROM: CELLARTIS AB TO: TAKARA BIOTECHNOLOGY EUROPE AG |
|
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20140625 |
|
| RJ01 | Rejection of invention patent application after publication |