CN102574816A - 有效的小分子自噬抑制剂及其使用方法 - Google Patents
有效的小分子自噬抑制剂及其使用方法 Download PDFInfo
- Publication number
- CN102574816A CN102574816A CN2010800332736A CN201080033273A CN102574816A CN 102574816 A CN102574816 A CN 102574816A CN 2010800332736 A CN2010800332736 A CN 2010800332736A CN 201080033273 A CN201080033273 A CN 201080033273A CN 102574816 A CN102574816 A CN 102574816A
- Authority
- CN
- China
- Prior art keywords
- compound
- cell
- autophagy
- arbitrary described
- described compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CCc(c(C)c(*)c(N)c1S)c1I Chemical compound CCc(c(C)c(*)c(N)c1S)c1I 0.000 description 10
- MEAQIFAXXGMPAP-UHFFFAOYSA-N Brc1ccc(CNc(c2c3)[n]cnc2ccc3Br)cc1 Chemical compound Brc1ccc(CNc(c2c3)[n]cnc2ccc3Br)cc1 MEAQIFAXXGMPAP-UHFFFAOYSA-N 0.000 description 1
- OFSCBFDAYGADIP-UHFFFAOYSA-N Cc1ccc(CNc2c(cc(cc3)NOC)c3ncn2)cc1 Chemical compound Cc1ccc(CNc2c(cc(cc3)NOC)c3ncn2)cc1 OFSCBFDAYGADIP-UHFFFAOYSA-N 0.000 description 1
- PHGGTVWTVCTTKB-UHFFFAOYSA-N Fc(cc1)cc2c1ncnc2NCCc(cc1)ccc1C1=[I]C1 Chemical compound Fc(cc1)cc2c1ncnc2NCCc(cc1)ccc1C1=[I]C1 PHGGTVWTVCTTKB-UHFFFAOYSA-N 0.000 description 1
- CGZYKGWXIMRUBO-UHFFFAOYSA-N Fc(cc12)ccc1ncnc2NCc1ccc(C2[IH]C2)cc1 Chemical compound Fc(cc12)ccc1ncnc2NCc1ccc(C2[IH]C2)cc1 CGZYKGWXIMRUBO-UHFFFAOYSA-N 0.000 description 1
- AWIVHRPYFSSVOG-UHFFFAOYSA-N Fc1ccc(CNc(c2c3)ncnc2ccc3F)cc1 Chemical compound Fc1ccc(CNc(c2c3)ncnc2ccc3F)cc1 AWIVHRPYFSSVOG-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/86—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in position 4
- C07D239/94—Nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/86—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in position 4
- C07D239/88—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/86—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in position 4
- C07D239/93—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Communicable Diseases (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Hematology (AREA)
- Virology (AREA)
- Hospice & Palliative Care (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明的某些方面涉及小分子自噬抑制剂及其在治疗和预防癌症和急性胰腺炎中的用途。正如本申请所公开的,通过在已知的生物活性文库中利用以图像为基础的筛选方法筛选得到了小分子自噬抑制剂。研究发现这些自噬抑制剂通过加速自噬启动所必需的III型PI3激酶复合物的降解而产生作用。药物化学研究引领发现有效性和选择性更好的小分子自噬抑制剂。
Description
相关申请
本申请要求2010年1月20日提交的美国临时专利申请(申请号:61/296,735)和2009年7月21日提交的美国临时专利申请(申请号:61/227,164)的优先权;两件申请的全部内容在此参考并入。
政府支持
本发明是在政府支持和美国国立卫生研究院授予的PO1 AG027916、R37AG012859和DP1 OD000580下完成的。政府对本发明享有一定的权利。
背景技术
Vps34(空泡分选蛋白34)是一种III型磷脂酰肌醇3-激酶(PtdIns3),其首次被鉴定为酵母菌中空泡分选水解酶的调控物(Herman and Emr,1990)。Vps34特异性地磷酸化磷脂酰肌醇(PtdIns)的肌醇环上的D-3位点以生成PtdIns3P(Schu,P.V.,Takegawa,K.,Fry,M.J.,Stack,J.H.,Waterfield,M.D.,and Emr,S.D.(1993)Phosphatidylinositol 3-kinase encoded byyeast VPS34 gene essential for protein sorting.Science 260,88-91)。PtdIns3P涉及控制多种关键胞内膜运输途径,包括核内体至溶酶体的运输、退行性核内体至高尔基的运输、多泡体形成和自噬(Herman,P.K.,and Emr,S.D.(1990).Characterization of VPS34,a gene requiredfor vacuolar protein sorting and vacuole segregation in Saccharomyces cerevisiae.MoI Cell Biol10,6742-6754;Kihara,A.,Noda,T.,Ishihara,N.,and Ohsumi,Y.(2001).Two distinct Vps34phosphatidylinositol 3-kinase complexes function in autophagy and carboxypeptidase Y sortingin Saccharomyces cerevisiae.J Cell Biol 152,519-530)。PtdIns3P是自噬启动所必需的,所述自噬是进化保守性分解代谢机制,涉及细胞内细胞器和大蛋白复合体的更新。
Vps34位于酵母菌的两种复合体内:涉及自噬的复合体I(Vps34、Vps15、Vps30/Atg6和Atg14)和涉及空泡蛋白分选途径的复合体II(Vps34、Vps15、Vps30/Atg6和Vps38)(Kihara et al.,2001,引用如上)。在哺乳动物细胞中,至少两种蛋白复合体被发现有Vps34,Vps34复合体I和Vps34复合体II,它们的功能可能与其在酵母菌中的同源复合体相似。这两种哺乳动物Vps34复合体共享Vps34、Beclin1和p150的核心成分,其分别同源于酵母菌Vps34、Vps30/Atg6和Vps15。另外,复合体I中含有Atg14L,一种酵母菌Atg14的哺乳动物蛋白质的直系同源基因,在饥饿的过程中它集中于隔离膜/吞噬泡,并且是自噬体形成所必需的;而复合体II中含有UVRAG,一种酵母菌Vps38的类似体,它主要集中于次级内体(Itakura,E.,Kishi,C,Inoue,K.,and Mizushima,N.(2008).Beclin 1 forms two distinctphosphatidylinositol 3-kinase complexes with mammalian Atg14 and UVRAG.MoI Biol Cell19,5360-5372;Liang,C,Feng,P.,Ku,B.,Dotan,L,Canaani,D.,Oh,B.H.,and Jung,J.U.(2006).Autophagic and tumour suppressor activity of a novel Beclin 1-binding protein UVRAG.Nat Cell Biol 8,688-699;Matsunaga,K.,Saitoh,T.,Tabata,K.,Omori,H.,Satoh,T.,Kurotori,N.,Maejima,L,Shirahama-Noda,K.,Ichimura,T.,Isobe,T.,et al.(2009).Two Beclin1-binding proteins,Atg14L and Rubicon,reciprocally regulate autophagy at different stages.NatCell Biol 11,385-396.;Zhong,Y.,Wang,Q.J.,Li,X.,Yan,Y.,Backer,J.M.,Chait,B.T.,Heintz,N.,and Yue,Z.(2009).Distinct regulation of autophagic activity by Atg14L and Rubiconassociated with Beclin 1-phosphatidylinosito 1-3 -kinase complex.Nat Cell Biol 11(4),468-476)。有趣的是,Vps34复合体不同成分的稳定性相互依赖。一种成分的减少通常会降低复合体中其他成分的水平(Itakura et al.,2008,引用如上)。然而,我们对于Vps34复合体稳定性的调节机制所知甚少,所述Vps34复合体可能在多种泡状运输途径调节中起着重要作用。
自噬是一种分解代谢过程,其以溶酶体依赖性方式介导细胞内组分的更新(Levine,B.,and Klionsky,D.J.(2004).Development by self-digestion:molecular mechanisms and biologicalfunctions of autophagy.Dev Cell 6,463-477)。自噬由隔离膜形成启动,其通过形成双层膜囊泡(称为自噬体)扩张吞没部分细胞质,包括大蛋白复合体和有缺陷的细胞器。自噬体的内容物在与溶酶体融合形成自溶酶体之后被溶酶体水解酶降解。单细胞真核生物的自噬是饥饿条件下存活下来的策略,其已经受到了广泛的研究,这是因为细胞可以利用自噬降解的产物例如游离氨基酸、脂肪酸和核苷酸作为组成部件或者能量来源以助于在营养有限条件下存活下来(Levine,B.,and Klionsky,D.J.(2004).Development by self-digestion:molecularmechanisms and biological functions of autophagy.Dev Cell 6,463-477;and Levine,B.,andKroemer,G.(2008).Autophagy in the pathogenesis of disease.Cell 132,27-42)。
自噬的核心分子结构由一组ATG基因编码的蛋白质产物控制,该组ATG基因进化性地从酵母菌保存至哺乳动物。自噬小囊泡的成核过程需要PtdIns3P,III型PI3激酶复合体,包括Beclin 1(酵母菌Atg6的哺乳动物同族体)和Vps34,以及两种泛素样分子Atg12和LC3(Atg8的同族体),其继而作用介导自噬体的形成。在第一类泛素化反应中,Atg12与Atg5结合并形成大型多聚体蛋白复合体,该复合体在确定自噬体的成核过程中起着关键作用。在第二反应中,LC3与磷脂酰乙醇胺结合,导致膜转位,其对自噬体的延伸和闭合很重要(Fujita,N.,Itoh,T.,Omori,H.,Fukuda,M.,Noda,T.,and Yoshimori,T.(2008).TheAtg1βL Complex Specifies the Site of LC3 Lipidation for Membrane Biogenesis in Autophagy.MoI Biol Cell 19,2092-2100;and Levine,B.,and Kroemer,G.(2008).Autophagy in thepathogenesis of disease.Cell 132,27-42)。
在多细胞动物中,自噬作用作为必要的细胞内分解代谢机制通过介导机能障碍、老化或者受损蛋白质和细胞器的更新牵涉细胞的平衡(Levine,B.,and Kroemer,G.(2008).Autophagy in the pathogenesis of disease.Cell 132,27-42)。通过增加折叠错误蛋白质的累积向下调节自噬有助于神经退行性变(Hara,T.,Nakamura,K.,Matsui,M.,Yamamoto,A.,Nakahara,Y.,Suzuki-Migishima,R.,Yokoyama,M.,Mishima,K.,Saito,L,Okano,H.,et al.(2006).Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice.Nature 441,885-889;and Komatsu,M.,Waguri,S.,Chiba,T.,Murata,S.,Iwata,J.,Tanida,L,Ueno,T.,Koike,M.,Uchiyama,Y.,Kominami,E.,et al.(2006).Loss of autophagy in thecentral nervous system causes neurodegeneration in mice.Nature 441,880-884)。自噬也可以因响应营养饥饿之外的多种形式的细胞应激而被激活,包括DNA损伤、ER应激和细胞内病原体的侵袭,并且已证明自噬既参与先天性免疫,又参与了获得性免疫(Schmid,D.,Dengjel,J.,Schoor,O.,Stevanovic,S.,and Munz,C.(2006).Autophagy in innate and adaptiveimmunity against intracellular pathogens.J MoI Med 84,194-202)as well as in tumorsuppression(Liang,X.H.,Jackson,S.,Seaman,M.,Brown,K.,Kempkes,B.,Hibshoosh,H.,andLevine,B.(1999).Induction of autophagy and inhibition of tumorigenesis by beclin 1.Nature402,672-676)。对哺乳动物细胞中自噬的调节机制的探索才刚刚开始。
自噬在调节细胞平衡中起着重要作用,并有助于细胞存活、生长、分化和宿主的防御应答。自噬调节异常涉及多种人类疾病,包括癌症、神经退行性疾病、炎性疾病和感染性疾病。目前大部分有关自噬的知识来自于酵母菌巧妙的遗传学研究,这些遗传学研究鉴定了自噬“Atg”基因。最近的研究已经证明了核心自噬基因从酵母菌到哺乳动物是保守性进化;然而,哺乳动物自噬的机制和调节表现出的复杂性显著增加,对此我们知之甚少。
有人提出自噬在癌症的发展和治疗中起着复杂的作用。活化自噬可能提高肿瘤细胞在代谢应激下的成活性并且通过预防坏死细胞死亡和随后有助于肿瘤生长的炎症而产生肿瘤抑制机制作用(White,E.(2008).Autophagic cell death unraveled:Pharmacologicalinhibition of apoptosis and autophagy enables necrosis.Autophagy 4,399-401)。另一方面,自噬抑制可能会通过未知的机制使基因组不稳定,这可能可以解释多种癌症系中beclin 1杂合现象频率增加的原因(Qu,X.,Yu,J.,Bhagat,G.,Furuya,N.,Hibshoosh,H.,Troxel,A.,Rosen,J.,Eskelinen,EX.,Mizushima,N.,Ohsumi,Y.,et al.(2003).Promotion of tumorigenesisby heterozygous disruption of the beclin 1 autophagy gene.J Clin Invest 112,1809-1820;andYue,Z.,Jin,S.,Yang,C,Levine,A.J.,and Heintz,N.(2003).Beclin 1,an autophagy geneessential for early embryonic development,is a haploinsufficient tumor suppressor.Proc NatlAcad Sci U S A 100,15077-15082),及恶性上皮卵巢癌中自噬相关的蛋白质的表达降低的原因(Shen,Y.,Li,D.D.,Wang,L.L.,Deng,R.,and Zhu,X.F.(2008).Decreased expression ofautophagy-related proteins in malignant epithelial ovarian cancer.Autophagy 4,1067-8)。因此,自噬的慢性抑制可能会刺激肿瘤生成。
有研究提出自噬在抗癌治疗中的作用与在肿瘤生成过程中的作用相反。一旦肿瘤形成,自噬的急性抑制就可能会通过提高放射敏化作用和化学敏化作用而有益于治疗目标(Amaravadi,R.K.,and Thompson,CB.(2007).The roles of therapy-induced autophagy andnecrosis in cancer treatment.Clin Cancer Res 13,7271-7279)。在癌症治疗的动物模型中,使用抗关键自噬基因ATG5的shRNA或者抗疟疾药物氯喹抑制治疗诱导性自噬增强细胞的死亡和Myc驱动肿瘤的肿瘤消退,其中使用活化的p53或者烷化化疗以促使肿瘤细胞死亡(Amaravadi,R.K.,Yu,D.,Lum,J.J.,Bui,T.,Christophorou,M.A.,Evan,G.I.,Thomas-Tikhonenko,A.,and Thompson,CB.(2007).Autophagy inhibition enhancestherapy-induced apoptosis in a Myc-induced model of lymphoma.J Clin Invest 117,326-336)。氯喹引起大型自噬小囊泡的剂量依赖性累积并将烷化治疗诱导的细胞死亡提高至ATG5降低的相似水平。在另一实施例中发现靶向自噬过程特定成分(例如Beclin1或Vps34)的一般抑制方法逆转对TRAIL的抵抗性(Hou,W.,Han,J.,Lu,C,Goldstein,L.A.,andRabinowich,H.(2008).Enhancement of tumor-TRAIL susceptibility by modulation ofautophagy.Autophagy 4,940-943)。关于慢性髓性白血病(CML),氯喹对自噬的抑制作用显著性地提高了CML细胞株K562经伊马替尼诱导的死亡。而且,伊马替尼抗性细胞株BaF3/T315I和BaF3/E255K可以通过伊马替尼和氯喹的联合治疗诱导至死。因此,自噬抑制可以使肿瘤细胞敏化至伊马替尼诱导的细胞死亡。已有人提出将自噬的阻断作为CML治疗的新策略(Mishima,Y.,Terui,Y.,Taniyama,A.,Kuniyoshi,R.,Takizawa,T.,Kimura,S.,Ozawa,K.,and Hatake,K.(2008).Autophagy and autophagic cell death are next targets forelimination of the resistance to tyrosine kinase inhibitors.Cancer Sci 99,2200-8)。这些研究表明自噬可以提高对DNA损伤治疗的抵抗性。因为氯喹是溶酶体的阻滞剂,所以如果在以细胞为基础的分析和动物模型中观察到针对自噬过程不同阶段的特定抑制剂在提高化疗疗效中有相同的效应,那将是很有趣的。
另外,也有研究显示自噬在介导急性胰腺炎诱导的细胞损伤中起着重要作用。胰腺本身过早活化的消化蛋白酶引起的自身消化被认为是急性胰腺炎发作中的一例重要现象。胰腺腺泡细胞中缺少自噬相关(Atg)基因Atg5的条件性敲除鼠的急性胰腺炎(由蛙皮素诱导的)严重程度明显降低了。(Ohmuraya,M.,and Yamamura,K.(2008).Autophagy and acutepancreatitis:a novel autophagy theory for trypsinogen activation.Autophagy 4,1060-1062)。因此,自噬通过将胰蛋白酶原活化为胰蛋白酶而在胰腺腺泡细胞中发挥着不利作用。自噬的抑制剂可能会为急性胰腺炎提供重要的新疗法。
此外,小分子抑制剂是探索哺乳动物细胞中细胞机制的重要工具。然而,现有的唯一自噬小分子抑制剂就是3-甲基腺嘌呤(3-MA),它的工作浓度大约为10mM并且是高度非特异性的。因此,迫切需要研发可用于促进哺乳动物细胞中自噬研究的高度特异性小分子工具。
发明简介
本发明部分涉及自噬抑制剂化合物、包括所述化合物的组合物以及所述化合物和组合物的使用方法。
本发明一个方面涉及通式I所示的化合物:
或其可药用盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或者立体异构体,其中
n为0、1、2、3或4;
Y为-C(R1)=或-N=;
R为-H、低级烷基、-NO2、-OH、-NH2、-NH(低级烷基)、-N(低级烷基)2或低级炔基;
R1每次出现均独立地选自下组基团:-H、-F、-Cl、-Br、-I、-NO2、-OH、-NH2、-NH(低级烷基)、-N(低级烷基)2、-CH3、-CF3、-C(=O)(低级烷基)、-CN、-O(低级烷基)、-O(低级氟代烷基)、-S(=O)(低级烷基)、-S(=O)2(低级烷基)和-C(=O)O(低级烷基);
R2和R3独立地选自下组:-H、低级烷基、低级氟代烷基、低级炔基和低级羟烷基;
X为-O-、-S-、-N(H)-、-N(低级烷基)-、-CH2-、-CH2CH2-、-CH2CH2CH2-.-CH2CH2CH2CH2-、-CH2CH2CH2CH2CH2-或-CH2CH2CH2CH2CH2CH2-;并且
Z为苯基、吡啶基、乙烯基、吗啡基、邻二氮杂菲铁、萘基、呋喃基或苯并噻唑基;并且任选地被一个或多个选在下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
本发明的另外一个方面涉及一种药物组合物,所述组合物包括通式I所示的化合物或者其可药用的盐,生物活性代谢物、溶剂化物、水合物、前药、对映异构体或者立体异构体和一种或多种可药用的载体,单独使用或者与另外一种治疗药物联合使用。本发明所述药物组合物可以根据本发明所述方法给药,通常作为治疗或预防癌症或者胰腺炎相关状况和疾病的治疗方案的一部分。
本发明的另外一个方面涉及一种治疗或预防癌症、胰腺炎或者细胞内病原体引起的疾病的方法,其包括对需要的主体给药治疗有效量的一种或多种本发明的化合物或药物组合物。
附图简述
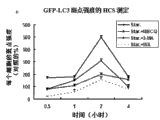
图1涉及通过基于图像的筛选鉴定小分子自噬抑制剂。A,MBCQ的结构。B,定量分析每个细胞LC3-GFP斑点数(a),每个细胞斑点大小(b),每个细胞斑点强度(c)。数据表述为对照溶剂处理的细胞的百分比。将H4-LC3细胞接种于96孔培养板并用对照溶剂(1%DMSO,二甲基亚砜)、伴有或不伴有10μM MBCQ的0.2μM雷帕霉素(RAPA)培养一定的时间,用4%低聚甲醛固定,并用4,6-二脒基-2-苯吲哚(DAPI,3μg/ml)染色。通过配有20x物镜的ArrayScan HCS 4.0 Reader(Cellomic,匹兹堡,宾夕法尼亚州)分析每种化合物治疗的1000个细胞的图像。
图2描述了MBCQ对饥饿(Star.)诱导的自噬的抑制相关结果。使用HCS定量测量每个细胞LC3-GFP斑点数(a),每个细胞斑点大小(b)和每个细胞斑点强度(c),并表述为对照的百分比。使用3-MA(10mM)或渥曼青霉素(WA)(0.1μM)作为阳性对照。
图3描述了MBCQ对自噬的影响的电子显微镜分析。使用0.1%DMSO(溶剂)、雷帕霉素(0.2μM)、MBCQ(10μM)或MBCQ和雷帕霉素处理H4细胞4小时。细胞经EM处理并成像。
图4描述了生成MBCQ衍生物的方法。
图5描述了MBCQ的活性衍生物降低MEF细胞中LC3II水平的相关结果。A,经DMSO(1‰)、雷帕霉素(0.2μM)单独处理的MEF细胞或者与MBCQ(10μM)、C43(spautin)(10μM)或者C71(10μM)一起处理4小时的MEF细胞。收集细胞溶解产物使用抗LC-3抗体进行蛋白质印迹法。B,电子显微镜证实了C43(spautin)对MEF细胞的自噬抑制效应。使用对照溶剂(1‰DMSO)和其他指定的化合物处理MEF细胞4小时。雷帕霉素(0.2μM)和C43(spautin)(10μM)。然后用戊二醛固定细胞,并制备样品用于EM测定。Bar,1:11,000。箭头表示双层和多层膜自噬的溶剂。N:细胞核。
图6描述了MBCQ对H4细胞生长几乎没有影响的结果。A,经MBCQ(5μM)处理5天的H4细胞,并且每天收集细胞用于在台盼蓝中的细胞计数;B,经MBCQ(5μM)处理24小时和48小时的H4细胞,然后用70%乙醇固定细胞,用碘化丙啶(40μg/mL)染色并用RNase(200μg/mL)溶液培养30分钟。用流式细胞计分析细胞周期特征和可能的凋亡细胞的死亡。
图7描述了MBCQ和C43(spautin)部分抑制依托泊苷(et.)诱导的bax/bak DKO细胞死亡的结果。A-C,Bax/bak DKO细胞在有或没有依托泊苷(8μM)的情况下经MBCQ(10μM)或3-MA(10mM)处理8小时或24小时。A,图像证明的细胞存活。B,MTT测定证明的细胞存活。C,收集细胞用于使用抗LC-3抗体的蛋白质印迹法,α-微管蛋白用作对照物。D-F,Bax/bak DKO细胞在有或没有依托泊苷(Etop.)(8μM)的情况下经spautin(10μM)或指定的浓度处理8小时或指定的时间。D,图像证明的细胞存活和E,MTT测定证明的细胞存活。F,收集细胞用于使用抗LC-3抗体的蛋白质印迹法,α-微管蛋白用作对照物。
图8描述了MBCQ和C43(spautin)减少FYVE-RFP斑点但是对FYVE-RFP蛋白水平没有作用的结果。H4-FYVE细胞经DMSO(0.1%)、MBCQ(10μM)或C43(spautin)(10μM)处理指定的时间。A,用荧光显微镜检查分析图像,并且在4%低聚甲醛固定之后用HCS定量,并用4,6-二脒基-2-苯基吲哚(DAPI,3μg/ml)染色。通过配有20x物镜的ArrayScan HCS 4.0Reader(Cellomic,匹兹堡,宾夕法尼亚州)分析每种化合物治疗的1000个细胞的图像。B,经DMSO(0.1%)、RAPA(0.2μM)单独处理,MBCQ(10μM)或C43(spautin)(10μM)伴有或不伴有RAPA(0.2μM)处理8小时的H4-FYVE细胞。收集细胞溶解产物用于蛋白质印迹法,且抗-RFP和抗-微管蛋白抗体作为加载对照物。
图9描述了MBCQ和C43(spautin)选择性地降低PtdIns3P的细胞水平的结果。MEF细胞经DMSO(0.1%)、RAPA(0.2μM)单独,A,MBCQ(10μM)或B,C43(spautin)(10μM)伴有或不伴有RAPA(0.2μM)处理3小时。提取细胞PtdIns类并涂覆于聚偏氟乙烯膜。使用GST-PX结构域蛋白和抗GST抗体检测PtdIns3P水平。
图10描述了C43(SPAYTIN)及其活性衍生物选择性地促进Beclin1/Vps34/p150复合体降解的结果。A,C43(spautin)不是Vps34酶活性的直接抑制剂。在有32P-ATP,没有或有指定浓度的C43(spautin)和渥曼青霉素(10uM)的情况下,在室温下将来源于293T的抗-HA免疫沉淀的外源性HA-Vps34复合体与PtdIns一同培养10分钟。用薄层色谱法和放射自显影术分析产物。在泳道1,使用反应缓冲液作为阴性对照,而不是Vps34/Beclin-1复合体。B,MBCQ、C29和C43(spautin)处理降低了外源性Vps34和Beclin1的水平。使用HA-Vps34和flag-Beclin1表达载体转染293T细胞,转染二十四小时之后,使用指定的化合物处理细胞12小时。使用抗HA、anti-flag或抗微管蛋白通过蛋白质印迹法分析细胞溶解产物。C,MBCQ和C43(spautin)降低GFP-P 150蛋白质的水平。使用GFP-P 150载体转染293T细胞。转染二十四小时之后,MBCQ(10μM)、C43(spautin)(10μM)额外处理细胞4小时。使用抗GFP或抗微管蛋白通过蛋白质印迹法分析细胞溶解产物。D,MBCQ和C43(spautin)降低myc-Atg14蛋白质的水平。使用myc-Atg14载体转染293T细胞。转染二十四小时之后,使用MBCQ(10μM)、C43(spautin)(10μM)额外处理细胞4小时。使用抗霉菌(抗-myc)或抗微管蛋白通过蛋白质印迹法分析细胞溶解产物。E,使用雷帕霉素(0.2μM)在伴有或不伴有C43(spautin)(10μM)或3-MA(10mM)下处理H4细胞4小时,并使用DMSO(1‰)作为阴性对照。收集细胞溶解产物并使用抗-Beclin1、抗-Atg14、抗Vps34和抗UVRAG通过蛋白质印迹法进行分析。使用抗α微管蛋白作为加载对照。F,在CHX存在的情况下,使用MBCQ或spautin处理293T细胞指定的时间以抑制蛋白质合成,并使用抗-Beclin1通过蛋白质印迹法分析细胞溶解产物。CHX(5μM)、MBCQ(10μM)、C43(spautin)(10μM)。G,使用雷帕霉素(Rap)(0.2μM)在伴有或不伴有spautin(10μM)或3-MA(10mM)下处理H4细胞4小时,并使用DMSO(1‰)作为阴性对照。收集细胞溶解产物并使用抗-Beclin1和抗-LC3通过蛋白质印迹法进行分析。使用抗-α-微管蛋白作为加载对照。H-M,使用指定的载体转染293T细胞。转染二十四小时之后,使用MBCQ(10μM)、C43(spautin)(10μM)或雷帕霉素(0.2μM)额外处理293T细胞4小时。使用指定的抗体通过蛋白质印迹法分析细胞溶解产物。
图11描述了在无糖条件下选定的癌症细胞株对MBCQ及其活性衍生物的敏感性结果。BT549在正常DMEM(A)或无血清条件(B)下经指定浓度的C43处理24小时。通过MTT测定细胞存活度或者收集细胞用于抗-LC3的蛋白质印迹法测定(C)。MCF-7细胞在有糖(D)或无糖(E)DMEM中经DMSO(1‰)、C43(10μM)处理12小时。使用MTT或图像测定细胞存活度(F)。使用抗-LC3通过蛋白质印迹法分析细胞溶解产物,并使用α微管蛋白作为加载对照(G)。Bcap-37细胞在正常DMEM(H)或无血清条件(I)下经指定浓度的C43处理24小时。通过MTT或图像测定细胞存活度(J)。并且使用抗-RARP(L)或抗-LC3(M)通过蛋白质印迹法分析经C43处理指定时间的细胞溶解产物,并且使用α-微管蛋白作为加载对照。(K)经C43处理的Bcap-37的细胞周期特征。Bcap-37细胞经DMSO(0.1%)(左图)、C43(10μM)(右图)处理12小时。然后细胞用70%乙醇固定,用碘化丙啶(PI,40μg/mL)染色并在黑暗处用核糖核酸酶(200μg/mL)溶液处理30分钟。使用流式细胞计统计分析细胞周期特征和可能的细胞凋亡性死亡。
图12描述了spautin不会诱导非癌细胞凋亡的实验结果。A-B,MDCK细胞在有糖或无糖DMEM中经DMSO(1‰)和指定浓度的spautin处理24小时。图像(A)和MTT测定(B)所表明的细胞存活性。C-D,Hs578Bst细胞在有糖或无糖DMEM中经DMSO(1‰)和指定浓度的C43处理24小时。图像(C)和MTT测定(D)所表明的细胞存活性。
图13描述了MBCQ和衍生物的体内作用结果。(A)向小鼠体内单独注射雷帕霉素(10mg/kg)作为阳性对照,或与C43或MBCQ(40mg/kg)一起腹膜内注射,每小时一次,持续4小时,然后在第5小时处死。使用抗-LC3抗体通过蛋白质印迹法分析肝脏内的自噬水平。(B)C43降低由蛙皮素诱导的自噬水平。向大鼠腹膜内单独注射蛙皮素(50μg/kg)或与C43(40mg/kg)一起注射,每小时一次,注射4次。在最后一次注射之后一小时将大鼠处死,并分离胰脏用于使用抗-LC3和抗微管蛋白(作为对照)的蛋白质印迹法分析。
图14描述了可以抑制自噬的MBCQ衍生物。为了计算EC50,将H4-LC3细胞接种于96孔培养板并用不同浓度的化合物培养24小时,然后用多聚甲醛固定,并用4,6-二脒基-2-苯吲哚(DAPI,3μg/ml)染色。通过配有20x物镜的ArrayScan HCS 4.0Reader(Cellomics,匹兹堡,宾夕法尼亚州)采集DAPI标记的细胞核和自噬标记物GFP-LC3的图像数据。使用Spot Detector Bio-Application获得并分析优化之后的图像。分析了每种化合物处理的1000个细胞的图像以获得每个视野的平均细胞数、荧光斑点数、每个细胞的面积和亮度。分别使用DMSO和雷帕霉素作为阴性和阳性对照。通过除以DMSO处理样品的变化值计算LC3-GFP变化的百分比。每种处理重复三次以计算平均值和SD。也使用传统的荧光显微镜目测分析图像。重复实验三次。
图15描述了抑制自噬能力降低的或没有抑制自噬能力的MBCQ衍生物。为了计算EC50,将H4-LC3细胞接种于96孔培养板并用不同浓度的化合物培养24小时,然后用多聚甲醛固定,并用4,6-二脒基-2-苯吲哚(DAPI,3μg/ml)染色。通过配有20x物镜的ArrayScan HCS 4.0Reader(Cellomic,匹兹堡,宾夕法尼亚州)采集DAPI标记的细胞核和自噬标记物GFP-LC3的图像数据。使用Spot Detector Bio-Application获得并分析优化之后的图像。分析每种化合物处理的1000个细胞的图像以获得每个视野的平均细胞数、荧光斑点数、每个细胞的面积和亮度。分别使用DMSO和雷帕霉素作为阴性和阳性对照。通过除以DMSO处理的样品的变化值计算LC3-GFP变化的百分比。每种处理重复三次以计算平均值和SD。也使用传统的荧光显微镜目测分析图像。重复实验三次。
图16描述了spautin通过蛋白酶体途径促进Beclin1降解的实验结果。A,使用GFP-Beclin1转染293T细胞,转染24小时之后,使用指定的化合物额外处理细胞24小时。DMSO(1‰)、MBCQ(10μM)、spautin(10μM)、NH4Cl(10mM)、MG132(5μM)。使用抗-GFP通过蛋白质印迹法分析细胞溶解产物。B,使用GFP-Beclin1和HA-Ub表达载体转染293T细胞,转染二十四小时之后,使用MG 132或spautin处理细胞24小时。使用抗-GFP抗体免疫沉淀细胞溶解产物,并使用抗-HA抗体通过蛋白质印迹法分析免疫复合体。
图17描述了敲除siRNA的USP3、USP10、USP13、USP16和USP18对选定的自噬蛋自稳定性的影响结果。使用指定的siRNA转染H4细胞72小时或使用雷帕霉素(0.2μM)或spautin(10μM)处理4小时,并使用非靶向siRNA(N.T.siRNA)作为阴性对照。收集细胞溶解产物并使用指定蛋白特异性的抗体通过蛋白质印迹法(左侧)分析细胞溶解产物。使用抗-α-微管蛋白作为加载对照。
图18描述了敲除siRNA的USP3、USP10、USP13、USP16和USP18对USP蛋白稳定性的影响结果。使用指定的siRNA转染H4细胞72小时或使用雷帕霉素(0.2μM)或spautin(10μM)处理4小时,并使用非靶向siRNA(N.T.siRNA)作为阴性对照。收集细胞溶解产物并使用指定蛋白特异性的抗体通过蛋白质印迹法(左侧)分析细胞溶解产物。使用抗-α-微管蛋白作为加载对照。
图19描述了敲除siRNA的USP3、USP10、USP13、USP16、USP18和Beclin1对P53稳定性的影响结果。使用指定的siRNA(每个USP 3个)转染H4细胞并使用雷帕霉素(0.2μM)处理4小时,并使用DMSO(1%)作为阴性对照。收集细胞溶解产物并使用抗-p53抗体或其他的指定抗体通过蛋白质印迹法分析细胞溶解产物。使用抗-α-微管蛋白作为加载对照。
图20描述了GFP-USP10和Myc-USP13确实可以相互作用并且该相互作用在spautin处理的细胞中受到抑制的实验结果。使用GFP-USP10(泳道1-4)、Myc-USP13(泳道2-4)、MG 132(泳道3-4)和/或spautin(泳道4)转染293T细胞。使用抗GFP抗体免疫沉淀溶解产物,并通过带有指定抗体的蛋白质印迹法分析免疫复合体。
图21描述了flag-USP10和GFP-Beclin1确实可以相互作用并且该相互作用在spautin处理的细胞中受到抑制的实验结果。使用GFP-Beclin1(泳道1)、GFP-Beclin1和flag-USP10(泳道2-4)质粒转染293T细胞12小时,在有或没有spautin(10μM)的MG 132(10μM)中培养4小时,使用抗GFP抗体免疫沉淀细胞溶解产物,并使用抗Flag抗体通过蛋白质印迹法分析免疫复合体。
图22描述了flag-USP10和GFP-Beclin1确实可以相互作用并且该相互作用在spautin处理的细胞中几乎没有受到影响的实验结果。使用GFP-Beclin1(泳道1)、GFP-Beclin1和Myc-USP 13(泳道2-4)质粒转染293T细胞12小时,在有或没有spautin(10μM)的MG 132(10μM)中培养4小时,使用抗GFP抗体免疫沉淀细胞溶解产物,并使用抗霉菌抗体通过蛋白质印迹法分析免疫复合体。
图23描述了A9的1H核磁共振谱图。
图24描述了A30的1H核磁共振谱图。
图25描述了A36的1H核磁共振谱图。
发明详述
自噬,一种细胞分解代谢过程,通过介导细胞内组分的溶酶体依赖性更新循环而在代谢应激条件下促进细胞存活中起着重要作用。已经有人提出将自噬抑制作为一种潜在的癌症新疗法。
在基于图像的自噬小分子调节剂筛选中,确定了一种自噬抑制剂MBCQ。对MBCQ广泛的药物化学修饰产生了新的衍生物,例如C43。据公开,C43抑制自噬且在基于细胞的测定中其IC50为大约0.8μM。在本发明的某些实施例中,C43被称为“spautin”(特异且有效的自噬抑制剂)。也已经制备了IC50大约为30nM的C43衍生物。
另外,本发明公开了MBCQ和spautin可以促进Vps34复合体(例如涉及Beclin1/Vps34/p150的III类PtdIns3激酶复合体,其产物PtdIns3P是自噬开始所必需的)降解。进一步公开了去泛素化蛋白酶复合体调节Vps34复合体的泛素化和降解,所述去泛素化蛋白酶复合体包括USP3、USP10、USP13、USP16和USP18。本发明提出了spautin抑制自噬的机制,即该复合体破坏泛素化蛋白酶复合体(包括USP 10和USP 13),该复合体涉及调节哺乳动物细胞中Vps34复合体的更新。
本发明进一步公开了spautin大体上不具有细胞毒性,但是在饥饿条件下会诱导癌症细胞亚组的细胞凋亡。此外,本发明公开了spautin抑制胰腺炎动物模型体内的自噬。
定义
为了方便起见,此处汇集了说明书、实施例和附加权利要求中使用的某些术语。本申请定义和使用的所有定义均取代字典定义、参考并入文件中的定义和/或被定义的术语的普通含义。
本申请使用的冠词“一”和“一种”是指一个或多于一个(即至少一个)所对应的物品。举个例子,“一元素”是指一种元素或多于一种的元素。
本申请的说明书和权利要求书中所使用的短语“和/或”应该理解为所连接两个元素中的“任何一个或两者”,即在某些情况下两种元素联合出现,在另外一些情况下两种元素分离地出现。用“和/或”列出的多种元素应以相同的方式结合,即所连接元素中的“一个或多个”。其他元素可能以可选的方式出现,而不是通过“和/或”从句特别确定,这与那些特定的元素有关或者无关。因此,作为一个非限制性的例子,当“A和/或B”与开放性语句例如“包括”联合使用时,在一个实施例中可以仅仅指A(可选地包括B以外的元素);在另外一个实施例中可以仅仅指B(可选地包括A以外的元素);或在另外一个实施例中可以指A和B(可选地包括其他元素)等等。
本发明的说明书和权利要求书中使用的“或”应该理解为与以上定义的“和/或”有相同的含义。例如,当在分离列表中的项目时,“或”或“和/或”应该解释为包括性的,即包括多个元素或元素列表中的至少一个或者多个或以及可选地,附加的未列出的项目。只有明确地指明其相反面,例如“只有其中一个”或“正好只有一个”或当用于权利要求书中,“由……组成”是仅指包括很多元素或元素列表中的一个元素。一般地,当本申请使用的术语“或”之前有排他性术语例如“两者之一”、“其中一个”、“仅其中一个”或“正好只有其中一个”时,“或”应该只被解释为指定的排他的供选方案(即“一个或另外一个但是不是两者都”)。当“基本由……组成”用于权利要求书时,它应该有其在专利法领域中使用的普通含义。
如在本申请的说明书和权利要求书中所使用的,关于一种或多种元素的列表中的短语“至少一个”应该理解为从元素列表中的一种或多种元素中选择至少一种元素,但是不需包括元素列表中特别列出的每个和每种元素中的至少一个,并且不排除元素列表中元素的任何组合。该定义也允许短语“至少一个”可选地出现那些不是元素列表中特别确定的元素,其可以与那些特别确定的元素有关或无关。因此,作为一个非限制性的例子,“A和B中至少一个”(或,相等地,“A或B中至少一个”或,相等地,“A和/或B中至少一个”)在一个实施例中可以是指至少一个,可选地包括多于一个,A,不出现B(并且可选地包括B以外的元素);在另外一个实施例中,可以是指至少一个,可选地包括多于一个,B,不出现A(并且可选地包括A以外的元素);然而在另外一个实施例中,可以是指至少一个,可选地包括多于一个,A,并且至少一个,可选地包括多于一个B(并且可选地包括其他元素)等等。
也应该理解的是,除非明确地指明相反面,否则在本申请所要求的包括多于一个步骤或行动的任何方法中,方法的步骤或行动顺序不需局限于所引用方法的步骤或行动顺序。
在权利要求书以及上述的说明书中,所有的过渡性短语例如“包括”、“带有”、“有”、“含有”、“涉及”、“持有”、“由……构成”等等均被理解为开放性的,即表示包括但不限于。只有过渡性短语“由……组成”和“基本由……组成”应该分别是封闭的或半封闭的过渡性短语,如美国专利局的专利审查手册,第2111.03章节所述。
每个表述的定义,即烷基、m、n等等,当其以任意组织形式出现多于一次时,其所要表示定义与其在别处以相同组织形式出现的表述相互独立。
可以理解的是“取代”或“被……取代”包括含蓄的限制性条款,即该取代符合被取代原子和取代基的允许化合价,并且取代产生了稳定的化合物,即不会自发地进行转化的化合物,例如通过重排、环化、消除或其他反应。
术语“被取代的”也旨在包括有机化合物的所有可行的取代基。在广泛的一方面,可行的取代基包括有机化合物的非环的和环化的、支链的和非支链的、碳环的和杂环的、芳香性和非芳香性取代基。说明性取代基包括,例如,本发明如下所述的取代基。可行的取代基可能是一种或多种且对于合适的有机化合物可以是相同或不同的。出于本发明的目的,杂原子例如氮可能有氢取代基和/或本发明所描述的满足杂原子化合价的有机化合物的任何可行的取代基。有机化合物可行的取代基不以任何方式意图限制本发明。当指明有“一个或多个”取代基时,可能有,例如,1、2、3、4或5个取代基。
当术语“低级”附加于下列任何基团时,其表明该基团含有少于七个碳原子(即六个或更少)。例如“低级烷基”是指含有1-6个碳原子的烷基。
出于本发明的目的,化学元素根据元素周期表,CAS版,化学与物理手册,第67版,1986-87,封面内页确定。
术语“烷基”是指含有1至20、1至15或1至10个碳原子的脂肪烃基或环烃基。烷基的代表性实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、2-甲基环戊基和1-环己基乙基。术语“氟烷基”是指一个或多个氢原子被氟取代的烷基。
术语“烷氧基”是指通过氧与母体部分相连接的烷基。术语“氟烷氧基”是指通过氧与母体部分相连接的氟烷基。
选定的自噬抑制剂
本发明一个方面涉及通式I表示的化合物:
或其可药用的盐,生物活性代谢物、溶剂化物、水合物、前药、对映异构体或者立体异构体,其中
n为0、1、2、3或4;
Y为-C(R1)=或-N=;
R为-H、低级烷基、-CH3、低级氟代烷基、-CH2F、-CHF2、-CF3、-NO2、-OH、-NH2、-NH(低级烷基)、-N(低级烷基)2或低级炔基;
R1每次出现均独立地选自下组:-H、-F、-Cl、-Br、-I、-NO2、-OH、-NH2、-NH(低级烷基)、-N(低级烷基)2、-CH3、-CF3、-C(=O)(低级烷基)、-CN、-O(低级烷基)、-O(低级氟代烷基)、-S(=O)(低级烷基)、-S(=O)2(低级烷基)和-C(=O)O(低级烷基);
R2和R3独立地选自下组:-H、低级烷基、低级氟烷基、低级炔基和羟烷基;
X为-O-、-S-、-N(H)-、-N(低级烷基)、-CH2-、-CH2CH2-、-CH2CH2CH2-、-CH2CH2CH2CH2-、-CH2CH2CH2CH2CH2-或-CH2CH2CH2CH2CH2CH2-;并且
Z为苯基、吡啶基、乙烯基、吗啡基、邻二氮杂菲铁、萘基、呋喃基或苯并噻唑基;并且任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟烷基、-OCH3、-OCF3、低级氟烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及所有前述的化合物及其定义,条件是化合物不是其中J为Cl、OCHF2、OCH2CH3、OCH2CF3、O(CH2)2CH3、OCH(CH3)2、O(CH2)3CH3或O(环戊基)。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为0。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为1。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为2。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为4。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-C(R1)=。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-C(H)=。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-N。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-H。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R为低级烷基或低级氟代烷基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R为-CH3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R为-CH2F、-CHF2或-CF3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中只有一个R1为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中只有两个R1为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中只有三个R1为-H。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中至少有一个R1为-NH2、-Cl、-NO2、-I或-OMe。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中有一个R1为-NH2、-Cl、-NO2、-I或-OMe;并且至少有两个R1为-H。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为-CH3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为羟烷基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R3为-CH3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R3为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R3为羟烷基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为-CH3,并且R3为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为-H,并且R3为-H。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中X为-O-、-S-、-N(H)-、-N(低级烷基)或-CH2-。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中X为-N(H)-或-N(低级烷基)-。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中X为-N(H)-。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为0或1;X为-N(H)-;R2为-H;R3为-H;并且R为-H。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Z为4-吡啶基,并且任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Z为吗啡基,并且任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Z为2-呋喃基,并且任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Z为1-萘基或2-萘基,其任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Z为苯并噻唑-5-基或苯并噻唑-6-基,其任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Z为苯基,其任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为0或1;并且Z为苯基,其任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为0或1;X为-N(H)-;并且Z为苯基,其任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为0或1;X为-N(H)-;R2为-H;R3为-H;并且Z为苯基,其任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为0或1;X为-N(H)-;R2为-H;R3为-H;R为-H;并且Z为苯基,其任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。
本发明一个方面涉及通式II表示的化合物:
或其可药用的盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或者立体异构体,其中
n为0、1、2、3或4;
Y为-C(R1)=或-N=;
R为-H、低级烷基、-CH3、低级氟代烷基、-CH2F、-CHF2或-CF3;
R1每次出现均独立地选自下组基团:-H、-CH3、-F、-Cl、-Br、-I或-NO2;
R2和R3独立地选自下组基团:-H、-CH3、-CH2CH3、-CH2CH2CH3或-CH(CH3)2;
R4,R5和R8独立地选自下组基团:-H、-CH3、-CF3、-OCH3、-OCF3、-F、-Cl、-Br或-I;并且
R6和R7独立地选自下组基团:-H、-CH3、-CF3、-OCH3、-OCF3、-F、-Cl、-Br或-I;或R6和R7一起为-OCH2O-。
在某些实施例中,本发明涉及任何前述的化合物及其定义,条件是化合物不是
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为0。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为1。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为2。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中n为4。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-C(R1)=。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-C(H)=。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-N=。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中Y为-H。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R为低级烷基或低级氟代烷基。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R为-CH3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R为-CH2F、-CHF2或-CF3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R1为-F。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R1为-Cl。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R1为-Br。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R1为-I。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R1为-NO2。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R1为-CH3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为-CH3、-CH2CH3、-CH2CH2CH3或-CH(CH3)2。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R2为-CH3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R3为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R3为-CH3、-CH2CH3、-CH2CH2CH3或-CH(CH3)2。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R3为-CH3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R4为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R4为-F。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R4为-Cl。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R4为-CH3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R4为-OCH3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R5为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R5为-F。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R5为-Cl。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R5为-CH3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R5为-OCH3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-H、-F、-Cl、-Br或-I。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-H。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-F。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-Cl。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-Br。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-CH3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-CF3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-OCH3。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6为-OCF3。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R6和R7一起为-OCH2O-。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R7为-H、-F、-Cl、-Br或-I。在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R7为-H。
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中R8为-H。
本发明一个方面涉及一种化合物或其可药用的盐,生物活性代谢物、溶剂化物、水合物、前药、对映异构体或者其立体异构体,其选自下组:
在某些实施例中,本发明涉及任何前述的化合物及其定义,其中化合物为自噬抑制剂;并且自噬抑制剂的EC50小于大约100nM。
在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物抑制自噬并且IC50小于大约10μM。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物抑制自噬并且IC50小于大约5μM。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物抑制自噬并且IC50小于大约1μM。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物抑制自噬并且IC50小于大约750nM。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物抑制自噬并且IC50小于大约500nM。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物抑制自噬并且IC50小于大约250nM。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物抑制自噬并且IC50小于大约100nM。
在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物为一种自噬抑制剂;并且化合物不抑制PDE5。
在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物既抑制自噬又抑制PDE5,化合物的自噬IC50在大约0.001μM与大约10μM之间;并且PDE5IC50与自噬IC50的比例在大约10与大约50之间。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物既抑制自噬又抑制PDE5,化合物的自噬IC50在大约0.001μM与大约10μM之间;并且PDE5IC50与自噬IC50的比例在大约50与大约100之间。在某些实施例中,本发明涉及任何一种前述的化合物,其中化合物既抑制自噬又抑制PDE5,化合物的自噬IC50在大约0.001μM与大约10μM之间;并且PDE5IC50与自噬IC50的比例在大约100与大约1,000之间。
本发明的某些带有酸性取代基的化合物可能与可药用的碱以盐的形式存在。本发明包括这种盐。这种盐的实例包括钠盐、钾盐、赖氨酸盐和精氨酸盐。可采用本领域技术人员所熟知的方法制备这些盐。
本发明的某些化合物及其盐可能以不止一种的晶形存在,并且本发明包括每种晶形及其混合物。
本发明的某些化合物及其盐也可能以溶剂化物的形式存在,例如水合物,并且本发明包括每种溶剂化物及其混合物。
本发明的某些化合物可能含有一个或多个手性中心,并且以不同的旋光形式存在。当本发明的化合物含有一个手性中心时,该化合物以两种对映体形式存在,并且本发明既包括对映异构体又包括对映异构体的混合物,例如外消旋混合物。可以通过本领域技术人员所熟知的方法解决该对映异构体,例如通过形成非对映异构盐,它们可以通过,例如结晶作用,而分离;形成非对映异构衍生物或者复合体,它们可以通过,例如结晶作用、气相-液相或者液相色谱法分离;一种对映异构体和一种对映异构体特定试剂的选择性反应,例如酶的酯化作用;或者在手性环境中的气相-液相或者液相色谱法,例如在一个手性支撑物上如键合有手性配基的二氧化硅或者是在一种手性溶剂中。最好可以通过以上所述的分离程序之一将需要的对映异构体转换成另外一种化学个体,可能进一步使用步骤来释放需要的对映体形式。可选择的,可以使用旋光活性试剂、底物、催化剂或溶剂通过不对称合成或使用不对称转化通过将一种对映异构体转化为另外一种对映异构体来合成特异对映异构体。
当本发明的一种化合物含有多于一个手性中心时,它可能以非对映异构的形式存在。可以通过该领域技术人员所熟知的技术,例如色谱法或结晶将非对映异构化合物分离,各个对映异构体可以通过以上所述的方法分离。本发明包括发明化合物的每个非对映异构体及其混合物。
本发明的某些化合物可能以不同的互变异构形式存在或作为不同的几何异构体存在,并且本发明包括发明化合物的每种互变异构体和/或几何异构体及其混合物。
本发明的某些化合物可能以不同的稳定构象形式存在,这些形式可能是可分离的。由于不对称单键阻碍旋转(例如由于空间位阻或环间张力)而造成的扭转型不对称可能会允许分离不同构象异构体的。本发明包括本发明化合物的每种构象异构体及其混合物。
本发明的某些化合物可能以两性离子的形式存在,并且本发明包括本发明化合物的各种两性离子形式及其混合物。
本发明中使用的术语“前药”是指在体内被某些生理学化学过程(例如一种前药在生理学pH条件下被转换为目标药物形式)转换为母体药物的制剂。前药通常是有用的,因为在某些情况下,它们可能比母体药物更容易给药。例如,它们可能通过口服即可生物获得,而母体药物却不能。前药在药理学组合物中的溶解度也可能比母体药物高。前药的一个非限制性例子是本发明的一种化合物,它以酯(“前药”)的形式给药以促进穿过细胞膜的传送,这里水溶性并不是有益的;但是之后一旦进入细胞,其被代谢水解为羧酸,在细胞内水溶性是有益的。前药有很多有用的性质。例如,前药的水溶性可能比最终药物更好,从而使药物的静脉内给药更为便利。前药也可能比最终药物有更高水平的口服生物利用度。给药之后,前药以通过酶或化学方法裂开从而将最终药物运送至血液或组织。
示例性前药释放本发明的一种化合物的胺,其中胺的游离氢被以下基团取代:(C1-C6)烷酰氧甲基、1-((C1-C6)烷酰氧基)乙基、1-甲基-1-((C1-C6)烷酰氧基)乙基、(C1-C6)烷氧羰及氧基甲基、N-(C1-C6)烷氧羰基氨基甲基、琥珀酰基、(C1-C6)烷酰基、α-氨基(C1-C4)烷酰基、芳乙酰基和α-氨酰基或α-氨酰基-α-氨酰基其中所述α-氨酰基部分独立地是蛋白质中自然产生的L-氨基酸,-P(O)(OH)2、-P(O)(O(C1-C6)烷基)2或糖基(碳水化合物半缩醛的羟基分离所产生的基团)。
药物组合物
本发明的一种或更多的化合物可以自己或以药物组合物的形式给药至人类患者,在药物组合物中它们与生理适宜的载体或赋形剂以治疗或改善本发明所述的疾病或状况的剂量混合。这些化合物的混合物也可以以简单混合物或适当的制剂药物组合物的形式给予患者。例如,本发明一个方面涉及包括以下物质的药物组合物:治疗有效剂量的通式I或II的化合物、或其可药用的盐、生物学活性代谢物、溶剂化物、水合物、前药、对映异构体或其立体异构体;和可药用的稀释剂或载体。
本申请使用的治疗有效剂量是指足够预防或缓解本发明所述的疾病或状况的的化合物或多种化合物的量。本中请化合物的制剂和给药技术可参见在本领域普通技术人员所熟知的参考文献,例如“Remington′s Pharmaceutical Sciences”,Mack出版公司,伊斯顿,宾夕法尼亚州,最新版本。
适当的给药途径可以,例如,包括口服、滴眼、直肠、穿黏膜、局部或肠内给药;肠胃外给药,包括肌肉内、皮下、髓内注射以及鞘内、直接心室内、静脉内、腹膜内、鼻内或眼内注射。
可选择地,患者可以以局部而不是全身的方式给予化合物,例如,通过将化合物直接注射进入水肿部位,通常为长效制剂或持续释放制剂。
此外,患者可以通过靶向药物递送系统对该药给药,例如,在用内皮细胞特异性抗体包被的脂质体中。
本发明的药物组合物可能以它本身已知的方式来制备,例如,通过常规的混合、溶解、粒化、制糖锭剂、水飞、乳化、包封、包载或冻干工艺的方法制备。
因此,本发明使用的药物组合物可以使用一个或多个生理学可接受的载体,以常规方法配制,所述载体包括赋形剂和辅料,它们能促进活性化合物进入药学上使用的药剂的过程。适当的制剂取决于选择的给药途径。
对于注射,本发明的药剂可以在水溶液中配制,优选在生理学相容性缓冲剂中,例如汉克斯液、林格液或生理学盐缓冲剂。对于穿黏膜给药,在制剂中使用对渗透障碍适宜的渗透剂。这些渗透剂一般是本领域所公知的。
对于口服给药,可以通过将活性化合物与本领域所公知的可药用的载体相结合的方法容易地制备化合物。这种载体能使本发明的化合物制成为片剂、丸剂、糖锭剂、胶囊、液体、凝胶、糖浆剂、膏剂、悬浮液及类似制剂,用于给接受治疗的患者口服。可以通过将活性化合物与固体赋形剂相结合的方法获得口服用药物制剂,任选地磨碎获得混合物,并在加入适当的辅料之后(如果需要的话)加工颗粒混合物,以获得片剂或糖锭剂芯。适当的赋形剂为,特别地,填充剂例如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂例如,玉米淀粉、小麦淀粉、米淀粉、土豆淀粉、明胶、黄蓍树胶、甲基纤维素、羟丙甲基纤维素、羧甲基纤维素钠、和/或聚乙烯吡咯烷酮(PVP)。如果需要,可以加入崩解剂,例如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐例如海藻酸钠。
糖锭剂芯与适当的包衣一起提供。出于此目的,可能使用浓缩的糖溶液,可选地包括阿拉伯树胶、滑石、聚乙烯吡咯烷酮、聚羧乙烯凝胶、聚乙二醇、和/或二氧化钛、漆溶液和适当的有机溶剂或溶剂混合物。可以在片剂或糖锭剂包衣中加入染料或色素以鉴定或特征化活性化合物剂量的不同组合。
可以口服使用的药物制剂包括由明胶制成的推入配合(push-fit)胶囊以及由明胶和增塑剂,例如甘油或山梨醇,制成的软性密封胶囊。推入配合胶囊可以包含活性成分与填充剂例如乳糖,黏合剂例如淀粉混合和/或润滑剂例如滑石或硬脂酸镁的混合物,且可选地,包括稳定剂。在软胶囊中,活性化合物可以溶于或悬浮于适当的液体中,例如脂肪油、液态石蜡或液态聚乙烯二醇。另外,可能加入稳定剂。所有用于口服给药的制剂剂量均应适用于所述给药。
对于口腔投药,组合物可能采用以常规方式制备的片剂或锭剂形式。
对于吸入给药,本发明使用的化合物可方便地通过使用适当的推进剂经加压包或雾化器以气雾喷雾器制剂的形式递送,所述推进剂例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体。关于加压的气溶胶,可以通过提供阀门来确定剂量单位以递送定量的剂量。用于吸入器或吹入器的胶囊和药筒(例如,明胶的)可以制成含有化合物和适当粉末基底的粉末混合物,粉末基底例如乳糖或淀粉。
化合物可以制成注射的非消化道给药剂型,例如单次快速静脉注射或连续输注。注射制剂可能以单位剂量的形式呈现,例如在安瓿或多剂量容器中,并有防腐剂加入。组合物可以采取如下几种形式例如悬浮液、溶液或在油性或水性溶剂中的乳状剂,并可能含有配方制剂例如悬浮、稳定和/或分散剂。
用于非消化道给药的药物制剂包括水溶性形式的活性化合物的水溶液。另外,可以将活性化合物的悬浮液制成为适当的油性注射悬浮液。适当的亲脂性溶剂或介质包括脂肪油,例如芝麻油,或人造脂肪酸酯,例如油酸乙酯或甘油三酯,或脂质体。水性注射悬浮液可能含有增加悬浮液粘度的物质,例如羧甲基纤维素钠、山梨醇或葡聚糖。可选地,悬浮液可能也含有适当的稳定剂或能够增加化合物的溶解度以制备高度浓缩溶液的制剂。
可选择的,在使用之前,活性成分可以以粉末的形式与适当的溶剂组合,例如灭菌无热原水。
化合物也可以制成直肠组合物制剂,例如栓剂或保留灌肠剂,例如含有常规的栓剂基质例如可可豆脂或其他甘油酯类。
除了之前描述的制剂之外,化合物也可以制成长效制剂。这种长效制剂可以通过植入给药(例如皮下或肌内或通过肌内注射)。因此,例如,化合物可能与适当的多聚体或疏水材料(例如溶于可接受油的乳状液)或离子交换树脂类制剂制成略溶的衍生物,例如制成略溶的盐。
可选择的,可能使用疏水药物化合物的其他递送系统。脂质体和乳状剂是公知的疏水药物递送介质或载体的实例。虽然通常要付出较大的毒性代价,也可以使用某些有机溶剂例如二甲基亚砜。另外,可以使用持续释放系统递送化合物,例如含有治疗药物的固体疏水聚合物的半渗透性基质。已经确定了各种持续释放材料,并且是本领域技术人员所熟知的。持续释放胶囊根据它们的化学性质可能释放化合物若干周到超过100天。根据治疗药物的化学性质和生物稳定性,可以使用额外的蛋白质稳定策略。
药物组合物可能也包括适当的固体或凝胶态载体或介质。这种载体或介质的实例包括但不限于碳酸钙、磷酸钙、各种糖、淀粉、纤维素衍生物、明胶和聚合物例如聚乙烯二醇。
本发明的很多化合物可能以药学上相容的平衡离子的盐(即可药用的盐)的形式提供。“可药用的盐”是指一旦给予受体就能直接地或间接地提供本发明的化合物或化合物的前药的任何非毒性的盐。“可药用的平衡离子”是指给予受体之后从盐中释放出来时没有毒性的盐的离子部分。药学上相容的盐可能与很多酸一起形成,包括但不限于,盐酸、硫酸、乙酸、乳酸、酒石酸、苹果酸、琥珀酸等等。盐比相应的自由基形式更易溶解于水性或其他质子性溶剂。
通常用于形成可药用的盐的酸包括无机酸例如硫化氢、盐酸、氢溴酸、氢碘酸、硫酸和磷酸以及有机酸例如对甲苯磺酸、水杨酸、酒石酸、二酒石酸、抗坏血酸、顺丁烯二酸、苯磺酸、反丁烯二酸、葡萄糖酸、葡萄糖醛酸、甲酸、谷氨酸、甲基磺酸、乙基磺酸、苯磺酸、乳酸、草酸、对溴代苯磺酸、碳酸、琥珀酸、柠檬酸、苯甲酸和乙酸以及有关的无机酸和有机酸。因此所述可药用的盐包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、醋酸盐、丙酸盐、癸酸盐、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、癸酸盐、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、延胡索酸盐、马来酸盐、丁炔-1,4-二酸盐、己炔-1,6二酸盐、苯甲酸盐、氯苯甲酸盐、苯甲酸甲酯、二硝基苯甲酸酯、羟苯酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、对苯二酸盐、磺酸盐、二甲苯磺酸盐、苯醋酸盐、苯丙酸盐、苯基丁酸盐、柠檬酸盐、乳酸盐、β羟基丁酸盐、羟乙酸盐、马来酸盐、酒石酸盐、甲磺酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、扁桃酸盐及类似盐。优选的可药用的酸式加成盐包括那些与无机酸形成的盐,例如盐酸和氢溴酸,以及特别地那些与有机酸形成的盐,例如顺丁烯二酸。
能与酸性官能团形成可药用的盐的适合碱包括但不限于,碱金属的羟化物类例如钠、钾和锂;碱土金属的羟化物类例如钙和镁;其他金属的羟化物类,例如铝和锌;铵和有机胺,例如未被取代的或羟基取代的单、双或三烷基胺;二环己胺;三丁胺;吡啶;N-甲基,N-乙胺;二乙胺;三乙胺;单、双或三-(2-羟基-低级烷基胺),例如单、双或三-(2-羟乙基)胺,2-羟基-叔丁胺,或三(羟甲基)甲胺,N,N-二烷基-N-(羟烷基)胺,例如N,N-二甲基-N-(2-羟乙基)胺或三-(2-羟乙基)胺;N-甲基-D-葡萄糖胺;和氨基酸如精氨酸、赖氨酸及类似物。
适用于本发明的药物组合物包括其中含有能达到其预期目的有效剂量的有效成分的组合物。更具体的,治疗有效剂量是指对预防正在接受治疗的主体的现存症状的发展和减轻正在接受治疗的主体的现存症状的有效剂量。有效剂量的确定属于本领域技术人员的能力范围之内。
选定的使用方法
本发明一方面提供了一种在主体内抑制自噬的方法,对于所述主体,抑制自噬是有益的,该方法包括对主体给药本发明中的化合物以改变主体内的自噬活动并达到治疗或预防的目的。在某些实施例中,主体是人类。
本发明中使用的术语“治疗”包括向主体给入和/或施用本发明所述的一种或多种化合物,以预防或处理和/或补救状况。本发明中“治疗”的目的是可以,但不一定必须,提供治愈的效果;“治疗”的形式可以是处理所述状况。当本发明所描述的化合物用于治疗非必要细胞增殖包括癌细胞时,“治疗”包括指在正常细胞破坏影响最小的情况下部分或者全部破坏这些非必要的增殖细胞。细胞水平上治疗非必要的快速增殖细胞的机制是凋亡,所述细胞包括癌细胞。
本申请中使用的术语“预防”包括预防或减缓临床上明显的所有非必要的细胞增殖的发作或者对有风险的个体在临床明显的非必要细胞增殖阶段开始前进行预防或延迟。“预防”的定义还包括预防或减缓恶性肿瘤细胞转移或者阻止或反转恶性肿瘤细胞的进程。“预防”的定义也包括对那些有患上前期癌症或癌症风险的主体进行预防性治疗。“预防”的定义还包括预防或减缓主体在接受了血管形成术或移植片固定模程序后的再狭窄。
术语治疗的“主体”包括已被确诊,有疾病症状或有患疾病风险并且可从自噬抑制中受益的任何人或动物主体。对于预防方法,主体是指任何人或动物主体。举例说明,对于预防,主体可以是人主体,其有患非必要细胞快速增殖为特征的疾病如癌症的风险,或因遗传因素易患此类疾病。主体会有所述风险的原因是接触了致癌剂或是因遗传因素更易患非必要细胞快速增殖为特征的疾病或是其他的原因等。除了可用于治疗人类,本发明中所述的化合物还可以用于治疗牲畜哺乳动物,包括宠物和家畜,包括但不限于狗、猫、马、牛、羊和猪。
本发明一方面涉及一种治疗或预防癌症的方法,包括将有效治疗量的通式I或通式II的一种或多种化合物或其可药用的盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或立体异构体给药至需要的主体的步骤。
由于可以增强放疗敏感度和化疗敏感度,自噬抑制已被提议作为一种新的抗癌疗法。在治疗癌症的动物模型中,通过针对自噬关键基因ATG5的shRNA或抗疟疾药氯喹抑制治疗诱导性自噬可以提高细胞的死亡以及Myc驱动肿瘤的肿瘤衰退,其中激活的p53或烷基化合物治疗被用于驱动肿瘤细胞死亡。(Amaravadi,R.K.,et al.,Autophagy inhibitionenhances therapy-induced qpoptosis in a Myc-induced model of lymphoma.J Clin Invest,2007.117(2):p.326-36)。氯喹可引发剂量依赖性大自噬体囊泡积聚且能增强烷基化治疗诱导的细胞死亡,使其达到与ATG5基因敲除后相同的细胞死亡程度。对于慢性髓细胞性白血病(CML),氯喹可以显著的增强伊马替尼诱导的CML细胞株K562的细胞死亡。此外,可以通过伊马替尼和氯喹的共同治疗诱导伊马替尼抗性细胞株,BaF3/T315I和BaF3/E255K死亡。这些研究显示抑制自噬可以增强常规的化疗效果。
国立癌症研究所按字母顺序列出的癌症包括:急性淋巴细胞白血病,成人;急性淋巴细胞白血病,儿童期;急性骨髓性白血病,成人;肾上腺皮质癌;肾上腺皮质癌,儿童期;艾滋病相关的淋巴瘤;艾滋病相关的恶性肿瘤;直肠癌;星细胞瘤,儿童小脑;星细胞瘤,儿童大脑;胆管癌,肝外;膀胱癌;膀胱癌,儿童期;骨癌,骨肉瘤/恶性纤维组织细胞瘤;脑干胶质细胞瘤,儿童期;脑瘤,成人;脑瘤,脑干胶质细胞瘤,儿童期;脑瘤,小脑星细胞瘤,儿童期;脑瘤,星细胞瘤/恶性胶质细胞瘤,儿童期;脑瘤,室鼓膜瘤,儿童期;脑瘤,髓母细胞瘤,儿童期;脑瘤,幕上原始神经外胚瘤,儿童期;脑瘤,视通路和下丘脑瘤,儿童期;脑瘤,儿童期(其他);乳腺癌;乳腺癌且妊娠期;乳腺癌,儿童期;乳腺癌,男性;支气管腺瘤/良性肿瘤,儿童期;类癌肿瘤,儿童期;类癌肿瘤,胃肠道;癌症,肾上腺皮质的;癌症,胰岛细胞;原发灶不明的转移癌;中枢神经系统淋巴瘤,原发的;小脑星细胞瘤,儿童期;大脑星细胞瘤/神经胶质瘤;儿童期;宫颈癌;儿童癌;慢性淋巴细胞白血病;慢性髓性白血病;慢性骨髓增殖性疾病;腱鞘透明细胞肉瘤;结肠癌;结肠直肠癌,儿童期;皮肤T-细胞性淋巴瘤;子宫内膜癌;室管膜癌,儿童期;上皮样癌,卵巢;食管癌;食管癌,儿童期;尤文氏家族肿瘤;颅外生殖细胞肿瘤,儿童期;生殖细胞肿瘤;肝外胆管癌;眼癌,眼内黑色素瘤;眼癌,视网膜母细胞瘤;胆囊癌;胃部(胃)癌;胃部(胃)癌,儿童期;胃肠道类癌肿瘤;胚细胞瘤,颅外,儿童期;胚细胞瘤,性腺外;胚细胞瘤,卵巢;妊娠滋养细胞肿瘤;神经胶质瘤,儿童脑干;神经胶质瘤,儿童视通路和下丘脑;多毛细胞白血病;头颈癌;肝细胞的(肝)癌,成人(原发性);肝细胞的(肝)癌,儿童期(原发性);何杰金氏淋巴瘤,成人;何杰金氏淋巴瘤,儿童期;妊娠期何杰金氏淋巴瘤;下咽癌;下丘脑和视通路神经胶质瘤,儿童期;眼内黑色素瘤;胰岛细胞癌(内分泌胰腺);卡波西肉瘤;肾癌;喉癌;喉癌,儿童期;白血病,急性成淋巴细胞,成人;白血病,急性成淋巴细胞,儿童期;白血病,急性骨髓细胞,成人;白血病,急性骨髓细胞,儿童期;白血病,慢性淋巴细胞;白血病,慢性髓性;白血病,毛细胞;唇和口腔癌;肝癌,成人(原发性);肝癌,儿童期(原发性);肺癌,非小细胞;肺癌,小细胞;成淋巴细胞性白血病,成人急性;成淋巴细胞性白血病,儿童期急性;淋巴细胞性白血病,慢性;淋巴瘤,艾滋病相关;淋巴瘤,中枢神经系统(原发性);淋巴瘤,皮肤T细胞;淋巴瘤,霍奇金,成人;淋巴瘤,霍奇金,儿童期;淋巴瘤,妊娠期霍奇金;淋巴瘤,非霍奇金,成人;淋巴瘤,非霍奇金,儿童期;淋巴瘤,妊娠期非霍奇金;淋巴瘤,原发性中枢神经系统;巨球蛋白血症,瓦尔登斯特伦氏;男性乳腺癌;恶性间皮瘤,成人;恶性间皮瘤,儿童期;恶性胸腺瘤;髓母细胞瘤,儿童期;黑色素瘤;黑色素瘤,眼内;莫克细胞癌;间皮瘤,恶性;原发灶隐匿的转移性颈部鳞状细胞癌;多发性内分泌肿瘤结合症,儿童期;多发性骨髓瘤/浆细胞肿瘤;蕈样真菌病;骨髓增生异常综合症;髓性白血病,慢性;粒细胞性白血病,儿童急性;骨髓瘤,多发性;骨髓增殖性疾病,慢性;鼻腔和鼻旁窦癌;鼻咽癌;鼻咽癌,儿童期;神经母细胞瘤;非何杰金淋巴瘤,成人;非何杰金淋巴瘤,儿童期;非何杰金淋巴瘤,妊娠期;非小细胞肺癌;口癌,儿童期;口腔和唇癌;口咽癌;骨肉瘤/恶性骨纤维组织细胞瘤;卵巢癌,儿童期;卵巢上皮样癌;卵巢生殖细胞肿瘤;卵巢低度潜在恶性肿瘤;胰腺癌;胰腺癌,儿童期;胰腺癌,胰岛细胞;鼻旁窦和鼻腔癌;甲状旁腺癌;阴茎癌;嗜铬细胞瘤;松果体和幕上原始神经外胚瘤,儿童期;垂体瘤;浆细胞肿瘤/多发性骨髓瘤;脏层胸膜胚细胞瘤;妊娠期且乳腺癌;妊娠期且霍奇金淋巴瘤;妊娠期且非霍奇金淋巴瘤;原发性中枢神经系统淋巴瘤;原始性肝癌,成人;原发性肝癌,儿童期;前列腺癌;直肠癌;肾细胞(肾)癌;肾细胞癌,儿童期;肾盂和尿管,移行细胞癌;眼癌;横纹肌肉瘤,儿童期;涎腺癌;涎腺癌,儿童期;肉瘤,尤文氏瘤;肉瘤,卡波西氏;肉瘤(骨肉瘤)/恶性骨纤维组织细胞瘤;肉瘤,横纹肌肉瘤,儿童期;肉瘤,软组织,成人;肉瘤,软组织,儿童期;塞扎里综合症;皮肤癌;皮肤癌,儿童期;皮肤癌(黑色素瘤);皮肤癌,默克尔细胞;小细胞肺癌;小肠癌;软组织肉瘤,成人;软组织肉瘤,儿童期;原发灶隐匿的颈部鳞状细胞癌,转移性;胃(胃部)癌;胃(胃部)癌,儿童期;幕上原始神经外胚瘤,儿童期;T细胞淋巴瘤,皮肤;睾丸癌;胸腺瘤,儿童;胸腺瘤,恶性;甲状腺癌;甲状腺癌,儿童期;肾盂和尿管的移行细胞癌,;滋养细胞瘤,妊娠期的;原发灶隐匿的,癌,儿童期;儿童期罕见癌症;输尿管和肾盂,移行细胞癌;尿道癌;子宫肉瘤;阴道癌;视通路和下丘脑神经胶质瘤,儿童期;外阴癌;沃尔登斯特伦巨球蛋白血症和韦尔姆斯氏瘤;本发明所述方法可用于治疗上述各类癌症。
本发明另一方面涉及一种治疗或预防急性胰腺炎的方法,该方法包括将有效治疗量的通式I或通式II的一种或多种化合物或其可药用的盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或立体异构体给药至需要的主体的步骤。
胰腺炎是一种由于消化酶释放介导的胰腺炎症,其最终导致器官的自我破坏。胰腺炎可以是一种严重的,危机生命的且伴有多并发症的疾病。严重时,出血,心脏、肺和肾脏的组织损伤和感染都有可能出现。美国每年大约有80,000例急性胰腺炎发生;其中约20%较为严重。目前对胰腺炎还没有很好的疗法。目前胰腺炎的处理方法包括等待胰腺炎自己好转和对出现的心脏、肺和肾脏并发症进行治疗。
研究表明自噬在介导急性胰腺炎诱导的细胞损伤中起着重要的作用。胰腺过早激活的消化蛋白酶自动消化胰腺被认为是急性胰腺炎发作的重要原因。尽管已知溶酶体水解酶在胰腺胰蛋白酶原激活中起重要作用,但胰蛋白酶原具体在什么部位以及怎样与溶酶体水解酶相互作用始终是未知。最近的报道提出自噬在胰腺炎动物模型中的胰腺消化酶的释放中起关键作用(Hashimoto,D.,et al.,Involvement of autophagy in trypsinogen activation withinthe pancreatic acinar cells.J Cell Biol,2008.181(7):p.1065-72;以及Ohmuraya,M.and K.Yamamura,Autophagy and acute pancreatitis:a novel autophagy theory for trypsinogenactivation.Autophagy,2008.4(8):p.1060-2.)。在关键自噬基因Atg5缺陷的Atg5-/5小鼠中,蛙皮素诱导的急性胰腺炎的严重性随着胰蛋白酶原激活水平的显著下降而得到极大缓解。因此自噬激活可能会通过介导激活胰蛋白酶原为胰蛋白酶而对胰腺腺泡细胞产生不利的影响。自噬抑制可能为阻断急性胰腺炎中的胰蛋白酶原激活提供唯一的机会。开发自噬抑制剂可以为急性胰腺炎提供极为重要的抑制剂。
本发明另一方面涉及一种治疗或预防细胞内病原体引起的疾病的方法,包括将有效治疗量的通式I或通式II的一种或多种化合物或其可药用的盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或立体异构体给药至需要的主体的步骤。实例可参见Chen等人的美国专利申请公开号No.2009/0111799的专利。其内容在此参考并入。
最近的研究已经确定了自噬在细胞性防御细胞内病原体中的作用,所述病原体包括细菌如结核分枝杆菌、酿脓链球菌、志贺氏菌和鼠伤寒沙门氏菌以及病毒和通过自噬体增殖的原生动物。自噬的过程在很大程度上受上游信号转导系统的调节,生理因素(如营养状况、生长因子/细胞活素和缺氧)对所述上游信号转导系统的影响很大。药理学上的自噬诱导是一种治疗策略,其通过触发或放大先天性免疫作用物来防御细胞内病原体。
本发明的另一方面涉及一种使去泛素化蛋白酶复合物失活的方法,包括使通式I或通式II的一种或多种化合物与去泛素化蛋白酶复合物接触;其中去泛素化蛋白酶复合物包括USP3和USP10。这些方法还能用于改善去泛素化蛋白酶复合物活力引发的或增强的任何状态。
组合治疗
在本发明的一方面,本发明中的化合物或其可药用的盐可以单独使用或与另一种治疗剂组合使用用于治疗疾病,如癌症和胰腺炎。应当理解的是本发明中的化合物可以单独使用或与添加剂组合使用,如治疗剂。所述的添加剂由技术人员根据预期目的挑选。例如添加剂可以是所属技术领域公认的对本发明化合物治疗的疾病或状况有用的治疗剂。添加剂也可以是有益于治疗组合物的制剂,如影响组合物粘性的制剂。
本发明构思的组合治疗包括,例如,给药含有本发明中的化合物或其可药用的盐和一种或多种添加剂的单一药物制剂,以及将本发明中的化合物或其可药用的盐和一种或多种添加剂分别制成药物制剂用于给药。换句话说,组合给药是指对主体给药至少两种药剂以同时提供这两种药剂的有益作用。举例来说,这些制剂可以同时给药或者在一定时间内相继给药。
应进一步了解的是本发明包括的组合是那些可用于其预期目的的组合。以下例举的药剂是为了说明并非意图限制。作为本发明的一部分,组合可以是本发明的化合物和选自下表的至少一种添加剂。组合还可以包括多于一种添加剂,例如,如果组合使形成的组合物能发挥其预期的功能,那么组合包括两种或三种添加剂。
例如,本发明一方面涉及小分子自噬抑制剂(如通式I或通式II的化合物)与抗血管生成抑制剂联用用于治疗癌症。已知抗血管生成抑制剂预期能够通过抑制肿瘤血管的生长抑制肿瘤生长,所述血管生长时支持肿瘤存活及生长所必须的。例如,血管抑制剂内皮抑制素和相关的化学品能抑制血管的构建和抑制肿瘤生长。目前正在进行临床试验的抗血管生成药物有上百种。在患者测试中,抗血管生成治疗能够抑制肿瘤生长且副作用相对较小。但是单独使用抗血管生成治疗并不足以延长病人的生存期。因此,与传统的化疗组合可能是有益的。具体来说,自噬抑制剂为单独使用或与抗血管生成治疗组合使用提供了一新的选择。
内皮抑制素已被证实能通过调节Beclin1自噬蛋白和β-环连蛋白的水平来引导内皮细胞内的自噬(Nguyen,T.M.,et al.,Endostatin induces autophagy in endothelial cells bymodulating Beclin 1 and beta-catenin levels.J Cell MoI Med,2009)。如本申请所公开的,已知自噬抑制可选择性地杀死一组饥饿状态下的癌症细胞。因此,有人提出抗血管生成治疗可以诱导额外的代谢应激从而使癌症细胞对自噬抑制剂敏感,其通常没有细胞毒性。因此,抗血管生成治疗与抗自噬治疗的组合可以为对正常细胞无毒性的癌症治疗提供一种新的选择(Ramakrishnan,S.,et al.,Autophagy and angiogenesis inhibition.Autophagy,2007.3(5):p.512-5)。
能与抗血管生成剂组合的本发明化合物的非限制性例子包括如下:贝伐单抗(Avastin)、羧胺三唑、TNP-470、CM101、IFN-α、IL-12、血小板因子-4、舒拉明、SU5416、凝血酶敏感蛋白、VEGFR拮抗剂、带有肝磷脂抑制血管生成的甾类、源自软骨的新生血管抑制因子、基质金属蛋白酶抑制剂、血管生成抑制素、内皮抑制素、2-甲氧基雌二醇、替可加兰钠、凝血酶敏感蛋白、催乳素、αVβ3抑制剂和利诺胺。
此外,如Thompson等在美国专利申请公开号No.2008/0269259中所描述(在此整体参考并入),一种或多种自噬抑制剂可以通过与一种或多种抗癌化合物组合用于治疗已被诊断为糖酵解依赖性癌症的主体,所述抗癌化合物能转换糖酵解依赖性癌症为糖酵解障碍的细胞。能转换糖酵解依赖性癌症为糖酵解障碍的细胞的抗癌化合物例子包括:烷化剂;亚硝基脲;抗肿瘤抗生素;皮质类固醇激素;抗雌激素;芳香酶抑制剂;孕激素;抗雄激素;LHRH激动剂;激酶抑制剂;和抗体疗法如白消安、顺铂、卡铂、苯丁酸氮芥、环磷酰胺、异环磷酰胺、达卡巴嗪(DTIC)、二氯甲基二乙胺(氮芥)、美法仑、卡莫司汀(BCNU)、洛莫司汀(CCNU)、更生霉素、柔红霉素、多柔霉素(亚德里亚霉素)、伊达比星、米托蒽醌、强的松、地塞米松、他莫昔芬、氟维司群、阿那曲唑、来曲唑、醋酸甲地孕酮、比卡鲁胺、氟他胺、亮丙瑞林、戈舍瑞林、格列卫、易瑞沙、塔西法、赫赛汀、阿瓦斯丁、左旋天冬酰胺酶和维甲酸。
剂量
本发明使用的“治疗有效量”或者“治疗有效剂量”是指能完全或部分阻断病情进程或者至少减轻一种或多种病情症状的本发明的一种化合物或者两种或更多种这些化合物组合的量。治疗有效量同样也指预防上有效的量。治疗有效剂量依赖于患者的体型和性别、治疗的状况、病情的严重程度和要达到的疗效。对于给定的患者,治疗有效量可以通过本领域的技术人员公知的方法确定。
对于本发明方法中使用的任何一种化合物,治疗有效剂量可以根据细胞实验初步确定。例如可以在细胞模型和动物模型中形成剂量以获得体内循环浓度范围,该范围浓度包括细胞实验确定的IC50值(即达到最大抑制一半效果时受试化合物的浓度)。在某些情况下,适宜在3%到5%血清白蛋白存在时确定IC50,因为这样的测定结果近似血浆蛋白对化合物的结合影响。这些信息可用于更精确的计算人体内有益的剂量。
治疗有效剂量是指能改善患者症状的化合物的量。这些化合物的毒性和治疗效果可以在细胞培养或实验动物中通过标准的药物学操作测定,例如,用于确定最大耐受剂量(MTD)和ED50(达到最大效应50%所需的有效剂量)的操作。毒性和治疗作用间的剂量比率是治疗指数且其可以表达为MTD和ED50的比值。在细胞培养实验和动物研究中获得的数据可用于将人用的剂量范围公式化。这些化合物的剂量优选位于包括了低毒或无毒的ED50值的循环浓度范围内。根据使用的不同的药物剂型和给药途径,剂量可以在此范围内相应改变。医生会根据患者的情况来决定准确的配方、给药途径和给药剂量。(可参见Fingl et ah,1975,in″The Pharmacological Basis of Therapeutics″,Ch.1 pi)。在处理紧急情况时,为了快速获得效应可能需要快速给药或灌入接近最大耐受剂量的急性药物。
剂量和间隔可以根据个体进行调整以提供足以维持激酶调节效应的活性部分的血浆水平,或是最低有效浓度(MEC)。每个化合物的MEC可能不一样,但是可以通过体外的数据来估算。个体特征和给药途径决定了维持MEC所需的药物剂量。但是,HPLC分析或生物分析可用于确定血浆浓度。
剂量间隔同样可以使用MEC确定。化合物应当根据计划给药,所述计划保持血浆浓度在10%到90%,更优选的是30%到90%,最优选的是50%到90%的时间里高于MEC,直至获得预期的症状的减轻。在局部给药或选择性吸收的情况下,药物的局部有效浓度可能与血浆药物浓度无关。
组合物的给药剂量将同样依赖于接受治疗的主体、主体的体重、病情的严重程度、给药方式和处方医师的判断。
试剂盒
本发明的化合物和组合物(例如通式I或通式II的化合物和组合物)可以,必要时,存在于试剂盒中(例如包装物或是分配器)。例如,包装物可以包括金属或塑料箔材,例如泡罩包装。伴随这些包装物或分配器的可以有本申请描述的任何一种方法中的化合物的使用说明书。同样优选的是包括本发明化合物和相容的药物载体的组合物,其被置于合适的容器中且带有用于治疗指定状况的标签。同样也可以提供使用说明书。
实施例
此前已总体性的描述了本发明,参考下述实施例将有助于更好地了解本发明。下述实施例仅仅用于对本发明的某些方面和实施情况进行说明,并非意图限制本发明。
实施例1:小分子自噬抑制剂的分离
为研究自噬的机理和识别更多能激活自噬的小分子,开发了一种基于图像的高通量筛选自噬调节剂的方法。这套筛选系统利用了GFP偶合的轻链-3(LC3-GFP)能在自噬诱导下定位于自噬体膜(Zhang,L.,Yu,J.,Pan,H.,Hu,P.,Hao,Y.,Cai,W.,Zhu,H.,Yu,A.D.,Xie,X.,Ma,D.,et al.(2007)。小分子自噬调节剂由基于图像的高通量筛选来识别(Proc Natl AcadSci USA 104,19023-19028)。研究表明酵母ATG8的同源物哺乳动物LC-3能特异性标记自噬体膜(Kabeya,Y.,Mizushima,N.,Ueno,T.,Yamamoto,A.,Kirisako,T.,Noda,T.,Kominami,E.,Ohsumi,Y.,and Yoshimori,T.(2000))。研究还表明加工后的酵母Apg8p的哺乳动物同源物LC-3能定位于自噬体膜上。EMBO J 19,5720-5728;and Mizushima,N.,and Yoshimori,T.(2007).How to interpret LC3 immunoblotting.Autophagy 3,542-545)。每个细胞上LC3-GFP阳性的自噬体数目在正常生长条件下非常低,但在血清饥饿或加入雷帕霉素的条件下,此数目会快速增长。尽管如此,增加LC3-GFP细胞水平的化合物不一定能增加自噬的降解活性。相反,LC3-GFP的增加可能与细胞死亡有关或是溶酶体缺陷的结果,因此与自噬阻断相关。
在筛选480个已知的生物活性化合物时,基于LC3-GFP的高通量图像筛选与低通量长寿命蛋白分解检测联用可以有助于区分能引起特异性自噬降解的化合物和通过细胞损伤或是下游溶酶体功能阻断非特异性增加LC3-GFP水平的化合物。在筛选中获得了八个化合物,其中的七个药物通过了美国食品药品监督管理局(FDA)认证,这七个药物在引导自噬并且促进长寿命蛋白降解,同时不会引起明显的细胞损伤。(Zhang,L.,Yu,J.,Pan,H.,Hu,P.,Hao,Y.,Cai,W.,Zhu,H.,Yu,A.D.,Xie,X.,Ma,D.,et al.(2007).Small molecule regulatorsof autophagy identified by an image-based high-throughput screen.Proc Natl Acad Sci USA 104,19023-19028)。
在筛选过程中证实了一种已知生物活性的化合物,MBCQ(图1A)具有自噬抑制的活性,其之前公知为PDE5的抑制剂(MacPherson,J.D.,Gillespie,T.D.,Dunkerley,H.A.,Maurice,D.H.,and Bennett,B.M.(2006)Inhibition of phosphodiesterase 5 selectively reverses nitratetolerance in the venous circulation.J Pharmacol Exp Ther 317,188-195)。LC3-FAP-H4细胞在雷帕霉素(0.2μM)刺激后产生了预期的LC3-GFP水平的上升。MBCQ的存在既能抑制基准水平又能抑制雷帕霉素刺激后的LC3-GFP水平。与单独加入雷帕霉素相比,同时加入MBCQ和雷帕霉素1小时后的LC3-GFP斑点明显减少。图1B用高通量显微镜定量分析了LC3-GFP斑点数。与对照或单用雷帕霉素组相比,MBCQ处理减少了LC3-GFP斑点数目、减小了斑点大小,以及斑点强度。测定雷帕霉素和MBCQ同时使用或雷帕霉素单用时的LC3-GFP的强度并作对比,MBCQ的IC50值为0.788μM,这是常用的III型PtdIns3P激酶抑制剂,3-甲基腺嘌呤(3-MA)效力的10,000倍,3-MA的工作浓度为10mM。
为了证实MBCQ对自噬的抑制,使用MBCQ处理H4-LC3细胞、293T细胞和鼠胚胎成纤维细胞,且通过蛋白质印迹法测定内源性LC3II的水平。与单独使用雷帕霉素相比,在MBCQ和雷帕霉素共同处理后的H4-LC3细胞、293T细胞和MEF细胞中的LC3II的水平一致下降,结果与MBCQ的抑制活性相一致。与LC3-GFP分析结果一致(图1B),与单独使用雷帕霉素相比,LC3II的水平在MBCQ和雷帕霉素共同处理1小时后显著降低。
为了确定MBCQ对饥饿诱导的自噬的影响,H4-LC3-GFP细胞在汉克斯缓冲液中培养1小时,其足以诱导自噬,如图2所示的LC3-GFP斑点水平增加所证实的。在MBCQ存在的条件下(5μM),饥饿诱导的自噬显著降低。LC3-GFP斑点数目、大小和强度的定量测定证实了饥饿诱导的自噬被MBCQ(5μM)或3-MA的阳性对照或渥曼青霉素(0.1μM)抑制。
确定MBCQ存在和不存在情况下,雷帕霉素处理后细胞的超微结构。MBCQ单独处理4小时后细胞的形态与介质(1%DMSO)处理的对照组的细胞形态相类似。雷帕霉素处理导致了大量以双层膜为特征的自噬体的形成。在雷帕霉素和MBCQ共同处理后的细胞明显没有这种双层膜自噬体(图3)。
实施例2:MBCQ的结构和活性关系(SAR)
MBCQ是4位杂原子取代的喹唑啉化合物。为了研究SAR,如图4A所示将MBCQ的结构分成三个部分:A部分、B部分和C部分。
在A部分中,6-位引入不同的取代基:卤素、缺电子基团(如硝基和二甲基磺酰基)和多电子基团(如甲氧基和氨基);7-位引入卤素;6-位和8-位引入卤素;2-位引入甲基和氨基。
在B部分,用氧原子或硫原子取代氮;延长亚甲基链;且在亚甲基链中加入分支点(即取代位点)。
在C部分,研究了不同芳香环的影响,包括:4-吡啶基、吗啉基以及取代的和未取代的苯基。取代苯基的取代物包括吸电子基团(如被卤素、硝基和三氟甲基取代的苯基5)和供电子基团(如氨基、甲氧基)。
总共合成了具有以上MBCO结构修饰的194种化合物,并对其抑制自噬的活性进行了分析。
SAR结果总结如下(也可参见图4B):
(1)喹唑啉6-位取代基的性质对于活性很重要。吸电子取代物(如硝基或氟基团)能增强活性(如图16中的C29)。6-位由供电子基团取代的化合物没有活性(如图14中的C71)。6-位没有取代的化合物活性一般。
(2)7-位和8-位取代对化合物活性有负面影响。例如,当喹唑啉7-位或8-单独被取代时,化合物失去活性(如C83),同样的当6-位和8-位同时被氯双取代时化合物也失去活性(如C19、C20)。
(3)A部分的立体位阻会阻碍活性(如C68、C01)。
(4)当B部分的杂原子是氧或硫原子时,化合物检测不到活性(如C101、C45)。
(5)当C部分的苯替换为吗啉或呋喃时化合物失去活性(如C78、C54)。
(6)C部分带有4-CF3,4-NO2或4-嘧啶时,化合物没有活性(如C15)。当3-位、4-位和5-位同时有取代基时,化合物检测不到活性(如C15).
(7)当B部分的杂原子是与1到3个碳连接的氮原子时(如C16、C51和C13),观察到的化合物活性很高。当连接A部分和C部分的链中有多于三个亚甲基单元时,检测不到活性(如C30、C49)。此外,支链上大量的取代基将导致化合物无活性(如C81、C86和C94)。进一步的说,支链上不同的旋光构型(左旋或右旋)对于化合物活性几乎没有影响(如C69和C84、C76和C77)。
在合成MBCQ的衍生物并用于自噬抑制活性分析中,44个化合物的活性类似或高于MBCQ的活性(图16)。同时发现了许多结构上与MBCQ相似但没有自噬抑制活性的化合物如C71和C82,这些化合物可以在随后的实验中作为阴性对照(图15)。
为确认自噬抑制活性,使用C29、C43或C71在雷帕霉素存在和不存在的条件下处理小鼠胚胎成纤维细胞(MEF)4小时,自噬水平通过LC3蛋白质印迹法测定。C43或C29处理抑制了雷帕霉素诱导的自噬,而阴性对照C71则不能。(图5A)。
C29和C43对于自噬的影响通过电子显微镜进一步确证。在雷帕霉素处理过的MEF细胞中能观察到许多有双层膜结构的自噬体小泡以及许多有多层膜的小泡(图5B)。在雷帕霉素和C29或C43处理的细胞中,自噬体大量缺失(图5),这同介质处理的细胞一样。
实施例3:MBCQ抑制涉及自噬的选择性细胞死亡模型
为了表征MBCQ对细胞活性的影响,MBCQ对细胞生存和细胞周期影响根据如下概括确定。连续5天用MBCQ(5μM)处理H4细胞并每天收集细胞用于细胞计数,细胞计数时使用台盼蓝。如图6A所示,MBCQ处理对细胞增殖无影响。同样还确定了细胞周期情况和MBCQ(5μM)处理24小时和48小时后H4细胞中可能产生的凋亡细胞。如图6B所示,检测不到MBCQ对于细胞周期分布的影响。
有人提出自噬有助于许多凋亡缺陷型细胞的死亡。例如,bax/bak双重缺陷小鼠胚胎成纤维细胞(DKO MEFs)对细胞凋亡有很高的抵抗力。(Wei,M.C,Zong,W.X.,Cheng,E.H.,Lindsten,T.,Panoutsakopoulou,V.,Ross,A.J.,Roth,K.A.,MacGregor,G.R.,Thompson,CB.,and Korsmeyer,S.J.(2001).Proapoptotic BAX and BAK:a requisite gateway to mitochondrialdysfunction and death.Science 292,727-730)。已知用依托泊甙刺激bax/bak DKO mefs细胞能部分通过自噬诱导诱导细胞死亡(Shimizu,S.,Kanaseki,T.,Mizushima,N.,Mizuta,T.,Arakawa-Kobayashi,S.,Thompson,CB.,and Tsujimoto,Y.(2004).Role of Bcl-2 familyproteins in a non-apoptotic programmed cell death dependent on autophagy genes.Nat Cell Biol6,1221-1228)。为了测试MBCQ是否能抑制依托泊甙诱导的bax/bak DKO细胞死亡,使用依托泊甙在MBCQ(10μM)存在的情况下处理bax/bak DKO细胞或用3-MA(10mM)处理8小时作为阳性对照。如图7A所示,MBCQ的存在能显著减少bax/bak DKO MEF细胞死亡。此外,与MBCQ抑制一致,依托泊甙处理过的细胞中LC3II的水平增加而有MBCQ存在时细胞中LC3II水平降低了。(图7B)。
实施例4:MBCQ选择性降低PI3P的细胞水平
由于MBCQ能抑制雷帕霉素和饥饿诱导的自噬,因此首先确定MBCQ是否能影响mTOR的活性。蛋白质印迹法分析证实了在对照或雷帕霉素处理过的细胞中,MBCQ对mTOR的磷酸化和其靶点p70S6K和S6没有影响。MBCQ对于GSK-3α/β的磷酸化同样也没有任何影响。由于AKT的磷酸化受I型PtdIns3(PI3)激酶的调节,这说明了MBCQ对I型PI3激酶没有影响。因此,结论是MBCQ对于mTOR通路或I型PI3激酶没有影响。
用EEA1作为标记物的免疫染色确定MBCQ对早期内体的影响,用Iamp2或Lysotracker作为标记物的免疫染色确定MBCQ对溶酶体的影响,用GaIT-YFP作为标记物的确定MBCQ对转运高尔基体的影响。在所有这些实验中都没有检测到MBCQ的影响。因此,结论是MBCQ不影响主要的细胞内细胞器。
此外,确定了MBCQ对使用pEGFP-CL1,短寿蛋白融合的GFP的蛋白酶体降解通路的影响(Bence,N.F.,Sampat,R.M.,and Kopito,R.R.(2001).Impairment of theubiquitin-proteasome system by protein aggregation.Science 292,1552-1555)。结果发现MBCQ并不影响pEGFP-CL1的水平,这表明MBCQ对于蛋白酶体通路总体没有影响(未显示数据)。此外,MBCQ的处理对聚泛素的总体水平也没有影响。因此,结论是MBCQ对于泛素-蛋白酶体降解通路总体没有影响。
已知PtdIns3P(PI3P)的水平在介导自噬中起关键作用(Levine,B.,and Klionsky,D.J.(2004).Development by self-digestion:molecular mechanisms and biological functions ofautophagy.Dev Cell 6,463-477)。为了确定MBCQ对PI3P是否有影响,使用了表达FYVE-RFP的H4细胞。FYVE能与PI3P特异结合并已广泛用作为PI3P细胞水平的标记物。(Gaullier,J.M.,Simonsen,A.,D′Arrigo,A.,Bremnes,B.,Stenmark,H.,and Aasland,R.(1998).FYVE fingers bind PtdIns(3)P.Nature 394,432-433)。有意思的是,MBCQ处理快速且有效地降低了基准H4细胞和雷帕霉素处理的H4细胞中的FYVE-RFP斑点水平,但同时通过蛋白质印迹法检测到的FYVE-RFP水平并没有发生变化(图8)。
为了进一步确定MBCQ对PtdIns3P细胞水平的影响,使用了脂质斑点印迹分析。提取细胞PtdIns种型并施用于聚偏二氟乙烯膜上。PtdIns3P的水平通过GST-PX域蛋白和抗GST抗体来检测。如图9所示,MBCQ和C43的处理选择性降低了基准细胞和雷帕霉素处理的细胞中PtdIns3P的细胞水平。综上所述,结论是MBCQ降低PtdIns3P的水平。
实施例5:MBCQ及其活性衍生物选择性促进Vps34复合物的降解
由于PtdIns磷酸化生成PtdIns3P是由III型PtdIns3激酶复合物,Vps34/Beclin1/p150引起,所以确定了MBCQ对Vps34复合物激酶活性的抑制活性。使用HA-Vps34/GFP-Beclin1转染293T细胞。用抗HA免疫沉淀的Vps34复合物与PtdIns在γ-32P-ATP存在的条件下共同培养。用薄层色谱法分析磷酸化产物并随后用放射自显影。如图10A所示,PtdIns的磷酸化被渥曼青霉素抑制但不受MBCQ抑制。因此,结论是MBCQ不是Vps34酶活性的直接抑制剂。
另一方面需要注意的是,MBCQ、C29或C43处理后的细胞中带标记的Beclin1和HA-Vps34的水平低于C82,无活性的类似物(图10B)。使用MBCQ、C29或C43的处理同样也降低了GFP-p150和Atg14L的水平而C82不能(图10C-D)。
同样发现MBCQ和C43能降低H4细胞和293T细胞的(图10F)内源性Beclin1、Vps34和Atg14L的水平(图10E),而已知的自噬抑制剂3-MA对H4细胞的内源性Beclin1没有影响(图10G)。
为了确定MBCQ和C43对内源性Beclin1的作用是否相似,在CHX存在的情况下使用MBCQ或C43处理293T细胞来抑制蛋白合成。与单用CHX相比,在MBCQ或C43处理细胞6小时后的Beclin1水平显著降低(图10E)。因此得出结论是MBCQ和C43都可以促进内源性Beclin1降解。
为了研究MBCQ和C43降低Vsp34复合物水平的机理,使用C43和蛋白酶体抑制剂MG132或NH4Cl处理293T细胞来抑制溶酶体降解。结果发现MG132的存在能抑制GFP-Beclin1的降低,但NH4Cl不能。以上结果表明C43通过蛋白酶体通路促进Beclin1的降解。因此得出结论:C43通过选择性促进包括Vps34/Beclin1/p150/Atg14L/UVRAG的III型PI3激酶复合物的降解来抑制自噬。
实施例6:MBCQ及其活性衍生物增强饥饿诱导的细胞凋亡
因为在代谢应激条件下,激活的自噬能支持细胞存活,因此测试化合物以确定其是否能促进饥饿状态下细胞的死亡。结果发现C43能降低无血清条件下的MDA-MB-231细胞的存活(图1IA)和无糖条件下的MCF-7细胞(图HB)的存活。蛋白质印迹分析结果表明C43处理在基准及无糖条件下抑制MCF-7细胞自噬。
此外发现C43在10%牛血清存在条件下抑制Bcap-37细胞(乳腺癌细胞株)的增殖(图11C)。此外,Mcap-37细胞在无糖条件下变的对C43高度敏感(图11D)。对照条件和无糖条件下培养的Bcap-37细胞的蛋白质印迹分析证实了C43处理在基准条件下和无糖条件下均抑制自噬。
为了研究C43诱导Bcap-37细胞死亡的机制,使用FACS分析DNA成分。结果发现在无糖条件下处理Bcap-37细胞诱导亚二倍体DNA的峰(图11E),其与凋亡的DNA碎片一致。此外,在无糖条件下C43处理6小时后的Bcap-37细胞中还检测到了PARP的分裂,一种细胞凋亡蛋白酶激活的特点(图11F)。另一种乳腺癌细胞株BT549证实了C43处理相似的反应。
与上述分析的癌细胞株相反,在无糖条件下使用spautin处理来源于马-达氏犬肾的MDCK细胞不诱导凋亡。当以10μM浓度的spautin处理48小时后仅观察到25%的生长抑制(图12A和12B)。Hs578Bst细胞(建立于肿瘤周围正常组织中且原始为肌上皮的)对Spautin也不敏感(图12C和12D)。这些结果与癌细胞比非癌症细胞在代谢应激增加的情况下对自噬抑制更敏感的可能性相一致。
已证明在细胞凋亡缺陷条件下增强自噬激活能介导细胞死亡。为了测试这种可能性,在spautin存在或不存在的情况下,用依托泊甙测试Bax-Bak双敲除(DKO)细胞来诱导DNA受损反应。结果发现C43、MBCQ和3-MA抑制依托泊甙诱导的Bax-BakDKO细胞死亡。
因此可得出结论:一组癌细胞可能对自噬抑制作用的敏感性具有选择性。
实施例7:MBCQ衍生物的体内活性
为了开始测试MBCQ衍生物的体内作用,研究了MBCQ衍生物在注射了雷帕霉素的小鼠体内抑制自噬的能力。以单独给药雷帕霉素(10mg/kg)的小鼠作为阳性对照,将C43或MBCQ(40mg/kg)注入小鼠腹膜,每小时注射一次并持续四小时,在第5小时的时候处死小鼠。之后用抗LC-3抗体通过蛋白质印迹法分析肝中的自噬水平。如图13A所示,C43或MBCQ给药后能显著降低LC3II的水平。因此,确定了C43和MBCQ在体内都具有抑制自噬的活性。
有人提出自噬有助于胰腺炎中的组织损伤,因此MBCQ衍生物被测试是否能够减轻蛙皮素注射诱导的组织损伤,这是一个得到广泛认可的胰腺炎动物模型(Hashimoto,D.,Ohmuraya,M.,Hirota,M.,Yamamoto,A.,Suyama,K.,Ida,S.,Okumura,Y.,Takahashi,E.,Kido,H.,Araki,K.,et al.(2008).Involvement of autophagy in trypsinogen activation within thepancreatic acinar cells.J Cell Biol 181,1065-1072;and Ohmuraya,M.,and Yamamura,K.(2008).Autophagy and acute pancreatitis:a novel autophagy theory for trypsinogen activation.Autophagy 4,1060-1062)。大鼠腹膜内单独注射蛙皮素(50ng/kg)或与C43(40mg/kg)一同注射,每小时一次,注射4次。大鼠在最后一次注射结束1小时后处死并分离胰腺用于蛋白质印迹分析。如图13B所示,报道的蛙皮素注射诱导自噬。与C43一同注射显著降低了蛙皮素注射诱导的自噬水平。综上所述,结论是C43有效降低蛙皮素诱导胰腺炎诱导的自噬。
实施例8:化合物的制备
以下方案1描述了通式I和通式II化合物合成的总体方法。
方案1
[1]第一步为喹唑啉-4-酮(或8-氮-喹唑啉-4-酮)的形成。
在一种方法中,邻氨基苯甲酸甲酯(或2-氨基烟酸甲酯)与甲酰胺以摩尔比1∶15-20的比例相混合,之后加热至约170-190℃。反应完成后,将混合物冷却、过滤、清洗和干燥。得到的粗产物不需加工可直接用于下一步的反应。
[2]第二步为4-氯喹唑啉(或8-氮-4-氯喹唑啉)的形成。
在一种方法中,将第一步得到的粗产物与磷酰氯以摩尔比1∶8.7-10的比例相混合,之后加热至约110-115℃。反应完成后,大约需10-12小时,将混合物冷却,通过旋转蒸发除去多余的磷酰氯。加入有机溶剂,例如二氯甲烷溶解固体,然后加入氨水将溶液的pH调至7-8。得到的混合物用二氯甲烷萃取,干燥并用色谱柱纯化。
在另一种方法中,将第一步得到的粗产物与亚硫酰二氯以摩尔比1∶15-20的比例混合后,其中含有催化剂量无水DMF(如0.5-1mL),加热至约80-90℃。反应完成后,约需10-12小时,将混合物冷却,通过旋转蒸发除去多余的亚硫酰二氯。加入有机溶剂,如二氯甲烷用于溶解固体,然后加入氨水将溶液的pH调至7-8。得到的混合物用二氯甲烷萃取,干燥并用色谱柱纯化。
在另一种方法中,将第一步得到的粗产物在氩气下与草酰氯相混合并逐滴滴入无水DMF,从而形成混合物,混合物的摩尔比例为:1∶1.5∶1.5(第一步产物∶草酰氯∶DMF),然后加热至约85-95℃。约7-10小时后用饱和的磷酸氢二钠终止反应。之后使用有机溶剂萃取反应混合物,所述有机溶剂如二氯甲烷,通过色谱柱。
[3]第三步为N-取代的-4-氨基-喹唑啉(或8-氮-N-取代的-4-氨基喹唑啉)的形成。
在充氩下,将第二步的反应产物,HXC(R2)(R3)(CH2)nZ(如本申请所定义的)和三乙胺以摩尔比1∶1.25∶1.68混合于有机溶剂中,例如四氢呋喃,并加热至约75-80℃。大约12-18个小时后通过旋转蒸发除去有机溶剂。获得的粗产物通过色谱柱纯化。
为了进一步说明,下列详细描述了化合物A9、A30和A36的合成。如上所述,其他化合物可以通过改变与任选的取代的4-氯喹唑啉偶联的胺来制备(如下面9-3所示)。
A9的制备
方案2
在冰浴氩气的条件下,将化合物9-1(500mg,2.65mmol)逐滴加入AgNO2的乙醚(5mL)悬液中(448.5mg,2.92mmol)。将混合物加热至室温并搅拌过夜。将反应混合物过滤,滤液在真空中浓缩。剩余物通过硅胶色谱(EA∶PE,1∶100)纯化得到三种化合物。通过1HNMR很难确定哪一种是所需的化合物9-2。
含有化合物9-2(150mg,0.967mmol,MCO449-41-2)和KOH(81.4mg,1.451mmol)和CH3CN/H2O的混合物在室温下搅拌2小时。在上述混合中加入一部分选择性氟试剂(Selectfluor)(514.0mg,1.451mmol)。混合物在室温下搅拌过夜。将反应混合物倒入水(10mL)中,用乙酸乙酯提取(20mL×2)。组合的有机物用盐水清洗(10mL)、MgSO4干燥、用硅胶色谱(PE)浓缩和纯化后得到无色油状的产物,化合物9-3(70mg,产率:42%)。
将Et3N(46μL,0.33mmol)加入含化合物9-3(50mg,0.27mmol)和(4-氯苯基)-甲胺(47mg,0.33mmol)的异丙醇(5mL)溶液中。溶液在150℃微波20分钟。TLC显示反应完成。混合物通过快速色谱法浓缩和纯化,得到淡黄色的油状产物,A9(52mg,产率:67%,经1HNMR和LC-MS鉴定)。1HNMR的结果如图23所示。
A30的制备
方案3
将含有化合物9-3(105mg,0.573mmol)、30-9(94mg,0.573mmol)和NEt3(0.22mL,1.64mmol)的异丙醇溶液(4mL)于150℃条件下微波20分钟。通过色谱柱浓缩和纯化得到黄色固体,A30(80mg,产率:45%,经1HNMR鉴定)。1HNMR的结果如图24所示。
A36的制备
方案4
将含有化合物36-1(1.0g,5.3mmol)和NaCN(520mg,10.6mmol)的DMSO溶液(10mL)于30℃条件下搅拌过夜。TLC显示反应完成。用水(30mL)稀释混合物并用乙酸乙酯(50mL)萃取。有机溶液层用水(10mL×5)和NaHCOs(饱和的,20mL)清洗,用无水Na2SO4干燥和浓缩。剩余物用快速色谱法纯化后得到无色的油状产物,36-2(360mg,产率:50%)。
将雷尼镍加入含有化合物36-2(346mg,2.56mmol)的THF(10mL)中。之后用浓缩氨水调节混合物pH至10并于30℃条件下搅拌过夜。TLC显示反应完成。混合物用西莱特过滤,滤液浓缩后得到黄色油状产物36-3(120mg,产率:34%)。
将Et3N(46μL,0.33mmol)加入含化合物9-3(50mg,0.27mmol)和36-3(46mg,0.33mmol)的异丙醇(5mL)溶液中。溶液在150℃微波20分钟。TLC显示反应完成。通过快速色谱法浓缩和纯化得到白色固体,A36(48.4mg,产率:63%,经二甲亚砜中400MHZ 1HNMR和MS鉴定)。1HNMR如图25所示。
实施例9:区分自噬抑制活性和PDE5抑制活性
研究MBCQ衍生物的结构活性关系(SAR)来确定其抑制自噬的活性能够与抑制PDE5的活性区分开。在已合成且其自噬抑制活性已分析过的MBCQ衍生物中,如上所述,一些化合物显示出与MBCQ相近或是高于MBCQ的活性,而其他化合物没有抑制自噬的活性,因此其可用作阴性对照。
有研究挑选了14种MBCQ衍生物并筛选它们对PDE5的活性(Wang,H.,Yan,Z.,Yang,S.,Cai,J.,Robinson,H.,and Ke,H.(2008).Kinetic and structural studies ofphosphodiesterase-8A and implication on the inhibitor selectivity.Biochemistry 47,12760-12768)。其中发现IC50为0.87μM与MBCQ相近的有效的自噬抑制剂C43(6-氟-N-(4-氟苯基)喹唑啉-4-胺)对PDE5和其他PDED的抑制活性大大的降低了。因此MBCQ对PDE5的抑制活性能与MBCQ抑制自噬的活性化学区分。
表1 PDE5活性抑制百分比测定结果
与结论一致的是,生物活性库中经筛选有许多其它已知的PDE5抑制剂,包括MY-5445、双嘧达莫、IBMX和昔多芬,但它们并不是以自噬抑制剂回收。为了进一步确认该结论,用雷帕霉素与其他PDE5抑制剂包括MY-5445(30μM)、双嘧达莫(80μM)和IBMX(100μM)或昔多芬,但它们并不是以自噬抑制剂回收。为了进一步确认该结论,用雷帕霉素与其他PDE5抑(10μM)处理H4-LC3-GFP细胞,以MBCQ作为阳性对照。测试的PDE5抑制剂包括对PDE5的EC50为2.5nM,最有效的抑制剂昔多芬(伟哥)对自噬都没有任何活性。根据这些数据可以得出结论MBCQ抑制自噬的活性与它抑制PDE5的活性无关。
实施例10:去泛素化蛋白酶复合物鉴别Vps34复合物I
泛素化代表介导蛋白酶体降解中的必要关键步骤。因此进行实验以确定C43处理的细胞中的Beclin1的泛素化是否有增加。如图16所示,C43提高Beclin1的泛素化。
因此假设C43靶向去泛素化蛋白酶复合物(DUB),所述复合物的正常功能为负调节Vps34复合物I的泛素化。这与通常的发现时一致的,即小分子物质更有可能是抑制剂而不是激活剂。为了直接测试以上的假设,在一组127个来自Dharmacon library SMART pools的靶向人去泛素化酶的siRNA中筛选DUB。当LC3-GFP-H4细胞作为分析物时,敲除引起自噬抑制。
将SiPLK1用于确认转染活性,且包括siVps34作为阳性对照。转染72小时后,分别重复使用DMSO和雷帕霉素(200nM)诱导自噬,或者使用雷帕霉素溶液(200nM)和Spautin(10μM)再处理8小时。用Hoechst33342(0.5μM)复染色细胞并用3.8%PFA固定。用CellWoRx高容量细胞分析系统拍摄荧光图片和进行量化。
筛选得到了USP10、USP13、USP3、USP16和USP18五个基因,这些基因被敲除后引起基准条件下和雷帕霉素存在下的自噬水平下降,比检测中间值至少降低1.5个标准误差值。分析了敲除这五个USP基因对H4细胞中Vps34复合物的蛋白表达水平的影响。结果发现这五个USP基因中任何一个被敲除都会降低内源性Vps34、Beclin1、Atg14L和UVRAG的水平(图17)。此外,敲除这五个USP基因中任何一个都会引起其他四个USP基因蛋白表达水平降低(图18)。有意思的是C43处理也能降低这五个USP基因的水平(图18)。Spautin处理也能降低293T细胞和Bcap-37细胞中USP13和USP10的水平,但对于USP44(无关的USP基因)的水平几乎没有影响。
这些结果表明如果USP3、USP10、USP13、USP16和USP18都存在于一个大的复合物中,那么它们的稳定是相互依赖是可能的。为了测试上述可能性,将GFP-USP10和Myc-USP13质粒转染至293T细胞并通过GFP-USP10的交互作用和Myc-USP13的免疫沉淀进行检测。结果发现GFP-USP10和Myc-USP13确实能相互作用,重要的是在spautin处理过的细胞中这种相互作用被抑制(图19)。因此,结论是spautin能中断USP10和USP13的相互作用,而该相互作用可能是适当靶向去泛素化蛋白酶复合物从而调节Vps34复合物泛素化状态所必需的。
已知USP10是p53的DUB,因此还研究了敲除这些USP基因对p53的影响。结果发现敲除这五个USP基因中的任何一个都能导致p53降低(图20)。这些数据表明USP3、USP10、USP13、USP16和USP18都是p53的调节物。
为了进一步证实USP10和USP13是Vps34复合物的去泛素化蛋白酶,通过免疫沉淀分析Flag-USP10/GFP-Beclin1和Myc-USP13/GFP-Beclin1在293T细胞中的相互作用。结果发现Flag-USP10和Myc-USP13都能与GFP-Beclin1相互作用;且有意思的是,spautin处理能削弱Flag-USP10和GFP-Beclin1的相互作用(图21A),但不能削弱Myc-USP13和GFP-Beclin1的相互作用(图21B)。这些结果表明spautin可能靶向USP10上游从而阻断USP10和Beclin1的相互作用。重要的是,Beclin1或Vps34敲除发现能降低USP10和p53的内源性水平,其已知是USP10的底物(图21C)。这表明Vps34复合物可以通过稳定它的去泛素化蛋白酶,包括USP10和USP13来调节自我的水平。此外,这为解释Beclin1在许多种癌症中常常缺失的原因提供了机理,即Beclin1的缺失会通过抑制它的泛素化蛋白酶从减少p53。
参考并入
本申请引用的所有美国专利和公开的美国专利申请在此参考并入。
等同物
虽然本申请描述和阐释了多个本发明的实施例,但是本领域的普通技术人员能够很容易的想到许多其他方法和/或者结构以实现所述功能和/或者获得所述结果和/或者一项或多项本申请描述的优点,且这些变化和/或者修饰仍属于本发明的范围内。更概括的讲,本领域的普通技术人员应当容易的理解到本申请中描述的所有参数、尺度、材料和构造是为了用于示例,且具体的参数、尺度、材料和/或者构造都取决于具体的应用,本发明已做了教导。本领域的普通技术人员在通过更多常规实验的条件下将认识到或能够确定很多本发明描述的具体实施例等同物。因此,需要了解的是前述实施例只通过示例的方式呈现,在所附权利要求书及其等同物范围内,本发明可以通过具体描述或要求外的方式实施。本发明指本申请所述的每个单独的特征、系统、条款、材料、试剂盒和/或者方法。此外,如果这些特征、系统、条款、材料、试剂盒和/或者方法不相互矛盾,则任意两种或多种这些特征、系统、条款、材料、试剂盒和/或者方法的组合属于本发明的范围内。
Claims (57)
1.通式I表示的化合物:
或其可药用的盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或立体异构体,其中
n为0、1、2、3、或4;
Y为-C(R1)=或-N=;
R为-H、低级烷基、-CH3、低级氟代烷基、-CH2F、-CHF2、-CF3、-NO2、-OH、-NH2、-NH(低级烷基)、-N(低级烷基)2、或低级炔基;
R1每次出现均独立的选自下组基团:-H、-F、-Cl、-Br、-I、-NO2、-OH、-NH2、-NH(低级烷基)、-N(低级烷基)2、-CH3、-CF3、-C(=O)(低级烷基)、-CN,-O(低级烷基)、-O(低级氟代烷基)、-S(=O)(低级烷基)、-S(=O)2(低级烷基)和-C(=O)O(低级烷基);
R2和R3独立的选自下组基团:-H、低级烷基、低级氟代烷基、低级炔基和羟基烷基;
X为-O-、-S-、-N(H)-、-N(低级烷基)-、-CH2-、-CH2CH2-、-CH2CH2CH2-、-CH2CH2CH2CH2-、-CH2CH2CH2CH2CH2-或-CH2CH2CH2CH2CH2CH2-;以及
Z为苯基、吡啶基、乙烯基、吗啡基、邻二氮杂菲铁基、萘基、呋喃基或苯并噻唑基;并且任选地被一个或多个选自下组的取代基取代:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲二氧基。条件是所述化合物不是
2.根据权利要求1所述的化合物,其中Y为-C(R1)=。
3.根据权利要求1所述的化合物,其中n为Y为-N=。
4.根据权利要求1-3任一所述的化合物,其中R为-H。
5.根据权利要求1-4任一所述的化合物,其中至少一个R1为-NH2、-Cl、-NO2、-I或-OMe。
6.根据权利要求1-5任一所述的化合物,其中至少一个R1为-NH2、-Cl、-NO2、-I或-OMe;并且至少两个R1为-H。
7.根据权利要求1-6任一所述的化合物,其中R2为-CH3。
8.根据权利要求1-6任一所述的化合物,其中R2为-H。
9.根据权利要求1-8任一所述的化合物,其中R3为-CH3。
10.根据权利要求1-8任一所述的化合物,其中R3为-H。
11.根据权利要求1-10任一所述的化合物,其中X为-O-、-S-、-N(H)-、-N(低级烷基)-或-CH2-。
12.根据权利要求1-10任一所述的化合物,其中X为-N(H)-或-N(低级烷基)-。
13.根据权利要求1-10任一所述的化合物,其中X为-N(H)-。
14.根据权利要求1-13任一所述的化合物,其中Z为任选地被选自下组的一个或多个取代基取代的苯基:-CH3、低级烷基、氟代烷基、-OCH3、-OCF3、低级氟代烷氧基、-F、-Cl、-Br、-I、-NO2、低级烷氧基、-NH(低级烷基)、-N(低级烷基)2、-CF3和3,4-亚甲基二氧基。
15.通式II表示的化合物:
或其可药用的盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或立体异构体,其中
n为0、1、或2;
Y为-C(R1)=或-N=;
R为-H、低级烷基、-CH3、低级氟代烷基、-CH2F、-CHF2、或-CF3;
R1每次出现均独立的选自下组基团:-H、-CH3、-F、-Cl、-Br、-I或-NO2;
R2和R3独立的选自下组基团:-H、-CH3、-CH2CH3、-CH2CH2CH3或-CH(CH3)2;
R4、R5和R8独立的选自下组基团:-H、-CH3、-CF3、-OCH3、-OCF3、-F、-Cl、-Br或-I;以及
R6和R7独立的选自下组基团:-H、-CH3、-CF3、-OCH3、-OCF3、-F、-Cl、-Br或-I;或者R6和R7一起为-OCH2O-;
条件是所述化合物不是
16.根据权利要求15所述的化合物,其中Y为-C(R1)=。
17.根据权利要求15所述的化合物,其中Y为-N=。
18.根据权利要求15-17任一所述的化合物,其中n为R为-H、-CH3、-CH2F、-CHF2或-CF3。
19.根据权利要求15-17任一所述的化合物,其中R为H。
20.根据权利要求15-17任一所述的化合物,其中R为-CH2F、-CHF2或-CF3。
21.根据权利要求15-18任一所述的化合物,其中R1为-F、-Cl、-Br或-I。
22.根据权利要求15-18任一所述的化合物,其中R1为-CH3。
23.根据权利要求15-18任一所述的化合物,其中R1为-NO2。
24.根据权利要求15-23任一所述的化合物,其中R2为-H。
25.根据权利要求15-23任一所述的化合物,其中R2为-CH3。
26.根据权利要求15-25任一所述的化合物,其中R3为-H。
27.根据权利要求15-25任一所述的化合物,其中R3为-CH3。
28.根据权利要求15-27任一所述的化合物,其中R4为-H。
29.根据权利要求15-27任一所述的化合物,其中R4为-F、-Cl、-CH3或-OCH3。
30.根据权利要求15-29任一所述的化合物,其中R5为-H。
31.根据权利要求15-29任一所述的化合物,其中R5为-F、-Cl、-CH3或-CF3。
32.根据权利要求15-31任一所述的化合物,其中R6为-H。
33.根据权利要求15-31任一所述的化合物,其中R6为-F、-Cl或-Br。
34.根据权利要求15-31任一所述的化合物,其中R6为-CH3或-CF3。
35.根据权利要求15-31任一所述的化合物,其中R6为-OCH3或-OCF3。
36.根据权利要求15-31任一所述的化合物,其中R6和R7一起为-OCH2O-。
37.根据权利要求15-36任一所述的化合物,其中R7为-H。
38.根据权利要求15-37任一所述的化合物,其中R8为-H。
40.一种药物组合物包括权利要求1-39任一所述的化合物,或者其可药用的盐、生物活性代谢物、溶剂化物、水合物、前药、对映异构体或立体异构体;以及可药用的稀释剂或载体。
41.一种治疗癌症、胰腺炎、神经退行性疾病、炎症性疾病、感染疾病或细胞内病原体引起的感染的方法,包括将有效治疗剂量的一种或多种权利要求书1-39任一所述的化合物,或权利要求40所述的药物组合物给药至需要的主体的步骤。
42.根据权利要求41所述的方法,其中所述方法用于治疗癌症。
43.根据权利要求42所述的方法,其中所述癌症选自下组:白血病、非小细胞肺癌、结肠癌、中枢神经系统癌症、黑素瘤、卵巢癌、肾癌、前列腺癌和乳腺癌。
44.根据权利要求41所述的方法,其中所述方法用于治疗胰腺炎。
45.根据权利要求41所述的方法,其中所述方法用于治疗神经退行性疾病。
46.根据权利要求41所述的方法,其中所述方法治疗的神经退行性状况选自下组:血管性痴呆、早老性痴呆、唐氏综合症中的神经退化和爱滋病相关的痴呆。
47.根据权利要求41所述的方法,其中所述方法用于治疗神经退行性疾病;并且所述方法提高患有所述神经退行性状况的所述主体的认知能力或阻止认知减退。
48.根据权利要求41所述的方法,其中所述方法用于治疗细胞内病原体引起的感染。
49.根据权利要求48所述的方法,其中所述感染是由细菌或病毒引起的。
50.根据权利要求41-49任一所述的方法,进一步包括给药至少一种附加的治疗剂。
51.根据权利要求50所述的方法,其中所述至少一种附加的治疗剂与所述的一种或多种权利要求1-39任一所述的化合物,或权利要求40所述的药物组合物同时给药。
52.根据权利要求50所述的方法,其中所述至少一种附加的治疗剂与所述的一种或多种权利要求1-39任一所述的化合物,或权利要求40所述的药物组合物相继给药。
53.根据权利要求51或权利要求52所述的方法,其中所述至少一种附加的治疗剂是抗血管生成剂。
55.根据权利要求51或权利要求52所述的方法,其中所述至少一种附加的治疗剂是抗癌化合物,所述抗癌药物将糖酵解依赖癌转换成糖酵解障碍细胞。
56.根据权利要求55所述的方法,其中将糖酵解依赖癌转换成糖酵解障碍细胞的所述抗癌化合物选自下组:白消安、顺铂、卡铂、苯丁酸氮芥、环磷酰胺、异环磷酰胺、达卡巴嗪(DTIC)、二氯甲基二乙胺(氮芥)、美法仑、卡莫司汀(BCNU)、洛莫司汀(CCNU)、更生霉素、柔红霉素、多柔霉素(亚德里亚霉素)、伊达比星、米托蒽醌、强的松、地塞米松、他莫昔芬、氟维司群、阿那曲唑、来曲唑、醋酸甲地孕酮、比卡鲁胺、氟他胺,亮丙瑞林、戈舍瑞林、格列卫、易瑞沙、塔西法、赫赛汀、阿瓦斯丁、左旋天冬酰胺酶和维甲酸。
57.一种使去泛素化蛋白酶复合物失活的方法,包括使所述去泛素化蛋白酶复合物与一种或多种权利要求1-39任一所述的化合物相接触;其中所述去泛素化蛋白酶复合物包括USP3、USP10、USP13、USP16和USP18。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US22716409P | 2009-07-21 | 2009-07-21 | |
| US61/227,164 | 2009-07-21 | ||
| US29673510P | 2010-01-20 | 2010-01-20 | |
| US61/296,735 | 2010-01-20 | ||
| PCT/US2010/042759 WO2011011522A2 (en) | 2009-07-21 | 2010-07-21 | Potent small molecule inhibitors of autophagy, and methods of use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102574816A true CN102574816A (zh) | 2012-07-11 |
Family
ID=42829077
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2010800332736A Pending CN102574816A (zh) | 2009-07-21 | 2010-07-21 | 有效的小分子自噬抑制剂及其使用方法 |
Country Status (18)
| Country | Link |
|---|---|
| US (1) | US20120258975A1 (zh) |
| EP (1) | EP2456761A2 (zh) |
| JP (1) | JP2013500255A (zh) |
| KR (1) | KR20120100886A (zh) |
| CN (1) | CN102574816A (zh) |
| AU (1) | AU2010276223A1 (zh) |
| BR (1) | BR112012001316A2 (zh) |
| CA (1) | CA2767772A1 (zh) |
| CL (1) | CL2012000163A1 (zh) |
| IL (1) | IL217502A0 (zh) |
| IN (1) | IN2012DN01478A (zh) |
| MX (1) | MX2012000940A (zh) |
| PE (1) | PE20120798A1 (zh) |
| PH (1) | PH12012500097A1 (zh) |
| RU (1) | RU2012105914A (zh) |
| SG (1) | SG177486A1 (zh) |
| WO (1) | WO2011011522A2 (zh) |
| ZA (1) | ZA201201224B (zh) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104164471A (zh) * | 2013-11-04 | 2014-11-26 | 复旦大学 | 基于细胞自噬的抗肿瘤药物的筛选方法 |
| CN107835688A (zh) * | 2015-05-08 | 2018-03-23 | 得克萨斯州大学系统董事会 | 用于治疗阿尔茨海默病的神经元钙池操纵的钙进入途径的活化 |
| WO2018214813A1 (zh) * | 2017-05-22 | 2018-11-29 | 苏州偶领生物医药有限公司 | 一种共价键修饰哺乳动物atg8同源物的方法 |
| CN109721554A (zh) * | 2019-01-08 | 2019-05-07 | 贵州大学 | 一类4-氨基喹唑啉类化合物及其制备方法和应用 |
| CN111304230A (zh) * | 2013-07-26 | 2020-06-19 | 哈佛大学校长及研究员协会 | 基因组工程 |
| CN112608302A (zh) * | 2020-12-28 | 2021-04-06 | 郑州大学第一附属医院 | 低氧还原激活靶向泛素化降解egfr蛋白的喹唑啉类衍生物及其应用 |
| CN114258318A (zh) * | 2019-06-17 | 2022-03-29 | 德西费拉制药有限责任公司 | 氨基嘧啶酰胺自噬抑制剂及其使用方法 |
| US12071432B2 (en) | 2019-05-10 | 2024-08-27 | Deciphera Pharmaceuticals, Llc | Phenylaminopyrimidine amide autophagy inhibitors and methods of use thereof |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2475378B1 (en) | 2009-09-10 | 2019-07-24 | Mayo Foundation For Medical Education And Research | USP10 modulation for use in the treatment of cancer |
| US8598344B2 (en) * | 2009-11-30 | 2013-12-03 | Senex Biotechnology | CDKI pathway inhibitors and uses thereof |
| EA023998B1 (ru) | 2011-03-04 | 2016-08-31 | Глэксосмитклайн Интеллекчуал Проперти Дивелопмент Лимитед | Аминохинолины в качестве ингибиторов киназ |
| TWI547494B (zh) | 2011-08-18 | 2016-09-01 | 葛蘭素史克智慧財產發展有限公司 | 作為激酶抑制劑之胺基喹唑啉類 |
| SG11201401343YA (en) * | 2011-09-13 | 2014-08-28 | Igor Roninson | TREATMENT OF DISEASE OR DISORDERS CAUSED BY INDUCED NFkB TRANSCRIPTIONAL ACTIVITY |
| AR092529A1 (es) | 2012-09-13 | 2015-04-22 | Glaxosmithkline Llc | Compuesto de aminoquinazolina, composicion farmaceutica que lo comprende y uso de dicho compuesto para la preparacion de un medicamento |
| CA2896731A1 (en) * | 2012-12-28 | 2014-07-03 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Inhibitors of the usp1/uaf1 deubiquitinase complex and uses thereof |
| CN104968200B (zh) | 2013-02-01 | 2018-03-06 | 维尔斯达医疗公司 | 具有抗炎、抗真菌、抗寄生物和抗癌活性的胺化合物 |
| JP6301374B2 (ja) | 2013-02-21 | 2018-03-28 | グラクソスミスクライン、インテレクチュアル、プロパティー、ディベロップメント、リミテッドGlaxosmithkline Intellectual Property Development Limited | キナーゼ阻害剤としてのキナゾリン類 |
| WO2014134169A1 (en) * | 2013-02-26 | 2014-09-04 | Senex Biotechnology, Inc. | Inhibitors of cdk8/19 for use in treating estrogen receptor positive breast cancer |
| US9393244B2 (en) | 2013-03-15 | 2016-07-19 | Georgetown University | Increasing parkin activity by administering a deubiquitinating enzyme inhibitor |
| WO2014145512A2 (en) * | 2013-03-15 | 2014-09-18 | President And Fellows Of Harvard College | Potent small molecule inhibitors of autophagy, and methods of use thereof |
| JP2016517439A (ja) * | 2013-03-15 | 2016-06-16 | ザ ボード オブ トラスティーズ オブ ザ レランド スタンフォード ジュニア ユニバーシティー | 医学的状態の治療のためのクロマチン修飾因子の標的化 |
| KR20180086187A (ko) * | 2015-10-05 | 2018-07-30 | 더 트러스티이스 오브 콜롬비아 유니버시티 인 더 시티 오브 뉴욕 | 자가포식 유동의 활성체 및 포스포리파제 d 및 타우를 포함하는 단백질 응집물의 클리어런스 및 단백질질환의 치료 |
| EP3184514A1 (en) * | 2015-12-23 | 2017-06-28 | Deutsches Krebsforschungszentrum | Autophagy inhibitors |
| GB201700814D0 (en) * | 2017-01-17 | 2017-03-01 | Liverpool School Tropical Medicine | Compounds |
| CN112566906A (zh) | 2018-07-26 | 2021-03-26 | 多曼治疗学公司 | 取代的喹唑啉酮衍生物和它们作为mglur4的正变构调节剂的用途 |
| US20210215710A1 (en) * | 2019-12-23 | 2021-07-15 | University Health Network | Methods for use of cdx2 as a biomarker to guide use of autophagy inhibitors in ovarian cancer |
| KR20230004456A (ko) | 2020-03-04 | 2023-01-06 | 리제너론 파아마슈티컬스, 인크. | 면역 요법에 대한 종양 세포의 감작화를 위한 방법 및 조성물 |
| WO2022187411A1 (en) * | 2021-03-02 | 2022-09-09 | Kumquat Biosciences Inc. | Heterocycles and uses thereof |
| WO2023034411A1 (en) | 2021-09-01 | 2023-03-09 | Oerth Bio Llc | Compositions and methods for targeted degradation of proteins in a plant cell |
| CN114224895B (zh) * | 2022-01-06 | 2023-06-30 | 山东农业大学 | 3-甲基腺嘌呤在清除牛乳腺上皮细胞内无乳链球菌中的应用 |
| AU2023255692A1 (en) | 2022-04-20 | 2024-10-03 | Kumquat Biosciences Inc. | Macrocyclic heterocycles and uses thereof |
| CN116179494B (zh) * | 2022-10-13 | 2024-01-26 | 武汉生物制品研究所有限责任公司 | 低成瘤性的mdck细胞株及其构建方法和应用 |
| DE102022131212A1 (de) | 2022-11-25 | 2024-05-29 | Dr. Ing. H.C. F. Porsche Aktiengesellschaft | Luftzufuhrvorrichtung einer Kraftfahrzeugkarosserie eines Kraftfahrzeugs |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS542325A (en) * | 1977-06-07 | 1979-01-09 | Sankyo Co Ltd | Agricultural and horticultural pesticide |
| JPS542327A (en) * | 1977-06-07 | 1979-01-09 | Sankyo Co Ltd | Agricultural and horticultural pesticide |
| IL89027A (en) * | 1988-01-29 | 1993-01-31 | Lilly Co Eli | Quinazoline derivatives, process for their preparation and fungicidal, insecticidal and miticidal compositions containing them |
| GT198900008A (es) * | 1988-01-29 | 1990-07-17 | Derivados de quinolina, quinazolina y cinolina. | |
| US5034393A (en) * | 1989-07-27 | 1991-07-23 | Dowelanco | Fungicidal use of pyridopyrimidine, pteridine, pyrimidopyrimidine, pyrimidopyridazine, and pyrimido-1,2,4-triazine derivatives |
| US5227387A (en) * | 1991-09-03 | 1993-07-13 | Dowelanco | Quinoline nematicidal method |
| PT100905A (pt) * | 1991-09-30 | 1994-02-28 | Eisai Co Ltd | Compostos heterociclicos azotados biciclicos contendo aneis de benzeno, ciclo-hexano ou piridina e de pirimidina, piridina ou imidazol substituidos e composicoes farmaceuticas que os contem |
| US6046206A (en) * | 1995-06-07 | 2000-04-04 | Cell Pathways, Inc. | Method of treating a patient having a precancerous lesions with amide quinazoline derivatives |
| US6262059B1 (en) * | 1995-06-07 | 2001-07-17 | Cell Pathways, Inc. | Method of treating a patient having precancerous lesions with quinazoline derivatives |
| DE10042060A1 (de) * | 2000-08-26 | 2002-03-07 | Boehringer Ingelheim Pharma | Bicyclische Heterocyclen, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| AU2003207291A1 (en) * | 2002-02-06 | 2003-09-02 | Ube Industries, Ltd. | Process for producing 4-aminoquinazoline compound |
| JP2004059454A (ja) * | 2002-07-25 | 2004-02-26 | Japan Energy Corp | キナゾリン誘導体及びNF−κB活性化阻害剤 |
| US7388014B2 (en) * | 2004-02-19 | 2008-06-17 | Rexahn Pharmaceuticals, Inc. | Quinazoline derivatives and therapeutic use thereof |
| JP2008526734A (ja) * | 2004-12-31 | 2008-07-24 | エスケー ケミカルズ カンパニー リミテッド | 糖尿及び肥満治療予防に有効なキナゾリン誘導体 |
| CA2595156A1 (en) | 2005-01-19 | 2006-07-27 | The Trustees Of The University Of Pennsylvania | Regulation of autophagy and cell survival |
| WO2008122038A1 (en) * | 2007-04-02 | 2008-10-09 | President And Fellows Of Harvard College | Regulating autophagy |
| US8039502B2 (en) | 2007-07-24 | 2011-10-18 | The Ohio State University Research Foundation | Anti-infective agents against intracellular pathogens |
-
2010
- 2010-01-13 PH PH12012500097A patent/PH12012500097A1/en unknown
- 2010-07-21 WO PCT/US2010/042759 patent/WO2011011522A2/en active Application Filing
- 2010-07-21 IN IN1478DEN2012 patent/IN2012DN01478A/en unknown
- 2010-07-21 CN CN2010800332736A patent/CN102574816A/zh active Pending
- 2010-07-21 MX MX2012000940A patent/MX2012000940A/es not_active Application Discontinuation
- 2010-07-21 RU RU2012105914/04A patent/RU2012105914A/ru not_active Application Discontinuation
- 2010-07-21 PE PE2012000085A patent/PE20120798A1/es not_active Application Discontinuation
- 2010-07-21 SG SG2012000253A patent/SG177486A1/en unknown
- 2010-07-21 US US13/382,572 patent/US20120258975A1/en not_active Abandoned
- 2010-07-21 KR KR1020127004431A patent/KR20120100886A/ko not_active Application Discontinuation
- 2010-07-21 BR BR112012001316A patent/BR112012001316A2/pt not_active IP Right Cessation
- 2010-07-21 JP JP2012521755A patent/JP2013500255A/ja active Pending
- 2010-07-21 AU AU2010276223A patent/AU2010276223A1/en not_active Abandoned
- 2010-07-21 EP EP10737435A patent/EP2456761A2/en not_active Withdrawn
- 2010-07-21 CA CA2767772A patent/CA2767772A1/en not_active Abandoned
-
2012
- 2012-01-12 IL IL217502A patent/IL217502A0/en unknown
- 2012-01-20 CL CL2012000163A patent/CL2012000163A1/es unknown
- 2012-02-17 ZA ZA2012/01224A patent/ZA201201224B/en unknown
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111304230A (zh) * | 2013-07-26 | 2020-06-19 | 哈佛大学校长及研究员协会 | 基因组工程 |
| CN104164471A (zh) * | 2013-11-04 | 2014-11-26 | 复旦大学 | 基于细胞自噬的抗肿瘤药物的筛选方法 |
| CN107835688A (zh) * | 2015-05-08 | 2018-03-23 | 得克萨斯州大学系统董事会 | 用于治疗阿尔茨海默病的神经元钙池操纵的钙进入途径的活化 |
| WO2018214813A1 (zh) * | 2017-05-22 | 2018-11-29 | 苏州偶领生物医药有限公司 | 一种共价键修饰哺乳动物atg8同源物的方法 |
| US20200069609A1 (en) * | 2017-05-22 | 2020-03-05 | Wigen Biomedicine Technology (shanghai) Co., Ltd. | Method for covalent bond modifying mammalian atg8 homologue |
| CN110933932A (zh) * | 2017-05-22 | 2020-03-27 | 微境生物医药科技(上海)有限公司 | 一种共价键修饰哺乳动物atg8同源物的方法 |
| CN109721554A (zh) * | 2019-01-08 | 2019-05-07 | 贵州大学 | 一类4-氨基喹唑啉类化合物及其制备方法和应用 |
| US12071432B2 (en) | 2019-05-10 | 2024-08-27 | Deciphera Pharmaceuticals, Llc | Phenylaminopyrimidine amide autophagy inhibitors and methods of use thereof |
| CN114258318A (zh) * | 2019-06-17 | 2022-03-29 | 德西费拉制药有限责任公司 | 氨基嘧啶酰胺自噬抑制剂及其使用方法 |
| CN112608302A (zh) * | 2020-12-28 | 2021-04-06 | 郑州大学第一附属医院 | 低氧还原激活靶向泛素化降解egfr蛋白的喹唑啉类衍生物及其应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| BR112012001316A2 (pt) | 2017-08-08 |
| CL2012000163A1 (es) | 2012-07-13 |
| CA2767772A1 (en) | 2011-01-27 |
| KR20120100886A (ko) | 2012-09-12 |
| US20120258975A1 (en) | 2012-10-11 |
| SG177486A1 (en) | 2012-02-28 |
| MX2012000940A (es) | 2012-05-08 |
| IL217502A0 (en) | 2012-02-29 |
| AU2010276223A1 (en) | 2012-03-08 |
| WO2011011522A2 (en) | 2011-01-27 |
| ZA201201224B (en) | 2012-10-31 |
| WO2011011522A3 (en) | 2011-08-25 |
| JP2013500255A (ja) | 2013-01-07 |
| PE20120798A1 (es) | 2012-07-27 |
| RU2012105914A (ru) | 2013-08-27 |
| IN2012DN01478A (zh) | 2015-06-05 |
| EP2456761A2 (en) | 2012-05-30 |
| PH12012500097A1 (en) | 2011-01-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102574816A (zh) | 有效的小分子自噬抑制剂及其使用方法 | |
| US9718787B2 (en) | Poly (ADP-ribose) polymerase inhibitor | |
| JP2013500255A5 (zh) | ||
| US20190169195A1 (en) | Bet protein degraders | |
| EP2809324B1 (en) | Cdk8/cdk19 selective inhibitors and their use in anti-metastatic and chemopreventive methods for cancer | |
| US9382232B2 (en) | Quinoline and cinnoline derivatives and their applications | |
| CN103080092B (zh) | 吡唑并喹啉类化合物 | |
| EP1505068A1 (en) | PYRAZOLO (1,5-a) PYRIMIDINE DERIVATIVE AND NAD(P)H OXIDASE INHIBITOR CONTAINING THE SAME | |
| WO2010139180A1 (zh) | 作为蛋白激酶抑制剂和组蛋白去乙酰化酶抑制剂的萘酰胺衍生物、其制备方法及应用 | |
| CN101189239A (zh) | 蛋白激酶抑制剂 | |
| US9249106B2 (en) | Substituted hydrazide compounds and use thereof | |
| KR20210027382A (ko) | 접히지 않은 단백질 반응의 활성화제 | |
| CN102066367A (zh) | 噻唑基哌啶衍生物 | |
| CN107530304A (zh) | Olig2活性的抑制 | |
| CN115666561A (zh) | Cns的增殖性疾病的治疗 | |
| Liu et al. | Discovery of novel tacrine derivatives as potent antiproliferative agents with CDKs inhibitory property | |
| US20160311795A1 (en) | Pyrimidine diamine derivatives as inhibitors of cytosolic hsp90 | |
| US20080200433A1 (en) | Molecular Chaperone Function Regulator | |
| US20200147039A1 (en) | Compounds useful in inhibiting human trefoil factor 3 | |
| US20230241025A1 (en) | Antiviral use of fabp4 modulating compounds | |
| US20230255933A1 (en) | Antiviral use of fabp4 modulating compounds | |
| US20230000876A1 (en) | Treating cancers with a cyclin-dependent kinase inhibitor | |
| US10058618B2 (en) | PAK1-blocking 1,2,3-triazolyl esters | |
| CN107011337B (zh) | N-[5-(1,2,4-三唑-1-基)噻唑-2-基]哌啶基酰胺及其医药用途 | |
| CN102134246A (zh) | 一种埃博霉素衍生物及其制备和药物应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1171232 Country of ref document: HK |
|
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20120711 |
|
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: WD Ref document number: 1171232 Country of ref document: HK |