PEDIDOS RELACIONADOS
[001] Este pedido reivindica prioridade ao Pedido Provisório U.S. de N° de Série 61/012.411, depositado em Dezembro de 2007, Pedido Provisório U.S. de N° de Série 61/012.409, depositado em 7 de Dezembro de 2007, Pedido Provisório U.S. de N° de Série 61/012.408, depositado em 7 de Dezembro de 2007 e Pedido Provisório U.S. de N° de Série 61/080.048, depositado aos 11 de Julho de 2008, que são por meio deste aqui incorporados em suas totalidades como referências.
FUNDAMENTOS DA INVENÇÃO
[002] Compostos macrocíclicos, e.g., macrolídeos semelhantes a zearalenona tal como F152 (LL-Z1640-2), têm propriedades biológicas vantajosas. Por exemplo, F152 e certos seus isômeros
inibem a enzima de fosforilação Map/Erk quinase (MEK). Além disso, derivados de F152 também têm exibido atividade como inibidores de tirosina quinase, inibidores de outras proteína quinases, e.g., MEK1, inibidores de ativação de NF-KB, e inibidores de ativação de AP-1, para nomear alguns. Frequentemente, contudo, F152 e seus derivados são obtidos por técnicas de fermentação e modificações no produto natural e assim eram limitados o número e os tipos de derivados que poderiam ser preparados e avaliados para atividade biológica.
[003] Síntese química de F152 e derivados também têm sido revelados (veja, e.g., WO 03/076424), contudo, tais sínteses são frequentemente complexas e têm muitas etapas de purificação cromatográfica com o propósito de remover as impurezas.
BREVE SUMÁRIO DA INVENÇÃO
[004] A presente invenção é baseada, pelo menos em parte, na descoberta de novos métodos e intermediários para a preparação de macrolídeos. Sem o desejo de se ligar a alguma teoria específica, acredita-se que tais intermediários podem ser úteis, e.g., na obtenção de pontos de purificação nas sínteses, diminuindo ou mesmo removendo assim a necessidade de etapas cromatográficas consumidoras de tempo e caras até aquele ponto de purificação específico. Sem o desejo de se ligar a alguma teoria específica, também é crido que estes novos métodos podem ser úteis na obtenção de composições de macrolídeos tendo pureza aumentada e rendimento aumentado em comparação com os métodos convencionais.
[005] Consequentemente, em algumas modalidades, a presente invenção é direcionada aos intermediários de fórmula (VII):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; Rii e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a): R19 R20 (a);

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo- alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
R17, e R18 são cada um independentemente selecionados do grupo consistindo de H, NO2, -NH3+, -COH, -CO(C1- 4alquila), -COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio.
[006] Em algumas modalidades, R3 é um primeiro grupo protetor de oxigênio contendo anel aromático.
[007] Em outras modalidades, a presente invenção é direcionada aos intermediários de fórmula (VII):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é um primeiro grupo protetor de oxigênio contendo anel aromático; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, CI_6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, CI_6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os carbonos nos quais estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo- alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
(b); e R13 é um segundo grupo protetor de oxigênio contendo anel aromático.
[008] Em algumas modalidades, R13 é
R14, R15, R16, R17, e R18 são cada um independentemente selecionados do grupo consistindo de H, NO2, -NH3+, -COH, -CO(C1- 4alquila), -COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio.
[009] Em algumas modalidades, R1 é hidrogênio. Em algumas modalidades, R2 é hidrogênio. Em certas modalidades, R3 é selecionado de benzoíla ou benzila, sendo que a benzoíla ou benzila estão cada uma substituídas com 0, 1, 2 ou 3 substituintes independentemente selecionados de -OH, -O(C1-4alquila), -NH2, -NH(C1-4alquila), -N(C1- 4alquila)2, amidas, -OCO(C1-4alquila) e (C1-4alquila). Em algumas modalidades, R3 é 4-metóxi-benzila. Em algumas modalidades, R5 é selecionado do grupo consistindo de hidrogênio e C1-6 alquila, e.g., hidrogênio ou metila. Em algumas modalidades, R6 é selecionado do grupo consistindo de hidrogênio e C1-6 alquila, e.g., hidrogênio ou metila.
[010] Em algumas modalidades, o composto de fórmula (VII) é cristalino.
[011] Em algumas modalidades, um de Ru, R15, Ru, R17, e R18 é selecionado do grupo consistindo de NO2, -NH3+, -COH, -CO(C1- 4alquila), -COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio e os outros quatro de R14, R15, R16, R17, e Ru são hidrogênio. Em algumas modalidades, pelo menos um de Ru, R15, R16, R17, e Ru é selecionado do grupo consistindo de NO2, -NH3+, -COH, -CO(C1-4alquila), - COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio e os outros de Ru, R15, R16, R17, e Ru são hidrogênio. Em algumas modalidades, Ru é NO2 e cada um de Ru, R15, R17, e Ru são independentemente hidrogênio.
[012] Em algumas modalidades, o composto de fórmula (VII) é um composto de fórmula (VIIa):
[013] Em algumas modalidades, o composto de fórmula (VII) é um composto de fórmula (VIIb):
[014]Em outras modalidades, a presente invenção é direcionada aos intermediários de fórmula (VIIc):
sendo que R1 e selecionados do grupo consistindo de hidrogênio e C1-6 alquila; R3 é selecionado de benzoíla ou benzila, sendo que a benzoíla ou benzila estão cada uma substituídas com 0, 1, 2 ou 3 substituintes independentemente selecionados de -OH, -O(C1-4alquila), -NH2, -NH(C1- 4alquila), -N(C1-4alquila)2, amidas, -OCO(C1-4alquila) e (C1-4alquila); R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C1-6 halo-alquila, e C1-6 alcoxila; R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a): R19 R20 (a);

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, CI_6 alquila, C1-6 halo- alquila e C1-6 alcoxila; e pelo menos um de R14, R15, RI6, R17, e R18 é selecionado do grupo consistindo de NO2, -NH3+, -COH, -CO(C1-4alquila), - COCl, -COOH, -COO(Ci-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio e o restante de R14, R15, RI6, R17, e R18 são cada um independentemente H.
[015] Em algumas modalidades, R1 e R2 são cada um independentemente hidrogênio. Em algumas modalidades, R3 é 4-metóxi- benzila. Em algumas modalidades, R5 e R6 são cada um independentemente hidrogênio ou metila. Em algumas modalidades, R16 é NO2 e cada um de R14, R15, R17, e R18 são independentemente hidrogênio.
BREVE DESCRIÇÃO DOS DESENHOS
[016] A Figura 1 é um raio-X de cristal único de composto intermediário 011.
[017] A Figura 2 mostra raios-X de cristal único de intermediários 002 e 011a.
[018] A Figuras 3-12 são espectros de 13C NMR a 100 MHz (A) e de 1H NMR a 400 MHz (B) de intermediários exemplares e de um produto final exemplar da presente invenção em CDCl3.
DESCRIÇÃO DETALHADA DA INVENÇÃO
[019] A presente invenção fornece métodos e intermediários para a preparação de macrolídeos, e.g., compostos de fórmula (IV)

sendo que R1 e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não- conjugado de 5-6 membros; R7 é selecionado do grupo consistindo de hidrogênio e -ORa sendo que Ra é hidrogênio ou um grupo protetor de oxigênio estável à base; R8 é selecionado do grupo consistindo de hidrogênio e -ORg sendo que Rg é hidrogênio ou um grupo protetor de oxigênio estável à base; R9 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORb, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila, -SRd e -NReRf sendo que Rb é hidrogênio ou um grupo protetor de oxigênio estável à base, sendo que Rd é selecionado do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C16 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila e sendo que Re e Rf são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila ou um grupo protetor de nitrogênio estável à base; e R10 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORc, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila e C1-6 alcoxila, sendo que Re é hidrogênio ou um grupo protetor de oxigênio estável à base; e R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo- alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
e composições compreendendo os mesmos.
[020] Com o propósito de descrever mais claramente e concisamente o presente tema das reivindicações, as seguintes definições são intencionadas para fornecerem orientação sobre os significados dos termos específicos aqui utilizados.
[021] É para ser entendido que as formas no singular "um", "uma", "o", e "a" como aqui usadas incluem "pelo menos um(a)" e "um(a) ou mais" salvo indicado em contrário. Assim, por exemplo, referência a "um veículo farmaceuticamente aceitável" inclui misturas de dois ou mais veículos bem como um único veículo, e semelhante.
[022] Numerosos valores e faixas são citados em conexão com as várias modalidades da presente invenção, e.g., quantidade de um composto da invenção presente em uma composição. É para ser entendido que todos os valores e faixas que caem entre os valores e faixas listados são intencionados para estarem incluídos pela presente invenção salvo explicitamente indicado em contrário. Adicionalmente, também é para ser entendido que todos os valores numéricos aqui listados estão implicitamente modificados pelo termo "cerca de" salvo especificamente indicado em contrário. O termo "cerca de" como aqui usado em associação com parâmetros, faixas e quantidades, significa que o parâmetro ou a quantidade está dentro de ± 1,0 % do parâmetro ou da quantidade indicado(a).
[023] Como aqui usados, grupos "alquila" incluem hidrocarbonetos saturados tendo um ou mais átomos de carbono, incluindo grupos alquila de cadeia linear (e.g., metila, etila, propila, butila, pentila, hexila, etc.), grupos alquila cíclicos (ou grupos "ciclo-alquila" ou "alicíclicos" ou "carbocíclicos") (e.g., ciclo-propila, ciclo-pentila, ciclo-hexila, etc.), grupos alquila de cadeia ramificada (isopropila, terc-butila, sec-butila, isobutila, etc.), e grupos alquila substituídos com alquila (e.g., grupos ciclo- alquila substituídos com alquila e grupos alquila substituídos com ciclo- alquila). Em certas modalidades, um grupo alquila de cadeia linear ou de cadeia ramificada pode ter 8 ou menos átomos de carbono em sua estrutura principal, e.g., C1-CS para cadeia linear ou C3-C8 para cadeia ramificada. Em certas modalidades, um grupo alquila de cadeia linear ou de cadeia ramificada pode ter 6 ou menos átomos de carbono em sua estrutura principal, e.g., C1-C6 para cadeia linear ou C3-C6 para cadeia ramificada. Em ainda outras modalidades, um grupo alquila inclui cerca de 1 a 4 carbonos. Em outras modalidades, um grupo alquila inclui cerca de 1 a 3 carbonos. Em ainda outras modalidades, um grupo alquila inclui cerca de 1 ou 2 carbonos. Em algumas modalidades, grupos alquila preferidos incluem grupos C1-C6 alquila. Os termos "C1-C6" e "C1-6" como em "C1-C6 alquila" e "C1-6 alquila" são usados intercambiavelmente para significarem grupos alquila contendo 1 a 6 átomos de carbono. O termo "halo-alquila" significa grupos alquila sendo que um ou mais, e.g., 1 a 3, átomos de hidrogênio têm estado substituídos por um halogênio. Os termos "alquenila" e "alquinila" referem-se aos grupos alifáticos insaturados análogos às alquilas, mas que contêm pelo menos uma ligação de carbono-carbono dupla ou tripla respectivamente. Em estruturas complexas, cadeias de carbonos podem ser ramificadas, ligadas por ponte, ou reticuladas. Os termos "alquenila não-conjugada" e "alquinila não-conjugada" respectivamente referem-se aos grupos alquenila e alquinila que não estão conjugados com uma porção da molécula núcleo.
[024] O termo "grupo heteroalquila" inclui estruturas de cadeia linear ou de cadeia ramificada análogas aos grupos alquila nas quais um ou mais dos átomos de carbono na cadeia é um elemento diferente de carbono, por exemplo nitrogênio, enxofre, ou oxigênio. O termo "grupo heteroalquenila" inclui estruturas de cadeia linear ou de cadeia ramificada análogas aos grupos alquenila nas quais um ou mais dos átomos de carbono na cadeia é um elemento diferente de carbono, por exemplo, nitrogênio, enxofre, ou oxigênio. O termo "grupos heteroalquinila" inclui estruturas de cadeia linear ou de cadeia ramificada análogas aos grupos alquinila nas quais um ou mais dos átomos de carbono na cadeia é um elemento diferente de carbono, por exemplo, nitrogênio, enxofre, ou oxigênio. O termo "CI_6 heteroalquila" e "CI-CÔ heteroalquila" são usados intercambiavelmente para se referirem a um grupo que tem de 1-6 carbonos e um ou mais heteroátomos.
[025] O termo "alcoxila" como aqui usado significa um grupo alquila tendo um átomo de oxigênio ligado no mesmo. Em algumas modalidades, grupos alcoxila incluem grupos tendo 1 a cerca de 8 átomos de carbono. Em outras modalidades, grupos alcoxila incluem grupos tendo 1 a cerca de 6 átomos de carbono. Em ainda outras modalidades, grupos alcoxila incluem grupos tendo menos do que cerca de 4 átomos de carbono. Em algumas modalidades, grupos alcoxila preferidos incluem grupos C1-C6 alcoxila. Exemplos de grupos alcoxila incluem, mas não são limitados aos grupos metoxila, etoxila, isopropil-oxila, propoxila, butoxila, e pentoxila. Os grupos alcoxila podem ser de cadeia linear ou ramificada.
[026] O termo "grupo aromático" ou "grupo arila" inclui hidrocarbonetos cíclicos insaturados e aromáticos bem como heterociclos insaturados e aromáticos contendo um ou mais anéis. Grupos arila incluem, por exemplo grupos C5-8 arila. Grupos arila também podem estar fusionados ou ligados por ponte com anéis alicíclicos ou heterocíclicos que não são aromáticos de modo a formar um policliclo (e.g., tetralina).
[027] O termo "grupo heterocíclico" inclui estruturas de anel fechado análogas aos grupos carbocíclicos nos quais um ou mais, e.g., 1, 2 ou 3, dos átomos de carbono no anel é um elemento diferente de carbono, por exemplo, nitrogênio, enxofre, ou oxigênio. Grupos heterocíclicos podem estar saturados ou insaturados. Adicionalmente, grupos heterocíclicos (tais como pirrolila, piridila, isoquinolila, quinolila, purinila, e furila) podem ou não ter caráter aromático, em cujo caso podem ser chamados de grupos "heteroarila" ou "heteroaromático". O termo grupo heterocíclico inclui anéis que estão ligados na estrutura núcleo via quer uma ligação em um dos heteroátomos no anel quer uma ligação em um dos carbonos no anel. Grupos heterocíclicos exemplares incluem, mas não são limitados a:
limitados a imidazolila, morfolinila, e.g.:
piperidinila, e.g.:
pirrolidinila, e.g.:
piperazinila, e.g.:
[028] O termo "amina" ou "amino," como aqui usado, refere-se a um grupo não-substituído ou substituído de fórmula -NRxRy, na qual Rx e Ry são cada um independentemente hidrogênio, alquila, arila, ou heterociclila, ou Rx e Ry, tomados juntos com o átomo de nitrogênio no qual estão ligados, formam um grupo cíclico tendo de 3 a 8 átomos no anel. Assim, o termo amino inclui grupos amino cíclicos tais como grupos piperidinila ou pirrolidinila, salvo indicação em contrário.
[029] Os grupos químicos dos compostos da invenção, incluindo aqueles grupos discutidos acima, podem estar " substituídos ou não- substituídos". Em algumas modalidades, o termo "substituído" significa que o grupo tem substituintes posicionados no grupo diferentes de hidrogênio (i.e., na maioria dos casos, substituindo um hidrogênio), o que permite que a molécula realize sua função intencionada. Será entendido que "substituição" ou "substituído com" inclui a condição implícita de que tal substituição está de acordo com a valência permitida do átomo substituído e do substituinte, e que a substituição resulta em um composto estável, e.g., que espontaneamente não sofre transformação tal como por rearranjo, ciclização, eliminação, etc. Como aqui usado, o termo "substituído" significa incluir todos os substituintes possíveis de compostos orgânicos. Em um aspecto amplo, substituintes permissíveis incluem substituintes alicíclicos e cíclicos, ramificados e não-ramificados, carbocíclicos e heterocíclicos, aromáticos e não-aromáticos e são usados intercambiavelmente para indicar uma ligação dupla tendo dois substituintes, onde os substituintes podem estar quer cis quer trans.
[030] Quando nomes químicos compostos, e.g., "alquil- arila", "aril-oxila," e semelhantes, são aqui usados, eles são entendidos para terem uma conectividade específica com o núcleo da estrutura química. O grupo listado mais afastado à direita (e.g., arila em "alquil-arila"), é o grupo que está diretamente conectado no núcleo. Assim, um grupo "aril-alquila", por exemplo, é um grupo alquila substituído com um grupo arila (e.g., fenil- metila (i.e., benzila)). Um grupo "alquil-arila" é um grupo arila substituído com um grupo alquila (e.g.,p-metil-fenila (i.e.,p-tolila))..
[031] As convenções
são usadas intercambiavelmente para indicar uma ligação dupla tendo dois substituintes, onde os substituintes podem estar quer cis quer trans.
[032] Como aqui usado, o termo "composto" é intencionado para significar uma substância feita de moléculas que adicionalmente consistem de átomos. Um composto geralmente refere-se a uma entidade química, seja na fase sólida, líquida ou gasosa, e se em uma mistura bruta ou na forma purificada ou isolada. Compostos incluem o próprio composto químico bem como, onde aplicável: formas amorfas e cristalinas do composto, incluindo formas polimórficas, ditas formas em mistura ou em isolamento; formas de base livre ou de ácido livre do composto; isômeros do composto, incluindo isômeros geométricos, isômeros ópticos, e isômeros tautoméricos, ditos isômeros ópticos incluindo enantiômeros e diastereômeros, isômeros quirais e isômeros não-quirais, ditos isômeros ópticos incluindo isômeros ópticos isolados ou misturas de isômeros ópticos incluindo misturas racêmicas e não-racêmicas; ditos isômeros geométricos incluindo formas trans e cis, onde um isômero pode estar na forma isolada ou misturado com um ou mais outros isômeros; isótopos do composto, incluindo compostos contendo deutério e trítio, e incluindo compostos contendo radioisótopos, incluindo radioisótopos terapêutica e diagnosticamente eficazes; formas multiméricas do composto, incluindo formas diméricas, triméricas, etc.; sais do composto, incluindo sais de adição de ácido e sais de adição de base, incluindo contra-íons orgânicos e contra- íons inorgânicos, e incluindo formas zuiteriônicas, onde se um composto está associado com dois ou mais contra-íons, os dois ou mais contra-íons podem ser iguais ou diferentes; e solvatos do composto, incluindo hemi-solvatos, mono-solvatos, di-solvatos, etc., incluindo solvatos orgânicos e solvatos inorgânicos, ditos solvatos inorgânicos incluindo hidratos; onde se um composto está associado com duas ou mais moléculas de solvente, as duas ou mais moléculas de solvente podem ser iguais ou diferentes.
[033] O termo "grupo protetor" como aqui usado, refere-se a um grupo funcional específico, e.g., O, S, ou N, estando temporariamente bloqueado de modo que uma reação pode ocorrer seletivamente em outro sítio reativo em um composto multifuncional. Em várias modalidades, um grupo protetor reage seletivamente com bom rendimento para dar um substrato protegido que é estável às reações planejadas; é seletivamente removido com bom rendimento por reagentes prontamente disponíveis, preferivelmente não- tóxicos de modo que não ataquem outros grupos funcionais; forma um derivado facilmente separável (mais preferivelmente sem a geração de novos centros estereogênicos); e tem um mínimo de funcionalidade adicional para se evitarem outros sítios de reação. Compatibilidade dos grupos protetores tipicamente considerará as condições de reação em etapas subsequentes. Assim, se condições básicas são usadas, um grupo protetor prontamente clivável por grupos básicos pode não ser preferido. Similarmente, se condições ácidas são usadas, um grupo protetor prontamente clivável por grupos ácidos pode não ser preferido. Grupos protetores usados em várias modalidades da presente invenção são descritos aqui com mais detalhe. Métodos para remover os grupos protetores são bem conhecidos na técnica. Por exemplo, em relação aos grupos protetores de oxigênio; grupos acetila podem ser removidos sob condições ácidas ou condições básicas; grupos metóxi-etóxi-metil-éter podem ser removidos sob condições ácidas; grupos metóxi-metil-éter podem ser removidos sob condições ácidas; grupos metóxi- benzil-éter podem ser removidos sob condições ácidas, por hidrogenólise, ou por oxidação; grupos metil-tio-metila podem ser removidos sob condições ácidas; grupos pivaloíla podem ser removidos sob condições ácidas, condições básicas ou com agentes redutores; grupos tetra-hidro-pirano podem ser removidos sob condições ácidas; grupos silil-éter (incluindo trimetil-silil (TMS), terc-butil-dimetil-silil (TBDMS), e triisopropil-silil (TIPS) éteres) podem ser removidos sob condições ácidas ou com íon fluoreto tal como NaF ou TBAF; e metil-éteres podem ser removidos com TMSI em dicloro-metano ou MeCN ou clorofórmio ou BBr3 em dicloro-metano. Em outro exemplo, em relação aos típicos grupos protetores de nitrogênio, grupos carbobenzil-oxila podem ser removidos por hidrogenólise; grupos terc-Butil-óxi-carbonila podem ser removidos com ácido forte, concentrado, tal como HCl ou CF3COOH; grupos 9-Fluorenil-metil-óxi-carbonila podem ser removidos com base tal como piperidina; grupos benzila podem ser removidos por hidrogenólise; e/ou grupo metóxi-fenila (PMP) pode ser removido com nitrato de amônio e cério (IV). Como aqui usado, o termo grupo protetor "estável à base" refere-se a um grupo protetor que é estável sob condições básicas de qualquer reação do composto que ocorre subsequentemente à proteção e antes da remoção do grupo protetor. Similarmente, como aqui usado, o termo grupo protetor "estável a ácido" refere-se a um grupo protetor que é estável sob condições ácidas de qualquer reação do composto que ocorre subsequentemente à proteção e antes da remoção do grupo protetor. Um técnico experiente entenderá que um grupo protetor "estável à base" não é necessariamente estável a todas as bases (e.g., pode não ser estável ao hidróxido de sódio concentrado) mas é estável a algumas bases utilizadas em alguma reação do composto que ocorre subsequentemente à proteção e antes da remoção do grupo protetor. Grupos protetores estáveis à base exemplares incluem, mas não são limitados a grupos acetila, grupos metóxi-etóxi-metil- éter, grupos metóxi-etil-éter, grupos metóxi-benzil-éter, grupos metil-tio- metil-éter, grupos pivaloíla, grupos tetra-hidro-pirano, grupos silil-éter (incluindo trimetil-silil (TMS), terc-butil-dimetil-silil (TBDMS), e triisopropil-sil-l (TIPS) éteres) e metil-éteres, grupos carbobenzil-oxila, grupos terc-butil-óxi-carbonila, grupos benzila grupos p-metóxi-fenila (PMP). Similarmente, um técnico experiente entenderá que um grupo protetor "estável a ácido" não é estável as todos ácidos, (e.g., pode não ser estável ao ácido clorídrico concentrado) mas é estável a alguns ácidos em alguma reação do composto que ocorre subsequentemente à proteção e antes da remoção do grupo protetor.
[034] O termo "reagir" como aqui usado, refere-se a qualquer processo químico ou processos químicos no qual (nos quais) dois ou mais reagentes são permitidos entrarem em contato um com o outro para realizar uma transformação ou mudança química. Por exemplo, quando reagente A e reagente B são permitidos entrarem em contato um com o outro para dar um ou mais novos compostos químicos C (C', C", etc.), A é dito em ter "regido" com B para produzir C.
[035] A linguagem "escala grande" como usada na linguagem "preparação em escala grande" inclui reações que resultam em produção em uma quantidade, e.g., maior do que 26 g, e.g., maior do que 30 g, e.g., maior do que 35 g, e.g., maior do que 40 g, e.g., maior do que 45 g, e.g., maior do que 50 g, e.g., maior do que 60 g, e.g., maior do que 70 g, e.g., maior do que 80 g, e.g., maior do que 90 g, e.g., maior do que 100 g, e.g., maior do que 200 g, e.g., maior do que 500 g, e.g., maior do que 1 kg, e.g., maior do que 2 kg, e.g., maior do que 5 kg, e.g., maior do que 10 kg, e.g., maior do que 20 kg, e.g., maior do que 40 kg, e.g., maior do que 60 kg, e.g., maior do que 100 kg, e.g., maior do que 300 kg e.g., maior do que 500 kg.
[036] A linguagem "alfa-aumentadas" é usada com referência à composição compreendendo os intermediários, e.g., compostos de fórmula (V) e/ou (VI), que incluem uma razão mais alta de isômero α para isômero β do que as composições previamente preparadas. Os isômeros α e β de fórmula (V) e (VI) são mostrados abaixo.
[037] Composições previamente preparadas (veja e.g., Publicação de Pedido de Patente U.S. de N° 20060247448, publicada aos 2 de Novembro de 2006; parágrafos [1242]-[1248]) tipicamente têm uma razão de isômero α para isômero β de cerca de 1:2. Em algumas modalidades, o termo composições "alfa-aumentadas" que incluem compostos de fórmula (V) e/ou (VI) têm uma razão de isômero α para isômero β de pelo menos cerca de 1:1.5. Em algumas modalidades, o termo "alfa-aumentada" refere-se às composições que incluem compostos de fórmula (V) e/ou (VI) em uma razão de isômero α para isômero β de pelo menos cerca de 1:1, e.g., pelo menos cerca de 2:1, 3:1, 4:1, 5:1, 10:1, 25:1, 50:1, 100:1, 500:1, ou 1000:1. Em algumas modalidades, o termo "alfa-aumentadas" refere-se às composições que incluem compostos de fórmula (V) e/ou (VI) tendo apenas o isômero α. Deve ser observado que as composições alfa-aumentadas da invenção não são intencionadas para serem limitadas em escala da reação que produz os compostos. Similarmente a linguagem "intermediário-alfa" é usado para se referir aos intermediários, e.g., compostos de fórmula (V) e/ou (VI), que representam o isômero α, como descrito aqui com mais detalhe.
[038] A linguagem "de rendimento aumentado" é usada para se referir à composição compreendendo compostos de fórmula (IV) sintetizados usando composições de intermediário alfa-aumentadas (veja, e.g., Publicação de Pedido de Patente U.S. de N° 20060247448). Estas composições têm um rendimento mais alto de composto alvo (e.g., compostos de fórmula (IV)) em comparação com os produtos sintetizados usando composições de intermediário não-alfa-aumentadas. Em algumas modalidades, o termo "de rendimento aumentado" refere-se a rendimento adicional de pelo menos 5% versus uma composição não-alfa-aumentada. Em algumas modalidades, o termo "de rendimento aumentado" refere-se ao rendimento adicional de pelo menos 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% ou 200% versus uma composição não-alfa-aumentada. Deve ser observado que as percentagens usadas no contexto de rendimento percentual são intencionadas para descreverem percentagens relativas ao rendimento do produto final (i.e., peso por peso, p/p). Também deve ser observado que as composições de rendimento aumentado da invenção não são intencionadas para serem limitadas pela escala da reação que produz os compostos.
[039] A linguagem "de pureza aumentada" é usada para se referir às composições compreendendo o produto final, e.g., uma composição compreendendo um composto de fórmula (IV) como o agente terapêutico, que está significativamente livre de impurezas, e.g., impurezas que são subprodutos da reação ou material inicial residual que seriam considerados inadequados para administração a um sujeito, e.g., um humano, ou preferencialmente omitidos por um técnico experiente de uma composição farmacêutica preparada para administração a um sujeito. Em algumas modalidades, o termo "de pureza aumentada" refere-se à pureza de produtos sintetizados usando composições de intermediário alfa-aumentadas versus produtos sintetizados usando composições de intermediário que não são alfa- aumentadas (veja, e.g., Publicação de Pedido de Patente U.S. de N° 20060247448). Deve ser observado que as composições de pureza aumentada da invenção não são intencionadas para serem limitadas pela escala da reação que produz os compostos.
[040] A linguagem "livre de" é aqui usada, em referência a uma composição da presente invenção que está significativamente, substancialmente ou completamente faltante de um item referido, por exemplo (tal como p-anisaldeído), que tem sido introduzido na reação por intermédio do processo sintético. Por exemplo, em certas modalidades, a linguagem "livre de" não é intencionada para incluir impurezas, por exemplo, sódio residual, que tem sido introduzido por meio de fatores ambientais em vez de por intermédio do processo de síntese.
[041] A linguagem "significativamente livre de" como usada na linguagem "significativamente livre de impurezas" caracteriza a presença de impurezas, e.g., dímeros, produtos de eliminação de acetonida, compostos onde a metila alílica está eliminada, etc., em um produto final, e.g., uma composição compreendendo um composto de fórmula (IV) como o agente terapêutico, em uma quantidade que é menor do que ou igual a 10%, e.g., menor do que ou igual a 9%, e.g., menor do que ou igual a 8%, e.g., menor do que ou igual a 7%, e.g., menor do que ou igual a 6%, e.g., menor do que ou igual a 5%, e.g., menor do que ou igual a 4%, e.g., menor do que ou igual a 3%, e.g., menor do que ou igual a 2%, e.g., menor do que ou igual a 1,5%, e.g., menor do que ou igual a 1%, e.g., menor do que ou igual a 0,5%, e.g., menor do que ou igual a 0,4%, e.g., menor do que ou igual a 0,3%, e.g., menor do que ou igual a 0,2%, e.g., menor do que ou igual a 0,175%, e.g., menor do que ou igual a 0,15%, e.g., menor do que ou igual a 0,125%, e.g., menor do que ou igual a 0,1%, e.g., menor do que ou igual a 0,75%, e.g., menor do que ou igual a 0,5%, e.g., menor do que ou igual a 0,25%, e e.g., 0%. Em modalidades específicas as composições de pureza aumentada da presente invenção estão significativamente livres de impurezas orgânicas, e.g., impurezas compostas, pelo menos parcialmente, de átomos de carbono, e.g., p-anisaldeído (ou quaisquer outros intermediários ou produtos de eliminação possíveis aqui mostrados). A linguagem "substancialmente livre de" como usada na linguagem "substancialmente livre de impurezas" caracteriza a presença de impurezas, e.g., dímeros, produtos de eliminação de acetonida, compostos onde uma metila alílica está eliminada, etc., em um produto final, e.g., uma composição compreendendo um composto de fórmula (IV) como o agente terapêutico, em uma quantidade que é menor do que ou igual a 5%, e.g., menor do que ou igual a 4%, e.g., menor do que ou igual a 3%, e.g., menor do que ou igual a 2%, e.g., menor do que ou igual a 1,5%, e.g., menor do que ou igual a 1%, e.g., menor do que ou igual a 0,5%, e.g., menor do que ou igual a 0,4%, e.g., menor do que ou igual a 0,3%, e.g., menor do que ou igual a 0,2%, e.g., menor do que ou igual a 0,175%, e.g., menor do que ou igual a 0,15%, e.g., menor do que ou igual a 0,125%, e.g., menor do que ou igual a 0,1 %, e.g., menor do que ou igual a 0,75%, e.g., menor do que ou igual a 0,5%, e.g., menor do que ou igual a 0,25%, e e.g., 0%. A linguagem "substancialmente puro" como aqui usada, também se refere à presença de impurezas de menor do que ou igual a 5%, e.g., menor do que ou igual a 4%, e.g., menor do que ou igual a 3%, e.g., menor do que ou igual a 2%, e.g., menor do que ou igual a 1,5%, e.g., menor do que ou igual a 1%, e.g., menor do que ou igual a 0,5%, e.g., menor do que ou igual a 0,4%, e.g., menor do que ou igual a 0,3%, e.g., menor do que ou igual a 0,2%, e.g., menor do que ou igual a 0,175%, e.g., menor do que ou igual a 0,15%, e.g., menor do que ou igual a 0,125%, e.g., menor do que ou igual a 0,1%, e.g., menor do que ou igual a 0,75%, e.g., menor do que ou igual a 0,5%, e.g., menor do que ou igual a 0,25%, e e.g., 0%. Deve ser observado que as percentagem usadas no contexto de percentagem de impurezas são intencionadas para descreverem as percentagens em relação ao peso do produto final, e.g., composição farmacêutica (i.e., peso por peso, p/p). Em algumas modalidades, as percentagens de impurezas são medidas como impureza % em área (e.g., por HPLC). Métodos da Invenção
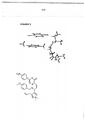
[042] A presente invenção é direcionada, pelo menos em parte, aos novos métodos para sintetizar macrolídeos. Em algumas modalidades, a presente invenção é direcionada à preparação em escala grande de macrolídeos. Esquemas 1 e 2 mostram métodos exemplares para sintetizar macrolídeos da presente invenção. Esquema 1 é um esquemático mostrando a proteção e a abertura de anel de uma molécula de ribose, seguidas pela copulação em um sal de trifenil-fosfônio, copulação em um triflato bicíclico e fechamento de anel para formar o macrolídeo.
Esquema 1: Síntese de fórmula (IV) a partir de ribose - rota 1
[043] Adicionalmente, os mesmos blocos de construção podem ser utilizados em Esquema2, que é um esquemático mostrando a proteção e a abertura de anel de uma molécula de ribose, seguidas pela copulação em triflato bicíclico, copulação em um sal de trifenil-fosfônio e fechamento de anel para formar o macrolídeo.
Esquema 2: Síntese de fórmula (IV) a partir de ribose - rota 2
[044] Consequentemente, em alguns aspectos, a presente invenção é direcionada aos métodos para preparar um composto de fórmula (V): sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base;

R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):
sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo-alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
R13 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base.
[045] Compostos de fórmula (V) são sintetizados pela reação de um composto de fórmula I:
sendo que R4 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base; com um composto de fórmula (II):
sendo que X é um halogênio; sob condições adequadas, de tal modo que um composto de fórmula (V) é formado.
[046] Em algumas modalidades, condições adequadas para formar um composto de fórmula (V) são condições básicas apropriadas. Em algumas modalidades, condições adequadas para formar um composto de fórmula (V) incluem o uso de uma base, e.g., um C1-6 alquil-lítio, um C1-6 t- alcóxido de potássio, hidróxido de sódio, hidreto de sódio, amônia, sal de sódio de dimetil-sulfóxido e hexametil-dissilil-amida de sódio. Em algumas modalidades, condições adequadas para formar um composto de fórmula (V) incluem o uso de uma base de C1-6 alquil-lítio tal como butil-lítio.
[047] T Os compostos de fórmula (I) e fórmula (II) podem ter estereoquímicas variadas em cada carbono quiral. Em modalidades preferidas, os compostos de fórmula (I) e fórmula (II) têm uma estereoquímica específica em cada carbono quiral.
[048] Consequentemente, o composto de fórmula (V) resultante pode ter estereoquímicas variadas em cada carbono quiral. Por exemplo, em algumas modalidades, o composto de fórmula (V) é um composto de fórmula (Va):
[049] Isto é, o composto de fórmula (II) pode ser um composto de fórmula (IIa):
[050] Em algumas modalidades, o composto de fórmula (V) é um composto de (Vb):
[051] Isto é, o composto de fórmula (I) pode ser um composto de fórmula (Ib):
[052] Em algumas modalidades, o composto de fórmula
[053] Grupos protetores adequados variam dependendo da natureza das reações ocorrendo, e.g., das condições adequadas para produzir um composto de fórmula (V). Em algumas modalidades, grupos protetores de oxigênio adequados para R3 incluem grupos acetato, grupos éster, grupos benzila e grupos benzoato. Em algumas modalidades, grupos protetores de oxigênio adequados para R4 incluem grupos silila. Em algumas modalidades, grupos protetores de oxigênio adequados para R13 incluem grupos silila. Em algumas modalidades, a proteção de oxigênio por R13 resulta em um produto predominantemente cis-olefínicos, enquanto que se R13 é um hidrogênio, é formado uma olefina predominantemente trans. Em algumas modalidades, a olefina cis é preferida.
[054] Em algumas modalidades, a ligação dupla representada por
representa uma ligação dupla onde os substituintes estão situados em uma posição cis, um em relação ao outro.
[055] Em alguns aspectos, a presente invenção é direcionada aos métodos para preparar um composto de fórmula (VI): sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada;

R3 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base; R4 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base; R8 é selecionado do grupo consistindo de hidrogênio e -ORg sendo que Rg é hidrogênio ou um grupo protetor de oxigênio estável à base, R9 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORb, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila, -SRd e -NReRf sendo que Rb é hidrogênio ou um grupo protetor de oxigênio estável à base, sendo que Rd é selecionado do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, Ci— 6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila e sendo que Re e Rf são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila ou um grupo protetor de nitrogênio estável à base; e R10 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORc, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila e C1-6 alcoxila, sendo que Rc é hidrogênio ou um grupo protetor de oxigênio estável à base; e R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo- alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
[056] Em algumas modalidades, condições adequadas para formar um composto de fórmula (VI) são condições básicas apropriadas. Em algumas modalidades, condições adequadas para formar um composto de fórmula (V) incluem o uso de um catalisador de paládio. Catalisadores de paládio podem ser usados em química orgânica para facilitar a formação de ligação de carbono-carbono, e.g., pela coordenação em uma ligação dupla de um fragmento para formar um complexo pi-coordenado. Catalisadores de paládio exemplares incluem, mas não são limitados a tetraquis(trifenil- fosfina)paládio(0), cloreto de paládio e acetato de paládio(II). Em algumas modalidades, condições adequadas para formar um composto de fórmula (V) incluem condições de copulação de Heck. Em algumas modalidades condições apropriadas de copulação de Heck incluem, mas não são limitadas à reação de um triflato ou haleto insaturado com um alqueno e uma base forte e catalisador de paládio para formar um alqueno substituído.
[057] Compostos de fórmula (VI) são sintetizados pela reação de um composto de fórmula (I):
com um composto de fórmula (III):
sendo que Y é um halogênio ou um triflato (-O-SO2CF3) sob condições adequadas, de tal modo que um composto de fórmula (VI) é formado.
[058] Os compostos de fórmula (I) e fórmula (III) podem ter estereoquímicas variadas em cada carbono quiral. Em modalidades preferidas, os compostos de fórmula (I) e fórmula (III) têm uma estereoquímica específica em cada carbono quiral. Consequentemente, o resultante composto de fórmula (VI) pode ter estereoquímicas variadas em cada carbono quiral. Por exemplo, em algumas modalidades, o composto de fórmula (VI) é um composto de fórmula (VIb): composto de fórmula (Ib):
[059] Isto é, o composto de fórmula (I) pode ser um composto de fórmula (Ib):
[060] Grupos protetores adequados variam dependendo da natureza das reações ocorrendo, e.g., as condições adequadas para produzir um composto de fórmula (VI). Em algumas modalidades, grupos protetores de oxigênio adequados para R3 incluem grupos acetato, grupos éster, grupos benzila e grupos benzoato. Em algumas modalidades, grupos protetores de oxigênio adequados para R4 incluem grupos silila. Grupos protetores adequados (oxigênio e/ou nitrogênio) para os substituintes de R8, R9 e R10 (i.e., Rb-Rg) dependerão do substituinte resultante. Por exemplo, sob as condições básicas adequadas da reação para produzir um composto de fórmula (VI) sendo que R9 é -NReRf, Re e Rf podem ser cada um independentemente um grupo protetor de nitrogênio adequadamente estável à base, e.g., BOC. Similarmente, sob as condições básicas adequadas da reação para produzir um composto de fórmula (VI) sendo que R9 é -ORb, Rb pode ser um grupo protetor de oxigênio adequadamente estável à base. Em algumas modalidades, grupos protetores de oxigênio adequados para R13 incluem grupos silila.
[061] Em algumas modalidades, a ligação dupla representada por
representa uma ligação dupla onde os substituintes estão situados em uma posição cis, um em relação ao outro.
[062] Em alguns aspectos, a presente invenção é direcionada aos métodos para preparar um composto de fórmula (IV):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não- conjugado de 5-6 membros; R7 é selecionado do grupo consistindo de hidrogênio e -ORa sendo que Ra é hidrogênio ou um grupo protetor de oxigênio estável à base; R8 é selecionado do grupo consistindo de hidrogênio e -ORg sendo que Rg é hidrogênio ou um grupo protetor de oxigênio estável à base; R9 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORb, Ci—6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila, -SRd e -NReRf sendo que Rb é hidrogênio ou um grupo protetor de oxigênio estável à base, sendo que Rd é selecionado do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C16 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila e sendo que Re e Rf são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila ou um grupo protetor de nitrogênio estável à base; e R10 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORc, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila e C1-6 alcoxila, sendo que Re é hidrogênio ou um grupo protetor de oxigênio estável à base; e R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo- alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b): (b).
[063] Compostos de fórmula (IV) são sintetizados pela combinação de um composto de fórmula (I) com um composto de fórmula (II) ou um composto de fórmula (III) sob condições adequadas, de tal modo que um composto de fórmula (IV) é formado. Compostos de fórmula (I), fórmula (II) e fórmula (III) são aqueles listados acima, em relação com a síntese de compostos de fórmula (V) e fórmula (VI). Em algumas modalidades, compostos de fórmula (IV) são sintetizados pela combinação de um composto de fórmula (I) com um composto de fórmula (II) ou um composto de fórmula (III) sob condições adequadas, de tal modo que um intermediário-alfa e um composto de fórmula (IV) são formados. Em algumas modalidades, o intermediário-alfa é um composto de fórmula (V). Em outras modalidades, o intermediário-alfa é um composto de fórmula (VI).
[064] Em algumas modalidades, a síntese de compostos de fórmula (IV) não é limitada pela inclusão de todos os três compostos iniciais específicos (i.e., compostos de fórmula (I), fórmula (II) e fórmula (III)). Isto é, desde que o composto (I) seja reagido quer com composto (II) quer com composto (III), o restante da síntese é continuado via a rota que especificamente não inclui o terceiro composto. Consequentemente, em algumas modalidades, o composto de fórmula (I) é reagido com o composto de fórmula (II) para formar um composto de fórmula (V), que é subsequentemente usado na síntese de um composto de fórmula (IV). Em outras modalidades, o composto de fórmula (I) é reagido com o composto de fórmula (III) para formar um composto de fórmula (VI), que é subsequentemente usado na síntese de um composto de fórmula (IV).
[065] Em algumas modalidades, a síntese de compostos de fórmula (IV) é limitada pela inclusão de todos os três compostos iniciais específicos (i.e., compostos de fórmula (I), fórmula (II) e fórmula (III)). Isto é, em algumas modalidades, a presente invenção inclui um método para preparar um composto de fórmula (IV) compreendendo combinar um composto de fórmula (I) com um composto de fórmula (II) e um composto de fórmula (III), sob condições adequadas, de tal modo que um composto de fórmula (IV) é formado. Consequentemente, em algumas modalidades, o composto de fórmula (I) é reagido com o composto de fórmula (II) para formar um composto de fórmula (V), que é subsequentemente reagido com o composto de fórmula (III). Em outras modalidades, o composto de fórmula (I) é reagido com o composto de fórmula (III) para formar um composto de fórmula (VI), que é subsequentemente reagido com o composto de fórmula (II).
[066] Grupos protetores adequados variam dependendo da natureza das reações ocorrendo, e.g., as condições adequadas para produzir um composto de fórmula (IV). Em algumas modalidades, grupos protetores de oxigênio adequados para R3 incluem grupos acetato, grupos éster, grupos benzila e grupos benzoato. Em algumas modalidades, grupos protetores de oxigênio adequados para R4 incluem grupos silila. De novo, grupos protetores adequados (oxigênio e/ou nitrogênio) para os substituintes de R8, R9 e R10 (i.e., Rb-Rg) dependerão do substituinte resultante. Por exemplo, sob as condições básicas adequadas da reação para produzir um composto de fórmula (VI) sendo que R9 é -NReRf, Re e Rf podem ser cada um independentemente um grupo protetor de nitrogênio adequadamente estável à base, e.g., BOC. Similarmente, sob as condições básicas adequadas da reação para produzir um composto de fórmula (VI) sendo que R9 é -ORb, Rb pode ser um grupo protetor de oxigênio adequadamente estável à base. Em algumas modalidades, grupos protetores de oxigênio adequados para R13 incluem grupos silila e/ou grupos éster ou grupos alílicos.
[067] Como com a síntese de compostos de fórmula (V) e fórmula (VI), os compostos de fórmula (I), fórmula (II) e fórmula (III) podem ter estereoquímicas variadas em cada carbono quiral. Em modalidades preferidas, os compostos de fórmula (I), fórmula (II) e fórmula (III) têm uma estereoquímica específica em cada carbono quiral. Consequentemente, o resultante composto de fórmula (IV) pode ter estereoquímicas variadas em cada carbono quiral. Por exemplo, em algumas modalidades, o composto de fórmula (IV) é um composto de fórmula (IVa):
[068] Isto é, o composto de fórmula (II) pode ser um composto de fórmula (IIa), como descrito acima.
[069] Os vários substituintes em cada uma das fórmulas (I)-(VI) podem estar presentes em qualquer combinação. Em algumas modalidades, RI é hidrogênio. Em algumas modalidades, R2 é hidrogênio. Em algumas modalidades, RI e R2 são ambos hidrogênio. Em algumas modalidades, R5 é hidrogênio ou a C1-6 alquila. Em algumas modalidades, Re é hidrogênio ou a Ci-6 alquila. Em algumas modalidades, R5 e Re são cada um independentemente hidrogênio ou metila. Em algumas modalidades, R5 e Re são tomados juntos para formarem um anel carbocíclico de 5-6 membros não- conjugado, e.g., ciclo-pentila, ciclo-pentenila não-conjugada, ciclo-hexila ou ciclo-hexenila não conjugada. Em algumas modalidades, R7 é hidrogênio ou hidroxila. Em algumas modalidades, Rs é hidrogênio ou hidroxila. Em algumas modalidades, R9 é -ORb ou -NReRf. Em algumas modalidades, Rb é hidrogênio ou a C1-6 alquila. Em algumas modalidades, R9 é -NReRf. Em algumas modalidades, Re é hidrogênio ou a C1-6 alquila. Em algumas modalidades, Rf é hidrogênio, a Ci_6 alquila ou um grupo protetor de nitrogênio estável à base. Em algumas modalidades, Re é C1-6 alquila, e.g., metila ou etila, e Rf é hidrogênio ou um grupo protetor de nitrogênio estável à base. Em algumas modalidades, R10 é hidrogênio.
[070] A presente invenção é baseada, pelo menos em parte, no controle da estereoquímica no carbono indicado abaixo em fórmula (V):
e/ou no carbono indicado abaixo em fórmula (VI):
[071] Em métodos prévios de formação dos compostos de fórmula (IV), a preparação deste fragmento deu uma mistura 1:2 dos isômeros α e β de fórmula (V). Foi adicionalmente determinado pelos presente inventores que os isômeros α e β produziram rendimentos vastamente diferentes quando usados na síntese subsequente do produto macrolídeo final. Por exemplo, na produção de composto 010, onde os isômeros α e β dos compostos de fórmula (V) foram:
os rendimentos obtidos das reações subsequentes são mostradas abaixo em Tabela 1.
1 A reação de etilação gerou uma mistura ~ 1:1 do produto desejado e um produto de eliminação. Os 2 materiais não foram separáveis. 2 * Rendimento da reação de clivagem de TBS é baseado na mistura 1:1 mencionada acima. 3 ** O rendimento da reação de macrolactonização pode ser melhorado para 63% pela modificação para bis(trimetil-silil)amida de lítio.
[072] Como pode ser visto em Tabela 1, o isômero β do composto de fórmula (V) deu rendimento significativamente menor em numerosas subsequentes etapas de reação. Além disso, a eliminação do subproduto que ocorreu na etilação do isômero β é indicativa de não apenas uma perda significativa em rendimento, mas também de uma impureza que é difícil de separar. Consequentemente, e sem desejar se ligar a alguma teoria específica, acredita-se que a eliminação do isômero β do composto de fórmula (V) produziria não apenas um rendimento mais alto em reações subsequentes, mas também um produto final mais puro.
[073] Em algumas modalidades, os compostos e as composições estão substancialmente livres de produtos de eliminação, e.g., compostos de fórmula (XI):
[074] Em algumas modalidades, os compostos e composições estão substancialmente livres de produto de eliminação representado pela seguinte estrutura:
[075] Consequentemente, em alguns aspectos, a presente invenção é direcionada ao método de preparar uma composição alfa- aumentada compreendendo um composto de fórmula (V). Foi determinado pelos presentes inventores que uma composição alfa-aumentada pode ser obtida pelo uso de materiais iniciais tendo uma estereoquímica apropriada. Consequentemente, a composição alfa-aumentada compreendendo um composto de fórmula (V) pode ser formada pela reação de um composto de fórmula (I) com um composto de fórmula (II) sob condições adequadas, de tal modo que uma composição alfa-aumentada compreendendo um composto de fórmula (V) é formada. Similarmente, em alguns aspectos, a presente invenção é direcionada ao método de preparar uma composição alfa- aumentada compreendendo um composto de fórmula (VI). Uma tal composição alfa-aumentada pode ser formada pela reação de um composto de fórmula (I) com um composto de fórmula (III) sob condições adequadas, de tal modo que uma composição alfa-aumentada compreendendo um composto de fórmula (VI) é formada. Em algumas modalidades, o composto de fórmula (I) é um composto de fórmula (Ib):

[076] A presente invenção é também baseada, pelo menos em parte, no fato de que intermediários cristalinos podem ser isolados, de tal modo que cromatografia mínima é necessária na síntese de produto de macrolídeo. Em métodos prévios de formar os compostos de fórmula (IV), numerosas purificações cromatográficas eram necessárias para remover as impurezas. (Veja, e.g., WO 03/076424, parágrafos [1099]-[1119]). Consequentemente, e sem desejar se ligar a alguma teoria específica, acredita- se que a eliminação de etapas cromatográficas com manutenção da pureza e da estereoquímica apropriadas melhoraria o rendimento do produto de macrolídeo final.
[077] Consequentemente, em algumas modalidades, o composto de fórmula (I) é cristalino. Em outras modalidades, o composto de fórmula (II) é cristalino. Em ainda outras modalidades, o composto de fórmula (III) é cristalino. Em outras modalidades, o composto de fórmula (IV) é produzido em forma substancialmente pura sem o uso de cromatografia. Em outras modalidades, o composto de fórmula (V) é produzido em forma substancialmente pura sem o uso de cromatografia. Em outras modalidades, o composto de fórmula (VI) é produzido em forma substancialmente pura sem o uso de cromatografia.
[078] Em ainda outras modalidades, o composto de fórmula (V) e/ou o composto de fórmula (VI) é cristalino. Será reconhecido pelo técnico experiente que a cristalização de intermediários não necessariamente processa-se facilmente ou eficazmente. Consequentemente, em algumas modalidades, um análogo cristalizável do composto fórmula (V) e/ou do composto de fórmula (VI) é formado como um intermediário. Como aqui usado, o termo "análogos cristalizáveis " refere-se aos compostos de fórmula (V) e/ou fórmula (VI) que têm sido modificados de tal modo que são capazes de serem cristalizáveis, ao mesmo tempo mantendo sua reatividade em etapas de reação subsequentes. Por exemplo, compostos de fórmula (V) e/ou fórmula (VI) podem ser modificados em um dos oxigênios pendentes com um grupo protetor, de tal modo que o grupo protetor facilite a cristalização. Quando o análogo cristalizável é utilizado em etapas subsequentes, o grupo protetor pode ser removido.
[079] Por exemplo, sem desejar se ligar a alguma teoria específica, acredita-se que a introdução de dois anéis conjugados em uma ou mais das moléculas da presente invenção pode facilitar a cristalização, e.g., pela formação de uma interação favorável entre os dois anéis. Tal interação pode ser, por exemplo, empilhamento dos anéis devido à interação dos orbitais-pi. Este fenômeno pode ser chamado de "empilhamento-pi". Assim, em algumas modalidades, as moléculas da invenção compreendem dois anéis conjugados, que são capazes de empilhamento-pi. Em algumas modalidades, os anéis compreendem um ou mais substituintes que facilitam o empilhamento-pi. Por exemplo, o empilhamento-pi pode ser aumentado pela formação de anéis com características eletrônicas dissimilares (e.g., um anel rico em elétrons e um anel pobre em elétrons). Tais anéis podem ser escolhidos, por exemplo, baseado na presença de certos grupos doadores de elétrons e/ou grupos removedores de elétrons. Isto é, a presença de grupos doadores de elétrons tipicamente dará um anel mais rico em elétrons, enquanto que a presença de grupos removedores de elétrons tipicamente dará um anel mais pobre em elétrons. Grupos doadores de elétrons exemplares incluem, mas não são limitados a -O-, -OH, -OR, -NH2, -NR2, amidas, - OCOR, alquilas (e.g., alquilas ramificadas), grupos fenila e alquenilas conjugadas. Grupos removedores de elétrons incluem, mas não são limitados a, grupos -NO2, -NH3+, -NR3+, -SO3H, nitrila, -CF3, carbonila (e.g., -COH, - COR, -COOH e -COOR) e halogênios.
[080] Em algumas modalidades, o análogo cristalizável do composto de fórmula (V) é um composto de fórmula (VII):
e.g., fórmula (VII'):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; Rii e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo-alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
R13 é um grupo de fórmula (VIII):
R14, R15, R16, R17 e R18 são cada um independentemente selecionados do grupo consistindo de H, NO2, -NH3+, -COH, -CO(C1- 4alquila), -COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio.
[081] Em algumas modalidades, R3 é um primeiro anel aromático contendo grupo protetor de oxigênio, e.g., a benzila ou benzoíla substituída com 0, 1, 2 ou 3 substituintes independentemente selecionados de -OH, -O(Ci—4alquila), -NH2, -NH(Ci—4alquila), -N(Ci—4alquila)2, amidas, - OCO(Ci—4alquila) e (C^alquila).
[082] Em algumas modalidades, o análogo cristalizável do composto de fórmula (V) é um composto de fórmula (VII):
e.g., fórmula (VII'):
sendo que R1 e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é um primeiro grupo protetor de oxigênio contendo anel aromático; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; Rii e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo-alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
R13 é um segundo grupo protetor de oxigênio contendo anel aromático.
[083] Em algumas modalidades, R13 é uma benzoíla ou benzila substituída com pelo menos um substituinte, onde cada substituinte é independentemente selecionado de -NO2, -NH3+, -NH2(C1-4alquila)+, -NH(C1- 4alquila)2+, -N(C1-4alquila)3+, -SO3H, nitrila, -CF3, -COH, -CO(C1-4alquila), - COOH e -COO(C1-4alquila).
[084] Em algumas modalidades, R13 é um grupo de fórmula (VIII):
[085] Como aqui usado, o termo "anel aromático contendo grupo protetor de oxigênio" refere-se a um grupo protetor de oxigênio como descrito aqui com mais detalhe, que possui na estrutura pelo menos um anel aromático. Um anel aromático refere-se a um sistema de anel (e.g., benzeno) contendo ligações duplas conjugadas. Uma tal estrutura tipicamente resulta em elétrons deslocalizados ao redor do sistema de anel. Em algumas modalidades, o anel aromático contendo grupo protetor de oxigênio é uma benzoíla substituída ou não-substituída. Em algumas modalidades, o anel aromático contendo grupo protetor de oxigênio é uma benzila substituída ou não-substituída.
[086] Em algumas modalidades, o primeiro anel aromático contendo grupo protetor de oxigênio é uma benzoíla ou benzila substituída com pelo menos um grupo removedor de elétrons e o segundo anel aromático contendo grupo protetor de oxigênio é uma benzoíla ou benzila substituída com pelo menos um grupo doador de elétrons. Em outras modalidades, o primeiro anel aromático contendo grupo protetor de oxigênio é uma benzoíla ou benzila substituída com pelo menos um grupo doador de elétrons e o segundo anel aromático contendo grupo protetor de oxigênio é uma benzoíla ou benzila substituída com pelo menos um grupo removedor de elétrons. Os grupos doadores de elétrons e removedores de elétrons podem ser qualquer um daqueles descritos acima. Em algumas modalidades, o primeiro anel aromático contendo grupo protetor de oxigênio é uma benzoíla ou benzila substituída com pelo menos um substituinte, onde cada substituinte é independentemente selecionado de -OH, -O(C1-4alquila), -NH2, -NH(C1- 4alquila), -N(C1-4alquila)2, amidas, -OCO(C1-4alquila) e (C1-4alquila). Em algumas modalidades, o segundo anel aromático contendo grupo protetor de oxigênio é uma benzoíla ou benzila substituída com pelo menos um substituinte, onde cada substituinte é independentemente selecionado de - NO2, -NH3+, -NH2(C1-4alquila)+, -NH(C1-4alquila)2+, -N(C1-4alquila)3+, -SO3H, nitrila, -CF3, -COH, -CO(C1-4alquila), -COOH e -COO(C1-4alquila).
[087] Em relação aos compostos de fórmula (VII), em algumas modalidades, RI é hidrogênio. Em algumas modalidades, R2 é hidrogênio. Em algumas modalidades, RI e R2 são ambos hidrogênio. Em algumas modalidades, R3 é uma benzila substituída com 0, 1, 2, ou 3 substituintes independentemente selecionados de -OH, -O(C1-6alquila), -NH2, -NH(C1-4alquila), -N(C1-4alquila)2, amidas, -OCO(C1-6alquila) e (C1-6alquila). Em algumas modalidades, R3 é 4-metóxi-benzila. Em algumas modalidades, R5 é hidrogênio ou a C1-6 alquila. Em algumas modalidades, R6 é hidrogênio ou a C1-6 alquila. Em algumas modalidades, R5 e R6 são cada um independentemente hidrogênio ou metila.
[088] Em algumas modalidades, um de R14, R15, RI6, R17, e R18 é selecionado do grupo consistindo de NO2, -NH3+, -COH, -CO(C1- 4alquila), -COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio e os outros quatro de R14, R15, R16, R17, e R18 são hidrogênio. Em algumas modalidades, pelo menos um de R14, R15, R16, R17, e R18 é selecionado do grupo consistindo de NO2, -NH3+, -COH, -CO(CM alquila), - COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio e os outros de R14, R15, R16, R17, e R18 são hidrogênio. Em algumas modalidades, R16 é NO2 e cada um de R14, R15, R17, e R18 são independentemente hidrogênio.
[089] Em algumas modalidades, a ligação dupla representada por
representa uma ligação dupla onde os substituintes estão situados em uma posição cis, um em relação ao outro.
[090] Em algumas modalidades, o composto de fórmula (VII) é um composto de fórmula (VIIa)
[091] Em algumas modalidades, o composto de fórmula (VII) é um composto de fórmula (VIIb):
[092] A presente invenção é também baseada, pelo menos em parte, no fato de que intermediários elevadamente solúveis podem ser separados das impurezas solúveis ou levemente solúveis, de tal modo que menos cromatografia seja necessária na síntese do produto de macrolídeo. Como indicado supra, métodos prévios de formar compostos de fórmula (IV) baseiam-se em numerosas purificações cromatográficas para remover impurezas. De novo, sem desejar se ligar a alguma teoria específica, acredita- se que a eliminação de uma ou mais de tais etapas cromatográficas com a manutenção das pureza e estereoquímica apropriadas não apenas melhoraria o rendimento do produto de macrolídeo final, mas também diminuiria o tempo e o custo de produção e decresceria a quantidade de reagentes, e.g., solventes orgânicos, utilizada na síntese de compostos de fórmula (IV).
[093] Consequentemente, em algumas modalidades, os intermediários da presente invenção podem ser tornados elevadamente solúveis pela ligação de um grupo promovedor de solubilidade. Em algumas modalidades, a ligação de um grupo promovedor de solubilidade é reversível. Por exemplo, em algumas modalidades a adição do grupo promovedor de solubilidade pode ser ligada na adição de um grupo protetor de oxigênio ou de nitrogênio. Sem desejar se ligar a alguma teoria específica, acredita-se que a ligação de um grupo promovedor de solubilidade permite que o composto alvo seja atraído para a água, deixando assim algum grupo que não se tornou derivado com o grupo promovedor de solubilidade no meio orgânico. Consequentemente, em algumas modalidades, um análogo solúvel do composto fórmula (I) é formado como um intermediário. Como aqui usado, o termo "análogos solúveis" refere-se aos compostos de fórmula (I) que têm sido modificados (e.g., pela ligação de um grupo promovedor de solubilidade) de tal modo que sejam solúveis em soluções aquosas. Por exemplo, compostos de fórmula (I) e/ou fórmula (VI) podem ser modificados em um dos oxigênios pendentes com um grupo promovedor de solubilidade, de tal modo que o grupo promovedor de solubilidade facilite a dissolução do composto em meio aquoso. O técnico experiente pode se beneficiar da vantagem da diferença em solubilidade do composto de interesse e das impurezas para isolar o composto de interesse sem o uso de cromatografia. O grupo promovedor de solubilidade pode ser removido subsequentemente ao isolamento do composto de interesse.
[094] Em algumas modalidades, o análogo solúvel do composto de fórmula (I) é um composto de fórmula (XIII): (XIII’)
e.g., fórmula (XIII'):
sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base; R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):
sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo-alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b):
um, dois ou três deR2i, R22, R23, R24, e R25 são grupos contendo hidrogênio ácido ou seus sais, e o restante de R21, R22, R23, R24, e R25 são cada um independentemente hidrogênio, metila, hidroxila ou amino.
[095] Como aqui usado, o termo "grupo contendo hidrogênio ácido" refere-se a um grupo substituinte que inclui pelo menos um hidrogênio ácido. Grupos contendo hidrogênio ácido incluem, por exemplo, - COOH, -SO3H, -SO4H, -PO3H2 e -PO4H2. É para ser entendido que um grupo contendo hidrogênio ácido pode estar posicionado orto, meta ou para em relação ao núcleo do composto de fórmula (XII), i.e., o grupo
[096] Em algumas modalidades, um grupo contendo hidrogênio ácido está orto em relação ao núcleo do composto de fórmula (XII).
[097] Em algumas modalidades, R21 é -COOH ou um seu sal. Em algumas modalidades R21 é -SO3H ou um seu sal. Em algumas modalidades, R22, R23, R24, e R25 são cada um independentemente hidrogênio. Em algumas modalidades, R22 é -COOH ou um seu sal. Em algumas modalidades R22 é -SO3H ou um seu sal. Em algumas modalidades, R21, R23, R24, e R25 são cada um independentemente hidrogênio.
[098] Em algumas modalidades, R1, R2 , R3, R11, R12, R19 e R20 são selecionados dos substituintes fornecidos em conexão com o Composto (I). Por exemplo, em algumas modalidades, Ri e R2 são cada um independentemente hidrogênio. Em algumas modalidades, R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):
sendo que R19 e R20 são cada um independentemente Ci-6 alquila.
[099] Em algumas modalidades, os compostos de fórmula (I), formula (II) e formula (III) são reagidos com um composto de fórmula (IV):
que é subsequentemente convertido em um composto de fórmula (IV), e.g., por macrolactonização usando t-butóxido de potássio e subsequente desproteção/oxidação. Também tem sido determinado que a remoção de um grupo protetor na posição R3 de fórmula (IV) (e.g., a remoção de DDQ do p- metóxi-benzil-éter para formar um grupo hidroxila) gera p-anisaldeído. Tem sido verificado que p-anisaldeído, por sua vez, é responsável pela formação de uma impureza dimérica:
sendo que os substituintes são como descritos acima. Embora o dímero fosse ressubmetido às condições de reação, ele não se degradou de volta para o monômero e p-anisaldeído. Isto indica que ele é estável. Também, algum teste biológico inicial indicou que o dímero tinha potência menor e citotoxicidade maior do que as do monômero, tornando-o uma impureza indesejável.
[0100] Consequentemente, em algumas modalidades, os compostos e as composições da presente invenção estão substancialmente livres de produtos diméricos. Em algumas modalidades, um cloridrato de semicarbazida na presença de acetato de sódio é adicionado na mistura reacional. Sem desejar se ligar a alguma teoria específica, acredita-se que isto pode formar um derivado de imina, que poderia precipitar da solução e ser removido por filtração.
[0101] Em algumas modalidades, os compostos de fórmula (I), formula (II) e formula (III) são reagidos com um composto de fórmula (IV"):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é um grupo protetor de oxigênio estável à base; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, CI_6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; R7 é -ORa sendo que Ra é um grupo protetor de oxigênio estável à base; R8 é selecionado do grupo consistindo de hidrogênio e -ORg sendo que Rg é hidrogênio ou um grupo protetor de oxigênio estável à base; R9 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORb, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila, -SRd e -NReRf sendo que Rb é hidrogênio ou um grupo protetor de oxigênio estável à base, sendo que Rd é selecionado do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C16 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila e sendo que Re e Rf são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila ou um grupo protetor de nitrogênio estável à base; e R10 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORc, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila e C1-6 alcoxila, sendo que Re é hidrogênio ou um grupo protetor de oxigênio estável à base; que é subsequentemente convertido em um composto de fórmula (IV), e.g., por subsequente desproteção/oxidação. Desproteção pode ocorrer em alguns de ou todos os R3, R7 ou na estrutura representada pela heterociclildiila de fórmula XII:

[0102] Em algumas modalidades, desproteção ocorre em todos os R3, R7 e na estrutura representada pela heterociclildiila de fórmula (XII) ao mesmo tempo. Em outras modalidades, desproteção ocorre em R7 primeiro, seguida por desproteção subsequente em R3 e na estrutura representada pela heterociclildiila de fórmula (XII).
[0103] Em outros aspectos, a presente invenção é direcionada aos métodos de preparar uma composição de pureza aumentada compreendendo um composto de fórmula (IV). Também foi determinado pelos presentes inventores que uma composição de pureza aumentada pode ser obtida pelo uso de materiais iniciais tendo a estereoquímica apropriada, e formando assim os intermediários alfa-aumentados (e.g., composições alfa- aumentadas compreendendo fórmula (V) ou fórmula (VI)) bem como intermediários cristalinos alvo que podem ser isolados em forma substancialmente pura sem cromatografia. Os métodos para preparar uma composição de pureza aumentada compreendendo um composto de fórmula (IV) tipicamente incluem combinar um composto de fórmula (I) com um composto de fórmula (II) e um composto de fórmula (III), sob condições adequadas, de tal modo que uma composição de pureza aumentada compreendendo um composto de fórmula (IV) é formada.
[0104] Similarmente, em outros aspectos, a presente invenção é direcionada aos métodos para preparar uma composição compreendendo um composto de fórmula (IV), sendo que a composição está substancialmente livre de impurezas orgânicas. Os métodos tipicamente incluem combinar um composto de fórmula (I) com um composto de fórmula (II) e um composto de fórmula (III), sob condições adequadas, de tal modo que uma composição compreendendo um composto de fórmula (IV) substancialmente livre de impurezas orgânicas é formada.
[0105] Em ainda outros aspectos, a presente invenção é direcionada aos métodos para preparar uma composição de rendimento aumentado compreendendo um composto de fórmula (IV). Os métodos tipicamente incluem combinar um composto de fórmula (I) com um composto de fórmula (II) e um composto de fórmula (III), sob condições adequadas, de tal modo que uma composição compreendendo um composto de fórmula (IV) é formada.
[0106] O técnico experiente seria capaz de reconhecer que as condições de reação aqui utilizadas podem variar. Por exemplo, muitos reagentes podem ser utilizados em copulação dos compostos de algumas fórmulas (I)-(III) e (V)-(VI) uns com os outros. Além disso, numerosos reagentes podem ser utilizados em proteção, desproteção, macrolactonização e oxidação de vários intermediários. Adicionalmente, o tempo demorado para a reação pode variar dependendo dos reagentes e das concentrações. Adicionalmente, as reações da presente invenção podem ocorrer em temperaturas variadas. Numerosos solventes também podem ser utilizados nas reações da presente invenção. Solventes adequados são líquidos na temperatura ambiente e na pressão ambiente ou permanecem no estado líquido sob as condições de temperatura e de pressão usadas na reação. Solventes úteis não são particularmente restritos desde que não interfiram com a própria reação (isto é, preferivelmente são solventes inertes), e eles dissolvem uma certa quantidade dos reagentes. Dependendo das circunstâncias, solventes podem estar destilados ou desgaseificados. Solventes podem ser, por exemplo, hidrocarbonetos alifáticos (e.g., hexanos, heptanos, ligroína, éter de petróleo, ou metil-ciclo-hexano) e hidrocarbonetos halogenados (e.g., cloreto de metileno, clorofórmio, tetracloreto de carbono, dicloro-etano, cloro-benzeno, ou dicloro-benzeno); hidrocarbonetos aromáticos (e.g., benzeno, tolueno, tetra-hidro-naftaleno, etil-benzeno, ou xileno); éteres (e.g., diglima, metil-terc-butil-éter, metil-terc-amil-éter, etil- terc-butil-éter, dietil-éter, diisopropil-éter, tetra-hidro-furano ou metil-tetra- hidro-furanos, dioxano, dimetóxi-etano, ou dietilenoglicol-dimetil-éter); nitrilas (e.g., acetonitrila); cetonas (e.g., acetona); ésteres (e.g., acetato de metila ou acetato de etila); alcoóis (e.g., metanol) e suas misturas. O técnico experiente seria capaz de determinar, sem experimentação indevida, as condições de reação apropriadas usando os ensinamentos da presente invenção.
Análise das Propriedades de Reação Benéficas
[0107] Em uma modalidade, os métodos de preparação da invenção são vantajosos sobre os métodos que correntemente estão em uso para a síntese de macrolídeos da presente invenção. Em certas modalidades, um método da invenção possui uma propriedade de reação benéfica (BRP).
[0108] A linguagem "propriedade de reação benéfica ou BRP" inclui uma propriedade de uma reação que é benéfica sobre uma maneira existente de realizar a mesma reação. A propriedade pode ser qualquer propriedades adequada para comparação com a metodologia existente, tal como aquela propriedade que é igual a ou melhor em natureza do que a propriedade da metodologia existente. Exemplos de tais propriedades incluem, sem limitação, segurança de material inicial, tempo de reação, custo de energia, balanço de massa de produto (redução de desperdício), limpeza de reação, rejeito, produtividade, processamento, tempo de processo total, e custo total do produto alvo. Alguns exemplos específicos variados de propriedades de reação benéficas como aplicadas para a preparação de composto 010 são discutidas abaixo.
Efetividade de Custo
[0109] I Na preparação de composto 010, a etilação do nitrogênio aromático (i.e., R9 em fórmula (IV)) é uma etapa limitante de produtividade. Na metodologia que tem sido previamente usada, a etilação ocorre depois na síntese onde o esqueleto de carbono inteiro existe. Assim, algumas limitações da reação de etilação colocam sob risco o esqueleto inteiro, incluindo todos os materiais iniciais. Pela realização da etilação mais cedo, o risco para os outros fragmentos é eliminado e toda a convergência sintética é aumentada. Consequentemente, em algumas modalidades, o substituinte R9 do composto de fórmula (III) é tal que nenhuma alquilação necessita ocorrer em etapas subsequentes na formação de um composto de fórmula (IV). Resíduo/Impurezas
[0110] Teoricamente, para os métodos prévios para sintetizar o composto 010, pelo menos 33% da massa no lado de produtos é resíduo. Por exemplo, cerca de 66% do composto de fórmula (V) produzido em métodos prévios é o isômero β, e cerca de 50% do produto resultante do isômero β é um subproduto de eliminação inseparável de estrutura:
[0111] Além disso, com relação à quantidade total de resíduo, os métodos da presente invenção podem adicionalmente reduzir resíduo em comparação com os métodos prévios pela eliminação de etapas de cromatografia. Tal redução de resíduo pode levar, e.g., a economias adicionais em tempo, custo, tratamento de resíduos perigosos, etc. Intermediários da Invenção
[0112] A presente invenção também é direcionada, pelo menos em parte, aos intermediários para uso na síntese de compostos e composições da presente invenção, e.g., compostos de fórmula (IV). Como discutido acima, é desejável que haja intermediários cristalinos na síntese de um produto final, pelo menos de modo que etapas de cromatografia sejam eliminadas.
[0113] É para ser entendido que, em adição aos intermediários específicos listados em Esquemas 1 e 2, acima, a presente invenção também inclui análogos cristalizáveis de tais intermediários. Em algumas modalidades, um ou mais dos intermediários listados em Esquemas 1 e 2 não se cristalizarão prontamente ou eficientemente. Como descrito com mais detalhe acima, os intermediários podem ser modificados de tal modo que sejam capazes de serem cristalizados. Tais intermediários modificados manterão sua reatividade em etapas de reação subsequentes.
[0114] Consequentemente, em alguns aspectos a presente invenção é direcionada aos intermediários de fórmula (VII):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é selecionado do grupo consistindo de hidrogênio e de um grupo protetor de oxigênio estável à base; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; Rii e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

R13 é um grupo de fórmula (VIII):
R14, R15, R16, R17 e R18 são cada um independentemente selecionados do grupo consistindo de H, NO2, -NH3+, -COH, -CO(C1- 4alquila), -COCl, -COOH, -COO(C1-4alquila), -NR3+, -SO3H, nitrila, -CF3 e halogênio.
[0115] Em certos aspectos, a presente invenção é direcionada aos intermediários de fórmula (VII):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R3 é um grupo protetor de oxigênio contendo anel aromático; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, C1-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; R11 e R12 são cada um independentemente selecionados do grupo consistindo de hidrogênio e um grupo protetor de oxigênio estável à base; ou R11 e R12 são tomados juntos para formarem uma heterociclildiila de 5 membros de estrutura (a):

sendo que R19 e R20 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C1-6 halo-alquila, C1-6 alcoxila e fenila, ou R19 e R20 juntos representam um grupo fluorenila de estrutura (b): (b);
R13 é um grupo protetor de oxigênio contendo anel aromático.
[0116] Valores exemplares para RI, R2 , R3, R5, R6, R11, R12 e R13 são descritos com mais detalhe acima em conexão com os análogos cristalizáveis de fórmula (VII).
[0117] Em algumas modalidades, o composto de fórmula (VII) é um composto de fórmula (VIIa)
[0118] Em alguns aspectos, a presente invenção é direcionada a um intermediário de fórmula (IX):
sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada.
[0119] Em algumas modalidades, RI é hidrogênio. Em algumas modalidades, R2 é hidrogênio.
[0120] Em algumas modalidades, RI e R2 são cada um independentemente hidrogênio.
[0121] Em ainda outros aspectos a presente invenção é direcionada a um intermediário de fórmula (X):

sendo que RI e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, CI_6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila, CI_6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1-3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; R8 é selecionado do grupo consistindo de hidrogênio e -ORg sendo que Rg é hidrogênio ou um grupo protetor de oxigênio estável à base, R9 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORb, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila, -SRd e -NReRf sendo que Rb é hidrogênio ou um grupo protetor de oxigênio estável à base, sendo que Rd é selecionado do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C16 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila e sendo que Re e Rf são cada um independentemente selecionados do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila ou um grupo protetor de nitrogênio estável à base; e R10 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORc, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila e C1-6 alcoxila, sendo que Re é hidrogênio ou um grupo protetor de oxigênio estável à base. Em algumas modalidades, RI é hidrogênio. Em algumas modalidades, R2 é hidrogênio. Em algumas modalidades, RI e R2 são cada um independentemente hidrogênio. Em algumas modalidades, R5 é hidrogênio ou a C1-6 alquila. Em algumas modalidades, R6 é hidrogênio ou a C1-6 alquila. Em algumas modalidades, R5 e R6 são cada um independentemente hidrogênio ou metila. Em algumas modalidades, R8 é hidrogênio. Em algumas modalidades, R10 é hidrogênio. Em algumas modalidades, R9 é -ORb ou -NReRf. Em algumas modalidades, Rb é hidrogênio ou uma C1-6 alquila Em algumas modalidades, R9 é -NReRf. Em algumas modalidades, Re é hidrogênio ou uma C1-6 alquila. Em algumas modalidades, Rf é hidrogênio, uma C1-6 alquila ou um grupo protetor de nitrogênio estável à base. Em algumas modalidades, Re é C1-6 alquila, e.g., metila ou etila, e Rf é hidrogênio ou um grupo protetor de nitrogênio estável à base.
[0122] Em algumas modalidades, o composto de fórmula (X) é um composto de fórmula (Xa)
sendo que Re é selecionado do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 heteroalquila, heteroarila, e arila; e Rf é um grupo protetor de nitrogênio estável à base.
[0123] Em outras modalidades, a presente invenção é direcionada às composições que incluem intermediários de fórmula (X), sendo que a composição está substancialmente livre de compostos de fórmula (IV):

sendo que Ri e R2 são cada um independentemente selecionados do grupo consistindo de hidrogênio, Ci-6 alquila, C3-6 alquenila não-conjugada e C3-6 alquinila não-conjugada; R5 e R6 são cada um independentemente selecionados do grupo consistindo de hidrogênio, halogênio, Ci-6 alquila, C2-6 alquenila, C2-6 alquinila, Ci-6 halo-alquila, Ci-6 alcoxila, fenila e benzila, sendo que a fenila ou benzila estão substituídas com 0, 1, 2, ou 3 substituintes independentemente selecionados de halogênio, hidroxila, C1—3 alquila, e NH2; ou R5 e R6 são tomados juntos com os átomos de carbono no qual estão ligados para formarem um anel carbocíclico não-conjugado de 5-6 membros; R7 é -ORa sendo que Ra é um grupo protetor de oxigênio estável à base; R8 é selecionado do grupo consistindo de hidrogênio e -ORg sendo que Rg é hidrogênio ou um grupo protetor de oxigênio estável à base; R9 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORb, C1-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, C1-6 halo-alquila, -SRd e -NReRf sendo que Rb é hidrogênio ou um grupo protetor de oxigênio estável à base, sendo que Rd é selecionado do grupo consistindo de hidrogênio, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, Ci- 6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila e sendo que Re e Rf são cada um independentemente selecionados do grupo consistindo de hidrogênio, Ci-6 alquila, C2-6 alquenila, C2-6 alquinila, Ci-6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila ou um grupo protetor de nitrogênio estável à base; Rio é selecionado do grupo consistindo de hidrogênio, halogênio, -ORc, Ci-6 alquila, C3-6 alquenila não-conjugada, C3-6 alquinila não- conjugada, Ci-6 halo-alquila e Ci-6 alcoxila, sendo que Re é hidrogênio ou um grupo protetor de oxigênio estável à base; e Rii e Ri2 são cada um independentemente hidrogênio.
[0124] Em outros aspectos a presente invenção é direcionada a um intermediário de fórmula (III):
sendo que Y é um halogênio ou um triflato (-O-SO2CF3); R8 é selecionado do grupo consistindo de hidrogênio e -ORg sendo que Rg é hidrogênio ou um grupo protetor de oxigênio estável à base, R9 é -NReRf; sendo que Re é selecionado do grupo consistindo de C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 heteroalquila, heteroarila de 5-7 membros compreendendo 1, 2 ou 3 heteroátomos, e C5-7 arila, e sendo que Rf é um grupo protetor de nitrogênio estável à base; e R10 é selecionado do grupo consistindo de hidrogênio, halogênio, -ORc, C1-6 alquila, C2-6 alquenila, C2-6 alquinila, C1-6 halo-alquila e C1-6 alcoxila, sendo que Rc é hidrogênio ou um grupo protetor de oxigênio estável à base. Em algumas modalidades, R8 é hidrogênio.
[0125] Em algumas modalidades, R10 é hidrogênio. Em algumas modalidades, Rc é uma C1-6 alquila, e.g., metila ou etila. Em algumas modalidades, Rf é -BOC.
[0126] Em ainda outros aspectos, a presente invenção é direcionada a um intermediário de qualquer uma das fórmulas (I)-(III) ou (V)- (VII) como descritas aqui acima na seção de Métodos.
[0127] Em outros aspectos, a presente invenção é direcionada ao uso de qualquer um dos compostos de fórmulas (I)-(III) ou (V)-(IX) como um intermediário na síntese de um composto de fórmula (IV). Por exemplo, em algumas modalidades, a presente invenção é direcionada ao uso de qualquer um dos compostos de fórmulas (I)-(III) ou (V)-(IX) como um intermediário na síntese de uma composição de pureza aumentada ou de rendimento aumentado compreendendo um composto de fórmula (IV). Em algumas modalidades, a presente invenção é direcionada ao uso de uma composição alfa-aumentada compreendendo um composto de fórmula (V) e/ou fórmula (VI) na síntese de uma composição de pureza aumentada ou de rendimento aumentado compreendendo um composto de fórmula (IV).
Compostos e Composições Preparados Usando os Métodos da Invenção
[0128] Em alguns aspectos, a presente invenção é direcionada aos compostos e às composições preparados(as) usando os métodos da presente invenção, e.g., composições alfa-aumentadas. Em algumas modalidades, os compostos e as composições são apropriados(as) para uso nas formulações terapêuticas. Tais formulações terapêuticas podem ser, e.g., aquelas descritas com mais detalhe abaixo. Em outras modalidades, os compostos e as composições são apropriados(as) para uso na síntese de outros produtos, e.g., compostos de fórmula (IV). Usos de Composições da Invenção
[0129] Em geral, a presente invenção fornece compostos úteis para o tratamento de distúrbios inflamatórios ou imunes e para o tratamento de câncer, particularmente de tumores sólidos. Em algumas modalidades, os compostos da invenção inibem a atividade NF-KB, e consequentemente podem ser eficazes em distúrbios inflamatórios e imunes (veja, geralmente, "NF-KB in Defense and Disease", J. Clin. Investig. 2001, 107, 7). Ademais, também tem sido sabido que certos compostos da invenção mostram inibição da atividade de receptor tirosina quinase tais como VEGFr e PDGFr in vitro, e são úteis para o tratamento de câncer, incluindo tumores sólidos (veja, "Angiogenesis: Potentials for Pharmacologic Intervention in the Treatment of Cancer, Disease cardiovasculars, and Chronic Inflammation", Pharmacological Reviews, 2000, 52, 237).
[0130] Consequentemente, em algumas modalidades, compostos da presente invenção exibiram valores de IC50 para inibição de NF-KB de menores do que 10 μ M. Em certas outras modalidades, compostos da presente invenção exibiram valores de IC50 menores do que 7,5 μ M. Em certas modalidades, compostos da presente invenção exibiram valores de IC50 menores do que 5 μ M, menores do que 2,5 μ M, menores do que 1 μ M. Em certas modalidades, compostos da presente invenção exibiram valores de IC50 menores do que 0,75 μ M, menores do que 0,5 μ M, menores do que 0,25 μ M, menores do que 0,1 μ M, menores do que 75 nM, menores do que 50 nM ou mesmo menores do que 25 nM.
[0131] Em ainda outras modalidades, compostos da presente invenção exibiram valores de IC50 para a inibição do crescimento de linhagens celulares de tumor in vitro de menores do que 10 μM. Em certas outras modalidades, compostos da presente invenção exibiram valores de IC50 menores do que 7,5 μM. Em certas modalidades, compostos da presente invenção exibiram valores de IC50 menores do que 5 μ M, menores do que 2,5 μ M, menores do que 1 μ M. Em certas modalidades, compostos da presente invenção exibiram valores de IC50 menores do que 0,75 μ M, menores do que 0,5 μ M, menores do que 0,25 μ M, menores do que 0,1 μ M, menores do que 75 nM, menores do que 50 nM ou mesmo menores do que 25 nM.
[0132] Como discutido acima, compostos da invenção exibem atividade imunomodulatória e exibem atividade para a inibição de angiogênese por intermédio da inibição de receptores de tirosina quinase. Como tais, os compostos da invenção podem ser úteis para o tratamento de uma variedade de distúrbios, os compostos da invenção podem ser úteis para o tratamento de uma variedade de distúrbios, incluindo, mas não limitados a, sepsia, glomerulonefropatia, artrite reumatóide (incluindo espondilite anquilosante), artrite psoriática, osteoartrite, osteoporose, rinite alérgica, inflamação ocular, doença intestinal inflamatória, dermatite atópica, psoríase, asma, doença de Crohn, colite ulcerativa, doença pulmonar inflamatória, hepatite, distúrbios autoimunes, diabetes, AIDS, cânceres de tumor sólido, leucemia, linfomas, linfomas de célula-B de não-Hodgkin, leucemia linfocítica crônica (CLL), mieloma múltiplo, lúpus eritematoso sistêmicos, doença de hospedeiro versus enxerto/rejeição de aloenxerto, eczema, urticária, miastenia grave, trombocitopenia púrpura idiopática, doença cardiovascular (e.g., enfarto do miocárdio, aterosclerose), hepatite, nefrite produtiva, adenovírus, doenças/distúrbios do sistema nervoso central (derrame cerebral, mal de Alzheimer, epilepsia) e para o tratamento dos sintomas de malária, para nomear alguns. Em certas modalidades, compostos da invenção são particularmente úteis para o tratamento de artrite reumatóide, psoríase, esclerose múltipla, asma e câncer. Em certas modalidades, compostos da invenção são particularmente úteis para o tratamento de psoríase. Em certas modalidades, compostos da invenção são particularmente úteis para o tratamento de câncer. Em certas modalidades, compostos da invenção são particularmente úteis para o tratamento de dermatite atópica. Informação e orientação adicionais para o tratamento de tais doenças podem ser encontradas , e.g., em Publicação de Pedido de Patente U.S. de número 2006/0247448, cujo conteúdo inteiro é aqui incorporado como referência. Dosagens e Modos de Administração Será reconhecido que os compostos e as composições formados(as) de acordo com os métodos da presente invenção podem ser administrados(as) usando qualquer quantidade e qualquer rota de administração eficazes para o tratamento de qualquer um dos estados doentios aqui indicados. Assim, a expressão "quantidade eficaz" como aqui usada para o tratamento de câncer, refere-se a uma quantidade suficiente de agente para inibir o crescimento de células tumorais, ou refere-se a uma quantidade suficiente para reduzir os efeitos do câncer. A quantidade exata exigida variará de sujeito para sujeito, dependendo da espécie, da idade, e da condição geral do sujeito, da severidade das doenças, do agente anticâncer específico, de seu modo de administração, e semelhantes. Os compostos da invenção são preferivelmente formulados em forma de dosagem unitária para facilitar a administração e a uniformidade da dosagem. A expressão "forma de dosagem unitária" como aqui usada refere-se a uma unidade fisicamente discreta do agente terapêutico apropriado para o paciente a ser tratado. Será entendido, contudo, que a uso diário total dos compostos e das composições da presente invenção será decidido pelo médico atendente dentro do escopo do julgamento médico confiável. A dosagem específica terapeuticamente eficaz para qualquer organismo ou paciente particular dependerá de uma variedade de fatores incluindo o distúrbio sendo tratado e a severidade do distúrbio; a atividade do composto específico sendo utilizado; a composição usada; a idade, o peso corporal, a saúde geral, o sexo e a dieta do paciente; o tempo de administração, a rota de administração, e a taxa de excreção do composto específico utilizado; a duração do tratamento; as drogas usadas em combinação ou coincidentes com o composto específico utilizado; e fatores semelhantes bem conhecidos nas técnicas médicas (veja, por exemplo, Goodman e Gilman's, "The Pharmacological Basis of Therapeutics", Tenth Edition, A. Gilman, J.Hardman e L. Limbird, eds., McGraw-Hill Press, 155- 173, 2001, que é aqui incorporado em sua totalidade como referência). Composições farmacêuticas podem ser administradas sistemicamente, e.g., métodos enterais e parenterais de administração tais como administração intravenosa, administração intraperitoneal, administração intramuscular, administração intracoronariana, administração intraarterial (e.g., para dentro de uma artéria carótida), administração intradermal, administração subcutânea, liberação transdermal, administração intratraqueal, administração subcutânea, administração intra-articular, administração intraventricular, inalação (e.g., aerossol), administração intracerebral, nasal, naval, oral, intraocular, pulmonar, impregnação de um cateter, por supositório e injeção direta para dentro de um tecido, ou administração mucosal ou tópica sistemicamente absorvida. Orientação para a administração sistêmica de composições da presente invenção, incluindo formas de dosagem, dosagens, e horários de dosagem apropriadas(o) podem ser encontrada, e.g., em Publicação de Pedido de Patente U.S. de número 2006/0247448, cujo conteúdo inteiro é aqui incorporado como referência. Em certas modalidades exemplares, os compostos da invenção podem ser usados como revestimento para stents. Orientação sobre o uso dos compostos da invenção nesta capacidade pode ser encontrada, por exemplo, em WO 05/023792. EQUIVALENTES Aquelas pessoas experientes na técnica reconhecerão, ou serão capazes de averiguar usando não mais do que experimentação rotineira, muitos equivalentes das modalidades específicas da invenção aqui descritas. Tais equivalentes são intencionados para estarem incluídos nas reivindicações seguintes. INCORPORAÇÃO COMO REFERÊNCIA Os conteúdos de todas as referências, patentes, e pedidos de patente citados em todo este pedido são por meio deste aqui incorporados como referências. EXEMPLIFICAÇÃO As seguintes convenções de nomes são aqui usadas:

Quantidades de reagentes dadas abaixo estão em relação ao primeiro reagente listado para qualquer esquema dado. Quando volumes são fornecidos, eles são calculados usando o fator de conversão de 1 kg de peso = 1 L de volume. Exemplo 1: Síntese de Composto 010 Esquema 3: Síntese de diol a partir de D-ribose

D-Ribose (1 peso) foi suspensa em acetona (5 volumes). Ácido sulfúrico (0,05 peso) foi adicionado e a mistura foi agitada até homogênea. Imidazol (0,6 peso) foi adicionado. A mistura foi permitida agitar 15 minutos, e então a acetona foi destilada. Acetona (0,5 vol) foi carregada para dentro do reator. A acetona foi destilada e o procedimento foi repetido Dicloro-metano (0,5 vol) foi carregado para dentro do reator e destilado. O material foi usado bruto na reação seguinte. Na acetonida (1 peso) foi adicionado imidazol (0,36 peso). A mistura foi suspensa em dicloro-metano (5 vol) a 25°C. A mistura foi esfriada para 0°C e cloreto de terc-butil-difenil-silila (1,4 pesos) foi adicionado. Uma solução saturada de cloreto de amônio (2 vol) e água (1 vol) foi adicionada e a mistura foi agitada 15 minutos. TBME (2,5 vol) foi adicionado na mistura e agitado 5 minutos. A solução orgânica foi separada e lavada com água (2 vol) e salmoura (2 vol). A camada orgânica foi concentrada e o lactol protegido com TBDPS bruto foi obtido. O material foi usado bruto na etapa seguinte. Em uma solução de TBDPS-acetonida (1 peso) em THF (1,6 vol) a -20°C foi adicionada uma solução de brometo de vinil-magnésio (1 M/THF, 5,8 vol) em uma vazão permitindo que a temperatura ficasse abaixo de -10°C. A solução foi permitida aquecer lentamente para até 25°C. A reação foi transferida para uma mistura fria de cloreto de amônio aquoso saturado (4,5 vol), TBME (4,5 vol) e água (1,8 vol). A camada aquosa foi separada e a solução orgânica foi lavada duas vezes com água (2,25 vol). A solução orgânica foi lavada com salmoura (4,5 vol) e concentrada. Diol bruto 001 (35,2% de rendimento a partir de d-ribose) foi cristalizado em heptano. Os sólidos foram colhidos e lavados com heptano frio, e secos com ar. Esquema 4: Síntese de Acetato por Redução Alílica

Em uma solução agitada de diol 001 (1 peso), dimetil-amino- piridina (0,002 peso) e trietil-amina (0,76 vol) em terc-butil-metil-éter (1,75 vol) a 0°C foi adicionado anidrido acético (0,46 vol). A solução foi permitida aquecer para 25°C e foi então agitada por cerca de 1 h. A mistura reacional foi esfriada para 0°C e a reação foi interrompida com cloreto de amônio aquoso saturado (2 vol). TBME (1 vol) foi adicionado. A fase orgânica foi separada e lavada com água (2 vol) seguida por salmoura (2 vol). A solução orgânica combinada foi concentrada para dar diacetato que foi usado sem purificação adicional. Um reator foi carregado com catalisador Pd(Ph3P)4 (0,02 peso), trietil-amina (0,37 peso) e THF (3 vol). A solução foi esfriada para 5°C. Ácido fórmico (0,17 vol) foi então adicionado. Após a completitude da adição de ácido fórmico, uma solução de diacetato (1 peso) em THF (1 vol) foi adicionada. A mistura foi aquecida para refluxar (65°C) por 2 horas. Com completitude, a mistura foi esfriada para 0°C e a reação foi interrompida com água (1,82 vol). terc-butil-metil-éter (2,73 vol) foi adicionado e agitado por 15 minutos. Após separação da camada aquosa, a solução foi lavada com cisteína aquosa 10% em peso (2,0 vol) e então cloreto de sódio saturado (1,82 vol). A fase orgânica foi concentrada. O resíduo oleoso bruto foi dissolvido em IPA/água (9:1) (5 vol), aquecido para 70°C e então esfriado para -5°C. O acetato cristalino 002 foi filtrado. O bolo foi lavado com IPA/água (9:1) frio (0,5 vol) e então seco (64,8% de rendimento a partir de 001; P.F. 64-67°C). 13C e 1H NMR de 002 são mostrados em Figuras 3A e 3B. Esquema 5: Conversão de Acetato em Álcool Primário

Acetato 002 (1 peso) foi suspenso em THF (4,7 vol). Na suspensão foi adicionado MeOH (2,33 vol). Nesta suspensão resultante foi adicionada uma pasta fluida de carbonato de potássio (0,3 peso) em MeOH (2,33 vol). A mistura foi esfriada para 10°C e então água (8,0 vol) e metil- terc-butil-éter (8 vol) foram adicionados. Após agitação (15 minutos), a reação foi permitida sedimentar (15 minutos) e a camada orgânica foi separada. A fase orgânica foi então lavada com salmoura (4 vol) e concentrada. O álcool bruto foi usado sem purificação adicional. O álcool (1 peso) foi azeotropicamente destilado com THF (3x1,78 pesos) até que os níveis de água fossem <0,03%. No óleo resultante foi adicionada uma suspensão de TBAI (0,17 peso) em DMF (1,05 peso). A mistura foi então esfriada para -15°C. O reator foi então carregado com terc-butóxido de potássio 20% em peso em THF (1,4 pesos) diluído em THF anidro (0,94 peso). A mistura foi agitada por 15 minutos. Cloreto de 4-metóxi-benzila (0,43 peso) foi então adicionado. Com a completitude, a reação foi interrompida com uma solução de metóxido de sódio 0,5M em metanol (0,55 peso). A mistura foi então permitida agitar na temperatura ambiente. A mistura foi concentrada e o óleo restante foi dividido entre água (5 pesos) e terc-butil-metil-éter (3,7 pesos). A camada orgânica foi lavada com cloreto de amônio aquoso saturado e foi então concentrada. O óleo bruto foi usado com purificação. O silil-éter (1,0 peso) foi dissolvido em THF (2,3 pesos). Fluoreto de tetrabutil-amônio (1,0 M em THF) (1,9 pesos) foi adicionado. Com completitude, bicarbonato de sódio aquoso 10% (2,6 pesos) foi adicionado e a mistura foi extraída duas vezes com terc-butil-metil-éter (1,9 pesos). As camadas orgânicas combinadas foram lavadas com cloreto de amônio aquoso saturado (2,6 pesos). A camada orgânica foi então concentrada para dar o composto bruto 003.

No composto bruto 003 (1,0 peso baseado em massa teórica) foi adicionado TBME (2,95 pesos), DMAP (0,04 pesos), trietil-amina (0,31 pesos), e anidrido ftálico (0,69 pesos). Com completitude composto 003a foi extraído com NaHCO3 aquoso 3% (9,98 pesos). As extrações em bicarbonato de sódio aquoso combinadas foram retornadas para o reator e então lavadas duas vezes com heptano (2,27 pesos). Hidróxido de sódio (1,23 pesos) foi então adicionado. Com conversão de volta para o composto 003, a camada aquosa foi extraída com TBME (2,73 pesos). As camadas orgânicas de TBME foram então concentradas dando um óleo laranja amarelo de 003 (66,2% de rendimento a partir de 002). I3C e 1H NMR de 003 são mostrados em Figuras 4A e 4B. Esquema 6: Oxidação em SO3-piridina

Álcool primário 003 (1 peso) foi dissolvido em dicloro-metano anidro (5,0 vol.). A solução foi esfriada para 0°C, e então diisopropil-etil- amina (1,38 vol.) foi adicionada. Complexo de trióxido de enxofre - piridina (1,29 peso) foi dissolvido em dimetil-sulfóxido anidro (5,00 vol.) em um reator separado. A solução de SO3 Py/DMSO foi adicionada em solução de álcool/CH2Cl2 . Com completitude, a mistura reacional teve a reação interrompida com água fria (6,4 vol.). A camada orgânica foi separada. A fase aquosa foi extraída com uma mistura de heptano (4,50 vol.) e dicloro-metano (0,30 vol.). As fases orgânicas combinadas foram lavadas com ácido cítrico aquoso 5% em peso (5,0 vol.) até o valor de pH da camada aquosa foi < 3. A fase orgânica foi lavada com bicarbonato de sódio aquoso 10% em peso (2,50 vol.), e então cloreto de amônio aquoso saturado (4,80 vol.). A fase orgânica foi concentrada e seca por destilação azeotrópica com heptano (2 x 4,0 vol.), dando o aldeído 004. Esquema 7: Síntese de Álcool e Sal de Fosfônio a partir de 3-(S)-Hidróxi- butirato de Etila imidazol, Acetona, então EtOAc

3-(S)-Hidróxi-buritato de etila (1 peso) foi adicionado em uma solução de diisopropil-amida de lítio 2,0 M (10 peso) a 0°C. A mistura foi agitada por 30 minutos, e então foi esfriada para -20°C. Uma solução de iodeto de metila (1,8 peso) em THF (3,4 peso) foi adicionada enquanto a temperatura da reação era mantida abaixo de -15°C. Com completitude, a reação foi interrompida com cloreto de amônio aquoso saturado (8 vol.). A mistura foi extraída duas vezes com acetato de etila (6 vol. cada). As camadas combinadas de acetato de etila foram lavadas duas vezes com cloreto de amônio aquoso saturado (6 vol. cada), então concentradas sob pressão reduzida. A mistura bruta foi seca por destilação azeotrópica com heptano e usada diretamente na reação seguinte. O material bruto (1 peso) foi dissolvido em DMF anidra (3,7 peso). Imidazol (0,77 peso) e cloreto de terc-butil-dimetil-silila (1,25 peso) foram adicionados. Com completitude, a reação foi interrompida com água (4 peso) e extraída duas vezes com heptano (4 pesos cada). As camadas de heptano foram concentradas sob pressão reduzida, então o solvente foi extraído para tolueno e usado diretamente na reação seguinte. O éster bruto (1,0 peso) foi dissolvido em tolueno anidro (1,22 peso) e a solução foi esfriada para -10°C. Uma solução de hidreto de diisobutil-alumínio em tolueno (4,5 peso) foi adicionada mantendo uma temperatura de reação abaixo de 0°C. Com a completitude de reação, metanol (0,4 peso) foi adicionado. A mistura reacional foi transferida para uma solução de ácido clorídrico aquoso frio (6,0 peso). A mistura foi extraída duas vezes com metil-terc-butil-éter (2,3 pesos cada). As camadas orgânicas combinadas foram concentradas sob pressão reduzida. O produto bruto 005 (68,7% de rendimento a partir do material inicial 3-(S)-hidróxi-butirato de etila) foi então purificado por destilação a vácuo (100-120°C a 1.333 Pascal). O álcool 005 (1,0 peso) foi dissolvido em THF (3 peso) e esfriado para 0°C. Trietil-amina (0,51 peso) foi adicionada seguida por cloreto de metano-sulfonila (0,55 peso). Com completitude da reação, água (2,5 peso) foi adicionada seguida por heptano (3,5 peso). Após a separação de fases, a camada de heptano foi lavada com cloreto de sódio saturado (2,5 peso) e então concentrada sob pressão reduzida. O material bruto foi usado diretamente na reação seguinte. O mesilato (1,0 peso) foi dissolvido em acetona (3,33 peso). Iodeto de sódio (1,0 peso) foi adicionado e a mistura foi aquecida para refluxar. Com completitude, a reação foi esfriada para a temperatura ambiente e água (2,8 peso) foi adicionada. A mistura foi extraída com heptano (4,0 vol). A camada de heptano foi lavada consecutivamente com bicarbonato de sódio aquoso saturado (1 peso), tiossulfato de sódio aquoso saturado (2,5 peso) e cloreto de amônio aquoso saturado (2,0 peso). A camada de heptano foi concentrada sob pressão reduzida e usada diretamente na reação seguinte. Trifenil-fosfina (3,0 peso) foi aquecida para 100°C. O iodeto (1,0 peso) foi adicionado e a mistura foi agitada a 100°C até que o iodeto fosse consumido. Acetato de etila (5 peso) foi adicionado e a mistura foi mantida sob refluxo por 20 minutos, e então esfriada para 0°C. O sal de fosfônio sólido resultante 006 (72,4% de rendimento a partir de 005) foi filtrado, lavado com acetato de etila adicional (7 vol) e então seco sob nitrogênio. 13C e 1H NMR de 006 são mostrados em Figuras 5A e 5B. Esquema 9: Copulação de Wittig

Sal de fosfônio 006 (2,40 pesos) foi seco por destilação azeotrópica com THF anidro (9,60 vol.). THF anidro foi adicionado (4,80 vol) e a mistura foi esfriada para 0°C. n-Butil-lítio 1,6 M (2,42 vol.) foi adicionado, e a solução foi agitada por 20 min. Uma solução de aldeído 004 (1 peso) em THF anidro (1 vol.) foi adicionada na mistura reacional e a reação foi aquecida para 20°C. Com completitude, Celite (1,3 peso) foi adicionado seguido por uma solução de ácido cítrico/água D.I. (0,13 peso/0,15 vol.). Heptano (3,90 vol.) foi adicionado e a mistura foi filtrada e lavada com heptano (2 x 5,23 vol.). Os filtrados combinados foram concentrados. Heptano (3,78 vol.) foi adicionado e a solução foi filtrada, lavando com heptano (2 x 3,78 vol.). Os filtrados combinados foram concentrados e o material bruto foi usado sem purificação adicional. 13C e HNMR de 007 são mostrados em Figuras 6A e 6B. Esquema 10: Reação de Heck

007a (1,1 peso), a olefina 007 tris(dibenzil-ideno-acetona)-dipaládio foram combinados em um reator. N-metil- pirrolidinona (3,3 vol) e diciclo-hexil-metil-amina (0,77 peso) foram adicionadas. A mistura foi agitada a 80°C. Com completitude, a mistura foi esfriada para 20°C, e Celite (1,5 peso) e acetato de etila (10 vol) foram adicionados. A mistura foi filtrada e os sólidos lavados com acetato de etila (30 vol). Os filtrados foram concentrados sob pressão reduzida. O concentrado bruto foi purificado por cromatografia em gel de sílica, que deu um rendimento de 72,5%. Esquema 11: Macrolactonização

A Boc-amida 008 foi dissolvida em dimetil-tetra-hidro- pirimidinona e esfriada para 0°C. Uma solução 1,0 M de bis(trimetil- silil)amida de lítio em THF (2,5 vol) foi adicionada. Iodo-etano (1,2 peso) foi adicionado, então a mistura foi aquecida para 0°C. Com completitude, a mistura foi esfriada para 0°C e a reação foi interrompida com cloreto de amônio aquoso saturado (25 vol). A mistura foi extraída duas vezes com uma mistura de heptano (4,0 vol) e metil-terc-butil-éter (4,0 vol). As camadas orgânicas combinadas foram lavadas com cloreto de amônio aquoso saturado (25 vol) e então concentradas sob pressão reduzida. O concentrado de silil- éter bruto foi purificado por cromatografia em gel de sílica, que deu um rendimento de 94%. Cloridrato de imidazol (0,44 peso) foi dissolvido em fluoreto de tetrabutil-amônio 1,0 M em THF (8,5 vol). Uma solução do silil-éter (1,0 peso) em THF (4,8 vol) foi adicionada. Com completitude, a mistura teve a reação interrompida com cloreto de amônio aquoso saturado (15,0 vol) e foi extraída três vezes com metil-terc-butil-éter (10 vol cada). As camadas orgânicas combinadas foram lavadas com água (33 vol) e cloreto de amônio aquoso saturado (33 vol), e então concentradas sob pressão reduzida. O concentrado de álcool bruto foi purificado por cromatografia em gel de sílica, que deu um rendimento de 51,6%. O álcool (1,0 peso) foi dissolvido em THF (47 vol) e a solução foi esfriada para 0°C. Uma solução 0,5 M de bis(trimetil-silil)amida de potássio (3,0 vol) foi adicionada durante um período de 3 horas. Com completitude, uma solução de cloreto de terc-butil-dimetil-silila (1,0 peso) em THF (1,0 vol) foi adicionada. Com completitude, cloreto de amônio aquoso saturado (25 vol) e água (4 vol) foram adicionados. A mistura foi extraída com terc-butil-metil-éter (25 vol). Após remoção da camada aquosa, a camada orgânica foi lavada com cloreto de amônio aquoso saturado (25 vol). A camada orgânica combinada foi concentrada sob pressão reduzida. O concentrado bruto foi purificado por cromatografia em gel de sílica, dando o composto 009 (57,4% de rendimento). 13C e 1H NMR de 009 são mostrados em Figuras 7A e 7B. Esquema12: Composto 010

Uma solução de macrolídeo 009 (1 peso) em dicloro-metano (2,7 vol.) foi adicionada em um reator contendo dicloro-diciano- benzoquinona (DDQ, 0,35 peso) e água (0,6 vol). Com completitude, a reação foi interrompida com bicarbonato de sódio aquoso saturado (4,0 vol) e tiossulfato de sódio saturado (1 vol). Após separação de fases, a camada aquosa foi extraída com uma mistura de acetato de etila (1,3 vol) e heptano (2,6 vol). As camadas orgânicas combinadas foram concentradas sob pressão reduzida. O concentrado bruto foi dissolvido em acetato de etila (1,6 vol) e a solução foi adicionada em uma solução de cloridrato de semicarbazida (0,22 peso) e acetato de sódio (0,54 peso) em água (0,96 vol). Com completitude, os sólidos foram filtrados e lavados com acetato de etila (3,34 vol). A fase aquosa foi removida dos filtrados e a camada orgânica foi concentrada sob pressão reduzida. O concentrado foi dissolvido em uma mistura de heptano (2 vol) e dicloro-metano (2,0 vol), muito bem filtrado, e concentrado sob pressão reduzida, dando o álcool alílico. O álcool alílico (1,0 peso) foi dissolvido em dicloro-metano (4,0 vol). Periodinano de Dess-Martin (0,68 peso) foi adicionado em porções. Com completitude, a reação foi interrompida com bicarbonato de sódio aquoso saturado (7,0 vol.). Uma solução de tiossulfato de sódio aquoso 10% em peso (5,5 vol.) foi adicionada. A fase orgânica foi separada e a camada aquosa foi extraída com uma mistura de acetato de etila (2,2 vol) e heptano (2,2 vol). As fases orgânicas combinadas foram concentradas sob pressão reduzida. O concentrado foi dissolvido em acetato de etila (4,5 vol.), e foi lavado com cloreto de amônio aquoso saturado (1,5 vol.). A fase orgânica foi concentrada sob pressão reduzida, dando a enona. Uma solução da enona (1,0 peso) em dicloro-metano (6,5 vol) foi adicionada em uma solução de ácido trifluoro-acético a 0°C (6,1 vol) em água (0,3 vol). Com completitude, a reação foi interrompida com hidróxido de amônio aquoso 15,0% gelado (0°C) (11,0 vol). Após a separação da camada orgânica, a camada aquosa foi extraída com dicloro-metano (2,3 vol). As camadas orgânicas combinadas foram lavadas com cloreto de sódio saturado (4,6 vol). A fase orgânica foi concentrada sob pressão reduzida. t-Butil-metil- éter (2,2 vol) foi adicionado e a mistura foi aquecida para 55°C. Heptano (2,2 vol) foi gradualmente adicionado, então a solução foi esfriada para 0°C. Os sólidos foram filtrados e lavados com uma mistura a 0°C de heptano (1,4 vol) e t-butil-metil-éter (1,4 vol). O sólido 010 foi seco e então suspenso em 2- propanol (5,0 vol) e aquecido para 65°C. Água (0,1 vol) foi adicionada seguida pela adição gradual de heptano (7,5 vol). A mistura foi então esfriada para 0°C e os sólidos de 010 (80,7% de rendimento a partir de 009; P.F. 157-159°C) foram filtrados, lavados com uma mistura de heptano (2,4 vol) e 2- propanol (2,4 vol), e então secos. 13C e 1H NMR de 010 são mostrados em Figuras 8A e 8B. Exemplo 2: Síntese de Composto 010 Esquema 13: Oxidação seguida por copulação de Wittig

Composto 007 foi sintetizado a partir de composto 003 como descrito acima em Exemplo 1. Esquema 14: Intermediário Cristalino 011

O TBS éter 007 (1 peso) foi dissolvido em THF (0,88 peso). Uma solução 1,0 M de fluoreto de tetrabutil-amônio em THF (2,1 peso) foi adicionada. A solução foi aquecida para 50°C. Com completitude, a mistura foi esfriada para 20°C. Bicarbonato de sódio aquoso 10% em peso (3 vol) foi adicionado e a mistura foi extraída com terc-butil-metil-éter (6 vol). A camada orgânica foi lavada com cloreto de amônio aquoso saturado (3 vol) e foi então concentrada. O material bruto foi usado sem purificação adicional. 4-(Dimetil-amino)piridina (0,03 peso) foi adicionada em uma solução do álcool (1 peso) em THF anidro (9 vol.). Trietil-amina (0,3 pesos) foi adicionada e então cloreto de 4-nitro-benzoíla (0,5 peso) como uma solução em THF (1,0 vol.). A mistura reacional foi então agitada a 35°C. Com completitude, a reação foi esfriada para 20°C. Bicarbonato de sódio aquoso 5% em peso (10 vol) foi adicionado seguido por t-butil-metil-éter (15 vol). A fase orgânica foi lavada com cloreto de sódio aquoso 20% em peso (10 vol). A fase orgânica foi concentrada e o solvente foi extraído em metanol. Metanol (6 vol.) foi adicionado e a mistura foi aquecida para 50°C, seguida por agitação a 50°C por 30 minutos, e então esfriamento para 0°C. O sólido cristalino (56,1% de rendimento; P.F. 86-89°C) foi filtrado, lavado com metanol frio e seco. Um cristal único de composto 011 foi isolado, e a estrutura do cristal é mostrada em Figura 1. 13C e 1H NMR de 011 são mostrados em Figuras 9A e 9B. Esquema 15: Desproteção seguida por copulação de Heck

O éster de p-nitro-benzoato 011 (1,0 peso) foi dissolvido em THF (2,65 peso) e metanol (0,4 peso). Uma solução aquosa a 10% em peso de hidróxido de sódio (1,65 peso) foi adicionada e a mistura foi aquecida para 35°C. Com completitude, a reação foi esfriada para 20°C. Água (3,0 vol) foi adicionada seguida por metil-terc-butil-éter (6 vol). Após separação, a camada orgânica foi lavada com cloreto de sódio 25% em peso (4 vol). O solvente foi removido sob pressão reduzida. O triflato de arila 011a [1,26 peso; preparado pelo tratamento de 007a com LiHDMS e DMPU seguido por um término da reação com iodeto de etila; 13C e 1H NMR mostrados em Figuras 11A e 11B; raios-X de cristal único mostrado em Figura 2] e tris(dibenzilidino-acetona)dipaládio (0,12 peso) foram combinados em um reator. Uma solução da olefina (1,0 peso) em N-metil-pirrolidinona (1,6 peso) foi adicionada seguida por N-metil- diciclo-hexil-amina (0,53 peso). A mistura foi aquecida para 80°C. Com completitude, a mistura foi esfriada para 20°C.Uma pasta fluida de Celite (0,5 peso) em MTBE (3,70 peso) foi adicionada. A mistura foi filtrada e os sólidos foram lavados 3 vezes com MTBE (3,70 peso cada). Os filtrados combinados foram lavados com ácido clorídrico aquoso 1 N (5,1 peso), duas vezes com L- cisteína aquosa 5% em peso (5 peso), então cloreto de sódio aquoso 25% em peso (5,33 peso). O solvente foi concentrado sob pressão reduzida, dando o composto 012. 13C e 1H NMR de 012 são mostrados em Figuras 10A e 10B. Esquema 16: Macrolactonização

O álcool 012 (1 peso) foi dissolvido em THF (23 vol) e adicionado em uma solução fria de terc-butóxido de potássio 20% em peso em THF (0,88 vol) diluída com THF (19,7 vol.). Com completitude, uma solução de cloreto de terc-butil-dimetil-silila (0,33 peso) em THF (0,28 vol.) foi adicionada. Bicarbonato de sódio aquoso saturado (3,5 vol.) foi então adicionado, e o solvente foi removido sob pressão reduzida. O resíduo foi dissolvido com terc-butil-metil-éter (7 vol.) e a fase aquosa foi separada. A fase orgânica foi lavada com cloreto de sódio aquoso 25% em peso (8,4 vol.). O solvente foi evaporado sob pressão reduzida, dando o macrolídeo 009. Esquema 17: Composto 010
Composto 010 foi sintetizado a partir de composto 009 como descrito acima em Exemplo 1. Exemplo 3: Desproteção de 009 Esquema 18: Desproteção

Em uma solução de enona 009 (1,0 peso) em dicloro-metano (2,0 vol) e metanol (2,0 vol) foi adicionado fluoreto de potássio (0,16 peso). Com completitude, água (4,0 peso) e metil-terc-butil-éter (4,0 vol) foram adicionados. Após separação da camada aquosa, a fase orgânica foi lavada com cloreto de sódio aquoso 25% em peso, então concentrada sob pressão reduzida. O concentrado bruto foi extraído em solvente com 2-propanol (2,0 peso). O produto bruto 009a foi transformado em pasta fluida com metanol (5 vol) e aquecido para 65°C. A solução foi esfriada para -20°C. Os sólidos (67% de rendimento; P.F. 174-175°C) foram filtrados e lavados com metanol (5,0 vol) que fora pré-esfriado para -20°C. [Rendimento total a partir de 011 foi 29%]. 13C e 1H NMR de 009a são mostrados em Figuras 12A e 12B. Em uma solução de fenol 009a (1,0 peso) em dicloro-metano (8,0 peso) e água (0,2 peso) foi adicionado ácido trifluoro-metano-sulfônico (0,51 peso). A mistura reacional foi aquecida para 30°C. Com completitude, a reação foi interrompida com bicarbonato de sódio aquoso (5,0 peso), e terc-butil-metil- éter (6,0 peso) foi adicionado. A camada aquosa foi removida. A fase orgânica foi lavada com água (4,0 peso) e cloreto de sódio aquoso 25% em peso (4,0 peso). A fase orgânica foi bem filtrada, então concentrada sob pressão reduzida. O produto bruto foi extraído em solvente com 2-propanol (2,0 peso) e concentrado até a secura. O sólido bruto foi transformado em pasta fluida com 2-propanol (10 vol.). A mistura foi aquecida para 65°C. A solução foi então esfriada para a temperatura de 40°C e cristais semente foram adicionados. A mistura foi então esfriada para 0°C, e então os sólidos foram filtrados. Os sólidos foram lavados com 2-propanol (2,0 vol) pré- esfriado para -20°C. O bolo foi então seco, dando o composto 010 em 72,6% de rendimento (P.F. 157-159°C; rotação óptica +47° a 5 mg/mL em MeOH).