BR112015018360B1 - Combinação de ceftazidima, ou um sal farmaceuticamente aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo para o tratamento de pneumonia nosocomial - Google Patents
Combinação de ceftazidima, ou um sal farmaceuticamente aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo para o tratamento de pneumonia nosocomial Download PDFInfo
- Publication number
- BR112015018360B1 BR112015018360B1 BR112015018360-3A BR112015018360A BR112015018360B1 BR 112015018360 B1 BR112015018360 B1 BR 112015018360B1 BR 112015018360 A BR112015018360 A BR 112015018360A BR 112015018360 B1 BR112015018360 B1 BR 112015018360B1
- Authority
- BR
- Brazil
- Prior art keywords
- ceftazidime
- avibactam
- hours
- combination
- mic
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/439—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom the ring forming part of a bridged ring system, e.g. quinuclidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/529—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5383—1,4-Oxazines, e.g. morpholine ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/542—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame ortho- or peri-condensed with heterocyclic ring systems
- A61K31/545—Compounds containing 5-thia-1-azabicyclo [4.2.0] octane ring systems, i.e. compounds containing a ring system of the formula:, e.g. cephalosporins, cefaclor, or cephalexine
- A61K31/546—Compounds containing 5-thia-1-azabicyclo [4.2.0] octane ring systems, i.e. compounds containing a ring system of the formula:, e.g. cephalosporins, cefaclor, or cephalexine containing further heterocyclic rings, e.g. cephalothin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/65—Tetracyclines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/7036—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin having at least one amino group directly attached to the carbocyclic ring, e.g. streptomycin, gentamycin, amikacin, validamycin, fortimicins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/14—Peptides containing saccharide radicals; Derivatives thereof, e.g. bleomycin, phleomycin, muramylpeptides or vancomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Molecular Biology (AREA)
- Pulmonology (AREA)
- Dermatology (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Oncology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
TERAPIA DE COMBINAÇÃO PARA O TRATAMENTO DE PNEUMONIA NOSOCOMIAL. A presente invenção refere-se a um método de tratamento de pneumonia nosocomial, usando uma combinação de ceftazidima (uma cefalosporina de terceira geração) e avibactam (um novo inibidor de Beta-lactamase), opcionalmente com um ou mais agentes terapêuticos adicionais.
Description
[001] A presente invenção refere-se a um método de tratamento de pneumonia nosocomial usando a combinação de ceftazidima (uma cefalosporina de terceira geração) e avibactam (um novo inibidor de β- lactamase), opcionalmente com um ou mais agentes terapêuticos adicionais.
[002] A comunidade microbiológica internacional e de doença in fecciosa continua a expressar uma séria preocupação que a evolução contínua da resistência antibacteriana pode resultar em cepas bacteri- anas, em oposição aos agentes antibacterianos atualmente disponíveis, serão ineficazes. O resultado de tal ocorrência poderá ter considerável morbilidade e mortalidade.
[003] Na luta em oposição a infecção bacteriana, antibióticos de beta-lactama são essenciais. Beta-lactamas são uma ampla classe de fármacos em que todos têm beta-lactama em sua estrutura molecular de núcleo, e tipicamente mostram eficácia em oposição a um largo espectro de bactérias Gram-positivas e Gram-negativas, inibindo a síntese da parede da célula da bactéria. Por causa do alvo do fármaco não ter análogo eucariótico, sua toxicidade é baixa e eles são geralmente bem tolerados. Antibióticos de beta-lactama incluem derivados de penicilina (penamas), cefalosporinas, monobactamas e carbapenemas. Eles permanecem entre os fármacos mais amplamente prescritos, seguros e eficazes, e disponíveis para combater infecção bacteriana. Entretanto, sua eficácia é limitada pelas cepas infecciosas altamente re- sistentes tais como Staphylococcus aureus resistente à meticilina (MRSA) e cepas resistentes à multifármacos (MDR) de Pseudomonas aeruginosa, Acinetobacter baumannii, Escherichia coli, Klebsiella pneumonia, e outras Enterobacteriáceas. Tais bactérias resistentes são as principais causas de mobilidade e mortalidade do paciente. Hel- fand, β-lactamas Em oposição a 'Superbactérias' Emergentes: Progresso e Armadilhas, Expert Rev. Clin. Pharmacol. 1(4):559-571 (2008).
[004] Para ajudar a melhorar a eficácia de antibióticos beta- lactama, alguns inibidores de beta-lactamase têm sido desenvolvidos. Entretanto, os inibidores de β-lactamase atualmente disponíveis, em muitos casos são insuficientes para impedir a diversidade de β- lactamases constantemente aumentando. Os três agentes de serina beta-lactamase mais comuns atualmente usados - ácido clavulânico, tazobactama e sulbactama - têm atividade somente em oposição a certas enzimas de Classe A, que gravemente limitam suas utilidades. Inibidores de beta-lactamase mais novos, atualmente em experiências clínicas, tais como Avibactama, trabalham em ambas as enzimas de Classe A e C, com alguma eficácia limitada em oposição a betalactamases de Class D. Bebrone, et al., Current Challenges in Antimicrobial Chemoterapia: Focus on β-Lactamase Inhibition (Desafios Atuais em Quimioterapia Antimicrobiana: Foco na Inibição de β- Lactamase), Fármacos, 70(6) : 651- Antibióticos de beta-lactama, sós e em combinação como inibidores de beta-lactamase, continuam a representar uma porção essencial de agentes antibacterianos usados para combater doença. A resistência de β-lactama às infecções por Gram-negativos é principalmente dirigida pela atividade de β- lactamase; e a significativa dependência em antibióticos de β-lactama tem levado à diversificação e predominância aumentada de β- lactamases. Essas β-lactamases estão dirigindo resistência para até os mais novos antibióticos de β-lactama. Llarrull, et al., The Future of Beta-Lactamas, Current Opinion in Microbiologia (O Futuro de Beta- Lactamas, Opinião Atual em Microbiologia), 13 :551-557 (2010). β- lactanase de espectro prolongado (ESBL)-, AmpC-, KPC-, NDM- e OXA-48- produzindo Enterobacteriaceas como Acinetobacter bauman- nii e Pseudomonas aeruginosa, estão entre os patógenos nosocomiais mais importantes e frequentemente isolados, e são muitas vezes resistentes a muitas classes de antibióticos. D.M. Livermore, et al. Combinações de Atividadies de NXL104 com Ceftazidima e Aztreonam em Oposição a Carbapenemase-Produzindo Enterobacteriaceos, Quimioterapia de Agentes Antimicrobianos, 55 (2011), pp. 390-394; S. Mushtaq, et al., Atividade In Vitro de Ceftazidima + NXL104 Em oposição a Pseudômonas aeruginosa e outros não Fermentadores; J. Quimioterapia Antimicrobiana, 65(2010) 2376-381; A. Endimiani, et al., Atividade In Vitro de NXL104 em Combinação com β-Lactamas Em oposição a pneumonia Klebsiella, Isolados Produzindo KPC Carbape- nemases; Quimioterapia de Agentes Antimicrobianos, 53 (2009) 35993601 .
[005] Pneumonia nosocomial refere-se a qualquer pneumonia contraída por um paciente em um hospital pelo menos 48-72 horas depois de ser internado, e inclui pneumonia adquirida no hospital (HAP) e pneumonia associada a ventilador (VAP). Dos pacientes com infecções por pneumonia nosocomial, HAP é responsável por cerca de 70% de pacientes com pneumonia nosocomial, e os restantes, aproximadamente 30%, têm VAP. Em pacientes com HAP, as taxas de mortalidade hospitalar varia de 12-35% (Freire et al 2010; Chung et al 2011), mas as taxas atuais são muitas vezes associadas com condições subjacentes dos pacientes. Pacientes com VAP são reconhecidos como sendo a população mais gravemente enferma, com taxas de mortalidade que podem ser atribuídas, citadas na faixa de 33-50% (Am J Respir Crit Care Med, 2005, 171, pp388).
[006] Existe uma necessidade significativa, em pneumonia noso comial, por opções de um primeiro tratamento (empírico) que são mais eficazes para tratar os patógenos mais comumente encontrados em pneumonia nosocomial. A confirmação de patógenos demora até 48 horas, e em algumas instalações clínicas, tais como HAP, as taxas de detecção são relativamente baixas (cerca de 60%>) significando que a escolha do tratamento é feita na suspeita de patógeno e/ou na possibilidade de resistência. Existe uma necessidade significativa por opções de terapia empírica, que são mais eficazes para tratar os patógenos mais comumente encontrados em pneumonia nosocomial, como opções de tratamento existentes para patógenos Gram negativos, tendo níveis de susceptibilidade para patógenos resistentes chaves de abaixo de 80%>. Existem poucos agentes empíricos eficazes para tratar infecções por Gram negativos sérios (Pseudomonas aeruginosa, e pa- tógenos resistentes expressando Espectro Prolongado de β- Lactamases (ESBLs), ou Klebsiella pneumoniae Carbapenemases (KPCs). A diminuição da eficácia de opções terapêuticas empíricas existentes (por exemplo, carbapenemas, cefalosporinas) cria uma necessidade significativa de agentes, como a combinação de ceftazidi- ma-avibactam (CAZ-AVI), que comparada aos tratamentos estabelecidos é ativa versus um espectro mais expandido de patógenos difíceis de tratar e resistentes. Novos tratamentos tais como CAZ-AVI são necessários para uso empírico para aumentar as taxas de tratamento bem sucedidos nos pacientes em risco mais elevado de mortalidade e mobilidade, se a terapia empírica é inadequada.
[007] Foi surpreendentemente e inesperadamente descoberto que a combinação de CAZ-AVI provê uma excelente opção de tratamento para pacientes de pneumonia nosocomial. Enquanto o espectro in vitro desta combinação mostrou promessa para tartar as principais cepas bacterianas responsáveis por causar pneumonia nosocomial, nossas descobertas mostram que a combinação pode penetrar nos tecidos alvos em quantidades suficientes para eficazmente tratar a infecção.
[008] A presente invenção é dirigida para o uso de uma combina ção de ceftazidima e Avibactam para tratar pneumonia nosocomial, including HAP e VAP, opcionalmente em combinação com um ou mais agentes terapêuticos adicionais. A presente invenção é também dirigida para um método de tratamento de uma infecção por pneumonia nosocomial em um paciente com necessidade do mesmo, compreendendo administrar para o paciente uma quantidade eficaz da combinação de ceftazidima ou um sal da mesma farmaceuticamente aceitável, e Avibactam, ou um sal do mesmo farmaceuticamente aceitável. Em uma modalidade, esta combinação ainda compreende administrar a combinação com um ou mais agentes terapêuticos adicionais.
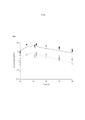
[009] Figura 1. Perfil do tempo de concentração de soro simula do de ser humano para 2000-500 mg de ceftazidima-avibactam a cada 8 horas, como uma infusão por 2 horas em homem, quando comparado com exposições de soro observadas em camundongos fêmeas ICR infectados e não infectados. A linha preta é a exposição de ceftazidima humana, círculos pretos são concentrações de soro de ceftazidima de camundongos infectados, quadrados pretos são concentrações de soro de ceftazidima de camundongos não infectados, e a linha pontilhada é a exposição de avibactam de ser humano, círculos brancos são concentrações de soro de avibactam de camundongos infectados, e quadrados brancos são as concentrações de soro de avibactam de camundongos não infectados.
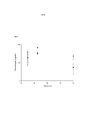
[0010] Figura 2. Perfil do tempo de concentração do fluido de re- vestimento epitelial (ELF) depois de doses simuladas de soro humano, de ceftazidima-avibactam de 2000-500 mg cada 8 horas com uma infusão de 2 horas em homem, observada em camundongos infectados e não infectados. Em A), os círculos pretos são concentrações de cef- tazidima ELF em camundongos ICR fêmeas infectadas; os quadrados pretos são concentrações de ceftazidima ELF em camundongos não infectados; em B), os triângulos pretos são as concentrações de avi- bactam ELF em camundongos infectados, e os diamantes pretos são concentrações de avibactam de ELF em camundongos não infectados.
[0011] Figura 3. O perfil do tempo de concentração de soro, de pois de doses de soro simuladas humanas de ceftazidima-avibactam de 2000-500 mg, cada 8 horas como um infusão de 2 horas em homem, quando comparado com aquele observado em camundongos ICR, fêmeas, infectados. A linha preta é uma exposição de ceftazidima humana, os círculos pretos são concentrações de soro de ceftazidima em camundongos, a linha pontilhada é a exposição de avibactam humano, e os triângulos brancos são concentrações de soro de avibac- tam em camundongos.
[0012] Figura 4. Perfil do tempo de concentração de fluido de re vestimento epitelial (ELF) depois de doses de soro de ser humano simulado de ceftazidima-avibactam de 2000-500 mg cada 8 horas como uma infusão de 2 horas em homem observadas em camundongos ICR fêmeas infectadas. Os círculos pretos são concentrações de ELF de ceftazidima em camundongos, e os quadrados pretos são as concentrações de ELF de avibactam.
[0013] Figura 5. A eficácia de doses de soro humano simulado de ceftazidima-avibactam de 2000-500 mg cada 8 horas como uma infusão de 2 horas, e associada a ELF fT>MIC em oposição a P. aeruginosa em modelos de infecção pulmonar neutropênica. (MICs de CAZ- AVI são mostrados entre parêntesis por cada nome de cepa). As bar- ras representam média ± SD
[0014] Figura 6. Perfil do tempo de concentração de soro, depois de doses de soro humano simuladas de 2000 mg de ceftazidima cada 8 horas, como uma infusão de 2 horas em homem, observada em camundongos ICR fêmeas, infectadas. Os círculos pretos são concentrações de soro de ceftazidima em camundongos, os quadrados pretos são as concentrações de ELF de ceftazidima em camundongos.
[0015] Figura 7. Eficácia de doses de soro humano simulado de 2000 mg de ceftazidima cada 8 horas, como uma infusão de 2 horas em oposição a P. aeruginosa, no modelo de infecção pulmonar neu- tropênica. (MICs de CAZ são mostrados entre parêntesis por cada nome de cepa). As barras representam a média ± SD
[0016] Figura 8. O perfil do tempo de concentração de soro depois de um regime de ceftazidima para produzir ELF fT>MIC direto, observado em camundongos ICR fêmeas, infectados. Os círculos pretos são concentrações de ceftazidima de soro em camundongos, os quadrados pretos são as concentrações de ceftazidima ELF em camundongos.
[0017] Figura 9. A eficácia das doses de soro humano simuladas de ceftazidima ELF fT>MIC dirigido e ELF fT>MIC associado, em oposição a P. aeruginosa no modelo de infecção de pulmão neutropênica. (MICs de CAZ são mostrados entre parêntesis por cada nome de cepa). As barras representam a média ± SD
[0018] Figura 10. Resposta da exposição de avibactam em ca mundongos infectados restritos, tratados com ceftazidima q2 horas: fracionamento de dose.
[0019] Figura 11: Resposta da exposição de avibactam em ca mundongos infectados restritos tratados com ceftazidima q2 horas para 6 cepas de P. aeruginosa.
[0020] Figura 12: Tratamento de camundongos de pulmão infec- tado, com dosagem de ceftazidima cada 2 horas e avibactam cada 2 ou 8 horas
[0021] Figura 13: Resposta da exposição de avibactam em ca mundongos de pulmão infectado, tratados com ceftazidima q2 horas: fracionamento de dose.
[0022] Figura 14: Resposta da exposição de avibactam em ca mundongos de pulmão infectado tratados com ceftazidima q2 horas por 4 cepas P. aeruginosa.
[0023] A combinação de CAZ-AVI demonstra atividade significativa em oposição a patógenos Gram negativos clinicamente importantes (por exemplo, P. aeruginosa e Enter obacteriaceae, incluindo as espécies K. pneumoniae, e Enterobacter), incluindo aqueles resistentes à espectro de cefalosporinas, piperacilina/tazobactam e carbapenemas prolongadas, através da produção de β-lactamase de ESBL, KPCs, AmpC ou OXA-48. CAZ-AVI também demonstra taxas mais altas de susceptibilidade versus padrão de antibióticos de cuidado em oposição a patógenos Gram negativos locais chaves (por exemplo, P. aeruginosa, e Enterobacteriaceae, incluindo K. pneumoniae) incluindo cepas resistentes aos antibióticos comumente usados, incluindo cepas resistentes a multifármacos.
[0024] Este espectro potente poderá prover cobertura eficaz po tencial para a vasta maioria de pacientes com infecções por pneumonia nosocomial, mas somente se os fármacos podem realmente penetrar no sítio da infecção a níveis clinicamente eficazes. Numerosos agentes com potencialmente relevante eficácia em patógenos não são capazes de eficazmente tratar infecções por pneumonia nosocomial, com base em suas incapacidades de chegar até o sítio da infecção (penetrar no fluido de revestimento epitelial (ELF)) em quantidades eficazes. Muitas vezes, a carga do fármaco deve ser significativamente aumentada para prover uma quantidade eficaz de fármaco para o sítio da infecção, que aumenta o potencial de efeitos colaterais sofridos pelo paciente, que por sua vez pode levar a uma não aceitação do plano de administração ou descontinuação do tratamento. Não só um tratamento potencial para pneumonia nosocomial requer penetração eficaz de ELF, mas um agente eficaz é também necessário para reter sua atividade antibacteriana na presença de um tensoativo de pulmão, e não sofrer interações fármaco-fármaco prejudiciais, com agentes terapêuticos adicionais que podem ser coadministrados ao paciente, em um regime de tratamento total. Qualquer um desses empecilhos consideráveis pode tornar um agente antibacteriano potencialmente atraente não disponível para o tratamento de infecções por pneumonia nosocomial tais como HAP e VAP.
[0025] Surpreendentemente e inesperadamente nós descobrimos que a combinação de CAZ-AVI tem o perfil requerido para tratar com sucesso infecções nosocomiais - não só ela provê um perfil atraente em oposição aos principais patógenos, que causam infecções por pneumonia nosocomial, mas ela pode eficazmente penetrar na ELF para alcançar o sítio da infecção, não perde a eficácia na presença de tensoativos do pulmão, e pode ser administrada com sucesso com muitos agentes comuns por um plano de tratamento total para esta população de pacientes extremamente doentes. O nível de penetração de avibactam para ELF de ser humano (aproximadamente 30%) e o fato de que o tensoativo do pulmão não impacta a eficácia de avibac- tam, para restaurar a atividade de ceftazidima no sítio de uma infecção de pneumonia nosocomial, ainda nos mesmos níveis de dose usados para tratar infecções em outros sítios no corpo, é surpreendende e representa um imenso avanço em opções de tratamento possíveis para pacientes de PN.
[0026] Em um aspecto da invenção está um método de tratar pneumonia nosocomial, em um paciente com necessidade do mesmo, compreendendo administrar para o paciente uma quantidade eficaz de ceftazidima, ou um sal farmaceuticamente aceitável do mesmo, e avi- bactam, ou um sal farmaceuticamente aceitável do mesmo.
[0027] Ceftazidima é penta-hidrato (6R,7R)-7-[[(2Z)-2-(2-amino-l,3- tiazol-4-il)-2-(l-hidróxi-2-metil-l-oxopropan-2-il)oxi-iminoacetil]amino]-8-oxo-3-(piridin-1-ium-1-ilmetil)-5-tia-1-azabiciclo[4.2.0]oct-2-eno-2- carboxilato. A estrutura química é ilustrada abaixo:
[0029] provê métodos para tratar infecções por pneumonia nosocomial, em pacientes com necessidade dos mesmos, provendo uma forma de do-sagem compreendendo cerca de 2000 mg de ceftazidima e cerca de 500 mg de avibactam. Nesta modalidade, a administração de uma forma de dosagem constitui administrar uma dose da combinação. Em um aspecto desta modalidade, o paciente recebe uma dose da combinação cada 8 horas. Em um aspecto desta modalidade, o paciente recebe cada dose da combinação através de uma infusão intravenosa. Em um aspecto desta modalidade, o paciente recebe cada dose da combinação através de infusão intravenosa, que é administrada durante o curso de aproximadamente duas horas. Em um aspecto desta modalidade, o paciente recebe cada dose da combinação através de uma infusão intravenosa, que é administrada durante o curso de apro-ximadamente uma hora. Em um aspecto desta modalidade, o paciente recebe a combinação em uma única infusão. Em um aspecto desta modalidade, o paciente recebe a combinação em uma série de infusões.
[0030] Em algumas modalidades, a presente invenção provê com posições consistindo essencialmente da combinação de ceftazidima e avibactam, ou um sal farmaceuticamente aceitável de um ou ambos os componentes da mesma. Em tais composições, ceftazidima e avibac- tam são os únicos ingredientes ativos. Um ingrediente ativo, como de-finido aqui, é um que é eficaz para o tratamento de infecções de pneumonia nosocomial. Tais composições podem ter outros ingredientes que são agentes antibacterianos, agentes antimicrobianos inativos e/ou não. Exemplos de tais ingredientes incluem, mas não são limitados a, um ou mais veículos, excipientes, aditivos farmaceuticamente aceitáveis, ou outros ingredientes úteis na formulação das composições.
[0031] Uma modalidade da invenção é a combinação de ceftazi- dima, ou um sal farmaceuticamente aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo, para uso como um medicamento.
[0032] Uma modalidade da invenção é a combinação de ceftazi- dima, ou um sal farmaceuticamente aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo, para uso no tratamento de uma infecção de pneumonia nosocomial. Em um aspecto desta modalidade, a combinação é para uso no tratamento de uma infecção de pneumonia nosocomial, que é causada por um ou mais patógenos que expressam uma ou mais beta-lactamase. Em um as-pecto desta modalidade, a combinação é usada para o tratamento de uma infecção de pneumonia nosocomial, que não é susceptível à cef- tazidima como uma monoterapia. Em um aspecto desta invenção, a combinação é usada para o tratamento de uma infecção de pneumonia nosocomial, que é pneumonia adquirida no hospital (HAP). Em um aspecto desta invenção, a combinação é usada para o tratamento de uma infecção de pneumonia nosocomial, que é pneumonia adquirida por ventilador (VAP).
[0033] Em uma modalidade da invenção, a combinação de cefta- zidima, ou um sal farmaceuticamente aceitável da mesma, e avibac- tam, ou um sal farmaceuticamente aceitável do mesmo, ainda com-preende um ou mais agentes terapêuticos adicionais. Em um aspecto desta modalidade, a combinação ainda compreende um agente tera-pêutico adicional, que é selecionado do grupo consistindo em agenes antibacterianos, inibidores de beta-lactamase e agentes antifúngicos. Em um aspecto desta modalidade, a combinação ainda compreende um agente antibacteriano selecionado do grupo consistindo em tobra- micina, levofloxacina, vancomiicina, linezolida, tigeciclina e colistina.
[0034] Em uma modalidade da invenção, a combinação de cefta- zidima, ou um sal farmaceuticamente aceitável da mesma, e avibac- tam, ou um sal farmaceuticamente aceitável do mesmo, são adminis-trados simultaneamente. Em outra modalidade da invenção, a combinação de ceftazidima, ou um sal farmaceuticamente aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo, são independentemente formulados e coadministrados. Em outra modalidade da invenção, a combinação de ceftazidima, ou um sal far- maceuticamente aceitável da mesma, e avibactam, ou um sal farma- ceuticamente aceitável do mesmo, são independentemente formula- dos e administrados sequencialmente. Em qualquer uma das modalidades acima da invenção, a combinação compreende cerca de 2000 mg de ceftazidima, ou um sal farmaceuticamente aceitável da mesma, e cerca de 500 mg de avibactam, ou um sal farmaceuticamente acei-tável do mesmo, por dose. Em um aspecto destas modalidades, a combinação é administrada aproximadamente a cada oito horas. Em um aspecto de qualquer uma destas modalidades, a combinação é administrada aproximadamente a cada doze horas.
[0035] Em uma modalidade da invenção, a combinação de cefta- zidima, ou um sal farmaceuticamente aceitável da mesma, e avibac- tam, ou um sal farmaceuticamente aceitável do mesmo, é administra-da intravenosamente. Em um aspecto desta modalidade, a combinação é administrada intravenosamente durante o curso de aproxima-damente 1 a 2 horas. Em um aspecto desta modalidade, a combinação é administrada intravenosamente durante o curso de aproxima-damente 1 hora. Em um aspecto diferente desta modalidade, a combinação é administrada intravenosamente durante o curso de 2 horas.
[0036] Qualquer uma das modalidades acima e aspectos das mo dalidades podem ser combinadas com qualquer outra para formar modalidades pretendidas adicionais da invenção.
[0037] Numerosas referências padrão estão disponíveis, que des crevem procedimentos para preparar várias composições apropriadas para administrar os compostos de acordo com a invenção. Exemplos de composições e preparações potenciais estão contidos, por exemplo, no Manual de Excipientes Farmacêuticos, Associação Farmacêu-tica Americana (edição atual); Formas de Dosagem Farmacêutica: Comprimidos (Lieberman, Lachman e Schwartz, editores) edição atual, publicada por Marcel Dekker, Inc., como também Ciências Farmacêuticas de Remington (Arthur Osol, editor), 1553-1593 (edição atual).
[0038] As composições podem ser sólidas ou líquidas e ser apre- sentadas nas formas farmacêuticas, tais como por exemplo, comprimidos simples ou revestidos de açúcar, cápsulas de gelatina, grânulos, supositórios, preparações injetáveis, unguentos, cremes, géis, e preparadas de acordo com os métodos usuais. O ingrediente ou ingredi-entes ativos podem ser incorporados com excipientes normalmente empregados nessas composições farmacêuticas, tais como talco, go-ma arábica, lactose, amido, estearato de magnésia, manteiga de cacau, veículos aquosos ou não aquosos, substâncias gordurosas de origem animal ou vegetal, derivados de parafina, glicóis, vários umidifi- cantes, agentes dispersantes ou emulsificantes e conservantes. Em uma modalidade da invenção, a dose da combinação de ceftazidima e avibactam é administrada intravenosamente.
[0039] As composições podem ser apresentadas na forma de um liofilisato destinado a ser dissolvido extemporaneamente em um veículo apropriado, por exemplo, água estéril apirogênica. Por exemplo, a composição pode ser formulada como uma forma de dosagem sólida, tal como um pó seco, para ser constituída com um diluente antes da administração. Em modalidades exemplares, a composição pode ser formulada como um pó seco compreendendo uma combinação de cef- tazidima e avibactam. O pó seco pode ser constituído com um diluente estéril, tal como água, para formar uma solução constituída antes da administração. O pH da solução constituída pode ser entre cerca de 4 e cerca de 10. Em outras modalidades, o pH da solução constituída pode ser entre cerca de 5,6 e cerca de 7. A solução constituída pode ainda ser diluída antes da administração usando uma solução apropri-ada, tal como uma solução de infusão. Exemplos de tais soluções de infusão são 0,9% de cloreto de sódio (soro normal), 5% de dextrose, 2,5% de dextrose e 0,45% de cloreto de sódio, e solução de Ringer lactada.
[0040] As composições podem ser formuladas em várias formas de dosagem oral líquida, incluindo soluções aquosas e não aquosas, emulsões, suspensões, xaropes, e elixires. Tais formas de dosagem podem também conter diluentes inertes apropriados conhecidos na técnica, tais como água e excipientes apropriados conhecidos na téc-nica tais como conservantes, agentes umidificantes, adoçantes, flavo- rizantes, como também agentes para emulsificar e/ou suspender os compostos da invenção. As composições da presente invenção podem ser injetadas, por exemplo, intravenosamente, na forma de uma solução estéril isotônica. Outras preparações são também possíveis.
[0041] Em algumas modalidades, os métodos podem incluir admi nistrar a combinação de ceftazidima e avibactam cada 4 horas, 6 horas, 8 horas, 12 horas, 18 horas ou cada 24 horas. Por exemplo, a combinação de ceftazidima e avibactam pode ser administrada cada 8 horas, intravenosamente, por infusão durante aproximadamente uma hora. Por exemplo, a combinação de ceftazidima e avibactam pode ser administrada cada 8 horas intravenosamente por infusão, durante aproximadamente duas horas. Em outras modalidades, os métodos podem incluir administrar a combinação de ceftazidima e avibactam através de infusão contínua ou prolongada. Por exemplo, a combinação de ceftazidima e avibactam pode ser administrada por infusão du-rante 3 horas, 4 horas, 5 horas, 6 horas, 7 horas, 8 horas, 9 horas, 10 horas, 11 horas ou 12 horas. Em outras modalidades, a duração da infusão pode ser mais de 12 horas, por exemplo, 13 horas, 14 horas, 15 horas, 16 horas, 17 horas, 18 horas, 19 horas, 20 horas, 21 horas ou 22 horas, 23 horas ou 24 horas.
[0042] A duração do tratamento pode depender da gravidade da infecção e do progresso clínico e biológico do paciente, como também quaisquer co-morbilidades que o paciente possa ter. Em algumas modalidades, o tratamento pode durar entre cerca de 5 a 14 dias. Em outras modalidades, o tratamento pode durar entre cerca de 5 a 7 dias. Por exemplo, cerca da combinação de cerca de 2000 mg de ceftazidi- ma e cerca de 500 mg de avibactam podem ser administradas cada 8 horas por cerca de cinco a quatorze dias. Em modalidades adicionais, cerca de 2000 mg de ceftazidima e cerca de 500 mg de avibactam podem ser administradas cada 8 horas por cerca de cinco a dez dias. Em outras modalidades, cerca de 2000 mg de ceftazidima e cerca de 500 mg de avibactam podem ser administradas cada 8 horas por cerca de cinco a sete dias.
[0043] O termo "cerca de" ou "aproximadamente" significa dentro de uma aceitável faixa de erro para o valor particular, como determinado por uma pessoa de conhecimento comum na técnica, que de-penderá em parte de como o valor é medido ou determinado, isto é, as limitações do sistema de medição. Por exemplo, "cerca de" pode significar dentro de 1 ou mais do que 1 desvio padrão, por prática na técnica. Alternativamente, "cerca de" em relação às composições pode significar mais ou menos uma faixa de até 20%, preferivelmente até 10%, mais preferivelmente até 5%. Alternativamente, particularmente em relação aos sistemas ou processos biológicos, o termoo pode significar dentro de uma ordem de magnitude, preferivelmente dentro de 5 vezes, e mais preferivelmente dentro de 2 vezes, um valor. Quando valores particulares são descritos nos pedidos e reivindicações, a menos que de outra maneira estabelecido, o termo "cerca de" significa dentro de uma faixa de erro aceitável para o valor particular. Por exemplo, quando se referindo a um período de tempo, por exemplo, horas, os presentes valores (± 20%) são mais aplicáveis. Desse modo, 6 horas pode ser, por exemplo, 4,8 horas, 5,5 horas, 6,5 horas, 7,2 horas, como também às 6 horas usuais.
[0044] O termos "trata," "tratamento," e "tratar" referem-se a um ou mais dos a seguir: mitigar ou aliviar pelo menos um sintoma de uma infecção bacteriana em um sujeito; mitigar ou aliviar a intensidade e/ou duração de uma manifestação da infecção bacteriana experimentada por um sujeito; e interromper, atrasar o começo (isto é, o período antes da manifestação clínica da infecção) e/ou reduzir o risco de desenvolver ou piorar uma infecção bacteriana.
[0045] O termo "terapeuticamente eficaz" aplicado para dose ou quantidade se refere àquela quantidade de um composto ou composição farmacêutica que é suficiente para resultar em uma atividade de-sejada mediante administração para um mamífero com necessidade do mesmo. Uma "quantidade eficaz" significa a quantidade de um composto de acordo com a invenção que, quando administrada para um paciente para tratar uma infecção ou doença é suficiente para efe-tuar tal tratamento. A "quantidade eficaz" vai variar dependendo do ingrediente ativo, o estado da infecção, doença ou condição a ser tra-tada e sua gravidade, e a idade, peso, condição física e reação do mamífero a ser tratado.
[0046] As cepas bacterianas usadas neste teste faziam parte da coleção de cultura microbiológica alojada em AstraZeneca R&D Boston (Coleção de Pesquisa AstraZeneca, designada ARC). O painel de isolados bacterianos usado para esse teste foi compreendido de cinco cepas de referência CLSI QC e o restante foi isolados clínicos recen-tes expressando β-lactamases, ou isolados dos painéis de varredura bacteriana primária.
[0047] Valores de MIC foram determinados usando a metodologia de microdiluição de caldo CLSI com ligeira variação. Placas mães de composto de estoque foram preparadas e usadas para marcar 2 μL de alíquotas de diluições de fármaco, de 2-vezes em série, para colunas 1-11 de placas filhas de 96- cavidades, usando um distribuidor Perkin- Elmer MiniTrak™ MultiPosition. A Coluna 12 não continha fármaco e serviu como um controle de crescimento. Um volume de inocular de 100 (5 x 10E5 CFU/mL) em CAMHB contendo 0, 1, 2,5, 5, ou 10% de tensoativo pulmonar, foi adicionado usando um multicanal Finnpipet- te® para cada poço da placa de 96 cavidades. Avibactam foi testado em uma concentração fixa de 4 μg/mL, quando testado em combinação com ceftazidima.
[0048] Os valores da concentração inibidora mínima (MIC), em oposição a cada combinação organismo/fármaco, foram determinados usando metodologia de microdiluição de caldo, de acordo com orientações de CLSI. As cepas bacterianas de referência recomendadas para cada grupo de teste e compostos de referência, foram incorporados em cada teste. Para Gram-negativas, as cepas bacterianas de referência foram Escherichia coli ATCC 25922, E. coli ATCC 35218, Klebsiella pneumoniae ATCC 700603, e Pseudomonas aeruginosa ATCC 27853. Staphylococcus aureus ATCC 29213 foi a cepa bacteriana de referência para as Gram-positivas.
[0049] Valores de MIC para isolados individuais foram visualmente lidos. Os MICs para cada composto ou combinação, em tensoativo pulmonar, foram comparados ao composto ou combinação testada em CAMHB só.
[0050] A atividade antibacteriana de ceftazidima, avibactam, cefta- zidima-avibactam, e daptomicina testada em concentrações variadas de CAMHB está listada na Tabela 1. Em vez de uma variação transi-ente de 2 vezes (+/-) ocasional em MIC, aumentos no MIC foram observados para ceftazidima, avibactam, ou ceftazidima-avibactam em oposição a quaisquer cepas bacterianas Gram-positivas ou Gram- negativas testadas em até de tensoativo pulmonar. Ao contrário, MICs de daptomicina aumentaram substancialmente (32 - a > 128- vezes) versus as cepas de S. aureus testadas. Tão pequeno quanto 1% de tensoativo pulmonar, resultou em um aumento de 32- vezes em MICs S. aureus de daptomicina.
[0051] Dados de MIC para ceftazidima, ceftazidima-avibactam e daptomicina versus cepas bacterianas de referência CLSI QC estão listados em Erro! Fonte de referência não encontrada. Valores de MIC para ceftazidima, ceftazidima-avibactam, e daptomicina estavam dentro das faixas de CLSI QC para cada cepa.
[0052] Nenhum aumento de MIC relacionado ao tensoativo foi ob servado para ceftazidima, avibactam, ou ceftazidima-avibactam, na presença de até 10% de tensoativo pulmonar, em oposição a quaisquer cepas bacterianas testadas. A atividade antibacteriana consistente de ceftazidima, avibactam, ceftazidima-avibactam, na presença de concentrações de tensoativo pulmonar variados, é notável especialmente para fármacos que podem ser considerados para tratar infecções respiratórias. Como esperado, MICs para o controle positivo de daptomicina aumentou significativamente em oposição a S. aureus, como a concentração de tensoativo pulmonar foi aumentada.
[0053] Um ensaio de tabuleiro quadriculado"checkerboard" foi usado para determinar qual, se houve alguma, interação entre ceftazi- dima e a combinação ceftazidima-avibactam tinha com seis agentes antibacterianos estabelecidos: tobramicina, levofloxacina, vancomici- na, linezolida, tigeciclina e colistina. O MIC de ceftazidima e ceftazidi- ma-avibactam, com e sem a presença desses agentes antibacterianos, em várias concentrações, foi comparado para dar uma série de valores de índice de concentração inibidora fracional (FICI). Uma media de FICI foi tirade de cada combinação tabuleiro quadriculado e interpretada de acordo com critérios aceitos. Quando agentes antibacterianos não tiveram efeito (vancomicina e linezolida em oposição a isolados Gram negativos; colistina em oposição a isolados Gram positivos) o MIC sozinho de ceftazidima e ceftazidima-avibactam foi comparado com o MIC em combinação com os CmaX e 0,5 x Cmax desses agentes antibacterianos. Quatro AmpC altamente expressos, oito betalactamase (ESBL) prolongados, incluindo dois CTX-M-15 e cinco KPC, produzindo Enterobacteriaceae e P. aeruginosa, foram incluídos como também representantes de cada espécie, com MICs basal. Três S. aureus e três E. faecalis foram também incluídos. Nenhuma interação, sinergística ou antagonística, entre ceftazidima ou ceftazidima- avibactam e qualquer outro agente antibacteriano foi observada. A partir deste experimento, foi concluído que ceftazidima e ceftazidima- avibactam não vão interagir adversamente microbiologicamente com qualquer um dos fármacos testados, quando usadas em combinação. Tabela 2:
[0054] Tobramicina, Levofloxacina, Vancomicina e Colistina foram supridos por Sigma-Aldrich (Dorset, Reino Unido). Linezolida e Tigeci- clina foram supridos por Molekula (Dorset, Reino Unido).
[0055] Todas as determinações de MIC, incluindo aquelas realiza das no ensaio de tabuleiro quadriculado feito com caldo de Mueller- Hinton de cátion ajustado (comprado de Becton Dickinson, Oxford UK).
[0056] Dados de MIC iniciais foram determinados por métodos de diluição de microcaldo, como recomendado por CLSI (2012b). Tabuleiros quadriculados foram feitos de acordo com o método dado por Pillai et.al., (Combinações Antimicrobianas em Antibióticos, LABORATÓRIO DE MEDICINA (Lorian Ed., --- Ed. (2003)) p. 365-440 as per testes de diluição de microcaldo padrão, mas com agentes em combinação.
[0057] Soluções de estoque foram feitas e diluídas em série no caldo Mueller-Hinton de cátion ajustado com concentrações em quatro vezes como requerido, exceto ceftazidima-avibactam caracterizado pelo fato de que ambos os agentes foram feitos em oito vezes na concentração requerida, por conta das diluições antibacterianas a serem feitas. Uma concentração final de avibactam de 4 mg/L foi usada por todo o estudo. Agentes antibacterianos foram combinados em placas de microtitulação usando o sistema de manuseio líquido Evolution III.
[0058] No caso de isolados Gram-negativos, em oposição a van- comicina e linezolida, o MIC sozinho de ceftazidima e ceftazidima- avibactam foi comparado com o MIC na presença de Cmax e 0,5 x Cmax de vancomicina (Baxter Healthcare Corp., 2008) e linezolida (MacGowan, Perfil de Farmacocinéticos e Farmacodinâmicos de Line- zolida em Voluntários Saudáveis e Pacientes com Infecções Gram- Positivas, JAC, 51 (Sup S2):iil7-1125 (2003)).
[0059] No caso de isolados Gram-positivos, em oposição a colisti- na, o MIC sozinho de ceftazidima e ceftazidima-avibactam foi comparado com o MIC na presença de Cmax e 0,5 x Cmax de colistina, como referido em Couet et.al, Microbiologia Clínica e Infecção, Farmacociné- ticos de Colistina: o Nevoeiro está Subindo, CMI 18:30-39 (2011).
[0060] Placas de tabuleiro quadriculado foram inoculadas e incu badas de acordo com com orientações de CLSI (2012b) a 35±2°C no ar ambiente por 16-20 horas. MICs foram registrados no dia seguinte com a concentração mais baixa ou combinação de concentrações requeridas para inibir todo crescimento visível.
[0061] A partir dos dados de MIC, FICIs foram calculados para ca da tabuleiro quadriculado, de acordo com o método de Meletiadis et.al, Definindo Suspensões do Índice de Concentração Inibidora Fracional para Interações de Aditivos Baseadas nas Combinações Aditivas de Auto-Fármaco, Análise de Simulação de Monte Carlo e Dados de Cor-relação in vitro - in vivo para Combinações de Fármacos Antifúngicos em oposição a Aspergillus fumigatus, AAC 54:602-09 (2010). Cada poço correspondente a um MIC tinha um FICI calculado pela fórmula a seguir:
[0062] Quando MICA é o MIC do agente de combinação antimicro bial sozinho, e MICB é o MIC de ceftazidima ou ceftazidima-avibactam só. CA é a concentração do fármaco de combinação em combinação, e CB é a concentração de ceftazidima ou ceftazidima-avibactam em combinação. Como cada tabuleiro quadriculado dá um número de va-lores de FICI, uma média aritmética é calculada de todos os valores para dar a média FICI para dois agentes combinados, em oposição a um isolado. As médias de FICIs foram interpretadas pelos critérios a seguir dados por Odds (2003), que são agora os critérios aceitos pela maioria dos diários:
[0063] A ampla variação de FICI para interpretar interações indife rentes é devida à variabilidade inerente de resultados de MIC em esquemas de diluição em duplicação (Pillai et al. 2005). Meletiadis et al. (2010) sugere que um FICI de mais do que 2 deverá ser interpretado como antagonístico, mas tais interpretações devem ser tratadas com cuidado devido a essa variabilidade.
[0064] O sumário de dados de MIC é mostrado na Tabela 3. Su mário da média de dados de FICI é mostrado na Tabela 4. Proporções de MIC de ceftazidima/ceftazidima-avibactam sozinhos e em combinação foram cálculos de FICI e não são possíveis, como mostrado na Tabela 5.
[0065] A média de variação de FICI para ceftazidima combinada com um segundo agente, para todos os agentes antibacterianos, em que ele foi calculado, foi 0,64 a 1,99.
[0066] Não houve casos de uma média de FICI de mais do que 2, em todas as combinações com ceftazidima.
[0067] Quando Cmax e 0,5 x Cmax de vancomicina e linezolida foram combinados com ceftazidima, em oposição a isolados Gram-negativos, o MIC de ceftazidima só e em combinação permaneceu dentro de uma diluição dupla em todos os casos. Similarmente, quando Cmax e 0,5 x Cmax de colistina foram combinados com ceftazidima, em oposição aos isolados Gram-positivos, o MIC de ceftazidima, só e em combinação, permaneceu dentro de uma diluição dupla em todos os casos. Ceftazidima-avibactam
[0068] A média da faixa de FICI para ceftazidima-avibactam com binados com todos os agentes antibacterianos foi 0,72 a 2,13.
[0069] Ceftazidima-avibactam em combinação com colistina em oposição a K. pneumoniae 012, deu um FICI médio de 2,13. Esse foi o único exemplo de uma média de FICI de mais do que 2 para todas as combinaçãos com ceftazidima-avibactam.
[0070] Quando os Cmax e 0,5 x Cmax de vancomicina e linezolida foram combinados com ceftazidima-avibactam, em oposição a isolados Gram-negativos, o MIC de ceftazidima-avibactam só e em combi- nação permaneceu dentro de uma diluição dupla em todos os casos, exceto um. Neste caso (E. coli 08) o MIC de ceftazidima-avibactam reduziu de 0,12mg/L para 0,03mg/L quando em combinação com o Cmax de vancomicina. Qundo o Cmax e 0,5 x Cmax de colistina foram combinados com ceftazidima-avibactam, em oposição a isolados Gram-positivos, o MIC de ceftazidima-avibactam só e em combinação permaneceram dentro uma diluição dupla em todos os casos.
[001] Estudos farmacocinéticos foram realizados para descrever a disposição pulmonar de ceftazidima-avibactam, dentro de camun-dongos infectados e não infectados. Depois, estudos da eficácia de ceftazidima e ceftazidima-avibactam, em oposição a isolados de Pseudomonas aeruginosa, foram empreendidos usando o modelo de infecção neutropênica do pulmão. Entre camundongos infectados e não infectados, não houve difereças farmacocinéticas observadas no soro ou ELF. Usando doses de soro humano simuladas de 2000 mg de ceftazidima e 500 mg de avibactam, como uma infusão de 2 horas, atividade máxima foi observada em oposição a aqueles isolados com MICs de 32 μg/mL, caracterizado pelo fato de que ELF fT>MIC > 19% para 95% de intervalo de confiança superior. Em vista do MIC90 para ceftazidima-avibactam ser 8 μg/mL, existem poucos isolados com MICs mais altos e ainda menos do que são capazes de crescer dentro do modelo de infecção de pulmão de murino. Como tal, estudos de ELF fT>MIC dirigidos para ceftazidima foram conduzidos e mostraram atividade em oposição a MICs de 32 μg/mL, em que ELF fT>MIC foi 12%.
[002] Camundongos ICR fêmeas sem patógenos, pesando apro ximadamente 25 g, foram adquiridos de Harlan Sprague Dawley, Inc. (Indianapolis, IN) e utilizados em todos esses experimentos. Os animais foram mantidos e usados de acordo com as recomendações do Conselho Nacional de Pesquisas, e provido alimento e água ad libitum. Os camundongos foram tornados neutropênicos com 100 e 250 mg/kg de injeções intraperitoneais de ciclofosfamida (Cytoxan®; Bristol-Myers Squibb, Princeton, NJ) dadas um e quatro dias antes da inoculação, respectivamente. Três dias antes da inoculação, os camundongos re-ceberam também uma única injeção intraperitoneal de 5 mg/kg de ni- trato de uranil. Isto produz um grau previsível de comprometimento renal para diminuir a depuração do fármaco. Duas horas antes do início da terapia antimicrobiana, os camundongos foram ligeiramente anestesiados usando isofluorano (2,5% em v/v a 100%) veículo de oxigênio) até a taxa respiratória ter diminuído mediante inspeção visual. A pneumonia foi induzida pela instilação de 0,05 mL de um inocu- lante 107 CFU do isolado de teste suspenso em 3%> murino em salino normal. Enquanto o camundongo é anestesiado, a inoculação é distribuída na cavidade oral dos animais, bloqueando as narinas e mantendo o camundongo em uma posição vertical. A aspiração de bactérias nos pulmões ocorreu quando os animais começaram a respirar espontaneamente. Depois de esperar total recuperação da anestesia em uma câmara enriquecida de oxigênio, os camundongos inoculados foram randomizados em grupos de controle (0 hora e 24 horas) e grupos de tratamento (CAZ e CAZ-AVI).
[003] Nesses estudos, nós utilizamos o regime de dosagem ante riormente determinado descrito acima.
[004] Estudos farmacocinéticos de soro confirmadores foram em preendidos em camundongos infectados. Para esses estudos, camun-dongos neutropênicos infectados foram dosados com o regime calculado acima, e grupos de seis camundongos foram submetidos à euta- nasia em múltiplos pontos de tempo, em todo um período de 24 horas para confirmar exposições alvos. O sangue foi coletado através de pulsão cardíaca e as amostras de sangue foram armazenadas a -80 C° até análise. Os estudos farmacocinéticos foram empreendidos para descrever as concentrações de fluidos do revestimento epitelial nos camundongos infectados. Para esses estudos, camundongos neu- tropêncios infectados foram dosados com o regime calculado acima, e grupos de seis camundongos foram submetidos à eutanásia em múltiplos pontos ao longo de todo o terceiro período de dosagem (isto é, 16-24 horas). Uma vez submetidos à eutanásia, soro e amostras de BAL foram coletados como descritoa cima. Soro e amostras de BAL foram armazenados a -80 C° até análise. Utilizando o perfil do tempo de concentração de BAL, o ELF fT>MIC foi calculado incluindo o intervalo de confiança 95% superior.
[005] Foi utilizado um regime de dosagem anteriormente deter minado, em camundongos, que simulou o soro fT>MIC observado em homem em vista de 2000 mg de ceftazidima cada 8 horas como uma infusão de 2 horas (8). Estudos farmacocinéticos confirmadores foram empreendidos em camundongos infectados e análises farmacodinâmi- cas e uma avaliação de ELF fT>MIC foi feita a partir do perfil do tempo de concentração resultante. Para estes estudos, camundongos neu- tropênicos infectados foram dosados com o regime calculado acima e grupos de seis camundongos foram submetidos à eutanásia em múltiplos pontos de tempo por todo o intervalo de dosagem (isto é, 16-24 horas) para confirmar exposições alvos.
[006] Estudos farmacinéticos foram empreendidos para descre ver as concentrações de fluidos do revestimento epitelial em camun-dongos infectados. Para esses estudos, camundongos neutropênicos infectados foram dosados com o regime calculado acima e grupos de seis camundongos foram submetidos à eutanásia em múltiplos pontos de tempo, em todo o terceiro período de dosagem (isto é, 16-24 horas). Uma vez submetidos à eutanásia, soro e amostras de BAL foram coletados como descrito acima. Soro e amostras de BAL foram armazenados a -80 C° até análise. Utilizando o perfil de tempo de concentração de BAL, o ELF fT>MIC foi calculado incluindo o intervalo de confiança 95% superior.
[007] Foi observado nos estudos de supervisão que o MIC90 para ceftazidima-avibactam em oposição a P. aeruginosa é 8 μg/mL (1012). Em vista disto, existem poucos isolados com MICs mais altos e o número que cresceria dentro do modelo de infecção de pulmão de mu- rino é ainda menos. A literatura anterior também descobriu alvos de eficácia de fT>MIC de sangue derivado para ceftazidima-avibactam em oposição a P. aeruginosa, bem correlacionados com aqueles obtidos para monoterapia de ceftazidima, como também outras cefalosporinas. Em vista de MICs relativos para ceftazidima estarem prontamente >32 μg/mL, foi planejado usar o regime de ceftazidima humanizada descrito acima para prover ainda percepção da ruptura farmacodinâmica, entre eficácia e crescimento bacteriano. Foi observado durante os ex-perimentos, que o ELF fT>MIC era significativamente mais do que es-perado e produziu ELF fT>MIC, que não nos permitiu diferenciar um fT>MIC necessário para eficácia. Como tal, esses estudos foram con-duzidos para projetar um regime em camundongos que resultou em ELF fT>MIC suficientemente baixo de maneira que fomos capazes de observar uma perda de eficiência dentro do modelo de infecção do pulmão. Doses do regime antecipadamente humanizado, descrito acima, foram diminuídas em todo o período de dosagem, e estudos far- macocinéticos adicionais foram realizados. Nesses estudos, os ca-mundongos foram dosados em um regime de ceftazidima durante um período de 24 horas, e a amostragem teve lugar durante o último dos três intervalos (isto é, 16-24 horas). Os camundongos foram submetidos à eutanásia e soro e amostras de BAL foram coletados, como descrito acima, em tempos pré-determinados.
[008] Para cada um dos 28 isolados de P. aeruginosa, grupos de camundongos foram administrados regimes de ceftazidima-avibactam, começando duas horas depois do início da infecção. Todas as doses foram administradas como injeções subcutâneas de 0,2 mL, e consisti-ram de três intervalos de 8 horas (isto é, 24 horas). Para servir como animais de controle, foram administrados para um grupo adicional de camundongos salina normal no mesmo volume, via, e frequência como o regime de tratamento. Os pulmões de todos os animais foram colhidos 24 horas depois do início da terapia; camundongos que não conseguiram sobreviver por 24 horas, foram coletados na hora da expiração. O procedimento de coleta de todos os camundongos para estudo começou com submissão à eutanásia, por exposição a CO2 seguida de deslocamento cervical. Depois do sacrifício, os pulmões foram re-movidos e individualmente homogeneizados em salina normal. Diluições em série do pulmão homogeneizado foram plaqueados em ágar de soja tríptico com 5% de sangue de carneiro para determinação de CFU. Além do que foi mencinado acima, grupos de tratamento e control, outro grupo de 6 camundongos infectados, não tratados foram colhidos no início da dosagem e servidos como controles de 0 hora. Eficácia, designada como a troca em densidade bacteriana, foi calculada como a troca em CFU bacteriana de log10 obtida para camundongos tratados depois de 24 horas a partir daquela das densidades de partida observada em animais de controle de 0 hora. O desenvolvimento da resistência foi também testado plaqueando um inoculador direto do homogenato nas placas contendo 32-4 μg/mL de ceftazidima- avibactam.
[009] Nove isolados de P. aeruginosa foram testados em oposi ção a esse regime de ceftazidima antes descrito (8). Grupos de ca-mundongos receberam administração do regime de ceftazidima come- çando duas horas depois do início da infecção. Todas as doses foram administradas como 0,2 mL de injeções subcutâneas e consistiram de três intervalos de dosagem de 8 horas (isto é, 24 horas). Para servir como animais de controle, um grupo adicional de camundongos recebeu a administração de salina normal no mesmo volume, via, e frequência como o regime de tratamento. Colheita e processamento de pulmões de cada animal foram feitos com anteriormente descrito, e a eficácia foi definida como a troca em densidade bacteriana, calculada como a troca em CFU bacteriana log10 obtida para tratar camundongos depois de 24 horas daquela das densidades de partida observada em animais de controle à 0 hora.
[0010] Para estes estudos, 9 isolados de P. aeruginosa foram ava liados, em oposição ao regime de CAZ, em camundongos que renderam ELF fT>MIC específico. As doses foram iniciadas 2 horas depois da inoculação dos organismos de teste e todas as doses foram admi-nistradas como injeções subcutâneas de 0,2mL e consistiram de três intervalos de dosagem de 8 horas (isto é, 24 horas). Para servir como animais de controle, foi administrada para um grupo adicional de ca-mundongos uma salina normal no mesmo volume, via, e frequência como o regime de tratamento. O procedimento de colheita para todos os camundongos do estudo começou coma submissão à eutanásia por exposião a C02 seguida pelo deslocamento cervical. Depois dosacrifí- cio, os pulmões foram removidos e individualmente homogeneizados em salina normal. As diluições em série do homogenate do pulmão foram plaqueadas em ágar de soja tríptico com 5% de sangue de carneiro para determinação de CFU. Em adição aos grupos de tratamento e controle mencionados acima, outro grupo de 6 camundongos infectados, não tratados foi colhido no início da dosagem e servido como controles de 0 hora. A eficácia, designada como a mudança na densi- dade bacteriana, foi calculada como a mudança em CFU bacteriana log10 obtida para camundongos tratados, depois de 24 horas a partir daquela das dnsidades de partida observada em animais de controle de 0 hora.
[0011] Ceftazidima comercialmente disponível (Fortaz®, Lote: L716, GlaxoSmithKline Research Triangle Park, NC, USA) foi obtida do Departamento de Farmácia do Hospital Hartford e utilizada para todos os estudos in vivo, avibactam de grau analítico foi feito por AstraZeneca Pharmaceuticals (Waltham, MA, USA). Frascos clínicos de ceftazidima foram reconstituidos como descrito na informação de prescrição, e diluído como apropriado para realizar as concentrações desejadas; pós de avibactam analítico foram pesados em uma quantidade suficiente para realizar as concentrações requeridas e reconstituidos imediatamente antes de usar.
[0012] Os MICs de ceftazidima e ceftazidima-avibactam para os 28 isolados incluidos nos estudos de eficácia são mostrados na Tabela 6. Tabela 6: Dados de fenótipos para os 29 isolados Gram-negativos utilizados durante estudos da eficácia in vivo.
CAZ: ceftazidima; CAZ-AVI: ceftazidima-avibactam; fT>MIC: estudos de ELF fT>MIC dirigidos
[0013] Os perfis de soro de fármaco livre e tempo de concentração de ELF, determinados in vivo para ceftazidima-avibactam em camun-dongos infectados e não infectados, são mostrados na Figura 1 e Figura 2. As proporções de penetração para camundongos infectados e não infectados foram similares uma a outra, como descrito na Tabela 7. Ainda, o princípio farmacodinâmico calculado, fT>MIC foi comparável entre camundongos infectados e não infectados (Tabela 8). Tabela 7. Proporções de penetração do ponto de fluido de revestimento epitelial (ELF) para ceftazidima e avibactam sobre o terceiro intervalo de dosagem (isto é, 16-24 horas) comparado com concentrações de soro em camundongos infectados e não infectados. Proporções de Penetração do Ponto de ELF para Ceftazidima e Avi- bactam Tabela 8: Estimativa de farmacodinâmica de soro e fluido de revestimento epitelial (ELF) para ceftazidima e avibactam, depois de doses de soro simuladas por ser humano de 2000-500 mg de ceftazidima- avibactam cada 8 horas como uma infusão de 2 horas em homem, quando comparado com aquela observada em camundongos infectados e não infectados. Caracterização de Concentrações de Fulido de Revestimento Epitelial (ELF) para Ceftazidima-Avibactam
[0014] Os perfis farmacocinéticos de soro de fármaco livre deter minados in vivo para ceftazidima-avibactam são mostrados na Figura 3. Está claro a partir destas figuras que os perfis de exposição ao soro de murino são similares àqueles observados em seres humanos, de modo importante, todo o fT>MIC no soro alcançado por esses regimes testados ao longo da faixa de MICs foram comparáveis. As concentrações de ELF, durante o terceiro intervalo de dosagem são mostrados na Figura 4. A partir desses dados, os valores de fT>MIC foram determinados em oposição a uma faixa de MICs. O intervalo de confiança 95% médio e superior são descritos na Figura 5.
[0015] Os perfis farmacocinéticos ELF e soro de fármaco livre de terminados in vivo paara ceftazidima são mostrados na Figura 6. Durante a condução dos estudos, foi determinado que este regime não produziria faixa suficiente de fT>MIC dentro de ELF para observar a ruptura em eficácia. Como tal, os dados da eficácia descritos e ilustra-dos na Tabela 9 e Figura 7 naão foram usados para quaisquer determinações farmacodinâmicas. Tabela 9: Resultados dos estudos in vivo da eficácia utilizando o regime de ceftazidima no modelo de infecção de pulmão neutropênica. *Dados de Controle de 0 hora representativos da densidade bacteriana no início da dosagem.
Determinação do regime de dosagem por estudos dirigidos de ELF fT>MIC para Ceftazidima
[0016] O perfil farmacocinético de fármaco livre determinado in vi vo para ceftazidima só, é mostrado na Figura 8. Ainda as concentrações de ELF, durante o terceiro intervalo de dosagem para o regime acima, são também mostrados na Figura 8. A partir desses dados, os valores de fT>MIC foram determinados em oposição a uma faixa de MICs. A média e o intervalo de confiança 95% superior são descritos na Figura 9.
[0017] Os estudos foram conduzidos em animais neutropênicos. As respectivas densidades bacterianas em camundongos de controle, no início da dosagem foram 5,98 ± ,44 de CFU log10, aumentando para 9,13 ± 0,80 de CFU log10 depois de 24 horas. Resultados dos estudos neutropênicos são mostrados na Tabela 10 e Figura 5. Em oposição a coleção de P. aeruginosa, foi observada a atividade para ceftazidima- avibactam em oposição a isolatos com MICs de 32 μg/mL e menos, com exceção de um isolado de um MIC de 64 μg/mL. A atividade não foi observada em oposição ao isolado só com um an MIC de 64 μg/mL. Depois de plaquear o homogenato direto no fármaco contendo placas, nenhum crescimento foi observado significando nanhum desenvolvi- mentoi da presente resistência. Tabela 10. Resultados dos estudos de eficácia in vivo utilizando o regime de ceftazidima-avibactam no modelo de infecção pulmonar neu- tropênica. *Dados de controle de 0 h representativos da densidade bacteriana no início da dosagem.
Eficácia in vivo: Estudos de ELF fT>MIC dirigidos para ceftazidima
[0018] Os resultados dos estudos dirigidos da eficácia de ELF fT>MIC são mostrados na Tabela 11 e Figura 9. Os estudos foram conduzidos em animais neutropênicos. Respectivas densidades bacte- rianas nos camundongos de controle, no início da dosagem, foram 5,89 ± 0,30 e CFU log10, aumentando para 8,75 ± 0,93 e CFU log10 depois de 24 horas. Os isolados foram escolhidos com base no MIC de ceftazidima, entre a faixa de 32 e 128 μg/mL. A atividade foi obser-vada em oposição àqueles isoladois com MICs de 32 μg/mL. A eficácia foi variável oposição a isolados com MICs de 64 μg/mL; isolados com MICs de 128 μg/mL viram pouca a nenhuma atividade, usando o regime de monoterapia de ceftazidima. Tabela 11: Resultados dos estudos da eficácia in vivo utilizando o re- gime direto de ceftazidima de ELF fT>MIC no modelo de infecção pulmonar neutropênica. *Dados de controle de 0 hora representativos da densidade bacteriana no início da dosagem.
[0019] Dentro do modelo de infecção pulmonar de murino, a com binação de ceftazidima-avibactam produz concentrações consideráveis, dentro do pulmão irrespectivo do estado imune do hospedeiro. Utilizando um regime de ceftazidima-avibactam anteriormente determinado, foi observada a eficácia em oposição àqueles isolados com < 32 μg/mL de MICs, caracterizado pelo fato de que ELF fT>MIC > 19%. Em vista dessas observações, a necessidade de fT>MIC dentro do pulmão, pode ser menos do que anteriormente pensado para cefalos- porinas, aproximadamente 60%. Certamente onde não há ELF fT>MIC notados, em MICs de 64 μg/mL para a combinação, ceftazidima- avibactam não produz eficácia. Os resultados de ELF fT>MIC direto de ceftazidima, também demonstraram que isto pode ser verdade com a atividade observada em oposição a MICs de 32 μg/mL, caracterizado pelo fato de que ELF fT>MIC é 12% e variável para nenhuma atividade em MICs de 64 e 128 μg/mL.
[0020] Camundongos neutropênicos de CD-1 foram infectados com aproximadamente 106 cfu β-lactamase produzindo cepas de P. aeruginosa no fêmur. O tratamento foi iniciado 2 horas depois com cef- tazidima só (q2 horas com várias doses) por 24 horas e cfu determinado no fêmur para estabelecer sua relação de reação à exposição. Es-tudos de fracionamento de dose completa de avibactam fora realizados por 2 cepas (MICS de ceftazidima e 64 mg/L). A reação à exposi-ção de avibactam q2 horas foi determinada por outras 6 cepas de P. aeruginosa (64-128 mg/mL de MICs de ceftazidima). O modelo de Emax foi ajustado para as respostas à dose e ao índice de PK/PD (PDI) para determinar os valores de PDI de ceftazidima só ou em combinação com avibactam resultando em um efeito estático, matar 1- e 2-log10. Para avibactam o % de tempo do intervalo de dosagem acima de um MIC virtual in vivo (concentrações de limiar, CT) % de fT>CT foram calculadas (CT de 0,25, 1 e 4 mg/L).
[0021] O % estático de fT>MIC de ceftazidima para monoterapia foi entre 0 e 38%, com algumas cepas requerendo o mais baixo % de fT>MICs. Avibactam reduziu o % de fT>MIC da estática de ceftazidima para todas as cepas. Nos estudos de fracionamento da dose, a melhor correlação de PDI para avibactam foi observada para % fT>CT de 1mg/L. Em um CT de 1 mg/L, um % de fT>CT de 30.2-74.1 foi requerido. Para outras 6 cepas a média do % fT>CT 1 mg/L foi 36,3% (14,162,5). As estimativas requeridas para um efeito estático foram parcialmente dependentes da dose de ceftazidima (um valor mais baixo requerido, se a dose de ceftazidima foi mais alta). O efeito de avibactam foi principalmente dependente do % de fT>CT 1 mg/L do limiar de tempo acima, com um valor médio de 36,3%, quando em vista de concomitantemente com ceftazidima. Exposições relativamente mais altas foram requeridas em doses mais baixas de ceftazidima.
[0022] Ceftazidima (CAZ)
[0023] Providos por AstraZeneca (ex GSK)
[0024] Lote no. : G263770,
[0025] Data de expedição: 05 de dezembro de 2012
[0026] Date de Fabricação: 6 de dezembro de 2010
[0027] CAS no: 78439-06-2
[0028] Potência: 77,2%
[0029] Avibactam
[0030] AstraZeneca (ex Dr Reddy)
[0031] Lote no.: AFCH005151 (07113P028), Número analítico: A1002CQ055
[0032] Data de expedição: março de 2013
[0033] Potência: 91,7%
[0034] Sete cepas de Pseudomonas aeruginosa resistentes a cef- tazidima bem caracterizas, obtidas de uma variedade de fontes clinicamente relevantes, foram usadas nos experimentos como mostrado na Tabela 1. MICs foram tirados de um estudo adiantado de tabuleiro quadriculado in vitro (Berkhout & Mouton 2013 CAZ-AVI-M 1-061) e foram determinados por microdiluição, de acordo com as orientações de ISO- (ISO 2006). Este método é compatível com o CLSI.
[0035] Camundongos CD-I fêmeas desenvolvidas (outbred) (Char les River, Netherlands), 4 a 5 semanas de idade, pesando 20 a 25 g, foram usadas nos experimentos. Granulocitopenia foi induzida por du-as doses de ciclofosfamida s.c : uma em quatro dias (150 mg/kg) e a outra em um dia (100 mg/kg) antes do experimento de infecção.
[0036] Os animais foram abrigados sob condições padrão com su primento de bebida e alimentação ad libitum, e foram examinados uma vez por dia e, depois da imunossupressão, 2-3 vezes por dia. Os estudos dos animais foram conduzidos de acordo com as recomendações da European Community (Comunidade Européia) (Diretriz 86/609/EEC, 24 de novembro de 1986), e todos os procedimentos nos animais foram arovados pelo Comitê de do Bem-estar dos Animais da Universidade de Radboud (RU-DEC 2012-003).
[0037] Os camundongos neutropênicos foram infectados com duas cepas de P. aeruginosa por animal, uma na coxa esquerda e outra na direita. 0,05 mL de suspensão bacteriana, consistindo em aproxima-damente 105 - 106 de bactérias, foi inoculada intramuscularmente. O tratamento com doses aumentadas de ceftazidima ou salina (controle), cada dose sendo 0,1 mL administrada subcutaneamente, foi iniciado a t=0 hora, 2 horas depois doinício da infecção, com um regime de dosagem de q2 horas, que continuou por um período de 24 horas. Todos os regimes de dosagem foram realizados em, pelo menos, dois animais. A t=0 hora, 2 camundongos foram humanamente sacrificados para determinar o início da inoculação logo antes do tratamento. Todos os outros animais foram sacrificados a t=24 horas, a menos que o bem-estar dos animais tenha indicado que a terminação mais cedo era necessária, segindo os regulamentos de bem estar do animal. As coxas foram tiradas e movidas para um tubo de plástico de 10-mL pré- refrigerado (Tubo de transporte, Omnilabo, NL) contendo 2 mL (?) de fosfato saslino tamponado (PBS; NaCI 8,00 g/L, NA2HPO4 2 1,44 g/L, KH2PO4 0,26 g/L 7,2 - 7,4). Subsequentemente as coxas foram trituradas uasndo um Ultra-Turrax (IKA Labortechnik, Alemanha). Uma série de diluições de dez vezes foi preparada e 3x10 μL plaqueadas (Chromagar, Biomerieux, NL) por diluição. No dia seguinte, as colonias foram contadas e o número de cfu por coxa foi calculado. O efeito do fármaco foi depois determinado como a diferença entre os valores de log10[cfu/coxa] em t=24 horas e t=0 hora (valor médio de 2 camundongos) expressos como "dcfu".
[0038] Sangue foi separado do plasma usando uma centrifuga re frigerada. Amostras foram divididas e armazenadas a -80°C. Concentrações de ceftazidima e avibactam foram determinadas pelo Metabo-lismo de Fármaco e grupo de Farmacocinéticos em AstraZeneca (Waltham, MA) com um limite mais baixo de quantificação de 1,5 ng/mL para ceftazidima e 1,8 ng/mL para avibactam. A ligação de proteínas foi 10% para ceftazidima e 8% para avibactam, como determinado na câmara de diálise de equilíbrio eanalisada através de LC-MS/MS.
[0039] A relação exposição-resposta de avibactam em camundon- gos neutropênicos, com infecção experimental da coxa, foi determinada sob tratamento com um regime de dosagem fixa de ceftazidima, resultando em um aumento de cfu de 1 a 2 log10 quando comparado à inoculação inicial inoculum da cepa particular, depois de 24 horas de tratamento com ceftazidima. Este regime foi escolhido por causa da sensibilidade a mudanças em efeitos de avibactam. A quantidade de avibactam administrada variou em frequência e dose. Exposições de ceftazidima e avibactam foram determinadas usando MicLab 2,36 (Medimatics, Maastricht, The Netherlands) usando estimativas de parâmetro farmacocinético obtidos de estudos farmacocinéticos. Nas si-mulações uma ligação de proteínas foi usada de 10% para ceftazidima e 8% para avibactam. O efeito de fármaco foi determinado como a diferença entre os valores de log10 [cfu/coxa] em t=24 horas e t=0 hora (valor médio de 2 camundongos) expressos como dcfu. Concentra-ções de fármacos livres foram usadas em todos os cálculos. O modelo Emax (ou regressão linear) foi adaptado para as respostas de doses e índice de PK/PD (PDI)m para determinar os valores de PDI de ceftazi- dima só em combinação com avibactam, resultando em um efeito estático, ou particular de log-matar especificado. Para avibactam % de fT>CT, o % de tempo do intervalo de dosagem acima, limite de concentração de CT, foram calculados para CT de 0,25, 1 e 4 mg/L. Os valores de CT foram escolhidos baseados na atividade de avibactam in vitro, 4 mg/L sendo usadas em teste de susceptibilidade, mas concentrações mais baixas também sendo ativas como determinado nos estudos de tabuleiro quadriculado in vitro, e em um modelo de fibra oca com Enterobacteriaceae (Nichols W, Levasseur P, Li J, Das S. 2012). Uma concentração de limite de avibactam (AVI) durante a fase de declínio farmacocinético, abaixo da qual a inibição de β-lactamase em Enterobacteriaceae se tonar ineficaz. Apresentação oral na 52a Conferência de Interciência sobre Agentes e Quimioterapia Antimicro- biana, São Francisco, CA. Abstrato #A-1760). Tabela 12: Cepas de P. aeruginosa usadas para estudos farmacodi- nâmicos de ceftazidima e avibactamAs cepas de Pseudomonas aeruginosa usadas nos experimentos foram selecionadas com base nos MICs in vitro, e os resultados dos tabuleiros quadriculados in vitro. CAZ = ceftazidima, CAZ-AVI = combinação de ceftazidima e avibactam, *MIC CAZ-AVI determinado em avibactam de 4 mg/L. Tabela 13: Design de experimentos de fracionamento de doses.
[0040] Exemplo de um design de fracionamentos de dose para tra tamento de camundongos fêmeas CD-I neutropênicos, com regimes combinados de ceftazidima e avibactam. Cada grupo consistiu de 2 camundongos e recebeu uma dose fixa de ceftazidima cada 2 horas, com base em um aumento de 2 log10 comparado à inoculação inicial e avibactam, como exibido no planejamento. Tabela 14: Exposições de avibactam associadas a uma resposta de 24 horas de estase para 6 cepas de P. aeruginosa no tratamento de coxas de camundongos infectadas, quando combinadas com uma dose constante predeterminada de ceftazidima. CT1= concentração limite de 1 mg/L , TDD = dose diária total, CAZ = ceftazidima, AVI = avibactam Tabela 15: Resultados de regressão não linear (modelo Emax) do tra-tamento de camundongos com ceftazidima q2 h e avibactam q2 h SE entre parênteses
[0041] Como exibido na Tabela 12, o % de fT>MIC estático de cef- tazidima durante a monoterapia foi entre 0 e 38%. Para as cepas mais resistentes, nenhum efeito pode ser observado, requeredo o % mais baixo de fT>MICs. Isto indica que menos % de fT>MIC é necessário para algumas cepas altamente resistentes. Avibactam reduziu o % es- tático de fT > MIC de ceftazidima para todas as cepas.
[0042] O design dos estudos de fracionamento da dose toda é mostrado na Tabela 13. A Figura 10 mostra os resultados de duas cepas submetidas a um estudo de fracionamento da dose toda de avi- bactam. Embora cada um dos índices Cmax, AUC/MIC e dose mostraram alguma correlação, a inspeção visual das figuras leva à conclusão de que % de fT> CT é um previsor um tanto melhor, mas parece ser variação significativa. Isto indicates que o % de fT>CT não é o único fator que determina o início desta composição.
[0043] A figura mostra o % de fT> CT para três concentrações de CT. O % de fT> CT 1 mg/L parece ser um previsor um tanto melhor do que 0,25 mg/L e 4 mg/L. Em uma concentração de 1 mg/L, um % de fT > CT de 30,2 (7 cepas) ou 74,1 (18 cepas) foi requerida para suportar o efeito bacterioestático.
[0044] As doses requeridas para conseguir o efeito estático, com várias doses de avibactam com um regime de dosagem fixo de cefta- zidima, foram determinadas para 6 cepas (Figura 11). A partir desses resultados, % de fT> CT 1 mg/L foram determinados para cada cepa. A média de % de fT >CT foi 36,3% ((14.1-02.3) (Tabela 14). As estimativas requeridas para o efeito estático foram parcialmente dependentes da dose de ceftazidima (um valor mais baixo era requerido, se a dose de ceftazidima fosse relativamente mais alta em relação ao MIC da cepa).
[0045] A Tabela 15 mostra os resultados da análise linear de não- regressão para as e cepas de P. aeruginosa. As estimativas mostram um erro padrão significativo, em alguns casos.
[0046] Camundongos CD-1 neutropênicos foram infectados com aproximadamente 106 cfu no pulmão, por instilação através das nari- nas sob anestesia leve. O tratamento foi iniciado depois de 2 horas com ceftazidima só (q2 horas com várias doses) por 24 horas e cfu determinado no pulmão para estabelecer sua relação de resposta de exposição. Avibactam foi dado q2 horas ou q8 horas para duas cepas com MICs para ceftazidima de 32 e 128 mg/L, respectivamente, em doses aumentando duas vezes nas exposições de ceftazidima, que em experimentos de monoterapia de ceftazidima tinham sido as exposições máximas que tinham provido crescimento de 2 log10. Estudos de fracionamento da dose toda de avibactam foram realizados para 2 cepas em dois níveis de dose diferentes de ceftazidima; em adição a eficácia de avibactam q2 horas foi determinada por outras 2 cepas. O modelo de Emax foi ajustado para respostas da dose e índice de PK/PD (PDI), para determinar os valores de PDI de ceftazidima só e em combinação com avibactam resultando em um efeito estático, um 1- e um 2-log letais. Para avibactam o % de tempo do intervalo de dosagem acima de uma virtual concentração de limiar in vivo, CT, % de fT>CT, foram calculados (CT de 0,25, 1 e 4 mg/L).
[0047] Relações de resposta de exposição para avibactam (R2 0,54-0,86) indicaram que q2 horas foram mais eficazes do que q8 horas, reduzindo a dose diária por fatores de 2,7 e 10,1 para as 2 cepas para obter um efeito estático da combinação. Isto corresponde a uma média de % de fT> CT 1 mg/L de 20,1 (faixa 16,1-23,5). No estudo de fracionamento de dose, a melhor correlação de PDI para avibactam foi observada para % de fT>CT 1 mg/L. A estimativa da exposição de avi- bactam exigiu para um efeito estático que fosse parcialmente dependente da dose de ceftazidima (um valor mais baixo requerido se da dose de ceftazidima fosse mais alta). Para duas cepas de controle as estimativas do % de fT> CT 1 mg/L foram 22,4 e 21,6%.
[0048] Conclusão, o efeito de avibactam foi dependente da fre quência da dose; uma diminuição do efeito foi observada com a dimi- nuição da frequência. O principal índice de PK/PD correlacionado ao efeito foi o tempo acima do CT liminar. Para a maioria das cepas, o % de fT>CT de 1 mg/L para um efeito estático foi entre 16 e 25%. Para definir o efeito mínimo da concentração de avibactam, um novo índice farmacodinâmico é introduzido baseado em uma concentração do limite de CT. Este parâmetro representa uma concentração limite de avi- bactam para resultar em significativo efeito in vivo. Consequentemente, a exposição de avibactam, que é requerida para efeitos farmacodi- nâmicos, pode ser expressa usando este parâmetro. Desse modo, a exposição de avibactam é espressa como o índice farmacodinâmico % de fT>CT, análogo a fT>MIC de β-lactam, neste estudo de ceftazidima. Similar a ceftazidima, a estimativa do % de fT>Cx depende do próprio Cx. Mas enquanto que o MIC de β-lactama é normalmente conhecido a partir de dados in vitro, o CT não é. Nos experimentos apresentados aqui, os valores de teste de CT foram usados: 0.25, 1 e 4 mg/L, a fim de empiricamente selecionar um valor ideal. Um valor teórico atualmente não é conhecido.
[0049] Neste estudo, o modelo de camundongo neutropênico, com uma infecção no pulmão, foi usado para determinar a relação de expo-sição-resposta de avibactam com uma frequência de dosagem fixa de ceftazidima cada 2 horas para P. aeruginosa bij comparando regimes de dosagem diferentes de avibactam.
[0050] Ceftazidima (CAZ)
[0051] Providos por AstraZeneca (ex GSK)
[0052] Lote no.: G263770,
[0053] Data da Expiração: 05 de dezembro de 2012
[0054] Data de fabricação: 6 de dezembro de 2010
[0055] CAS no: 78439-06-2
[0056] Potência: 77,2%
[0057] Avibactam
[0058] AstraZeneca (ex Dr Reddy)
[0059] Lote no.: AFCH005151 (07113P028), Número analítico: A1002CQ055
[0060] Data da expiração: março-2013
[0061] Potência: 91,7%
[0062] Sete cepas de Pseudomonas aeruginosa bem caracteriza das resistentes à ceftazidima, obtidas de uma variedade de fontes cli-nicamente relevantes, foram usadas em experimentos como mostrado em Erro! Fonte de referência não encontrada. MICs foram determinados em um estudo de tabuleiro quadriculado in vitro mais cedo (AstraZeneca estudo reportado # CAZ-AVI-M 1-061) e foram determinados por microdiluição, de acordo com as orientações de ISO (ISO 2006). Este método é CLSI compatível.
[0063] Camundongos CD-1 fêmeas desenvolvidos (Charles River, Netherlands), 4 a 5 semanas de idade, pesando 20 a 25 g, foram usados nos experimentos. Granulocitopenia foi induzida por duas doses de ciclofosfamida s.c. quatro dias (150 mg/kg) e um dia (100 mg/kg) antes do experimento de infecção.
[0064] Os animais foram alojados sob condições padrão com be bida e alimentação suprida ad libitum, e foram examinados uma vez por dia e, depois de imunossupressão, 2-3 vezes por dia. Os estudos dos animais foram conduzidos de acordo com as recomendações da Comunidade Européia (Instrução 86/609/EEC, 24 de novembro de 1986), e todos os procedimentos de animais foram aprovados pelo Comite do Bem Estar Animal da Universidade de Radboud (RU-DEC 2012-003).
[0065] Camundongos neutropênicos foram infectados com uma cepa de P. aeruginosa por animal. 0,05 mL de suspensão bacteriana, consistindo em aproximadamente 105 - 106 bactérias foram inoculadas intranasalmente com uma seringa sob anestesia leve com isoflurano. Tratamento com doses aumentadas de 0,1 mL de ceftazidima ou salina (controle) administradas subcutaneamente, foi começado 2 horas depois da iniciação da infecção (t=0h) com um regime de dosagem de q2 horas que continuou por um período de 24 horas. Todos os regimes de dosagem foram realizados em, pelo menos, dois animais. Em t=0 hora, 2 camundongos foram humanamente sacrificados para determinar a inoculação inicial logo antes do inicio do tratamento. Todos os outros animais foram sacrificados a t=24 horas, a menos que o bem estar dos animais tenha indicado que terminação mais cedo era necessária, seguindo os regulamentos de bem estar do animal. Os pulmões foram tirados e movidos para um tubo de plástico de 10-mL pré- refrigerado (Tubo de Transporte, Omnilabo, NL) contendo 2 mL de fosfato tamponado salino (PBS; NaCl 8.00 g/L, Na2HP04 * 2 H20 1.44 g/L, KH2P04 0.26 g/L, pH 7,2 - 7,4). Subsequentemente os pulmões foram triturados usando uma Ultra-Turrax (IKA Labortechnik, Alemanha). Uma série de diluições de dez vezes foi preparada e 3x10 μE plaqueada (Chromagar, Biomerieux, NL) por diluição. No dia seguinte, as colônias foram contadas e o número de cfu calculado por pulmão.
[0066] A relação exposição-resposta de avibactam em camundon gos neutropênicos com pneumonia experimental, foi determinada sob tratamento com um regime de dosagem fixa da dose mais alta de cef- tazidima que resultou em um aumento de cfu de 1- a 2-log10 comparado à inoculação inicial da cepa particular depois de 24 horas de tratamento de ceftazidima. Este regime foi scolhido por causa da sensibili- dade às mudanças em efeitos de avibactam. A quantidade de avibac- tam administrada variou em frequência e dose. Exposições de ceftazi- dima e avibactam foram determinadas usando o software MicLab 2.36 (Medimatics, Maastricht, The Netherlands) usando estimativas de pa-râmetros farmacocinéticos obtidos de estudos farmacocinéticos (As-traZeneca relatório de estudo # CAZ-AVI-Ml-065). Nas simulações uma ligação de proteína foi usada de 10% para ceftazidima e 8% para avibactam. O efeito do fármaco foi determinado como a diferença entre os valores de cfu de log10 em t=24 e t=0 11 (valor médio de 2 camundongos) expresso como dcfu. Concentrações de fármaco livre foram usadas em todos os cálculos. O modelo Emax (ou regressão linear) foi ajustado para as respostas de dose e índice PK/PD (PDI) para determinar os valores de PDI de ceftazidima só e, separadamente, de avi- bactam em combinação com ceftazidima. Para % fT>CT de avibactam, o % de tempo do intervalo de dosagem da concetração de limiar CT acima foram calculados para CT de 0,25, 1 e 4 mg/L. Os valores de CT foram escolhidos baseados na atividade de avibactam in vitro, 4 mg/L sendo usados no teste de susceptibilidade, mas concentrações mais baixas também sendo ativas como determinado nos estudos de tabuleiro quadriculado in vitro.
[0067] Tabela 11 mostra as características das cepas usadas e a eficácia da monoterapia. O % de fT>MIC de ceftazidima durante a mo-noterapia foi entre 0 e 38%. Para as cepas mais resistentes, nenhum efeito poude ser observado. Por outro lado, menos de % de fT > MIC pareceu ser necessário para algumas cepas altamente resistentes. Avibactam reduziu a estática de % de fT>MIC de ceftazidima para todas as cepas.
[0068] Curvas de respostas à exposição (R2 0,54-0,86) para avi- bactam q2 horas ou q8 horas indicaram que o regime de q2 horas foi mais eficiente do que o regime de q8 horas (Figura 12). A dose diária de avibactam resultante em um efeito estático, quando os camundongos foram expostos à ceftazidima, foi mais baixa para avibactam q2 horas do que q8 horas pelos fatores de 2,7 e 10,1 para cepas 11 e 18, respectivamente. Isto correspondeu a uma média toda de % de fT>CT 1 mg/L para avibactam de 20,1 % (faixa de 16,1-23,5) (Tabela 16). A Tabela 17 mostra a estimativa do parâmetro dos ajustes do modelo Emax.
[0069] Figura 13 mostra os resultados de duas cepas submetidas a um estudo de fracionamento de dose inteira de avibactam. Embora cada um dos índices Cmax, AUC/MIC e dose mostraram alguma correlação, a inspeção visual das figuras levou à conclusão de que % de fT> CT foi um previsor um tanto melhor, mas houve significativa variação. Isto indica que % de fT> CT não é o único fato que determina resultado nesta composição. A figura mostra o % de fT> CT para três concentrações do CT. O % de fT> CT 1 mg/L pareceu ser um previsor um tanto melhor do que 0,25 mg/L e 4 mg/L. Entretanto, o valor limite exato não pode ser determinado a partir desta figura. As estimativas requeridas para um efeito estático foram parcialmente dependentes da dose de ceftazidima (um valor mais baixo requerido se a dose de cef- tazidima foi mais alta).
[0070] Figura 14 mostra a relação de exposição resposta de avi- bactam para quatro cepas de P. aeruginosa (7, 5, 19 e 1), quando tratadas com várias doses de ceftazidima q2 horas. Duas das quatro cepas de P. aeruginosa mostraram mais resposta para avibactam do que esperado, quando observadas a partir de 2 paineis mais baixos. A Tabela 18 provê as estimativas de % de fT> CT 1 mg/L de avibactam das quatro cepas para a mudança em log10(amostra de cfu/tecido) = 0, ou estase durante 24 horas. Para cepas 1 e 19 que motraram uma efeito melhor do que previsto, esta poderia não ser confiavelmente estimada. Para as outras duas cepas foi 21,4 e 19,4%. Tabela 16: 1 mgL de % de /T>CT de avibactam em camundongos tratados com ceftazidima q2 h e avibactam q2 h e q8 h.
[0071] CT = concentração limite (concentração inibidora virtual in vivo), TDD = dose diária total, CAZ = ceftazidima, AVI = avibactam Tabela 17: estimativas de parâmetro (SE) de regressão não linear (modelo de Emax) de efeitos com tratamento com ceftazidima q2 h e avibactam q2 h ou q8 h.
Tabela 18: Exposição-resposta de 4 cepas P. aeruginosa para camun-dongos tratados com ceftazidima q2 h e avibactam.
[0072] Determinação de % de tempo que a concentração de fár- maco livre excede 4 mg/L (ceftazidima) e 1 mg/L (avibactam) no ponto de estase em 24 h: isto é, dlog10cfu (E) = 0 CT = Concentração limite (concentração inibidora virtual in vivo), TDD = dose diária total, CAZ = ceftazidima, AVI = avibactam
Claims (3)
1. Combinação de ceftazidima, ou um sal farmaceuticamen- te aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo, caracterizada pelo fato de ser para uso como um medicamento para tratamento de uma infecção de pneumonia nosocomial; em que a quantidade de ceftazidima é 2000 mg e a quantidade de avi- bactam é 500 mg por dose; em que a combinação é administrada aproximadamente a cada oito horas; em que a combinação de ceftazidima e avibactam é administrada simultaneamente; e em que a combinação é administrada intravenosamente durante o curso de aproximadamente 2 horas.
2. Combinação de acordo com a reivindicação 1, caracterizada pelo fato de que a infecção de pneumonia nosocomial é pneumonia adquirida em hospital (HAP).
3. Combinação de acordo com a reivindicação 1, caracterizada pelo fato de que a infecção de pneumonia nosocomial é pneumonia adquirida por ventilator (VAP).
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361761369P | 2013-02-06 | 2013-02-06 | |
| US61/761,369 | 2013-02-06 | ||
| PCT/GB2014/050354 WO2014122468A1 (en) | 2013-02-06 | 2014-02-06 | Combination therapy for the treatment of nosocomial pneumonia |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112015018360A2 BR112015018360A2 (pt) | 2017-07-18 |
| BR112015018360B1 true BR112015018360B1 (pt) | 2022-03-22 |
Family
ID=50114393
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112015018360-3A BR112015018360B1 (pt) | 2013-02-06 | 2014-02-06 | Combinação de ceftazidima, ou um sal farmaceuticamente aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo para o tratamento de pneumonia nosocomial |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20150374673A1 (pt) |
| EP (1) | EP2953626A1 (pt) |
| JP (1) | JP6383367B2 (pt) |
| KR (1) | KR20150115761A (pt) |
| CN (2) | CN110302203A (pt) |
| AU (1) | AU2014213795B2 (pt) |
| BR (1) | BR112015018360B1 (pt) |
| CA (1) | CA2897446A1 (pt) |
| CL (1) | CL2015002180A1 (pt) |
| MX (1) | MX2015010077A (pt) |
| RU (1) | RU2684112C2 (pt) |
| UA (1) | UA115683C2 (pt) |
| WO (1) | WO2014122468A1 (pt) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT3221313T (pt) * | 2014-11-17 | 2019-04-15 | Entasis Therapeutics Ltd | Terapia combinada para tratamento de infecções bacterianas resistentes |
| TW201639853A (zh) * | 2015-03-31 | 2016-11-16 | 木塔比利斯公司 | 雜環化合物及其於預防或治療細菌感染之用途 |
| JP2018515481A (ja) | 2015-09-16 | 2018-06-14 | シュアンチュー ファーマ カンパニー,リミティド | β−ラクタマーゼ阻害剤とその利用 |
| WO2017216765A1 (en) * | 2016-06-17 | 2017-12-21 | Wockhardt Limited | Antibacterial compositions |
| MX2021010077A (es) | 2016-09-16 | 2022-05-23 | Entasis Therapeutics Ltd | Compuestos inhibidores de beta-lactamasa. |
| US10434089B2 (en) | 2017-01-25 | 2019-10-08 | The Johns Hopkins University | Avibactam and carbapenems antibacterial agents |
| SI3630111T1 (sl) | 2017-05-08 | 2022-05-31 | Entasis Therapeutics, Inc. | Spojine in postopki za zdravljenje bakterijskih okužb |
| US11905286B2 (en) | 2018-08-09 | 2024-02-20 | Antabio Sas | Diazabicyclooctanones as inhibitors of serine beta-lactamases |
| RU2746833C1 (ru) * | 2020-08-03 | 2021-04-21 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Волгоградский государственный медицинский университет" Министерства здравоохранения Российской Федерации ФГБОУ ВО ВолгГМУ МЗ РФ | Способ моделирования экспериментального воспаления легких у крыс |
| CN113413367A (zh) * | 2021-08-16 | 2021-09-21 | 浙江尖峰药业有限公司 | 一种注射用阿维巴坦头孢甲肟复方粉针及其制备方法 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2007007235A (es) * | 2004-12-17 | 2007-10-19 | Venus Remedies Ltd | Combinacion de antibioticos para proporcionar una solucion total al tratamiento de infecciones. |
| CN101074235B (zh) * | 2006-05-15 | 2010-05-12 | 中国药品生物制品检定所 | 头孢硫脒醇水化合物及其制备方法 |
| CN101245080A (zh) * | 2007-02-14 | 2008-08-20 | 山东轩竹医药科技有限公司 | 含有吡唑并三唑的头孢菌素衍生物 |
| AU2010229721A1 (en) * | 2009-03-26 | 2011-10-06 | Pulmatrix, Inc. | Methods for treating and preventing pneumonia and ventilator-associated tracheobronchitis |
-
2014
- 2014-02-06 WO PCT/GB2014/050354 patent/WO2014122468A1/en active Application Filing
- 2014-02-06 US US14/765,606 patent/US20150374673A1/en not_active Abandoned
- 2014-02-06 CN CN201910679229.5A patent/CN110302203A/zh active Pending
- 2014-02-06 KR KR1020157020951A patent/KR20150115761A/ko not_active Application Discontinuation
- 2014-02-06 CA CA2897446A patent/CA2897446A1/en not_active Abandoned
- 2014-02-06 EP EP14704881.3A patent/EP2953626A1/en not_active Withdrawn
- 2014-02-06 BR BR112015018360-3A patent/BR112015018360B1/pt active IP Right Grant
- 2014-02-06 RU RU2015132369A patent/RU2684112C2/ru active
- 2014-02-06 CN CN201480007538.3A patent/CN104994860A/zh active Pending
- 2014-02-06 JP JP2015556566A patent/JP6383367B2/ja active Active
- 2014-02-06 AU AU2014213795A patent/AU2014213795B2/en active Active
- 2014-02-06 UA UAA201507554A patent/UA115683C2/uk unknown
- 2014-02-06 MX MX2015010077A patent/MX2015010077A/es unknown
-
2015
- 2015-08-05 CL CL2015002180A patent/CL2015002180A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US20150374673A1 (en) | 2015-12-31 |
| CN104994860A (zh) | 2015-10-21 |
| JP2016507547A (ja) | 2016-03-10 |
| KR20150115761A (ko) | 2015-10-14 |
| CL2015002180A1 (es) | 2015-11-27 |
| AU2014213795A1 (en) | 2015-07-30 |
| JP6383367B2 (ja) | 2018-08-29 |
| MX2015010077A (es) | 2016-01-25 |
| BR112015018360A2 (pt) | 2017-07-18 |
| CA2897446A1 (en) | 2014-08-14 |
| CN110302203A (zh) | 2019-10-08 |
| AU2014213795B2 (en) | 2016-10-13 |
| RU2684112C2 (ru) | 2019-04-04 |
| RU2015132369A (ru) | 2017-03-13 |
| UA115683C2 (uk) | 2017-12-11 |
| EP2953626A1 (en) | 2015-12-16 |
| WO2014122468A1 (en) | 2014-08-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| BR112015018360B1 (pt) | Combinação de ceftazidima, ou um sal farmaceuticamente aceitável da mesma, e avibactam, ou um sal farmaceuticamente aceitável do mesmo para o tratamento de pneumonia nosocomial | |
| US10376499B2 (en) | Combination therapy for treatment of resistant bacterial infections | |
| JP7245289B2 (ja) | 細菌感染症の処置方法 | |
| Zhanel et al. | Intravenous fosfomycin: an assessment of its potential for use in the treatment of systemic infections in Canada | |
| JP6870029B2 (ja) | セフトロザン抗生物質組成物 | |
| EP3003307B1 (en) | Combination therapy comprising oxazolidinone-quinolones for use in treating bacterial infections | |
| AU2009222020A1 (en) | Stable liquid formulations of anti-infective agents and adjusted anti-infective agent dosing regimens | |
| WO2017203266A1 (en) | Combination therapy for treatment of resistant bacterial infections | |
| KR20180125866A (ko) | 항균 조성물 | |
| ES2905979T3 (es) | Composiciones antibacterianas | |
| RU2813568C2 (ru) | Антибактериальные композиции |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B25A | Requested transfer of rights approved |
Owner name: PFIZER ANTI-INFECTIVES AB (SE) |
|
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] |
Free format text: NOTIFICACAO DE ANUENCIA RELACIONADA COM O ART 229 DA LPI |
|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 06/02/2014, OBSERVADAS AS CONDICOES LEGAIS. |
|
| B17A | Notification of administrative nullity (patentee has 60 days time to reply to this notification) |
Free format text: REQUERENTE DA NULIDADE: ASSOCIACAO BRAS DAS INDUSTRIAS DE QUIMICA FINA -ABIFINA. - 870220080477 - 05/9/2022 |