KR20150115761A - 병원내 폐렴을 치료하기 위한 조합 요법 - Google Patents
병원내 폐렴을 치료하기 위한 조합 요법 Download PDFInfo
- Publication number
- KR20150115761A KR20150115761A KR1020157020951A KR20157020951A KR20150115761A KR 20150115761 A KR20150115761 A KR 20150115761A KR 1020157020951 A KR1020157020951 A KR 1020157020951A KR 20157020951 A KR20157020951 A KR 20157020951A KR 20150115761 A KR20150115761 A KR 20150115761A
- Authority
- KR
- South Korea
- Prior art keywords
- ceftazidime
- combination
- avibactam
- pharmaceutically acceptable
- mic
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/439—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom the ring forming part of a bridged ring system, e.g. quinuclidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/529—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5383—1,4-Oxazines, e.g. morpholine ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/542—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame ortho- or peri-condensed with heterocyclic ring systems
- A61K31/545—Compounds containing 5-thia-1-azabicyclo [4.2.0] octane ring systems, i.e. compounds containing a ring system of the formula:, e.g. cephalosporins, cefaclor, or cephalexine
- A61K31/546—Compounds containing 5-thia-1-azabicyclo [4.2.0] octane ring systems, i.e. compounds containing a ring system of the formula:, e.g. cephalosporins, cefaclor, or cephalexine containing further heterocyclic rings, e.g. cephalothin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/65—Tetracyclines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/7036—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin having at least one amino group directly attached to the carbocyclic ring, e.g. streptomycin, gentamycin, amikacin, validamycin, fortimicins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/14—Peptides containing saccharide radicals; Derivatives thereof, e.g. bleomycin, phleomycin, muramylpeptides or vancomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Molecular Biology (AREA)
- Pulmonology (AREA)
- Dermatology (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Oncology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 세프타지딤 (제3세대 세팔로스포린)과 아비박탐 (신규 β-락타마제 억제제)의 조합물을, 임의로 하나 이상의 추가의 치료제와 함께 사용하여 병원내 폐렴을 치료하는 방법에 관한 것이다.
Description
본 발명은 세프타지딤(ceftazidime) (제3세대 세팔로스포린)과 아비박탐(avibactam) (신규 β-락타마제 억제제)의 조합물을, 임의로 하나 이상의 추가의 치료제와 함께 사용하여 병원내 폐렴을 치료하는 방법에 관한 것이다.
국제 미생물학 및 감염성 질환 커뮤니티는 항박테리아 내성이 계속해서 진화함에 따라, 그에 대항하여 현재 이용가능한 항박테리아제의 효력이 없게 될 박테리아 균주가 발생될 수 있다는 심각한 우려를 지속적으로 표출하고 있다. 이러한 발생에 따른 결과로서, 상당한 이환률과 사망률이 초래될 수 있다.
박테리아성 감염과 싸우는 데 있어서는, 베타-락탐계 항생제가 필수적이다. 베타-락탐계는 모두, 그의 코어 분자 구조 내에 베타-락탐을 갖고, 전형적으로 박테리아의 세포벽 합성을 억제함으로써 광범위한 스펙트럼의 그램-양성 및 그램-음성 박테리아에 대항하여 유효성을 나타내는 광범위한 부류의 약물이다. 이러한 약물 표적은 진핵 유사체를 갖고 있지 않기 때문에, 상기 약물의 독성은 낮고 상기 약물은 일반적으로 잘 용인되고 있다. 베타-락탐계 항생제는 페니실린 유도체 (페남), 세팔로스포린, 모노박탐 및 카르바페넴을 포함한다. 이들은 박테리아성 감염과 싸우기 위해 이용가능한, 여전히 가장 널리 처방되고 있는 안전하고도 유효한 약물이다. 그러나, 이들의 유효성은 고도로 내성인 감염성 균주, 예컨대 메티실린-내성 스타필로코쿠스 아우레우스 (Staphylococcus aureus) (MRSA), 및 슈도모나스 아에루기노사 (Pseudomonas aeruginosa), 아시네토박터 바우만니이 (Acinetobacter baumannii), 에스케리키아 콜라이 (Escherichia coli), 클레브시엘라 뉴모니아 (Klebsiella pneumonia) 및 기타 엔테로박테리아세아에 (Enterobacteriaceae)의 다중-약물 내성 (MDR) 균주에 의해 제한된다. 이러한 내성 박테리아는 환자의 이환률과 사망률의 주요 원인이 된다 [Helfand, β- lactams Against Emerging 'Superbugs': Progress and Pitfalls, Expert Rev. Clin. Pharmacol. 1(4):559-571 (2008)].
베타-락탐계 항생제의 유효성을 개선시키는 것을 도와주기 위하여, 일부 베타-락타마제 억제제가 개발되었다. 그러나, 현재 이용가능한 β-락타마제 억제제는 많은 경우에 있어서, β-락타마제의 다양성이 지속적으로 증가하고 있는 상황에 대응하기에 불충분하다. 현재 사용되고 있는 가장 흔한 3가지 세린 베타-락타마제 작용제, 즉 클라불란산(clavulanic acid), 타조박탐(tazobactam) 및 술박탐(sulbactam)은 특정의 부류 A 효소에 대항해서만 활성을 지니고 있으므로, 그의 유용성이 심하게 제한된다. 현재 임상 시험 중인, 보다 새로운 베타-락타마제 억제제, 예컨대 아비박탐은 부류 A 효소와 부류 C 효소 둘 다에 대해 작용하는데, 부류 D 베타-락타마제에 대항해서는 일부 제한된 유효성을 나타낸다 [Bebrone, et al., Current Challenges in Antimicrobial Chemotherapy: Focus on β- Lactamase Inhibition, Drugs, 70(6):651-679 (2010)].
단독으로, 그리고 베타-락타마제 억제제와 조합되는 베타-락탐계 항생제는, 질환과 싸우기 위해 사용되는 항박테리아제의 필수 부분을 지속적으로 나타낸다. 그램-음성 감염에 대한 β-락탐계 내성은 주로, β-락타마제 활성에 의해 구동되고; β-락탐계 항생제에 대한 상당한 의존성으로 인해, β-락타마제가 다양해졌고 그 만연함이 증가하였다. 이들 β-락타마제는 심지어 가장 새로운 β-락탐계 항생제에 대해서도 강력하게 내성이다 [Llarrull, et al., The Future of Beta- Lactams, Current Opinion in Microbiology, 13:551-557 (2010)]. 확장된 스펙트럼 β-락타마제 (ESBL)-, AmpC-, KPC-, NDM- 및 OXA-48-생산 엔테로박테리아세아에 뿐만 아니라 아시네토박터 바우만니이 및 슈도모나스 아에루기노사가, 가장 중요하고도 빈번하게 단리된 병원내 병원체들이고, 종종 많은 부류의 항생제에 대해 내성이다 [D.M. Livermore, et al. Activities of NXL104 Combinations with Ceftazidime and Aztreonam Against Carbapenemase -Producing Enterobacteriaceae, Antimicrobial Agents Chemotherapy, 55 (2011), pp. 390-394; S. Mushtaq, et al., In Vitro Activity of Ceftazidime + NXL104 Against Pseudomonas aeruginosa and other Non-Fermenter, J. Antimicrobial Chemotherapy, 65(2010) 2376-381; A. Endimiani, et al., In Vitro Activity of NXL104 in Combination with β- Lactams Against Klebsiella pneumonia Isolates Producing KPC Carbapenemases, Antimicrobial Agents Chemotherapy, 53 (2009) 3599-3601].
병원내 폐렴은 병원에 입원한지 적어도 48시간 내지 72시간 후에 환자가 걸리는 모든 폐렴을 지칭하고, 이는 병원 획득 폐렴 (HAP) 및 인공호흡기 연관 폐렴 (VAP)을 포함한다. 병원내 폐렴 감염 환자 중에서, HAP가 병원내 폐렴 환자의 약 70%를 차지하고, 나머지 대략 30%가 VAP 환자이다. HAP 환자의 병원 사망률은 12% 내지 35%의 범위이지만 (문헌 [Freire et al. 2010]; [Chung et al. 2011]), 급성 사망률은 종종 기저 질환이 있는 환자와 연관이 있다. VAP 환자는 보다 중증의 병든 집단인 것으로서 인식되는데, 이에 기인하는 사망률은 33% 내지 50%의 범위인 것으로 인용된다 [Am J Respir Crit Care Med, 2005, 171, pp388].
병원내 폐렴에서 가장 흔히 발견되는 병원체를 치료하는 데 있어서 보다 유효한 첫 번째 치료 (경험적) 옵션이 병원내 폐렴에 있어서 상당히 필요하다. 병원체를 확인하는 데에만 48시간 정도가 소요되고, 일부 임상 환경, 예컨대 HAP에서는, 검출률이 비교적 낮은데 (약 60%), 이는 병원체의 의혹 및/또는 내성의 가능성만을 가지고 치료의 선택이 이루어진다는 것을 의미한다. 그램 음성 병원체에 대한 기존의 치료 옵션으로, 주요 내성 병원체에 대한 감수성 수준이 80% 아래이기 때문에, 병원내 폐렴에서 가장 흔히 발견되는 병원체를 치료하는 데 있어서 보다 유효한 경험적 요법 옵션이 상당히 필요하다. 중증의 그램 음성 감염 (슈도모나스 아에루기노사, 및 확장된 스펙트럼 β-락타마제 (ESBL) 또는 클레브시엘라 뉴모니아에 카르바페네마제 (KPC)를 발현하는 내성 병원체)을 치료하는 데 유효한 경험적 작용제는 거의 없다. 기존의 경험적 치료 옵션 (예를 들어, 카르바페넴, 세팔로스포린)의 유효성 저하로 인해, 기존에 확립된 치료법과 비교해서 치료하기가 어려운 보다 광범위한 스펙트럼의 내성 병원체에 대해 활성을 나타내는 세프타지딤-아비박탐 (CAZ-AVI) 조합물과 같은 작용제가 상당히 필요해진다. CAZ-AVI와 같은 새로운 치료법은, 경험적 요법이 불충분한 경우에 사망률과 이환률 위험이 보다 높은 환자에서 치료 성공률을 증가시키기 위해 경험적으로 사용할 필요가 있다.
놀랍고도 예상치 못하게, CAZ-AVI 조합물이 병원내 폐렴 환자에 대한 우수한 치료 옵션을 제공한다는 사실이 밝혀졌다. 이러한 조합물의 시험관내 스펙트럼이 병원내 폐렴을 유발시키는 데 책임이 있는 주요 박테리아 균주의 치료 가능성을 나타냈지만, 본 발명자들의 연구 결과는 상기 조합물이 상기 감염을 효과적으로 치료하기에 충분한 양으로 표적 조직 내로 침투할 수 있다는 것을 보여준다.
본 발명은 병원내 폐렴 (HAP 및 VAP 포함)을 치료하기 위하여 세프타지딤과 아비박탐의 조합물을, 임의로 하나 이상의 추가의 치료제와 조합해서 사용하는 것에 관한 것이다. 본 발명은 또한, 병원내 폐렴 감염의 치료를 필요로 하는 환자에게 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물의 유효량을 투여하는 것을 포함하는, 상기 환자에서 병원내 폐렴 감염을 치료하는 방법에 관한 것이다. 한 실시양태에서, 상기 방법은 상기 조합물을 하나 이상의 추가의 치료제와 함께 투여하는 것을 추가로 포함한다.
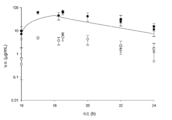
도 1: 감염된 암컷 ICR 마우스와 감염되지 않은 암컷 ICR 마우스에서 관찰된 혈청 노출과 비교된, 남자에서의 2 h 주입으로의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg에 대한 인간 모의 혈청 농도-시간 프로파일. 흑색 선은 인간 세프타지딤 노출이고, 흑색 원은 감염된 마우스의 세프타지딤 혈청 농도이고, 흑색 사각형은 감염되지 않은 마우스의 세프타지딤 혈청 농도이고, 점선은 인간 아비박탐 노출이고, 백색 원은 감염된 마우스의 아비박탐 혈청 농도이고, 백색 사각형은 감염되지 않은 마우스의 아비박탐 혈청 농도이다.
도 2: 감염된 마우스와 감염되지 않은 마우스에서 관찰된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량 투여 후 상피 내층 유체 (ELF) 농도-시간 프로파일. a)에서, 흑색 원은 감염된 암컷 ICR 마우스에서의 ELF 세프타지딤 농도이고; 흑색 사각형은 감염되지 않은 마우스에서의 ELF 세프타지딤 농도이며; b)에서, 흑색 삼각형은 감염된 마우스에서의 ELF 아비박탐 농도이고, 흑색 마름모형은 감염되지 않은 마우스에서의 ELF 아비박탐 농도이다.
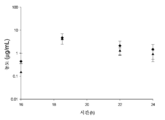
도 3: 감염된 암컷 ICR 마우스에서 관찰된 것과 비교된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량 투여 후 혈청 농도-시간 프로파일. 흑색 선은 인간 세프타지딤 노출이고, 흑색 원은 마우스에서의 세프타지딤 혈청 농도이고, 점선은 인간 아비박탐 노출이고, 백색 삼각형은 마우스에서의 아비박탐 혈청 농도이다.
도 4: 감염된 암컷 ICR 마우스에서 관찰된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량 투여 후 상피 내층 유체 (ELF) 농도-시간 프로파일. 흑색 원은 마우스에서의 세프타지딤 ELF 농도이고, 흑색 사각형은 마우스에서의 아비박탐 ELF 농도이다.
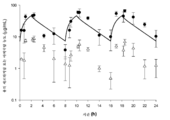
도 5: 호중구감소성 폐 감염 모델에서 피. 아에루기노사 (P. aeruginosa)에 대항한 관련 ELF fT>MIC 및 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량의 효능. (CAZ-AVI의 MIC는 각 균주명에 의해 괄호 안에 제시된다). 막대는 평균 ± SD를 나타낸다.
도 6: 감염된 암컷 ICR 마우스에서 관찰된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤 2000 mg의 인간 모의 혈청 용량 투여 후의 혈청 농도-시간 프로파일. 흑색 원은 마우스에서의 세프타지딤 혈청 농도이고, 흑색 사각형은 마우스에서의 세프타지딤 ELF 농도이다.
도 7: 호중구감소성 폐 감염 모델에서 피. 아에루기노사에 대항하여 2 h 주입으로서의 8 h 마다의 세프타지딤 2000 mg의 인간 모의 혈청 용량의 효능. (CAZ의 MIC는 각 균주명에 의해 괄호 안에 제시된다). 막대는 평균 ± SD를 나타낸다.
도 8: 감염된 암컷 ICR 마우스에서 관찰된, 유도된 ELF fT>MIC를 생성하기 위한 세프타지딤의 요법 후 혈청 농도-시간 프로파일. 흑색 원은 마우스에서의 세프타지딤 혈청 농도이고, 흑색 사각형은 마우스에서의 세프타지딤 ELF 농도이다.
도 9: 호중구감소성 폐 감염 모델에서 피. 아에루기노사에 대항한 세프타지딤 유도된 ELF fT>MIC 및 관련 ELF fT>MIC의 인간 모의 혈청 용량의 효능. (CAZ의 MIC는 각 균주명에 의해 괄호 안에 제시된다). 막대는 평균 ± SD를 나타낸다.
도 10: 세프타지딤 q2h로 처리된 대퇴 감염된 마우스에서의 아비박탐의 노출 반응: 용량 분할.
도 11: 6개의 피. 아에루기노사 균주에 대하여 세프타지딤 q2h로 처리된 대퇴 감염된 마우스에서의 아비박탐의 노출 반응.
도 12: 폐 감염된 마우스를, 2시간마다 세프타지딤을 투여 처리하고 2시간 또는 8시간마다 아비박탐을 투여 처리한다.
도 13: 세프타지딤 q2h로 처리된 폐 감염된 마우스에서의 아비박탐의 노출 반응: 용량 분할.
도 14: 4개의 피. 아에루기노사 균주에 대하여 세프타지딤 q2h로 처리된 폐 감염된 마우스에서의 아비박탐의 노출 반응.
도 2: 감염된 마우스와 감염되지 않은 마우스에서 관찰된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량 투여 후 상피 내층 유체 (ELF) 농도-시간 프로파일. a)에서, 흑색 원은 감염된 암컷 ICR 마우스에서의 ELF 세프타지딤 농도이고; 흑색 사각형은 감염되지 않은 마우스에서의 ELF 세프타지딤 농도이며; b)에서, 흑색 삼각형은 감염된 마우스에서의 ELF 아비박탐 농도이고, 흑색 마름모형은 감염되지 않은 마우스에서의 ELF 아비박탐 농도이다.
도 3: 감염된 암컷 ICR 마우스에서 관찰된 것과 비교된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량 투여 후 혈청 농도-시간 프로파일. 흑색 선은 인간 세프타지딤 노출이고, 흑색 원은 마우스에서의 세프타지딤 혈청 농도이고, 점선은 인간 아비박탐 노출이고, 백색 삼각형은 마우스에서의 아비박탐 혈청 농도이다.
도 4: 감염된 암컷 ICR 마우스에서 관찰된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량 투여 후 상피 내층 유체 (ELF) 농도-시간 프로파일. 흑색 원은 마우스에서의 세프타지딤 ELF 농도이고, 흑색 사각형은 마우스에서의 아비박탐 ELF 농도이다.
도 5: 호중구감소성 폐 감염 모델에서 피. 아에루기노사 (P. aeruginosa)에 대항한 관련 ELF fT>MIC 및 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량의 효능. (CAZ-AVI의 MIC는 각 균주명에 의해 괄호 안에 제시된다). 막대는 평균 ± SD를 나타낸다.
도 6: 감염된 암컷 ICR 마우스에서 관찰된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤 2000 mg의 인간 모의 혈청 용량 투여 후의 혈청 농도-시간 프로파일. 흑색 원은 마우스에서의 세프타지딤 혈청 농도이고, 흑색 사각형은 마우스에서의 세프타지딤 ELF 농도이다.
도 7: 호중구감소성 폐 감염 모델에서 피. 아에루기노사에 대항하여 2 h 주입으로서의 8 h 마다의 세프타지딤 2000 mg의 인간 모의 혈청 용량의 효능. (CAZ의 MIC는 각 균주명에 의해 괄호 안에 제시된다). 막대는 평균 ± SD를 나타낸다.
도 8: 감염된 암컷 ICR 마우스에서 관찰된, 유도된 ELF fT>MIC를 생성하기 위한 세프타지딤의 요법 후 혈청 농도-시간 프로파일. 흑색 원은 마우스에서의 세프타지딤 혈청 농도이고, 흑색 사각형은 마우스에서의 세프타지딤 ELF 농도이다.
도 9: 호중구감소성 폐 감염 모델에서 피. 아에루기노사에 대항한 세프타지딤 유도된 ELF fT>MIC 및 관련 ELF fT>MIC의 인간 모의 혈청 용량의 효능. (CAZ의 MIC는 각 균주명에 의해 괄호 안에 제시된다). 막대는 평균 ± SD를 나타낸다.
도 10: 세프타지딤 q2h로 처리된 대퇴 감염된 마우스에서의 아비박탐의 노출 반응: 용량 분할.
도 11: 6개의 피. 아에루기노사 균주에 대하여 세프타지딤 q2h로 처리된 대퇴 감염된 마우스에서의 아비박탐의 노출 반응.
도 12: 폐 감염된 마우스를, 2시간마다 세프타지딤을 투여 처리하고 2시간 또는 8시간마다 아비박탐을 투여 처리한다.
도 13: 세프타지딤 q2h로 처리된 폐 감염된 마우스에서의 아비박탐의 노출 반응: 용량 분할.
도 14: 4개의 피. 아에루기노사 균주에 대하여 세프타지딤 q2h로 처리된 폐 감염된 마우스에서의 아비박탐의 노출 반응.
CAZ-AVI 조합물은 ESBL, KPC, AmpC 또는 OXA-48 β-락타마제 생성을 통하여 확장된 스펙트럼 세팔로스포린, 피페라실린/타조박탐 및 카르바페넴에 대해 내성인 병원체를 포함한, 임상적으로 중요한 그램-음성 병원체 [예를 들어, 피. 아에루기노사 및 엔테로박테리아세아에 (케이. 뉴모니아에 (K. pneumoniae) 포함), 및 엔테로박터 종]에 대항하여 상당한 활성을 명확히 보여준다. CAZ-AVI는 또한, 흔히 사용되는 항생제에 대해 내성인 균주 (다중 약물 내성 균주 포함)를 포함한, 주요 국소 그램-음성 병원체 [예를 들어, 피. 아에루기노사 및 엔테로박테리아세아에 (케이. 뉴모니아에 포함)]에 대항하여 표준 치료 항생제에 비해 더 높은 감수성 비율을 명확히 보여준다.
이러한 강력한 스펙트럼은, 상기 약물이 임상적으로 유효한 수준에서 실제적으로 감염 부위 내로 침투할 수 있는 경우에만, 대부분의 병원내 폐렴 감염 환자에 대해 잠재적 유효 적용 범위를 제공할 수 있었다. 잠재적으로 관련된 병원체 효능을 지닌 수많은 작용제는 유효량에서 감염 부위에 도달 [상피 내층 유체 (ELF)에 침투]할 수 없기 때문에 병원내 폐렴 감염을 효과적으로 치료할 수 없다. 종종, 약물의 유효량을 감염 부위에 제공하기 위해서는 약물 부하량을 상당히 증가시켜야만 하는데, 이는 환자에게 고통을 주는 잠재적 부작용을 증가시켜, 결국에는 환자가 투여 스케줄을 준수하지 못하게 되거나 치료를 중단할 수 있다. 병원내 폐렴에 대한 잠재적 치료를 위해서는 효과적인 ELF 침투가 요구될 뿐만 아니라, 유효 작용제가 또한 폐 계면활성제의 존재 하에서도 그의 항박테리아 활성을 보유할 필요가 있고, 전반적인 치료 요법 동안 환자에게 공-투여될 수 있는 추가의 치료제와의 해로운 약물-약물 상호작용으로 인해 고통받지 않아야 한다. 이들 상당한 장애물 중의 어느 하나는 잠재적으로 매력적인 항박테리아제를, 병원내 폐렴 감염, 예컨대 HAP 및 VAP를 치료하는 데 이용할 수 없도록 만들 수 있다.
본 발명자들은 놀랍고도 예상치 못하게, CAZ-AVI 조합물이 병원내 폐렴 감염을 유발시키는 주요 병원체에 대항하여 매력적인 프로파일을 제공할 뿐만 아니라, ELF에 효과적으로 침투되어 감염 부위에 도달할 수 있고, 폐 계면활성제의 존재 하에서도 효능을 상실하지 않으며, 극도로 병든 환자 집단에 대한 전체 치료 계획 동안 통상의 많은 작용제와 함께 성공적으로 투여될 수 있는, 병원내 감염을 성공적으로 치료하는 데 요구되는 프로파일을 갖고 있다는 사실을 밝혀내었다. 인간 ELF에 대한 아비박탐 침투 수준 (대략 30%)과, 폐 계면활성제가 심지어 신체 내의 다른 부위에서의 감염을 치료하기 위해 사용된 동일한 용량 수준 하에서도, 병원내 폐렴 감염 부위에서 세프타지딤의 활성을 복원시키기 위해 아비박탐의 효능에 전혀 영향을 미치지 않는다는 사실은 놀라운 것이고, 이는 NP 환자에 대한 가능한 치료 옵션에 있어서의 엄청난 진전을 나타낸다.
본 발명의 한 측면은 병원내 폐렴의 치료를 필요로 하는 환자에게 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 유효량을 투여하는 것을 포함하는, 상기 환자에서 병원내 폐렴을 치료하는 방법이다.
세프타지딤은 (6R,7R)-7-[[(2Z)-2-(2-아미노-1,3-티아졸-4-일)-2-(1-히드록시-2-메틸-1-옥소프로판-2-일)옥시이미노아세틸]아미노]-8-옥소-3-(피리딘-1-이움-1-일메틸)-5-티아-1-아자비시클로[4.2.0]옥트-2-엔-2-카르복실레이트 5수화물이다. 화학 구조는 다음에 제시된다:
아비박탐은 [(2S,5R)-2-카르바모일-7-옥소-1,6-디아자비시클로[3.2.1]옥탄-6-일] 히드로겐 술페이트이다. 화학 구조는 다음에 제시된다:
일부 실시양태에 따라서, 본 발명은 약 2000 mg의 세프타지딤과 약 500 mg의 아비박탐을 포함하는 투여 형태를 제공함으로써, 병원내 폐렴 감염의 치료를 필요로 하는 환자에서 병원내 폐렴 감염을 치료하는 방법을 제공한다. 이러한 실시양태에서, 투여 형태의 투여는 상기 조합물의 용량을 투여하는 것으로 구성된다. 이러한 실시양태의 한 측면에서, 상기 환자에게 8시간마다 상기 조합물의 용량을 투여한다. 상기 실시양태의 한 측면에서, 환자에게 상기 조합물의 각 용량을 정맥내 주입을 통하여 투여한다. 상기 실시양태의 한 측면에서, 환자에게 상기 조합물의 각 용량을 대략 2시간의 기간에 걸쳐 정맥내 주입을 통하여 투여한다. 상기 실시양태의 한 측면에서, 환자에게 상기 조합물의 각 용량을 대략 1시간의 기간에 걸쳐 정맥내 주입을 통하여 투여한다. 상기 실시양태의 한 측면에서, 환자에게 상기 조합물을 단일 주입으로 투여한다. 상기 실시양태의 한 측면에서, 환자에게 상기 조합물을 일련의 주입으로 투여한다.
일부 실시양태에서, 본 발명은 본질적으로 세프타지딤과 아비박탐 또는 그의 어느 한 성분 또는 양 성분의 제약상 허용되는 염의 조합물로 이루어진 조성물을 제공한다. 이러한 조성물에서는, 세프타지딤과 아비박탐이 유일한 활성 성분들이다. 본원에 정의된 바와 같은 활성 성분은 병원내 폐렴 감염을 치료하는 데 유효한 것이다. 상기 조성물은 불활성이고/이거나 항박테리아제, 항미생물제가 아닌 기타 성분을 가질 수 있다. 이러한 성분의 예는 하나 이상의 제약상 허용되는 담체, 부형제, 첨가제, 또는 상기 조성물을 제제화하는 데 유용한 기타 성분을 포함하지만, 이에 제한되지 않는다.
본 발명의 한 실시양태는 의약으로서 사용하기 위한, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물이다.
본 발명의 한 실시양태는 병원내 폐렴 감염을 치료하는 데 사용하기 위한, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물이다. 이러한 실시양태의 한 측면에서, 상기 조합물은 하나 이상의 베타-락타마제를 발현하는 하나 이상의 병원체에 의해 유발되는 병원내 폐렴 감염을 치료하는 데 사용된다. 상기 실시양태의 한 측면에서, 조합물은 단독요법으로서의 세프타지딤에 대해서는 감수성이지 않은 병원내 폐렴 감염을 치료하기 위해 사용된다. 본 발명의 한 측면에서, 조합물은 병원 획득 폐렴 (HAP)인 병원내 폐렴 감염을 치료하기 위해 사용된다. 본 발명의 한 측면에서, 조합물은 인공호흡기 연관 폐렴 (VAP)인 병원내 폐렴 감염을 치료하기 위해 사용된다.
본 발명의 한 실시양태에서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물은 추가로, 하나 이상의 추가의 치료제를 포함한다. 상기 실시양태의 한 측면에서, 상기 조합물은 추가로, 항박테리아제, 베타-락타마제 억제제 및 항진균제로 이루어진 군으로부터 선택되는 추가의 치료제를 포함한다. 상기 실시양태의 한 측면에서, 조합물은 추가로, 토브라마이신(tobramycin), 레보플록사신(levofloxacin), 반코마이신(vancomyicn), 리네졸리드(linezolid), 티게시클린(tigecycline) 및 콜리스틴(colistin)으로 이루어진 군으로부터 선택된 항박테리아제를 포함한다.
본 발명의 한 실시양태에서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물은 동시에 투여된다. 본 발명의 또 다른 실시양태에서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물은 독립적으로 제제화되고 공-투여된다. 본 발명의 또 다른 실시양태에서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물은 독립적으로 제제화되고 순차적으로 투여된다. 본 발명의 상기 실시양태의 어느 것에서, 조합물은 용량당 약 2000 mg의 세프타지딤 또는 그의 제약상 허용되는 염과 약 500 mg의 아비박탐 또는 그의 제약상 허용되는 염을 포함한다. 이들 실시양태의 한 측면에서, 조합물은 대략 8시간마다 투여된다. 이들 실시양태 중 어느 것의 한 측면에서, 조합물은 대략 12시간마다 투여된다.
본 발명의 한 실시양태에서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물은 정맥내 투여된다. 상기 실시양태의 한 측면에서, 상기 조합물은 대략 1 내지 2시간의 기간에 걸쳐 정맥내 투여된다. 상기 실시양태의 한 측면에서, 조합물은 대략 1시간의 기간에 걸쳐 정맥내 투여된다. 상기 실시양태의 상이한 측면에서, 조합물은 대략 2시간의 기간에 걸쳐 정맥내 투여된다.
상기 실시양태 및 실시양태의 측면 중 어느 것을 다른 것과 조합하여 본 발명의 추가의 의도된 실시양태를 형성할 수 있다.
본 발명에 따라서 화합물을 투여하기에 적합한 각종 조성물을 제조하기 위한 과정을 설명하는 수많은 표준 참고문헌이 입수가능하다. 잠재적 조성물 및 제제의 예가, 예를 들어 문헌 ([the Handbook of Pharmaceutical Excipients, American Pharmaceutical Association (current edition); Pharmaceutical Dosage Forms: Tablets (Lieberman, Lachman and Schwartz, editors) current edition, published by Marcel Dekker, Inc.] 및 [Remington's Pharmaceutical Sciences (Arthur Osol, editor), 1553-1593 (current edition)])에 함유되어 있다.
상기 조성물은 고형이거나 액상일 수 있고, 약제 형태, 예컨대 예를 들어 플레인 또는 당피정, 젤라틴 캡슐, 과립제, 좌제, 주사 가능한 제제, 연고, 크림, 젤로 제시될 수 있고, 통상적인 방법에 따라서 제조할 수 있다. 활성 성분(들)은 이들 제약 조성물에 통상적으로 이용되고 있는 부형제, 예컨대 탈크, 아라비아 검, 락토스, 전분, 마그네슘 스테아레이트, 코코아 버터, 수성 또는 비-수성 비히클, 동물 또는 식물성 기원의 지방 물질, 파라핀 유도체, 글리콜, 각종 습윤제, 분산제 또는 유화제 및 보존제와 함께 혼입될 수 있다. 본 발명의 한 실시양태에서, 세프타지딤과 아비박탐의 조합물의 용량은 정맥내 투여된다.
상기 조성물은 적당한 비히클, 예를 들어 무발열원성 멸균수에서 즉시 용해되도록 의도된 동결건조물의 형태로 제시될 수 있다. 예를 들어, 이 조성물은 투여 전에 희석제와 함께 구성되는 고형 투여 형태, 예컨대 건조 분말로서 제제화될 수 있다. 예시적 실시양태에서, 상기 조성물은 세프타지딤과 아비박탐의 조합물을 포함하는 건조 분말로서 제제화될 수 있다. 이러한 건조 분말은 투여 전에 구성된 용액을 형성하기 위하여 멸균성 희석제, 예컨대 물과 함께 구성될 수 있다. 이와 같이 구성된 용액의 pH는 약 4 내지 약 10일 수 있다. 다른 실시양태에서, 상기 구성된 용액의 pH는 약 5.6 내지 약 7일 수 있다. 상기 구성된 용액은 적당한 용액, 예컨대 주입 용액을 이용하여 투여 전에 추가로 희석시킬 수 있다. 이러한 주입 용액의 예는 0.9% 염화나트륨 (생리 염수), 5% 덱스트로스, 2.5% 덱스트로스 및 0.45% 염화나트륨 및 락테이트화 링거(Ringer) 용액이다.
상기 조성물은 각종 액상 경구 투여 형태로 제제화할 수 있는데, 이는 수성 및 비-수성 용액, 에멀젼, 현탁액, 시럽 및 엘릭시르를 포함한다. 이러한 투여 형태는 또한, 관련 기술분야에 공지된 적합한 불활성 희석제, 예컨대 물, 및 관련 기술분야에 공지된 적합한 부형제, 예컨대 보존제, 습윤제, 감미제, 향미제 뿐만 아니라 본 발명의 화합물을 유화시키고/시키거나 현탁시키기 위한 작용제를 함유할 수 있다. 본 발명의 조성물은, 예를 들어 등장성 멸균 용액의 형태로 정맥내 주사할 수 있다. 기타 제제도 또한 가능하다.
일부 실시양태에서, 상기 방법은 세프타지딤과 아비박탐의 조합물을 4시간마다, 6시간마다, 8시간마다, 12시간마다, 18시간마다 또는 24시간마다 투여하는 것을 포함할 수 있다. 예를 들어, 세프타지딤과 아비박탐의 조합물은 대략 1시간에 걸쳐 주입함으로써 8시간마다 정맥내 투여할 수 있다. 예를 들어, 세프타지딤과 아비박탐의 조합물은 대략 2시간에 걸쳐 주입함으로써 8시간마다 정맥내 투여할 수 있다. 다른 실시양태에서, 상기 방법은 세프타지딤과 아비박탐의 조합물을 지속적 또는 연장된 주입을 통하여 투여하는 것을 포함할 수 있다. 예를 들어, 세프타지딤과 아비박탐의 조합물은 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간 또는 12시간에 걸쳐 주입함으로써 투여할 수 있다. 다른 실시양태에서, 주입 기간은 12시간 초과, 예를 들어 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간 또는 24시간일 수 있다.
치료 기간은 감염 중증도 및 환자의 임상 및 박테리아학적 진행 뿐만 아니라 환자가 지닐 수 있는 모든 동반 질환에 좌우될 수 있다. 일부 실시양태에서, 치료는 약 5일 내지 14일간 지속될 수 있다. 다른 실시양태에서, 치료는 약 5일 내지 7일간 지속될 수 있다. 예를 들어, 약 2000 mg의 세프타지딤과 약 500 mg의 아비박탐의 조합물을 약 5일 내지 14일 동안 8시간마다 투여할 수 있다. 추가 실시양태에서, 약 2000 mg의 세프타지딤과 약 500 mg의 아비박탐을 약 5일 내지 10일 동안 8시간마다 투여할 수 있다. 다른 실시양태에서, 약 2000 mg의 세프타지딤과 약 500 mg의 아비박탐을 약 5일 내지 7일 동안 8시간마다 투여할 수 있다.
용어 "약" 또는 "대략"은 통상의 기술자에 의해 결정된 바와 같이 특별한 값에 대해 허용되는 오차 범위 내를 의미하는데, 이는 부분적으로, 상기 값을 측정하거나 결정하는 방식, 즉 측정 시스템의 제한사항에 좌우될 것이다. 예를 들어, "약"은 기술 분야의 관행에 따라, 1 이내이거나 1을 초과하는 표준 편차를 의미할 수 있다. 또 다른 한편, 조성물과 관련하여 "약"은 ± 20% 이하, 바람직하게 ± 10% 이하, 보다 바람직하게 ± 5% 이하의 범위를 의미할 수 있다. 또 다른 한편, 특별히 생물학적 시스템 또는 공정과 관련하여, 상기 용어는 특정 값의 특정 자릿수 이내, 바람직하게 5배 이내, 보다 바람직하게 2배 이내를 의미할 수 있다. 특별한 값이 본 출원과 청구범위에 기재되는 경우, 달리 언급되지 않는 한 용어 "약"은 특별한 값에 대해 허용되는 오차 범위 내를 의미한다. 예를 들어, 특정 기간, 예를 들어 시간에 대해 언급하는 경우, 제시 값 (± 20%)이 보다 적용가능하다. 따라서, 6시간은, 예를 들어 4.8시간, 5.5시간, 6.5시간, 7.2시간 뿐만 아니라 통상적인 6시간일 수 있다.
용어 "치료하다", "치료" 및 "치료하는"은 다음 중 한 가지 이상을 지칭한다: 특정 대상체에서 박테리아성 감염의 한 가지 이상의 증상을 경감 또는 완화시키고; 특정 대상체가 경험하는 박테리아성 감염 징후의 세기 및/또는 지속기간을 경감 또는 완화시키며; 박테리아성 감염의 발병 (즉, 감염의 임상 징후 이전의 시기)을 저지, 지연시키고/시키거나 박테리아성 감염의 발생 또는 악화 위험을 저하시킨다.
용량 또는 양에 적용된 용어 "치료 유효한"은 특정 화합물 또는 제약 조성물을 필요로 하는 포유동물에게 투여할 때 목적하는 활성을 야기시키기에 충분한 상기 화합물 또는 제약 조성물의 양을 지칭한다. "유효량"은 감염 또는 질환을 치료하기 위하여 환자에게 투여하는 경우에, 이러한 치료를 수행하기에 충분한, 본 발명에 따르는 화합물의 양을 의미한다. "유효량"은 활성 성분, 감염 상태, 치료하고자 하는 질환 또는 병태 및 그의 중증도, 및 치료하고자 하는 포유동물의 연령, 체중, 신체 상태 및 반응성에 따라서 다양할 것이다.
실시예
실시예
1
- 폐
계면활성제에 있어서의
CAZ
-AVI의
시험관내
효력
박테리아 균주
본 시험에 사용된 박테리아 균주는 아스트라제네카 알앤디 보스톤 (AstraZeneca R&D Boston)에 보관된 미생물 배양 컬렉션 [아스트라제네카 리서치 컬렉션 (AstraZeneca Research Collection; ARC로 지명됨)]의 일부이다. 본 시험을 위해 사용된 박테리아 단리물의 패널은 5개의 CLSI QC 참조 균주로 구성되었고, 나머지는 β-락타마제를 발현하는 최근의 임상 단리물이거나 또는 일차 박테리아 스크리닝 패널로부터의 단리물이었다.
연구 설계
약간 변동시킨 CLSI 브로쓰 미세희석 방법론을 이용하여 MIC 값을 결정하였다. 스톡 화합물 모 플레이트를 제조하고 사용하여, 일련의 2배 약물 희석물의 2 ㎕ 분취액을 퍼킨-엘머 미니트랙 멀티포지션(Perkin-Elmer MiniTrak™ MultiPosition) 연속 분주기를 이용하여 96-웰 딸 플레이트의 칼럼 1 내지 11에 스폿하였다. 칼럼 12는 약물을 함유하지 않았고 성장 대조군으로서 제공되었다. 0, 1, 2.5, 5, 또는 10% 폐 계면활성제를 함유하는 CAMHB 중의 100 ㎕ 부피의 접종물 (5 x 10E5 CFU/mL)을, 다채널 핀피펫(Finnpipette)®을 이용하여 96-웰 플레이트의 각 웰에 가하였다. 아비박탐을 세프타지딤과 조합해서 시험하는 경우에는, 이를 4 ㎍/mL의 고정된 농도로 시험하였다.
실험 과정
약물 조합물당 각 유기체에 대항한 최소 억제 농도 (MIC) 값은 CLSI 지침에 따라서 브로쓰 미세희석 방법론을 이용하여 결정하였다. 각 시험 군에 대해 권장된 참조 박테리아 균주 및 참조 화합물을 각 시험 내로 혼입하였다. 그램-음성물의 경우, 참조 박테리아 균주는 에스케리키아 콜라이 ATCC 25922, 이. 콜라이 (E. coli) ATCC 35218, 클레브시엘라 뉴모니아에 ATCC 700603, 및 슈도모나스 아에루기노사 ATCC 27853이었다. 스타필로코쿠스 아우레우스 ATCC 29213은 그램-음성물에 대한 참조 박테리아 균주였다.
데이터 분석
개개의 단리물에 대한 MIC 값을 가시적으로 판독하였다. 폐 계면활성제 중에서의 각 화합물 또는 조합물에 대한 MIC를 CAMHB 단독에서 시험된 화합물 또는 조합물과 비교하였다.
결과
다양한 농도의 CAMHB에서 시험된 세프타지딤, 아비박탐, 세프타지딤-아비박탐, 및 답토마이신(daptomycin)의 항박테리아 활성이 표 1에 열거되어 있다. MIC에 있어서의 우발적인 (+/-) 2배 과도적 변동 이외에는, 10% 이하의 폐 계면활성제에서 시험된 그램-양성 또는 그램-음성 박테리아 균주 중 어느 것에 대항한 세프타지딤, 아비박탐, 또는 세프타지딤-아비박탐에 대해 MIC 증가가 전혀 관찰되지 않았다. 이와는 달리, 답토마이신 MIC는 시험된 에스. 아우레우스 (S. aureus)와 비교해서 실질적으로 증가하였다 (32배 내지 >128배로 증가함). 1% 정도로 작은 폐 계면활성제는 답토마이신 에스. 아우레우스 MIC를 32배 증가시켰다.
CLSI QC 참조 박테리아 균주와 비교한 세프타지딤, 세프타지딤-아비박탐 및 답토마이신에 대한 MIC 데이터는 '오류! 참조 공급원을 찾을 수 없다'에 열거되어 있다. 세프타지딤, 세프타지딤-아비박탐 및 답토마이신에 대한 MIC 값은 각 균주에 대해 CLSI QC 범위 이내였다.
결론
시험된 박테리아 균주 중 어느 것에 대항한 10% 이하의 폐 계면활성제의 존재 하에서의 세프타지딤, 아비박탐, 또는 세프타지딤-아비박탐에 대해서는 계면활성제-관련 MIC 증가가 전혀 관찰되지 않았다. 다양한 농도의 폐 계면활성제의 존재 하에서 세프타지딤, 아비박탐, 및 세프타지딤-아비박탐의 일관되는 항박테리아 활성은, 호흡기 감염을 치료하기 위해 고려될 수 있는 약물에 특히 주목할 만하다. 예상된 바와 같이, 답토마이신 양성 대조군에 대한 MIC는 에스. 아우레우스에 대항하여 상당히 증가되었는데, 이는 폐 계면활성제 농도가 증가되었기 때문이다.
<표 1>
다양한 농도의 폐 계면활성제의 존재 하에서 세프타지딤, 아비박탐, 및 세프타지딤-아비박탐의 항박테리아 활성
a CAZ-AVI=세프타지딤-아비박탐
실시예
2
- 기타 통상적으로 공-투여된 작용제와의 잠재적 약물 상호작용
체커보드(checkerboard) 검정을 이용하여, 존재하는 경우, 다음 6가지 확립된 항박테리아제를 이용하여 세프타지딤과 세프타지딤-아비박탐 조합물 간에 어떠한 상호작용이 있는지를 결정하였다: 토브라마이신, 레보플록사신, 반코마이신, 리네졸리드, 티게시클린 및 콜리스틴. 다양한 농도 하의 이들 항박테리아제의 존재를 수반하는 및 수반하지 않는 세프타지딤 및 세프타지딤-아비박탐의 MIC를 비교하여, 일련의 분할 억제 농도 지수 (FICI) 값을 수득하였다. 각 조합물 체커보드로부터 평균 FICI를 취하였고, 허용된 기준에 따라서 이를 해석하였다. 항박테리아제가 전혀 효과를 나타내지 않은 경우 (그램 음성 단리물에 대항한 반코마이신 및 리네졸리드; 그램-양성 단리물에 대항한 콜리스틴), 세프타지딤 및 세프타지딤-아비박탐의 MIC 단독을, 이들 항박테리아제의 Cmax 및 0.5 x Cmax와 조합한 MIC와 비교하였다. 4개의 고도로 발현된 AmpC, 8개의 확장된 스펙트럼 베타-락타마제 (ESBL) (2개의 CTX-M-15 포함) 및 5개의 KPC 생산 엔테로박테리아세아에 및 피. 아에루기노사 뿐만 아니라 기저 MIC를 갖는 각 종으로부터의 대표물이 포함되었다. 3개의 에스. 아우레우스 및 3개의 이. 파에칼리스 (E. faecalis)가 또한 포함되었다. 세프타지딤 또는 세프타지딤-아비박탐과 다른 항박테리아제 간에는 상승작용적 또는 길항적 상호작용이 전혀 관찰되지 않았다. 이러한 실험으로부터, 세프타지딤 및 세프타지딤-아비박탐은 조합해서 사용되는 경우에 시험된 약물 중 어느 것과도 미생물학적으로 불리하게 상호작용하지 않을 것으로 결론지었다.
시험된 균주는 다음 표 2에 열거되어 있다.
<표 2>
약물 제품의 공급:
토브라마이신, 레보플록사신, 반코마이신 및 콜리스틴은 시그마-알드리히 (Sigma-Aldrich; 영국 도싯)로부터 공급하였다. 리네졸리드 및 티게시클린은 몰레쿨라 (Molekula; 영국 도싯)로부터 공급하였다.
시험관내
감수성 시험 방법:
체커보드 검정에서 수행된 것을 포함한 모든 MIC 결정을 양이온-조정된 뮐러-힌톤(Mueller-Hinton) 브로쓰[벡톤 디킨슨 (Becton Dickinson; 영국 옥스포드)로부터 구입함]에서 수행하였다.
초기 MIC 데이터는 CLSI (2012b)에 의해 권장된 바와 같은 미세브로쓰 희석 방법에 의해 결정하였다. 작용제들을 조합해서 사용하는 것을 제외하고는 표준 미세브로쓰 희석 시험에 따라서 문헌 [Pillai et.al., Antimicrobial Combinations in Antibiotics, LABORATORY MEDICINE (Lorian Ed., 5th Ed. (2005)) p. 365-440]에 의해 제공된 방법에 따라서 체커보드를 만들었다.
스톡 용액을 만들었고, 이를, 세프타지딤과 아비박탐 양 작용제를 요구되는 농도의 8배로 만든 경우를 제외하고는, 항박테리아 희석물이 만들어져야 하는 이유를 설명하기 위해 요구되는 것 보다 4배의 농도를 이용하여 양이온-조정된 뮐러-힌톤 브로쓰에서 일련으로 희석시켰다. 4 mg/L의 최종 아비박탐 농도를 본 연구 내내 사용하였다. 에볼루션 (Evolution) III 액체 핸들링 시스템을 이용하여 항박테리아제를 미세역가 플레이트 내로 합하였다.
반코마이신 및 리네졸리드에 대항한 그램-음성 단리물의 경우에는, 세프타지딤 및 세프타지딤-아비박탐의 MIC 단독을 반코마이신 [박스터 헬스케어 코포레이션 (Baxter Healthcare Corp.), 2008] 및 리네졸리드 (문헌 [MacGowan, Pharmacokinetics and Pharmacodynamic Profile of Linezolid in Healthy Volunteers and Patients with Gram-Positive Infections, JAC, 51 (Sup S2):ii17-1125 (2003)])의 Cmax 및 0.5 x Cmax의 존재 하에서의 MIC와 비교하였다.
콜리스틴에 대항한 그램-양성 단리물의 경우에는, 세프타지딤 및 세프타지딤-아비박탐의 MIC 단독을 문헌 [Couet et. al., Clinical Microbiology and Infection, Colistin Pharmacokinetics : the Fog is Lifting, CMI 18:30-39 (2011)]에서 언급된 바와 같은 콜리스틴의 Cmax 및 0.5 x Cmax의 존재 하에서의 MIC와 비교하였다.
체커보드 플레이트에 접종하고, 이를 주위 공기 하의 35±2℃에서 16 내지 20 h 동안 CLSI 지침 (2012b)에 따라서 인큐베이션하였다. 그 다음 날, 가시적인 모든 성장을 억제하는 데 요구되는 가장 낮은 농도 또는 농도의 조합으로서 MIC를 기록하였다.
이러한 MIC 데이터로부터, 문헌 [Meletiadis et. al., Defining Fractional Inhibitory Concentration Index Cutoffs for Additive Interactions Based on Self-Drug Additive Combinations, Monte Carlo Simulation Analysis and in vitro-in vivo Correlation Data for Antifungal Drug Combinations Against Aspergillus fumigatus, AAC 54:602-09 (2010)]의 방법에 따라서 각 체커보드에 대해 FICI를 계산하였다. MIC에 상응하는 각 웰은 다음 식에 의해 계산된 FICI를 갖고 있다:
FICI = FICA + FICB = (CA/MICA) + (CB/MICB)
상기에서, MICA는 조합 항박테리아제 단독의 MIC이고, MICB는 세프타지딤 또는 세프타지딤-아비박탐 단독의 MIC이다. CA는 조합되는 조합 약물의 농도이고, CB는 조합되는 세프타지딤 또는 세프타지딤-아비박탐의 농도이다.
각 체커보드는 수많은 FICI 값을 제공하기 때문에, 산술 평균은 모든 값으로부터 계산되어, 하나의 단리물에 대항하여 조합된 2개의 작용제에 대한 평균 FICI를 제공한다. 평균 FICI는 문헌 [Odds (2003)]에 의해 제공된 다음 기준 (이는 현재 대부분의 저널에 의해 허용된 기준이다)으로써 해석된다:
≤ 0.5
상승작용
0.51 - 4
무차별
> 4
길항작용
무차별 상호작용을 해석하기 위한 광범위한 FICI는 이중 희석 방식 (문헌 [Pillai et al. 2005])에 있어서의 MIC 결과의 고유 가변성에 기인한다. 문헌 [Meletiadis et al. (2010)]에는 2 초과의 FICI는 길항성인 것으로 해석되어야 하지만, 이와 같이 해석하기 위해서는 상기 가변성에 기인하여 조심스럽게 처리해야 한다고 제안되어 있다.
결과
요약 MIC 데이터가 표 3에 제시되어 있다. 요약 평균 FICI 데이터는 표 4에 제시되어 있다. 세프타지딤/세프타지딤-아비박탐 MIC 비 단독 및 조합 비 (여기서, FICI 계산은 가능하지 않다)는 표 5에 제시되어 있다.
세프타지딤
모든 항박테리아제에 대한 제2의 작용제와 조합된 세프타지딤에 대한 평균 FICI 범위는, 이를 계산한 경우, 0.64 내지 1.99였다.
세프타지딤과의 모든 조합물에서 평균 FICI가 2를 초과하는 경우는 없었다.
반코마이신 및 리네졸리드의 Cmax 및 0.5 x Cmax를 그램-음성 단리물에 대항하여 세프타지딤과 조합하는 경우, 세프타지딤 단독 및 조합한 경우의 MIC는 모든 경우에 있어서 여전히 하나의 이중 희석 내에 있었다. 유사하게, 콜리스틴의 Cmax 및 0.5 x Cmax를 그램-양성 단리물에 대항하여 세프타지딤과 조합하는 경우, 세프타지딤 단독 및 조합한 경우의 MIC는 모든 경우에 있어서 여전히 하나의 이중 희석 내에 있었다.
세프타지딤-아비박탐
모든 항박테리아제와 조합된 세프타지딤-아비박탐에 대한 평균 FICI 범위는 0.72 내지 2.13이었다.
세프타지딤-아비박탐을 케이. 뉴모니아에 012에 대항하여 콜리스틴과 조합하면, 2.13의 평균 FICI가 제공된다. 이는 세프타지딤-아비박탐과의 모든 조합물에 대한 2 초과의 평균 FICI의 유일한 예이다.
반코마이신 및 리네졸리드의 Cmax 및 0.5 x Cmax를 그램-음성 단리물에 대항하여 세프타지딤-아비박탐과 조합하는 경우, 세프타지딤-아비박탐 단독 및 조합한 경우의 MIC는, 하나를 제외한 모든 경우에 있어서 여전히 하나의 이중 희석 내에 있었다. 이러한 경우 (이. 콜라이 08)에서는, 세프타지딤-아비박탐 MIC가 반코마이신의 Cmax와 조합되는 경우에 0.12 mg/L에서 0.03 mg/L으로 감소되었다. 콜리스틴의 Cmax 및 0.5 x Cmax를 그램-양성 단리물에 대항하여 세프타지딤-아비박탐과 조합하는 경우, 세프타지딤-아비박탐 단독 및 조합한 경우의 MIC는 모든 경우에 있어서 여전히 하나의 이중 희석 내에 있었다.
<표 3>
모든 단리물에 대항한 모든 항박테리아제에 대한 요약 MIC 데이터. 활성을 전혀 나타내지 않는 항박테리아제-단리물 조합물은 포함되지 않았다.
<표 4>
모든 조합물 (적절한 경우)에 대한 평균 FICI 요약. FICI 값은 활성을 전혀 나타내지 않는 항박테리아제-단리물 조합물을 포함하는 검정에 대해 계산되지 않았다.
<표 5>
그램-음성 단리물에 대항한 반코마이신 및 리네졸리드 및 그램-양성 단리물에 대항한 콜리스틴의 0.5 x Cmax 및 Cmax의 존재를 수반하는 및 수반하지 않는 세프타지딤/세프타지딤-아비박탐의 MIC 비.
조합된 caz/caz-avi의 MIC를 단독 caz/caz-avi의 MIC로 나눔으로써 계산된 비
실시예
3
-
CAZ
-
AVI의
ELF
내로의 침투
감염된 마우스와 감염되지 않은 마우스 내에서의 세프타지딤-아비박탐의 폐 배치를 설명하기 위하여 약동학적 연구를 수행하였다. 이어서, 호중구감소성 폐 감염 모델을 이용하여, 슈도모나스 아에루기노사 단리물에 대항한 세프타지딤 및 세프타지딤-아비박탐의 효능 연구를 진행하였다. 감염된 마우스와 감염되지 않은 마우스 간에는, 혈청 또는 ELF에서 관찰된 약동학적 차이가 전혀 없었다. 2 h 주입으로서 세프타지딤 2000 mg과 아비박탐 500 mg의 인간 모의 혈청 용량을 이용하여, 이들 단리물에 대항하여 32 ㎍/mL의 MIC로 최대 활성이 인지되었는데, 상위 95% 신뢰 구간에 대해 ELF fT>MIC ≥ 19%이다. 세프타지딤-아비박탐에 대한 MIC90이 8 ㎍/mL라는 것을 고려해 볼때, 뮤린 폐 감염 모델 내에서 성장할 수 있는 보다 높고 심지어 보다 낮은 MIC를 나타내는 단리물은 거의 없었다. 따라서, 세프타지딤 유도된 ELF fT>MIC 연구를 수행하였는데, 이는 32 ㎍/mL의 MIC에 대항한 활성을 나타냈다 (여기서, ELF fT>MIC는 12%였다).
호중구감소성 폐 감염 모델
체중이 대략 25 g인, 병원체가 없는 암컷 ICR 마우스를 하를란 스프라그 돌리, 인크. (Harlan Sprague Dawley, Inc.; 미국 인디애나주 인디애나폴리스)로부터 획득하였고, 이를 상기 실험 내내 활용하였다. 동물은 미국 국립 연구 회의 권고사항에 따라서 유지 및 사용하였고, 음식과 물을 무제한으로 공급하였다. 접종하기 1일 전 및 4일 전에 마우스에게 시클로포스파미드 [시톡산(Cytoxan)®; 브리스톨-마이어 스큅 (Bristol-Myers Squibb; 미국 뉴저지주 프린스톤)] 100 및 250 mg/kg을 각각 복강내 주사하여 호중구감소성이 되도록 하였다. 접종하기 3일 전에는, 마우스에게 또한, 우라닐 니트레이트 5 mg/kg 단일 용량을 복강내 주사하였다. 이로써, 예측 가능한 정도의 신장 손상이 야기되어 약물 클리어런스가 느려졌다. 항미생물 요법을 개시하기 2시간 전에, 마우스의 호흡률이 육안 검사시 감소될 때까지 이소플루오란 (100% 산소 캐리어 중의 2.5% v/v)을 이용하여 마우스를 가볍게 마취시켰다. 생리 염수 중의 3% 점액소에 현탁시킨 시험 단리물의 107 CFU 접종물 0.05 mL를 점적 주입함으로써 폐렴을 유발시켰다. 마우스가 마취되긴 하였지만, 콧구멍을 차단시키고 마우스를 수직 위치로 유지시키면서 접종물을 상기 동물의 구강 내로 전달한다. 동물이 자발적으로 호흡하기 시작함에 따라 박테리아가 폐 내로 흡인되었다. 산소-강화 챔버 내에서 마취로부터 완전히 회복될 수 있게 한 후, 접종된 마우스를 대조군 (0 h 및 24 h)과 처리군 (CAZ 및 CAZ-AVI)으로 무작위로 나누었다.
세프타지딤
-
아비박탐에
대한 상피 내층 유체 (ELF) 농도의 특징규명
이들 연구에서, 본 발명자들은 상기 언급된, 기존에 결정된 투여 요법을 활용하였다. 감염된 마우스에서 확증적 혈청 약동학적 연구를 수행하였다. 이들 연구를 위해, 감염된 호중구감소성 마우스에게 상기 계산된 요법에 따라 투여하였고, 6마리 마우스 군을 24 h 기간 전반에 걸친 여러 시점에서 안락사시켜 표적 노출을 확인하였다. 심장 천자를 통하여 혈액을 수집하였고, 혈청 샘플을 분석할 때까지 -80℃ 하에 저장하였다.
감염된 마우스에서의 상피 내층 유체 농도를 설명하기 위하여 약동학적 연구를 수행하였다. 이들 연구를 위해, 감염된 호중구감소성 마우스에게 상기 계산된 요법에 따라 투여하였고, 6마리 마우스 군을 세 번째 투여 구간 (즉, 16 내지 24 h) 전반에 걸친 여러 시점에서 안락사시켰다. 일단 안락사시키면, 혈청 및 BAL 샘플을 상기 언급된 바와 같이 수집하였다. 혈청 및 BAL 샘플을 분석할 때까지 -80℃ 하에 저장하였다. BAL 농도-시간 프로파일을 활용하여, 상위 95% 신뢰 구간을 포함한 ELF fT>MIC를 계산하였다.
세프타지딤에
대한 상피 내층 유체 (ELF) 농도의 특징규명
본 발명자들은 2시간 주입으로서 8시간마다 세프타지딤 2000 mg을 투여한 남자에서 관찰된 혈청 fT>MIC를 모의한 마우스에서, 기존에 결정된 투여 요법을 활용하였다 (8). 감염된 마우스에서 확증적 약동학적 연구를 진행하였고, 약역학적 분석 및 ELF fT>MIC의 평가는, 상기 생성된 농도-시간 프로파일로부터 이루어졌다. 이들 연구를 위해, 감염된 호중구감소성 마우스에게 상기 계산된 요법에 따라 투여하였고, 6마리 마우스 군을 세 번째 투여 구간 (즉, 16 내지 24 h) 전반에 걸친 여러 시점에서 안락사시켜 표적 노출을 확인하였다.
감염된 마우스에서의 상피 내층 유체 농도를 설명하기 위하여 약동학적 연구를 수행하였다. 이들 연구를 위해, 감염된 호중구감소성 마우스에게 상기 계산된 요법에 따라 투여하였고, 6마리 마우스 군을 세 번째 투여 구간 (즉, 16 내지 24 h) 전반에 걸친 여러 시점에서 안락사시켰다. 일단 안락사시키면, 혈청 및 BAL 샘플을 상기 언급된 바와 같이 수집하였다. 혈청 및 BAL 샘플을 분석할 때까지 -80℃ 하에 저장하였다. BAL 농도-시간 프로파일을 활용하여, 상위 95% 신뢰 구간을 포함한 ELF fT>MIC를 계산하였다.
유도된 ELF
fT
>
MIC
연구에 대한
세프타지딤
투여 요법의 결정
감시 연구에서는, 피. 아에루기노사에 대항한 세프타지딤-아비박탐에 대한 MIC90이 8 ㎍/mL인 것으로 관찰되었다 (10-12). 이를 고려해 볼때, 보다 높은 MIC를 나타내는 단리물은 거의 없고, 뮤린 폐 감염 모델 내에서 성장할 수 있는 그 수도 훨씬 적다. 기존의 문헌에서는 또한, 피. 아에루기노사에 대항하여 세프타지딤-아비박탐에 대해 유래된 혈액 fT>MIC 효능 목표가 세프타지딤 단독요법 뿐만 아니라 기타 세팔로스포린류에 대해 수득된 것과 상당히 상관이 있는 것으로 밝혀졌다. 세프타지딤에 대한 상대적 MIC가 순조롭게 ≥ 32 ㎍/mL이라는 것을 고려해 볼때, 본 발명자들은 상기 언급된 인간화 세프타지딤 요법을 이용하여, 효능과 박테리아 성장 간의 약역학적 중단을 추가로 통찰하도록 계획을 세웠다. 이러한 실험 동안에는, ELF fT>MIC가 예상되고 생성된 ELF fT>MIC 보다 상당히 더 많은 것으로 관찰되었다 (이로써 본 발명자들은 효능에 필요한 fT>MIC을 구별할 수 없없다). 따라서, 이들 연구를 수행하여, 본 발명자들이 폐 감염 모델 내에서 효능 상실을 관찰할 수 있을 정도로 충분히 낮은 ELF fT>MIC를 초래하는 마우스에서의 특정 요법을 설계하였다. 상기 언급된, 기존의 인간화 요법의 용량은 투여 기간 내내 감소되었고, 추가의 약동학적 연구를 수행하였다. 이들 연구에서는, 마우스에게 24 h의 기간에 걸쳐 세프타디짐의 요법을 투여하였고, 마지막 3 구간 (즉, 16 내지 24 h) 동안에 샘플링을 수행하였다. 마우스를 안락사시키고, 혈청 및 BAL 샘플을 미리 결정된 시점에서 상기 언급된 바와 같이 수집하였다.
생체내
효능:
세프타지딤
-
아비박탐
요법
28개의 피. 아에루기노사 단리물 각각에 대해, 감염을 개시한지 2시간 후에 시작하는 세프타지딤-아비박탐의 요법을 마우스 군에게 투여하였다. 모든 용량은 0.2 mL 피하 주사물로서 투여하였고, 이는 8-시간 투여 구간으로 3회 이루어졌다 (즉, 24시간). 대조군 동물로서 제공되기 위해서는, 추가 마우스 군에게 처리 요법과 동일한 부피, 경로 및 빈도로 생리 염수를 투여하였다. 요법을 개시한지 24시간 후에 모든 동물로부터 폐를 채취하였는데; 24시간 동안 살아남지 못한 마우스로부터는 사망시에 채취하였다. 모든 연구 마우스에 대한 채취 과정은 CO2에 노출시켜 안락사시키면서 시작하고, 이어서 경추 탈구시킨다. 희생시킨 후, 폐를 꺼내고 개별적으로 생리 염수에서 균질화시켰다. 이러한 폐 균질화물의 일련의 희석물을, CFU 결정을 위해 5% 양 혈액을 수반한 트립티카제 콩 한천 상에 도말하였다. 상기 언급된 처리군과 대조군 이외에도, 감염되었지만 처리되지 않은 6마리 마우스의 또 다른 군을 투여 개시시 채취하고 0 h 대조군으로서 제공하였다. 박테리아 밀도 상의 변화로서 지명된 효능은, 0 h 대조군 동물에서 관찰된 출발 밀도로부터, 24 h 후 처리된 마우스에 대해 수득된 log10 박테리아 CFU의 변화로서 계산하였다. 상기 균질화물의 직접 접종물을, 32-4 ㎍/mL의 세프타지딤-아비박탐을 함유하는 플레이트 상으로 도말함으로써, 내성의 발생을 또한 시험하였다.
생체내
효능:
세프타지딤
요법
9개의 피. 아에루기노사 단리물을 기존에 보고된 (8) 상기 세프타지딤 요법에 대항하여 시험하였다. 감염을 개시한지 2시간 후에 시작하는 세프타지딤 요법을 마우스 군에게 투여하였다. 모든 용량은 0.2 mL 피하 주사물로서 투여하였고, 이는 8-시간 투여 구간으로 3회 이루어졌다 (즉, 24시간). 대조군 동물로서 제공되기 위해서는, 추가 마우스 군에게 처리 요법과 동일한 부피, 경로 및 빈도로 생리 염수를 투여하였다. 각 동물로부터 폐를 채취하고 처리하는 것은 앞서 기재된 바와 같이 수행하였고, 효능은 0 h 대조군 동물에서 관찰된 출발 밀도로부터, 24 h 후 처리된 마우스에 대해 수득된 log10 박테리아 CFU의 변화로서 계산된, 박테리아 밀도 상의 변화로서 정의되었다.
생체내
효능:
세프타지딤
유도된 ELF
fT
>
MIC
연구
이들 연구를 위해, 9개의 피. 아에루기노사 단리물을, 특이적인 ELF fT>MIC를 산출한 마우스에서 CAZ 요법에 대항하여 평가하였다. 시험 유기체를 접종한지 2시간 후에 투여를 개시하였고, 모든 용량은 0.2 mL 피하 주사물로서 투여하였고, 이는 8-시간 투여 구간으로 3회 이루어졌다 (즉, 24시간). 대조군 동물로서 제공되기 위해서는, 추가 마우스 군에게 처리 요법과 동일한 부피, 경로 및 빈도로 생리 염수를 투여하였다. 모든 연구 마우스에 대한 채취 과정은 CO2에 노출시켜 안락사시키면서 시작하고, 이어서 경추 탈구시킨다. 희생시킨 후, 폐를 꺼내고 개별적으로 생리 염수에서 균질화시켰다. 이러한 폐 균질화물의 일련의 희석물을, CFU 결정을 위해 5% 양 혈액을 수반한 트립티카제 콩 한천 상에 도말하였다. 상기 언급된 처리군과 대조군 이외에도, 감염되었지만 처리되지 않은 6마리 마우스의 또 다른 군을 투여 개시시 채취하고 0 h 대조군으로서 제공하였다. 박테리아 밀도 상의 변화로서 지명된 효능은, 0 h 대조군 동물에서 관찰된 출발 밀도로부터, 24 h 후 처리된 마우스에 대해 수득된 log10 박테리아 CFU의 변화로서 계산하였다.
항박테리아제:
시판되고 있는 세프타지딤 [포르타즈(Fortaz)®, 로트: L716, 글락소스미스클라인 리서치 트라이앵글 파크 (GlaxoSmithKline Research Triangle Park; 미국 노스캐롤라이나주)]은 하트포드(Hartford) 병원 약국 부서로부터 구입하였고, 이를 모든 생체내 연구에 활용하였으며, 분석 등급 아비박탐은 아스트라제네카 파마슈티칼즈 (AstraZeneca Pharmaceuticals; 미국 매사추세츠주 월섬)에 의해 제조되었다. 세프타지딤의 임상 바이알은 처방 정보에 기재된 바와 같이 재구성하였고, 적당히 희석시켜 목적 농도를 달성하였는데; 분석적 아비박탐 분말은 이와 같이 요구되는 농도를 달성하기에 충분한 양으로 칭량하고, 사용하기 직전에 재구성하였다.
결과
박테리아
단리물
효능 연구에 포함된 28개 단리물에 대한 세프타지딤 및 세프타지딤-아비박탐 MIC가 표 6에 제시되어 있다.
<표 6>
생체내 효능 연구 동안 활용된 29개의 그램-음성 단리물에 대한 표현형별 데이터.
약동학적 프로파일에 대한 숙주 감염 상태의 결정
감염된 마우스 및 감염되지 않은 마우스에서 세프타지딤-아비박탐에 대해 생체내에서 결정된 유리 약물 혈청 및 ELF 농도-시간 프로파일이 도 1 및 도 2에 도시되어 있다. 감염된 마우스 및 감염되지 않은 마우스에 대한 침투 비는 표 7에 기재된 바와 같이 서로 유사하였다. 추가로, 계산된 약역학적 원리 fT>MIC는 감염된 마우스와 감염되지 않은 마우스 간에 거의 동등한 수준이었다 (표 8).
<표 7>
감염된 마우스 및 감염되지 않은 마우스에서의 혈청 농도와 비교된, 세 번째 투여 구간 (즉, 16 내지 24 h) 전반에 걸친 세프타지딤 및 아비박탐에 대한 상피 내층 유체 (ELF) 점 침투 비.
<표 8>
감염된 마우스 및 감염되지 않은 마우스에서 관찰된 것과 비교된, 남자에서의 2 h 주입으로서의 8 h 마다의 세프타지딤-아비박탐 2000-500 mg의 인간 모의 혈청 용량 투여 후 세프타지딤 및 아비박탐에 대한 상피 내층 유체 (ELF) 및 혈청 약역학적 평가.
세프타지딤
및
아비박탐에
대한
약역학적
평가
세프타지딤
-
아비박탐에
대한 상피 내층 유체 (
ELF
) 농도의 특징규명
세프타지딤-아비박탐에 대하여 생체내에서 결정된 유리 약물 혈청 약동학적 프로파일이 도 3에 도시되어 있다. 이 도면으로부터, 뮤린 혈청 노출 프로파일이 인간에서 관찰된 것과 유사하다는 것이 명백한데, 중요하게는 시험된 MIC의 범위 전반에 걸쳐 이들 요법에 대해 획득된 혈청 중의 모든 fT>MIC가 거의 동등한 수준이었다. 세 번째 투여 구간에 걸친 ELF 농도가 도 4에 도시되어 있다. 이들 데이터로부터, 특정 범위의 MIC에 대항한 fT>MIC 값을 결정하였다. 평균 및 상위 95% 신뢰 구간이 도 5에 기재되어 있다.
세프타지딤에
대한 상피 내층 유체 (ELF) 농도의 특징규명
세프타지딤에 대하여 생체내에서 결정된 유리 약물 혈청 및 ELF 약동학적 프로파일이 도 6에 도시되어 있다. 이러한 연구의 수행 동안, 상기 요법이 ELF 내에서 충분한 범위의 fT>MIC를 생성하지 못하여서 효능 상의 일시 정지가 관찰될 수 있는 것으로 결정되었다. 따라서, 표 9 및 도 7에 기재되고 도시된 효능 데이터를 모든 약역학적 결정에 사용하지 못하였다.
<표 9>
호중구감소성 폐 감염 모델에서 세프타지딤 요법을 활용하는 생체내 효능 연구의 결과. * 투여 시작시의 박테리아 밀도를 대표하는 0 h 대조군 데이터.
세프타지딤에
대한 유도된 ELF
fT
>
MIC
연구를 위한 투여 요법의 결정
세프타지딤 단독에 대하여 생체내에서 결정된 유리 약물 약동학적 프로파일이 도 8에 도시되어 있다. 추가로, 상기 요법에 대한 세 번째 투여 구간 전반에 걸친 ELF 농도가 또한 도 8에 제시되어 있다. 이들 데이터로부터, 특정 범위의 MIC에 대항한 fT>MIC 값을 결정하였다. 평균 및 상위 95% 신뢰 구간이 도 9에 기재되어 있다.
생체내
효능:
세프타지딤
-
아비박탐
인간 모의 혈청 연구
연구를 호중구감소성 동물에서 수행하였다. 투여 개시시 대조군 마우스에서의 각각의 박테리아 밀도는 5.98 ± 0.44 log10CFU였는데, 24시간 후에는 9.13 ± 0.80 log10CFU로 증가하였다. 호중구감소성 연구의 결과가 표 10 및 도 5에 제시되어 있다. 피. 아에루기노사의 컬렉션에 대항하여, 세프타지딤-아비박탐의 경우에는 32 ㎍/mL 이하의 MIC를 나타내는 단리물에 대항한 활성이 관찰되었는데, 16 ㎍/mL의 MIC 하의 하나의 단리물은 제외된다. 64 ㎍/mL의 MIC를 나타내는 단독 단리물에 대항한 활성은 관찰되지 않았다. 직접 균질화물을 약물 함유 플레이트 상으로 도말한 후, 성장이 전혀 관찰되지 않았는데, 이는 내성 발생이 전혀 존재하지 않는다는 것을 의미한다.
<표 10>
호중구감소성 폐 감염 모델에서 세프타지딤-아비박탐 요법을 활용하는 생체내 효능 연구의 결과. * 투여 시작시의 박테리아 밀도를 대표하는 0 h 대조군 데이터.
생체내
효능:
세프타지딤
유도된 ELF
fT
>
MIC
연구
유도된 ELF fT>MIC 효능 연구의 결과가 표 11 및 도 9에 제시되어 있다. 연구를 호중구감소성 동물에서 수행하였다. 투여 개시시 대조군 마우스에서의 각각의 박테리아 밀도는 5.89 ± 0.30 log10CFU였는데, 24시간 후에는 8.75 ± 0.93 log10CFU로 증가하였다. 32 내지 128 ㎍/mL 범위의 세프타지딤 MIC에 근거하여 단리물을 선택하였다. 32 ㎍/mL의 MIC를 나타내는 단리물에 대항한 활성이 관찰되었다. 효능은 64 ㎍/mL의 MIC를 나타내는 단리물에 대항하여 가변적이었는데; 128 ㎍/mL의 MIC를 나타내는 단리물은, 세프타지딤 단독요법을 이용하는 경우에 활성을 거의 내지는 전혀 보여주지 않았다.
<표 11>
호중구감소성 폐 감염 모델에서 유도된 ELF fT>MIC 세프타지딤 요법을 활용하는 생체내 효능 연구의 결과. * 투여 시작시의 박테리아 밀도를 대표하는 0 h 대조군 데이터.
결론
뮤린 폐 감염 모델 내에서, 세프타지딤-아비박탐의 조합물은 숙주 면역 상태와 무관하게 폐 내에 상당한 농도를 생성시킨다. 앞서 결정된 세프타지딤-아비박탐의 요법을 활용하여, MIC ≤ 32 ㎍/mL를 나타내는 단리물에 대항한 활성을 관찰하였다 (여기서, ELF fT>MIC ≥ 19%이다). 이들 관찰 결과를 고려해 볼때, 폐 내에서 필요한 fT>MIC는 세팔로스포린에 대해 기존에 생각된 것 (대략 60%) 보다 적을 수 있다. 분명하게도, 상기 조합물에 대한 64 ㎍/mL의 MIC 하에서, 눈에 띄는 ELF fT>MIC가 없는 경우에, 세프타지딤-아비박탐은 효능을 야기시키지 않는다. 세프타지딤 유도된 ELF fT>MIC의 결과는 또한, 이것이 32 ㎍/mL의 MIC에 대항하여 관찰된 활성에도 적용될 수 있다는 것을 입증해 준다 (여기서, ELF fT>MIC는 12%이고, 64 및 128 ㎍/mL의 MIC에서는 가변적 활성을 나타내거나 활성을 전혀 나타내지 않는다).
실시예
4:
호중구감소성 대퇴 모델
CD-1 호중구감소성 마우스를 대상으로 하여, 그 대퇴에 대략 106 cfu β-락타마제-생산 피. 아에루기노사 균주로 감염시켰다. 세프타지딤 단독으로 2 h 후에 (다양한 농도를 수반한 q2h) 24 h 동안 치료를 시작하였고, 그의 노출 반응 관계를 확립시키기 위하여 상기 대퇴에서 cfu를 결정하였다. 2개 균주 (세프타지딤 MIC 32 및 64 mg/L)에 대한 아비박탐의 완전 용량 분할 연구를 수행하였다. 아비박탐 q2h의 노출 반응을 또 다른 6개 피. 아에루기노사 균주 (세프타지딤 MIC 64 내지 128 mg/L)에 대하여 결정하였다. Emax 모델을 용량 및 PK/PD 지수 (PDI) 반응에 피팅하여, 정지 효과, 즉 1- 및 2-log10 사멸을 초래하는 세프타지딤 단독의 PDI 값 및 세프타지딤과 아비박탐의 조합물의 PDI 값을 결정하였다. 아비박탐에 대하여, 가상 생체내 MIC (역치 농도, CT) %fT>CT 위의 투여 구간의 % 시간을 계산하였다 (0.25, 1 및 4 mg/L의 CT).
단독요법에 대한 세프타지딤의 정지 %fT>MIC는 0 내지 38%였는데, 일부 균주는 더 낮은 %fT>MIC를 요구하였다. 아비박탐은 모든 균주에 대하여 세프타지딤 정지 %fT>MIC를 감소시켰다. 용량 분할 연구에서는, 1 mg/L의 %fT>CT의 경우에 아비박탐에 대한 최상의 PDI 상관 관계가 관찰되었다. 1 mg/L의 CT에서는, 30.2 내지 74.1의 %fT>CT가 요구되었다. 또 다른 6개 균주에 대해서는, 평균 %fT>CT 1 mg/L이 36.3% (14.1-62.5)였다. 정지 효과에 대해 요구되는 추정치는 부분적으로, 세프타지딤의 용량에 의존적이었다 (세프타지딤 용량이 더 높은 경우에는, 더 낮은 값이 요구되었다).
아비박탐의 효과는 주로, 역치 %fT>CT 1 mg/L 위의 시간에 의존적이었는데, 세프타지딤과 동시에 투여되는 경우에는 평균 값이 36.3%였다. 더 낮은 용량의 세프타지딤 하에서는 비교적 더 많은 노출이 요구되었다.
재료 및 방법
항박테리아제:
세프타지딤 (CAZ)
아스트라제네카 (이전명: GSK)에 의해 제공됨
로트 번호: G263770,
만료일: 2012년 12월 5일
제조일: 2010년 12월 6일
CAS 번호: 78439-06-2
효력: 77.2%
아비박탐
아스트라제네카 [이전명: 닥터 레디(Dr Reddy)]
로트 번호: AFCH005151 (07113P028), 분석 번호: A1002CQ055
만료일: 2013년 3월
효력: 91.7%.
박테리아 균주 및 감수성 시험:
임상적으로 관련된 각종 공급원으로부터 수득된, 7개의 널리 명확히 특징규명된 세프타지딤-내성 슈도모나스 아에루기노사 균주를 표 1에 제시된 바와 같은 실험에 사용하였다. 보다 초기의 시험관내 체커보드 연구 (Berkhout & Mouton 2013 CAZ-AVI-M1-061)로부터 MIC를 취하고, ISO-지침 (ISO 2006)에 따라서 미세희석함으로써 결정하였다. 이 방법은 CLSI 화합성이다.
동물:
체중이 20 내지 25 g인 4 내지 5주령의 비-근친계 암컷 CD-1 마우스 [찰스 리버 (Charles River; 네덜란드)]를 본 실험에 사용하였다. 시클로포스파미드 2회 용량을 피하 투여함으로써 과립구감소증을 유발시켰는데; 1회 용량은 감염 실험하기 4일 전에 투여하였고 (150 mg/kg) 다른 1회 용량은 하루 전에 투여하였다 (100 mg/kg).
상기 동물은 음료수와 음식을 무제한으로 공급하는 표준 조건 하에 사육하였고, 1일 1회 조사하였으며 면역억제 후에는 1일 2 내지 3회 조사하였다. 유럽 위원회의 권고 사항 (지시 86/609/EEC, 1986년 11월 24일)에 따라서 동물 연구를 수행하였고, 모든 동물 과정은 라드바우드(Radboud) 대학의 동물 복지 위원회에 의해 승인되었다 (RU-DEC 2012-003).
감염:
호중구감소성 마우스를, 1마리 동물당 2개의 피. 아에루기노사 균주로 감염시켰는데, 1개 균주는 좌측 대퇴에 감염시켰고 다른 1개 균주는 우측 대퇴에 감염시켰다. 대략 105개 내지 106개 박테리아로 이루어진 0.05 mL의 박테리아 현탁물을 근육내 접종하였다. 증가 용량의 세프타지딤 또는 염수 (대조군)를 이용한 치료 (모든 용량은 피하 투여되는 0.1 mL이다)는 t=0 h (감염 개시 후 2시간)에서 시작하였는데, 24 h의 기간 동안 지속되는 q2h의 투여 요법을 수행하였다. 모든 투여 요법을 적어도 2마리 동물에서 수행하였다. t=0 h에서는, 2마리 마우스를 인도적으로 희생시켜, 치료 직전에 초기 접종물을 결정하였다. 동물 복지 규정에 따라서, 동물의 복지가 조기 종결이 필요하다고 지시하지 않는 한은 다른 모든 동물은 t=24 h에 희생시켰다. 대퇴를 취하고, 이를, 2 mL 인산염 완충 염수 (PBS; NaCl 8.00 g/L, Na2HPO4 * 2 H2O 1.44 g/L, KH2PO4 0.26 g/L, pH 7.2 - 7.4)를 함유하는 미리-냉각된 10-mL용 플라스틱 튜브 [트랜스포트 튜브 (Transport Tube; 네덜란드 옴닐라보)]에 옮겼다. 연속해서, 울트라-터랙스(Ultra-Turrax) [IKA 라보르테크닉 (IKA Labortechnik; 독일)]를 이용하여 대퇴를 분쇄하였다. 10배 희석 시리즈를 제조하였고, 희석물당 3x10 ㎕을 도말하였다 [크로마가르 (Chromagar), 바이오메리엑스 (Biomerieux; 네덜란드)]. 그 다음 날, 콜로니를 계수하고, 대퇴당 cfu의 수를 계산하였다. 이어서, "dcfu"로서 표현된, t=24 h 및 t=0 h에서 log10[cfu/대퇴] 값 (2마리 마우스의 평균 값) 간의 차이로서 약물 효과를 결정하였다.
항생제 농도 측정
냉각된 원심분리기를 이용하여, 혈액을 혈장으로부터 분리시켰다. 샘플을 분열시키고 -80℃ 하에 저장하였다. 아스트라제네카 (미국 매사추세츠주 월섬) 내의 약물 대사 및 약동학 그룹에 의해 세프타지딤과 아비박탐의 농도를 결정하였는데, 세프타지딤의 경우에는 정량 하한치가 1.5 ng/mL이고 아비박탐의 경우에는 정량 하한치가 1.8 ng/mL이다. 평형 투석 챔버 내에서 결정되고 LC-MS/MS를 통하여 분석된 바와 같이, 단백질 결합도는 세프타디짐의 경우에는 10%였고 아비박탐의 경우에는 8%였다.
조합된 투여 방식의 평가 및 검증
실험적 대퇴 감염이 이루어진 호중구감소성 마우스 내에서의 아비박탐의 노출-반응 관계는, 세프타지딤으로 처리한지 24 h 후 특별한 균주의 초기 접종물과 비교된 바와 같이 1 내지 2 log10 cfu 증가를 초래하는 세프타지딤의 고정 투여 요법을 이용한 치료 하에 결정하였다. 이러한 요법은 아비박탐의 효과 상의 변화에 대한 민감성 때문에 선택되었다. 투여된 아비박탐의 양은 그 빈도와 용량 면에서 다양하였다. 세프타지딤 및 아비박탐의 노출은 약동학적 연구로부터 수득된 약동학적 파라미터 추정치를 이용하여, 믹랩(MicLab) 2.36 [메디매틱스 (Medimatics; 네덜란드 마스트리히트)]을 사용하여 결정하였다. 모의 실험에서, 세프타지딤의 경우에는 단백질 결합도가 10%로 사용되었고 아비박탐의 경우에는 8%로 사용되었다. dcfu로서 표현된, t=24 h 및 t=0 h에서 log10[cfu/대퇴] 값 (2마리 마우스의 평균 값) 간의 차이로서 약물 효과를 결정하였다. 유리 약물 농도를 모든 계산에 사용하였다. Emax 모델 (또는 선형 회귀)을 용량 및 PK/PD 지수 (PDI) 반응에 피팅하여, 정지 효과, 또는 특별히 명시된 log-사멸 효과를 초래하는 세프타지딤 단독의 PDI 값 및 세프타지딤과 아비박탐의 조합물의 PDI 값을 결정하였다. 아비박탐 %fT>CT에 대해서는, 역치 농도 CT 위의 투여 구간의 % 시간을 0.25, 1 및 4 mg/L의 CT에 대하여 계산하였다. 시험관내에서 아비박탐의 활성에 근거하여 CT 값을 선택하였는데, 4 mg/L이 감수성 시험에 사용되었지만, 보다 낮은 농도가 또한, 시험관내 체커보드 연구에서 및 엔테로박테리아세아에를 이용한 중공 섬유 모델에서 결정된 바와 같이 활성이었다 (Nichols W, Levasseur P, Li J, Das S. 2012. A threshold concentration of avibactam (AVI) during the pharmacokinetic decline phase, below which β-lactamase inhibition in Enterobacteriaceae becomes ineffective. Oral presentation at the 52nd Interscience Conference on Antimicrobial Agents and Chemotherapy, San Francisco, CA. Abstract #A-1760).
<표 12>
세프타지딤
및
아비박탐의
약역학적
연구를 위해 사용된 피.
아에루기노사
균주
본 실험에 사용된 슈도모나스 아에루기노사 균주는 시험관내에서의 MIC 및 시험관내에서의 체커보드의 결과에 근거하여 선택하였다. CAZ = 세프타지딤, CAZ-AVI = 세프타지딤과 아비박탐의 조합물, * 4 mg/L 아비박탐 하에서 결정된 MIC CAZ-AVI.
<표 13>
용량 분할 실험의 설계.
세프타지딤과 아비박탐의 조합 요법을 이용하여 호중구감소성 CD-1 암컷 마우스를 치료하기 위한 용량 분할 설계의 예. 각 군은 2마리 마우스로 이루어졌고, 스케줄에 표시된 바와 같이 아비박탐 및 초기 접종물과 비교하여 2 log10 증가에 근거하여 2시간마다 세프타지딤의 고정 용량을 투여하였다.
Gr, 군; FZ, 생리학적 염수; uur, 시간; C, 대조군. 용량 (mg/kg).
<표 14>
세프타지딤의 미리-결정된 일정한 투여량과 조합되는 경우 대퇴 감염된 마우스를 치료하는 데 있어서 6개 피. 아에루기노사 균주에 대한 정체의 24-h 반응과 연관된 아비박탐의 노출.
CT1= 1 mg/L의 역치 농도, TDD = 총 1일 용량, CAZ = 세프타지딤, AVI = 아비박탐
<표 15>
마우스를
세프타지딤
q2h
및
아비박탐
q2h로
처리한 비-선형 회귀 (
E
max
모델) 결과
괄호 안은 SE이다.
결과
표 12에 나타낸 바와 같이, 단독요법 동안 세프타지딤의 정지 %fT > MIC는 0 내지 38%였다. 대부분의 내성 균주의 경우에는, 효과가 전혀 관찰될 수 없었는데, 이는 보다 낮은 %fT > MIC를 요구한다. 이는 일부 고도로 내성인 균주에 대해서는 더 적은 %fT > MIC가 필요하다는 것을 표시한다. 아비박탐은 모든 균주에 대해 세프타지딤의 정지 %fT > MIC를 감소시켰다.
완전 용량 분할 연구의 설계가 표 13에 제시되어 있다. 도 10은 아비박탐의 완전 용량 분할 연구에 제출된 2개 균주의 결과를 도시한 것이다. 지수 Cmax, AUC/MIC 및 용량 각각이 일부 상관 관계를 나타내긴 하였지만, 상기 도면을 육안으로 검사한 결과, %fT> CT는 다소 우수한 예측 변수이지만, 상당히 변동적인 것으로 여겨진다는 결론에 이르렀다. 이는 %fT> CT가 상기 환경에서의 성과를 결정하는 유일한 요인이 아니라는 것을 표시한다. 상기 도면은 CT의 3가지 농도에 대한 %fT> CT를 도시한다. %fT> CT 1 mg/L은 0.25 mg/L 및 4 mg/L 보다 다소 우수한 예측 변수인 것으로 여겨진다. 1 mg/L의 농도에서, 박테리아 성장 정지 효과를 뒷받침하기 위해서는 30.2 (균주 7) 또는 74.1 (균주 18)의 %fT > CT가 요구되었다.
세프타지딤의 고정 투여 요법을 이용하여 아비박탐의 다양한 용량으로 정지 효과를 달성하는 데 요구되는 용량을 6개 균주에 대해 결정하였다 (도 11). 이들 결과로부터, %fT> CT 1 mg/L을 각 균주에 대하여 결정하였다. 평균 %fT> CT는 36.3% (14.1 내지 62.5)였다 (표 14). 정지 효과에 요구되는 추정치는 부분적으로, 세프타지딤의 용량에 의존적이었다 (세프타지딤 용량이 균주의 MIC를 기준으로 하여 비교적 더 높은 경우에는 더 낮은 값이 요구되었다).
표 15는 6개의 피. 아에루기노사 균주에 대한 비-선형 회귀 분석의 결과를 나타낸다. 추정치는 일부 경우에 있어서 상당한 표준 오차를 나타낸다.
실시예
5
: 실험적 폐렴이 있는 호중구감소성 암컷 CD-1 마우스에서
세프타
지딤 및 아비박탐의 약역학
CD-1 호중구감소성 마우스를 대상으로 하여, 가벼운 마취 하에 콧구멍을 통하여 점적 주입함으로써 폐에 대략 106 cfu로 감염시켰다. 세프타지딤 단독으로 2 h 후에 (다양한 용량을 수반한 q2h) 24 h 동안 치료를 시작하였고, 그의 노출 반응 관계를 확립시키기 위하여 상기 폐에서 cfu를 결정하였다. 세프타지딤 단독요법 실험에서는 최대 노출을 나타낸 바 있는 (이는 2 log10 성장을 허용하였다) 세프타지딤 노출 하에 2배 증가 용량에서 각각 32 및 128 mg/L의 세프타지딤에 대한 MIC를 나타내는 2개 균주에 대해 아비박탐이 q2h 또는 q8h 제공되었다. 세프타지딤의 2가지 상이한 용량 수준에서 2개 균주에 대한 아비박탐의 완전 용량 분할 연구를 수행하였고; 또한, 아비박탐 q2h의 효능을 또 다른 2개 균주에 대하여 결정하였다. Emax 모델을 용량 및 PK/PD 지수 (PDI) 반응에 피팅하여, 정지 효과, 즉 1- 및 2-log10 사멸을 초래하는 세프타지딤 단독의 PDI 값 및 세프타지딤과 아비박탐의 조합물의 PDI 값을 결정하였다. 아비박탐에 대하여, 가상 생체내 역치 농도 CT, % fT>CT 위의 투여 구간의 % 시간을 계산하였다 (0.25, 1 및 4 mg/L의 CT).
아비박탐에 대한 노출 반응 관계 (R2 0.54-0.86)는 q2h가 q8h 보다 더 효능이 있어서, 상기 2개 균주에 대한 1일 용량을 2.7 및 10.1 인자 정도로 감소시켜 조합물의 정지 효과를 수득하였다. 이는 20.1 (범위 16.1 내지 23.5)의 평균 %fT> CT 1 mg/L에 상응한다. 용량 분할 연구에서는, %fT>CT 1 mg/L 경우에 아비박탐에 대한 최상의 PDI 상관 관계가 관찰되었다. 정지 효과에 대해 요구되는 아비박탐 노출 추정치는 부분적으로, 세프타지딤의 용량에 의존적이었다 (세프타지딤 용량이 더 높은 경우에는, 더 낮은 값이 요구되었다). 2개의 대조군 균주에 대해서는, %fT> CT 1 mg/L 추정치가 22.4 및 21.6%였다.
결론적으로, 아비박탐의 효과는 투여 빈도에 의존적이었는데; 투여 빈도를 감소시키면 효과 감소가 관찰되었다. 효과와 상관이 있는 주요 PK/PD 지수는 역치 CT 위의 시간이었다. 대부분의 균주의 경우에는, 정지 효과를 위한 1 mg/L의 %fT> CT가 16 내지 25%였다.
아비박탐의 최소 효과 농도를 정의하기 위하여, 역치 농도 CT에 근거하여 새로운 약역학적 지수를 도입한다. 이 파라미터는 생체내에서 상당한 효과를 초래하는 아비박탐의 역치 농도를 나타낸다. 결과적으로, 약역학적 효과를 위해 요구되는 아비박탐의 노출은 상기 파라미터를 이용하여 표현될 수 있다. 따라서, 아비박탐의 노출은 본 연구 세프타지딤에서 β-락탐의 %fT>MIC과 유사하게, 약역학적 지수 %fT>CT로서 표현된다. 세프타지딤과 유사하게, %fT>CT의 추정치는 CT 그 자체에 좌우된다. 그러나, β-락탐의 MIC가 시험관내 데이터로부터 통상적으로 공지되어 있는 반면, CT는 그렇치 않다. 본 실시예에서 제시된 실험에서는, 최적의 값을 실험적으로 선택하기 위하여, CT의 시험 값, 즉 0.25, 1 및 4 mg/L를 사용하였다. 이론 값은 현재 공지되어 있지 않다.
본 연구에서는, 폐 감염된 호중구감소성 마우스 모델을 사용하여, 아비박탐의 상이한 투여 요법과 비교하여 피. 아에루기노사 bij에 대한 2 h 마다의 세프타지딤의 고정 투여 빈도와 아비박탐의 노출-반응 관계를 결정하였다.
재료 및 방법
항박테리아제:
세프타지딤 (CAZ)
아스트라제네카 (이전명: GSK)에 의해 제공됨
로트 번호: G263770,
만료일: 2012년 12월 5일
제조일: 2010년 12월 6일
CAS 번호: 78439-06-2
효력: 77.2%
아비박탐
아스트라제네카 [이전명: 닥터 레디]
로트 번호: AFCH005151 (07113P028), 분석 번호: A1002CQ055
만료일: 2013년 3월
효력: 91.7%.
박테리아 균주 및 감수성 시험:
임상적으로 관련된 각종 공급원으로부터 수득된, 7개의 널리 명확히 특징규명된 세프타지딤-내성 슈도모나스 아에루기노사 균주를 '오류! 참조 공급원을 찾을 수 없다'에 제시된 바와 같은 실험에 사용하였다. 보다 초기의 시험관내 체커보드 연구 (아스트라제네카 연구 보고서 # CAZ-AVI-M1-061)에서 MIC를 결정하고, ISO-지침 (ISO 2006)에 따라서 미세희석함으로써 결정하였다. 이 방법은 CLSI 화합성이다.
동물:
체중이 20 내지 25 g인 4 내지 5주령의 비-근친계 암컷 CD-1 마우스 (찰스 리버; 네덜란드)를 본 실험에 사용하였다. 시클로포스파미드 2회 용량을 피하 투여함으로써 과립구감소증을 유발시켰는데; 1회 용량은 감염 실험하기 4일 전에 투여하였고 (150 mg/kg) 다른 1회 용량은 1일 전에 투여하였다 (100 mg/kg).
상기 동물은 음료수와 음식을 무제한으로 공급하는 표준 조건 하에 사육하였고, 1일 1회 조사하였으며 면역억제 후에는 1일 2 내지 3회 조사하였다. 유럽 위원회의 권고 사항 (지시 86/609/EEC, 1986년 11월 24일)에 따라서 동물 연구를 수행하였고, 모든 동물 과정은 라드바우드 대학의 동물 복지 위원회에 의해 승인되었다 (RU-DEC 2012-003).
감염:
호중구감소성 마우스를, 1마리 동물당 1개의 피. 아에루기노사 균주로 감염시켰다. 대략 105개 내지 106개 박테리아로 이루어진 0.05 mL의 박테리아 현탁물을, 이소플루란으로의 가벼운 마취 하에 주사기로 비내 접종하였다. 증가 용량의 0.1 mL 세프타지딤 또는 염수 (대조군)를 이용한 치료 (피하 투여됨)는 감염 개시 후 2시간 (t=0 h)에서 시작하였는데, 24 h의 기간 동안 지속되는 q2h의 투여 요법을 수행하였다. 모든 투여 요법을 적어도 2마리 동물에서 수행하였다. t=0 h에서는, 2마리 마우스를 인도적으로 희생시켜, 치료를 시작하기 직전에 초기 접종물을 결정하였다. 동물 복지 규정에 따라서, 동물의 복지가 조기 종결이 필요하다고 지시하지 않는 한은 다른 모든 동물을 t=24 h에 희생시켰다. 폐를 취하고, 이를, 2 mL 인산염 완충 염수 (PBS; NaCl 8.00 g/L, Na2HPO4 * 2 H2O 1.44 g/L, KH2PO4 0.26 g/L, pH 7.2 - 7.4)를 함유하는 미리-냉각된 10-mL용 플라스틱 튜브 (트랜스포트 튜브; 네덜란드 옴닐라보)에 옮겼다. 연속해서, 울트라-터랙스 (IKA 라보르테크닉; 독일)를 이용하여 폐를 분쇄하였다. 10배 희석 시리즈를 제조하였고, 희석물당 3x10 ㎕을 도말하였다 (크로마가르, 바이오메리엑스; 네덜란드). 그 다음 날, 콜로니를 계수하고, 폐당 cfu의 수를 계산하였다.
데이터 분석:
실험적 폐렴이 이루어진 호중구감소성 마우스 내에서의 아비박탐의 노출-반응 관계는, 세프타지딤으로 처리한지 24 h 후 특별한 균주의 초기 접종물과 비교된 바와 같이 1- 내지 2-log10 cfu 증가를 초래하는 세프타지딤의 가장 높은 용량의 고정 투여 요법을 이용한 치료 하에 결정하였다. 이러한 요법은 아비박탐의 효과 상의 변화에 대한 민감성 때문에 선택되었다. 투여된 아비박탐의 양은 그 투여 빈도와 용량 면에서 다양하였다. 세프타지딤 및 아비박탐의 노출은 약동학적 연구로부터 수득된 약동학적 파라미터 추정치를 이용하여, 믹랩 2.36 소프트웨어 (메디매틱스; 네덜란드 마스트리히트)를 사용하여 결정하였다 (아스트라제네카 연구 보고서 # CAZ-AVI-M1-065). 모의 실험에서, 세프타지딤의 경우에는 단백질 결합도가 10%로 사용되었고 아비박탐의 경우에는 8%로 사용되었다. dcfu로서 표현된, t=24 h 및 t=0 h에서 log10 cfu 값 (2마리 마우스의 평균 값) 간의 차이로서 약물 효과를 결정하였다. 유리 약물 농도를 모든 계산에 사용하였다. Emax 모델 (또는 선형 회귀)을 용량 및 PK/PD 지수 (PDI) 반응에 피팅하여, 세프타지딤 단독의 PDI 값, 및 별개로 세프타지딤과 아비박탐의 조합물의 PDI 값을 결정하였다. 아비박탐 %fT>CT에 대해서는, 역치 농도 CT 위의 투여 구간의 % 시간을 0.25, 1 및 4 mg/L의 CT에 대하여 계산하였다. 시험관내에서 아비박탐의 활성에 근거하여 CT 값을 선택하였는데, 4 mg/L이 감수성 시험에 사용되었지만, 보다 낮은 농도가 또한, 시험관내 체커보드 연구에서 결정된 바와 같이 활성이었다.
결과
표 11은 사용된 균주의 특징 및 단독요법의 효능을 나타낸다. 단독요법 동안 세프타지딤의 정지 %fT > MIC는 0 내지 38%였다. 대부분의 내성 균주의 경우에는, 효과가 전혀 관찰될 수 없었다. 다른 한편으로는, 일부 고도로 내성인 균주에 대해서는 더 적은 %fT > MIC가 필요한 것으로 여겨진다. 아비박탐은 모든 균주에 대해 세프타지딤의 정지 %fT > MIC를 감소시켰다.
아비박탐 q2h 또는 q8h에 대한 노출 반응 곡선 (R2 0.54-0.86)은 q2h 요법이 q8h 요법 보다 더 효능이 있었다는 것을 표시하였다 (도 12). 마우스를 세프타지딤에 노출시킨 경우에 정지 효과를 초래하는 아비박탐의 1일 용량은, 균주 11 및 18 각각에 대해 2.7 및 10.1 인자 정도로 아비박탐 q8h 보다는 아비박탐 q2h에 대해 더 낮았다. 이는 20.1% (범위 16.1 내지 23.5)의 아비박탐에 대한 전체 평균 %fT> CT 1 mg/L에 상응한다 (표 16). 표 17은 Emax 모델 피트의 파라미터 추청치를 나타낸다.
도 13은 아비박탐의 완전 용량 분할 연구에 제출된 2개 균주의 결과를 도시한 것이다. 지수 Cmax, AUC/MIC 및 용량 각각이 일부 상관 관계를 나타내긴 하였지만, 상기 도면을 육안으로 검사한 결과, %fT> CT는 다소 우수한 예측 변수이지만, 상당히 변동적이었다는 결론에 이르렀다. 이는 %fT> CT가 상기 환경에서의 성과를 결정하는 유일한 요인이 아니라는 것을 표시한다. 상기 도면은 CT의 3가지 농도에 대한 %fT> CT를 도시한다. %fT> CT 1 mg/L은 0.25 mg/L 및 4 mg/L 보다 다소 우수한 예측 변수인 것으로 여겨진다. 그러나, 상기 도면으로부터는 정확한 역치 값을 결정할 수 없다. 정지 효과에 대해 요구되는 추정치는 부분적으로, 세프타지딤의 용량에 의존적이었다 (세프타지딤 용량이 더 높은 경우에는, 더 낮은 값이 요구되었다).
도 14는 세프타지딤 q2h의 각종 용량으로 처리한 경우에, 4개의 피. 아에루기노사 균주 (7, 5, 19 및 1)에 대한 아비박탐의 노출 반응 관계를 도시한 것이다. 4개의 피. 아에루기노사 균주 중 2개는 하부 2개 패널로부터 관찰된 바와 같이 예상되는 것 보다 아비박탐에 대해 더 많은 반응을 나타내었다. 표 18은 log10(cfu/조직 샘플) 상의 변화 = 0, 또는 24 h에 걸친 정체에 대한 4개 균주의 %fT> CT 1 mg/L 아비박탐 추정치를 제공한다. 예측된 것 보다 우수한 효과를 나타낸 균주 1 및 19에 대해서는, 이것이 신뢰할만하게 추정될 수 없었다. 다른 2개 균주에 대해서는 21.4 및 19.4%였다.
<표 16>
세프타지딤
q2h
및
아비박탐
q2h
및
q8h로
처리된 마우스에서
%
f
T
>C
T
1 mg
/L의
아비박탐
.
CT = 역치 농도 (가상 생체내 억제 농도), TDD = 총 1일 용량, CAZ = 세프타지딤, AVI = 아비박탐
<표 17>
세프타지딤
q2h
및
아비박탐
q2h
또는
q8h로의
처리를 이용한 효과의 비-선형 회귀 (E
max
모델) 파라미터 추정치 (SE).
<표 18>
세프타지딤
q2h
및
아비박탐으로
처리된 마우스에 대한 4개의 피.
아에루기노사
균주의 노출-반응
24 h에서의 정체 시점에 유리 약물 농도가 4 mg/L (세프타지딤) 및 1 mg/L (아비박탐)을 초과하는 시간의 %의 결정: 즉, dlog10cfu (E) = 0.
CT = 역치 농도 (가상 생체내 억제 농도), TDD = 총 1일 용량, CAZ = 세프타지딤, AVI = 아비박탐.
Claims (37)
- 병원내 폐렴 감염의 치료를 필요로 하는 환자에게 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물의 유효량을 투여하는 것을 포함하는, 상기 환자에서 병원내 폐렴 감염을 치료하는 방법.
- 제1항에 있어서, 병원내 폐렴 감염이 하나 이상의 베타-락타마제를 발현하는 하나 이상의 병원체에 의해 유발되는 것인 방법.
- 제1항 또는 제2항에 있어서, 병원내 폐렴 감염이 단독요법으로서의 세프타지딤에 대해 감수성이지 않은 것인 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 병원내 폐렴 감염이 병원 획득 폐렴인 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 병원내 폐렴 감염이 인공호흡기 연관 폐렴인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 하나 이상의 추가의 치료제를 투여하는 것을 추가로 포함하는 방법.
- 제6항에 있어서, 하나 이상의 추가의 치료제가 항박테리아제, 베타-락타마제 억제제 및 항진균제로 이루어진 군으로부터 선택되는 것인 방법.
- 제7항에 있어서, 하나 이상의 추가의 치료제가 토브라마이신, 레보플록사신, 반코마이신, 리네졸리드, 티게시클린 및 콜리스틴으로 이루어진 군으로부터 선택된 항박테리아제인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 세프타지딤과 아비박탐의 조합물이 동시에 투여되는 것인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 세프타지딤과 아비박탐의 조합물이 독립적으로 제제화되고 공-투여되는 것인 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 세프타지딤과 아비박탐의 조합물이 독립적으로 제제화되고 순차적으로 투여되는 것인 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 조합물의 유효량이 용량당 약 2000 mg의 세프타지딤과 약 500 mg의 아비박탐을 포함하는 것인 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 조합물의 유효량이 대략 8시간마다 투여되는 것인 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 조합물의 유효량이 대략 12시간마다 투여되는 것인 방법.
- 제13항 또는 제14항에 있어서, 조합물의 유효량이 정맥내 투여되는 것인 방법.
- 제15항에 있어서, 조합물의 유효량이 대략 1 내지 2시간의 기간에 걸쳐 정맥내 투여되는 것인 방법.
- 제16항에 있어서, 조합물의 유효량이 대략 2시간의 기간에 걸쳐 정맥내 투여되는 것인 방법.
- 제16항에 있어서, 조합물의 유효량이 대략 1시간의 기간에 걸쳐 정맥내 투여되는 것인 방법.
- 의약으로서 사용하기 위한, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물.
- 병원내 폐렴 감염을 치료하는 데 사용하기 위한, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물.
- 제20항에 있어서, 병원내 폐렴 감염이 하나 이상의 베타-락타마제를 발현하는 하나 이상의 병원체에 의해 유발되는 것인 조합물.
- 제20항에 있어서, 병원내 폐렴 감염이 단독요법으로서의 세프타지딤에 대해 감수성이지 않은 것인 조합물.
- 제20항 내지 제22항 중 어느 한 항에 있어서, 병원내 폐렴 감염이 병원 획득 폐렴 (HAP)인 조합물.
- 제20항 내지 제22항 중 어느 한 항에 있어서, 병원내 폐렴 감염이 인공호흡기 연관 폐렴 (VAP)인 조합물.
- 제20항 내지 제24항 중 어느 한 항에 있어서, 하나 이상의 추가의 치료제를 추가로 포함하는 조합물.
- 제25항에 있어서, 추가의 치료제가 항박테리아제, 베타-락타마제 억제제 및 항진균제로 이루어진 군으로부터 선택되는 것인 조합물.
- 제26항에 있어서, 하나 이상의 추가의 치료제가 토브라마이신, 레보플록사신, 반코마이신, 리네졸리드, 티게시클린 및 콜리스틴으로 이루어진 군으로부터 선택된 항박테리아제인 조합물.
- 제20항 내지 제27항 중 어느 한 항에 있어서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물이 동시에 투여되는 것인 조합물.
- 제20항 내지 제27항 중 어느 한 항에 있어서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물이 독립적으로 제제화되고 공-투여되는 것인 조합물.
- 제20항 내지 제27항 중 어느 한 항에 있어서, 세프타지딤 또는 그의 제약상 허용되는 염과 아비박탐 또는 그의 제약상 허용되는 염의 조합물이 독립적으로 제제화되고 순차적으로 투여되는 것인 조합물.
- 제20항 내지 제30항 중 어느 한 항에 있어서, 용량당 약 2000 mg의 세프타지딤 또는 그의 제약상 허용되는 염과 약 500 mg의 아비박탐 또는 그의 제약상 허용되는 염을 포함하는 조합물.
- 제20항 내지 제31항 중 어느 한 항에 있어서, 대략 8시간마다 투여되는 조합물.
- 제20항 내지 제31항 중 어느 한 항에 있어서, 대략 12시간마다 투여되는 조합물.
- 제20항 내지 제33항 중 어느 한 항에 있어서, 정맥내 투여되는 조합물.
- 제34항에 있어서, 대략 1 내지 2시간의 기간에 걸쳐 정맥내 투여되는 조합물.
- 제35항에 있어서, 대략 1시간의 기간에 걸쳐 정맥내 투여되는 조합물.
- 제35항에 있어서, 대략 2시간의 기간에 걸쳐 정맥내 투여되는 조합물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361761369P | 2013-02-06 | 2013-02-06 | |
| US61/761,369 | 2013-02-06 | ||
| PCT/GB2014/050354 WO2014122468A1 (en) | 2013-02-06 | 2014-02-06 | Combination therapy for the treatment of nosocomial pneumonia |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150115761A true KR20150115761A (ko) | 2015-10-14 |
Family
ID=50114393
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157020951A KR20150115761A (ko) | 2013-02-06 | 2014-02-06 | 병원내 폐렴을 치료하기 위한 조합 요법 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20150374673A1 (ko) |
| EP (1) | EP2953626A1 (ko) |
| JP (1) | JP6383367B2 (ko) |
| KR (1) | KR20150115761A (ko) |
| CN (2) | CN110302203A (ko) |
| AU (1) | AU2014213795B2 (ko) |
| BR (1) | BR112015018360B1 (ko) |
| CA (1) | CA2897446A1 (ko) |
| CL (1) | CL2015002180A1 (ko) |
| MX (1) | MX2015010077A (ko) |
| RU (1) | RU2684112C2 (ko) |
| UA (1) | UA115683C2 (ko) |
| WO (1) | WO2014122468A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT3221313T (pt) * | 2014-11-17 | 2019-04-15 | Entasis Therapeutics Ltd | Terapia combinada para tratamento de infecções bacterianas resistentes |
| TW201639853A (zh) * | 2015-03-31 | 2016-11-16 | 木塔比利斯公司 | 雜環化合物及其於預防或治療細菌感染之用途 |
| JP2018515481A (ja) | 2015-09-16 | 2018-06-14 | シュアンチュー ファーマ カンパニー,リミティド | β−ラクタマーゼ阻害剤とその利用 |
| WO2017216765A1 (en) * | 2016-06-17 | 2017-12-21 | Wockhardt Limited | Antibacterial compositions |
| MX2021010077A (es) | 2016-09-16 | 2022-05-23 | Entasis Therapeutics Ltd | Compuestos inhibidores de beta-lactamasa. |
| US10434089B2 (en) | 2017-01-25 | 2019-10-08 | The Johns Hopkins University | Avibactam and carbapenems antibacterial agents |
| SI3630111T1 (sl) | 2017-05-08 | 2022-05-31 | Entasis Therapeutics, Inc. | Spojine in postopki za zdravljenje bakterijskih okužb |
| US11905286B2 (en) | 2018-08-09 | 2024-02-20 | Antabio Sas | Diazabicyclooctanones as inhibitors of serine beta-lactamases |
| RU2746833C1 (ru) * | 2020-08-03 | 2021-04-21 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Волгоградский государственный медицинский университет" Министерства здравоохранения Российской Федерации ФГБОУ ВО ВолгГМУ МЗ РФ | Способ моделирования экспериментального воспаления легких у крыс |
| CN113413367A (zh) * | 2021-08-16 | 2021-09-21 | 浙江尖峰药业有限公司 | 一种注射用阿维巴坦头孢甲肟复方粉针及其制备方法 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2007007235A (es) * | 2004-12-17 | 2007-10-19 | Venus Remedies Ltd | Combinacion de antibioticos para proporcionar una solucion total al tratamiento de infecciones. |
| CN101074235B (zh) * | 2006-05-15 | 2010-05-12 | 中国药品生物制品检定所 | 头孢硫脒醇水化合物及其制备方法 |
| CN101245080A (zh) * | 2007-02-14 | 2008-08-20 | 山东轩竹医药科技有限公司 | 含有吡唑并三唑的头孢菌素衍生物 |
| AU2010229721A1 (en) * | 2009-03-26 | 2011-10-06 | Pulmatrix, Inc. | Methods for treating and preventing pneumonia and ventilator-associated tracheobronchitis |
-
2014
- 2014-02-06 WO PCT/GB2014/050354 patent/WO2014122468A1/en active Application Filing
- 2014-02-06 US US14/765,606 patent/US20150374673A1/en not_active Abandoned
- 2014-02-06 CN CN201910679229.5A patent/CN110302203A/zh active Pending
- 2014-02-06 KR KR1020157020951A patent/KR20150115761A/ko not_active Application Discontinuation
- 2014-02-06 CA CA2897446A patent/CA2897446A1/en not_active Abandoned
- 2014-02-06 EP EP14704881.3A patent/EP2953626A1/en not_active Withdrawn
- 2014-02-06 BR BR112015018360-3A patent/BR112015018360B1/pt active IP Right Grant
- 2014-02-06 RU RU2015132369A patent/RU2684112C2/ru active
- 2014-02-06 CN CN201480007538.3A patent/CN104994860A/zh active Pending
- 2014-02-06 JP JP2015556566A patent/JP6383367B2/ja active Active
- 2014-02-06 AU AU2014213795A patent/AU2014213795B2/en active Active
- 2014-02-06 UA UAA201507554A patent/UA115683C2/uk unknown
- 2014-02-06 MX MX2015010077A patent/MX2015010077A/es unknown
-
2015
- 2015-08-05 CL CL2015002180A patent/CL2015002180A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US20150374673A1 (en) | 2015-12-31 |
| CN104994860A (zh) | 2015-10-21 |
| JP2016507547A (ja) | 2016-03-10 |
| CL2015002180A1 (es) | 2015-11-27 |
| AU2014213795A1 (en) | 2015-07-30 |
| JP6383367B2 (ja) | 2018-08-29 |
| MX2015010077A (es) | 2016-01-25 |
| BR112015018360A2 (pt) | 2017-07-18 |
| BR112015018360B1 (pt) | 2022-03-22 |
| CA2897446A1 (en) | 2014-08-14 |
| CN110302203A (zh) | 2019-10-08 |
| AU2014213795B2 (en) | 2016-10-13 |
| RU2684112C2 (ru) | 2019-04-04 |
| RU2015132369A (ru) | 2017-03-13 |
| UA115683C2 (uk) | 2017-12-11 |
| EP2953626A1 (en) | 2015-12-16 |
| WO2014122468A1 (en) | 2014-08-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20150115761A (ko) | 병원내 폐렴을 치료하기 위한 조합 요법 | |
| US10376499B2 (en) | Combination therapy for treatment of resistant bacterial infections | |
| JP7245289B2 (ja) | 細菌感染症の処置方法 | |
| JP6543611B2 (ja) | セフトロザン抗生物質組成物 | |
| US10420841B2 (en) | Ceftolozane antibiotic compositions | |
| RU2524665C2 (ru) | Композиции и способы лечения, включающие цефтаролин | |
| US20120115836A1 (en) | Stable liquid formulations of anti-infective agents and adjusted anti-infective agent dosing regimens | |
| US11129840B2 (en) | Methods for identifying novel dosing regimens | |
| AU2015200599B2 (en) | Ceftolozane Antibiotic Compositions | |
| Pawar et al. | Newer antibiotics for musculoskeletal infections |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application | ||
| J201 | Request for trial against refusal decision | ||
| J301 | Trial decision |
Free format text: TRIAL NUMBER: 2021101001258; TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20210517 Effective date: 20211022 |