WO2013172467A1 - 放射線滅菌耐性蛋白質組成物 - Google Patents
放射線滅菌耐性蛋白質組成物 Download PDFInfo
- Publication number
- WO2013172467A1 WO2013172467A1 PCT/JP2013/063867 JP2013063867W WO2013172467A1 WO 2013172467 A1 WO2013172467 A1 WO 2013172467A1 JP 2013063867 W JP2013063867 W JP 2013063867W WO 2013172467 A1 WO2013172467 A1 WO 2013172467A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- protein
- cellulose ether
- ether derivative
- sterilization
- protein composition
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/26—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/465—Hydrolases (3) acting on ester bonds (3.1), e.g. lipases, ribonucleases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/47—Hydrolases (3) acting on glycosyl compounds (3.2), e.g. cellulases, lactases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/482—Serine endopeptidases (3.4.21)
- A61K38/4833—Thrombin (3.4.21.5)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/22—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing macromolecular materials
- A61L15/225—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/44—Medicaments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L17/00—Materials for surgical sutures or for ligaturing blood vessels ; Materials for prostheses or catheters
- A61L17/06—At least partially resorbable materials
- A61L17/10—At least partially resorbable materials containing macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/505—Stabilizers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L28/00—Materials for colostomy devices
- A61L28/0007—Materials for colostomy devices containing macromolecular materials
- A61L28/0026—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L29/00—Materials for catheters, medical tubing, cannulae, or endoscopes or for coating catheters
- A61L29/04—Macromolecular materials
- A61L29/049—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/041—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/143—Stabilizers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7007—Drug-containing films, membranes or sheets
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01021—Beta-glucosidase (3.2.1.21)
Definitions
- the present invention relates to a protein composition having resistance to radiation sterilization, comprising a specific amino acid group and / or a cellulose ether derivative.
- Sterilization methods include heat sterilization in an autoclave, ionizing radiation sterilization with gamma rays and electron beams, gas sterilization with ethylene oxide gas, plasma sterilization with hydrogen peroxide, separation using chemical sterilants using glutaraldehyde preparations and filters. Sterilization and the like are known.
- the activity of proteins such as physiologically active proteins decreases when sterilized by heat or radiation.
- Sterilization with ethylene oxide not only has the possibility of producing by-products by chemical reaction, but is also highly toxic and the residual gas may adversely affect the human body and the like.
- Sterilization with a chemical sterilant has a problem that it is necessary to consider resistance of the protein to the sterilant, change in pH, change in ionic strength, or change in temperature. Therefore, in the case of producing pharmaceuticals / medical products containing / fixed proteins, the entire production process must be performed in a sterile state, which requires an enormous production cost. Moreover, although the solution containing protein is separated and sterilized by a filter, it is difficult to apply to a composition containing large particles, or a solid or semi-solid composition.
- EP0437095 shows that neutralized oxidized cellulose products (nORC) complexed with heparin or heparin fragments can be sterilized by gamma irradiation.
- EP 0 562 864 shows a composite wound dressing material comprising a collagen sponge matrix, a second bioabsorbable polymer (eg, dispersed fiber of oxidized regenerated cellulose (ORC)), and an active agent (eg, peptide). It is described that the active agent can be included in the matrix or bioabsorbable polymer, or both, and that the composite sponge material can be packaged and sterilized.
- US 5730933 shows a method of sterilizing biologically active peptides with gamma rays or electron beam irradiation without losing their biological activity.
- This method is a technique comprising forming a mixture containing a biologically active peptide and a foreign protein such as gelatin, freezing or lyophilizing the mixture, and then irradiating the mixture. The presence is described as stabilizing the peptide and preventing a decrease in the activity of the peptide.
- International Publication WO 2000/033893 describes a complex of a therapeutic peptide and a polysaccharide selected from the group consisting of oxidized regenerated cellulose, neutralized oxidized regenerated cellulose, and mixtures thereof.
- JP 2011-47089 A describes a method for producing enzyme-containing nanofibers having excellent enzyme activity. In this method, a spinning solution containing an enzyme and a polymer dissolved in a nonaqueous solvent is spun by an electrostatic spinning method to form enzyme precursor nanofibers, and then water is applied and dried.
- this document does not describe the sterilization of enzyme-containing nanofibers.
- An object of the present invention is to provide a protein composition having resistance to radiation sterilization.
- the present inventors have surprisingly found that a mixture of glycine, phenylalanine and histidine and / or a cellulose ether derivative coexisted so that the protein has resistance to radiation sterilization. And the present invention has been reached. That is, the present invention is a protein composition containing a mixture of glycine, phenylalanine and histidine and / or a cellulose ether derivative as an additive.
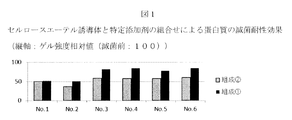
- FIG. 1 shows the protein sterilization resistance effect (vertical axis: gel strength relative value (before sterilization: 100)) by the combination of the cellulose ether derivative of the present invention and a specific additive.
- FIG. 2 shows the sterilization resistance effect (vertical axis: protein aggregate increase (%)) by the combination of the cellulose ether derivative of the present invention and the specific additive.
- the present invention is a protein composition comprising a mixture of glycine, phenylalanine and histidine and / or a cellulose ether derivative as an additive.
- the protein used in the present invention is not particularly limited, and examples thereof include hemostatic proteins represented by fibrinogen and thrombin, asparaginase, catalase, superoxide desmutase, enzymes represented by lipase, hemoglobin, serum albumin, and low density lipoprotein.
- HGF growth factors represented by factor
- hemostatic proteins include hemostatic proteins, enzymes, transport proteins, muscle proteins, defense proteins, toxin proteins, protein hormones, storage proteins, structural proteins, and growth factors are preferred, and fibrinogen is particularly preferred.
- the protein used in the present invention may be derived from an animal or produced by a gene recombination technique. Human origin is preferable if it is animal origin.
- a protein produced by a gene recombination technique may be a modified product in which an amino acid sequence is replaced with another amino acid sequence as long as the essential biological activity is the same.
- the thing which modified these proteins, and these mixtures can also be used.
- the protein used in the present invention may be added with a pharmaceutically acceptable stabilizer or additive in addition to the component (hereinafter, this is expressed as “stabilizer etc.” Distinguish from additives that coexist with proteins to provide radiation sterilization resistance).
- stabilizers include arginine, isoleucine, glutamic acid, citric acids, calcium chloride, sodium chloride, protease inhibitors (eg aprotinin), albumin, surfactant, phospholipid, polyethylene glycol, sodium hyaluronate, Examples include glycerin, trehalose, and sugar alcohols (eg, glycerol, mannitol).
- the mixture of protein and stabilizer used in the present invention contains 35 parts by weight or less, preferably 30 parts by weight or less of protein with respect to 100 parts by weight of the mixture.
- the additive used in the present invention is a mixture composed of glycine, phenylalanine and histidine, glycine is usually 5 parts by weight or more and 90 parts by weight or less, preferably 15 parts by weight with respect to 100 parts by weight of the additive and protein in total.
- phenylalanine is usually 1 part by weight or more and 80 parts by weight or less, preferably 2 parts by weight or more and 40 parts by weight or less, more preferably 4 parts by weight or more and 20 parts by weight or less.
- histidine is usually contained in an amount of 2 to 70 parts by weight, preferably 5 to 40 parts by weight, more preferably 8 to 20 parts by weight.
- the protein used in the present invention or a mixture of a protein and a stabilizer may be supported on the cellulose ether derivative, but is contained in the cellulose ether derivative (
- the term “containing” means that the protein is present in a state in which at least a part of the protein has entered the cellulose ether derivative.
- molecules such as proteins and stabilizers may be present in the cellulose ether derivative in a dispersed manner.
- particles in which molecules such as protein molecules and stabilizers are collected are further collected (hereinafter referred to as stabilizers and the like).
- the mixed particles may be referred to as “protein particles”).
- the preferred form of presence of such proteins and protein particles in the cellulose ether derivative is the same when the additive is not only the cellulose ether derivative but also a mixture of glycine, phenylalanine and histidine and a cellulose ether derivative.
- Specific examples of the cellulose ether derivative used in the present invention include hydroxypropylcellulose, methylcellulose, hydroxyethylcellulose, hydroxypropylmethylcellulose, sodium carboxymethylcellulose, and mixtures thereof. Among these, it is preferably selected from the group consisting of hydroxypropylcellulose, hydroxyethylcellulose, hydroxypropylmethylcellulose, and mixtures thereof, most preferably hydroxypropylcellulose.
- the molecular weight of the cellulose ether derivative used in the present invention is not particularly limited.
- the viscosity when the viscosity is measured at a concentration of 2% and 20 ° C., 1 to 10000 mPa ⁇ s, preferably 2 to 5000 mPa ⁇ s, More preferably, a molecular weight showing a viscosity of 2 to 4000 mPa ⁇ s is selected.
- the cellulose ether derivative used in the present invention is preferably highly pure, and in particular, residues such as additives, plasticizers, residual catalysts, residual monomers, residual solvents used in molding and post-processing included in the cellulose ether derivatives. Is preferably less.
- the shape of the protein composition of the present invention is not particularly limited including those having an indefinite shape, and examples thereof include films, fibers, sheets, plates, tubular bodies, linear bodies, rod-like bodies, cushion materials, foams, A porous body etc. are mentioned.
- the molding method for producing the molded product is not particularly limited as long as the protein activity does not decrease. For example, extrusion molding, injection molding, calendar molding, compression molding, blow molding, vacuum molding, powder molding, casting An appropriate molding method such as molding and casting can be employed. Among these, a film and a fiber shape are suitable for the protein composition of the present invention.
- the fiber shape refers to a three-dimensional molded body in which one or a plurality of obtained fibers are laminated and woven, knitted, or formed by other methods.
- Specific examples of the fiber form include a nonwoven fabric.
- tubes, meshes and the like processed based on them are also included in the fiber shape.
- any of the methods conventionally used for the production of films or plastic fibers can be adopted, such as casting method (casting method), electrospinning method, inflation extrusion molding method, T-die extrusion molding method, etc. Examples thereof include an extrusion molding method and a calendar method.
- the molding may be performed by solution molding or melt molding, but solution molding is preferable in order to easily disperse the protein or protein particles in order to prevent the protein from deteriorating.
- a method for producing a protein composition having a film shape will be described by taking a casting method as an example.
- Protein freeze-dried powder is pulverized in a mortar or the like to produce protein particles having an average particle size (usually 0.1 to 200 ⁇ m, preferably 1 to 100 ⁇ m) suitable for dispersion in a solvent. Disperse this in one or more suitable solvents (2-propanol, ethanol, etc.) that can dissolve cellulose ether derivatives, form suspensions with protein particles, and evaporate in the film production stage to form films.
- the protein or protein particle is usually 100% by weight or more, preferably 500% by weight or more, based on the cellulose ether derivative, depending on the type of protein or cellulose ether derivative. More preferably, the content is 800 to 950% by weight. If the amount is less than these, the function of the protein may not be sufficiently exhibited, and if the amount is more, the moldability of the film may be poor.
- the average thickness (thickness) of the film of the protein composition having a film shape is preferably 10 to 1000 ⁇ m, although it depends on the application.
- the protein composition having a fiber shape has an average fiber diameter of, for example, 0.01 to 50 ⁇ m, and those skilled in the art can appropriately determine it depending on the purpose of use.
- the long fiber specifically refers to a fiber that is formed without adding a fiber cutting step in the process from spinning to processing into a fiber molded body.
- the electrospinning method, the spunbond method, and the melt blow method is preferably used because it can be formed without applying heat and the decrease in protein function can be suppressed.
- the electrospinning method is a method of obtaining a fiber molded body on an electrode by applying a high voltage to a liquid in which a polymer is dissolved.
- the steps include a step of producing a spinning solution in which a polymer is dissolved, a step of applying a high voltage to the solution, a step of ejecting the solution, and evaporating the solvent from the ejected solution to form a fiber molded body.
- the spinning solution in the present invention is preferably a suspension comprising a cellulose ether derivative solution and protein particles.
- the concentration of the cellulose ether derivative in the suspension is preferably 1 to 30% by weight. When the concentration of the cellulose ether derivative is lower than 1% by weight, it is difficult to form a fiber molded body, which is not preferable. On the other hand, if it is higher than 30% by weight, the fiber diameter of the obtained fiber molded product becomes large, and the viscosity of the suspension becomes high, which is not preferable.
- a more preferable concentration of the cellulose ether derivative in the suspension is 1.5 to 20% by weight.
- the solvent of the cellulose ether derivative is not particularly limited as long as it can dissolve the cellulose ether derivative and can form a suspension with the protein particles and evaporate at the spinning stage to form a fiber. It may be used alone or in combination with a plurality of solvents.
- the method for preparing the suspension by mixing the cellulose ether derivative solution and the protein particles is not particularly limited, and ultrasonic waves and various stirring methods can be used.
- the stirring method high-speed stirring such as a homogenizer, stirring methods such as an attritor and a ball mill can be used. Of these, a dispersion method using ultrasonic treatment is preferable. It is also possible to form a suspension with a solvent and protein particles, and then add a cellulose ether derivative to prepare a spinning solution.
- the protein particles can be finely processed before preparing the suspension. The fine processing includes dry pulverization and wet pulverization.
- the dry pulverization treatment examples include a treatment using a ball mill, a treatment using a planetary mill or a vibration mill, a pulverization treatment using a pestle using a mortar, a medium agitation pulverizer, a jet mill, and a pulverization treatment using a stone mill.
- the wet pulverization treatment in a state where protein particles are dispersed in an appropriate dispersion medium, the treatment is performed with a high shearing force stirring device, a kneading device or the like, or the ball mill or bead mill treatment in a state dispersed in the medium. Etc.
- protein particles produced by a spray dryer can also be used.
- the size of the protein particles is not particularly limited, but is preferably in the range of 0.01 to 100 ⁇ m. It is technically difficult to produce a protein powder smaller than 0.01 ⁇ m, and if it is larger than 100 ⁇ m, the dispersibility is poor and the fiber molded body becomes fragile.
- the sterilization method used in the protein composition of the present invention is radiation sterilization. Radiation includes alpha rays, beta rays, gamma rays, neutron rays, electron rays, and X-rays.
- a gamma ray or an electron beam is preferable, and an electron beam is most preferable.
- These sterilization methods are not particularly limited, and the radiation dose is 10 to 80 kGy, preferably 20 to 30 kGy.
- the temperature condition is not particularly limited, but is ⁇ 80 to 40 ° C., preferably ⁇ 80 to 30 ° C.
- radiation such as alpha rays, positron rays, gamma rays, neutron rays, electron rays, and X-rays hits a substance, it strips the electrons from the molecules and atoms that make up the substance.
- the protein composition of the present invention may further contain an electron / ion scavenger, an energy transfer agent, a radical scavenger, an antioxidant, and a plasticizer.
- an electron / ion scavenger include N, N′-tetramethylphenylenediamine, diphenylenediamine, pyrene, and quinone.
- the energy transfer agent include acenaphthene.
- radical scavenger examples include mercaptan, octahydrophenanthrene, monoalkyldiphenyl ether, tocopherol, citric acid, butylated hydroxyanthole, butylated hydroxytoluene, t-butylhydroquinone, propyl gallate, and ascorbic acid derivatives.
- antioxidant examples include BHT, phosphite triester, phenolic antioxidant, and organic thioates. Of these, additives that are generally recognized as safe for use in foods and pharmaceuticals are preferred.
- the amount of the additive is not particularly limited.
- the additive can be contained in an amount of 0.01 to 10% by weight based on the cellulose ether derivative in the protein composition.
- the cellulose ether derivative containing the protein in a sterilization process does not contain moisture.
- the moisture content is preferably 10% by weight or less, more preferably 4% by weight or less, and still more preferably substantially anhydrous.
- the protein composition of the present invention may be packaged in a packaging material and sterilized by radiation.
- a packaging material it is preferable to use a material having a high gas barrier property such as aluminum.
- both of the above may be performed in a hermetically sealed manner together with an oxygen scavenger and a desiccant, or may be packaged in a state filled with an inert gas after deaeration.
- Such oxygen scavengers and desiccants are preferably those that do not harm the human body and do not deactivate during radiation sterilization.
- the protein composition of the present invention can be used, for example, as a medical material that requires protein function and sterility.
- the present invention also includes a sterilized protein composition obtained by sterilizing the protein composition of the present invention with radiation.
- ELISA measurement (1) Fibrinogen An anti-human fibrinogen antibody (DAKO A0080) was immobilized at 10 ⁇ g / mL on an ELISA plate (NUNC 466667).
- Block Ace (DS Pharma Biomedical UK-B80) is added to each well for masking. After washing with PBS containing 0.05% Tween 20, the specimen was added. A standard curve was prepared using human fibrinogen (Enzyme Research Laboratories No. FIB3) as a standard. After washing with PBS containing 0.05% Tween 20, an HRP-labeled anti-human fibrinogen antibody (CPL5523) was added, and after the reaction, it was washed with PBS containing 0.05% Tween 20, and TMB reagent (KPL 50-76-02 50 -65-02) was added and allowed to stand for 6 minutes for color development.
- CPL5523 HRP-labeled anti-human fibrinogen antibody
- an HRP-labeled anti-human thrombin antibody ((Affinity Biological, No. SAHT-HRP) was added at 0.1 ⁇ g / mL. After the reaction, 0.05% Tween 20 was contained. Washed with PBS, added TMB reagent (DaKo S1599), allowed to stand for 10 minutes for color development, added 0.5 MH 2 SO 4 to stop color development, and measured OD450-650 nm with a microplate reader. . 4).
- Thrombin activity measurement 20 ⁇ L of a sample and a dilution solution for activity measurement (0.01% F-68, 50 mmol / L NaCl, 50 mmol / L Tris-HCl, pH 8.4) were added to a polystyrene tube manufactured by BD, and the mixture was incubated at 37 ° C. for 3 minutes. Incubated.
- recombinant thrombin JPU Thrombin Standard 400 U / mL or WHO / US Thrombin Standard, 110 IU / mL: in-house adjusted product
- test team chromogenic substrate S-2238 (1 mM: Daiichi Kagaku Kogyo) was added to the reaction mixture and mixed by stirring. After reaction at 37 ° C. for 7 minutes, 800 ⁇ L of 0.1 M citric acid solution was added to react. Stopped. 200 ⁇ L of the reaction solution was transferred to a 96-well plate, and OD405 / 650 was measured.
- the inner diameter of the ejection nozzle was 0.8 mm, the voltage was 11 kV, the spinning solution flow rate was 1.2 mL / h, and the distance from the ejection nozzle to the flat plate was 15 cm.
- the obtained fiber molded body had an average fiber diameter of 0.86 ⁇ m and an average thickness of 137 ⁇ m.
- the obtained sheet was sterilized by electron beam at 20 kGy. The sterilized sheet was cut into 0.5 cm ⁇ 0.5 cm, the protein was extracted with 62.5 ⁇ L of physiological saline, and ELISA measurement was performed. As a result, the amount of immobilized protein was 0.15 mg / cm 2 .
- Spinning was performed by electrospinning at a temperature of 22 ° C. and a humidity of 26% or less to obtain a sheet-like fiber molded body.
- the inner diameter of the ejection nozzle was 0.8 mm
- the voltage was 12.5 kV
- the spinning solution flow rate was 1.2 mL / h
- the distance from the ejection nozzle to the flat plate was 15 cm.
- the obtained fiber molded body had an average fiber diameter of 0.43 ⁇ m and an average thickness of 152 ⁇ m.
- the obtained sheet was sterilized by electron beam at 20 kGy. The sterilized sheet was cut into 0.5 cm ⁇ 0.5 cm, the protein was extracted with 62.5 ⁇ L of physiological saline, and ELISA measurement was performed.
- Example 3 After fibrinogen freeze-dried powder (for Bolheel tissue adhesion: vial 1) is dispersed in 2-propanol, hydroxypropylcellulose (6-10 mPa ⁇ s, manufactured by Wako Pure Chemical Industries, Ltd.) is dissolved to a concentration of 16 wt%, and fibrinogen freezing is performed.
- a spinning solution of dry powder / hydroxypropylcellulose 100 (46 as fibrinogen) / 100 (w / w) was prepared. Spinning was performed by electrospinning at a temperature of 22 ° C. and a humidity of 26% or less to obtain a sheet-like fiber molded body.
- the inner diameter of the ejection nozzle was 0.8 mm
- the voltage was 12.5 kV
- the spinning solution flow rate was 1.2 mL / h
- the distance from the ejection nozzle to the flat plate was 15 cm.
- the obtained fiber molded body had an average fiber diameter of 0.35 ⁇ m and an average thickness of 191 ⁇ m.
- the obtained sheet was sterilized by electron beam at 20 kGy.
- the sterilized sheet was cut into 0.5 cm ⁇ 0.5 cm, the protein was extracted with 62.5 ⁇ L of physiological saline, and ELISA measurement was performed. As a result, the amount of immobilized protein was 0.78 mg / cm 2 . On the other hand, as a result of conducting ELISA measurement similarly about the sheet
- Proteins were extracted with 1 mL of physiological saline and subjected to ELISA measurement. As a result, the ELISA measurement value was 31 ⁇ g / mL. On the other hand, as a result of performing ELISA measurement similarly about the lyophilized powder (Bolhir) which has not been sterilized, the ELISA measurement value was 90 ⁇ g / mL. From the above, the protein recovery rate of the sterilized sheet relative to the non-sterile sheet was 34%.
- the resulting fiber molded body had a thickness of 204 ⁇ m, a basis weight of 2.08 mg / cm 2 , and a bulk density of 101 mg / cm 3 .
- the obtained sheet was cut into a diameter of 1 cm, and the protein was extracted with 200 ⁇ L of physiological saline to measure the activity. As a result, the measured activity value was 110.3 U / cm 2 .
- the obtained sheet was sterilized by irradiation with an electron beam of 30 kGy, and then thrombin activity was measured. The thrombin activity immediately after electron beam irradiation was 68.4% when the pre-sterilization was taken as 100%.
- Thrombin activity was measured after sterilizing thrombin-containing particles (freeze-dried aqueous solution of pH 7 containing recombinant thrombin 1 mg / mL, sodium chloride, sodium citrate, calcium chloride and mannitol) and then sterilizing.
- the thrombin activity before irradiation was 404.73 U / vial.
- the thrombin activity immediately after electron beam irradiation was 51.8% when the pre-sterilization was taken as 100%.
- Activity retention rate (%) ⁇ active enzyme amount after sterilization (mg / cm 2 ) / active enzyme amount before sterilization (mg / cm 2 ) ⁇ ⁇ 100
- the activity of ⁇ -glucosidase was measured by fluorescence measurement using Tokyogreen (registered trademark, the same shall apply hereinafter) - ⁇ Glu (Sekisui Medical Co., Ltd.).
- the activity recovery rate was calculated by the following formula.
- the immobilized enzyme theoretical weight was calculated from the weight% of the charged enzyme powder and the weight of the composition.
- Activity recovery rate (%) ⁇ active enzyme amount (mg) / (theoretical immobilized enzyme theoretical weight (mg) ⁇ ⁇ 100
- the activity retention rate was calculated by the following formula.
- Activity retention rate (%) ⁇ activity recovery rate after sterilization (%) / activity recovery rate before sterilization (%) ⁇ ⁇ 100
- lipase powder derived from porcine pancreas, manufactured by Wako Pure Chemicals, the same below
- hydroxypropyl cellulose (6-10 mPa ⁇ s manufactured by Wako Pure Chemicals) is dissolved to a concentration of 13 wt%, and lipase is prepared.
- a spinning solution of powder / hydroxypropylcellulose 50/100 (w / w) was prepared. Spinning was performed by electrospinning at a temperature of 27 ° C. and a humidity of 27% or less to obtain a sheet-like fiber molded body.
- the inner diameter of the ejection nozzle was 0.8 mm, the voltage was 18 kV, the spinning solution flow rate was 1.2 mL / h, and the distance from the ejection nozzle to the flat plate was 16.5 cm.
- the average thickness of the obtained fiber molded body (10 cm ⁇ 14 cm) was 168 ⁇ m.
- the obtained fiber molded body was sterilized by electron beam at 20 kGy. After the sterilized fiber molded body was cut into 1 cm ⁇ 1 cm, lipase was extracted with 1 mL of Lipase buffer included in the kit, and the activity was measured. As a result, the amount of active enzyme was 0.46 mg / cm 2 .
- the inner diameter of the ejection nozzle was 0.9 mm, the voltage was 18 kV, the spinning solution flow rate was 1.2 mL / h, and the distance from the ejection nozzle to the flat plate was 16.5 cm.
- the average thickness of the obtained fiber molded body (10 cm ⁇ 10 cm) was 207 ⁇ m.
- the obtained fiber molded body was cut into 2 cm ⁇ 2 cm and then sterilized with an electron beam at 20 kGy.
- ⁇ -Glucosidase was extracted from the obtained sterilized sheet with 1 mL of physiological saline, and the activity was measured with Tokyogreen- ⁇ Glu. As a result, the activity recovery rate was 42%.
- the activity recovery rate was 46%. From the above, it was found that the activity retention rate of the sterilized fiber molded body relative to the unsterilized fiber molded body was 91%, and that the inactivation of the enzyme could be suppressed by being included in the cellulose ether derivative. Comparative Example 3
- the lipase powder was sterilized with 20 kGy by electron beam. The activity was measured by adding 1 mL of Lipase buffer to 1 mg of the powder. As a result, the activity value was 0.25 pmol / mL ⁇ min. Met.
- the activity value is 0.34 pmol / mL ⁇ min. Met. From the above, the activity retention rate of the sterilized powder relative to the unsterilized powder was 74%. Comparative Example 4 The ⁇ -glucosidase powder was sterilized by electron beam at 20 kGy. 2 mg of the powder was dissolved in 1 mL of physiological saline, and the activity was measured with Tokyogreen- ⁇ Glu. As a result, the activity retention rate was 81%.
- the comparative evaluation was performed by measuring gel strength with a small desktop testing machine EZTest (manufactured by Shimadzu Corporation) and measuring aggregate content by BioSep-SEC-s4000 (manufactured by Phenomenex) (analysis conditions: 50 mM phosphate buffer (pH 7.0), 0). Fractionation was performed at a flow rate of 1.0 ml / min using a 5 M arginine hydrochloride as a mobile phase, and the target substance was detected at a wavelength of 280 nm; the peak detected earlier than the monomer peak was quantified as an aggregate).
- the sample (analytical sample) preparation procedure at the time of analysis is to dissolve vials of non-sterile lyophilized products and sterilized lyophilized products with 1 mL of distilled water. The solution was centrifuged at 15000 rpm ⁇ 5 minutes, passed through a 0.45 ⁇ m filtration filter, and then used as a sample for analysis.
- Example 8 The effect of sterilization resistance of proteins by the combination of cellulose ether derivatives and specific additives was investigated by the following method. (Method) A bulk solution of fibrinogen having a composition of “cellulose ether derivative + specific additive” (composition (1) shown in No.
- composition (1) freeze-dried powder and hydroxypropylcellulose were suspended in 2-propanol and sheeted
- composition (2) freeze-dried powder
- the solution was diluted to a concentration of 2 mg / mL with 270 mM sodium chloride, pH 8.5 buffer.
- composition (2) Specific additive composition
- the composition (1) does not contain a cellulose ether derivative (hydroxypropylcellulose: HPC) relative to the composition (1).
- cellulose ether derivative hydroxypropylcellulose (HPC) and a bulk solution of fibrinogen having eight compositions shown in Table 5 below were used. 1.0% fibrinogen, 110 mM sodium chloride, 1.0% glycine, and 0.2% mannitol are common to the following eight types of compositions. The results are shown in Table 6 and FIG. Addition of the cellulose ether derivative suppressed the increase in protein aggregate content. Moreover, the increase suppression effect of the same content by presence of a cellulose ether derivative was remarkable in the compositions 2 to 4 in which phenylalanine and histidine coexist. From this, in Example 7, the composition No. No improvement in sterilization resistance due to the presence of the cellulose ether derivative was observed in composition No. 1. What was recognized and remarkable in 3 to 6 is that the composition no. This is considered to be because 3-6 phenylalanine and histidine coexist with the cellulose ether derivative to bring about a remarkable protein sterilization resistance effect.
- HPC hydroxypropylcellulose
- Table 5 a
- the protein composition of the present invention has resistance to radiation sterilization.
- the sterilized composition of the present invention retains the protein structure and function while being sterilized.
- the protein composition of the present invention is used, for example, in the manufacture of medical products that require protein function and sterility.
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Surgery (AREA)
- Vascular Medicine (AREA)
- Materials Engineering (AREA)
- Hematology (AREA)
- Dermatology (AREA)
- General Chemical & Material Sciences (AREA)
- Heart & Thoracic Surgery (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Transplantation (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Diabetes (AREA)
- Marine Sciences & Fisheries (AREA)
- Zoology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Endocrinology (AREA)
- Materials For Medical Uses (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Apparatus For Disinfection Or Sterilisation (AREA)
- Compositions Of Macromolecular Compounds (AREA)
Abstract
Description
また、蛋白質を含む溶液はフィルターにより分離滅菌しているが、大きい粒子を含む組成物、または固体もしくは半固体組成物には適用が困難であった。
EP0437095号にはヘパリンまたはヘパリンフラグメントと複合する中和酸化セルロース生成物(nORC)をガンマ線照射で滅菌できることが示されている。しかし、この文献には蛋白質が結合しているORCまたはnORCを滅菌することは示されていない。
EP0562864号にはコラーゲンスポンジマトリックス、第二の生体吸収性ポリマー(例えば酸化再生セルロース(ORC)の分散繊維)、および活性剤(例えばペプチド)を含む複合傷手当物質が示されている。活性剤はマトリックスまたは生体吸収性ポリマー、またはそれらの両方に含むことができ、該複合スポンジ物質をパッケージして滅菌できることが記載されている。
US5730933号には生物学的に活性なペプチドをその生物学的活性を消失することなくガンマ線または電子ビーム照射で滅菌する方法が示されている。この方法は、生物学的に活性なペプチドとゼラチン等の外来蛋白質を含む混合物を形成し、この混合物を凍結または凍結乾燥し、次にこの混合物を照射する工程を含む技術であり、外来蛋白質の存在がペプチドを安定化してペプチドの活性低下を防ぐと記載されている。
国際公開WO2000/033893号には治療ペプチドと、酸化再生セルロース、中和酸化再生セルロース、およびこれらの混合物からなる群から選択されるポリサッカライドとの複合体が記載されている。そして電離放射線で滅菌する前にペプチドを有効量のポリサッカライドと共に製剤することにより、電離放射線で滅菌してもペプチド治療剤の生物学的活性は消失しないで安定化すると記載されている。
しかし、これらの文献は、電離放射線で滅菌する際の蛋白質の失活をセルロースエーテル誘導体や特定のアミノ酸群と共存させることにより抑制できることは示唆していない。
一方で、特開2011−47089号公報には酵素活性に優れる酵素含有ナノファイバーの製造方法が記載されている。この方法は、酵素と非水溶媒に溶解したポリマーとを含有する紡糸液を、静電紡糸法により紡糸して酵素前駆ナノファイバーを形成後、水を付与し乾燥するものである。しかし、この文献には酵素含有ナノファイバーを滅菌することに関する記述はない。
本発明者らは前記課題を解決するために鋭意研究した結果、驚くべきことに、グリシンとフェニルアラニンとヒスチジンとからなる混合物、および/またはセルロースエーテル誘導体を共存させることにより、放射線滅菌に対する蛋白質の耐性が向上することを見出し、本発明に到達した。
すなわち、本発明は、添加剤として、グリシンとフェニルアラニンとヒスチジンとからなる混合物、および/またはセルロースエーテル誘導体を含む、蛋白質組成物である。
図2は、本発明のセルロースエーテル誘導体と特定添加剤の組合せによる滅菌耐性効果(縦軸:蛋白質凝集体増加量(%))を示す。
本発明で用いられる蛋白質は特に限定されないが、例えばフィブリノゲンやトロンビンに代表される止血性蛋白質、アスパラギナーゼ、カタラーゼ、スーパーオキシドデスムターゼ、リパーゼに代表される酵素、ヘモグロビン、血清アルブミン、低密度リポ蛋白質に代表される輸送蛋白質、アクチン、ミオシンに代表される筋肉蛋白質、抗体、補体に代表される防御蛋白質、ジフテリア毒素、ボツリヌス毒素、ヘビ毒に代表される毒素蛋白質、インスリン、増殖因子、サイトカインに代表される蛋白質ホルモン、卵アルブミン、フェリチンに代表される貯蔵蛋白質、コラーゲン、ケラチンに代表される構造蛋白質、上皮成長因子(Epidermal growth factor:EGF)、インスリン様成長因子(Insulin−like growth factor:IGF)、トランスフォーミング成長因子(Transforming growth factor:TGF)、神経成長因子(Nerve growth factor:NGF)、脳由来神経栄養因子(Brain−derived neurotrophic factor:BDNF)、血管内皮細胞増殖因子(Vesicular endothelial growth factor:VEGF)、顆粒球コロニー刺激因子(Granulocyte−colony stimulating factor:G−CSF)、顆粒球マクロファージコロニー刺激因子(Granulocyte−macrophage−colony stimulating factor:GM−CSF)、血小板由来成長因子(Platelet−derived growth factor:PDGF)、エリスロポエチン(Erythropoietin:EPO)、トロンボポエチン(Thrombopoietin:TPO)、塩基性線維芽細胞増殖因子(basic fibroblast growth factor:bFGFまたはFGF2)、肝細胞増殖因子(Hepatocyte growth factor:HGF)に代表される成長因子が挙げられる。なかでも好ましいのは、止血性蛋白質、酵素、輸送蛋白質、筋肉蛋白質、防御蛋白質、毒素蛋白質、蛋白質ホルモン、貯蔵蛋白質、構造蛋白質、および成長因子であり、特にはフィブリノゲンが好ましい。
本発明において使用される蛋白質は、動物由来のものでも遺伝子組換え技術により製造したものでもよい。動物由来であればヒト由来が好ましい。また、遺伝子組み換え技術により作製された蛋白質は、本質的な生物活性が同様であればアミノ酸配列を別のアミノ酸配列に置換した改変体でもよい。また、これらの蛋白質を修飾したもの、およびこれらの混合物を用いることもできる。
また、本発明で用いられる蛋白質は、当該成分に加えて、薬学的に許容しうる安定剤や添加剤を添加してもよい(以下、これを「安定剤等」と表現し、本発明において放射線滅菌耐性を与えるために蛋白質と共存させる添加剤とは区別する。)。そのような安定剤等の例としては、アルギニン、イソロイシン、グルタミン酸、クエン酸類、塩化カルシウム、塩化ナトリウム、プロテアーゼ抑制剤(例えばアプロチニン)、アルブミン、界面活性剤、リン脂質、ポリエチレングリコール、ヒアルロン酸ナトリウム、グリセリン、トレハロースおよび糖アルコール(例えばグリセロール、マンニトール)などが挙げられ、なかでも好ましいのは、アルギニン、塩化ナトリウム、トレハロース、マンニトール、およびクエン酸類から選ばれる1種以上であり、特にクエン酸類が好ましい。
本発明で用いられる蛋白質と安定剤等との混合物は、蛋白質を当該混合物100重量部に対して、35重量部以下、好ましくは30重量部以下含有する。
本発明で用いる添加剤がグリシンとフェニルアラニンとヒスチジンとからなる混合物である場合、添加剤と蛋白質の合計100重量部に対し、グリシンは通常、5重量部以上90重量部以下、好ましくは15重量部以上60重量部以下、さらに好ましくは20重量部以上40重量部以下、フェニルアラニンは通常1重量部以上80重量部以下、好ましくは2重量部以上40重量部以下、さらに好ましくは4重量以上20重量部以下、ヒスチジンは通常2重量部以上70重量部以下、好ましくは5重量部以上40重量部以下、さらに好ましくは8重量部以上20重量部以下、含有することが好ましい。
本発明における添加剤がセルロースエーテル誘導体である場合、本発明で用いられる蛋白質または蛋白質と安定剤等との混合物は、セルロースエーテル誘導体上に担持されていてもよいが、セルロースエーテル誘導体中に含有(ここで含有とは、蛋白質の少なくとも一部分がセルロースエーテル誘導体内部に入り込んでいる状態をいう)された状態で存在していることが好ましい。この場合、セルロースエーテル誘導体中に蛋白質や安定剤等の分子が分散して存在していてもよいが、蛋白質分子や安定剤等の分子がそれぞれ集まったものがさらに集まった粒子(以下安定剤等との混合粒子を含めて「蛋白質粒子」と記載する場合がある。)として分散して存在することが好ましい。
こうした蛋白質や蛋白質粒子のセルロースエーテル誘導体における好適な存在態様は、添加剤がセルロースエーテル誘導体のみでなく、グリシンとフェニルアラニンとヒスチジンとからなる混合物およびセルロースエーテル誘導体である場合も同様である。
本発明において使用されるセルロースエーテル誘導体の具体例としては、ヒドロキシプロピルセルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、およびナトリウムカルボキシメチルセルロース、およびこれらの混合物が例示できる。
これらの中でも、好ましくはヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、およびそれらの混合物からなる群から選択され、最も好ましくはヒドロキシプロピルセルロースである。
また、本発明で用いるセルロースエーテル誘導体の分子量は特に限定されるものではないが、例えば濃度2%、20℃で粘度測定を行った場合、1~10000mPa・s、好ましくは2~5000mPa・s、より好ましくは2~4000mPa・sの粘度を示す分子量が選択される。
本発明の蛋白質組成物においては、その目的を損なわない範囲で、他のポリマーや他の化合物を併用してもよい。
本発明で用いるセルロースエーテル誘導体は高純度であることが好ましく、とりわけセルロースエーテル誘導体中に含まれる添加剤や可塑剤、残存触媒、残存モノマー、成形加工や後加工に用いた残留溶媒などの残留物は少ない方が好ましい。特に、医療に用いる場合は、安全性の基準値未満に抑える必要がある。
本発明の蛋白質組成物の形状は不定形のものを含み特に限定されるものではなく、例えばフィルム、繊維、シート、板状体、管状体、線状体、棒状体、クッション材、発泡体、多孔質体等が挙げられる。成形品を製造する際の成形方法は、蛋白質の活性が低下しない方法であれば特に制限されず、例えば押出成形、射出成形、カレンダー成形、圧縮成形、ブロー成形、真空成形、粉末成形、流延成形、注型などの適当な成形方法を採用することができる。その中でも、本発明の蛋白質組成物はフィルムおよび繊維形状が適している。ここで繊維形状とは、得られた一本または複数本の繊維が積層され、織り、編まれ、もしくはその他の手法により形成された3次元の成形体をいう。具体的な繊維の形態としては、例えば不織布が挙げられる。さらに、それをもとに加工したチューブ、メッシュなども繊維形状に含まれる。
それらの製造に当たってはフィルムまたはプラスチック繊維の製造に従来から採用されているいずれの方法も採用でき、例えば流延法(キャスト法)、エレクトロスピニング法、インフレーション押出成形法、Tダイ押出成形法などの押出成形法、カレンダー法などを挙げることができる。前記成形は、溶液成形によって行っても、または溶融成形によって行ってもよいが、蛋白質の機能低下を防ぐべく蛋白質または蛋白質粒子を容易に分散させるためには溶液成形が好ましい。
本発明のうち、フィルム形状を有する蛋白質組成物の製造法を、流延法を例にとり説明する。蛋白質の凍結乾燥粉末を乳鉢等で粉砕し溶媒への分散に適当な平均粒子径(通常0.1~200μm、好ましくは1~100μm)を有する蛋白質粒子を作製する。これを、セルロースエーテル誘導体を溶解可能で、かつ蛋白質粒子と懸濁液を形成し、フィルム作製段階で蒸発しフィルムを形成可能な一種または複数の適当な溶媒(2−プロパノールやエタノール等)に分散させた後、セルロースエーテル誘導体さらに必要に応じてマクロゴール等の可塑剤を溶解し、蛋白質粒子がセルロースエーテル誘導体溶液中に分散されたドープ液を調製する。得られたドープ液を用いて流延法によりフィルムを作製する。
本発明のうちフィルム形状を有する蛋白質組成物において、蛋白質または蛋白質粒子は、セルロースエーテル誘導体に対して、蛋白質やセルロースエーテル誘導体の種類にもよるが、通常100重量%以上、好ましくは500重量%以上、より好ましくは800~950重量%含有する。これらより少ないと、蛋白質の機能が十分発揮されない場合があり、多いとフィルムの成形性が不良となる場合がある。
本発明のうちフィルム形状を有する蛋白質組成物のフィルムの平均厚み(厚さ)は、用途にもよるが、10~1000μmであることが好ましい。
本発明のうち、繊維形状を有する蛋白質組成物は、その平均繊維径は、例えば0.01~50μmであるが、当業者であれば使用目的に応じて適宜定めることができる。また、長繊維よりなるものであってもよい。長繊維とは、具体的には紡糸から繊維成形体への加工に至る工程の中で、繊維を切断する工程を加えずに形成される繊維をいい、エレクトロスピニング法、スパンボンド法、メルトブロー法などで形成することができるが、熱を加えずに成形でき、蛋白質の機能低下を抑制できる点からエレクトロスピニング法が好ましく用いられる。
エレクトロスピニング法は、ポリマーが溶解している液に高電圧を印加することで、電極上に繊維成形体を得る方法である。工程としては、ポリマーが溶解している紡糸液を製造する工程と、該溶液に高電圧を印加する工程と、該溶液を噴出させる工程と、噴出させた溶液から溶媒を蒸発させて繊維成形体を形成させる工程と、任意に実施しうる工程として形成された繊維成形体の電荷を消失させる工程と、電荷消失によって繊維成形体を累積させる工程を含む。
以下、エレクトロスピニング法を例にとり、本発明のうち、繊維形状または不織布形状を有する蛋白質組成物の製造法を説明する。
エレクトロスピニング法における、紡糸液を製造する段階について説明する。本発明における紡糸液は、セルロースエーテル誘導体溶液と蛋白質粒子からなる懸濁液を使用することが好ましい。
該懸濁液におけるセルロースエーテル誘導体の濃度は1~30重量%であることが好ましい。セルロースエーテル誘導体の濃度が1重量%より低いと繊維成形体を形成することが困難となり好ましくない。また、30重量%より高いと得られる繊維成形体の繊維径が大きくなり、また懸濁液の粘度が高くなり好ましくない。より好ましい懸濁液におけるセルロースエーテル誘導体の濃度は1.5~20重量%である。
セルロースエーテル誘導体の溶媒は、セルロースエーテル誘導体を溶解可能で、かつ蛋白質粒子と懸濁液を形成し、紡糸する段階で蒸発し、繊維を形成可能なものであれば特に限定されず、また一種を単独で用いても複数の溶媒を組み合わせてもよい。例えばクロロホルム、2−プロパノール、トルエン、ベンゼン、ベンジルアルコール、ジクロロメタン、四塩化炭素、シクロヘキサン、シクロヘキサノン、トリクロロエタン、メチルエチルケトン、酢酸エチル、アセトン、エタノール、メタノール、テトラヒドロフラン、1,4−ジオキサン、1−プロパノール、フェノール、ピリジン、酢酸、蟻酸、ヘキサフルオロ−2−プロパノール、ヘキサフルオロアセトン、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、アセトニトリル、N−メチル−2−ピロリジノン、N−メチルモルホリン−N−オキシド、1,3−ジオキソラン、水、およびこれらの溶媒の混合溶媒が挙げられる。これらのうち、取り扱い性や物性などから、2−プロパノール、エタノールを用いることが好ましい。
セルロースエーテル誘導体溶液と蛋白質粒子を混合し、懸濁液を調製する方法としては、特に限定されないが、超音波や各種攪拌方法を用いることができる。攪拌方法としては、ホモジナイザーのような高速攪拌やアトライター、ボールミル等の攪拌方法も使用することができる。なかでも超音波処理による分散方法が好ましい。
また、溶媒と蛋白質粒子とで懸濁液を形成した後、セルロースエーテル誘導体を添加して紡糸液を調製することも可能である。
また、懸濁液を調製する前に蛋白質粒子を微細処理することができる。微細処理としては、乾式粉砕と湿式粉砕とがあり、本発明においては、いずれの方式も採用することができ、両者を組み合わせることもできる。
乾式粉砕処理としては、ボールミルを用いた処理、遊星ミルや振動ミルを用いた処理、乳鉢を用い乳棒によりすり潰す処理、媒体攪拌型粉砕機、ジェットミル、石臼を用いてすりつぶす処理等が挙げられる。
一方、湿式粉砕処理としては、適当な分散媒に蛋白質粒子を分散させた状態で、高い剪断力の攪拌装置、混練装置等により攪拌する処理や、媒体中に分散した状態でのボールミル、ビーズミル処理等が挙げられる。
さらには、スプレードライヤーにより作製した蛋白質粒子を使用することもできる。
本発明のうち、繊維形状または不織布形状を有する蛋白質組成物において、蛋白質粒子のサイズは特に限定されるものではないが、0.01~100μmの範囲にあることが好ましい。0.01μmよりも小さい蛋白質粉末を作製することは技術的に困難であり、100μmよりも大きいと分散性が悪く、繊維成形体が脆弱となり好ましくない。
本発明の蛋白質組成物で用いる滅菌方法は、放射線滅菌である。放射線としては、アルファ線、ベータ線、ガンマ線、中性子線、電子線、およびエックス線が挙げられる。なかでもガンマ線あるいは電子線が好ましく、最も好ましいのは電子線である。これらの滅菌方法は、特に限定されるものではないが、放射線の照射量としては10~80kGy、好ましくは20~30kGyである。温度条件としては、特に限定されるものではないが−80~40℃、好ましくは−80~30℃である。
アルファ線、陽電子線、ガンマ線、中性子線、電子線、エックス線などの放射線は、物質に当たると物質を構成する分子・原子から電子をはぎ取る。この際に分子結合が切断され、反応性の高いラジカル等が生じ、周辺物質と2次的に化学反応する。
蛋白質は放射線照射により機能(活性)を失いやすいことがよく知られている。これは照射により分子結合が切れ、機能発現の根源である「高次構造」が壊されることによるものと考えられる。しかしながら、本発明の蛋白質組成物は放射線照射してもその機能低下が抑制されている。これは本発明組成物中の蛋白質の高次構造が保持されていることを意味し、これは蛋白質一般において共通の効果である。この効果は透過するセルロースエーテル誘導体の厚みから考えて遮蔽によるものとは考えられず、抑制機構は定かではない。また、当該セルロースエーテル誘導体の効果が、特定のアミノ酸群の添加によって顕著に向上する現象の機構も不明である。
本発明の蛋白質組成物は、さらに電子・イオン捕捉剤、エネルギー移動剤、ラジカル捕捉剤、酸化防止剤、可塑剤を含んでもよい。電子・イオン捕捉剤としては、N,N’−テトラメチルフェニレンジアミン、ジフェニレンジアミン、ピレン、キノン等が挙げられる。エネルギー移動剤としては、アセナフテン等が挙げられる。ラジカル捕捉剤としては、メルカプタン、オクタヒドロフェナントレン、モノアルキルジフェニルエーテル、トコフェロール、クエン酸、ブチル化ヒドロキシアンソール、ブチル化ヒドロキシトルエン、t−ブチルヒドロキノン、没食子酸プロピル、アスコルビン酸誘導体等が挙げられる。酸化防止剤としては、BHT、亜リン酸トリエステル、フェノール系老化防止剤、有機チオ酸塩類等が挙げられる。なかでも食品や医薬品に使用するのに安全であると一般に認められている添加剤が好ましい。添加剤の量は特に限定されるものではないが、例えば蛋白質組成物におけるセルロースエーテル誘導体に対して0.01~10重量%の添加剤を含むことができる。
また、滅菌工程における蛋白質を含有するセルロースエーテル誘導体は水分を含んでいないことが好ましい。水分率は10重量%以下が好ましく、より好ましくは4重量%以下、さらに好ましくは実質的に無水のものである。
また、本発明の蛋白質組成物は、包装材に包装して放射線滅菌してもよい。かかる包装材料として、アルミニウムのようなガスバリア性の高い材料を使用することが好ましい。また、脱酸素剤や乾燥剤と共に密封包装しても、脱気後に不活性ガスを充填した状態で包装しても、これら両方を行ってもよい。かかる脱酸素剤および乾燥剤は、人体に害がなく、放射線滅菌時に失活しないものが好ましい。
本発明の蛋白質組成物は、例えば蛋白質の機能および滅菌性が求められる医療用材料として使用できる。
また、本発明には、本発明の蛋白質組成物を放射線滅菌してなる滅菌蛋白質組成物が含まれる。
実施例1~4および比較例1~2についての測定法
1.平均繊維径:
得られた繊維成形体の表面を走査型電子顕微鏡(キーエンス株式会社:商品名「VE8800」)により、倍率3000倍で撮影して得た写真から無作為に20箇所を選んで繊維の径を測定し、すべての繊維径の平均値を求めて平均繊維径とした。n=20である。
2.平均厚み:
50mm×100mmのサイズにカットした繊維成形体を高精度デジタル測長機(株式会社ミツトヨ:商品名「ライトマチックVL−50」)を用いて測長力0.01Nによりn=15にて繊維成形体の膜厚を測定した平均値を算出した。なお、本測定においては測定機器が使用可能な最小の測定力で測定を行った。
3.ELISA測定
(1)フィブリノゲン
ELISAプレート(NUNC 468667)に抗ヒトフィブリノゲン抗体(DAKO A0080)を10μg/mLで固定化した。0.05%Tween20を含むPBSで洗浄後、ブロックエース(DSファーマバイオメディカルUK−B80)を各ウェルに添加し、マスキングを行う。0.05%Tween20を含むPBSで洗浄後、検体を添加した。標準品としてヒトフィブリノゲン(Enzyme Research Laboratories No.FIB3)を用い、検量線を作成した。0.05%Tween20を含むPBSで洗浄後、HRP標識抗ヒトフィブリノゲン抗体(CPL5523)を添加し、反応後、0.05%Tween20を含むPBSで洗浄し、TMB試薬(KPL 50−76−02 50−65−02)を添加し、6分間静置して発色させた。1M H3PO4を加え、発色を停止し、マイクロプレートリーダーでOD450−650nmを測定した。
(2)トロンビン
ELISAプレート(NUNC 468667)に抗ヒトトロンビン抗体(Affinity Biological社、No.SAHT−AP)を5μg/mLで固定化した。0.05%Tween20を含むPBSで洗浄後、ブロックエース(DSファーマバイオメディカル UK−B80)を各ウェルに添加し、マスキングを行った。0.05%Tween20を含むPBSで洗浄後、検体を添加した。標準品としてヒトトロンビン(ヘマトロジックテクノロジー社:HCT−0020)を用い、検量線を作成した。0.05%Tween20を含むPBSで洗浄後、HRP標識抗ヒトトロンビン抗体((Affinity Biological社、No.SAHT−HRP)を0.1μg/mLで添加した。反応後、0.05%Tween20を含むPBSで洗浄し、TMB試薬(DaKo S1599)を添加し、10分間静置して発色させた。0.5M H2SO4を加え、発色を停止し、マイクロプレートリーダーでOD450−650nmを測定した。
4.トロンビン活性測定
BD社製ポリスチレンチューブに試料20μLと活性測定用希釈溶液(0.01% F−68、50mmol/L NaCl、50mmol/L Tris−HCl、pH8.4)80μL加え、37℃で3分インキュベーションした。標準品として組換トロンビン(JPU Thrombin Standard 400U/mLまたはWHO/US Thrombin Standard、110IU/mL:自社調整品)を同バッファーでJPUの場合、4、2、1、0.5、0.25U/mL、IUの場合、6、3、1.5、0.75、0.375IU/mLに希釈したものを用いた。その反応液にテストチーム発色基質S−2238(1mM:第一化学薬品工業)を100μL添加して攪拌混合し、37℃で7分間の反応後、0.1Mクエン酸溶液を800μL加えて反応を停止した。反応液200μLを96ウェルプレートに移し、OD405/650を測定した。
実施例1
2−プロパノールにフィブリノゲン凍結乾燥粉末(ボルヒール(登録商標、以下同じ)組織接着用:バイアル1)を分散させた後、16wt%になるようにヒドロキシプロピルセルロース(6−10mPa・s 和光純薬製)を溶解し、フィブリノゲン含有粒子/ヒドロキシプロピルセルロース=20(フィブリノゲンとして9.2)/100(w/w)の紡糸液を調製した。温度22℃、湿度26%以下でエレクトロスピニング法により紡糸を行い、シート状の繊維成形体を得た。噴出ノズルの内径は0.8mm、電圧は11kV、紡糸液流量は1.2mL/h、噴出ノズルから平板までの距離は15cmであった。得られた繊維成形体の平均繊維径は0.86μm、平均厚みは137μmであった。得られたシートを20kGyで電子線滅菌した。滅菌したシートを0.5cm×0.5cmに切断して、62.5μLの生理食塩水で蛋白質を抽出してELISA測定を実施した。結果、固定化蛋白質量は0.15mg/cm2であった。一方で、滅菌処理していないシートについても同様にELISA測定を実施した結果、固定化蛋白質量は、0.16mg/cm2であった。以上のことから、未滅菌シートに対しての滅菌シートの蛋白回収率は94%であった。
実施例2
2−プロパノールにフィブリノゲン凍結乾燥粉末(ボルヒール組織接着用:バイアル1)を分散させた後、16wt%になるようにヒドロキシプロピルセルロース(6−10mPa・s 和光純薬製)を溶解し、フィブリノゲン凍結乾燥粉末/ヒドロキシプロピルセルロース=40(フィブリノゲンとして18)/100(w/w)の紡糸液を調製した。温度22℃、湿度26%以下でエレクトロスピニング法により紡糸を行い、シート状の繊維成形体を得た。噴出ノズルの内径は0.8mm、電圧は12.5kV、紡糸液流量は1.2mL/h、噴出ノズルから平板までの距離は15cmであった。得られた繊維成形体の平均繊維径は0.43μm、平均厚みは152μmであった。得られたシートを20kGyで電子線滅菌した。滅菌したシートを0.5cm×0.5cmに切断して、62.5μLの生理食塩水で蛋白質を抽出してELISA測定を実施した。結果、固定化蛋白質量は0.27mg/cm2であった。一方で、滅菌処理していないシートについても同様にELISA測定を実施した結果、固定化蛋白質量は、0.30mg/cm2であった。以上のことから、未滅菌シートに対しての滅菌シートの蛋白回収率は90%であった。
実施例3
2−プロパノールにフィブリノゲン凍結乾燥粉末(ボルヒール組織接着用:バイアル1)を分散させた後、16wt%になるようにヒドロキシプロピルセルロース(6−10mPa・s、和光純薬製)を溶解し、フィブリノゲン凍結乾燥粉末/ヒドロキシプロピルセルロース=100(フィブリノゲンとして46)/100(w/w)の紡糸液を調製した。温度22℃、湿度26%以下でエレクトロスピニング法により紡糸を行い、シート状の繊維成形体を得た。噴出ノズルの内径は0.8mm、電圧は12.5kV、紡糸液流量は1.2mL/h、噴出ノズルから平板までの距離は15cmであった。得られた繊維成形体の平均繊維径は0.35μm、平均厚みは191μmであった。得られたシートを20kGyで電子線滅菌した。滅菌したシートを0.5cm×0.5cmに切断して、62.5μLの生理食塩水で蛋白質を抽出してELISA測定を実施した。結果、固定化蛋白質量は0.78mg/cm2であった。一方で、滅菌処理していないシートについても同様にELISA測定を実施した結果、固定化蛋白質量は、0.76mg/cm2であった。以上のことから、未滅菌シートに対しての滅菌シートの蛋白回収率は102%であった。
比較例1
フィブリノゲン凍結乾燥粉末(ボルヒール組織接着用:バイアル1)を20kGyで電子線滅菌した。1mLの生理食塩水で蛋白質を抽出してELISA測定を実施した。結果、ELISA測定値は、31μg/mLであった。一方で、滅菌処理していないフィブリノゲン凍結乾燥粉末(ボルヒール)についても同様にELISA測定を実施した結果、ELISA測定値は、90μg/mLであった。以上のことから、未滅菌シートに対しての滅菌シートの蛋白質回収率は34%であった。
実施例4
2−プロパノールにトロンビン含有粒子(リコンビナントトロンビン1mg/mL、塩化ナトリウム、クエン酸ナトリウム、塩化カルシウム及びマンニトールを含有するpH7の水溶液を凍結乾燥したもの)を分散させた後、13重量%になるようにヒドロキシプロピルセルロース(2.0−2.9mPa・s 日本曹逹製)を溶解し、トロンビン含有粒子/ヒドロキシプロピルセルロース=100/100(w/w)のドープ液を調製した。エレクトロスピニング法により紡糸を行い、シート状の繊維成形体を得た。得られた繊維成形体の厚さは204μm、目付けは2.08mg/cm2、嵩密度101mg/cm3であった。得られたシートを直径1cmに切り出し、200μLの生理食塩水で蛋白質を抽出して活性測定を実施した。その結果、活性測定値は110.3U/cm2であった。得られたシートは、30kGyの電子線を照射し滅菌後、トロンビン活性を測定した。電子線照射直後のトロンビン活性は、滅菌前を100%としたとき、68.4%の保持率であった。
比較例2
トロンビン含有粒子(リコンビナントトロンビン1mg/mL、塩化ナトリウム、クエン酸ナトリウム、塩化カルシウム及びマンニトールを含有するpH7の水溶液を凍結乾燥したもの)に30kGyの電子線を照射し滅菌後、トロンビン活性を測定した。照射前のトロンビン活性は、404.73U/バイアルであった。電子線照射直後のトロンビン活性は、滅菌前を100%としたとき、51.8%の保持率であった。
実施例5~6および比較例3~4についての測定法
1.平均厚み:
適当なサイズにカットした組成物を高精度デジタル測長機(株式会社ミツトヨ:商品名「ライトマチックVL−50」)を用いて測長力0.01Nによりn=9にて繊維成形体の膜厚を測定した平均値を算出した。なお、本測定においては測定機器が使用可能な最小の測定力で測定を行った。
2.酵素活性測定
リパーゼの活性測定にはContinuous Fluorometric Lipase Testキット(PROGEN BIOTECHNIK GMBH製)を使用した。以下の式により活性保持率を算出した。活性酵素量は、活性値から濃度換算して算出した。
活性保持率(%)={滅菌後の活性酵素量(mg/cm2)/滅菌前の活性酵素量(mg/cm2)}×100
一方、β‐グルコシダーゼの活性測定にはTokyogreen(登録商標、以下同じ。)−βGlu(積水メディカル株式会社)を用いた蛍光測定により行った。以下の式により活性回収率を算出した。固定化酵素理論重量は、仕込み酵素粉末重量%と組成物の重量から算出した。
活性回収率(%)={活性酵素量(mg)/(固定化酵素理論重量(mg)}×100
以下の式により活性保持率を算出した。
活性保持率(%)={滅菌後の活性回収率(%)/滅菌前の活性回収率(%)}×100
実施例5
2−プロパノールにリパーゼ粉末(ブタ膵臓由来、和光純薬製、以下同じ)を分散させた後、13wt%になるようにヒドロキシプロピルセルロース(6−10mPa・s 和光純薬製)を溶解し、リパーゼ粉末/ヒドロキシプロピルセルロース=50/100(w/w)の紡糸液を調製した。温度27℃、湿度27%以下でエレクトロスピニング法により紡糸を行い、シート状の繊維成形体を得た。噴出ノズルの内径は0.8mm、電圧は18kV、紡糸液流量は1.2mL/h、噴出ノズルから平板までの距離は16.5cmであった。得られた繊維成形体(10cm×14cm)の平均厚みは168μmであった。得られた繊維成形体を20kGyで電子線滅菌した。滅菌した繊維成形体を1cm×1cmに切断後、キットに含まれるLipase buffer 1mLでリパーゼを抽出して活性測定を実施した。結果、活性酵素量は0.46mg/cm2であった。一方で、滅菌処理していないシートについても同様に活性測定を実施した結果、活性酵素量は、0.40mg/cm2であった。以上のことから、未滅菌繊維成形体に対しての滅菌繊維成形体の活性保持率は115%であり、電子線滅菌により失活していないことがわかった。
実施例6
2−プロパノールにリパーゼ粉末を分散させた後、13wt%になるようにヒドロキシプロピルセルロース(6−10mPa・s、和光純薬製)を溶解し、リパーゼ粉末/ヒドロキシプロピルセルロース=50/100(w/w)のキャスト液を調製した。ドクターブレード(YOSHIMITSU製、YBA−3型)を用い、塗工幅15milでキャスティングし、シートを得た。得られたシート(4cm×6cm)の平均厚みは180μmであった。得られたシートを20hGyで電子線滅菌した。滅菌したシートを1cm×1cmに切断後、キットに含まれるLipase buffer 1mLでリパーゼを抽出して活性測定を実施した。結果、活性酵素量は0.69mg/cm2であった。一方で、滅菌処理していないシートについても同様に活性測定を実施した結果、活性酵素量は、0.64mg/cm2であった。以上のことから、未滅菌シートに対しての滅菌シートの活性保持率は108%であり、電子線滅菌により失活していないことがわかった。
実施例7
2−プロパノールにβ‐グルコシダーゼ粉末(アーモンド由来、オリエンタル酵母工業製、以下同じ)を分散させた後、13wt%になるようにヒドロキシプロピルセルロース(6−10mPa・s 和光純薬製)を溶解し、β‐グルコシダーゼ粉末/ヒドロキシプロピルセルロース=38/62(w/w)の紡糸液を調製した。温度27℃、湿度27%以下でエレクトロスピニング法により紡糸を行い、シート状の繊維成形体を得た。噴出ノズルの内径は0.9mm、電圧は18kV、紡糸液流量は1.2mL/h、噴出ノズルから平板までの距離は16.5cmであった。得られた繊維成形体(10cm×10cm)の平均厚みは207μmであった。得られた繊維成形体を2cm×2cmに切断後、20kGyで電子線滅菌した。得られた滅菌シートを生理食塩水1mLでβ‐グルコシダーゼを抽出してTokyogreen−βGluで活性測定を実施した。結果、活性回収率は42%であった。一方で、滅菌処理していないシートについても同様に活性測定を実施した結果、活性回収率は46%であった。以上のことから、未滅菌繊維成形体に対しての滅菌繊維成形体の活性保持率は91%であり、セルロースエーテル誘導体に包含されることによって酵素の失活を抑制できることがわかった。
比較例3
リパーゼ粉末を20kGyで電子線滅菌した。粉末1mgに1mLのLipase bufferを添加して活性測定を実施した。結果、活性値は、0.25pmol/mL・min.であった。一方で、滅菌処理していないリパーゼ粉末についても同様に活性測定を実施した結果、活性値は0.34pmol/mL・min.であった。以上のことから、未滅菌粉末に対しての滅菌粉末の活性保持率は74%であった。
比較例4
β‐グルコシダーゼ粉末を20kGyで電子線滅菌した。粉末2mgを1mLの生理食塩水に溶解させ、Tokyogreen−βGluで活性測定を実施した。その結果、活性保持率は81%であった。
実施例8~10についての測定法
フィブリノゲン凍結乾燥粉末(フィブリノゲン含有粒子)に対して電子線を照射した際、フィブリノゲンの変化(凝集体増加、ゲル強度低下)が生じる。電子線照射によるフィブリノゲンの変化を抑制する効果(滅菌耐性効果)を調べるために、フィブリノゲンのバルク液を調製し、5mLのガラスバイアルに1mLを充填後に凍結乾燥を実施した。凍結乾燥が終了した一部のバイアルについて30kGyの電子線を照射し、滅菌前後の比較を各凍結乾燥品について行った。
比較評価は、小型卓上試験機EZTest(島津製作所製)によるゲル強度測定およびBioSep−SEC−s4000(Phenomenex社製)による凝集体含量測定(分析条件:50mM リン酸緩衝液(pH7.0)、0.5M アルギニン塩酸塩を移動相として、流速1.0ml/minにて分画、280nmの波長により目的物質を検出;単量体ピークより早く検出されるピークを凝集体として定量)を実施した。
分析に際しての検体(分析用検体)調製手順は、未滅菌凍結乾燥品および滅菌済凍結乾燥品のバイアルを1mLの蒸留水により溶解。その溶液を遠心チューブ15000rpm×5分間遠心し、0.45μmのろ過フィルターを通液した後、分析用検体として用いた。
実施例8
以下の方法によりセルロースエーテル誘導体と特定添加剤の組合せによる蛋白質の滅菌耐性効果を調べた。
(方法)「セルロースエーテル誘導体+特定添加剤」組成(下記表1のNo.1~6に示す組成①)およびこれらよりセルロースエーテル誘導体を除いた組成に相当する組成②の、フィブリノゲンのバルク液を用い、そのゲル強度を測定することでフィブリノゲンとしての機能を評価し滅菌前後のゲル強度を比較することで滅菌耐性効果を調べた。結果を表2に示した。
組成①(凍結乾燥粉末とヒドロキシプロピルセルロースを2−プロパノールに懸濁後シート化)、組成②(凍結乾燥粉末)共に、各試料を1% Fbg濃度になるように水にて溶解後、10mM アルギニン、270mM 塩化ナトリウム、pH8.5の緩衝液にて2mg/mLの濃度になるように希釈した。
2mLポリプロピレンチューブにフィブロガミン(240単位/mL)10μL、トロンビン溶液(0.2mg/mL、100mM 塩化カルシウムを含む)110μLを加え、ピペッティング後に2mg/mLのフィブリノゲン溶液900μLを気泡が入らないよう添加し、37℃で1時間静置した後、小型卓上試験機EZTest(島津製作所製)にてゲルの強度を測定した。
上記組成①に対しセルロースエーテル誘導体(ヒドロキシプロピルセルロース:HPC)を含有しないもの。
(結果)
滅菌前を100とした場合の滅菌後のゲル強度の値を表2および図1に示す。
実施例9
実施例8と同様の方法により、下記表3の組成(2種)によりグリシンの滅菌耐性効果を調べた。結果を表4に示した。
実施例10
実施例8と同様の方法により、セルロースエーテル誘導体と特定添加剤の組合せによる滅菌耐性効果を調べた。
セルロースエーテル誘導体としてヒドロキシプロピルセルロース(HPC)および下記表5の8種の組成のフィブリノゲンのバルク溶液を用いた。1.0%フィブリノゲン、110mM 塩化ナトリウム、1.0%グリシン、0.2%マンニトールは下記8種の組成について共通である。結果を表6と図2に示した。
Claims (12)
- 添加剤として、グリシンとフェニルアラニンとヒスチジンとからなる混合物、および/またはセルロースエーテル誘導体を含む、蛋白質組成物。
- 添加剤がセルロースエーテル誘導体であり、蛋白質がセルロースエーテル誘導体に含有された状態で存在する請求項1に記載の蛋白質組成物。
- 添加剤がグリシンとフェニルアラニンとヒスチジンとからなる混合物である請求項1に記載の蛋白質組成物。
- 添加剤がグリシンとフェニルアラニンとヒスチジンとからなる混合物、およびセルロースエーテル誘導体であり、蛋白質がセルロースエーテル誘導体に含有された状態で存在している請求項1に記載の蛋白質組成物。
- セルロースエーテル誘導体がヒドロキシプロピルセルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、ナトリウム カルボキシメチルセルロース、およびそれらの混合物からなる群から選択される請求項1、2、4のいずれかに記載の蛋白質組成物。
- セルロースエーテル誘導体がヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、およびそれらの混合物からなる群から選択される請求項1、2、4のいずれかに記載の蛋白質組成物。
- セルロースエーテル誘導体がヒドロキシプロピルセルロースである請求項1、2、4のいずれかに記載の蛋白質組成物。
- 蛋白質が酵素、輸送蛋白質、筋肉蛋白質、防御蛋白質、毒素蛋白質、蛋白質ホルモン、貯蔵蛋白質、構造蛋白質、成長因子、およびそれらの混合物からなる群から選択される請求項1から7のいずれかに記載の蛋白質組成物。
- 蛋白質がフィブリノゲンである請求項1から7のいずれかに記載の蛋白質組成物。
- フィルム形状である請求項1から9のいずれかに記載の蛋白質組成物。
- 繊維形状または不織布形状である請求項1から9のいずれかに記載の蛋白質組成物。
- 放射線滅菌された請求項1から11のいずれかに記載の蛋白質組成物。
Priority Applications (16)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020147031797A KR102112375B1 (ko) | 2012-05-14 | 2013-05-13 | 방사선 멸균 내성 단백질 조성물 |
| EP13790434.8A EP2851083B8 (en) | 2012-05-14 | 2013-05-13 | Radiation-sterilization-resistant protein composition |
| CN201380025293.2A CN104271145B (zh) | 2012-05-14 | 2013-05-13 | 放射线灭菌耐性的蛋白组合物 |
| RU2014150497A RU2678828C2 (ru) | 2012-05-14 | 2013-05-13 | Белковая композиция, устойчивая к стерилизации облучением |
| DK13790434.8T DK2851083T3 (en) | 2012-05-14 | 2013-05-13 | RADIATION STERILIZATION RESISTANT PROTEIN COMPOSITION |
| PL13790434T PL2851083T3 (pl) | 2012-05-14 | 2013-05-13 | Kompozycja białkowa odporna na sterylizację promieniowaniem |
| MX2014013723A MX355012B (es) | 2012-05-14 | 2013-05-13 | Composicion de proteinas resistente a esterilizacion por radiacion. |
| ES13790434.8T ES2682024T3 (es) | 2012-05-14 | 2013-05-13 | Composición de proteína resistente a la esterilización por radiación |
| IN9624DEN2014 IN2014DN09624A (ja) | 2012-05-14 | 2013-05-13 | |
| AU2013261307A AU2013261307B2 (en) | 2012-05-14 | 2013-05-13 | Radiation-sterilization-resistant protein composition |
| CA2873655A CA2873655C (en) | 2012-05-14 | 2013-05-13 | Radiation sterilization-resistant protein composition |
| BR112014028441-5A BR112014028441B1 (pt) | 2012-05-14 | 2013-05-13 | Composição de proteína |
| US14/400,978 US20150132279A1 (en) | 2012-05-14 | 2013-05-13 | Radiation sterilization-resistant protein composition |
| EP18167342.7A EP3366301A1 (en) | 2012-05-14 | 2013-05-13 | Radiation sterilization-resistant protein composition |
| JP2014515697A JP5872032B2 (ja) | 2012-05-14 | 2013-05-13 | 放射線滅菌耐性蛋白質組成物 |
| HK15105625.5A HK1204948A1 (en) | 2012-05-14 | 2015-06-15 | Radiation-sterilization-resistant protein composition |
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012-110764 | 2012-05-14 | ||
| JP2012110764 | 2012-05-14 | ||
| JP2012110395 | 2012-05-14 | ||
| JP2012-110395 | 2012-05-14 | ||
| JP2013040594 | 2013-03-01 | ||
| JP2013-040594 | 2013-03-01 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2013172467A1 true WO2013172467A1 (ja) | 2013-11-21 |
Family
ID=49583865
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2013/063867 WO2013172467A1 (ja) | 2012-05-14 | 2013-05-13 | 放射線滅菌耐性蛋白質組成物 |
Country Status (18)
| Country | Link |
|---|---|
| US (1) | US20150132279A1 (ja) |
| EP (2) | EP3366301A1 (ja) |
| JP (2) | JP5872032B2 (ja) |
| KR (1) | KR102112375B1 (ja) |
| CN (1) | CN104271145B (ja) |
| AU (1) | AU2013261307B2 (ja) |
| BR (1) | BR112014028441B1 (ja) |
| CA (1) | CA2873655C (ja) |
| DK (1) | DK2851083T3 (ja) |
| ES (1) | ES2682024T3 (ja) |
| HK (1) | HK1204948A1 (ja) |
| IN (1) | IN2014DN09624A (ja) |
| MX (1) | MX355012B (ja) |
| PL (1) | PL2851083T3 (ja) |
| PT (1) | PT2851083T (ja) |
| RU (1) | RU2678828C2 (ja) |
| TW (1) | TWI590836B (ja) |
| WO (1) | WO2013172467A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107213479B (zh) * | 2017-06-22 | 2018-12-28 | 苏州杰纳生物科技有限公司 | 一种包含过氧化氢酶的组合物及用途 |
| JP6976501B2 (ja) | 2019-01-31 | 2021-12-08 | セルメディシン株式会社 | 無機塩類タンパク複合医療機器 |
| WO2021152121A1 (en) * | 2020-01-30 | 2021-08-05 | Leukocare Ag | Reduction of adsorption |
Citations (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0437095A2 (en) | 1990-01-12 | 1991-07-17 | JOHNSON & JOHNSON MEDICAL, INC. | Process for preparing a neutralized oxidized cellulose product and its method of use |
| EP0562864A1 (en) | 1992-03-25 | 1993-09-29 | JOHNSON & JOHNSON MEDICAL, INC. | Heteromorphic sponges containing active agents |
| JPH07252145A (ja) * | 1993-10-28 | 1995-10-03 | Clintec Nutrition Co | アミノ酸をベースとする成分 |
| US5730933A (en) | 1996-04-16 | 1998-03-24 | Depuy Orthopaedics, Inc. | Radiation sterilization of biologically active compounds |
| WO2000033893A1 (en) | 1998-12-07 | 2000-06-15 | Johnson & Johnson Medical Limited | Sterile complex of therapeutic peptide bond to a polysaccharide |
| JP2002513645A (ja) * | 1998-05-07 | 2002-05-14 | ジェンザイム・コーポレーション | 止血化合物および生体吸収性ポリマーを含む組成物 |
| JP2005505552A (ja) * | 2001-08-31 | 2005-02-24 | クリアラント・インコーポレイテッド | アルブミン含有製剤を殺菌する方法 |
| JP2005505324A (ja) * | 2001-08-31 | 2005-02-24 | クリアラント・インコーポレイテッド | 消化酵素製剤を殺菌する方法 |
| JP2006508971A (ja) * | 2002-11-20 | 2006-03-16 | アライバ−プロメティック インコーポレイティド | プロテアーゼ阻害剤を使用して炎症性疾患を治療する組成物及び方法 |
| JP2007016049A (ja) * | 1996-12-11 | 2007-01-25 | Praecis Pharmaceuticals Inc | 持続した薬物送達のための水不溶性複合体を含む薬学的処方物 |
| JP2007295936A (ja) * | 1995-11-09 | 2007-11-15 | Bristol Myers Squibb Co | 安定なビオチン化生体分子の組成物及び方法 |
| JP2008516735A (ja) * | 2004-10-20 | 2008-05-22 | エシコン・インコーポレイテッド | 吸収性止血材 |
| JP2011047089A (ja) | 2009-08-28 | 2011-03-10 | Japan Vilene Co Ltd | 酵素含有ナノファイバーの製造方法、酵素含有ナノファイバー、この酵素含有ナノファイバーを含む不織布及びこの不織布を用いた反応装置 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3648573B2 (ja) * | 1995-03-29 | 2005-05-18 | 第一工業製薬株式会社 | カルボキシメチルセルロースナトリウム塩の溶解方法 |
| US6103266A (en) * | 1998-04-22 | 2000-08-15 | Tapolsky; Gilles H. | Pharmaceutical gel preparation applicable to mucosal surfaces and body tissues |
| ATE321577T1 (de) * | 1998-11-18 | 2006-04-15 | Zlb Behring Gmbh | Stabilisierte proteinzubereitungen für einen gewebekleber |
| DE10022092A1 (de) * | 2000-05-08 | 2001-11-15 | Aventis Behring Gmbh | Stabilisiertes Protein-Präparat und Verfahren zu seiner Herstellung |
| CA2462596A1 (en) * | 2001-10-03 | 2003-04-10 | Christopher J. Woolverton | Storage-stable human fibrinogen solutions |
| GB0505975D0 (en) * | 2005-03-23 | 2005-04-27 | Queen Mary & Westfield College | Novel use of peptide |
| AU2008230476B2 (en) * | 2007-03-22 | 2012-11-01 | Km Biologics Co., Ltd. | Solid fibrinogen preparation |
| EP2143440A1 (fr) * | 2008-07-09 | 2010-01-13 | Sanofi Pasteur | Agent stabilisant et composition vaccinale comprenant un ou plusieurs flavivirus vivants atténués |
| DK2529004T3 (en) * | 2010-01-28 | 2017-09-25 | Advanced Bionutrition Corp | DRY GLASSY COMPOSITION INCLUDING A BIOACTIVE MATERIAL |
-
2013
- 2013-05-13 WO PCT/JP2013/063867 patent/WO2013172467A1/ja active Application Filing
- 2013-05-13 EP EP18167342.7A patent/EP3366301A1/en not_active Withdrawn
- 2013-05-13 BR BR112014028441-5A patent/BR112014028441B1/pt not_active IP Right Cessation
- 2013-05-13 EP EP13790434.8A patent/EP2851083B8/en active Active
- 2013-05-13 ES ES13790434.8T patent/ES2682024T3/es active Active
- 2013-05-13 CN CN201380025293.2A patent/CN104271145B/zh active Active
- 2013-05-13 PL PL13790434T patent/PL2851083T3/pl unknown
- 2013-05-13 US US14/400,978 patent/US20150132279A1/en not_active Abandoned
- 2013-05-13 PT PT13790434T patent/PT2851083T/pt unknown
- 2013-05-13 AU AU2013261307A patent/AU2013261307B2/en not_active Ceased
- 2013-05-13 MX MX2014013723A patent/MX355012B/es active IP Right Grant
- 2013-05-13 RU RU2014150497A patent/RU2678828C2/ru active
- 2013-05-13 IN IN9624DEN2014 patent/IN2014DN09624A/en unknown
- 2013-05-13 TW TW102116957A patent/TWI590836B/zh not_active IP Right Cessation
- 2013-05-13 KR KR1020147031797A patent/KR102112375B1/ko active IP Right Grant
- 2013-05-13 JP JP2014515697A patent/JP5872032B2/ja active Active
- 2013-05-13 CA CA2873655A patent/CA2873655C/en active Active
- 2013-05-13 DK DK13790434.8T patent/DK2851083T3/en active
-
2015
- 2015-06-15 HK HK15105625.5A patent/HK1204948A1/xx not_active IP Right Cessation
- 2015-11-05 JP JP2015217255A patent/JP6317307B2/ja active Active
Patent Citations (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0437095A2 (en) | 1990-01-12 | 1991-07-17 | JOHNSON & JOHNSON MEDICAL, INC. | Process for preparing a neutralized oxidized cellulose product and its method of use |
| EP0562864A1 (en) | 1992-03-25 | 1993-09-29 | JOHNSON & JOHNSON MEDICAL, INC. | Heteromorphic sponges containing active agents |
| JPH07252145A (ja) * | 1993-10-28 | 1995-10-03 | Clintec Nutrition Co | アミノ酸をベースとする成分 |
| JP2007295936A (ja) * | 1995-11-09 | 2007-11-15 | Bristol Myers Squibb Co | 安定なビオチン化生体分子の組成物及び方法 |
| US5730933A (en) | 1996-04-16 | 1998-03-24 | Depuy Orthopaedics, Inc. | Radiation sterilization of biologically active compounds |
| JP2007016049A (ja) * | 1996-12-11 | 2007-01-25 | Praecis Pharmaceuticals Inc | 持続した薬物送達のための水不溶性複合体を含む薬学的処方物 |
| JP2002513645A (ja) * | 1998-05-07 | 2002-05-14 | ジェンザイム・コーポレーション | 止血化合物および生体吸収性ポリマーを含む組成物 |
| JP2002531532A (ja) * | 1998-12-07 | 2002-09-24 | ジョンソン・アンド・ジョンソン・メディカル・リミテッド | ポリサッカライドと結合した治療ペプチドの滅菌複合体 |
| WO2000033893A1 (en) | 1998-12-07 | 2000-06-15 | Johnson & Johnson Medical Limited | Sterile complex of therapeutic peptide bond to a polysaccharide |
| JP2005505324A (ja) * | 2001-08-31 | 2005-02-24 | クリアラント・インコーポレイテッド | 消化酵素製剤を殺菌する方法 |
| JP2005505552A (ja) * | 2001-08-31 | 2005-02-24 | クリアラント・インコーポレイテッド | アルブミン含有製剤を殺菌する方法 |
| JP2006508971A (ja) * | 2002-11-20 | 2006-03-16 | アライバ−プロメティック インコーポレイティド | プロテアーゼ阻害剤を使用して炎症性疾患を治療する組成物及び方法 |
| JP2008516735A (ja) * | 2004-10-20 | 2008-05-22 | エシコン・インコーポレイテッド | 吸収性止血材 |
| JP2011047089A (ja) | 2009-08-28 | 2011-03-10 | Japan Vilene Co Ltd | 酵素含有ナノファイバーの製造方法、酵素含有ナノファイバー、この酵素含有ナノファイバーを含む不織布及びこの不織布を用いた反応装置 |
Non-Patent Citations (1)
| Title |
|---|
| See also references of EP2851083A4 |
Also Published As
| Publication number | Publication date |
|---|---|
| HK1204948A1 (en) | 2015-12-11 |
| EP2851083A1 (en) | 2015-03-25 |
| DK2851083T3 (en) | 2018-08-27 |
| PL2851083T3 (pl) | 2019-04-30 |
| MX355012B (es) | 2018-03-28 |
| KR102112375B1 (ko) | 2020-05-18 |
| PT2851083T (pt) | 2018-10-18 |
| RU2014150497A (ru) | 2016-07-10 |
| TW201350146A (zh) | 2013-12-16 |
| IN2014DN09624A (ja) | 2015-07-31 |
| BR112014028441A2 (pt) | 2017-06-27 |
| BR112014028441B1 (pt) | 2021-04-27 |
| CN104271145B (zh) | 2017-01-18 |
| KR20150020539A (ko) | 2015-02-26 |
| ES2682024T3 (es) | 2018-09-18 |
| EP2851083B8 (en) | 2018-08-08 |
| EP2851083A4 (en) | 2015-05-06 |
| AU2013261307B2 (en) | 2017-12-21 |
| US20150132279A1 (en) | 2015-05-14 |
| CA2873655C (en) | 2021-04-06 |
| JPWO2013172467A1 (ja) | 2016-01-12 |
| TWI590836B (zh) | 2017-07-11 |
| RU2678828C2 (ru) | 2019-02-04 |
| EP3366301A1 (en) | 2018-08-29 |
| MX2014013723A (es) | 2015-08-10 |
| AU2013261307A1 (en) | 2014-12-04 |
| CA2873655A1 (en) | 2013-11-21 |
| CN104271145A (zh) | 2015-01-07 |
| JP6317307B2 (ja) | 2018-04-25 |
| JP5872032B2 (ja) | 2016-03-01 |
| JP2016053063A (ja) | 2016-04-14 |
| EP2851083B1 (en) | 2018-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11433160B2 (en) | Formed sheet product and hemostatic material | |
| JP5746430B2 (ja) | 滅菌組成物 | |
| JP6317307B2 (ja) | 放射線滅菌耐性蛋白質組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 13790434 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2014515697 Country of ref document: JP Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: MX/A/2014/013723 Country of ref document: MX |
|
| ENP | Entry into the national phase |
Ref document number: 20147031797 Country of ref document: KR Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 2873655 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 14400978 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2013261307 Country of ref document: AU Date of ref document: 20130513 Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2013790434 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: 2014150497 Country of ref document: RU Kind code of ref document: A |
|
| REG | Reference to national code |
Ref country code: BR Ref legal event code: B01A Ref document number: 112014028441 Country of ref document: BR |
|
| ENP | Entry into the national phase |
Ref document number: 112014028441 Country of ref document: BR Kind code of ref document: A2 Effective date: 20141114 |