WO2013012022A1 - アルギニンアミドまたはその類似化合物を含む安定なタンパク質含有製剤 - Google Patents
アルギニンアミドまたはその類似化合物を含む安定なタンパク質含有製剤 Download PDFInfo
- Publication number
- WO2013012022A1 WO2013012022A1 PCT/JP2012/068276 JP2012068276W WO2013012022A1 WO 2013012022 A1 WO2013012022 A1 WO 2013012022A1 JP 2012068276 W JP2012068276 W JP 2012068276W WO 2013012022 A1 WO2013012022 A1 WO 2013012022A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- protein
- antibody
- preparation
- arginine
- amide
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Definitions
- the present invention relates to a stable protein-containing preparation.
- the present invention relates to a protein-containing preparation that is stable against light stress.
- a high concentration antibody-containing solution tends to form a solution with high viscosity due to the nature of the protein as a macromolecule and intermolecular interaction. Furthermore, when the protein is stored in a high-concentration solution, deterioration phenomena such as the formation of aggregates become a problem and must be prevented. In particular, when a high-concentration antibody-containing solution is stored in a frozen state or in a solution state for a long time, or when it is freeze-thawed, an aggregate is likely to be formed (Non-Patent Documents 1 and 2).
- the solution preparation is not lyophilized.
- the high-concentration antibody-containing solution preparation tends to form an aggregate.
- antibody-containing solution preparations are easier to handle than lyophilized preparations, and moreover, they are easily applied to prefilled syringe preparations, so there is a high demand for their development.
- the present inventors added a arginine amide to a protein-containing sample, and compared with methionine and arginine reported so far. It was found that a stabilizing effect against light stress can be obtained. And, by adding at least one selected from the group consisting of arginine amide, arginine ethyl ester, homoarginine, and valine amide as a stabilizer to a protein-containing sample, it was found that a stable protein-containing preparation was obtained. Completed the invention.
- the present invention provides a stable protein-containing preparation characterized by containing arginine amide. Furthermore, the present invention relates to a method for suppressing protein association, which comprises adding arginine amide to a protein-containing sample. Furthermore, the present invention relates to a method for suppressing protein destabilization, which comprises adding arginine amide to a protein-containing sample.
- the concentration of arginine amide used in the preparation of the present invention is preferably 1 to 1500 ⁇ mM, more preferably 50 to 1000 ⁇ mM, more preferably 50 to 200 ⁇ mM. That is, it may be 60 mM, 70 mM, 80 mM, 90 mM, 100 mM, 110 mM, 120 mM, 130 mM, 140 mM, 150 mM, 160 mM, 170 mM, 180 mM, or 190 mM as long as the concentration is between 50 mM and 200 mM.
- the concentration of at least one stabilizer selected from the group consisting of arginine amide, arginine ethyl ester, homoarginine, and valine amide used in the preparation of the present invention is preferably 1 to 1500 ⁇ mM, more preferably 50 to 1000 mm, more preferably 50 to 200 mm. That is, it may be 60 mM, 70 mM, 80 mM, 90 mM, 100 mM, 110 mM, 120 mM, 130 mM, 140 mM, 150 mM, 160 mM, 170 mM, 180 mM, or 190 mM as long as the concentration is between 50 mM and 200 mM.
- the solution or liquid formulation of the present invention has a refrigeration temperature (2-8 ° C) for at least 12 months, preferably 2 years, more preferably 3 years, or at room temperature (22-28 ° C) for at least 6 months, preferably 1 year. More preferably, no significant changes are observed for 2 years.
- the solution or liquid formulation of the present invention is stable at 22-28 ° C. for at least 6 months.
- the term “stable” means that the preparation of the present invention is a preparation in which long-term storage, freezing and thawing, light stress, or a protein aggregate caused by any cause is not likely to occur, that is, insoluble during storage. In addition, it refers to a preparation that hardly undergoes degradation reactions such as the formation of soluble aggregates.
- the buffer that can be used in the present invention can adjust the pH within a desired range, and is acceptable as a pharmaceutical product.
- the pH of the preparation of the present invention is preferably 4.5 to 7.0, more preferably 5.0 to 7.0, and further preferably 5.5 to 6.5.
- These buffering agents are known to those skilled in the art and examples include inorganic salts such as phosphate (sodium or potassium) and sodium bicarbonate; citrate (sodium or potassium), sodium acetate, and sodium succinate
- organic acids such as phosphoric acid, carbonic acid, citric acid, succinic acid, malic acid, and gluconic acid.
- Tris buffer In addition, Tris buffer, Good buffers such as MES and MOPS, histidine (eg, histidine hydrochloride) and glycine can be used.
- the buffer is preferably a histidine buffer and / or a citrate buffer, and a histidine buffer is particularly preferable.
- the concentration of the buffer is generally 1 to 500 ⁇ mM, preferably 5 to 100 ⁇ mM, more preferably 15 to 25 ⁇ mM.
- the buffer when a histidine buffer is used, the buffer preferably contains histidine at a concentration of 10-30 ⁇ mM, more preferably 15-25 ⁇ mM.
- the preparation of the present invention further includes not only acidic amino acids such as aspartic acid and glutamic acid, but also methionine, proline, glycine, alanine, phenylalanine, tryptophan, serine, threonine, asparagine, glutamine, arginine, cysteine, histidine, isoleucine, leucine, Amino acids such as lysine, tyrosine and valine may be contained as a stabilizer.
- the amino acids of the present invention include free amino acids, salts such as sodium salts, potassium salts and hydrochlorides thereof.
- the preparation of the present invention preferably contains at least one amino acid among the amino acids described therein.
- the amount of amino acid added to the preparation of the present invention is generally 1 ⁇ m to 1500 ⁇ mM, preferably 1 ⁇ m to 1000 ⁇ mM, more preferably 5 ⁇ m to 500 ⁇ mM, most preferably 10 ⁇ m to 300 ⁇ mM. .
- the preparation of the present invention preferably contains 1 to 500 MmM histidine buffer and / or citrate buffer, 1 to 1500 ⁇ ⁇ ⁇ ⁇ ⁇ mM of at least one amino acid, and 1 to 250 mg / mL protein. It is a formulation.
- the pH and the like can be set in an appropriate range, and it is preferably set to 5.0 to 7.0.
- the antibody-containing preparation that is stable to light stress in the present invention means that it is difficult to produce an aggregate of a protein such as an antibody due to light stress in the preparation, that is, due to light stress during solution or cryopreservation. It refers to a preparation that is less prone to deterioration reactions such as the formation of insoluble and soluble aggregates.
- the antibody concentration contained in the preparation of the present invention is not particularly limited, but preferably contains a high concentration of antibody. That is, the present invention relates to a high concentration antibody-containing preparation excellent in stability.
- the antibody concentration is preferably 50 mg / mL or more, more preferably 80 mg / mL or more, more preferably 100 mg / mL or more, more preferably 120 mg / mL or more, more preferably 150 mg / mL or more, more preferably Is 180 mg / mL or more.
- the upper limit of the antibody concentration contained in the preparation of the present invention is not particularly limited, but is usually 250 mg / mL.
- the antibody used in the present invention is not particularly limited as long as it binds to a desired antigen, and may be a polyclonal antibody or a monoclonal antibody, and a monoclonal antibody is preferable in that a homogeneous antibody can be stably produced.
- the monoclonal antibodies used in the present invention include not only monoclonal antibodies derived from animals such as humans, mice, rats, hamsters, rabbits, sheep, camels, monkeys, but also artificial antibodies such as chimeric antibodies, humanized antibodies, and bispecific antibodies. Modified genetically modified antibodies are also included. In addition, antibody properties may be modified to modify antibody molecule physical properties (specifically, isoelectric point (pI) modification, Fc receptor affinity modification, etc.) for the purpose of improving blood retention and pharmacokinetics. Also included are genetically engineered antibodies in which the constant region and the like are artificially modified.
- the immunoglobulin class of the antibody used in the present invention is not particularly limited, and may be any class such as IgG1, IgG2, IgG3, IgG4, IgG, IgA, IgD, IgE, IgM, etc. IgM is preferred.
- the antibody used in the present invention can be prepared by methods well known to those skilled in the art.
- a hybridoma producing a monoclonal antibody can be basically produced using a known technique as follows. That is, a desired antigen or a cell expressing the desired antigen is used as a sensitizing antigen and immunized according to a normal immunization method, and the resulting immune cell is fused with a known parent cell by a normal cell fusion method. And can be prepared by screening monoclonal antibody-producing cells (hybridomas) by a normal screening method.
- the hybridoma can be produced, for example, according to the method of Milstein et al. (Kohler. G. and Milstein, C., Methods Enzymol. (1981) 73: 3-46). When the immunogenicity of the antigen is low, immunization may be performed by binding to an immunogenic macromolecule such as albumin.
- a recombinant antibody produced by cloning an antibody gene from a hybridoma, incorporating it into a suitable vector, introducing it into a host, and using a gene recombination technique can be used (for example, Carl, A). K. Borrebaeck, James, W. Larrick, THERAPEUTIC MONOCLONAL ANTIBODIES, Published in the United Kingdom by MACMILLAN PUBLISHERS LTD, 1990).
- cDNA of the variable region (V region) of the antibody is synthesized from the hybridoma mRNA using reverse transcriptase.
- DNA encoding the V region of the target antibody When DNA encoding the V region of the target antibody is obtained, it is ligated with DNA encoding the desired antibody constant region (C region) and incorporated into an expression vector.
- DNA encoding an antibody V region may be incorporated into an expression vector containing antibody C region DNA. It is incorporated into an expression vector so as to be expressed under the control of an expression control region such as an enhancer or promoter.
- host cells can be transformed with this expression vector to express the antibody.
- a recombinant antibody artificially modified for the purpose of reducing the heterologous antigenicity to humans for example, a chimeric antibody or a humanized antibody
- modified antibodies can be produced using known methods.
- a chimeric antibody is a mammal other than a human, for example, a mouse antibody heavy chain, light chain variable region and a human antibody heavy chain, light chain constant region, and a DNA encoding the murine antibody variable region.
- a humanized antibody also called a reshaped human antibody, is a non-human mammal, such as a mouse antibody complementarity-determining region (CDR) grafted to the complementarity-determining region of a human antibody.
- CDR complementarity-determining region
- the preparation of the present invention has a high stabilizing effect on an antibody having a low isoelectric point, which is hardly present particularly in nature.
- examples of the isoelectric point of such an antibody include 5.0 to 8.0, preferably 5.0 to 7.5, more preferably 5.0 to 7.0, and particularly preferably 5.5 to 6.5.
- a method for obtaining a human antibody is also known.
- human lymphocytes are sensitized with a desired antigen or cells expressing the desired antigen in vitro, and the sensitized lymphocytes are fused with human myeloma cells, such as U266, to have a desired human antibody having an antigen-binding activity.
- a desired human antibody can be obtained by immunizing a transgenic animal having all repertoires of human antibody genes with an antigen (WO 93/12227, WO 92/03918, WO 94/02602, WO 94 / 25585, WO 96/34096, WO 96/33735).
- variable region of a human antibody is expressed as a single chain antibody (scFv) on the surface of the phage by the phage display method, and a phage that binds to the antigen can be selected.
- scFv single chain antibody
- the DNA sequence encoding the variable region of the human antibody that binds to the antigen can be determined. If the DNA sequence of scFv that binds to the antigen is clarified, a suitable expression vector containing the sequence can be prepared and a human antibody can be obtained.
- an antibody gene is once isolated and introduced into an appropriate host to produce an antibody
- a combination of an appropriate host and an expression vector can be used.
- eukaryotic cells animal cells, plant cells, and fungal cells can be used.
- Animal cells include (1) mammalian cells such as CHO, COS, myeloma, BHK (baby hamster kidney ,), HeLa, Vero, (2) amphibian cells such as Xenopus oocytes, or (3) insect cells.
- mammalian cells such as CHO, COS, myeloma, BHK (baby hamster kidney ,), HeLa, Vero, (2) amphibian cells such as Xenopus oocytes, or (3) insect cells.
- mammalian cells such as CHO, COS, myeloma, BHK (baby hamster kidney ,), HeLa, Vero
- amphibian cells such as Xenopus oocytes
- insect cells for example, sf9, sf21, Tn5, etc. are known.
- yeasts such as the genus Saccharomyces, such as Saccharomyces cerevisiae, and filamentous fungi such as the genus Aspergillus, such as Aspergillus niger.
- the antibodies used in the present invention include not only whole antibodies but also antibody fragments, low molecular weight antibodies, and modified antibodies.
- Fab, Fab ′, F (ab ′) 2 Fv, sFv, dsFv (disulphide stablized Fv) or Fv of antibody H chain and L chain are suitable as peptide linkers or the like.
- Single-chain or higher-valent single chain Fv linked with a linker (Diabody such as scFv, sc (Fv) 2 and scFv dimer) (Huston, JS et al., Proc. Natl. Acad. Sci.
- Preferred reshaped humanized antibodies used in the present invention include humanized anti-interleukin 6 (IL-6) receptor antibodies (tocilitumab, hPM-1 or MRA) (see WO92 / 19759), humanized anti-HM1.24.
- Antigen monoclonal antibody see WO98 / 14580
- humanized anti-parathyroid hormone related peptide antibody anti-PTHrP antibody
- humanized anti-tissue factor antibody see WO99 / 51743
- humanized anti-IL31 receptor Examples include antibodies (see WO2009 / 072604).
- Preferred surfactants are polyoxyethylene sorbitan fatty acid esters and polyoxyethylene polyoxypropylene alkyl ethers, particularly preferred are polysorbates (PS) 20, 21, 40, 60, 65, 80, 81, and 85, And pluronic surfactants, most preferred are polysorbates 20 and 80, and pluronic F-68 (Poloxamer 188 (PX188)).
- the amount of surfactant added to the formulation of the present invention is generally 0.0001 to 10% (w / v), preferably 0.001 to 5%, more preferably 0.005 to 3%.
- the preparation of the present invention includes, as necessary, a cryoprotectant, a suspending agent, a solubilizing agent, an isotonic agent, a preservative, an adsorption inhibitor, a diluent, an excipient, a pH adjuster, a soothing agent
- a cryoprotectant such as an agent, a sulfur-containing reducing agent and an antioxidant, can be appropriately added.
- cryoprotective agents include saccharides such as trehalose, sucrose (sucrose), mannitol, meglumine and sorbitol.
- solubilizers include polyoxyethylene hydrogenated castor oil, polysorbate 80, nicotinic acid amide, polyoxyethylene sorbitan monolaurate, Magrogol, castor oil fatty acid ethyl ester, and the like.
- tonicity agents examples include sodium chloride, potassium chloride, calcium chloride and the like.
- preservatives include methyl paraoxybenzoate, ethyl paraoxybenzoate, ethyl parahydroxybenzoate, sorbic acid, phenol, cresol, chlorocresol and the like.
- adsorption inhibitor examples include human serum albumin, lecithin, dextran, ethylene oxide / propylene oxide copolymer, hydroxypropyl cellulose, methyl cellulose, polyoxyethylene hydrogenated castor oil, polyethylene glycol and the like.
- diluent for example, water, ethanol, propylene glycol, ethoxylated isostearyl alcohol, polyoxylated isostearyl alcohol, polyoxyethylene sorbitan fatty acid esters and the like can be used.
- lactose for example, lactose, fructose, sucrose, glucose, mannitol, sorbitol, sodium chloride, glucose, urea, starch, calcium carbonate, kaolin, crystalline cellulose, silicic acid, silicon dioxide and the like can be used.
- pH adjusters examples include hydrochloric acid, citric acid, succinic acid, acetic acid, boric acid, maleic acid, sodium hydroxide and the like.
- a surface anesthetic, a local anesthetic or a local numbing agent is used.
- the soothing agent used in the present invention include benzalkonium chloride, procaine hydrochloride, meprilucaine hydrochloride, lidocaine hydrochloride, lidocaine, chlorobutanol, dibucaine hydrochloride, tetracaine hydrochloride, ethyl aminobenzoate and the like.
- a soothing agent may be used only by 1 type and may be used in combination of 2 or more type.
- sulfur-containing reducing agents examples include N-acetylcysteine, N-acetylhomocysteine, thioctic acid, thiodiglycol, thioethanolamine, thioglycerol, thiosorbitol, thioglycolic acid and its salts, sodium thiosulfate, glutathione, carbon atoms
- sulfur-containing reducing agents include N-acetylcysteine, N-acetylhomocysteine, thioctic acid, thiodiglycol, thioethanolamine, thioglycerol, thiosorbitol, thioglycolic acid and its salts, sodium thiosulfate, glutathione, carbon atoms
- sulfur-containing reducing agents examples include N-acetylcysteine, N-acetylhomocysteine, thioctic acid, thiodiglycol, thioethanolamine,
- Antioxidants such as erythorbic acid, dibutylhydroxytoluene, butylhydroxyanisole, ⁇ -tocopherol, tocopherol acetate, L-ascorbic acid and its salts, L-ascorbyl palmitate, L-ascorbic acid stearate, sodium bisulfite, sodium sulfite Chelating agents such as sodium, triamyl gallate, propyl gallate or disodium ethylenediaminetetraacetate (EDTA), sodium pyrophosphate, sodium metaphosphate and the like can be mentioned.
- EDTA disodium ethylenediaminetetraacetate
- the present invention also relates to a protein light stress stabilizer comprising as an active ingredient at least one selected from the group consisting of arginine amide, arginine ethyl ester, homoarginine, and valine amide.
- the protein is preferably a protein contained in a solution.
- the protein in the drug of the present invention is preferably an antibody.
- the present invention suppresses protein association caused by light stress, characterized in that at least one compound selected from the group consisting of arginine amide, arginine ethyl ester, homoarginine, and valine amide is added to a protein-containing sample. How to do.
- the present invention also relates to protein destabilization due to light stress, characterized in that at least one compound selected from the group consisting of arginine amide, arginine ethyl ester, homoarginine, and valine amide is added to a protein-containing solution. It is related with the control method.
- the protein in the method of the present invention is preferably an antibody. That is, as one embodiment of the method of the present invention, for example, at least one compound selected from the group consisting of arginine amide, arginine ethyl ester, homoarginine, and valine amide is used as a stabilizer in a high concentration antibody-containing preparation. And a method for suppressing antibody association due to light stress during storage of the preparation in a solution state.
- Dosage forms for oral administration and parenteral administration and methods for producing the same are well known to those skilled in the art, and the pharmaceutical preparation according to the present invention is produced according to a conventional method by mixing a pharmaceutically acceptable carrier and the like. be able to.
- the osmotic pressure ratio of the buffer is close to isotonic 1.0 from the viewpoint of pain. Accordingly, the osmotic pressure of the solution preparation of the present invention is preferably about 1.
- arginine or saccharides are added to stabilize it, but if the osmotic pressure exceeds isotonicity, it may cause pain during subcutaneous administration.
- the agent is preferably added in consideration of osmotic pressure.
- the formulations of the present invention are usually supplied in sealed and sterilized plastic or glass vials, ampoules, syringes of a defined volume such as syringes, and large volumes of containers such as bags and bottles. Can do. From the viewpoint of convenience, other container forms include, for example, prefilled syringes and cartridges for pen-type syringes, but are not limited to these forms.
- the present invention also provides a kit containing the preparation of the present invention and a kit for use in various methods of the present invention.
- the kit of the present invention contains the preparation of the present invention.
- the kit of the present invention can be appropriately packaged with instructions describing the method of use.
- the present invention also relates to use as at least one light stress stabilizer selected from the group consisting of arginine amide, arginine ethyl ester, homoarginine, and valinamide for protein solutions.
- Mab1 Antibody production method Mab1, which is an anti-IL-6 receptor antibody described in WO2009 / 041621 (H chain / SEQ ID NO: 1, L chain / SEQ ID NO: 2; an antibody with an isoelectric point modified to 5.8) is stable in CHO cells
- the expression strain was expressed by a method known to those skilled in the art, purified to a high purity by a method known to those skilled in the art including protein A, and used in the stability test of the following Examples.
- the stabilization effect in protein-containing formulations of compounds that may have a stabilizing effect was investigated.
- Sample preparation was performed by adjusting the concentration of each component to the concentration shown in Table 1 using the above-mentioned Mab1 high-concentration stock solution. Size exclusion chromatography was performed after the thermal acceleration test and the light irradiation test. Each sample was analyzed at the same concentration using a G3000SWXL 7.8 mm ID ⁇ 30 cm column (Tosoh).
- the mobile phase was analyzed using a 50 mM phosphate buffer (pH 7.0) containing 300 mM NaCl at a flow rate of 0.5 mL / min (detection wavelength: 280 nm).
- the peak eluted earlier than the monomer was analyzed as an aggregate, and the peak eluted later than the monomer was analyzed as a low molecular degradation product, and the respective content (%) was calculated by the area percentage method.
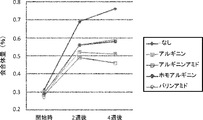
- Figures 1 and 2 show the results of aggregate increase (%) for each formulation after storage at 25 ° C or after light irradiation, respectively.
- arginine amide was added in the light irradiation test, the increase in aggregates after the test was clearly reduced as compared with the case where arginine, which is generally known as a stabilizer, was added.
- the degree of decrease was concentration-dependent, whereas arginine showed little change due to concentration.
- methionine which is known to have a photostabilization effect, a decrease in the amount of aggregates increased by the same level or more was observed.
- Example 2 Examination of Candidate Stabilizers Based on the results of Example 1, it was decided to examine the stabilizing effect of arginine amide and its similar compounds in protein-containing preparations.
- Sample preparation was performed by adjusting the concentration of each component to the concentration shown in Table 2 using the above-mentioned Mab1 high-concentration stock solution. Size exclusion chromatography was performed after the thermal acceleration test and the light irradiation test. Dilute each sample to approximately 1.0 mg / mL with the following mobile phase, and analyze them with SWXL6.0 mmI.D. ⁇ 4 cm (Tosoh) guard column and G3000SWXL 7.8 mm ID ⁇ 30 cm column (Tosoh) did.
- the mobile phase was analyzed using a 50 mM phosphate buffer (pH 7.0) containing 300 mM NaCl and 0.05% NaN 3 at a flow rate of 0.5 mL / min (detection wavelength: 280 nm).
- the peak eluted earlier than the monomer was analyzed as an aggregate, and the peak eluted later than the monomer was analyzed as a low molecular degradation product, and the respective content (%) was calculated by the area percentage method.
- Tables 3 to 4 show the results of increase in aggregate (%) of each formulation after light irradiation or storage at 25 ° C. by adding a compound similar to arginine amide.
- arginine amide-like compounds when arginine ethyl ester was added, the amount of aggregate increase was the smallest, followed by arginine amide.
- arginine ethyl ester had a significantly increased aggregate increase compared to the comparative sample, and arginine amide had a decreased aggregate increase compared to the comparative sample.
- arginine ethyl ester is most suitable when considering only light stability, but arginine amide also exhibits stability during storage, considering the results of thermal acceleration tests assuming stability during storage. It was found to be a stabilizer with improved light stability while keeping it.
- Example 3 Examination of stabilizing effect with different formulations A sample was prepared by dialyzing the above-mentioned Mab1 high-concentration stock solution to remove arginine, and then adding a pre-preparation solution having an appropriate composition. The concentration was adjusted to the concentration shown in Table 5, and the effect of stabilizing the preparation in a formulation different from Example 2 was examined. The thermal acceleration test was carried out by storing at 25 ° C. for 1 month, 2 months or 3 months, and at 40 ° C. for 2 weeks or 4 weeks, and the light irradiation test was carried out in the same manner as in Example 1. After each test, each sample was diluted to about 1.0 mg / mL with the mobile phase used in Example 1, and then size exclusion chromatography was performed under the same conditions as in Example 1 to obtain the respective contents (% ) Was calculated by the area percentage method.
- Tables 6 and 7 show the results of increase in aggregate (%) after storage at 25 ° C. for 2 months and after light irradiation in the new formulation. Further, FIG. 3 shows the results showing the change with time when stored at 25 ° C., and FIG. 4 and Table 8 show the results showing the change with time when stored at 40 ° C. In addition, in the case of storage at 40 ° C., it was impossible to measure the amount of aggregate due to the gelation phenomenon of the sample, so FIG. 4 is a graph excluding the data on arginine ethyl ester.
- Test method Using Mab2, the stability of the compound added to the basic formulation (Mab 2: 80 mg / mL, Tris 20 mM, Arginine 50 mM) was evaluated by a thermal acceleration test or a light irradiation test.
- a pre-preparation solution with an appropriate composition was added to Mab2 high-concentration stock solution (Mab2: 91 mg / mL, Tris 20 mM, arginine 55.8 mM, pH 7.0). It was carried out by adjusting so that the density shown in FIG.
- the thermal acceleration test and the light irradiation test were performed under the same conditions as in Example 3. After each test, size exclusion chromatography was performed under the same conditions as in Example 3, and each content (%) was calculated by the area percentage method.
- FIG. 5 and Table 10 show the results showing the time course of the aggregate amount when stored at 25 ° C.
- FIGS. 6 and 11 show the results showing the time course of the aggregate amount when stored at 40 ° C.
- 5 and 6 are graphs excluding arginine ethyl ester data.
- the thermal acceleration test at 25 ° C. it was found that there was almost no increase / decrease in aggregates in the formulation to which valine amide and arginine amide were added.
- the formulation to which arginine amide and valine amide were added had the smallest amount of aggregate increase.
- Arginine ethyl ester also had the smallest increase in aggregates after these.
- Example 5 Examination of stabilizing effect of additive with Mab3 Mab3 (tocilitumab) is expressed by a method known to those skilled in the art using a CHO cell stable expression strain and purified to a high purity by a method known to those skilled in the art. Then, the Mab3 high-concentration stock solution (Mab3: 248 mg / mL, histidine 7.7 mM, pH 6.3) was used for the stability test of the following Examples.
- Test method Using Mab 3, the stability of the compound added to the formulation without additives was evaluated by a thermal acceleration test or a light irradiation test. Sample preparation was performed by adding a pre-preparation solution having an appropriate composition to the Mab3 high-concentration stock solution and adjusting the concentration of each component to the concentration shown in Table 13. The thermal acceleration test and the light irradiation test were performed under the same conditions as in Example 3. After each test, size exclusion chromatography was performed under the same conditions as in Example 3, and each content (%) was calculated by the area percentage method.
- a protein-containing preparation having excellent stability is provided.
- a high-concentration antibody-containing preparation excellent in stability against light stress was provided.
- formation of aggregates due to light stress in a preparation in a solution state is suppressed, that is, a preparation containing a high concentration of antibody can be provided. Since the high-concentration antibody-containing preparation of the present invention is stable against light stress, it can be stored in a solution state for a long period of time. Stabilization against light stress has the advantage that less consideration of the light-shielding property of the container for storing the antibody preparation is required.
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Description
〔1〕 アルギニンアミドまたはバリンアミドを含むことを特徴とする、安定なタンパク質含有製剤。
〔2〕 アルギニンアミドまたはバリンアミドの濃度が50 mM~200 mMである、〔1〕に記載の製剤。
〔3〕 1~500 mMのヒスチジン緩衝液および/又はクエン酸緩衝液および1~250 mg/mLのタンパク質を含む、〔1〕または〔2〕に記載の製剤。
〔4〕 1~500 mMのヒスチジン緩衝液および/又はクエン酸緩衝液、1~1500 mMの少なくとも一つのアミノ酸、1~250 mg/mLのタンパク質を含む、〔1〕または〔2〕に記載の製剤。
〔5〕 1~50mMのトリス緩衝液、1~1500mMの少なくとも一つのアミノ酸、1~250 mg/mLのタンパク質を含む、〔1〕または〔2〕に記載の製剤。
〔6〕 溶液製剤である、〔1〕~〔5〕のいずれか一項に記載の製剤。
〔7〕 pHが5.0~7.0である、〔1〕~〔6〕のいずれか一項に記載の製剤。
〔8〕 タンパク質が抗体である、〔1〕~〔7〕のいずれか一項に記載の製剤。
〔9〕 タンパク質含有試料にアルギニンアミドまたはバリンアミドを添加することを特徴とする、タンパク質の会合化を抑制する方法。
〔10〕 タンパク質含有試料にアルギニンアミドまたはバリンアミドを添加することを特徴とする、タンパク質の不安定化を抑制する方法。
〔11〕 タンパク質が抗体である、〔9〕または〔10〕に記載の方法。
〔12〕 アルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを安定化剤として含むことを特徴とする、光ストレスに対して安定なタンパク質含有製剤。
〔13〕 安定化剤がアルギニンアミドであることを特徴とする、〔12〕に記載の製剤。
〔14〕 安定化剤がアルギニンエチルエステルであることを特徴とする、〔12〕に記載の製剤。
〔15〕 安定化剤がホモアルギニンであることを特徴とする、〔12〕に記載の製剤。
〔16〕 安定化剤がバリンアミドであることを特徴とする、〔12〕に記載の製剤。
〔17〕 安定化剤の濃度が50 mM~200 mMである、〔12〕~〔16〕のいずれか一項に記載の製剤。
〔18〕 1~500 mMのヒスチジン緩衝液および/又はクエン酸緩衝液、1~1500 mMの少なくとも一つのアミノ酸、1~250 mg/mLのタンパク質を含む、〔12〕~〔17〕のいずれか一項に記載の製剤。
〔19〕 溶液製剤である、〔12〕~〔18〕のいずれか一項に記載の製剤。
〔20〕 pHが5.0~7.0である、〔12〕~〔19〕のいずれか一項に記載の製剤。
〔21〕 タンパク質が抗体である、〔12〕~〔20〕のいずれか一項に記載の製剤。
〔22〕 アルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを有効成分とする、タンパク質の光ストレス安定化剤。
〔23〕 タンパク質が溶液中に含まれるタンパク質である、〔22〕に記載の薬剤。
〔24〕 タンパク質が抗体である、〔22〕または〔23〕に記載の薬剤。
〔25〕 タンパク質含有試料にアルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを添加することを特徴とする、光ストレスによるタンパク質の会合化を抑制する方法。
〔26〕 タンパク質含有試料にアルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを添加することを特徴とする、光ストレスによるタンパク質の不安定化を抑制する方法。
〔27〕 タンパク質が抗体である、〔25〕または〔26〕に記載の方法。
〔28〕 タンパク質溶液に対する、アルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つの、光ストレス安定化剤としての使用。
〔29〕 タンパク質含有試料にアルギニンアミドを添加する工程を含む、安定化したタンパク質含有製剤の製造方法。
即ち本発明は、アルギニンアミドを含有することを特徴とする、安定なタンパク質含有製剤を提供する。さらに、本発明は、タンパク質含有試料にアルギニンアミドを添加することを特徴とする、タンパク質の会合化を抑制する方法に関する。 さらに、本発明は、タンパク質含有試料にアルギニンアミドを添加することを特徴とする、タンパク質の不安定化を抑制する方法に関する。
本発明において安定であるとは、本発明の製剤が、長期保存、凍結融解、光ストレス、またはこれらに限らず何らかの原因で生じるタンパク質の会合体が生じにくい製剤であること、即ち保存中に不溶性及び可溶性会合体の生成を始めとする劣化反応が起こりにくい製剤であることを指す。
モノクローナル抗体を産生するハイブリドーマは、基本的には公知技術を使用し、以下のようにして作製できる。すなわち、所望の抗原や所望の抗原を発現する細胞を感作抗原として使用して、これを通常の免疫方法にしたがって免疫し、得られる免疫細胞を通常の細胞融合法によって公知の親細胞と融合させ、通常のスクリーニング法により、モノクローナルな抗体産生細胞(ハイブリドーマ)をスクリーニングすることによって作製できる。ハイブリドーマの作製は、たとえば、ミルステインらの方法(Kohler. G. and Milstein, C., Methods Enzymol. (1981) 73: 3-46 )等に準じて行うことができる。抗原の免疫原性が低い場合には、アルブミン等の免疫原性を有する巨大分子と結合させ、免疫を行えばよい。
キメラ抗体は、ヒト以外の哺乳動物、例えば、マウス抗体の重鎖、軽鎖の可変領域とヒト抗体の重鎖、軽鎖の定常領域からなる抗体であり、マウス抗体の可変領域をコードするDNAをヒト抗体の定常領域をコードするDNAと連結し、これを発現ベクターに組み込んで宿主に導入し産生させることにより得ることができる。
低分子化抗体としては、抗TPO受容体アゴニストDiabody(WO02/33072参照)、抗CD47アゴニストDiabody(WO01/66737参照)などが好ましい。
さらに、等電点が改良された抗体としては、例えば、WO 2009/041621に記載された抗IL-6レセプター抗体であるMab1(H鎖/配列番号:1、L鎖/配列番号:2)などがあげられる。
本発明の製剤に添加される界面活性剤の量は、一般に、0.0001~10%(w/v)であり、好ましくは0.001~5%、より好ましくは0.005~3%である。
本発明の製剤に対する糖類の添加量は、一般には1 mM~1000 mMであり、好ましくは5 mM~500 mMであり、さらに好ましくは10 mM~300 mMである。
抗体の作製方法:
WO2009/041621に記載された抗IL-6レセプター抗体であるMab1(H鎖/配列番号:1、L鎖/配列番号:2;等電点を5.8に改変した抗体)は、CHO細胞安定発現株を用いて当業者の公知の方法で発現し、protein Aを含む当業者公知の方法で高純度に精製し、下記の実施例の安定性試験に使用した。
Mab1を用い、基礎処方(Mab1:180mg/mL、ヒスチジン20mM、アルギニン100mM)に対して添加する化合物の安定性を、熱加速試験または光照射試験により評価した。サンプル調製は、Mab1高濃度原液(Mab1: 272 mg/mL、ヒスチジン 13.1 mM、アルギニン106.0 mg/mL)に対して、適切な組成の予調製液を添加し、各成分の濃度が表1に示す濃度となるように調整することにより行った。熱加速試験は、25℃で2ヶ月間保存することにより行った。光照射試験は、1000ルクスの光を7日間照射することにより行った。光照射後および25℃2か月保存後の各サンプルの会合体量は、サイズ排除クロマトグラフィー(SEC)を用い面積百分率法により算出した。会合体(%)の増加はMab1の安定性低下を示唆することから、各処方の安定性比較の指標として会合体増加量(%)を用いた。
サンプル調製は、前述のMab1高濃度原液を用いて、各成分の濃度が表1に示す濃度となるように調整することにより行った。
熱加速試験と光照射試験、それぞれの試験後にサイズ排除クロマトグラフィーを行った。各サンプルはそのままの濃度でG3000SWXL 7.8 mm I.D.×30 cmカラム(東ソー)を用いて分析した。移動相には300 mM NaCl を含む50 mM リン酸緩衝液(pH7.0)を用い、流速0.5 mL/minにて分析した(検出波長:280 nm)。単量体よりも早く溶出したピークを会合体、単量体よりも溶出が遅いピークを低分子分解物として解析し、それぞれの含量(%)を面積百分率法により算出した。
実施例1の結果を受けて、アルギニンアミドおよびその類似化合物の、タンパク質含有製剤における安定化効果を調べることにした。
サンプル調製は、前述のMab1高濃度原液を用いて、各成分の濃度が表2に示す濃度となるように調整することにより行った。熱加速試験と光照射試験、それぞれの試験後にサイズ排除クロマトグラフィーを行った。各サンプルを下記移動相により約1.0 mg/mLとなるように希釈し、これらをSWXL6.0 mmI.D.×4 cm(東ソー)ガードカラムおよびG3000SWXL 7.8 mm I.D.×30 cmカラム(東ソー)により分析した。移動相には300 mM NaCl および0.05%NaN3を含む50 mM リン酸緩衝液(pH7.0)を用い、流速0.5 mL/minにて分析した(検出波長:280 nm)。単量体よりも早く溶出したピークを会合体、単量体よりも溶出が遅いピークを低分子分解物として解析し、それぞれの含量(%)を面積百分率法により算出した。
サンプルは、前述のMab1高濃度原液に対して透析を行ってアルギニンを除去した後、適切な組成の予調製液を添加し、各成分の濃度が表5に示す濃度となるように調整し、実施例2とは異なる処方における製剤の安定化効果を調べた。熱加速試験は25℃で1ヶ月、2ヶ月または3ヵ月の保存、及び40℃で2週間又は4週間の保存をすることにより行い、光照射試験は実施例1と同様に行った。 それぞれの試験後に、各サンプルを実施例1で用いた移動相により約1.0 mg/mLとなるように希釈した後、サイズ排除クロマトグラフィーを実施例1と同様の条件で行い、それぞれの含量(%)を面積百分率法により算出した。
抗体クラスがIgG2である、アミノ酸配列を改変してpI値を5.6に低下させたNR10ヒト化抗体(WO2009/072604の実施例12に記載の方法で作製した、完全ヒト化NS22抗体)Mab2を、下記の実施例の安定性試験に使用した。
Mab2を用い、基礎処方(Mab2:80mg/mL、トリス20mM、アルギニン50mM)に対して添加する化合物の安定性を、熱加速試験または光照射試験により評価した。サンプル調製は、Mab2高濃度原液(Mab2: 91 mg/mL、トリス 20 mM、アルギニン55.8mM, pH7.0)に対して、適切な組成の予調製液を添加し、各成分の濃度が表9に示す濃度となるように調整することにより行った。熱加速試験、及び光照射試験は、実施例3と同様の条件で行った。それぞれの試験後にサイズ排除クロマトグラフィーを、実施例3と同様の条件で行い、それぞれの含量(%)を面積百分率法により算出した。
Mab3(トシリツマブ)は、CHO細胞安定発現株を用いて当業者の公知の方法で発現し、当業者公知の方法で高純度に精製した後にMab3高濃度原液(Mab3: 248 mg/mL、ヒスチジン 7.7 mM、pH6.3)の状態で保存していたものを下記の実施例の安定性試験に使用した。
Mab3を用い、添加剤なしの処方に対して添加する化合物の安定性を、熱加速試験または光照射試験により評価した。サンプル調製は、Mab3高濃度原液に対して、適切な組成の予調製液を添加し、各成分の濃度が表13に示す濃度となるように調整することにより行った。熱加速試験及び光照射試験は、実施例3と同様の条件で行った。それぞれの試験後にサイズ排除クロマトグラフィーを、実施例3と同様の条件で行い、それぞれの含量(%)を面積百分率法により算出した。
また本発明により、溶液状態の製剤における光ストレスによる会合体生成が抑制され、即ち高濃度の抗体を含む製剤を提供することが可能となった。本発明の高濃度抗体含有製剤は、光ストレスに対して安定であるので、溶液状態で安定して長期保存することが可能である。光ストレスに対して安定化できることは、抗体製剤を保存する容器の遮光性の考慮が少なくてよいというメリットがある。
Claims (29)
- アルギニンアミドまたはバリンアミドを含むことを特徴とする、安定なタンパク質含有製剤。
- アルギニンアミドまたはバリンアミドの濃度が50 mM~200 mMである、請求項1に記載の製剤。
- 1~500 mMのヒスチジン緩衝液および/又はクエン酸緩衝液および1~250 mg/mLのタンパク質を含む、請求項1または2に記載の製剤。
- 1~500 mMのヒスチジン緩衝液および/又はクエン酸緩衝液、1~1500 mMの少なくとも一つのアミノ酸、1~250 mg/mLのタンパク質を含む、請求項1または2に記載の製剤。
- 1~50mMの1~50mMのトリス緩衝液、1~1500mMの少なくとも一つのアミノ酸、1~250 mg/mLのタンパク質を含む、請求項1または2に記載の製剤。
- 溶液製剤である、請求項1~5のいずれか一項に記載の製剤。
- pHが5.0~7.0である、請求項1~6のいずれか一項に記載の製剤。
- タンパク質が抗体である、請求項1~7のいずれか一項に記載の製剤。
- タンパク質含有試料にアルギニンアミドまたはバリンアミドを添加することを特徴とする、タンパク質の会合化を抑制する方法。
- タンパク質含有試料にアルギニンアミドまたはバリンアミドを添加することを特徴とする、タンパク質の不安定化を抑制する方法。
- タンパク質が抗体である、請求項9または10に記載の方法。
- アルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを安定化剤として含むことを特徴とする、光ストレスに対して安定なタンパク質含有製剤。
- 安定化剤がアルギニンアミドであることを特徴とする、請求項12に記載の製剤。
- 安定化剤がアルギニンエチルエステルであることを特徴とする、請求項12に記載の製剤。
- 安定化剤がホモアルギニンであることを特徴とする、請求項12に記載の製剤。
- 安定化剤がバリンアミドであることを特徴とする、請求項12に記載の製剤。
- 安定化剤の濃度が50 mM~200 mMである、請求項12~16のいずれか一項に記載の製剤。
- 1~500 mMのヒスチジン緩衝液および/又はクエン酸緩衝液、1~1500 mMの少なくとも一つのアミノ酸、1~250 mg/mLのタンパク質を含む、請求項12~17のいずれか一項に記載の製剤。
- 溶液製剤である、請求項12~18のいずれか一項に記載の製剤。
- pHが5.0~7.0である、請求項12~19のいずれか一項に記載の製剤。
- タンパク質が抗体である、請求項12~20のいずれか一項に記載の製剤。
- アルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを有効成分とする、タンパク質の光ストレス安定化剤。
- タンパク質が溶液中に含まれるタンパク質である、請求項22に記載の薬剤。
- タンパク質が抗体である、請求項22または23に記載の薬剤。
- タンパク質含有試料にアルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを添加することを特徴とする、光ストレスによるタンパク質の会合化を抑制する方法。
- タンパク質含有試料にアルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つを添加することを特徴とする、光ストレスによるタンパク質の不安定化を抑制する方法。
- タンパク質が抗体である、請求項25または26に記載の方法。
- タンパク質溶液に対する、アルギニンアミド、アルギニンエチルエステル、ホモアルギニン、およびバリンアミドからなるグループより選択される少なくとも一つの、光ストレス安定化剤としての使用。
- タンパク質含有試料にアルギニンアミドを添加する工程を含む、安定化したタンパク質含有製剤の製造方法。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2013524738A JP6176849B2 (ja) | 2011-07-19 | 2012-07-19 | アルギニンアミドまたはその類似化合物を含む安定なタンパク質含有製剤 |
| US14/232,922 US9574005B2 (en) | 2011-07-19 | 2012-07-19 | Stable Protein-containing preparation containing argininamide or analogous compound thereof |
| EP12814155.3A EP2735315B1 (en) | 2011-07-19 | 2012-07-19 | Stable protein-containing preparation containing argininamide or valinamide |
| US15/400,355 US10898572B2 (en) | 2011-07-19 | 2017-01-06 | Stable protein-containing preparation containing argininamide or analogous compound thereof |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011157654 | 2011-07-19 | ||
| JP2011-157654 | 2011-07-19 |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US14/232,922 A-371-Of-International US9574005B2 (en) | 2011-07-19 | 2012-07-19 | Stable Protein-containing preparation containing argininamide or analogous compound thereof |
| US15/400,355 Division US10898572B2 (en) | 2011-07-19 | 2017-01-06 | Stable protein-containing preparation containing argininamide or analogous compound thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2013012022A1 true WO2013012022A1 (ja) | 2013-01-24 |
Family
ID=47558197
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2012/068276 WO2013012022A1 (ja) | 2011-07-19 | 2012-07-19 | アルギニンアミドまたはその類似化合物を含む安定なタンパク質含有製剤 |
Country Status (4)
| Country | Link |
|---|---|
| US (2) | US9574005B2 (ja) |
| EP (1) | EP2735315B1 (ja) |
| JP (2) | JP6176849B2 (ja) |
| WO (1) | WO2013012022A1 (ja) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015099165A1 (ja) * | 2013-12-27 | 2015-07-02 | 中外製薬株式会社 | 等電点の低い抗体の精製方法 |
| JP2017502922A (ja) * | 2013-10-29 | 2017-01-26 | アルブミディクス アクティーゼルスカブ | 抗体組成物 |
| WO2017057644A1 (ja) * | 2015-09-30 | 2017-04-06 | 持田製薬株式会社 | 高濃度抗体含有液体製剤 |
| JP2018154616A (ja) * | 2017-02-22 | 2018-10-04 | アムジエン・インコーポレーテツド | 低粘度、高濃度エボロクマブ製剤及びそれらの製造方法 |
| JP2020114819A (ja) * | 2014-05-16 | 2020-07-30 | グラクソスミスクライン、インテレクチュアル、プロパティー、マネジメント、リミテッドGlaxosmithkline Intellectual Property Management Limited | 抗体処方物 |
| JP6845973B1 (ja) * | 2019-11-20 | 2021-03-24 | 中外製薬株式会社 | 抗体含有製剤 |
| WO2023149512A1 (ja) * | 2022-02-03 | 2023-08-10 | 天野エンザイム株式会社 | 酵素製剤 |
| US11773173B2 (en) | 2015-04-14 | 2023-10-03 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6176849B2 (ja) | 2011-07-19 | 2017-08-09 | 中外製薬株式会社 | アルギニンアミドまたはその類似化合物を含む安定なタンパク質含有製剤 |
| EA202191513A1 (ru) | 2014-10-23 | 2021-11-30 | Эмджен Инк. | Снижение вязкости фармацевтических составов |
| AR104050A1 (es) * | 2015-03-26 | 2017-06-21 | Chugai Pharmaceutical Co Ltd | Proceso de producción con iones de cobre controlados |
| US11845798B2 (en) | 2017-05-02 | 2023-12-19 | Merck Sharp & Dohme Llc | Formulations of anti-LAG3 antibodies and co-formulations of anti-LAG3 antibodies and anti-PD-1 antibodies |
| JOP20190260A1 (ar) | 2017-05-02 | 2019-10-31 | Merck Sharp & Dohme | صيغ ثابتة لأجسام مضادة لمستقبل الموت المبرمج 1 (pd-1) وطرق استخدامها |
| WO2019217927A1 (en) | 2018-05-10 | 2019-11-14 | Regeneron Pharmaceuticals, Inc. | High concentration vegf receptor fusion protein containing formulations |
| US20200369760A1 (en) * | 2019-05-24 | 2020-11-26 | Regeneron Pharmaceuticals, Inc. | Stabilized formulations containing anti-angptl3 antibodies |
| EP3763356A1 (en) * | 2019-07-12 | 2021-01-13 | Ludwig-Maximilians-Universität München | Excipient for biotherapeutics |
Citations (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0239400A2 (en) | 1986-03-27 | 1987-09-30 | Medical Research Council | Recombinant antibodies and methods for their production |
| JPH0159878B2 (ja) | 1982-05-21 | 1989-12-20 | Yunibaashitei Obu Karifuorunia | |
| WO1992001047A1 (en) | 1990-07-10 | 1992-01-23 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| WO1992003918A1 (en) | 1990-08-29 | 1992-03-19 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| WO1992019759A1 (en) | 1991-04-25 | 1992-11-12 | Chugai Seiyaku Kabushiki Kaisha | Reconstituted human antibody against human interleukin 6 receptor |
| WO1992020791A1 (en) | 1990-07-10 | 1992-11-26 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| WO1993006213A1 (en) | 1991-09-23 | 1993-04-01 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| WO1993011236A1 (en) | 1991-12-02 | 1993-06-10 | Medical Research Council | Production of anti-self antibodies from antibody segment repertoires and displayed on phage |
| WO1993012227A1 (en) | 1991-12-17 | 1993-06-24 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| WO1993019172A1 (en) | 1992-03-24 | 1993-09-30 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| WO1994002602A1 (en) | 1992-07-24 | 1994-02-03 | Cell Genesys, Inc. | Generation of xenogeneic antibodies |
| WO1994025585A1 (en) | 1993-04-26 | 1994-11-10 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| WO1995001438A1 (en) | 1993-06-30 | 1995-01-12 | Medical Research Council | Sbp members with a chemical moiety covalently bound within the binding site; production and selection thereof |
| WO1995015388A1 (en) | 1993-12-03 | 1995-06-08 | Medical Research Council | Recombinant binding proteins and peptides |
| WO1996002576A1 (fr) | 1994-07-13 | 1996-02-01 | Chugai Seiyaku Kabushiki Kaisha | Anticorps humain reconstitue contre l'interleukine-8 humaine |
| WO1996033735A1 (en) | 1995-04-27 | 1996-10-31 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| WO1996034096A1 (en) | 1995-04-28 | 1996-10-31 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| WO1997004801A1 (en) | 1995-07-27 | 1997-02-13 | Genentech, Inc. | Stabile isotonic lyophilized protein formulation |
| WO1998013388A1 (fr) | 1996-09-26 | 1998-04-02 | Chugai Seiyaku Kabushiki Kaisha | Anticorps contre les peptides lies a la parathormone humaine |
| WO1998014580A1 (fr) | 1996-10-04 | 1998-04-09 | Chugai Seiyaku Kabushiki Kaisha | Anticorps anti-hm1.24 humain reconstitue |
| WO1999051743A1 (fr) | 1998-04-03 | 1999-10-14 | Chugai Seiyaku Kabushiki Kaisha | Anticorps humanise contre le facteur tissulaire humain (tf) et procede de production d'anticorps humanises |
| WO2001066737A1 (fr) | 2000-03-10 | 2001-09-13 | Chugai Seiyaku Kabushiki Kaisha | Polypeptide provoquant l'apoptose |
| WO2002033072A1 (en) | 2000-10-20 | 2002-04-25 | Chugai Seiyaku Kabushiki Kaisha | Degraded tpo agonist antibody |
| WO2003068260A1 (en) * | 2002-02-14 | 2003-08-21 | Chugai Seiyaku Kabushiki Kaisha | Antibody-containing solution pharmaceuticals |
| JP2004091469A (ja) | 2002-07-11 | 2004-03-25 | Asahi Kasei Pharma Kk | 光に安定なカルシトニン水溶液 |
| WO2005005636A1 (ja) | 2003-07-15 | 2005-01-20 | Chugai Seiyaku Kabushiki Kaisha | 形質転換細胞によるIgMの産生とその定量方法 |
| WO2006065746A2 (en) | 2004-12-16 | 2006-06-22 | Genentech, Inc. | Methods of treating ige-mediated disorders comprising the administration of high concentration anti-ige antibody formulations |
| JP3976257B2 (ja) | 2002-09-17 | 2007-09-12 | 栄研化学株式会社 | 蛋白質の安定化方法 |
| WO2007114319A1 (ja) | 2006-03-31 | 2007-10-11 | Chugai Seiyaku Kabushiki Kaisha | 抗体の血中動態を制御する方法 |
| JP2007332093A (ja) | 2006-06-16 | 2007-12-27 | Apro Life Science Institute Inc | タンパク質のリフォールディング添加剤及びそれを用いたタンパク質の再生方法 |
| JP2009002709A (ja) * | 2007-06-19 | 2009-01-08 | Univ Of Tsukuba | 蛋白質を含む液状組成物中における蛋白質の安定化方法 |
| WO2009041613A1 (ja) | 2007-09-26 | 2009-04-02 | Chugai Seiyaku Kabushiki Kaisha | 抗体定常領域改変体 |
| WO2009041621A1 (ja) | 2007-09-26 | 2009-04-02 | Chugai Seiyaku Kabushiki Kaisha | 抗il-6レセプター抗体 |
| WO2009072604A1 (ja) | 2007-12-05 | 2009-06-11 | Chugai Seiyaku Kabushiki Kaisha | 抗nr10抗体、およびその利用 |
| WO2009084659A1 (ja) | 2007-12-27 | 2009-07-09 | Chugai Seiyaku Kabushiki Kaisha | 高濃度抗体含有溶液製剤 |
| JP2009525986A (ja) * | 2006-02-03 | 2009-07-16 | メディミューン,エルエルシー | タンパク質製剤 |
| WO2011090088A1 (ja) * | 2010-01-20 | 2011-07-28 | 中外製薬株式会社 | 安定化抗体含有溶液製剤 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6013718A (ja) | 1983-07-05 | 1985-01-24 | Chemo Sero Therapeut Res Inst | B型肝炎ワクチン |
| JPS60193925A (ja) | 1984-03-13 | 1985-10-02 | Chemo Sero Therapeut Res Inst | 凍結乾燥製剤化ワクチン |
| US4597966A (en) | 1985-01-09 | 1986-07-01 | Ortho Diagnostic Systems, Inc. | Histidine stabilized immunoglobulin and method of preparation |
| JP2942412B2 (ja) | 1991-12-26 | 1999-08-30 | 鐘紡株式会社 | 化粧料 |
| PT1314437E (pt) | 2000-08-11 | 2014-08-29 | Chugai Pharmaceutical Co Ltd | Preparações estabilizadas contendo anticorpo |
| US20040156835A1 (en) | 2001-05-30 | 2004-08-12 | Taiji Imoto | Protein preparation |
| AU2006256041B2 (en) * | 2005-06-10 | 2012-03-29 | Chugai Seiyaku Kabushiki Kaisha | Stabilizer for protein preparation comprising meglumine and use thereof |
| US7390786B2 (en) | 2005-12-21 | 2008-06-24 | Wyeth | Protein formulations with reduced viscosity and uses thereof |
| PE20081610A1 (es) | 2007-01-09 | 2008-12-09 | Wyeth Corp | Formulaciones de anticuerpos anti-il-13 y usos de los mismos |
| EP2068923A4 (en) * | 2007-03-30 | 2010-11-24 | Medimmune Llc | ANTIBODIES HAVING REDUCED DEAMIDATION PROFILES |
| WO2009104369A1 (ja) | 2008-02-22 | 2009-08-27 | パナソニック株式会社 | 血漿に含まれる成分の検出方法ならびにそれに用いられる試薬および検出デバイス |
| JP2013525484A (ja) | 2010-05-03 | 2013-06-20 | ジェネンテック, インコーポレイテッド | タンパク質含有製剤の粘度を低減させるために有用な組成物及び方法 |
| JP6176849B2 (ja) | 2011-07-19 | 2017-08-09 | 中外製薬株式会社 | アルギニンアミドまたはその類似化合物を含む安定なタンパク質含有製剤 |
-
2012
- 2012-07-19 JP JP2013524738A patent/JP6176849B2/ja active Active
- 2012-07-19 EP EP12814155.3A patent/EP2735315B1/en active Active
- 2012-07-19 WO PCT/JP2012/068276 patent/WO2013012022A1/ja active Application Filing
- 2012-07-19 US US14/232,922 patent/US9574005B2/en active Active
-
2017
- 2017-01-06 US US15/400,355 patent/US10898572B2/en active Active
- 2017-06-13 JP JP2017115935A patent/JP6469765B2/ja active Active
Patent Citations (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0159878B2 (ja) | 1982-05-21 | 1989-12-20 | Yunibaashitei Obu Karifuorunia | |
| EP0239400A2 (en) | 1986-03-27 | 1987-09-30 | Medical Research Council | Recombinant antibodies and methods for their production |
| WO1992001047A1 (en) | 1990-07-10 | 1992-01-23 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| WO1992020791A1 (en) | 1990-07-10 | 1992-11-26 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| WO1992003918A1 (en) | 1990-08-29 | 1992-03-19 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| WO1992019759A1 (en) | 1991-04-25 | 1992-11-12 | Chugai Seiyaku Kabushiki Kaisha | Reconstituted human antibody against human interleukin 6 receptor |
| WO1993006213A1 (en) | 1991-09-23 | 1993-04-01 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| WO1993011236A1 (en) | 1991-12-02 | 1993-06-10 | Medical Research Council | Production of anti-self antibodies from antibody segment repertoires and displayed on phage |
| WO1993012227A1 (en) | 1991-12-17 | 1993-06-24 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| WO1993019172A1 (en) | 1992-03-24 | 1993-09-30 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| WO1994002602A1 (en) | 1992-07-24 | 1994-02-03 | Cell Genesys, Inc. | Generation of xenogeneic antibodies |
| WO1994025585A1 (en) | 1993-04-26 | 1994-11-10 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| WO1995001438A1 (en) | 1993-06-30 | 1995-01-12 | Medical Research Council | Sbp members with a chemical moiety covalently bound within the binding site; production and selection thereof |
| WO1995015388A1 (en) | 1993-12-03 | 1995-06-08 | Medical Research Council | Recombinant binding proteins and peptides |
| WO1996002576A1 (fr) | 1994-07-13 | 1996-02-01 | Chugai Seiyaku Kabushiki Kaisha | Anticorps humain reconstitue contre l'interleukine-8 humaine |
| WO1996033735A1 (en) | 1995-04-27 | 1996-10-31 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| WO1996034096A1 (en) | 1995-04-28 | 1996-10-31 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| WO1997004801A1 (en) | 1995-07-27 | 1997-02-13 | Genentech, Inc. | Stabile isotonic lyophilized protein formulation |
| WO1998013388A1 (fr) | 1996-09-26 | 1998-04-02 | Chugai Seiyaku Kabushiki Kaisha | Anticorps contre les peptides lies a la parathormone humaine |
| WO1998014580A1 (fr) | 1996-10-04 | 1998-04-09 | Chugai Seiyaku Kabushiki Kaisha | Anticorps anti-hm1.24 humain reconstitue |
| WO1999051743A1 (fr) | 1998-04-03 | 1999-10-14 | Chugai Seiyaku Kabushiki Kaisha | Anticorps humanise contre le facteur tissulaire humain (tf) et procede de production d'anticorps humanises |
| WO2001066737A1 (fr) | 2000-03-10 | 2001-09-13 | Chugai Seiyaku Kabushiki Kaisha | Polypeptide provoquant l'apoptose |
| WO2002033072A1 (en) | 2000-10-20 | 2002-04-25 | Chugai Seiyaku Kabushiki Kaisha | Degraded tpo agonist antibody |
| WO2003068260A1 (en) * | 2002-02-14 | 2003-08-21 | Chugai Seiyaku Kabushiki Kaisha | Antibody-containing solution pharmaceuticals |
| JP2004091469A (ja) | 2002-07-11 | 2004-03-25 | Asahi Kasei Pharma Kk | 光に安定なカルシトニン水溶液 |
| JP3976257B2 (ja) | 2002-09-17 | 2007-09-12 | 栄研化学株式会社 | 蛋白質の安定化方法 |
| WO2005005636A1 (ja) | 2003-07-15 | 2005-01-20 | Chugai Seiyaku Kabushiki Kaisha | 形質転換細胞によるIgMの産生とその定量方法 |
| WO2006065746A2 (en) | 2004-12-16 | 2006-06-22 | Genentech, Inc. | Methods of treating ige-mediated disorders comprising the administration of high concentration anti-ige antibody formulations |
| JP2009525986A (ja) * | 2006-02-03 | 2009-07-16 | メディミューン,エルエルシー | タンパク質製剤 |
| WO2007114319A1 (ja) | 2006-03-31 | 2007-10-11 | Chugai Seiyaku Kabushiki Kaisha | 抗体の血中動態を制御する方法 |
| JP2007332093A (ja) | 2006-06-16 | 2007-12-27 | Apro Life Science Institute Inc | タンパク質のリフォールディング添加剤及びそれを用いたタンパク質の再生方法 |
| JP2009002709A (ja) * | 2007-06-19 | 2009-01-08 | Univ Of Tsukuba | 蛋白質を含む液状組成物中における蛋白質の安定化方法 |
| WO2009041613A1 (ja) | 2007-09-26 | 2009-04-02 | Chugai Seiyaku Kabushiki Kaisha | 抗体定常領域改変体 |
| WO2009041621A1 (ja) | 2007-09-26 | 2009-04-02 | Chugai Seiyaku Kabushiki Kaisha | 抗il-6レセプター抗体 |
| WO2009072604A1 (ja) | 2007-12-05 | 2009-06-11 | Chugai Seiyaku Kabushiki Kaisha | 抗nr10抗体、およびその利用 |
| WO2009084659A1 (ja) | 2007-12-27 | 2009-07-09 | Chugai Seiyaku Kabushiki Kaisha | 高濃度抗体含有溶液製剤 |
| WO2011090088A1 (ja) * | 2010-01-20 | 2011-07-28 | 中外製薬株式会社 | 安定化抗体含有溶液製剤 |
Non-Patent Citations (28)
| Title |
|---|
| ANN L. DAUGHERTY; RANDALL J. MRSNY: "Formulation and delivery issues for monoclonal antibody therapeutics", ADV DRUG DEL REV, vol. 58, no. 5-6, 2006, pages 686 - 706 |
| BETTER, M.; HORWITZ, A. H., METHODS ENZYMOL., vol. 178, 1989, pages 476 - 496 |
| BIRD, R. E.; WALKER, B. W., TRENDS BIOTECHNOL., vol. 9, 1991, pages 132 - 137 |
| CANCER J., vol. 14, no. 3, May 2008 (2008-05-01), pages 154 - 69 |
| CARL, A.; K. BORREBAECK; JAMES, W. LARRICK: "Therapeutic Monoclonal Antibodies", 1990, UNITED KINGDOM BY MACMILLAN PUBLISHERS |
| CO, M. S. ET AL., J. IMMUNOL., vol. 152, 1994, pages 2968 - 2976 |
| DAISUKE KAMEOKA ET AL.: "Hitogata-ka Kotai Yoeki no Rekka Gensho ni Oyobosu Yoeki pH no Eikyo", JOURNAL OF JAPANESE BIOCHEMICAL SOCIETY, vol. 73, no. 8, 2001, pages 947, XP008173241 * |
| DAISUKE KAMEOKA ET AL.: "Seiri Kassei o Yusuru Hitogata-ka Kotai no Netsu Hensei Gensho ni Kansuru Kento (1st Report, Neteu Hensei Chukantai no Bussei Hyoka)", ABSTRACTS OF ANNUAL MEETING OF PHARMACEUTICAL SOCIETY OF JAPAN, vol. 121, no. 4, 2001, pages 16, XP008172961 * |
| EWERT S; HONEGGER A; PLUCKTHUN A: "Stability improvement of antibodies for extracellular and intracellular applications: CDR grafting to stable frameworks and structure-based framework engineering.", METHODS, vol. 34, no. 2, October 2004 (2004-10-01), pages 184 - 99 |
| FARMACO, vol. 54, no. 8, 30 August 1999 (1999-08-30), pages 497 - 516 |
| GHETIE V; POPOV S; BORVAK J; RADU C; MATESOI D; MEDESAN C; OBER RJ; WARD ES: "Increasing the serum persistence of an IgG fragment by random mutagenesis", NAT BIOTECHNOL., vol. 15, no. 7, July 1997 (1997-07-01), pages 637 - 40 |
| HAMADA H ET AL.: "L-argininamide improves the refolding more effectively than L-arginine.", J BIOTECHNOL., vol. 130, no. 2, 2007, pages 153 - 160, XP025317923 * |
| HINTON PR; XIONG JM; JOHLFS MG; TANG MT; KELLER S; TSURUSHITA N: "An engineered human IgG antibody with longer serum half-life", J IMMUNOL., vol. 176, no. 1, 1 January 2006 (2006-01-01), pages 346 - 56 |
| HIROYUKI HAMADA; KENTARO SHIRAKI: "L-Argininamide improves the refolding more effectively than L-arginine", J. BIOTECHNOLOGY, vol. 130, 2007, pages 153 - 160 |
| HUSTON, J. S. ET AL., PROC. NATL. ACAD. SCI. U.S.A., vol. 85, 1988, pages 5879 - 5883 |
| KIM SJ; PARK Y; HONG HJ.: "Antibody engineering for the development of therapeutic antibodies", MOL CELLS., vol. 20, no. 1, 31 August 2005 (2005-08-31), pages 17 - 29 |
| KOHLER, G.; MILSTEIN, C., METHODS ENZYMOL., vol. 73, 1981, pages 3 - 46 |
| LAMOYI, E., METHODS ENZYMOL., vol. 121, 1986, pages 652 - 663 |
| PLUCKTHUN, A.; SKERRA, A., METHODS ENZYMOL., vol. 178, 1989, pages 497 - 515 |
| RAJPAL A; BEYAZ N; HABER L; CAPPUCCILLI G; YEE H; BHATT RR; TAKEUCHI T; LERNER RA; CREA R.: "A general method for greatly improving the affinity of antibodies by using combinatorial libraries.", PROC NATL ACAD SCI U S A., vol. 102, no. 24, 14 June 2005 (2005-06-14), pages 8466 - 71 |
| ROUSSEAUX, J. ET AL., METHODS ENZYMOL., vol. 121, 1986, pages 663 - 669 |
| SATO, K. ET AL., CANCER RES., vol. 53, 1993, pages 851 - 856 |
| See also references of EP2735315A4 * |
| SHIRE J SHIRE., CURR OPIN BIOTECHNOL., vol. 20, no. 6, 31 October 2009 (2009-10-31), pages 708 - 14 |
| STEVEN J SHIRE ET AL.: "Challenges in the development of high protein concentration formulations", J PHARM SCI, vol. 93, no. 6, 2004, pages 1390 - 1402 |
| TSUNEYOSHI MATSUOKA ET AL.: "Amidated Amino Acids Are Prominent Additives for Preventing Heat-Induced Aggregation of Lysozyme", J. BIOSCI BIOENG, vol. 103, no. 5, 2007, pages 440 - 443 |
| TSURUSHITA N; HINTON PR; KUMAR S: "Design of humanized antibodies: from anti-Tac to Zenapax.", METHODS, vol. 36, no. 1, May 2005 (2005-05-01), pages 69 - 83 |
| WEI WANG ET AL.: "Antibody structure, instability, and formulation", J PHARM SCI, vol. 96, no. 1, 2007, pages 1 - 26 |
Cited By (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017502922A (ja) * | 2013-10-29 | 2017-01-26 | アルブミディクス アクティーゼルスカブ | 抗体組成物 |
| CN106029682A (zh) * | 2013-12-27 | 2016-10-12 | 中外制药株式会社 | 等电点低的抗体的纯化方法 |
| JPWO2015099165A1 (ja) * | 2013-12-27 | 2017-03-23 | 中外製薬株式会社 | 等電点の低い抗体の精製方法 |
| WO2015099165A1 (ja) * | 2013-12-27 | 2015-07-02 | 中外製薬株式会社 | 等電点の低い抗体の精製方法 |
| EP3088411A4 (en) * | 2013-12-27 | 2018-12-19 | Chugai Seiyaku Kabushiki Kaisha | Method for purifying antibody having low isoelectric point |
| US10654933B2 (en) | 2013-12-27 | 2020-05-19 | Chugai Seiyaku Kabushiki Kaisha | Method for purifying antibody having low isoelectric point |
| TWI715524B (zh) * | 2013-12-27 | 2021-01-11 | 日商中外製藥股份有限公司 | 等電點低之抗體的精製方法 |
| JP7277681B2 (ja) | 2014-05-16 | 2023-05-19 | グラクソスミスクライン、インテレクチュアル、プロパティー、マネジメント、リミテッド | 抗体処方物 |
| JP2020114819A (ja) * | 2014-05-16 | 2020-07-30 | グラクソスミスクライン、インテレクチュアル、プロパティー、マネジメント、リミテッドGlaxosmithkline Intellectual Property Management Limited | 抗体処方物 |
| US11773173B2 (en) | 2015-04-14 | 2023-10-03 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| WO2017057644A1 (ja) * | 2015-09-30 | 2017-04-06 | 持田製薬株式会社 | 高濃度抗体含有液体製剤 |
| JP2018154616A (ja) * | 2017-02-22 | 2018-10-04 | アムジエン・インコーポレーテツド | 低粘度、高濃度エボロクマブ製剤及びそれらの製造方法 |
| JP7377596B2 (ja) | 2017-02-22 | 2023-11-10 | アムジエン・インコーポレーテツド | 低粘度、高濃度エボロクマブ製剤及びそれらの製造方法 |
| JP2021091704A (ja) * | 2019-11-20 | 2021-06-17 | 中外製薬株式会社 | 抗体含有製剤 |
| JP2021169448A (ja) * | 2019-11-20 | 2021-10-28 | 中外製薬株式会社 | 抗体含有製剤 |
| US11260125B2 (en) | 2019-11-20 | 2022-03-01 | Chugai Seiyaku Kabushiki Kaisha | Anti-IL31RA antibody-containing formulations |
| WO2021100794A1 (ja) * | 2019-11-20 | 2021-05-27 | 中外製薬株式会社 | 抗体含有製剤 |
| US11723976B2 (en) | 2019-11-20 | 2023-08-15 | Chugai Seiyaku Kabushiki Kaisha | Methods of administering anti-IL31A antibody-containing formulations |
| JP6845973B1 (ja) * | 2019-11-20 | 2021-03-24 | 中外製薬株式会社 | 抗体含有製剤 |
| WO2023149512A1 (ja) * | 2022-02-03 | 2023-08-10 | 天野エンザイム株式会社 | 酵素製剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2735315A1 (en) | 2014-05-28 |
| EP2735315B1 (en) | 2019-10-02 |
| JPWO2013012022A1 (ja) | 2015-02-23 |
| US10898572B2 (en) | 2021-01-26 |
| JP6469765B2 (ja) | 2019-02-13 |
| US20140206845A1 (en) | 2014-07-24 |
| JP2017222654A (ja) | 2017-12-21 |
| US9574005B2 (en) | 2017-02-21 |
| EP2735315A4 (en) | 2014-12-24 |
| US20170112930A1 (en) | 2017-04-27 |
| JP6176849B2 (ja) | 2017-08-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6469765B2 (ja) | アルギニンアミドまたはその類似化合物を含む安定なタンパク質含有製剤 | |
| US20230277442A1 (en) | Solution preparation containing stabilized antibody | |
| JP6567024B2 (ja) | 高濃度抗体含有溶液製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12814155 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2013524738 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2012814155 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 14232922 Country of ref document: US |