WO2009021663A1 - Dotiertes halbleitermaterial und dessen verwendung - Google Patents
Dotiertes halbleitermaterial und dessen verwendung Download PDFInfo
- Publication number
- WO2009021663A1 WO2009021663A1 PCT/EP2008/006465 EP2008006465W WO2009021663A1 WO 2009021663 A1 WO2009021663 A1 WO 2009021663A1 EP 2008006465 W EP2008006465 W EP 2008006465W WO 2009021663 A1 WO2009021663 A1 WO 2009021663A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- semiconductor material
- doped semiconductor
- material according
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
- 0 *c1cc(*)c(*)c(*)c1* Chemical compound *c1cc(*)c(*)c(*)c1* 0.000 description 2
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K71/00—Manufacture or treatment specially adapted for the organic devices covered by this subclass
- H10K71/30—Doping active layers, e.g. electron transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/311—Phthalocyanine
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1022—Heterocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1074—Heterocyclic compounds characterised by ligands containing more than three nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/18—Metal complexes
- C09K2211/188—Metal complexes of other metals not provided for in one of the previous groups
Definitions
- the invention relates to a doped semiconductor material with increased charge carrier density and charge carrier mobility, which is at least one semiconductive one
- the dopant is selected from the group consisting of nitrogen-containing macrocycles and polycyclic aromatic hydrocarbons and their oligomers.
- the dopants serve both to increase or regulate the conductivity of the semiconductive matrix material and to increase the stability to damage to the layer.
- OLED organic light-emitting diodes
- matrix materials such as ⁇ -NPB (N, N '- (naphthyl-lyl) -N, IST-diphenyl-benzidine) or 9, 9 ⁇ -spirobi [9H-fluoro rene] -2, 2 v , 7, 7 '- tetraamine.
- ⁇ -NPB N, N '- (naphthyl-lyl) -N, IST-diphenyl-benzidine
- 9 ⁇ -spirobi [9H-fluoro rene] -2, 2 v , 7, 7 '- tetraamine Through the use of a dopant, which is able to generate charge carriers in the matrix due to its molecular orbitals, the conductivity of the matrix can be clearly increased by several powers of ten. This reduces the required operating voltage and the efficiency of the device increases. The doping further reduces the requirement for the electrode with respect to the work function.
- the LUMO (lowest unoccupied molecular orbital) of the dopant should be lower in energy than the HOMO (highest occupied molecular orbital) of the matrix.
- a doping effect at the same energy or slightly higher energy can also occur, since at low energy differences already the ambient or operating temperature is sufficient to overcome the energy barrier.
- n-doping an electron from the HOMO of the dopant is transferred into the LUMO of the matrix.
- the LUMO of the matrix should be lower in energy than the dopant's HOMO.
- a doping effect is possible with the same energy or slightly higher energy, since even here with low energy differences, the ambient or operating temperature is already sufficient to overcome the energy barrier.
- a matrix is n- or p-dopable is due, among other things, to the energetic layers of the molecular orbitals of the matrix and the dopant. Another reason may be steric hindrance.
- organic dopants u.a. from DE 10 2004 010 954 A1, EP 1 596 445 A1, EP 1 538 684 A1, WO 2005/086251 A2 and WO 2003/070822 A2.
- a doped semiconductor material with increased charge carrier density and charge carrier mobility which contains a semiconducting matrix material and at least one dopant. It is essential that the dopant is selected from the group consisting of nitrogen-containing macrocycles and polycyclic aromatic hydrocarbons and their oligomers.
- the evaporation temperatures should be similar. For very different evaporation temperatures, the
- Molecules should be present as individually as possible in the matrix and should not form larger clusters.
- the evaporation temperature of the doping molecules could be significantly increased.
- the evaporation temperature in a high vacuum is considerably above 200 0 C.
- the molecular nature of the Dotand- could be detected layer, the solution is similar to the spectrum.
- a strong broadening of the absorption bands can be expected, as can be observed with crystalline zinc (II) phthalocyanine layers.
- the introduction of bulky substituents also reduced the diffusion / migration of the dopant.
- targeted modification of the described molecules an adaptation of the molecular orbital energy levels and the respective matrix material is possible.
- Another advantage, especially phthalocyanines, is protection against sputter damage.
- this is an advantage because less material is needed.
- the risk of contamination is reduced and it comes through the elimination of an additional source of evaporation to reduce costs for the manufacturing process.
- the nitrogen-containing macrocycle is based on a tetrapyrrole skeleton, which may also be preferably a tetrapyrrole-metal complex.
- the central atom M of the tetrapyrrole-metal complexes is preferably selected from the group consisting of 2H, 2Li, Cu, Zn, Co, Ni, Fe, V, U, B, Li, Si 7 Cr, Mn, Ti, Ga, Ge , Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os and.
- the central atoms can thereby also * may be satisfied by other ligands or in the form of compounds such as oxides or hydroxides are present.
- the nitrogen-containing macrocycle is preferably selected from the group of phthalocyanines, in particular naphthalocyanines, subphthalocyanines, perphthalocyanines and mixtures thereof.
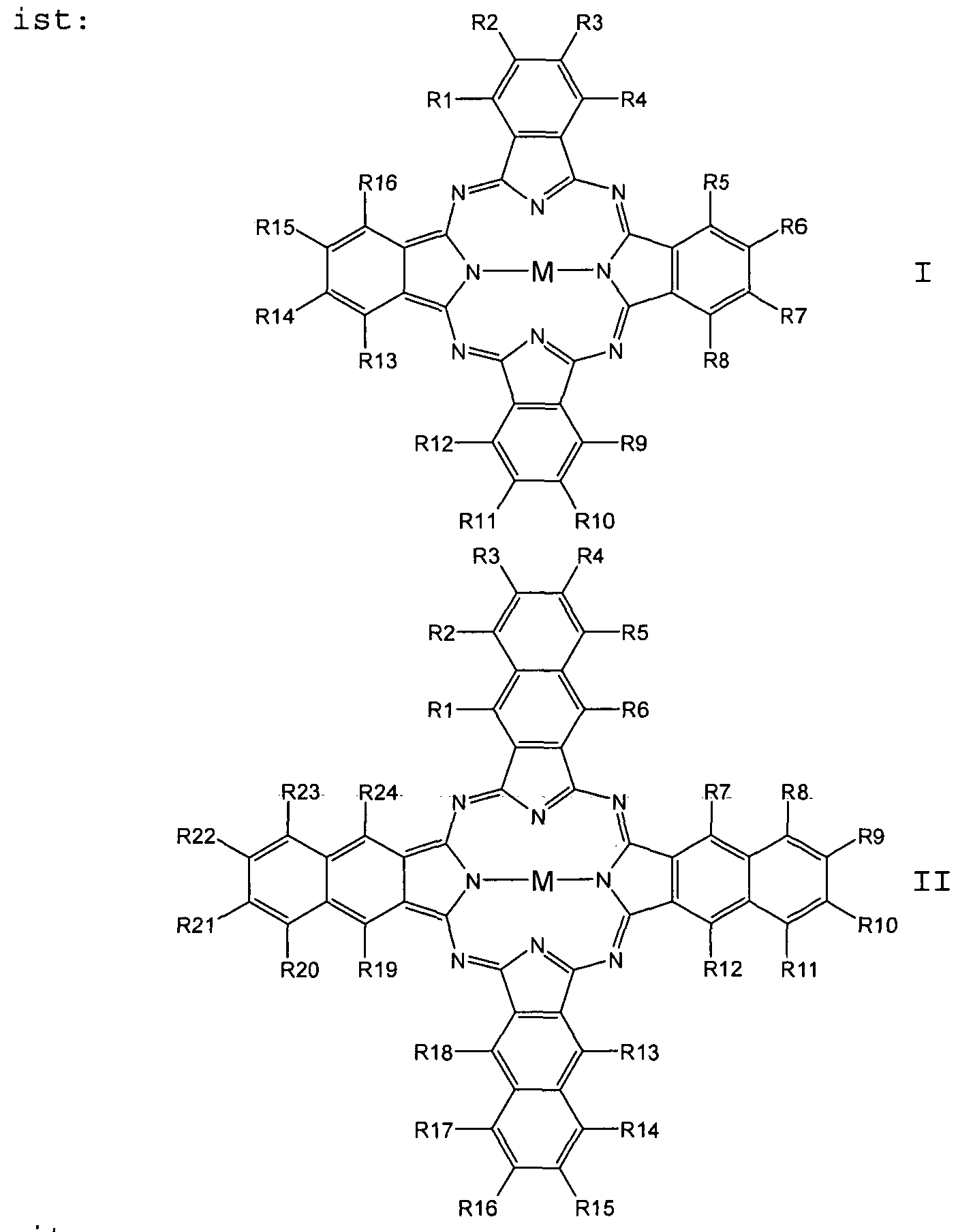
- the phthalocyanine is a compound of general formula I and the naphthalocyanine is a compound of general formula II:
- X S, O, NR
- the radicals R are each independently selected from the group consisting of H, F, Cl, Br, I, NH 2 , OH, SH, NO 2 , CN, CH 3 , OCH 3 , N (CH 3 ) 2 , CF 3 , C (CF 3 ) 3 , C (CH 3 J 3 , C 2 H 5 , phenyl, O-phenyl,
- M is selected from the group consisting of 2H, 2Li,
- Another preferred phthalocyanine has the formula III:
- a further preferred variant provides that the at least one nitrogen-containing macrocycle is selected from the group of porphyrins, in particular tetraphenylporphyrins, tetrabenzporphyrins, tetraphenyl-tetrabenzporphyrins and mixtures thereof.
- the porphyrin is selected from the group of compounds of general formulas IV to VI:
- X S, O, NR
- M is selected from the group consisting of 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si (OH) 2, Cr 7 of Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au , Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os and As.
- Another preferred compound for a nitrogen-containing macrocycle is the general formula VII.
- X S, O, NR
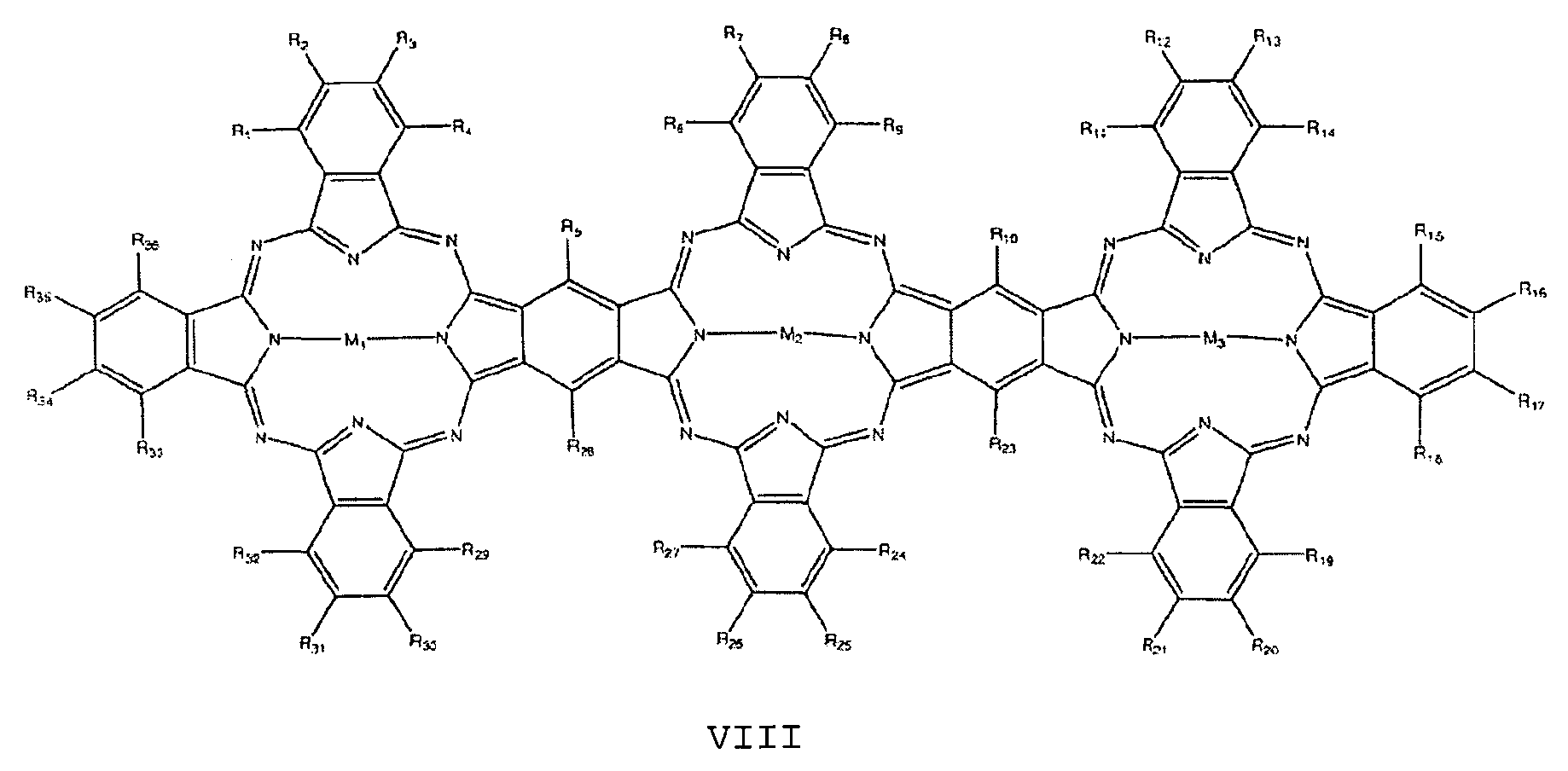
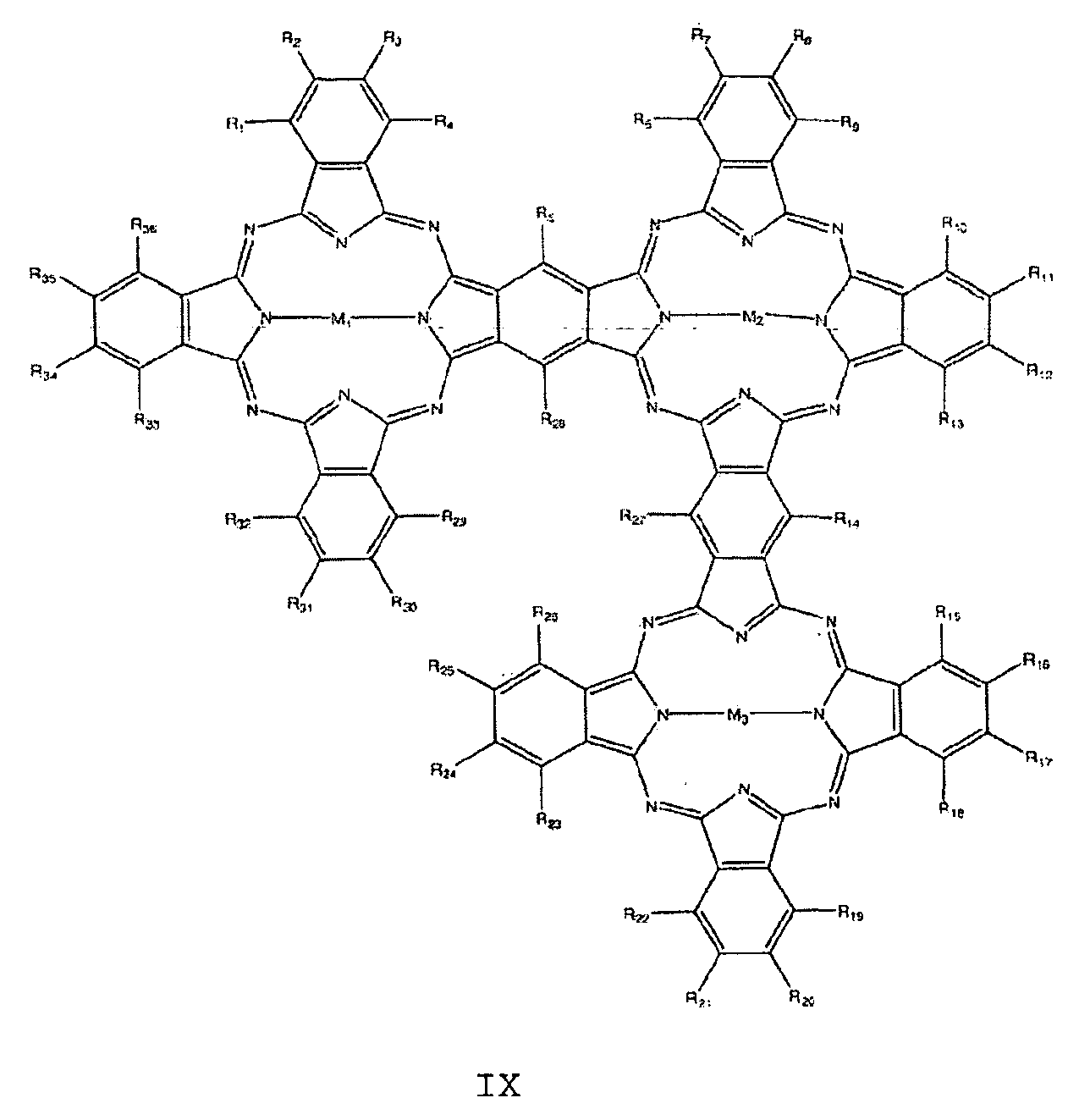
- the at least one nitrogen-containing macrocycle is furthermore preferably selected from the group of compounds having the general formulas VIII to X:
- R 1 to R 40 are independently H, F, Cl, Br, I, OR, SR, SO 2 , SO 3 , CN, NRR, NO, NO 2 , C n (RR) 2n + 1 , C 1 -C 18 alkyl , Aryl, arylalkyl, phenyl, pyrrole, thiophene,
- M 1 , M 2 , M 3 , M 4 are each independently selected from the group consisting of 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si (OH) 2 , Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os and As.
- the at least one nitrogen-containing macrocycle is selected from the group of compounds having general formulas XI to XIII:
- Mi is selected from the group consisting of 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si (OH) 2 , Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au , Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os and As.
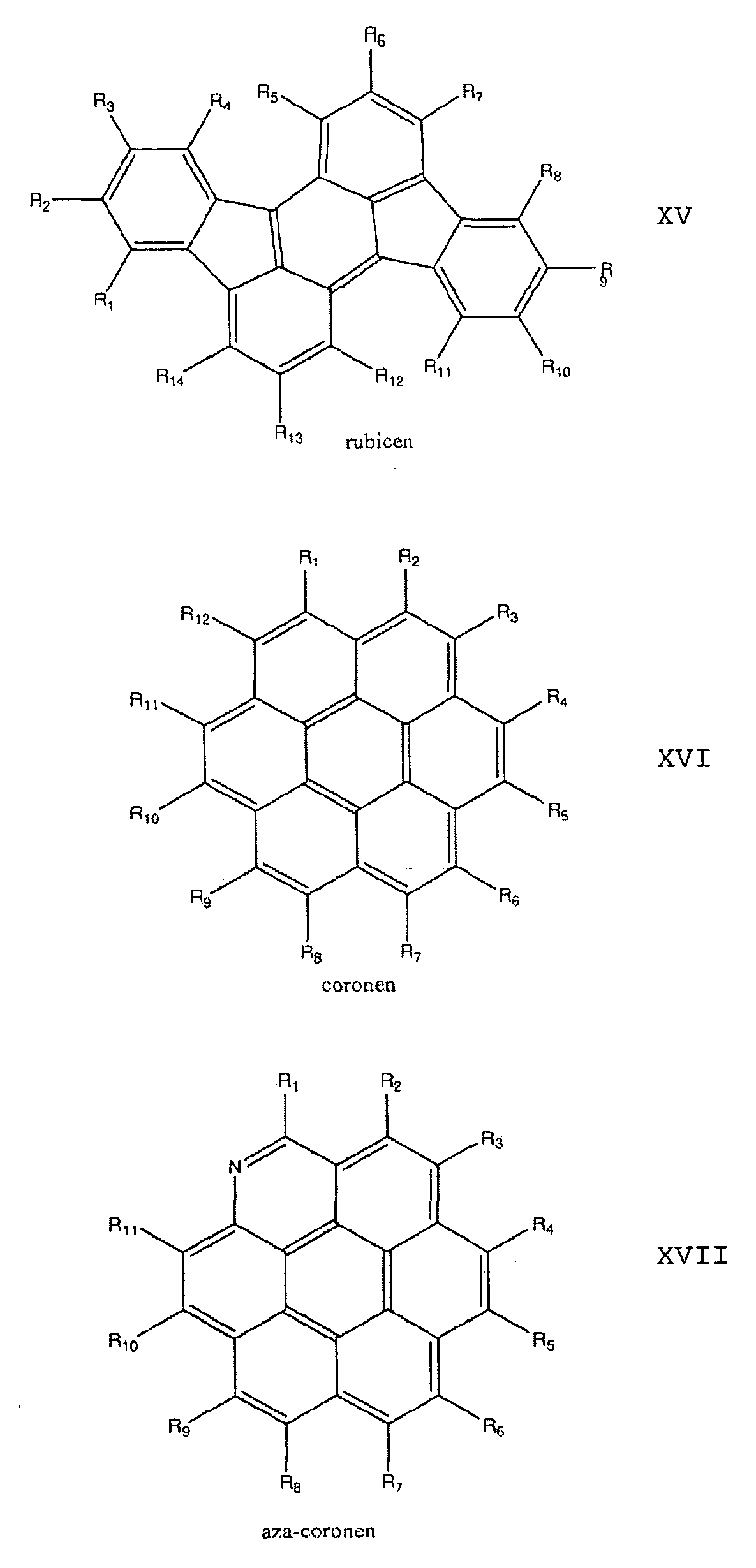
- the dopant is a polycyclic aromatic hydrocarbon which is preferably selected from the group consisting of anthracenes, tetracenes, pentacenes, corones, pyrenes, rubicens and their oligomers.
- the preferred polycyclic aromatic hydrocarbons are selected from the group of compounds having general formulas XIV to XXXV:
- radicals R are each independently selected from the group consisting of H, F, Cl, Br, I, NH 2 , OH, SH, NO 2 , CN, CH 3 , OCH 3 , N (CH 3 ) 2 , CF 3 , c (CF 3 ) 3 , C (CH 3 ) 3 , C 2 H 5 , phenyl, O-phenyl, SO 3 H, NHCH 3 and N (CH 3 ) 2 ,
- Mi is selected from the group consisting of 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si (OH) 2 , Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au , Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os and As.
- the semiconducting matrix material may be both an inorganic or organic semiconductor.
- the matrix materials are selected from the group consisting of N, N'- (Napthylen-1-yl) -N, N'-diphenyl-benzidine and 9, 9'-spirobi [9H-fluoren] - 2, 2 ', 7, 7'-tetraamine are preferred.
- the dopants according to the invention are used in particular for increasing or adjusting the electrical conductivity of inorganic or organic host materials and for increasing the stability to layer damage by, for example, sputtering techniques.
- 1 shows a schematic representation of the principle of electron transfer during doping.
- FIG. 2 shows a UV-Vis spectrum of a layer of a doped semiconductor material according to the invention.
- FIG. 3 shows the dependence of the conductivity of the matrix on the dopant concentration on the basis of a diagram.
- one of the described phthalocyanine derivatives with suitable HOMO-LUMO layers which had previously been calculated by means of the Hyperchem 7.1 commercial software by Hypercube Inc., was selected, and on a likewise commercially available vapor deposition system from Sunic Systems, Korea, with the Covers the matrix material.
- a 50 nm thick film of the pure dopant was deposited on quartz, and its absorption was determined by means of a UV-Vis spectrometer (see Fig. 2).
- the UV-Vis spectrum clearly shows the band structure of the molecule and the small width of the band suggests that there is little interaction between the molecules, which argues against a strong aggregation.
- mixed layers of the matrix with different p-dopant concentrations were prepared and the conductivity was determined. The measured conductivities are shown in FIG.
- unsubstituted metal phthalocyanines and pentacene should be able to be doped.
- Increasing the charge carrier concentration can result in positive effects for use as (doped) organic semiconductors in organic field effect transistors.
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Manufacturing & Machinery (AREA)
- Electroluminescent Light Sources (AREA)
- Electrodes Of Semiconductors (AREA)
- Catalysts (AREA)
Abstract
Die Erfindung betrifft ein dotiertes Halbleitermaterial mit erhöhter Ladungsträgerdichte und Ladungsträgerbeweglichkeit, das mindestens ein halbleitendes Matrixmaterial und mindestens einen Dotanden enthält. Der Dotand ist dabei ausgewählt aus der Gruppe bestehend aus stickstoffhaltigen Makrozyklen und polyzyklischen aromatischen Kohlenwasserstoffen sowie deren Oligomeren. Die Dotanden dienen dabei sowohl der Erhöhung oder Regelung der Leitfähigkeit des halbleitenden Matrixmaterials als auch der Erhöhung der Stabilität gegenüber Schichtbeschädigung.
Description
Dotiertes Halbleitermaterial und dessen Verwendung
Die Erfindung betrifft ein dotiertes Halbleitermaterial mit erhöhter Ladungsträgerdichte und Ladungsträ- gerbeweglichkeit , das mindestens ein halbleitendes
Matrixmaterial und mindestens einen Dotanden enthält. Der Dotand ist dabei ausgewählt aus der Gruppe bestehend aus stickstoffhaltigen Makrozyklen und polyzyklischen aromatischen Kohlenwasserstoffen sowie deren Oligomeren. Die Dotanden dienen dabei sowohl der Erhöhung oder Regelung der Leitfähigkeit des halbleitenden Matrixmaterials als auch der Erhöhung der Stabilität gegenüber Schichtbeschädigung.
Für den Bau organischer elektronischer Bauelemente, insbesondere organischer Leuchtdioden (OLED) , kommen zum Teil Materialien zum Einsatz, deren Leitfähigkeit nicht ausreichend ist. Dies gilt insbesondere für Matrixmaterialien wie α-NPB (N, N' - (Naphthylen-lyl) - N, IST -diphenyl-benzidin) oder 9 , 9 λ -Spirobi [9H-fluo-
rene] -2 , 2 v , 7, 7 ' - tetraamine . Durch den Einsatz eines Dotanden, der aufgrund seiner Molekülorbitale in der Lage ist Ladungsträger in der Matrix zu erzeugen, lässt sich die Leitfähigkeit der Matrix deutlich, um mehrere 10er Potenzen erhöhen. Dadurch verringert sich die benötigte Betriebsspannung und die Effizienz des Bauelements steigt. Durch die Dotierung sinkt weiter die Anforderung an die Elektrode bezüglich der Austrittsarbeit .
Es wird grundsätzlich, analog zur anorganischen Halbleitertechnologie, zwischen p- und n-Dotierung unterschieden. Welche Dotierung vorliegt ist von den energetischen Lagen der Molekülorbitale abhängig, wie in Fig. 1 schematisch gezeigt.
Bei der p-Dotierung sollte das LUMO (Lowest Unoccu- pied Molecular Orbital, niedrigstes unbesetztes Molekülorbital) des Dotanden energetisch tiefer liegen als das HOMO (Highest Occupied Molecular Orbital, höchstes besetztes Molekülorbital) der Matrix. Eine Dotierwirkung bei gleicher Energie oder geringfügig höherer Energie kann ebenfalls auftreten, da bei geringen Energieunterschieden bereits die Umgebungs- bzw. Betriebstemperatur ausreicht, um die Energiebarriere zu überwinden.
Bei der n-Dotierung wird ein Elektron aus dem HOMO des Dotanden in das LUMO der Matrix transferiert. Da- zu sollte das LUMO der Matrix energetisch tiefer als das HOMO des Dotanden liegen. Auch hier ist eine Dotierwirkung bei gleicher Energie oder geringfügig höherer Energie möglich, da auch hier bei geringen Energieunterschieden bereits die Umgebungs- bzw. Be- triebstemperatur ausreicht, um die Energiebarriere zu überwinden.
Ob eine Matrix n- oder p-dotierbar ist, liegt u.a. an den energetischen Lagen der Molekülorbitale von Matrix und dem Dotanden. Ein weiterer Grund kann in der sterischen Hinderung liegen.
Aus dem Stand der Technik sind organische Dotiermaterialien u.a. aus DE 10 2004 010 954 Al, EP 1 596 445 Al, EP 1 538 684 Al, WO 2005/086251 A2 sowie WO 2003/070822 A2 bekannt.
Ausgehend von diesem Stand der Technik war es Aufgabe der vorliegenden Erfindung, Dotanden und dotierte Halbleitermaterialien bereitzustellen, die effizient die elektrische Leitfähigkeit der Host-Materialien erhöhen oder einstellen können und gleichzeitig einfach zu prozessieren sind.
Diese Aufgabe wird durch das gattungsgemäße dotierte Halbleitermaterial mit den kennzeichnenden Merkmalen des Anspruchs 1 gelöst. Die weiteren abhängigen Ansprüche zeigen vorteilhafte Weiterbildungen auf. In den Ansprüchen 22 und 23 werden erfindungsgemäße Verwendungen genannt .
Erfindungsgemäß wird ein dotiertes Halbleitermaterial mit erhöhter Ladungsträgerdichte und Ladungsträgerbe- weglichkeit bereitgestellt, das ein halbleitendes Matrixmaterial und mindestens einen Dotanden enthält. Wesentlich ist dabei, dass der Dotand ausgewählt ist aus der Gruppe bestehend aus stickstoffhaltigen Makrozyklen und polyzyklischen aromatischen Kohlenwasserstoffen sowie deren Oligomeren.
Um eine gute und vor allem stabile Dotierung zu er- reichen sind folgende Randbedingungen möglichst gut zu erfüllen:
- angepasste HOMO-LUMO-Energien von Dotand und Matrix,
- Bei Aufdampfschichten sollten die Verdampfungs- temperaturen ähnlich sein. Bei stark unter- schiedlichen Verdampfungstemperaturen ist die
Gefahr von Kontamination von benachbarten Verdampferquellen sehr groß. (Vgl. F4TCNQ) .
- möglichst amorphes Schichtwachstum von Matrix/Dotand-Gemisch, - Keine Aggregatbildung der Dotiermoleküle. Die
Moleküle sollten möglichst einzeln in der Matrix vorliegen und dürfen keine größeren Cluster bilden.
- Geringe Mobilität der Dotiermoleküle in der Matrix, ansonsten ist die Stabilität des Bauelementes durch Migration/Diffusion der Dotan- den nicht gewährleistet.
Diese Randbedingungen werden durch die erfindungsge- maß bereitgestellten Dotanden überzeugend erfüllt.
Gegenüber den aus dem Stand der Technik bekannten Dotiermolekülen konnte die Verdampfungstemperatur der Dotiermoleküle deutlich erhöht werden. Die Verdamp- fungstemperatur im Hochvakuum liegt deutlich oberhalb von 200 0C. Anhand von UV-Vis-Spektren von Festkörpern konnte der molekulare Charakter der Dotand- schicht nachgewiesen werden, die dem Lösungsspektrum gleicht. Bei starker Aggregation und der daraus re- sultierenden Wechselwirkungen der Moleküle ist mit einem starken Verbreitern der Absorptionsbanden zu rechnen, wie es bei kristallinen Zink (II) -Phthalo- cyanin Schichten zu beobachten ist. Durch die Einführung sperriger Substituenten konnte außerdem die Dif- fusion/Migration des Dotanden verringert werden.
Durch gezielte Modifikation der beschriebenen Moleküle ist eine Anpassung der Molekülorbitalenergieniveaus und das jeweilige Matrixmaterials möglich.
Ein weiterer Vorteil, insbesondere der Phthalocyani- ne, ist der Schutz vor Sputter-Schäden. Für eine Produktion ist dies jedoch ein Vorteil, da ein Material weniger benötigt wird. Damit wird die Gefahr der Kontamination verringert und es kommt durch den Wegfall einer zusätzlichen Verdampferquelle zur Kostenreduktion für den Herstellungsprozess .
Vorzugsweise basiert der stickstoffhaltige Makrozyklus auf einem Tetrapyrrolgerüst , wobei dies auch be- vorzugt ein Tetrapyrrol-Metall-Komplex sein kann. Das Zentralatom M der Tetrapyrrol-Metall -Komplexe ist vorzugsweise ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, V, U, B, Li, Si7 Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und .As . Die Zentralatome können dabei auch* durch weitere Liganden abgesättigt sein können bzw. in Form von Verbindungen, z.B. Oxiden oder Hydroxiden, vorliegen.
Vorzugsweise ist der stickstoffhaltige Makrozyklus ausgewählt aus der Gruppe der Phthalocyanine, insbesondere Naphthalocyaninen, Subphthalocyaninen, Su- perphthalocyaninen sowie Mischungen hiervon.
Vorzugsweise ist das Phthalocyanin eine Verbindung der allgemeinen Formel I und das Naphthalocyanin eine Verbindung der allgemeinen Formel II:
mit
Ri bis R24 unabhängig voneinander = H, F, Cl, Br, I,
OR, SR, CN, NRR, NO2, Cn(RR)2n+1,
wobei X = S, O, NR, die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3,
N(CH3)2, CF3, C(CF3)3, C(CH3J3, C2H5, Phenyl, O-Phenyl,
SO3H, NHCH3 und N(CH3) 2, n = 1 bis 12 und
M ausgewählt aus der Gruppe bestehend aus 2H, 2Li,
Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge,
Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te,
Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
Ein weiteres bevorzugtes Phthalocyanin weist die Formel III auf :
Eine weitere bevorzugte Variante sieht vor, dass der mindestens eine stickstoffhaltige Makrozyklus ausgewählt ist aus der Gruppe der Porphyrine, insbesondere Tetraphenylporphyrinen, Tetrabenzporphyrinen, Tetra- phenyl-Tetrabenzporphyrinen sowie Mischungen hiervon.
Vorzugsweise ist das Porphyrin ausgewählt aus der Gruppe von Verbindungen mit den allgemeinen Formel IV bis VI:
wobei X = S, O, NR, die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, C(CF3)3, C(CH3J3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N(CH3J2, n = 1 bis 12 und
M ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr7 Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
Eine weitere bevorzugte Verbindung für einen stickstoffhaltigen Makrozyklus stellt die allgemeine Formel VII dar.
Ri bis R8 unabhängig voneinander = H, F, Cl, Br, I, OR, SR, CN, NRR, NO2, Cn(RR)2n+1,
wobei X = S, O, NR, die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3J2, CF3, C(CF3)3, C(CH3J3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N(CH3)2 und n = 1 bis 12.
Der mindestens eine stickstoffhaltige Makrozyklus ist weiterhin vorzugsweise ausgewählt aus der Gruppe von Verbindungen mit den allgemeinen Formeln VIII bis X:
mit
Ri bis R40 unabhängig voneinander = H, F, Cl, Br, I, OR, SR, SO2, SO3, CN, NRR, NO, NO2, Cn(RR)2n+1, C1-C18- Alkyl , Aryl , Arylalkyl, Phenyl, Pyrrol, Thiophen,
oder
wobei die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, c (CF3) 3, C (CH3) 3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N(CH3) 2, n = 1 bis 12 und
M1, M2, M3, M4 jeweils unabhängig voneinander ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
Vorzugsweise ist der mindestens eine stickstoffhaltige Makrozyklus ausgewählt aus der Gruppe von Verbindungen mit den allgemeinen Formeln XI bis XIII :
Corrol
mit
Ri bis Ri6 unabhängig voneinander = H, F, Cl, Br, I, OR, SR, SO2, SO3, CN, NRR, NO, NO2, Cn(RR)2n+1, C1-C18 Alkyl, Aryl, Arylalkyl, Phenyl , Pyrrol, Thiophen,
wobei die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, c (CF3) 3, C(CH3J3, C2H5, Phenyl, 0-Phenyl, SO3H, NHCH3 und N(CH3J2, n = 1 bis 12 und
Mi ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
Eine weitere Variante sieht vor, dass der Dotand ein polyzyklischer aromatischer Kohlenwasserstoff ist, der vorzugsweise ausgewählt ist aus der Gruppe bestehend aus Anthracenen, Tetracenen, Pentacenen, Corone- nen, Pyrenen, Rubicenen und deren Oligomeren.
Die bevorzugten polyzyklischen aromatischen Kohlenwasserstoffe sind ausgewählt aus der Gruppe der Verbindungen mit den allgemeinen Formeln XIV bis XXXV:
Ri bis Ri6 unabhängig voneinander = H, F, Cl, Br, I, OR, SR, SO2, SO3, CN, NRR, NO, NO2, Cn(RR)2n+I, C1-C18- Alkyl, Aryl, Arylalkyl, Phenyl, Pyrrol, Thiophen,
wobei die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N (CH3) 2, CF3, c(CF3)3, C (CH3) 3, C2H5, Phenyl, O- Phenyl, SO3H, NHCH3 und N (CH3) 2,
X, Xi, Y, Y1 = 0, S, NRi und
Mi ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
Das halbleitende Matrixmaterial kann dabei sowohl ein anorganischer oder organischer Halbleiter sein. Im Falle eines organischen Halbleiters sind die Matrix- materialien ausgewählt aus der Gruppe bestehend aus N, N'- (Napthylen-1-yl) -N, N' -diphenyl-benzidin und 9, 9'-Spirobi [9H-fluoren] -2, 2' , 7, 7'-tetraamin bevorzugt .
Verwendung finden die erfindungsgemäßen Dotanden insbesondere zur Erhöhung oder Einstellung der elektrischen Leitfähigkeit von anorganischen oder organischen Host-Materialien und zur Erhöhung der Stabilität gegenüber Schichtschädigung durch z.B. Sputter- techniken.
Anhand der nachfolgenden Figuren und des Beispiels soll der erfindungsgemäße Gegenstand näher erläutert werden, ohne diesen auf die hier gezeigten speziellen Ausführungsformen einschränken zu wollen.
Fig. 1 zeigt anhand einer schematischen Darstellung das Prinzip des Elektronentransfers bei der Dotierung .
Fig. 2 zeigt ein UV-Vis -Spektrum einer Schicht eines erfindungsgemäßen dotierten Halbleitermaterials.
Fig. 3 zeigt anhand eines Diagrams die Abhängigkeit der Leitfähigkeit der Matrix von der Dotierstoffkon- zentration.
Beispiel
Am Beispiel einer p-Dotierung des kommerziell erhält- liehen Lochtransportmatrixmaterials 9 , 9 λ -Spirobi [9H- fluorene] -2, 2 v , 7, 7 x -tetraamine HTM14 (Merck AG) , NHT- 5 (Novaled AG) soll die Eignung der vorgeschlagenen Dotiermaterialien demonstriert werden. Dabei wird die Leitfähigkeit der Matrix in Abhängigkeit der Do- tierkonzentration bestimmt. Für die Erzielung einer p-Dotierung ist es wie bereits beschrieben nötig, einen Dotanden mit energetisch tief liegendem LUMO zu wählen.
Dazu wurde eines der beschriebenen Phthalocyanin- Derivate mit geeigneten HOMO-LUMO-Lagen, die zuvor mittels der kommerziellen Software Hyperchem 7.1 von Hypercube Inc. berechnet wurden, ausgewählt und an einer ebenfalls kommerziell erhältlichen Aufdampfan- läge der Firma Sunic Systems, Korea, mit dem Matrixmaterial coverdampft .
Zum Ermitteln der Eigenschaften wurde zunächst ein 50 nm dicker Film des reinen Dotanden auf Quarz abgeschieden und dessen Absorption mittels eines UV-Vis- Spektrometers ermittelt (s. Fig. 2) .
Das UV-Vis- Spektrum zeigt deutlich die Bandenstruktur des Moleküls und die geringe Breite der Bande lässt auf geringe Wechselwirkung der Moleküle untereinander schließen, was gegen eine starke Aggregation spricht. Anschließend wurden Mischschichten der Matrix mit verschiedenen p-Dotand-Konzentrationen hergestellt und die Leitfähigkeit bestimmt. Die gemessenen Leitfähigkeiten sind in Fig. 3 dargestellt.
Neben dem beschriebenen Beispiel sollten insbesondere unsubstituierte Metall-Phthalocyanine und Pentacen dotiert werden können. Durch die Erhöhung der Ladungsträgerkonzentration können positive Effekte für den Einsatz als (dotierte) organische Halbleiter in organischen Feldeffekttransistoren resultieren.
Claims
Patentansprüche
1. Dotiertes Halbleitermaterial mit erhöhter Ladungsträgerdichte und Ladungsträgerbeweglichkeit enthaltend mindestens ein halbleitendes Matrixmaterial und mindestens einen Dotanden,
d a d u r c h g e k e n n z e i c h n e t ,
dass der mindestens eine Dotand ausgewählt ist aus der Gruppe bestehend aus stickstoffhaltigen Makrozyklen und polyzyklischen aromatischen Kohlenwasserstoffen sowie deren Oligomeren.
2. Dotiertes Halbleitermaterial nach Anspruch 1, dadurch gekennzeichnet, dass der mindestens -eine Dotand eine Verdampfungstemperatur von mindestens 135 0C, insbesondere von mindestens 200 0C bei einem Vakuum von 10"6 mbar.
3. Dotiertes Halbleitermaterial nach einem der An- Sprüche 1 oder 2, dadurch gekennzeichnet, dass der mindestens eine Dotand als Einzelmolekül und nicht in Form von Clustern im Matrixmaterial verteilt ist.
4. Dotiertes Halbleitermaterial nach einem der Ansprüche 1 bis 3, dadurch gekennzeichnet, dass der stickstoffhaltige Makrozyklus auf einem Tetrapyrrolgerüst ba-
siert .
5. Dotiertes Halbleitermaterial nach Anspruch 2, dadurch gekennzeichnet, dass der stickstoffhaltige Makrozyklus ein Tetrapyrrol -Metall-Komplex ist.
6. Dotiertes Halbleitermaterial nach Anspruch 2 oder 3 , dadurch gekennzeichnet, dass das Zentralatom M der Tetrapyrrol-Metall-Komplexe ausgewählt ist aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, V, U, B, Li, Si, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und
As, wobei die Zentralatome durch weitere Liganden abgesättigt sein können oder in Form von Verbindungen, z.B. Oxiden oder Hydroxiden, vorliegen.
7. Dotiertes Halbleitermaterial nach einem der vorhergehenden Ansprüche , dadurch gekennzeichnet, dass der mindestens eine stickstoffhaltigen Makrozyklus ausgewählt ist aus der Gruppe der Phthalocyanine .
8. Dotiertes Halbleitermaterial nach dem vorhergehenden Anspruch, dadurch gekennzeichnet, dass die Phthalocyanine ausgewählt sind aus der Gruppe bestehend aus
Naphthalocyaninen, Subphthalocyaninen, Su- perphthalocyaninen sowie Mischungen hiervon.
9. Dotiertes Halbleitermaterial nach einem der Ansprüche 7 oder 8 , dadurch gekennzeichnet, dass das Phthalocyanin eine Verbindung der allgemeinen Formel I oder II
Ri bis R24 unabhängig voneinander = H, F, Cl, Br, I, OR, SR, CN, NRR, NO2, Cn(RR)2n+1,
wobei X = S, O, NR, die Reste R jeweils unabhän-
gig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, C(CF3)3, C(CH3)3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N (CH3) 2, n = 1 bis 12 und
M ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
Dotiertes Halbleitermaterial nach einem der Ansprüche 7 bis 9, dadurch gekennzeichnet, dass das Phthalocyanin die Formel III aufweist:
11. Dotiertes Halbleitermaterial nach einem der Ansprüche 1 bis 6 , dadurch gekennzeichnet, dass der mindestens eine stickstoffhaltige Makrozyklus ausgewählt ist aus der Gruppe der Porphyrine .
12. Dotiertes Halbleitermaterial nach dem vorhergehenden Anspruch, dadurch gekennzeichnet, dass die Porphyrine ausgewählt sind aus der Gruppe bestehend aus Tetraazaporphyrinen, Tetraphenylporphyrinen, Tetrabenzporphyrinen, Tetraphenyl- Tetrabenzporphyrinen sowie Mischungen hiervon.
13. Dotiertes Halbleitermaterial nach einem der Ansprüche 11 oder 12, dadurch gekennzeichnet, dass das Porphyrin ausgewählt ist aus der Gruppe von Verbindungen mit den allgemeinen Formel IV bis VI:
mit
Ri bis R20 unabhängig voneinander = H, F, Cl, Br, I, OR, SR, CN, NRR, NO2, Cn(RR)2n+1,
wobei X = S, O, NR, die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3J2, CF3, C(CF3J3, C(CH3J3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N(CH3J2, n = 1 bis 12 und
M ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
14. Dotiertes Halbleitermaterial nach Anspruch 1 bis 6, dadurch gekennzeichnet, dass der mindestens eine stickstoffhaltige Makrozyklus eine Verbindung
der allgemeinen Formel VII ist:
Ri bis Rio unabhängig voneinander = H, Fr Cl, Br,
I1 OR, SR, CN, NRR, NO2, Cn(RR)2n+I,
wobei X = S, O, NR, die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, c(CF3)3, C(CH3)3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N(CH3)2 und n = 1 bis 12.
15. Dotiertes Halbleitermaterial nach Anspruch 1 bis 6, dadurch gekennzeichnet, dass der mindestens eine stickstoffhaltige Makrozyklus ausgewählt ist aus der Gruppe von Verbindungen mit den allgemeinen Formeln VIII bis X:
mit
Ri bis R40 unabhängig voneinander = H, F, Cl, Br,
I, OR, SR, SO2, SO3, CN, NRR, NO, NO2, Cn(RR)2n+I,
Cl-C18-Alkyl, Aryl , Arylalkyl, Phenyl, Pyrrol,
Thiophen,
wobei die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H,
F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, c(CF3)3, C(CH3J3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N (CH3) 2, n = 1 bis 12 und
M1, M2, M3, M4 jeweils unabhängig voneinander ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As .
16. Dotiertes Halbleitermaterial nach Anspruch 1 bis 3, dadurch gekennzeichnet, dass der mindestens eine stickstoffhaltige Makrozyklus ausgewählt ist aus der Gruppe von Verbindungen mit den allgemeinen Formeln XI bis XIII:
Ri bis R16 unabhängig voneinander = H, F, Cl, Br, I, OR, SR, SO2, SO3, CN, NRR, NO, NO2, Cn(RR)2n+1, Cl-C18-Alkyl, Aryl, Arylalkyl, Phenyl, Pyrrol, Thiophen,
wobei die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, c(CF3)3, C(CH3)3, C2H5, Phenyl , O-Phenyl, SO3H, NHCH3 und N (CH3) 2/ n - 1 bis 12 und
Mi ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As.
17. Dotiertes Halbleitermaterial nach einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass die polyzyklischen aromatischen Kohlenwasserstoffe ausgewählt sind aus der Gruppe bestehend aus Anthracenen, Tetra- cenen, Pentacenen, Coronenen, Pyrenen, Rubicenen und deren Oligomeren.
18. Dotiertes Halbleitermaterial nach dem vorhergehenden Anspruch, dadurch gekennzeichnet, dass die polyzyklischen aromatischen Kohlenwasserstoffe ausgewählt sind aus der Gruppe der Verbindungen mit den allgemeinen Formeln XIV bis XXXV:
Ri bis Ri6 unabhängig voneinander = H, F, Cl , Br ,
I , OR , SR , SO2 , SO3 , CN, NRR , NO , NO2 , Cn (RR) 2n+I ,
Cl-C18-Alkyl, Aryl , Arylalkyl, Phenyl, Pyrrol,
Thiophen,
wobei die Reste R jeweils unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus H, F, Cl, Br, I, NH2, OH, SH, NO2, CN, CH3, OCH3, N(CH3)2, CF3, c(CF3)3, C(CH3)3, C2H5, Phenyl, O-Phenyl, SO3H, NHCH3 und N(CH3) 2, X, Xi, Y, Yi = 0, S, NR1 und
Mi ausgewählt aus der Gruppe bestehend aus 2H, 2Li, Cu, Zn, Co, Ni, Fe, VO, Si(OH)2, Cr, Mn, Ti, Ga, Ge, Sn, Sb, In, Cd, Ag, Au, Pt, Pd, Ir, Pb, Bi, Se, Te, Ru, Rh, Mo, Nb, Zr, Y, Hf, Ta, W, Re, Os und As .
19. Dotiertes Halbleitermaterial nach einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass das halbleitende Matrixmaterial ein anorganischer Halbleiter ist.
20. Dotiertes Halbleitermaterial nach einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass das halbleitende Matrixmaterial ein organischer Halbleiter ist.
21. Dotiertes Halbleitermaterial nach dem vorhergehenden Anspruch, dadurch gekennzeichnet, dass das halbleitende Matrixmaterial ausgewählt ist aus der Gruppe bestehend aus N, N'- (Napthylen-1-yl) -N,N'-diphenyl- benzidin und 9, 9' -Spirobi [9H- fluoren] -2 ,2 ' , 7, 7' - tetraamin.
22. Verwendung der in den vorhergehenden Ansprüchen aufgeführten Dotanden zur Erhöhung oder Regelung der Leitfähigkeit von halbleitenden Matrixmaterialien.
23. Verwendung der in den vorhergehenden Ansprüchen aufgeführten Dotanden zur Erhöhung der Stabilität gegenüber Schichtbeschädigungen durch z.B. Sputtertechniken .
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102007037905A DE102007037905B4 (de) | 2007-08-10 | 2007-08-10 | Dotiertes Halbleitermaterial und dessen Verwendung |
| DE102007037905.8 | 2007-08-10 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2009021663A1 true WO2009021663A1 (de) | 2009-02-19 |
Family
ID=39876566
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2008/006465 Ceased WO2009021663A1 (de) | 2007-08-10 | 2008-08-06 | Dotiertes halbleitermaterial und dessen verwendung |
Country Status (2)
| Country | Link |
|---|---|
| DE (1) | DE102007037905B4 (de) |
| WO (1) | WO2009021663A1 (de) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2551949A1 (de) * | 2011-07-28 | 2013-01-30 | Ecole Polytechnique Fédérale de Lausanne (EPFL) | Metallkomplexe zur Verwendung als Dotierungsmittel und andere Verwendungen |
| WO2016050335A1 (en) * | 2014-09-30 | 2016-04-07 | Merck Patent Gmbh | Semiconductor composition comprising an inorganic semiconducting material and an organic binder |
| CN115197219A (zh) * | 2021-04-09 | 2022-10-18 | 中国科学院化学研究所 | 非苯型苝二酰亚胺共轭稠环分子及其制备方法与应用 |
| CN115490688A (zh) * | 2022-08-29 | 2022-12-20 | 南开大学 | 基于三氮杂蒄的二维导电金属有机框架材料及其制备方法与应用 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102014114224A1 (de) | 2014-09-30 | 2016-03-31 | Osram Oled Gmbh | Organisches elektronisches Bauteil, Verwendung eines Zinkkomplexes als p-Dotierungsmittel für organische elektronische Matrixmaterialien |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005036667A1 (de) * | 2003-10-10 | 2005-04-21 | Novaled Gmbh | N- dotierung von organischen halbleitern |
| US20050101218A1 (en) * | 2002-12-09 | 2005-05-12 | National Cheng Kung University | Method for manufacturing organic light-emitting diodes |
| US20050244672A1 (en) * | 2004-04-30 | 2005-11-03 | Chi-Ming Che | Organic light-emitting devices |
| US20070181874A1 (en) * | 2004-12-30 | 2007-08-09 | Shiva Prakash | Charge transport layers and organic electron devices comprising same |
| WO2008058525A2 (de) * | 2006-11-13 | 2008-05-22 | Novaled Ag | Verwendung einer koordinationsverbindung zur dotierung von organischen halbleitern |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3172862A (en) * | 1960-09-29 | 1965-03-09 | Dow Chemical Co | Organic electroluminescent phosphors |
| DE10207859A1 (de) | 2002-02-20 | 2003-09-04 | Univ Dresden Tech | Dotiertes organisches Halbleitermaterial sowie Verfahren zu dessen Herstellung |
| DE10357044A1 (de) | 2003-12-04 | 2005-07-14 | Novaled Gmbh | Verfahren zur Dotierung von organischen Halbleitern mit Chinondiiminderivaten |
| DE102004010954A1 (de) | 2004-03-03 | 2005-10-06 | Novaled Gmbh | Verwendung eines Metallkomplexes als n-Dotand für ein organisches halbleitendes Matrixmaterial, organisches Halbleitermaterial und elektronisches Bauteil |
| DE102005062674B4 (de) * | 2005-12-23 | 2011-06-16 | Technische Universität Darmstadt | Kompositzusammensetzung für eine Solarzelle, p-i-n-Halbleiterstruktur, enthaltend diese Zusammensetzung, Solarzelle und Verfahren zur Herstellung einer Kompositzusammensetzung |
-
2007
- 2007-08-10 DE DE102007037905A patent/DE102007037905B4/de active Active
-
2008
- 2008-08-06 WO PCT/EP2008/006465 patent/WO2009021663A1/de not_active Ceased
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050101218A1 (en) * | 2002-12-09 | 2005-05-12 | National Cheng Kung University | Method for manufacturing organic light-emitting diodes |
| WO2005036667A1 (de) * | 2003-10-10 | 2005-04-21 | Novaled Gmbh | N- dotierung von organischen halbleitern |
| US20050244672A1 (en) * | 2004-04-30 | 2005-11-03 | Chi-Ming Che | Organic light-emitting devices |
| US20070181874A1 (en) * | 2004-12-30 | 2007-08-09 | Shiva Prakash | Charge transport layers and organic electron devices comprising same |
| WO2008058525A2 (de) * | 2006-11-13 | 2008-05-22 | Novaled Ag | Verwendung einer koordinationsverbindung zur dotierung von organischen halbleitern |
Non-Patent Citations (1)
| Title |
|---|
| GOLDSMITH G J ET AL: "Copper phthalocyanine as an efficient dopant in development of solar cells", MATERIALS RESEARCH BULLETIN, ELSEVIER, KIDLINGTON, GB, vol. 32, no. 5, 1 May 1997 (1997-05-01), pages 539 - 546, XP004088902, ISSN: 0025-5408 * |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2551949A1 (de) * | 2011-07-28 | 2013-01-30 | Ecole Polytechnique Fédérale de Lausanne (EPFL) | Metallkomplexe zur Verwendung als Dotierungsmittel und andere Verwendungen |
| WO2016050335A1 (en) * | 2014-09-30 | 2016-04-07 | Merck Patent Gmbh | Semiconductor composition comprising an inorganic semiconducting material and an organic binder |
| CN107078217A (zh) * | 2014-09-30 | 2017-08-18 | 默克专利股份有限公司 | 包含无机半导体材料和有机粘合剂的半导体组合物 |
| US20170309848A1 (en) * | 2014-09-30 | 2017-10-26 | Merck Patent Gmbh | Semiconductor Composition Comprising an Inorganic Semiconducting Material and an Organic Binder |
| JP2018501634A (ja) * | 2014-09-30 | 2018-01-18 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | 無機半導体材料および有機結合剤を含む半導体組成物 |
| US10326090B2 (en) | 2014-09-30 | 2019-06-18 | Merck Patent Gmbh | Semiconductor composition comprising an inorganic semiconducting material and an organic binder |
| CN115197219A (zh) * | 2021-04-09 | 2022-10-18 | 中国科学院化学研究所 | 非苯型苝二酰亚胺共轭稠环分子及其制备方法与应用 |
| CN115197219B (zh) * | 2021-04-09 | 2023-11-07 | 中国科学院化学研究所 | 非苯型苝二酰亚胺共轭稠环分子及其制备方法与应用 |
| CN115490688A (zh) * | 2022-08-29 | 2022-12-20 | 南开大学 | 基于三氮杂蒄的二维导电金属有机框架材料及其制备方法与应用 |
| CN115490688B (zh) * | 2022-08-29 | 2024-04-16 | 南开大学 | 基于三氮杂蒄的二维导电金属有机框架材料及其制备方法与应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| DE102007037905B4 (de) | 2011-02-24 |
| DE102007037905A1 (de) | 2009-04-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2006092135A1 (de) | Photoaktives bauelement mit organischen schichten | |
| EP1861886B8 (de) | Organisches photoaktives bauelement | |
| DE102006053320B4 (de) | Verwendung einer Koordinationsverbindung zur Dotierung organischer Halbleiter | |
| DE102006054524B4 (de) | Verwendung von Dithiolenübergangsmetallkomplexen und Selen- analoger Verbindungen als Dotand | |
| DE102009051142B4 (de) | Photoaktives Bauelement mit invertierter Schichtfolge und Verfahren zu seiner Herstellung | |
| EP3157072B1 (de) | Verwendung eines metallkomplexes als p-dotand für ein organisches halbleitendes matrixmaterial, organisches halbleitermaterial und organische leuchtdiode | |
| EP2342772B1 (de) | Organisches elektronisches bauelement und verfahren zu dessen herstellung | |
| EP2959520B1 (de) | Optoelektronisches bauelement | |
| DE112011102747T5 (de) | Dotierte Graphendünnschichten mit verringertem Flächenwiderstand | |
| DE102013017361A1 (de) | Organisches Licht emittierendes Bauelement und Verfahren zur Herstellung eines organischen Licht ermittierenden Bauelements | |
| KR102261523B1 (ko) | 페로브스카이트 태양전지 및 이의 제조방법 | |
| DE102007037905B4 (de) | Dotiertes Halbleitermaterial und dessen Verwendung | |
| DE102013107113A1 (de) | Organisches Licht emittierendes Bauelement und Verfahren zur Herstellung eines organischen Licht emittierenden Bauelements | |
| DE202014106226U1 (de) | Organisches elektronisches Bauteil | |
| DE102007028237A1 (de) | Verwendung eines Metallkomplexes als p-Dotand für ein organisches halbleitendes Matrixmaterial, organisches Halbleitermaterial und elektronisches Bauteil | |
| DE102015200699A1 (de) | Aminophosphazen-Basen als n-Dotierstoffe in der organischen Elektronik | |
| WO2010139310A2 (de) | Invertierte oder transparente organische solarzelle oder photodetektor mit verbesserter absorption | |
| DE102016106917A1 (de) | Organisches elektronisches Bauteil mit Ladungsträgergenerationsschicht | |
| EP4147283A1 (de) | Schichtsystem für ein organisches elektronisches bauelement | |
| WO2021058065A1 (de) | Verbindungen mit einer furopyrrol- oder einer thienopyrrolgruppe, optoelektronische bauelemente mit einer solchen verbindung, und verwendung einer solchen verbindung in optoelektronischen bauelementen | |
| WO2010133205A1 (de) | Organische solarzelle oder photodetektor mit verbesserter absorption | |
| EP3410505A1 (de) | Polyphenole und polyamino-derivate in organischen optoelektronischen bauelementen | |
| WO2009021655A2 (de) | Elektronisches bauelement und verwendung von stickstoffhaltigen makrozyklen als dielektrikum in organischen elektronischen bauteilen | |
| DE102009024953A1 (de) | Mehrschichtelektrode für photovoltaische Bauelemente, Verfahren zu ihrer Herstellung und photovoltaisches Bauelement mit einer solchen Mehrschichtelektrode | |
| DE102013110373B4 (de) | Optoelektronisches Bauelement |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 08785385 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 08785385 Country of ref document: EP Kind code of ref document: A1 |