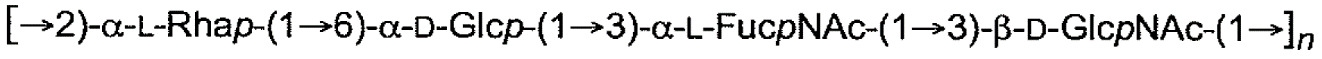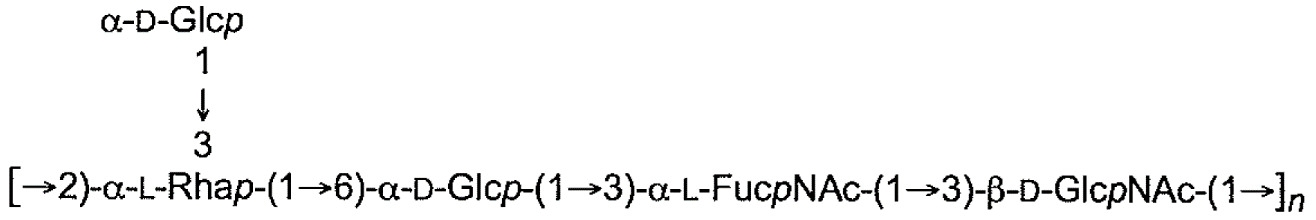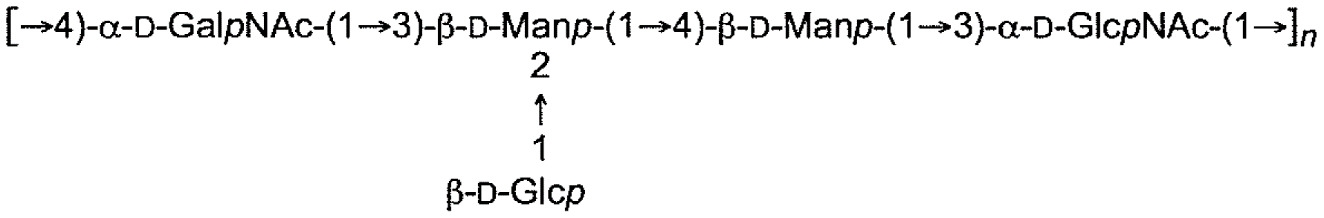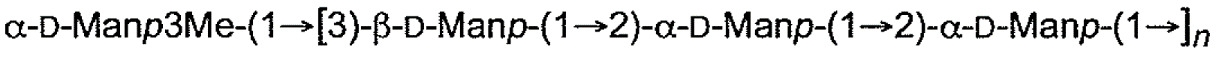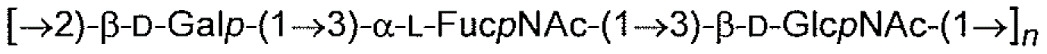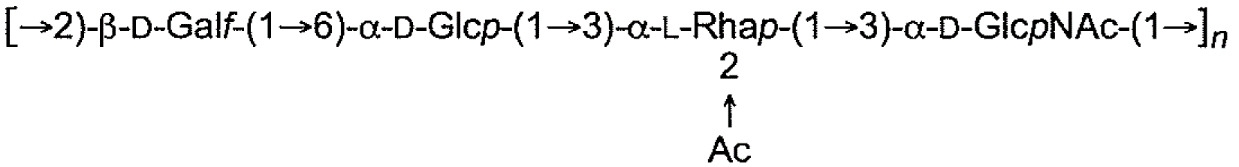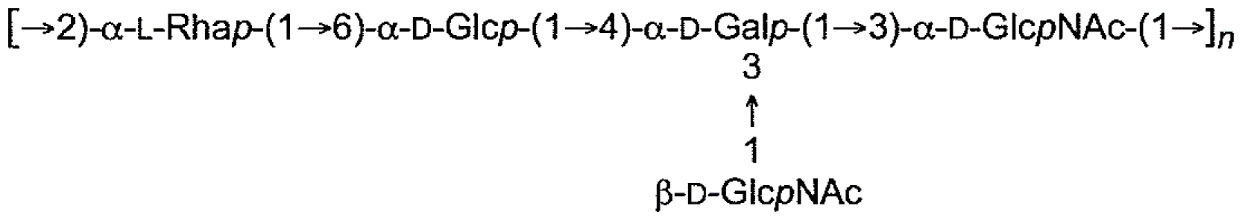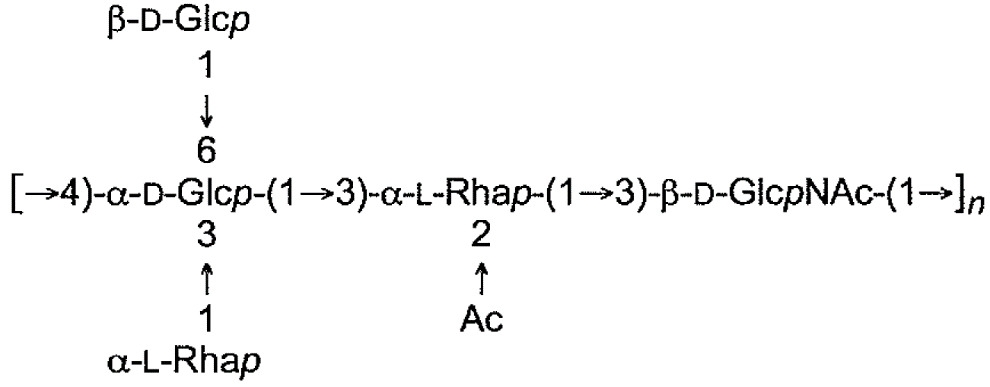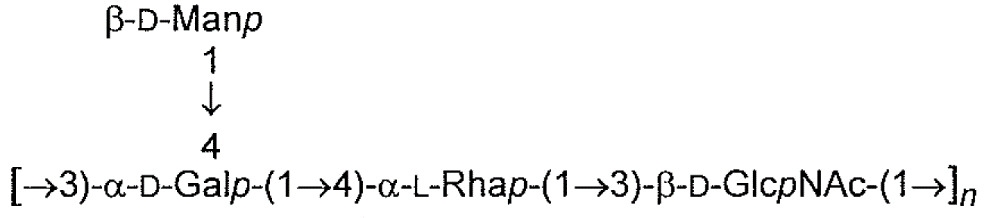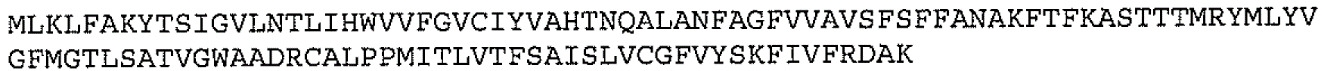TWI771663B - E. coli O-抗原多醣生物結合物之製備方法、其組合物及其使用方法 - Google Patents
E. coli O-抗原多醣生物結合物之製備方法、其組合物及其使用方法 Download PDFInfo
- Publication number
- TWI771663B TWI771663B TW109109076A TW109109076A TWI771663B TW I771663 B TWI771663 B TW I771663B TW 109109076 A TW109109076 A TW 109109076A TW 109109076 A TW109109076 A TW 109109076A TW I771663 B TWI771663 B TW I771663B
- Authority
- TW
- Taiwan
- Prior art keywords
- antigen
- coli
- polysaccharide
- amino acid
- seq
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P19/00—Preparation of compounds containing saccharide radicals
- C12P19/04—Polysaccharides, i.e. compounds containing more than five saccharide radicals attached to each other by glycosidic bonds
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y204/00—Glycosyltransferases (2.4)
- C12Y204/99—Glycosyltransferases (2.4) transferring other glycosyl groups (2.4.99)
- C12Y204/99018—Dolichyl-diphosphooligosaccharide—protein glycotransferase (2.4.99.18)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/025—Enterobacteriales, e.g. Enterobacter
- A61K39/0258—Escherichia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/085—Staphylococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/09—Lactobacillales, e.g. aerococcus, enterococcus, lactobacillus, lactococcus, streptococcus
- A61K39/092—Streptococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/095—Neisseria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/102—Pasteurellales, e.g. Actinobacillus, Pasteurella; Haemophilus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/104—Pseudomonadales, e.g. Pseudomonas
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/107—Vibrio
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/385—Haptens or antigens, bound to carriers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/646—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the entire peptide or protein drug conjugate elicits an immune response, e.g. conjugate vaccines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/21—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Pseudomonadaceae (F)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/24—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Enterobacteriaceae (F), e.g. Citrobacter, Serratia, Proteus, Providencia, Morganella, Yersinia
- C07K14/245—Escherichia (G)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/70—Vectors or expression systems specially adapted for E. coli
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1048—Glycosyltransferases (2.4)
- C12N9/1081—Glycosyltransferases (2.4) transferring other glycosyl groups (2.4.99)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/02—Preparation of peptides or proteins having a known sequence of two or more amino acids, e.g. glutathione
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/6037—Bacterial toxins, e.g. diphteria toxoid [DT], tetanus toxoid [TT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/62—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Immunology (AREA)
- Mycology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Virology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
- Enzymes And Modification Thereof (AREA)
Abstract
本發明提供使用重組宿主細胞製備共價連接至載體蛋白之O-抗原多醣之生物結合物的方法。用於本文所描述之該等方法中之該等重組宿主細胞編碼特定寡醣基轉移酶,其視待製備之該O-抗原多醣生物結合物而定。該等寡醣基轉移酶可為PglB寡醣基轉移酶或其變異體。亦提供含有該等生物結合物之組合物,及使用本文所描述之該等生物結合物及組合物對個體進行疫苗接種來對抗腸外病原性大腸桿菌(ExPEC)之方法。
Description
連同共生大腸桿菌菌株一起,腸外病原性大腸桿菌(extraintestinal pathogenicEscherichia coli
,ExPEC)菌株通常為人類胃腸道之無害居住者。ExPEC分離株無法藉由血清型輕鬆地與共生分離株區分,儘管許多純系譜系受ExPEC控制,如O-抗原、膠囊及鞭毛抗原血清型(縮寫為O:K:H,例如O25:K1:H4)所定義。相比於共生大腸桿菌,ExPEC菌株表現一系列廣泛的毒性因子,使該等菌株能夠在胃腸道中定殖以及引起廣泛範圍之腸道感染,該等感染與歸因於住院及死亡之顯著醫療費用負擔相關。新生兒、老年及免疫功能不全患者尤其易遭受ExPEC感染,包括侵襲性ExPEC疾病(IED)。
ExPEC菌株為泌尿道感染(UTI)之最常見病因及手術部位感染與新生兒腦膜炎之重要促成因素。該等菌株亦與腹部及骨盆感染及心包肺炎相關,且偶爾涉及其他腸外感染,諸如骨髓炎、蜂窩組織炎及傷口感染。所有此等主要感染部位可導致ExPEC菌血症。ExPEC為群體發作菌血症之最常見病因及病院菌血症中之主要病原性病原體,且發現於約17%至37%臨床上顯著之血液分離株中。具有ExPEC陽性血液培養物之患者通常遭受敗血症症候群、嚴重敗血症或敗血性休克。已觀測到ExPEC對一線抗生素(包括頭胞菌素、氟喹諾酮及曲美普林/磺胺甲基異噁唑)之抗性不斷增加。ExPEC序列類型131 (ST131)之出現及快速全球傳播視為增加藥物抗性之主要驅動因素,包括多藥物抗性。此純系發現於12.5%至30%之所有ExPEC臨床分離株中,大多呈現血清型O25b:H4,且展示對氟喹諾酮之高水準的抗性,其通常伴有曲美普林/磺胺甲基噁唑抗性及廣譜β內醯胺酶賦予之針對頭胞菌素之抗性。
O-抗原包含革蘭氏陰性細菌(Gram-negative bacteria)(包括大腸桿菌)中之細胞壁脂多醣(LPS)的免疫顯性組分。當前存在>180個經鑑別的血清學上獨特之大腸桿菌O-抗原,其中ExPEC分離株中之絕大部分被分類於小20種O-抗原血清型內。全長大腸桿菌O-抗原通常由約10至25個附著至高度保守之LPS核心結構的重複糖單元構成,其中各組分分別藉由分別主要在rfb
及rfa
基因叢中經編碼之酶合成。在聚合O-抗原之後,O-抗原多醣主鏈可通常經由添加乙醯基或葡萄糖殘基而經修飾。此等修飾藉由產生抗原性相異血清型來有效地增加血清型多樣性,該等血清型共用一個常見的多醣主鏈,但在側分支方面不同。編碼O-抗原修飾酶之基因通常滯留於染色體上之rfb
簇外部,且在一些情況下,此等基因見於溶源性噬菌體內。
屬於O4血清群之ExPEC分離株通常一直在對美國及歐盟血液分離株進行的當代監測研究中鑑別。O4多醣結構確定為-->2) α-L-Rha (1->6) α-D-Glc (1->3) α-L-FucNAc (1->3) β-D-GlcNAc (1->來自大腸桿菌O4:K52菌株(Jann等人,Carbohydr . Res .
(1993) 第248卷, 第241-250頁)。確定O4:K3、O4:K6及O4:K12菌株的O4多醣結構之相異形式,其中上述結構藉由添加連接至多醣之鼠李糖殘基的α-D-Glc (1->3)來修飾(Jann等人, 1993, 同上),此形式之多醣在下文中稱為「葡糖基化O4」。未鑑別出引起大腸桿菌O4菌株內之O-抗原修飾的酶。
研發防止ExPEC感染之疫苗的努力集中於O-抗原多醣結合物。12價O-抗原結合物疫苗經由提取及純化O-抗原多醣及化學結合至解毒之綠膿桿菌(P. aeruginosa
)外毒素A合成,且在1期臨床研究中測試安全性及免疫原性(Cross等人,J . Infect . Dis .
(1994) 第170卷, 第834-40頁)。此候選疫苗從未授權用於臨床用途。最近已研發大腸桿菌之生物結合系統,其中多醣抗原及載體蛋白均在活體內合成且隨後經由在大腸桿菌中表現之寡醣基轉移酶PglB(一種空腸曲桿菌(Campylobacter jejuni
)酶)之活性在活體內結合(Wacker等人,Proc . Nat . Acad . Sci .
(2006) 第103卷, 第7088-93頁)。此N連接之蛋白質醣基化系統能夠將不同多醣轉移至載體蛋白,從而允許用以純化結合物的簡單方法。
生物結合已成功地用於製備用於大腸桿菌四價O-抗原候選疫苗之結合物多醣(Poolman及Wacker, J. Infect. Dis. (2016) 第213(1)卷, 第6-13頁)。然而,研發出成功的ExPEC疫苗需要覆蓋優勢血清型,且其他O-抗原修飾在ExPEC分離株子組中之存在展現在覆蓋顯示未經修飾及經修飾之LPS的分離株方面的另一挑戰。此外,製備用於覆蓋多種血清型之較複雜疫苗組合物的多種組分之效率變得愈來愈重要,且因此仍需要在製備具有特異性O-抗原之各個生物結合物上進行改良。
鑒於在ExPEC分離株中增加抗生素抗性及在主要O-血清型中存在其他O-抗原修飾,需要對此等感染之預防性及治療性治療進行改良。本發明藉由限定當代臨床分離株之基因組成,包括鑑別編碼O-抗原修飾酶之基因,因此允許對能夠合成O-抗原生物結合物(包括包含所選O-抗原修飾之生物結合物)的重組宿主細胞進行工程改造,從而滿足此需求。另外,在本發明之一個態樣中,基於以不可預測之血清型依賴方式使用某些寡醣基轉移酶(OST)變異體用於某些大腸桿菌O-抗原生物結合物的優勢,提供宿主細胞及藉由用於使用OST之變異體來改良特異性O-抗原之生物結合物製備的方法。在某些情況下,此類OST變異體之使用亦可影響生物結合物之醣基化模式,例如相比於使用野生型或OST之其他變異體製備之生物結合物,藉由增加偶合至載體蛋白之聚醣的相對數目,且因此亦提供藉由此類方法製備之新穎生物結合物作為本發明之態樣。
在一個態樣中,提供一種製得共價連接至載體蛋白之大腸桿菌Ox
抗原多醣之生物結合物的方法,該方法包含:
(i)提供包含以下之重組宿主細胞:
a.該Ox
-抗原多醣之rfb
基因叢核苷酸序列;
b.編碼包含至少一個醣基化位點之該載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO: 1,較佳具有SEQ ID NO: 2之醣基化共同序列;及
c.編碼寡醣基轉移酶PglBy
之核苷酸序列;及
(ii)在用於製備該生物結合物之條件下培養該重組宿主細胞,
其中:
當該Ox
-抗原為O1A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為葡糖基化O4抗原多醣時,該PglBy
包含胺基酸突變N311V或胺基酸突變Y77H及N311V,且該重組宿主細胞進一步包含編碼葡糖基轉移酶GtrS的序列,該葡糖基轉移酶GtrS與SEQ ID NO: 4具有至少80%一致性且能夠藉由添加葡萄糖修飾大腸桿菌O4抗原多醣以產生該大腸桿菌葡糖基化O4抗原多醣,及編碼分別與SEQ ID NO: 7及8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇(bactoprenol)連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化;
當該Ox
-抗原為O6A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O8抗原多醣時,該PglBy
在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;
當該Ox
-抗原為O15抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O16抗原多醣時,該PglBy
包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V;
當該Ox
-抗原為O18A抗原多醣時,該PglBy
在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;及
當該Ox
-抗原為O75抗原多醣時,該PglBy
包含胺基酸突變N311V,
其中在各種情況下,該等胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB,
其中該等O1A、葡糖基化O4、O6A、O8、O15、O16、O18A及O75抗原多醣分別具有式(O1A)、(O4-Glc+)、(O6A)、(O8)、(O15)、(O16)、(O18A)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
在一個實施例中,Ox
-抗原為O1A抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
在一個實施例中,Ox
-抗原為葡糖基化O4抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V。在一個實施例中,Ox
-抗原為葡糖基化O4抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變Y77H及N311V。在Ox
-抗原為葡糖基化O4抗原多醣之實施例中,重組宿主細胞較佳進一步包含編碼與SEQ ID NO: 4具有至少80%一致性之GtrS的序列,及編碼分別與SEQ ID NO: 7及8具有至少80%序列一致性之GtrA及GtrB的核苷酸序列。
在一個實施例中,Ox
-抗原為O6A抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
在一個實施例中,Ox
-抗原為O8抗原多醣,PglBy
在位置77、80、287、289、311、482、483及669處相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB不包含胺基酸突變。
在一個實施例中,Ox
-抗原為O15抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
在一個實施例中,Ox
-抗原為O16抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V。
在一個實施例中,Ox
-抗原為O18A抗原多醣,PglBy
在位置77、80、287、289、311、482、483及669處不包含與具有胺基酸序列SEQ ID NO: 6之野生型PglB有關的胺基酸序列,且較佳包含胺基酸序列SEQ ID NO: 6。
在一個實施例中,Ox
-抗原為O75抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V。
在一特定態樣中,提供一種製得共價連接至載體蛋白之大腸桿菌Ox
-抗原多醣之生物結合物的方法,該方法包含:
(i)提供包含以下之重組宿主細胞:
a.該Ox
-抗原多醣之rfb
基因叢核苷酸序列;
b.編碼包含至少一個醣基化位點之該載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO: 1,較佳具有SEQ ID NO: 2之醣基化共同序列;及
c.編碼寡醣基轉移酶PglBy
之核苷酸序列;及
(ii)在用於製備該生物結合物之條件下培養該重組宿主細胞,
其中該PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V,
其中Ox
-抗原為O1A抗原多醣、葡糖基化O4抗原多醣、O6A抗原多醣、O15抗原多醣、O16抗原多醣或O75抗原多醣,且當Ox
-抗原為葡糖基化O4抗原多醣時,重組宿主細胞進一步包含編碼與SEQ ID NO: 4具有至少80%一致性之葡糖基轉移酶GtrS且能夠藉由添加葡萄糖來修飾大腸桿菌O4抗原多醣以產生大腸桿菌葡糖基化O4抗原多醣,及分別與SEQ ID NO: 7及8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化,及
其中該等O1A、葡糖基化O4、O6A、O15、O16及O75抗原多醣分別具有式(O1A)、(O4-Glc+)、(O6A)、(O15)、(O16)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
在某些實施例中,該方法進一步包含自重組宿主細胞分離生物結合物。
在某些實施例中,載體蛋白係選自由以下組成之群:解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌(S . aureus
)溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌(Streptococcus pneumoniae
)溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌(Neisseria meningitidis
)之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌(Haemophilus influenzae
)之蛋白D。
在某些實施例中,載體蛋白為解毒之綠膿桿菌外毒素A (EPA)。較佳地,EPA載體蛋白包含1-10個、較佳2-4個、更佳4個醣基化位點。在某些實施例中,各醣基化位點包含具有SEQ ID NO: 2之醣基化共同序列。在一特定實施例中,EPA載體蛋白包含SEQ ID NO: 3。
在某些實施例中,重組宿主細胞為大腸桿菌細胞,例如大腸桿菌K-12菌株,諸如菌株W3110。
在另一態樣中,提供一種生物結合物,其藉由如本文所述的製得共價連接至載體蛋白之Ox
抗原多醣的生物結合物的方法製備。
在另一態樣中,提供一種包含此類生物結合物之組合物。在一些實施例中,組合物包含至少2個、較佳至少3個、更佳至少5個、再更佳至少7個此類生物結合物。
在某些實施例中,根據本發明之組合物包含共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣之生物結合物,其中葡糖基化O4抗原多醣具有如表1中所示之式(O4-Glc+)之結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。在某些實施例中,根據本發明之組合物進一步包含共價連接至載體蛋白之大腸桿菌O25B抗原多醣之至少一種生物結合物,其中O25B抗原多醣具有如表1中所示之式(O25B)之結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。在某些實施例中,根據本發明之組合物進一步包含共價連接至載體蛋白之大腸桿菌O2抗原多醣的至少一種生物結合物,其中O2抗原多醣具有如表1中所示之式(O2)之結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
在某些實施例中,本發明之組合物包含:(i)共價偶合至載體蛋白之大腸桿菌O1A抗原多醣之生物結合物,(ii)共價偶合至載體蛋白之大腸桿菌O2抗原多醣之生物結合物,(iii)共價偶合至載體蛋白之大腸桿菌葡糖基化O4抗原多醣之生物結合物,(iv)共價偶合至載體蛋白之大腸桿菌O6A抗原多醣之生物結合物,(v)共價偶合至載體蛋白之大腸桿菌O8抗原多醣之生物結合物, (vi) 共價偶合至載體蛋白之大腸桿菌O15抗原多醣之生物結合物,(vii) 共價偶合至載體蛋白之大腸桿菌O16抗原多醣之生物結合物,(viii) 共價偶合至載體蛋白之大腸桿菌O25B抗原多醣之生物結合物,及(ix) 共價偶合至載體蛋白之大腸桿菌O75抗原多醣之生物結合物,其中O1A、O2、葡糖基化O4、O6A、O8、O15、O16、O25B及O75抗原多醣分別具有式(O1A)、(O2)、(O4-Glc+)、(O6A)、(O8)、(O15)、(O16)、(O25B)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。在某些實施例中,此類組合物進一步包含:(x)共價偶合至載體蛋白之大腸桿菌O18A抗原多醣之生物結合物,其中O18A抗原多醣具有如表1中所示之式(O18A)結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。在某些實施例中,本發明之組合物為免疫原性組合物。
在其他態樣中,提供一種對個體進行疫苗接種來對抗腸外病原性大腸桿菌(ExPEC)之方法,其包含向個體投與如本文所描述之此類生物結合物或組合物。在其他態樣中,提供如本文所描述之此類生物結合物或組合物,其用於疫苗接種來對抗腸外病原性大腸桿菌(ExPEC)。
在其他態樣中,提供用於製得共價連接至載體蛋白之大腸桿菌Ox
抗原多醣之生物結合物的重組宿主細胞,該重組宿主細胞包含:
(a) Ox
-抗原多醣之rfb
基因叢核苷酸序列;
(b)編碼包含至少一個醣基化位點之載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO: 1,較佳具有SEQ ID NO: 2之醣基化共同序列;及
(c)編碼寡醣基轉移酶PglBy
之核苷酸序列,
其中:
當該Ox
-抗原為O1A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為葡糖基化O4抗原多醣時,該PglBy
包含胺基酸突變N311V或胺基酸突變Y77H及N311V,且該重組宿主細胞進一步包含編碼葡糖基轉移酶GtrS的序列,該葡糖基轉移酶GtrS與SEQ ID NO: 4具有至少80%一致性且能夠藉由添加葡萄糖修飾大腸桿菌O4抗原多醣以產生該大腸桿菌葡糖基化O4抗原多醣,及編碼分別與SEQ ID NO: 7及8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化;
當該Ox
-抗原為O6A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O6A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O15抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O16抗原多醣時,該PglBy
包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V;
當該Ox
-抗原為O18A抗原多醣時,該PglBy
在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;及
當該Ox
-抗原為O75抗原多醣時,該PglBy
包含胺基酸突變N311V,
其中在各種情況下,該等胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB,及
其中該等O1A、葡糖基化O4、O6A、O8、O15、O16、O18A及O75抗原多醣分別具有式(O1A)、(O4-Glc+)、(O6A)、(O8)、(O15)、(O16)、(O18A)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
在某些實施例中,提供此類宿主細胞,其中Ox
-抗原為O1A抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為葡糖基化O4抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V。在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為葡糖基化O4抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變Y77H及N311V。在其中Ox
-抗原為葡糖基化O4抗原多醣之某些實施例中,重組宿主細胞進一步包含編碼具有胺基酸序列SEQ ID NO: 4之GtrS的序列及分別編碼具有胺基酸序列SEQ ID NO: 7及8之GtrA及GtrB的核苷酸序列。
在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為O6A抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為O8抗原多醣,PglBy
在位置77、80、287、289、311、482、483及669處相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB不包含胺基酸突變。
在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為O15抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為O16抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V。
在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為O18A抗原多醣,PglBy
在位置77、80、287、289、311、482、483及669處相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB不包含胺基酸突變。
在某些實施例中,提供本發明之重組宿主細胞,其中Ox
-抗原為O75抗原多醣,PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V。
在某些實施例中,提供本發明之重組宿主細胞,其中載體蛋白係選自由以下組成之群:解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌之蛋白D。
在某些實施例中,提供本發明之重組宿主細胞,其中載體蛋白為解毒之綠膿桿菌外毒素A (EPA)。在其某些實施例中,EPA載體蛋白包含1-10個、較佳2-4個、更佳4個醣基化位點。在某些實施例中,各醣基化位點包含具有SEQ ID NO: 2之醣基化共同序列。在某些實施例中,EPA載體蛋白包含SEQ ID NO: 3。
在某些實施例中,提供本發明之重組宿主細胞,其中重組宿主細胞為大腸桿菌細胞,例如大腸桿菌K-12菌株,諸如菌株W3110。
在用於製得共價連接至根據本發明之載體蛋白的大腸桿菌葡糖基化O4抗原多醣之生物結合物的宿主細胞及方法之某些實施例中,大腸桿菌O4抗原多醣之rfb
基因叢包含編碼產生大腸桿菌O4抗原多醣(表1中之式(O4-Glc-))之酶且與SEQ ID NO: 9至少80% (例如至少90%,例如至少95%,例如至少98%)一致的序列。在某些實施例中,rfb
基因叢包含SEQ ID NO: 9。
在用於製得共價連接至本發明之載體蛋白的大腸桿菌葡糖基化O4抗原多醣之生物結合物的宿主細胞及方法的某些實施例中,能夠修飾大腸桿菌O4抗原多醣以產生大腸桿菌葡糖基化O4抗原多醣之葡糖基轉移酶具有與SEQ ID NO: 4具有至少90%、較佳至少95%、較佳至少98%序列一致性之胺基酸序列。在某些實施例中,葡糖基轉移酶包含SEQ ID NO: 4。
在用於製得共價連接至本發明之載體蛋白的大腸桿菌葡糖基化O4抗原多醣之生物結合物的宿主細胞及方法的某些實施例中,易位酶能夠使與細菌萜醇連接之葡萄糖易位且與SEQ ID NO: 7具有至少90%、較佳至少95%、較佳至少98%序列一致性。在某些實施例中,易位酶包含SEQ ID NO: 7。
在用於製得共價連接至根據本發明之載體蛋白的大腸桿菌葡糖基化O4抗原多醣之生物結合物的宿主細胞及方法之某些實施例中,醣基轉移酶能夠使細菌萜醇葡糖基化且與SEQ ID NO: 8具有至少90%、較佳至少95%、較佳至少98%序列一致性。在某些實施例中,醣基轉移酶包含SEQ ID NO: 8。
相關申請案之交叉引用
本申請案主張2019年3月18日申請之美國臨時申請案第62/819,762號之優先權,其揭示內容以全文引用之方式併入本文中。
對以電子方式提交之序列表之參考
本申請案含有序列表,該序列表係以2020年3月11日創建的檔案名稱為「004852_11612_Sequence-Listing」且大小為199 KB之ASCII格式序列表經由EFS-Web以電子方式提交。此經由EFS-Web提交之序列表係說明書之一部分且以全文引用的方式併入本文中。
先前技術及本說明書通篇引用或描述各種出版物、文章及專利;該等參考文獻各自以全文引用的方式併入本文中。本說明書中所包括的文獻、操作、材料、器件、文章或類似物之論述係出於提供本發明之內容的目的。此類論述並非承認任何或所有此等內容形成關於所揭示或所主張之任何發明之現有技術的一部分。
除非另外定義,否則本文所用的所有技術及科學術語均具有與本發明所屬領域的一般技術者通常所理解相同的含義。另外,本文中使用之某些術語具有如本說明書中所述之含義。
必須注意,除非上下文另有明確規定,否則如本文及隨附申請專利範圍中所用,單數形式「一(a)」、「一(an)」及「該(the)」包括複數個提及物。
除非另外指示,否則在一系列要素之前的術語「至少」應理解為指該系列中之每一要素。
熟習此項技術者將認識到或使用至多常規實驗即能夠明確本文所述之本發明之特定實施例的許多等效物。本發明意欲涵蓋此類等效物。
在本說明書通篇及隨後的申請專利範圍中,除非上下文另有要求,否則詞語「包含(comprise)」及變化形式諸如「包含(comprises)」及「包含(comprising)」應理解為暗示包括一個所述整數或步驟或者一組整數或步驟,但不排除任何其他整數或步驟或者整數或步驟組。當在本文中使用時,術語「包含」可以用術語「含有」或「包括」取代,或有時當在本文中使用時,用術語「具有」取代。
當在本文中使用時,「由……組成」排除所主張要素中未規定之任何要素、步驟或成分。當在本文中使用時,「基本上由……組成」不排除不會實質上影響技術方案之基本及新穎特徵之材料或步驟。每當本文中在本發明之態樣或實施例之上下文中使用時,前述術語「包含」、「含有」、「包括」及「具有」中之任一個可以用術語「由……組成」或「基本上由……組成」替代以改變本發明之範疇。
如本文中所用,多個所述要素之間的合取術語「及/或」理解為涵蓋單獨及組合選項。舉例而言,當兩個要素藉由「及/或」連結時,第一個選擇係指第一要素之適用性,不含第二要素。第二個選擇係指第二要素之適用性,不含第一要素。第三個選擇係指第一要素與第二要素一起之適用性。此等選擇中之任一個應理解為在該含義之範圍內,且因此滿足如本文所使用之術語「及/或」之要求。該等選擇中多於一個之同時適用性亦應理解為在該含義之範圍內,且因此滿足術語「及/或」之要求。
鑑別出大腸桿菌O4血清型內之O-抗原結構修飾(即葡萄糖分支) (Jann等人, 1993)對發現及研發靶向此血清型內之細菌分離株的醣結合物疫苗提出了挑戰。未知表現未經修飾(不具有葡萄糖側分支)及經修飾(具有葡萄糖側分支)形式之O4 O-抗原的臨床當代O4分離株之比例。獲得的關於此特徵之資訊對於選擇相關抗原結構而言至關重要。另外,尚未確定疫苗誘導之抗體引發成一種形式之O4多醣與另一形式交叉反應的程度。不含脂質A之O-抗原純化及隨後與載體蛋白之結合為漫長且費勁的過程。另外,純化、脂質A解毒及化學結合過程會引起抗原決定基喪失、抗原異質性及結合之多醣的免疫原性降低。藉由生物結合合成醣結合物可克服傳統純化及化學結合之此等侷限性,但活體內合成葡萄糖分支型O4 O-抗原需要多醣分支酶之活性,該多醣分支酶處於rfb
基因叢外。迄今為止,尚未鑑別出負責O4 大腸桿菌菌株中之葡萄糖分支的O-抗原修飾酶。將O4rfb
基因叢選殖至表現PglB之生物結合大腸桿菌菌株中將不足以合成葡萄糖分支型O4醣結合物,而是將僅製備非葡萄糖分支型O4生物結合物(其聚醣之結構展示於表1中之式(O4)中)。如本文所用,術語「葡糖基化O4」、「葡萄糖分支型O4」、「O4 Glc+」及「Glc+ O4」O-抗原係指具有葡萄糖側分支之O4 O-抗原,且其結構展示於表1之式(O4-Glc+)中。
本文揭示編碼負責大腸桿菌O4抗原多醣之葡萄糖分支的O-抗原修飾酶的基因。本文亦揭示宿主細胞,例如以重組方式經工程改造的包含編碼能夠產生生物結合物之酶之核酸的宿主細胞,該等生物結合物包含活體內共價鍵結至載體蛋白之葡糖基化O4抗原多醣。此類宿主細胞可用於製備包含連接至載體蛋白之葡糖基化O4抗原的生物結合物,該等生物結合物可用於例如治療性及/或預防性組合物(例如疫苗)之調配物中。本文進一步提供包含單獨的葡糖基化O4抗原多醣或與其他大腸桿菌抗原(例如O1、O2、O6、O8、O15、O16、O18、O25及/或O75抗原多醣及其子血清型)組合之生物結合物的組合物。組合物可用於預防性及/或治療性方法中,例如對宿主進行疫苗接種來對抗大腸桿菌感染,且適用於製備抗體,該等抗體可用於例如治療性方法中,諸如用於對個體免疫接種。
如此處所用,術語「O-抗原」、「O-抗原多醣」、「O-抗原醣」、及「OPS」係指革蘭氏陰性細菌之O-抗原。通常,O-抗原為免疫原性重複多醣單元之聚合物。在一特定實施例中,術語「O-抗原」、「O-抗原多醣」、「OPS」係指大腸桿菌之O-抗原。不同血清型之大腸桿菌表現不同的O-抗原。在大腸桿菌中,涉及O-抗原生物合成之基因產物由rfb
基因叢編碼。
如本文所用,「rfb
簇」及「rfb
基因叢」係指編碼能夠合成O-抗原主鏈結構之酶促機制的基因叢。術語rfb
簇可適用於任何O-抗原生物合成簇,且較佳地係指來自埃希氏桿菌(Escherichia
),尤其大腸桿菌(大腸桿菌)之基因叢。
如本文所用,術語「O1A」係指大腸桿菌之O1A抗原(大腸桿菌血清型O1之子血清型)。術語「O2」係指大腸桿菌之O2抗原(大腸桿菌血清型O2)。術語「O6A」係指大腸桿菌之O6A抗原(大腸桿菌血清型O6之子血清型)。The 術語「O8」係指大腸桿菌之O8抗原(大腸桿菌血清型O8)。術語「O15」係指大腸桿菌之O15抗原(大腸桿菌血清型O15)。術語「O16」係指大腸桿菌之O16抗原(大腸桿菌血清型O16)。術語「O18A」係指大腸桿菌之O18A抗原(大腸桿菌血清型O18A之子血清型)。術語「O25B」係指來自大腸桿菌之O25B抗原(大腸桿菌血清型O25B之子血清型)。術語「O75」係指大腸桿菌之O75抗原(大腸桿菌血清型O75)。
下表1中展示本申請案通篇中所提及之大腸桿菌O-抗原多醣之結構。展示各大腸桿菌O-抗原多醣之單一重複單元。表 1
:大腸桿菌O-抗原多醣之結構
1
各n獨立地為整數1至100,諸如1-50、1-40、1-30、1-20及1-10、3-50、3-40,例如至少5,諸如5-40,例如7-30,例如7-25,例如10-20,但在一些情況下,可為1-2。
| 大腸桿菌 O - 抗原多醣 | 重複單元之結構 1 |
| 非葡糖基化O4抗原多醣(O4-Glc-) | |
| 葡糖基化O4抗原多醣(O4-Glc+) | |
| O1A抗原多醣(O1A) | |
| O2抗原多醣(O2) | |
| O6A抗原多醣(O6) | |
| O8抗原多醣(O8) | |
| O15抗原多醣(O15) | |
| O16抗原多醣(O16) | |
| O18A抗原多醣(O18A) | |
| O25B抗原多醣(O25B) | |
| O75抗原多醣(O75) |
本文所述之所有單醣均具有其在此項技術中已知之常見含義。單醣可具有D或L組態。若未規定D或L,則將糖理解為具有D組態。單醣通常藉由此項技術中通常已知並使用的縮寫來指代。舉例而言,Glc係指葡萄糖;D-Glc係指D-葡萄糖;且L-Glc係指L-葡萄糖。單醣之其他常見縮寫包括:Rha,鼠李糖;GlcNAc,N-乙醯葡萄胺糖;GalNAc,N-乙醯半乳胺糖;Fuc,海藻糖;Man,甘露糖;Man3Me,3-O-甲基-甘露糖;Gal,半乳糖;FucNAc,N-乙醯海藻胺糖;及Rib,核糖。字尾「f」係指呋喃糖且字尾「p」係指哌喃糖。
如關於O-抗原所使用之術語「RU」、「重複單元(repeat unit)」、及「重複單元(repeating unit)」係指O-抗原在其藉由細胞機制(例如醣基轉移酶)而在活體內合成時的生物重複單元(BRU)。O-抗原之RU之數目可根據血清型變化,且在本發明之實施例中通常在約1-100個RU,較佳約1至50個RU (諸如1-50個RU、1-40個RU、1-30個RU、1-20個RU及1-10個RU),且更佳在至少3個RU、至少4個RU、至少5個RU(諸如3-50個RU,較佳地5-40個RU,例如7-25個RU,例如10-20個RU)範圍內變化。然而,在一些情況下,O-抗原之RU數目可為1-2。本文中特定描述之各O-抗原之結構展示為含有一個RU,其中變量「n」指明RU之數目。在本發明生物結合物中之各O-抗原多醣中,n獨立地為整數1-100,諸如1-50、1-40、1-30、1-20、1-10,較佳至少3,更佳至少5,諸如3-50,較佳5-40 (例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40),但在一些情況下可為1-2。在一些實施例中,n獨立地為約7-25之整數,例如約10-20。組合物中的各個O-抗原多醣之間的值可變化,且此處以平均值形式提供,亦即若生物結合物在本文中描述為n獨立地為5-40之整數,則組合物含有大多數具有5-40個重複單位之O-抗原多醣,但亦可含有一些具有少於5個重複單位或多於40個重複單位之O-抗原多醣。
術語「醣結合物」係指連接至另一化學物種的糖或醣抗原(例如,寡醣及多醣)-蛋白質結合物,該等化學物質包括但不限於蛋白質、肽、脂質等。醣結合物可以化學方式製得,例如藉由蛋白質與糖或醣抗原之化學(合成)鍵。術語醣結合物亦包括生物結合物。
術語「生物結合物」係指在宿主細胞背景,較佳細菌宿主細胞,例如大腸桿菌宿主細胞中製得之蛋白質(例如載體蛋白)與糖或醣抗原(例如寡醣及多醣)之間的結合物,其中宿主細胞將抗原連接至蛋白質(例如N連接)。較佳地,術語「生物結合物」係指蛋白質(例如載體蛋白)與O-抗原之間的結合物,該O-抗原較佳為在宿主細胞背景中製得之大腸桿菌O-抗原(例如O1A、O2、葡糖基化O4、O6A、O8、O15、O16、O18A、O25B、O75等),其中宿主細胞機制將抗原連接至蛋白質(例如N連接)。因為生物結合物藉由宿主細胞機制在宿主細胞中製得,所以抗原及蛋白質經由醣苷鍵或生物結合物中之鍵共價連接。生物結合物可在經工程改造以表現合成O-抗原及/或將O-抗原連接至靶蛋白所需之細胞機制的重組宿主細胞中製得。如本文所述,生物結合物具有優於以化學方式製得之醣結合物(其中聚醣自細菌細胞壁純化且隨後以化學方式偶合至載體蛋白)的有利特性,例如生物結合物在製造中需要較少化學物質且就所產生之最終產物而言更加恆定,且含有較少或無(亦即,未結合至載體蛋白)聚醣。因此,在典型實施例中,生物結合物優於化學製備之醣結合物。
術語「約」當與數字結合使用時,係指在參考數字之±1、±5或±10%內的任何數字。
相比於構成胺基酸序列之總體長度的胺基酸殘基之數目,術語「序列一致性百分數(%)」或「一致性%」描述兩個或更多個經比對之胺基酸序列的一致胺基酸的匹配(「成功結果」)數目。在其他方面,對於兩個或更多個序列,使用比對,當序列經比較及比對以獲得最大對應性時(如使用此項技術中已知之序列比較演算法所量測),或當手動比對及目視檢查時,可確定相同(例如90%、95%、97%或98%一致性)胺基酸殘基之百分比。因此,供比較以確定序列一致性的序列可能因胺基酸之取代、添加或刪除而不同。適合用於比對蛋白質序列之程式係熟習此項技術者已知的。蛋白質序列之序列一致性百分比可用諸如CLUSTALW、Clustal Omega、FASTA或BLAST之程式,例如使用NCBI BLAST演算法(Altschul SF等人(1997),Nucleic Acids Res. 25:3389-3402)確定。
舉例而言,對於胺基酸序列,可藉由使用此項技術中已知之標準技術確定序列一致性及/或相似性,該等標準技術包括但不限於Smith及Waterman, 1981, Adv. Appl. Math. 2:482之局部序列一致性演算法,Needleman及Wunsch;1970, J. Mol. Biol.48:443之序列一致性比對演算法;Pearson及Lipman, 1988, Proc. Nat. Acad. Sci. U.S.A. 85:2444之搜尋相似性方法;此等演算法之電腦化實施(威斯康辛州麥迪遜市575科學驅動遺傳電腦集團威斯康辛州遺傳套裝軟體(the Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Madison, Wis.)中之GAP、BESTFIT、FASTA及TFASTA);由Devereux等人1984, Nucl. Acid Res. 12:387-395描述之最佳擬合序列程式(Best Fit sequence program)。較佳使用預設設定,或藉由檢驗。在某些實施例中,百分比一致性藉由FastDB基於以下參數計算:錯配罰分1;空隙罰分1;空隙大小罰分0.33;及接合罰分30,「Current Methods in Sequence Comparison and Analysis,」 Macromolecule Sequencing and Synthesis, Selected Methods and Applications, 第127-149頁 (1988), Alan R. Liss, Inc。
有用演算法之另一實例係以下中描述之BLAST演算法:
Altschul等人, 1990, J. Mol. Biol. 215:403-410; Altschul等人, 1997, Nucleic Acids Res. 25:3389-3402; 及Karin等人, 1993, Proc. Natl. Acad. Sci. U.S.A. 90:5873-5787。尤其適用之BLAST程式為自Altschul等人, 1996, Methods in Enzymology 266:460-480獲得之WU-BLAST-2程式。WU-BLAST-2使用若干搜尋參數,其中之大部分設定成預設值。
另一種適用演算法為由Altschul等人, 1993, Nucl. Acids Res. 25:3389-3402報導之空隙BLAST。
術語「侵襲性腸外病原性大腸桿菌(ExPEC)疾病(IED)」在本文中定義為併發有全身性細菌感染之急性疾病,其藉由以下兩者中之一者而在微生物學上得以證實:藉由分離及鑑別來自血液或其他通常無菌身體部位之大腸桿菌,或者藉由分離及鑑別來自患者之尿液的大腸桿菌,該患者展現侵襲性疾病(全身性發炎反應症候群(SIRS)、敗血症或敗血性休克)之病徵及症狀,且無其他可鑑別的感染源。
大腸桿菌
葡糖基化
O
4
抗原多醣生物結合物
在一個態樣中,本文提供一種共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣的生物結合物。如本文所用,術語「O4」係指來自大腸桿菌之O4抗原(大腸桿菌血清型O4)。已知O-抗原結構修飾存在於大腸桿菌O4血清型內。特定言之,一些O4血清型表現具有分支型葡萄糖單元之經修飾之O-抗原。如本文所用,「葡糖基化O4抗原」、「葡糖基化O4抗原多醣」、「O4-Glc+抗原多醣」及「O4-Glc+抗原」係指具有葡萄糖分支之O4抗原(例如大腸桿菌O4抗原),其中D-葡萄糖被連接至重複單元L-Rha→D-Glc→L-FucNAc→D-GlcNAc中之L鼠李糖。在一特定實施例中,大腸桿菌葡糖基化O4抗原多醣包含式(O4-Glc+)之結構,如表1中所示,其中n為1至100之整數。在較佳實施例中,n為整數3至50,例如5至40,例如7至25,例如10至20。
大腸桿菌O4菌株不依賴於葡萄糖分支狀態,攜有編碼負責產生O4抗原多醣之基因的實質上一致之rfb
基因叢。然而,活體內合成具有葡萄糖分支的經修飾之O4抗原需要多醣分支酶之活性,該酶處於rfb
基因叢外部。據本發明人所知,負責對O4抗原之葡萄糖修飾的多醣分支酶的特性迄今為止仍是未知的。此處,本發明人發現負責對O4抗原之葡萄糖修飾的多醣分支酶的序列。鑑別此酶使得能夠製備具有葡萄糖分支之經修飾之O4抗原多醣的生物結合物。O4抗原多醣之葡萄糖修飾形式存在於主要血清型中,且因此可用於提供改良之免疫反應,例如用於預防性或治療性用途。
特定言之,本文提供編碼對大腸桿菌血清型O4具有特異性之葡糖基轉移酶的gtrS
基因之序列,該葡糖基轉移酶使O4抗原葡糖基化。一般而言,gtrA
、gtrB
及gtrS
基因編碼負責O-抗原葡糖基化之酶。雖然不同血清型中之gtrA
及gtrB
基因高度同源且可互換,但gtrS
基因編碼血清型特異性O-抗原葡糖基轉移酶。大腸桿菌血清型O4之gtrS
基因編碼GtrS酶,該酶藉由引入葡萄糖分支來修飾O4抗原。O4血清型之當代臨床大腸桿菌分離株之表徵揭示在78%測試分離株中存在gtrS
,指示經添加葡萄糖殘基修飾之大腸桿菌O4抗原多醣在當前感染之分離株中為主要的。
在一個實施例中,本文提供來自編碼GtrS葡糖基轉移酶之大腸桿菌血清型O4的gtrS
基因之核酸,該葡糖基轉移酶包含胺基酸序列SEQ ID NO: 4。在另一實施例中,gtrS
核酸編碼GtrS蛋白質,其來自大腸桿菌血清型O4 (與SEQ ID NO: 4之胺基酸序列約80%、85%、90%、95%、96%、97%、98%、99%或100%一致的,較佳與SEQ ID NO: 4之胺基酸序列98%、99%或100%一致的)。與SEQ ID NO: 4之胺基酸序列至少80%一致的GtrS蛋白質能夠特異性地使大腸桿菌O4抗原多醣葡糖基化,獲得具有如表1中所示之式(O4-Glc+)之結構的葡糖基化O4抗原。一般熟習此項技術者將能夠製成與SEQ ID NO: 4具有至少80%序列一致性的SEQ ID NO: 4之GtrS蛋白質之突變形式,且鑒於本發明,測試此類序列之大腸桿菌O4抗原之葡糖基化活性。包含編碼大腸桿菌血清型O4之葡糖基轉移酶GtrS基因的核酸序列的重組宿主細胞及重組宿主細胞在製備經葡萄糖修飾之O4抗原多醣及其生物結合物中的用途更詳細地描述於下文中。
經gtrA
及gtrB
編碼之蛋白質的序列,充當與細菌萜醇連接之葡萄糖易位酶(GtrA,將內部膜上的與細菌萜醇連接之葡萄糖翻轉至周質)及細菌萜醇葡糖基轉移酶(GtrB,將葡萄糖連接至細菌萜醇),可分別包含與SEQ ID NO: 7及8至少約80%一致的胺基酸序列。在某些實施例中,編碼分別與SEQ ID NO: 7及8至少約80%、85%、90%、95%、96%、97%、98%、99%或100%一致且分別具有與細菌萜醇連接之葡萄糖易位酶及細菌萜醇葡糖基轉移酶活性的GtrA及GtrB蛋白質之核酸序列,亦分別存在於本發明之宿主細胞中,該等核酸序列進一步包含O4-特異性rfb
基因座、編碼上文所述之序列的O4-特異性GtrS、如本文所述之寡醣基轉移酶及編碼具有一或多個如本文所述之醣基化共同序列之載體蛋白的序列,以製備大腸桿菌葡糖基化O4血清型(包含表1中之式(O4-Glc+)之聚醣結構)的生物結合物。
本文所提供之大腸桿菌葡糖基化O4抗原多醣生物結合物較佳藉由醣苷鍵共價連接至載體蛋白。可使用熟習此項技術者鑒於本發明已知之任何載體蛋白。適合的載體蛋白包含但不限於解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌之蛋白D。已描述與含有所需共同醣基化序列之各種不同載體蛋白的生物結合,展示可使用此技術使多種蛋白質醣基化(參見例如WO 06/119987、WO 2015/124769、WO 2015/158403、WO 2015/82571、WO 2017/216286及WO 2017/67964,其一起展示廣泛多種成功用於生物結合之載體蛋白)。
在某些實施例中,載體蛋白經修飾,例如以使得蛋白質毒性較低且/或更易於醣基化之方式經修飾。在一特定實施例中,本文所使用之載體蛋白經修飾,使得載體蛋白中醣基化位點之數目以允許待投與(例如以免疫原性組合物,尤其以其生物結合物形式)之蛋白質之較低濃度的方式最大化。
因此,在某些實施例中,本文所述之載體蛋白經修飾以包括1、2、3、4、5、6、7、8、9、10個或比通常與載體蛋白相關之醣基化位點多的醣基化位點(例如相對於與原生/天然的,亦即「野生型」狀態的載體蛋白相關之醣基化位點的數目)。可如下實現醣基化位點至載體蛋白中的引入:藉由例如添加新胺基酸至蛋白質之一級結構來將醣基化共同序列插入至蛋白質之一級結構中之任何位置,以使得醣基化位點完全或部分地添加,或藉由使蛋白質中之現有胺基酸突變以產生醣基化位點。一般熟習此項技術者將認識到,蛋白質之胺基酸序列可容易使用此項技術中已知之方法,例如包括對編碼蛋白質之核酸序列之修飾的重組方法來修飾。在特定實施例中,醣基化共同序列被引入至載體蛋白之特定區域,例如蛋白質之表面結構中,蛋白質之N或C末端處,及/或藉由在蛋白質之鹼基處的二硫橋鍵穩定之環中。在一些實施例中,可藉由添加離胺酸殘基以更有效醣基化來延長醣基化共同序列。
可插入至載體蛋白中或在載體蛋白中產生的醣基化共同序列之例示性實例包括:Asn-X-Ser(Thr),其中X可為除Pro (SEQ ID NO: 1)以外之任何胺基酸;及Asp(Glu)-X-Asn-Z-Ser(Thr),其中X及Z獨立地選自除Pro (SEQ ID NO: 2)以外之任何胺基酸。
在一些實施例中,大腸桿菌葡糖基化O4抗原多醣共價連接至載體蛋白中之天冬醯胺(Asn)殘基(例如N連接),其中Asn殘基存在於包含具有SEQ ID NO: 1、更佳具有SEQ ID NO: 2之醣基化共同序列的醣基化位點中。通常,載體蛋白包含1-10個醣基化位點,較佳2至4個醣基化位點,最佳4個醣基化位點,諸如1-10個、較佳2-4個且更佳4個醣基化位點,該等醣基化位點各自包含具有胺基酸序列SEQ ID NO: 1,且更佳胺基酸序列SEQ ID NO: 2之醣基化共同序列。
在特定實施例中,載體蛋白為解毒之綠膿桿菌外毒素A。對於EPA,各種解毒蛋白變異體已描述於文獻中且可用作載體蛋白。舉例而言,根據Lukac等人, 1988,Infect Immun
, 56: 3095-3098, 及Ho等人, 2006,Hum Vaccin
, 2:89-98,可藉由使催化必需的殘基L552V及ΔE553突變及對其刪除來實現解毒。如本文所用,「EPA」係指解毒之綠膿桿菌外毒素A。在其中載體蛋白為EPA之彼等實施例中,大腸桿菌葡糖基化O4抗原多醣可共價連接至包含具有SEQ ID NO: 1之醣基化共同序列的醣基化位點中之Asn殘基,且較佳共價連接至包含具有SEQ ID NO: 2之醣基化共同序列的醣基化位點中之Asn殘基。較佳地,EPA載體蛋白包含1-10個醣基化位點,較佳2至4個醣基化位點,最佳4個醣基化位點,諸如1-10個、較佳2-4個且更佳4個醣基化位點,該等醣基化位點各自包含具有胺基酸序列SEQ ID NO: 1,且更佳胺基酸序列SEQ ID NO: 2之醣基化共同序列。
在一些實施例中,EPA載體蛋白包含四個各自包含醣基化共同序列之醣基化位點,例如包含具有SEQ ID NO: 2之醣基化共同序列的醣基化位點。如本文所用,「EPA-4載體蛋白」及「EPA-4」係指包含四個醣基化位點的解毒之綠膿桿菌外毒素A載體蛋白,該等醣基化位點各自包含具有SEQ ID NO: 2之醣基化共同序列。EPA-4載體蛋白之例示性較佳實例為包含胺基酸序列SEQ ID NO: 3之EPA載體蛋白。
組合物
在另一態樣中,本文提供一種組合物,其包含共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣的生物結合物。本文所提供之組合物可包括共價連接至本文所述之載體蛋白(例如EPA)的任何大腸桿菌葡糖基化O4抗原多醣的生物結合物。
在一些實施例中,組合物為免疫原性組合物。如本文所用,「免疫原性組合物」係指可在組合物所投與之宿主或個體中引發免疫反應的組合物。免疫原性組合物可進一步包含醫藥學上可接受之載劑。在一些實施例中,組合物為進一步包含醫藥學上可接受之載劑的醫藥組合物。如本文所用,「醫藥學上可接受之載劑」係指與組合物一起投與之稀釋劑、佐劑、賦形劑或媒劑,且無毒並且不應干擾活性成分之功效。舉例而言,生理鹽水及右旋糖水溶液及甘油溶液亦可用作液體載劑,尤其用於可注射溶液。適合之賦形劑包括澱粉、葡萄糖、乳糖、蔗糖、明膠、麥芽、稻穀、麵粉、白堊、矽膠、硬脂酸鈉、甘油單硬脂酸酯、滑石、氯化鈉、脫脂奶粉、甘油、丙烯、二醇、水、乙醇及其類似物。適合之醫藥學上可接受之載劑之其他實例描述於E.W. Martin之「Remington's Pharmaceutical Sciences」中。
在一個實施例中,本發明之組合物包含本發明生物結合物於pH 7.4的Tris緩衝生理鹽水(TBS) (例如含有Tris、NaCl及KCl,例如分別為25 mM、137 mM及2.7 mM)中。在其他實施例中,本發明之組合物包含本發明生物結合物於約10 mM,pH為約7.0的KH2
PO4
/Na2
HPO4
緩衝液中,該緩衝液具有約5% (w/v)山梨糖醇、約10 mM甲硫胺酸及約0.02% (w/v)聚山梨醇酯80。在其他實施例中,本發明之組合物包含本發明生物結合物於約10 mM,pH為約7.0的KH2
PO4
/Na2
HPO4
緩衝液中,該緩衝液具有約8% (w/v)蔗糖、約1 mM EDTA及約0.02% (w/v)聚山梨醇酯80 (有關用於共價鍵結至EPA載體蛋白之大腸桿菌O-抗原之生物結合物的適合緩衝液,參見例如WO 2018/077853)。
在一些實施例中,本文所述之組合物為單價調配物,且含有一種大腸桿菌O-抗原多醣,例如呈經分離形式或作為醣結合物或生物結合物之一部分,諸如大腸桿菌葡糖基化O4抗原多醣。本文亦提供作為多價組合物,例如二價、三價、四價等組合物之組合物(例如醫藥及/或免疫原性組合物)。舉例而言,多價組合物包含超過一種抗原,諸如大腸桿菌O-抗原、其醣結合物或生物結合物。在特定實施例中,本文所提供之多價組合物包含大腸桿菌葡糖基化O4抗原多醣生物結合物及至少一種額外抗原。
在一個實施例中,組合物(例如醫藥及/或免疫原性組合物)係包含共價連接至如本文所述之載體蛋白的大腸桿菌葡糖基化O4抗原多醣之雙結合物的單價組合物。
在另一實施例中,組合物(例如醫藥及/或免疫原性組合物)為多價組合物,其包含共價連接至如本文所述之載體蛋白的大腸桿菌葡糖基化O4抗原多醣及至少一種其他抗原。
在一些實施例中,額外抗原為抗原醣或多醣,更佳為大腸桿菌O-抗原多醣,諸如O1、O2、O6、O8、O15、O16、O18、O25及O75血清型及其子血清型中之一或多者的大腸桿菌O-抗原。在一些實施例中,其他大腸桿菌O-抗原多醣中之每一者為醣結合物,意謂大腸桿菌O-抗原多醣諸如藉由化學或酶促方法共價連接至另一化學物種,例如蛋白質、肽、脂質等,最佳載體蛋白。在較佳實施例中,額外大腸桿菌O-抗原多醣中之每一者為生物結合物,其中O-抗原多醣經由宿主細胞機制酶促之醣苷鍵而共價連接至例如載體蛋白。本文所提供之組合物在某些實施例中可包含1-20種額外醣結合物,更佳地大腸桿菌O-抗原多醣生物結合物,諸如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20種額外醣結合物,或較佳大腸桿菌O-抗原多醣生物結合物。其他抗原可包括於本文所提供之組合物中,諸如肽、蛋白質或脂質抗原等。
在一些實施例中,組合物(例如醫藥及/或免疫原性組合物)包含大腸桿菌葡糖基化O4抗原多醣生物結合物及選自由以下組成之群的至少一種額外抗原多醣:大腸桿菌O1A抗原多醣、大腸桿菌O2抗原多醣、大腸桿菌O6A抗原多醣、大腸桿菌O8抗原多醣、大腸桿菌O15抗原多醣、大腸桿菌O16抗原多醣、大腸桿菌O18A抗原多醣、大腸桿菌O25B抗原多醣及大腸桿菌O75抗原多醣。較佳地,額外的O-抗原多醣中之每一者共價連接至載體蛋白,且更佳為生物結合物。
在一個實施例中,O1A抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分)用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O1A抗原多醣包含如表1中所示之式(O1A)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O1A抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O2抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分)用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O2抗原多醣包含如表1中所示之式(O2)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O2抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O6A抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分) 用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O6A抗原多醣包含如表1中所示之式(O6A)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O6A抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O8抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分) 用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O8抗原多醣包含如表1中所示之式(O8)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O8抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O15抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分) 用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O15抗原多醣包含如表1中所示之式(O15)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O15抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O16抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分) 用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O16抗原多醣包含如表1中所示之式(O16)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O16抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O18A抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分) 用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O18A抗原多醣包含如表1中所示之式(O18A)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O18A抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O25B抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分) 用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O25B抗原多醣包含如表1中所示之式(O25B)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O25B抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在一個實施例中,O75抗原多醣(例如呈分離形式或作為醣結合物或生物結合物之一部分) 用於本文所提供之組合物中(例如與葡糖基化O4抗原多醣或其生物結合物組合)。在一特定實施例中,O75抗原多醣包含如表1中所示之式(O75)之結構,其中n為整數1-100,較佳3-50,例如5-40,例如7至25,例如10至20。較佳地,O75抗原多醣為生物結合物之一部分且共價連接至載體蛋白,例如EPA。
在另一實施例中,組合物(例如醫藥及/或免疫原性組合物)至少包含大腸桿菌O1A抗原多醣、大腸桿菌O2抗原多醣、大腸桿菌葡糖基化O4抗原多醣、大腸桿菌O6A抗原多醣及大腸桿菌O25B抗原多醣,較佳共價連接至載體蛋白,例如EPA (亦即五價組合物)之O1A、O2、葡糖基化O4、O6A及O25B抗原多醣的生物結合物。
在一較佳實施例中,組合物(例如醫藥及/或免疫原性組合物)包含至少大腸桿菌O1A抗原多醣、大腸桿菌O2抗原多醣、大腸桿菌葡糖基化O4抗原多醣、大腸桿菌O6A抗原多醣、大腸桿菌O8抗原多醣、大腸桿菌O15抗原多醣、大腸桿菌O16抗原多醣、大腸桿菌O25B抗原多醣及大腸桿菌O75抗原多醣,較佳共價連接至載劑蛋白質,例如EPA (亦即9價組合物)之O1A、O2、葡糖基化O4、O6A、O8、O15、O16、O25B及O75抗原多醣的生物結合物。
在另一較佳實施例中,組合物(例如醫藥及/或免疫原性組合物)包含至少大腸桿菌O1A抗原多醣、大腸桿菌O2抗原多醣、大腸桿菌葡糖基化O4抗原多醣、大腸桿菌O6A抗原多醣、大腸桿菌O8抗原多醣、大腸桿菌O15抗原多醣、大腸桿菌O16抗原多醣、大腸桿菌O18A抗原多醣、大腸桿菌O25B抗原多醣及大腸桿菌O75抗原多醣,較佳共價連接至載體蛋白,例如EPA (亦即10價組合物)之O1A、O2、葡糖基化O4、O6A、O8、O15、O16、O18A、O25B及O75抗原多醣的生物結合物。
本文亦涵蓋視情況進一步包含來自其他大腸桿菌血清型之額外O-抗原(例如呈分離形式或作為醣結合物或生物結合物之部分)的組合物。
在一些實施例中,額外大腸桿菌O1A、O2、O6A、O8、O15、O16、O18A、O25B及/或O75抗原多醣中之每一者共價連接至載體蛋白。O-抗原多醣可藉由化學或其他合成方法連接至載體蛋白,或O-抗原多醣可為生物結合物之一部分,且較佳為生物結合物之一部分。可使用熟習此項技術者鑒於本發明已知之任何載體蛋白。適合的載體蛋白包括但不限於解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌之蛋白D。較佳地,載體蛋白為EPA。
在一些實施例中,額外大腸桿菌O1A、O2、O6A、O8、O15、O16、O18A、O25B及/或O75抗原多醣中之每一者尤其在生物結合物之一部分共價連接至載體蛋白中之天冬醯胺(Asn)殘基時,其中Asn殘基存在於包含醣基化共同序列Asn-X-Ser(Thr)之醣基化位點中,其中X可為除Pro (SEQ ID NO: 1)外之任何胺基酸,較佳地其中Asn殘基存在於包含醣基化共同序列Asp(Glu)-X-Asn-Z-Ser(Thr)之醣基化位點中,其中X及Z獨立地選自除Pro (SEQ ID NO: 2)之任何胺基酸。載體蛋白可包含1-10個醣基化位點,較佳2至4個醣基化位點,最佳4個醣基化位點,該等醣基化位點各自包含醣基化共同序列。在一特定實施例中,載體蛋白為EPA-4載體蛋白,例如包含胺基酸序列SEQ ID NO: 3之EPA-4載體蛋白。
在一特定實施例中,本文提供一種組合物(例如醫藥及/或免疫原性組合物),其包含:(i)共價連接至解毒之綠膿桿菌外毒素A載體蛋白的大腸桿菌葡糖基化O4抗原多醣的生物結合物,該載體蛋白包含SEQ ID NO: 3 (EPA-4載體蛋白),其中大腸桿菌葡糖基化O4抗原多醣包含式(O4-Glc+)之結構;(ii)共價連接至EPA-4載體蛋白之大腸桿菌O1A抗原多醣的生物結合物,其中該大腸桿菌O1A抗原多醣包含式(O1A)之結構;(iii)共價連接至EPA-4載體蛋白之大腸桿菌O2抗原多醣的生物結合物,其中該大腸桿菌O2抗原多醣包含式(O2)之結構;(iv)共價連接至EPA-4載體蛋白之大腸桿菌O6A抗原多醣的生物結合物,其中該大腸桿菌O6A抗原多醣包含式(O6A)之結構;(v)共價連接至EPA-4載體蛋白之大腸桿菌O8抗原多醣的生物結合物,其中該大腸桿菌O8抗原多醣包含式(O8)之結構;(vi)共價連接至EPA-4載體蛋白之大腸桿菌O15抗原多醣的生物結合物,其中該大腸桿菌O15抗原多醣包含式(O15)之結構;(vii)共價連接至EPA-4載體蛋白之大腸桿菌O16抗原多醣的生物結合物,其中該大腸桿菌O16抗原多醣包含式(O16)之結構; (viii)共價連接至EPA-4載體蛋白之大腸桿菌O25B抗原多醣的生物結合物,其中該大腸桿菌O25B抗原多醣包含式(O25B)之結構;及(ix)共價連接至EPA-4載體蛋白之大腸桿菌O75抗原多醣的生物結合物,其中該大腸桿菌O75抗原多醣包含式(O75)之結構, 其中所述式中之每一者提供於表1中,且對於所述式中之每一者,n獨立地為整數1至100,例如1至50,較佳3至50,例如5至40。
在一特定實施例中,該組合物(例如醫藥及/或免疫原性組合物)進一步包含:(x)共價連接至EPA-4載體蛋白之大腸桿菌O18A抗原多醣的生物結合物,其中大腸桿菌O18A抗原多醣包含如表1中所示之式(O18A)之結構,其中此結構之n為整數1至100,例如1至50,較佳3至50,例如5至40。
在一些實施例中,本文所提供之組合物包含大腸桿菌葡糖基化O4抗原多醣與大腸桿菌O25B抗原多醣之至少一種生物結合物生物結合物之雙結合物,其中大腸桿菌O25B抗原多醣生物結合物以高於組合物中存在之任何其他生物結合物之濃度約1.5至6倍,例如約2至4倍,諸如1.5、2、3、4、5或6倍的濃度存在於組合物中。
在特定實施例中,組合物包含大腸桿菌O1A抗原多醣、大腸桿菌O2抗原多醣、大腸桿菌葡糖基化O4抗原多醣、大腸桿菌O6A抗原多醣、大腸桿菌O8抗原多醣、大腸桿菌O15抗原多醣、大腸桿菌O16抗原多醣、大腸桿菌O25B抗原多醣及大腸桿菌O75抗原多醣生物結合物,其中O1A:O2:葡糖基化O4:O6A:O8:O15:O16:O25B:O75生物結合物以1:1:1:1:1:1:1:2:1或2:1:1:2:1:1:1:4:1之比率(以O-抗原多醣之重量計)存在。
在特定實施例中,組合物包含大腸桿菌O1A抗原多醣、大腸桿菌O2抗原多醣、大腸桿菌葡糖基化O4抗原多醣、大腸桿菌O6A抗原多醣、大腸桿菌O8抗原多醣、大腸桿菌O15抗原多醣、大腸桿菌O16抗原多醣、大腸桿菌O18A抗原多醣、大腸桿菌O25B抗原多醣及大腸桿菌O75抗原多醣生物結合物,其中O1A:O2:葡糖基化O4:O6A:O8:O15:O16:O18A:O25B:O75之生物結合物以1:1:1:1:1:1:1:1:2:1或2:1:1:2:1:1:1:1:4:1之比率(以O-抗原多醣之重量計)存在。
在一些實施例中,本文所提供之組合物包含大腸桿菌葡糖基化O4抗原多醣生物結合物及至少大腸桿菌O25B抗原多醣生物結合物,其中大腸桿菌O25B抗原多醣生物結合物以2至50 µg/mL,較佳8至40 µg/mL,更佳16-32 µg/mL,諸如16、18、20、22、24、26、28、30或32 µg/mL之濃度存在於組合物中。在此類實施例中,大腸桿菌O25B抗原多醣生物結合物之濃度比組合物中所存在之其他生物結合物中之任一者之濃度高約1.5至6倍,例如約2至4倍,諸如1.5、2、3、4、5或6倍。
在某些實施例中,本文所述之組合物(例如醫藥及/或免疫原性組合物)包含佐劑或與佐劑組合投與。與本文所述之組合物組合投與之佐劑可在投與該組合物之前(例如72小時、48小時、24小時、12小時、6小時、2小時、1小時、10分鐘內)、與該組合物同時或在投與該組合物之後(例如72小時、48小時、24小時、12小時、6小時、2小時、1小時、10分鐘內)投與。如本文所用,術語「佐劑」係指符合以下的化合物:當該化合物與本文所述之組合物結合投與或作為本文所述之組合物之一部分投與時,其加強、促進及/或增強對生物結合物中之大腸桿菌O-抗原多醣免疫反應,但當該佐劑化合物單獨投與時,其不產生對生物結合物中之大腸桿菌抗原多醣的免疫反應。在一些實施例中,佐劑促進對其生物結合物中之大腸桿菌O-抗原多醣的免疫反應且不產生過敏或其他不良反應。佐劑可藉由若干機制,包括例如淋巴球募集、B細胞及/或T細胞之刺激及巨噬細胞之刺激來增強免疫反應。
適合的佐劑之實例包括但不限於:鋁鹽(礬) (諸如氫氧化鋁、磷酸鋁、硫酸鋁及氧化鋁,包括包含礬或奈米礬調配物之奈米粒子);磷酸鈣;單磷醯基脂質A (MPL)或3-去氧醯基化單磷醯基脂質A (3D-MPL) (參見例如英國專利GB2220211、EP0971739、EP1194166、US6491919);AS01、AS02、AS03及AS04 (所有GlaxoSmithKline;參見例如針對AS04之EP1126876、US7357936,針對AS02之EP0671948、EP0761231、US5750110);MF59 (Novartis);咪唑并吡啶化合物(參見WO2007/109812);咪唑并喹喏啉化合物(參見WO2007/109813);δ-菊糖;STING活化合成之環二核苷酸(例如US20150056224);卵磷脂及卡波姆(carbomer)均聚物之組合(例如US6676958);及皂苷,諸如QuilA及QS21 (參見例如Zhu D及W Tuo, 2016, Nat Prod Chem Res 3: e113 (doi:10.4172/2329-6836.1000e113);Matrix M、Iscoms、Iscomatrix等,視情況與QS7組合(參見Kensil等, 在「Vaccine Design: The Subunit and Adjuvant Approach」 (編者Powell及Newman, Plenum Press, NY, 1995)中;美國專利案第5,057,540號)。在一些實施例中,佐劑為弗氏佐劑(Freund's adjuvant) (完全或不完全)。其他佐劑為水包油乳液(諸如角鯊烯或花生油),視情況與諸如單磷醯基脂質A之免疫刺激劑組合(參見Stoute等人, N. Engl. J. Med. 336, 86-91 (1997))。另一佐劑為CpG (Bioworld Today, 1998年11月15日)。佐劑之其他實例為含有免疫刺激劑之脂質體,諸如MPL及QS21,諸如AS01E及AS01B (例如US 2011/0206758)。佐劑之其他實例為CpG (Bioworld Today,1998年11月15日)及咪唑并喹啉(諸如咪喹莫特(imiquimod)及R848)。參見例如Reed G等人, 2013,Nature Med
, 19: 1597-1608。在某些實施例中,佐劑含有鐸樣受體4 (TLR4)促效劑。TLR4促效劑在此項技術中為所熟知的,參見例如Ireton GC及SG Reed, 2013, Expert Rev Vaccines 12: 793-807。在某些實施例中,佐劑包含TLR4促效劑,其包含脂質A或其類似物或衍生物,諸如MPL;3D-MPL;RC529 (例如EP1385541);PET-脂質A;GLA (葡萄哌喃醣基脂質佐劑,一種合成雙醣醣脂;例如US20100310602、US8722064);SLA (例如Carter D等人, 2016, Clin Transl Immunology 5: e108 (doi: 10.1038/cti.2016.63),其描述優化人類疫苗之TLR4配位體之結構-功能方法);PHAD (磷酸化六醯基雙醣);3DAD-PHAD (其結構與GLA之結構相同);3D-(6-醯基)-PHAD (3D(6A)-PHAD) (PHAD、3D-PHAD及3D(6A)PHAD為合成的脂質A變異體,參見例如avantilipids.com/divisions/adjuvants,其亦提供此等分子之結構);E6020 (CAS編號287180-63-6);ONO4007;OM-174及其類似者。
在某些實施例中,本文所述之組合物不包含佐劑且不與佐劑組合投與。
在某些實施例中,本文所述之組合物經調配以適合於向個體之預期投與途徑。舉例而言,本文所述之組合物(例如醫藥及/或免疫原性)可經調配用於皮下、非經腸、經口、舌下、頰內、皮內、經皮、結腸直腸、腹膜內、直腸投與、靜脈內、鼻內、氣管內、肌肉內、局部、經皮或皮內投與。在一個特定實施例中,本文所提供之組合物(例如醫藥及/或免疫原性)經調配用於肌肉內注射。
使用方法
本文所提供之生物結合物及組合物可用於在個體中誘導對抗大腸桿菌葡糖基化O4抗原之抗體,且用於對個體進行疫苗接種來對抗大腸桿菌,尤其是腸外病原性大腸桿菌(ExPEC)。如本文所用,「個體」意謂任何動物,較佳哺乳動物,將向其投與或已向其投與本文所提供之生物結合物或組合物。如本文所用,術語「哺乳動物」涵蓋任何哺乳動物。哺乳動物之實例包括但不限於牛、馬、綿羊、豬、貓、狗、小鼠、大鼠、兔、天竺鼠、非人類靈長類動物(NHP),諸如猴或猿、人類等。在某些實施例中,個體為人類。人類個體可為任何年齡。在某些實施例中,個體為約兩個月至約18歲,例如1歲至18歲之人類。在某些實施例中,個體為至少18歲之人類。在某些實施例中,個體為15至50歲,例如18至45歲,例如20至40歲之人類。在某些實施例中,個體為人類男性。在某些實施例中,個體為人類女性。在某些實施例中,個體免疫功能不全。在某些實施例中,個體為至少50歲、至少55歲、至少60歲、至少65歲之人類。在某些實施例中,個體為不大於100歲、不大於95歲、不大於90歲、不大於85歲、不大於80歲或不大於75歲之人類。在某些實施例中,個體為至少60歲且不大於85歲之人類。在某些實施例中,個體為處於穩定健康狀況下之人類。在某些實施例中,個體為處於穩定健康狀況下的至少60歲且不超過85歲之人類成人。在某些實施例中,個體為具有泌尿道感染(UTI,亦即尿道、膀胱、輸尿管及/或腎臟中之細菌感染)之病史,亦即在其生命中具有至少一次UTI發作之人類。在某些實施例中,個體係在過去二十年、十五年、十二年、十個、九個、八個、七個、六個、五個、四個、三個、兩年或一年中具有UTI之病史的人類。在某些實施例中,個體為在過去兩年具有UTI病史之人類。在某些實施例中,個體為具有復發性UTI之病史,亦即具有六個月內之至少兩次UTI或一年內之至少三次UTI的人類個體。在某些實施例中,個體為在過去兩年具有復發性UTI病史之人類個體。在某些實施例中,個體為處於穩定健康狀況下之60歲或更年長之人類。在某些實施例中,個體為在過去兩年具有UTI病史之60歲或更年長之人類。在某些實施例中,個體為至少60歲及小於75歲之人類,其在過去的兩年具有UTI病史。在某些實施例中,個體為在過去兩年具有UTI病史之75歲或更年長之人類個體。在某些實施例中,個體為安排進行選擇性泌尿生殖及/或腹部程序或手術,例如經直腸超音波引導之前列腺穿刺活檢(TRUS-PNB)的患者。
在一個態樣中,本文提供一種在個體中誘導對抗大腸桿菌葡糖基化O4抗原之抗體的方法,其包含向該個體投與共價連接至本文所述之載體蛋白的大腸桿菌葡糖基化O4抗原生物結合物中之任一者或包含共價連接至蛋白質之大腸桿菌葡糖基化O4抗原生物結合物的組合物,單獨或進一步與其他大腸桿菌O-抗原多醣或其醣結合物或生物結合物組合。
在某些實施例中,針對大腸桿菌葡糖基化O4抗原誘導、引發或鑑別之抗體具有調理調理吞噬活性。在特定實施例中,誘導、引發或鑑別之抗體為能夠介導大腸桿菌葡糖基化與未葡糖基化O4菌株之調理吞噬殺滅之交聯反應性抗體。
在某些實施例中,針對大腸桿菌葡糖基化O4抗原誘導、引發或鑑別之抗體特異性識別未經修飾及經葡萄糖修飾之O4抗原多醣。在某些實施例中,針對大腸桿菌葡糖基化O4抗原誘導、引發或鑑別之抗體特異性識別O4血清型之大腸桿菌。在某些實施例中,相比於未葡糖基化O4抗原,由大腸桿菌葡糖基化O4抗原生物結合物誘導之抗體優先結合至葡糖基化O4抗原。
由本文所述之生物結合物及組合物誘導之抗體可包括免疫球蛋白分子及免疫球蛋白分子之免疫活性部分,亦即含有特異性結合於大腸桿菌O-抗原多醣(例如,葡糖基化O4抗原多醣)之抗原結合位點的分子。
使用本文所提供之生物結合物或組合物誘導、引發或鑑別之抗體可用於監測療法及/或疾病進展之功效。此項技術中已知之任何免疫分析系統可用於此目的,包括但不限於:使用諸如放射免疫分析之技術的競爭性及非競爭性分析系統、ELISA (酶聯免疫吸附分析)、基於電化學發光(ECL)之免疫分析、「夾心」免疫分析、沈澱素反應、凝膠擴散沈澱素反應、免疫擴散分析、免疫放射量測定、螢光免疫分析、蛋白質A免疫分析及免疫電泳分析。若干此等分析(例如基於ECL免疫分析)可以多重形式進行,且通常多重分析形式為較佳的。
使用大腸桿菌葡糖基化O4抗原多醣生物結合物誘導、引發或鑑別之抗體可用於例如自複數個大腸桿菌菌株偵測大腸桿菌O4菌株,尤其葡糖基化O4菌株,及/或診斷由大腸桿菌O4或葡糖基化O4菌株造成之感染。
在另一態樣中,本文提供一種對個體進行疫苗接種來對抗大腸桿菌(例如腸外病原性大腸桿菌,ExPEC)之方法,其包含向個體投與共價連接至本文所述之載體蛋白的大腸桿菌葡糖基化O4抗原生物結合物中之任一者或包含共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原生物結合物的組合物,單獨或進一步與其他大腸桿菌O-抗原或其醣結合物或生物結合物組合。熟習此項技術者應理解,將對個體進行疫苗接種來對抗大腸桿菌菌株,該等大腸桿菌菌株之O抗原或其醣結合物或生物結合物存在於所投與之組合物中。舉例而言,投與包含O1A、O2、葡糖基化O4、O6A及O25B抗原多醣之組合物可用於對個體進行疫苗接種來對抗大腸桿菌血清型O1A、O2、O4、O6A及O25B。
在某些實施例中,疫苗接種用於預防侵襲性ExPEC疾病(IED),例如尿路性敗血症(urosepsis)、菌血症、敗血症等。在某些實施例中,疫苗接種係預防或降低泌尿道感染之發生率或嚴重程度。在某些實施例中,IED可為醫院獲得性的(例如在經歷泌尿生殖及/或腹部程序或手術之患者中)。在某些實施例中,IED可例如在接受另一病狀之醫療之患者中,例如經由中央管線、導管等,例如在醫院、救員手術中心、末期腎病設施、長期照護設施等中,為醫療相關的。在某些實施例中,IED可為群體獲得性的(例如在最近未暴露於醫療風險之患者中)。
在另一態樣中,本文提供一種在個體中誘導對抗大腸桿菌(例如ExPEC)之免疫反應的方法,其包含向該個體投與共價連接至本文所述之載體蛋白的大腸桿菌葡糖基化O4抗原生物結合物中之任一者或包含共價連接至載體蛋白之大腸桿菌葡糖基化O4生物結合物的組合物,單獨或進一步與其他大腸桿菌O-抗原或其醣結合物或生物結合物組合。在一個實施例中,個體在投與時具有大腸桿菌(例如ExPEC)感染。在一個較佳實施例中,個體在投與時不具有大腸桿菌(例如ExPEC)感染。
在某些實施例中,本文所述之組合物及生物結合物可投與個體以誘導免疫反應,包括產生抗體,較佳具有調理吞噬活性之抗體。此類抗體可使用熟習此項技術者已知之技術(例如免疫親和層析、離心、沈澱等)分離。
本文所述之生物結合物及組合物在個體中產生免疫反應之能力可使用熟習此項技術者已知或本文所述之任何方法評定。在一些實施例中,生物結合物在個體中產生免疫反應之能力可藉由使個體(例如小鼠、大鼠、兔或猴)或一組具有本文所述之生物結合物之個體免疫接種及使額外個體(例如小鼠、大鼠、兔或猴)或一組具有對照物(PBS)之個體免疫來評定。隨後可用ExPEC對個體或一組個體攻擊且可測定個體或一組個體中ExPEC引起疾病(例如UTI、菌血症或其他疾病)之能力。熟習此項技術者將認識到,若用對照組進行免疫接種之個體或一組個體在ExPEC攻擊之後患有疾病,但用本文所述之生物結合物或其組合物進行免疫接種之個體或一組個體患有疾病較輕或不患有疾病,則生物結合物能夠在個體體內產生免疫反應。本文所述之生物結合物或其組合物誘導與來自ExPEC之O抗原交叉反應之抗血清的能力可藉由例如免疫分析,諸如ELISA (參見例如Van den Dobbelsteen等人, 2016, Vaccine 34: 4152-4160)或基於ECL免疫分析來測試。
舉例而言,本文所述之生物結合物在個體中產生免疫反應之能力可使用血清殺菌分析(SBA)或調理吞噬殺滅分析(opsonophagocytic killing assay,OPK分析或OPKA)來評定,展現已用於獲得基於醣結合物之疫苗之批准的已建立的且公認的方法。此類分析為此項技術中熟知的,且簡言之,包含以下步驟:藉由向個體(例如小鼠、大鼠、兔或猴)投與引發此類抗體之化合物來產生及分離對抗相關目標(例如O抗原多醣,例如大腸桿菌葡糖基化O4抗原多醣)的抗體。隨後,可藉由例如在抗體存在下培養所討論之細菌(例如相關血清型之大腸桿菌)及補充(且視分析而定的)嗜中性球,及分析抗體介導殺滅及/或中和細菌之能力,來評定抗體之殺細菌能力。關於大腸桿菌生物結合物疫苗之OPK分析之一個實例,參見例如Abbanat等人, 2017, Clin. Vaccine Immunol. 24: e00123-17。OPK分析可以單重形式或多重形式進行,其中多重格式(例如同時測試多種血清型)通常較佳。多重OPK分析在本文中有時稱為「MOPA」。
在一些實施例中,本文所述之方法包含投與有效量的共價連接至本文所述之載體蛋白之大腸桿菌葡糖基化O4抗原生物結合物,或包含共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原生物結合物的組合物,單獨或進一步與其他大腸桿菌O-抗原或其醣結合物或生物結合物組合。在一個實施例中,「有效量」為對個體進行疫苗接種來對抗大腸桿菌(例如ExPEC)的量。在另一個實施例中,「有效量」為在個體中誘導對抗大腸桿菌(例如ExPEC)之免疫反應的量,諸如包括產生抗體之免疫反應,較佳為具有調理吞噬活性之抗體。
在本文所提供之組合物包含大腸桿菌葡糖基化O4抗原多醣生物結合物及至少大腸桿菌O25B抗原多醣生物結合物的特定實施例中,有效量之大腸桿菌O25B抗原多醣比組合物中所存在之其他生物結合物中之任一者之濃度高約1.5至6倍,例如約2至4倍,諸如1.5、2、3、4、5或6倍。在此類實施例中,大腸桿菌O25B抗原多醣之有效量為例如每次投與約5至18 µg,諸如每次投與5、6、7、8、9、10、11、12、13、14、15、16、17、18 µg。
在某些實施例中,向個體投與根據本發明之生物結合物或組合物一次。在某些實施例中,向個體投與根據本發明之生物結合物或組合物超過一次,例如在初打-加打方案(prime-boost regimen)中。在某些實施例中,兩次投與之間的時間為至少兩週、至少一個月、至少兩個月、至少三個月、至少六個月、至少一年、至少兩年、至少五年、至少十年或至少十五年。在人類中,所需免疫反應可通常藉由單次投與根據本發明之生物結合物或組合物來產生。在某些實施例中,提供在例如十年之後之重複投與。
宿主細胞
本文提供能夠產生大腸桿菌O抗原及包含此類大腸桿菌O抗原之生物結合物的宿主細胞,例如原核宿主細胞。本文所提供之宿主細胞較佳經修飾以包含(例如,經由基因工程改造的)編碼宿主細胞機構(例如,醣基轉移酶)之核酸中的一或多種,該宿主細胞機制用於製備大腸桿菌O-抗原多醣及/或其生物結合物。
可使用熟習此項技術者已知之任何宿主細胞產生本文所述之大腸桿菌O抗原多醣(例如大腸桿菌葡糖基化O4抗原多醣)及包含本文所述之大腸桿菌O抗原多醣的生物結合物(例如大腸桿菌葡糖基化O4抗原多醣生物結合物),該等宿主細胞包括古菌、原核宿主細胞及真核宿主細胞。在一較佳實施例中,宿主細胞為原核宿主細胞。用於製備本文所述之大腸桿菌O抗原多醣及包含本文所述之大腸桿菌O抗原多醣的生物結合物的例示性原核宿主細胞包括但不限於埃希氏桿菌物種、志賀桿菌(Shigella
)物種、克雷伯氏菌(Klebsiella
)物種、黃單胞菌(Xhantomonas
)物種、沙門氏菌(Salmonella
)物種、耶氏桿菌(Yersinia
)物種、乳球菌(Lactococcus
)物種、乳桿菌(Lactobacillus
)物種、假單胞菌(Pseudomonas
)物種、棒狀桿菌(Corynebacterium
)物種、鏈黴菌(Streptomyces
)物種、鏈球菌(Streptococcus
)物種、葡萄球菌(Staphylococcus
)物種、芽孢桿菌(Bacillus
)物種及梭菌(Clostridium
)物種。
在一特定實施例中,用於製備本文所述之大腸桿菌O抗原多醣的宿主細胞及包含本文所述之大腸桿菌O抗原多醣的生物結合物為原核宿主細胞,且較佳為大腸桿菌。
在某些實施例中,用於製備本文所述之大腸桿菌O抗原多醣及生物結合物之宿主細胞經工程改造以包含異源核酸,例如包含所需O抗原血清型之rfb
基因叢之異源核酸、編碼一或多種載體蛋白及/或醣基轉移酶之異源核酸。在一特定實施例中,可將異源rfb
基因及/或編碼涉及醣基化路徑(例如原核及/或真核醣基化路徑)之蛋白質的異源核酸引入至本文所述之宿主細胞中。此類核酸可以編碼蛋白質,包括但不限於寡醣基轉移酶及/或醣基轉移酶。
本文描述適用於製成重組宿主細胞之各種編碼醣基轉移酶之基因及基因叢的序列,該等重組宿主細胞可例如用於製得大腸桿菌O抗原多醣及其生物結合物。熟習此項技術者應瞭解,歸因於基因密碼之簡併,具有特定胺基酸序列之蛋白質可由多個不同核酸編碼。因此,熟習此項技術者應理解,可改變本文所提供之核酸,其方式為使得其序列不同於本文所提供之序列而不影響由核酸編碼之蛋白質之胺基酸序列。
本文提供用於生產大腸桿菌葡糖基化O4抗原多醣、O1A抗原多醣、O2抗原多醣、O6A抗原多醣、O8抗原多醣、O15抗原多醣、O16抗原多醣、O18A多醣、O25B抗原多醣或O75抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)。本文所提供之宿主細胞包含編碼能夠產生大腸桿菌O抗原多醣之酶(例如,醣基轉移酶)的核酸。本文所提供之宿主細胞可天然地表現能夠產生相關O抗原的核酸,或可使得宿主細胞表現此類核酸。在某些實施例中,核酸與宿主細胞異源且使用此項技術中已知之基因方法引入至宿主細胞中。舉例而言,核酸可藉由基因操作引入至宿主細胞中(例如基因叢在一個質體或多個質體上表現或整合至宿主細胞基因組中(參見例如,國際專利申請公開案WO 2014/037585、WO 2014/057109、WO 2015/052344)。
在一個實施例中,本文提供一種能夠產生共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)。此類宿主細胞較佳地藉由工程改造前驅細胞來包含編碼gtrS
基因之核酸序列,據發明者所知,該基因在本文中首次鑑別為編碼能夠將葡萄糖轉移至大腸桿菌O4抗原的多醣分支酶(亦即對大腸桿菌O4抗原多醣具有特異性之葡糖基轉移酶),且尤其經由α-1,3-醣苷鍵轉移至L-Rha之多醣分支酶。此類分枝酶之胺基酸序列之實例提供於SEQ ID NO: 4中。其他實例包含與其至少80%一致之胺基酸序列。編碼對大腸桿菌O4抗原多醣具有特異性之gtrS
基因之核酸序列的例示性實例包括但不限於SEQ ID NO: 5,或其編碼SEQ ID NO: 4之簡併核酸序列,或對與SEQ ID NO: 4具有至少80%一致性之功能性O4-特異性GtrS酶進行編碼的核酸序列。
在一特定實施例中,能夠產生共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)包含編碼葡糖基轉移酶的核苷酸序列,該葡糖基轉移酶與SEQ ID NO: 4具有至少80%序列一致性,諸如與SEQ ID NO: 4具有約80%、85%、90%、91%、92%、93%、94%、95%、95%、97%、98%、99%或100%序列一致性。鑒於基因密碼冗餘性,一般熟習此項技術者必要時可例如使用經密碼子優化之序列製成編碼葡糖基轉移酶之胺基酸序列的核酸之變異體。
在某些實施例中,能夠產生共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣的生物結合物、包含編碼與SEQ ID NO: 4具有至少80%序列一致性之葡糖基轉移酶(GtrS)的核苷酸序列的宿主細胞(例如重組宿主細胞),進一步包含編碼與SEQ ID NO: 7具有至少80%序列一致性之與細菌萜醇連接之葡萄糖易位酶(GtrA)的核苷酸序列,及編碼與SEQ ID NO: 8具有至少80%序列一致性之細菌萜醇葡糖基轉移酶(GtrB)的核苷酸序列。在某些實施例中,該等核酸序列編碼分別與SEQ ID NO: 7及8至少約80%、85%、90%、95%、96%、97%、98%、99%或100%一致的GtrA及GtrB蛋白質,且分別具有與細菌萜醇連接之葡萄糖易位酶(SEQ ID NO: 7)及細菌萜醇葡糖基轉移酶(SEQ ID NO: 8)活性。鑒於基因密碼冗餘性,一般熟習此項技術者必要時可例如使用經密碼子優化之序列製成編碼與細菌萜醇連接之葡萄糖易位酶之胺基酸序列及細菌萜醇葡糖基轉移酶之胺基酸序列的核酸之變異體。
能夠產生共價連接至本文所提供之載劑蛋白之大腸桿菌葡糖基化O4抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)進一步包含大腸桿菌O4抗原多醣之rfb
基因叢核苷酸序列。適用於製備大腸桿菌O4抗原多醣之rfb
基因叢之實例在本文中提供為SEQ ID NO: 9。另一實例可見於GenBank,基因座AY568960中。亦可使用編碼與由此序列編碼相同之酶的簡併核酸序列或編碼至少80%一致,較佳至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%一致之酶的序列。
在一特定實施例中,本文提供一種產生葡糖基化O4抗原多醣之宿主細胞(例如重組宿主細胞,較佳重組原核宿主細胞,較佳重組大腸桿菌宿主細胞),其中宿主細胞包含gtrS
、大腸桿菌O4抗原多醣之rfb
基因叢及編碼載體蛋白之核酸。此類宿主細胞可使用重組方法經工程改造以包含一或多種質體,該一或多種質體包含gtrS
基因、rfb
基因叢及/或編碼載體蛋白之核酸,或包含一些或所有相關基因,諸如整合至宿主細胞基因組中之gtrS
、rfb
簇及/或編碼載體蛋白之核酸。在某些實施例中,基因或基因叢已使用同源重組整合至宿主細胞之基因組中。基因整合至宿主細胞之基因組中之優勢為在不存在抗生素選擇之情況下具有穩定性。
在另一特定實施例中,本文提供產生葡糖基化O4抗原多醣之宿主細胞(例如重組宿主細胞,較佳重組原核宿主細胞),其中宿主細胞包含GtrS (葡糖基轉移酶)以及由O4rfb
簇編碼之酶。在某些實施例中,前述酶中之一些或全部與宿主細胞異源。
在其他特定實施例中,本文提供一種產生大腸桿菌葡糖基化O4抗原多醣,較佳大腸桿菌葡糖基化O4抗原多醣生物結合物之宿主細胞(例如重組宿主細胞,較佳重組原核宿主細胞),其中宿主細胞進一步包含編碼寡醣基轉移酶之核苷酸序列及/或編碼載體蛋白之核苷酸序列。在一個特定實施例中,寡醣基轉移酶與宿主細胞異源。在另一特定實施例中,載體蛋白與宿主細胞異源。較佳地,宿主細胞包含編碼與SEQ ID NO: 4具有至少80%序列一致性之葡糖基轉移酶的異源核苷酸序列。在較佳實施例中,O4簇之rfb
基因與宿主細胞異源。較佳地,編碼能夠將分支型葡萄糖側鏈引入至O4抗原之酶的序列,亦即gtrS
基因(編碼與SEQ ID NO: 4具有至少80%序列一致性之葡糖基轉移酶)與宿主細胞異源。若相同序列不天然存在於該宿主細胞中,則核酸與宿主細胞異源。異源核酸可例如藉由基因工程改造,例如藉由轉化(例如化學轉化或電穿孔)及/或重組引入母細胞中。在某些實施例中,將諸如所需rfb
基因座之異源核酸、gtrS
編碼序列、載體蛋白編碼序列及/或醣基轉移酶編碼序列整合至宿主細胞、較佳細菌宿主細胞、較佳大腸桿菌宿主細胞之基因組中。在較佳實施例中,內源性rfb
基因座及若適用的gtrS
編碼序列相比於其前身已失活,較佳自重組宿主細胞之基因組刪除,且較佳地此等基因座及序列分別由所需異源rfb
基因座及若適用的所需gtrS
編碼序列置換。在某些實施例中,相比於原代野生型分離株,宿主細胞為大腸桿菌之K-12 (作為非限制性實例,大腸桿菌菌株W3110為K-12菌株),或大腸桿菌之B菌株(作為非限制性實例,大腸桿菌菌株BL21為B菌株),或任何其他明確界定的大腸桿菌菌株,例如實驗室菌株或生產菌株。在較佳實施例中,宿主細胞來源於不表現O4抗原或葡糖基化O4抗原之大腸桿菌,該過程藉由將O4rfb
基因座及編碼與SEQ ID NO: 4具有至少80%序列一致性之葡糖基轉移酶的gtrS
基因引入至該大腸桿菌中。使用經充分表徵之菌株,諸如大腸桿菌K-12或大腸桿菌B作為宿主細胞之前驅體的優點為可能針對不同O-抗原生物結合物使用類似生產過程,因為生產菌株之特徵為明確界定的。儘管不同O-抗原生物結合物將表現不同且表現過程可根據生產菌株優化,但至少使用此類明確界定之前驅體菌株比未知菌株(諸如野生型分離株)用作用於製備宿主菌株之前驅體時,將更可預測製備O-抗原生物結合物之基礎過程。以此方式,可使用製備先前所述之大腸桿菌O-抗原生物結合物(諸如O1A、O2、O6A及O25B生物結合物,如例如WO 2015/124769及WO 2017/035181中所述)之經驗作為設計其他大腸桿菌O-抗原生物結合物之製備的基礎。不同於gtrS
、gtrA
及gtrB
基因不具有血清型特異性,且在某些實施例中,此等基因與宿主細胞同源(例如大腸桿菌K12菌株W3110包括gtrA
及gtrB
基因,該等基因能夠與O4-血清型特異性的以重組方式引入之gtrS
基因一起起作用,該以重組方式引入之gtrS
基因編碼具有SEQ ID NO: 4之葡糖基轉移酶或與其至少80%一致之葡糖基轉移酶,置換內源性gtrS
基因)。在其他實施例中,亦將gtrA
及gtrB
基因中之一者或兩者(編碼分別與SEQ ID NO: 7及8至少約80%一致且分別具有與細菌萜醇連接之葡萄糖易位酶及細菌萜醇葡糖基轉移酶活性之GtrA及GtrB蛋白質)以重組方式引入至宿主細胞中,例如在宿主細胞不具有內源性gtrA
及/或gtrB
基因之情況下。
本文亦提供能夠產生共價連接至載體蛋白之大腸桿菌O1A、O2、O6A、O8、O15、O16、O18A、O25B或O75抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)。此類宿主細胞(例如重組宿主細胞)包含對O-抗原多醣具有特異性之rfb
基因叢之核苷酸序列。rfb
基因叢可自野生型大腸桿菌菌株分離,且在一個宿主細胞內與編碼寡醣基轉移酶(例如PglB)及載體蛋白(例如EPA)之核酸組合,以獲得產生相關大腸桿菌O-抗原或其生物結合物的重組宿主細胞。舉例而言,使用生物結合技術,諸如WO 2014/037585、WO 2009/104074及WO 2009/089396中所述之生物結合技術,此類宿主細胞可使用重組方法工程改造以包含一或多種質體,該一或多種質體包含rfb
基因叢、寡醣基轉移酶(例如PglB)及載體蛋白(例如EPA)。較佳地,宿主細胞包含整合至其基因組中之rfb
基因叢。在某些實施例中,編碼寡醣基轉移酶、載體蛋白及適用的gtrS
基因之核酸亦整合至宿主細胞之基因組中。在某些實施例中,異源或同源gtrA
及gtrB
基因亦整合於宿主細胞之基因組中。
用於O1A、O2、O6A及O25B抗原之生物結合物之製得已在WO 2015/124769及WO 2017/035181中詳細地描述。各大腸桿菌O抗原(rfb
基因座)之例示性基因叢已描述於Iguchi A等人, DNA Research, 2014, 1-7 (doi: 10.1093/dnares/dsu043)中, 及DebRoy C等人, PLoS One. 2016, 11(1):e0147434 (doi: 10.1371/journal.pone.0147434; correction in: Plos One. 2016, 11(4):e0154551, doi: 10.1371/journal.pone.0154551)中。rfb
簇之核酸序列及在其中編碼之蛋白質的胺基酸序列亦可發現於公共資料庫(諸如GenBank)中。可在用於具有本文所揭示之血清型之多醣抗原之生物結合物的生產菌株中使用的rfb
簇之例示性序列亦提供於SEQ ID NO: 9及11-19中。因此,對於上文所提及之所需生物結合物中之每一者,可將各別rfb
簇引入至宿主細胞中,以獲得具有所需O-抗原之特定rfb
簇以及含有編碼寡醣基轉移酶及載體蛋白之核酸的宿主細胞。出於上文所指示之原因,宿主細胞較佳為重組宿主細胞,且較佳來源於具有相對熟知特徵之菌株,諸如大腸桿菌實驗室菌株或生產菌株,例如大腸桿菌K12或大腸桿菌BL21等。較佳地,rfb
簇與宿主細胞異源,例如引入至宿主細胞之前驅細胞中,且較佳整合至其基因組中。較佳地,若在前驅細胞中存在初始rfb
基因叢,則該基因叢經宿主細胞中相關之O-抗原的rfb
基因叢置換,以使得能夠產生相關之O-抗原的生物結合物。較佳地,寡醣基轉移酶與宿主細胞異源,且在某些實施例中,將編碼此類寡醣基轉移酶之核酸整合至宿主細胞之基因組中。
本文所提供之宿主細胞中之任一者(例如重組宿主細胞,較佳重組原核宿主細胞)包含編碼額外的在蛋白質之N
-醣基化中具有活性的酶之核酸,例如本文所提供之宿主細胞可進一步包含編碼寡醣基轉移酶之核酸或編碼其他醣基轉移酶之核酸。
本文所提供之宿主細胞包含編碼寡醣基轉移酶之核酸。寡醣基轉移酶將與脂質連接之寡醣轉移至具有包含N
-醣基化共同基序之初生多肽鏈的天冬醯胺殘基。編碼寡醣基轉移酶之核酸可為宿主細胞原生的,或可使用基因方法引入至宿主細胞中。在較佳實施例中,寡醣基轉移酶與宿主細胞異源。大腸桿菌非天然包含寡醣基轉移酶,且因此若大腸桿菌用作產生生物結合物之宿主細胞,則例如在藉由基因工程改造引入後,異源寡醣基轉移酶包含於此類宿主細胞中。根據本發明,寡醣基轉移酶可來自此項技術中已知之任何來源。
在某些實施例中,例如作為非限制性實例PglL的具有N
-醣基轉移酶活性之寡醣基轉移酶(諸如O
-醣基轉移酶)之替代方案,可與載體蛋白中之獨立不同的醣基化共同序列結合使用,如例如WO 2016/82597中所述。諸如O
-醣基轉移酶之其他醣基轉移酶因此亦可用作根據本發明之寡醣基轉移酶。
在某些較佳實施例中,寡醣基轉移酶為來自曲桿菌(Campylobacter)之寡醣基轉移酶。舉例而言,在一個實施例中,寡醣基轉移酶為來自空腸曲桿菌之寡醣基轉移酶(亦即pglB
; 參見例如Wacker等人, 2002,Science
298:1790-1793; 亦參見例如NCBI Gene ID: 3231775, UniProt寄存編號O86154)。在另一實施例中,寡醣基轉移酶為來自海鷗曲桿菌(Campylobacter lari)之寡醣基轉移酶(參見例如NCBI Gene ID:7410986)。
在特定實施例中,寡醣基轉移酶為來自空腸曲桿菌之PglB寡醣基轉移酶,包括天然(野生型)蛋白質或其任何變異體,諸如國際專利申請公開案WO 2016/107818及WO 2016/107819中所述之彼等。PglB可將與脂質連接之寡醣轉移至共同序列SEQ ID NO: 1及SEQ ID NO: 2中之天冬醯胺殘基。在特定實施例中,PglB寡醣基轉移酶包含SEQ ID NO: 6或其變異體。在某些實施例中,野生型PglB中之一或多個內源性醣基化共同序列已經突變以避免PglB自體醣基化,例如包含突變N534Q之SEQ ID NO: 6。適用於本文提供之重組宿主細胞之變異PglB寡醣基轉移酶之實例包括具有SEQ ID NO: 6之PglB寡醣基轉移酶,該寡醣基轉移酶包含至少一種選自由以下組成之群的突變:N311V、K482R、D483H、A669V、Y77H、S80R、Q287P及K289R。在一個特定實施例中,變異PglB寡醣基轉移酶具有包含突變N311V之SEQ ID NO: 6。在另一特定實施例中,變異PglB寡醣基轉移酶具有包含突變Y77H及N311V之SEQ ID NO: 6。在另一特定實施例中,變異PglB寡醣基轉移酶具有包含突變N311V、K482R、D483H及A669V之SEQ ID NO: 6。在另一特定實施例中,變異PglB寡醣基轉移酶具有包含突變Y77H、S80R、Q287P、K289R及N311V之SEQ ID NO: 6。本文中發現及描述,某些PglB寡醣基轉移酶變異體在製備具有特異性血清型之大腸桿菌O-抗原生物結合物方面產生出人意料地經改良的產率。對於既定大腸桿菌O-抗原,經改良或最佳PglB變異體不為可預測的。在某些態樣中,本發明因此亦提供使用特定PglB變異體作為寡醣基轉移酶製備具有特異性大腸桿菌O-抗原之生物結合物之方法。PglB之其他變異體亦可用於製備生物結合物,該等PglB之其他變異體與SEQ ID NO: 6至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%一致,且仍具有寡醣基轉移酶活性,較佳在本文組合中所揭示之指示位置上具有特定胺基酸中之一或多種(例如77Y、80S、287Q、289K、311N、482K、483D、669A;或311V;或311V、482R、483H、669V;或77H、80R、287P、289R、311V;或77H、311V;等)。
在一特定實施例中,能夠產生共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)進一步包含編碼來自空腸曲桿菌之PglB寡醣基轉移酶的核苷酸序列,該寡醣基轉移酶具有胺基酸序列SEQ ID NO: 6,或較佳包含突變N311V之SEQ ID NO: 6,或更佳包含突變Y77H及N311V之SEQ ID NO: 6。
在其他特定實施例中,能夠產生共價連接至載體蛋白之大腸桿菌O1A、O6A或O15抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)進一步包含編碼來自空腸曲桿菌之PglB寡醣基轉移酶的核苷酸序列,該寡醣基轉移酶具有胺基酸序列SEQ ID NO: 6,或較佳包含突變N311V、K482R、D483H及A669V之SEQ ID NO: 6。
在一特定實施例中,能夠產生共價連接至載體蛋白之大腸桿菌O16抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)進一步包含編碼來自空腸曲桿菌之PglB寡醣基轉移酶的核苷酸序列,該寡醣基轉移酶具有胺基酸序列SEQ ID NO: 6,或較佳包含Y77H、S80R、Q287P、K289R及N311V之SEQ ID NO: 6。
在一特定實施例中,能夠產生共價連接至載體蛋白之大腸桿菌O75抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)進一步包含編碼來自空腸曲桿菌之PglB寡醣基轉移酶的核苷酸序列,該寡醣基轉移酶具有胺基酸序列SEQ ID NO: 6,或較佳包含突變N311V之SEQ ID NO: 6。
在一特定實施例中,能夠產生共價連接至載體蛋白之大腸桿菌O8、O18A、O25B或O2抗原多醣的生物結合物的宿主細胞(例如重組宿主細胞)進一步包含編碼來空腸曲桿菌之PglB寡醣基轉移酶的核苷酸序列,該寡醣基轉移酶具有胺基酸序列SEQ ID NO: 6,較佳地其中SEQ ID NO: 6在位置77、80、287、289、311、482、483及669處不包含胺基酸突變。
在一些實施例中,本文所提供之宿主細胞中之任一者包含編碼載體蛋白之核酸,例如由宿主細胞醣基化機制產生之O-抗原多醣可附著至該蛋白質以形成生物結合物。宿主細胞可包含編碼鑒於本發明之熟習此項技術者已知之任何載體蛋白的核酸,包括但不限於: 解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌之蛋白D。
在較佳實施例中,宿主細胞進一步包含編碼解毒之綠膿桿菌外毒素A (EPA)之核酸。較佳地,EPA載體蛋白包含1-10個醣基化位點,較佳2至4個醣基化位點,最佳4個醣基化位點,諸如1-10個、較佳2-4個且更佳4個醣基化位點,該等醣基化位點各自包含具有胺基酸序列SEQ ID NO: 1,且更佳具有胺基酸序列SEQ ID NO: 2之醣基化共同序列。在一特定實施例中,宿主細胞進一步包含編碼包含SEQ ID NO: 3之EPA-4載體蛋白的核酸。
在某些實施例中,用於藉由本文所述之宿主細胞製備生物結合物之載體蛋白包含「標記」,亦即允許分離及/或鑑別載體蛋白之胺基酸序列。舉例而言,將標記添加至載體蛋白可適用於該蛋白質之純化,且因此包含經標記之載體蛋白的結合物疫苗之純化。可在本文中使用之例示性標記包括但不限於組胺酸(HIS)標記(例如六組胺酸標記或6XHis-標記)、FLAG-TAG及HA標記。在某些實施例中,本文所用之標記為可移除的,例如一旦不再需要標記,例如在蛋白質已純化之後,藉由化學劑或藉由酶手段移除。在其他實施例中,載體蛋白不包含標記。
在某些實施例中,本文所述之載體蛋白包含使載體蛋白靶向表現載體蛋白之宿主細胞之周質空間的信號序列。在一特定實施例中,信號序列來自大腸桿菌DsbA、大腸桿菌外膜孔蛋白A(OmpA)、大腸桿菌麥芽糖結合蛋白(MalE)、胡蘿蔔軟腐歐文氏菌(Erwinia carotovorans
)果膠解離酶(PelB)、FlgI、NikA或木聚糖內切酶芽孢桿菌(Bacillus sp . endoxylanase
,XynA)、熱不穩定大腸桿菌腸毒素LTIIb、木聚糖內切酶芽孢桿菌XynA或大腸桿菌鞭毛蛋白(FlgI)。在一個實施例中,信號序列包含SEQ ID NO: 10。信號序列可在蛋白質易位至周質之後分裂,且因此可不再存在於生物結合物之最終載體蛋白中。
在某些實施例中,可將額外修飾引入(例如使用重組技術)至本文所述之宿主細胞中。舉例而言,可以使宿主細胞核酸(例如基因)失活/功能異常(亦即,經刪除/修飾之宿主細胞核酸不編碼功能蛋白)之方式在宿主細胞背景(基因組)中刪除或修飾編碼形成可能競爭的或干擾的醣基化路徑(例如與一個或多個涉及以重組方式引入至宿主細胞中之醣基化的異源基因競爭或對其干擾)之部分之蛋白質的該等宿主細胞核酸。在某些實施例中,當核酸自本文所提供之宿主細胞之基因組刪除時,其經所需序列,例如適用於製備O抗原多醣或其生物結合物之序列置換。
可在宿主細胞中刪除之例示性基因或基因叢(且在一些情況下,經其他所需核酸序列置換)包括涉及醣脂生物合成之宿主細胞的基因或基因叢,諸如waaL
(參見例如Feldman等人, 2005, PNAS USA 102:3016-3021)、脂質A核心生物合成簇(waa
)、半乳糖簇(gal
)、阿拉伯糖(arabinose
)簇(arc
)、結腸酸簇(wc
)、莢膜多醣簇、十一萜醇-p合成基因(例如uppS
、uppP
)、und-P再循環基因(und-P recycling genes)、參與核苷酸活化糖生物合成之代謝酶、腸內細菌常見抗原簇(eca
)及原噬菌體O抗原修飾簇,如gtrABS
簇或其區域。在一特定實施例中,本文所述之宿主細胞經修飾以使其不產生除所需O抗原多醣外之任何O抗原多醣,例如葡糖基化O4抗原多醣。
在一特定實施例中,自本文所提供之宿主細胞(例如重組宿主細胞)之基因組刪除waaL
基因或使其功能上失活。術語「waaL
」及「waaL
基因」指編碼具有位於周質中之活性位點之膜結合酶的O-抗原連接酶基因。經編碼之酶將與十一碳二烯磷酸酯(undecaprenylphosphate,UPP)結合之O抗原轉移至脂質A核心,從而形成脂多醣。刪除或破壞內源性waaL
基因(例如ΔwaaL
菌株)破壞O-抗原至脂質A之轉移,且反而可增強O-抗原至另一生物分子,諸如載體蛋白之轉移。
在另一特定實施例中,waaL
基因、gtrA
基因、gtrB
基因、gtrS
基因及rfb
基因叢中之一或多者自本文所提供之原核宿主細胞之初始基因組刪除或功能上失活。
在一個實施例中,本文所使用之宿主細胞為產生葡糖基化O4抗原多醣生物結合物之大腸桿菌,其中自宿主細胞之基因組刪除waaL
基因或使其功能上失活,且插入對大腸桿菌O4抗原多醣具有特異性之gtrS
基因。在葡糖基化O4 O-抗原生物結合物之生產菌株的某些實施例中,將編碼與SEQ ID NO: 4具有至少80%序列一致性之葡糖基轉移酶的gtrS
基因插入至母株之gtrS
基因的位置,以便用負責O4抗原之葡糖基化之基因置換該母株中之gtrS
基因。此類母株之實例為大腸桿菌K-12菌株W3110。gtrA
及gtrB
基因可與母株同源,或替代地此等基因中之一者或兩者可與母株異源。通常,且不同於gtrS
基因,此等gtrA
及gtrB
基因對O-抗原結構不具有特異性。
本文亦提供製成重組宿主細胞之方法。藉由本文所述之方法製備之重組宿主細胞可用於製備大腸桿菌O抗原生物結合物。該等方法包含將一或多種重組核酸分子引入至細胞中以製備重組宿主細胞。通常,重組核酸分子為異源核酸分子。鑒於本發明,此項技術中已知之任何方法均可用於將重組核酸分子引入至宿主細胞中。可使用一般技術者已知之任何方法將重組核酸引入至本文所述之宿主細胞中,例如電穿孔、化學轉化、藉由熱衝擊、天然轉化、噬菌體轉導及結合。在特定實施例中,使用質體將重組核酸引入至本文所述之宿主細胞中。舉例而言,異源核酸可藉由質體(例如表現載體)在宿主細胞中表現。在另一特定實施例中,使用插入至基因組中之方法將異源核酸引入至本文所述之宿主細胞中,如例如國際專利申請公開案WO 2014/037585、WO 2014/057109或WO 2015/052344中所述。
在一個實施例中,一種製成用於製備共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣之生物結合物的重組宿主細胞的方法包含將一或多種重組核酸分子引入至細胞(較佳大腸桿菌細胞)中,以製備重組宿主細胞。在此類實施例中,引入至細胞中之重組核酸分子包括(i)大腸桿菌O4抗原多醣之rfb
基因叢核苷酸序列;(ii)編碼與SEQ ID NO: 4具有至少80%序列一致性之葡糖基轉移酶的核苷酸序列,其中葡糖基轉移酶能夠修飾大腸桿菌O4抗原多醣以產生大腸桿菌葡糖基化O4抗原多醣;(iii)編碼載體蛋白之核苷酸序列;及(iv)編碼能夠使大腸桿菌葡糖基化O4抗原多醣共價連接至載體蛋白以產生生物結合物之寡醣基轉移酶之核苷酸序列。在較佳實施例中,編碼與SEQ ID NO: 4具有至少80%序列一致性之葡糖基轉移酶的核苷酸序列置換內源性gtrS
基因。刪除內源性gtrS
之優點在於其將不干擾葡糖基化O4抗原多醣結構之產生。在某些實施例中,大腸桿菌O4抗原多醣之rfb
基因叢之核苷酸序列置換用於製成重組宿主細胞之母株的內源性rfb
基因叢。若細胞尚未編碼gtrA
及/或gtrB
基因,則可以將編碼分別與SEQ ID NO: 7及8具有至少80%一致性之易位酶(gtrA)及醣基轉移酶(gtrB)的核苷酸序列引入至細胞中。若細胞已編碼gtrA
及gtrB
基因(諸如大腸桿菌K-12菌株W3110之情況),則不需要引入或改變此等基因。
在一個特定實施例中,葡糖基轉移酶(對將葡萄糖分支添加至O4抗原具有特異性之gtrS)具有SEQ ID NO: 4。
在一特定實施例中,寡醣基轉移酶為來自空腸曲桿菌之PglB。在一個此類實施例中,寡醣基轉移酶包含SEQ ID NO: 6之胺基酸序列。在另一此類實施例中,寡醣基轉移酶包含含突變N311V之胺基酸序列SEQ ID NO: 6。在另一此類實施例中,寡醣基轉移酶包含含突變Y77H及N311V胺基酸序列SEQ ID NO: 6。
在另一特定實施例中,載體蛋白包含至少一個包含具有SEQ ID NO: 1、較佳SEQ ID NO: 2之醣基化共同序列的醣基化位點。在另一特定實施例中,載體蛋白為EPA,較佳為EPA-4,諸如包含SEQ ID NO: 3之EPA-4。
在根據本發明之某些實施例中,在分子生物學中作為工具及模型生物體兩者而常規使用的大腸桿菌菌株可例如用作宿主細胞之母體。非限制性實例包括大腸桿菌K12菌株(例如W1485、W2637、W3110、MG1655、DH1、DH5α、DH10等)、B菌株(例如BL-21、REL606等)、C菌株或W菌株。在一個特定實施例中,主體菌株來源於母株W3110。此菌株可例如獲自耶魯大學大腸桿菌基因庫存中心。對於關於大腸桿菌之更多資訊,參見例如Ecoliwiki.net。
製備結合物及生物結合物之方法
亦提供製備本文所述之大腸桿菌O抗原多醣之醣結合物的方法。醣結合物(包括生物結合物)可例如使用本文所述之用於製備製程的重組宿主細胞在活體外或活體內製得。
在一些實施例中,醣結合物可藉由化學合成製得,亦即於宿主細胞外部(活體外)製得。舉例而言,大腸桿菌O抗原多醣可使用一般熟習此項技術者已知之方法結合至載體蛋白,包括藉助於使用多醣/寡醣以及載體蛋白中之活化反應基。參見例如Pawlowski等人, 2000,Vaccine
18:1873-1885;及Robbins等人, 2009,Proc Natl Acad Sci USA
106:7974-7978),其揭示內容以引用的方式併入本文中。此類方法包含自宿主細胞提取抗原多醣/寡醣,純化該等多醣/寡醣,以化學方式活化該等多醣/寡醣,且將該等多醣/寡醣結合至載體蛋白。
在一些實施例中,本文所述之宿主細胞可用於製備包含共價連接至載體蛋白之大腸桿菌O抗原多醣的生物結合物。使用宿主細胞製備此類生物結合物之方法在此項技術中已知。參見例如WO 2003/074687及WO 2006/119987。此類方法包含在製備生物結合物之條件下培養本文所述之重組宿主細胞中之任一者。鑒於本發明,可使用此項技術中已知之任何方法自重組宿主細胞分離、分開及/或純化生物結合物。舉例而言,生物結合物可藉由此項技術中已知之用於純化蛋白質之任何方法,例如藉由層析(例如離子交換、陰離子交換、親和性及篩分管柱層析)、離心、差示溶解度或藉由用於純化蛋白質之任何其他標準技術純化。參見例如WO 2009/104074中描述之方法。另外,生物結合物可與異源多肽序列稠合以促進純化。用於純化特定生物結合物之實際條件部分地視諸如生物結合物之淨電荷、疏水性及/或親水性之因素而定,且對於熟習此項技術者而言為顯而易見的。用於O1A、O2、O6A及O25B之生物結合物以及包含此等生物結合物之疫苗組合物的製得方案已描述於例如WO 2015/124769中及WO 2017/035181中。
亦提供藉由本文所述之方法,亦即使用本文所述之重組宿主細胞來製備生物結合物。
在一些實施例中,製得共價連接至載體蛋白之大腸桿菌O-抗原多醣的生物結合物的方法包含:(i)提供重組宿主細胞,其包含(a) O-抗原多醣之rfb
基因叢核苷酸序列; (b)編碼載體蛋白,較佳為EPA之核苷酸序列,該核苷酸序列包含至少一個醣基化位點,該至少一個醣基化位點包含具有SEQ ID NO: 1,較佳SEQ ID NO: 2之醣基化共同序列,且更佳地該核苷酸序列包含四個醣基化位點,該等醣基化位點各自包含具有SEQ ID NO: 2之醣基化共同序列;及(c)編碼寡醣基轉移酶,例如PglB寡醣基轉移酶或其變異體之核苷酸序列。
在某些實施例中,使用本文所述之重組宿主細胞製備的大腸桿菌O-抗原多醣以特定多醣與蛋白質之重量比(w/w)共價鍵結至載體蛋白。共價鍵結至載體蛋白之O-抗原多醣之量的此重量比稱為「聚醣/蛋白質比率」或「多醣/蛋白質比率」或「PS/蛋白質比率」。在一些實施例中,O-抗原多醣以約1:20至20:1、較佳1:10至10:1、更佳1:3至3:1之多醣與蛋白質(w/w)比率共價鍵結至載體蛋白。在本文所述之生物結合物之某些非限制性實施例中,聚醣/蛋白質比率為約0.1至0.5,諸如0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45或0.5。在此類實施例中,視特定的O-抗原血清型而定,O-抗原多醣:蛋白質之重量比為約1:10至1:2,諸如1:10: 1:9: 1:8、1:7、1:6、1:5、1:4、1:3或1:2。在某些實施例中,聚醣/蛋白質比率為約0.15至約0.45。一般而言,更佳的是O-抗原多醣與載體蛋白之較高聚醣/蛋白質比率,因為在一些情況下,大量載體蛋白可引起免疫干擾。此外,較高的聚醣/蛋白質比率將幫助獲得以生物結合物形式給藥之足夠的抗原多醣,同時使載體蛋白之量保持相對較低,從而尤其有益於多種血清型由組合物覆蓋之多價組合物,例如包含來自至少4種不同O-抗原、至少5種不同O-抗原、至少6種不同O-抗原、至少7種不同O-抗原、至少8種不同O-抗原、至少9種不同O-抗原、至少10種不同O-抗原等之生物結合物的組合物。
本發明結合物之聚醣/蛋白質比率可藉由測定蛋白質量及聚醣量來測定。蛋白質之量可藉由量測280 nm下之UV吸光度(A280)來測定。聚醣量可基於離子層析法對重複單元中之糖(例如,表1中O8之Man,及表1中其他聚醣之GlcNAc)進行脈衝電流分析檢測(IC-PAD)來測定。其後,重複單元之結構資訊可用於計算總聚醣量(例如O1A之重複單元具有845 Da之莫耳質量,且一莫耳此類重複單元含有一莫耳GlcNAc,從而使得能夠在已藉由IC-PAD測定GlcNAc之量時計算總聚醣量)。
在一些實施例中,根據本文所述之細胞及方法使用重組宿主細胞製備共價連接至載體蛋白之大腸桿菌O25B抗原多醣的生物結合物在L-Rh糖之位置2處一定程度乙醯化。生物結合物中O25B抗原多醣之O-乙醯化程度較佳為至少30%,較佳至少50%,諸如至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
類似地,生物結合物中大腸桿菌O16抗原多醣之O-乙醯化程度較佳為至少30%,較佳至少50%,諸如至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
在特定實施例中,一種製得O-抗原多醣生物結合物的方法包含提供包含編碼特定寡醣基轉移酶,尤其PglB寡醣基轉移酶或其變異體之核酸序列的重組宿主細胞,其視待生產之O-抗原多醣生物結合物而定。特定寡醣基轉移酶變異體可影響由宿主細胞產生生物結合物之產率。通常,較高產率為較佳的,因為產率將影響製備特異性生物結合物之成本,其對於包含數種不同生物結合物之多價組合物尤其重要。在一些實施例中,該方法進一步包含自重組宿主細胞分離生物結合物。
在一個特定實施例中,當O-抗原為O1A、O6A或O15抗原多醣時,PglB寡醣基轉移酶包含胺基酸突變N311V、K482R、D483H及A669V,其中胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB。
在另一特定實施例中,當O-抗原為葡糖基化O4抗原多醣時,PglB寡醣基轉移酶包含胺基酸突變N311V或胺基酸突變Y77H及N311V,其中胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB。
在另一特定實施例中,當O-抗原為O16抗原多醣時,PglB寡醣基轉移酶包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V,其中胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB。
在另一特定實施例中,當O-抗原為O75抗原多醣時,PglB寡醣基轉移酶包含胺基酸突變N311V,其中胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB。
在另一特定實施例中,當O-抗原為O8、O18A、O25B或O2抗原多醣時,PglB寡醣基轉移酶包含胺基酸序列SEQ ID NO: 6,其中SEQ ID NO: 6在位置77、80、287、289、311、482、483及669處不包含胺基酸突變。在其某些實施例中,PglB寡醣基轉移酶包含胺基酸序列SEQ ID NO: 6。
在一些實施例中,載體蛋白係選自由以下組成之群:解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌之蛋白D。
在某些實施例中,載體蛋白為解毒之綠膿桿菌外毒素A (EPA)。較佳地,EPA載體蛋白包含1-10個、較佳2-4個、更佳4個醣基化位點。較佳地,各醣基化位點包含具有胺基酸序列SEQ ID NO: 2之醣基化共同序列。在一特定實施例中,宿主細胞包含編碼包含SEQ ID NO: 3之EPA-4載體蛋白的核酸。
在某些實施例中,重組宿主細胞為大腸桿菌細胞,例如大腸桿菌K-12菌株,諸如菌株W3110。
本文亦提供O-抗原多醣生物結合物,該等生物結合物根據上文所指示之O-抗原/PglB寡醣基轉移酶配使用編碼寡醣基轉移酶之重組宿主細胞來製備。亦提供包含此類生物結合物之組合物。在某些實施例中,組合物包含至少2個、較佳至少3個、更佳至少5個、再更佳至少7個此類生物結合物。
在一些實施例中,由編碼寡醣基轉移酶之重組宿主細胞根據上文所指示之O-抗原/PglB寡醣基轉移酶對而製備之O-抗原多醣生物結合物較佳具有本文中所述之較佳屬性中之一或多者,例如聚醣/蛋白質比率及/或經多次醣基化之載體蛋白的量或比率。
實施例
實施例1為一種製得共價連接至載體蛋白之大腸桿菌Ox
抗原多醣之生物結合物的方法,該方法包含:
(i)提供包含以下之重組宿主細胞:
a.該Ox
-抗原多醣之rfb
基因叢核苷酸序列;
b.編碼包含至少一個醣基化位點之該載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO: 1,較佳具有SEQ ID NO: 2之醣基化共同序列;及
c.編碼寡醣基轉移酶PglBy
之核苷酸序列;及
(ii)在用於製備該生物結合物之條件下培養該重組宿主細胞;其中:
當該Ox
-抗原為O1A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為葡糖基化O4抗原多醣時,該PglBy
包含胺基酸突變N311V或胺基酸突變Y77H及N311V,且該重組宿主細胞進一步包含編碼葡糖基轉移酶GtrS的序列,該葡糖基轉移酶GtrS與SEQ ID NO: 4具有至少80%一致性且能夠藉由添加葡萄糖修飾大腸桿菌O4抗原多醣以產生該大腸桿菌葡糖基化O4抗原多醣, 及編碼分別與SEQ ID NO: 7及8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化;
當該Ox
-抗原為O6A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O8抗原多醣時,該PglBy
在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;
當該Ox
-抗原為O15抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O16抗原多醣時,該PglBy
包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V;
當該Ox
-抗原為O18A抗原多醣時,該PglBy
在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;及
當該Ox
-抗原為O75抗原多醣時,該PglBy
包含胺基酸突變N311V;
其中在各種情況下,該等胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB,及
其中該等O1A、葡糖基化O4、O6A、O8、O15、O16、O18A及O75抗原多醣分別具有式(O1A)、(O4-Glc+)、(O6A)、(O8)、(O15)、(O16)、(O18A)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例2為如實施例1之方法,其中Ox
-抗原為O1A抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
實施例3為如實施例1之方法,其中Ox
-抗原為葡糖基化O4抗原多醣,且該PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V或胺基酸突變Y77H及N311V。
實施例4為如實施例3之方法,其中重組宿主細胞進一步包含編碼具有胺基酸序列SEQ ID NO: 4之GtrS的序列,及分別編碼具有胺基酸序列SEQ ID NO: 7及SEQ ID NO: 8之GtrA及GtrB的核苷酸序列。
實施例5為如實施例1之方法,其中Ox
-抗原為O6A抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
實施例6為如實施例1之方法,其中Ox
-抗原為O8抗原多醣,且PglBy
在位置77、80、287、289、311、482、483及669處相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB不包含胺基酸突變。
實施例7為如實施例1之方法,其中Ox
-抗原為O15抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
實施例8為如實施例1之方法,其中Ox
-抗原為O16抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V。
實施例9為如實施例1之方法,其中Ox
-抗原為O18A抗原多醣,且PglBy
在位置77、80、287、289、311、482、483及669處相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB不包含胺基酸突變。
實施例10為如實施例1之方法,其中Ox
-抗原為O75抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V。
實施例11為一種製得共價連接至載體蛋白之大腸桿菌Ox
抗原多醣之生物結合物的方法,該方法包含:
(i)提供包含以下之重組宿主細胞:
(a) Ox
-抗原多醣之rfb
基因叢核苷酸序列;
(b)編碼包含至少一個醣基化位點之載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO: 1,較佳具有SEQ ID NO: 2之醣基化共同序列;及
(c)編碼寡醣基轉移酶PglBy
之核苷酸序列;及
(ii)在用於製備該生物結合物之條件下培養該重組宿主細胞,
其中該PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V,
其中Ox
-抗原為O1A抗原多醣、葡糖基化O4抗原多醣、O6A抗原多醣、O15抗原多醣、O16抗原多醣或O75抗原多醣,且當Ox
-抗原為葡糖基化O4抗原多醣時,重組宿主細胞進一步包含編碼與SEQ ID NO: 4具有至少80%一致性之葡糖基轉移酶GtrS且能夠藉由添加葡萄糖來修飾大腸桿菌O4抗原多醣以產生大腸桿菌葡糖基化O4抗原多醣,及分別與SEQ ID NO: 7及8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化,及
其中該等O1A、葡糖基化O4、O6A、O15、O16及O75抗原多醣分別具有式(O1A)、(O4-Glc+)、(O6A)、(O15)、(O16)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例12為如實施例1至11中任一項之方法,其進一步包含自重組宿主細胞分離生物結合物。
實施例13為如實施例1至12中任一項之方法,其中該載體蛋白係選自由以下組成之群:解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌之蛋白D。
實施例14為如實施例13之方法,其中載體蛋白為解毒之綠膿桿菌外毒素A (EPA)。
實施例15為如實施例14之方法,其中EPA載體蛋白包含1-10個、較佳2-4個、更佳4個醣基化位點。
實施例16為如實施例15之方法,其中各醣基化位點包含具有SEQ ID NO: 2之醣基化共同序列。
實施例17為如實施例16之方法,其中EPA載體蛋白包含SEQ ID NO: 3。
實施例18為實施例1至17中之任一項之方法,其中重組宿主細胞為大腸桿菌細胞,例如大腸桿菌K12菌株,諸如菌株W3110。
實施例19為一種藉由如實施例1至18中任一項之方法製備之生物結合物。
實施例20為一種包含如實施例19之生物結合物的組合物。
實施例21為包含至少2個、較佳至少3個、更佳至少5個、再更佳至少7個如實施例19之生物結合物的組合物。
實施例22為如實施例20或21之組合物,其包含共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣之生物結合物,其中葡糖基化O4抗原多醣具有如表1中所示之式(O4-Glc+)之結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例23為如實施例20至22中任一項之組合物,其進一步包含共價連接至載體蛋白之大腸桿菌O25B抗原多醣之至少一種生物結合物,其中O25B抗原多醣具有如表1中所示之式(O25B)之結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例24為如實施例20至23中任一項之組合物,其進一步包含共價連接至載體蛋白之大腸桿菌O2抗原多醣的生物結合物,其中O2抗原多醣具有如表1中所示之式(O2)之結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例25為如實施例20至24中任一項之組合物,其包含:
(i)共價偶合至載體蛋白之大腸桿菌O1A抗原多醣之生物結合物,(ii)共價偶合至載體蛋白之大腸桿菌O2抗原多醣之生物結合物,(iii)共價偶合至載體蛋白之大腸桿菌葡糖基化O4抗原多醣之生物結合物,(iv)共價偶合至載體蛋白之大腸桿菌O6A抗原多醣之生物結合物,(v)共價偶合至載體蛋白之大腸桿菌O8抗原多醣之生物結合物, (vi) 共價偶合至載體蛋白之大腸桿菌O15抗原多醣之生物結合物,(vii) 共價偶合至載體蛋白之大腸桿菌O16抗原多醣之生物結合物,(viii) 共價偶合至載體蛋白之大腸桿菌O25B抗原多醣之生物結合物,及(ix) 共價偶合至載體蛋白之大腸桿菌O75抗原多醣之生物結合物,其中O1A、O2、葡糖基化O4、O6A、O8、O15、O16、O25B及O75抗原多醣分別具有式(O1A)、(O2)、(O4-Glc+)、(O6A)、(O8)、(O15)、(O16)、(O25B)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例26為實施例25之組合物,其進一步包含:(x)共價偶合至載體蛋白之大腸桿菌O18A抗原多醣之生物結合物,其中O18A抗原多醣具有如表1中所示之式(O18A)結構,且n為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例27為如實施例20至26中任一項之組合物,其中該組合物為免疫原性組合物。
實施例28為一種對個體進行疫苗接種來對抗大腸桿菌,尤其腸外病原性大腸桿菌(ExPEC)之方法,其包含向個體投與如實施例19之生物結合物或如實施例20至27中任一項之組合物或免疫原性組合物。
實施例29為如實施例19之生物結合物或如實施例20至27中任一項之組合物或免疫原性組合物,其用於進行疫苗接種來對抗腸外病原性大腸桿菌(ExPEC)。
實施例30為用於製得共價連接至載體蛋白之大腸桿菌Ox
抗原多醣之生物結合物的重組宿主細胞,該重組宿主細胞包含:
(a) Ox
-抗原多醣之rfb
基因叢核苷酸序列;
(b)編碼包含至少一個醣基化位點之載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO: 1,較佳具有SEQ ID NO: 2之醣基化共同序列;及
(c)編碼寡醣基轉移酶PglBy
之核苷酸序列;
其中:
當該Ox
-抗原為O1A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為葡糖基化O4抗原多醣時,該PglBy
包含胺基酸突變N311V或胺基酸突變Y77H及N311V,且該重組宿主細胞進一步包含編碼葡糖基轉移酶GtrS的序列,該葡糖基轉移酶GtrS與SEQ ID NO: 4具有至少80%一致性且能夠藉由添加葡萄糖修飾大腸桿菌O4抗原多醣以產生該大腸桿菌葡糖基化O4抗原多醣, 及編碼分別與SEQ ID NO: 7及8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化;
當該Ox
-抗原為O6A抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O8抗原多醣時,該PglBy
在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;
當該Ox
-抗原為O15抗原多醣時,該PglBy
包含胺基酸突變N311V、K482R、D483H及A669V;
當該Ox
-抗原為O16抗原多醣時,該PglBy
包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V;
當該Ox
-抗原為O18A抗原多醣時,該PglBy
在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;及
當該Ox
-抗原為O75抗原多醣時,該PglBy
包含胺基酸突變N311V;
其中在各種情況下,該等胺基酸突變係相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB,及
其中該等O1A、葡糖基化O4、O6A、O8、O15、O16、O18A及O75抗原多醣分別具有式(O1A)、(O4-Glc+)、(O6A)、(O8)、(O15)、(O16)、(O18A)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例31為如實施例30之重組宿主細胞,其中Ox
-抗原為O1A抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
實施例32為如實施例30之重組宿主細胞,其中Ox
-抗原為葡糖基化O4抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V或胺基酸突變Y77H及N311V。
實施例33為如實施例32之重組宿主細胞,其中該重組宿主細胞進一步包含編碼具有胺基酸序列SEQ ID NO: 4之GtrS的序列,及分別編碼具有SEQ ID NO: 7及8之胺基酸序列之GtrA及GtrB的核苷酸序列。
實施例34為如實施例30之重組宿主細胞,其中Ox
-抗原為O6A抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含基酸突變N311V、K482R、D483H及A669V。
實施例35為如實施例30之重組宿主細胞,其中Ox
-抗原為O8抗原多醣,且PglBy
在位置77、80、287、289、311、482、483及669處相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB不包含胺基酸突變。
實施例36為如實施例30之重組宿主細胞,其中Ox
-抗原為O15抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V、K482R、D483H及A669V。
實施例37為如實施例30之重組宿主細胞,其中Ox
-抗原為O16抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V。
實施例38為如實施例30之重組宿主細胞,其中Ox
-抗原為O18A抗原多醣,且PglBy
在位置77、80、287、289、311、482、483及669處相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB不包含胺基酸突變。
實施例39為如實施例30之重組宿主細胞,其中Ox
-抗原為O75抗原多醣,且PglBy
相對於具有胺基酸序列SEQ ID NO: 6之野生型PglB包含胺基酸突變N311V。
實施例40為實施例30至39中任一項之重組宿主細胞,其中該載體蛋白係選自由以下組成之群:解毒之綠膿桿菌外毒素A (EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素變異體、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素變異體、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌之蛋白D。
實施例41為如實施例30至40中任一項之重組宿主細胞,其中載體蛋白為解毒之綠膿桿菌外毒素A (EPA)。
實施例42為如實施例41之重組宿主細胞,其中EPA載體蛋白包含1-10個、較佳2-4個、更佳4個醣基化位點。
實施例43為如實施例42之重組宿主細胞,其中各醣基化位點包含具有SEQ ID NO: 2之醣基化共同序列。
實施例44為如實施例43之重組宿主細胞,其中EPA載體蛋白包含SEQ ID NO: 3。
實施例45為如實施例30至實施例44中任一項之重組宿主細胞,其中重組宿主細胞為大腸桿菌細胞,例如大腸桿菌K-12菌株,諸如菌株W3110。
實施例46為如實施例19之生物結合物,其中該生物結合物為共價連接至載體蛋白之大腸桿菌葡糖基化O4抗原多醣之生物結合物。
實施例47為如實施例46之生物結合物,其中載體蛋白為包含SEQ ID NO: 3之EPA載體蛋白。
實施例48為如實施例46或47之生物結合物,其中葡糖基化O4抗原多醣具有如表1中所示之式(O4-Glc+)之結構,且n為5至40之整數。
實施例49為一種包含如實施例46至48中任一項之生物結合物的組合物。
實施例50為如實施例49之組合物,其進一步包含一或多種各自包含共價偶合至載體蛋白之大腸桿菌抗原多醣之結合物。
實施例51為如實施例50之組合物,其中一或多種結合物包含具有以下大腸桿菌血清型中之一或多者的大腸桿菌抗原多醣:O1A、O2、O6A、O8、O15、O16、O18A、O25B及O75,其中O1A、O2、O6A、O8、O15、O16、O18A、O25B及O75抗原多醣分別具有式(O1A)、(O2)、(O6A)、(O8)、(O15)、(O16)、(O18A)、(O25B)及(O75)之結構,如表1中所示,且各n獨立地為整數1至100,較佳3至50,例如5至40,例如7至25,例如10至20。
實施例52為如實施例51之組合物,其包含具有以下大腸桿菌血清型之結合物:O1A、O2、O6A、O8、O15、O16、O18A、O25B及O75。
實施例53為如實施例52之組合物,其中結合物中之每一者為生物結合物。
實例
本發明之以下實例進一步說明本發明之性質。應理解,以下實例並不限制本發明且本發明之範疇係由所附申請專利範圍決定。實例 1 :大腸桿菌感染之流行病資料
為測定菌血症引起之大腸桿菌的O-血清型分佈,進行全球監測研究。在2011年與2017年之間,自在北美、歐洲、亞太區及南美內之國家中的年齡≥60歲的住院患者中收集超過3200個大腸桿菌血流分離株。使用經典凝集技術及基於序列之O-基因分型來分析各菌株之O抗原血清型。參見表2。
分析經分離之人類血液樣品以確定其中之病原體及其抗生素抗性模式之一致性。在分析之後自樣品獲得大腸桿菌分離株。藉由MALDI-TOF MS驗證大腸桿菌身分。使用基於抗血清之凝集分析進行關於大腸桿菌分離株之進一步分析,以確定其O-抗原血清型(DebRoy等人(2011) Animal health research reviews / Conference of Research Workers in Animal Diseases 12, 169-185)。藉由凝集方法不可分型之分離株進一步藉由全基因組測序,隨後基於O-血清型特異性wzy
及wzx
基因序列的O-基因分型來分析。
表 2 :
基於藉由凝集之O-血清分型加上不可藉由凝集分型的分離株之O-基因分型,來自2011年與2017年間在全球範圍內收集的3217血液分離株之集合的最常見菌血症相關之大腸桿菌O-血清型之分佈。在以下國家中的住院個體:美國、加拿大、阿根廷、巴西、英國、德國、西班牙、意大利、荷蘭、法蘭、日本、泰國、韓國及澳大利亞。
| O - 血清型 | 流行率n (%) |
| O25 | 737 (22.9%) |
| O2 | 268 (8.3%) |
| O6 | 261 (8.1%) |
| O1 | 255 (7.9%) |
| O75 | 145 (4.5%) |
| O15 | 110 (3.4%) |
| O8 | 104 (3.2%) |
| O16 | 103 (3.2%) |
| O4 | 96 (3.0%) |
| O18 | 91 (2.8%) |
菌血症相關之大腸桿菌的全球組中的地理區位之分層展示與區位無關的前10種O-血清型之流行率,表明此等為在全球範圍內與菌血症引起之大腸桿菌相關的主要O-血清型。
在全球組菌血症相關之多重抗藥性大腸桿菌分離株(n=345),亦即對至少三種類別的臨床上相關之抗微生物藥物具有抗性之彼等菌株中,前10種O-血清型之流行率為75.4%。
將來自理論學分析之所有資訊結合在一起,假設覆蓋不可分型之菌株之子部分,10種主要的O-血清型可覆蓋估計60-80%的大腸桿菌相關之菌血症感染。
覆蓋相當大比例的菌血症引起之大腸桿菌血清型的多價疫苗將極適用。表2之O-血清型因此將為基於O-抗原之多價疫苗的良好候選物。此類疫苗可宜使用生物結合技術製得。
前10種(表2)血清型中之一者為O4。因此,製得包括偶合至載體蛋白之大腸桿菌血清型O4之O-抗原多醣的生物結合物疫苗將為有益的。實例 2 : 編碼 O - 抗原修飾酶之基因的當代 O4 臨床分離株之表徵
已描述大腸桿菌O4抗原多醣之兩種變異體(參見例如Jann B等人, 1993, Carbohydr. Res. 248: 241-250),一者具有未分支結構(表1中展示為(O4-Glc-)之結構),及另一變異體經額外葡萄糖側分支取代(表1中展示為(O4-Glc+)之結構)。在當代臨床分離株中發現此等兩種變異體之比例未知。儘管兩種變異體與O4抗血清反應,但亦不知曉此等變異體之間是否存在免疫差異。此外,負責使葡萄糖側分支附著以產生(O4-Glc+)抗原多醣之酶迄今為止未被鑑別出,且其推定編碼序列可能存在於O4rfb
基因叢外部。
對最初在2011-2012年時段期間自美國及歐盟之個體分離的一組32個證實凝集之大腸桿菌O4臨床分離株進行全基因組序列分析。將來自32個經測序之O4分離株的經提取之rfb
基因叢序列與參考菌株之序列比對且在核苷酸層面上比較。除一些天然存在之單核苷酸多形現象以外,經表徵之分離株皆顯示與O4參考菌株一致之rfb
簇,指示大腸桿菌O4菌株(與其Glc分支狀態無關)攜有一致的rfb
基因叢。因此,為製備大腸桿菌O4-Glc+抗原多醣,可能需要編碼大腸桿菌O4-特異性分支酶且必須存在於大腸桿菌O4rfb
基因叢外部某處的序列未知之基因。若吾人想要製備在菌株中具有大腸桿菌O4-Glc+抗原多醣之生物結合物,則需要鑑別及採用此未知基因之序列,否則將僅製備具有大腸桿菌O4-Glc-抗原多醣之生物結合物。
接著分析全基因組序列資料之rfb
基因叢外之可編碼O-抗原修飾酶之基因之存在。首先在大腸桿菌O4中鑑別副痢疾桿菌(Shigella flexneri
)中之gtrAB
同源物。接著推定將大腸桿菌中gtrAB
下游之開放閱讀框架鑑別為大腸桿菌O4-特異性基因gtrS
,該基因可編碼負責向大腸桿菌O4抗原添加葡萄糖分支之推定的大腸桿菌O4特異性分支酶GtrS。
大腸桿菌O4特異性GtrS酶之胺基酸序列提供為SEQ ID NO: 4。編碼此蛋白質之例示性核酸序列提供為SEQ ID NO: 5。
在經表徵之大腸桿菌O4分離株中,發現大致80%攜有此處鑑別出之gtrS
基因(32個中有26個)。亦藉由PCR,在20個證實凝集之大腸桿菌O4臨床分離株(在2014-2016時段期間自美國及歐盟中之個體分離)之獨立組中使用序列特異性引子,來測定大腸桿菌O4-特異性gtrS
序列之流行率。此分析證明20個分離株中之17個攜有O4gtrS
序列,其對應於85%之流行率。 實例 3 : 將 O4 gtrS 選殖至 大腸桿菌 W3110 中 , 製備經 Glc - 修飾之 O4 生物結合物及對其進行結構證實
為測試是否可製得包含經分支化葡萄糖修飾之O4-抗原多醣的生物結合物,構築具有推定之分支酶之大腸桿菌O4-抗原EPA生物結合物生產菌株。為此,藉由同源重組在大腸桿菌菌株W3110ΔwzzE-wecG ∆waaL ΔwbbI-J-K
中,內源性O16 - gtrS
基因經推定之O4 - gtrS
(SEQ ID NO: 5,參見實例2)基因取代,且O16rfb
簇經O4rfb
簇置換。替代地,在一些菌株中,O4rfb
簇編碼於質體上。
隨後,將編碼解毒之綠膿桿菌外毒素A (EPA)載體蛋白之質體(具有2或4個共同醣基化位點之變異體,分別稱為「EPA-2」及「EPA-4」)及寡醣基轉移酶PglB引入至菌株中。藉由使大腸桿菌生產菌株在生物反應器培養物中生長來製備經Glc修飾之O4-EPA生物結合物,且分別藉由IPTG及阿拉伯糖誘導PglB及EPA表現。自生物質周質提取物提取O4-EPA生物結合物。
為證實O4-EPA生物結合物之詳細的多醣組合物及鍵,對具有EPA-4載體蛋白之生物結合物進行多次NMR實驗(資料未示出)。所獲得之分配與已公開之文獻(Jansson, P.E.等人, 1984, Carbohydr. Res. 134(2): 283-291; Jann B.等人, 1993, Carbohydr. Res. 248: 241-250)一致。在313K下記錄之1D譜展示較大HOD信號及來自具有五個變旋異構、兩個NAc及兩個H6信號(Rha及FucNAc)的O4戊糖RU之較小急劇信號。
1D質子分配藉由使用2D質子-質子及質子-碳相關性NMR實驗證實。首先,2D TOCSY (120 ms)實驗證明預期交叉峰來自O4戊糖RU之H1及H6 (對於Rha及FucNAc)且較小峰來自末端RU及EPA。在甲基區域中,TOCSY展示來自α-Rha之H6至H1及對於O4 RU的α-FucNAc之H6至H5的交叉峰。觀測到的其他峰來自EPA胺基酸及末端Rha(tRha)。其次,對於O4 RU,碳NMR譜含有良好分散及診斷的單峰。藉由使用HSQC實驗,經由所附著之質子間接描繪碳輪廓。HSQC-DEPT實驗得到CH2
基團之倒置峰。對於特徵區域中之O4戊糖RU [5個變旋異構,環,兩個N-乙醯基及兩個甲基(Rha及FucNAc)]基團以及EPA胺基酸,HSQC給出交叉峰。可基於質子分配及文獻來分配O4之質子/碳對中之每一者。
結構表徵實驗由此證實,可使用實例2中所鑑別出的推定之大腸桿菌O4-gtrS
基因來製備Glc-分支型O4生物結合物(包含如表1中之式(O4-Glc+)所指示之多醣抗原結構)。實例 4 : 兔子中之 Glc - 分支型 O4 生物結合物之免疫原性
藉由應用快速兔子方案(Eurogentec)將經Glc修飾之O4生物結合物(亦即具有如表1中所示之式(O4-Glc+)之結構之聚醣)用於兔子免疫接種。對於針對具有(Glc+;亦即含有葡糖基化O4多醣)或無Glc分支(Glc-;亦即不含有葡糖基化O4多醣)之經純化O4脂多醣(LPS)的抗O4 IgG力價,藉由ELISA分析來自經免疫接種之兔子的血清。用生物結合物免疫接種,在兩隻兔子中產生高IgG力價(圖1)。在兩種情況下,由O4生物結合物誘導之抗體力價相比於Glc-LPS比Glc+ LPS高。
血清亦經彙集且用於具有大腸桿菌O4分離株測試組的全細胞ELISA研究中,該等分離株具有經表徵之gtrS
狀態。測試五個gtrS
-陰性(無Glc-分支)及六個gtrS
-陽性(Glc-分支) 大腸桿菌O4分離株及陰性對照菌株。由經Glc修飾之O4生物結合物免疫接種之兔子的經彙集之血清含有特異性識別所測試之O4分離株的較高力價之IgG (圖2)。根據LPS ELISA,所有測試之O4分離株由免疫血清識別。gtrS
-陽性分離株顯示比gtrS
-陰性分離株之總體更高之結合(圖2)。特定言之,以下分離株為gtrS
-陽性:Y1382、E551、OC24334、stGVXN4983、stGVXN4994及OC24794,且以下分離株為gtrS
-陰性:A2625、stGVXN4988、OC24784、OC24787及OC24788。免疫血清不結合不相關的O-血清型大腸桿菌OC9487 (ATCC 35383)之陰性對照菌株。
自銀染色之聚丙烯醯胺凝膠中之gtrS
-陽性及gtrS
-陰性分離株測試組提取的LPS之概況未揭示表現O4抗原之未經修飾及經修飾形式的分離株之間的顯著差異,證實LPS表現量(資料未展示)之定量差異未解釋所觀測到之差異。
使用經彙集之免疫血清,對所提取之LPS進行西方墨點法,以評定藉由IgG的對O4 O-抗原之識別,該等IgG響應於用經Glc修飾之O4生物結合物免疫而引發。觀測到藉由來自經修飾之O4免疫接種之兔子的IgG來將經修飾與未經修飾之O4 LPS兩者結合,且包括跨越廣泛範圍之大小的LPS帶,包括高分子量LPS帶之特異性識別(圖3)。
在以下其他實驗中,除非另外特定指示,否則當參考「O4」生物結合物或「生產菌株」或「EcoO4」時,意謂Glc-分支型O4 (具有表1中之聚醣結構(O4-Glc+))之生物結合物或生產菌株(術語「O4」及「O4-Glc+」因此在彼等實驗中可互換地用於生物結合物或生產菌株)。實例 5 : 大鼠中之 Glc - 分支型 O4 生物結合物之免疫原性
用調配緩衝液或(O4-Glc+)-EPA生物結合物(亦即,共價偶合至EPA載體蛋白之葡糖基化O4抗原多醣之生物結合物;載體蛋白為如以上實例3中所述之EPA-2)以3種不同劑量(0.04 µg、0.40 µg或4.0 µg)對史泊格多利大白鼠進行肌肉內免疫接種3次。在免疫接種後第0天、第14天及第42天藉由ELISA量測血清抗體含量。
當與調配緩衝液相比時,在免疫接種後42天,用(0.04 µg、0.40 µg及4.00 µg之(O4-Glc+)-EPA生物結合物進行的免疫接種誘導IgG抗體含量顯著增加(圖4A)。由(O4-Glc+)-結合物誘導之抗體具有功能性,亦即能夠介導(O4-Glc+)大腸桿菌菌株之殺滅(圖4B)。
相比於在基線(對於所有劑量,在第42天對比第0天,P=0.006)及免疫接種後第14天(對於所有劑量,在第42天對比第14天,P=0.006)偵測到之抗體含量,在第42天由0.04 µg、0.40 µg及4.0 µg之(O4-Glc+)-EPA生物結合物誘導之抗體含量顯著增加(圖5)。在接受4.0 µg生物結合物之群中,相比於第0天,在第14天力價亦顯著增加,指示單次劑量4.0 µg之(O4-Glc+)-EPA生物結合物誘導IgG力價顯著增加(第14天對比第0天,P=0.012)。對於所測試生物結合物之所有三種濃度,在第14天與第42天之間觀測到的IgG力價之顯著增加展示,第三劑量之(O4-Glc+)-EPA生物結合物能夠增強抗體反應(圖5)。
由O4-Glc+-EPA結合物在用調配緩衝液或生物結合物以4.00 µg/劑量進行肌肉內免疫接種3次之大鼠中誘導之抗體的功能性,係使用O4(Glu+)及O4(Glu-)大腸桿菌菌株藉由調理吞噬殺滅分析(OPKA)確定。由(O4-Glc+)-EPA生物結合物誘導之抗體具有功能性,亦即能夠介導(O4-Glc+)大腸桿菌菌株之殺滅(圖4B、圖6)。值得注意的是,由(O4-Glc+)-EPA生物結合物誘導之抗體能夠介導(O4-Glc+)大腸桿菌菌株及(O4-Glc-,亦即具有含有表1中式(O4-Glc-)之結構的聚醣,亦即無Glc-分枝之O4多醣)大腸桿菌菌株(圖6)之殺滅。
總之,由O4-Glc+-EPA生物結合物誘導之抗體具有交叉反應性,且能夠在葡萄糖分支存在及不存在下介導大腸桿菌O4菌株之殺滅。實例 6 : 大腸桿菌 O - 抗原生物結合物之生產菌株及所得生物結合物產物
除了如上文所述製得之(O4-Glc+)-EPA生物結合物之外,亦製備了九種(9)其他生物結合物。特定言之,另外製備之生物結合物包括大腸桿菌O1A-EPA生物結合物、O2-EPA生物結合物、O6A-AEPA生物結合物、O8-EPA生物結合物、O15-EPA生物結合物、O16-EPA生物結合物、O18A-EPA生物結合物、O25B-EPA生物結合物及O75-EPA生物結合物。此等結合物之聚醣的化學結構可見於表1中之各別式中。包含10個生物結合物之組合物在本文中稱為「ExPEC10V」。包含O1A-EPA、O2-EPA、O6A-EPA及O25B-EPA生物結合物之組合物稱為「ExPEC4V」(且先前描述於例如WO 2015/124769及WO 2017/035181中)。
大腸桿菌
W3110
母株
非病原性大腸桿菌K12菌株W3110用作構築所有十種生產菌株之母株。大腸桿菌K12菌株W3110自大腸桿菌基因庫存中心(美國新哈芬市(New Haven)(CT)耶魯大學,產品編號CGSC#4474)獲得。先前描述了其相關基因型(大腸桿菌W3110, F-, λ-, IN(rrnD-rrnE)1, rph-1),且先前公開了其基因組序列(Hayashi K等人, 2006, Mol. Syst. Biol. 2006.0007 (doi:10.1038/msb4100049)。大腸桿菌W3110菌株經基因修飾以使得能夠產生大腸桿菌O-抗原生物結合物中之每一者(表3)。
生物結合物生產菌株
「ExPEC4V」及「ExPEC10V」組合物均包含來自相同生產菌株之O2-EPA生物結合物及O25B-EPA生物結合物。「ExPEC4V」組合物包含來自stGVXN4411或stLMTB10217生產菌株之O1A-EPA生物結合物,而「ExPEC10V」組合物包含來自stLMTB10217生產菌株之O1A-EPA生物結合物。「ExPEC4V」組合物包含來自stGVXN4112生產菌株之O6A-EPA生物結合物,而「ExPEC10V」組合物包含來自標準stLMTB10923生產菌株之O6A-EPA生物結合物。此外,「ExPEC10V」組合物包含來自不用於「ExPEC4V」之生產菌株的O4-EPA (亦即(O4-Glc+)-EPA)、O8-EPA, O15-EPA, O16-EPA, O18A-EPA及O75-EPA生物結合物。如下文所指示,不同生產菌株可在質體中變化以用於表現EPA載體蛋白及/或寡醣基轉移酶PglB。若干生產菌株之概述提供於下表3中。 表 3 : 對用於 ExPEC4V 及 ExPEC10V 疫苗組合物的 O - 抗原生物結合物之大腸桿菌生產菌株之基因工程改造的概述
| 血清型 | 菌株名稱 | 基因組突變 | 質體 | |||
| rfb 基因叢 | waaL | gtrABS | pglB | epa | ||
| O1A (ExPEC4V) | stGVXN4411 | Δrfb ::O1Arfb upecGVXN_032 | ΔwaaL | - | pGVXN970 | pGVXN1076 |
| O1A (ExPEC4V; ExPEC10V) | stLMTB10217 | Δrfb ::O1Arfb upecGVXN_032 | ΔwaaL | - | pGVXN1221 | pGVXN1076 |
| O2 | stGVXN4906 | Δrfb ::O2rfb upecGVXN_116 | ΔwaaL | - | pGVXN971 | pGVXN1076 |
| O4 | BVEC-L-00684 | Δrfb ::O4rfb CCUG11450 | ΔwaaL | ΔgtrS ::gtrS O4 | pGVXN1217 | pGVXN1076 |
| O6A (ExPEC4V) | stGVXN4112 | Δrfb ::O6Arfb CCUG11309 | ΔwaaL | - | pGVXN114 | pGVXN659 |
| O6A (ExPEC10V) | stLMTB10923 | Δrfb ::O6Arfb CCUG11309 | ΔwaaL | - | pGVXN1221 | pGVXN1076 |
| O8 | stLMTB11734 | Δrfb ::O8rfb E2420 | ΔwaaL | ΔgtrABS | pGVXN970 | pGVXN1076 |
| O15 | stLMTB11738 | Δrfb ::O15rfb OC24891 | ΔwaaL | ΔgtrABS | pGVXN1221 | pGVXN1076 |
| O16 | stLMTB11739 | Δrfb ::O16rfb OC24208 | ΔwaaL | ΔgtrABS | pGVXN2381 | pGVXN1076 |
| O18A | BVEC-L-00559 | Δrfb ::O18Arfb OC24255 | ΔwaaL | ΔgtrABS | pGVXN970 | pGVXN1076 |
| O25B | stGVXN4459 | Δrfb ::O25Brfb upecGVXN_138 | ΔwaaL | ΔgtrABS | pGVXN970 | pGVXN1076 |
| O75 | stLMTB11737 | Δrfb ::O75rfb CCUG31 | ΔwaaL | ΔgtrABS | pGVXN1217 | pGVXN1076 |
O
-
抗原生物合成
(
rfb
)
基因叢
在所有大腸桿菌O-抗原生產菌株中,天然存在之大腸桿菌W3110基因組O16::IS5-抗原生物合成(rfb
)基因叢經來自所選擇血清型之大腸桿菌菌株的經選擇之O-抗原性特異性生物合成簇置換,編碼血清型特異性O-抗原結構(關於此等O-抗原結構參見表1)。在對大腸桿菌血液分離株之全基因組分析之後,選擇或證實十個供體rfb
簇。在單一同源重組事件中實現W3110 O16::IS5rfb
基因叢之置換,該置換在O-抗原生物合成中為缺乏的。在O16及O18Arfb
基因叢之情況下,供體DNA經由側接gnd
及rmlCA
基因重組,而其他菌株之rfb
基因叢經由側接gnd
及galF
基因重組。生產菌株中之rfb
簇之序列提供於SEQ ID NO: 9及11-19中。
O
-
抗原連接酶
(
waaL
)
基因
所有大腸桿菌O-抗原生產菌株攜有人工引入的由waaL
基因編碼之大腸桿菌W3110基因組O-抗原連接酶之缺失。在ΔwaaL菌株中,O-抗原至脂質A之轉移遭破壞,其反而引導O-抗原轉移至載體蛋白以增加產物產率。
O - 抗原
葡糖基化 ( gtrABS ) 基因
在大腸桿菌O8、O15、O16、O18A、O25B及O75生產菌株中,已刪除負責O16 O-抗原葡糖基化的大腸桿菌W3110基因組gtrABS
基因。雖然不同血清型中之gtrA
及gtrB
基因高度同源且可互換,但gtrS
基因編碼血清型特異性O-抗原醣基轉移酶。在大腸桿菌W3110中,GtrS可將葡萄糖(Glc)殘基轉移至大腸桿菌O16 O-抗原之α-L-Rha-(1→3)-D-GlcNAc基元中之GlcNAc糖。在大腸桿菌O1A、O2及O6A生產菌株中,未發生gtrABS
基因之缺失或置換。此等O-抗原丟失了為大腸桿菌O16gtrS
之天然受質的α-L-Rha-(1→3)-D-GlcNAc基元。在大腸桿菌O4生產菌株中,已用大腸桿菌O4gtrS
基因置換W3110gtrS
基因以適應大腸桿菌O4 O-抗原之適當葡糖基化。
寡醣基轉移酶
PglB
所有大腸桿菌O-抗原生產菌株表現空腸曲桿菌醣基轉移酶PglB之變異體,該等菌株可藉由N
-醣基化將O-抗原轉移至載體蛋白上之胺基酸共同序列上。PglB具有較廣的基質識別,但由於較低的產物產率,製得表現具有經修飾之基質特異性之PglB變異體的若干生產菌株,其使得產物產率得以改良(參見例如WO 2016/107818、WO 2016/107819)。pglB
基因置於質體上之異丙基β-D-1-硫代半乳糖苷(IPTG)可誘導的啟動子後。下表4列舉由質體編碼之PglB變異體,該等質體用於製備上文所述之ExPEC4V及ExPEC10V組合物之生物結合物的大腸桿菌O-抗原生產菌株。對於生物結合物生產,亦已成功地測試在載體主鏈、抗生素抗性標記物及/或替代的PglB變異體中具有變化形式之其他質體。
表 4
:用於大腸桿菌O-抗原生產菌株中之PglB及EPA質體
1
SpR,抗觀黴素(spectinomycin);AmpR,抗安比西林(ampicillin);KanR,抗康黴素(kanamycin)
| 質體名稱 | 基因 | 描述 1 |
| pGVXN114 | pglB | 空腸曲桿菌密碼子使用法;SpR |
| pGVXN970 | pglB | 大腸桿菌密碼子使用法經優化;SpR |
| pGVXN971 | pglB N534Q | 大腸桿菌密碼子使用法經優化;不活化PglB之天然醣基化位點;SpR |
| pGVXN1217 | pglB N311V | 大腸桿菌密碼子使用法經優化;經受質優化之PglB;SpR |
| pGVXN1221 | pglB N311V,K482R,D483H,A669V | 大腸桿菌密碼子使用法經優化;經受質優化之PglB;SpR |
| pGVXN2381 | pglB Y77H,S80R,Q287P,K289R,N311V | 大腸桿菌密碼子使用法經優化;經受質優化之PglB;SpR |
| pGVXN659 | EPA-4 | 具有四個生物結合位點之EPA;AmpR |
| pGVXN1076 | EPA-4 | 具有四個生物結合位點之EPA;KanR |
載體蛋白
(
EPA
)
所有大腸桿菌O-抗原生產菌株將基因解毒之綠膿桿菌ADP-核糖基轉移酶類毒素(EPA)表現為用於O-抗原之載體蛋白。EPA類毒素在兩個殘基上不同於野生型EPA毒素:Leu552變為Val且Glu553 (在催化域中)遭缺失。Glu553缺失據報導顯著降低毒性。除解毒突變以外,引入四個(EPA-4)共同N
-醣基化位點基元。將epa
基因置於質體上之L-阿拉伯糖(Ara)可誘導的啟動子後(表4)。表4限於生物結合物的生產菌株中所用之質體,該等生物結合物用於上文所述之「ExPEC4V」及「ExPEC10V」組合物中。對於生物結合物生產,亦已成功地測試在載體主鏈、抗生素抗性標記物及/或EPA變異體中具有變化形式(例如,在共同N-醣基化位點基元(例如具有兩個此類基元,EPA-2)之數目上變化)之質體。實例 7 : 優化寡醣基轉移酶以製備具有葡糖基化 O 4 ( O4 - Glc + ) 抗原之生物結合物
對生物結合物生產進行的產率優化可藉由修飾空腸曲桿菌寡醣基轉移酶PglB來實現,其可使得相關O-抗原至EPA載體蛋白之更有效或更高程度之N
-醣基化。在用於製備具有葡糖基化O4 (O4-Glc+) O-抗原多醣之生物結合物的大腸桿菌菌株中,應用此類優化策略且產生改良生物結合物產物產率之(O4-Glc+)-特異性優化之PglB變異體。
在此方法中,用多種不同PglB表現質體轉化製備含有EPA表現質體之菌株的O4-Glc+ O-抗原多醣,其中之每一者在PglB蛋白質中含有不同胺基酸取代,改變受質特異性。在滲壓衝擊實驗中,在振盪燒瓶水準下評定各菌株之生物結合物生產水準及及概況,且使用O4-Glc+-特異性單株抗體藉由對周質提取物之毛細電泳免疫分析來進行讀取。
發現含有N311V胺基酸取代之所測試之PglB變異體中之一者顯著提高葡糖基化O4生物結合物之產物產率(圖7A)。
在其中N311V PglB-變異體經進一步修飾之進一步改良中,Y77H胺基酸取代進一步增強O4-Glc+-特異性產物產率,且與N311V PglB-變異體相比,展示二醣基化及三醣基化產物之程度增加,其中發現其他修飾為中性或對產物產率具有負面影響(圖7B)。質體pLMTB4008 (SpR)編碼經優化之大腸桿菌密碼子使用法,(O4-Glc+)-受質經優化,具有突變Y77H及N311V之PglB變異體。
與第一輪經優化之PglB-N311V變異體相比,發現具有O4-Glc+ O-抗原多醣的經優化之受質特異性的PglB變異體(相對於野生型(wt)空腸曲桿菌醣基轉移酶PglB含有N311V及Y77H胺基酸取代),使生物結合物產率加倍。
類似地,使用篩選,亦確定ExPEC10V組合物中其他九種血清型之大腸桿菌O-抗原生物結合物製備的最佳產率PglB變異體。
對於具有O1A、O6A或O15抗原多醣之生物結合物,發現具有胺基酸突變N311V、K482R、D483H及A669V之PglB得到最高產率。
對於具有O2、O8、O18A或O25B抗原多醣之生物結合物,發現野生型PglB (亦即在位置77、80、287、289、311、482、483及669處不具有胺基酸突變)產生最高產率。
對於具有O16抗原多醣之生物結合物,發現具有胺基酸突變Y77H、S80R、Q287P、K289R及N311V之PglB產生最高產率。
對於具有O75抗原多醣之生物結合物,發現具有胺基酸突變N311V之PglB產生最高產率。
自此等結果可見,對於不同的O-抗原,最佳PglB變異體不同,且用於製備具有給定O-抗原多醣之生物結合物的最佳PglB變異體不可預測。實例 8 : 來自 10 種大腸桿菌血清型之 O - 抗原之生物結合物及其品質屬性
目標O-抗原之O-聚醣殘基在結構上多樣化且具有可變的重複單元。醣基轉移酶PglB之特異性及親和力連接至聚醣結構。因此,製成具有所需品質屬性(例如,純度、聚醣/蛋白質比率等)之生物結合物為具有挑戰性的、非簡單的任務。PglB與EPA載體蛋白之適當組合決定產率且可影響醣基化效率。藉由優化PglB及載體蛋白,製備具有所需品質屬性之生物結合物。維持整個載體蛋白之下限值亦可為重要的,尤其當將一或多種O-抗原生物結合物組合在一起且以單個組合物或疫苗投與時,因為極高量之載體蛋白可致使免疫干擾。為避免此類現象,具有較高聚醣/蛋白質比率之結合物為較佳的。因此,對於ExPEC10V疫苗,製備具有至少相當(與先前所述之已經受臨床試驗之ExPEC4V疫苗相比)之醣基化比率的生物結合物。
生物結合物各藉由在生物反應器(10 L及/或200 L容積)中培養相應宿主細胞(實例6,表3)及生物結合物表現,遵循先前所述之方法來製備。各藥物物質藉由細菌批次醱酵分批製造以產生含有相應多醣血清型之所表現生物結合物的生物質。細胞經培養且用IPTG及阿拉伯糖誘導。生物結合物藉由滲壓衝擊自生物反應器培養物中之細胞之周質分離,隨後層析純化。針對10個生物結合物中之每一者進行此製程。
由此製得之為ExPEC10V及ExPEC4V之藥物物質(DS)的大腸桿菌O-抗原生物結合物展示類似的關鍵品質屬性:(1)與製程相關之純度(藉由RP-HPLC量測)高於95%,(2)多醣/蛋白質比率在約0.1-0.5之間,大部分在0.15與0.45之間,(3)細菌內毒素(Ph. Eur. 2.2.3)小於0.5 EU/µg多醣。各個多醣鏈之平均長度通常在約10-20個重複單元之間(使用高解析度SDS-PAGE量測)。
針對上文所述之ExPEC10V組合物為DS之所有十個生物結合物,證實(藉由結合物之NMR及MS/MS,完整或經胰蛋白酶消化)多醣重複單元之結構為表1中之相應血清型所示之式中的結構。
O18血清型具有十個血清型中的生物結合物製備之最低產率,該等生物結合物製成用以ExPEC10V組合物。
ExPEC10V藥品(DP)包含上文所述之十個單價DS之混合物。實例 9 : ExPEC10V 疫苗之毒理學
在雌性NZW兔子中進行對ExPEC10V的單次劑量先導毒性及之局部耐受研究(非GLP)。一組(n=2)接受對照物(生理鹽水)之肌肉內(IM)注射(在第0天),且第二組(n=4)使用給藥體積0.6 mL (176 µg PS/mL),以105.6 µg總多醣(PS)/劑量(分別對於O-血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75,每劑9.6: 9.6: 9.6: 9.6: 9.6: 9.6: 9.6: 9.6: 19.2: 9.6 µg PS),接受ExPEC10VIM注射。在第2天進行屍檢。
未觀測到死亡率。另外,對於臨床觀測結果(包括使用Draize評分之得到的注射部位作用)、體重、食物消耗及體溫未指出有疫苗相關作用。組織病理學上,在投與部位或引流(髂)淋巴結處未觀測到疫苗相關變化。在四個經處理動物中之一者(第2天)中觀測到脾臟中生發中心形成的增加最少,且視為對注射疫苗之正常免疫反應。總體而言,向雌性兔子投與單次IM劑量之ExPEC10V為耐受良好的。實例 10 : 兔子中的 ExPEC10V 摻合調配物之免疫原性
ExPEC4V疫苗(包含大腸桿菌O1A、O2、O6A及O25B血清型之生物結合物)先前已展示在大鼠、兔子及人類中對此四種血清型具有免疫原性(參見例如WO 2015/124769; WO 2017/035181; Huttner等人, 2017, Lancet Infect Dis, http://dx.doi.org/10.1016/S1473-3099(17)30108-1; RW Frenck Jr, 等人, abstract 5587, ASM Microbe 2018)。具有大腸桿菌葡糖基化O4血清型之本發明新穎生物結合物在以上實例4及5中展示為免疫原性的。當向大鼠分開投與(單價)時,大腸桿菌血清型O8、O15、O16、O18A及O75 (全部在此實驗中具有EPA-2作為載體蛋白)之生物結合物之免疫原性證實,此等生物結合物中之每一者亦為免疫原性的,因為ELISA資料指示此等生物結合物中之每一者可引發較高含量之大腸桿菌O-抗原特異性抗體(未展示)。
亦測試如上文所述之含有10個生物結合物之混合物的10價疫苗之免疫原性。紐西蘭白色(NZW)兔子(雌性,12-16週齡)接受ExPEC10V或生理鹽水3次肌肉內免疫接種,相隔2週投與(表5;在第0、14及27天投與)。將作為此等實驗中使用之ExPEC10V疫苗之一部分的10種多醣與含有4個醣基化位點之載體蛋白EPA (EPA-4)結合。疫苗以3種不同劑量調配:第1組(「高劑量」):8 µg/劑量之O1A、O2、O6A、O4、O8、O15、O16、O18及O75及16 µg/劑量之O25B;第2組(「中等劑量」):4 µg/劑量之O2、O4、O8、O15、O16、O18及O75,8 µg/劑量之O1A及O6A,及16 µg劑量之O25B;第3組(「低劑量」):0.4 µg/劑量之O2、O4、O8、O15、O16、O18及O75,0.8 µg/劑量之O1A及O6A,及1.6 µg/劑量之O25B。來自對照組(第4組)之動物僅接受生理鹽水(0.9% (w/v)氯化鈉溶液) (表5)。
在第0天(免疫接種前)及免疫接種後第14天、第27天及第42天評估抗體反應。藉由ELISA (總IgG),使用血清型特異性LPS作為塗佈材料來量測疫苗及載體蛋白EPA中所包括之各生物結合物誘導之血清抗體含量。抗體力價以EC50值形式報告,該值對應於基於標繪於4-參數邏輯非線性回歸模型中的12-步驟滴定曲線之重複的半最大有效濃度。功能活性藉由OPK確定。 表 5 .
實驗組之描述.
| 實驗組 | 給藥 ( μ g/PS) O1A:O2:O6A:O25B:O4:O8:O15:O16:O18A:O75 | 樣品大小 |
| 第1組(高劑量) | 8:8:8:16:8:8:8:8:8:8 | 7 |
| 第2組(中等劑量) | 8:4:8:16:4:4:4:4:4:4 | 7 |
| 第3組(低劑量) | 0.8:0.4:0.8:1.6:0.4:0.4:0.4:0.4:0.4:0.4 | 7 |
| 第4組(對照) | 0.9% (w/v)氯化鈉溶液 | 7 |
結果展示於圖8中且概述於表6中。
表 6
.對由NZW兔子中之ExPEC10V誘導的大腸桿菌O-抗原特異性抗體反應之概述.
深灰色正方形展示血清型特異性抗體反應,其中p值在統計學上顯著。淺灰色正方形展示血清型特異性抗體反應,其中p值在統計學上不顯著(ns)。威爾科克森秩和檢定以及邦弗朗尼校正用於多重比較。比較經ExPEC10V疫苗接種之動物(第1組、第2組及第3組)對比生理鹽水對照組(第4組)。*p≤0.05,**p≤0.01。#
P值在自對照組排除離群值動物之後為統計學上顯著的(敏感性分析)。
| ExPEC10V | 疫苗接種後第14天抗體反應 | |||||||||
| 劑量 | O1A | O2 | O6A | O25B | O4 | O8 | O15# | O16 | O18A | O75 |
| 高 | * | ** | ** | * | ** | ns | ** | ** | * | ns |
| 中等 | * | ** | ** | ** | ** | ns | ** | ** | ns | ns |
| 低 | * | * | * | * | * | ns | ** | ** | ns | ns |
| ExPEC10V | 疫苗接種後第27天抗體反應 | |||||||||
| 劑量 | O1A | O2 | O6A | O25B | O4 | O8 | O15# | O16 | O18A | O75 |
| 高 | ** | ** | ** | ** | ** | * | ** | ** | ** | ** |
| 中等 | ** | ** | ** | ** | ** | * | ** | ** | * | ** |
| 低 | ** | ** | ** | ** | ** | * | ** | ** | ** | ** |
| ExPEC10V | 疫苗接種後第42天抗體反應 | |||||||||
| 劑量 | O1A | O2 | O6A | O25B | O4 | O8 | O15# | O16 | O18A | O75 |
| 高 | ** | ** | ** | ** | ** | ** | ** | ** | ** | ** |
| 中等 | ** | ** | ** | ** | ** | ** | ** | ** | ** | ** |
| 低 | ** | ** | ** | ** | ** | ** | ** | ** | ** | ** |
當與用於O1A、O2、O4、O6A、O16、O18A及O25B之生理鹽水對照組相比時,高劑量之ExPEC10V (第1組)在所有所探究之時間點(免疫接種後第14天、第27天及第42天)誘導的IgG抗體含量顯著較高(圖8,表6)。在免疫接種後第27天及第42天觀測到當與生理鹽水對照組相比時,由O8及O75結合物誘導的抗體力價顯著較高(圖8,表6)。
當與O1A、O2、O4、O6A、O16及O25B之生理鹽水對照組相比時,中等劑量之ExPEC10V (第2組)及低劑量(第3組)在所有所探究之時間點(免疫接種後第14天、第27天及第42天)誘導的抗體含量顯著較高(圖8,表6)。在免疫接種後第27天及第42天觀測到,由O8、O18A及O75結合物誘導之抗體力價相比於生理鹽水對照組顯著較高,表明在兔子中增加劑量增強了對此等O-血清型之反應(圖8,表6)。
對於O15結合物,自對照組省略離群值動物之敏感性分析展示,當與生理鹽水對照組相比時,所有三種劑量之ExPEC10V疫苗在免疫接種後第14、27及42天誘導的抗體反應顯著增強(圖8,表6)。
在所探究之所有時間點(第14、27及42天),對於測試的三種劑量之ExPEC10V (高、中等及低),藉由載體蛋白EPA誘導之抗體顯著高於經生理鹽水處理(對照)組中之EPA抗體力價(圖8)。
在劑量比較(未展示)之間展示,在疫苗接種後第14天,對於大多數測試之結合物(O1A、O2、O4、O6A、O15、O16、O18A及O25B),高劑量之ExPEC10V相比於低劑量誘導的抗體反應顯著較強。相比於O1A、O2、O4、O18A、O25B及O75之較低劑量,ExPEC10V之中等劑量亦誘導顯著較強的抗體反應。對於O8結合物而言,ExPEC10V之所以三種調配物在疫苗接種後第14天誘導類似含量之抗體。
當與用於O1A、O2、O4、O16、O25B及O75結合物的高劑量及中等劑量之ExPEC10V相比時,低劑量之ExPEC10V在疫苗接種後第42天(在初免及兩個增強免疫劑量之後)誘導的抗體反應顯著增強。此等研究結果與結合物疫苗之其他經驗一致,其中例如在用肺炎鏈球菌結合物疫苗接種之嬰兒中觀測到,對初始疫苗接種有抗體反應的劑量與量值之間無明顯關係(Poolman JT.等人 Expert Rev Vaccines. 2013, 12(12):1379-94)。
在疫苗接種後第42天所測試之O6A、O8及O15結合物的三次劑量之ExPEC10V之間無顯著差異。對於O18A結合物,在疫苗接種後第42天,當與中等劑量相比時,高劑量之ExPEC10V誘導顯著較強的抗體反應。
對於載體蛋白(EPA),當與疫苗接種後第14天之低劑量相比時,ExPEC10V之高劑量及中等劑量誘導顯著較強的抗體反應。當與疫苗接種後第42天之低劑量相比時,高劑量之疫苗亦誘導顯著較強的抗體反應。
總之,在第0、14、27天經由肌肉內注射投與的ExPEC10V之三種調配物(高、中等及低)在兔子中具有免疫原性。
迄今為止,針對血清型O1A、O2、O4、O6A、O15、O16及O25B展示能夠在兔子中殺滅由此疫苗誘導之大腸桿菌菌株的功能性抗體。
在另一實驗中,製得GMP批次之ExPEC10V疫苗(參見上文實例8進行生產)且作為毒理學研究之一部分注射至NZW兔子中(表7)。在此研究中,NZW兔子(雄性及雌性)接受3次ExPEC10V疫苗之肌肉內注射(0.6 mL) (第1天、第15天及第29天)且對照組接受0.9% (w/v)氯化鈉溶液(生理鹽水)。各劑量之疫苗含有針對血清型O1A、O2、O4、O6A、O8、O15、O16、O18A及O75之9.6 µg多醣(PS)及針對血清型O25B之19.2 µg PS,對應於105.6 µg總PS (176 µg總PS/mL)及382.8 µg總EPA (638 µg EPA/mL)。自在預處理時段期間(第1天)及免疫接種後第31天及第50天收集之樣品測定針對O-抗原及載體蛋白(EPA)之IgG力價。
相比於僅接受生理鹽水之對照組,在第31天及第50天疫苗接種後在接受ExPEC10V之組中觀測到針對所有O-抗原及載體蛋白EPA之抗體反應顯著增強(圖9,表8)。對於O1A血清型,當經疫苗接種動物與對照物相比時,在第1天(基線)亦觀測到顯著較強的抗體反應。此等結果表明一些動物預暴露於大腸桿菌或具有與O1A-LPS交叉反應之抗體。
表 7
.用於NZW兔子之實驗組及ExPEC10V劑量.
*各劑量(0.6 mL給藥體積)分別對於血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B、O75 (176 µg總PS/mL)含有9.6:9.6:9.6:9.6:9.6:9.6:9.6:9.6:19.2:9.6 µg多醣(PS)。各劑量含有382.8 µg EPA蛋白質(638 µg EPA/mL)。表 8 .
作為毒理學研究之一部分的NZW兔子中之ExPEC10V之免疫原性.
藉由ExPEC10V誘導之抗體反應。淺灰色正方形展示血清型,其中相比於對照組,在疫苗組中觀測到抗體反應顯著增強。用似然比測試之杜賓模型。****P≤0.0001。實例 11 : 在人類中用 ExPEC10V 疫苗進行之 1 / 2a 期 試驗
| 組 | 處理 | 劑量 | 給藥天數 | 主要 ( 第 31 天 ) ( 雄性 / 雌性 ) | 恢復 ( 第 50 天 ) ( 雄性 / 雌性 ) |
| 1 | 對照組 | 0 | 1, 15, 29 | 10 | 10 |
| 2 | ExPEC10V | 105.6 µg PS* | 1, 15, 29 | 10 | 10 |
| 處理 | 疫苗接種後第31天抗體反應 | |||||||||
| ExPEC10V | O1A | O2 | O6A | O25B | O4 | O8 | O15 | O16 | O18A | O75 |
| 第31天 | **** | **** | **** | **** | **** | **** | **** | **** | **** | **** |
| 第50天 | **** | **** | **** | **** | **** | **** | **** | **** | **** | **** |
目前,不存在可用於預防IED之疫苗。選擇包含ExPEC10V疫苗之血清型(O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75)以解決由臨床上相關之ExPEC菌株之大部分造成的侵襲性疾病,該等菌株亦展現引起抗微生物抗IED (包括ST131)之ExPEC分離株之大部分。所選血清型代表在年長群體中引起血流感染且引起大致70%由ExPEC引起之血流感染的十種流行ExPEC O-血清型。
因為結合物疫苗在預防侵襲性疾病中之作用機制預期不受抗生素抗藥性機制影響,所以咸信ExPEC10V疫苗提供針對由抗藥性及藥物敏感性O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75血清型引起之IED的保護。
存在用ExPEC4V之先前臨床經驗,其為一種包含亦發現於ExPEC10V中之四種大腸桿菌O-抗原結合物(O1A、O2、O6A及O25B)之子組的早期候選疫苗。基於四種臨床研究(兩個完成的1期研究、一個完成的2期研究及進行中的2期研究)的結果,研究參與者充分耐受ExPEC4V且在高達16 µg多醣(PS)/血清型(O1A、O2、O6A及O25B)的劑量下未觀測到疫苗相關之安全性信號。大部分不良事件(AE)為1級及2級,報導極少3級AE。用較高劑量之ExPEC4V,主要觀測到遲發性誘發局部AE (疫苗接種後第5天開始之AE)。在各研究中, ExPEC4V疫苗為免疫原性的,證明了劑量依賴性疫苗免疫反應,及如藉由酶聯結免疫吸附分析(ELISA)所量測,O-抗原特異性免疫球蛋白G (IgG)力價升高。用經ExPEC4V優化之調理吞噬殺滅分析(OPKA)證明抗體之功能活性。ELISA及OPKA測試結果之共分析展示檢定反應之間的相關性(在第2期臨床試驗[研究4V-BAC2001]中,第30天及第360天皮爾森相關係數(Pearson correlation coefficient)分別為≥0.61及≥0.48),證明使用ELISA作為ExPEC4V抗體力價之主要量測及用以預測功能性抗體活性。對免疫原性資料之分析已證明在用ExPEC4V疫苗接種之後三年免疫反應之耐久性。現已觀測到,在被動轉移至隨後經O25B或O2血清型之大腸桿菌菌株進行腹膜內刺激之小鼠中時,來自用ExPEC4V進行疫苗接種且具有較高力價之血清型特異性調理吞噬抗體的人類的血清,能夠在活體內介導保護(未展示)。因此,ExPEC4V-特異性調理吞噬人類抗體介導活體內細菌殺滅,與其他結合物疫苗一致,其中所提出之保護機制係藉由誘導介導細菌殺滅之調理吞噬抗體進行。
ExPEC10V包括總共十種血清型且使覆蓋度在60歲及更年長成人中由ExPEC引起之血流感染自約50% (ExPEC4V)增加至大致70%。基於如以上實例中所論述之ExPEC4V之臨床經驗及基於ExPEC10V之臨床前資料,預期投與ExPEC10V將誘導對大腸桿菌血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75之免疫反應。
在處於穩定健康狀況下的年齡60至85歲之人類中進行隨機性觀察者盲法的首次用於人體1/2a期研究以評估三種不同劑量之ExPEC10V疫苗的安全性、反應原性及免疫原性(研究10V-BAC1001)。研究設計包括2個群組:總共1,004參與者參與研究,其中在第1群組中有404個處於穩定健康狀況下年齡≥60至≤85歲之參與者(100個參與者/ExPEC10V劑量),且在第2群體中有另外600個參與者,其處於穩定健康狀況下,年齡≥60歲,且在過去5年有UTI病史。
ExPEC10V為用於研發預防年齡在60歲及更大之成人中的侵襲性腸外病原性大腸桿菌(ExPEC)疾病(IED)的10價疫苗候選物。ExPEC10V由以下組成:分別生物結合至載體蛋白的ExPEC血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75之O-抗原多醣(PS)、衍生自綠膿桿菌之基因解毒形式之外毒素A (EPA)及其生產物已描述於上文中。O4 PS為具有表1中式(O4-Glc+)之結構的葡糖基化形式。
目標及終點
第1群組—具有開放標記長期隨訪時段之1/2a期觀察者盲法時段(N=404):
第2群組——具有雙盲長期隨訪時段之雙盲時段(N=600):
| 目標 | 終點 |
| 主要方面 | |
| ● 評估不同劑量之ExPEC10V在年齡≥60至≤85歲之參與者中之安全性及反應原性 | ● 疫苗接種後14天(自第1天至第15天)收集的所誘發之局部及全身性不良事件(AE) ● 自研究疫苗之投與直至疫苗接種後29天(自第1天至第30天)收集的未誘發之AE ● 自投與研究疫苗直至第181天收集的嚴重不良事件(SAE) |
| ● 評估第15天ExPEC10V在年齡≥60至≤85歲之參與者中之劑量依賴性免疫原性 | ● ExPEC10V之抗體力價,如在第15天藉由多重基於電化學發光(ECL)之免疫分析及多重調理吞噬分析(MOPA)所測定 |
| 次要方面 | |
| ● 評估在第15天的多重基於ECL之免疫分析(總抗體)與MOPA (功能性抗體)血清力價之間的相關性 | ● ExPEC10V之抗體力價,如在第15天藉由多重基於ECL之免疫分析及MOPA所測定 |
| ● 評估在第30天及第181天ExPEC10V在年齡≥60至≤85歲之參與者中之劑量依賴性免疫原性 | ● ExPEC10V之抗體力價,如在第30天及第181天藉由多重基於ECL之免疫分析及MOPA所測定 |
| 目標 | 終點 |
| ● 在長期隨訪(LTFU)時段中基於第30天主要分析,在年齡≥60至≤85歲之參與者中,評估選擇用於進一步臨床研發的ExPEC10V劑量之安全性 | ● 關於自第182天收集直至研究結束之研究疫苗或研究程序的SAE |
| ● 在LTFU時段中基於第30天主要分析,評估選擇用於進一步臨床研發的ExPEC10V劑量之免疫原性 | ● ExPEC10V之抗體力價,如在第1年(第366天)、第2年(第731天)及第3年(第1096天)藉由多重基於ECL之免疫分析及MOPA所測定 |
| 目標 | 終點 |
| 主要方面 | |
| ● 評估所選擇劑量之ExPEC10V在過去5年有UTI病史年齡≥60之參與者中之安全性及反應原性 | ● 疫苗接種後14天(第1天至第15天)收集的誘發之局部及全身性AE ● 自研究疫苗之投與直至疫苗接種後29天(自第1天至第30天)收集的未誘發之AE ● 自研究疫苗投與直至第181天收集的SAE |
| ● 評估在第30天所選擇劑量之ExPEC10V在過去5年有UTI病史年齡≥60歲之參與者中的免疫原性 | ● ExPEC10V之抗體力價,如在第30天藉由多重基於ECL之免疫分析及MOPA所測定 |
| 次要方面 | |
| ● 在過去5年有UTI病史年齡≥60歲之參與者中,評估第30天的多重基於ECL之免疫分析(總抗體)與MOPA (功能性抗體)血清力價之間的相關性 | ● ExPEC10V之抗體力價,如在第30天藉由多重基於ECL之免疫分析及MOPA所測定 |
| ● 評估在第15天及第181天所選擇劑量之ExPEC10V在過去5年有UTI病史年齡≥60歲之參與者中的免疫原性 | ● ExPEC10V之抗體力價,如在第15天及第181天藉由多重基於ECL之免疫分析及MOPA所測定 |
| 目標 | 終點 |
| ● 在LTFU時段中,評估在過去5年有UTI病史年齡≥60歲之參與者中的所選擇劑量之ExPEC10V的安全性。 | ● 關於自第182天收集直至研究結束之研究疫苗或研究程序的SAE |
| ● 在LTFU時段中,評估所選擇劑量之ExPEC10V在過去5年有UTI病史年齡≥60歲之參與者中之免疫原性。 | ● ExPEC10V之抗體力價,如在第1年(第366天)、第2年(第731天)及在第3年(第1096天)藉由多重基於ECL之免疫分析及MOPA所測定 |
| 探索 | |
| ● 藉由總體基因組分析評估ExPEC10V對腸道(大便)微生物群落之作用 | ● 對來自所選參與者子組的大便樣品進行總體基因組學以評估ExPEC10V對以下各者之作用: - 腸菌族中之病原體(例如艱難梭菌(Clostridium difficile ))之流行率 - 腸菌族中之ExPEC10V血清型之流行率 |
總體設計
此為包括兩個群組之隨機化多中心干預研究。
對於第1群組,該研究具有觀察者盲法主動控制式設計,且包括總共404個年齡≥60至≤85歲之成年參與者,其處於穩定健康狀況下,具有或不具有UTI病史。第1群組之研究設計包含三個時段:最大28天篩選時段;在第1天使用疫苗接種之觀察者盲法181天隨訪時段;及自第182天持續直至疫苗接種後3年(第1096天)之開放標記LTFU時段(圖10A)。僅來自ExPEC10V選擇劑量組(大致100個參與者)之參與者及來自Prevnar 13組之參與者進展至LTFU時段。第1群組之終點為最後一個參與者第3年訪視(第1096天)。
對於第2群組,該研究具有雙盲、安慰劑對照設計,且包括總共600個年齡≥60歲之成年參與者,其處於穩定健康狀態下,在過去5年有UTI病史。參與在完成1/2a期主要分析及自第1群組選擇之ExPEC10V劑量之後開始。第2群組之研究設計包含三個時段:最大28天篩選時段、在第1天使用疫苗接種之雙盲181天隨訪時段以及自182天持續直至疫苗接種後3年(第1096天)之雙盲LTFU時段(圖10B)。第2群組中之所有參與者進展至LTFU時段。研究結束為第2群組之最後參與者第3年訪視(第1096天)。
第
1
群組:
1
期
在第1群組之1期中,總共84個參與者參與交錯方法,隨後在自一個步驟進展至下一步驟之前,具有適當安全性評估的逐步劑量遞增程序。內部資料審查委員會(internal Data Review Committee,DRC)針對此研究係審查此等84個1期參與者的身體檢查資料(基線以及靶向)、基線人口統計資料及14天疫苗接種後安全性資料(包括所誘發之局部及全身性AE、非誘發之AE、SAE、臨床實驗室資料及生命體徵)。在此研究階段中,參與者參與且隨機分六個步驟:
步驟1:四個標記參與者參與且隨機分組;在ExPEC10V低劑量組中有兩個參與者(表11),且各自在ExPEC4V及Prevnar 13組中有一個參與者。
步驟2:二十四個參與者參與且對其隨機分組;在ExPEC10V低劑量組中有18個參與者(表11),且各自在ExPEC4V及Prevnar 13組中有三個參與者。
步驟3:四個標記參與者參與且對其隨機分組;在ExPEC10V中等劑量組(表11)中有兩個參與者,及各自在ExPEC4V及Prevnar 13組中有一個參與者。
步驟4:二十四個參與者參與且對其隨機分組;在ExPEC10V中等劑量組中有18個參與者(表11),且各自在ExPEC4V及Prevnar 13組中有三個參與者。
步驟5:四個標記參與者參與且對其隨機分組;在ExPEC10V高劑量組(表11)中有兩個參與者,及各自在ExPEC4V及Prevnar 13組中有一個參與者。
步驟6:二十四個參與者參與且對其隨機分配;在ExPEC10V高劑量組中有18個參與者(表11),且各自在ExPEC4V及Prevnar 13組中有三個參與者。
所有參與者在第1天根據指定研究疫苗接種組接受單次肌肉內(IM)注射ExPEC10V (3個劑量中之1個)、ExPEC4V或Prevnar 13。在步驟1、3及5中之每一者中之四個標記參與者在疫苗接種後24小時藉由電話聯繫以收集安全性資訊。由主要研究者(PI)、研究負責醫師(SRP)及主持者醫療領導(SML)審查具有四個標記參與者之各組中之盲法疫苗接種後24小時安全性資料。停止針對額外參與者進行用於下一步驟之隨機分組直至完成此第2天的標記安全性評估。
在無任何臨床上顯著發現之情況下,額外24個參與者參與(用於步驟2、4及6)且對其隨機分入三個研究疫苗接種組中之一者(表11)以在第1天接受單次IM注射ExPEC10V (3個劑量中之1個)、ExPEC4V或Prevnar 13。
在各劑量水準(步驟2中之低劑量、步驟4中之中等劑量及步驟6中之高劑量)下對額外24位參與者進行疫苗接種之後,DRC在進展至下一劑量水準或2a期之前審查各劑量水準下所有28 (4+24)位參與者之疫苗接種後14天的安全性資料。
第
1
群
組:
2a
期
基於可接受之安全性及反應原性(在不存在任何安全性問題或符合特定研究暫停規則之任何事件的情況下),如在審查初始84個參與者疫苗接種後14天的安全性資料之後的DRC所測定,對來自第1群組之剩餘320個參與者進行隨機分組且在研究2a期中給藥。此等額外320個參與者參與且以2:2:2:1:1比率並行隨機分入五個研究疫苗接種組中之一者,以在第1天接受單次IM注射ExPEC10V (3個劑量中的1個)、ExPEC4V或Prevnar13 (表11)。除對初始84個參與者進行14天安全性審查外,DRC亦在研究過程內評估第1群組之安全性資料,且審查符合特定研究疫苗接種暫停規則之任何事件或可能出現之任何其他安全性問題。
對於第1群組,當所有參與者已完成第30天訪視(第4次訪視)或已較早中斷時,進行主要分析。當所有參與者已完成第181天訪視或已較早中斷時,進行最終分析。對於進展至開放標記長期隨訪(LTFU)時段(ExPEC10V選擇劑量組及Prevnar 13組)的參與者,每年隨訪分析包括收集安全性及免疫原性資料(多重基於ECL之免疫分析及MOPA),直至疫苗接種後的第1年(第366天)、第2年(第731天)及第3年(第1096天)之訪視時間。
第
2
群組
在第2群組中,在年齡≥60歲處於穩定健康狀況下且過去5年有UTI病史之參與者中,評價所選擇劑量之ExPEC10V (基於第1群組之主要分析結果)的安全性、反應原性及免疫原性。對於第2群組,該研究具有雙盲、安慰劑對照設計,且總計600個參與者參與且以2:1比率進行並行隨機分組(ExPEC10V組中400個參與者及安慰劑組中200個參與者)。
所有參與者在第1天根據指定研究疫苗接種組接受所選劑量之ExPEC10V或安慰劑的單次IM注射(表12)。
對於第2群組,主要分析包括安全性及免疫原性資料,且當所有參與者已完成第30天訪視(第4次訪視)或已較早中斷時進行。當所有參與者已完成第181天訪視或已較早中斷時,進行最終分析。對於所有參與者,每年隨訪分析包括收集安全性及免疫原性資料(多重基於ECL之免疫分析及MOPA),直至疫苗接種後第1年(第366天)、第2年(第731天)及第3年(第1096天)之訪視時間。
在所選參與者子組中進行大便樣品分析以使用總體基因組學評估ExPEC10V對病原體(例如艱難梭菌屬)及ExPEC10V血清型在腸道菌群中之流行率的影響。
參與者數目
總計1004個參與者參與研究;第1群組中之404個參與者及第2群組中之600個參與者。
干預組
干預之描述
ExPEC10V
:在含有分別生物結合至EPA載體蛋白之ExPEC血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75之O-抗原PS的磷酸鹽緩衝溶液中的大腸桿菌生物結合物疫苗。第1天,三次劑量之ExPEC10V中之一者的單次0.5 mL IM (三角肌)注射。
ExPEC4V
:含有分別生物結合至EPA載體蛋白之ExPEC血清型O1A、O2、O6A、O25B (4:4:4:8 µg PS/ExPEC血清型)之O-抗原PS的生理鹽水緩衝溶液中的大腸桿菌生物結合物疫苗。第1天,ExPEC4V的單次0.5 mL IM (三角肌)注射。
Prevnar 13
:單獨地連接至無毒白喉CRM197蛋白質之肺炎鏈球菌血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F及23F之莢膜抗原的無菌醣類懸浮液。第1天,單次0.5 mL IM (三角肌)注射,供應於單次劑量預填充注射器中。
安慰劑
:標準生理鹽水。第1天,安慰劑的單次0.5 mL IM (三角肌)注射。
ExPEC研究干預材料描述於表9中。
表 9
. BAC1001MV ExPEC研究疫苗.
EPA=來源於綠膿桿菌的基因解毒形式之外毒素A;PS=多醣
ExPEC4V由分離生物結合至EPA載體蛋白之ExPEC血清型O1A、O2、O6A及O25B之O-抗原多醣(PS)組成。
ExPEC10V由分別生物結合至EPA載體蛋白之ExPEC血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75之O-抗原多醣(PS)組成。
劑量僅基於PS。EPA(µg)為量測值。
| 研究隊組 | O1A (µg) | O2 (µg) | O4 (µg) | O6A (µg) | O8 (µg) | O15 (µg) | O16 (µg) | O18A (µg) | O25B (µg) | O75 (µg) | EPA (µg) | PS (Total) (µg) |
| 低劑量ExPEC10V | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 8 | 4 | 160 | 44 |
| 中等劑量ExPEC10V | 8 | 4 | 4 | 8 | 4 | 4 | 4 | 4 | 16 | 4 | 221 | 60 |
| 高劑量ExPEC10V | 8 | 8 | 8 | 8 | 8 | 8 | 8 | 8 | 16 | 8 | 320 | 88 |
| ExPEC4V | 4 | 4 | - | 4 | - | - | - | - | 8 | - | 72 | 20 |
ExPEC10V由10種單價藥物物質(DS)構成。對於此臨床研究,製備2種不同濃度(中等及高)之藥品(DP) (表10)。在臨床中藉由用與調配緩衝液相同之稀釋緩衝液稀釋高濃度1:1來獲得第三(低)濃度。各DP在pH 7.0之磷酸鈉/磷酸鉀緩衝液(0.02% [w/w]聚山梨醇酯80、5% [w/w]山梨糖醇、10 mM甲硫胺酸)中調配。
表10:用於1/2a期臨床研究之ExPEC10V疫苗之組成
EPA=用作載體蛋白的基因解毒之綠膿桿菌外毒素Aa
活性成分為由PS抗原及載體蛋白(EPA)構成之生物合成結合物;劑量僅基於PS部分計算。b
在臨床中藉由用稀釋緩衝液稀釋「高濃度」1:1來獲得「低濃度」。
| 成分 | 量 (µg/mL)a | ||
| 活性成分 a | 低濃度 b | 中等濃度 | 高濃度 |
| O- 抗原多醣 | |||
| EcoO1A | 8 | 16 | 16 |
| EcoO2 | 8 | 8 | 16 |
| EcoO4 | 8 | 8 | 16 |
| EcoO6A | 8 | 16 | 16 |
| EcoO8 | 8 | 8 | 16 |
| EcoO15 | 8 | 8 | 16 |
| EcoO16 | 8 | 8 | 16 |
| EcoO18A | 8 | 8 | 16 |
| EcoO25B | 16 | 32 | 32 |
| EcoO75 | 8 | 8 | 16 |
| 載體蛋白 | |||
| EPA | 320 | 441 | 640 |
| 賦形劑 | |||
| KH2 PO4 | 6.19 mM | ||
| Na2 HPO4 | 3.81 mM | ||
| 山梨糖醇 | 5% (w/w) | ||
| 甲硫胺酸 | 10 mM | ||
| 聚山梨醇酯80 | 0.02% (w/w) |
安全性評估
關鍵安全性評定包括所誘發之局部及全身性AE、非誘發之AE、SAE、體檢、生命徵象量測及臨床實驗室測試。
免疫原性評估
所收集血清之關鍵免疫原性評估包括評估由疫苗引發之ExPEC10V及ExPEC4V血清型特異性總IgG抗體含量,如藉由多重基於ECL之免疫分析所量測;及ExPEC10V及ExPEC4V血清型特異性抗體,如藉由呈多重格式(MOPA)之調理吞噬殺滅分析(OPKA)所量測。未執行由Prevnar 13引發之肺炎球菌抗體力價之免疫原性評估。
藉由基於多重電化學發光(ECL)之免疫分析來量測藉由ExPEC10V誘導之血清抗體含量。此分析將高結合碳電極組合於塗佈有不同大腸桿菌O-LPS抗原或載體蛋白EPA之多斑點96孔格式微量培養板中。存在於血清樣品中之抗原特異性抗體之含量係使用經SULFO-TAG標記之二級抗體(抗人類IgG)偵測。SULFO-TAG在電刺激存在下在與所結合之IgG抗體的量成比例增加的強度下發光。此分析根據對國際協調會議(International Conference on Harmonisation,ICH)建議限定。
由ExPEC10V誘導之功能抗體之含量藉由多重調理吞噬殺滅分析(MOPA)量測。簡言之,將熱滅活血清樣品連續稀釋且與特異性針對不同類型之抗生素之大腸桿菌菌株一起培育。此後,向反應物中添加人類補體及吞噬細胞(HL60),且在第二培育時段之後,將反應混合物之等分試樣轉移至含有補充有選擇性地允許生長對特定抗生素具有抗性之菌株的特異性抗生素之培養基的不同PVDF親水性膜過濾器板。在隔夜生長之後,對菌落形成單位(CFU)計數以測定存活細菌之數目。根據ICH建議來限定此分析。
對於如藉由多重基於ECL之免疫分析及MOPA所量測之ExPEC10V血清型抗體,及如僅藉由多重基於ECL之免疫分析所量測之EPA,針對所有免疫原性時間點,依據研究疫苗接種組評估及列表免疫原性之以下量測:
- 參與者比例,其中自第1天(疫苗接種前)之血清抗體力價≥2倍及≥4倍增加
- 幾何平均力價(GMT)
- GMR:自基線之倍數變化,自後基線/基線值計算。
對於LTFU時段,為各血清型提供免疫原性之描述性概述。
針對稍後階段之劑量選擇考慮在第1群組之主要分析時可獲得之全部證據(第30天結果)。
表 11
:第1群組:疫苗接種時程
*ExPEC10V由以下組成:分別生物結合至載體蛋白的ExPEC血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B及O75之O-抗原多醣(PS)、衍生自綠膿桿菌之基因解毒形式之外毒素A (EPA)。
**ExPEC4V由分別生物結合至載體蛋白之ExPEC血清型O1A、O2、O6A及O25B之O-抗原多醣(PS)組成,該載體蛋白為來源於綠膿桿菌的基因解毒形式之外毒素A (EPA)。
***Prevnar 13、肺炎鏈球菌13價結合物疫苗(白喉CRM197蛋白質)為肺炎鏈球菌血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F及23F之莢膜抗原的無菌醣類懸浮液,其單獨地連接至無毒白喉CRM197蛋白質。
| 1 期 | 2a 期 | 總計 | ||||||||
| 步驟 1 | 步驟 2 | 步驟 3 | 步驟 4 | 步驟 5 | 步驟 6 | 步驟 7 | ||||
| 研究疫苗接種組 | 第 1 天疫苗接種 | 標記參與者 ( 低劑量 ) | 額外參與者 ( 低劑量 ) | 標記參與者 ( 中等劑量 ) | 額外參與者 ( 中等劑量 ) | 標記參與者 ( 高劑量 ) | 額外參與者 ( 高劑量 ) | 額外 2a 期參與者 | ||
| G1 | 低劑量ExPEC10V* | 2 | 18 | 80 | 100 | |||||
| G2 | 中等劑量ExPEC10V* | 2 | 18 | 80 | 100 | |||||
| G3 | 高劑量ExPEC10V* | 2 | 18 | 80 | 100 | |||||
| G4 | ExPEC4V** | 1 | 3 | 1 | 3 | 1 | 3 | 40 | 52 | |
| G5 | Prevnar 13*** | 1 | 3 | 1 | 3 | 1 | 3 | 40 | 52 | |
| 總計 | 4 | 24 | 4 | 24 | 4 | 24 | 320 | 404 | ||
表 12
:第2群組:疫苗接種時程
a
ExPEC10V由以下組成:分別生物結合至載體蛋白的ExPEC血清型O1A、O2、O4、O6A、O8、O15、O16、O18A、O25B以及O75之O-抗原多醣(PS)、衍生自綠膿桿菌之基因解毒形式之外毒素A (EPA)。
| 研究疫苗接種組 | 第 1 天疫苗接種 | 總計 |
| G6 | ExPEC10Va | 400 |
| G7 | 安慰劑 | 200 |
| 總計 | 600 |
參與研究第2群組之參與者的隨機化比率為2:1 (ExPEC10V:安慰劑)。第2群組使用之ExPEC10V劑量係基於第1群組之主要分析(第30天)結果。
狀態
完成上文所述之研究之第1群組的參與及疫苗接種。研究以盲法方式進行。基於進行中的安全性資料審查,未鑑別到重大安全性問題,且ExPEC10V疫苗具有可接受安全性概況。
第1群組臨床樣品之免疫原性之分析以盲法方式進行。ECL資料經100%接受品質限制(Acceptance Quality Limit,AQL)檢查且上傳用於資料管理。對MOPA樣本之分析在進行中。資料揭盲及統計分析藉由使用臨床研究組織(CRO)進行。
在已基於對來自第1群組之第30天結果的最終主要分析來鑑別用於該群組之ExPEC10V劑量後,開始第2群組疫苗接種。
熟習此項技術者應瞭解,在不脫離本發明之較寬廣發明理念之情況下,可對上述實施例作出改變。因此,應理解,本發明不限於所揭示之特定實施例,而是意圖涵蓋在本說明書所界定的本發明精神及範疇內之修改。
序列SEQ ID NO : 1 ( 醣基化共同序列 )
Asn-X-Ser(Thr),其中X可為除Pro外之任何胺基酸SEQ ID NO : 2 ( 經 優化之醣基化共同序列 )
Asp(Glu)-X-Asn-Z-Ser(Thr),其中X及Z獨立地選自除了Pro之任何胺基酸SEQ ID NO : 3
(包含4個醣基化共同序列之EPA載體蛋白(EPA-4)) SEQ ID NO : 4
(O4 GtrS胺基酸序列) SEQ ID NO : 5
(實例O4gtrS
核酸序列) SEQ ID NO : 6
(實例PglB序列(『野生型』)) SEQ ID NO : 7
(實例gtrA胺基酸序列;大腸桿菌W3110 yfdG, GenBank: BAA16209.1) SEQ ID NO : 8
(例如gtrB胺基酸序列——大腸桿菌W3110 yfdH, GenBank: BAA16210.1) SEQ ID NO : 9
(實例O4rfb
基因座核苷酸序列——O4-EPA生產菌株BVEC-L-00684f) SEQ ID NO : 10
(用於EPA載體蛋白之實例信號序列) SEQ ID NO : 11
(實例O1Arfb
基因座核苷酸序列——O1A-EPA生產菌株stGVXN4411及stLMTB10217) SEQ ID NO : 12
(實例O2rfb
基因座核苷酸序列——O2-EPA生產菌株stGVXN4906) SEQ ID NO : 13
(實例O6Arfb
基因座核苷酸序列——O6A-EPA生產菌株stGVXN4112及stLMTB10923) SEQ ID NO : 14
(實例O8rfb
基因座核苷酸序列——O8-EPA生產菌株stLMTB11734) SEQ ID NO : 15
(實例O15rfb
基因座核苷酸序列——O15-EPA生產菌株stLMTB11738) SEQ ID NO : 16
(實例O16rfb
基因座核苷酸序列——O16-EPA生產菌株stLMTB11739) SEQ ID NO : 17
(實例O18Arfb
基因座核苷酸序列——O18A-EPA生產菌株BVEC-L00559) SEQ ID NO : 18
(實例O25Brfb
基因座核苷酸序列——O25B-EPA生產菌株stGVXN4459) SEQ ID NO : 19
(實例O75rfb
基因座核苷酸序列——O75-EPA生產菌株stLMTB11737)
當結合附圖閱讀時將更好地瞭解以上概述以及本發明之以下詳細描述。應理解,本發明不限於附圖中顯示之確切實施例。
在圖式中:
圖 1
展示針對來自兩隻兔子之血清中的未經修飾(GLC-)或經葡萄糖修飾(GLC+)之O4 LPS的ELISA IgG力價,該等兔子用如實例4中所述的經Glc修飾之O4多醣生物結合物進行免疫接種;一式四份測定ELISA力價;
圖 2
展示來自兔子的經彙集之血清之全細胞ELISA中的IgG力價,該等兔子用針對具有如實例4中所述之經表徵之gtrS
狀態之大腸桿菌O4分離株的經Glc修飾之O4生物結合物進行免疫接種;以下分離株為gtrS
-陰性:A2625、stGVXN4988、OC24784、OC24787及OC24788;以下分離株為gtrS
-陽性:Y1382、E551、OC24334、stGVXN4983、stGVXN4994及OC24794;亦包括陰性對照菌株OC9487 (ATCC 35383;血清型O75);
圖 3
展示自gtrS
-陽性及gtrS
-陰性O4分離株提取之LPS的西方墨點法,該等分離株對來自用經修飾之O4多醣進行免疫接種之兔子的經彙集之血清用探針探得;
圖 4A
及圖 4B
展示由葡糖基化O4 (O4-Glc+)-EPA生物結合物誘導之抗體反應;圖 4A
展示在免疫接種後第0天、第14天及第42天藉由ELISA量測之血清抗體含量;展示各個力價(log10 EC50力價)及GMT±95% CI;灰色點線指示臨限值,高於該臨限值的樣品之稀釋曲線具有4PL擬合;圖 4B
展示調理吞噬(opsonophagocytic,OPK)分析之結果,以確定在免疫接種後第42天用葡糖基化O4 (O4-Glc+)-EPA生物結合物(4.0 µg)獲得之血清樣品中的抗體之功能性;威爾科克森秩和檢定(Wilcoxon rank sum test)及邦弗朗尼校正(Bonferroni correction);*P≤0.05,***P≤0.0001;
圖 5
展示如實例4中所述的在以3個不同劑量免疫接種之史泊格多利大白鼠(Sprague Dawley rat)中之葡糖基化O4 (O4 Glc+)-EPA生物結合物的增強免疫作用;在免疫接種後第0天、第14天及第42天藉由ELISA量測血清抗體含量;展示各動物之各個力價(log10 EC50力價);資料點之間的線在時間上連接各動物之IgG力價;灰色點線指示臨限值,高於該臨限值的樣品之稀釋曲線具有4PL擬合;藉由用於多重比較的威爾科克森符號秩檢定及邦弗朗尼校正來進行統計分析(第14天對比第0天,對於4.0 µg/劑量,P=0.012;第42天對比第0天,對於所有劑量,P=0.006;第42天對比第14天,對於所有劑量,P=0.006);
圖 6
展示由O4-Glc+-EPA生物結合物誘導之抗體的功能性;用調配緩衝液或以4.00 µg/劑量之O4(Glc+)-EPA生物結合物對史泊格多利大白鼠進行3次肌肉內免疫接種;藉由調理吞噬殺滅分析(opsonophagocytic killing assay,OPKA)使用O4(Glc+)及O4(Glc-) 大腸桿菌菌株來確定抗體之功能性;展示各個調理素力價(OI)及GMT±95% CI。
圖 7
展示使用單株抗體偵測周質部分中之O4-Glc+生物結合物,在墨點樣影像中進行各測試菌株之PglB篩選可視化O4-Glc+生物結合物生產的毛細電泳讀數。單醣基化產物大致180 kDa,二醣基化產物大致320 kDa及三醣基化產物大致450 kDa。A)第一篩選回合。色帶3中Wt PglB,色帶2及色帶4中N311V-PglB,色帶1中空對照菌株及色帶5及色帶6中其他PglB變異體。B)第二篩選回合。色帶3中N311V PglB,色帶9中N311V+Y77H PglB,色帶1及色帶2中空對照菌株,剩餘色帶中其他PglB變異體。
圖 8
展示在紐西蘭白兔中藉由ExPEC10V疫苗誘導之抗體反應。動物接受用ExPEC10V或生理鹽水之3次肌肉內免疫接種,相隔2週投與。ExPEC10V疫苗以3種不同濃度投與(第1組:高劑量,第2組:中等劑量及第3組:低劑量,表11)且對照組僅接受生理鹽水(第4組,0.9% (w/v)氯化鈉溶液)。在第0天(疫苗接種前)及第14天、第27天及第42天(疫苗接種後)藉由ELISA量測抗體含量。展示各個力價(EC50力價)及幾何平均力價(GMT) ±95% CI。威爾科克森秩和檢定以及邦弗朗尼校正用於多重比較。比較經ExPEC10V疫苗接種之動物(第1組、第2組及第3組)對比生理鹽水對照組(第4組)。*p≤0.05,**p≤0.01;***p≤0.001;****p≤0.0001。LOD:偵測極限。
圖 9
展示藉由ExPEC10V誘導之抗體反應。紐西蘭白兔接受用ExPEC10V(105.6 µg總多醣)或0.9% w/v氯化鈉溶液(對照組)之3次肌肉內免疫接種。在第1天(免疫接種前,n=20隻/組)、第31天(免疫接種後,n=20隻/組)及第50天(免疫接種後,n=10隻/組)藉由ELISA測定IgG力價。繪圖展示各組之各個力價及幾何平均值±95%信賴區間。使用杜賓模型(Tobit model)藉由似然比測試來分析ExPEC10V與對照組之間的IgG力價差異。認為p值≤0.05為顯著的。*P≤0.05,****P≤0.0001。
圖 10
展示在人類中使用ExPEC10V疫苗之1/2a期臨床試驗之總體研究設計。圖 10A
展示第1群組的總體研究設計,且圖 10B
展示第2群組的總體研究設計。細節參見實例11。
Claims (18)
- 一種製得共價連接至載體蛋白之大腸桿菌Ox抗原多醣之生物結合物的方法,該方法包含:(i)提供包含以下之重組宿主細胞:a.該Ox-抗原多醣之rfb基因叢核苷酸序列;b.編碼包含至少一個醣基化位點之該載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO:1之醣基化共同序列;及c.編碼寡醣基轉移酶PglBy之核苷酸序列;及(ii)在用於製備該生物結合物之條件下培養該重組宿主細胞,其中:當該Ox-抗原為O1A抗原多醣時,該PglBy包含胺基酸突變N311V、K482R、D483H及A669V;當該Ox-抗原為葡糖基化O4抗原多醣時,該PglBy包含胺基酸突變N311V或胺基酸突變Y77H及N311V,且該重組宿主細胞進一步包含編碼葡糖基轉移酶GtrS的序列,該葡糖基轉移酶GtrS與SEQ ID NO:4具有至少80%一致性且能夠藉由添加葡萄糖修飾大腸桿菌O4抗原多醣以產生該大腸桿菌葡糖基化O4抗原多醣,及編碼分別與SEQ ID NO:7及8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇(bactoprenol)連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化;當該Ox-抗原為O6A抗原多醣時,該PglBy包含胺基酸突變N311V、K482R、D483H及A669V; 當該Ox-抗原為O8抗原多醣時,該PglBy在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;當該Ox-抗原為O15抗原多醣時,該PglBy包含胺基酸突變N311V、K482R、D483H及A669V;當該Ox-抗原為O16抗原多醣時,該PglBy包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V;當該Ox-抗原為O18A抗原多醣時,該PglBy在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;及當該Ox-抗原為O75抗原多醣時,該PglBy包含胺基酸突變N311V,其中在各種情況下,該等胺基酸突變係相對於具有胺基酸序列SEQ ID NO:6之野生型PglB,及其中該等O1A、葡糖基化O4、O6A、O8、O15、O16、O18A及O75抗原多醣分別具有下式之結構:(O1A):
- 如請求項1之方法,其中該Ox-抗原為葡糖基化O4抗原多醣,且該PglBy相對於具有胺基酸序列SEQ ID NO:6之野生型PglB包含胺基酸突變N311V或胺基酸突變Y77H及N311V。
- 如請求項2之方法,其中該重組宿主細胞進一步包含編碼具有胺基酸序列SEQ ID NO:4之GtrS的序列,及分別編碼具有胺基酸序列SEQ ID NO:7及SEQ ID NO:8之GtrA及GtrB的核苷酸序列。
- 如請求項1之方法,其中該載體蛋白中的醣基化位點包含具有SEQ ID NO:2之醣基化共同序列。
- 如請求項1之方法,其中各n獨立地為整數7至25。
- 一種製得共價連接至載體蛋白之大腸桿菌Ox抗原多醣之生物結合物的方法,該方法包含:(i)提供包含以下之重組宿主細胞:a.該Ox-抗原多醣之rfb基因叢核苷酸序列;b.編碼包含至少一個醣基化位點之該載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO:1之醣基化共同序列;及c.編碼寡醣基轉移酶PglBy之核苷酸序列;及(ii)在用於製備該生物結合物之條件下培養該重組宿主細胞,其中該PglBy相對於具有胺基酸序列SEQ ID NO:6之野生型PglB包含胺基酸突變N311V,其中該Ox-抗原為O1A抗原多醣、葡糖基化O4抗原多醣、O6A抗原多醣、O15抗原多醣、O16抗原多醣或O75抗原多醣,且當該Ox-抗原為葡糖基化O4抗原多醣時,該重組宿主細胞進一步包含:編碼葡糖基轉移酶GtrS之序列,該葡糖基轉移酶GtrS與SEQ ID NO:4具有至少80%一致性且能夠藉由添加葡萄糖來修飾大腸桿菌O4抗原多醣以產生該大腸桿菌葡糖基化O4抗原多醣;及編碼分別與SEQ ID NO:7及 8具有至少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化,及其中該等O1A、葡糖基化O4、O6A、O15、O16及O75抗原多醣分別具有下式之結構:(O1A):
- 如請求項6之方法,其中各n獨立地為整數7至25。
- 如請求項1至7中任一項之方法,其進一步包含自該重組宿主細胞分離該生物結合物。
- 如請求項1至7中任一項之方法,其中該載體蛋白係選自由以下組成之群:解毒之綠膿桿菌外毒素A(EPA)、大腸桿菌鞭毛蛋白(FliC)、CRM197、麥芽糖結合蛋白(MBP)、白喉類毒素、破傷風類毒素、解毒之金黃色葡萄球菌(S.aureus)溶血素A、凝集因子A、凝集因子B、大腸桿菌熱不穩定腸毒素、解毒之大腸桿菌熱不穩定腸毒素、霍亂毒素B次單位(CTB)、霍亂毒素、解毒之霍亂毒素、大腸桿菌Sat蛋白質、大腸桿菌Sat蛋白質之乘客域、肺炎鏈球菌(Streptococcus pneumoniae)溶血素、匙孔螺血氰蛋白(KLH)、綠膿桿菌PcrV、奈瑟氏腦膜炎菌(Neisseria meningitidis)之外膜蛋白(OMPC)及來自不可分型流感嗜血桿菌(Haemophilus influenzae)之蛋白D。
- 如請求項9之方法,其中該載體蛋白為解毒之綠膿桿菌外毒素A(EPA)。
- 如請求項9之方法,其中該載體蛋白包含SEQ ID NO:3。
- 如請求項1至7中任一項之方法,其中該重組宿主細胞為大腸桿菌細胞。
- 如請求項12之方法,其中該大腸桿菌細胞係來自大腸桿菌K-12菌株。
- 如請求項12之方法,其中該大腸桿菌細胞係來自大腸桿菌W3110菌株。
- 一種重組宿主細胞,其用於製得共價連接至載體蛋白之大腸桿菌Ox抗原多醣之生物結合物,該重組宿主細胞包含:a.該Ox-抗原多醣之rfb基因叢核苷酸序列;b.編碼包含至少一個醣基化位點之該載體蛋白的核苷酸序列,該至少一個醣基化位點包含具有SEQ ID NO:1之醣基化共同序列;及c.編碼寡醣基轉移酶PglBy之核苷酸序列其中:當該Ox-抗原為O1A抗原多醣時,該PglBy包含胺基酸突變N311V、K482R、D483H及A669V;當該Ox-抗原為葡糖基化O4抗原多醣時,該PglBy包含胺基酸突變N311V或胺基酸突變Y77H及N311V,且該重組宿主細胞進一步包含編碼葡糖基轉移酶GtrS的序列,該葡糖基轉移酶GtrS與SEQ ID NO:4具有至少80%一致性且能夠藉由添加葡萄糖修飾大腸桿菌O4抗原多醣以產生該大腸桿菌葡糖基化O4抗原多醣,及編碼分別與SEQ ID NO:7及8具有至 少80%序列一致性之易位酶GtrA及醣基轉移酶GtrB的核苷酸序列,其中該易位酶能夠使與細菌萜醇連接之葡萄糖易位且該醣基轉移酶能夠使細菌萜醇葡糖基化;當該Ox-抗原為O6A抗原多醣時,該PglBy包含胺基酸突變N311V、K482R、D483H及A669V;當該Ox-抗原為O8抗原多醣時,該PglBy在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;當該Ox-抗原為O15抗原多醣時,該PglBy包含胺基酸突變N311V、K482R、D483H及A669V;當該Ox-抗原為O16抗原多醣時,該PglBy包含胺基酸突變Y77H、S80R、Q287P、K289R及N311V;當該Ox-抗原為O18A抗原多醣時,該PglBy在位置77、80、287、289、311、482、483及669處不包含胺基酸突變;及當該Ox-抗原為O75抗原多醣時,該PglBy包含胺基酸突變N311V,其中在各種情況下,該等胺基酸突變係相對於具有胺基酸序列SEQ ID NO:6之野生型PglB,及其中該等O1A、葡糖基化O4、O6A、O8、O15、O16、O18A及O75抗原多醣分別具有下式之結構:(O1A):
- 如請求項15之重組宿主細胞,其中該載體蛋白中的醣基化位點包含具有SEQ ID NO:2之醣基化共同序列。
- 如請求項15之重組宿主細胞,其中各n獨立地為整數7至25。
- 如請求項15至17中任一項之重組宿主細胞,其中該重組宿主細胞係來自大腸桿菌W3110菌株之細胞。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962819762P | 2019-03-18 | 2019-03-18 | |
| US62/819,762 | 2019-03-18 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| TW202102670A TW202102670A (zh) | 2021-01-16 |
| TWI771663B true TWI771663B (zh) | 2022-07-21 |
Family
ID=70285928
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW109109076A TWI771663B (zh) | 2019-03-18 | 2020-03-18 | E. coli O-抗原多醣生物結合物之製備方法、其組合物及其使用方法 |
Country Status (24)
| Country | Link |
|---|---|
| US (3) | US11491220B2 (zh) |
| EP (2) | EP4253554A3 (zh) |
| JP (1) | JP7589164B2 (zh) |
| KR (1) | KR102574882B1 (zh) |
| CN (1) | CN113950524B (zh) |
| AR (1) | AR118389A1 (zh) |
| AU (1) | AU2020240075A1 (zh) |
| BR (1) | BR112021018258A2 (zh) |
| CA (1) | CA3134045A1 (zh) |
| EA (1) | EA202192392A1 (zh) |
| ES (1) | ES2951442T3 (zh) |
| HR (1) | HRP20231026T1 (zh) |
| HU (1) | HUE063875T2 (zh) |
| IL (1) | IL286467B1 (zh) |
| MA (1) | MA55365B1 (zh) |
| MD (1) | MD3942028T2 (zh) |
| MX (1) | MX2021011418A (zh) |
| PL (1) | PL3942028T3 (zh) |
| RS (1) | RS64521B1 (zh) |
| SG (1) | SG11202110303XA (zh) |
| SM (1) | SMT202300265T1 (zh) |
| TW (1) | TWI771663B (zh) |
| WO (1) | WO2020191088A1 (zh) |
| ZA (1) | ZA202107879B (zh) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112015014991B1 (pt) | 2013-01-17 | 2024-01-23 | Janssen Pharmaceuticals, Inc | Anticorpo específico para e. coli mdr, plasmídeo, cassete de expressão, célula hospedeira, método de produção do anticorpo, método para identificar um anticorpo candidato, preparação farmacêutica e de diagnóstico, epítopo, imunogênio e ácido nucleico utilizados |
| EA035991B9 (ru) | 2014-02-24 | 2020-10-21 | Глаксосмитклайн Байолоджикалс С.А. | Новый полисахарид и его применения |
| TWI715617B (zh) | 2015-08-24 | 2021-01-11 | 比利時商葛蘭素史密斯克藍生物品公司 | 對抗腸道外病原性大腸桿菌之免疫保護之方法及組合物 |
| AR109621A1 (es) | 2016-10-24 | 2018-12-26 | Janssen Pharmaceuticals Inc | Formulaciones de vacunas contra glucoconjugados de expec |
| IL286467B1 (en) | 2019-03-18 | 2025-10-01 | Janssen Pharmaceuticals Inc | Methods for producing bioconjugates of E. COLI O-antigen polysaccharides, preparations thereof and methods for using them |
| MY205586A (en) | 2019-03-18 | 2024-10-28 | Janssen Pharmaceuticals Inc | Bioconjugates of e. coli o-antigen polysaccharides, methods of production thereof, and methods of use thereof |
| KR20230043157A (ko) * | 2020-09-17 | 2023-03-30 | 얀센 파마슈티칼즈, 인코포레이티드 | 다가 백신 조성물 및 이의 용도 |
| CA3203450C (en) | 2020-11-30 | 2025-05-13 | Janssen Pharmaceuticals Inc | METHOD FOR ANALYSIS OF GLYCOCONJUGATES USING A CAPILLARY-BASED IMMUNOASSAY SYSTEM |
| WO2022214620A1 (en) | 2021-04-08 | 2022-10-13 | Janssen Pharmaceuticals, Inc. | Process for bioconjugate production |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016107818A1 (en) * | 2014-12-30 | 2016-07-07 | Glycovaxyn Ag | Compositions and methods for protein glycosylation |
Family Cites Families (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3700612A (en) | 1971-06-23 | 1972-10-24 | Tenneco Chem | Aqueous surface-coating compositions containing hydroxyalkyl ethers of galactomannan gums as thickeners |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| GB8422653D0 (en) | 1984-09-07 | 1984-10-10 | Technology Licence Co Ltd | Monoclonal antibodies |
| US5057540A (en) | 1987-05-29 | 1991-10-15 | Cambridge Biotech Corporation | Saponin adjuvant |
| US4912094B1 (en) | 1988-06-29 | 1994-02-15 | Ribi Immunochem Research Inc. | Modified lipopolysaccharides and process of preparation |
| US5370872A (en) | 1991-08-12 | 1994-12-06 | Swiss Serum And Vaccine Institute Berne | Escherichia coliO-polysaccharide-protein conjugate vaccine |
| EP0761231B1 (en) | 1992-06-25 | 2000-01-12 | SMITHKLINE BEECHAM BIOLOGICALS s.a. | Vaccine composition containing adjuvants |
| AUPM399594A0 (en) | 1994-02-21 | 1994-03-17 | Csl Limited | Antigenic preparation for treatment or prevention of helicobacter infection |
| FI102976B (fi) | 1994-02-28 | 1999-03-31 | Valtion Teknillinen | Menetelmä lisäkeittokemikaalien tuottamiseksi sekä käyttämiseksi sulfa attiselluloosaprosessissa |
| CA2284586C (en) | 1997-04-01 | 2011-02-08 | Ribi Immunochem Research, Inc. | Aqueous immunologic adjuvant compositions of monophosphoryl lipid a |
| US6491919B2 (en) | 1997-04-01 | 2002-12-10 | Corixa Corporation | Aqueous immunologic adjuvant compostions of monophosphoryl lipid A |
| US6858211B1 (en) | 1998-07-20 | 2005-02-22 | The United States Of America As Represented By The Department Of Health And Human Services | Vaccines against Escherichia coli O157 infection |
| CZ301212B6 (cs) | 1998-10-16 | 2009-12-09 | Smithkline Beecham Biologicals S. A. | Vakcinacní prostredek |
| WO2001078777A2 (en) | 2000-04-13 | 2001-10-25 | Mossman, Sally | Immunostimulant compositions comprising an aminoalkyl glucosaminide phosphate and qs-21 |
| AU2001253568A1 (en) | 2000-04-18 | 2001-10-30 | Dan C. Deborde | Lipopolysaccharide-conjugate vaccine for sepsis treatment |
| RU2189253C1 (ru) | 2001-04-09 | 2002-09-20 | Государственный научный центр прикладной микробиологии | Диагностикум для идентификации escherichia coli o157 : h7 и способ его получения |
| US7117096B2 (en) | 2001-04-17 | 2006-10-03 | Abmaxis, Inc. | Structure-based selection and affinity maturation of antibody library |
| US6676958B2 (en) | 2001-06-19 | 2004-01-13 | Advanced Bioadjuvants, Llc | Adjuvant composition for mucosal and injection delivered vaccines |
| WO2003074679A2 (en) | 2002-03-01 | 2003-09-12 | Xencor | Antibody optimization |
| CA2477794C (en) | 2002-03-07 | 2013-08-20 | Eidgenoessische Technische Hochschule Zuerich | System and method for the production of recombinant glycosylated proteins in a prokaryotic host |
| AU2003901008A0 (en) | 2003-03-04 | 2003-03-20 | Anadis Ltd | Composition for the treatment and prevention of bacterial infections |
| CN1324134C (zh) * | 2003-12-22 | 2007-07-04 | 南开大学 | 对大肠杆菌o81型的o-抗原特异的核苷酸 |
| AU2005229434B2 (en) | 2004-03-30 | 2010-09-30 | Nsgene A/S | Therapeutic use of a growth factor, NsG33 |
| JP5356807B2 (ja) | 2005-05-11 | 2013-12-04 | アイトヘネーシシェ テフニーシェ ホフシューレ チューリッヒ | 原核細胞由来の組み換えn−グリコシル化タンパク質 |
| TWI457133B (zh) | 2005-12-13 | 2014-10-21 | Glaxosmithkline Biolog Sa | 新穎組合物 |
| CA2646539A1 (en) | 2006-03-23 | 2007-09-27 | Novartis Ag | Imidazoquinoxaline compounds as immunomodulators |
| EP2007765B1 (en) | 2006-03-23 | 2012-06-27 | Novartis AG | Immunopotentiating compounds |
| JP4791866B2 (ja) | 2006-03-24 | 2011-10-12 | 国立大学法人秋田大学 | 下痢原性大腸菌感染症の判別に用いられる固相等 |
| US8877688B2 (en) | 2007-09-14 | 2014-11-04 | Adimab, Llc | Rationally designed, synthetic antibody libraries and uses therefor |
| CA2697193C (en) | 2007-09-14 | 2017-06-06 | Adimab, Inc. | Rationally designed, synthetic antibody libraries and uses therefor |
| EP2242505A4 (en) | 2008-01-08 | 2012-03-07 | Biogenerix Ag | GLYCOCONJUGATION OF POLYPEPTIDES USING OLIGOSACCHARYLTRANSFERASES |
| HRP20181259T1 (hr) | 2008-02-20 | 2018-10-05 | Glaxosmithkline Biologicals S.A. | Biokonjugati načinjeni iz rekombinantnih n-glikoziliranih proteina iz prokariotskih stanica |
| ES2684696T3 (es) | 2009-04-27 | 2018-10-04 | Immuron Limited | Preparación de inmunoglobulina enriquecida con anti-LPS para su uso en el tratamiento y/o la profilaxis de esteatohepatitis no alcohólica |
| LT2437753T (lt) | 2009-06-05 | 2016-12-12 | Infectious Disease Research Institute | Sintetiniai gliukopiranozillipidų adjuvantai ir juos turinčios vakcinų kompozicijos |
| AU2010322454B2 (en) | 2009-11-19 | 2016-05-19 | Glaxosmithkline Biologicals S.A. | Biosynthetic system that produces immunogenic polysaccharides in prokaryotic cells |
| WO2012009568A2 (en) | 2010-07-16 | 2012-01-19 | Adimab, Llc | Antibody libraries |
| US20130273098A1 (en) | 2010-12-10 | 2013-10-17 | Jeffrey T. Blue | Novel formulations which mitigate agitation-induced aggregation of immunogenic compositions |
| AU2012306345A1 (en) | 2011-09-06 | 2014-03-20 | Glycovaxyn Ag | Bioconjugate vaccines made in prokaryotic cells |
| US9932598B2 (en) | 2012-08-02 | 2018-04-03 | The Regents Of The University Of California | Metabolic engineering of microbial organisms |
| AU2013311534A1 (en) | 2012-09-10 | 2015-03-12 | Glycovaxyn Ag | Bioconjugates comprising modified antigens and uses thereof |
| TR201904022T4 (tr) | 2012-10-12 | 2019-04-22 | Glaxosmithkline Biologicals Sa | Konakçı hücre modifikasyon yöntemleri. |
| SG11201503308XA (en) | 2012-11-07 | 2015-05-28 | Glycovaxyn Ag | PRODUCTION OF RECOMBINANT VACCINE IN <i>E. COLI</i> BY ENZYMATIC CONJUGATION |
| JP2016501550A (ja) | 2012-12-27 | 2016-01-21 | グリコヴァキシン アーゲー | Crm197に関する方法及び組成物 |
| BR112015014991B1 (pt) | 2013-01-17 | 2024-01-23 | Janssen Pharmaceuticals, Inc | Anticorpo específico para e. coli mdr, plasmídeo, cassete de expressão, célula hospedeira, método de produção do anticorpo, método para identificar um anticorpo candidato, preparação farmacêutica e de diagnóstico, epítopo, imunogênio e ácido nucleico utilizados |
| PE20160080A1 (es) | 2013-05-18 | 2016-02-21 | Aduro Biotech Inc | Composiciones y metodos para activar la senalizacion que depende del estimulador del gen de interferon |
| US11220676B2 (en) | 2013-10-11 | 2022-01-11 | Glaxosmithkline Biological Sa | Methods of host cell modification |
| EP2870974A1 (en) | 2013-11-08 | 2015-05-13 | Novartis AG | Salmonella conjugate vaccines |
| WO2015082571A1 (en) | 2013-12-04 | 2015-06-11 | Glycovaxyn Ag | Prevention of staphylococcus aureus infections by glycoprotein vaccines synthesized in escherichia coli |
| CN106536551B (zh) | 2014-02-06 | 2021-04-16 | X4制药(奥地利)有限责任公司 | 大肠杆菌特异性抗体序列 |
| EA035991B9 (ru) * | 2014-02-24 | 2020-10-21 | Глаксосмитклайн Байолоджикалс С.А. | Новый полисахарид и его применения |
| SI3131577T1 (sl) | 2014-04-17 | 2020-08-31 | Glaxosmithkline Biologicals S.A. | Modificirane gostiljske celice in uporabe le-teh |
| CN105695497B (zh) | 2014-11-27 | 2019-09-24 | 中国人民解放军军事医学科学院生物工程研究所 | 一种细菌多糖修饰的重组融合蛋白的制备方法及其应用 |
| TWI715617B (zh) | 2015-08-24 | 2021-01-11 | 比利時商葛蘭素史密斯克藍生物品公司 | 對抗腸道外病原性大腸桿菌之免疫保護之方法及組合物 |
| GB201518668D0 (en) | 2015-10-21 | 2015-12-02 | Glaxosmithkline Biolog Sa | Immunogenic Comosition |
| GB201610599D0 (en) | 2016-06-17 | 2016-08-03 | Glaxosmithkline Biologicals Sa | Immunogenic Composition |
| AR109621A1 (es) | 2016-10-24 | 2018-12-26 | Janssen Pharmaceuticals Inc | Formulaciones de vacunas contra glucoconjugados de expec |
| GB201711635D0 (en) | 2017-07-19 | 2017-08-30 | Glaxosmithkline Biologicals Sa | Immunogenic composition |
| GB201721582D0 (en) * | 2017-12-21 | 2018-02-07 | Glaxosmithkline Biologicals Sa | S aureus antigens and immunogenic compositions |
| MY205586A (en) | 2019-03-18 | 2024-10-28 | Janssen Pharmaceuticals Inc | Bioconjugates of e. coli o-antigen polysaccharides, methods of production thereof, and methods of use thereof |
| IL286467B1 (en) | 2019-03-18 | 2025-10-01 | Janssen Pharmaceuticals Inc | Methods for producing bioconjugates of E. COLI O-antigen polysaccharides, preparations thereof and methods for using them |
| FR3098334B1 (fr) | 2019-07-05 | 2021-07-23 | Airbus Operations Sas | Procédé et système de surveillance d’un état de conscience d’un opérateur dans un poste de pilotage d’un aéronef |
| KR20230043157A (ko) | 2020-09-17 | 2023-03-30 | 얀센 파마슈티칼즈, 인코포레이티드 | 다가 백신 조성물 및 이의 용도 |
| CA3215752A1 (en) | 2021-04-01 | 2022-10-06 | Janssen Pharmaceuticals, Inc. | Production of e. coli o18 bioconjugates |
-
2020
- 2020-03-17 IL IL286467A patent/IL286467B1/en unknown
- 2020-03-18 JP JP2021556239A patent/JP7589164B2/ja active Active
- 2020-03-18 KR KR1020217033419A patent/KR102574882B1/ko active Active
- 2020-03-18 AR ARP200100747A patent/AR118389A1/es unknown
- 2020-03-18 EP EP23177116.3A patent/EP4253554A3/en active Pending
- 2020-03-18 HU HUE20718990A patent/HUE063875T2/hu unknown
- 2020-03-18 PL PL20718990.3T patent/PL3942028T3/pl unknown
- 2020-03-18 BR BR112021018258A patent/BR112021018258A2/pt unknown
- 2020-03-18 HR HRP20231026TT patent/HRP20231026T1/hr unknown
- 2020-03-18 EA EA202192392A patent/EA202192392A1/ru unknown
- 2020-03-18 SM SM20230265T patent/SMT202300265T1/it unknown
- 2020-03-18 MD MDE20220091T patent/MD3942028T2/ro unknown
- 2020-03-18 SG SG11202110303XA patent/SG11202110303XA/en unknown
- 2020-03-18 ES ES20718990T patent/ES2951442T3/es active Active
- 2020-03-18 WO PCT/US2020/023415 patent/WO2020191088A1/en not_active Ceased
- 2020-03-18 US US16/822,403 patent/US11491220B2/en active Active
- 2020-03-18 MA MA55365A patent/MA55365B1/fr unknown
- 2020-03-18 TW TW109109076A patent/TWI771663B/zh active
- 2020-03-18 AU AU2020240075A patent/AU2020240075A1/en active Pending
- 2020-03-18 CN CN202080036789.XA patent/CN113950524B/zh active Active
- 2020-03-18 CA CA3134045A patent/CA3134045A1/en active Pending
- 2020-03-18 EP EP20718990.3A patent/EP3942028B9/en active Active
- 2020-03-18 RS RS20230733A patent/RS64521B1/sr unknown
- 2020-03-18 MX MX2021011418A patent/MX2021011418A/es unknown
-
2021
- 2021-10-15 ZA ZA2021/07879A patent/ZA202107879B/en unknown
-
2022
- 2022-10-06 US US17/938,454 patent/US12233121B2/en active Active
-
2025
- 2025-01-17 US US19/029,679 patent/US20250222093A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016107818A1 (en) * | 2014-12-30 | 2016-07-07 | Glycovaxyn Ag | Compositions and methods for protein glycosylation |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI751513B (zh) | E. coli O-抗原多醣生物結合物、其製備方法及其使用方法 | |
| TWI771663B (zh) | E. coli O-抗原多醣生物結合物之製備方法、其組合物及其使用方法 | |
| US20220088165A1 (en) | Multivalent vaccine compositions and uses thereof | |
| HK40101412A (zh) | 生产大肠杆菌o-抗原多糖的生物缀合物的方法、其组合物及其使用方法 | |
| OA20646A (en) | Bioconjugates of E. coli O-antigen polysaccharides, methods of production thereof, and methods of use thereof. | |
| EA046636B1 (ru) | Способы получения биоконъюгатов полисахаридных о-антигенов e. coli, их композиции и способы их применения | |
| HK40058952A (zh) | 生產大腸桿菌o-抗原多糖的生物綴合物的方法、其組合物及其使用方法 | |
| HK40058952B (zh) | 生產大腸桿菌o-抗原多糖的生物綴合物的方法、其組合物及其使用方法 | |
| EA046206B1 (ru) | Биоконъюгаты полисахаридных о-антигенов e.coli, способы их получения и способы их применения |