RU2705244C2 - Композиции и способы лечения рака мозга - Google Patents
Композиции и способы лечения рака мозга Download PDFInfo
- Publication number
- RU2705244C2 RU2705244C2 RU2015128078A RU2015128078A RU2705244C2 RU 2705244 C2 RU2705244 C2 RU 2705244C2 RU 2015128078 A RU2015128078 A RU 2015128078A RU 2015128078 A RU2015128078 A RU 2015128078A RU 2705244 C2 RU2705244 C2 RU 2705244C2
- Authority
- RU
- Russia
- Prior art keywords
- sequence
- isolated
- protein
- seq
- virus
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/66—Microorganisms or materials therefrom
- A61K35/76—Viruses; Subviral particles; Bacteriophages
- A61K35/766—Rhabdovirus, e.g. vesicular stomatitis virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0085—Brain, e.g. brain implants; Spinal cord
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/14011—Filoviridae
- C12N2760/14033—Use of viral protein as therapeutic agent other than vaccine, e.g. apoptosis inducing or anti-inflammatory
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20211—Vesiculovirus, e.g. vesicular stomatitis Indiana virus
- C12N2760/20232—Use of virus as therapeutic agent, other than vaccine, e.g. as cytolytic agent
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20211—Vesiculovirus, e.g. vesicular stomatitis Indiana virus
- C12N2760/20233—Use of viral protein as therapeutic agent other than vaccine, e.g. apoptosis inducing or anti-inflammatory
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20211—Vesiculovirus, e.g. vesicular stomatitis Indiana virus
- C12N2760/20261—Methods of inactivation or attenuation
- C12N2760/20262—Methods of inactivation or attenuation by genetic engineering
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2810/00—Vectors comprising a targeting moiety
- C12N2810/50—Vectors comprising as targeting moiety peptide derived from defined protein
- C12N2810/60—Vectors comprising as targeting moiety peptide derived from defined protein from viruses
- C12N2810/6072—Vectors comprising as targeting moiety peptide derived from defined protein from viruses negative strand RNA viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2810/00—Vectors comprising a targeting moiety
- C12N2810/50—Vectors comprising as targeting moiety peptide derived from defined protein
- C12N2810/60—Vectors comprising as targeting moiety peptide derived from defined protein from viruses
- C12N2810/6072—Vectors comprising as targeting moiety peptide derived from defined protein from viruses negative strand RNA viruses
- C12N2810/6081—Vectors comprising as targeting moiety peptide derived from defined protein from viruses negative strand RNA viruses rhabdoviridae, e.g. VSV
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Epidemiology (AREA)
- Genetics & Genomics (AREA)
- Microbiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Immunology (AREA)
- Wood Science & Technology (AREA)
- Biochemistry (AREA)
- Mycology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Cell Biology (AREA)
- Developmental Biology & Embryology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
Abstract
Изобретение относится к биотехнологии и представляет собой изолированную рабдовирусную частицу для применения в онколитической вирусной терапии у пациента с глиобластомой, где выделенная рабдовирусная частица включает геном, способный экспрессировать: белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 1, белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 2, белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 3, белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 4, и белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 7. Изобретение относится также к набору, содержащему указанную рабдовирусную частицу, для лечения глиобластомы. Изобретение позволяет расширить арсенал средств для лечения глиобластомы. 5 н. и 15 з.п. ф-лы, 16 ил., 1 табл., 8 пр.
Description
Область техники
Настоящее изобретение касается химер рабдовирусов и их применения для онколитического лечения. Более конкретно, настоящее изобретение касается химер рабдовируса Мараба (Maraba) и их применения в лечении первичного и вторичного рака мозга.
Уровень техники
Опухоли головного мозга состоят из клеток, которые демонстрируют неограниченный рост в мозге. Они могут быть доброкачественными (то есть нераковыми) или злокачественными (то есть раковыми). Раковые опухоли головного мозга далее классифицируются как первичные или вторичные опухоли.
Первичные опухоли возникают в головном мозге, тогда как вторичные опухоли попадают в мозг из другого участка, такого как молочная железа или легкие. Вторичные опухоли также могут называться метастатическими. Вторичная (то есть метастатическая) опухоль головного мозга возникает тогда, когда раковые клетки попадают в мозг из первичной раковой опухоли в другой части тела. Вторичные опухоли головного мозга встречаются в три раза чаще, чем первичные опухоли. Все метастатические опухоли головного мозга являются злокачественными.
Опухоли головного мозга, как правило, называются и классифицируются в соответствии со следующими принципами: тип клеток головного мозга, из которых они образуются, или место, в котором развивается рак. Биологическое разнообразие этих опухолей делает классификацию трудной. Около 80% первичных злокачественных опухолей головного мозга известны под общим названием глиомы (то есть они возникают в глиальных клетках) и подразделяются на 4 класса, отражающих степень злокачественности.
Рак мозга является ведущей причиной смертности, связанной с раком, у пациентов моложе 35 лет и составляет примерно 10% всех случаев рака, диагностированных в Северной Америке. Лечение опухолей головного мозга осложняется тем, что имеется более 120 различных типов опухолей, которые варьируют от астроцитом низкого класса до многоформенной глиобластомы (GBM) 4 класса.
Злокачественные глиомы, такие как GBM, являются на сегодняшний день наиболее распространенным раком мозга, встречающимся у взрослых, а также самыми быстрорастущими и самыми злокачественными первичными опухолями головного мозга и, следовательно, наиболее трудно поддаются лечению. Даже при жестких одиночных и смешанных способах лечения, таких как хирургия, химиотерапия, облучение и применение низкомолекулярных ингибиторов, выживаемость остается неизменной на протяжении последних трех десятилетий, с медианой выживаемости менее одного года после постановки диагноза.
Причины безуспешности традиционного лечения являются многофакторными, включая высоко инфильтративную/инвазивную природу GBM, ограничение доставки лекарств через гематоэнцефалический барьер и нервную паренхиму, а также генетическую гетерогенность, приводящую к внутренней устойчивости к доступным методам лечения, и увеличение числа агрессивных устойчивых клонов. Таким образом, существует острая потребность в новых вариантах лечения, что привело к возобновлению онколитической вирусной терапии рака мозга в целом и в частности, GBM.
Вирус везикулярного стоматита (VSV) является сильнодействующим онколитическим рабдовирусом, который инфицирует и убивает широкий спектр типов опухолевых клеток (Brun et al., Mol Ther 18: 1440-1449, 2010). Как и в случае с другими рабдовирусами, нейротропизм с последующей нейровирулентностью, а также мощный ответ в виде nAb, остаются главными проблемами (Diallo et al., Methods Mol Biol 797: 127-140, 2011). Хотя, как известно, VSV является эффективным при системной доставке в моделях неврологических опухолей (Сагу et al., J Virol 85:5708-5717,2011; Lun et al., J Natl Cancer Inst 98: 1546-1547, 2006; Wollmann et al., J Virol 84: 1563-1573, 2010), его собственная нейротоксичность препятствует его рассмотрению в качестве кандидата для клинического применения (Hoffmann et al., J Gen Virol 91: 2782-2793, 2010; Sur et al., Vet Pathol 40:512-520,2003).
Вирус Мараба представляет собой недавно охарактеризованный онколитический рабдовирус, который имеет некоторое сходство по последовательности, подобный и даже более мощный онколитический спектр, и близкий профиль нейротоксичности с VSV (Brun et al., Mol Ther 18: 1440-1449, 2010). Рабдовирусы VSV и Мараба являются одними из самых эффективных вирусов, прошедших доклинические испытания. Однако желательным способом доставки вируса при раке мозга является внутримозговое введение, что в настоящее время невозможно как для VSV, так и для Мараба вследствие присущей им нейротоксичности.
Таким образом, желательно предоставить онколитическую вирусную терапию для лечения рака, и, более конкретно, для лечения рака головного мозга, которая бы устраняла или смягчала, по меньшей мере, один недостаток, имеющийся у предшествующих вариантов онколитических вирусных терапий.
Раскрытие изобретения
Целью настоящего изобретения является устранение или смягчение, по меньшей мере, одного недостатка предшествующих вариантов онколитических вирусных терапий. В некоторых примерах онколитическая вирусная терапия может демонстрировать пониженные уровни нейротоксичности.
Согласно одному аспекту настоящего изобретения предоставляется изолированная вирусная частица, геном которой включает открытые рамки считывания, которые кодируют: белок, имеющий последовательность, включающую SEQ ID NO: 1, или его вариант; белок, имеющий последовательность, включающую SEQ ID NO: 2, или его вариант; белок, имеющий последовательность, включающую SEQ ID NO: 3, или его вариант; белок, имеющий последовательность, включающую SEQ ID NO: 4 или 5, или его вариант; и белок, имеющий последовательность, включающую SEQ ID NO: 6, 7 или 8.
Вариантом эталонного белка может быть белок, имеющий последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, или, по меньшей мере, на 95% идентична последовательности эталонного белка, и данный вариант белка выполняет такую же биологическую функцию, что и эталонный белок.
Геном может включать открытую рамку считывания, кодирующую белок, имеющий последовательность, включающую SEQ ID NO: 6. В качестве альтернативы, геном может включать открытую рамку считывания, кодирующую белок, имеющий последовательность, включающую SEQ ID NO: 7. В качестве альтернативы, геном может включать открытую рамку считывания, кодирующую белок, имеющий последовательность, включающую SEQ ID NO: 8.
Вирусный геном может включать открытые рамки считывания, кодирующие: белок, имеющий последовательность, включающую SEQ ID NO: 1; белок, имеющий последовательность, включающую SEQ ID NO: 2; белок, имеющий последовательность, включающую SEQ ID NO: 3; белок, имеющий последовательность, включающую SEQ ID NO: 5; и белок, имеющий последовательность, включающую SEQ ID NO: 7.
Согласно другому аспекту настоящего изобретения предоставляется изолированная вирусная частица, которая включает полинуклеотид РНК, который содержит последовательность, которая включает: обратный комплемент последовательности, определяемой положениями от 64 до 1332 в SEQ ID NO: 10 или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 1393 до 2190 в SEQ ID NO: 10, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 4943 до 11272 в SEQ ID NO: 10, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 2256 до 2945 в SEQ ID NO: 10, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 3041 до 4816 в SEQ ID NO: 10; и обратные комплементы их промоторов.
Консервативный вариант последовательности нуклеотидов может представлять собой последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, или, по меньшей мере, на 95% идентична эталонной последовательности нуклеотидов. Консервативный вариант может представлять собой последовательность, которая включает одну или более молчащих замен.
Изолированная вирусная частица может быть изолированной вирусной частицей, способной продуцировать полинуклеотид кДНК, включающий последовательность согласно SEQ ID NO: 9, когда вирус находится в клетке-хозяине.
Изолированная вирусная частица может быть изолированной вирусной частицей, которая включает полинуклеотид РНК, который включает последовательность согласно SEQ ID NO: 10.
Согласно еще одному аспекту настоящего изобретения предоставляется изолированная вирусная частица, которая включает полинуклеотид РНК, который содержит последовательность, которая включает: обратный комплемент последовательности, определяемой положениями от 64 до 1332 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 1393 до 2190 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 4664 до 10993 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 2256 до 2945 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 3041 до 4537 в SEQ ID NO: 12; и обратные комплементы их промоторов.
Консервативный вариант последовательности нуклеотидов может представлять собой последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, или, по меньшей мере, на 95% идентична эталонной последовательности нуклеотидов. Консервативный вариант может представлять собой последовательность, содержащую одну или более молчащих замен.
Изолированная вирусная частица может быть изолированной вирусной частицей, способной продуцировать полинуклеотид кДНК, включающий последовательность, соответствующую SEQ ID NO: 11, когда вирус находится в клетке-хозяине.
Изолированная вирусная частица может быть изолированной вирусной частицей, которая включает полинуклеотид РНК, который включает последовательность согласно SEQ ID NO: 12.
Согласно еще одному аспекту настоящего изобретения предоставляется изолированная вирусная частица, которая включает полинуклеотид РНК, который содержит последовательность, которая включает: обратный комплемент последовательности, определяемой положениями от 64 до 1332 в SEQ ID NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 1393 до 2190 в SEQ ID NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 5195 до 11524 в SEQ ID NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 2256 до 2942 в SEQ ID NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 3038 до 5068 в SEQ ID NO: 14; и обратные комплементы их промоторов.
Консервативный вариант последовательности нуклеотидов может представлять собой последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, или, по меньшей мере, на 95% идентична эталонной последовательности нуклеотидов. Консервативный вариант может представлять собой последовательность, содержащую одну или более молчащих замен.
Изолированная вирусная частица может быть изолированной вирусной частицей, способной продуцировать полинуклеотид кДНК, включающий последовательность, соответствующую SEQ ID NO: 13, когда вирус находится в клетке-хозяине.
Изолированная вирусная частица может быть изолированной вирусной частицей, которая включает полинуклеотид РНК, который включает последовательность согласно SEQ ID NO: 14.
Согласно дополнительному аспекту настоящего изобретения предоставляется применение изолированной вирусной частицы в соответствии с настоящим изобретением для лечения рака. Рак может быть раком мозга. Рак мозга может быть глиобластомой.
Изолированная вирусная частица может применяться для инфицирования клетки, где инфицированная клетка применяется для лечения рака.
Согласно еще одному аспекту настоящего изобретения предоставляется применение изолированной вирусной частицы в соответствии с настоящим изобретением для индукции цитотоксического ответа у человека, которому вводится вирус. Цитотоксический ответ может быть противораковым ответом.
Изолированная вирусная частица может быть приготовлена для прямой доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Изолированная вирусная частица может быть приготовлена для введения с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Изолированная вирусная частица может применяться для инфицирования клетки, где инфицированная клетка применяется для генерации цитотоксического ответа. Инфицированная клетка может быть приготовлена для прямой доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Изолированная вирусная частица может быть приготовлена для введения с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Согласно еще одному аспекту настоящего изобретения предоставляется способ лечения рака. Способ включает введение изолированной вирусной частицы согласно настоящему изобретению пациенту, болеющему раком. Рак может быть раком мозга. Рак мозга может быть глиобластомой.
Изолированная вирусная частица может быть введена пациенту непосредственно. Изолированная вирусная частица может быть введена прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Изолированная вирусная частица может быть введена пациенту с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Способ может включать инфицирование клетки изолированной вирусной частицей и введение инфицированной клетки пациенту. Инфицированная клетка может быть введена прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Инфицированная клетка может быть введена пациенту с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Согласно еще одному аспекту настоящего изобретения предоставляется способ индукции цитотоксического ответа у пациента. Способ включает введение пациенту изолированной вирусной частицы согласно настоящему изобретению.
Изолированная вирусная частица может быть введена пациенту непосредственно. Изолированная вирусная частица может быть введена прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Изолированная вирусная частица может быть введена пациенту с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Способ может включать инфицирование клетки изолированной вирусной частицей и введение инфицированной клетки пациенту. Инфицированная клетка может быть введена прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Инфицированная клетка может быть введена пациенту с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Согласно еще одному аспекту настоящего изобретения предоставляется набор для лечения рака у пациента. Данный набор включает: изолированную вирусную частицу, согласно настоящему изобретению, и инструкции по введению изолированной вирусной частицы пациенту.
Рак может быть раком мозга. Рак мозга может быть глиобластомой.
Изолированная вирусная частица может быть приготовлена для прямой доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Изолированная вирусная частица может быть приготовлена для введения с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Изолированная вирусная частица может быть приготовлена для инфицирования клетки и клетка может быть приготовлена для доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Клетка может быть введена с помощью интратекального (подоболочечного) введения, внутривенного введения, внутричерепной инъекции или с помощью любой комбинации этих способов для последовательного или одновременного введения.
Другие аспекты и особенности настоящего изобретения станут очевидными для специалистов в данной области техники после рассмотрения следующего описания конкретных примеров в сочетании с прилагаемыми фигурами.
Краткое описание фигур
Воплощения настоящего изобретения будут теперь описаны только с помощью примера со ссылкой на прилагаемые фигуры.
Фигура 1 представляет собой график, иллюстрирующий идентификацию ненейротоксических рабдовирусов на основе выживания мышей Balb/C после однократного внутричерепного введения дозы указанного вируса (107 БОЕ, бляшкообразующих единиц). У животных контролировали потерю веса, пилоэрекцию (появление «гусиной кожи»), паралич задних конечностей, заболеваемость и смертность.
Фигура 2А представляет собой схематическое изображение расположения участка, кодирующего белок G, у MRB G и его замены на соответствующие участки BGG или EbG.
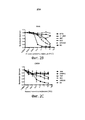
Фигуры 2В и 2С представляют собой графики, иллюстрирующие результаты анализов жизнеспособности, показывающих затухание вируса в нормальных астроцитах человека (NHA) и фибробластах кожи GM38. Величина разброса показывает стандартную ошибку среднего арифметического (SEM) для 4 биологических повторов.
Фигуры от 2D до 2К представляют собой графики, иллюстрирующие результаты анализов жизнеспособности, демонстрирующих, что MRBGG является цитолитическим для клеточных линий рака мозга человека. Жизнеспособность оценивали с помощью Alamar blue через 72 часа после лечения. Величина разброса показывает стандартную ошибку среднего арифметического (SEM) для 4 биологических повторов.
Фигура 3А суммирует данные по внутримозговой токсичности вирусов дикого типа FMT, BG, MS, MRB и нескольких генно-инженерных штаммов рабдовирусов на основе векторов VSV и MRB. Вирусы MRBGG и Мараба EbG А51 являются вирусами согласно настоящему изобретению.
Фигура 3В суммирует данные по вирусной нагрузке в гомогенатах мозга животных, умерщвленных через 3 месяца после внутримозгового введения. Предел обнаружения составляет 101.
Фигура 3С показывает фотографии патологий. Фотографии патологии мозга в случае мышей Balb/C, остро инфицированных вирусами FMT и MRBGG, неотличимы от фотографий мозга животных, которым вводили солевой раствор. Мышам Balb/C инокулировали в мозг указанные вирусы (107 БОЕ) и умерщвляли их через 48 часов после инокуляции.
Фигура 3D представляет собой график, иллюстрирующий моторную функцию мышей, получавших ненейротоксичные рабдовирусы, и контрольных мышей. Двигательная функция не нарушена после внутримозгового введения ненейротоксичных рабдовирусов. Двигательную функцию оценивали с помощью теста вращающегося стержня (rotorod analysis), измеряя задержку перед падением с вращающегося с ускорением стержня.
Фигура 3Е представляет собой график, иллюстрирующий профиль токсичности после однократного внутривенного введения химеры либо FMT, либо MRBGG в различных дозах. Максимально переносимая доза (МПД) равна самой высокой дозе, которая не приводит к достоверной заболеваемости, измеряемой по изменению поведения и веса.
Фигура 4А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG после внутривенного введения MRBGG или EbG (3 дозы 109 БОЕ) по сравнению с контрольным лечением фосфатным буфером (PBS). Системная доставка этих вирусов повышает эффективность в модели ксенотрансплантанта U87MG человека.
Фигура 4В представляет собой график, демонстрирующий значительную регрессию опухоли в ответ на три внутривенные дозы (109 БОЕ) MRBGG или EbG. Разброс представляет собой SEM.
Фигура 4С представляет собой график выживания в координатах Каплана-Меира для животных, получавших внутривенное лечение MRBGG (логарифмический ранговый тест Р = 0,01) и EBG (логарифмический ранговый тест Р = 0,01).
Фигура 5 представляет собой график, иллюстрирующий онколитическую активность различных вирусов на панели клеток глиобластомы человека.
Фигура 6А представляет собой график, иллюстрирующий in vivo нейротоксичность химерных вирусов Мараба согласно настоящему изобретению по сравнению с контрольными вирусами. График в координатах Каплана-Меира показывает выживание мышей Balb/C после однократной внутримозговой дозы указанного вируса (106 БОЕ).
Фигура 6В представляет собой график, показывающий изменение веса животных, представленных на фигуре 6А.
Фигура 7А представляет собой график, иллюстрирующий in vivo эффективность химер Мараба в соответствии с настоящим изобретением по сравнению с контрольными вирусами. График в координатах Каплана-Меира показывает выживание голых мышей CD-1 с опухолями U87MG после лечения.
Фигура 7В представляет собой график, показывающий изменение веса животных, представленных на фигуре 7А.
Фигура 8А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность контроля PBS в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли до и после лечения (1 неделя, 2 недели, 3 недели, 4 недели).
Фигура 8В представляет собой график, иллюстрирующий значительное увеличение веса опухоли с течением времени у не получавших лечения контрольных животных.
Фигура 9А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность лечения вирусом BG дикого типа (BG-WT) в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли U87MG после лечения BG (1 неделя, 2 недели, 3 недели, 4 недели) (1 доза 107 БОЕ: внутричерепное введение).
Фигура 9В представляет собой график, иллюстрирующий умеренную начальную регрессию опухоли в ответ на внутричерепную дозу (107 БОЕ) BG с последующим рецидивом и увеличением опухоли.
Фигура 10А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность лечения вирусом FMT дикого типа (FMT-WT) в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли U87MG после лечения FMT-WT (1 неделя, 2 недели, 3 недели, 4 недели) (1 доза 107 БОЕ: внутричерепное введение).
Фигура 10В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепную дозу FMT-WT (107 БОЕ).
Фигура 11А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность лечения MRB BG(G) в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли U87MG после лечения MRB BG(G) (1 неделя, 2 недели, 3 недели, 4 недели) (1 доза 107 БОЕ: внутричерепное введение).
Фигура 11В представляет собой график, иллюстрирующий умеренную регрессию опухоли в ответ на внутричерепную дозу MRB BG(G) (107 БОЕ).
Фигура 12А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность лечения MRB FMT(G) в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли U87MG после лечения MRB FMT(G) (1 неделя, 2 недели, 3 недели) (1 доза 107 БОЕ).
Фигура 12 В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепную дозу (107 БОЕ) MRB FMT(G). Однако все животные погибли вследствие нейротоксических эффектов при лечении MRB FMT(G) еще до 4 недели после лечения.
Фигура 13А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность лечения FMT MRB(G) в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли U87MG после лечения FMT MRB(G) (1 неделя, 2 недели, 3 недели) (1 доза 107 БОЕ: внутричерепное введение).
Фигура 13В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепную дозу (107 БОЕ) FMT MRB(G). Однако все животные погибли вследствие нейротоксических эффектов при лечении FMT MRB(G) еще до 4 недели после лечения.
Фигура 14А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность лечения VSV-LCMV(G) в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли U87MG после лечения VSV-LCMV(G) (1 неделя, 2 недели, 3 недели, 4 недели) (1 доза 107 БОЕ: внутричерепное введение).
Фигура 14В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепную дозу (107 БОЕ) VSV-LCMV(G).
Фигура 15А представляет собой изображение, полученное в аппарате IVIS [при регистрации биолюминесценции люциферазы светлячка] (IVIS image), опухолей U87MG, иллюстрирующее in vivo эффективность лечения MRB-LCMV(G) в модели ксенотрансплантанта U87MG человека. Изображение показывает опухоли U87MG после лечения MRB-LCMV(G) (1 неделя, 2 недели, 3 недели, 4 недели) (1 доза 107 БОЕ: внутричерепное введение).
Фигура 15 В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепную дозу (107 БОЕ) MRB-LCMV(G).
Фигура 16 представляет собой график, иллюстрирующий титры нейтрализующих антител у мышей Balb/C, обработанных вирусом Мараба дикого типа, ослабленным VSV (VSV-A51), химерой Мараба LCMV(G) или химерой VSV-LCMV(G).
Раскрытие изобретения
Определения
В настоящем раскрытии применяются некоторые термины, которые определены в следующих пунктах.
В используемом здесь значении слова "желание" или "желательный" относятся к воплощениям способа, которые дают определенные преимущества при определенных условиях. Однако другие воплощения могут быть также желательными в таких же или других условиях. Кроме того, перечисление одного или более желательных воплощений не подразумевает, что другие воплощения не являются пригодными, и не предназначено для исключения других воплощений из рамок настоящего изобретения.
В используемом здесь значении слово "включать" и его варианты предназначены для того, чтобы быть неограничивающими, то есть перечисление позиций в списке не исключает других подобных элементов, которые также могут быть полезны в материалах, композициях, устройствах и способах согласно настоящему изобретению. Аналогично этому термины "может" и "могут" и их варианты предназначены для того, чтобы быть неограничивающими, то есть перечисление того, что воплощение может включать определенные элементы или особенности, не исключает других воплощений настоящего изобретения, которые не содержат таких элементов или особенностей.
Несмотря на то, что неограничивающий термин "содержащий", как синоним неограничивающих терминов, таких как включающий, содержащий или имеющий, используется здесь для описания воплощений настоящего изобретения, воплощения могут быть альтернативно описаны с использованием более ограничивающих терминов, таких как "состоящий из" или "состоящий, в основном, из». Таким образом, для любого конкретного воплощения, где указываются материалы, компоненты или этапы способа, данное изобретение также включает, в частности, воплощения, состоящие из, или состоящие, в основном, из таких материалов, компонентов или способов без учета дополнительных материалов, компонентов или способов (для состоящего из) и исключающие дополнительные материалы, компоненты или способы, изменяющие существенные свойства воплощения (для состоящего, в основном, из), даже если такие дополнительные материалы, компоненты или способы в явном виде не перечислены в этой заявке. Например, описание композиции или способа, включающего элементы А, В и С, специально предусматривает воплощения, состоящие из и состоящие, в основном, из А, В и С, и не включающие элемент D, который может быть известен в данной области техники, хотя элемент D не описан в явном виде как исключенный в данном документе.
Как здесь указано, процентные составы всех композиций даны в весовых процентах от общего веса композиции, если не указано иначе. Раскрытие диапазонов, если не указано иначе, включает конечные точки и включает все различные значения и все поддиапазоны в пределах всего диапазона. Так, например, диапазон "от А до В" или "от примерно А до примерно Б" включает точки А и Б. Раскрытие значений и диапазонов значений для конкретных параметров (таких как температуры, молекулярные веса, весовые проценты и т.д.) не исключает других значений и диапазонов значений, которые могут применяться. Предполагается, что два или более конкретных значений, которые приведены в качестве примеров значения для данного параметра, могут определять конечные точки для диапазона значений, которые могут быть заданы для этого параметра. Например, если параметр X в приведенном здесь примере имеет значение А, а в другом приведенном здесь примере имеет значение Z, то предполагается, что параметр X может иметь диапазон значений от примерно А до примерно Z. Аналогично этому предполагается, что раскрытие двух или более диапазонов значений для параметра (где такие диапазоны входят один в другой, перекрываются или отделены друг от друга) означает суммирование всех возможных комбинаций диапазонов значений для этого параметра, которые могут быть получены с учетом конечных точек раскрытых диапазонов. Например, если параметр X в примерах настоящего изобретения имеет значения в диапазонах 1-10, или 2-9, или 3-8, также предполагается, что параметр X может иметь и другие диапазоны значений, в том числе 1-9, 1- 8, 1-3, 1-2, 2-10, 2-8, 2-3, 3-10 и 3-9.
В используемом здесь значении употребление неопределенного артикля в английском тексте означает, что присутствует, "по меньшей мере, один" из элементов; может присутствовать и множество таких элементов, когда это возможно.
"Примерно" в отношении числовых параметров означает, что вычисление или измерение допускает некоторую небольшую неточность в значении (с некоторой точностью приближения к значению; примерно или достаточно близко к значению, почти). Если, по какой-то причине, выражение содержит слово «примерно», это не всегда должно пониматься так, как это обычно принято в данной области техники, то есть "примерно" в используемом здесь значении означает, по меньшей мере, те вариации, которые могут возникнуть при определении таких параметров с использованием обычных методов измерения.
В используемом здесь значении термин "и/или" включает любые и все возможные комбинации одного или более из перечисленных связанных элементов.
В используемом здесь значении вирус, который имеет "пониженные уровни нейротоксичности" или "пониженную нейротоксичность" следует понимать как вирус, который при введении в правое полосатое тело мозга мыши в данной дозе приводит к проявлению у мыши меньшего числа признаков нейротоксичности (например, таких, как потеря веса, пилоэрекция, паралич задних конечностей, заболеваемость и смертность), чем у мыши, которой вводится соответствующий вирус дикого типа.
В используемом здесь значении вирус, "практически не имеющий нейротоксичности" или "практически не нейротоксичный", следует понимать как вирус, который при введении пациенту в эффективной дозе не приводит к обнаружению признаков пониженной двигательной функции по сравнению с пациентом до инъекции вируса с использованием стандартного протокола для пациента этого вида. Например, вирус, являющийся "практически не нейротоксичным", следует понимать как вирус, который при введении мыши в дозе 107 БОЕ не вызывает у мыши каких-либо детектируемых признаков пониженной двигательной функции при измерении времени в тесте с вращающимся стержнем по сравнению с мышью до инъекции вируса.
Осуществление изобретения
Из более чем 250 идентифицированных в настоящее время рабдовирусов, авторы настоящего изобретения протестировали несколько рабдовирусов дикого типа и выяснили, что многие из них эффективно уничтожают клетки клеточных линий опухолей ЦНС. Было также показано, что некоторые из этих сильнодействующих вирусных изолятов демонстрировали заметное ослабление, что обеспечивало 100% выживаемость после внутримозговой инокуляции. Это разительно отличается от ранее испытанных вирусов Мараба и VSV. Авторы настоящего изобретения далее секвенировали и создали генно-инженерные химерные вирусы для тестирования совместно с известными не нейротоксичными изолятами дикого типа.
В общем, настоящее изобретение предоставляет системы, способы, применения, процессы, предметы и композиции, которые касаются генно-инженерных химерных рабдовирусов Мараба и связанных с ними нуклеотидных и белковых последовательностей. Например, настоящее изобретение предоставляет применение химерного рабдовируса Мараба для онколитического лечения, например, для лечения первичного или вторичного рака мозга.
Рассматриваемые онколитические вирусы могут применяться для лечения рака путем прямого введения вируса пациенту или путем инфицирования клетки вирусом и введения зараженной клетки пациенту для доставки вируса. Клетка, которую инфицируют вирусом, может быть раковой клеткой данного пациента, нормальной иммунной клеткой или стволовой клеткой. В некоторых примерах рак, подлежащий лечению, представляет собой рак мозга, такой как злокачественная глиома. Одним из примеров злокачественной глиомы является глиобластома.
Вирусные частицы в соответствии с настоящим изобретением могут не содержать плазмиду дикого типа, могут не содержать последовательности, которые кодируют G-белок Мараба дикого типа, или представляют собой оба эти варианта
В одном из примеров вирусных частиц в соответствии с настоящим изобретением предоставляется изолированная вирусная частица, геном которой включает открытые рамки считывания, которые кодируют белки: белки N, Р, и L Мараба или любые их варианты; а также белок М или белок А51М Мараба, или любые их варианты; и белок G Bahia Grande, белок G LCMV или белок G Эбола.
Белок N Мараба может иметь последовательность, которая включает SEQ ID NO: 1. Белок Р Мараба может иметь последовательность, которая включает SEQ ID NO: 2. Белок L Мараба может иметь последовательность, которая включает SEQ ID NO: 3. Белки М и А51М могут иметь последовательность, которая включает SEQ ID NO: 4 и 5 соответственно; Белок G Bahia Grande может иметь последовательность, которая включает SEQ ID NO: 6. Белок G LCMV может иметь последовательность, которая включает SEQ ID NO: 7. Белок G Эбола может иметь последовательность, которая включает SEQ ID NO: 8.
Вариантом эталонного белка может быть белок, имеющий последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, или, по меньшей мере, на 95% идентична последовательности эталонного белка, и вариант белка обеспечивает ту же биологическую функцию, что и эталонный белок. Например, вариант белка будет рассматриваться как поддерживающий такую же биологическую функцию, что и эталонный белок, если вирусная частица, содержащая модифицированный белок-вариант, имеет ту же самую цитотоксичность и нейротоксичность, что и вирусная частица с эталонным белком.
В конкретном примере изолированная вирусная частица имеет геном, включающий открытые рамки считывания, которые кодируют белки, имеющие последовательности, которые включают SEQ ID NO: 1, 2, 3, 4 и 6.
В другом примере изолированная вирусная частица имеет геном, включающий открытые рамки считывания, которые кодируют белки, имеющие последовательности, которые включают SEQ ID NO: 1, 2, 3,4 и 7.
В еще одном примере изолированная вирусная частица имеет геном, включающий открытые рамки считывания, которые кодируют белки, имеющие последовательности, которые включают SEQ ID NO: 1, 2, 3, 4 и 8.
В дополнительном примере изолированная вирусная частица имеет геном, включающий открытые рамки считывания, которые кодируют белки, имеющие последовательности, которые включают SEQ ID NO: 1, 2, 3, 5, и 6.
В еще одном примере изолированная вирусная частица имеет геном, включающий открытые рамки считывания, которые кодируют белки, имеющие последовательности, которые включают SEQ ID NO: 1, 2, 3, 5, и 7.
В еще одном дополнительном примере изолированная вирусная частица имеет геном, включающий открытые рамки считывания, которые кодируют белки, имеющие последовательности, которые включают SEQ ID NO: 1, 2, 3, 5 и 8.
В другом примере вирусных частиц в соответствии с настоящим изобретением предоставляется изолированная вирусная частица, которая содержит полинуклеотид РНК, имеющий последовательность, которая включает: обратный комплемент последовательности, определяемой положениями от 64 до 1332 в SEQ ID NO: 10, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 1393 до 2190 в SEQ ID NO: 10, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 4943 до 11272 в SEQ ID NO: 10, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 2256 до 2945 в SEQ ID NO: 10, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 3041 до 4816 в последовательности SEQ ID NO: 10; и обратные комплементы их промоторов.
Консервативный вариант может представлять собой последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95% идентична эталонной последовательности нуклеотидов. Консервативный вариант может представлять собой последовательность, содержащую одну или более молчащих замен.
Конкретный пример вирусной частицы в соответствии с настоящим изобретением представляет собой изолированную вирусную частицу, способную продуцировать полинуклеотид кДНК, содержащий последовательность, соответствующую SEQ ID NO: 9, когда вирус находится в клетке-хозяине.
Конкретный пример вирусной частицы в соответствии с настоящим изобретением представляет собой изолированную вирусную частицу, содержащую полинуклеотид РНК, содержащий последовательность, соответствующий SEQ ID NO: 10.
В другом примере вирусных частиц в соответствии с настоящим изобретением предоставляется изолированная вирусная частица, содержащая полинуклеотид РНК, имеющий последовательность, которая включает: обратный комплемент последовательности, определяемой положениями от 64 до 1332 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 1393 до 2190 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 4664 до 10993 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 2256 до 2945 в SEQ ID NO: 12, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 3041 до 4537 в последовательности SEQ Ш NO: 12; и обратные комплементы их промоторов.
Консервативный вариант может представлять собой последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95% идентична эталонной последовательности нуклеотидов. Консервативный вариант может представлять собой последовательность, содержащую одну или более молчащих замен.
Конкретный пример вирусной частицы в соответствии с настоящим изобретением представляет собой изолированную вирусную частицу, способную продуцировать полинуклеотид кДНК, содержащий последовательность, соответствующую SEQ ID NO: 11, когда вирус находится в клетке-хозяине.
Конкретный пример вирусной частицы в соответствии с настоящим изобретением представляет собой изолированную вирусную частицу, содержащую полинуклеотид РНК, содержащий последовательность в соответствии с SEQ ID NO: 12.
В другом примере вирусных частиц в соответствии с настоящим изобретением предоставляется изолированная вирусная частица, содержащая полинуклеотид РНК, который содержит последовательность, которая включает: обратный комплемент последовательности, определяемой положениями от 64 до 1332 в SEQ ID NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 1393 до 2190 в SEQ ID NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 5195 до 11524 SEQ ID NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 2256 до 2942 в SEQ ГО NO: 14, или его консервативный вариант; обратный комплемент последовательности, определяемой положениями от 3038 до 5068 в последовательности SEQ ГО NO: 14; и обратные комплементы их промоторов.
Консервативный вариант может представлять собой последовательность, которая, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95% идентична эталонной последовательности нуклеотидов. Консервативный вариант может представлять собой последовательность, содержащую одну или более молчащих замен.
Конкретный пример вирусной частицы в соответствии с настоящим изобретением представляет собой изолированную вирусную частицу, способную продуцировать полинуклеотид кДНК, содержащий последовательность, соответствующую SEQ ID NO: 13, когда вирус находится в клетке-хозяине.
Конкретный пример вирусной частицы в соответствии с настоящим изобретением представляет собой изолированную вирусную частицу, содержащую полинуклеотид РНК, содержащий последовательность в соответствии с SEQ ID NO: 14.
Согласно другому аспекту настоящего изобретения изолированная вирусная частица в соответствии с настоящим изобретением может применяться для лечения рака. Рак может быть раком мозга, например, глиобластомой.
Изолированная вирусная частица может применяться для инфицирования клетки и инфицированная клетка может применяться для лечения рака.
Согласно другому аспекту настоящего изобретения изолированная вирусная частица в соответствии с настоящим изобретением может применяться для индукции цитотоксического ответа у персоны, которой введен вирус. Цитотоксический ответ может представлять собой противораковый ответ. Изолированная вирусная частица может применяться для инфицирования клетки, и инфицированная клетка может применяться для индукции цитотоксического ответа.
Изолированная вирусная частица может быть приготовлена для прямой доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Изолированная вирусная частица может быть приготовлена для введения с помощью интратекального введения, внутривенного введения, внутричерепной инъекции или любой комбинации этих способов для последовательного или одновременного введения.
Инфицированная клетка может быть приготовлена для прямой доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Инфицированная клетка может быть приготовлена для введения с помощью интратекального введения, внутривенного введения, внутричерепной инъекции или путем любой комбинации этих способов для последовательного или одновременного введения.
Согласно другому аспекту настоящего изобретения предоставляется способ лечения рака, который включает введение изолированной вирусной частицы в соответствии с настоящим изобретением пациенту, больному раком. Рак может быть раком мозга, например, глиобластомой.
Изолированная вирусная частица может прямо вводиться пациенту. Изолированная вирусная частица может вводиться прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Изолированная вирусная частица может вводиться пациенту интратекально, внутривенно, путем внутричерепной инъекции или путем любой комбинации этих способов для последовательного или одновременного введения.
Способ может включать инфицирование клетки изолированной вирусной частицей и введение инфицированной клетки пациенту. Инфицированная клетка может вводиться прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Инфицированная клетка может вводиться пациенту интратекально, внутривенно, путем внутричерепной инъекции или путем любой комбинации этих способов для последовательного или одновременного введения.
Согласно другому аспекту настоящего изобретения предоставляется способ индуцирования цитотоксического ответа у пациента, который включает введение пациенту изолированной вирусной частицы в соответствии с настоящим изобретением.
Изолированная вирусная частица может вводиться прямо пациенту. Изолированная вирусная частица может вводиться прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Изолированная вирусная частица может вводиться пациенту интратекально, внутривенно, путем внутричерепной инъекции или путем любой комбинации этих способов для последовательного или одновременного введения.
Способ может включать инфицирование клетки изолированной вирусной частицей и введение инфицированной клетки пациенту. Инфицированная клетка может вводиться прямо в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или с помощью любой комбинации этих способов введения. Инфицированная клетка может вводиться пациенту интратекально, внутривенно, путем внутричерепной инъекции или путем любой комбинации этих способов для последовательного или одновременного введения.
Согласно другому аспекту настоящего изобретения предоставляется набор для лечения рака у пациента. Набор включает изолированную вирусную частицу согласно настоящему изобретению и инструкции по введению пациенту изолированной вирусной частицы.
Рак может быть раком мозга, например глиобластомой.
Изолированная вирусная частица может быть приготовлена для прямой доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Изолированная вирусная частица может быть приготовлена для введения с помощью интратекального введения, внутривенного введения, внутричерепной инъекции или путем любой комбинации этих способов для последовательного или одновременного введения.
Изолированная вирусная частица может быть приготовлена для инфицирования клетки, предназначенной для доставки в центральную нервную систему, снаружи от гематоэнцефалического барьера, внутрь гематоэнцефалического барьера, или для любой комбинации этих способов введения. Клетка может быть приготовлена для введения с помощью интратекального введения, внутривенного введения, внутричерепной инъекции или путем любой комбинации этих способов для последовательного или одновременного введения.
В любом из указанных выше аспектов введение с помощью одного способа может комбинироваться с одним или несколькими другими способами введения. Введение вирусной частицы различными способами может быть последовательным и/или одновременным. Способ или путь введения вируса в соответствии с настоящим изобретением не оказывает влияния на способность вируса инфицировать и убивать раковые клетки, независимо от того, вводится ли вирус непосредственно или сначала им инфицируют клетку и вводят пациенту инфицированную клетку. Ожидается, что вирусы в соответствии с настоящим изобретением при введении либо за гематоэнцефалический барьер, либо снаружи от гематоэнцефалического барьера, способны проходить через гематоэнцефалический барьер и инфицировать раковые клетки по другую сторону гематоэнцефалического барьера.
Способы инфицирования клетки вирусом и применения инфицированной клетки для доставки вируса обсуждаются, например, в: Power AT, et al. Carrier cell-based delivery of an oncolytic virus circumvents antiviral immunity. Mol Ther. 2007 Jan; 15(1): 123-30; и Tyler MA, et al. Neural stem cells target intracranial glioma to deliver an oncolytic adenovirus in vivo. Gene Ther. 2009 Feb; 16(2):262-78.
Полинуклеотидные и аминокислотные последовательности
Предоставляются полинуклеотиды, включающие последовательности нуклеиновых кислот (например, ДНК и РНК), и аминокислотные (то есть белковые) последовательности, которые могут применяться в различных способах и подходах, известных специалистам в области молекулярной биологии. Они включают изолированные, очищенные и рекомбинантные формы перечисленных последовательностей и дополнительно включают полные или частичные формы перечисленных последовательностей. Неограничивающие варианты применения для аминокислотных последовательностей включают создание антител к белкам или пептидам, содержащим описанные аминокислотные последовательности. Неограничивающие варианты применения для полинуклеотидных последовательностей включают создание зондов для гибридизации, использования в качестве праймеров для применения в полимеразной цепной реакции (ПЦР), для картирования хромосом и генов и тому подобное. Полные или частичные аминокислотные или полинуклеотидные последовательности могут применяться в таких способах и подходах.
Настоящее изобретение предоставляет идентификацию полинуклеотидных последовательностей, включая последовательности генов и последовательности кодирующих нуклеиновых кислот, а также аминокислотные последовательности. В дополнение к последовательностям, специально предоставленным в прилагаемом списке последовательностей, настоящее изобретение также включает полинуклеотидные последовательности, которые связаны с ними структурно и/или функционально. Настоящее изобретение также включает полинуклеотидные последовательности, которые гибридизуются в жестких условиях с любой из полинуклеотидных последовательностей из перечня последовательностей или с ее подпоследовательностью (например, подпоследовательность включает, по меньшей мере, 100 последовательно расположенных нуклеотидов). Полинуклеотидные последовательности также включают последовательности и/или подпоследовательности, предназначенные для продукции РНК и/или трансляции, например, мРНК, антисмысловые РНК, смысловые РНК, конфигурации РНК для сайленсинга и интерференции, и т.д.
Полинуклеотидные последовательности, которые по существу идентичны тем, которые приведены в перечне последовательностей, могут применяться в композициях и способах, раскрытых здесь. В значительной степени идентичные или в значительной степени аналогичные полинуклеотидные последовательности определяются как полинуклеотидные последовательности, которые идентичны на основании последовательности нуклеотидов, по меньшей мере, подпоследовательности эталонного полинуклеотида. Такие полинуклеотиды могут включать, например, вставки, делеции и замены по отношению к любой последовательности из перечисленных в перечне последовательностей. Например, такие полинуклеотиды, как правило, по меньшей мере примерно на 70% идентичны эталонному полинуклеотиду, выбираемому из таковых из перечня последовательностей, или его подпоследовательности. Например, по меньшей мере, 7 из 10 нуклеотидов в пределах окна сравнения идентичны выбранной эталонной последовательности. Кроме того, такие последовательности могут быть, по меньшей мере, примерно на 70%, по меньшей мере, примерно на 75%, по меньшей мере, примерно на 80%, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 98%, по меньшей мере, примерно на 99% или, по меньшей мере, примерно на 99,5% идентичны эталонной последовательности. Подпоследовательности этих полинуклеотидов могут содержать, по меньшей мере, примерно 5, по меньшей мере, примерно 10, по меньшей мере, примерно 15, по меньшей мере, примерно 20, по меньшей мере, примерно 25, по меньшей мере, примерно 50, по меньшей мере примерно 75, по меньшей мере, примерно 100, по меньшей мере, примерно 500, примерно 1000 или более последовательно расположенных нуклеотидов или комплементарные подпоследовательности. Такими подпоследовательностями могут быть, например, олигонуклеотиды, такие как синтетические олигонуклеотиды, изолированные олигонуклеотиды или полноразмерные гены или кДНК. Полинуклеотидные последовательности, комплементарные любой из описанных последовательностей, также включены в рамки настоящего изобретения.
Аминокислотные последовательности включают аминокислотные последовательности, представленные в перечне последовательностей, и их подпоследовательности. Также включены аминокислотные последовательности, которые высоко родственны с ними структурно и/или функционально. Например, в дополнение к аминокислотным последовательностям из перечня последовательностей, в раскрытых композициях и способах могут применяться аминокислотные последовательности, которые по существу идентичны им. По существу идентичные или по существу аналогичные аминокислотные последовательности определяются как аминокислотные последовательности, которые идентичны на основе аминокислотной последовательности, по меньшей мере, подпоследовательности в составе эталонной аминокислотной последовательности. Такие аминокислотные последовательности могут включать, например, вставки, делении и замены по отношению к любой из аминокислотных последовательностей из перечня последовательностей. Например, такие аминокислоты, как правило, по меньшей мере, примерно на 70% идентичны эталонной аминокислотной последовательности или ее подпоследовательности. Например, по меньшей мере, 7 из 10 аминокислот внутри окна сравнения идентичны выбранной эталонной аминокислотной последовательности. Часто такие аминокислотные последовательности, по меньшей мере, примерно на 70%, по меньшей мере, примерно на 75%, по меньшей мере, примерно на 80%, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 98%, по меньшей мере, примерно на 99% или, по меньшей мере, примерно на 99,5%, идентичны эталонной последовательности. Подпоследовательности аминокислотных последовательностей могут включать, по меньшей мере, примерно 5, по меньшей мере, примерно 10, по меньшей мере, примерно 15, по меньшей мере, примерно 20, по меньшей мере, примерно 25, по меньшей мере, примерно 50, по меньшей мере, примерно 75, по меньшей мере, примерно 100, по меньшей мере, примерно 500, примерно 1000 или более последовательно расположенных аминокислот. Консервативные варианты аминокислотных последовательностей или подпоследовательностей также возможны. Аминокислотные последовательности могут быть цитотоксическими, ферментативно активными, ферментативно неактивными, и тому подобное.
Когда полинуклеотидные последовательности транслируются с образованием полипептида или подпоследовательности полипептида, изменения нуклеотидов могут приводить либо к консервативным, либо к неконсервативным аминокислотным заменам. Консервативные аминокислотные замены касаются взаимозаменяемых остатков, имеющих функционально сходные боковые цепи. Таблицы консервативных замен, обеспечивающих функционально аналогичные аминокислоты, хорошо известны в данной области техники. В таблице 1 приведены примеры шести групп, содержащих аминокислоты, которые являются "консервативными заменами" по отношению друг к другу. Другие таблицы консервативных замен доступны в данной области техники и могут быть использованы аналогичным образом.
Специалист в данной области техники должен понимать, что многие консервативные замены приводят к функционально идентичным конструкциям. Например, как отмечалось выше, в связи с вырожденностью генетического кода "молчащие замены" (т.е. замены в полинуклеотидной последовательности, которые не приводят к изменению в кодируемом полипептиде) являются подразумеваемой особенностью каждой полинуклеотидной последовательности, которая кодирует аминокислоту. Аналогичным образом, "консервативные аминокислотные замены" одной или нескольких аминокислот в аминокислотной последовательности (например, примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10% или более) являются заменами на другие аминокислоты с очень похожими свойствами, они также легко идентифицируются как в высокой степени сходные с раскрываемой конструкцией. Такие консервативные варианты каждой раскрытой последовательности также входят в рамки настоящего изобретения.
Способы для получения консервативных вариантов, а также более расходящихся версий полинуклеотидных и аминокислотных последовательностей, широко известны в данной области техники. В дополнение к встречающимся в природе гомологам, которые могут быть получены, например, путем скрининга геномных или экспрессионных библиотек согласно любому из множества хорошо известных протоколов, смотри, например, Ausubel et al. Current Protocols in Molecular Biology (supplemented through 2004) John Wiley & Sons, New York ("Ausubel"); Sambrook et al. Molecular Cloning - A Laboratory Manual (2nd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989 ("Sambrook"), и Berger and Kirnmel Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif. ("Berger"), дополнительные варианты могут быть получены с помощью любого из множества методов мутагенеза. Многие такие методы известны в данной области техники, включая сайт-направленный мутагенез, олигонуклеотид-направленный мутагенез и многие другие. Например, сайт-направленный мутагенез описан в Smith (1985) "In vitro mutagenesis" Ann. Rev. Genet. 19: 423-462, и в ссылках в этой работе, Botstein & Shortle (1985) "Strategies and applications of in vitro mutagenesis" Science 229:1193-1201; и Carter (1986) "Site-directed mutagenesis" Biochem. J. 237:1-7. Олигонуклеотид-направленный мутагенез описан, например, в Zoller & Smith (1982) "Oligonucleotide-directed mutagenesis using M13-derived vectors: an efficient and general procedure for the production of point mutations in any DNA fragment" Nucleic Acids Res. 10:6487-6500. Мутагенез с использованием молифицированньгх оснований описан, например, в Kunkel (1985) "Rapid and efficient site-specific mutagenesis without phenotypic selection" Proc. Natl. Acad. Sci. USA 82:488-492, и Taylor et al. (1985) "The rapid generation of oligonucleotide-directed mutations at high frequency using phosphorothioate-modified DNA" Nucl. Acids Res. 13: 8765-8787. Мутагенез с использованием содержащей разрывы двуспиральной ДНК описан, например, в Kramer et al. (1984) "The gapped duplex DNA approach to oligonucleotide-directed mutation construction" Nucl. Acids Res. 12: 9441-9460. Мутагенез с точечными несовпадениями описан, например, в Kramer et al. (1984) "Point Mismatch Repair" Cell 38: 879-887. Мутагенез с разрывом двуспиральной ДНК описан, например, в Mandecki (1986) "Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis" Proc. Natl. Acad. Sci. USA, 83:7177-7181, и в Arnold (1993) "Protein engineering for unusual environments" Current Opinion in Biotechnology 4: 450-455. Мутагенез с использованием дефицитных в отношении репарации штаммов-хозяев описан, например, в Carter et al. (1985) "Improved oligonucleotide site-directed mutagenesis using M13 vectors" Nucl. Acids Res. 13: 4431-4443. Мутагенез путем полного синтеза гена описан, например, в Nambiar et al. (1984) "Total synthesis and cloning of a gene coding for the ribonuclease S protein" Science 223: 1299-1301. ДНК-шаффлинг (перетасовывание) описан, например, в Stemmer (1994) "Rapid evolution of a protein in vitro by DNA shuffling" Nature 370:389-391, и Stemmer (1994) "DNA shuffling by random fragmentation and reassembly: In vitro recombination for molecular evolution," Proc. Natl. Acad. Sci. USA 91:10747-10751.
Многие из вышеупомянутых методов более подробно описаны в Methods in Enzymology Volume 154, в котором также описаны полезные способы устранения проблем, возникающих при применении разных методов мутагенеза. Наборы для мутагенеза, библиотеки конструкций и другие способы создания разнообразия также являются коммерчески доступными. Например, наборы можно приобрести в Amersham International pic (Piscataway, N.J.) (например, для использования метода Eckstein, описанного выше), Bio/Can Scientific (Mississauga, Ontario, CANADA), Bio-Rad (Hercules, Calif.) (например, для использования метода Kunkel, описанного выше), Boehringer Mannheim Corp.(Ridgefield, Conn.), Clonetech Laboratories of BD Biosciences (Palo Alto, Calif.), DNA Technologies (Gaithersburg, Md.), Epicentre Technologies (Madison, Wis.) (например, набор 5 prime 3 prime); Genpak Inc. (Stony Brook, N.Y.), Lemargo Inc (Toronto, CANADA), Invitrogen Life Technologies (Carlsbad, Calif.), New England Biolabs (Beverly, Mass.), Pharmacia Biotech (Peapack, N.J.), Promega Corp.(Madison, Wis.), QBiogene (Carlsbad, Calif), и Stratagene (La Jolla, Calif.) (например, набор для сайт-направленного мутагенеза QuickChange™ и набор для сайт-направленного мутагенеза двуспиральной ДНК Chameleon™).
Определение взаимоотношений последовательностей
Сходство последовательностей может быть объективно оценено большим числом способов, например, определением процента идентичности, гибридизацией, иммунологически и тому подобное. Различные методы для определения взаимоотношений между двумя или более последовательностями (например, идентичности, подобия и/или гомологии) доступны и хорошо известны в данной области техники. Например, такие методы включают ручное выравнивание, компьютерное выравнивание последовательностей и их комбинации. Множество алгоритмов для выравнивания последовательностей (которое, как правило, выполняются компьютером) широко доступно, и выравнивание может быть выполнено специалистом. Эти методы включают, например, алгоритм локальной гомологии Смита и Ватермана (Smith and Waterman (1981) Adv. Appl. Math. 2: 482); алгоритм выравнивания по гомологии Ниддмана и Вунша (Needleman and Wunsch (1970) J. Mol. Biol. 48:443); метод поиска подобия Пирсона и Липмана (Pearson and Lipman (1988) Proc. Natl. Acad. Sci. (USA) 85:2444); и/или компьютеризированное применение этих алгоритмов (например, GAP, BESTFIT, FASTA, и TFASTA в Wisconsin Genetics Software Package Release 7.0, Genetics Computer Group, 575 Science Dr., Madison, Wis.).
Например, программное обеспечение для выполнения анализа идентичности последовательности (и подобия последовательности) с использованием алгоритма BLAST, описано в Altschul et al. (1990) J. Mol. Biol. 215:403-410. Это программное обеспечение является общедоступным, например, через National Center for Biotechnology Information no интернету по адресу ncbi.nlm.nih.gov. Этот алгоритм сначала идентифицирует пары последовательностей с высоким уровнем подобия (HSPs) путем идентификации коротких слов длиной W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому имеющему положительное значение пороговому баллу Т при выравнивании со словом той же длины в последовательности из базы данных. Т называют пороговым значением оценки соседних слов. Эти первоначально найденные соседние слова выступают в качестве затравки для начала поиска длинных HSPs, в состав которых они входят. Совпадения слов затем продлеваются в обоих направлениях вдоль каждой последовательности до тех пор, как совокупный балл выравнивания может возрастать. Совокупные баллы рассчитываются с использованием для нуклеотидных последовательностей параметров М (положительные баллы за пару совпадающих остатков; всегда >0) и N (отрицательные баллы за несовпадающие остатки; всегда <0). Для аминокислотных последовательностей для расчета общего числа баллов используется оценочная матрица. Расширение совпадения слов в каждом направлении останавливается, если: совокупная оценка выравнивания падает на величину X от его максимально достигнутого значения; общее число баллов стремится к нулю или ниже, вследствие накопления одного или более выравниваний остатков, имеющих отрицательный счет; или когда достигнут конец любой последовательности. Параметры алгоритма BLAST W, Т и X и определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует в качестве значений по умолчанию длину слова (W), равную 11, ожидание (Е), равное 10, отсечку, равную 100, М = 5, N = -4 и сравнение обеих нуклеотидных цепей. Для аминокислотных последовательностей, программа BLASTP (BLAST Protein) использует в качестве значения по умолчанию длину слова (W), равную 3, ожидание (Е), равное 10, и оценочную матрицу BLOSUM62 (смотри, Henikoff & Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915).
Кроме того, алгоритм BLAST выполняет статистический анализ подобия между двумя последовательностями (смотри, например, Karlin & Altschul (1993) Proc. Nat'l. Acad. Sci. USA 90:5873-5787). Одной мерой сходства, которую дает алгоритм BLAST, является наименьшая суммарная вероятность (p(N)), которая предоставляет значение вероятности, с которой совпадение между двумя нуклеотидными или аминокислотными последовательностями могло бы произойти случайно. Например, нуклеиновую кислоту считают аналогичной эталонной последовательности (и, следовательно, в данном контексте, гомологичной), если наименьшая суммарная вероятность при сравнении тестируемой нуклеиновой кислоты с эталонной нуклеиновой кислотой составляет меньше, чем примерно 0,1, или меньше, чем примерно 0,01, или даже меньше, чем примерно 0,001.
Другим примером алгоритма выравнивания последовательности является алгоритм PILEUP, который проводит множественное выравнивание последовательностей из группы родственных последовательностей с использованием прогрессивных попарных выравниваний. Он также может построить дерево, отображающее кластерные отношения, используемые для проведения выравнивания. PILEUP использует упрощение метода прогрессивного выравнивания Фенга и Дулиттла (Feng & Doolittle (1987) J. Mol. Evol. 35: 351-360). Используемый метод подобен методу, описанному Хиггинсом и Шарпом (Higgins & Sharp (1989) CABIOS5: 151-153). Данная программа может выровнять, например, до 300 последовательностей с максимальной длиной 5000 букв. Процедура множественного выравнивания начинается с попарного выравнивания двух наиболее сходных последовательностей и создания кластера из двух выровненных последовательностей. Этот кластер затем может быть выровнен со следующей наиболее родственной последовательностью или с кластером выровненных последовательностей. Два кластера последовательностей могут быть выровнены с помощью простого расширения попарного выравнивания двух отдельных последовательностей. Окончательное выравнивание достигается серией последовательных попарных выравниваний. Программа также может быть использована для построения дендрограммы или дерева, показывающего взаимоотношения кластеров. Программа работает путем определения специфических последовательностей и координат их аминокислот или нуклеотидов для областей сравнения последовательностей.
Дополнительным примером алгоритма, который пригоден для множественных выравниваний последовательностей ДНК или аминокислот, является программа CLUSTALW (Thompson, J.D. et al. (1994) Nucl. Acids. Res. 22: 4673-4680). CLUSTALW выполняет множественное попарное сравнение между группами последовательностей и выстраивает их во множественное выравнивание на основе гомологии. Gap open и Gap extension penalties могут быть равны, например, 10 и 0,05 соответственно. Для выравнивания аминокислотных последовательностей может быть использован алгоритм BLOSUM в качестве весовой матрицы белков. Смотри, например, Henikoff and Henikoff (1992) Proc. Natl. Acad. Sci. USA 89: 10915-10919.
Гибридизационное сходство полинуклеотидов может быть оценено также путем гибридизации между одноцепочечными нуклеиновыми кислотами (или их одноцепочечными участками) с комплементарными или частично комплементарными последовательностями полинуклеотидов. Гибридизация является мерой физической ассоциации между нуклеиновыми кислотами, как правило, в растворе, или с одной из цепей нуклеиновой кислоты, иммобилизованной на твердом носителе, например, на мембраны, шарике, чипе, фильтре и т.д. Гибридизация нуклеиновой кислоты обеспечивается рядом хорошо охарактеризованных физико-химических сил, таких как водородные связи, вытеснение растворителя, стекинг-взаимодействие оснований и тому подобное. Многочисленные протоколы для гибридизации нуклеиновых кислот хорошо известны в данной области техники. Подробное пособие по гибридизации нуклеиновых кислот можно найти в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, part I, chapter 2, "Overview of principles of hybridization and the strategy of nucleic acid probe assays," (Elsevier, N.Y.), а также в Ausubel et al. Current Protocols in Molecular Biology (supplemented through 2004) John Wiley & Sons, New York ("Ausubel"); Sambrook et al. Molecular Cloning - A Laboratory Manual (2nd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989 ("Sambrook") и Berger and Kimmel Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif. ("Berger"), Hames and Higgins (1995) Gene Probes 1, IRL Press at Oxford University Press, Oxford, England (Hames and Higgins 1) и Hames and Higgins (1995) Gene Probes 2, IRL Press at Oxford University Press, Oxford, England (Hames and Higgins 2) предоставляют детальную информацию о синтезе, мечении, детектировании и количественном определении ДНК и РНК, включая олигонуклеотиды.
Условия, подходящие для проведения гибридизации, в том числе дифференциальной гибридизации, между комплементарными и частично комплементарными нуклеиновыми кислотами выбирают в зависимости от теоретической температуры плавления (Tm). При определенном наборе условий, например, составе растворителя, ионной силе и т.д., Tm представляет собой температуру, при которой дуплекс между цепями гибридизуемой нуклеиновой кислоты денатурирует на 50%. То есть Tm является температурой, соответствующей средней точке при переходе из спирали в статистический клубок; для длинных нуклеотидных последовательностей она зависит от длины полинуклеотидов, нуклеотидного состава и ионной силы.
После гибридизации негибридизованные нуклеиновые кислоты могут быть удалены с помощью серии промывок, жесткость условий которых можно регулировать в зависимости от желаемых результатов. Промывки в условиях низкой жесткости (например, с использованием более высокой концентрации соли и более низкой температуры) увеличивают чувствительность, но могут давать неспецифические сигналы гибридизации и высокие фоновые сигналы. Более жесткие условия (например, с использованием более низких концентраций соли и более высокой температуры, которая ближе к T.sub.m) снижают фоновый сигнал, как правило, при этом сохраняется только специфический сигнал; смотри также Rapley, R. and Walker, J.M. eds., Molecular Biomethods Handbook (Humana Press, Inc. 1998).
"Жесткие условия промывки при гибридизации" или "жесткие условия" в контексте экспериментов по гибридизации нуклеиновых кислот, таких как Саузерн- и Нозерн-гибридизация, зависят от природы последовательности и различаются при разных параметрах окружающих условий. Исчерпывающее пособие по гибридизации нуклеиновых кислот можно найти в Tijssen (1993), supra, и в Hames and Higgins 1 и Hames and Higgins 2, supra.
Примером жестких условиях гибридизации для гибридизации на фильтре комплементарных нуклеиновых кислот, которые имеют более 100 комплементарных остатков, при Саузерн или Нозерн-блоттинге являются: 2×SSC, 50% формамид при 42°С, для гибридизации, которая проводится в течение ночи (например, в течение примерно 20 часов). Примером жестких условий отмывки является промывка 0,2×SSC при 65°С в течение 15 минут (состав буфера SSC смотри в Sambrook, supra). Часто отмывке при определенной жесткости предшествует отмывка при низкой жесткости для удаления сигнала, связанного с оставшимся негибридизированным зондом. Примером отмывки низкой жесткости является использование 2xSSC при комнатной температуре (например, при 20°С в течение 15 минут).
Обычно соотношение сигнал/шум составляет, по меньшей мере, 2,5× -5× (и, как правило, выше), чем это наблюдается для неродственного зонда в определенных условиях гибридизации и указывает на наличие специфической гибридизации. Обнаружение, по меньшей мере, жесткой гибридизации между двумя последовательностями указывает на относительно большое структурное сходство с последовательностями, которые представлены в приведенном здесь списке последовательностей.
Как правило, условия гибридизации "высокой жесткости" и условия отмывки выбираются так, чтобы температура была примерно на 5°С или меньше ниже точки плавления (Tm) для конкретной последовательности при определенных ионной силе и рН (как указано ниже, условия высокой жесткости могут также описываться в сравнительных терминах). Целевые последовательности, которые являются близкородственными или идентичными интересующей нуклеотидной последовательности (например, "зонд") могут быть идентифицированы при жестких или очень жестких условиях. Менее жесткие условия являются подходящими для последовательностей, которые являются в меньшей степени комплементарными.
Например, при определении условий жесткой или очень жесткой гибридизации (или даже более жесткой гибридизации) и отмывки, жесткость условий гибридизации и отмывки постепенно увеличивается (например, путем повышения температуры, снижения концентрации соли, увеличения концентрации детергента, и/или увеличения концентрации органических растворителей, таких как формамид, при гибридизации или отмывке) до тех пор, пока не будет достигнут желаемый набор критериев. Например, жесткость условий гибридизации и отмывки постепенно повышают до тех пор, пока зонд, включающий одну или более из имеющихся полинуклеотидных последовательностей или их субпоследовательностей, и/или их комплементарных полинуклеотидных последовательностей, связывается с идеально подходящей комплементарной мишенью с соотношением сигнал/шум, по меньшей мере 2,5×, и, необязательно, 5×, или 10× или 100× или больше, если это желательно, по сравнению с наблюдаемой гибридизацией зонда с неподходящей мишенью.
С использованием подпоследовательностей, происходящих из нуклеиновых кислот, перечисленных в перечне последовательностей, могут быть получены целевые нуклеиновые кислоты; такие целевые нуклеиновые кислоты также являются предметом настоящего изобретения. Например, такие целевые нуклеиновые кислоты включают последовательности, которые гибридизуются в жестких условиях с олигонуклеотидным зондом, который соответствует уникальной подпоследовательности любого из полинуклеотидов из перечня последовательностей, или ее комплементарной последовательности; зонд необязательно кодирует уникальную подпоследовательность, входящую в состав любой из аминокислотных последовательностей из перечня последовательностей.
Например, выбирают такие условия гибридизации, при которых целевой олигонуклеотид, который является идеально комплементарным олигонуклеотидному зонду, гибридизуется с зондом с соотношением сигнал/шум, по меньшей мере, примерно в 5-10× выше, чем при гибридизации целевого олигонуклеотида с отрицательным контролем, который представляет собой некомплементарную нуклеиновую кислоту. Более высокие соотношения сигнал/шум могут быть достигнуты путем увеличения жесткости условий гибридизации, так, что будет получено соотношение примерно 15×, 20×, 30×, 50× или больше. Конкретный сигнал будет зависеть от зонда, используемого в соответствующем исследовании, например, от типа флуоресцентного зонда, калориметрического зонда, радиоактивного зонда, или т.п.
Векторы, промоторы и системы экспрессии
Полинуклеотидные последовательности согласно настоящему изобретению могут представлять собой любую из разнообразных форм, например, экспрессионные кассеты, векторы, плазмиды, вирусные частицы или линейные последовательности нуклеиновых кислот.Например, векторы, плазмиды, космиды, бактериальные искусственные хромосомы (BACs), YACs (дрожжевые искусственные хромосомы), фаги, вирусы и сегменты нуклеиновых кислот, которые включают представленные последовательности нуклеиновых кислот или их подпоследовательности. Эти конструкции нуклеиновых кислот могут дополнительно включать промоторы, энхансеры, полилинкеры, регуляторные гены и т.д. Таким образом, настоящее изобретение также касается, например, векторов, содержащих полинуклеотиды, раскрываемые в настоящем изобретении, клеток-хозяев, которые включают эти векторы, и продукции различных раскрываемых полипептидов (включая таковые из перечня последовательностей) с помощью рекомбинантных методов.
В соответствии с этими аспектами, вектор может быть, например, плазмидным вектором, одноцепочечным или двухцепочечным фаговым вектором или вирусным вектором с одноцепочечной или двухцепочечной РНК или ДНК. Такие векторы могут быть введены в клетки в виде полинуклеотидов, предпочтительно ДНК, с помощью хорошо известных методов для введения ДНК и РНК в клетки. Векторы, в случае фаговых и вирусных векторов, также могут вводиться и предпочтительно вводятся в клетки в виде упакованного или инкапсулированного вируса с использованием хорошо известных методов инфицирования и трансдукции. Вирусные векторы могут быть компетентными или дефектными по репликации. В последнем случае, как правило, размножение вирусов будет происходить только в комплементирующих клетках-хозяевах.
В некоторых примерах векторы включают таковые, которые пригодны для экспрессии полинуклеотидов и полипептидов настоящего изобретения. Как правило, такие векторы содержат цис-действующие контрольные участки, нужные для экспрессии в хозяине, функционально связанные с полинуклеотидом, который необходимо экспрессировать. Пригодные транс-действующие факторы обеспечиваются хозяином, поставляются с помощью комплементирующего вектора или поставляться в составе самого вектора при введении в хозяина.
В этой связи в некоторых примерах векторы обеспечивают экспрессию белка. Такая предпочтительная экспрессия может быть индуцибельной экспрессией, экспрессией, ограниченной во времени, или экспрессией, осуществляемой преимущественно определенными типами клеток, или может быть любой комбинацией вышеперечисленного. Для некоторых воплощений индуцибельных векторов экспрессия может быть индуцирована факторами окружающей среды, которыми легко управлять, такими как температура и добавки питательных веществ. Множество векторов, пригодных для данного аспекта, включая конститутивные и индуцибельные векторы экспрессии для использования в прокариотических и эукариотических хозяевах, хорошо известны и обычно используются специалистами в данной области техники. Такие векторы включают, среди прочего, векторы, происходящие из хромосом, эписом и вирусов, например, векторы, полученные из бактериальных плазмид, из бактериофагов, из транспозонов, из дрожжевых эписом, из элементов вставок, из дрожжевых хромосомных элементов, из вирусов, таких как рабдовирусы, бакуловирусы, паловавирусы, таких как SV40, вирусы осповакцины, аденовирусы, вирусы оспы домашней птицы, вирусы псевдобешенства и ретровирусы, и векторы, полученные путем их комбинаций, такие как векторы, происходящие из плазмид и генетических элементов бактериофагов, таких как космиды и фагемиды, и бинарных элементов, используемых для трансформации, опосредованной Agrobacterium.
Векторы могут включать селектируемый маркер и ген-репортер. Для простоты получения достаточных количеств вектора, может быть использована бактериальная точка начала репликации, которая обеспечивает репликацию в E.coli. В качестве примера приведены следующие векторы, которые имеются в продаже. Среди векторов, предпочтительных для использования в бактериях, можно назвать: pQE70, pQE60 и pQE-9, доступные от Qiagen; векторы pBS, векторы Phagescript, векторы Bluescript, pNH8A, pNH16a, pNH18A, pNH46A, доступные от Stratagene; и ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5, доступные от Pharmacia. Среди предпочтительных эукариотических векторов можно назвать pWLNEO, pSV2CAT, pOG44, pXT1 и pSG, доступные от Stratagene; и pSVK3, pBPV, pMSG и pSVL, доступные от Pharmacia. Пригодные для растений бинарные векторы включают BIN 19 и его производные, доступные от Clontech. Эти векторы приведены исключительно в качестве иллюстрации многих коммерчески доступных и хорошо известных векторов, которые доступны специалистам в данной области техники. Следует иметь в виду, что любая другая плазмида или вектор, пригодные для, например, введения, поддержания, распространения или экспрессии одного или более полинуклеотидов и/или полипептидов, которые показаны в настоящем перечне последовательностей, включая их описанные варианты, может использоваться в клетке-хозяине.
Как правило, экспрессионные конструкции будут содержать сайты инициации транскрипции и терминации и, в транскрибируемой области, сайт связывания рибосы для осуществления трансляции, когда конструкция кодирует полипептид. Кодирующая часть зрелых транскриптов, экспрессируемых конструкциями, будет содержать кодон начала трансляции AUG в начале и кодон терминации, соответствующим образом расположенный в конце полипептида, который будет транслироваться. Кроме того, конструкции могут содержать контрольные участки, которые регулируют, а также начинают экспрессию. Как правило, в соответствии с многими обычно используемыми методами, такие участки будут работать, контролируя транскрипцию, как, например, факторы транскрипции, сайты связывания репрессора и сигналы терминации, и другие. Для секреции транслируемого белка в просвет эндоплазматического ретикулума, в периплазматическое пространство или во внеклеточную среду, в экспрессируемый полипептид могут быть включены соответствующие сигналы секреции. Эти сигналы могут быть эндогенными по отношению к полипептиду или они могут быть гетерологическими сигналами.
Эффективность транскрипции ДНК (например, кодирующей полипептиды) настоящего изобретения в высших эукариотах может быть усилена путем встраивания в вектор последовательности энхансера. Энхансеры представляют собой цис-действующие элементы ДНК, обычно имеющие размер примерно от 10 до 300 п.о., которые действуют, увеличивая транскрипционную активность промотора в данном типе клетки-хозяина. Примеры энхансеров включают энхансер SV40, который расположен в дальней области сайта инициации репликации на расстоянии от 100 до 270 п.о., энхансер раннего промотора цитомегаловируса, энхансер полиомы в дальней области сайта инициации репликации, и энхансеры аденовирусов. Дополнительные энхансеры, пригодные в настоящем изобретении для увеличения транскрипции введенного сегмента ДНК, включают, в частности, вирусные энхансеры, подобные имеющимся в промоторе 35S, как показано в Odell et al., Plant Mol. Biol. 10:263-72 (1988), и энхансер из гена опина, как описано в Fromm et al., Plant Cell 1:977 (1989). Энхансер может изменять тканевую специфичность и/или временную специфичность экспрессии последовательностей, включенных в вектор.
Участки терминации также облегчают эффективную экспрессию, обеспечивая завершение транскрипции в соответствующих точках. Пригодные терминаторы включают, но ими не ограничиваются, pinII (смотри An et al., Plant Cell 1(1): 115-122 (1989)), glb1 (смотри Genbank Accession #L22345), gz (see gzw64a terminator, Genbank Accession #S78780), и терминатор nos из Agrobacterium. Участок терминации транскрипции может быть нативным по отношению к нуклеотидной последовательности промотора, может быть нативным по отношению к представляющей интерес последовательности ДНК или может быть получен из другого источника. Например, другие удобные участки терминации доступны из Ti-плазмиды A. tumefaciens, такие как участки терминации октопинсинтазы и нопалинсинтазы. Смотри также: Guerineau et al. (1991) Mol. Gen. Genet. 262:141-144; Proudfoot (1991) Cell 64:671-674; Sanfacon et al. (1991) Genes Dev. 5:141-149; Mogen et al. (1990) Plant Cell 2:1261-1272; Munroe et al. (1990) Gene 91:151-158; Ballas et al. (1989) Nucleic Acids Res. 17:7891-7903; и Joshi et al. (1987) Nucleic Acid Res. 15:9627-9639.
Среди известных эукариотических промоторов, пригодных для универсальной экспрессии, можно назвать немедленный ранний промотор CMV, промотор тимидинкиназы HSV, ранние и поздние промоторы SV40, промоторы ретровирусных LTRs, такие, как промотор вируса саркомы Рауса ("RSV"), промоторы металлотионеинов, такие как промотор металлотионеина-I мыши, и различные промоторы растений, такие как промотор глобулина-1. Также могут быть использованы нативные промоторы полинуклеотидных последовательностей, которые показаны в перечне последовательностей. Представители прокариотических промоторов включают промотор PL фага лямбда, промоторы lac, trp и tac E.coli, которые можно назвать только в качестве некоторых из хорошо известных промоторов.
В состав настоящего изобретения также входят изолированные или рекомбинантные вирусы, инфицированные вирусом клетки, или клетки, включающие один или более участков из представленных полинуклеотидных последовательностей и/или экспрессирующие один или более участков из представленных аминокислотных последовательностей.
Полинуклеотид, необязательно кодирующий гетерологическую структурную последовательность раскрываемой здесь аминокислотной последовательности, как правило, будет вставлен в вектор с использованием стандартных методов таким образом, чтобы он был функционально связан с промотором, обеспечивающим экспрессию. Термин «функционально связанный» в используемом здесь значении включает указание на функциональную связь между промотором и второй последовательностью, где последовательность промотора инициирует и опосредует транскрипцию ДНК, соответствующую второй последовательности. Как правило, функционально связанный означает, что последовательность полинуклеотида является непрерывной и, в случае необходимости, объединяет две кодирующие белок смежные последовательности в одной и той же рамке считывания. Когда полинуклеотид предназначен для экспрессии полипептида, полинуклеотид будет устроен таким образом, чтобы участок начала транскрипции был расположен надлежащим образом в 5'-положении по отношению к участку связывания рибосомы. Участок связывания рибосомы будет расположен в 5'-положении по отношению к стартовому кодону AUG, который инициирует трансляцию полипептида, который должен быть экспрессирован. Как правило, такая конструкция не содержит никаких других открытых рамок считывания, которые начинаются с инициирующего кодона, как правило, AUG, и находятся между участком связывания рибосомы и инициирующим кодовом. Кроме того, в конструкциях для использования в эукариотических хозяевах обычно в конце транслируемого полипептида будет расположен стоп-кодон, терминирующий трансляцию, и будет находиться сигнал полиаденилирования. В полинуклеотидную конструкцию также могут быть включены сигналы терминации транскрипции, соответствующим образом расположенные на 3'-конце транскрибируемой области.
Для конструкций нуклеиновых кислот, предназначенных для экспрессии полипептида, кассеты экспрессии могут дополнительно содержать 5'-лидерные последовательности. Такие лидерные последовательности могут действовать как усилители трансляции. Лидерные последовательности трансляции известны в данной области техники и включают: лидерные последовательности пикорнавирусов, например: лидерную последовательность EMCV (5'-некодирующий участок вируса энцефаломиокардита), Elroy-Stein et al. (1989) Proc. Nat. Acad. Sci. USA 86:6126-6130; лидерные последовательности потивирусов, например, лидерную последовательность TEV (вируса гравировки табака), Allison et al. (1986); лидерную последовательность MDMV (вируса карликовой мозаики кукурузы), Virology 154:9-20; белка, связывающего тяжелые цепи иммуноглобулинов человека (BiP), Macejak et al. (1991) Nature 353:90-94; нетранслируемую лидерную последовательность из мРНК белка оболочки вируса альфа-мозаики (AMV RNA 4), Jobling et al. (1987) Nature 325:622-625); лидерную последовательность вируса табачной мозаики (TMV), Gallie et al. (1989) Molecular Biology of RNA, pages 237-256; и лидерную последовательность вируса пятнистого хлороза кукурузы (MCMV) Lornmel et al. (1991) Virology 81:382-385. Смотри также Della-Cioppa et al. (1987) Plant Physiology 84:965-968. Кассета может также содержать последовательности, которые усиливают трансляцию и/или повышают стабильность мРНК, такие как интроны. Кассета экспрессии может также включать участок терминации трансляции, находящийся на 3'-конце изолированной целевой нуклеотидной последовательности.
В тех случаях, когда желательно иметь экспрессированньш продукт полинуклеотидной последовательности, направляющийся в конкретную органеллу или секретируемый на поверхности клетки, кассета экспрессии может дополнительно содержать последовательность, кодирующую транзитный (адресующий) пептид. Такие транзитные пептиды хорошо известны в данной области техники и включают, но ими не ограничиваются: транзитный пептид для белка-переносчика ацильных групп, малой субъединицы RUBISCO, EPSP-синтазы растений, и тому подобное.
При создании кассеты экспрессии различные фрагменты ДНК можно расположить таким образом, чтобы обеспечить правильную ориентацию полинуклеотидных последовательностей и, в соответствующих случаях, в подходящей рамке считывания. Для этой цели могут быть использованы адаптеры или линкеры, чтобы соединить фрагменты ДНК, или могут быть проведены другие манипуляции, чтобы обеспечить удобные сайты для рестрикции, удаление избыточной ДНК, удаление сайтов рестрикции или тому подобное. Для этой цели могут применяться in vitro мутагенез, восстановление праймеров, обработка рестриктазами, отжиг и повторные замены, такие как перестройки и трансверсии.
Введение конструкции в клетку-хозяина может быть осуществлено путем трансфекции с использованием фосфата кальция, трансфекции, опосредованной DEAE-декстраном, микроинъекции, трансфекции, опосредованной катионными липидами, электропорации, трансдукции, введением при соскабливании, баллистическим введением, инфицированием или другими методами. Такие методы описаны во многих стандартных лабораторных руководствах, таких Davis et al., Basic Methods in Molecular Biology, (1986) и Sambrook et al., Molecular Cloning - A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989).
Характерные примеры подходящих хозяев включают бактериальные клетки, такие как клетки стрептококков, стафилококков, Е. coli, Streptomyces и Salmonella typhimurium; клетки грибов, такие как клетки дрожжей и клетки Aspergillus; клетки насекомых, такие как клетки Drosophila S2 и Spodoptera Sf9; клетки животных, такие как СНО, COS и клетки меланомы Боуэса; и клетки растений.
Клетки-хозяева могут культивироваться в обычных питательных средах, которые могут быть изменены как это необходимо, в частности, для активации промоторов, отбора трансформантов или амплификации генов. Условия культивирования, такие как температура, рН и т.п., которые ранее использовались для клеток-хозяев, выбранных для экспрессии, как правило, будут пригодны для экспрессии нуклеиновых кислот и/или полипептидов, что будет очевидно специалистам в данной области техники. Зрелые белки могут быть экспрессированы в клетках млекопитающих, дрожжей, бактерий или в других клетках под контролем соответствующих промоторов. Для получения таких белков с использованием РНК, полученных из раскрываемых здесь полинуклеотидов, могут также использоваться бесклеточные системы трансляции.
После трансформации подходящего штамма-хозяина и выращивания штамма-хозяина до подходящей плотности клеток, где выбранный промотор является индуцибельным и он индуцируется с помощью соответствующих способов (например, сдвигом температуры или воздействием химического индуктора), клетки культивируются в течение дополнительного периода времени. Как правило, клетки затем собирают центрифугированием, разрушают физическими или химическими способами, и полученный неочищенный экстракт сохраняют для дальнейшей очистки. Клетки микробов, используемые для экспрессии белков, могут быть разрушены любым обычным способом, в том числе, замораживанием-оттаиванием, обработкой ультразвуком, механическим разрушением или с использованием агентов, лизирующих клеток; такие способы хорошо известны специалистам в данной области техники.
Композиции и способы настоящего изобретения могут включать введение полинуклеотидов и/или аминокислот, как здесь представлено. Например, лечение глиобластомы может включать введение одного или более полинуклеотидов и/или аминокислот. Один или более полинуклеотидов и/или аминокислот могут применяться в изолированной форме или входить в состав композиции, включая вирусную частицу. В различных воплощениях введение может принимать следующие формы: внутрикожное, трансдермальное, парентеральное, внутрисосудистое, внутривенное, внутримышечное, интраназальное, подкожное, региональное, чрескожное, внутритрахиальное, внутрибрюшинное, внутриартериальное, внутрипузырное, внутриопухолевое, в виде ингаляции, орошения, перфузии, прямой инъекции, алиментарное, пероральное или внутричерепное введение.
ПРИМЕРЫ
Пример 1. Идентификация не нейротоксических рабдовирусов и in vitro цитотоксичность
Для определения in vivo нейротоксичности группы самок мышей BALB/c (n = 3/группу) возрастом 6-8 недель получали однократную внутричерепную (IC) инъекцию указанных вирусов в дозе 107 БОЕ. После внутричерепной инъекции мышей ежедневно проверяли на появление признаков заболевания, включая потерю веса, пилоэрекцию, паралич задних конечностей и респираторный дистресс-синдром.
Фигура 1 показывает выживание мышей BALB/C после однократного внутричерепного введения указанного вируса (107 БОЕ). Животные, которым вводили посредством внутричерепной инъекции вирус VSV, вирус Мараба (MR) или вирус Carajas (CRJ), выживали менее чем 10 дней, а контрольные животные (PBS), и все другие животные, которым вводили путем внутричерепной инъекции вирусы Farmington (FMT), Bahia Grande (BG) и Muir Springs (MS), продемонстрировали 100% выживаемость в течение 30 дней после внутричерепной инъекции, что указывает на их ненейротоксичный потенциал. Было проведено сравнение графиков выживания в координатах Каплана-Мейера с использованием логарифмического рангового критерия Мантеля-Кокса (Graphpad Prism).
В дополнение к исследованию онколитического потенциала вирусов FMT, BG и MS дикого типа, авторы настоящего изобретения предположили, что создание химерных вирусов из вируса Мараба (MRB) и не нейротоксичного вируса (например, BG) в результате приведет к созданию вируса с обоими желаемыми свойствами. Гликопротеин из BG был перенесен в MRB, что привело к созданию химерного вируса Мараба с гликопротеином BG, называемого "Мараба BGG", или "MRBGG", или "MRB-BG(G) или его вариаций, включая последовательность РНК, которая представляет собой обратньш комплемент SEQ ID NO: 10. Рабдовирусы, такие как вирус Мараба, несут свой генетический материал в виде несмысловой одноцепочечной РНК. Раскрываемые здесь последовательности РНК соответствуют цепям РНК, которые кодируют вирусный генетический материал и представляют собой, следовательно, обратньш комплемент генетической РНК, которая переносится рабдовирусами.
Геном вирусной частицы Мараба MGG содержит открытые рамки считывания, которые кодируют белки N, Р и L Мараба; а также белок М Мараба; и белок G Bahia Grande. Белок N Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 1. Белок Р Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 2. Белок L Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 3. Белок М Мараба имеет последовательность, которая соответствует последовательности SEQ ГО NO: 4. Белок G Bahia Grande имеет последовательность, которая соответствует последовательности SEQ ID NO: 6.
Другой химерный вирус был получен путем замены гликопротеина G MRB на гликопротеин Эбола, на этот раз в более ослабленном векторе Мараба (Δ51MRB), чтобы создать химерный вирус, названный "Мараба EbG" или "EbG" или их вариации, включая последовательность РНК, которая является обратным комплементом SEQ ID NO: 14 (смотри Фигуру 2А). Геном вирусной частицы Мараба EbG содержит открытые рамки считывания, которые кодируют белки N, Р и L Мараба; а также белок А51М Мараба и белок G Эбола. Белок N Мараба имеет последовательность, которая соответствует последовательности SEQ ГО NO: 1. Белок Р Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 2. Белок L Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 3. Белок Δ51М Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 5. Белок G Эбола имеет последовательность, которая соответствует последовательности SEQ ID NO: 8.
Авторы настоящего изобретения предположили, что вариант Мараба EbG мог бы увеличить терапевтическое окно для химерного вируса в реплицирующихся онколитических рабдовирусах (фигура 2А), поскольку ранее было показано, что лентивирусный вектор, псевдотипированный с гликопротеином Эбола-Заир, не давал вирусной трансдукции ЦНС мыши, сохраняя способность к трансдукции линии раковых клеток 293Т (смотри Watson, D.J., Kobinger, G.P., Passini, М.А., Wilson, J.M. & Wolfe, J.H. Targeted transduction patterns in the mouse brain by lentivirus vectors pseudotyped with VSV, Ebola, Mokola, LCMV, or MuLV envelope proteins. Mol Ther 5, 528-537 (2002); и Watson, D.J., Passini, M.A. & Wolfe, J.H. Transduction of the choroid plexus and ependyma in neonatal mouse brain by vesicular stomatitis virus glycoprotein-pseudotyped lentivirus and adeno-associated virus type 5 vectors. Hum Gene Ther 16,49-56 (2005)).
Чтобы проверить способность этих химерных вирусов убивать клетки в сравнении с изолятами дикого типа, проводили исследование гибели клеток на 2 нормальных диплоидных клеточных линях человека: первичных нормальных астроцитах (NHA) человека и первичных фибробластах (GM38) (Фигуры 2В и 2С) и на панели из 8 клеточных линий опухолей ЦНС SF268, SNB19, U118, U343, SF295, SNB75, SF539 и U373 (Фигуры от 2D до 2К).
Клетки были получены из National Institute of General Medical Sciense Mutant Cell Repository, Camden, NJ, и выращивались в среде Дульбекко в модификации Игла (Hyclone, Logan, UT), дополненной 10% фетальной телячьей сывороткой (Cansera, Etobicoke, Ontario, Canada). Анализ жизнеспособности с использованием указанных клеточных линий проводили следующим образом: Клетки высевали при плотности 10000 клеток/лунку в 96-луночные планшеты и на следующий день инфицировали либо: вирусом Мараба дикого типа, вирусом FMT дикого типа, вирусом BG дикого типа, ослабленным вирусом Мараба, химерами Мараба EBG или Мараба BGG в различных инфекционных дозах (0,0001-107 БОЕ/лунку).
После 48-часовой инкубации был добавлен Alamar Blue (натриевая соль ресазурина (Sigma-Aldrich)) до конечной концентрации 20 мкг/мл. После 6 часов инкубации измеряли поглощение при длине волны 573 нм. В то время как Мараба дикого типа очень мощно действовал в отношении всех клеточных линий GBM, он также показывал сильную литическую активность и в отношении NHA и GM38. В противоположность этому, Мараба EBG и BG дикого типа продемонстрировали селективное действие в отношении уничтожения опухолевых клеточных линий в тех инфекционных дозах (107 БОЕ), которые были безвредны для нормальных клеток (NHA и GM38). Химерный вирус "MRBGG" продемонстрировал более высокую эффективность, чем Мараба EBG или BG дикого типа, против большинства клеточных линий GBM, оставаясь практически безопасным в отношении нормальных фибробластов. FMT дикого типа продемонстрировал самый большой терапевтический индекс, по силе действия соперничая с MRB в отношении большинства линий GBM, оставаясь при этом сильно ослабленным в отношении первичных клеточных линий NHA и GM38. Это свидетельствует о том, что FMT дикого типа и генно-инженерные вирусы Мараба, являющиеся химерами и содержащие гликопротеины из BG или Эбола, обладают мощным и селективным онколитическим действием при испытании в отношении линий раковых клеток головного мозга.
Пример 2. In vivo безопасность двух химер вируса Мараба
Изоляты дикого типа (FMT, BG и MS) и два химерных вируса (EBG и MRBGG), которые продемонстрировали ослабление в нетрансформированных клетках in vitro (смотри Пример 1), были протестированы для выяснения, сохраняется ли наблюдаемое ослабление и безопасность in vivo. Животным в мозг были введены две дозы: низкая (103 БОЕ) и высокая (107 БОЕ) дозы этих вирусов (фигура 3А).
Было установлено, что все 5 вирусов были безопасными, с 100% выживанием животных без признаков инфекции в течение 100 дней после введения вирусов. При введении этих доз животные демонстрировали временную потерю веса и пилоэрекцию, что согласуется с вирусной инфекцией, но эти симптомы проходили в течение 5-7 дней после инокуляции. В противоположность этому, все животные, получившие с помощью внутричерепного введения такие же дозы вируса Мараба дикого типа или ослабленного Мараба и штаммов VSV заболели в течение недели (фигура 3А). Эти животные проявляли клинические признаки инфекции ЦНС с быстрой и прогрессирующей потерей веса, параличом задних конечностей и имели значительные титры вируса в мозге непосредственно перед смертью (данные не показаны).
Вирусные титры определяли по количеству бляшек в мозге животных через 3 месяца после введения FMT дикого типа (внутричерепное и внутривенное введение) и химерных вирусов Мараба (EBG и MRBGG). Анализ бляшек проводили с клетками Vero, которые высевали при плотности клеток на 5×105/лунку в 6-луночный планшет. На следующий день к клеткам Vero добавляли по 100 мкл серийных разведений вируса на 1 час. После адсорбции вируса, добавляли 2 мл агарозы (1:1 1% агароза: 2×DMEM и 20% фетальной сыворотки теленка) и на следующий день подсчитывали бляшки. Вирус не был обнаружен в мозге животных через 3 месяца после внутричерепного инфицирования (фигура 3В).
Кроме того, после введения высоких доз FMT (107 БОЕ) и MRBGG (107 БОЕ) в головном мозге не было обнаружено никаких признаков гибели клеток или воспалительных реакций, что было сравнимо контрольными мышами, которым вводили солевой раствор (Фигура 3С). Это резко отличается от животных, инфицированных MRB дикого типа, которые показали резкое увеличение количества воспалительных клеток, конденсированные ядра и перфорированную морфологию.
Хотя не было обнаружено острой нейротоксичности при внутричерепном введении FMT, BG или MS, в течение нескольких дней после заражения вирусом проводилась оценка их когнитивной и моторной функции. Двигательная функция была оценена до и после введения этих 3 вирусов дикого типа (фигура 3D). Моторная функция/поведение мышей Balb/C оценивалась в аппарате с вращающимся стержнем до внутричерепного введения вируса. Мышей помещали в аппарат 3 раза в день в течение 4 последовательных дней. После того, как животные в течение 0,5 минут привыкали к аппарату, стержень начинал вращаться с ускорением на 0,1 об/секунду. Время до падения животного измерялось в минутах, и животные были разделены на группы, включающие по 3 мыши. Моторную функцию оценивали через одну неделю после инъекции у (неинфицированных) мышей и у животных, которым была сделана внутричерепная инъекция PBS (фосфатного буферного раствора), и вирусов FMT, Мараба EbG, BG, MRBGG и MS. Рассчитывали стандартную ошибку среднего арифметического. Не было обнаружено достоверной разницы во времени до падения между ложно-инфицированными животными или животными, инфицированными вирусом, при измерении за 1 неделю до и через 1 неделю после инъекции (фигура 3D).
В дополнение к внутричерепной токсичности, токсичность FMT и MRBGG оценивали, используя иммунокомпетентных мышей, при внутривенном введении им возрастающей дозы вируса (фигура 3Е). Мыши переносят MRBGG до дозы 3×108 БОЕ, что демонстрирует безопасность внутривенного введения, которое на порядок безопаснее, чем опубликованные данные для Мараба дикого типа. FMT хорошо переносился при внутривенном введении и даже никогда не достигал LD50 при использовании в данном исследовании самой высокой дозы 3×109 БОЕ, что сопоставимо с ослабленной версией Мараба, как описано ранее (Brun, J. et al. Identification of Genetically Modified Maraba Virus as an Oncolytic Rhabdovirus. Mol Ther 18, 1440 (2010). Животные, которым внутривенно вводили FMT в дозах более 3×108 БОЕ, демонстрировали временную потерю веса и умеренную пилоэрекцию, которые проходили через 5-7 дней после введения (данные не показаны).
Пример 3. Эффективность in vivo химер вируса Мараба
Эффективность in vivo химерных вирусов Мараба также определяли в моделях глиобластомы мыши. Чувствительность линии клеток глиобластомы человека U87MG к вирусной инфекции была определена in vitro. FMT и Мараба дикого типа были одинаково сильнодействующими в отношении уничтожения клеток U87MG со значение ЕС50 менее 0,001 множественности заражения (multiplicities of infection, MOI) (данные не показаны). Химеры вируса Мараба (Мараба EbG, Мараба BGG) и BG дикого типа также мощно убивали клетки U87MG in vitro со значением ЕС50 менее 0,1 множественности заражения (данные не показаны).
После адаптирования клеток глиомы человека U87MG для проведения биолюминесцентного анализа, была создана модель внутримозговой глиомы U87MG у безтимусных мышей и в этой модели была проведена оценка эффективности химер вируса Мараба в соответствии с настоящим изобретением при внутривенном введении (Фигура 4А-С). В модели ксенотрансплантата глиобластомы человека, клетки глиобластомы U87MG были адаптированы для визуализации биолюминесценции с помощью трансдукции лентивирусом, содержащим люциферазу светлячка (FLUC) и, соответственно, трансфицированы плазмидой FLUC. Клетки U87MG FLUC вводили в головной мозг CD1 безтимусным мышам. У не получавших лечение CD-I животных опухоли развиваются примерно на 15-21 день.
Животных с экспрессирующими FLUC опухолями для оценки развития опухоли наблюдали с использованием системы прижизненного наблюдения Live Imaging IVIS Xenogen 200 system после внутрибрюшинной инъекции люциферина (Gold Biotechnology Inc). Животных также проверяли на наличие признаков дистресса, включая выживание, потерю веса, осложнения, пилоэрекцию, паралич задних конечностей и респираторный дистресс. Значительное уменьшение размера опухоли наблюдалось уже через три дня после первого лечения с максимальным эффектом, проявляющимся на 7-й день (фигуры 4А и В). Однако начиная с 14 дня опухоли начинали расти. Также наблюдалась задержка во времени наступления смерти после внутривенного введения химер вируса Мараба (фигура 4С). Интересно отметить, что в этой модели у всех животных с опухолями, получавших лечение химерами вируса Мараба, полностью исчезали метастазы в спинном мозге. В противоположность этому, у животных, получавших инактивированный ультрафиолетом вирус, на 7 день наблюдалось значительное увеличение опухоли, после чего животные начинали демонстрировать неврологические симптомы, связанные с опухолью в их головном мозге. Все получавшие внутривенное лечение животные демонстрировали признаки улучшения, а 3 мыши из 8 полностью выздоровели и жили после лечения более 100 дней.
Пример 4. Исследование других химер вируса Мараба
Вирус везикулярного стоматита (VSV) является сильнодействующим онколитическим рабдовирусом. Однако проблемами, связанными с лечением VSV, являются его нейротропизм с последующей нейровирулентностью, а также сильный ответ в виде нейтрализующих антител (nAb). Присущая данному вирусу нейротоксичность затрудняет его рассмотрение в качестве клинического кандидата.
Предполагается, что присущая данному вирусу нейротоксичность опосредована его гликопротеином (VSV-G). Однако у лентивирусных векторов, которые, как правило, используют VSV-G, нейротоксичность была ослаблена с помощью псевдотипирования с G белком вируса лимфоцитарного хориоменингита (LCMV-G) (Beyer et al., J Virol 76:1488-1495, 2002; и U.S. Patent Publication No. 2011/0250188, выданный Von Laer). LCMV является прототипным членом семейства аренавирусов, несущих несмысловую РНК оболочечных вирусов. Авторы настоящего изобретения предположили, что нейротоксичность вируса Мараба может быть ослаблена путем замены его гликопротеина (белок G Мараба) на G белок LCMV. Химерный вирус Мараба, содержащий G белок LCMV, был получен путем замены G гликопротеина MRB на гликопротеин LCMV, с получением химерного вируса, получившего название "Мараба LCMV-G" или "Мараба LCMV(G)", включая последовательность РНК, которая представляет собой обратный комплемент SEQ ID NO: 12 (смотри Фигуру 2А).
Геном вирусной частицы Мараба LCMV-G содержит открытые рамки считывания, которые кодируют белки N, Р, и L Мараба; а также белок М Мараба; и G белок LCMV. Белок N Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 1. Белок Р Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 2. Белок L Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 3. Белок М Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 4. Белок G LCMV имеет последовательность, которая соответствует последовательности SEQ ГО NO: 7.
Создание и сохранение химерных вирусов Мараба осуществляли следующим образом: Плазмида, кодирующая рекомбинантный вирусный геном Мараба дикого типа (Bran et al., 2010) был модифицирован стандартными методами клонирования ДНК так, чтобы последовательность гликопротеина Мараба была заменена на последовательности гликопротеина из вируса Bahia Grande, вируса лейкоцитарного хориоменингита (LCMV) или вируса Farmington. Кратко, сайт рестрикции NotI был введен с помощью мутагенеза на основе ГЩР непосредственно после стоп-кодона в последовательности Мараба G. Используя этот вновь введенный сайт NotI и существующий KpnI-сайт между последовательностями белков М и G, последовательность, кодирующую белок G Мараба, удаляли с помощью расщепления рестриктазами и получали плазмиду pMRB(-G)-KpnI/NotI. Были созданы праймеры для амплификации последовательностей, кодирующих гликопротеины вирусов Farmington и Bahia Grande, чтобы ввести в них сайты рестрикции 5' KpnI и 3' NotI. Эти последовательности амплифицировали с помощью ГЩР и лигировали в TpMRB(-G)-KpnI/NotI. Была синтезирована последовательность предшественника гликопротеина LCMV (GenBank, EF 164923.1) с введенными сайтами 5' KpnI и 3' NotI (Integrated DNA Technologies, Coralville, LA). Этот фрагмент ДНК литировали в вышеописанный pMKB(-G)-KpnI/NotI, в результате чего были получены pMRB-LCMV-G, pMRB-BG-G и pMRB-FMT-G.
Кроме того, был изменен рекомбинантный геном вируса Farmington путем замены гликопротеина вируса Farmington дикого типа на гликопротеин Мараба, как описано в заявке на Патент No. РСТ/СА2012/050385, и аналогичным образом были созданы варианты гликопротеина Мараба, описанные выше.
Рекомбинантные вирусные частицы Мараба [MRBGG, MRB FMTG, MRB LCMVG] были получены с использованием методов, описанных ранее (Brun et al., 2010) из модифицированных геномных плазмид Мараба, описанных выше. Вкратце, клетки А549 были инфицированы при MOI 10 экспрессирующим Т7 РНК-полимеразу вирусом осповакцины в течение 1,5 часов. Затем клетки трансфицировали липофектамином 2000 с вышеописанными модифицированными рекомбинантными геномными плазмидами Мараба вместе с конструкциями pCI-Neo, кодирующими белки N, Р и L Мараба. Через сорок восемь часов после трансфекции среду удаляли, фильтровали через фильтр с порами 0,2 мкм и фильтрат использовали для инфицирования клеток SNB19. В успешных случаях выживания цитопатический эффект наблюдался через сорок восемь часов, а затем вирус три раза очищался из бляшек на клетках Vero. Вирус FMT-MRB-G был создан таким же образом, как описано выше за исключением того, что начальная трансфекция содержала конструкции pFMT-MRB-G и PCI-Neo, кодирующие белки N, Р и L Farrnington.
Рекомбинантные вирусы прошли три раунда очистки бляшек (на клетках SNB19), затем наращивались, очищались на сахарозной подушке и ресуспендировались в фосфатном буфере, содержащем 15% глюкозы.
Относительная цитотоксичность различных вирусов была определена на панели клеток глиобластомы (астроцитомы) человека (U87MG, SF268, U118, U373, U343, SNB19, 2 образца клеток первичной глиобластомы, полученные от пациентов). Указанные клеточные линии высевали в 96-луночные планшеты (104 клеток/лунку). На следующий день клетки инфицировали указанными вирусами: BG дикого типа, FMT дикого типа, VSV LCMVG ("VSV (LCMV G)"), MRB BGG ("MRB (BGG)") или MRB LCMVG ("MRB (LCMV G)") в различных дозировках (MOI 0,0001-107 БОЕ/лунку). После 96-часовой инкубации был добавлен Alamar Blue (натриевая соль ресазурина (Sigma-Aldrich)) в конечной концентрации 20 мкг/мл. После 6 часов инкубации измеряли поглощение при длине волны 573 нм. На графике откладывали метаболическую жизнеспособность клеток и определяли значение множественности заражения (MOI) для ЕС50; полученные данные ранжировали по следующим диапазонам: 1 = MOI <0,01; 2 = MOI <0,1; 3 = MOI <1; 4 = MOI <10; 5 = MOI >10; 6 = устойчивый. Для каждого вируса рассчитывали среднее значение ЕС50 для всех 8 линий глиомы (Фигура 5). Химера MRB-LCMVG имела наименьшее значение ЕС50 (и, следовательно, самую высокую эффективность в плане онколитической активности против клеточных линий рака головного мозга) по сравнению с химерами MRBBG и VSV-LCMVG или не нейротоксичными вирусами дикого типа BG hFMT.
Пример 5. Безопасность in vivo других химер рабдовирусов
Для определения in vivo нейротоксичности: группы самок мышей BALB//c (n = от 2 до 10/на группу) возрастом 6-8 недель получали однократную внутричерепную инъекцию указанных вирусов в дозе 107 БОЕ. После введения общего анестетика (изофлуран), мышей готовили к операции: брили голову, применяя в качестве дезинфицирующего средства для кожи головы хлоргексидин, обрабатывали глаза мазью с антибиотиком и вводили местный анестетик в уши. Мышей помещали в стереотаксический аппарат и иммобилизовали с помощью ушных фиксаторов. Скальпелем делали надрез размером 0,5 см вниз по средней линии головы, чтобы обнажить верхнюю часть черепа. Используя одноразовую иглу 23 G, на правой стороне черепа делали отверстие на расстоянии примерно 0,5 мм над венечным швом и на расстоянии 2 мм от стреловидного шва. В стеклянный шприц фирмы Гамильтон объемом 10 мкл набирали раствор вируса в фосфатном буфере (PBS) и устанавливали его в стереотаксический аппарат. Иглу вводили на глубину 4 мм и через 30 секунд выдвигали на 0,5 мм. Затем в мозг вводили вирус (доза 107 БОЕ) со скоростью 5 мкл/минуту. Ждали 30 секунд, вынимали иглу, отверстие в черепе заклеивали ветеринарным клеем, и оставляли животных для восстановления от общей анестезии в инкубаторе для новорожденных. Мыши вводили обезболивающее (бупренорфин) в течение 72 часов после операции, в это время определяли массу тела и оценивали состояние здоровья каждые 12 часов.
Фигура 6А показывает графики выживания в координатах Каплана-Мейера мышей BALB/c после однократного внутричерепного введения указанного вируса (107 БОЕ). Графики выживания сравнивали с использованием логарифмического рангового критерия Мантеля-Кокса (Graphpad Prism). Животные, получившие внутричерепные инъекции вируса Мараба дикого типа (MRB-WT) или химерного вируса Farmington, содержащего белок G Мараба (FMT-MRB(G)) погибали менее чем за 10 дней, тогда как животные, которым вводили в мозг вирус Farmington дикого типа (FMT-WT), Мараба LCMV-G и Мараба BGG, показали 100% выживаемости через 30 дней после внутричерепной инъекции вируса, что говорит об отсутствии у них нейротоксического потенциала. Химерный вирус Мараба, содержащий белок G Farmington (MRB-FMT(G)), показал менее чем 100% выживаемость через 30 дней после внутричерепной инъекции, однако выживаемость была увеличена по сравнению с контролем. Животные, обработанные химерой MRB-FMT(G) продемонстрировали промежуточную выживаемость в результате того, что две мыши были подвергнуты эвтаназии раньше срока из-за потери веса.
Вирусная частица MRB-FMT(G) продуцирует полинуклеотид кДНК, который включает последовательность SEQ ID NO: 15, когда вирус находится в клетке-хозяине. Вирусная частица MRB-FMT(G) включает последовательность РНК, которая является обратным комплементом SEQ Ш NO: 16. Геном вируса MRB-FMT(G) содержит открытые рамки считывания, которые кодируют белки N, Р, и L Мараба; а также белок М Мараба; и белок G вируса Farmington. Белок N Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 1. Белок Р Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 2. Белок L Мараба имеет последовательность, которая соответствует последовательности SEQ ID NO: 3. Белок М Мараба имеет последовательность, которая соответствует последовательности SEQ LD NO: 4. Белок G вируса Farmington имеет последовательность, которая соответствует последовательности SEQ ID NO: 17.
Вирусная частица FMT-MRB(G) продуцирует полинуклеотид кДНК, который включает последовательность SEQ ID NO: 18, когда вирус находится в клетке-хозяине. Вирусная частица FMT-MRB(G) включает последовательность РНК, которая является обратным комплементом SEQ LD NO: 19. Геном вируса FMT-MRB(G) содержит открытые рамки считывания, которые кодируют белки N, Р и L вируса Farmington; а также белок М Farmington; и белок G Мараба. Белок N вируса Farmington имеет последовательность, которая соответствует последовательности SEQ ID NO: 20. Белок Р вируса Farmington имеет последовательность, которая соответствует последовательности SEQ ID NO: 21. Белок L вируса Farmington имеет последовательность, которая соответствует последовательности SEQ ID NO: 22. Белок М вируса Farmington имеет последовательность, которая соответствует последовательности SEQ ID NO: 23. Белок G Мараба имеет последовательность, которая соответствует последовательности SEQ LD NO: 24.
Фигура 6В показывает соответствующие изменения массы тела. Все животные показали первоначальное снижение массы тела через 3-5 дней после операции. У животных, получавших внутричерепные инъекции FMT дикого типа или химер MRBGG или MRB LCMVG, падение массы тела было временным, и животные восстанавливали исходную массу тела через 20-25 дней после обработки. Трое животных, которые выжили в группе, обработанной химерой MRB FMTG, показали умеренное восстановление массы тела в течение того же периода времени.
Фигуры 6А и 6В показывают (а), что вирус Farrnington, не нейротоксичный вирус, может быть превращен в нейротоксичный путем замены его G-белка G-белком вируса Мараба дикого типа, нейротоксичного вируса; и (б) вирус Мараба, нейротоксичный вирус, не становится не нейротоксичным при замене его G-белка на любой G-белок из не нейротоксичного вируса, поскольку замена на G-белок вируса Farmington не делает его не нейротоксичным (чтобы быть точным, вирус Мараба становится не нейротоксичным при замене его G-белка на конкретные не нейротоксичные G-белки).
Пример 6. Эффективность in vivo химерных вирусов Мараба согласно настоящему изобретению и контрольных вирусов
Эффективность химерных вирусов in vivo также определяли в моделях глиобластомы мыши. Шести-восьминедельным CD-1 безтимусным мышам вводили в головной мозг 106 клеток глиобластомы человека U87MG-Fluc (трансдуцированных лентивирусом для экспресии люциферазы светлячка), как описано выше. Через неделю мышей обследовали с помощью системы для прижизненного наблюдения (Xenogen rVIS 200 Imaging System, Caliper Life Sciences) и разбивали на группы по пять мышей, имеющих близкие уровни экспрессии люциферазы светлячков в образовавшихся в мозге опухолях. Вкратце, мышей анестезировали с помощью изофлурана, вводили раствор люциферина (2 мг/мышь) и помещали в приборы IVIS. Получали изображения и количественно оценивали люминесценцию, используя программное обеспечение производителя (Living Image®, Caliper Life Sciences). Сигнал опухоли у каждой мыши нормализовали к фоновому сигналу данной экспозиции. Значение сигнала до обработки было принято за 100%, и все последующие значения сравнивали с этим исходным значением. На следующий день мышам снова вводили в стереотаксическом аппарате указанный вирус (доза 107 БОЕ, или фосфатный буфер в качестве контроля), как описано ранее. Мышей обследовали с помощью IVIS с интервалом в одну неделю в течение пяти недель, в течение этого времени регистрировали связанные с опухолью показатели состояния здоровья, после чего мышей подвергали эвтаназии в соответствии с профессиональными принципами.
На фигуре 7А представлен график, иллюстрирующий эффективность химер Мараба в соответствии с настоящим изобретением in vivo по сравнению с контрольными вирусами. График в координатах Каплана-Мейра показывает выживание CD-I бестимусных мышей с опухолями U87MG после лечения. Животные, обработанные FMT-MRB(G) и MRB-FMT(G), выживали более 20 дней, но менее 30 дней после внутричерепной инъекции. Животные, обработанные фосфатным буфером, выживали в течение примерно 30 дней после внутричерепной инъекции, после чего погибали от опухолей. Животные, обработанные MRB-BGG, показали более 50% выживания в течение 30 дней после внутричерепной инъекции. Лечение BG дикого типа продемонстрировало более чем 75% выживания через 30 дней после внутричерепной инъекции. Лечение MRB-LCMV(G), VSV-LCMV(G) и FMT-WT показало 100% выживания через 30 дней после внутричерепной инъекции. Фигура 7 В представляет собой график, показывающий изменение веса животных, показанных на Фигуре 7А. Все животные продемонстрировали первоначальное снижение веса тела через 3-5 дней после обработки. У животных, получавших внутричерепные инъекции FMT дикого типа, BG или химер MRB LCMVG или VSV LCMVG падение веса тела было временным, и животные восстанавливали начальную массу тела к 20 дням после лечения. Животные, обработанные химерами MRB FMTG или FMT MRBG или контрольные животные (получавшие PBS) не показали восстановления массы тела за тот же период времени. Подробные результаты показаны на Фигурах 8-15.
Фигура 8А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность контроля (PBS) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли до и после (1 неделя, 2 недели, 3 недели, 4 недели) лечения. На фигуре 8 В представлен график, иллюстрирующий значительное увеличение опухоли во времени у контрольных животных, не получавших лечения.
Фигура 9А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность лечения вирусом BG дикого типа (BG-WT) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли U87MG после (1 неделя, 2 недели, 3 недели, 4 недели) лечения BG (1 доза 107 БОЕ: внутричерепное введение). Фигура 9 В представляет собой график, иллюстрирующий умеренную начальную регрессию опухоли в ответ на внутричерепное введение BG (107 БОЕ) с последующим рецидивом и ростом опухоли.
Фигура 10А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность лечения вирусом FMT дикого типа (FMT-WT) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли U87MG после (1 неделя, 2 недели, 3 недели, 4 недели) лечения FMT-WT (1 доза 107 БОЕ: внутричерепное введение). Фигура 10 В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепное введение FMT-WT (107 БОЕ).
Фигура 11А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность лечения MRB BG(G) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли U87MG после (1 неделя, 2 недели, 3 недели, 4 недели) лечения MRB BG(G) (1 доза 107 БОЕ: внутричерепное введение). Фигура 11 В представляет собой график, иллюстрирующий умеренную регрессию опухоли в ответ на внутричерепное введение MRB BGG (107 БОЕ).
Фигура 12А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность лечения MRB FMT(G) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли U87MG после (1 неделя, 2 недели, 3 недели) лечения MRB FMT(G) (1 доза 107 БОЕ: внутричерепное введение). Фигура 12В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепное введение MRB FMT(G) (107 БОЕ). Однако все животные погибли вследствие нейротоксических эффектов при лечении MRB FMT(G) до конца 4 недели после лечения.
Фигура 13А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность лечения FMT MRB(G) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли U87MG после (1 неделя, 2 недели, 3 недели) лечения FMT MRB(G) (1 доза 107 БОЕ: внутричерепное введение). Фигура 13 В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепное введение FMT MRB(G) (107 БОЕ). Однако все животные погибли вследствие нейротоксических эффектов лечения FMT MRB(G) до конца 4 недели после лечения.
Фигура 14А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность лечения VSV-LCMV(G) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли U87MG после (1 неделя, 2 недели, 3 недели, 4 недели) лечения VSV-LCMV(G) (1 доза 107 БОЕ: внутричерепное введение). Фигура 14В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепное введение VSV-LCMV(G) (107 БОЕ).
Фигура 15А представляет собой изображение IVIS опухолей U87MG, иллюстрирующее in vivo эффективность лечения MRB LCMV(G) в модели U87MG ксенотрансплантанта человека. Изображение показывает опухоли U87MG после (1 неделя, 2 недели, 3 недели, 4 недели) лечения MRB LCMV(G) (1 доза 107 БОЕ: внутричерепное введение). Фигура 15В представляет собой график, иллюстрирующий значительную регрессию опухоли в ответ на внутричерепное введение MRB LCMV(G) (107 БОЕ).
Пример 7. Ответы нейтрализующих антител на химерные вирусы Мараба
Количественное определение наличия нейтрализующих антител против указанных вирусов проводили, как описано ранее (Propagation, Purification, and In Vivo Testing of Oncolytic Vesicular Stomatitis Virus Strains, J-S Diallo et al., Oncolytic Viruses: Methods and Protocols, Methods in Molecular Biology Vol 797 (2012)).
Вкратце, в день 0 отбирали по 50 мкл крови из подкожной вены 6-8 недельных самок мышей BALB/c в покрытые гепарином пробирки, центрифугировали и брали сыворотку. Далее животным, в группах по три мыши, вводили в хвостовую вену 107 БОЕ указанного вируса. У мышей снова отбирали кровь на 7-й день, после чего снова вводили вирус таким же образом, как в день 0. В последний раз у мышей отбирали кровь на 14-й день путем пункции сердца. Сыворотку каждого животного из каждой из трех временных точек (0, 7, 14 дней) серийно разводили в отношении 1:2 в лунках 96-луночного планшета, начиная с начального разведения 1/50. В каждую содержащую сыворотку лунку вносили 2,5×104 БОЕ/лунку соответствующего вируса и инкубировали в течение одного часа, используя начальное разведение сыворотки 1/100. Смесь сыворотки и вируса затем добавляли в 96-луночные планшеты, засеянные накануне клетками Vero в количестве 1,25×104 клеток/лунку. Через два дня оценивали монослои с помощью микроскопии на наличие цитопатического эффекта (СРЕ). Самое низкое разбавление, при котором 50 процентный СРЕ был очевиден, определяло титр нейтрализующих антител для конкретного образца.
Фигура 16 представляет собой график, иллюстрирующий титры нейтрализующих антител у мышей линии BALB/C, обработанных ослабленным VSV (VSV-Δ51) или вирусом Мараба дикого типа (MRB-WT) по сравнению с химерными вирусами VSV-LCMV(G) или Mapa6a-LCMV(G). MRB дикого типа и VSV Δ51 (ослабленный) индуцировали значительные титры нейтрализующих антител, тогда как соответствующие химеры VSV-LCMV(G) и MRB-LCMV(G) не вызывали нейтрализующего иммунного ответа. Были проведены также реципрокные анализы сывороток, полученных от мышей на 14 день. Сыворотки, собранные при инфицировании каждым из вирусов MRB дикого типа, VSV Δ51 (ослабленный), VSV-LCMV(G), MRB-LCMV(G) были протестированы с использованием MRB-LCMV(G), VSV-LCMV(G), VSV-Δ51 (ослабленный) и MRB дикого типа соответственно. Во всех случаях ответ нейтрализующих антител не был очевиден.
Пример 8. Титры химерных вирусов в продуцирующих клетках
Для наработки указанных вирусов каждый из них инокулировали в сорок 15-см пластиковых чашек для культуры тканей с субконфлюентным монослоем клеток Vero при множественности инфекции 0,01. Двадцать часов спустя среду собирали и вирус очищали и титровали в соответствии с Diallo et al 2012. Рассчитывали выход и сравнивали каждую химеру LCMV(G) с ее родительским диким типом. По сравнению с его родительским штаммом вирус MRB-LCMV(G) давал выход в 2 раз больше, чем вирус VSV-LCMV(G) (отношение титра VSV-LCMVG к VSV дикого типа составляет 0,028; для сравнения, отношение титра MRB-LCMV(G) к MRB дикого типа составляет 0,067).
В предшествующем описании с целью разъяснения подробно описаны многие детали для того, чтобы обеспечить полное понимание примеров. Однако для специалиста в данной области техники будет очевидно, что эти конкретные детали не являются необходимыми. Описанные выше примеры предназначены только для иллюстрации. В конкретные воплощения специалисты в данной области техники могут внести изменения, модификации и вариации без отступления от сущности и объема настоящего изобретения, которые определены исключительно прилагаемой формулой изобретения.
Claims (34)
1. Изолированная рабдовирусная частица для применения в онколитической вирусной терапии у пациента с глиобластомой, где выделенная рабдовирусная частица включает геном, способный экспрессировать:
белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 1,
белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 2,
белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 3,
белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 4, и
белок, имеющий последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 7.
2. Изолированная рабдовирусная частица по п. 1, которая включает геном, способный экспрессировать:
белок, имеющий последовательность, которая включает SEQ ID NO: 1,
белок, имеющий последовательность, которая включает SEQ ID NO: 2,
белок, имеющий последовательность, которая включает SEQ ID NO: 3,
белок, имеющий последовательность, которая включает SEQ ID NO: 4, и
белок, имеющий последовательность, которая включает SEQ ID NO: 7.
3. Применение изолированной рабдовирусной частицы по п. 1 или 2 для лечения глиобластомы.
4. Применение по п. 3, где изолированная рабдовирусная частица изготовлена способом, подходящим для прямой доставки изолированной выделенной частицы в центральную нервную систему.
5. Применение по п. 4, где изолированная рабдовирусная частица изготовлена для введения, включающего интратекальную инъекцию.
6. Применение по п. 4, где изолированная рабдовирусная частица изготовлена для введения, включающего внутривенную инъекцию.
7. Применение по п. 4, где изолированная рабдовирусная частица изготовлена для введения, включающего внутричерепную инъекцию.
8. Способ лечения пациента с глиобластомой, включающий введение указанному пациенту изолированной рабдовирусной частицы по п. 1 или 2.
9. Способ по п. 8, где изолированная рабдовирусная частица вводится прямо в центральную нервную систему.
10. Способ по п. 8, где изолированная рабдовирусная частица вводится снаружи от гематоэнцефалического барьера.
11. Способ по п. 8, где изолированная вирусная частица вводится внутрь гематоэнцефалического барьера.
12. Способ по п. 8, где изолированная рабдовирусная частица изготовлена для введения, включающего интратекальную инъекцию.
13. Способ по п. 8, где изолированная рабдовирусная частица изготовлена для введения, включающего внутривенную инъекцию.
14. Способ по п. 8, где изолированная рабдовирусная частица изготовлена для введения, включающего внутричерепную инъекцию.
15. Набор для лечения глиобластомы у пациента, включающий:
изолированную рабдовирусную частицу по п. 1 и
инструкции по введению изолированной рабдовирусной частицы пациенту.
16. Набор для лечения глиобластомы пациенту, включающий:
изолированную рабдовирусную частицу по п. 2 и
инструкции по введению изолированной рабдовирусной частицы пациенту.
17. Набор по любому из пп. 15 или 16, где изолированная рабдовирусная частица изготовлена способом, подходящим для прямой доставки изолированной выделенной частицы в центральную нервную систему.
18. Набор по п. 17, где изолированная рабдовирусная частица изготовлена для введения, включающего интратекальную инъекцию.
19. Набор по п. 17, где изолированная рабдовирусная частица изготовлена для введения, включающего внутривенную инъекцию.
20. Набор по п. 17, где изолированная рабдовирусная частица изготовлена для введения, включающего внутричерепную инъекцию.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/CA2012/050893 WO2014089668A1 (en) | 2012-12-12 | 2012-12-12 | Compositions and methods for the treatment of brain cancers |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2015128078A RU2015128078A (ru) | 2019-03-27 |
| RU2015128078A3 RU2015128078A3 (ru) | 2019-03-27 |
| RU2705244C2 true RU2705244C2 (ru) | 2019-11-06 |
Family
ID=50933623
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015128078A RU2705244C2 (ru) | 2012-12-12 | 2012-12-12 | Композиции и способы лечения рака мозга |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20150307559A1 (ru) |
| EP (1) | EP2931880B1 (ru) |
| JP (1) | JP6162818B2 (ru) |
| CN (1) | CN105008524A (ru) |
| AU (1) | AU2012396787B9 (ru) |
| BR (1) | BR112015013669A2 (ru) |
| CA (1) | CA2894618A1 (ru) |
| IL (1) | IL239374B (ru) |
| MX (1) | MX366493B (ru) |
| RU (1) | RU2705244C2 (ru) |
| WO (1) | WO2014089668A1 (ru) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102858959B (zh) | 2009-12-10 | 2016-02-24 | 渥太华医院研究院 | 溶瘤弹状病毒 |
| ES2627529T3 (es) | 2011-06-08 | 2017-07-28 | Children's Hospital Of Eastern Ontario Research Institute Inc. | Composiciones para tratamiento de glioblastoma |
| RU2684211C2 (ru) | 2013-02-21 | 2019-04-04 | Тёрнстоун Лимитед Партнершип | Композиция вакцины |
| WO2018213412A1 (en) * | 2017-05-19 | 2018-11-22 | Georgia State University Research Foundation, Inc. | Recombinant oncolytic virus |
| US12091434B2 (en) * | 2017-09-22 | 2024-09-17 | Centre National De La Recherche Scientifique (Cnrs) | Mutated glycoprotein of vesicular stomatitis virus |
| DE102018215551A1 (de) * | 2018-09-12 | 2020-03-12 | Virolutions Biotech Gmbh | Verfahren zur Herstellung eines antitumoralen Arenavirus sowie Arenavirusmutanten |
| CN112442114A (zh) * | 2019-08-29 | 2021-03-05 | 渥太华Hdl药物研发公司 | 一种多肽及其应用 |
| WO2022170219A1 (en) | 2021-02-05 | 2022-08-11 | Iovance Biotherapeutics, Inc. | Adjuvant therapy for cancer |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2301260C2 (ru) * | 2000-09-22 | 2007-06-20 | Вирэкссис Корпорейшн | Вирусные векторы с зависимой от условий репликацией и их применение |
| CA2739963A1 (en) * | 2008-10-08 | 2010-04-15 | Tsanan Heimann | Lcmv-gp-vsv pseudotyped vectors and tumor infiltrating virus-producing cells for the therapy of tumors |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009016433A2 (en) * | 2006-09-15 | 2009-02-05 | Ottawa Health Research Institute | Oncolytic rhabdovirus |
-
2012
- 2012-12-12 MX MX2015007093A patent/MX366493B/es active IP Right Grant
- 2012-12-12 EP EP12889818.6A patent/EP2931880B1/en active Active
- 2012-12-12 RU RU2015128078A patent/RU2705244C2/ru active
- 2012-12-12 AU AU2012396787A patent/AU2012396787B9/en active Active
- 2012-12-12 JP JP2015546782A patent/JP6162818B2/ja active Active
- 2012-12-12 CA CA2894618A patent/CA2894618A1/en not_active Abandoned
- 2012-12-12 CN CN201280077698.6A patent/CN105008524A/zh active Pending
- 2012-12-12 BR BR112015013669A patent/BR112015013669A2/pt not_active Application Discontinuation
- 2012-12-12 WO PCT/CA2012/050893 patent/WO2014089668A1/en active Application Filing
- 2012-12-12 US US14/651,761 patent/US20150307559A1/en not_active Abandoned
-
2015
- 2015-06-11 IL IL239374A patent/IL239374B/en active IP Right Grant
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2301260C2 (ru) * | 2000-09-22 | 2007-06-20 | Вирэкссис Корпорейшн | Вирусные векторы с зависимой от условий репликацией и их применение |
| CA2739963A1 (en) * | 2008-10-08 | 2010-04-15 | Tsanan Heimann | Lcmv-gp-vsv pseudotyped vectors and tumor infiltrating virus-producing cells for the therapy of tumors |
Non-Patent Citations (7)
| Title |
|---|
| ALEXANDER MUIK et al., Pseudotyping Vesicular Stomatitis Virus with Lymphocytic Choriomeningitis Virus Glycoproteins Enhances Infectivity for Glioma Cells and Minimizes Neurotropism, JOURNAL OF VIROLOGY, June 2011, Vol. 85, No. 11, pp.5679-5684. * |
| GUIDO WOLLMANN et al., Oncolytic Virus Therapy of Glioblastoma Multiforme - Concepts;and Candidates, Cancer J. 2012, Vol.18, No.1, pp. 69-81. * |
| GUIDO WOLLMANN et al., Oncolytic Virus Therapy of Glioblastoma Multiforme - Concepts;and Candidates, Cancer J. 2012, Vol.18, No.1, pp. 69-81. ALEXANDER MUIK et al., Pseudotyping Vesicular Stomatitis Virus with Lymphocytic Choriomeningitis Virus Glycoproteins Enhances Infectivity for Glioma Cells and Minimizes Neurotropism, JOURNAL OF VIROLOGY, June 2011, Vol. 85, No. 11, pp.5679-5684. WINFRIED R. BEYER et al., Oncoretrovirus and Lentivirus Vectors Pseudotyped with Lymphocytic Choriomeningitis Virus Glycoprotein: Generation, Concentration, and Broad Host Range, JOURNAL OF VIROLOGY Feb. 2002, Vol. 76, No. 3, pp. 1488-1495. JAN BRUN et al., Identification of Genetically Modified Maraba Virus as an Oncolytic Rhabdovirus, Molecular Therapy Aug. 2010, Vol. 18, No.8, pp.1440-1449. * |
| JAN BRUN et al., Identification of Genetically Modified Maraba Virus as an Oncolytic Rhabdovirus, Molecular Therapy Aug. 2010, Vol. 18, No.8, pp.1440-1449. * |
| Maraba virus from Brazil, complete genome, GenBank: * |
| Maraba virus from Brazil, complete genome, GenBank: HQ6600766, 22.06.2011. * |
| WINFRIED R. BEYER et al., Oncoretrovirus and Lentivirus Vectors Pseudotyped with Lymphocytic Choriomeningitis Virus Glycoprotein: Generation, Concentration, and Broad Host Range, JOURNAL OF VIROLOGY Feb. 2002, Vol. 76, No. 3, pp. 1488-1495. * |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2012396787B2 (en) | 2019-09-19 |
| EP2931880A4 (en) | 2016-05-18 |
| CN105008524A (zh) | 2015-10-28 |
| AU2012396787A1 (en) | 2015-07-02 |
| AU2012396787B9 (en) | 2019-10-03 |
| MX2015007093A (es) | 2016-01-12 |
| EP2931880A1 (en) | 2015-10-21 |
| JP2016501528A (ja) | 2016-01-21 |
| EP2931880B1 (en) | 2019-03-20 |
| MX366493B (es) | 2019-07-10 |
| RU2015128078A (ru) | 2019-03-27 |
| BR112015013669A2 (pt) | 2017-11-14 |
| WO2014089668A1 (en) | 2014-06-19 |
| US20150307559A1 (en) | 2015-10-29 |
| IL239374B (en) | 2021-03-25 |
| RU2015128078A3 (ru) | 2019-03-27 |
| IL239374A0 (en) | 2015-07-30 |
| CA2894618A1 (en) | 2014-06-19 |
| JP6162818B2 (ja) | 2017-07-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2705244C2 (ru) | Композиции и способы лечения рака мозга | |
| JP7340471B6 (ja) | ウイルスベクター産生系 | |
| US20170051307A1 (en) | Evolution of high-titer virus-like vesicles for vaccine applications | |
| CN101586120B (zh) | 狂犬病病毒Flury-LEP疫苗株反向遗传操作系统及LEP绿色荧光蛋白重组病毒载体 | |
| EP4305181A1 (en) | Minimal nephrin promoter | |
| US20230293668A1 (en) | Compositions and methods for glioblastoma treatment | |
| WO2015154197A1 (en) | Compositions and methods for glioblastoma treatment | |
| CN114213505B (zh) | 一种适用于特异感染u87-mg细胞的腺相关病毒突变体 | |
| CN113462723B (zh) | 表达CAR和shRNA的逆转录病毒载体及其应用 | |
| EP2558113B1 (en) | Serca2 therapeutic compositions and methods of use | |
| CN114195859B (zh) | 一种适用于特异感染u251细胞的腺相关病毒突变体 | |
| CN118406684A (zh) | 一种shRNA腺相关病毒载体及其构建方法和应用 | |
| KR20230123925A (ko) | Neurod1 및 dlx2 벡터 | |
| CN113846068A (zh) | 融合基因ril-7重组牛痘病毒及其在制备抗肿瘤药物中的应用 | |
| CN116555195A (zh) | 一种能通过血脑屏障并且减轻急性低压缺氧脑损伤的腺相关病毒及其应用 | |
| CN114984189A (zh) | 一种白细胞介素16蛋白的新用途 | |
| CN115772503A (zh) | 一种表达pah的基因修饰细胞药物及其制备方法与应用 | |
| CN116761812A (zh) | Neurod1和dlx2载体 | |
| CN117580941A (zh) | 多重CRISPR/Cas9介导的靶基因激活系统 |