RU2668212C1 - N4-Замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе - Google Patents
N4-Замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе Download PDFInfo
- Publication number
- RU2668212C1 RU2668212C1 RU2017139534A RU2017139534A RU2668212C1 RU 2668212 C1 RU2668212 C1 RU 2668212C1 RU 2017139534 A RU2017139534 A RU 2017139534A RU 2017139534 A RU2017139534 A RU 2017139534A RU 2668212 C1 RU2668212 C1 RU 2668212C1
- Authority
- RU
- Russia
- Prior art keywords
- group
- general formula
- ylmethyl
- carbon atoms
- triazol
- Prior art date
Links
- 230000000855 fungicidal effect Effects 0.000 title claims abstract description 19
- 239000000203 mixture Substances 0.000 title claims abstract description 16
- 239000000417 fungicide Substances 0.000 title claims description 8
- 230000001105 regulatory effect Effects 0.000 title abstract description 5
- 238000004519 manufacturing process Methods 0.000 title abstract 2
- 230000012010 growth Effects 0.000 title description 6
- -1 tetrahydrofuran-2-ylmethyl Chemical group 0.000 claims abstract description 61
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 29
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 16
- 125000003118 aryl group Chemical group 0.000 claims abstract description 12
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 10
- 239000001257 hydrogen Substances 0.000 claims abstract description 10
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 9
- 125000005010 perfluoroalkyl group Chemical group 0.000 claims abstract description 9
- 125000000753 cycloalkyl group Chemical group 0.000 claims abstract description 8
- 125000005843 halogen group Chemical group 0.000 claims abstract description 8
- 125000003710 aryl alkyl group Chemical group 0.000 claims abstract description 7
- 125000005160 aryl oxy alkyl group Chemical group 0.000 claims abstract description 7
- 239000000126 substance Substances 0.000 claims abstract description 5
- 125000005002 aryl methyl group Chemical group 0.000 claims abstract 3
- 239000003630 growth substance Substances 0.000 claims abstract 2
- 150000001350 alkyl halides Chemical class 0.000 claims description 6
- 238000000034 method Methods 0.000 claims description 6
- 239000005648 plant growth regulator Substances 0.000 claims description 6
- 229910052799 carbon Inorganic materials 0.000 claims description 4
- 125000005670 ethenylalkyl group Chemical group 0.000 claims description 4
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 claims description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 3
- 150000003839 salts Chemical class 0.000 claims description 3
- 229910000288 alkali metal carbonate Inorganic materials 0.000 claims description 2
- 150000008041 alkali metal carbonates Chemical class 0.000 claims description 2
- 239000002585 base Substances 0.000 claims description 2
- 150000004679 hydroxides Chemical class 0.000 claims description 2
- 239000003880 polar aprotic solvent Substances 0.000 claims description 2
- 239000003586 protic polar solvent Substances 0.000 claims description 2
- 150000003512 tertiary amines Chemical class 0.000 claims description 2
- 230000003993 interaction Effects 0.000 claims 1
- 150000001875 compounds Chemical class 0.000 abstract description 22
- 230000000694 effects Effects 0.000 abstract description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 abstract description 4
- 230000008635 plant growth Effects 0.000 abstract description 4
- 241000233866 Fungi Species 0.000 abstract description 3
- 239000000243 solution Substances 0.000 description 21
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 16
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- 239000002904 solvent Substances 0.000 description 12
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 9
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 9
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 9
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 7
- AJKQSTXJOPINFK-UHFFFAOYSA-N 2-(1,2,4-triazol-1-yl)acetohydrazide Chemical compound NNC(=O)CN1C=NC=N1 AJKQSTXJOPINFK-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 241000209140 Triticum Species 0.000 description 5
- 235000021307 Triticum Nutrition 0.000 description 5
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 239000010410 layer Substances 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- WURBVZBTWMNKQT-UHFFFAOYSA-N 1-(4-chlorophenoxy)-3,3-dimethyl-1-(1,2,4-triazol-1-yl)butan-2-one Chemical compound C1=NC=NN1C(C(=O)C(C)(C)C)OC1=CC=C(Cl)C=C1 WURBVZBTWMNKQT-UHFFFAOYSA-N 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- 239000013543 active substance Substances 0.000 description 4
- 230000029936 alkylation Effects 0.000 description 4
- 238000005804 alkylation reaction Methods 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 239000012044 organic layer Substances 0.000 description 4
- 238000007363 ring formation reaction Methods 0.000 description 4
- JQZAEUFPPSRDOP-UHFFFAOYSA-N 1-chloro-4-(chloromethyl)benzene Chemical compound ClCC1=CC=C(Cl)C=C1 JQZAEUFPPSRDOP-UHFFFAOYSA-N 0.000 description 3
- 229920001817 Agar Polymers 0.000 description 3
- 240000008067 Cucumis sativus Species 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 239000008272 agar Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 238000009835 boiling Methods 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000012141 concentrate Substances 0.000 description 3
- 239000012153 distilled water Substances 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 235000011181 potassium carbonates Nutrition 0.000 description 3
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 2
- PYRFHJUXDGQZPM-UHFFFAOYSA-N 1,2,4-triazole-3-thione Chemical class S=C1N=CN=N1 PYRFHJUXDGQZPM-UHFFFAOYSA-N 0.000 description 2
- RMOGWMIKYWRTKW-UHFFFAOYSA-N 1-(4-chlorophenyl)-4,4-dimethyl-2-(1H-1,2,4-triazol-1-yl)pentan-3-ol Chemical compound C1=NC=NN1C(C(O)C(C)(C)C)CC1=CC=C(Cl)C=C1 RMOGWMIKYWRTKW-UHFFFAOYSA-N 0.000 description 2
- QMNUDYFKZYBWQX-UHFFFAOYSA-N 1H-quinazolin-4-one Chemical class C1=CC=C2C(=O)N=CNC2=C1 QMNUDYFKZYBWQX-UHFFFAOYSA-N 0.000 description 2
- 125000006283 4-chlorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Cl)C([H])([H])* 0.000 description 2
- 235000010799 Cucumis sativus var sativus Nutrition 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 208000031888 Mycoses Diseases 0.000 description 2
- 241000607479 Yersinia pestis Species 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000000767 anti-ulcer Effects 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 125000006367 bivalent amino carbonyl group Chemical group [H]N([*:1])C([*:2])=O 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000035784 germination Effects 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- BRWIZMBXBAOCCF-UHFFFAOYSA-N hydrazinecarbothioamide Chemical compound NNC(N)=S BRWIZMBXBAOCCF-UHFFFAOYSA-N 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 2
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 2
- AQIXEPGDORPWBJ-UHFFFAOYSA-N pentan-3-ol Chemical compound CCC(O)CC AQIXEPGDORPWBJ-UHFFFAOYSA-N 0.000 description 2
- 239000000575 pesticide Substances 0.000 description 2
- 230000007226 seed germination Effects 0.000 description 2
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- 125000003626 1,2,4-triazol-1-yl group Chemical group [*]N1N=C([H])N=C1[H] 0.000 description 1
- SAYMXFPRQVLVEO-UHFFFAOYSA-N 1-(2-bromoethoxy)-4-chloro-2-methylbenzene Chemical compound CC1=CC(Cl)=CC=C1OCCBr SAYMXFPRQVLVEO-UHFFFAOYSA-N 0.000 description 1
- YYFLBDSMQRWARK-UHFFFAOYSA-N 1-(2-bromoethoxy)-4-chlorobenzene Chemical compound ClC1=CC=C(OCCBr)C=C1 YYFLBDSMQRWARK-UHFFFAOYSA-N 0.000 description 1
- PXNMFQMREJNQQT-UHFFFAOYSA-N 1-(chloromethyl)-1,2,4-triazole Chemical compound ClCN1C=NC=N1 PXNMFQMREJNQQT-UHFFFAOYSA-N 0.000 description 1
- GGZHVNZHFYCSEV-UHFFFAOYSA-N 1-Phenyl-5-mercaptotetrazole Chemical class SC1=NN=NN1C1=CC=CC=C1 GGZHVNZHFYCSEV-UHFFFAOYSA-N 0.000 description 1
- YXZFFTJAHVMMLF-UHFFFAOYSA-N 1-bromo-3-methylbutane Chemical compound CC(C)CCBr YXZFFTJAHVMMLF-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- AFBBKYQYNPNMAT-UHFFFAOYSA-N 1h-1,2,4-triazol-1-ium-3-thiolate Chemical class SC=1N=CNN=1 AFBBKYQYNPNMAT-UHFFFAOYSA-N 0.000 description 1
- GVNVAWHJIKLAGL-UHFFFAOYSA-N 2-(cyclohexen-1-yl)cyclohexan-1-one Chemical compound O=C1CCCCC1C1=CCCCC1 GVNVAWHJIKLAGL-UHFFFAOYSA-N 0.000 description 1
- KZNWGOUEXMAIMG-UHFFFAOYSA-N 5-(1,2,4-triazol-1-ylmethyl)-4,5-dihydro-1,2-oxazole Chemical class C1=NC=NN1CC1CC=NO1 KZNWGOUEXMAIMG-UHFFFAOYSA-N 0.000 description 1
- 241000219310 Beta vulgaris subsp. vulgaris Species 0.000 description 1
- 241000190150 Bipolaris sorokiniana Species 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- 235000009849 Cucumis sativus Nutrition 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- 241000223221 Fusarium oxysporum Species 0.000 description 1
- 241000233732 Fusarium verticillioides Species 0.000 description 1
- 240000005979 Hordeum vulgare Species 0.000 description 1
- 235000007340 Hordeum vulgare Nutrition 0.000 description 1
- 238000012404 In vitro experiment Methods 0.000 description 1
- NHTMVDHEPJAVLT-UHFFFAOYSA-N Isooctane Chemical compound CC(C)CC(C)(C)C NHTMVDHEPJAVLT-UHFFFAOYSA-N 0.000 description 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 1
- 244000141359 Malus pumila Species 0.000 description 1
- 235000011430 Malus pumila Nutrition 0.000 description 1
- 235000015103 Malus silvestris Nutrition 0.000 description 1
- PRWDYLIYVXBZEN-UHFFFAOYSA-N N1(N=CN=C1)CC1=NC(N=N1)=S Chemical class N1(N=CN=C1)CC1=NC(N=N1)=S PRWDYLIYVXBZEN-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 102100038239 Protein Churchill Human genes 0.000 description 1
- 241000813090 Rhizoctonia solani Species 0.000 description 1
- 241000221696 Sclerotinia sclerotiorum Species 0.000 description 1
- 241000209056 Secale Species 0.000 description 1
- 235000007238 Secale cereale Nutrition 0.000 description 1
- 102100028656 Sigma non-opioid intracellular receptor 1 Human genes 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 235000021536 Sugar beet Nutrition 0.000 description 1
- 241000228452 Venturia inaequalis Species 0.000 description 1
- FSIOTXJNQYVARL-UHFFFAOYSA-N [N+]=1(NC=NC=1)[S-] Chemical compound [N+]=1(NC=NC=1)[S-] FSIOTXJNQYVARL-UHFFFAOYSA-N 0.000 description 1
- OFLXLNCGODUUOT-UHFFFAOYSA-N acetohydrazide Chemical compound C\C(O)=N\N OFLXLNCGODUUOT-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 229940058303 antinematodal benzimidazole derivative Drugs 0.000 description 1
- 150000001556 benzimidazoles Chemical class 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 125000004803 chlorobenzyl group Chemical group 0.000 description 1
- 208000030499 combat disease Diseases 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- JVSWJIKNEAIKJW-UHFFFAOYSA-N dimethyl-hexane Natural products CCCCCC(C)C JVSWJIKNEAIKJW-UHFFFAOYSA-N 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 125000004175 fluorobenzyl group Chemical group 0.000 description 1
- 238000004362 fungal culture Methods 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- JXZRQHPYVJBEBI-UHFFFAOYSA-N isocyanatosulfanylcyclohexane Chemical compound O=C=NSC1CCCCC1 JXZRQHPYVJBEBI-UHFFFAOYSA-N 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 125000006178 methyl benzyl group Chemical group 0.000 description 1
- 125000001326 naphthylalkyl group Chemical group 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 230000020477 pH reduction Effects 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 125000003884 phenylalkyl group Chemical group 0.000 description 1
- 230000003032 phytopathogenic effect Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 239000002985 plastic film Substances 0.000 description 1
- 229920006255 plastic film Polymers 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229940072033 potash Drugs 0.000 description 1
- 235000015320 potassium carbonate Nutrition 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 108010085082 sigma receptors Proteins 0.000 description 1
- 108010080097 sigma-1 receptor Proteins 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000004546 suspension concentrate Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- NONOKGVFTBWRLD-UHFFFAOYSA-N thioisocyanate group Chemical group S(N=C=O)N=C=O NONOKGVFTBWRLD-UHFFFAOYSA-N 0.000 description 1
- 150000003583 thiosemicarbazides Chemical class 0.000 description 1
- 238000011282 treatment Methods 0.000 description 1
- 229960003386 triazolam Drugs 0.000 description 1
- 125000006493 trifluoromethyl benzyl group Chemical group 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000004562 water dispersible granule Substances 0.000 description 1
- 239000004563 wettable powder Substances 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/64—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with three nitrogen atoms as the only ring hetero atoms
- A01N43/647—Triazoles; Hydrogenated triazoles
- A01N43/653—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Изобретение относится к N-замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, в которой R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XCH, арилметильную группу общей формулы XCHCHили гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XCH(СН), или арилоксиалкильную группу общей формулы XCHO(CH), или арилвинилалкильную группу общей формулы XCHCH=СН(СН), где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3. Изобретение также относится к способу получения, к фунгицидной композиции и к рострегуляторной композиции. Технический результат: получены новые соединения общей формулы I, которые эффективны в борьбе с вредоносными грибами, а также могут применяться для увеличения продуктивности сельскохозяйственных культур за счет регулирования роста растений. 4 н.п. ф-лы, 9 табл., 15 пр.
Description
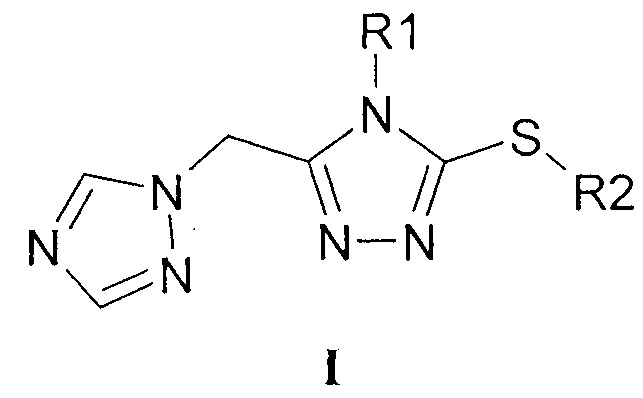
Изобретение относится к химии гетероциклических соединений, а именно к N4-замещенным 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолам общей формулы I:
где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(СН2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
а также к их с агрохимически или фармацевтически приемлемым солям.
Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов, а также регуляторов роста растений.
Изобретение относится также к способам получения соединений общей формулы I, к использованию этих соединений в композициях с другими активными и вспомогательными соединениями для борьбы с грибковыми болезнями сельскохозяйственных культур, животных и человека, а также в композициях для регулирования роста растений.
Известен ряд структурных аналогов алкилсульфанил-1,2,4-триазолов общей формулы II, где, означают R1-R3 - независимо водород или галоген; R4 - С1-С6 алкил; R5 и R6 - независимо С1-С6 алкил или образуют, вместе с атомом азота, к которому они присоединены, 5-7-членную гетероциклильную группу, в которой 6-членный гетероциклил может дополнительно содержать один атом кислорода или азота и может быть замещен ацетилом, С1-С6 алкилом или фенилом; X=S-, -SO-, -SO2- или О; и n - целое число, выбранное из 1-8; или их фармацевтически приемлемых солей, стереоизомеров или сольватов, в качестве профилактики и лечения заболеваний или состояний, опосредованных действием на сигма-1-рецепторы.
[Патент RU 2451015 (Российская Федерация) МПК C07D 249/06. Производные 1,2,4-триазола в качестве ингибиторов сигма рецептора / Жажеровик Н., Кумела-Монтанчес X.М., Гойя-Ласа М.П., Дордал Суарэс А., Куберес-Алтисент М.Р. Заявл. 07.11.2007.], заявленных в качестве промежуточных соединений, составляющих фармацевтических композиций.
Из близкого N4-фенил-5-(2-этилсульфанил(бензимидазол-1-илметил))-1,2,4-триазол-3-тиона III, полученного реакцией циклоконденсации соответствующего тиосемикарбазида под действием щелочи, в результате алкилирования с различными алкилгалогенидами, в присутствии ацетата натрия получают 3-алкил-сульфанил-N4-фенил-5-(2-этилсульфанил(бензимидазол-1-илметил))-1,2,4-триазолы IV [Eisa Н.М., Barghash A.M., Badr S.M., Farahat A.A. Synthesis and antimicribal activity of certain benzimidazole and fused benzimidazole derivatives// Ind. J. Chem. - 2010. - Vol. 49B. - P. - 1515-1525].
Данные 3-алкилсульфанил-1,2,4-триазолы IV предложено применять в качестве антимикробных препаратов.
Близким по структуре и по способу получения является ряд 3-алкил-сульфанил-4-арил-5-ариламинометил-1,2,4-триазолов общей формулы V, где, Va Х=С, R=-CH2-NH-(4-CH3C6H4), R1=4-СН3ОС6Н4, R2=NH-(2-СН3С6Н4) или Vb Х=С, R=-CH2-O-C6H5, R1=-CH2C6H5, R2=2,4-F2C6H5O-CH2 или Vc X=C, R=-CH2-S-(4-CH3C6H4), R1=R2=C6H5 или Vd X=N, R1=C6H5, R2=NH(4-CH3C6H4), или IIe X=N, R1=C6H5,, R2=NHC6H5. [Патент UA 89537 (Украина) МПК C07D 257/04, C07D 249/08, A61K 31/00. Алкилированные производные 1,2,4-триазол-3-тиола, 1-фенил-1H-тетразол-5-тиола, которые проявляют противоязвенную активность /. Георгiянц В.А., Дроговоз С.М., Кадамов I.М., Тимофеев М.П., Сааод X., Северiна Г.I., Саiдов Н.Б. Заявл. 15.11.2013.], заявленных в качестве соединений проявляющих противоязвенную активность, получаемых алкилированием соответствующих 1,2,4-триазол-3-тионов различными α-галогенкарбонильными соединениями, в присутствии гидроксида калия в этаноле, с выходами до 85%.
Близким по применению является ряд 5-(1,2,4-триазол-1-илметил)-дигидроизоксазолов VI, где R1 и R2 такие, как водород, алкоксиалкил, галоакил, циклоалкильную группу, фенилалкил, нафтилалкил, арил, гетерил, заявленных в качестве фунгицидов и регуляторов роста растений [Патент US 5156669 (США) 5-(1,2,4-triazol-1-ylmethyl)-isoxazolines / Zierke Т., Kuekenhoehner Т., Frank J., Ammermann E., Lorenz G. Заявл. 09.04.1991].
Наиболее близким к заявленным 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолам общей формулы I, как по получению, так и по применению является ряд 3-[(5-алкилсульфанил-4-фенил-1,2,4-триазол-1-ил)метил]хиназолин-4-онов VII, где R означает бензил, фторбензил, хлорбензил, трифторметилбензил, метилбензил, получаемых из 3-[(5-тио-4-фенил-1,2,4-триазол-1-ил)метил]-хиназолин-4-онов VIII алкилированием алкилгалогенидами в диметилформамиде, в присутствии поташа при комнатной тепературе. Соединения VII, обладают фунгицидной активностью [Патент CN 104829598 (Китай) 1,2,4-Triazole sulfide-containing quinazolinone compound, synthetic method and application as plant fungicide / Bao X.; Yan В.; Lv X.; Du H. Заявл. 27.05.2015].
Задача, решаемая данным изобретением, состоит в увеличении эффективности борьбы с вредоносными грибами и расширении ассортимента фунгицидных препаратов, а также увеличении продуктивности сельскохозяйственных культур за счет регулирования роста растений, расширении ассортимента регуляторов роста растений.
Поставленная задача решается получением соединений общей формулы I, обладающих фунгицидной и рострегуляторной активностью, а также в увеличении эффективности фунгицидных и рострегуляторных средств за счет применения N4-замещенных 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I и расширении ассортимента фунгицидных и рострегуляторных препаратов.
Согласно настоящему изобретению, N4-замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, получают взаимодействием N4-замещенных 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионов общей формулы IX, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
с алкилгалогенидами X, где R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
в присутствии оснований: гидроксидов, алкоголятов, карбонатов щелочных металлов, третичных аминов, в полярных апротонных или протонных растворителях при температуре от 20°С до 160°С.
Техническим результатом изобретения являются новые N4-замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, и способ их получения. В указанном патенте [Патент CN 104829598 (Китай)] алкилирование 3-[(5-тио-4-фенил-1,2,4-триазол-1-ил)метил]хиназолин-4-онов алкилгалогенидов предлагается проводить при комнатной температуре в сравнительно трудноудаляемом растворителе в присутствии карбоната калия. Мы предлагаем получать новые N4-замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, более простым и эффективным малоотходным способом: взаимодействием 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионов общей формулы IX алкилгалогенидами в легко удаляемых дешевых полярных растворителях.
(1,2,4-Триазол-1-ил)ацетгидразид XI получают по описанной в литературе методике [Попков С.В., Алексеенко А.Л., Тихомиров Д.С. Синтез, строение и фунгицидная активность замещенных N2-фенилалкилиден-2-(азол-1-ил)ацетгидразидов // Изв. вузов. Химия и хим. технология. - 2007. - Т. 50, В. 6. - С. 98-101.], далее его ацилируют замещенными тиоизоцианатами в абс. этаноле с получением N4-замещенных-N1-(1,2,4-триазол-1-илацетил)-тиосемикарбазидов XII, где R1 означает циклогексильную, фурфурильную, бензильную группу, которые затем циклоконденсируют в ключевые N4-замещенные 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионы IX, где R1 означает циклогексильную, фурфурильную, бензильную группу, под действием водного раствора гидроксида натрия, с последующим подкислением водным раствором кислот, по описанной в литературе методике [Цаплин Г.В.; Попков С.В. Синтез N4-(бензил)- и N4-(циклогексил)-N1-(1,2,4-триазол-1-илацетил)тиосемикарбазидов и продуктов их циклоконденсации в кислой и основной среде.// Успехи в химии и хим. технологии: сб. науч. тр. Том XXX, №11, М: РХТУ им. Д.И. Менделеева. - 2016. - С. 91-93.].
Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества, могут включать в свой состав вспомогательные вещества: наполнители, растворители, поверхностно-активные вещества, умягчители воды, синергические добавки и др. Известен препарат триадимефон, который применяют в виде 5, 25%-ного смачивающегося порошка, 10%-ного эмульгирующего концентрата для борьбы с болезнями пшеницы, ржи, ячменя, сахарной свеклы, яблони, огурцов в период вегетации, а также как протравитель семян. [Пестициды и регуляторы роста растений: Справ. изд. / Н.Н. Мельников, К.В. Новожилов, С.Р. Белан. - М.: Химия, 1995, с. 24, с. 287.]
Техническим результатом изобретения также является разработка фунгицидных композиций, состоящих из замещеных 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для борьбы с вредоносными грибковыми болезнями сельскохозяйственных культур, животных или человека. По результатам фунгицидных испытаний in vitro замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы I, выбранные из группы, соединения 13-26 близки или превосходят по фунгитоксичности эталон, известный фунгицид триадимефон (3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-2-бутанон) по отношению к определенным видам грибов фитопатогенов.
Техническим результатом изобретения также является разработка рострегуляторных композиций, состоящих из замещеных 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для регулирования роста сельскохозяйственных культур. По результатам рострегуляторных испытаний in vitro замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, выбранные из группы, соединения 11, 21 превосходят используемый в качестве эталонного известный регулятор роста растений - паклобутразол при тестировании в концентрации 10 мг/л проявляют ретардантный эффект, уменьшая длину ростка на 29% и 43% соответственно, а уменьшая сухой веса ростка на 35% и 51% соответственно.
Изобретение может быть проиллюстрировано следующими примерами:
Пример 1. Получение 2-(1Н-1,2,4-триазол-1-ил)ацетгидразида (1)
К раствору 16,92 г (0,12 моль) метилового эфира 1Н-(1,2,4-триазол-1-ил)уксусной кислоты в 25 мл этанола, добавляют 14,96 мл (0,3 моль) 98% гидразин гидрата, кипятят в течение 6 ч., охлаждают, осадок отфильтровывают на фильтре Шотта и промывают этанолом (3×10 мл), получают 13,2 г (78%) 2-(1Н-1,2,4-триазол-1-ил)ацетгидразида, с т.пл. 115-116°С; ср., лит. [Попков С.В., Алексеенко А.Л., Тихомиров Д.С. Синтез, строение и фунгицидная активность замещенных N2-фенилалкилиден-2-(азол-1-ил)ацетгидразидов // Изв. вузов. Химия и хим. технология. - 2007. - Т. 50, В. 6. - С. 98-101] т.пл. 115-116°С.
1Н ЯМР-спектр (δ, м.д.; 3J, Гц): 4,35 с (2Н, NH2); 4,83 с (2Н, СН2); 7,95 т (1Н, C3HTrz); 8,49 т (1H, C5HTrz); 9,42 с (1H,NH).
Пример 2. Получение N4-циклогексил-N1-(1,2,4-триазол-1-илацетил)-тиосемикарбазида (2)
К раствору 2,00 г (0,0142 моль) 2-(1Н-1,2,4-триазол-1-ил)ацетгидразида в 15 мл этанола, добавляют 2,004 г (0,0142 моль) циклогексилтиоизоцианата, кипятят в течение 2 ч, охлаждают, осадок отфильтровывают на фильтре Шотта, получают 5,123 г (93%) 5-(1,2,4-триазол-1-ил)метил-N-фенил тиосемикарбазида с т.пл. 183-184°С, ср., лит. [Цаплин Г.В., Попков С.В. Синтез N4-(бензил) И N4-(циклогексил) -N1-(1,2,4-триазол-1-ил-ацетил)тиосемикарбазидов и продуктов цилклоконденсации в кислой и основной среде // Успехи в химии и химической технологии. - 2016. - Т. 30, №11 (180). - С. 91-93] т.пл. 184-185°С.
1Н ЯМР-спектр (δ, м.д., 3J, Гц): Смесь конформеров А:Б=89:11. 1.20 м (5Н, СНСН2 2СН2 6, СН3), 1.55-1.9 м (5Н, СНСН2 3СН2 4, CH3), 4.10 уш.с. (1H, СНСН2СН2), 4.98 с (2Н, CH2N), 7.64 уш.с. (1Н, NHCH2C6H5, А) 7.97 с (1H, C5HTrz, Б) 8.01 с (1Н, C5HTrz, А), 8.19 ущ.с. (1Н, NHCH2C6H5, Б), 8.42 с (1H, C3HTrz, Б) 8.54 с (1Н, C3HTrz,A), 9.29 уш.с. (1Н, NHCS, А), 9.37 уш.с. (1Н, NHCS, Б), 9.58 уш.с. (1H, NHCO, Б), 10.20 уш.с. (1Н, NHCO, А).
Аналогично получают другие замещенные тиосемикарбазиды 3,4. (Таблица 1 и 2).
Пример 3. Получение N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона (5)
К раствору 0,192 г (4,8 моль) гидроксида натрия в 10 мл воды, добавляют 1,360 г (4,69 ммоль) N4-бензил-N1-(1,2,4-триазол-1-илацетил)тиосемикарбазида, кипятят в течение 3 ч, подкисляют до рН=6 водным раствором 1М соляной кислоты, выпавший осадок отфильтровывают, высушивают на воздухе, получают 1,163 г (91%) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона, с т.пл. 208-211°С, ср. лит. [Dobosz M., Sikorska М. The reactions of cyclization of thiosemicarbazide deriveties with 1,2,4-triazole system.//Acta Pol. Pharm. - 1994. - Vol. 51, №4-5. - P. 369-376] т.пл. 192-194°C. Rf=0,87 (система: хлороформ : метанол 10:1)
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 5.32 с (2Н, СН 2С6Н5), 5.54 с (2H, CH 2N), 7.145 д (2Н, С3Н, С5Н, 3J=8.1), 7.30 д (3Н, С2Н, С4Н,C6HAr, 3J=6.6), 7.9 с (1H, C3HTrz),8.52 с (1Н, C5HTrz), 14.03 c (1H, NH).
Аналогично получают другие замещенные 1,2,4-триазол-3-тионы 5, 7, 8. (Таблица 1 и Таблица 2)
Пример 4. Получение N4-фурфурил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона (6)
К раствору 2,0 г (0,014 моль) 2-(1H-1,2,4-триазол-1-ил)ацетгидразида в 35 мл абс. ТГФ и 25 мл абс. ацетонитрила, добавляют 1,972 г (0,014 моль) 2-фурфурилметилтиоизоцианата в 10 мл абс. ацетонитрила, споласкивая колбу (2×5 мл) абс. ацетонитрилом. Реакционную массу кипятят в течение 5 ч, добавляют 0,049 мл триэтиламина (0,0356 г, 0,4 ммоль). После 4ех часового кипячения добавляют 0,05 г (моль) трет-бутилата калия и кипятят еще в течение 2х ч. Смесь растворителей отгоняют на РПИ в вакууме водоструйного насоса, остаток перекристаллизовывают из пропан-2-ола, получают 1,75 г (44%) N4-(фурфурил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона, с т.пл. 219-220°С. Rf0,74 (система: хлороформ : метанол 6:1).
1Н NMR Спектр (δ, м.д., 3J, Гц): 5.34 с (2Н, CH 2NN), 5.7 с (2Н, СН 2СО), 6.4 д (2Н, ОСН=СНСН=С, 3J=7.3), 7.58 с (1H, OCH), 8.01 с (1Н, C3HTrz),8.67 с (1H, C5HTrz), 13.96 с (1Н, NH).
Аналогично получают другие замещенные 1,2,4-триазол-3-тионы 6,7. (Таблица 3 и 4)
1Н NMR Спектр (δ, м.д., 3J, Гц): 5.34 с (2Н, CH 2NN), 5.7 с (2Н, СН 2СО), 6.4 д (2Н, ОСН=СНСН=С, 3J=7.3), 7.58 с (1Н, OCH), 8.01 с (1Н, C3HTrz),8.67 с (1H, C5HTrz), 13.96 с (1Н, NH).
*(С4Н3О)СН2 - фурфурил (фуран-2-илметил).
Пример 5. Получение N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9)
К раствору 0,24 г (0,88 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 10 мл ацетона, добавляют 0,21 г (1,5 ммоль) карбоната калия, 0,1441 г (0,88 ммоль) 4-хлорбензилхлорида, кипятят в течение 6 ч. Затем на РПИ в вакууме водоструйного насоса отгоняют растворитель, к остатку добавляют 1 мл воды и экстрагируют хлороформом (3×5 мл), органический слой сушат над сульфатом магния, отфильтровывают, фильтрат упаривают на РПИ в вакууме водоструйного насоса. К остатку в виде масла добавляют 5 мл серного эфира, выпавшие кристаллы отфильтровывают на фильтре Шотта, получают 0,1974 г N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (57%), с т.пл. 104-106°С.
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 4.33 с (2Н, CH2C6H4Cl), 5.22 с (2Н, СН 2С6Н5), 5.66 с (2Н, CH 2N), 6.86 м (2Н, Ar), 7.27-7.32 м (7Н, Ar), 7.94 с (1H, C3HTrz), 8.58 с (1H, C5HTrz).
Аналогично получают соедиение 12.
Пример 6. Получение N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9)
К раствору 0,408 г (1,5 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 8 мл этанола, добавляют 0,084 г (1,5 ммоль) гидроксида калия. К нагретой до кипения реакционной массе добавляют 0,2415 г (1,5 ммоль) 4-хлорбензилхлорида, растворенного в 3 мл этанола, кипятят в течение 6 ч., упаривают растворитель на РПИ в вакууме водоструйного насоса. Технический продукт растворяют в хлористом метилене (5 мл), перемешивают с 8% водным раствором гидроксида калия в течение 2 ч, органический слой отделяют, водный слой экстрагируют хлористым метиленом (2×5 мл), осушают сульфатом магния, отфильтровывают, фильтрат упаривают на РПИ в вакууме водоструйного насоса, получают 0,303 г (51%) N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 105-106°С.
Пример 7. Получение N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9)
К раствору 0,1904 г (0,7 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 2,5 мл диметилформамида, добавляют 0,107 мл (0,77 ммоль) триэтиламина. К нагретой до кипения реакционной массе добавляют 0,1127 г (0,7 ммоль) 4-хлорбензилхлорида, растворенного в 1 мл диметилформамида, нагревают до 140°С и перемешивают в течение 6 ч., реакционную массу охлаждают, добавляют 20 мл серного эфира, 10 мл воды, отделяют органический слой. Водный слой промывают 2×15 мл серного эфира и 2×5 мл воды. Объединяют органические фазы, растворитель отгоняют на РПИ в вакууме водоструйного насоса. Технический продукт растворяют в хлористом метилене (5 мл), перемешивают с 8% водным раствором гидроксида калия в течение 2 ч, органический слой отделяют, водный слой экстрагируют хлористым метиленом (2×5 мл), осушают сульфатом магния, отфильтровывают, фильтрат упаривают на РПИ в вакууме водоструйного насоса, получают 0,215 г (87%) N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 104-106°С.
Пример 8. Получение N4-бензил-3-изоамилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (10)
К раствору 0,17 г (0,685 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 7 мл ТГФ добавляют 0,148 г (1,07 ммоль) карбоната калия,, кипятят в течение 0.5 ч, добавляют раствор 0,103 г (0,685 ммоль) изоамилбромида в 3 мл ТГФ, через 2 ч. отгоняют растворитель на РПИ в вакууме водоструйного насоса, получают технический продукт в виде масла, который кипятят с изооктаном (5×5 мл), верхний слой декантируют, из остатка отгоняют растворитель на РПИ в вакууме водоструйного насоса, получают 0,15 г N4-бензил-3-(изоамил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (69%), с т.пл. 104-106°С.
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 0.83-0.9 м (7Н, (СН 3)2СН), 1.47 к (2Н, СН 2 СН, 3J=7.3), 3,06 т (2Н, СН 2СН2, 3J=7.3), 5.33 с (2Н, СН 2С6Н5), 5.70 с (2Н, CH 2N), 6.96 м (2Н,), 7.31 м (3Н, CHAr), 7.94 с (1H, C3HTrz), 8.60 с (1Н, C5HTrz)
Пример 9. Получение N4-бензил-3-((4-хлорфенокси)этилсульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (11).
К раствору 0,5 г (1,8 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 18 мл абс. ТГФ добавляют 0,202 г (1,8 ммоль) трет-бутилата калия, кипятят в течение 30 мин, добавляют раствор 0,424 г (1,8 ммоль) 1-(2-бромэтокси)-4-хлорбензола в 4 мл абс. ТГФ, кипятят в течение 9 ч, растворитель отгоняют на РПИ в вакууме водоструйного насоса. Остаток промывают серным эфиром (2×3 мл), получают 0,502 г (66%) N4-бензил-3-((4-хлорфенилокси)этилсульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 97-99°С.
1Н ЯМР-Спектр (δ, м.д., 3J, Гц): 3.46 дд (2Н, CH 2 S, 3J=6.6, 3J=5.5), 4.20 т (2Н, CH 2O, 3J=6.6), 5.32 с (2Н, СН 2С6Н5), 5.69 с (2Н, CH 2 N), 6.92 м (4Н, 4CHAr), 7.26 м (5Н, 5CHAr), 7.93 с (1H, C3HTrz), 8.59 с (1Н, C5HTrz).
Аналогично получают соединения (13-26).
Пример 10. Получение N4-бензил-3-((2-метил-4-хлорфенокси)этил-сульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (27).
К раствору 0,204 г (0,75 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 10 мл абс. ТГФ добавляют 0,0924 г (0,825 ммоль) трет-бутилата калия, кипятят в течение 1 ч, добавляют раствор 0,187 г (0,75 ммоль) 1-(2-бромэтокси)-2-метил-4-хлорбензола в 3 мл абс. ТГФ, кипятят в течение 6 ч, растворитель отгоняют на РПИ в вакууме водоструйного насоса. Остаток промывают серным эфиром (2×3 мл), получают 0,215 г (65%) N4-бензил-3-((2-метил-4-хлорфенокси)этилсульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 88-90°С.
1Н ЯМР-Спектр (δ, м.д., 3J, Гц): 2.4 с (3Н, CH3Ar), 3.51 т (2Н, CH 2 S, 3J=5.9), 4.22 т (2Н, CH 2O,3J=5.9), 5.34 с (2Н, СН 2С6Н5), 5.71 с (2Н, CH 2 N), 6.92-7.05 м (3Н, 3CHAr), 7.26 м (5H, 5CHAr), 7.94 с (1Н, C3HTrz), 8.60 с (1H, C5HTrz).
Продолжение Табл. 6.
Пример 11. Получение гидрохлорида N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9*).
К раствору 0,12 г (0,302 ммоль) N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола в 2 мл абс. этанола, добавляют 137 мкл 2.2 М раствора соляной кислоты (0,302 ммоль) в диэтиловом эфире, перемешивают в течение 4 ч., растворитель отгоняют на РПИ в вакууме водоструйного насоса. К остатку в виде масла добавляют 0.2 мл серного эфира, выпавшие кристаллы отфильтровывают на фильтре Шотта, получают 0,123 г гидрохлорида N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (93%), с т.пл. 93-95°С.
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 4.36 с (2Н, CH2C6H4Cl), 5.25 с (2Н, СН 2С6Н5), 5.72 с (2Н, CH 2N), 6.86 м (2Н, Ar), 7.27-7.33 м (7Н, Ar), 8.07 с (1Н, C3HTrz), 8.79 с (1Н, C5HTrz).
Пример 12. Композиция концентрата эмульсии
Действующее вещество (N4-(бензил)-3-[2-(3,4-дихлорфенил-окси)этилсульфанил]-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол) 6 г
Алкилбензолсульфокислоты кальциевая соль (АБСК) 2 г
Оксиэтилированный октилфенол (ОП-7) 8 г
Циклогексанон 29 г
Ксилол 16 г
Нефтяной сольвент 29 г.
Пример 13.
Испытания на фунгицидную активность соединений общей формулы I, проводили в экспериментах in vitro. [Методические рекомендации по определению фунгицидной активности новых соединений. Черкассы: НИИТЭХИМ. 1984. 34 с.]. Действие препаратов на радиальный рост мицелия определяли растворением композиции соединения в ацетоне и внесением аликвоты в картофеле-сахарозный агар при 50°С до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах с действующими веществами составили 1%. В чашки Петри, содержащие 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в инкубаторе при 25°С и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 7.
Обозначения: V.i. - Venturia inaequalis, R.s. - Rhizoctonia solani, F.o. - Fusarium oxysporum, F.m. - Fusarium moniliforme, B.s. - Bipolaris sorokiniana, S.s. - Sclerotinia sclerotiorum.
* - Триадимефон - 3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-бутанон-2
Пример 14.
Испытания на рострегуляторную активность соединений общей формулы I, где R1 и R2 разные, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемый из группы, фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группы общей формулы XnC6H5-nO(СН2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(CH2)m, где X означает атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 6, перфторалкильную группу с числом атомов углерода от 1 до 3, n - означает целое число от 0 до 5, m означает целое число от 1 до 3, проводили в экспериментах in vivo на проростках огурца сорта «Единство». Испытания проводили в соответствии с методическими рекомендациями на трехдневных проростках. Растворы соединений, с концентрацией 10 мг/мл вещества в ДМСО, доводили до необходимой концентрации - 10, 0,1 и 0,001 мг/л добавлением дистиллированной воды [Методические рекомендации по проведению лабораторного скрининга синтетических регуляторов роста растений. Под ред. Шаповалова А.А. // Черкассы.: НИИТЭХим. - 1985. - 29 с.].
Семена огурца равномерно раскладывали в чашки Петри на фильтры, смоченные раствором исследуемого вещества; на одну чашку брали 10 семян и 4 мл раствора. Каждый вариант включал х 3 чашки с семенами, которые выдерживали трое суток в термостате при температуре 24°С. Соединения испытывали так же в трех концентрациях - 10; 0,1 и 0,001 мг/л. Контролем служили чашки с дистиллированной водой.
В качестве эталона использовали паклобутразол.
Через 3 дня проводили учет всхожести семян, затем в каждой чашке отбирали по 5 хорошо развитых проростков и измеряли у них длину корня и гипокотиля, определяли суммарную сырую и сухую массу гипокотилей.
Полученные результаты представлены в таблице 8.
* Эталон - паклобутразол(4,4-диметил-2-(1,3,4-триазол-1-ил)-1-(4-хлорфенил)пентанол-3
Пример 15.
Оценку рострегуляторной активности проводили рулонным методом на семенах яровой пшеницы сорта "Дарья". Метод основан на проращивании семян пшеницы предварительно обработанных растворами испытуемых соединений. Используемые конц. соединений 10, 0,1 и 0,001 мг/л.
Семена пшеницы выкладывали в чашки Петри и заливали растворами испытываемых соединений до полного погружения. Спустя 14 часов семена извлекали и укладывали по 30 шт. на заготовку для проращивания. Заготовка состояла из 3 слоев - полоса полиэтиленовой пленки 12×55 см, и такого же размера фильтровальной бумаги и миллиметровки, сверху семена накрывали такой же бумагой, увлажняли опрыскиванием из пульверизатора и, свернув рулоном, помещали в пластиковые стаканчики с 50 мл дистиллированной воды после чего оставляли для прорастания при температуре 22°С.
Через 7 суток проводилась оценка длины, веса ростков и корней пшеницы. Каждый опыт включал себя по 3 повторности по 10 семян. В качестве эталона использовали Паклобутразол. Через 3 дня проводили учет всхожести семян, затем в каждой чашке отбирали по 5 хорошо развитых проростков и измеряли у них длину корня и гипокотиля, определяли суммарную сырую и сухую массу гипокотилей.
Полученные результаты представлены в таблице 9.
* Эталон - паклобутразол (4,4-диметил-2-(1,3,4-триазол-1-ил)-1-(4-хлорфенил)пентанол-3
Claims (11)
1. N4-Замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I:
где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, арилметильную группу общей формулы XnC6H5-nCH2 или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(СН2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3 или их агрохимически или фармацевтически приемлемые соли.
2. Способ получения N4-замещенных-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, арилметильную группу общей формулы XnC6H5-nCH2 или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=CH(СН2)m, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
заключающийся в том, что N4-замещенные 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионы общей формулы IX, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
вводят во взаимодействие с алкилгалогенидами X, где R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(СН2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
в присутствии оснований: гидроксидов, алкоголятов, карбонатов щелочных металлов, третичных аминов, в полярных апротонных или протонных растворителях при температуре от 20 до 160°С
3. Фунгицидная композиция, содержащая фунгицид в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве фунгицида используют N4-замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы I по п. 1.
4. Рострегуляторная композиция, содержащая регулятор роста растений в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве регулятора роста используют замещенные N4-замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы I по п. 1.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2017139534A RU2668212C1 (ru) | 2017-11-14 | 2017-11-14 | N4-Замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2017139534A RU2668212C1 (ru) | 2017-11-14 | 2017-11-14 | N4-Замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2668212C1 true RU2668212C1 (ru) | 2018-09-27 |
Family
ID=63668928
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017139534A RU2668212C1 (ru) | 2017-11-14 | 2017-11-14 | N4-Замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2668212C1 (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2757808C1 (ru) * | 2020-04-30 | 2021-10-21 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Российский химико-технологический университет имени Д.И. Менделеева" (РХТУ им. Д.И. Менделеева) | 2-Алкилтио-5-(1Н-1,2,4,-триазол-1-илметил)-1,3,4-тиадиазолы, способ их получения и фунгицидные композиции на их основе |
| RU2793284C1 (ru) * | 2022-07-04 | 2023-03-30 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Пермская государственная фармацевтическая академия" Министерства здравоохранения Российской Федерации | Применение производного циннамилтио-1,2,4-триазола в качестве антигельминтного и ларвицидного средств |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104829598A (zh) * | 2015-05-27 | 2015-08-12 | 贵州大学 | 一种含1,2,4-三氮唑硫醚的喹唑啉酮类化合物及其合成方法和应用 |
-
2017
- 2017-11-14 RU RU2017139534A patent/RU2668212C1/ru active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104829598A (zh) * | 2015-05-27 | 2015-08-12 | 贵州大学 | 一种含1,2,4-三氮唑硫醚的喹唑啉酮类化合物及其合成方法和应用 |
Non-Patent Citations (5)
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2757808C1 (ru) * | 2020-04-30 | 2021-10-21 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Российский химико-технологический университет имени Д.И. Менделеева" (РХТУ им. Д.И. Менделеева) | 2-Алкилтио-5-(1Н-1,2,4,-триазол-1-илметил)-1,3,4-тиадиазолы, способ их получения и фунгицидные композиции на их основе |
| RU2794339C1 (ru) * | 2022-03-21 | 2023-04-17 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Российский химико-технологический университет имени Д.И. Менделеева" (РХТУ им. Д.И. Менделеева) | 2-Алкилтио-5-(1,2,4-триазол-1-илметил)-1,3,4-оксадиазолы, способ их получения и фунгицидные композиции на их основе |
| RU2793284C1 (ru) * | 2022-07-04 | 2023-03-30 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Пермская государственная фармацевтическая академия" Министерства здравоохранения Российской Федерации | Применение производного циннамилтио-1,2,4-триазола в качестве антигельминтного и ларвицидного средств |
| RU2810785C1 (ru) * | 2023-04-24 | 2023-12-28 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Российский химико-технологический университет имени Д.И. Менделеева" (РХТУ им. Д.И. Менделеева) | 5-Алкилтио-4-арилиденамино-3-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения и фунгицидные композиции на их основе |
| RU2819160C1 (ru) * | 2023-10-23 | 2024-05-14 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Российский химико-технологический университет имени Д.И. Менделеева" (РХТУ им. Д.И. Менделеева) | Фунгицидная композиция N-(5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-ил)-метаниминов |
| RU2827565C1 (ru) * | 2023-10-23 | 2024-09-30 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Российский химико-технологический университет имени Д.И. Менделеева" (РХТУ им. Д.И. Менделеева) | N-(5-(1,2,4-Триазол-1-илметил)-1,2,4-триазол-3-ил)-метанимины и способ их получения |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0264217B1 (en) | Aralkylaminopyrimidine derivative, process for producing thereof and insecticide, acaricide and fungicide containing said derivative as active ingredient | |
| DE69524925T2 (de) | Pyrazinone und ihre Verwendung als Fungizide | |
| HU199430B (en) | Herbicides comprising 1h-imidazole derivatives as active ingredient and process for producing the compounds | |
| IL44710A (en) | 1-phenyl-2-azolyl-formamidines their preparation and their use as herbicides | |
| JPS6097962A (ja) | 1−置換イミダゾ−ル−5−カルボン酸誘導体,それらの製造方法ならびにそれらを含有する殺菌剤,除草剤および植物生長調整剤 | |
| CN103755700B (zh) | 一种吡唑酰胺类化合物及其用途 | |
| RU2668212C1 (ru) | N4-Замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе | |
| CS208757B2 (en) | Fungicide means and method of making the active substances | |
| CS195322B2 (en) | Fungicide and method of preparing active substances therefor | |
| KR900001910B1 (ko) | 1-디메틸카르바모일-3-치환-5-치환-1h-1,2,4-트리아졸 및 그의 제조방법 | |
| CS236691B2 (en) | Agent for regulation of plant growth and fungicide agent and production method of its efficient components | |
| JPH0261945B2 (ru) | ||
| DK146026B (da) | Beta-azolylketoner med fungicid virkning | |
| JPS5865281A (ja) | 1,2,4−トリアゾ−ル誘導体および農園芸用殺菌剤 | |
| JPS6025427B2 (ja) | アシル化イミダゾリル−o,n−アセタ−ル、その製造法および殺菌用組成物 | |
| NO792575L (no) | 1,2,3-triazolcarboxylsyreamider, fremgangsmaate for fremstilling av disse, samt biocide midler inneholdende disse | |
| RU2794339C1 (ru) | 2-Алкилтио-5-(1,2,4-триазол-1-илметил)-1,3,4-оксадиазолы, способ их получения и фунгицидные композиции на их основе | |
| RU2757808C1 (ru) | 2-Алкилтио-5-(1Н-1,2,4,-триазол-1-илметил)-1,3,4-тиадиазолы, способ их получения и фунгицидные композиции на их основе | |
| RU2810785C1 (ru) | 5-Алкилтио-4-арилиденамино-3-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения и фунгицидные композиции на их основе | |
| RU2819160C1 (ru) | Фунгицидная композиция N-(5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-ил)-метаниминов | |
| EP0375414B1 (en) | Substituted guanidine and amidine compounds, their production and fungicidal use | |
| CN108117519B (zh) | 一种含吡唑环的酰胺类化合物及其制备方法与应用 | |
| JPS6067479A (ja) | 新規なビラゾリル‐およびイソキゾリルスルホニル尿素、それらの製造方法およびそれらを含有する除草剤および植物生長調整剤 | |
| US4596801A (en) | 4H-3,1-benzoxazine derivatives, process for producing the same and agricultural or horticultural fungicide containing the same | |
| DE68928885T2 (de) | 1-Dimethylcarbamoyl-1H-1,2,4-triazole-substituiert in Stellungen 3 und 5 |