RU2646416C2 - Способ получения высокочистого раствора нитрата церия (iii) - Google Patents
Способ получения высокочистого раствора нитрата церия (iii) Download PDFInfo
- Publication number
- RU2646416C2 RU2646416C2 RU2016129173A RU2016129173A RU2646416C2 RU 2646416 C2 RU2646416 C2 RU 2646416C2 RU 2016129173 A RU2016129173 A RU 2016129173A RU 2016129173 A RU2016129173 A RU 2016129173A RU 2646416 C2 RU2646416 C2 RU 2646416C2
- Authority
- RU
- Russia
- Prior art keywords
- cerium
- excess
- stoichiometric amount
- solution
- hydrogen peroxide
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 37
- HSJPMRKMPBAUAU-UHFFFAOYSA-N cerium(3+);trinitrate Chemical compound [Ce+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O HSJPMRKMPBAUAU-UHFFFAOYSA-N 0.000 title claims abstract description 33
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 claims abstract description 35
- CETPSERCERDGAM-UHFFFAOYSA-N ceric oxide Chemical compound O=[Ce]=O CETPSERCERDGAM-UHFFFAOYSA-N 0.000 claims abstract description 30
- 229910000422 cerium(IV) oxide Inorganic materials 0.000 claims abstract description 29
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 claims abstract description 28
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 claims abstract description 19
- 229910017604 nitric acid Inorganic materials 0.000 claims abstract description 19
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 claims abstract description 18
- 238000010438 heat treatment Methods 0.000 claims abstract description 17
- 239000000047 product Substances 0.000 claims abstract description 17
- 235000006408 oxalic acid Nutrition 0.000 claims abstract description 9
- 238000003756 stirring Methods 0.000 claims abstract description 6
- 238000001914 filtration Methods 0.000 claims abstract description 4
- 238000001816 cooling Methods 0.000 claims abstract description 3
- 239000012467 final product Substances 0.000 claims abstract description 3
- 238000004090 dissolution Methods 0.000 claims description 12
- 239000002244 precipitate Substances 0.000 claims description 10
- 238000000926 separation method Methods 0.000 claims description 3
- 230000015572 biosynthetic process Effects 0.000 claims description 2
- 239000000243 solution Substances 0.000 abstract description 36
- 239000007864 aqueous solution Substances 0.000 abstract description 7
- 238000005516 engineering process Methods 0.000 abstract description 7
- 229960001759 cerium oxalate Drugs 0.000 abstract description 5
- ZMZNLKYXLARXFY-UHFFFAOYSA-H cerium(3+);oxalate Chemical compound [Ce+3].[Ce+3].[O-]C(=O)C([O-])=O.[O-]C(=O)C([O-])=O.[O-]C(=O)C([O-])=O ZMZNLKYXLARXFY-UHFFFAOYSA-H 0.000 abstract description 5
- 239000000126 substance Substances 0.000 abstract description 3
- 230000000694 effects Effects 0.000 abstract description 2
- 239000000706 filtrate Substances 0.000 abstract 1
- 239000011737 fluorine Substances 0.000 description 22
- 229910052731 fluorine Inorganic materials 0.000 description 22
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 19
- -1 fluoride anions Chemical class 0.000 description 16
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 8
- 239000012535 impurity Substances 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 229910052684 Cerium Inorganic materials 0.000 description 7
- GWXLDORMOJMVQZ-UHFFFAOYSA-N cerium Chemical compound [Ce] GWXLDORMOJMVQZ-UHFFFAOYSA-N 0.000 description 7
- 150000001785 cerium compounds Chemical class 0.000 description 7
- 229910052761 rare earth metal Inorganic materials 0.000 description 7
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 6
- 239000004327 boric acid Substances 0.000 description 6
- 238000000605 extraction Methods 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 150000000703 Cerium Chemical class 0.000 description 5
- 239000003960 organic solvent Substances 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 239000002994 raw material Substances 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 4
- 238000001354 calcination Methods 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 229910015900 BF3 Inorganic materials 0.000 description 2
- 229910002651 NO3 Inorganic materials 0.000 description 2
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 239000012266 salt solution Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- STCOOQWBFONSKY-UHFFFAOYSA-N tributyl phosphate Chemical compound CCCCOP(=O)(OCCCC)OCCCC STCOOQWBFONSKY-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 229910052776 Thorium Inorganic materials 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 238000010306 acid treatment Methods 0.000 description 1
- 150000008043 acidic salts Chemical class 0.000 description 1
- 239000003929 acidic solution Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- RGCKGOZRHPZPFP-UHFFFAOYSA-N alizarin Chemical compound C1=CC=C2C(=O)C3=C(O)C(O)=CC=C3C(=O)C2=C1 RGCKGOZRHPZPFP-UHFFFAOYSA-N 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 229910000420 cerium oxide Inorganic materials 0.000 description 1
- DRVWBEJJZZTIGJ-UHFFFAOYSA-N cerium(3+);oxygen(2-) Chemical class [O-2].[O-2].[O-2].[Ce+3].[Ce+3] DRVWBEJJZZTIGJ-UHFFFAOYSA-N 0.000 description 1
- ITZXULOAYIAYNU-UHFFFAOYSA-N cerium(4+) Chemical compound [Ce+4] ITZXULOAYIAYNU-UHFFFAOYSA-N 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000004042 decolorization Methods 0.000 description 1
- 239000002283 diesel fuel Substances 0.000 description 1
- 150000002222 fluorine compounds Chemical class 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- DXTCFKRAUYBHRC-UHFFFAOYSA-L iron(2+);dithiocyanate Chemical compound [Fe+2].[S-]C#N.[S-]C#N DXTCFKRAUYBHRC-UHFFFAOYSA-L 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 238000005272 metallurgy Methods 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000005304 optical glass Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 238000005498 polishing Methods 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000012797 qualification Methods 0.000 description 1
- 238000004451 qualitative analysis Methods 0.000 description 1
- 150000002910 rare earth metals Chemical class 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01F—COMPOUNDS OF THE METALS BERYLLIUM, MAGNESIUM, ALUMINIUM, CALCIUM, STRONTIUM, BARIUM, RADIUM, THORIUM, OR OF THE RARE-EARTH METALS
- C01F17/00—Compounds of rare earth metals
- C01F17/20—Compounds containing only rare earth metals as the metal element
- C01F17/276—Nitrates
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01F—COMPOUNDS OF THE METALS BERYLLIUM, MAGNESIUM, ALUMINIUM, CALCIUM, STRONTIUM, BARIUM, RADIUM, THORIUM, OR OF THE RARE-EARTH METALS
- C01F17/00—Compounds of rare earth metals
- C01F17/20—Compounds containing only rare earth metals as the metal element
- C01F17/206—Compounds containing only rare earth metals as the metal element oxide or hydroxide being the only anion
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G1/00—Methods of preparing compounds of metals not covered by subclasses C01B, C01C, C01D, or C01F, in general
- C01G1/08—Nitrates
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Geology (AREA)
- Inorganic Chemistry (AREA)
- Compounds Of Alkaline-Earth Elements, Aluminum Or Rare-Earth Metals (AREA)
- Inorganic Compounds Of Heavy Metals (AREA)
Abstract
Изобретение может быть использовано при производстве катализаторов, присадок к дизельному топливу, люминофоров, а также в оптическом стекловарении. Для осуществления способа проводят обработку высокочистого диоксида церия при 70-80оС концентрированной азотной кислотой, содержащей 1,5-5 мас.% плавиковой кислоты от стехиометрического, последующее добавление перекиси водорода в 1,5-5-кратном избытке от стехиометрического количества, нагрев реакционной массы до 90-100°С при перемешивании, охлаждение и фильтрацию полученного раствора. Затем фильтрат, содержащий нитрат церия, нагревают до 50-60°С, добавляют щавелевую кислоту в избытке 10-20% относительно стехиометрического количества. Выпавший осадок оксалата церия подвергают термообработке на воздухе при 320-370°С. Продукт термообработки растворяют при 80-90°С в концентрированной азотной кислоте, используемой в избытке 5-20% от стехиометрического количества, и при добавлении перекиси водорода, взятой в 1,5-5 кратном избытке от стехиометрического количества по отношению к диоксиду церия до образования конечного продукта - водного раствора нитрата церия(III). Способ обеспечивает получение высокочистого продукта, удовлетворяющего требованиям современных отраслей техники. 1 табл., 3 пр.
Description
Изобретение относится к технологии получения чистых солей редкоземельных элементов, применяемых при производстве катализаторов, присадок к дизельному топливу, люминофоров, а также в оптическом стекловарении и в других областях техники и непосредственно касается технологии получения высокочистого водного раствора нитрата церия(III).
Известно, что для получения различных церийсодержащих соединений применяются высокочистые растворы солей церия, в частности - растворы нитрата церия(III). В качестве исходного продукта при получении растворов солей церия, в частности - нитратов церия, в ряде случаев используется диоксид церия. Однако использование диоксида церия в качестве исходного продукта при получении чистых растворов нитрата церия осложнено тем, что диоксид церия трудно растворим в азотной кислоте. Поэтому растворение диоксида церия с получением трехвалентного нитрата в известных публикациях предлагается проводить в избытке азотной кислоты с добавлением фторид-анионов и перекиси водорода. Фторид-анионы вводятся для облегчения вскрытия диоксида церия, а перекись водорода вводится для восстановления церия до трехвалентного состояния [Коровин С.С., Зимина Г.В., Резник A.M., Букин В.И., Корнюшко В.Ф. Редкие и рассеянные элементы. Химия и технология. Книга 1. Под ред. Коровина С.С. М: МИСИС. 1996. 376 с.]. Как результат, получаемые описанным методом растворы нитрата церия содержат значительное количество фторид-аниона, что может оказаться нежелательным для применения таких продуктов в ряде современных отраслей техники. Таким образом, наличие ионов фтора в церийсодержащих продуктах является одной из проблем. Наличие фтора в церийсодержащих продуктах объясняется и тем фактом, что основным исходным сырьем для получения соединений церия является минерал бастнезит, содержащий значительное количество фтора, являющийся смесью фторкарбонатов лантанидов [RU 2114204, С22В 59/00, 1998]. Поэтому одной из задач, которую ставят перед собой разработчики технологии получения чистых соединений церия, в частности оксидов и солей церия, является очистка этих соединений от примесей фтора.
Отдельную сложность представляет собой количественное определение фторид-аниона в небольших количествах для контроля получаемых соединений церия.
Количественное определение концентрации фторид-ионов в растворе обычно проводят с помощью ионоселективного электрода, но рабочий диапазон pH фторидного электрода лежит в интервале 5,5-6,5, и такая методика не может применяться в кислой среде.
Существующие методики для определения фторидов в кислой среде являются трудно реализуемыми: например, ториметрическое титрование (титрование солями тория) в присутствии ализаринового красного [Киселева Е.К. Анализ фторсодержащих соединений. Л.: Химия, 1966, с. 71]. Качественное определение F-, например, обесцвечивание роданида железа или визуальный цирконий-ализариновый метод, не обладает чувствительностью для определения фторида при содержании <1% [Крешков А.П. Основы аналитической химии. Теоретические основы. Качественный анализ. М.: Химия, 1970, с. 406]. Сложность определения фторид-иона в кислых растворах является еще одним основанием для получения нитрата церия заведомо без добавления HF при растворении.
Поэтому особенную актуальность приобретают способы получения соединений церия, при реализации которых отсутствие фтора гарантируется химизмом процессов.
Как видно из известных научно-технических и патентных публикаций, очистка от фтора РЗЭ, в том числе соединений церия, решается различными методами. Широко применяется для данных целей обработка очищаемого продукта химическими соединениями, связывающими фтор.
Например, для очистки от фтора применяется борная кислота или соединения, образующие борную кислоту [Михайличенко И.А. и др. Редкоземельные металлы. М.: Металлургия, 1987, с. 53; GB 1491180 С1А, 1977].
Удаление фтора из фторсодержащих растворов РЗЭ, включающих церий, при обработке их борной кислотой осуществляется благодаря связыванию фтора и протекает по следующему механизму связывания фтора:
4HF+H3BO3=3H2O+HBF4.
При этом, как известно, получаются стабильные борфторидные ионы, легко растворимые в воде, которые экстрагируются из органической фазы. Например, в известном способе получения редкоземельных элементов, не содержащих фтора, из соединений редкоземельных элементов, содержащих фтор, согласно патенту [GB 1491180 С1А, 1977], процесс осуществляют путем выделения соли РЗЭ из кислотного раствора соли в присутствии борной кислоты, взятой в количестве, необходимом для связывания ионов фтора. При этом связанные ионы фтора остаются в растворе, а соль РЗЭ, в частности нитрат церия, не содержащая ионы фтора, выделяется из раствора. При осуществлении такой очистки от фтора с помощью борной кислоты существенное влияние оказывает последовательность обработки очищаемого от фтора раствора соли церия. Как сказано в описании к патенту [GB 1491180], оптимально сначала осуществлять обработку борной кислотой исходного азотнокислого раствора солей РЗЭ, а затем проводить экстракцию нитрата Се3+ трибутилфосфатом при определенном pH среды. В качестве исходного очищаемого продукта в описании к данному патенту приводится пример на способ очистки раствора солей РЗЭ, содержащих 6,2 мас.% диоксида церия на 1 л и 2,7 мас.% фтора. После отделения водного раствора борфторидных ионов в раствор соли церия вводится 2,5N водный раствор щавелевой кислоты. Получаемые таким образом оксалаты РЗЭ после фильтрации и промывки не содержат ионов фтора. Прокаливанием оксалата на последней стадии получается диоксид церия, не содержащий фтора. Недостатком этого метода является то, что конечным продуктом оказывается диоксид церия, а не растворимая соль.
В качестве прототипа предлагаемого способа выбран известный способ получения нитрата церия(III), очищенного от фтора, включающий экстракцию церия(IV) из фторсодержащего раствора органическим растворителем (50%-ным ТБФ в ксилоле), последующую реэкстракцию в присутствии восстановителя (перекиси водорода) и затем обработку реэкстракта при pH 3,0-5,2 соединениями, обладающими щелочными свойствами (гидроксидами или карбонатами щелочных металлов или аммония) [RU 2085494, C07F 17/00, 1997]. Благодаря этому способу происходит выпадение осадка, захватывающего из раствора фторид-анион.
Вышеприведенный способ предлагается применять для получения церия из сырья относительно низкой чистоты, например полировальных порошков. Данный способ не применим для решения задач в области высокочистых веществ, поскольку он имеет ряд недостатков. Так, при полной реализации способа он включает в себя стадии экстракции и реэкстракции с использованием органического растворителя, что повышает трудоемкость процесса и, следовательно, риск загрязнения. При частичной реализации, способ не гарантирует полной очистки от фтора и требует тщательного подбора условий. Кроме того, способ подразумевает использование для очистки раствора Се(III), который получается после реэкстракции церия и органического растворителя в присутствии восстановителя.
С целью создания эффективного процесса, обеспечивающего высокую степень чистоты получаемого раствора нитрата церия(III), осуществляемого без использования дорогостоящего оборудования и применения больших объемов органических растворителей, предлагается новый способ получения высокочистого раствора нитрата церия(III), который включает следующие последовательные стадии процесса: обработку высокочистого диоксида церия при 70-80°С концентрированной азотной кислотой, содержащей 1-5 мас.% плавиковой кислоты по отношению к диоксиду церия, и последующее добавление перекиси водорода в 1-10-кратном избытке от стехиометрического количества по отношению к диоксиду церия, нагрев реакционной массы до 90-100°С при перемешивании, охлаждение и фильтрацию полученного раствора, нагревание его до 50-60°С и добавление к нему щавелевой кислоты в избытке 0-20% относительно стехиометрического количества, отделение и термообработку выпавшего осадка на воздухе при 320-370°С и последующее растворение продукта термообработки при 80-90°С в концентрированной азотной кислоте, используемой в избытке 0-20% от стехиометрического количества и при добавлении перекиси водорода, взятой в 1-10-кратном избытке от стехиометрического количества по отношению к диоксиду церия до получения конечного продукта.
В отличие от прототипа, предлагаемый способ не включает стадии экстракции и реэкстракции с использованием органического растворителя, требующие для эффективного проведения использования специального оборудования и повышающие риск загрязнения получаемых соединений посторонними примесями.
В качестве исходных продуктов в предлагаемом способе на всех стадиях используются высокочистое химическое сырье, а именно высокочистый диоксид церия, высокочистые химические соединения (квалификации не ниже ч.д.а.), такие как азотная кислота, перекись водорода, плавиковая кислота, щавелевая кислота.
Существенным признаком данного изобретения являются режимы проведения всего процесса. Например, прокалка оксалата церия проводится на воздухе при температуре в интервале 320-370°С, что приводит к формированию оксидного производного церия, которое затем растворяют в азотной кислоте с добавлением перекиси водорода в качестве восстановителя, получая раствор нитрата церия(III). Данную стадию проводят без добавления фторид-иона и существенного избытка кислоты, в отличие от известных аналогов, в которых прокаливание проводится при более высокой температуре, а процесс растворения проводится в присутствии плавиковой кислоты и значительного избытка азотной кислоты.
Основным преимуществом предлагаемого способа является подборка условий возможности проведения процесса растворения диоксида церия на последней стадии без добавления фторид-ионов и, соответственно, получение конечного раствора нитрата церия(III), не содержащего фторид-иона, что важно для их дальнейшего применения. Предлагаемый способ технологичен, экономически доступен благодаря использованию коммерчески доступного сырья и несложного аппаратурного оформления процесса.
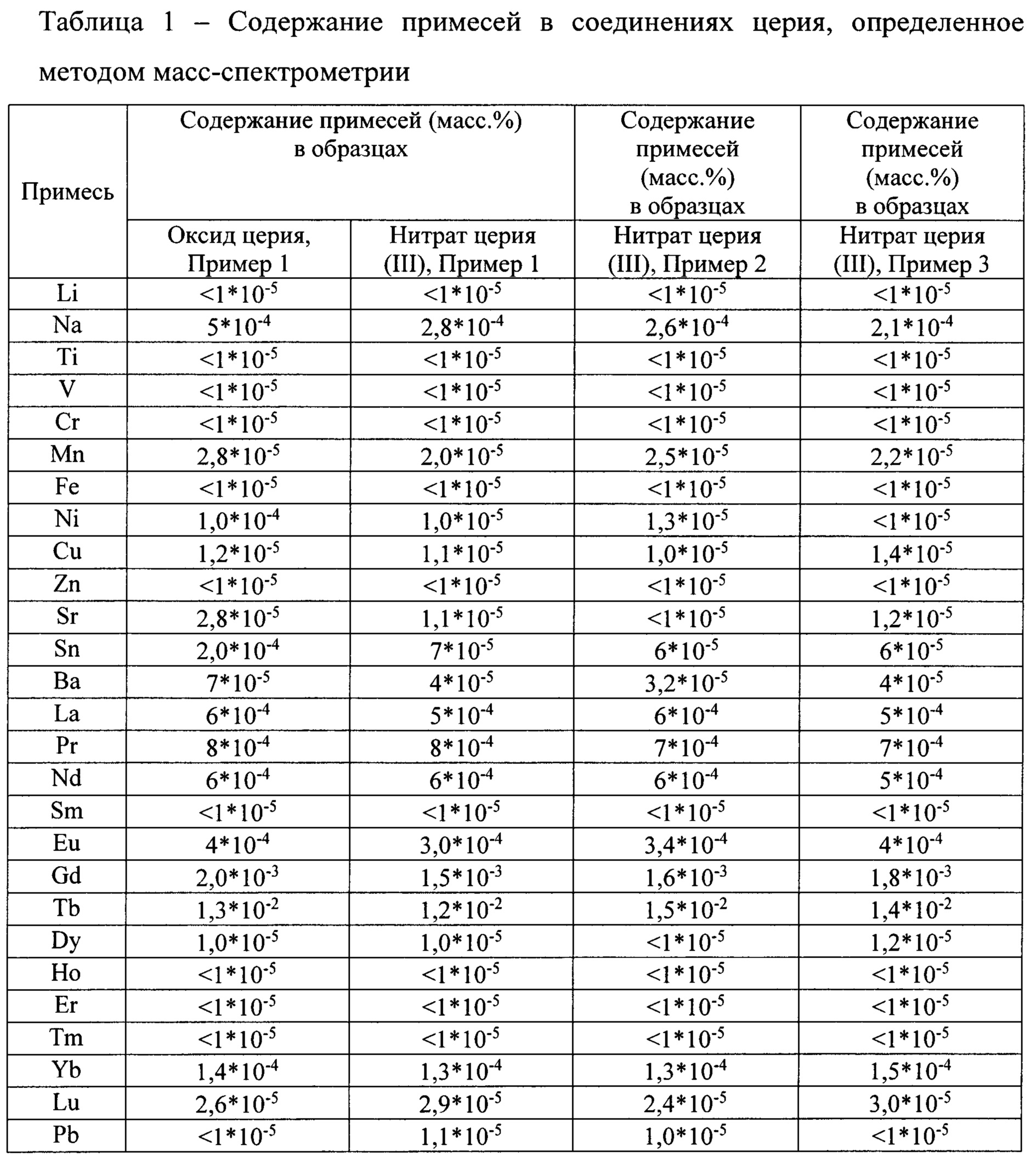
Эффективность способа подтверждается приведенной ниже Таблицей 1, в которой приводится содержание примесей в соединениях церия, определенное методом масс-спектрометрии. Относительная погрешность определения - не более 30%.
Предлагаемое изобретение иллюстрируется следующими примерами.
Пример 1.
В качестве исходного сырья используют диоксид церия СеО2 с чистотой 99,99%, примесный состав которого приведен в таблице 1. Также используют азотную кислоту и перекись водорода квалификации ос.ч., плавиковую кислоту и щавелевую кислоту квалификации х.ч.
В емкость для растворения вносят 20 г диоксида церия, добавляют 60 мл азотной кислоты с концентрацией 50% и 1,7 мл плавиковой кислоты с концентрацией 50% (5 мас.% от количества СеО2). Реакционную массу нагревают до 70-80°С и постепенно по каплям приливают 25 мл раствора перекиси водорода с концентрацией 10% (1,5-кратный избыток). Далее поднимают температуру реакционной массы до 90-100°С и ведут нагрев с перемешиванием до растворения диоксида церия (допускается наличие остаточной взвеси). Полученный раствор остужают и фильтруют.
Полученный раствор нагревают до 50-60°С и добавляют 165 мл водного раствора щавелевой кислоты с концентрацией 100 г/л (избыток 10%). Полученный осадок оксалата церия отфильтровывают, затем проводят термообработку осадка в температурном интервале 320-370°С на воздухе в течение 2 ч.
Полученный продукт прокаливания, по составу соответствующий диоксиду церия СеО2, вносят в емкость для растворения, добавляют азотную кислоту с избытком 5% от стехиометрического и нагревают до 80-90°С. Затем по каплям приливают 25 мл раствора перекиси водорода с концентрацией 10% (1,5-кратный избыток). Ведут нагревание до растворения продукта термообработки. Продукт растворяется полностью. Таким образом, получают водный раствор нитрата церия(III). Примесный состав полученного нитрата церия приведен ниже в Таблице 1.
Пример 2.
Процесс проводят аналогично примеру 1, используя иные соотношения реагентов. В емкость для растворения вносят 20 г диоксида церия, добавляют 60 мл азотной кислоты с концентрацией 50% и 0,5 мл плавиковой кислоты с концентрацией 50% (1,5 мас.% от количества СеО2). Реакционную массу нагревают до 70-80°С и постепенно по каплям приливают 110 мл раствора перекиси водорода с концентрацией 3% (2-кратный избыток). Далее поднимают температуру реакционной массы до 90-100°С и ведут нагрев с перемешиванием до растворения диоксида церия (допускается наличие остаточной взвеси). Полученный раствор остужают и фильтруют.
Полученный раствор нагревают до 50-60°С и добавляют 185 мл раствора щавелевой кислоты с концентрацией 100 г/л (избыток 20%). Полученный осадок оксалата церия отфильтровывают, затем проводят термообработку осадка в температурном интервале 320-370°С на воздухе в течение 2 ч.
Полученный продукт прокаливания, по составу соответствующий диоксиду церия СеО2, вносят в емкость для растворения, добавляют стехиометрическое количество азотной кислоты с избытком 20% и нагревают до 80-90°С. Затем по каплям приливают 110 мл раствора перекиси водорода с концентрацией 3% (2-кратный избыток). Ведут нагревание до растворения продукта. Примесный состав полученного нитрата церия приведен ниже в Таблице 1.
Пример 3.
Процесс проводят аналогично примеру 1.
В емкость для растворения вносят 20 г диоксида церия, добавляют 60 мл азотной кислоты с концентрацией 50% и 0,5 мл плавиковой кислоты с концентрацией 50% (1,5 мас.% от количества СеО2). Реакционную массу нагревают до 70-80°С и постепенно по каплям приливают 100 мл раствора перекиси водорода с концентрацией 10% (5-кратный избыток). Далее поднимают температуру реакционной массы до 90-100°С и ведут нагрев с перемешиванием до растворения диоксида церия (допускается наличие остаточной взвеси). Полученный раствор остужают и фильтруют.
Полученный раствор нагревают до 50-60°С и добавляют 185 мл раствора щавелевой кислоты с концентрацией 100 г/л (избыток 20%). Полученный осадок оксалата церия отфильтровывают, затем проводят термообработку осадка в температурном интервале 320-370°С на воздухе в течение 2 ч.
Полученный продукт прокаливания, по составу соответствующий диоксиду церия СеО2, вносят в емкость для растворения, добавляют азотную кислоту с избытком 20% от стехиометрического количества и нагревают до 80-90°С. Затем по каплям приливают 100 мл раствора перекиси водорода с концентрацией 10% (5-кратный избыток). Ведут нагревание до растворения продукта. Таким образом, получают водный раствор нитрата церия(III). Примесный состав полученного нитрата церия приведен ниже в Таблице 1.
Таким образом, предлагаемым способом из распространенного коммерческого сырья - высокочистого оксида церия(IV) может быть получен высокочистый раствор нитрата церия(III) с высокой степенью чистоты.
Ниже в Таблице 1 приводится содержание примесей в соединениях церия, определенное методом масс-спектрометрии. Относительная погрешность определения - не более 30%.
К изобретению «Способ получения высокочистого раствора нитрата церия(III)»
Claims (1)
- Способ получения высокочистого раствора нитрата церия(III), включающий следующие последовательные стадии процесса: обработку высокочистого диоксида церия при 70-80oС концентрированной азотной кислотой, содержащей 1,5-5 мас.% плавиковой кислоты от стехиометрического, и последующее добавление перекиси водорода в 1,5-5-кратном избытке от стехиометрического количества, нагрев реакционной массы до 90-100°С при перемешивании, охлаждение и фильтрацию полученного раствора, нагревание его до 50-60°С и добавление к нему щавелевой кислоты в избытке 10-20% относительно стехиометрического количества, отделение и термообработку выпавшего осадка на воздухе при 320-370°С и последующее растворение продукта термообработки при 80-90°С в концентрированной азотной кислоте, используемой в избытке 5-20% от стехиометрического количества и при добавлении перекиси водорода, взятой в 1,5-5-кратном избытке от стехиометрического количества по отношению к диоксиду церия до образования конечного продукта.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2016129173A RU2646416C2 (ru) | 2016-07-18 | 2016-07-18 | Способ получения высокочистого раствора нитрата церия (iii) |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2016129173A RU2646416C2 (ru) | 2016-07-18 | 2016-07-18 | Способ получения высокочистого раствора нитрата церия (iii) |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015143579/05A Division RU2601763C1 (ru) | 2015-10-13 | 2015-10-13 | Способ получения высокочистого водного раствора нитрата церия (iv) (варианты) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2016129173A RU2016129173A (ru) | 2018-01-23 |
| RU2646416C2 true RU2646416C2 (ru) | 2018-03-05 |
Family
ID=61024038
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016129173A RU2646416C2 (ru) | 2016-07-18 | 2016-07-18 | Способ получения высокочистого раствора нитрата церия (iii) |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2646416C2 (ru) |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1491180A (en) * | 1975-07-25 | 1977-11-09 | Treibacher Chemische Werke Ag | Method of preparing rare earth metal compounds |
| EP0153227A1 (fr) * | 1984-02-20 | 1985-08-28 | Rhone-Poulenc Chimie | Oxyde cérique à nouvelles caractéristiques morphologiques et son procédé d'obtention |
| JPS63223190A (ja) * | 1987-03-13 | 1988-09-16 | Nippon Shokubai Kagaku Kogyo Co Ltd | 硝酸第2セリウム溶液の製造法 |
| RU2085494C1 (ru) * | 1995-07-11 | 1997-07-27 | Институт химии и технологии редких элементов и минерального сырья Кольского научного центра РАН | Способ получения очищенного от фтора нитрата церия |
| RU2162821C2 (ru) * | 1999-05-05 | 2001-02-10 | Всероссийский научно-исследовательский институт химической технологии | Способ выделения церия (+4) из азотнокислого раствора редкоземельных элементов |
| CN1559909A (zh) * | 2004-02-21 | 2005-01-05 | 延边大学 | 再生硝酸高铈酸性溶液的方法 |
| RU2414330C2 (ru) * | 2008-12-03 | 2011-03-20 | Открытое акционерное общество "Государственный научно-исследовательский и проектный институт редкометаллической промышленности" ОАО "ГИРЕДМЕТ" | Способ получения наноразмерных порошков индивидуальных оксидов лантаноидов |
-
2016
- 2016-07-18 RU RU2016129173A patent/RU2646416C2/ru active
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1491180A (en) * | 1975-07-25 | 1977-11-09 | Treibacher Chemische Werke Ag | Method of preparing rare earth metal compounds |
| EP0153227A1 (fr) * | 1984-02-20 | 1985-08-28 | Rhone-Poulenc Chimie | Oxyde cérique à nouvelles caractéristiques morphologiques et son procédé d'obtention |
| JPS63223190A (ja) * | 1987-03-13 | 1988-09-16 | Nippon Shokubai Kagaku Kogyo Co Ltd | 硝酸第2セリウム溶液の製造法 |
| RU2085494C1 (ru) * | 1995-07-11 | 1997-07-27 | Институт химии и технологии редких элементов и минерального сырья Кольского научного центра РАН | Способ получения очищенного от фтора нитрата церия |
| RU2162821C2 (ru) * | 1999-05-05 | 2001-02-10 | Всероссийский научно-исследовательский институт химической технологии | Способ выделения церия (+4) из азотнокислого раствора редкоземельных элементов |
| CN1559909A (zh) * | 2004-02-21 | 2005-01-05 | 延边大学 | 再生硝酸高铈酸性溶液的方法 |
| RU2414330C2 (ru) * | 2008-12-03 | 2011-03-20 | Открытое акционерное общество "Государственный научно-исследовательский и проектный институт редкометаллической промышленности" ОАО "ГИРЕДМЕТ" | Способ получения наноразмерных порошков индивидуальных оксидов лантаноидов |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2016129173A (ru) | 2018-01-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Zarrougui et al. | Highly efficient extraction and selective separation of uranium (VI) from transition metals using new class of undiluted ionic liquids based on H-phosphonate anions | |
| JP5545418B2 (ja) | 希土類元素の回収方法 | |
| JPH0665609B2 (ja) | 蓚酸稀土類アンモニウム複塩の製造方法及びそれらの稀土類酸化物製造への利用 | |
| CN103361486A (zh) | 从含钪和钛的废酸液中提取高纯氧化钪及钛的方法 | |
| US20160024616A1 (en) | A method for re-extraction of rare-earth metals from organic solutions and preparing concentrate of rare-earth metals | |
| AU2015275231A1 (en) | Solvent extraction of scandium from leach solutions | |
| JP3950968B2 (ja) | YおよびEuを分離回収する方法 | |
| US3575687A (en) | Process for the selective separation of rare earth metals from their aqueous solutions | |
| RU2315716C2 (ru) | Способ переработки химического концентрата природного урана | |
| Cox et al. | Separating hafnium from zirconium. Solvent extraction with tributyl phosphate | |
| RU2646416C2 (ru) | Способ получения высокочистого раствора нитрата церия (iii) | |
| Crouse | Recovery of thorium, uranium, and rare earths from monazite sulfate liquors by the amine extraction (AMEX) process | |
| US2849286A (en) | Method of processing monazite sand | |
| RU2601763C1 (ru) | Способ получения высокочистого водного раствора нитрата церия (iv) (варианты) | |
| DE2633115B2 (de) | Verfahren zur Abtrennung von Seltenen Erden | |
| CN102205986B (zh) | 从富集钪的原料中分离锆的方法及氧化钪的制备方法 | |
| RU2678651C1 (ru) | Способ получения оксида иттербия-176 | |
| RU2563015C2 (ru) | Способ выделения церия из нитратных растворов, содержащих сумму редкоземельных элементов | |
| RU2697128C1 (ru) | Способ разделения редкоземельных металлов иттрия и иттербия от примесей железа (3+) | |
| RU2511375C2 (ru) | Способ фотометрического определения редкоземельных элементов | |
| RU2477758C1 (ru) | Способ извлечения америция | |
| RU2623978C1 (ru) | Способ извлечения циркония из кислых водных растворов | |
| RU2162821C2 (ru) | Способ выделения церия (+4) из азотнокислого раствора редкоземельных элементов | |
| JP7522510B1 (ja) | 光学ガラス廃材からレアメタルを回収する方法 | |
| RU2645990C1 (ru) | Экстракционная смесь для выделения америция и европия из карбонатно-щелочных растворов |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| QB4A | Licence on use of patent |
Free format text: LICENCE FORMERLY AGREED ON 20180912 Effective date: 20180912 |