RU2642783C2 - Новое производное бензоазепина и его медицинское применение - Google Patents
Новое производное бензоазепина и его медицинское применение Download PDFInfo
- Publication number
- RU2642783C2 RU2642783C2 RU2015131020A RU2015131020A RU2642783C2 RU 2642783 C2 RU2642783 C2 RU 2642783C2 RU 2015131020 A RU2015131020 A RU 2015131020A RU 2015131020 A RU2015131020 A RU 2015131020A RU 2642783 C2 RU2642783 C2 RU 2642783C2
- Authority
- RU
- Russia
- Prior art keywords
- group
- lower alkyl
- substituted
- alkyl group
- methyl
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D223/00—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom
- C07D223/14—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D223/16—Benzazepines; Hydrogenated benzazepines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4025—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil not condensed and containing further heterocyclic rings, e.g. cromakalim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/4155—1,2-Diazoles non condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/422—Oxazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Изобретение относится к области органической химии, а именно к новому производному бензоазепина формулы (I) или к его фармакологически приемлемой соли, где R1 представляет собой гидроксильную группу, низшую алкоксигруппу или , где А отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, пятичленную ароматическую гетероциклическую группу, содержащую 3 гетероатома, выбранных из азота и кислорода, которая может быть замещена низшей алкильной группой, пятичленную неароматическую гетероциклическую группу, содержащую один атом азота, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена низшей алкильной группой; R2 представляет собой атом водорода или низшую алкильную группу; R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора, или атом галогена; R4 представляет собой низшую алкоксигруппу, которая может быть замещена 1-3 атомами галогена, пятичленную ароматическую моноциклическую гетероциклическую группу или пятичленную неароматическую моноциклическую гетероциклическую группу (при условии, что каждая из этих гетероциклических групп содержит один атом азота, два атома азота, или один атом азота и один атом кислорода в кольце, и может содержать низшую алкильную группу); и R5 представляет собой атом водорода, низшую алкильную группу или атом галогена. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I) и промежуточным соединениям формул (II) и (IV). Технический результат: получены новые производные бензоазепина, обладающие активностью агониста рецептора V2. 4 н. и 10 з.п. ф-лы, 12 табл., 128 пр.
Description
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому производному бензоазепина, полезному в качестве медицинского продукта, и к его медицинскому применению. Соединение имеет различные медицинские применения в качестве агониста рецепторов V2.
УРОВЕНЬ ТЕХНИКИ
Аргинин-вазопрессин синтезируется в гипоталамической области, и он представляет собой пептид, состоящий из 9 аминокислот, который экскретируется из задней доли гипофиза. Рецепторы аргинин-вазопрессина классифицируют на три подтипа: V1a, V1b и V2, рецептор V1a находится в печени, сосудистых клетках мышечной ткани, тромбоцитах крови, периферических тканях и центральной нервной системе, рецептор V1b находится в центральной нервной системе, и рецептор V2 находится в клетках собирающих почечных канальцев. Когда аргинин-вазопрессин связывается с рецепторами V2, в собирающих почечных канальцах стимулируется реабсорбция воды и объем мочи снижается. Таким образом, когда аргинин-вазопрессина недостаточно, возникает полиурия, и примеры заболеваний вследствие полиурии включают центральный несахарный диабет, ночной энурез детского возраста, никтурию и гиперактивный мочевой пузырь. Таким образом, агонист рецептора V2 является полезным в качестве профилактического или терапевтического средства от этих заболеваний. Кроме того, агонист рецептора V2 обладает действием высвобождения фактора крови VIII и фактора Виллебранда и, таким образом, он может лечить геморрагические заболевания (такие как гемофилия и болезнь Виллебранда).
Традиционно десмопрессин, который представляет собой пептид (аргинин-вазопрессин, в котором аминогруппа 1 остатка цистеина удалена и 8 остаток аргинина преобразован в d-тип), используют для лечения центрального несахарного диабета и ночного энуреза в качестве агониста рецепторов V2. Однако пероральное средство десмопрессин имеет очень низкую биологическую доступность и для достижения его эффектов требуется высокая дозировка. Более того, препарат десмопрессина является дорогостоящим, а также существует обеспокоенность о возникновении побочных эффектов, вызываемых флуктуацией всасывания среди индивидуумов, и препарат десмопрессина не всегда является удовлетворительным с точки зрения безопасности. Таким образом, является желательным создание медицинского лекарственного средства, обладающего высокой биологической доступностью и меньшей флуктуацией всасывания.
С другой стороны, метаболическая реакция цитохрома P-450 (CYP) играет доминирующую роль в исчезновении лекарственного средства из организма, и, когда лекарственные средства, метаболизируемые CYP, имеющие один молекулярный тип, конкурируют друг с другом на метаболическом ферменте, предполагают, что возникает некоторый тип метаболического ингибирования. Ингибирование CYP может приводить к варьированию концентрации лекарственного средства в крови и в ткани, изменению эффектов лечения и возникновению серьезных побочных эффектов. Таким образом, является желательным создание медицинского лекарственного средства, имеющего низкую аффинность в отношении CYP и вызывающего меньше опасений, касающихся ферментативного ингибирования.
До настоящего времени бензогетероциклические производные (патентные документы 1-3), производные бензоазепина (патентные документы 4 и 5), амидное производное (патентный документ 6), производное бензодиазепина (патентный документ 7) описывались в качестве соединений, имеющих действие агониста рецептора вазопрессина, и замещенное спиробензоазепиновое производное (патентный документ 8) описывалось в качестве соединения, имеющего действие агониста рецептора вазопрессина; однако эти соединения отличаются от соединения настоящей заявки структурой, имеющей карбонильную группу на 4 атоме углерода бензоазепина.
ДОКУМЕНТЫ УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
Патентный документ 1: WO № 95/34540
Патентный документ 2: JP-A № 09-221476
Патентный документ 3: JP-A № 2000-351768
Патентный документ 4: WO № 97/22591
Патентный документ 5: JP-A № 11-60488
Патентный документ 6: JP-A № 11-1456
Патентный документ 7: WO № 2006/104008
Патентный документ 8: WO № 2005/37795
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Задачей настоящего изобретение является предоставление соединения, имеющего действие агониста рецептора V2, и предоставление профилактического или терапевтического средства для лечения центрального несахарного диабета, ночного энуреза, никтурии, гиперактивности мочевого пузыря, гемофилии или болезни Виллебранда, основанного на действии агониста рецептора V2.
РЕШЕНИЕ ПРОБЛЕМ
В рамках настоящего изобретения, ввиду описанных выше положений, соединение, имеющее новую базовую структуру, сочли эффективным в качестве средства для решения описанных выше проблем, и были проведены неоднократные исследования для создания нового агониста рецепторов V2. В результате, было обнаружено, что соединение, соответствующее общей формуле (I), описанной ниже, и его соль обладают превосходными действиями агониста рецептора V2, что и составило предмет настоящего изобретения.
Следовательно, в соответствии с настоящим изобретением предусматривается соединение, соответствующее общей формуле (I):
[Формула 1]
[где R1 представляет собой гидроксильную группу, низшую алкоксигруппу, или имеет формулу, описанную ниже:
[Формула 2]
(где A отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, ароматическую гетероциклическую группу, которая может быть замещена низшей алкильной группой, неароматическую гетероциклическую группу, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена низшей алкильной группой); R2 представляет собой атом водорода или низшую алкильную группу; R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора, или атом галогена; R4 представляет собой низшую алкоксигруппу, которая может быть замещена атомом галогена, пятичленную ароматическую моноциклическую гетероциклическую группу или пятичленную неароматическую моноциклическую гетероциклическую группу (при условии, что каждая из этих гетероциклических групп содержит по меньшей мере один атом азота и может быть замещена низшей алкильной группой), и R5 представляет собой атом водорода, низшую алкильную группу или атом галогена] или его фармакологически приемлемая соль; и это соединение называется "соединением по настоящему изобретению". Различные варианты осуществления соединения по настоящему изобретению приведены ниже.
Один вариант осуществления настоящего изобретения представляет собой соединение, где в упомянутой выше общей формуле (I) R1 представляет собой гидроксильную группу, низшую алкоксигруппу или имеет формулу, описанную ниже:
[Формула 3]
[где A отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, ароматическую гетероциклическую группу, которая может быть замещена низшей алкильной группой, неароматическую гетероциклическую группу, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена низшей алкильной группой при условии, что соединения, в которых A представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, и оба R6 и R7 представляют собой атомы водорода, и соединения, в которых A отсутствует, R6 представляет собой низшую алкильную группу, и R7 представляет собой атом водорода, исключены].
Другой вариант осуществления настоящего изобретения представляет собой соединение, где в описанной выше общей формуле (I), R1 имеет формулу, описанную ниже:
[Формула 4]
[где A отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена 1 или 2 низшими алкильными группами при условии, что соединения, в которых A представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, оба R6 и R7 представляют собой атомы водорода, и соединения, в которых A отсутствует, R6 представляет собой низшую алкильную группу, и R7 представляет собой атом водорода, исключены].
Другой вариант осуществления настоящего изобретения представляет собой соединение, где в описанной выше общей формуле (I), R1 имеет формулу, описанную ниже:
[Формула 5]
[где A представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода; R7 представляет собой гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, или карбамоильную группу].
Другой вариант осуществления настоящего изобретения представляет собой соединение, где в описанной выше общей формуле (I) R4 представляет собой низшую алкоксигруппу, которая может быть замещена 1-3 атомами фтора, группу пирролидина, которая может быть замещена 1-4 низшими алкильными группами, пиразольную группу, которая может быть замещена 1-3 низшими алкильными группами, или оксазолильную группу, которая может быть замещена 1 или 2 низшими алкильными группами.
Другой вариант осуществления настоящего изобретения представляет собой соединение, где в описанной выше общей формуле (I) R4 представляет собой группу, выбранную из следующей группы:
[Формула 6]
[где R8 представляет собой атом водорода или низшую алкильную группу].
Другой вариант осуществления настоящего изобретения представляет собой соединение, где в описанной выше общей формуле (I) R4 представляет собой группу, выбранную из следующей группы:
[Формула 7]
[где R8 представляет собой низкую алкильную группу].
Другой вариант осуществления настоящего изобретения представляет собой соединение, где R5 представляет собой метильную группу или атом фтора в описанной выше общей формуле (I).
Другой вариант осуществления настоящего изобретения представляет собой соединение, где R3 представляет собой метильную группу, трифторметильную группу или атом хлора в описанной выше общей формуле (I).
Другой вариант осуществления настоящего изобретения представляет собой соединение, где в описанной выше общей формуле (I), R1 имеет формулу, описанную ниже:
[Формула 8]
[где A представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода; R7 представляет собой гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, или карбамоильную группу], R2 представляет собой атом водорода, R3 представляет собой метильную группу, трифторметильную группу или атом хлора, R4 представляет собой группу, выбранную из следующей группы:
[Формула 9]
[где R8 представляет собой низшую алкильную группу], и R5 представляет собой метильную группу или атом фтора.
Настоящее изобретение также относится к соединению, соответствующему общей формуле (II), которое представляет собой промежуточное соединение соединения по настоящему изобретению, соответствующего общей формуле (I):
[Формула 10]
[где R2 представляет собой атом водорода или низшую алкильную группу; R5 представляет собой атом водорода, метильную группу, этильную группу или атом галогена; R9 представляет собой атом водорода или защитную группу карбоксигруппы; и R10 представляет собой атом водорода или защитную группу аминогруппы при условии, что соединения, в которых оба R2 и R5 представляют собой атомы водорода, исключены].
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение по настоящему изобретению в качестве активного ингредиента. Следовательно, фармацевтическую композицию по настоящему изобретению используют для предупреждения или лечения заболевания, выбранного из группы, состоящей из центрального несахарного диабета, ночного энуреза, никтурии, гиперактивности мочевого пузыря, гемофилии и болезни Виллебранда.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Соединение по настоящему изобретению имеет превосходное действие агониста рецептора V2 и является пригодным в качестве профилактического или терапевтического средства от заболевания, выбранного из группы, состоящей из центрального несахарного диабета, ночного энуреза, никтурии, гиперактивности мочевого пузыря, гемофилии и болезни Виллебранда. Следует отметить, что главное соединение по настоящему изобретению селективно действует на рецепторы V2 и имеет низкую активность ингибирования метаболизирующих лекарственные средства ферментов CYP3A4 и CYP2C9 по сравнению с общеизвестными соединениями, имеющими действие агониста рецепторов V2, и, более того, также ввиду физических свойств в качестве медицинского продукта, таких как растворимость и проницаемость через мембрану, и ввиду кинетики, такой как выведение из плазмы и объем распределения, имеет превосходные свойства и, таким образом, настоящее изобретение является безопасным и полезным медицинским лекарственным средством, которое является превосходным с точки зрения устранения различных побочных эффектов (цитотоксичность, действие на hERG и CYP) и медицинской пользы.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже пояснено соединение по настоящему изобретению.
[Формула 11]
Соединение по настоящему изобретению представляет собой соединение, где R1, R2, R3, R4 и R5 определены ниже для соединения, выражаемого описанной выше общей формулой (I), или его фармакологически приемлемую соль.
R1 представляет собой гидроксильную группу, низшую алкоксигруппу или имеет формулу, описанную ниже:
[Формула 12]
[где A отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, ароматическую гетероциклическую группу, которая может быть замещена низшей алкильной группой, неароматическую гетероциклическую группу, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена низшей алкильной группой]; среди них R1 предпочтительно представляет собой гидроксильную группу, низшую алкоксигруппу или имеет формулу, описанную ниже:
[Формула 13]
[где A отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, ароматическую гетероциклическую группу, которая может быть замещена низшей алкильной группой, неароматическую гетероциклическую группу, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена низшей алкильной группой при условии, что соединения, в которых A представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, и оба R6 и R7 представляют собой атомы водорода, и соединения, в которых A отсутствует, R6 представляет собой низшую алкильную группу, и R7 представляет собой атом водорода, исключены]; и среди них R1 особенно предпочтительно имеет формулу, описанную ниже:
[Формула 14]
[где A отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, группу пирролидина, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена 1 или 2 низшими алкильными группами при условии, что соединения, в которых A представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, и оба R6 и R7 представляют собой атомы водорода, и соединения, в которых A отсутствует, R6 представляет собой низшую алкильную группу, и R7 представляет собой атом водорода, исключены]; и среди них A предпочтительно представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, R6 предпочтительно представляет собой атом водорода, и R7 предпочтительно представляет собой гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, или карбамоильную группу.
R2 представляет собой атом водорода или низшую алкильную группу и предпочтительно представляет собой атом водорода. R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора, или атом галогена, и, среди них, предпочтительно представляет собой метильную группу, трифторметильную группу или атом хлора.
R4 представляет собой низшую алкоксигруппу, которая может быть замещена атомом галогена, пятичленную ароматическую моноциклическую гетероциклическую группу или пятичленную неароматическую моноциклическую гетероциклическую группу (при условии, что каждая из этих гетероциклических групп содержит по меньшей мере один атом азота и может быть замещена низшей алкильной группой). Среди них, R4 предпочтительно представляет собой группу, выбранную из следующей группы:
[Формула 15]
[где R8 представляет собой атом водорода или низшую алкильную группу]; и, среди них, R4 особенно предпочтительно представляет собой группу, выбранную из следующей группы:
[Формула 16]
[где R8 представляет собой нижнюю алкильную группу].
R5 представляет собой атом водорода, низшую алкильную группу или атом галогена и, среди них, R5 предпочтительно представляет собой метильную группу или атом фтора.
Особенно предпочтительным соединением по настоящему изобретению является соединение, в котором в общей формуле (I), R1 имеет формулу, описанную ниже:
[Формула 17]
[где A представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, R6 представляет собой атом водорода, R7 представляет собой гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, или карбамоильную группу], R2 представляет собой атом водорода, R3 представляет собой метильную группу, трифторметильную группу или атом хлора, R4 представляет собой группу, выбранную из следующей группы:
[Формула 18]
[где R8 представляет собой низшую алкильную группу], и R5 представляет собой метильную группу или атом фтора.
Кроме того, в описании используются определения, как описано ниже.
"Низшая алкоксигруппа" означает -O-(C1-C3 алкильную группу), и ее примеры включают метоксигруппу, этоксигруппу, н-пропоксигруппу и изопропоксигруппу.
"Низшая алкильная группа" означает линейную алкильную группу, имеющую 1-3 атома углерода, и ее примеры включают метильную группу, этильную группу и н-пропильную группу.
"Низшая алкиленовая группа" означает линейную алкиленовую группу, имеющую 1-3 атомов углерода, и ее примеры включают метиленовую группу, этиленовую группу и н-пропиленовую группу.
"Ароматическая гетероциклическая группа" означает от моноциклической до трициклической ароматическую кольцевую группу, которая содержит по меньшей мере один гетероатом, такой как азот, кислород и сера, и ее примеры включают пиридильную группу, тиенильную группу, фурильную группу, пиразинильную группу, пиридазинильную группу, тиазолильную группу, пиримидинильную группу, пиразолильную группу, пирролильную группу, оксазолильную группу, оксадиазолильную группу, изотиазолильную группу, изоксазолильную группу, имидазолильную группу, хинолиновую группу, хиназолиновую группу, пуриновую группу и акридиновую группу.
"Неароматическая гетероциклическая группа" означает 3-10-членную неароматическую кольцевую группу, которая может частично иметь ненасыщенные связи и содержит по меньшей мере один гетероатом, такой как азот, кислород и сера, и ее примеры включают пирролидинильную группу, пиперидинильную группу, азепинильную группу, морфолинильную группу, тиоморфолинильную группу, пиперазинильную группу, пиразолидинильную группу, пиперазинильную группу, индолильную группу, 1,2-дигидроизохинолильную группу и 1,2,3,4-тетрагидрохиноксалинильную группу.
"Атом галогена" означает атом фтора, атом хлора, атом брома или атом иода.
"5-членная ароматическая или неароматическая моноциклическая гетероциклическая группа" означает моноциклическую группу, которая может иметь ненасыщенную связь и содержит по меньшей мере один гетероатом, такой как азот, кислород и сера, и ее примеры включают пирролидинильную группу, тиенильную группу, фурильную группу, пиразолильную группу, оксазолильную группу, оксадиазолильную группу и имидазолильную группу.
"Фармакологически приемлемая соль" означает соль, которая обладает биологической эффективностью и характеристиками соединения, выражаемого общей формулой (I), и не является неблагоприятной также в биологических и других аспектах. Такая фармакологически приемлемая соль включена в объем настоящего изобретения. Примеры фармакологически приемлемой соли включают соли с аминокислотами (например, соли с лизином, аргинином и т.п.), аддитивные соли щелочных металлов (например, соли с натрием, калием и т.п.), аддитивные соли щелочноземельных металлов (например, соли с кальцием, магнием и т.п.), аддитивные соли органических аминов (например, соли с диэтиламином, диэтаноламином, пиперазином и т.п.), аддитивные соли неорганических кислот (например, соли с хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, азотной кислотой и т.п.), и органические кислотно-аддитивные соли (например, соли с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой и т.п.). Реакцию образования этих аддитивных солей можно осуществлять в соответствии с общим способом.
В случае преобразования в описанную выше общую формулу (I) путем реакции с ферментом, желчной кислотой и т.п. в физиологических условиях в живом организме, эти соединения включены в объем настоящего изобретения. Их примеры включают случаи, когда R1 в соединении, выражаемом общей формулой (I), образует карбоксигруппу с гидроксильной группой, соединения, в которых карбоксигруппа этерифицирована (например, этиловая этерификация, карбоксиметиловая этерификация и пивалоилоксиметилирование) или амидирована (например, метиламидирование). Кроме того, когда группа, выражаемая R1, имеет гидроксильную группу, ее примеры включают соединения, в которых гидроксильная группа ацилирована (например, ацетилирование, пропионилирование и трет-бутилкарбонилирование), алкоксикарбонилирована (например, метоксикарбонилирование, этоксикарбонилирование и трет-бутоксикарбонилирование), или сукцинилирована.
Далее поясняется соединение, которое является промежуточным соединением для соединения по настоящему изобретению.
[Формула 19]
Промежуточное соединение для соединения по настоящему изобретению представляет собой соединение, выражаемое описанной выше общей формулой (II), где R2 представляет собой атом водорода или низшую алкильную группу, R5 представляет собой атом водорода, метильную группу, этильную группу или атом галогена, R9 представляет собой атом водорода или защитную группу карбоксигруппы, и R10 представляет собой атом водорода или защитную группу аминогруппы (при условии, что соединение, в котором оба R2 и R5 представляют собой атомы водорода, исключено).
В рамках настоящего изобретения, "защитная группа карбоксигруппы" означает группу, общеизвестную в органическом синтезе как защитная группа для карбоксигруппы, и ее примеры включают (1) линейную или разветвленную низшую алкильную группу, имеющую от 1 до 4 атомов углерода (например, метильная группа, этильная группа, этильная группа, изопропильная группа и трет-бутильная группа), (2) галоген-низшую алкильную группу (например, 2-этилиодидная группа и 2,2,2-трихлорэтиловая группа), (3) низшую алкоксиметильную группу (например, метоксиметильная группа, этоксиметильная группа и изобутоксиметильная группа), (4) низшую алифатическую ацилоксиметильную группу (например, бутирилоксиметильная группа и пивалоилоксиметильная группа), (5) 1-низшую алкоксикарбонилоксиэтильную группу (например, 1-метоксикарбонилоксиэтильная группа и 1-этоксикарбонилоксиэтильная группа), (6) аралкильную группу (например, бензил, п-метоксибензильная группа, ο-нитробензильная группа и п-нитробензильная группа), (7) бензгидрильную группу и (8) фталидильную группу.
Кроме того, "защитная группа аминогруппы" означает группу, общеизвестную в органическом синтезе как защитная группа для аминогруппы, и ее примеры включают (1) замещенную или незамещенную низшую алканоильную группу (например, формильная группа, ацетильная группа, хлорацетильная группа, дихлорацетильная группа, пропионильная группа, фенилацетильная группа, феноксиацетильная группа и тиенилацетильная группа), (2) замещенную или незамещенную низшую алкоксикарбонильную группу (например, бензилоксикарбонильная группа, трет-бутоксикарбонильная группа, п-нитробензилоксикарбонильная группа и 9-флуоренилметилоксикарбонильная группа), (3) замещенную или незамещенную низшую алкильную группу (например, метильная группа, трет-бутильная группа, 2,2,2-трихлорэтильная группа, тритильная группа, п-метоксибензильная группа, п-нитробензильная группа, дифенилметильная группа и пивалоилоксиметильная группа), (4) замещенную силильную группу (например, триметилсилильная группа и трет-бутилдиметилсилильная группа), и (5) замещенную или незамещенную бензилиденовую группу (например, бензилиденовая группа, салициденовая группа, п-нитробензилиденовая группа, м-хлорбензилиденовая группа, 3,5-ди(трет-бутил)-4-гидроксибензилиденовая группа и 3,5-ди(трет-бутил)бензилиденовая группа).
Когда один или несколько асимметричных атомов углерода присутствуют в соединении по настоящему изобретению, изобретение включает любое соединение изомера на основе асимметричных атомов углерода и любую их комбинацию. Кроме того, когда в соединении по изобретению присутствует геометрическая изомерия или таутомерия, изобретение включает любое его геометрический изомер или таутомер. Более того, соединение по настоящему изобретению также включает сольват с растворителем, который является приемлемым в качестве медицинского продукта, таким как вода, этанол и изопропанол.
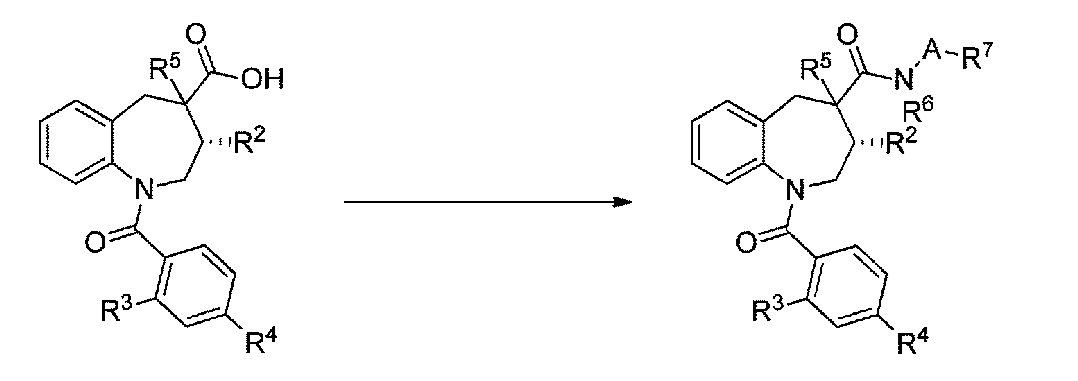
Соединение, соответствующее общей формуле (I), которое представляет собой соединение по настоящему изобретению, можно изготавливать способом, показанным на схеме стадий реакции I, представленной ниже, способом, описанным в примерах, или способом комбинирования известных способов:
[Схема стадий реакции I]
[Формула 20]
[где R2 представляет собой атом водорода или низшую алкильную группу; R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора, или атом галогена; R4 представляет собой низшую алкоксигруппу, которая может быть замещена атомом галогена, пятичленную ароматическую моноциклическую гетероциклическую группу или пятичленную неароматическую моноциклическую гетероциклическую группу (при условии, что каждая из этих гетероциклических групп содержит по меньшей мере один атом азота и может быть замещена низшей алкильной группой); R5 представляет собой атом водорода, низшую алкильную группу или атом галогена; A отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, ароматическую гетероциклическую группу, которая может быть замещена низшей алкильной группой, неароматическую гетероциклическую группу, которая может быть замещена оксогруппой или карбамоильную группу, которая может быть замещена низшей алкильной группой; и R9 представляет собой защитную группу карбоксигруппы].
[Стадия I-1]
Соединение, выражаемое общей формулой (III), преобразуют в хлорангидрид кислоты в подходящем растворителе (например, толуол и метиленхлорид) с использованием хлорирующего агента (например, тионилхлорид и оксалилхлорид) в присутствии или в отсутствие дополнительного компонента (например, N,N-диметилформамид), а затем подвергают реакции с соединением, выражаемым общей формулой (IIa), в подходящем растворителе (например, толуол, метиленхлорид, тетрагидрофуран и ацетонитрил) с использованием основания (например, триэтиламин, N,N-диэтиланилин и пиридин), с получением, таким образом, соединения, выражаемого общей формулой (IV). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов. Кроме того, соединения, выражаемые общей формулой (III) и общей формулой (IIa), являются продуктами, доступными в качестве коммерческих продуктов, но также их можно получать способом согласно схемам стадий реакции II-IV, описанным ниже.
[Стадия I-2]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R9 в соединении, выражаемом общей формулой (IV), удаляют с получением, таким образом, соединения, выражаемого общей формулой (V).
[Стадия I-3]
Соединение, выражаемое общей формулой (V), и соединение, выражаемое общей формулой (VI), подвергают реакции в подходящем растворителе (например, N,N-диметилформамид, метиленхлорид и тетрагидрофуран), с использованием конденсирующего агента (например, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и дициклогексилкарбодиимид) в присутствии и в отсутствие дополнительного компонента (например, диизопропилэтиламин, 4-диметиламинопиридин и 1-гидроксибензотриазол) с получением, таким образом, соединения, выражаемого общей формулой (I). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов. Кроме того, соединение, выражаемое общей формулой (VI), представляет собой продукт, доступный в качестве коммерческого продукта, но также его можно получать известным способом.
Соединение, выражаемое общей формулой (III), которое используют в качестве исходного материала на схеме стадий реакции I, можно изготавливать способами, представленными на схемах стадий реакции II и III, описанных ниже, способами, описанными в справочных примерах или известными способами:
[Схема стадий реакции II]
[Формула 21]
[где R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора или атомом галогена; R8 представляет собой низшую алкильную группу; R11 представляет собой защитную группу карбоксигруппы; и X представляет собой атом галогена или уходящую группу, такую как трифлат и мезилат].
[Стадия II-1]
Соединение, выражаемое общей формулой (VII), и соединение, выражаемое общей формулой (VIII), подвергают реакции в подходящем растворителе (например, N,N-диметилформамид, диметилсульфоксид и N-метил-2-пирролидон) с использованием основания (например, карбонат калия и карбонат натрия) с получением, таким образом, соединения, выражаемого общей формулой (IX). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов. Кроме того, соединения, выражаемые общими формулами (VII) и (VIII), представляют собой продукты, доступные в качестве коммерческих продуктов, но также их можно получать известным способом.
[Стадия II-2]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R11 в соединении, выражаемом общей формулой (IX), удаляют с получением, таким образом, соединения, выражаемого общей формулой (IIIa).
[Схема стадий реакции III]
[Формула 22]
[В формуле R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора, или атом галогена; R8 представляет собой низшую алкильную группу; R11 представляет собой защитную группу карбоксигруппы; R12 представляет собой защитную группу карбоксигруппы, которую можно отличить от R11 при удалении защитной группы; и X представляет собой атом галогена или уходящую группу, такую как трифлат и мезилат.]
[Стадия III-1]
Соединение, выражаемое общей формулой (X), преобразуют в хлорангидрид кислоты в подходящем растворителе (например, толуол и метиленхлорид) с использованием хлорирующего агента (например, тионилхлорид и оксалилхлорид) в присутствии или в отсутствие дополнительного компонента (например, N,N-диметилформамид), а затем подвергают реакции со спиртами (например, метанол, этанол, изопропанол и бензиловый спирт) в подходящем растворителе (например, толуол, метиленхлорид, тетрагидрофуран и ацетонитрил), с использованием основания (например, триэтиламин, N,N-диэтиланилин и пиридин) с получением, таким образом, соединения, выражаемого общей формулой (XI). Температура реакции составляет от 0°С до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов. Кроме того, соединение, выражаемое общей формулой (X), представляет собой продукт, доступный в качестве коммерческого продукта, но его также можно изготавливать известным способом.
[Стадия III-2]
Соединение, выражаемое общей формулой (XI), подвергают реакции в подходящем растворителе (например, диметилсульфоксид, N,N-диметилформамид, метанол и этанол) с использованием основания (например, триэтиламин, диизопропилэтиламин и карбонат цезия), палладиевого катализатора (например, ацетат палладия, хлорид палладия, [1,1'-бис(дифенилфосфино)ферроцен]палладий дихлорид и тетракис(трифенилфосфин)палладий) в атмосфере монооксида углерода в присутствии или в отсутствие дополнительного компонента (например, 1,3-бис(трифенилфосфино)пропан и 1,1'-бис(дифенилфосфино)ферроцен) с получением, таким образом, соединения, выражаемого общей формулой (XII). Температура реакции составляет от 40°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов.
[Стадия III-3]
Ссылаясь на способ, описанный в "Protecting Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R12 в соединении, выражаемом общей формулой (XII), удаляют с получением, таким образом, соединения, выражаемого общей формулой (XIII).
[Стадия III-4]
Соединение, выражаемое общей формулой (XIII), и соединение, выражаемое общей формулой (XIV), подвергают реакции в подходящем растворителе (например, N,N-диметилформамид, метиленхлорид и тетрагидрофуран) с использованием конденсирующего агента (например, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и дициклогексилкарбодиимид) в присутствии или в отсутствие дополнительного компонента (например, диизопропилэтиламин, 4-диметиламинопиридин и 1-гидроксибензотриазол) с получением, таким образом, соединения, выражаемого общей формулой (XV). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов. Кроме того, соединение, выражаемое общей формулой (XIV), представляет собой продукт, доступный в качестве коммерческого продукта, однако его также можно получать известным способом.
Соединение, выражаемое общей формулой (XV), подвергают реакции в подходящем растворителе (например, метиленхлорид и тетрагидрофуран) с использованием окислителя (например, реагент Десс-Мартина и комплекс пиридин-триоксид серы) в присутствии или в отсутствие дополнительного компонента (диметилсульфоксид) с получением, таким образом, соединения, выражаемого общей формулой (XVI). Температура реакции составляет от 0°C до комнатной температуры, и время реакции составляет от 30 минут до 48 часов.
[Стадия III-6]
Соединение, выражаемое общей формулой (XVI), подвергают реакции в подходящем растворителе (например, метиленхлорид и ацетонитрил) с использованием хлорирующего агента (например, гексахлорэтан и 1,2-дибром-1,1,2,2-тетрахлорэтан) и основания (например, диизопропилэтиламин, пиридин и триэтиламин) в присутствии дополнительного компонента (трифенилфосфин) с получением, таким образом, соединения, выражаемого общей формулой (XVII). Температура реакции составляет от 0°C до комнатной температуры, и время реакции составляет от 30 минут до 5 часов.
[Стадия III-7]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R11 в соединении, выражаемом общей формулой (XVII), удаляют с получением, таким образом, соединения, выражаемого общей формулой (IIIb).
Соединение, выражаемое общей формулой (IIa), которое используют в качестве исходного материала на схеме стадий реакции I, можно изготавливать способами, представленными на схемах стадий реакции с IV по VI, описанных ниже, способами, описанными в справочных примерах, или способом комбинирования известных способов.
[Схема стадий реакции IV]
[Формула 23]
[На схеме R2 представляет собой атом водорода или низшую алкильную группу; R5 представляет собой низшую алкильную группу или атом галогена; R9 представляет собой защитную группу карбоксигруппы; R10 представляет собой защитную группу атома азота; R13 представляет собой цианогруппу или производное карбоновой кислоты (например, метиловый сложный эфир и этиловый сложный эфир).
[Стадия IV-1]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", атом азота (2-аминофенил)метанола защищают посредством R10 с получением, таким образом, соединения, выражаемого общей формулой (VIII). Кроме того, (2-аминофенил)метанол доступен в качестве коммерческого продукта.
[Стадия IV-2]
Соединение, выражаемое общей формулой (XVIII), подвергают реакции в подходящем растворителе (например, метиленхлорид, хлороформ, ацетон и тетрагидрофуран) с использованием оксида марганца(IV) с получением, таким образом, соединения, выражаемого общей формулой (XIX). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов.
[Стадия IV-3]
Соединение, выражаемое общей формулой (XIX), и соединение, выражаемое общей формулой (XX), подвергают реакции в подходящем растворителе (например, N,N-диметилформамид и диметилсульфоксид) с использованием основания (например, карбонат калия и гидрид натрия) с получением, таким образом, соединения, выражаемого общей формулой (XXI). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов. Кроме того, соединение, выражаемое общей формулой (XX), можно получать способом согласно схеме стадий реакции VII, описанной ниже.
[Стадия IV-4]
Соединение, выражаемое общей формулой (XXI), подвергают реакции в подходящем растворителе (например, диэтилкарбонат и этанол) с использованием основания (например, этоксид натрия и трет-бутоксид калия) в присутствии или в отсутствие дополнительного компонента (например, бромид натрия, бромид лития и иодид натрия) с получением, таким образом, соединения, выражаемого общей формулой (XXII).
[Стадия IV-5]
Соединение, выражаемое общей формулой (XXII), подвергают реакции в подходящем растворителе (например, уксусная кислота и вода) с использованием кислоты (например, серная кислота и хлористоводородная кислота) с получением, таким образом, соединения, выражаемого общей формулой (XXIII). Температура реакции составляет от комнатной температуры до температуры кипения растворителя, и время реакции составляет от 12 часов до 7 суток.
[Стадия IV-6]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", карбоксигруппу в соединении, выражаемом общей формулой (XXIII), защищают посредством R9 с получением, таким образом, соединения, выражаемого общей формулой (XXIV).
[Стадия IV-7]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", атом азота в соединении, выражаемом общей формулой (XXIV), защищают посредством R10 с получением, таким образом, соединения, выражаемого общей формулой (XXV).
[Стадия IV-8]
Соединение, выражаемое общей формулой (XXV), подвергают реакции в подходящем растворителе (например, метанол, этанол и 1,4-диоксан) с использованием палладиевого катализатора (например, палладий на угле и катализатор Перлмана) в атмосфере водорода с получением, таким образом, соединения, выражаемого общей формулой (XXVI). Температура реакции составляет от комнатной температуры до 60°C, и время реакции составляет от 1 часа до 48 часов.
[Стадия IV-9]
Соединение, выражаемое общей формулой (XXVI) и электрофильный агент (например, метилиодид, метилбромид, этилиодид и N-фторбензолсульфонимид) подвергают реакции в подходящем растворителе (например, тетрагидрофуран и диэтиловый эфир) с использованием основания (например, литий диизопропиламин, н-бутиллитий и трет-бутиллитий) с получением, таким образом, соединения, выражаемого общей формулой (XXVII). Температура реакции составляет от -78°C до 0°C, и время реакции составляет от 30 минут до 24 часов.
[Стадия IV-10]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R10 в соединении, выражаемом общей формулой (XXVII), удаляют с получением, таким образом, соединения, выражаемого общей формулой (IIa).
[Схема стадий реакции V]
[Формула 24]
[В формуле R5 представляет собой низшую алкильную группу или атом галогена; R9 представляет собой защитную группу карбоксигруппы; и R10 представляет собой защитную группу атома азота.]
[Стадия V-1]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", атом азота в 3,4-дигидро-1H-бензо[b]азепин-5(2H)-оне защищают посредством R10 с получением, таким образом, соединения, выражаемого общей формулой (XXVIII). Кроме того, 3,4-дигидро-1H-бензо[b]азепин-5(2H)-он доступен в качестве коммерческого продукта.
[Стадия V-2]
Соединение, выражаемое общей формулой (XXVIII), подвергают реакции в подходящем растворителе (например, диметилкарбонат и диэтилкарбонат) с использованием основания (например, метоксид натрия и этоксид натрия) с получением, таким образом, соединения, выражаемого общей формулой (XXIX). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 5 часов.
[Стадия V-3]
Соединение, выражаемое общей формулой (XXIX), и электрофильный агент (например, метилиодид, метилбромид, этилиодид и N-фторбензолсульфонимид) подвергают реакции в подходящем растворителе (например, тетрагидрофуран, ацетон и этанол) с использованием основания (например, карбонат калия, карбонат цезия и гидрид натрия) с получением, таким образом, соединения, выражаемого общей формулой (XXX). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов.
[Стадия V-4]
Соединение, выражаемое общей формулой (XXX), и восстановитель (например, триэтилсилан) подвергают реакции в подходящем растворителе (например, метиленхлорид и тетрагидрофуран) с использованием кислоты (например, трифторуксусная кислота, метансульфоновая кислота и комплекс трифторид бора-диэтиловый эфир) с получением, таким образом, соединения, выражаемого общей формулой (XXXI). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов.
[Стадия V-5]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R10 в соединении, выражаемом общей формулой (XXXI), удаляют с получением, таким образом, соединения, выражаемого общей формулой (IIb).
[Схема стадий реакции VI]
[Формула 25]
[На схеме R5 представляет собой атом водорода, низшую алкильную группу или атом галогена; R9 представляет собой защитную группу карбоксигруппы; R10 представляет собой защитную группу атома азота; R14 и R15 представляют собой алкильные группы, которые отличаются друг от друга и могут быть замещены, или арильные группы, которые могут быть замещены.]
[Стадия VI-1]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R9 в соединении, выражаемом общей формулой (XXXI), удаляют с получением, таким образом, соединения, выражаемого общей формулой (XXXII).
[Стадия VI-2]
Соединение, выражаемое общей формулой (XXXII), и соединение, выражаемое общей формулой (XXXIII), подвергают реакции в подходящем растворителе (например, N,N-диметилформамид, метиленхлорид и тетрагидрофуран) с использованием конденсирующего агента (например, 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид и дициклогексилкарбодиимид) в присутствии или в отсутствие дополнительного компонента (например, диизопропилэтиламин, 4-диметиламинопиридин и 1-гидроксибензотриазол) с получением, таким образом, соединения, выражаемого общей формулой (XXXIV). Температура реакции составляет от 0°C до температуры кипения растворителя, и время реакции составляет от 30 минут до 48 часов.
[Стадия VI-3]
Соединение, выражаемое общей формулой (XXXIV), подвергают реакции в подходящем растворителе (например, метанол, этанол и бензиловый спирт) с использованием кислоты (например, серная кислота и хлористоводородная кислота) с получением, таким образом, соединения, выражаемого общей формулой (XXXV). Температура реакции составляет от комнатной температуры до температуры кипения растворителя, и время реакции составляет от 30 минут до 72 часов.
[Стадия VI-4]
Ссылаясь на способ, описанный в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", защитную группу R10 в соединении, выражаемом общей формулой (XXXV), удаляют с получением, таким образом, соединения, выражаемого общей формулой (IIe).
Соединение, выражаемое общей формулой (XX), которое используют на схеме стадий реакции IV, можно изготавливать способом, представленным на схеме стадий реакции VII, описанной ниже, способами, описанными в справочных примерах, или способом комбинирования известных способов.
[Схема стадий реакции VII]
[Формула 26]
[На схеме R2 представляет собой атом водорода или низшую алкильную группу; R13 представляет собой цианогруппу или производное карбоновой кислоты (например, метиловый сложный эфир и этиловый сложный эфир); и X представляет собой атом галогена или уходящую группу, такую как трифлат и мезилат.]
[Стадия VII-1]
Соединение, выражаемое общей формулой (XXXVI), подвергают реакции в подходящем растворителе (например, N,N-диметилформамид, диметилсульфоксид и ацетонитрил) с использованием цианирущего агента (например, цианид натрия и цианид калия) в присутствии или в отсутствие дополнительного компонента (например, бромид тетрабутиламмония, иодид натрия и 18-краун-6-эфир) с получением, таким образом, соединения, выражаемого общей формулой (XXXVII). Температура реакции составляет от комнатной температуры до температуры кипения растворителя, и время реакции составляет от 30 минут до 24 часов.
[Стадия VII-2]
Соединение, выражаемое общей формулой (XXXVII), и нуклеофильный агент (например, тионилхлорид, метансульфонилхлорид и трифторметансульфонилангидрид) подвергают реакции в подходящем растворителе (например, метиленхлорид и толуол) с использованием основания (например, триэтиламин, диизопропилэтиламин и пиридин) с получением, таким образом, соединения, выражаемого общей формулой (XX). Температура реакции составляет от 0°C до комнатной температуры, и время реакции составляет от 30 минут до 24 часов.
Некоторые другие соединения, используемые в качестве исходных материалов, промежуточных соединений или реагентов, которые необходимы для получения соединения по настоящему изобретению, являются доступными в качестве коммерческих продуктов, и их также можно получать известными способами.
В некоторых случаях может быть эффективным внесение подходящей защитной группы в заместитель (например, гидроксильная группа, аминогруппа и карбоксигруппа), который находится в соединении по настоящему изобретению или соединении, используемом для получения соединения, на стадии исходного материала или промежуточного соединения для получения соединения, и можно соответственно выбирать защитную группу, описанную в "Protective Groups in Organic Synthesis, 3rd Edition, Wiley (1999)", описанную выше, при необходимости.
Для выделения или очистки соединения по настоящему изобретению и соединения, используемого для получения соединения, из реакционного раствора, можно применять обычно используемый способ. Например, можно применять экстракцию растворителем, ионообменную смолу, колоночную хроматографию с использованием силикагеля, оксида алюминия или сходных с ними в качестве носителя, препаративное выделение с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), тонкослойную хроматографию, поглотительную смолу, перекристаллизацию, и т.п., и эти способы выделения и очистки можно применять отдельно или в комбинации. Выделение и очистку можно проводить каждый раз после каждой реакции или после завершения некоторых реакций.
Когда соединение в описании имеет асимметричный атом углерода и существуют оптические изомеры, эти оптические изомеры могут быть разделены на диастереомеры обычным способом оптического разделения рацемических соединений, например, фракционной кристаллизацией перекристаллизующихся диастереомеров в качестве солей диастереомеров, образованных с универсальным оптически активным соединением, или реакцией с универсальным оптически активным соединением, в обычном способе, таком как хроматография. Кроме того, каждый оптический изомер можно выделять также препаративным выделением высокоэффективной жидкостной хроматографией (ВЭЖХ) с использованием колонки для разделения оптически активного материала.
Соединение по настоящему изобретению, полученное, как описано выше, действует в качестве агониста рецептора V2 и, таким образом, его используют в качестве фармацевтической композиции для предупреждения или лечения центрального несахарного диабета, ночного энуреза, никтурии, гиперактивности мочевого пузыря, гемофилии или болезни Виллебранда. Следует отметить, что основное соединение по изобретению селективно действует на рецептор V2 и, таким образом, является преимущественным с точки зрения побочных эффектов. Кроме того, по сравнению с общеизвестными соединениями, имеющими действие агониста рецептора V2, соединение по настоящему изобретению обладает низким ингибирующим действием на метаболизирующие лекарственные средства ферменты CYP3A4 и CYP2C9, и, более того, ввиду физических свойств в качестве фармацевтического продукта, таких как растворимость и мембранная проницаемость, и ввиду кинетики, такой как выведение из плазмы и объем распределения, обладает превосходными свойствами и, таким образом, настоящее изобретение можно безопасно использовать.
В качестве формы введения, когда соединение по настоящему изобретению используют в качестве медицинского лекарственного средства, можно выбирать различные формы введения, описанные в общих правилах для препаратов в "Japanese Pharmacopoeia" в соответствии с назначением. Например, когда соединение изготавливают в форме таблетки, как правило, можно выбирать компоненты, которые можно принимать перорально, используемые в данной области. Например, компоненты представляют собой носители, такие как лактоза, кристаллическая целлюлоза, сахароза и фосфат калия. Более того, если желательно, можно добавлять различные добавки, которые регулярно используют в области составления лекарственных средств, такие как связующее вещество, дезинтегрирующее вещество, смазывающее вещество и дефлокулирующее вещество.
Количество соединения по настоящему изобретению, содержащегося в препарате по настоящему изобретению в качестве активного ингредиента, конкретно не ограничено, и его соответствующим образом выбирают из широкого диапазона. Вводимое количество соединения по настоящему изобретению соответствующим образом выбирают в зависимости от его применения, возраста, пола и других характеристик пациента, и степени выраженности заболевания, и в случае перорального введения количество соединения по настоящему изобретению за одни сутки составляет приблизительно от 1 мкг до 100 мг на 1 кг массы тела, предпочтительно соответственно от приблизительно 10 мкг до 20 мг, и более предпочтительно соответственно от приблизительно 50 мкг до 5 мг, и такое количество можно соответствующим образом вводить от 1 до 4 раз отдельно за одни сутки. Однако, поскольку вводимое количество и количество раз определяют, учитывая соответствующие обстоятельства, включающие степень выраженности симптома, подвергаемого лечению, выбор соединения, подлежащего введению, и выбранный путь введения, описанные выше диапазоны вводимых количеств и количество раз введения не ограничивают объем настоящего изобретения.
Примеры
Ниже содержание настоящего изобретения будет более конкретно пояснено с помощью примеров, справочных примеров и примеров фармакологических испытаний, и технические пределы настоящего изобретения не ограничивается описанным содержимым.
Спектры ядерного магнитного резонанса (1H-NMR) в нижеследующих примерах и справочных примерах описаны с использованием тетраметилсилана в качестве стандартного вещества и с выражением величины химического сдвига в качестве величины δ (м.д.). Для паттернов разделения, единичная линия показана как "с", двойная линия показана как "д", тройная линия показана как "т", четверная линия показана как "к", пятерная линия показана как "квин", множественная линия показана как "м", и уширенная линия показана как "ушир". Анализ масс проводили в режиме электрораспылительной ионизации (ESI). В таблицах, метильная группа представлена как "Me", и этильная группа представлена как "Et".
Справочный пример 1
Метиловый эфир (S)-2-метил-4-(3-метилпирролидин-1-ил)бензойной кислоты
Метиловый эфир 4-фтор-2-метилбензойной кислоты (970 мг) растворяли в N-метил-2-пирролидоне (20 мл), добавляли гидрохлорид (S)-3-метилпирролидина (772 мг) в присутствии карбоната калия (2,39 г), а затем реакционную смесь перемешивали при 120°C в течение 6 часов. Реакционный раствор возвращали к комнатной температуре, добавляли этилацетат, промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией на силикагеле (этилацетат/гексан = 1/6) с получением, таким образом, указанного в заголовке соединения (720 мг) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,88 (д, J=8,0 Гц, 1H), 6,34-6,30 (м, 2H), 3,82 (c, 3H), 3,51-3,47 (м, 1H), 3,45-3,39 (м, 1H), 3,36-3,29 (м, 1H), 2,92-2,88 (м, 1H), 2,59 (c, 3H), 2,45-2,32 (м, 1H), 2,17-2,10 (м, 1H), 1,68-1,58 (м, 1H), 1,13 (д, J=8,0 Гц, 3H).
ESI/MS (m/z) 234 (M+H)+.
Справочный пример 2
(S)-2-Метил-4-(3-метилпирролидин-1-ил)бензойная кислота
Метиловый эфир (S)-2-метил-4-(3-метилпирролидин-1-ил)бензойной кислоты (710 мг) растворяли в метаноле (7 мл), добавляли воду (6 мл) и моногидрат гидроксида лития (383 мг), и реакционную смесь перемешивали при 60°C в течение 6 часов. Реакционный раствор концентрировали при пониженном давлении, добавляли этилацетат для подкисления 5% водным раствором лимонной кислоты, а затем органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (660 мг) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 12,36 (ушир.c, 1H), 8,00 (д, J=8,0 Гц, 1H), 6,36 (д, J=8,0 Гц, 1H), 6,31 (c, 1H), 3,51-3,48 (м, 1H), 3,47-3,41 (м, 1H), 3,37-3,31 (м, 1H), 2,93-2,89 (м, 1H), 2,62 (c, 3H), 2,42-2,35 (м, 1H), 2,18-2,10 (м, 1H), 1,68-1,59 (м, 1H), 1,13 (д, J=8,0 Гц, 3H).
ESI/MS (m/z) 220 (M+H)+, 218 (M-H)-.
Справочный пример 3
Бензиловый эфир 4-бром-2-метилбензойной кислоты
4-Бром-2-метилбензойную кислоту (2,15 г) растворяли в тионилхлориде (5,0 мл) и N,N-диметилформамиде (100 мкл) и реакционную смесь перемешивали при 50°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный осадок растворяли в метиленхлориде (10 мл), добавляли бензиловый спирт (1,0 мл) и пиридин (1,6 мл), и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия и реакционный раствор экстрагировали метиленхлоридом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором и сушили водным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией на силикагеле (гексан/этилацетат = от 1/0 до 6/1) с получением, таким образом, указанного в заголовке соединения (2,65 г).
1H-ЯМР (400 МГц, CDCl3) δ 7,82 (д, J=8,4 Гц, 1H), 7,47-7,30 (м, 7H), 5,33 (c, 2H), 2,58 (c, 3H).
Справочный пример 4
Метиловый эфир 4-[(бензилокси)карбонил]-3-метилбензойной кислоты
Бензиловый эфир 4-бром-2-метилбензойной кислоты (4,86 г) растворяли в смешанном растворителе из диметилсульфоксида (48 мл) и метанола (48 мл) и добавляли ацетат палладия (358 мг), 1,3-бис(дифенилфосфино)пропан (657 мг) и диизопропилэтиламин (5,4 мл), и реакционную смесь подвергали вытеснению монооксидом углерода и перемешивали при 60°C в течение ночи. В реакционный раствор добавляли воду и экстрагировали этилацетатом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией на силикагеле (гексан/этилацетат = от 24/1 до 3/1) с получением, таким образом, указанного в заголовке соединения (3,91 г).
1H-ЯМР (400 МГц, CDCl3) δ 7,97 (д, J=8,1 Гц, 1H), 7,94-7,90 (м, 1H), 7,87 (дд, J=8,1, 1,7 Гц, 1H), 7,49-7,43 (м, 2H), 7,43-7,33 (м, 3H), 5,36 (c, 2H), 3,93 (c, 3H), 2,63 (c, 3H).
ESI/MS (m/z) 285 (M+H)+.
Справочный пример 5
4-[(Бензилокси)карбонил]-3-метилбензойная кислота
Метиловый эфир 4-[(бензилокси)карбонил]-3-метилбензойной кислоты (3,03 г) растворяли в смешанном растворителе из тетрагидрофурана (30 мл) и воды (30 мл), добавляли моногидрат гидроксида лития (671 мг) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли 1M хлористоводородную кислоту для подкисления, а затем экстрагировали этилацетатом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (2,84 г) в виде белого твердого вещества.
1H-ЯМР (400 МГц ДМСО) δ 13,21 (c, 1H), 7,92 (д, J=8,0 Гц, 1H), 7,90-7,77 (м, 2H), 7,53-7,30 (м, 5H), 5,35 (c, 2H), 2,55 (c, 3H).
ESI/MS (m/z) 269 (M-H)-.
Справочный пример 6
Бензиловый эфир 4-[(1-гидроксипропан-2-ил)карбамоил]-2-метилбензойной кислоты
4-[(Бензилокси)карбонил]-3-метилбензойную кислоту (1,24 г) растворяли в N,N-диметилформамиде (23 мл), добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,76 г), 1-гидроксибензотриазол (1,41 г), диизопропилэтиламин (3,1 мл) и DL-2-амино-1-пропанол (730 мкл), и реакционную смесь перемешивали при 40°C в течение ночи. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией на силикагеле (хлороформ/этилацетат = 1/2) с получением, таким образом, указанного в заголовке соединения (1,07 г).
1H-ЯМР (400 МГц, CDCl3) δ 7,90 (д, J=8,1 Гц, 1H), 7,60 (c, 1H), 7,56 (д, J=8,1 Гц, 1H), 7,48-7,29 (м, 5H), 6,71 (ушир.c, 1H), 5,32 (c, 2H), 4,31-4,15 (м, 1H), 3,73 (дд, J=11,1, 3,7 Гц, 1H), 3,61 (дд, J=11,1, 5,5 Гц, 1H), 3,37 (ушир.c, 1H), 2,56 (c, 3H), 1,25 (д, J=6,8 Гц, 3H).
ESI/MS (m/z) 328 (M+H)+, 326 (M-H)-.
Справочный пример 7
Бензиловый эфир 2-метил-4-[(1-оксопропан-2-ил)карбамоил]бензойной кислоты
Бензиловый эфир 4-[(1-гидроксипропан-2-ил)карбамоил]-2-метилбензойной кислоты (1,07 г) растворяли в метиленхлориде (16 мл), добавляли реагент Десс-Мартина (2,08 г) при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали метиленхлоридом. Органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией на силикагеле (гексан/этилацетат = от 1/1 до 2/5) с получением, таким образом, указанного в заголовке соединения (846 мг).
1H-ЯМР (400 МГц, CDCl3) δ 9,64 (c, 1H), 7,98 (д, J=8,1 Гц, 1H), 7,68 (c, 1H), 7,66-7,59 (м, 1H), 7,48-7,31 (м, 5H), 7,01 (ушир.c, 1H), 5,35 (c, 2H), 4,79-4,62 (м, 1H), 2,63 (c, 3H), 1,49 (д, J=7,4 Гц, 3H).
ESI/MS (m/z) 326 (M+H)+, 324 (M-H)-.
Справочный пример 8
Бензиловый эфир 2-метил-4-(4-метилоксазол-2-ил)бензойной кислоты
Трифенилфосфин (2,05 г) и гексахлорэтан (1,85 г) растворяли в ацетонитриле (18 мл), добавляли раствор ацетонитрила (8 мл), содержавший бензиловый эфир 2-метил-4-[(1-оксопропан-2-ил)карбамоил]бензойной кислоты (846 мг), и реакционную смесь перемешивали при комнатной температуре в течение 10 минут. В реакционную смесь добавляли пиридин (1,3 мл) и перемешивали при комнатной температуре в течение 1 часа. В реакционный раствор добавляли воду и экстрагировали этилацетатом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией на силикагеле (гексан/этилацетат = от 12/1 до 5/2) с получением, таким образом, указанного в заголовке соединения (691 мг).
1H-ЯМР (400 МГц, CDCl3) δ 8,02 (д, J=8,2 Гц, 1H), 7,95-7,90 (м, 1H), 7,89-7,82 (м, 1H), 7,50-7,30 (м, 6H), 5,36 (c, 2H), 2,66 (c, 3H), 2,26 (д, J=1,2 Гц, 3H).
ESI/MS (m/z) 308 (M+H)+.
Справочный пример 9
2-Метил-4-(4-метилоксазол-2-ил)бензойная кислота
Бензиловый эфир 2-метил-4-(4-метилоксазол-2-ил)бензойной кислоты (69,0 мг) растворяли в метаноле (8 мл), добавляли 1М водный раствор гидроксида натрия (4 мл), и реакционную смесь перемешивали при 50°C в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, к полученному осадку добавляли 1M хлористоводородную кислоту для подкисления, а затем выпавший в осадок кристалл получали путем фильтрования и промывали водой с получением, таким образом, указанного в заголовке соединения (429 мг) в качестве белого кристалла.
1H-ЯМР (400 МГц ДМСО) δ 7,97 (кв, J=1,2 Гц, 1H), 7,93 (д, J=8,1 Гц, 1H), 7,90-7,86 (м, 1H), 7,86-7,79 (м, 1H), 2,59 (c, 3H), 2,18 (д, J=1,2 Гц, 3H).
ESI/MS (m/z) 218 (M+H)+, 216 (M-H)-.
Справочный пример 10
Этиловый эфир 1-тозил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты
(2-Аминофенил)метанол (13,4 г) растворяли в хлороформе (400 мл) и охлаждали до 0°C. Добавляли пиридин (11 мл) и п-толуолсульфонилхлорид (24,8 г) и реакционную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционный раствор разбавляли водой и добавляли 6M хлористоводородную кислоту для подкисления, а затем экстрагировали хлороформом. Органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давления с получением, таким образом, N-[2-(гидроксиметил)фенил]-4-метилбензолсульфонамида.
Описанный выше N-[2-(гидроксиметил)фенил]-4-метилбензолсульфонамид (32,0 г) растворяли в ацетоне (480 мл), добавляли оксид марганца (IV) (75,0 г), и реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 24 часов. После фильтрации реакционный раствор промывали этилацетатом. Фильтрат концентрировали при пониженном давлении и осадок разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении с получением, таким образом, N-(2-формилфенил)-4-метилбензолсульфонамида.
Описанный выше N-(2-формилфенил)-4-метилбензолсульфонамид (24,0 г) растворяли в N,N-диметилформамиде (300 мл), добавляли этилбромбутират (36,4 г) и карбонат калия (36,1 г) и реакционную смесь перемешивали при 80°C в течение 36 часов. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении с получением, таким образом, этилового эфира 4-[N-(2-формилфенил)-4-метилфенилсульфонамид]масляной кислоты.
Описанный выше этиловый эфир 4-[N-(2-формилфенил)-4-метилфенилсульфонамид]масляной кислоты растворяли в диэтилкарбонате (480 мл), добавляли 20% раствор этоксида натрия в этаноле (43,1 г), и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор разбавляли водой и добавляли 6M хлористоводородную кислоту для подкисления, а затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования, осадок, полученный путем концентрирования фильтрата при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан = от 1/10 до 1/4) с получением, таким образом, указанного в заголовке соединения (18,2 г) в виде желто-белого маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 6,97-6,87 (м, 1H), 6,61-6,53 (м, 1H), 6,48 (д, J=7,9 Гц, 1H), 3,86 (c, 1H), 3,14-3,00 (м, 2H), 2,86-2,76 (м, 2H), 1,86-1,74 (м, 2H), 1,69-1,60 (м, 2H).
Справочный пример 11
Метиловый эфир 2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты
Этиловый эфир 1-тозил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты (18,2 г) растворяли в уксусной кислоте (180 мл), добавляли серную кислоту (90 мл) и воду (9 мл) и реакционную смесь перемешивали при 90°C в течение 36 часов. Реакционный раствор охлаждали до 0°C и разбавляли метиленхлоридом и водой. В смешанный раствор добавляли 5М гидроксид натрия для нейтрализации, а затем экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении с получением, таким образом, 2,3-дигидро-1H-бензо[1b]азепин-4-карбоновой кислоты.
Описанную выше 2,3-дигидро-1H-бензо[b]азепин-4-карбоновую кислоту растворяли в метаноле (180 мл), капельно добавляли серную кислоту (10 мл) при комнатной температуре, и реакционную смесь нагревали до температуры кипения в течение 17 часов. Реакционный раствор концентрировали при пониженном давлении и полученный осадок разбавляли водой, а затем добавляли 5М гидроксид натрия для нейтрализации, после чего экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрации осадок, полученный путем концентрирования фильтрата при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан = от 1/10 до 1/4) с получением, таким образом, указанного в заголовке соединения (8,30 г) в виде желто-белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,65 (c, 1H), 7,29-7,23 (м, 1H), 7,13-7,06 (м, 1H), 6,78-6,72 (м, 1H), 6,63-6,57 (м, 1H), 4,55 (c, 1H), 3,80 (c, 3H), 3,42-3,34 (м, 2H), 2,89-2,83 (м, 2H).
Справочный пример 12
1-Тозил-3,4-дигидро-1H-бензо[b]азепин-5(2H)-он
3,4-Дигидро-1H-бензо[b]азепин-5(2H)-он (10,0 г) растворяли в пиридине (30 мл), добавляли п-толуолсульфонилхлорид (13,6 г) на ледяной бане и реакционную смесь перемешивали при комнатной температуре в течение 12 часов. В реакционный раствор добавляли воду (60 мл), а затем перемешивали при комнатной температуре в течение 40 минут. Полученный кристалл собирали фильтрованием и промывали водой, а затем сушили с получением, таким образом, указанного в заголовке соединения (18,9 г) в качестве светло-желто-белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,71 (ддд, J=7,8, 1,7, 0,4 Гц, 1H), 7,59 (д, J=8,3 Гц, 2H), 7,55-7,46 (м, 2H), 7,41-7,35 (м, 1H), 7,23-7,30 (м, 2H), 3,86 (т, J=6,6 Гц, 2H), 2,45-2,39 (м, 5H), 2,00-1,91 (м, 2H).
ESI/MS (m/z) 316 (M+H)+.
Справочный пример 13
Метиловый эфир 5-оксо-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты
1-Тозил-3,4-дигидро-1H-бензо[b]азепин-5(2H)-он (47,3 г) растворяли в диметилкарбонате (300 мл), добавляли метоксид натрия (48,6 г) при комнатной температуре и реакционную смесь перемешивали при 70°C в течение 40 минут. Затем реакционный раствор охлаждали до комнатной температуры и переливали в ледяную воду с последующей экстракцией этилацетатом, реакционный раствор промывали водой и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. К полученному осадку добавляли метанол и выпавший в осадок кристалл собирали фильтрованием с получением, таким образом, указанного в заголовке соединения (43,8 г).
1H-ЯМР (400 МГц, CDCl3) δ 11,9 (ушир.c, 1H), 7,81-7,10 (м, 8H), 4,10 (т, J=6,4 Гц, 2H), 3,75-3,69 (м, 3H), 2,57-2,17 (м, 5H).
Справочный пример 14
Метиловый эфир 4-метил-5-оксо-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Метиловый эфир 5-оксо-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (100 мг) растворяли в ацетоне (2 мл), добавляли карбонат калия (74,1 мг) и метилиодид (33 мкл) и реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 1,5 часов. В реакционный раствор добавляли воду, экстрагировали этилацетатом, а затем промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Реакционный раствор концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией (гексан/этилацетат = от 4/1 до 2/1) с получением, таким образом, указанного в заголовке соединения (99,2 мг) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,55 (д, J=8,4 Гц, 2H), 7,46-7,31 (м, 4H), 7,28-7,21 (м, 3H), 4,08-3,99 (м, 1H), 3,87-3,77 (м, 1H), 3,61 (c, 3H), 2,47-2,31 (м, 4H), 1,89-1,78 (м, 1H), 1,31 (c, 3H).
ESI/MS (m/z) 388 (M+H)+.
В настоящем описании "рацематом" обозначат рацемическое соединение по четвертичному атому углерода, когда четвертичный атом углерода является асимметричным атомом углерода, как показано, например, в формуле, описанной ниже;
[Формула 27]
Кроме того, нижеследующее соединение, получаемое с использованием описанного выше соединения и исходного материала, имеющего рацемат по четвертичному атому углерода, обозначается как (рацемат) в конце его обозначения.
Пример 1
Метиловый эфир 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Метиловый эфир 4-метил-5-оксо-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 74,0 мг) растворяли в метиленхлориде (2 мл), к нему добавляли трифторуксусную кислоту (29 мкл), триэтилсилан (120 мкл), метансульфоновую кислоту (19 мкл) и комплекс трифторид бора-диэтиловый эфир (36 мкл) на ледяной бане, и реакционную смесь сразу перемешивали в течение 30 минут, и перемешивали при комнатной температуре в течение 2 часов. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагировали этилацетатом, затем промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Реакционный раствор концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией (гексан/этилацетат = от 9/1 до 1/1) с получением, таким образом, указанного в заголовке соединения (34,2 мг).
1H-ЯМР (400 МГц, CDCl3) δ 7,62 (д, J=8,3 Гц, 2H), 7,33-7,06 (м, 6H), 4,14-3,37 (м, 5H), 2,69 (д, J=13,8 Гц, 1H), 2,53-2,37 (м, 4H), 2,21-2,09 (м, 1H) 1,83-1,54 (м, 1H), 1,12 (ушир.c, 3H).
ESI/MS (m/z) 374 (M+H)+.
Пример 2
Метиловый эфир 4-метил-2,3,4,5,-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Метиловый эфир 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 434 мг) растворяли в метаноле (12 мл), к нему добавляли магний (283 мг) и реакционную смесь перемешивали при 60°C в течение 30 минут. В реакционный раствор добавляли насыщенный водный раствор хлорида аммония и перемешивали при комнатной температуре в течение 1 часа, а затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и полученный осадок очищали хроматографией на силикагеле (гексан/этилацетат = 3/2) с получением, таким образом, указанного в заголовке соединения (255 мг) в виде желтого маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,09 (дд, J=7,4, 1,6 Гц, 1H), 7,04 (тд, J=7,4, 1,6 Гц, 1H), 6,81 (тд, J=7,4, 1,2 Гц, 1H), 6,67 (дд, J=7,4, 1,2 Гц, 1H), 3,71 (ушир.c, 1H), 3,62 (c, 3H), 3,18-3,05 (м, 3H), 2,79 (д, J=13,7 Гц, 1H), 2,26 (дддд, J=13,9, 7,0, 2,6, 1,1 Гц, 1H), 1,70 (ддд, J=13,9, 9,1, 3,2 Гц, 1H), 1,24 (c, 3H).
ESI/MS (m/z) 220 (M+H)+.
Пример 3
4-Метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Метиловый эфир 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 4,82 г) растворяли в смешанном растворителе из тетрагидрофурана (35 мл) и метанола (35 мл), к нему добавляли 1М гидроксид натрия (37 мл), и реакционную смесь перемешивали при 50°C в течение 11 часов. Реакционный раствор концентрировали при пониженном давлении и в полученный осадок добавляли воду и экстрагировали этилацетатом. В водную фазу добавляли 6 M хлористоводородную кислоту для подкисления, а затем экстрагировали метиленхлоридом, и органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (3,92 г) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,62 (д, J=8,3 Гц, 2H), 7,27-7,12 (м, 6H), 3,98-3,49 (м, 3H), 2,71 (д, J=14,0 Гц, 1H), 2,49 (д, J=14,0 Гц, 1H), 2,43 (c, 3H), 2,19-2,13 (м, 1H), 1,78-1,71 (м, 1H), 1,16 (ушир.c, 3H).
ESI/MS (m/z) 360 (M+H)+, 358 (M-H)-.
Справочный пример 15
N-[(R)-2-гидрокси-1-фенилэтил]-4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамид (хиральное соединение A)
Справочный пример 16
N-[(R)-2-гидрокси-1-фенилэтил]-4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамид (хиральное соединение B)
4-Метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновую кислоту (рацемат: 1,00 г) растворяли в N,N-диметилформамиде (20 мл), к нему добавляли 1-гидроксибензотриазол (563 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (800 мг) и (R)-(-)-2-фенилглицинол (572 мг), и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. В реакционный раствор добавляли воду и экстрагировали этилацетатом, а затем органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом, а затем сушили безводным сульфатом натрия. После фильтрации фильтрат концентрировали при пониженном давлении и полученный осадок очищали хроматографией на силикагеле (гексан/этилацетат = 1/1) с получением, таким образом, указанных в заголовке соединений [Справочный пример 15 (хиральное соединение A): 526 мг и справочный пример 16 (хиральное соединение B): 629 мг] в виде бесцветных маслянистых веществ.
Справочный пример 15 (хиральное соединение A):
1H-ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=8,3 Гц, 2H), 7,32-7,23 (м, 9H), 7,17 (тд, J=7,4, 1,4 Гц, 1H), 7,09 (дд, J=7,4, 1,4 Гц, 1H), 6,96 (ушир.c, 1H), 6,16 (д, J=6,9 Гц, 1H), 4,94-4,90 (м, 1H), 3,88-3,74 (м, 1H), 3,81 (дд, J=5,3, 5,3 Гц, 2H), 3,63-3,49 (м, 1H), 2,64 (д, J=14,3 Гц, 1H), 2,52 (д, J=14,3 Гц, 1H), 2,40 (c, 3H), 2,29-2,23 (м, 1H), 1,72-1,65 (м, 1H), 1,12 (ушир.c, 3H).
ESI/MS (m/z) 479 (M+H)+, 477 (M-H)-.
Справочный пример 16 (хиральное соединение B):
1H-ЯМР (400 МГц, CDCl3) δ 7,62 (д, J=8,3 Гц, 2H), 7,37-7,20 (м, 9H), 7,17 (д, J=8,0 Гц, 2H), 7,12 (дд, J=7,0, 1,8 Гц, 1H), 6,16 (д, J=6,9 Гц, 1H), 4,96-4,92 (м, 1H), 3,78-3,74 (м, 4H), 2,64 (д, J=14,1 Гц, 1H), 2,59-2,53 (м, 1H), 2,42 (c, 3H), 2,27-2,22 (м, 1H), 1,70-1,62 (м, 1H), 1,11 (ушир.c, 3H).
ESI/MS (m/z) 479 (M+H)+, 477 (M-H)-.
В рамках настоящего изобретения, "хиральным соединением A" обозначают оптически активный высокополярный изомер по четвертичному атому углерода, когда четвертичный атом углерода представляет собой асимметричный атом углерода, как показано, например, в формуле, описанной ниже;
[Формула 28]
Кроме того, описанное выше соединение и нижеследующее соединение, полученное с использованием исходного материала, имеющего оптически активный высокополярный изомер по четвертичному атому углерода, аналогичным образом обозначают как (хиральное соединение A) в конце его обозначения.
В рамках настоящего изобретения, "хиральное соединение B" обозначают как оптически активный низкополярный изомер по четвертичному атому углерода, когда четвертичный атом углерода представляет собой асимметричный атом, как показано, например, в формуле, описанной ниже;
[Формула 29]
Кроме того, описанное выше соединение и нижеследующее соединение, полученное с использованием исходного материала, имеющего оптически активный низкополярный изомер по четвертичному атому углерода, аналогичным образом обозначают как (хиральное соединение B) в конце его обозначения.
Пример 4
Метиловый эфир 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A)
N-[(R)-2-гидрокси-1-фенилэтил]-4-метил-1-тозил-2,3,4,тетрагидро-1H-бензо[b]азепин-4-карбоксамид (хиральное соединение A: 526 мг) растворяли в метаноле (11 мл), к нему добавляли концентрированную серную кислоту (2,2 мл), и реакционную смесь перемешивали при 80°C в течение 11 часов. Реакционный раствор концентрировали при пониженном давлении, к полученному осадку добавляли воду и экстрагировали этилацетатом. Органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и полученный осадок очищали хроматографией на силикагеле (гексан/этилацетат = 2/1) с получением, таким образом, указанного в заголовке соединения (434 мг) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,62 (д, J=8,3 Гц, 2H), 7,28-7,25 (м, 2H), 7,23-7,14 (м, 3H), 7,12-7,08 (м, 1H), 4,00-3,87 (м, 1H), 3,64-3,48 (м, 1H), 3,53 (c, 3H), 2,69 (д, J=13,8 Гц, 1H), 2,47 (д, J=13,8 Гц, 1H), 2,43 (c, 3H), 2,18-2,13 (м, 1H), 1,76-1,70 (м, 1H), 1,12 (ушир.c, 3H).
ESI/MS (m/z) 374 (M+H)+.
Пример 5
Метиловый эфир 4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A)
Реакцию проводили тем же способом, что и в примере 2, с использованием метилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) вместо метилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,09 (дд, J=7,4, 1,4 Гц, 1H), 7,04 (тд, J=7,4, 1,4 Гц, 1H), 6,81 (тд, J=7,4, 1,4 Гц, 1H), 6,67 (дд, J=7,4, 1,4 Гц, 1H), 3,71 (ушир.c, 1H), 3,62 (c, 3H), 3,18-3,05 (м, 3H), 2,79 (д, J=13,7 Гц, 1H), 2,26 (дддд, J=13,9, 7,0, 2,6, 1,1 Гц, 1H), 1,70 (ддд, J=13,9, 9,1, 3,2 Гц, 1H), 1,24 (c, 3H).
ESI/MS (m/z) 220 (M+H)+.
Справочный пример 17
Этиловый эфир 1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Этиловый эфир 1-тозил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты (631 мг) растворяли в этаноле (8 мл), к нему добавляли 10% палладий на угле (63,0 мг), и реакционную смесь перемешивали в атмосфере водорода при 50°C в течение 14,5 часов. Палладий на углероде отфильтровывали с помощью целита, а затем фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (634 мг) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,66-7,58 (м, 2H), 7,31-7,23 (м, 3H), 7,22-7,12 (м, 3H), 4,20-3,96 (м, 2H), 3,65-3,38 (м, 1H), 2,75-2,57 (м, 2H), 2,55-2,45 (м, 1H), 2,42 (c, 3H), 2,15-1,96 (м, 3H), 1,19 (т, J=7,1 Гц, 3H).
Пример 6
Этиловый эфир 4-фтор-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты
Этиловый эфир 1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 1,00 г) растворяли в тетрагидрофуране (25 мл) и реакционную смесь охлаждали до -78°C. К ней капельно добавляли 2М раствор диизопропиламида лития в тетрагидрофуране (1,7 мл) при -78°C, а затем реакционный раствор перемешивали в течение 30 минут. В реакционный раствор капельно добавляли раствор тетрагидрофурана (10 мл), содержавший N-фторбензолсульфонимид (1,27 г) при той же температуре и раствор перемешивали в течение 10 минут, а затем температуру увеличивали до -40°C, и реакционный раствор далее перемешивали в течение 10 минут. В реакционный раствор добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором, и сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и полученный осадок очищали колоночной хроматографией на силикагеле (этилацетат/гексан = 1/6) с получением, таким образом, указанного в заголовке соединения (93 6 мг) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,66-7,61 (м, 2H), 7,31-7,19 (м, 5H), 7,16-7,11 (м, 1H), 4,25-4,16 (м, 2H), 3,63-3,41 (м, 1H), 3,01-2,80 (м, 2H), 2,56-2,37 (м, 4H), 2,15-2,03 (м, 2H), 1,30-1,25 (м, 3H).
ESI/MS (m/z) 392 (M+H)+.
Пример 7
Метиловый эфир 4-фтор-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Реакцию проводили тем же способом, как и в примере 2, с использованием этилового эфира 4-фтор-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,65-7,60 (м, 2H), 6,88 (тд, J=7,9, 1,2 Гц, 1H), 6,78 (дд, J=7,9, 1,2 Гц, 1H), 3,82 (c, 3H), 3,45-3,06 (м, 4H), 2,28-2,46 (м, 1H), 2,24-2,11 (м, 1H).
ESI/MS (m/z) 224 (M+H)+.
Пример 8
4-Фтор-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 3, с использованием этилового эфира 4-фтор-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,63 (д, J=8,3 Гц, 2H), 7,32-7,21 (м, 5H), 7,17-7,12 (м, 1H), 4,23 (д, J=13,7 Гц, 1H), 3,55-3,42 (м, 1H), 3,05-2,87 (м, 2H), 2,63-2,39 (м, 4H), 2,16-2,09 (м, 1H).
ESI/MS (m/z) 364 (M+H)+.
Справочный пример 18
4-Фтор-N-[(R)-2-гидрокси-1-фенилэтил]-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамид (хиральное соединение A)
Справочный пример 19
4-Фтор-N-[(R)-2-гидрокси-1-фенилэтил]-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамид (хиральное соединение B)
Реакции проводили способами, аналогичными способам примеров 15 и 16, с использованием 4-фтор-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанных в заголовке соединений [справочный пример 18 (хиральное соединение A) и справочный пример 19 (хиральное соединение B)].
Справочный пример 18 (хиральное соединение A):
1H-ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=8,3 Гц, 2H), 7,46-7,17 (м, 10H), 7,07-7,02 (м, 1H), 7,01-6,94 (м, 1H), 5,07-5,01 (м, 1H), 4,35 (д, J=14,8 Гц, 1H), 3,92-3,86 (м, 2H), 3,48-3,36 (м, 1H), 2,91-2,73 (м, 1H), 2,69-2,47(м, 3H), 2,39 (c, 3H), 2,08-1,92 (м, 1H).
ESI/MS (m/z) 483 (M+H)+.
Справочный пример 19 (хиральное соединение B):
1H-ЯМР (400 МГц, CDCl3) δ 7,58 (д, J=8,3 Гц, 2H), 7,44 (дд, J=7,8, 1,4 Гц, 1H), 7,39-7,21 (м, 9H), 7,12 (дд, J=7,4, 1,5 Гц, 1H), 7,00-6,97 (м, 1H), 5,06-5,02 (м, 1H), 4,32 (дт, J=14,8, 4,0 Гц, 1H), 3,92-3,89 (м, 2H), 3,39 (дд, J=13,8, 13,8 Гц, 1H), 2,91-2,72 (м, 2H), 2,58-2,41 (м, 1H), 2,41 (c, 3H), 2,03 (дд, J=6,6, 5,8 Гц, 1H), 1,94-1,87 (м, 1H).
ESI/MS (m/z) 483 (M+H)+.
Пример 9
Метиловый эфир 4-фтор-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 4, с использованием 4-фтор-N-[(R)-2-гидрокси-1-фенилэтил]-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамида (хиральное соединение A) вместо N-[(R)-2-гидрокси-1-фенилэтил]-4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамида (хиральное соединение A) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,64 (д, J=8,3 Гц, 2H), 7,31-7,19 (м, 5H), 7,13 (дд, J=5,1, 2,5 Гц, 1H), 4,25-4,07 (м, 1H), 3,77 (c, 3H), 3,61-3,42 (м, 1H), 3,09-2,80 (м, 2H), 2,57-2,39 (м, 4H), 2,15-2,04 (м, 1H).
ESI/MS (m/z) 378 (M+H)+.
Пример 10
Метиловый эфир 4-фтор-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 2, с использованием метилового эфира 4-фтор-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) вместо метилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,65-7,60 (м, 2H), 6,88 (тд, J=7,9, 1,2 Гц, 1H), 6,78 (дд, J=7,9, 1,2 Гц, 1H), 3,82 (c, 3H), 3,45-3,06 (м, 4H), 2,28-2,46 (м, 1H), 2,24-2,11 (м, 1H).
ESI/MS (m/z) 224 (M+H)+.
Пример 11
Этиловый эфир 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Реакцию проводили способом, аналогичным способу примера 6, с использованием метилиодида вместо N-фторбензолсульфонимида с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,62 (д, J=8,3 Гц, 2H), 7,31-7,08 (м, 6H), 4,08-3,86 (м, 3H), 3,71-3,41 (м, 1H), 2,67 (д, J=13,9 Гц, 1H), 2,52-2,39 (м, 4H), 2,21-2,10 (м, 1H), 1,82-1,63 (м, 1H), 1,21-1,02 (м, 6H).
ESI/MS (m/z) 388 (M+H)+.
Пример 12
Этиловый эфир 4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Реакцию проводили способом, аналогичным примеру 2, с использованием этилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,12-7,06 (м, 1H), 7,03 (тд, J=7,5, 1,4 Гц, 1H), 6,81 (тд, J=7,5, 1,4 Гц, 1H), 6,67 (дд, J=7,5, 1,4 Гц, 1H), 4,06(кв, J=7,2 Гц, 2H), 3,71 (ушир.c, 1H), 3,20-3,63 (м, 3H), 2,79 (д, J=13,8 Гц, 1H), 2,31-2,22 (м, 1H), 1,74-1,64 (м, 1H), 1,24 (c, 3H), 1,19 (т, J=7,2 Гц, 3H).
ESI/MS (m/z) 234 (M+H)+.
Справочный пример 20
Метиловый эфир 1-(трет-бутоксикарбонил)-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты
Метиловый эфир 2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты (114 г) растворяли в тетрагидрофуране (1,2 л), к нему добавляли 4-диметиламинопиридин (6,85 г) и ди-трет-бутилдикарбонат (490 г), и реакционную смесь перемешивали при 80°C в течение 5 часов. Затем в реакционный раствор дополнительно добавляли 4-диметиламинопиридин (68,5 г) и ди-трет-бутилдикарбонат (184 г) и перемешивали при 80°C в течение 15 часов. Реакционный раствор концентрировали при пониженном давлении и добавляли этилацетат, и органическую фазу последовательно промывали 20% водным раствором лимонной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, и сушили безводным сульфатом натрия. После фильтрования осадок, полученный путем концентрирования фильтрата при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан = 1/6) с получением, таким образом, указанного в заголовке соединения (141 г) в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,67 (c, 1H), 7,41-7,27 (м, 3H), 7,19 (т, J=8,0 Гц, 1H), 3,82 (c, 3H), 3,65 (c, 2H), 2,89 (т, J=4,0 Гц, 2H), 1,47 (c, 9H).
ESI/MS (m/z) 304 (M+H)+.
Справочный пример 21
Метиловый эфир 1-(трет-бутоксикарбонил)-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты
Реакцию проводили способом, аналогичным способу примера 17, с использованием метилового эфира 1-(трет-бутоксикарбонил)-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты вместо этилового эфира 1-тозил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,26-7,12 (м, 4H), 4,45-4,25 (м, 1H), 3,69 (c, 3H), 3,00-2,10 (м, 4H), 2,10-2,00 (м, 2H), 1,53-1,36 (м, 9H).
ESI/MS (m/z) 306 (M+H)+.
Пример 13
Метиловый эфир 1-(трет-бутоксикарбонил)-4-этил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Реакцию проводили способом, аналогичным способу примера 6, с использованием метилового эфира 1-(трет-бутоксикарбонил)-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты вместо этилового эфира 1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты и с использованием этилиодида вместо N-фторбензолсульфонимида, с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,21-7,08 (м, 4H), 4,30 (c, 1H), 3,59 (c, 3H), 3,00-2,83(м, 3H), 2,23-2,18 (м, 1H), 1,69-1,37 (м, 12H), 0,85 (т, J=8,0 Гц, 3H).
ESI/MS (m/z) 334 (M+H)+.
Пример 14
1-(Трет-бутоксикарбонил)-4-этил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 2, с использованием метилового эфира 1-(трет-бутоксикарбонил)-4-этил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,26-7,10 (м, 4H), 4,29-2,83 (м, 4H), 2,20-2,16 (м, 1H), 1,68-1,37 (м, 12H), 0,91-0,87 (м, 3H).
ESI/MS (m/z) 320 (M+H)+, 318 (M-H)-.
Справочный пример 22
Трет-бутиловый эфир 4-этил-4-{[(R)-2-гидрокси-1-фенилэтил]карбамоил}-2,3,4,5-тетрагидро-1H-бензо[b]азепин-1-карбоновой кислоты (хиральное соединение A)
Справочный пример 23
Трет-бутиловый эфир 4-этил-4-{[(R)-2-гидрокси-1-фенилэтил]карбамоил}-2,3,4,5-тетрагидро-1H-бензо[b]азепин-1-карбоновой кислоты (хиральное соединение B)
Реакции проводили способами, аналогичными способам справочных примеров 15 и 16, с использованием 1-(трет-бутоксикарбонил)-4-этил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо 4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанных в заголовке соединений [справочный пример 22 (хиральное соединение A) и справочный пример 23 (хиральное соединение B)].
Справочный пример 22 (хиральное соединение A):
1H-ЯМР (400 МГц, CDCl3) δ 7,33-6,93 (м, 9H), 6,31 (c, 1H), 4,98 (c, 1H), 4,30-3,83 (м, 3H), 2,96-2,27 (м, 4H), 1,68-1,37 (м, 13H), 0,95-0,91 (м, 3H).
ESI/MS (m/z) 439 (M+H)+, 437 (M-H)-.
Справочный пример 23 (хиральное соединение B):
1H-ЯМР (400 МГц, CDCl3) δ 7,35-7,14 (м, 9H), 6,25 (ушир.с, 1H), 4,97-4,94 (м, 1H), 4,36-4,23 (м, 1H), 3,77-3,70 (м, 2H), 3,00-2,95 (м, 2H), 2,38-2,20 (м, 2H), 1,71-1,53 (м, 3H), 1,37 (c, 9H), 0,86 (т, J=7,7 Гц, 3H).
ESI/MS (m/z) 439 (M+H)+, 437 (M-H)-.
Пример 15
Метиловый эфир 4-этил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 4, с использованием трет-бутилового эфира этил-4-{[(R)-2-гидрокси-1-фенилэтил]карбамоил}-2,3,4,5-титрагидро-1H-бензо[b]азепин-1-карбоновой кислоты (хиральное соединение A) вместо N-[(R)-2-гидрокси-1-фенилэтил]-4-метил-1-тозил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамида (хиральное соединение A) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,09 (д, J=8,0 Гц, 1H), 7,03 (т, J=8,0 Гц, 1H), 6,80 (т, J=8,0 Гц, 1H), 6,65 (д, J=8,0 Гц, 1H), 3,72 (ушир.c, 1H), 3,61 (c, 3H), 3,22-2,83 (м, 4H), 2,28-2,22 (м, 1H), 1,76-1,51 (м, 3H), 0,85 (т, J=8,0 Гц, 3H).
ESI/MS (m/z) 234 (M+H)+.
Справочный пример 24
Сложный эфир (S)-3-циано-2-метилпропилметансульфоновой кислоты
(R)-3-бром-2-метил-1-пропанол (30,1 г) растворяли в диметилсульфоксиде (130 мл), к нему добавляли цианид натрия (10,1 г), и реакционную смесь перемешивали при 60°C в течение 1,5 часов. В реакционный раствор добавляли воду и экстрагировали метиленхлоридом 4 раза. Органическую фазу последовательно промывали водой и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением, таким образом, (S)-4-гидрокси-3-метилбутаннитрила.
Описанный выше (S)-4-гидрокси-3-метилбутаннитрил растворяли в метиленхлориде (400 мл), к нему добавляли триэтиламин (44 мл) и метансульфонилхлорид (18,4 мл) при 0°C, а затем реакционную смесь перемешивали при 0°C в течение 30 минут. В реакционный раствор добавляли 1М хлористоводородную кислоту для подкисления, а затем экстрагировали метиленхлоридом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (29,9 г) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 4,25 (дд, J=10,3, 4,7 Гц, 1H), 4,08 (дд, J=10,3, 7,5 Гц, 1H), 3,06 (c, 3H), 2,57-2,41 (м, 2H), 2,41-2,25 (м, 1H), 1,18 (д, J=6,9 Гц, 3H).
Справочный пример 25
(S)-N-(3-Циано-2-метилпропил)-N-(2-формилфенил)-4-метилбензолсульфонамид
N-(2-Формилфенил)-4-метилбензолсульфонамид (33,0 г) и сложный эфир (S)-3-циано-2-метилпропилметансульфоновой кислоты (23,3 г) растворяли в N,N-диметилформамиде (480 мл), к нему добавляли бромид лития (15,6 г) и карбонат калия (24,9 г), и реакционную смесь перемешивали при 70°C в течение 18 часов. В реакционный раствор добавляли воду и экстрагировали этилацетатом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором, и сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении, и полученный осадок очищали колоночной хроматографией на силикагеле (гексан/этилацетат = от 3/1 до 1/2) с получением, таким образом, указанного в заголовке соединения (23,5 г) в виде желтого маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 10,45-10,38 (м, 1H), 8,04 (дд, J=7,1, 2,3 Гц, 1H), 7,56-7,45 (м, 2H), 7,43-7,39 (м, 2H), 7,28 (д, J=8,3 Гц, 2H), 6,82-6,71 (м, 1H), 3,85-3,64 (м, 1H), 3,50-3,21 (м, 1H), 2,62-2,39 (м, 1H), 2,45 (c, 3H), 2,35 (дд, J=6,4, 2,4 Гц, 1H), 2,13-1,95 (м, 1H), 1,20-1,04 (м, 3H).
ESI/MS (m/z) 357 (M+H)+.
Справочный пример 26
(S)-3-Метил-1-тозил-2,3-дигидро-1H-бензо[b]азепин-4-карбонитрил
(S)-N-(3-Циано-2-метилпропил)-N-(2-формилфенил)-4-метилбензолсульфонамид (17,7 г) растворяли в диэтилкарбонате (830 мл), к нему добавляли 20% раствор этоксида натрия в этаноле (24 мл), и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования осадок, полученный путем концентрирования фильтрата при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан = от 1/9 до 1/1) с получением, таким образом, указанного в заголовке соединения (9,00 г).
1H-ЯМР (400 МГц, CDCl3) δ 7,65 (дд, J=8,0, 1,0 Гц, 1H), 7,46-7,33 (м, 1H), 7,42 (д, J=8,4 Гц, 2H), 7,29 (тд, J=7,5, 1,0 Гц, 1H), 7,21-7,18 (м, 3H), 6,71 (д, J=1,8 Гц, 1H), 4,40 (дд, J=13,5, 4,2 Гц, 1H), 3,23-3,01 (м, 2H), 2,39 (c, 3H), 1,21 (д, J=6,6 Гц, 3H).
ESI/MS (m/z) 339 (M+H)+, 337 (M-H)-.
Справочный пример 27
Метиловый эфир (S)-3-метил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты
Реакцию проводили способом, аналогичным способу справочного примера 11, с использованием (S)-3-метил-1-тозил-2,3-дигидро-1H-бензо[b]азепин-4-карбонитрила вместо этилового эфира 1-тозил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,62 (c, 1H), 7,27 (дд, J=7,8, 1,6 Гц, 1H), 7,11 (ддд, J=8,3, 7,2, 1,6 Гц, 1H), 6,73 (ддд, J=7,8, 7,2, 1,2 Гц, 1H), 6,69-6,61 (м, 1H), 4,57 (ушир.с, 1H), 3,80 (c, 3H), 3,42-3,25 (м, 2H), 3,04 (д, J=12,8 Гц, 1H), 1,15 (д, J=6,8 Гц, 3H).
ESI/MS (m/z) 218 (M+H)+.
Пример 16
Метиловый эфир (3S)-1-(трет-бутоксикарбонил)-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Метиловый эфир (S)-3-метил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты (305 мг) растворяли в тетрагидрофуране (3 мл), к нему добавляли ди-трет-бутилдикарбонат (1,1 мл) и 4-диметиламинопиридин (305 мг), и реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 17 часов. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования осадок, полученный концентрированием фильтрата при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан = от 1/4 до 1/2) с получением, таким образом, метилового эфира (3S)-1-(трет-бутоксикарбонил)-3-метил-3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты.
Описанный выше метиловый эфир (3S)-1-(трет-бутоксикарбонил)-3-метил-2,3-дигидро-1H-бензо[b]азепин-4-карбоновой кислоты растворяли в этаноле (4 мл) и к нему добавляли 10% палладий на угле (30,0 мг). После заполнения внутреннего содержимого контейнера водородом реакционный раствор перемешивали при 50°C в течение 4 часов. Реакционный контейнер заполняли аргоном, а затем реакционный раствор фильтровали через целит и промывали этилацетатом. В фильтрат добавляли воду и разделяли, а затем органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (251 мг).
1H-ЯМР (400 МГц, CDCl3) δ 7,29-7,01 (м, 4H), 4,54-3,91 (м, 1H), 3,82-3, 40 (м, 3H), 3,27-2,07 (м, 5H), 1,60-1,30 (м, 9H), 1,13-0, 79 (м, 3H).
Пример 17
Метиловый эфир (3S)-1-(трет-бутоксикарбонил)-3,4-диметил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Метиловый эфир (3S)-1-(трет-бутоксикарбонил)-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (251 мг) растворяли в тетрагидрофуране (5 мл) и охлаждали до -78°C. К нему капельно добавляли диизопропиламид лития (1,8M раствор в тетрагидрофуране) (870 мкл) и реакционную смесь перемешивали в течение 30 минут. В реакционный раствор добавляли метилиодид (98 мкл) и перемешивали при -40°C в течение 1 часа. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрования осадок, полученный путем концентрирования фильтрата при пониженном давлении, очищали колоночной хроматографией на силикагеле (этилацетат/гексан = от 1/10 до 1/4) с получением, таким образом, указанного в заголовке соединения (219 мг).
1H-ЯМР (400 МГц, CDCl3) δ 7,25-7,04 (м, 4H), 4,22-4,04 (м, 1H), 3,74 (c, 3H), 3,23(д, J=13,2 Гц, 1H), 2,71-2,35 (м, 3H), 1,60-1,31 (м, 9H), 0,85-0,69 (м, 3H).
Пример 18
Метиловый эфир (3S)-3,4-диметил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Метиловый эфир (3S)-1-(трет-бутоксикарбонил)-3,4-диметил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 219 мг) растворяли в метиленхлориде (4,4 мл), к нему добавляли трифторуксусную кислоту (730 мкл) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор охлаждали до 0°C и разбавляли метиленхлоридом и водой. В смешанный раствор добавляли 5М гидроксид натрия для нейтрализации, а затем экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (144 мг).
ESI/MS (m/z) 234 (M+H)+.
Пример 19
Метиловый эфир (3S)-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты
Метиловый эфир (3S)-1-(трет-бутоксикарбонил)-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 913 мг) растворяли в метиленхлориде (9 мл), к нему добавляли трифторуксусную кислоту (3 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор охлаждали до 0°C и разбавляли метиленхлоридом и водой. В смешанный раствор добавляли 5М гидроксид натрия для нейтрализации, а затем экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (560 мг).
ESI/MS (m/z) 220 (M+H)+.
Пример 20
Метиловый эфир (3R)-4-фтор-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
Метиловый эфир (3S)-1-(трет-бутоксикарбонил)-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 571 мг) растворяли в тетрагидрофуране (7 мл) и охлаждали до -78°C. К нему капельно добавляли 2М раствор диизопропиламида лития в тетрагидрофуране (1,8 мл) при -78°C, а затем перемешивали в течение 30 минут. В реакционный раствор капельно добавляли раствор тетрагидрофурана (2 мл), содержавший N-фторбензолсульфонимид (1,13 г) при той же температуре, реакционный раствор перемешивали в течение 10 минут, а затем температуру увеличивали до -40°C, и реакционный раствор далее перемешивали в течение 10 минут. В реакционный раствор добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органическую фазу последовательно промывали водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении, и полученный осадок очищали колоночной хроматографией на силикагеле (этилацетат/гексан = 1/4) с получением, таким образом, метилового эфира (3R)-1-(трет-бутоксикарбонил)-4-фтор-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 463 мг).
Описанный выше метиловый эфир (3R)-1-(трет-бутоксикарбонил)-4-фтор-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 456 мг) растворяли в метиленхлориде (5 мл), к нему добавляли трифторуксусную кислоту (1,7 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор охлаждали до 0°C и разбавляли метиленхлоридом и водой. В смешанный раствор добавляли 5М гидроксид натрия для нейтрализации, а затем экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (259 мг).
ESI/MS (m/z) 238 (M+H)+.
Пример 21
Метиловый эфир 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат)
2-Метил-4-(3-метил-1H-пиразол-1-ил)бензойную кислоту (507 мг) суспендировали в тионилхлориде (5 мл) и реакционный раствор перемешивали при 50°C в течение 30 минут, а затем концентрировали при пониженном давлении. Полученный осадок растворяли в метиленхлориде (8 мл), к нему добавляли раствор метиленхлорида (2 мл), содержавший метиловый эфир 4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 466 мг) и пиридин (430 мкл), а затем реакционную смесь перемешивали при комнатной температуре в течение 3 часов. В реакционный раствор добавляли воду и экстрагировали метиленхлоридом, и органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, и сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении, и полученный осадок очищали хроматографией на силикагеле (гексан/этилацетат = от 2/1 до 1/1) с получением, таким образом, указанного в заголовке соединения (848 мг) в виде желтого маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,84-7,42 (м, 2H), 7,16-5,56 (м, 6H), 6,27-6,19 (м, 1H), 4,85-4,61 (м, 1H), 3,79-3,44 (м, 4H), 3,13-2,80 (м, 3H), 2,53-2,29 (м, 6H), 1,99-1,93 (м, 1H), 1,43 (ушир.c, 2H), 1,06 (ушир.c, 1H).
ESI/MS (m/z) 418 (M+H)+.
Пример 22
4-Метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Метиловый эфир 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат: 848 мг) растворяли в смешанном растворителе из тетрагидрофурана (5 мл) и метанола (5 мл), к нему добавляли 5М гидроксид натрия (2 мл) и реакционную смесь перемешивали при 50°C в течение 3,5 часов. Реакционный раствор концентрировали при пониженном давлении и к полученному осадку добавляли воду и экстрагировали этилацетатом. К водной фазе добавляли 6 M хлористоводородную кислоту для подкисления, а затем экстрагировали метиленхлоридом, и органическую фазу промывали насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением, таким образом, указанного в заголовке соединения (819 мг) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,84-7,45 (м, 2H), 7,21-6,55 (м, 6H), 6,27-6,20 (м, 1H), 4,87-4,61 (м, 1H), 3,75-2,82 (м, 4H), 2,53-2,28 (м, 6H), 2,01-1,95 (м, 1H), 1,50 (ушир.с, 2H), 1,10 (ушир.c, 1H).
ESI/MS (m/z) 404 (M+H)+, 402 (M-H)-.
Пример 23
N-(2-амино-2-оксоэтил)-N,4-диметил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоксамид (рацемат)
4-Метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновую кислоту (рацемат: 20,0 мг) растворяли в метиленхлориде (1,5 мл), к нему добавляли 1-гидроксибензотриазол (13,4 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (19,0 мг) и гидрохлорид N-метилглицинамида (12,4 мг) и реакционную смесь перемешивали при комнатной температуре в течение 17,5 часов. К реакционному раствору добавляли воду и экстрагировали метиленхлоридом, а затем органическую фазу последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, а затем сушили безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и полученный осадок очищали тонкослойной хроматографией на силикагеле (хлороформ/метанол = 10/1) с получением, таким образом, указанного в заголовке соединения (2,00 мг) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,84-7,44 (м, 2H), 7,19-6,76 (м, 4H), 7,11 (дд, J=8,2, 2,0 Гц, 1H), 6,60 (д, J=7,4 Гц, 1H), 6,27-6,19 (м, 1H), 5,56 (ушир.c, 1H), 5,33 (ушир.c, 1H), 4,96-4,82 (м, 1H), 4,56-4,49 (м, 1H), 4,18-3,94 (м, 2H), 3,61-3,15 (м, 5H), 2,93-2,88 (м, 1H), 2,52-2,33 (м, 6H), 1,95-1,89 (м, 1H), 1,56 (ушир.c, 2H), 1,26 (ушир.c, 1H).
ESI/MS (m/z) 474 (M+H)+, 472 (M-H)-.
Соединения синтезировали в соответствии со схемой реакции, описанной ниже, способом примера 21. Синтезированные соединения и данные представлены в таблицах 1 и 2.
[Формула 30]
| Таблица 1 | |||||||
| Примеры | Исходный материал | R2 | R3 | R4 | R5 | R10 | ESI/MS (m/z) |
| 24 (хиральное соединение А) |
Пример 5 | H | Me | Me | Me | 418 (M+H)+ | |
| 25 (хиральное соединение А) |
Пример 5 | H | Me | Me | Me | 407 (M+H)+ | |
| 26 (рацемат) |
Пример 12 | H | Me | Me | Et | 435 (M+H)+ | |
| 27 (рацемат) |
Пример 12 | H | Me | Me | Et | 433 (M+H)+ | |
| 28 (хиральное соединение А) |
Пример 5 | H | Cl | Me | Me | 438 (M+H)+ | |
| 29 (рацемат) |
Пример 12 | H | Cl | Me | Et | 448 (M+H)+ | |
| 30 (хиральное соединение А) |
Пример 5 | H | Cl | Me | Me | 456 (M+H)+ | |
| 31 (рацемат) |
Пример 2 | H | Cl | Me | Me | 427 (M+H)+ | |
| 32 (рацемат) |
Пример 2 | H | Cl | Me | Me | 416 (M+H)+ | |
| 33 (рацемат) |
Пример 2 | H | Cl | Me | Me | 425 (M+H)+ | |
| 34 (рацемат) |
Пример 2 | H | Cl | Me | Me | 424 (M+H)+ | |
| 35 (хиральное соединение А) |
Пример 5 | H | CF3 | Me | Me | 472 (M+H)+ | |
| 36 (хиральное соединение А) |
Пример 5 | H | CF3 | Me | Me | 461 (M+H)+ | |
| 37 (хиральное соединение А) |
Пример 10 | H | Me | F | Me | 422 (M+H)+ |
| Таблица 2 | |||||||
| Примеры | Исходный материал | R2 | R3 | R4 | R5 | R10 | ESI/MS (m/z) |
| 38 (хиральное соединение А) |
Пример 10 | H | Me | F | Me | 411 (M+H)+ | |
| 39 (рацемат) |
Пример 7 | H | Me | F | Me | 425 (M+H)+ | |
| 40 (хиральное соединение А) |
Пример 15 | H | Me | Et | Me | 432 (M+H)+ | |
| 41 (хиральное соединение А) |
Пример 18 | Me | Me | Me | Me | 432 {M+H)+ | |
| 42 (рацемат) |
Пример 19 | Me | Cl | H | Me | 427 (M+H)+ | |
| 43 (рацемат) |
Пример 20 | Me | Cl | F | Me | 445 (M+H)+ | |
Пример 44
4-Метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,84-7,45 (м, 2H), 7,21-6,55 (м, 6H), 6,27-6,20 (м, 1H), 4,87-4,61 (м, 1H), 3,75-2,82 (м, 4H), 2,53-2,28 (м, 6H), 2,01-1,95 (м, 1H), 1,50 (ушир.с, 2H), 1,10 (ушир.c, 1H).
ESI/MS (m/z) 404 (M+H)+, 402 (M-H)-.
Пример 45
4-Метил-1-[2-метил-4-(пирролидин-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 4-метил-1-[2-метил-4-(пирролидин-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
ESI/MS (m/z) 393 (M+H)+, 391 (M-H)-.
Пример 46
4-Метил-1-[2-метил-4-(4-метилоксазол-2-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием этилового эфира 4-метил-1-[2-метил-4(4-метилоксазол-2-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,78 (c, 1H), 7,50-7,37 (м, 2H), 7,22-6,80 (м, 4H), 6,62-6,57 (м, 1H), 4,86-4,61 (м, 1H), 3,49-3,47 (м, 1H), 3,29-2,83 (м, 2H), 2,53 (c, 3H), 2,34-2,27 (м, 1H), 2,20 (д, J=1,2 Гц, 2H), 2,10 (c, 1H), 2,02-1,96 (м, 1H), 1,50 (ушир.с, 2Н), 1,10 (ушир.с, 1Н).
ESI/MS (m/z) 405 (M+H)+, 403 (M-H)-.
Пример 47
1-[2-Хлор-4-(3-метил-1H-пиразол-1-ил)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 1-[2-хлор-4-(3-метил-1H-пиразол-1-ил)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,84-7,70 (м, 1H), 7,64-7,60 (м, 1H), 7,52-6,83 (м, 6H), 6,30-6,21 (м, 1H), 4,80-4,59 (м, 1H), 3,51-2,77 (м, 3H), 2,47-1,95 (м, 5H), 1,62-1,07 (м, 3H).
ESI/MS (m/z) 424 (M+H)+, 422 (M-H)-.
Пример 48
1-[2-Хлор-4-(3-фторпропокси)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием этилового эфира 1-[2-хлор-4-(3-фторпропокси)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,38-6,78 (м, 6H), 6,54 (д, J=8,5 Гц, 1H), 4,83-4,51 (м, 3H), 4,16-3,97 (м, 2H), 3,76-3,48 (м, 1H), 3,28-2,77 (м, 2H), 2,44-2,21 (м, 1H), 2,13 (квинт, J=5,9 Гц, 1H), 2,07 (квинт, J=5,9 Гц, 1H), 2,02-1,95 (м, 1H), 1,47 (ушир.c, 2H), 1,08 (ушир.c, 1H).
ESI/MS (m/z) 420 (M+H)+, 419 (M-H)-.
Пример 49
1-[2-Хлор-4-(пирролидин-1-ил)бензоил)-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 1-[2-хлор-4-(пирролидин-1-ил)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,19 (д, J=7,3 Гц, 1H), 7,07-6,92 (м, 2H), 6,85-6,81 (м, 1H), 6,75 (д, J=8,5 Гц, 1H), 6, 36 (д, J=2,3 Гц, 1H), 6,11 (дд, J=8,5, 2,3 Гц, 1H), 4,84-4,78 (м, 1H), 4,63-4,57 (м, 1H), 3,52-3,49 (м, 1H), 3,18-3,15 (м, 4H), 3,10-3,08 (м, 1H), 2,41-2,23 (м, 2H), 1,95 (ддд, J=6,6, 3,3, 3,3 Гц, 4H), 1,46 (ушир.c, 2H), 1,09 (ушир.c, 1H).
ESI/MS (m/z) 413 (M+H)+, 411 (M-H)-.
Пример 50
1-(2-Хлор-4-пропоксибензоил)-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 1-(2-хлор-4-пропоксибензоил)-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,20 (д, J=7,5 Гц, 1H), 7,13-6,81 (м, 4H), 6,77 (д, J=2,5 Гц, 1H), 6,53 (дд, J=8,5, 2,5 Гц, 1H), 4,82-4,58 (м, 1H), 3,80 (т, J=6,6 Гц, 2H), 3,50 (д, J=13,7 Гц, 1H), 3,27-3,04 (м, 2H), 2,45-2,24 (м, 1H), 2,02-1,94 (м, 1H), 1,73 (секст, J=7,2 Гц, 2H), 1,47 (ушир.c, 2H), 1,08 (ушир.c, 1H), 0,98 (т, J=7,2 Гц, 3H).
ESI/MS (m/z) 402 (M+H)+, 400 (M-H)-.
Пример 51
1-[2-Хлор-4-(оксазол-2-ил)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили тем же способом, как и в примере 22, с использованием метилового эфира 1-[2-хлор-4-(оксазол-2-ил)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,95 (ушир.c, 1H), 7,71-7,68 (м, 1H), 7,68 (c, 1H), 7,22 (c, 1H), 7,22-7,00 (м, 3H), 6,98-6,89 (м, 2H), 4,83-4, 62 (м, 1H), 3,54-3,50 (м, 1H), 3,31-3,08 (м, 2H), 2,49-2,29 (м, 1H), 2,06-1,98 (м, 1H), 1,49 (ушир.c, 2H), 1,09 (ушир.c, 1H).
ESI/MS (m/z) 411 (M+H)+, 409 (M-H)-.
Пример 52
1-[2-Хлор-4-(1H-пиразол-1-ил)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 1-[2-хлор-4-(1H-пиразол-1-ил)бензоил]-4-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,83 (д, J=2,5 Гц, 1H), 7,68 (д, J=1,7 Гц, 1H), 7,67-7,65 (м, 1H), 7,38-7,34 (м, 1H), 7,21-6,86 (м, 5H), 6,44 (дд, J=2,5, 1,7 Гц, 1), 4,84-4,61 (м, 1H), 3,53-3,50 (м, 1H), 3,32-3,07 (м, 2H), 2,48-2,24 (м, 1H), 2,05-1,98 (м, 1H), 1,49 (ушир.c, 2H), 1,09 (ушир.c, 1H).
ESI/MS (m/z) 410 (M+H)+, 408 (M-H)-.
Пример 53
4-Метил-1-[4-(3-метил-1H-пиразол-1-ил)-2-(трифторметил)бензоил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 4-метил-1-[4-(3-метил-1H-пиразол-1-ил)-2-(трифторметил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 8,07-7,90 (м, 1H), 7,76-7,75 (м, 1H), 7,61-7,48 (м, 1H), 7,37-6,87 (м, 4H), 6,79-6,72 (м, 1H), 6,33-6,24 (м, 1H), 4,81-4, 60 (м, 1H), 3,47-2,82 (м, 3H), 2,39-1,97 (м, 5H), 1,64-1,09 (м, 3H).
ESI/MS (m/z) 458 (M+H)+, 456 (M-H)-.
Пример 54
4-Фтор-1-[2-метил-4-(пирролидин-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепеин-4-карбоновая кислота (хиральное соединение A)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира 4-фтор-1-[2-метил-4-(пирролидин-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (хиральное соединение A) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,24-7,16 (м, 1H), 7,14-6,94 (м, 2H), 6,76-6,47 (м, 2H), 6,37-6,23 (м, 1H), 6,09-5,94 (м, 1H), 5,03-4,82 (м, 1H), 3,78-2,86 (м, 7H), 2,71-2,38 (м, 4H), 2,29-2,13 (м, 1H), 2,09-1,84 (м, 4H).
ESI/MS (m/z) 397 (M+H)+.
Пример 55
(3S)-3,4-Диметил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира (3S)-3,4-диметил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
ESI/MS (m/z) 418 (M+H)+, 416(M-H)-.
Пример 56
(3S)-1-[2-Хлор-4-(пирролидин-1-ил)бензоил]-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота (рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира (3S)-1-[2-хлор-4-(пирролидин-1-ил)бензоил]-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,18 (д, J=7,3 Гц, 1H), 7,08-6,93 (м, 2H), 6,90-6,72 (м, 3H), 6,38-6,36 (м, 1H), 6,15-6,09 (м, 1H), 6,15-6,09 (м, 1H), 4,96 (д, J=12,0 Гц, 1H), 3,40-3,29 (м, 1H), 3,18-3,15 (м, 4H), 2,96-2,90 (м, 1H), 2,50-2,42 (м, 2H), 2,23-2,17 (м, 1H), 1,97-1,93 (м, 4H), 1,17-1,04 (м, 3H).
ESI/MS (m/z) 413 (M+H)+, 411 (M-H)-.
Пример 57
(3R)-1-[2-Хлор-4-(пирролидин-1-ил)бензоил]-4-фтор-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновая кислота(рацемат)
Реакцию проводили способом, аналогичным способу примера 22, с использованием метилового эфира (3R)-1-[2-хлор-4-(пирролидин-1-ил)бензоил]-4-фтор-3-метил-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) вместо метилового эфира 4-метил-1-[2-метил-4-(3-метил-1H-пиразол-1-ил)бензоил]-2,3,4,5-тетрагидро-1H-бензо[b]азепин-4-карбоновой кислоты (рацемат) с получением, таким образом, указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 7,14 (д, J=7,0 Гц, 1H), 7,09-7,02 (м, 2H), 6,88 (д, J=7,3 Гц, 1H), 6,76 (д, J=8,4 Гц, 1H), 6,35 (д, J=2,2 Гц, 1H), 6,12 (дд, J=8,4, 2,2 Гц, 1H), 4,81-4,77 (м, 1H), 3,71 (дд, J=44,3, 14,7 Гц, 1H), 3,20-3,14 (м, 5H), 2,89-2,74 (м, 2H), 1,95(ддд, J=6,7, 3,6, 3,6 Гц, 4H), 1,06 (д, J=6,2 Гц, 3H).
ESI/MS (m/z) 431 (M+H)+, 429 (M-H)-.
Соединения синтезировали в соответствии со схемой реакции, описанной ниже, согласно способу примера 22. Синтезированные соединения и данные представлены в таблице 3.
[Формула 31]
| Таблица 3 | ||||||
| Примеры | Исходный материал | R3 | R4 | R5 | R10 | ESI/MS (m/z) |
| 58 (рацемат) |
Пример 26 | Me | Me | Et | 407 (M+H)+ 405 (M-H)- |
|
| 59 (хиральное соединение A) |
Пример 30 | Cl | Me | Me | 442 (M+H)+ 440 (M-H)- |
|
| 60 (хиральное соединение A) |
Пример 36 | CF3 | Me | Me | 447 (M+H)+ 445 (M-H)- |
|
| 61 (хиральное соединение A) |
Пример 37 | Me | F | Me | 408 (M+H)+ 410 (M-H)- |
|
| 62 (рацемат) |
Пример 39 | Me | F | Me | 411 (M+H)+ 409 (M-H)- |
|
| 63 (хиральное соединение A) |
Пример 40 | Me | Et | Me | 418 (M+H)+ 416 (M-H)- |
|
Соединения синтезировали в соответствии со схемой реакции, описанной ниже, согласно способу примера 23. Синтезированные соединения представлены в таблицах 4-6 и данные представлены в таблицах 7-9.
[Формула 32]
| Таблица 7 | ||
| Примеры | 1H-ЯМР (400 MГц, CDCl3) δ | ESI/MS (m/z) |
| 64 (рацемат) |
7,84-7,45 (м, 2H) 7,17-6,75 (м, 4H), 6,61-6,39 (м, 2H), 6,27-6,19 (м, 1H), 5,78 (ушир.c, 1H), 5,67 (д, J=7,9 Гц, 1H), 4,80-4,70 (м, 1H), 4,39-3,99 (м, 2H), 3,53-3,03 (м, 4H), 2,93-2,64 (м, 2H), 2,54-2,33 (м, 6H), 2,02-1,89 (м, 1H), 1,74-1,63 (м, 1H), 1,45 (д, J=5,7 Гц, 1H), 1,08 (д, J=5,7 Гц, 2H). | 486 M+H)+ 484 (M-H)- |
| 65 (хиральное соединение A) |
7,84-7,45 (м, 2H), 7,16-6,74 (м, 5H), 6,62-6,57 (м, 1H), 6,27 (ушир.c, 1H), 6,19 (д, J=2,4 Гц, 1H), 4,82-4,45 (м, 3H), 3,55-2,81 (м, 3H), 2,63-2,39 (м, 6H), 2,33 (c, 3H), 2,00-1,94 (м, 1H), 1,70-1,65 (м, 1H), 1,46 (ушир.c, 1H), 1,10 (ушир.c, 2H). | 499 (M+H)+ 497 (M-H)- |
| 66 (хиральное соединение A) |
7,84-7,70 (м, 1H), 7,63-7,45 (м, 1H), 7,20-7,01 (м, 3H), 6,91-6,76 (м, 2H), 6,60 (д, J=6,6 Гц, 1H), 6,27-6,19 (м, 1H), 5,84-5,48 (м, 2H), 4,79-4,73 (м, 1H), 3,57-3,40 (м, 1H), 3,26-2,80 (м, 2H), 2,54-2,33 (м, 6H), 2,27-1,94 (м, 1H), 1,68-1,60 (м, 1H), 1,45 (ушир.c, 1H), 1,07 (ушир.c, 2H). | 403 (M+H)+ |
| 67 (хиральное соединение A) |
7,84-7,45 (м, 2H), 7,20-7,10(м, 1H), 7,03 (т, J=7,7 Гц, 1H), 6,92-6,75 (м, 2H), 6,61 (дд, J=7,8, 0,9 Гц, 1H), 6,27-6,19 (м, 1H), 5,93-5,91 (м, 1H), 5,64-5,6,3 (м, 1H), 4,82-4,74 (м, 1H), 4,18-3,58 (м, 3H), 3,49-3,14 (м, 3H), 2,99 (д, J=13,5 Гц, 1H), 2,82 (д, J=13,5 Гц, 1H), 2,54-2,33 (м, 6H), 2,06-1,63 (м, 2H), 1,43 (ушир.c, 1H), 1,25-1,05 (м, 3H). | 461 (M+H)+ 459 (M-H)- |
| 68 (хиральное соединение A) |
7,18-7,13 (м, 1H), 7,05-6,91 (м, 2H), 6,64-6,51 (м, 2H), 6,25-5,97 (м, 3H), 5,71 (ушир.c, 1H), 5,41-5,13 (м, 1H), 4,76 (ушир.с, 1H), 4,55-4,35 (м, 1H), 3,49-3,01 (м, 6H), 2,83-2,77 (м, 1H), 2,40 (c, 3H), 2,40-2,23 (м, 1H), 1,95-1,92 (м, 4H), 1,58-1,56 (м, 1H), 1,43 (ушир.c, 3H), 1,30 (ушир.c, 1H), 1,07 (ушир.c, 2H). | 463 (M+H)+ 461 (M-H)- |
| 69 (рацемат) |
7,82-6,41 (м, 5H), 6,28-6,07 (м, 1H), 6,02-5,40 (м, 2H), 4,86-4,50 (м, 1H), 4,32-2,99 (м, 10H), 2,86-2,65 (м, 1H), 2,51-1,69 (м, 7H), 1,65-0,79(м, 7H). | 463 (M+H)+ 461 (M-H)- |
| 70 (рацемат) |
7,20-6,92 (м, 3H), 6,61-6,51 (м, 2H), 6,22 (c, 1H), 5,96-5,92 (м, 1H), 5,71-5,68 (м, 1H), 4,81-4,73 (м, IH), 4,15-3,92 (м, 1H), 3,74-3,02 (м, 7H), 2,85-2,74 (м, 2H), 2,40 (c, 3H), 2,36-2,05 (м, 2H), 1,62-1,22 (м, 4H), 1,07 (д, J=6,6 Гц, 3H), 1,07 (д, J=6,6 Гц, 3H). | 464 (M+H)+ 462 (M-H)- |
| 71 (рацемат) |
7,78 (c, 1H), 7,49-7,35 (м, 2H), 7,21-6,60 (м, 5H), 6,38-5,29 (м, 3H), 4,84-4,32 (м, 2H), 3,55-3,45 (м, 1H), 3,24-2,73 (м, 2H), 2,54-2,20 (м, 7H), 1,95 (т, J=12,1 Гц, 1H), 1,47-1,16 (м, 5H), 1,06 (ушир.c, 1H). | 475 (M+H)+ 473 (M-H)- |
| 72 (хиральное соединение A) |
7,84-7,59 (м, 2H), 7,46-6,85 (м, 6H), 6,30-6,22 (м, 1H), 6,03-5,70 (м, 1H), 4,77-4,73 (м, 1H), 4,15-2,73 (м, 7H), 2,48-1,88 (м, 5H), 1,64-1,03 (м, 6H). | 481 (M+H)+ 479 (M-H)- |
| 73 (рацемат) |
7,13-7,10 (м, 1H), 7,05 (т, J=7,3 Гц, 1H), 6,97-6,84 (м, 3H), 6,78 (c, 1H), 6,54 (д, J=7,3 Гц, 1H), 6,37-6,14 (м, 1H), 5,74-5,28 (м, 2H), 4,82-4,68 (м, 1H), 4,57 (дт, J=47,0, 5,8 Гц, 2H), 4,35-4,19 (м, 1H), 3,99 (т, J=5,8 Гц, 2H), 3,58-3,48 (м, 1H), 3,23-2,71 (м, 2H), 2,40-2,32 (м, 1H), 2,09(д квин, J=25,9, 5,8 Гц, 2H), 2,01-1,88 (м, 1H), 1,65-1,61 (м, 1H), 1,41-0,67 (м, 9H). | 518 (M+H)+ 516 (M-H)- |
| 74 (рацемат) |
7,17-6,78 (м, 5H), 6,55-6,15 (м, 2H), 5,88 (ушир.c, 1H), 5,52-5,26 (м, 2H), 4,81-4,68 (м, 1H), 4,58 (дт, J=47,0, 5,7 Гц, 2H), 4,38-4,11 (м, 1H), 3,98 (т, J=5,7 Гц, 2H), 3,53-3,14 (м, 1H), 3,01-2,73 (м, 1H), 2,47-2,26 (м, 1H), 2,l0 (д квин, J=26,2, 5,7 Гц, 2H), 2,01-1,94 (м, 1H), 1,43 (ушир.c, 1H), 1,31-1,26 (м, 2H), 1,06-0,83 (м, 6H). | 504 (M+H)+ 502 (M-H)- |
| 75 (хиральное соединение A) |
7,58-6,79 (м, 6H), 6,68-6,53 (м, 1H), 5,90-5,14 (м, 2H), 4,84-4,65 (м, 1H), 4,46-4,19 (м, 2H), 3,67-2,72 (м, 3Н), 2,51-0,80 (м, 5Н). | 441 (M+H)+ 439 (M-H)- |
| 76 (хиральное соединение A) |
7,58-6,72 (м, 6H), 6,65-5,99 (м, 2H), 5,74-5,06 (м, 2H), 4,83-4,17 (м, 4H), 3,63-2,64 (м, 3H), 2,51-1,87 (м, 2H), 1,70-0,78 (м, 6H). | 512 (M+H)+ 510 (M-H)- |
| Таблица 8 | ||
| Примеры | 1H-ЯМР (400 MГц, CDCl3) δ | ESI/MS (m/z) |
| 77 (хиральное соединение A) |
7,57-6,77 (м, 6Н, 6,65-6,52 (м, 1Н), 6,05-5,59 (м, 1Н), 4,83-4,65 (м, 1Н), 4,45-3,87 (м, 3H), 3,81-1,85 (м, 8H), 1,70-0,81 (м, 6Н). | 499 (M+H)+ 497 (M-H)- |
| 78 (рацемат) |
7,18-7,11 (м, 1Н), 7,05-6,94 (м, 2H), 6,86-6,81 (м, 1H), 6,75 (д, J=8,4 Гц, 1Н), 6,36 (ушир.с, 1Н), 6,12-6,09 (м, 1H), 5,75-5,47(м, 1Н), 4,75-4,71 (м, 1H), 3,55-3,44 (м, 1Н), 3,30-2,78 (м, 8H), 2,41-2,19 (м, 1Н), 2,03-1,93 (м, 5H), 1,63-1,32 (м, 2H), 1,39 (ушир.с, 2H), 1,02 (ушир.с, 1Н), 0,98-0,72 (м, 3H), | 454 (M+H)+ |
| 79 (рацемат) |
9,99 (ушир.с, 1Н), 7,19-7,14 (м, 1Н), 7,08-6,92 (м, 2H), 6,86-674 (м, 2H), 6,37-6,35 (м, 1H), 6,13-6,07 (м, 1Н), 4,82-4,66 (м, 1Н), 3,64-3,53 (м, 1Н), 3,29-3,15 (м, 5H), 2,90-2,82(м, 1H), 2,54-2,39 (м, 4H), 2,04-1,94 (м, 5H), 1,44 (ушир.с, 1Н), 1,18 (ушир.с, 2H). | 494 (M+H)+ 492 (M-H)- |
| 80 (рацемат) |
7,23-7,10 (м, 1Н),7,04-6,93 (м, 2H), 6,86-6,74 (м, 2H), 6,59-6,48 (м, 1Н), 6,37-6,29 (м, 1Н), 6,13-6,09 (м, 1Н), 5,85-5,55 (м, 1H), 4,81-4,65 (м, 1Н), 3,96-3,75 (м, 1H), 3,57-3,49 (м, 1H), 3,37-3,00 (м, 7H), 2,78-2,73 (м, 1Н), 2,4 4-2,24 (м, 1Н), 2,05-1,94 (м, 5H), 1,42 (ушир.с, 1Н), 1,28-1,05 (м, 5H). | 497 (M+H)+ 495 (M-H)- |
| 81 (рацемат) |
7,26-7,10 (м, 1H), 7,05-6,96 (м, 2H), 6,93-6,73 (м, 3H), 6,36 (ушир.с, 1H), 6,13-6,09 (м, 1Н), 4,78-4,63 (м, 1Н), 4,10-3,83 (м, 2H), 3,55-2,75 (м, 1H), 2,46-2,25 (м, 1Н), 2,05-1,93 (м, 5H), 1,42 (ушир.с, 1Н), 1,25-1,12 (м, 6Н, 1,08 (ушир.с, 2H). | 525 (M+H)+ |
| 82 (рацемат) |
8,42-8,26 (м, 1Н), 7,18-7,12 (м, 1Н), 7,07-6,94 (м, 2H), 6,86-6,81 (м, 1Н), 6,74-6,72 (м, 1Н), 6,36-6,31 (м, 2H), 6,13-6,08 (м, 1Н), 4,79-4,51 (м, 3H), 3,1Н), 2,05-1,93 (м, 5H), 1,44, (ушир.с, 1Н), 1,08 (ушир.с, 2H). | 494 (M+H)+ 492 (M-H)- |
| 83 (рацемат) |
7,19-7,11 (м, 1Н), 7,08-7,03 (м, 1Н), 6,99-6,82 (м, 3H), 6,77 (д, J=10,0 Гц, 1Н), 6,54-6,51 (м, 1Н), 6,92-6,63 (м, 1Н), 4,78-4,71 (м, 1Н), 4,17-3,93 (м, 1Н), 3,80 (т, J=6,6 Гц, 2H), 3,61-3,32 (м, 3H), 3,22-3,11 (м, 1H), 2,98-2,92 (м, 1Н), 2,56-2,22 (м, 2H), 2,09-1,90 (м, 1Н), 1,86-1,69 (м, 2H), 1,41 (ушир.с, 2H), 1,25-1,11 (м, 3H), 1,03 (ушир.с, 1H), 0,98 (т, J=6,6 Гц, 3H). | 459 (M+H)+ |
| 84 (рацемат) |
7,23-7,19 (м, 1H), 7,13-6,76 (м, 5H), 6,67-6,35 (м, 2H), 6,95-6,28 (м, 2H), 4,79-4,66 (м, 1Н), 4,02 (д, J=4,8 Гц, 1Н), 3,82-3,78 (м, 3H), 3,53 (д, J=13,6 Гц, 1Н), 3,21-3,01 (м, 2H), 2,47-2,26 (м, 1Н), 2,00-1,94 (м, 1H), 1,86-1,69 (м, 2H), 1,43 (ушир.с, 2H), 1,07 (ушир.с, 1Н), 0,98 (т, J=7,4 Гц, 3H). | 458 (M+H)+ 456 (M-H)- |
| 85 (рацемат) |
7,95 (д, J=10,0 Гц, 1Н), 7,72-7,68 (м, 2H), 7,21 (д, J=0,8 Гц, 1H), 7,20-7,03 (м, 3H), 6,97-6,90 (м, 2H), 6,94-6,62 (м, 1Н), 4,80-4,73 (м, 1Н), 4,18-3,74 (м, 2H), 3,63-3,15 (м, 3H), 2,99-2,79 (м, 1Н), 2,52-2,18 (м, 2H), 2,01-1,94 (м, 1Н), 1,42 (ушир.с, 1Н), 1,28-0,96 (м, 3H), 1,04 (ушир.с, 2H). | 468 (M+H)+ 466 (M-H)- |
| 86 (рацемат) |
7,95 (д, J=7,8 Гц, 1Н), 7,70-7,66 (м, 2H), 7,21 (д, J=0,8 Гц, 1Н), 7,13-6,88 (м, 5H), 6,62-6,33 (м, 1Н), 6,91-6,53 (м, 2H), 4,79-4,67 (м, 1Н), 4,03 (д, J=4,8 Гц, 1H), 3,80 (д, J=4,8 Гц, 1Н), 3,58 (д, J=13,6 Гц, 1Н), 3,29-2,74 (м, 2H), 2,50-2,30 (м, 1H), 2,03-1,96 (м, 1Н), 1,43 (ушир.с, 1Н), 1,07 (ушир.с, 2H). | 467 (M+H)+ 465 (M-H)- |
| 87 (рацемат) |
7,83 (д, J=2,5 Гц, 1H), 7,69-7,65 (м, 2H), 7,39-7,33 (м, 1Н), 7,20-7,03 (м, 3H), 6,98-6,87 (м, 2H), 6,44 (ушир.с, 1H), 6,00-6,68 (м, 1Н), 4,80-4,73 (м, 1H), 4-19-3,73 (м, 2H), 3,61-3,31 (м, 2H), 3,23-2,78 (м, 2H), 2,48-2,30 (м, 2H), 1,9 9-1,92 (м, 1Н), 1,42 (ушир.с, 1Н), 1,25-0,96 (м, 3H), 1,04 (ушир.с, 2H). | 467 (M+H)+ 465 (M-H)- |
| 88 (рацемат) |
7,83 (д, J=2,5 Гц, 1H), 7,68-7,65 (м, 2H), 7,38-7,33 (м, 1H), 7,22-6,85 (м, 5H), 6,54-6,20 (м, 1Н), 6,45-6,44 (м, 1Н), 6,79-6,43 (м, 2H), 4,80-4,67 (м, 1H), 4,02 (д, J=4,8 Гц, 1Н),3,81 (д, J=4,8 Гц, 1H), 3,57 (д, J=13,7 Гц, 1Н), 3,29-2,75 (м, 2H), 2,49-2,29 (м, 1Н), 2,02-1,96 (м, 1Н), 1,44 (ушир.с, 1Н), 1,07 (ушир.с, 2H). | 466 (M+H)+ 464 (M-H)- |
| 89 (хиральное соединение A) |
8,11-7,86 (м, 1H), 7,60-6,75 (м, 6Н, 6,32-6,19 (м, 1H), 6,94-6,75 (м, 1Н), 4,76-4,73 (м, 1H), 4,18-2,80 (м, 7H), 2,54-1,66 (м, 5H), 1,42-1,04 (м, 6Н. | 515 (M+H)+ 513 (M-H)- |
| Таблица 9 | ||
| Примеры | 1H-ЯМР (400 MГц, CDCl3) δ | ESI/MS (m/z) |
| 90 (хиральное соединение A) |
7,22-7,12 (м, 1Н), 7,0 6-6,91 (м, 2H), 6,80-6,76 (м, 1Н), 6,68 (c, 1Н), 6,66-6,60 (м, 1Н), 6,44-6,04 (м, 3H), 5,39-5,12 (м, 1Н), 4,78-4,32 (м, 2H), 3,48-3,33 (м, 1Н), 3,23-2,77 (м, 6Н, 2,42-2,21 (м, 1Н), 2,09-1,87 (м, 5H), 1,45 (д, J=6,8 Гц, 2H), 1,41 (ушир.с, 2H), 1,29 (д, J=6,8 Гц, 1H), 1,06 (ушир.с, 1H). | 517 (M+H)+ 515 M-H)- |
| 91 (хиральное соединение A) |
7,71 (д, J=2,4 Гц, 1Н), 7,47 (д, J=1,9 Гц, 1Н), 7,20-6,90 (м, 5H), 6,80 (д, J=8,4 Гц, 1Н), 6,65 (д, J=7,7 Гц, 1H), 6,30-6,17 (м, 1Н), 6,07-5,86 (м, 1H), 5,49-5,33 (м, 1Н), 4,95 (д, J=13,7 Гц, 1Н), 4,59-4,49 (м, 1Н), 3,83-3,61 (м, 1H), 3,18-3,02 (м, 2H), 2,87-2,63 (м, 1H), 2,59-2,46 (м, 3H), 2,41-2,30 (м, 3H), 2,19-2,04 (м, 1Н), 1,72-1,3 7 (м, 3H). | 478 (M+H)+ |
| 92 (хиральное соединение A) |
7,30-6,92 (м, 4H), 6,81-6,44 (м, 2H), 6,37-5,89 (м, 3H), 5,72-5,53 (м, 1Н), 5,12-4,84 (м, 1Н), 4,16-3,90 (м, 2H), 3,88-3,61 (м, 1Н), 3,40-2,95 (м, 6Н, 2,79-2,34 (м, 4H), 2,21-1,85 (м, 5H). | 453 (M+H)+ |
| 93 (хиральное соединение A) |
7,21-6,91 (м, 3H), 6,79-6,46 (м, 3H), 6,36-6,19 (м, 1Н), 6,10-5,94 (м, 1Н), 5,13-4,86 (м, 1H), 4,22-4,04 (м, 1H), 3,91-3,54 (м, 3H), 3,35-2,91 (м, 6Н), 2,81-2,54 (м, 1Н), 2,50-2,32 (м, 3H), 2,17-1,83 (м, 5H), 1,30-1,18 (м, 3H). | 454 (M+H)+ |
| 94 (рацемат) |
7,32-6,13 (м, 7H), 5,93 (ушир.с, 1H), 5,52 (ушир.с, 1Н), 5,17-4,88 (м, 1Н), 3,91-2,98 (м, 6Н, 2,84-1,96 (м, 8H), 1,63-0,76 (м, 4H). | 410 (M+H)+ |
| 95 (рацемат) |
7,18-6,97 (м, 4H), 6,69-6,64 (м, 1Н), 6,58-6,53 (м, 1Н), 6,24 (c, 1Н), 5,96 (ушир.с, 2H), 5,50 (ушир.с, 1Н), 5,01-4,96 (м, 1Н), 4,04 (c, 2H), 3,81-3,68 (м, 2H), 3,37-3,08 (м, 4H), 2,79-2,57 (м, 2H), 2,42 (c, 3H), 2,36-2,27 (м, 1Н), 2,12-2,05 (м, 2H), 1,60-1,53 (м, 1H), 1,08 (д, J=6,5 Гц, 3H). | 467 (M+H)+ 465 (M-H)- |
| 96 (хиральное соединение A) |
7,81-7,70 (м, 1Н), 7,62-7,44 (м, 1Н), 7,27-6,75 (м, 5H), 6,60-6,58 (м, 1Н), 6,32-6,19 (м, 1H), 6,05-5,81 (м, 1H), 4,82-4,57 (м, 1Н),4,17-2,98 (м, 7H), 2,52-2,28 (м, 6Н, 2,20-0,83 (м, 10H). | 475 (M+H)+ 473 (M-H)- |
| 97 (рацемат) |
8,07-7,32 (м, 3H), 7,23-6,49 (м, 6Н, 6,33-5,37 (м, 4H), 4,96-4,71 (м, 1H), 4,20-3,28 (м, 4H), 2,86-2,29 (м, 7H), 1,40-0,40 (м, 6H). | 474 (M+H)+ 472 M-H)- |
| 98 (рацемат) |
7,16 (д, J=7,3 Гц, 1Н), 7,06-6,92 (м, 2H), 6,89-6,79 (м, 1Н), 6,69 (д, J=8,5 Гц , 1Н), 6,38-6,36 (м, 1Н), 6,13-6,04 (м, 1Н), 5,77-5,69 (м, 1Н), 4,95-4,68 (м, 1Н), 4,19-3,94 (м, 1Н), 3,77-3,70 (м, 1Н), 3,63-3,59 (м, 1H), 3,47-3,30 (м, 1H), 3,17-3,14 (м, 4H), 2,85-2,80 (м, 1H), 2,67-2,62 (м, 1Н), 2,48-2,36 (м, 1Н), 2,04-1,83 (м, 5H), 1,26-1,21 (м, 4H), 1,10-0,98 (м, 2H). | 470 (M+H)+ |
| 99 (рацемат) |
7,15 (д, J=7,3 Гц, 1H), 7,06-6,92 (м, 2H), 6,90-6,79 (м, 1Н), 6,71 (д, J=8,6 Гц, 1Н), 6,55-6,48 (м, 1Н), 6,38-6,35 (м, 1Н), 6,13-5,94 (м, 2H), 5,49-5,35 (м, 2H), 4,96-4,68 (м, 1Н), 4,03 (д, J=5,6 Гц, 2H), 3,49-3,30 (м, 2H), 3,17-3,15 (м, 4H), 2,85-2,78 (м, 1Н), 2,56-2,39 (м, 2H), 2,07-1,93 (м, 5H), 1,07-0,97 (м, 3H). | 469 (M+H)+ |
| 100 (рацемат) |
7,15 (д, J=7,3 Гц, 1Н), 7,08-7,01 (м, 2H), 6,88 (д, J=7,3 Гц, 1Н), 6,75 (д, J=8,5 Гц, 1H), 6,56 (т, J=7,3 Гц, 1H), 6,38 (д, J=2,2 Гц, 1Н), 6,11 (дд, J=8,5, 2,2 Гц, 1Н), 4,79 (дд, J=13,6, 3,2 Гц, 1Н), 4,22-4,16 (м, 1Н), 3,82-3,62 (м, 3H), 3,18-3,15 (м, 4H), 3,06 (д, J=14,9 Гц, 1Н), 2,94-2,70 (м, 2H), 2,31 (ушир.с, 1Н), 1,97-1,93 (м, 4H), 1,25 (д, J=6,6 Гц 3H), 0,96 (д, J=6,8 Гц, 3H). | 488 (M+H)+ 486 (M-H)- |
| 101 (рацемат) |
7,16-7,12 (м, 2H), 7,09-7,01 (м, 2H), 6,88 (д, J=8,1 Гц, 1Н), 6,76 (д, J=8,6 Гц, 1Н), 6,37 (д, J=2,3 Гц, 1Н), 6,11 (дд, J=8,6, 2,3 Гц, 1H), 5,93 (ушир.с, 1Н), 5,48 (ушир.с, 1Н), 4,79 (дд, J=13,3, 3,0 Гц, 1H), 4,06 (д, J=5,2 Гц, 2H), 3,74 (дд, J=38,8, 15,0 Гц, 1Н), 3,32-3,05 (м, 5H), 2,93-2,72 (м, 2H), 1,97-1,93 (м, 4H), 0,98 (д, J=6,7 Гц, 3H). | 487 (M+H)+ 485 (M-H)- |
Фармакологическое испытание
(1) Получение клетки, экспрессирующей рецептор V2 человека
Фрагмент ДНК, содержащий кодирующую область рецептора V2 человека, встраивали в экспрессирующий вектор клеток позвоночных. Экспрессирующий вектор генетически вводили в клетку животного, чтобы рецептор V2 человека экспрессировался на поверхности клетки. Поскольку экспрессирующий вектор мог экспрессировать ген neo, который выполнял функцию маркера устойчивости к G418, его культивировали в среде, содержавшей G418, тем самым, селективно получая клетку со стабильной экспрессией рецептора V2 человека.
(2) Испытание продуцирования cAMP в клетке, экспрессирующей рецептор V2
Клетки, экспрессировавшие рецептор V2 человека, которые получали описанным выше способом, выделяли и ресуспендировали в инкубационном буфере (среда F-12, 20 мМ HEPES), а затем по 5 мкл клеток распределяли в 384-луночный планшет при плотности 15000 клеток/лунка. В каждую лунку добавляли 5 мкл раствора соединения или раствора 8-AVP ((Arg8)-вазопрессин), которые были разбавлены буфером для анализа (среда F-12, 20 мМ HEPES, 1 мМ IBMX), (всего 10 мкл/лунка) (конечная концентрация: 15000 клеток/лунка, 500 мкМ IBMX, 1% диметилсульфоксид). После инкубации при комнатной температуре в течение 30 минут количество продуцируемого cAMP измеряли с использованием коммерчески доступного набора cAMP HTRF (Cisbio Inc.) в соответствии с описанным протоколом. Для поиска величин EC50 и Emax исследуемого соединения использовали Excel Fit. Величину Emax исследуемого соединения вычисляли, принимая максимальную реакцию 8-AVP за 100%, и величину, демонстрирующую 50% реакцию из кривой концентрация-реакция для исследуемого соединения, определяли как величину EC50, и полученные величины EC50 и Emax представлены в таблице 10.
В результате было выявлено, что все исследованные на этот раз соединения примеров обладают активностью агониста рецептора V2.
| Таблица 10 | |||||
| Пример | EC50 (нM) | Emax (%) | Пример | EC50 (нM) | Emax (%) |
| 31 (рацемат) | 7,9 | 102 | 73 (рацемат) | 1,9 | 100 |
| 32 (рацемат) | 9,1 | 104 | 76 (хиральное соединение A) | 0,99 | 102 |
| 33 (рацемат) | 20 | 96 | 79 (рацемат) | 0,90 | 100 |
| 34 (рацемат) | 9,8 | 98 | 80 (рацемат) | 2,8 | 101 |
| 35 (хиральное соединение A) | 1,4 | 102 | 81 (рацемат) | 6,6 | 100 |
| 38 (хиральное соединение A) | 0,060 | 101 | 82 (рацемат) | 1,1 | 101 |
| 42 (рацемат) | 0,80 | 103 | 83 (рацемат) | 3,4 | 100 |
| 43 (рацемат) | 0,10 | 102 | 84 (рацемат) | 2,5 | 100 |
| 45 (хиральное соединение A) | 0,34 | 102 | 85 (рацемат) | 15 | 94 |
| 49 (рацемат) | 0,50 | 102 | 86 (рацемат) | 17 | 88 |
| 50 (рацемат) | 0,90 | 100 | 87 (рацемат) | 9,5 | 97 |
| 51 (рацемат) | 6,0 | 73 | 88 (рацемат) | 8,1 | 93 |
| 52 (рацемат) | 3,9 | 85 | 89 (хиральное соединение A) | 1,4 | 102 |
| 54 (хиральное соединение A) | 0,28 | 102 | 90 (хиральное соединение A) | 0,39 | 101 |
| 55 (рацемат) | 0,20 | 101 | 94 (рацемат) | 0,41 | 101 |
| 56 (рацемат) | 0,10 | 102 | 95 (рацемат)) | 0,99 | 102 |
| 57 (рацемат) | 0,20 | 102 | 97 (рацемат) | 0,56 | 102 |
| 67 (хиральное соединение A) | 2,8 | 102 | 98 (рацемат) | 1,0 | 101 |
| 68 (хиральное соединение A) | 0,74 | 102 | 99 (рацемат) | 0,40 | 102 |
| 69 (рацемат) | 0,53 | 101 | 100 (рацемат) | 3,0 | 100 |
| 72 (хиральное соединение A) | 2,1 | 101 | 101 (рацемат) | I,I | 102 |
(3) Испытание PK на крысах
В качестве экспериментальных животных использовали самцов крыс Sprague-Dawely (Crj: CD(SD)IGS: CHARLES RIVER LABORATORIES JAPAN, INC.) в возрасте от 7 до 8 недель. Использовали крыс, подвергнутых голоданию в течение одной ночи. Исследуемое соединение растворяли в DMSO, к нему добавляли PEG и физиологический раствор для доведения концентрации до 0,5 мг/мл (20/20/60, об./об./об.) и раствор вводили в хвостовую вену в используемом количестве 0,5 мг/кг. Взятие образцов крови проводили шприцом, обработанным гепарином, из яремной вены через 6-8 часов после введения, и взятую кровь центрифугировали с получением плазмы. Концентрацию лекарственного средства в плазме измеряли с использованием LC/MS/MS. Для образцов для измерения LC/MS/MS использовали супернатант, полученный добавлением внутреннего стандартного вещества и ацетонитрила к плазме с последующей депротеинизацией. Параметры PK анализировали с помощью некомпартментной модели. Клиренс (CLP) вычисляли путем деления введенного количества на AUC0-∞. Объем распределения (Vdss) вычисляли путем умножения CLP на среднее время удержания (MRT). Полученные CLp и Vdss представлены в таблице 11.
В результате, все соединения, исследованные на этот раз, имели предпочтительный клиренс из плазмы и объем распределения, и было выявлено, что они были превосходными с точки зрения кинетики.
| Таблица 11 | |||
| Пример | AUC (мл/ч/кг) | CLp (мл/ч/кг) | Vdss (мл/кг) |
| 65 (хиральное соединение А) | 641 | 780 | 726 |
| 66 (хиральное соединение А) | 368 | 1360 | 27 |
| 67 (хиральное соединение А) | 360 | 1390 | 1220 |
| 71 (рацемат) | 522 | 958 | 666 |
| 72 (хиральное соединение А) | 430 | 1160 | 960 |
| 74 (рацемат) | 467 | 1070 | 896 |
| 89 (хиральное соединение А) | 371 | 1350 | 1230 |
| 90 (хиральное соединение А) | 613 | 816 | 1080 |
| 91 (хиральное соединение А) | 449 | 1110 | 1750 |
| 93 (хиральное соединение А) | 366 | 1370 | 1330 |
| Соединение для сравнения 1 | 176 | 2870 | 4720 |
Следует отметить, что соединение для сравнения 1 соответствует соединению примера 4, описанному в WO № 2006/104008 (соединение: N-(2-гидроксиэтил)-(R)-1-(2-хлор-4-пиразол-1-илбензоил)-3-мэтил-1,2,3,5-тетрагидробензо[e]-1,4-диазепин-4-карбоксамид)
(4) Испытание ингибирования фермента цитохрома P450 (3A4)
С использованием 96-луночного планшета, мидазолам (2,5 мкМ) в качестве субстрата, исследуемое соединение (от 0,21 до 50 мкМ), микросомы печени человека с концентрацией белка 0,1 мг белка/мл добавляли к 0,1М раствору буфера на основе фосфорной кислоты (pH=7,4), который содержал 1,55 мМ NADP+, 3,3 мМ глюкозо-6-фосфат, 3,3 мМ MgCl2 и 0,4 единиц/мл глюкозо-6-фосфатдегидрогеназы с получением реакционного раствора, имеющего общее количество 500 мкл. Реакционный раствор инкубировали при 37°C в течение 10 минут и к нему добавляли 4-кратное количество холодного ацетонитрила для завершения реакции. Затем реакционный раствор центрифугировали (5000g × 10 минут × 4°C) и супернатант собирали для измерения продуцируемого количества метаболизируемого продукта с помощью LC/MS/MS. Ингибиторное соотношение для каждой концентрации вычисляли с помощью величины, полученной без исследуемого соединения, и определяли верхнюю и нижнюю концентрации исследуемого соединения, которые ингибировали 50% уровня продукции метаболизируемого продукта. IC50 вычисляли с использованием этих двух концентраций исследуемого соединения и ингибиторного соотношения. Полученная величина IC50 представлена в таблице 12.
(5) Испытание ингибирования фермента P450 (2C9)
С использованием 96-луночного планшета, сульфафеназол (10 мкМ) в качестве субстрата, исследуемое соединение (от 0,21 до 50 мкМ), микросомы печени человека с концентрацией белка 0,1 мг белка/мл добавляли к 0,1М раствору буфера на основе фосфорной кислоты (pH=7,4), который содержал 1,55 мМ NADP+, 3,3 мМ глюкозо-6-фосфат, 3,3 мМ MgCl2 и 0,4 единиц/мл глюкозо-6-фосфатдегидрогеназы с получением реакционного раствора, имеющего общее количество 500 мкл. Реакционный раствор инкубировали при 37°C в течение 10 минут и к нему добавляли 4-кратное количество холодного ацетонитрила для завершения реакции. Затем реакционный раствор центрифугировали (5000g × 10 минут × 4°C) и супернатант собирали для измерения продуцируемого количества метаболизируемого продукта с помощью LC/MS/MS. Ингибиторное соотношение для каждой концентрации вычисляли с помощью величины, полученной без исследуемого соединения, и определяли верхнюю и нижнюю концентрации исследуемого соединения, которые ингибировали 50% уровня продукции метаболизируемого продукта. IC50 вычисляли с использованием этих двух концентраций исследуемого соединения и ингибиторного соотношения. Полученная величина IC50 представлена в таблице 12.
Полученные величины IC50 представлены в таблице 12.
В результате, было обнаружено, что все исследованные на этот раз соединения примеров продемонстрировали низкое ингибиторное действие в отношении метаболизирущих лекарственные средства ферментов CYP3A4 и CYP2C9.
| Таблица 12 | ||
| Пример | IC50 (мкМ) | |
| CYP3A4 | CYP2C9 | |
| 65 (хиральное соединение А) | >50 | 44,2 |
| 67 (хиральное соединение А) | >50 | >50 |
| 72 (хиральное соединение А) | >50 | 46,8 |
| 89 (хиральное соединение А) | >50 | 40,2 |
| 93 (хиральное соединение А) | 46,0 | 46,1 |
| Соединение для сравнения 2 | 0,4 | 0,2 |
Следует отметить, что соединение для сравнения 2 соответствует соединению примера 32, описанному в WO № 97/22591 (соединение: 2-[(5R)-1-(2-хлор-4-пирролидин-1-илбензоил)-2,3,4,5-тетрагидробензоазепин-5-ил]-N-изопропилацетамид).
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Соединение по настоящему изобретению обладает действием агониста рецепторов V2 и, таким образом, является пригодным в качестве профилактического или терапевтического средства для лечения центрального несахарного диабета, ночного энуреза, никтурии, гиперактивности мочевого пузыря, гемофилии или болезни Виллебранда.
Claims (47)
1. Соединение, соответствующее общей формуле (I):
[Формула 1]
[где R1 представляет собой гидроксильную группу, низшую алкоксигруппу или имеет формулу, описанную ниже:
[Формула 2]
(где А отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, пятичленную ароматическую гетероциклическую группу, содержащую 3 гетероатома, выбранных из азота и кислорода, которая может быть замещена низшей алкильной группой, пятичленную неароматическую гетероциклическую группу, содержащую один атом азота, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена низшей алкильной группой); R2 представляет собой атом водорода или низшую алкильную группу; R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора, или атом галогена; R4 представляет собой низшую алкоксигруппу, которая может быть замещена 1-3 атомами галогена, пятичленную ароматическую моноциклическую гетероциклическую группу или пятичленную неароматическую моноциклическую гетероциклическую группу (при условии, что каждая из этих гетероциклических групп содержит один атом азота, два атома азота, или один атом азота и один атом кислорода в кольце, и может содержать низшую алкильную группу); и R5 представляет собой атом водорода, низшую алкильную группу или атом галогена] или его фармакологически приемлемая соль.
2. Соединение по п.1, где в описанной выше общей формуле (I) R1 представляет собой гидроксильную группу, низшую алкоксигруппу или имеет формулу, описанную ниже:
[Формула 3]
[где А отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, пятичленную ароматическую гетероциклическую группу, содержащую 3 гетероатома, выбранных из азота и кислорода, которая может быть замещена низшей алкильной группой, пятичленную неароматическую гетероциклическую группу, содержащую один атом азота, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена низшей алкильной группой, при условии, что соединения, в которых А представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, и оба R6 и R7 представляют собой атомы водорода, и соединения, в которых А отсутствует, R6 представляет собой низшую алкильную группу, и R7 представляет собой атом водорода, исключены].
3. Соединение по п.2, где R1 имеет формулу, описанную ниже:
[Формула 4]
[где А отсутствует или представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода или низшую алкильную группу; R7 представляет собой атом водорода, гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, группу пирролидина, которая может быть замещена оксогруппой, или карбамоильную группу, которая может быть замещена 1 или 2 низшими алкильными группами при условии, что соединения, в которых А представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой, и оба R6 и R7 представляют собой атомы водорода, и соединения, в которых А отсутствует, R6 представляет собой низшую алкильную группу, и R7 представляет собой атом водорода, исключены].
4. Соединение по п.3, где R1 имеет формулу, описанную ниже:
[Формула 5]
[где А представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода; R7 представляет собой гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, или карбамоильную группу].
5. Соединение по п.1, где в описанной выше формуле (I), R4 представляет собой низшую алкоксигруппу, которая может быть замещена 1-3 атомами фтора, группу пирролидина, которая может быть замещена низшей алкильной группой, группу пиразола, которая может быть замещена низшей алкильной группой, или группу оксазолила, которая может быть замещена низшей алкильной группой.
6. Соединение по п.5, где R4 представляет собой группу, выбранную из следующей группы:
[Формула 6]
[где R8 представляет собой атом водорода или низшую алкильную группу].
7. Соединение по п.6, где R4 представляет собой группу, выбранную из следующей группы:
[Формула 7]
[где R8 представляет собой низшую алкильную группу].
8. Соединение по п.1, где R5 представляет собой метильную группу или атом фтора в описанной выше общей формуле (I).
9. Соединение по п.1, где R3 представляет собой метильную группу, трифторметильную группу или атом хлора в описанной выше общей формуле (I).
10. Соединение по п.1, где в описанной выше общей формуле (I) R1 имеет формулу, описанную ниже:
[Формула 8]
[где А представляет собой низшую алкиленовую группу, которая может быть замещена низшей алкильной группой; R6 представляет собой атом водорода; R7 представляет собой гидроксильную группу, группу оксадиазола, которая может быть замещена низшей алкильной группой, или карбамоильную группу], R2 представляет собой атом водорода, R3 представляет собой метильную группу, трифторметильную группу или атом хлора, R4 представляет собой группу, выбранную из следующей группы
[Формула 9]
[где R8 представляет собой низшую алкильную группу], и R5 представляет собой метильную группу или атом фтора.
11. Соединение, соответствующее общей формуле (II):
[Формула 10]
[где R2 представляет собой атом водорода или низшую алкильную группу; R5 представляет собой атом водорода, метильную группу, этильную группу или атом галогена; R9 представляет собой атом водорода или защитную группу карбоксигруппы, выбранную из группы, состоящей из метильной группы, этильной группы, изопропильной группы, трет-бутильной группы, 2-этилиодидной группы, 2,2,2-трихлорэтиловой группы, метоксиметильной группы, этоксиметильной группы, изобутоксиметильной группы, бутирилоксиметильной группы, пивалоилоксиметильной группы, 1-метоксикарбонилоксиэтильной группы, 1-этоксикарбонилоксиэтильной группы, бензильной группы, п-метоксибензильной группы, о-нитробензильной группы, п-нитробензильной группы, бензгидрильной группы и фталидильной группы; и R10 представляет собой атом водорода или защитную группу аминогруппы, выбранную из группы, состоящей из формильной группы, ацетильной группы, хлорацетильной группы, дихлорацетильной группы, пропионильной группы, фенилацетильной группы, феноксиацетильной группы, тиенилацетильной группы, бензилоксикарбонильной группы, трет-бутоксикарбонильной группы, п-нитробензилоксикарбонильной группы, 9-флуоренилметилоксикарбонильной группы, метильной группы трет-бутильной группы, 2,2,2-трихлорэтильной группы, тритильной группы, п-метоксибензильной группы, п-нитробензильной группы, дифенилметильной группы, пивалоилоксиметильной группы, триметилсилильной группы, трет-бутилдиметилсилильной группы, бензилиденовой группы, салициденовой группы, п-нитробензилиденовой группы, м-хлорбензилиденовой группы, 3,5-ди(трет-бутил)-4-гидроксибензилиденовой группы и 3,5-ди(трет-бутил)бензилиденовой группы); при условии, что соединения, в которых оба R2 и R5 представляют собой атомы водорода, исключены].
12. Фармацевтическая композиция, обладающая активностью агониста рецептора V2, содержащая соединение по любому из пп.1-10 в качестве активного ингредиента.
13. Фармацевтическая композиция по п.12 для предупреждения или лечения заболевания, выбранного из группы, состоящей из центрального несахарного диабета, ночного энуреза, никтурии и гиперактивности мочевого пузыря.
14. Соединение, соответствующее общей формуле (IV):
[Формула 11]
[где R2 представляет собой атом водорода или низшую алкильную группу; R3 представляет собой низшую алкильную группу, которая может быть замещена 1-3 атомами фтора, или атом галогена; R4 представляет собой низшую алкоксигруппу, которая может быть замещена 1-3 атомами галогена, пятичленную ароматическую моноциклическую гетероциклическую группу или пятичленную неароматическую моноциклическую гетероциклическую группу (при условии, что каждая из этих гетероциклических групп содержит один атом азота, два атома азота, или один атом азота и один атом кислорода, и может быть замещена низшей алкильной группой); и R5 представляет собой атом водорода, низшую алкильную группу или атом галогена; R9 представляет собой группу, выбранную из группы, состоящей из трет-бутильной группы, 2-этилиодидной группы, 2,2,2-трихлорэтиловой группы, метоксиметильной группы, этоксиметильной группы, изобутоксиметильной группы, бутирилоксиметильной группы, пивалоилоксиметильной группы, 1-метоксикарбонилоксиэтильной группы, 1-этоксикарбонилоксиэтильной группы, бензильной группы, п-метоксибензильной группы, о-нитробензильной группы, п-нитробензильной группы, бензгидрильной группы и фталидильной группы].
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012281908 | 2012-12-26 | ||
| JP2012-281908 | 2012-12-26 | ||
| PCT/JP2013/084937 WO2014104209A1 (ja) | 2012-12-26 | 2013-12-26 | 新規ベンゾアゼピン誘導体及びその医薬用途 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2015131020A RU2015131020A (ru) | 2017-01-30 |
| RU2642783C2 true RU2642783C2 (ru) | 2018-01-26 |
Family
ID=51021283
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015131020A RU2642783C2 (ru) | 2012-12-26 | 2013-12-26 | Новое производное бензоазепина и его медицинское применение |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US9586905B2 (ru) |
| EP (1) | EP2940008B1 (ru) |
| JP (2) | JP5968466B2 (ru) |
| KR (1) | KR101983880B1 (ru) |
| CN (1) | CN104884436B (ru) |
| AU (1) | AU2013367084B2 (ru) |
| BR (1) | BR112015015663A2 (ru) |
| CA (1) | CA2889239C (ru) |
| DK (1) | DK2940008T3 (ru) |
| ES (1) | ES2633981T3 (ru) |
| HK (1) | HK1208676A1 (ru) |
| MX (1) | MX362478B (ru) |
| PL (1) | PL2940008T3 (ru) |
| RU (1) | RU2642783C2 (ru) |
| WO (1) | WO2014104209A1 (ru) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL2940008T3 (pl) * | 2012-12-26 | 2017-10-31 | Sanwa Kagaku Kenkyusho Co | Nowa pochodna benzoazepiny i jej zastosowanie farmaceutyczne |
| JP2022055368A (ja) * | 2019-02-19 | 2022-04-08 | 株式会社三和化学研究所 | ベンゾアゼピン誘導体の製造方法及びその中間体 |
| JPWO2020171055A1 (ru) * | 2019-02-19 | 2020-08-27 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1991005549A1 (en) * | 1989-10-20 | 1991-05-02 | Otsuka Pharmaceutical Co., Ltd. | Benzoheterocyclic compounds |
| US5258510A (en) * | 1989-10-20 | 1993-11-02 | Otsuka Pharma Co Ltd | Benzoheterocyclic compounds |
| WO1997022591A1 (en) * | 1995-12-15 | 1997-06-26 | Otsuka Pharmaceutical Company, Limited | Benzazepine derivatives with vasopressin agonistic activity |
| RU2268882C1 (ru) * | 2001-11-16 | 2006-01-27 | Яманоути Фармасьютикал Ко., ЛТД | Производное 4,4-дифтор-1,2,3,4-тетрагидро-5н-бензазепина, его соль и содержащая его фармацевтическая композиция |
| EA017308B1 (ru) * | 2007-05-10 | 2012-11-30 | Олбани Молекьюлар Рисерч, Инк. | Арилокси- и гетероарилоксизамещенные тетрагидробензазепины и их применение для блокировки обратного захвата норэпинефрина, допамина и серотонина |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4952573A (en) * | 1988-03-23 | 1990-08-28 | Laboratoirs Alcon S.A. | Compounds having GABA like activity, and use of same in tissue irrigating solutions |
| US5753677A (en) | 1989-10-20 | 1998-05-19 | Otsuka Pharmaceutical Co., Ltd. | Benzoheterocyclic compounds |
| US5985869A (en) | 1989-10-20 | 1999-11-16 | Otsuka Pharmaceutical Company, Limited | Benzoheterocyclic compounds |
| JP2905909B2 (ja) * | 1991-04-19 | 1999-06-14 | 大塚製薬株式会社 | バソプレシン拮抗剤 |
| CN100384825C (zh) | 1994-06-15 | 2008-04-30 | 大塚制药株式会社 | 苯并杂环衍生物 |
| JPH09221476A (ja) | 1995-12-15 | 1997-08-26 | Otsuka Pharmaceut Co Ltd | 医薬組成物 |
| JP2964031B2 (ja) * | 1995-12-15 | 1999-10-18 | 大塚製薬株式会社 | ベンゾアゼピン誘導体 |
| JP2926335B2 (ja) | 1997-06-13 | 1999-07-28 | 大塚製薬株式会社 | 医薬組成物 |
| JPH111456A (ja) | 1997-06-13 | 1999-01-06 | Otsuka Pharmaceut Co Ltd | アミド誘導体 |
| JP4238978B2 (ja) * | 2003-04-22 | 2009-03-18 | 大塚製薬株式会社 | ベンゾアゼピン化合物及びその製造法 |
| ZA200508080B (en) * | 2003-04-28 | 2007-03-28 | Astellas Pharma Inc | 4,4-difluoro-1,2,3,4-tetrhydro-5H-1-benzazepine derivative or salt thereof |
| ME00320B (me) | 2003-06-17 | 2011-05-10 | Janssen Pharmaceutica Nv | Supstituisani spirobenzazepini |
| EP1867639A1 (en) | 2005-03-25 | 2007-12-19 | Kissei Pharmaceutical Co., Ltd. | Urea derivative, medicinal composition containing the same, and medicinal use of these |
| US7825111B2 (en) | 2006-09-22 | 2010-11-02 | Janssen Pharmaceutica Nv | Substituted spiroheterocycles |
| DK2860175T3 (da) * | 2012-06-11 | 2018-01-29 | Tacurion | Fremgangsmåde til fremstilling af 4,4,7-trifluor-1,2,3,4-tetrahydro-5h-1-benzazepin-forbindelse og intermediat til syntese deraf |
| PL2940008T3 (pl) * | 2012-12-26 | 2017-10-31 | Sanwa Kagaku Kenkyusho Co | Nowa pochodna benzoazepiny i jej zastosowanie farmaceutyczne |
-
2013
- 2013-12-26 PL PL13867980T patent/PL2940008T3/pl unknown
- 2013-12-26 CA CA2889239A patent/CA2889239C/en not_active Expired - Fee Related
- 2013-12-26 WO PCT/JP2013/084937 patent/WO2014104209A1/ja active Application Filing
- 2013-12-26 AU AU2013367084A patent/AU2013367084B2/en not_active Ceased
- 2013-12-26 JP JP2014554554A patent/JP5968466B2/ja not_active Expired - Fee Related
- 2013-12-26 EP EP13867980.8A patent/EP2940008B1/en not_active Not-in-force
- 2013-12-26 CN CN201380067762.7A patent/CN104884436B/zh not_active Expired - Fee Related
- 2013-12-26 ES ES13867980.8T patent/ES2633981T3/es active Active
- 2013-12-26 BR BR112015015663A patent/BR112015015663A2/pt not_active Application Discontinuation
- 2013-12-26 KR KR1020157014600A patent/KR101983880B1/ko active IP Right Grant
- 2013-12-26 MX MX2015008399A patent/MX362478B/es active IP Right Grant
- 2013-12-26 DK DK13867980.8T patent/DK2940008T3/en active
- 2013-12-26 RU RU2015131020A patent/RU2642783C2/ru active
- 2013-12-26 US US14/438,920 patent/US9586905B2/en active Active
-
2015
- 2015-09-24 HK HK15109366.0A patent/HK1208676A1/xx not_active IP Right Cessation
-
2016
- 2016-07-05 JP JP2016133380A patent/JP6231621B2/ja not_active Expired - Fee Related
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1991005549A1 (en) * | 1989-10-20 | 1991-05-02 | Otsuka Pharmaceutical Co., Ltd. | Benzoheterocyclic compounds |
| US5258510A (en) * | 1989-10-20 | 1993-11-02 | Otsuka Pharma Co Ltd | Benzoheterocyclic compounds |
| WO1997022591A1 (en) * | 1995-12-15 | 1997-06-26 | Otsuka Pharmaceutical Company, Limited | Benzazepine derivatives with vasopressin agonistic activity |
| RU2268882C1 (ru) * | 2001-11-16 | 2006-01-27 | Яманоути Фармасьютикал Ко., ЛТД | Производное 4,4-дифтор-1,2,3,4-тетрагидро-5н-бензазепина, его соль и содержащая его фармацевтическая композиция |
| EA017308B1 (ru) * | 2007-05-10 | 2012-11-30 | Олбани Молекьюлар Рисерч, Инк. | Арилокси- и гетероарилоксизамещенные тетрагидробензазепины и их применение для блокировки обратного захвата норэпинефрина, допамина и серотонина |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2015008399A (es) | 2015-09-23 |
| JP2016199575A (ja) | 2016-12-01 |
| AU2013367084B2 (en) | 2017-06-08 |
| JP6231621B2 (ja) | 2017-11-15 |
| WO2014104209A1 (ja) | 2014-07-03 |
| PL2940008T3 (pl) | 2017-10-31 |
| JP5968466B2 (ja) | 2016-08-10 |
| ES2633981T3 (es) | 2017-09-26 |
| US20150291533A1 (en) | 2015-10-15 |
| AU2013367084A1 (en) | 2015-05-28 |
| CA2889239C (en) | 2020-10-27 |
| DK2940008T3 (en) | 2017-08-07 |
| EP2940008A4 (en) | 2016-05-18 |
| US9586905B2 (en) | 2017-03-07 |
| EP2940008B1 (en) | 2017-05-17 |
| RU2015131020A (ru) | 2017-01-30 |
| EP2940008A1 (en) | 2015-11-04 |
| MX362478B (es) | 2019-01-11 |
| BR112015015663A2 (pt) | 2017-07-11 |
| KR20150098614A (ko) | 2015-08-28 |
| CN104884436B (zh) | 2017-06-13 |
| CN104884436A (zh) | 2015-09-02 |
| CA2889239A1 (en) | 2014-07-03 |
| HK1208676A1 (en) | 2016-03-11 |
| KR101983880B1 (ko) | 2019-05-29 |
| JPWO2014104209A1 (ja) | 2017-01-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2442779C2 (ru) | Производные 2,4,5-трифенилимидазолина как ингибиторы взаимодействия между белками p53 и mdm2, предназначенные для применения в качестве противораковых средств | |
| EP0930298B1 (en) | Fluorinated 1,4-disubstituted piperidine derivatives | |
| US7169772B2 (en) | 4,4-difluoro-1,2,3,4-tetrahydro-5H-1-benzazepine derivatives or salts thereof | |
| HUE028373T2 (en) | Arylalkylamines and processes for their preparation | |
| JP2009533393A (ja) | 酵素阻害薬 | |
| US20230322723A1 (en) | Compounds for suppressing egfr mutant cancer and pharmaceutical use thereof | |
| US8901295B2 (en) | Inhibitors of cyclophilins and uses thereof | |
| US20080234280A1 (en) | Use of Mc4 Receptor Agonist Compounds | |
| US20150158860A1 (en) | Cyclic amide derivatives as inhibitors of 11 - beta - hydroxysteroid dehydrogenase and uses thereof | |
| US7592467B2 (en) | Inhibitors of prolyl endopeptidase | |
| KR20100052507A (ko) | mGlu5 길항제로서의 신규 헤테로 고리 화합물 | |
| RU2642783C2 (ru) | Новое производное бензоазепина и его медицинское применение | |
| KR20220137657A (ko) | Adamts 억제제, 이의 제조 방법 및 의약적 용도 | |
| US20120101137A1 (en) | Novel thiophenecarboxamide derivative and pharmaceutical use thereof | |
| TWI643847B (zh) | Novel benzoazepine derivatives and their medical uses | |
| JP2000351773A (ja) | フラン誘導体からなる医薬 | |
| KR100848490B1 (ko) | 베타아미노기를 갖는 1,2,5-트리아제판 유도체, 이의약학적으로 허용 가능한 염 및 이의 제조 방법 | |
| FI106551B (fi) | Menetelmä lääkeaineena käyttökelpoisen alfa-[(heterosyklyylialkoksi)fenyyli]-omega-aryylialkaani- tai alfa-((heterosyklyylioksi)fenyyli)-omega-aryylialkaaniyhdisteen valmistamiseksi | |
| JPH06234736A (ja) | 脂環式アミン誘導体 |