RU2577698C2 - Сухие порошкообразные составы и способы лечения легочных заболеваний - Google Patents
Сухие порошкообразные составы и способы лечения легочных заболеваний Download PDFInfo
- Publication number
- RU2577698C2 RU2577698C2 RU2011137960/15A RU2011137960A RU2577698C2 RU 2577698 C2 RU2577698 C2 RU 2577698C2 RU 2011137960/15 A RU2011137960/15 A RU 2011137960/15A RU 2011137960 A RU2011137960 A RU 2011137960A RU 2577698 C2 RU2577698 C2 RU 2577698C2
- Authority
- RU
- Russia
- Prior art keywords
- weight
- particles
- calcium
- less
- dry powder
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0075—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a dry powder inhaler [DPI], e.g. comprising micronized drug mixed with lactose carrier particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/14—Quaternary ammonium compounds, e.g. edrophonium, choline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/194—Carboxylic acids, e.g. valproic acid having two or more carboxyl groups, e.g. succinic, maleic or phthalic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/06—Aluminium, calcium or magnesium; Compounds thereof, e.g. clay
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/14—Alkali metal chlorides; Alkaline earth metal chlorides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/0028—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up
- A61M15/003—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up using capsules, e.g. to be perforated or broken-up
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/0028—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up
- A61M15/0045—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up using multiple prepacked dosages on a same carrier, e.g. blisters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2202/00—Special media to be introduced, removed or treated
- A61M2202/06—Solids
- A61M2202/064—Powder
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Inorganic Chemistry (AREA)
- Pulmonology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Virology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Otolaryngology (AREA)
- Anesthesiology (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Изобретение относится к области медицины, в частности к фармакологии и к аспектам, относящимся к лечению или профилактике заболеваний верхних дыхательных путей, и описывает пригодный для вдыхания сухой порошок, включающий сухие частицы, содержащие соль магния, а также способы лечения респираторного заболевания, лечения обострения респираторного заболевания, лечения или профилактики инфекционного заболевания дыхательных путей, причем указанные способы включают введение в дыхательные пути пациента, нуждающегося в этом, эффективного количества пригодного для вдыхания сухого порошка. Частицы по изобретению обладают высокой диспергируемостью, отсутствием склонности к агрегации несмотря на их малый размер, а также являются концентрированными в отношении активного ингредиента. Изобретение может использоваться для терапии заболеваний верхних дыхательных путей, а также для изготовления лекарственного препарата для лечения, профилактики, диагностирования заболеваний дыхательных путей и/или инфекций. 4 н. и 21 з.п. ф-лы, 37 ил., 40 табл., 26 пр.
Description
Данная заявка притязает на преимущества предварительной заявки США на патент №61/305819, поданной 18 февраля 2010 г, предварительной заявки США на патент №61/298092, поданной 25 января 2010 г., предварительной заявки США на патент №61/267747, поданной 8 декабря 2009 г., предварительной заявки США на патент №61/255764, поданной 28 октября 2009 г., предварительной заявки США на патент №61/163772, поданной 26 марта 2009 г., предварительной заявки США на патент №61/163767, поданной 26 марта 2009 г. и предварительной заявки США на патент №61/163763, поданной 26 марта 2009 г. Полное содержание указанных выше заявок включено в данную заявку посредством отсылки.
УРОВЕНЬ ТЕХНИКИ
Доставка терапевтических агентов в легкие имеет несколько преимуществ по сравнению с другими способами доставки. Эти преимущества включают быстрое начало действия, удобство для пациента, который сам может вводить лекарство, возможность уменьшения возникновения побочных эффектов, простоту доставки лекарства путем ингаляции, устранение применения игл и т.п. Ингаляция способна обеспечить систему доставки лекарства для стационарных и амбулаторных пациентов, обеспечивая при этом быстрое начало действия лекарства при минимальных побочных эффектах.
Дозирующие ингаляторы (MDIs) применяются для доставки лекарств в дыхательные пути. MDIs обычно подходят для доставки терапевтических агентов, которые могут быть в составе твердых сухих частиц в летучей жидкости, который используется для ингаляции под давлением. Открытие клапана приводит к высвобождению суспензии с высокой скоростью. Затем жидкость испаряется, оставляя быстро перемещающийся аэрозоль, содержащий сухие частицы, которые включают терапевтический агент. MDIs являются надежными для доставки лекарств только в дыхательные пути среднего размера для лечения заболеваний дыхательных путей. Однако часто местом проявления легочных заболеваний, таких как астма и инфекции, являются дыхательные пути маленького размера (а именно бронхиолы и альвеолы).
Доставка жидкостей в аэрозоле представляет собой один из старейших способов доставки лекарств в легкие. Обычно жидкие аэрозоли получаются при помощи воздушного струйного небулайзера, который высвобождает сжатый воздух через небольшое отверстие с большой скоростью, что приводит к созданию низкого давления в районе выхода воздуха благодаря эффекту Бернулли. См. патент США №5511726. Низкое давление обеспечивает вытягивание жидкости, которая должна быть в виде аэрозоля, из второй трубки. Эта жидкость разбивается на маленькие капли по мере того, как она ускоряется потоком воздуха. Недостатки устройства этого стандартного небулайзера состоят в получении капель аэрозоля сравнительно большого размера, что часто требует сжатия первичных капель в турбулизаторе для получения вторичных разбрызгиваемых капель нужного при вдыхании размера, в отсутствии однородных размеров капель жидкого аэрозоля, в значительной рециркуляции раствора лекарства и в низкой величине плотности маленьких капель вдыхаемого жидкого аэрозоля во вдыхаемом воздухе.
Ультразвуковые небулайзеры используют плоские или вогнутые пьезоэлектрические диски, находящиеся ниже резервуара с жидкостью, для создания резонанса жидкости в резервуаре с образованием конуса в жидкости, который выталкивает частицы аэрозоля с ее поверхности (заявка США №2006/0249144 и патент США №5551416). Поскольку в процессе получения аэрозоля не требуется потока воздуха, могут быть достигнуты высокие концентрации аэрозоля, однако, применение пьезоэлектрических компонентов является довольно дорогим и неэффективным при получении аэрозоля суспензий, когда требуется растворение активного лекарства в низкой концентрации в воде или в физиологическом растворе.
Более современные технологии получения жидких аэрозолей включают получение более мелких и более однородных вдыхаемых сухих частиц в жидкости путем пропускания жидкости, которая должна быть в аэрозоле, через отверстия микронного размера. См., например, патент США №6131570, патент США №5724957 и патент США №6098620.
Недостатки этих технологий включают применение сравнительно дорогих пьезоэлектрических компонентов и компонентов с очень мелкими отверстиями, а также закупоривание этих отверстий остаточными солями и частицами твердой суспензии.
Ингаляция сухих порошков исторически была основана на применении смесей с лактозой, чтобы обеспечить дозирование частиц, которые являются достаточно мелкими для вдыхания, но не являются достаточно диспергируемыми сами по себе. Известно, что такой процесс является неэффективным и не может применяться для некоторых лекарств.
Некоторые исследователи пытались устранить эти недостатки, создавая составы для ингаляции сухих порошков (DPI), которые можно вдыхать и которые диспергируются и поэтому не требуют смешения с лактозой. Составы сухих порошков для ингаляции описаны в патенте США №5993805, Sutton et al.; в патенте США №69216527, Platz et al.; в заявке WO 0000176, Robinson et al.; в заявке WO 9916419, Таrаrа et al.; в заявке WO 0000215, Bot et al; в патенте США №5855913, Hanes et al.; и в патентах США №№6136295 и 5874064, Edwards et al.
Широкое клиническое применение доставки сухих порошков путем ингаляции было ограничено из-за трудностей, связанных с получением сухих порошков с соответствующими размером частиц, плотностью частиц и диспергируемостью, необходимостью хранения сухого порошка в сухом состоянии и создания удобного ручного устройства, которое эффективно диспергирует вдыхаемые сухие частицы в воздухе. Кроме того, размер частиц сухого порошка для доставки путем ингаляции ограничен тем фактом, что более мелкие вдыхаемые сухие частицы труднее диспергировать в воздухе. Составы сухих порошков, хотя и имеют преимущества по сравнению с объемными жидкими лекарственными формами и составами на основе пропеллентов, склонны к агрегированию и низкой текучести, что значительно снижает их диспергируемость и эффективность применения терапии с использованием ингаляции на основе сухих порошков. Например, известно, что Ван-дер-ваальсовское взаимодействие частиц и эффекты капиллярной конденсации способствуют агрегации сухих частиц. Hickey, A. et al, "Factors Influencing the Dispersion of Dry Powders as Aerosols", Pharmaceutical Technology, August, 1994.
Для преодоления адгезионного взаимодействия частиц Batycky et а/, в патенте США №7182961 предложили получать так называемые "аэродинамически легкие, пригодные для вдыхания частицы", которые имеют объемный медианный геометрический диаметр (VMGD) более 5 мкм, измеренный методом с применением прибора лазерной дифракции, такого как HELOS (изготовленного фирмой Sympatec, Princeton, N.J.). См. Batycky et al, колонка 7, строки 42-65.
Другой подход к улучшению диспергируемости пригодных к вдыханию частиц со средним размером менее 10 мкм включает добавление растворимого в воде полипептида или добавление подходящих эксципиентов (включая аминокислотные эксципиенты, такие как лейцин) в количестве от 50% до 99,9% по весу от всей композиции. Eljamal et al, патент США №6 582 729, колонка 4, строки 12-19 и колонка 5, строка 55 до колонки 6, строка 31.
Однако этот подход приводит к снижению количества активного агента, которое может быть доставлено с применением фиксированного количества порошка. Следовательно требуется увеличение количества порошка для достижения нужного терапевтического результата, например, возможности осуществления многих ингаляций и/или частого применения. Другие подходы включают применение устройств, которые используют механические силы, такие как давление сжатых газов, для воздействия на мелкие частицы для исключения адгезии между частицами во время введения или непосредственно пред их введением. См., например, патенты США №№7601336, Lewis et al, 6 737 044, Dickinson et al, 6 546 928, Ashurst et al. или заявку США на патент №2009/0208582, Johnston et al
Дальнейшее ограничение, свойственное каждому из указанных выше методов, состоит в том, что полученные аэрозоли обычно включают значительные количества инертных носителей, растворителей, эмульгаторов, пропеллентов и других веществ, не являющихся лекарствами. В общем, для эффективного образования пригодных для вдыхания сухих частиц достаточно мелкого размера (например, менее 5 мкм и предпочтительно менее 3 мкм) для доставки в альвеолы, требуются большие количества нелекарственных веществ. Однако эти количества нелекарственных веществ способствуют также уменьшению чистоты и количества активного лекарственного вещества, которое может быть доставлено. Таким образом, эти методы не могут обеспечить точное введение больших доз активного лекарства пациенту при системной доставке.
Следовательно, остается необходимость в получении аэрозолей с частицами мелкого размера, которые являются хорошо диспергируемыми. Кроме того, необходимы способы, которые обеспечивают получение аэрозолей, содержащих большие количества лекарства и меньшие количества нелекарственных веществ. Наконец, необходим способ, который дает возможность пациенту быстро вводить стандартную дозу при одном или двух вдохах небольшого объема.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к пригодным для вдыхания сухим порошкам, состоящим из сухих частиц, которые содержат один или более двухвалентных катионов металлов, таких как катион кальция (Са2+), в качестве активного ингредиента, и к сухим порошкам, которые содержат пригодные для вдыхания частицы. Настоящее изобретение относится также к пригодным для вдыхания частицам, которые содержат один или более одновалентных катионов (таких как Na+) и к сухим порошкам, которые содержат пригодные для вдыхания частицы. Активный ингредиент (например, ион Са2+) обычно содержится в сухих порошках и в сухих частицах в виде одной или более солей, которые независимо могут быть кристаллическими, аморфными или могут представлять собой комбинацию кристаллического и аморфного ингредиентов. Сухие порошки и сухие частицы могут дополнительно включать соли одновалентных металлов (например, соли натрия), терапевтически активные агенты или фармацевтически приемлемые эксципиенты. Согласно одному аспекту изобретения пригодные для вдыхания сухие частицы могут быть маленькими и очень хорошо диспергируемыми. Согласно другому аспекту изобретения пригодные для вдыхания сухие частицы могут быть большими или маленькими, например, иметь геометрический диаметр (VMGD) между 0,5 мкм и 30 мкм. MMAD частиц может находиться между 0,5 мкм и 10 мкм, более предпочтительно между 1 мкм и 5 мкм.
Согласно нескольким аспектам изобретения пригодные для вдыхания сухие порошки могут иметь объемный медианный геометрический диаметр (VMGD), составляющий примерно 10 мкм или менее, и отношение диспергируемости [отношение VMGD, измеренного при давлении дисперсии равном 1 бар, к VMGD, измеренному при давлении 4 бар] (1/4 бар) менее примерно 2, измеренное методом лазерной дифракции (система RODOS/HELOS), и содержат соль кальция.
Пригодные для вдыхания сухие порошки могут содержать фракцию мелких частиц (FPF) размером менее 5,6 мкм или менее в количестве равном по меньшей мере 45%, FPF размером менее 3,4 мкм в количестве, составляющем по меньшей мере 30%, и/или FPF размером менее 5,0 мкм в количестве, составляющем по меньшей мере 45%. Альтернативно или в дополнение, пригодные для вдыхания сухие порошки могут иметь массовый медианный аэродинамический диаметр (MMAD) равный примерно 5 мкм или менее. Отношение молекулярных весов катиона двухвалентного металла и соли катиона двухвалентного металла, содержащихся в пригодной для вдыхания сухой частице, может составлять более примерно 0,1 и/или более примерно 0,16.
Составы пригодного для вдыхания порошка могут включать фармацевтически приемлемый эксципиент, такой как лейцин, мальтодекстрин или маннит, который может содержаться в количестве равном примерно 50% или менее по весу, предпочтительно в количестве равном примерно 20% или менее по весу.
Соль двухвалентного металла, которая содержится в пригодных для вдыхания сухих порошках, может быть солью бериллия, солью магния, солью кальция, солью стронция, солью бария, солью радия и солью железа. Например, соль катиона двухвалентного металла может быть солью кальция, такой как лактат кальция, сульфат кальция, цитрат кальция, хлорид кальция, или комбинацией указанных солей. Соль одновалентного металла, которая может содержаться в пригодной для вдыхания сухой частице, может быть солью натрия, солью лития, солью калия или любой их комбинацией.
Согласно некоторым аспектам пригодный для вдыхания сухой порошок содержит соль катиона двухвалентного металла и соль одновалентного металла и содержит аморфную фазу катиона двухвалентного металла и кристаллическую фазу одновалентного металла. Температура стеклования аморфной фазы может равняться по меньшей мере примерно 120°С. Такие пригодные для вдыхания сухие частицы могут также содержать эксципиент, такой как лейцин, мальтодекстрин или маннит, который может быть аморфным, кристаллическим или смесью указанных форм. Пригодные для вдыхания сухие частицы могут иметь теплоту растворения между примерно -10 ккал/моль и 10 ккал/моль.
Предпочтительно, когда соль двухвалентного металла является солью кальция, а соль одновалентного металла представляет собой соль натрия. Соль кальция может быть цитратом кальция, лактатом кальция, сульфатом кальция, хлорид кальция, или любой комбинацией указанных солей, а соль натрия может быть хлоридом натрия.
Согласно другим аспектам пригодный для вдыхания сухой порошок содержит соль двухвалентного металла, которая обеспечивает наличие катиона в количестве равном примерно 5% или более от веса сухого порошка, пригодный для вдыхания сухой порошок имеет отношение Хауснера более 1,5 и отношение 1/4 бар или 0,5/4 бар, составляющее 2 или менее.
Данное изобретение относится также к пригодному для вдыхания сухому порошку, который содержит пригодные для вдыхания сухие частицы, содержащие цитрат кальция или сульфат кальция, которые получены по способу, который включает: а) обеспечение первого исходного жидкого раствора, представляющего собой водный раствор хлорида кальция, и второго исходного жидкого раствора, представляющего собой водный раствор сульфата натрия или цитрата натрия; б) смешение первого исходного жидкого раствора и второго исходного жидкого раствора с получением смеси, в которой происходит реакция ионного обмена с получением насыщенного или пересыщенного раствора, содержащего сульфат кальция и хлорид натрия; и в) сушку насыщенного или пересыщенного раствора, полученного на стадии б) с получением пригодных для вдыхания сухих частиц. Смешение на стадии б) может быть периодическим или статическим.
Изобретение относится также к способам лечения заболевания верхних дыхательных путей, такого как астма, сверхчувствительность дыхательных путей, сезонная аллергия, бронхиостаз, хронический бронхит, эмфизема, хроническое обструктивное заболевание легких, кистозный фиброз и т.п. , включающим введение в дыхательные пути субъекта, нуждающегося в таком лечении, эффективного количества пригодных для вдыхания сухих частиц или сухого порошка.
Данное изобретение относится также к лечению, профилактике и/или уменьшению распространения инфекционного заболевания дыхательных путей у субъекта, нуждающегося в таком лечении, включающим введение в дыхательные пути эффективного количества пригодных для вдыхания сухих частиц или сухого порошка.
Изобретение относится также к пригодным для вдыхания сухому порошку или сухим частицам, описанным в данной заявке, пригодным для использования в терапии (например, при лечении, профилактике или диагностировании). Настоящее изобретение относится также к применению пригодных для вдыхания сухого порошка или сухих частиц, описанным в данной заявке, для лечения, профилактики или/или уменьшения распространения инфекционного заболевания дыхательных путей, описанных в данной заявке, и к изготовлению лекарственного препарата для лечения, профилактики или диагностирования заболевания дыхательных путей и/или инфекции Краткое описание фигур
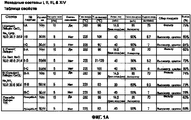
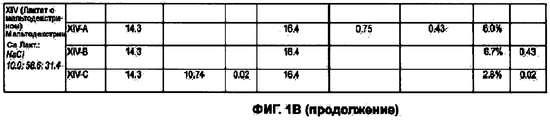
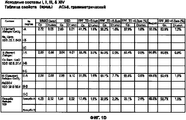
На Фигурах 1А-1F представлена таблица, в которой приведены свойства сухих порошков, полученных из исходных растворов I, II, III и XIV, описанных в примерах 1-3 и 14. На Фигуре 1А показаны параметры сушки при распылении порошков. На Фигуре 1В приведены результаты определения методом ВЭЖХ содержания в порошках иона кальция, величины плотности, включая величину насыпного веса и насыпной массы после уплотнения, и результаты определения содержания воды в порошках по Карлу Фишеру. На Фигуре 1 С приведены содержание фракции мелких частиц (FPF) и масса порошков, собранных в двухстадийном (ACI-2) каскадном импакторе фирмы Andersen. На Фигуре 1 D показаны содержание фракции мелких частиц (FPF) и величина массы порошков, собранных в восьмистадийном (ACI-8) каскадном импакторе фирмы Andersen. На Фигуре 1Е приведены величины массового медианного аэродинамического диаметра (MMAD) и FPF (в расчете на всю порцию и на выделенную порцию). На Фигуре 1 F показаны величины объемного медианного геометрического диаметра (DV50), геометрического стандартного отклонения (GSD) и объема частиц размером менее 5,0 мкм (V<5,0 мкм), измеренного на приборе Spraytec, и геометрическое или объемное распределение частиц по размерам (которое обозначается также как VMGD, ×50/дг или ×50), GSD и величины 1/4 бар и 0,5/4 бар, измеренные при помощи HELOS с присоединенным прибором RODOS.
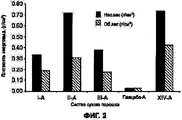
На Фигуре 2 приведен график, который отражает сравнение между величинами насыпного веса и насыпной массы после уплотнения для частиц, полученных из исходных растворов состава I, II и III и плацебо.
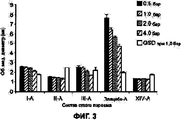
На Фигуре 3 приведен график, который отражает сравнение между частицами, (полученными из исходных растворов I-III и плацебо) при разном давлении дисперсии (регулятора) для частиц с измеренным объемным медианным геометрическим диаметром (×50) с использованием метода лазерной дифракции и прибора HELOS с RODOS.
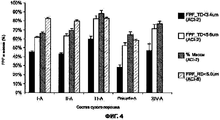
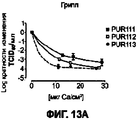
На Фигуре 4 приведен график, который отражает сравнение между частицами, полученными из исходных растворов I (идентифицируемых как PUR 111 (Цитрат, Citrate)), II (идентифицируемых как PUR 113 (Лактат, Lactate)) и III (идентифицируемых как PUR 112 (Сульфат), и плацебо для средней величины FPF, полученными в ACI-2 и ACI-8.
На Фигурах 5А-D приведены электронные микрофотографии состава (Фиг.5А); состава II (Фиг.5В); состава III (Фиг.5С); и состава XIV (Фиг.5D).
На Фигурах 6А-6В показана таблица, в которой приведены свойства сухих порошков, полученных из исходных растворов 6.1-6.9. Состав 6.1 на Фигуре 5 соответствует составу II-В в примере 2. Состав 6.4 на Фигуре 5 соответствует составу I-В в примере 1. Состав 6.7 на Фигуре 5 соответствует составу III-В в примере 3. Сокращения в заголовке таблицы описаны в описании. На Фигуре 5 показаны порошки, полученные при помощи распылительной сушилки Büchi.
На Фигуре 7 схематически показана модель процесса.
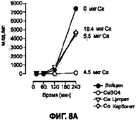
На Фигуре 8А показана модель, иллюстрирующая воздействие бактерий на сухие порошки. Порошок, содержащий сульфат кальция (4,5 мкг Са/см2 доставленной дозы), замедлял движение бактерий через миметический альгинат натрия, iii. На Фигуре 8В показан график, иллюстрирующий результаты прохождения бактерий с применением этой модели, когда бактерии воздействуют на сухие порошки. Испытанные сухие порошки, содержащие соль кальция, приготовленные из исходных составов А-Е, содержали 0 мкг, 4,3 мкг, 6,4 мкг или 10 мкг кальция. Порошки, содержащие сульфат кальция (4,3 мкг Са/см2 доставленной дозы), ацетат кальция (10 мкг Са/см2 доставленной дозы) и лактат кальция (6,4 мкг Са/см2 доставленной дозы) уменьшали продвижение бактерий через миметический альгинат натрия.
На Фигуре 9 приведен график, который показывает зависимое от величины дозы действие пригодных для вдыхания сухих порошков, приготовленных из исходных составов от 10-1 до 10-4 в примере 10-А, на вирус гриппа A/WSN/33 (H1N1).
На Фигуре 10 приведен график, который показывает зависимое от величины дозы действие пригодных для вдыхания сухих порошков, приготовленных в примере 10-В, на вирус гриппа A/Panama/99/2007 (H3N2).
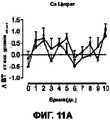
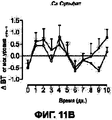
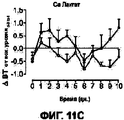
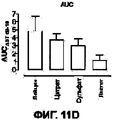
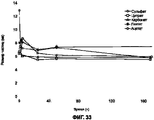
На Фигурах 11А-D приведены графики, которые показывают, что составы сухих порошков, содержащих соли кальция и хлорид натрия, уменьшают развитие гриппа у африканских хорьков. Фигура 11А показывает изменение температуры тела у указанных хорьков, которых лечили порошком, содержащим цитрат кальция, по сравнению с контрольными животными. Фигура 11В показывает изменение температуры тела у указанных хорьков, которых лечили порошком, содержащим сульфат кальция, по сравнению с контрольными животными. Фигура 11С показывает изменение температуры тела у указанных хорьков, которых лечили порошком, содержащим лактат кальция, по сравнению с контрольными животными. Фигура 11D показывает изменение температуры тела от исходного уровня у каждого животного с использованием площади под кривой в течение опыта (d0-d10). Приведенные данные отражают среднюю величину ±SEM для каждой группы (р=0.09 для контрольной группы, получавшей лейцин, и группы, получавшей лактат при проведении t - теста Стьюдента).
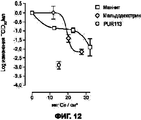
На Фигуре 12 приведен график, показывающий снижение титра гриппа при действии порошковых составов, содержащих различные эксципиенты (маннит, мальтодекстрин) наряду с лактатом кальция и хлоридом натрия, при более высоких концентрациях по сравнению с порошком, содержащим только состав III.
На Фигурах 13А-С показаны графики, иллюстрирующие различную эффективность порошковых составов с кальцием по отношению к различным вирусным патогенам. В качестве контроля применяли клетки Calu-3, не обработанные составом, они сравнивались с клетками, на которые воздействовали состав I, состав II и состав III. Оценивали количественно концентрацию вируса, высвобождавшегося клетками, на которые действовал каждый состав аэрозоля. Символы обозначают среднее и стандартное отклонения для каждого опыта в дупликатных лунках.
На Фигуре 14 приведен график, показывающий величины выделенных доз порошкового состава III из капсул с различным весом (25 мг, 60 мг, 75 мг) при различной величине энергии вдоха.
На Фигуре 15 приведен график, показывающий распределение по размерам порошков с лактатом кальция (состав II), выделяемых различными ингаляторами, характеризуемых объемным медианным диаметром (Dv50), в зависимости от энергии вдоха. Величины Dv50 при уменьшении значений энергии показывают, что порошок диспергируется хорошо, так как дополнительная энергия не приводит к дополнительной деагломерации выделенного порошка.
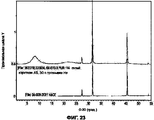
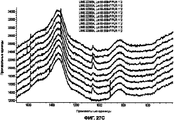
На Фигуре 16 показано, что порошковый состав I характеризуется высоким разрешением на дифрактограмме XRPD. Эта дифрактограмма показывает, что порошковый состав I состоит из комбинации кристаллического хлорида натрия и слабо кристаллического или аморфного цитрата кальция и, возможно, обогащенной хлоридом кальция фазы.
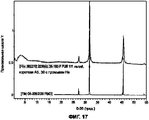
На Фигуре 17 показано сравнение дифрактограмм порошкового состава I с отражением от кристалла NaCl.
На Фигуре 18 показано перекрытие при циклическом изменении температуры на термограмм DSC для состава I. Для аморфной обогащенной кальцием фазы температура стеклования на термограмме DSC составляла примерно 167°С.
На Фигуре 19 показано, что порошковый состав III характеризуется высоким разрешением на дифрактограмме XRPD. Эта дифрактограмма показывает, что порошковый состав I состоит из комбинации кристаллического хлорида натрия и слабо кристаллического или аморфного лактата кальция и, возможно, обогащенной хлоридом кальция фазы.
На Фигуре 20 показано сравнение дифрактограммы порошкового состава I и рентгенограммы кристалла NaCl.
На Фигуре 21 показано перекрытие значений при циклическом изменении температуры на термограмм DSC для состава III. Для аморфной обогащенной кальцием фазы температура стеклования на термограмме DSC составляла примерно 144°С.
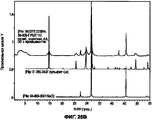
На Фигуре 22 показано, что порошковый состав XIV характеризуется высоким разрешением на дифрактограмме XRPD.
На Фигуре 23 показано сравнение дифрактограмм порошкового состава XIV и рентгенограммы кристалла NaCl.
На Фигуре 24 показано перекрытие значений при циклическом изменении температуры на термограмм DSC для состава XIV. Для аморфной обогащенной кальцием фазы температура стеклования на термограмме DSC составила примерно 134°С.
На Фигуре 25А показано, что порошковый состав III характеризуется высоким разрешением на дифрактограмме XRPD. Эта дифрактограмма показывает, что в составе III содержится соль кальция с некоторой степенью кристалличности (сульфат кальция) в дополнение к кристаллическому хлориду натрия. На Фигуре 25В показано сравнение дифрактограмм порошкового состава III с отражением от кристалла NaCl.
На Фигуре 26 показано перекрытие значений при циклическом изменении температуры на термограмм DSC для состава III. Для аморфной обогащенной кальцием фазы температура стеклования на термограмме DSC составила примерно 159°С.
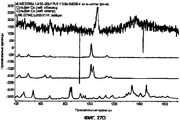
На Фигурах 27А-Н представлены спектры Рамана. На Фигуре 27А приведены рамановские спектры для шести частиц из состава I, они перекрываются. На Фигуре 27В показан спектр 389575 - 6 за вычетом фона, который перекрывается с рамановскими спектрами для тетрагидрата цитрата кальция, цитрата натрия и лейцина. На Фигуре 27 С приведены рамановские спектры для восьми частиц из состава III, они перекрываются. На Фигуре 27D показан спектр 388369 - 4 за вычетом фона, который перекрывается с рамановскими спектрами сульфата кальция, дигидрата сульфата кальция, безводного сульфата натрия и лейцина. На Фигуре 27Е показаны спектры Рамана для двенадцати частиц из образца состава II, они перекрываются. На Фигуре 27F показан спектры 389576 - 7 и 389576 - 12 за вычетом фона, они перекрываются со спектрами Рамана для пентагидрата лактата кальция и лейцина. На Фигуре 27G показаны спектры Рамана для двенадцати частиц из образца состава XIV, они перекрываются. На Фигуре 27Н показан спектр 389577 - 9 за вычетом фона, он перекрывается со спектром Рамана для пентагидрата лактата кальция.
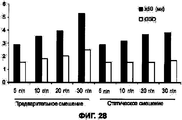
На Фигуре 28 приведен график, который показывает результаты измерения объемного размера частиц для высушенного при распылении порошкового состава III (сульфат кальция), полученного из предварительно статически смешанных исходных жидких составов с увеличивающейся концентрацией твердых частиц. Распределение частиц по размерам расширяется (увеличивается GSD) и значительно возрастает значение медианного объемного размера частиц (×50) с увеличением концентрации твердых частиц. С увеличением концентрации твердых частиц в смешанных при статических условиях исходных жидких растворах распределение частиц по размерам остается постоянным, в то время, как медианный объемный размер немного увеличивается, что и ожидалось
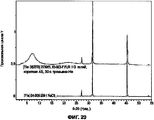
На Фигуре 29 приведен график, который показывает результаты измерения объемного размера частиц для высушенного при распылении порошкового состава III (сульфат кальция), полученного из предварительно смешанных и смешанных в статических условиях исходных жидких составов с увеличивающейся концентрацией твердых частиц. Распределение частиц по размерам расширяется с увеличением концентрации твердых частиц для порошков из предварительно смешанных исходных растворов и остается узким для порошков из смешанных в статических условиях исходных жидких растворов. Треугольники обозначают порошки из смешанных в статических условиях растворов, 5 г/л; квадратики обозначают порошки из предварительно смешанных растворов, 5 г/л; ромбы обозначают порошки из смешанных в статических условиях растворов, 30 г/л; кружочки обозначают порошки из предварительно смешанных растворов, 30 г/л.
На Фигуре 30 приведен график зависимости свойств высушенных при распылении порошков аэрозоля состава III (сульфат кальция), полученных из предварительно смешанных и смешанных в статических условиях исходных жидких составов, от концентрации твердых частиц.
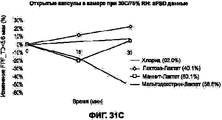
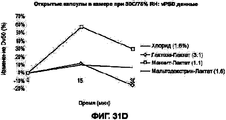
На Фигурах 31А-В приведены графики, которые показывают изменение количества фракции мелких частиц (FPF) в составе I (цитрат кальция), в составе II (лактат кальция) и в составе III (сульфат кальция) в процессе измерения стабильности при применении в экстремальных условиях. На графике сравниваются изменение количества FPF (вся доза) размером <5.6 микрон (%) в зависимости от времени пребывания в камере при экстремальных температуре и влажности (30°С, 75% RH). Величины, указанные в надписях, показывают истинное значение в момент времени 0. Графики отражают флуктуацию как функцию изменения по сравнению с моментом времени 0. На Фигуре 31В приведен график, показывающий изменение величины объемного размера частиц в составе I (цитрат кальция), в составе II (лактат кальция) и в составе III (сульфат кальция) в процессе измерения стабильности при применении в экстремальных условиях. На графике сравнивается изменение величины медианного объемного размера частиц в зависимости от времени пребывания в камере при экстремальных температуре и влажности (30°С, 75% RH). Величины, указанные в надписях, показывают истинное значение в момент времени 0. Графики отражают флуктуацию как функцию изменения по сравнению с моментом времени 0. Фигуры 31 С, D отражают похожие данные для второго набора высушенных при распылении составов: контрольного порошка, содержащего хлорид кальция:хлорид натрия:лейцин и 10% (i) лактозы, (ii) маннита или (iii) мальтодекстрина в качестве эксципиентов. На Фигуре 31С сравниваются изменение количества FPF (во всей дозе) размером <5.6 микрон (%) в зависимости от времени пребывания в камере второго набора порошков при экстремальных температуре и влажности (30°С, 75% RH). Величины, указанные в надписях, показывают истинное значение в момент времени 0. Графики отражают флуктуацию как функцию изменения по сравнению с моментом времени 0. Фигура 31D отражает график, показывающий изменение величины объемного размера частиц для второго набора порошков в процессе измерения стабильности при применении в экстремальных условиях. На графике сравнивается изменение величины медианного объемного размера частиц в зависимости от времени пребывания в камере при экстремальных температуре и влажности (30°С, 75% RH). Величины, указанные в надписях, показывают истинное значение в момент времени 0. Графики отражают флуктуацию как функцию изменения по сравнению с моментом времени 0.
На Фигуре 32 приведен график, показывающий стабильность порошков различных видов, которая определена как изменение объемного размера частиц при воздействии влажности, составляющей -40% RH, в течение недели.
На Фигуре 33 показан график, показывающий величины объемного размера частиц порошков различных видов при воздействии влажности, составляющей ~40% RH, в течение недели. Эта Фигура идентична Фигуре 32, но измерения были проведены в отсутствие хлорида для получения лучших результатов.
На Фигуре 34 приведен график, показывающий репрезентативную теомограмму TGA для состава I.
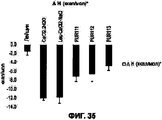
На Фигуре 35 приведен график, показывающий величины теплоты растворения растворов, полученных при растворении составов I-III. Составы I-III характеризовались значительно более низкими значениями теплоты растворения по сравнению как с сырым дигидратом хлорида кальция, так и с контрольным порошком, содержащим хлорид кальция:хлорид натрия:лейцин.
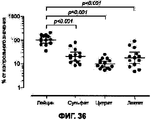
На Фигуре 36 приведен график, показывающий результаты in vivo изучения протекания пневмонии. Животные, которых лечили при помощи состава III (сульфат кальция), имели величины бактериальных титров, которые были в 5 раз ниже, животные, которых лечили при помощи состава I (цитрат кальция), имели величины бактериальных титров, которые были в 10,4 раза ниже и животные, которых лечили при помощи состава II (лактат кальция), имели величины бактериальных титров, которые были в 5,9 раз ниже.
На Фигуре 37 приведена таблица, показывающая виды применявшихся порошковых составов.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в одной своей части относится к пригодным для вдыхания сухим порошкам, которые доставляют в качестве активного ингредиента один или более катионов металлов, таких как кальций, и к пригодным для вдыхания сухим частицам, содержащим катионы двухвалентного металла (например, содержащим кальций), которые входят в состав порошков. Данное изобретение относится также к пригодным для вдыхания сухим частицам, которые содержат один или более катионов одновалентных металлов (таких как натрий), и к сухим порошкам, которые содержат эти пригодные для вдыхания частицы.
Согласно одному аспекту изобретения пригодные для вдыхания сухие порошки и сухие частицы согласно изобретению могут представлять собой плотные пригодные для вдыхания частицы с катионом двухвалентного металла (например, с кальцием), которые являются мелкими и диспергируемыми. Согласно другому аспекту изобретения пригодные для вдыхания сухие частицы могут быть большими или маленькими, например, сухой порошок может иметь геометрический диаметр (VMGD), составляющий величину между 0,5 мкм и 30 мкм. MMAD сухого порошка может быть равным величине между 0,5 мкм и 10 мкм, более предпочтительно между 1 мкм и 5 мкм.
Пригодные для вдыхания сухие порошки, которые содержат мелкие частицы и которые диспергируются в среде воздуха и которые предпочтительно являются концентрированными (например, в отношении активного ингредиента) не являются тривиальными. Хорошо известно, что склонность частиц к агрегированию или агломерации увеличивается с уменьшением размера частиц. См, например, Hickey, A. et al, "Factors Influencing the Dispersion of Dry Powders as Aerosols", Pharmaceutical Technology, August, 1994.
Как описано в данной заявке, данное изобретение предусматривает пригодные для вдыхания сухие порошки, которые содержат пригодные для вдыхания частицы, являющиеся мелкими и диспергируемыми в среде воздуха без применения дополнительных источников энергии кроме энергии вдыхания субъектом. Таким образом, пригодные для вдыхания сухие порошки и пригодные для вдыхания частицы могут быть применены в терапии без применения больших количеств неактивных компонентов (например, эксципиентов) в частицах или порошках или с использованием механических сил для разрушения агрегатов или агломератов частиц во время их применения или непосредственно перед их применением.
Пригодные для вдыхания сухие порошки и пригодные для вдыхания частицы по изобретению обычно являются концентрированными в отношении активного (-ых) ингредиента (-ов), а именно катионов двухвалентных металлов (например, соли или солей кальция). Например, как описано в данной заявке, когда в состав пригодного для вдыхания сухого порошка или сухих частиц включен эксципиент, этот эксципиент содержится в небольшом количестве (например, примерно 50% или менее по весу, предпочтительно примерно 20% или менее по весу, примерно 12% или менее по весу, примерно 10% или менее по весу, примерно 8% или менее по весу). Таким образом, согласно одному аспекту изобретения пригодные для вдыхания частицы являются не только мелкими и хорошо диспергируемыми, но могут содержать большое количество катиона двухвалентного металла, например, кальция (двухвалентного Са). Соответственно, для введения, чтобы доставить желаемую дозу катиона двухвалентного металла (например, кальция), будут требоваться меньшие количества порошка. Например, желательная доза кальция может быть доставлена при одном или двух вдохах из ингалятора капсульного или блистерного типа.
Определения
Термин " сухой порошок ", используемый в данной заявке, относится к композиции, содержащей мелкодисперсные, пригодные для вдыхания диспергированные частицы, которые способны диспергироваться в ингаляторе и затем вдыхаться субъектом. Такой сухой порошок или сухая частица могут содержать до примерно 15% воды или другого растворителя или могут практически не содержать воды или другого растворителя, или могут быть безводными.
Термин " сухие частицы ", используемый в данной заявке, относится к пригодным для вдыхания частицам, которые могут содержать до примерно 15% воды или другого растворителя или могут практически не содержать воды или другого растворителя, или могут быть безводными.
Термин " пригодные для вдыхания ", используемый в данной заявке, относится к сухим частицам или сухим порошкам, которые пригодны для доставки в дыхательные пути (например, в легкие) субъекта путем ингаляции. Пригодные для вдыхания сухие порошки и пригодные для вдыхания сухие частицы могут иметь массовый медианный аэродинамический диаметр (MMAD) менее примерно 10 мкм, предпочтительно равный примерно 5 мкм или менее.
Применяемый в данной заявке термин " введение " пригодных для вдыхания сухих частиц относится к введению сухих частиц в дыхательные пути субъекта.
Применяемый в настоящей заявке термин " дыхательные пути " включает верхние дыхательные пути (например, носовые проходы, носовую полость, горло, гортань), дыхательные пути (например, гортань, трахеи, бронхи, бронхиолы и легкие (например, дыхательные бронхиолы, альвеолярные ходы, альвеолярные мешочки, альвеолы).
Термин " диспергируемый " является известным и описывает характеристику сухого порошка или сухих частиц, рассеиваемых во вдыхаемом аэрозоле. Диспергируемость сухого порошка или сухих частиц выражается в данной заявке как частное от деления объемного медианного геометрического диаметра (VMGD), измеренного при давлении дисперсии (например, регулятора) равном 1 бар, на величину VMGD, измеренного при давлении 4 бар при помощи системы HELOS/RODOS. Эти величины обозначаются в данной заявке как " 1/4 бар " и " 1/4 бар ", соответственно, и диспергируемость коррелирует с низким значение такого частного. Например, величина 1/ 4 бар относится к величине VMGD пригодных для вдыхания сухих частиц или порошков, выделившихся из отверстия диспергатора сухих порошков RODOS (или эквивалентного устройства) при давлении равном примерно 1 бар, измеренном при помощи системы HELOS или другой лазерной дифракционной системы, деленной на VMGD тех же самых пригодных для вдыхания сухих частиц или порошков, измеренный при давлении 4 бар при помощи системы HELOS/RODOS. Таким образом, хорошо диспергируемый сухой порошок или сухие частицы будут иметь отношение 1/4 бар или 0,5/4 бар, которое близко к 1. Хорошо диспергируемые порошки имеют небольшую тенденцию к агломерации, агрегированию или слеживанию друг с другом и/или, если произошла агломерация, агрегирование или слеживание, диспергируются легко или деагломерируют, когда они высвобождаются из ингалятора и вдыхаются субъектом.
Диспергируемость можно также оценить путем измерения размера частиц, выходящих из ингалятора как функции скорости потока.
Термины "FPF(<5,0)," "FPF(<5,0 микрон)" и "фракция мелких частиц размером менее 5,0 микрон", применяемые в данной заявке, относятся к фракции пригодных для вдыхания сухих частиц, которые имеют аэродинамический диаметр менее 5,0 микрон. Например, FPF (<5,0) можно определить, используя восьмистадийный ACI со скоростью потока равной 60 л/мин, путем экстраполяции полученного набора данных. Этот параметр может быть также определен как "FPF_TD (<5,0)," где TD означает величину дозы.
Используемый в данной заявке термин " высвободившаяся доза " or " ED " относится к доставке лекарства из применяемого ингалятора после пуска. Более конкретно, для сухих порошкообразных составов ED является мерой количества порошка, которое извлекается из упаковки, содержащей стандартную дозу, и находится в загубнике ингаляционного устройства. ED определяется как отношение величины дозы, доставленной ингалятором, к номинальной дозе (то есть величине массы порошка в стандартной дозе, помещенной в ингалятор перед пуском). ED представляет собой параметр, определяемый опытным путем, и может быть определена с применением метода, описанного в USP Section 601 Aerosols, Metered - Dose Inhalers and Dry Powder Inhalers, Delivered - Dose Uniformity, Sampling the Delivered Dose from Dry Powder Inhalers, United States Pharmacopia convention, Rockville, MD, 13th Revision, 222-225, 2007. Этот метод предусматривает применение in vitro прибора для имитирования дозирования, осуществляемого пациентом.
Термин "эффективное количество", используемый в данной заявке, относится к количеству активного агента, необходимому для достижения нужного эффекта, такому как количество, которое достаточно для увеличения поверхности и/или вязкоэластичности слизистой оболочки дыхательного пути (например, количества промывной жидкости воздушного пути), увеличения гелеобразования в слизистой оболочке дыхательного тракта (например, гелеобразования на его поверхности и/или в массе), увеличения поверхностного натяжения в слизистой оболочке дыхательного пути, увеличения эластичности слизистой оболочки дыхательного пути (например, эластичности на поверхности или в массе), увеличения вязкости на поверхности слизистой оболочки дыхательного пути (например, поверхностной вязкости и/или вязкости в массе), уменьшения количества выделенных частиц, снижения количества патогена (например, бактерий, вирусов), ослабления симптомов (например, лихорадки, кашля, чихания, насморка, диареи и т.п. ), уменьшения количества появляющихся инфекций, уменьшения репликации вирусов или улучшения или предотвращения ухудшения дыхательной функции (например, увеличения объема выдоха в секунду, FEV1, и/или выдыхаемого объема в секунду FEV1 как отношения объема максимального спокойного выдоха FEV1/FVC, уменьшения сжатия бронхов). Действительное эффективное количество в конкретном случае может меняться в зависимости от вида сухого порошка или сухих частиц, способа введения и возраста, веса, общего состояния здоровья субъекта, степени серьезности симптомов или состояния, подвергающегося лечению. Подходящие количества сухих порошков и сухих частиц, которые должны быть введены, и режим дозирования для конкретного пациента могут быть определены клиницистом или обычным специалистом на основе приведенных выше рассуждений.
Термин " фармацевтически приемлемый эксципиент", применяемый в данной заявке, означает, что этот эксципиент может быть введен в легкие без появления значительных токсикологических эффектов. Такой эксципиент обычно рассматривается в U.S. Food and Drug Administration как безопасный.
Сухие порошки и сухие частицы
Данное изобретение относится к пригодным для вдыхания сухим порошкам и сухим частицам, которые содержат в качестве активного ингредиента один или более катионов двухвалентных металлов, таких как бериллий (Ве2+), магний (Mg2+), кальций (Са2+), стронций (Sr2+), барий (Ва2+), радий (Ra2+) или железо (ион двухвалентного железа, Fe2+). Активный катион двухвалентного металла (например, кальция) обычно содержится в сухих порошках и в сухих частицах в виде соли, которая может быть кристаллической или аморфной. Сухие порошки и сухие частицы могут также включать дополнительные соли (например, соли одновалентных металлов, такие как соли натрия, соли калия, а также соли лития), терапевтически активные агенты или фармацевтически приемлемые эксципиенты.
Согласно некоторым аспектам данного изобретения пригодные для вдыхания сухие порошки и сухие частицы содержат одну или более солей группы IIА (то есть одну или более солей бериллия, солей магния, солей кальция, солей бария, солей радия или любую комбинацию этих солей). Согласно конкретным аспектам пригодные для вдыхания сухие порошки и сухие частицы содержат одну или более солей кальция, солей магния или любую комбинацию этих солей. Согласно одним конкретным аспектам пригодные для вдыхания сухие порошки и сухие частицы содержат одну или более солей кальция. Согласно другим конкретным аспектам пригодные для вдыхания сухие порошки и сухие частицы содержат одну или более солей магния.
Подходящие соли бериллия включают, например, фосфат бериллия, ацетат бериллия, тартрат бериллия, цитрат бериллия, глюконат бериллия, малеат бериллия, сукцинат бериллия, смешанную натрий - бериллиевую соль яблочной кислоты, бериллиевую соль альфа - бромсульфоната камфоры, ацетилацетонат бериллия, формиат бериллия или любую комбинацию этих солей.
Подходящие соли магния включают, например, фторид магния, хлорид магния, бромид магния, йодид магния, фосфат магния, сульфат магния, сульфит магния, карбонат магния, окись магния, нитрат магния, борат магния, ацетат магния, цитрат магния, глюконат магния, малеат магния, сукцинат магния, малат магния, таурат магния, оротат магния, глицинат магния, нафтенат магния, ацетилацетонат магния, формиат магния, гидроксид магния, стеарат магния, гексафторсиликат магния, салицилат магния, а также любую комбинацию этих солей.
Подходящие соли кальция включают, например, хлорид кальция, сульфат кальция, лактат кальция, цитрат кальция, карбонат кальция, ацетат кальция, фосфат кальция, альгинат кальция, стеарат кальция, сорбат кальция, глюконат кальция и т.п.
Подходящие соли стронция включают, например, хлорид стронция, фосфат стронция, сульфат стронция, карбонат стронция, окись стронция, нитрат стронция, ацетат стронция, тартрат стронция, цитрат стронция, глюконат стронция, малеат стронция, сукцинат стронция, малат стронция, аспартат стронция в L- и/или в D-форме, фумарат стронция, глутамат стронция в L- и/или в D-форме, глутарат стронция, лактат стронция, L-треонат стронция, малонат стронция, ранелат (органический хелат металла) стронция, аскорбат стронция, бутират стронция, клодронат стронция, ибандронат стронция, салицилат стронция, ацетилсалицилат стронция или любую комбинацию этих солей.
Подходящие соли бария включают, например, гидроокись бария, фторид бария, хлорид бария, бромид бария, йодид бария, сульфат бария, сульфид бария (S), карбонат бария, перекись бария, нитрат бария, ацетат бария, тартрат бария, цитрат бария, глюконат бария, малеат бария, сукцинат бария, малат бария, глутамат бария, оксалат бария, малонат бария, нафтенат бария, ацетилацетонат бария, формиат бария, бензоат бария, п-трет.бутилбензоат бария, адипинат бария, пимелат бария, суберат бария, азелат бария, себацинат бария, фталат бария, изофталат бария, терефталат бария, антранилат бария, манделат бария, салицилат бария, титанат бария или любую комбинацию этих солей.
Подходящие соли радия включают, например, фторид радия, хлорид бария, бромид бария, йодид радия, окись радия, нитрид радия, а также любую комбинацию этих солей.
Подходящие соли железа (двухвалентного) включают, например, сульфат железа, окиси железа, ацетат железа, цитрат железа, смешанный цитрат аммония и железа, глюконат железа, оксалат железа, фумарат железа, малеат железа, соль железа и яблочной кислоты, лактат железа, аскорбат железа, эритробат железа, глицерат железа, пируват железа или любую комбинацию этих солей.
Согласно одному аспекту данного изобретения сухие частицы являются мелкими, обогащенными катионом двухвалентного металла (например, кальция) и диспергируемыми. Размер сухих частиц может быть выражен разными способами, общеизвестными из уровня техники, таким как количество фракции мелких частиц (FPF), объемный медианный геометрический диаметр (VMGD) или массовый медианный аэродинамический диаметр (MMAD). Обычно сухие частицы по изобретению имеют величину VMGD, измеренного при помощи HELOS/RODOS при давлении 1 бар, равную примерно 10 мкм или менее (например, от примерно 0, 1 мкм до примерно 10 мкм). Предпочтительно, когда сухие частицы по изобретению имеют величину VMGD, составляющую примерно 9 мкм или менее (например, от примерно 0,1 мкм до примерно 9 мкм), примерно 8 мкм или менее (например, от примерно 0,1 мкм до примерно 8 мкм), примерно 7 мкм или менее (например, от примерно 0,1 мкм до примерно 7 мкм), примерно 6 мкм или менее (например, от примерно 0,1 мкм до примерно 6 мкм), примерно 5 мкм или менее (например, от примерно 0,1 мкм до примерно 5 мкм), примерно 4 мкм или менее (например, от примерно 0,1 мкм до примерно 4 мкм), примерно 3 мкм или менее (например, от примерно 0,1 мкм до примерно 3 мкм), примерно 2 мкм или менее (например, от примерно 0,1 мкм до примерно 2 мкм), примерно 1 мкм или менее (например, от примерно 0,1 мкм до примерно 1 мкм), от примерно 1 мкм до примерно 6 мкм, от примерно 1 мкм до примерно 5 мкм, от примерно 1 мкм до примерно 4 мкм, от примерно 1 мкм до примерно 3 мкм, от примерно 1 мкм до примерно 2 мкм, причем этот параметр измерен при давлении 1 бар при помощи HELOS/RODOS.
Согласно другому аспекту сухие частицы по изобретению являются крупными, предпочтительно обогащенными кальцием и диспергируемыми. Обычно сухие частицы по изобретению имеют величину VMGD, измеренного при помощи HELOS/RODOS при давлении 1 бар, равную примерно 10 мкм или менее (например, от примерно 0, 1 мкм до примерно 10 мкм). Предпочтительно, когда сухие частицы по изобретению имеют величину VMGD, измеренную при помощи HELOS/RODOS при давлении 1 бар. равную примерно 30 мкм или менее (например, от примерно 5 мкм до примерно 30 мкм). Предпочтительно, когда сухие частицы по изобретению имеют величину VMGD, равную примерно 25 мкм или менее (например, от примерно 5 мкм до примерно 25 мкм), равную примерно 20 мкм или менее (например, от примерно 5 мкм до примерно 20 мкм), равную примерно 15 мкм или менее (например, от примерно 5 мкм до примерно 15 мкм), равную примерно 12 мкм или менее (например, от примерно 5 мкм до примерно 12 мкм), равную примерно 10 мкм или менее (например, от примерно 5 мкм до примерно 10 мкм) или равную примерно 8 мкм или менее (например, от примерно 6 мкм до примерно 8 мкм), причем этот параметр измерен при давлении 1 бар при помощи HELOS/RODOS.
Кроме того, независимо от того, являются ли частицы мелкими или крупными, эти сухие частицы по изобретению являются диспергируемыми и имеют отношение, равное 1/4 бар и/или 0,5/4 бар, равное примерно 2,2 или менее (например, равное от примерно 1,0 до примерно 2,2) или равное примерно 2,0 или менее (например, от примерно 1,0 до примерно 2,0). Предпочтительно, если сухие частицы по изобретению имеют отношение, равное 1/4 бар и/или 0,5/4 бар, равное примерно 1,9 или менее (например, равное от примерно 1,0 до примерно 1,9), равное примерно 1,8 или менее (например, равное от примерно 1,0 до примерно 1,8), равное примерно 1,7 или менее (например, равное от примерно 1,0 до примерно 1,7), равное примерно 1,6 или менее (например, равное от примерно 1,0 до примерно 1,6), равное примерно 1,5 или менее (например, равное от примерно 1,0 до примерно 1,5), равное примерно 1,4 или менее (например, равное от примерно 1,0 до примерно 1,4), равное примерно 1,3 или менее (например, равное от примерно 1,0 до примерно 1,3), равное примерно 1,2 или менее (например, равное от примерно 1,0 до примерно 1,2), равное примерно 1,1 или менее (например, равное от примерно 1,0 до примерно 1,1) или сухие частицы по изобретению имеют это отношение, равное от 1/4 бар до примерно 1,0.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут иметь MMAD, равный примерно 10 мкм или менее, например, могут иметь MMAD, составляющий от примерно 0,5 мкм до примерно 10 мкм. Предпочтительно, когда сухие частицы по изобретению могут иметь MMAD, равный примерно 5 мкм или менее (например, от примерно 0,5 микрон до примерно 5 микрон, предпочтительно от примерно 1 микрон до примерно 5 микрон), от примерно 4 микрон или менее (например, от примерно 1 микрон до примерно 4 микрон), от примерно 3,8 микрон или менее (например, от примерно 1 микрон до примерно 3,8 микрон), от примерно 3,5 микрон или менее (например, от примерно 1 микрон до примерно 3,5 микрон), от примерно 3,2 микрон или менее (например, от примерно 1 микрон до примерно 3,2 микрон), от примерно 3,0 микрон или менее (например, от примерно 1 микрон до примерно 3 микрон), от примерно 2,8 микрон или менее (например, от примерно 1 микрон до примерно 2,8 микрон), от примерно 2,2 микрон или менее (например, от примерно 1 микрон до примерно 2,2 микрон), от примерно 2,0 микрон или менее (например, от примерно 1 микрон до примерно 2,0 микрон) или равный примерно 1,8 микрон или менее (например, от примерно 1 микрон до примерно 1,8 микрон).
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать FPF размером менее примерно 5,6 микрон (FPF<5,6 мкм) в количестве равном по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, предпочтительно по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65% или по меньшей мере примерно 70%.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать FPF размером менее примерно 5,0 микрон (FPF TD<5,0 мкм) в количестве равном по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 45%, предпочтительно по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере 65% или по меньшей мере примерно 70%.
Альтернативно или в дополнение, пригодные для вдыхания сухие порошки и сухие частицы по изобретению могут содержать в высвободившейся дозе FPF размером менее примерно 5,0 микрон (FPF_ED<5.0 мкм) в количестве равном по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80% или по меньшей мере примерно 85%. Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать FPF размером менее примерно 3,4 микрон (FPF<3,4 мкм) в количестве равном по меньшей мере примерно 20%, по меньшей примерно 25%, %, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50% или по меньшей мере примерно 55%.
Альтернативно или в дополнение, пригодные для вдыхания сухие порошки и сухие частицы по изобретению могут иметь плотность утряски (насыпной вес при утряске), составляющий от примерно 0.1 г/см3 до примерно 1,0 г/см3. Например, мелкие и диспергируемые сухие частицы по изобретению имеют насыпной вес при утряске, равный от примерно 0,1 г/см3 до примерно 0,9 г/см3, от примерно 0,2 г/см3 до примерно 0,9 г/см3, от примерно 0,3 г/см3 до примерно 0,9 г/см3, от примерно 0,4 г/см3 до примерно 0,9 г/см3, от примерно 0,5 г/см3 до примерно 0,9 г/см3 или от примерно 0,5 г/см3 до примерно 0,8 г/см3, более примерно 0,4 г/см3, более примерно 0,5 г/см3, более примерно 0,6 г/см3, более примерно 0,7 г/см3, от примерно 0,1 г/см3 до примерно 0,8 г/см3, от примерно 0,1 г/см3 до примерно 0,7 г/см3, от примерно 0,1 г/ см3 до примерно 0,6 г/см3, от примерно 0,1 г/см3 до примерно 0,5 г/см3, от примерно 0,1 г/см3 до примерно 0,4 г/см3, от примерно 0,1 г/см3 до примерно 0,3 г/см3, менее примерно 0,3 г/см3. Согласно предпочтительному варианту насыпной вес при утряске составляет величину более примерно 0,4 г/см3. Согласно другому предпочтительному варианту насыпной вес при утряске равен величине, превышающей 0,5 г/см3. Альтернативно, насыпной вес при утряске может быть менее примерно 0,4 г/см3.
Альтернативно или в дополнение, пригодные для вдыхания сухие порошки и сухие частицы по изобретению могут содержать воду или растворитель в количестве менее примерно 15% по весу в расчете на пригодную для вдыхания сухую частицу. Например, пригодные для вдыхания сухие порошки и сухие частицы по изобретению могут содержать воду или растворитель в количестве менее примерно 15% по весу, менее, чем примерно 13% по весу, менее, чем примерно 11,5% по весу, менее, чем примерно 10% по весу, менее, чем примерно 9% по весу, менее, чем примерно 8% по весу, менее, чем примерно 7% по весу, менее, чем примерно 6% по весу, менее, чем примерно 5% по весу, менее, чем примерно 4% по весу, менее, чем примерно 3% по весу, менее, чем примерно 2% по весу, менее, чем примерно 1% по весу или могут быть безводными. Пригодные для вдыхания сухие порошки и сухие частицы по изобретению могут содержать воду или растворитель количестве менее примерно 6% и более примерно 1%, менее, чем примерно 5,5% и более, чем примерно 1,5%, менее, чем примерно 5% и более, чем примерно 2%, примерно 2%, примерно 2,5%, примерно 3%, примерно 3,5%, примерно 4%, примерно 4,5%. примерно 5%.
Как описано в данной заявке, пригодные для вдыхания сухие частицы по изобретению содержат в качестве активного ингредиента один или более катионов двухвалентных металлов (например, кальция (Са2+)), которые содержатся обычно в виде соли (например, кристаллической и/или аморфной). Подходящие соли кальция, которые могут входить в состав пригодных для вдыхания сухих частиц по изобретению, включают, например, хлорид кальция, сульфат кальция, лактат кальция, цитрат кальция, карбонат кальция, ацетат кальция, фосфат кальция, альгинат кальция, стеарат кальция, сорбат кальция, глюконат кальция и т.п. Согласно некоторым предпочтительным аспектам изобретения пригодные для вдыхания сухие частицы по изобретению не содержат фосфата кальция, карбоната кальция, альгината кальция, стеарата кальция или глюконата кальция. Согласно другому предпочтительному аспекту изобретения сухой порошок или сухие частицы по изобретению включают цитрат кальция, лактат кальция, хлорид кальция, сульфат кальция или любую комбинацию указанных солей. Согласно другому предпочтительному аспекту изобретения сухой порошок или сухие частицы по изобретению включают цитрат кальция, лактат кальция или любую комбинацию указанных солей. Если это желательно, пригодные для вдыхания сухой порошок или сухие частицы по изобретению содержат соль катиона двухвалентного металла (например, соль кальция (Са2+)), и дополнительно содержат одну или более других солей, таких как одна или более нетоксичных солей натрия, калия, магния, кальция, алюминия, кремния, скандия, титана, ванадия, хрома, кобальта, никеля, меди, марганца, цинка, олова, серебра и т.п. Предпочтительно, если сухие частицы содержат по меньшей мере одну соль кальция и по меньшей мере одну соль одновалентного катиона (например, соль натрия).
Подходящие соли натрия, которые могут содержаться в пригодных для вдыхания сухих частицах по изобретению, включают, например, хлорид натрия, цитрат натрия, сульфит натрия, лактат натрия, ацетат натрия, бикарбонат натрия, карбонат натрия, стеарат натрия, аскорбат натрия, бензоат натрия, дифосфат натрия, фосфат натрия, бисульфит натрия, борат натрия, глюконат натрия, метасиликат натрия и т.п. Согласно предпочтительному аспекту изобретения сухие порошки и сухие частицы по изобретению включают хлорид натрия, цитрат натрия, лактат натрия, сульфат натрия или любую комбинацию этих солей.
Подходящие соли лития включают, например, хлорид лития, бромид лития, карбонат лития, нитрат лития, сульфат лития, ацетат лития, лактат лития, цитрат лития, аспартат лития, глюконат лития, литиевую соль яблочной кислоты, аскорбат лития, оротат лития, сукцинат лития или их комбинации.
Подходящие соли калия включают, например, хлорид калия, бромид калия, йодид калия, бикарбонат калия, нитрит калия, персульфат калия, сульфит калия, бисульфит калия, фосфат калия, ацетат калия, цитрат калия, глутамат калия, дикалийгуанилат, глюконат калия, калиевую соль яблочной кислоты, аскорбат калия, сорбат калия, сукцинат калия, смешанную соль калия, натрия и винной кислоты или любые их комбинации.
Предпочтительные соли двухвалентных металлов (например, соли кальция) имеют одну, предпочтительно две или более из следующих характеристик:
(i) могут быть введены в состав пригодной для вдыхания сухой частицы,
(ii) обладают достаточной физико-химической стабильностью в сухом порошке, чтобы способствовать получению порошка, который диспергируется и стабилен физически при используемых условиях, включая выдержку в условиях повышенной влажности, (iii) быстро растворяется при осаждении в легких, например, половинное количество катиона двухвалентного металла может растворяться менее, чем за 30 мин, менее, чем за 15 мин, менее, чем за 5 мин, менее, чем за 2 мин, менее, чем за 1 мин или менее, чем за 30 с, и (iv) не обладают свойствами, которые приводят к плохой переносимости или появлению вредных явлений, таких как значительная экзотермическая или эндотермическая теплота растворения (АН). Например, ДН бывает меньше, чем примерно - 10 ккал/моль или больше, чем примерно 10 ккал/моль. Скорее, предпочтительная величина ДН находится в интервале от примерно - 9 ккал/моль до примерно 9 ккал/моль, от примерно - 8 ккал/моль до примерно 8 ккал/моль, от примерно - 7 ккал/моль до примерно 7 ккал/моль, от примерно - 6 ккал/моль до примерно 6 ккал/моль, от примерно - 5 ккал/моль до примерно 5 ккал /моль, от примерно - 4 ккал/моль до примерно 4 ккал/моль, от примерно - 3 ккал/моль до примерно 3 ккал /моль, от примерно - 2 ккал/моль до примерно 2 ккал/моль, от примерно - 1 ккал/моль до примерно 1 ккал/моль или равна примерно 0 ккал/моль.
Что касается скорости растворения при осаждении сухого порошка или сухих частиц в легких, альтернативы быстрого растворения частиц в легких, то соль двухвалентного металла подвергается пролонгированному растворению после осаждения. Время пролонгированного растворения, согласно одному аспекту, составляет минуты, например, половинное количество соли катиона двухвалентного металла может высвобождаться из частицы в течение промежутка времени более примерно 30 мин или более примерно 45 мин. Согласно другому аспекту изобретения время пролонгированного растворения составляет часы, например, половинное количество соли катиона двухвалентного металла может высвобождаться из частицы в течение промежутка времени более примерно 1 час, более примерно 1,5 час, более примерно 2 час, более примерно 4 час, более примерно 8 час или более примерно 12 час. Согласно еще одному аспекту пролонгированное растворение длится один день или 2 дня.
Подходящие соли катиона двухвалентного металла (например, соли кальция) могут иметь желательные характеристики растворимости. В общем, предпочтительными являются соли катиона двухвалентного металла (например, соли кальция) с высокой или умеренной растворимостью. Например, подходящие соли катиона двухвалентного металла (например, соли кальция), которые содержатся в пригодных для вдыхания сухих частицах и сухих порошках могут иметь растворимость в дистиллированной воде при комнатной температуре (20-30°С) и давлении, равном 1 бар, составляющую по меньшей мере примерно 0,4 г/л, по меньшей мере примерно 0,85 г/л, по меньшей мере примерно 0,90 г/л, по меньшей мере примерно 0,95 г/л, по меньшей мере примерно 1,0 г/л, по меньшей мере примерно 2,0 г/л, по меньшей мере примерно 5,0 г/л, по меньшей мере примерно 6,0 г/л, по меньшей мере примерно 10,0 г/л, по меньшей мере примерно 20 г/л, по меньшей мере примерно 50 г/л, по меньшей мере примерно 90 г /л, по меньшей мере примерно 120 г/л, а по меньшей мере примерно 500 г/л, по меньшей мере примерно 700 г/л или по меньшей мере примерно 1000 г/л. Предпочтительно, соль катиона двухвалентного металла имеет растворимость более примерно 0,90 г/л, более примерно 2,0 г/л или более примерно 90 г /л.
Согласно данному изобретению, если это желательно, могут быть получены сухие частицы и сухие порошки, которые содержат соли катиона двухвалентного металла (например, соли кальция), которые не обладают высокой растворимостью в воде. Как описано в данной заявке, такие сухие частицы и сухие порошки могут быть получены при применении исходного раствора другой, более растворимой соли и проведения анионного обмена для получения желаемых солей катиона двухвалентного металла (например, соли кальция) до или одновременно с сушкой при распылении.
Согласно данному изобретению сухие частицы и сухие порошки могут содержать в своем составе большое количество активного ингредиента (например, катиона двухвалентного металла (например, кальция)) и быть обогащенными катионом двухвалентного металла. Сухие частицы могут содержать 3% или более, 5% или более, 10% или более, 15% или более, 20% или более, 25% или более, 30% или более, 35% или более, 40% или более, 50% или более, 60% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более или 95% или более активного ингредиента.
Предпочтительно, когда соль катиона двухвалентного металла (например, соль кальция) диссоциирует с получением двух или более молей катиона двухвалентного металла (например, Са2+) на моль соли. Такие соли могут быть применены для получения пригодных для вдыхания сухих порошков и сухих частиц, которые содержат большое количество катиона двухвалентного металла (например, кальция). Например, один моль цитрата кальция при растворении обеспечивает получение трех молей высшей степени предпочтительно, когда соль катиона двухвалентного металла (например, соль кальция) представляет собой соль с низким молекулярным весом и/или содержит анионы с низким молекулярным весом. Соли катиона двухвалентного металла с низким молекулярным весом, такие как соли кальция, которые содержат ионы кальция и анионы с низким молекулярным весом, содержат большое количество двухвалентного катиона (например, Са2+) по сравнению с высокомолекулярными солями и солями, включающими анионы с высоким молекулярным весом. В общем предпочитают соль катиона двухвалентного металла (например, соль кальция), которая имеет молекулярный вес, равный примерно 1000 г/моль, менее примерно 950 г/моль, менее примерно 900 г/моль, менее примерно 850 г/моль, менее примерно 800 г/моль, менее примерно 750 г/моль, менее примерно 700 г/моль, менее примерно 650 г/моль, менее примерно 600 г/моль, менее примерно 550 г/моль, менее примерно 510 г/моль, менее примерно 500 г/моль, менее примерно 450 г/моль, менее примерно 400 г/моль, менее примерно 350 г /моль, менее примерно 300 г/моль, менее примерно 250 г/моль, менее примерно 200 г/моль, менее примерно 150 г/моль, менее примерно 125 г/моль или менее примерно 100 г/моль. В дополнение или альтернативно, обычно является предпочтительным, чтобы катион двухвалентного металла (например, ион кальция) обеспечивал значительную долю веса от всего веса соли катиона двухвалентного металла. Обычно предпочтительно, если катион двухвалентного металла (например, ион кальция) обеспечивает по меньшей мере 10% от веса соли, по меньшей мере 16%, по меньшей мере 20%, по меньшей мере 24,5%, по меньшей мере 26%, по меньшей мере 31%, по меньшей мере 35% или по меньшей мере 38% от общего веса соли катиона двухвалентного металла (например, соли кальция).
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут включать подходящую (например, соль кальция), которая обеспечивает образование катиона двухвалентного соль катиона двухвалентного металла (например, Са2+) при весовом отношении катиона двухвалентного металла (например, иона кальция) к общему весу указанной соли, составляющем величину между примерно 0,1 и примерно 0,5. Например, весовое отношении катиона двухвалентного металла (например, иона кальция) к общему весу указанной соли, составляет от примерно 0,15 до примерно 0,5, от примерно 0,18 до примерно 0,5, от примерно 0,2 до примерно 5, от примерно 0,25 до примерно 0,5, от примерно 0,27 до примерно 0,5, от примерно 0,3 до примерно 5, от примерно 0,35 до примерно 0,5, от примерно 0,37 до примерно 0,5 или от примерно 0,4 до примерно 0,5.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать соль катиона двухвалентного металла (например, соль кальция), которая обеспечивает наличие двухвалентного катиона (например, Са2+) в количестве равном по меньшей мере примерно 5% от веса пригодных для вдыхания сухих частиц. Например, пригодные для вдыхания сухие частицы по изобретению могут включать соль катиона двухвалентного металла (например, соль кальция), которая обеспечивает наличие двухвалентного катиона (например, Са2+) в количестве равном по меньшей мере примерно 7% по весу, по меньшей мере примерно 10% по весу, по меньшей мере примерно 11% по весу, по меньшей мере примерно 12% по весу, по меньшей мере примерно 13% по весу, по меньшей мере примерно 14% по весу, по меньшей мере примерно 15% по весу, по меньшей мере примерно 17% по весу, по меньшей мере примерно 20% по весу, по меньшей мере примерно 25% по весу, по меньшей мере примерно 30% по весу, по меньшей мере примерно 35% по весу, по меньшей мере примерно 40% по весу, по меньшей мере примерно 45% по весу, по меньшей мере примерно 50% по весу, по меньшей мере примерно 55% по весу, по меньшей мере примерно 60% по весу, по меньшей мере примерно 65% по весу или по меньшей мере примерно 70% по весу в расчете на пригодные для вдыхания сухие частицы.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать соль катиона двухвалентного металла, которая обеспечивает наличие двухвалентного катиона (например, Са2+, Ве2+, Mg2+, Sr2+, Ва2+, Fe2+), в количестве равном по меньшей мере примерно 5% от веса пригодных для вдыхания сухих частиц, и содержат также соль одновалентного металла (например, соль натрия, соль лития, соль калия), которая обеспечивает наличие одновалентного катиона (например, Na+, Li+, К+) в количестве равном по меньшей мере примерно 3% от веса пригодных для вдыхания сухих частиц. Например, пригодные для вдыхания сухие частицы по изобретению могут включать соль катиона двухвалентного металла (например, соль кальция), которая обеспечивает наличие двухвалентного катиона (например, Са2+) в количестве равном по меньшей мере примерно 7% по весу, по меньшей мере примерно 10% по весу, по меньшей мере примерно 11% по весу, по меньшей мере примерно 12% по весу, по меньшей мере примерно 13% по весу, по меньшей мере примерно 14% по весу, по меньшей мере примерно 15% по весу, по меньшей мере примерно 17% по весу, по меньшей мере примерно 20% по, по меньшей мере примерно 25% по весу, по меньшей мере примерно 30% по весу, по меньшей мере примерно 35% по весу, по меньшей мере примерно 40% по весу, по меньшей мере примерно 45% по весу, по меньшей мере примерно 50% по весу, по меньшей мере примерно 55% по весу, по меньшей мере примерно 60% по весу, по меньшей мере примерно 65% по весу или по меньшей мере примерно 70% по весу в расчете на пригодные для вдыхания сухие частицы; и дополнительно могут содержать соль одновалентного катиона натрия (Na+) в количестве, равном по меньшей мере примерно 3%, по меньшей мере примерно 4%, по меньшей мере примерно 5%, по меньшей мере примерно 6%, по меньшей мере примерно 7%, по меньшей мере примерно 8%, по меньшей мере примерно 9%, по меньшей мере примерно 10%, по меньшей мере примерно 11%, по меньшей мере примерно 12%, по меньшей мере примерно 14%, по меньшей мере примерно 16%, по меньшей мере примерно 18%, по меньшей мере примерно 20%, по меньшей мере примерно 22%, по меньшей мере примерно 25%, по меньшей мере примерно 27%, по меньшей мере примерно 29%, по меньшей мере примерно 32%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50% или по меньшей мере примерно 55% по весу в расчете на пригодные для вдыхания сухие частицы.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать соль катиона двухвалентного металла и соль катиона одновалентного металла, при этом соль катиона двухвалентного металла как компонента одной или более солей содержится в количестве равном по меньшей мере примерно 5% от веса пригодных для вдыхания сухих частиц и весовое отношение катиона двухвалентного металла к катиону одновалентного металла составляет от примерно 50:1 (то есть примерно 50 к примерно 1) до примерно 0, 1:1 (то есть примерно 0,1 к примерно 1). Весовое отношение катиона двухвалентного металла к катиону одновалентного металла рассчитывается на основе количеств катиона двухвалентного металла и катиона одновалентного металла, которые содержатся в соли катиона двухвалентного металла и соли катиона одновалентного металла, соответственно, входящих в состав сухой частицы. В конкретных примерах весовое отношение катиона двухвалентного металла к катиону одновалентного металла составляет примерно 0,2:1, примерно 0,3:1, примерно 0,4:1, примерно 0,5:1, примерно 0,6:1, примерно 0,7:1, примерно 0,8:1, примерно 0,86:1, примерно 0,92:1, примерно 1:1; примерно 1,3:1, примерно 2:1, примерно 5:1, примерно 10:1, примерно 15:1, примерно 20:1, примерно 25:1, примерно 30:1, примерно 35:1, примерно 40:1, примерно 45:1, или примерно 50:1, от примерно 20:1 до примерно 0,1:1, от примерно 15:1 до примерно 0,1:1, от примерно 10:1 до примерно 0,1:1 или от примерно 5:1 до примерно 0,1:1.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать соль катиона двухвалентного металла и соль катиона одновалентного металла, при этом соль катиона двухвалентного металла и соль катиона одновалентного металла содержат анион хлорида, лактата, цитрата или сульфата в качестве противоиона, и мольное отношение катиона двухвалентного металла (например, Са2+, Ве2+, Mg2+, Sr2+, Ва2+, Fe2+) к катиону одновалентного металла (например, Na+, Li+, К+) составляет от примерно 50:1 (то есть, примерно 50 к примерно 1) до примерно 0,1:1 (то есть, примерно 0,1 к примерно 1). Мольное отношение катиона двухвалентного металла к катиону одновалентного металла рассчитывается на основе количеств катиона двухвалентного металла и катиона одновалентного металла, которые содержатся в соли катиона двухвалентного металла и соли катиона одновалентного металла, соответственно, входящих в состав сухой частицы. Предпочтительно, если катион двухвалентного металла, являющийся компонентом одной или более солей катиона двухвалентного металла, содержится в количестве, равном по меньшей мере 5% от веса пригодной для вдыхания сухой частицы. В конкретных примерах катион двухвалентного металла и катион одновалентного металла в пригодных для вдыхания сухих частицах содержатся в мольном отношении от примерно 8,0:1, примерно 7,5:1, примерно 7,0:1, примерно 6,5:1, примерно 6,0:1, примерно 5,5:1, примерно 5,0:1, примерно 4,5:1, примерно 4,0:1, примерно 3,5:1, примерно 3,0:1, примерно 2,5:1, примерно 2,0:1, примерно 1,5:1, примерно 1,0:1, примерно 0,77:1, примерно 0,65:1, примерно 0,55:1, примерно 0,45:1, примерно 0,35:1, примерно 0,25:1 или примерно 0,2:1, от примерно 8,0:1 до примерно 0,55:1, от примерно 7,0:1 до примерно 0,55:1, от примерно 6,0:1 до примерно 0,55:1, от примерно 5,0:1 до примерно 0,55:1, от примерно 4,0:1 до примерно 0,55:1, от примерно 3,0:1 до примерно 0,55:1, от примерно 2,0:1 до примерно 0,55:1 или от примерно 1,0:1 до примерно 0,55:1.
Предпочтительные пригодные для вдыхания сухие частицы содержат по меньшей мере одну соль кальция, выбранную из группы, состоящей из лактата кальция, цитрата кальция, сульфата кальция и хлорида кальция, и содержат также хлорид натрия.
Цитрат кальция, сульфат кальция и лактат кальция обладают достаточной растворимостью в воде, чтобы их можно было ввести в состав пригодных для вдыхания для вдыхания сухих порошков путем сушки при распылении и они облегчают их растворение после осаждения в легких, но обладают достаточно низкой гигроскопичностью, чтобы обеспечить получение сухих порошков с высоким содержанием соли кальция, которые обладают довольно большой физической стабильностью при выдержке в условиях нормальной и повышенной влажности. Цитрат кальция, сульфат кальция и лактат кальция также имеют достаточно низкую теплоту растворения, чем хлорид кальция, что подходит для их применения в дыхательных путях, и ионы цитрата, сульфата и лактата являются безопасными и приемлемыми для включения в фармацевтические композиции.
Соответственно, в дополнение к любой комбинации признаков и свойств, описанных в данной заявке, пригодные для вдыхания сухие частицы по изобретению могут содержать одну или более солей в общем количестве, составляющем по меньшей мере примерно 51% по весу в расчете на пригодные для вдыхания сухие частицы; при этом каждая из одной или более солей независимо представляет содержит катион, выбранный из группы, состоящей из кальция и натрия, и анион, выбранный из группы, состоящей из лактата (С3Н5О3), хлорида (Сl-), цитрата (С6H5O7 3-) и сульфата , при условии, что по меньшей мере одна из солей представляет собой соль кальция. Например, пригодные для вдыхания сухие частицы по изобретению могут включать одну или более солей в общем количестве равном по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 91%, по меньшей мере примерно 92% или по меньшей мере примерно 95% по весу в расчете на пригодные для вдыхания сухие частицы.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать соль кальция и соль натрия, при этом катион кальция как компонент одной или более солей содержится в количестве равном по меньшей мере примерно 5% от веса сухой частицы и весовое отношение иона кальция к иону натрия составляет от примерно 50:1 (то есть, примерно 50 к примерно 1) до примерно 0,1:1 (то есть, примерно 0,1 к примерно 1). Весовое отношение катиона двухвалентного металла к катиону одновалентного металла рассчитывается на основе количеств катиона двухвалентного металла и катиона одновалентного металла, которые содержатся в соли катиона двухвалентного металла и соли катиона одновалентного металла, соответственно, входящих в состав сухой частицы. В конкретных примерах весовое отношение катиона двухвалентного металла к катиону одновалентного металла составляет примерно 0,2:1, примерно 0,3:1, примерно 0,4:1, примерно 0,5:1, примерно 0,6:1, примерно 0,7:1, примерно 0,8:1, примерно 0,86:1, примерно 0,92:1, примерно 1:1; примерно 1,3:1, примерно 2:1, примерно 5:1, примерно 10:1, примерно 15:1, примерно 20:1, примерно 25:1, примерно 30:1, примерно 35:1, примерно 40:1, примерно 45:1, или примерно 50:1, от примерно 20:1 до примерно 0,1:1, от примерно 15:1 до примерно 0,1:1, от примерно 10:1 до примерно 0,1:1 или от примерно 5:1 до примерно 0,1:1.
Альтернативно или в дополнение, пригодные для вдыхания сухие частицы по изобретению могут содержать соль кальция и соль натрия, при этом соль кальция и соль натрия содержат анион хлорида, лактата, цитрата или сульфата в качестве противоиона, и мольное отношение катиона кальция к катиону натрия составляет от примерно 50:1 (то есть, примерно 50 к примерно 1) до примерно 0,1:1 (то есть, примерно 0,1 к примерно 1). Мольное отношение катиона кальция к катиону натрия рассчитывается на основе количеств кальция и натрия, которые содержатся в соли кальция и соли натрия, соответственно, входящих в состав сухой частицы. Предпочтительно, если кальций являющийся компонентом одной или более солей кальция, содержится в количестве, равном по меньшей мере 5% от веса пригодной для вдыхания сухой частицы. В конкретных примерах катионы кальция и натрия в пригодных для вдыхания сухих частицах содержатся в мольном отношении от примерно 8,0:1, примерно 7,5:1, примерно 7,0:1, примерно 6,5:1, примерно 6,0:1, примерно 5,5:1, примерно 5,0:1, примерно 4,5:1, примерно 4,0:1, примерно 3,5:1, примерно 3,0:1, примерно 2,5:1, примерно 2,0:1, примерно 1,5:1, примерно 1,0:1, примерно 0,77:1, примерно 0,65:1, примерно 0,55:1, примерно 0,45:1, примерно 0,35:1, примерно 0,25:1 или примерно 0,2:1, от примерно 8,0:1 до примерно 0,55:1, от примерно 7,0:1 до примерно 0,55:1, от примерно 6,0:1 до примерно 0,55:1, от примерно 5,0:1 до примерно 0,55:1, от примерно 4,0:1 до примерно 0,55:1, от примерно 3,0:1 до примерно 0,55:1, от примерно 2,0:1 до примерно 0,55:1 или от примерно 1,0:1 до примерно 0,55:1.
Если это желательно, пригодные для вдыхания сухие частицы по изобретению могут включать физиологически или фармацевтически приемлемый носитель или эксципиент. Например, фармацевтически приемлемый эксципиент включает любой из обычных углеводов, сахарный спирт и аминокислотные носители, которые известны из уровня техники как пригодные эксципиенты для ингаляционной терапии, или в отдельности, или в любой желательной комбинации. Эти эксципиенты обычно представляют собой довольно свободно перетекающие частицы, они не загущаются и не полимеризуются при контакте с водой, являются нетоксичными при ингаляции в виде диспергированного порошка и не взаимодействуют в значительной степени с активным агентом таким образом, чтобы это отрицательно влияло на желаемое физиологическое действие солей по изобретению. Углеводные эксципиенты, которые приемлемы в этом отношении, включают моно - и полисахариды. Примеры моносахаридов включают углеводные эксципиенты, такие как декстроза (безводная или моногидрат; называется также глюкоза и моногидрат глюкозы), галактоза, маннит, D - манноза, сорбоза и т.п. Примеры дисахаридов включают лактозу, мальтозу, сахарозу, трегалозу и т.п. Примеры трисахаридов включают раффинозу и т.п. Другие углеводные эксципиенты включают мальдекстрин и циклодекстрины, такие как 2 - гидроксипропил - бета - циклодекстрин, и могут быть также применены, если это желательно. Примеры сахарных спиртов включают маннит, сорбит и т.п.
Подходящие аминокислотные эксципиенты включают любую из природных аминокислот, которые образуют порошок при осуществлении обычных, принятых в фармацевтике процедур, они включают неполярные (гидрофобные) аминокислоты и полярные (незараженные, положительно зараженные и отрицательно зараженные) аминокислоты, такие аминокислоты являются фармацевтическими и обычно считаются U.S. Food and Drug Administration безопасными (GRAS). Примерами неполярных аминокислот являются аланин, изолейцин, лейцин, метионин, фенилаланин, пролин, триптофан и валин. Репрезентативные примеры полярных незаряженных аминокислот включают цистин, глицин, глютамин, серии, треонин и тирозин. Репрезентативные примеры полярных положительно заряженных аминокислот включают аргинин, гистидин и лизин. Репрезентативные примеры отрицательно заряженных аминокислот включают аспартовую кислоту и глутаминовую кислоту. Эти аминокислоты обычно являются доступными в коммерческих источниках, которые производят фармацевтические продукты, таких как Aldrich Chemical Company, Inc., Milwaukee, Wis. или Sigma Chemical Company, St. Louis, Mo.
Предпочтительные аминокислотные эксципиенты, такие как гидрофобная аминокислота лейцин, могут содержаться в сухих частицах по изобретению в количестве равном примерно 50% или менее от веса пригодных для вдыхания сухих частиц. Например, пригодные для вдыхания сухие частицы по изобретению могут содержать аминокислоту лейцин в количестве равном от примерно 5% до примерно 30% по весу, от примерно 10% до примерно 20% по весу, от примерно 5% до примерно 20% по весу, в количестве примерно 45% или менее по весу, примерно 40% или менее по весу, примерно 35% или менее по весу, примерно 30% или менее по весу, примерно 25% или менее по весу, примерно 20% или менее по весу, примерно 18% или менее по весу, примерно 16% или менее по весу, примерно 15% или менее по весу, примерно 14% или менее по весу, примерно 13% или менее по весу, примерно 12% или менее по весу, примерно 11% или менее по весу, примерно 10% или менее по весу, примерно 9% или менее по весу, примерно 8% или менее по весу, примерно 7% или менее по весу, примерно 6% или менее по весу, примерно 5% или менее по весу, примерно 4% или менее по весу, примерно 3% или менее по весу, примерно 2% или менее по весу или примерно 1% или менее по весу.
Предпочтительные углеводные эксципиенты, такие как мальтодекстрин и маннит, могут содержаться в сухих частицах по изобретению в количестве равном 50% или менее от веса пригодных для вдыхания сухих частиц. Например, пригодные для вдыхания сухие частицы по изобретению могут содержать мальтодекстрин в количестве равном примерно 45% или менее по весу, примерно 40% или менее по весу, примерно 35% или менее по весу, примерно 30% или менее по весу, примерно 25% или менее по весу, примерно 20% или менее по весу, примерно 18% или менее по весу, примерно 16% или менее по весу, примерно 15% или менее по весу, примерно 14% или менее по весу, примерно 13% или менее по весу, примерно 12% или менее по весу, примерно 11% или менее по весу, примерно 10% или менее по весу, примерно 9% или менее по весу, примерно 8% или менее по весу, примерно 7% или менее по весу, примерно 6% или менее по весу, примерно 5% или менее по весу, примерно 4% или менее по весу, примерно 3% или менее по весу, примерно 2% или менее по весу или примерно 1% или менее по весу. Согласно некоторым предпочтительным аспектам изобретения сухие частицы содержат эксципиент, выбранный из лейцина, мальтодекстрина, маннита и любую их комбинацию. Согласно конкретным вариантам изобретения эксципиент представляет собой лейцин, мальтодекстрин или маннит.
Согласно конкретным вариантам пригодные для вдыхания сухие частицы по изобретению могут содержать (а) соль кальция, выбранную из лактата кальция, цитрата кальция или сульфата кальция, в количестве равном по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 45% по весу или по меньшей мере примерно 50% от веса сухой частицы; и (б) соль натрия, такую как хлорид натрия, в количестве равном по меньшей мере примерно 25% или по меньшей мере примерно 30% от веса сухой частицы, и иметь любые из свойств или признаков, указанных в данной заявке. Если это желательно, эксципиент, такой как лейцин, мальтодекстрин, маннит и любая их комбинация, может содержаться в количестве равном примерно 50% или менее или примерно 20% или менее от веса сухой частицы. Например, пригодные для вдыхания сухие частицы по изобретению могут содержать (а) соль кальция в количестве равном от примерно 30% до примерно 65%, от примерно 40% до примерно 65% или от примерно 45% до примерно 65% от веса сухой частицы; (б) соль натрия, такую как хлорид натрия, в количестве равном от примерно 25% до примерно 60% или от примерно 30% до примерно 60% от веса сухой частицы; (в) эксципиент, такой как лейцин, мальтодекстрин, маннит и любая их комбинация, в количестве равном от примерно 20% или менее от веса сухой частицы, или, более предпочтительно, примерно 10% или менее от веса сухой частицы, и (г) иметь любое из свойств или любой признак, такой как отношение 1/4 бар, 0,5/4 бар, VMGD, MMAD, FPF, описанные в данной заявке.
Согласно некоторым аспектам пригодные для вдыхания сухие частицы по изобретению содержат соль иона двухвалентного металла и соль иона одновалентного металла и характеризуются наличием кристаллических и аморфных частиц. Например, пригодные для вдыхания сухие частицы по изобретению могут включать смесь аморфных и кристаллических частиц, в них содержатся аморфная фаза, обогащенная солью иона двухвалентного металла и фаза кристаллической соли одновалентного металла. Пригодные для вдыхания сухие частицы этого типа имеют несколько преимуществ. Например, как описано в данной заявке, кристаллическая фаза (например, кристаллический хлорид натрия) может вносить вклад в стабильность сухой частицы в сухом состоянии и в характеристики диспергируемости, в то время, как аморфная фаза (например, аморфная соль кальция) может способствовать быстрому поглощению воды растворению частицы после отложения в дыхательных путях. Особенно предпочтительно, когда соли с относительно высокой растворимостью в воде (такие как хлорид натрия), которые содержатся в сухих частицах, находятся в кристаллическом состоянии и когда соли с относительно низкой растворимостью в воде (такие как цитрат кальция) содержатся в сухих частицах в аморфном состоянии.
Аморфная фаза характеризуется также высокой температурой стеклования (Tg), такой как Tg, равная по меньшей мере 100°С, по меньшей мере НО°С, 120°С, по меньшей мере 125°С, по меньшей мере 130°С, по меньшей мере 135°С, по меньшей мере 140°С, температура между 120°С и 200°С, между 125°С и 200°С, между 130°С и 200°С, между 120°С и 190°С, между 125°С и 190°С, между 130°С и 190°С, между 120°С и 180°С, между 125°С и 180°С или между 130° Согласно некоторым аспектам пригодные для вдыхания сухие частицы по изобретению содержат аморфную фазу, обогащенную солью иона двухвалентного металла, и кристаллическую фазу, обогащенную солью иона одновалентного металла, и отношение аморфной фазы к кристаллической фазе (вес:вес) составляет от примерно 5:95 до примерно 95:5, от примерно 5:95 до примерно 10:90, от примерно 10:90 до примерно 20:80, от примерно 20:80 до примерно 30:70, от примерно 30:70 до примерно 40:60, от примерно 40:60 до примерно 50:50; от примерно 50:50 до примерно 60:40, от примерно 60:40 до примерно 70:30, от примерно 70:30 до примерно 80:20 или от примерно 90:10 до примерно 95:5. Согласно другим аспектам пригодные для вдыхания сухие частицы по изобретению содержат аморфную фазу, обогащенную солью иона двухвалентного металла, и кристаллическую фазу, обогащенную солью иона одновалентного металла, и отношение аморфной фазы к частице по весу (вес:вес) составляет от примерно 5:95 до примерно 95:5, от примерно 5:95 до примерно 10:90, от примерно 10:90 до примерно 20:80, от примерно 20:80 до примерно 30:70, от примерно 30:70 до примерно 40:60, от примерно 40:60 до примерно 50:50; примерно 50:50 до примерно 60:40, от примерно 60:40 до примерно 70:30, от примерно 70:30 до примерно 80:20 или от примерно 90:10 до примерно 95:5.
Согласно некоторым аспектам пригодные для вдыхания сухие частицы по изобретению содержат соль кальция, такую как цитрат кальция, сульфат кальция, лактат кальция, хлорид кальция или любая их комбинация, и соль натрия, такую как хлорид натрия, цитрат натрия, сульфат натрия, лактат натрия или любая их комбинация, при этом пригодные для вдыхания сухие частицы содержат аморфную фазу, обогащенную солью кальция, и кристаллическую фазу соли натрия. Согласно конкретным аспектам аморфная фаза, обогащенная солью кальция, включает цитрат кальция и по меньшей мере некоторое количество хлорида кальция или сульфата кальция и по меньшей мере некоторое количество хлорида кальция. Согласно некоторым аспектам пригодные для вдыхания сухие частицы по изобретению содержат аморфную фазу, обогащенную солью кальция и кристаллическую фазу соли натрия и отношение аморфной фазы к кристаллической фазе (вес:вес) составляет от примерно 5:95 до примерно 95:5, от примерно 5:95 до примерно 10:90, от примерно 10:90 до примерно 20:80, от примерно 20:80 до примерно 30:70, от примерно 30:70 до примерно 40:60, от примерно 40:60 до примерно 50:50; от примерно 50:50 до примерно 60:40, от примерно 60:40 до примерно 70:30, от примерно 70:30 до примерно 80:20 или от примерно 90:10 до примерно 95:5. Согласно другим аспектам пригодные для вдыхания сухие частицы по изобретению содержат аморфную фазу, обогащенную солью кальция, и кристаллическую фазу соли натрия и отношение аморфной фазы к частице по весу (вес:вес) составляет от примерно 5:95 до примерно 95:5, от примерно 5:95 до примерно 10:90, от примерно 10:90 до примерно 20:80, от примерно 20:80 до примерно 30:70, от примерно 30:70 до примерно 40:60, от примерно 40:60 до примерно 50:50; от примерно 50:50 до примерно 60:40, от примерно 60:40 до примерно 70:30, от примерно 70:30 до примерно 80:20 или от примерно 90:10 до примерно 95:5. Согласно другим аспектам пригодные для вдыхания сухие частицы по изобретению содержат аморфную фазу, обогащенную солью кальция и кристаллическую фазу соли натрия и отношение аморфной фазы к частице по весу (вес:вес) составляет от примерно 5:95 до примерно 95:5, от примерно 5:95 до примерно 10:90, от примерно 10:90 до примерно 20:80, от примерно 20:80 до примерно 30:70, от примерно 30:70 до примерно 40:60, от примерно 40:60 до примерно 50:50; от примерно 50:50 до примерно 60:40, от примерно 60:40 до примерно 70:30, от примерно 70:30 до примерно 80:20 или от примерно 90:10 до примерно 95:5.
Предпочтительно, если пригодные для вдыхания сухие частицы имеют отношение 1/4 бар или 0, 5/4 бар равное 2 или менее, как описано в данной заявке, например, отношение 1/4 бар или 0, 5/4 бар равное 1,9 или менее, 1,8 или менее, 1,7 или менее, 1,6 или менее, 1,5 или менее, 1,4 или менее, 1,3 или менее, 1,2 или менее, 1,1 или менее или равное примерно 1,0. Альтернативно или в дополнение, пригодные для вдыхания сухие частицы имеют MMAD равный примерно 5 микрон или менее. Альтернативно или в дополнение, пригодные для вдыхания сухие частицы могут иметь величину VMGD между примерно 0,5 микрон и примерно 5 микронами или величину VMGD между примерно 5 мкм и примерно 20 мкм. Альтернативно или в дополнение пригодные для вдыхания сухие частицы могут иметь величину теплоты растворения, которая не больше, чем примерно - 10 ккал/моль (например, находится между -10 ккал/моль и 10 ккал/моль).
Как описано в данной заявке, пригодные для вдыхания сухие частицы могут также содержать эксципиент, такой как лейцин, мальтодекстрин или маннит. Эксципиент может быть кристаллическим или аморфным и может быть комбинацией этих форм. Согласно некоторым вариантам эксципиент является аморфным или преимущественно аморфным.
Как описано в данной заявке, спектры Рамана пригодных для вдыхания сухих порошков, которые содержат эксципиент (то есть, лейцин, мальтодекстрин) не имеют пиков, характерных для эксципиентов. Это показывает, что эксципиенты не концентрируются на поверхности частиц и что эксципиенты или равномерно распределены в частице, или не находятся на поверхности частицы. В частности, сообщалось, что эксципиент лейцин улучшает диспергируемость, когда концентрируется на поверхности частиц. См., например, заявку США №2003/0186894. Соответственно, получается, что лейцин в данном случае не действует как добавка, способствующая диспергируемости. Таким образом, в пригодных для вдыхания сухих частицах по изобретению, которые содержат эксципиент (например, лейцин), эксципиент может быть распределен внутри частицы, но не на поверхности частиц, или быть распределен в частице (например, распределен гомогенно). Например, согласно конкретным вариантам пригодная для вдыхания сухая частица по изобретению не дает характерный пик, свидетельствующий о наличии эксципиента (например, лейцина) при получении спектров Рамана. Согласно более конкретным вариантам сухой пригодный для вдыхания порошок, который содержит лейцин, не характеризуется характерным для лейцина пиком (например, при 1340 см-1 в спектрах Рамана.
Как описано в данной заявке, некоторые порошки по изобретению обладают плохой текучестью. Удивительным является то, что эти порошки тем не менее имеют высокую диспергируемость. Это удивительно, так как известно, что на текучесть и диспергируемость отрицательно влияют агломерация или агрегация частиц. Таким образом, оказалось неожиданным, что частицы, обладающие низкой текучестью, очень хорошо диспергируются.
В дополнение к любому из свойств и признаков в любой комбинации, описанных в данной заявке, пригодные для вдыхания сухие частицы могут иметь низкую текучесть, но все еще хорошую диспергируемость. Например, пригодные для вдыхания сухие частицы могут иметь отношение Хауснера более 1,35 (например, 1,4 или более, 1,5 или более, 1,6 или более, 1,7 или более, 1,8 или более, 1,9 или более, 2,0 или более) и также имеют отношение 1/4 бар или 0,5 бар, равное 2 или менее, 1,9 или менее, 1,8 или менее, 1,7 или менее, 1,6 или менее, 1,5 или менее, 1,4 или менее, 1,3 или менее, 1,2 или менее, 1,1 или менее или равное примерно 1.0.
В дополнение к любому из свойств и признаков в любой комбинации, описанных в данной заявке, пригодные для вдыхания сухие частицы могут иметь теплоту растворения, которая является не очень экзотермической. Предпочтительно, если теплота растворения определяется с применением ионной жидкости стимулированного легкого (например, как описано в Moss, O.R. 1979. Simulants of lung interstitial fluid. Health Phys. 36, 447-448; ли в Sun, G. 2001. Oxidative interactions of synthetic lung epithelial lining fluid with metal-containing particulate matter. Am. J. Physiol. Lung Cell Mol. Physiol. 281, L807 - L815) при pH 7,4 и при температуре 37°С в изотермическом калориметре. Например, пригодные для вдыхания сухие частицы могут иметь теплоту растворения, которая является менее экзотермической, чем теплота растворения дигидрата хлорида кальция, например, имеют эту величину, которая превышает - 10 ккал/ммоль, превышает - 9 ккал/ммоль, превышает - 8 ккал/ммоль, превышает - 7 ккал/ммоль, превышает - 6 ккал/ммоль, превышает - 5 ккал/ммоль, превышает - 4 ккал/ммоль, превышает - 3 ккал/ммоль, превышает -2 ккал/ммоль, превышает - 1 ккал/ммоль или составляет от примерно - 10 ккал/ммоль до примерно 10 ккал/ммоль.
Если это желательно, состав соли может включать один или более дополнительных агентов, таких как мукоактивные или муколитические агенты, поверхностно - активные вещества, антибиотики, противовирусные агенты, антигистаминные средства, подавители кашля, бронхорасширяющие средства, противовоспалительные агенты, стероиды, вакцины, адъюванты, отхаркивающие средства, макромолекулы, терапевтические средства, которые полезны для хронического поддержания CF.
Примеры подходящих мукоактивных или муколитических агентов включают муцины MUC5AC, MUC5B, ДНК - азу, N - ацетилцистеин (NAC), цистеин, нацистелин, альфа - дорназу, гелсолин, гепарин, гепаринсульфат, агонисты P2Y2 (например, UTP, INS365), гипертонический физиологический раствор и маннит.
Подходящие поверхностно - активные вещества включают дипальмитоил-L-альфа-фосфатидилхолин ("DPPC"), дифосфатидилглицерин (DPPG), 1,2-дипальмитоил-sn-глицеро-3-фосфо-L-серии (DPPS), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (DSPC), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), 1-пальмитоил - 2-олеоилфосфатидилхолин (РОРС), алифатические спирты, полиоксиэтилен - 9 - лауриловый эфир, поверхностно - активные жирные кислоты, триолеат сорбитана (Span 85), гликохолат, сурфактин, полоксамеры, сорбитановые эфиры жирных кислот, тилоксапол, фосфолипиды и алкилированные сахара.
Если это желательно, состав соли может включать антибиотик. Например, состав соли для лечения бактериальной пневмонии может также включать антибиотик, такой как макролид (например, азитромицин, кларитромицин и эритромицин), тетрациклин (например, доксициклин, тигециклин), фторхинолон (например, гемифлоксацин, левофлоксацин, ципрофлоксацин и моксифлоксацин), цефалоспорин (например, цефтриаксон, дефотаксим, цефтазидим, цефепим), пенициллин (например, амоксициллин, амоксициллин с клавуланатом, ампициллин, пиперациллин и тикарциллин), возможно вместе с бета - лактамазным ингибитором (например, сулбактамом, тазобактамом и клавулановой кислотой), например, комбинацию ампициллин - сулбактам, пиперациллин - тазобактам и тикарциллин - клавуланат, аминогликозид (например, амикацин, арбекацин, гентамицин, канамицин, неомицин, нетиомицин, парамомицин, родострептимицин, стрептомицин, тобрамицин и меропенем), монобактам (например, азтреонам), оксазолидинон (например, линезолид), ванкомицин, гликопептидные антибиотики (например, телованцин), антибиотики для лечения микобактериального туберкулеза и т.п.
Если это желательно, состав соли может содержать агент для лечения микобактериальных инфекций, таких как Mycobacterium tuberculosis. Подходящие агенты для лечения микобактериальных инфекций (например, М. tuberculosis), включают аминогликозид (например, капреомицин, канамицин и стрептомицин), фторхинолон (например, левофлоксацин, ципрофлоксацин и моксифлоксацин), изозианид и аналоги изозианида (например, этионамид), аминосалицилат, циклосерин, диарилхинолин, этамбутол, пиразинимид, протионамид, рифампин и т.п.
Если это желательно, состав соли может содержать подходящий противовирусный агент, такой как оселтамивир, занамивир, амантидин или римантадин, рибавирин, ганцикловир, валганцикловир, фоскавир, Cytogam® (иммуноглобулин против цитомегаловируса), плеконарил, рупинтривир, паливизумаб, мотавизумаб, цитарабин, докозанол, денотивир, цидофовир и ацикловир. Состав соли может включать подходящий противовирусный агент, такой как занамивир, оселтамивир, амантадин или римантадин.
Подходящие антигистаминные средства включают клемастин, асаластин, лоратидин, фексофенадин и т.п.
Подходящие подавители кашля включают бензонатат, бенпроперин, клобутинал, дифенгидрамин, декстрометорфан, дибунат, федрилат, глауцин, оксаламин, пиперидион, опиоиды такие как кодеин и т.п..
Подходящие бронхорасширяющие средства включают быстродействующие бета2-агонисты, бета2-агонисты длительного действия (LABA), мускариновые агонисты длительного действия (LAMA), комбинации LABAs и LAMAs, метилксантины и т.п. Подходящие быстродействующие бета2-агонисты включают альбутерол, эпинефрин, пирбутерол, левалбутерол, метапротеронол, максаир и т.п. Подходящие LABAs включают салметерол, формотерол и его изомеры (например, арформотерол), кленбутерол, тулобутерол, вилантерол (Revolair™), индакатерол и т.п. Примеры LAMAs включают тиотропий, гликопирролат, аклидиний, ипратропий и т.п. Примеры комбинаций LABAs и LAMAs включают индакатерол с гликопирролатом, индакатерол с тиотропием и т.п. Примеры метилксантинов включают теофиллин и т.п.
Подходящие противовоспалительные агенты включают ингибиторы лейкотриена, ингибиторы PDE4, другие противовоспалительные агенты и т.п. Подходящие ингибиторы лейкотриена включают монтелукаст (ингибиторы цистиниловых лейкотриенов), масилукаст, зафирлейкаст (ингибиторы рецепторов лейкотриена D4 и Е4), зилеутон (ингибиторы 5-липоксигеназы) и т.п. Подходящие ингибиторы PDE4 включают циломиласт, пофлумиласт и т.п. Другие противовоспалительные агенты включают омализумаб (иммуноглобулин против IgE), ингибиторы рецепторов IL - 13 и IL - 13 (такие как AMG - 317, MILR1444A, CAT - 354, QAX576, IMA - 638, анрукинзумаб, IMA - 026, МК - 6105,DOM - 0910 и т.п.), ингибиторы рецепторов IL - 4 и IL - 4 (такие как Pitrakinra, AER - 003,AIR - 645, APG - 201, DOM - 0919 и т.п.), ингибиторы IL - 1, такие как канакинумаб, антагонисты рецепторов CRTh2, такие как AZD1981 (AstraZeneca), ингибитор нейтрофил - эластазы, такой как AZD 9668 (AstraZeneca), ингибитор киназы Р38, такой как лосмапимед и т.п.
Подходящие стероиды включают кортикостероиды, комбинации кортикостероидов и LABAs, комбинации кортикостероидов и LAMAs и т.п. Подходящие кортикостероиды включают будесонид, флутиказон, флунизолид, триамцинолон, беклометазон, мометазон, циклесонид, дексаметазон и т.п. Комбинации кортикостероидов и LABAs включают салметерол с флутиказоном, формотерол с будесонидом, формотерол с флутиказоном, формотерол с мометазоном, индакатерол с мометазоном и т.п.
Подходящие отхаркивающие средства включают гвайфенесин, гвайаколкулфонат, хлорид аммония, йодид калия, тилоксапол, пентасульфид сурьмы и т.п.
Подходящие вакцины включают вакцины против гриппа, которые вводят путем ингаляции через нос и т.п.
Подходящие макромолекулы включают белки и большие пептиды, полисахариды и олигосахариды и молекулы ДНК и РНК и их аналогов, обладающих терапевтическими, профилактическими и диагностическими свойствами. Белки могут включать антитела, такие как моноклональные тела. Молекулы нуклеиновых кислот включают гены, антисмысловые молекулы, такие как SiRNAs (малые интерферирующие РНК), которые связываются с комплементарными ДНК, РНК или рибосомами для ингибирования транскрипции или трансляции.
Для системного применения выбираются следующие макромолекулярные лекарства: кальцитонин, эритропоетин (ЕРО), Фактор IX, стимулирующий фактор колонии гранулоцитов (G-CSF), стимулирующий фактор колонии гранулоцитных макрофагов (GM-CSF), гормон роста, инсулин, альфа-интерферон, бета-интерферон, гамма - интерферон, лютеин - высвобождающий гормон (LHRH), FSH, ресничный нейротрофический фактор, фактор, высвобождающий гормон роста (GRF), инсулиноподобный фактор роста, инсулинотропин, антагонист рецептора интерлейкина - 1, интерлейкин - 3, интерлейкин - 4, интерлейкин - 6, стимулирующий фактор колонии макрофагов (М - CSF), тимозин - альфа1, ингибитор IIb/IIIа, антитрипсин - альфа - 1, антитело против RSV, паливизумаб, мотавизумаб и ALN - RSV, ген трансмембранного регулятора муковисцидоза (CFTR), дезоксирибонуклеаза (Дназу), гепарин, бактерицидный белок, увеличивающий проницаемость (BPI), антитело против цитомегаловируса (CMV), антагонист рецептора интерлейкина - 1 и т.п.
Терапевтические средства, которые пригодны при хроническом кистозном фиброзе (CF), включают антибиотики/макролидные антибиотики, бронхорасширяющие средства, LAB As для ингаляции и агенты для промотирования секреции из дыхательных путей.
Подходящие примеры антибиотиков/макролидных антибиотиков включают тобрамицин, азитромицин, ципрофлоксацин, колистин и т.п. Подходящие примеры бронхорасширяющих средств включают быстродействующие бета2-агонисты для ингаляции, такие как албутерол и т.п. Подходящие примеры LABAs для ингаляции включают салметерол, формотерол и т.п. Подходящие примеры агентов для промотирования секреции из дыхательных путей включают дорназу - альфа, гипертонический физиологический раствор и т.п.
Обычно предпочитают, чтобы пригодные для вдыхания частицы и сухие порошки не содержали солей, эксципиентов или других активных ингредиентов, которые имеют молекулярный вес более примерно 1 килодальтон (1000 дальтон, Da). Например, пригодные для вдыхания частицы по изобретению предпочтительно не содержат белка, полипептида, олигопептидов, нуклеиновой кислоты или олигонуклеотида с молекулярным весом более 1 КДа, более примерно 900 Да, более примерно 800 Да, более примерно 700 Да или более примерно 600 Да.
Так как пригодные для вдыхания сухие частицы и пригодные для вдыхания сухие порошки, описанные в данной заявке, содержат соли, они могут быть гигроскопичными. Соответственно, желательно, чтобы пригодные для вдыхания сухие частицы и пригодные для вдыхания сухие порошки хранились или выдерживались при условиях, предотвращающих гидратацию порошков и частиц. Например, желательно, чтобы предотвратить гидратацию, относительная влажность среды, при которой осуществляется хранение, была менее 75%, менее 60%, менее 50%, менее 40%, менее 30%, менее 25%, менее 20%, менее 15%, менее 10% или менее 5%. Пригодные для вдыхания сухие частицы и пригодные для вдыхания сухие порошки в этих условиях могут быть упакованы (например, в герметичные капсулы, блистеры или флаконы).
Данное изобретение относится также к пригодным для вдыхания сухим порошкам или к пригодным для вдыхания сухим частицам, полученным путем приготовления исходного раствора, эмульсии или суспензии и сушки исходного состава при распылении в соответствии с методами, описанными в данной заявке. Исходный состав может быть приготовлен с применением (а) соли кальция, которая представляет собой такую соль, как лактат кальция или хлорид кальция, в количестве равном по меньшей мере примерно 25% по весу (например в расчете на общее количество растворенных веществ, использованных для приготовления исходного состава) и (б) соли натрия, такой как цитрат натрия, хлорид натрия или сульфат натрия, в количестве равном по меньшей мере примерно 1% по весу (например, в расчете на общее количество растворенных веществ, использованных для приготовления исходного состава). Если это желательно, в исходный состав может быть добавлен эксципиент, такой как лейцин, в количестве, составляющем по меньшей мере примерно 74% или менее по весу (например, в расчете на общее количество растворенных веществ, использованных для приготовления исходного состава. Например, соль кальция, использованная для приготовления исходного состава, может быть в количестве равном по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60% или по меньшей мере примерно 70% от веса всех растворенных веществ, использованных для приготовления исходного состава. Соль натрия, использованная для приготовления исходного состава, может быть в количестве равном по меньшей мере примерно 2%, по меньшей мере примерно 3%, по меньшей мере примерно 4%, по меньшей мере примерно 5%, по меньшей мере примерно 6%, по меньшей мере примерно 7%, по меньшей мере примерно 8%, по меньшей мере примерно 9%, по меньшей мере примерно 10%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 55% или по меньшей мере примерно 65% от веса всех растворенных веществ, использованных для приготовления исходного состава. Эксципиент, добавленный к исходному составу, может быть в количестве равном, например, примерно 50% или менее, примерно 30% или менее, примерно 20% или менее, примерно 10% или менее, примерно 9% или менее, примерно 8% или менее, примерно 7% или менее, примерно 6% или менее, примерно 5% или менее, примерно 4% или менее, примерно 3% или менее, примерно 2% или менее, примерно 1% или менее от веса всех растворенных веществ, использованных для приготовления исходного состава.
Согласно одному из аспектов пригодные для вдыхания сухие порошки или пригодные для вдыхания сухие частицы по изобретению могут быть получены путем (1) приготовления исходного состава, содержащего (а) сухие вещества, включающие примерно 10,0% лейцина в расчете на все растворенные вещества, использованные для приготовления исходного состава, примерно 35,1% хлорида кальция и примерно 54,9% цитрата натрия и (б) один или более подходящих растворителей для растворения веществ и образования исходного раствора и (2) сушки исходного состава при распылении. Согласно другому варианту пригодные для вдыхания сухие порошки или сухие частицы по изобретению могут быть получены путем (1) приготовления исходного состава, содержащего (а) сухие вещества, включающие примерно 10,0% лейцина в расчете на все растворенные вещества, использованные для приготовления исходного состава, примерно 58,6% лактата кальция и примерно 31,4% хлорида натрия и (б) один или более подходящих растворителей для растворения веществ и образования исходного раствора и (2) сушки исходного состава при распылении. Согласно еще одному варианту пригодные для вдыхания сухие порошки или сухие частицы по изобретению могут быть получены путем (1) приготовления исходного состава, содержащего (а) сухие вещества, включающие примерно 10,0% лейцина в расчете на все растворенные вещества, использованные для приготовления исходного состава, примерно 39,6% хлорида кальция и примерно 50,44% сульфата натрия и (б) один или более подходящих растворителей для растворения веществ и образования исходного раствора и (2) сушки исходного состава при распылении. Согласно еще одному варианту пригодные для вдыхания сухие порошки или сухие частицы по изобретению могут быть получены путем (1) приготовления исходного состава, содержащего (а) сухие вещества, включающие примерно 10,0% мальтодекстрина в расчете на все растворенные вещества, использованные для приготовления исходного состава, примерно 58,6% лактата кальция и примерно 31,4% сульфата натрия и (б) один или более подходящих растворителей для растворения веществ и образования исходного раствора и (2) сушки исходного состава при распылении. Как описано в данной заявке, из уровня техники известны различные методы смешения растворяемых веществ и растворителей (например, статическое смешение, смешение в массе) для приготовления исходных составов. Если это желательно, могут быть применены другие методы смешения. Например, в исходный состав могут быть включены дополнительные компоненты, которые вызывают или облегчают смешение. Например, двуокись углерода вызывает вспенивание или выделение пузырьков и, таким образом, способствует физическому смешению указанных веществ и растворителей. Различные карбонатные или бикарбонатные соли приводят к появлению того же эффекта, что и двуокись углерода и, следовательно, могут быть использованы для приготовления исходных составов по изобретению.
Согласно предпочтительным вариантам данного изобретения пригодные для вдыхания сухие порошки или сухие частицы в аэрозоле имеют характеристики, которые приводят к эффективной доставке сухих частиц в респираторную систему без применения пропеллентов.
Согласно одному из вариантов природные для вдыхания сухие порошки или пригодные для вдыхания сухие частицы по изобретению могут быть получены по реакции ионного обмена. Согласно некоторым вариантам данного изобретения два насыщенных или пересыщенных раствора подают в статический миксер для того, чтобы получить насыщенный или пересыщенный раствор после смешения в статических условиях. Предпочтительно, если после смешения раствор является пересыщенным. Оба раствора могут быть водными или органическими, но предпочтительно, если они являются практически водными. Раствор после статического смешения подается в атомизирующий элемент распылительной сушилки. Согласно предпочтительному аспекту изобретения раствор после статического смешения немедленно подается в атомизирующее устройство. Некоторые примеры атомизирующего устройства включают пневмораспылители, роторный атомизатор или нагнетательное сопло. Предпочтительно, атомизирующее устройство представляет собой пневмораспылитель. Согласно одному из вариантов пневмораспылитель является соплом внутреннего смешения, что означает, что газ воздействует на подаваемую жидкость до выхода через самое наружное отверстие. Согласно другому варианту пневмораспылитель представляет собой сопло наружного смешения, это означает, что газ воздействует на жидкость после выхода через самое наружное отверстие.
Сухие частицы по изобретению могут быть смешаны с активным ингредиентом или введены в состав с активным ингредиентом для поддержания характерной высокой диспергируемости сухих частиц и сухих порошков по изобретению.
Согласно одному из аспектов соли двухвалентных катионов (например, кальция, магния) могут быть введены в состав с активным агентом, не являющимся кальцием, для получения мелкодисперсных, хорошо диспергирующихся порошков или больших пористых частиц. Эти частицы могут включать соль одновалентного катиона (например, натрия, калия) и могут содержать эксципиенты (например, лейцин, мальтодекстрин, маннит, лактозу). Эти компоненты могут быть смешаны (например, смешаны в виде одного раствора, смешаны в статических условиях в виде двух растворов) с получением одной частицы перед сушкой при распылении.
Согласно другому аспекту сухие частицы по изобретению являются крупными, пористыми и диспергируемыми. Размер сухих частиц может быть выражен различным образом. Частицы могут иметь VMAD от 5 до 30 мкм или от 5 до 20 мкм с насыпным весом после утряски менее 0,5 г/см, предпочтительно менее 0,4 г/см.
Способы получения сухих частиц и сухих порошков
Пригодные для вдыхания сухие частицы и сухие порошки могут быть получены любым подходящим способом. Многие подходящие способы получения пригодных для вдыхания сухих порошков и частиц являются общеизвестными из уровня техники и включают испарение растворителя из одинарной и двойной эмульсии, сушку при распылении, измельчении (например, струйное измельчение), смешение, экстракцию растворителя, выпаривание растворителя, разделение фаз, простую и сложную коацервацию, межфазную поликонденсацию, методы, которые включают применение сверхкритической двуокиси углерода (СО2) и другие подходящие методы. Пригодные для вдыхания сухие частицы могут быть получены с применением методов, используемых для получения микросфер или микрокапсул, известных из уровня техники. Эти методы могут быть применены при условиях, которые приводят к образованию пригодных для вдыхания сухих частиц с желательными аэродинамическими свойствами (например, аэродинамическим диаметром и геометрическим диаметром). Если это желательно, пригодные для вдыхания сухие частицы с нужными свойствами, такими как размер и плотность, могут быть отобраны подходящими методами, например, путем рассева.
Пригодные для вдыхания сухие частицы сушат, предпочтительно, при распылении. Приемлемые способы сушки при распылении описаны, например, в К. Masters "Spray Drying Handbook", John Wiley & Sons, New York (1984). Обычно в процессе сушки при распылении теплота горячего газа, такого как нагретый воздух или азот, используется для испарения растворителя из капель, образовавшихся при атомизации непрерывного потока жидкости. Если это желательно, сушка при распылении или другие методы, например, метод струйного измельчения, используемые для получения сухих частиц могут включать применения встроенного сортировального устройства, сортирующего частицы по геометрическим размерам, которое определяет геометрический диаметр полученных пригодных для вдыхания сухих частиц, и/или встроенного сортировального устройства, сортирующего частицы по аэродинамическому параметру, которое определяет аэродинамический диаметр полученных пригодных для вдыхания сухих частиц.
Для проведения сушки при распылении эмульсии или суспензии, которые содержат компоненты сухих частиц, получаемых в подходящем растворителе (например, водном растворителе, органическом растворителе, смеси воды с органическим растворителем или в эмульсии), распределяются в устройстве для сушки при помощи атомизирующего устройства. Например, для распределения раствора или суспензии в сушилке можно применять распылительную форсунку или центробежный распылитель. Например, можно использовать центробежный распылитель (пневмораспылитель), содержащий колесо с 4 или 24 лопастями. Примеры подходящих распылительных сушилок, которые могут быть снабжены или центробежным распылителем или форсункой, включают Mobile Minor Spray Dryer или Model PSD-1, которые производит копания NIRO, Inc. (Denmark). Условия сушки при распылении будут зависеть, частично, от состава раствора, подвергаемого сушке, или суспензии, подвергаемой сушке, и скорости потока. Обычно специалист способен определить соответствующие условия на основании состава раствора, эмульсии или суспензии, которые должны быть подвергнуты сушке при распылении, желаемых свойств частиц и других факторов. В общем, температура на входе в распылительную сушилку составляет от примерно 100°С до примерно 300°С и, предпочтительно, от примерно 220°С до примерно 285°С. Температура на выходе из сушилки зависит от таких факторов, как температура подаваемого состава и свойств материалов, подвергаемых сушке. В общем, температура на выходе из сушилки составляет от примерно 50°С до примерно 150°С, предпочтительно от примерно 90°С до примерно 120°С или от примерно 98°С до примерно 108°С. Если это желательно, пригодные для вдыхания сухие частицы, получаемые по этому способу, могут быть подвергнуты фракционированию по объемному размеру, например, с применением сита, или по аэродинамическому размеру, например, с применением циклона и/или затем разделены по плотности с использованием известных специалистам методов.
При приготовлении пригодных для вдыхания сухих частиц по изобретению обычно готовят раствор, эмульсии или суспензию, которые содержат желаемые компоненты сухого порошка (то есть исходного состава), и сушат их при распылении в подходящих условиях. Предпочтительно, концентрация растворенных или суспендированных веществ в исходном растворе равна по меньшей мере примерно 1 г/л, по меньшей мере примерно 2 г/л, по меньшей мере примерно 5 г/л, по меньшей мере примерно 10 г/л, по меньшей мере примерно 15 г/л, по меньшей мере примерно 20 г/л, по меньшей мере примерно 30 г/л, по меньшей мере примерно 40 г/л, по меньшей мере примерно 50 г/л, по меньшей мере примерно 60 г/л, по меньшей мере примерно 70 г/л, по меньшей мере примерно 80 г/л, по меньшей мере примерно 90 г/л или по меньшей мере примерно 100 г/л. Можно получать исходный состав может быть приготовлен из одного раствора или суспензии, полученных путем растворения или суспендирования подходящих компонентов (например, солей, эксципиентов, других активных компонентов) в подходящем растворителе. Раствор, эмульсия или суспензия могут быть получены любым подходящим способом, таким как смешение в массе сухих и/или жидких компонентов или статическое смешение жидких компонентов с образованием их комбинации. Например, гидрофильный компонент (например, водный раствор) и гидрофобный компонент (например, раствор в органическом растворителе) могут быть соединены с образованием их комбинации в статическом смесителе. Затем комбинацию можно атомизировать (распылить) с получением капель, которые подвергают сушке с образованием сухих частиц. Предпочтительно осуществлять стадию атомизации сразу же после соединения компонентов в статическом смесителе.
В одном примере пригодные для вдыхания сухие частицы, которые содержат цитрат кальция, хлорид натрия и лейцин, получают путем сушки при распылении. Готовят первую фазу, которая включает водный раствор цитрата натрия и лейцин. Получают также вторую фазу, которая содержит хлорид кальция в подходящем растворителе. Один раствор или оба раствора могут быть в отдельности нагреты, если необходимо, для обеспечения растворимости их компонентов. Затем первую и вторую фазу соединяют в статическом смесителе с образованием их комбинации. Эту комбинацию подвергают сушке для получения пригодных для вдыхания сухих частиц.
Исходный состав или компоненты исходного состава могут быть получены с применением любого подходящего растворителя, такого как органический растворитель, водный растворитель или их смеси. Подходящие органические растворители, которые могут быть применены, включают, но без ограничения, спирты, такие как, например, этанол, метанол, пропанол, изопропанол, бутанол и др. Другие органические растворители включают, но без ограничения, перфторуглеводороды, дихлорметан, хлороформ, простой эфир, этилацетат, метилтрет.бутиловый эфир и другие. Сорастворители, которые могут быть использованы, но без ограничения, водный растворитель и органический растворитель, такой как, без ограничения, органические растворители, как описано выше. Водные растворители включают воду и буферные растворы.
Исходный раствор или его компоненты могут иметь любую желаемую величину pH, вязкость или другие свойства. Если это желательно, буфер может быть добавлен к растворителю или сорастворителю или к полученной их смеси. Обычно величина pH смеси колеблется от примерно 3 до примерно 8.
Пригодные для вдыхания сухие частицы и сухие порошки могут быть получены и затем выделены, например, путем фильтрования или центрифугирования при помощи циклона с получением партии частиц с заданным распределением по размерам. Например, более примерно 30%, более примерно 40%, более примерно 50%, более примерно 60%, более примерно 70%, более примерно 80% или более примерно 90% от веса пригодных для вдыхания сухих частиц в партии могут иметь величину диаметра в выбранном интервале. Этот выбранный интервал, в котором может находиться некоторое количество пригодных для вдыхания сухих частиц, может быть, например, любым из интервалов размеров, описанных в данной заявке, таким как между примерно 0,1 мкм до примерно 3 мкм VMGD.
Диаметр пригодных для вдыхания сухих частиц, например, их VMGD, может быть измерен с применением прибора, чувствительного к электрической зоне, такого как Multisizer Не (Coulter Electronic, Luton, Beds, England) ли прибора с лазерной дифракцией, такого как система HELOS (Sympatec, Princeton, NJ). Другие приборы для измерения геометрического размера частиц хорошо известны из уровня техники. Диаметр пригодных для вдыхания сухих частиц в образце, может колебаться в зависимости от таких факторов, как состав частиц и методы их получения. Распределение пригодных для вдыхания сухих частиц по размерам в образце может быть выбрано таким, чтобы обеспечить оптимальное осаждение в целевых сайтах дыхательной системы.
Экспериментально, аэродинамический диаметр может быть определен с использованием величины времени свободного пролета частиц (TOF). Например, для измерения аэродинамического диаметра можно применять такой прибор, как Model 3225 Aerosizer DSP Particle Size Analyzer (Amherst Process Instrument, Inc, Amherst, MA). При помощи Aerosizer измеряют время, необходимое для прохождения отдельных пригодных для вдыхания сухих частиц между двумя фиксированными лазерными лучами.
Аэродинамический диаметр может быть также определен экспериментально с непосредственным применением обычных гравитационных методов осаждения, когда измеряется время, требуемое для осаждения на некотором расстоянии образца пригодных для вдыхания сухих частиц. Косвенные методы измерения массового медианного аэродинамического диаметра включают применение импактора Andersen Cascade Impactor и многостадийного поглотительного прибора для жидкостей (MSLI). Методы и приборы для измерения аэродинамического диаметра частиц хорошо известны из уровня техники.
Насыпной вес после утряски представляет собой меру плотности оболочки, характеризующей частиц. Плотность оболочки частицы статистически изотропной формы определяется как величина массы частицы, деленной на минимальный объем сферической оболочки, внутри которой она может быть заключена. Признаки, которые определяют низкий насыпной вес утряски, включают нерегулярную текстуру поверхности и пористую структуру. Насыпной вес утряски может быть измерен с применением приборов, известных специалисту, таких как Dual Platform Tester (Vankel, NC), прибор GeoPyc™ (Micrometrics Instrument Corp., Norcross, GA), или SOTAX Tap Density Tester model TD2 (SOTAX Corp., Horsham, PA). Насыпной вес утряски можно определить методом USP Bulk Density и Tapped Density, United States Pharmacopia convention, Rockville, MD, 10th Supplement, 4950-4951, 1999.
Фракцию мелких частиц можно использовать для характеристики поведения аэрозоля диспергированного порошка. Фракция мелких частиц описывает распределение частиц, содержащихся в воздухе и пригодных для вдыхания, по размерам. Гравиметрический анализ, использующий каскадный импактор, является одним из методов измерения распределения частиц по размерам или величины фракции мелких частиц или содержащихся в воздухе и пригодных для вдыхания, по размерам. Гравиметрический анализ, использующий каскадный импактор, является одним из методов измерения распределения частиц по размерам или величины фракции мелких частиц или содержащихся в воздухе пригодных для вдыхания сухих частиц. Каскадный импактор фирмы Андерсен (АО) является восьмистадийным импактором, который может разделять аэрозоли на девять отличающихся друг от друга фракций на основании аэродинамического размера. Количество граничных частиц на каждой стадии зависит от величины скорости потока, которая наблюдается при работе ACI. В ACI имеется несколько стадий, на которых функционирует ряд форсунок (а именно, пластинчатых сопел), и поверхность импакции (то есть импакционный диск). На каждой стадии поток аэрозоля проходит через форсунки и сталкивается с указанной поверхностью. Пригодные для вдыхания сухие частицы в потоке аэрозоля с достаточно большой инертностью будут сталкиваться с пластиной. Более мелкие пригодные для вдыхания сухие частицы, которые не обладают достаточной инертностью, чтобы сталкиваться с пластиной, будут оставаться в потоке аэрозоля и уноситься на следующую стадию. Каждая последующая стадия ACI характеризуется более высокой скоростью аэрозоля в форсунках, поэтому более мелкие пригодные для вдыхания сухие частицы могут быть собраны на каждой последующей стадии.
Если это желательно, для определения количества фракции мелких частиц может быть также применен коллапсный двухстадийный ACI. Двухстадийный коллапсный ACI состоит только из верхних двух стадий восьмистадийного ACI и позволяет собирать две отдельные фракции порошка. Конкретно, двухстадийный коллапсный ACI калибруется таким образом, чтобы фракция порошка, которая собирается на первой стадии, состояла из пригодных для вдыхания сухих частиц, которые имеют величину аэродинамического диаметра менее 5,6 мкм и более 3,4 мкм. Фракция порошка, прошедшего первую стадию и осадившегося на фильтре, состоит, таким образом из пригодных для вдыхания сухих частиц, имеющих величину аэродинамического диаметра менее 3,4 мкм. Скорость потока воздуха при таком калибровании составляет примерно 60 л/мин.
Как было показано FPF (размер менее 5,6 мкм) коррелирует с фракцией порошка, которая способна попадать в легкие пациента, в то время как FPF (размер менее 3,4 мкм) коррелирует с фракцией порошка, которая достигает нижнюю область легких пациента. Эти корреляции представляют собой количественный индикатор, который может быть применен для оптимизации размера частиц.
ACI можно использовать для примерного определения выделившейся дозы, которая в данной заявке называется гравиметрической выделившейся дозой и аналитической выделившейся дозой. "Гравиметрическая выделившаяся доза" определяется как величина отношения количества порошка, взвешенного на фильтрах всех стадий ACI к номинальной дозе. "Аналитическая выделившаяся доза" определяется как величина отношения количества порошка, выделившегося при промывке на всех стадиях, всех фильтров и места ввода в ACI, к номинальной дозе. FPF_TD (<5,0) представляет собой отношение интерполированного количества порошка с частицами размером менее 5,0 мкм, осажденного в ACI, к номинальной дозе. FPF_RD (<5,0) является отношением интерполированного количества порошка с частицами размером менее 5,0 мкм, осадившегося в ACI, или к гравиметрической выделившейся дозе, или к аналитической выделившейся дозе.
Другой метод определения примерной выделившейся дозы состоит в определении количества порошка, покинувшего свой контейнер, например, капсулу или блистер, при запуске ингалятора для сухих порошков (DPI). Этот метод учитывает количество порошка, выделившегося из капсулы, но не принимает во внимание любое количество порошка, осадившегося на поверхности DPI. Выделившаяся доза представляет собой отношение веса капсулы с дозой порошка до запуска ингалятора к весу капсулы после запуска ингалятора. Эта величина может быть также названа выделившейся из капсулы массой порошка (СЕРМ).
Многостадийный жидкостной импинджер (MSLI) представляет собой другое устройство, которое можно применять для измерения количества фракции мелких частиц. Многостадийный жидкостной импинджер работает по тому же принципу, что и ACI, хотя вместо 8 стадий он имеет пять. Кроме того, каждая стадия MSLI состоит из увлажненной этанолом стеклянной фритты вместо твердой пластины. Эта стадия используется для предотвращения отскакивания и вторичного уноса частиц, которые происходят при применении ACI.
Данное изобретение относится также к способу получения пригодного для вдыхания сухого порошка, включающего пригодные для вдыхания сухие частицы, которые содержат цитрат кальция или сульфат кальция. Способ включает а) обеспечение получения первого исходного жидкого состава, включающего водный раствор кальция хлорида, и второго исходного жидкого состава, содержащего водный раствор сульфата натрия или цитрата натрия; б) смешение исходного первого жидкого состава и исходного второго жидкого состава с получением смеси, в которой происходит реакция анионного обмена с образованием насыщенного или пересыщенного раствора, содержащего сульфат кальция и хлорид натрия или цитрат кальция и хлорид натрия; и в) сушку при распылении насыщенного или пересыщенного раствора, полученного на стадии б) с получением пригодных для вдыхания сухих частиц. Исходные жидкие первый и второй растворы могут быть смешаны в одной емкости или, предпочтительно, в статическом смесителе. Согласно некоторым вариантам полученную смесь сушат при распылении и атомизируют в течение 60 мин, в течение 30 мин, в течение 15 мин, в течение 10 мин, в течение 5 мин, в течение 4 мин, в течение 3 мин, в течение 2 мин, в течение 1 мин, в течение 45 с, в течение 30 с, в течение 15 с смешения, предпочтительно, в статических условиях.
Настоящее изобретение относится также к пригодному для вдыхания сухому порошку или к пригодным для вдыхания сухим частицам, полученным любым из описанных в данной заявке методом.
Пригодные для вдыхания сухие частицы по изобретению могут быть также охарактеризованы величиной химической стабильности солей или эксципиентов, которые содержат пригодные для вдыхания сухие частицы. Химическая стабильность солей может влиять на важные характеристики природных для вдыхания частиц, включая предельный срок хранения, подходящие условия для хранения, подходящую среду для введения, биологическую совместимость и эффективность этих солей. Химическая стабильность может быть оценена методами, хорошо известными в уровне техники. Одним примером таких методов оценки химической стабильности является высокоэффективная жидкостная хроматография с обращенными фазами (RP-ВЭЖХ). Пригодные для вдыхания сухие частицы по изобретению включают соли, которые обычно стабильны в течение длительного времени.
Если желательно, пригодные для вдыхания сухие частицы и сухие порошки по изобретению могут быть обработаны далее с целью повышения стабильности. Важной характеристикой фармацевтических сухих порошков является их стабильность при различных температурах и влажности. Нестабильные порошки будут абсорбировать влагу из окружающей среды и агломерировать, при этом меняется распределение частиц порошка по размерам.
Для получения более стабильных частиц и порошков можно использовать эксципиенты, такие как мальтодекстрин. Мальтодекстрин может действовать как стабилизатор аморфной фазы и ингибировать компоненты состава от превращения из аморфного состояния в кристаллическое. Или же, альтернативно, можно применять последующую стадию обработки полученных частиц, чтобы способствовать процессу кристаллизации частиц контролируемым образом, и полученный порошок может быть далее обработан для восстановления диспергируемости частиц, если во время кристаллизации произойдет их агломерация, например, путем пропускания частиц через циклон для разрушения агломератов. Другой возможный подход состоит в оптимизации условий проведения процесса, что приведет к получению частиц с большей степенью кристалличности и, следовательно, с более высокой стабильностью. Еще один подход заключается в использовании различных эксципиентов или разных количеств используемых в этом составе эксципиентов с целью получения более стабильных форм солей.
Пригодные для вдыхания сухие частицы и сухие порошки, описанные в данной заявке, пригодны для ингаляционной терапии. Пригодные для вдыхания сухие частицы можно получать из соответствующих веществ, с поверхностной твердостью, подходящими величинами диаметра и насыпного веса утряски для локализованной доставки в выбранные участки дыхательной системы, такие как нижняя часть легких или верхние или центральные дыхательные пути. Например, пригодные для вдыхания сухие частицы большего размера или с более высокой плотностью можно использовать для доставки в верхние дыхательные пути или же смесь пригодных для вдыхания частиц разного размера в образце при условии наличия одного и того же или различного состава может вводиться в различные участки легкого при одном введении.
Для того, чтобы соотнести поведение дисперсии порошка с различными объемами вдоха, скоростями потока в процессе ингаляции из ингаляторов с различным сопротивлением, можно рассчитать энергию, требующуюся для осуществления ингаляции. Энергия воздушной струи при вдохе может быть определена по уравнению Е=R2Q2V, где Е обозначает энергию ингаляции в Дж, R обозначает сопротивление ингалятора в кПа1/2/LPM, Q обозначает устойчивую скорость потока в л/мин и V обозначает объем вдыхаемого воздуха в л.
Считается, что популяция здоровых взрослых людей способна достичь величины энергии воздушной струи в пределах от 2,9 до 22 Дж с использованием пиковых величин скорости потока при вдохе (PIFR), измеренных Clarke et al. (Journal of Aerosol Med, 6(2), p.99-110, 1993) для скорости потока Q при двух значениях сопротивления ингалятора, равных 0,02 и 0,055 кПа1/2/LРМ, объеме вдоха 2 л, что описано в двух инструкциях FDA по применению порошковых ингаляторов и в работе Tiddens et al. (Journal of Aerosol Med, 19, 4 (4), p.456-465, 2006), которые выявили взрослых, которые вдыхали объем равный в среднем 2,2 л при использовании различных DPIs.
Пациенты со слабым, умеренным или сильным COPD способны достигать энергии воздушной струи от 5,1 до 21 Дж, от 5,2 до 19 Дж и от 2,3 до 18 Дж, соответственно. Эти цифры опять-таки основаны на измерении величин PIRF для скорости потока Q в уравнении для определения энергии воздушной струи. PIFR, достигаемая каждой группой, является функцией. Работа Breeders et al. (Eur. Respir. J., 18, p.780-783,2001) была использована для предсказания максимальной и минимальной PIFR при применении двух порошковых ингаляторов с сопротивлением 0,021 и 0,032 кПа1/2/LРМ.
Точно также ожидается, что взрослые пациенты, больные астмой, способны развивать энергию при вдохе от 7,4 до 21 Дж, при этом исходят из тех же предположений, что и в случае больных COPD и с учетом величин PIFR по Breeders et al.
Здоровые взрослые пациенты, пациенты, больные COPD и пациенты с астмой способны, например, иметь достаточную энергию ингаляции для вдоха и диспергирования сухих порошков по изобретению. Например, было установлено, что в случае дозы в 25 мг состава III требуется только 0,16 Дж для опорожнения 80% от загрузки деагломерированных частиц в контейнере за один вдох, что показывает величина Dv50 равная 1 мкм при более высокой энергии ингаляции. Все популяции взрослых пациентов, перечисленные выше, как было рассчитано, способны достичь величины энергии, превышающей более, чем на 2 Дж значение энергии ингаляции, требующейся при вдохе.
Преимуществом данного изобретения является получение порошков, которые хорошо диспергируются в широком интервале скоростей потока и относительно не зависимы от скорости потока. Сухие частицы и порошки по изобретению дают возможность использовать простые пассивные DPI для широкого круга пациентов.
Способы
Пригодные для вдыхания сухие порошки и пригодные для вдыхания сухие частицы по изобретению, предназначены для введения в дыхательные пути. Сухие порошки и сухие частицы по изобретению можно вводить субъекту, нуждающемуся в этом, для лечения заболеваний дыхательных путей (например, легочных заболеваний, таких как астма, гиперчувствительность дыхательных путей, сезонная аллергия, бронхиостаз, хронический бронхит, эмфизема, хроническое обструктивное заболевание легких, кистозный фиброз и т.п.) и для лечения и/или профилактики обострений этих хронических болезней, таких как обострения, вызванные вирусными инфекциями (например, вирусами гриппа, парагриппа, респираторным синцитиальным вирусом, риновирусом, аденовирусом, метапневмовирусом, вирусом Коксэки, эховирусом, коронавирусом, вирусом герпеса, цитомегаловирусом и т.п.), бактериальными инфекциями (например, Streptococcus pneumoniae, который называют пневмонией, вызванной пневмококком, Staphylococcus aureus, Burkholderis ssp., Streptococcus agalactiae, Haemophilus influenzae, Haemophilus parainfluenzae Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa, Moraxella catarrhalis, Chlamydophila pneumoniae, Mycoplasma pneumoniae, Legionella pneumophila, Serratia marcescens, Mycobacterium tuberculosis, Bordetella pertussis, и т.п.), грибковыми инфекциями (например, Histoplasma capsulatum, Cryptococcus neoformans, Pneumocystis jiroveci, Coccidioides immitis, и т.п.) и паразитами (например, Toxoplasma gondii, Strongyloides stercoralis, и т.п.) или аллергенами из окружающей среды, раздражителями (например, аэроаллергенами, включая пыльцу и кошачью перхоть, частицы, содержащиеся в воздухе и т.п.
Сухие порошки и сухие частицы по изобретению можно вводить субъекту нуждающемуся в этом, для лечения и/или профилактики и/или ослабления степени инфицирования болезнями дыхательного тракта, такими как пневмония (пневмония, приобретенная в больнице, НАР; (НСАР), пневмония, связанная с работой вентиляторов (VAP)), трахеобронхит, связанный с работой вентиляторов (VAT), бронхит, круп (например, пост-интубационный круп и инфекционный круп), туберкулез, грипп, обычная простуда, вирусные инфекции (например, вызванные вирусом гриппа, вирусом парагриппа, респираторным синцитиальным вирусом, риновирусом, аденовирусом, метапневмовирусом, вирусом Коксэки, эховирусом, коронавирусом, вирусом герпеса, цитомегаловирусом и т.п.), бактериальные инфекции (например, Streptococcus pneumoniae, который называют пневмонией, вызванной пневмококком, Staphylococcus aureus, Streptococcus agalactiae, Haemophilus influenzae, Haemophilus parainfluenzae Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa, Moraxella catarrhalis, Chlamydophila pneumoniae, Mycoplasma pneumoniae, Legionella pneumophila, Serratia marcescens, Mycobacterium tuberculosis, Bordetella pertussis, и т.п.), грибковые инфекции (например, Histoplasma capsulatum, Cryptococcus neoformans, Pneumocystis jiroveci, Coccidioides immitis, и т.п.) или инфекции, вызванные паразитами (например, Toxoplasma gondii, Strongyloides stercoralis, и т.п.), или болезни, вызванные аллергенами в окружающей среде и раздражителями (например, аэроаллергенами, частицами в воздухе и т.п.).
Пригодные для вдыхания сухие частицы и сухой порошок можно вводить с целью изменения биофизических и/или биологических свойств слизистой оболочки в дыхательных путях (например, жидкости, покрывающей дыхательные пути) и лежащей ниже ткани (например, эпителия дыхательных путей). Эти свойства включают, например, образование геля на поверхности слизистой оболочки, поверхностное натяжение слизистой оболочки, поверхностную эластичность и/или вязкость слизистой оболочки, объемную эластичность и/или вязкость слизистой оболочки. Не основываясь на какой-либо конкретной теории, можно предположить, что преимущества, получаемые при применении пригодных для вдыхания сухих частиц или сухого порошка и методов, описанных в данной заявке (например, терапевтические и профилактические преимущества) получаются в результате увеличения количества катиона кальция (Са2+, содержащегося в солях кальция в пригодных для вдыхания сухих частицах или сухом порошке) в дыхательных путях (например, в слизистой оболочке легких или в жидкости, покрывающей дыхательные пути) после введения пригодных для вдыхания сухих частиц или сухого порошка.
Пригодные для вдыхания сухие порошки и сухие частицы могут вводиться для увеличения клиренса реснитчатого эпителия. Клиренс микробов и частиц, попавших после ингаляции, является важной функцией дыхательных путей с целью предотвращения инфекции дыхательных путей и воздействия потенциально опасных агентов или их систематической абсорбции. Клиренс является интегральной функцией эпителиального, выделяющего слизь иммунологического отклика клеток, находящихся на поверхности дыхательных путей. Она включает реснички на поверхности эпителиальных клеток в дыхательных путях, функция которых состоит в синхронном сокращении для передачи расположенной сверху жидкой защитной слизистой оболочки по направлению ко рту, где она покидает дыхательные пути и проглатывается или отхаркивается.
Пригодные для вдыхания сухие порошки и сухие частицы могут вводиться для осуществления этих всех функций. Путем увеличения поверхностной вязкоэластичности пригодные для вдыхания сухие порошки и сухие частицы удерживают микробы и частицы на поверхности слизистой оболочки дыхательных путей, где они не испытывают системного воздействия хозяина. Гипертоничные сухие порошки и сухие частицы индуцируют транспорт воды/жидкости из эпителиальных клеток воздушных путей, делая сокращение ресничек более эффективным при их движении и очищая расположенную выше защитную слизистую оболочку. Сухие частицы и сухие порошки, которые содержат в качестве фармакологически активного агента соли кальция, также вызывают увеличение частоты сокращения ресничек и силу или энергию сокращений ресничек с получающимся увеличением скорости клиренса расположенной сверху слизистой оболочки.
Мукоцилиарный клиренс измеряется хорошо известным методом, когда количественно определяются функция и скорость клиренса с применением безопасного вдыхаемого препарата радиоизотопа (например, Technitium (99mТс)) в растворе. Количество радиоизотопа определяется количественно методом сцинтиграфии. Серийные измерения в течение нескольких часов позволяют оценить скорость клиренса и зависимость действия лекарства от отношения исходной и контрольной величин.
Согласно некоторым аспектам изобретение относится к способу лечения легочных заболеваний, таких как астма, гиперчувствительность дыхательных путей, эмфизема, сезонная аллергия, бронхиостаз, хронических бронхит, хроническое обструктивное заболевание легких, кистозный фиброз и т.п., путем введения эффективного количества сухих частиц или порошка.
Согласно другим аспектам изобретение относится к способу лечения или профилактики острых обострений хронической обструктивной болезни легких, такой как астма, гиперчувствительность дыхательных путей, эмфизема, сезонная аллергия, бронхиостаз, хронических бронхит, хроническое обструктивное заболевание легких, кистозный фиброз и т.п., путем введения эффективного количества сухих частиц или порошка.
Согласно дальнейшим аспектам данное изобретение относится к способу лечения, профилактик и/или уменьшения распространения инфекционной болезни дыхательных путей, включающему введение в дыхательные пути субъекта, нуждающегося в этом, эффективного количества пригодных для вдыхания сухих частиц или сухого порошка, как описано в данной заявке.
Пригодные для вдыхания сухие частицы и сухие порошки могут быть введены в дыхательные пути субъекта, нуждающегося в этом, с применением любого подходящего способа, такого как метод инсталляции и/или с помощью прибора для ингаляции, такого как ингалятор для сухих порошков (DPI) или дозирующий ингалятор (MDI). Доступными являются многие DPIs, такие как ингаляторы, описанные в патентах США №№4995385 и 4069819, Spinhaler® (Fisons, Loughborough, U.K.), Rotahalers®, Diskhaler® и Diskus® (GlaxoSmithKline, Research Triangle Technology Park, North Carolina), FlowCapss® (Hovione, Loures, Portugal), Inhalators® (Boehringer-Ingelheim, Germany), Aerolizer® (Novartis, Switzerland) и другие приборы, известные специалистам.
Обычно устройства для ингаляции (например, DPIs) способны доставлять максимальное количество сухого порошка или сухих частиц за один вдох, что относится к пропускной способности блистеров, капсул (например, размером 000, 00, 0Е, 0, 1, 2, 3 и 4 с соответствующей объемной пропускной способностью, равной 1,37 м, 950 мкл, 770 мкл, 680 мкл, 480 мкл, 360 мкл, 270 мкл и 200 мкл) и других средств, которые содержат сухие частицы или сухие порошки в ингаляторе. Соответственно, доставка желательной дозы или эффективного количества, может потребовать применения двух или более ингаляций. Предпочтительно, если каждая доза, которая вводится субъекту, нуждающемуся в этом, содержит эффективное количество пригодных для вдыхания сухих частиц или сухого порошка и вводится с применением не более четырех ингаляций. Например, каждая доза пригодных для вдыхания сухих частиц или сухого порошка может быть введена за один вдох или за 2,3 или 4 вдоха. Пригодные для вдыхания сухие частицы и сухие порошки предпочтительно вводятся за одну, активированную вдохом стадию с применением активированного вдохом DPI. Когда применяется этот тип устройства, энергия вдоха субъекта диспергирует пригодные для вдыхания сухие частицы и всасывает их в дыхательные пути.
Пригодные для вдыхания сухие частицы и сухие частицы могут быть доставлены путем ингаляции в нужный участок дыхательных путей, если это желательно. Хорошо известно, что частицы с аэродинамическим диаметром равным от примерно 1 мкм до примерно 3 мкм могут быть доставлены в нижние доли легких. Частицы с большими аэродинамическими диаметрами, например, равными от примерно 3 мкм до примерно 5 мкм, могут быть доставлены в центральные и верхние дыхательные пути.
Полагают, что когда вводятся некоторые сухие порошки, которые содержат в качестве активных ингредиентов соли двухвалентного металла, существует возможность того, что по меньшей мере, некоторое количество пригодного для вдыхания сухого порошка будет осаждаться в полости рта и приводить к неприятному ощущению "соленого рта". Можно предвидеть, что это ощущение может не удовлетворить пациентов, и они могут прервать лечение. Преимущество пригодных для вдыхания сухих порошков по изобретению состоит в том, что они представляют собой мелкие частицы и хорошо диспергируются и, следовательно, отложение их в полости рта уменьшается, уменьшается поэтому возникновение ощущения соленого рта тоже уменьшается или предотвращается.
В случае ингаляторов для сухих порошков осаждение частиц в полости рта в основном зависит от инерционных столкновений этих частиц и характеризуется числом Стокса аэрозоля (DeHaan et al. Journal of Aerosol Science, 35 (3), 309-331, 2003). Для эквивалентной геометрии ингалятора тип дыхания и геометрия полости рта, число Стокса и, следовательно, степень осаждения в полости рта в первую очередь зависят от аэродинамического размера вдыхаемого порошка. Следовательно, факторы, которые влияют на оральное осаждение порошка, включают распределение индивидуальных частиц по размерам и диспергируемость порошка. Если MMAD индивидуальных частиц слишком велик, например, более 5 мкм, в полости рта будет осаждаться большее количество порошка. Подобно этому, если порошок обладает плохой диспергируемостью, это свидетельствует о том, что частицы будут выходить из ингалятора для сухих порошков и в виде агломератов попадать в полость рта. Агломерированный порошок будет вести себя как индивидуальная частица с размером агломерата, поэтому, даже если индивидуальные частицы являются мелкими (например, MMAD равен 5 мкм или менее), распределение частиц вдыхаемого порошка по размерам покажет, что частицы могут иметь MMAD более 5 мкм, что приведет к увеличению степени осаждения в полости рта.
Следовательно, желательно иметь порошок, который представляет собой мелкие частицы (например, MMAD равен 5 мкм или менее, например, он составляет от 1 до 5 мкм) и хорошо диспергируется (например, отношение % бар или, альтернативно 0,5/4 бар равно 2,0 и, предпочтительно, меньше 1,5). Более предпочтительно, если пригодный для вдыхания сухой порошок состоит из пригодных для вдыхания сухих частиц с MMAD от 1 до 4 мкм или от 1 до 3 мкм и имеет отношение ¼ бар менее 1,4 или менее 1,3 и, более предпочтительно, менее 1,2.
Абсолютный геометрический диаметр частиц, измеренный при давлении равном 1 бар с применением системы HELOS, не является критическим при условии, что плотность оболочки частицы является достаточной, чтобы MMAD находился в одном из интервалов, указанных выше, при этом MMAD равен величине VMGD, умноженной на квадратный корень величины плотности оболочки (MMAD=VMGD* кв. корень (плотность оболочки)). Если желательно доставить большую стандартную дозу соли с применением фиксированного объема дозирующего контейнера, тогда следует использовать частицы с более высокой плотностью оболочки. Более высокая плотность оболочки позволяет включать в контейнер с фиксированным объемом большее количество порошка. Предпочтительные величины плотности оболочки превышают 0,1 г/см3, 0,25 г/см3, 0,4 г/см3, 0,5 г/см3 и 0,6 г/см3.
Пригодные для вдыхания сухие порошки и частицы по изобретению могут применяться в виде композиций, подходящих для доставки лекарств через респираторную систему. Например, такие композиции могут включать смеси пригодных для вдыхания сухих частиц по изобретению и одной или более других сухих частиц или порошков, таких как сухие частицы или порошки, которые содержат другой активный агент или которые состоят или практически состоят из одного или более фармацевтически приемлемых эксципиентов.
Пригодные сухие порошки или сухие частицы, пригодные для применения при осуществлении способов по изобретению, могут перемещаться по верхним дыхательным путям (например, через ротогортань и глотку), нижние дыхательные пути, которые включают трахеи, с последующим раздвоением и перемещением в бронхи и бронхиолы и в концевые бронхиолы, которые в свою очередь подразделяются на дыхательные бронхиолы, затем имеются концевая дыхательная зона, альвеолы или нижние доли легких. Согласно одному из вариантов изобретения самое большое количество пригодных для вдыхания сухих порошков или частиц осаждается в нижних долях легких. Согласно другому варианту изобретения частицы доставляются в основном в центральные дыхательные пути. Согласно еще одному варианту частицы доставляются в верхние дыхательные пути.
Пригодные для вдыхания сухие частицы или сухие порошки по изобретению могут быть доставлены в различные участки дыхательного цикла путем ингаляции (например, ламинарный поток при среднем вдохе). Преимущество хорошей диспергируемости сухих порошков и сухих частиц по изобретению состоит в способности нацеливать осаждение в дыхательные пути. Например, контролируемая вдохом доставка растворов из небулайзера представляет собой последнюю разработку в области доставки жидких аэрозолей (Dalby et al. In Inhalation Aerosols, edited by Hickey 2007, p.437). В этом случае распыленные капли высвобождаются только во время некоторых частей дыхательного цикла. При доставке в нижние доли легких капли высвобождаются в начале цикла ингаляции, в то время как для попадания в центральные дыхательные пути они высвобождаются позднее при ингаляции.
Хорошо диспергируемые порошки по изобретению обеспечивают преимущества, касающиеся регулирования времени доставки лекарств во время дыхательного цикла, а также места доставки в легкие человека. Так как пригодные для вдыхания порошки по изобретению могут быстро диспергироваться, например, во фракции при обычном методе ингаляции, время доставки порошка может контролироваться для доставки аэрозоля в конкретные моменты времени при ингаляции.
Хорошо диспергируемые порошки по изобретению позволяют осуществить диспергирование всей дозы аэрозоля в начале ингаляции. В то время как скорость потока воздуха при вдохе пациента быстро повышается до пикового значения, хорошо диспергирующийся порошок начинает диспергироваться уже в начале этого повышения и может полностью диспергировать дозы на первой стадии ингаляции. Поскольку воздух, который вдыхается в начале ингаляции, будет попадать в самые нижние доли легких, диспергирование большей части аэрозоля на первой стадии ингаляции является предпочтительным для осаждения в нижних долях легких. Подобным образом, для осаждения в центральных дыхательных путях диспергирование аэрозоля с высокой концентрацией в воздухе, который проходит в центральные дыхательные пути, может быть достигнуто путем быстрого диспергирования дозы на стадиях ингаляции от средней до конечной. Это может быть осуществлено при помощи ряда механических и других средств, таких как переключатель, управляемый временным параметром, величиной давления или скоростью потока, который направляет воздух, вдыхаемый пациентом, на порошок, который должен быть диспергирован только после того, как удовлетворяются условия переключения.
Дозы аэрозоля, вид состава и системы для доставки могут быть выбраны в зависимости от конкретного терапевтического применения, как описано, например в Gonda, I. "Aerosols for delivery of therapeutic and diagnostic agents to the respiratory tract," in Critical Reviews in Therapeutic Drug Carrier Systems, 6:273-313 (1990); и в Moren, "Aerosol Dosage Forms and Formulations," in Aerosols in Medicine, Principles, Diagnosis and Therapy, Moren, et al., Eds., Esevier, Amsterdam (1985).
Как описано в данной заявке, полагают, что терапевтическое и профилактическое действие пригодных для вдыхания сухих частиц и сухих порошков является результатом наличия повышенного количества кальция в дыхательных путях (например, в легких) после введения пригодных для вдыхания сухих частиц и сухих порошков. Соответственно, поскольку количество введенного кальция может меняться в зависимости от вида конкретной соли, дозирование может основываться на желательной величине количества кальция, которое следует доставить в легкое. Например, один моль хлорида кальция (СаСl2) диссоциирует с получением одного моля Са2+, но один моль цитрата кальция может обеспечить получение трех молей Са.
Обычно эффективное количество фармацевтического состава будет доставлять дозу равную примерно от 0,001 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,002 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,005 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 60 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 50 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 40 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 30 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 20 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 10 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 5 мг Са2+/кг веса, дозу равную примерно от 0,01 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,02 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,03 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,04 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,05 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,1 мг Са2+/кг до примерно 2 мг Са2+/кг веса, дозу равную примерно от 0,1 мг Са2+/кг до примерно 1 мг Са2+/кг веса, дозу равную примерно от 0,1 мг Са2+/кг до примерно 0,5 мг Са2+/кг веса, дозу равную примерно от 0,2 мг Са2+/кг до примерно 0,5 мг Са2+/кг веса, дозу равную примерно от 0,18 мг Са2+/кг до примерно 0,001 мг Са2+/кг веса, дозу равную примерно от 0,005 мг Са2+/кг до примерно 0,01 мг Са2+/кг веса, дозу равную примерно от 0,02 мг Са2+/кг до примерно 0,5 мг Са2+/кг веса.
Согласно некоторым вариантам данного изобретения количество кальция, доставленного в дыхательные пути (например, в легкие, в дыхательные пути, где происходит газообмен), составляет от примерно 0,001 мг Ca+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,002 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,005 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 60 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 50 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 40 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 30 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 20 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 10 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 5 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,02 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,03 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,04 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,05 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,1 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,1 мг Са+2/кг веса до примерно 1 мг Са+2/кг веса, от примерно 0,1 мг Са+2/кг веса до примерно 0,5 мг Са+2/кг веса, от примерно 0,2 мг Са+2/кг веса до примерно 0,5 мг Са+2/кг веса, от примерно 0,18 мг Са+2/кг веса до примерно 0,001 мг Са+2/кг веса, от примерно 0,005 мг Са+2/кг веса до примерно 0,01 мг Са+2/кг веса, от примерно 0,02 мг Са+2/кг веса до примерно 0,5 мг Са+2/кг веса.
Согласно еще одним вариантам данного изобретения количество кальция, доставленного в верхние дыхательные пути (например, в носовую полость) составляет от примерно 0,001 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,002 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,005 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 60 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 50 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 40 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 30 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 20 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 10 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 5 мг Са+2/кг веса, от примерно 0,01 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,02 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,03 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,04 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,05 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,1 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,1 мг Са+2/кг веса до примерно 2 мг Са+2/кг веса, от примерно 0,1 мг Са+2/кг веса до примерно 1 мг Са+2/кг веса, от примерно 0,1 мг Са+2/кг веса до примерно 0,5 мг Са+2/кг веса, от примерно 0,2 мг Са+2/кг веса до примерно 0,5 мг Са+2/кг веса, от примерно 0,18 мг Са+2/кг веса до примерно 0,001 мг Са+2/кг веса.
Кроме того, когда пригодные для вдыхания сухие частицы и сухие порошки включают соль натрия, эти сухие частицы и сухие порошки могут быть введены в количестве, которое достаточно для доставки дозы от примерно 0,001 мг Na+/кг веса до примерно 10 мг Na+/кг веса, от примерно 0,01 мг Na+/кг веса до примерно 10 мг Nа+/кг веса, от примерно 0,1 мг Na+/кг веса до примерно 10 мг Nа+/кг веса, от примерно 1,0 мг Na+/кг веса до примерно 10 мг Na+/кг веса, от примерно 0,001 мг Na+/кг веса до примерно 1 мг Nа+/кг веса, от примерно 0,01 мг Na+/кг веса до примерно 1 мг Na+/кг веса, от примерно 0,1 мг Nа+/кг веса до примерно 1 мг Na+/кг веса, от примерно 0,2 мг Na+/кг веса до примерно 0,8 мг Nа+/кг веса, от примерно 0,3 мг Na+/кг веса до примерно 0,7 мг Nа+/кг веса, от примерно 0,4 мг Na+/кг веса до примерно 0,6 мг Nа+/кг веса.
Согласно некоторым аспектам данного изобретения количество натрия, доставляемого в дыхательные пути (например, в легкие, в дыхательные пути, где происходит газообмен), составляет от примерно 0,001 мг/кг веса до примерно 10 мг/кг веса, от примерно 0,01 мг/кг веса до примерно 10 мг/кг веса, от примерно 0,1 мг/кг веса до примерно 10 мг/кг веса, от примерно 1 мг/кг веса до примерно 10 мг/кг веса, от примерно 0,001 мг/кг веса до примерно 1 мг/кг веса, от примерно 0,01 мг/кг веса до примерно 1 мг/кг веса, от примерно 0,1 мг/кг веса до примерно 1 мг/кг веса, от примерно 0,2 мг/кг веса до примерно 0,8 мг/кг веса, от примерно 0,3 мг/кг веса до примерно 0,7 мг/кг веса, от примерно 0,4 мг/кг веса до примерно 0,6 мг/кг веса.
Согласно еще одним аспектам настоящего изобретения количество натрия, доставляемого в верхние дыхательные пути (например, в носовую полость) составляет от примерно 0,001 мг/кг веса до примерно 10 мг/кг веса, от примерно 0,01 мг/кг веса до примерно 10 мг/кг веса, от примерно 0,1 мг/кг веса до примерно 10 мг/кг веса, от примерно 1 мг/кг веса до примерно 10 мг/кг веса, от примерно 0,001 мг/кг веса до примерно 1 мг/ кг веса, от примерно 0,01 мг/кг веса до примерно 1 мг/кг веса, от примерно 0,1 мг/кг веса до примерно 1 мг/кг веса, от примерно 0,2 мг/кг веса до примерно 0,8 мг/кг веса, от примерно 0,3 мг/кг веса до примерно 0,7 мг/кг веса, от примерно 0,4 мг/кг веса до примерно 0,6 мг/кг веса.
Подходящие интервалы величин доз, обеспечивающих достижение желательного терапевтического результата, можно определить в зависимости от серьезности состояния (например, инфекционного заболевания), общего состояния здоровья субъекта и переносимости субъектом пригодных для вдыхания сухих частиц и сухих порошков и других соображений. С учетом этих и других факторов клиницист может определить интервал величин доз. В общем, пригодные для вдыхания сухие частицы и сухие порошки вводят один раз, два или три раза в день, если это необходимо.
Если это показано или желательно, пригодные для вдыхания сухие частицы и сухие порошки, описанные в данной заявке, можно вводить вместе с одним или более другими терапевтическими агентами. Другие терапевтические агенты могут быть введены любым подходящим способом, например, перорально, парентерально (например, внутривенно, внутриартериально, внутримышечно или путем подкожной инъекции), топически, путем ингаляции (например, внутрибронхиально, внутриназально или перорально, в виде капель в нос), ректально, внутривагинально и т.п. Пригодные для вдыхания сухие порошки и сухие частицы и другой терапевтический агент вводят таким образом, чтобы достигалось практическое перекрытие их фармакологических активностей.
Другим преимуществом применения пригодных для вдыхания сухих порошков и сухих частиц, является то, что эффективность дозирования может быть увеличена в результате гигроскопичного роста частиц в легких благодаря увеличению влажности частиц. Склонность частично аморфных композиций с высоким содержанием соли по изобретению поглощать воду при повышенной влажности также может быть предпочтительной в отношении их in vivo профилей осаждения. Благодаря быстрому поглощению воды при повышенной влажности эти составы порошков могут подвергаться гигроскопическому росту, поглощая воду из влажного воздуха в дыхательных путях по мере того, как они проходят в легкие. Это может привести к увеличению их эффективного аэродинамического диаметра во время перехода в легкие, что будет затем способствовать их осаждению в дыхательных путях.
ПРИМЕРЫ
Вещества, использованные в приведенных ниже примерах, и источники их приобретения перечислены ниже. Дигидрат хлорида кальция, пентагидрат лактата кальция, хлорид натрия, L - лейцин, мальтодекстрин, маннит, лактоза и трегалоза были приобретены в Sigma-Aldrich Co. (St. Louis, МО) или в Spectrum Chemicals (Gardena, СА); сульфат натрия приобретали в EMD Chemicals (Gibbstown, NJ), Sigma Aldrich Co. (St. Louis, Mo) или Spectrum Chemicals (Gardena, СА); и дигидрат цитрата натрия в J.T. Baker (Phillipsburg, NJ), Mallinckrodt Baker (Phillipsburg, NJ) или Spectrum Chemicals (Gardena, СА). Ультрачистую воду получали из системы очистки воды (Millipore Corp., Billerica, MA).
Методы:
Определение геометрического или объемного диаметра. Объемный медианный диаметр (х50), который также можно назвать объемным медианным геометрическим диаметром (VMGD), определяли методом лазерной дифракции. Оборудование состояло из дифрактометра RODOS и диспергатора RODOS для сухих порошков (Sympatec, Inc., Princeton, NJ). Диспергатор RODOS использует силу сдвига образца частиц, контролируемую давлением сжатого сухого воздуха в регуляторе (давление обычно равно 1,0 бар и давление в кольце отверстия составляет 7 мбар). Величины давления могут меняться для изменения количества энергии, используемой для диспергирования порошка. Например, давление в регуляторе может меняться от 0,2 бар до 4,0 бар; давление в кольцевом отверстии может меняться от 5,00 мбар до 115,00 мбар. Образец порошка загружают микрошпателем в воронку RODOS. Диспергированные частицы проходят через пучок лучей лазера, где полученные дифрагированные лучи собираются, обычно с использованием линзы R2, рядом детекторов. Затем полная рентгенограмма дифракционных полос при помощи дифракционной модели Fraunhofer преобразуется в объемное распределение частиц по размерам на основе того, что более мелкие частицы дифрагируют свет под большими углами. Этим методом определяли также геометрическое стандартное отклонение (GSD) от величины объемного медианного геометрического диаметра.
Фракция мелких частиц. Аэродинамические свойства порошков, диспергированных при помощи ингалятора, определяли, используя каскадный импактор Mk-II 1 ACFM Andersen Cascade Impactor (Copley Scientific Limited, Nottinham, UK). Прибор работал в контролируемых условиях окружающей среды, при температуре от 18°С до 25°С и относительной влажности от 20 до 40%. Это устройство включает восемь стадий, на которых частицы аэрозоля разделяются на основе их инерционного столкновения. На каждой стадии поток аэрозоля проходит через ряд форсунок и сталкивается с соответствующей перегородкой. Частицы со сравнительно небольшой инерцией будут вместе с потоком аэрозоля проходить на следующую стадию, в то время как оставшиеся частицы сталкиваются с перегородкой. На каждой последующей стадии аэрозоль проходит через форсунки с большей скоростью, а мелкие с аэродинамической точки зрения частицы будут собираться на перегородке (пластине). После прохождения последней стадии на фильтре собираются остающиеся самые мелкие частицы. Затем проводят гравиметрический и/или химический анализ для определения распределения частиц по размерам. Для снижения промежутка времени для оценки границ отделения двух аэродинамических размеров частиц. При помощи этого коллапсного каскадного импактора устраняется ряд стадий за исключением тех, которые требуются для определения фракций тонкодисперсных и грубых частиц.
Применение метода столкновений позволило собрать две или восемь фракций порошка. Капсулы (НРМС, размер 3; Shionogi Qualicaps, Madrid, Spain) примерно до половины заполняли порошком и помещали в ручной активируемый при вдохе ингалятор для сухих порошков (DPI), RS 01 DPI (Plastiape, Osnago, Italy) с большим сопротивлением. Капсулу прокалывали, порошок поступал в каскадный импактор, работающий со скоростью потока 60,0 л/мин в течение 2 с.При этой скорости потока калибровочные отсекаемые величины диаметра были равны 5,6 мкм и 3,4 мкм. Фракции собирали на фильтрах и определяли количество порошка, который столкнулся с ними, методом гравиметрического анализа или методом ВЭЖХ, как отмечено в таблицах. Фракция мелких частиц во всей дозе порошка (FPF_TD), которые имели эффективный отсеченный аэродинамический диаметр, определялась путем деления массы порошка, выделившегося на желательных стадиях импактора на общую массу частиц в капсуле. Результаты приведены в виде количества фракции мелких частиц размером менее 5,6 мкм (FPF<5,6 мкм) и фракции мелких частиц размером менее 3,4 мкм (FPF<3,4 мкм). Количество фракции мелких частиц альтернативно может быть рассчитано на основе выделившейся дозы порошка путем деления массы порошка, выделившегося на желательных стадиях импактора, на всю массу выделившегося порошка.
Аэродинамический диаметр. Массовый медианный аэродинамический диаметр (MMAD) определяли по информации, полученной в Andersen Cascade Impactor. Кумулятивная масса частиц с размером менее отсеченных на данной стадии величин рассчитывается для каждой стадии и нормализуется по величине выделившейся дозы порошка. MMAD частиц порошка рассчитывают путем линейной интерполяции отсеченных величин диаметра на данной стадии, которые захватывают в вилку 50-й (медианный) процентиль.
Выделившаяся доза. Величина выделившегося порошка определялась по информации, полученной в ACI. В начале опыта записывали весь заполненной капсулы, а конечный вес капсулы записывали после окончания опыта. Разница между этими величинами представляла количество порошка, выделившегося из капсулы (СЕРМ или масса порошка, выделившегося из капсулы). Выделившуюся дозу рассчитывали путем деления количества порошка, выделившегося из капсулы на начальную массу частиц в капсуле.
Насыпной вес после утряски. Для определения насыпного веса после утряски применяли два метода. (1) Вначале использовали модифицированный метод, требующий меньших количеств порошка, по USP<616>с применением микроцентрифужной пробирки объемом 1,5 см3 (Eppendorf AG, Hamburg, Germany). (2) Использовали метод USP<616>с применением градуированного цилиндра объемом 100 см. Приборы для измерения насыпного веса после утряски, известные специалистам, включали, но без ограничения Dual Platform Microprocessor Controlled Tap Density Tester (Vankel, Cary, NC) или a GeoPyc instrument (Micrometrics Instrument Corp., Norcross, GA). Насыпной вес (плотность) после утряски представляет собой стандартную величину плотности оболочки. Плотность оболочки изотропной частицы определяется как масса частицы, деленная на минимальный объем сферической оболочки, в которую она заключена.
Сканирующая электронная микроскопия (SEM). SEM осуществляли, используя сканирующий электронный микроскоп FEI Quanta 200 (Hillsboro, Oregon), снабженный детектором Everhart Thornley (ET). Изображения собирали и анализировали при помощи программ xTm (v.2.01) и XT-Docu (v.3.2), соответственно. Степень увеличения верифицировали, используя прослеживаемый стандарт NIST. Каждый образец для анализа готовили путем помещения небольшого количества порошка на углеродную пластинку, укрепленную на алюминиевой опоре. На каждый образец затем наносили покрытие Au/Pd путем разбрызгивания, применяя авторазбрызгиватель Cressington 108 в течение 75 с при силе тока 20 мА и давлении 0,13 мбар (Аr). Полученные данные появлялись на панели информации в нижней части каждой микрофотографии. Величина увеличения, указанная в нижней части фотографии, была выверена при изменении размера и должна использоваться при проведении определения размера.
Получение жидких исходных составов для сушки распылением. Сушка гомогенных частиц требует, чтобы нужные ингредиенты были солюбилизированы в растворе или суспендированы в однородной и стабильной суспензии. Некоторые соли кальция, такие как хлорид кальция, ацетат кальция и лактат кальция, являются достаточно растворимыми в воде для приготовления подходящих для сушки при распылении растворов. Однако другие соли кальция, такие как сульфат кальция, цитрат кальция и карбонат кальция, обладают низкой растворимостью в воде. Растворимость в воде некоторых солей кальция показана в Таблице 1. Как следствие этой плохой растворимости определенный состав исходных растворов является необходимым для приготовления растворов или суспензий, которые могут быть высушены при распылении. Эти растворы или суспензии включали комбинации солей в подходящем растворителе, обычно в воде, а также в смеси этанола и воды или в других растворителях, как указано выше в данной заявке.
| Таблица 1 | |
| Растворимость солей кальция в воде | |
| Растворимость солей кальция в воде (при 20-30°С, 1 бар) | |
| Соль | Растворимость в воде (г/л) |
| Хлорид кальция | 13681,2 |
| Ацетат кальция | 3471 |
| Лактат кальция | 1051 |
| Глюконат кальция | 33.233 |
| Сульфат кальция | 2.981 |
| Цитрат кальция | 0.961 |
| Двуосновный фосфат кальция | 0.21 |
| Карбонат кальция | Практич. нераств.2 |
| Стеарат кальция | Практич. нераств.2 |
| Альгинат кальция | Не применяется |
| Карбонат натрия | 5051 |
| Хлорид натрия | 3601 |
| Цитрат натрия | 9101 |
| Сульфат натрия | 1941 |
| 1 Perry, Robert Н., Don W. Green, and James О. Maloney. Perry's Chemical Engineers' Handbook. 7th ed. New York: McGraw-Hill, 1997. Print. 2 Solubility at 60°C. 3 O'Neil, Maryadele J. The Merck Index: an Encyclopedia of Chemicals, Drugs, and Biologicals. 14th ed. Whitehouse Station, N.J.: Merck, 2006. Print. |
|
Как упоминалось ранее, хлорид кальция хорошо растворяется в воде. Соли натрия, такие как сульфат натрия, цитрат натрия и карбонат натрия, также хорошо растворяются в воде. Как будет обсуждено в нижеследующих примерах, хлорид кальция и соли натрия ("исходные вещества") соединяются в растворе или суспензии с получением стабильных солей кальция в конечной порошкообразной форме. При соединении хлорида кальция и соли натрия в растворе кальций и анион из соли натрия могут взаимодействовать по реакции осаждения с получением желаемой соли кальция (а именно, СаСl2+2NaXX→СаХХ+2NaCl). В этом случае максимальная концентрация твердых веществ, которая еще приводит к образованию прозрачного раствора или стабильной суспензии, применяется при сушке растворов при распылении. Некоторые соли кальция обладают достаточной растворимостью в воде, чтобы растворяться в ней и затем подвергаться сушке. Этот же принцип можно применять в случае, например, солей магния, используя хлорид магния, солей калия, используя хлорид калия, и солей натрия.
Для завершения реакции осаждения называемой "завершающаяся реакция", используют мольные количества исходных веществ. Содержание иона кальция в вес. %% в солях кальция указано в Таблице 2.
| Таблица 2 | |||
| Содержание Са2+ в молекулах солей, % | |||
| Содержание иона Са в молекуле соли, вес. % | |||
| Соль | Формула | М. вес | Содержание Са2+ в молекуле, вес. % |
| Карбонат кальция | СаСО3 | 100,09 | 40,0 |
| Хлорид кальция | СаСl2 | 110,98 | 36,0 |
| Двухосновный фосфат кальция | СаНРO4 | 136,06 | 29,4 |
| Сульфат кальция | CaSO4 | 136,14 | 29,4 |
| Ацетат кальция | Са(С2Н3O2)2 | 158,17 | 25,3 |
| Цитрат кальция | Са3(С6Н5O7)2 | 498,46 | 24,1 |
| Лактат кальция | Са(С3Н5O3)2 | 218,218 | 18,3 |
| Сорбат кальция | CaC12H14O4 | 262,33 | 15,2 |
| Глюконат кальция | CaC12H22O14 | 430,373 | 9,3 |
| Стеарат кальция | СаС36Н70O4 | 607,02 | 6,6 |
| Альгинат кальция | [Са(С6Н7O6)2]n | Не прим. | Не прим. |
Или же, альтернативно, можно добавить избыток хлорида кальция в случае неполной реакции или "незавершенной реакции", когда данное количество хлорида кальция содержится в конечном порошке. Хотя хлорид кальция является гигроскопичным, его высокая растворимость в воде может быть благоприятной, его небольшие количества в конечном продукте повышают растворимость конечного продукта, можно управлять профилем растворения и повышать отношение иона кальция к катиону натрия или другим катионам, содержащимся в составе. Для облегчения получения составов требуемые мольные отношения хлорида кальция и соли натрия были превращены в массовые отношения хлорида кальция и соли натрия. Примером является цитрат кальция (хлорид кальция + цитрат натрия), когда реакция осаждения проходит следующим образом:
3СаСl2+2Na3C6H5O7→Са3(С6Н5O7)2+6NaCl
Эта реакция характеризуется мольным отношением ионов Са:Na равным 1:2. Для завершения реакции требуются 3 моля хлорида кальция и 2 моля цитрата натрия. Для превращения в массу в г и получения весового отношения мольные количества солей умножаются на молекулярный вес солей в г/моль:
Для хлорида кальция: 3МСаСl2×111 г/моль=333 г СаСl2
Для цитрата натрия: 2МNa3С6Н5О7×258 г/моль=516 г Na3С6Н5O7
Следовательно, для полной реакции требуется весовое отношение СаСl2:Na3С6Н5O7 равное 1:1,55 или 39:61.
Составы с этими отношениями солюбилизировались и высушивались при распылении с получением состава, содержащего "чистую соль". Кроме того, получали сухие порошки с дополнительным эксципиентом, таким как лейцин или лактоза. Отношение кальция к соли натрия оставалось тем же самым, и происходила "полная реакция". Например, состав содержал 50% (вес/вес) лейцина, остальное составляли соли, такие как цитрат кальция (СаСl2:Na3С6Н5O7), поддерживалось весовое отношение СаСl2:Na3С6Н5Сl2, равное 39:61. Таким образом, для этой реакции следовало добавлять 50% (вес/вес) лейцина, 19,5% (вес/вес) СаСl2 и 30,5% (вес/вес) Na3С6Н5O7. Для осуществления сушки при распылении соли и другие эксципиенты должны растворяться или суспендироваться в растворителе (а именно, в воде). Концентрацию твердых веществ в растворе (вес/об) можно выбирать в зависимости от растворимости различных компонентов. В случае состава с цитратом подходящей концентрацией является величина равная 5 мг/мл, предел растворимости цитрата кальция составляет 0,95 мг/мл. Следовательно, в 1 л ультрачистой воды следует растворить 5 г твердых веществ (а именно, 2,5 г лейцина, 0,975 г хлорида кальция и 1,525 г цитрата натрия).
Кроме того, при приготовлении растворов, пригодных для сушки при распылении нужно учитывать вес воды в гидратированном исходном материале. Отношения компонентов составов рассчитываются на основе молекулярного веса безводных солей. Для некоторых солей более доступными являются их гидратированные формы по сравнению с безводными формами. Это потребовало корректировки первоначально рассчитанных отношений с помощью умножающего устройства, позволяющего осуществлять корреляцию молекулярного веса безводной соли с молекулярным весом гидрата. Пример такого расчета приведен ниже.
Для примера, приведенного выше, молекулярный вес безводного хлорида кальция равен 110,98 г/моль, молекулярный вес дигидрата хлорида кальция составляет 147,01 г/моль. Безводный цитрат натрия имеет молекулярный вес равный 258,07 г/моль, эта же характеристика для дигидрата этой соли равна 294,10 г/моль.
Величина умножения аналогична отношению молекулярного веса дигидрата к молекулярному весу безводной соли, например, это 1,32 для хлорида кальция и 1,14 для цитрата натрия. Следовательно, в случае дигидратных форм имеем:2,5 г лейцина, 1,287 г (то есть, 0,975 г × 1,32) дигидрата кальция и 1,738 г (то есть 1,525 г × 1,14) дигидрата цитрата натрия растворяли и полученный раствор подвергали сушке распылением.
Сушка при распылении в сушилке Niro. Сухие порошки получали путем сушки при распылении при помощи сушилки Niro Mobile Minor (GEA Process Engineering Inc., Columbia, MD), порошок собирали из циклона, на фильтре, или и на фильтре и в циклоне. Распыление жидкого состава осуществляли, используя пневмораспылитель фирмы Niro (GEA Process Engineering Inc., Columbia, MD) или распылитель Spraying Systems (Carol Stream, IL) с газовой шапкой 67147 и жидкой шапкой 2850SS, хотя можно применять другие форсунки с двумя потоками. Другие методы распыления включают роторную атомизацию или применение форсунки под давлением. Жидкие составы подавали при помощи шестеренчатых насосов (Cole - Parmer Instrument Company, Vernon Hills, IL), прямо в форсунку или в статический смеситель (Charles Ross and Son Company, Hauppauge, NY) непосредственно перед введением в форсунку. Другим способом подачи жидкого состава является подача из автоклава. В качестве осушающего газа может быть использован азот или воздух, при условии, что влага в воздухе по меньшей мере частично удалена перед его применением. В качестве распыляющего газа в форсунке можно использовать сжатый азот или воздух. Температура газа на входе может быть в интервале от 100°С до 300°С, а температура на выходе может составлять от 50°С до 120°С, скорость подачи жидкого состава может быть равна от 20 мл/ мин до 100 мл/ мин. Газ, подаваемый в распылитель, подается со скоростью, которая может зависеть от выбранной форсунки, в случае форсунки фирмы Niro с параллельными жидкими потоками эта скорость может быть от 8 кг/ ч до 15 кг/ ч, величина давления может составлять от 0,5 бар до 2,0 бар, а в случае форсунки Spraying Systems с газовой шапкой 67147 и с жидкой шапкой 2850SS скорость потока может быть равна от 40 г/мин до 100 г/мин. Скорость распыляющего (атомизирующего) газа устанавливают так, чтобы достичь некоторого массового отношения газа к жидкости, которое непосредственно влияет на размер получаемых капель. Давление внутри сушильного барабана может колебаться от +3"WC до -6"WC. Высушенные при распылении порошки могут быть собраны в контейнер на выходе из циклона, на фильтре картриджа или на тканевом фильтре или же и из циклона, и с указанных фильтров.
Сушка при распылении в сушилке Büchi. Сухие порошки были также получены путем сушки при распылении в сушилке Büchi В-290 Mini Spray Dryer (BÜCHI Labortechnik AG, Flawil, Switzerland), сбор порошка осуществляли или из стандартного циклона, или из высокопроизводительного циклона. В этой системе использовали осушитель Büchi В - 296 для обеспечения стабильных температуры и влажности воздуха, применяемого для сушки при распылении. Кроме того, когда относительная влажность в помещении превышала 30% RH, постоянно работал внешний осушитель LG (модель 49007903, LG Electronics, Englewood Cliffs, NJ). При распылении жидкого состава применяли форсунку Büchi с двумя потоками с диаметром отверстия 1,5 мм. Температура газа на входе могла меняться от 100°С до 220°С, температура на выходе - от 80°С до 120°С при скорости подачи жидкого потока равной от 3 мл/ мин до 10 мл/мин. Давление распыляющего газа колебалось от 25 мм до 35 мм (от 300 л/ч до 530 л/ч (LPH)) и скорость аспиратора от 70% до 100% (28 м3/ч - 38 м3/ч).
В таблице 3 приведен состав исходных композиций, использованных при получении сухих порошков.
| Таблица 3 | |
| Исходные составы | |
| Состав | Композиция (вес/вес) |
| I | 10,0% лейцина, 35,1% хлорида кальция, 54,9% цитрата натрия |
| II | 10,0% лейцина, 58,6% лактата кальция, 31,4% хлорида натрия |
| III | 10,0% лейцина, 39,6% хлорида кальция, 50,4% сульфата натрия |
| XIV | 10,0% мальтодекстрина, 58,6% лактата кальция, 31,4% хлорида натрия |
В таблице 4 приведен состав полученных сухих порошков. Эти композиции получали, ожидая, что реакция ионного обмена, описанная выше, завершается полностью для составов I и III. Не основываясь только на одной конкретной теории, ожидают, что испарение капель, которое происходит при сушке при распылении, вызывает вначале осаждение наименее растворимой соли, которой в составах I и III являются цитрат Са и сульфат Са, соответственно.
| Таблица 4 | |
| Сухие порошки, полученные сушкой при распылении | |
| Состав | Состав(вес/вес) |
| I | 10,0% лейцина, 52,8% хлорида кальция, 37, 2% хлорида натрия |
| II | 10,0% лейцина, 58,6% лактата кальция, 31,4% хлорида натрия |
| III | 10,0% лейцина, 48,4% сульфата кальция, 41,6% хлорида натрия |
| XIV | 10,0% мальтодекстрина, 58,6% лактата кальция, 31,4% хлорида натрия |
Описание плацебо
Состав плацебо, содержащий 100 вес. % лейцина, получали путем сушки при распылении. Водную фазу готовили путем периодического способа при растворении лейцина в ультрачистой воде при постоянном перемешивании до полного растворения веществ в воде при комнатной температуре. В процессе статического перемешивания ультрачистую воду делили пополам и половину требуемого количества лейцина растворяли в каждом объеме воды. Затем растворы сушили при распылении, применяя сушилку при распылении Niro или Büchi. Для получения состава плацебо были приготовлены две порции (А и В) исходных составов, которые сушили при распылении. Общая концентрация твердых частиц для партии А составляла 15 г/л и для партии В была равна 5 г/л. Условия процесса сушки партии А (Плацебо - А) в сушилке Niro Mobile Minor были похожи на условия сушки распылением состава I-А в примере 1. Условия процесса сушки партии В (Плацебо - В) были похожи на условия сушки распылением состава I-С в примере 1, за исключением того, что температура на выходе была равна примерно 82°С для состава Плацебо - В. Дополнительная информация, касающаяся условий процесса и свойств порошкообразных составов и/или частиц составов Плацебо - А и Плацебо - В, полученных в этом примере, представлена в Таблицах или на графиках, приведенных на Фигурах 1A-1Fh 2-4.
ПРИМЕР 1
В этом примере описано приготовление сухих порошков с применением Состава I:100 вес. % лейцина, 5,1 вес. % хлорида кальция и 54,9% цитрата натрия.
Водную фазу готовили, применяя периодический способ, при растворении в ультрачистой воде лейцина, затем дигидрата цитрата натрия и, наконец, дигидрата хлорида кальция. Раствор или суспензию выдерживали при перемешивании в течение всего процесса до полного растворения веществ в воде при комнатной температуре. При смешении в статических условиях соль натрия и соль кальция применяли в виде отдельных растворов. В процессе статического перемешивания ультрачистую воду делили пополам и половину требуемого количества лейцина растворяли в каждом объеме воды. Дигидрат цитрата натрия растворяли в одной водной фазе и дигидрат хлорида кальция растворяли в другой водной фазе. Растворы или суспензии выдерживали в течение всего процесса при перемешивании до полного растворения всех веществ в воде при комнатной температуре. Затем растворы или суспензии сушили при распылении, применяя распылительные сушилки марки Niro или Büchi. Для каждого состава были приготовлены и высушены при распылении три порции (А, В и С). Детали получения жидких составов для каждой из трех порций показаны в Таблице 5, где общая концентрация твердых частиц приведена в расчете на общий вес растворенных безводных веществ. Порция частиц состава А была получена из исходного состава А в сушилке марки Niro. Партии частиц В и С были получены из соответствующих исходных составов с применением сушилки Büchi.
| Таблица 5 | ||||
| Получение четырех партий частиц из жидких исходных составов для состава I | ||||
| Состав: | I-А | I-В | I-С | I-D |
| Смешение жидких составов | Статическое | Периодич. | Периодич. | Статическое |
| Общая концентрация твердых частиц | 10 г/л | 5 г/л | 5 г/л | 15 г/л |
| Общее количество твердых веществ | 380 г | 6,25 г | 10,50 г | 570 г |
| Общий объем воды | 38,0 л | 1,25 л | 2,1 л | 38 л |
| Количество лейцина в 1 л | 1,00 г | 0,50 г | 1,05 г | 1,5 г |
| Количество дигидрата цитрата натрия в 1 л | 6,26 г | 3,13 г | 3,13 г | 9,39 г |
| Количество дигидрата хлорида кальция в 1 л | 4,65 г | 2,32 г | 2,32 г | 6,98 г |
Партия А (I-А) сухого порошка была получена путем сушки при распылении в распылительной сушилке Niro Mobile Minor (GEA Process Engineering Inc., Columbia, MD), порошок собирали на фильтре. При атомизации применяли пневмораспылитель с параллельными потоками марки Niro (GEA Process Engineering Inc., Columbia, MD) с вставкой 1,0 мм. Жидкость подавали в статический смеситель) (Charles Ross & Son Company, Hauppauge, NY) при помощи шестеренчатых насосов (Cole - Parmer Instrument Company, Vernon Hills, IL) непосредственно перед введением в пневмораспылитель. В качестве газа для сушки применяли азот. Температура при вводе газа была равна 282°С, а температура при выходе составляла примерно 98°С. Скорость подачи газа в пневмораспылитель составляла 14,5 кг/ч, а давление было равно 2 ф/дюйм2, скорость потока газа составляла 85 кг/ч и давление равнялось 25 ф/дюйм2, давление внутри сушильного барабана составляло - 2 "WC (вод. ст.). Общая скорость исходного жидкого состава была равна 70 мл/мин, каждый поток подавали со скоростью 35 мл/мин. Порошки, высушенные при распылении, собирали с фильтра.
Сухие порошки партий В (I-В) и С (I -С) были получены путем сушки при распылении в распылительной сушилке Büchi В-290 Mini Spray Dryer (BÜCHI Labortechnik AG, Flawil, Switzerland) с пневмораспылителем марки Büchi с соплом диаметром 1,5 мм и порошок собирали в высокопроизводительном циклоне. В этой системе применяли влагоотделитель Büchi В-296 для обеспечения стабильной температуры влажности воздуха, использованного для сушки при распылении. Температура при вводе газа была равна 220°С, скорость потока исходного жидкого состава составляла 6,7 мл/мин для состава I-В и 7 мл/мин для состава I-С. Температура на выходе была равна примерно 108°С для состава I-В и примерно 95°С для состава I-С. Атомизирующий газ был под давлением 40 мм и скорость аспиратора равнялась 90%.
Сухие порошки партии D (I-D) были получены путем сушки при распылении в сушилке Niro Mobile Minor (GEA Process Engineering Inc., Columbia, MD), при этом порошки собирали с мембраны фильтра. При атомизации жидкого потока применяли пневмораспылитель из Spraying Systems (Carol Stream, IL) с газовой шапкой 67147 и фланцем 2850SS. Жидкий поток в статический смеситель (Charles Ross & Son Company, Hauppauge, NY) подавали при помощи шестеренчатых насосов (Cole-Parmer Instrument Company, Vernon Hills, IL) непосредственно перед введением в сопло пневмораспылителя. В качестве газа для сушки применяли азот. Температура при вводе газа была равна 265°С, а температура при выходе составляла примерно 99°С. Скорость подачи газа в пневмораспылитель составляла 80 г/мин, скорость потока газа составляла 80 кг/ч, давление внутри сушильного барабана составляло - 2 "WC (вод. ст.). Общая скорость исходного жидкого состава была равна 66 мл/мин, каждый поток подавали со скоростью 33 мл/мин. Порошки, высушенные при распылении, собирали с мембраны фильтра.
Некоторые из физических свойств частиц, полученных для четырех отдельных партий (партии I-A, I-B, I-С и I-D), приведены в Таблице 6. В дополнение к свойствам, указанным в Таблице 5, ниже приведены свойства, полученные для сухих порошков из состава I-A. Величина фракции мелких частиц (FPF), измеренная при помощи гравиметрического анализа в восьмистадийном каскадном импакторе Andersen Cascade Impactor в среднем составила 56,2% для FPF размером менее 5,6 мкм и 41,7% для FPF размером менее 3.4 мкм. Аэродинамический диаметр также был измерен методом гравиметрического анализа в ACI (Andersen Cascade Impactor). Средняя величина массового медианного аэродинамического диаметра (MMAD) была равна 2,72 мкм. Объемный размер был определен методом лазерной дифракции на системе HELOS/RODOS. Средняя величина объемного медианного диаметра (×50) при давлении равном 1 бар составила 2,57 мкм. Кроме того, порошок характеризовался сравнительно независимой скоростью текучести, что можно видеть по отношению величины ×50, измеренной при давлении 0,5 бар, к величине ×50, измеренной при давлении 4.0 бар, которое составило 1.19. Величина для отношения 1/4 бар для этих частиц была равна 1,17.
Дополнительные свойства сухих порошков, полученных в составе I-D приведены ниже. Величина фракции мелких частиц (FPF), измеренная при помощи гравиметрического анализа в восьмистадийном каскадном импакторе Andersen Cascade Impactor в среднем составила 58,8% для FPF размером менее 5,6 мкм и 46,7% для FPF размером менее 3,4 мкм. Аэродинамический диаметр также был измерен методом гравиметрического анализа в ACI (Andersen Cascade Impactor). Средняя величина массового медианного аэродинамического диаметра (MMAD) была равна 2,38 мкм. Объемный размер был определен методом лазерной дифракции на системе HELOS/RODOS, средняя величина объемного медианного диаметра (×50) при давлении равном 1 бар составила 2,45 мкм. Кроме того, порошок характеризовался сравнительно независимой скоростью текучести, что можно видеть по отношению величины ×50, измеренной при давлении 0,5 бар, к величине ×50, измеренной при давлении 4,0 бар, которое составило 1,12. Величина для отношения 1/4 бар для этих частиц была равна 1,09.
| Таблица 6 | ||||
| Данные для четырех порций частиц состава, полученные в ACI-2 | ||||
| Состав: | 1-А | 1-В | 1-С | I-D |
| FPF размером менее 5,6 мкм в ACI-2 (%) | 61,6 | 49,2 | 64,8 | 67,2 |
| FPF размером менее 3,4 мкм в ACI-2 (%) (%) | 45,7 | 33,3 | 52,1 | 54,8 |
Дополнительная информация, относящаяся к свойствам порошка состава I-А и/или частиц, полученных в этом примере, приведены в Таблицах или на графиках на Фигурах IА-IF и 2-4. GSD на Фигуре ID относится к геометрическому стандартному отклонению. Dv50 на Фигуре 1F относится к объемному медианному геометрическому диаметру (VMGD), измеренному при помощи прибора Spraytec instrument; V относится к объему. Сканирующую электронную микроскопию (SEM) проводили как описано выше (Фиг.5А).
ПРИМЕР 2
Этот пример описывает получение сухих порошков из состава II:10,0 вес. % лейцина, 58,6 вес. % лактата кальция и 31,4 вес. % хлорида натрия.
Водную фазу получали периодическим способом путем растворения сначала лейцина, затем хлорида натрия и, наконец, пентагидрата лактата кальция в ультрачистой воде. Раствор выдерживали при перемешивании в течение всего процесса до полного растворения веществ в воде при комнатной температуре. В случае состава с лактатом кальция были приготовлены и высушены при распылении четыре партии (А, В, С и D). Подробности получения исходных жидких растворов для каждой из четырех партий приведены в Таблице 7, где общая концентрация твердых веществ указана в расчете на общий вес всех растворенных веществ. Частицы в партиях А и D были получены из исходных составов А и D, соответственно, в распылительной сушилке марки Niro. Условия процесса сушки для партии А (II-А) были подобны условиям, использованным для сушки сухого состава I-А в примере 1 и условия для партии D (II-D) были подобны условиям, использованным для сушки сухого состава I-D в примере 1. Частицы партий В и С были получены из соответствующих исходных составов в сушилке Büchi Mini при условиях процесса, подобных условиям, использованным для сушки при распылении составов I-В и I-С в примере 1, за исключением следующих условий. Скорость потока жидкого состава была равна 5,2 мл/мин для состава II-В и 6 мл/мин для состава II-С. Для состава II-В температура на выходе составила от примерно 91°С до примерно 109°С и для состава II-С она была равна примерно 100°С.
| Таблица 7 | ||||
| Получение четырех партий частиц состава II | ||||
| Состав: | II-А | II-В | II-С | II-D |
| Смешение исходных жидких составов | Статическое | Периодическое | Периодическое | Статическое |
| Общая концентрация твердых частиц | Юг/л | 5 г/л | 5 г/л | 15 г/л |
| Общее количество твердых частиц | 400 г | 10,0 г | 9,20 г | 570 г |
| Общий объем воды | 40,0 л | 2,00 л | 1,84 л | 38 л |
| Количество лейцина в 1 л | 1,00 г | 0,50 г | 0,50 г | 1,5 г |
| Количество хлорида натрия в 1 л | 3,14 л | 1,57 г | 1,57 г | 4,71 г |
| Количество пентагидрата лактата кальция в 1 л | 8,28 г | 4,13 г | 4,13 г | 12,42 г |
Некоторые из физических свойств, полученных в четырех отдельных партиях (составы II-А, II-В, II-С и II-D), приведены в Таблице 8. В дополнение к свойствам, указанным в Таблице 8, ниже приведены следующие свойства сухих частиц, полученных из исходного состава II-А. Количество фракции мелких частиц (FPF), измеренное методом гравиметрического анализа в 8 - стадийном импакторе Andersen Cascade Impactor, в среднем составило 55, 3% для FPF размером менее 5,6 мкм и 39,7% для FPF размером менее 3,4 мкм. Аэродинамический диаметр также был измерен методом гравиметрического анализа в ACI (Andersen Cascade Impactor). Средняя величина массового медианного аэродинамического диаметра (MMAD) была равна 2,89 мкм. Объемный размер был определен методом лазерной дифракции на системе HELOS/RODOS. Средняя величина объемного медианного диаметра (×50) при давлении равном 1 бар составила 1,51 мкм. Кроме того, порошок характеризовался сравнительно независимой скоростью текучести, что можно видеть по отношению величины ×50, измеренной при давлении 0,5 бар, к величине ×50, измеренной при давлении 4,0 бар, которое составило 1,12. Величина для отношения 1/4 бар для этих частиц была равна 1,08.
Дополнительная информация, относящаяся к свойствам порошка состава II-D, приведена ниже. Количество фракции мелких частиц (FPF), измеренное методом гравиметрического анализа в 8 - стадийном импакторе Andersen Cascade Impactor, в среднем составило 62,2% для FPF размером менее 5,6 мкм и 45,3% для FPF размером менее 3,4 мкм. Аэродинамический диаметр также был измерен методом гравиметрического анализа в ACI (Andersen Cascade Impactor). Средняя величина массового медианного аэродинамического диаметра (MMAD) была равна 2,72 мкм. Объемный размер был определен методом лазерной дифракции на системе HELOS/RODOS. Средняя величина объемного медианного диаметра (х50) при давлении равном 1 бар составила 1,47 мкм. Кроме того, порошок характеризовался сравнительно независимой скоростью текучести, что можно видеть по отношению величины ×50, измеренной при давлении 0,5 бар, к величине ×50, измеренной при давлении 4,0 бар, которое составило 1,08. Величина для отношения 1/4 бар для этих частиц была равна 1,03.
| Таблица 8 | ||||
| Данные для четырех партий частиц состава II, полученные в ACI-2 | ||||
| Состав: | II-А | II-В | II-С | II-D |
| FPF размером менее 5,6 мкм в ACI -2(%) | 63,5 | 55,4 | 56,5 | 71,4 |
| FPF размером менее 3,4 мкм в ACI -2 (%) | 43,4 | 35,5 | 34,7 | 49,7 |
Дополнительная информация, относящаяся к свойствам порошков и/или частиц состава II, полученных в этом примере, приведена в таблицах или на графиках, показанных на Фигурах 1А - 1F и 2 - 4. SEM проводили, как описано выше (Фиг.5 В).
ПРИМЕР 3
Этот пример описывает приготовление сухих порошков с использованием исходного состава III:10 вес. % лейцина, 39,6 вес. % хлорида кальция и 50,4 вес. % сульфата натрия.
Водную фазу получали периодическим способом путем растворения сначала лейцина, затем сульфата натрия и, наконец, дигидрата хлорида кальция в ультрачистой воде. Раствор выдерживали при перемешивании в течение всего процесса до полного растворения веществ в воде при комнатной температуре. В случае статического смешения применяли соль натрия и соль кальция в виде отдельных растворов. В процессе статического перемешивания ультрачистую воду делили пополам и половину требуемого количества лейцина растворяли в каждом объеме воды. Сульфат натрия растворяли в одной водной фазе и дигидрат хлорида кальция растворяли в другой водной фазе. Растворы или суспензии выдерживали в течение всего процесса при перемешивании до полного растворения всех веществ в воде при комнатной температуре. Затем растворы или суспензии сушили при распылении, применяя распылительные сушилки марки Niro или Büchi. Для каждого состава были приготовлены и высушены при распылении четыре порции (А, В, С и D). Детали получения жидких составов для каждой из трех порций показаны в Таблице 9, где общая концентрация твердых частиц приведена в расчете на общий вес растворенных безводных веществ. Порция частиц состава А была получена из исходного состава А в сушилке марки Niro. Партии частиц В и С были получены из соответствующих исходных составов с применением сушилки Büchi.
Условия процесса сушки для партии А (III-А) были подобны условиям, использованным для сушки сухого состава I-А в примере 1 и условия для партии D (III-D) были подобны условиям, использованным для сушки сухого состава I-D в примере 1. Частицы партий В и С были получены из соответствующих исходных составов в сушилке Büchi Mini при условиях процесса, подобных условиям, использованным для сушки при распылении составов I-В и I-С в примере 1, за исключением следующих условий. Скорость потока жидкого состава была равна 8,3 мл/мин для состава III-В и 7 мл/мин для состава III-С. Для состава III-В температура на выходе составила примерно 83°С и для состава III-С она была равна примерно 92°С. В случае состава III-В показатель аспиратора был равен 80%.
| Таблица 9 | |
| Данные для четырех партий частиц состава III |
| Состав: | III-А | III-В | III-С | III-D |
| Смешение исходного жидкого состава | Статическое | Периодическое | Периодическое | Статическое |
| Общая концентрация твердых частиц | 10 г/л | 5 г/л | 5 г/л | 15 г/л |
| Общее количество твердых веществ | 400 г | 2,5 г | 9,5 г | 185 г |
| Общий объем воды | 40 л | 0,5 л | 1,9 л | 37 л |
| Количество лейцина в 1 л | 1,00 г | 0,5 г | 0,5 г | 0,5 г |
| Количество сульфата натрия в 1 л | 5,04 г | 2,52 г | 2,52 г | 2,52 г |
| Количество дигидрата хлорида кальция в 1 л | 5,25 г | 2,61 г | 2,61 г | 2,61 г |
Некоторые из физических свойств, полученных в четырех отдельных партиях (составы III-А, III-В, III-С и III-D), приведены в Таблице 10, другие данные для сухих порошков, приготовленных из исходного состава III-А приведены ниже. Количество фракции мелких частиц (FPF), измеренное методом гравиметрического анализа в 8 - стадийном импакторе Andersen Cascade Impactor, в среднем составило 68,7% для FPF размером менее 5,6 мкм и 51,5% для FPF размером менее 3,4 мкм. Аэродинамический диаметр также был измерен методом гравиметрического анализа в ACI (Andersen Cascade Impactor). Средняя величина массового медианного аэродинамического диаметра (MMAD) была равна 2,59 мкм. Объемный размер был определен методом лазерной дифракции на системе HELOS/RODOS. Средняя величина объемного медианного диаметра (×50) при давлении равном 1 бар составила 2,50 мкм. Кроме того, порошок характеризовался сравнительно независимой скоростью текучести, что можно видеть по отношению величины ×50, измеренной при давлении 0,5 бар, к величине х50, измеренной при давлении 4,0 бар, которое составило 1,47. Величина для отношения 1/4 бар для этих частиц была равна 1,42.
Дополнительные свойства сухих порошков, полученных из исходного состава III-D приведены ниже. Количество фракции мелких частиц (FPF), измеренное методом гравиметрического анализа в 8 - стадийном импакторе Andersen Cascade Impactor, в среднем составил 77,9% для FPF размером менее 5,6 мкм и 68,3% для FPF размером менее 3,4 мкм. Аэродинамический диаметр также был измерен методом гравиметрического анализа в ACI (Andersen Cascade Impactor). Средняя величина массового медианного аэродинамического диаметра (MMAD) была равна 2,17 мкм. Объемный размер был определен методом лазерной дифракции на системе HELOS/RODOS. Средняя величина объемного медианного диаметра (×50) при давлении равном 1 бар составила 1,90 мкм. Кроме того, порошок характеризовался сравнительно независимой скоростью текучести, что можно видеть по отношению величины ×50, измеренной при давлении 0,5 бар, к величине ×50, измеренной при давлении 4,0 бар, которое составило 1,17. Величина для отношения 1/4 бар для этих частиц была равна 1,63.
| Таблица 10 | ||||
| Данные для четырех партий частиц состава III, полученные в ACI-2 | ||||
| Состав: | III-А | III-В | III-С | III-D |
| FPF менее 5,6 мкм в ACI-2 (%) | 82,7 | 62,0 | 69,0 | 82,8 |
| FPF менее 3,4 мкм в ACI-2 {%) | 60,1 | 47,4 | 53,2 | 70,9 |
Дополнительная информация, касающаяся свойств порошков и/или частиц состава III, полученных в этом примере, приведена в Таблицах или на графиках, показанных на Фигурах 1А-1F и 2-4. SEM проводили, как описано выше (Фиг.5С).
ПРИМЕР 4
В этом примере говорится о выделившейся из ингалятора дозе сухих порошков партий I-B, II-В и III-В.
Метод: высушенными при распылении порошками трех различных партий состава (I-В, II-В и III-В) заполняли наполовину (примерно 13-30 мг в зависимости от порошка), капсулы размера 2 из НРМС (Quali - V, Qualicaps, Whitsett, NC). Капсулы перед помещением в одну из четырех капсул DPIs прокалывали для того, чтобы получить адекватные отверстия в капсуле. Затем капсулы помещали горизонтально в ингаляторы, которые затем соединяли с несерийной камерой. В каждом из ингаляторов имелся датчик давления, соединенный с монитором для мониторинга скорости потока через ингалятор во время опыта. После начала опыта через каждый ингалятор тремя короткими пусками, по 0,3 с каждый, осуществляемыми через 1 мин, пропускали поток воздуха со скоростью 45 л/мин. Во время каждого пуска воздух, проходящий через ингалятор, заставлял капсулу вращаться и выделять порошок в одну из четырех подкамер, которая содержала один ряд лунок с 3 тканевыми культурами, формирующими дно подкамеры. Облаку аэрозоля давали осесть в течение 1 мин перед следующими 3 пусками, всего через ингалятор пропускали 0,68 л воздуха. Продолжительность пропускания и общую скорость потока воздуха контролировали при помощи контролирующего устройства (ТРК - 2000, MSP Corporation, Shoreview, MN) и записывали при помощи флоуметра (model# 3063, TSI Inc., Shoreview, MN). Скорости потока в отдельных ингаляторах измеряли при помощи датчиков давления (model #ASCX01DN, Honeywell International Inc., Morristown, NJ), которые были предварительно откалиброваны и сигнал которых превращался в величину скорости потока через код использования Lab - view. В одном случае камера помещалась на лабораторный стол при условиях окружающей среды, в то время, как в двух других случаях она помещалась в климатическую камеру (Darwin Chambers Company, St. Louis, МО), в которой температура равнялась 37°С и относительная влажность RH составляла 90%. В первом случае выдержки в климатической камере капсулы прокалывали и помещали в ингаляторы при условиях окружающей среды, дверь камеры открывали, присоединяли ингаляторы и пропускали воздух примерно через 30 с после помещения капсул в камеру. Во втором случае капсулы вначале помещали непроколотыми в климатическую камеру на 3 мин, затем удаляли из камеры, прокалывали и загружали при условиях окружающей среды, и пропускали воздух в течение 30 с пребывания второй раз в камере. После каждого опыта капсулы удаляли из ингаляторов и взвешивали и использовали для определения количества порошка, выделившегося из капсулы. В каждом из этих трех случаев порошки каждой из испытанных партий воздействовали на тканевые культуры в двух 12 - луночных планшетах (в каждом планшете требовались 4 капсулы в четырех ингаляторах, каждый из которых доставлял порошок в 3 лунки), всего каждый порошок выделялся из 8 капсул при каждом наборе температуры и влажности.
Как показано в Таблице 11 ниже, для всех трех партий порошков (I-В, II-В и III-В) среднее количество порошка, выделившегося из капсулы, было больше 99% (определено на основе изменения веса капсулы).
| Таблица 11 | |
| Выделившаяся доза, % | |
| Порция порошка | Выдел. доза, % |
| I-В | 99,45 |
| II-В | 100,0 |
| III-В | 99,38 |
ПРИМЕР 5
В этом примере описаны свойства дисперсий и плотность порошков составов I-А, II-А, III-А и состава плацебо с лейцином, как показано в Таблице 12. Все данные, приведенные в Таблице 12, показаны также на Фигурах 1А-1Е. Как показывают результаты, приведенные в Таблице 12, все составы обладали хорошей диспергируемостью, что означает, что их измеренные объемные размеры относительно не зависят от давления в системе HELOS/RODOS. Как показано в таблице 12, отношение объемных медианных размеров, полученных при низком давлении дисперсии (0,5 бар или 1,0 бар) и при высоком давлении дисперсии (4,0 бар) может быть использовано в качестве индикатора диспергируемости. Эти величины обозначаются как отношение 0,5 бар/4,0 бар или отношение 1,0 бар/4.0 бар.
Насыпной вес после утряски был определен модифицированным методом USP<616> с применением пробирки микроцентрифуги объемом 1,5 см3, средняя величина насыпного веса после 1000 встряхиваний составила 0,29, 0,69, 0,34 и 0,04 г/см3, соответственно. Величины MMAD, измеренные в восьмистадийном Andersen Cascade Impactor (ACI), были равны 2,72, 2,89, 2.59 и 4,29 мкм. соответственно. Количество FPF размером менее 3.4 мкм, измеренное в указанном ACI, составило 41,7%, 39,7%, 51,5% и 17,4%, соответственно. Объемный размер был определен методом лазерной дифракции, средние величины объемного медианного размера (×50) при давлении 1 бар были равны 2,57 мкм, 1,51 мкм, 2,50 мкм и 6,47 мкм, соответственно. Величины при давлении, равном 0,5 бар, 2,0 бар и 4,0 бар, приведены в Таблице 12. Кроме того, порошок характеризовался сравнительно независимой скоростью текучести, что можно видеть по отношению величины ×50, измеренной при давлении 0,5 бар, к величине ×50, измеренной при давлении 4,0 бар, которое приведено в таблице 12. Эти величины составили 1,19, 1,12, 1,47 и 1,62, соответственно. Таблица также включает величины отношения 1,0 бар/4,0 бар для сравнения, так как это является другим показателем зависимости скорости потока.
| Таблица 12 | |||||||||
| Получение дисперсии и величины плотности составов I-А, II-А, III-А и плацебо | |||||||||
| Плотность | ACI-8, гравиметрия | Spraytec | HELOS/RODOS | ||||||
| Состав | Насыпной вес (г/см3) | MMAD (мкм) | FPF_TD <3,4 мкм | FPF_TD <5,6 мкм | Dv50 (мкм) | Регулятор давл. (бар) | ×50 (мкм) | 0.5 бар/4 бар | 1 бар/4 бар |
| Средн. | Средн. | Средн. | Средн. | Средн. | Средн. | ||||
| 0,5 | 2,62 | ||||||||
| Состав I-А | 0,29 | 2,72 | 41,7% | 56,2% | 3,07 | 1,0 | 2,57 | 1,19 | 1,17 |
| 2,0 | 2,49 | ||||||||
| 4,0 | 2,20 | ||||||||
| 0.5 | 1.57 | ||||||||
| Состав II-А | 0,69 | 2,89 | 39,7% | 55,3% | 1,78 | 1,0 | 1,51 | 1,12 | 1,08 |
| 2,0 | 1,47 | ||||||||
| 4,0 | 1,40 | ||||||||
| 0,5 | 2,59 | ||||||||
| Состав III-А | 0,34 | 2,59 | 51.5% | 68,7% | 3,05 | 1,0 | 2,50 | 1,47 | 1,42 |
| 2,0 | 2,17 | ||||||||
| 4,0 | 1,76 | ||||||||
| 0,5 | 7,68 | ||||||||
| Плацебо (100% лейцина) | 0,04 | 4,29 | 17,4% | 32,5% | 21,77 | 1,0 | 6,47 | 1,62 | 1,37 |
| 2,0 | 5,69 | ||||||||
| 4,0 | 4,74 | ||||||||
ПРИМЕР 6
Этот пример описывает приготовление сухих порошков с использованием исходных составов 6.1-6.9, что показано в Таблице 13 ниже.
| Таблица 13 | |
| Исходные составы 6.1-6.9 | |
| Состав | Состав и вес, % (вес/вес) |
| 6.1 | 10,0% лейцина, 58,6% лактата кальция, 31,4% хлорида натрия |
| 6.2 | 50,0% лейцина, 48,4% лактата кальция, 1,6% хлорида натрия |
| 6.3 | 10,0% лейцина, 66,6% лактата кальция, 23,4% хлорида натрия |
| 6.4 | 10,0% лейцина, 35,1% хлорида кальция, 54,9% цитрата натрия |
| 6.5 | 67,1% лейцина, 30,0% хлорида кальция, 2,9% цитрата натрия |
| 6.6 | 39,0% хлорида кальция, 61,0% цитрата натрия |
| 6.7 | 10,0% лейцина, 39,6% хлорида кальция, 50,4% сульфата натрия |
| 6.8 | 67,6% лейцина, 30,0% хлорида кальция, 2,4% сульфата натрия |
| 6.9 | 44,0% хлорида кальция, 56,0% сульфата натрия |
Общий способ получения сухих порошков в этом примере похож на способ получения порошков, описанный в предыдущих примерах, за исключением того, что порошки в этом примере были высушены при распылении в сушилке Büchi В - 290, снабженной высокопроизводительным циклоном High Performance cyclone. Составы 6.1, 6.4 и 6.7 в этом примере соответствуют составам II-В, I-В и III-В, соответственно, в примерах, приведенных выше.
Физические свойства порошков и/или частиц, полученных в этом примере, приведены в Таблицах, показанных на Фигурах 6А-6В. Составы 6.1-6.9 в Таблице 13 соответствуют составам 6.1-6.9 на Фигурах 6А и 6В, соответственно. На Фигуре 6А параметры ×50 и Dv50 относятся к объемному медианному диаметру или объемному медианному геометрическому диаметру (VMGD); и величина GSD относится к геометрическому стандартному отклонению. На Фигуре 6 В выход в % % относится к отношению величины веса выделившегося продукта в сборнике, присоединенном к циклону High Performance cyclone, к весу растворенных веществ в исходном составе. Все другие сокращения описаны в данном описании.
ПРИМЕР 7
В этом примере описаны величины доз порошков, полученных из составов 6.1-6.9 и выделившихся из ингалятора для сухих порошков при комнатной и при повышенной температурах. Некоторые из этих данных были приведены выше в примере 4.
Метод: высушенными при распылении порошками девяти различных партий состава (6.1-6.9) заполняли наполовину (примерно 13-30 мг в зависимости от порошка) капсулы размера 2 из НРМС (Quali-V, Qualicaps, Whitsett, NC). Капсулы перед помещением в одну из четырех капсул DPIs прокалывали для того, чтобы получить адекватные отверстия в капсуле. Затем капсулы помещали горизонтально в ингаляторы, которые затем соединяли с несерийной камерой. В каждом из ингаляторов имелся датчик давления, соединенный с монитором для мониторинга скорости потока через ингалятор во время опыта. После начала опыта через каждый ингалятор тремя короткими пусками, по 0,3 с каждый, осуществляемыми через 1 мин, пропускали поток воздуха со скоростью 45 л/мин. Во время каждого пуска воздух, проходящий через ингалятор, заставлял капсулу вращаться и выделять порошок в одну из четырех подкамер, которая содержала один ряд лунок с 3 тканевыми культурами, формирующими дно подкамеры. Облаку аэрозоля давали осесть в течение 1 мин перед следующими 3 пусками, всего через ингалятор пропускали 0,68 л воздуха. Продолжительность пропускания и общую скорость потока воздуха контролировали при помощи контролирующего устройства (ТРК - 2000, MSP Corporation, Shoreview, MN) и записывали при помощи флоуметра (model# 3063, TSI Inc., Shoreview, MN). Скорости потока в отдельных ингаляторах измеряли при помощи датчиков давления (model #ASCX01DN, Honeywell International Inc., Morristown, NJ), которые были предварительно откалиброваны и сигнал которых превращался в величину скорости потока через код использования Lab - view. В одном случае камера помещалась на лабораторный стол при условиях окружающей среды, в то время, как в двух других случаях она помещалась в климатическую камеру (Darwin Chambers Company, St. Louis, МО), в которой температура равнялась 37°С и относительная влажность RH составляла 90%. В первом случае выдержки в климатической камере капсулы прокалывали и помещали в ингаляторы при условиях окружающей среды, дверь камеры открывали, присоединяли ингаляторы и пропускали воздух примерно через 30 с после помещения капсул в камеру. Во втором случае капсулы вначале помещали непроколотыми в климатическую камеру на 3 мин, затем удаляли из камеры, прокалывали и загружали при условиях окружающей среды, и пропускали воздух в течение 30 с пребывания второй раз в камере. После каждого опыта капсулы удаляли из ингаляторов и взвешивали и использовали для определения количества порошка, выделившегося из капсулы. В каждом из этих трех случаев порошки каждой из испытанных партий воздействовали на тканевые культуры в двух 12 - луночных планшетах (в каждом планшете требовались 4 капсулы в четырех ингаляторах, каждый из которых доставлял порошок в 3 лунки), всего каждый порошок выделялся из 8 капсул при каждом наборе температуры и влажности.
Как показано в Таблице 14 ниже, для всех девяти партий порошков (6.1-6.9) среднее количество порошка, выделившегося из капсулы, было больше 98% (определено на основе изменения веса капсулы).
| Таблица 14 | |
| Выделившаяся доза, % | |
| Состав | Выделив, доза (%) |
| 6.1 | 100,00% |
| 6.2 | 98,86% |
| 6.3 | 99,85% |
| 6.4 | 99,45% |
| 6.5 | 99.68% |
| 6.6 | 100,00% |
| 6.7 | 99,38% |
| 6.8 | 98,05% |
| 6.9 | 100,00% |
ПРИМЕР 8
В этом примере описаны результаты опыта определения стабильности в течение короткого промежутка времени, который проводили для сухих порошков, полученных из исходных составов 6.1, 6.4 и 6.7.
Важной характеристикой фармацевтических сухих порошков является их стабильность при различных величинах температуры и влажности. К получению нестабильного порошка может привести тенденция порошка абсорбировать влагу из окружающей среды, что, по всей вероятности, затем приводит к агломерации частиц и изменению истинного размера частиц порошка при тех же условиях получения дисперсии. Высушенные при распылении порошки выдерживали при различных условиях в течение промежутка времени от одной недели до трех или более месяцев и периодически определяли распределение частиц по размерам. Условия хранения включали наличие закрытых капсул во флаконах, выдерживаемых при температуре 25°С и относительной влажности RH, равной 60%, закрытых капсул во флаконах, выдерживаемых при температуре 40°С и влажности RH, равной 75%, закрытых капсул во флаконах, выдерживаемых при комнатной температуре и влажности RH, равной 40%, открытых капсул, выдерживаемых при температуре 30°С и влажности RH, равной 65%, и открытых капсул, выдерживаемых при температуре 40°С и влажности RH, равной 75%. Капсулы размера 3 из НРМС (Quali-V, Qualicaps, Whitsett, NC) были наполовину заполнены каждым порошком. Один образец испытывали сразу же в Spraytec (Malvern Instruments Inc., Westborough, MA), системе, использующей метод лазерной дифракции частиц, где сухие порошки могут быть диспергированы из ингалятора с применением начальной фазы работы камеры ингалятора. Примерно 16 капсул были заполнены каждым из порошков, полученных из исходных растворов составов 6.1, 6.4 и 6.7. Капсулы выдерживали в лаборатории при контролируемых условиях влажности и температуры (-23-28% RH), а также вне лаборатории при переменных температуре и влажности (-40-75% RH). Капсулы хранили при температуре 25°С и 60% RH, 40°С и 75% RH, 30°С и 65% RH и 30°С и 75% RH в климатических камерах (Darwin Chambers Company, St. Louis, МО), где выдерживались указанные условия. В определенные моменты времени (от 30 мин до 3 мес), от одной до трех капсул испытывали в каждой камере, определяли при помощи системы Spraytec геометрическое распределение частиц по размерам и аэродинамические свойства частиц в ACI-2.
Обычно порошки, которые были в закрытых капсулах во флаконах, оставались стабильными в течение длительного периода времени, более трех мес. Порошки, которые были в открытых капсулах, агломерировали после выдержки при высоких значениях влажности. Данные по стабильности приведены в Таблице 15 ниже.
| Таблица 15 | |
| Результаты определения стабильности после выдержки в течение короткого времени |
| Противоион | Эксципиент | Закрытые капсулы во флаконах | Закрытые капсулы, без флаконов | Открытые капсулы, без флаконов | ||||||
| Состав | 25С/60% RH | 40С/75% RH | Sprayteс 40% RH | ACl-2 40% RH | Sprayteс 30С/65%RH | ACl-2 30С/65% RH | Spraytec 30С/75% RH | ACl-2 30С/75%RH | ||
| 6.1 | Лактат | 10% лейцина | >3 мес | 0.5-1 мес | >8дн | 4-6дн | >30 мин | >30 мин | >30 мин | >30 мин |
| 6.4 | Цитрат | 10% лейцина | >3 мес | 1-3 мес | >7дн | н/о | >30 мин | >30 мин | <30 мин | >30 мин |
| 6.7 | Сульфат | 10% лейцина | >3 мес | 1-3 мес | 2-7дн | н/о | >30 мин | >30 мин | >30 мин | >30 мин |
ПРИМЕР 9
Этот пример описывает способ анализа перемещения бактерий, проведенный с применением сухих порошков, полученных из исходных составов А-Е.
Способ: Для определения влияния составов сухих порошков в виде аэрозоля на прохождение бактерий через слизистую оболочку применяли модель транслокации бактерий. В этой модели на апикальную поверхность 12 мм мембраны Costar Transwell (Corning, Lowell, MA; размер пор 3.0 мкм) добавляли 200 мкл 4% альгината натрия (Sigma-Aldrich, St. Louis, МО) и затем осуществляли воздействие сухих порошков. Аэрозоль сухих порошков вводили в камеру, используя порошковдуватель сухих порошков (Perm - Century, Inc., Philadelphia, PA), и давали аэрозолю осесть под действием силы тяжести в течение 5 мин. Затем на апикальную поверхность миметика добавляли 10 мкл Klebsiella pneumoniae (-10 ед/мл физиологического раствора). В различные моменты времени после добавления бактерий удаляли аликвоты базолатерального буфера и путем серийного разбавления и помещения на агаровые пластины с кровью определяли количество бактерий. Схема проведения этого опыта показана на Фигуре 7. Концентрацию соли, которая была доставлена в каждый трансвелл, определяли количественно методом ВЭЖХ. Для этой цели пустые лунки 12 - луночного планшета с клеточной культурой, которые соседствовали с каждым трансвеллом и подвергались воздействию такой же дозы состава, промывали водой и разбавляли 1:1 уксусной кислотой для солюбилизации кальциевых солей в каждом порошке.
Изучали влияние порошков, содержавших кальций, на перемещение К. pneumoniae через слизистую оболочку миметика из альгината натрия. Проводили скрининг составов сухих порошков, включающих соли кальция с различными профилями растворимости вместе с лейцином и хлоридом натрия, с целью определения активности. В Таблице 16 (ниже) указаны исходные составы порошков, которые были испытаны. Была необходима концентрация лейцина равная 50,0% (вес/вес), в отличие от составов, содержавших 10,0% (вес/вес) лейцина, описанных в примерах, приведенных выше вследствие ограничений в их дозировании и определении в модели транслокации. Мольное отношение кальция к натрию было выбрано для каждого порошка равным 1:1 без необходимости сильного уменьшения относительных весов каждой конкретной соли. Таким образом, составы с лактатом, цитратом и ацетатом имели это отношение не 1:1 для того, чтобы поддерживать количество хлорида натрия и хлорида кальция в этих составах, составляющее, соответственно, выше примерно 10% по весу.
| Таблица 16 | ||
| Исходные составы | ||
| Состав | Композиция (вес/вес) | Мольное отношение Са:Na |
| А | 50,0% лейцина, 22,0% хлорида кальция, 28,0% сульфата натрия | 1,0:2,0 |
| В | 50,0% лейцина, 25,5% хлорида кальция, 24,5% карбоната натрия | 1,0:2,0 |
| С | 50,0% лейцина, 19,5% хлорида кальция, 30,5% цитрата натрия | 1,0:2,0 |
| D | 50,0% лейцина, 37,0% лактата кальция, 13,0% хлорида натрия | 1,0:1,3 |
| Е | 50,0% лейцина, 33,75% ацетата кальция, 16,25% хлорида натрия | 1,0:1,8 |
Результаты, полученные в этом опыте, показаны на Фигурах 8А и 8 В. На этих двух разных Фигурах показаны два разных эксперимента, которые проводились в одних и тех же условиях. Контрольный опыт с лейцином и данные с сульфатом позволяют провести сравнение между этими двумя экспериментами. Порошки, содержавшие анионы сульфата, лактата и ацетата, то есть сухие порошки, полученные из исходных составов А, D и Е, соответственно, приводили к уменьшению движения бактерий через миметик, в то время, как порошки, содержавшие анионы карбоната и цитрата, то есть порошки, полученные из исходных составов В и С, не оказывали влияния. Эти данные коррелировали с известными величинами растворимости солей кальция в воде, что дает возможность предположить, что отсутствие способности карбонатной и цитратной солей ингибировать перемещение К.pneumoniae может быть связано с растворимостью этих порошков на поверхности миметика из альгината натрия. Этот вывод основывается также на вероятном предположении того, что реакция ионного обмена, описанная ранее, завершается в процессе сушки при распылении и что формой соли кальция в составах А-Е являются сульфат кальция, карбонат кальция, цитрат кальция, лактат кальция и ацетат кальция, соответственно. Растворимость этих солей от наименее растворимой до наиболее растворимой следующая: карбонат кальция<цитрат кальция<сульфат кальция<лактат кальция<ацетат кальция. (См. Таблицу 1 выше)
ПРИМЕР 10
В этом примере описано поведение сухих порошков при уменьшении репликации вирусов с применением модели вирусной репликации.
В этом примере описан ряд опытов по изучению зависимости от дозы для различных сухих порошков, полученных из исходных составов, содержащих различные соли кальция. Сухие порошки получали из составов, содержавших лейцин, соль кальция (лактат или хлорид) и соль натрия (хлорид, сульфат, цитрат или карбонат). Исходные составы 10 - 1, 10-2 и 10-3 сушили при распылении в минисушилке Büchi В-290. При этом в системе применялся осушитель Büchi В-296 для обеспечения стабильных температуры и влажности воздуха, используемого для сушки при распылении. Состав 10-4 сушили при распылении в сушилке Niro Mobile Minor Spray Dryer при проведении открытого цикла при помощи азота.
Были приготовлены четыре жидких состава, компоненты которых и соотношение (весовое) указаны в Таблице 17.
| Таблица 17 | |||
| Исходные составы | |||
| Состав | Композиция составов (вес/вес) | Номер партии | Мольное отношение Са:Na |
| 10-1 | 50,0% лейцина, 37,0% лактата кальция, 13,0% хлорида натрия | 45.6.1 | 1,0:1,3 |
| 10-2 | 50,0% лейцина, 22,0% хлорида кальция, 28,0% сульфата натрия | 27.155.1 | 1,0:2,0 |
| 10-3 | 50,0% лейцина, 19,5% хлорида кальция, 30,5% цитрата натрия | 27.156.1 | 1,0:2,0 |
| 10-4 | 50,0% лейцина, 25,5% хлорида кальция, 24,5% карбоната натрия | 26.019.1 | 1,0:2,0 |
Была необходима концентрация лейцина равная 50,0% (вес/вес), в отличие от составов, содержавших 10,0% (вес/вес) лейцина, описанных в примерах, приведенных выше вследствие ограничений в их дозировании и определении в модели репликации вирусов. Мольное отношение кальция к натрию было выбрано для каждого порошка равным 1:1 без необходимости сильного уменьшения относительных весов каждой конкретной соли. Таким образом, составы с лактатом и цитратом имели это отношение не равное 1:1 для того, чтобы поддерживать количество хлорида натрия и хлорида кальция в этих составах, составляющее, соответственно, выше примерно 10% по весу.
Составы 10-1, 10-2 и 10-3 сушили при распылении при концентрации твердых частиц в исходных составах равной 5 г/л, при этом точное количество солей и эксципиента, растворенных в ультрачистой воде, и ее конкретный объем менялись. Применялись следующие условия: температура на входе в сушилку была равна 220°С, скорость жидкого потока составляла примерно 10 мл/мин, температура окружающей среды составляла 23,2-24,6°С, относительная влажность RH была равна 19-21% и осушающий воздух имел параметры 3-5°С и 30% RH. Температура на выходе из сушилки, скорость в циклоне и аспираторе менялись. Состав 10-1 сушили при распылении с применение высокопроизводительного циклона и параметра аспиратора равного 80% при температуре на выходе равной 93°С. Сухие составы 10-2 и 10-3 получали с применение циклона при параметре аспиратора 100% и температуре на выходе равной 111-115°С. Состав 10-4 сушили при распылении при концентрации твердых частиц в исходных составах равной 2,7 г/л при следующих параметрах: температуре на входе равной 140°С, температуре на выходе равной 75°С, скорости исходного жидкого потока равной 30 мл/мин, скорости потока газа равной 100 кг/ч, скорости потока атомизирующего газа равной 20 г/мин и давлении в камере сушильного барабана равном - 2 "WC (вод. ст.).
Для изучения свойств составов 1-4 использовали модель клеточной культуры гриппа. Клетки Calu - 3 (American Type Culture Collection, Manasas, VA) культивировали на проницаемых мембранах (12 мм Transwells; размер пор 0,4 мкм, Corning Lowell, MA) до тех пор, пока при удалении апикальной среды и выдерживании при температуре равной 37°С/5% СО2 не получались конфлюентные (мембрана была полностью покрыта клетками) культуры с границей раздела (ALI) воздух - жидкость. Клетки культивировали в течение >2 нед (ALI) перед каждым опытом. Перед каждым экспериментом апикальная поверхность каждого из трансвеллов промывалась 3 раза PBS (Hyclone, Logan, UT). Клетки Calu - 3 подвергались воздействию сухих порошков с применением патентованной камеры для осаждения сухих порошков. Для того, чтобы клетки подверглись воздействию эквивалентных доз кальция, капсулы заполняли различными количествами каждого порошка. Большая, средняя и низкая нагрузки были рассчитаны на основе подбора количества кальция, доставленного каждым порошком (4,23 мг, 1,06 мг и 0,35 мг). Для каждого испытуемого порошка взвешивали по две пустые капсулы, заполненные капсулы и капсулы после окончания опыта для того, чтобы определить выделившуюся дозу порошка. В Таблице 18 (ниже) приведены величины весов капсул до воздействия порошков и после него и концентрации кальция, доставленного в клетки, определенные методом ВЭЖХ. Сразу же после окончания процесса воздействия порошков базолатеральная среда (среда на дне трансвелла) была заменена свежей порцией среды. Лунки в каждом опыте в тройном повторе обрабатывались сухими порошками каждого из исходных составов. Второй планшет с клеточной культурой подвергался воздействию тех же самых сухих порошков исходных составов с целью количественного определения соли или кальция, доставленных в клетки. Через час после окончания действия порошков клетки инфицировали 10 мкл вируса гриппа Influenza A/WSN/33/1 (H1N1) или Influenza A/Panama/2007/99 (H3N2) с множественностью заражения 0,1 - 0,01 (0,1 - 0,01 вириона на клетку). Через 4 ч после обработки аэрозолем апикальные поверхности промывали для удаления избытка сухих порошков и неприсоединенные вирусы и клетки культивировали еще в течение 20 ч при температуре 37°С в присутствии 5% СО2. Через 24 ч после обработки аэрозолем вирусы, высвободившиеся на апикальной поверхности инфицированных клеток, собирали в культуральной среде или PBS и количественно определяли концентрацию вирусов в промывочной среде методом измерения TCID50 (50% инфекционной дозы клеточной культуры). Метод определения TCID50 является стандартным методом анализа с титрованием в конечной точке, применяемым для количественного определения количества вирусов в образце.
Таблица 18. Сухие порошки, полученные из исходных составов 10-1-10-4, испытывали для оценки их действия на инфекцию Influenza A/WSN/33/1 в модели клеточной культуры. Для доставки эквивалентного количества иона кальция (Са+2) рассчитывали нужное количество каждого состава сухого порошка, необходимое для заполнения капсул. Капсулы Qualicap взвешивали пустыми, заполненными и затем взвешивали капсулы после окончания действия порошков с целью определения величины высвободившейся дозы. Трипликатные лунки подвергали обработке порошками из каждой капсулы и затем лунки промывали. Методом ВЭЖХ определяли количество Са+2, доставленного в клетки из этих образцов.
* означает использование двух капсул для получения нужного веса для заполнения капсул.
а обозначает n=3, b обозначает n=1
| Исходный состав (для получения сухих порошков) | Загрузка капсулы (мг) | Вес пустой капсулы (мг) | Вес заполненной капсулы (мг) | Вес капсулы после опыта (мг) | Конц. иона кальция, опред. методом ВЭЖХ (мкг/см2) |
| 10-1 (50,0% лейцина, 22,0% хлорида кальция, 28,0% сульфата натрия) | 53,18 | 31,7 | 83,0 | 31,9 | 20,5±0.7а |
| 13,29 | 32,5 | 45,9 | 33,9 | 5,8b | |
| 4,43 | 33,3 | 38,4 | 33,9 | 2,8b | |
| 10-2 (50,0% лейцина, 37,0% лактата кальция, 13,0% хлорида натрия) | 62,17 | 64,972, 63,122* | 99,649, 98,881* | 64,994, 63,679* | 50,9+1,1а |
| 15,54 | 63,525 | 81,926 | 68,141 | 12.7±1,7а | |
| 5,18 | 62.453 | 67,796 | 62,49 | 4,0b | |
| 10-3 (50,0% лейцина, 19,5% хлорида кальция, 30,5% цитрата натрия) |
60,0 | 64,4 | 123,6 | 81,994 | 20,5±5,7а |
| 14,99 | 64,0 | 78,5 | 65,388 | 7,6±0,9а | |
| 5,00 | 63,5 | 70,3 | 63,829 | 3,6±1,5а | |
| 10-4 (50,0% лейцина, 25,5% хлорида кальция, 24,5% карбоната натрия) |
45,88 | 64,6 | 104,7 | 66,685 | 28,1±7,3а |
| 11,47 | 61,5 | 72,0 | 63,186 | 8,1±2,6а | |
| 3,82 | 61,8 | 62,6 | 63,341 | 5,62±2,7а |
ПРИМЕР 10А
Сухой порошок, приготовленный из исходных составов 10-1-10-4, уменьшает степень инфицирования вирусом Influenza А/ WSN /33/1 (H1N12) в зависимости от дозы порошка.
Для определения этого действия сухих порошков на вирус гриппа в модели клеточной культуры клетки Calu - 3 подвергались действию четырех разных порошкообразных составов, каждый из которых состоял из 50% лейцина, соли кальция и хлорида натрия. Степень инфицирования вирусом оценивали путем определения количества репликаций вируса в течение 24 ч. Состав испытанных порошков приведен выше в Таблице 18, эти составы включали карбонатную, лактатную, сульфатную и цитратную соли. Для достижения воздействия эквивалентных количеств кальция из четырех составов, содержащих кальций, капсулы заполняли соответствующими рассчитанными количествами порошков перед дозированием. Клетки, не подвергавшиеся воздействию состава (на воздухе), использовали в качестве контрольных клеток.
Как видно на Фигуре 9, каждый состав порошка проявлял свойство уменьшать инфекцию вирусом гриппа в зависимости от дозы; однако, величина этого эффекта была различной у четырех порошков. При низких концентрациях кальция наиболее эффективным был лактат кальция, что дает возможность предположить, что он является наиболее активным из испытанных порошков. При высоких концентрациях кальция порошки с лактатом кальция и цитратом проявляли сходную активность. Дополнительное испытание порошка с цитратом кальция с даже более высокими концентрациями может продемонстрировать, что он является самым активным порошком. Порошок с сульфатом кальция характеризовался промежуточным эффектом и был сравним с порошком с цитратом кальция при применении нескольких концентраций. Порошок с карбонатом кальция оказывал минимальное действие на репликацию вируса даже при самых высоких концентрациях (менее, чем в 10 раз). Следует отметить, что порошок с карбонатом кальция является наименее растворимым из испытанных порошков.
Как показано на Фигуре 9, испытанные сухие порошки влияют на степень инфицирования в зависимости от величины дозы. Клетки Calu - 3, не подвергавшиеся воздействию состава, использовали в качестве контрольных клеток и сравнивали с клетками Calu - 3, которые подверглись действию составов сухих порошков при различной степени заполнения капсул. Затем определяли количество вирусов, высвободившихся из клеток, подвергшихся действию каждого состава аэрозоля. Столбцы представляют среднее и стандартное отклонение для трипликатных лунок при каждом наборе условий. Данные анализировали с применением однопроходного статистического метода анализа ANOVA и метода множественного сравнения данных после опыта (критерий Turkey's).
ПРИМЕР 10В
Сухой порошок, приготовленный из исходных составов 10-1 - 10-4, уменьшает степень инфицирования вирусом Influenza A/Panama/2007/99 (H3N2) в зависимости от дозы порошка, что показано в Таблице 19.
Для проведения этого исследования испытывали те же самые порошки для воздействия на второй штамм гриппа [Influenza A/Panama/2007/99 (H3N2)]. Как и примере 10А, клетки Calu - 3 подвергались действию четырех различных составов, каждый из которых содержал 50% лейцина, соль кальция и хлорид натрия. Степень инфицирования вирусом оценивали путем определения количества репликаций вируса в течение 24 ч. Состав испытанных порошков приведен выше в Таблице 19, эти составы включали карбонатную, лактатную, сульфатную и цитратную соли. Для достижения воздействия эквивалентных количеств кальция из четырех составов, содержащих кальций, капсулы заполняли соответствующими рассчитанными количествами порошков перед дозированием. Клетки, не подвергавшиеся воздействию состава (на воздухе), использовали в качестве контрольных клеток.
Как видно на Фигуре 10, при применении этого штамма для каждого порошка наблюдалась похожая эффективность: лактат кальция был наиболее эффективным, цитрат кальция и сульфат кальция проявляли промежуточную активность, а карбонат кальция был наименее эффективным. Эти данные подтверждают широкий спектр активности Са:Na сухих порошков при действии на многие штаммы гриппа.
Таблица 19. Сухие порошки, приготовленные из исходных составов 10-1-10-4, испытывали для оценки их действия на вирус Influenza A/Panama/99/2007 (H3N2). Для доставки эквивалентного количества иона кальция (Са+2) рассчитывали нужное количество каждого состава сухого порошка, необходимое для заполнения капсул. Капсулы Qualicap взвешивали пустыми, заполненными и затем взвешивали капсулы после окончания действия порошков с целью определения величины высвободившейся дозы. Трипликатные лунки подвергали обработке порошками из каждой капсулы и затем лунки промывали. Методом ВЭЖХ определяли количество Са+2, доставленного в клетки из этих образцов.
| Исходный состав (для получения сухих порошков) | Загрузка капсулы (мг) | Вес пустой капсулы (мг) | Вес заполненной капсулы (мг) | Вес капсулы после опыта (мг) | Конц. иона кальция, опред. методом ВЭЖХ (мкг/см2) |
| 10-1 (50,0% лейцина, 22,0% хлорида кальция, 28,0% сульфата натрия) | 53,18 | 31,7 | 83,0 | 31,9 | 20,5°0.7а |
| 13,29 | 32,5 | 45,9 | 33,9 | 5,8b | |
| 4,43 | 33,3 | 38,4 | 33,9 | 2,8b | |
| 10-2 (50,0% лейцина, 37,0% лактата кальция, 13,0% хлорида натрия) | 62,17 | 64,972, | 99,649, | 64,994, | 50,9±1,1а |
| 63,122* | 98,881* | 63,679* | |||
| 15,54 | 63,525 | 81,926 | 68,141 | 12,7±1,7а | |
| 5,18 | 62.453 | 67,796 | 62,49 | 4,0b | |
| 10-3 (50,0% лейцина, 19,5% хлорида кальция, 30,5% цитрата натрия) | 60,0 | 64,4 | 123,6 | 81,994 | 20,5±5,7а |
| 14,99 | 64,0 | 78,5 | 65,388 | 7,6±0,9а | |
| 5,00 | 63,5 | 70,3 | 63,829 | 3,6±1,5а | |
| 10-4 (50,0% лейцина, 25,5% хлорида кальция, 24,5% карбоната натрия) | 45,88 | 64,6 | 104,7 | 66,685 | 28,1±7,3а |
| 11,47 | 61,5 | 72,0 | 63,186 | 8,1±2,6а | |
| 3,82 | 61,8 | 62,6 | 63,341 | 5,62±2,7а |
Как показано на Фигуре 10, сухие порошки, полученные для этого примера, уменьшали инфекцию вируса Influenza A/Panama/99/2007 (H3N2), при этом это действие зависело от дозы. Клетки Calu - 3, не подвергнутые действию составов (0 мкг Са2+/см2), использовались как контрольные и сравнивались с клетками Calu - 3, на которые действовали составы сухих порошков с различной степенью заполнения капсул и, следовательно, с различной концентрацией кальция. Затем определяли концентрацию кальция, доставленного в клетки из каждой капсулы, методом ВЭЖХ при измерении количества кальция в промывной жидкости из пустых планшетов, обработанных каждым составом. Концентрацию вируса, выделившегося клетками, подвергшимися действию каждого состава аэрозоля, количественно определяли через 24 ч после дозирования методом анализа TCID50. Приведенные данные показывают среднее и стандартное отклонение для трипликатных лунок, обработанных каждым составом.
ПРИМЕР 11. In vivo модель гриппа
Этот пример показывает, что составы сухих порошков по изобретению, включающие соли кальция и соли натрия, уменьшают степень инфицирования вирусом гриппа у африканских хорьков. Состав испытанных веществ приведен в Таблице 20. Хорьки в контрольной группе получали порошок, состоящий из 100% лейцина, при тех же условиях. В процессе предварительного in vitro исследования было установлено, что этот контрольный порошок не оказывает влияния на репликацию вируса. Порошки, включающие кальций, и контрольный порошок (состав I, партия: 26-190-F, состав III, партия: 65-009-F, состав II, партия: 65-003-F и лейцин, партия: 65-017-F) были получены в виде аэрозоля в диспергаторе твердых частиц Palas Rotating Brush Generator 1000 (RBG, Palas GmbH, Karlsruhe, Germany). Хорькам (n=8 в группе) вводили ~0,2 мг Са/кг и оценивали степень тяжести инфекции во времени. Каждый состав диспергировали в нос каждого хорька за 1 ч до инфицирования, через 4 ч после инфицирования и затем BID (два раза в день) в течение 4 дн (d1-4). Опыт заканчивали на 10-й день. Два раза в день измеряли температуру тела, начиная со дня 0 опыта. У хорьков, инфицированных вирусом гриппа, обычно наблюдается повышение температуры в течение 2 дн болезни, снижение веса в течение опыта и клинические признаки инфекции, такие как летаргия и чихание. Эти изменения совпадают с увеличением титра вируса гриппа в носу и усилением воспаления в носу.
| Таблица 20 | |
| Составы, испытанные на хорьках | |
| Состав | Композиция |
| Состав I | 10,0% лейцина, 35,1% хлорида кальция, 54,9% цитрата натрия (активность 12,7% иона кальция) |
| Состав II | 10,0% лейцина, 39,6% хлорида кальция, 50,4% сульфата натрия (активность 14,3% иона кальция) |
| Состав III | 10,0% лейцина, 58,6% лактата кальция, 31,4% хлорида натрия (активность 10,8% иона кальция) |
На 4-й день опыта хорькам имплантировали чипы под кожу правого заднего сустава и в плечо. Чип радиоответчика (IPTT-300 Implantable Programmable Temperature and Identification Transponder; Bio Medic Data Systems, Inc, Seaford, Delaware 19973) позволяет идентифицировать хорьков и обеспечивает определение подкожной температуры тела у хорьков во время опыта при помощи электронного контактного считывающего устройства BMDS electronic proximity reader wand (WRS-6007; Biomedic Data Systems Inc, Seaford, Delaware). Величины подкожной температуры тела, измеренные на дни от -3 дня до - 1 дня, были использованы как исходные величины и применены для определения изменения от исходного уровня для каждого животного в течение опыта. Лечение составом сухого порошка, состоящим из лейцина (эсципиент), Са - лактата (состав III), и NaCl, оказывает значительное влияние на температуру тела (Фигуры ЮС и 10D). В этой группе средняя величина температуры тела оставалось на исходном уровне или была ниже и площадь под кривой (AUC) была примерно в 5 раз меньше, чем у контрольной группы. Два других испытанных порошка обладали менее выраженной эффективностью, которая была ограничена различием с контрольной группой в конкретные дни исследования. В частности, и группа, получавшая цитрат Са, и группа, получавшая сульфат кальция Са, характеризовались меньшими температурами тела, чем контрольные животные на 3-й день опыта (Фигуры 11А и 11В, соответственно) и группа, получавшая сульфат Са характеризовалась меньшими величинами температуры тела в последние 3 дня опыта.
ПРИМЕР 12
Этот пример показывает, что составы сухих порошков, содержащие различные эксципиенты, снижают степень инфицирования, но при более высоких дозах, чем состав, содержащий лейцин.
Для оценки влияния вида эксципиента на in vitro эффективность мы испытали два состава сухих порошков (Таблица 21), которые отличались эксципиентом, и сравнивали их эффективность с эффективностью состава III, включающего лейцин, с применением модели репликации вируса. Эти составы содержали одинаковую концентрацию лактата кальция и хлорида натрия и одинаковое весовое количество эксципиента (10%).
| Таблица 21 | |
| Составы с различными эксципиентами, применявшиеся для оценки эффективности против множественных вирусов гриппа |
| Партия | Состав | Композиция | Мольное отношение Са:1Ма | Изготовитель |
| 26-190 F | Состав 1 | 10,0% лейцина, 35,1% хлорида кальция, 54.9% цитрата натрия (активность 12,7% иона кальция) | 1:2 | Niro |
| 65-003-F | Состав II | 10,0% лейцина, 39,6% хлорида кальция, 50,4% сульфата натрия (активность 14,3% иона кальция) | 1:2 | Niro |
| 65-009-F | Состав III | 10,0% лейцина, 58,6% лактата кальция, 31.4% хлорида натрия (активность 10,8% иона кальция) | 1:2 | Niro |
| 45.137.2 | Н/о | 10,0% маннита, 58,6% лактата кальция, 31,4% хлорида натрия (активность 10,8% иона кальция) | 1:2 | Büchi |
| 45.137.3 | Состав XIV | 10,0% мальтодекстрина, 58,6% лактата кальция, 31,4% хлорида натрия (активность 10,8% иона кальция) | 1:2 | Büchi |
Клетки Calu - 3, не подвергавшиеся действию состава, использовали в качестве контрольных и сравнивали с клетками Calu - 3, на которые действовал состав сухого порошка, состоящий из лактата кальция, хлорида натрия и различных эксципиентов. Применяли три разных состава с маннитом и мальтодекстрином с различной степенью заполнения капсул с интервалом доз между 10 и 30 мкг Са2+/см2. Количественно определяли концентрацию вируса, выделившегося из клеток, испытавших воздействие каждого аэрозоля (Фигура 12). На этой Фигуре приведены величины среднего и стандартного отклонения для дупликатных лунок при каждой концентрации. Данные анализировали с применением однофакторного дисперсионного анализа ANOVA и метода множественного сравнения данных после опыта (критерий Tukey). Данные, касающиеся низкой дозы каждого порошка, получены в двух независимых опытах.
Составы, содержащие и маннит, и мальтодекстрин, уменьшают степень инфекции, при этом это действие зависит от величины дозы, однако, эти составы являются значительно менее активными, чем порошок, включающий лейцин. При дозе равной 14,8 мкг Са2+/см2, порошок, содержащий лейцин, уменьшал степень инфекции вирусом гриппа на 2,9±0,2 log10 ТСID50/мл, в то время, как порошок с маннитом при сравнимой дозе (12,2 мкг Са2+/см2) снижал степень инфекции на 0,85±0.0 log10 TCID50/мл и порошок с мальтодекстрином (при дозе 11,9 мкг Са2+/см2) не оказывал влияния на репликацию вируса (Фигура 12). Даже при более высоких дозах (>27 мкг Са2+/ см2), величина максимального снижения в случае наличия маннита (1,9±0,50 log10 TCID50/мл) и наличия мальтодекстрина (2,2±0,14 log10 TCID50/мл) была меньше, чем в случае наличия лейцина. Следует заметить, что предыдущие опыты с порошками, содержащими 100% лейцина, не обладают влиянием этого одного эксципиента на репликацию вируса. Эти данные позволяют предположить, что природа эксципиента может влиять на эффективность составов, содержащих кальций.
ПРИМЕР 13
Этот пример показывает эффективность составов сухих порошков, содержащих соль кальция, а именно, лактат кальция, сульфат кальция или цитрат кальция, при лечении гриппа, пара - гриппа или инфекции, вызванной риновирусом.
Составы порошков I, II и III получали путем сушки при распылении с применением сушилки Mobile Minor spray dryer (Niro, GEA Process Engineering Inc., Columbia, MD). Все растворы содержали твердые вещества в концентрации 10 г/л и были получены из компонентов, перечисленных в Таблице 22. Лейцин и соль кальция растворяли в дистиллированной (DI) воде, а лейцин и соль натрия растворяли в DI воде раздельно и эти два раствора содержали в отдельных сосудах. Атомизацию жидкого состава осуществляли с использованием пневмораспылителя с параллельными потоками (Niro, GEA Process Engineering Inc., Columbia, MD). Жидкий состав подавали при помощи шестеренчатых насосов (Cole - Parmer Instrument Company, Vernon Hills, IL) в статический смеситель (Charles Ross & Son Company, Hauppauge, NY) непосредственно перед введением в пневмораспылитель. В качестве осушающего газа применяли азот и в качестве атомизирующего газа в пневмораспылителе использовали сухой сжатый воздух. Температура газа на входе была равна 282°С и температура на выходе составляла 98°С при скорости подачи жидкого потока равной 70 мл/мин. Подача газа в пневмораспылитель составляла примерно 14,5 кг/ч. Величина давления в сушильной камере была равна - 2 "WC. Продукт, высушенный при распылении, собирали с фильтра в контейнер.
| Таблица 22 | ||||
| Составы, использованные для оценки их эффективности в отношении различных респираторных вирусов | ||||
| Партия # | Состав | Композиция | Мольное отношение Са:Na | Изготовитель |
| 26-190-F | Состав I | 10,0% лейцина, 35,1% хлорида кальция, 54,9% цитрата натрия (активность 12,7% иона кальция) | 1:2 | Niro |
| 65-003-F | Состав III | 10,0% лейцина, 39,6% хлорида кальция, 50,4% сульфата натрия (активность 14,3% иона кальция) | 1:2 | Niro |
| 65-009-F | Состав II | 10,0% лейцина, 58,6% лактата кальция, 31,4% хлорида натрия (активность 10,8% иона кальция) | 1:2 | Niro |
Для оценки эффективности сухих порошкообразных составов применяли модель клеточной культуры вируса гриппа A/Panama/2007/99, человеческого вируса пара -гриппа типа 3 (hPIV3) или риновируса (Rv16). Эта модель была подробно описана ранее (см. Пример 10), в ней в качестве модели инфекции гриппа эпителиальных клеток дыхательных путей использованы клетки Calu - 3, выращенные на поверхности раздела воздух - жидкость. Клетки Calu - 3 подвергались воздействию сухих порошков с применением камеры для осаждения сухих порошков. Количество иона кальция (Са2+), доставленного в каждую лунку, определяли методом ВЭЖХ, используя сухой порошок, выделенный из пустой лунки планшета с клеточной культурой. Концентрация осажденного кальция в каждом опыте указана в Таблице 23.
| Таблица 23 | |||||||||
| Осаждение кальция | |||||||||
| Состав 1 (мкг Са/см2) | Состав III (мкг Са/см2) | Состав II (мкг Са/см2) | |||||||
| Низк. | Средн. | Высок. | Низкая | Средняя | Высок. | Низкая | Средняя | Высок. | |
| Грипп | 12,74 | 17,12 | 28,85 | 11,37 | 15,84 | 27,73 | 10,93 | 16,01 | 26,61 |
| Пара-грипп | 10,58 | 16,19 | 25,04 | 12,26 | 15,71 | 25,32 | 11,03 | 16,81 | 26,33 |
| Риновирус | 11,63 | 16,25 | 24,11 | 10,86 | 15,01 | 23,89 | 11,49 | 15,22 | 24,69 |
Через 1 ч после обработки порошком клетки инфицировали 10 мкл вируса Influenza A/Panama/ 99/2007 с множественностью инфекции 0,1-0,01 (0,1-0,01 вириона на клетку), человеческого вируса пара-гриппа типа 3 (hPIV3) с множественностью инфекции 0,1-0,01 (0,1-0,01 вириона на клетку) или 10 мкл риновируса (Rv16) с множественностью инфекции 0,1-0,01 (0,1-0,01 вириона на клетку). Через 4 ч после обработки порошком апикальные поверхности промывали для удаления избытка состава и не присоединенных вирусов и культивировали клетки в течение еще 20 ч при температуре 37°С плюс 5% СО2. На следующий день (через 24 ч после инфицирования) вирусы, выделившиеся на апикальной поверхности инфицированных клеток, собирали в культуральной среде и количественно определяли концентрацию вируса методом определения TCID50 (50% инфекционной дозы тканевой культуры). Метод определения TCID50 является стандартным методом анализа с титрованием в конечной точке, применяемым для количественного определения количества вирусов в образце. Для каждого из трех порошков клетки Calu - 3 подвергались действию трех различных доз Са2+ и оценивалась степень репликации каждого вируса.
Грипп
В модели гриппа все три порошка значительно снижали титр вируса до сравнимых уровней при самой высокой испытанной дозе: состав I, состав III и состав II снижали титр вируса до 3,25, 3,80 и 3,95 logio TCID50/ мл, соответственно (Фигура 13А). Важно заметить, что в то время, как при самой высокой дозе эти испытанные порошки проявляли похожую активность против гриппа, полученные при более низких дозах данные позволяют сделать вывод, что наиболее эффективным составом был состав II (состоящий из лейцина, лактата кальция и хлорида натрия). Состав II снижал вирусные титры на 3,70 и 3,75 logio TCID50/ мл при низкой и средней величинах доз, в то время как низкие дозы состава I и состава III снижали вирусные титры на 2,50 и 2,95 logio TCID50/мл, а средние дозы состава I и состава III снижали вирусные титры до 2,65 и 3,30 log10 TCID50/ мл, соответственно.
Пара - грипп
Состав I, состав II и состав III испытывали в похожем интервале доз в отношении пара - гриппа. Титр вируса пара - гриппа в клеточных культурах, обработанных составом III, был сравним с титром контрольных клеток (Фигура 13В) при дозах кальция, похожих на дозы, применявшиеся в опыте с вирусом гриппа, что показывает, что состав на основе сульфата кальция может проявлять активность только против специфичных патогенов. В противоположность этому, состав I и состав II после обработки ими приводили к зависимому от дозы снижению степени инфекции, вызванной вирусом пара- гриппа. В случае высоких доз состав I и состав II снижали инфекцию на 2,70 и 4,10 log10 TCID50/мл, соответственно, по сравнению с контрольными клетками. Точно так же состав II проявлял большую эффективность, чем состав I в случае средней дозы, однако, ни один состав не уменьшал инфекцию при самых низких испытанных дозах (Фигура 12 В; Таблица 25). Все вместе эти данные показывают, что составы сухих порошков на основе кальция эффективно снижают степень инфицирования вирусом пара - гриппа. Это действие специфично для некоторых солей кальция и интервал эффективных доз значительно отличается от наблюдавшегося интервала в случае гриппа.
Риновирус
Вирусы гриппа и пара - гриппа представляют собой оболочечные вирусы. Для определения широты спектра активности составов сухих порошков, содержащих кальций, и распространения возможности их применения для необолочечных вирусов те же самые порошки испытывали против риновируса. Все три состава снижали степень инфекции, вызванной риновирусом, в некоторой степени, при этом порошковый состав II показал наибольшую активность (Фигура 13С). Обработка составом II к значительному, 2,80 log10 TCID50/ мл, уменьшению степени инфицирования при наиболее высокой испытанной дозе. Низкие и средние дозы этого порошка уменьшали титр на 1,15 и 2,10 log10 TCID50/мл, соответственно, по сравнению с контрольными клетками. Обработка составом I и составом III также снижала степень инфицирования, хотя и в меньшей степени, чем состав II. В случае самых высоких испытанных доз состав I снижал степень инфицирования на 1,70 log10 TCID50/мл и состав III снижал степень инфицирования на 1,60 logio ТСID50/мл. Вместе эти результаты показывают, что составы сухих порошков на основе кальция могут найти широкое применение для различных вирусных инфекций.
Вышеприведенные данные дают возможность предположить, что при увеличении доставленной дозы составов сухих порошков, содержащих кальций, они проявляют большую активность, чем ранее наблюдавшаяся активность при более низких дозах. Степень инфицирования вирусом гриппа снижалась в случае всех трех испытанных порошков, хотя состав на основе лактата кальция (состав II) имел большую активность, чем состав с сульфатом кальция (состав III) и цитратом кальция (состав I). Кроме того, в случае всех трех вирусных штаммов состав II после обработки им приводил к наибольшему снижению вирусного титра. При более высоких дозах состав I эффективно снижал вирусный титр во всех трех вирусных штаммах, но этот эффект был более выраженным в случае гриппа и пара - гриппа, можно предположить, что имеется различие в механизме, что может быть связано со специфичностью вирусного штамма. Состав III был активным против пара - гриппа, но проявлял большую активность как против гриппа, так и против риновируса, видимо, специфичный противоион кальция может играть некоторую роль для проявления оптимальной активности состава.
ПРИМЕР 14. Сухой порошок, содержащий лактат кальция, хлорид натрия и мальтодекстрин
В этом примере описано получение сухих порошков с применением исходного состава XIV:10,0 вес. % мальтодекстрина, 58,6 вес. % лактата кальция и 31,4 вес. % хлорида натрия.
Водную фазу готовили периодическим способом при растворении в ультрачистой воде мальтодекстрина, затем пентагидрата лактата кальция и, наконец, хлорида натрия. Раствор перемешивали до полного растворения всех веществ в воде при комнатной температуре. В случае составов с мальдекстрином и лактатом кальция были приготовлены при партии (А, В&С) исходного состава и высушены при распылении. Подробности приготовления каждой из трех партий приведены в Таблице 24, где указана общая концентрация твердых веществ в расчете на вес всех растворенных безводных веществ. Растворы или суспензии затем подвергали сушке при распылении, используя сушилку Büchi. Были приготовлены и высушены при распылении три порции каждого состава (А, В&С), частицы в партиях А, В и С были получены с применением соответствующих исходных составов в сушилке Büchi Mini spray dryer при условиях, которые были похожи на условия для сушки составов I-В и I-С в примере 1, за исключением следующих условий процесса. Скорость подачи исходных жидких составов была равна 5,2 мл/мин для состава XIV - А и состава XIV - В и 5,6 мл/мин для состава XIV - С.Температура на выходе из сушилки составляла от примерно 90°С до 98°С для состава XIV - А, примерно 100°С для состава XIV - В и примерно 106°С для состава XIV - С.
| Таблица 24 | |||
| Получение трех партий частиц состава XIV из жидкого исходного состава | |||
| Состав: | XIV-А | XIV-В | XIV-С |
| Смешение жидкого состава | Периодическое смешение | Периодическое смешение | Периодическое смешение |
| Общая концентрация твердых веществ | 5 г/л | 5 г/л | 5 г/л |
| Количество твердых веществ | 5 г | 5 г | 20 г |
| Общий объем воды | 1,0 л | 1,0 л | 4,0 л |
| Количество лейцина в 1 л | 0,5 г | 0,5 г | 0,5 г |
| Количество хлорида натрия в 1 л | 1,55 г | 1,55 г | 1,55 г |
| Количество пентагидрата лактата кальция в 1 л | 4,13 г | 4,13 г | 4,13 г |
Некоторые из физических свойств частиц, полученных в виде трех отдельных партий (состав XIV-А, XIV-В и XIV-С), приведены в Таблице 25. В дополнение к данным, приведенным в Таблице 25, ниже указаны другие свойства сухих частиц, полученных из состава XIV-А. Количество фракции мелких частиц (FPF), измеренное в 2 - стадийном компакторе Andersen Cascade Impactor методом гравиметрического анализа, в среднем составило 71,3% для FPF размером менее 5,6 мкм и 47,5% для FPF размером менее 3,4 мкм. Объемный размер частиц определяли методом лазерной дифракции в системе HELOS/RODOS и средняя величина объемного медианного диаметра (×50) при давлении равном 1 бар была равна 1,40 мкм. Кроме того, порошок характеризовался независимой скоростью текучести, что можно видеть по отношению ×50, измеренного при давлении 0,5 бар к ×50, измеренному при давлении 4,0 бар, которое составило 1,04. Величина отношения 1/4 бар для этих частиц была равна 1,00, что свидетельствует о высокой диспергируемости частиц.
| Таблица 25 | |||
| Данные, полученные в ACI-2 для трех партий частиц состава XIV | |||
| Состав: | XIV-А | XIV-В | XIV-С |
| FPF размером менее 5,6 мкм в ACl-2 (%) | 71,3 | 66,6 | 68,2 |
| FPF размером менее 3,4 мкм в ACl-2 (%) | 47,5 | 44,8 | 48,7 |
Дополнительная информация о свойствах порошка и/или частиц, полученных в этом примере из состава XIV, приведена в таблицах и на графиках на Фигурах 1А-1F.
Пример 15: Диспергируемость
Диспергируемость сухих порошков, содержащих лактат кальция, сульфат кальция или цитрат кальция, после доставки из различных порошковых ингаляторов, работающих в разном режиме, оценивали в сравнении с обычным микронизированным лекарственным продуктом, диспергированным таким же образом.
Диспергируемость различных порошковых составов была исследована путем измерения геометрического размера частиц и количества порошка, выделившегося из капсул при вдохе, с применением ингаляторов для сухих порошков со скоростями потока, обеспечиваемыми пациентом. Распределение частиц по размерам и изменение веса заполненных капсул определяли для многих порошковых составов как функцию скорости потока, выдыхаемого объема и веса заполненных порошков с использованием 2 пассивных ингаляторов для сухих порошков.
Три капсулы из НРМС (Capsugel V-Caps) вручную заполнялись порошковыми составами, вес заполненных порошков измеряли гравиметрически, используя аналитические весы (Mettler Tolerdo XS205). В капсулы вводили 25 и 35 мг порошка состава I (партия # 26-190-F), 25, 60 и 75 мг состава II (партия #69-191-1), 25 и 40 мг состава III (партия #65-009-F), 10 мг высушенного при распылении порошка лейцина (партия #65-017-F) и 25 мг микронизированного альбутеролсульфата (Cirrus партия #073-001-02-039А). Использовали два пассивных ингалятора для сухих порошков (RS-01 Model 7, Low resistance Plastiape S.p.A. и RS - 01 Model 7, High resistance Plastiape S.p.A.), поступающих из капсул, которые имели удельное сопротивление, составляющее 0,020 и 0,036 кПа1/2/LPM, что перекрывает типичный интервал величин сопротивления ингаляторов для сухих порошков. Величины скорости потока и объема вдыхаемого воздуха устанавливали с применением контролируемого таймером клапана с электромагнитным управлением потока (ТРК2000, Copley Scientific). Капсулы помещали в соответствующий ингалятор для сухих порошков, прокалывали и прикладывали ингалятор ко входу в сортировальный прибор с лазерной дифракцией (Spraytec, Malvern). Начинали пропускать устойчивый поток воздуха через систему, используя ТРК2000, распределение частиц по размерам определяли при помощи Spraytec при частоте 1 кГц в течение по меньшей мере 2 с до окончания ингаляции. Параметры распределения частиц по размерам включали объемный медианный диаметр (Dv50) и стандартное геометрическое отклонение (GSD) и величину фракции мелких частиц (FPF) размером менее 5 мкм в диаметре. После окончания ингаляции открывали ингалятор для сухих порошков, капсулу удаляли и снова взвешивали для определения массы порошка, который выделился из капсулы во время ингаляции. При каждых условиях опыта применяли 5 капсул и определяли средние величины Dv50, FPF и массы порошка, выделившегося из капсулы (СЕРМ).
Для того, чтобы связать диспергируемость порошка с различными скоростями потока, объемами и типом ингаляторов с различным сопротивлением, рассчитывали величину энергии, требуемой для осуществления ингаляции, и размер частиц и выделившуюся дозу в зависимости от энергии вдоха. Энергию вдоха рассчитывали по уравнению E=R2Q2V, где Е обозначает энергию вдоха в Дж, R обозначает сопротивление при вдохе в кПа1/2/LPM, Q обозначаете устойчивую величину скорости потока в л/мин и V обозначает объем вдыхаемого воздуха в л.
На Фигуре 14 показаны величины дозы порошка состава II, выделившегося из капсулы при трех различных величинах веса заполнения, при применении ингаляторов для сухих порошков RS-01 как с высоким сопротивлением, так и с низким сопротивлением. В случае каждой величины веса заполненного порошка устойчивая ингаляция наблюдалась при максимальной энергии равной от 9,2 Дж, что эквивалентно скорости потока 60 л/мин в ингаляторе с высоким сопротивлением (R=0.036 кПа1/2/LPM) и общим объемом, составляющим 2 л, до более низкой величины энергии при объеме, уменьшенном до 1 л, скоростях потока, уменьшенных до 15 л/мин и более низком сопротивлении ингалятора (R=0,020 кПа1/2/LPM). Как можно видеть на Фигуре 14, вся масса порошка состава II, помещенного в каждую капсулу (25, 60 и 75 мг), высвобождается из всех трех капсул при одном вдохе при наибольшем значении величины энергии. При помещении 25 мг порошка при всех условиях ингаляции с энергией равной 0,16 Дж выделяется более 80% полной загрузки в среднем. При помещении 60 мг, величина выделившейся из капсулы дозы падает ниже 80% от полной загрузки при энергии, составляющей 0,36 Дж. При помещении загрузки равной 75 мг величина выделившейся дозы падает ниже 80% от полной загрузки при энергии, составляющей 1,2 Дж.
Как показано на Фигуре 14, использовали две полных загрузки микронизированного сульфата альбутерола весом 25 мг и 40 мг, это лекарство измельчали в струйном измельчителе до получения частиц со средним размером равным 1,8 мкм, вручную заполняли этим порошком три капсулы и диспергировали при помощи ингалятора RS-01 с высоким сопротивлением. Как видно, в случае полных загрузок, составляющих 25 и 40 мг при энергии ингаляции равной 9,2 Дж (устойчивая ингаляция с 60 л/мин для объема 2 л), средняя величина СЕРМ выше 80% от полной загрузки капсулы (93% для полной загрузки в 25 мг и 84% для полной загрузки в 40 мг). Однако при всех более низких значениях энергии величина СЕРМ падает ниже 10 мг (<30% от полной загрузки капсулы) для обеих величин полной загрузки и монотонно снижается с уменьшением величины энергии.
На Фигуре 15 показано распределение частиц по размерам порошков состава II, которые высвобождались из ингаляторов, характеризующееся объемным медианным диаметром (Dv50) в зависимости от примененной энергии ингаляции. Соответствующие величины Dv50 при снижении величин энергии показывают, что порошок является хорошо диспергируемым, так как дополнительная энергия не приводит к дополнительной деагломерации выделившегося порошка. Величины Dv50 согласуются со всеми тремя полными загрузками в 75, 60 и 25 мг при всех высоких значениях энергии, при этом Dv50 остается менее 2 мкм при снижении энергии до 0,51 Дж для всех трех полных загрузок (Фиг.16). Принимая во внимание то, что при полных загрузках в 60 и 75 мг энергия ингаляции в интервале от 0,5 до 1,2 Дж не обеспечивает полного выделения порошка из капсулы (Фиг.14), ясно, что порошок, который выделился, был еще полностью диспергированным в DPI (FIG. 15). В этом интервале величина Dv50 незначительно увеличивается, что можно было бы ожидать, если бы выделившийся порошок содержал множество агломератов и не был хорошо диспергирован.
На Фигуре 15 приведены также две полных загрузки микронизированного сульфата альбутерола весом 25 мг и 40 мг, это лекарство измельчали в струйном измельчителе до получения частиц со средним размером равным 1,8 мкм, вручную заполняли этим порошком три капсулы и диспергировали при помощи ингалятора RS-01 с высоким сопротивлением. Как видно, в случае полных загрузок, составляющих 25 и 40 мг при энергии ингаляции равной 9,2 Дж (устойчивая ингаляция с 60 л/мин для объема 2 л), средняя величина Dv50 ниже 2 мкм (1,8 мкм и 1,6 мкм, соответственно), что свидетельствует о наличии хорошей дисперсии и сравнительном небольшом количестве агломератов. Однако при более низких величинах энергии Dv50 возрастает до величины более 2 мкм (3,9 и 3,1 мкм, соответственно) и продолжает монотонно увеличиваться с уменьшением величины энергии, свидетельствуя об агломерации и слабой диспергируемости первичных частиц.
При всех условиях опыта и средних величинах СЕРМ и Dv50 были испытаны другие порошки (Таблица 26). Эти результаты демонстрируют способность порошковых составов полностью высвобождаться и деагломерировать при уменьшенных до примерно 0,5 Дж величинах энергии ингаляции.
| Таблица 26 | ||||||||
| Средние величины СЕРМ, Dv(50) и FPF в зависимости от величин полной загрузки, скорости потока и продолжительности опыта для составов I-III и плацебо | ||||||||
| Порошок | DPI | Полная загрузка (мг) | Скорость потока (л/мин) | Продолжительность | Энерг. ингаляции, E=R2Q2V (Дж) | Средн. велич. СЕР М (мг) | Средн. велич. Dv(50) (мкм) | Среднее колич. FPF, % <5 мкм |
| Состав I | RS.01. HR | 25 | 15 | 4 | 0,29 | 15,8 4 | 4,77 | 52,09 |
| Состав I | RS.01. HR | 25 | 20 | 3 | 0,51 | 22,8 8 | 3,46 | 65,79 |
| Состав I | RS.01. HR | 25 | 30 | 2 | 1,15 | 24,7 5 | 2,94 | 72,88 |
| Состав I | RS.01. HR | 25 | 60 | 2 | 9,18 | 24,7 2 | 2,93 | 73,39 |
| Состав I | 25 | 15 | 4 | 0,09 | 4,30 | 7.29 | 31,97 | |
| Состав I | RS.01. LR | 25 | 20 | 3 | 0,16 | 8,05 | 5,10 | 48,98 |
| Состав I | RS.01. LR | 25 | 30 | 2 | 0,36 | 19,9 4 | 3,28 | 71,09 |
| Состав I | RS.01. LR | 25 | 60 | 2 | 2,85 | 24,7 5 | 2,51 | 80,26 |
| Состав I | RS.01. HR | 35 | 30 | 2 | 1,15 | 33,7 7 | 2,17 | 83,17 |
| Состав I | RS.01. HR | 35 | 60 | 2 | 9,18 | 34,7 3 | 2,33 | 81,42 |
| Состав I | RS.01. LR | 35 | 30 | 2 | 0,36 | 13,0 7 | 3,16 | 73,22 |
| Состав I | RS.01. LR | 35 | 60 | 2 | 2,85 | 34,5 7 | 2,34 | 83,15 |
| Плацебо | RS.01. HR | 10 | 15 | 4 | 0,29 | 3,87 | 25,7 1 | 6,22 |
| Плацебо | RS.01. HR | 10 | 20 | 3 | 0,51 | 8,79 | 22,8 0 | 8,64 |
| Плацебо | RS.01. HR | 10 | 30 | 2 | 1,15 | 9,42 | 22,9 5 | 11,83 |
| Плацебо | RS.01. HR | 10 | 60 | 2 | 9,18 | 9,78 | 21,4 5 | 12,52 |
| Плацебо | RS.01. LR | 10 | 15 | 4 | 0,09 | 1,87 | 40,3 6 | 3,17 |
| Плацебо | RS.01. LR | 10 | 20 | 3 | 0,16 | 3,08 | 28,1 6 | 5,20 |
| Плацебо | RS.01. LR | 10 | 30 | 2 | 0.36 | 7.01 | 18.6 2 | 9.39 |
| Плацебо | RS.01. LR | 10 | 60 | 2 | 2.85 | 9.82 | 15.2 6 | 16.41 |
| Состав III | RS.01. | 25 | 15 | 4 | 0,29 | 24,8 | 3,26 | 68,77 |
| HR | 7 | |||||||
| Состав III | RS.01. HR | 25 | 20 | 3 | 0,51 | 25,4 8 | 3,06 | 72,61 |
| Состав III | RS.01. HR | 25 | 30 | 2 | 1,15 | 25,0 5 | 2,90 | 74,06 |
| Состав III | RS.01. HR | 25 | 60 | 2 | 9,18 | 25,2 8 | 2,92 | 71,87 |
| Состав III | RS.01. LR | 25 | 15 | 4 | 0,09 | 18,9 7 | 5,59 | 43,81 |
| Состав III | RS.01. LR | 25 | 20 | 3 | 0,16 | 24,9 5 | 3,45 | 68,14 |
| Состав III | RS.01. LR | 25 | 30 | 2 | 0,36 | 25,0 8 | 2,72 | 76,82 |
| Состав III | RS.01. LR | 25 | 60 | 2 | 2,85 | 24,8 8 | 2,66 | 75,76 |
| Состав III | RS.01. HR | 40 | 30 | 2 | 1,15 | 39,5 5 | 2,76 | 74,92 |
| Состав III | RS.01. HR | 40 | 60 | 2 | 9,18 | 40,1 3 | 3,14 | 67,35 |
| Состав III | RS.01. LR | 40 | 30 | 2 | 0,36 | 39,7 4 | 2,89 | 75,51 |
| Состав III | RS.01. LR | 40 | 60 | 2 | 2,85 | 39,8 5 | 2,65 | 77,00 |
| Состав II | RS.01. HR | 25 | 15 | 4 | 0,29 | 24,4 5 | 3,56 | 63,96 |
| Состав II | RS.01. HR | 25 | 17.5 | 3.4 | 0,39 | 21,4 3 | 2,34 | 80,07 |
| Состав II | RS.01. HR | 25 | 20 | 3 | 0,51 | 23,5 5 | 2Д5 | 82,08 |
| Состав II | RS.01. HR | 25 | 25 | 2.4 | 0,80 | 24,4 2 | 1,39 | 90,70 |
| Состав II | RS.01. HR | 25 | 30 | 2 | 1,15 | 24,8 8 | 1,28 | 88,29 |
| Состав II | RS.01. HR | 25 | 60 | 2 | 9,18 | 25,0 7 | 1,59 | 85,28 |
| Состав II | RS.01. | 25 | 15 | 4 | 0,09 | 7,47 | 7,46 | 32,20 |
| LR | ||||||||
| Состав II | RS.01. LR | 25 | 20 | 3 | 0,16 | 20,3 9 | 4,29 | 57,09 |
| Состав II | RS.01. LR | 25 | 30 | 2 | 0,36 | 24,2 3 | 2,52 | 78,85 |
| Состав II | RS.01. LR | 25 | 60 | 2 | 2,85 | 24,8 1 | 1,61 | 89,78 |
| Состав II | RS.01. HR | 60 | 25 | 2,4 | 0,80 | 52,4 2 | 0,99 | 90,45 |
| Состав II | RS.01. HR | 60 | 30 | 2 | 1,15 | 56,5 0 | 0,78 | 92,70 |
| Состав II | RS.01. HR | 60 | 60 | 2 | 9,18 | 59,4 2 | 1,19 | 90,64 |
| Состав II | RS.01. LR | 60 | 30 | 2 | 0,36 | 26,6 2 | 2,48 | 80,08 |
| Состав II | RS.01. LR | 60 | 60 | 2 | 2,85 | 59,5 1 | 1Д9 | 90,64 |
| Состав II | RS.01. HR | 75 | 25 | 2.4 | 0,80 | 47,6 3 | 1,36 | 89,83 |
| Состав II | RS.01. HR | 75 | 30 | 2 | 1Д5 | 51,8 4 | 1,07 | 92,59 |
| RS.01. HR | 75 | 60 | 2 | 9,18 | 74,9 0 | 1,41 | 85,20 | |
| Микрониз. альбутерол 073-001-02-039А | RS.01. HR | 25 | 15 | 4 | 0,29 | ЗД2 | 16,7 6 | 13,00 |
| Микрониз. альбутерол 073-001-02-039А | RS.01. HR | 25 | 20 | 3 | 0,51 | 5,00 | 8,40 | 32,10 |
| Микрониз. альбутерол 073-001-02-039А | RS.01. HR | 25 | 30 | 2 | 1Ю15 | 7,08 | 3,86 | 59,44 |
| Микрониз. альбутерол 073-001-02-039А | RS.01. LR | 25 | 60 | 2 | 2,85 | 15,2 8 | 2,57 | 75,01 |
| Микрониз. альбутерол 073-001-02-039А | RS.01. HR | 25 | 60 | 2 | 9,18 | 23,1 8 | 1,77 | 81,65 |
| Микрониз. Альбутерол 073-001-02-039А | RS.01. HR | 40 | 15 | 4 | 0,29 | 2,43 | 7,63 | 10,73 |
| Микрониз. альбутерол 073- | RS.01. | 40 | 20 | 3 | 0,51 | 4,97 | 6,34 | 42,24 |
| 001-02-039А | HR | |||||||
| Микрониз. Альбутерол 073-001-02-039А | RS.01. HR | 40 | 30 | 2 | 1,15 | 8,55 | 3,13 | 67,18 |
| Микрониз. альбутерол 073-001-02-039А | RS.01. LR | 40 | 60 | 2 | 2,85 | 18,8 8 | 2,62 | 73,98 |
| Микрониз. альбутерол 073-001-02-039А | RS.01. HR | 40 | 60 | 2 | 9,18 | 33,4 0 | 1,60 | 84,30 |
ПРИМЕР 16:АНАЛИЗ ЧАСТИЦ В ТВЕРДОМ СОСТОЯНИИ
А. Порошковая рентгеновская дифракция
Анализировали содержание аморфной/кристаллической фаз и полиморфных форм в составах I, II, III XIV с применением порошковой рентгеновской дифракции с высоким разрешением (XRPD) и дифференциальной сканирующей калориметрии (DSC). В случае XRPD проводили идентификацию фаз с целью выявления любых кристаллических фаз на каждой рентгенограмме XRPD. Рентгенограммы XRPD получали с применением дифрактометра PANalytical X'Pert Pro (Almelo, The Netherlands). Образец анализировали, используя излучение Си, полученное при помощи тонкофокусного источника Optix. Для фокусировки X - лучей источника при пропускании через образец в детекторе применяли эллиптически калиброванное многослойное зеркало. Образец помещали между слоями толстых пленок толщиной 3 мкм, анализировали геометрию пропускания через кристалл и вращали для оптимизации статистики ориентации. Использовали прерыватель рентгеновских лучей вместе с промывкой гелием в некоторых случаях для минимизации фона, генерированного при рассеянии воздуха. Для направления лучей применяли щелевидный коллиматор Соллера и дифрагированные лучи с целью минимизации осевой дивергенции. Рентгенограммы получали с помощью сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца. Параметры каждой рентгенограммы приведены над фотографией каждого образца в Приложении С.До проведения анализа анализировали силиконовый образец (стандартный эталонный материал 640 с NIST) для верификации положения пика кремния (111). Рассчитанные рентгенограммы для потенциальных кристаллических компонентов (включая безводные и гидратированные формы) были получены или в структурной базе Cambridge Structural Database или в базе данных International Center for Diffraction Data (ICDD), их сравнивали с экспериментальными рентгенограммами. Количественно определяли кристаллические компоненты. Получали также порошковые рентгенограммы XRPD, порошки выдерживали при относительной влажности 75% RH в течение 3-4 ч в системе Dynamic Vapor Sorption для того, чтобы оценить склонность указанных порошков к перекристаллизации после кратковременного хранения в условиях повышенной влажности.
Дифференциальную сканирующую калориметрию (DSC) проводили, используя калориметр ТА Instruments differential scanning calorimeter Q2000 (New Castle, DE). Образец помещали на алюминиевый DSC поддон и записывали точный вес. Параметры процесса и полученные данные были видны на каждой термограмме. В качестве калибровочного стандарта применяли металлический индий. Температура стеклования (Ге) определялась по точке перегиба на кривой. Вначале DSC проводили стандартным методом для испытуемых порошков, чтобы оценить их термическое поведение. Для того, чтобы попытаться определить появление температуры стеклования этих порошков в интересующем температурном интервале, выявленном на стандартных термограммах, DSC проводили циклически.
Неожиданно оказалось, что были получены порошки с высоким содержанием солей кальция и натрия, которые содержали смесь аморфной и кристаллической фаз, что определяло оптимальные свойства, касающиеся их диспергируемости и стабильности в сухом состоянии и их растворения и поглощения ими воды в гидратированном состоянии. Как показано на Фигурах 16 and 17, рентгенограмма порошка состава I показала наличие комбинации кристаллического хлорида натрия и слабокристаллического или аморфного цитрата кальция и, возможно, обогащенной хлоридом кальция фазы (о чем свидетельствовало отсутствие любых характеристических пиков для любой соли кальция в этом порошке, а также отсутствие любых характеристических пиков для лейцина). Как показано на Фигуре 18, была отмечена температура стеклования равная примерно 167°С при проведении циклической DSC для обогащенной кальцием аморфной фазы, что свидетельствует о том, что эта аморфная фаза довольно стабильна, чтобы произошло ее превращение в кристаллическое состояние при стандартных условиях (25°С, 30% RH). Наличие кристаллического хлорида натрия способствует диспергируемости и стабильности этого порошка. Наличие соли кальция в виде слабокристаллической и аморфной форм в порошке состава I также может способствовать быстрому поглощению воды и растворимости порошка состава I после осаждения в легких (то есть кристаллический хлорид натрия легко растворяется, в то время как цитрат кальция растворяется плохо).
Похожие результаты были получены для порошков состава II и состава XIV. Как видно на Фигурах 19 and 20, порошок состава II по данным XRPD состоит из комбинации кристаллического хлорида натрия и слабокристаллического лактата кальция и, возможно, обогащенной хлоридом кальция фазы (о чем свидетельствовало отсутствие любых характеристических пиков для любой соли кальция в этом порошке, а также отсутствие любых характеристических пиков для лейцина). Как показано на Фигуре 21, была отмечена температура стеклования равная примерно 144°С при проведении циклической DSC для обогащенной кальцием аморфной фазы, что свидетельствует о том, что эта аморфная фаза довольно стабильна, чтобы произошло ее превращение в кристаллическое состояние при стандартных условиях (25°С, 30% RH). Почти такие же результаты были отмечены в случае порошка состава XIV, который содержал 10% и сравнивался с порошком с 10% лейцина (см. Фигуры 22 и 23) по данным XRPD, на Фигуре 24 показано, что температура стеклования составляла примерно 134°С.
В противоположность этому, в порошке состава III было отмечено наличие некоторого количества кристаллической соли кальция (сульфата кальция) в дополнение к кристаллическому хлориду натрия (см. Фигуры 25А и 25 В). Однако этот порошок все еще содержал значительное количество аморфной, обогащенной кальцием фазы, о чем свидетельствует величина температуры стеклования, составляющая примерно 159°С по данным DSC (см. Фиг.26).
В. Картирование поверхности с применением спектров Рамана
Картирование поверхности с получением спектров Рамана проводили для образцов порошков составов I-III и XIV с целью определения природы химической композиции на поверхности частиц, входящих в эти составы. Спектры Рамана получали на приборе Renishaw inVia Ramascope (Gloucestershire, UK), снабженном микроскопом Leica DM LM (Wetzlar, Germany). Прибор был откалиброван с применением кремниевой полупроводниковой пластины в качестве эталона. Длина волны возбуждения была равна 785 нм, источником служил лазерный диод с высокой мощностью в области близкой к инфракрасной. Данные для составов I, III и состава XIV собирали при статическом сканировании в течение 30 с при 10 накоплениях. Данные для состава II собирали при продолжительном сканировании для одного накопления в течение 60 с.Для получения изображения применяли камеру Philips ToUcam Pro II camera (модель PCVC 840K) (Amsterdam, the Netherlands) с объективом 50x. Для сбора данных и их обработки использовали программу Renishaw WiRE 3.1 (пакет 9) (Gloucestershire, UK).
Для шести частиц образца состава I получали спектры Рамана, показанные на Фигуре 27А. Файлы 389575-1 и 389575-6 характеризуются наличием слабых пиков 1450, 965 и 850 см-1. Эти пики заметны как очень слабые в файле 389575-6, и не обнаруживаются в остальных спектральных файлах. На Фигуре 27В, в спектре 389575-6 вычтен фон, спектр накладывается на рамановский спектр для порошка с тетрагидратом цитрата кальция, цитратом натрия и лейцином. На спектре частиц образца наблюдались пики при примерно 1450 и 850 см-1, которые типичны как для лейцина, так и для цитратных солей. На спектре был виден дополнительный пик примерно 965 см-1, который согласуется с довольно большим пиком в спектре порошка с цитратными солями (то есть тетрагидрата цитрата кальция и цитрата натрия). Характерный для лейцина пик 1340 см-1 на спектре не наблюдался.
Для восьми частиц образца состава III получали спектры Рамана, показанные на Фигуре 27С. Файлы 389575-1 и 389575-6 характеризуются наличием слабых пиков при 1450, 965 и 850 см-1. Все спектры частиц имели пик при примерно 1060 см-1. В спектральном файле 38836-4 имелся дополнительный пик при примерно 670 см-1. Пик при примерно 670 см-1 имелся также на спектрах 388369-1, 3 и 8 после вычета фона (не показано). На Фигуре 27D приведен спектр 388369 - 4 за вычетом фона, спектр накладывается на рамановский спектр для порошка с сульфатом кальция, дигидратом сульфата кальция, безводным сульфатом натрия и лейцином. Спектр образца за вычетом фона показал возможное наличие третьего пика около примерно 520 см-1. Пики при 1060 см-1 и 670 см-1 находились в положениях, подобных характеристическим пикам сульфатных ионов, но спектры точно не накладывались. Частота пиков при 1060 и 670 см-1 согласуется с растягивающими и поперечными колебаниями, соответственно, функциональной группы сульфатного иона. Пики, характеризующие наличие лейцина, в спектрах частиц не были обнаружены.
Спектры Рамана снимали также для двенадцати частиц образца состава II, они накладывались, что показано на Фигуре 27Е. Все спектры частиц характеризовались наличием пиков при примерно 1045 и 860 см-1. На различных спектрах наблюдались дополнительные пики при примерно 1450, 1435, 1125, 1095, 930 и 775 см-1, что в общем коррелирует в отношении относительной интенсивности с большим пиком при 1045 см-1. На Фигуре 27F показаны спектры 389576-7 и 389576-12 за вычетом фона, они накладываются на рамановские спектры порошков с пентагидратом лактата кальция и лейцином. Между спектрами этого образца и образца порошка с пентагидратом лактата кальция наблюдалось хорошее соответствие. Однако на спектрах этого образца наблюдались дополнительные пики при примерно 1345, 1170, 960, 830 и 760 см-1, которые отсутствовали на спектре порошка с пентагидратом лактата кальция. Похожие пики видны на спектре эталонного порошка с лейцином, хотя относительные интенсивности и частоты слегка отличаются.
Спектры Рамана снимали также для двенадцати частиц образца состава XIV, они накладывались, что показано на Фигуре 27G. Все спектры частиц характеризовались наличием пиков при примерно 1045 см-1. Все спектры частиц кроме файла 389577-2 также имели пик при примерно 860 см-1. Дополнительные пики можно было наблюдать на различных спектрах при примерно 1450, 1435, 1125, 1095, 930 и 775 см-1, что в общем коррелирует в отношении относительной интенсивности с большим пиком при 1045 см-1. На Фигуре 27Н показан спектр 389577-9 за вычетом фона, он накладывается на рамановские спектры порошков с пентагидратом лактата кальция. Между спектром этого образца и спектром порошка с пентагидратом лактата кальция наблюдается хорошее соответствие. Пики, характерные для мальтодекстрина (не показано) на спектре образца не наблюдались.
Таким образом, анализ картирования поверхности при помощи спектров Рамана показывает, что поверхность частиц порошка каждого из составов I-XIV характеризуется наличием различных солей кальция (цитрата кальция для состава I, сульфата кальция для состава III и лактата кальция для составов II и XIV). В случае составов I-III это противоречит известному факту использования лейцина в качестве агента, улучшающего диспергируемость порошков для получения аэрозолей благодаря концентрации на поверхности частиц, составляющих указанные порошки. Для составов, описанных в данной заявке, лейцин не действует как агент, способствующий диспергируемости таким образом, что подтверждается похожими результатами для порошков составов II (состава, содержащего лейцин и лактат кальция) и XIV (состава, содержащего лактат кальция и мальтодекстрин) в отношении состава поверхности и диспергируемости.
ПРИМЕР 17: РЕАКЦИЯ ИОННОГО ОБМЕНА ПРИ СУШКЕ ПРИ РАСПЫЛЕНИИ ПЕРЕСЫЩЕННОГО РАСТВОРА ЦИТРАТА КАЛЬЦИЯ И
СУЛЬФАТА КАЛЬЦИЯ
Для проведения процесса сушки при распылении были приготовлены насыщенный и пересыщенный водные растворы сульфата кальция и цитрата кальция с применением хлорида кальция и сульфата натрия или хлорида кальция или цитрата кальция в качестве исходных веществ. Готовили растворы с общей концентрацией твердых веществ от 5 до 30 г /л путем (i) предварительного смешения обеих солей в воде или (ii) приготовления отдельных растворов соли кальция и соли натрия с последующим статическим перемешиванием этих растворов непосредственно перед сушкой. Все полученные исходные жидкие растворы содержали количества сульфата кальция, обеспечивающие образование насыщенного или пересыщенного растворов сульфата кальция (предел растворимости сульфата кальция в воде составляет 2,98 г/л) и количества цитрата кальция обеспечивающие образование насыщенного или пересыщенного растворов цитрата кальция (предел растворимости цитрата кальция в воде составляет 0,96 г/л). С учетом осаждения хлорида кальция и сульфата натрия реакция стремится к завершению (СаСl2+Na2SO4→CaSO4+2NaCl), соответствующие конечные концентрации сульфата кальция приведены в Таблице 24. Такие же данные для реакции с осаждением хлорида кальция и цитрата натрия (3СаСl2+2Na3С6Н5O7→Са3(С6Н5O7)2+6NaCl) также приведены в Таблице 28.
| Таблица 28 | ||
| Общая концентрация твердых веществ в исходных жидких растворах и конечная концентрация сульфата кальция или цитрата кальция при величинах растворимости в воде сульфата кальция 2,98 г/л и цитрата кальция 0,96 г /л | ||
| Общая конц. твердых веществ (г/л) | Конечная концентр, сульфата кальция (г/л) | Конечная концентр, цитрата кальция (г/ л) |
| 5 | 2,7 | 2,9 |
| 10 | 5,4 | 5,9 |
| 15 | 8,1 | 8,8 |
| 20 | 10,8 | 11,7 |
| 30 | 16,1 | 17,6 |
Составы, включающие 44 вес. % хлорида кальция и 56 вес. % сульфата натрия, были получены путем сушки при распылении с применением сушилки Mobile Minor spray dryer (Niro, GEA Process Engineering Inc., Columbia, MD). Исходные жидкие растворы имели концентрацию твердых веществ в интервале от 5 до 30 г/л. В случае получения растворов с предварительным смешением солей в дистиллированной воде при постоянном перемешивании магнитной мешалкой растворяли вначале соль кальция и затем соль натрия. В случае получения растворов при статическом смешении в дистиллированной воде растворяли соль кальция, затем в дистиллированной воде отдельно растворяли соль натрия, эти два раствора хранили в отдельных сосудах при постоянном перемешивании. Распыление жидкого состава осуществляли с помощью распылителя с параллельными потоками (Niro, GEA Process Engineering Inc., Columbia, MD). Жидкий состав, полученный предварительным смешением компонентов, подавали при помощи шестеренчатых насосов (Cole-Parmer Instrument Company, Vernon Hills, IL) непосредственно в распылитель с параллельными потоками, а отдельные растворы подавали в статический смеситель (Charles Ross & Son Company, Hauppauge, NY) непосредственно перед введением в пневмораспылитель. В качестве осушающего газа применяли азот, в качестве атомизирующего газа для распылителя использовали сухой сжатый воздух. Температура на входе газа была равна 240-250°С, а температура на выходе составляла 94-98°С, скорость подачи жидкого потока составляла 50-70 мл/мин. Скорость подачи газа в пневмораспылитель составляла примерно 11 кг 1 ч. Величина давления в сушильной камере составляла - 2"WC. Высушенный при распылении продукт собирали из циклона и определяли объемный размер частиц методом лазерной дифракции, используя систему HELOS/RODOS, а для определения свойств частиц применяли коллапсный двухстадийный ACI.
Для растворов, полученных с предварительным смешением солей, определяли стабильность растворов и прозрачность. При общей концентрации твердых веществ равной 5 г/л, когда конечная концентрация сульфата кальция слегка превышала предел растворимости сульфата кальция, раствор оставался прозрачным в течение 30-минутного смешения и сушки при распылении. Когда общая концентрация твердых веществ увеличивалась и конечная концентрация сульфата кальция намного превышала предел растворимости, исходный раствор становился мутным и происходило заметное осаждение. При концентрации 10 г/л раствор был слегка мутным, при концентрации 20 г/л раствор был прозрачным в течение примерно 5-10 мин перед тем, как он становился очень мутным через 10 мин, и при концентрации равной 30 г/л жидкость была прозрачной в течение примерно 2 мин после смешения с видимым осаждением через примерно 5 мин.
Исходные жидкие составы, полученные при предварительном смешении и при статическом смешении, сушили при распылении и полученные порошки собирали из циклона. Результаты, полученные при помощи системы HELOS/RODOS, показаны на Фигуре 28, а распределение частиц по размерам показано на Фигуре 29. Хотя увеличение размера частиц с возрастанием концентрации твердых веществ в исходных растворах является ожидаемым (что наблюдается в случае составов, полученных при статическом смешении), значительное увеличение размера частиц и широкое распределение частиц по размерам нежелательны.
Характеристика аэрозолей сухих порошков при помощи коллапсного ACI приведена на Фигуре 30.
Нестабильные растворы с постоянным осаждением могут отрицательно влиять на воспроизводимое образование частиц во время сушки при распылении, а также приводить к широкому распределению частиц. Пересыщенные растворы, являющиеся прозрачными в течение 2-10 мин при более высокой концентрации твердых частиц, позволяют предположить, что растворы могут быть получены при статическом смешении для достижения более высокой производительности сушилки с получением частиц с узким распределением по размерам.
Похожие результаты были получены для цитрата кальция, что видно из примера 1 для состава, содержащего 10,0 вес. % лейцина, 35,1 вес. % хлорида кальция и 54,9 вес. % цитрата натрия (состав I-А). Реакция с осаждением будет приводить к получению состава, содержащего 10,0 вес. % лейцина, 52,8 вес. % цитрата кальция и 37,2 вес. % хлорида натрия. При общей концентрации твердых веществ, равной 10 г/л, конечная концентрация цитрата кальция будет составлять 5,3 г/л, что превышает предел растворимости цитрата кальция в воде, составляющий 0,96 г/л. Как показывают свойства порошка, высушенного при распылении (Фигуры 1А-1Е и 2-4), этот пересыщенный раствор привел к получению пригодных для вдыхания частиц с узким распределением частиц по размерам.
ПРИМЕР 18
Мелкие диспергируемые частицы получали из составов, содержащих кальций с лейцином или без него, а также из составов, содержащих магний и только натрий.
С применением сушилки Büchi В-290 и высокопроизводительного циклона со скоростью подачи воздуха равной 30 мм, параметром аспиратора 90% и небольшого стеклянного приемника получали следующие порошки. Концентрация твердых частиц составляла 5 г /л, исходные вещества смешивали в дистиллированной воде, при этом следующий компонент в том порядке, как он указан ниже, вводили после полного растворения предыдущего.
18-1) 10,0% лактозы, 30,6% хлорида магния, 59,4% цитрата натрия, отношение Ca:Na=1:2
18-2) 63,4% лактата магния, 36,6% хлорида натрия, отношение Са:Na=1:2 18-3) 10,0% лейцина, 58,4% лактата магния, 31.6% хлорида натрия, отношение Са:Na=1:2
18-4) 50,0% лейцина, 50% лактата кальция 18-5) 10% лейцина, 90% хлорида натрия 18-6) 60% лейцина, 40% хлорида натрия
18-7) 10,0% албутерола, 58.6% лактата кальция, 31.4% хлорида натрия 18-8) 90,0% албутерола, 5,9% лактата кальция, 3,1% хлорида натрия
Свойства этих порошков приведены ниже в Таблице 29. Все восемь порошков хорошо диспергировались, это подтверждается величинами ×50, отношений 0,5/4 и 1/4. Количество FPF's размером <5,6 мкм колебалось от 18,7% до 75,6%.
| Таблица 29 | ||||||||||
| Составы, содержащие натрий, кальций и составы на основе магния | ||||||||||
| Партия | Состав | Метод | ×50 (мкм) @ 1 бар | GSD@ 1 бар | 1/4 бар | 0,5/4 бар | FPF_TD <3,4 мкм % | FPF_TD <5,6 мкм % | Вес % | Выход % |
| 68.124.1 | лакт:МgСl2:Ма3Цит 10:30.6:59.4 | Buchi HP | 2,9 | 2,3 | 1Д | 1Д | 18,1% | 37,8% | 55,7% | 88,9% |
| 68.129.1 | лейцин: МgЛакт:NaСl 10:58.6:31.4 | Buchi HP | 2,7 | 2,4 | 0,8 | 1,1 | 14,5% | 32,3% | 53,0% | 80,0% |
| 68.129.2 | Mgлакт:NaCl 63.4:36.6 | Buchi HP | 3,3 | 2,1 | 1,0 | 1,0 | 16,5% | 39,3% | 59,8% | 78,0% |
| 68.125.1 | лейц:СаЛакт 50:50 | Buchi HP | 3,5 | 2,2 | 1,1 | 1,1 | 19,2% | 38,5% | 60,4% | 76,0% |
| 68.124.2 | лейц:NаСl 10:90 | Buchi HP | 1,1 | 1,7 | 1,0 | 1,2 | 53,0% | 71,0% | 78,6% | 67,9% |
| 68.124.3 | лейц: NаСl 60:40 | Buchi HP | 1,4 | 2,2 | 1Д | 1,2 | 49,7% | 75,6% | 85,2% | 54,3% |
| 68.125.2 | албутерол:СаЛакт:NаСl 10:58.6:31.4 | Buchi HP | 2,8 | 2,3 | 0,9 | 1,0 | 16,0% | 38,6% | 60,2% | 81,5% |
| 68.125.3 | албутерол:СаЛакт: NaСl 90:5.9:3.1 | Buchi HP | 3,5 | 2,3 | 1,0 | 1,1 | 8,9% | 18,7% | 29,1% | 40,5% |
Были получены несколько дополнительных составов, не содержащих кальция, с применением различных систем для сушки (Büchi, Labplant и Niro) способом, описанным выше. Свойства полученных порошков приведены в Таблице 30 (отсутствие величин в клетках означает, что данное свойство этого порошка не определялось).
Были также получены несколько составов, или не содержащих эксципиентов, или содержащих другие эксципиенты вместо лейцина с применением различных систем для сушки (Buchi, Labplant Niro) способами, описанными выше. Свойства полученных порошков приведены в Таблице 31 (отсутствие величин в клетках означает, что данное свойство этого порошка не определялось).
В Таблице 32 приведены свойства дополнительных составов с мелкими диспергируемыми частицами, содержащими лейцин и кальций, полученных с применением систем для сушки Buchi или Niro способом, похожим на описанные выше способы (отсутствие величин в клетках означает, что данное свойство этого порошка не определялось).
| Таблица 32 | ||||||||||||
| Составы с мелкими диспергируемыми частицами, содержащие лейцин и кальций | ||||||||||||
| Партия порошка | Состав | Метод | x50 (мкм) @ 1 бар | GSD @ 1 бар | 1/4 бар | 0,5/ 4 бар |
вода % | FPF_TD <3,4 мкм % | FPF_TD <5,6 мкм % | Масса, % | Выход % | Нас. вес после утр. (г/см) |
| Хлорид | ||||||||||||
| 26.010.2 | лей:СаСl2:NaCl 50:2,.5:20,5 | Niro | 4,8 | 2,2 | 1,1 | 15,8% | 35,9% | 50,8% | 64,1% | |||
| 26.041.3 | лей:СаСl2:NаСl 50:29,5:20,5 | Niro | 4,9 | 2,4 | 14,7% | 28,0% | 43,0% | 50,2% | ||||
| Цитрат | ||||||||||||
| 26.013.1 | лей:СаСl2: Na3Цит2 50:19,5:30,5 | Niro | 4,2 | 2,1 | 1,6 | 16,8% | 35,2% | 53,8% | 56,1% | |||
| 26.013.2 | лей:СаСl2:Nа3Цит2 | Niro | 4,8 | 1,8 | 1,3 | 20,8% | 39,6% | 52,2% | 57,5% | |||
| 10:35,1:54,9 | ||||||||||||
| 26-190-F | лейцин:СаСl2:Nа3Цит2 10.0:35,1:54,9 | Niro | 2,6 | 1,9 | 1,2 | 1,2 | 45,7% | 61,6% | 66,3% | 74,8% | 0,29 | |
| Сульфат | ||||||||||||
| 26.013.4 | лей:СаСl2:Na2SO4 10:39,6:50,4 | Niro | 3,7 | 2,0 | 1,4 | 19,6% | 39,4% | 60,9% | 73,1% | |||
| 26.060.2 | лей:СаСl2:Nа2SO4 10:39,6:50,4 | Niro | 2,9 | 1,9 | 1,2 | 16,2% | 35,2% | 53,2% | 46,5% | 0,18 | ||
| 26.060.4 | лей:СаСl2:Na2SO4 10:39,6:50,4 | Niro | 2,9 | 1,7 | 1,3 | 18,8% | 45,1% | 64,4% | 49,9% | 0,17 | ||
| 27.154.2 | лейцин:СаСl2: Na2SO4 10:39,6:50,4 | Buchi | 3,8 | 1,9 | 1,1 | 17,2% | 37,5% | 55,5% | 56,1% | 0,30 | ||
| 65-009-F | лейцин:СаСl2:Na2SO4 10.0:39,6:50,4 | Niro | 2,5 | 2,2 | 1,4 | 1,5 | 60,1% | 82,7% | 88,6% | 74,2% | 0,34 | |
| 26.053.1 | лейцин:СаСl2:Na2SO4 50:22:28 | Niro | 4,2 | 2,0 | 1,5 | 3,3% | 23,0% | 39,6% | 52,0% | 59,6% | ||
| 27.114.4 | лейцин:СаСl2:Na2SO4 50:22:28 | Niro | 4,7 | 1,8 | 1,9 | 3,8% | 21,2% | 44,6% | 59,6% | 59,6% | ||
| 27.155.1 | лей:СаСl2: Na2SO4 50:22:28 | Buchi | 3,7 | 1,9 | 1,2 | 15,7% | 42,9% | 68,8% | 47,6% | 0,35 | ||
| Сульфат кальция | ||||||||||||
| 26.019.4 | лей:СаSO4 50:50 | Niro | 4,1 | 2,1 | 1,4 | 11,9% | 28,0% | 56,0% | 101,8 % | |||
| Карбонат | ||||||||||||
| 26.019.1 | лей:СаСl2:NaСО3 50:25,5:24,5 | Niro | 3,4 | 1,9 | 1,7 | 9,6% | 22,2% | 35,9% | 46,3% | |||
| 26.019.2 | лей:СаСl2:NaСО3 10:45,9:44,1 | Niro | 2,7 | 1,8 | 1,4 | 10,6% | 23,8% | 37,5% | 51,0% | |||
| Лактат | ||||||||||||
| 26.041.4 | лей:СаЛакт:NaСl 50:36.8:13.1 | Niro | 5,0 | 1,9 | 9,7% | 25,9% | 46,6% | 56,5% | ||||
| 27.183.2 | Лей:СаЛакт: NaСl 50:48,4:1,6 | Buchi | 3,7 | 1,8 | 1Д | 24,9% | 48,9% | 62,7% | 34,1% | |||
| 27.185.1 | лей:СаЛакт: NaСl 10:66,6:23,4 | Buchi | 3,0 | 1,9 | 1,0 | 26,1% | 53,7% | 70,0% | 44,8% | |||
| 45.19.1 | лей:СаЛакт: NaСl 10:66,6:23,4 | Buchi HP | 3,4 | 2,3 | 0,9 | 5,2% | 12,8% | 29,1% | 50,3% | 75,6% | 0,74 | |
| 45.76.1 | лей:СаЛакт: NaСl 10:58.6:31.4 | Buchi HP | 3,8 | 2,1 | 1,0 | 5,0% | 8,6% | 20,9% | 36,6% | 78,5% | ||
| 45.78.1 | лей:СаЛакт: NaСl 10:58,6:31,4 | Buchi HP | 1,5 | 1,9 | 1,1 | 4,8% | 30,6% | 53,4% | 62,9% | 60,8% | ||
| 45.80.1 | лей:СаЛакт: NaСl 10:58,6:31,4 | Buchi HP | 1,5 | 1,9 | 1,1 | 4,4% | 30,3% | 53,5% | 63,8% | 71,0% | ||
| 45.81.1 | лей:СаЛакт: NaСl 10:58,6:31,4 | Buchi HP | 2,4 | 2,8 | 1,3 | 7,2% | 19,3% | 34,1% | 44,3% | 64,6% | ||
| 68.70.1 | лей:СаЛакт: NaСl 10:58,6:31,4 | Buchi HP | 1,5 | 1,9 | 1,0 | 42,8% | 63,2% | 67,8% | 73,9% | |||
| 65-003-F | лей:СаЛакт:NaCl 10,0:58,6:31,4 | Niro | 1,5 | 2,5 | 1,1 | 1,1 | 43,4% | 63,5% | 69,7% | 62,9% | 0,69 | |
| Глюконат | ||||||||||||
| 27.184. 1 | лей:СаГлюк:№С1 50:49,15:0,85 | Buchi | 3,4 | 2,1 | 1,0 | 35,0% | 61,4% | 76,3% | 51,9% | |||
| 27.184. 4 | лей:СаГлюк:№С1 50:42,35:7,65 | Buchi | 3,5 | 2,0 | 1,2 | 34,1% | 60,7% | 71,5% | 46,3% | |||
| 27.184. 2 | лей:СаГлюк:№С1 10:88.5:1.5 | Buchi | 2,7 | 2,0 | 1,0 | 24,9% | 52,2% | 64,2% | 51,0% | |||
ПРИМЕР 19
Чистый хлорид кальция высушивали при распылении в системе Labplant spray drying system при температуре на входе газа равной 180°С.Исходный жидкий состав содержал 20 г твердого дигидрата хлорида кальция/л деионизированной воды. По мере растворения хлорида кальция в воде вода конденсировалась в сборнике и нельзя было собрать порошок. Чистый хлорид кальция является слишком гигроскопичным, чтобы его можно было высушить при распылении водного раствора с большим содержанием воды в выходящем осушающем газе. Затем в исходный раствор вместо воды вводили 70% этанол для уменьшения влажности в выходящем осушающем газе. При этом концентрация твердого вещества была равна 20 г/л, температура на входе составляла 200°С и температура на выходе была равна 69°С. Вода продолжала конденсироваться в сборнике и порошок казался влажным. Был сделан вывод, что хлорид кальция является слишком гигроскопичным, чтобы его можно было сушить при распылении без смешения с другими солями или с эксципиентом для снижения содержания хлорида кальция в конечном порошке.
Чистый хлорид магния высушивали при распылении в системе Labplant spray drying system при температуре на входе газа равной 195°С и температуре на выходе равной 68°С.Исходный жидкий состав содержал 20 г твердого гексагидрата хлорида магния /л деионизированной воды. Сухой порошок в сборнике выглядел влажным и средний медианный диаметр, измеренный при помощи системы HELOS/RODOS, составлял 21 мкм. Затем в исходный раствор вместо воды вводили 70% этанол для уменьшения влажности в выходящем осушающем газе, при этом концентрация твердого вещества была равна 50 г/л, температура на входе составляла 200°С и температура на выходе была равна 74°С.Этот порошок хлорида магния не выглядел влажным и имел медианный объемный размер частиц равный 4 мкм, но он оказался гранулированным и содержал фракцию мелких частиц размером менее 5,6 мкм в количестве 19%, что свидетельствовало о том, что этот порошок не совсем пригоден для вдыхания.
ПРИМЕР 20: Крупные пористые частицы
ПРИМЕР 21:СТАБИЛЬНОСТЬ
Полученные порошки были также испытаны с целью определения их стабильности при повышенной температуре и высокой влажности (ICH, Climatic Zone XIV), которые составляли 30°С и 75% RH. В капсулы помещали примерно по 25 мг состава I, состава II и состава III. Капсулы оставляли открытыми и затем помещали с камеру для определения стабильности при указанных выше условиях на 15 и 30 мин. Капсулы удаляли в соответствующий момент времени и определяли aPSD, используя коллапсный 2-стадийный компактор ACI, для определения gPSD применяли Malvern Spraytec. Оба определения проводили при 60 LPM в течение 2 с. Каждое определение повторяли, n=2. Полученные результаты сравнивали с величинами PSD/gPSD для порошка, выдерживаемого при комнатной температуре и 25 - 30% RH.
Все составы (состав I, состав II и состав III) характеризовались изменением (которое было менее +/-5%) величины фракции мелких частиц в полной дозе (FPFTD) размером менее 5,6 мкм при стандартных условиях (22°С, 25-30% RH) после 30 - минутной выдержки при повышенной температуре и высокой влажности (30°С, 75% RH). При определении gPSD состав I характеризовался увеличением этой величины, составляющим 30% через мин, в то время как состав III оставался наиболее стабильным, а для состава II было отмечено уменьшение Dv50 примерно на 15% через 30 мин.
В то время как при выдержке всех трех составов в течение 30 мин при 30°С, 75% RH были отмечены незначительные изменения свойств аэрозоля, изменение геометрического размера частиц было более очевидным (Фигуры 31А и 31В). Размер частиц состава I (с цитратом кальция) увеличивался примерно на 30%, в то время как размер частиц состава II (с лактатом кальция) уменьшался примерно на 15%. Размер частиц состава III (с сульфатом кальция) уменьшался, но незначительно.
Испытывали другие составы (порошок, содержащий 38.4% лейцина, 30,0% хлорида кальция, 31,6% хлорида натрия) и три порошка с лактатом кальция и с различными эксципиентами (лактоза, маннит, мальтодекстрин), соответствующие составу II (10,0% эксципиента, 58,6% лактата кальция, 31,4% хлорида натрия).
После 30 - минутной экспозиции при указанных температуре и влажности (30°С, 75% RH), состав с мальтодекстрином (состав XIV) и состав с маннитом характеризовались величиной изменения количества фракции мелких частиц размером менее 5,6 мкм в полной дозе, составляющей менее +/- 10% при стандартных условиях (22°С, 25-30% RH). В случае порошков с хлоридом кальция и лактозой происходило снижение этого параметра (количества фракции мелких частиц с размером менее 5,6 мкм) более, чем на 50% и увеличение примерно на 20%, соответственно (Фигура 31С). В случае gPSD результаты были противоположными, порошок с хлоридом кальция и состав с лактозой через 30 мин характеризовались величиной изменения Dvso менее +/- 10%, в то время как для состава с маннитом во время опыта наблюдалось увеличение Dvso на 30%-60% (Фигура 32D). Для состава с мальтодекстрином изменение Dvso нe определялось.
ПРИМЕР 22:Стабильность в течение небольшого времени при комнатной температуре и 30% и 40% RH
Высушенные при распылении порошки выдерживались при комнатной температуре и влажности около 30% и 40% RH в течение одной недели и для них периодически определяли распределение частиц по размерам. Капсулы с размером 3 из НРМС (Quali-V, Qualicaps, Whitsett, NC) заполняли наполовину каждым из сухих порошков. Один образец испытывали сразу же в Spraytec (Malvern Instruments Inc., Westborough, MA), системе с определением размера частиц методом лазерной дифракции, где сухие порошки могут быть диспергированы при помощи ингалятора. Примерно 16 капсул заполняли порошками. Половину капсул выдерживали в лаборатории при контролируемых величинах температуры и давления (~23-28% RH), а другую половину выдерживали вне лаборатории при различных температуре и влажности (~38-40% RH). В определенные моменты времени (t=1 ч, 2 ч, 4 ч, 24 ч, 48 ч, 1 нед), одна капсула из помещения с контролируемыми параметрами окружающей среды и одна капсула, взятая вне этого помещения, подвергались испытанию в Spraytec с целью определения объемного распределения частиц по размерам.
Результаты выбора составов, содержащих 50% лейцина и комбинацию кальция хлорида и соли натрия, показаны на Фигуре 32 и Фигуре 33. Составы, содержащие хлорид кальция и хлорид натрия, агломерировали в значительной степени после действия на них высокой влажности. Состав с ацетатом в начальные моменты времени характеризовался переменными результатами. Составы с сульфатом, цитратом и карбонатом были довольно стабильны в течение всего опыта.
Составы сухих порошков, содержащие хлорид кальция и хлорид натрия, были нестабильными при комнатной температуре и влажности равной 40% RH через час экспозиции, в то время как состав с ацетатом также характеризовался переменными результатами в отношении размера частиц. У порошков с сульфатом и лактатом частицы слегка увеличивались по размеру, а порошков с карбонатом и цитратом размер частиц слегка уменьшался. Составы, содержащие только хлорид и содержащие ацетат, не были достаточно стабильными, чтобы их можно было испытывать дальше.
ПРИМЕР 22. ТЕКУЧЕСТЬ СУХИХ ПОРОШКОВ
Текучесть порошков составов I, II, III и XIV оценивали, используя обычные методы характеристики текучести порошков. Индекс текучести каждого порошка определяли с применением прибора Flodex Powder Flowability Test Instrument (Hanson Research Corp., model 21-101-000). В каждом опыте загружали весь образец при помощи воронки из нержавеющей стали, направленной в центр отверстия в крышке цилиндра. Нужно было обращать внимание на то, чтобы не касаться горки порошка в цилиндре. После загрузки ждали 30 с для того, чтобы образовались хлопья, крышку цилиндра освобождали от порошка, слегка потряхивая прибор. Опыт считался законченным, если порошок попал в цилиндр, было видно отверстие в крышке, если смотреть на прибор сверху, и осадок в цилиндре образовал перевернутый конус; если же отверстие не было видно или порошок не образовал конуса, опыт считался неудачным. Было испытано достаточное количество дисков для того, чтобы определить минимальный размер отверстия, через которое может пройти порошок, для проведения удачного опыта. Диск с минимальным отверстием испытывали еще два раза, чтобы получить 3 положительных результата из 3 попыток. Индекс текучести (FI) выражен как величина минимального диаметра отверстия.
Объемная плотность (удельный вес) и насыпной вес после утряски определяли при помощи прибора SOTAX Тар Density Tester model TD2. В каждом опыте все количество образца помещали в тарированный градуированный цилиндр объемом 100 мл через воронку из нержавеющей стали. Записывали массу и первоначальный объем (V0) и помещали цилиндр на столик прибора и проводили определение по методу USP I. Вначале цилиндр встряхивали, применяя Тар Count 1 (500 встряхиваний) и записывали полученный объем Va. Во второй раз использовали Тар Count 2 (750 встряхиваний), получая величину объема Vb1. Если Vb1>98% от величины Va, опыт считался законченным, в противоположном случае применяли Тар Count 3 (1250 встряхиваний) до тех пор, пока величина Vbn не стала >98% от величины Vbn-1. Затем определяли объемную плотность (dB), насыпной вес после утряски (dT), отношение Хауснера (Н) и индекс прессуемости (С), при этом два последних параметра являются стандартными показателями текучести порошка. "Н" обозначает отношение насыпного веса после утряски к объемной плотности, а "С" равняется 100 * (1 - (отношение объемной плотности к насыпному весу после утряски)). При помощи системы Micromeritics Analytical Services, использующей Accupyc II 1340, как метод вытеснения гелия для определения объема порошков определяли "скелетную плотность " порошков. Эта система позволяет определять объем каждого образца за исключением пустот междуузлий в объеме частиц порошка и любых открытых пор в индивидуальных частицах, в которые может поступать газ. Внутренние (закрытые) поры тоже входили в величину объема. Плотность определяли с учетом объема образца и веса образца, который определяли путем взвешивания. Объем каждого образца измеряли по 10 раз, ниже указаны скелетная плотность (dS) как средняя величина от 10 измеренных величин с учетом стандартного отклонения.
Результаты определения этих величин указаны в Таблицах 34 и 35. Для всех четырех видов порошков были характерны отношения Хауснера и индексы прессуемости, которые, как описано в литературе, свойственны порошкам с чрезвычайно плохой текучестью (см., например, USP <1174>). Было удивительно, что эти порошки тем не менее хорошо диспергировались и из них получались хорошие аэрозоли, как описано в данной заявке.
| Таблица 34 | |||||
| Объемный удельный вес и насыпной вес после утряски для составов I-III и XIV | |||||
| Образец | FI (мм) | dB (г/мл) | dT (г/мл) | Н | С |
| Состав I | 26 | 0Д93 | 0,341 | 1,77 | 43,4% |
| Состав II | 22 | 0,313 | 0,722 | 2,31 | 56,7% |
| Состав III | 18 | 0,177 | 0,388 | 2,19 | 54,3% |
| Состав XIV | >34 | 0,429 | 0,751 | 1,75 | 42,9% |
| Таблица 35 | ||
| Величины "скелетной плотности" порошков составов I-II и XIV | ||
| ОБРАЗЕЦ | dS1±σ (г/ мл) | dS2±σ (г/мл) |
| Состав I | 1,7321±0,0014 | 1,7384±0,0042 |
| Состав II | 1,6061±0,0007 | 1,6074±0.0004 |
| Состав III | 2,1243±0,0011 | 2,1244±0,0018 |
| Состав XIV | 1,6759±0,0005 | 1.6757±0.0005 |
В описании метода USP <1174>, упомянутого выше, отмечено, что сухие порошки с отношением Хауснера более 1,35 имеют плохую текучесть. Как на текучесть, так и на диспергируемость отрицательно влияли агломерация или агрегирование частиц. Тем более удивительным было то, что сухие порошки с величиной отношения Хауснера более, чем от 1,75 до 2,31 будут очень хорошо диспергироваться.
ПРИМЕР 23:Содержание воды и гигроскопичность
Содержание воды в порошках составов I, II, III и XIV определяли методом гравиметрического анализа (TGA) и анализа по методу Карла Фишера (Karl Fischer). Термогравиметрический анализ (TGA) проводили на анализаторе ТА Instruments Q5000 IR (New Castle, DE). Образец помещали на алюминиевый поддон и затем в печь для TG. Полученные данные и параметры процесса были указаны на каждой термограмме. В качестве калибровочных стандартов Nickel and Alumel™. При гравиметрическом анализе содержание воды определяли по потере массы образцов при нагревании до температуры 150°С (в случае TGA, поскольку растворителем является одна вода, 100%, предполагалось, что в качестве летучего компонента в этих порошках присутствовала только вода). Пример термограммы порошка состава I показан на Фигуре 34. Кулонометрическое определение содержания воды по Карлу Фишеру (KF) проводили, используя титратор Mettler Toledo DL39 KF (Greifensee, Switzerland). Образец помещали в титровальный сосуд KF, содержавший Hydranal - Coulomat AD и перемешивали в течение 10 с для растворения. Затем образец титровали при помощи электрода, который обеспечивает получение йода вследствие электрохимического окисления: 2 I-=>I2+2е. Обычно проводили один опыт для определения интервала параметров и повторяли его два раза, чтобы обеспечить получение воспроизводимых данных. Содержание воды в порошках указано в Таблице 36.
| Таблица 36 | ||
| Содержание воды в порошкообразных составах I, II, III и XIV, определенное методом TGA и методом по Карлу Фишеру (Karl Fischer) | ||
| Порошок | Содержание воды по данным ТГА | Содержание воды по Karl Fischer |
| Состав I | 4,9% | 3,9% |
| Состав II | 2,0% | 2,0% |
| Состав III | 5,1% | 4,6% |
| Состав XIV | 2,2% | 2,1% |
Определение динамической сорбции паров (DVS) проводили для сравнения гигроскопичности и способности поглощать воду порошками составов I, II, III и XIV и порошком, содержащим сырой дигидрат хлорида кальция, а также контрольным порошком, включающим 1:2 хлорид кальция и хлорид натрия, полученным путем сушки при распылении состава, содержащего 38,4% лейцина, 30% СаСl2 и 31,6% NaCl (было установлено, что допустимая для получения хороших свойств без поглощения влаги из воздуха в приемнике сразу же после сушки максимальная нагрузка кальция в порошке, полученном при распылении, составляла 30 вес. %). С учетом условий работы DVS порошки вначале выдерживали при 0% RH, затем в условиях 30% RH в течение 1 ч и при 75% RH в течение 4 ч. Поглощение воды в % % каждым из порошков показано в Таблице 37. Как видно из Таблицы 37, и порошок с сырым дигидратом хлорида кальция, и контрольный порошок были очень гигроскопичными, поглощая примерно до 14-15% воды при выдержке при 30% RH в течение 1 ч и поглощали значительно более 100% от величины их массы после выдержки при влажности 75% RH. В противоположность этому порошки составов I, II, III и ХIV поглощали менее 2,5% воды после выдержки при 30% RHb течение 1 ч и от 14% до 33% воды при выдержке при 75% RH в течение 4 ч.
| Таблица 37 | ||
| Изменение массы в % вследствие поглощения воды после (i) выдержки при 30% RH в течение 1 ч и (ii) после выдержки при 75% RH в течение 4 ч, определенное методом DVS | ||
| Порошок | % изменения массы вследствие поглощения воды после выдержки при 30% RH в течение 1 ч | % изменения массы вследствие поглощения воды после выдержки при 75% RH в течение 1 ч |
| СаСl2*2Н20 (сырой) | 13,7 | 146 |
| СаСl2 - контроль | 15,3 | 124 |
| Состав I | 1,68 | 14,7 |
| Состав II | 1,27 | 28,3 |
| Состав III | 2,45 | 20,8 |
| Состав XIV | 1,36 | 32,8 |
ПРИМЕР 24:Величина теплоты растворения
Величины теплоты растворения были получены при растворении образцов составов I-III в HBSS буфере в сравнении с (i) контрольным порошком, состоящим из 30% хлорида кальция, 31,6% хлорида натрия и 38,4% лейцина, (ii) сырым дигидратом хлорида кальция и (iii) сырым лейцином. Как показано в Таблице 38, в качестве образцов, содержащих кальций, испытывали порошки состава I (PUR111), II (PUR113) и III (PUR112), содержащие эквивалентные количества иона кальция. Результаты показаны на Фигуре 35, составы I-III имели значительно сниженные величины теплоты растворения по сравнению с сырым дигидратом хлорида кальция и контрольным порошком. Известно, что дигидрат хлорида кальция обладает большой величиной экзотермической теплоты растворения, высвобождая значительное количество тепла при контакте с водой. При некоторых условиях, таких, когда большое количество дигидрата хлорида кальция или других солей, которые выделяют большое количество тепла при растворении, быстро растворяются в воде, высвобождается большое количество тепла, которое может вызвать ожоги. Таким образом, существуют некоторые проблемы безопасности, связанные с контактированием поверхности слизистой оболочки с дигидратом хлорида кальция. Эти проблемы можно устранить при получении порошков, таких как составы I-III, которые не имеют больших величин экзотермической теплоты растворения и поэтому снижается возможность появления нежелательных экзотермических эффектов.
| Таблица 38 | ||||||||||||
| Величины теплоты растворения для порошков составов I-III, контрольного порошка, содержащего хлорид кальция, сырой дигидрат хлорида кальция и сырой лейцин | ||||||||||||
| Порошок | Лейцин 65-017-F(-4) | СаСl2·2Н2O Спектр | СаСl2-контроль 68-113-1 | PUR111 26-190-F | PUR112 65-009-F | PUR113 65-003-F | ||||||
| Средн. | Ст. откл. | Средн. | Ст. откл. | Средн.. | Ст. откл. | Средн. | Ст. откл. | Средн. | Ст. откл. | Средн. | Ст. откл. | |
| г | 0,032 | 0,000 | 0,036 | 0,001 | 0,090 | 0,001 | 0,077 | 0,000 | 0,068 | 0,000 | 0,090 | 0,000 |
| ммол* | 0,244 | 0,001 | 0,242 | 0,000 | 0,242 | 0,000 | 0,242 | 0,000 | 0,243 | 0,000 | 0,242 | 0,000 |
| ΔT (град.С) | 0,003 | 0,002 | 0,024 | 0,001 | 0,023 | 0,003 | 0,014 | 0,002 | 0,012 | 0,003 | 0,009 | 0,002 |
| Q (кал) | 0,37 | 0,20 | 2.93 | 0,12 | 2,8 | 0,3 | 1,7 | 0,2 | 1,5 | 0,4 | 1,0 | 0,3 |
| ΔН | -1,5 | 0,8 | -12,1 | 0,4 | -11,7 | 1,4 | -6,9 | 1,0 | -6,2 | 1,6 | -4,3 | 1,1 |
| (ккал/моль)* | ||||||||||||
| ΔН | -6 | 4 | -50,6 | 1,6 | -49 | 6 | -29 | 4 | -26 | 7 | -18 | 4 |
| (кДж/моль)* | ||||||||||||
| * моль Са для всех порошков, за исключением лейцина, для которого указаны моль. | ||||||||||||
ПРИМЕР 25. In vivo модель пневмонии
Бактерии были приготовлены путем выращивания культур в планшетах на питательной среде, представляющей собой кровяной трипсиновый соевый агар (TSA) в течение ночи при температуре 37°С плюс 5% СО2. Одиночные колонии снова суспендировали в стерильном PBS до достижения OD600 ~0,3 и затем разбавляли 1:4 в стерильном PBS (~2×107 колониеобразующих единиц (кое/мл)). Мышей инфицировали 50 мкл бактериальной суспензии (~1×106 кое) путем интратрахеальной инсталляции после анестезии.
Мышей C57BL6 подвергали воздействию на весь организм аэрозоля жидкого состава с применением или небулайзера с высокой производительностью, или небулайзера Pari LC Sprint nebulizer, соединенного с камерой в виде клетки, в которой находились 11 животных. Мышам вводили сухие порошки (Таблица 39) за 2 ч до заражения S. pneumoniae. Животным в контрольной группе вводили такое же количество порошка со 100% лейцина. Через 24 ч после заражения мышей умерщвляли инъекцией пентобарбитала и вынутые легкие гомогенизировали в стерильном PBS. Образцы гомогенатов легких серийно разбавляли в стерильном PBS и помещали в планшеты с кровяным TSA. К.О.Е определяли на другой день.
По сравнению с животными в контрольной группе животные, которым вводили сухой порошок, содержащий кальций, через 24 ч после заражения характеризовались пониженными бактериальными титрами. Конкретно, животные, которым вводили состав, состоящий из сульфата кальция и хлорида натрия (состав III) имели в 5 раз меньшие бактериальные титры, животные, которым вводили состав, состоящий из цитрата кальция и хлорида натрия (состав I) имели в 10,4 раза меньшие бактериальные титры и животные, которым вводили состав, состоящий из лактата кальция и хлорида натрия (состав II) имели в 5,9 раз меньшие бактериальные титры (Фигура 36).
| Таблица 39 | ||
| Составы, использованные для оценки эффективности | ||
| Состав | Композиция | Мольное отношение Са:Na |
| Состав I | 10,0% лейцина, 35,1% хлорида кальция, 54,9% цитрата натрия (активность 12?7% иона кальция) | 1:2 |
| Состав III | 10,0% лейцина, 39,6% хлорида кальция, 50.4% сульфата натрия (активность 14,3% иона кальция) | 1:2 |
| Состав II | 10,0% лейцина, 58,6% лактата кальция, 31,4% хлорида натрия (активность 10,8% иона кальция) | 1:2 |
Представленные данные показывают, что сухие порошки, содержащие соли двухвалентного металла, которые являются хорошо диспергируемыми, можно получить и применить для лечения бактериальных и вирусных инфекций.
Пример 26. Определение стабильности порошков после выдержки в течение 3 мес в условиях охлаждения, при стандартных условиях и в условиях ускоренного старения
Было проведено определение стабильности сухих порошков в течение 3 мес, использовали образцы порошков составов I-III, которыми заполняли капсулы с размером 3 из МС (Shionogi Qualicaps, Madrid, Spain), эти капсулы выдерживали при следующих условиях:(i) при охлаждении при температуре 2-8°С, (ii) при 25°С/ 60% RH, капсулы хранили под десиккантом и (iii) при 40°С/ 60% RH, капсулы хранили под десикантом. Проводили мониторинг количества FPF<5,6 и 3,4, а также Dv50 (Spraytec) и содержания воды по Карлу Фишеру до истечения 3 мес. Как видно из Таблицы 40, каждый из составов I-III обладал хорошей стабильностью свойств при указанных условиях.
Содержание каждого из патентов, заявок на патенты, патентных публикаций и опубликованных статей, упомянутых в данном описании, полностью включено в данную заявку посредством отсылки.
Claims (25)
1. Пригодный для вдыхания сухой порошок, включающий пригодные для вдыхания сухие частицы, содержащие соль магния; причем соль магния обеспечивает наличие ионов магния в количестве, равном примерно 5% или более от веса сухой частицы, причем пригодные для вдыхания сухие частицы имеют объемный медианный геометрический диаметр (VMGD), равный менее 5 мкм, плотность утряски более 0,4 г/см3 и отношение диспергируемости (1/4 бар), измеренное методом лазерной дифракции (система RODOS/HELOS), менее примерно 1,5.
2. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что он содержит фракцию мелких частиц (FPF) с размером менее 5,6 мкм в количестве, равном по меньшей мере 45%.
3. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что он содержит фракцию мелких частиц (FPF) с размером менее 3,4 мкм в количестве, равном по меньшей мере 30%.
4. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что он содержит фракцию мелких частиц (FPF) с размером менее 5,0 мкм в количестве, равном по меньшей мере 45%.
5. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что он имеет массовый медианный аэродинамический диаметр (MMAD), равный примерно 5,0 мкм или менее.
6. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что соль магния имеет растворимость в воде ≥0,5 г/л.
7. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что отношение молекулярных весов иона магния и соли магния больше примерно 0,1.
8. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что отношение молекулярных весов иона магния и соли магния больше примерно 0,16.
9. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что он дополнительно содержит по меньшей мере один фармацевтически приемлемый эксципиент.
10. Пригодный для вдыхания сухой порошок по п. 9, отличающийся тем, что по меньшей мере один эксципиент содержится в количестве примерно ≤20% по весу и включает лейцин.
11. Пригодный для вдыхания сухой порошок по п. 9, отличающийся тем, что по меньшей мере один эксципиент содержится в количестве примерно ≤50% по весу и включает лейцин.
12. Пригодный для вдыхания сухой порошок по п. 9, отличающийся тем, что по меньшей мере один эксципиент содержится в количестве примерно ≤20% по весу и включает мальтодекстрин или маннит.
13. Пригодный для вдыхания сухой порошок по п. 9, отличающийся тем, что по меньшей мере один эксципиент содержится в количестве примерно ≤50% по весу и включает мальтодекстрин или маннит.
14. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что соль магния представляет собой лактат магния.
15. Пригодный для вдыхания сухой порошок по п. 1, отличающийся тем, что соль магния выбрана из группы, состоящей из цитрата магния, хлорида магния и сульфата магния.
16. Пригодный для вдыхания сухой порошок по п. 1, дополнительно содержащий соль натрия.
17. Пригодный для вдыхания сухой порошок по п. 16, отличающийся тем, что указанная соль натрия представляет хлорид натрия.
18. Пригодный для вдыхания сухой порошок по п. 16, отличающийся тем, что указанная соль натрия представляет собой цитрат натрия, лактат натрия или сульфат натрия.
19. Способ лечения респираторного заболевания, включающий введение в дыхательные пути пациента, нуждающегося в этом, эффективного количества пригодного для вдыхания сухого порошка по п. 1.
20. Способ по п. 19, в котором респираторное заболевание представляет собой астму, сверхчувствительность дыхательных путей, сезонную аллергию, бронхиостаз, хронический бронхит, эмфизему, хроническое обструктивное заболевание легких или кистозный фиброз.
21. Способ лечения обострения респираторного заболевания, включающий введение в дыхательные пути пациента, нуждающегося в этом, эффективного количества пригодного для вдыхания сухого порошка по п. 1.
22. Способ по п. 21, в котором респираторное заболевание представляет собой астму, сверхчувствительность дыхательных путей, сезонную аллергию, бронхиостаз, хронический бронхит, эмфизему, хроническое обструктивное заболевание легких или кистозный фиброз.
23. Способ по п. 21, в котором обострение заболевания вызвано вирусной инфекцией, бактериальной инфекцией, грибковой инфекцией или инфекцией, вызванной паразитами.
24. Способ лечения или профилактики инфекционного заболевания дыхательных путей, включающий введение в дыхательные пути пациента, нуждающегося в этом, эффективного количества пригодного для вдыхания сухого порошка по п. 1.
25. Способ по п. 24, в котором инфекционное заболевание дыхательных путей вызвано вирусной инфекцией, бактериальной инфекцией, грибковой инфекцией или инфекцией, вызванной паразитами.
Applications Claiming Priority (15)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US16376309P | 2009-03-26 | 2009-03-26 | |
| US16377209P | 2009-03-26 | 2009-03-26 | |
| US16376709P | 2009-03-26 | 2009-03-26 | |
| US61/163,763 | 2009-03-26 | ||
| US61/163,767 | 2009-03-26 | ||
| US61/163,772 | 2009-03-26 | ||
| US25576409P | 2009-10-28 | 2009-10-28 | |
| US61/255,764 | 2009-10-28 | ||
| US26774709P | 2009-12-08 | 2009-12-08 | |
| US61/267,747 | 2009-12-08 | ||
| US29809210P | 2010-01-25 | 2010-01-25 | |
| US61/298,092 | 2010-01-25 | ||
| US30581910P | 2010-02-18 | 2010-02-18 | |
| US61/305,819 | 2010-02-18 | ||
| PCT/US2010/028961 WO2010111680A2 (en) | 2009-03-26 | 2010-03-26 | Dry powder formulations and methods for treating pulmonary diseases |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011137960A RU2011137960A (ru) | 2013-05-10 |
| RU2577698C2 true RU2577698C2 (ru) | 2016-03-20 |
Family
ID=42635067
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011137960/15A RU2577698C2 (ru) | 2009-03-26 | 2010-03-26 | Сухие порошкообразные составы и способы лечения легочных заболеваний |
Country Status (16)
| Country | Link |
|---|---|
| US (3) | US20120064126A1 (ru) |
| EP (2) | EP2410981B2 (ru) |
| JP (2) | JP5671001B2 (ru) |
| KR (1) | KR101639098B1 (ru) |
| CN (2) | CN102497853B (ru) |
| AU (1) | AU2010229668C1 (ru) |
| BR (1) | BRPI1011721B1 (ru) |
| CA (1) | CA2754691C (ru) |
| DK (1) | DK2410981T4 (ru) |
| ES (1) | ES2625260T5 (ru) |
| HK (1) | HK1165709A1 (ru) |
| IL (1) | IL215276A (ru) |
| MX (1) | MX354829B (ru) |
| PT (1) | PT2410981T (ru) |
| RU (1) | RU2577698C2 (ru) |
| WO (1) | WO2010111680A2 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2805512C2 (ru) * | 2018-08-07 | 2023-10-18 | Софар С.П.А. | Композиция, содержащая муколитический агент, для лечения гиперсекреции слизи и устройство для ее дозирования |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2410981B2 (en) | 2009-03-26 | 2020-02-26 | Pulmatrix Operating Company, Inc. | Dry powder formulations and methods for treating pulmonary diseases |
| GB0918450D0 (en) * | 2009-10-21 | 2009-12-09 | Innovata Ltd | Composition |
| US8758824B2 (en) | 2010-08-30 | 2014-06-24 | Pulmatrix, Inc. | Respirably dry powder comprising calcium lactate, sodium chloride and leucine |
| CN105640925B (zh) * | 2010-08-30 | 2019-08-16 | 普马特里克斯营业公司 | 干燥粉末配方及用于治疗肺部疾病的方法 |
| ES2899621T3 (es) * | 2010-09-29 | 2022-03-14 | Pulmatrix Operating Co Inc | Polvos secos catiónicos que comprenden sal de magnesio |
| KR101915241B1 (ko) * | 2010-09-29 | 2018-11-06 | 풀매트릭스 오퍼레이팅 컴퍼니, 인크 | 흡입용의 1가 금속 양이온 건조 분말 |
| WO2012058719A1 (en) * | 2010-11-02 | 2012-05-10 | The Universtity Of Sydney | Inhalable compositions |
| MX346244B (es) * | 2011-05-19 | 2017-03-13 | Savara Inc | Composiciones de vancomicina en polvo seco y metodos asociados. |
| US9572774B2 (en) | 2011-05-19 | 2017-02-21 | Savara Inc. | Dry powder vancomycin compositions and associated methods |
| US20140336159A1 (en) | 2011-10-07 | 2014-11-13 | Pulmatrix, Inc. | Methods for treating and diagnosing respiratory tract infections |
| NZ722952A (en) | 2012-02-28 | 2018-12-21 | Iceutica Holdings Inc | Inhalable pharmaceutical compositions |
| CA2865972C (en) * | 2012-02-29 | 2022-01-04 | Pulmatrix, Inc. | Inhalable dry powders |
| US10660869B2 (en) | 2012-08-01 | 2020-05-26 | Purac Biochem B.V. | Lactate powder and method for the preparation thereof |
| BR112015010601B1 (pt) | 2012-11-09 | 2022-07-19 | Civitas Therapeutics, Inc. | Composição farmacêutica e uso da composição |
| US8545878B1 (en) | 2012-11-09 | 2013-10-01 | Civitas Therapeutics, Inc. | Capsules containing high doses of levodopa for pulmonary use |
| US9757395B2 (en) | 2012-12-20 | 2017-09-12 | Otitopic Inc. | Dry powder inhaler and methods of use |
| EP2769630B1 (en) | 2013-02-26 | 2016-04-27 | Purac Biochem N.V. | Improved nisin production process |
| EP2754356A1 (en) | 2013-01-15 | 2014-07-16 | Purac Biochem N.V. | Improved nisin production process |
| CA2907566C (en) | 2013-04-01 | 2023-08-22 | Pulmatrix, Inc. | Tiotropium dry powders |
| EP3607941A1 (en) * | 2013-04-30 | 2020-02-12 | Otitopic Inc. | Dry powder formulations and methods of use |
| CA2923010C (en) * | 2013-09-03 | 2022-08-30 | Georgia Tech Research Corporation | Thermally stable vaccine formulations and microneedles |
| CN107106641B (zh) | 2014-10-31 | 2021-12-21 | 葛兰素史密斯克莱知识产权发展有限公司 | 粉末制剂 |
| US10046007B2 (en) | 2015-06-24 | 2018-08-14 | Prescient Pharma, Llc | Compositions and methods for treatment of short telomere disorders |
| US20170135969A1 (en) | 2015-11-12 | 2017-05-18 | Jds Therapeutics, Llc | Topical arginine-silicate-inositol for wound healing |
| EP3463378A4 (en) * | 2016-06-03 | 2020-01-08 | Otitopic Inc. | DRY POWDER FORMULAS FOR INHALATION |
| JP2019526638A (ja) | 2016-09-01 | 2019-09-19 | ジェイディーエス・セラピューティクス、エルエルシー | ビオチン酸マグネシウム組成物および使用方法 |
| JP2022515314A (ja) | 2018-11-02 | 2022-02-18 | ニュートリション・21,エルエルシー | イノシトール安定化アルギニンケイ酸塩複合体及びイノシトールを含有するビデオゲームプレーヤーの認知機能を改善するための組成物 |
| CA3165102A1 (en) | 2019-12-16 | 2021-06-24 | Nutrition 21, Llc | Methods of production of arginine-silicate complexes |
| WO2023114375A2 (en) * | 2021-12-16 | 2023-06-22 | Alveolus Bio, Inc. | Inhalable or ingestible lactic acid compositions for the treatment of chronic lung disease |
| WO2024046582A1 (en) * | 2022-09-02 | 2024-03-07 | Liita Care Aps | Pharmaceutical dry powder composition and methods for treating respiratory tract infections |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5466680A (en) * | 1992-03-26 | 1995-11-14 | Cytologics, Inc. | Method and compositions for enhancing white blood cell functioning on a mucosal or cutaneous surface |
| US7384649B2 (en) * | 2001-11-20 | 2008-06-10 | Advanced Inhalation Research, Inc. | Particulate compositions for pulmonary delivery |
Family Cites Families (102)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4069819A (en) | 1973-04-13 | 1978-01-24 | Societa Farmaceutici S.P.A. | Inhalation device |
| US4233405A (en) | 1979-10-10 | 1980-11-11 | Rohm And Haas Company | Process for spray drying enzymes |
| US4637815A (en) | 1985-08-06 | 1987-01-20 | Lemole Gerald M | Irrigational hemostatic solution |
| US5511726A (en) | 1988-09-23 | 1996-04-30 | Battelle Memorial Institute | Nebulizer device |
| IT1228459B (it) | 1989-02-23 | 1991-06-19 | Phidea S R L | Inalatore con svuotamento regolare e completo della capsula. |
| US5993805A (en) | 1991-04-10 | 1999-11-30 | Quadrant Healthcare (Uk) Limited | Spray-dried microparticles and their use as therapeutic vehicles |
| GB2291605B (en) | 1991-11-12 | 1996-05-01 | Medix Ltd | A nebuliser and nebuliser control system |
| US5785049A (en) | 1994-09-21 | 1998-07-28 | Inhale Therapeutic Systems | Method and apparatus for dispersion of dry powder medicaments |
| US6582728B1 (en) | 1992-07-08 | 2003-06-24 | Inhale Therapeutic Systems, Inc. | Spray drying of macromolecules to produce inhaleable dry powders |
| US5724957A (en) | 1993-01-29 | 1998-03-10 | Aradigm Corporation | Intrapulmonary delivery of narcotics |
| US6098620A (en) | 1993-01-29 | 2000-08-08 | Aradigm Corporation | Device for aerosolizing narcotics |
| NZ328476A (en) | 1993-06-24 | 1999-05-28 | Astra Ab | Use of a two component insulin preparation in an inhalation device |
| AUPM411494A0 (en) | 1994-02-25 | 1994-03-24 | Central Sydney Area Health Service | Method and device for the provocation of upper or lower airway narrowing and/or the induction of sputum |
| JP3414539B2 (ja) | 1994-05-11 | 2003-06-09 | 有限会社ドット | 経鼻吸収用組成物 |
| US6586006B2 (en) | 1994-08-04 | 2003-07-01 | Elan Drug Delivery Limited | Solid delivery systems for controlled release of molecules incorporated therein and methods of making same |
| US6290991B1 (en) | 1994-12-02 | 2001-09-18 | Quandrant Holdings Cambridge Limited | Solid dose delivery vehicle and methods of making same |
| US5747002A (en) | 1995-04-05 | 1998-05-05 | Genentech, Inc. | Preparation of sodium chloride aerosol formulations |
| US5612053A (en) | 1995-04-07 | 1997-03-18 | Edward Mendell Co., Inc. | Controlled release insufflation carrier for medicaments |
| US6258341B1 (en) | 1995-04-14 | 2001-07-10 | Inhale Therapeutic Systems, Inc. | Stable glassy state powder formulations |
| US6165463A (en) | 1997-10-16 | 2000-12-26 | Inhale Therapeutic Systems, Inc. | Dispersible antibody compositions and methods for their preparation and use |
| EE04004B1 (et) | 1995-04-14 | 2003-04-15 | Glaxo Wellcome Inc. | Flutikasoonpropionaati doseeriv inhalaator |
| CA2218074C (en) | 1995-04-14 | 2002-10-08 | Mohammed Eljamal | Powdered pharmaceutical formulations having improved dispersibility |
| GB9515182D0 (en) | 1995-07-24 | 1995-09-20 | Co Ordinated Drug Dev | Improvements in and relating to powders for use in dry powder inhalers |
| US5628984A (en) | 1995-07-31 | 1997-05-13 | University Of North Carolina At Chapel Hill | Method of detecting lung disease |
| US20050054682A1 (en) * | 1996-01-04 | 2005-03-10 | Phillips Jeffrey O. | Pharmaceutical compositions comprising substituted benzimidazoles and methods of using same |
| EP0877602B1 (de) * | 1996-01-24 | 2002-01-23 | Byk Gulden Lomberg Chemische Fabrik GmbH | Verfahren zur herstellung von pulverförmigen lungensurfactant-zubereitungen |
| GB9606677D0 (en) | 1996-03-29 | 1996-06-05 | Glaxo Wellcome Inc | Process and device |
| US5874064A (en) | 1996-05-24 | 1999-02-23 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| USRE37053E1 (en) | 1996-05-24 | 2001-02-13 | Massachusetts Institute Of Technology | Particles incorporating surfactants for pulmonary drug delivery |
| US5985309A (en) | 1996-05-24 | 1999-11-16 | Massachusetts Institute Of Technology | Preparation of particles for inhalation |
| US5855913A (en) | 1997-01-16 | 1999-01-05 | Massachusetts Instite Of Technology | Particles incorporating surfactants for pulmonary drug delivery |
| US6254854B1 (en) | 1996-05-24 | 2001-07-03 | The Penn Research Foundation | Porous particles for deep lung delivery |
| US6131570A (en) | 1998-06-30 | 2000-10-17 | Aradigm Corporation | Temperature controlling device for aerosol drug delivery |
| US20010031244A1 (en) | 1997-06-13 | 2001-10-18 | Chiesi Farmaceutici S.P.A. | Pharmaceutical aerosol composition |
| US6565885B1 (en) | 1997-09-29 | 2003-05-20 | Inhale Therapeutic Systems, Inc. | Methods of spray drying pharmaceutical compositions |
| ATE239447T1 (de) | 1997-09-29 | 2003-05-15 | Inhale Therapeutic Syst | In verneblern verwendbare, stabilisierte zubereitungen |
| GB9807232D0 (en) | 1998-04-03 | 1998-06-03 | Univ Cardiff | Aerosol composition |
| WO2000000215A1 (en) | 1998-06-29 | 2000-01-06 | Inhale Therapeutic Systems, Inc. | Particulate delivery systems and methods of use |
| GB9814172D0 (en) | 1998-06-30 | 1998-08-26 | Andaris Ltd | Formulation for inhalation |
| EP1131055B1 (en) * | 1998-11-10 | 2005-11-09 | ALTANA Pharma AG | Treatment set containing lungsurfactant compositions |
| US6926911B1 (en) | 1998-12-22 | 2005-08-09 | The University Of North Carolina At Chapel Hill | Compounds and methods for the treatment of airway diseases and for the delivery of airway drugs |
| CA2361421A1 (en) | 1999-02-03 | 2000-08-10 | Biosante Pharmaceuticals, Inc. | Therapeutic calcium phosphate particles and methods of manufacture and use |
| US6858199B1 (en) | 2000-06-09 | 2005-02-22 | Advanced Inhalation Research, Inc. | High efficient delivery of a large therapeutic mass aerosol |
| GB9916316D0 (en) * | 1999-07-12 | 1999-09-15 | Quadrant Holdings Cambridge | Dry powder compositions |
| ATE285755T1 (de) * | 1999-08-25 | 2005-01-15 | Advanced Inhalation Res Inc | Grosse poröse partikel erhältlich durch sprühtrocknung und geeignet zur pulmonalen anwendung |
| US7678364B2 (en) | 1999-08-25 | 2010-03-16 | Alkermes, Inc. | Particles for inhalation having sustained release properties |
| US6749835B1 (en) | 1999-08-25 | 2004-06-15 | Advanced Inhalation Research, Inc. | Formulation for spray-drying large porous particles |
| ES2343124T3 (es) | 1999-10-29 | 2010-07-23 | Novartis Ag | Composiciones de polvo seco con dispersabilidad mejorada. |
| SK284948B6 (sk) | 2000-04-06 | 2006-03-02 | Zentiva, A. S. | Liečivý prípravok s obsahom vápnika alebo zmesi vápnika a vitamínu D, alebo zmesi vápnika a horčíka v novej liekovej forme |
| SI1276495T1 (sl) * | 2000-04-12 | 2006-10-31 | Altana Pharma Ag | Uporaba rekombinantnega pljucnega surfaktanta za zgodnje zdravljenje akutnih pljucnih bolezni |
| EP1280520B2 (en) * | 2000-05-10 | 2018-03-21 | Novartis AG | Phospholipid-based powders for drug delivery |
| KR100949539B1 (ko) | 2000-06-27 | 2010-03-25 | 벡투라 리미티드 | 약학 조성물용 입자의 제조 방법 |
| US7575761B2 (en) | 2000-06-30 | 2009-08-18 | Novartis Pharma Ag | Spray drying process control of drying kinetics |
| US6613308B2 (en) | 2000-09-19 | 2003-09-02 | Advanced Inhalation Research, Inc. | Pulmonary delivery in treating disorders of the central nervous system |
| EP1920763B2 (en) | 2000-11-30 | 2022-06-15 | Vectura Limited | Pharmaceutical compositions for inhalation |
| AU2002231244B2 (en) | 2000-12-27 | 2006-06-29 | Gilead Sciences, Inc. | Inhalable aztreonam for treatment and prevention of pulmonary bacterial infections |
| US20020141946A1 (en) | 2000-12-29 | 2002-10-03 | Advanced Inhalation Research, Inc. | Particles for inhalation having rapid release properties |
| US6766799B2 (en) | 2001-04-16 | 2004-07-27 | Advanced Inhalation Research, Inc. | Inhalation device |
| US6667344B2 (en) | 2001-04-17 | 2003-12-23 | Dey, L.P. | Bronchodilating compositions and methods |
| WO2003035028A1 (en) | 2001-10-19 | 2003-05-01 | Nektar Therapeutics | Modulating charge density to produce improvements in the characteristics of spray-dried proteins |
| KR20040058324A (ko) | 2001-11-26 | 2004-07-03 | 다이이찌 산토리 파마 가부시키가이샤 | 경비흡수용 의약 조성물 |
| WO2003072080A1 (en) | 2002-02-22 | 2003-09-04 | Advanced Inhalation Research, Inc. | Inhalable formulations for sustained release |
| US7008644B2 (en) | 2002-03-20 | 2006-03-07 | Advanced Inhalation Research, Inc. | Method and apparatus for producing dry particles |
| WO2003079992A2 (en) | 2002-03-20 | 2003-10-02 | Advanced Inhalation Research, Inc. | Pulmonary delivery for levodopa |
| GB0207906D0 (en) | 2002-04-05 | 2002-05-15 | 3M Innovative Properties Co | Formoterol and mometasone aerosol formulations |
| SI1531794T1 (sl) † | 2002-06-28 | 2017-12-29 | Civitas Therapeteutics, Inc. | Epinefrin za vdihavanje |
| US7371729B2 (en) * | 2002-09-09 | 2008-05-13 | Trigen Limited | Boronic acid salts useful in parenteral formulations |
| US20040105821A1 (en) * | 2002-09-30 | 2004-06-03 | Howard Bernstein | Sustained release pharmaceutical formulation for inhalation |
| US7534781B2 (en) | 2003-03-21 | 2009-05-19 | Dsm Ip Assets B.V. | Crystalline amoxicillin trihydrate powder |
| CN1194062C (zh) | 2003-04-04 | 2005-03-23 | 王泽斌 | 一种融雪融冰组合物及其制备方法和应用 |
| CA2523740C (en) | 2003-05-01 | 2012-05-15 | Innogene Kalbiotech Pte Ltd | Lactate containing pharmaceutical composition and uses thereof |
| EP1646370A1 (en) * | 2003-07-11 | 2006-04-19 | Glaxo Group Limited | Pharmaceutical formulations |
| DE10339197A1 (de) * | 2003-08-22 | 2005-03-24 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Sprühgetrocknete amorphe Pulver mit geringer Restfeuchte und guter Lagerstabilität |
| GB0324918D0 (en) * | 2003-10-24 | 2003-11-26 | Glaxo Group Ltd | Composition |
| GB0324897D0 (en) | 2003-10-24 | 2003-11-26 | Glaxo Group Ltd | Composition |
| KR20050056622A (ko) | 2003-12-10 | 2005-06-16 | 주식회사 대우일렉트로닉스 | 플레쉬롬 다운로드 장치 |
| EP1701714A2 (en) * | 2004-01-07 | 2006-09-20 | Nektar Therapeutics | Improved sustained release compositions for pulmonary administration of insulin |
| US20050207983A1 (en) | 2004-03-05 | 2005-09-22 | Pulmatrix, Inc. | Formulations decreasing particle exhalation |
| SE528121C2 (sv) | 2004-03-29 | 2006-09-05 | Mederio Ag | Preparering av torrpulver för på förhand uppmätt DPI |
| CA2602596A1 (en) | 2004-03-30 | 2005-10-13 | Malcolm King | Compositions and methods for improved mucus function |
| US20050281740A1 (en) | 2004-06-16 | 2005-12-22 | Glen Gong | Imaging damaged lung tissue |
| KR20070054644A (ko) | 2004-07-26 | 2007-05-29 | 액테리온 파마슈티칼 리미티드 | 미립자 제형으로 흡입된 일로프로스트에 의한 폐고혈압의치료 |
| EP1796637A4 (en) * | 2004-09-20 | 2010-01-13 | Gilead Sciences Inc | TARGETED DISTRIBUTION OF LIDOCAINE AND OTHER LOCAL ANESTHETICS AND METHOD OF TREATING COUGH AND LARYNGETIC ATTACKS |
| GB0425758D0 (en) | 2004-11-23 | 2004-12-22 | Vectura Ltd | Preparation of pharmaceutical compositions |
| EP1888257A1 (en) | 2005-05-05 | 2008-02-20 | Pulmatrix, Inc. | Ultrasonic aerosol generator |
| US7838532B2 (en) | 2005-05-18 | 2010-11-23 | Mpex Pharmaceuticals, Inc. | Aerosolized fluoroquinolones and uses thereof |
| WO2006125153A2 (en) * | 2005-05-18 | 2006-11-23 | Pulmatrix Inc. | Formulations for alteration of biophysical properties of mucosal lining |
| GB0520794D0 (en) | 2005-10-12 | 2005-11-23 | Innovata Biomed Ltd | Inhaler |
| GB0523576D0 (en) | 2005-11-18 | 2005-12-28 | Theradeas Ltd | Drug composition and its use in therapy |
| GB0625322D0 (en) | 2006-12-19 | 2007-01-24 | Pharmakodex Ltd | Pharmaceutical compositions |
| WO2009037503A2 (en) | 2007-09-18 | 2009-03-26 | Astrazeneca Ab | New combination - 012 for the treatment of respiratory diseases |
| DK2252275T3 (en) | 2008-02-13 | 2018-03-05 | Univ Texas | CREATED NON-OPEN FLOCKS OF ANISOTROPIC PARTICLES FOR IMPROVED TRANSPORT INTO THE Lungs |
| EP2098219A1 (en) | 2008-03-05 | 2009-09-09 | PARI Pharma GmbH | Macrolide compositions having improved taste and stability |
| JP5727927B2 (ja) | 2008-05-15 | 2015-06-03 | ノバルティス アーゲー | フルオロキノロンの肺送達 |
| GB0818476D0 (en) | 2008-10-09 | 2008-11-12 | Vectura Delivery Device Ltd | Inhaler |
| EP2410981B2 (en) | 2009-03-26 | 2020-02-26 | Pulmatrix Operating Company, Inc. | Dry powder formulations and methods for treating pulmonary diseases |
| WO2010111640A2 (en) | 2009-03-26 | 2010-09-30 | Pulmatrix, Inc. | Anti-influenza formulations and methods |
| WO2010111641A2 (en) | 2009-03-26 | 2010-09-30 | Pulmatrix, Inc. | Methods for treating and preventing pneumonia and ventilator-associated tracheobronchitis |
| JP2012522012A (ja) | 2009-03-26 | 2012-09-20 | パルマトリックス,インコーポレイテッド | 粘膜内層の生物物理学的性質の改変のためのクエン酸カルシウムおよび乳酸カルシウム製剤 |
| RU2011137961A (ru) | 2009-03-26 | 2013-05-10 | Пулмэтрикс, Инк. | Фармацевтические составы и способы лечения инфекций дыхательных путей |
| GB0918450D0 (en) | 2009-10-21 | 2009-12-09 | Innovata Ltd | Composition |
| PT106094A (pt) | 2012-01-13 | 2013-07-15 | Hovione Farmaciencia S A | Administração por inalação de formulações com dose elevada |
-
2010
- 2010-03-26 EP EP10713283.9A patent/EP2410981B2/en active Active
- 2010-03-26 RU RU2011137960/15A patent/RU2577698C2/ru active
- 2010-03-26 ES ES10713283T patent/ES2625260T5/es active Active
- 2010-03-26 KR KR1020117024843A patent/KR101639098B1/ko active IP Right Grant
- 2010-03-26 MX MX2011009957A patent/MX354829B/es active IP Right Grant
- 2010-03-26 WO PCT/US2010/028961 patent/WO2010111680A2/en active Application Filing
- 2010-03-26 CN CN201080023554.3A patent/CN102497853B/zh not_active Expired - Fee Related
- 2010-03-26 CA CA2754691A patent/CA2754691C/en active Active
- 2010-03-26 EP EP17000124.2A patent/EP3184099A1/en active Pending
- 2010-03-26 DK DK10713283.9T patent/DK2410981T4/da active
- 2010-03-26 AU AU2010229668A patent/AU2010229668C1/en active Active
- 2010-03-26 US US13/259,635 patent/US20120064126A1/en not_active Abandoned
- 2010-03-26 PT PT107132839T patent/PT2410981T/pt unknown
- 2010-03-26 BR BRPI1011721-0A patent/BRPI1011721B1/pt active IP Right Grant
- 2010-03-26 JP JP2012502314A patent/JP5671001B2/ja active Active
- 2010-03-26 CN CN201810147094.3A patent/CN108434126B/zh active Active
-
2011
- 2011-09-21 IL IL215276A patent/IL215276A/en active IP Right Grant
-
2012
- 2012-06-29 HK HK12106373.0A patent/HK1165709A1/zh active IP Right Maintenance
-
2014
- 2014-12-18 JP JP2014256325A patent/JP5964939B2/ja active Active
-
2015
- 2015-03-25 US US14/667,857 patent/US9119778B2/en active Active
- 2015-07-21 US US14/804,940 patent/US9238005B2/en active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5466680A (en) * | 1992-03-26 | 1995-11-14 | Cytologics, Inc. | Method and compositions for enhancing white blood cell functioning on a mucosal or cutaneous surface |
| US7384649B2 (en) * | 2001-11-20 | 2008-06-10 | Advanced Inhalation Research, Inc. | Particulate compositions for pulmonary delivery |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2805512C2 (ru) * | 2018-08-07 | 2023-10-18 | Софар С.П.А. | Композиция, содержащая муколитический агент, для лечения гиперсекреции слизи и устройство для ее дозирования |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2577698C2 (ru) | Сухие порошкообразные составы и способы лечения легочных заболеваний | |
| AU2010229668B9 (en) | Dry powder formulations and methods for treating pulmonary diseases | |
| US9233158B2 (en) | Dry powder formulations and methods for treating pulmonary diseases | |
| EP2448571B1 (en) | Respirably dry powder comprising calcium lactate, sodium chloride and leucine |