RU2169727C2 - Замещенные 1,2,3,4-тетрагидро-2-нафталинамины, способ их получения и фармацевтическая композиция на их основе - Google Patents
Замещенные 1,2,3,4-тетрагидро-2-нафталинамины, способ их получения и фармацевтическая композиция на их основе Download PDFInfo
- Publication number
- RU2169727C2 RU2169727C2 RU97119872/04A RU97119872A RU2169727C2 RU 2169727 C2 RU2169727 C2 RU 2169727C2 RU 97119872/04 A RU97119872/04 A RU 97119872/04A RU 97119872 A RU97119872 A RU 97119872A RU 2169727 C2 RU2169727 C2 RU 2169727C2
- Authority
- RU
- Russia
- Prior art keywords
- ome
- compound
- free base
- formula
- acid
- Prior art date
Links
- 0 *CC(*S)C1Cc2c(*)ccc(NI)c2CC1 Chemical compound *CC(*S)C1Cc2c(*)ccc(NI)c2CC1 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/06—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals
- C07D295/073—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals with the ring nitrogen atoms and the substituents separated by carbocyclic rings or by carbon chains interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C217/00—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton
- C07C217/54—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/33—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings
- C07C211/39—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of an unsaturated carbon skeleton
- C07C211/41—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of an unsaturated carbon skeleton containing condensed ring systems
- C07C211/42—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of an unsaturated carbon skeleton containing condensed ring systems with six-membered aromatic rings being part of the condensed ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/46—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C215/64—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with rings other than six-membered aromatic rings being part of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C217/00—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton
- C07C217/54—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C217/74—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with rings other than six-membered aromatic rings being part of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/48—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a six-membered aromatic ring being part of a condensed ring system of the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C255/00—Carboxylic acid nitriles
- C07C255/49—Carboxylic acid nitriles having cyano groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C255/58—Carboxylic acid nitriles having cyano groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing cyano groups and singly-bound nitrogen atoms, not being further bound to other hetero atoms, bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/02—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements
- C07D295/027—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring
- C07D295/033—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring with the ring nitrogen atoms directly attached to carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2602/00—Systems containing two condensed rings
- C07C2602/02—Systems containing two condensed rings the rings having only two atoms in common
- C07C2602/04—One of the condensed rings being a six-membered aromatic ring
- C07C2602/10—One of the condensed rings being a six-membered aromatic ring the other ring being six-membered, e.g. tetraline
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Virology (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- AIDS & HIV (AREA)
- Tropical Medicine & Parasitology (AREA)
- Molecular Biology (AREA)
- Cardiology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Pain & Pain Management (AREA)
- Heart & Thoracic Surgery (AREA)
- Endocrinology (AREA)
- Diabetes (AREA)
- Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Epidemiology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Hydrogenated Pyridines (AREA)
Abstract
Изобретение относится к новым замещенным 1,2,3,4-тетрагидро-2-нафталинамина формулы I, где R1 и R2 независимо представляют собой водород, С1-4алкил, С1-4алкоксил, галоген, трифторметил; R3 представляет собой водород, гидроксил, С1-4алкоксил, циaнoгpуппу, карбамоил; R4 и R5 независимо представляют собой водород, С1-4алкил, гидрокси С2-4алкил, или образуют вместе с атомом азота, к которому они присоединены, пиперидиногруппу; в виде свободного основания или соли, полученной присоединением кислоты. Способ получения соединения формулы I путем взаимодействия соединения формулы II с соединением формулы III, и полученное соединение выделяют в виде свободного основания или соли, полученной присоединением кислоты. Фармацевтическая композиция, обладающая антиконвульсивной активностью, активностью при ишемии, вызванной нейрональными повреждениями и активностью в условиях, включающих высвобождение глютамата, содержащая соединение формулы I в форме свободного основания или фармацевтически приемлемой соли, в терапевтически эффективном количестве. 3 c. и 5 з.п. ф-лы, 1 табл.
Description
Настоящее изобретение относится к новым амино-тетралинам (тетрагидро-нафталинаминам), их получению, их использованию в качестве фармацевтических средств, и к содержащим их фармацевтическим композициям.
В первом аспекте в соответствии с изобретением предлагаются 1,2,3,4-тетрагидро-2-нафталинамины, несущие фенильный заместитель в ароматическом кольце, и их соли, полученные присоединением кислоты.
Фенильный заместитель предпочтительно находится в положении 5 2-нафталинамина.
Фенильный заместитель может нести дополнительные заместители, например, как в случае формулы I, приведенной ниже.
Дополнительные заместители могут быть также представлены удобным образом, но не исключительно на ароматическом кольце, например, в положении 8 2-нафталинамина, когда фенильная группа находится в положении 5.
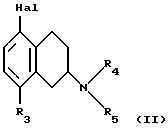
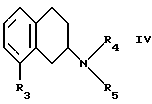
В частности, в настоящем изобретении предлагается соединение формулы I
где R1 и R2 независимо представляют собой водород, (C1-4)алкил, (C1-4)алкоксил, (C1-4)алкилтиогруппу, галоген, трифторметил, трифторометоксил, цианогруппу, (C2-5)алканоил, (C1-4)алкилсульфонил или сульфамоил,
R3 представляет собой водород, гидроксил, (C1-4)алкил, (C1-4)алкоксил, галоген, цианогруппу, (C2-5)алканоил, карбамоил, (C1-4)алкилсульфонилоксил или трифторметилсульфонилоксил, и
R4 и R5 независимо представляют собой водород, (C1-4)алкил, гидрокси(C2-4)алкил или фенил(C1-4)алкил, или образуют, вместе с атомом азота, к которому они присоединены, пирролидинил, пиперидиногруппу или пиперазинил,
в форме свободного основания или соли, полученной присоединением кислоты.
где R1 и R2 независимо представляют собой водород, (C1-4)алкил, (C1-4)алкоксил, (C1-4)алкилтиогруппу, галоген, трифторметил, трифторометоксил, цианогруппу, (C2-5)алканоил, (C1-4)алкилсульфонил или сульфамоил,
R3 представляет собой водород, гидроксил, (C1-4)алкил, (C1-4)алкоксил, галоген, цианогруппу, (C2-5)алканоил, карбамоил, (C1-4)алкилсульфонилоксил или трифторметилсульфонилоксил, и
R4 и R5 независимо представляют собой водород, (C1-4)алкил, гидрокси(C2-4)алкил или фенил(C1-4)алкил, или образуют, вместе с атомом азота, к которому они присоединены, пирролидинил, пиперидиногруппу или пиперазинил,
в форме свободного основания или соли, полученной присоединением кислоты.
Галоген представляет собой фтор, хлор, бром, или иод, предпочтительно фтор или хлор.
Любые алкильные, алкоксильные и алкилтио-радикалы предпочтительно являются радикалами с прямой цепью. Они предпочтительно имеют от 1 до 3-х атомов углерода, более предпочтительно они являются метилом, метоксилом и метилтиогруппой.
Предпочтительны следующие значения и их комбинации:
R1 и R2 независимо представляют собой водород, (C1-4)алкил, (C1-4)алкоксил, галоген или трифторметил,
R3 представляет собой водород, гидроксил, (C1-4)алкоксил, цианогруппу или карбамоил,
R4 и R5 независимо представляют собой водород или (C1-4)алкил, или образуют вместе с азотом, к которому они присоеденены, пиперидиногруппу.
R1 и R2 независимо представляют собой водород, (C1-4)алкил, (C1-4)алкоксил, галоген или трифторметил,
R3 представляет собой водород, гидроксил, (C1-4)алкоксил, цианогруппу или карбамоил,
R4 и R5 независимо представляют собой водород или (C1-4)алкил, или образуют вместе с азотом, к которому они присоеденены, пиперидиногруппу.
В частной группе соединений формулы I, R1 и R2 независимо представляют собой водород, (C1-4)алкил, (C1-4)алкоксил, (C1-4)алкилтиогруппу, галоген, трифторметил, цианогруппу или (C2-5)алканоил, R3 - такой, как описано выше, и R4 и R5 независимо представляют собой водород, (C1-4)алкил или фенил(C1-4)алкил, или образуют, вместе с атомом азота, к которому они присоединены, пирролидинил, пиперидиногруппу или пиперазинил.
Соединения по изобретению имеют асимметричный углеродный атом в положении 2. Поэтому они могут существовать в оптически активной форме или в форме смеси оптических изомеров, например в форме рацемических смесей. Все оптические изомеры и их смеси, включая рацемические смеси, являются частью настоящего изобретения.
Если соединение по изобретению находится в оптически активной форме, то предпочтительной является R конфигурация.
В еще одном аспекте изобретения предлагается способ получения соединений по изобретению, при котором 1,2,3,4-тетрагидро-2-нафталинамин, несущий галоген в ароматическом кольце, подвергают взаимодействию с возможно замещенной фенилбороновой кислотой и полученное соединение выделяют в форме свободного основания или соли, полученной присоединением кислоты.
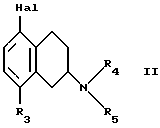
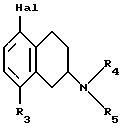
В частности, в изобретении предлагается способ получения соединений по изобретению, при котором соединение формулы II
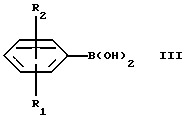
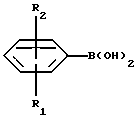
где R3, R4, и R5 такие, как определено выше, и Hal представляет собой галоген, подвергают взаимодействию с соединением формулы III
где R1 и R2 такие, как определено выше, и полученное соединение выделяют в форме свободного основания или соли, полученной присоединением кислоты.
где R3, R4, и R5 такие, как определено выше, и Hal представляет собой галоген, подвергают взаимодействию с соединением формулы III
где R1 и R2 такие, как определено выше, и полученное соединение выделяют в форме свободного основания или соли, полученной присоединением кислоты.
Реакция может быть осуществлена известным способом, предпочтительно путем осуществления катализируемого металлом переходного арил-арил сочетания, например, как описано в примере 1. В качестве галогена предпочтителен бром или иод, особенно бром.
Обработку реакционных смесей, полученных согласно вышеописанному способу, и очистку полученных таким образом соединений можно выполнять в соответствии с известными процедурами.
Соли, полученные присоединением кислоты, могут быть произведены известным способом из форм свободного основания и наоборот. Подходящие фармацевтически приемлемые соли, полученные присоединением кислоты, для использования в соответствии с настоящим изобретением включают в себя, например, гидрохлорид, гидромалеат, гидрофумарат и гидромалонат.
Рацемические соединения по изобретению могут быть получены из рацемических исходных материалов. Оптически активные изомеры могут быть получены из оптически активных исходных материалов или из рацемата. Энантиомеры могут быть получены из рацемата известными методами, например фракционной кристаллизацией диастериоизомерных солей, например их солей с (+)-ди-O,O'-п-толуоил-D-винной кислотой или (-)-ди-O,O'-p-толуоил-L-винной кислотой.
Исходные материалы формулы II могут быть получены путем галогенизирования соединений формулы IV
где R3, R4 и R5 такие, как определено выше, в соответствии с известными процедурами, например как описано в примере 1.
где R3, R4 и R5 такие, как определено выше, в соответствии с известными процедурами, например как описано в примере 1.
Исходные материалы формул III и IV известны или могут быть произведены аналогичным образом известными способами.
Соединения по изобретению, например соединения формулы I и их фармацевтически приемлемые соли, полученные присоединением кислоты, в дальнейшем именуемые как агенты по изобретению, проявляют фармакологическую активность, поэтому успешно применимы как фармацевтические препараты.
Агенты по изобретению обеспечивают продолжительную защиту против максимального судорог у мышей, вызываемых электрошоком, в дозах примерно от 1 до 100 мг/кг перорально и примерно от 0,32 до 32 мг/кг внутрибрюшинно [cf. E. A. Swinyard, J. Am. Pharm. Assoc. Scient. Ed. 38, 201 (1949); J. Pharmacol. Exptl. Therap. 106, 319 (1952)].
Агенты по изобретению поэтому пригодны для лечении эпилепсии и других судорожных состояний, таких как судорожная форма гипертонического криза.
Более того, агенты по изобретению уменьшают неврологическое повреждение, вызываемое ишемией, и сопутствующие симптомы в модели окклюзии средней мозговой артерии на крысах в дозе от 1 до 30 мг/кг внутрибрюшинно, внутривенно и перорально [cf. A. Tamura et al., J. Cereb. Blood Flow Metabol. 1, 53-60 (1981)), A. Sauter, M. Rudin, Stroke IZ, 1228-1234 (1986)).
Поэтому агенты по изобретению пригодны для лечения любых клинических состояний, включая компонент церебральной аноксии, гипоксии и/или ишемии, например при ишемическом повреждении серого и белого вещества, ударе, субарахноидальном кровоизлиянии, повреждениях и травме головного и спинного мозга, высоком внутричерепном давлении, при деменции вследствие множественных инфарктов и сосудистой деменции, при любых хирургических вмешательствах, потенциально связанных с церебральной аноксией, гипоксией и/или ишемией (например при искусственном кровообращении, операциях на внемозговых сосудах).
Агенты по изобретению проявляют свойство связываться с чувствительным к вератридину натриевым каналом с ИК50, составляющими от примерно 0,1 до примерно 100 мкМ. Процедура связывания известна (J.B. Braun, Journal of Neuroscience 6, 2064-2070 (1986). Они блокируют вератридин-индуцированное высвобождение глютамата в препаратах срезов крысиного гипокампа в концентрациях примерно 0,1 - 1 мкМ. Эксперимент проводят согласно известной модификации [M. J. Leach et al. In Epilepsia 27, 490-497 (1986) and Stroke 24, 1063-1067 (1993)], используя экзогенный глютамат.
Как результат, агенты по изобретнию показаны для лечения любой патологии, нарушения или клинического состояния, этиология которых включает в себя высвобождение глютамата, включая психические расстройства (такие как шизофрения, депрессия, чувство тревоги, приступы паники, дефицит внимания и расстройство познавательной способности, социальное отчуждение); гормональные нарушения (избыток секреции гормона роста (GH) [например, при лечении диабета, ангиопатии и акромегалии] или избыток секреции лютеинизирующего гормона (LH) [гипертрофия предстательной железы, климактерический синдром], избыток секреции кортикостерона при стрессе); метаболически индуцированное поражение головного мозга (гипогликемия, некетотиновая гиперглицинемия [глициновая энцефалопатия] , дефицит сульфитоксидазы, печеночная энцефалопатия, связанная с несостоятельностью печени), рвоту, спазмы, шум в ушах, боль (онкологическая, при артритах) и злоупотребление лекарственными средствами (этанол, опиаты [включая синтетические с опиатоподобным действием, например петидин, метадон], кокаин, амфетамин, барбитураты и другие седативные средства; бензодиазепины) и абстиненцию.
Кроме того, агенты по изобретению показаны при лечении любых патологий, включающих в себя неврологическое повреждение, например нейродегенеративных расстройств (таких как болезни Альцгеймера (Aizheimer's), Хантингтона (Huntington's), Паркинсона (Parkinson's)), нейродегенерации, индуцированной вирусами (включая ВИЧ), амиотрофического бокового склероза (ALS), надъядерного паралича, оливомостомозжечковую атрофию (OPCA), воздействия окружающей среды, экзогенных нейротоксинов.
Для вышеуказанных показаний подходящая доза будет, конечно, варьировать в зависимости от, например, используемого соединения, реципиента, способа введения и природы и тяжести состояния, подлежащего лечению. Однако в общем удовлетворительные результаты на животных получают при суточной дозе от примерно 0,1 до примерно 100, предпочтительно от примерно 0,5 до примерно 100 мг/кг массы тела животного. Для крупных млекопитающих, например человека, указанная суточная доза лежит в пределах от примерно 1 до примерно 500, предпочтительно от примерно 1 до примерно 300 мг агента по изобретению, при соответствующем введении, например в виде разделенных доз до 4-х раз в день или в форме поддерживаемого высвобождения.
Для всех этих показаний предпочтительным соединением является (R)-1,2,3,4-тетрагидро-8-метокси-N, N-диметил-5-[4-трифторометил)фенил] -2- нафталинамин, который является соединением примера 21. Например, было установлено, что в вышеупомянутой модели электрошока это соединение обеспечивает защиту против максимальных индуцируемых электрошоком судорог в пороговой дозе 10 мг/кг перорально на период до 8 часов после введения. В модели MCA окклюзии было установлено, что соединение, введенное внутрибрюшинно немедленно после окклюзии, дозозависимым образом уменьшает размер инфаркта при 3,2, 10 и 32 мг/кг (19, 43 и 53% соответственно). В тесте с вератридин-индуцированным высвобождением глютамата было обнаружено, что соединение блокирует высвобождение с ИК50, составляющей 0,5 мкМ, что согласуется с его сродством к сайту связывания вератридина (ИК50 = 125 нМ).
Соединение примера 21, например, превосходит стандарт лифразин в модели MCA окклюзии (снижение размеров инфаркта на 43% против 25% после дозы 10 мг/кг, введенной внутрибрюшинно). В тесте с вератридин-индуцированным высвобождением глютамата было обнаружено, что оно примерно равно по силе действия лифразину, но превосходит стандарты рилюзола и ламотригин (ИК50 = 0.5 мкМ против 5 мкМ и 20 мкМ соответственно).
Предпочтительными показаниями являются эпилепсия, удар, травма головного мозга и спинальная травма.
Агент по изобретению может быть введен любым традиционным способом, в частности энтерально, предпочтительно перорально, например в форме таблеток или капсул, или парентерально, например в форме инъекционных растворов или суспензий.
Согласно вышеупомянутому, в настоящем изобретении предлагается также агент по изобретению для использования в качестве фармацевтического средства, например, для лечения эпилепсии, удара, травмы головного мозга и спинальной травмы.
В настоящем изобретении дополнительно предлагается фармацевтическая композиция, содержащая агент по изобретению в сочетании с по меньшей мере одним фармацевтическим наполнителем или разбавителем. Такие композиции могут быть изготовлены традиционным способом. Формы стандартной дозы содержат, например, от примерно 0,25 до примерно 150, предпочтительно от 0,25 до примерно 25 мг соединения по изобретению.
Кроме того, в настоящем изобретении предлагается использование агента по изобретению для изготовления лекарственного средства для лечения любого из вышеуказанных состояний, например эпилепсии, удара, травмы головного мозга и спинальной травмы.
В еще одном аспекте настоящего изобретения предлагается способ лечения любого из вышеуказанных состояний, например эпилепсии, удара, травмы головного мозга и спинальной травмы, у субъекта в случае необходимости в таком лечении, при котором на указанного субъекта воздействуют терапевтически эффективным количеством агента по изобретению.
Следующие примеры иллюстрируют изобретение. Температуры даны в градусах Цельсия и нескорректированы.
Пример 1: (+/-)-1,2,3,4-тетрагидро-5-(4-хлорфенил)-8-метокси-N, N- диметил-2-нафталинамин
0,57 г (2 ммоль) (+/-)-1,2,3,4-тетрагидро-5-бром-8-метокси-N,N- диметил-2-нафталинамина растворяют в 8 мл толуола. Добавляют 0,55 г (3,54 ммоль) 4-хлорфенилбороновой кислоты, 0,07 г (0,23 ммоль) три(ортотолил)фосфина, 3 мл 2N водного карбоната натрия и 0,7 мл метилового спирта. После дегазации и заполнения системы аргоном добавляют 0,031 г (0,14 ммоль) ацетата палладия (II) и смесь перемешивают в течение ночи при температуре 80 градусов. Водную фазу отделяет и экстрагируют этилацетатом. Объединенные органические фазы экстрагируют 2N уксусной кислотой, кислые экстракты подщелачивают водным раствором аммиака и снова экстрагируют этилацетатом. После высушивания с сульфатом натрия, фильтрации и испарения органической фазы полученное светло-коричневое масло обрабатывают фумаровой кислотой в метил-трет.-бутилэфире. Полученную соль перекристаллизовывают от изопропанола, получая белые кристаллы гидрофумарата соединения, указанного в заголовке, с температурой плавления 213-216o.
0,57 г (2 ммоль) (+/-)-1,2,3,4-тетрагидро-5-бром-8-метокси-N,N- диметил-2-нафталинамина растворяют в 8 мл толуола. Добавляют 0,55 г (3,54 ммоль) 4-хлорфенилбороновой кислоты, 0,07 г (0,23 ммоль) три(ортотолил)фосфина, 3 мл 2N водного карбоната натрия и 0,7 мл метилового спирта. После дегазации и заполнения системы аргоном добавляют 0,031 г (0,14 ммоль) ацетата палладия (II) и смесь перемешивают в течение ночи при температуре 80 градусов. Водную фазу отделяет и экстрагируют этилацетатом. Объединенные органические фазы экстрагируют 2N уксусной кислотой, кислые экстракты подщелачивают водным раствором аммиака и снова экстрагируют этилацетатом. После высушивания с сульфатом натрия, фильтрации и испарения органической фазы полученное светло-коричневое масло обрабатывают фумаровой кислотой в метил-трет.-бутилэфире. Полученную соль перекристаллизовывают от изопропанола, получая белые кристаллы гидрофумарата соединения, указанного в заголовке, с температурой плавления 213-216o.
Исходный материал может быть получен следующим образом:
4,1 г (20 ммоль) (+/-)-1,2,3,4-тетрагидро-8-метокси-N,N-диметил-2- нафталинамин растворяют в 50 мл уксусной кислоты и добавляют 1,8 г (22 ммоль) ацетата натрия. Раствор 1,02 мл (20 ммоль) брома в 5 мл уксусной кислоты добавляют капля за каплей при комнатной температуре приблизительно в течение 30 минут. Формируется бесцветный осадок. После перемешивания в течение ночи растворитель отгоняют в условиях вакуума, остаток собирают водой и экстрагируют этилацетатом. Оставшуюся водную фазу подщелачивают водным раствором аммиака и экстрагируют этилацетатом. Органическую фазу сушат сульфатом натрия, фильтруют и выпаривают до сухого остатка. Оставшееся масло перегоняют в аппарате для перегонки "колба в колбу", получая светло-желтое масло с температурой кипения 170-180o при 0,04 мбар.
4,1 г (20 ммоль) (+/-)-1,2,3,4-тетрагидро-8-метокси-N,N-диметил-2- нафталинамин растворяют в 50 мл уксусной кислоты и добавляют 1,8 г (22 ммоль) ацетата натрия. Раствор 1,02 мл (20 ммоль) брома в 5 мл уксусной кислоты добавляют капля за каплей при комнатной температуре приблизительно в течение 30 минут. Формируется бесцветный осадок. После перемешивания в течение ночи растворитель отгоняют в условиях вакуума, остаток собирают водой и экстрагируют этилацетатом. Оставшуюся водную фазу подщелачивают водным раствором аммиака и экстрагируют этилацетатом. Органическую фазу сушат сульфатом натрия, фильтруют и выпаривают до сухого остатка. Оставшееся масло перегоняют в аппарате для перегонки "колба в колбу", получая светло-желтое масло с температурой кипения 170-180o при 0,04 мбар.
Следующие соединения получают аналогично примеру (см. таблицу).
Желатиновые капсулы могут быть получены обычным способом и пригодны для использования при лечении эпилепсии и мозговых ударов.
Желатиновые капсулы
Соединение формулы I, например, пример 21 в виде свободного основания - 10,0 мг
Лактоза - 165,5 мг
Диоксид кремния (Аэросил) - 1,5 мг
Кукурузный крахмал - 120,0 мг
Стеарат магния - 3,0 мг
Всего - 300,0 мг
Пустая капс. - 77,0 мг
Результ. вес - 377,0а
Соединение формулы I, например, пример 21 в виде свободного основания - 10,0 мг
Лактоза - 165,5 мг
Диоксид кремния (Аэросил) - 1,5 мг
Кукурузный крахмал - 120,0 мг
Стеарат магния - 3,0 мг
Всего - 300,0 мг
Пустая капс. - 77,0 мг
Результ. вес - 377,0а
Claims (8)
1. Замещенные 1,2,3,4-тетрагидро-2-нафталинамины общей формулы I
R1 и R2 независимо представляют собой водород, C1-4алкил, C1-4алкоксил, галоген, трифторметил;
R3 представляет собой водород, гидроксил, C1-4алкоксил, цианогруппу, карбамоил;
R4 и R5 независимо представляют собой водород, C1-4алкил, гидрокси-C2-4алкил, или образуют вместе с атомом азота, к которому они присоединены, пиперидино-группу,
в виде свободного основания или соли, полученной присоединением кислоты.
R1 и R2 независимо представляют собой водород, C1-4алкил, C1-4алкоксил, галоген, трифторметил;
R3 представляет собой водород, гидроксил, C1-4алкоксил, цианогруппу, карбамоил;
R4 и R5 независимо представляют собой водород, C1-4алкил, гидрокси-C2-4алкил, или образуют вместе с атомом азота, к которому они присоединены, пиперидино-группу,
в виде свободного основания или соли, полученной присоединением кислоты.
2. Соединение по п.1, отличающееся тем, что R1 и R2 независимо представляют собой водород, C1-4алкил, C1-4алкоксил, галоген, трифторметил; R3 представляет собой водород, гидроксил, C1-4алкоксил, цианогруппу, карбамоил R4 и R5 независимо представляют собой водород, C1-4алкил, или образуют вместе с атомом азота, к которому они присоединены, пиперидино-группу, в виде свободного основания или соли, полученной присоединением кислоты.
3. Соединение по п.1, отличающееся тем, что представляет собой соединение формулы I, в оптически активной или рацемической форме, где
R1=4-Cl, R2=H, R3=OMe, R4=Me, R5=Me,
R1=H, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Me, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-OMe, R2=H, R3=OMe, R4=Me, R5=Me,
R1=H, R2=H, R3=OH, R4=Me, R5=Me,
R1=H, R2=H, R3=H, R4=Me, R5=Me,
R1=4-Me, R2=H, R3=OMe, R4=Me, R5-Me,
R1=4-CF3, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=4-Cl, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2H, R3=OMe, R4=Me, R5=Me,
R1=3-Cl, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=OMe, R4=Me, R5=H,
R1=H, R2=H, R3=OMe, R4+R5=пиперидино,
R1=2-Cl, R2=H, R3=OMe, R4+R5=пиперидино,
R1=H, R2=H, R3=OMe, R4=n-Pr, R5=n-Pr,
R1=4-CF3, R2=H, R3=OH, R4=Me, R5=Me,
R1=2-Et, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=CN, R4=Me, R5=Me,
R1=2-Cl, R2=4-F, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2=4-F, R3=OMe, R4=Me, R5=Me,
R1=2-OMe, R2=4-OMe, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2=3-F, R3=OMe, R4=Me, R5=Me,
R1=2-OMe, R2=3-OMe, R3=OMe, R4=Me, R5=Me,
R1=2-Me, R2=5-Me, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=3-Cl, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2=5-F, R3=OMe, R4=Me, R5=Me,
R1=2-Me, R2=4-Me, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=CONH2, R4=Me, R5=Me,
R1=4-CF3, R2-H, R3=OMe, R4=Me, R5=H,
R1=4-OMe, R2=H, R3=OMe, R4=Me, R5=Me,
R1=4-F, R2=H, R3=OMe, R4=Me, R5=Me,
R1=4-CF3, R2=H, R3=OMe, R4=Et-OH, R5=Me, и
R1=4-CF3, R2=H, R3=H, R4=Me, R5=Me
Me -метил, Et - этил и Pr - пропил, в виде свободного основания или соли, полученной присоединением кислоты.
R1=4-Cl, R2=H, R3=OMe, R4=Me, R5=Me,
R1=H, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Me, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-OMe, R2=H, R3=OMe, R4=Me, R5=Me,
R1=H, R2=H, R3=OH, R4=Me, R5=Me,
R1=H, R2=H, R3=H, R4=Me, R5=Me,
R1=4-Me, R2=H, R3=OMe, R4=Me, R5-Me,
R1=4-CF3, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=4-Cl, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2H, R3=OMe, R4=Me, R5=Me,
R1=3-Cl, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=OMe, R4=Me, R5=H,
R1=H, R2=H, R3=OMe, R4+R5=пиперидино,
R1=2-Cl, R2=H, R3=OMe, R4+R5=пиперидино,
R1=H, R2=H, R3=OMe, R4=n-Pr, R5=n-Pr,
R1=4-CF3, R2=H, R3=OH, R4=Me, R5=Me,
R1=2-Et, R2=H, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=CN, R4=Me, R5=Me,
R1=2-Cl, R2=4-F, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2=4-F, R3=OMe, R4=Me, R5=Me,
R1=2-OMe, R2=4-OMe, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2=3-F, R3=OMe, R4=Me, R5=Me,
R1=2-OMe, R2=3-OMe, R3=OMe, R4=Me, R5=Me,
R1=2-Me, R2=5-Me, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=3-Cl, R3=OMe, R4=Me, R5=Me,
R1=2-F, R2=5-F, R3=OMe, R4=Me, R5=Me,
R1=2-Me, R2=4-Me, R3=OMe, R4=Me, R5=Me,
R1=2-Cl, R2=H, R3=CONH2, R4=Me, R5=Me,
R1=4-CF3, R2-H, R3=OMe, R4=Me, R5=H,
R1=4-OMe, R2=H, R3=OMe, R4=Me, R5=Me,
R1=4-F, R2=H, R3=OMe, R4=Me, R5=Me,
R1=4-CF3, R2=H, R3=OMe, R4=Et-OH, R5=Me, и
R1=4-CF3, R2=H, R3=H, R4=Me, R5=Me
Me -метил, Et - этил и Pr - пропил, в виде свободного основания или соли, полученной присоединением кислоты.
4. Соединение по п.1, которое представляет собой (R)-1,2,3,4-тетрагидро-8-метокси-N, N-диметил-5-[4-(трифторметил)фенил] -2-нафталинамин в виде свободного основания или соли, полученной присоединением кислоты.
5. Соединение по п. 1 в виде свободного основания или фармацевтически приемлемой соли, полученной присоединением кислоты, для использования в фармацевтическом средстве.
6. Соединение по п. 1 в виде свободного основания или фармацевтически приемлемой соли, полученной присоединением кислоты, обладающее антиконвульсивной активностью, активностью при нейрональных повреждениях, вызванных ишемией, и активностью в условиях, включающих высвобождение глютамата.
7. Способ получения замещенных 1,2,3,4-тетрагидронафтиламинов общей формулы I по п.1 в виде свободного основания или соли, полученной присоединением кислоты, отличающийся тем, что соединение формулы II,
где R3, R4 и R5 такие, как определено в п.1;
Hal представляет собой галоген, подвергают взаимодействию с соединением формулы III
где R1 и R2 такие, как определено в п.1, и полученное соединение выделяют в виде свободного основания или соли, полученной присоединением кислоты.
где R3, R4 и R5 такие, как определено в п.1;
Hal представляет собой галоген, подвергают взаимодействию с соединением формулы III
где R1 и R2 такие, как определено в п.1, и полученное соединение выделяют в виде свободного основания или соли, полученной присоединением кислоты.
8. Фармацевтическая композиция, обладающая антиконвульсивной активностью, активностью при ишемии, вызванной нейрональными повреждениями и активностью в условиях, включающих высвобождение глютамата, содержащая активный агент в сочетании с фармацевтическим наполнителем или разбавителем, отличающаяся тем, что в качестве активного агента она содержит соединение I по п. 1 формулы в форме свободного основания или фармацевтически приемлемой соли, полученной присоединением кислоты, в терапевтически эффективном количестве.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB9509156.7 | 1995-05-05 | ||
| GBGB9509156.7A GB9509156D0 (en) | 1995-05-05 | 1995-05-05 | Organic compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2169727C2 true RU2169727C2 (ru) | 2001-06-27 |
Family
ID=10774032
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU97119872/04A RU2169727C2 (ru) | 1995-05-05 | 1996-05-03 | Замещенные 1,2,3,4-тетрагидро-2-нафталинамины, способ их получения и фармацевтическая композиция на их основе |
Country Status (32)
| Country | Link |
|---|---|
| US (1) | US6169116B1 (ru) |
| EP (1) | EP0823892B1 (ru) |
| JP (1) | JP3194965B2 (ru) |
| KR (1) | KR100435009B1 (ru) |
| CN (1) | CN1122019C (ru) |
| AR (1) | AR004484A1 (ru) |
| AT (1) | ATE193884T1 (ru) |
| AU (1) | AU706392B2 (ru) |
| BR (1) | BR9608169A (ru) |
| CA (1) | CA2217855C (ru) |
| CO (1) | CO4440486A1 (ru) |
| CZ (1) | CZ292022B6 (ru) |
| DE (1) | DE69608891T2 (ru) |
| DK (1) | DK0823892T3 (ru) |
| ES (1) | ES2148772T3 (ru) |
| FI (1) | FI973530A7 (ru) |
| GB (1) | GB9509156D0 (ru) |
| GR (1) | GR3033715T3 (ru) |
| HU (1) | HUP9801068A3 (ru) |
| IL (1) | IL118141A (ru) |
| MX (1) | MX9708510A (ru) |
| NO (1) | NO308948B1 (ru) |
| NZ (1) | NZ308471A (ru) |
| PE (1) | PE54797A1 (ru) |
| PL (1) | PL182857B1 (ru) |
| PT (1) | PT823892E (ru) |
| RU (1) | RU2169727C2 (ru) |
| SK (1) | SK282022B6 (ru) |
| TR (1) | TR199701298T1 (ru) |
| TW (1) | TW359667B (ru) |
| WO (1) | WO1996034849A1 (ru) |
| ZA (1) | ZA963540B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2348410C2 (ru) * | 2003-03-25 | 2009-03-10 | ВАЗОФАРМ ГмбХ | Применение производных птеридина для лечения повышенного внутричерепного давления, вторичной ишемии и заболеваний, связанных с повышенным уровнем цитотоксических реакционноспособных соединений кислорода |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2002364545A1 (en) * | 2001-12-27 | 2003-07-24 | Ortho-Mcneil Pharmaceutical Inc. | Aroyl pyrrole heteroeryl and methanols useful for treating a central nervous system disorder |
| EP1506166B1 (en) | 2002-05-17 | 2011-11-16 | Janssen Pharmaceutica NV | Aminotetralin-derived urea modulators of vanilloid vr1 receptor |
| EP1956006A1 (en) * | 2007-02-06 | 2008-08-13 | Laboratorios del Dr. Esteve S.A. | Heterocyclyl-substituted-tetrahydro-naphthalen derivatives as 5-HT7 receptor ligands |
| EP1975161A1 (en) | 2007-03-28 | 2008-10-01 | Laboratorios del Dr. Esteve S.A. | Heterocyclyl-substituted- tetrahydro-napthalen-amine derivatives, their preparation and use as medicaments |
| WO2008154044A1 (en) * | 2007-06-15 | 2008-12-18 | University Of Florida Research Foundation | Therapeutic compounds and methods of use |
| EP2011786A1 (en) | 2007-07-05 | 2009-01-07 | Laboratorios del Dr. Esteve S.A. | Indane-amine derivatives, their preparation and use as medicaments |
| CN106573872B (zh) * | 2014-05-19 | 2021-07-20 | 东北大学 | 5-羟色胺受体靶向化合物和方法 |
| CN116438169A (zh) * | 2020-08-19 | 2023-07-14 | 东北大学 | 血清素受体调节剂 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0399982A1 (en) * | 1989-05-26 | 1990-11-28 | Astra Aktiebolag | Novel 8-substituted-2-amino-tetralines |
| EP0640618A1 (de) * | 1993-08-27 | 1995-03-01 | F. Hoffmann-La Roche Ag | Tetrahydronaphtalin-Peptidderivate |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6045179B2 (ja) * | 1977-06-08 | 1985-10-08 | フナイ薬品工業株式会社 | 新規環状アミノアルコ−ル類およびその製造法 |
| EP0257285A3 (en) | 1986-07-28 | 1989-12-27 | Whitby Research Incorporated | Method and compositions for reducing the intraocular pressure of mammals |
| DE3718317A1 (de) | 1986-12-10 | 1988-06-16 | Bayer Ag | Substituierte basische 2-aminotetraline |
| EP0381902A1 (en) | 1989-01-09 | 1990-08-16 | Merrell Dow Pharmaceuticals Inc. | Tetralin derivatives |
| JP2931986B2 (ja) | 1989-02-17 | 1999-08-09 | 武田薬品工業株式会社 | アラルキルアミン誘導体 |
| FR2711139B1 (fr) * | 1993-10-15 | 1995-12-01 | Adir | Nouveaux dérivés de 1,2,3,4-tétrahydronaphtalène, leur procédé de préparation et les compositions pharmaceutiques qui les contiennent. |
-
1995
- 1995-05-05 GB GBGB9509156.7A patent/GB9509156D0/en active Pending
-
1996
- 1996-05-02 CO CO96021819A patent/CO4440486A1/es unknown
- 1996-05-03 CA CA002217855A patent/CA2217855C/en not_active Expired - Fee Related
- 1996-05-03 AT AT96919659T patent/ATE193884T1/de not_active IP Right Cessation
- 1996-05-03 SK SK1485-97A patent/SK282022B6/sk unknown
- 1996-05-03 AU AU58129/96A patent/AU706392B2/en not_active Ceased
- 1996-05-03 CN CN96193739A patent/CN1122019C/zh not_active Expired - Fee Related
- 1996-05-03 ES ES96919659T patent/ES2148772T3/es not_active Expired - Lifetime
- 1996-05-03 AR ARP960102447A patent/AR004484A1/es unknown
- 1996-05-03 MX MX9708510A patent/MX9708510A/es not_active IP Right Cessation
- 1996-05-03 PE PE1996000309A patent/PE54797A1/es not_active Application Discontinuation
- 1996-05-03 NZ NZ308471A patent/NZ308471A/xx unknown
- 1996-05-03 TR TR97/01298T patent/TR199701298T1/xx unknown
- 1996-05-03 CZ CZ19973486A patent/CZ292022B6/cs not_active IP Right Cessation
- 1996-05-03 PT PT96919659T patent/PT823892E/pt unknown
- 1996-05-03 BR BR9608169A patent/BR9608169A/pt not_active IP Right Cessation
- 1996-05-03 JP JP53301096A patent/JP3194965B2/ja not_active Expired - Fee Related
- 1996-05-03 TW TW085105300A patent/TW359667B/zh active
- 1996-05-03 FI FI973530A patent/FI973530A7/fi not_active IP Right Cessation
- 1996-05-03 WO PCT/EP1996/001841 patent/WO1996034849A1/en not_active Ceased
- 1996-05-03 EP EP96919659A patent/EP0823892B1/en not_active Expired - Lifetime
- 1996-05-03 RU RU97119872/04A patent/RU2169727C2/ru not_active IP Right Cessation
- 1996-05-03 HU HU9801068A patent/HUP9801068A3/hu unknown
- 1996-05-03 DK DK96919659T patent/DK0823892T3/da active
- 1996-05-03 DE DE69608891T patent/DE69608891T2/de not_active Expired - Lifetime
- 1996-05-03 IL IL11814196A patent/IL118141A/en not_active IP Right Cessation
- 1996-05-03 ZA ZA9603540A patent/ZA963540B/xx unknown
- 1996-05-03 KR KR1019970707827A patent/KR100435009B1/ko not_active Expired - Fee Related
- 1996-05-03 PL PL96323037A patent/PL182857B1/pl not_active IP Right Cessation
-
1997
- 1997-11-04 NO NO975087A patent/NO308948B1/no unknown
-
1999
- 1999-06-28 US US09/340,818 patent/US6169116B1/en not_active Expired - Fee Related
-
2000
- 2000-06-16 GR GR20000401405T patent/GR3033715T3/el unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0399982A1 (en) * | 1989-05-26 | 1990-11-28 | Astra Aktiebolag | Novel 8-substituted-2-amino-tetralines |
| EP0640618A1 (de) * | 1993-08-27 | 1995-03-01 | F. Hoffmann-La Roche Ag | Tetrahydronaphtalin-Peptidderivate |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2348410C2 (ru) * | 2003-03-25 | 2009-03-10 | ВАЗОФАРМ ГмбХ | Применение производных птеридина для лечения повышенного внутричерепного давления, вторичной ишемии и заболеваний, связанных с повышенным уровнем цитотоксических реакционноспособных соединений кислорода |
| US8222238B2 (en) | 2003-03-25 | 2012-07-17 | Vasopharm Biotech Gmbh | Use of pteridine derivatives for the treatment of increased intracranial pressure, secondary ischemia, and disorders associated with an increased level of cytotoxic reactive oxygen species |
| US9382252B2 (en) | 2003-03-25 | 2016-07-05 | Vasopharm Gmbh | Use of pteridine derivatives for the treatment of increased intracranial pressure, secondary ischemia, and disorders associated with an increased level of cytotoxic reactive oxygen species |
| US9422289B2 (en) | 2003-03-25 | 2016-08-23 | Vasopharm Gmbh | Use of pteridine derivatives for the treatment of increased intracranial pressure, secondary ischemia, and disorders associated with an increased level of cytotoxic reactive oxygen species |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5763609B2 (ja) | 認識機能障害(cognitiveimpairment)を治療するための、組み合わされたセロトニン再取り込み、5−HT3および5−HT1A活性を有する化合物としての1−[2−(2,4−ジメチルフェニルスルファニル)−フェニル]ピペラジン | |
| CA2223978A1 (en) | Compounds active at a novel site on receptor-operated calcium channels useful for treatment of neurological disorders | |
| RU2169727C2 (ru) | Замещенные 1,2,3,4-тетрагидро-2-нафталинамины, способ их получения и фармацевтическая композиция на их основе | |
| CN101754958A (zh) | 制备高纯度的2,4′-二甲基-3-哌啶-苯丙酮(托哌酮)的方法,包含其的药物组合物以及包含托哌酮的活性物质配制剂 | |
| JPH0643388B2 (ja) | 3―フェノキシ―1―アゼチジンカルボキサミド、その製造方法及びそれからなる抗痙れん剤 | |
| AU740448B2 (en) | Biphenyl derivatives as pharmaceuticals | |
| SI9300217A (sl) | Farmacevtiki, ki vsebujejo ariloksialkilamino in ariltioalkilamino derivate | |
| JP7179035B2 (ja) | 認識機能障害(cognitive impairment)を治療するための、組み合わされたセロトニン再取り込み、5-HT3および5-HT1A活性を有する化合物としての1-[2-(2,4-ジメチルフェニルスルファニル)-フェニル]ピペラジン | |
| SK281060B6 (sk) | Farmakologicky účinné enantioméry, spôsob ich prípravy, medziprodukty tohto postupu | |
| HU205751B (en) | Process for producing new 1,3-oxazines and pharmaceutical compositions comprising same | |
| CZ20001592A3 (cs) | Nové deriváty bifenylu, způsob jejich přípravy a farmaceutický prostředek, který je obsahuje | |
| HK1014929B (en) | Tetralines | |
| WO1998047889A1 (en) | Chroman derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20050504 |