KR20220101432A - 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법 - Google Patents
갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법 Download PDFInfo
- Publication number
- KR20220101432A KR20220101432A KR1020210003451A KR20210003451A KR20220101432A KR 20220101432 A KR20220101432 A KR 20220101432A KR 1020210003451 A KR1020210003451 A KR 1020210003451A KR 20210003451 A KR20210003451 A KR 20210003451A KR 20220101432 A KR20220101432 A KR 20220101432A
- Authority
- KR
- South Korea
- Prior art keywords
- green tea
- composition
- tea extract
- less
- gallate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/82—Theaceae (Tea family), e.g. camellia
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/105—Plant extracts, their artificial duplicates or their derivatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
- A61K31/353—3,4-Dihydrobenzopyrans, e.g. chroman, catechin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0095—Drinks; Beverages; Syrups; Compositions for reconstitution thereof, e.g. powders or tablets to be dispersed in a glass of water; Veterinary drenches
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
- A61K9/1623—Sugars or sugar alcohols, e.g. lactose; Derivatives thereof; Homeopathic globules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2200/00—Function of food ingredients
- A23V2200/30—Foods, ingredients or supplements having a functional effect on health
- A23V2200/332—Promoters of weight control and weight loss
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2250/00—Food ingredients
- A23V2250/30—Other Organic compounds
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2300/00—Processes
- A23V2300/24—Heat, thermal treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2236/00—Isolation or extraction methods of medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicine
- A61K2236/30—Extraction of the material
- A61K2236/33—Extraction of the material involving extraction with hydrophilic solvents, e.g. lower alcohols, esters or ketones
- A61K2236/331—Extraction of the material involving extraction with hydrophilic solvents, e.g. lower alcohols, esters or ketones using water, e.g. cold water, infusion, tea, steam distillation or decoction
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biophysics (AREA)
- Mycology (AREA)
- Botany (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Hematology (AREA)
- Medical Informatics (AREA)
- Alternative & Traditional Medicine (AREA)
- Biotechnology (AREA)
- Child & Adolescent Psychology (AREA)
- Microbiology (AREA)
- Dermatology (AREA)
- Food Science & Technology (AREA)
- Polymers & Plastics (AREA)
- Nutrition Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Biochemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Plant Substances (AREA)
Abstract
본 개시는 추출물의 총 중량을 기준으로 4 중량% 이상의 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법에 관한 것으로, 본 개시에 따르면, 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 함유함으로써 체지방 감소의 효능이 우수하다는 장점이 있다. 이에 따라 다각적인 연구를 통한 효과적인 비만 치료용 물질을 제공하는 효과가 있다.
Description
본 명세서에는 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법이 개시된다.
비만은 음식물로 섭취한 에너지와 신체 활동으로 소비한 에너지 간의 불균형에 의하여 과잉의 에너지가 체지방으로 축적된 상태로서, 지방조직 내 지방세포의 수가 증가하거나 지방세포의 크기가 늘어나 지방이 증가하게 된 상태를 지칭한다. 비만은 이 외에도 유전적 요인, 서구화된 식생활에 의한 환경적 요인, 심리적 요인, 에너지 대사 이상 등 다양한 원인이 작용한다고 알려져 있다. 이러한 비만 상태가 오랜 시간에 걸쳐 지속되면 당뇨병, 고지혈증, 심장병, 뇌졸중, 동맥경화증, 지방간 등의 각종 대사성 질환과 성인병이 유발된다.
바람직한 비만의 치료 방법으로는 운동을 통한 에너지 소비 촉진과 부작용이 적은 비만 치료용 약제를 병행하는 것이 가장 안전하고 효과적인 방법으로 제시되고 있다. 그러나 비만 치료용 약제의 경우, 지방변, 복부 통증, 구토, 가려움증, 간 손상, 두통, 식욕 부진, 불면, 변비 등의 심각한 부작용들이 보고되고 있으며 안전성에 대한 명확한 신뢰가 뒷받침되지 않고 있는 실정이다. 따라서, 인체에 대해서 항비만의 우수한 효능을 나타내면서도 100% 안전성이 보장되는 물질의 개발이 요구되고 있다. 일례로서 대한민국 공개특허 제10-2015-0105563호에서는 한약재의 추출물을 포함하는 비만의 예방 및 치료용 조성물을 개시한 바 있다. 그러나 여전히 생체 내의 지방 연소/분해 기전과 에너지 대사 증진 기전 등의 다각적인 연구를 통한 효과적인 비만 치료용 물질에 대한 개발은 미흡한 실정이다.
본 개시는 상기와 같은 문제점을 해결하기 위하여 안출된 것으로서, 본 개시의 목적은 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 함유함으로써 체지방 감소의 우수한 효능을 나타내는 조성물 및 이의 제조방법을 제공하는 것이다.
전술한 본 개시의 목적을 달성하기 위하여, 본 개시는 추출물의 총 중량을 기준으로 4 중량% 이상의 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법을 제공한다.
본 개시에 따르면, 추출물의 총 중량을 기준으로 4 중량% 이상의 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 함유함으로써 체지방 감소의 효능이 우수하다는 장점이 있다. 이에 따라 다각적인 연구를 통한 효과적인 비만 치료용 물질을 제공하는 효과가 있다.
도 1 및 2는 녹차 추출물의 지질 합성 유전자의 발현 억제 효능 평가 결과를 나타낸 그래프.
도 3은 녹차 추출물의 지질 합성 또는 축적 억제 효능 평가 결과를 나타낸 이미지 및 그래프.
도 4는 녹차 추출물 성분의 지질 합성 또는 축적 억제 효능 평가 결과를 나타낸 그래프.
도 5, 6 및 8은 녹차 추출물의 지방산 산화 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 7은 녹차 추출물 성분의 지방산 산화 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 9는 녹차 추출물의 중성지방 분해 촉진 효능 평가 결과를 나타낸 그래프.
도 10, 11 및 13은 녹차 추출물의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가 결과를 나타낸 그래프.
도 12는 녹차 추출물 성분의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가 결과를 나타낸 그래프.
도 14 및 16은 녹차 추출물 성분의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 15 및 17은 녹차 추출물의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 18는 녹차 추출물의 지방세포 내 에너지 대사 활성 촉진 효능 평가 결과를 나타낸 그래프.
도 3은 녹차 추출물의 지질 합성 또는 축적 억제 효능 평가 결과를 나타낸 이미지 및 그래프.
도 4는 녹차 추출물 성분의 지질 합성 또는 축적 억제 효능 평가 결과를 나타낸 그래프.
도 5, 6 및 8은 녹차 추출물의 지방산 산화 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 7은 녹차 추출물 성분의 지방산 산화 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 9는 녹차 추출물의 중성지방 분해 촉진 효능 평가 결과를 나타낸 그래프.
도 10, 11 및 13은 녹차 추출물의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가 결과를 나타낸 그래프.
도 12는 녹차 추출물 성분의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가 결과를 나타낸 그래프.
도 14 및 16은 녹차 추출물 성분의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 15 및 17은 녹차 추출물의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 결과를 나타낸 그래프.
도 18는 녹차 추출물의 지방세포 내 에너지 대사 활성 촉진 효능 평가 결과를 나타낸 그래프.
본 명세서에서 사용되는 용어는 본 개시에서의 기능을 고려하면서 가능한 현재 널리 사용되는 일반적인 용어들을 선택하였으나, 이는 당해 분야에 종사하는 기술자의 의도, 판례, 또는 새로운 기술의 출현 등에 따라 달라질 수 있다. 또한, 특정한 경우는 출원인이 임의로 선정한 용어도 있으며, 이 경우 해당되는 발명의 설명 부분에서 상세히 그 의미를 기재할 것이다. 따라서 본 개시에서 사용되는 용어는 단순한 용어의 명칭이 아닌, 그 용어가 가지는 의미와 본 개시의 전반에 걸친 내용을 토대로 정의되어야 한다.
다르게 정의되지 않는 한, 기술적이거나 과학적인 용어를 포함하여 여기에서 사용되는 모든 용어들은 본 발명이 속하는 기술 분야에서 통상의 지식을 가진 자에 의하여 일반적으로 이해되는 것과 동일한 의미를 가진다. 일반적으로 이해되는 용어들은 관련 기술의 문맥상 가지는 의미와 동일한 의미를 가지는 것으로 해석되어야 하며, 본 개시에서 명백하게 정의하지 않는 한, 이상적이거나 과도하게 형식적인 의미로 해석되지 않는다.
수치 범위는 본 개시에 정의된 수치를 포함한다. 본 명세서에 걸쳐 주어진 모든 최대의 수치 제한은 낮은 수치 제한이 명확히 쓰여져 있는 것처럼 모든 더 낮은 수치 제한을 포함한다. 본 명세서에 걸쳐 주어진 모든 최소의 수치 제한은 더 높은 수치 제한이 명확히 쓰여져 있는 것처럼 모든 더 높은 수치 제한을 포함한다. 본 명세서에 걸쳐 주어진 모든 수치 제한은 더 좁은 수치 제한이 명확히 쓰여져 있는 것처럼, 더 넓은 수치 범위 내의 더 좋은 모든 수치 범위를 포함할 것이다.
이하, 본 개시에 대해서 실시예 및 도면을 참조하여 구체적으로 설명한다. 그러나, 하기 실시예 및 도면에 의하여 본 발명이 한정되지 아니함은 자명하다.
일 측면에서, 본 개시는 갈로카테킨 갈레이트(gallocatechin gallate, GCG)를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물을 제공한다.
상기 “녹차 추출물”은 추출방법, 추출용매, 추출된 성분 또는 추출물의 형태를 불문하고, 차과에 속하는 상록수인 차(카멜리아 시넨시스; Camellia sinensis)로부터 추출한 것 또는 바실러스 서브틸리스(Bacillus subtilis spp.)를 접종하고 발효시킨 차잎 등으로부터 추출한 것을 포함하고, 상기 추출한 것을 특정 용매로 분획한 분획물을 포함한다. 상기 차는 차나무 잎, 꽃, 줄기, 열매, 뿌리, 줄기, 및 뿌리의 심재로 구성된 군에서 선택되는 하나 이상이 포함되며, 바람직하게는 잎일 수 있다. 또한, 상기 추출물의 형태는 바람직하게는 분말 형태일 수 있다. 상기 추출 또는 분획은 물, 유기 용매, 또는 이들의 혼합용매를 사용하여 할 수 있다. 유기용매는 알코올, 이소프로판올, 아세톤, 헥산, 에틸아세테이트, 이산화탄소, 또는 이들 중 둘 이상의 혼합용매를 사용할 수 있으나 이에 한정되지는 않으며, 녹차의 유효 성분이 파괴되지 않거나 최소화된 조건에서 실온 또는 가온하여 추출 또는 분획할 수 있다. 상기 알코올은 C1~C5의 저급 알코올일 수 있다. 추출 또는 분획의 횟수나 방법은 특별히 제한되지 않으며, 예를 들어 냉침 추출, 초음파 추출, 환류 냉각 추출, 열수 추출 등의 방법을 사용할 수 있고, 바람직하게는 냉침 또는 가온하여 유효성분을 추출 또는 분획하고 여과한 다음, 그 여과액을 감압농축하여 본 발명의 녹차 추출물을 얻을 수 있다.
녹차에는 폴리페놀 화합물(flavanols, flavandiols flavonoid, phenolic acid)이 포함되어 있으며, 상기 폴리페놀 화합물의 대부분은 “카테킨(catechin)”류 화합물로 알려진 플라보놀이다. 이 외에도 녹차에는 색소류, 데아닌과 글루타민산을 포함한 28종의 아미노산류, 무기질, 여러 가지 효소류, 유기산 그리고 탄수화물 등을 함유하고 있다. 상기 “카테킨(catechin)”류 화합물로는 카테킨(catechin, C), 에피카테킨(epicatechin, EC), 갈로카테킨(gallocatechin, GC), 에피갈로카테킨(epigallocatechin, EGC), 카테킨 갈레이트(catechin gallate, CG), 에피카테킨 갈레이트(epicatechin gallate, ECG), 갈로카테킨 갈레이트(gallocatechin gallate, GCG), 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 주요 8종 화합물들을 들 수 있다. 보다 구체적으로는, (-)-카테킨, (-)-에피카테킨, (-)-갈로카테킨, (-)-에피갈로카테킨, (-)-카테킨 갈레이트, (-)-에피카테킨 갈레이트, (-)-갈로카테킨 갈레이트, 및 (-)-에피갈로카테킨 갈레이트일 수 있다.
상기 “갈로카테킨 갈레이트(gallocatechin gallate, GCG)”는 에피갈로카테킨 갈레이트의 에피머로서, 본 발명자들은 체지방 감소용 조성물을 탐색하기 위해 예의연구를 거듭한 결과, 놀랍게도 상기 갈로카테킨 갈레이트의 추출물 내 함량, 에피갈로카테킨 갈레이트 및 상기 갈로카테킨 갈레이트의 중량비, 총 카테킨 함량이 특정한 범위 내일 경우 체지방 감소 활성이 있는 것을 알아내어 본 발명을 완성시키기에 이르렀다.
상기 “총 카테킨 함량”은 상기 8종의 카테킨류 화합물 즉, 카테킨, 에피카테킨, 갈로카테킨, 에피갈로카테킨, 카테킨 갈레이트, 에피카테킨 갈레이트, 갈로카테킨 갈레이트, 및 에피갈로카테킨 갈레이트의 총 함량을 의미한다.
상기 “유효성분”은 목적하는 활성을 나타내는 성분 또는 그 자체는 활성이 없는 담체와 함께 활성을 나타낼 수 있는 성분을 의미한다.
상기 “유효성분으로 포함하는”은 체지방 감소 효능을 나타내거나, 비만 예방, 개선 또는 치료 효능을 나타내는 성분으로서 포함하는 것을 의미할 수 있다.
상기 “체지방 감소” 효능은 체중의 변화가 없음에도 불구하고, 체지방을 감소시켜 체지방률이 감소되는 효능, 및 체지방의 증가를 억제하여 체지방률의 증가를 억제하는 효능을 의미한다. 본 개시의 체지방 감소용 조성물을 투여 또는 섭취하고 있는 기간 중에 정기적으로 가벼운 운동을 함으로써 체지방의 감소 효과를 더욱 높일 수 있다. 본 개시에서의 체지방 감소용 조성물을 투여 또는 섭취시킴으로써 체지방의 증가를 억제하여, 그 결과 비만을 방지하는 효과도 갖는다. 과잉의 체지방을 감소시킴으로써, 비만이나 과체중이 원인이라고 말해지고 있는 질환, 예를 들면, 당뇨병, 동맥 경화, 고혈압, 암, 고지혈증, 류머티스, 고뇨산혈증, 변형성 관절증, 통풍, 뇌졸중, 허혈성 심질환, 호흡장해, 췌장염, 신장염, 백내장, 알츠하이머병, 알레르기성 질환, 노화, 다한증, 허혈질환, 당뇨병의 합병증인 신증이나 신경 장해나 망막 장해에 관한 질병의 치료·개선·예방 효과도 갖고 있다. 신경 장해에 있어서는, 돌발성 난청, 눈이나 안면의 이상(마비나 통증), 기립성 저혈압, 발한 이상, 설사나 변비(소화기증상), 배뇨 장해, 사지 통증, 지각 이상, 근육 위축, 괴증의 치료·개선·예방에 효과가 있다. 눈의 장해에 있어서는, 백내장, 단순 망막증, 전증식 망막증 및 증식 망막증에 효과가 있다. 또한, 허혈성 질환에 있어서는 뇌경색·심근 경색의 예방, 개선 또는 치료에도 효과가 있다.
본 개시의 일 구현예에 있어서, 상기 녹차 추출물은 상기 갈로카테킨 갈레이트를 추출물의 총 중량을 기준으로 4 중량% 이상의 함량으로 함유한다. 보다 구체적으로 4 중량% 이상, 4.5 중량% 이상, 5 중량% 이상, 5.3 중량% 이상, 5.5 중량% 이상, 5.59 중량% 이상 또는 5.6 중량% 이상일 수 있으나, 이에 제한되는 것은 아니다. 또한 상기 갈로카테킨 갈레이트의 함량의 상한은 특별히 제한되지 아니한다.
본 개시의 일 구현예에 있어서, 상기 녹차 추출물은 상기 갈로카테킨 갈레이트를 추출물의 총 중량을 기준으로 4 중량% 내지 15 중량%의 함량으로 함유한다. 보다 구체적으로, 4 중량% 이상, 4.5 중량% 이상, 5 중량% 이상, 5.5 중량% 이상 또는 5.6 중량% 이상; 15 중량% 이하, 14.5 중량% 이하, 14 중량% 이하, 13.5 중량% 이하, 13 중량% 이하, 12.5 중량% 이하, 12 중량% 이하, 11.5 중량% 이하, 11 중량% 이하, 10.5 중량% 이하, 10 중량% 이하, 9.5 중량% 이하, 9 중량% 이하, 8.5 중량% 이하, 8 중량% 이하, 7.5 중량% 이하, 7 중량% 이하, 6.5 중량% 이하, 6 중량% 이하 또는 5.6 중량% 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 녹차 추출물은 상기 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)를 추출물의 총 중량을 기준으로 4 중량% 내지 15 중량%의 함량으로 함유한다. 보다 구체적으로, 4 중량% 이상, 4.5 중량% 이상, 5 중량% 이상 또는 5.3 중량% 이상; 15 중량% 이하, 14.5 중량% 이하, 14 중량% 이하, 13.5 중량% 이하, 13 중량% 이하, 12.5 중량% 이하, 12 중량% 이하, 11.5 중량% 이하, 11 중량% 이하, 10.5 중량% 이하, 10 중량% 이하, 9.5 중량% 이하, 9 중량% 이하, 8.5 중량% 이하, 8 중량% 이하, 7.5 중량% 이하, 7 중량% 이하, 6.5 중량% 이하, 6 중량% 이하, 5.5 중량% 이하 또는 5.3 중량% 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 녹차 추출물의 1일 적용량은 10 mg/kg 내지 2000 mg/kg이다. 보다 구체적으로 1일 적용량은 10 mg/kg 이상, 20 mg/kg 이상, 25 mg/kg 이상, 50 mg/kg 이상, 75 mg/kg 이상, 100 mg/kg 이상, 125 mg/kg 이상, 150 mg/kg 이상, 175 mg/kg 이상, 200 mg/kg 이상, 225 mg/kg 이상, 250 mg/kg 이상, 275 mg/kg 이상, 300 mg/kg 이상, 325 mg/kg 이상, 350 mg/kg 이상, 375 mg/kg 이상 또는 400 mg/kg 이상; 2000 mg/kg 이하, 1750 mg/kg 이하, 1500 mg/kg 이하, 1250 mg/kg 이하, 1000 mg/kg 이하, 975 mg/kg 이하, 950 mg/kg 이하, 925 mg/kg 이하, 900 mg/kg 이하, 875 mg/kg 이하, 850 mg/kg 이하, 825 mg/kg 이하, 800 mg/kg 이하, 775 mg/kg 이하, 750 mg/kg 이하, 725 mg/kg 이하, 700 mg/kg 이하, 675 mg/kg 이하, 650 mg/kg 이하, 625 mg/kg 이하, 600 mg/kg 이하, 575 mg/kg 이하, 550 mg/kg 이하, 525 mg/kg 이하, 500 mg/kg 이하, 475 mg/kg 이하, 450 mg/kg 이하, 425 mg/kg 이하 또는 400 mg/kg 이하일 수 있으나, 이에 제한되는 것은 아니다. 상기 적용은 1일 1회 내지 수회 나누어 적용할 수도 있다. 예를 들면, 1일 2회 내지 24회, 3일 1회 내지 2회, 1주일 1회 내지 6회, 2주일 1회 내지 10회, 3주일 1회 내지 15회, 4주일 1회 내지 3회, 또는 1년에 1회 내지 12회 적용될 수 있다.
상기 “적용”은 임의의 적절한 방법으로 적용 대상에 상기 조성물을 제공하는 것을 의미하며, 투여, 도포, 흡수 및 섭취 등을 포함하는 의미이다. 이때, 적용 대상은 상기 조성물을 적용할 수 있는 인간, 원숭이, 개, 염소, 돼지 또는 쥐 등 모든 동물을 의미한다.
본 개시의 일 구현예에 있어서, 본 개시의 상기 녹차 추출물의 함량은 조성물 총 중량에 대하여 0.4 중량% 내지 100 중량%의 함량으로 포함되는 것일 수 있다. 보다 구체적으로 0.4 중량% 이상, 0.5 중량%, 1 중량% 이상, 10 중량% 이상, 20 중량% 이상, 30 중량% 이상, 40 중량% 이상, 50 중량% 이상, 60 중량% 이상, 70 중량% 이상, 80 중량% 이상 또는 90 중량% 이상; 100 중량% 이하, 90 중량% 이하, 80 중량% 이하, 70 중량% 이하, 60 중량% 이하, 50 중량% 이하, 40 중량% 이하, 30 중량% 이하 또는 20 중량% 이하일 수 있으나, 이에 제한되는 것은 아니다.
상기 녹차 추출물의 함량은 제형, 용도, 적용 횟수 및 적용 경로에 따라 다를 수 있다. 특히, 본 개시의 조성물의 제형에 있어서 주사제 등 비경구 제형으로 제조될 경우, 또는 식품, 알약 및 시럽 등 경구 제형으로 제조될 경우, 본 개시의 상기 유효성분의 함량은 조성물의 장 내 흡수율, 소화율 등에 따라 다를 수 있다. 본 개시의 조성물의 1일 적용량을 고려하면, 체중이 60 kg인 적용 대상에 대하여 600 mg 내지 120,000 mg로 적용될 수 있다. 1일 적용량을 150 g으로 가정하면 본 개시의 상기 녹차 추출물의 함량은 조성물 총 중량에 대하여 0.4 중량% 내지 80 중량%의 함량으로 포함되는 것일 수 있다.
본 개시의 일 구현예에 있어서, 상기 녹차 추출물은 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG) 및 갈로카테킨 갈레이트(gallocatechin gallate, GCG)를 1 : 0.33 내지 3의 중량비로 함유한다. 보다 구체적으로, 상기 중량비는 1 : 0.33 이상, 1 : 0.35 이상, 1 : 0.4 이상, 1 : 0.45 이상, 1 : 0.5 이상, 1 : 0.55 이상, 1 : 0.6 이상, 1 : 0.65 이상, 1 : 0.7 이상, 1 : 0.75 이상, 1 : 0.8 이상, 1 : 0.9 이상, 1 : 1 이상, 1 : 1.05 이상, 1 : 1.051 이상, 1 : 1.052 이상, 1 : 1.053 이상, 1 : 1.054 이상, 1 : 1.055 이상, 1 : 1.056 이상 또는 1 : 1.057 이상; 1 : 3 이하, 1 : 2.5 이하, 1 : 2 이하, 1 : 1.5 이하, 1 : 1.4 이하, 1 : 1.3 이하, 1 : 1.2 이하, 1 : 1.1 이하, 1 : 1.09 이하, 1 : 1.08 이하, 1 : 1.07 이하, 1 : 1.06 이하, 1 : 1.059 이하, 1 : 1.058 이하 또는 1 : 1.057 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 녹차 추출물은 카테킨(catechin, C), 에피카테킨(epicatechin, EC), 갈로카테킨(gallocatechin, GC), 에피갈로카테킨(epigallocatechin, EGC), 카테킨 갈레이트(catechin gallate, CG), 에피카테킨 갈레이트(epicatechin gallate, ECG), 갈로카테킨 갈레이트(gallocatechin gallate, GCG), 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)를 추출물의 총 중량을 기준으로 19 내지 30 중량%의 함량으로 함유한다. 상기 8종의 카테킨류 화합물의 함량은 “총 카테킨 함량”이며, 보다 구체적으로, 19 중량% 이상, 19.5 중량% 이상, 20 중량% 이상, 20.5 중량% 이상, 21 중량% 이상, 21.5 중량% 이상, 22 중량% 이상 또는 24.6 중량% 이상; 30 중량% 이하, 29.5 중량% 이하, 29 중량% 이하, 28.5 중량% 이하, 28 중량% 이하, 27.5 중량% 이하, 27 중량% 이하, 26.5 중량% 이하, 26 중량% 이하, 25.5 중량% 이하, 25 중량% 이하, 24.5 중량% 이하, 24 중량% 이하, 23.5 중량% 이하, 23 중량% 이하, 22.5 중량% 이하 또는 24.6 중량% 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 조성물은 지방세포 내 중성지방 분해 촉진용 조성물이다. 중성지방을 글리세롤 및 유리 지방산으로 분리시킴으로써 비축된 지방이 분해될 수 있다.
본 개시의 일 구현예에 있어서, 상기 유효성분은 PGC-1α(peroxisome proliferator-activated receptor gamma coactivator 1-alpha), ACO(acyl-CoA Oxidase), CPT1(carnitine palmitoyl transferase 1) 및 mCAD(medium chain acyl-CoA dehydrogenase)로 이루어진 군으로부터 선택되는 하나 이상의 지방산 산화 유전자의 발현을 증가시킨다.
본 개시의 일 구현예에 있어서, 상기 조성물은 지방세포의 크기를 감소시키는 것이다. 상기 “지방세포의 크기”는 지방세포의 직경을 의미한다. 상기 지방세포의 크기는 세포 내에 축적된 지방의 양에 의해 결정되므로, 지방세포의 크기가 감소하는 것은 세포 내의 지방의 양이 감소하는 것일 수 있다.
본 개시의 일 구현예에 있어서, 상기 조성물은 지방세포 내 (triglyceride, TG, 트리글리세라이드) 합성 또는 축적 억제용 조성물이다. 체내에서 잉여 에너지는 주로 중성지방의 형태로 저장되는데, 체지방 감소의 첫 번째 단계로서 상기 중성지방의 합성 또는 축적을 억제할 필요가 있다.
본 개시의 일 구현예에 있어서, 상기 조성물은 지질 합성 유전자의 발현을 억제하여 지방세포 내 중성지방의 합성 또는 축적을 억제할 수 있다. 상기 지질은 예를 들어 중성지방일 수 있다. 상기 지질 합성 유전자는 SREBP1c(sterol-regulatory element binding protein 1c), ACC(acetyl-CoA carboxylase), FAS(Fatty acid synthase) 및 Stearoyl-CoA Desaturase-1(SCD-1)를 예로 들 수 있지만, 이에 제한되지 않는다. 본 개시의 일 구현예에 있어서, 상기 유효성분은 SREBP1c, ACC, FAS 및 SCD-1로 이루어진 군으로부터 선택되는 하나 이상의 지질 합성 유전자의 발현을 억제한다.
본 개시의 일 구현예에 있어서, 상기 조성물은 지방세포 내 미토콘드리아의 활성 촉진용 조성물이다. 비만인 경우, 지방세포에서 지방이 분해되더라도, 분해 산물인 유리 지방산 등이 에너지 대사를 통하여 적절히 소비되지 않으면, 이들이 다른 세포 및 조직으로 이동하여 다시 지방 축적이 일어나는 등의 지질 조절이상(lipid dysregulation) 작용이 일어나 대사질환의 원인이 될 수 있다. 따라서, 지방세포 내에서 분해된 지방이 소비되어 ATP로 전환될 수 있어야 체지방 감소 효능을 달성할 수 있으므로, 미토콘드리아의 활성이 촉진되어 에너지 대사가 활성화 되어야 한다. 즉 지방세포 내 중성지방 분해 촉진 및 미토콘드리아의 활성 촉진이 병행되어야 최적의 체지방 감소 효능이 발휘될 수 있다.
본 개시의 일 구현예에 있어서, 상기 조성물은 기초 대사량 증가용 조성물이다. 본 개시의 조성물은 상기 유효성분을 포함함으로써 지방산 산화 유전자의 발현을 증가시키고, 지방세포 내 미토콘드리아의 활성을 촉진하여 기초 대사량 증가, 근육 손상 억제, 지구력 강화, 근력 강화, 근육통 억제 등의 효과를 가진다.
본 개시의 일 구현예에 있어서, 상기 조성물은 백색 지방세포의 베이지색 지방세포화를 유도하는 것이다.
지방세포는 지방조직을 이루는 주된 세포로 기능과 형태적인 특징 그리고 분화 기원에 따라 백색 지방세포(white adipocyte), 갈색 지방세포(brown adipocyte), 베이지색 지방세포(beige/brite adipocyte)로 구분된다.
상기 “백색 지방세포(white adipocyte)”는 지방을 저장하는 지방세포를 의미하며, 당뇨, 비만 등의 성인병의 원인이 되는 세포이다. 상기 백색 지방세포는 에너지를 중성지방(triglyceride, TG, 트리글리세라이드)으로 저장하고 전신 사용을 위해 에너지가 필요할 때 유리 지방산을 동원한다. 유리 지방산의 해방은 중성지방의 분해(TG의 가수 분해)를 필요로 하며, 이는 주로 지방 트리글리세라이드 리파아제(adipose triglyceride lipase, ATGL) 및 호르몬 민감성 리파아제(hormone sensitive lipase, HSL)를 포함하는 세포질 리파아제의 cAMP 의존성 단백질 인산화 효소 A(cAMP dependent protein kinase A)의 활성화에 의해 조절된다.
상기 “갈색 지방세포(brown adipocyte)” 및 “베이지색 지방세포(beige/brite adipocyte)”는 지방을 에너지로 연소시키는 세포를 의미하며, 갈색 지방세포에서는 ATP합성에서 미토콘드리아의 경사도를 끌어내리는 양자(protons)의 짝풀림(uncoupling)이 유도되어 비(非) 떨림 열이 발생한다. 따라서, 갈색 지방세포 및 베이지색 지방세포는 체온조절 및 에너지 생산에 중요한 역할을 수행하는 세포이다.
갈색 지방세포와 베이지색 지방세포는 몇 가지 차이점이 있다. 갈색 지방세포는 근육세포와 같은 전구세포(Myf5+/Pax7+ precursor)로부터 분화되고, 견갑골, 쇄골, 신장 등의 위치에서 주로 발견된다. 생쥐의 경우 출생 직전에 분화가 이루어지고 전 생애 동안 그 기능과 형태를 유지하는 반면, 사람의 경우 어린 시절에 일시적으로 나타났다가 성인이 되면서 점차 사라지는 것으로 알려져 있다. 베이지색 지방세포는 백색 지방세포나(Trans-differentiation) 백색 지방전구세포(PDGFRα+/SCA1+ precursor)로부터 분화(De novo differentiation)가 유도되고, 추위에 노출되었을 때에 특이적으로 백색 지방조직(주로 피하지방)에서 나타나게 된다.
백색 지방세포가 갈색 지방세포로 전환되면 체내에 저장되는 지방보다 연소되는 지방의 양이 증가하므로, 같은 열량의 음식을 섭취하더라도 체중을 유지하기가 쉬워지고 비만을 개선할 수 있게 된다. 다만 본 개시의 상기 조성물은 갈색 지방세포로의 분화보다는 백색 지방세포의 베이지색 지방세포화를 유도하는 것이다. 상기 조성물은 백색 지방세포를 베이지색 지방세포화 시키는 작용을 통하여 갈색 지방세포와 유사한 역할을 하도록 하는 지방세포의 에너지 대사 전환(fat transformation), 이른바 베이지색 지방세포화 현상을 유도한다.
본 개시의 일 구현예에 있어서, 상기 조성물은 지방세포에서 UCP1(uncoupling protein 1, 짝풀림 단백질 1)의 발현을 증가시킨다. 상기 UCP1은 갈색 지방세포 내의 미토콘드리아 내막에 존재하며 산화와 인산화의 결합을 막는 작용을 한다. UCP1은 백색 지방세포 등 다른 세포에서는 발현되지 않아 갈색 지방세포의 분자 마커로 사용된다. UCP1은 광인산화반응이 ATP 합성으로 이어지지 못하게 하고 에너지를 열로 방출되게 한다.
본 개시의 일 구현예에 있어서, 상기 조성물은 비만 예방, 개선 또는 치료용 약제학적 조성물이다.
상기 “비만”은 체내에 지방조직이 과다한 상태를 의미한다. 남자는 체지방이 체중의 25% 이상일 때, 여자는 체중의 30% 이상일 때 비만이라고 하며, 음식으로 섭취하는 열량이 몸을 움직이며 소비하는 열량보다 많을 때 비만이 생긴다. 비만이 생기면 외형적으로 뚱뚱해 보이며, 숨이 쉽게 차고, 관절 통증, 당뇨병, 고혈압 등의 증상이 동반되기도 한다.
상기 “약제학적 조성물”은 질병의 예방, 개선 또는 치료를 필요로 하는 개체에 투여하기에 적합한 조성물을 의미한다.
상기 “개체”는 질병의 예방 또는 치료를 필요로 하는 대상을 의미하고, 보다 구체적으로 인간 또는 비-인간인 영장류, 생쥐(mouse), 쥐(rat), 개, 고양이, 말 및 소 등의 포유류를 의미한다.
상기 “예방”은 본 개시의 조성물의 투여에 의해 비만을 억제시키거나 또는 지연시키는 모든 행위를 의미한다. 상기 “개선”은 상기 조성물의 투여로 비만이 호전되거나 이롭게 변경되는 모든 행위를 의미한다. 상기 “치료”는 본 개시의 조성물의 투여에 의해 비만의 의심 및 발병 개체의 증상이 호전되거나 이롭게 변경되는 모든 행위를 의미한다.
본 개시에 유효성분이 약제학적 조성물에 포함되는 경우, 본 개시에 따른 유효성분 이외에 약학적으로 허용 가능한 담체 즉 식염수, 멸균수, 링거액, 완충 식염수, 사이클로덱스트린, 덱스트로즈 용액, 말토덱스트린 용액, 글리세롤, 에탄올, 리포좀 및 이들 성분 중 1종 이상을 혼합하여 사용할 수 있으며, 필요에 따라 항산화제, 완충액 등 다른 통상의 첨가제를 더 포함할 수 있다. 또한 희석제, 분산제, 계면활성제, 결합제 및/또는 윤활제를 부가적으로 첨가하여 수용액, 현탁액, 유탁액 등과 같은 주사용 제형, 환약, 캡슐, 과립 또는 정제로 제제화할 수 있다.
상기 약제학적 조성물은 약학적으로 유효한 양으로 투여한다. 상기 “약학적으로 유효한 양”은 적용 가능한 합리적인 수혜/위험 비율로 질환을 예방 또는 치료하기에 충분한 양을 의미하며, 유효 용량 수준은 환자의 질환의 종류, 질환의 중증도, 약물의 활성, 약물에 대한 민감도, 투여 시간, 투여 경로 및 배출 비율, 치료 기간, 동시 사용되는 약물을 포함한 요소 및 기타 약학적으로 잘 알려진 요소에 따라 결정될 수 있다.
상기 약제학적 조성물은 경구 투여 제형(예를 들면, 분말, 정제, 캡슐, 시럽, 알약, 또는 과립), 또는 비경구 제형(예를 들면, 주사제)으로 제형화될 수 있고, 전신 제형, 또는 국부 제형으로 제조될 수 있다.
상기 약제학적 조성물은 개별 치료제로 투여하거나 다른 치료제와 병용하여 투여될 수 있고 종래의 치료제와는 순차적 또는 동시에 투여될 수 있으며, 단일 또는 다중 투여될 수 있다. 상기한 요소들을 모두 고려하여 부작용 없이 최소한의 양으로 최대 효과를 얻을 수 있는 양을 투여하는 것이 중요하며, 이는 당업자에 의하여 용이하게 결정될 수 있다. 또한, 상기 약제학적 조성물은 단독으로, 또는 수술, 방사선 치료, 호르몬 치료, 화학치료 및 생물학적 반응 조절제를 사용하는 방법들과 병용하여 사용될 수 있다.
본 개시의 일 구현예에 있어서, 상기 조성물은 비만 예방 또는 개선용 식품 조성물이다.
상기 “예방”은 본 개시의 조성물의 투여에 의해 비만을 억제시키거나 또는 지연시키는 모든 행위를 의미한다. 상기 “개선”은 상기 조성물의 투여로 비만이 호전되거나 이롭게 변경되는 모든 행위를 의미한다.
상기 “식품”은 육류, 소시지, 빵, 초콜릿, 캔디류, 스낵류, 과자류, 피자, 라면, 기타 면류, 껌류, 아이스크림류를 포함한 낙농제품, 각종 스프, 음료수, 차, 드링크제, 알코올음료, 비타민 복합제, 건강 기능(성) 식품 및 건강 식품 등이 있으며, 통상적인 의미에서의 식품을 모두 포함한다.
상기 건강 기능(성) 식품(functional food)이란, 특정보건용 식품(food for special health use, FOSHU)과 동일한 용어로, 영양 공급 외에도 생체조절기능이 효율적으로 나타나도록 가공된 의학, 의료효과가 높은 식품을 의미한다. 여기서 기능(성)이라 함은 인체의 구조 및 기능에 대하여 영양소를 조절하거나 생리학적 작용 등과 같은 보건용도에 유용한 효과를 얻는 것을 의미한다. 상기 건강 식품(health food)은 일반식품에 비해 적극적인 건강유지나 증진 효과를 가지는 식품을 의미하고, 건강보조식품(health supplement food)은 건강보조 목적의 식품을 의미한다. 경우에 따라, 건강 기능 식품, 건강 식품, 건강 보조 식품의 용어는 혼용된다.
상기 식품은 당 업계에서 통상적으로 사용되는 방법에 의하여 제조가능하며, 상기 제조시에는 당 업계에서 통상적으로 첨가하는 원료 및 성분을 첨가하여 제조할 수 있다. 또한 상기 식품의 제형 또한 식품으로 인정되는 제형이면 제한 없이 제조될 수 있다. 본 발명의 식품용 조성물은 다양한 형태의 제형으로 제조될 수 있으며, 일반 약품과는 달리 식품을 원료로 하여 약품의 장기 복용 시 발생할 수 있는 부작용 등이 없는 장점이 있고, 휴대성이 뛰어나, 본 발명의 식품은 비만의 예방 또는 개선의 효과를 증진시키기 위한 보조제로 섭취가 가능하다.
본 개시의 일 구현예에 있어서, 상기 조성물은 비만 예방, 개선용 사료 조성물이다.
상기 “사료”는 가축이 먹고, 섭취하며, 소화시키기 위한 또는 이에 적당한 임의의 천연 또는 인공 규정식, 한끼식 등 또는 상기 한끼식의 성분을 의미한다. 상기 사료는 사료 첨가제 또는 보조사료를 포함할 수 있다. 상기 사료의 종류는 특별히 제한되지 않으며, 당해 기술 분야에서 통상적으로 사용되는 사료를 사용할 수 있다. 상기 사료의 비제한적인 예로는, 곡물류, 근과류, 식품 가공 부산물류, 조류, 섬유질류, 제약 부산물류, 유지류, 전분류, 박류 또는 곡물 부산물류 등과 같은 식물성 사료; 단백질류, 무기물류, 유지류, 광물성류, 유지류, 단세포 단백질류, 동물성 플랑크톤류 또는 음식물 등과 같은 동물성 사료를 들 수 있다. 이들은 단독으로 사용되거나 2종 이상을 혼합하여 사용될 수 있다.
본 개시의 일 구현예에 있어서, 상기 녹차 추출물은 녹차를 75 내지 100℃의 스팀을 1 내지 2 kgf/cm2의 압력으로 1 내지 7시간 동안 처리하는 고온처리 단계를 포함하여 얻어진 것이다.
다른 측면에서, 본 개시는 녹차를 75 내지 100℃의 스팀을 1 내지 2 kgf/cm2의 압력으로 1 내지 7시간 동안 처리하는 고온처리 단계를 포함하는, 제1항 내지 제12항 중 한 항에 따른 조성물의 제조방법을 제공한다.
본 개시의 일 구현예에 있어서, 상기 고온처리 단계 이전에, 녹차에 물 및 C1 내지 C4의 알코올 중 어느 하나 이상을 가하고 50 내지 65℃에서 30분 내지 4시간 동안 추출하여 제1 녹차 추출물을 수득하는 단계를 더 포함할 수 있으며, 추출 후 여과 및 감압농축시켜서 제1 녹차 추출물을 수득하는 단계를 더 포함할 수 있다. 상기 추출 후 여과 및 감압하여 상기 물 및 C1 내지 C4의 알코올 중 어느 하나 이상을 제거하는 단계를 더 포함할 수 있다.
상기 C1 내지 C4의 알코올은 에탄올일 수 있다. 다른 측면에서 상기 알코올은 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상 또는 70% 이상의 에탄올일 수 있다. 또 다른 측면에서 상기 알코올은 70% 이하, 60% 이하, 50% 이하, 40% 이하 또는 30% 이하의 에탄올일 수 있다.
본 개시의 일 구현예에 있어서, 상기 제1 녹차 추출물을 수득하는 단계의 추출 온도는 50℃ 이상, 55℃ 이상, 60℃ 이상, 62℃ 이상, 64℃ 이상; 65℃ 이하, 62℃ 이하, 60℃ 이하, 55℃ 이하, 52℃ 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 제1 녹차 추출물을 수득하는 단계의 추출 시간은 30분 이상, 40분 이상, 50분 이상, 60분 이상, 70분 이상, 80분 이상, 90분 이상, 100분 이상, 120분 이상, 140분 이상, 160분 이상, 180분 이상, 200분 이상, 220분 이상; 240분 이하, 220분 이하, 200분 이하, 180분 이하, 160분 이하, 140분 이하, 120분 이하, 100분 이하, 90분 이하, 80분 이하, 70분 이하, 60분 이하, 50분 이하, 40분 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 고온처리 단계의 스팀 온도는 75 내지 100℃이다. 보다 구체적으로, 75℃ 이상; 100℃ 이하, 98℃ 이하, 95℃ 이하, 90℃ 이하, 85℃ 이하, 80℃ 이하 또는 75℃ 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 고온처리 단계의 스팀 압력은 1 내지 2 kgf/cm2이다. 보다 구체적으로, 1 kgf/cm2 이상, 1.2 kgf/cm2 이상, 1.4 kgf/cm2 이상 또는 1.5 kgf/cm2 이상; 2 kgf/cm2 이하, 1.8 kgf/cm2이하, 1.7 kgf/cm2 이하 또는 1.5 kgf/cm2 이하일 수 있다.
본 개시의 일 구현예에 있어서, 상기 고온처리 단계는 교반을 수반할 수 있으며, 상기 고온처리 단계의 교반 시간은 1시간 이상, 2시간 이상, 3시간 이상, 4시간 이상 또는 5시간 이상; 7시간 이하, 6시간 이하 또는 5시간 이하일 수 있으나, 이에 제한되는 것은 아니다.
본 개시의 일 구현예에 있어서, 상기 고온처리 단계 이후에 여과 및 감압농축 시키는 단계를 더 포함할 수 있다.
다른 하나의 양태로서, 본 개시는 체지방 감소용 조성물을 제조하는 데 있어서의 갈로카테킨 갈레이트를 함유하는 녹차 추출물의 용도를 제공한다.
다른 하나의 양태로서, 본 개시는 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 조성물을 이를 필요로 하는 개체에 적용하는 단계를 포함하는, 체지방 감소 방법을 제공한다.
다른 하나의 양태로서, 본 개시는 체지방 감소에 사용하기 위한 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 제공한다.
{실시예}
이하, 본 개시를 실시예에 의하여 상세히 설명한다. 다만, 하기 실시예는 본 개시의 전반적인 이해를 돕기 위한 예시일 뿐, 본 개시의 내용이 하기 실시예에 한정되는 것은 아니다.
<제조예 1> 일반 녹차 추출물, 후발효 녹차 추출물 및 고온처리 녹차 추출물의 제조
1. 일반 녹차 추출물(green tea extract, GTE)의 제조
100g의 녹차(Camellia sinensis, 제주 오설록 농장)에 50% 에탄올 1000ml를 가하여 60에서 1시간 환류 교반하였다. 상기 시료의 온도를 실온으로 낮추고 여과하여 얻은 용액을 감압증류하여 진한 갈색분말의 일반 고시형 녹차 추출물(green tea extract, GTE) 23g을 수득하였다(수율 23%).
2. 후발효 녹차 추출물(fermented green tea extract, FGT)의 제조
100g의 녹차(Camellia sinensis, 제주 오설록 농장)에 물을 첨가하여 수분 함량을 40 중량%으로 조정하였다. 여기에 바실러스 서브틸리스 (Bacillus Subtilis) 5×106cfu/g을 접종하고, 50℃에서 3일간 발효시킨 후 80℃에서 4일간 발효시켰다. 발효된 녹차를 80℃의 열풍으로 수분 함량 4중량% 내지 6중량%까지 건조한 후, 10℃에서 100일간 숙성하여 후발효 녹차를 제조하였다. 상기 후발효 녹차 1 kg을 50%(v/v) 에탄올 용액 15 L에 침지하여 70℃에서 3시간 동안 환류한 후, 상온에서 12시간 추출하였다. 추출액을 여과하여 진공 상태로 감압농축하고 동결 건조하여 분말 형태의 후발효 녹차 추출물(fermented green tea extract, FGT)을 제조하였다. 수율은 15~20%이었으며, 조제된 분말은 사용 전까지 4℃에서 보관하였다.
3. 고온처리 녹차 추출물(heat-transformed green tea extract, HTGT)의 제조
고온처리 녹차 추출물을 제조하기 위하여, 100g의 녹차(Camellia sinensis, 제주 오설록 농장)에 50% 에탄올 1000ml를 가하여 60℃에서 1시간 환류 교반하고 여과 및 감압증류하여 제1 녹차 추출물을 수득하였다. 상기 제1 녹차 추출물을 농축한 다음 75℃ 온도의 스팀 1.5 kgf/cm2에서 5시간 동안 교반시켰다. 이후 온도를 실온으로 낮추고 불용성 물질을 여과하고 감압농축하여 고온처리 녹차 추출물(heat-transformed green tea extract, HTGT) 10g을 수득하였다. 이 때, 교반 시간대 1~7시간 별로 얻은 상기 고온처리 녹차 추출물에 대해 하기 시험예 1에서와 같은 성분 분석을 수행하였고, 5시간 째에 열에 의한 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 갈로카테킨 갈레이트(gallocatechin gallate, GCG)로의 전환이 가장 많으면서, 8종의 총 카테킨의 양도 더 이상 줄어들지 않음을 확인하여, 교반 시간을 5시간으로 설정하였다.
<시험예 1> 녹차 추출물의 성분 분석
1. 분석 방법
제조예 1에서 제조한 녹차 추출물(일반 녹차 추출물, 후발효 녹차 추출물 및 고온처리 녹차 추출물)을 0.45㎛ PVDF 필터에 여과, 전처리 후 분석 기기(HPLC)에 주입하였다. 분석에 사용된 용매는 HPLC급 시약을 사용하였으며, 데이터 처리는 워터스(Waters) 사의 Empower II 프로그램을 사용하여 성분 분석을 수행하였다. 분석 기기의 조건은 하기 표 1에 나타내었다.
| 컬럼 | Thermofisher C18 5um, 4.6 × 250mm |
| 디텍터 | UV 280nm |
| 희석 | A-0.1% TFA (Trifluoro acetic acid) in water B-5% 아세토나이트릴(Acetonitrile, ACN) |
| 그래디언트 프로파일 (Gradient profile) | 0~29 min A(90) : B(10) 30~41 min A(85) : B(15) 42~43 min A(80) : B(20) 44~48 min A(5) : B(95) 49~50 min A(90) : B(10) |
| 속도 (Flow rate) | 1ml/min |
| 주입량 (Injection volume) | 20μl |
2. 분석 결과
상기 측정 결과 스펙트럼을 표 2에 나타내었다. C는 카테킨, EC는 에피카테킨, GC는 갈로카테킨, EGC는 에피갈로카테킨, CG는 카테킨 갈레이트, ECG는 에피카테킨 갈레이트, GCG는 갈로카테킨 갈레이트, EGCG는 에피갈로카테킨 갈레이트를 의미한다. 단위는 모두 녹차 추출물 전체 중량 대비 해당 물질의 중량%이다.
| 구분 | 카페인 | C | EC | GC | EGC | CG | ECG | GCG | EGCG | 에피 카테킨 | 에피 카테킨 에피머 | 총 카테킨 |
| GTE | 3.2 | 0.2 | 3.9 | 0.6 | 13.0 | N.D | 3.4 | 0.3 | 19.0 | 39.3 | 1.1 | 40.4 |
| FGT | 4.3 | N.D | 0.8 | N.D | 1.8 | 0.3 | 1.6 | 3.0 | 5.7 | 9.3 | 3.3 | 13.2 |
| HTGT | 3.9 | 1.6 | 1.0 | 4.9 | 3.6 | 1.3 | 1.3 | 5.6 | 5.3 | 11.2 | 13.4 | 24.6 |
상기 표 2로부터, 고온처리 녹차 추출물(HTGT)의 조성은 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)의 조성과 다르다는 것을 확인하였다. 구체적으로, 고온처리 녹차 추출물(HTGT)의 경우, 일반 녹차 추출물(GTE)에 비하여 EGC의 함량(3.6 중량%)이 낮았다. 또한, 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)에 비하여 EGCG의 함량(5.3 중량%)이 낮고, 총 카테킨 함량(24.6 중량%)이 낮았으며, 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)에서는 검출되지 않은 성분인 3종의 에피카테킨 에피머가 추가로 생성되는 것을 확인할 수 있었다.
표 2에서 나타난 바와 같이, 녹차 추출물, 후발효 녹차 추출물, 고온처리 녹차 추출물은 총 카테킨 함량(녹차 추출물 40.4 중량%, 후발효 녹차 추출물 13.2 중량%, 고온처리 녹차 추출물 24.6 중량%) 및 에피카테킨의 함량이 상이하고 (녹차 추출물 39.3 중량%, 후발효 녹차 추출물 9.9 중량%, 고온처리 녹차 추출물 11.2 중량%), 고온처리 녹차 추출물의 주요 효능 성분인 EGCG 및 GCG의 함량 비율 역시 19.0:0.3 (녹차 추출물), 5.7:3.0 (후발효 녹차 추출물), 5.3:5.6 (고온처리 녹차 추출물)로 완전히 상이한 것으로 나타났다. 따라서, 상기한 3종류의 녹차 추출물 및 녹차 가공 추출물은 서로 다른 대사 효능을 보이는 독립된 소재로 보는 것이 타당하다.
<참고예 1> 지방세포의 분화
3T3-L1 생쥐 유래 지방세포주(American Type Culture Collection, ATCC)를 10% 우아혈청(bovine calf serum, BCS; HyClone), 1% 페니실린/스트렙토마이신(P/S; Sigma Aldrich)이 포함된 DMEM(Dulbecco’s Modified Eagle’s Medium; Sigma Aldrich) 배지를 이용하여 배양기에서 표준 조건(37℃, 5% CO2)으로 배양하였다. 세포 분화를 위하여, 플레이트에 세포가 100% 가득찬 뒤 48시간 후 10% 소 태아 혈청(fetal bovine serum, FBS; Hyclone), 1% P/S, 0.5 mM 3-이소부틸-1-메틸잔틴(3-isobutyl-1-methylxanthine, IBMX; Sigma Aldrich), 1 μM 덱사메타손(dexamethasone; Sigma Aldrich), 5 μg/ml 인슐린(insulin; Sigma Aldrich)이 첨가된 DMEM 배지로 갈아주고 48시간을 더 배양하였다. 이후 이틀 간격으로 10% FBS 및 5 μg/ml 인슐린, 1% P/S이 포함된 배지로 갈아주면서 10일 간 더 배양하여 지방세포 분화를 유도하였다.
<참고예 2> 유전자 발현 평가 방법
Trizol™ 시약(Thermo Fisher Scientific)을 이용하여 RNA를 추출하고, RevertAid™ 1st strand cDNA synthesis kit(Thermo Fisher Scientific)를 이용하여 cDNA를 합성하였다. Bio-Rad사의 CFX96 실시간 정량적 PCR(real-time quantitative PCR, qPCR) 기기를 이용하여 평가 대상 유전자의 발현 수준을 하우스키핑 유전자(housekeeping gene; Cyclophilin)로 정량하였다.
<시험예 2> 녹차 추출물의 지질 합성 유전자의 발현 억제 효능 평가 1
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 고온처리 녹차 추출물(HTGT)을 각각 10, 50 및 100 μg/ml(HTGT 10, HTGT 50 및 HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
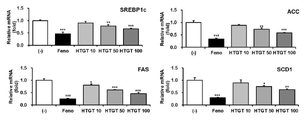
참고예 2의 방법에 따라 지방 합성 관련 유전자(SREBP1c, ACC, FAS 및 SCD-1)의 발현 수준을 정량한 결과를 도 1에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 1로부터, 대조군인 Feno 처리군에서와 같이, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 농도 의존적으로 지질 합성 유전자들의 발현을 억제하는 것으로 나타났다. 이로부터 고온처리 녹차 추출물(HTGT)을 포함하는 조성물은 우수한 지질 합성 또는 축적 억제 효능을 가짐을 확인할 수 있다.
<시험예 3> 녹차 추출물의 지질 합성 유전자의 발현 억제 효능 평가 2
상기 표 2에 나타난 바와 같이 일반 녹차 추출물(GTE)의 총 카테킨 함량은 40.4 중량%이며, 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량은 24.6 중량%이다. 이에 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정(24.6/40.4≒0.61)하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 일반 녹차 추출물(GTE)을 각각 61 및 100 μg/ml(GTE 61 및 GTE 100)로 24시간 처리하고, 한편 고온처리 녹차 추출물(HTGT)을 100 μg/ml(HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
참고예 2의 방법에 따라 지방 합성 관련 유전자(SREBP1c, ACC 및 FAS)의 발현 수준을 정량한 결과를 도 2에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 2로부터, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지질 합성 유전자들의 발현을 억제하는 것으로 나타났다. 또한, 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정할 경우, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 더욱 우수하게 지질 합성 유전자들의 발현을 억제하는 것으로 나타났다.
<시험예 4> 녹차 추출물의 지질 합성 또는 축적 억제 효능 평가
1. 평가 방법
고온처리 녹차 추출물(HTGT)에 의한 지질 합성 관련 유전자들의 발현 억제가 실제 지방 합성 및 축적에 관여할 수 있는지 알아보기 위하여, 참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 고온처리 녹차 추출물(HTGT)을 각각 10, 50 및 100 μg/ml(HTGT 10, HTGT 50 및 HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
이후 세포를 인산완충생리식염수(Phosphate-buffered Saline, PBS; Sigma Aldrich)으로 2번 세척 후 포르말린(Formalin) 용액(Sigma Aldrich)으로 고정시켰다. 15분 후 다시 PBS로 2번 세척 후 300 nM 나일-레드(Nile-red) 용액(Sigma Aldrich)을 이용하여 세포 내 축적된 중성지방을 염색하였다. 30분 후 다시 PBS로 3회 세척 후 형광현미경으로 세포를 관찰하였다. 지질의 양을 나타낸 이미지 및 이를 정량화 한 그래프를 도 3에 나타내었다.
2. 평가 결과
도 3으로부터, 본 개시의 고온처리 녹차 추출물(HTGT)은 농도 의존적으로 지방세포 내에서 지질이 합성 또는 축적되는 것을 억제하는 효능을 가지는 것으로 확인되었다.
<시험예 5> 녹차 추출물 성분의 지질 합성 또는 축적 억제 효능 평가
녹차 추출물의 성분 중 갈로카테킨 갈레이트(GCG) 및 에피갈로카테킨 갈레이트(EGCG)의 함량비에 따른 지질 합성 또는 축적 억제 효능을 비교하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 갈레이트(epigallocatechin gallate, EGCG) 및 갈로카테킨 갈레이트(gallocatechin gallate, GCG)를 중량을 기준으로 10:0 내지 0:10(10:0, 8:2, 6:4, 5:5, 4:6, 2:8, 0:10)으로 24시간 처리하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
이후 세포를 인산완충생리식염수(Phosphate-buffered Saline, PBS; Sigma Aldrich)으로 2번 세척 후 포르말린(Formalin) 용액(Sigma Aldrich)으로 고정시켰다. 15분 후 다시 PBS로 2번 세척 후 300 nM 나일-레드(Nile-red) 용액(Sigma Aldrich)을 이용하여 세포 내 축적된 중성지방을 염색하였다. 30분 후 다시 PBS로 3회 세척 후 형광현미경으로 세포를 관찰하였다. 지질의 양을 정량화 한 그래프를 도 4에 나타내었다(***P< 0.001 vs. (-), **P < 0.01 vs. (-), &&&P < 0.001 vs. GCG 100% (0:10), &&P < 0.01 vs. GCG 100% (0:10), &P < 0.05 vs. GCG 100% (0:10)).
2. 평가 결과
도 4로부터, 본 개시의 고온처리 녹차 추출물(HTGT)의 성분 중 갈로카테킨 갈레이트(GCG) 및 에피갈로카테킨 갈레이트(EGCG)의 함량비가 6:4 및 4:6 사이일 경우 지질 합성 또는 축적 억제 효능이 우수한 것으로 확인되었다.
<시험예 6> 녹차 추출물의 지방산 산화 유전자의 발현 증가 효능 평가 1
본 개시의 고온처리 녹차 추출물(HTGT)의 처리 농도에 따른 지방산 산화 유전자들의 발현 증가 효능을 확인하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 고온처리 녹차 추출물(HTGT)을 각각 10, 50 및 100 μg/ml(HTGT 10, HTGT 50 및 HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
Trizol™ 시약(Thermo Fisher Scientific)을 이용하여 RNA를 추출하고, RevertAid™ 1st strand cDNA synthesis kit(Thermo Fisher Scientific)를 이용하여 cDNA를 합성하였다. Bio-Rad사의 CFX96 실시간 정량적 PCR(real-time quantitative PCR, qPCR) 기기를 이용하여 지방산 산화 관련 유전자(ACO, CPT1 및 mCAD)의 발현 수준을 하우스키핑 유전자(housekeeping gene; Cyclophilin)로 정량하였다. 그 결과를 도 5에 나타내었다(***P<0.001 vs. (-), **P<0.01 vs. (-), *P<0.05 vs. (-)).
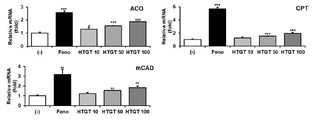
2. 평가 결과
도 5로부터, 대조군인 Feno 처리군에서와 같이, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 농도 의존적으로 지방산 산화 유전자들의 발현을 증가시키는 것으로 나타났다. 이로부터 고온처리 녹차 추출물(HTGT)을 포함하는 조성물은 우수한 지방산 산화 효능을 가짐을 예상할 수 있다.
<시험예 7> 녹차 추출물의 지방산 산화 유전자의 발현 증가 효능 평가 2
본 개시의 고온처리 녹차 추출물(HTGT)과 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)의 지방산 산화 유전자들의 발현 증가 효능을 비교하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 일반 녹차 추출물(GTE), 후발효 녹차 추출물(FGT), 고온처리 녹차 추출물(HTGT)을 각각 100 μg/ml(GTE 100, FGT 100 및 HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 100 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
참고예 2의 방법에 따라 지방산 산화 관련 유전자(PGC-1α, ACO 및 CPT1)의 발현 수준을 정량한 결과를 도 6에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
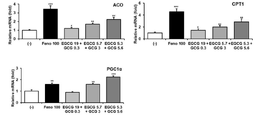
2. 평가 결과
도 6으로부터, 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지방산 산화 유전자들의 발현을 우수하게 증가시키는 것으로 나타났다. 이로부터 고온처리 녹차 추출물(HTGT)을 포함하는 조성물은 우수한 지방산 산화 효능을 가짐을 확인할 수 있다.
<시험예 8> 녹차 추출물 성분의 지방산 산화 유전자의 발현 증가 효능 평가 3
녹차 추출물의 성분 중 갈로카테킨 갈레이트(GCG) 및 에피갈로카테킨 갈레이트(EGCG)의 함량 내지 함량비에 따른 지방산 산화 유전자들의 발현 증가 효능을 비교하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 일반 녹차 추출물(GTE), 후발효 녹차 추출물(FGT), 고온처리 녹차 추출물(HTGT)의 갈로카테킨 갈레이트(gallocatechin gallate, GCG) 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 성분 함량을 나타낸 상기 표 2에 따라서, GTE 및 EGCG를 24시간 처리하였다(GTE: GCG 0.3 중량%, EGCG 19.0 중량%; FGT: GCG 3.0 중량%, EGCG 5.7 중량%; HTGT: GCG 5.6 중량%, EGCG 5.3 중량%). 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 100 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
참고예 2의 방법에 따라 지방산 산화 관련 유전자(PGC-1α, ACO 및 CPT1)의 발현 수준을 정량한 결과를 도 7에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 7로부터, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지방산 산화 유전자들의 발현을 우수하게 증가시키는 것으로 나타난 상기 시험예 7의 결과는 본 개시의 고온처리 녹차 추출물(HTGT)의 갈로카테킨 갈레이트(gallocatechin gallate, GCG) 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 함량 내지 함량비에 기인하는 것으로 예상할 수 있다.
<시험예 9> 녹차 추출물의 지방산 산화 유전자의 발현 증가 효능 평가 3
상기 표 2에 나타난 바와 같이 일반 녹차 추출물(GTE)의 총 카테킨 함량은 40.4 중량%이며, 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량은 24.6 중량%이다. 이에 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정(24.6/40.4≒0.61)하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 일반 녹차 추출물(GTE)을 각각 61 및 100 μg/ml(GTE 61 및 GTE 100)로 24시간 처리하고, 한편 고온처리 녹차 추출물(HTGT)을 100 μg/ml(HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
참고예 2의 방법에 따라 지방산 산화 관련 유전자(ACO 및 CPT1)의 발현 수준을 정량한 결과를 도 8에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
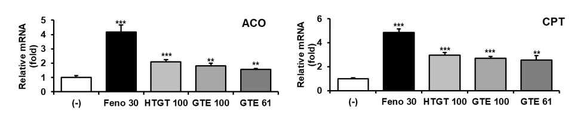
2. 평가 결과
도 8로부터, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지방산 산화 유전자들의 발현을 우수하게 증가시키는 것으로 나타났다. 또한, 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정할 경우, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 더욱 우수하게 지방산 산화 유전자들의 발현을 증가시키는 것으로 나타났다.
<시험예 10> 녹차 추출물의 중성지방 분해 촉진 효능 평가
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 고온처리 녹차 추출물(HTGT)을 각각 10, 50 및 100 μg/ml(HTGT 10, HTGT 50 및 HTGT 100)로 4시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 분해 유도 물질인 3-이소부틸-1-메틸잔틴(3-isobutyl-1-methylxanthine, IBMX 500 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
중성지방 분해 산물로 생성된 글리세롤(Glycerol)의 양을 글리세롤 시약(glycerol reagent, Sigma Aldrich)을 이용하여 정량하는 방식으로 지방 분해 정도를 측정하였다. 그 결과를 도 9에 나타내었다(***P<0.001 vs. (-)).
2. 평가 결과
도 9로부터, 대조군인 IBMX 처리군에서와 같이, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 농도 의존적으로 지방세포 내에서 중성지방의 분해를 촉진시키는 효능을 갖는 것을 확인할 수 있었다.
<시험예 11> 녹차 추출물의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가 1
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 고온처리 녹차 추출물(HTGT)을 각각 10, 50 및 100 μg/ml(HTGT 10, HTGT 50 및 HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
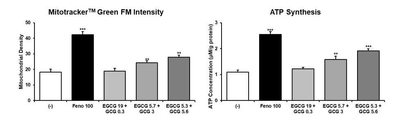
이어서, MitoTrackerTM Green FM (Invitrogen by Thermo Fisher Scientific) dye를 사용하여 미토콘드리아를 염색한 후 형광값을 측정하여 정량하였다. 한편 미토콘드리아 수 증가에 따른 에너지 생성이 촉진되는지 함께 알아보기 위하여 ATP assay kit(Sigma Aldrich)을 이용하여 세포 내 ATP 양을 관찰하였다. 그 결과를 도 10에 나타내었다(***P<0.001 vs. (-), **P<0.01 vs. (-)).
2. 평가 결과
도 10으로부터, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지방세포에서 미토콘드리아의 양 내지 활성을 증가시키며, ATP의 생성을 촉진시키는 것을 확인할 수 있었다. 이로부터 본 개시의 조성물은 지방 분해 및 연소에 이은 에너지 생성을 극대화함으로써 우수한 슬리밍 효과를 발휘할 것으로 예상된다.
<시험예 12> 녹차 추출물의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가 2
본 개시의 고온처리 녹차 추출물(HTGT)과 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능을 비교하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
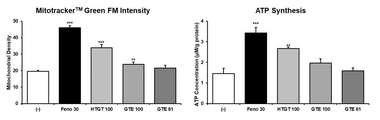
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 일반 녹차 추출물(GTE), 후발효 녹차 추출물(FGT), 고온처리 녹차 추출물(HTGT)을 각각 100 μg/ml(GTE 100, FGT 100 및 HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 100 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
이어서, MitoTrackerTM Green FM (Invitrogen by Thermo Fisher Scientific) dye를 사용하여 미토콘드리아를 염색한 후 형광값을 측정하여 정량하였다. 한편 미토콘드리아 수 증가에 따른 에너지 생성이 촉진되는지 함께 알아보기 위하여 ATP assay kit(Sigma Aldrich)을 이용하여 세포 내 ATP 양을 관찰하였다. 그 결과를 도 11에 나타내었다(***P<0.001 vs. (-), **P<0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 11로부터, 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지방세포에서 미토콘드리아의 양 내지 활성을 우수하게 증가시키며, ATP의 생성을 우수하게 촉진시키는 것을 확인할 수 있었다.
<시험예 13> 녹차 추출물 성분의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가
녹차 추출물의 성분 중 갈로카테킨 갈레이트(GCG) 및 에피갈로카테킨 갈레이트(EGCG)의 함량 내지 함량비에 따른 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능을 비교하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 일반 녹차 추출물(GTE), 후발효 녹차 추출물(FGT), 고온처리 녹차 추출물(HTGT)의 갈로카테킨 갈레이트(gallocatechin gallate, GCG) 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 성분 함량을 나타낸 상기 표 2에 따라서, GTE 및 EGCG를 24시간 처리하였다(GTE: GCG 0.3 중량%, EGCG 19.0 중량%; FGT: GCG 3.0 중량%, EGCG 5.7 중량%; HTGT: GCG 5.6 중량%, EGCG 5.3 중량%). 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 100 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
이어서, MitoTrackerTM Green FM (Invitrogen by Thermo Fisher Scientific) dye를 사용하여 미토콘드리아를 염색한 후 형광값을 측정하여 정량하였다. 한편 미토콘드리아 수 증가에 따른 에너지 생성이 촉진되는지 함께 알아보기 위하여 ATP assay kit(Sigma Aldrich)을 이용하여 세포 내 ATP 양을 관찰하였다. 그 결과를 도 12에 나타내었다(***P<0.001 vs. (-), **P<0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 12로부터, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지방세포에서 미토콘드리아의 양 내지 활성을 우수하게 증가시키며, ATP의 생성을 우수하게 촉진시키는 것으로 나타난 상기 시험예 12의 결과는 본 개시의 고온처리 녹차 추출물(HTGT)의 갈로카테킨 갈레이트(gallocatechin gallate, GCG) 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 함량 내지 함량비에 기인하는 것으로 예상할 수 있다.
<시험예 14> 녹차 추출물의 미토콘드리아의 활성 촉진 효능 및 ATP 생성 촉진 효능 평가 3
상기 표 2에 나타난 바와 같이 일반 녹차 추출물(GTE)의 총 카테킨 함량은 40.4 중량%이며, 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량은 24.6 중량%이다. 이에 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정(24.6/40.4≒0.61)하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 일반 녹차 추출물(GTE)을 각각 61 및 100 μg/ml(GTE 61 및 GTE 100)로 24시간 처리하고, 한편 고온처리 녹차 추출물(HTGT)을 100 μg/ml(HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
이어서, MitoTrackerTM Green FM (Invitrogen by Thermo Fisher Scientific) dye를 사용하여 미토콘드리아를 염색한 후 형광값을 측정하여 정량하였다. 한편 미토콘드리아 수 증가에 따른 에너지 생성이 촉진되는지 함께 알아보기 위하여 ATP assay kit(Sigma Aldrich)을 이용하여 세포 내 ATP 양을 관찰하였다. 그 결과를 도 13에 나타내었다(***P<0.001 vs. (-), **P<0.01 vs. (-)).
2. 평가 결과
도 13으로부터, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 지방세포에서 미토콘드리아의 양 내지 활성을 증가시키며, ATP의 생성을 촉진시키는 것으로 나타났다. 또한, 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정할 경우, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 더욱 우수하게 미토콘드리아의 양 내지 활성을 증가시키며, ATP의 생성을 촉진시키는 것으로 나타났다.
<시험예 15> 녹차 추출물 성분의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 1
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 고온처리 녹차 추출물(HTGT) 에 특히 많이 함유된 것으로 나타난(표 2) 갈로카테킨 갈레이트(gallocatechin gallate, GCG)를 각각 0.1, 1, 5, 10 및 20 μM로 24시간 처리하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
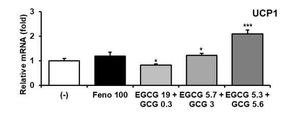
참고예 2의 방법에 따라 갈색 지방세포 관련 마커인 Ucp1(uncoupling protein 1, 짝풀림 단백질 1), Cidea(cell death-inducing DFFA-like effector a), Cox8b(cytochrome c oxidase subunit 8B), Dio2(iodothyronine deiodinase 2), Elovl3(elongation of very long chain fatty acids), Pgc1a(peroxisome proliferator-activated receptor c coactivator 1a) 및 Prdm16(PR domain containing 16)의 발현 수준을 정량한 결과를 도 14에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 14로부터, 본 개시의 고온처리 녹차 추출물(HTGT)에 특히 많이 함유된 것으로 나타난 갈로카테킨 갈레이트(GCG)의 처리는 지방 분해에 관련된 Elovl3 및 짝풀림 단백질 1인 Ucp1의 발현을 증가시키는 것으로 나타났다. 다만 갈색 지방세포로의 분화와 관련된 Prdm16의 발현은 크게 변하지 않은 것으로 보아, GCG는 갈색 지방세포로의 분화보다는 백색 지방세포를 베이지색 지방세포화 시키는 작용을 통하여 갈색 지방세포와 유사한 역할을 하도록 하는 지방세포의 에너지 대사 전환(fat transformation), 이른바 베이지색 지방세포화 현상을 유도하는 것으로 예상된다.
<시험예 16> 녹차 추출물의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 1
본 개시의 고온처리 녹차 추출물(HTGT)과 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)의 갈색 지방세포 관련 유전자의 발현 증가 효능을 비교하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
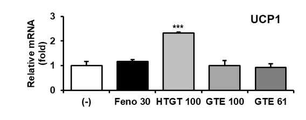
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 일반 녹차 추출물(GTE), 후발효 녹차 추출물(FGT), 고온처리 녹차 추출물(HTGT)을 각각 100 μg/ml(GTE 100, FGT 100 및 HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 100 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
참고예 2의 방법에 따라 갈색 지방세포 관련 마커인 Ucp1(uncoupling protein 1, 짝풀림 단백질 1)의 발현 수준을 정량한 결과를 도 15에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 15로부터, 일반 녹차 추출물(GTE) 및 후발효 녹차 추출물(FGT)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 짝풀림 단백질 1인 Ucp1의 발현을 우수하게 증가시키는 것으로 나타났다.
<시험예 17> 녹차 추출물 성분의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 2
녹차 추출물의 성분 중 갈로카테킨 갈레이트(GCG) 및 에피갈로카테킨 갈레이트(EGCG)의 함량 내지 함량비에 따른 갈색 지방세포 관련 유전자의 발현 증가 효능을 비교하기 위하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 일반 녹차 추출물(GTE), 후발효 녹차 추출물(FGT), 고온처리 녹차 추출물(HTGT)의 갈로카테킨 갈레이트(gallocatechin gallate, GCG) 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 성분 함량을 나타낸 상기 표 2에 따라서, GTE 및 EGCG를 24시간 처리하였다(GTE: GCG 0.3 중량%, EGCG 19.0 중량%; FGT: GCG 3.0 중량%, EGCG 5.7 중량%; HTGT: GCG 5.6 중량%, EGCG 5.3 중량%). 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 100 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
참고예 2의 방법에 따라 갈색 지방세포 관련 마커인 Ucp1(uncoupling protein 1, 짝풀림 단백질 1)의 발현 수준을 정량한 결과를 도 16에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 16으로부터, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 짝풀림 단백질 1인 Ucp1의 발현을 우수하게 증가시키는 것으로 나타난 상기 시험예 16의 결과는 본 개시의 고온처리 녹차 추출물(HTGT)의 갈로카테킨 갈레이트(gallocatechin gallate, GCG) 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)의 함량 내지 함량비에 기인하는 것으로 예상할 수 있다.
<시험예 18> 녹차 추출물의 갈색 지방세포 관련 유전자의 발현 증가 효능 평가 2
상기 표 2에 나타난 바와 같이 일반 녹차 추출물(GTE)의 총 카테킨 함량은 40.4 중량%이며, 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량은 24.6 중량%이다. 이에 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정(24.6/40.4≒0.61)하여 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 제조예 1에서 제조한 일반 녹차 추출물(GTE)을 각각 61 및 100 μg/ml(GTE 61 및 GTE 100)로 24시간 처리하고, 한편 고온처리 녹차 추출물(HTGT)을 100 μg/ml(HTGT 100)로 24시간 처리하였다. 실험 결과 확인을 위한 대조군으로는 지방 합성을 억제하고 지방산 산화를 촉진하는 페노피브레이트(fenofibrate, Feno) 30 μM을 사용하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
참고예 2의 방법에 따라 갈색 지방세포 관련 마커인 Ucp1(uncoupling protein 1, 짝풀림 단백질 1)의 발현 수준을 정량한 결과를 도 17에 나타내었다(***P < 0.001 vs. (-), **P < 0.01 vs. (-), *P < 0.05 vs. (-)).
2. 평가 결과
도 17로부터, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 짝풀림 단백질 1인 Ucp1의 발현을 우수하게 증가시키는 것으로 나타났다. 또한, 일반 녹차 추출물(GTE)의 총 카테킨 함량을 고온처리 녹차 추출물(HTGT)의 총 카테킨 함량과 동일하게 보정할 경우, 일반 녹차 추출물(GTE)의 처리에 비하여, 본 개시의 고온처리 녹차 추출물(HTGT)의 처리는 더욱 우수하게 짝풀림 단백질 1인 Ucp1의 발현을 우수하게 증가시키는 것으로 나타났다.
<시험예 19> 녹차 추출물의 지방세포 내 에너지 대사 활성 촉진 효능 평가
본 개시의 고온처리 녹차 추출물(HTGT)에 특히 많이 함유된 것으로 나타난 갈로카테킨 갈레이트(gallocatechin gallate, GCG)가 실제로 세포의 산소 호흡을 증가시킬 수 있는지 알아보기 위하여, 다음과 같은 실험을 수행하였다.
1. 평가 방법
참고예 1에서와 같이 분화가 완료된 지방세포에 고온처리 녹차 추출물(HTGT)에 특히 많이 함유된 것으로 나타난(표 2) 갈로카테킨 갈레이트(gallocatechin gallate, GCG)를 20 μM로 24시간 처리하였다. 음성 대조군으로서 비히클(증류수)을 처리하였다.
이어서, XF 분석기(XF Analyzer, Agilent, 산타클라라, 캘리포니아주, 미국)를 이용하여 산소 농도 및 산소 소비율(oxygen consumption rate, OCR)을 측정하였다. 보다 구체적으로, 올리고마이신 A(oligomycin A) 1.5μM, 카르보닐 시아나이드 p-(트리플루오로메톡시)페닐히드라존(carbonyl cyanide p-(trifluoromethoxy)phenylhydrazone, FCCP) 1.5μM, 및 로테논/안티마이신 A(rotenone/antimycin A) 각 0.5μM을 A, B, C 각 시점에 차례로 주입하였다.
OCR은 단백질 농도에 따라 표준화되었다. 시간에 따른 OCR, ATP 생성량(ATP production), 양성자 누출(Proton Leak)을 도 18에 나타내었다(***P < 0.001, ** P < 0.01, * P < 0.05).
2. 평가 결과
도 18로부터, 갈로카테킨 갈레이트(GCG)의 처리는 미토콘드리아 활성을 조절하는 다양한 약물(올리고마이신, FCCP, 로테논/안티마이신 A)의 처리 여부에 관계 없이 OCR이 증가하며, 이러한 세포 호흡의 결과로 에너지 생성 (ATP production) 및 에너지 짝풀림(Proton Leak)이 모두 증가하는 것을 알 수 있다. 이로부터 갈로카테킨 갈레이트(GCG)의 처리는 지방세포에서 실제로 산소 호흡을 증가시키는 것을 확인할 수 있었다.
이하, 본 발명에 따른 조성물의 제형예를 설명하나, 약제학적 조성물 및 식품 조성물은 여러 가지 제형으로 응용 가능하며, 이는 본 발명을 한정하고자 함이 아닌 단지 구체적으로 설명하고자 함이다.
[제형예 1] 환제의 제조
하기 표 3에 기재된 조성에 따라 통상적인 방법으로 환제를 제조하였다.
| 성분 | 함량(중량%) |
| 고온처리 녹차 추출물(HTGT) | 24 |
| 옥수수전분 | 30 |
| 글리세린 | 20 |
| 솔비톨 분말 | 26 |
[제형예 2] 정제의 제조
하기 표 4에 기재된 조성에 따라 통상적인 방법으로 정제를 제조하였다.
| 성분 | 함량(중량%) |
| 고온처리 녹차 추출물(HTGT) | 24 |
| 유당 | 20.5 |
| 덱스트린 | 20 |
| 말티톨 분말 | 20 |
| 자일리톨 분말 | 13 |
| 슈거 에스테르(sugar ester) | 2.5 |
[제형예 3] 과립제의 제조
하기 표 5에 기재된 조성에 따라 통상적인 방법으로 과립제를 제조하였다.
| 성분 | 함량(중량%) |
| 고온처리 녹차 추출물(HTGT) | 24 |
| 자일리톨 | 11 |
| 이소말트 | 65 |
[제형예 4] 주사제의 제조
하기 표 6에 기재된 조성에 따라 통상적인 방법으로 주사제를 제조하였다.
| 성분 | 함량(mg) |
| 고온처리 녹차 추출물(HTGT) | 8~40 |
| 주사용 멸균 증류수 | 적량 |
| pH 조절제 | 적량 |
[제형예 5] 드링크제의 제조
하기 표 7에 기재된 조성에 따라 통상적인 방법으로 드링크제를 제조하였다.
| 성분 | 함량(g) |
| 고온처리 녹차 추출물(HTGT) | 0.08 |
| 포도당 | 10 |
| 구연산 | 2 |
| 정제수 | 188 |
다양한 양태에서, 본 개시는 적어도 하기 양태에 관한 것이며, 적어도 하기 양태를 포함한다.
[양태 1] 추출물의 총 중량을 기준으로 4 중량% 이상의 갈로카테킨 갈레이트(gallocatechin gallate, GCG)를 함유하는 녹차 추출물을 유효성분으로 포함하는, 체지방 감소용 조성물.
[양태 2] 양태 1에 있어서, 상기 녹차 추출물은 상기 갈로카테킨 갈레이트를 추출물의 총 중량을 기준으로 4 중량% 내지 15 중량%의 함량으로 함유하는, 조성물.
[양태 3] 양태 1 또는 양태 2에 있어서, 상기 녹차 추출물은 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)를 추출물의 총 중량을 기준으로 4 중량% 내지 15 중량%의 함량으로 함유하는, 조성물.
[양태 4] 양태 1 내지 양태 3 중 하나의 양태에 있어서, 상기 녹차 추출물은 에피갈로카테킨 갈레이트 및 갈로카테킨 갈레이트를 1 : 0.33 내지 3의 중량비로 함유하는, 조성물.
[양태 5] 양태 1 내지 양태 4 중 하나의 양태에 있어서, 상기 녹차 추출물은 카테킨(catechin, C), 에피카테킨(epicatechin, EC), 갈로카테킨(gallocatechin, GC), 에피갈로카테킨(epigallocatechin, EGC), 카테킨 갈레이트(catechin gallate, CG), 에피카테킨 갈레이트(epicatechin gallate, ECG), 갈로카테킨 갈레이트(gallocatechin gallate, GCG), 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)를 추출물의 총 중량을 기준으로 19 내지 30 중량%의 함량으로 함유하는, 조성물.
[양태 6] 양태 1 내지 양태 5 중 하나의 양태에 있어서, 상기 조성물은 지방세포 내 중성지방 분해 촉진용 조성물인, 조성물.
[양태 7] 양태 1 내지 양태 6 중 하나의 양태에 있어서, 상기 유효성분은 PGC-1α, ACO, CPT1 및 mCAD로 이루어진 군으로부터 선택되는 하나 이상의 지방산 산화 유전자의 발현을 증가시키는, 조성물.
[양태 8] 양태 1 내지 양태 7 중 하나의 양태에 있어서, 상기 조성물은 지방세포의 크기를 감소시키는, 조성물.
[양태 9] 양태 1 내지 양태 8 중 하나의 양태에 있어서, 상기 조성물은 지방세포 내 중성지방 합성 또는 축적 억제용 조성물인, 조성물.
[양태 10] 양태 1 내지 양태 9 중 하나의 양태에 있어서, 상기 유효성분은 SREBP1c, ACC, FAS 및 SCD-1로 이루어진 군으로부터 선택되는 하나 이상의 지질 합성 유전자의 발현을 억제하는, 조성물.
[양태 11] 양태 1 내지 양태 10 중 하나의 양태에 있어서, 상기 조성물은 지방세포 내 미토콘드리아의 활성 촉진용 조성물인, 조성물.
[양태 12] 양태 1 내지 양태 11 중 하나의 양태에 있어서, 상기 조성물은 기초 대사량 증가용 조성물인, 조성물.
[양태 13] 양태 1 내지 양태 12 중 하나의 양태에 있어서, 상기 조성물은 백색 지방세포의 베이지색 지방세포화를 유도하는, 조성물.
[양태 14] 양태 1 내지 양태 13 중 하나의 양태에 있어서, 상기 조성물은 비만 예방, 개선 또는 치료용 약제학적 조성물인, 조성물.
[양태 15] 양태 1 내지 양태 14 중 하나의 양태에 있어서, 상기 조성물은 비만 예방 또는 개선용 식품 조성물인, 조성물.
[양태 16] 양태 1 내지 양태 15 중 하나의 양태에 있어서, 상기 녹차 추출물은 녹차를 75 내지 100℃의 스팀을 1 내지 2 kgf/cm2의 압력으로 1 내지 7시간 동안 처리하는 고온처리 단계를 포함하여 얻어진 것인, 조성물.
[양태 17] 녹차를 75 내지 100℃의 스팀을 1 내지 2 kgf/cm2의 압력으로 1 내지 7시간 동안 처리하는 고온처리 단계를 포함하는, 제1항 내지 제13항 중 한 항에 따른 조성물의 제조방법.
본 발명이 상기 언급된 바람직한 실시예와 관련하여 설명되었지만, 발명의 요지와 범위로부터 벗어남이 없이 다양한 수정이나 변형을 하는 것이 가능하다. 따라서 첨부된 청구범위에는 본 발명의 요지에 속하는 한 이러한 수정이나 변형이 포함될 것이다.
Claims (17)
- 추출물의 총 중량을 기준으로 4 중량% 이상의 갈로카테킨 갈레이트(gallocatechin gallate, GCG)를 함유하는 녹차 추출물을 유효성분으로 포함하는, 체지방 감소용 조성물.
- 제1항에 있어서,
상기 녹차 추출물은 상기 갈로카테킨 갈레이트를 추출물의 총 중량을 기준으로 4 중량% 내지 15 중량%의 함량으로 함유하는, 조성물. - 제1항에 있어서,
상기 녹차 추출물은 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)를 추출물의 총 중량을 기준으로 4 중량% 내지 15 중량%의 함량으로 함유하는, 조성물. - 제1항에 있어서,
상기 녹차 추출물은 에피갈로카테킨 갈레이트 및 갈로카테킨 갈레이트를 1 : 0.33 내지 3의 중량비로 함유하는, 조성물. - 제1항에 있어서,
상기 녹차 추출물은 카테킨(catechin, C), 에피카테킨(epicatechin, EC), 갈로카테킨(gallocatechin, GC), 에피갈로카테킨(epigallocatechin, EGC), 카테킨 갈레이트(catechin gallate, CG), 에피카테킨 갈레이트(epicatechin gallate, ECG), 갈로카테킨 갈레이트(gallocatechin gallate, GCG), 및 에피갈로카테킨 갈레이트(epigallocatechin gallate, EGCG)를 추출물의 총 중량을 기준으로 19 내지 30 중량%의 함량으로 함유하는, 조성물. - 제1항에 있어서,
상기 조성물은 지방세포 내 중성지방 분해 촉진용 조성물인, 조성물. - 제1항에 있어서,
상기 유효성분은 PGC-1α, ACO, CPT1 및 mCAD로 이루어진 군으로부터 선택되는 하나 이상의 지방산 산화 유전자의 발현을 증가시키는, 조성물. - 제1항에 있어서,
상기 조성물은 지방세포의 크기를 감소시키는, 조성물. - 제1항에 있어서,
상기 조성물은 지방세포 내 중성지방 합성 또는 축적 억제용 조성물인, 조성물. - 제1항에 있어서,
상기 유효성분은 SREBP1c, ACC, FAS 및 SCD-1로 이루어진 군으로부터 선택되는 하나 이상의 지질 합성 유전자의 발현을 억제하는, 조성물. - 제1항에 있어서,
상기 조성물은 지방세포 내 미토콘드리아의 활성 촉진용 조성물인, 조성물. - 제1항에 있어서,
상기 조성물은 기초 대사량 증가용 조성물인, 조성물. - 제1항에 있어서,
상기 조성물은 백색 지방세포의 베이지색 지방세포화를 유도하는, 조성물. - 제1항 내지 제13항 중 한 항에 있어서, 상기 조성물은 비만 예방, 개선 또는 치료용 약제학적 조성물인, 조성물.
- 제1항 내지 제13항 중 한 항에 있어서, 상기 조성물은 비만 예방 또는 개선용 식품 조성물인, 조성물.
- 제1항에 있어서,
상기 녹차 추출물은 녹차를 75 내지 100℃의 스팀을 1 내지 2 kgf/cm2의 압력으로 1 내지 7시간 동안 처리하는 고온처리 단계를 포함하여 얻어진 것인, 조성물. - 녹차를 75 내지 100℃의 스팀을 1 내지 2 kgf/cm2의 압력으로 1 내지 7시간 동안 처리하는 고온처리 단계를 포함하는, 제1항 내지 제13항 중 한 항에 따른 조성물의 제조방법.
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020210003451A KR20220101432A (ko) | 2021-01-11 | 2021-01-11 | 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법 |
| US17/570,765 US12364728B2 (en) | 2021-01-11 | 2022-01-07 | Composition for reducing body fat comprising green tea extract containing gallocatechin gallate as an active ingredient and manufacturing method thereof |
| CN202210026234.8A CN114748552A (zh) | 2021-01-11 | 2022-01-11 | 绿茶提取物的用途及组合物的制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020210003451A KR20220101432A (ko) | 2021-01-11 | 2021-01-11 | 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20220101432A true KR20220101432A (ko) | 2022-07-19 |
Family
ID=82322591
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020210003451A Pending KR20220101432A (ko) | 2021-01-11 | 2021-01-11 | 갈로카테킨 갈레이트를 함유하는 녹차 추출물을 유효성분으로 포함하는 체지방 감소용 조성물 및 이의 제조방법 |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US12364728B2 (ko) |
| KR (1) | KR20220101432A (ko) |
| CN (1) | CN114748552A (ko) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150105563A (ko) | 2014-03-07 | 2015-09-17 | 동의대학교 산학협력단 | 한약재의 추출물을 유효성분으로 포함하는 비만의 예방 또는 치료용 조성물 |
Family Cites Families (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3018013B2 (ja) | 1989-10-19 | 2000-03-13 | 三井農林株式会社 | α―アミラーゼ活性阻害剤 |
| US5318986A (en) | 1989-10-19 | 1994-06-07 | Mitsui Norin Co., Ltd. | Method of inhibiting the activity of α-amylase |
| JP3088787B2 (ja) | 1991-07-08 | 2000-09-18 | 三井農林株式会社 | シュクラーゼ活性阻害剤 |
| US5605929A (en) | 1992-05-27 | 1997-02-25 | Arch Development Corp. | Methods and compositions for inhibiting 5α-reductase activity |
| KR100592796B1 (ko) | 2004-03-19 | 2006-06-26 | 삼아약품 주식회사 | 녹차카테킨을 유효성분으로 포함하는 고지혈증 예방 및치료제 |
| TW200604190A (en) | 2004-07-05 | 2006-02-01 | Suntory Ltd | Lipase inhibitor |
| US20060173070A1 (en) * | 2005-01-31 | 2006-08-03 | Kao Corporation | Method of enhancing motor function |
| CN1939296B (zh) | 2005-09-29 | 2011-04-13 | 中国人民解放军军事医学科学院毒物药物研究所 | 一种茶多酚组合物及其制备方法 |
| DE102005056652A1 (de) | 2005-11-25 | 2007-05-31 | Südzucker AG Mannheim/Ochsenfurt | Präparat enthaltend eine polyphenolhaltige Zusammensetzung und Isomaltulose |
| JP2008013473A (ja) | 2006-07-05 | 2008-01-24 | Kao Corp | 筋機能低下抑制剤 |
| KR20080006895A (ko) * | 2006-07-14 | 2008-01-17 | (주)아모레퍼시픽 | Gcg 고함량 녹차 및 그 제조방법 |
| WO2008081542A1 (ja) | 2006-12-28 | 2008-07-10 | Kao Corporation | 茶抽出物 |
| CN101310718A (zh) * | 2007-05-23 | 2008-11-26 | 中国科学院上海生命科学研究院 | 减肥降血脂的含儿茶素的组合物及其用途 |
| JP5576694B2 (ja) | 2009-04-10 | 2014-08-20 | 花王株式会社 | Gip上昇抑制剤 |
| CN101869633B (zh) | 2009-04-24 | 2013-01-16 | 南京苏中药物研究有限公司 | 含表没食子儿茶素没食子酸酯的肠溶药物组合物 |
| KR101381590B1 (ko) | 2011-01-10 | 2014-04-10 | 전남대학교산학협력단 | 인간 소장 말타아제의 활성 저해제 |
| CN104602538A (zh) | 2012-05-21 | 2015-05-06 | 帝斯曼营养产品股份公司 | 用于增加食品添加剂的稳定性的组合物和方法 |
| WO2015064600A1 (ja) | 2013-10-29 | 2015-05-07 | 花王株式会社 | 緑茶抽出組成物 |
| KR101923840B1 (ko) | 2014-08-28 | 2019-02-27 | 칼리웨이 바이오파마슈티칼스 코., 엘티디. | 체중 및 체지방 감소용 조성물 및 의약 생성물, 및 상기 생성물의 용도 |
| JP5969717B1 (ja) | 2015-04-28 | 2016-08-17 | 花王株式会社 | 緑茶抽出組成物 |
| KR20170109875A (ko) | 2016-03-22 | 2017-10-10 | (주)팜앤비즈 | 녹차추출물을 함유하는 건강식품조성물 |
| CN107865149A (zh) | 2016-09-26 | 2018-04-03 | 海口惟斯康医药科技有限公司 | 一种具有减肥功效的新型茶饮料的制备方法 |
| JP2018087171A (ja) | 2016-11-29 | 2018-06-07 | 株式会社明治 | 交感神経活性化用組成物 |
| US20190328020A1 (en) | 2016-12-21 | 2019-10-31 | Suntory Holdings Limited | Food and beverages containing epigallocatechin gallate and cyclo(prolyl-threonine) |
| JP2020515552A (ja) | 2017-03-28 | 2020-05-28 | カリウェイ バイオファーマシューティカルズ カンパニー リミテッド | 体重と体脂肪減少に用いられる組成物又は医薬品及びその用途 |
| JP7246386B2 (ja) | 2017-07-20 | 2023-03-27 | エイエムアールアイ エスエスシーアイ, リミテッド ライアビリティ カンパニー | エピガロカテキンガレートの非晶質分散体 |
| KR20190047873A (ko) * | 2017-10-30 | 2019-05-09 | (주)아모레퍼시픽 | 특정 성분 함량이 증가된 차 추출물을 포함하는 지방대사 이상의 예방 및 개선용 조성물 |
| KR102394664B1 (ko) * | 2017-11-14 | 2022-05-06 | (주)아모레퍼시픽 | 녹차 추출물 제조방법 및 이로부터 제조된 녹차 추출물 |
| CN108514119A (zh) | 2018-03-30 | 2018-09-11 | 北京斯利安药业有限公司 | 一种组合物、其应用和减肥增肌的产品 |
| CN109123627A (zh) | 2018-08-24 | 2019-01-04 | 国珍健康科技(北京)有限公司 | 一种具有减肥功效的保健食品 |
| KR102267472B1 (ko) | 2018-10-24 | 2021-06-21 | 전남대학교산학협력단 | 녹차 카테킨을 포함하는 중성지방 저감용 식품 조성물, 대사성 질환 개선용 식품 조성물 및 대사성 질환 예방 또는 치료용 약학 조성물 |
| KR20200046418A (ko) | 2018-10-24 | 2020-05-07 | 전남대학교산학협력단 | 녹차 카테킨을 포함하는 중성지방 저감용 식품 조성물, 대사성 질환 개선용 식품 조성물 및 대사성 질환 예방 또는 치료용 약학 조성물 |
| CN109770145A (zh) | 2019-01-03 | 2019-05-21 | 西安源森生物科技有限公司 | 一种辅助改善脂质代谢紊乱的固体饮料及其制备方法 |
| CN110151752B (zh) | 2019-06-03 | 2021-12-31 | 湖北省农业科学院畜牧兽医研究所 | 一种茶多酚类组合物及其在制备抗猪链球菌药物中的应用 |
| CN110663788A (zh) | 2019-10-06 | 2020-01-10 | 杏辉天力(杭州)药业有限公司 | 一种茶叶提取物及其工业化制备方法和用途 |
| CN110839890B (zh) | 2019-12-03 | 2022-06-21 | 湖南农业大学 | 一种茶黄素健肌的膳食营养补充剂的及其制备方法 |
| CN111035697A (zh) | 2019-12-31 | 2020-04-21 | 格律药业有限公司 | 一种药物组合物及其应用和纳米颗粒的制备方法和茶叶提取物的提取工艺及茶叶提取物 |
| KR20210113716A (ko) * | 2020-03-09 | 2021-09-17 | (주)아모레퍼시픽 | 성분 함량이 변화된 녹차 추출물을 포함하는 여성호르몬 조절 이상 질환 또는 증상의 예방, 완화, 개선 또는 치료용 조성물 |
| CN111514129A (zh) | 2020-05-14 | 2020-08-11 | 南开大学 | Egcg在制备改善或治疗内源性内毒素血症药物或保健食品中的应用 |
-
2021
- 2021-01-11 KR KR1020210003451A patent/KR20220101432A/ko active Pending
-
2022
- 2022-01-07 US US17/570,765 patent/US12364728B2/en active Active
- 2022-01-11 CN CN202210026234.8A patent/CN114748552A/zh active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150105563A (ko) | 2014-03-07 | 2015-09-17 | 동의대학교 산학협력단 | 한약재의 추출물을 유효성분으로 포함하는 비만의 예방 또는 치료용 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| US12364728B2 (en) | 2025-07-22 |
| CN114748552A (zh) | 2022-07-15 |
| US20220218778A1 (en) | 2022-07-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Chowdhury et al. | Protective role of epigallocatechin-3-gallate in health and disease: a perspective | |
| KR102323969B1 (ko) | 후발효차 추출물을 포함하는 조성물 | |
| EP2859896B1 (en) | Pharmaceutical compositions for the treatment of muscular disorders | |
| US9144556B2 (en) | Composition for promoting lipolysis | |
| Chen et al. | Polyphenol-rich extracts from Oiltea camellia prevent weight gain in obese mice fed a high-fat diet and slowed the accumulation of triacylglycerols in 3T3-L1 adipocytes | |
| CN102648284B (zh) | 多酚衍生物及其制造方法 | |
| KR20110005294A (ko) | 글루타티온 생산 촉진제, 글루타티온의 결핍에 기인하는 질환의 예방·치료제, 음식품 및 사료 | |
| KR20230142324A (ko) | 포포나무 추출물을 포함하는 비만 또는 지질 대사 개선용 조성물 | |
| US11096981B2 (en) | Composition for preventing or treating muscle atrophy comprising lycii radicis cortex | |
| KR102160424B1 (ko) | 유파틸린을 유효성분으로 포함하는 비만 예방, 치료, 또는 개선용 조성물 | |
| KR20180115916A (ko) | Hesperetin을 유효성분으로 포함하는 퇴행성신경질환 예방, 개선 또는 치료용 약학조성물 | |
| JP7303582B2 (ja) | インディアングーズベリー抽出物と大麦若葉抽出物との複合物(ib複合物)を有効成分として含む肥満及び/または糖尿を伴うメタボリックシンドロームの予防、改善治療用組成物 | |
| US12364728B2 (en) | Composition for reducing body fat comprising green tea extract containing gallocatechin gallate as an active ingredient and manufacturing method thereof | |
| KR20180130268A (ko) | 괭생이모자반추출물을 유효성분으로 포함하는 퇴행성신경질환 예방, 개선 또는 치료용 약학조성물 | |
| US20250205294A1 (en) | Composition for ameliorating obesity or lipid metabolism comprising asimina triloba extract | |
| JP2009203209A (ja) | アカシア属樹皮由来物を含有する血糖降下及び/又は抗肥満組成物 | |
| KR102779977B1 (ko) | 새싹귀리 추출물을 포함하는 체지방 감소용 조성물 | |
| HK40070307A (en) | Use of green tea extract and preparing method of composition | |
| CA3092802A1 (en) | Synergistic herbal compositions for the treatment of obesity and overweight | |
| KR20220071741A (ko) | 대두 추출물 및 효소적으로 처리된 루틴, 이의 염, 이의 입체 이성질체, 이의 수화물 또는 이의 용매화물을 유효성분으로 함유하며 미토콘드리아의 활성을 촉진시키며 백색 지방세포로부터 갈색 지방세포로의 형성을 유도하는 항비만 조성물 | |
| JP6964974B2 (ja) | 紅茶エキスを有効成分とする自律神経調節用組成物 | |
| KR102507569B1 (ko) | 돌외잎 추출물의 제조방법 및 이에 따른 돌외잎 추출물 | |
| KR20150067937A (ko) | 사이코사포닌 에이를 유효성분으로 함유하는 비만증 치료 및 예방용 조성물 | |
| CN115645431B (zh) | 一种组合物及其应用 | |
| JP2013107897A (ja) | フルクトース吸収阻害剤、組成物、食品および医薬製剤、動物飼料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application |
St.27 status event code: A-0-1-A10-A12-nap-PA0109 |
|
| PG1501 | Laying open of application |
St.27 status event code: A-1-1-Q10-Q12-nap-PG1501 |
|
| A201 | Request for examination | ||
| PA0201 | Request for examination |
St.27 status event code: A-1-2-D10-D11-exm-PA0201 |
|
| PN2301 | Change of applicant |
St.27 status event code: A-3-3-R10-R13-asn-PN2301 St.27 status event code: A-3-3-R10-R11-asn-PN2301 |
|
| D13-X000 | Search requested |
St.27 status event code: A-1-2-D10-D13-srh-X000 |