KR20200040924A - 생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 - Google Patents
생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 Download PDFInfo
- Publication number
- KR20200040924A KR20200040924A KR1020207010401A KR20207010401A KR20200040924A KR 20200040924 A KR20200040924 A KR 20200040924A KR 1020207010401 A KR1020207010401 A KR 1020207010401A KR 20207010401 A KR20207010401 A KR 20207010401A KR 20200040924 A KR20200040924 A KR 20200040924A
- Authority
- KR
- South Korea
- Prior art keywords
- cell
- nanoparticles
- alteration
- cells
- functionalized biocompatible
- Prior art date
Links
- 239000002105 nanoparticle Substances 0.000 title claims abstract description 114
- 230000003834 intracellular effect Effects 0.000 title claims abstract description 21
- 210000004027 cell Anatomy 0.000 claims abstract description 100
- 125000000524 functional group Chemical group 0.000 claims abstract description 25
- 230000000975 bioactive effect Effects 0.000 claims abstract description 24
- 230000003915 cell function Effects 0.000 claims abstract description 12
- 238000000576 coating method Methods 0.000 claims abstract description 10
- 108091023040 Transcription factor Proteins 0.000 claims abstract description 9
- 102000040945 Transcription factor Human genes 0.000 claims abstract description 9
- 239000011248 coating agent Substances 0.000 claims abstract description 8
- 229920000642 polymer Polymers 0.000 claims abstract description 8
- 210000004962 mammalian cell Anatomy 0.000 claims abstract description 7
- 239000012528 membrane Substances 0.000 claims abstract description 6
- 101100247004 Rattus norvegicus Qsox1 gene Proteins 0.000 claims abstract description 4
- 101100239628 Danio rerio myca gene Proteins 0.000 claims abstract description 3
- 108700021430 Kruppel-Like Factor 4 Proteins 0.000 claims abstract description 3
- 101150111214 lin-28 gene Proteins 0.000 claims abstract description 3
- 238000000034 method Methods 0.000 claims description 23
- 230000004075 alteration Effects 0.000 claims description 15
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 10
- 210000000130 stem cell Anatomy 0.000 claims description 10
- 230000001413 cellular effect Effects 0.000 claims description 9
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 claims description 6
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 claims description 6
- 229910052742 iron Inorganic materials 0.000 claims description 5
- 239000000126 substance Substances 0.000 claims description 5
- 150000001413 amino acids Chemical class 0.000 claims description 4
- 230000000877 morphologic effect Effects 0.000 claims description 2
- 230000000149 penetrating effect Effects 0.000 claims description 2
- 230000002062 proliferating effect Effects 0.000 claims description 2
- 241000124008 Mammalia Species 0.000 claims 1
- 230000035899 viability Effects 0.000 claims 1
- 108090000623 proteins and genes Proteins 0.000 abstract description 71
- 102000004169 proteins and genes Human genes 0.000 abstract description 68
- 108090000765 processed proteins & peptides Proteins 0.000 abstract description 39
- 102000004196 processed proteins & peptides Human genes 0.000 abstract description 27
- 235000018102 proteins Nutrition 0.000 description 65
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 30
- 238000006243 chemical reaction Methods 0.000 description 30
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 24
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 24
- 239000005090 green fluorescent protein Substances 0.000 description 23
- 101000945318 Homo sapiens Calponin-1 Proteins 0.000 description 15
- 101000652736 Homo sapiens Transgelin Proteins 0.000 description 15
- 102100031013 Transgelin Human genes 0.000 description 15
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 description 15
- 125000003277 amino group Chemical group 0.000 description 13
- 239000003153 chemical reaction reagent Substances 0.000 description 13
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 12
- 150000001875 compounds Chemical class 0.000 description 12
- 125000003396 thiol group Chemical group [H]S* 0.000 description 12
- 150000001412 amines Chemical class 0.000 description 10
- 239000011324 bead Substances 0.000 description 10
- 239000000243 solution Substances 0.000 description 10
- 229920001223 polyethylene glycol Polymers 0.000 description 9
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 8
- 238000005859 coupling reaction Methods 0.000 description 8
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 7
- 230000008878 coupling Effects 0.000 description 7
- 238000010168 coupling process Methods 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 230000008672 reprogramming Effects 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- 230000004069 differentiation Effects 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 201000006681 severe congenital neutropenia Diseases 0.000 description 6
- -1 Nanog Proteins 0.000 description 5
- 239000003431 cross linking reagent Substances 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 150000003384 small molecules Chemical class 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 208000025212 Constitutional neutropenia Diseases 0.000 description 4
- 239000004606 Fillers/Extenders Substances 0.000 description 4
- 108010028275 Leukocyte Elastase Proteins 0.000 description 4
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 4
- 239000004472 Lysine Substances 0.000 description 4
- 230000002159 abnormal effect Effects 0.000 description 4
- 230000001588 bifunctional effect Effects 0.000 description 4
- 210000001185 bone marrow Anatomy 0.000 description 4
- 210000000170 cell membrane Anatomy 0.000 description 4
- 230000003833 cell viability Effects 0.000 description 4
- 235000018417 cysteine Nutrition 0.000 description 4
- 150000004662 dithiols Chemical class 0.000 description 4
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 4
- 238000007306 functionalization reaction Methods 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 238000002372 labelling Methods 0.000 description 4
- 208000032839 leukemia Diseases 0.000 description 4
- 239000002122 magnetic nanoparticle Substances 0.000 description 4
- 210000003205 muscle Anatomy 0.000 description 4
- 210000000440 neutrophil Anatomy 0.000 description 4
- IHVODYOQUSEYJJ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 6-[[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]amino]hexanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCNC(=O)C(CC1)CCC1CN1C(=O)C=CC1=O IHVODYOQUSEYJJ-UHFFFAOYSA-N 0.000 description 3
- 239000004970 Chain extender Substances 0.000 description 3
- 208000000280 Cyclic neutropenia Diseases 0.000 description 3
- 229920002307 Dextran Polymers 0.000 description 3
- 208000026350 Inborn Genetic disease Diseases 0.000 description 3
- 206010052210 Infantile genetic agranulocytosis Diseases 0.000 description 3
- 102000016799 Leukocyte elastase Human genes 0.000 description 3
- HDFGOPSGAURCEO-UHFFFAOYSA-N N-ethylmaleimide Chemical compound CCN1C(=O)C=CC1=O HDFGOPSGAURCEO-UHFFFAOYSA-N 0.000 description 3
- 208000037919 acquired disease Diseases 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 238000004132 cross linking Methods 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 230000002526 effect on cardiovascular system Effects 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 230000003394 haemopoietic effect Effects 0.000 description 3
- 210000002216 heart Anatomy 0.000 description 3
- JDNTWHVOXJZDSN-UHFFFAOYSA-N iodoacetic acid Chemical compound OC(=O)CI JDNTWHVOXJZDSN-UHFFFAOYSA-N 0.000 description 3
- 201000002364 leukopenia Diseases 0.000 description 3
- 231100001022 leukopenia Toxicity 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 229920001282 polysaccharide Polymers 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 238000003260 vortexing Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- QYEAAMBIUQLHFQ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 6-[3-(pyridin-2-yldisulfanyl)propanoylamino]hexanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCNC(=O)CCSSC1=CC=CC=N1 QYEAAMBIUQLHFQ-UHFFFAOYSA-N 0.000 description 2
- VHJLVAABSRFDPM-UHFFFAOYSA-N 1,4-dithiothreitol Chemical compound SCC(O)C(O)CS VHJLVAABSRFDPM-UHFFFAOYSA-N 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- 201000005943 Barth syndrome Diseases 0.000 description 2
- 208000031229 Cardiomyopathies Diseases 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 2
- 208000024556 Mendelian disease Diseases 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 2
- 102100035423 POU domain, class 5, transcription factor 1 Human genes 0.000 description 2
- 101710126211 POU domain, class 5, transcription factor 1 Proteins 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 201000001546 cyclic hematopoiesis Diseases 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 150000001945 cysteines Chemical class 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- DNJIEGIFACGWOD-UHFFFAOYSA-N ethyl mercaptane Natural products CCS DNJIEGIFACGWOD-UHFFFAOYSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 125000003827 glycol group Chemical group 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- WTFXARWRTYJXII-UHFFFAOYSA-N iron(2+);iron(3+);oxygen(2-) Chemical compound [O-2].[O-2].[O-2].[O-2].[Fe+2].[Fe+3].[Fe+3] WTFXARWRTYJXII-UHFFFAOYSA-N 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 230000004066 metabolic change Effects 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 230000002438 mitochondrial effect Effects 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 210000002894 multi-fate stem cell Anatomy 0.000 description 2
- 230000003387 muscular Effects 0.000 description 2
- 208000004235 neutropenia Diseases 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 238000007747 plating Methods 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 239000012460 protein solution Substances 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 208000027390 severe congenital neutropenia 3 Diseases 0.000 description 2
- VUFNRPJNRFOTGK-UHFFFAOYSA-M sodium;1-[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]oxy-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].O=C1C(S(=O)(=O)[O-])CC(=O)N1OC(=O)C1CCC(CN2C(C=CC2=O)=O)CC1 VUFNRPJNRFOTGK-UHFFFAOYSA-M 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 125000000020 sulfo group Chemical group O=S(=O)([*])O[H] 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- NOLWAGXBBKJFEE-UHFFFAOYSA-N 1-aminosulfanylethanol Chemical compound CC(O)SN NOLWAGXBBKJFEE-UHFFFAOYSA-N 0.000 description 1
- ASNTZYQMIUCEBV-UHFFFAOYSA-N 2,5-dioxo-1-[6-[3-(pyridin-2-yldisulfanyl)propanoylamino]hexanoyloxy]pyrrolidine-3-sulfonic acid Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)CCCCCNC(=O)CCSSC1=CC=CC=N1 ASNTZYQMIUCEBV-UHFFFAOYSA-N 0.000 description 1
- VYMHBQQZUYHXSS-UHFFFAOYSA-N 2-(3h-dithiol-3-yl)pyridine Chemical group C1=CSSC1C1=CC=CC=N1 VYMHBQQZUYHXSS-UHFFFAOYSA-N 0.000 description 1
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 1
- AYKYXWQEBUNJCN-UHFFFAOYSA-N 3-methylfuran-2,5-dione Chemical compound CC1=CC(=O)OC1=O AYKYXWQEBUNJCN-UHFFFAOYSA-N 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 1
- 102000007644 Colony-Stimulating Factors Human genes 0.000 description 1
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 208000027205 Congenital disease Diseases 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 102000018832 Cytochromes Human genes 0.000 description 1
- 108010052832 Cytochromes Proteins 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 102100037362 Fibronectin Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108010054017 Granulocyte Colony-Stimulating Factor Receptors Proteins 0.000 description 1
- 102100039622 Granulocyte colony-stimulating factor receptor Human genes 0.000 description 1
- 101150092841 HAX1 gene Proteins 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 208000012565 Kostmann syndrome Diseases 0.000 description 1
- VHJLVAABSRFDPM-IMJSIDKUSA-N L-1,4-dithiothreitol Chemical compound SC[C@H](O)[C@@H](O)CS VHJLVAABSRFDPM-IMJSIDKUSA-N 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- GHAZCVNUKKZTLG-UHFFFAOYSA-N N-ethyl-succinimide Natural products CCN1C(=O)CCC1=O GHAZCVNUKKZTLG-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102100033174 Neutrophil elastase Human genes 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 241000242583 Scyphozoa Species 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 101150025256 TAZ gene Proteins 0.000 description 1
- 108010093528 Wiskott Aldrich Syndrome protein Proteins 0.000 description 1
- 208000027413 X-linked severe congenital neutropenia Diseases 0.000 description 1
- ZXKIFUWANBZSKF-UHFFFAOYSA-N [I].CC(O)=O Chemical compound [I].CC(O)=O ZXKIFUWANBZSKF-UHFFFAOYSA-N 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 208000014843 autosomal recessive severe congenital neutropenia Diseases 0.000 description 1
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 239000002981 blocking agent Substances 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 108091092356 cellular DNA Proteins 0.000 description 1
- 230000007248 cellular mechanism Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 102000054766 genetic haplotypes Human genes 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 210000000224 granular leucocyte Anatomy 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 210000002064 heart cell Anatomy 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 230000004777 loss-of-function mutation Effects 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 238000002587 lymphangiography Methods 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 230000009456 molecular mechanism Effects 0.000 description 1
- 230000004660 morphological change Effects 0.000 description 1
- 210000003643 myeloid progenitor cell Anatomy 0.000 description 1
- 229940031182 nanoparticles iron oxide Drugs 0.000 description 1
- 210000005155 neural progenitor cell Anatomy 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000008775 paternal effect Effects 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 238000005897 peptide coupling reaction Methods 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 1
- 239000008055 phosphate buffer solution Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000004952 protein activity Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B60—VEHICLES IN GENERAL
- B60R—VEHICLES, VEHICLE FITTINGS, OR VEHICLE PARTS, NOT OTHERWISE PROVIDED FOR
- B60R22/00—Safety belts or body harnesses in vehicles
- B60R22/34—Belt retractors, e.g. reels
- B60R22/341—Belt retractors, e.g. reels comprising energy-absorbing means
- B60R22/3413—Belt retractors, e.g. reels comprising energy-absorbing means operating between belt reel and retractor frame
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54353—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals with ligand attached to the carrier via a chemical coupling agent
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/02—Peptides of undefined number of amino acids; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6921—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere
- A61K47/6923—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being an inorganic particle, e.g. ceramic particles, silica particles, ferrite or synsorb
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6921—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere
- A61K47/6927—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores
- A61K47/6929—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle
- A61K47/6931—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle the material constituting the nanoparticle being a polymer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6921—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere
- A61K47/6927—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores
- A61K47/6929—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle
- A61K47/6931—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle the material constituting the nanoparticle being a polymer
- A61K47/6939—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle the material constituting the nanoparticle being a polymer the polymer being a polysaccharide, e.g. starch, chitosan, chitin, cellulose or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B60—VEHICLES IN GENERAL
- B60R—VEHICLES, VEHICLE FITTINGS, OR VEHICLE PARTS, NOT OTHERWISE PROVIDED FOR
- B60R22/00—Safety belts or body harnesses in vehicles
- B60R22/28—Safety belts or body harnesses in vehicles incorporating energy-absorbing devices
- B60R2022/286—Safety belts or body harnesses in vehicles incorporating energy-absorbing devices using deformation of material
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B60—VEHICLES IN GENERAL
- B60R—VEHICLES, VEHICLE FITTINGS, OR VEHICLE PARTS, NOT OTHERWISE PROVIDED FOR
- B60R22/00—Safety belts or body harnesses in vehicles
- B60R22/28—Safety belts or body harnesses in vehicles incorporating energy-absorbing devices
- B60R2022/289—Energy-absorption curves
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/10—Fusion polypeptide containing a localisation/targetting motif containing a tag for extracellular membrane crossing, e.g. TAT or VP22
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/60—Fusion polypeptide containing spectroscopic/fluorescent detection, e.g. green fluorescent protein [GFP]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Nanotechnology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Organic Chemistry (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Marine Sciences & Fisheries (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Mechanical Engineering (AREA)
- Toxicology (AREA)
- Ceramic Engineering (AREA)
- Inorganic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
Abstract
세포 기능을 조정하기 위한 복수의 생물활성 분자를 세포내 전달할 수 있고 포유동물 세포막을 관통할 수 있는 작용화 생체적합성 나노입자가 본원에 개시된다. 작용화 생체적합성 나노입자는 하기를 포함한다: 크기 범위가 약 5 내지 약 50 nm 인 중심의 나노입자로서, 그에 중합체 코팅을 갖는 중심의 나노입자, 중합체 코팅에 공유 부착된 복수의 작용기로서, 이때 복수의 생물활성 분자가 복수의 작용기에 부착되고, 복수의 생물활성 분자는 하나 이상의 펩티드 및 단백질을 포함하고, 펩티드는 포유동물 세포막을 관통해 세포 내로 진입할 수 있고, 단백질은 세포 내에 새로운 작용성을 제공할 수 있는, 복수의 작용기. 단백질은 Oct4, Sox2, Nanog, Lin28, cMyc, 및 Klf4 로 이루어진 군으로부터 선택된 전사 인자일 수 있다.
Description
관련 출원의 상호 참조
본 출원은 모든 목적을 위해 본원에 그 전문이 참조로서 포함되어 있는 미국 가출원 제 61/550,213 호 (2011년 10월 21일 출원) 의 이점을 우선권 주장한다.
기술 분야
본 발명은 일반적으로 유기 합성 및 나노생명공학, 더욱 특히 세포 기능의 조절을 위해 생물활성 분자를 세포로 전달하기 위한 작용화 나노입자, 및 이와 관련된 방법에 관한 것이다.
다양한 유전성 질환 또는 후천성 질환에서 조혈계 및/또는 심혈관계 세포를 포함하는 (이에 한정되지는 않음) 세포가 정상적으로 증식하고, 이동하고 다양한 세포형으로 분화하는 능력은 배발생 및 성숙 세포의 기능에서 결정적인 것이다. 줄기 세포 및/또는 더욱 분화한 특정 세포 유형의 이러한 작용성 능력은 다양한 병리학적 병태에서 변경되나, 이는 생물학적 활성 성분의 세포내 도입시 정상화될 수 있다. 예를 들어, 골수 줄기 세포/조상 세포의 호중구로의 분화 및/또는 생존 손상과 같은 비정상 세포 기능은, 생명에 위협적인 중증 감염을 앓고 있고 급성 골수성 백혈병 또는 다른 악성물로 진행될 수 있는 주기성호중구감소증 또는 중증 선천성 백혈구감소증을 앓고 있는 환자에서 관찰된다 [Aprikyan et al, Impaired survival of bone marrow hematopoietic progenitor cells in cyclic neutropenia. Blood, 97, 147 (2001); Goran Carlsson et al, Kostmann syndrome: severe congenital neutropenia associated with defective expression of Bcl-2, constitutive mitochondrial release of cytochrome C, and excessive apoptosis of myeloid progenitor cells. Blood, 103, 3355 (2004)]. 유전적 장애 또는 후천적 장애, 예컨대 선천적 호중구감소증 또는 바쓰 증후군 (Barth syndrome) 은 다양한 유전자 돌연변이에 의해 촉발되며 이는 환자의 혈액 세포 및/또는 심장 세포의 생산 결핍 및 기능 결핍으로 인한 것이며, 이로 인해 백혈구감소증, 심근증 및/또는 심부전이 야기된다 [Makaryan et al., The cellular and molecular mechanisms for neutropenia in Barth syndrome. Eur J Haematol. 88: 195-209 (2012)]. 중증 선천적 호중구감소증 질병 표현형은 호중구 엘라스타아제 유전자, HAX1 유전자, 또는 Wiskott-Aldrich 증후군 단백질 유전자에서의 상이한 치환, 결손, 삽입 또는 절단 돌연변이에 의해 야기될 수 있다 [Dale et al, Mutations in the gene encoding neutrophil elastase in congenital and cyclic neutropenia. Blood. 96:2317-2322 (2000); Devriendt et al, Constitutively activating mutation in WASP causes X-linked severe congenital neutropenia. Nat Genet. 27:313-7 (2001); Klein et al, HAXl deficiency causes autosomal recessive severe congenital neutropenia (Kostmann disease) Nat Genet. 39:86-92 (2007)].
미토콘드리아 TAZ 유전자에서 기능손실 돌연변이에 의해 유도되는 것으로 추정되는 다중시스템 줄기 세포 장애인 바쓰 증후군과 같은 다른 유전성 질환은, 백혈구감소증과 연계되어 있으며 (혈액 호중구의 수준이 감소됨), 이는 재발성 중증 감염 및 종종 생명에 위협적인 치명적인 감염 및/또는 심근증을 야기할 수 있으며, 이는 심장 이식에 의해서 해결될 수 있는 심부전을 야기할 수 있다. 대부분의 경우, 돌연변이체 유전자 산물 (유전적 또는 후천적 인간 질병의 진행 및 발병학과 관련) 은 별개의 세포 내 사건에 영향을 미치며, 이는 비정상 세포 기능을 초래하고 특정 질병의 표현형을 야기한다.
과립성 백혈구 콜로니-자극 인자 (G-CSF) 를 갖는 이들 환자의 치료는, 세포 표면 상에 위치한 G-CSF 수용체 분자에서 형태학적 변화를 유도하며, 이는 후속적으로 세포 내 사건의 사슬을 촉발하며, 결과적으로 호중구의 생산을 정상 수준 가까이 회복시키고 환자의 삶의 질을 개선시킨다 [Welte and Dale. Pathophysiology and treatment of severe chronic neutropenia. Ann. Hematol. 72, 158 (1996)]. 그럼에도 불구하고, G-CSF 로 치료된 환자는 백혈병이 진행될 수 있다 [Aprikyan et al., Cellular and molecular abnormalities in severe congenital neutropenia predisposing to leukemia. Exp Hematol. 31, 372 (2003); Philip Rosenberg et al, Neutrophil elastase mutations and risk of leukaemia in severe congenital neutropenia. Br J Haematol.140, 210 (2008); Peter Newburger et al, Cyclic Neutropenia and Severe Congenital Neutropenia in Patients with a Shared ELANE Mutation and Paternal Haplotype: Evidence for Phenotype Determination by Modifying Genes. Pediatr.Blood Cancer, 55, 314 (2010)] (이는 대안적인 신규 접근법이 왜 연구되었는지에 대한 것임).
세포내 이벤트는 뚜렷하게 작용화된 나노입자를 사용하여 상이한 생물학적 활성 분자의 세포내 전달할 때, 보다 효과적으로 영향을 받으며 조절될 수 있다. 이들 생물활성 (bioactive) 분자는 세포 기능을 정상화시킬 수 있거나 필요시 원치않는 세포를 제거할 수 있다. 그러나, 세포막은 외인성 자극에 의해 영향받는 것으로부터 세포내 이벤트의 캐스케이드를 보호하는 활성 배리어로서 역할한다.
따라서, 세포막을 관통할 수 있고 관심사인 세포내 이벤트를 발생시킬 수 있는 새로운 유형의 생물활성 분자에 대한 필요성이 당업계에 존재한다. 본 발명은 이러한 필요를 충족시키며 추가적인 관련 이점을 제공한다.
발명의 개요
일부 구현예에서 본 발명은 세포 기능을 조정하기 위한 생체적합성 나노입자에 단백질 및/또는 펩티드를 연결하는 작용화 방법에 관한 것이다. 일부 구현예에서, 본 발명은 작용화된 생체적합성 나노입자 자체에 관한 것이다.
한 구현예에서, 세포 기능을 조정하기 위한 복수의 생물활성 분자를 세포내 전달할 수 있고 포유동물 세포막을 통해 관통할 수 있는 작용화된 생체적합성 나노입자는 하기를 포함한다: 크기가 5 내지 50 nm 이고 그에 코팅된 중합체를 갖는 중심의 나노입자 (central nanoparticle), 중합체 코팅에 공유 결합된 복수의 작용기 (이때, 복수의 생물활성 분자는 복수의 작용기에 부착되고, 복수의 생물활성 분자는 하나 이상의 펩티드 및 단백질을 포함하고, 펩티드는 포유동물 세포막을 통해 관통할 수 있고 세포 내로 진입할 수 있으며, 단백질은 세포 내에서 새로운 작용성을 제공할 수 있음).
중심의 나노입자는 철을 포함할 수 있으며 자성일 수 있다. 본 발명의 펩티드는 단백질에 부착될 수 있다 (나노입자에 부착되는 바와 반대로). 펩티드 및 단백질은 각각 하나 이상의 개재 (interposing) 링커 분자에 의해 나노입자에 부착될 수 있다. 일부 구현예에서 펩티드는 5 내지 9 개의 염기성 아미노산을 포함할 수 있는 한편, 다른 구현예에서 펩티드는 9 개 이상의 염기성 아미노산을 포함한다. 단백질은 예를 들어 Oct4, Sox2, Nanog, Lin28, cMyc 및 Klf4 로 이루어지는 군에서 선택되는 전사 인자와 같은 전사 인자일 수 있다.
또 다른 양상에서, 본 발명은 포유동물 세포 내의 세포 작용성을 변경시키는 방법에 관한 것이다. 이러한 신규 방법은 유효량의 작용화된 생체적합성 나노입자를 세포에 투여하고, 세포 내 세포 작용성을 변경시키는 것을 포함한다. 세포 작용성의 변경은 세포의 물리화학적 특성의 변경, 세포의 증식 특성의 변경, 세포의 생존 능력의 변경 또는 세포의 형태적 표현형 특성의 변경을 포함할 수 있다. 세포 작용성 변경은 줄기 세포 또는 보다 특수화된 세포 유형을 포함하는 새로운 세포 유형이 생성되도록 하는 세포의 획득된 능력을 포함할 수 있다.
본 발명의 이들 양상 및 기타 양상은 하기의 상세한 설명 및 첨부된 도면을 참조로 하여 보다 명백해질 것이다. 그러나 본질적 취지 및 범주에서 벗어나지 않고, 다양한 변화, 변경 및 대체가 본원에 개시된 특정 구현예에 가해질 수 있다는 것이 이해된다. 마지막으로, 본원에 인용된 다양한 참고문헌 모두는 참조로 본원에 명백히 포함된다.
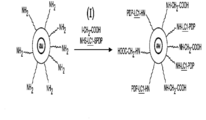
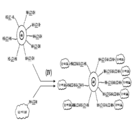
도 1 은 본 발명의 구현예에 따른 나노입자에 펩티드 및 단백질 분자를 동시에 부착시키는 것을 기반으로 하는 나노입자의 다단계 작용화 모식도를 나타낸다.
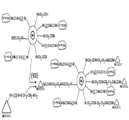
도 2A 는 본 발명의 구현예에 따른 아민기를 함유하는 나노입자와 등몰비의 장쇄 LC1-SPDP 및 요오도아세트산 나노입자와의 반응을 나타낸다.
도 2B 는 본 발명의 구현예에 따른 자유 SH 기 나노입자가 제공되도록 하는 PDP 의 디술파이드 결합의 환원을 나타낸다.
도 2C 는 본 발명의 구현예에 따른 단백질 나노입자의 리신기와 장쇄 LC1-SMCC 와의 반응을 나타낸다.
도 2D 는 본 발명의 구현예에 따른 말단 반응성 말레이미드기 나노입자를 함유하며 SMCC 와 반응한 단백질과 다작용성 나노입자와의 반응을 나타낸다.
도 2E 는 펩티드의 아미노기와 LC2-SMCC 와의 반응을 나타낸다. 본 발명의 구현예에 따라 상기 반응 이후 메르캅토에탄올과의 반응이 이어져 말단 말레이미드가 알코올 나노입자로 전환된다.
도 2F 는 본 발명의 구현예에 따른 나노입자 위의 자유 카르복실 기에 대한 개질된 펩티드와 기능성 비드 (및 부착된 단백질) 와의 반응을 나타낸다.
도 3A 는 본 발명의 구현예에 따른 LC1-SPDP 나노입자와 아민 기를 함유하는 나노입자와의 반응을 나타낸다.
도 3B 는 본 발명의 구현예에 따른 자유 SH 기 나노입자를 제공하도록 하는 PDP 의 디술파이드 결합의 환원을 나타낸다.
도 3C 는 본 발명의 구현예에 따른 단백질 나노입자의 리신 기와 장쇄 LC2-SMCC 와의 반응을 나타낸다.
도 3D 는 본 발명의 구현예에 따른 말단 반응성 말레이미드 기 나노입자를 함유하며 SMCC 와 반응한 단백질과 다작용성 나노입자와의 반응을 나타낸다.
도 2A 는 본 발명의 구현예에 따른 아민기를 함유하는 나노입자와 등몰비의 장쇄 LC1-SPDP 및 요오도아세트산 나노입자와의 반응을 나타낸다.
도 2B 는 본 발명의 구현예에 따른 자유 SH 기 나노입자가 제공되도록 하는 PDP 의 디술파이드 결합의 환원을 나타낸다.
도 2C 는 본 발명의 구현예에 따른 단백질 나노입자의 리신기와 장쇄 LC1-SMCC 와의 반응을 나타낸다.
도 2D 는 본 발명의 구현예에 따른 말단 반응성 말레이미드기 나노입자를 함유하며 SMCC 와 반응한 단백질과 다작용성 나노입자와의 반응을 나타낸다.
도 2E 는 펩티드의 아미노기와 LC2-SMCC 와의 반응을 나타낸다. 본 발명의 구현예에 따라 상기 반응 이후 메르캅토에탄올과의 반응이 이어져 말단 말레이미드가 알코올 나노입자로 전환된다.
도 2F 는 본 발명의 구현예에 따른 나노입자 위의 자유 카르복실 기에 대한 개질된 펩티드와 기능성 비드 (및 부착된 단백질) 와의 반응을 나타낸다.
도 3A 는 본 발명의 구현예에 따른 LC1-SPDP 나노입자와 아민 기를 함유하는 나노입자와의 반응을 나타낸다.
도 3B 는 본 발명의 구현예에 따른 자유 SH 기 나노입자를 제공하도록 하는 PDP 의 디술파이드 결합의 환원을 나타낸다.
도 3C 는 본 발명의 구현예에 따른 단백질 나노입자의 리신 기와 장쇄 LC2-SMCC 와의 반응을 나타낸다.
도 3D 는 본 발명의 구현예에 따른 말단 반응성 말레이미드 기 나노입자를 함유하며 SMCC 와 반응한 단백질과 다작용성 나노입자와의 반응을 나타낸다.
본 발명의 이들 및 기타 양상은 하기 상세한 설명과 첨부된 도면을 참조할 때 통상의 기술자에게 더욱 명백해질 것이다.
발명의 상세한 설명
생물 활성 분자를 세포 내로 전달하기 위해, 본 발명의 발명자들은 공유 결합된 생물 활성 분자를 갖는 세포 막-관통성 나노입자에 기반하는 범용 장치를 제시한다. 이러한 목적을 위해, 본 발명의 발명자들은 본원에서 나노입자에 단백질 및 펩티드를 공유 결합시킬 수 있는 신규한 작용화 방법을 제시한다. 본 발명의 개질된 세포-투과성 나노입자는 세포 기능 조절 및/또는 정상화를 위해 생물 활성 분자를 세포내 전달하는 범용 메카니즘을 제공한다.
각종 선천적 또는 후천적 질환에서의 조혈 및 심혈관계의 줄기/전구 (progenitor) 및 더욱 분화된 세포를 포함하나 이에 제한되지 않는, 세포의 정상적 증식, 이주 및 다양한 세포 유형으로의 분화 능력은 배발생 및 성숙 세포의 기능에서 매우 중요하다. 줄기 세포 및/또는 더욱 분화된 특수화된 세포 유형의 이러한 기능적 능력은 다양한 병리 상태에서 세포내 이벤트의 비정상적 변경으로 인해 변경되나, 생물 활성 성분의 세포내 도입시 정상화될 수 있다. 예를 들어, 중증 생명 위협적 감염을 겪는 백혈병으로 진행할 수 있는 주기성 또는 중증 선천적 호중구감소증 환자에서 관찰되는 인간 골수 전구 세포의 감소된 생존 및 호중구로의 분화는, 비정상적 세포내 이벤트를 간섭하고 정상 표현형을 명백히 복구하는, 호중구 엘라스타제 세포 막-침투성 소분자 저해인자에 의해 정상화될 수 있다. 그럼에도 불구하고, 질환을 야기하는 표적 돌연변이 산물에 특이적인 그러한 소분자는 입수하기가 매우 힘들며, 이것이 세포 기능 조정 능력을 갖는 생물 활성 분자의 세포내 전달을 위한 대안적인 효율적 세포 막-관통성 장치가 필요한 이유이다.
본원에 공개된 방법은, 예를 들어, 이전에 과학 문헌에 기재된 것들과 유사한 초상자성 (superparamagnetic) 산화 철 입자를 포함하는, 생체적합성 나노입자를 이용한다. 이러한 유형의 나노입자는 임상 현장에서 골수 세포, 림프절, 비장 및 간의 자기 공명 영상화를 위해 사용될 수 있다 [예를 들어, Shen et al, Monocrystalline iron oxide nanocompounds (MION); physicochemical properties. Magn. Reson. Med., 29, 599 (1993); Harisinghani et. al, MR lymphangiography using ultrasmall superparamagnetic iron oxide in patients with primary abdominal and pelvic malignancies. Am. J. Roentgenol. 172, 1347 (1999) 참조]. 이들 자성 산화 철 나노입자는 가교된 덱스트란으로 코팅된 ~5 ㎚ 핵을 함유하고, 전체 입자 크기가 ~45 ㎚ 이다. 중요하게, 가교된 세포 막-투과성 Tat-유래 펩티드를 함유하는 이들 나노입자가 조혈 및 신경 전구 세포 내로 세포 1 개 당 초상자성 철 나노입자 30 pg 이하의 양으로 효율적으로 내부화한다는 사실이 입증되었다 [Lewin et al, Tat peptide-derivatized magnetic nanoparticles allow in vivo tracking and recovery of progenitor cells. Nat. Biotechnol. 18, 410 (2000)]. 게다가, 나노입자 함입은 골수-유래 CD34+ 원시 전구 세포의 증식 및 분화 특성 또는 세포 생존력에 영향을 미치지 않는다 [Maite Lewin et al, Nat. Biotechnol. 18, 410 (2000)]. 이들 나노입자는 생체 내에서 라벨링된 세포를 트래킹하기 위해 사용될 수 있다.
라벨링된 세포는 그들의 분화 능력을 보유하고, 또한 조직 샘플 내에서 자기 공명 영상화를 사용하여 탐지될 수 있다. 본원에서 본 발명의 발명자들은 표적 세포내 이벤트를 표적화하고 세포 기능 및 특성을 조정하는 세포 재프로그래밍 해법에서 생물 활성 분자의 세포내 전달을 위한 우수한 비히클로서 작용할 수 있는 펩티드 및 단백질을 운반하도록 작용화된 신규한 나노입자-기반 장치를 제시한다.
나노입자-펩티드/단백질 컨쥬게이트의 일반적인 상세사항:
X/Y 작용기를 이용한 생체적합성 코팅 (예를 들어, 덱스트란 다당류) 에, 다양한 길이의 링커가 결합되어 있고, 이에 따라 상기 X/Y 작용기를 통해 단백질 및/또는 펩티드 (또는 여타 소형 분자들) 가 공유 결합되어 있는 철 또는 여타 재료 기재의 나노입자.
다양한 길이의 링커가 결합되어 있는 X/Y 작용기, 이에 따라 그 X/Y 작용기를 통해 단백질 및/또는 펩티드 (또는 여타 소형 분자들) 이 공유결합되는 상기 X/Y 작용기를 이용한 생체적합성 코팅 (예를 들어, 덱스트란 다당류) 을 함유하는 철 또는 여타 재료 기재의 나노입자.
가교에 이용될 수 있는 작용기에는 하기의 것이 포함된다:
-NH2 (예를 들어, 리신, a-NH2);
-SH,
-COOH,
-NH-C(NH)(NH2),
탄수화물,
-히드록실 (OH),
- 링커 상의 아지도기의 광화학을 통한 결합.
가교제는 하기의 것을 포함할 수 있다:
SMCC [숙신이미딜 4-(N-말레이미도-메틸) 시클로헥산-1-카르복실레이트]. 아미노 및 티올기를 가교하기 위한 술포숙신이미딜 유도체인 Sulfo-SMCC 도 이용가능하다.
LC-SMCC (장쇄 SMCC). 또한 Sulfo-LC-SMCC.
SPDP [N-숙신이미딜-3-(피리딜디티오)-프로프리오네이트] 또한, Sulfo-SPDP. 아민과 반응하여 티올기 제공.
LC-SPDP (장쇄 SPDP). 또한 Sulfo-LC-SPDP.
EDC [1-에틸 히드로클로라이드-3-(3-디메틸아미노프로필)카르보디이미드] -COOH 기를 -NH2 기로 연결하기 위해 이용되는 시약.
SM(PEG)n, 여기서 n=1, 2, 3, 4........24 글리콜 단위체. 또한 Sulfo-SM(PEG)n 유도체.
SPDP(PEG)n, 여기서 n=1, 2, 3, 4.........12 글리콜 단위체. 또한 Sulfo-SPDP(PEG)n 유도체.
카르복실 및 아민기를 모두 포함하는 PEG 분자.
카르복실 및 술프히드릴기를 모두 포함하는 PEG 분자.
캡핑 및 블로킹제는 하기를 포함한다:
시트라콘산 무수물 --- NH 에 특이적임
에틸 말레이미드 --- SH 에 특이적임
메르캅토에탄올 --- 말레이미드에 특이적임
상기의 관점에서, 생체적합성 나노입자를 처리하여 표면 상에 작용성 아민을 제공하고, 이어서 단백질 및 짧은 펩티드를 화학적으로 결합하는데 이용했다.
단백질 결합의 경우, 예를 들어 녹색 형광 단백질 또는 전사 인자를 초상자성 또는 대안적으로 나노입자에 결합시키는 경우, 하기의 프로토콜이 이용될 수 있다: 외부에 아미노 작용기를 포함하는 초상자성 비드가 다양한 제조사로부터 시판되어 구입가능하다. 이들은 크기가 20 내지 50 nm 범위일 수 있고, 나노입자 당 10 개 이상의 아민기가 있는 1015 내지 1020 개의 나노입자가 ml 당 존재할 수 있다. 나노입자는 분자량 컷오프가 10,000 달톤인 Amicon 원심분리 여과 단위체 (마이크로컬럼) 을 이용하여 올바른 반응 완충액 (0.1 M 의 포스페이트 완충액, pH 7.2) 에 넣는다. 적절한 완충 시스템을 보장하기 위해서는 보통 약 4 회의 세정이 필요하다. 제조사에서 권장한 바와 같이 필터 단위체로부터 나노입자를 제거한다 (저속에서 스피닝하여 컬럼/필터 기기를 반전시킴).
SMCC (Thermo Fisher 사 제조) 를 1 mg/ml 농도로 ACROS (밀봉된 바이알이며 무수성) 로부터 입수되는 디메틸포름아미드 (DMF) 에 녹였다. 시료를 밀봉하고, 거의 즉시 이용한다.
10 마이크로리터의 용액을 200 마이크로리터 부피 중의 나노입자에 첨가한다. 이는 존재하는 이용가능한 아민기에 과량의 SMCC 를 제공하게 되며, 반응이 1 시간 동안 진행되도록 한다. 과량의 SM 및 DMF 는 컷오프가 3,000 달톤인 Amicon 원심분리 필터 컬럼을 이용해 제거할 수 있다. 적절한 완충액 교환을 보장하기 위해 보통 5 회의 등부피 교환이 필요하다. 과량의 SMCC 는 본 단계에서 제거되어야 한다는 점이 중요하다.
예를 들어 시판되어 입수가능한 녹색 형광 단백질 (GFP) 또는 정제된 재조합 GFP 또는 여타 단백질과 같은, 임의의 펩티드 기재의 분자를 -30 ℃ 에서 냉동한 특정양의 에틸렌 글리콜을 포함하는 용액에 첨가한다. 14 마이크로리터 중의 단백질 3 마이크로그램에, PBS 중의 10 마이크로리터의 새로 제조한 DTT (디티오트레이톨, Cleland's 시약) 용액을 세게 볼텍싱 (vortexing) 시키며 첨가한다. 단백질은 일반적으로 1 개 초과의 시스테인을 포함하기 때문에, 상이한 GFP 분자들을 가교시키는 경향이 있다. 따라서, 과량의 DTT 는 디티올 연결 및 유리된 GFP 를 환원시킨다. 반응을 2 시간 동안 4℃ 에서 진행되도록 하고, 이어서 3,000 MW 컷오프의 Amicon 원심분리 필터 단위체로 과량의 시약을 제거한다.
활성화된 나노입자 및 단백질 용액을 결합하고, 두 시간 동안 반응시키고, 이후 반응하지 않은 단백질을 적절한 MW 컷오프 (GFP 를 사용하는 예에서, 이는 50,000 달톤 컷오프임) 를 갖는 Amicon 원심분리기 유닛에 의해 제거한다. 샘플을 -80℃ 에서 저장한다. Amicon 회전 여과 컬럼을 사용하는 대신, 고체 크기 필터링 성분을 함유하는 작은 회전 컬럼, 예를 들어 Bio Rad P 컬럼이 또한 사용될 수 있다. 이들은 크기 배제 컬럼이다. SMCC 가 또한 술포 유도체 (Sulfo-SMCC) 로서 구입되어, 이를 보다 수용성으로 만들어 줄 수 있다는 점에 또한 주목해야 한다. DMSO 는 또한 라벨링 시약을 위한 용매 담체로서 DMF 에 대해 치환될 수 있고; 또한, 이는 무수이어야 한다.
모든 다른 가교제는 유사한 방식으로 적용될 것이다. SPDP 는 또한 SMCC 와 동일한 방식으로 단백질/적용가능한 펩티드로 적용된다. 이는 DMF 에서 쉽게 용해될 수 있다. 디티올은 1 시간 이상 동안 DTT 와의 반응에 의해 제공된다. 부산물 및 반응하지 않은 물질의 제거 후, 3,000 MW 컷오프를 갖는 Amicon 원심분리기 컬럼을 사용하여 정제한다.
펩티드 및 단백질로 나노입자를 라벨링하는 또 다른 더 직접적인 그리고 제어된 방법은 두 개의 상이한 이관능성 커플링화제를 사용하는 것이다. 반응 순서는 도 1 의 순서와 다소 유사하다. 요오드아세트산은 나노입자 표면 상에서 "카르복실" 기의 선택 수를 도입하기 위해 사용된다.
LC-SMCC 를 함유하는 펩티드는 아미노메르캅토에탄올로 처리한다. 이는 술프히드릴 기를 통해서 연결을 만들고, 유리 아미노 기를 제공한다. 상기 아미노 기는 그 후 EDC 를 사용하여 나노입자 상에서 커플링된다. EDC 는 1-에틸-3[3-디메틸아미노프로필] 카르보디이미드 하이드로클로라이드로서 공지되어 있다. 상기 커플링 단계를 반응식 중 마지막에 수행한다.
도 1 은 자기 나노입자---단백질/펩티드 부가물의 일반적인 설명을 나타낸다. 자기 나노입자는 다당류로 코팅되고, 그 후 작용화된다. 이는 표면 상에서 아민을 가진채로 구입될 수 있다. 이들은 또한 임의의 다른 작용 형태로 바뀌거나/변경될 수 있다. 연장제/커넥터는 물리적으로 두 개의 유닛 서로간에 결합한다.
가교 반응을 통해서 나노입자를 단백질에 화학적으로 부착하기 위해 다양한 작용기기가 사용될 수 있다. 이용가능한 다양한 작용기는 점진적으로 나노입자에 부착될 많은 단백질/펩티드를 허용한다.
유사하게, 다양한 가교제 또는 반응성 촉매는 헤테로-이관능성 시약을 통해서 나노입자를 단백질/펩티드와 가교시키기 위해 사용될 수 있다. 상기 가교제가 다양한 길이를 갖는다는 점에 또한 주목해야 한다. 예를 들어, 대부분은 연장제 또는 "장쇄" 로 지칭되는 LC 노테이션을 함유한다. 페길화 화합물은 또한 다양한 길이로 이용가능하다. 이러한 방식으로, 다양한 길이의 링커는 나노입자로 첨가될 수 있고, 큰 분자, 예를 들어 단백질 및 작은 분자, 예를 들어 펩티드에 대해 상이한 부착 길이를 제공한다.
시간 차 (time different) 단백질은 흔히 동일한 작용기를 함유하여, 다양한 단백질을 갖는 나노입자를 라벨링하는 것을 어렵게 만들 수 있다. 작용기에 대해서 변화를 하게 해주는 시약이 존재하고; 따라서 본 발명자들은 단백질 상에서 작용기를 변화시킬 수 있고, 그에 따라 다른 단백질로부터의 간섭 없이 단계적인 방식으로 선택성을 본 발명자들에게 제공한다. 이는 단백질 상에서 작용기를 변화시키는 것을 필요로 한다.
작용기와 같이 단백질에 부착하기 위해 상이한 화학물질이 사용될 수 있도록 다양한 시약이 단백질을 변경하기 위해 사용될 수 있다. 예를 들어, SPDP 와 같은 화합물은 아민을 술프히드릴로 전환하기 위해 사용될 수 있고, 이는 그 후 말레이미드 부분과의 반응에 대하여 수용성을 갖는다.
단계적인 방식으로 단백질을 비드 (나노입자) 에 부착하는 경우에, 종종 사전에 부착된 단백질의 잔류물 및 활성 기는 커플링 화학물질을 간섭할 수 있다. 따라서, 영구적이거나 또는 가역적인 캡핑된 시약은 나노입자에 2차 또는 3 차 단백질을 부착하기 위해 사용하고자 하는 시약의 간섭으로부터 이들 활성 부분을 차단하기 위해 사용될 수 있다.
많은 상이한 캡핑된 화합물이 반응하지 않는 부분을 차단하기 위해 사용될 수 있다. 이들은 단백질 활성을 간섭할 수도 있는 캡핑된 화합물로서 적절하게 사용될 필요가 있다. 2 차 화학적 부착 단계가 필요한 경우가 흔히 사용되고, 상기 작용기가 간섭할 것이다.
상기 언급한 화학물질을 사용하여 단백질이 비드 (나노입자) 에 부착할 수 있다는 것을 나타내기 위하여, 본 발명자들은 자기 나노입자의 합성을 제공하고, 이는 해파리로부터 유래된 녹색 형광 단백질을 함유하였다. LCC-SMCC 를 본 합성 식에서 사용하였다.
화학적 결합을 형성하기 위해 N-히드록시숙신이미드를 나노 입자 상에서 유리 아미 기와 화학적으로 반응시킨다. 이는 GFP 와 반응할 수 있는 말레이미드 말단기를 제공한다. GFP 가 두 개의 시스테인을 갖고, 다양한 GFP 분자로부터의 시스테인은 반응하여 디술파이드 결합을 형성할 수 있다는 것이 공지되어 있다. 상기 간섭을 제거하기 위해, 분자는 우선 클리란드 (Cleland's) 시약으로 환원된다.
단백질을 정제한 후, LC-말레이미드기를 포함하는 비드와 반응시킨다. 반응을 1 시간 동안 진행시키고, Amicon 스핀 필터 (50K 컷오프) 에서 반응물을 정제하였다. 형광 전자 현미경으로 사진을 찍었다.
다유형의 작용기를 나노입자 상에 만들 수 있다. 이는 부착되는 3 개 이상의 상이한 단백질의 첨가를 가능하게 한다.
우선, 표면 상의 아민으로 개시한다.
Traut 시약을 이들 아민의 일부를 술프히드릴로 전환시키는데 사용할 수 있다. 추가로, 요오도아세트산을 일부 아민을 카르복실산으로 전환시키는데 사용할 수 있다.
단백질 및 펩티드 둘 모두를 위해, 아민을 하기에 더 상세히 기재된 바와 같은 상이한 링커를 갖는 작용기로 전환시킨다. 이는 단백질 및 펩티드를 부착하기 위한 일반화기로서 기여할 것이다.
도 1 은 나노입자 작용화 및 펩티드 및 단백질의 나노입자에의 결합을 나타내는 개략도이다.
합성 및 코팅을 하기와 같이 수행한다: Thermo Fisher 를 통해 시판되는 NHS-LC-SPDP 는 둘 중 한쪽에 2 작용성 커플링 시약을 포함하는 장쇄 연장제이며, 이는 술파이드로 전환될 수 있는 디술파이드 및 아민에 대해 특이적이다.
한쪽 말단은 N-히드록시숙신이미드 에스테르를 갖지만, 연장제의 다른 한쪽 말단은 피리딜디티올기를 포함한다. 상기 디티올기를 환원시켜 술프히드릴을 생성할 수 있다. NHS-LC-SPDP 를 나노입자와 반응시키고, 미혼입된 NHS-LC-SPD 로부터 반응을 클리어 (cleared) 할 수 있다. 이후, 커플링된 나노입자를 도 1 에 나타낸 바와 같이 환원시킨다.
커플링된 단백질의 제조: 친화 컬럼을 사용해 정제한 생물학적 활성 단백질은 나노입자에의 결합을 촉진시키기 위해 첨가되는 카르복시-말단 리신 잔기로부터의 유리 엡실론-아민기를 포함한다. NHS-LC-SMCC 는 이작용성 커플링 시약으로서 사용된다. 분자는 LC1 사슬 연장제를 갖는다. 한쪽 말단은 아민에 대해 특이적인 N-히드록시숙신이미드 시약을 갖는다. 다른 한쪽 말단은 술프히드릴기에 매우 특이적인 말레이미드기를 포함한다. 일단 물질을 단백질에 커플링시키고 반응 혼합물로부터 분리시키면, 말레이미드 커플링된 단백질을 술프히드릴 함유 나노입자에 첨가할 것이다. 수득한 물질을 겔 여과에 의해 분리시킨다.
나노입자에의 펩티드 커플링: 상기 경우에, 펩티드는 또한 NHS 에스테르-LC-말레이미드 커플링을 위한 염기로서 기여하는 카르복시-말단 리신을 포함한다. 분자는 LC2 사슬 연장제를 갖는다. 모든 절차는 단백질에 대해 상기 기재된 것들과 유사하다.
최적화 동안, 막-투과성 펩티드 및 단백질을 나노입자에 커플링되는 분자의 최대수에 도달하도록 상이한 비로 혼합할 것이다. 이전에 공개된 연구를 기준으로, 나노입자 당 표면-지향 세포-투과 펩티드의 3-4 개의 분자는 초상자성 나노입자의 효율적인 세포내 전달에 충분하다.
LC2-연장제 암 (arm) 의 사용은 지향된 펩티드-기재 분자의 수를 증가시키는 중요한 수단을 제공한다. 상이한 농도의 NHS-LC-SPDP 의 사용은 나노입자의 표면에 정착된 펩티드 및 단백질 분자의 수를 증가시키는 것을 가능하게 하고, 따라서 더 효율적인 투과를 가능하게 하고, 결과적으로 더 강건한 세포 재프로그래밍 활성을 가능하게 한다.
하나의 나노입자 상의 펩티드 및 단백질의 부착: 이는 도 1 에 나타낸 절차를 사용해 달성될 수 있다. 상기 경우에, 소정비의 SMCC 라벨링된 단백질 및 펩티드를 비드에 첨가하고, 반응시킨다.
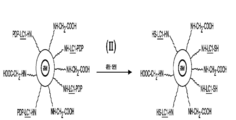
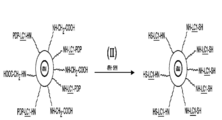
펩티드 및 단백질로 나노입자를 라벨링하는 또 다른 더 직접적이고 조절되는 방식은 2 개의 상이한 2 작용성 커플링 시약을 사용하는 것일 것이다 (도 2A-F). 반응 순서는 하기 기재된 일부 변형법과 함께 도 1 의 순서와 약간 유사하다.
요오도아세트산을 나노입자 표면에 선택된 수의 "카르복실"기를 도입시키는데 사용한다. 상기를 단계 I 에서 수행한다; 도2A-F, 단계 (I-VII) 을 참조.
NH-LC-SMCC 를 포함하는 펩티드를 아미노에탄올로 처리한다. 이는 술프히드릴기를 통한 연결부를 만들고, 유리 아미노기를 제공한다. 이후, 상기 아미노기를 EDAC (EDC) 를 사용해 나노입자 상의 카르복실기에 커플링시킨다. EDAC 는 1-에틸-3[3-디메틸아미노프로필] 카르보디이미드 히드로클로라이드로서 공지되어 있다. 상기 커플링 단계를 반응식의 마지막에 수행한다.
또 다른 양상에서, 본 발명은 또한 세포내 활성의 조정을 위한 작용화 나노입자에 부착되는 생물활성 분자의 전달 방법에 관한 것이다. 예를 들어, 시판되거나, 또는 표준 또는 개질된 실험 절차를 사용해 수득한 인간 세포, 섬유아세포 또는 기타 세포 유형을 우선 멸균 조건 하에 고체 표면 상에 세포가 부착되는 기질 (공급자 세포, 젤라틴, 마티겔 (martigel), 파이브로넥틴 등) 의 유무 하에 플레이팅한다. 플레이팅된 세포를 세포 분화/증식 또는 허용가능한 세포 생존력의 유지를 가능하게 하는 특정 인자 조합으로 소정 시간 동안 배양한다. 예는 혈청 및/또는 각종 성장 인자이며, 이는 이후에 철회되거나, 리프레싱될 수 있어 배양 지속될 수 있다. 플레이팅된 세포를 자기장의 유무 하에 본원에 기재된 각종 방법을 사용해 부착되는 생물활성 분자와 함께 작용화 생체적합한 세포-투과성 나노입자의 존재 하에 배양한다. 초상자성 나노입자의 경우에 자석의 사용은 세포 및 나노입자 사이의 접촉 표면적의 중요한 증가를 가능하게 하고, 이로써 세포막을 통한 작용화 나노입자의 추가로 개선된 투과를 강화한다. 필요시에, 세포 집단을 작용화 나노입자로 반복적으로 처리하여 생물활성 분자를 세포내로 전달한다.
상기 세포는 배양 매질 중에 현탁되고, 비(非)혼입된 나노입자는 원심분리 또는 세포 분리에 의해 제거되어, 남아있는 세포는 군집으로서 존재한다. 그 후, 상기 군집된 세포는 새로운 매질 중에 적합한 기간 동안 재현탁 및 재배양된다. 상기 세포는 세포내에서 유래된 특정한 생물활성 분자에 의해 야기되는 결과적인 생물학적 효과가 관찰될 때까지, 분리, 재현탁 및 재배양의 복수의 사이클을 거칠 수 있다.
본 발명의 일 목적은 세포 재프로그래밍에 영향을 미치는 화합물 (또는 화합물들)의 스크리닝이다. 이는 나노입자에 부착된 화합물을 본원에 개시된 하나 이상의 방법을 사용하여 관심있는 세포군과 조합하고, 적합한 기간 동안 배양한 후, 상기 화합물(들)에서 야기된 임의의 조절 효과를 측정하는 것을 포함한다. 이에는 세포 재프로그래밍의 개시 및 다분화성 줄기 세포의 생성, 보다 특정화된 또는 상이한 특정화 세포 유형으로의 분화 또는 전환분화, 독성, 대사 변화 또는 수축 작용 및 기타 기능에 대한 영향에 대한 세포의 시험이 포함될 수 있다.
본 발명의 또 다른 용도는 인간 또는 동물 신체의 치료를 위해 의도된 전달 장치에서의 또는 약제로서의 특정화된 세포의 제형이다. 이는 임상의가 손상된 조직 (심장, 근육, 간 등) 내 또는 주변의 세포를 맥관구조로부터 또는 직접적으로 근육 또는 기관벽 내로 투여하는 것을 가능하게 하여, 특정화된 세포가 융합하고, 손상을 제한하고, 조직의 근육계의 재생 및 특정화된 기능의 복구에 참여하는 것을 가능하게 한다.
본 발명의 용도는 원래의 게놈을 보존하면서 세포 재프로그래밍 및 줄기 또는 더욱 분화된 세포 유형의 생성을 보장하기 위하여, 나노입자를 Oct4 및 Sox2 전사 인자와 같은 기타 단백질과 관능화시키는 것을 포함한다.
본 발명의 또 다른 용도는 세포 재프로그래밍에 영향을 미치는 화합물 (또는 화합물들)의 스크리닝이다. 이는 나노입자에 부착된 화합물을 본원에 개시된 방법을 사용하여 관심있는 세포군과 조합하고, 적합한 기간 동안 배양한 후, 상기 화합물(들)에서 야기된 임의의 조절 효과를 측정하는 것을 포함한다. 이에는 세포 재프로그래밍의 개시 및 다분화성 줄기 세포의 생성, 보다 특정화된 또는 상이한 특정화 세포 유형으로의 분화 또는 전환분화, 독성, 대사 변화 또는 수축 작용 및 기타 기능에 대한 영향에 대한 세포의 시험이 포함될 수 있다.
본 발명의 다른 용도는 인간 또는 동물 신체의 치료를 위해 의도된 전달 장치에서의 또는 약제로서의 특정화된 세포의 제형이다. 이는 임상의가 손상된 조직 (심장, 근육, 간 등) 내 또는 주변의 세포를 맥관구조로부터 또는 직접적으로 근육 또는 기관벽 내로 투여하는 것을 가능하게 하여, 특정화된 세포가 융합하고, 손상을 제한하고, 조직의 근육계의 재생 및 특정화된 기능의 복구에 참여하는 것을 가능하게 한다.
추가적인 예시의 방법으로, 본 발명의 기타 측면을 하기 실시예에서 개시하지만, 이에 제한되는 것은 아니다.
실시예
실시예 1
GFP 를 가교제 (비드의 아민기에 부착됨) 로서 LC-SMM 를 사용하여 초상자성 입자와 연결한 후, GFP 상에 술프히드릴기와 직접적으로 커플링하였다. LC-SMCC (Thermo Fisher 사) 를 1 mg/ml 의 농도로 ACROS (밀봉된 바이알 및 무수) 의 디메틸포름아미드 (DMF) 중에 용해시켰다. 샘플을 밀봉하고, 바로 거의 즉시 사용하였다.
십 (10) ㎕의 상기 용액을 200 ㎕ 부피 중의 나노입자에 첨가하였다. 이는 존재하는 가능한 이용가능한 아민기에 대하여 과량의 SMCC 를 제공한 것으로, 상기 반응을 1 시간 동안 진행하였다. 과량의 SMCC 및 DMF 를 Amicon 스핀 여과기를 사용하여 3,000 달톤의 컷오프로 제거하였다. 적절한 완충액 교환을 보장하기 위하여 5 회의 부피 교환이 요구되었다. 과량의 SMCC 가 상기 단계에서 제거되는 것이 중요하였다.
임의의 펩티드 기반 분자 (예를 들어, 시판되는 Green Fluorescent Protein (GFP) 또는 정제된 재조합 GFP 또는 기타 단백질) 을 -30 ℃ 에서 동결시키기 위하여 일정량의 에틸렌 글리콜을 함유하는 용액에 첨가하였다. 14 ㎕ 중 3 ㎍ 의 단백질에, PBS 중 10 ㎕ 의 새로 제조된 DTT (디티오트레이톨, 클리랜드 (Cleland) 시약) 용액을 격렬한 볼텍싱 하에서 첨가하였다. 단백질이 통상적으로 하나 이상의 시스테인을 함유하기 때문에, 상이한 GFP 분자가 가교결합하는 경향이 있었다. 따라서, 과량의 DTT 는 디티올 연결을 감소시키고, GFP 를 유리시켰다. 반응을 4 ℃ 에서 2 시간 동안 진행한 후, 과량의 시약을 Amicon 스핀 여과기를 사용하여 3,000 MW 컷오프로 제거하였다.
활성화된 나노입자 및 단백질 용액을 수합하고, 2 시간 동안 반응하게 두고, 그 후 미반응된 단백질을 적절한 MW 컷오프 (GFP 의 예에서는, 50,000 달톤 컷오프임) 를 갖는 Amicon 원심분리 필터 장치에 의해 제거하였다. 샘플을 -80 ℃ 에서 보관하였다. 또한, 보다 수 용해성을 지닌 SMCC (술포-SMCC) 의 술포 유도체가 사용될 수 있다는 것에 주목해야 한다. DMSO 는 또한 라벨링제에 대해 용매 담체로서의 DMF 로 대체될 수 있으며; 또, 이것은 무수물이어야 한다.
실시예 2
이 방법에서는, 리신의 아미노기가 비드 상에서의 술히드릴기와의 커플링 반응에 사용되었다. pH 7.2 의 0.1 M 인산염 완충액으로 새로 평형화시킨 비드가 이들 시험에 사용되었다. 1 mg/ml (DMF 중) 의 LC-SPDP 를 새로 제조하였다. 10 마이크로리터의 SPDP 용액을 격렬한 볼텍싱 하에 비드 현탁액에 첨가하고, 1 시간 동안 반응하게 두었다. 이후, 미반응된 물질을 원심분리에 의해 제거하고, 나노입자를 10K 의 컷오프를 갖는 Amicon Spin 필터를 이용하여 인산염 완충액으로 세정하였다. SPDP 의 디술파이드 결합을 Clelands 시약을 이용해 끊었다; 1 mg 을 상기 용액에 첨가하고, 반응을 1 시간 동안 진행하게 두었다. 부산물 및 미반응된 Clelands 시약을 10K 의 컷오프를 갖는 Amicon spin 필터를 통해 제거하였다.
상기 반응이 진행되면서, GFP 는 N-에틸말레이미드를 이용해 블록킹되었다. 과잉의 에틸말레이미드를 GFP 용액에 첨가하였다. 반응을 실온에서 1 시간 동안 진행시키고, 원치않는 물질을 3K 의 컷오프를 갖는 Amicon Spin 필터를 이용해 제거하였다. 이후, GFP 를 과잉의 SMCC 와 1 시간 동안 반응하게 두었다. 그 후, GFP 를 스핀 칼럼 상에서 정제한 후, PDP-나노입자와 반응시켰다. 반응을 1 시간 동안 진행시키고, 최종 산물을 50K 의 컷오프를 갖는 Amicon spin 필터를 이용해 정제하였다.
실시예 3
시판되거나 또는 기재되어 있는 바와 같은 표준 실험 절차 [Moretti et al, Mouse and human induced pluripotent stem cells as a source for multipotent Isll cardiovascular progenitors. FASEB J. 24:700 (2010)] 를 이용하여 수득한 인간 섬유아세포를, 공급자 세포를 6-웰 플레이트 내 150,000 - 200,000 밀도로 예비플레이팅하거나 또는 예비플레이팅하는 일 없이, 고체 표면 상에서 무균 조건 하에 150,000 세포 밀도로 플레이팅한다. 상기 공급자 세포는 상업적으로 또는 표준 실험실 절차에 의해 수득하였다. 상기 플레이팅한 세포를 혈청-함유 배양 배지에서 세포 분할/증식 또는 허용가능한 세포 생존력의 유지를 가능하게 하는 특정 인자의 조합에 의해 어느 정도 시간 동안 배양하고, 이후 상기 배지를 철수하거나 새롭게 하여 배양을 5% CO2 및 대기 O2 에 의해 적신 인큐베이터에서 무균 조건 하에 지속하였다.
원뿔형 튜브의 바닥에서 수집한 세포 또는 플레이팅된 세포를, 자기장의 존재 또는 부재 하에 본원에 개시된 각종 방법을 이용하여, 생물활성 분자가 부착되어 있는 작용화된 생체적합성 세포-침투성 나노입자를 함유하는 50 마이크로리터의 현탁액으로 처리한다.
초상자성 나노입자의 경우 자기장의 이용은 세포와 나노입자 사이의 접촉 표면적의 중대한 증가를 제공함으로써, 세포막을 통한 작용화된 나노입자의 개선된 침투를 확보할 수 있다. 중요하게, PEG 가 부착되어 있는 수 개의 단백질-기재 약물 (PEG-GCSF, Amgen, CA; PEG-Interferon, Schering-Plough/Merck, NJ) 의 폴리(에틸렌 글리콜) PEG-매개의 보호와 유사하게, 커플링된 펩티드와 함께 사용된 나노입자는 폴리펩티드의 크기를 증대시키고 단백질의 표면을 마스킹함으로써, 단백질분해 효소에 의한 단백질 분해를 저감시키고 그 결과 사용된 단백질 분자의 안정성을 연장시킨다. 필요에 따라, 세포 집단을 작용화된 나노입자로 반복 처리하여 세포내에서 생물활성 분자를 전달시킨다.
상기 세포를 배양 배지에 현탁시키고, 비-혼입된 나노입자를 대략 1200 x g 에서의 10 분 동안의 원심분리에 의해 제거하여, 펠릿 내 군집으로서 존재하는 세포를 이탈시킨다. 이후, 군집된 세포를 재현탁시키고, 유사한 절차를 이용해 다시 세정하고, 적절한 기간 동안 새로운 배지에서 재배양한다. 세포내에서 전달된 특정 생물활성 분자에 의해 촉발된 결과적인 생물학적 효과가 관찰될 때까지 다수의 분리, 재현탁 및 재배양 사이클을 통해 세포를 취할 수 있다.
녹색 형광 단백질에 관한 상기 특정 실시예에서, 세포-침투 나노입자는 세포 내부에서 단백질을 전달하고, 이것은 표적 세포에 의한 새로운 녹색 형광성의 획득을 부여한다. 이러한 새로 획득된 특성은 각종 적용에 추가로 사용될 수 있는 고도의 동종성으로 세포내 전달된 단밸질을 갖는 세포의 후속적인 분류 및 분리를 가능하게 한다. 중요하게는, 단백질 부착된 세포-침투성 작용화된 나노입자의 이용은 세포 게놈 내로의 어떠한 통합도 없으며, 이에 의해 신규한 (이 경우에는 형광) 특성을 갖는 모든 세포가 무결점 게놈을 확실하게 유지하고 세포 DNA 의 완전성을 보존하는 것이 보장된다.
본 발명은 그의 취지 및 필수적인 특징으로부터 벗어나지 않으면서 다른 특정한 형태로 구현될 수 있다. 상기 구현예는 따라서 본원에 기재된 발명을 제한하기보다는 예시하는 것으로서 고려된다. 즉, 본 발명의 범위는 상기 설명에 의해서라기 보다는 첨부된 청구범위에 의해 제시되며, 청구범위의 균등성의 의미 및 범위 내에 들어오는 모든 변경들은 본원에 포함되는 것으로 의도된다.
Claims (12)
- 세포 기능을 조정하기 위한 하나 이상의 생물활성 (bioactive) 분자를 포유동물의 세포막을 관통하여 세포 내로 전달하기 위한 작용화 생체적합성 나노입자로서, 상기 작용화 생체적합성 나노입자는:
크기 범위가 5 내지 50 nm 이고, 그에 중합체 코팅을 갖는 중심 나노입자 및
상기 중합체 코팅에 공유결합으로 부착된 하나 이상의 작용기를 포함하고,
상기 하나 이상의 생물활성 분자는 상기 하나 이상의 작용기에 부착되고,
상기 하나 이상의 생물활성 분자는 상기 포유동물의 세포막을 관통하여 상기 세포 내로 진입하기 위한 하나 이상의 세포 관통 펩티드 및 상기 세포 내 세포 기능을 조정하기 위한 하나 이상의 전사 인자를 포함하고,
각각의 상기 세포 관통 펩티드는 상기 중합체 코팅에 공유결합으로 부착된 첫 번째 작용기에 첫 번째 링커 분자를 통해 부착되고,
각각의 상기 전사 인자는 상기 중합체 코팅에 공유결합으로 부착된 두 번째 작용기에 두 번째 링커 분자를 통해 부착되고,
각각의 세포 관통 펩티드는 각각의 상기 전사 인자로부터 독립적으로 상기 나노 입자에 부착되는, 작용화 생체적합성 나노입자. - 제 1 항에 있어서, 상기 나노입자가 철을 포함하는, 작용화 생체적합성 나노입자.
- 제 1 항에 있어서, 하나 이상의 상기 세포 관통 펩티드가 5 내지 9 개의 염기성 아미노산을 포함하는, 작용화 생체적합성 나노입자.
- 제 1 항에 있어서, 하나 이상의 상기 세포 관통 펩티드가 9 개 이상의 염기성 아미노산을 포함하는, 작용화 생체적합성 나노입자.
- 제 1 항에 있어서, 하나 이상의 상기 전사 인자가 Oct4, Sox2, Nanog, Lin28, cMyc, 및 Klf4 로 이루어진 군으로부터 선택되는, 작용화 생체적합성 나노입자.
- 유효량의 제 1 항의 작용화 생체적합성 나노입자를 세포에 투여하고, 세포 내 세포 작용성을 변경하는 것을 포함하는, 분리된 포유동물의 세포 내 세포 작용성의 변경 방법.
- 제 6 항에 있어서, 상기 세포 작용성의 상기 변경이 세포의 물리-화학적 특성의 변경을 포함하는, 분리된 포유동물 세포 내 세포 작용성의 변경 방법.
- 제 6 항에 있어서, 상기 세포 작용성의 상기 변경이 상기 세포의 증식 특성의 변경을 포함하는, 분리된 포유동물 세포 내 세포 작용성의 변경 방법.
- 제 6 항에 있어서, 상기 세포 작용성의 상기 변경이 상기 세포의 생존능의 변경을 포함하는, 분리된 포유동물 세포 내 세포 작용성의 변경 방법.
- 제 6 항에 있어서, 상기 세포 작용성의 상기 변경이 상기 세포의 형태적 표현형 특성의 변경을 포함하는, 분리된 포유동물 세포 내 세포 작용성의 변경 방법.
- 제 6 항에 있어서, 상기 세포 작용성의 상기 변경이, 줄기 세포 또는 보다 분화된 세포 유형을 비롯한 새로운 세포 유형을 생성하도록 하는 세포의 획득된 능력과 관련된, 분리된 포유동물 세포 내 세포 작용성의 변경 방법.
- 제 1 항에 있어서, 상기 첫 번째 링커 분자가 상기 두 번째 링커 분자와 다른 길이를 갖는, 작용화 생체적합성 나노입자.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161550213P | 2011-10-21 | 2011-10-21 | |
| US61/550,213 | 2011-10-21 | ||
| PCT/US2012/061391 WO2013059831A1 (en) | 2011-10-21 | 2012-10-22 | Functionalized nanoparticles for intracellular delivery of biologically active molecules |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197018256A Division KR20190077124A (ko) | 2011-10-21 | 2012-10-22 | 생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200040924A true KR20200040924A (ko) | 2020-04-20 |
Family
ID=48141479
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207010401A KR20200040924A (ko) | 2011-10-21 | 2012-10-22 | 생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 |
| KR20147010620A KR20150001711A (ko) | 2011-10-21 | 2012-10-22 | 생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 |
| KR1020197018256A KR20190077124A (ko) | 2011-10-21 | 2012-10-22 | 생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR20147010620A KR20150001711A (ko) | 2011-10-21 | 2012-10-22 | 생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 |
| KR1020197018256A KR20190077124A (ko) | 2011-10-21 | 2012-10-22 | 생물학적 활성 분자의 세포내 전달을 위한 작용화 나노입자 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US9675708B2 (ko) |
| EP (2) | EP3400956A1 (ko) |
| JP (3) | JP2014532628A (ko) |
| KR (3) | KR20200040924A (ko) |
| CN (2) | CN104094119A (ko) |
| AU (3) | AU2012325723A1 (ko) |
| BR (1) | BR112014009753B1 (ko) |
| CA (2) | CA2938661A1 (ko) |
| HK (1) | HK1201089A1 (ko) |
| IN (1) | IN2014DN03224A (ko) |
| MX (3) | MX2014004778A (ko) |
| RU (2) | RU2018135567A (ko) |
| SG (2) | SG10201601746TA (ko) |
| WO (1) | WO2013059831A1 (ko) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2012325723A1 (en) * | 2011-10-21 | 2014-05-15 | Stemgenics, Inc | Functionalized nanoparticles for intracellular delivery of biologically active molecules |
| EP3673913A1 (en) | 2013-03-01 | 2020-07-01 | Stealth Biotherapeutics Corp | Methods for the treatment of mitochondrial disease |
| HUE046924T2 (hu) * | 2013-03-01 | 2020-03-30 | Stealth Biotherapeutics Corp | Módszerek és készítmények Barth szindróma megelõzésében vagy kezelésében történõ alkalmazásra |
| CA2916977A1 (en) | 2013-06-26 | 2014-12-31 | Stealth Biotherapeutics Corp | Methods and compositions for detecting and diagnosing diseases and conditions |
| US10100332B2 (en) | 2013-08-23 | 2018-10-16 | Rutgers, The State University Of New Jersey | Biologically active synthetic nanoparticle constructs and methods of use thereof |
| US11306326B2 (en) | 2013-08-23 | 2022-04-19 | Rutgers, The State University Of New Jersey | Biologically active synthetic nanoparticle constructs and methods of use thereof |
| EP3105318A1 (en) * | 2014-02-10 | 2016-12-21 | Nvigen, Inc. | Cell modulation nanocomposition, and methods of use |
| CN105440112A (zh) * | 2015-12-07 | 2016-03-30 | 国家纳米科学中心 | 多肽-白蛋白偶联药物、其制备方法及应用 |
| KR20190028665A (ko) * | 2016-06-03 | 2019-03-19 | 스템제닉스 인코포레이티드 | 기능화된 나노입자(functionalized nanoparticles)를 사용하여 선택된(예정된) 분화된 세포에 대한 사람 체세포의 직접적인 재프로그래밍 |
| US20210154323A1 (en) * | 2016-06-03 | 2021-05-27 | Stemgenics, Inc. | Functionalized nanoparticles for the intracellular delivery of biologically active molecules and methods for their manufacture and use |
| US20190233820A1 (en) * | 2016-10-11 | 2019-08-01 | Stemgenics, Inc. | Nanoparticles functionalized with gene editing tools and related methods |
| US11491114B2 (en) | 2016-10-12 | 2022-11-08 | Curioralrx, Llc | Formulations for enteric delivery of therapeutic agents |
| JOP20190248A1 (ar) | 2017-04-21 | 2019-10-20 | Amgen Inc | بروتينات ربط مولد ضد trem2 واستخداماته |
| WO2018226529A1 (en) * | 2017-06-05 | 2018-12-13 | The Regents Of The University Of Michigan | Complexes for delivery of antigenic peptides |
| CN108287235B (zh) * | 2018-02-07 | 2021-03-09 | 常州天地人和生物科技有限公司 | 一种高效、稳定的磁性免疫微球的制备和应用 |
| US20200326325A1 (en) | 2019-04-12 | 2020-10-15 | Lisa Diamond | Nanosensor chip with compound nanopores |
| CN110642876A (zh) * | 2019-10-10 | 2020-01-03 | 南京市口腔医院 | 半胱氨酸修饰金纳米颗粒和制备方法、应用及促进骨组织再生产品 |
| CN112472685B (zh) * | 2020-12-10 | 2023-03-24 | 哈尔滨工业大学 | 一种杂化中性粒细胞机器人的制备方法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6767635B1 (en) * | 1999-09-14 | 2004-07-27 | Biomedical Apherese Systeme Gmbh | Magnetic nanoparticles having biochemical activity, method for the production thereof and their use |
| US7329638B2 (en) | 2003-04-30 | 2008-02-12 | The Regents Of The University Of Michigan | Drug delivery compositions |
| CN101389314A (zh) * | 2005-03-14 | 2009-03-18 | 得克萨斯大学体系董事会 | 生物活性fus1肽和纳米颗粒-多肽复合物 |
| EP1957045A2 (en) * | 2005-03-14 | 2008-08-20 | Board of Regents, The University of Texas System | Bioactive fus1 peptides and nanoprticle-polypeptide complexes |
| CA2611985C (en) * | 2005-06-17 | 2016-08-16 | The University Of North Carolina At Chapel Hill | Nanoparticle fabrication methods, systems, and materials |
| EP2099496A2 (en) * | 2006-12-08 | 2009-09-16 | Massachusetts Institute of Technology | Delivery of nanoparticles and/or agents to cells |
| CA2672998C (en) | 2007-01-02 | 2013-08-06 | University Of Central Florida Research Foundation, Inc. | Methods and materials for stimulating proliferation of stem cells |
| KR100925689B1 (ko) * | 2007-07-25 | 2009-11-10 | 한국생명공학연구원 | 항체와 나노입자를 세포 내로 동시에 전달할 수 있는다기능성 단백질 |
| WO2009035541A1 (en) | 2007-09-10 | 2009-03-19 | Merck & Co., Inc. | Method of treating inherited severe neutropenia |
| KR100951719B1 (ko) * | 2007-10-02 | 2010-04-07 | 재단법인서울대학교산학협력재단 | 세포투과성 펩타이드와 형광표지 자성나노입자의 복합체 및그 용도 |
| US20110190729A1 (en) * | 2007-11-30 | 2011-08-04 | Cytomatrix Pty Ltd | Methods of inducing pluripotency involving sox2 protein |
| AU2009215426B2 (en) * | 2008-02-21 | 2015-06-11 | Burnham Institute For Medical Research | Methods and compositions related to peptides and proteins with C-terminal elements |
| CA2748009A1 (en) * | 2008-12-23 | 2010-07-01 | Vivoscript, Inc. | Compositions and methods for re-programming cells without genetic modification |
| TWI576432B (zh) * | 2009-04-07 | 2017-04-01 | 陶氏農業科學公司 | 序列特異性核酸酶之奈米粒子媒介式遞送技術 |
| AU2012325723A1 (en) * | 2011-10-21 | 2014-05-15 | Stemgenics, Inc | Functionalized nanoparticles for intracellular delivery of biologically active molecules |
-
2012
- 2012-10-22 AU AU2012325723A patent/AU2012325723A1/en not_active Abandoned
- 2012-10-22 RU RU2018135567A patent/RU2018135567A/ru not_active Application Discontinuation
- 2012-10-22 WO PCT/US2012/061391 patent/WO2013059831A1/en active Application Filing
- 2012-10-22 US US14/353,280 patent/US9675708B2/en active Active - Reinstated
- 2012-10-22 BR BR112014009753-4A patent/BR112014009753B1/pt active IP Right Grant
- 2012-10-22 CA CA2938661A patent/CA2938661A1/en not_active Abandoned
- 2012-10-22 MX MX2014004778A patent/MX2014004778A/es unknown
- 2012-10-22 MX MX2018002306A patent/MX367656B/es unknown
- 2012-10-22 EP EP18160010.7A patent/EP3400956A1/en not_active Withdrawn
- 2012-10-22 RU RU2014120465/15A patent/RU2014120465A/ru unknown
- 2012-10-22 CA CA2853128A patent/CA2853128C/en active Active
- 2012-10-22 CN CN201280063870.2A patent/CN104094119A/zh active Pending
- 2012-10-22 SG SG10201601746TA patent/SG10201601746TA/en unknown
- 2012-10-22 EP EP12842115.3A patent/EP2769217A4/en not_active Withdrawn
- 2012-10-22 KR KR1020207010401A patent/KR20200040924A/ko not_active Application Discontinuation
- 2012-10-22 KR KR20147010620A patent/KR20150001711A/ko active Application Filing
- 2012-10-22 JP JP2014537369A patent/JP2014532628A/ja not_active Withdrawn
- 2012-10-22 SG SG11201401658SA patent/SG11201401658SA/en unknown
- 2012-10-22 KR KR1020197018256A patent/KR20190077124A/ko not_active Application Discontinuation
- 2012-10-22 IN IN3224DEN2014 patent/IN2014DN03224A/en unknown
- 2012-10-22 CN CN201610644097.9A patent/CN106822868A/zh active Pending
-
2014
- 2014-04-21 MX MX2018010696A patent/MX2018010696A/es unknown
-
2015
- 2015-02-12 HK HK15101563.8A patent/HK1201089A1/xx unknown
-
2017
- 2017-06-30 JP JP2017128822A patent/JP6560302B2/ja not_active Expired - Fee Related
-
2018
- 2018-05-31 AU AU2018203848A patent/AU2018203848A1/en not_active Abandoned
- 2018-09-03 JP JP2018164676A patent/JP2018184485A/ja active Pending
-
2020
- 2020-08-27 AU AU2020223737A patent/AU2020223737A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| AU2020223737A1 (en) | 2020-09-17 |
| BR112014009753B1 (pt) | 2020-09-15 |
| RU2014120465A (ru) | 2015-11-27 |
| HK1201089A1 (en) | 2015-08-21 |
| US9675708B2 (en) | 2017-06-13 |
| JP2017165781A (ja) | 2017-09-21 |
| AU2018203848A1 (en) | 2018-06-21 |
| MX2014004778A (es) | 2014-10-17 |
| CA2938661A1 (en) | 2013-04-25 |
| IN2014DN03224A (ko) | 2015-05-22 |
| KR20150001711A (ko) | 2015-01-06 |
| JP6560302B2 (ja) | 2019-08-14 |
| CN106822868A (zh) | 2017-06-13 |
| SG11201401658SA (en) | 2014-07-30 |
| MX2018010696A (es) | 2020-09-02 |
| AU2012325723A1 (en) | 2014-05-15 |
| JP2014532628A (ja) | 2014-12-08 |
| WO2013059831A1 (en) | 2013-04-25 |
| KR20190077124A (ko) | 2019-07-02 |
| CN104094119A (zh) | 2014-10-08 |
| RU2018135567A (ru) | 2018-11-15 |
| EP2769217A4 (en) | 2015-06-03 |
| US20140342004A1 (en) | 2014-11-20 |
| MX367656B (es) | 2019-08-29 |
| JP2018184485A (ja) | 2018-11-22 |
| CA2853128C (en) | 2016-09-27 |
| BR112014009753A2 (pt) | 2017-04-25 |
| EP2769217A1 (en) | 2014-08-27 |
| CA2853128A1 (en) | 2013-04-25 |
| EP3400956A1 (en) | 2018-11-14 |
| SG10201601746TA (en) | 2016-04-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6560302B2 (ja) | 生物活性分子の細胞内輸送のための機能性ナノ粒子 | |
| US10179194B2 (en) | Self-assembling peptides, peptidomimetics and peptidic conjugates as building blocks for biofabrication and printing | |
| US7399831B2 (en) | Targeted delivery of biological factors using self-assembling peptide nanofibers | |
| JP2020519605A (ja) | 組織エンジニアリングおよびバイオプリンティングにおける使用のためのゲルを形成し得るペプチド | |
| EP3261677B1 (en) | Targeted transplantation of mitochondria to hepatocytes | |
| Suh et al. | Efficient labeling of mesenchymal stem cells using cell permeable magnetic nanoparticles | |
| JPS62181221A (ja) | 免疫不全症候群治療用医薬組成物 | |
| Li et al. | Nanoparticle-mediated conversion of primary human astrocytes into neurons and oligodendrocytes | |
| US20180346930A1 (en) | Biologically active synthetic nanoparticle constructs and methods of use thereof | |
| EP3638313B1 (en) | Non-covalently assembled biomatrix layer | |
| US11298424B2 (en) | Non-ionic and thermoresponsive diblock copolypeptide hydrogels for delivery of molecules and cells | |
| EP4317190A1 (en) | C-met protein-binding peptide complex | |
| US11306326B2 (en) | Biologically active synthetic nanoparticle constructs and methods of use thereof | |
| Ma | Engineered Biomaterials for Human Neural Stem Cell Applications |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |