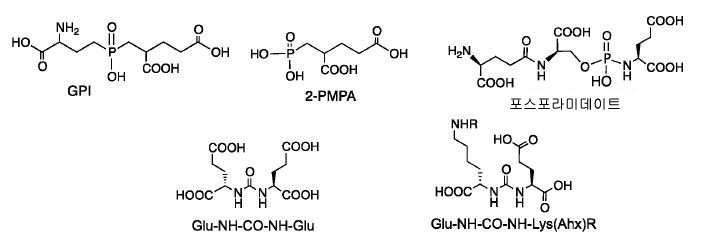
PET/CT를 위한 방사성 의약품을 얻기에 매력적이고 변통적인 접근법은 68Ga (T1/2 = 68 분) PET 영상화제를 제조하기 위해 68Ge/68Ga 발생제를 사용하는 것이다. PET 영상화를 위해 68Ga를 이용하는 것에는 몇 가지 장점이 존재한다: (1) 이것은 짧은-수명의 양전자 방출제이다(반-감기 68 분, β+). (2) 68Ge/68Ga 발생제는 근접 입자가속기가 없는 실험실 환경에서 68Ga를 쉽게 만든다. (3) 모원소, 68Ge는 270일의 물리적 반-감기를 가져, 6 내지 12달의 유용한 수명을 제공한다. (4) 현재 통상 기준으로의 임상적 실시를 위해 이러한 발생제를 제공하는 몇몇 유통 판매 업체가 존재한다. (5) Ga(III)의 배위 화학은 고도로 유연하며 여러가지 안정성 상수 및 금속 킬레이트화 선택성을 가지는 다량의 Ga 킬레이트가 보고되어 있으며; 68Ga 방사성 의약품이 암 진단을 위한 다양한 조직 또는 생리학적 과정을 표적화하는 것이 입증되어 있다. (6) 고려해야 하는 중요한 요인은 18F 및 68Ga에 대해 방출하는 β+ 에너지가 각각 0.63 MeV 및 1.90 MeV라는 점이다. 그러나, β+ 에너지에서의 차이에도 불구하고, 18F 및 68Ga 방사성 의약품은 인간 조직에서 유사한 공간 분해능, 감수성, 영상 대조, 및 활성 회복 계수를 제공하고, 이들은 인간에서 필적하는 임상적 영상을 만든다. 상기 나열된 이러한 요인들은 이들로 하여금 임상적 진단을 위한 68Ga 방사성 의약품의 개발에 적합하게 만든다.
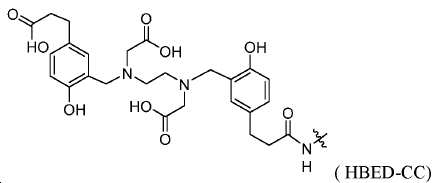
지난 20년 동안 다양한 종양의 영상화를 위해 68Ga 표지된 소형 분자 및 펩티드를 이용하는 것에 관한 많은 보고가 존재하였다. 그중에서도 [68Ga]DOTA-TOC, [68Ga]DOTA-TATE, 및 [68Ga]DOTA-NOC는 소마토스타틴 수용체를 발현하는 신경내분비계 종양 (NET)을 검출하기 위해 가장 흔히 사용되는 물질이다. 68Ga 물질, 가령 NOTA, HBED-CC, TRAP을 만들기 위한 추가적인 킬레이트, 및 많은 다른 폴리아자 카르복실산이 보고되어 있다(도식 7). 향상된 킬레이트, 가령 NOTA, NODAGA, 및 NOTGA는 실온에서 안정한 68Ga 표지된 복합체(즉 시험관 내 및 생체 내에서 안정함)를 형성하는 장점을 가질 것이며, 이는 제조를 단순하게 하고 이를 임상 환경에 더 적절하게 만든다. Ga-HBED, Ga-NOTA, 및 Ga-DOTA에 대한 안정성 상수(로그 Kd)는 각각 39, 31, 및 21임이 이미 보고되어 있다.
도식 7
68Ga 표지된 물질은 근접 입자가속기에 대한 필요성 없이 발생제-기반 PET 영상화제로의 대안적인 접근법을 제공한다. 몇몇 상이한 버전의 68Ga 표지된 PSMA 영상화제가 최근에 보고되었다. Ga(III) 복합화를 위한 킬레이트화 기, 가령 DOTA, 트리아자사이클로노난-트리포스피네이트, 1,4,7-트리아자사이클로노난-1,4-비스[메틸렌(하이드록시메틸)포스핀산]-7-[메틸렌(2-카르복시에틸)포스핀산] (NOPO), H2CHX데드파 (사이클로헥실-1,2-[[6-카르복시-피리딘-2-일]-메틸아미노]에탄), 및 (5S,8S,22S,26S)-1-아미노-5,8-디벤질-4,7,10,19,24-펜타옥소-3,6,9,18,23,25-헥사아자옥타코산-22,26,28-트리-카르복실산 트리플루오로아세테이트(CHX-A''-DTPA-DUPA-Pep)가 보고되어 있다. 모든 Ga-PSMA 태그 복합체는 시험관 내 PSMA 발현 종양 모델의 높은 친화성 결합 및 효과적인 표적화를 나타내었다. 하지만, 제한된 전임상 데이터만이 이들 68Ga 표지된 물질에 대해 입수가능하다.
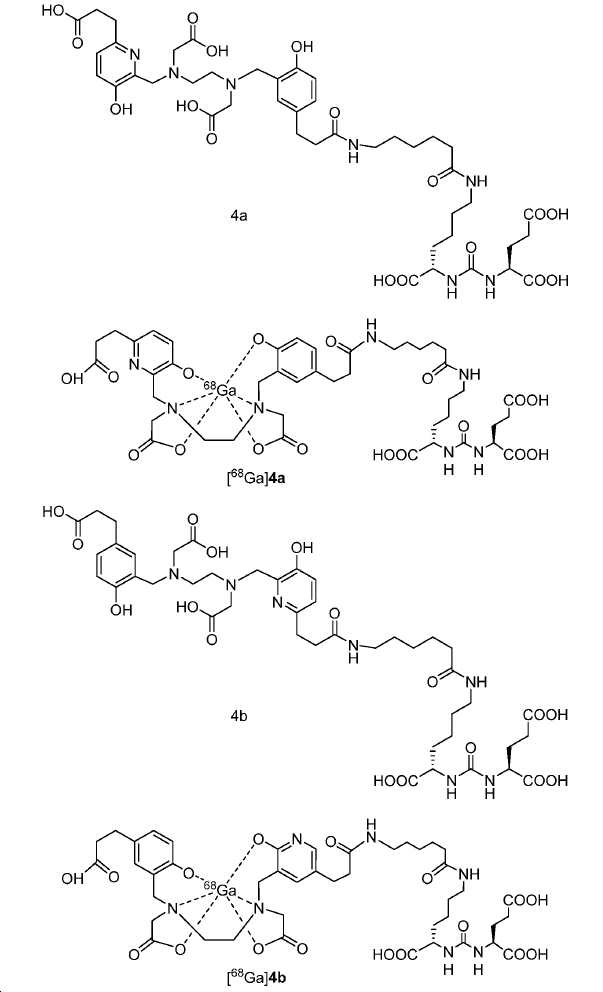
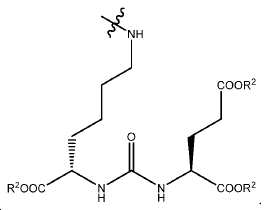
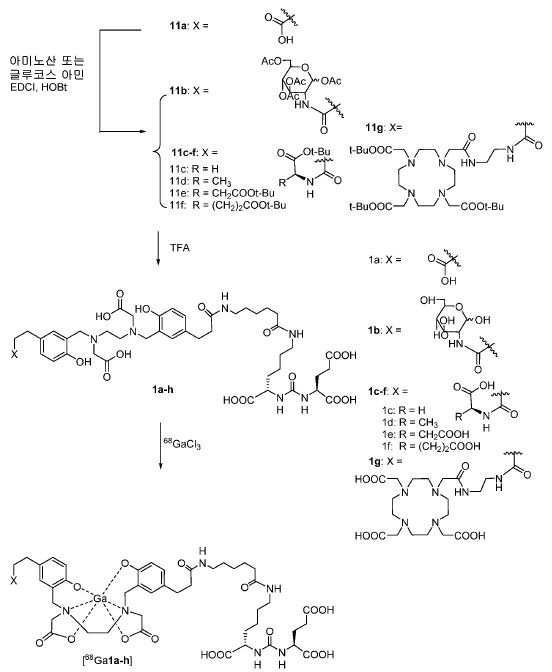
신규한 아미드 유도체 1b-g (도식 8)가 제조되었다. 특히 흥미롭고 신규한 것은 HBED (Ga(III)를 킬레이트화) 및 DOTA (방사선 요법을 위한 다른 방사성 금속을 킬레이트화) 모이어티 둘다가 한 분자 내에 포함된 리간드 1g이다. 이러한 접근법은 복수의 적용을 위해 상이한 유형의 방사성 금속을 표지하기 위한 하나의 리간드의 사용을 가능하게 한다. 추가적으로, 디-피리딜 유도체 2 및 3, 및 모노-피리딜 유도체, 4a 및 4b가 또한 제조되었다.
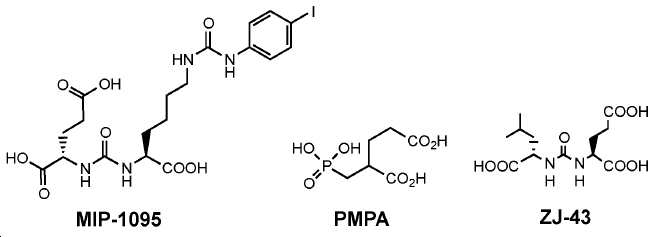
68Ga 표지된 Glu-NH-CO-NH-Lys(Ahx)-HBED-CC, [68Ga]1a를 이용한 종양 표적화 전립선-특이적 막 항원 (PSMA)의 성공적인 PET/CT 영상화 연구는 전립선 암의 진단에서 임상을 위해 대단한 가능성을 입증하였고; 인간에서 [68Ga]1a를 이용한 성공적인 영상화 연구는 널리 보고되어 있다. HBED-CC 유도체 함유 아미노산, 2-글루코사민 및 DOTA (1b-g), 디-피리딜 유도체 (2 및 3) 및 모노-피리딜 유도체 (4a 및 4b)를 비롯한 다섯 가지 상이한 일련의 Glu-NH-CO-NH-Lys(Ahx) 아미드 유도체가 제조되었다(도식 8). "차가운" 리간드인, 1b-g, 2, 3, 4a 및 4b는 PSMA 결합 부위에 대해 매우 우수한 결합 친화성(IC50 = 3 -35 nM)을 나타내었다. 이들 신규한 리간드, 1b-g, 2, 3, 4a 및 4b는 높은 수율 및 우수한 방사화학적 순도를 가지는 [68Ga]GaCl3로 표지되었다. 마우스에서 [68Ga]1b-g, 4a 및 4b의 정맥 내 주사 후 생체 내 생물학적 분배 연구 결과는 이들이 PSMA 부위를 발현하는 조직에서 특이적으로 국재화되어 있음을 시사하였다. 따라서, [68Ga]1b-g, 4a 및 4b는 종양 조직 내에서 PSMA 발현을 검출하기 위한 영상화제로서 유용하다. DOTA 함유 유도체, 1g는 또한 PSMA 발현 종양의 방사선 요법을 위해 177Lu, 90Y 및 213Bi로 별도로 표지될 수 있다.
도식 8
도식 8 (이어서)
도식 8 (이어서)
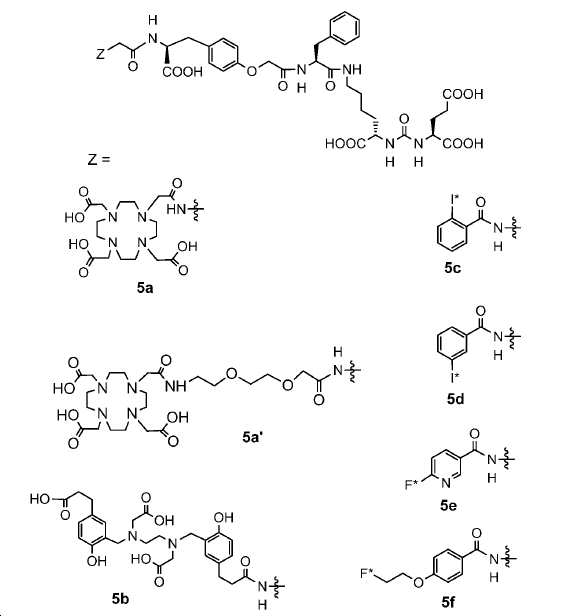
신규한 페녹시 링커를 가지는 화합물이 제조되었다. 우레아계 PSMA 표적화 모이어티의 하위-구조 및 신규한 링커를 포함하는 이러한 일련의 PSMA 저해제는 시험관 내 결합, 종양 세포 흡수 뿐만 아니라 생체 내 생물학적 분배 연구에 의해 시험되었다. 이들 PSMA 저해제는 [68Ga]1a와 동일하거나 더 나은 결합 친화성을 나타내었다. 신규한 PSMA 저해제, 가령 화합물 5a, 5a', 및 5b는 킬레이트화 모이어티를 가질 수 있고; 또는 가령 화합물 5c, 5d, 5e, 및 5f는 방사성 기를 가질 수 있다(도식 9).
도식 9
한 구체예에서, 본 발명은 식 I에 따른 화합물:
또는 이들의 약제학적으로 허용되는 염에 관한 것이며, 여기서
A1 및 A2는 독립적으로 사슬, 고리, 또는 이들의 조합 내에 1 내지 10개의 탄소 원자를 포함하는 2가 연결 모이어티이고, 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체되고;
B는 CR4R5이고;
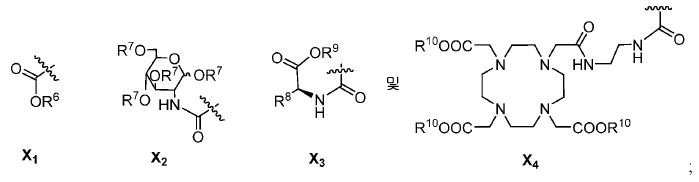
X는 다음으로 이루어진 군에서 선택되고:
Y1, Y2, Y3, Y4, Y5, 및 Y6는 독립적으로 CH 또는 N이고;
R1, R2, R6, R9, 및 R10는 독립적으로 수소 또는 카르복실산 보호기이고;
R3는 수소, 알킬, 사이클로알킬, 헤테로사이클로알킬, 아릴, 알킬아릴, 및 헤테로아릴로 이루어진 군에서 선택된다.
R4 및 R5는 독립적으로 수소, (C1-C6) 알킬 기, 에틸렌 글리코일 기, 또는 프로필렌 글리코일 기이고;
R7는 수소 또는 (C1-C6) 알카노일 기이고; 및
R8는 수소 또는 아미노산의 α-위치 치환기이고,
다만 A1, A2, 및 B가 CH2이고 Y1, Y2, Y3, Y4, Y5, 및 Y6이 CH일 때, X는 X1이 아니다.
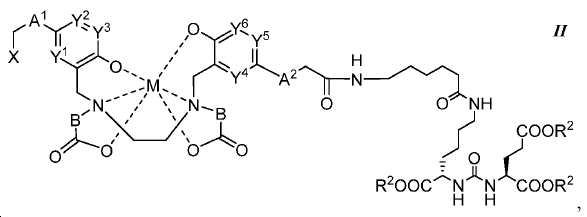
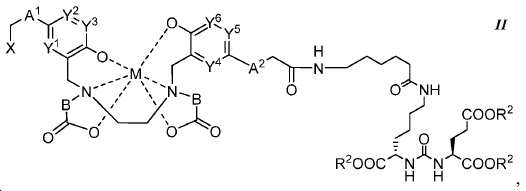
또다른 구체예에서, 본 발명은 식 II에 따른 화합물에 관한 것이며:
여기서
A1 및 A2는 독립적으로 사슬, 고리, 또는 이들의 조합 내에 1 내지 10개의 탄소 원자를 포함하는 2가 연결 모이어티이고, 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체되고;
B는 CR4R5이고;
X는 다음으로 이루어진 군에서 선택되고:
Y1, Y2, Y3, Y4, Y5, 및 Y6는 독립적으로 CH 또는 N이고;
R1, R2, R6, R9, 및 R10는 독립적으로 수소 또는 카르복실산 보호기이고;
R3는 수소, 알킬, 사이클로알킬, 헤테로사이클로알킬, 아릴, 알킬아릴, 및 헤테로아릴로 이루어진 군에서 선택된다.
R4 및 R5는 독립적으로 수소, (C1-C6) 알킬 기, 에틸렌 글리코일 기, 또는 프로필렌 글리코일 기이고;
R7는 수소 또는 (C1-C6) 알카노일 기이고;
R8는 수소 또는 아미노산의 α-위치 치환기이고; 및
M은 44Sc, 47Sc, 67Ga, 68Ga, 99mTc, 72As, 111In, 90Y, 97Ru, 62Cu, 64Cu, 52Fe, 52mMn, 140La, 175Yb, 153Sm, 166Ho, 149Pm, 177Lu, 142Pr, 159Gd, 213Bi, 149Pm, 67Cu, 111Ag, 199Au, 161Tb, 203Pb, 및 51Cr으로 이루어진 군에서 선택된 금속이고,
다만 A1, A2, 및 B가 CH2이고 Y1, Y2, Y3, Y4, Y5, 및 Y6이 CH일 때, X는 X1이 아니다.
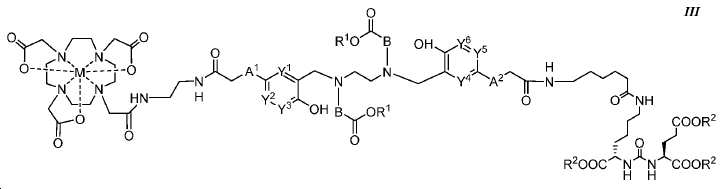
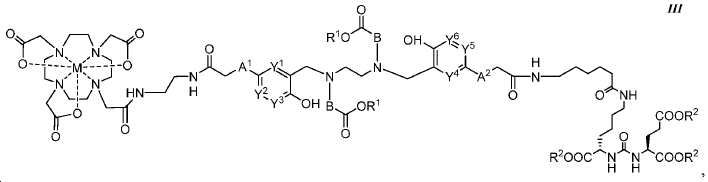
또다른 구체예에서, 본 발명은 식 III에 따른 화합물에 관한 것이며:
여기서
A1 및 A2는 독립적으로 사슬, 고리, 또는 이들의 조합 내에 1 내지 10개의 탄소 원자를 포함하는 2가 연결 모이어티이고, 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체되고;
B는 CR4R5이고;
Y1, Y2, Y3, Y4, Y5, 및 Y6는 독립적으로 CH 또는 N이고;
R1 및 R2는 독립적으로 수소 또는 카르복실산 보호기이고;
R3는 수소, 알킬, 사이클로알킬, 헤테로사이클로알킬, 아릴, 알킬아릴, 및 헤테로아릴로 이루어진 군에서 선택된다.
R4 및 R5는 독립적으로 수소, (C1-C6) 알킬 기, 에틸렌 글리코일 기, 또는 프로필렌 글리코일 기이고; 및
M은 44Sc, 47Sc, 68Ga, 99mTc, 111In, 90Y, 153Sm, 166Ho, 177Lu, 159Gd, 213Bi, 149Pm, 161Tb, 203Pb, 및 51Cr으로 이루어진 군에서 선택된 킬레이트화 금속이다.
특정한 구체예에서, 본 발명의 화합물은 일반식 I, II, 및 III 및 수반되는 정의에 의해 표시되며, 여기서 A1 및 A2는 독립적으로 사슬, 고리, 또는 이들의 조합 내에 1 내지 10개의 탄소 원자를 포함하는 2가 연결 모이어티이고, 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체된다. 또다른 구체예에서, A1 및 A2는 독립적으로 C1-C10 알킬렌 기를 포함하는 2가 연결 모이어티이고 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체된다. 또다른 구체예에서, A1 및 A2는 독립적으로 (CH2)n이고, 여기서 n은 0 내지 6 중의 한 정수이다. 또다른 구체예에서, A1 및 A2는 독립적으로 (CH2)n이고, 여기서 n은 1, 2, 또는 3이다. 또다른 구체예에서, A1 및 A2는 CH2이다. 2가 연결 모이어티의 유용한 예시는 -CH2-, -CH2CH2-, -CH2CH2CH2-, -OCH2-, -OCH2CH2-, -OCH2CH2CH2-, -NHCH2-, -NHCH2CH2-, -NHCH2CH2CH2-, -COCH2-, -COCH2CH2-, 및 -COCH2CH2CH2-를 포함한다.
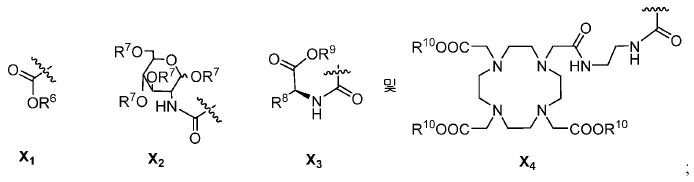
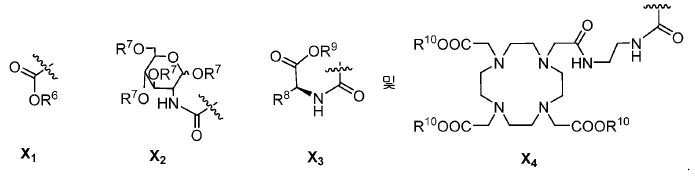
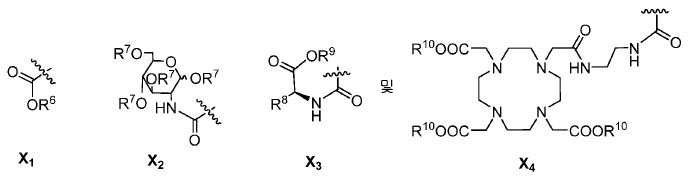
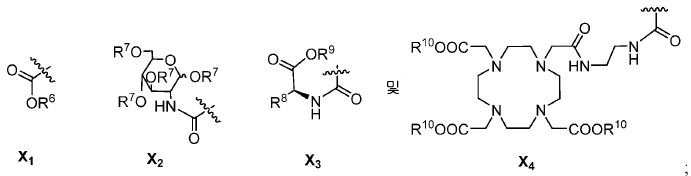
특정한 구체예에서, 본 발명의 화합물은 일반식 I 및 II 및 수반되는 정의에 의해 표시되며, 여기서 X는 다음으로 이루어진 군에서 선택된다:
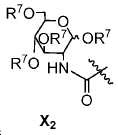
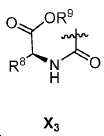
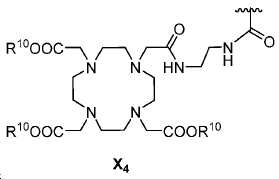
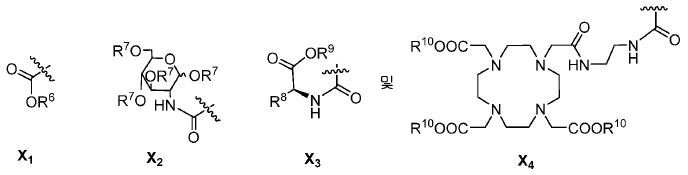
또다른 구체예에서, X는 카르복실산 기 또는 이의 유도체이다(X1). 또다른 구체예에서, X는 글루코사민 기 또는 이의 유도체(X2)를 내포한다. 또다른 구체예에서, X는 아미노산 잔기 또는 글리신, 아스파르트산, 글루탐산을 비롯한 이의 유도체(X3)를 내포한다. 또다른 기에서, X는 DOTA 모이어티(X4)를 내포한다.
유용한 R6, R9, 및 R10 기는 메틸 에스테르, t-부틸 에스테르, 벤질 에스테르, 및 알릴 에스테르를 포함한다.
한 구체예에서, Y1, Y2, Y3, Y4, Y5, 및 Y6를 내포하는 고리 모이어티는 예컨대, 벤젠, 피리딘, 피리미딘, 피라진, 피리다진, 및 1,2,4-트리아진으로부터 유도될 수 있다.
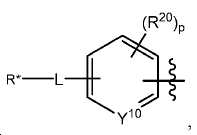
한 구체예에서, 본 발명은 식 IV에 따른 화합물:
또는 이들의 약제학적으로 허용되는 염에 관한 것이며,
여기서
Z는 킬레이트화 모이어티, 또는
다음 구조를 가지는 기이며:
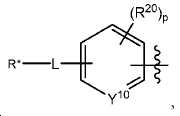
여기서 Y10는 CH 또는 N이고;
L은 사슬, 고리, 또는 이들의 조합 내에 1 내지 6개의 탄소 원자를 포함하는 결합 또는 2가 연결 모이어티이고, 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체되고;
R*는 양전자 방출 방사성 동위원소이고;
R20는 알킬, 알콕실, 할라이드, 할로알킬, 및 CN으로 이루어진 군에서 선택되고;
p는 0 내지 4중의 한 정수이며, 여기서 p가 1을 초과하는 경우, 각각의 R20는 동일하거나 상이하고;
W는 PSMA-표적화 리간드이고;
A4는 사슬, 고리, 또는 이들의 조합 내에 1 내지 10개의 탄소 원자를 포함하는 결합 또는 2가 연결 모이어티이고, 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체되고;
G는 O, S, 또는 NR3이고;
R1는 수소 또는 카르복실산 보호기이고;
R3는 수소, 알킬, 사이클로알킬, 헤테로사이클로알킬, 아릴, 알킬아릴, 및 헤테로아릴로 이루어진 군에서 선택된다.
R11, R12, R13, R14, R15, 및 R16는 각각 독립적으로 수소, 알킬, 알콕실, 또는 할라이드이고;
R17 및 R18는 각각 독립적으로 수소, 알킬, 아릴, 또는 알킬아릴이고;
R19는 알킬, 알콕실, 할라이드, 할로알킬, 및 CN으로 이루어진 군에서 선택되고;
m은 1 내지 6 중의 한 정수이고; 및
o는 0 내지 4중의 한 정수이며, 여기서 o가 1을 초과하는 경우, 각각의 R19는 동일하거나 상이하다.
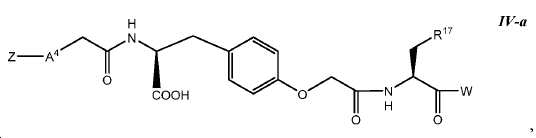
한 구체예에서, 본 발명은 식 IV-a에 따른 화합물:
또는 이들의 약제학적으로 허용되는 염에 관한 것이며,
여기서 R17는 아릴이고; 및 여기서 A4, Z, 및 W는 본 명세서에서 정의된 바와 같다.
킬레이트화 모이어티는 당해 분야에 공지되어 있고 이들은 금속-결합 기를 가리킨다. 일부 구체예에서, Z는 DOTA, HBED-CC, NOTA, NODAGA, TRAP, NOPO, PCTA, DFO, DTPA, CHX-DTPA, AAZTA, DEDPA, 및 옥소-Do3A으로 이루어진 군에서 선택된 킬레이트화 모이어티이다. 이들 킬레이트화 모이어티는 1,4,7,10-테트라아자사이클로도데칸-N,N',N'',N'''-테트라아세트산 (=DOTA), N,N''-비스[2-하이드록시-5-(카르복시에틸)벤질]에틸렌디아민-N,N''-디아세트산 (=HBED-CC), 1,4,7-트리아자사이클로노난-1,4,7-트리아세트산 (=NOTA), 2-(4,7-비스(카르복시메틸)-1,4,7-트리아조난-1-일)펜탄이산 (NODAGA), 2-(4,7,10-트리스(카르복시메틸)-1,4,7,10-테트라아자사이클로도데칸-1-일)펜탄이산 (DOTAGA), 1,4,7-트리아자사이클로노난 포스핀산 (TRAP), 1,4,7-트리아자사이클로노난-1-[메틸(2-카르복시에틸)포스핀산]-4,7-비스[메틸(2-하이드록시메틸)포스핀산] (NOPO), 3,6,9,15-테트라아자바이사이클로[9.3.1.]펜타데카-1(15),11,13-트리엔-3,6,9-트리아세트산 (=PCTA), N'-{5-[아세틸(하이드록시)아미노]펜틸}-N-[5-({4-[(5-아미노펜틸)(하이드록시)아미노]-4-옥소부타노일}아미노)펜틸]-N-하이드록시석신아미드 (DFO), 디에틸렌트리아민펜타아세트산 (DTPA), 트랜스-사이클로헥실-디에틸렌트리아민펜타아세트산 (CHX-DTPA), 1-옥사-4,7,10-트리아자사이클로도데칸-4,7,10-트리아세트산 (옥소-Do3A), p-이소티오시아네이토벤질-DTPA (SCN-Bz-DTPA), 1-(p-이소티오시아네이토벤질)-3-메틸-DTPA (1B3M), 2-(p-이소티오시아네이토벤질)-4-메틸-DTPA (1M3B), 1-(2)-메틸-4-이소시아네이토벤질-DTPA (MX-DTPA)로부터 유도된다. 킬레이트화 모이어티는 US 2016/0228587호에 개시되어 있고, 이 문헌은 본 명세서에 그 전체가 참고로서 포함된다.
양전자 방출 방사성 동위원소는 당해 분야에 공지되어 있고, 이들은, 예를 들면, 11C, 18F, 123I, 125I, 및 131I일 수 있다.
PSMA-표적화 리간드는 당해 분야에 공지되어 있고 이들은 PSMA에 결합할 수 있는 기를 가리킨다. PSMA-표적화 리간드는 본 명세서에 논의된 우레아계 리간드 시스템일 수 있다.
일부 구체예에서, PSMA-표적화 리간드 W는 다음 구조를 가지며:
여기서 R20 및 R21는 각각 독립적으로 이들의 아미노 기를 통해 인접한 -C(O)- 기에 연결된 아미노산 잔기이다.
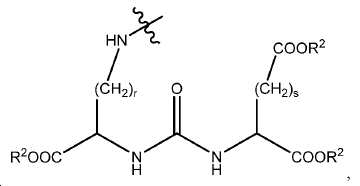
일부 구체예에서, W는 다음 구조를 가지며:
여기서 R2는 수소 또는 카르복실산 보호기이고, r는 1 내지 6 중의 한 정수이고, s는 1 내지 4 중의 한 정수이다. 한 구체예에서, W는 다음 구조를 가진다:
특정한 구체예에서, 본 발명의 화합물은 일반식 IV 및 IV-a, 및 수반되는 정의에 의해 표시된다.
일부 구체예에서, L은 사슬, 고리, 또는 이들의 조합 내에 1 내지 6개의 탄소 원자를 포함하는 결합 또는 2가 연결 모이어티이고, 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체된다. 일부 구체예에서, L은 결합이다. 또다른 구체예에서, L은 C1-C6 알킬렌 기를 포함하는 2가 연결 모이어티이고 여기서 적어도 하나의 탄소 원자는 임의로 O, -NR3-, 또는 -C(O)-로 대체된다. 일부 구체예에서, L은 (CH2)n, -(OCH2CH2)n-, -(NHCH2CH2)n-, 또는 -C(O)(CH2)n-이고, 여기서 n는 1, 2, 또는 3이다. 또다른 구체예에서, L은 -OCH2CH2-이다. 2가 연결 모이어티의 다른 유용한 예시는 -CH2-,CH2CH2-, -CH2CH2CH2-, -OCH2CH2CH2-, -NHCH2CH2-, -NHCH2CH2CH2-, -COCH2-, -COCH2CH2-, 및 -COCH2CH2CH2-를 포함한다.
일부 구체예에서, A4는 결합, (CH2)n, -NHC(O)-, -(OCH2CH2)n-, -(NHCH2CH2)n-, -NH(CO)CH2-, -NHC(O)CH2(OCH2CH2) n-, 또는 -NHC(O)CH2(NHCH2CH2) n-이고, 여기서 n는 1, 2, 또는 3이다. 일부 구체예에서, A4는 결합, -(OCH2CH2)n-, 또는 -NHC(O)CH2(OCH2CH2)n-이고, 여기서 n는 1 또는 2이다. 한 구체예에서, A4는 -NHC(O)CH2(OCH2CH2)2이다. 또다른 구체예에서, A4는 결합이다. 또다른 구체예에서, A4는 -NHC(O)-이다.
일부 구체예에서, R17는 아릴이다. 한 구체예에서, R17는 임의로 치환된 페닐이다. 또다른 구체예에서, R17는 임의로 치환된 나프틸이다.
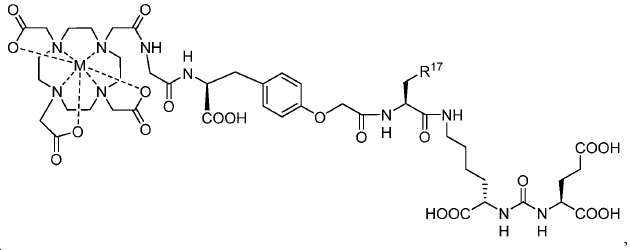
일부 구체예에서, 본 발명은 금속 M에 킬레이트를 형성한 식 IV에 따른 화합물을 포함하는 복합체에 관한 것이며 여기서 Z는 킬레이트화 모이어티이다. 일부 구체예에서, 금속 M은 44Sc, 47Sc, 203Pb, 67Ga, 68Ga, 72As, 99mTc,111In, 90Y, 97Ru, 62Cu, 64Cu, 52Fe, 52mMn, 140La, 175Yb, 153Sm, 166Ho, 149Pm, 177Lu, 142Pr, 159Gd, 213Bi, 67Cu, 111Ag, 199Au, 161Tb, 및 51Cr, 99mTc으로 이루어진 군에서 선택된다.
일부 구체예에서, 복합체는 다음 구조를 가지며:
여기서 R17는 아릴이다. 일부 구체예에서, R17는 페닐이다. 일부 구체예에서, M는 68Ga이다.
한 구체예에서, 본 발명은 식 I, II, 및 III의 화합물을 제조하는 방법에 관한 것이다.
한 구체예에서, 본 발명은 약제학적으로 허용되는 담체 및 식 I, II, III, 및 IV의 화합물을 포함하는 약제학적 조성물을 제공한다. 본 발명은 또한 약제학적으로 허용되는 담체 및 식 I의 화합물의 약제학적으로 허용되는 염을 포함하는 약제학적 조성물을 제공한다. 특정한 구체예에서, 약제학적 조성물은 방사선표지된 전구체와의 조합에 따라 식 I 또는 이의 하위 화학식에 따른 화합물 또는 염을 생성하기 위해 필수적인 반응 전구체를 포함할 것이다.
한 구체예에서, 본 발명은 식 I 또는 식 IV의 화합물을 함유하는 무균 용기 또는 이의 정맥 내 주사를 위한 약제학적으로 허용되는 등장성 용액, 및 진단적 촬영 (예를 들면, 68Ga) 및 방사선 요법 (예를 들면, 90Y) 사용을 위한 설명서를 포함하는, 키트 형태를 제공한다.
본 발명은 또한 유효량의 방사성금속 복합체 또는 본 명세서에 개시된 방사성 화합물을 개체에 투여하고, 개체에서 복합체 또는 화합물의 방사능 패턴을 검출하는 것을 포함하는, 생체 내 영상화 방법을 제공한다. 한 구체예에서, 본 발명은 개체에서의 영상화를 위한 방법에 관한 것으로, 본 명세서에 개시된 방사선표지된 화합물을 개체에게 투여하고; 개체 또는 개체의 일부의 영상을 수득하는 단계를 포함하는 방법이다. 또다른 구체예에서, 영상화를 위한 방법은 양전자 방출을 검출할 수 있는 장치를 이용하여 영상을 수득하는 것을 포함한다.
본 발명은 또한 유효량의 방사성금속 복합체 또는 본 명세서에 개시된 방사성 화합물을 개체에 투여하고, 상기 개체에서 복합체 또는 화합물의 방사능 패턴을 검출하는 것을 포함하는, 생체 내 영상화 방법을 제공한다.
본 발명의 화합물이 투여될 수 있는 전형적인 개체는 포유동물, 특히 영장류, 특별히 인간일 것이다. 수의학적 적용에 있어서, 다양한 개체, 예컨대 가축 가령 소, 양, 염소, 젖소, 돼지 등; 가금류 가령 닭, 오리, 거위, 칠면조, 등; 및 길들여진 동물 특히 개 및 고양이와 같은 애완동물이 적절할 수 있다. 진단 또는 연구용 적용에 있어서, 설치류(예컨대 마우스, 래트, 햄스터), 토끼, 영장류, 및 돼지 가령 동종번식(inbred) 돼지 등을 비롯한 다양한 포유동물이 적절한 개체일 것이다. 추가적으로, 시험관 내 적용, 가령 시험관 내 진단 및 연구 적용에 있어서, 상기 개체의 체액 및 세포 샘플 가령 포유류, 특히 영장류 가령 인간, 혈액, 뇨 또는 조직 샘플, 또는 수의학적 적용을 위해 언급된 동물의 혈액 뇨 또는 조직 샘플이 사용하기에 적절할 수 있다.
본 발명에 따른 방사성 의약품은 양전자 방출 갈륨-68 복합체일 수 있고 이는 68Ge/68Ga 모/자원소 방사선핵종 발생제 시스템과 함께 사용될 경우, PET 영상화 연구를 가능하게 하고, 방사선핵종 생산을 위한 업체 내(in-house) 입자가속기의 가동에 따르는 비용 지출을 방지할 것이다.
이 복합체는 비경구 진단제의 제조를 위한 표준 기술을 이용하여 정맥내 투여를 위해 적절한 수성 용액으로 제형화된다. 본 발명의 복합체의 수성 용액은, 예를 들면, 시판되는 0.2 마이크론 필터를 통과시킴으로써 무균화될 수 있다. 복합체는 전형적으로 조직을 영상화하기에 필요한 광자(감마/양전자) 유속을 제공하기에 충분한 방사선핵종 복합체의 조직 농도를 제공하기에 효과적인 양으로 정맥 내에 투여된다. 본 발명의 임의의 소정의 복합체에 있어서 허용되는 조직 영상화를 얻기 위한 투여 수준은 이의 특정한 생물학적 분배 및 조직 영상화 장비의 감수성에 의존적이다. 효과적인 투여 수준은 통상적인 실험을 통해 확인될 수 있다. 이들은 전형적으로 약 5 내지 약 30 밀리퀴리 범위다. 복합체가 심근 조직의 PET 영상화를 위한 갈륨-68 복합체인 경우, 적절한 광자 유속은 복합체의 약 5 내지 약 30 밀리퀴리의 정맥내 투여에 의해 얻어질 수 있다.
본 명세서에서 사용된 용어 "아미노산"은 자연발생적 아미노산 및 비자연적 아미노산을 모두 포함한다. 자연발생적 아미노산은 단백질의 기본 구성물질을 형성하기 위해 사용되는 것으로 공지된 아미노산, 가령 알라닌, 아르기닌, 아스파라긴, 아스파르트산, 시스테인, 시스틴, 글루타민, 글루탐산, 글리신, 히스티딘, 하이드록시프롤린, 이소류신, 류신, 라이신, 메티오닌, 오르니틴, 페닐알라닌, 프롤린, 세린, 트레오닌, 트립토판, 티로신, 발린, 및 이들의 조합을 가리킨다. 비자연적 아미노산의 예시는 다음을 포함한다: 티로신 아미노산의 비자연적 유사체; 글루타민 아미노산의 비자연적 유사체; 페닐알라닌 아미노산의 비자연적 유사체; 세린 아미노산의 비자연적 유사체; 트레오닌 아미노산의 비자연적 유사체; 알킬, 아릴, 아실, 아지도, 시아노, 할로, 하이드라진, 히드라지드, 하이드록실, 알케닐, 알키닐, 에테르, 티올, 설포닐, 셀레노, 에스테르, 티오산, 보레이트, 보로네이트, 포스포, 포스포노, 포스핀, 헤테로사이클릭, 에논, 이민, 알데히드, 하이드록실아민, 케토, 또는 아미노 치환된 아미노산, 또는 이들의 임의의 조합; 광활성화가능 가교-링커를 가진 아미노산; 스핀-표지된 아미노산; 형광 아미노산; 신규한 관능기를 가진 아미노산; 또다른 분자와 공유적으로 또는 비공유적으로 상호작용하는 아미노산; 금속 결합 아미노산; 금속-함유 아미노산; 방사성 아미노산; 광포집된(photocaged) 및/또는 광이성질화가능 아미노산; 비오틴 또는 비오틴-유사체 함유 아미노산; 당화 또는 탄수화물 변형된 아미노산; 케토 함유 아미노산; 폴리에틸렌 글리콜 또는 폴리에테르를 포함하는 아미노산; 중원자 치환된 아미노산; 화학적으로 절단가능한 또는 광절단가능한 아미노산; 연장된 곁사슬을 가진 아미노산; 독성 기를 함유하는 아미노산; 당 치환된 아미노산, 예컨대, 당 치환된 세린 등; 탄소-연결된 당-함유 아미노산; 산화환원-활성 아미노산; α-하이드록시 함유 산; 아미노 티오산 함유 아미노산; α,α 이중치환 아미노산; β-아미노산; 및 프롤린이 아닌 사이클릭 아미노산.
본 명세서에서 사용된 용어 "알카노일"은 하기의 구조를 가리키며:
여기서 R
30는 알킬, 사이클로알킬, 아릴, (사이클로알킬)알킬, 또는 아릴알킬이고, 이중 어느 하나는 임의로 치환된다. 아실 기는, 예를 들면, C
1-6 알킬카르보닐(가령, 예를 들면, 아세틸), 아릴카르보닐(가령, 예를 들면, 벤조일), 레불리노일, 또는 피발로일일 수 있다. 또다른 구체예에서, 아실 기는 벤조일이다.
본 명세서에서 사용된 용어 "알킬"은 명시된 수의 탄소 원자를 가지는 분지형 및 선형-사슬 포화된 지방족 탄화수소 기 모두를 포함한다. 알킬의 예시는 메틸, 에틸, n-프로필, i-프로필, n-부틸, s-부틸, t-부틸, n-펜틸, 및 s-펜틸을 포함하지만 이에 제한되지 않는다. 바람직한 알킬 기는 C1-C10 알킬 기이다. 전형적인 C1-10 알킬 기는 그 중에서도 메틸, 에틸, n-프로필, n-부틸, n-펜틸, n-헥실, n-헵틸, n-옥틸, n-노닐, 및 n-데실, 이소프로필, sec-부틸, tert-부틸, 이소-부틸, 이소-펜틸, 네오펜틸, 1-메틸부틸, 2 메틸부틸, 3-메틸부틸, 1,1-디메틸프로필, 1,2-디메틸프로필, 1-메틸펜틸, 2 메틸펜틸, 3-메틸펜틸, 4-메틸펜틸, 1-에틸부틸, 2-에틸부틸, 3-에틸부틸, 1,1 디메틸부틸, 1,2-디메틸부틸, 1,3-디메틸부틸, 2,2-디메틸부틸, 2,3-디메틸부틸, 3,3 디메틸부틸, 1-메틸헥실, 2-메틸헥실, 3-메틸헥실, 4-메틸헥실, 5-메틸헥실, 1,2 디메틸펜틸, 1,3-디메틸펜틸, 1,2-디메틸헥실, 1,3-디메틸헥실, 3,3-디메틸헥실, 1,2 디메틸헵틸, 1,3-디메틸헵틸, 및 3,3-디메틸헵틸을 포함한다. 한 구체예에서, 유용한 알킬 기는 선형 사슬 C1-6 알킬 기 및 분지형 사슬 C3-6 알킬 기 중에서 선택된다. 전형적인 C1-6 알킬 기는 그 중에서도 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, tert-부틸, 이소-부틸, 펜틸, 3-펜틸, 헥실을 포함한다. 한 구체예에서, 유용한 알킬 기는 선형 사슬 C2-6 알킬 기 및 분지형 사슬 C3-6 알킬 기 중에서 선택된다. 전형적인 C2-6 알킬 기는 그 중에서도 에틸, 프로필, 이소프로필, 부틸, sec-부틸, tert-부틸, 이소-부틸, 펜틸, 3-펜틸, 헥실을 포함한다. 한 구체예에서, 유용한 알킬 기는 선형 사슬 C1-4 알킬 기 및 분지형 사슬 C3-4 알킬 기 중에서 선택된다. 전형적인 C1-4 알킬 기는 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, tert-부틸, 및 이소-부틸을 포함한다.
본 명세서에서 사용된 용어 "사이클로알킬"은 명시된 수의 탄소 원자를 가지는 포화된 고리 기, 가령 사이클로프로필, 사이클로부틸, 사이클로펜틸, 또는 사이클로헥실을 포함한다. 사이클로알킬 기는 전형적으로 3 내지 약 12개 고리 구성원을 가질 것이다. 한 구체예에서, 사이클로알킬은 하나 또는 두 개의 고리를 가진다. 또다른 구체예에서, 사이클로알킬은 C3-C8 사이클로알킬이다. 또다른 구체예에서, 사이클로알킬은 C3-7 사이클로알킬이다. 또다른 구체예에서, 사이클로알킬은 C3-6 사이클로알킬이다. 예시적인 사이클로알킬 기는 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 사이클로헵틸, 사이클로옥틸, 노르보르닐, 데칼린, 및 아다만틸을 포함한다.
본 명세서에서 사용된 용어 "헤테로사이클로알킬"은 포화된 헤테로사이클릭 알킬 기를 가리킨다.
본 명세서에서 사용된 용어 "아릴"은 C6-14 아릴, 특별히 C6-10 아릴을 포함한다. 전형적인 C6-14 아릴 기는 페닐, 나프틸, 페난트릴, 안트라실, 인데닐, 아줄레닐, 바이페닐, 바이페닐에닐, 및 플루오레닐 기, 더 바람직하게는 페닐, 나프틸, 및 바이페닐 기를 포함한다.
본 명세서에서 사용된 용어 "헤테로아릴" 또는 "헤테로방향족"은 5 내지 14개의 고리 원자를 가지고, 사이클릭 배열 내에 공유된 6, 10 또는 14 π 전자와 함께, 탄소 원자 및 1, 2, 또는 3개의 산소, 질소 또는 황 헤테로원자, 또는 4개의 질소 원자를 내포하는 기를 가리킨다. 한 구체예에서, 헤테로아릴 기는 5- 내지 10-원 헤테로아릴 기이다. 헤테로아릴 기의 예시는 티에닐, 벤조[b]티에닐, 나프토[2,3-b]티에닐, 티안트레닐, 푸릴, 벤조푸릴, 피라닐, 이소벤조푸라닐, 벤조옥사조닐, 크로메닐, 잔테닐, 2H-피롤릴, 피롤릴, 이미다졸릴, 피라졸릴, 피리딜, 피라지닐, 피리미디닐, 피리다지닐, 이소인돌릴, 3H-인돌릴, 인돌릴, 인다졸릴, 퓨리닐, 이소퀴놀릴, 퀴놀릴, 프탈라지닐, 나프티리디닐, 신놀리닐, 퀴나졸리닐, 프테리디닐, 4aH-카르바졸릴, 카르바졸릴, β-카르볼리닐, 페난트리디닐, 아크리디닐, 피리미디닐, 페난트롤리닐, 페나지닐, 티아졸릴, 이소티아졸릴, 페노티아졸릴, 이속사졸릴, 퓨라자닐, 및 페녹사지닐을 포함한다. 전형적인 헤테로아릴 기는 티에닐 (예컨대, 티엔-2-일 및 티엔-3-일), 푸릴 (예컨대, 2-푸릴 및 3-푸릴), 피롤릴 (예컨대, 피롤-1-일, 1H-피롤-2-일 및 1H-피롤-3-일), 이미다졸릴 (예컨대, 이미다졸-1-일, 1H-이미다졸-2-일 및 1H-이미다졸-4-일), 테트라졸릴 (예컨대, 테트라졸-1-일 및 테트라졸-5-일), 피라졸릴 (예컨대, 1H-피라졸-3-일, 1H-피라졸-4-일, 및 1H-피라졸-5-일), 피리딜 (예컨대, 피리딘-2-일, 피리딘-3-일, 및 피리딘-4-일), 피리미디닐 (예컨대, 피리미딘-2-일, 피리미딘-4-일, 피리미딘-5-일, 및 피리미딘-5-일), 티아졸릴 (예컨대, 티아졸-2-일, 티아졸-4-일, 및 티아졸-5-일), 이소티아졸릴 (예컨대, 이소티아졸-3-일, 이소티아졸-4-일, 및 이소티아졸-5-일), 옥사졸릴 (예컨대, 옥사졸-2-일, 옥사졸-4-일, 및 옥사졸-5-일) 및 이속사졸릴 (예컨대, 이속사졸-3-일, 이속사졸-4-일, 및 이속사졸-5-일)을 포함한다. 5-원 헤테로아릴은 최대 4개의 헤테로원자를 내포할 수 있다. 6-원 헤테로아릴은 최대 3개의 헤테로원자를 내포할 수 있다. 각각의 헤테로원자는 질소, 산소 및 황 중에서 독립적으로 선택된다.
적절한 카르복실산 보호기는 널리 공지되어 있으며, 예를 들면, Wuts, P. G. M. & Greene, T. W., Greene's Protective Groups in Organic Synthesis, 4판, pp. 16-430 (J. Wiley & Sons, 2007)에 개시된 임의의 적절한 카르복실산 보호기를 포함하고, 이 문헌은 본 명세서에 그 전체가 참고로서 포함된다. 당해 분야의 숙련가는 보호기의 선별, 부착, 및 절단과 익숙할 것이며 많은 상이한 보호기가 당해 분야에 공지되어 있음, 하나의 보호기 또는 또다른 기의 적합성이 계획된 특정 합성식에 따라 달라질 수 있음을 이해할 것이다. 적절한 카르복실산 보호기는, 예를 들면, 메틸 에스테르, t-부틸 에스테르, 벤질 에스테르, 및 알릴 에스테르를 포함한다.
재료 및 방법
일반
모든 시약 및 용매는 업체(Aldrich, Acros, 또는 Alfa Inc.)로부터 구입하였고 달리 지시되지 않는 한 추가의 정제 없이 사용하였다. 용매는 분자체 시스템(퓨어 솔브 용매 정제 시스템; Innovative Technology, Inc.)을 통해 건조하였다. 1H 및 13C NMR 스펙트럼은 Bruker Avance 분광계에서 각각 400 MHz 및 100 MHz에서, 지시된 대로 NMR 용매를 기준으로 하여 기록하였다. 화학적 이동은 ppm(δ)로, 커플링 상수, J는 Hz로 기록된다. 다중도는 단일항 (s), 이중항 (d), 삼중항 (t), 넓음 (br), 및 다중항 (m)으로 정의된다. 고-해상도 질량 분석(HRMS) 데이터는 Agilent (Santa Clara, CA) G3250AA LC/MSD TOF 시스템을 이용하여 수득하였다. 박막 크로마토그래피(TLC) 분석은 Merck (Darmstadt, Germany) 실리카겔 60 F254 플레이트를 이용하여 수행하였다. 일반적으로, 미정제 화합물은 실리카겔 (Aldrich)로 충진된 플래시 컬럼 크로마토그래피 (FC)로 정제하였다. 고성능 액체 크로마토그래피(HPLC)는 Agilent 1100 시리즈 시스템에서 수행하였다. 감마 계수기(Cobra II 자동-감마 계수기, Perkin-Elmer)로 68Ga 방사능을 측정하였다. 비-방사성 화학 화합물의 반응은 실리카겔 60 F254의 예비-코팅된 플레이트를 이용하여 박막 크로마토그래피 (TLC) 분석으로 관찰하였다 [68Ga]GaCl3의 수성 용액을 68Ge/68Ga 발생제(Radiomedix Inc.)로부터 얻었다. 고체상 추출 카트리지 (SEP Pak® Light QMA, Oasis® HLB 3cc)는 Waters (Milford, MA, USA)로부터 입수하였다.
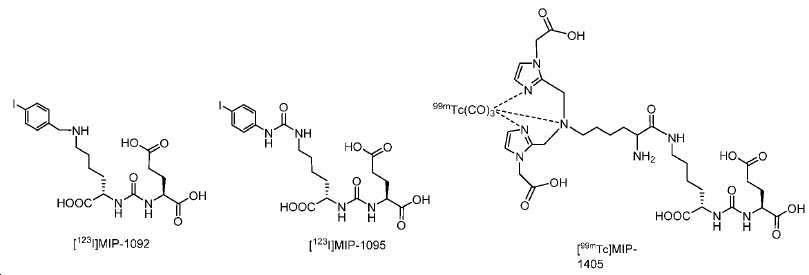
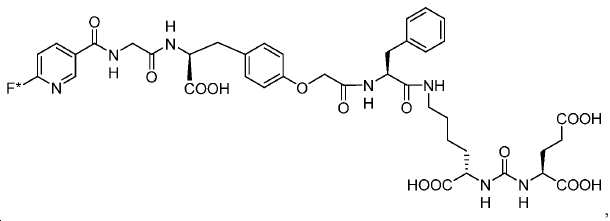
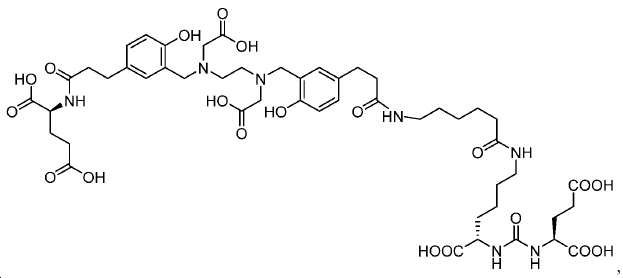
Glu-NH-CO-NH-Lys(Ahx)-HBED-CC 기를 내포하는 예시 화합물, 1a-g, 2, 3, 4a-b, 및 5a-f의 합성을 하기 단락에 기술된 반응에 의해 제조하였다. [68Ga]1a, (흔히 PSMA-11로 공지됨)이 공지의 PSMA 영상화제이며, PSMA에 대한 결합의 양성 대조로서 제시됨에 유의하라.
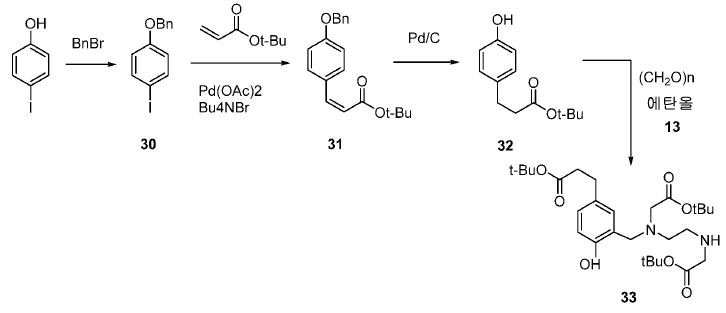
기존에 보고된 Glu-NH-CO-NH-Lys(Ahx)-HBED-CC (단량체, 1a) 및 (Glu-NH-CO-NH-Lys(Ahx))2-HBED-CC (이량체)의 합성은 중간체로서 HBED-CC의 Fe-복합체를 사용하였다. 이 반응 도식은 그리 효율적이지 않았고, Fe(III) HBED-CC 복합체를 사용하지 않는 새로운 도식을 고안하였다(도식 10).
화합물 12, 13, 30, 31 및 32는 다음 문헌에 따라 합성하였다: Ghassan Bechara, Nadine Leygue, Chantal Galaup, Beatrice Mestre-Voegtle, Claude Picard. Tetrahedron. 2010, 66, 8594-8604; Pijus K. Mandal, John S. McMurray. J. Org. Chem. 2007, 72, 6599-6601; Eric Assen B. Kantchev, Guang-Rong Peh, Chi Zhang, Jackie Y. Ying. Org. Lett. 2008, 10(18), 3949-3952.
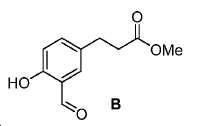
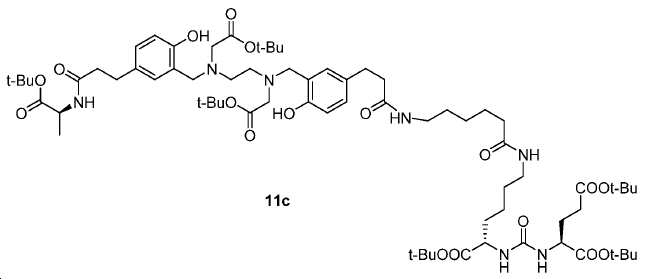
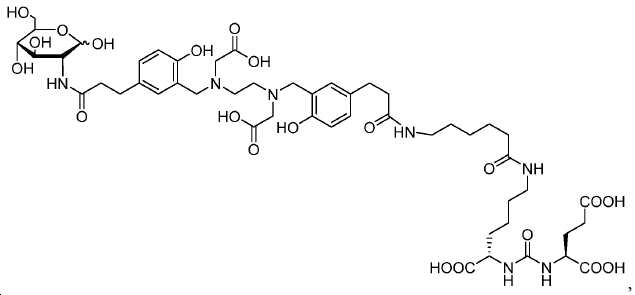
메틸 3-(4-하이드록시페닐)프로파노에이트 (A)를 카르복실산의 O-메틸화(에스테르화)에 의해 좋은 수율(84%)로 제조하였다. 메틸 에스테르를 MgCl2 및 파라포름알데히드로 처리하여 살리실알데히드, B를 우수한 수율 (90%)로 얻었다. 에틸렌디아민과 살리실알데히드의 축합반응은 추가의 정제 없이 Schiff 염기를 생성하였다. 상응하는 이차 아민, 7을 Schiff 염기로부터 수소화붕소나트륨과의 환원 반응 후에 69% 수율로 얻었다. 이차 아민은 과량의 tert-부틸 브로모아세테이트와 축합되어 8을 87% 수율로 제공하였다. 화합물, 8의 메틸 에스테르 기는 NaOH 가수분해에 의해 선택적으로 제거되어 산, 9를 96% 수율로 제공하였다. 이어지는 tert-부틸 2-(3-((S)-6-(6-아미노헥산아미도)-1-tert-부톡시-1-옥소헥산-2-일)우레이도)펜탄디오에이트 (10)와의 HOBt/EDCI 촉진된 커플링 반응은 보호된 Glu-NH-CO-NH-Lys(Ahx)-HBED-CC (11a)를 생성하였다. 중간체 11b-g는 상응하는 아미노산과 11a의 커플링 반응에 의해, 22-63% 수율로 합성되었다. tert-부틸 보호 기는 이후 제거되어 1a-g를 26-79% 수율로 제공하였다. 전구체, 1a-g는 표지를 위한 출발 물질로서, 및 나중에는 GaCl3와의 복합체 형성을 위해 사용되어 "차가운 화합물" [천연Ga]1a-g을 제공하였다.
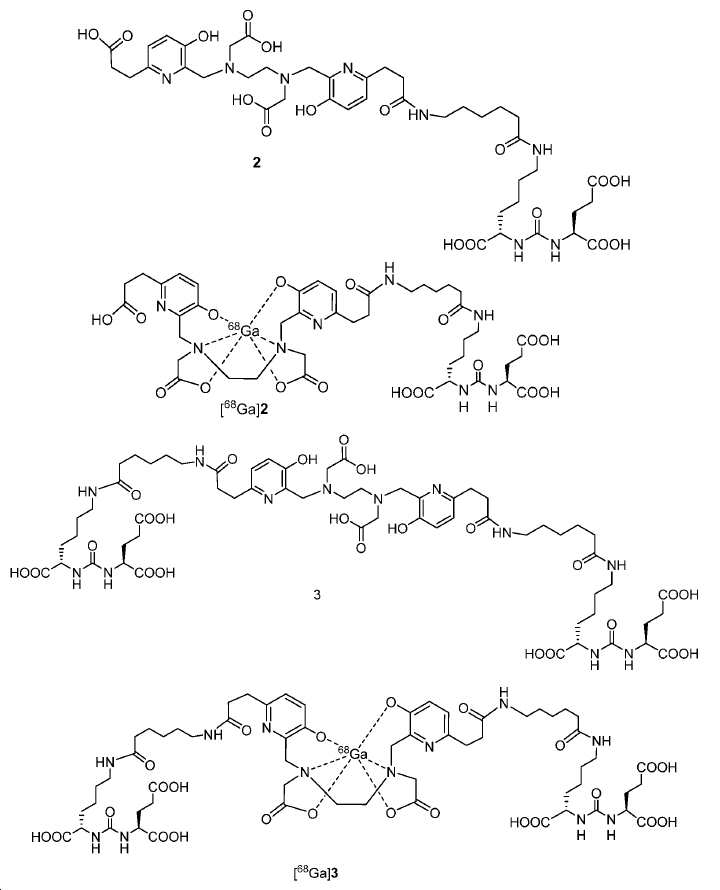
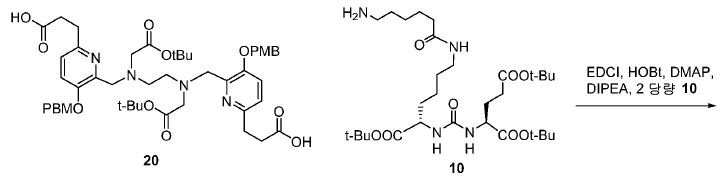
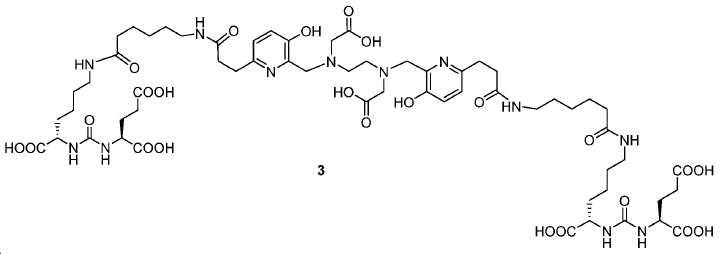
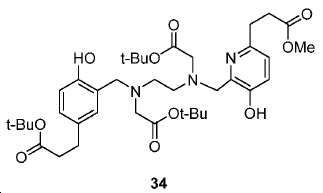
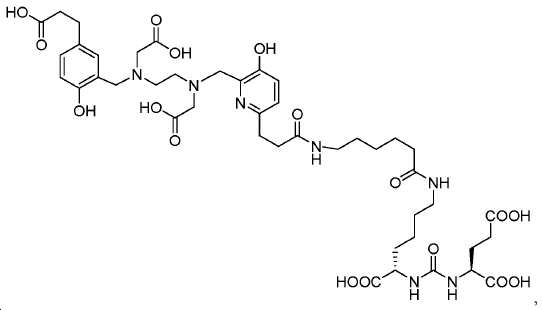
도식 12 및 13은 화합물 2 및 3을 효율적으로 생산하기 위해 적용된 합성 전략을 요약한다. 핵심 중간체, 20은 9단계 반응을 통해 성공적으로 제조되었다(도식 11). 나중에, 10과의 HOBt/EDCI 촉진된 커플링 반응은 보호된 Glu-NH-CO-NH-Lys(Ahx)-HPyED-CC 단량체 (21) 및 이량체 (22)를 생성하고, 이후 단순 산성 탈-보호를 거쳐 최종 화합물 2 및 3을 제공하였다.
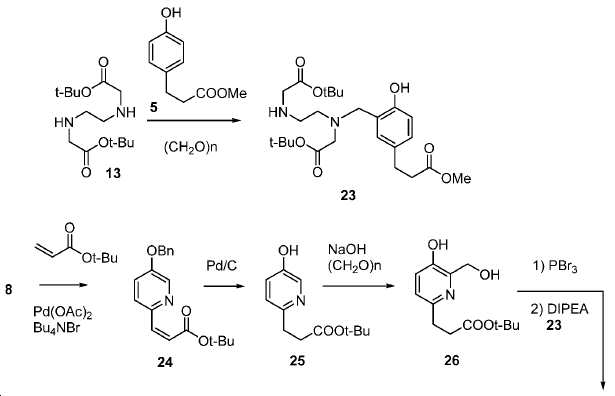
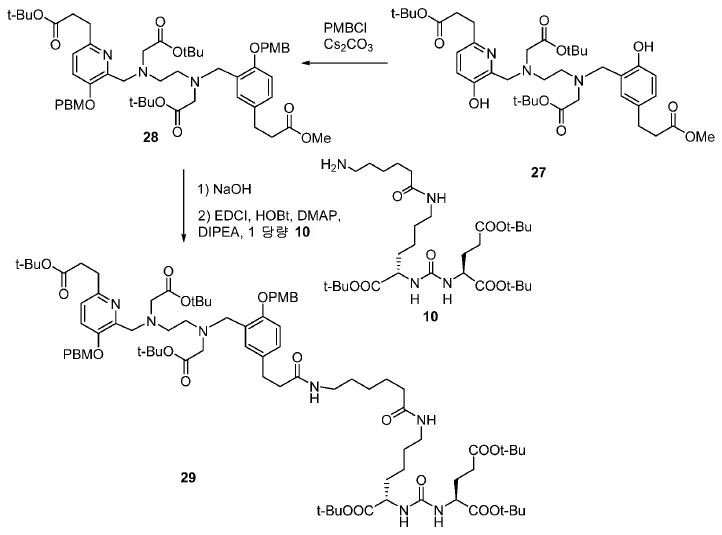
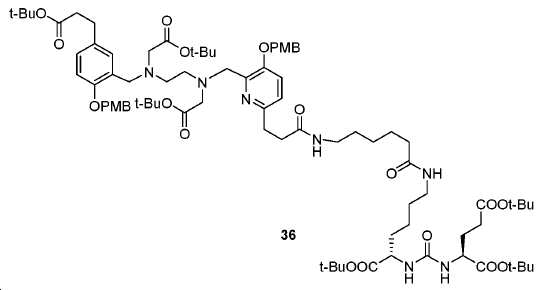
아미드 결합을 통해 연결된 다른 피리디닐 유도체의 합성을 위해, 중간체 28 (도식 14) 및 35 (도식 16)를 유사한 방법에 따라 쉽게 제조하였다. 메틸 에스테르는 NaOH로의 처리에 의해 카르복실산으로 전환되고, 이는 10과 커플링 반응되어 Glu-NH-CO-NH-Lys(Ahx)-HBE-HPyED-CC (29) 및 Glu-NH-CO-NH-Lys(Ahx)-HPyED-HBED-CC (36)을 제공하였다. 보호 기는 TFA의 존재에서 쉽게 제거되어 4a 및 4b를 제공하였다.
도식 10
도식 10 (이어서)
실시예 1
메틸 3-(4-하이드록시페닐)프로파노에이트 (A).
50 mL MeOH 내 3-(4-하이드록시페닐)프로판산 (3 g, 18.1 mmol)의 용액에 BF3·Et2O (0.3 mL)를 부가하였다. 혼합물을 실온에서 8시간 동안 교반하였다. 혼합물을 농축하고, 잔사를 플래시 크로마토그래피 (FC) (에틸 아세테이트 (EtOAc) /헥산 = 2/8)로 정제하여 2.72 g 백색 고체 A (수율: 84%)를 얻었다: 1HNMR(400 MHz, CDCl3) δ: 7.07(d, 2H, J = 8.4 Hz), 6.76(d, 2H, J = 8.4 Hz), 4.72(s, 1H), 3.68(s, 3H), 2.89(t, 2H, J = 7.6 Hz), 2.60(t, 2H, J = 7.6 Hz). HRMS (ESI) C10H13O3 (M+H+)에 대한 계산값, 181.0865; 측정값, 181.0889.
실시예 2
메틸 3-(3-포르밀-4-하이드록시페닐)프로파노에이트 (B).
70 mL 아세토니트릴 내 A (2.72 g, 15.1 mmol)의 용액에 MgCl2 (2.87 g, 30.2 mmol), 파라포름알데히드 (3.66 g, 120.8 mmol) 및 Et3N (6.1 g, 60.4 mmol)를 부가하였다. 혼합물을 가열하여 8시간 동안 환류시켰다. 반응 혼합물을 이후 100 mL 5% HCl에 쏟고 Et2O (50 mL x 3)로 추출하였다. 유기층을 무수 황산나트륨 (Na2SO4)으로 건조하고 여과하였다. 여과액을 농축하고, 잔사를 플래시 크로마토그래피 (FC) (EtOAc/헥산 = 2/8)에 의해 정제하여 2.84 g 백색 고체 B (수율: 90%)를 얻었다: 1HNMR(400 MHz, CDCl3) δ: 7.37-7.40(m, 2H), 6.93-6.52(m, 1H), 3.68(s, 3H), 2.95(t, 2H, J = 7.6 Hz), 2.64(t, 2H, J = 7.6 Hz). HRMS (ESI) C11H13O4 (M+H+)에 대한 계산값, 209.0814; 측정값, 209.0797.
실시예 3
디메틸 3,3'-(((에탄-1,2-디일비스(아자네디일))비스(메틸렌))비스(4-하이드록시-3,1-페닐렌))디프로파노에이트 (7).
60 mL MeOH 내 B (2.84 g, 13.6 mmol) 및 에틸렌디아민 (0.372 g, 6.18 mmol)의 용액을 50 ℃로 밤새 가열하였다. 혼합물을 이후 얼음-수조로 냉각시켰다. NaBH4 (1.05 g, 27.81)를 여러 번에 걸쳐 부가하였다. 12시간 동안 실온에서 교반한 후에, 혼합물을 EtOAc (200 mL)로 희석하고, H2O (50 mL) 및 염수 (50) mL로 세척하고, Na2SO4상에서 건조하고, 농축하고 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 2.08 g 투명한 오일 7 (수율: 69%)을 얻었다: 1HNMR(400 MHz, CDCl3) δ: 7.00(dd, 2H, J = 2.0 Hz, J = 8.4 Hz), 6.81(d, 2H, J = 2.0 Hz), 6.76(d, 2H, J = 8.4 Hz), 3.97(s, 2H), 3.67(s, 6H), 2.83-2.87(m, 8 H), 2.58(t, 2H, J = 7.8 Hz). HRMS (ESI) C24H33N2O6 (M+H+)에 대한 계산값, 445.2339; 측정값, 445.2326.
실시예 4
디메틸 3,3'-(((2,2,13,13-테트라메틸-4,11-디옥소-3,12-디옥사-6,9-디아자테트라데칸-6,9-디일)비스(메틸렌))비스(4-하이드록시-3,1-페닐렌))디프로파노에이트 (8).
50 mL 아세토니트릴 내 7 (2.08 g, 4.67 mmol)의 용액에 tert-부틸 브로모아세테이트 (1.91 g, 9.8 mmol) 및 Na2CO3 (1.98 g, 18.68 mmol)를 부가하였다. 밤새 60 ℃로 가열한 후, EtOAc (200 mL)를 부가하였다. 혼합물을 H2O (50 mL) 및 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조하고, 농축하고 FC (EtOAc/헥산 = 3/7)에 의해 정제하여 2.74 g 투명한 오일 8 (수율: 87%)을 얻었다: 1HNMR(400 MHz, CDCl3) δ: 7.00(dd, 2H, J = 2.0 Hz, J= 8.4 Hz), 6.77(d, 2H, J = 8.4 Hz), 6.74(d, 2H, J = 2.0 Hz), 3.70(s, 4H), 3.67(s, 6H), 3.17(s, 4H), 2.83(t, 4H, J = 7.8 Hz), 2.69(s, 4H), 2.57(t, 4H, J = 7.8 Hz), 1.46(s, 18H). HRMS (ESI) C36H53N2O10 (M+H+)에 대한 계산값, 673.3700; 측정값, 673.3680.
실시예 5
3,3'-(((2,2,13,13-테트라메틸-4,11-디옥소-3,12-디옥사-6,9-디아자테트라데칸-6,9-디일)비스(메틸렌))비스(4-하이드록시-3,1-페닐렌))디프로판산(9).
10 mL MeOH/H2O(1/1) 내 8 (0.673 g, mmol)의 용액에 NaOH(0.4 g, 10 mmol)를 부가하였다. 실온에서 4시간 동안 교반한 후, pH = 4-5가 될 때까지 1 N HCl를 혼합물에 부가하였다. 생성된 혼합물을 이후 EtOAc(20 mL x 3)로 세척하였다. 유기층을 수집하고, 염수(20 mL)로 세척하고, Na2SO4로 건조하고 여과하였다. 여과액을 농축하여 0.62 g 백색 고체 9 (수율: 96%)를 얻었다: 1HNMR(400 MHz, CDCl3) δ: 7.03(dd, 2H, J = 2.0 Hz, J = 8.0 Hz), 6.80(d, 2H, J = 8.0 Hz), 6.71(d, 2H, J = 2.0 Hz), 3.56(s, 4H), 3.26(s, 6H), 2.84(t, 4H, J = 7.0 Hz), 2.62(t, 4H, J = 7.0 Hz), 2.56(s, 4H),1.48(s, 18H). HRMS (ESI) C36H53N2O10 (M+H+)에 대한 계산값, 673.3700; 측정값, 673.3680.
실시예 6a
3-(3-(((2-((5-((7S,11S)-7,11-비스(tert-부톡시카르보닐)-2,2-디메틸-4,9,17,24-테트라옥소-3-옥사-8,10,16,23-테트라아자헥사코산-26-일)-2-하이드록시벤질)(2-(tert-부톡시)-2-옥소에틸)아미노)에틸)(2-(tert-부톡시)-2-옥소에틸)아미노)메틸)-4-하이드록시페닐)프로판산(11a).
10 mL DMF 내 9 (0.62 g, 0.96 mmol)의 용액에 Glu-NH-CO-NH-Lys(Ahx)-NH2(10, 0.519 g, 0.86 mmol), N,N′-디사이클로헥실카르보디이미드 (EDCI, 0.274 g, 1.44 mol), N-하이드록시벤조트리졸 (HOBt, 0.243 g, 1.44 mmol), 4-(디메틸아미노)피리딘 (DMAP, 0.012 g, 0.1 mmol) 및 N,N-디이소프로필에틸아민 (DIPEA, 0.495 g, 3.84 mmol)을 부가하였다. 밤새 실온에서 교반한 후에, 혼합물을 EtOAc (50 mL)로 희석하고, H2O (15 x 2mL) 및 염수 (15) mL로 세척하고, Na2SO4상에서 건조하고, 농축하고 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 0.545 g 투명한 오일 11a (수율: 46.2%)을 얻었다: 1HNMR(400 MHz, CDCl3) δ: 6.98-7.01(m, 2H), 6.73-6.77(m, 4H), 6.55(t, 1H, J = 6.4 Hz), 6.07(t, 1H, J = 6.4 Hz), 5.78-5.82(m, 2H), 4.28-4.33(m, 2H), 3.69(s, 2H), 3.67(s, 2H), 3.12-3.31(m, 8H), 2.80-2.86(m, 4H), 2.68(s, 4H), 2.62(t, 2H, J = 8.0 Hz), 22.31-2.44(m, 4H), 2.04-2.18(m, 3H), 1.77-1.85(m, 2H), 1.43-1.60(m, 54H), 1.22-1.28(m, 2H); HRMS (ESI) C64H103N6O17 (M+H+)에 대한 계산값, 1227.7380; 측정값, 1227.7309.
실시예 6b
(3S,7S)-트리-tert-부틸 22-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(2-하이드록시-5-(3-옥소-3-(((3R,4R,5S,6R)-2,4,5-트리아세트옥시-6-(아세트옥시메틸)테트라하이드로-2H-피란-3-일)아미노)프로필)벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실레이트(11b).
2 mL DMF 내 11a (50 mg, 0.04 mmol)의 용액에 1,3,4,6-테트라-O-아세틸-2-아미노-2-데옥시-β-D-글루코피라노스 하이드로클로라이드 (23 mg, 0.06 mmol), EDCI (11.5 mg, 0.06 mol), HOBt(10.1 mg, 0.06 mmol), DMAP (0.5 mg, 0.004 mmol)
및 DIPEA (15.5 mg, 0.12 mmol)를 부가하였다. 밤새 실온에서 교반한 후에, 혼합물을 EtOAc (20 mL)로 희석하고, H2O (10 x 2mL) 및 염수 (10) mL로 세척하고, Na2SO4상에서 건조하고, 농축하고 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 39 mg 투명한 오일 11b (수율: 62.6%)을 얻었다: 1HNMR(400 MHz, CDCl3) δ: 6.98-7.01(m, 2H), 6.73-6.77(m, 4H), 6.55(t, 1H, J = 6.4 Hz), 6.07(t, 1H, J = 6.4 Hz), 5.78-5.82(m, 2H), 4.12-4.30(m, 6H), 3.67-3.84(m, 5H), 3.12-3.47(m, 10H), 2.80-2.86(m, 4H), 2.68(s, 4H), 2.62(t, 2H, J = 8.0 Hz), 2.31-2.44(m, 4H), 2.04-2.18(m, 3H), 1.77-1.85(m, 2H), 1.37-1.60(m, 66H), 1.22-1.28(m, 2H); HRMS (ESI) C78H122N7O25 (M+H+)에 대한 계산값, 1556.8490; 측정값, 1556.8360.
실시예 6c
(3S,7S)-트리-tert-부틸 22-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(5-(3-((2-(tert-부톡시)-2-옥소에틸)아미노)-3-옥소프로필)-2-하이드록시벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실레이트(11c).
화합물 11c는 11a (50 mg, 0.04 mmol), 글리신 t-부틸 에스테르 하이드로클로라이드 (10 mg, 0.06 mmol), EDCI (11.5 mg, 0.06 mol), HOBt(10.1 mg, 0.06 mmol), DMAP (0.5 mg, 0.004 mmol) 및 DIPEA (15.5 mg, 0.12 mmol)로부터 화합물 11b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 11c: 20 mg(수율: 37.3%): 1HNMR(400 MHz, CDCl3) δ: 6.98-7.01(m, 2H), 6.73-6.77(m, 4H), 6.55(t, 1H, J = 6.4 Hz), 6.07(t, 1H, J = 6.4 Hz), 5.78-5.82(m, 2H), 4.31-4.33(m, 2H), 4.14(d, 2H, J = 6.8 Hz), 3.67-3.69(m, 4H), 3.12-3.31(m, 8H), 2.68-2.86(m, 8H), 2.44-2.53(m, 4H), 2.32-2.35(m, 2H), 2.04-2.18(m, 3H), 1.77-1.85(m, 2H), 1.43-1.60(m, 63H), 1.22-1.28(m, 2H); HRMS (ESI) C70H114N7O18 (M+H+)에 대한 계산값, 1340.8220; 측정값, 1340.8227.
실시예 6d
(3S,7S)-트리-tert-부틸 22-(3-(((2-((5-(3-(((S)-1-(tert-부톡시)-1-옥소프로판-2-일)아미노)-3-옥소프로필)-2-하이드록시벤질)(2-(tert-부톡시)-2-옥소에틸)아미노)에틸)(2-(tert-부톡시)-2-옥소에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실레이트(11d).
화합물 11d는 11a (50 mg, 0.04 mmol), 알라닌 tert-부틸 에스테르 하이드로클로라이드 (10.9 mg, 0.06 mmol), EDCI (11.5 mg, 0.06 mol), HOBt(10.1 mg, 0.06 mmol), DMAP (0.5 mg, 0.004 mmol) 및 DIPEA (15.5 mg, 0.12 mmol)로부터 화합물 11b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 11d: 19 mg(수율: 35.1%): 1HNMR(400 MHz, CDCl3) δ: 6.98-7.01(m, 2H), 6.73-6.77(m, 4H), 6.55(t, 1H, J = 6.4 Hz), 6.07(t, 1H, J = 6.4 Hz), 5.78-5.82(m, 2H), 4.31-4.45(m, 3H), 3.67-3.69(m, 4H), 3.12-3.31(m, 8H), 2.81-2.86(m, 8H), 2.44-2.53(m, 4H), 2.32-2.35(m, 2H), 2.04-2.18(m, 3H), 1.77-1.85(m, 2H), 1.43-1.60(m, 66H), 1.22-1.28(m, 2H); HRMS (ESI) C71H116N7O18 (M+H+)에 대한 계산값, 1354.8377; 측정값, 1354.8431.
실시예 6e
(3S,7S)-트리-tert-부틸 22-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(5-(3-(((S)-1,4-디-tert-부톡시-1,4-디옥소부탄-2-일)아미노)-3-옥소프로필)-2-하이드록시벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실레이트(11e).
화합물 11e는 11a (50 mg, 0.04 mmol), L-아스파르트산 디-tert-부틸 에스테르 하이드로클로라이드 (14.4 mg, 0.06 mmol), EDCI (11.5 mg, 0.06 mol), HOBt(10.1 mg, 0.06 mmol), DMAP (0.5 mg, 0.004 mmol) 및 DIPEA (15.5 mg, 0.12 mmol)로부터 화합물 11b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 11e: 31 mg(수율: 35.1%): 1HNMR(400 MHz, CDCl3) δ: 6.98-7.01(m, 2H), 6.73-6.77(m, 4H), 6.55(t, 1H, J = 6.4 Hz), 6.07(t, 1H, J = 6.4 Hz), 5.78-5.82(m, 2H), 4.66-4.68(m, 1H), 4.28-4.33(m, 2H), 3.67-3.69(m, 4H), 3.12-3.31(m, 8H), 2.81-2.86(m, 8H), 2.44-2.68(m, 6H), 2.32-2.35(m, 2H), 2.04-2.18(m, 3H), 1.77-1.85(m, 2H), 1.43-1.60(m, 72H), 1.22-1.28(m, 2H); HRMS (ESI) C76H124N7O20 (M+H+)에 대한 계산값, 1454.8901; 측정값, 1454.8998.
실시예 6f
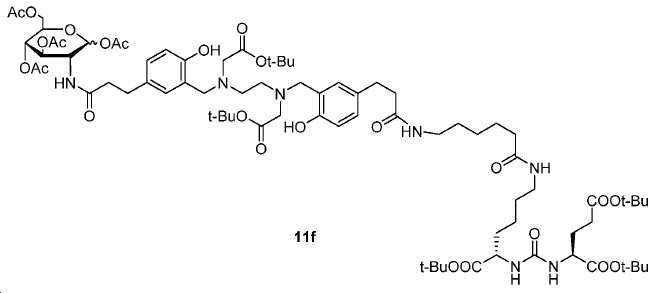
(3S,7S)-트리-tert-부틸 22-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(5-(3-(((S)-1,5-디-tert-부톡시-1,5-디옥소펜탄-2-일)아미노)-3-옥소프로필)-2-하이드록시벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실레이트(11f).
화합물 11f는 11a (50 mg, 0.04 mmol), L-글루탐산 디-tert-부틸 에스테르 하이드로클로라이드 (17.7 mg, 0.06 mmol), EDCI (11.5 mg, 0.06 mol), HOBt(10.1 mg, 0.06 mmol), DMAP (0.5 mg, 0.004 mmol) 및 DIPEA (15.5 mg, 0.12 mmol)로부터 화합물 11b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 11f:31 mg(수율: 35.1%): 1HNMR(400 MHz, CDCl3) δ: 6.98-7.01(m, 2H), 6.73-6.77(m, 4H), 6.55(t, 1H, J = 6.4 Hz), 6.07(t, 1H, J = 6.4 Hz), 5.78-5.82(m, 2H), 4.46-4.51(m, 1H), 4.28-4.33(m, 2H), 3.67-3.69(m, 4H), 3.12-3.31(m, 8H), 2.81-2.86(m, 8H), 2.04-2.57(m, 13H), 1.77-1.85(m, 2H), 1.43-1.60(m, 72H), 1.22-1.28(m, 2H); HRMS (ESI) C77H126N7O20 (M+H+)에 대한 계산값, 1468.9058; 측정값, 1468.9239.
실시예 6g
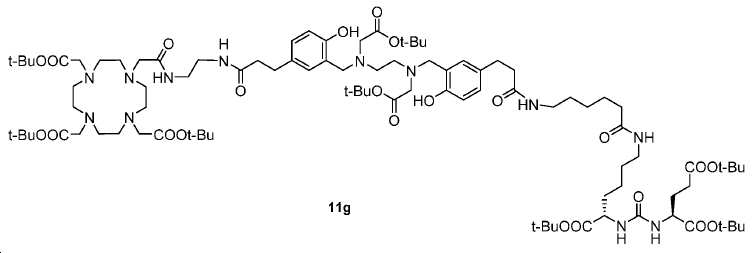
tert-부틸-(S)-6-(6-(3-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(2-하이드록시-5-(3-옥소-3-((2-(2-(4,7,10-트리스(2-(tert-부톡시)-2-옥소에틸)-1,4,7,10-테트라아자사이클로도데칸-1-일)아세트아미도)에틸)아미노)프로필)벤질)아미노)에틸)아미노)
메틸)-4-하이드록시페닐)프로판아미도)헥산아미도)-2-(3-((S)-1,5-디-tert-부톡시-1,5-디옥소펜탄-2-일)우레이도) 헥사노에이트 (11g)
화합물 11g는 11a (60 mg, 0.049 mmol), 2-아미노에틸-모노-아미드-DOTA-트리스-tBu 에스테르 (34 mg, 0.049 mmol), EDCI (14 mg, 0.074 mol), HOBt(12.4 mg, 0.074 mmol), 및 DIPEA (25.2 mg, 0.196 mmol)로부터 화합물 11b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 11g: 20 mg (수율: 22.4%): HRMS (ESI) C94H159N12O23 (M+H+)에 대한 계산값, 1824.1641; 측정값, 1824.1629.
실시예 7b
(3S,7S)-22-(3-(((카르복시메틸)(2-((카르복시메틸)(2-하이드록시-5-(3-옥소-3-(((3R,4R,5S,6R)-2,4,5-트리하이드록시-6-(하이드록시메틸)테트라하이드로-2H-피란-3-일)아미노)프로필)벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산(1b).
0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 11b (39 mg, 0.025 mmol)의 용액을 실온에서 3시간 동안 교반하였다. 반응 혼합물을 진공에서 증발시키고, 잔사를 에테르/EtOH로부터 재결정화시켜 13.2 mg 백색 고체 1b (수율: 47.4%)을 얻었다:1HNMR(400 MHz, MeOD) δ: 7.09-7.13(m, 4H), 6.80(d, 2H, J = 8.8 Hz), 4.24-4.33(m, 3H), 4.15(s, 2H), 4.09(s, 2H), 3.66-3.85(m, 9H), 3.16(t, 2H, J = 6.6 Hz), 3.11(t, 2H, J = 6.6 Hz), 2.80-2.84(m, 4H), 2.39-2.51(m, 6H), 2.13-2.17(m, 3H), 1.82-1.94(m, 2H), 1.42-1.67(m, 9H), 1.23-1.29(m, 2H); HRMS (ESI) C50H74N7O21(M+H+)에 대한 계산값, 1108.4938; 측정값, 1108.1940.
실시예 7c
(3S,7S)-22-(3-(((카르복시메틸)(2-((카르복시메틸)(5-(3-((카르복시메틸)아미노)-3-옥소프로필)-2-하이드록시벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산(1c).
화합물 1c를 0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 11c (20 mg, 0.015 mmol)로부터, 화합물 1b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 1c: 6.3 mg (수율: 41.8%): 1HNMR(400 MHz, MeOD) δ: 7.08-7.13(m, 4H), 6.80(d, 2H, J = 8.8 Hz), 4.24-4.33(m, 3H), 4.14(s, 2H), 4.08(s, 2H), 3.88(s, 2H), 3.68(s, 2H), 3.63(s, 2H), 3.17(t, 2H, J = 6.8 Hz), 3.09(t, 2H, J = 6.8 Hz), 2.80-2.87(m, 4H), 2.39-2.53(m, 6H), 2.13-2.17(m, 3H), 1.82-1.94(m, 2H), 1.42-1.67(m, 9H), 1.23-1.29(m, 2H); HRMS (ESI) C46H66N7O18(M+H+)에 대한 계산값, 1004.4464; 측정값, 1004.4498.
실시예 7d
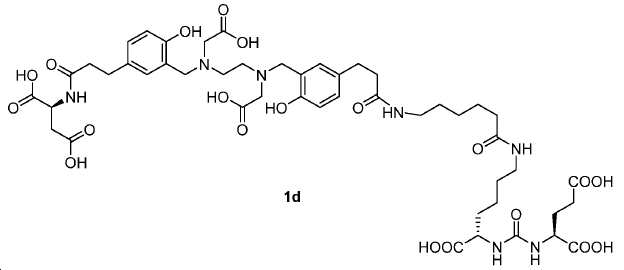
(3S,7S)-22-(3-(((2-((5-(3-(((S)-1-카르복시에틸)아미노)-3-옥소프로필)-2-하이드록시벤질)(카르복시메틸)아미노)에틸)(카르복시메틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산(1d).
화합물 1d를 0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 11d (20 mg, 0.014 mmol)로부터, 화합물 1b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 1d: 8.3 mg (수율: 58.2%): 1HNMR(400 MHz, MeOD) δ: 7.05-7.13(m, 4H), 6.80(d, 2H, J = 8.8 Hz), 4.24-4.33(m, 3H), 4.12(s, 2H), 4.09(s, 2H), 3.88(s, 2H), 3.68(s, 2H), 3.63(s, 2H), 3.17(t, 2H, J = 6.8 Hz), 3.10(t, 2H, J = 6.8 Hz), 2.80-2.87(m, 4H), 2.40-2.53(m, 6H), 2.13-2.17(m, 3H), 1.81-1.94(m, 2H), 1.42-1.67(m, 12H), 1.23-1.29(m, 2H); HRMS (ESI) C47H68N7O18(M+H+)에 대한 계산값, 1018.4621; 측정값, 1018.4707.
실시예 7e
(3S,7S)-22-(3-(((카르복시메틸)(2-((카르복시메틸)(5-(3-(((S)-1,2-디카르복시에틸)아미노)-3-옥소프로필)-2-하이드록시벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산(1e).
화합물 1e를 0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 11e (30 mg, 0.0206 mmol)로부터, 화합물 1b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 1e: 5.7 mg (수율: 26.1%): 1HNMR(400 MHz, MeOD) δ: 7.05-7.13(m, 4H), 6.80(d, 2H, J = 8.8 Hz), 4.72(t, 1H, J = 6.0 Hz), 4.24-4.33(m, 2H), 4.16(s, 2H), 4.08(s, 2H), 3.71(s, 2H), 3.64(s, 2H), 3.17(t, 2H, J = 6.8 Hz), 3.11(t, 2H, J = 6.8 Hz), 2.76-2.85(m, 6H), 2.39-2.52(m, 6H), 2.13-2.17(m, 3H), 1.81-1.94(m, 2H), 1.42-1.67(m, 9H), 1.23-1.29(m, 2H); HRMS (ESI) C48H68N7O20(M+H+)에 대한 계산값, 1062.4519; 측정값, 1062.4549.
실시예 7f
(3S,7S)-22-(3-(((카르복시메틸)(2-((카르복시메틸)(5-(3-(((S)-1,3-디카르복시프로필)아미노)-3-옥소프로필)-2-하이드록시벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산(1f).
화합물 1f를 0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 11f (40 mg, 0.027 mmol)로부터, 화합물 1b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 1f: 13.5 mg (수율: 46.4%): 1HNMR(400 MHz, MeOD) δ: 7.09-7.13(m, 4H), 6.81(dd, 2H, J = 4.4 Hz, J = 8.8 Hz), 4.41(dd, 1H, J = 4.8 Hz, J = 9.2 Hz), 4.24-4.33(m, 2H), 4.15(s, 2H), 4.09(s, 2H), 3.71(s, 2H), 3.65(s, 2H), 3.17(t, 2H, J = 6.8 Hz), 3.11(t, 2H, J = 6.8 Hz), 2.80-2.85(m, 4H), 2.39-2.52(m, 6H),2.27-2.31(m, 2H), 2.10-2.17(m, 4H), 1.81-1.94(m, 3H), 1.42-1.67(m, 9H), 1.23-1.29(m, 2H); HRMS (ESI) C49H70N7O20(M+H+)에 대한 계산값, 1076.4676; 측정값, 1076.4877.
실시예 7g
(3S,7S)-22-(3-(((카르복시메틸)(2-((카르복시메틸)(2-하이드록시-5-(3-옥소-3-((2-(2-(4,7,10-트리스(카르복시메틸)-1,4,7,10-테트라아자사이클로도데칸-1-일)아세트아미도)에틸)아미노)프로필)
벤질)아미노)에틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산 (1g).
화합물 1g를 0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 11g (20 mg, 0.011 mmol)로부터, 화합물 1b에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물1g: 12 mg (수율: 79.3%):1HNMR(400 MHz, MeOD) δ: 7.12(d, 1H, J = 2.0 Hz), 7.10(d, 1H, J = 2.0 Hz), 7.07-7.09(m, 2H), 6.80(dd, 2H, J = 2.0 Hz, J = 8.0 Hz), 4.24-4.33(m, 2H), 4.14(s, 2H), 4.11(s, 2H), 3.89(s, 4H), 3.77(s, 2H), 3.59-3.62(m, 6H), 3.45-3.38(m, 8H), 3.15-3.22(m, 10H), 3.11(t, 2H, J = 6.8 Hz), 2.80-2.85(m, 4H), 2.39-2.53(m, 6H), 2.13-2.17(m, 3H) 1.82-1.94(m, 2H), 1.42-1.67(m, 9H), 1.23-1.29(m, 2H); HRMS (ESI) C62H95N12O23(M+H+)에 대한 계산값, 1375.6633, 측정값, 1375.6654.
도식 11
도식 11 (이어서)
실시예 8
5-(벤질옥시)-2-아이오도피리딘 (14).
NaH (광물 오일 내 60%, 211 mg, 7 mmol)를 헥산으로 세척한 이중-목 플라스크에 담았다. 20 mL DMF를 부가하여 현탁액을 형성하였다. 10 mL DMF 내 5-하이드록시-2-브로모피리딘 (779 mg, 3.5 mmol)의 용액을 0 ℃에서 점적하여 부가하였다. 실온에서 30분간 교반한 후, 혼합물을 0 ℃까지 냉각시키고, 벤질 브로마이드 (898 mg, 5.25 mmol)를 점적하여 부가하고, 반응 혼합물을 실온에서 밤새 교반하였다. 혼합물을 이후 50 mL 차가운 포화 NH4Cl에 쏟고, DCM (50 mL x 2)으로 추출하였다. 유기층을 H2O (30 mL) 및 염수 (30 mL)로 세척하고, Na2SO4상에서 건조하고, 농축하고 FC (EtOAc/헥산 = 2/8)에 의해 정제하여 1.08 g 투명한 오일 14 (수율: 99%)을 얻었다.
실시예 9
(Z)-메틸 3-(5-(벤질옥시)피리딘-2-일)아크릴레이트 (15).
100 mL DMF 내 14 (4.67 g, 21.6 mmol), 메틸 아크릴레이트 (7.39 g, 43.2 mmol), 탄산칼륨 (K2CO3, 7.45 g, 54 mmol), 테트라부틸암모늄 브로마이드 (13.9 g, 43.2 mmol), 및 팔라듐 아세테이트 (Pd(OAc)2, 263.5 mg, 1.08 mmol)의 혼합물을 질소로 15분간 퍼징하여 산소를 없애고 이후 120 ℃로 밤새 가열하였다. 혼합물을 실온까지 냉각시키고, 300 mL EtOAc로 희석하고 H2O (80 mL x 2) 뿐만 아니라 염수 (80 mL)로 세척하였다. 유기층을 Na2SO4로 건조하고 여과하였다. 여과액을 농축하고, 잔사를 FC (EtOAc/헥산 = 2/8)에 의해 정제하여 3.86 g 무색 오일 15 (수율: 66.2%)를 얻었다: HRMS (ESI) C16H16NO3 (M+H+)에 대한 계산값, 270.1130; 측정값, 270.1109.
실시예 10
메틸 3-(5-하이드록시피리딘-2-일)프로파노에이트 (16).
50 mL MeOH 내 15 (3.86 g, 14.3 mmol) 및 Pd/C (500 mg)의 혼합물을 실온에서 H2하에 4시간 동안 교반하였다. 생성된 혼합물을 여과하고 여과액을 농축하여 2.6 g 무색 오일 16 (수율: 100%)을 얻었다: HRMS (ESI) C9H12NO3 (M+H+)에 대한 계산값, 182.0817; 측정값, 182.0740.
실시예 11
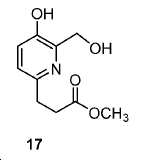
메틸 3-(5-하이드록시-6-(하이드록시메틸)피리딘-2-일)프로파노에이트 (17).
15 mL H2O 내 16 (480 mg, 2.7 mmol)의 용액에 NaOH (216 mg, 5.4 mmol) 및 파라포름알데히드 (486 mg, 16.2 mmol)를 부가하였다. 90 ℃에서 6시간 동안 교반한 후, 혼합물을 얼음-수조를 이용하여 냉각시켰다. 1 N HCl를 이용하여 pH를 7로 조정하였다. 용매를 진공에서 제거하였다. 20 mL DMF를 이후 잔사에 부가하고, 이어서 아이오도메탄 (2.3 g, 16.2 mmol) 및 중탄산 나트륨 (1.36 g, 16.2 mmol)을 부가하였다. 밤새 실온에서 교반한 후, 혼합물을 이후 100 mL EtOAc에 쏟고 H2O (30 mL x 2) 뿐만 아니라 염수 (30 mL)로 세척하였다. 유기층을 Na2SO4로 건조하고 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 440 mg 백색 고체 17 (수율: 76.9%)를 얻었다: HRMS (ESI) C10H14NO4 (M+H+)에 대한 계산값, 212.0923; 측정값, 212.0933.
실시예 12
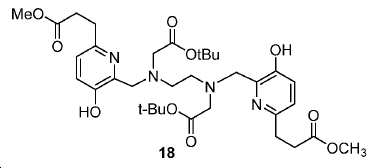
디메틸 3,3'-(6,6'-((2,2,13,13-테트라메틸-4,11-디옥소-3,12-디옥사-6,9-디아자테트라데칸-6,9-디일)비스(메틸렌))비스(5-하이드록시피리딘-6,2-디일))디프로파노에이트 (18).
5 mL 클로로포름 내 17 (190 mg, 0.90 mmol)의 용액에 포스포러스 트리브로마이드 (121 mg, 0.45 mmol)를 얼음-수조 하에서 한 방울씩 부가하였다. 혼합물을 실온까지 가열하고 3시간 동안 유지하였다. 생성된 혼합물을 이후 0 ℃로 냉각시켰다. DIPEA (462 mg, 3.58 mmol)를 부가하고 이어서 13 (102.5 mg, 0.356 mmol)을 부가하였다. 얼음-수조를 이후 제거하였다. 혼합물을 실온에서 밤새 교반하였다. 용매를 진공에서 제거하고 잔사를 FC (DCM/MeOH/NH4OH = 85/15/1.5)에 의해 정제하여 140 mg 무색 오일 18 (수율: 58.3%)를 얻었다: HRMS (ESI) C34H51N4O10 (M+H+)에 대한 계산값, 675.3605; 측정값, 675.3545.
실시예 13
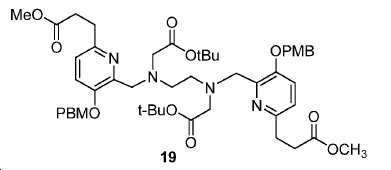
디메틸 3,3'-(6,6'-((2,2,13,13-테트라메틸-4,11-디옥소-3,12-디옥사-6,9-디아자테트라데칸-6,9-디일)비스(메틸렌))비스(5-((4-메톡시벤질)옥시)피리딘-6,2-디일))디프로파노에이트(19).
5 mL DMF 내 18 (140 mg, 0.21 mmol)의 용액에 0 ℃에서 4-메톡시벤질 (130 mg, 0.83 mmol) 및 NaH (33.2 mg, 0.83 mmol)를 부가하였다. 혼합물을 실온까지 가온하고 6시간 동안 유지하였다. 생성된 혼합물을 이후 30 mL EtOAc에 쏟고 H2O (10 mL x 2) 뿐만 아니라 염수 (10 mL)로 세척하였다. 유기층을 Na2SO4로 건조하고 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 61.8 mg 백색 고체 19 (수율: 32.6%)를 얻었다: HRMS (ESI) C50H67N4O12 (M+H+)에 대한 계산값, 915.4755; 측정값, 915.4689.
도식 12
도식 12 (이어서)
실시예 14
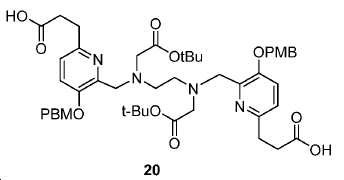
3,3'-(6,6'-((2,2,13,13-테트라메틸-4,11-디옥소-3,12-디옥사-6,9-디아자테트라데칸-6,9-디일)비스(메틸렌))비스(5-((4-메톡시벤질)옥시)피리딘-6,2-디일))디프로판산 (20).
2 mL MeOH 내 19 (61.8 mg, 0.068 mmol)의 용액에 2 mL NaOH (1 N)를 부가하였다. 실온에서 4시간 동안 교반한 후, pH = 4-5가 될 때까지 1 N HCl를 혼합물에 부가하였다. 생성된 혼합물을 이후 EtOAc(20 mL x 3)로 추출하였다. 유기층을 수집하고, 염수(20 mL)로 세척하고, Na2SO4로 건조하고 여과하였다. 여과액을 농축하여 47.7 mg 백색 고체 20(수율: 79.1%)를 얻었다: HRMS (ESI) C48H63N4O12 (M+H+)에 대한 계산값, 887.4442; 측정값, 887.4342.
실시예 15
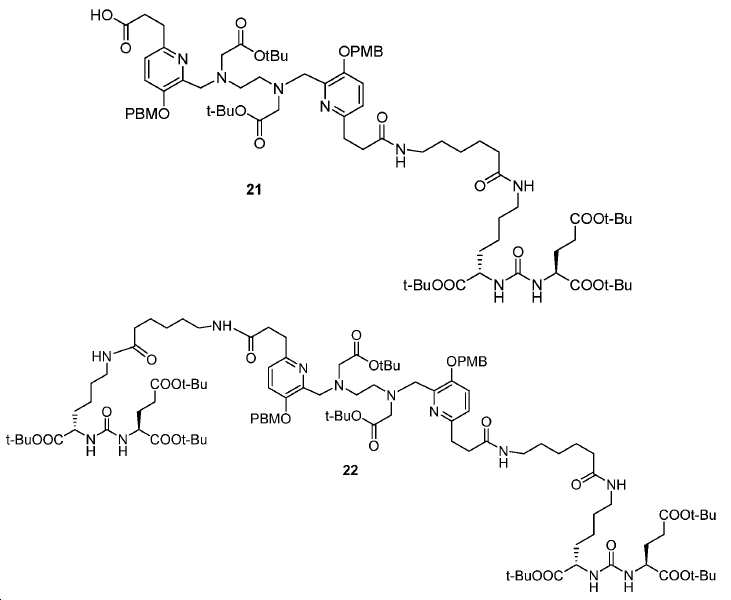
tert-부틸-3-(6-(((2-(((6-((7S,11S)-7,11-비스(tert-부톡시카르보닐)-2,2-디메틸-4,9,17,24-테트라옥소-3-옥사-8,10,16,23-테트라아자헥사코산-26-일)-3-((4-메톡시벤질)옥시)피리딘-2-일)메틸)(2-(tert-부톡시)-2-옥소에틸)아미노)에틸)(2-(tert-부톡시)-2-옥소에틸)아미노)메틸)-5-((4-메톡시벤질)옥시)피리딘-2-일)프로파노에이트 (21) 및 (S,2S,2'S)-6,6'-((6,6'-((3,3'-(6,6'-((2,2,13,13-테트라메틸-4,11-디옥소-3,12-디옥사-6,9-디아자테트라데칸-6,9-디일)비스(메틸렌))비스(5-((4-메톡시벤질)옥시)피리딘-6,2-디일))비스(프로파노일))비스 (아자네디일))비스(헥사노일))비스(아자네디일))비스(tert-부틸-2-(3-((S)-1,5-디-tert-부톡시-1,5-디옥소펜탄-2-일)우레이도)헥사노에이트) (22).
4 mL DMF 내 20 (47.7 mg, 0.054 mmol)의 용액에 10 (32.7 mg, 0.054 mmol), N,N′-디사이클로헥실카르보디이미드 (EDCI, 15.4 mg, 0.081 mol), N-하이드록시벤조트리졸 (HOBt, 13.7 mg, 0.081 mmol), 및 DIPEA (20.9 mg, 0.162 mmol)을 부가하였다. 밤새 실온에서 교반한 후에, 혼합물을 EtOAc (30 mL)로 희석하고, H2O (10 x 2mL) 및 염수 (10 mL)로 세척하고, Na2SO4상에서 건조하고, 농축하고 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 19 mg 투명한 오일 21 (수율: 23.9%) 및 10 mg 22 (수율: 9.1%)을 얻었다: 화합물 21: HRMS (ESI) C78H117N8O19 (M+H+)에 대한 계산값, 1469.8435; 측정값, 1469.8511; 화합물 22: HRMS (ESI) C108H171N12O28 (M+H+)에 대한 계산값, 2052.2427; 측정값, 2052.2408.
실시예 16
(3S,7S)-22-(6-(((2-(((6-(2-카르복시에틸)-3-하이드록시피리딘-2-일)메틸)
(카르복시메틸)아미노)에틸)(카르복시메틸)아미노)메틸)-5-하이드록시피리딘-2-일)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산 (2).
0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 21 (19 mg, 0.013 mmol)의 용액을 실온에서 3시간 동안 교반하였다. 반응 혼합물을 진공에서 증발시키고, 잔사를 에테르/EtOH로부터 재결정화시켜 10 mg 백색 고체 2 (수율: 81.0%)을 얻었다:1HNMR(400 MHz, MeOD) δ: 7.65-7.74(m, 4H), 4.40(s, 2H), 4.35(s, 2H), 4.29-4.33(m, 1H), 4.20-4.24(m, 1H), 3.80(s, 2H), 3.74(s, 2H), 3.44-3.45(m, 4H), 3.14-3.29(m, 8H), 2.91(t, 2H, J = 7.0 Hz), 2.74(t, 2H, J = 7.2 Hz), 2.55(t, 2H, J = 7.2 Hz), 2.19-2.26(m, 3H), 1.99-2.04(m, 1H), 1.86-1.88(m, 1H), 1.73-1.77(m, 1H), 1.45-1.61(m, 8H), 1.25-1.29(m, 2H); HRMS (ESI) C42H61N8O17(M+H+)에 대한 계산값, 949.4155; 측정값, 949.4116.
도식 13
도식 13 (이어서)
실시예 17
(3S,3'S,7S,7'S)-22,22'-(6,6'-((에탄-1,2-디일비스((카르복시메틸)아자네디일)) 비스(메틸렌))비스(5-하이드록시피리딘-6,2-디일))비스(5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산) (3).
화합물 3를 0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 22 (10 mg, 0.0049 mmol)로부터, 화합물 2에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 3: 3.6 mg (수율: 53.9%): 1HNMR(400 MHz, MeOD) δ: 7.68(d, 2H, J = 8.4 Hz), 7.62(d, 2H, J = 8.4 Hz), 4.30-4.35(m, 6H), 4.21-4.23(m, 2H), 3.72(s, 4H), 3.46(s, 4H), 3.15-3.23(m, 12H), 2.71-2.75(m, 4H), 2.54-2.58(m, 4H), 2.20-2.27(m, 6H), 1.99-2.04(m, 2H), 1.86-1.88(m, 2H), 1.73-1.77(m, 2H), 1.45-1.61(m, 16H), 1.25-1.29(m, 4H); HRMS (ESI) C60H91N12O24(M+H+)에 대한 계산값, 1363.6269; 측정값, 1363.6332.
도식 14
도식 14 (이어서)
실시예 18
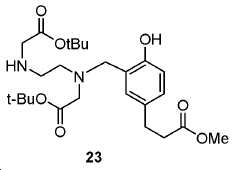
메틸 3-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)아미노)에틸) 아미노)메틸)-4-하이드록시페닐)프로파노에이트 (23).
75 mL EtOH 및 75 mL 톨루엔 내 13 (1.7 g, 5.9 mmol)의 용액에 실온에서 5 (885 mg, 4.92 mmol) 및 파라포름알데히드 (1.06 g, 35.3 mmol)를 부가하였다. 혼합물을 밤새 환류 하에 가열하였다. 혼합물을 농축하고, 잔사를 플래시 크로마토그래피 (FC) (EtOAc/헥산 = 2/8)에 의해 정제하여 850 mg 무색 오일 23 (수율: 36%)을 얻었다: HRMS (ESI) C25H41N2O7 (M+H+)에 대한 계산값, 481.2914; 측정값, 481.2963.
실시예 19
(Z)-tert-부틸 3-(5-(벤질옥시)피리딘-2-일)아크릴레이트 (24).
75 mL DMF 내 14 (5.56 g, 17.8 mmol), tert-부틸 아크릴레이트 (4.58 g, 35.7 mmol), 탄산칼륨 (K2CO3, 4.92 g, 35.7 mmol), 테트라부틸암모늄 브로마이드 (11.5 g, 35.7 mmol), 및 팔라듐 아세테이트 (Pd(OAc)2, 217 mg, 0.89 mmol)의 혼합물을 질소로 15분간 퍼징하여 산소를 없애고 이후 120 ℃로 밤새 가열하였다. 혼합물을 실온까지 냉각시키고, 250 mL EtOAc로 희석하고 H2O (60 mL x 2) 뿐만 아니라 염수 (60 mL)로 세척하였다. 유기층을 Na2SO4로 건조하고 여과하였다. 여과액을 농축하고, 잔사를 FC (EtOAc/헥산 = 2/8)에 의해 정제하여 2.15 g 무색 오일 24 (수율: 38.7%)를 얻었다: HRMS (ESI) C19H22NO3 (M+H+)에 대한 계산값, 312.1600; 측정값, 312.1672.
실시예 20
메틸 3-(5-하이드록시피리딘-2-일)프로파노에이트 (25).
50 mL MeOH 내 24 (2.15 g, 6.89 mmol) 및 Pd/C (430 mg)의 혼합물을 실온에서 H2하에 4시간 동안 교반하였다. 생성된 혼합물을 여과하고 여과액을 농축하여 1.54 g 무색 오일 25 (수율: 100%)을 얻었다: HRMS (ESI) C12H18NO3 (M+H+), 224.1287에 대한 계산값; 측정값, 224.1208.
실시예 21
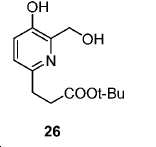
tert-부틸 3-(5-하이드록시-6-(하이드록시메틸)피리딘-2-일)프로파노에이트 (26).
50 mL H2O 내 25 (2.15 g, 9.6 mmol)의 용액에 NaOH (422 mg, 10.56 mmol) 및 파라포름알데히드 (1.73 g, 57.6 mmol)를 부가하였다. 90 ℃에서 3시간 동안 교반한 후, 혼합물을 얼음-수조를 이용하여 냉각시켰다. 1 N HCl를 이용하여 pH를 7로 조정하였다. 용매를 진공에서 제거하였다. 잔사를 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 1.3 g 백색 고체 26 (수율: 53.3%)를 얻었다: HRMS (ESI) C13H20NO4 (M+H+)에 대한 계산값, 254.1392; 측정값, 254.1436.
실시예 22
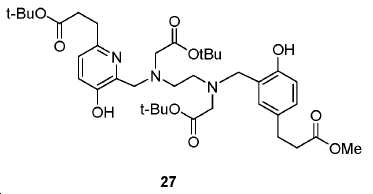
tert-부틸 3-(6-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(2-하이드록시-5-(3-메톡시-3-옥소프로필)벤질)아미노)에틸)아미노)메틸)-5-하이드록시피리딘-2-일)프로파노에이트 (27).
5 mL 클로로포름 내 26 (153 mg, 0.6 mmol)의 용액에 포스포러스 트리브로마이드 (81.4 mg, 0.3 mmol)를 얼음-수조 하에서 한 방울씩 부가하였다. 혼합물을 실온까지 가열하고 3시간 동안 유지하였다. 생성된 혼합물을 이후 0 ℃로 냉각시켰다. DIPEA (384 mg, 3 mmol)를 부가하고 이어서 23 (241 mg, 0.5 mmol)을 부가하였다. 얼음-수조를 이후 제거하였다. 혼합물을 실온에서 밤새 교반하였다. 용매를 진공에서 제거하고 잔사를 FC (DCM/MeOH/NH4OH = 85/15/1.5)에 의해 정제하여 25 mg 무색 오일 27 (수율: 7%)를 얻었다: HRMS (ESI) C38H58N3O10 (M+H+)에 대한 계산값, 716.4122; 측정값, 716.4169.
실시예 23
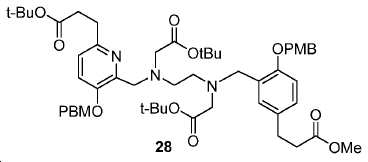
tert-부틸 3-(6-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(5-(3-메톡시-3-옥소프로필)-2-((4-메톡시벤질)옥시)벤질)아미노)에틸)아미노)메틸)-5-((4-메톡시벤질)옥시)피리딘-2-일)프로파노에이트 (28).
2 mL DMF 내 27 (23 mg, 0.032 mmol)의 용액에 0 ℃에서 4-메톡시벤질 (17.4 mg, 0.064 mmol) 및 Cs2CO3 (20.93 mg, 0.064 mmol)를 부가하였다. 혼합물을 실온까지 가온하고 4시간 동안 유지하였다. 생성된 혼합물을 이후 30 mL EtOAc에 쏟고 H2O (10 mL x 2) 뿐만 아니라 염수 (10 mL)로 세척하였다. 유기층을 Na2SO4로 건조하고 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 25 mg 투명한 오일 28 (수율: 81.5%)를 얻었다: HRMS (ESI) C54H74N3O12 (M+H+)에 대한 계산값, 956.5272; 측정값, 956.5240.
실시예 24
(S)-6-(6-(3-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)((6-(3-(tert-부톡시)-3-옥소프로필)-3-((4-메톡시벤질)옥시)피리딘-2-일)메틸)아미노)에틸) 아미노)메틸)-4-((4-메톡시벤질)옥시)페닐)프로판아미도)헥산아미도)-2-(3-((S)-1,5-디-tert-부톡시-1,5-디옥소펜탄-2-일)우레이도)헥산산 (29).
1 mL MeOH 내 28 (25 mg, 0.026 mmol)의 용액에 1 mL NaOH (1 N)를 부가하였다. 실온에서 4시간 동안 교반한 후, pH = 4-5가 될 때까지 1 N HCl를 혼합물에 부가하였다. 생성된 혼합물을 이후 EtOAc(10 mL x 3)로 추출하였다. 유기층을 수집하고, 염수(10 mL)로 세척하고, Na2SO4로 건조하고 여과하였다. 여과액을 농축하여 23 mg 백색 고체를 얻었다. 2 mL DMF를 이후 잔사에 부가하고, 이어서 Glu-NH-CO-NH-Lys(Ahx)-NH2(10, 19.1 mg, 0.032 mmol), N,N′-디사이클로헥실카르보디이미드 (EDCI, 7.57 mg, 0.040 mol), N-하이드록시벤조트리졸 (HOBt, 6.7 mg, 0.040 mmol), 및
DIPEA (6.84 mg, 0.053 mmol)를 부가하였다. 밤새 실온에서 교반한 후에, 혼합물을 EtOAc (30 mL)로 희석하고, H2O (10 x 2mL) 및 염수 (10 mL)로 세척하고, Na2SO4상에서 건조하고, 농축하고 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 15 mg 투명한 오일 29 (수율: 37.7%)을 얻었다: HRMS (ESI) C83H126N7O19 (M+H+)에 대한 계산값, 1524.9108; 측정값, 1524.9088.
도식 15
실시예 25
(3S,7S)-22-(3-(((2-(((6-(2-카르복시에틸)-3-하이드록시피리딘-2-일)메틸)(카르복시메틸)아미노)에틸)(카르복시메틸)아미노)메틸)-4-하이드록시페닐)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산 (4a).
화합물 4a를 0.9 mL 트리플루오로아세트산 (TFA) 및 0.1 mL 디메틸 설파이드 내 29 (15 mg, 0.0098 mmol)로부터, 화합물 2에 대해 기술된 것과 동일한 절차로 제조하였다. 화합물 4a: 4.5 mg (수율: 48.4%): 1HNMR(400 MHz, MeOD) δ: 7.68-7.71(m, 1H), 7.58-7.65(m, 1H), 7.09-7.21(m, 2H), 6.82(dd, 1H, J = 6.4 Hz, J = 8.4 Hz), 4.43(2H), 4.20-4.36(m, 4H), 3.87(s, 2H), 3.48-3.51(m, 6H), 3.10-3.21(m, 6H), 2.83-2.86(m, 4H), 2.39-2.46(m, 4H), 2.11-2.19(m, 3H), 1.82-1.94(m, 2H), 1.42-1.67(m, 9H), 1.23-1.29(m, 2H); HRMS (ESI) C43H62N7O17(M+H+)에 대한 계산값, 948.4202; 측정값, 948.4173.
도식 16
실시예 26
tert-부틸 3-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)아미노) 에틸)아미노)메틸)-4-하이드록시페닐)프로파노에이트 (33).
30 mL EtOH 내 32 (565 mg, 2.54 mmol)의 용액에 실온에서 13 (880 mg, 3 mmol) 및 파라포름알데히드 (762 mg, 25.4 mmol)를 부가하였다. 혼합물을 환류 하에 6시간 동안 가열하였다. 혼합물을 농축하고, 잔사를 플래시 크로마토그래피 (FC) (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 900 mg 무색 오일 33 (수율: 67.7%)을 얻었다: HRMS (ESI) C28H47O7 (M+H+)에 대한 계산값, 523.3383; 측정값, 523.3484.
도식 17
실시예 27
tert-부틸 3-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)((3-하이드록시-6-(3-메톡시-3-옥소프로필)피리딘-2-일)메틸)아미노)에틸)아미노)메틸)-4-하이드록시페닐)프로파노에이트 (34).
5 mL 클로로포름 내 17 (150 mg, 0.71 mmol)의 용액에 포스포러스 트리브로마이드 (95.6 mg, 0.35 mmol)를 얼음-수조 하에서 한 방울씩 부가하였다. 혼합물을 실온까지 가열하고 3시간 동안 유지하였다. 생성된 혼합물을 이후 0 ℃로 냉각시켰다. DIPEA (547 mg, 4.24 mmol)를 부가하고 이어서 33 (295 mg, 0.57 mmol)을 부가하였다. 얼음-수조를 이후 제거하였다. 혼합물을 실온에서 밤새 교반하였다. 용매를 진공에서 제거하고 잔사를 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 120 mg 무색 오일 34 (수율: 29.6%)를 얻었다: HRMS (ESI) C38H58N3O10 (M+H+)에 대한 계산값, 716.4122; 측정값, 716.4241.
실시예 28
tert-부틸 3-(3-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)((6-(3-메톡시-3-옥소프로필)-3-((4-메톡시벤질)옥시)피리딘-2-일)메틸)아미노)에틸)아미노) 메틸)-4-((4-메톡시벤질)옥시)페닐)프로파노에이트 (35).
5 mL DMF 내 34 (120 mg, 0.17 mmol)의 용액에 0 ℃에서 4-메톡시벤질 (105 mg, 0.67 mmol) 및 Cs2CO3 (217.8 mg, 0.67 mmol)를 부가하였다. 혼합물을 실온까지 가온하고 6시간 동안 유지하였다. 생성된 혼합물을 이후 30 mL EtOAc에 쏟고 H2O (10 mL x 2) 뿐만 아니라 염수 (10 mL)로 세척하였다. 유기층을 Na2SO4로 건조하고 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 80 mg 투명한 오일 35 (수율: 49.8%)를 얻었다: HRMS (ESI) C54H74N3O12 (M+H+)에 대한 계산값, 956.5272; 측정값, 956.5322.
실시예 29
(3S,7S)-트리-tert-부틸 22-(6-(((2-(tert-부톡시)-2-옥소에틸)(2-((2-(tert-부톡시)-2-옥소에틸)(5-(3-(tert-부톡시)-3-옥소프로필)-2-((4-메톡시벤질)옥시)벤질)아미노)에틸) 아미노)메틸)-5-((4-메톡시벤질)옥시)피리딘-2-일)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실레이트 (36).
2 mL MeOH 내 35 (80 mg, 0.084 mmol)의 용액에 2 mL NaOH (1 N)를 부가하였다. 실온에서 4시간 동안 교반한 후, pH = 4-5가 될 때까지 1 N HCl를 혼합물에 부가하였다. 생성된 혼합물을 이후 EtOAc(20 mL x 3)로 추출하였다. 유기층을 수집하고, 염수(20 mL)로 세척하고, Na2SO4로 건조하고 여과하였다. 여과액을 농축하여 65 mg 백색 고체를 얻었다. 4 mL DMF를 이후 잔사에 부가하고, 이어서 Glu-NH-CO-NH-Lys(Ahx)-NH2(10, 41.4mg, 0.069 mmol), N,N′-디사이클로헥실카르보디이미드 (EDCI, 19.7mg, 0.104 mol), N-하이드록시벤조트리졸 (HOBt, 17.5mg, 0.104 mmol), 및 DIPEA (26.7mg, 0.207 mmol)를 부가하였다. 밤새 실온에서 교반한 후에, 혼합물을 EtOAc (30 mL)로 희석하고, H2O (10 x 2mL) 및 염수 (10 mL)로 세척하고, Na2SO4상에서 건조하고, 농축하고 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 20 mg 투명한 오일 36 (수율: 15.6%)을 얻었다: HRMS (ESI) C83H126N7O19 (M+H+)에 대한 계산값, 1524.9108; 측정값, 1524.9266.
실시예 30
(3S,7S)-22-(6-(((2-((5-(2-카르복시에틸)-2-하이드록시벤질)(카르복시메틸)아미노)에틸) (카르복시메틸)아미노)메틸)-5-하이드록시피리딘-2-일)-5,13,20-트리옥소-4,6,12,19-테트라아자도코산-1,3,7-트리카르복실산 (4b).
1 mL 트리플루오로아세트산 (TFA) 내 36 (20 mg, 0.013 mmol)의 용액을 실온에서 3시간 동안 교반하였다. 반응 혼합물을 진공에서 증발시키고, 잔사를 Et2O로 세척하고 반-분취 HPLC에 의해 정제하여 6.7 mg 백색 고체 4b (수율: 54.4%)을 얻었다:1HNMR(400 MHz, MeOD) δ: 7.79(d, 1H, J = 8.4 Hz), 7.62(d, 1H, J = 8.4 Hz), 7.20-7.27(m, 2H), 6.84(d, 1H, J = 8.4 Hz), 4.55(s, 2H), 4.23-4.33(m, 4H), 3.98 (s, 2H), 3.53(s, 4H), 3.16-3.25(m, 6H), 2.83-2.87(m, 2H), 2.74-2.77(m, 2H), 2.38-2.59(m, 4H), 2.11-2.19(m, 3H), 1.82-1.94(m, 2H), 1.42-1.67(m, 9H), 1.23-1.29(m, 2H); HRMS (ESI) C43H62N7O17(M+H+)에 대한 계산값, 948.4202; 측정값, 948.4137.
실시예 31
방사선표지
0.05 N HCl 용액 내에 용리된 갈륨-68을 68Ge/68Ga 발생제 (iTG, Germany)로부터 얻었다. 68Ga 표지를 위한 전구체로서 HBED-PSMA 유도체를 이용하여 신규한 리간드를 제조하기 위해, 1 mL 0.1 N NaOAc 내 1 mg의 스톡 용액을 제조하고 각각의 방사선표지 연구를 위해 사용하였다. 68Ga의 표지는 68Ga 용액 및 2N NaOAc 용액을 리간드에 부가한 후에 수행하였다. 최적 반응 척도를 다양한 pH 수준 (2-7) 및 0.6-3.0 μM 범위의 리간드 농도에 걸쳐 측정하였다. 생체 내 연구를 위해서는, 68Ga 표지된 물질의 더 높은 양의 방사능이 요구되었다. 표지는 수성 NaOAc 완충액 (120 μL, 2.0 M) 내에서 리간드 용액 (20 μL, 1 mg/mL)을 68Ga 용액 (0.05 N HCl 내 4 mL)에 부가함으로써 수행되었다. 용액의 최종 pH는 4.10였다.
[68Ga]1a-g, 2, 3 및 4a-b의 표지에 대한 다른 금속 이온의 영향을 다양한 가능한 금속 오염물질, 가령 Zn+2, Fe+3, Cu+2 및 Sn+2의 존재에서 최적화 표지 반응을 수행함으로써 시험하였다. 표지는 수성 NaOAc 완충액 (30 μL, 0.2 M) 내에서 리간드 용액 (5 μL, 0.1 mg/mL), 68Ga 용액 (0.05 N HCl 내 100 μL) 및 요망되는 최종 오염 농도를 얻기 위해 필요한 각각의 금속 염화물의 15 μL 스톡 용액을 조합함으로써 수행되었다.
반응 혼합물을 실온에서 10분간 방치한 후 방사선표지 수율을 측정하였다. [68Ga]1a-g, 2, 3 및 4a-b에 대한 방사화학적 수율은 HPLC에 의해 측정하였다. HPLC 시스템은 Gemini C18 컬럼 (용매 A: MeOH; 용매 B: 물 내 0.1% TFA)을 이용하고 구배: 0-6분 (0-100% A); 유속 2 mL/분으로 구성하였다. 모든 리간드, [68Ga]1a-g, 2, 3 및 4a-b의 68Ga 복합체화는 실온에서 10분의 반응 시간 후에 90-99%의 방사화학적 수율을 생성하였다. 그 결과로서, 방사선추적자가 나중에 추가의 정제 없이 시험관 내 및 생체 내 실험을 위해 사용되었다.
적절한 금속 이온, 가령 Lu(III) 클로라이드가 DOTA 및 HBED와의 금속 복합체에 대한 금속의 복합화 성능 및 안정성 상수의 차이를 근거로, 화합물 1g의 DOTA 모이어티의 선택적 방사선표지를 위한 것으로 확인될 수 있다. 선택적 방사선표지를 위한 조건은 68Ga(III)에 대해 앞서 기술된 바와 유사한 반응 조건 하에서, 단 177Lu(III) 및 리간드, 1g의 반응 혼합물을 95℃로 30분간 가열하는 것이 필요함을 받아들이는 것을 제외하고는 통상적으로 최적화될 수 있다. [177Lu]1g를 제조하기 위한 반응은 우수한 방사화학적 수율 (> 99%)로 매끄럽게 진행되었다.
중간체 화합물 43의 제조는 하기의 화학 반응 (도식 18)을 기초로 하였다.
도식 18
도식 18 (이어서)
실시예 32
(5S,12S,16S)-트리-tert-부틸 5-벤질-3,6,14-트리옥소-1-페닐-2-옥사-4,7,13,15-테트라아자옥타데칸-12,16,18-트리카르복실레이트. (37)
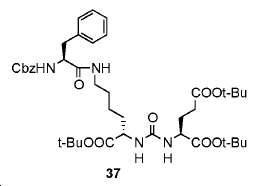
20 mL DCM 내 Z-Phe-OH (218.3 mg, 0.55 mmol)의 용액에, 트리에틸아민 (Et3N, 101 mg, 1 mmol , (S)-디-tert-부틸-2-(3-((S)-6-아미노-1-tert-부토이-1-옥소헥산-2-일)우레이도)펜탄디오에이트 (248 mg, 0.5 mmol) HOBt (10 mg) 및 EDCI (197 mg, 1.1mmol)를 실온에서 밤새 부가하였다. 용매를 제거하고 잔사를 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 37을 무색 오일로서 얻었다(수율: 250 mg, 65%): 1HNMR (400 MHz, CDCl3) δ: 7.29-7.34 (m, 5H), 7.17-7.23 (m, 5H), 6.88 (br s, 1H), 6.11 (br s, 1H), 5.99 (br s, 1H), 5.65 (br s, 1H), 4.99-5.10 (m, 2H), 4.40-4.97 (m, 2H), 4.29-4.34 (m, 1H), 3.42 (br s, 1H), 2.96-3.08 (m, 3H), 2.32-2.37 (m, 2H), 2.03-2.12 (m, 1H), 1.78-1.89 (m, 1H), 1.66-1.73 (m, 1H), 1.57-1.66 (m, 1H), 1.27-1.52 (m, 31H).HRMS C41H60N4O10에 대한 계산값 768.4309, 측정값 769.4491 [M+H]+.
실시예 33
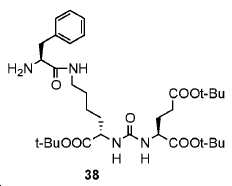
(S)-디-tert-부틸 2-(3-((S)-6-((S)-2-아미노-3-페닐프로판아미도)-1-(tert-부톡시)-1-옥소헥산-2-일)우레이도)펜탄디오에이트. (38)
10 mL EtOH 내 37 (250 mg, 0.325 mmol) 및 Pd/C(50 mg)의 혼합물을 실온에서 H2하에 밤새 교반하였다. 반응 혼합물을 이후 여과하였다. 여과액을 농축하여 38을 무색 오일로서 얻었다 (수율: 200 mg, 96.9%): 1HNMR (400 MHz, CDCl3) δ: 7.21-7.35 (m, 5H), 5.52-5.58 (m, 2H), 4.27-4.38 (m, 2H), 3.59-3.62 (m, 1H), 3.17-3.36 (m, 3H), 2.66-2.72(m, 1H), 2.24-2.39 (m, 2H), 2.02-2.11 (m, 1H), ), 1.78-1.89 (m, 1H), 1.66-1.73 (m, 1H), 1.57-1.66 (m, 1H), 1.27-1.52 (m, 31H).HRMS C33H54N4O8에 대한 계산값 634.3942, 측정값 635.4011 [M+H]+.
실시예 34
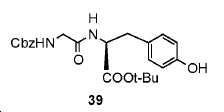
(S)-tert-부틸 2-(2-(((벤질옥시)카르보닐)아미노)아세트아미도)-3-(4-하이드록시페닐)프로파노에이트. (39)
5 mL DMF 내 2-(((벤질옥시)카르보닐)아미노)아세트산 (0.836 g, 4 mmol)의 용액에, N,N-디이소프로필에틸아민 (DIPEA, 1.55 g, 12 mmol), 1-하이드록시벤조트리아졸 하이드레이트 (HOBt, 6 mmol, 1.01 g), N-(3-디메틸아미노프로필)-N-에틸카르보디이미드 하이드로클로라이드 (EDCI, 1.14 g, 6 mmol) 및 (R)-tert-부틸 2-아미노-3-(4-하이드록시페닐)프로파노에이트 (0.949 g, 4 mmol)를 0 ℃에서 부가하였다. 혼합물을 실온에서 밤새 교반한 후에 30 mL EtOAc를 반응 혼합물에 부가하였다. 이를 이후 H2O (10 mL x 2) 및 염수 (10 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 39를 백색 고체로서 얻었다 (수율: 1.66 g, 96.7%): 1HNMR (400 MHz, CDCl3) δ: 7.33-7.38 (m, 5H), 6.99 (d, 2H, J = 8.0 Hz), 6.71 (d, 2H, J = 8.0 Hz), 6.32 (br s, 1H), 5.31 (br s, 1H), 5.14 (s, 2H), 4.83 (d, 1 H, J = 6.0 Hz), 3.80-3.93 (m, 2H), 3.03 (d, 2H, J = 5.2 Hz), 1.43 (s, 9H). HRMS C23H28N2O6에 대한 계산값 428.1947, 측정값 429.2014 [M+H]+.
실시예 35
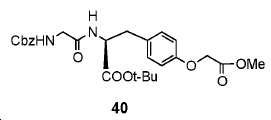
(S)-tert-부틸 2-(2-(((벤질옥시)카르보닐)아미노)아세트아미도)-3-(4-(2-메톡시-2-옥소에톡시)페닐)프로파노에이트. (40)
40 mL ACN 내 39 (1.66 g, 3.88 mmol)의 용액에, 메틸 브로모아세테이트 (1.66 g, 8.51 mmol) 및 K2CO3 (1.07 g, 7.76 mmol)를 부가하였다. 혼합물을 이후 실온에서 3시간 동안 교반하고 여과하였다. 여과액을 농축하고, 잔사를 FC (EtOAc/헥산 = 1/1)에 의해 정제하여 40을 무색 오일로서 얻었다 (수율: 1.76 g, 90.5%). 1HNMR (400 MHz, CDCl3) δ: 7.32-7.37(m, 5H), 7.10(d, 2H, J = 8.4 Hz), 6.81(d, 2H, J = 8.4 Hz), 6.32(br s, 1H), 5.31(br s, 1H), 5.14(s, 2H), 4.69-4.74(m, 1H), 4.60(s, 2H), 3.80-3.93(m, 5H), 3.04(d, 2H, J = 6.4 Hz), 1.43(s, 9H).HRMS C26H32N2O8에 대한 계산값 500.2159, 측정값 501.2043 [M+H]+.
실시예 36
(S)-2-(4-(2-(2-(((벤질옥시)카르보닐)아미노)아세트아미도)-3-(tert-부톡시)-3-옥소프로필)페녹시)아세트산. (41)
20 mL MeOH/NaOH (1 N) (V/V=1/1) 내 40 (1.76 g, 3.51 mmol)의 용액을 실온에서 2시간 동안 교반하였다. HCl (1 N)를 이후 pH = 4-5가 될 때까지 반응 혼합물에 부가하였다. 생성된 혼합물을 EtOAc(50 mL x 3)로 추출하였다. 유기층을 이후 MgSO4상에서 건조하고 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 90/9/1)에 의해 정제하여 41을 백색 고체로서 얻었다 (수율: 0.91 g, 53.2%). 1HNMR (400 MHz, CDCl3) δ: 7.32-7.37 (m, 5H), 7.05 (d, 2H, J = 8.4 Hz), 6.81 (d, 2H, J = 8.4 Hz), 6.50 (br s, 1H), 5.48 (br s, 1H), 5.14 (s, 2H), 4.70-4.75 (m, 1H), 4.59 (s, 2H), 3.84 (s, 2H), 3.04 (d, 2H, J = 6.4 Hz), 1.43 (s, 9H).HRMS C25H30N2O8에 대한 계산값 486.2002, 측정값 487.1999 [M+H] +.
실시예 37
(4S,11S,15S)-트리-tert-부틸 4-벤질-1-(4-((S)-2-(2-(((벤질옥시)카르보닐)아미노)아세트아미도)-3-(tert-부톡시)-3-옥소프로필)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실레이트. (42)
15 mL DMF 내 41 (559 mg, 1.2 mmol)에, 0 ℃에서 DIPEA (309.6 mg, 2.4 mmol), HOBt(304 mg, 1.8 mmol), 38 (762 mg, 1.2 mmol) 및 EDCI (342 mg, 1.8 mmol)를 부가하였다. 혼합물을 실온에서 밤새 교반한 후에 30 mL EtOAc를 반응 혼합물에 부가하였다. 이를 이후 H2O (10 mL x 2) 및 염수 (10 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 42를 백색 고체로서 얻었다 (수율: 987 mg, 74.6%): 1HNMR (400 MHz, CDCl3) δ: 7.32-7.37 (m, 5H), 7.19-7.24 (m, 5H), 6.97 (d, 2H, J = 7.6 Hz), 6.70 (d, 2H, J = 8.4 Hz), 6.22 (br s, 1H), 6.01 (br s, 1H), 5.63 (d, 1H, J = 6.8 Hz), 5.06-5.13 (m, 2H), 4.83-4.91 (m, 1H), 4.69-4.70 (m, 2H), 4.31-4.38 (m, 2H), 4.19-4.28 (m, 2H), 3.86 (dd, 2H, J = 5.2 Hz, J = 17.2 Hz), 3.36-3.44 (m, 1H), 2.99-3.16 (m, 4H), 2.84-2.91 (m, 1H), 2.32-2.37 (m, 2H), 2.03-2.12 (m, 1H), 1.78-1.89 (m, 1H), 1.66-1.73 (m, 1H), 1.57-1.66 (m, 1H), 1.27-1.52 (m, 40H). HRMS C29H42N3O15/2 (1/2M + H)+에 대한 계산값: 552.2998, 측정값 552.3054.
실시예 38
(4S,11S,15S)-트리-tert-부틸 1-(4-((S)-2-(2-아미노아세트아미도)-3-(tert-부톡시)-3-옥소프로필)페녹시)-4-벤질-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실레이트. (43)
10 mL EtOH 내 42 (987 mg, 0.895 mmol) 및 Pd/C (200 mg)의 혼합물을 실온에서 H2하에 밤새 교반하였다. 반응 혼합물을 이후 여과하였다. 여과액을 농축하여 43을 무색 오일로서 얻었다 (수율: 788 mg, 91.2%): 1HNMR (400 MHz, CD3OD) δ: 7.20-7.30(m, 5H), 7.17 (d, 2H, J = 8.4 Hz), 6.87 (d, 2H, J = 8.8 Hz), 4.66-4.69(m, 1H), 4.43-4.59(m, 3H), 4.21 (dd, 1H, J = 5.2 Hz, J = 8.6 Hz), 4.13 (dd, 1H, J = 5.2 Hz, J = 8.6 Hz), 3.26 (d, 2H, J = 3.2 Hz), 2.93-3.17 (m, 6H), 2.32-2.37 (m, 2H), 2.03-2.12 (m, 1H), 1.78-1.89 (m, 1H), 1.66-1.73 (m, 1H), 1.57-1.66 (m, 1H), 1.27-1.52 (m, 40H).HRMS C33H54N4O8에 대한 계산값 634.3942, 측정값 635.4011 [M+H] +.
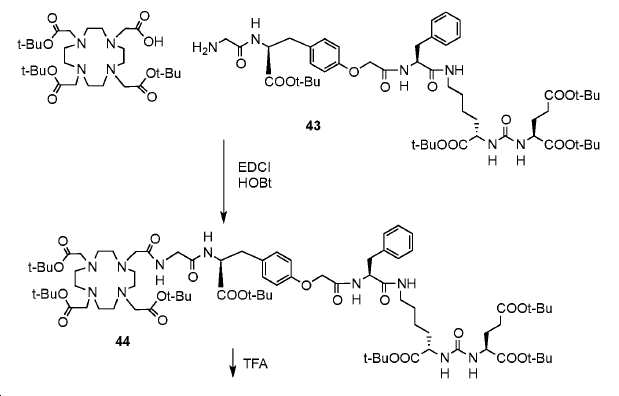
화합물 5a의 제조는 하기의 화학 반응 (도식 19)을 기초로 하였다.
도식 19
도식 19 (이어서)
실시예 39
(4S,11S,15S)-트리-tert-부틸4-벤질-1-(4-((S)-3-(tert-부톡시)-3-옥소-2-(2-(2-(4,7,10-트리스(2-(tert-부톡시)-2-옥소에틸)-1,4,7,10-테트라아자사이클로도데칸-1-일)아세트아미도)아세트아미도)프로필)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실레이트. (44)
2 mL DMF 내 DOTA-트리스-tBu 에스테르 (28.6 mg, 0.05 mmol)에, 0 ℃에서 DIPEA (24.8 mg, 0.192 mmol), HOBt (16.2 mg, 0.096 mmol), 43 (50 mg, 0.048 mmol) 및 EDCI (18.2 mg, 0.096 mmol)를 부가하였다. 혼합물을 실온에서 밤새 교반하고, 이후 15 mL EtOAc를 상기 용액에 부가하였다. 이를 이후 H2O (5 mL x 2) 및 염수 (5 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 43을 무색 오일로서 얻었다 (수율: 26 mg, 35.6%): HRMS C39H64N5O10 (1/2M + H)+에 대한 계산값: 762.4653, 측정값 762.4787.
실시예 40
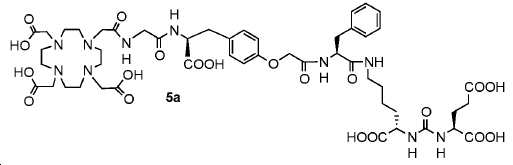
(4S,11S,15S)-4-벤질-1-(4-((S)-2-카르복시-2-(2-(2-(4,7,10-트리스(카르복시메틸)-1,4,7,10-테트라아자사이클로도데칸-1-일)아세트아미도)아세트아미도)에틸)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실산. (5a)
1 mL 트리플루오로아세트산 (TFA) 내 기질 44 (26 mg, 0.017 mmol)의 용액을 실온에서 5시간 동안 교반하였다. 반응 혼합물을 진공에서 증발시키고, 잔사를 에테르/EtOH로부터 재결정화시켰다. 생성된 백색 고체를 1 mL MeOH에 용해하고 분취-HPLC (A: H2O 내 0.1% TFA, B: MeOH, 0-18 분, 0%-80% B)에 의해 정제하여 5.3 mg 백색 고체 5a (수율: 27.6%)를 얻었다: 1HNMR(400 MHz, CD3OD) δ: 1HNMR (400 MHz, CD3OD) δ: 7.19-7.27 (m, 5H), 7.15 (d, 2H, J = 8.4 Hz), 6.85 (d, 2H, J = 8.4 Hz), 4.64-4.6 (m, 2H), 4.43-4.53(m, 2H), 4.29-4.33 (m, 1H), 4.21-4.24 (m, 1H), 3.71-4.01 (m, 8H), 3.27-3.43 (m, 16H), 3.07-3.19 (m, 6H), 2.94-3.02 (m, 2H), 2.38-2.43 (m, 2H), 2.09-2.18(m, 1H), 1.77-1.93 (m, 2H), 1.59-1.64 (m, 1H), 1.30-1.48 (m, 4H); HRMS (ESI) C25H36N5O10 (1/2M +H+)에 대한 계산값, 566.2642, 측정값, 566.2545.
화합물 5b의 제조는 하기의 화학 반응 (도식 20)을 기초로 하였다.
도식 20
도식 20 (이어서)
실시예 41
3-(3-(((2-((5-(3-((2-(((S)-3-(4-(((4S,11S,15S)-4-벤질-11,15-비스(tert-부톡시카르보닐)-20,20-디메틸-2,5,13,18-테트라옥소-19-옥사-3,6,12,14-테트라아자헤니코실)옥시)페닐)-1-(tert-부톡시)-1-옥소프로판-2-일)아미노)-2-옥소에틸)아미노)-3-옥소프로필)-2-하이드록시벤질)(2-(tert-부톡시)-2-옥소에틸)아미노)에틸)(2-(tert-부톡시)-2-옥소에틸)아미노)메틸)-4-하이드록시페닐)프로판산. (46)
2 mL DMF 내 HBED-CC(59.8 mg, 0.092 mmol)의 용액에 0 ℃에서 DCC (19.0 mg, 0.092 mmol) 및 NHS(10.6 mg, 0.092 mmol)를 부가하였다. 혼합물을 실온에서 6시간 동안 교반한 후에 15 mL EtOAc를 반응 혼합물에 부가하였다. 이를 이후 H2O (5 mL x 2) 및 염수 (5 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사 (45)를 정제 없이 직접 사용하였다. 3 mL DMF를 잔사에 부가하고, 이어서 DIPEA (11.9 mg, 0.092 mmol) 및 43 (45 mg, 0.046 mmol)를 부가하였다. 혼합물을 실온에서 밤새 교반하였다. 15 mL EtOAc를 반응 혼합물에 부가하였다. 이를 이후 H2O (5 mL x 2) 및 염수 (5 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 46을 무색 오일로서 얻었다 (수율: 38 mg, 51.8%): 1HNMR (400 MHz, CDCl3) δ: 7.20-7.24 (m, 5H), 6.99-7.04 (m, 4H), 6.63-6.78 (m, 6H), 5.66 (d, 1H, J = 8.4 Hz), 4.93(br s, 1H), 4.72-4.75 (m, 1H), 4.26-4.40 (m, 3H), 3.79-3.84 (m, 2H), 3.57 (s, 4H), 3.41-3.45 (m, 1H), 3.24 (s, 2H), 3.21 (s, 2H), 2.89-3.17 (m, 6H), 2.78-2.85 (m, 4H), 2.45-2.63 (m, 8H), 2.32-2.37 (m, 2H), 2.03-2.12 (m, 1H), 1.78-1.89 (m, 1H), 1.66-1.73 (m, 1H), 1.57-1.66 (m, 1H), 1.27-1.52 (m, 58H); HRMS C42H62N4O11 (1/2M + H)+에 대한 계산값: 798.4415, 측정값 798.4492.
실시예 42
(4S,11S,15S)-4-벤질-1-(4-((S)-2-카르복시-2-(2-(3-(3-(((2-((5-(2-카르복시에틸)-2-하이드록시벤질)(카르복시메틸)아미노)에틸)(카르복시메틸)아미노)메틸)-4-하이드록시페닐)프로판아미도)아세트아미도)에틸)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실산. (5b)
화합물 5d (수율: 11.3 mg, 37.7%)는 46 (38 mg, 0.0238 mmol) 및 1 mL TFA로부터, 화합물 5a에 대해 기술된 것과 동일한 절차에 따라 제조하였다. 1HNMR (400 MHz, CD3OD) δ: 7.09-7.29 (m, 11H), 6.79-6.86 (m, 4H), 4.64-4.69 (m, 2H), 4.41-4.54 (m, 2H), 4.31-4.34 (m, 1H), 4.24-4.27 (m, 1H), 4.12 (s, 2H), 4.10 (s, 2H), 3.78-3.87 (m, 2H), 3.67 (s, 4H), 3.30 (s, 4H), 3.07-3.18 (4H), 2.93-3.03 (m, 2H), 2.81-2.85 (m, 4H), 2.49-2.58 (m, 4H), 2.39-2.44 (m, 2H), 2.11-2.19 (m, 1H), 1.87-1.95 (m, 1H), 1.77-1.83 (m, 1H), 1.58-1.67 (m, 1H), 1.31-1.47 (m, 4H); 13C NMR (100 MHz, DMSO-d 6 ) δ 175.02, 174.63, 174.31, 174.20, 173.29, 172.29, 170.81, 170.56, 169.37, 167.84, 157.78, 156.83, 155.01, 154.94, 137.94, 132.41, 132.32, 131.86, 130.59, 130.41, 129.66, 128.54, 126.82, 115.84, 114.80, 65.37, 54.13, 53.99, 52.73, 52.11, 49.92. 35.99, 32.20, 29.92, 27.96, 23.07, 18.98. HRMS C30H38N4O11 (1/2M + H)+에 대한 계산값: 630.2537, 측정값 630.3151.
실시예 43
5b의 68Ga-표지
68Ge/68Ga 발생제 (ITG) 및 25 μL 2 N NaOAc의 0.05 M HCl 내 0.5-1mL 용리액을 부가하고 전구체 5b (2-4 nmol)와 혼합하고 60 ℃에서 항온처리하였다. 10분 후에, 표지 효율성 및 방사화학적 순도를 Radio-HPLC를 이용하여 측정하였다. 68Ga-표지된 접합체의 방사화학적 순도는 ≥ 98%이었다. 그러므로, 추적자는 추가의 정제 없이 희석되고 시험관 내 및 생체 내 실험에 사용되었다. 68Ga-표지된 PSMA 저해제의 특이적 활성은 500 내지 1000 Ci/mmol이었다. 분석용 역상 고성능 액체 크로마토그래피 (RP-HPLC)를 Agilent 구배 HPLC 시스템을 사용하는 Luna C18 (5 μm, 150 x 4.6 mm) 컬럼에서 수행하였다. [68Ga]P16-093는 상이한 구배의 H2O 내 0.1% (v/v) 트리플루오로아세트산 (TFA) 및 MeOH 내 0.1% TFA (v/v)를 적용하여 2 mL/분 (0-6 분, 0.1% TFA를 갖는 100% H2O로부터 0.1% TFA를 갖는 100% MeOH로 및 이후 다시 0.1% TFA를 갖는 100% H2O로 6-8 분)의 일정한 유속으로 용리하였다. 방사선표지 수율은 꾸준히 > 90%이었고 방사화학적 순도는 >98%이었다.
화합물 5c 및 5d는 하기의 화학 반응 (도식 21)을 기초로 제조하였다.
도식 21
실시예 44
(4S,11S,15S)-트리-tert-부틸 4-벤질-1-(4-((S)-3-tert-부톡시-2-(2-(3-아이오도벤즈아미도)아세트아미도)-3-옥소프로필)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실레이트 (47a).
2 mL DMF 내 3-아이오도벤조산 (112 mg, 0.048 mmol)에, 0 ℃에서 DIPEA (24.8 mg, 0.192 mmol), HOBt(16.2 mg, 0.096 mmol), EDCI (18.2 mg, 0.096 mmol) 및 43 (50 mg, 0.048 mmol)를 부가하였다. 혼합물을 실온에서 밤새 교반한 후에 15 mL EtOAc를 반응 혼합물에 부가하였다. 이를 이후 H2O (5 mL x 2) 및 염수 (5 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 43을 무색 오일로서 얻었다 (수율: 40 mg, 69.4%): 1HNMR (400 MHz, CDCl3) δ: 8.11 (s, 1H), 7.81-7.84 (m, 1H), 7.68 (d, 1H, J = 7.6 Hz), 7.25-7.27 (m, 5H), 7.14 (t, 1H, J = 8.0 Hz), 6.92 (d, 2H, J = 8.4 Hz), 6.64 (d, 2H, J = 8.4 Hz), 5.65 (d, 1H, J = 8.4 Hz), 5.18 (br s, 1H), 4.97 (br s, 1H), 4.80-4.85 (m, 1H), 4.49-4.52 (m, 1H), 4.25-4.30 (m, 1H), 4.11-4.15 (m, 1H), 3.95 (dd, 1H, J = 4.0 Hz, J = 17.2 Hz), 3.58 (br s, 1H), 3.34-3.39 (m, 1H), 3.18-3.25 (m, 2H), 3.02-3.12 (m, 2H), 2.85-2.90 (m, 1H), 2.28-2.42 (m, 2H), 2.08-2.14 (m, 1H), 1.81-1.90 (m, 1H), 1.66-1.73 (m, 1H), 1.57-1.66 (m, 1H), 1.27-1.52 (m, 40H); HRMS C57H80IN6O14 (M + H)+에 대한 계산값: 1199.4777, 측정값 1199.4886.
실시예 45
(4S,11S,15S)-트리-tert-부틸 4-벤질-1-(4-((S)-3-tert-부톡시-2-(2-(2-아이오도벤즈아미도)아세트아미도)-3-옥소프로필)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실레이트 (47b).
화합물 47b (수율: 25 mg, 43.4%)는 43 (50 mg, 0.048 mmol)로부터, 화합물 47a에 대해 기술된 것과 동일한 절차에 따라 제조하였다. 7.86(d, 1H, J = 8.0 Hz), 7.38-7.39 (m, 2H), 7.19-7.27 (m, 5H), 7.03-7.13 (m, 3H), 6.73-6.79 (m, 2H), 6.22 (br s, 1H), 5.99-6.00 (m, 1H), 5.73-5.75 (m, 1H), 5.66 (d, 1H, J = 8.0 Hz), 4.93 (br s, 1H), 4.74-4.82 (m, 2H), 4.21-4.46 (m, 3H), 4.04-4.11 (m, 1H), 3.48 (br s, 1H), 3.38-3.41 (m, 1H), 3.04-3.20 (m, 4H), 2.88-2.99 (m, 1H), 2.28-2.42 (m, 2H), 2.08-2.14 (m, 1H), 1.81-1.90 (m, 1H), 1.66-1.73(m, 1H), 1.57-1.66(m, 1H), 1.27-1.52 (m, 40H); HRMS C57H80IN6O14 (M + H)+에 대한 계산값: 1199.4777, 측정값 1199.4845.
실시예 46
(4S,11S,15S)-4-벤질-1-(4-((S)-2-카르복시-2-(2-(3-아이오도벤즈아미도)아세트아미도)에틸)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실산 (5c).
1 mL 트리플루오로아세트산 (TFA) 내 기질 (40 mg, 0.033 mmol)의 용액을 실온에서 5시간 동안 교반하였다. 반응 혼합물을 진공에서 증발시키고, 잔사를 에테르/EtOH로부터 재결정화시켜 25 mg 백색 고체 (수율: 77.8%)을 얻었다: 1HNMR(400 MHz, CD3OD) δ: 1HNMR (400 MHz, CD3OD) δ: 8.19-8.20 (m, 1H), 7.87-7.93 (m, 2H), 7.81-7.84 (m, 1H), 7.11-7.28 (m, 7H), 6.77 (d, 2H, J = 8.4 Hz), 4.64-4.72 (m, 2H), 4.42 (dd, 2H, J = 14.8 Hz, J = 34.8 Hz), 4.29-4.33 (m, 1H), 4.22-4.25 (m, 1H), 4.01 (d, 2H, J = 2.8 Hz), 3.07-3.17 (m, 4H), 2.96-3.02 (m, 2H), 2.38-2.42 (m, 2H), 2.09-2.17 (m, 1H), 1.75-1.9 3(m, 2H), 1.56-1.65 (m, 1H), 1.40-1.46 (m, 2H), 1.31-1.37 (m, 2H); HRMS C41H48IN6O14 (M + H)+에 대한 계산값: 975.2273, 측정값: 975.2386.
실시예 47
(4S,11S,15S)-4-벤질-1-(4-((S)-2-카르복시-2-(2-(2-아이오도벤즈아미도)아세트아미도)에틸)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실산 (5d).
1 mL 트리플루오로아세트산 (TFA) 내 기질 (60 mg, 0.05 mmol)의 용액을 실온에서 5시간 동안 교반하였다. 반응 혼합물을 진공에서 증발시키고, 잔사를 에테르/EtOH로부터 재결정화시켜 29 mg 백색 고체 (수율: 59.5%)을 얻었다: 1HNMR(400 MHz, CD3OD) δ: 1HNMR (400 MHz, CD3OD) δ: 7.94-8.00 (m, 1H), 7.88-7.90 (m, 1H), 7.37-7.44 (m, 2H), 7.14-7.28 (m, 7H), 6.83 (d, 2H, J = 8.8 Hz), 4.63-4.73 (m, 2H), 4.44 (dd, 2H, J = 14.8 Hz, J = 34.8 Hz), 4.29-4.33 (m, 1H), 4.22-4.25 (m, 1H), 4.01 (dd, 2H, J = 16.6 Hz, J = 26.5 Hz), 3.06-3.20 (m, 4H), 2.96-3.04 (m, 2H), 2.38-2.42 (m, 2H), 2.09-2.17 (m, 1H), 1.75-1.93 (m, 2H), 1.56-1.65 (m, 1H), 1.40-1.46 (m, 2H), 1.31-1.37 (m, 2H); HRMS C41H48IN6O14 (M + H)+에 대한 계산값: 975.2273, 측정값: 975.2281.
실시예 48
3-(트리부틸스탄닐)벤조산 (48).
8 mL 톨루엔 내 3-아이오도벤조산 (248 mg, 1 mmol), Pd(PPh3)4 (115.8 mg, 0.1 mmol) 및 비스(트리부틸주석)(2.9 g, 5 mmol)의 혼합물을 15분간 질소로 퍼징시켜 산소를 제거하고 이후 95 ℃로 4시간 동안 가열하였다. 용매를 제거하고, 잔사를 FC (EtOH/헥산 = 4/6)에 의해 정제하여 48을 무색 오일로서 얻었다 (수율: 40 mg, 69.4%): 1HNMR (400 MHz, CDCl3) δ: 8.16-8.25 (m, 1H), 8.02-8.04 (m, 1H), 7.66-7.76 (m, 1H), 7.41-7.45 (m, 1H), 1.46-1.64 (m, 6H), 1.30-1.41 (m, 6H), 1.02-1.20 (m, 6H), 0.89-0.95(m, 9H).
실시예 49
(4S,11S,15S)-트리-tert-부틸 4-벤질-1-(4-((S)-3-tert-부톡시-3-옥소-2-(2-(3-(트리부틸스탄닐)벤즈아미도)아세트아미도)프로필)페녹시)-2,5,13-트리옥소-3,6,12,14-테트라아자헵타데칸-11,15,17-트리카르복실레이트 (6a).
2 mL THF 내 48 (59.8 mg ,0.092 mmol)의 용액에 0 ℃에서 DCC (19.0 mg, 0.092 mmol) 및 NHS(10.6 mg, 0.092 mmol)를 부가하였다. 혼합물을 실온에서 6시간 동안 교반한 후에 15 mL EtOAc를 반응 혼합물에 부가하였다. 이를 이후 H2O (5 mL x 2) 및 염수 (5 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사를 정제 없이 직접 사용하였다. 3 mL DMF를 잔사에 부가하고, 이어서 DIPEA (11.9 mg, 0.092 mmol) 및 43 (50 mg, 0.046 mmol)를 부가하였다. 혼합물을 실온에서 밤새 교반하였다. 15 mL EtOAc를 반응 혼합물에 부가하였다. 이를 이후 H2O (5 mL x 2) 및 염수 (5 mL)로 세척하고, MgSO4상에서 건조하고, 여과하였다. 여과액을 농축하고, 잔사를 FC (DCM/MeOH/NH4OH = 95/5/0.5)에 의해 정제하여 6a를 무색 오일로서 얻었다 (수율: 39 mg, 62.2%): 1HNMR (400 MHz, CDCl3) δ: 7.90-8.00 (m, 1H), 7.58-7.63 (m, 2H), 7.33-7.37 (m, 1H), 7.19-7.29 (m, 5H), 6.95 (d, 2H, J = 8.4 Hz), 6.46 (d, 2H, J = 8.4 Hz), 5.72 (d, 1H, J = 8.4 Hz), 5.18 (br s, 1H), 4.81-4.85 (m, 2H), 4.45-4.50 (m, 1H), 4.28-4.33 (m, 1H), 4.11-4.15 (m, 1H), 4.00-4.05 (m, 1H), 3.64 (br s, 1H), 3.39-3.41 (m, 1H), 3.03-3.22 (m, 4H), 2.90-2.92 (m, 1H), 2.29-2.44 (m, 2H), 2.07-2.15 (m, 1H), 1.81-1.90 (m, 1H), 1.27-1.66 (m, 52H), 1.02-1.20 (m, 6H), 0.89-0.95 (m, 9H); HRMS C79H106N6O14Sn (M + H)+에 대한 계산값: 1363.6867, 측정값 1363.7005.
화합물 5e는 하기의 화학 반응 (도식 22)을 기초로 제조하였다.
도식 22
도식 22 (이어서)
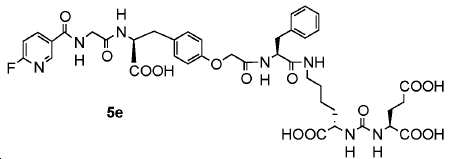
실시예 50
화합물 49의 합성
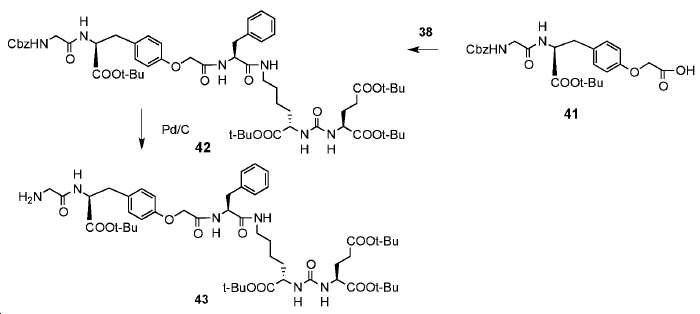
교반된 화합물 43 (200 mg, 2.1 mmol), 및 6-플루오로피리딘-3-카르복실산(28 mg, 2 mmol)의 DMF (20 mL) 용액에, Et3N(2ml), HOBt(10 mg), HBTU(148 mg, 4 mmol)를 차례로 부가하였다. 반응물을 실온에서 2시간 동안 교반하고, 용액을 에틸 아세테이트로 추출하고, 염수로 세척하고, Na2SO4로 건조하였다. 용액을 회전 증발에 의해 제거하여 점성 오일을 얻었고, 이를 콤비플래시(DCM: 메탄올:NH3 H2O 90: 9:1)에 의해 정제하여 표제 화합물 49를 무색 오일로서 얻었다(138 mg, 61.2%). 1HNMR (400 MHz, CDCl3) δ:8.60 (d, J=2.28Hz, 1H), 8.48-8.41 (m, 2H), 8.14-8.10 (m, 2H), 7.92 (s, 1H), 6.94 (dd, J=2.8, 2.8Hz, 1H), 6.85 (d, J=8.4Hz, 2H), 5.72 (d, J=8.4Hz, 1H), 5.39-5.33 (m, 2H), 4.87-4.84 (m, 1H), 4.55-4.50 (m, 1H), 4.30-4.25 (m, 1H), 4.17 (s, 1H), 4.03-3.91 (m, 2H), 3.45-3.42 (m, 1H), 3.33-3.26 (m, 2H), 3.18-3.13 (m, 2H), 3.06 (dd, J=4.0, 4.0Hz, 1H), 2.95-2.88 (m, 1H), 2.44-2.28(m, 2H), 2.17-2.08 (m, 1H). 1.93-1.83 (m, 1H), 1.54 (s, 9H) , 1.45 (s, 18H), 1.28 (s, 9H). 13CNMR (100 MHz, CDCl3) δ:175.57, 172.37, 172.13, 172.08, 170.07, 169.94, 168.59, 166.30, 165.43, 163.88, 157.50, 155.94, 148.33, 140.48, 140.39, 137.02, 130.65, 129.43, 128.74, 128.30, 127.46, 127.41, 126.63, 114.07, 109.35, 108.99, 82.65, 82.11, 81.25, 80.35, 77.38. 77.07, 76.75, 65.88, 54.43, 53.83, 52.76, 52.43, 42.94, 39.91, 39.00, 36.74, 33.11, 31.67, 28.92, 28.57. 28.21, 28.11, 27.99, 27.90, 22.61. HRMS C56H78FN7O14에 대한 계산값, 1091.5591. 측정값 1092.5743 [M+H]+.
실시예 51
화합물 5e의 합성
10 mL TFA 내 화합물 49 (120mg, 0.11)의 교반된 용액을 실온에서 밤새 교반하였다. 혼합물을 이후 진공 하에 제거하고, 에테르를 잔사에 부가하여 백색 산물 5e (95 mg, 100%)을 얻었다.1HNMR (400 MHz, DMSO-d6) δ: 8.93 (t, J=5.6Hz, 1H), 8.71 (d, J=2.4Hz, 1H), 8.41-8.36 (m, 1H), 8.25 (d, J=8.0Hz, 1H), 8.06 (d, J=8.0Hz, 2H), 7.31 (dd, J=2.4, 2.4Hz, 1H), 7.24-7.18 (m, 5H), 7.10 (d, J=8.4Hz, 2H), 6.72 (d, J=8.4Hz, 2H), 6.33-6.28 (m, 5H), 4.52 (d, J=5.2Hz, 1H), 4.4 (s, 3H), 4.1-4.0 (m, 3H), 3.97-3.82 (m, 4H), 3.11-3.04 (m, 3H), 3.01-2.96 (m, 5H), 2.89-2.80 (m, 3H), 2.27-2.21 (m, 2H), 1.92-1.89(m, 1H), 1.73-1.61 (m, 2H), 1.52-1.48 (m, 1H), 1.35-1.33 (m, 2H), 1.25-1.19 (m, 2H). 13CNMR (100 MHz, DMSO-d6) δ: 175.02, 174.63, 174.20, 173.30, 170.81, 169.04, 167.84, 164.35, 157.77, 156.84, 148.00, 141.99, 141.90, 137.95, 130.61, 130.45, 129.66, 128.55, 126.82, 114.79, 110.10, 109.72, 67.06, 54.16, 53.99, 52.73, 52.11, 42.99, 36.37, 32.20, 30.34, 29.12, 27.96, 23.06 HRMS C40H46FN7O14에 대한 계산값 867.3087 측정값 868.3088[M+H] +.
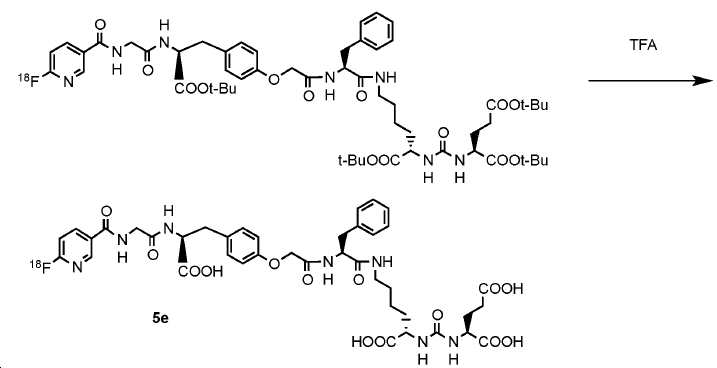
5e의 방사선표지는 하기 기술된 도식에 의해 생성될 수 있다(도식 23)
도식 23
화합물 5f는 하기의 화학 반응 (도식 24)을 기초로 제조하였다. 5f의 방사선표지는 공지의 방법에 의해 수행될 수 있다.
도식 24
실시예 52
5a 및 5b의 68Ga 표지
68Ge/68Ga-발생제 (ITG, Germany)를 4 mL의 0.01N HCl로 용리하였다. 전형적으로, 2 nmol의 5a 또는 5b를 25 μL 2 N NaOAc 및 500 μL [68Ga]GaCl3 용리액의 혼합물에 부가하였다. 표지 용액의 pH는 다양한 강도의 NaOAc 용액을 이용하여 조정하였다. 반응 혼합물을 5a는 90℃에서 및 5b는 실온에서 10분간 항온처리하였다. 방사화학적 순도 (RCP)를 분석용 RP-HPLC를 통해 측정하였다.
[68Ga]GaCl3를 이용한 표지는 5a 및 5b 두 가지 모두에 있어서 전형적으로 97%를 초과하는 방사화학적 순도를 얻었다. 표지에 있어서 리간드 양, 시간, pH 및 온도의 효과를 시험하였다.
5b를 pH 3.2~4.6의 조건에서, 2 n몰의 리간드 만큼 적게 그리고 실온에서 4분 이상 [68Ga]GaCl3로 정량적으로 표지하였다. 5a의 표지를 위해서는 5분간 70-90℃로의 가열이 필요하였다.
생물학적 평가
실시예 53
PSMA에 대한 IC50를 측정하기 위한 시험관 내 경쟁적 결합 어세이
결합 친화성을 측정하기 위해, 시험관 내 경쟁적 결합 어세이를 수행하였다. LNCaP 세포를 10가지 상이한 농도의 경쟁 약물의 존재에서 150,000 cpm의 [125I]MIP-1095와 함께 배양하였다. 37 ℃에서 1시간 동안 배양한 후, 결합 및 유리 방사능을 Brandel M-24R 세포 수확기를 이용하여 GF/B 여과지를 통해 진공 여과시켜 분리하고 두 차례 세척하였다. 비-특이적 결합은 10 μM PMPA로 확인되었다. 세포 결합 방사능을 감마 계수기, 2470 Wizard2 (Perkin-Elmer, IL)로 측정하였다. 비선형 회귀 알고리즘 (GraphPad Software)를 이용하여 데이터를 정합시켜 IC50 값을 산출하였다.
PSMA 결합 친화성을 LNCaP 인간 전립선 암종 세포 및 공지의 높은 친화성 PSMA 리간드, [125I]MIP-1095를 방사성 리간드로 이용하는 경쟁적 결합 어세이로 측정하였다. 무-금속 PSMA-저해 리간드 및 공지의 PSMA 저해제에 대한 IC50 값이 표 1에 요약되어 있다. 데이터는 중간 ±SD (n = 4)로서 표현된다.
표 1. 차가운 리간드의 PSMA 결합 친화성 (IC50, nM)
| 리간드 |
IC50 (nM) |
리간드 |
IC50 (nM) |
|
1a (PSMA-11)
|
16.6 ± 2.4 |
4b
|
40.5 ± 20.5 |
|
1b
|
53.3 ± 30.9 |
5a
|
36.1 ± 18.1 |
|
1c
|
25.6 ± 9.4 |
5b
|
11.6 ± 5.2 |
|
1d
|
26.8 ± 6.3 |
[
천연
Ga]5b
|
16.5 ± 3.1 |
|
1e
|
29.5 ± 11.0 |
5c
|
5.0 ± 1.9 |
|
1f
|
37.2 ± 18.6 |
5d
|
5.3 ± 2.2 |
|
1g
|
70.2 ± 29.1 |
5e
|
6.0 ± 1.8 |
|
2
|
40.4 ± 18.3 |
MIP-1095
|
4.6 ± 1.4 |
|
3
|
132 ± 11 |
2-PMPA
|
147 ± 44 |
|
4a
|
67.4 ± 30.3 |
ZJ-43
|
74 ± 29 |
도식 25
화합물 5b는 각각 11.6 ± 5.2 nM 및 16.6 ± 2.4 nM의 IC50 값을 가지며 PSMA-11에 대해 거의 적게 향상된 친화성을 가진다. 공지의 PSMA 저해제, ZJ-43 및 2-PMPA는 화합물 5b보다 훨씬 더 낮은 결합 친화성을 나타내었다. 5b에의 갈륨 도입은 화합물 5b의 저해제 활성에 변화를 야기하지 않아, PSMA에 대해 킬레이트를 형성하지 않은 화합물에 필적하는 더 높은 결합 친화성을 보여주었다.
실시예 54
68Ga 표지된 리간드의 시험관 내 결합 신호
[68Ga]표지된 리간드의 결합 친화성 및 특이성을 비교하기 위해, 뜨거운 리간드를 이용한 세포 결합 연구를 수행하였다. 100μL의 갓 수확한 PSMA 세포 (3가지 상이한 세포 수: 4 x 105, 2 x 105 , 1 x 105)를 100 μL 뜨거운 리간드 및 TB에는 50 μL PBS 또는 비-특이적 결합 (NSB)에는 50 μL 1a(PSMA11) (10 μM)와 함께 배양하였다. 37℃에서 60분간 배양한 후, 세포 결합 분획을 세포 수확기 (Brandel, MD)를 이용하여 수집하였다. 5 mL의 아주 차가운 세척 완충액으로 두 차례 세척 후, 세포-결합 방사능을 감마 계수기 (Wizard, Perkin Elmer)를 이용하여 측정하였다.
표 2. LNCaP 종양 파쇄액 내 Ga-68 방사선표지된 리간드의 결합 신호
| |
총 결합 (TB) |
비특이적 결합 (NSB) |
특이적 결합 (SB)
SB=TB-NSB |
|
1a (PSMA11)
|
13.5 |
1.2 |
12.3
|
|
1b
|
10.8 |
2.0 |
8.8
|
|
1c
|
13.4 |
1.6 |
11.8
|
|
1d
|
12.6 |
1.4 |
11.2
|
|
1e
|
14.8 |
1.6 |
13.2
|
|
1f
|
13.5 |
1.5 |
12.0
|
|
1g
|
10.5 |
1.5 |
9.0
|
|
2
|
9.2 |
5.1 |
4.1
|
|
3
|
10.0 |
4.2 |
5.8
|
|
4a
|
13.4 |
1.4 |
12.0
|
|
4b
|
10.3 |
1.5 |
8.8
|
|
5a
|
3.30 |
0.47 |
2.83
|
|
5b
|
10.73 |
0.18 |
10.54
|
모든 추적자 ([68Ga]1a-g, 2, 3, 4a-b 및 5a-b)가 LNCaP 종양 파쇄액에 대해 특이적 결합을 나타내었다 (표 2). 그러나, [68Ga]2 및 [68Ga]3은 높은 비특이적 결합 및 더 낮은 특이적 결합을 나타내었다. [68Ga]1b-g, [68Ga]4a, [68Ga]4b 및 [68Ga]5b의 특이적 결합은 공지의 화합물, [68Ga]1a (PSMA11)의 그것에 필적하였다. 이 결과는 이들 신규한 HBED-PSMA 유도체가 PSMA 발현 종양에 대한 유용한 영상화제일 수 있음을 시사한다.
실시예 55
세포 흡수 비교
세포 흡수 연구를 PSMA 발현 LNCaP 세포를 이용하여 수행하였다. 세포를 6 웰 플레이트에서 2 일간 성장시켰다. 68Ga-표지된 리간드와 1시간 동안 37℃에서 배양한 후, 배지를 제거하였다. 3 mL PBS 완충액으로 두 차례 세척한 후, 세포를 0.1 N NaOH와 함께 용해하였다. 용해된 세포를 여과지로 흡수시키고 여과지 내 방사능을 감마 계수기로 측정하였다.
도 1에 나타난 바와 같이, 대부분의 추적자, [68Ga]1b-g, 및 4a-b는 [68Ga]1a에 대해 더 낫거나 필적하는 세포 흡수를 나타내었다. LNCaP 세포의 PSMA 수용체 결합 부위 과발현, 결합 수준, %흡수/웰은 PSMA 결합의 척도였고, 더 높을 수록 더 나았다. 공지의 PSMA 영상화제 (PSMA-11)인 [68Ga]1a가 대조로서 사용되었다. ([68Ga]1b-g 및 4a-b가 [68Ga]1a의 그것에 필적하거나 그보다 더 나은 우수한 흡수를 나타냄이 관찰되었다. 그러나, 디-피리딜 유도체인 [68Ga]2 및 3 (화살표로 표시된 것)은 낮은 세포 흡수를 나타내어, 어세이 조건 하에서 이들 두 리간드가 최소의 결합을 나타냈음을 시사하였다. [68Ga]2 및 3은 시험 배지 내에서 안정하지 않을 것 같다.
실시예 56
LNCaP 종양 및 마우스 신장 단면의 시험관 내 자기방사선촬영
LNCaP 종양 및 마우스 신장을 동결조직절편기에서 20 μm로 절단하였고, 슬라이드 위에 해동-고정시켰다. 슬라이드는 PBS 내 방사선추적자 (3μ Ci/ml)와 함께 30분간 항온처리되고 PBS로 두 차례 각각 3분씩 세척된다. 건조 후, 슬라이드는 30분간 노출을 위해 플레이트 위에 놓인다. 영상을 Typhoon FLA 7000 (GE Healthcare)로 촬영하였다.
PSMA 결합을 증명하기 위해, LNCaP 종양 및 마우스 신장 단면을 이용한 시험관 내 자기방사선촬영 연구를 수행하였다. 자기방사선촬영 연구는 모든 방사성리간드가 LNCaP 종양 및 신장에 대해 양호한 결합을 가짐을 입증하였다. 공지의 PSMA 저해제인 2-PMPA와의 배양은, 종양 및 신장에 대한 방사선추적자의 결합을 차단하였다. 이들 데이터는 모든 추적자([68Ga]1a-g, 2, 3 및 4a-b)가 전립선 종양 내 PSMA 및 신장에서 발현된 PSMA에 결합함을 확인시켜준다.
도 2A-2K는 LNCaP 종양 (좌측) 및 마우스 신장 단면 (우측)의 시험관 내 자기방사선 사진을 보여준다. 표적 화합물인 신규한 [68Ga]1b-g, 2, 3 및 4a-b는 LNCaP 종양 및 마우스 신장에서 발현된 PSMA에 대해 높은 결합을 나타내었다.이들 신규한 PSMA 표적 화합물은 단면 내에서 높은 흡수를 나타낸다. [68Ga]1a (PSMA-11)가 대조로서 사용되었다.
실시예 57
마이크로PET를 이용한 소형 동물 영상화
수컷 무흉선 마우스 (CD-1 누드, 5-6주령)를 Charles River로부터 공급받고, 종양을 이식하기 전에 1주 동안 사육장에서 적응하게 하였다. 마우스는 사료와 물을 무제한으로(ad libitum) 제공받았다. LNCaP 종양을 재구성된 기저막 (BD Matrigel™, Collaborative Biomedical Products Inc., Bedford, MA)이 있는 배지의 1:1 v/v 혼합물의 200 μL 세포 현탁액 내 5.0×106 세포를 피하) 주사함으로써 왼쪽 어깨에 도입하였다. 유사하게, PC-3 종양을 2.0×106 세포의 피하 주사에 의해 우측 어깨에 도입하였다. 뚜렷한 LNCaP 종양이 4-5주의 기간 후에 발생하였다.
LNCaP (왼쪽 어깨) 및 PC-3 (우측 어깨) 종양 내포 누드 마우스의 동적 소형 동물 PET (APET) 영상화 연구를 [68Ga]1a 및 [68Ga]4a를 이용하여 수행하였다. PET 영상화 연구는 11.5 cm의 영상화 관측 시야를 가지는 Phillips Mosaic 소형 동물 PET 스캐너에서 수행하였다. 이소플루란 마취 (1-2%, 1L/분 산소) 하에서, 종양-내포 누드 마우스는 측면 꼬리 정맥으로 정맥내 주사에 의해 0.5 mCi 활성을 주입하였다.데이터 획득은 주사 후 30분 시점에 시작하였다. 동적 스캔은 1시간의 기간에 걸쳐 수행하였다(5분/프레임; 영상 복셀 크기 0.5 mm3). 마우스를 호흡에 관해 육안으로 관찰하였고, 전기 방석을 전체 과정 내내 체온을 유지하기 위해 사용하였다. 영상을 재구성하고 관심 부위 (ROI) 분석을 AMIDE 소프트웨어 (http://amide.sourceforge.net/)를 이용하여 수행하였다.
[68Ga]1a, 및[68Ga]4a의 정맥내 주사 후 60 내지 75분 시점에 LNCaP 이종이식편 마우스의 대표적인 동물 PET 영상이 도 3A-3F에 나타난다. LNCaP 종양 만이 양호한 종양-대-바탕 대비를 가지는 모든 추적자를 통해 또렷하게 가시화되었다. PSMA 음성 종양인 PC-3는 방사선추적자의 어떠한 흡수도 보여주지 않았다. 결과는 PSMA (LNCaP 종양)을 고도로 발현하는 종양 이종이식편이 높은 흡수 및 잔류를 나타냄을 나타내었다. 이들 물질은 또한 높은 신장 흡수 및 우세한 신장 배출을 나타냈다. 도 3A-3F는 좌측 어깨에 LNCaP 종양 및 우측 어깨에 PC-3 종양을 가지는 누드 마우스의 [68Ga]1a (도 3A-3C) 및 [68Ga]4a (도 3D-3F)의 정맥내 주사 후 60 내지 75분 시점의 APET 사진의 시상, 경축 및 관상 단면을 나타낸다.데이터는 왼쪽 어깨의 PSMA 양성 종양이 정맥내 주사 후 60분 시점에 높은 흡수 및 잔류를 나타냄을 확인해주었다.
실시예 58
세포 결합 및 내재화
[68Ga]1a, [68Ga]5a 및 [68Ga]5b의 세포 흡수 및 내재화 동역학을 PSMA-발현 LNCaP 세포를 이용하여 측정하였다. 게다가, 총 세포 활성 (막-연관 및 내재화 활성의 합)과 내재화 활성을 구별할 수 있기 위해, 모든 배양 후에는 4℃에서 약한 산을 이용한 세척 단계를 통해 특이적으로 치환에 의해 세포-표면 결합된 방사성리간드를 제거하였다.
LNCaP 세포 (6-웰 플레이트 내 삼중복)를 37 ℃에서 0-2시간 동안 RPMI-1640 배지 내에서 [68Ga]1a, [68Ga]5a 또는 [68Ga]5b와 함께 배양하였다. 지정된 시간에, 배지를 제거하고 세포를 두 차례 세척하고 이후 4℃에서 5분간 약산성 완충액 (50 mM 글리신, 150 mM NaCl, pH 3.0)으로 배양하였다. 상청액 (세포 표면-결합된 방사능을 함유)을 수집하고 세포 펠렛 (내재화 방사능을 함유)을 여과지로 수집하고 이후 상청액 및 세포 펠렛 내의 방사능을 감마 계수기에서 계수하였다.
표 3. 방사선추적자의 세포 결합 및 내재화
LNCaP 세포를 최대 2시간 동안 37℃에서 [68Ga]1a, [68Ga]5a 및 [68Ga]5b와 함께 배양하여 화합물이 엔도시토시스에 의해 내재화되었는지 확인하였다. 세포를 이후 약한 산 완충액으로 세척하여 세포외에 결합된 화합물을 제거하였다. LNCaP 세포에 대한 세포 표면 결합 및 산-비민감성 결합, 또는 내재화된 화합물이 표 3에 나타난다. [68Ga]1a, [68Ga]5a 및 [68Ga]5b의 세포 결합 및 내재화는 시간에 따른 시간-의존성 증가를 나타내었고 60 내지 90 분 사이에 평형에 도달하였다. [68Ga] 5b의 내재화 활성은 [68Ga]1a 및 [68Ga]5a의 그것보다 훨씬 더 높았다.
도 4는 PSMA 발현 LNCaP 세포에서 [68Ga]5b 흡수의 동역학을 나타낸다. 비 특이적 결합 (NSB)을 20 μM PMPA로 차단하여 평가하였다. 세포 흡수 (SB)의 특이성은 PMPA 차단으로 생성된 각각의 신호를 제함으로써 산출하였다. 수치는 106 세포에 결합된 적용된 방사능의 %로서 표시된다. 데이터는 비특이적 결합 (NSB)이 극도로 낮고 세포에 대한 [68Ga]5b의 결합이 특이적 결합부터 PSMA까지의 분포였음을 분명하게 시사하였다.
실시예 59
PSMA 양성 종양 내포 누드 마우스에서 [68Ga] 표지된 리간드의 생물학적 분배
50% Matrigel (Becton Dickinson, Heidelberg, Germany) 내에 5 x 106 세포의 LNCaP를 담은 접시에서 수컷 5- 내지 6-주령 CD-1 nu/nu 마우스 (Charles River Laboratories)의 왼쪽 어깨로 피하 접종하였다. 종양을 8 주 동안 대략 0.5 cm3 크기가 될 때까지 성장하게 두었다.
68Ga-방사선표지된 화합물을 꼬리 정맥 (마우스당 25 μCi; 0.1-0.2 nmol)을 통해 주사하였다. 주사 후 1시간 시점에, 동물을 희생시켰다. 관심의 장기를 절제하고 중량을 측정하였다. 방사능을 감마 계수기로 측정하고 % ID/g로서 계산하였다.
표 4. LNCaP 종양 내포 누드 마우스에서 [68Ga] 방사선추적자의 장기 분포 (주사-후 1시간)(%용량/g, AVG ± SD, n=3)
| |
[68Ga]1a |
[68Ga]5a |
[68Ga]5b |
| 혈액 |
0.37±0.07 |
0.36±0.05 |
0.46±0.04 |
| 심장 |
0.59±0.14 |
0.19±0.04 |
0.51±0.12 |
| 근육 |
0.58±0.24 |
0.21±0.15 |
0.34±0.07 |
| 폐 |
2.44±1.03 |
0.46±0.13 |
2.27±0.37 |
| 신장 |
176±5.66 |
23.5±8.96 |
156±22.7 |
| 비장 |
18.48±3.02 |
0.70±0.38 |
11.09±3.35 |
| 췌장 |
1.38±0.63 |
0.20±0.05 |
0.97±0.23 |
| 간 |
0.62±0.24 |
0.36±0.10 |
0.78±0.09 |
| 피부 |
1.14±0.58 |
0.33±0.17 |
1.16±0.57 |
| 뇌 |
0.04±0.01 |
0.03±0.01 |
0.05±0.01 |
| 뼈 |
0.21±0.05 |
0.11±0.04 |
0.27±0.07 |
| LNCaP 종양 |
10.07±3.32 |
5.15±1.86 |
11.26±2.61 |
[68Ga]5b는 높은 종양 및 신장 흡수를 나타내었다. 또한, [68Ga]5b는 다른 장기들에서 [68Ga]1a보다 훨씬 더 많이 사라졌다. 비록 [68Ga]5a가 더 낮은 종양 흡수를 보였지만, 이의 신장 잔류는 가장 낮았고, 이는 치료적 약물에 있어서 바람직하다. 예를 들면, [177Lu]5a는 치료적 약물로서 사용될 수 있다.
실시예 60
정상 마우스에서 [68Ga] 방사선추적자의 생물학적 분배
정상 CD-1 수컷 마우스에 35 μCi의 [68Ga]방사선추적자 (0.2 n몰의 리간드)를 꼬리 정맥을 통해 주입하였다. 각각의 네 마리 마우스를 주사 후 2, 30, 60 및 120분에 경추 분리에 의해 희생하였다. 모든 장기를 제거하고 혈액을 또한 수집하였다. 각각의 장기는 무게를 재고, 조직 방사능을 자동 감마 계수기 (Wizard , Perkin Elmer)로 측정하였다. %ID/g를 초기 용량의 표준 희석 샘플과 비교하여 산출하였다. 모든 측정치는 붕괴에 대해 조정하였다.
PSMA가 마우스의 신장 및 비장에서 자연적으로 발현되고 [68Ga]5b가 또한 신장을 통해 배출되기 때문에, 신장 및 비장은 생물학적 분배에서 가장 우세한 장기들이다. 추적자는 신장 및 비장을 제외하고는 빠르게 거의 사라진다. 다른 조직에서는 상당한 추적자 활성이 보이지 않는다.
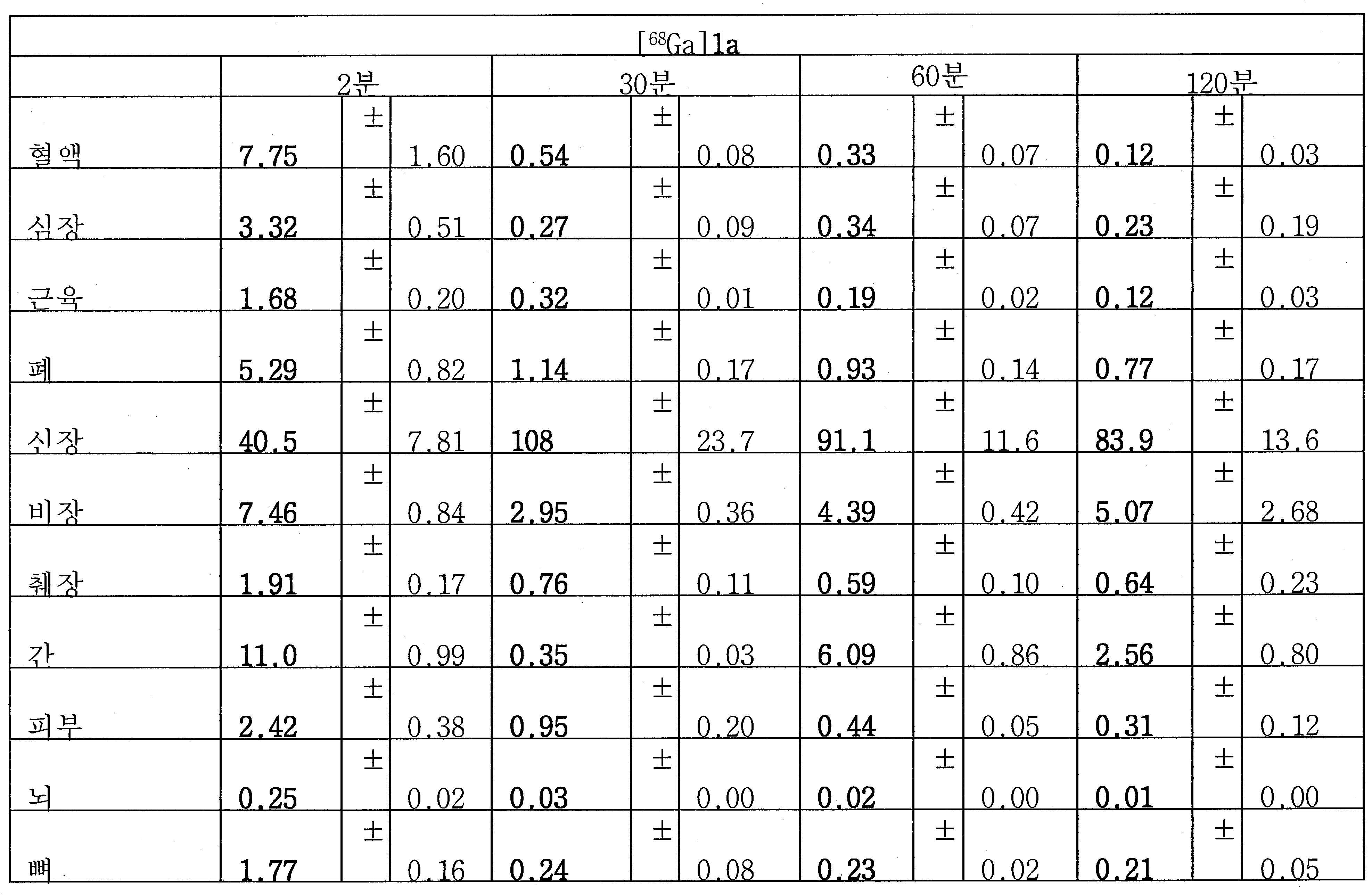
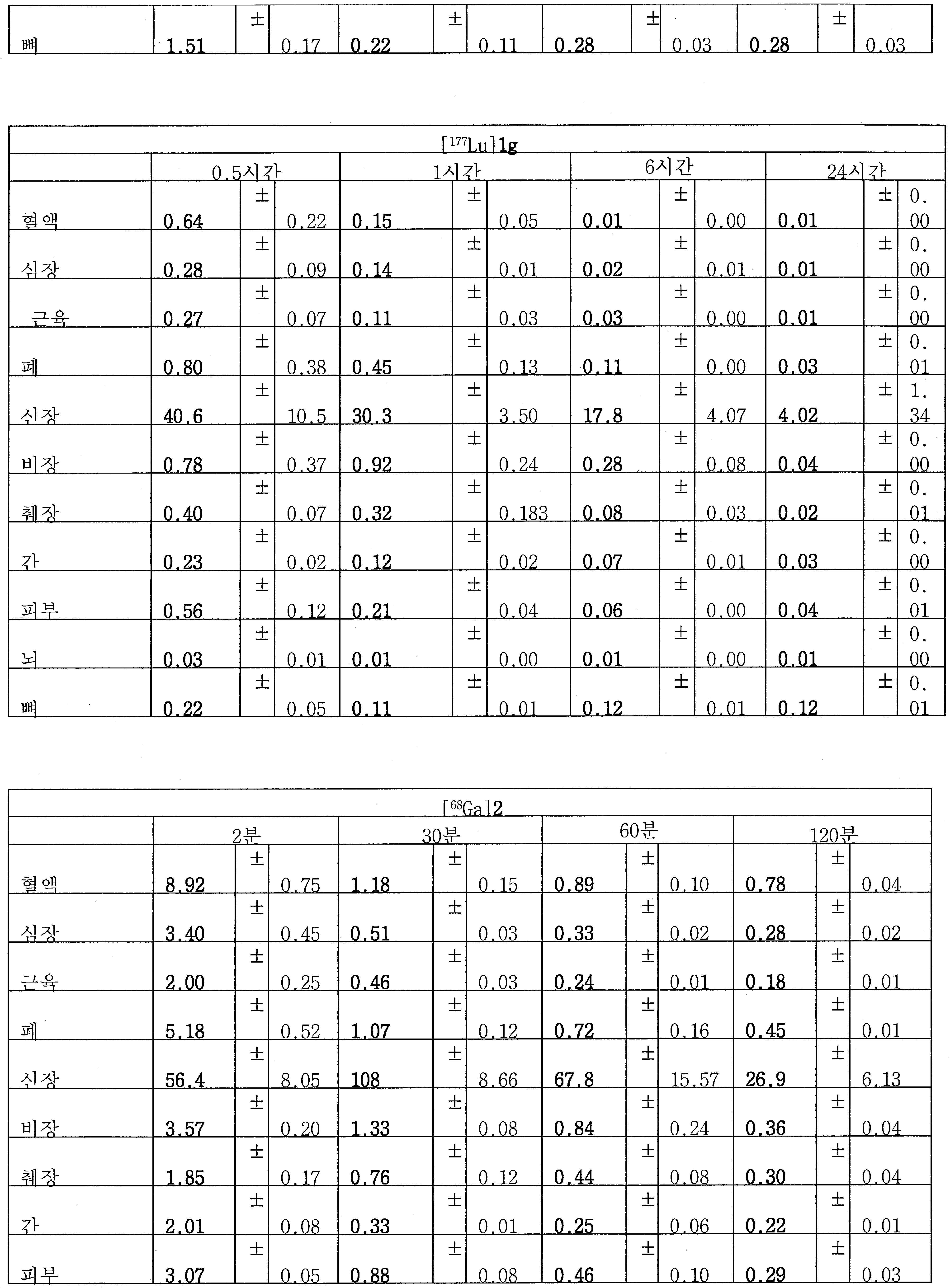
[177Lu]1g에 대한 추가적인 생물학적 분배 연구를 정상 마우스에서 수행하였다. 루테튬-177는 더 긴 반-감기 (T1/2, 6.73일) 및 방사선요법에서 약한 베타 방출을 가지는 동위원소이다. PSMA 결합에 대한 지표로서의 신장 내 초기 흡수는 [68Ga]1g의 그것에 필적하였고, 이는 Lu-DOTA가 종양 표적화에서 아무 효과도 없음을 암시한다. 이 결과는 68Ga 및 177Lu 둘다가 1g를 표지하기 위해 사용될 수 있고, [68Ga]1g 및 [177Lu]1g가 높은 종양 PSMA 표적화를 보유할 것임을 시사하였다.
표 5.정상 수컷 마우스에서 [68Ga]1a-g, 2, 3 및 4a-b 및 [177Lu]1g의 생물학적 분배 (%용량/g, n=3)
표 6. 정상 CD-1 수컷 마우스에서 [68Ga]5b의 생물학적 분배 (% 용량/g, 평균± SD, n=3)
| |
2 분 |
30 분 |
60 분 |
120 분 |
| 혈액 |
7.94 ± 0.52 |
1.13 ± 0.13 |
0.48 ± 0.11 |
0.27 ± 0.07 |
| 심장 |
4.33 ± 0.11 |
0.98 ± 0.06 |
0.40 ± 0.09 |
0.22 ± 0.06 |
| 근육 |
1.97 ± 0.16 |
0.67 ± 0.05 |
0.31 ± 0.07 |
0.16 ± 0.01 |
| 폐 |
5.75 ± 0.26 |
2.63 ± 0.08 |
1.28 ± 0.31 |
0.61 ± 0.07 |
| 신장 |
50.32 ± 3.31 |
73.96 ± 5.56 |
62.77± 12.55 |
49.00 ± 4.76 |
| 비장 |
3.86 ± 0.57 |
1.70 ± 0.44 |
1.71 ± 0.66 |
1.39 ± 0.38 |
| 췌장 |
2.18 ± 0.04 |
0.80 ± 0.09 |
0.52 ± 0.02 |
0.32 ± 0.02 |
| 간 |
2.97 ± 0.24 |
0.95 ± 0.11 |
0.54 ± 0.09 |
0.37 ± 0.06 |
| 피부 |
2.38 ± 0.10 |
1.14 ± 0.15 |
0.58 ± 0.19 |
0.26 ± 0.02 |
| 뇌 |
0.19 ± 0.02 |
0.05 ± 0.01 |
0.03 ± 0.00 |
0.02 ± 0.00 |
| 뼈 |
2.16 ± 0.11 |
0.60 ± 0.02 |
0.38 ± 0.04 |
0.26 ± 0.01 |
| 위 |
0.81 ± 0.29 |
0.31 ± 0.07 |
0.17 ± 0.06 |
0.22 ± 0.05 |
| 소장 |
2.46 ± 0.15 |
1.03 ± 0.07 |
0.74 ± 0.17 |
0.45 ± 0.12 |
| 대장 |
1.20 ± 0.20 |
0.37 ± 0.04 |
0.31 ± 0.21 |
0.54 ± 0.16 |
| 지방 |
2.08 ± 0.27 |
1.45 ± 0.13 |
0.73 ± 0.11 |
0.35 ± 0.04 |
| 고환 |
0.96 ± 0.15 |
1.14 ± 0.21 |
0.82 ± 0.06 |
0.68 ± 0.06 |
| 정낭 |
1.47 ± 0.25 |
1.13 ± 0.19 |
0.94 ± 0.22 |
0.64 ± 0.10 |
| 꼬리 |
8.08 ± 0.78 |
2.92 ± 0.95 |
1.73 ± 0.55 |
0.55 ± 0.04 |
| 신체 나머지 |
2.30 ± 0.05 |
0.98 ± 0.05 |
0.52 ± 0.11 |
0.27 ± 0.01 |
실시예 61
종양 내포 누드 마우스에서 소형 동물 마이크로PET 영상화
[68Ga]5b의 PSMA 영상화를 위한 PET 추적자로서의 유용성을 예시하기 위해, 종양 내포 누드 마우스를 이용한 마이크로 PET 연구를 수행하였다. 이러한 연구는 소형 동물 영상화 설비에서 수행하였다 수컷 CD-1-nu/nu 마우스에 5 × 106 LNCaP 세포 및 PC-3 세포를 피하로 이식하였다. 종양이 대략 5-10 mm 직경에 도달했을 때, 마우스를 마이크로PET 영상화를 위해 사용하였다. LNCaP 종양 및 PC-3 종양을 내포하는 마우스에 꼬리 정맥을 통해 ~0.5 mCi의 [68Ga]5b를 주입하였다. 영상화 연구는 30% 산소/공기 내 10%의 흡입으로의 유도 및 6.5% 이소플루란의 흡입으로 유지하는 동물의 일반 마취 하에 수행하였다. 동물을 스캐너에 엎드린 자세로 위치시켰다. 전체 신체 스캔은 방사선추적자의 주사-후 60분 시점부터 15분간 수행하였다. PET 영상은 AMIDE 소프트웨어를 이용하여 생성하였다. [68Ga]5b의 주사 후 60분 내지 75분 시점에 LNCaP 및 PC-3 종양 이종이식편에서 얻은 마이크로 PET 사진이 도 5A-5C에 나타난다.
도 5A, 5B, 및 5C는 종양 (LNCaP PSMA+ 및 PC-3 PSMA-) 내포 마우스의 [68Ga]5b 주사 후 60분 내지 75분 시점의 마이크로 PET 영상을 도시한다.
강한 [68Ga]5b 흡수는 신장, 방광 및 PSMA 양성 LNCaP 종양에서만 관찰되었다. PSMA 음성 PC-3 종양은 어떠한 [68Ga]5b의 흡수도 나타내지 않았다. 강한 신장 흡수는 부분적으로 근위 신장 세관에 대한 방사선추적자의 특이적 결합 뿐만 아니라 이러한 친수성 화합물의 배출 때문이었다.
2-PMPA로의 [68Ga]5b의 차단을 동일한 마우스에서 수행하였다. LNCaP 및 PC-3 종양 이종이식편을 내포하는 CD-1 nu/nu 마우스에 [68Ga]5b를 단독으로 또는 구조적으로 비연관된 PSMA 저해제인 2-PMPA (2 mg/kg)와 함께 주입하여, LNCaP 종양에 대한 결합이 PSMA에 대해 특이적이었는지 알아보았다.
도 6A 및 6B는 LNCaP (좌측 어깨) 및 PC-3 (우측 어깨) 종양 내포 마우스의 (a) [68Ga]5b 단독 및 (b) [68Ga] 5b와 2-PMPA (2mg/kg, 동시-주사) 주입 후의 관상 마이크로 PET 사진(주사 후 1시간 시점에 15분간)을 나타낸다.
[68Ga]1a, 및[68Ga]5b의 정맥내 주사 후 60 내지 75분 시점에 LNCaP 이종이식편 마우스의 대표적인 동물 PET 영상이 도 5A-5C에 나타난다. LNCaP 종양 만이 양호한 종양-대-바탕 대비를 가지는 모든 추적자를 통해 또렷하게 가시화되었다. PSMA 음성 종양인 PC-3는 방사선추적자의 어떠한 흡수도 보여주지 않았다. 결과는 PSMA (LNCaP 종양)을 고도로 발현하는 종양 이종이식편이 높은 흡수 및 잔류를 나타냄을 나타내었다. 이들 물질은 또한 높은 신장 흡수 및 우세한 신장 배출을 나타냈다. 도 5A-5C는 좌측 어깨에 LNCaP 종양 및 우측 어깨에 PC-3 종양을 가지는 누드 마우스의 [68Ga]1a 및 [68Ga]5b의 정맥내 주사 후 60 내지 75분 시점의 APET 사진의 시상, 경축 및 관상 단면을 나타낸다. 데이터는 왼쪽 어깨의 PSMA 양성 종양이 정맥내 주사 후 60분 시점에 높은 흡수 및 잔류를 나타냄을 확인해주었다. 흡수는 PSMA 발현 신장 및 LNCaP 종양 이종이식편에서 높았다. 또한 방광을 통한 신장 배출이 분명하였다. [68Ga]5b는 PSMA-발현 LNCaP 종양에 편재되었지만, PSMA-결핍 PC-3 종양에는 그렇지 않았다. 추가로, 2 mg/kg 용량의 2-PMPA를 동시-주사했을 때 결합이 LNCaP 종양 및 신장 조직에서 없어졌고, 이는 결합이 실제로 포화가능하고 PSMA에 대해 특이적임을 나타낸다. 이들 결과는 [68Ga]5b가 전립선암에서 PET를 이용한 PSMA 영상화를 위한 추적자로서 적절함을 분명히 알려준다.
특정한 구체예가 예시되고 기술되었지만, 하기 청구 범위에 정의된 바와 같은 이의 더 넓은 측면의 기술로부터 벗어나지 않고 이에 더해 당해 분야의 기술에 따라 변화 및 변형이 만들어질 수 있음이 이해되어야 한다.
본 개시는 본 명세서에 기술된 특정 구체예의 관점에 제한되지 않는다. 당해 분야의 숙련가에겐 명백할 내용으로, 본 발명의 사상과 범위에서 벗어나지 않고 변형과 변화가 만들어질 수 있다. 본 명세서에 열거된 것들 외에 본 개시의 범위 내에 있는 기능적으로 균등한 방법 및 조성물이 전술된 상세한 설명으로부터 당해 분야의 숙련가에게 명백할 것이다. 그러한 변형 및 변화는 첨부된 청구범위의 범위 내에 속한다고 간주된다. 본 개시는 첨부된 청구 범위, 및 그러한 청구 내용에 해당하는 것과 등가의 총 범위에 의해서만 제한되어야 한다. 이러한 개시가 물론 변화될 수 있는 특정 방법, 시약, 화합물 조성 또는 생물학적 시스템에 제한되지 않음이 이해되어야 한다. 또한 본 명세서에서 사용된 명칭이 특정 구체예를 설명하기 위한 목적을 위한 것이며, 제한하는 것으로 의도되지 않음이 이해되어야 한다.
본 명세서에서 언급된 모든 공보, 특허 출원, 공개 특허, 및 다른 문헌은 마치 각각의 개별적인 공보, 특허 출원, 공개 특허, 또는 다른 문헌이 구체적이고 개별적으로 그 전체가 참고로서 포함된 것을 나타내는 것과 같이 본 명세서에 참고로서 포함된다. 참고문헌으로 포함된 문헌에 포함된 정의는 이들이 본 개시의 정의와 상반되는 한 배제된다.
참고문헌
[1] Stasiuk GJ and Long NJ. The ubiquitous DOTA and its derivatives: the impact of 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid on biomedical imaging. Chem. Commun. (Camb.) 2013;49:2732-46.
[2] Roosenburg S, Laverman P, Joosten L, Cooper MS, Kolenc-Peitl PK, Foster JM, et al. PET and SPECT imaging of a radiolabeled minigastrin analogue conjugated with DOTA, NOTA, and NODAGA and labeled with (64)Cu, (68)Ga, and (111)In. Mol. Pharm. 2014;11:3930-7.
[3] Notni J, Simecek J, and Wester HJ. Phosphinic acid functionalized polyazacycloalkane chelators for radiodiagnostics and radiotherapeutics: unique characteristics and applications. ChemMedChem 2014;9:1107-15.
[4] Baum RP, Kulkarni HR, Muller D, Satz S, Danthi N, Kim YS, et al. First-In-Human Study Demonstrating Tumor-Angiogenesis by PET/CT Imaging with (68)Ga-NODAGA-THERANOST, a High-Affinity Peptidomimetic for alphavbeta3 Integrin Receptor Targeting. Cancer Biother. Radiopharm. 2015;30:152-9.
[5] Eisenwiener KP, Prata MI, Buschmann I, Zhang HW, Santos AC, Wenger S, et al. NODAGATOC, a new chelator-coupled somatostatin analogue labeled with [67/68Ga] and [111In] for SPECT, PET, and targeted therapeutic applications of somatostatin receptor (hsst2) expressing tumors. Bioconjug. Chem. 2002;13:530-41.
[6] Eder M, Wangler B, Knackmuss S, LeGall F, Little M, Haberkorn U, et al. Tetrafluorophenolate of HBED-CC: a versatile conjugation agent for 68Ga-labeled small recombinant antibodies. Eur. J. Nucl. Med. Mol. Imaging 2008;35:1878-86.
[7] Schafer M, Bauder-Wust U, Leotta K, Zoller F, Mier W, Haberkorn U, et al. A dimerized urea-based inhibitor of the prostate-specific membrane antigen for 68Ga-PET imaging of prostate cancer. EJNMMI Res 2012;2:23.
[8] Price EW and Orvig C. Matching chelators to radiometals for radiopharmaceuticals. Chem. Soc. Rev. 2014;43:260-90.
[9] Boros E, Ferreira CL, Yapp DT, Gill RK, Price EW, Adam MJ, et al. RGD conjugates of the H2dedpa scaffold: synthesis, labeling and imaging with 68Ga. Nucl. Med. Biol. 2012;39:785-94.
[10] Manzoni L, Belvisi L, Arosio D, Bartolomeo MP, Bianchi A, Brioschi C, et al. Synthesis of Gd and (68)Ga complexes in conjugation with a conformationally optimized RGD sequence as potential MRI and PET tumor-imaging probes. ChemMedChem 2012;7:1084-93.
[11] Waldron BP, Parker D, Burchardt C, Yufit DS, Zimny M, and Roesch F. Structure and stability of hexadentate complexes of ligands based on AAZTA for efficient PET labelling with gallium-68. Chem. Commun. (Camb.) 2013;49:579-81.
[12] Pomper MG, Musachio JL, Zhang J, Scheffel U, Zhou Y, Hilton J, et al. 11C-MCG: synthesis, uptake selectivity, and primate PET of a probe for glutamate carboxypeptidase II (NAALADase). Mol. Imaging 2002;1:96-101.
[13] Rowe SP, Gage KL, Faraj SF, Macura KJ, Cornish TC, Gonzalez-Roibon N, et al. (1)(8)F-DCFBC PET/CT for PSMA-Based Detection and Characterization of Primary Prostate Cancer. J. Nucl. Med. 2015;56:1003-10.
[14] Cho SY, Gage KL, Mease RC, Senthamizhchelvan S, Holt DP, Jeffrey-Kwanisai A, et al. Biodistribution, tumor detection, and radiation dosimetry of 18F-DCFBC, a low-molecular-weight inhibitor of prostate-specific membrane antigen, in patients with metastatic prostate cancer. J. Nucl. Med. 2012;53:1883-91.
[15] Chen Y, Pullambhatla M, Foss CA, Byun Y, Nimmagadda S, Senthamizhchelvan S, et al. 2-(3-{1-Carboxy-5-[(6-[18F]fluoro-pyridine-3-carbonyl)-amino]-pentyl}-ureido)-pen tanedioic acid, [18F]DCFPyL, a PSMA-based PET imaging agent for prostate cancer. Clin. Cancer Res. 2011;17:7645-53.
[16] Szabo Z, Mena E, Rowe SP, Plyku D, Nidal R, Eisenberger MA, et al. Initial Evaluation of [(18)F]DCFPyL for Prostate-Specific Membrane Antigen (PSMA)-Targeted PET Imaging of Prostate Cancer. Mol. Imaging Biol. 2015;17:565-74.
[17] Eder M, Eisenhut M, Babich J, and Haberkorn U. PSMA as a target for radiolabelled small molecules. Eur. J. Nucl. Med. Mol. Imaging 2013;40:819-23.
[18] Eder M, Neels O, Mueller M, Bauder-Wuest U, Remde Y, Schaefer M, et al. Novel preclinical and radiopharmaceutical aspects of [68Ga]Ga-PSMA-HBED-CC: a new PET tracer for imaging of prostate cancer. Pharmaceuticals 2014;7:779-96.
[19] Eiber M, Maurer T, Souvatzoglou M, Beer AJ, Ruffani A, Haller B, et al. Evaluation of Hybrid 68Ga-PSMA Ligand PET/CT in 248 Patients with Biochemical Recurrence After Radical Prostatectomy. J. Nucl. Med. 2015;56:668-74.
[20] Benesova M, Schafer M, Bauder-Wust U, Afshar-Oromieh A, Kratochwil C, Mier W, et al. Preclinical Evaluation of a Tailor-Made DOTA-Conjugated PSMA Inhibitor with Optimized Linker Moiety for Imaging and Endoradiotherapy of Prostate Cancer. J. Nucl. Med. 2015;56:914-20.
[21] Kabasakal L, AbuQbeitah M, Aygun A, Yeyin N, Ocak M, Demirci E, et al. Pre-therapeutic dosimetry of normal organs and tissues of Lu-PSMA-617 prostate-specific membrane antigen (PSMA) inhibitor in patients with castration-resistant prostate cancer. Eur. J. Nucl. Med. Mol. Imaging 2015.
[22] Afshar-Oromieh A, Hetzheim H, Kratochwil C, Benesova M, Eder M, Neels OC, et al. The novel theranostic PSMA-ligand PSMA-617 in the diagnosis of prostate cancer by PET/CT: biodistribution in humans, radiation dosimetry and first evaluation of tumor lesions. J. Nucl. Med. 2015.
[23] Weineisen M, Schottelius M, Simecek J, Baum RP, Yildiz A, Beykan S, et al. 68Ga- and 177Lu-Labeled PSMA I&T: Optimization of a PSMA-Targeted Theranostic Concept and First Proof-of-Concept Human Studies. J. Nucl. Med. 2015;56:1169-76.
[24] Herrmann K, Bluemel C, Weineisen M, Schottelius M, Wester HJ, Czernin J, et al. Biodistribution and radiation dosimetry for a probe targeting prostate-specific membrane antigen for imaging and therapy. J. Nucl. Med. 2015;56:855-61.
[25] Ristau BT, O'Keefe DS, and Bacich DJ. The prostate-specific membrane antigen: lessons and current clinical implications from 20 years of research. Urol Oncol 2014;32:272-9.
[26] Barinka C, Rojas C, Slusher B, and Pomper M. Glutamate carboxypeptidase II in diagnosis and treatment of neurologic disorders and prostate cancer. Curr. Med. Chem. 2012;19:856-70.
[27] Pavlicek J, Ptacek J, Cerny J, Byun Y, Skultetyova L, Pomper MG, et al. Structural characterization of P1'-diversified urea-based inhibitors of glutamate carboxypeptidase II. Bioorg. Med. Chem. Lett. 2014;24:2340-5.
[28] Davis MI, Bennett MJ, Thomas LM, and Bjorkman PJ. Crystal structure of prostate-specific membrane antigen, a tumor marker and peptidase. Proc. Natl. Acad. Sci. U. S. A. 2005;102:5981-6.
[29] Akhtar NH, Pail O, Saran A, Tyrell L, and Tagawa ST. Prostate-Specific Membrane Antigen-Based Therapeutics. Advances in Urology 2012;2012:9.
[30] Osborne JR, Akhtar NH, Vallabhajosula S, Anand A, Deh K, and Tagawa ST. Prostate-specific membrane antigen-based imaging. Urol Oncol 2013;31:144-54.
[31] Franc BL, Cho SY, Rosenthal SA, Cui Y, Tsui B, Vandewalker KM, et al. Detection and localization of carcinoma within the prostate using high resolution transrectal gamma imaging (TRGI) of monoclonal antibody directed at prostate specific membrane antigen (PSMA)--proof of concept and initial imaging results. Eur. J. Radiol. 2013;82:1877-84.
[32] Tagawa ST, Milowsky MI, Morris M, Vallabhajosula S, Christos P, Akhtar NH, et al. Phase II study of Lutetium-177-labeled anti-prostate-specific membrane antigen monoclonal antibody J591 for metastatic castration-resistant prostate cancer. Clin. Cancer Res. 2013;19:5182-91.
[33] Osborne JR, Green DA, Spratt DE, Lyashchenko S, Fareedy SB, Robinson BD, et al. A prospective pilot study of (89)Zr-J591/prostate specific membrane antigen positron emission tomography in men with localized prostate cancer undergoing radical prostatectomy. J. Urol. 2014;191:1439-45.
[34] Holland JP, Divilov V, Bander NH, Smith-Jones PM, Larson SM, and Lewis JS. 89Zr-DFO-J591 for immunoPET of prostate-specific membrane antigen expression in vivo. J. Nucl. Med. 2010;51:1293-300.
[35] Li Y, Tian Z, Rizvi SM, Bander NH, and Allen BJ. In vitro and preclinical targeted alpha therapy of human prostate cancer with Bi-213 labeled J591 antibody against the prostate specific membrane antigen. Prostate Cancer Prostatic Dis 2002;5:36-46.
[36] Hao G, Kumar A, Dobin T, Oz OK, Hsieh J-T, and Sun X. A Multivalent Approach of Imaging Probe Design To Overcome an Endogenous Anion Binding Competition for Noninvasive Assessment of Prostate Specific Membrane Antigen. Mol. Pharm. 2013;10:2975-85.
[37] Humblet V, Misra P, Bhushan KR, Nasr K, Ko YS, Tsukamoto T, et al. Multivalent scaffolds for affinity maturation of small molecule cell surface binders and their application to prostate tumor targeting. J. Med. Chem. 2009;52:544-50.
[38] Misra P, Humblet V, Pannier N, Maison W, and Frangioni JV. Production of multimeric prostate-specific membrane antigen small-molecule radiotracers using a solid-phase 99mTc preloading strategy. J. Nucl. Med. 2007;48:1379-89.
[39] Lapi SE, Wahnishe H, Pham D, Wu LY, Nedrow-Byers JR, Liu T, et al. Assessment of an 18F-labeled phosphoramidate peptidomimetic as a new prostate-specific membrane antigen-targeted imaging agent for prostate cancer. J. Nucl. Med. 2009;50:2042-8.
[40] Nedrow-Byers JR, Moore AL, Ganguly T, Hopkins MR, Fulton MD, Benny PD, et al. PSMA-targeted SPECT agents: mode of binding effect on in vitro performance. Prostate 2013;73:355-62.
[41] Nedrow-Byers JR, Jabbes M, Jewett C, Ganguly T, He H, Liu T, et al. A phosphoramidate-based prostate-specific membrane antigen-targeted SPECT agent. Prostate 2012;72:904-12.
[42] Kozikowski AP, Zhang J, Nan F, Petukhov PA, Grajkowska E, Wroblewski JT, et al. Synthesis of urea-based inhibitors as active site probes of glutamate carboxypeptidase II: efficacy as analgesic agents. J. Med. Chem. 2004;47:1729-38.
[43] Rong SB, Zhang J, Neale JH, Wroblewski JT, Wang S, and Kozikowski AP. Molecular modeling of the interactions of glutamate carboxypeptidase II with its potent NAAG-based inhibitors. J. Med. Chem. 2002;45:4140-52.
[44] Nan F, Bzdega T, Pshenichkin S, Wroblewski JT, Wroblewska B, Neale JH, et al. Dual function glutamate-related ligands: discovery of a novel, potent inhibitor of glutamate carboxypeptidase II possessing mGluR3 agonist activity. J. Med. Chem. 2000;43:772-4.
[45] Banerjee SR, Pullambhatla M, Foss CA, Nimmagadda S, Ferdani R, Anderson CJ, et al. (64)Cu-labeled inhibitors of prostate-specific membrane antigen for PET imaging of prostate cancer. J. Med. Chem. 2014;57:2657-69.
[46] Castanares MA, Mukherjee A, Chowdhury WH, Liu M, Chen Y, Mease RC, et al. Evaluation of prostate-specific membrane antigen as an imaging reporter. J. Nucl. Med. 2014;55:805-11.
[47] Banerjee SR and Pomper MG. Clinical applications of Gallium-68. Appl. Radiat. Isot. 2013;76:2-13.
[48] Banerjee SR, Pullambhatla M, Byun Y, Nimmagadda S, Green G, Fox JJ, et al. 68Ga-labeled inhibitors of prostate-specific membrane antigen (PSMA) for imaging prostate cancer. J. Med. Chem. 2010;53:5333-41.
[49] Vallabhajosula S, Nikolopoulou A, Babich JW, Osborne JR, Tagawa ST, Lipai I, et al. 99mTc-labeled small-molecule inhibitors of prostate-specific membrane antigen: pharmacokinetics and biodistribution studies in healthy subjects and patients with metastatic prostate cancer. J. Nucl. Med. 2014;55:1791-8.
[50] Barrett JA, Coleman RE, Goldsmith SJ, Vallabhajosula S, Petry NA, Cho S, et al. First-in-man evaluation of 2 high-affinity PSMA-avid small molecules for imaging prostate cancer. J. Nucl. Med. 2013;54:380-7.
[51] Maresca KP, Hillier SM, Femia FJ, Keith D, Barone C, Joyal JL, et al. A series of halogenated heterodimeric inhibitors of prostate specific membrane antigen (PSMA) as radiolabeled probes for targeting prostate cancer. J. Med. Chem. 2009;52:347-57.
[52] Zechmann CM, Afshar-Oromieh A, Armor T, Stubbs JB, Mier W, Hadaschik B, et al. Radiation dosimetry and first therapy results with a (124)I/ (131)I-labeled small molecule (MIP-1095) targeting PSMA for prostate cancer therapy. Eur. J. Nucl. Med. Mol. Imaging 2014;41:1280-92.
[53] Dietlein M, Kobe C, Kuhnert G, Stockter S, Fischer T, Schom
cker K, et al. Comparison of [18F]DCFPyL and [68Ga]Ga-PSMA-HBED-CC for PSMA-PET Imaging in Patients with Relapsed Prostate Cancer
. Mol. Imaging Biol. 2015;17:575-84.
[54] Rowe SP, Gorin MA, Hammers HJ, Som Javadi M, Hawasli H, Szabo Z, et al. Imaging of metastatic clear cell renal cell carcinoma with PSMA-targeted F-DCFPyL PET/CT. Ann. Nucl. Med. 2015.
[55] Huang SS, Wang X, Zhang Y, Doke A, DiFilippo FP, and Heston WD. Improving the biodistribution of PSMA-targeting tracers with a highly negatively charged linker. Prostate 2014;74:702-13.
[56] Smith DL, Breeman WA, and Sims-Mourtada J. The untapped potential of Gallium 68-PET: the next wave of (6)(8)Ga-agents. Appl. Radiat. Isot. 2013;76:14-23.
[57] Burke BP, Clemente GS, and Archibald SJ. Recent advances in chelator design and labelling methodology for (68) Ga radiopharmaceuticals. J Labelled Comp Radiopharm 2014;57:239-43.
[58] Velikyan I. Prospective of (68)Ga-radiopharmaceutical development. Theranostics 2013;4:47-80.
[59] Breeman WA, de Blois E, Sze Chan H, Konijnenberg M, Kwekkeboom DJ, and Krenning EP. (68)Ga-labeled DOTA-peptides and (68)Ga-labeled radiopharmaceuticals for positron emission tomography: current status of research, clinical applications, and future perspectives. Semin. Nucl. Med. 2011;41:314-21.
[60] Rosch F. Past, present and future of 68Ge/68Ga generators. Appl. Radiat. Isot. 2013;76:24-30.
[61] Velikyan I. 68Ga-Based Radiopharmaceuticals: Production and Application Relationship. Molecules 2015;20:12913-43.
[62] Sanchez-Crespo A. Comparison of Gallium-68 and Fluorine-18 imaging characteristics in positron emission tomography. Appl. Radiat. Isot. 2013;76:55-62.
[63] Velikyan I, Sundin A, Sorensen J, Lubberink M, Sandstrom M, Garske-Roman U, et al. Quantitative and qualitative intrapatient comparison of 68Ga-DOTATOC and 68Ga-DOTATATE: net uptake rate for accurate quantification. J. Nucl. Med. 2014;55:204-10.
[64] Sandstrom M, Velikyan I, Garske-Roman U, Sorensen J, Eriksson B, Granberg D, et al. Comparative biodistribution and radiation dosimetry of 68Ga-DOTATOC and 68Ga-DOTATATE in patients with neuroendocrine tumors. J. Nucl. Med. 2013;54:1755-9.
[65] Beiderwellen KJ, Poeppel TD, Hartung-Knemeyer V, Buchbender C, Kuehl H, Bockisch A, et al. Simultaneous 68Ga-DOTATOC PET/MRI in patients with gastroenteropancreatic neuroendocrine tumors: initial results. Invest. Radiol. 2013;48:273-9.
[66] Eder M, Neels O, Muller M, Bauder-Wust U, Remde Y, Schafer M, et al. Novel Preclinical and Radiopharmaceutical Aspects of [68Ga]Ga-PSMA-HBED-CC: A New PET Tracer for Imaging of Prostate Cancer. Pharmaceuticals (Basel) 2014;7:779-96.
[67] Mjos KD and Orvig C. Metallodrugs in medicinal inorganic chemistry. Chem. Rev. 2014;114:4540-63.
[68] Velikyan I, Maecke H, and Langstrom B. Convenient preparation of 68Ga-based PET-radiopharmaceuticals at room temperature. Bioconjug. Chem. 2008;19:569-73.
[69] Motekaitis RJ, Rogers BE, Reichert DE, Martell AE, and Welch MJ. Stability and Structure of Activated Macrocycles. Ligands with Biological Applications. Inorg. Chem. 1996;35:3821-7.
[70] Mease RC, Foss CA, and Pomper MG. PET imaging in prostate cancer: focus on prostate-specific membrane antigen. Curr. Top. Med. Chem. 2013;13:951-62.
[71] Eder M, Schafer M, Bauder-Wust U, Hull WE, Wangler C, Mier W, et al. 68Ga-complex lipophilicity and the targeting property of a urea-based PSMA inhibitor for PET imaging. Bioconjug. Chem. 2012;23:688-97.
[72] Verburg FA, Krohn T, Heinzel A, Mottaghy FM, and Behrendt FF. First evidence of PSMA expression in differentiated thyroid cancer using [(68)Ga]PSMA-HBED-CC PET/CT. Eur. J. Nucl. Med. Mol. Imaging 2015;42:1622-3.
[73] Ahmadzadehfar H, Rahbar K, Kurpig S, Bogemann M, Claesener M, Eppard E, et al. Early side effects and first results of radioligand therapy with (177)Lu-DKFZ-617 PSMA of castrate-resistant metastatic prostate cancer: a two-centre study. EJNMMI Res 2015;5:114.
[74] Weineisen M, Simecek J, Schottelius M, Schwaiger M, and Wester HJ. Synthesis and preclinical evaluation of DOTAGA-conjugated PSMA ligands for functional imaging and endoradiotherapy of prostate cancer. EJNMMI Res 2014;4:63.
[75] Weineisen M, Schottelius M, Simecek J, Baum RP, Yildiz A, Beykan S, et al. 68Ga- and 177Lu-Labeled PSMA I&T: Optimization of a PSMA-Targeted Theranostic Concept and First Proof-of-Concept Human Studies. J. Nucl. Med. 2015;56:1169-76.
[76] Simecek J, Notni J, Kapp TG, Kessler H, and Wester HJ. Benefits of NOPO as chelator in gallium-68 peptides, exemplified by preclinical characterization of (68)Ga-NOPO-c(RGDfK). Mol. Pharm. 2014;11:1687-95.
[77] Simecek J, Hermann P, Havlickova J, Herdtweck E, Kapp TG, Engelbogen N, et al. A cyclen-based tetraphosphinate chelator for the preparation of radiolabeled tetrameric bioconjugates. Chemistry 2013;19:7748-57.
[78] Simecek J, Hermann P, Wester HJ, and Notni J. How is (68)Ga labeling of macrocyclic chelators influenced by metal ion contaminants in (68)Ge/(68)Ga generator eluates? ChemMedChem 2013;8:95-103.
[79] Simecek J, Zemek O, Hermann P, Notni J, and Wester HJ. Tailored Gallium(III) Chelator NOPO: Synthesis, Characterization, Bioconjugation, and Application in Preclinical Ga-68-PET Imaging. Mol. Pharm. 2013.
[80] Ramogida CF, Cawthray JF, Boros E, Ferreira CL, Patrick BO, Adam MJ, et al. H2CHXdedpa and H4CHXoctapa-Chiral Acyclic Chelating Ligands for (67/68)Ga and (111)In Radiopharmaceuticals. Inorg. Chem. 2015;54:2017-31.
[81] Baur B, Solbach C, Andreolli E, Winter G, Machulla HJ, and Reske SN. Synthesis, Radiolabelling and In Vitro Characterization of the Gallium-68-, Yttrium-90- and Lutetium-177-Labelled PSMA Ligand, CHX-A''-DTPA-DUPA-Pep. Pharmaceuticals (Basel) 2014;7:517-29.
[82] Afshar-Oromieh A, Avtzi E, Giesel FL, Holland-Letz T, Linhart HG, Eder M, et al. The diagnostic value of PET/CT imaging with the 68Ga-labelled PSMA ligand HBED-CC in the diagnosis of recurrent prostate cancer. Eur. J. Nucl. Med. Mol. Imaging 2014:Ahead of Print.
[83] Afshar-Oromieh A, Haberkorn U, Schlemmer HP, Fenchel M, Eder M, Eisenhut M, et al. Comparison of PET/CT and PET/MRI hybrid systems using a 68Ga-labelled PSMA ligand for the diagnosis of recurrent prostate cancer: initial experience. Eur. J. Nucl. Med. Mol. Imaging 2014;41:887-97.
[84] Maurer T, Beer AJ, Wester HJ, Kubler H, Schwaiger M, and Eiber M. Positron emission tomography/magnetic resonance imaging with 68Gallium-labeled ligand of prostate-specific membrane antigen: promising novel option in prostate cancer imaging? Int. J. Urol. 2014;21:1286-8.
[85] Chakraborty PS, Tripathi M, Agarwal KK, Kumar R, Vijay MK, and Bal C. Metastatic Poorly Differentiated Prostatic Carcinoma With Neuroendocrine Differentiation: Negative on 68Ga-PSMA PET/CT. Clin. Nucl. Med. 2015;40:e163-6.
[86] Eiber M, Nekolla SG, Maurer T, Weirich G, Wester HJ, and Schwaiger M. Ga-PSMA PET/MR with multimodality image analysis for primary prostate cancer. Abdom. Imaging 2014.
[87] Afshar-Oromieh A, Avtzi E, Giesel FL, Holland-Letz T, Linhart HG, Eder M, et al. The diagnostic value of PET/CT imaging with the (68)Ga-labelled PSMA ligand HBED-CC in the diagnosis of recurrent prostate cancer. Eur. J. Nucl. Med. Mol. Imaging 2015;42:197-209.
[88] Delker A, Fendler WP, Kratochwil C, Brunegraf A, Gosewisch A, Gildehaus FJ, et al. Dosimetry for Lu-DKFZ-PSMA-617: a new radiopharmaceutical for the treatment of metastatic prostate cancer. Eur. J. Nucl. Med. Mol. Imaging 2015.
[89] Sun Y, Anderson CJ, Pajeau TS, Reichert DE, Hancock RD, Motekaitis RJ, et al. Indium (III) and gallium (III) complexes of bis(aminoethanethiol) ligands with different denticities: stabilities, molecular modeling, and in vivo behavior. J. Med. Chem. 1996;39:458-70.
[90] Mandal PK and McMurray JS. Pd-C-Induced Catalytic Transfer Hydrogenation with Triethylsilane. J. Org. Chem. 2007;72:6599-601.
[91] Kantchev EAB, Peh G-R, Zhang C, and Ying JY. Practical Heck-Mizoroki Coupling Protocol for Challenging Substrates Mediated by an N-Heterocyclic Carbene-Ligated Palladacycle. Org. Lett. 2008;10:3949-52.
[92] Bechara G, Leygue N, Galaup C, Mestre-Voegtle B, and Picard C. Polyazamacrocycles based on a tetraaminoacetate moiety and a (poly)pyridine intracyclic unit: direct synthesis and application to the photosensitization of Eu(III) and Tb(III) ions in aqueous solutions. Tetrahedron 2010;66:8594-604.