KR20170122216A - 초순수화 dsba 및 dsbc와 이를 제조하고 사용하는 방법 - Google Patents
초순수화 dsba 및 dsbc와 이를 제조하고 사용하는 방법 Download PDFInfo
- Publication number
- KR20170122216A KR20170122216A KR1020177026459A KR20177026459A KR20170122216A KR 20170122216 A KR20170122216 A KR 20170122216A KR 1020177026459 A KR1020177026459 A KR 1020177026459A KR 20177026459 A KR20177026459 A KR 20177026459A KR 20170122216 A KR20170122216 A KR 20170122216A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- dsba
- dsbc
- polypeptide
- composition
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/573—Immunoassay; Biospecific binding assay; Materials therefor for enzymes or isoenzymes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/16—Extraction; Separation; Purification by chromatography
- C07K1/22—Affinity chromatography or related techniques based upon selective absorption processes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/40—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0051—Oxidoreductases (1.) acting on a sulfur group of donors (1.8)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/90—Isomerases (5.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y108/00—Oxidoreductases acting on sulfur groups as donors (1.8)
- C12Y108/04—Oxidoreductases acting on sulfur groups as donors (1.8) with a disulfide as acceptor (1.8.4)
- C12Y108/04002—Protein-disulfide reductase (glutathione) (1.8.4.2), i.e. BdbC or BdbD
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y503/00—Intramolecular oxidoreductases (5.3)
- C12Y503/04—Intramolecular oxidoreductases (5.3) transposing S-S bonds (5.3.4)
- C12Y503/04001—Protein disulfide-isomerase (5.3.4.1), i.e. disufide bond-forming enzyme
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/902—Oxidoreductases (1.)
- G01N2333/90212—Oxidoreductases (1.) acting on a sulfur group of donors (1.8)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/99—Isomerases (5.)
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 발명은 매우 높은 수준의 순도로 이황화 산화환원효소 A (DsbA) 및 이황화 산화환원효소 C (DsbC) 폴리펩티드를 생산하는 방법을 제공한다. 또한 초순수 DsbA 및 DsbC와, 예를 들면, 박테리아에서 생산된 생물제제로부터의 DsbA 및 DsbC의 제거를 나타내는 면역검정에 사용하기 위해, 이를 사용하는 방법이 제공된다.
Description
관련 출원에 대한 교차-참조
본원은 개시내용이 모든 목적을 위해 그 전체가 본원에 참조로 편입되는, 2015년 3월 6일 출원된 미국 특허 가출원 번호 62/129,701의 이점을 주장한다.
ASCII 텍스트 파일 상에서의 서열목록 제출
ASCII 텍스트 파일 상에서의 하기 제출된 내용은 이들의 전문이 본원에 참조로 인용된다: 서열 목록의 컴퓨터 판독가능 형태 (CRF) (파일명: 146392026040SeqList.txt, 기록된 날짜: 2016년 3월 4일 금요일, 크기: 9 KB).
기술 분야
본 발명은 매우 높은 수준의 순도로 이황화 산화환원효소 A (DsbA) 및 이황화 산화환원효소 C (DsbC) 폴리펩티드를 생산하는 방법을 제공한다. 또한 초순수 DsbA 및 DsbC와, 예를 들면, 박테리아에서 생산된 생물제제로부터 DsbA 및 DsbC의 제거를 나타내는 면역검정에 사용하기 위해, 이를 사용하는 방법이 제공된다.
발효 조건 하에서 박테리아 숙주 세포에서의 발현에 의해 대량으로 생산된 진핵 폴리펩티드의 생산 수율 및 품질은 분비된 이종다량체 단백질 (예컨대, 항체)의 적절한 조립 및 접힘을 개선하기 위해 종종 변형된다. DsbA 및 DsbC를 포함하는 이황화 산화환원효소 (Dsb) 단백질과 같은 샤페론 단백질의 과발현은 박테리아 숙주 세포에서 생성된 항체와 같은 이종성 단백질의 적절한 접힘 및 용해도를 용이하게 한다. DsbA는 강한 티올 산화제이며 분비된 단백질에 대한 이황화 결합의 중간체 공여체이다. DsbC는 이황화 결합의 이성질화를 촉매하고 오류접힘된 이황화 결합을 뒤섞을 수 있다. Dsb 단백질은 박테리아에서 이황화 결합 형성 및 이성질화의 주요 촉매제이며 단백질의 올바른 단백질 접힘을 촉진한다. Chen et al. (1999) J Bio Chem 274:19601-19605; Georgiou et al., U.S. Patent No. 6,083,715; Georgiou et al., U.S. Patent No. 6,027,888; Bothmann and Pluckthun (2000) J. Biol . Chem. 275:17100-17105; Ramm and Pluckthun (2000) J. Biol . Chem. 275:17106-17113; Arie et al. (2001) Mol . Microbiol. 39:199-210.
재조합 생물의학적 단백질이 인간 환자에 투여에 대해 허용가능하도록 되기 위해, 제조 및 정제 공정에서 생기는 잔류 불순물을 최종 생물학적 제제에서 제거하는 것이 중요하다. 이들 공정 성분은 배양 배지 단백질, 면역글로불린 친화도 리간드, 바이러스, 내독소, DNA 및 숙주세포 단백질을 포함한다. 이들 숙주세포 불순물은 재조합 DNA 기술로부터 유래된 생물학적 생성물의 공정-관련 불순물인 공정-특이적 숙주세포 단백질 (HCP), 예를 들면 단백질 접힘을 촉진하기 위해 과발현된 DsbA 및 DsbC 샤페론을 포함한다. HCP는 전형적으로 최종 약물 물질에 소량으로 (의도된 재조합 폴리펩티드의 밀리그램 당 백만분율 또는 나노그램으로) 존재하지만, HCP는 바람직하지 않으며 이의 양은 최소화되어야한다는 것이 기술적으로 인식된다. 예를 들면, 미국 식품의약품안전청 (FDA)은 생체내 인간 사용을 위해 의도된 생물의약품은 가능한 한 이질적인 불순물이 없어야 한다는 것을 요구하고, HCP와 같은 잠재적인 불순물의 검출 및 정량화 시험을 요구한다. 또한, 국제 조화 회의 (ICH)는 생물공학/생물학적 생성물에 대한 시험 절차 및 허용 기준에 대한 지침을 제공한다. 지침은 HCP에 대해 광범위한 단백질 불순물을 검출할 수 있는 민감성 면역검정이 이용된다는 것을 제안한다. 면역글로불린, DNA, 내독소, 바이러스 및 총 HCP, 예를 들면, 총 이 . 콜라이 단백질 (ECP)을 검출하기 위한 검정 및 시약이 개발되었지만, DsbA 또는 DsbC와 같은 보조 단백질을 정확하게 검출하지 못하는 그러한 검정 및 시약이 개발되었다. 전형적으로 박테리아에서는 높은 수준으로 발현되지 않지만 생물학적 생성물의 접힘 및 분비를 용이하게 하기 위해 재조합 박테리아 숙주 세포에서 과발현될 수 있는 DsbA 또는 DsbC와 같은 단백질의 검출 및 정량화를 위한 충분한 특이성 및 민감성의 상업적 시약 또는 분석 방법은 현재 없다.
DsbA 및 DsbC 검출용 시약, 방법 및 키트는 충분한 일관성, 민감성, 특이성 또는 효율의 현존하는 검정 및 시약이 없는 곳에서 특히 필요하다. 본 명세서에 기재된 본 발명은 상기-기재된 필요성 중 특정한 것을 충족시키고 다른 이점을 제공한다.
출원 및 문헌들을 비롯하여 본원에 언급된 모든 참조들은 그 전체가 본원에 참조로 편입되었다.
일부 양태에서, 본 발명은 a) DsbA 폴리펩티드를 포함하는 세포 용해물에 약 0.01% 내지 약 1.0%의 최종 농도로 폴리에틸렌이민 (PEI)을 첨가하는 단계, b) 원심분리에 의해 상기 세포 용해물을 정화하는 단계, c) DsbA 폴리펩티드를 포함하는 정화된 세포 용해물을 음이온 교환 크로마토그래피 물질에 적용하는 단계, d) DsbA 폴리펩티드를 포함하는 음이온 교환 용출액을 생성시키도록 음이온 교환 크로마토그래피 물질로부터 DsbA 폴리펩티드를 용출시키는 단계, e) DsbA 폴리펩티드를 포함하는 음이온 교환 용출액을 양이온 교환 크로마토그래피 물질에 적용하는 단계, f) 정제된 DsbA 폴리펩티드를 포함하는 양이온 교환 용출액을 생성시키도록 양이온 교환 크로마토그래피 물질로부터 DsbA 폴리펩티드를 용출시키는 단계를 포함하는, DsbA 폴리펩티드를 포함하는 세포 용해물로부터 DsbA 폴리펩티드를 정제하는 방법을 제공한다. 일부 구현예에서, DsbA 폴리펩티드를 포함하는 세포 용해물은 음이온 교환 크로마토그래피 이전에, 적어도 약 16시간 동안 PEI 내에 보유된다. 일부 구현예에서, 용해물 내 PEI의 최종 농도는 약 0.1%이다. 일부 구현예에서, DsbA 폴리펩티드 및 PEI를 포함하는 용해물은 약 7.0의 pH이다.
상기 구현예의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 강한 음이온 교환인자(exchanger)이다. 일부 구현예에서, 상기 강한 음이온 교환인자는 4급 아민을 포함한다. 추가 구현예에서, 4급 아민은 가교결합된 아가로스에 연결된다. 일부 구현예에서, 음이온 교환인자는 QSFF 음이온 교환인자이다.
상기 구현예의 일부 구현예에서, DsbA는 염 구배를 사용하여 음이온 크로마토그래피 물질로부터 용출된다. 추가 구현예에서, 염 구배는 단계 구배이다. 일부 구현예에서, 정화된 용해물은 10mM MOPS, pH 7.1을 포함한다.
일부 구현예 또는 상기 구현예에서, DsbA는 하기 단계로 음이온 교환 크로마토그래피 물질로부터 용출된다: 약 4개 칼럼 용적에 대해 약 pH 9.2에서 약 15%의 약 25mM Tris 및 약 250mM NaCl, 약 4개 칼럼 용적에 대해 약 pH 9.2에서 약 20%의 약 25mM Tris 및 약 250mM NaCl, DsbA가 칼럼으로부터 용출할 때까지 약 pH 9.2에서 약 25%의 약 25mM Tris 및 약 250mM NaCl.
상기 구현예의 일부 구현예에서, 단계 b)의 DsbA 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 0.22μm 필터를 통해 통과된다. 일부 구현예에서, 단계 b)의 DsbA 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 pH 약 9.0으로 조정된다.
일부 구현예에서, 음이온 교환 용출액은 분획으로 수집된다. 일부 구현예에서, 분획은 약 0.3 내지 약 1.0 칼럼 용적(CV)이다. 일부 구현예에서, 분획은 양이온 교환 크로마토그래피 이전에 크기 배제 크로마토그래피에 의해 분석된다. 일부 구현예에서, 적어도 약 55% DsbA를 포함하는 분획이 추가의 정제를 위해 선택된다.
상기 구현예의 일부 구현예에서, 양이온 교환 크로마토그래피 물질은 설포프로필 모이어티를 포함한다. 일부 구현예에서, 설포프로필 모이어티가 가교결합된 폴리(스티렌-디비닐벤젠) 매트릭스에 연결된다. 일부 구현예에서, 양이온 교환 배지는 포로스(POROS) HS 50 또는 동등물이다. 일부 구현예에서, 단계 d)의 음이온 교환 용출액은 양이온 교환 크로마토그래피 전에 pH 약 5.0으로 조정된다.
일부 구현예에서, DsbA는 염 구배를 사용하여 양이온 크로마토그래피 물질로부터 용출된다. 일부 구현예에서, 양이온 크로마토그래피 물질은 5 칼럼 용적의 12.5mM MES로 세정된다. 일부 구현예에서, 염 구배는 15 칼럼 용적에 걸쳐 약 0% 내지 약 60% 12.5mM MES 및 1M NaCl의 구배이다. 일부 구현예에서, 양이온 교환 용출액은 분획으로 수집된다. 일부 구현예에서, 분획은 크기 배제 크로마토그래피에 의해 분석된다. 일부 구현예에서, 적어도 약 95% DsbA를 포함하는 분획이 풀링된다.
임의의 상기 구현예 중 일부 구현예에서, DsbA 폴리펩티드는 에스케리치아 콜라이 DsbA 폴리펩티드이다. 일부 구현예에서, DsbA 폴리펩티드는 서열 번호: 1의 아미노산 서열을 포함한다. 다른 구현예에서, DsbA 폴리펩티드의 아미노산 서열은 서열번호: 1의 아미노산 서열에 적어도 약 80% 동일하다. 일부 구현예에서, DsbA는 세포에서 발현된다. 일부 구현예에서, 세포는 원핵 세포이다. 추가 구현예에서, 세포는 이. 콜라이 세포이다. 일부 구현예에서, 세포는 DsbA의 내인성 발현보다 더 큰 수준으로 DsbA를 발현하도록 가공된다. 일부 구현예에서, 세포는 미세유동화기를 사용하여 용해된다.
일부 양태에서, 본 발명은 상기 구현예 중 어느 하나의 방법에 의해 정제된 DsbA 폴리펩티드를 포함하는 조성물을 제공한다. 일부 양태에서, 본 발명은 정제된 DsbA 폴리펩티드를 포함하는 조성물을 제공하며, 여기서 상기 조성물은 적어도 약 95% 모노머 DsbA 폴리펩티드를 포함한다. 일부 양태에서, 본 발명은 정제된 DsbA 폴리펩티드를 포함하는 조성물을 제공하며, 여기서 상기 조성물은 적어도 약 98% 모노머 DsbA 폴리펩티드를 포함한다. 일부 구현예에서, 본 조성물은 약 2% 미만 저분자량 종을 포함한다. 일부 구현예에서, 본 조성물은 약 1% 미만의 고분자량 종을 포함한다. 일부 구현예에서, 모노머 DsbA 폴리펩티드의 백분율은 크기 배제 크로마토그래피에 의해 검출된다. 일부 구현예에서, 본 조성물은 약 5% 미만 불순물을 포함한다. 일부 구현예에서, 본 불순물은 천연 또는 목적 DsbA에 비해 고분자량 및/또는 저분자량 폴리펩티드 종이다. 일부 구현예에서, 불순물은 이. 콜라이 단백질 (ECP), DsbA 응집물, DsbA 단편, 핵산 또는 세포 배양 배지 성분 중 하나 이상의 것이다. 일부 구현예에서, DsbA는 하나 이상의 냉각-해동 주기에 대해 안정적이다. 일부 구현예에서, DsbA는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 10 초과의 냉각-해동 주기에 대해 안정하다. 일부 구현예에서, 초순수 DsbA는 참조 표준으로서; 예를 들면, 시험 샘플 내 DsbA의 양 또는 농도를 계측하기 위해 사용된다. 일부 구현예에서, 초순수 DsbA는 양성 대조군으로; 예를 들면, 샘플 내 DsbA의 존재 및/또는 양을 계측하기 위한 검정에 사용된다.
일부 구현예에서, 조성물 내 DsbA 폴리펩티드의 순도는 크로마토그래피, SDS 폴리아크릴아미드 겔 전기영동 또는 웨스턴 블롯 분석에 의해 측정된다. 일부 구현예에서, 조성물 내 DsbA 폴리펩티드의 순도는 고성능 액체 크로마토그래피 (HPLC)에 의해 측정된다. 일부 구현예에서, 크로마토그래피는 크기 배제 크로마토그래피 (예컨대, SEC-HPLC)이다. 일부 구현예에서, 조성물 내 DsbA 폴리펩티드의 순도는 형광 단백질 염색 또는 은 염색을 사용한 SDS 겔 전기영동에 의해 측정된다. 일부 구현예에서, 조성물 내 비-DsbA 폴리펩티드의 존재는 웨스턴 블롯 분석에 의해 나타난 바와 같이 항-DsbA 항체와 면역반응성이 아닌 겔 전기영동에 의해 식별된 종의 존재에 의해 식별된다. 일부 구현예에서, 조성물 내 DsbA 폴리펩티드의 응집물의 존재는 웨스턴 블롯 분석에 의해 천연 DsbA보다 더 큰 분자량을 갖는 종의 존재에 의해 식별된다. 일부 구현예에서, 조성물 내 DsbA 폴리펩티드의 단편의 존재는 웨스턴 블롯 분석에 의해 천연 DsbA보다 더 작은 분자량을 갖는 종의 존재에 의해 식별된다.
일부 양태에서, 본 발명은 DsbA에 특이적으로 결합하는 항체를 생성하는 방법을 제공하며, 이는 상기 기술된 바와 같이 정제된, 초순수 DsbA에 동물을 노출시키는 단계를 포함한다. 추가 구현예에서, 상기 방법은 동물로부터 혈청을 수집하는 단계를 포함하며, 여기서 상기 혈청은 DsbA에 특이적으로 결합하는 항체를 포함한다. 일부 구현예에서, 혈청은 DsbA에 특이적으로 결합하는 다클론성 항체를 포함한다. 일부 양태에서, 본 발명은 혈청으로부터 단리된 하나 이상의 단클론성 항체를 제공한다. 일부 구현예에서, 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭이다.
일부 양태에서, 본 발명은 DsbA에 특이적으로 결합하는 항체를 정제하는 방법을 제공하며, 상기 방법은 지지 물질에 부착된 초순수 DsbA를 포함하는 크로마토그래피 물질에 항-DsbA 항체를 포함하는 조성물을 접촉하는 단계, 비결합된 화합물을 제거하기 위해 크로마토그래피 물질을 세정하는 단계, 및 항-DsbA 항체를 용출시키는 단계를 포함한다. 일부 구현예에서, 초순수 DsbA는 적어도 약 95% 모노머 DsbA 폴리펩티드를 포함한다. 일부 구현예에서, 초순수 DsbA는 약 5% 미만의 불순물, 약 1% 미만의 불순물, 또는 약 0.1% 미만의 불순물을 포함한다. 일부 구현예에서, 초순수 DsbA는 본 명세서에서 기재된 방법 중 임의의 것에 의해 제조된다. 일부 구현예에서, 항체는 다클론성 항체이다. 일부 구현예에서, 항체는 본원에 기술된 방법 중 임의의 것에 따라 제조된다. 일부 구현예에서, 1% 미만의 항체가 비-DsbA 화합물에 특이적으로 결합한다.
일부 양태에서, 본 발명은 DsbA에 특이적으로 결합하는 다클론성 항체를 포함하는 조성물을 제공하고, 여기서 상기 다클론성 항체는 동물을 상기에 기재된 임의의 DsbA 조성물에 노출함에 의해 생성된다. 일부 구현예에서, 다클론성 항체는 동물의 혈청으로부터 수집된다. 일부 구현예에서, 본 발명은 DsbA에 특이적으로 결합하는 단클론성 항체를 포함하는 조성물을 제공하고, 여기서 상기 단클론성 항체는 동물을 상기에 기재된 임의의 DsbA 조성물에 노출함에 의해 생성된다. 일부 구현예에서, 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭이다.
일부 구현예에서, 본 발명은 DsbA의 양 및/또는 존재에 대해 재조합 폴리펩티드 샘플을 분석하는 방법을 제공하며, 이는 면역검정을 사용하여 샘플 내 DsbA를 검출하는 단계 및 샘플 내에서 검출된 DsbA의 양을 초순수 DsbA 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함한다. 일부 구현예에서, 참조 표준 DsbA의 수많은 상이한 농도가 참조 표준에서 검출 수준과 DsbA의 농도 사이의 상관관계를 확립하기 위해 시험된다. 시험 샘플 내 DsbA의 농도는 시험 샘플 내 DsbA의 검출 수준을 참조 표준 내 공지된 DsbA의 농도의 검출과 비교함에 의해 계측될 수 있다. 일부 구현예에서, 상기 제제는 임의의 약 1% 미만의 불순물을 포함한다. 일부 구현예에서, 초순수 DsbA 참조 표준은 본 명세서에서 기재된 방법에 의해 제조된다. 일부 구현예에서, 면역검정은 초순수 DsbA에 특이적으로 결합하는 항체를 포함한다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 약 1% 미만의 임의의 비-DsbA 화합물에 결합한다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 다클론성 항체이다. 기타 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 단클론성 항체이다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 면역검정 내 포획 항체로서 사용된다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 검출 항체로서 사용된다. 일부 구현예에서, 검출 항체는 검출제 (예컨대, 호스래디쉬 퍼옥시다아제)에 콘주게이트된다. 일부 구현예에서, DsbA 단백질은 이. 콜라이 DsbA이다. 일부 구현예에서, 재조합 폴리펩티드는 숙주세포 (예컨대, 이. 콜라이 숙주세포)에서 제조된다. 일부 구현예에서, 숙주 세포는 DsbA를 과발현한다 (예컨대, DsbA를 과발현하는 이. 콜라이 숙주 세포임). 일부 구현예에서, 샘플은 세포 용해물이거나, 또는 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다.
일부 양태에서, 본 발명은 샘플 내 DsbA를 검출하는 면역검정 방법을 제공하며, 예를 들어, 여기서 상기 샘플은 재조합 폴리펩티드 제제 또는 숙주 세포주로부터 수득되고, 상기 방법은 하기를 포함한다: (a) DsbA에 결합하는 포획 항체를 샘플에 접촉시켜 이로써 샘플-포획 항체 조합 물질을 생성하는 단계; (b) DsbA에 결합하는 검출 항체를 상기 샘플-포획 항체 조합 물질에 접촉시키는 단계; 및 (c) 상기 샘플-포획 항체 조합 물질에 결합된 항체를 검출하는 단계. 추가 구현예에서, 본 방법은 표준 적정 곡선을 사용하여 결합된 검출 항체의 수준을 정량화하는 것을 포함한다. 추가 구현예에서, 본 방법은 결합된 검출 항체의 수준에 기초하여 샘플 내 존재하는 DsbA의 양을 산출하는 것을 포함한다. 일부 구현예에서, 샘플 내 존재하는 DsbA의 양은 표준 적정 곡선을 초순수 DsbA 조성물로 생성된 표준 적정 곡선과 비교함에 의해 계측된다. 일부 구현예에서, 초순수 DsbA 조성물은 적어도 약 95% 모노머 DsbA 폴리펩티드를 포함한다. 일부 구현예에서, 초순수 DsbA 조성물은 약 5% 미만의 불순물, 약 1% 미만의 불순물, 또는 약 0.1% 미만의 불순물을 포함한다. 일부 구현예에서, 조성물 내 초순수 DsbA는 본 명세서에서 기재된 방법 중 임의의 것에 의해 제조된다. 일부 구현예에서, 포획 항체는 초순수 DsbA에 특이적으로 결합한다. 일부 구현예에서, 검출 항체는 초순수 DsbA에 특이적으로 결합한다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 다클론성 항체이다. 일부 구현예에서, DsbA에 결합하는 검출 항체는 호스래디쉬 퍼옥시다아제에 콘주게이트된다. 일부 구현예에서, 면역검정은 샌드위치(sandwich) 검정이다. 추가 구현예에서, 샌드위치 검정은 효소-결합 면역흡착 검정 (ELISA)이다. 일부 구현예에서, DsbA 단백질은 이. 콜라이 DsbA이다. 일부 구현예에서, 재조합 폴리펩티드 제제 또는 숙주 세포주는 이. 콜라이로부터 수득된다. 일부 구현예에서, 숙주 세포주는 DsbA를 과발현한다 (예컨대, DsbA를 과발현하는 이. 콜라이 숙주 세포임). 일부 구현예에서, 샘플은 세포 용해물이다. 일부 구현예에서, 샘플은 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다. 일부 구현예에서, 재조합 폴리펩티드 제제 내 함유된 재조합 폴리펩티드는 항체 또는 면역접합체이다. 일부 구현예에서, 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편이다. 일부 구현예에서, 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4이다.
일부 구현예에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물에 대한 품질 검정을 제공하며, 상기 방출 검정은, 상기 약제학적 조성물을 본원에 기술된 면역검정으로 처리하는 것을 포함하고, 여기서 상기 면역검정 내 DsbA의 검출은 상기 약제학적 조성물이 동물로의 치료적 투여에 적합하지 않다는 것을 표지한다. 일부 구현예에서, 약 1ppm 미만의 약제학적 조성물 내 DsbA의 양은 약제학적 조성물이 동물에 투여에 대해 적합하다는 것을 나타낸다. 일부 구현예에서, 재조합 폴리펩티드는 이. 콜라이 세포로부터 제조된다. 일부 구현예에서, 박테리아 세포는 DsbA를 과발현한다. 일부 구현예에서, 샘플은 세포 용해물이다. 일부 구현예에서, 샘플은 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다. 일부 구현예에서, 재조합 폴리펩티드 제제 내 함유된 재조합 폴리펩티드는 항체 또는 면역접합체이다. 일부 구현예에서, 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편이다. 일부 구현예에서, 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4이다.
일부 양태에서, 본 발명은 세포 용해물 유래의 DsbC 폴리펩티드를 정제하는 방법을 제공하며, 상기 DsbC는 하기를 포함한다: a) DsbC 폴리펩티드를 포함하는 세포 용해물에 약 0.01% 내지 약 1.0%의 최종 농도로 폴리에틸렌이민 (PEI)을 첨가하는 단계, b) 원심분리에 의해 상기 세포 용해물을 정화하는 단계, c) DsbC 폴리펩티드를 포함하는 정화된 세포 용해물을 음이온 교환 크로마토그래피 물질에 적용하는 단계, d) DsbC 폴리펩티드를 포함하는 음이온 교환 용출액을 생성시키도록 음이온 교환 크로마토그래피 물질로부터 DsbC 폴리펩티드를 용출시키는 단계, e) DsbC 폴리펩티드를 포함하는 음이온 교환 용출액을 소수성 상호작용 크로마토그래피 (HIC) 물질에 적용하는 단계, f) HIC 물질 유래의 DsbC 폴리펩티드를 용출시켜 HIC 용출액을 생성하는 단계, g) DsbC 폴리펩티드를 포함하는 HIC 용출액을 크기 배제 크로마토그래피에 적용시키는 단계, h) 정제된 DsbC 폴리펩티드를 포함하는 크기 배제 크로마토그래피 유래의 분획을 수집하는 단계. 일부 구현예에서, DsbC 폴리펩티드를 포함하는 세포 용해물은 음이온 교환 크로마토그래피 이전에, 적어도 약 16시간 동안 PEI 내에 보유된다. 일부 구현예에서, 용해물 내 PEI의 최종 농도는 약 0.1%이다. 일부 구현예에서, DsbC 폴리펩티드 및 PEI를 포함하는 용해물은 약 7.0의 pH이다.
상기 구현예의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 약한 음이온 교환인자(exchanger)이다. 또다른 추가 구현예에서, 상기 약한 음이온 교환인자는 4급 아민을 포함한다. 또다른 추가 구현예에서, 4급 아민은 가교결합된 아가로스에 연결된다.
일부 구현예에서, DsbC는 염 구배를 사용하여 양이온 크로마토그래피 물질로부터 용출된다. 추가 구현예에서, 염 구배는 선형 구배이다. 일부 구현예에서, 음이온 교환 물질은 10mM MOPS에서 세정된다. 일부 구현예에서, 염 구배는 15 칼럼 용적에 걸쳐 약 0% 내지 약 60% 10mM MOPS 및 250mM NaCl의 구배이다.
상기 구현예의 일부 구현예에서, 단계 b)의 DsbC 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 0.22μm 필터를 통해 통과된다. 일부 구현예에서, 단계 b)의 DsbC 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 pH 약 8.0으로 조정된다.
일부 구현예에서, 음이온 교환 용출액은 분획으로 수집된다. 일부 구현예에서, 분획은 소수성 상호작용 크로마토그래피 이전에 크기 배제 크로마토그래피에 의해 분석된다. 일부 구현예에서, 적어도 약 25% DsbC를 포함하는 분획이 추가의 정제를 위해 선택된다.
상기 구현예의 일부 구현예에서, HIC 물질은 페닐 모이어티를 포함한다. 추가 구현예에서, 페닐 모이어티는 가교결합된 아가로스에 연결된다. 일부 구현예에서, 음이온 교환 용출액은 HIC 크로마토그래피 전에 약 0.54M 황산나트륨 및 약 50mM PO4 를 함유하여 약 pH 7로 컨디셔닝된다. 일부 구현예에서, DsbC는 물을 사용하여 HIC 물질로부터 용출된다. 일부 구현예에서, HIC 용출액은 분획으로 수집된다. 추가 구현예에서, DsbC를 포함하는 분획이 풀링된다.
상기 구현예 중 일부 구현예에서, 크기 배제 크로마토그래피 물질은 가교결합된 아가로스 및 덱스트란의 구형 복합체를 포함한다. 일부 구현예에서, 크기 배제 흐름은 분획으로 수집된다. 일부 구현예에서, HIC 용출액은 크기 배제 크로마토그래피 전에 한외여과된다. 일부 구현예에서, DsbC를 포함하는 분획이 풀링된다.
상기 구현예 중 일부 구현예에서, DsbC 폴리펩티드는 에스케리치아 콜라이 DsbC 폴리펩티드이다. 일부 구현예에서, DsbC 폴리펩티드는 서열 번호: 3의 아미노산 서열을 포함한다. 일부 구현예에서, DsbC 폴리펩티드의 아미노산 서열은 서열번호: 3의 아미노산 서열에 적어도 약 80% 동일하다.
상기 구현예의 일부 구현예에서, DsbC는 세포에서 발현된다. 일부 구현예에서, 세포는 원핵 세포이다. 일부 구현예에서, 세포는 이. 콜라이 세포이다. 일부 구현예에서, 세포는 DsbC의 내인성 발현보다 더 큰 수준으로 DsbC를 발현하도록 가공된다. 일부 구현예에서, 세포는 미세유동화기를 사용하여 용해된다.
일부 양태에서, 본 발명은 상기 구현예 중 어느 하나의 방법에 의해 정제된 DsbC 폴리펩티드를 포함하는 조성물을 제공한다. 일부 양태에서, 본 발명은 정제된 DsbC 폴리펩티드를 포함하는 조성물을 제공하며, 여기서 상기 조성물은 적어도 약 95% 모노머 DsbC 폴리펩티드를 포함한다. 일부 구현예에서, 본 조성물은 적어도 약 98% 모노머 DsbC 폴리펩티드를 포함한다. 일부 구현예에서, 본 조성물은 적어도 약 99% 모노머 DsbC 폴리펩티드를 포함한다. 일부 구현예에서, 본 조성물은 적어도 약 99.5% 모노머 DsbC 폴리펩티드를 포함한다. 일부 구현예에서, 본 조성물은 약 2% 미만 저분자량 종을 포함한다. 일부 구현예에서, 본 조성물은 약 1% 미만의 고분자량 종을 포함한다. 일부 구현예에서, 모노머 DsbC 폴리펩티드의 백분율은 크기 배제 크로마토그래피에 의해 검출된다. 일부 구현예에서, 불순물은 천연 또는 목적 DsbC에 비해 고분자량 및/또는 저분자량 폴리펩티드 종이다. 일부 구현예에서, 불순물은 이. 콜라이 단백질 (ECP), DsbC 응집물, DsbC 단편, 핵산 또는 세포 배양 배지 성분 중 하나 이상의 것이다. 일부 구현예에서, DsbC는 하나 이상의 냉각-해동 주기에 대해 안정적이다. 일부 구현예에서, DsbC는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 10 초과의 냉각-해동 주기에 대해 안정하다. 일부 구현예에서, 초순수 DsbC는 참조 표준으로서; 예를 들면, 시험 샘플 내 DsbC의 양 또는 농도를 계측하기 위해 사용된다. 일부 구현예에서, 초순수 DsbC는 양성 대조군으로; 예를 들면, 샘플 내 DsbC의 존재 및/또는 양을 계측하기 위한 검정에 사용된다.
일부 구현예에서, 조성물 내 DsbC 폴리펩티드의 순도는 크로마토그래피, SDS 폴리아크릴아미드 겔 전기영동 또는 웨스턴 블롯 분석에 의해 측정된다. 일부 구현예에서, 조성물 내 DsbC 폴리펩티드의 순도는 고성능 액체 크로마토그래피 (HPLC)에 의해 측정된다. 일부 구현예에서, 크로마토그래피는 크기 배제 크로마토그래피 (예컨대, SEC-HPLC)이다. 일부 구현예에서, 조성물 내 DsbC 폴리펩티드의 순도는 형광 단백질 염색 또는 은 염색을 사용한 SDS 겔 전기영동에 의해 측정된다. 일부 구현예에서, 조성물 내 비-DsbC 폴리펩티드의 존재는 웨스턴 블롯 분석에 의해 나타난 바와 같이 항-DsbC 항체와 면역반응성이 아닌 겔 전기영동에 의해 식별된 종의 존재에 의해 식별된다. 일부 구현예에서, 조성물 내 DsbC 폴리펩티드의 응집물의 존재는 웨스턴 블롯 분석에 의해 천연 DsbC보다 더 큰 분자량을 갖는 종의 존재에 의해 식별된다. 일부 구현예에서, 조성물 내 DsbC 폴리펩티드의 단편의 존재는 웨스턴 블롯 분석에 의해 천연 DsbC보다 더 작은 분자량을 갖는 종의 존재에 의해 식별된다.
일부 양태에서, 본 발명은 DsbC에 특이적으로 결합하는 항체를 생성하는 방법을 제공하며, 이는 상기 기술된 바와 같이 정제된, 초순수 DsbC에 동물을 노출시키는 단계를 포함한다. 추가 구현예에서, 상기 방법은 동물로부터 혈청을 수집하는 단계를 포함하며, 여기서 상기 혈청은 DsbC에 특이적으로 결합하는 항체를 포함한다. 일부 구현예에서, 혈청은 DsbC에 특이적으로 결합하는 다클론성 항체를 포함한다. 일부 양태에서, 본 발명은 혈청으로부터 단리된 하나 이상의 단클론성 항체를 제공한다. 일부 구현예에서, 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭이다.
일부 양태에서, 본 발명은 DsbC에 특이적으로 결합하는 항체를 정제하는 방법을 제공하며, 상기 방법은 지지 물질에 부착된 초순수 DsbC를 포함하는 크로마토그래피 물질에 항-DsbC 항체를 포함하는 조성물을 접촉하는 단계, 비결합된 화합물을 제거하기 위해 크로마토그래피 물질을 세정하는 단계, 및 항-DsbC 항체를 용출시키는 단계를 포함한다. 일부 구현예에서, 초순수 DsbC는 약 95% 초과의 모노머 DsbC 폴리펩티드를 포함한다. 일부 구현예에서, 초순수 DsbC는 약 5% 미만의 불순물, 약 1% 미만의 불순물, 또는 약 0.1% 미만의 불순물을 포함한다. 일부 구현예에서, 초순수 DsbC는 본 명세서에서 기재된 방법 중 임의의 것에 의해 제조된다. 일부 구현예에서, 항체는 다클론성 항체이다. 일부 구현예에서, 항체는 본원에 기술된 방법 중 임의의 것에 따라 제조된다. 일부 구현예에서, 1% 미만의 항체가 비-DsbC 화합물에 특이적으로 결합한다.
일부 양태에서, 본 발명은 DsbC에 특이적으로 결합하는 다클론성 항체를 포함하는 조성물을 제공하고, 여기서 상기 다클론성 항체는 동물을 상기에 기재된 임의의 DsbC 조성물에 노출함에 의해 생성된다. 일부 구현예에서, 다클론성 항체는 동물의 혈청으로부터 수집된다. 일부 구현예에서, 본 발명은 DsbC에 특이적으로 결합하는 단클론성 항체를 포함하는 조성물을 제공하고, 여기서 상기 단클론성 항체는 동물을 상기에 기재된 임의의 DsbC 조성물에 노출함에 의해 생성된다. 일부 구현예에서, 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭이다.
일부 구현예에서, 본 발명은 DsbC의 양 및/또는 존재에 대해 재조합 폴리펩티드 샘플을 분석하는 방법을 제공하며, 이는 면역검정을 사용하여 샘플 내 DsbC를 검출하는 단계 및 샘플 내에서 검출된 DsbC의 양을 초순수 DsbC 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함한다. 일부 구현예에서, 참조 표준 DsbC의 수많은 상이한 농도가 참조 표준에서 검출 수준과 DsbC의 농도 사이의 상관관계를 확립하기 위해 시험된다. 시험 샘플 내 DsbC의 농도는 시험 샘플 내 DsbC의 검출 수준을 참조 표준 내 공지된 DsbC의 농도의 검출과 비교함에 의해 계측될 수 있다. 일부 구현예에서, 상기 제제는 임의의 약 1% 미만의 불순물을 포함한다. 일부 구현예에서, 초순수 DsbC 참조 표준은 본 명세서에서 기재된 방법에 의해 제조된다. 일부 구현예에서, 면역검정은 초순수 DsbC에 특이적으로 결합하는 항체를 포함한다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 약 1% 미만의 임의의 비-DsbC 화합물에 결합한다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 다클론성 항체이다. 기타 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 단클론성 항체이다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 면역검정 내 포획 항체로서 사용된다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 검출 항체로서 사용된다. 일부 구현예에서, 검출 항체는 검출제 (예컨대, 호스래디쉬 퍼옥시다아제)에 콘주게이트된다. 일부 구현예에서, DsbC 단백질은 이. 콜라이 DsbC이다. 일부 구현예에서, 재조합 폴리펩티드는 숙주세포 (예컨대, 이. 콜라이 숙주세포)에서 제조된다. 일부 구현예에서, 숙주 세포는 DsbC를 과발현한다 (예컨대, DsbC를 과발현하는 이. 콜라이 숙주 세포임). 일부 구현예에서, 샘플은 세포 용해물이거나, 또는 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다.
일부 양태에서, 본 발명은 샘플 내 DsbC를 검출하는 면역검정 방법을 제공하며, 예를 들어, 여기서 상기 샘플은 재조합 폴리펩티드 제제 또는 숙주 세포주로부터 수득되고, 상기 방법은 하기를 포함한다: (a) DsbC에 결합하는 포획 항체를 샘플에 접촉시켜 이로써 샘플-포획 항체 조합 물질을 생성하는 단계; (b) DsbC에 결합하는 검출 항체를 상기 샘플-포획 항체 조합 물질에 접촉시키는 단계; 및 (c) 상기 샘플-포획 항체 조합 물질에 결합된 항체를 검출하는 단계. 추가 구현예에서, 본 방법은 표준 적정 곡선을 사용하여 결합된 검출 항체의 수준을 정량화하는 것을 포함한다. 추가 구현예에서, 본 방법은 결합된 검출 항체의 수준에 기초하여 샘플 내 존재하는 DsbC의 양을 산출하는 것을 포함한다. 일부 구현예에서, 샘플 내 존재하는 DsbC의 양은 표준 적정 곡선을 초순수 DsbC 조성물로 생성된 표준 적정 곡선과 비교함에 의해 계측된다. 일부 구현예에서, 초순수 DsbC 조성물은 적어도 약 95% 모노머 DsbC 폴리펩티드를 포함한다. 일부 구현예에서, 초순수 DsbC 조성물은 약 5% 미만의 불순물, 약 1% 미만의 불순물, 또는 약 0.1% 미만의 불순물을 포함한다. 일부 구현예에서, 조성물 내 초순수 DsbC는 본 명세서에서 기재된 방법 중 임의의 것에 의해 제조된다. 일부 구현예에서, 포획 항체는 초순수 DsbC에 특이적으로 결합한다. 일부 구현예에서, 검출 항체는 초순수 DsbC에 특이적으로 결합한다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 다클론성 항체이다. 일부 구현예에서, DsbC에 결합하는 검출 항체는 호스래디쉬 퍼옥시다아제에 콘주게이트된다. 일부 구현예에서, 면역검정은 샌드위치(sandwich) 검정이다. 추가 구현예에서, 샌드위치 검정은 효소-결합 면역흡착 검정 (ELISA)이다. 일부 구현예에서, DsbC 단백질은 이. 콜라이 DsbC이다. 일부 구현예에서, 재조합 폴리펩티드 제제 또는 숙주 세포주는 이. 콜라이로부터 수득된다. 일부 구현예에서, 숙주 세포주는 DsbC를 과발현한다 (예컨대, DsbC를 과발현하는 이. 콜라이 숙주 세포임). 일부 구현예에서, 샘플은 세포 용해물이다. 일부 구현예에서, 샘플은 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다. 일부 구현예에서, 재조합 폴리펩티드 제제 내 함유된 재조합 폴리펩티드는 항체 또는 면역접합체이다. 일부 구현예에서, 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편이다. 일부 구현예에서, 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4이다.
일부 구현예에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물에 대한 품질 검정을 제공하며, 상기 방출 검정은, 상기 약제학적 조성물을 본원에 기술된 면역검정으로 처리하는 것을 포함하고, 여기서 상기 면역검정 내 DsbC의 검출은 상기 약제학적 조성물이 동물로의 치료적 투여에 적합하지 않다는 것을 표지한다. 일부 구현예에서, 약 1ppm 미만의 약제학적 조성물 내 DsbC의 양은 약제학적 조성물이 동물에 투여에 대해 적합하다는 것을 나타낸다. 일부 구현예에서, 재조합 폴리펩티드는 이. 콜라이 세포로부터 제조된다. 일부 구현예에서, 박테리아 세포는 DsbC를 과발현한다. 일부 구현예에서, 샘플은 세포 용해물이다. 일부 구현예에서, 샘플은 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다. 일부 구현예에서, 재조합 폴리펩티드 제제 내 함유된 재조합 폴리펩티드는 항체 또는 면역접합체이다. 일부 구현예에서, 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편이다. 일부 구현예에서, 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4이다.
일부 양태에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내에서 DsbA의 검출을 위한 키트를 제공하고, 상기 키트는 본 명세서에서 기재된 임의의 방법에 의해 제조된 항-DsbA 항체 또는 본 명세서에 기재된 임의의 항-DsbA 항체의 조성물을 포함한다.
일부 양태에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내에서 DsbC의 검출을 위한 키트를 제공하고, 상기 키트는 본 명세서에서 기재된 임의의 방법에 의해 제조된 항-DsbC 항체 또는 본 명세서에 기재된 임의의 항-DsbC 항체의 조성물을 포함한다.
일부 양태에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내에서 DsbA 및 DsbC의 검출을 위한 키트를 제공하고, 상기 키트는 본 명세서에서 기재된 임의의 방법에 의해 제조된 항-DsbA 항체 및 항-DsbC 항체 또는 본 명세서에 기재된 임의의 항-DsbA 항체 및 임의의 항-DsbC 항체의 조성물을 포함한다. 일부 구현예에서, 키트는 추가로 샘플 내 DsbA 및/또는 DsbC를 정량화하기 위한 표준 곡선을 생성하는데 참조 표준으로 사용하기 위한 초순수 DsbA 및/또는 DsbC를 포함한다. 일부 구현예에서, 본 키트는 더욱이 샘플 내 DsbA 및/또는 DsbC를 검출하기 위한 검정에서 양성 대조군으로서 사용하기 위한 초순수 DsbA 및/또는 DsbC를 포함한다.
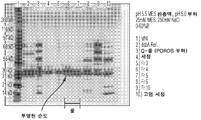
도 1은 DsbA의 정제를 위한 QSFF 분획의 크기 배제 크로마토그래피를 나타내는 크로마토그램을 도시한다. 최상부로부터 바닥면까지, 본 크로마토그램은 하기 분획을 나타낸다: 부하, 분획 3, 분획 7, 분획 10, 분획 11 및 분획 15.
도 2는 DsbA의 정제를 위한 포로스 HS 풀 분획의 SDS 폴리아크릴아미드 겔 전기영동 (PAGE)이다.
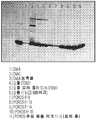
도 3은 DsbA의 정제를 위한 포로스 부하 및 포로스 풀 분획의 크기 배제 크로마토그래피의 크로마토그래프를 도시한다.
도 4는 DsbA 포로스 HS 풀 분획의 웨스턴 블롯을 도시한다. 모의 풀은 주로 DsbA 분자를 함유한다.
도 5는 DsbC의 정제를 위한 분획의 SDS 폴리아크릴아미드 겔 전기영동이다.
도 6a는 DsbC의 정제를 위한 DEAE FF 크로마토그래피의 크로마토그램을 도시한다. 도 6b는 도 6a에 제시된 용출 부분의 확대를 도시한다.
도 7은 DsbC의 정제를 위한 DEAE-FF 분획의 SDS PAGE를 도시한다.
도 8a 및 8b는 DsbC의 정제에서 크로마토그래피 샘플의 전기영동을 도시한다. 도 8a는 검출제로서 항-DsbC-HRP를 사용한 웨스턴 블롯이다. 도 8b는 쿠마씨 청색으로 염색된, 분획의 SDS PAGE이다.
도 9는 SPFF 분획의 SDS-PAGE를 도시한다.
도 10은 DsbC의 정제를 위한 선별 HIC 크로마토그래피에 사용된 SDS-PAGE를 도시한다.
도 11은 DsbC의 정제를 위한 선별 HIC 크로마토그래피에 사용된 SDS-PAGE를 도시한다.
도 12는 DsbC의 정제에서의 HIC 크로마토그래피 분획의 SDS PAGE를 도시한다.
도 13은 DsbC의 슈퍼덱스(superdex) 75 크로마토그래피 분획의 SDS-PAGE를 도시한다.
도 14는 제형화된 DsbC의 고성능 액체 크로마토그래피 (HPLC)를 나타내는 크로마토그램을 도시한다.
도 15는 DsbA 및 DsbC의 SDS-PAGE를 도시한다. 비-환원된 샘플은 좌측 칼럼에 제공된다. 환원된 샘플은 우측 칼럼에 제공된다.
도 16은 직접적인 결합 ELISA에서 항-DsbC 친화도 풀의 비교를 도시한다. 정사각형은 분획화된 물질(94% 주요 피크)을 나타내고, 원은 비-분획화된 물질(78% 주요 피크)를 나타낸다.
도 17은 낮은 응집물 슈퍼덱스 200 항-DsbC 친화도 풀을 사용하여 ELISA의 결과를 도시한다.
도 2는 DsbA의 정제를 위한 포로스 HS 풀 분획의 SDS 폴리아크릴아미드 겔 전기영동 (PAGE)이다.
도 3은 DsbA의 정제를 위한 포로스 부하 및 포로스 풀 분획의 크기 배제 크로마토그래피의 크로마토그래프를 도시한다.
도 4는 DsbA 포로스 HS 풀 분획의 웨스턴 블롯을 도시한다. 모의 풀은 주로 DsbA 분자를 함유한다.
도 5는 DsbC의 정제를 위한 분획의 SDS 폴리아크릴아미드 겔 전기영동이다.
도 6a는 DsbC의 정제를 위한 DEAE FF 크로마토그래피의 크로마토그램을 도시한다. 도 6b는 도 6a에 제시된 용출 부분의 확대를 도시한다.
도 7은 DsbC의 정제를 위한 DEAE-FF 분획의 SDS PAGE를 도시한다.
도 8a 및 8b는 DsbC의 정제에서 크로마토그래피 샘플의 전기영동을 도시한다. 도 8a는 검출제로서 항-DsbC-HRP를 사용한 웨스턴 블롯이다. 도 8b는 쿠마씨 청색으로 염색된, 분획의 SDS PAGE이다.
도 9는 SPFF 분획의 SDS-PAGE를 도시한다.
도 10은 DsbC의 정제를 위한 선별 HIC 크로마토그래피에 사용된 SDS-PAGE를 도시한다.
도 11은 DsbC의 정제를 위한 선별 HIC 크로마토그래피에 사용된 SDS-PAGE를 도시한다.
도 12는 DsbC의 정제에서의 HIC 크로마토그래피 분획의 SDS PAGE를 도시한다.
도 13은 DsbC의 슈퍼덱스(superdex) 75 크로마토그래피 분획의 SDS-PAGE를 도시한다.
도 14는 제형화된 DsbC의 고성능 액체 크로마토그래피 (HPLC)를 나타내는 크로마토그램을 도시한다.
도 15는 DsbA 및 DsbC의 SDS-PAGE를 도시한다. 비-환원된 샘플은 좌측 칼럼에 제공된다. 환원된 샘플은 우측 칼럼에 제공된다.
도 16은 직접적인 결합 ELISA에서 항-DsbC 친화도 풀의 비교를 도시한다. 정사각형은 분획화된 물질(94% 주요 피크)을 나타내고, 원은 비-분획화된 물질(78% 주요 피크)를 나타낸다.
도 17은 낮은 응집물 슈퍼덱스 200 항-DsbC 친화도 풀을 사용하여 ELISA의 결과를 도시한다.
본 발명은 DsbA 및 DsbC의 초순수 조성물을 생성하는 방법을 제공한다. 이러한 조성물은 DsbA 또는 DsbC에 매우 특이적인 항체를 생성하기 위해 사용된다. 항체 이어서 DsbA 및 DsbC가 과발현되어 재조합 폴리펩티드 접힘 및 조립을 용이하게 하는 박테리아 발효 배양에서 제조된 재조합 폴리펩티드에서 DsbA 및 DsbC를 검출하는데 유용하다. 예를 들면, 항체는 항체와 같은 재조합 폴리펩티드의 약제학적 제형의 개발에서 방출 검정에 유용할 수 있다.
I. 정의
용어 "검출하는"은 표적 분자의 정성적 및 정량적 측정 양자를 포함하는 가장 넓은 의미로 본 명세서에서 사용된다. 검출은 샘플 내에 표적 분자의 단순한 존재를 식별하는 것뿐만 아니라 표적 분자가 검출가능한 수준으로 샘플 내에 존재하는지 여부를 계측하는 것을 포함한다.
용어 "폴리펩티드" 및 "단백질"은 임의의 길이의 아미노산의 폴리머를 나타내는데 본원에서 상호교환적으로 사용된다. 상기 중합체는 선형 또는 분지형일 수 있고, 이는 변형된 아미노산을 포함할 수 있고, 그리고 이는 비-아미노산에 의하여 저해될 수 있다. 상기 용어는 또한 천연적으로 또는 처치(intervention); 예를 들어, 이황화 결합 형성, 글리코실화, 지질화, 아세틸화, 인산화, 또는 임의의 다른 가공 또는 변형, 예를 들어, 표지화 성분을 사용한 콘주게이트에 의해 변형된 아미노산 중합체를 포괄한다. 예를 들면, 아미노산 (예컨대, 비천연 아미노산 등 포함)의 하나 이상의 유사체, 뿐만 아니라 당해기술에 공지된 다른 변형을 함유하는 폴리펩티드가 또한 상기 정의내에 포함된다. 본 명세서에서 사용된 바와 같은 용어들 "폴리펩티드" 및 "단백질"은 구체적으로 항체를 포괄한다.
“정제된” 폴리펩티드 (예컨대, 항체 또는 면역접합체)는, 폴리펩티드의 순도가 증가되어, 이로써 이것이 천연 환경 및/또는 실험실 조건 하에서 초기 합성되고/되거나 증폭될 경우에서 존재하는 것보다 더욱 순수한 형태로 존재한다는 것을 의미한다. 순도는 상대적인 용어이며, 절대적인 순도를 필연적으로 의미하지 않는다.
본 명세서에서 사용된 바와 같이, "초순수 DsbA" 및 "초순수 DsbC"는 조성물에서 적어도 약 95%의 단백질이 목적 단백질인 모노머 DsbA 또는 모노머 DsbC인 DsbA 또는 DsbC 조성물을 지칭한다. 일부 예에서, 초순수 DsbA 및 초순수 DsbC는 적어도 약 96%, 97%, 98%, 99%, 또는 99.5% 모노머 DsbA 또는 모노머 DsbC를 포함한다. 일부 구현예에서, 모노머 DsbA 또는 모노머 DsbC는 SEC에 의해 계측된다.
폴리펩티드에 대해 참조로 사용될 때, "Dsb" 단백질은 박테리아 이황화 산화환원효소를 지칭한다. 박테리아 이황화 산화환원효소는 효소 중 이황화 결합 계열의 구성원이다. Dsb 패밀리의 구성원은 DsbA, DsbB, DsbC, DsbD 및 DsbG를 포함한다. DsbA는 펩티드가 세포의 주변세포질으로 나타남에 따라 쇄내 이황화 결합을 형성하며 그리고 DsbC는 세포의 주변세포질에서 산화적 단백질-접힘 동안 이황화 결합 이소머라아제로서 작용한다.
본원에 사용된 바와 같이, "DsbA"는 또한 주변세포질의 단백질 이황화 이소머라아제 I로서 알려질 수 있다. 예시적 DsbA 단백질은 이. 콜라이 DsbA이다. 이. 콜라이 DsbA의 아미노산 서열은 NCBI 수탁 번호 NP_418297 (서열 번호:1)로 제공되며, 이. 콜라이 dsbA 유전자의 핵산 서열은 NCBI 수탁 번호 NC_000913.3 또는 EcoGene:EG11297 (서열 번호:2)로 제공된다.
본 명세서에서 사용된 바와 같은, "DsbC"는 또한 주변세포질의 단백질 이황화 이소머라아제 II로서 알려질 수 있다. 예시적인 DsbC 단백질은 이. 콜라이 DsbC이다. 이. 콜라이 DsbC의 아미노산 서열은 NCBI 수탁 번호 NP_417369.1 (서열 번호:3)로 제공되며, 이. 콜라이 dsbC 유전자의 핵산 서열은 NCBI 수탁 번호 NC_000913.3 또는 EcoGene:EG11070 (서열 번호:4)로 제공된다.
"샘플"은 더 많은 양의 물질 중 작은 일부분을 지칭한다. 일반적으로, 본 명세서에서 기재된 방법에 따른 시험은 샘플에 대해 수행된다. 샘플은 전형적으로, 예를 들면 또한 본 명세서에서 "생성물 세포주"라고도 언급되는 배양된 재조합 폴리펩티드-발현 세포주 또는 배양된 숙주 세포로부터 수득된 재조합 폴리펩티드 제제으로부터 수득된다. 본 명세서에서 사용된 바와 같은, "숙주세포"는 관심 재조합 폴리펩티드 또는 생성물의 발현을 위한 유전자를 함유하지 않는다. 샘플은, 예를 들면 비제한적으로, 수확된 세포 배양액, 정제 공정의 특정 단계에서의 공정 중 풀 또는 최종 정제된 생성물로부터 수득될 수 있다.
"포획 항체"는 샘플 내 표적 분자에 특이적으로 결합하는 항체를 지칭한다. 특정 조건 하에서, 포획 항체는 표적 분자와 복합체를 형성하며, 이로써 상기 항체-표적 분자 복합체는 상기 샘플의 나머지로부터 분리될 수 있다. 특정 구현예에서, 이러한 분리는 포획 항체에 결합하지 않는 샘플 내 물질 또는 재료를 세정하는 것을 포함할 수 있다. 특정 구현예에서, 포획 항체는 고형 지지체 표면, 예컨대, 예를 들면 비제한적으로, 플레이트 또는 비드에 부착될 수 있다.
"검출 항체"는 샘플 내, 또는 샘플-포획 항체 조합 물질 내 표적 분자에 특이적으로 결합하는 항체를 지칭한다. 특정 조건 하에서, 검출 항체는 표적 분자 또는 표적 분자-포획 항체 복합체와 복합체를 형성한다. 검출 항체는 증폭될 수 있는 표지를 통해 직접적으로 또는 예를 들면, 표지되고 검출 항체에 결합하는 또 다른 항체의 사용을 통해 간접적으로 검출될 수 있다. 직접 표지에 대해, 검출 항체는 전형적으로 예를 들면, 비제한적으로, 바이오틴 또는 루테늄을 포함하는 일부 수단에 의해 검출 가능한 모이어티에 콘주게이트된다.
용어들 "표지" 또는 "검출가능한 표지"는 검출되거나 정량화될 물질, 예를 들면 항체에 연결될 수 있는 임의의 화학적 기 또는 모이어티를 지칭한다. 전형적으로, 표지는 물질의 민감성 검출 또는 정량화에 적합한 검출가능한 표지이다. 검출가능한 표지의 예는, 비제한적으로, 발광성 표지, 예를 들면, 형광, 인광, 화학발광, 생물발광 및 전기화학발광 표지, 방사성 표지, 효소, 입자, 자기 물질, 전기활성 종 등을 포함한다. 대안적으로, 검출가능한 표지는 특이적 결합 반응에 참여함으로써 그 존재를 나타낼 수 있다. 이러한 표지의 예는 합텐, 항체, 바이오틴, 스트렙타비딘, his-태그, 니트릴로트리아세트산, 글루타티온 S-전달효소, 글루타티온 등을 포함한다.
용어 "검출 수단"은 검정에서 그런 다음 판독된 신호보고를 통해 검출가능한 항체의 존재를 검출하는데 사용되는 모이어티 또는 기술을 지칭한다. 전형적으로, 검출 수단은 미세적정 플레이트, 예를 들면, 아비딘 또는 스트렙타비딘-HRP 상에 포획된 표지와 같은 고정화된 표지를 증폭하는 시약을 사용한다.
"광 발광"은 물질이 빛의 물질에 의한 흡수에 이어서 발광하는 과정을 지칭한다 (대안적으로 일명 전자기 방사선). 형광 및 인광은 2개의 상이한 유형의 광 발광이다. "화학 발광" 과정은 화학 반응에 의한 발광성 종의 창출을 포함한다. "전기-화학발광" 또는 "ECL"은 종, 예를 들면, 항체가 적절한 주변 화학 환경에서 전기화학적 에너지에 그 종의 노출에 의해 발광하는 과정이다.
관심 항원, 예를 들면 숙주세포 단백질에 "결합하는" 항체는 항체가 검정 시약으로, 예를 들면, 포획 항체 또는 검출 항체로 유용하도록 충분한 친화도로 항원에 결합하는 것이다. 전형적으로, 그와 같은 항체는 다른 폴리펩티드와 유의미하게 교차-반응하지 않는다.
표적 분자에 폴리펩티드의 결합에 관하여, 특정한 폴리펩티드 또는 특정한 폴리펩티드 표적 상의 에피토프에 "특이적 결합" 또는 "특이적으로 결합한다" 또는 "특이적인"이라는 용어는 비-특이적 상호작용과는 다른 측정가능한 결합을 의미한다. 특이적 결합은 예를 들면, 일반적으로 결합 활성을 갖지 않는 유사한 구조의 분자인 대조군 분자의 결합에 비교된 표적 분자의 결합을 계측함에 의해 측정될 수 있다. 일부 구현예에서 다클론성 항체의 제제는 DsbA 또는 DsbC에 특이적으로 결합한다. 예를 들면, 다클론성 항체 제제 내 적어도 약 99%의 항체가 목적 폴리펩티드 (예컨대, DsbA 또는 DsbC)에 결합한다.
"친화도"는 분자 (예컨대, 항체)의 단일 결합 부위와 그 결합 파트너 (예컨대, 항원) 사이의 비공유 상호작용의 총계의 강도를 지칭한다. 다르게 명시되지 않으면, 본원에서 사용된 바와 같이, "결합 친화도"는 결합 쌍 (예컨대, 항체 및 항원)의 구성원 사이의 1:1 상호작용을 반영하는 고유 결합 친화도를 지칭한다. 그 파트너 Y에 대한 분자 X의 친화도는 일반적으로 해리 상수 (Kd)로 나타낼 수 있다. 친화성은 본원에서 기재된 것을 포함하여 당해분야에서 공지된 공통의 방법으로 측정될 수 있다.
본 명세서의 목적상 "활성인" 또는 "활성"은 천연 또는 천연 발생 폴리펩티드의 생물학적 및/또는 면역학적 활성을 보유하는 폴리펩티드의 형태(들)을 지칭하고, 여기서 "생물학적" 활성은 천연 또는 천연 발생 폴리펩티드에 의해 보유된 항원성 에피토프에 대한 항체의 생산을 유도하는 능력 이외의 천연 또는 천연 발생 폴리펩티드에 의해 야기된 생물학적 작용 (저해 또는 자극 중 어느 하나)을 지칭하고 "면역학적" 활성은 천연 또는 천연 발생 폴리펩티드에 의해 보유된 항원성 에피토프에 대한 항체의 생산을 유도하는 능력을 지칭한다.
용어 “길항제”는 가장 광범위한 의미로 사용되고, 천연 폴리펩티드의 생물학적 활성을 부분적으로 또는 완전하게 차단, 억제, 또는 중화하는 임의의 분자를 포함한다. 유사한 방식으로, 용어 “효능제”는 가장 광범위한 의미로 사용되고, 천연 폴리펩티드의 생물학적 활성을 모방하는 임의의 분자를 포함한다. 적합한 효능제 또는 길항제 분자는 특히 하기를 포함한다: 천연 폴리펩티드 등의 효능제 또는 길항제 항체 또는 항체 단편, 단편 또는 아미노산 서열 변이체. 효능제 또는 길항제를 식별하는 방법은 하기를 포함할 수 있다: 폴리펩티드를 후보 효능제 또는 길항제 분자와 접촉시키는 단계 및 상기 폴리펩티드와 정상적으로 연관된 하나 이상의 생물학적 활성의 검출가능한 변화를 측정하는 단계.
본 명세서에서 용어 "항체"는 가장 넓은 의미로 사용되고 구체적으로 단클론성 항체, 다클론성 항체, 적어도 2종의 무손상 항체로부터 형성된 다중특이적 항체 (예컨대 이중특이적 항체), 및 이들이 목적 생물학적 활성을 나타내는 한 항체 단편을 포함한다. 용어 "면역글로불린" (Ig)는 본원에서 "항체"와 상호교환적으로 사용된다.
항체는 전부 면역글로불린 접힘을 기반으로 가변 구조를 갖는 천연 발생 면역글로불린 분자이다. 예를 들면, IgG 항체는 작용적 항체를 형성하도록 이황화-결합된 2개의 "중" 쇄 및 2개의 "경" 쇄를 갖는다. 각 중쇄 및 경쇄 자체는 "상수"(C) 및 "가변"(V) 영역을 포함한다. V 영역은 항체의 항원 결합 특이성을 결정하는 반면, C 영역은 면역 효과기와 비-항원-특이적 상호작용에서 구조적 지지 및 작용을 제공한다. 항체의 항원 결합 특이성 또는 항체의 항원-결합 단편은 특정한 항원에 특이적으로 결합하는 항체의 능력이다.
항체의 항원 결합 특이성은 V 영역의 구조적 특징에 의해 계측된다. 가변성은 가변 도메인의 110-아미노산 범위에 걸쳐 고르게 분포되지 않는다. 대신에, V 영역은 각각 9-12 아미노산 길이인 "초가변성 영역"이라 불리는 극단적인 가변성의 짧은 영역에 의해 분리된 15-30 아미노산의 프레임워크 영역 (FR)으로 불리는 상대적으로 불변의 뻗기로 구성된다. 천연 중쇄 및 경쇄의 가변 도메인 각각은 3개의 초가변성 영역에 의해 연결된, 크게는 β-시트 입체배치를 채택한 4개의 FR을 포함하여, β-시트 구조를 연결하고, 그리고 일부 경우에는 β-시트 구조의 일부를 형성하는 루프를 형성한다. 각 쇄의 초가변성 영역은 FR에 의해 근접하여 함께 유지되고, 그리고 다른 쇄로부터의 초가변성 영역과 함께 항체의 항원-결합 부위의 형성에 기여한다 (참고: Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). 불변 도메인은 항원에 항체에 결합하는 것에 직접적으로 관여하지는 않지만, 항체 의존성 세포 독성 (ADCC)에서의 항체의 참여와 같은 다양한 효과기 작용을 나타낸다.
각 V 영역은 전형적으로 3개의 상보성 결정 영역 ("CDR", 각각은 "초가변성 루프"를 포함함) 및 4개의 프레임워크 영역을 포함한다. 특정한 목적 항원에 실질적인 친화도로 결합하는데 요구되는 최소 구조 단위인 항체 결합 부위는 따라서 전형적으로 적절한 형태로 CDR을 보유하고 존재하도록 그 사이에 산재된 3개의 CDR, 및 적어도 3개, 바람직하게는 4개의 프레임워크 영역을 포함할 것이다. 고전적 4개의 쇄 항체는 협력하여 VH 및 VL 도메인에 의해 정의되는 항원 결합 부위를 갖는다. 낙타(camel) 및 상어(shark) 항체와 같은 특정 항체는 경쇄가 없고 중쇄에 의해서만 형성된 결합 부위에 의존한다. 단일 도메인으로 가공된 면역글로불린은 VH 와 VL 사이의 협력의 부재로 중쇄 또는 경쇄 단독으로 결합 부위가 형성되어 제조될 수 있다.
용어 "가변"은 가변 도메인의 특정 부분이 항체 중에 서열에서 광범위하게 상이하고 그리고 이의 특정한 항원에 대한 각각의 특정한 항체의 결합 및 특이성에서 사용된다는 사실을 지칭한다. 그러나, 가변성은 항체의 가변 도메인 전체를 통해 고르게 분포되어 있지 않다. 그것은 경쇄 및 중쇄 가변 도메인에서 모두 초가변성 영역으로 불리는 3개의 분절에 집중되어 있다. 가변 도메인의 더 고도로 보존 된 부분은 프레임워크 영역 (FR)이라고 불린다. 천연 중쇄 및 경쇄의 가변 도메인 각각은 3개의 초가변성 영역에 의해 연결된, 크게는 β-시트 입체배치를 채택한 4개의 FR을 포함하여, β-시트 구조를 연결하고, 그리고 일부 경우에는 β-시트 구조의 일부를 형성하는 루프를 형성한다. 각 쇄의 초가변성 영역은 FR에 의해 근접하여 함께 유지되고, 그리고 다른 쇄로부터의 초가변성 영역과 함께 항체의 항원-결합 부위의 형성에 기여한다 (참고: Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). 불변 도메인은 항원에 항체에 결합하는 것에 직접적으로 관여하지는 않지만, 항체 의존성 세포 독성 (ADCC)에서의 항체의 참여와 같은 다양한 효과기 작용을 나타낸다.
본 명세서에서 사용될 때 용어 "초가변성 영역"은 항원-결합을 담당하는 항체의 아미노산 잔기를 언급한다. 초가변성 영역은 하기를 포함할 수 있다: "상보성 결정 영역" 또는 "CDR” 유래의 아미노산 잔기 (예컨대, VL 내에 대략 약 잔기 24-34 (L1), 50-56 (L2) 및 89-97 (L3), 및 VH 내에 대략 약 31-35B (H1), 50-65 (H2) 및 95-102 (H3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) 및/또는 "초가변성 루프” 유래의 이들 잔기 (예컨대 VL 내 잔기 26-32 (L1), 50-52 (L2) 및 91-96 (L3), 및 VH 내 26-32 (H1), 52A-55 (H2) 및 96-101 (H3) (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)).
“프레임워크” 또는 “FR” 잔기들은 본원에 정의된 바와 같이 초가변 영역 잔기들 이외의 다른 가변 도메인 잔기들이다.
항체 또는 절반-항체의 맥락에서, "힌지 영역"은 일반적으로 인간 IgG1의 Glu216로부터 Pro230까지 연신되는 것으로 정의된다 (Burton, Molec . Immunol.22:161-206 (1985)). 다른 IgG 이소형의 힌지 영역이 중쇄간 S-S 결합을 형성하는 첫 번째와 마지막 시스테인 잔기를 동일한 위치 내에 배치함으로써 IgG1 서열과 함께 정렬될 수 있다.
Fc 영역의 "보다 낮은 힌지 영역"은 잔기가 C-말단으로부터 힌지 영역으로 바로 연신되는, 즉 Fc 영역의 잔기 233으로부터 239까지 연신되는 것으로 일반적으로 정의된다. 본 발명에 앞서, FcγR 결합은 일반적으로 IgG Fc 영역의 보다 낮은 힌지 영역 내의 아미노산 잔기로 인하여 발생한다.
인간 IgG Fc 영역의 "CH2 도메인"은 보통, IgG의 잔기 약 231로부터 약 340까지 연신된다. CH2 도메인은 다른 도메인과 밀접하게 쌍을 이루지 않는 독특한 것이다. 오히려, 2개의 N-연결된 분지형 탄수화물 쇄가 손상되지 않은 천연 IgG 분자의 2개의 CH2 도메인 사이에 개재되어 있다. 탄수화물은 도메인-도메인 쌍형성을 위한 치환체를 제공하고, CH2 도메인을 안정화하는데 도움을 줄 수 있는 것으로 고려된다. Burton, Molec. Immunol.22:161-206 (1985).
"CH3 도메인"은, Fc 영역 내 잔기 C-말단으로부터 CH2 도메인으로의 연신 (즉, IgG의 아미노산 잔기 약 341로부터 아미노산 잔기 약 447까지)을 포함한다.
"항체 단편"은 바람직하게는 이들의 항원-결합 영역을 포함하는 무손상 항체의 일부를 포함한다. 항체 단편의 예는 Fab, Fab', F(ab')2, 및 Fv 단편; 디아바디; 탠덤 디아바디 (taDb), 선형 항체(예컨대, 미국 특허 번호 5,641,870, 실시예 2; Zapata et al., Protein Eng. 8(10):1057-1062 (1995)); 단일-아암 항체, 단일 가변 도메인 항체, 미니바디, 단일-쇄 항체 분자; 항체 단편으로부터 형성된 다중특이적 항체 (예컨대, 비제한적으로, Db-Fc, taDb-Fc, taDb-CH3, (scFV)4-Fc, di-scFv, bi-scFv, 또는 탠덤 (di,tri)-scFv를 포함함); 및 이중특이적 T-세포 연관체 (BiTE)를 포함한다.
항체의 파파인 소화는 "Fab" 단편으로 불리는 2개의 동일한 항원 결합 단편을 생산하고, 그리고 쉽게 결정화하는 능력을 반영하는 명칭인 잔여 "Fc" 단편을 생산한다. Fab 단편은 하기에 따른 전체 L 쇄로 구성된다: H 쇄의 가변 영역 도메인 (VH), 및 일 중쇄의 제1 불변 도메인 (CH1). 항체의 펩신 처리는 단일의 큰 F(ab')2 단편을 산출하고, 이는 일상적으로 2가 항원-결합 활성을 갖는 2개의 이황화 연결된 Fab 단편에 상응하고, 여전히 항원과 가교결합할 수 있다. Fab' 단편은 항체-힌지 영역으로부터의 하나 이상의 시스테인을 포함하는 중쇄 CH1 도메인의 카르복시 말단에서 추가의 소수 잔기를 가짐에 의하여 Fab 단편과 상이하다. Fab'-SH는 불변 도메인의 시스테인 잔기(들)가 자유 티올 그룹을 보유하는 Fab'에 대해 본원에서 지정된다. F(ab')2 항체 단편은 본래 그들 사이에 힌지 시스테인을 갖는 Fab' 단편의 쌍으로서 생성되었다. 항체 단편의 다른 화학적 커플링이 또한 공지되어있다.
"Fv"는 완벽한 항원-인식 및 항원-결합 부위를 함유하는 최소 항체 단편이다. 이 영역은 단단하고 비-공유 회합으로 하나의 중쇄 및 하나의 경쇄 가변 도메인의 이량체로 구성된다. VH-VL 이량체의 표면에 항원-결합 부위를 정의하기 위해 각 가변 도메인의 3개의 초가변성 영역이 상호 작용하는 것이 이 입체배치에 있다. 종합적으로, 6개의 초가변성 영역은 항체에 항원-결합 특이성을 부여한다. 그러나 단일 가변 도메인 (또는 항원에 특이적인 단지 3개의 초가변성 영역만을 포함하는 Fv의 절반)조차도, 비록 전체 결합 부위보다 낮은 친화도로 이지만, 항원을 인식하고 결합하는 능력을 갖는다.
Fab 단편은 또한 경쇄의 불변 도메인 및 중쇄의 제1 불변 도메인 (CH1)을 함유한다. Fab' 단편은 항체 힌지 영역으로부터 하나 이상의 시스테인을 포함하는 중쇄 CH1 도메인의 카르복시 말단에서 몇 개의 잔기를 첨가함으로써 Fab 단편과 상이하다. Fab'-SH는 불변 도메인의 시스테인 잔기(들)가 적어도 1종의 유리 티올 기를 갖는 Fab'에 대한 본 명세서에서의 지정이다. F(ab')2 항체 단편은 본래 이들 사이에 힌지 시스테인을 갖는 Fab' 단편의 쌍으로서 생산되었다. 항체 단편의 다른 화학적 커플링이 또한 공지되어있다.
임의의 척추동물 종으로부터의 항체(면역글로불린) "경쇄"는 이의 불변 도메인의 아미노산 서열에 기반하여, 카파(κ) 및 람다(λ)로 불리는 2개의 명확히 구별되는 유형 중 하나에 배정될 수 있다.
이의 중쇄의 불변 도메인의 아미노산 서열에 따라, 항체가 상이한 "부류"에 배정될 수 있다. 하기 5개 주요 부류의 항체가 있다: IgA, IgD, IgE, IgG, 및 IgM (이들 중 몇몇은 하위부류(이소형), 예를 들면 IgG1, IgG2, IgG3, IgG4, IgA, 및 IgA2 로 추가 구분될 수 있음). 항체의 상이한 부류에 상응하는 중쇄 불변 도메인은 각각 α, δ, ε, γ, 및 μ로 지칭된다. 면역글로불린의 상이한 부류의 하부단위 구조 및 3차원 입체배치가 잘 알려져 있다.
"단일-쇄 Fv" 또는 "scFv" 항체 단편은 항체의 VH 및 VL 도메인을 포함하고, 여기서 이들 도메인은 단일 폴리펩티드 쇄에 존재한다. 일부 구현예에서, Fv 폴리펩티드는 VH와 VL 도메인 사이에 폴리펩티드 링커를 더욱 포함하는데, 이것은 scFv가 항원 결합을 위한 목적 구조를 형성할 수 있게 한다. sFv의 재고를 위해, 하기를 참고한다: in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
용어 "디아바디"는 2개의 항원-결합 부위를 갖는 작은 항체 단편을 나타내며, 이 단편은 동일한 폴리펩티드 쇄(VH - VL)에서 경쇄 가변 도메인(VL)에 연결된 중쇄 가변 도메인(VH)을 포함한다. 동일한 쇄 상에서 2개의 도메인 간 쌍형성을 허용하기에는 너무 짧은 링커를 이용함으로써, 도메인은 또 하나의 쇄의 상보적 도메인과 쌍을 이루고 2개의 항원-결합 부위를 생성하도록 유도된다. 디아바디는 하기에 더욱 충분히 기술된다: 예를 들면, EP 404,097; WO 93/11161; 및 Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
용어 "다중특이적 항체"는 가장 넓은 의미로 사용되며, 특히 폴리에피토프 특이성을 갖는 항체를 포괄한다. 그러한 다중특이적 항체는 비제한적으로 중쇄 가변 도메인 (VH)및 경쇄 가변 도메인 (VL)을 포함하고, 여기서 VH VL 단위는 하기를 갖는다: 폴리에피토프 특이성, 2개 이상의 VL 및 VH 도메인을 갖는 항체 (상이한 에피토프에 결합하는 각각의 VH VL 단위를 가짐), 2개 이상의 단일 가변 도메인을 갖는 항체 (상이한 에피토프에 결합하는 각각의 단일 가변 도메인을 가짐), 전장 항체, 항체 단편 (예컨대 Fab, Fv, dsFv, scFv, 디아바디, 트리아바디, 3작용성 항체), 공유적이거나 비-공유적으로 연결된 항체 단편. "다중에피토프 특이성"은 동일하거나 상이한 표적(들)상에 2개 이상의 상이한 에피토프에 특이적으로 결합하는 능력을 지칭한다. "단일 특이적"은 단지의 하나의 에피토프에 결합하는 능력을 언급한다. 일 구현예에 따라서, 다중특이적 항체는 5 μM 내지 0.001 pM, 3 μM 내지 0.001 pM, 1 μM 내지 0.001 pM, 0.5 μM 내지 0.001 pM, 또는 0.1 μM 내지 0.001 pM의 친화도로 각 에피토프에 결합하는 IgG 항체이다.
표현 "단일 도메인 항체" (sdAbs) 또는 "단일 가변 도메인 (SVD) 항체"는 일반적으로 단일 가변 도메인 (VH 또는 VL)이 항원 결합을 부여할 수 있는 항체를 지칭한다. 환언하면, 단일 가변 도메인은 표적 항원을 인식하기 위해 또 다른 가변 도메인과 상호작용할 필요가 없다. 단일 도메인 항체의 예는 낙타과 (라마 및 낙타) 및 연골 어류 (예컨대, 수염 상어) 및 인간과 마우스 항체로부터 재조합 방법으로 유도된 것들을 포함한다 (Nature (1989) 341:544-546; Dev Comp Immunol (2006) 30:43-56; Trend Biochem Sci (2001) 26:230-235; Trends Biotechnol (2003):21:484-490; WO 2005/035572; WO 03/035694; FEBS Lett (1994) 339:285-290; WO00/29004; WO 02/051870).
본원에 사용된 바와 같이, 용어 "단클론성 항체"는 실질적으로 균질 항체의 집단으로부터 수득된 항체를 지칭하며, 즉, 상기 집단을 포함하는 개별 항체는, 단클론성 항체의 생산 동안 발생할 수 있는 가능한 변이체 항체 (상기 변이체는 일반적으로 소량으로 존재한다)를 제외하고, 동일하고/하거나 동일한 에피토프에 결합한다. 전형적으로 상이한 결정인자 (에피토프)에 관련된 상이한 항체를 포함하는 다클론성 항체 제조와 대조되게, 각각의 단클론성 항체는 항원에서 단일 결정인자에 관련된다. 이들의 특이성에 첨가하여, 단클론성 항체는 이들이 다른 면역글로불린에 의해 오염되지 않는다는 점에서 유리하다. 수식어 "단클론성"은 실질적으로 균질 한 항체 집단으로부터 수득된 것으로서의 항체의 특성을 나타내며, 임의의 특정 방법에 의한 항체의 생산을 요하는 것으로서 해석되지 않아야 한다. 예를 들어, 본원에 제공된 방법에 따라 사용되는 단일클론 항체는 우선 하기에 의해 기재된 하이브리도마 세포 방법에 의해 제조될 수 있거나, 재조합 DNA 방법(예를 들어, 미국 특허 제4,816,567호 참조)에 의해 제조될 수 있다: Kohler et al., Nature 256:495 (1975). 단클론성 항체는 또한 예를 들면 하기에 기재된 기술을 사용하여 파아지 항체 라이브러리로부터 단리될 수 있다: Clackson et al., Nature 352:624-628 (1991) 및 Marks et al., J. Mol. Biol. 222:581-597 (1991).
본원의 단클론성 항체는 구체적으로 "키메라" 항체(면역글로불린)을 포함하고, 여기서, 중쇄 및/또는 경쇄 부분은 특정 종으로부터 유래된 항체에서 상응하는 서열과 동일하거나 이에 상동성이거나 특정 항체 부류 또는 하위부류에 속하고, 쇄(들)의 나머지는 또 다른 종으로부터 유래된 항체에서 상응하는 서열과 동일하거나 상동성이거나 이들이 목적하는 생물학적 활성을 나타내는 한 상기 항체의 단편 뿐만 아니라 또 다른 항체 부류 또는 하위부류에 속한다(미국 특허 번호 4,816,567; Morrison et al., Proc . Natl . Acad . Sci . USA 81:6851-6855 (1984)). 본 명세서에서 관심 키메라성 항체는 비-인간 영장류 (예컨대 구대륙 원숭이, 예컨대 개코원숭이, 레수스 또는 시노몰구스 원숭이)로부터 유도된 가변 도메인 항원-결합 서열 및 인간 불변 영역 서열을 포함하는 "영장류화된" 항체를 포함한다 (미국 특허번호 5,693,780).
비인간 (예를 들어, 뮤린) 항체의 "인간화된" 형태는 비인간 면역글로불린으로부터 유래하는 최소 서열을 함유하는 키메라 항체이다. 대개, 인간화된 항체는 수령체의 초가변성 영역으로부터의 잔기가 목적 특이성, 친화도, 및 수용력을 가지는 비-인간 종 (공여체 항체) 예컨대 마우스, 랫트, 토끼 또는 비인간 영장류의 초가변성 영역으로부터의 잔기로 대체된 인간 면역글로불린 (수령체 항체)이다. 일부 예에서, 인간 면역글로불린의 프레임워크 영역 (FR) 잔기는 상응하는 비-인간 잔기로 대체된다. 더욱이, 인간화된 항체는 수령체 항체에서 또는 공여체 항체에서 발견되지 않는 잔기를 포함할 수 있다. 이들 변형은 항체 성능을 더욱 개선하기 위해 만들어졌다. 일반적으로, 인간화된 항체는 실질적으로 적어도 하나, 그리고 전형적으로는 2개의 모든 가변 도메인을 포함할 것이며, 모든 또는 실질적으로 모든 초가변성 루프는 비-인간 면역글로불린의 것과 상응하고 모든 또는 실질적으로 모든 FR은 인간 면역글로불린 서열의 것들이다 (상기 주지된 FR 치환(들) 제외). 인간화된 항체는 임의로 또한 면역글로불린 불변 영역의 적어도 일부, 전형적으로 인간 면역글로불린의 부분을 포함할 것이다. 추가 세부사항에 대해서는, 하기를 참고한다: Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); and Presta, Curr . Op. Struct . Biol . 2:593-596 (1992).
본 명세서에서의 목적상, "무손상 항체"는 중쇄 및 경쇄 가변 도메인 뿐만 아니라 Fc 영역을 포함하는 것이다. 불변 도메인은 천연 서열 불변 도메인 (예컨대, 인간 천연 서열 불변 도메인) 또는 이의 아미노산 서열 변이체일 수 있다. 바람직하게는, 무손상 항체는 하나 이상의 효과기 작용을 가진다.
"천연 항체"는 보통 2개의 동일한 경 (L) 쇄 및 2개의 동일한 중 (H) 쇄로 구성된, 약 150,000 달톤의 이종사량체 당단백질이다. 각 경쇄는 하나의 공유 이황화 결합에 의해 중쇄에 연결되고, 반면 이황화 연결기의 수는 상이한 면역글로불린 이소형의 중쇄 중에서 가변한다. 각 중쇄 및 경쇄는 또한 규칙적으로 이격된 쇄내 이황화 가교를 가진다. 각 중쇄는 하나의 말단에 가변 도메인 (VH)과 그 다음 수많은 불변 도메인을 가진다. 각각의 경쇄는 하나의 말단에 가변 도메인(VL)을 그리고 그 다른 말단에 불변 도메인을 갖는다; 경쇄의 불변 도메인은 중쇄의 제1 불변 도메인과 정렬되며, 경쇄 가변 도메인은 중쇄의 가변 도메인과 정렬된다. 특정한 아미노산 잔기가 경쇄 및 중쇄 가변 도메인 간 계면을 형성하는 것으로 여겨진다.
"네이키드(naked) 항체” (본원에 정의됨)는 이종성 분자, 예컨대 세포독성 모이어티 또는 방사성 표지에 콘주게이트되지 않은 항체이다.
본원에서 사용된 바와 같이, 용어 "면역접합체(immunoadhesin)"는 이종성 단백질 ("콘주게이트")의 결합 특이성을 면역글로불린 불변 도메인의 효과기 작용과 조합하는 분자를 가리킨다. 구조적으로, 면역접합체는 목적 결합 특이성을 갖는 아미노산 서열의 융합을 포함하고, 이의 아미노산은 항체의 항원 인식 및 결합 부위 (즉, 항체의 불변 영역과 비교하여 "이종성"임) 및 면역글로불린 불변 도메인 서열 (예를 들어, IgG의 CH2 및/또는 CH3 서열) 이외의 것이다. 예시적인 콘주게이트 서열은 관심 단백질에 결합하는 수용체 또는 리간드의 부분을 포함하는 인접 아미노산 서열을 포함한다. 콘주게이트 서열은 또한 관심 단백질에 결합하는 서열일 수 있으나, 수용체 또는 리간드 서열 (예를 들어, 펩티바디 내 콘주게이트 서열)이 아니다. 그러한 폴리펩티드 서열은 파지 디스플레이 기술 및 높은 처리율 분류 방법을 포함한 다양한 방법에 의하여 선택 및 식별될 수 있다. 면역접합체 내의 면역글로불린 불변 도메인 서열은 임의의 면역글로불린, 예컨대 IgG-1, IgG-2, IgG-3, 또는 IgG-4 하위유형, IgA (IgA-1 및 IgA-2 포함), IgE, IgD, 또는 IgM으로부터 수득될 수 있다.
일부 구현예에서, 항체 "효과기 작용"은 항체의 Fc 영역 (천연 서열 Fc 영역 또는 아미노산 서열 변이체 Fc 영역)에 기인하는 이들 생물학적 활성을 지칭하고, 항체 이소형에 따라 다변한다. 항체 효과기 작용의 실례에는 하기가 포함된다: C1q 결합 및 보체 의존적 세포독성; Fc 수용체 결합; 항체-의존적 세포-매개된 세포독성 (ADCC); 식균작용; 세포 표면 수용체의 하향 조절.
"보체 의존적 세포독성" 또는 "CDC"는 보체의 존재하에 표적을 용해시키는 분자의 능력을 지칭한다. 보체 활성화 경로는 동족 항원으로 복합된 분자 (예컨대 폴리펩티드 (예컨대, 항체))에 대한 보체계 (C1q)의 제1 성분의 결합에 의해 개시된다. 보체 활성화를 평가하기 위해, 예를 들면 하기에 기술된 CDC 분석이 수행될 수 있다: Gazzano-Santoro et al., J. Immunol . Methods 202:163 (1996).
"항체-의존적 세포-매개된 세포독성" 및 "ADCC"는 Fc 수용체 (FcR) (예컨대 자연 살해 (NK) 세포, 호중구, 및 대식세포)를 발현하는 비특이적 세포독성 세포가 표적 세포에서 결합된 항체를 인식하고 그리고 차후에 표적 세포의 용해를 유발하는 세포-매개된 반응을 언급한다. ADCC를 매개하기 위한 주요 세포인 NK 세포는 FcγRIII만을 발현하는 반면, 단핵구는 FcγRI, FcγRII 및 FcγRIII을 발현한다. 조혈 세포상의 FcR 발현은 다음 문헌의 464 페이지 상의 표 3에 요약되어 있다: Ravetch and Kinet, Annu . Rev. Immunol 9:457-92 (1991). 해당 분자의 ADCC 활성을 평가하기 위해, 예컨대 미국 특허 번호 5,500,362 또는 5,821,337에 기재된, 시험 관내 ADCC 검정이 수행될 수 있다. 이러한 검정을 위한 유용한 효과기 세포는 말초 혈액 단핵 세포 (PBMC) 및 자연 살해 (NK) 세포를 포함한다. 대안적으로, 또는 첨가적으로, 해당 분자의 ADCC 활성은 하기와 같이 생체내 평가된다: 예를 들면, 하기에 기술된 바와 같은 동물 모델: Clynes et al., Proc . Natl . Acad . Sci . (USA) 95:652-656 (1998).
"인간 효과기 세포"는 하나 이상의 FcRs을 발현하고 효과기 작용을 수행하는 백혈구이다. 일부 구현예에서, 세포는 적어도 FcγRIII을 발현시키고 ADCC 효과기 작용(들)을 수행한다. ADCC를 매개하는 인간 백혈구의 예에는 말초 혈액 단핵구(PBMC), 자연 살해(NK) 세포, 단핵구, 세포독성 T 세포 및 호중구가 포함되며; PBMCs 및 NK 세포가 바람직하다.
용어 "Fc 수용체" 또는 "FcR"은 항체의 Fc 영역에 결합하는 수용체를 설명하기 위해 사용된다. 일부 구현예에서, FcR은 천연 서열 인간 FcR이다. 게다가, 바람직한 FcR은 IgG 항체 (감마 수용체)에 결합하는 것이고 그리고, 대립유전자 변이체 및 대안적으로 이들 수용체의 스플라이스된 형태를 포함하여, FcγRI, FcγRII, 및 FcγRIII 하위부류의 수용체를 포함한다. FcγRII 수용체는 FcγRIIA (“활성화 수용체”) 및 FcγRIIB (“억제 수용체”)를 포함하고, 이는 이의 세포질 도메인 내에서 주로 상이한 유사한 아미노산 서열을 갖는다. 활성화 수용체 FcγRIIA는 그 세포질 도메인에 면역수용체 티로신-기반 활성화 모티프(ITAM)를 함유한다. 억제 수용체 FcγRIIB는 그 세포질 도메인에 면역수용체 티로신계 억제 모티프(ITIM)를 함유한다. (참고: , Annu . Rev. Immunol . 15:203-234 (1997)). FcR은 하기에 검토된다: Ravetch and Kinet, Annu . Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); 및 de Haas et al., J. Lab. Clin . Med. 126:330-41 (1995). 향후 식별될 것들을 포함하는 다른 FcR이 본원에서 용어 "FcR"에 포괄된다. 상기 용어에는 또한 신생아 수용체, FcRn이 포함되며, 이는 모계 IgGs의 태아로의 전달에 관여한다(Guyer et al., J. Immunol. 117:587 (1976) and Kim et al., J. Immunol. 24:249 (1994)).
용어 “숙주 세포”, “숙주 세포주” 및 “숙주 세포 배양물”은 상호교환적으로 사용되고 상기 세포의 후손을 포함하는, 외인성 핵산이 도입된 세포를 지칭한다. 숙주 세포는 1차 형질전환된 세포 및 계대 횟수와 상관없이 이로부터 유래된 후손을 포함하는 ”형질전환체” 및 “형질전환된 세포”를 포함한다. 자손은 핵산 함량에 있어서 모 세포와 완전히 동일하지 않을 수 있지만, 돌연변이를 함유할 수 있다. 원래 형질전환된 세포에 대해 선별되거나 선택된 바와 동일한 작용 또는 생물학적 활성을 갖는 돌연변이 자손이 본원에 포함된다.
본 명세서에서 사용된 바와 같이 용어 "불순물"은 목적 폴리펩티드 생성물과 상이한 물질 또는 재료를 지칭한다. 불순물은 비제한적으로: 숙주 세포 물질, 예컨대 이. 콜라이 숙주세포 단백질 (ECP); 침출된 단백질 A; 핵산; 목적 폴리펩티드의 변이체, 단편, 응집물 또는 유도체; 또 다른 폴리펩티드; 내독소; 바이러스 오염물질; 세포 배양 배지 성분, 등을 포함한다. 일부 예에서, 불순물은 예를 들면 비제한적으로, 박테리아 세포 예컨대 이. 콜라이 세포 (예컨대, ECP)로부터 숙주세포 단백질 (HCP)일 수 있다. 일부 구현예에서, 불순물은 자른 DsbA 또는 DsbC 및/또는 DsbA 또는 DsbC의 응집물일 수 있다.
"단리된" 핵산은 그 자연 환경의 성분으로부터 분리되는 핵산 분자를 지칭한다. 단리된 핵산은 핵산 분자를 원래 함유하는 세포에 함유된 핵산 분자를 포함하지만, 핵산 분자는 염색체외에 또는 이의 자연 염색체 위치와는 다른 염색체 위치에 존재한다.
표준 폴리펩티드 서열과 관련하여 “퍼센트 (%) 아미노산 서열 동일성”은 서열을 정렬하고 필요한 경우 최대 퍼센트 서열 동일성을 성취하기 위해 갭을 도입한 후 표준 폴리펩티드 서열내 아미노산 잔기와 동일한 후보 서열에서의 아미노산 잔기의 %로서 정의되고 서열 동일성의 일부로서 임의의 보존성 치환을 고려하지 않는다. 아미노산 서열 동일성 퍼센트를 계측하기 위한 목적으로의 정렬은, 예를 들면, BLAST, BLAST-2, ALIGN 또는 Megalign (DNASTAR) 소프트웨어와 같은 공개적으로 이용 가능한 컴퓨터 소프트웨어를 사용하여 당업계의 재량 내에 있는 다양한 방식으로 달성될 수 있다. 당업계의 숙련가들은 비교되는 서열의 전체 길이에 걸쳐 최대의 정렬을 달성하는데 필요한 알고리즘을 포함하여, 서열을 정렬하기 위한 적합한 파라미터를 결정할 수 있다. 특정 구현예에서, 본원의 목적을 위해, % 아미노산 서열 상동성 값은 서열 비교 컴퓨터 프로그램 ALIGN-2를 사용하여 생성된다. ALIGN-2 서열 비교 컴퓨터 프로그램은 제조사 (Genentech, Inc.)에 의해 개발되었고, 소스 코드는 사용자 기록문서와 함께 하기와 같이 제출되었다: 미국 저작권 청, 워싱턴 D.C., 20559, 하기 하에서 등록됨: 미국 저작권 등록 번호 TXU510087. ALIGN-2 프로그램은 캘리포니아주 사우스 샌 프란시스코에 소재하는 Genentech, Inc.로부터 공개적으로 이용 가능하거나, 또는 소스 코드로부터 편집될 수 있다. ALIGN-2 프로그램은 디지털 UNIX V4.0D를 포함한 UNIX 운영 체제에서 사용하기 위해 편집되어야 한다. 모든 서열 비교 매개변수는 ALIGN-2 프로그램에 의해 설정되어 바뀌지 않는다.
ALIGN-2가 아미노산 서열 비교에 사용되는 상황에서, 소정의 아미노산 서열 A 내지, 및, 또는 소정의 아미노산 서열 B(이것은 소정의 아미노산 서열 B에 대해 특정의 아미노산 서열 동일성 %를 갖거나 포함하는 소정의 아미노산 서열 A로서 표현될 수 있음)의 아미노산 서열 동일성 %는 다음과 같이 산출된다:
분수 X/Y의 100배
여기서, X는 A 및 B의 프로그램 정렬에서 서열 정렬 프로그램 ALIGN-2에 의한 동일한 매치로서 스코어되는 아미노산 잔기의 수이고 Y는 B에서 아미노산 잔기의 총 수이다. 아미노산 서열 A의 길이가 아미노산 서열 B의 길이와 동일하지 않은 경우, A 대 B의 % 아미노산서열 동일성은 B 대 A의 % 아미노산 서열 동일성은 동일하지 않음을 인식할 것이다. 달리 구체적으로 기재하지 않은 경우, 본원에 사용된 모든 % 아미노산 서열 동일성 값은 ALIGN-2 컴퓨터 프로그램을 사용하여 바로 직전의 문단에 기재된 바와 같이 수득한다.
용어 "가변 영역" 또는 "가변 도메인"은 항체를 항원에 결합시키는데 관여하는 항체 중쇄 또는 경쇄의 도메인을 나타낸다. 천연 항체의 중쇄 및 경쇄 (각각 VH 및 VL)의 가변 도메인은 일반적으로 유사한 구조를 갖고, 각각의 도메인은 4개의 보존된 프레임워크 영역(FR) 및 3개의 초가변 영역(HVR)을 포함한다. (예컨대, 참고: Kindt et al., Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)). 단일 VH 또는 VL 도메인은 항원 결합 특이성을 부여하기에 충분할 수 있다. 더욱이, 특정 항원에 결합하는 항체는 항원에 결합하여 각각 상보성 VL 또는 VH 도메인의 라이브러리를 선별하는 항체로부터 VH 또는 VL 도메인을 사용하여 단리될 수 있다. 참고: 예를 들면, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
본원에 사용된 바와 같은 용어 “벡터”는 이것이 연결된 또 다른 핵산을 증가시킬 수 있는 핵산 분자를 언급한다. 용어는 자가-복제 핵산 구조로서의 벡터 뿐만 아니라 이것이 도입되는 숙주 세포의 게놈에 삽입되는 벡터를 포함한다. 특정 벡터는 이들이 작동적으로 연결되는 핵산의 발현을 지시할 수 있다. 상기 벡터는 본원에서 "발현 벡터"로서 지칭된다.
크로마토그래피에 관해 본 명세서에서 사용된 바와 같은 용어 "순차적인"은 제1 크로마토그래피 그 다음 제2 크로마토그래피를 갖는 것을 지칭한다. 추가의 단계는 제1 크로마토그래피와 제2 크로마토그래피 사이에 포함될 수 있다.
크로마토그래피에 관해 본 명세서에서 사용된 바와 같은 용어 "연속적인"은 제1 크로마토그래피 그 다음 제2 크로마토그래피를, 직접적으로 연결하여, 또는 상기 2개 크로마토그래피 물질 사이의 연속적 유동을 가능케하는 일부 기타 기전으로 갖는 것을 지칭한다.
"부하 밀도"는 크로마토그래피 물질의 용적, 예를 들면 리터와 접촉하는 조성물의 양, 예를 들면 그램을 지칭한다. 일부 예에서, 부하 밀도는 g/L로 표시된다.
본원에서 "약" 값 또는 파라미터에 대한 지칭은 상기 값 또는 파라미터 그 자체에 관한 변이를 포함한다 (그리고 기재한다). 예를 들면, "약 X"를 언급하는 기술은 "X"의 언급을 포함한다.
본 명세서에서 그리고 첨부되는 청구범위에서, 단수 형태는 달리 명확하게 표시되지 않는 한 복수의 대상을 포함한다. 본원에 기재된 발명의 양태 및 구현예는 "구성되는(consisting)" 및/또는 "~로 본질적으로 구성되는"의 양태 및 구현예를 포함하는 것으로 이해된다.
II. 정제의 방법
DsbA 및 DsbC의 초순수 제제를 생성하기 위한 방법이 본원에 제공된다. 일부 구현예에서, 제제는 약 임의의 95.0%, 96.0%, 97.0%, 98.0%, 99.0%, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9%보다 많은 순수한 DsbA 또는 DsbC를 포함한다. 일부 구현예에서, 99% 순수한 DsbA 또는 99% 순수한 DsbC인 제제는 상기 제제 내 1% 미만의 물질이 DsbA 또는 DsbC의 생산 동안 존재하는 세포 또는 세포 용해물 (예컨대, 단백질, 핵산, 지질, 등)에 존재하는 물질이라는 것을 나타낸다. DsbA 또는 DsbC의 99% 순수한 제제는 DsbA 또는 DsbC의 정제 또는 제형에 사용된 완충제, 염 또는 다른 부형제를 함유할 수 있다.
A.
DsbA의
정제
일부 양태에서, 본 발명은 DsbA의 초순수 제제를 생성하기 위한 방법을 제공한다. 일부 구현예에서, DsbA는 박테리아 발효 배양 예컨대 이. 콜라이 배양에서 DsbA를 과발현함에 의해 생성된다. 발효에 이어, 박테리아 세포가 수집되고 원심분리된다. 수득한 세포 페이스트는 세포용해 완충제(예컨대, 10mM MOPS pH 7.1)에 재현탁되고 용해되었다(예컨대, 미세유동화기를 사용함에 의해). 일부 구현예에서, 세포 용해물은 폴리에틸렌이민(PEI)으로 컨디셔닝되었다. 일부 구현예에서, 세포 용해물은 하기 중 임의의 것을 초과하는 최종 농도에서 PEI로 컨디셔닝된다: 약 0.01%, 0.05%, 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6%, 0.7%, 0.8%, 0.9%, 또는 1.0%. 일부 구현예에서, 세포 용해물은 하기 중 임의의 것의 초과 동안 PEI로 컨디셔닝 된다: 약 15분, 30분, 45분, 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 8시간, 12시간, 16시간, 20시간, 또는 24시간. 일부 구현예에서, 세포 용해물은 하기 중 임의의 것의 초과에서 PEI로 컨디셔닝된다: 약 0 °C, 4 °C, 또는 21 °C. 일부 구현예에서, 세포 용해물은 주위 온도 (~21 °C)에서 PEI로 컨디셔닝된다. 일부 구현예에서, PEI-컨디셔닝된 용해물은 원심분리되어 미립자가 제거되었다. 일부 구현예에서, PEI-컨디셔닝된 용해물은 크로마토그래피 전에 여과되었다. 일부 구현예에서, PEI-컨디셔닝된 용해물은 크로마토그래피 전에 22 μm 필터를 통하여 여과되었다.
일부 구현예에서, 상기 방법은 DsbA 폴리펩티드를 포함하는 세포 용해물로부터 DsbA 폴리펩티드를 정제하는 방법을 포함하며, 상기 방법은 하기 단계를 포함한다: a) DsbA 폴리펩티드를 포함하는 세포 용해물에 약 0.01% 내지 약 1.0%의 최종 농도로 폴리에틸렌이민 (PEI)을 첨가하는 단계, b) 원심분리에 의해 상기 세포 용해물을 정화하는 단계, c) DsbA 폴리펩티드를 포함하는 정화된 세포 용해물을 음이온 교환 크로마토그래피 물질에 적용하는 단계, d) DsbA 폴리펩티드를 포함하는 음이온 교환 용출액을 생성시키도록 음이온 교환 크로마토그래피 물질로부터 DsbA 폴리펩티드를 용출시키는 단계, e) DsbA 폴리펩티드를 포함하는 음이온 교환 용출액을 양이온 교환 크로마토그래피 물질에 적용하는 단계, f) 정제된 DsbA 폴리펩티드를 포함하는 양이온 교환 용출액을 생성시키도록 양이온 교환 크로마토그래피 물질로부터 DsbA 폴리펩티드를 용출시키는 단계.
본원에 기술된 상기 방법들의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 양으로 하전된 고체 상이며, 상기 고체 상에서, 또는 이를 통해 전달된 수성 용액 내 음이온과의 교환을 위하여 유리 음이온을 갖는다. 본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 음이온 교환 물질은, 막, 모놀리스(monolith), 또는 수지이다. 일 구현예에서, 음이온 교환 물질은 수지일 수 있다. 일부 구현예에서, 음이온 교환 물질은 1차 아민, 2차 아민, 3차 아민 또는 4급 암모늄 이온 작용기, 폴리아민 작용기, 또는 디에틸아미노에틸 작용기를 포함할 수 있다. 상기의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 음이온 교환 크로마토그래피 칼럼이다. 상기의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 음이온 교환 크로마토그래피 막이다.
본원에 기술된 상기 방법들의 일부 구현예에서, 양이온 교환 물질은 음으로 하전된 고체 상이며, 상기 고체 상에서, 또는 이를 통해 전달된 수성 용액 내 양이온과의 교환을 위하여 유리 양이온을 갖는다. 본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 양이온 교환 물질은, 막, 모놀리스(monolith), 또는 수지이다. 일부 구현예에서, 양이온 교환 물질은 수지일 수 있다. 양이온 교환 물질은 카르복실산 작용기 또는 설폰산 작용기 예컨대, 비제한적으로, 설포네이트, 카르복실, 카르복시메틸 설폰산, 설포이소부틸, 설포에틸, 카르복실, 설포프로필, 설포닐, 설폭시에틸, 또는 오르토포스페이트를 포함할 수 있다. 상기의 일부 구현예에서, 양이온 교환 크로마토그래피 물질은 양이온 교환 크로마토그래피 칼럼이다. 상기의 일부 구현예에서, 양이온 교환 크로마토그래피 물질은 양이온 교환 크로마토그래피 막이다. 본 발명의 일부 구현예에서, 크로마토그래피 물질은 양이온 교환 크로마토그래피 물질이 아니다.
본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 이온 교환 물질은, 기존 크로마토그래피 물질 또는 대류 크로마토그래피 물질을 사용할 수 있다. 종래의 크로마토그래피 물질은, 예를 들면, 살포성의 물질(예컨대, 폴리 (스티렌-디비닐벤젠) 수지) 및 확산성의 물질(예컨대, 가교결합된 아가로스 수지)을 포함한다. 일부 구현예에서, 폴리 (스티렌-디비닐벤젠) 수지는 포로스(Poros) 수지일 수 있다. 일부 구현예에서, 가교결합된 아가로스 수지는 설포프로필-세파로오스® 패스트 플로우("SPSFF") 수지일 수 있다. 대류적인 크로마토그래피 물질은 막(예컨대, 폴리에테르설폰) 또는 모놀리스 물질(예컨대 가교결합된 폴리머)일 수 있다. 폴리에테르설폰 막은 머스탱(Mustang)일 수 있다. 가교결합된 폴리머 모놀리스 물질은 가교결합된 폴리(글리시딜 메타크릴레이트-코-에틸렌 디메트아크릴레이트)일 수 있다.
음이온 교환 물질의 예는 당해 기술에 공지되어 있고 그리고, 비제한적으로 포로스 HQ 50, 포로스 PI 50, 포로스 D, 머스탱 Q, Q 세파로오스® FF (QSFF), 및 DEAE 세파로오스® 또는 이들의 동등물을 포함한다. 일부 구현예에서, 음이온 교환 물질은 약 음이온 교환 물질; 예를 들면 DEAE이다. 기타 구현예에서, 음이온 교환 물질은 강 음이온 교환 물질; 예를 들면 QSFF이다.
양이온 교환 물질의 예는 당해 기술에 공지되어 있고, 비제한적으로 머스탱 S, 사르토바인드(Sartobind) S, SO3 모놀리스, S 세라믹 HyperD, 포로스 XS, 포로스 HS50, 포로스 HS20, SPSFF, SP-세파로오스® XL(SPXL), CM 세파로오스® 패스트 플로우, 캡토(Capto) S, 프락토젤(Fractogel) Se HiCap, 프락토젤 SO3, 또는 프락토젤 COO 또는 이들의 동등물을 포함한다. 본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 양이온 교환 물질을 포로스 HS50이다. 일부 구현예에서, 포로스 HS 수지는 포로스 HS 50 μm 또는 포로스 HS 20 μm 입자일 수 있다. 일부 구현예에서, 양이온 교환 물질은 약 양이온 교환 물질; 예를 들면, CM 세파로오스® 또는 이들의 동등물이다. 다른 구현예에서, 양이온 교환 물질은 강한 양이온 교환 물질; 예를 들면, 포로스 HS 50 또는 이들의 동등물이다.
크로마토그래피 물질 상에 DsbA를 포함하는 조성물의 부하는 불순물로부터 DsbA 생성물의 분리를 위해 최적화될 수 있다. 일부 구현예에서, 크로마토그래피 물질 위의 조성물 상에 부하는 크로마토그래피 물질에 불순물의 결합에 대해 최적화된다. 예를 들어, 상기 조성물은, 상기 부하 완충제의 전도도가 일정할 동안에, 크로마토그래피 물질, 예컨대 부하 완충제 내 크로마토그래피 칼럼 상에서, 다수의 상이한 pH에서 부하될 수 있다. 대안적으로, 상기 조성물은, 상기 부하 완충제의 pH가 일정할 동안에, 부하 완충제 내 크로마토그래피 물질 상에서, 다수의 상이한 전도도에서 부하될 수 있다. 크로마토그래피 물질 위의 조성물 상에 부하 및 크로마토그래피 물질로부터 풀 분획 안으로 생성물의 용출의 완료에 의해, 풀 분획 내 오염물질의 양은 주어진 pH 또는 전도도에 대한 불순물로부터 생성물의 분리에 관한 정보를 제공한다.
본 명세서에서 기재된 임의의 방법의 일부 구현예에서, DsbA를 포함하는 조성물은 음이온 교환 크로마토그래피 물질 중 약 임의의 10mg/mL, 9mg/mL, 8mg/mL, 7mg/mL, 6mg/mL, 5mg/mL, 4mg/mL, 3mg/mL, 2mg/mL, 또는 1mg/mL 이하의 폴리펩티드의 부하된 밀도로 음이온 교환 크로마토그래피 물질 상에 부하된다. 상기 조성물은 하기 중 임의의 폴리펩티드 부하 밀도에서 음이온 크로마토그래피 물질 상에 부하될 수 있다: 음이온 교환 크로마토그래피 물질의 1 mg/mL 내지 2 mg/mL, 2 mg/mL 내지 3 mg/mL, 3 mg/mL 내지 4 mg/mL, 4 mg/mL 내지 5 mg/mL, 5 mg/mL 내지 6 mg/mL, 6 mg/mL 내지 7 mg/mL, 7 mg/mL 내지 8 mg/mL, 8 mg/mL 내지 9 mg/mL, 또는 9 mg/mL 내지 10 mg/mL. 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 아가로스에 가교결합된 4급 아민; 예를 들면, QSFF이다.
본 명세서에서 기재된 임의의 방법의 일부 구현예에서, DsbA를 포함하는 조성물은 양이온 교환 크로마토그래피 물질 중 약 임의의 10mg/mL, 9mg/mL, 8mg/mL, 7mg/mL, 6mg/mL, 5mg/mL, 4mg/mL, 3mg/mL, 2mg/mL, 또는 1mg/mL 이하의 폴리펩티드의 부하된 밀도로 음이온 교환 크로마토그래피 물질 상에 부하된다. 상기 조성물은 하기 중 임의의 폴리펩티드 부하 밀도에서 양이온 크로마토그래피 물질 상에 부하될 수 있다: 양이온 교환 크로마토그래피 물질의 1 mg/mL 내지 2 mg/mL, 2 mg/mL 내지 3 mg/mL, 3 mg/mL 내지 4 mg/mL, 4 mg/mL 내지 5 mg/mL, 5 mg/mL 내지 6 mg/mL, 6 mg/mL 내지 7 mg/mL, 7 mg/mL 내지 8 mg/mL, 8 mg/mL 내지 9 mg/mL, 또는 9 mg/mL 내지 10 mg/mL. 일부 구현예에서, 양이온 교환 크로마토그래피 물질은, 폴리(스티렌-디비닐벤젠) 매트릭스에 가교결합된 설포프로필 모이어티; 예컨대, 포로스 HS50 또는 이의 등가물이다.
크로마토그래피 물질로부터의 DsbA의 용출은 최소 불순물로 그리고 최소 풀 용적에서 DsbA의 생산에 대해 최적화될 수 있다. 예를 들면, 본 조성물은 부하 완충제에서 크로마토그래피 물질, 예를 들면 크로마토그래피 칼럼 상에서 부하될 수 있다. 부하의 완료에 의해, 생성물은 수많은 상이한 pH로 완충제로 용출되는 반면 용출 완충제의 전도도는 일정하다. 대안적으로, 생성물은 수많은 상이한 전도도로 용출 완충제에 크로마토그래피 물질로부터 용출될 수 있는 반면 본 용출 완충제의 pH는 일정하다. 크로마토그래피 물질 유래 생성물의 용출의 완료에 의해, 풀 분획 내 오염물질의 양은 주어진 pH 또는 전도도에 대한 불순물로부터 생성물의 분리에 관한 정보를 제공한다. 높은 수의 분획(예컨대 8칼럼 용적)에서 생성물의 용출은 용출 프로파일의 "꼬리물기(tailing)"를 나타낸다. 본 발명의 일부 구현예에서, 용출의 꼬리물기는 최소화된다.
이용될 수 있는 다양한 완충제는, 예를 들면, 완충제의 목적 pH, 완충제의 목적 전도도, 관심 단백질의 특징, 및 정제 방법에 의존한다. 본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 본 방법은 완충제를 사용하는 것을 포함한다. 완충제는 부하 완충제, 평형 완충제, 또는 세정 완충제일 수 있다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제 중 하나 이상은 동일한 것이다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제는 상이하다. 본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 완충제는 염을 포함한다. 부하 완충제는 염화나트륨, 아세트산나트륨 또는 이들의 혼합물을 포함할 수 있다. 일부 구현예에서, 부하 완충제는 염화나트륨 완충제이다. 일부 구현예에서, 부하 완충제는 아세트산나트륨 완충제이다.
본 명세서에서 사용된 바와 같이, 부하는 크로마토그래피 물질 위로 부하된 조성물이다. 부하 완충제는 크로마토그래피 물질 위에 DsbA를 포함하는 조성물을 부하하기 위해 사용된 완충제이다. 크로마토그래피 물질은 정제되도록 되는 조성물을 부하하기 전에 평형 완충제로 평형화될 수 있다. 일부 예에서, 세정 완충제는 크로마토그래피 물질 위로 조성물을 부하하기 전 및 고체 상으로부터 관심 폴리펩티드의 용출 전에 사용된다.
본 명세서에서 사용된 바와 같이, 용출은 크로마토그래피 물질로부터 생성물, 예를 들면 DsbA의 제거이다. 용출 완충제는 크로마토그래피 물질로부터 관심 폴리펩티드 또는 다른 생성물을 용출하기 위해 사용된 완충제이다. 많은 사례에서, 용출 완충제는 부하 완충제과 상이한 물리적 특징을 가진다. 예를 들면, 용출 완충제는 부하 완충제과 상이한 전도도 또는 부하 완충제과 상이한 pH를 가질 수 있다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 낮은 전도도를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 높은 전도도를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 낮은 pH를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 높은 pH를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제과 상이한 전도도 및 상이한 pH를 가진다. 용출 완충제는 보다 높은 또는 보다 낮은 전도도 및 보다 높은 또는 보다 낮은 pH의 임의의 조합을 가질 수 있다.
전도도는 두 전극 사이에 전류를 전도하는 수용액의 능력을 지칭한다. 용액에서, 전류는 이온 수송에 의해 흐른다. 따라서, 수용액에서 존재하는 이온의 양이 증가하므로, 용액은 보다 높은 전도도를 가질 것이다. 전도도에 대한 측정의 기본 단위는 Siemen (또는 mho), mho (mS/cm)이며, 전도도 측정기, 예컨대 오리온(Orion) 전도도 측정기의 다양한 모델을 사용하여 측정될 수 있다. 전해 전도도는 전류를 나르는 용액 내의 이온의 수용력이기 때문에, 용액의 전도도는 그 안의 이온의 농도를 변화함에 의해 변경될 수 있다. 예를 들면, 용액 내의 완충제의 농도 및/또는 염(예컨대 염화나트륨, 아세트산나트륨, 또는 염화칼륨)의 농도는 목적 전도도를 달성하기 위해 변경될 수 있다. 바람직하게는, 다양한 완충제의 염 농도가 목적 전도도를 달성하기 위해 변형될 수 있다.
본원에 기술된 상기 방법들의 일부 구현예에서, 부하 완충제는 하기 중 임의의 것을 초과의 전도도를 갖는다: 약 4.0 mS/cm, 4.5 mS/cm, 5.0 mS/cm, 5.5 mS/cm, 6.0 mS/cm, 6.5 mS/cm, 7.0 mS/cm, 7.5 mS/cm, 8.0 mS/cm, 8.5 mS/cm, 9.0 mS/cm, 9.5 mS/cm, 또는 10 mS/cm. 일부 구현예에서, 전도도는 하기 중 임의의 것일 수 있다: 약 4 mS/cm 내지 17 mS/cm, 4 mS/cm 내지 10 mS/cm, 4 mS/cm 내지 7 mS/cm, 5 mS/cm 내지 17 mS/cm, 5 mS/cm 내지 10 mS/cm, 또는 5 mS/cm 내지 7 mS/cm. 일부 구현예에서, 전도도는 4 mS/cm, 4.5 mS/cm, 5.0 mS/cm, 5.5 mS/cm, 6.0 mS/cm, 6.5 mS/cm, 7.0 mS/cm, 7.5 mS/cm, 8.0 mS/cm, 8.5 mS/cm, 9.0 mS/cm, 9.5 mS/cm, 또는 10 mS/cm 중 대략 임의의 것이다. 일 양태에서, 전도도는 부하 완충제, 평형 완충제, 및/또는 세정 완충제의 전도도이다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및 세정 완충제 중 하나 이상의 전도도는 동일한 것이다. 일부 구현예에서, 부하 완충제의 전도도는 세정 완충제 및/또는 평형 완충제의 전도도와 상이하다.
일부 구현예에서, 용출 완충제는 부하 완충제의 전도도 초과의 전도도를 가진다. 본원에 기술된 상기 방법들의 일부 구현예에서, 용출 완충제는 하기 중 임의의 것을 초과하는 전도도를 갖는다: 약 5 mS/cm, 10 mS/cm, 15 mS/cm, 20 mS/cm, 25 mS/cm, 30 mS/cm, 35 mS/cm, 40 mS/cm, 45 mS/cm, 50 mS/cm, 55 mS/cm, 60 mS/cm, 65 mS/cm, 70 mS/cm, 75 mS/cm, 80 mS/cm, 85 mS/cm, 90 mS/cm, 95 mS/cm, 또는 100 mS/cm. 일부 구현예에서, 상기에 기재된 용출 완충제가 음이온 교환 또는 양이온 교환 크로마토그래피에 사용된다. 일부 구현예에서, 용출 완충제의 전도도는 용출 완충제의 염 농도를 변화함에 의해 변경된다.
임의의 상기 구현예의 일부 양태에서, 용출 완충제의 전도도는 단계 구배 또는 선형 구배에 의해 등용매적으로 부하 및/또는 세정 완충제로부터 변하였다.
일부 구현예에서, DsbA는 하기 단계로 음이온 교환 크로마토그래피 물질로부터 용출된다: 1) 약 4개 칼럼 용적에 대해 약 pH 9.2에서 약 15%의 약 25mM Tris 및 약 250mM NaCl, 2) 약 4개 칼럼 용적에 대해 약 pH 9.2에서 약 20%의 약 25mM Tris 및 약 250mM NaCl, 및 3) DsbA가 칼럼으로부터 용출할 때까지 약 pH 9.2에서 약 25%의 약 25mM Tris 및 약 250mM NaCl. 일부 구현예에서, DsbA는 15 칼럼 용적에 걸친, 약 0% 내지 약 60% 12.5mM MES 및 1M NaCl의 염 구배를 사용하여 양이온 교환 크로마토그래피로부터 용출된다.
본원에 기술된 상기 방법들의 일부 구현예에서, 음이온 교환 부하 완충제는 10, 9, 8, 7, 6, 또는 5 중 임의의 것 미만의 pH를 갖는다. 본원에 기술된 상기 방법들의 일부 구현예에서, 부하 완충제는 4, 5, 6, 7, 8, 또는 9 중 임의의 것 초과의 pH를 갖는다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제 중 하나 이상의 pH는 동일한 것이다. 일부 구현예에서, 부하 완충제의 pH는 평형 완충제 및/또는 세정 완충제의 pH와 상이하다.
일부 구현예에서, 용출 완충제는 부하 완충제의 pH 미만의 pH를 가진다. 본원에 기술된 상기 방법들의 일부 구현예에서, 용출 완충제는 8, 7, 6, 5, 4, 3 또는 2 중 임의의 것 미만의 pH를 갖는다. 용출 완충제의 pH는 약 임의의 4 내지 9, 4 내지 8, 4 내지 7, 4 내지 6, 4 내지 5, 5 내지 9, 5 내지 8, 5 내지 7, 5 내지 6, 6 내지 9, 6 내지 8, 6 내지 7 사이일 수 있다. 일부 구현예에서, 용출 완충제의 pH는 약 4.0, 4.5, 5.0, 5.5, 6.0, 6.5, 7/0, 7.5, 8.0, 8.5 또는 9.0 중 임의의 것이다.
본원에 기술된 상기 방법들의 일부 구현예에서, 양이온 교환 부하 완충제는 4, 5, 6, 또는 7 중 임의의 것 미만의 pH를 갖는다. 본원에 기술된 상기 방법들의 일부 구현예에서, 부하 완충제는 4, 5, 6, 또는 7 중 임의의 것 초과의 pH를 갖는다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제 중 하나 이상의 pH는 동일한 것이다. 일부 구현예에서, 부하 완충제의 pH는 평형 완충제 및/또는 세정 완충제의 pH와 상이하다.
일부 구현예에서, 용출 완충제는 부하 완충제의 pH 초과의 pH를 가진다. 본원에 기술된 상기 방법들의 일부 구현예에서, 용출 완충제는 5, 6, 7, 8, 또는 9 중 임의의 것 초과의 pH를 갖는다. 용출 완충제의 pH는 약 4 내지 9, 5 내지 9, 6 내지 9, 7 내지 9, 8 내지 9, 4 내지 8, 5 내지 8, 6 내지 8, 7 내지 8, 4 내지 7, 5 내지 7, 및 6 내지 7 중 임의의 것일 수 있다.
본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 유속은 약 50 CV/hr, 40 CV/hr, 또는 30 CV/hr 중 임의의 것 미만이다. 유속은 약 5 CV/hr 내지 50 CV/hr, 10 CV/hr 내지 40 CV/hr, 또는 18 CV/hr 내지 36 CV/hr 중 임의의 것일 수 있다. 일부 구현예에서, 유속은 약 임의의 9CV/hr, 18CV/hr, 25CV/hr, 30CV/hr, 36CV/hr, 또는 40CV/hr이다. 본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 유속은 약 임의의 200cm/hr, 150cm/hr, 100cm/hr, 75cm/hr, 또는 50cm/hr 미만이다. 유속은 하기 중 임의의 것일 수 있다: 약 25 cm/hr 내지 200 cm/hr, 25 cm/hr 내지 175 cm/hr, 25 cm/hr 내지 150 cm/hr, 25 cm/hr 내지 100 cm/hr, 50 cm/hr 내지 100 cm/hr, 또는 65 cm/hr 내지 85 cm/hr.
층 높이는 사용된 크로마토그래피 물질의 높이이다. 본원에 기술된 방법 중 임의의 것의 일부 구현예에서, 베드(bed) 높이는 하기 중 임의의 것의 초과이다: 약 3 cm, 10 cm, 15 cm, 20 cm, 25 cm, 30 cm, 35 cm, 40 cm, 45 cm, 또는 50 cm. 베드(bed) 높이는 하기일 수 있다: 약 3 cm 내지 50 cm, 5 cm 내지 35 cm, 3 cm 내지 35 cm, 또는 5 cm 내지 50 cm. 일부 구현예에서, 베드(bed) 높이는 부하 중 폴리펩티드 또는 불순물의 양을 기준으로 계측된다.
일부 구현예에서, 크로마토그래피는 약 1mL, 2mL, 3mL, 4mL, 5mL, 6mL, 7mL, 8mL, 9mL, 10mL, 15mL, 20mL, 25mL, 30mL, 40mL, 50mL, 75mL, 100mL, 또는 200mL 초과의 용적을 갖는 용기의 칼럼에 있다.
본 발명의 일부 구현예에서, 분획은 크로마토그래피로부터 수집된다. 일부 구현예에서, 수집된 분획은 하기 초과의 것이다: 약 0.01 CV, 0.02 CV, 0.03 CV, 0.04 CV, 0.05 CV, 0.06 CV, 0.07 CV, 0.08 CV, 0.09 CV, 0.1 CV, 0.2 CV, 0.3 CV, 0.4 CV, 0.5 CV, 0.6 CV, 0.7 CV, 0.8 CV, 0.9 CV, 1.0 CV, 2.0 CV, 3.0 CV, 4.0 CV, 5.0 CV, 6.0 CV, 7.0 CV, 8.0 CV, 9.0 CV, 또는 10.0 CV. 일부 구현예에서, 생성물, 예컨대 폴리펩티드를 함유하는 분획이 풀링된다. 일부 구현예에서, 부하 분획 유래의, 그리고 용출 분획 유래의 폴리펩티드를 함유하는 분획이 풀링된다. 분획 내 폴리펩티드의 양은 당해 분야의 숙련가에 의해 계측될 수 있다; 예를 들면, 분획 내 폴리펩티드의 양은 UV 분광법에 의해 계측될 수 있다. 일부 구현예에서, 검출가능한 폴리펩티드 단편을 함유하는 분획이 풀링된다. 일부 구현예에서, 분획 내 DsbA의 존재 및 순도는 크기 배제 크로마토그래피에 의하여 계측된다.
예시적인 구현예
일부 구현예에서, 본 발명은 DsbA의 초순수 제제를 생성하기 위한 하기의 예시적이나 비제한적인 방법을 제공한다. DsbA는 이. 콜라이에서 발현된다. 세포 페이스트는 10mM MOPS pH 7.1 내에 현탁되고(50g 세포 페이스트/1L) 현탁액이 균질해질 때까지 혼합된다. 세포 용해는 실내압에서 3 패스(pass)로, 미세유동화기 110F를 사용하여 수행된다(~7000 psi). 균질물은 (10% PEI 스톡 용액을 사용하여) 0.1% PEI로 컨디셔닝되고 30분 동안 주위 온도(~21℃)에서 혼합된다. 현탁액은 30분 동안 8500rpm에서 "GSA" 회전자를 사용하여 Sorval RC-5B+ 원심분리기 내에서 원심분리된다. 농축물을 수집하고 0.22um Durapore 필터를 통하여 여과한다.
(a) Q-세파로오스®단계
세포 용해물은 결합 및 용출 방식으로 Q-세파로오스®FF (GE)에 적용된다. 칼럼 높이는 약 20-30cm 높이이고, 유속은 150cm/h이고 부하 밀도는 ≤6 mg/mL이다. 칼럼을 4개 칼럼 용적(CV)으로 25mM 트리스, 1M NaCl, pH 9.2, 86 mS/cm로 사전-평형화한다. 칼럼은 25mM Tris, pH 9.1, 4CV로 0.3 mS/cm로 평형화된다. DsbA를 포함하는 농축물은 물로 희석(1:1)되고, 그런 다음 1.5M Tris 염기 pH 9.0으로 9.0으로 pH-조정, 전도도 ~ 1.0 mS/cm, ≤6mg/mL로 된다. 칼럼은 그런 다음 6CV의 평형 완충제로 세정된다. DsbA는 염 농도의 단계 구배 증가(step gradient increase)를 사용하여 칼럼으로부터 용출된다. 완충제 B는 25mM 트리스, 250mM NaCl pH 9.2, 26 mS/cm이다. DsbA는 먼저 4CV 용 15% 완충제 B, 그런 다음 4CV 용 20% 완충제 B, 그리고 마지막으로 용출 단계의 나머지 용 25% 완충제 B를 적용함에 의해 칼럼으로부터 용출된다. 풀은 SEC에 의해 검정되고 최대 양의 DsbA를 함유하는 분획을 기반으로 풀링된다.
(b) 포로스 HS50 단계
풀링된 QSFF 분획은 그런 다음 결합 및 용출 방식으로 포로스 HS50 칼럼에 적용된다. QSFF 분획을 2.0M 아세트산으로 pH 5.0으로 조정된다. 칼럼 높이는 약 20-30cm 높이이고, 유속은 약 150cm/h이고 부하 밀도는 약 ≤6mg/mL이다. 포로스 HS50 칼럼은 먼저 4CV에 대해 12.5mM MES, pH 5.5, 0.4 mS/cm로 평형화된다. 2M 아세트산으로 5.0까지 조정되고, 이후 물 (1:2) pH 5.0, 0.4 mS/cm로 희석된 QSFF 풀 pH가 포로스 HS50 칼럼 상에 부하된다. 칼럼은 그런 다음 5 CV의 평형 완충제로 세정된다. DsbA는 염 구배로 칼럼으로부터 용출된다. 완충제 B는 12.5mM MES, 250mM NaCl pH 5.5, 25 mS/cm이다. 구배는 15CV에 걸쳐 0 내지 60% B이다. 1 CV 분획이 피크 수집(collected peak)된다. 분획을, SDS-PAGE 겔 및 SEC에 의한, 순도를 기준으로 하여 분석하여 풀링하였다. 포로스 풀을 Sorval RC-3B 원심분리기로 3000rpm에서 ~ 30분 동안 원심분리된 10kD 센트리콘(Centricon) 막(밀리포어 사)을 사용하여 ~ 3.0mg/mL로 농축시킨다.
B.
DsbC의
정제
일부 양태에서, 본 발명은 DsbC의 초순수 제제를 생성하기 위한 방법을 제공한다. 일부 구현예에서, DsbC는 박테리아 발효 배양 예컨대 이. 콜라이 배양에서 DsbC를 과발현함에 의해 생성된다. 발효에 이어, 박테리아 세포가 수집되고 원심분리된다. 수득한 세포 페이스트는 세포용해 완충제(예컨대, 10mM MOPS pH 7.1)에 재현탁되고 용해되었다(예컨대, 미세유동화기를 사용함에 의해). 일부 구현예에서, 세포 용해물은 폴리에틸렌이민(PEI)으로 컨디셔닝되었다. 일부 구현예에서, 세포 용해물은 하기 중 임의의 것을 초과하는 최종 농도에서 PEI로 컨디셔닝된다: 약 0.01%, 0.05%, 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6%, 0.7%, 0.8%, 0.9%, 또는 1.0%. 일부 구현예에서, 세포 용해물은 하기 중 임의의 것의 초과 동안 PEI로 컨디셔닝 된다: 약 15분, 30분, 45분, 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 8시간, 12시간, 16시간, 20시간, 또는 24시간. 일부 구현예에서, 세포 용해물은 하기 중 임의의 것의 초과에서 PEI로 컨디셔닝된다: 약 0 °C, 4 °C, 또는 21 °C. 일부 구현예에서, 세포 용해물은 주위 온도 (~21 °C)에서 PEI로 컨디셔닝된다. 일부 구현예에서, PEI-컨디셔닝된 용해물은 원심분리되어 미립자가 제거되었다. 일부 구현예에서, PEI-컨디셔닝된 용해물은 크로마토그래피 전에 여과되었다. 일부 구현예에서, PEI-컨디셔닝된 용해물은 크로마토그래피 전에 22 μm 필터를 통하여 여과되었다.
일부 구현예에서, 본 방법은 DsbC 폴리펩티드를 포함하는 세포 용해물 유래의 DsbC 폴리펩티드를 정제하는 방법을 포함하며, 상기 방법은 하기를 포함한다: a) DsbC 폴리펩티드를 포함하는 세포 용해물에 약 0.01% 내지 약 1.0%의 최종 농도로 폴리에틸렌이민 (PEI)을 첨가하는 단계, b) 원심분리에 의해 상기 세포 용해물을 정화하는 단계, c) DsbC 폴리펩티드를 포함하는 정화된 세포 용해물을 음이온 교환 크로마토그래피 물질에 적용하는 단계, d) DsbC 폴리펩티드를 포함하는 음이온 교환 용출액을 생성시키도록 음이온 교환 크로마토그래피 물질로부터 DsbC 폴리펩티드를 용출시키는 단계, e) DsbC 폴리펩티드를 포함하는 음이온 교환 용출액을 소수성 상호작용 크로마토그래피 (HIC) 물질에 적용하는 단계, f) HIC 물질 유래의 DsbC 폴리펩티드를 용출시켜 HIC 용출액을 생성하는 단계, g) DsbC 폴리펩티드를 포함하는 HIC 용출액을 크기 배제 크로마토그래피에 적용시키는 단계, h) 정제된 DsbC 폴리펩티드를 포함하는 크기 배제 크로마토그래피 유래의 분획을 수집하는 단계.
본원에 기술된 상기 방법들의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 양으로 하전된 고체 상이며, 상기 고체 상에서, 또는 이를 통해 전달된 수성 용액 내 음이온과의 교환을 위하여 유리 음이온을 갖는다. 본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 음이온 교환 물질은, 막, 모놀리스(monolith), 또는 수지일 수 있다. 일 구현예에서, 음이온 교환 물질은 수지일 수 있다. 일부 구현예에서, 음이온 교환 물질은 1차 아민, 2차 아민, 3차 아민 또는 4급 암모늄 이온 작용기, 폴리아민 작용기, 또는 디에틸아미노에틸 작용기를 포함할 수 있다. 상기의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 음이온 교환 크로마토그래피 칼럼이다. 상기의 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 음이온 교환 크로마토그래피 막이다.
본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 음이온 교환 물질은, 기존 크로마토그래피 물질 또는 대류 크로마토그래피 물질을 사용할 수 있다. 종래의 크로마토그래피 물질은, 예를 들면, 살포성의 물질(예컨대, 폴리 (스티렌-디비닐벤젠) 수지) 및 확산성의 물질(예컨대, 가교결합된 아가로스 수지)을 포함한다. 일부 구현예에서, 폴리 (스티렌-디비닐벤젠) 수지는 포로스(Poros) 수지일 수 있다. 일부 구현예에서, 가교결합된 아가로스 수지는 설포프로필-세파로오스® 패스트 플로우("SPSFF") 수지일 수 있다. 대류적인 크로마토그래피 물질은 막(예컨대, 폴리에테르설폰) 또는 모놀리스 물질(예컨대 가교결합된 폴리머)일 수 있다. 폴리에테르설폰 막은 머스탱(Mustang)일 수 있다. 가교결합된 폴리머 모놀리스 물질은 가교결합된 폴리(글리시딜 메타크릴레이트-코-에틸렌 디메트아크릴레이트)일 수 있다.
음이온 교환 물질의 예는 당해 기술에 공지되어 있고 그리고, 비제한적으로 포로스 HQ 50, 포로스 PI 50, 포로스 D, 머스탱 Q, Q 세파로오스® FF (QSFF), 및 DEAE 세파로오스® 또는 이들의 동등물을 포함한다. 일부 구현예에서, 음이온 교환 물질은 약 음이온 교환 물질; 예를 들면 DEAE이다. 기타 구현예에서, 음이온 교환 물질은 강 음이온 교환 물질; 예를 들면 QSFF이다. 일부 구현예에서, DsbC의 정제에 사용된 음이온 교환 물질은 약 음이온 교환 물질이다. 일부 구현예에서, 상기 약 음이온 교환 물질은 4급 아민을 포함한다. 일부 구현예에서, 4급 아민은 가교결합된 아가로스에 연결된다. 일부 구현예에서, DsbC의 정제에 사용된 음이온 교환 물질은 DEAE 세파로오스® 이다.
본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 소수성 상호작용 크로마토그래피 (HIC)는 소수성에 따라 생체분자를 분리하는 액체 크로마토그래피 기술이다. HIC 크로마토그래피 물질의 예는, 비제한적으로, 토요펄(Toyopearl) 헥실 650, 토요피어(Toyopear) 부틸 650, 토요펄 페닐 650, 토요펄 에테르 650, 공급원, 자원, 세파로오스® Hi-Trap, 옥틸 세파로오스® 페닐 세파로오스® 를 포함한다. 상기의 일부 구현예에서, HIC 크로마토그래피 물질은 HIC 크로마토그래피 칼럼이다. 상기의 일부 구현예에서, HIC 크로마토그래피 물질은 HIC 크로마토그래피 막이다. 일부 구현예에서 HIC 물질은 페닐 모이어티를 포함한다. 일부 구현예에서, 페닐 모이어티는 가교결합된 아가로스에 연결된다. 일부 구현예에서, DsbC의 정제에 사용된 HIC 물질은 페닐 세파로오스® 이다.
본 명세서에서 기재된 임의의 방법 중 일부 구현예에서, 크기 배제 크로마토그래피는 이들의 크기 및 형상에 따라 생체분자를 분리하는 액체 크로마토그래피 기술이다. 크기 배제 크로마토그래피 물질은 특정한 중량 범위의 분자를 효율적으로 분리를 위한 상이한 공극 크기로 제공된다. 크기 배제 크로마토그래피 물질의 예는, 비제한적으로, 덱스트란, 다공성 아가로스 입자, 가교결합된 아가로스, 가교결합된 아가로스 및 덱스트란, 및 가교결합된 아크릴아미드를 포함한다. 크기 배제 크로마토그래피 물질의 예는, 비제한적으로 세파덱스, 슈퍼덱스, 세파크릴, TSKgel, 및 바이오-겔을 포함한다. 일부 구현예에서, 슈퍼덱스 75 크기 배제 크로마토그래피는 DsbC의 정제에 사용된다.
크로마토그래피 물질 상에 DsbC를 포함하는 조성물의 부하는 불순물로부터 DsbC 생성물의 분리를 위해 최적화될 수 있다. 일부 구현예에서, 크로마토그래피 물질 위의 조성물 상에 부하는 크로마토그래피 물질에 불순물의 결합에 대해 최적화된다. 예를 들어, 상기 조성물은, 상기 부하 완충제의 전도도가 일정할 동안에, 크로마토그래피 물질, 예컨대 부하 완충제 내 크로마토그래피 칼럼 상에서, 다수의 상이한 pH에서 부하될 수 있다. 대안적으로, 상기 조성물은, 상기 부하 완충제의 pH가 일정할 동안에, 부하 완충제 내 크로마토그래피 물질 상에서, 다수의 상이한 전도도에서 부하될 수 있다. 크로마토그래피 물질 위의 조성물 상에 부하 및 크로마토그래피 물질로부터 풀 분획 안으로 생성물의 용출의 완료에 의해, 풀 분획 내 오염물질의 양은 주어진 pH 또는 전도도에 대한 불순물로부터 생성물의 분리에 관한 정보를 제공한다.
본 명세서에서 기재된 임의의 방법의 일부 구현예에서, DsbC를 포함하는 조성물은 음이온 교환 크로마토그래피 물질 중 약 임의의 10mg/mL, 9mg/mL, 8mg/mL, 7mg/mL, 6mg/mL, 5mg/mL, 4mg/mL, 3mg/mL, 2mg/mL, 또는 1mg/mL 이하의 폴리펩티드의 부하된 밀도로 음이온 교환 크로마토그래피 물질 상에 부하된다. 상기 조성물은 하기 중 임의의 폴리펩티드 부하 밀도에서 음이온 크로마토그래피 물질 상에 부하될 수 있다: 음이온 교환 크로마토그래피 물질의 1 mg/mL 내지 2 mg/mL, 2 mg/mL 내지 3 mg/mL, 3 mg/mL 내지 4 mg/mL, 4 mg/mL 내지 5 mg/mL, 5 mg/mL 내지 6 mg/mL, 6 mg/mL 내지 7 mg/mL, 7 mg/mL 내지 8 mg/mL, 8 mg/mL 내지 9 mg/mL, 또는 9 mg/mL 내지 10 mg/mL. 일부 구현예에서, 음이온 교환 크로마토그래피 물질은 아가로스에 가교결합된 4급 아민; 예를 들면, DEAE 세파로오스® 이다.
본 명세서에서 기재된 임의의 방법의 일부 구현예에서, DsbC를 포함하는 조성물은 HIC 물질 중 약 임의의 10mg/mL, 9mg/mL, 8mg/mL, 7mg/mL, 6mg/mL, 5mg/mL, 4mg/mL, 3mg/mL, 2mg/mL, 또는 1mg/mL 이하의 폴리펩티드의 부하된 밀도로 HIC 물질 상에 부하된다. 상기 조성물은 하기 중 임의의 폴리펩티드 부하 밀도에서 HIC 크로마토그래피 물질 상에 부하될 수 있다: HIC 크로마토그래피 물질의 1 mg/mL 내지 2 mg/mL, 2 mg/mL 내지 3 mg/mL, 3 mg/mL 내지 4 mg/mL, 4 mg/mL 내지 5 mg/mL, 5 mg/mL 내지 6 mg/mL, 6 mg/mL 내지 7 mg/mL, 7 mg/mL 내지 8 mg/mL, 8 mg/mL 내지 9 mg/mL, 또는 9 mg/mL 내지 10 mg/mL. 일부 구현예에서, HIC 물질은 가교결합된 아가로스에 가교결합된 페닐 모이어티; 예를 들면, 페닐 세파로오스® 이다.
크로마토그래피 물질로부터의 DsbC의 용출은 최소 불순물로 그리고 최소 풀 용적에서 DsbC의 생산에 대해 최적화될 수 있다. 예를 들면, 본 조성물은 부하 완충제에서 크로마토그래피 물질, 예를 들면 크로마토그래피 칼럼 상에서 부하될 수 있다. 부하의 완료에 의해, 생성물은 수많은 상이한 pH로 완충제로 용출되는 반면 용출 완충제의 전도도는 일정하다. 대안적으로, 생성물은 수많은 상이한 전도도로 용출 완충제에 크로마토그래피 물질로부터 용출될 수 있는 반면 본 용출 완충제의 pH는 일정하다. 크로마토그래피 물질 유래 생성물의 용출의 완료에 의해, 풀 분획 내 오염물질의 양은 주어진 pH 또는 전도도에 대한 불순물로부터 생성물의 분리에 관한 정보를 제공한다. 높은 수의 분획(예컨대 8칼럼 용적)에서 생성물의 용출은 용출 프로파일의 "꼬리물기(tailing)"를 나타낸다. 본 발명의 일부 구현예에서, 용출의 꼬리물기는 최소화된다.
이용될 수 있는 다양한 완충제는, 예를 들면, 완충제의 목적 pH, 완충제의 목적 전도도, 관심 단백질의 특징, 및 정제 방법에 의존한다. 본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 본 방법은 완충제를 사용하는 것을 포함한다. 완충제는 부하 완충제, 평형 완충제, 또는 세정 완충제일 수 있다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제 중 하나 이상은 동일한 것이다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제는 상이하다. 본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 완충제는 염을 포함한다. 부하 완충제는 염화나트륨, 아세트산나트륨 또는 이들의 혼합물을 포함할 수 있다. 일부 구현예에서, 부하 완충제는 염화나트륨 완충제이다. 일부 구현예에서, 부하 완충제는 아세트산나트륨 완충제이다.
본 명세서에서 사용된 바와 같이, 부하는 크로마토그래피 물질 위로 부하된 조성물이다. 부하 완충제는 크로마토그래피 물질 위에 DsbC를 포함하는 조성물을 부하하기 위해 사용된 완충제이다. 크로마토그래피 물질은 정제되도록 되는 조성물을 부하하기 전에 평형 완충제로 평형화될 수 있다. 일부 예에서, 세정 완충제는 크로마토그래피 물질 위로 조성물을 부하하기 전 및 고체 상으로부터 관심 폴리펩티드의 용출 전에 사용된다.
본 명세서에서 사용된 바와 같이, 용출은 크로마토그래피 물질로부터 생성물, 예를 들면 DsbC의 제거이다. 용출 완충제는 크로마토그래피 물질로부터 관심 폴리펩티드 또는 다른 생성물을 용출하기 위해 사용된 완충제이다. 많은 사례에서, 용출 완충제는 부하 완충제과 상이한 물리적 특징을 가진다. 예를 들면, 용출 완충제는 부하 완충제과 상이한 전도도 또는 부하 완충제과 상이한 pH를 가질 수 있다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 낮은 전도도를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 높은 전도도를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 낮은 pH를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제보다 높은 pH를 가진다. 일부 구현예에서, 용출 완충제는 부하 완충제과 상이한 전도도 및 상이한 pH를 가진다. 용출 완충제는 보다 높은 또는 보다 낮은 전도도 및 보다 높은 또는 보다 낮은 pH의 임의의 조합을 가질 수 있다.
전도도는 두 전극 사이에 전류를 전도하는 수용액의 능력을 지칭한다. 용액에서, 전류는 이온 수송에 의해 흐른다. 따라서, 수용액에서 존재하는 이온의 양이 증가하므로, 용액은 보다 높은 전도도를 가질 것이다. 전도도에 대한 측정의 기본 단위는 Siemen (또는 mho), mho (mS/cm)이며, 전도도 측정기, 예컨대 오리온(Orion) 전도도 측정기의 다양한 모델을 사용하여 측정될 수 있다. 전해 전도도는 전류를 나르는 용액 내의 이온의 수용력이기 때문에, 용액의 전도도는 그 안의 이온의 농도를 변화함에 의해 변경될 수 있다. 예를 들면, 용액 내의 완충제의 농도 및/또는 염(예컨대 염화나트륨, 아세트산나트륨, 또는 염화칼륨)의 농도는 목적 전도도를 달성하기 위해 변경될 수 있다. 바람직하게는, 다양한 완충제의 염 농도가 목적 전도도를 달성하기 위해 변형될 수 있다.
본원에 기술된 상기 방법들의 일부 구현예에서, 음이온 교환 부하 완충제는 하기 중 임의의 것을 초과의 전도도를 갖는다: 약 4.0 mS/cm, 4.5 mS/cm, 5.0 mS/cm, 5.5 mS/cm, 6.0 mS/cm, 6.5 mS/cm, 7.0 mS/cm, 7.5 mS/cm, 8.0 mS/cm, 8.5 mS/cm, 9.0 mS/cm, 9.5 mS/cm, 또는 10 mS/cm. 일부 구현예에서, 전도도는 하기 중 임의의 것이다: 약 4 mS/cm 내지 17 mS/cm, 4 mS/cm 내지 10 mS/cm, 4 mS/cm 내지 7 mS/cm, 5 mS/cm 내지 17 mS/cm, 5 mS/cm 내지 10 mS/cm, 또는 5 mS/cm 내지 7 mS/cm. 일부 구현예에서, 전도도는 4 mS/cm, 4.5 mS/cm, 5.0 mS/cm, 5.5 mS/cm, 6.0 mS/cm, 6.5 mS/cm, 7.0 mS/cm, 7.5 mS/cm, 8.0 mS/cm, 8.5 mS/cm, 9.0 mS/cm, 9.5 mS/cm, 또는 10 mS/cm 중 대략 임의의 것이다. 일 양태에서, 전도도는 부하 완충제, 평형 완충제, 및/또는 세정 완충제의 전도도이다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및 세정 완충제 중 하나 이상의 전도도는 동일한 것이다. 일부 구현예에서, 부하 완충제의 전도도는 세정 완충제 및/또는 평형 완충제의 전도도와 상이하다.
일부 구현예에서, 음이온 교환 용출 완충제는 부하 완충제의 전도도 초과의 전도도를 가진다. 본원에 기술된 상기 방법들의 일부 구현예에서, 용출 완충제는 하기 중 임의의 것을 초과하는 전도도를 갖는다: 약 5 mS/cm, 10 mS/cm, 15 mS/cm, 20 mS/cm, 25 mS/cm, 30 mS/cm, 35 mS/cm, 40 mS/cm, 45 mS/cm, 50 mS/cm, 55 mS/cm, 60 mS/cm, 65 mS/cm, 70 mS/cm, 75 mS/cm, 80 mS/cm, 85 mS/cm, 90 mS/cm, 95 mS/cm, 또는 100 mS/cm. 일부 구현예에서, 용출 완충제의 전도도는 용출 완충제의 염 농도를 변화함에 의해 변경된다.
일부 구현예에서, HIC 부하 완충제는 용출 완충제의 전도도 초과의 전도도를 가진다. 본원에 기술된 상기 방법들의 일부 구현예에서, HIC 부하 완충제는 하기 중 임의의 것을 초과하는 전도도를 갖는다: 약 5 mS/cm, 10 mS/cm, 15 mS/cm, 20 mS/cm, 25 mS/cm, 30 mS/cm, 35 mS/cm, 40 mS/cm, 45 mS/cm, 50 mS/cm, 55 mS/cm, 60 mS/cm, 65 mS/cm, 70 mS/cm, 75 mS/cm, 80 mS/cm, 85 mS/cm, 90 mS/cm, 95 mS/cm, 또는 100 mS/cm. 일부 구현예에서, 용출 완충제의 전도도는 용출 완충제의 염 농도를 변화함에 의해 변경된다.
본원에 기술된 상기 방법들의 일부 구현예에서, HIC 용출 완충제는 하기 중 임의의 것을 미만의 전도도를 갖는다: 약 4.0 mS/cm, 4.5 mS/cm, 5.0 mS/cm, 5.5 mS/cm, 6.0 mS/cm, 6.5 mS/cm, 7.0 mS/cm, 7.5 mS/cm, 8.0 mS/cm, 8.5 mS/cm, 9.0 mS/cm, 9.5 mS/cm, 또는 10 mS/cm.
임의의 상기 구현예의 일부 양태에서, 용출 완충제의 전도도는 단계 구배 또는 선형 구배에 의해 등용매적으로 부하 및/또는 세정 완충제로부터 변하였다.
일부 구현예에서, DsbC는 15 칼럼 용적에 걸친, 약 0% 내지 약 60% 10 mM MOPS 및 250 mM NaCl의 염 구배를 사용하여 음이온 교환 크로마토그래피 물질로부터 용출된다. 일부 구현예에서, 염 구배는 10 칼럼 용적에 걸쳐 약 0% 내지 약 60% 10mM MOPS 및 250mM NaCl이다.
일부 구현예에서, DsbC는 DsbC가 HIC 물질로부터 용출될 때까지 정제수를 사용하여 HIC 물질로부터 용출된다.
본원에 기술된 상기 방법들의 일부 구현예에서, 음이온 교환 부하 완충제는 10, 9, 8, 7, 6, 또는 5 중 임의의 것 미만의 pH를 갖는다. 본원에 기술된 상기 방법들의 일부 구현예에서, 부하 완충제는 4, 5, 6, 7, 8, 또는 9 중 임의의 것 초과의 pH를 갖는다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제 중 하나 이상의 pH는 동일한 것이다. 일부 구현예에서, 부하 완충제의 pH는 평형 완충제 및/또는 세정 완충제의 pH와 상이하다.
일부 구현예에서, 용출 완충제는 부하 완충제의 pH 미만의 pH를 가진다. 본원에 기술된 상기 방법들의 일부 구현예에서, 용출 완충제는 8, 7, 6, 5, 4, 3 또는 2 중 임의의 것 미만의 pH를 갖는다. 용출 완충제의 pH는 약 임의의 4 내지 9, 4 내지 8, 4 내지 7, 4 내지 6, 4 내지 5, 5 내지 9, 5 내지 8, 5 내지 7, 5 내지 6, 6 내지 9, 6 내지 8, 6 내지 7 사이일 수 있다. 일부 구현예에서, 용출 완충제의 pH는 약 4.0, 4.5, 5.0, 5.5, 6.0, 6.5, 7/0, 7.5, 8.0, 8.5 또는 9.0 중 임의의 것이다. 일부 구현예에서, DsbC를 포함하는 조성물은 pH 8에서 부하 완충제 내 음이온 교환 물질 상으로 부하되고, 그리고 pH 약 7.0 또는 7.1에서 용출 완충제 내 음이온 교환 물질로부터 용출된다.
본원에 기술된 상기 방법들의 일부 구현예에서, HIC 부하 완충제는 약 6, 7, 또는 8 중 임의의 것 미만의 pH를 갖는다. 본원에 기술된 상기 방법들의 일부 구현예에서, 부하 완충제는 6, 7, 또는 8 중 임의의 것 초과의 pH를 갖는다. 일부 구현예에서, 부하 완충제, 평형 완충제, 및/또는 세정 완충제 중 하나 이상의 pH는 동일한 것이다. 일부 구현예에서, 부하 완충제의 pH는 평형 완충제 및/또는 세정 완충제의 pH와 상이하다.
일부 구현예에서, 크기 배제 크로마토그래피는 통과액 방식으로 사용된다. 일부 구현예에서, 크기 배제 크로마토그래피에 사용된 완충제는 PBS pH 7.0 ±0.4이다.
본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 유속은 약 50 CV/hr, 40 CV/hr, 또는 30 CV/hr 중 임의의 것 미만이다. 유속은 약 5 CV/hr 내지 50 CV/hr, 10 CV/hr 내지 40 CV/hr, 또는 18 CV/hr 내지 36 CV/hr 중 임의의 것일 수 있다. 일부 구현예에서, 유속은 약 임의의 9CV/hr, 18CV/hr, 25CV/hr, 30CV/hr, 36CV/hr, 또는 40CV/hr이다. 본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 유속은 약 임의의 200cm/hr, 150cm/hr, 100cm/hr, 75cm/hr, 또는 50cm/hr 미만이다 유속은 하기 중 임의의 것일 수 있다: 약 25 cm/hr 내지 200 cm/hr, 25 cm/hr 내지 175 cm/hr, 25 cm/hr 내지 150 cm/hr, 25 cm/hr 내지 100 cm/hr, 50 cm/hr 내지 100 cm/hr, 또는 65 cm/hr 내지 85 cm/hr. 일부 구현예에서, 유속은 대략 하기 초과의 것이다: 약 0.1 mL/min, 0.25 mL/min, 0.5 mL/min, 0.75 mL/min,1 mL/min, 2 mL/min, 3 mL/min, 4 mL/min, 5 mL/min, 6 mL/min, 7 mL/min, 8 mL/min, 9 mL/min, 10 mL/min, 11 mL/min, 12 mL/min, 13 mL/min, 14 mL/min, 15 mL/min, 20 mL/min, 25 mL/min, 및 50 mL/min. 일부 구현예에서, 유속은 약 0.1mL/min 내지 1mL/min, 1mL/min 내지 5mL/min, 1mL/min 내지 10mL/min, 5mL/min 내지 10mL/min, 10mL/min 내지 15mL/min, 10mL/min 내지 25mL/min, 및 15mL/min 내지 25mL/min 사이이다. 일부 구현예에서, DsbC의 음이온 교환 크로마토그래피에 대한 유속은 약 13.3 ml/min이다. 일부 구현예에서, DsbC의 소수성 상호작용 크로마토그래피에 대한 유속 약 13.2mL/min이다. 일부 구현예에서, DsbC의 크기 배제 크로마토그래피에 대한 유속은 약 1 ml/min이다.
층 높이는 사용된 크로마토그래피 물질의 높이이다. 본원에 기술된 방법 중 임의의 것의 일부 구현예에서, 베드(bed) 높이는 하기 중 임의의 것의 초과이다: 약 3 cm, 10 cm, 15 cm, 20 cm, 25 cm, 30 cm, 35 cm, 40 cm, 45 cm, 50 cm, 60 cm, 70 cm, 80 cm, 90 cm 또는 100 cm. 베드(bed) 높이는 하기일 수 있다: 약 3 cm 내지 50 cm, 5 cm 내지 35 cm, 3 cm 내지 35 cm, 또는 5 cm 내지 50 cm. 일부 구현예에서, 베드(bed) 높이는 부하 중 폴리펩티드 또는 불순물의 양을 기준으로 계측된다.
일부 구현예에서, 크로마토그래피는 약 1mL, 2mL, 3mL, 4mL, 5mL, 6mL, 7mL, 8mL, 9mL, 10mL, 15mL, 20mL, 25mL, 30mL, 40mL, 50mL, 75mL, 100mL, 또는 200mL 초과의 용적을 갖는 용기의 칼럼에 있다.
본 발명의 일부 구현예에서, 분획은 크로마토그래피로부터 수집된다. 일부 구현예에서, 수집된 분획은 하기 초과의 것이다: 약 0.01 CV, 0.02 CV, 0.03 CV, 0.04 CV, 0.05 CV, 0.06 CV, 0.07 CV, 0.08 CV, 0.09 CV, 0.1 CV, 0.2 CV, 0.3 CV, 0.4 CV, 0.5 CV, 0.6 CV, 0.7 CV, 0.8 CV, 0.9 CV, 1.0 CV, 2.0 CV, 3.0 CV, 4.0 CV, 5.0 CV, 6.0 CV, 7.0 CV, 8.0 CV, 9.0 CV, 또는 10.0 CV. 일부 구현예에서, 생성물, 예컨대 폴리펩티드를 함유하는 분획이 풀링된다. 일부 구현예에서, 부하 분획 유래의, 그리고 용출 분획 유래의 폴리펩티드를 함유하는 분획이 풀링된다. 분획 내 폴리펩티드의 양은 당해 분야의 숙련가에 의해 계측될 수 있다; 예를 들면, 분획 내 폴리펩티드의 양은 UV 분광법에 의해 계측될 수 있다. 일부 구현예에서, 검출가능한 폴리펩티드 단편을 함유하는 분획이 풀링된다. 일부 구현예에서, 분획 내 DsbC의 존재 및 순도는 크기 배제 크로마토그래피에 의하여 계측된다.
예시적인 구현예
일부 구현예에서, 본 발명은 DsbC의 초순수 제제를 생성하기 위한 하기의 예시적이나 비제한적인 방법을 제공한다. DsbC는 이. 콜라이에서 발현된다. 세포 페이스트는 10mM MOPS pH 7.1 내에 현탁되고(50g 세포 페이스트/1L) 현탁액이 균질해질 때까지 혼합된다. 세포 용해는 실내압에서 3 패스(pass)로, 미세유동화기 110F를 사용하여 수행된다 (~7000 psi). 균질물은 (10% PEI 스톡 용액을 사용하여) 0.1% PEI로 컨디셔닝되고 30분 동안 주위 온도(~21℃)에서 혼합된다. 현탁액은 30분 동안 8500rpm에서 "GSA" 회전자를 사용하여 Sorval RC-5B+ 원심분리기 내에서 원심분리된다. 농축물을 수집하고 0.22um Durapore 필터를 통하여 여과한다.
(a) DEAE 세파로오스
정화된 농축물 (1.5M Tris 염기로 pH 8.0로 컨디셔닝됨)은 결합 및 용출 방식으로 DEAE 세파로오스® 패스트 플로우 (GE 헬쓰케어 사)를 함유하는 칼럼에 부하된다. 칼럼은 하기 특성을 갖는다: 칼럼은 28.4 cm × 2.6 cm 직경, 용적 151mL, 단백질 수용력 ≤50mg/mL 수지였다. 칼럼은 3CV 250mM MOPS pH 7.1; cond. 6.2 mS/cm로 예비 평형화되고 그리고 10mM MOPS, pH 7.1; cond. 0.3 mS/cm로 평형화된다. 부하의 말단에 칼럼은 12CV의 평형 완충제로 세정된다. DsbC는 0 - 60% 완충제 B의 15CV 구배를 사용하여 용출된다. 용출은 15CV에 걸쳐 용출 완충제로 0-60% 완충제 B의 선형 구배이다. 분획은 SDS-PAGE에 의해 분석된다.
(b) 페닐 세파로오스
풀링된 DEAE 분획을 이후 결합 및 용출로의 페닐 세파로오스® 크로마토그래피 상에 적용한다. 칼럼은 하기 특성을 갖는다: 칼럼은 20 cm × 2.6 cm 직경, 용적 106mL, 단백질 수용력 ≤20 mg/mL 수지였다. 칼럼을 0.6M 황산나트륨, 50mM 인산나트륨, pH 7.0로 평형화한다. 부하 전, 1.2M 황산나트륨으로 1:1, 1M 인산나트륨으로 1:20으로의 희석 후 페닐 세파로오스 칼럼 상에 DsbC를 포함하는 컨디셔닝된 DEAE 풀을 부하하고, pH 7.0, ~68 mS/cm로 조정한다. 칼럼을 이후 7 CV 0.6 M 황산나트륨, 50 mM 인산 나트륨 (pH 7.0)으로, 이후 7 CV 0.6 M 황산나트륨, 50 mM 인산 나트륨 (pH 7.0)으로 세정한다. DsbC는 정제수로 칼럼으로부터 용출된다. 분획을 수집하고, 상기 칼럼 분획의 SDS-PAGE 분석에 의하여 분석한다.
(c) 슈퍼덱스(Superdex)
풀링된 페닐 세파로오스 분획은 그런 다음 슈퍼덱스 75를 사용하여, 크기 배제 크로마토그래피에 적용된다. 이 단계는 임의의 잔류 고 MW 및 저 MW 종을 제거하고 DsbC를 형성하기 위해사용된다. 슈퍼덱스 75는 DsbC와 같이 더 작은 단백질(~ 24kDa)에 더 적합한 분별화 범위(5kDa 내지 70kDa)를 가진다. 칼럼은 슈퍼덱스 75이며 하기 특성을 가진다: 칼럼은 60 cm × 2.6 cm 직경, 용적 320mL, 부하 용적 ≤16mL였다. HIC 풀(분획 7-11)은 원심 분리 필터를 사용하여 ≤ 16mL의 용적(≤ 5%의 SEC CV)으로 농축된다. 단위는 표적 용적에 도달할 때까지 20분 간격으로 임상 원심분리기를 사용하여 4000rpm으로 원심분리된다. 슈퍼덱스 75 크기 배제 칼럼은 3CV PBS, pH 7.0 ± 0.4로 평형화된다. 페닐 세파로오스 분획을 칼럼 상에 부하하고, 1 mL/min의 유속에서 PBS, pH 7.0 ± 0.4로 용출시킨다.
C.
DsbA
및
DsbC의
순도를 계측하는 방법
DsbA 및 DsbC의 제제의 순도를 계측하는 방법이 본원에 공지된다. 일부 구현예에서, 제제 내 DsbA 또는 DsbC 순도는 크기 배제 크로마토그래피 (SEC)에 의하여 계측된다. 일부 구현예에서, 제제 내 DsbA 또는 DsbC 순도는 고성능 액체 크로마토그래피 크기 배제 크로마토그래피 (HPLC SEC)에 의하여 계측된다. 일부 구현예에서, 제제 중 순도 DsbA 또는 DsbC는 나트륨 도데실 설페이트 폴리아크릴아미드 겔 전기영동(SDS-PAGE)에 의해 계측된다. 일부 구현예에서, SDS PAGE 겔 상의 단백질은 형광 단백질 염색을 사용하여 식별된다. 일부 구현예에서, 형광 단백질 염색은 Sypro® Ruby 염색이다. 일부 구현예에서, SDS-PAGE 상의 단백질은 헤우케쇼벤(Heukeshoven) 은 염색을 사용하여 가시화된다. 다른 구현예에서, DsbA 또는 DsbC 분자의 동일성은 비제한적으로 N-말단 서열 분석, 펩티드 질량 핑거프린트(Fingerprinting)(PMF), CHIP TOF에 의한 무손상/감소된 질량, 및 웨스턴 블롯 분석을 포함하는 특성규명 검정을 사용하여 식별된다.
일부 구현예에서, 본 발명은 DsbA의 초순수 제제를 제공한다. 일부 구현예에서, 본 발명은 DsbA의 제제를 제공하며, 여기서 모노머 DsbA는 적어도 상기 제제 중 약 95%, 96%, 97%, 98%, 99%, 또는 99.5% 중 임의의 것을 구성한다. 일부 구현예에서, 모노머 DsbA는 제제 중에 약 임의의 95%, 96%, 97%, 98%, 99%, 및/또는 99.5%이다. 일부 구현예에서, 상기 제제는 불순물의 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 또는 0.01% 중 임의의 것 미만을 포함한다. 불순물은, 비제한적으로 숙주세포 단백질 예컨대 이. 콜라이 숙주세포 단백질, 핵산, 바이러스, 세포 배양 성분 예컨대 세포 배양 배지 성분뿐만 아니라 DsbA의 응집물 또는 DsbA의 단편(예컨대, DsbA의 비-작용적 단편)을 포함한다. 일부 구현예에서, 상기 제제는 약 2%, 1.5%, 또는 1% 중 임의의 것 미만의 저분자량 종을 포함한다. 일부 구현예에서, 상기 제제는 약 1%, 0.5%, 또는 0.1% 중 미만의 고분자량 종을 포함한다. 일부 구현예에서, 고분자량 종은 검출 불가능하다. 일부 구현예에서, 모노머 DsbA, 저분자량 종, 및/또는 고분자량 종의 존재는 SEC에 의해 검출된다.
일부 구현예에서, 본 발명은 DsbC의 초순수 제제를 제공한다. 일부 구현예에서, 본 발명은 DsbC의 제제를 제공하며, 여기서 모노머 DsbC는 적어도 상기 제제 중 약 95%, 96%, 97%, 98%, 99%, 또는 99.5% 중 임의의 것을 구성한다. 일부 구현예에서, 모노머 DsbC는 제제 중에 약 임의의 95%, 96%, 97%, 98%, 99%, 및/또는 99.5%이다. 일부 구현예에서, 상기 제제는 불순물의 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 또는 0.01% 중 임의의 것 미만을 포함한다. 불순물은, 비제한적으로 숙주세포 단백질 예컨대 이. 콜라이 숙주세포 단백질, 핵산, 바이러스, 세포 배양 성분 예컨대 세포 배양 배지 성분뿐만 아니라 DsbC의 응집물 또는 DsbC의 단편(예컨대, DsbC의 비-작용적 단편)을 포함한다. 일부 구현예에서, 상기 제제는 약 1%, 0.5%, 또는 0.1% 중 임의의 것 미만의 저분자량 종을 포함한다. 일부 구현예에서, 상기 제제는 약 1%, 0.5%, 또는 0.1% 중 미만의 고분자량 종을 포함한다. 일부 구현예에서, 모노머 DsbC, 저분자량 종, 및/또는 고분자량 종의 존재는 SEC에 의해 검출된다.
DNA 예컨대 숙주세포 DNA를 측정하는 방법은 당해 기술에 공지되어 있고 그리고 실시예 부분에 기재된다. 본원에 기술된 상기 방법들의 일부 구현예에서, DNA의 양은 하기 중 임의의 것의 초과 만큼 감소된다: 약 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 또는 90 %. DNA의 양은 하기 중 임의의 것 만큼 감소될 수 있다: 약 10 % 내지 99 %, 30% 내지 95%, 30 % 내지 99 %, 50% 내지 95%, 50 % 내지 99 %, 75 % 내지 99 %, 또는 85 % 내지 99 %. DNA의 양은 약 임의의 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 또는 99%로 감소될 수 있다. 일부 구현예에서, 감소는 정제 단계(들)로부터 회수된 조성물 내 DNA 양을 정제 단계(들) 이전의 조성물 내 DNA 양과 비교함으로써 결정된다.
세포 배양 배지 성분은 세포 배양 배지에 존재하는 성분을 지칭한다. 세포 배양 배지는 세포를 수확할 때의 세포 배양 배지일 수 있다. 일부 구현예에서, 세포 배양 배지 성분은 겐타마이신이다. 겐타마이신의 양은 ELISA에 의해 측정될 수 있다. 본원에 기술된 상기 방법들의 일부 구현예에서, 세포 배양 배지 성분의 양은 하기 중 임의의 것의 초과 만큼 감소된다: 약 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 또는 90 %. 세포 배양 배지 성분의 양은 하기 중 임의의 것 만큼 감소될 수 있다: 10 % 내지 99 %, 30% 내지 95%, 30 % 내지 99 %, 50% 내지 95%, 50 % 내지 99 %, 75 % 내지 99 %, 또는 85 % 내지 99 %. 일부 구현예에서, 세포 배양 배지 성분의 양은 약 임의의 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 또는 98%로 감소된다. 일부 구현예에서, 감소는 정제 단계(들)로부터 회수된 조성물 내 세포 배양 배지 성분의 양을 정제 단계(들) 이전의 조성물 내 세포 배양 배지 성분의 양과 비교함으로써 결정된다.
III. 폴리펩티드
-
DsbA
및
DsbC
본 발명은 DsbA 및 DsbC의 초순수 제제를 생성하는 방법을 제공한다. 용어 "Dsb" 단백질은 박테리아 이황화 산화환원효소를 지칭한다. DsbA는 펩티드가 세포의 주변세포질으로 나타남에 따라 쇄내 이황화 결합을 형성하며 그리고 DsbC는 세포의 주변세포질에서 산화적 단백질-접힘 동안 이황화 결합 이소머라아제로서 작용한다. 일부 구현예에서, DsbA 및 DsbC는 박테리아로부터 유도된다. 일부 구현예에서, DsbA 및 DsbC 폴리펩티드는 이. 콜라이 DsbA 및 DsbC 폴리펩티드이다. 기타 구현예에서, DsbA 및 DsbC 폴리펩티드는 하기 중 임의의 종 유래의 것이다: 엔테로박테리아 ( Enterobacteria ), 아크티네토박터 (Actinetobacter), 아조아르쿠스 ( Azoarcus ), 살모넬라(Salmonella), 부크네라 ( Buchnera ), 자일엘라 (Xylella), 잔 토모나스(Xanthmonas), 캄필로박터 ( Campylobacter ), 쉬겔라( Shigella ), 슈도모나스(Pseudomonas), 예르시나 ( Yersina ), 에르위니아 ( Erwinia ), 및 나이세리아 (Neisseria). 일부 구현예에서, DsbA 폴리펩티드는 서열 번호: 1의 아미노산 서열을 포함한다. 일부 구현예에서, DsbA 폴리펩티드는 서열 번호: 1의 아미노산 서열과 적어도 약 70%, 75%, 80%, 85%, 90%, 95%, 또는 99% 동일성 중 임의의 것을 갖는 아미노산 서열을 포함한다. 일부 구현예에서, DsbC 폴리펩티드는 서열 번호: 3의 아미노산 서열을 포함한다. 일부 구현예에서, DsbC 폴리펩티드는 서열 번호: 3의 아미노산 서열과 적어도 약 70%, 75%, 80%, 85%, 90%, 95%, 또는 99% 동일성 중 임의의 것을 갖는 아미노산 서열을 포함한다.
본 명세서에서 기재된 방법을 사용하여 정제되어 지는 DsbA 및 DsbC 폴리펩티드는 재조합 기술을 사용하여 일반적으로 생산된다. 박테리아 내에 재조합 폴리펩티드를 생산하는 방법은 당해 기술에 공지되어 있다. 재조합 기술을 이용하는 경우, 폴리펩티드는 세포 내에서 생산되거나, 원형질막 주위 공간에서 생산되거나 또는 배지 내로 직접 분비될 수 있다. 일부 구현예에서, DsbA 또는 DsbC를 암호화하는 핵산은 폴리펩티드의 과발현을 위해 숙주세포에 도입된다. 일부 구현예에서, DsbA 또는 DsbC를 암호화하는 핵산은 발현 벡터; 예를 들면, 플라스미드로부터 과발현된다. 일부 구현예에서, DsbA 폴리펩티드를 암호화하는 핵산은 서열번호: 2의 핵산 서열을 포함한다. 일부 구현예에서, DsbA 를 암호화하는 핵산은 서열 번호: 2의 핵산 서열과 적어도 약 70%, 75%, 80%, 85%, 90%, 95%, 또는 99% 동일성 중 임의의 것을 갖는 핵산 서열을 포함한다. 일부 구현예에서, DsbC를 암호화하는 핵산은 서열번호: 4의 핵산 서열을 포함한다. 일부 구현예에서, DsbC를 암호화하는 핵산은 서열 번호: 3의 핵산 서열과 적어도 약 70%, 75%, 80%, 85%, 90%, 95%, 또는 99% 동일성 중 임의의 것을 갖는 핵산 서열을 포함한다.
폴리펩티드는 배양 배지 또는 숙주 세포 용해물로부터 회수될 수 있다. 폴리펩티드의 발현에 이용된 세포는 다양한 물리적 또는 화학적 수단, 예컨대 냉각-해동 주기링, 초음파처리, 기계적 교란, 또는 세포 용해 제제에 의해 교란될 수 있다. 폴리펩티드가 세포내로 생산되는 경우, 제1 단계로 숙주 세포 또는 용해된 단편인 미립자 잔해가, 예를 들면 원심분리 또는 한외여과에 의해 제거된다. 문헌 [Carter et al., Bio/Technology 10: 163-167 (1992)]는 이. 콜라이의 원형질막 주위 공간에 분비되는 폴리펩티드를 단리하기 위한 절차를 기재한다. 간략히, 세포 페이스트를 아세트산나트륨 (pH 3.5), EDTA, 및 페닐메틸설포닐플루오라이드 (PMSF)의 존재 하에 약 30분에 걸쳐서 해동시킨다. 세포 파편을 원심분리로 제거할 수 있다. 폴리펩티드가 배지 내로 분비되는 경우, 그와 같은 발현계의 상청액은 일반적으로 먼저 상업적으로 이용가능한 폴리펩티드 농축 필터, 예를 들면 Amicon 또는 Millipore Pellicon 한외여과 단위를 이용해서 농축된다. 프로테아제 억제제, 예컨대 PMSF가 단백질분해를 억제하기 위해 임의의 전술된 단계에 포함될 수 있고, 항생제가 우발적인 오염물질의 성장을 예방하기 위해 포함될 수 있다.
IV.
DsbA
및/또는
DsbC를
위한 폴리펩티드가 생산에 사용될 수 있다.
단백질 접힘 및 조립가 DsbA 및/또는 DsbC의 과발현에 의해 보조될 수 있는 박테리아(예컨대, 이 콜라이)에서 생성될 수 있는 폴리펩티드의 예는, 비제한적으로 면역글로불린, 면역접합체, 항체, 효소, 호르몬, 융합 단백질, Fc-함유 단백질, 면역접합체, 사이토카인 및 인터류킨을 포함한다. 폴리펩티드의 예는 포유동물 단백질, 예를 들면, 예컨대 비제한적으로 하기를 포함한다: 레닌; 호르몬: 인간 성장 호르몬 및 소 성장 호르몬을 포함하는 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 지질단백질; 알파-1-항트립신; 인슐린 A-쇄; 인슐린 B-쇄; 프로인슐린; 여포자극 호르몬; 칼시토닌; 황체형성 호르몬; 글루카곤; 응고 인자 예컨대 인자 VIIIC, 인자 IX, 조직 인자, 및 폰빌레브란트 인자; 항-응고 인자 예컨대 단백질 C; 심방 나트륨 이뇨 인자; 폐 계면활성제; 플라스미노겐 활성제, 예컨대 우로키나제 또는 인간 소변 또는 조직-유형 플라스미노겐 활성제 (t-PA); 봄베신; 트롬빈; 조혈 성장 인자; 종양 괴사 인자-알파 및 -베타; 엔케팔리나제; RANTES (활성화에 대해 조절된 일반적으로 T-세포 발현된 및 분비된); 인간 대식세포 염증성 단백질 (MIP-1-알파); 혈청 알부민 예컨대 인간 혈청 알부민; 뮐러관 억제 물질(Muellerian-inhibiting substance); 릴락신 A-쇄; 릴락신 B-쇄; 프로릴락신; 마우스 성선자극호르몬-관련된 펩티드; 효소: 미생물 단백질, 예컨대 베타-락타마제; DNase; IgE; 세포독성 T-림프구 관련된 항원 (CTLA), 예컨대 CTLA-4; 인히빈; 액티빈; 혈관 내피 성장 인자 (VEGF); 호르몬 또는 성장 인자를 위한 수용체; 단백질 A 또는 D; 류마티스성 인자; 신경친화성 인자 예컨대 골-유도된 신경친화성 인자 (BDNF), 뉴로트로핀-3, -4, -5 또는 -6 (NT-3, NT-4, NT-5 또는 NT-6), 또는 신경 성장 인자 예컨대 NGF-b; 혈소판-유도된 성장 인자 (PDGF); 섬유아세포 성장 인자 예컨대 aFGF 및 bFGF; 표피 성장 인자 (EGF); TGF-β1, TGF-β2, TGF-β3, TGF-β4 또는 TGF-β5를 포함하는, 형질전환 성장 인자 (TGF) 예컨대 TGF-알파 및 TGF-베타; 인슐린-유사 성장 인자-I 및 -II (IGF-I 및 IGF-II); des(1-3)-IGF-I (뇌 IGF-I), 인슐린-유사 성장 인자 결합 단백질 (IGFBPs); 시토카인: CD 단백질 예컨대 CD3, CD4, CD8, CD19 및 CD20; 에리트로포이에틴; 골유도성 인자; 면역독소; 융합 폴리펩티드, 즉, 재조합 핵산에 의하여 암호화되고, 2 이상의 이종성 폴리펩티드 또는 이의 단편 상에 구성된 폴리펩티드; Fc-함유 폴리펩티드, 예를 들어, 제2 폴리펩티드에 융합된, 면역글로불린 Fc 영역, 또는 이의 단편을 포함하는 융합 단백질; 면역콘주게이트; 골 형성 단백질 (BMP); 인터페론 예컨대 인터페론-알파, -베타, 및 -감마; 집락 자극 인자 (CSF), 예를 들면, M-CSF, GM-CSF 및 G-CSF; 인터루킨 (ILs), 예를 들면, IL-1 내지 IL-10; 수퍼록사이드 디스무타제; T-세포 수용체; 표면 막 단백질; 붕괴 촉진 인자; 바이러스 항원, 예를 들면, AIDS 봉입체의 일부; 수송 단백질; 귀소 수용체; 아드레신; 조절 단백질; 인테그린 예컨대 CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 및 VCAM; 종양 관련된 항원 예컨대 CA125 (난소암 항원) 또는 HER2, HER3 또는 HER4 수용체; 면역접합체; 및 임의의 상기-열거된 단백질의 단편 및/또는 변이체 뿐만 아니라, 예를 들면, 임의의 상기-열거된 단백질을 포함하는 단백질에 결합하는, 항체 단편을 포함하는 항체.
일부 구현예에서, 본원에 기술된 검정 방법 중 임의의 것에서 사용하기 위한 폴리펩티드 제제는 관심 항체를 함유하며, 즉, 숙주 세포에 의하여 생산된 재조합 폴리펩티드는 항체이다.
상기 항체에 대한 분자 표적은 하기를 비제한적으로 포함하는 CD 단백질 및 이들의 리간드를 포함한다: (i) CD3, CD4, CD8, CD19, CD11a, CD20, CD22, CD34, CD40, CD79? (CD79a), 및 CD79? (CD79b); (ii) ErbB 수용체 계열 예컨대 EGF 수용체, HER2, HER3 또는 HER4 수용체의 구성원; (iii) 세포 콘주게이트 분자 예컨대 LFA-1, Mac1, p150,95, VLA-4, ICAM-1, VCAM 및 αv/β3 인테그린으로, 이들의 알파 또는 베타 소단위를 포함함 (예컨대, 항-CD11a, 항-CD18 또는 항-CD11b 항체); (iv) 성장 인자 예컨대 VEGF; IgE; 혈액형 항원; flk2/flt3 수용체; 비만(OB) 수용체; mpl 수용체; CTLA-4; 단백질 C, BR3, c-met, 조직 인자, β7 등; 및 (v) 세포 표면 및 막투과성 종양-관련된 항원 (TAA), 예컨대 미국 특허 번호 7,521,541에 기재된 것들.
다른 예시적인 항체는, 비제한적으로, 항-에스트로겐 수용체 항체, 항-프로게스테론 수용체 항체, 항-p53 항체, 항-HER-2/neu 항체, 항-EGFR 항체, 항-카텝신 D 항체, 항-Bcl-2 항체, 항-E-카드헤린 항체, 항-CA125 항체, 항-CA15-3 항체, 항-CA19-9 항체, 항-c-erbB-2 항체, 항-P-당단백질 항체, 항-CEA 항체, 항-망막모세포종 단백질 항체, 항-ras 종양단백질 항체, 항-루이스 X 항체, 항-Ki-67 항체, 항-PCNA 항체, 항-CD3 항체, 항-CD4 항체, 항-CD5 항체, 항-CD7 항체, 항-CD8 항체, 항-CD9/p24 항체, 항-CD10 항체, 항-CD11a 항체, 항-CD11c 항체, 항-CD13 항체, 항-CD14 항체, 항-CD15 항체, 항-CD19 항체, 항-CD20 항체, 항-CD22 항체, 항-CD23 항체, 항-CD30 항체, 항-CD31 항체, 항-CD33 항체, 항-CD34 항체, 항-CD35 항체, 항-CD38 항체, 항-CD41 항체, 항-LCA/CD45 항체, 항-CD45RO 항체, 항-CD45RA 항체, 항-CD39 항체, 항-CD100 항체, 항-CD95/Fas 항체, 항-CD99 항체, 항-CD106 항체, 항-유비퀴틴 항체, 항-CD71 항체, 항-c-myc 항체, 항-사이토케라틴 항체, 항-비멘틴 항체, 항-HPV 단백질 항체, 항-카파 경쇄 항체, 항-람다 경쇄 항체, 항-멜라로솜 항체, 항-전립선 특이적 항원 항체, 항-S-100 항체, 항-타우 항원 항체, 항-피브린 항체, 항-케라틴 항체 및 항-Tn-항원 항체로부터 선택될 것들을 포함한다.
다클론성
항체
일부 구현예에서, 항체는 다클론성 항체이다. 다클론성 항체는 관련된 항원 및 아쥬반트의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 바람직하게는 상승된다. 면역화되기 위해 종에서 면역원성인 폴리펩티드, 예를 들면, 키홀 림펫 헤모시아닌, 혈청 알부민, 소 티로글로불린, 또는 이중작용성을 갖는 대두 트립신 억제제 또는 유도화제, 예를 들어, 말레이미도벤조일 설포석신이미드 에스테르 (시스테인 잔기를 통한 콘주게이션), N-하이드록시석신이미드 (라이신 잔기를 통한), 글루타르알데하이드, 석신산 무수물, SOCl2, 또는 R1N=C=NR (여기에서 R 및 R1은 상이한 알킬기이다)에 관련된 항원을 콘주게이션하는 것이 유용할 수 있다.
동물은, 예를 들면, (토끼 또는 마우스, 각각용) 100 μg 또는 5 μg의 폴리펩티드 또는 콘주게이트를 3 용적의 프로인트 완전 아쥬반트와 조합 및 다중 부위에서 진피내로 용액 주사에 의해 항원, 면역원성 콘주게이트, 또는 유도체에 대해 면역화된다. 1 개월 후 동물은 다중 부위에서 피하 주사에 의해 프로인트 완전 아쥬반트에서 펩티드 또는 콘주게이트의 최초 양의 1/5 내지 1/10로 부스팅된다. 7 내지 14 일 후 동물은 채혈되고 혈청은 항체 역가에 대하여 검정된다. 동물은 역가 안정기까지 부스팅된다. 일부 구현예에서, 동물은 동일한 항원의 콘주게이트로 부스팅되지만, 상이한 폴리펩티드에 및/또는 상이한 가교결합 시약을 통해 콘주게이트된다. 콘주게이트는 또한 폴리펩티드 융합으로서 재조합 세포 배양물에서 제조될 수 있다. 또한, 응집화 제제 예컨대 명반은 면역 반응을 증진시키기 위해 적합하게 사용된다.
단클론성
항체
일부 구현예에서, 항체는 단클론성 항체이다. 단클론성 항체는 실질적으로 균질한 항체의 집단으로부터 얻어지며, 즉 집단을 포함하는 개별적인 항체는 단클론성 항체의 생산 동안 발생하는 가능한 변이체를 제외하고 동일한 에피토프에 동일하거나 및/또는 결합하며, 이러한 변이체는 일반적으로 소량으로 존재한다. 따라서, 수식어 "단클론성"은 구별되거나 다클론성 항체의 혼합물이 아닌 항체의 특징을 나타낸다.
예를 들어, 상기에 기재된 바와 같이, 단클론성 항체는 먼저 문헌 [Kohler et al., Nature 256:495 (1975)]에 의해 기재된 하이브리도마 방법을 사용하여 제작될 수 있거나, 재조합 DNA 방법(미국 특허 번호 4,816,567)에 의해 제작될 수 있다.
하이브리도마 방법에서, 마우스 또는 다른 적절한 숙주 동물이 본원에 기술된 바와 같이 면역화되어 면역화를 위해 사용된 폴리펩티드에 특이적으로 결합하는 항체를 생산하거나 또는 생산할 수 있는 림프구를 유도한다. 대안적으로, 림프구는 시험관내 면역화될 수 있다. 림프구는 그런 다음 하이브리도마 세포를 형성하기 위해 적합한 융합 제제, 예컨대 폴리에틸렌 글리콜을 사용하여 골수종 세포와 융합된다 (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)).
이렇게 제조된 하이브리도마 세포를 바람직하게는 비융합된, 친계 골수종 세포의 성장 또는 생존을 억제하는 하나 이상의 물질을 함유하는 적합한 배양 배지에 씨딩하고 성장시킨다. 예를 들어, 만약 친계 골수종 세포가 효소 하이포잔틴 구아닌 포스포리보실전달효소 (HGPRT 또는 HPRT)가 부재하다면, 하이브리도마 세포를 위한 배양 배지는 전형적으로 하기를 포함할 것이다: HGPRT-결핍 세포의 성장을 방지하는 물질인, 하이포잔틴, 아미노프테린, 및 티미딘 (HAT 배지).
일부 구현예에서, 골수종 세포는 효율적으로 융합하고, 선택된 항체-생산 세포에 의한 안정한 고 수준의 항체 생산을 지지하는 것들이고, 이는 예컨대 HAT 배지와 같은 배지에 민감성이다. 무엇보다도, 일부 구현예에서, 골수종 세포주는, 비제한적으로, 뮤린 골수종 세포주, 예컨대 미국 캘리포니아주 샌디에이고 소재의 솔크 연구소 세포 분배 센터로부터 이용가능한 MOPC-21 및 MPC-11 마우스 종양, 및 메릴랜드주 록빌 소재의 미국 종균 협회로부터 이용가능한 SP-2 또는 X63-Ag8-653 세포로부터 유도된 것들을 포함한다. 인간 골수종 및 마우스-인간 이종성골수종 세포주가 또한, 인간 단클론성 항체의 생산에 대해 하기와 같이 기술되었다: Kozbor, J. Immunol. 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications pp. 51-63 (Marcel Dekker, Inc., New York, 1987).
하이브리도마 세포가 성장하는 배양 배지는 항원에 대한 단클론성 항체의 생성에 대해 분석된다. 일부 구현예에서, 하이브리도마 세포에 의하여 생산된 단클론성 항체의 결합 특이성은 하기에 의하여 측정된다: 면역 침전 또는 시험관내 결합 검정, 예컨대 방사면역검정 (RIA) 또는 효소-연결 면역흡착 검정 (ELISA).
단클론성 항체의 결합 친화도는, 예를 들어 하기에 의하여 측정될 수 있다: 스케쳐드(Scatchard) 분석 (Munson et al., Anal. Biochem. 107:220 (1980)).
목적 특이성, 친화도, 및/또는 활성의 항체를 생산하는 하이브리도마 세포가 식별된 후, 클론은 희석 절차를 제한함에 의해 아클론되고 그리고 표준 방법에 의해 성장될 수 있다 (Goding, Monoclonal Antibodies: Principles and Practice pp. 59-103 (Academic Press, 1986)). 이러한 목적을 위해 적합한 배양 배지는, 예를 들면, D-MEM 또는 RPMI-1640 배지를 포함한다. 또한, 하이브리도마 세포는 동물에서 복수 종양으로 생체내에서 성장될 수 있다.
서브클론에 의하여 분비된 단클론성 항체는 기존 면역글로불린 정제 절차, 예컨대 폴리펩티드 A-세파로오스(세파로오스), 하이드록실아퍼타이트 크로마토그래피, 겔 전기영동, 투석, 또는 친화성 크로마토그래피에 의해 배양 배지 또는 복수 유체 또는 혈청으로부터 적절하게 분리된다.
단클론성 항체를 암호화하는 DNA는 통상적인 방법을 사용하여 용이하게 분리시키고 서열화한다 (예를 들어, 특히 뮤린 항체의 중쇄 및 경쇄를 암호화하는 유전자에 결합될 수 있는 올리고뉴클레오티드 프로브를 사용함으로써). 일부 구현예에서, 하이브리도마 세포는 이러한 DNA의 공급원으로서 사용된다. 일단 단리되면, DNA는 발현 벡터 내에 배치될 수 있으며, 그 다음 발현 벡터는 숙주 세포, 예컨대 이. 콜라이 세포, 원숭이 COS 세포, 인간 배아 신장 (HEK) 293 세포, 차이니즈 햄스터 난소 (CHO) 세포, 또는 달리는 면역글로불린 폴리펩티드를 생성하지 않는 골수종 세포 내로 형질감염되어, 재조합 숙주 세포에서 단일클론 항체의 합성물을 얻는다. 항체를 암호화하는 DNA의 세균내 재조합 발현에 대한 검토 기사는 [Skerra et al., Curr . Opinion in Immunol. 5:256-262 (1993) 및 , Immunol . Revs., 130:151-188 (1992)]를 포함한다.
추가 구현예에서, 항체 또는 항체 단편은, 예를 들면 하기에 기재된 기술을 사용하여 항체 파아지 라이브러리로부터 단리될 수 있다: McCafferty et al., Nature 348:552-554 (1990). 문헌 [Clackson et al., Nature 352:624-628 (1991) 및 Marks et al., J. Mol . Biol . 222:581-597 (1991)]은 각각 파아지 라이브러리를 사용한, 뮤린 및 인간 항체의 단리를 기술한다. 후속의 공보는 매우 큰 파아지 라이브러리(하기 문헌)에 대한 전략으로서 쇄 셔플링(문헌 [Marks et al., Bio/Technology 10:779-783 (1992)])에 의한 고친화도(nM 범위) 인간 항체의 생산뿐만 아니라 조합 감염 및 생체내 재조합을 기술한다: Waterhouse et al., Nuc . Acids. Res. 21:2265-2266 (1993). 따라서, 이들 기술은 단클론성 항체의 단리를 위한 전통적인 단클론성 항체 하이브리도마 기술에 대한 실행 가능한 대안이다.
DNA는 또한, 예를 들면, 상동성 뮤린 서열 [하기 문헌] 대신 인간 중쇄 및 경쇄 불변 도메인을 위한 암호화 서열을 치환함으로써, 또는 비-면역글로불린 폴리펩티드를 위한 면역글로불린 암호화 서열 모두 또는 암호화 서열의 일부에 공유적으로 연결함으로써 변형될 수 있다: 미국 특허 번호 4,816,567; Morrison et al., Proc. Natl Acad. Sci. USA 81:6851 (1984)).
전형적으로 이러한 비-면역글로불린 폴리펩티드는 항체의 불변 도메인에 대해 치환되거나, 또는 이들은 항체의 일 항원-결합 부위의 가변 도메인에 대해 치환되어 항원에 대한 특이성을 갖는 일 항원-결합 부위 및 상이한 항원에 대한 특이성을 갖는 또 다른 항원-결합 부위를 포함하는 키메라성 2가 항체를 만든다.
본 명세서에서 기재된 임의의 방법의 일부 구현예에서, 항체는 IgA, IgD, IgE, IgG, 또는 IgM이다. 일부 구현예에서, 항체는 IgG 단클론성 항체이다.
항체 단편
일부 구현예에서, 항체는 항체 단편이다. 항체 단편의 생산을 위하여 다양한 기술이 개발되었다. 전통적으로, 이들 단편은 무손상 항체의 단백분해 소화를 통해 유도되었다 (참고: 예를 들면, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) 및 Brennan et al., Science 229:81 (1985)). 그러나, 이들 단편은 재조합 숙주 세포에 의해 직접적으로 이제 생산될 수 있다. 예를 들어, 항체 단편은 상기 고찰된 항체 파아지 라이브러리로부터 단리될 수 있다. 항체 단편은 항체 파지 라이브러리에서 단리될 수 있다. 대안적으로, Fab'-SH 단편은 이. 콜라이에서 직접 회수되고 화학적으로 커플링되어 F(ab')2 단편을 형성할 수 있다(Carter et al., Bio/Technology 10:163-167 (1992)). 또 다른 접근에 따르면, F(ab')2 단편은 재조합 숙주 세포 배양으로부터 직접 단리될 수 있다. 항체 단편을 생산하기 위한 다른 기술은 당업자에게 명백할 것이다. 기타 구현예에서, 선택된 항체는 단일쇄 Fv 단편 (scFv)이다. 참고: WO 93/16185; 미국 특허 번호 5,571,894; 및 미국 특허 번호 5,587,458. 항체 단편은 또한, 예를 들면, 미국 특허 5,641,870에서, 예를 들어 기재된 바와 같이 "선형 항체"일 수 있다. 상기 선형 항체 단편은 단일특이적 또는 이중특이적일 수 있다.
일부 구현예에서, 본원에 기술된 항체 단편이 제공된다. 일부 구현예에서, 항체 단편은 항원-결합 단편이다. 일부 구현예에서, 항원 결합 단편은 Fab 단편, Fab' 단편, F(ab')2 단편, scFv, Fv, 및 디아바디로 구성된 군으로부터 선택된다.
폴리펩티드
변이체
및 변형
특정 구현예에서, 본원에서 단백질의 아미노산 서열 변이체가 고려된다. 예를 들어, 상기 단백질의 결합 친화도 및/또는 기타 생물학적 특성들을 증진시키는 것이 바람직한 일일 수 있다. 단백질의 아미노산 서열 변이체는 단백질을 암호화하는 뉴클레오티드 서열로 적당한 변형을 도입하거나 펩티드 합성에 의해 제조될 수 있다. 이러한 변형은, 예를 들면, 단백질의 아미노산 서열 내의 잔기의 결실, 및/또는 삽입 및/또는 치환을 포함한다. 최종 작제물에 도달하도록 결실, 삽입, 및 치환의 임의의 조합이 이루어질 수 있으며, 단 최종 작제물은 목적하는 특징, 예컨대, 항원-결합을 가져야 한다.
변이체
폴리펩티드
"폴리펩티드 변이체"는, 본 명세서에서 정의된 바와 같이 폴리펩티드의 전장 천연 서열, 신호 펩티드를 결하는 폴리펩티드 서열, 신호 펩티드의 유무에 관계없이 폴리펩티드의 세포외 도메인과 적어도 약 80% 아미노산 서열 동일성을 갖는 폴리펩티드, 예를 들면, 활성 폴리펩티드를 의미한다. 이러한 폴리펩티드 변이체는, 예를 들면, 하나 이상의 아미노산 잔기가 전장 천연 아미노산 서열의 N 또는 C-말단에서 첨가되거나, 또는 결실된 폴리펩티드를 포함한다. 통상적으로, 폴리펩티드 변이체는 전장 천연 서열 폴리펩티드, 신호 펩티드를 결하는 폴리펩티드 서열, 신호 펩티드의 유무에 관계없이 폴리펩티드의 세포외 도메인에 적어도 약 80% 아미노산 서열 동일성, 대안적으로 적어도 약 임의의 85%, 90%, 95%, 96%, 97%, 98%, 또는 99% 아미노산 서열 동일성을 가질 것이다. 선택적으로, 변이체 폴리펩티드는 천연 폴리펩티드 서열에 비교하여 1 이하 보존적 아미노산 치환, 대안적으로 천연 폴리펩티드 서열에 비교하여 약 임의의 2, 3, 4, 5, 6, 7, 8, 9, 또는 10 이하 보존적 아미노산 치환을 가질 것이다.
변이체 폴리펩티드는 N-말단 또는 C-말단에서 절단될 수 있고, 또는 예를 들면, 전장 천연 폴리펩티드와 비교될 때, 내부 잔기를 결할 수 있다. 특정 변이체 폴리펩티드는 목적 생물학적 활성을 위해 필수적이지 않은 아미노산 잔기를 갖지 결할 수 있다. 절단, 결실 및 삽입을 갖는 이들 변이체 폴리펩티드는 임의의 수의 종래의 기술에 의해 제조될 수 있다. 목적 변이체 폴리펩티드는 화학적으로 합성될 수 있다. 또 다른 적합한 기술은 중합효소 연쇄 반응(PCR)에 의해 목적 변이체 폴리펩티드를 암호화하는 핵산 단편을 단리하고 증폭하는 것을 포함한다. 핵산 단편의 목적 말단을 한정하는 올리고뉴클레오티드는 PCR에서 5' 및 3' 프라이머에서 이용된다. 바람직하게는, 변이체 폴리펩티드는 본 명세서에 개시된 천연 폴리펩티드와 적어도 하나의 생물학적 및/또는 면역학적 활성을 공유한다.
아미노산 서열 삽입은 하나의 잔기 내지는 백 개 이상의 잔기를 함유하는 함유하는 폴리펩티드의 길이에 이르는 아미노- 및/또는 카르복실-말단 융합, 뿐만 아니라 단일 또는 다중 아미노산 잔기의 서열내 삽입을 포함한다. 말단 삽입의 예는 N-말단 메티오닐 잔기를 갖는 항체 또는 세포독성 폴리펩티드에 융합된 항체를 포함한다. 항체 분자의 다른 삽입 변이체는 항체의 혈청 반감기를 증가시키는 효소 또는 폴리펩티드에 대한 항체의 N- 또는 C-말단에 대한 융합을 포함한다.
예를 들어, 상기 폴리펩티드의 결합 친화도 및/또는 기타 생물학적 특성들을 증진시키는 것이 바람직한 일일 수 있다. 폴리펩티드의 아미노산 서열 변이체는 적절한 뉴클레오티드 변화를 항체 핵산에 도입하거나 펩티드 합성에 의해 제조된다. 이러한 변형은, 예를 들면, 폴리펩티드의 아미노산 서열 내의 잔기의 결실, 및/또는 삽입 및/또는 치환을 포함한다. 최종 작제물에 도달하도록 결실, 삽입, 및 치환의 임의의 조합이 이루어지며, 단 최종 작제물은 목적하는 특징, 예컨대, 항원-결합을 가져야 한다. 아미노산 변화는 또한 글리코실화 부위의 수 또는 위치를 변화시키는 것과 같은 폴리펩티드(예컨대, 항체)의 번역 후 과정을 변화시킬 수 있다.
목적 활성에 부정적으로 영향을 미침이 없이 아미노산 잔기가 삽입, 치환 또는 결실될 수 있는가를 계측하기 위한 지침은 폴리펩티드의 서열을 동종의 공지된 폴리펩티드 분자의 서열과 비교하고, 높은 상동성의 영역에서 만들어진 아미노산 서열 변화의 수를 최소화함에 의해 알려질 수 있다.
돌연변이유발을 위한 바람직한 위치인, 폴리펩티드 (예컨대, 항체)의 특정 잔기들 또는 영역들의 식별을 위해 유용한 방법은 다음 문헌에 기재된 바와 같이 “알라닌 스캐닝 돌연변이유발”로 불리운다: Cunningham and Wells, Science 244:1081-1085 (1989). 여기서, 잔기 또는 표적 잔기의 그룹이 식별되었고 (예컨대, 하전된 잔기 예컨대 Arg, Asp, His, Lys, 및 Glu) 중성 또는 음으로 하전된 아미노산(가장 바람직하게는 알라닌 또는 폴리알라닌)으로 대체되어 항원과 아미노산의 상호작용에 영향을 미친다. 치환에 대한 작용성 민감성을 입증하는 아미노산 위치는 그런 다음 치환의 부위에 대해 또는 치환 부위에 다른 변이체를 추가로 도입함에 의해 정제된다. 따라서, 아미노산 서열 변동을 도입하기 위한 부위는 예정된 반면, 돌연변이 자체의 특성은 예정될 필요가 없다. 예를 들면, 주어진 부위에서 돌연변이의 수행을 분석하기 위해, ala 스캐닝 또는 무작위 돌연변이유발이 표적 코돈 또는 영역에서 수행되고, 그리고 과발현된 항체 변이체가 목적 활성에 대해 선별된다.
또 다른 유형의 변이체는 아미노산 치환 변이체이다. 이들 변이체는 상이한 잔기에 의해 대체된 항체 분자 내 적어도 1종의 아미노산 잔기를 가진다. 치환적 돌연변이유발에 관심이 큰 부위는 초가변 영역을 포함하지만, FR 변경이 또한 고려된다. 만일 상기 치환이 생물학적 활성에서 변화를 초래한다면, 표 1에서 "예시적인 치환"으로 명명된, 또는 아미노산 클래스를 참조하여 아래 추가로 기재된 바와 같은 더욱 실질적인 변화가 도입될 수 있고 생성물이 스크리닝될 수 있다.
| 본래 잔기 |
예시적 치환 |
보존적 치환 |
| Ala (A) | Val; Leu; Ile | Val |
| Arg (R) | Lys; Gln; Asn | Lys |
| Asn (N) | Gln; His; Asp, Lys; Arg | Gln |
| Asp (D) | Glu; Asn | Glu |
| Cys (C) | Ser; Ala | Ser |
| Gln (Q) | Asn; Glu | Asn |
| Glu (E) | Asp; Gln | Asp |
| Gly (G) | Ala | Ala |
| His (H) | Asn; Gln; Lys; Arg | Arg |
| Ile (I) | Leu; Val; Met; Ala; Phe; 노르류신 | Leu |
| Leu (L) | 노르류신; Ile; Val; Met; Ala; Phe | Ile |
| Lys (K) | Arg; Gln; Asn | Arg |
| Met (M) | Leu; Phe; Ile | Leu |
| Phe (F) | Trp; Leu; Val; Ile; Ala; Tyr | Tyr |
| Pro (P) | Ala | Ala |
| Ser (S) | Thr | Thr |
| Thr (T) | Val; Ser | Ser |
| Trp (W) | Tyr; Phe | Tyr |
| Tyr (Y) | Trp; Phe; Thr; Ser | Phe |
| Val (V) | Ile; Leu; Met; Phe; Ala; 노르류신 | Leu |
폴리펩티드의 생물학적 특성에서 실질적인 변형은 (a) 예를 들면, 시트 또는 나선 형태로서, 치환의 구역에서 폴리펩티드 골격의 구조, (b) 표적 부위에서 분자의 전하 또는 소수성, 또는 (c) 측쇄의 벌크 유지에서 그 효과가 유의미하게 상이한 치환을 선택함으로써 달성된다. 아미노산은 이들의 측쇄의 특성의 유사성에 따라 그룹화될 수 있다 (참고: A. L. Lehninger, Biochemistry second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) 비극성: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) 비하전 극성: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) 산성: Asp (D), Glu (E)
(4) 염기성: Lys (K), Arg (R), His(H)
대안적으로, 천연 발생 잔기는 하기 공통의 측쇄 특성에 기반하여 그룹으로 분할될 수 있다:
(1) 소수성: 노르류신, Met, Ala, Val, Leu, Ile;
(2) 중성 친수성: Cys, Ser, Thr, Asn, Gln;
(3) 산성: Asp, Glu;
(4) 염기성: His, Lys, Arg;
(5) 쇄 배향에 영향을 주는 잔기: Gly, Pro;
(6) 방향족: Trp, Tyr, Phe.
비-보존적 치환은 이들 부류 중의 하나의 구성원을 다른 부류로 교체함을 수반할 것이다.
항체의 적절한 형태 유지에 관여되지 않은 임의의 시스테인 잔기는 또한, 일반적으로 세린과 함께, 치환되어, 분자의 산화적 안정성을 개선할 수 있고 그리고 비정상적인 가교결합을 예방할 수 있다. 반대로, 시스테인 결합(들)은, 특히 폴리펩티드가 항체 단편 예컨대 Fv 단편인 경우, 항체에 첨가되어 그 안정성을 개선할 수 있다.
치환형 변이체의 한 예시는 친계 항체 (예컨대 인간화 항체)의 하나 또는 그 초과 초가변 영역 잔기의 치환을 포함한다. 일반적으로, 추가의 전개를 위해 선택된 수득한 변이체(들)는 이들이 생성된 모 항체와 비교하여 개선된 생물학적 특성을 가질 것이다. 이러한 치환형 변이체를 생성하는데 편리한 방법은 파아지 디스플레이를 이용한 친화도 성숙을 포함한다. 간단하게는, 몇 개의 초가변성 영역 부위(예컨대, 6-7 부위)가 돌연변이되어 각 부위에서 모든 가능한 아미노 치환을 생성한다. 이렇게 생성된 항체 변이체는 각 입자 내에 포장된 M13의 유전자 III 생성물에 대한 융합으로서 섬사상 파아지 입자로부터 1가 방식으로 표시된다. 파아지-표시된 변이체는 그런 다음 본 명세서에서 개시된 바와 같은 이의 생물학적 활성(예컨대, 결합 친화도)에 대해 선별된다. 변형을 위한 후보 초가변성 영역 부위를 식별하기 위해, 알라닌 스캐닝 돌연변이유발이 항원 결합에 유의미하게 기여하는 초가변성 영역 잔기를 식별하기 위해 수행될 수 있다. 대안적으로, 또는 추가로, 항체와 표적 간의 접촉 지점을 식별하기 위한 항원-항체 착물의 결정 구조를 분석하는 것이 이점을 가질 수 있다. 이러한 접촉 잔기 및 인접하는 잔기는 본 명세서에서 정교화된 기술에 따른 치환을 위한 후보자이다. 일단 이러한 변이체가 생성되면, 변이체의 패널은 본 명세서에서 기재된 바와 같이 스크리닝 대상이 되고, 그리고 하나 이상의 관련된 검정에서 우수한 특성을 갖는 항체를 추가의 개발을 위해 선택될 수 있다.
폴리펩티드의 또 다른 유형의 아미노산 변이체는 항체의 최초 글리코실화 패턴을 변경한다. 폴리펩티드는 비-아미노산 모이어티를 포함할 수 있다. 예를 들면, 폴리펩티드는 글리코실화될 수 있다. 이러한 글리코실화는 숙주세포 또는 숙주 유기체에서 폴리펩티드의 발현 중에 자연적으로 발생할 수 있거나 인간의 개입으로부터 의도적인 변형일 수 있다. 변경하는 것은 폴리펩티드에서 발견되는 하나 이상의 탄수화물 모이어티를 결실하는 것 및/또는 폴리펩티드에 존재하지 않는 하나 이상의 글리코실화 부위를 첨가하는 것을 의미한다.
폴리펩티드의 글리코실화는 전형적으로 N-연결 또는 O-연결된다. “N-연결됨”은 탄수화물 모이어티가 아스파라긴 잔기의 측쇄에 결합하는 것을 말한다. 트리펩티드 서열 아스파라긴-X-세린, 및 아스파라긴-X-트레오닌 (여기에서 X는 프롤린을 제외한 임의의 아미노산이다)은 아스파라긴 측쇄에 탄수화물 모이어티의 효소 부착을 위한 인식 서열이다. 따라서, 폴리펩티드내 상기 트리펩티드 서열의 존재는 잠재적인 글리코실화 부위를 생성한다. O-연결된 글리코실화는 하이드록시아미노산, 가장 일반적으로는 세린 또는 트레오닌으로의 당 N-아세틸갈락토사민, 갈락토오스 또는 자일로스의 부착을 의미하지만, 5-하이드록시프롤린 또는 5-하이드록시라이신이 또한 사용될 수 있다.
폴리펩티드에 글리코실화 부위의 첨가는 아미노산 서열을 변경함으로써 편리하게 달성되고 이로써 (N-연결 글리코실화 부위에 대한) 상기-기재된 트리펩티드 서열 중 하나 이상을 함유한다. 변경은 또한 (O-연결 글리코실화 부위에 대한) 최초 항체의 서열에 하나 이상의 세린 또는 트레오닌 잔기의 첨가, 또는 치환에 의해 실시될 수 있다.
폴리펩티드 상에 존재하는 탄수화물 모이어티의 제거는 화학적으로 또는 효소적으로 또는 글리코실화의 표적으로 작용하는 아미노산 잔기에 대해 암호화하는 코돈의 돌연변이 치환에 의해 달성될 수 있다. 폴리펩티드 상의 탄수화물 모이어티의 효소적 절단은 다양한 엔도- 및 엑소- 글리코시다아제의 사용에 의하여 달성될 수 있다.
다른 변형은 각각 상응하는 글루타밀 및 아스파르틸 잔기로 글루타미닐 및 아스파르기닐 잔기의 탈아미드화, 프롤린 및 라이신의 하이드록실화, 세릴 또는 트레오닐 잔기의 하이드록실 기의 인산화, 라이신, 아르기닌, 및 히스티딘 측쇄의 γ-아미노 기의 메틸화, N-말단 아민의 아세틸화, 및 임의의 C-말단 카르복실 기의 아미드화를 포함한다.
키메라성
폴리펩티드
본 명세서에 기재된 폴리펩티드는 또 다른, 이종성 폴리펩티드 또는 아미노산 서열에 융합된 폴리펩티드를 포함하는 키메라성 분자를 형성하는 방법으로 변형될 수 있다. 일부 구현예에서, 키메라성 분자는 항-태그 항체가 선택적으로 결합될 수 있는 에피토프를 제공하는 태그 폴리펩티드를 갖는 폴리펩티드의 융합을 포함한다. 에피토프 태그는 일반적으로 폴리펩티드의 아미노- 또는 카르복실-말단에 위치된다. 폴리펩티드의 이러한 에피토프-태그된 형태의 존재는 태그 폴리펩티드에 대한 항체를 사용하여 검출될 수 있다. 또한, 에피토프 태그의 제공은 폴리펩티드가 에피토프 태그에 결합하는 항-태그 항체 또는 또 다른 유형의 친화도 매트릭스를 사용하여 친화도 정제에 의해 쉽게 정제되도록 할 수 있다.
다중특이적 항체
특정 구현예에서, 본 명세서에서 제공된 항체는 다중특이적 항체, 예를 들면 이중특이적 항체이다. 다중특이적 항체는 최소한 두 개의 상이한 자리에 대해 결합 특이성을 갖는 단클론성 항체이다. 특정 구현예에서, 상기 결합 특이성들 중 하나는 c-met에 대한 것이고, 다른 하나는 그 밖의 다른 항원에 대한 것이다. 특정 구현예에서, 이중특이적 항체는 c-met의 상이한 2개의 에피토프에 결합할 수 있다. 이중특이적 항체가 또한 c-met을 발현하는 세포에 세포독성제를 국소화하는데 사용될 수 있다. 이중특이적 항체는 전장 항체 또는 항체 단편으로서 제조될 수 있다.
다중특이적 항체를 제조하기 위한 기술은 하기를 비제한적으로 포함한다: 상이한 특이성을 갖는 2개의 면역글로불린 중쇄-경쇄 쌍의 재조합 동시 발현 (참고: Milstein and Cuello, Nature 305: 537 (1983), WO 93/08829, 및 Traunecker et al., EMBO J. 10: 3655 (1991), 및 "크놉-인-홀" 가공 (참고: 예를 들면, 미국 특허 번호 5,731,168). 다중 특이적 항체는 또한 다음과 같이 제조될 수 있다: 항체 Fc-이종이량체 분자를 제조하기 위한 정전기 스티어링 효과를 가공함에 의해 (WO 2009/089004A1); 2개 이상의 항체 또는 단편을 가교 결합시킴에 의해 (참고: 예를 들면, 미국 특허 번호 4,676,980, 및 Brennan et al., Science, 229: 81 (1985)); 이중특이적 항체를 생산하기 위하여 류신 지퍼(leucine zipper)를 사용함으로써 (참고: 예를 들어, Kostelny et al., J. Immunol ., 148(5):1547-1553 (1992)); 이중특이적 항체 단편을 제조하디 위한 "디아바디" 기술을 사용함으로써 (참고: 예를 들어, Hollinger et al., Proc . Natl. Acad . Sci . USA, 90:6444-6448 (1993)); 및 단일쇄 Fv(sFv) 이량체를 사용함에 의해 (참고: 예를 들어, Gruber et al., J. Immunol ., 152:5368 (1994)); 및 다음 문헌에 기재된 바와 같이 3특이적 항체를 제조함에 의해, 예를 들어, Tutt et al. J. Immunol. 147: 60 (1991).
“옥토퍼스 항체"를 포함하는, 3개 이상의 작용성 항원 결합 부위를 갖는 가공된 항체는 또한 본원에 포함된다(참조: 예를 들어 US 2006/0025576A1).
본원의 항체 또는 절편에는 c-met뿐만 아니라 또 다른 상이한 항원, 예컨대 EGFR에 결합하는 항원 결합부를 포함하는 "이중 작용 FAb" 또는 "DAF"가 포함된다(예를 들어, US 2008/0069820 참조).
이중특이적 항체를 제조하는 방법은 본 분야에 알려져 있다. 전통적으로, 이중특이적 항체의 재조합 생산은 전장 이중특이적 항체의 전통적 생산은 2개의 면역글로불린 중쇄-경쇄 쌍의 공-발현에 근거하며, 여기서 2개의 중쇄는 상이한 특이성을 갖는다(Milstein and Cuello, Nature, 305: 537 (1983)). 면역글로불린 중쇄 및 경쇄의 무작위 집합으로 인하여, 이러한 하이브리도마 (4혼성체(quadroma))는 10개의 상이한 항체 분자의 잠재적 혼합물을 생산하며, 이중 오직 하나만이 정확한 이중특이적 구조를 갖는다. 보통 친화도 크로마토그래피 단계에 의하여 수행되는, 정확한 분자의 정제는 다소 번거롭고, 생성물 산출량은 낮다. 유사한 절차가 하기에 개시된다: WO 93/08829 (1993년 5월 13일 공보됨), 및 Traunecker et al., EMBO J., 10: 3655 (1991).
상이하고 더욱 바람직한 접근에 따라, 목적 결합 특이성을 갖는 항체 가변 도메인 (항체-항원 조합 부위)은 면역글로불린 불변 도메인 서열로 융합된다. 융합은 바람직하게는 면역글로불린 중쇄 불변 도메인을 갖고, 힌지, CH2 및 CH3 영역의 적어도 일부를 포함한다. 상기 융합 중 적어도 하나에서 존재하는, 경쇄 결합에 대해 필요한 부위를 함유하는, 제1 중쇄 불변 영역 (CH1)을 갖는 것이 바람직하다. 면역글로불린 중쇄 융합 및, 원할 시 면역글로불린 경쇄를 암호화하는 DNA는 개별 발현 벡터에 삽입되고, 적절한 숙주 유기체에 공-형질감염된다. 이것은 작제물에서 사용된 3개의 폴리펩티드 쇄의 불균등 비가 최적의 수율을 제공하는 경우 구현예에서 3개의 폴리펩티드 단편의 상호 분율 조정에서 큰 가요성을 제공한다. 그러나, 균등 비에서 적어도 2 폴리펩티드 쇄의 발현이 고수율을 초래하는 경우 또는 비가 특정한 유의성이 없는 경우 한 발현 벡터에서 2 또는 모든 3개의 폴리펩티드 쇄에 대한 암호화 서열을 삽입하는 것이 가능하다.
이러한 접근의 바람직한 구현예에서, 이중특이적 항체는 하나의 아암 내의 제1 결합 특이성을 갖는 혼성체 면역글로불린 중쇄 및 다른 아암 내의 혼성체 면역글로불린 중쇄-경쇄 쌍 (제2 결합 특이성을 제공)으로 구성된다. 이중특이적 분자의 오직 1/2 내의 면역글로불린 경쇄의 존재가 분리의 용이한 방법을 제공하므로, 이러한 비대칭 구조는 원치않는 면역글로불린 쇄 조합으로부터의 목적 이중특이적 화합물의 분리를 촉진하는 것으로 발견되었다. 이러한 접근은 WO 94/04690에 개시된다. 이중특이적 항체 생성의 추가적인 세부사항에 대해서는, 예를 들어, 하기를 참조한다: Suresh et al., Methods in Enzymology, 121:210 (1986).
또 다른 접근에 따르면, 항체 분자 페어 간의 계면은 재조합 세포 배양으로부터 회수되는 이종이량체 백분율을 최대화하기 위해 가공될 수 있다. 바람직한 계면은 항체 불변 도메인의 CH3 도메인의 적어도 일부를 포함한다. 상기 방법에서, 제1 항체 분자 계면으로부터 하나 이상의 작은 아미노산 측쇄가 더 큰 측쇄(예컨대, 티로신 또는 트립토판) (크놉(knob) 또는 돌출부(protuberance))로 대체된다. 큰 아미노산 측쇄를 작은 것(예컨대, 알라닌 또는 트레오닌)으로 대체하여 큰 측쇄(들)에 대해 동일하거나 유사한 크기의 보상적 "내강"이 제2 항체 분자의 계면 상에 생성된다. 이는 동종이량체와 같은 다른 원치 않는 최종 산물에 비해 이종이량체 수율을 증가시키기 위한 기전을 제공한다. 크놉(knob) 및 홀(hole)은 추가로 본원에 기술된다.
홀(hole) 내의 크놉(knob)
다중특이적 항체 및/또는 외팔 항체 및/또는 면역접합체를 생성하는 방법으로 크놉 인투 홀(knobs into holes)의 사용은 당해 기술에 잘 알려져 있다. 참고: 미국 특허 번호 5,731,168 (1998년 3월 24일 Genentech에 수여됨), PCT 공보 번호 WO2009089004 (2009년 7월 16일 공보되고, Amgen에게 수여됨), 및 미국 특허 공보 번호 20090182127 (2009년 7월 16일 공보되고, Novo Nordisk A/S에게 수여됨). 또한 하기 참조: Marvin and Zhu, Acta Pharmacologica Sincia (2005) 26(6):649-658 및 Kontermann (2005) Acta Pharacol . Sin., 26:1-9. 간단한 고찰이 본원에 제공된다.
"돌출부"는 이종다량체를 안정화하고, 그리고 그렇게 함으로써, 예를 들면 동종다량체 형성보다 이종다량체 형성에 유리하도록, 제1 폴리펩티드의 계면로부터 돌출하고 그리고 따라서 인접한 계면 (즉 제2 폴리펩티드의 계면) 내 보상성 공동에 위치할 수 있는 적어도 1종의 아미노산 측쇄를 지칭한다. 본 돌출부는 본래 계면에 존재할 수 있거나, (예컨대, 계면을 암호화하는 핵산을 변경시킴에 의해) 합성적으로 도입될 수 있다. 정상적으로, 제1 폴리펩티드의 계면을 암호화하는 핵산은 돌출부(protuberance)을 암호화하도록 변형된다. 이를 성취하기 위해, 제1 폴리펩티드의 계면에서 적어도 하나의 "본래의" 아미노산 잔기를 암호화하는 핵산은 본래의 아미노산 잔기보다 큰 측쇄 용적을 갖는 적어도 하나의 "유입(import) 아미노산 잔기"를 암호화하는 핵산으로 대체된다. 하나 초과의 원래의 및 상응하는 유입 잔기가 존재할 수 있는 것으로 이해될 것이다. 대체되는 본래의 잔기들의 수에 대한 상한치는 제1 폴리펩티드의 계면에서 잔기들의 총수이다. 다양한 아미노산 잔기의 측쇄 용적은 하기 표에 나타난다.
| 아미노산 |
1-글자 축약 |
질량a (달톤) |
용적b (옹스트롬3) |
접근가능한 표면적c (옹스트롬2) |
| 알라닌 (Ala) | A | 71.08 | 88.6 | 115 |
| 아르기닌 (Arg) | R | 156.20 | 173.4 | 225 |
| 아스파라긴 (Asn) | N | 114.11 | 117.7 | 160 |
| 아스파르트산 (Asp) | D | 115.09 | 111.1 | 150 |
| 시스테인 (Cys) | C | 103.14 | 108.5 | 135 |
| 글루타민 (Gln) | Q | 128.14 | 143.9 | 180 |
| 글루탐산 (Glu) | E | 129.12 | 138.4 | 190 |
| 글리신 (Gly) | G | 57.06 | 60.1 | 75 |
| 히스티딘 (His) | H | 137.15 | 153.2 | 195 |
| 이소류신 (Ile) | I | 113.17 | 166.7 | 175 |
| 류신 (Leu) | L | 113.17 | 166.7 | 170 |
| 라이신 (Lys) | K | 128.18 | 168.6 | 200 |
| 메티오닌 (Met) | M | 131.21 | 162.9 | 185 |
| 페닐알라닌 (Phe) | F | 147.18 | 189.9 | 210 |
| 프롤린 (Pro) | P | 97.12 | 122.7 | 145 |
| 세린 (Ser) | S | 87.08 | 89.0 | 115 |
| 트레오닌 (Thr) | T | 101.11 | 116.1 | 140 |
| 트립토판 (Trp) | W | 186.21 | 227.8 | 255 |
| 티로신 (Tyr) | Y | 163.18 | 193.6 | 230 |
| 발린 (Val) | V | 99.14 | 140.0 | 155 |
a아미노산 분자량 - 물 분자량. 값은 하기에서 유래됨: Handbook of Chemistry and Physics, 43rd ed. Cleveland, Chemical Rubber Publishing Co., 1961.
b값은 하기에서 유래됨: A.A. Zamyatnin, Prog . Biophys . Mol . Biol. 24:107-123, 1972.
c값은 하기에서 유래됨: C. Chothia, J. Mol . Biol. 105:1-14, 1975. 접근가능한 표면적은 이 참조문헌의 도 6 내지 20에서 정의된다.
돌출부를 형성하기 위한 바람직한 유입 잔기는 일반적으로 천연 발생 아미노산 잔기이고 바람직하게 아르기닌(R), 페닐알라닌 (F), 티로신 (Y) 및 트립토판 (W)으로부터 선택된다. 가장 바람직한 것은 트립토판 및 티로신이다. 일 구현예에서, 돌출부의 형성에 대한 본래 잔기는 알라닌, 아스파라긴, 아스파르트산, 글리신, 세린, 트레오닌, 또는 발린과 같이 작은 측쇄 용적을 갖는다. 돌출부를 형성하기 위한 CH3 도메인 내의 예시적인 아미노산 치환은 비제한적으로 T366W 치환을 포함한다.
"공동(cavity)"은 제2 폴리펩티드의 계면으로부터 오목하고, 따라서 제1 폴리펩티드의 인접한 계면 상에 상응하는 돌출부 ("크놉")을 수용하는 적어도 하나의 아미노산 측쇄를 지칭한다. 본 공동은 최초 계면에 존재할 수 있거나, (예컨대, 계면을 암호화하는 핵산을 변경시킴에 의해) 합성적으로 도입될 수 있다. 보통, 제2 폴리펩티드의 계면을 암호화하는 핵산은 공동을 암호화하도록 변경된다. 이를 달성하기 위해, 제2 폴리펩티드의 계면에서의 적어도 하나의 "원래의" 아미노산 잔기를 암호화하는 핵산이 원래의 아미노산 잔기보다 작은 측쇄 용적을 가지는 적어도 하나의 "유입" 아미노산 잔기를 암호화하는 DNA에 의해 대체된다. 하나 초과의 원래의 및 상응하는 유입 잔기가 존재할 수 있는 것으로 이해될 것이다. 대체되는 본래의 잔기들의 수에 대한 상한치는 제2 폴리펩티드의 계면에서 잔기들의 총수이다. 다양한 아미노산 잔기의 측쇄 용적은 상기 표 2에 나타난다. 공동을 형성하기 위한 바람직한 유입 잔기는 일반적으로 천연 아미노산 잔기이고 바람직하게 알라닌(A), 세린(S), 트레오닌(T), 및 발린(V)으로부터 선택된다. 가장 바람직한 것은 세린, 알라닌 또는 트레오닌이다. 일 구현예에서, 공동의 형성에 대한 본래 잔기는 티로신, 아르기닌, 페닐알라닌 또는 트립토판과 같이 큰 측쇄 용적을 갖는다. 공동을 형성하기 위한 CH3 도메인 내의 예시적인 아미노산 치환은 비제한적으로 T366S, L368A 및 Y407A 치환을 포함한다.
"본래의" 아미노산 잔기는 본래의 잔기보다 작거나 큰 측쇄 용적을 가질 수 있는 "유입" 잔기에 의해 대체되는 잔기이다. 유입 아미노산 잔기는 천연 발생 또는 비천연 발생 아미노산 잔기일 수 있지만, 바람직하게는 전자이다. "천연 발생" 아미노산 잔기는 유전적 코드에 의하여 암호화되고, 상기 표 2에서 열거된, 그러한 잔기이다. "비천연 발생" 아미노산 잔기란 유전자 코드에 의해 암호화되지 않지만, 폴리펩티드 쇄에서의 인접한 아미노산 잔기(들)에 공유로 결합할 수 있는 잔기를 의미한다. 비천연적으로 존재하는 아미노산 잔기의 예는 노르류신, 오르니틴, 노르발린, 호모세린, 및 예를 들어,하기 문헌에 기재된 것들과 같은 다른 아미노산 잔기 유사체이다: 예를 들어, Ellman et al., Meth . Enzym. 202:301-336 (1991). 상기 비천연적으로 존재하는 아미노산 잔기를 생성하기 위해, 문헌[참조: Noren et al. Science 244: 182 (1989) 및 Ellman et al., 상기]의 절차를 사용할 수 있다. 간단히 말하면, 이것은 비천연 발생 아미노산 잔기에 의한 억제자 tRNA의 화학적 활성화, 이어서 RNA의 실험실내 전사 및 번역을 포함한다. 본 발명의 방법은 적어도 하나의 본래의 아미노산 잔기를 대체함을 포함하지만 1 초과의 본래의 잔기는 대체될 수 있다. 일반적으로, 제1 또는 제2 폴리펩티드의 계면에서 총수 이하의 잔기는 대체된 본래의 아미노산 잔기를 포함한다. 전형적으로, 대체를 위한 본래의 잔기는 "묻혀(buried)"있다. "묻혀"있는 이란, 잔기가 근본적으로 용매에 접근불가능한 것임을 의미한다. 일반적으로, 유입 잔기는 이황화 결합의 가능한 산화 또는 오류쌍형성을 막기 위해 시스테인이 아니다.
돌출부는 공동에서 "배치 가능"하고, 이것은 각각 제1 폴리펩티드 및 제2 폴리펩티드의 계면 상의 돌출부 및 공동의 공간 위치 및 돌출부 및 공동의 크기가, 돌출부가 계면에서의 제1 및 제2 폴리펩티드의 일반 회합을 상당히 방해하지 않으면서 공동에 배치될 수 있게 한다는 것을 의미한다. 돌출부, 예컨대 Tyr, Phe 및 Trp가 통상적으로 계면의 축으로부터 직각으로 연장되지 않고 바람직한 입체형태를 가지지 않으므로, 상응하는 공동에 의한 돌출부의 정렬은 예컨대 X선 결정학 또는 핵 자기 공명(nuclear magnetic resonance: NMR)에 의해 얻은 3차원 구조에 기초하여 돌출부/공동 쌍을 모델링하는 것에 의존한다. 이것은 당해 기술에서 널리 허용된 기술을 사용하여 달성될 수 있다.
"본래의 또는 주형 핵산"이란 볼록한 부분 또는 강을 암호화하도록 "변형된"(즉, 유전학적으로 가공되거나 돌연변이된) 것일 수 있는 목적하는 폴리펩티드를 암호화하는 핵산을 의미한다. 본래의 또는 개시 핵산은 천연적으로 존재하는 핵산일 수 있거나 사전 변형된 핵산(예를 들어, 인간화된 항체 단편)을 포함할 수 있다. 핵산을 "변형"시키는 것이란 본래의 핵산이 목적하는 아미노산 잔기를 암호화하는 적어도 하나의 코돈을 삽입하거나, 결실시키거나 대체함에 의해 돌연변이됨을 의미한다. 일반적으로, 본래의 잔기를 암호화하는 코돈은 유입 잔기를 암호화하는 코돈에 의해 대체된다. 이러한 방식으로 DNA를 유전적으로 변형시키기 위한 기술은 하기에 검토되며: Mutagenesis: a Practical Approach, M.J. McPherson, Ed., (IRL Press, Oxford, UK. (1991), 그리고 예를 들어, 부위-지향된 돌연변이생성, 카세트 돌연변이생성 및 폴리머라아제 쇄 반응 (PCR) 돌연변이생성을 포함한다. 본래/주형 핵산을 변이시킴으로써, 본래/주형 핵산에 의하여 암호화된 본래/주형 폴리펩티드는 이에 따라 상응하여 변경된다.
돌출부 또는 공동은 합성 수단에 의해, 예를 들어, 재조합 기술, 시험관내 펩티드 합성, 이전에 기재된 비천연적으로 발생하는 아미노산 잔기들을 도입하기 위한 기술, 펩티드의 효소적 또는 화학적 커플링에 의하여, 또는 이들 기술의 일부 조합에 의해 제1 또는 제2 폴리펩티드의 계면으로 "도입"될 수 있다. 따라서, "도입된" 돌출부 또는 공동은 "비천연적으로 존재하거나", "비천연"이고, 이는 이것이 천연적으로 또는 본래의 폴리펩티드(예를 들어, 인간화된 단클론성 항체)에 존재하지 않음을 의미한다.
일반적으로, 돌출부를 형성하기 위한 유입 아미노산 잔기들은 비교적 소수의 "로타머"(예를 들어, 약 3-6)를 갖는다. "로타머"는 아미노산 측쇄의 에너지학적으로 우호적인 형태이다. 다양한 아미노산 잔기에 대한 로타머의 수는 하기 문헌에서 검토된다: Ponders and Richards, J. Mol. Biol. 193: 775-791 (1987).
일 구현예에서, 제1 Fc 폴리펩티드 및 제2 Fc 폴리펩티드는 계면에서 계합/상호작용한다. 일부 구현예에서, 제1 및 제2 Fc 폴리펩티드가 계면에서 계합할 때, 제2 Fc 폴리펩티드 (서열)의 계면은 돌출부 (또한 "크놉"이라고 불림)을 포함하고, 이는 제1 Fc 폴리펩티드 (서열)의 계면 내에서 공동 (또한 "홀"이라고 불림) 내에서 위치가능하다. 일 구현예에서, 제1 Fc 폴리펩티드는 공동을 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경되거나, 제2 Fc 폴리펩티드는 돌출부, 또는 둘 다를 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경된다. 일 구현예에서, 제1 Fc 폴리펩티드는 공동을 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경되고, 제2 Fc 폴리펩티드는 돌출부를 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경된다. 일 구현예에서, 제2 Fc 폴리펩티드의 계면은, 제1 Fc 폴리펩티드의 계면 내 공동에서 위치가능한 돌출부를 포함하고, 공동 또는 돌출부, 또는 둘 다는 제1 및 제2 Fc 폴리펩티드 각각의 계면으로 도입된다. 일부 구현예에서, 제1 및 제2 Fc 폴리펩티드가 계면에서 계합할 때, 제2 Fc 폴리펩티드 (서열)의 계면은 돌출부를 포함하고, 이는 제1 Fc 폴리펩티드 (서열)의 계면 내에서 공동 내에서 위치가능하다. 일 구현예에서, 제2 Fc 폴리펩티드는 공동을 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경되거나, 제1 Fc 폴리펩티드는 돌출부, 또는 둘 다를 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경된다. 일 구현예에서, 제2 Fc 폴리펩티드는 공동을 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경되고, 제1 Fc 폴리펩티드는 돌출부를 암호화하기 위하여 주형/본래 폴리펩티드로부터 변경된다. 일 구현예에서, 제1 Fc 폴리펩티드의 계면은, 제2 Fc 폴리펩티드의 계면 내의 공동 에서 위치가능한 돌출부를 포함하고, 공동 또는 돌출부, 또는 둘 다는 제1 및 제2 Fc 폴리펩티드 각각의 계면으로 도입된다.
일 구현예에서, 돌출부 및 공동은 각각 천연 발생 아미노산 잔기를 포함한다. 일 구현예에서, 돌출부를 포함하는 Fc 폴리펩티드는 주형/본래 폴리펩티드의 계면으로부터의 본래 잔기를, 본래 잔기보다 더 큰 측쇄 용적을 갖는 유입 잔기로 대체함으로서 생성된다. 일 구현예에서, 돌출부를 포함하는 Fc 폴리펩티드는, 상기 폴리펩티드의 계면으로부터의 본래 잔기를 암호화하는 폴리뉴클레오티드가 본래 보다 더 큰 측쇄 용적을 갖는 유입 잔기를 암호화하는 폴리뉴클레오티드로 대체되는 단계를 포함하는 방법에 의하여 생성될 수 있다. 일 구현예에서, 본래 잔기는 트레오닌이다. 일 구현예에서, 본래 잔기는 T366이다. 일 구현예에서, 유입 잔기는 아르기닌 (R)이다. 일 구현예에서, 유입 잔기는 페닐알라닌 (F)이다. 일 구현예에서, 유입 잔기는 티로신 (Y)이다. 일 구현예에서, 유입 잔기는 트립토판 (W)이다. 일 구현예에서, 유입 잔기는 R, F, Y 또는 W이다. 일 구현예에서, 돌출부는 주형/본래 폴리펩티드에 2종 이상의 잔기를 대체함에 의해 생성된다. 일 구현예에서, 돌출부를 포함하는 Fc 폴리펩티드는 위치 366에서 트레오닌의 트립토판으로의 대체를 포함하며, 이는 다음의 EU 넘버링 도식에 따른 아미노산 넘버링에 따른다: Kabat et al. (pp. 688-696 in Sequences of proteins of immunological interest, 5th ed., Vol. 1 (1991; NIH, Bethesda, MD)).
일부 구현예에서, 공동 포함하는 Fc 폴리펩티드는 주형/본래 폴리펩티드의 계면으로부터의 본래 잔기를, 본래 잔기보다 더 작은 측쇄 용적을 갖는 유입 잔기로 대체함으로서 생성된다. 예를 들어, 공동을 포함하는 Fc 폴리펩티드는, 상기 폴리펩티드의 계면으로부터의 본래 잔기를 암호화하는 폴리뉴클레오티드가 본래 보다 더 작은 측쇄 용적을 갖는 유입 잔기를 암호화하는 폴리뉴클레오티드로 대체되는 단계를 포함하는 방법에 의하여 생성된다. 일 구현예에서, 본래 잔기는 트레오닌이다. 일 구현예에서, 본래 잔기는 류신이다. 일 구현예에서, 본래 잔기는 티로신이다. 일 구현예에서, 유입 잔기는 시스테인 (C)이 아니다. 일 구현예에서, 유입 잔기는 알라닌 (A)이다. 일 구현예에서, 유입 잔기는 세린 (S)이다. 일 구현예에서, 유입 잔기는 트레오닌 (T)이다. 일 구현예에서, 유입 잔기는 발린 (V)이다. 공동은 주형/본래 폴리펩티드의 하나 이상의 본래 잔기를 대체함으로써 생성될 수 있다. 예를 들어, 일 구현예에서, 공동을 포함하는 Fc 폴리펩티드는 트레오닌, 류신, 및 티로신으로 구성된 그룹으로부터 선택된 2개 이상의 본래 아미노산의 대체를 포함한다. 일 구현예에서, 공동을 포함하는 Fc 폴리펩티드는 알라닌, 세린, 트레오닌, 및 발린으로 구성된 그룹으로부터 선택된 2개 이상의 유입 잔기를 포함한다. 일부 구현예에서, 공동을 포함하는 Fc 폴리펩티드는 트레오닌, 류신, 및 티로신으로 구성된 그룹으로부터 선택된 2개 이상의 본래 아미노산의 대체를 포함하고, 상기 본래 아미노산은 알라닌, 세린, 트레오닌, 및 발린으로 구성된 그룹으로부터 선택된 유입 잔기로 대체된다. 일부 구현예에서, 대체된 본래 아미노산은 T366, L368 및/또는 Y407이다. 일 구현예에서, 공동을 포함하는 Fc 폴리펩티드는 위치 366에서 트레오닌의 세린으로의 대체를 포함하며, 이는 다음의 EU 넘버링 도식에 따른 아미노산 넘버링에 따른다: Kabat et al. 상기. 일 구현예에서, 공동을 포함하는 Fc 폴리펩티드는 위치 368에서 류신의 알라닌으로의 대체를 포함하며, 이는 다음의 EU 넘버링 도식에 따른 아미노산 넘버링에 따른다: Kabat et al. 상기. 일 구현예에서, 공동을 포함하는 Fc 폴리펩티드는 위치 407에서 티로신의 발린으로의 대체를 포함하며, 이는 다음의 EU 넘버링 도식에 따른 아미노산 넘버링에 따른다: Kabat et al. 상기. 일 구현예에서, 공동을 포함하는 Fc 폴리펩티드는 T366S, L368A 및 Y407V으로 구성된 그룹으로부터 선택된 2개 이상의 아미노산 대체를 포함하며, 이는 다음의 EU 넘버링 도식에 따른 아미노산 넘버링에 따른다: Kabat et al. 상기. 이러한 항체 단편의 일부 구현예에서, 돌출부를 포함하는 Fc 폴리펩티드는 위치 366에서 트레오닌의 트립토판으로의 대체를 포함하며, 이는 하기의 EU 넘버링에 따른 아미노산 넘버링에 따른다: Kabat et al. 상기.
일 구현예에서, 항체는, WO2005/063816에서 기술된 바와 같이, "크놉" 및 "홀"을 구성하는 Fc 돌연변이를 포함한다. 예를 들어, 홀 돌연변이는 Fc 폴리펩티드 내의 T366A, L368A 및/또는 Y407V 중 하나 이상일 수 있으며, 크놉 돌연변이는 T366W일 수 있다.
V. 벡터, 숙주 세포 및 재조합 방법
DsbA 및 DsbC를 사용한, 이종성 폴리펩티드 (예를 들어, 항체)의 재조합 생산을 위하여, 이것을 암호화하는 핵산은 추가의 클로닝 (DNA의 증폭) 또는 발현을 위하여 복제가능한 벡터로 단리 및 삽입된다. 폴리펩티드 (예를 들어, 항체)를 암호화하는 DNA는 통상적인 절차를 사용하여 용이하게 단리 및 서열분석될 수 있다 (예를 들어, 항체의 중쇄 및 경쇄를 암호화하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브를 사용함으로써). 많은 벡터가 이용가능하다. 벡터의 선택은 부분적으로 사용될 숙주 세포에 따라 달라진다. 일반적으로, 바람직한 숙주 세포는 원핵생물 기원의 것이다. IgG, IgM, IgA, IgD, 및 IgE를 포함하는, 임의의 이소형의 불변 영역이, 이러한 목적을 이용하여 사용될 수 있고, 그러한 불변 영역이 임의의 인간 또는 동물 종으로부터 수득될 수 있다는 것이 이해될 것이다.
A. 원핵생물 숙주 세포를 사용한 항체 생성:
i. 벡터
작제
본 발명의 폴리펩티드 (예컨대, 항체)의 폴리펩티드 성분을 암호화하는 폴리뉴클레오티드 서열이 표준 재조합 기술을 사용하여 수득될 수 있다. 목적 폴리뉴클레오티드 서열은 항체 생성 세포, 예컨대 하이브리도마 세포로부터 단리 및 서열분석될 수 있다. 대안적으로, 폴리뉴클레오티드는 뉴클레오티드 합성기 또는 PCR 기술을 사용하여 합성될 수 있다. 일단 수득되면, 폴리펩티드를 암호화하는 서열은, 원핵생물 숙주 내 이종성 폴리펩티드를 복제 및 발현할 수 있는 재조합 벡터에 삽입된다. 이용가능하고 본 분야에 알려진 많은 벡터가 본 발명의 목적을 위하여 사용될 수 있다. 적절한 벡터의 선택은 벡터에 삽입될 핵산의 크기 및 벡터로 변형될 특정 숙주세포에 따라 달라질 것이다. 각 벡터는 이의 작용 (이종성 폴리뉴클레오티드의 증폭 또는 발현, 또는 둘 다) 및 이것이 상주하는 특정 숙주 세포와의 호환성에 따라 다양한 성분을 함유한다. 벡터 성분은 일반적으로, 비제한적으로 하기를 포함한다: 복제 기점, 선택 마커 유전자, 프로모터, 리보솜 결합 부위 (RBS), 신호 서열, 이종성 핵산 삽입체 및 전사 종결 서열.
일반적으로, 숙주 세포와 호환가능한 종으로부터 유래된 복제단위 및 조절 서열을 함유하는 플라스미드 벡터는 이러한 숙주와 연결되어 사용된다. 이러한 벡터는 본래, 복제 부위, 뿐만 아니라 변형된 세포 내 표현형 선택이 가능한 마킹(marking) 서열을 수반한다. 예를 들면, 이. 콜라이는 이. 콜라이 종으로부터 유도된 플라스미드인 pBR322를 사용하여 전형적으로 전환된다. pBR322는 암피실린 (Amp) 및 테트라사이클린 (Tet)을 내성을 암호화하는 유전자를 함유하며, 따라서 변형된 세포를 식별하기 위한 용이한 수단을 제공한다. pBR322, 이의 유도체, 또는 다른 미생물 플라스미드 또는 박테리오파지는 또한, 내인성 단백질의 발현을 위하여 미생물 유기체에 의하여 사용될 수 있는 프로모터를 또한 함유하거나, 함유하도록 변형될 수 있다. 특정 항체의 발현을 위하여 사용된 pBR322 유도체의 예시는 하기에 자세히 기술된다: Carter et al., 미국 특허 번호 5,648,237.
또한, 숙주 미생물과 호환가능한 복제단위 및 조절서열을 함유하는 파지 벡터는 이러한 숙주와 연결되어 변형 벡터로서 사용될 수 있다. 예를 들어, 박테리오파지, 예컨대 GEM™-11은 재조합 벡터의 제조에서 사용될 수 있으며, 이는 민감한 숙주 세포, 예컨대 이. 콜라이 LE392를 변형시키기 위하여 사용될 수 있다.
본 발명의 발현 벡터는 폴리펩티드 성분 각각을 암호화하는 2개 이상의 프로모터-시스트론 쌍을 포함할 수 있다. 프로모터는 이의 발현을 조절하는 시스트론에 업스트림 (5')에 위치한 비번역된 조절 서열이다. 원핵생물 프로모터는 전형적으로 2개 부류, 유도가능한 부류 및 구성적 부류로 분류된다. 유도가능한 프로모터는 배양 조건, 예를 들면, 영양소의 존재 또는 부재 또는 온도의 변화에서 일부 변화에 반응하여 이들의 조절하에 시스트론의 증가된 전사 수준을 개시하는 프로모터이다.
다양한 잠재적 숙주 세포로 인식된 다수의 프로모터는 익히 공지되어 있다. 선택된 프로모터는, 제한 효소 소화를 통한 공급원 DNA로부터의 프로모터를 제거함으로써, 그리고 본 발명의 벡터로 단리된 프로모터 서열을 삽입함으로써 경쇄 또는 중쇄를 암호화하는 시스트론 DNA로 작동가능하게 연결될 수 있다. 천연 프로모터 서열 및 많은 이종성 프로모더 둘 다는 표적 유전자의 증폭 및/또는 발현을 지시하기 위하여 사용될 수 있다. 일부 구현예에서, 이종성 프로모터가 이용되며, 이는 그들이 일반적으로, 천연 표적 폴리펩티드 프로모터와 비교하여, 발현된 표적 유전자의 보다 큰 전사 및 보다 높은 수율을 허용하기 때문이다.
원핵생물 숙주와 함께 사용되기에 적절한 프로모터는, PhoA 프로모터, -락타마제 및 락토오스 프로모터 시스템, 트립토판 (trp) 프로모터, 및 혼성체 프로모터 예컨대 tac 또는 trc 프로모터를 포함한다. 그러나, 박테리아 (예컨대 기타 알려진 박테리아 또는 파지 프로모터) 내의 작용적인 다른 프로모터 또한 적절하다. 이의 뉴클레오티드 서열은 공개되었고, 이로써 숙련된 작업자가 작동가능하게 임의의 요구된 제한 부위를 공급하기 위해 링커 또는 어댑터를 사용하여 표적 경쇄 및 중쇄를 암호화하는 시스트론에 이들을 결찰하는 것을 가능하게 한다 (Siebenlist et al., (1980) Cell 20: 269) (임의의 요구된 제한 부위를 공급하는 링커 또는 어댑터를 사용하여).
번역 개시 영역(TIR)은 단백질의 전체 번역 수준의 주요 결정 인자이다. TIR은 신호 서열을 암호화하는 폴리뉴클레오티드를 포함하고, 샤인-델가노(Shine-Delgarno) 서열의 바로 상류로부터 개시 코돈의 약 20개 뉴클레오티드 하류까지 연장된다. 일반적으로, 벡터는 TIR을 포함할 것이고, TIR 및 변이체 TIR은 본 분야에 알려져 있고, TIR을 생성하기 위한 방법은 본 분야에 알려져 있다 일련의 핵산 서열 변이체는 일정 범위의 번역 강도로 생성되어, 이로써 많은 상이한 폴리펩티드의 최적 분비를 위하여 이러한 인자를 조정하는 용이한 수단을 제공할 수 있다. 이러한 변이체, 예컨대 PhoA에 융합된 리포터 유전자의 사용은, 상이한 번역 개시 영역의 상대적 번역 강도를 정량화하는 방법을 제공한다. 변이체 또는 돌연변이체 TIR은 플라스미드 벡터의 배경에서 제공되어, 이로써, 성숙 폴리펩티드의 최대 발현을 위하여 최적 범위의 번역 강도를 수립하기 위하여 관심 유전자가 삽입되고, 이의 발현이 측정되는 플라스미드 세트를 제공할 수 있다. 변이체 TIR은 USP 8,241,901에 개시된다.
본 발명의 일 양태에서, 재조합 벡터 내의 각 시스트론은 막에 걸쳐 발현된 폴리펩티드의 전좌를 지시하는 분비 신호 서열 성분을 포함한다. 일반적으로, 신호 서열은 벡터의 성분일 수 있거나, 이는 벡터 내로 삽입되는 표적 폴리펩티드 DNA의 부분일 수 있다. 본 발명의 목적을 위하여 선택된 신호 서열은 숙주 세포에 의하여 인식 및 점유 (즉, 신호 펩티다제에 의하여 절단된) 것일 것이다. 이종성 폴리펩티드에 천연인 신호 서열을 인식하고 점유하지 못하는 원핵생물 숙주 세포에 대하여, 신호 서열은 예를 들어, 본 발명의 폴리펩티드로부터 선택된 원핵생물 신호 서열에 의하여 치환된다. 또한, 벡터는 알칼라인 알칼리포스파타제, 페니실린, Lpp, 또는 열-안정 엔테로톡신 II (STII) 리더, LamB, PhoE, PelB, OmpA, 및 MBP로 구성된 군으로부터 선택된 신호 서열을 포함할 수 있다.
일 양태에서, 하나 이상의 폴리뉴클레오티드 (예컨대, 발현 벡터)는 총체적으로 항체를 암호화한다. 일 구현예에서, 단일 폴리뉴클레오티드는 항체의 경쇄를 암호화하고, 개별 폴리뉴클레오티드는 항체의 중쇄를 암호화한다. 일 구현예에서, 단일 폴리뉴클레오티드는 항체의 경쇄 및 중쇄를 암호화한다. 일부 구현예에서, 하나 이상의 폴리뉴클레오티드 (예컨대, 발현 벡터)는 총체적으로 단일-아암 항체를 암호화한다. 일 구현예에서, 단일 폴리뉴클레오티드는 (a) 단일-아암(one-armed) 항체의 경쇄 및 중쇄, 및 (b) Fc 폴리펩티드를 암호화한다. 일 구현예에서, 단일 폴리뉴클레오티드는 단일-아암(one-armed) 항체의 경쇄 및 중쇄를 암호화하고, 개별 폴리뉴클레오티드는 Fc 폴리펩티드를 암호화한다. 일 구현예에서, 개별 폴리뉴클레오티드는 단일-아암(one-armed) 항체의 경쇄 성분, 단일-아암 항체의 중쇄 성분 및 Fc 폴리펩티드를 각각 암호화한다. 단일-아암(one-armed) 항체의 생산은 예를 들어, WO2005063816에 기술된다.
본 발명의 항체를 발현하기에 적절한 원핵생물 숙주세포는 고세균(Archaebacteria) 및 진정세균(Eubacteria), 예컨대 그람-음성 또는 그람-양성 유기체를 포함한다. 유용한 박테리아의 예시는 하기를 포함한다: 에세리키아(Escherichia) (예컨대 이. 콜라이), 바킬루스(Bacilli) (예컨대 B. 서브틸리스), 엔테로박테리아(Enterobacteria), 슈도모나스(Pseudomonas) 종 (예컨대 P. 애루기노사), 살모넬라 티피무리움 (Salmonella typhimurium ), 세라티아 마르세스캔스 (Serratia marcescans ), 클렙시엘라(Klebsiella), 프로테우스(Proteus), 쉬겔라(Shigella), 리조비아(Rhizobia), 비트레오실라(Vitreoscilla), 또는 파라코커스(Paracoccus). 일 구현예에서, 그람-음성 세포가 사용된다. 일 구현예에서, 이. 콜라이 세포는 본 발명을 위한 숙주로서 사용된다. 이. 콜라이 균주의 예시는 하기를 포함한다: 균주 W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D.C.: American Society for Microbiology, 1987), pp. 1190-1219; ATCC수탁 번호 27,325) 및 유전자형 W3110 ΔfhuA (ΔtonA) ptr3 lac Iq lacL8 ΔompTΔ (nmpc-fepE) degP41 kanR을 갖는 균주 33D3 (미국 특허번호 5,639,635) 및 균주 63C1 및 64B4를 포함하는 이의 유도체. 일부 구현예에서, 이. 콜라이 균주는 62A7 (ΔfhuA (ΔtonA) ptr3, lacIq, lacL8, ompTΔ(nmpc-fepE) ΔdegP ilvG 보수됨)로 명명된 W3110 유도체이다. 기타 균주 및 이의 유도체, 예컨대 이. 콜라이 294 (ATCC 31,446), 이. 콜라이 B, 이. 콜라이 λ 1776 (ATCC 31,537) 및 이. 콜라이 RV308(ATCC 31,608)가 또한 적합하다. 이러한 실시예는 제한적이기보다 예시적이다. 정의된 유전자형을 갖는 상기-언급된 박테리아 중 임의의 것의 유도체를 작제하는 방법은 본 분야에 알려져 있으며, 예를 들어, 하기에 기술된다: Bass et al., Proteins, 8:309-314 (1990). 일반적으로, 박테리아의 세포 내 복제 단위의 복제를 고려한 적절한 박테리아를 선택하는 것이 필요하다. 예를 들어, 이. 콜라이 세라티아(Serratia) 또는 살모넬라(Salmonella) 종은, 잘 알려진 플라스미드, 예컨대 pBR322, pBR325, pACYC177, 또는 pKN410이 복제단위를 공급하는데 사용될 경우, 숙주 세포로 적절하게 사용될 수 있다. 전형적으로, 숙주 세포는 단백질분해 효소의 최소량을 분비할 것이며, 추가의 프로테아제 억제제는 세포 배양물로 바람직하게 편입될 수 있다.
박테리아 배양에서 폴리펩티드의 생산 수율 및 품질을 개선하기 위해, 박테리아 세포가 변형될 수 있다. 예를 들면, 분비된 항체 폴리펩티드의 적절한 조립 및 접힘을 개선하기 위해, 박테리아 숙주세포는 추가의 벡터 과발현 샤페론 단백질을 포함할 수 있고, 예컨대 Dsb 단백질 (DsbA, DsbB, DsbC, DsbD, 및/또는 DsbG)은 숙주 원핵 세포를 공동 형질전환하기 위해 사용될 수 있다. 샤페론 단백질은, 박테리아 숙주 세포 내 생성된 이종성 단백질의 적절한 접힘 및 용해성을 촉진하기 위한 것으로 예증되었다.
ii. 항체 생산
숙주 세포는 상기 기술된 발현 벡터로 변형되고, 프로모터를 유도하거나, 변형체를 선택하거나, 또는 목적 서열을 암호화하는 유전자를 증폭하는데 적절한 것으로서 변형된 기존 영양 배지 내에서 배양된다.
변형은 DNA를 원핵생물 숙주에 도입하여, 이로써 DNA가 염색체외 요소로서, 또는 염색체 구성성분에 의하여 복제가능하도록 하는 것을 의미한다. 사용된 숙주 세포에 따라서, 변형은 그러한 세포에 적절한 표준 기술을 사용하여 완료된다. 염화칼슘을 채용한 칼슘 처리는 일반적으로 실질적인 세포-벽 장벽을 함유한 박테리아 세포에 사용된다. 변형을 위한 또 다른 방법은 폴리에틸렌 글리콜/DMSO를 채용한다. 사용된 또 다른 기술은 전기천공이다.
본 발명의 폴리펩티드를 생성하는데 사용되는 원핵생물 세포는 본 분야에 알려지고 선택된 숙주 세포의 배양에 적절한 배지에서 성장한다. 적절한 배지의 예시는 루리아(Luria) 브로쓰 (LB)에 더하여 필수적인 영양 보충물을 포함한다. 일부 구현예에서, 배지는, 발현 벡터를 함유하는 원핵생물 세포의 성장을 선택적으로 허용하는, 발현 벡터의 작제를 기반으로 선택된, 선택 제제를 또한 함유한다. 예를 들어, 암피실린은 암피실린 내성 유전자를 발현하는 세포의 성장을 위한 배지에 첨가된다.
탄소, 질소, 및 무기 포스페이트 공급원을 제외한 임의의 필요한 보충물이 단독으로, 또는 다른 보충물 또는 배지 예컨대 복합 질소 공급원과의 혼합물로서 도입된 적절한 농도로 또한 포함될 수 있다. 임의로, 배양 배지는 글루타티온, 시스테인, 시스타민, 티오글리콜레이트, 디티오에리트리톨 및 디티오트레이톨로 구성된 그룹으로부터 선택된 하나 이상의 환원제를 함유한다.
원핵생물 숙주 세포는 적절한 온도에서 배양된다. 이. 콜라이 성장을 위하여, 예를 들면, 바람직한 온도는 약 20 °C 내지 약 39 °C, 더욱 바람직하게는 약 25 °C 내지 약 37 °C, 더 더욱 바람직하게는 약 30 °C 범위이다. 배지의 pH는, 주로 숙주 유기체에 따라서, 약 5 내지 약 9의 범위의 pH일 수 있다. 이. 콜라이에 대하여, pH는 바람직하게는 약 6.8 내지 약 7.4이고, 더욱 바람직하게는 약 7.0이다.
유도가능한 프로모터가 본 발명의 발현 벡터로 사용될 경우, 단백질 발현은 프로모터의 활성화에 적절한 조건 하에서 유도된다. 본 발명의 일 양태에서, PhoA 프로모터는 폴리펩티드의 전사를 조절하게 위하여 사용된다. 따라서, 변형된 숙주 세포는 유도를 위하여 포스페이트-제한 배지에서 배양된다. 바람직하게는, 포스페이트-제한 배지는 C.R.A.P 배지 (예컨대, 참고: Simmons et al., J. Immunol . Methods (2002), 263:133-147)또는 WO2002/061090에 기술된 배지이다. 본 분야에 알려진 바와 같이, 채용된 벡터 작제물에 따라, 다양한 유도제가 사용될 수 있다.
일 구현예에서, 본 발명의 발현된 폴리펩티드는 숙주 세포의 주변세포질로 분비되고 회수된다. 단백질 회수는 전형적으로, 삼투압충격법, 음파처리 또는 용해와 같은 수단에 의하여 미생물을 교란하는 것을 포함한다. 일단 세포가 교란되면, 세포 파편 또는 전체 세포는 원심분리 또는 여과에 의하여 제거될 수 있다. 단백질은 예를 들어, 친화도 수지 크로마토그래피에 의하여 추가로 정제될 수 있다. 대안적으로, 단백질은 세포 배지에 이동되고, 그 안에 단리될 수 있다. 세포는 생성된 단백질의 추가의 정제를 위하여 여과되고 농축된 배양물 및 배양 상청액으로부터 제거될 수 있다. 발현된 폴리펩티드는, 폴리아크릴아미드 겔 전기영동 (PAGE) 및 웨스턴 블롯 검정과 같은 통상적으로 알려진 방법을 사용하여 추가로 단리 및 식별될 수 있다.
본 발명의 일 양태에서, 항체 생산은 발효 과정에 의하여 다량으로 수행된다. 다양한 대규모 공급-뱃치(공급-뱃치) 발효 절차는 재조합 폴리펩티드의 생산을 위하여 이용가능하다. 대규모 발효는 적어도 1000 리터의 용량, 바람직하게는 약 1,000 내지 100,000 리터의 용량을 갖는다. 이러한 발효기는 산소 및 영양분, 특히 글루코스 (바람직한 탄소/에너지 공급원)를 분배하기 위하여 교반기 임펠러를 사용한다. 소규모 발효는 일반적으로, 용적 용량이 대략 100 리터 미만이고, 약 1 리터 내지 약 100 리터 범위일 수 있는 발효기 내에서의 발효를 지칭한다.
발효 과정에서, 단백질 발현의 유도는 전형적으로, 세포가 초기 고정 상 단계에 있는, 목적 밀도, 예컨대 약 180-220의 OD550의 적절한 조건 하에서 성장한 후 개시된다. 본 분야에 알려지고 상기 기술된 바와 같이, 채용된 벡터 작제물에 따라, 다양한 유도제가 사용될 수 있다. 세포는 유도 전에 보다 짧은 기간 동안 재배할 수 있다. 세포는 일반적으로 약 12-50 시간 동안 유도되나, 보다 길거나 짧은 유도 시간이 사용될 수 있다.
본 발명의 폴리펩티드의 생산 수율 및 품질을 개선하기 위하여, 다양한 발효 조건이 변형될 수 있다. 예를 들면, 분비된 항체 폴리펩티드의 적절한 조립 및 접힘을 개선하기 위해, 추가의 벡터 과발현 샤페론 단백질, 예컨대 Dsb 단백질 (DsbA, DsbB, DsbC, DsbD, 및/또는 DsbG)은 숙주 원핵 세포를 공동 형질전환하기 위해 사용될 수 있다. 샤페론 단백질은, 박테리아 숙주 세포 내 생성된 이종성 단백질의 적절한 접힘 및 용해성을 촉진하기 위한 것으로 예증되었다. Chen et al., (1999) J. Biol . Chem. 274:19601-19605; Georgiou et al., 미국 특허 번호 6,083,715; Georgiou et al., 미국 특허 번호 6,027,888; Bothmann and Pluckthun (2000) J. Biol . Chem . 275:17100-17105; Ramm and Pluckthun, (2000) J. Biol . Chem. 275:17106-17113; Arie et al., (2001) Mol . Microbiol. 39:199-210. 일부 구현예에서, DsbA 및 C는 박테리아 숙주 세포 내에서 발현된다.
발현된 이종성 단백질 (특히 단백질분해적으로 민감한 것들)의 단백질분해를 최소화하기 위하여, 단백질분해 효소가 결핍된 특정 숙주 균주가 본 발명을 위하여 사용될 수 있다. 예를 들어, 숙주세포 균주는 알려진 박테리아 프로테아제, 예컨대 프로테아제 III, OmpT, DegP, Tsp, 프로테아제 I, 프로테아제 Mi, 프로테아제 V, 프로테아제 VI, 및 이의 조합을 암호화하는 유전자 내에서 유전자 변이(들)을 초래하도록 변형될 수 있다. 일부 이. 콜라이 프로테아제-결핍 균주는 예를 들어, 하기에서 기술되며 이용가능하다: Joly et al., (1998), 상기; Georgiou et al., 미국 특허 번호 5,264,365; Georgiou et al., 미국 특허 번호 5,508,192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
일 구현예에서, 단백질가수분해 효소가 결핍되고, 하나이상의 샤페론 단백질을 과발현하는 플라스미드로 변형된 이. 콜라이 균주가 본 발명의 발현계에서 숙주 세포로서 사용된다.
iii. 항체 정제
본 분야에서의 표준 단백질 정제 방법이 채용될 수 있다. 하기 절차는 적절한 정제 절차에 대한 예시이다: 면역친화성 또는 이온-교환 칼럼 상의 분획화, 에탄올 침전, 역상 HPLC, DEAE와 같은 양이온-교환 수지 상의 또는 실리카 상의 크로마토그래피, 크로마토포커싱, SDS-PAGE, 황산암모늄 적정 및 예를 들어, 세파덱스(Sephadex) G-75를 사용한 겔 적정.
일 양태에서, 고체 상에 고정화된 단백질 A는 본 발명의 항체 생성물의 면역친화성 정제를 위하여 사용된다. 단백질 A는 항체의 Fc 영역으로 고친화성으로 결합하는 스타필로코커스 아우레아스(Staphylococcus aureas)로부터 유래된 41kD 세포벽 단백질이다. Lindmark et al., (1983) J. Immunol . Meth. 62:1-13. 단백질 A가 고정화되는 고체 상은, 바람직하게는 유리 또는 실리카 표면을 포함하는 칼럼이고, 더욱 바람직하게는 조절된 공극 유리 칼럼 또는 규산 칼럼이다. 일부 적용에서, 칼럼을 불순물의 비특이적 부착을 예방하기 위한 시도로서 글리세롤과 같은 시약으로 코팅하였다.
정제의 제1 단계로서, 상기 기술된 세포 배양물로부터 유래된 제조물을 단백질 A 고정화된 고체 상에 적용하여 단백질 A로의 관심 항체의 특이적 결합이 가능하도록 하였다. 이러한 고체 상을 이후 세정하여 고체 상과 비-특이적으로 결합된 불순물을 제거하였다. 최종적으로, 관심 항체는 용출에 의하여 고체 상으로부터 회수된다.
본 발명의 일부 구현예에서, 상기 정제 단계 중 하나 이상으로부터 유도된 분획은 DsbA 및/또는 DsbC의 제거에 대해 분석된다. 일부 구현예에서, DsbA 및/또는 DsbC의 제거는 면역검정에 의해; 예를 들면, 본 명세서에 기재된 면역검정에 의해 계측된다.
본 발명은 또한, "면역콘주게이트(immunoconjugate)" ("항체-약물 콘주게이트" 또는 "ADC"와 상호교환가능하게 지칭됨)는 예를 들어, 세포독성제, 예컨대 화학치료제, 약물, 성장 억제제, 독소 (예를 들어, 단백질 독소, 박테리아, 진균, 식물 또는 동물 기원 (이의 단편 및/또는 변이체 포함)의 효소적 활성 독소 또는 이의 단편), 또는 방사성 동위원소 (즉, 방사콘주게이트(radioconjugate))에 콘주게이트된 본원에 기술된 임의의 항체를 의미한다.
VI.
DsbA
및
DsbC의
조성물
일부 양태에서, 본 발명은 초순수 DsbA 및/또는 DsbC를 포함하는 조성물을 제공한다. 일부 구현예에서, 본 조성물은 DsbA를 포함하고 여기서 상기 DsbA는 약 임의의 95.0%, 96.0%, 97.0%, 98.0%, 99.0%, 또는 99.5% 초과의 모노머DsbA이다. 일부 구현예에서, 95% 모노머 DsbA를 포함하는 조성물은, 상기 제제 내 5% 미만의 물질이 DsbA의 생산 동안 존재하는 세포 또는 세포 용해물 (예컨대, 단백질, 핵산, 지질, 등)에 존재하는 기타 물질인, 조성물이다. 일부 구현예에서, 모노머 DsbA 폴리펩티드의 백분율은 크기 배제 크로마토그래피 (예컨대, SEC-HPLC)에 의해 측정된다. 일부 구현예에서, 초순수 DsbA를 포함하는 조성물은, 약 5%, 4%, 3%, 2%, 1%, 0.5% 또는 0.1% 중 임의의 것 미만의 저분자량 종 (예컨대, SEC 또는 SDS-PAGE에 의하여 측정시, 모노머 DsbA 보다 작은 분자량을 갖는 종)을 포함한다. 일부 구현예에서, 초순수 DsbA를 포함하는 조성물은 약 2% 미만의 저분자량 종을 포함한다. 일부 구현예에서, 초순수 DsbA를 포함하는 조성물은, 약 5%, 4%, 3%, 2%, 1%, 0.5% 또는 0.1% 중 임의의 것 미만의 고분자량 종 (예컨대, SEC 또는 SDS-PAGE에 의하여 측정시, 모노머 DsbA 보다 큰 분자량을 갖는 종)을 포함한다. 일부 구현예에서, 초순수 DsbA를 포함하는 조성물은 약 1% 미만의 고분자량 종을 포함한다.
일부 구현예에서, 본 조성물은 DsbC를 포함하고 여기서 상기 DsbC는 약 임의의 95.0%, 96.0%, 97.0%, 98.0%, 99.0%, 또는 99.5% 초과의 모노머 DsbC이다. 일부 구현예에서, 95% 모노머 DsbC를 포함하는 조성물은, 상기 제제 내 5% 미만의 물질이 DsbC의 생산 동안 존재하는 세포 또는 세포 용해물 (예컨대, 단백질, 핵산, 지질, 등)에 존재하는 기타 물질인, 조성물이다. 일부 구현예에서, 모노머 DsbC 폴리펩티드의 백분율은 크기 배제 크로마토그래피 (예컨대, SEC-HPLC)에 의해 측정된다. 일부 구현예에서, 초순수 DsbC를 포함하는 조성물은, 약 5%, 4%, 3%, 2%, 1%, 0.5% 또는 0.1% 중 임의의 것 미만의 저분자량 종 (예컨대, SEC 또는 SDS-PAGE에 의하여 측정시, 모노머 DsbC 보다 작은 분자량을 갖는 종)을 포함한다. 일부 구현예에서, 초순수 DsbC를 포함하는 조성물은 약 2% 미만의 저분자량 종을 포함한다. 일부 구현예에서, 초순수 DsbC를 포함하는 조성물은, 약 5%, 4%, 3%, 2%, 1%, 0.5% 또는 0.1% 중 임의의 것 미만의 고분자량 종 (예컨대, SEC 또는 SDS-PAGE에 의하여 측정시, 모노머 DsbC 보다 큰 분자량을 갖는 종)을 포함한다. 일부 구현예에서, 초순수 DsbC를 포함하는 조성물은 약 1% 미만의 고분자량 종을 포함한다.
일부 구현예에서, 고도로 정제된 DsbA 또는 DsbC를 포함하는 조성물이 사용을 위해 제형화된다. 일부 구현예에서, 초순수 DsbA 또는 DsbC를 포함하는 조성물이; 예를 들면, 면역 반응의 생성을 용이하게 하기 위해 아쥬반트를 첨가함에 의해, DsbA 또는 DsbC에 대한 항체를 발생하도록 동물을 면역화하기 위해 제형화된다. 다른 구현예에서, 초순수 DsbA 또는 DsbC를 포함한 조성물이; 예를 들면, 양성 대조군으로 또는 표준 곡선으로 면역검정에서의 사용을 위해 제형화된다.
VII.
DsbA
및
DsbC에
대한 항체 생성
특정 양태에서, 본 발명은 DsbA 및/또는 DsbC의 존재에 대해서 재조합 폴리펩티드 샘플을 분석하기 위한 면역검정에 사용하기 위한 항체(예컨대, 다클론성 항체 및/또는 단클론성 항체)를 생성하기 위한 면역원으로 사용하기 위한 초순수 DsbA 및 초순수 DsbC를 제공한다. 예를 들면, 항체는 재조합 폴리펩티드가 DsbA 및/또는 DsbC를 과발현하는 박테리아 세포에서 생산되는 재조합 폴리펩티드 샘플 내 DsbA 및 또는 DsbC를 검출 및/또는 정량화하기 위한 면역검정에 사용될 수 있다. 일부 구현예에서, 본 발명은 초순수 DsbA에 특이적으로 결합하는 다클론성 항체 및/또는 초순수 DsbC에 특이적으로 결합하는 다클론성 항체를 제공한다. 일부 양태에서, 다클론성 항체는 DsbA 또는 DsbC의 상이한 에피토프에 특이적으로 결합하고 따라서 DsbA 또는 DsbC 단편, 변이체, 오류접힘된 단백질, 등을 검출하는 유용성을 제공한다. 면역검정에서 측정되는 샘플에서 DsbA 또는 DsbC의 수준의 과-정량화를 초래할 수 있는 숙주세포 단백질 불순물에 대한 토끼 항체의 생성을 최소화하기 위해, 동물(예컨대, 토끼)이 초순수 DsbA 또는 DsbC로 면역화된다.
본 발명은 DsbA에 특이적으로 결합하는 항체 및 DsbC에 특이적으로 결합하는 항체를 제공한다. 일부 구현예에서, 항체는 다클론성 항체이다. 다클론성 항체는 관련된 항원 및 아쥬반트의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 바람직하게는 상승된다. 면역화되기 위해 종에서 면역원성인 폴리펩티드, 예를 들면, 키홀 림펫 헤모시아닌, 혈청 알부민, 소 티로글로불린, 또는 이중작용성을 갖는 대두 트립신 억제제 또는 유도화제, 예를 들어, 말레이미도벤조일 설포석신이미드 에스테르 (시스테인 잔기를 통한 콘주게이션), N-하이드록시석신이미드 (라이신 잔기를 통한), 글루타르알데하이드, 석신산 무수물, SOCl2, 또는 R1N=C=NR (여기에서 R 및 R1은 상이한 알킬기이다)에 관련된 항원을 콘주게이션하는 것이 유용할 수 있다.
동물은, 예를 들면, (토끼 또는 마우스, 각각용) 100 μg 또는 5 μg의 폴리펩티드 또는 콘주게이트를 3 용적의 프로인트 완전 아쥬반트와 조합 및 다중 부위에서 진피내로 용액 주사에 의해 항원, 면역원성 콘주게이트, 또는 유도체에 대해 면역화된다. 1 개월 후 동물은 다중 부위에서 피하 주사에 의해 프로인트 완전 아쥬반트에서 펩티드 또는 콘주게이트의 최초 양의 1/5 내지 1/10로 부스팅된다. 7 내지 14 일 후 동물은 채혈되고 혈청은 항체 역가에 대하여 분석된다. 동물은 역가 안정기까지 부스팅된다. 일부 구현예에서, 동물은 동일한 항원의 콘주게이트로 부스팅되지만, 상이한 폴리펩티드에 및/또는 상이한 가교결합 시약을 통해 콘주게이트된다. 콘주게이트는 또한 폴리펩티드 융합으로서 재조합 세포 배양물에서 제조될 수 있다. 또한, 응집화 제제 예컨대 명반은 면역 반응을 증진시키기 위해 적합하게 사용된다.
일부 구현예에서, DsbA 또는 DsbC로 면역화된 동물은 염소, 양, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭이다.
일부 구현예에서, DsbA 또는 DsbC에 특이적으로 결합하는 항체는 단클론성 항체이다. 단클론성 항체는 실질적으로 균질한 항체의 집단으로부터 얻어지며, 즉 집단을 포함하는 개별적인 항체는 단클론성 항체의 생산 동안 발생하는 가능한 변이체를 제외하고 동일한 에피토프에 동일하거나 및/또는 결합하며, 이러한 변이체는 일반적으로 소량으로 존재한다. 따라서, 수식어 "단클론성"은 구별되거나 다클론성 항체의 혼합물이 아닌 항체의 특징을 나타낸다. 상기에 기재된 바와 같이, 단클론성 항체는 먼저 문헌 [Kohler et al., Nature 256:495 (1975)]에 의해 기재된 하이브리도마 방법을 사용하여 제작될 수 있거나, 재조합 DNA 방법(미국 특허 번호 4,816,567)에 의해 제작될 수 있다.
일부 양태에서, 본 발명은 DsbA에 특이적으로 결합하는 항체를 정제하는 방법을 제공하며, 상기 방법은 지지 물질에 부착된 초순수 DsbA를 포함하는 크로마토그래피 물질에 항-DsbA 항체를 포함하는 조성물을 접촉하는 단계, 비결합된 화합물을 제거하기 위해 크로마토그래피 물질을 세정하는 단계, 및 항-DsbA 항체를 용출시키는 단계를 포함한다. 일부 구현예에서, 지지 물질에 부착된 초순수 DsbA는 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.05%, 0.01% 중 임의의 것 미만의 불순물을 포함한다. 일부 구현예에서, 초순수 DsbA는 본원에 기술된 방법에 의해 제조된다. 일부 구현예에서, 본 발명은 DsbA에 특이적으로 결합하는 다클론성 항체를 정제하는 방법을 제공한다. 일부 구현예에서, 약 임의의 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.05%, 0.01% 미만의 다클론성 항체가 비-DsbA 화합물에 특이적으로 결합한다.
일부 양태에서, 본 발명은 DsbC에 특이적으로 결합하는 항체를 정제하는 방법을 제공하며, 상기 방법은 지지 물질에 부착된 초순수 DsbC를 포함하는 크로마토그래피 물질에 항-DsbC 항체를 포함하는 조성물을 접촉하는 단계, 비결합된 화합물을 제거하기 위해 크로마토그래피 물질을 세정하는 단계, 및 항-DsbC 항체를 용출시키는 단계를 포함한다. 일부 구현예에서, 지지 물질에 부착된 초순수 DsbA는 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.05%, 0.01% 중 임의의 것 미만의 불순물을 포함한다. 일부 구현예에서, 초순수 DsbC는 본원에 기술된 방법에 의해 제조된다. 일부 구현예에서, 본 발명은 DsbC에 특이적으로 결합하는 다클론성 항체를 정제하는 방법을 제공한다. 일부 구현예에서, 약 임의의 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.05%, 0.01% 미만의 다클론성 항체가 비-DsbC 화합물에 특이적으로 결합한다.
일부 구현예에서, 항-DsbA 및/또는 항-DsbC 항체는 크로마토그래피 물질 상에 고정화된 초순수 DsbA 또는 DsbC(예컨대, 활성화된 글리세릴-제어된 기공 유리에 고정화된 초순수 DsbA 및 또는 DsbC)에 항체를 접촉함에 의해 정제된다. 일부 구현예에서, 항체는, 예를 들어, 고정화된 DsbA 또는 DsbC와의 접촉 전에, 암모늄 설페이트 침전법에 의하여 농축된다. 일부 구현예에서, 항체는 고정화된 DsbA 또는 DsbC에 결합되고 그리고 그 다음 고정화된 DsbA 또는 DsbC-항체 복합체는 비-결합된 불순물을 제거하기 위해 세정된다. 추가 구현예에서, 항체는 부하 완충제로 상이한 pH에서 완충제로 용출함에 의해 고정화된 DsbA 또는 DsbC로부터 용출된다; 예를 들면, 항체는 중성 pH(예컨대, pH 7.2)에서 고정화된 DsbA 또는 DsbC에 결합되고 산성 pH(예컨대, pH 2.0)에서 용출된다. 일부 추가 구현예에서, 항-DsbA 또는 항-DsbC 항체는 추가의 크로마토그래피; 예를 들어 크기 배제 크로마토그래피로 처리된다. 일부 구현예에서, 정제된 항-DsbA 또는 항-DsbC 항체 (예컨대, 다클론성 항체)는 초순수 DsbA 또는 DsbC, 각각에 대한 이들의 결합에 대해 검정된다.
VIII.
DsbA
및
DsbC에
대해 항체를 사용한 면역검정
일부 구현예에서, 본 발명은 DsbA의 양 및/또는 존재에 대해 재조합 폴리펩티드 샘플을 분석하는 방법을 제공하며, 이는 면역검정을 사용하여 샘플 내 DsbA를 검출하는 단계 및 샘플 내에서 검출된 DsbA의 양을 초순수 DsbA 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함한다. 일부 구현예에서, 상기 제제는 불순물의 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 또는 0.01% 중 임의의 것 미만을 포함한다. 일부 구현예에서, 초순수 DsbA 참조 표준은 본 명세서에서 기재된 방법에 의해 제조된다. 일부 구현예에서, 면역검정은 초순수 DsbA에 특이적으로 결합하는 항체를 포함한다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는, 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 또는 0.01% 중 임의의 것 미만의 비-DsbA 화합물에 결합한다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 다클론성 항체이다. 기타 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 단클론성 항체이다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 면역검정 내 포획 항체로서 사용된다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 검출 항체로서 사용된다. 일부 구현예에서, 검출 항체는 검출제 (예컨대, 호스래디쉬 퍼옥시다아제)에 콘주게이트된다. 일부 구현예에서, DsbA 단백질은 이. 콜라이 DsbA이다. 일부 구현예에서, 재조합 폴리펩티드는 숙주세포 (예컨대, 이. 콜라이 숙주세포)에서 제조된다. 일부 구현예에서, 숙주 세포는 DsbA를 과발현한다 (예컨대, DsbA를 과발현하는 이. 콜라이 숙주 세포임). 일부 구현예에서, 샘플은 세포 용해물이거나, 또는 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다. 일부 구현예에서, 초순수 DsbA에 특이적으로 결합하는 항체는 하기 중 임의의 것 및/또는 이의 미만을 검출할 수 있다: 면역 검정 내 DsbA의 약 50 ng/mL, 25 ng/mL, 15 ng/mL, 10 ng/mL, 5 ng/mL, 2.5 ng/mL, 및/또는 1.5 ng/mL.
일부 구현예에서, 본 발명은 DsbC의 양 및/또는 존재에 대해 재조합 폴리펩티드 샘플을 분석하는 방법을 제공하며, 이는 면역검정을 사용하여 샘플 내 DsbC를 검출하는 단계 및 샘플 내에서 검출된 DsbC의 양을 초순수 DsbC 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함한다. 일부 구현예에서, 상기 제제는 불순물의 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 또는 0.01% 중 임의의 것 미만을 포함한다. 일부 구현예에서, 초순수 DsbC 참조 표준은 본 명세서에서 기재된 방법에 의해 제조된다. 일부 구현예에서, 면역검정은 초순수 DsbC에 특이적으로 결합하는 항체를 포함한다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는, 약 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 또는 0.01% 중 임의의 것 미만의 비-DsbC 화합물에 결합한다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 다클론성 항체이다. 기타 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 단클론성 항체이다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 면역검정 내 포획 항체로서 사용된다. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 하기 중 임의의 것 및/또는 이의 미만을 검출할 수 있다: 면역 검정 내 DsbC의 50 ng/mL, 35 ng/mL, 25 ng/mL, 15 ng/mL, 10 ng/mL, 5 ng/mL, 2.5 ng/mL, 1.5 ng/mL, 및/또는 1 ng/mL. 일부 구현예에서, 초순수 DsbC에 특이적으로 결합하는 항체는 검출 항체로서 사용된다. 일부 구현예에서, 검출 항체는 검출제 (예컨대, 호스래디쉬 퍼옥시다아제)에 콘주게이트된다. 일부 구현예에서, DsbC 단백질은 이. 콜라이 DsbC이다. 일부 구현예에서, 재조합 폴리펩티드는 숙주세포 (예컨대, 이. 콜라이 숙주세포)에서 제조된다. 일부 구현예에서, 숙주 세포는 DsbC를 과발현한다 (예컨대, DsbC를 과발현하는 이. 콜라이 숙주 세포임). 일부 구현예에서, 샘플은 세포 용해물이거나, 또는 재조합 폴리펩티드 제제로부터 수득되며, 여기서 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드 제제는 최종 정제된 생성물이다.
일부 양태에서, 본 발명은 DsbA 및 DsbC의 검출 및 정량화를 위한 면역검정 방법을 제공한다. 이러한 방법은 DsbA 및/또는 DsbC가 폴리펩티드 접힘 및 조립을 용이하게 하도록 과발현된 숙주세포, 예를 들면 이. 콜라이에서 생산된 재조합 폴리펩티드 제제 내 DsbA 및 DsbC의 검출 및 정량화를 위해 사용될 수 있다. 일부 구현예에서, 면역검정 방법은 본 명세서에 기재된 포획 및 검출 항-DsbA 또는 DsbC 항체를 사용한다. 일부 구현예에서, 항체는 비제한적으로, 샌드위치 검정, 효소-결합 면역흡착 검정(ELISA) 검정, 전기화학적 검정(ECL) 검정, 자기 면역검정을 포함하는, 당해 기술에서 공지된 임의의 면역검정 방법에 사용된다. 특정 구현예에서, 상기 방법은 DsbA 또는 DsbC에 항-DsbA 또는 항-DsbC 항체의 결합 및 복합체가 각각 항-DsbA 또는 항-DsbC 항체와 DsbA 또는 DsbC 사이에 형성되는지 여부를 검출에 대해 허용된 조건 하에서, 재조합 폴리펩티드 제제의 샘플을 본 명세서에서 기재된 바와 같은 항-DsbA 또는 항-DsbC 항체와 접촉하는 것을 포함한다.
특정 구현예에서, 표지된 항-DsbA 및/또는 항-DsbC 항체가 제공된다. 표지는 직접적으로 검출되는 표지 또는 모이어티(예컨대, 형광성, 발색성, 전자-밀도, 화학발광성, 및 방사성 표지), 뿐만 아니라 예를 들면, 효소 반응 또는 분자 상호작용을 통해 간접적으로 검출되는 모이어티, 예를 들면, 효소 또는 리간드를 포함하지만, 이에 제한되지 않는다. 예시적인 표지는, 비제한적으로, 하기를 포함한다: 방사성동위원소 32P, 14C, 125I, 3H, 및 131I, 형광단 예컨대 희토류 킬레이트 또는 플루오레신 및 그 유도체, 로다민 및 그 유도체, 단실, 엄벨리페론, 루세리페라제, 예를 들면, 개똥벌레 루시퍼라아제 및 박테리아 루시퍼라아제 (미국 특허 번호 4,737,456), 루시페린, 2,3-디하이드로프탈라진디온, 호스래디쉬 퍼옥시다아제 (HRP), 알칼리성 포스파타제, β-갈락토시다아제, 글루코아밀라아제, 리소자임, 사카라이드 옥시다제, 예를 들면, 글루코오스 옥시다제, 갈락토오스 옥시다제, 및 글루코오스-6-포스페이트 탈수소효소, 염료 전구체 예컨대 HRP를 산화하기 위해 과산화수소를 사용하는 효소로 커플링된, 헤테로사이클릭 옥시다제 예컨대 우리카제 및 잔틴 옥시다제, 락토퍼옥시다아제, 또는 마이크로퍼옥시다아제, 바이오틴/아비딘, 스핀 표지, 박테리오파아지 표지, 안정한 유리 라디칼, 등.
특정 구현예에서, 포획 항-DsbA 또는 항-DsbC 항체는 고체 상에 고정화된다. 일부 구현예에서, 고정화를 위해 사용된 고체 상은, 예를 들면, 표면, 입자, 다공성 매트릭스, 비드 등의 형태로 된 지지체를 포함하여, 본질적으로 수불용성이고 면역계측 검정에 유용한 임의의 불활성 지지체 또는 담체이다. 통상적으로 사용된 지지체의 예는 작은 시트, SEPHADEX®, 겔, 폴리비닐 염화물, 플라스틱 비드, 및 96-웰 미세적정 플레이트뿐만 아니라 미립자 물질 예컨대 여과지, 아가로스, 가교결합된 덱스트란, 및 다른 다당류를 포함하여 폴리에틸렌, 폴리프로필렌, 폴리스티렌, 등으로부터 제조된 검정 플레이트 또는 시험관을 포함한다. 대안적으로, 하기에 기재된 반응성 수-불용성 매트릭스 예컨대 시아노겐-브로마이드-활성화된 탄수화물 및 반응성 기질이 포획-시약 고정화에 적합하게 이용된다: 미국 특허 번호 3,969,287; 3,691,016; 4,195,128; 4,247,642; 4,229,537; 및 4,330,440. 일부 구현예에서, 고정화된 포획 시약은 몇 개의 샘플 한꺼번에 분석하기 위해 사용될 수 있는 미세적정 플레이트 상에 코팅된다. 예시적인 미세적정 플레이트는, 비제한적으로, MICROTEST®, MAXISORP®, NUNCMAXISORB®, 및 IMMULON® 을 포함한다. 고체 상은 상기에서 정의된 바와 같은 포획 시약으로 코팅되어, 비-공유 또는 공유 상호작용 또는 물리적 연결에 의해 바라던 대로 연결될 수 있다. 부착을 위한 기술은 미국 특허 번호 4,376,110 본 명세서에서 인용된 참조문헌에 기재된 것들을 포함한다. 공유 결합이면, 플레이트 또는 다른 고체 상은 당해 기술에서 잘 알려진 조건하에서 예컨대 1시간 동안 실온에서 포획 시약과 함께 가교결합제로 항온처리된다. 일부 구현예에서, 플레이트는 분석 자체에 아주 앞서 적층 및 코팅되고, 그 다음 검정은 로봇 공학을 사용하는 것과 같은 매뉴얼, 세미-자동, 또는 자동 방식으로 여러 샘플에서 동시에 수행된다.
일부 구현예에서, 코팅된 플레이트는 플레이트의 웰들 상의 과잉 부위에 대한 유리 리간드의 원치 않는 결합을 방지하기 위해 결합 부위에 비특이적으로 결합하고 포화시키는 차단제로 처리된다. 이러한 목적을 위한 적절한 차단제의 예는 비제한적으로, 예를 들면, 젤라틴, 소 혈청 알부민, 난 알부민, 카세인, 및 비-지방 밀크를 포함한다. 차단 처리는 전형적으로 주위 온도의 조건하에 전형적으로 약 1-4 시간인 일정한 기간 동안 일어난다.
일부 구현예에서, 코팅 및 차단 후에, 적절히 희석된, 분석되어 지는 샘플이 고정화된 상에 첨가된다. 이러한 목적을 위해 희석하는데 사용될 수 있는 예시적인 완충제는, 비제한적으로, (a) 0.5% BSA, 0.05% TWEEN 20® 세정제 (P20), 0.05% PROCLIN® 300 항생제, 5 mM EDTA, 0.25% 3-((3-콜라미도프로필)디메틸암모니오)-1-프로판설포네이트 (CHAPS) 계면활성제, 0.2% 베타-감마 글로불린, 및 0.35M NaCl을 함유하는 포스페이트-완충된 염수 (PBS); (b) 0.5% 소 혈청 알부민 (BSA), 0.05% P20, 및 0.05% PROCLIN® 300을 함유하는 PBS, pH 7; (c) 0.5% BSA, 0.05% P20, 0.05% PROCLIN® 300, 5 mM EDTA, 및 0.35 M NaCl을 함유하는 PBS, pH 6.35; (d) 0.5% BSA, 0.05% P20, 0.05% PROCLIN® 300, 5mM EDTA, 0.2% 베타-감마 글로불린, 및 0.35 M NaCl을 함유하는 PBS; 및 (e) 0.5% BSA, 0.05% P20, 0.05% PROCLIN®300, 5mM EDTA, 0.25% CHAPS,및 0.35 M NaCl을 함유하는 PBS를 포함한다.
샘플 및 고정화된 포획 시약의 항온처리를 위한 조건은 검정의 민감성을 최대화하고 해리를 최소화하고, 그리고 샘플 내에 존재하는 관심 임의의 분석물 (예컨대 DsbA 또는 DsbC)이 고정화된 포획 시약에 결합하는 것을 확실히 하도록 선택된다. 선택적으로, 샘플은 비포획된 물질을 제거하기 위해 고정화된 포획 시약으로부터 (예를 들어, 세정에 의해) 분리된다. 세정에 사용되는 용액은 일반적으로 완충제(예컨대, "세정 완충제")이다. 관심 포획된 물질이 후속의 단계에서 어느 정도까지 해리될 수 있는 임의의 우려가 있을 수 있다면, 가교결합제 또는 다른 적합한 제제가 또한 이 단계에서 첨가될 수 있어 관심 현재 결합된 물질(예컨대, DsbA 또는 DsbC)이 포획 시약에 공유결합되도록 할 수 있다.
존재하는 관심 임의의 결합된 물질을 갖는 고정화된 포획 시약은 검출 항-DsbA 또는 항-DsbC 항체와 접촉된다. 일부 구현예에서, 검출 항체는 비오틴일화된다. 일부 구현예에서, 비오틴일화 표지를 위한 검출 수단은 아비딘 또는 스트렙타비딘-HRP이다. 일부 구현예에서, 검출 수단의 판독은 형광측정 또는 비색이다.
포획 시약에 현재 결합된 샘플로부터 관심 임의의 유리 물질의 수준 (예컨대, DsbA 또는 DsbC)은 검출 항체에 대한 검출 수단을 사용하여 측정되거나 또는 정량화된다. 일부 구현예에서, 측정 또는 정량화는 것은 공지된 양에 비교하여 관심 물질(예컨대, DsbA 또는 DsbC)의 수준을 결정하기 위해 표준 곡선과 상기 단계의 결과로서 일어나는 반응을 비교하는 것을 포함한다.
고정화된 포획 시약에 첨가된 항체는 직접적으로 표지되어 질 것이거나, 또는, 과잉의 제1 항체를 세정한 후, 제1 항체의 동물 종의 IgG에 대해 지향된 몰 과잉의 제2 표지된 항체의 첨가에 의해 간접적으로 검출될 것이다. 간접적인 검정인 후자에서는, 제1 항체에 대해 표지된 항혈청이 동일계내에서 표지된 항체를 생산하도록 샘플에 첨가된다.
제1 항체 또는 제2 항체 중 어느 하나에 대해 사용된 표지는 제1 및 제2 항체에 대해 관심 유리 물질(예컨대, DsbA 또는 DsbC)의 결합을 방해하지 않는 임의의 검출 가능한 작용기이다. 적합한 표지의 예는 면역검정에서 사용을 위해 공지된 것들, 예컨대 상기에 열거된 것들을 포함한다.
기존의 방법은 단백질이나 폴리펩티드에 공유 결합된 표지에 결합할 수 있다. 예를 들면, 디알데히드, 카보디이미드, 디말레이미드, 비스-이미데이트, 비스-디아조화 벤지딘 등과 같은 커플링제를 상술한 형광체, 화학 발광체 및 효소 표지로 항체를 태깅하는 데 사용할 수 있다. 예를 들어 다음을 참조: 미국 특허 번호 3,940,475 (형광측정법) 및 미국 특허 번호 3,645,090 (효소); Hunter et al., Nature 144:945 (1962); David et al., Biochemistry, 13:1014-1021 (1974); Pain et al., J. Immunol . Methods 40:219-230 (1981); 및 Nygren, J. Histochem . and Cytochem., 30:407-412 (1982). 일부 구현예에서, 표지는 검출 수단용 스트렙타비딘-HRP을 사용한 바이오틴이다.
효소를 포함한 그러한 표지의 항체로의 콘주게이션은 면역검정 기술에서 당업자에게 표준 가공 절차이다. 참고: 예를 들면, O'Sullivan et al. "Methods for the Preparation of Enzyme-antibody Conjugates for Use in Enzyme Immunoassay," in Methods in Enzymology, ed. J. J. Langone and H. Van Vunakis, Vol. 73 (Academic Press, New York, N.Y., 1981), pp. 147-166.
최종 표지된 항체의 첨가 후, 결합된 항체의 양을 하기에 의하여 계측한다: 세정을 통한 과량의 비결합 표지된 항체를 제거하는 것, 이후 상기 표지에 적절한 검출 방법을 사용하여 상기 부착된 표지의 양을 측정하거나 정량화하는 것, 및 상기 측정된 양을 생물학적 샘플 내 관심 항체의 양과 연관시키는 것. 예를 들면, 효소의 경우에 있어서, 전개되고 측정된 색상의 양은 존재하는 관심 항체의 양의 정량화를 가능하게 하는 직접적인 측정일 것이다. 일 구현예에서, HRP는 표지이고 색상은 490-nm 흡광도에서 기판 OPD를 사용하여 검출된다.
일 예에서, 제1 비표지된 항체에 대해 지향된 효소-표지된 제2 항체가 고정화된 상으로부터 세정된 후, 색상 또는 화학 발광은 고정화된 포획 시약을 효소의 기질과 함께 배양함으로써 전개되고 측정된다. 이후 관심 물질 (예컨대, DsbA 또는 DsbC)의 농도는 표준 실행에 의해 생성된 색상 또는 화학발광과 병렬적으로 비교함에 의해 산출된다.
일부 구현예에서, 본 발명은 단백질 접힘 및 조립을 용이하게 하기 위해 DsbA 및/또는 DsbC를 포함하는 박테리아에서 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물에 대한 품질 검정을 제공한다. 일부 구현예에서, 박테리아 세포는 DsbA 및/또는 DsbC를 과발현한다. 일부 구현예에서, 박테리아 세포는 이. 콜라이 세포이다. 일부 구현예에서, 박테리아 세포는 DsbA 및/또는 DsbC를 과발현한 이. 콜라이 세포이다. 일부 구현예에서, 품질 검정은, 재조합 폴리펩티드를 포함하는 조성물의 샘플을 DsbA 또는 DsbC를 검출하는 면역검정으로 처리하는 단계를 포함하고, 여기서 특정 양 초과의 DsbA 또는 DsbC의 검출은, 상기 치료적 폴리펩티드의 약제학적 조성물이 동물에의 투여에 적합하지 않다는 것을 표지한다. 일부 구현예에서, 재조합 폴리펩티드를 포함하는 조성물의 샘플은 세포 용해물이다. 일부 구현예에서, 샘플은 재조합 폴리펩티드를 포함하는 조성물로부터 수득되며, 여기서 상기 재조합 폴리펩티드는 하나 이상의 크로마토그래피 정제 단계로 처리된 것이다. 일부 구현예에서, 재조합 폴리펩티드를 포함하는 조성물은 최종 정제된 생성물이다. 일부 구현예에서, 약 50 ppm, 40 ppm, 30 ppm, 20 ppm, 10 ppm, 9 ppm, 8 ppm, 7 ppm, 6 ppm, 5 ppm, 4 ppm, 3 ppm, 2 ppm, 1 ppm, 0.9 ppm, 0.8 ppm, 0.7 ppm, 0.6 ppm, 0.5 ppm, 0.4 ppm, 0.3 ppm, 0.2 ppm, 또는 0.1 ppm 중 임의의 것 미만의 DsbA 및/또는 DsbC의 농도는, 상기 약제학적 조성물이 동물에의 투여에 적합하다는 것을 표지한다.
IX. 제조 물품 및
키트
본 명세서에서 기재된 방법에 의해 정제된 폴리펩티드 및/또는 본 명세서에서 기재된 방법에 의해 정제된 폴리펩티드를 포함하는 제형은 제조 물품 내에 함유될 수 있다. 일부 구현예에서, 제조물품은, 본원에 기술된 초순수 DsbA 및 /또는 DsbC 폴리펩티드를 사용하여 생성된 항체를 포함한다. 제조 물품은 폴리펩티드, 항체, 폴리펩티드 제형, 및/또는 항체 제형을 함유하는 용기를 포함할 수 있다. 바람직하게는, 제조 물품은: (a) 용기 내에 본 명세서에 기재된 폴리펩티드, 항체, 폴리펩티드 제형 및/또는 항체 제형을 포함하는 조성물을 포함하는 용기; 및 (b) 폴리펩티드 및/또는 항체를 사용하는 것에 대한 설명서를 갖는 포장 삽입물을 포함한다.
제조 물품은 용기 및 그 용기에 또는 관련된 표지 또는 포장 삽입물을 포함한다. 적절한 용기에는 예로서, 병, 바이알, 주사기 등이 포함된다. 상기 용기는 다양한 재료, 예컨대 유리 또는 플라스틱으로 형성될 수 있다. 용기는 배합물을 보유 또는 함유하고, 멸균된 접근 포트를 가질 수 있다 (예컨대 용기는 피하 주사 니들로 뚫을 수 있는 스토퍼를 갖는 정맥내 용액 백 또는 바이알일 수 있다). 상기 제조물품은 상업적으로 그리고 사용자 입장에서 목적 기타 재료들, 예를 들면 기타 완충제, 희석제, 여과제, 니들 및 주사기를 추가로 포함할 수 있다. 일부 구현예에서, 용기는 주사기이다. 일부 구현예에서, 주사기는 주입 장치 내에 추가로 함유된다. 일부 구현예에서, 주사 장치는 자동주사기이다.
"포장 삽입물"은 폴리펩티드, 항체, 폴리펩티드 제형, 및/또는 항체 제형에 대한 정보를 함유하는, 치료 제품의 상업적 패키지에 관례상 포함된 설명서를 지칭하기 위해 사용된다.
일부 구현예에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내 DsbA의 검출을 위한 키트를 제공하며, 여기서 상기 키트는 본원에 기술된 항-DsbA 항체를 포함한다. 일부 구현예에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내 DsbC의 검출을 위한 키트를 제공하며, 여기서 상기 키트는 본원에 기술된 항-DsbC 항체를 포함한다. 또 다른 기타 구현예에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내 DsbA 및 DsbC의 검출을 위한 키트를 제공하며, 여기서 상기 키트는 본원에 기술된 항-DsbA 항체 및 본원에 기술된 항-DsbC 항체를 포함한다. 일부 구현예에서, 본 발명은 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내 DsbA의 검출을 위한 키트를 제공하며, 여기서 상기 박테리아 세포 (예컨대, 이. 콜라이 세포)는 DsbA 및/또는 DsbC를 과발현한다. 일부 구현예에서, 키트는 사용 설명서를 포함한다. 일부 구현예에서, 키트는 추가로 샘플 내 DsbA 및/또는 DsbC를 정량화하기 위한 표준 곡선을 생성하는데 참조 표준으로 사용하기 위한 초순수 DsbA 및/또는 DsbC를 포함한다. 일부 구현예에서, 본 키트는 더욱이 샘플 내 DsbA 및/또는 DsbC를 검출하기 위한 검정에서 양성 대조군으로서 사용하기 위한 초순수 DsbA 및/또는 DsbC를 포함한다.
본 명세서에 개시된 모든 특징은 임의의 조합으로 조합될 수 있다. 본 명세서에서 개시된 각 특징은 동일한, 동등한 또는 유사한 목적을 위한 대안적인 특징으로 대체될 수 있다. 따라서, 달리 명확히 언급되지 않는 한, 개시된 각 특징은 단지 동등하거나 유사한 특징의 일반적인 시리즈의 예이다.
본 발명의 추가의 세부사항은 하기 비-제한적인 예에 의해 예시된다. 본 명세서의 모든 참조의 개시내용은 본 명세서에 참고로 명확히 편입된다.
실시예
하기의 실시예는 본 발명의 순전히 예시적인 것으로 의도되며, 따라서 본 발명을 어떤 식으로든 제한하는 것으로 간주되어서는 안된다. 하기 실시예 및 상세한 기술은 예시하기 위한 것으로 제공되며, 제한하고자 하는 것은 아니다.
실시예
1. 이.
콜라이
단백질의 검정은
DsbA
또는
DsbC를
적절하게 측정하지 않는다.
이황화 산화환원효소(DsbA)는 티올 이황화 교환 반응에 의해 단백질의 시스테인을 산화시켜 다설파이드 결합을 형성할 수 있는 강한 산화제이다. 이것은 박테리아에서 이황화 결합 형성의 주요 촉매제이며 단백질의 올바른 단백질 접힘을 촉진한다. 유사하게, 이황화 산화환원효소(DsbC)는 세포의 주변세포질에서 산화적 단백질-접힘을 하는 동안 이황화 결합 이소머라아제이다. DsbA 및 DsbC는 전형적으로 이. 콜라이에서 높은 수준으로 발현되지 않지만, DsbA 및/또는 DsbC를 과발현하는 이. 콜라이는 항체(예컨대, 다중특이적 항체)를 포함하는 이종다량체 진핵 단백질의 적절한 조립 및 접힘을 개선하기 위해 사용되어 왔다.
이. 콜라이 단백질(ECP)에 대한 분석이 DsbA 및/또는 DsbC의 존재를 적절하게 검출하고 정량할 수 있는지를 계측하기 위해, 정제된 DsbA 또는 DsbC의 샘플이 검정 희석제(0.15M NaCl/0.1M NaPO4/0.1%생선 젤라틴/0.05% 폴리소르베이트 20/0.05% 프로크린 300)에 상이한 농도로 첨가되고 ECP 검정에서 시험되었다 (Zhu-Shimoni, J. et al., 2014, Biotech and Bioeng. 111:2367-2379). 소 혈청 알부민은 이. 콜라이 단백질에 대한 검정은 이 포유동물 단백질을 검출해서는 아니되기 때문에 음성 대조군으로 사용되었다. 그 결과는 표 3에 나타나 있다.
LTR = 범위 미만
결과는 ECP 검정이 DsbA 또는 DsbC를 적절하게 검출하고 정량화하지 못한다는 것을 보여준다. 또한, 이. 콜라이에서 제조된 치료 단백질에 대한 방출 검정의 일부로서 이. 콜라이 잔류물 (예컨대, 이. 콜라이 단백질 및 핵산)을 검출하기 위한 상업적 검정은, 이들 검정이 DsbA 및/또는 DsbC 발현이 최소인 이. 콜라이 세포 추출물에 대한 다클론성 항체를 제조함에 의해 전형적으로 생성되기 때문에, DsbA 및/또는 DsbC를 식별하지 못한다. 이와 같이, DsbA 및/또는 DsbC 검출 검정을 방해할 수 있는 다른 이. 콜라이 단백질 및/또는 핵산에 대해 최소 반응성으로 DsbA 및/또는 DsbC에 고도로 특이적인 다클론성 항체를 생성하기 위해 초순수 DsbA 및/또는 DsbC를 제조할 필요가 있다. 또한, DsbA 및/또는 DsbC의 초순수 제조품은 치료 폴리펩티드 제조품에서의 DsbA 및/또는 DsbC의 정확한 검출을 위한 DsbA 및/또는 DsbC 표준의 생성에 그리고 연구용 검정 품질 및 상업적 폴리펩티드 생산을 보장하는 DsbA 및/또는 DsbC 양성 대조군의 생성에 유용하다.
실시예
2. 초순수
DsbA의
정제
물질 및 방법
추출 단계
DsbA는 이. 콜라이 (W3110 유도체 명명된 62A7 ΔfhuA (ΔtonA) ptr3, lacIq, lacL8, ompTΔ(nmpc-fepE) ΔdegPilvG 보수됨)에서 과발현되었다 (Joly, JC and Swartz JR 1994, Biochem . 33:4231-4236; Joly, JC and Swartz JR 1997, Biochem. 36:10067-10072; US Pat. No. 5,789,199; 미국 특허 번호 5,789,199). 세포 페이스트를 10mM MOPS pH 7.1 내에 현탁하고 (50g 세포 페이스트/1L) 현탁액이 균질해질 때까지 혼합하였다. 세포 용해는 7000psi에서 미세유동화기 110F를 사용하여 수행되었다. 균질물을 (10% PEI 스톡 용액을 사용하여) 0.1% PEI로 컨디셔닝하고 30분 동안 주위 온도(~21℃)에서 혼합하였다. 현탁액을 30분 동안 8500rpm에서 원심분리하였다. 농축물을 수집하고 0.22um Durapore 필터를 통하여 여과하였다.
정제 방법
모든 칼럼 크로마토그래피 단계는 GE 사로부터의 AKTA 익스플러러스(Explorers) 상에서 수행되었다. DsbA를 균질화 및 원심분리를 사용하여 이. 콜 라이 세포 페이스트로부터 추출하였다. 농축물을, Q 세파로오스® FF(QSFF)칼럼을 사용하여, 결합 및 용출 모드로의 음이온 교환 크로마토그래피로 정제한다. QSFF 풀을, 이후 포로스 50 HS 칼럼을 사용하여, 결합 및 용출 모드로의 양이온-교환 크로마토그래피로 정제한다. 상세한 실행 조건은 표 4 및 5에 기재된다
Q-세파로오스® 단계
모드: 결합 및 용출; 수지: Q-세파로오스® FF(GE);칼럼 높이: 20-30 cm; 유속: 150 cm/h; 부하 밀도: ≤6 mg/mL).
| 단계 | 완충제 | 칼럼 용적 |
| 사전 평형화(Pre Equil) | 25mM Tris, 1M NaCl, pH 9.2, 86 mS/cm | 4 |
| 평형 | 25mM Tris, pH 9.1, 0.3 mS/cm | 4 |
| 부하 | 농축물을 물로 희석(1:1)하고, 이후 하기로 pH-조정한다: 1.5M Tris Base pH 9.0, 전도도 ~ 1.0 mS/cm | ≤ 6 mg/mL |
| 세정 | 평형 완충제 | 6 |
| 용출 | 완충제 B: 25mM Tris, 250mM NaCl, pH 9.2, 26 mS/cm 4 CV에 대한 15%B 4 CV에 대한 20%B 잔여 용출 상에 대한 25%B 분획 수집 피크 (1 CV) |
20 |
|
|
QSFF 풀을 2.0M 아세트산으로 5.0으로 pH-조정하였다. |
|
| 고염 세정 | 25mM Tris, 1M NaCl, pH 9.2, 86 mS/cm | 5 |
| 위생처리 | 0.5 N NaOH | ≥ 30분 |
| 기억 장치 | 0.1 N NaOH | 3 |
풀링: 풀을 크기 배제 크로마토그래피 (SEC)에 의해 분석하고 최대 양의 DsbA를 함유하는 분획을 기반으로 풀링하였다 (데이터 비도시).
포로스 50 HS 단계
모드: 결합 및 용출 ; 수지: 포로스 50 HS (Applied Biosystems); 칼럼 높이: 20-30 cm; 유속: 150 cm/h; 부하 밀도: ≤6 mg/mL).
| 단계 | 완충제 | 칼럼 용적 |
| 평형 | 2.5 mM MES, pH 5.5, 0.4 mS/cm | 4 |
| 부하 | Q 풀을, 2M 아세트산으로 5.0까지 pH-조정하고, 이후 물과 (1:2) pH 5.0, 0.4 mS/cm로 희석하였다. |
요구시 |
| 세정 1 | 평형 완충제 | 5 |
| 용출 | 완충제 B: 12.5mM MES, 250mM NaCl pH 5.5, 25 mS/cm 15CV 내 0 내지 60% B 구배 분획 수집 피크 (1 CV) |
15 |
| 고염 | 12.5 mM MES, 1M NaCl, pH 5.5, 87 mS/cm | 5 |
| 위생처리 | 0.5 N NaOH | ≥ 30분 |
| 기억 장치 | 0.1 N NaOH | 3 |
풀링: 분획을, 하기에 의한, 순도를 기준으로 하여 분석하고 풀링하였다: SDS-PAGE 겔 및 SEC (도 3 및 4).
포로스 50 HS 풀 농도
풀은 3000rpm에서 ~ 30분 동안 원심분리된 10kD 센트리콘(Centricon) 막(밀리포어 사)을 사용하여 ~ 3.0mg/mL로 농축되었다.
분석 방법
역가
계측
DsbA 농축물 역가는 GE 헬쓰케어 사로부터의 슈퍼덱스 200 10/300 SEC 칼럼(ID# 0619081)을 사용하여 HPLC(애질런트 1100) 검정으로 정량화되었다. 칼럼은 주위 온도에서 0.5mL/min으로 작동되었다. 칼럼은 0.20M 인산칼륨, 0.25M 염화칼륨, pH 6.2 ± 0.1로 60분 동안 0.5mL/min에서 평형화되었다. 흡광도는 280nm에서 모니터링되고 용출 피크 면적이 정량화되었다. 흡광도는 1.15(mg/ml)-1*cm- 1 의 흡광 계수를 사용하여 320nm에서 280nm에서 배경 흡광도를 마이너스하여 측정하였다.
크기 배제 크로마토그래피(SEC)
DsbA 이종성, 퍼센트 고분자량, 모노머, 및 단편이 GE 헬쓰케어 사로부터의 슈퍼덱스 200 10/300 SEC 칼럼(ID# 0619081)을 사용하여 계측되었다. 칼럼을 0.20 M 인산칼륨, 0.25 M 염화칼륨, pH 6.2 ± 0.1에서 60분 동안 0.5mL/min에서, HPLC (Agilent 1100) 상에서 주위 온도로 구동시켰다. 표적 주입 용량은 50μg이였고 흡광도는 280nm에서 모니터링되었다. 피크 면적은 애질런트 사로부터 켐스테이션(Chemstation) 소프트웨어를 사용하여 산출되었다.
SDS-PAGE
SDS-PAGE는 4-12% 비스-Tris 프리캐스트 겔(인비트로젠 사 Cat. #NP0322)로 수행되었다. 겔은 헤우케쇼벤 은 염색 방법을 사용하여 염색되었다.
웨스턴
블롯
정제된 DsbA 단백질이 생성되었다. 토끼가 면역화되고 그리고 최종 채혈이 풀링되고 아래에 기재된 바와 같이 친화도 정제되었다.
면역블롯 분석을 위해, 단백질이 SDS 겔에서 니트로셀룰로오스 막 상으로 반-건식 이동 시스템(iBlot 인비트로젠 사 Cat. #SD1000)로 이동되었다. 니트로셀룰로오스는 1 × NET (A3017), 0.5% 젤라틴(바이오-래드 카탈로그 No. 170-6539) 용액을 사용하여 실온에서 30분 동안 블록킹되었다. 1차 항-DsbA 항체가 50mL의 1X NET에서 1:700K로 희석되고 블록킹화된 니트로셀룰로오스에 첨가되고 밤새 탐색되었다. 항-DsbA 항체는 정제된 DsbA로 토끼를 면역화함에 의해 생산되었다. 토끼 항혈청이 풀링되고, 친화도 정제되고 그리고 0.1% 나트륨 아자이드]를 함유하는 PBS, pH 7.5에 보관되었다. 2차 항-토끼-HRP(GE 헬쓰케어 사 cat#NA934V) 항체가 1:100K로 희석되고 그리고 2시간 동안 세정된 니트로셀룰로오스에 첨가되었다.
결과
DsbA는 pH 9.0 완충제 및 부하를 사용하여 칼럼에 결합할 수 있었다. QSFF 용출 상은 세 상이한 용출 피크를 가졌다. 용출 피크에 걸쳐 선택된 QSFF 풀 분획은 슈퍼덱스 200 10/300 GL SEC 칼럼을 사용하여 분석되었다(도 1). LMW 불순물은 제1 피크로 용출한다(분획 3). 제2 피크는 우세하게 HMW 종으로 구성되고(분획 7), 그리고 제3 피크는 표적 DsbA 단백질을 함유했다(분획 10 및 11). 꼬리-용출하는 어깨는 추가의 LMW 종과 미량의 DsbA를 함유했다(분획 15). DsbA 단백질을 함유하는 분획은 크기 배제 크로마토그래피 데이터에 기초하여 풀링되었다. QSFF 단계는 HMW 및 LMW 종의 부분적인 감소를 제공했다; 그러나, DsbA의 순도를 더욱 개선하기 위해 추가의 다운스트림 정제 단계가 시행되었다.
QSFF 풀을 정제하기 위해 포로스 50 HS 수지가 시행되었다. 포로스 50 HS 풀(분획 4 및 5)의 SDS-PAGE 분석은 주요 피크가 DsbA 단백질을 함유한다는 것을 나타냈다(도2, 레인 6 및 7). 정제된 DsbA 단백질을 나타내는 단일 밴드는 DsbA의 이전에 정제된 풀과 일치하는 분자량을 갖는다(레인 2. HMW 및 LMW 종은 구배 및 고염 세정에서 나중에 용출하였다(레인 9 및 10). 대표적인 포로스 50 HS로부터 SEC 데이터는 도 3에 도시된다. 풀링된 포로스 50HS 분획(분획 4 및 5)은 HMW 및 LMW가 부하로부터 제거되고 분획은 주로 DsbA 단백질로 구성되었음을 나타냈다. 응집 문제는 정제된 DsbA 물질에는 관측되지 않았다.
크로마토그래피 공정은 초순수 DsbA를 수득했다. DsbA는 도 4에 나타낸 바와 같이 > 98%였다 - 0.0% HMW 종 및 1.8% LMW 종으로 SEC에 의해 분석된 바와 같이 98.2% 주요 피크 및 0.0% HMW 종 및 0.8% LMW로 SEC에 의해 분석된 바와 같이 99.2% 주요 피크. 불순물은 도 3에서 포로스 부하(Q 풀)로 도시된 SEC에 의해 정량화되었다.
실시예 3. 초순수 DsbC의 정제
DsbC는 2-단계 크로마토그래피 공정(표 6; 공정 A)을 사용하여 미리 정제되었다. 단백질은 ELISA(효소-결합 면역흡착 검정) 전개를 위한 참조 표준을 생성하기 위해 그리고 분자 탐침자로 사용하기 위해 DsbC(토끼에서)에 대한 항체를 생성하는 면역원으로서 필요했다.
2-단계 공정으로부터 정제된 DsbC 벌크는 상업적으로 입수가능한 토끼 항-DsbC에 대한 웨스턴 블롯에 의해 분석되었다. SDS-PAGE 분석은 DsbC는 몇 개의 고분자량(HMW) 숙주세포-관련 단백질을 함유했다는 것을 드러냈다(도 5). 이들 불순물 때문에, 숙주세포 단백질 불순물에 대한 토끼 항체의 생성을 최소화하기 위한, 새로운 DsbC 물질이 높은 수준의 DsbC 순도를 제공하기 위해 생성되어, ELISA에서 측정되어 진 샘플 내 DsbC의 수준의 과-정량화를 초래할 수 있었다.
이 목적 수준의 순도를 달성하기 위해, 몇 개의 상이한 크로마토그래피 단계(뿐만 아니라 정제 공정에서의 이의 상대적인 위치화)가 평가되었다. 상이한 공정이 참조 및 면역원으로서 사용하기에 적합한 물질을 생성하기 위해 상대적 성능에 대해 평가되었다(표 6).
|
|
공정 A (본래) |
공정 B | 공정 C | 공정 D | 공정 E (최종) |
| 추출 | 세포 페이스트 재현탁 | ||||
| 세포 용해 | |||||
| 양이온 폴리머/희석 | |||||
| 원심분리 | |||||
| 크로마토그래피 1 | 약 음이온 교환 (AE): DEAE FF |
약 AE | 약 AE | 약 AE | 약 AE |
| 크로마토그래피 2 | N/A | 강 양이온 교환 (CE): SPFF |
강 CE | 소수성 상호작용 크로마토그래피 (HIC): 페닐 FF (저 치환(low sub)) | 소수성 상호작용 크로마토그래피 (HIC): 페닐 FF (저 치환(low sub)) |
| 크로마토그래피 3 | N/A | N/A | 소수성 상호작용 크로마토그래피 (HIC): 페닐 FF (저 치환(low sub)) | N/A | N/A |
| 최종 크로마토그래피/완충제 교환 | 크기 배제 크로마토그래피(SEC) 슈퍼덱스 200 | N/A | N/A | N/A | 크기 배제 크로마토그래피(SEC) 슈퍼덱스 75 |
세포 추출
이. 콜라이 (W3110 유도체 명명된 62A7 ΔfhuA (ΔtonA) ptr3, lacIq, lacL8, ompTΔ(nmpc-fepE) ΔdegPilvG 보수됨) (Joly, JC and Swartz JR 1994, Biochem. 33:4231-4236; Joly, JC and Swartz JR 1997, Biochem. 36:10067-10072; 미국 특허 번호 5,789,199) 세포 페이스트 (함유 DsbC)를, 용해 완충제 (10 mM MOPS, pH 7.0; 10 mL의 용해 완충제 당 1 그램의 세포 페이스트) 내 현탁시켰다. 세포 용해는 미세유동화기®(마이크로플루이딕스(Microfluidics) 사)를 사용하여 수행되었다(7-8 K psi에서 4회 통과). 폴리에틸렌이민(PEI; 응집)이 0.1%(m/v)의 최종 농도로 용해물에 첨가되고 그리고 그 다음 실온에서 30분 동안 혼합되었다. PEI 현탁액이 원심분리되고(10 K rpm, 45분, 18℃) 그리고 상청액이 수집되고 크로마토그래피 전에 0.22μm 필터를 통해 여과되었다.
정제: 공정 A
총 1.8L의 정제 농축물 (1.5 M Tris 염기 내지 pH 8.0로 컨디셔닝됨)을, 표 7에 기술된 결합 및 용출 모드로 DEAE 세파로오스® 패스트 플로우 (GE Healthcare)를 함유하는 칼럼에 부하하였다. 이 단계의 말단에서, DsbC를 함유하는 694mg 단백질이 회수되었다.
| 단계 | 완충제 | 사용된 용적 (CV) |
유속 (mL/min) |
| 사전-평형화(Pre-Equil) | 250 mM MOPS pH 7.1; cond. 6.2 mS/cm) |
3 | 13.3 |
| 평형 | A = 10 mM MOPS pH 7.1; cond. 0.3 mS/cm) |
3 | 13.3 |
| 부하 | 정화된 농축물 (pH 8 까지 컨디셔닝됨) |
1.77 L | 13.3 |
| 세정 | 평형화(Equil.) 완충제 | 12 | 13.3 |
| 용출 구배 (A) |
10 mM MOPS pH 7.1; cond. 0.3 mS/cm) |
15 CV에 대한 0-60% B | 13.3 |
| 용출 구배 (B) |
10 mM MOPS, 250 mM NaCl pH 7.0; cond. 25 mS/cm) |
13.3 | |
| 고염 세정 | 10 mM MOPS, 1 M NaCl pH 7.0; cond. ~86.7 mS/cm) |
5 | 13.3 |
| 재생(Regen)/저장 | 0.5 N NaOH/0.1 N NaOH | 5/5 | 13.3 (30분 노출) |
DEAE 세파로오스 칼럼® 에 대한 용출 프로파일이 도 6에 도시되었다. 1, 2 및 3으로 표지된 피크의 SDS-PAGE 분석(도 7)은 피크 1에서의 분획이 DsbC의 예상된 몰 질량(~ 24 kDa)에 대응하는 두드러진 밴드를 함유한다는 것을 나타낸다. 피크 1 분획이 풀링되고 그리고 그 다음 토끼 항-DsbC에 대해 면역-블롯팅되었다. 이 면역블롯의 결과(도 8a)는 DsbC의 존재를 확인하였다. SDS-PAGE 분석은 면역블롯에서 밝혀지지 않는 수많은 더 높은 분자량과 더 낮은 분자량 밴드를 밝혀, 이들이 DsbC와 관련이 없고 숙주-세포 관련 불순물임을 나타낸다(도 8b). 최초 공정(공정 A)로부터 크기-배제 크로마토그래피(SEC)는 DsbC의 것에 가까운 몰 질량을 갖는 단백질이 충분히 분리되지 않기 때문에 이들 불순물의 전부는 아니지만 일부를 제거할 수 있다. 다운스트림 정화를 위한 대안적인 수단은 방법(들) 및 단계 순서가 표적 징후에 대한 요구된 수준의 순도로 DsbC의 정제에 유효하게 되는 것을 보기 위해 평가되었다(시약 배경 부문에 대한 언급에서 개괄됨).
정제: 공정 B
강한 양이온 교환 크로마토그래피 매질인 SP 세파로오스® 패스트 플로우, (SP-FF; GE 헬쓰케어 사)는 DEAE 세파로오스® 패스트 플로우 크로마토그래피 풀에서 숙주세포 단백질의 제거에 대해 평가되었다.
SP 세파로오스® FF의 선별은 5.0, 5.5 및 6.0의 pH 값에서 수행되었다. 부하 밀도는 5mg/mL였다. 완충제는 아래와 같다: A. 평형/세정 완충제: pH 5는 50mM NaOAc, 3.1mS/cm였고; pH 5.5는 50mM NaOAc, 3.05mS/cm였고; pH 6은 20mM 포스페이트, 3.18mS/cm였다; B. 용출 완충제: pH 5는 Equil A 내 1M NaCl, 94 mS/cm였고; pH 5.5는 Equil A 내 1M NaCl, 92 mS/cm였고; pH 6은 Equil A 내 1M NaCl, 87 mS/cm였다. 각각 1 mL SPFF 수지를 함유하는 3개의 드립 칼럼(drip columns)을 설치하고, 적절한 pH 범위에서 시험하였다. 칼럼(PD10 칼럼, 세파덱스 25)은 10CV 평형 완충제로 평형화되었다. 부하는 pH 5, 5.5 및 6에서 적절한 SP 평형 완충제로 완충 교환된 DEAE 풀이였다. 칼럼을 7CV 세정 완충제로 세정되었다. 용출은 10% B, 20% B, 40% B, 60% B, 80% B, 및 100% B의 각각 5CV로 되었다.
시험된 각각의 pH 값에 대한 칼럼 분획은 SDS-PAGE에 의해 평가되었다. 최상의 결합 조건은 pH 5.0에서 관측되었다. pH 값을 증가하는 것은 칼럼을 통해 흐르는 완충제-교환된 DEAE-FF 풀의 전부에 대한 일부(some-to-all)을 유발하였다. 숙주세포 불순물의 전부는 아니지만 일부가 pH 5.0에서 제거되었다: ~ 20kDa의 단일 저 분자량 밴드가 칼럼 부하 중에 제거되었다.
100mM로 NaCl 농도를 증가하는 것은 DsbC의 불완전한 용출을 가져왔지만 몇 개의 더 높은 MW 밴드는 제거되었다. 200mM로 NaCl에서의 증가는 나머지 DsbC의 대부분을 용출했지만, 그러나 또한 몇 개의 다른 단백질 불순물도 용출되었다.
SP-FF의 초기 결과는 pH 5.0에서 추가 평가를 보증했다. 잔류 숙주세포 단백질 불순물을 제거하기 위한 SP-FF의 가능성을 평가하기 위해. 소규모 정제가 하기 파라미터를 사용하여 수행되었다: 정화된 농축물을 표 8에 기술된 결합 및 용출 모드로 SP 세파로오스® 패스트 플로우를 함유하는 칼럼에 부하하였다. SP-FF 칼럼 분획의 분석은 초기 평가에서 볼 수 있는 20kDa 불순물의 동일한 제거뿐만 아니라 구배에서 조기 용출된 37kDa에서의 밴드의 제거를 나타냈다(도 9). DsbC 분획은 이 크로마토그래피 단계로부터 증가된 순도를 보였으나, 그러나 여전히 잔류의 더 높은 MW 불순물과 미량의 더 낮은 MW 불순물을 함유했다(도 9). HPLC-SEC에 의한 풀링된 SP-FF 분획의 분석은 95.2% 주 피크, 0.8% HMW 종 및 4.0% LMW 종을 나타냈다. SP-FF 겔은 충분한 수준으로 나머지 불순물을 제거하지 않기 때문에, 다른 정제 방법이 평가되었다.
| 단계 | 완충제 | 사용된 용적 (CV) |
유속 (mL/min) |
| 평형 | A = 50mM NaOAc pH 5.0; cond. 3.5 mS/cm) |
7 | 0.85 |
| 부하 | NaOAc, pH 5.0(1:1)을 사용하여 pH 5.0으로 DEAE 풀을 pH 조절했고, 그리고 그 다음 컨디셔닝하여, ~4 mS/cm에 도달될 때까지 정제수로 추가로 희석하였다. | 전체 | 0.85 |
| 세정 | 평형 완충제 | 7 | 0.85 |
| 용출 구배 (A) |
평형 완충제 | 20 CV에 대한 0-60% B | 0.85 |
| 용출 구배 (B) |
50 mM NaOAc, 1 M NaCl, pH 5.0; cond. 88 mS/cm 구배 용출: 20CV 내 0-60% B; 용출 구배에 걸친 분획화. |
20 CV에 대한 0-60% B | 0.85 |
| 고염 세정 | 50 mM NaOAc, 1 M NaCl pH 5.0; cond. 88 mS/cm |
5 | 0.85 |
| 재생(Regen)/저장 | 0.5 N NaOH/0.1 N NaOh | 5/5 | 13.3 (30분 노출) |
정제: 공정 C
소수성 상호작용 크로마토그래피(HIC)는 SP-FF 풀에서 남아있는 불순물의 제거에 대해 평가되었다. 공정 C를 전개할 때, 5개 잠재적인 HIC 배지(Hi 프로필, 페닐 세파로오스® 6 패스트 플로우(낮은 치환), 페닐 세파로오스® 6 패스트 플로우(높은 치환), 부틸 세파로오스® 4 패스트 플로우, 및 옥틸 세파로오스® 4 패스트 플로우)가 SP-FF의 초기 평가에 대해 개괄된 바와 같은 동일한 1.0mL 칼럼(상기 공정 B)을 사용하여 평가되었다. 크로마토그래피 조건은 표 9에 상세된다.
| HIC 수지 스크린 |
형식: 그래비티(Gravity) (드립 방법) | ||
| 부하 밀도: 3 mg/mL | |||
| HIC 수지 |
1. Hi 프로필 | ||
| 2. 페닐 세파로오스 6 패스트 플로우 (저치환(low-sub)) | |||
| 3. 페닐 세파로오스 6 패스트 플로우 (고치환(hi-sub)) | |||
| 4. 부틸 세파로오스 4 패스트 플로우 | |||
| 5. 옥틸 세파로오스 4 패스트 플로우 | |||
| 완충제 |
평형화/세정 | 0.6 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |
| 용출 | 0.5 M 황산나트륨 + 50 mM 포스페이트, pH 7 | ||
| 0.4 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 0.3 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 0.2 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 0.1 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 정제수 (pw) | |||
| 프로토콜 | 5개 드립 칼럼을 시험을 위해 0.5mL 적절한 HIC 수지를 함유하여 세운다 | ||
| 칼럼의 평형화 | 10 CV |
|
|
| 부하 | 7.5 mg의 SPFF 풀을 희석하여 0.6 M 황산나트륨/50 mM 포스페이트 (pH 7)의 최종 농도를 함유하도록 하였다. 희석을 위해 1.2M 황산나트륨 및 1M 포스페이트 pH 7 스톡 용액이 사용됨 최종 pH가 7, 68 mS/cm로 조정됨 5개로 부하가 분할됨. 각 수지에 대한 부하 밀도는 3mg/mL였다 |
||
| 세정 | 7 CV (세정 1 (4CV), 세정 2 (3CV)) | ||
| 용출 (각 3 CV) | 0.5 M 황산나트륨 + 50 mM 포스페이트, pH 7 | ||
| 0.4 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 0.3 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 0.2 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 0.1 M 황산나트륨 + 50 mM 포스페이트, pH 7 | |||
| 정제수 (pw) | |||
| 분획을 수집하고 SDS PAGE를 수행하여 불순물 제거를 평가한다 | |||
SDS-PAGE에 의한 칼럼 분획의 분석은, 평가된 대부분의 HIC 배지에 대해, 숙주세포 불순물의 과반이 겔에 결합하지 않고 부하 및 세정 단계 도중에 제거되었다는 것을 나타냈다. 추가의 불순물은 이들 HIC 배지에의 결합에서 차이를 보였으나, 감소하는 염도 구배(50mM 인산나트륨, pH 7.0에서 0.5M 황산나트륨에서 0.1M 황산나트륨을 사용하여 성공적으로 제거되었다;(도 10). DsbC는 그 뒤에 정제수(PW)로 각각의 HIC 배지로부터 용출되었다. SDS-PAGE 결과는 페닐 세파로오스® FF (저 치환) 풀에서 가장 많은 양의 정제된 DsbC가 발견되었음을 보여준다(도 10).
정제: 공정 D
공정 C에서의 3개의 크로마토그래피 단계의 순서는 초기의 DEAE-FF 단계에 존재하는 잔류 숙주세포 불순물을 제거하는데 극도로 유효하여 극히 초순수 DsbC를 수득하였다. HIC 단계가 DEAE-FF 풀에서 숙주세포 불순물을 제거하여, SP-FF 단계를 제거하고 DsbC에 대한 정제 과정을 효과적으로 간소화할 만큼 충분히 강력한지를 식별하기 위한 추가의 평가가 수행되었다.
제2 위치에서 HIC 단계를 평가하기 위해, DEAE-FF 풀의 분취량이 컨디셔닝되고 개발된 HIC 조건을 사용하여 처리되었다 (표 6, 공정 C). HIC 공정에 대한 추가의 개량은 중간 세정 단계를 더 길게 0.1M 황산나트륨, 50mM 인산나트륨 세정 단계로 대체하는 것을 포함했다. PW로 DsbC를 용출하기 전에 칼럼에서 불순물을 제거하기 위한 추가의 세정 용적이 시행되었다.
제3 위치에서 HIC 단계를 평가하기 위해, DEAE-FF 풀 대신 강력한 SP-FF 풀을 사용하여 상기에 열거된 바와 동일한 실험 전략이 수행되었다. 이들 실험은 아래와 같이 수행되었다:
실험 도식: 위치 2에서의 HIC- DEAE 풀 > HIC
위치 3에서의 HIC- DEAE 풀>SPFF 풀>HIC
형식: 그래비티(Gravity) (드립 방법)
HIC 수지: 페닐 세파로오스 6 패스트 플로우 (저치환(LowSub))
부하 밀도: 5 mg/ml
완충제:
평형화/세정 1: 0.6 M 황산나트륨 + 50 mM 포스페이트, pH 7
세정 2: 0.1 M 황산나트륨 + 50 mM 포스페이트, pH 7
용출: PW (정제수)
각각 1 mL HIC 수지를 함유하는 2개의 드립 칼럼(drip columns)을 설치하였다.
평형화 (칼럼): 10 칼럼 용적 (CV)
부하: 위치 2에서의 HIC: 5 mg DEAE 풀을 취하고, 이를 희석하여 0.6 M 황산나트륨/50 mM 포스페이트 (pH 7)의 최종 농도를 함유하도록 하였다. 최종 pH 7; ~ 68 mS/cm으로 조정됨
위치 3에서의 HIC: 5 mg SPFF 풀을 취하고, 이를 희석하여 0.6 M 황산나트륨/50 mM 포스페이트 (pH 7)의 최종 농도를 함유하도록 하였다. 최종 pH 7; ~ 68 mS/cm으로 조정됨
세정 1: 5 CV
세정 2: 5 CV
용출: 3 CV
여분 3 CV
염기 재생: 0.1 N NaOH (2 CV)
분획을 수집하고 SDS-PAGE를 수행하여 불순물 제거를 평가한다.
2 단계 공정은 3 단계 공정에서와 같이 DsbC에서 비목적 불순물을 제거하는 데에도 유효하였다(도 11).
정제: 공정 E (최종 공정)
DEAE-FF 풀의 정제는 페닐 세파로오스® 패스트 플로우 (저 치환)를 사용하여 확대되었다. 표 10은 작동 파라미터를 열거한다. 주요 피크 분획은 HIC 단계에 대해 7, 8, 9, 10 및 11이었다.
칼럼은 결합 및 용출 모드로의 페닐 세파로오스® (LS)이었다. 칼럼에 부하된 질량은 536mg이었다.
| 단계 | 완충제 | 사용된 용적 (CV) |
유속 (mL/min) |
| 평형 | 0.6M 황산나트륨, 50mM 인산나트륨, pH 7.0 | 10 | 13.2 |
| 부하 | HIC 칼럼 상에 부하 전에 DEAE 풀이 컨디셔닝되고, 1.2M 황산나트륨으로 1:1, 1M 인산나트륨으로 1:20으로 희석되고 그리고 pH 7.0, ~ 68 mS/cm로 조정되었다. | 전체 | 13.2 |
| 세정 1 | 0.6M 황산나트륨, 50mM 인산나트륨, pH 7.0 | 7 | 13.2 |
| 세정 2 | 0.6M 황산나트륨, 50mM 인산나트륨, pH 7.0 | 7 | 13.2 |
| 용출 | 정제수, 매 14mL 분획화 | 12 | 13.2 |
칼럼 분획의 SDS-PAGE 분석은 HIC 단계에 의해 매우 양호한 불순물 제거를 나타내었다. 개별적인 HIC 분획 중 일부에서 2개의 희미한 밴드(15kDa 및 50kDa에서)가 관측되었다. 그러나, 주요 분획의 일부 또는 전첨가 조합될 때, DsbC에 대응하는 하나의 밴드 주요 밴드만 관측되었다(도 12). HPLC-SEC를 사용하여 주요 DsbC 분획(7-11)의 분석은 97.0% 주요 피크, 1.0% 낮은 MW 및 2.0% 높은 MW의 분포를 나타내었다. 더 좁은 컷(분수 8-10)을 취하면 98.2% 주요 피크, 1.7% 낮은 MW 및 0.1% 보다 높은 MW 종의 분포를 얻었다.
슈퍼덱스 75 (GE Healthcare)를 사용한 크기 배제 크로마토그래피 (SEC)를 임의의 잔류 고 MW 및 저 MW 종을 제거하고 DsbC를 형성하기 위해 사용하였다. 슈퍼덱스 75를 선택하였고, 이는 DsbC와 같이 더 작은 단백질(~ 24kDa)에 더 적합한 분별화 범위(5kDa 내지 70kDa)를 가진다. SEC 칼럼에 대한 작동 파라미터는 표 11에 나와있다.
크기-배제 크로마토그래피를 위한 제조에서, HIC 풀(분획 7-11)은 Amicon Ultra-3 원심 분리 필터 (Millipore)를 사용하여 ≤ 16mL의 용적(≤ 5%의 SEC CV)으로 농축시켰다. 단위를 표적 용적에 도달할 때까지 20분 간격으로 임상 원심분리기 (Eppendorf)를 사용하여 4000rpm으로 원심분리하였다.
| 단계 | 완충제 | 사용된 용적 (CV) |
유속 (mL/min) |
| 평형 | PBS, pH 7.0 ± 0.4 | 3 | 1 |
| 부하 | 농축된 HIC 풀 | ≤16 mL ≤5%의 1 CV |
1 |
| 용출 | PBS, pH 7.0 ± 0.4 | 1 | 1 |
농축된 HIC 풀은 SEC 칼럼에 부하되고, 그리고 부하는 평형 완충제로 체이싱되었다. 칼럼을 평형 완충제로 전개시키고, 2%의 SEC CV (6.4 mL)를 나타내는 분획을 수집하였다. 총 2개 크기-배제 구동이 수행되었다. 주요 분획(47-56)은 SDS-PAGE에 의해 분석되었고(도 13) 그리고 DsbC에 대응하는 1 주요 밴드(~ 24kDa)를 나타냈다. 동일한 분획이 또한 HPLC-SEC 검정에서 시험되었다. 최종 제형화된 DsbC 벌크는 배면측에 약간의 꼬리가 있는 단일의 크게 대칭 피크를 나타낸다(도 14). 분취 SEC 단계는 불순물 및 DsbC 벌크를 최종 제형 완충제로 교환하는 완충제를 추가로 제거하는데 성공적이었다; HPLC-SEC를 사용하여 99.85% 주요 피크, 0.10% 낮은 MW 및 0.05% 높은 MW의 분포를 보였다.
냉각 해동
안정성 및 분석
제형화된 벌크의 안정성은 ≤ -80℃의 온도에서 3회 냉각-해동 주기를 거침에 의해 평가되었다. 냉각-해동 샘플의 분석을, SDS-PAGE 및 HPLC-SEC를 사용하여 수행하였다.
총 600μl의 제형화된 벌크가 각 시점에 대해 4 × 150 μL로 분할되어 이 연구에 사용되었다. 한 개의 분취액은 냉장실(2-8℃)에 위치되었다("0" 냉각-해동). 나머지 3개의 분취액은 ≤ -80℃ 냉동고에 위치되었다. 4시간 후, 샘플은 실온에서 ~ 1 hr 동안 해동되었고 부드럽게 혼합되었다. 샘플 중 하나는 냉장실로 이동되었고("1" 냉각-해동) 그리고 나머지 샘플은 ≤ -80℃ 냉동고에 재위치되었다. 이 공정이 반복되어, "2" 냉각-해동 샘플을 생성했다. 나머지 샘플("3" 냉각-해동)은 ≤ -80℃ 냉동고에 밤새 보관되었다. "3" 냉각-해동 샘플은 다음날 해동되었다. 비-감소된 및 감소된 SDS-PAGE 결과 실행은 정제된 벌크 및 모든 냉각-해동 샘플에서 DsbC(~ 24kDa)에 대응하는 일 밴드를 나타낸다(데이터 도시되지 않음). HPLC-SEC 검정은 모든 샘플이 0.1 % HMW 종, 99.9% 주요 피크 및 LMW 종이 검출되지 않은 중첩 프로파일로, 비교할 수 있음을 나타낸다. 분자는 3회 냉각/해동 사이클 후 이의 물리적 및 작용성 특성을 유지한다.
SDS-PAGE 및 시프로루비(SyproRuby) 염색
다른 비-DsbC 불순물이 최종 제형화된 벌크에 존재하는 것을 공고히 하기 위해, SDS-PAGE가 수행되고 그리고 시프로루비 염색(바이오-래드; 도 15)을 사용하여 화상형성되었다.
작용성 시험
DsbC 분자의 동일성을 하기의 세트로 확인하였다: 특성화 검정 (N-말단 서열 분석, 펩티드 질량 핑거프린팅 (PMF), CHIP TOF에 의한 무손상/감소된 질량). 검정은 분자의 정확한 동일성을 확인했다.
정제된 DsbC 벌크 및 생성된 냉각-해동 샘플의 분취액의 작용성 시험이 수행되어 4개의 샘플 사이의 비교가능성을 입증되었으며, 이는 단백질이 3회의 냉각-해동에 대해 안정하고 작용성이었음을 나타낸다(데이터 도시되지 않음). 정제된 DsbC는 항-DsbC 항체를 생성하기 위한 토끼 면역화에 대해 허용 가능한 것으로 간주되어 나중에 토끼 항-혈청으로부터 항-DsbC를 정제하기 위한 친화성 크로마토그래피에 대한 리간드로서 사용되었다.
실시예
4. 항-
DsbA
및 항-
DsbC
항체의 생성 및 정제
초순수 DsbA 및 DsbC에 대해 생성된 다클론성 항체는 치료 폴리펩티드의 제제 내 DsbA 및 DsbC로부터 제거를 측정하기 위한 검정에서 사용하기 위해 생성되었다. 하기 실시예는 다클론성 DsbA 및 DsbC 항체를 생성시키는데 사용된 정제 방법을 기술한다. DsbA 및 DsbC 면역원과 함께 이들 중요한 시약은 특정 DsbA 및 DsbC ELISA의 개발에 요구되었다.
(면역원 당) 3마리의 토끼가 DsbA 또는 DsbC로 면역화되었다. 제42일에, 혈액을 개별 토끼로부터 취하였고, DsbA 및 DsbC 항혈청을 항-DsbA 및 항-DsbC 항체의 정제를 위하여 사용하였다.
분석 방법
나트륨 도데실 설페이트 폴리아크릴아미드 겔 전기영동 (SDS-PAGE)이 DsbA 및 DsbC 항체의 상대적 순도를 계측할 뿐만 아니라 단백질의 몰 질량을 식별하기 위해 사용되었다. 전기영동은 항체의 공유 응집을 평가하기 위해 이황화 결합 감소로 그리고 감소 없이 수행되었다.
SDS-PAGE는 바이오-래드 Criterion™ 4-20% TGX (Tris-Glycine eXtended) Stain-Free™ 겔을 사용하여 수행되고 바이오-래드 Criterion Stain Free™ Imager(바이오-래드 라보라토리스 사)로 화상형성되었다.
고성능 액체 크로마토그래피-크기 배제 크로마토그래피 HPLC-SEC)는 고분자량 (HMW) 종, 주요 피크 (모노머), 및 저분자량 (LMW) 종을 분리하기 위해 TSK 겔 3000SWxl 칼럼(토쇼 바이오사이언스(Tosoh Bioscience) 사)을 사용하여 천연 조건에서 DsbA 및 DsbC 항체의 크기 이종성을 모니터하기 위해 사용되었다.
DsbA
및
DsbC
항체의 정제
DsbA 및 DsbC 항체의 정제는 동일한 추출 및 크로마토그래피 단계를 사용하여 병렬적으로 수행되었다. 공정은 하기로 구성된다:
염 침전: 60% 암모늄 설페이트 (AS) 분별화 단계가 항혈청에 대해 수행되었다. 60% 암모늄 설페이트 펠렛이 친화성 크로마토그래피 전에 인산염 완충제에 용해되었다.
고정화된 (면역원) 친화성 크로마토그래피: 친화성 크로마토그래피 단계가 60% 암모늄 설페이트 펠렛 내 나머지 불순물에서 표적 항체를 분리하기 위해 설계되었다. 정제된 DsbA 및 DsbC (토끼를 면역화하기 위해 사용된 시약의 동일한 로트)가 별도의 친화도 지지체를 구성하기 위한 리간드로 사용되었다. 각 친화도 지지체는 환원성 아미노화 화학을 통해 활성화된 글리세릴-CPG (제어된 기공 유리; 밀리포어)에 특이적 면역원의 고정화에 의해 제작되었다. 이러한 유형의 친화성 크로마토그래피는 표적 항체에 대해 고도의 선택성을 제공했다.
크기-배제 크로마토그래피 (SEC): 분취 SEC가 표적 항체로부터 보다 높은 분자량 (MW) 및 보다 낮은 분자량 (MW)을 분리하고 이들을 적합한 보관 완충제로 제형화하기 위해 사용되었다. 항체 풀의 작용가가 그 뒤에 표적 검정 성능을 식별하기 위해 이의 각각의 ELISA에 의해 계측되었다.
크로마토그래피 단계를, 특정 DsbA 및 DsbC ELISA의 전개에 사용하기에 적합한 물질을 생성하기 위하여 수행하고 평가하였다.
항혈청의 침전 및 표적 항체의 식별
토끼 항-혈청 A, B, C가 풀링되었다(용적 = 72mL(항-DsbA), 76mL(항-DsbC). 52mL의 암모늄 설페이트 컨디셔닝 용액(상기)이 첨가하는 동안 온화하게 교반하면서 항-DsbA 용액에 서서히 첨가되고, 55mL가 항-DsbC에 첨가되었다. 용액은 13,000rpm에서 18℃에서 45분간 원심분리되었다. 암모늄 설페이트 펠렛(DsbA 및 DsbC 항체를 함유)가 친화성 크로마토그래피를 위해 준비가 될 때까지 ≤ -60℃에서 냉각되었다.
암모늄 설페이트 현탁액, 상청액 및 펠렛의 SDS-PAGE 분석은 상층액이 항체를 고갈시켰으며 펠릿이 모든 토끼 항체를 함유하고 있음을 식별하였다. 토끼 항-DsbA 및 항-DsbC 항체는 ~130 kDa의 몰 질량을 나타낸다. 감소에 의해 ~130 kDa에서 주요 밴드는 중쇄(~50 kDa)와 경쇄(~25 kDa)로 감소했다.
친화성 크로마토그래피
항-DsbA 및 항-DsbC 60% 암모늄 설페이트 펠렛은 이의 각각의 DsbA-CPG 또는 DsbC-CPG 친화성 칼럼 상에 부하하기 전에 pH 7.2의 포스페이트 완충된 염수(PBS)에서 재구성되었다.
친화성 크로마토그래피 단계는 표 12에 기재된 바와 같이 수행되었다.
수지는 DsbA-CPG 또는 DsbC-CPG였다. 크로마토그래피는 결합 및 용출 방식이였다. 층 높이는 6.0cm(DsbA-CPG) 또는 5.0cm(DsbC-CPG)이었다. 직경은 1.6cm이고 용적은 12.0 또는 10.0mL였다.
| 단계 | 완충제 기술 및 pH | 사용된 용적 (CV) |
유속
(mL/min) |
| 평형 | PBS, 0.02% 아지드화나트륨, pH 7.2 |
3 | 12.0 |
| 부하 | 60% AS 펠렛으로 추출됨 (노트(Note) 1) | 구동횟수 당 60 mL | 1.2 |
| 세정 | PBS, 0.02% 아지드화나트륨, pH 7.2 |
3 | 1.2 |
| 용출 | PBS, 0.02% 아지드화나트륨, pH 2.0 (노트(Note) 2 및 3) | 5 | 12.0 |
| 사전-평형화 | 250 mM Tris, 0.02% 아지드화나트륨, pH 7.5 | 3 | 12.0 |
각 칼럼으로부터 결합된 DsbA 및 DsbC 항체가 5CV의 용출 완충제로 용출되었고, 항체가 (매우 낮은 용출 pH로 인해 항체의 응집을 최소화할, 7.0-7.5의 pH를 유지하기 위해) 농축된 Tris 완충제로 수집되었다. 용출 풀은 17mL의 1.0M 트리스, pH 7.5를 함유하는 비커에 수집되었다.
항-DsbC 친화도 풀의 SDS-PAGE 분석은 표적 토끼 항-DsbC 항체 및 기타 가능한 생성물-관련된 보다 높은 MW 종 및 보다 낮은 MW (<75 kDa) 종에 대응하는 ~130kDa에서 현저한 밴드를 나타냈다. 감소하는 조건하에서 주요 ~130 kDa 밴드는 2 밴드로 감소한다: 각각 중쇄 및 경쇄에 대응하는 ~50kDa 및 ~25kDa. 유사한 SDS-PAGE 밴딩 패턴이 또한 항-DsbA 친화도 풀에서 관측되었다(데이터 도시되지 않음).
항-DsbA 풀의 HPLC-SEC 분석은 79% 주요 피크, 19%의 보다 높은 MW 종, 및 2%의 보다 낮은 MW 종의 분포를 보였다. 항-DsbC 풀에 대해서는, 78% 주요 피크, 16%의 보다 높은 MW 종 및 6%의 보다 낮은 MW 종이 관측되었다. 79%(주요 피크)의 전체 순도가 이 단계에서 달성되었다. 작용적으로 풀을 시험하기 전에 분취량의 풀이 추가로 분획화되어 주요 피크의 양을 풍부하게 하였다. 크기-배제 크로마토그래피 전후, 풀의 검정 성능이 ELISA에서 평가되었다.
크기 배제 크로마토그래피: SEC
보다 높은 수준의 순도를 얻기 위해 크기-배제 크로마토그래피 (SEC)가 슈퍼덱스 200 칼럼 (GE 헬쓰케어 사)을 사용하여 수행되었다. 제한된 양의 항-DsbA 친화도 풀로 인해, 분취량의 항-DsbC 친화도 풀이 먼저 분획화되었다. SEC 칼럼에 대한 작동 파라미터는 아래와 같다. 칼럼의 용적은 1120mL였고 부하 양은 ≤ 6mL(1CV의 ≤5%)였다. 칼럼을 0.5mL/min의 유속에서 3 CV에 대해 PBS, pH 7.2로 평형화하였다. 부하는 사이클 당 ≤ 6.0mL였다. 한 사이클은 항-DsbA에 대해 수행되고 두 사이클은 항-DsbC에 대해 수행되었다. 칼럼은 0.5mL/min에서 1CV에 대해 PBS, pH 7.2로 전개되었다. 각 사이클에 대해, 토끼 혈청으로부터의 pH 조절된 친화도 풀이 아미콘 울트라(Amicon Ultra) 10 kDa 필터를 사용하여 α 6.0mL의 최종 용적으로 농축되었다.
10mg 분취량의 항-DsbC 친화도 풀이 아미콘 울트라-3 원심 필터 (밀리포어 사)를 사용하여 ≤6.0mL(1CV의 ≤5%)의 용적으로 농축되었다.
농축된 항-DsbC 친화도 풀을 SEC 칼럼 상 부하하고, 그리고 상기 부하물을 평형 완충제로 체이싱하였다. 칼럼은 평형 완충제로 전개되고 2.4mL 분획(SEC CV의 2%)이 수집되었다. 주요 피크 풀 분획은 34-37이었다.
어느 시리즈의 분획이 최고 정도의 순도를 획득했는가를 계측하기 위해, 몇 몇의 모의 풀이 HPLC-SEC 검정에서 평가되었다(표 13). 더 좁은 컷(분획 35-36)은 95.1% 주요 피크, 1.0% HMW, 및 3.9% LMW 종의 분포를 보인 반면 더 넓은 컷(분획 34-37)은 93.9% 주요 피크, 1.4% 높은 MW 및 4.7% 낮은 MW 종을 보였다. 더 좁은 풀링은 순도를 유의미하게 개선시키지 않았고 그리고 보다 낮은 단백질 질량 회수를 가졌기 때문에, 더 넓은 풀링 도식이 선택되었다(표 13).
| 풀링 도식 |
HMW
(%) |
주요/모노머 (%) |
LMW
(%) |
농도 (mg/mL) | 질량 (mg) |
| 1) 34-35 | 3.7 | 95.0 | 1.3 | 0.39 | 1.85 |
| 2) 34-36 | 2.2 | 94.5 | 3.3 | 0.49 | 3.53 |
| 3) 35-36 | 1.0 | 95.1 | 3.9 | 0.62 | 2.98 |
| 4) 34-37 | 1.4 | 93.9 | 4.7 | 0.52 | 4.99 |
농도는 모의 풀링을 기반으로 예상되었다.
TSK 칼럼: QC Pak GFC 300, 유속=0.5mL/min; 실행 시간 =15 min
SEC 단계는 모노머 양을 79%(친화성 단계에서)에서 94%로 증가시켰다.
작용성 시험 결과
항-DsbC 친화도 풀(비-분획화 및 분획화됨)이 더 나은 검정 성능을 제공하기 위해 더 높은 순도가 요구되는지를 결정하기 위해 직접적인 결합 ELISA 포맷으로 평가되었다. 비교할만한 용량 반응 곡선은 높은 MW 종의 제거가 필요하지 않음을 나타내는 두 개의 풀에서 달성되었다(도 16).
상기 결과는 호스래디쉬 퍼옥시다아제(HRP)에 DsbC 항체의 콘주게이션을 요하는 보다 민감성 ELISA 샌드위치 검정의 추구를 촉진했다. 이 유형의 성공적인 콘주게이션(바이오티닐화)은 전형적으로 항체 풀이 높은 MW 종 (응집물)에서 낮게 되는 것을 요한다.
이 단계를 평가하기 위해, 낮은 응집물 친화도 풀이 HRP에 콘주게이트되었다. 도포로서 낮은 응집물 친화도 풀 및 검출을 위해 HRP에 콘주게이트된 낮은 응집물 친화도 풀을 사용하여, 낮은 응집물 항-DsbC 풀은 DsbC를 검출하기 위한 샌드위치 ELISA에서의 사용에 적합한 것으로 간주되었다(도 17).
최종 결정은 (응집물에서 보다 낮고, 주요 피크에서 보다 크게 풍부한) 슈퍼덱스 200 항-DsbC 풀을 사용하는 것이었다. 이 결정으로, 항-DsbC 풀의 나머지 절반과 전체 항-DsbA 풀이 SEC를 사용하여 더 분획화했다.
공정 B
SEC 단계는 낮은 수준의 응집물을 갖는 보다 높은 정도의 순도를 보장하기 위한 최종 크로마토그래피 단계로서 최종 정제 공정(B)에 첨가되었다.
항-DsbA 친화도 풀 및 나머지 항-DsbC 친화도 풀의 분획화를, 이전에 기재된 바와 같이 슈퍼덱스 200 칼럼을 사용하고 상기에 기재된 동일한 작동 파라미터를 사용하여 SEC에 의해 수행하였다.
항-DsbA에 대한 최종적인 풀링 컷은 분획 35-38이었고, 항-DsbC에 대한 분획 34-37이었다. 이들 풀링 절단은 높은 수준의 순도(주요 피크) 및 최대 생산물 수율을 얻도록 만들어졌다. HPLC-SEC에 의해 검정된 최종 분획화된 풀은 87.3% 주요 피크(항-DsbA) 및 92.5% 주요 피크(항-DsbC)를 함유하였다. SEC 단계는 높은 및 낮은 MW 종 및 풀을 최종 제형 완충제(PBS, pH 7.0 ± 0.2)으로 교환하는 완충제를 제거함으로써 주요 피크를 농축시키는데 성공적이었다.
DsbA 및 DsbC의 정제는 DsbA 및 DsbC ELISA의 성공적인 개발을 유도했다.
실시예
5.
DsbA
및
DsbC의
ELISA 검출
시약
코트 항체(다클론성 항-DsbA 또는 다클론성 항-DsbC)는 PBS로 약 1.2mg/mL로 희석되어 -60℃ 또는 그 아래에서 보관되었다. 해동 후, 코트 항체는 해동의 일로부터 최대 1주 동안 2-8℃에서 보관되었다. 표준 물질(DsbA 또는 DsbC)은 100 μg/mL로 희석되고 -60℃ 또는 그 아래에서 보관되었다. 검정 대조군 공급원은 검정 희석제로 희석되어 표준 곡선까지 낮고 높은 영역 내로 되고 -60℃ 또는 그 아래에서 보관되었다. HRP-콘주게이트(호스래디쉬 퍼옥시다아제에 콘주게이트된 DsbA 또는 DsbC에 대한 항체). 해동 후, HRP-콘주게이트 항체는 해동의 일로부터 최대 1주 동안 2-8℃에서 보관되었다. HRP-콘주게이트 항-DsbA 스톡 I은 -10℃ 내지 -30℃에서 보관하기 위해 글리세롤로 대략 1:1로 희석되었다. HRP-콘주게이트 항-DsbC 스톡 I은 -60℃에서 보관하기 위해 검정 희석제로 대략 1:20으로 희석되었다.
검정 희석제: 0.15M 염화나트륨 [NaCl]/0.1M 인산나트륨 [NaPO4]/0.1% 생선 젤라틴/0.05% 폴리소르베이트 20/0.05% 프로클린(Proclin) 300.
세정 완충제: PBS/0.05% 폴리소르베이트 20.
코팅 완충제: 0.05M 탄산나트륨 완충제.
기질액: 슈어블루 리저브(SureBlue Reserve)™ TMB 마이크로웰 퍼옥시다아제 기질(커크가드 앤 페리 랩스[KPL] 사, 카탈로그 # 53-00-00 또는 동등물).
정지 용액: 0.6N 황산.
표준, 대조 및 샘플 제제
표준 곡선이 제조되었다(1000, 100, 50, 25, 12.5, 6.25, 3.13, 1.56, 0.781, 0 ng/mL). 각 대조의 분취량의 대조 제제가 사용일에 해동되었다. 미사용된 해동된 대조는 폐기되었다. 시험 샘플이 검정 희석제로 표준 곡선의 범위 내로 되도록 희석되었다.
절차
코트 항체 스톡 I은 표준 곡선 농도와 목적 반응 범위를 생성하도록 코팅 완충제로 희석되었다. 100μL 희석된 코트 항체 스톡 I은 미세적정 플레이트의 각 웰에 피펫팅되었고 그리고 12 내지 72시간 동안 2-8℃에서 항온처리되었다. 각 웰은 세정되고 대략 400μL의 세정 완충제로 3회 플레이트 세정기를 사용하여 흡인되고 철저하게 지워졌다. 용액은 폐액 저장기 위로 플레이트를 뒤집음에 의해 웰로부터 제거되지 않았다. 대략 200μL의 검정 희석제가 각 웰에 첨가되고 주위 온도에서 진탕으로 1 내지 2시간 동안 배양되었다. 세정 단계가 반복되었다.
희석된 표준(중복하여), 대조(중복하여), 및 샘플의 웰 당 100μL가 적절한 웰로 피펫팅되었다. 진탕으로 주위 온도에서 2시간 ± 10분 동안 배양한다. 웰을 상기와 같이 세정하고, 플레이트를 회전시키고, 그리고 상기 세정 단계를 반복하였다.
HRP-콘주게이트 스톡 I은 검정 희석제로 희석되어 최대 OD 값 1.5 - 2.0 OD를 목표로 하여, 최고와 최저 표준 사이의 유의미한 OD 범위를 산출하였다. 100 μL의 희석된 HRP-콘주게이트 스톡 I을, 각 웰에 피펫팅하고, 교반과 함께 2 시간 ± 10 분 동안 주위 온도에서 항온처리하였다. 웰을 상기와 같이 세정하고, 플레이트를 회전시키고, 그리고 상기 세정 단계를 반복하였다.
기질액의 웰 당 100μL가 웰들에 피펫팅되고 최적의 표준 곡선 색상 전개를 가능하도록 어두운 주위 온도에서 충분한 시간 동안 항온처리되었다. 0.6 N 황산을 웰 당 100 μL로 피펫팅하였다.
OD는 검출 흡광도에 대해 450nm 및 참조 흡광도에 대해 620-630nm인, 두 필터를 사용한 플레이트 판독기를 사용하여 판독되었다(참조 파장은 선택적임).
산출 및 데이터 분석
샘플 농도는 최소 5-파라미터 로지스틱 곡선-피팅 프로그램을 갖는 데이터-처리 소프트웨어를 사용함에 의해 계측되었다.
실시예 4에 기재된 바와 같이 항체의 정제 동안 DsbA 및 DsbC 제거를 평가하기 위해 ELISA가 사용되었다.
실시예 5. 단클론성 항체의 정제 동안 DsbA 및 DsbC 제거의 평가
MAb1은 이황화 결합의 적절한 접힘 및 생성에 도움이 되도록 DsbA 및 DsbC를 과발현한 이. 콜라이 세포에서 생산되었다. 간단히는, MAb1, DsbA 및 DsbC를 발현하는 이. 콜라이 세포가 용해되고 그리고 용해물을 청징하기 위해 원심분리되었다. 농축물은 그런 다음 맥셀렉트 슈어(MabSelect Sure) 단백질 A 칼럼 (MSS)에 적용되었다. MAb 1을 함유하는 용출된 MSS 분획은 그 뒤에, 전부 결합 및 용출 방식인, 캡토어드히어(CaptoAdhere; 캡토) 혼합된 방식 크로마토그래피, 포로스 50 HS 양이온 교환 크로마토그래피 및 QSFF 음이온 교환 크로마토그래피에 적용되었다. MAb1을 함유하는 풀링된 QSFF 분획은 그런 다음 한외여과 및 정용여과를 사용하여 농축되고 제형화되었다.
각 정제 단계로부터의 분획(농축물, MSS 단백질 A, 캡토어드히어, 포로스 50 HS, QSFF, UFDF)은 단백질 농도, 아래에 기재된 바와 같은 이. 콜라이 단백질의 제거, 및 실시예 3에 기재된 DsbA 및 DsbC의 존재에 대해 분석되었다. 결과는 6번의 능력 실행에 대해 수득되었다.
숙주-세포 단백질(ECP)의 제거
항체의 정제를 위해 사용된 회수 공정이 숙주-세포 단백질 (이. 콜라이 단백질 또는 ECP)의 수준을 감소하는 이의 능력에 대해 평가되었다. ECP의 정량화는 아래에 기재된 ELISA 검정을 사용하여 공정중 및 여과된 벌크 샘플에서 수행되었다. 이들 데이터는 임상 항체 물질 내의 ECP가 <50ng/mg 항체 수준까지 회수 공정에 의해 유의미하게 감소되었음을 입증한다.
풀 샘플에서 ECP의 수준을 정량화하기 위해 이. 콜라이 단백질에 대한 다중-생성물 샌드위치 ELISA가 사용되었다. 친화도-정제된 염소 항-전체의 ECP 항체가 미세적정 플레이트 웰들 상에 고정되었다. 풀 샘플의 희석액은 웰들에서 항온처리되고, 그 다음 호스래디쉬 퍼옥시다아제에 콘주게이트된 친화도-정제된 염소 항-전체의 ECP로 항온처리되었다. 호스래디쉬 퍼옥시다아제 효소 활성은 o-페닐렌디아민 디하이드로클로라이드로 검출되었다. ECP는 미세적정 플레이트 리더에서 490nm에서 판독 흡광도에 의해 정량화되었다. 표준 곡선을 생성하고 샘플 농도를 자동으로 산출하기 위해 4-파라미터 컴퓨터 곡선-피팅 프로그램이 사용되었다. ELISA에 대한 검정 범위는 전형적으로 DsbA에 대해 1.56ng/mL 내지 50ng/mL 및 DsbC에 대해 1.09ng/mL 내지 35ng/mL였다.
결과
각 분획에서 발견된 단백질의 총량은 표 14에 제시된다.
| 풀 | 구동 1 | 구동 2 | 구동 3 | 구동 5 | 구동 6 |
| 농축물 | 1.06 | 1.05 | 0.93 | 0.91 | 1.05 |
| MSS | 12.57 | 12.57 | 13.71 | 12.64 | 12.47 |
| 캡토 | 6.83 | 7.06 | 7.65 | 6.36 | 6.29 |
| 포로스 | 6.58 | 6.44 | 6.48 | 5.91 | 6.25 |
| QSFF | 4.34 | 4.52 | 4.22 | 3.85 | 3.89 |
| UFDF | 76.818 | 77.452 | 72.07 | 68.189 | 67.411 |
이. 콜라이 단백질의 제거는 표 15에 도시된다.
| 풀 | 구동 1 | 구동 2 | 구동 3 | 구동 5 | 구동 6 |
| 농축물 | 3761682.4 | 3829524 | 4510806 | 4610109.9 | 3362492.1 |
| MSS | 893.9 | 928.6 | 1116 | 1385 | 969.7 |
| 캡토 | 63.7 | 67.6 | 79.80 | 77.2 | 55.9 |
| 포로스 | 14.7 | 18.3 | 29.5 | 20.6 | 13.7 |
| QSFF | 5.1 | 6.9 | 10 | 8 | 5.8 |
| UFDF | 8.7 | 9.6 | 13.2 | 11.1 | 8.4 |
각 분획에서 검출된 DsbA의 총량은 표 16에 제시된다.
| 풀 | 구동 1 | 구동 2 | 구동 3 | 구동 5 | 구동 6 |
| 농축물 | 132688 | 169288 | 156320 | 152944 | 150888 |
| MSS | 647 | 607 | 847 | 1171 | 733 |
| 캡토 | 1.68 | 2.55 | 4.00 | 1.61 | 2.22 |
| 포로스 | <0.78 | <0.78 | <0.78 | <0.78 | <0.78 |
| QSFF | <0.78 | <0.78 | <0.78 | <0.78 | <0.78 |
| UFDF | <0.78 | <0.78 | <0.78 | <0.78 | <0.78 |
각 분획 내 DsbA의 상대적인 양이 각 분획 내 총 단백질(표 14)에 대해 각 분획 내 총 DsbA(표 16)를 정규화함에 의해 계측되었다. 정규화된 DsbA 함량의 결과는 표 17에 도시되었다. 결과는 ng/ml DsbA/단백질 농도로 나타내어졌다.
| 풀 | 구동 1 | 구동 2 | 구동 3 | 구동 5 | 구동 6 |
| 농축물 | 125177.3585 | 161226.6667 | 168086.0215 | 168070.3297 | 143702.8571 |
| MSS | 51.5 | 48.3 | 61.8 | 92.6 | 58.8 |
| 캡토 | 0.2 | 0.4 | 0.5 | 0.3 | 0.4 |
| 포로스 | <0.1 | <0.1 | <0.1 | <0.1 | <0.1 |
| QSFF | <0.2 | <0.2 | <0.2 | <0.2 | <0.2 |
| UFDF | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
각 분획에서 검출된 DsbC의 총량은 표 18에 제시된다.
| 풀 | 구동 1 | 구동 2 | 구동 3 | 구동 5 | 구동 6 |
| 농축물 | 223328 | 283116 | 179370 | 218864 | 232976 |
| MSS | 4594 | 5792 | 5896 | 7765 | 5305 |
| 캡토 | <1.09 | <1.09 | <1.09 | <1.09 | <1.09 |
| 포로스 | <1.09 | <1.09 | <1.09 | <1.09 | <1.09 |
| QSFF | <1.09 | <1.09 | <1.09 | <1.09 | <1.09 |
| UFDF | <1.09 | <1.09 | <1.09 | <1.09 | <1.09 |
각 분획 내 DsbC의 상대적인 양이 각 분획 내 총 단백질(표 14)에 대해 각 분획 내 총 DsbC(표 18)를 정규화함에 의해 계측되었다. 정규화된 DsbC 함량의 결과는 표 19에 도시되었다. 결과는 ng/ml DsbA/단백질 농도로 나타내어졌다.
| 풀 | 구동 1 | 구동 2 | 구동 3 | 구동 5 | 구동 6 |
| 농축물 | 210687 | 269634 | 192871 | 240510 | 221882 |
| MSS | 365 | 461 | 430 | 614 | 425 |
| 캡토 | <0.2 | <0.2 | <0.2 | <0.2 | <0.2 |
| 포로스 | <0.2 | <0.2 | <0.2 | <0.2 | <0.2 |
| QSFF | <0.3 | <0.3 | <0.3 | <0.3 | <0.3 |
| UFDF | <0.015 | <0.015 | <0.015 | <0.015 | <0.015 |
DsbA 및 DsbC 검정의 결과는 DsbA 및 DsbC 양자가 한외여과/정용여과 단계 전에 제거되었음을 보여준다. DsbA는 캡토어드히어 단계 후에 제거되고 DsbC는 맵셀렉트 슈어(MabSelect Sure) 단계 후에 제거된다.
서열
이.
콜라이
DsbA
아미노산 서열 리더 서열 부재
AQYEDGKQYTTLEKPVAGAPQVLEFFSFFCPHCYQFEEVLHISDNVKKKLPEGVKMTKYHVNFMGGDLGKDLTQAWAVAMALGVEDKVTVPLFEGVQKTQTIRSASDIRDVFINAGIKGEEYDAAWNSFVVKSLVAQQEKAAADVQLRGVPAMFVNGKYQLNPQGMDTSNMDVFVQQYADTVKYLSEKK (서열 번호:1)
아미노산 서열 리더 서열 존재 (굵은 표시로)
MKKIWLALAGLVLAFSASAAQYEDGKQYTTLEKPVAGAPQVLEFFSFFCPHCYQFEEVLHISDNVKKKLPEGVKMTKYHVNFMGGDLGKDLTQAWAVAMALGVEDKVTVPLFEGVQKTQTIRSASDIRDVFINAGIKGEEYDAAWNSFVVKSLVAQQEKAAADVQLRGVPAMFVNGKYQLNPQGMDTSNMDVFVQQYADTVKYLSEKK (서열 번호:5)
핵산 서열
(서열 번호:2)
이.
콜라이
DsbC
아미노산 서열 리더 서열 부재
(서열 번호:3)
아미노산 서열 리더 서열 존재 (굵은 표시로)
(서열 번호:6)
핵산 서열
(서열 번호:4)
<110> Marc WONG
Liliana T. YEE
Amy LIM
Chris B. FONG
<120> ULTRAPURIFIED DsbA AND DsbC AND METHODS OF MAKING AND USING THE
SAME
<130> 146392026040
<150> US 62/129,701
<151> 2015-03-06
<160> 6
<170> KoPatentIn 3.0
<210> 1
<211> 189
<212> PRT
<213> E. coli
<400> 1
Ala Gln Tyr Glu Asp Gly Lys Gln Tyr Thr Thr Leu Glu Lys Pro Val
1 5 10 15
Ala Gly Ala Pro Gln Val Leu Glu Phe Phe Ser Phe Phe Cys Pro His
20 25 30
Cys Tyr Gln Phe Glu Glu Val Leu His Ile Ser Asp Asn Val Lys Lys
35 40 45
Lys Leu Pro Glu Gly Val Lys Met Thr Lys Tyr His Val Asn Phe Met
50 55 60
Gly Gly Asp Leu Gly Lys Asp Leu Thr Gln Ala Trp Ala Val Ala Met
65 70 75 80
Ala Leu Gly Val Glu Asp Lys Val Thr Val Pro Leu Phe Glu Gly Val
85 90 95
Gln Lys Thr Gln Thr Ile Arg Ser Ala Ser Asp Ile Arg Asp Val Phe
100 105 110
Ile Asn Ala Gly Ile Lys Gly Glu Glu Tyr Asp Ala Ala Trp Asn Ser
115 120 125
Phe Val Val Lys Ser Leu Val Ala Gln Gln Glu Lys Ala Ala Ala Asp
130 135 140
Val Gln Leu Arg Gly Val Pro Ala Met Phe Val Asn Gly Lys Tyr Gln
145 150 155 160
Leu Asn Pro Gln Gly Met Asp Thr Ser Asn Met Asp Val Phe Val Gln
165 170 175
Gln Tyr Ala Asp Thr Val Lys Tyr Leu Ser Glu Lys Lys
180 185
<210> 2
<211> 627
<212> DNA
<213> E. coli
<400> 2
atgaaaaaga tttggctggc gctggctggt ttagttttag cgtttagcgc atcggcggcg 60
cagtatgaag atggtaaaca gtacactacc ctggaaaaac cggtagctgg cgcgccgcaa 120
gtgctggagt ttttctcttt cttctgcccg cactgctatc agtttgaaga agttctgcat 180
atttctgata atgtgaagaa aaaactgccg gaaggcgtga agatgactaa ataccacgtc 240
aacttcatgg gtggtgacct gggcaaagat ctgactcagg catgggctgt ggcgatggcg 300
ctgggcgtgg aagacaaagt gactgttccg ctgtttgaag gcgtacagaa aacccagacc 360
attcgttctg cttctgatat ccgcgatgta tttatcaacg caggtattaa aggtgaagag 420
tacgacgcgg cgtggaacag cttcgtggtg aaatctctgg tcgctcagca ggaaaaagct 480
gcagctgacg tgcaattgcg tggcgttccg gcgatgtttg ttaacggtaa atatcagctg 540
aatccgcagg gtatggatac cagcaatatg gatgtttttg ttcagcagta tgctgataca 600
gtgaaatatc tgtccgagaa aaaataa 627
<210> 3
<211> 216
<212> PRT
<213> E. coli
<400> 3
Asp Asp Ala Ala Ile Gln Gln Thr Leu Ala Lys Met Gly Ile Lys Ser
1 5 10 15
Ser Asp Ile Gln Pro Ala Pro Val Ala Gly Met Lys Thr Val Leu Thr
20 25 30
Asn Ser Gly Val Leu Tyr Ile Thr Asp Asp Gly Lys His Ile Ile Gln
35 40 45
Gly Pro Met Tyr Asp Val Ser Gly Thr Ala Pro Val Asn Val Thr Asn
50 55 60
Lys Met Leu Leu Lys Gln Leu Asn Ala Leu Glu Lys Glu Met Ile Val
65 70 75 80
Tyr Lys Ala Pro Gln Glu Lys His Val Ile Thr Val Phe Thr Asp Ile
85 90 95
Thr Cys Gly Tyr Cys His Lys Leu His Glu Gln Met Ala Asp Tyr Asn
100 105 110
Ala Leu Gly Ile Thr Val Arg Tyr Leu Ala Phe Pro Arg Gln Gly Leu
115 120 125
Asp Ser Asp Ala Glu Lys Glu Met Lys Ala Ile Trp Cys Ala Lys Asp
130 135 140
Lys Asn Lys Ala Phe Asp Asp Val Met Ala Gly Lys Ser Val Ala Pro
145 150 155 160
Ala Ser Cys Asp Val Asp Ile Ala Asp His Tyr Ala Leu Gly Val Gln
165 170 175
Leu Gly Val Ser Gly Thr Pro Ala Val Val Leu Ser Asn Gly Thr Leu
180 185 190
Val Pro Gly Tyr Gln Pro Pro Lys Glu Met Lys Glu Phe Leu Asp Glu
195 200 205
His Gln Lys Met Thr Ser Gly Lys
210 215
<210> 4
<211> 711
<212> DNA
<213> E. coli
<400> 4
atgaagaaag gttttatgtt gtttactttg ttagcggcgt tttcaggctt tgctcaggct 60
gatgacgcgg caattcaaca aacgttagcc aaaatgggca tcaaaagcag cgatattcag 120
cccgcgcctg tagctggcat gaagacagtt ctgactaaca gcggcgtgtt gtacatcacc 180
gatgatggta aacatatcat tcaggggcca atgtatgacg ttagtggcac ggctccggtc 240
aatgtcacca ataagatgct gttaaagcag ttgaatgcgc ttgaaaaaga gatgatcgtt 300
tataaagcgc cgcaggaaaa acacgtcatc accgtgttta ctgatattac ctgtggttac 360
tgccacaaac tgcatgagca aatggcagac tacaacgcgc tggggatcac cgtgcgttat 420
cttgctttcc cgcgccaggg gctggacagc gatgcagaga aagaaatgaa agctatctgg 480
tgtgcgaaag ataaaaacaa agcgtttgat gatgtgatgg caggtaaaag cgtcgcacca 540
gccagttgcg acgtggatat tgccgaccat tacgcacttg gcgtccagct tggcgttagc 600
ggtactccgg cagttgtgct gagcaatggc acacttgttc cgggttacca gccgccgaaa 660
gagatgaaag aattcctcga cgaacaccaa aaaatgacca gcggtaaata a 711
<210> 5
<211> 208
<212> PRT
<213> E. coli
<400> 5
Met Lys Lys Ile Trp Leu Ala Leu Ala Gly Leu Val Leu Ala Phe Ser
1 5 10 15
Ala Ser Ala Ala Gln Tyr Glu Asp Gly Lys Gln Tyr Thr Thr Leu Glu
20 25 30
Lys Pro Val Ala Gly Ala Pro Gln Val Leu Glu Phe Phe Ser Phe Phe
35 40 45
Cys Pro His Cys Tyr Gln Phe Glu Glu Val Leu His Ile Ser Asp Asn
50 55 60
Val Lys Lys Lys Leu Pro Glu Gly Val Lys Met Thr Lys Tyr His Val
65 70 75 80
Asn Phe Met Gly Gly Asp Leu Gly Lys Asp Leu Thr Gln Ala Trp Ala
85 90 95
Val Ala Met Ala Leu Gly Val Glu Asp Lys Val Thr Val Pro Leu Phe
100 105 110
Glu Gly Val Gln Lys Thr Gln Thr Ile Arg Ser Ala Ser Asp Ile Arg
115 120 125
Asp Val Phe Ile Asn Ala Gly Ile Lys Gly Glu Glu Tyr Asp Ala Ala
130 135 140
Trp Asn Ser Phe Val Val Lys Ser Leu Val Ala Gln Gln Glu Lys Ala
145 150 155 160
Ala Ala Asp Val Gln Leu Arg Gly Val Pro Ala Met Phe Val Asn Gly
165 170 175
Lys Tyr Gln Leu Asn Pro Gln Gly Met Asp Thr Ser Asn Met Asp Val
180 185 190
Phe Val Gln Gln Tyr Ala Asp Thr Val Lys Tyr Leu Ser Glu Lys Lys
195 200 205
<210> 6
<211> 236
<212> PRT
<213> E. coli
<400> 6
Met Lys Lys Gly Phe Met Leu Phe Thr Leu Leu Ala Ala Phe Ser Gly
1 5 10 15
Phe Ala Gln Ala Asp Asp Ala Ala Ile Gln Gln Thr Leu Ala Lys Met
20 25 30
Gly Ile Lys Ser Ser Asp Ile Gln Pro Ala Pro Val Ala Gly Met Lys
35 40 45
Thr Val Leu Thr Asn Ser Gly Val Leu Tyr Ile Thr Asp Asp Gly Lys
50 55 60
His Ile Ile Gln Gly Pro Met Tyr Asp Val Ser Gly Thr Ala Pro Val
65 70 75 80
Asn Val Thr Asn Lys Met Leu Leu Lys Gln Leu Asn Ala Leu Glu Lys
85 90 95
Glu Met Ile Val Tyr Lys Ala Pro Gln Glu Lys His Val Ile Thr Val
100 105 110
Phe Thr Asp Ile Thr Cys Gly Tyr Cys His Lys Leu His Glu Gln Met
115 120 125
Ala Asp Tyr Asn Ala Leu Gly Ile Thr Val Arg Tyr Leu Ala Phe Pro
130 135 140
Arg Gln Gly Leu Asp Ser Asp Ala Glu Lys Glu Met Lys Ala Ile Trp
145 150 155 160
Cys Ala Lys Asp Lys Asn Lys Ala Phe Asp Asp Val Met Ala Gly Lys
165 170 175
Ser Val Ala Pro Ala Ser Cys Asp Val Asp Ile Ala Asp His Tyr Ala
180 185 190
Leu Gly Val Gln Leu Gly Val Ser Gly Thr Pro Ala Val Val Leu Ser
195 200 205
Asn Gly Thr Leu Val Pro Gly Tyr Gln Pro Pro Lys Glu Met Lys Glu
210 215 220
Phe Leu Asp Glu His Gln Lys Met Thr Ser Gly Lys
225 230 235
Claims (255)
- DsbA 폴리펩티드를 포함하는 세포 용해물로부터 DsbA 폴리펩티드를 정제하는 방법으로서,
a) 상기 DsbA 폴리펩티드를 포함하는 세포 용해물에 약 0.01% 내지 약 1.0%의 최종 농도로 폴리에틸렌이민 (PEI)을 첨가하는 단계,
b) 원심분리에 의해 상기 세포 용해물을 정화하는 단계,
c) 상기 DsbA 폴리펩티드를 포함하는 상기 정화된 세포 용해물을 음이온 교환 크로마토그래피 물질에 적용하는 단계,
d) 상기 DsbA 폴리펩티드를 포함하는 음이온 교환 용출액을 생성시키도록 상기 음이온 교환 크로마토그래피 물질로부터 상기 DsbA 폴리펩티드를 용출시키는 단계,
e) 상기 DsbA 폴리펩티드를 포함하는 상기 음이온 교환 용출액을 양이온 교환 크로마토그래피 물질에 적용하는 단계,
f) 상기 정제된 DsbA 폴리펩티드를 포함하는 양이온 교환 용출액을 생성시키도록 상기 양이온 교환 크로마토그래피 물질로부터 상기 DsbA 폴리펩티드를 용출시키는 단계를 포함하는, 방법. - 제1항에 있어서, 상기 DsbA 폴리펩티드를 포함하는 상기 세포 용해물은 음이온 교환 크로마토그래피 이전에, 적어도 약 16시간 동안 상기 PEI 내에 보유되는, 방법.
- 제1항 또는 제2항에 있어서, 상기 용해물 내 상기 PEI의 최종 농도는 약 0.1%인, 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 DsbA 폴리펩티드 및 상기 PEI를 포함하는 상기 용해물은 약 7.0의 pH로 된 것인, 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 음이온 교환 크로마토그래피 물질은 강한 음이온 교환인자(exchanger)인, 방법.
- 제5항에 있어서, 상기 강한 음이온 교환인자는 4급 아민을 포함하는, 방법.
- 제5항 또는 제6항에 있어서, 상기 4급 아민은 가교결합된 아가로스에 연결된 것인, 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 DsbA는 염 구배를 사용하여 상기 음이온 크로마토그래피 물질로부터 용출된 것인, 방법.
- 제8항에 있어서, 상기 염 구배는 단계 구배(step gradient)인, 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 정화된 용해물은 10mM MOPS (pH 7.1)를 포함하는, 방법.
- 제10항에 있어서, 상기 DsbA는 하기 단계로 상기 음이온 교환 크로마토그래피 물질로부터 용출되는, 방법:
약 4개 칼럼 용적에 대해 약 pH 9.2에서 약 15%의, 약 25mM Tris 및 약 250mM NaCl,
약 4개 칼럼 용적에 대해 약 pH 9.2에서 약 20%의, 약 25mM Tris 및 약 250mM NaCl,
DsbA가 상기 칼럼으로부터 용출할 때까지 약 pH 9.2에서 약 25%의, 약 25mM Tris 및 약 250mM NaCl. - 제1항 내지 제11항 중 어느 한 항에 있어서, 단계 b)의 상기 DsbA 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 0.22 μm 필터를 통해 통과되는, 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 단계 b)의 상기 DsbA 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 pH 약 9.0으로 조정되는, 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 음이온 교환 용출액은 분획 내 수집되는, 방법.
- 제13항에 있어서, 상기 분획은 양이온 교환 크로마토그래피 이전에 크기 배제 크로마토그래피에 의해 분석되는, 방법.
- 제15항에 있어서, 적어도 약 55% DsbA를 포함하는 분획이 추가의 정제를 위해 선택되는, 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 상기 양이온 교환 물질은 설포프로필 모이어티를 포함하는, 방법.
- 제17항에 있어서, 상기 설포프로필 모이어티가 가교결합된 폴리(스티렌-디비닐벤젠) 매트릭스 또는 이의 등가물에 연결되는, 방법.
- 제1항 내지 제18항 중 어느 한 항에 있어서, 단계 d)의 상기 음이온 교환 용출액은 양이온 교환 크로마토그래피 전에 pH 약 5.0으로 조정되는, 방법.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 상기 DsbA는 염 구배를 사용하여 상기 양이온 크로마토그래피 물질로부터 용출된 것인, 방법.
- 제20항에 있어서, 상기 양이온 크로마토그래피 물질은 5 칼럼 용적의 12.5mM MES로 세정되는, 방법.
- 제20항 또는 제21항에 있어서, 상기 염 구배는 15 칼럼 용적에 걸쳐 약 0% 내지 약 60% 12.5mM MES 및 1M NaCl의 구배인, 방법.
- 제20항 내지 제22항 중 어느 한 항에 있어서, 상기 양이온 교환 용출액은 분획 내 수집되는, 방법.
- 제23항에 있어서, 상기 분획은 크기 배제 크로마토그래피에 의해 분석되는, 방법.
- 제24항에 있어서, 적어도 약 95% DsbA를 포함하는 분획이 풀링되는, 방법.
- 제1항 내지 제25항 중 어느 한 항에 있어서, 상기 DsbA 폴리펩티드는 에스케 리치아 콜라이 (Escherichia coli) DsbA 폴리펩티드인, 방법.
- 제26항에 있어서, 상기 DsbA 폴리펩티드는 서열 번호: 1의 아미노산 서열을 포함하는, 방법.
- 제27항에 있어서, 상기 DsbA 폴리펩티드의 아미노산 서열은 서열 번호: 1의 아미노산 서열에 적어도 약 80% 동일한, 방법.
- 제1항 내지 제28항 중 어느 한 항에 있어서, 상기 DsbA는 세포 내 발현되는, 방법.
- 제29항에 있어서, 상기 세포는 원핵 세포인, 방법.
- 제29항 또는 제30항에 있어서, 상기 세포는 이.콜라이 세포인, 방법.
- 제29항 내지 제31항 중 어느 한 항에 있어서, 상기 세포는 DsbA의 내인성 발현보다 더 큰 수준으로 DsbA를 발현하도록 가공된 것인, 방법.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 상기 세포는 미세유동화기(microfluidizer)를 사용하여 용해된 것인, 방법.
- 제1항 내지 제33항 중 어느 한 항의 방법에 의해 정제된 DsbA 폴리펩티드를 포함하는, 조성물.
- 정제된 DsbA 폴리펩티드를 포함하는 조성물로서,
상기 조성물은 적어도 약 95%의 모노머 DsbA 폴리펩티드를 포함하는, 조성물. - 제35항에 있어서, 상기 조성물은 약 2% 미만의 저분자량 종을 포함하는, 조성물.
- 제35항 또는 제36항에 있어서, 상기 조성물은 약 1% 미만의 고분자량 종을 포함하는, 조성물.
- 제35항 내지 제37항 중 어느 한 항에 있어서, 상기 모노머 DsbA 폴리펩티드의 백분율은 크기 배제 크로마토그래피에 의해 검출된 것인, 조성물.
- 제35항에 있어서, 상기 조성물은 약 5% 미만의 불순물을 포함하는, 조성물.
- 제39항에 있어서, 상기 불순물은 천연 DsbA에 비해 고분자량 및/또는 저분자량 폴리펩티드 종인, 조성물.
- 제39항 또는 제40항에 있어서, 상기 불순물은 이. 콜라이 단백질 (ECP), DsbA 응집물, DsbA 단편, 핵산 또는 세포 배양 배지 성분 중 하나 이상의 것인, 조성물.
- 제34항 내지 제41항 중 어느 한 항에 있어서, 상기 DsbA는 1회 이상의 냉각-해동 주기에 대해 안정적인 것인, 조성물.
- 제42항에 있어서, 상기 DsbA는 3회 냉각-해동 주기에 대해 안정적인 것인, 조성물.
- 제34항 내지 제37항 또는 제39항 내지 제43항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbA 폴리펩티드의 순도는 크로마토그래피, SDS 폴리아크릴아미드 겔 전기영동 또는 웨스턴 블롯 분석 중 하나 이상에 의해 측정되는, 조성물.
- 제34항 내지 제44항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbA 폴리펩티드의 순도는 고성능 액체 크로마토그래피 (HPLC)에 의해 측정되는, 조성물.
- 제34항 내지 제45항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbA 폴리펩티드의 순도는 크기 배제 크로마토그래피(SEC)에 의해 측정되는, 조성물.
- 제34항 내지 제37항 또는 제39항 내지 제44항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbA 폴리펩티드의 순도는 형광 단백질 염색 또는 은 염색을 사용한 SDS 겔 전기영동에 의해 측정되는, 조성물.
- 제47항에 있어서, 상기 조성물 내 비-DsbA 폴리펩티드의 존재는, 웨스턴 블롯 분석에 의해 나타난 바와 같이, 항-DsbA 항체와 면역반응성이 아닌 겔 전기영동에 의해 식별된 종의 존재에 의해 식별되는, 조성물.
- 제48항에 있어서, 상기 조성물 내 상기 DsbA 폴리펩티드의 응집물의 존재는, 웨스턴 블롯 분석에 의해 상기 천연 DsbA보다 더 큰 분자량을 갖는 종의 존재에 의해 식별되는, 조성물.
- 제48항에 있어서, 상기 조성물 내 상기 DsbA 폴리펩티드의 단편의 존재는 웨스턴 블롯 분석에 의해 상기 천연 DsbA보다 더 작은 분자량을 갖는 종의 존재에 의해 식별되는, 조성물.
- 제34항 내지 제50항 중 어느 한 항의 조성물에 동물을 노출하는 단계를 포함하는, DsbA에 특이적으로 결합하는 항체를 생성하는 방법.
- 제51항에 있어서, 상기 동물로부터 혈청을 수집하는 단계를 추가로 포함하며, 상기 혈청은 DsbA에 특이적으로 결합하는 항체를 포함하는, 방법.
- 제52항에 있어서, 상기 혈청은 DsbA에 특이적으로 결합하는 다클론성 항체를 포함하는, 방법.
- 제52항 또는 제53항에 있어서, 하나 이상의 단클론성 항체는 혈청으로부터 단리된 것인, 방법.
- 제51항 내지 제54항 중 어느 한 항에 있어서, 상기 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭인, 방법.
- DsbA에 특이적으로 결합하는 항체를 정제하는 방법으로서,
지지 물질에 부착된 초순수 DsbA를 포함하는 크로마토그래피 물질에 항-DsbA 항체를 포함하는 조성물을 접촉시키는 단계,
비결합된 화합물을 제거하기 위해 상기 크로마토그래피 물질을 세정하는 단계, 및
상기 항-DsbA 항체를 용출시키는 단계를 포함하는, 방법. - 제56항에 있어서, 상기 초순수 DsbA를 포함하는 조성물은 적어도 약 95%의 모노머 DsbA 폴리펩티드를 포함하는, 방법.
- 제56항 또는 제57항에 있어서, 상기 초순수 DsbA는 제1항 내지 제33항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제56항 내지 제58항 중 어느 한 항에 있어서, 상기 항체가 다클론성 항체인, 방법.
- 제56항 내지 제59항 중 어느 한 항에 있어서, 상기 항체는 제51항 내지 제53항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제60항에 있어서, 약 1% 미만의 상기 항체가 비-DsbA 화합물에 특이적으로 결합하는, 방법.
- DsbA에 특이적으로 결합하는 다클론성 항체를 포함하는 조성물로서,
상기 다클론성 항체는 제34항 내지 제50항 중 어느 한 항의 조성물에 동물을 노출함에 의해 생성된 것인, 조성물. - 제62항에 있어서, 상기 다클론성 항체는 상기 동물의 상기 혈청으로부터 수집된 것인, 조성물.
- DsbA에 특이적으로 결합하는 단클론성 항체를 포함하는 조성물로서,
상기 단클론성 항체는 제34항 내지 제50항 중 어느 한 항의 조성물에 동물을 노출함에 의해 생성된 것인, 조성물. - 제62항 내지 제64항 중 어느 한 항에 있어서, 상기 항체는 제56항 내지 제61항 중 어느 한 항의 방법에 의해 정제된 것인, 조성물.
- 제62항 내지 제65항 중 어느 한 항에 있어서, 상기 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭인, 조성물.
- 샘플 내 DsbA를 정량화하는 방법으로서,
검출 시스템을 사용하여 상기 샘플 내 DsbA를 검출하는 단계, 및
상기 샘플 내에서 검출된 DsbA의 양을 초순수 DsbA 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함하는, 방법. - 제67항에 있어서, 상기 초순수 DsbA 참조 표준은 적어도 약 95% 모노머 DsbA 폴리펩티드를 포함하는 것인, 방법.
- 제67항 또는 제68항에 있어서, 상기 초순수 DsbA 참조 표준은 제1항 내지 제33항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제67항 내지 제69항 중 어느 한 항에 있어서, 상기 검출 시스템이 면역검정인, 방법.
- 제70항에 있어서, 상기 면역검정은 초순수 DsbA에 특이적으로 결합하는 항체를 포함하는, 방법.
- DsbA의 양 및/또는 존재에 대해 재조합 폴리펩티드 샘플을 분석하는 방법으로서,
면역검정을 사용하여 상기 샘플 내 DsbA를 검출하는 단계, 및
상기 샘플 내에서 검출된 상기 DsbA의 양을 초순수 DsbA 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함하는, 방법. - 제72항에 있어서, 상기 초순수 DsbA 참조 표준은 적어도 약 95%의 모노머 DsbA 폴리펩티드를 포함하는 것인, 방법.
- 제72항 또는 제73항에 있어서, 상기 초순수 DsbA 참조 표준은 제1항 내지 제33항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제72항 또는 제73항에 있어서, 상기 면역검정은 초순수 DsbA에 특이적으로 결합하는 항체를 포함하는, 방법.
- 제75항에 있어서, 초순수 DsbA에 특이적으로 결합하는 상기 항체는 다클론성 항체인, 방법.
- 제75항 또는 제76항에 있어서, 초순수 DsbA에 특이적으로 결합하는 상기 항체는 상기 면역검정 내 포획 항체로서 사용되는, 방법.
- 제75항 내지 제77항 중 어느 한 항에 있어서, 초순수 DsbA에 특이적으로 결합하는 상기 항체는 검출 항체로서 사용되는, 방법.
- 제78항에 있어서, 상기 검출 항체는 검출제에 콘주게이트되는 것인, 방법.
- 제75항 내지 제79항 중 어느 한 항에 있어서, 검출제가 호스래디쉬 퍼옥시다아제인, 방법.
- 제75항 내지 제80항 중 어느 한 항에 있어서, DsbA에 특이적으로 결합하는 상기 항체는 제40항 내지 제42항 중 어느 한 항의 방법에 따라 제조되는, 방법.
- 제72항 내지 제81항 중 어느 한 항에 있어서, 상기 DsbA는 이.콜라이 DsbA인, 방법.
- 제72항 내지 제82항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드가 숙주 세포 내 제조되는 것인, 방법.
- 제83항에 있어서, 상기 숙주 세포가 이.콜라이 세포인, 방법.
- 제83항 또는 제84항에 있어서, 상기 숙주 세포가 DsbA를 과발현하는, 방법.
- 제72항 내지 제85항 중 어느 한 항에 있어서, 상기 샘플은 세포 용해물인, 방법.
- 제72항 내지 제86항 중 어느 한 항에 있어서, 상기 샘플은 재조합 폴리펩티드 제제로부터 수득되며, 그리고 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것인, 방법.
- 제87항에 있어서, 상기 재조합 폴리펩티드 제제는 최종 정제된 생성물인, 방법.
- 제72항 내지 제88항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 샘플 내에 함유된 상기 재조합 폴리펩티드는 항체 또는 면역접합체인, 방법.
- 제89항에 있어서, 상기 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편인, 방법.
- 제89항 또는 제90항에 있어서, 상기 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4인, 방법.
- 샘플 내 DsbA를 검출하는 면역검정 방법으로서,
(a) DsbA에 결합하는 포획 항체를 샘플과 접촉시켜, 이로써 샘플-포획 항체 조합 물질을 생성하는 단계;
(b) 상기 샘플-포획 항체 조합 물질과 DsbA에 결합하는 검출 항체를 접촉시키는 단계; 및
(c) 상기 샘플-포획 항체 조합 물질에 결합된 검출 항체를 검출하는 단계를 포함하고,
상기 샘플은 재조합 폴리펩티드 제제 또는 숙주 세포주로부터 수득되는, 방법. - 제92항에 있어서, 표준 적정 곡선을 사용하여 결합된 상기 검출 항체의 수준을 정량화하는 단계를 추가로 포함하는, 방법.
- 제93항에 있어서, 상기 결합된 검출 항체의 수준에 기초하여, 상기 샘플 내 존재하는 DsbA의 양을 산출하는 단계를 추가로 포함하는, 방법.
- 제94항에 있어서, 상기 샘플 내 존재하는 DsbA의 양은, 상기 표준 적정 곡선을 초순수 DsbA 조성물로 생성된 표준 적정 곡선과 비교함에 의해 계측되는, 방법.
- 제95항에 있어서, 상기 초순수 DsbA 조성물은 적어도 약 95%의 모노머 DsbA 폴리펩티드를 포함하는, 방법.
- 제95항 또는 제96항에 있어서, 상기 조성물 내 상기 초순수 DsbA는 제1항 내지 제33항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제92항 내지 제97항 중 어느 한 항에 있어서, 상기 포획 항체는 초순수 DsbA에 특이적으로 결합하는, 방법.
- 제92항 내지 제98항 중 어느 한 항에 있어서, 상기 검출 항체는 초순수 DsbA에 특이적으로 결합하는, 방법.
- 제98항 또는 제99항에 있어서, 초순수 DsbA에 특이적으로 결합하는 상기 항체는 다클론성 항체인, 방법.
- 제92항 내지 제100항 중 어느 한 항에 있어서, DsbA에 결합하는 상기 검출 항체는 호스래디쉬 퍼옥시다아제에 콘주게이트되는, 방법.
- 제92항 내지 제101항 중 어느 한 항에 있어서, 상기 다클론성 항체는 청구항 51 내지 53 중 어느 한 항의 방법에 따라 생성된 것인, 방법.
- 제92항 내지 제102항 중 어느 한 항에 있어서, 상기 면역검정이 샌드위치(sandwich) 검정인, 방법.
- 제103항에 있어서, 상기 샌드위치 검정은 효소-결합 면역흡착 검정 (ELISA)인, 방법.
- 제92항 내지 제104항 중 어느 한 항에 있어서, 상기 DsbA는 이.콜라이 DsbA인, 방법.
- 제92항 내지 제105항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 제제 또는 상기 숙주 세포주는 이.콜라이로부터 수득된 것인, 방법.
- 제106항에 있어서, 상기 숙주 세포주는 DsbA를 과발현하는, 방법.
- 제92항 내지 제107항 중 어느 한 항에 있어서, 상기 샘플은 세포 용해물인, 방법.
- 제92항 내지 제107항 중 어느 한 항에 있어서, 상기 샘플은 상기 재조합 폴리펩티드 제제로부터 수득되며, 그리고 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것인, 방법.
- 제109항에 있어서, 상기 재조합 폴리펩티드 제제는 최종 정제된 생성물인, 방법.
- 제92항 내지 제110항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 제제 내에 함유된 상기 재조합 폴리펩티드는 항체 또는 면역접합체인, 방법.
- 제111항에 있어서, 상기 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편인, 방법.
- 제111항 또는 제112항에 있어서, 상기 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4인, 방법.
- 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물에 대한 품질 검정으로서,
상기 방출 검정은 상기 약제학적 조성물의 샘플이 제92항 내지 제113항 중 어느 한 항의 면역검정 방법으로 처리되도록 하는 단계를 포함하고,
상기 조성물 내 검출된 DsbA의 양은 상기 약제학적 조성물이 동물에 대한 투여에 대해 적합한지를 결정하는 것인, 품질 검정. - 제114항에 있어서, 약 1ppm 미만의 약제학적 조성물 내 DsbA의 양은 상기 약제학적 조성물이 상기 동물에 대한 투여에 대해 적합하다는 것을 나타내는, 품질 검정.
- 제114항 또는 제115항에 있어서, 상기 박테리아 세포는 이.콜라이 세포인, 품질 검정.
- 제114항 내지 제116항 중 어느 한 항에 있어서, 상기 박테리아 세포는 DsbA를 과발현하는 것인, 품질 검정.
- 제114항 내지 제117항 중 어느 한 항에 있어서, 상기 샘플은 세포 용해물인, 품질 검정.
- 제114항 내지 제118항 중 어느 한 항에 있어서, 상기 샘플은 재조합 폴리펩티드 제제로부터 수득되며, 그리고 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것인, 품질 검정.
- 제119항에 있어서, 상기 재조합 폴리펩티드 제제는 최종 정제된 생성물인, 품질 검정.
- 제114항 내지 제120항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 제제 내에 함유된 상기 재조합 폴리펩티드는 항체 또는 면역접합체인, 품질 검정.
- 제121항에 있어서, 상기 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편인, 품질 검정.
- 제122항에 있어서, 상기 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4인, 품질 검정.
- DsbC 폴리펩티드를 포함하는 세포 용해물로부터 DsbC 폴리펩티드를 정제하는 방법으로서,
a) 상기 DsbC 폴리펩티드를 포함하는 세포 용해물에 약 0.01% 내지 약 1.0%의 최종 농도로 폴리에틸렌이민 (PEI)을 첨가하는 단계,
b) 원심분리에 의해 상기 세포 용해물을 정화하는 단계,
c) 상기 DsbC 폴리펩티드를 포함하는 상기 정화된 세포 용해물을 음이온 교환 크로마토그래피 물질에 적용하는 단계,
d) 상기 DsbC 폴리펩티드를 포함하는 음이온 교환 용출액을 생성시키도록 상기 음이온 교환 크로마토그래피 물질로부터 상기 DsbC 폴리펩티드를 용출시키는 단계,
e) 상기 DsbC 폴리펩티드를 포함하는 상기 음이온 교환 용출액을 소수성 상호작용 크로마토그래피 (HIC) 물질에 적용하는 단계,
f) HIC 용출액을 생성시키도록 상기 HIC 물질로부터 상기 DsbC 폴리펩티드를 용출시키는 단계,
g) 크기 배제 크로마토그래피에 상기 DsbC 폴리펩티드를 포함하는 상기 HIC 용출액을 적용하는 단계,
h) 상기 정제된 DsbC 폴리펩티드를 포함하는 상기 크기 배제 크로마토그래피로부터 분획을 수집하는 단계를 포함하는, 방법. - 제124항에 있어서, 상기 DsbC 폴리펩티드를 포함하는 상기 세포 용해물은 음이온 교환 크로마토그래피 이전에, 적어도 약 16시간 동안 상기 PEI 내에 보유되는, 방법.
- 제124항 또는 제125항에 있어서, 상기 용해물 내 상기 PEI의 최종 농도는 약 0.1%인, 방법.
- 제124항 내지 제126항 중 어느 한 항에 있어서, 상기 DsbC 폴리펩티드 및 상기 PEI를 포함하는 상기 용해물은 약 7.0의 pH에서의 것인, 방법.
- 제124항 내지 제127항 중 어느 한 항에 있어서, 상기 음이온 교환 크로마토그래피 물질은 약 음이온 교환인자인, 방법.
- 제128항에 있어서, 상기 약 음이온 교환인자는 4급 아민을 포함하는, 방법.
- 제128항 또는 제129항에 있어서, 상기 4급 아민은 가교결합된 아가로스에 연결된 것인, 방법.
- 제124항 내지 제130항 중 어느 한 항에 있어서, 상기 DsbC는 염 구배를 사용하여 상기 양이온 크로마토그래피 물질로부터 용출된 것인, 방법.
- 제131항에 있어서, 상기 염 구배는 선형 구배인, 방법.
- 제132항에 있어서, 상기 음이온 교환 물질은 10mM MOPS에서 세정된 것인, 방법.
- 제133항에 있어서, 상기 염 구배는 15 칼럼 용적에 걸쳐 약 0% 내지 약 60% 10 mM MOPS 및 250 mM NaCl의 구배인, 방법.
- 제124항 내지 제134항 중 어느 한 항에 있어서, 단계 b)의 상기 DsbC 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 0.22μm 필터를 통해 통과되는, 방법.
- 제124항 내지 제135항 중 어느 한 항에 있어서, 단계 b)의 상기 DsbC 폴리펩티드를 포함하는 상기 정화된 용해물은 음이온 교환 크로마토그래피 이전에 pH 약 8.0으로 조정되는, 방법.
- 제124항 내지 제136항 중 어느 한 항에 있어서, 상기 음이온 교환 용출액은 분획 내 수집되는, 방법.
- 제137항에 있어서, 상기 분획은 소수성 상호작용 크로마토그래피 이전에 크기 배제 크로마토그래피에 의해 분석되는, 방법.
- 제138항에 있어서, 적어도 약 25% DsbC를 포함하는 분획이 추가의 정제를 위해 선택되는, 방법.
- 제124항 내지 제139항 중 어느 한 항에 있어서, 상기 HIC 물질은 페닐 모이어티를 포함하는, 방법.
- 제140항에 있어서, 상기 페닐 모이어티는 가교결합된 아가로스에 연결된 것인, 방법.
- 제124항 내지 제141항 중 어느 한 항에 있어서, 상기 음이온 교환 용출액은 HIC 크로마토그래피 이전에 약 0.54M 황산나트륨 및 약 50mM PO4 (약 pH 7)를 함유하도록 컨디셔닝되는, 방법.
- 제124항 내지 제142항 중 어느 한 항에 있어서, 상기 DsbC는 물을 사용하여 상기 HIC 물질로부터 용출된 것인, 방법.
- 제140항 또는 제143항에 있어서, 상기 HIC 용출액은 분획 내 수집되는, 방법.
- 제144항에 있어서, DsbC를 포함하는 분획이 풀링되는, 방법.
- 제124항 내지 제145항 중 어느 한 항에 있어서, 상기 크기 배제 크로마토그래피 물질은 가교결합된 아가로스 및 덱스트란의 구형 복합체를 포함하는 것인, 방법.
- 제146항에 있어서, 상기 크기 배제 유동 흐름(size exclusion flow through)은 분획 내 수집되는 것인, 방법.
- 제146항 또는 제147항에 있어서, 상기 HIC 용출액은 크기 배제 크로마토그래피 이전에 한외여과된 것인, 방법.
- 제146항 내지 제148항 중 어느 한 항에 있어서, DsbC를 포함하는 분획이 풀링되는, 방법.
- 제124항 내지 제149항 중 어느 한 항에 있어서, 상기 DsbC 폴리펩티드는 에 스케리치아 콜라이 DsbC 폴리펩티드인, 방법.
- 제150항에 있어서, 상기 DsbC 폴리펩티드는 서열 번호: 3의 아미노산 서열을 포함하는, 방법.
- 제151항에 있어서, 상기 DsbC 폴리펩티드의 상기 아미노산 서열은 서열 번호: 3의 아미노산 서열에 적어도 약 80% 동일한, 방법.
- 제124항 내지 제152항 중 어느 한 항에 있어서, 상기 DsbC는 세포 내 발현되는, 방법.
- 제153항에 있어서, 상기 세포는 원핵 세포인, 방법.
- 제153항 또는 제154항에 있어서, 상기 세포는 이.콜라이 세포인, 방법.
- 제153항 내지 제155항 중 어느 한 항에 있어서, 상기 세포는 DsbC의 내인성 발현보다 더 큰 수준으로 DsbC를 발현하도록 가공된 것인, 방법.
- 제124항 내지 제156항 중 어느 한 항에 있어서, 상기 세포는 미세유동화기(microfluidizer)를 사용하여 용해되는, 방법.
- 제124항 내지 제157항 중 어느 한 항의 방법에 의해 정제된 DsbC 폴리펩티드를 포함하는, 조성물.
- 정제된 DsbC 폴리펩티드를 포함하는 조성물로서,
상기 조성물은 적어도 약 95%의 모노머 DsbC 폴리펩티드를 포함하는, 조성물. - 제159항에 있어서, 상기 조성물은 약 2% 미만의 저분자량 종을 포함하는, 조성물.
- 제159항 또는 제160항에 있어서, 상기 조성물은 약 1% 미만의 고분자량 종을 포함하는, 조성물.
- 제159항 내지 제161항 중 어느 한 항에 있어서, 상기 모노머 DsbC 폴리펩티드의 백분율은 크기 배제 크로마토그래피에 의해 검출된 것인, 조성물.
- 제159항에 있어서, 상기 조성물은 약 5% 미만의 불순물을 포함하는, 조성물.
- 제163항에 있어서, 상기 불순물은 천연 DsbC에 비해 고분자량 및/또는 저분자량 폴리펩티드 종인, 조성물.
- 제163항 또는 제164항에 있어서, 상기 불순물은 이.콜라이 단백질 (ECP), DsbA의 응집물, DsbC의 단편, 핵산 또는 세포 배양 배지 성분 중 하나 이상의 것인, 조성물.
- 제162항 내지 제165항 중 어느 한 항에 있어서, 상기 DsbA는 1회 이상의 냉각-해동 주기에 대해 안정적인 것인, 조성물.
- 제166항에 있어서, 상기 DsbC는 3회 냉각-해동 주기에 대해 안정적인 것인, 조성물.
- 제158항 내지 제161항 또는 제163항 내지 제167항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbC 폴리펩티드의 순도는 크로마토그래피, SDS 폴리아크릴아미드 겔 전기영동 또는 웨스턴 블롯 분석 중 하나 이상에 의해 측정되는, 조성물.
- 제158항 내지 제168항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbC 폴리펩티드의 순도는 고성능 액체 크로마토그래피 (HPLC)에 의해 측정되는, 조성물.
- 제158항 내지 제169항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbC 폴리펩티드의 순도는 크기 배제 크로마토그래피(SEC)에 의해 측정되는, 조성물.
- 제158항 내지 제161항 또는 제163항 내지 제168항 중 어느 한 항에 있어서, 상기 조성물 내 상기 DsbC 폴리펩티드의 순도는 형광 단백질 염색 또는 은 염색을 사용한 SDS 겔 전기영동에 의해 측정되는, 조성물.
- 제171항에 있어서, 상기 조성물 내 비-DsbC 폴리펩티드의 존재는, 웨스턴 블롯 분석에 의해 나타난 바와 같이, 항-DsbC 항체와 면역반응성이 아닌 겔 전기영동에 의해 식별된 종의 존재에 의해 식별되는, 조성물.
- 제172항에 있어서, 상기 조성물 내 상기 DsbC 폴리펩티드의 응집물의 존재는 웨스턴 블롯 분석에 의해 상기 천연 DsbC보다 더 큰 분자량을 갖는 종의 존재에 의해 식별되는, 조성물.
- 제158항 내지 제173항 중 어느 한 항의 조성물에 동물을 노출하는 단계를 포함하는, DsbC에 특이적으로 결합하는 항체를 생성하는 방법.
- 제174항에 있어서, 상기 동물로부터 혈청을 수집하는 단계를 추가로 포함하며, 상기 혈청은 DsbC에 특이적으로 결합하는 항체를 포함하는, 방법.
- 제175항에 있어서, 상기 혈청은 DsbC에 특이적으로 결합하는 다클론성 항체를 포함하는, 방법.
- 제175항 또는 제176항에 있어서, 하나 이상의 단클론성 항체는 상기 혈청으로부터 단리된 것인, 방법.
- 제174항 내지 제177항 중 어느 한 항에 있어서, 상기 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭인, 방법.
- DsbC에 특이적으로 결합하는 항체를 정제하는 방법으로서,
지지 물질에 부착된 초순수 DsbC를 포함하는 크로마토그래피 물질에 항-DsbC 항체를 포함하는 조성물을 접촉시키는 단계,
비결합된 화합물을 제거하기 위해 상기 크로마토그래피 물질을 세정하는 단계, 및
상기 항-DsbC 항체를 용출시키는 단계를 포함하는, 방법. - 제179항에 있어서, 상기 초순수 DsbC가 적어도 약 95%의 모노머 DsbC 폴리펩티드를 포함하는 것인, 방법.
- 제179항 또는 제180항에 있어서, 상기 초순수 DsbC는 제66항 내지 제99항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제179항 내지 제181항 중 어느 한 항에 있어서, 상기 항체가 다클론성 항체인, 방법.
- 제179항 내지 제182항 중 어느 한 항에 있어서, 상기 항체는 제174항 내지 제176항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제183항에 있어서, 약 1% 미만의 상기 항체가 비-DsbC 화합물에 특이적으로 결합하는, 방법.
- DsbC에 특이적으로 결합하는 다클론성 항체를 포함하는 조성물로서,
상기 다클론성 항체는 제158항 내지 제173항 중 어느 한 항의 조성물에 동물을 노출함에 의해 생성된 것인, 조성물. - 제185항에 있어서, 상기 다클론성 항체는 상기 동물의 상기 혈청으로부터 수집된 것인, 조성물.
- DsbC에 특이적으로 결합하는 단클론성 항체를 포함하는 조성물로서,
상기 단클론성 항체는 제158항 내지 제173항 중 어느 한 항의 조성물에 동물을 노출함에 의해 생성된 것인, 조성물. - 제185항 내지 제187항 중 어느 한 항에 있어서, 상기 항체는 제179항 내지 제184항 중 어느 한 항의 방법에 의해 정제된 것인, 조성물.
- 제185항 내지 제187항 중 어느 한 항에 있어서, 상기 동물은 염소, 토끼, 마우스, 기니아 피그, 햄스터, 랫트, 당나귀 또는 닭인, 조성물.
- 샘플 내 DsbA를 정량화하는 방법으로서,
검출 시스템을 사용하여 상기 샘플 내 DsbC를 검출하는 단계, 및
상기 샘플 내에서 검출된 DsbC의 양을, 초순수 DsbC 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함하는, 방법 . - 제190항에 있어서, 상기 초순수 DsbC 참조 표준은 적어도 약 95%의 모노머 DsbC 폴리펩티드를 포함하는 것인, 방법.
- 제190항 또는 제191항에 있어서, 상기 초순수 DsbC 참조 표준은 제124항 내지 제157항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제190항 내지 제192항 중 어느 한 항에 있어서, 상기 검출 시스템이 면역검정인, 방법.
- 제193항에 있어서, 상기 면역검정은 초순수 DsbC에 특이적으로 결합하는 항체를 포함하는, 방법.
- DsbC의 양 및/또는 존재에 대해 재조합 폴리펩티드 샘플을 분석하는 방법으로서,
면역검정을 사용하여 상기 샘플 내 DsbC를 검출하는 단계, 및
상기 샘플 내에서 검출된 DsbC의 양을 초순수 DsbC 참조 표준 중 하나 이상의 농도의 검출결과와 비교하는 단계를 포함하는, 방법. - 제195항에 있어서, 상기 초순수 DsbC 참조 표준은 적어도 약 95%의 모노머 DsbC 폴리펩티드를 포함하는 것인, 방법.
- 제195항 또는 제196항에 있어서, 상기 초순수 DsbC 참조 표준은 제124항 내지 제157항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제195항 내지 제197항 중 어느 한 항에 있어서, 상기 면역검정은 초순수 DsbC에 특이적으로 결합하는 항체를 포함하는, 방법.
- 제198항에 있어서, 초순수 DsbC에 특이적으로 결합하는 상기 항체는 다클론성 항체인, 방법.
- 제198항 또는 제199항에 있어서, 초순수 DsbC에 특이적으로 결합하는 상기 항체는 상기 면역검정 내 포획 항체로서 사용되는, 방법.
- 제198항 내지 제200항 중 어느 한 항에 있어서, 초순수 DsbC에 특이적으로 결합하는 상기 항체는 검출 항체로서 사용되는, 방법.
- 제201항에 있어서, 상기 검출 항체는 검출제에 콘주게이트되는 것인, 방법.
- 제198항 내지 제202항 중 어느 한 항에 있어서, 검출제가 호스래디쉬 퍼옥시다아제인, 방법.
- 제198항 내지 제203항 중 어느 한 항에 있어서, DsbC에 특이적으로 결합하는 상기 항체는 제106항 내지 제108항 중 어느 한 항의 방법에 따라 제조되는, 방법.
- 제195항 내지 제204항 중 어느 한 항에 있어서, 상기 DsbC는 이.콜라이 DsbC인, 방법.
- 제195항 내지 제205항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드가 숙주 세포 내 제조되는 것인, 방법.
- 제206항에 있어서, 상기 숙주 세포가 이.콜라이 세포인, 방법.
- 제206항 또는 제207항에 있어서, 상기 숙주 세포가 DsbC를 과발현하는, 방법.
- 제195항 내지 제208항 중 어느 한 항에 있어서, 상기 샘플은 세포 용해물인, 방법.
- 제195항 내지 제209항 중 어느 한 항에 있어서, 상기 샘플은 재조합 폴리펩티드 제제로부터 수득되며, 그리고 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것인, 방법.
- 제210항에 있어서, 상기 재조합 폴리펩티드 제제는 최종 정제된 생성물인, 방법.
- 제195항 내지 제211항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 샘플 내에 함유된 상기 재조합 폴리펩티드는 항체 또는 면역접합체인, 방법.
- 제212항에 있어서, 상기 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편인, 방법.
- 제212항 또는 제213항에 있어서, 상기 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4인, 방법.
- 샘플 내 DsbC를 검출하는 면역검정 방법으로서,
(a) DsbC에 결합하는 포획 항체를 샘플과 접촉시켜, 이로써 샘플-포획 항체 조합 물질을 생성하는 단계;
(b) 상기 샘플-포획 항체 조합 물질과 DsbC에 결합하는 검출 항체를 접촉시키는 단계; 및
(c) 상기 샘플-포획 항체 조합 물질에 결합된 상기 항체를 검출하는 단계를 포함하는, 방법. - 제215항에 있어서, 표준 적정 곡선을 사용하여 결합된 검출 항체의 수준을 정량화하는 단계를 추가로 포함하는, 방법.
- 제216항에 있어서, 상기 결합된 검출 항체의 수준에 기초하여, 상기 샘플 내 존재하는 DsbC의 양을 산출하는 단계를 추가로 포함하는, 방법.
- 제217항에 있어서, 상기 샘플 내 존재하는 상기 DsbC의 양은, 상기 표준 적정 곡선을 초순수 DsbC 조성물로 생성된 표준 적정 곡선과 비교함에 의해 계측되는, 방법.
- 제218항에 있어서, 상기 초순수 DsbC 조성물은, 적어도 약 95%의 모노머 DsbC 폴리펩티드를 포함하는 것인, 방법.
- 제218항 또는 제219항에 있어서, 상기 조성물 내 상기 초순수 DsbC는 제66항 내지 제99항 중 어느 한 항의 방법에 따라 제조된 것인, 방법.
- 제215항 내지 제220항 중 어느 한 항에 있어서, 상기 포획 항체는 초순수 DsbC에 특이적으로 결합하는 것인, 방법.
- 제215항 내지 제221항 중 어느 한 항에 있어서, 상기 검출 항체는 초순수 DsbC에 특이적으로 결합하는, 방법.
- 제221항 또는 제222항에 있어서, 초순수 DsbC에 특이적으로 결합하는 상기 항체는 다클론성 항체인, 방법.
- 제215항 내지 제217항 중 어느 한 항에 있어서, DsbC에 결합하는 상기 제2 검출 항체는 호스래디쉬 퍼옥시다아제에 콘주게이트되는 것인, 방법.
- 제215항 내지 제224항 중 어느 한 항에 있어서, 상기 다클론성 항체는 제174항 내지 제176항 중 어느 한 항의 방법에 따라 생성된 것인, 방법.
- 제215항 내지 제225항 중 어느 한 항에 있어서, 상기 면역검정이 샌드위치 검정인, 방법.
- 제226항에 있어서, 상기 샌드위치 검정은 효소-결합 면역흡착 검정 (ELISA)인, 방법.
- 제215항 내지 제227항 중 어느 한 항에 있어서, 상기 DsbC는 이.콜라이 DsbC인, 방법.
- 제215항 내지 제228항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 제제 또는 상기 숙주 세포주는 이.콜라이로부터 수득된 것인, 방법.
- 제219항에 있어서, 상기 숙주 세포주는 DsbA를 과발현하는 것인, 방법.
- 제215항 내지 제230항 중 어느 한 항에 있어서, 상기 샘플은 세포 용해물인, 방법.
- 제215항 내지 제231항 중 어느 한 항에 있어서, 상기 샘플은 상기 재조합 폴리펩티드 제제로부터 수득되며, 그리고 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것인, 방법.
- 제232항에 있어서, 상기 재조합 폴리펩티드 제제는 최종 정제된 생성물인, 방법.
- 제215항 내지 제233항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 제제 내에 함유된 상기 재조합 폴리펩티드는 항체 또는 면역접합체인, 방법.
- 제234항에 있어서, 상기 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편인, 방법.
- 제234항 또는 제235항에 있어서, 상기 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4인, 방법.
- 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물에 대한 품질 검정으로서,
상기 약제학적 조성물의 샘플이 제49항 내지 제56항 중 어느 한 항의 면역검정 방법으로 처리되도록 하는 단계를 포함하고,
상기 면역검정 내의 검출결과는, 상기 약제학적 조성물이 동물에 대한 투여에 대해 적합한지를 나타내는, 품질 검정. - 제237항에 있어서, 약 1ppm 미만의 상기 약제학적 조성물 내 DsbC의 양은, 상기 약제학적 조성물이 상기 동물에 대한 투여에 대해 적합하다는 것을 나타내는, 품질 검정.
- 제237항 또는 제238항에 있어서, 상기 박테리아 세포는 이.콜라이 세포인, 품질 검정.
- 제237항 내지 제239항 중 어느 한 항에 있어서, 상기 박테리아 세포는 DsbC를 과발현하는, 품질 검정.
- 제237항 내지 제240항 중 어느 한 항에 있어서, 상기 샘플은 세포 용해물인, 품질 검정.
- 제237항 내지 제241항 중 어느 한 항에 있어서, 상기 샘플은 상기 재조합 폴리펩티드 제제로부터 수득되며, 그리고 상기 재조합 폴리펩티드 제제는 하나 이상의 크로마토그래피 정제 단계로 처리된 것인, 품질 검정.
- 제242항에 있어서, 상기 재조합 폴리펩티드 제제는 최종 정제된 생성물인, 품질 검정.
- 제237항 내지 제243항 중 어느 한 항에 있어서, 상기 재조합 폴리펩티드 제제 내에 함유된 상기 재조합 폴리펩티드는 항체 또는 면역접합체인, 품질 검정.
- 제244항에 있어서, 상기 항체는 다중특이적 항체, 이중특이적 항체, 절반 항체 또는 항체 단편인, 품질 검정.
- 제245항에 있어서, 상기 재조합 폴리펩티드는 IgG1, IgG2, IgG3, 또는 IgG4인, 품질 검정.
- 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내 DsbA의 검출용 키트로서,
제51항 내지 제55항 중 어느 한 항의 방법에 따라 제조된 항-DsbA 항체 또는 제56항 내지 제61항 중 어느 한 항의 항-DsbA 항체의 조성물을 포함하는, 키트. - 제247항에 있어서, 상기 키트는 샘플 내 DsbA를 정량화하기 위해 표준 곡선을 생성하는데 참조 표준으로서 사용하기 위해, 및/또는 양성 대조군으로서 사용하기 위해, 초순수 DsbA를 추가로 포함하는, 키트.
- 제248항에 있어서, 상기 초순수 DsbA는 제1항 내지 제33항 중 어느 한 항의 방법에 따라 제조된 것인, 키트.
- 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내 DsbC의 검출용 키트로서,
제174항 내지 제178항 중 어느 한 항의 방법에 따라 제조된 항-DsbC항체 또는 제185항 내지 제189항 중 어느 한 항의 항-DsbC 항체의 조성물을 포함하는, 키트. - 제250항에 있어서, 상기 키트는 샘플 내 DsbC를 정량화하기 위해 표준 곡선을 생성하는데 참조 표준으로서 사용하기 위해, 및/또는 양성 대조군으로서 사용하기 위해, 초순수 DsbC를 추가로 포함하는, 키트.
- 제251항에 있어서, 상기 초순수 DsbC는 제124항 내지 제157항 중 어느 한 항의 방법에 따라 제조된 것인, 키트.
- 박테리아 세포로부터 제조된 재조합 폴리펩티드를 포함하는 약제학적 조성물 내 DsbA 및 DsbC의 검출용 키트로서,
a) 제51항 내지 제55항 중 어느 한 항의 방법에 따라 제조된 항-DsbA 항체 또는 제56항 내지 제61항 중 어느 한 항의 항-DsbA 항체의 조성물; 및
b) 제174항 내지 제178항 중 어느 한 항의 방법에 따라 제조된 항-DsbC 항체 또는 제185항 내지 제189항 중 어느 한 항의 항-DsbC 항체의 조성물을 포함하는, 키트. - 제253항에 있어서, 상기 키트는 샘플 내 DsbA 및/또는 DsbC를 정량화하기 위해 표준 곡선을 생성하는데 참조 표준으로서 사용하기 위해, 및/또는 양성 대조군으로서 사용하기 위해, 초순수 DsbA 및 초순수 DsbC를 추가로 포함하는, 키트.
- 제254항에 있어서, 상기 초순수 DsbA는 제1항 내지 제33항 중 어느 한 항의 방법에 따라 제조되고/되거나, 상기 초순수 DsbC는 제124항 내지 제157항 중 어느 한 항의 방법에 따라 제조된 것인, 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562129701P | 2015-03-06 | 2015-03-06 | |
| US62/129,701 | 2015-03-06 | ||
| PCT/US2016/021059 WO2016144824A1 (en) | 2015-03-06 | 2016-03-04 | Ultrapurified dsba and dsbc and methods of making and using the same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170122216A true KR20170122216A (ko) | 2017-11-03 |
Family
ID=55637452
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177026459A KR20170122216A (ko) | 2015-03-06 | 2016-03-04 | 초순수화 dsba 및 dsbc와 이를 제조하고 사용하는 방법 |
Country Status (17)
| Country | Link |
|---|---|
| US (2) | US10073098B2 (ko) |
| EP (2) | EP3636749B1 (ko) |
| JP (2) | JP6865689B2 (ko) |
| KR (1) | KR20170122216A (ko) |
| CN (1) | CN107531749A (ko) |
| AR (1) | AR103852A1 (ko) |
| AU (1) | AU2016230018A1 (ko) |
| CA (1) | CA2978256A1 (ko) |
| ES (1) | ES2761726T3 (ko) |
| HK (1) | HK1247936A1 (ko) |
| HR (1) | HRP20192217T1 (ko) |
| IL (1) | IL254166A0 (ko) |
| MX (2) | MX2021000153A (ko) |
| PL (1) | PL3265557T3 (ko) |
| SG (2) | SG10202005917SA (ko) |
| SI (1) | SI3265557T1 (ko) |
| WO (1) | WO2016144824A1 (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10704021B2 (en) | 2012-03-15 | 2020-07-07 | Flodesign Sonics, Inc. | Acoustic perfusion devices |
| CA2935960C (en) | 2014-01-08 | 2023-01-10 | Bart Lipkens | Acoustophoresis device with dual acoustophoretic chamber |
| ES2761726T3 (es) | 2015-03-06 | 2020-05-20 | Hoffmann La Roche | DsbA y DsbC ultrapurificadas y procedimientos de preparación y uso de las mismas |
| US11377651B2 (en) | 2016-10-19 | 2022-07-05 | Flodesign Sonics, Inc. | Cell therapy processes utilizing acoustophoresis |
| US11708572B2 (en) | 2015-04-29 | 2023-07-25 | Flodesign Sonics, Inc. | Acoustic cell separation techniques and processes |
| US11214789B2 (en) | 2016-05-03 | 2022-01-04 | Flodesign Sonics, Inc. | Concentration and washing of particles with acoustics |
| AU2018385759B2 (en) | 2017-12-14 | 2021-10-21 | Flodesign Sonics, Inc. | Acoustic transducer driver and controller |
| AR119264A1 (es) * | 2019-06-05 | 2021-12-09 | Genentech Inc | Método para reutilización de cromatografía |
| CN115427113A (zh) * | 2020-04-09 | 2022-12-02 | 西托姆克斯治疗公司 | 含有可活化抗体的组合物 |
Family Cites Families (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2031216A1 (de) | 1969-06-19 | 1971-01-14 | Citizen Watch Co Ltd , Tokio | Tag und Datum Stellvorrichtung fur Uhren mit Kalender |
| US3691016A (en) | 1970-04-17 | 1972-09-12 | Monsanto Co | Process for the preparation of insoluble enzymes |
| US3940475A (en) | 1970-06-11 | 1976-02-24 | Biological Developments, Inc. | Radioimmune method of assaying quantitatively for a hapten |
| CA1023287A (en) | 1972-12-08 | 1977-12-27 | Boehringer Mannheim G.M.B.H. | Process for the preparation of carrier-bound proteins |
| US4195128A (en) | 1976-05-03 | 1980-03-25 | Bayer Aktiengesellschaft | Polymeric carrier bound ligands |
| US4330440A (en) | 1977-02-08 | 1982-05-18 | Development Finance Corporation Of New Zealand | Activated matrix and method of activation |
| CA1093991A (en) | 1977-02-17 | 1981-01-20 | Hideo Hirohara | Enzyme immobilization with pullulan gel |
| US4229537A (en) | 1978-02-09 | 1980-10-21 | New York University | Preparation of trichloro-s-triazine activated supports for coupling ligands |
| US4376110A (en) | 1980-08-04 | 1983-03-08 | Hybritech, Incorporated | Immunometric assays using monoclonal antibodies |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| US5508192A (en) | 1990-11-09 | 1996-04-16 | Board Of Regents, The University Of Texas System | Bacterial host strains for producing proteolytically sensitive polypeptides |
| US5264365A (en) | 1990-11-09 | 1993-11-23 | Board Of Regents, The University Of Texas System | Protease-deficient bacterial strains for production of proteolytically sensitive polypeptides |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| LU91067I2 (fr) | 1991-06-14 | 2004-04-02 | Genentech Inc | Trastuzumab et ses variantes et dérivés immuno chimiques y compris les immotoxines |
| MX9204374A (es) | 1991-07-25 | 1993-03-01 | Idec Pharma Corp | Anticuerpo recombinante y metodo para su produccion. |
| CA2116774C (en) | 1991-09-19 | 2003-11-11 | Paul J. Carter | Expression in e. coli antibody fragments having at least a cysteine present as a free thiol. use for the production of bifunctional f(ab') 2 antibodies |
| US5587458A (en) | 1991-10-07 | 1996-12-24 | Aronex Pharmaceuticals, Inc. | Anti-erbB-2 antibodies, combinations thereof, and therapeutic and diagnostic uses thereof |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| DE69233528T2 (de) | 1991-11-25 | 2006-03-16 | Enzon, Inc. | Verfahren zur Herstellung von multivalenten antigenbindenden Proteinen |
| CA2372813A1 (en) | 1992-02-06 | 1993-08-19 | L.L. Houston | Biosynthetic binding protein for cancer marker |
| DE69308573T2 (de) | 1992-08-17 | 1997-08-07 | Genentech Inc | Bispezifische immunoadhesine |
| GB9325718D0 (en) * | 1993-12-16 | 1994-02-16 | Ars Holding 89 Nv | Sensor device for sandwich assay |
| US5639635A (en) * | 1994-11-03 | 1997-06-17 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5789199A (en) * | 1994-11-03 | 1998-08-04 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US6027888A (en) | 1996-04-05 | 2000-02-22 | Board Of Regents, The University Of Texas System | Methods for producing soluble, biologically-active disulfide-bond containing eukaryotic proteins in bacterial cells |
| US6083715A (en) | 1997-06-09 | 2000-07-04 | Board Of Regents, The University Of Texas System | Methods for producing heterologous disulfide bond-containing polypeptides in bacterial cells |
| JP2000083670A (ja) * | 1998-09-09 | 2000-03-28 | Hsp Kenkyusho:Kk | DsbA/DsbB/DsbC/DsbD発現プラスミド |
| IL127127A0 (en) | 1998-11-18 | 1999-09-22 | Peptor Ltd | Small functional units of antibody heavy chain variable regions |
| AU3305100A (en) * | 1999-03-17 | 2000-10-04 | Medical Research Council | Method for refolding molecules of polypeptides containing ig domains |
| US6872563B1 (en) * | 1999-10-05 | 2005-03-29 | President And Fellows Of Harvard College | Compositions and methods for production of disulfide bond containing proteins in host cells |
| CN101289511A (zh) | 2000-04-11 | 2008-10-22 | 杰南技术公司 | 多价抗体及其应用 |
| MXPA03005273A (es) | 2000-12-14 | 2003-09-25 | Genentech Inc | Anticuerpos producidos procarioticamente y sus usos. |
| CA2447832C (en) | 2000-12-22 | 2012-09-25 | Jamshid Tanha | Phage display libraries of human vh fragments |
| JP2005289809A (ja) | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| PT1639011E (pt) | 2003-06-30 | 2009-01-20 | Domantis Ltd | Anticorpos (dab) de domínio único peguilados |
| PL1718677T3 (pl) | 2003-12-19 | 2012-09-28 | Genentech Inc | Jednowartościowe fragmenty przeciwciała stosowane jako środki lecznicze |
| JP4948413B2 (ja) | 2004-09-23 | 2012-06-06 | ジェネンテック, インコーポレイテッド | システイン操作抗体および結合体 |
| CN100475965C (zh) | 2005-07-22 | 2009-04-08 | 上海高科联合生物技术研发有限公司 | 一种大肠杆菌高效外分泌表达溶葡萄球菌酶的方法 |
| JP2009541275A (ja) | 2006-06-22 | 2009-11-26 | ノボ・ノルデイスク・エー/エス | 二重特異性抗体の生産 |
| DK2059533T3 (da) | 2006-08-30 | 2013-02-25 | Genentech Inc | Multispecifikke antistoffer |
| ES2426158T3 (es) * | 2007-01-22 | 2013-10-21 | Genentech, Inc. | Precipitación con polielectrolito y purificación de anticuerpos |
| DK2235064T3 (en) | 2008-01-07 | 2016-01-11 | Amgen Inc | A process for the preparation of heterodimeric Fc molecules using electrostatic control effects |
| SI2496601T1 (sl) * | 2009-11-05 | 2017-09-29 | F. Hoffmann-La Roche Ag | Tehnike in sestavek za sekrecijo heterolognih polipeptidov |
| AU2010201410B2 (en) * | 2010-03-30 | 2015-04-30 | Pelican Technology Holdings, Inc. | High level expression of recombinant CRM197 |
| GB201012519D0 (en) | 2010-07-26 | 2010-09-08 | Ucl Business Plc | Method and system for anomaly detection in data sets |
| GB201012599D0 (en) * | 2010-07-27 | 2010-09-08 | Ucb Pharma Sa | Process for purifying proteins |
| ES2637423T5 (es) * | 2011-11-02 | 2022-03-17 | Hoffmann La Roche | Cromatografía de sobrecarga y elución |
| ES2922358T3 (es) * | 2013-04-19 | 2022-09-13 | Sutro Biopharma Inc | Expresión de proteínas biológicamente activas en un sistema bacteriano de síntesis sin células utilizando extractos celulares con niveles elevados de chaperonas exógenas |
| RU2016107435A (ru) * | 2013-09-13 | 2017-10-18 | Дженентек, Инк. | Композиции и способы обнаружения и количественного определения белка клеток-хозяев в клеточных линиях и рекомбинантные полипептидные продукты |
| ES2761726T3 (es) | 2015-03-06 | 2020-05-20 | Hoffmann La Roche | DsbA y DsbC ultrapurificadas y procedimientos de preparación y uso de las mismas |
-
2016
- 2016-03-04 ES ES16712126T patent/ES2761726T3/es active Active
- 2016-03-04 EP EP19195777.8A patent/EP3636749B1/en active Active
- 2016-03-04 AU AU2016230018A patent/AU2016230018A1/en not_active Abandoned
- 2016-03-04 AR ARP160100573A patent/AR103852A1/es unknown
- 2016-03-04 SG SG10202005917SA patent/SG10202005917SA/en unknown
- 2016-03-04 SG SG11201707186YA patent/SG11201707186YA/en unknown
- 2016-03-04 PL PL16712126T patent/PL3265557T3/pl unknown
- 2016-03-04 EP EP16712126.8A patent/EP3265557B1/en active Active
- 2016-03-04 SI SI201630544T patent/SI3265557T1/sl unknown
- 2016-03-04 MX MX2021000153A patent/MX2021000153A/es unknown
- 2016-03-04 CN CN201680026013.3A patent/CN107531749A/zh active Pending
- 2016-03-04 WO PCT/US2016/021059 patent/WO2016144824A1/en active Application Filing
- 2016-03-04 US US15/061,943 patent/US10073098B2/en active Active
- 2016-03-04 KR KR1020177026459A patent/KR20170122216A/ko not_active Application Discontinuation
- 2016-03-04 CA CA2978256A patent/CA2978256A1/en not_active Abandoned
- 2016-03-04 MX MX2017011189A patent/MX2017011189A/es unknown
- 2016-03-04 JP JP2017546779A patent/JP6865689B2/ja active Active
-
2017
- 2017-08-27 IL IL254166A patent/IL254166A0/en unknown
-
2018
- 2018-06-04 HK HK18107289.5A patent/HK1247936A1/zh unknown
- 2018-07-24 US US16/044,360 patent/US10690671B2/en active Active
-
2019
- 2019-12-10 HR HRP20192217TT patent/HRP20192217T1/hr unknown
-
2021
- 2021-01-07 JP JP2021001186A patent/JP7191132B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| AR103852A1 (es) | 2017-06-07 |
| EP3636749B1 (en) | 2022-04-27 |
| CA2978256A1 (en) | 2016-09-15 |
| EP3636749A1 (en) | 2020-04-15 |
| US10073098B2 (en) | 2018-09-11 |
| MX2021000153A (es) | 2021-10-28 |
| WO2016144824A1 (en) | 2016-09-15 |
| MX2017011189A (es) | 2018-01-23 |
| CN107531749A (zh) | 2018-01-02 |
| IL254166A0 (en) | 2017-10-31 |
| SI3265557T1 (sl) | 2020-02-28 |
| US20160370369A1 (en) | 2016-12-22 |
| JP2021078502A (ja) | 2021-05-27 |
| PL3265557T3 (pl) | 2020-03-31 |
| EP3265557B1 (en) | 2019-10-16 |
| JP6865689B2 (ja) | 2021-04-28 |
| SG11201707186YA (en) | 2017-10-30 |
| HRP20192217T1 (hr) | 2020-02-21 |
| US20190056399A1 (en) | 2019-02-21 |
| HK1247936A1 (zh) | 2018-10-05 |
| EP3265557A1 (en) | 2018-01-10 |
| US10690671B2 (en) | 2020-06-23 |
| JP7191132B2 (ja) | 2022-12-16 |
| AU2016230018A1 (en) | 2017-09-21 |
| SG10202005917SA (en) | 2020-07-29 |
| ES2761726T3 (es) | 2020-05-20 |
| JP2018516229A (ja) | 2018-06-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7191132B2 (ja) | 超精製DsbA及びDsbC、ならびにそれらの作製及び使用方法 | |
| JP7203928B2 (ja) | オーバーロード/溶出クロマトグラフィー | |
| EP3337819B1 (en) | Method of purifying for producing recombinant polypeptides using fkpa | |
| JP6546178B2 (ja) | 細胞株中の宿主細胞タンパク質及び組換えポリペプチド産物を検出及び定量化するための組成物並びに方法 | |
| JP6602765B2 (ja) | クロマトグラフィー再使用のための方法 | |
| JP2022535526A (ja) | 過負荷クロマトグラフィーカラムの再生のための方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |