KR20150004830A - 유전적으로 조작된 pha 생산 미생물 - Google Patents
유전적으로 조작된 pha 생산 미생물 Download PDFInfo
- Publication number
- KR20150004830A KR20150004830A KR1020147031299A KR20147031299A KR20150004830A KR 20150004830 A KR20150004830 A KR 20150004830A KR 1020147031299 A KR1020147031299 A KR 1020147031299A KR 20147031299 A KR20147031299 A KR 20147031299A KR 20150004830 A KR20150004830 A KR 20150004830A
- Authority
- KR
- South Korea
- Prior art keywords
- pha
- microorganism
- ppu
- pseudomonas
- genetically engineered
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/62—Carboxylic acid esters
- C12P7/625—Polyesters of hydroxy carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/74—Vectors or expression systems specially adapted for prokaryotic hosts other than E. coli, e.g. Lactobacillus, Micromonospora
- C12N15/78—Vectors or expression systems specially adapted for prokaryotic hosts other than E. coli, e.g. Lactobacillus, Micromonospora for Pseudomonas
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1025—Acyltransferases (2.3)
- C12N9/1029—Acyltransferases (2.3) transferring groups other than amino-acyl groups (2.3.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/16—Hydrolases (3) acting on ester bonds (3.1)
- C12N9/18—Carboxylic ester hydrolases (3.1.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/62—Carboxylic acid esters
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y203/00—Acyltransferases (2.3)
- C12Y203/01—Acyltransferases (2.3) transferring groups other than amino-acyl groups (2.3.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12R—INDEXING SCHEME ASSOCIATED WITH SUBCLASSES C12C - C12Q, RELATING TO MICROORGANISMS
- C12R2001/00—Microorganisms ; Processes using microorganisms
- C12R2001/01—Bacteria or Actinomycetales ; using bacteria or Actinomycetales
- C12R2001/38—Pseudomonas
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/8215—Microorganisms
- Y10S435/822—Microorganisms using bacteria or actinomycetales
- Y10S435/874—Pseudomonas
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
본 발명은 폴리히드록시알카노에이트(polyhydroxyalkanoates, PHAs)의 생합성 분야에 관한 것이다. 특히, 본 발명은 재생산에 안정적이고 야생형의 미생물과 비교하여 PHA 합성효소(PHA synthase)를 코딩하는 하나 이상의 유전자의 증가된 카피수(number of copies)를 갖는 유전적으로 조작된 미생물에 관한 것이며, 여기서 상기 유전적 조작은 상기 미생물이 중간- 또는 긴-체인-길이 PHA를 과잉 생산(overproduce)하도록 한다.
Description
본 발명은 폴리히드록시알카노에이트(polyhydroxyalkanoates, PHAs)의 생합성 분야에 관한 것이다. 특히, 본 발명은 재생산에 안정적이고, 야생형의 미생물과 비교하여 PHA 합성효소(PHA synthase)를 코딩하는 하나 이상의 유전자의 증가된 카피수(number of copies)를 갖는 유전적으로 조작된 미생물에 관한 것이며, 여기서 상기 유전적 조작은 상기 미생물이 중간- 또는 긴-체인-길이 PHA를 과잉 생산(overproduce)하도록 한다.
PHA는 광범위한 산업 및 생물 의학 적용과 더불어 재생자원으로부터 생산되는 생분해성(biodegradable) 및 생체적합성(biocompatible) 플라스틱 물질(3-히드록시 지방산의 폴리에스테르, polyesters of 3-hydroxy fatty acids)인 중합체의 유형에 속한다(Williams & Peoples, 1996, Chemtech 26: 38-44). PHA는 광범위한 박테리아에 의해 합성되고, 플라스틱 폐기물의 유해한 영향으로부터 환경을 보호하기 위하여 기존의 석유 기반 플라스틱(petrochemical-based plastics)을 대체할 잠재적 용도로 인해 널리 연구되고 있다.
PHA는 그것들의 측쇄(side chains)의 길이 및 생합성 경로에 따라 두 그룹으로 나눌 수 있다. PHB, (R)-3-히드록시부티르산((R)-3-hydroxybutyric acid)의 동종중합체(homopolymer)와 같이 짧은 측쇄(side chains)를 가진 것들은 결정 열가소성 플라스틱(crystalline thermoplastics)인 반면에, 긴 측쇄를 가진 PHA들은 더욱 탄력이 있다. 전자는 약 70년 전부터 알려진(Lemoigne & Roukhelman, 1925, Ann Des Fermentation, 527-536) 반면에, 후자의 물질은 비교적 최근에 발견되었다(deSmet et al., 1983, J. Bacteriof. 154: 870-78). 그러나, 이러한 지정(designation) 이전에, (R)-3-히드록시부티르산((R)-3-hydroxybutyric acid) 유닛들 및 5 내지 16 개의 탄소 원자를 가진 긴 측쇄 (R)-3-히드록시산((R)-3-hydroxy acid) 유닛들을 포함하는 미생물 기원의 PHA들이 동정되었다(Wallen & Roweder 1975, Environ. Sci. Technol. 8: 576-79). (R)-3-히드록시부티르산((R)-3-hydroxybutyric acid) 및 5 내지 16 개의 탄소 원자를 포함하는 하나 이상의 긴 측쇄 히드록시산(hydroxy acid) 유닛들의 공중합체(copolymers)를 생산하는 많은 박테리아가 동정되었다(Steinbuchel & Wiese, 1992, Appl. Microbiol. Biotechnol. 37: 691-97; Valentin et al., 1992, Appl . Microbiol . Biotechnol. 36: 507-14; Valentin et al., Appl. Microbiol. Biotechnol. 1994, 40: 710-16; Abe et al., 1994, Int. J. Biol. Macromol. 16: 115-19; Lee et al., 1995, Appl. Microbiol. Biotechnol. 42: 901-09; Kato et al ., 1996, Appl. Microbiol. Biotechnol. 45: 363-70; Valentin et al., 1996, Appl. Microbiol. Biotechnol. 46: 261-67; and US-Patent No. 4,876,331). 이러한 공중합체는 PHB-co-HX(여기서 X는 6개 의상의 탄소 원자의 3-히드록시 알카노에이트(alkanoate) 또는 알케노에이트(alkenoate))로 지칭될 수 있다. 특정 두-성분(two-component) 공중합체의 유용한 예는 PHB-co-3-히드록시헥사노에이트(PHB-co-3-hydroxyhexanoate, PHB-co-3HH)이다(Brandl et al., 1989, Int. J. Biol. Macromol. 11 : 49-45; Amos & Mclnerey, 1991, Arch. Microbiol. 155: 103-06; US-Patent No. 5,292,860).
PHA는 (전술한 바와 같이) 그것의 생분해성 열가소성 플라스틱 및 생체고분자를 위한 재생가능한 자원으로서의 잠재적 용도에 의해 널리 연구되고, 상업적으로 개발되고 판매되어 왔음에도 불구하고(Hrabak, 1992, FEMS Microbiol. Rev. 103: 251-256), 그 제조 비용은 기존의 석유 기반 플라스틱(petrochemical-based plastics)에 비해 훨씬 높다. 이는 그것들의 보급에 큰 장애물에 되고 있다(Choi & Lee, 1997, Bioprocess Eng. 17: 335-342). 상기한 바와 같이, 많은 박테리아, 즉 알칼리게네스 유트로푸스(Alcaligenes eutrophus), 알칼리게네스 라투스(Alcaligenes latus), 아조박터 빈란디(Azotobacter vinlandii), 슈도모나스 아시토필라(Pseudomonas acitophila), 슈도모나스 올레오바란스(Pseudomonas oleovarans), 대장균(Escherichia coli), 로도코커스 유트로파(Rhodococcus eutropha), 크로모박테리움 바이오라세움(Chromobacterium violaceum), 크로마티움 비노숨(Chromatium vinosum), 알카니보락스 보르쿠멘시스(Alcanivorax borcumensis) 등이 PHA를 생산한다. 이러한 모든 PHA 생산 박테리아는 세포내 PHA를 생산하고 PHA 과립 내에 그것을 축적하는 해당 분야에 공지되어있다(Steinbuchel, 1991, Biomaterials, pp. 123-213).
비싼 PHA 생산 비용으로 인해 석유-기반 플라스틱(petrochemical-based plastics)에 비해 불리하게 되는 주요한 측면은, 물질을 고수율로 생산하는 것과 그것이 축적된 박테리아 세포 내로부터 생산된 PHA를 회수하는 것이 어렵다는 것이다. PHA의 총 생산 비용을 줄이기 위해, 효과적인 회수 과정의 개발은 i) 적절한 용매, ii) PHA의 차아염소산염 추출(hypochlorite extraction) 및/또는 iii) 비-PHA 세포 물질의 소화에 의한 세포 파괴를 목적으로 하는 것이 일반적으로 필요하다고 여겨졌다(Lee, 1996, Biotech, Bio-eng. 49: 1-14).
산업 규모에서, 상기 사용 가능한 미생물들은 아직 상대적으로 매우 적은 PHA를 제공하고, 이는 이들 미생물을 이용한 PHA의 생산을 경제적으로 실행 불가능하게 한다. 예를 들어, 슈도모나스 푸티다 U(Pseudomonas putida U)의 야생형 세포가 탄소원(carbon source)으로서 소디움 옥타노에이트(sodium octanoate, 15 mM)를 포함하는 변형된 MM 배지 내에서 배양된 경우, 처음 24시간 동안 PHA의 24.4% 만이 상기 미생물 내에 축적되었다. 해당 분야에 공지된 미생물 기반 PHA 생산을 위한 모든 방법은 생산 중에 대량의 물을 필요로 하고 이것들의 회수(recovery)를 위해 화학 시약 및/또는 효소가 추가로 필요하며, 이는 생산 비용의 절감에 장애물이 된다. 따라서, PHA 생산을 위한 대체 전략이 긴급하게 필요하다.
미생물에 의한 전체적으로 낮은 PHA 생산 뿐만 아니라, 배양의 특정 단계에서 축적된 PHA의 양이 감소하기 시작한다. 이러한 감소의 원인은 미생물이 변화하는 환경에서의 신속한 에너지원 및 환원력으로 박테리아에 제공되는 식량 저장 물질로서 PHA를 생산하는 사실로 설명할 수 있다. 모든 자유-생활 미생물들은 최대한도로 일종의 탄소원 관리를 수행한다. 많은 동물 및 식물들은 일반적으로 대사 요구에 맞는 탄소 흡수를 조절하는 반면에, 다른 생물체들, 특히 폭넓은 탄소 가용성 변동에 적응된 기회 환경 미생물은, 한편으로는 소비와 성장을 통해, 다른 한편으로는 저장 중합체로의 변환에 의한 보존을 통해 과량의 탄소를 흡수하고 그 이용을 관리 할 수 있다. 쉽게 신진대사가 가능한 저장 물질과 더 비활성의 그리고 어느 정도까지 세포 밖에 위치한 저장 물질간의 상호 교환은 이 메커니즘의 핵심이다. 심지어 탄소 흡수를 조절하는 생물체들은 그들의 세포 대사 네트워크 및 유기체 생태 생리학적 과정을 최적화 하기 위한 탄소 관리의 미조정(fine-tuning)을 위하여 이러한 변환을 활용한다.
상기한 바와 같이, PHA는 미생물계에서 저장물질로 널리 활용된다. 미생물에 PHA로 저장된 탄소의 이용을 가능하게 하기 위해, 미생물이 추가 탄소원을 필요로 할 때 PHA가 히드록시알카노에이트(즉, 단량체)로 재변환되는 것은 생물체에게 필수적이다. 이러한 중합체의 개별 단량체로의 변환을 담당하는 것은 PHA 탈중합효소(PHA depolymerases)이다.
상기 미생물은 PHA의 생산 및 분해에 관여하는 단백질의 두 가지 유형을 포함하기 때문에, 상기 생물체의 생존 및 번영을 보장하기 위한 하나의 중요한 문제는 그것들의 조절된 생산량에 의해 정해지는 PHA 합성효소(PHA synthase) 및 PHA 탈중합효소(PHA depolymerases)의 상대적인 양의 조절이다(Uchino et al., 2007; Ren et al., 2009a; and de Eugenio et al., 2010a, 2010b). 그러나, 지금까지 중합 및 탈중합(depolymerization)의 과정을 제어하는 인자는 거의 해명되지 않았다. 예를 들어, 슈도모나스 균주에서 PHA 탈중합효소의 단순한 넉아웃(knock-out)은 PHA의 축적을 개선시키지 않았다(Huisman et al., 1991; Solaiman et al., 2003). 따라서, 단순한 PHA 탈중합(depolymerization) 관여 유전자의 침묵이 미생물에서 효과적으로 PHA 함량을 증가시키는데 충분하지 않음이 판명되었다.
미생물에서 PHA 생산을 증가시키기 위한 다른 접근법은 PHA의 생산을 위한 미생물에 관여하는 PHA 합성효소(PHA synthases)를 조작하는 것이다. 예를 들어, PHA 유전자의 대사 공학(metabolic engineering)은 중간-사슬-길이의 PHA 생산 증가를 위한 좋은 전략으로 밝혀졌다. 이전의 연구는 슈도모나스 푸티다(Pseudomonas putida)에서 phaCl의 과발현에 의한 PHA 수율 증가를 시도하였다(Kraak et al., 1997; Prieto et al., 1999; Conte et al., 2006; Kim et al., 2006; Ren et al., 2009b). 그러나, 이러한 연구들은 세포 내에서 그들이 성장에 필수적이지 않고 해로운 영향을 부과할 때 phaC-포함 플라스미드가 손실되는 문제가 발생했다. 결과적으로, 상기 변형된 미생물들은 안정적으로 재생산되지 않았고, PHA의 과잉 생산에 관여하는 유전 정보를 잃었다. 다른 경우에는, 프로모터의 높은 유도가 항상 유전자 산물의 높은 활성을 수반하는 것은 아니므로, 더 적은 PHA가 축적되었다(Diederich et al., 1994; Ren et al., 2009).
이러한 시도가 유용하지 않은 이유는 상기 미생물 내 PHA의 생산, 저장 및 분해에 관련된 많은 다른 단백질 내에서 발견될 수 있다. 대부분의 미생물은 하나 이상의 PHA 합성 효소(PHA synthase)를 가지고 있고, 따라서 하나의 합성효소(synthase)의 유전자 카피 수의 증가는 다른 PHA 합성효소의 생산을 위한 중요한 대사산물(metabolites)로부터 미생물을 고갈시킬 수 있으며, 이로 인해 미생물에서 보통의 PHA 합성의 향상만을 야기할 수 있다.
또한, 파신(phasines)은 상기 미생물 내에서 PHA-과립 안정화(PHA-granule stabilisation)에 중요한 역할을 한다. 예를 들어, 파신(phasines)은 세포질과 PHA 과립의 소수성 코어(hydrophobic core) 사이에 간기(interphase)를 생성하는 PHA 과립의 수와 사이즈를 제어하고(Grage et al., 1999), 개별 과립들이 응집되는 것을 억제한다(Steinbuchel et al., 1995; York et al., 2002). 또한 파신 PhaF(phasin PhaF) 및 일부 포괄적 전사 인자(global transcriptional factors)(Crc 등)는 PhaC 활성의 조절에 중요한 것으로 제안되어 왔다(Prieto et al., 1999b; Casta-neda et al., 2000; essler & Witholt, 2001 ; Hoffmann & Rehm, 2005; Ren et al., 2010). P. 푸티다 KT2440(P. putida KT2440)에 대한 최근 연구들(Galan et al., 2011)은 과립 분리(granule segregation)에서 PhaF가 중요한 역할을 할 뿐만 아니라, 이러한 파신(phasin)의 부족은 세포질의 이러한 봉입체(inclusion bodies)의 응집을 수반함을 입증하였다.
그러므로 유의적인 정도까지 미생물이 PHA를 과잉 생산하도록 미생물을 변형하는 것은 상당한 도전인 동시에, 과잉 생산을 유도하는 변형이 미생물의 재생산시 안정적이고 어떤 단백질도 PHA의 미생물의 조작(handling)과 연관되지 않는다는 것을 보장하는 것은 매우 심각하여, 바람직한 결과는 과잉보상(overcompensated)된다. 또한 지금까지 추구해온 대부분의 방법으로 PHA 축적이 최고로 도달하여 PHA가 분해되기 전에 회수하는 적절한 시점을 발견하는 것은 어려웠다.
이 점에서 어느 정도 성공을 거둔 하나의 접근법이 WO 2007/017270 Al에 기술되어 있고, 여기서 알카니보락스 보르쿠멘시스(Alcanivorax borcumensis)는 tes5-유사 유전자(tes5-like gene)를 침묵(silencing)시켜 변형되었다. 상기 유전자는 (R)-3-OH-아실-CoA 중간체((R)-3-OH-Acyl-CoA intermediate)를 상응하는(corresponding) 산으로 변환하는 티오에스터라제(thioesterase)를 코딩한다. 이것은 PHA 합성에 필수적인 중간체로부터 미생물을 고갈시키는 중요한 부반응(side reaction)이다. 이 접근법은 더 많은 PHA의 축적을 달성한 점에서 어느 정도 성공적으로 검증되었으나, 상기 미생물이 PHA의 산업적 규모의 생산을 성공적으로 구현하기 위해 요구되는 안정성을 갖는지 여부는 미지수이다.
또 다른 접근법은 김(Kim) 등에 의해 기술된 P. 푸티다 KCTC1639(P. putida KCTC1639)에서 phaCl 및 phaC2 등의 PHA 합성효소를 과발현 시키는 것이었다(2006, Biotechnol. Prog. 22: 1541-1546). 이 조사에서, phaCl 및 phaC2 유전자의 추가적인 카피는 플라스미드를 통해 미생물 내로 도입되었고, 여기서 상기 유전자는 프로모터의 제어하에 있지 않았다. 김(Kim) 등은 상기 변형된 미생물 내에서의 PHA 합성효소 활성은 야생형의 1.6배 이상이라고 기술하였다. 상기 미생물이 phaCl을 과발현하는 경우에 증가된 PHA 생산(약 0.8g l-1 까지)을 관찰할 수 있으나, 상기 미생물의 phaC2 과발현은 야생형 이상의 PHA 생산 증가를 보이지 않았다. 이러한 관찰 결과는 phaC2 합성효소의 비활성 형태의 형성에 기인할 가능성이 있다.
또 다른 접근 방법은 야생형의 형태로 PHA를 생산하지 않는 미생물에 PHA 합성효소를 삽입하는 것이었다. 예를 들어 WO 99/14313, DE 44 17 169 Al 또는 퀴(Qi) 등(1997, FEMS Microbiol, Lett. 157: 155-162)은 대장균(E. coli) 내로 PHA 합성효소를 도입하는 것에 대하여 기술하였다. 그러나, 이러한 조작된(engineered) 미생물 내에서, PHA의 수율은 매우 낮아서 산업적 PHA 생산에는 적합하지 않다.
마지막으로, 캣(Cat) 등(2009, Biores. Technol. 100: 2265-2270)은 P. 푸티다 KT 2442(P. putida KT 2442)에서 PHA 탈중합효소(depolymerase)의 넉아웃(knock-out)을 통한 PHA의 생산 증가를 보고하였다. 상기 연구에서, 증가된 PHA 생산은 12g l-1과 같은 높은 탄소원의 농도 하에서 미생물이 배양된 경우 관찰될 수 있었다.
이러한 발전에도 불구하고, PHA를 과잉생산하는 동시에 이 목적을 위해 삽입된 유전 정보가 재생산시 손실되지 않도록 안정적인, 유전적으로 변형된 미생물에 대한 필요성이 남아있다. 본 출원은 이러한 요구를 해결한다.
본 출원의 하나의 목표는 유전적으로 조작된(engineered) 미생물을 제공하는 것이고, 여기서 미생물 내에서 중간-(medium-) 또는 긴-사슬-길이(long-chain-length) PHA의 과잉생산에 관여하는 유전 정보는 재생산(reproduction)시 안정적이다. 본 발명의 또 다른 목적은 배양 배지에 소정의 노출 시간 후 PHA의 감소가 발생하지 않도록 하고, 동시에 PHA 축적 비율(percentage)이 증가되도록 미생물을 변형하는 것이다. 또한, 본 출원의 또 다른 목적은 PHA가 축적된 이후 상당한 PHA가 분해되지 않도록 미생물을 변형하는 것이다.
본 발명은 이들 목적이 PHA 합성효소를 코딩하는 하나 이상의 유전자의 야생형 미생물과 비교하여 카피 수의 증가를 갖도록 PHA-생산 미생물을 변경함으로써 달성될 수 있다는 연구 결과에 근거한다. 바람직하게 추가 카피에 존재하는 유전자는 phaC2 또는 그것의 동족체(homologues)를 코딩한다. 본 출원에 사용된 용어로서 야생형 미생물은 자연에서 발생하는 미생물의 전형적인 형태를 의미한다. 바람직하게, 상기 야생형 미생물은 그 천연의 형태로 하나 이상의 PHA 합성효소를 코딩하는 유전자를 포함한다.
용어 "상동(homolog)"은 본 출원의 실시에서 실질적으로 동일한 기능을 가지나 다른, 모펩타이드(parent peptide)와 유사한 구조 및 서열인 단백질 또는 펩타이드로 정의된다. 본 출원의 문맥에서 용어 "퍼센트 상동성(percent homology)" 및 "서열 유사성(sequence similarity)"은 호환적으로 사용된다. 본 출원의 실시에서 상동(homolog)은 모 펩타이드와 적어도 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90 % 및 가장 바람직하게 적어도 95% 서열 동일성(sequence identity)을 갖는 것이 바람직하다. 두 서열의 비교를 위해 사용된 수학적 알고리즘의 바람직한 비-제한적인 예는 카를린(Karlin) 등(1993, PNAS 90: 5873-5877)의 알고리즘이다. 이러한 알고리즘은 본 발명의 핵산 서열에 대한 원하는 동일성(identity)을 갖는 시퀀스를 식별하기 위해 사용될 수 있는 NBLAST 프로그램에 포함되어 있다.
따라서, 본 출원의 하나의 주요한 측면은, 하나 이상의 PHA 합성효소를 코딩하는 유전자를 갖는 야생형 미생물과 비교하여 증가된 카피 수를 갖는, 자연적으로 PHA를 생산하는 미생물의 형태를 유전적으로 조작하는 것이며, 여기서 상기 증가된 카피 수는 상기 PHA 합성효소의 균형 잡힌 생산 과잉을 제공하고 궁극적으로미생물이 중간-(medium-) 또는 긴-사슬-길이(long-chain-length) PHA를 24시간 후에 야생형과 비교하여 적어도 1.2배의 양으로 과잉생산하는 것을 야기하며, 여기서 과잉 생산을 평가하기 위한 기준 조건은 변형된 15 mM 소듐 옥타노에이트(sodium octanoate)를 포함하는 MM 배지이다. 바람직한 실시예에서, 유전적으로 조작된(engineered) 상기 미생물은 재생산(reproduction)시 안정적이고, 바람직하게 하나 이상의 PHA 합성효소를 코딩하는 유전자를 갖는 야생형과 비교하여 하나의 추가적인 카피(copy)를 갖는다.
이러한 변형된 미생물이 식물성 지방 및 기름으로부터 유도된 지방산을 포함하는 저렴하고 손쉽게 구할 수 있는 원료로부터 PHA를 매우 비용 효율적으로 생산할 수 있도록 함이 예기치 않게 발견되었다. 본 발명의 미생물은, 어떤 경우에는 심지어 단지 24시간 후에, 배양 조건에 따라 높은 PHA 피크 농도를 제공하는 것이 관찰되었다. 또한 본 발명의 미생물은 단일 PHA 과립을 형성하기 위하여 미생물에서 개별 PHA 과립의 높은 유전적 안정성 및 융합을 나타낸다. 이는 차례로 미생물로부터 PHA의 회수를 매우 단순화하는데, 왜냐하면 그들은 염소화 용매(chlorinated solvents)로 추출한 것과 유사한 수율을 갖는 아세톤과 같은 비-염소화 용매(non-chlorinated solvents)로 추출될 수 있기 때문이다.
용어 "유전적으로 조작된(genetically engineered)"(또는 유전적으로 변형된, genetically modified)이라는 것은 본 발명의 미생물, 그것의 유전자(들) 및/또는 유전자 산물(들)(폴리펩타이드)의 인위적 조작을 의미한다.
바람직하게, 본 발명의 미생물은 재생산(reproduction)시 안정하다. "재생산시 안정하다"(이 용어는 본 출원의 실시에서 이해되어야만 하기 때문에)는 것은, 상기 생물이 다중(예를 들어 5 이상과 같이) 재생산 주기에서 유전 정보를 유지하고 유전정보가 손실되지 않는 것을 의미한다.
상기한 바와 같이, 본 발명의 미생물은 바람직하게 재생산시에 안정하고, 이는 유전적 변형이 상기 미생물 내에 재생산 및/또는 배양시 유지되는 것을 의미한다. 이러한 안정성에 더하여, 상기 미생물은 유전적 변형을 유지하기 위한 항생제의 압력을 필요로하지 않는 것이 바람직하다. 항생제의 첨가가 생략될 수 있어 항생제로 PHA가 오염될 위험이 배제될 수 있으므로, 이러한 미생물은 PHA 생산에 매우 유리하다. 본 출원의 바람직한 실시예에서 본 발명의 미생물은 항생제의 존재 유무에 관계없이 재생산 및/또는 배양시 그것의 유전적 변형을 유지한다.
용어 "균형잡힌 과발현(balanced overexpression)"이라는 것은 과발현에 의해 생산된 단백질이 증가된 수의 카피들(copies)로부터 예측되는 양보다 더 적게 생산됨을 의미한다. 예를 들어, 야생형이 하나의 유전자 카피(copy)를 포함하고 유전적으로 변형된 미생물이 두 개의 유전자 카피를 포함한다면, 유전적으로 변형된 미생물은 야생형보다 약 두 배의 단백질을 생산할 수 있음을 예측할 수 있다. 단백질의 양은 미생물의 성장 단계에서 내재된 PHA 합성효소의 활성으로부터 추정될 수 있다. 균형잡힌 과잉 생산이라는 용어는 과발현이 바람직하게는 단지 야생형의 미생물과 비교하여 24시간 이후의 성장 단계에서 내재된 PHA 합성효소의 활성을 0.6배까지, 바람직하게는 0.5배까지, 더욱 바람직하게는 0.35배까지 및 가장 바람직하게는 0.2배까지만 증가시키는 것을 의미한다.
"균형잡힌 과발현"이라는 용어를 사용함으로써, 상당량의 불활성 단백질이 형성되지 않음이 보장된다. 예를 들어, 단백질의 광범위한(또는 균형잡히지 않은) 과잉생산은 불활성형 단백질 및 용해되지 않는 단백질을 포함하는 봉입체(inclusion bodies)의 형성을 초래할 수 있다. 이런 이유로, 단백질의 과발현에도 불구하고, 개선된 단백질의 형성을 전혀 관찰할 수 없다. 균형잡힌 과발현을 보장하기 위한 하나의 방법은 유도물질(inducer)의 존재하지 않는 경우라도 억제된 단백질(suppressed protein)이 생산되도록 하는 누출성 프로모터 시스템(lebaky promoter system)을 사용하는 것이다.
본 출원의 바람직한 실시예에서, 과잉 생산(overproduction)은 적어도 부분적으로 PHA 합성효소를 코딩하는 하나 이상의 유전자의 카피 수의 증가에 기인한다. 더욱 바람직한 실시예에서, 하나 이상의 카피(copy)를 포함하는 미생물의 유전자는 PhaC2 합성효소를 코딩하는 유전자이다. 본 출원의 실시에서, PhaC2 유전자 및 그것의 동종체들(homologs)의 여러 카피들(multiple copies)의 삽입은 유익한 효과와 연관되어 있고, 특히 phaC2의 과발현(hyperexpression)은 특히 지수적 성장 단계 동안 함께 응집(coalesce)하기 위하여 나타나는 PHA 과립의 형태의 변화와 연관되어 있음이 발견되었다.
또한, 누출성 프로모터(leaky promoter)의 제어 하에서 PhaC2 합성효소 유전자의 여러 카피들(multiple copies)의 삽입은 PHA 대사와 관련된 다른 단백질에 긍정적으로 영향을 미쳐 미생물의 전반적인 PHA 생산 및 저장 시스템이 부정적인 영향을 받지 않도록 할 것으로 생각된다.
더욱 바람직한 실시예에서, PHA 합성효소 유전자의 발현은 누출성 프로모터 시스템(leaky promoter system)에 의해 조절된다. 누출성 프로모터 시스템(leaky promoter system)은 비록 프로모터가 해당하는 활성제(activator)와 함께 활성화되는 시스템에 비해 억제된 효능을 가짐에도 불구하고 프로모터에 의해 제어되는 유전자의 전사를 허용한다. 누출성 프로모터 시스템(leaky promoter system)은 바람직하게 단백질-기반(protein-based) 프로모터 시스템이고, 더욱 바람직하게 T7 폴리머라제/T7 폴리머라제 프로모터 시스템(T7 polymerase/T7 polymerase promoter system)이다. 더욱 바람직한 실시예에서, T7 폴리머라제/T7 폴리머라제 프로모터 시스템(T7 polymerase/T7 polymerase promoter system)에서 T7 폴리머라제의 생산은 작은 분자에 노출시 T7 폴리머라제의 형성을 유도할 수 있는 유도제(inducer)를 포함한다. 이러한 시스템에는 작은 분자의 첨가에 의한 T7 폴리머라제의 생산을 선택적으로 유발시켜 T7 폴리머라제의 형성을 유도하는 것을 가능하도록 하는 이점이 있다. 이것은 차례로 PHA 합성효소의 생산을 유발한다. 특히 바람직한 실시예에서, 상기 작은 분자는 3-메틸-벤조에이트(3-methyl-benzoate)이다.
하나의 매우 바람직한 본 발명의 자연적으로 PHA 를 생산하는 미생물의 유전적으로 조작된 형태는 이하 PpU 10-33으로 지정될 미생물 및 세포배양의 라이프니츠 연구소 DSMZ 독일 컬렉션(the Leibnitz Institute DSMZ German collection)의 DSM 26224로 기탁된 슈도모나스(Pseudomonas) 속이다.
본 출원의 실시에서, 야생형의 미생물과 비교하여 하나 이상의 PHA 합성효소를 코딩하는 유전자의 증가된 수의 카피들(copies)이 추가된 유전적으로 조작된 미생물은 PHA의 분해와 관련된 단백질을 코딩하는 하나 이상의 유전자에 하나 이상의 변형을 포함한다. 이러한 미생물에서의 변형 조합은 관찰된 PHA 축적에 관하여 시너지 효과를 가져는 것으로 확인되었다. 바람직한 실시예에서, 상기 미생물에서 PHA의 분해에 관여된 단백질을 코딩하는 하나 이상의 유전자의 하나 이상의 변형은 상기 유전자의 완전 또는 부분적 불활성화를 야기한다. 이러한 미생물은 또한 각각의 유전자의 넉-아웃(knock-out) 미생물이라고 한다.
넉-아웃(knock-out) 돌연변이는 당업자에게 공지된 임의의 적합한 방법에 의해 제조될 수 있다. 그러나, 유전자의 완전 또는 부분적 불활성화는 이중 교차-이벤트 재조합 접근방식(double recombinant crossover-event approach)에 의해 달성되는 것이 바람직하다.
특히 바람직한 실시예에서, PHA의 분해(degradation)에 관련된 단백질은 PHA 탈중합효소(depolymerase), 바람직하게 PhaZ 또는 그것의 동종체(homologue)이다. 또한, 유전적으로 조작된 미생물은 상기 미생물, 즉 유전자가 변형된 미생물에서 PHA의 분해와 관련된 단백질을 코딩하는 단일 유전자만을 포함하고, 여기서 PHA의 분해에 관련된 단백질은 하나 이상의 변형을 포함하는 것이 바람직하다. 다시 말해, 그 미생물은 상기 미생물 내에 PHA의 분해와 관련된 효소를 대체할 수 있는 임의의 다른 효소를 포함하지 않는 것이 바람직하다.
PHA 합성효소를 코딩하는 유전자의 다중 카피들(multiple copies) 및 불활성화된 phaZ 유전자를 모두 포함하는 자연적으로 PHA를 생산하는 미생물의 하나의 매우 바람직한 본 발명의 유전적으로 조작된 형태는 미생물 및 세포배양의 라이프니츠 연구소 DSMZ 독일 컬렉션(the Leibnitz Institute DSMZ German collection)의 DSM 26225로 기탁된 슈도모나스(Pseudomonas) 속이다. 상기 미생물은 이하 PpU 10-33-ΔphaZ로 지정된다.
전형적으로 히드록시산 유닛의 폴리에스테르(polyester of hydroxy acid units, PHA)는 5 내지 16개의 탄소 원자를 갖는 측쇄 히드록시산 유닛 [(R)-3-hydroxy acid units]을 포함한다. 본 발명의 실시에서 용어 "긴-사슬-길이 PHA(long-chain-length PHA)"는 단량체(분자)당 적어도 12개, 바람직하게는 14개의 탄소 원자를 포함하는 PHA를 의미하는 반면, "중간-사슬-길이 PHA(medium-chain-length PHAs)"는 5 내지 12개의 탄소 원자를 포함하는 것을 의미한다. 바람직한 실시예에서, 유전적으로 조작된 미생물은 중간-사슬-길이 PHA를 과잉생산한다.
본 발명의 특히 바람직한 실시예에서, 유전적으로 조작된 미생물은 24시간 후 야생형과 비교하여 PHA의 양을 적어도 1.2배, 바람직하게 1.5배 및 특히 적어도 2배(중량으로)로 과잉 생산하기 위한 유전적 조작(genetic engineering), 즉 예를 들어 PHA 합성효소를 코딩하는 하나 이상의 유전자의 야생형에 비해 증가된 수의 카피를 삽입하는 것 및/또는 상기 미생물 내에서 PHA의 분해와 관련된 단백질을 코딩하는 하나 이상의 유전자에 하나 이상의 변형을 삽입하는 것이고, 여기서 과잉생산을 평가하기 위한 기준 조건은 15mM 소듐 옥타노에이트(sodium octanoate)를 포함하는 변형된 MM 배지이다.
본 출원의 유전적으로 조작된 미생물의 기초를 형성하는 미생물은 미생물이 하나 이상의 PHA 합성효소를 코딩하는 유전자를 가져야 한다는 것을 제외하면 어떠한 수단에 의해서도 제한되지 않는다. 바람직하게, 미생물은 또한 상기 미생물 내에서 PHA의 분해와 관련된 단백질을 코딩하는 하나 이상의 유전자, 더욱 바람직하게는 단일 유전자(single gene)를 가져야만 한다.
본 출원에 따른 본 발명의 미생물은 바람직하게 PHA 생산 박테리아 그룹, 특히 슈도모나스 푸티다(Pseudomonas putida), 슈도모나스 에루지노사(Pseudomonas aeruginosa), 슈도모나스 시린가에(Pseudomonas syringae), 슈도모나스 플루오르세인스(Pseudomonas fluoresceins), 슈도모나스 아시토필라(Pseudomonas acitophila), 슈도모나스 올레바란스(Pseudomonas olevarans), 이디오마리나 로이히엔시스(Idiomarina loihiensis), 알카니보락스 보르쿠멘시스(Alcanivorax borkumensis), 아시네토박터 종(Acinetobacter sp.), 카울로박터 크레센투스(Caulobacter crescentus), 아프칼리제네스 유트로푸스(Afcaligenes eutrophus), 알칼리게네스 라투스(Alcaligenes latus), 아조박터 빈란디(Azotobacter vinlandii), 로도코커스 유트로파(Rhodococcus eutropha), 크로모박테리움 바이오라세움(Chromobacterium violaceum) 또는 크로마티움 비노숨(Chromatium vinosum)으로부터 선택된다. 본 발명에 따른 특히 바람직한 미생물은 슈도모나스 푸티다(Pseudomonas putida) 균주, 더욱 바람직하게 슈도모나스 푸티다 U(Pseudomonas putida U)이다.
본 발명의 미생물은 유도제 분자(inducer molecule)의 부존재 하에서 PHA 합성효소의 과잉 생산을 보임이 관찰되었다. 의외로, 비-유도된 미생물에 의한 PHA 의 생산은 유도제(inducer)로 처리된 동일한 미생물의 PHA의 생산에 상응하거나 심지어 이를 초과하였다. 이는 유도된 미생물이 과발현된 PHA 합성효소의 최적의 양을 오버슈트(overshoot) 할 수 있어, 봉입체(inclusion bodies) 또는 비-용해형과 같은 합성효소의 비-활성형의 형성을 야기함을 의미한다. 그러므로, 본 출원의 또 다른 측면은 상기한 바와 같이 유전적으로 조작된 미생물에 관한 것이고, 여기서 상기 미생물은 유도제 분자(inducer molecule)의 첨가 없이 PHA를 생산할 수 있다. 이는 값비싼 유도제(inducer) 및 제조 과정으로부터의 잠재적 오염을 배제할 수 있어 PHA의 산업적 규모 생산을 위한 이점이 있다.
또한 개별 세포 내에서 감소된 수 또는 심지어 단일 과립의 PHA를 생산하는본 출원의 미생물은, 야생형에 비해, 다른 형태를 가진 PHA를 생산하는 것이 예기치 않게 관찰되었다. 따라서 본 출원의 또 다른 측면은 상기한 바와 같이 유전적으로 조작된 미생물에 관한 것이고, 여기서 상기 미생물은 야생형 세포에 비해 미생물 당 감소된 수의 세포간 PHA 과립, 바람직하게 단일 세포간 PHA 과립(single intercellular PHA granule) 형태로 생산할 수 있다. 단일 과립의 형성은 PHA 분리 및 정제를 단순화하는 PHA 안정화 효소의 양의 감소와 관련이 있는 것으로 생각된다.
본 출원의 미생물은 PHA를 더 빨리 생산하고 경우에 따라서는 축적된 PHA가 장기간에 걸쳐 높은 수준으로 유지함이 예기치 않게 관찰되었다. 따라서 본 출원의 또 다른 측면은 상기한 바와 같이 유전적으로 조작된 미생물에 관한 것이고, 여기서 상기 미생물은 소듐 옥타노에이트(sodium octanoate)를 포함하는 변형된 MM 배지에 노출시 24시간 후에 PHA의 최대 함량을 생산할 수 있고, 또한 바람직하게 초기 24시간 축적 기간 후 적어도 48시간 동안, 최대 PHA 함량의 20% 중량 범위 내로 PHA 함량을 유지할 수 있으며, 여기서 PHA 생산 평가를 위한 기준 조건은 15 mM 소듐 옥타노에이트(sodium octanoate)를 포함하는 변형된 MM 배지이다.
본 발명의 또 다른 측면은
1) 본 발명의 미생물 또는 세포를 배양하는 단계; 및
2) 배양 배지로부터 PHA를 회수하는 단계를 포함하는 PHA를 생산하는 방법에 관한 것이다.
적합한 조건 하에서 미생물 또는 세포를 배양하는 표준 방법은 당업계에 공지되어 있다. 예를들어 아래의 실시예, 재료들(materials)을 참고하고 또한 Sambrook & Russell (2001)를 참고하라. PHA는 원심분리 또는 여과에 의한 배지로부터의 세포 분리, 성분(PHA)의 침전 또는 여과, 이어서 예를 들어 이온 교환 크로마토그래피(ion exchange chromatography), 친화성 크로마토그래피(affinity chromatography)와 같은 크로마토그래피 과정(chromatographic procedures)에 의한 정제를 포함하는 기존의 방법 또는 당업계에서 인정되는 유사한 절차에 의해 배양 배지로부터 분리될 수 있다.
상기 언급된 과정에서 PHA는 3 내지 8개의 탄소 원자를 가진 케톤(ketone), 바람직하게 아세톤으로 추출됨으로써 회수되는 것이 바람직하다. 추출 용매와 무관하게, 추출은 바람직하게 60℃ 또는 그 미만, 바람직하게 20 내지 40℃에서 수행된다.
본 출원의 특히 바람직한 실시예에서, 상기 방법은 PHA 과잉 생산 및/또는 PHA 합성효소의 과잉 생산을 시작하기 위하여 유도제 분자(inducer molecule)의 첨가와 관련이 없거나 이를 필요로하지 않는다. 또한, 본 출원의 실시에서 본 발명의 미생물은 심지어 항생제의 부존재 하에서도 도입된 변형에 관하여 안정함이 예기치 않게 발견되었기 때문에, 항생제의 존재 하에서 상기 미생물을 배양하는 것은 필요하지 않다. 이러한 항생제는 아텔루르산염(Tellurite), 리팜피신(Rifampicin) 및 카나마이신(Kanamycin) 제한 없이 포함한다.
상기한 과정을 위한 탄소 공급 원료(feedstock)로서 손쉽게 구할 수 있고 저렴한 식물성 지방 및 기름으로부터 유도된 지방산을 사용할 수 있다. 이러한 지방산의 바람직한 예는 헥사노익(hexanoic), 헵타노익(heptanoic), 옥타노익(octanoic) 및 데세노익(decenoic) 산과 같은 포화 카복실산(saturated carboxylic acids) 및 1-운데세노익산(1-undecenoic acid), 올레익산(oleic acid) 또는 리놀레익산(linoleic acid)과 같은 불포화 지방산(unsaturated fatty acids)을 포함한다. 또한 바람직하게 글리세롤(glycerol)과 같은 폴리히드릭 알콜(polyhydric alcohols)을 공급 원료(feedstock)로 사용할 수 있다.
본 발명의 또 다른 측면은 PHA, 특히 중간-(medium-) 및/또는 긴-사슬-길이(long-chain-length) PHA의 과잉 생산을 위한 본 발명의 미생물, 핵산, 벡터 및/또는 세포의 용도에 관한 것이다.
도 1은 PpU(a-c); PpU 10-33 비-유도된 세포(d-f) 및 PpU 10-33 유도된 세포(g-i); ΔphaZ-PpU 10-33 비-유도된 세포(j-l) 및 유도된 세포(m-o)의 전자 현미경 사진을 나타낸 도이다. 배양 균주는 탄소 공급원으로 소듐 옥타노에이트(sodium octanoate)(15 mM 및 20 mM 의 두 번의 펄스가 주어진)를 포함하는 변형된 MM에서 배양하였고 31 시간(a, d, g, j, m), 48 시간(b, e, h, k, n) 및 72 시간(c, f, i, l, o)에서 샘플링 하였다.
도 2는 P. 푸티다 U에서의 pha 유전자의 발현 및 PHA 축적을 나타낸 도이다. 각 패널은 PpU(각 숫자에서 첫 번째 막대), 비-유도된 PpU 10-33((a) 및 (c)에서 각 숫자에서 두 번째 막대) 및 유도된 PpU 10-33 ((a) 및 (c)에서 각 숫자에서 두 번째 막대), 비-유도된 ΔphaZ-PpU 10-33((b)에서 각 숫자에서 두 번째 막대) 및 유도된 ΔphaZ-PpU 10-33((b)에서 각 숫자에서 두 번째 막대)에서 Pha 유전자의 발현의 정규화된 폴드 증가(normalized fold-increased)를 보인다. 또한 PHA 함량(gl-1)은 그래프(c)에서 점을 가진 직선(PpU), 삼각형(유도된 PpU 10-33), 점(비-유도된 PpU 10-33)을 가진 아랫쪽의 점선(유도된 PpU 10-33), 삼각형을 가진 위쪽의 점선(비-유도된 ΔphaZ-PpU 10-33) 및 사각형을 가진 점선(유도된 ΔphaZ-PpU 10-33)으로 나타냈다.
도 3은 P. 푸티다 U에서 phaC2의 과발현을 위한 이분 시스템(bipartite system)의 유전자 구성(genetic organization)을 나타낸 도이다. 이 다이어그램은 염색체에 삽입된 두 개의 벡터, pCNB1mini-Tn5 xylS/Pm::T7pol 및 pUTminiTn5-Tel-T7phaC2을 보여준다.
도 4는 유전적으로 조작된 비-유도된 PpU 10-33(검은색 원), 유도된 PpU 10-33(흰색 원), 비-유도된 ΔphaZ-PpU 10-33(검은색 삼각형) 및 유도된 ΔphaZ-PpU 10-33(흰색 삼각형) 뿐만 아니라 야생형 PpU (사각형)에서의 PHA 생산 오버타임(overtime)을 나타낸 도이다.
도 5는 해당 항생제를 포함하거나 포함하지 않는 경우에, 기질로 옥타노에이트(20 mM)를 포함하는 MM+0.1%YE 배지에서 배양한 PpU 및 PpU 10-33-ΔphaZ의 바이오매스 및 PHA 수율을 나타낸 도이다. 결과는 두 번의 값(duplicates)의 평균이다.
도 2는 P. 푸티다 U에서의 pha 유전자의 발현 및 PHA 축적을 나타낸 도이다. 각 패널은 PpU(각 숫자에서 첫 번째 막대), 비-유도된 PpU 10-33((a) 및 (c)에서 각 숫자에서 두 번째 막대) 및 유도된 PpU 10-33 ((a) 및 (c)에서 각 숫자에서 두 번째 막대), 비-유도된 ΔphaZ-PpU 10-33((b)에서 각 숫자에서 두 번째 막대) 및 유도된 ΔphaZ-PpU 10-33((b)에서 각 숫자에서 두 번째 막대)에서 Pha 유전자의 발현의 정규화된 폴드 증가(normalized fold-increased)를 보인다. 또한 PHA 함량(gl-1)은 그래프(c)에서 점을 가진 직선(PpU), 삼각형(유도된 PpU 10-33), 점(비-유도된 PpU 10-33)을 가진 아랫쪽의 점선(유도된 PpU 10-33), 삼각형을 가진 위쪽의 점선(비-유도된 ΔphaZ-PpU 10-33) 및 사각형을 가진 점선(유도된 ΔphaZ-PpU 10-33)으로 나타냈다.
도 3은 P. 푸티다 U에서 phaC2의 과발현을 위한 이분 시스템(bipartite system)의 유전자 구성(genetic organization)을 나타낸 도이다. 이 다이어그램은 염색체에 삽입된 두 개의 벡터, pCNB1mini-Tn5 xylS/Pm::T7pol 및 pUTminiTn5-Tel-T7phaC2을 보여준다.
도 4는 유전적으로 조작된 비-유도된 PpU 10-33(검은색 원), 유도된 PpU 10-33(흰색 원), 비-유도된 ΔphaZ-PpU 10-33(검은색 삼각형) 및 유도된 ΔphaZ-PpU 10-33(흰색 삼각형) 뿐만 아니라 야생형 PpU (사각형)에서의 PHA 생산 오버타임(overtime)을 나타낸 도이다.
도 5는 해당 항생제를 포함하거나 포함하지 않는 경우에, 기질로 옥타노에이트(20 mM)를 포함하는 MM+0.1%YE 배지에서 배양한 PpU 및 PpU 10-33-ΔphaZ의 바이오매스 및 PHA 수율을 나타낸 도이다. 결과는 두 번의 값(duplicates)의 평균이다.
이하에서, 본 출원은 실시예에 의해서 더욱 설명되나, 어떤 방법에 의해서도 본 출원의 범위가 제한되지 않는다.
실시예
실험 과정(Experimental procedures)
본원에 사용된 미생물 및 벡터, 박테리아 균주, 돌연변이 및 플라스미드는 첨부 1에 요약되어 있다.
배양 배지 조건(Culture media conditions)
달리 명시되지 않는 한, 대장균(E. coli) 및 슈도모나스 푸티다(P. putida) 균주를 루리아 밀러 배지(Luria Miller Broth, LB)에서 배양되고, 각각 37℃ 및 30℃에서 배양하였다. 필요한 경우, 다음의 항생제를 첨가하였다; 리팜피신(rifampicin, Rf, 고체 배지에서 20 ㎍ ml-1 , 또는 액체 배지에서 5 ㎍ ml-1), 카나마이신(kanamycin, Km, 고체 배지에서 25 ㎍ ml-1, 또는 액체 배지에서 12,5 ㎍ ml-1), 암피실린(ampicillin, Ap, 100 ㎍ ml-1), 아텔루루산염(tellurite, Tel, 100 ㎍ ml-1), 젠타마이신(gentamicin, Gm, 30 ㎍ ml-1), 클로람페니콜(chloramphenicol, Cm, 30 ㎍ ml-1), 이소프로필-p-D-티오갈락토피라노사이드 (Isopropyl-p-D-thiogalactopyranoside, IPTG, 70 uM) 및 5-브로모-4-클로로-3-인돌릴-베타-D-갈락토피라노사이드(5-bromo-4-chloro-3-indolyl-beta-D- galactopyranoside, XGal, 34 ㎍ ml-1).
DNA 조작(DNA manipulations)
모든 유전적 과정은 Sambrook & Russell (2001)에 기재된 것과 같이 수행하였다. 게놈 및 플라스미드 DNA 추출, 아가로스(agarose) 젤 정제 및 PCR 클리닝(cleaning)은 제조사의 지시에 따라 해당 Qiagen 키트(독일)를 사용하여 수행하였다. 본원에 사용된 모든 DNA 변형 효소(제한효소(restriction endonucleases), DNA 리가아제(DNA ligase), 알칼리성 인산가수분해효소(alkaline phosphatase) 등)은 NEB(Massachusetts, USA)로부터 구입하였다. 중합 효소 연쇄 반응(Polymerase chain reactions, PCR)은 Eppendorf vapo. protect Thermal Cycler (Germany)를 이용하여 수행하였다. 50㎕ PCR 반응 혼합물은 희석된 게놈 DNA 2㎕(50 ㎍ ml-1), 1 x PCR 버퍼 및 2 mM MgCI2 (PROMEGA Co., USA), 각 프라이머 0.2 μM (Eu-rofins mgw Operon), 0.2 mM dNTPs (Amersham, GE Healthcare, UK), 1.25 U Go-Taq 핫 스타트 중합효소(Hot Start Polymerase)(PROMEGA Co., USA)로 이루어졌다. PCR 사이클링(cycling) 조건은: 초기 단계(initial step)는 96℃/ 10 min, 뒤이은 30 사이클은 96℃/ 30 s - -60℃/ 30 s -, 72℃/ 1 min, 최종단계는 72℃/ 5 min이다. 슈도모나스 균주로 플라스미스의 이동은 삼친 접합 실험(triparental conjugation experiments)에 의해 이루어졌다(Selvaraj & Iyer, 1983; Herrero et al., 1990). 간단히, 자살 플라스미드 pCNB1mini-Tn5 xylSPm::T7pol 또는 pUTminiTn5-Tel-phaC2를 숨기고 있는 대장균 CC 18λpir 공여 균주(coli CC 18Apir donor strain), 대장균 RK600 헬퍼 균주(coli RK600 helper strain), 및 슈도모나스 수용체 균주(Pseudomonas recipient strain)를 각각 8시간 동안 배양하고, 0.75:1:2의 비율로 혼합한 후, LB로 두 번 세척하였다. 상기 현탁액을 니트로셀룰로오스 필터(nitrocellulose filter)에 모으고 30℃, LB 플레이트에서 하룻밤 동안 배양하였다. 필터에서 자란 박테리아는 3 ml의 멸균 식염수(NaCl 0.9 %)로 재현탁하고 연속 희석하여 해당 선택 항생제가 첨가된 LB 한천 배지 플레이트에 플레이팅 하였다. 위의 플레이트들을 30℃에서 하룻밤 동안 배양하고 플레이트 상에 나타난 트랜스 접합체 클론들(transconjugants clones)을 PCR에 의해 확인했다.
DNA 시퀀싱(DNA sequencing)
시퀀싱을 위한 PCR 반응은 특정 올리고뉴클리오티드 또는 범용 프라이머 M13F 및 M13R의 세트(첨부 3)를 사용하여 수행하였다. 10 ㎕ 반응 혼합물은 6-12 ng의 정제된 PCR 생산물(또는 200-300 ng 플라스미드), 2 ㎕ BigDye Ready Reaction Mix, 1 ㎕ BigDye 시퀀싱 버퍼, 및 1 ㎕ 특정 프라이머(25 μM)로 이루어졌다. 사이클링(cycling) 조건은 하기의 단계를 포함하였다: 96℃/ 1 min에서의 초기 단계(initial step), 뒤이어 96℃/ 20 s -52℃-58℃/ 20 s - 60℃/ 4 min 25 사이클, 60℃/ 1 min에서의 최종 연장(extension)단계. 뉴클레오티드 서열(Nucleotide sequences)은 디데옥시-체인 종결 방법(dideoxy-chain termination method)을 이용하여 결정하였다(Big Dye Terminator v3 .1 Kit, Applied Biosystems, Foster City, USA). PCR 산물은 Qiagen DyeEx 2.0 Spin Kit (Germany)을 이용하여 정제하였다. 펠릿(Pellets)을 20 ㎕의 물에 재현탁한 후, ABI PRISM 3130 Genetic Analyser (Applied Biosystems, California, USA)에 로딩하였다. 얻어진 부분 시퀀스는 비-중복 뉴클레오티드 데이타베이스(non-redundant nucleotide databases)(www.ncbi.nlm.nih.gov)에 공지된 시퀀스를 이용하여 정렬하였다. 잠재적 전사(transcriptional) 프로모터 영역 및 터미네이터(terminators)의 동정은 Softberry(http://Iinuxl.softberry.com/cgi-bin/programs/gfindb/bprom.pl), Prom-Scan (http://molbiol-tools.ca/promscan/), 및 PDBG 온라인(http://www.fruitfly.org/seq_tools/promoter.html); 및 Arnold(http://rna. igmors.u-psud.fr/toolbox/amold/Index. php# esults) 생물정보학 도구(bioinformatics tools)를 이용하여 수행하였다.
phaC2
과-발현 균주 PpU 10-33의 디자인 및 구조(Design and construction of the
phaC2
hyper-expression strain PpU 10-33)
PpU 10-33은 phaC2 유전자 발현의 여분의 카피(copy)가 T7 중합효소 프로모터: T7 중합효소 시스템(T7 polymerase promoter: T7 polymerase system)에 의해 유도되는 슈도모나스 푸티다 U(Pseudomonas putida U) 유도체(derivative)이다. 이것은 두 개의 염색체-통합 카세트(chromosomally-integrated cassettes)로 구성된다: 하나는 T7 중합효소 프로모터(T7 polymerase promoter)로부터 발현된 phaC2 유전자를 포함하고, 다른 하나는 Pm 프로모터로부터 발현되고 TOL 플라스미드로부터 유도된 유사 벤조에이트/톨루에이트-유도성 XylS 레귤레이터(cognate benzoate/toluate-inducible XylS regulator)에 의해 조절되는 T7 중합효소 프로모터(T7 polymerase promoter)을 포함한다. phaC2 카세트(phaC2 cassette)는 다음과 같이 구축되었다: P. 푸티다 U(P. putida U)의 phaC2 유전자는 pBBRlMCS-3-phaC2 플라스미드로부터 적출하였고(Arias et al., 2008), pUC18NotI/T7 벡터 내로 클로닝 하였으며, 유전자의 올바른 방향은 시퀀싱에 의해 확인하였다. 그 다음 phaC2 유전자 및 T7 프로모터를 pUTminiTn5-Tel 벡터 내로 카세트(cassette)로서 도입하였다(Sanchez-Romero et al., 1998). 먼저 miniTn5 유도체(derivative) pCNB 1 xylS/Pm::7pol 을 필터-메이팅(filter-mating)에 의해 P. 푸티다 U(P. putida U) 내로 도입하고 Km 선별 마커(Km selection marker)에 의해 선별하였다(Harayama et al, 1989; Herrero et al., 1993). 게놈 내에서 전이인자(transposon)의 통합은 본질적으로 무작위이고, 다른 부위의 삽입은 삽입된 유전자의 전사(transcription) 수준에 현저하게 영향을 미칠 수 있으므로, 두 번째 도입(transfer)을 위해 약 100 개의 트랜스접합체(transconjugants)의 풀(pool)을 준비했다. 상기 풀(pool)의 LB 배양액 5ml을 3 시간 동안 배양하고(30℃, 180 rpm), pUTmini-Tn5-Tel- T7phaC2 구성체(construct)의 도입(transfer)을 위해 수용체(recipients)의 풀(pool)을 사용하였다. 트랜스접합체(transconjugants)는 그들이 텔루라이트(tellurite)(선별 마커)로 형질 전환(transform) 할 때 나타난 검은색에 의해 쉽게 기록되고, 이후 PCR에 의해 확인했다. 이후 두 개의 카세트(cassettes)의 다양한 도입 부위(insertion sites)를 가지는 최종 수용체(final recipients)의 PhaC2 및 PHA(결과)의 수준을 기록한 후, 가장 높은 수준을 기록한 것을 선택하여 PpU 10-33로 지정하였다.
PpU 10-33에서
phaZ
의 넉-아웃 및 보완성(Knock-out of
phaZ
in PpU 10-33 and complementation)
phaZ 유전자의 삭제는 이중-재조합 이벤트(double-recombination event) 및 치명적인 sacB 유전자의 발현에 의한 요구되는 돌연변이의 선택에 관한 문헌인 Quant & Hynes, 1983; Donnenberg & Kaper, 1991에 기재된 방법을 이용하여 수행되었다. 먼저, phaZ 유전자에 가까운 ORFs를 포함하고, PhaCl 및 PhaC2 합성효소를 코딩하는 DNA를 GENEART AG (Germany)를 이용하여 합성하고, 이어서 Gm 및 SacB의 선별 마커를 포함하는 pJQ200SK 벡터 내로 클로닝하였다. 그 다음 상기 하이브리드 플라스미드를 삼친 교배(triparental mating)에 의해 PpU 10-33 균주 내로 도입하였다. 단일 크로스오버(single crossover)에 의해 염색체 내로 상기 플라스미드가 통합된 트랜스접합체(transconjugants)를 Gm -plus km 및 플레이트를 포함하는 Tel- 상에서 선택하였고 PCR에 의해 확인하였다. 이어서 두 번째 재조합의 결과로 삭제된 돌연변이를 10% 수크로즈를 포함하는 LB 플레이트 상에서 선택하고, Gm에 대한 감수성(sensitivity)을 기록한 후, 삭제(deletion)의 위치와 정도를 확인하기 위하여 PCR을 이용하여 추가 분석을 수행하였다. 이를 위하여, 상동 재조합(homologous recombination)을 위해 사용된 단편(fragment)의 외부 또는 내부의 어닐링(annealing)인 두 다른 프라이머 세트, 즉 PhaCl-check-F / PhaC2-check-R 및 RT-phaZ F_PpU / RT-phaZ R_PpU가 각각 사용되었다. 하나의 삭제 돌연변이를 선택하고 ΔphaZ PpU 10-33로 지정하였다. 상기 삭제 돌연변이의 보완성(complementation)을 위하여, phaZ 유전자(921 bp)를 PCR를 이용하여 증폭시키고(phaZ-F-KpnI lphaZ-R-XbaI) pBBRlMCS-5 벡터 내로 클로닝하였다. Gm 내성으로 트랜스접합체(transconjugants)를 선택하고 PCR에 의해서 추가로 확인하였다.
형광현미경검사(Fluorescence microscopy)
1.5 ml 에펜도르프 튜브 내에서 배양액 1 ml을 디메틸설폭사이드(dimethylsulfoxide, 0.25 mg ml-1) 존재 하에 나일 레드 용액(Nile red solution) 두 방울과 혼합한 후 6,500 rpm 및 4℃에서 5분 동안 원심분리 하였다. 펠릿(Pellets)을 2 ml MgCl2 (10 mM)로 두 번 세척하고, 500 ㎕의 상기 용액으로 재현탁하고 5-10 ㎕의 세포 현탁액을 현미경 슬라이드에 도말하였다. PHA 과립의 존재 및 형태는 Cy3 필터(EX BP 550/25, BS FT 570, EM BP 605/70) (ZEISS, Jena, Germany)가 장착된 ZEISS Axio Imager A1 에피플루오르센스 현미경(epiflourescence microscope) 및 AxloVision re1 4.6.3 소프트웨어(Zeiss Imaging solutions GmbH, Germany)를 이용하여 시각화하였고, 세포들을 1.1 초의 노출 시간에서 촬영하였다(Bassas et a I., 2009).
투과 전자 현미경법(Transmission electron microscopy)
박테리아를 4℃, 성장 배지 내에서 2% 글루타르알데히드(glutaraldehyde) 및 5% 포름알데히드(formaldehyde)로 고정하고 카코딜염산(cacodylate) 버퍼(0.1 M cacodylate, 0.01 M CaCI2, 0.01 M MgCI2, 0.09 M sucrose, pH 6.9)로 세척한 후 실온에서 한 시간 동안 1% 오스뮴수(aqueous osmium)로 오스뮴화(osmificate)하였다. 그 다음 샘플을 일련의 단계의 아세톤(10%, 30%, 50%, 70%, 90%, and 100%)으로 각 단계에서 30분 동안 탈수(dehydrate)하였다. 70% 아세톤 탈수 단계는 2% 우라닐 아세테이트(uranyl acetate)를 포함하고 하룻밤 동안 수행되었다. 샘플을 경질 레진(hard resin)을 위해서는 Spurr 식(Spurr formula)에 따른 에폭시 레진으로, 전자 현미경을 위해서는 배지를 포함하는 저점도 에폭시 레진으로 침투시켰다(Spurr, 1969). 순수한 레진(resin)을 이용한 침투를 며칠 동안 수행하였다. 초박절편(ultrathin sections)을 다이아몬드 칼로 잘라 우라닐 아세테이트(uranyl acetate) 및 납 시트레이트(lead citrate)로 대비염색(counterstaine) 한 후 80 kV의 가속 전압에서 TEM910 투과전자현미경(TEM910 transmission electron microscope, Carl Zeiss, Germany)으로 조사하였다. 이미지를 라인 레플리카(line replica)를 이용하여 보정 배율(calibrated magnifications)에서 얻은 후 ITEM-Software(Olympus Soft Imaging Solutions, Germany)가 장착된 Slow-Scan CCD-Camera(ProScan, 1024x1024, Scheuring, Germany)를 이용하여 전자적으로 기록하였다.
RNA 조작(RNA manipulations)
성장 단계(growth phase)(4 시간, 7 시간, 24 시간, 27 시간, 31 시간, 48 시간 및 55 시간)의 배양액으로부터 샘플(3 ml)을 취하여 즉시 같은 부피의 RNA 보호 버퍼(Qiagen, Germany)와 혼합하였다. 실온에서 5분간 배양한 후, 현탁액을 13,000 rpm에서 원심분리하고, 상등액을 제거하고 펠릿(pellets)을 -80℃에 보관하였다. 총 RNA를 DNA 가수분해효소(DNase) 처리를 포함하는 RNeasy mini kit (Qiagen, Germany)를 이용하여 제조사의 프로토콜에 따라 추출하였다. 최종적으로, RNA 분해효소(RNase)를 포함하지 않는 물 100 ㎕에 RNA를 용출시키고 이를 -80 ℃에 보관하였다. RNA의 무결성(integrity)을 포름알데히드 아가로스젤에서 전기영동(electrophoresis)을 이용하여 평가하고 농도 및 순도를 분광광도법(spectrophotometry)(Spectrophotometer ND-100, peQIab-biotechnologie GmbH, Germany)으로 측정하였다.
cDNA를 10 ㎍의 총 RNA 및 무작위 프라이머를 사용한 20㎕의 반응물(reactions)내에서 합성하였다. 모든 시약(Superscript III RT 포함)을 Invitrogen (USA)으로부터 구입하였고 제조사의 프로토콜에 따라 반응들을 수행하였다. Superscript III RT가 첨가되지 않은 샘플을 음성 대조로 사용하였다. cDNA 합성 후, 남은 RNA를 1 M NaOH를 이용하여 침전시키고 65 ℃에서 10분간, 이어서 25℃에서 10분간 배양하였다. 즉시, 상기 반응물을 1 M KCl로 평형화(equilibrate)시켰다. 결과물인 cDNA를 PCR 정제 키트(PCR purification kit, Qiagen)를 사용하여 정제하고 그 농도 및 순도를 분광광도계(Spectrophotometer)를 이용하여 측정하였다. cDNA를 DEPC 물(DEPC water)을 사용하여 100 ㎍ ㎕-1의 농도로 희석하고 4℃에 보관하였다.
상대적 RT-PCR 분석(Relative RT-PCR assay)
RT-PCR 분석(Eurofins mgw Operon, Germany)에 사용된 올리고뉴클레오티드를 Primer3 (http://frodo.wi.mit.edu/primer3/) 및 Oligo Calc (http://www.basic.northwestem.edu/biotools/oligocalc.html) 생물-정보학 도구(bio-informatic tool)의 도움을 받아 설계하였고 이는 첨부 2에 정리되어 있다. 각각의 세트를 유사한 G+C 함량(contents), 및 따라서 유사한 어닐링(annealing) 온도(약 60℃), 300 bp 이하의 앰플리콘 생성물 사이즈(amplicon product size)를 갖고, 예측되는 헤어핀 루프(predicted hairpin loops), 이중가닥(duplexes) 또는 프라이머-다이머(primer-dimmer)를 형성하지 않도록 설계하였다. 실험 설계는 MIQE 가이드라인을 따랐다(Bustin et al., 2009). 먼저, 프라이머 각 세트의 최적의 PCR 조건을 분석하고, 템플릿(templates)으로서 샘플의 기준 세트(genomic DNA)를 이용하여 어닐링(annealing) 온도 및 프라이머 농도를 확립하였다. 프라이머 특이성은 용융 곡선 분석(melt curve analysis) 및 앰플리콘 밴드(amplicon bands)의 젤 시각화(gel visualization)로 측정하였다. 프라이머 효율(efficiency)은 cDNA 풀(pool)을 이용하여 측정하였고 표준 곡선(standard curve)을 수행하기 위해 5회 동안 4배 계열 희석(serial 4-folds dilutions) 시리즈가 수행되었다. 표준 PCR 프로토콜을 각 희석마다 세 번씩 수행하였다. 모든 경우에, 효율은 89% 와 100% 사이의 범위에서 측정되었다. 이 분석을 위해 CFX96 real-time PCR detection system(Bio-Rad, USA) 및 CFX Manager software(version 1.5.534.0511, Bio-Rad)가 사용되었다. 데이터 정규화(normalization)를 위한 적절한 참조 유전자(reference genes)의 선택은, 좋은 변이도(coefficient variance) 값 및 약 0.5-1의 M 값을 고려하여, CFS 소프트웨어에 존재하는 geNorm 방법을 이용하고, 다른 실험 조건 및 시전 간의 대상의 안정성을 고려하여 수행하였다. "하우스키핑(housekeeping)" 유전자(rpsL)를 포함하는 몇몇 후보 유전자, 일반 대사(general metabolism)와 관련되거나(gltA , gap-1, proCl, proC2), 세포 분열과 관련되거나(mreB, ftsZ) 또는 신호전달 기능(ffH)과 관련된 다른 것들을 시험하였고, 최종적으로, gltA 및 proC2를 참조 유전자(reference genes)로 선택하였다. 상대적인 RT-PCR(relative RT-PCR)을 위해서, 실험을 세 번씩 수행하였고, 데이터 정규화(data normalization)를 위하여 각 플레이트마다 항상 내부 교정기를 포함하였다. cDNA가 포함되지 않은 샘플을 음성 대조로 사용하였다. 12.5 ㎕의 iQ™ SYBR Green Supermix (2x) (Bio-Rad, USA), 1 ㎕ 포워드 프라이머(forward primer)( 10 μM ), 1 ㎕ 리벌스 프라이머(reverse primer)( 10 μM ), 2 ㎕ cDNA(1 /10 희석)을 포함하는 PCR 반응물(reactions)을 milliQ water를 사용하여 20 ㎕가 되도록 제조하였다. PCR 사이클링(cycling) 조건은 다음과 같다: 50 ℃/ 2분 및 95℃/ 10분, 뒤이은 40 사이클의 95℃/15초 - 60℃/30초 - 72℃/30초, 최종 연장(extension)단계는 72℃/ 10 분. 각 사이클의 끝에서 형광(fluorescence)을 측정하였다. 용융 곡선(melting curve)을 위해, 초기 변성 단계를 95℃/ 10분으로 설정하고, 65℃에서 시작하여 95℃까지 0.5℃/5초씩 온도를 상승시키고 신호 획득(signal acquisition)을 계속하였다. 대상 유전자의 상대적인 발현 비율은 평균 표준 오차와 정규화된 표현 방법(ΔΔ(Ct))을 사용하여 CFX 소프트웨어(Bio-Rad, USA)로 자동적으로 계산되었다. 값의 표현은 정규화된 증가 배율로 표현된다.
PHA 생산을 위한 배양 조건(Culture conditions for PHA production)
3-메틸벤조에이트(3-methylbenzoate, 3-MB)는 T7 중합 효소(T7 polymerase)를 유도하여 결과적으로 phaC2 합성효소의 발현을 자극하는 Pm 프로모터에 의한 XylS 전사 활성체(transcriptional activator)의 활성을 위한 유도제(inducer)로서 사용되었다. PpU 10-33 내에서 phaC2 발현/PHA 합성을 위한 최적의 조건을 정하기 위하여, 3-MB의 농도(0.2 내지 3 mM), 유도 시간(OD550nm 0.4 - 1.5), 및 탄소 공급원의 농도가 다른 조건에서 배양하였다. 0.1% 효모 추출물, 15 mM 소듐 옥타노에이트(sodium octanoate) 및 적당한 항생제가 첨가된 400 ml MM 변형 배지(Martinez-Bianco et al, 1990)를 포함하는 엘렌마이어 플라스크들(2 liter)에 20 mM 숙신산(succinate)이 포함된 MM 아가 배지 상에서 하룻밤 동안 30 ℃에서 배양한 세포 현탁액을 접종하였다. 플라스크들을 30 ℃의 회전식진탕기(rotary shaker)(INFORS AG, Switzerland) 내에서 180 rpm으로 배양하였다. 배양액이 약 0.8 OD550nm에 다다르면, 그 배양액을 둘로 나누고(1 리터 엘렌마이어 플라스크에 200 ml씩), 하나의 플라스크의 최종 농도가 0.5 mM가 되도록 3-MB를 첨가하였다. 동시에 소듐 옥타노에이트(sodium octanoate)(20 mM)의 두 번째 펄스(pulse)를 첨가하였다. 야생형 대조 균주를 위하여, 상기 과정을 유도(induction)를 제외하고 동일하게 수행하였다. 샘플을 24시간 마다 회수하고 바이오매스(CDW, 세포 건조 무게), PHA, OD550nm, 나일 레드 염색 및 NH4 + 농도를 측정하였다. CDW를 측정하기 위하여, 샘플을 80 ℃에서 24시간 동안 건조시키고 종래 배양액의 g/l로 표현하였다.
PHA 추출 및 정제(PHA extraction and purification)
배양 샘플을 4 ℃에서 15분 동안 6,500 ×g에서 원심분리하고(Allegra 25R, Beckman Coulter, USA), 펠릿(pellets)을 증류수로 두 번 세척한 후 -59 ℃ 및 0.140 mbar에서 동결건조(lyophilize) 시켰다(Lyophilizer alpha 1-4 LSC, Christ, Germany). PHA 생산을 모니터하기 위해 5 ml 샘플을 성장단계(growth phase)가 되도록 하고 이를 상기와 같은 방법으로 동결건조 하였다. 동결건조된 바이오매스(biomass)를 상기(Basas-Galia et al, 2012)한 바와 같이 80 ℃에서 3 시간 동안 10 ml의 클로로포름으로 추출하였다. PHA 함량(중량%)은 PHA에 의해 표현되는 CDW의 백분율로 정의된다.
NMR 분석(NMR analysis)
1H-NMR 분석을 위해서, CDCl3 0.7 ml에 5-10 mg의 중합체(polymer)를 용해시키고 5-10 mg의 중합체(polymer)를 13C 스펙트럼(spectra)을 기록하기 위하여 사용하였다. 1H 및 13C NMR 스펙트럼은 용매인 CDCl3의 중수소 공명(deuterium resonance)에 고정된 Bruker DPX-300 NMR 분광광도계(Spectrometer)로 300K에서 기록되었다. 화학적 이동(Chemical shift)은 용매의 신호에 대하여 ppm으로 주어지고(lH : 7.26, 13C 77.3) 커플링 상수는 Hz로 주어진다. Standard Bruker 펄스 프로그램(pulse programs)을 사용하였다.
PHA의 분자량 검출(Detection of Molecular weights of PHA)
평균 분자량을 Styragel HR5E 칼럼 및 2414 시차 굴절류률 검출기(2414 differential-refractive index detector)(Waters, USA)가 장착된 HPLC 시스템(Waters 2695 Alliance separations Module) 내에서 젤투과 크로마토그래피(에 gel permeation chromatography, GPC)의해 측정하였다. 테트라히드로퓨란(Tetrahydrofuran, THF)을 45 ℃ 및 유량 0.5 ml min-1 에서 용리액으로 사용하였다(등용매용리, isocratic). 샘플 농도 및 주입 용량(injection volume)은 각각 0.5 mg ml-1 및 50 ㎕ 였다. 검량선(calibration curve)을 10,000-700,000 g mol-1의 Mw 범위 내에서 폴리스티렌 표준 키트(polystyrene standards kit, Fluka)를 이용하여 얻었다.
PHA의 열적 특성(Thermal properties of PHAs)
미생물 폴리에스테르(microbial polyesters)의 열적 특성(thermal properties)은 분석을 위해 정제된 10-20 mg의 중합체(polymer)를 이용하여 시차주사 열량측정법(differential scanning calorimetry, DSC)에 의하여 측정하였다. DSC 분석은 DSC-30(Mettler Toledo Instruments, USA)을 이용하여 수행하였다. 알루미늄 팬 위에 샘플을 놓고 질소 존재 하에 (80 ml/min) 10 ℃ min-1로 -100 ℃ 부터 400 ℃까지 가열하였다. 모든 데이터를 STARe System 수집 및 처리 소프트웨어(STARe System acquisition and processing software, Mettler Toledo)로 수득하였다.
실시예 1: 슈도모나스 푸티다 U(
Pseudomonas putida
U) 내에서
phaC2
의 과-발현
(i) 특정 mini-Tn5, pCNBlxylS/Pm:: T7pol, XylS-3-메틸벤조에이트(3-MB)-조절된 프로모터 Pm으로부터 발현하는 T7 중합효소(polymerase); 및 (ii) T7 중합효소(polymerase)로부터 PhaC2를 발현하는 하이브리드 pUT-miniTn5-Tel 유도체(derivative)으로 이루어진 PpU PhaC2 합성효소를 위한 이분된(bipartite), 미니-전이인자-기반 과-발현 시스템(mini-transposon-based hyper-expression system)을 설계하였다(도 3 참조). 두 개의 미니 전이인자(minitransposon) 부분은 각각 그리고 무작위적으로 P. 푸티다 U(P. putida U, 이하 "PpU") 염색체 내로 삽입되었다. 최고의 PHA 생산자를 세포 단백질의 SDS-PAGE 분리에 의한 PhaC2 생산의 반-정량(semi-quantification) 및 나일 레드-염색 세포(Nile Red-stained cells)의 형광 현미경(fluorescence microscopy)에 의한 PHA 과립 형성의 검사와 관련된두 번의 스크리닝 후에 선택하였다. 이 균주는 PpU 10-33로 지정되었다.
다음에서 NI는 비-유도된(non-induced) 배양균을 의미하고 I는 0.5 mM의 3-LB로 유도된(induced) 세포를 의미한다. 재조합 균주 PpU 10-33 내의 PHA 함량에 있어 phaC2의 투여량의 영향을 분석하였다. 배양균을 두 번에 걸쳐 각각 15 mM 및 20 mM의 소듐 옥타노에이트(sodium octanoate) 펄스가 주어진(두 번째 펄스는 유도(induction) 시에 주어졌다) 변형된 MM 내에서 배양하였다. 바이오매스(biomass) 생산 피크는 PpU 및 PpU10-33 균주 모두에서 48시간 이후에 나타났다(각 3.1 및 3.2 g 1-1 CDW). 상기 결과를 표 1에 나타내었다:
[표 1] PpU, PpU 10-33 및 PpU 10-33-ΔphaZ 균주의 바이오매스 수율(Biomass yields)
3-MB에 노출된 세포는 야생형 및 비-유도된 세포(24.4 % 및 34.6%)와 비교하여 배양 초기 24 시간 동안 더 많은 양의 PHA(44 %)를 축적할 수 있었다. 상기 결과를 아래 표 2 및 도 4에 나타내었다.
[표 2] 비유도(NI) 및 유도(I) PpU, PpU 10-33 및 PpU 10-33-ΔphaZ 균주의 PHA 수율(PHA yields)
35 mM의 소듐 옥타노에이트(sodium octanoate)를 포함하는(15 및 20 mM의 두 번의 펄스가 주어진) 변형된 MM 내에서 배양균을 배양하고 이를 O.8의 OD550nm에서 0.5 mM 3-MB로 유도하거나(I), 또는 유도하지 않았다(NI).
과발현 균주에서의 PHA 수준은 24 시간에서 모 균주(parental strain)의 그것에 비해 약 50% 이상 높았으나 48 시간에서는 모균주의 PHA 수준보다 약 25% 낮았고 72 시간에서는 유사했다. 이는 PhaC2의 증가가 PHA를 일시적으로 증가시키고, 이어서 수준이 정상화될때까지 탈중합 활성(depolymerization activity)의 증가를 유발함을 의미한다. 중요한 것은, 세포 세포 건조 중량(중량%)의 PHA 비율(percentage)이 48 시간 이후 PpU의 경우 35 중량%에서 7 중량%로, PpU 10-33 유도 배양균의 경우 39 중량%에서 15 중량%로 급격히 떨어졌다는 것이다.
또한 24 시간에서 야생형 균주에 비해 비-유도 배양균 PpU 10-33가 50% 증가된 PHA 축적을 보이는 이유는 조사하지 않았으나, T7 프로모터의 누출(leakiness)이 영향을 미쳤을 것이라 추정된다(또한 RT-PCR 결과에 의해서도 나타남). 최고 바이오매스 수준인 PpU 경우의 3.07 g l-1 및 PpU 10-33 경우의 2.67 g l-1(비유도, NI) 및 2.73 g l-1(유도, I)(도 1A, 표 1), 및 최고 PHA 축적 수준인 각각 1.08 g l-1, 0.74 g l-1 및 1.07 g l-1(도 4, 표 2)은 두 균주의 배양 48 시간 이후에 도달하였다. 48 시간 이후, 바이오 메스 및 PHA 수준은 떨어졌고, PHA 수준은 바이오매스의 수준보다 더욱 크게 감소 또는 하락하였다. PpU 10-33 균주는 거의 모든 샘플링 시간에서 바이오매스의 비율(percentage)로 표현된 더 높은 PHA의 수율을 나타냈다. PpU의 24 중량% 및 유도된 PpU 10-33 세포의 35 중량%에 비해, 본 발명에서 측정된 가장 높은 PHA 수율인 44 중량%는 24 시간의 유도된 PpU 10-33 세포에서 얻어졌다(표 2). 48 시간에서, 최고의 바이오매스 수율이 얻어지는 경우에, 최고의 절대 수율은, PpU의 35 중량% 및 유도된 PpU 10-33 배양 균주의 40 중량%와 비교하여, 세포 건조 중량(cellular dry weight, CDW)의 41%가 비유도된 PpU 10-33 세포로부터 얻어졌다. 따라서, 유도(induction)의 효과는 상대적으로 젊은 배양균 내에서 주로 보인다. 중요한 것은, 48 시간 이후에 PHA의 비율이 PpU의 경우 7 중량%로, PpU 10-33의 경우 15-22 중량%로 급격히 떨어진다는 것이다.
실시예 2: PHA 생산에 있어 ΔphaZ 돌연변이(mutation)의 영향
PpU 10-33-phaZ로 지정된 PpU 10-33 균주의 phaZ 삭제 돌연변이를 PHA 축적을 위해 제조하고 이후 평가하였다. 도 4 및 표 2에 나타낸 바와 같이, 돌연변이 배양균주는 더 높은 PHA 수준(62 중량%)을 나타내었고, PhaZ-생산 균주에서의 상황과는 대조적으로 이러한 수준이 적어도 배양 96 시간까지 유지되었다. 따라서, ΔphaZ 넉아웃(knockout) 표현형(phenotype)은 PhaZ 탈중합효소(depolymerase)가 세포 내에서 PHA 의 축적 및 유지의 주요한 결정자(determinant)임을 나타낸다.
관련 실시예: ΔphaZ-PpU10-33 돌연변이의 보완성(complementation)
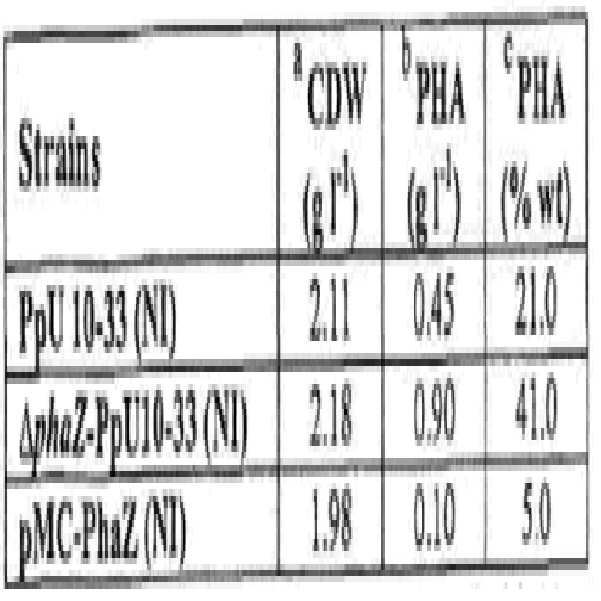
phaZ 유전자 돌연변이를 관찰된 표현형(phenotype)과 인과적으로 연관시키고 pha 클러스터(pha cluster)의 발현에 대한 간접적인 영향을 제거하기 위하여, phaZ 유전자를 PCR을 이용하여 증폭하여, pBBR1MCS-5 플라스미드 벡터에 클로닝하고, PpU 균주 내로 도입하였다. 보완된 돌연변이(complemented mutant)인 PpU 10-33-ΔphaZpMC-phaZ, 지정된 균주 pMC-phaZ 내에서의 PHA 생산 및 유지를 평가하였다. 표 3은 소듐 옥타노에이트(sodium octanoate)(20 mM)를 포함하는 변형된 MM 에서 44시간 동안 배양 후, PpU 10-33 균주, 그것의 phaZ 삭제 돌연변이 및 보완된 유도체(complemented derivative)의 바이오매스 및 PHA 수율을 보여준다.
[표 3] 축적의 PHA 수율에 대한 영향. PhaZ의 구조 및 결함의 보완.
상기 세 균주에 대한 바이오매스 수율은 약 2 gl-1로 유사하였던 반면에 PHA 수율은 PpU 10-33 균주에서는 21 중량%, 그것의 돌연변이에서는 41 중량% 및 보완된 균주(complemented strain)에서는 5 중량%였다. 보완된 균주(complemented strain)에서 PHA의 수준이 야생형보다 낮은 것은 다중 복제 벡터(multicopy vector)에 위치하는 보완적 유전자(complementing gene)로부터 발생되는 더 높은 세포 탈중합효소(cellular depolymerase)의 수준을 반영하는 것으로 추측된다.
중합체 특성(Polymer characteristics)
PhaC2 중합효소(polymerase)의 과발현 및 PhaZ 탈중합효소(depolymerase)의 불활성화는 정상 세포 화학량(normal cellular stoichiometry) 및 PHA 단백질과 그것과 연관된 단백질의 활성에서의 변화를 동반할 수 있으므로, 표현형(phenotypes)에서의 다른 변화는 이러한 유전적 조작(manipulations)으로부터 발생할 수 있다. 이러한 가능성을 평가하기 위하여, 다른 구조의 세포 내 PHA 과립의 미세구조(ultrastructure)를 투과 전자 현미경(transmission electron microscopy, TEM)를 이용하여 비교하였다. 도 1은 PpU 야생형 균주(도 1A-C)가 세포질 내에 균일하게 분포된 세포 당 하나 또는 두 개의 PHA 과립을 포함하는 반면, PpU 10-33 phaC2 과발현 균주(도 1D-F)는 더 작은 과립들이 융합된 형태를 나타내는 하나의 주요한 과립을 포함하는 경향이 있음을 보여준다. 이것은 특히 중간 지수 성장 단계(mid-exponential growth phase) 동안 유도된 배양 균주(induced cultures) 내에서 매우 확실하다. phaZ 삭제 돌연변이는 여러 개의 과립을 가지는 경향을 보였는데, 그것들 중 일부는 과립 융합(granule fusion)을 나타내는 불규칙한 경계를 가지고 있다(도 1G-I). 또한 현미경 분석으로 도 4에 나타난 결과, 즉 PpU 및 PpU 10-33 균주 내에 축적된 세포내 PHA가 배양 48 시간 이후 감소하기 시작하는 반면, 탈중합효소(depolymerase)가 결여된 돌연변이에서는 실험의 종료시까지 축적된 PHA가 유지됨을 확인하였다.
PpU 의 두 PHA 합성효소(synthases)가 약간 다른 기질 특이성(substrate specificities)을 가지는, 즉 PhaC2는 3-히드록시헥사노일(hydroxyhexanoyl)-CoA에 선호도를 나타내고, PhaCl은 3-히드록시옥타노일(hydroxyoctanoyl)-CoA에 편향되는 경우에(Arias et al., 2008),, PpU 10-33 내에서 PhaC2 합성효소의 과발현은 단량체 조성(monomer composition) 및/또는 생산된 중합체의 물리화학적 특성을 바꾸는 것이 가능했다. 표 4는 소듐 옥타노에이트(sodium octanoate)에서 배양한 동안 PpU, PpU 10-33 및 그것의 phaZ 삭제 돌연변이에 의해 생산된 PHA 가 NMR에 의해 확인된 바와 같이, 3-히드록시옥타노에이트(3-hydroxyoctanoate, 91.4-92.5% mol) 및 3-히드록시헥사노에이트(3-hydroxyhexanoate, 7.5-8.6% mol)로 조성된 P(3-히드록시옥타노에이트-코-3-히드록시헥사노에이트(P(3-hydroxyoctanoate-co-3-hydroxyhexanoate))의 공중합체(copolymers)인 유사한 조성물을 가짐을 보여준다.
[표 4] 다른 균주의 PHA의 물리화학적 특성
중합체(Polymers)는 옥타노에이트(octanoate) 35 mM을 포함하는 변형된 MM(15 mM 및 20 mM 두 번의 펄스가 주어진)에서 배양된 PpU, PpU 10-33 및 PpU 10-33-ΔphaZ의 비유도(NI) 및 유도(I) 세포로부터 얻었다.
a평균 분자량의 수; b평균 분자량의 무게;
c다분산 지수(polydispersity index)(Mw/Mn); d용융 온도; e융합의 엔탈피(enthalpy of fusion);
f분해 온도(decomposition temperature); 3-HHx = 3-히드록시헥사노에이트(Hydroxyhexanoate); 3-HO = 3-히드록시옥타노에이트(hydroxyoctanoate)
또한, 세 중합체(polymers)의 유리 전이 온도(glass transition temperature)인 Tg -35.9 to -40.8℃는(표 4), 중간 사슬 길이-PHA(medium chain length (mcl)-PHAs)에 대해 이전에 기술된 Tg와 일치하였고, 그것들은 유사한 용융 온도(melting temperatures)(Tm, 59-61 ℃)를 가지고 유사한 결정화도 등급(crystallinity grades)을 나타냈다.
그러나, 중합체는 길이에 있어 차이가 있다: PpU 모균주(parental strain) 및 PpU 10-33 (PhaC2 합성효소 과발현 구조)로부터 얻은 중합체의 분자량(Mw 및 n 값)은 각각 126-142 및 74-77 kDa의 범위로 유사하였으나, PhaZ 넉아웃(knockout) 균주로부터 얻은 것들은 각각 96 및 50 kDa으로 상당히 짧았다.
상대적 RT-PCR에 의한 PpU, PpU 10- 33 및 PpU10-33-ΔphaZ에서의 pha 오페론(operon)의 전사 분석(transcriptional analysis)
PHA 전환(turnove)과 phaC2의 과발현 및 phaZ 비활성화 사이의 관계를 조사하기 위하여, 세 균주에서 pha 클러스터(도 2)에 대하여 상대적 RT-PCR(relative RT-PCR)를 이용하여 전사 분석을 수행하였다. RT-PCR 데이터 정규화를 위한 참조 유전자(reference genes)로는 gltA 및 proC2를 이용하였다.
야생형에서, 최초 24 시간 배양 동안 두 개의 PHA 합성효소, PhaCl 및 PhaC2의 전사 수준(transcript level)에서의 큰 변화는 감지되지 않았고(P > 0.1), 이것은 PHA 축적의 꾸준한 증가를 동반하였다. 그러나, phaZ 전사의 두 배 증가(P < 0.001)가 PHA 생산의 시작에 해당하는 4 시간에서 측정되었고, 이후 낮은 수준로 떨어졌다. PHA 축적의 최대 수준과 관련있는 48 시간에서, phaCl의 신속하고 상당한 증(4.5-배, P < 0.0001)가가 관찰되었고, 동시에 phaZ 전사 활성에서 6 배의 증가(P < 0.001)가 관찰되었다. 이후 이것은 PHA 함량(도 2), 및 phaCl 및 phaZ 전사 수준(transcript levels)의 급격한 감소로 이어졌다. 이러한 결과들은, 한편으로는 phaCl 전사 및 PHA 축적, 다른 한변으로는 phaZ 전사 및 PHA 가동화(mobilization)의 미세하게 조정된 커플링(coupling)을 나타낸다.
PpU 10-33 균주의 경우에, phaC2 유전자의 발현은, 예측한 바와 같이, 배양 기간 동안(P < 0.008) 및 특히 48 시간에 피크(peak)일 때(3.5-배 증가, P < 0.0001) PpU 모균주(parental strain)에서보더 더 높게 나타났다. 흥미롭게도, 이 균주에서 phaC1의 발현은 PpU, 특히 유도된 배양 균주보다 대부분 7 시간, 24 시간 및 48 시간에서 더 낮았으며, 이는 phaC2의 과발현이 phaC1의 발현에 부정적인 영향을 미친다는 것을 나타낸다(도 2). 그러나, 비록 phaC2의 과발현이 phaC1의 발현 감소를 초래하였음에도 불구하고, 결합된 세포 합성효소 활성(combined cellular synthase activity)은 PHA 생산의 증가를 가져왔다. PpU 10-33에서의 phaZ의 전사 수준은 24 시간에서 더 높았던 것을 제외하면 모균주(parental strain)에서의 그것과 유사한 경향을 보였고, 이는 phaC2의 더 높은 수준의 발현과 연관이 있으며, 또한 그것이 더 높았던 48 시간 보다 더 오래된 배양 균주에서 더 높은 PhaC2 및 PHA 수준과 일치한다. 따라서, PhaC2 중합 효소 및 탈중합 효소 합성 사이에 또한 강한 커플링이 있다. PpU 10-33-DphaZ 균주에서, 야생형과 비교하였을 때 배양 기간 동안 상당히 더 높은 phaC2의 전사 수준이 관찰되었고(P 0.0005-0.017), 이는 얻어진 더 높은 PHA 수율(60 중량% 내지 66 중량%, 도 4 참조)과 일치한다. 또한 phaC1의 경우에도 24 시간 및 38 시간에서 더 높은 수준이 측정되었는데, 이는 단지 phaC2가 유도된 경우에만 측정되었다(P < 0.0017). 따라서, phaZ의 비활성화는 합성된 PHA의 전환(turnover) 및 재생(recycling)을 방지할 뿐만 아니라 PHA 중합효소의 높은 전사 수준을 허용한다.
PpU 균주로부터 PHA 회수(recovery)를 위한 용매 추출 방법
변형된 PpU 균주에서 생산된 PHA의 추출 조건을 클로로포름(chloroform), 디클로로메탄(dichloromethane) 및 아세톤(acetone)으로부터 선택된 다른 용매 시스템에서 조사하였다. 추출을 두 가지 다른 온도, 실온(RT) 및 80 ℃, 및 세 번의 추출(30 분, 1 시간, 3 시간 및 18 시간)을 이용하여 수행하였다. 본 실험에 사용된 동결 건조 세포는 P. 푸티다 U 및 그것의 유도체을 위한 표준 배양 조건에 따라 얻었다: 세 균주를 200 ml의 배지를 포함하는 1L 플라스크 내에서 기질로 옥탄산(octanoic acid, 10+20 mM)을 이용하여, MM+0.1%YE 내에서 72 시간 동안, 30 ℃ 및 200 rpm에서 배양하였다. 돌연변이 균주(PpU 10-33 및 PpU 10-33-ΔphaZ)는 유도되지(induced) 않았다. 40 mg 동결건조 바이오매스 샘플을 추출 튜브에 넣고 적당한 용매로 재현탁한 후 상기한 다른 조건 하에서 추출하였다. PHA의 회수율(Percentages of PHA recovery)은 동결건조 바이오매스 초기 40 mg에 대한 것을 나타낸다(표 5). 클로로포름을 사용한 전통적인 추출(3 시간 및 80 ℃)을 대조로 사용하였다.
[표 5] 다른 용매, 추출 시간 및 온도에서의 PHA 회수율(중량%)
결과는 세 번의 평균±표준편차이다. CH2CI2: 디클로로메탄(dichloromethane) 및 CHCl3: 클로로포름(chloroform)
PpU 10-33-ΔphaZ에서 조건들 간에 어떤 중대한 차이도 관찰되지 않았고 PHA 회수율은 56 내지 59 중량% 의 범위를 가졌다. 그러나, PpU(야생형) 및 단일 돌연변이에서는, PHA의 회수율이 아세톤을 용매로 사용한 경우 21-28 중량% 사이였던 반면, 다른 용매에 대해서는 회수율이 약 31-34 중량%였다.
균주 사이에 어떤 차이가 있는지를 평가하기 위하여, 대조 조건(클로로포름, 3 시간 및 80 ℃)에 대해 PHA 회수율이 최대(100%)였다고 가정하고, 상대적인 PHA 회수율을 계산하였다. 추출용매로 클로로포름을 사용한 경우에, 어떤 균주에서도 중대한 차이는 관찰되지 않았다. 그럼에도 불구하고, 상대적 PHA 회수율은 ΔphaZ 돌연변이(96-98 상대%)에서 조금 더 높았던 반면에, 야생형 및 단일 돌연변이에 대해서는 회수율이 약 91-93 상대% 였다.
유사한 행태가 용매로 디클로로메탄(dichloromethane)을 사용한 경우에 관찰되었다. ΔphaZ 돌연변이는 96-100 상대%의 상대적 PHA 회수율을 보인 반면, 다른 두 균주는 93-96 상대% 사이의 상대적 PHA 회수율 값을 보였다.
아세톤을 용매롤 사용한 경우에, 가장 중요한 차이를 관찰할 수 있었다. 테스트된 용매 중에서, 아세톤은 가장 친환경적인 용매인 동시에 또한 최소의 추출 용량(extraction capacity)을 가진 용매이다. 이 후자의 측면은 이중 돌연변이(double mutant, PpU 10-33-ΔphaZ)와 다른 두 균주(PpU 및 PpU 10-33) 사이의 PHA 회수율의 차이를 해명하기 위한 열쇠가 되었다.
ΔphaZ 돌연변이는 97-98 상대%의 가장 높은 회수율을 보여주었다. 놀랍게도 3 시간 또는 18 시간 추출 후에 차이점은 발견되지 않았는데, 이는 3 시간의 추출이 충분하다는 것을 나타낸다. 대조적으로, 다른 두 균주(PpU 및 PpU 10-33)에서는, PHA 상대회수율이 3 시간 추출 이후에 각각 64 상대% 및 74 상대%로 급격히 감소했다. 이러한 회수율은 18 시간 추출 이후에는 야생형 및 단일 돌연변이에 대해서는 각각 76 상대% 및 78 상대%로 어느 정도 증가하였다.
아세톤을 용매로 사용하여 짧은 시간 추출(30 분)한 경우, 야생형(PpU) 및 단일 돌연변이(PpU 10-33)에 대해 50-55 상대%이고 이중 돌연변이(double mutant, PpU 10-33-ΔphaZ)에 대해 86 상대%인 가장 큰 차이를 보인 놀랄만한 결과가 얻어졌다. 따라서, 균주들이 가장 현저한 차이를 나타냈던 용매는 아세톤이고, 이중 돌연변이(double mutant, PpU 10-33-ΔphaZ) 균주가 가장 높은 상대적 PHA 회수율을 나타냈다.
따라서, PpU 10-33-ΔphaZ 균주에 대해 아세톤은 PHA 회수 과정에서 클로로포름을 대체할 우수하면서도 친환경적인 대안 용매임을 보여준다. 또한, 그 결과는 세포 형태, 즉 PHA 과립 융합에 의해 효과가 크게 촉진됨을 나타낸다.
PpU 10-33-ΔphaZ의 기질 의존 PHA 생산의 최적화(Optimization of substrate dependant PHA production of PpU 10-33-ΔphaZ)
조작된 균주를 초기에 세 가지 다른 배지(E2, MM+0.1%YE 및 C-Y(2N))에서 배양하였고, 여덟 가지 다른 기질(헥사노에이트(hexanoate,C6), 헵타노에이트(heptanoate, C7), 옥타노에이트(octanoate, C8), 데카노에이트(decanoate, C1O), 10-운데카노에이트(10-undecenoate, Cll:l), 올레산(oleic acid), 리놀레산(linoleic acid) 및 글리세롤(glycerol))을 테스트하였다. 배지는 다음의 조성물을 포함한다;
1. Vogel & Borner (1956, 3, Biol. Chem. 218: 97-106)에 의해 기술된 E2 배지.
2. Martinez-Blanko et al. (1990, J, Biol. Chem, 265; 7084-7090)에 의해 기술된 MM 배지 + 0.1% 이스트 추출물.
3. Choi et al. (1994, Appl, Environ, Microbiol. 60: 3245-3254)에 의해 기술된 통상의(regular) 또는 두배 (C-Y(2N)) 질소 농도(0.66 및 1.32 g/l (NH4)2SO4)를 가지는 C-Y 배지.
최상의 결과는 MM+0.1%YE 및 C-Y(2N) 배지에서 얻어졌고, 따라서 키네틱 생산 연구(kinetic production studies)를 여덟 가지 기질을 사용하고 P. 푸티다 U 야생형(PpU)을 대조로 사용하여 수행하였다. 샘플을 바이오매스 및 PHA 생산을 측정하기 위하여 매 24 시간마다 모든 균주/배지/기질 조합에서 취하였다. 표 6에 회수 시간 뿐만 아니라 테스트된 다른 배양 조건에서 PHA 생산에 관한 최상의 생산 수율이 집계되어 있다.
[표 6] 두 다른 배지, MM+0.1%YE and C-Y(2N)에서 배양된 P. 푸티다 U (PpU) 및 조작된 균주 PpU 10-33-ΔphaZ에서 얻어진 바이오매스 및 PHA 생산수율
C6: 헥사노에이트(hexanoate); C7: 헵타노에이트(heptanoate); C8: 옥타노에이트(octanoate0; C1O; 데카노에이트(decanoate); C11:1: 10-운데세노이트(10-undecenoate).
테스트된 대부분의 기질에서, PHA 생산은 야생형에서보더 조작된 균주에서 더 높았고, 6 % 에서 300 %의 범위까지 증가되었다. PpU 10-33-ΔphaZ는 탄소 공급원으로 헥사노에이트(hexanoate) 또는 10-운데세노이트(10-undecenoate)를 포함하는 두 배지에서 배양된 경우에 부족한 중합체(polymer) 생산을 보였다. 대조적으로, PpU 10-33-ΔphaZ가 기질로 데카노에이트(decanoate)를 사용하여 C-Y(2N)에서 배양된 경우에 PHA 생산이 상당히 증가하였음이 관찰되었고, 주로 동일한 탄소 공급원을 포함하는 MM+0.1%YE에서 얻어진 PHA-수율이었다. 이중 돌연변이(double mutant)는 C-Y (2N)에서 배양된 경우에 24 시간에서 2.48 g/L (53.0 중량%)까지 PHA를 축적할 수 있었던 반면에 M+0.1%YE에서는 1.21 g/L (48.6 중량%)의 PHA를 생산하기 위하여 72 시간이 걸렸다. 대조적으로 유사한 생산 수준은 PpU 10-33-ΔphaZ를 옥타노에이트(octanoate)를 이용하여 배양한 경우 얻어졌고, 두 가지 배지에서 1.82-1.86 g/L (55.0-56.0 중량%)의 PHA 생산에 도달하였다.
일반적으로, 글리세롤, 올레산 및 리놀레산에서의 최대 PHA 생산은 더 긴 뱅양 시간을 필요로 했다. 글리세롤의 경우에, 돌연변이의 PHA 축적은 야생형(21-23 중량% vs. 8-15 중량%, 각각)에 비해 더 높았다. 올레산 및 리놀산 기질이 일반적으로 더 높은 PHA 축적률(35-42 중량%)을 가능하게 함에도 불구하고, 올레산 및 (부분적으로) 리놀산에서 유사한 패턴이 관찰되었고, 야생형(8-15 중량%)과 비교하여 상당한 증가가 있었음에도 불구하고, 다른 기질 테스트와 비교하여 더 낮은 PHA 생산을 보였다.
PpU 10-33-ΔphaZ 균주는 MM+0.1%YE/옥타노에이트(octanoate), MM+0.1%YE/올레산(oleic acid) 및 C-Y (2N)/데카노에이트(decanoate)에서 배양된 경우에 가장 높은 PHA 수율을 보였다. 이러한 세 가지 배지/기질 조합은 PHA 생산을 향상시키기 위하여 소규모(small-scale)(5L) 벤치(bench)에서 탑 생물 반응장치(top bioreactors)까지 확장하기 위한 우수한 후보들이다.
항생제 압력의 부재 하에서 PHA-생산의 조사(Investigation of PHA-production in the absence of antibiotic pressure)
프로세스의 확장을 용이하게하고 발효(fermentation)의 비용을 절감하기 위해서, 항생제 압력(antibiotic pressure) 하에서 돌연변이 균주의 유지를 연구하였다. 조작된 균주는 일반적으로 리팜피신(Rifampicin, Rf), 카나마이신(Kanamycin, Km) 및 아텔루루산염(Tellurite, Tell)의 존재 하에 보존되었다. 배양액 내에 아텔루루산염(Tellurite, Tell) 및 그것의 산화물의 존재는 바이오매스 측정 및 회수에 영향을 주도록 액체 배지를 어둡게 만든다. 따라서, 다음의 연구에서 항생제는 배양물로부터 제외되었다. 아텔루루산염(Tellurite)을 포함 및 포함하지 않는 배양물을 가지고 생산 수율에 대한 그것의 영향을 평가하였다. 그 연구는 어떤 변화도 감지되지 않았음을 보여 주었다. 또한, 바이오매스 및 중합체(polymer) 생산에서 리팜피신 및 카나마이신의 존재의 영향을 연구하기 위하여, 야생형 및 조작된 균주를 옥타노에이트를 기질로 사용한 미네랄 배지 MM+0.1%YE에서 배양하였고, 이 때 야생형에 대해서는 항생제 리팜피신을, 조작된 균주에 대해서는 리팜피신+카나마이신 조합의 항생제를 사용 및 비사용하였다. 이러한 연구의 결과를 도 5에 나타내었다.
바이오매스 및 중합체(polymer) 생산에서 어떤 차이도 관찰되지 않았는데, 이는 항생제의 존재 유무가 생산 수율에 영향을 미치미 못함을 의미한다. 또한, 조작된 규주의 유전자형이 항생재의 부재에 의하여 변형되지 않음이 확증되었다. 두 균주는 이전에 기술된 바와 같이 항생제 없이 배양되었다. 각 균주의 내성 패턴(resistance pattern)의 유지를 확인하기 위하여, 48 시간 및 72 시간에, 각 배양액의 희석물을 항생제 없이 LB 플레이트에 항생제 없이 플레이팅하고, 30 ℃에서 24 시간 배양한 후에, 50 콜로니를 취하여 항생제가 포함된 LB 플레이트에 도말(streaked)하고 30 ℃에서 24 시간 동안 배양하였다. 배양 후에, 모든 콜로니가 항생제가 포함된 플레이트에서 자랐고, 이는 항생제의 부재가 내성 표현형(resistance phenotype)에 영향을 미치지 않고, 따라서 내성 유전형(resistance genotype)이 조작된 균주에서 보존되어야만 한다는 것을 의미한다.
얻어진 결과는 항생제 (Rf+Km) 압력 및 아텔루루산염(Tellurite)이 없는 이중 돌연변이, PpU 10-33-ΔphaZ의 배양이 PHA 생산에 영향을 미치지 않는다는 것을 나타낸다.
참고문헌(References):
Arias S., Sandoval, A., Arcos, M., Canedo, M.L., Naharro, G., and Luengo, J.M.(2008) Micro Biotech 1 : 170-176.
Bassas, M. (2010) Isolation and Analysis of Storage Compounds. In Handbook of Hydrocarbon and Lipid Microbiology: Experimental Protocols and Appendices. Timmis K.N. (ed.). Berlin : . Springer Verlag, pp. 3725-3741.
Castaneda, M., Guzman, J., Moreno, S., and Espin, G. (2000) J Bacteriol 182: 2624-2628.
ChoiJ., Lee, S.Y. (1997) Bioprocess Eng. 17: 335-342.
Conte, E., Catara, V., Greco, S., Russo, M ., Alicata, R., Strano, L., Lombardo, A., Di Silvestro, S., and Catara, A. (2006) Appl Microbiol Biotechnol 72: 1054- 1062.
de Eugenio, L.I,, Escapa, I.F., Morales, V., Dinjaski, N., Galan, B., Garcia, J.L.,Prieto, M.A. (2010a). Environ Microbiol ' 12 207-221.
de Eugenio, L.I., Galan, B., Escapa, I.E., Maestro, B., Sanz, J.M., Garcia, J.L., Prieto, M.A. (2010b) Environ Microbiol 12: 1591-1603.
Diederich, L., Roth, A., and Messer, W. (1994) Bio Techniques 16: 916-923.
Donnenberg, M.S., and Kaper, J.B. (1991) Infect Inmun 59: 4310-4317.
Galan, B., Dinjaski, N., Maestro, B., de Eugenio, L.I., Escapa, I.F., Sanz, J.M., Garcia, J.L., Prieto, M.A. (2011) Mol Microbiol 79:402-418.
Grage, K., Jahns, A.C., Parlane, N., Palanisamy, R., Rasiah, I. A., Atwood, J. A., Rehm, B.H. (2009) Biomacromolecules 10: 660-669.
Harayama, S., Rekik, M., Wubbolts, M., Rose, K.R., Leppik, R.A. and Timmis, K.N. (1989) . J Bacteriol 171 :5048-5055.
Herrero, M., de Lorenzo, V., and Timmis, K.N . (1990) J Bacteriol 172: 6557- 6567.
Herrero, M., de Lorenzo, V., Ensley, B., and Timmis, K.N. (1993) Gene 134: 103- 106.
Hoffmann, N., and Rehm, B.H . (2005) Biotechnol Lett 27: 279-282.
Hrabak, O. (1992) FEMS Microbiol. Rev. 103: 251-256.
Huisman, G. W., Wonink, E., Meima, R., Kazemier, B., Terpstra, P., and Witholt, B. (1991) J Biol Chem 266: 2191-2198.
Kessler, B., and Witholt, B. (2001) J Biotechnol 86: 97-104.
Kraak, M.N., Kessler, B., and Witholt, B. (1997) Eur Biochem 250: 432-439.
Luengo, J. M., Garcia, B., Sandoval, A., Naharro, G., Olivera, E.R. (2003) Curr Opin Microbiol 6: 251-260.
Madison, L. L., and Huisman, G.W. (1999) Microbiol Mol Biol Rev 63 : 21-53.
Martinez-Blanco, H., Reglero, A., Rodriguez-Aparicio, L.B., and Luengo, J.M. (1990). J Biol Chem. 265: 7084- 7090.
Prieto, M.A., Buehler, B., Jung, K., Witholt, B., and Kessler, B. (1999a) J Bacteriol 181: 858-868.
Prieto, M .A., Kellerhals, M.B., Bozzato, G.B., Radnovic, D., Witholt, B., and Kessler, B. (1999b) Appl Environ Microbiol 65: 3265-3271.
Quant, J., and Hynes, M.P. (1983) Gene 127: 15-21.
Ren, Q., de Roo, G., Ruth, K., Witholt, B., Zinn, M., Thoeny-Meyer, L, (2009a) Biomacromolecules 10: 916-22.
Ren, Q., de Roo, G., Witholt, B., Zinn, M., and Thoeny-meyer, L. (2010) BMC Microbiol 10; 254,
Sambrook, J., and Russell, D.W. (2001) Molecular cloning. A laboratory manual. Cold Spring Harbor, N.Y: CSHL Press.
Sanchez-Romero, J.M., Diaz-Orejas, R., and de Lorenzo, V. (1998) Appl Environ Microbiol 64; 4040-4046.
Selvaraj, J., and lyer, V.N. (1983) J Bacteriol 156: 1292-1300.
Solaiman, D.K., Ashby, R.D., and Foglia, T.A. (2003) Appl Microbial Biotechnol 62: 536-543.
Spurr, A. R. (1969) J. Ultrastruct Res 26: 31-4 3.
Steinbuechel, A. Polyhydroxyalkanoic acids in Biomatertals, D. Byrom, ed., MacMillan Publishers, Basingstoke (1991), p. 123 ff.
Steinbuechel, A., Aerts, K., Babel, W., Follner, C, Liebergesell, M., Madkour, M.H., et al, (1995) Can J Microbiol 41 : 94-105.
Uchino, K., Saito, T., Gebauer, B., Jendrossek, D. (2007) J Bacteriol 189: 8250- 8256.
Williams and Peoples (1996) Chemtech 26, 38-44.
York, G.M., Stubbe, J., and Sinskey, A.J. (2002) J Bacteriol 184: 59-66.
첨부 1: 사용된 균주, 돌연변이 및 플라스미드
첨부 2: 본 연구에서 PT-PCR 방법을 위해 사용된 올리고뉴클리오티드들의 리스트. 숫자(1, 2)는 P. 푸티다 KT2440 또는 P. 푸티다 U의 DNA가 각각 주형(templet)으로 사용되었는지 여부를 나타낸다.
첨부 3: 사용된 추가적인 올리고뉴틀레오티드들의 리스트
SEQUENCE LISTING ?Rule 13ter
<110> Helmholtz-Zentrum f? Infektionsforschung GmbH
<120> PHA producing genetically engineered microorganisms
<140> EP 12163787.0-1212
<141> 2012-04-11
<160> 42
<210> 1
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of 16s ribisomal DNA for Pseudomonas Putida KT2440 as a template
<400> 1
acgatccgta actggtctga 20
<210> 2
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of 16s ribisomal DNA for Pseudomonas Putida KT2440 as a template
<400> 2
ttcgcacctc agtgtcagta 20
<210> 3
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Citrate synthase (glpA) PP_4194 for Pseudomonas Putida KT2440 as a template
<400> 3
gccgatttca tccagcatgg tc 22
<210> 4
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Citrate synthase (glpA) PP_4194 for Pseudomonas Putida KT2440 as a template
<400> 4
tggaccggat cttcatcctc ca 22
<210> 5
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Ribosomal protein S12 (rpsL) PP_0449 for Pseudomonas Putida KT2440 as a template
<400> 5
ggcaactatc aaccagctgg t 21
<210> 6
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Ribosomal protein S12 (rpsL) PP_0449 for Pseudomonas Putida KT2440 as a template
<400> 6
gctgtgctct tgcaggttgt g 21
<210> 7
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Glyceraldehyde 3-phosphate dehydrogenase (gap-1) PP_1009 for Pseudomonas Putida KT2440 as a template
<400> 7
cttgaggttg acggtgaggt c 21
<210> 8
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Glyceraldehyde 3-phosphate dehydrogenase (gap-1) PP_1009 for Pseudomonas Putida KT2440 as a template
<400> 8
aggtgctgac tgacgtttac ca 22
<210> 9
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Signal recognition particle protein Ffh (ffH) PP_1461 for Pseudomonas Putida KT2440 as a template
<400> 9
cggtagtcaa ggatttcgtc aac 23
<210> 10
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Signal recognition particle protein Ffh (ffH) PP_1461 for Pseudomonas Putida KT2440 as a template
<400> 10
caccatcacg ctctttttct tg 22
<210> 11
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Rod shape-determining protein MreB (mreB) PP_0933 for Pseudomonas Putida KT2440 as a template
<400> 11
cgtgaagtgt tcctgatcga ag 22
<210> 12
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Rod shape-determining protein MreB (mreB) PP_0933 for Pseudomonas Putida KT2440 as a template
<400> 12
ccgatttcct gcttgatacg tt 22
<210> 13
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Cell division protein FtsZ (ftsZ) PP_1342 for Pseudomonas Putida KT2440 as a template
<400> 13
cggtatctcc gacatcatca ag 22
<210> 14
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Cell division protein FtsZ (ftsZ) PP_1342 for Pseudomonas Putida KT2440 as a template
<400> 14
gagtactcac ccagcgacag gt 22
<210> 14
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Pyrroline-5-carboxylate reductase 1 (proC1) PP_3778 for Pseudomonas Putida KT2440 as a template
<400> 15
gcatttacca gccctttgaa gc 22
<210> 16
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Pyrroline-5-carboxylate reductase 1 (proC1) PP_3778 for Pseudomonas Putida KT2440 as a template
<400> 16
caatgacgaa aggcaaatcg ac 22
<210> 17
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Pyrroline-5-carboxylate reductase 2 (proC2) PP_5095 for Pseudomonas Putida KT2440 as a template
<400> 17
ctcccaactg accttgcaga c 21
<210> 18
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Pyrroline-5-carboxylate reductase 2 (proC2) PP_5095 for Pseudomonas Putida KT2440 as a template
<400> 18
gctccttatt tgcccagttg ttc 23
<210> 19
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of PHA synthase 1 (phaC1) for Pseudomonas Putida U as a template
<400> 19
gcatgtggcc cactttggc 19
<210> 20
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of PHA synthase 1 (phaC1) for Pseudomonas Putida U as a template
<400> 20
cccaggttct tgcccactt 19
<210> 21
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of PHA depolymerase (phaZ) for Pseudomonas Putida U as a template
<400> 21
agcagtttgc ccacgactac c 21
<210> 22
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of PHA depolymerase (phaZ) for Pseudomonas Putida U as a template
<400> 22
ggtggatctt gtgcagccag t 21
<210> 23
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of PHA synthase 2 (phaC2) for Pseudomonas Putida U as a template
<400> 23
ggcaacccca aggcctacta c 21
<210> 24
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of PHA synthase 2 (phaC2) for Pseudomonas Putida U as a template
<400> 24
ccgagcggtg gataggtact g 21
<210> 25
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Phasin PhaF (phaF) for Pseudomonas Putida U as a template
<400> 25
gtcagcttct cgatctgctt ggt 23
<210> 26
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Phasin PhaF (phaF) for Pseudomonas Putida U as a template
<400> 26
gaagaagacg gctgaagatg tagc 24
<210> 27
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Phasin PhaI (phaI) for Pseudomonas Putida U as a template
<400> 27
ctctttgtcg atgcgtttct tg 22
<210> 28
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Printer (5?3? of Phasin PhaI (phaI) for Pseudomonas Putida U as a template
<400> 28
catggccaaa gtgattgtga ag 22
<210> 29
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Printer (5?3? of PhaD transcriptional regulator (phaD) for Pseudomonas Putida U as a template
<400> 29
gaacgtatcc accctggaga tt 22
<210> 30
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Printer (5?3? of PhaD transcriptional regulator (phaD) for Pseudomonas Putida U as a template
<400> 30
ataaggtgca ggaacagcc agtag 24
<210> 31
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Long-chain-fatty-acid-CoA ligase 1 (fadD1) for Pseudomonas Putida U as a template
<400> 31
cgtgatcaag tacgtgaaga agatg 25
<210> 32
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Long-chain-fatty-acid-CoA ligase 1 (fadD1) for Pseudomonas Putida U as a template
<400> 32
gtgaaggcgt agatgtggta cag 23
<210> 33
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? of Long-chain-fatty-acid-CoA ligase 2 (fadD2) for Pseudomonas Putida U as a template
<400> 33
gctgtaccac atctatgcct tcac 24
<210> 34
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? of Long-chain-fatty-acid-CoA ligase 2 (fadD2) for Pseudomonas Putida U as a template
<400> 34
gccggagttg gtgactttca g 21
<210> 35
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? M13F
<400> 35
gtaaaacgac ggccag 16
<210> 36
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? M13r
<400> 36
aggaaacagc tatgac 16
<210> 37
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? PhaC1-check-F
<400> 37
gaatcggttg tgaaactcat gctc 24 24
<210> 38
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? PhaC2-check-R
<400> 38
ccttgccatg gaagtggtag tacag 25
<210> 39
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? RT-phaZ F_PpU
<400> 39
agcagtttgc ccacgactac c 21
<210> 40
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? RT-phaZ R_PpU
<400> 40
ggtggatctt gtgcagccag t 21
<210> 41
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward Primer (5?3? phaZ-F-KpnI
<400> 41
ggggtacccc cactttttca cgacagagtc gaacg 35
<210> 42
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse Primer (5?3? phaZ-R-XbaI
<400> 42
gctctagagc gcaacactcc ctcgtcttac c 31
* * *
3
Claims (15)
- 야생형 미생물에 비하여 하나 이상의 폴리히드록시알카노에이트(polyhydroxyalkanoate, PHA) 합성효소를 코딩하는 유전자의 증가된 수의 카피를 가지는, 자연적으로 PHA를 생산하는 미생물의 유전적으로 조작된 형태로서, 여기서 상기 증가된 수의 카피는 상기 PHA 합성효소의 균형 잡힌 과잉 생산을 제공하고 유전적 조작은 미생물이 24 시간 후 야생형과 비교하여 적어도 1.2 배의 양으로 중간-(medium-) 또는 긴-사슬-길이(long-chain-length) PHA를 과잉 생산하도록 하며, 여기서 상기 과잉 생산을 평가하기 기준 조건은 15 mM 소듐 옥타노에이트(sodium octanoate)를 포함하는 변형된 MM 배지인 것인, 유전적으로 조작된 미생물.
- 제1항에 있어서, 상기 유전자는 PhaC2 합성효소 또는 그것의 동족체들(homologues)을 코딩하는 유전자인 것인, 유전적으로 조작된 미생물.
- 제1항 또는 제2항에 있어서, 상기 PHA 합성효소의 발현은 프로모터 시스템, 바람직하게 단백질 기반, 더욱 바람직하게 T7 중합효소/T7 중합효소 프로모터 시스템에 의하여 조절되는 것인, 유전적으로 조작된 미생물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 미생물 내에 PHA의 분해와 관련된 단백질을 코딩하는 하나 이상의 유전자에 대한 하나 이상의 변형을 더 가지고, 여기서 상기 변형은 PHA의 분해에 관련된 단백질을 코딩하는 유전자의 완전 또는 부분적 불활성화, 더욱 바람직하게 상기 유전자의 완전한 불활성화를 유발하는 것인, 유전적으로 조작된 미생물.
- 제4항에 있어서, 상기 PHA의 분해와 연관된 단백질은 PHA 탈중합효소(depolymerase), 바람직하게 phaZ 및 그것의 동족체들인 것인, 유전적으로 조작된 미생물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 유전적 변형은 재생산 및/또는 배양시 바람직하게 항생제의 존재 또는 부재시 모두에서 미생물 내의 유전적 변형이 유지되는 것인, 유전적으로 조작된 미생물.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 유전적 조작은 24 시간 후 야생형과 비교하여 중간 사슬 폴리히드록시알카노에이트(들) PHA(medium chain polyhydroxyalkanoate(s) PHA)를 바람직하게 적어도 1.5 배 및 더욱 바람직하게 2배로 과잉 생산하도록 하고, 여기서 과잉 생산을 평가하기 위한 기준 조건은 15 mM 소듐 옥타노에이트(sodium octanoate)를 포함하는 변형된 MM 배지인 것인, 유전적으로 조작된 미생물.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 미생물은 슈도모나스 푸티다(Pseudomonas putida), 슈도모나스 에루지노사(Pseudomonas aeruginosa), 슈도모나스 시린가에(Pseudomonas syringae), 슈도모나스 플루오르세인스(Pseudomonas fluoresceins), 슈도모나스 아시토필라(Pseudomonas acitophila), 슈도모나스 올레바란스(Pseudomonas olevarans), 이디오마리나 로이히엔시스(Idiomarina loihiensis), 알카니보락스 보르쿠멘시스(Alcanivorax borkumensis), 아시네토박터 종(Acinetobacter sp.), 카울로박터 크레센투스(Caulobacter crescentus), 아프칼리제네스 유트로푸스(Afcaligenes eutrophus), 알칼리게네스 라투스(Alcaligenes latus), 아조박터 빈란디(Azotobacter vinlandii), 로도코커스 유트로파(Rhodococcus eutropha), 크로모박테리움 바이오라세움(Chromobacterium violaceum) 또는 크로마티움 비노숨(Chromatium vinosum)을 포함하는 그룹으로부터 선택되고, 바람직하게 슈도모나스 푸티다(Pseudomonas putida) 균주, 더욱 바람직하게 슈도모나스 푸티다 U(Pseudomonas putida U)인 것인, 유전적으로 조작된 미생물.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 미생물은 유도제 분자(inducer molecule)의 첨가 없이 PHA를 생산할 수 있는 것인, 유전적으로 조작된 미생물.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 미생물은 단일 세포내 과립(single intercellular granule)의 형태로 PHA를 생산할 수 있는 것인, 유전적으로 조작된 미생물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 미생물은 소듐 옥타노에이트(sodium octanoate)를 포함하는 변형된 MM 배지에 노출시 24 시간 후에 최대 함량의 PHA를 생산할 수 있고, 바람직하게 또한 적어도 48시간 동안 최대 PHA 함량의 ±20 % 의 범위의 무게로 PHA 함량을 유지할 수 있는 것인, 유전적으로 조작된 미생물.
- (a) 제1항 내지 제11항 중 어느 한 항의 미생물을 배양하는 단계; 및
(b) (a) 단계의 배양 배지로부터 PHA를 회수(recovering) 하는 단계;를 포함하는 PHA를 생산하는 방법. - 제12항에 있어서, 상기 방법은 미생물에서 PHA의 과잉 생산 및/또는 PHA 합성효소의 과잉 생산을 시작하기 위한 유도제 분자의 첨가 및/또는 유전적 변형의 손실을 막기 위한 항생제의 첨가를 수반 또는 요구하지 않는 방법인 것인, 방법.
- 제12항 또는 제13항에 있어서, 상기 PHA는 60 ℃ 또는 그 미만, 바람직하게 20 내지 40 ℃의 온도에서, 3 내지 8 개의 탄소 원자를 가지는 케톤에 의한 추출에 의해 회수되는 것인, 방법.
- 중간-(medium-) 및/또는 긴-사슬-길이(long-chain-length) PHA의 과잉 생산을 위한 제1항 내지 제11항 중 어는 한 항의 미생물의 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12163787.0 | 2012-04-11 | ||
| EP12163787 | 2012-04-11 | ||
| PCT/EP2013/057630 WO2013153180A1 (en) | 2012-04-11 | 2013-04-11 | Pha-producing genetically engineered microorganisms |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150004830A true KR20150004830A (ko) | 2015-01-13 |
Family
ID=48128294
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147031299A KR20150004830A (ko) | 2012-04-11 | 2013-04-11 | 유전적으로 조작된 pha 생산 미생물 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20150203878A1 (ko) |
| EP (1) | EP2836601A1 (ko) |
| JP (1) | JP2015512648A (ko) |
| KR (1) | KR20150004830A (ko) |
| CN (1) | CN104520433A (ko) |
| CA (1) | CA2869891A1 (ko) |
| HK (1) | HK1206787A1 (ko) |
| IN (1) | IN2014MN02184A (ko) |
| RU (1) | RU2014144504A (ko) |
| SG (1) | SG11201405636QA (ko) |
| WO (1) | WO2013153180A1 (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8802402B2 (en) * | 2010-07-14 | 2014-08-12 | Toyota Jidosha Kabushiki Kaisha | Mutant polyhydroxyalkanoic acid synthase gene and method for producing aliphatic polyester using the same |
| ES2952673T3 (es) | 2012-10-22 | 2023-11-03 | Kaneka Corp | Microbio productor de PHA de alto peso molecular y método de producción de PHA de alto peso molecular usando el mismo |
| CN104328062A (zh) * | 2014-06-13 | 2015-02-04 | 东北师范大学 | 一株假单胞菌诱变菌株及其在生产(r)-3-羟基丁酸中的应用 |
| CN110049953B (zh) * | 2016-12-09 | 2022-12-27 | 尼普生物股份有限公司 | 由醇利用细菌以微生物制造蛋白质和phb |
| CN110004182B (zh) * | 2019-04-02 | 2021-03-05 | 清华大学 | 一种微生物胞内大颗粒内含物的制备方法及其应用 |
| CN111909952B (zh) * | 2020-08-04 | 2024-04-26 | 北京大学深圳研究院 | 构建食烷菌敲除酰基辅酶a硫脂酶基因的方法和应用 |
| CN111982875A (zh) * | 2020-08-20 | 2020-11-24 | 北京大学深圳研究院 | 一种基于三维荧光光谱分析的产聚羟基脂肪酸酯菌的筛选方法 |
| CN114480317B (zh) * | 2022-04-06 | 2022-07-29 | 深圳蓝晶生物科技有限公司 | 表达乙酰乙酰辅酶a还原酶变体的工程化微生物及提高pha产量的方法 |
| CN116445440B (zh) * | 2022-10-26 | 2024-01-02 | 华南理工大学 | 黏性聚羟基脂肪酸酯及其制备和应用 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4417169A1 (de) * | 1994-05-17 | 1995-11-23 | Vogelbusch Gmbh | Rekombinante Herstellung von Polyhydroxyalkanoaten in glucosefreiem Medium |
| DE69838768T2 (de) * | 1997-09-19 | 2008-10-30 | Metabolix, Inc., Cambridge | Biologische Systeme zur Herstellung von Polyhydroxyalkanoat-Polymeren die 4-Hy droxysäure enthalten |
-
2013
- 2013-04-11 CA CA2869891A patent/CA2869891A1/en not_active Abandoned
- 2013-04-11 IN IN2184MUN2014 patent/IN2014MN02184A/en unknown
- 2013-04-11 EP EP13716773.0A patent/EP2836601A1/en not_active Withdrawn
- 2013-04-11 RU RU2014144504A patent/RU2014144504A/ru not_active Application Discontinuation
- 2013-04-11 CN CN201380019207.7A patent/CN104520433A/zh active Pending
- 2013-04-11 JP JP2015504961A patent/JP2015512648A/ja active Pending
- 2013-04-11 US US14/391,939 patent/US20150203878A1/en not_active Abandoned
- 2013-04-11 WO PCT/EP2013/057630 patent/WO2013153180A1/en active Application Filing
- 2013-04-11 KR KR1020147031299A patent/KR20150004830A/ko not_active Application Discontinuation
- 2013-04-11 SG SG11201405636QA patent/SG11201405636QA/en unknown
-
2015
- 2015-07-28 HK HK15107210.2A patent/HK1206787A1/xx unknown
Also Published As
| Publication number | Publication date |
|---|---|
| HK1206787A1 (en) | 2016-01-15 |
| RU2014144504A (ru) | 2016-06-10 |
| CA2869891A1 (en) | 2013-10-17 |
| CN104520433A (zh) | 2015-04-15 |
| EP2836601A1 (en) | 2015-02-18 |
| SG11201405636QA (en) | 2014-11-27 |
| WO2013153180A1 (en) | 2013-10-17 |
| JP2015512648A (ja) | 2015-04-30 |
| IN2014MN02184A (ko) | 2015-08-28 |
| US20150203878A1 (en) | 2015-07-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20150004830A (ko) | 유전적으로 조작된 pha 생산 미생물 | |
| EP2267133B1 (en) | Method for making poly(3-hydroxyproprionate) | |
| Jung et al. | Efficient production of polylactic acid and its copolymers by metabolically engineered Escherichia coli | |
| Brigham et al. | Elucidation of β-oxidation pathways in Ralstonia eutropha H16 by examination of global gene expression | |
| US20130017583A1 (en) | Methods for producing polyhydroxyalkanoate copolymer with high medium chain length monomer content | |
| CA2360801C (en) | Transgenic systems for the manufacture of poly(3-hydroxy-butyrate-co-3-hydroxyhexanoate) | |
| EP2669365B1 (en) | Method for producing high-molecular-weight pha | |
| EP0881293A1 (en) | Production of medium chain length poly-3-hydroxy alkanoates in Escherichia coli, and monomers derived therefrom | |
| WO2010003463A1 (en) | Method for polymerising glycolic acid with microorganisms | |
| JP5103619B2 (ja) | 共重合ポリエステルの製造法 | |
| US20110118434A1 (en) | Method for polymerising glycolic acid with microorganisms | |
| WO2021172559A1 (ja) | ブロック共重合体、及びその製造方法 | |
| AU2003200941C1 (en) | Polyhydroxyalkanoate biopolymer compositions | |
| Mahan et al. | Running title: Gene Expression Microarray Analysis of Ralstonia eutropha H16 7 8 9 | |
| JP2015006181A (ja) | 中鎖pha/長鎖pha及び特殊なphaの効率的な製造のための新規な環境分離微生物であるシュードモナス属微生物ipb−a36の使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |