KR20140107641A - Mogat-2 억제제로서 유용한 신규 모르폴리닐 유도체 - Google Patents
Mogat-2 억제제로서 유용한 신규 모르폴리닐 유도체 Download PDFInfo
- Publication number
- KR20140107641A KR20140107641A KR1020147021129A KR20147021129A KR20140107641A KR 20140107641 A KR20140107641 A KR 20140107641A KR 1020147021129 A KR1020147021129 A KR 1020147021129A KR 20147021129 A KR20147021129 A KR 20147021129A KR 20140107641 A KR20140107641 A KR 20140107641A
- Authority
- KR
- South Korea
- Prior art keywords
- mixture
- mmol
- added
- compound
- give
- Prior art date
Links
- WDMKNYMUOCXRSJ-UHFFFAOYSA-N CC(C)Oc(cccc1)c1C(CBr)=O Chemical compound CC(C)Oc(cccc1)c1C(CBr)=O WDMKNYMUOCXRSJ-UHFFFAOYSA-N 0.000 description 1
- JUONYSHFHZDWHI-FOIQADDNSA-N C[C@H](c1ccc(CN2C[C@H](c(cc3)ccc3F)OCC2)cc1)NS(C)(=O)=O Chemical compound C[C@H](c1ccc(CN2C[C@H](c(cc3)ccc3F)OCC2)cc1)NS(C)(=O)=O JUONYSHFHZDWHI-FOIQADDNSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/12—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms
- C07D295/135—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms with the ring nitrogen atoms and the substituent nitrogen atoms separated by carbocyclic rings or by carbon chains interrupted by carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C57/00—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms
- C07C57/02—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms with only carbon-to-carbon double bonds as unsaturation
- C07C57/13—Dicarboxylic acids
- C07C57/145—Maleic acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D265/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one oxygen atom as the only ring hetero atoms
- C07D265/28—1,4-Oxazines; Hydrogenated 1,4-oxazines
- C07D265/30—1,4-Oxazines; Hydrogenated 1,4-oxazines not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/02—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements
- C07D295/027—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring
- C07D295/03—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring with the ring nitrogen atoms directly attached to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
본 발명은 화학식 I의 화합물 또는 그의 제약 염, 상기 화합물을 사용하여 고트리글리세리드혈증을 치료하는 방법 및 상기 화합물의 제조 방법을 제공한다.
<화학식 I>
<화학식 I>
Description
과량의 식이 지방의 섭취는 식이 유발 비만의 주된 원인이고 사람들의 건강에 극심하게 유해한 효과를 미칠 수 있다. 인간의 경우 식이 지방의 90% 초과는 트리아실글리세롤 (또는 트리글리세리드)이고, 이는 소장에 의해 거의 완전히 흡수된다. 효소 아실 CoA:모노아실글리세롤 아실트랜스퍼라제-2 (MOGAT-2)는 소장에서의 식이 지방의 흡수에 중요한 역할을 하는 것으로 여겨진다. MOGAT-2 결핍 마우스는 고 지방 식이가 공급된 경우 비만, 글루코스 불내성, 고콜레스테롤혈증의 진행 및 지방간의 진행이 저지되는 것으로 입증되었다. 추가로, MOGAT-2 결핍 마우스는 식용 올리브 오일 투여 후 더 낮은 혈장 트리아실글리세롤 수준을 나타내는 것으로 또한 밝혀졌다 (문헌 [Yen, et al, Nat . Med . 2009, 15(4), 442-446]).
고트리글리세리드혈증의 치료를 위한 추가 약물에 대한 필요성이 있다. 또한, MOGAT-2 수용체의 신규 억제제에 대한 필요성이 있다. 본 발명은, 고트리글리세리드혈증의 치료에 적합할 수 있는 대안적 화합물 및 치료 방법을 제공함으로써 이들 필요성 중 하나 이상을 해결한다.
본 발명은 하기 화학식 I의 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 I>
상기 식에서, R1은 -CH3 및 -CF3으로부터 선택되고; R2는 H 및 -CH3으로부터 선택되고; R3은 H 및 -CH3으로부터 선택되고; R4는 H, -OC1 - 3알킬 및 할로겐으로부터 선택되고; R5는 H, -CF3, -OCH3 및 할로겐으로부터 선택되고; R6은 H 및 할로겐으로부터 선택되며; 단, R4, R5 및 R6 중 적어도 하나는 H이다.
본 발명의 화합물은 1개 이상의 키랄 중심을 가질 수 있다. 하기 화학식 II의 화합물에서, 키랄 중심 중 하나는 별표 (*)로 식별된다. R1이 -CH3인 경우, 바람직한 화합물은 이러한 키랄 중심에서 (R) 배위를 갖는다. R1이 -CF3인 경우, 바람직한 화합물은 (S) 배위를 갖는다.
<화학식 II>
한 실시양태에서 R1은 -CH3이다. 또 다른 실시양태에서 R1은 -CF3이다.
바람직하게는 R2는 H이다.
바람직하게는 R3은 H이다.
바람직하게는 R4는 H, -OCH(CH3)2 및 할로겐으로부터 선택된다. 보다 바람직하게는 R4는 H 및 할로겐으로부터 선택된다. 보다 더 바람직하게는 R4는 H 및 Cl로부터 선택된다.
바람직하게는 R5는 H, -CF3 -OCH3, F 및 Cl로부터 선택된다. 보다 바람직하게는 R5는 H, -CF3, F 및 Cl로부터 선택된다. 보다 더 바람직하게는 R5는 H이다.
바람직하게는 R6은 H 및 F로부터 선택된다. 바람직하게는 R6은 F이다.
본 발명은 하기 화학식 III의 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 III>
본 발명은 R1이 -CH3이고; R2가 H 및 -CH3으로부터 선택되고; R3이 H 및 -CH3으로부터 선택되고; R4가 H, -OCH(CH3)2 및 할로겐으로부터 선택되고; R5가 H, -CF3, -OCH3, Cl 및 F로부터 선택되고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CH3이고; R2가 H 및 -CH3으로부터 선택되고; R3이 H 및 -CH3으로부터 선택되고; R4가 H 및 할로겐으로부터 선택되고; R5가 H, -CF3, F 및 Cl로부터 선택되고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CH3이고; R2가 H 및 -CH3으로부터 선택되고; R3이 H 및 -CH3으로부터 선택되고; R4가 H 및 할로겐으로부터 선택되고; R5가 H, F 및 Cl로부터 선택되고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CH3이고; R2가 H이고; R3이 H이고; R4가 H 및 Cl로부터 선택되고; R5가 H, Cl 및 F로부터 선택되고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CH3이고; R2가 H이고; R3이 H이고; R4가 H 및 Cl로부터 선택되고; R5가 H이고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CH3이고; R2, R3, R4 및 R5 각각이 H이고; R6이 F인 화학식 I 또는 II에 따른 화합물을 제공한다.
본 발명은 R1이 -CF3이고; R2가 H 및 -CH3으로부터 선택되고; R3이 H 및 -CH3으로부터 선택되고; R4가 H, -OCH(CH3)2 및 할로겐으로부터 선택되고; R5가 H, -CF3, -OCH3, Cl 및 F로부터 선택되고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CF3이고; R2가 H 및 -CH3으로부터 선택되고; R3이 H 및 -CH3으로부터 선택되고; R4가 H 및 할로겐으로부터 선택되고; R5가 H, -CF3, F 및 Cl로부터 선택되고; R6이 H 및 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CF3이고; R2가 H 및 -CH3으로부터 선택되고; R3이 H 및 -CH3으로부터 선택되고; R4가 H 및 할로겐으로부터 선택되고; R5가 H, F 및 Cl로부터 선택되고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CF3이고; R2가 H이고; R3이 H이고; R4가 H 및 Cl로부터 선택되고; R5가 H, Cl 및 F로부터 선택되고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CF3이고; R2가 H이고; R3이 H이고; R4가 H 및 Cl로부터 선택되고; R5가 H이고; R6이 H 또는 F로부터 선택되는 것인 화학식 I 또는 II에 따른 화합물 또는 그의 제약상 허용되는 염을 제공한다.
본 발명은 R1이 -CF3이고; R2, R3, R4 및 R5 각각이 H이고; R6이 F인 화학식 I 또는 II에 따른 화합물을 제공한다.
바람직하게는 제약상 허용되는 염은 클로라이드 염 및 말레에이트 염으로부터 선택된다. 보다 바람직하게는 제약상 허용되는 염은 말레에이트 염이다.
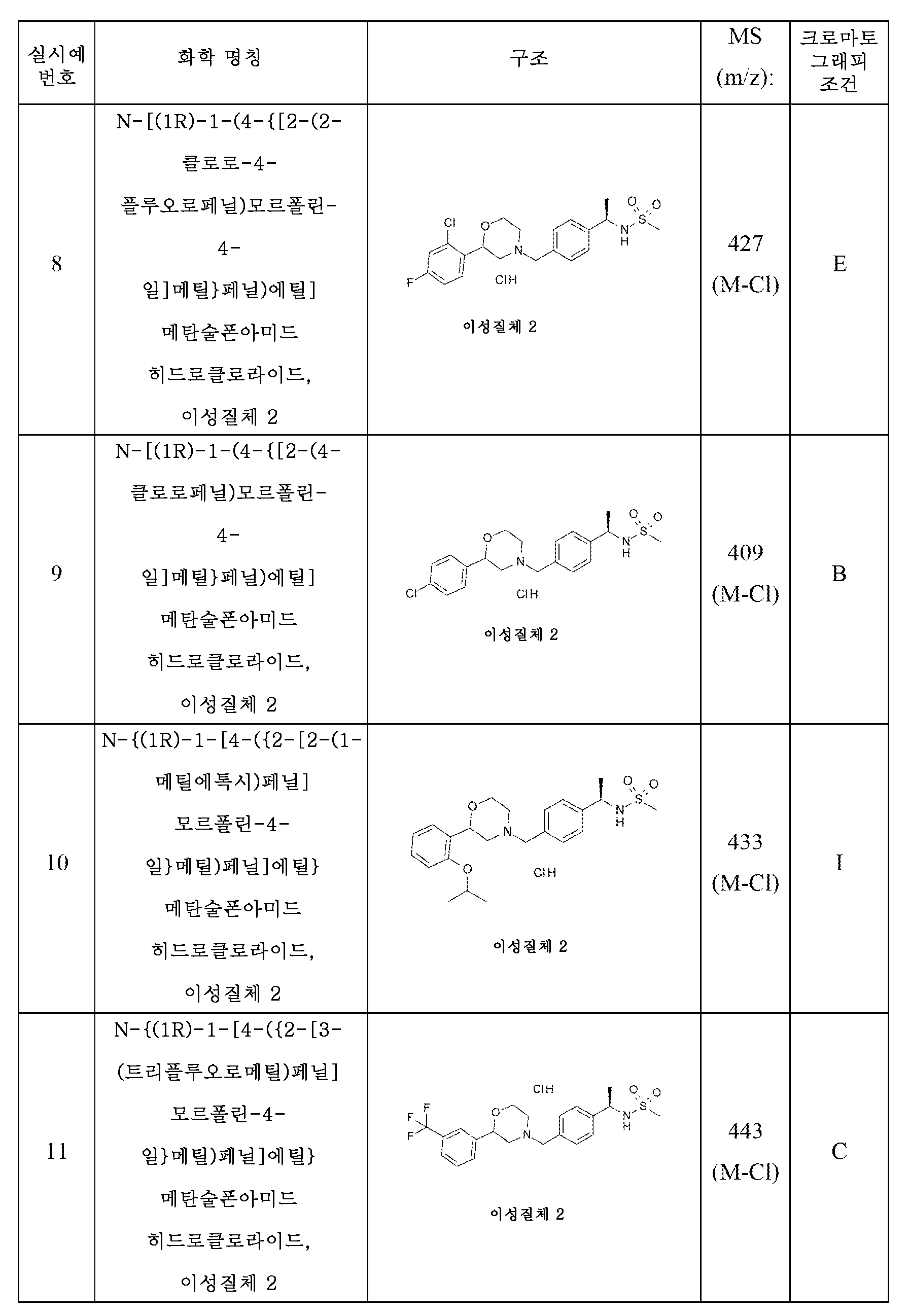
바람직한 화합물은 N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드;
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 히드로클로라이드; 및
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 말레산이다.
본 발명은 상기한 바와 같은 화학식 I, II 또는 III의 화합물 또는 그의 제약상 허용되는 염, 및 1종 이상의 제약상 허용되는 담체, 희석제 또는 부형제를 포함하는 제약 조성물을 제공한다.
또한, 본 발명은 고트리글리세리드혈증의 치료를 필요로 하는 환자에게 유효량의 상기 화학식 I, II 또는 III에 따른 화합물을 투여하는 것을 포함하는, 상기 환자를 치료하는 방법을 제공한다.
본 발명은 고트리글리세리드혈증의 요법에서 사용하기 위한 상기 화학식 I, II 또는 III에 따른 화합물을 제공한다.
본 발명은 고트리글리세리드혈증을 치료하는 의약의 제조에 있어서 상기 화학식 I, II 또는 III에 따른 화합물의 용도를 제공한다.
용어 "제약상 허용되는 염"은 임상적 및/또는 수의학적 용도에 허용되는 것으로 간주되는 본 발명의 화합물의 염을 지칭한다. 제약상 허용되는 염 및 이들을 제조하는 통상적인 방법론은 당업계에 주지되어 있다. 예를 들어, 문헌 [P. Stahl, et al ., Handbook of Pharmaceutical Salts: Properties, Selection and Use, (VCHA/Wiley-VCH, 2002)]; [S.M. Berge, et al ., "Pharmaceutical Salts," Journal of Pharmaceutical Sciences, Vol. 66, No. 1, January 1977]을 참조한다.
본 발명의 제약 제제는 공지되거나 용이하게 입수가능한 첨가제를 사용하여 당업계에 공지된 절차에 의해 제조될 수 있다. 본원에서 사용된 바와 같은 용어 "제약상 허용되는 담체, 희석제 또는 부형제"는 제제의 다른 성분과 상용성이고 환자에게 유해하지 않은 1종 이상의 담체, 희석제 및 부형제를 지칭한다. 제약 조성물 및 그의 제조 방법은 당업계에 공지되어 있고 예는 문헌 [Remington, "The Science and Practice of Pharmacy" (A. Gennaro, et al. eds. 19th ed. Mack Publishing Co.)]에서 찾을 수 있다. 이러한 제제에 적합한 제약상 허용되는 담체, 부형제 및 희석제의 비제한적 예는 하기를 포함한다: 전분, 당, 만니톨 및 실리카 유도체; 결합제, 예컨대 카르복시메틸 셀룰로스 및 다른 셀룰로스 유도체, 알기네이트, 젤라틴 및 폴리비닐-피롤리돈; 보습제, 예컨대 글리세롤; 붕해제, 예컨대 탄산칼슘 및 중탄산나트륨.
본원에서 사용된 바와 같은 환자는 치료를 필요로 하는 동물, 바람직하게는 포유동물, 바람직하게는 인간; 또는 대안적으로 반려 동물, 예컨대 개 또는 고양이; 또는 가금류를 지칭하지만 이에 제한되지는 않는다.
달리 언급되지 않는 한, 본원에서 설명된 화합물은 ACDLABS 또는 시믹스 드로우(Symyx Draw) 3.2를 사용하여 명명되고 넘버링된다.
일반 화학
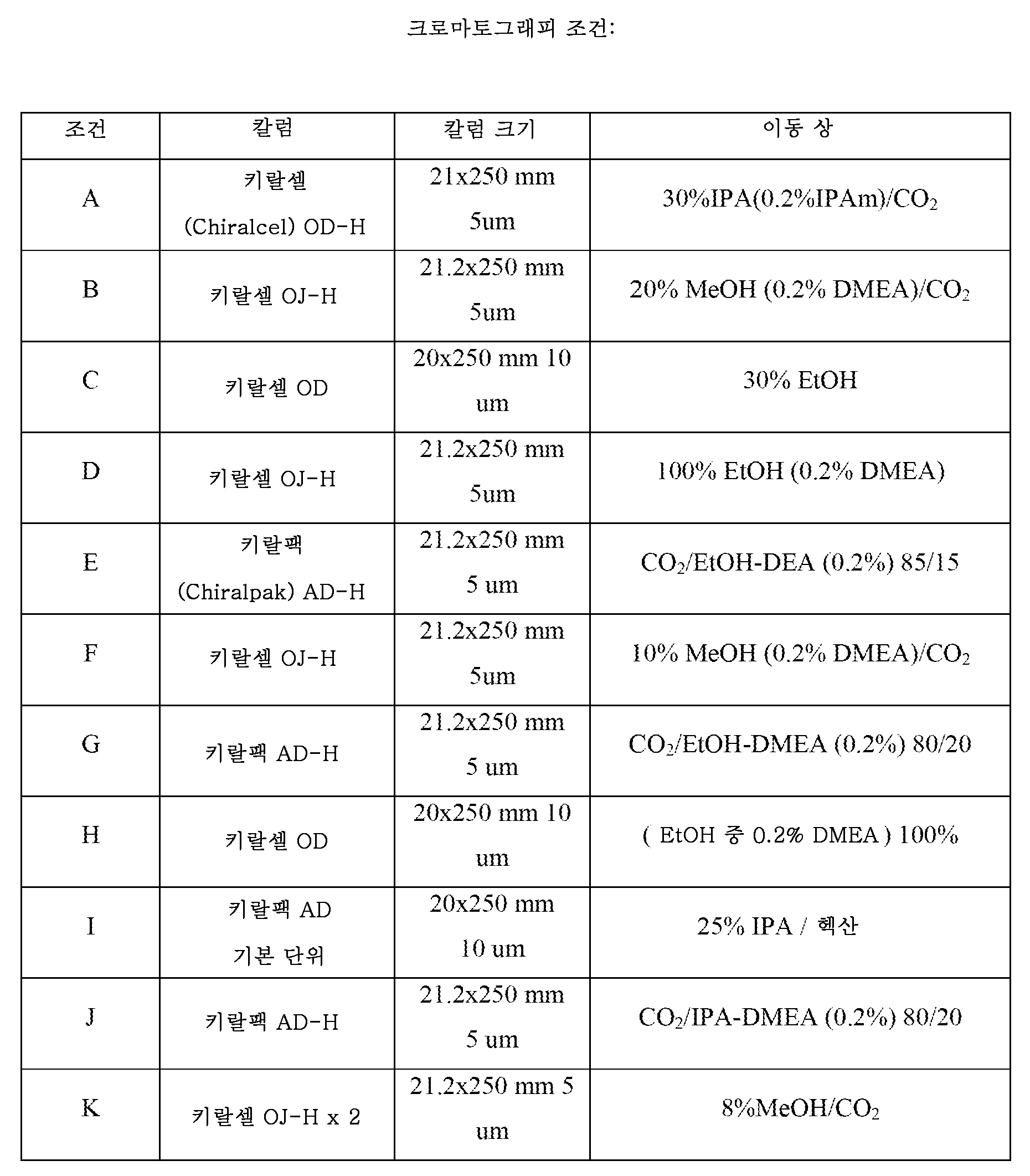
본원에서 사용된 바와 같이, 하기 용어는 다음 나타낸 의미를 갖는다: "ACN"은 아세토니트릴을 지칭하고; "DCM"은 디클로로메탄을 지칭하고; "DEA"는 디에틸아민을 지칭하고; "DMEA"는 디메틸에틸아민을 지칭하고; "DMF"는 디메틸 포름아미드를 지칭하고; "ee"는 거울상이성질체 과잉률을 지칭하고; "EtOAc"는 에틸 아세테이트를 지칭하고; "EtOH"는 에탄올을 지칭하고; "h"는 시간(들)을 지칭하고; "HPLC"는 고성능 액체 크로마토그래피를 지칭하고; "IPA"는 이소프로필 알콜을 지칭하고; "이성질체 1"은 제1 용리 이성질체를 지칭하고; "이성질체 2"는 제2 용리 이성질체를 지칭하고; "LC/MS"는 액체 크로마토그래피 후 질량 분광분석법을 지칭하고; "MeOH"는 메탄올을 지칭하고; "min"은 분(들)을 지칭하고; "MS"는 질량 분광분석법을 지칭하고; "NMR"은 핵 자기 공명을 지칭하고; "SFC"는 초임계 유체 크로마토그래피를 지칭하고; "THF"는 테트라히드로푸란을 지칭한다.
<반응식 1>
반응식 1은 화학식 I의 화합물의 일반적 합성을 설명하는 것이다.
상업적으로 입수가능하거나 공지된 문헌 방법에 의해 합성되는 치환 모르폴린 화합물 1은 환원성 아미노화 조건하에 알데히드 또는 케톤 2와 반응하여 화학식 I의 화합물을 제공한다. ((참조: 문헌 [Richard C. Larock, Comprehensive Organic Transformations : a guide to functional group preparations, 2nd edition, Page 835-846, Wiley-VCH, (1999)]). 바람직하게는, 모르폴린 화합물 1은 디클로로메탄 중 환원제, 예컨대 트리아세톡시보로히드라이드 및 산, 예컨대 아세트산의 존재하에 화합물 2와 반응하여 화학식 I의 화합물을 제공하고, 이를 적절한 산, 예를 들어 HCl을 사용하여 적합한 염으로 전환시켜 히드로클로라이드 염을 형성시킬 수 있다.
제조예
1
(N-Z)-N-[(4-브로모페닐)메틸렌]-(R)-2-메틸-프로판-2-술핀아미드
(R)-2-메틸프로판-2-술핀아미드 (40.5 g, 0.33 mol)를 톨루엔 (283 mL) 중 4-브로모벤즈알데히드 (65.57 g, 0.35 mol)의 용액에 조금씩 첨가하였다. 혼합물을 15분 동안 주위 온도에서 교반한 다음, 수산화나트륨 (1.34 g, 0.33 mol)을 첨가하였다. 12시간 동안 주위 온도에서 현탁액을 교반하였다. 황산나트륨 (16 g) 및 셀라이트(Celite)® (16 g)를 첨가하고, 현탁액을 15분 동안 교반하였다. 여과하고, 여과물을 감압하에 농축하였다. 잔류물을 헥산/EtOAc (100% 내지 70% 헥산)로 용리시키는 실리카겔 크로마토그래피에 의해 정제하여 표제 화합물을 백색 고체 (85.5 g, 88% 수율)로서 수득하였다. MS (m/z): 288 (M+1).
제조예
2
N-[(1S)-1-(4-브로모페닐)-2,2,2-트리플루오로-에틸]-(R)-2-메틸-프로판-2-술핀아미드
0℃에서 순수한(neat) (트리플루오로메틸)트리메틸실란 (109 mL, 0.74 mol)을 0℃에서 DMF (1.2 L) 중 테트라부틸암모늄 아세테이트 (88 g, 0.29 mol) 및 (N-Z)-N-[(4-브로모페닐)메틸렌]-(R)-2-메틸-프로판-2-술핀아미드 (85 g, 0.29 mol)의 교반 용액에 첨가하였다. 혼합물을 90분 동안 0-5℃에서 교반하였다. 포화 염화암모늄 수용액 (1.2 L)을 첨가하고, EtOAc (4 x 400 mL)로 추출하였다. 추출물을 합하고, 추출물을 물, 이어서 염수 (2 x 1 L)로 순차적으로 세척하고, 황산마그네슘 상에서 건조시키고, 여과하고, 여과물을 감압하에 농축하였다. 잔류물을 10분 동안 헥산 (200 mL)으로 연화처리하고, 여과하고, 여과물을 감압하에 건조시켜 표제 화합물을 황색 고체 (81 g, 76% 수율, >98 de)로서 수득하였다. MS (m/z): 358 (M+1).
제조예
3
(1S)-1-(4-
브로모페닐
)-2,2,2-
트리플루오로에탄아민
HCl (디옥산 중 4M, 226 mL, 0.9 mol)을 MeOH (670 mL) 중 N-[(1S)-1-(4-브로모페닐)-2,2,2-트리플루오로-에틸]-(R)-2-메틸-프로판-2-술핀아미드 (81 g, 0.23 mol)의 현탁액에 첨가하였다. 혼합물을 1시간 동안 주위 온도에서 교반하였다. 용매를 감압하에 제거하고, 잔류물을 10분 동안 메틸 tert-부틸 에테르 (200 mL)로 연화처리하여 HCl 염을 갈색 고체로서 수득하였다. 염을 물 (1.2)에 용해시키고, 2N NaOH 용액을 충분히 첨가하여 수용액의 pH를 pH 10으로 상승시켰다. 혼합물을 메틸 tert-부틸 에테르 (3 x 500 mL)로 추출하였다. 유기 상을 물, 이어서 염수 (500 mL 각각)로 세척하고, 황산마그네슘 상에서 건조시키고, 여과하고, 여과물을 감압하에 농축하여 표제 화합물을 황색 고체 (46 g, 80% 수율, 98% ee)로서 수득하였다. MS (m/z): 358 (M+1).
제조예
4
N-[(1S)-1-(4-브로모페닐)-2,2,2-트리플루오로-에틸]메탄술폰아미드
메탄술포닐 클로라이드 (16.42 mL, 0.21 mol)를 0℃에서 DCM (250 mL) 중 (1S)-1-(4-브로모페닐)-2,2,2-트리플루오로에탄아민 (49 g, 0.19 mol), 4-디메틸아미노피리딘 (1.18 g, 9.0 mmol), 2,6-루티딘 (67 mL, 0.57 mol)의 혼합물에 적가하였다. 혼합물을 주위 온도로 가온하고, 그 온도에서 20시간 동안 교반하였다. 반응 혼합물을 DCM (300 mL)으로 희석하고, 이를 2M HCl (2 x 200 mL), 물 (250 mL), 이어서 염수 (250 mL)로 순차적으로 세척하였다. 유기 상을 수집하고, 황산마그네슘 상에서 건조시키고, 여과하고, 여과물을 감압하에 농축하였다. 잔류물을 10분 동안 헥산 (200 mL)으로 연화처리하고, 여과하고, 고체를 감압하에 건조시켜 표제 화합물을 담갈색 고체 (60 g, 93% 수율, 98% ee)로서 수득하였다. MS (m/z): 332 (M+1).
제조예 5
N-[(1S)-2,2,2-트리플루오로-1-(4-포르밀페닐)에틸]메탄술폰아미드
톨루엔 (1.5 mL) 중 N-[(1S)-1-(4-브로모페닐)-2,2,2-트리플루오로-에틸]메탄술폰아미드 (30 g, 90 mmol), 팔라듐(II) 아세테이트 (0.81 g, 3.6 mmol), 부틸디-1-아다만틸포스핀 (3.89 g, 10.84 mmol) 및 테트라메틸에틸렌디아민 (10.50 g, 90 mmol)을 2L 파르(PARR) 반응기에 첨가하였다. 반응기를 밀봉하고, 이를 합성 가스로 가압하였다 (75 psi에서 1:1 CO/H2). 온도를 95℃에서 유지하면서 반응 혼합물을 16시간 동안 교반하였다. 혼합물을 냉각하고, 통풍시키고, 반응기를 개방하였다. 혼합물을 셀라이트®를 통해 여과하고, 여과물을 감압하에 농축하였다. 조 잔류물을 헥산/EtOAc (8:2 내지 1:1)로 용리시키는 실리카겔 크로마토그래피에 의해 정제하여 표제 화합물 (22.8 g, 90%, 80% ee)을 수득하였다. 화합물을 키랄 칼럼: 키랄팩 AS-H (2.1 x 25 cm, 5 uM) CO2/EtOH (9:1)을 통해 용리시킴으로써 그의 키랄 순도를 강화하여 표제 화합물 (19 g, 75% 수율, 98% ee)을 수득하였다. MS (m/z): 282 (M+1).
제조예
6
N-[(1R)-1-(4-브로모페닐)에틸]메탄술폰아미드
메탄술포닐 클로라이드 (13.44 mL, 0.17 mmol)를 0℃에서 DCM (250 mL) 중 (1R)-1-(4-브로모페닐)에탄아민 (25 g, 0.12 mol) 및 트리에틸아민 (51 mL, 0.36 mol)의 혼합물에 첨가하였다. 주위 온도로 가온하고, 2.5시간 동안 교반하였다. 반응 혼합물을 2M 수성 HCl (100 ml)로 세척하였다. 그 다음, 유기 상을 물, 이어서 염수 (2 x 100 mL)로 순차적으로 세척하였다. 유기 상을 무수 황산나트륨 상에서 건조시키고, 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하였다. 잔류물을 헥산 (150 mL)으로 연화처리하고, 여과하고, 감압하에 건조시켜 표제 화합물을 황색 고체 (33.24 g, 96%, ee > 98%)로서 수득하였다. MS (m/z): 278 (M+1).
제조예
7
N-[(1R)-1-(4-포르밀페닐)에틸]메탄술폰아미드
N-[(1R)-1-(4-브로모페닐)에틸]-메탄술폰아미드 (10 g, 35 mmol), (1,1'-비스(디페닐포스피노)-페로센)팔라듐(II) 클로라이드 (733 mg, 0.9 mmol), 탄산나트륨 (3.81 g, 35 mmol) 및 DMF (50 mL)를 300 mL 파르 반응기에서 합하였다. 트리에틸실란 (11.6 mL, 0.72 mmol)을 첨가하고, 반응기를 일산화탄소로 3회 퍼징하였다. 반응기를 일산화탄소 (50 psi)로 충전하고, 혼합물을 15시간 동안 90℃에서 교반하였다. 반응기를 주위 온도로 냉각하고, 개방하고, 혼합물을 셀라이트® 패드를 통해 여과하고, 패드를 DCM (150 mL)으로 세척하였다. 여과물을 물, 이어서 염수 (2 x 80 mL)로 순차적으로 세척하였다. 유기 상을 감압하에 농축하여 잔류물을 오렌지색 오일로서 수득하였다. 오렌지색 오일을 헥산/EtOAc (0 내지 30% EtOAc)로 용리시키는 실리카겔 플래시 크로마토그래피에 의해 정제하여 표제 화합물 (5.6 g, 70%, ee> 98%)을 수득하였다. MS (m/z): 228 (M+1).
제조예
8
(1S)-2-브로모-1-(4-플루오로페닐)에탄올
질소 분위기하에, 22℃에서 30 리터 환저 플라스크를 (S)-1-메틸-3,3-디페닐-3a,4,5,6-테트라히드로피롤로[1,2-c][1,3,2]옥사자보롤의 용액 (톨루엔 중 1 M; 44 mL; 44 mmol)으로 충전하였다. 메틸 t-부틸 에테르 (4.5 L) 중 보란-N,N-디에틸아닐린 착물 (1230 g; 7540 mmol)의 용액을 첨가하였다. 혼합물을 가열하고, 40℃에서 30분 동안 유지하였다. 메틸 t-부틸 에테르 (4.5 L) 중 브로모-4-플루오로아세토페논 (1640 g; 7530 mmol)의 용액을 30분에 걸쳐 적가하였다. 혼합물을 2시간 동안 40℃에서 교반하였다. 빙수조를 사용하여 10℃로 냉각한 다음, MeOH (590 mL)를 서서히 첨가하여 반응을 켄칭하였다. 혼합물을 10-20℃에서 유지하면서 30분 동안 교반하였다. 염산 (3.0 M, 7.5 L)을 10℃에 있는 동안 혼합물에 첨가하였다. 1시간 동안 교반하고, 여과하였다. 여과물을 수집하였다. 여과물 중에서 층을 분리하고, 수성 상을 메틸 tert-부틸 에테르 (1 x 3 L)로 추출하고, 유기 상을 합하고, 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 여과물로부터 휘발성 물질을 감압하에 제거하여 표제 화합물을 담황색 오일 (1650 g, 99%)로서 수득하였다. MS (m/z): 201 (M-OH); ee 값: 97.5% (1.0 mL/min의 유량으로 25℃에서 99:1 헥산:EtOH를 사용하는 AD-H 250 mm x 4.6 mm x 5 ㎛ 칼럼).
제조예
9
(S)-2-(4-플루오로페닐)옥시란
(1S)-2-브로모-1-(4-플루오로페닐)에탄올 (1650 g, 7.53 mol)을 6.8 L의 메틸 tert-부틸 에테르에 용해시켰다. 혼합물이 20℃에 있는 동안 NaOH (H2O 중 2M; 4.93 L)를 첨가하였다. 혼합물을 20-22℃에서 유지하면서 3시간 동안 교반하였다. 층을 분리하고, 수성층을 메틸 tert-부틸 에테르 (1 x 2 L)로 추출하였다. 유기 상을 합하고, 유기 상을 염수 (1 x 2 L)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 여과물을 농축하여 잔류물을 수득하였다. 생성물을 용리시키기 위해 석유 에테르:EtOAc의 50:1 혼합물을 사용하는 실리카겔 플래시 칼럼 크로마토그래피를 통해 정제하였다. 생성물 분획을 농축하여 표제 화합물을 담황색 오일 (880 g, 84%)로서 수득하였다.
제조예
10
(1S)-2-(벤질아미노)-1-(4-플루오로페닐)에탄올
10 L 환저 플라스크를 질소 분위기하에 (S)-2-(4-플루오로페닐)옥시란 (880 g, 6.38 mol)으로 충전하였다. 혼합물을 20℃에서 유지하면서 벤질아민 (2047 g, 19.13 mol)을 첨가하였다. 혼합물을 80℃로 가열하고, 이를 그 온도에서 5시간 동안 교반하였다. 22℃로 냉각하고, 16시간 동안 교반하였다. H2O (3 L)를 첨가하여 반응을 켄칭하였다. 여과하고, 여과 케이크를 물 (2 x 1 L)로 세척하였다. 수득된 고체를 헵탄 (2 L)과 슬러리화하고, 여과하여 표제 화합물 (1216 g, 77%)을 수득하였다. MS (m/z): 246 (M+1); ee 값: 99.0% (1.0 mL/min의 유량으로 25℃에서 90:10 헥산 (0.02% 디에틸아민 함유):EtOH를 사용하는 AD-H 250 mm x 4.6 mm x 5 ㎛ 칼럼).
제조예
11
N-벤질-2-클로로-N-[(2S)-2-(4-플루오로페닐)-2-히드록시에틸]아세트아미드
(1S)-2-(벤질아미노)-1-(4-플루오로페닐)에탄올 (1215 g, 4.96 mol)을 12.15 L DCM에 용해시키고, 혼합물을 0℃로 냉각하였다. NaOH (H2O 중 1M, 5.46 L, 5.46 mol)를 30분에 걸쳐 첨가하였다. 혼합물을 0-3℃에서 유지하면서 10분 동안 격렬하게 교반한 다음, 온도를 6℃ 미만으로 유지하면서 4.86 L의 DCM 중 클로로아세틸 클로라이드 (616.5 g, 5.46 mol)의 용액을 1시간에 걸쳐 적가하였다. 혼합물을 0℃에서 1시간 동안 교반하고, 층을 분리하고, 수성 상을 DCM (1 x 2 L)으로 추출하였다. 유기 층 및 추출물을 합하고, 이를 10% 염산 (1.5 L), 물 (1.5 L) 및 1M NaOH (1 L)로 세척하였다. Na2SO4 상에서 건조시키고, 여과하였다. 여과물을 수집하고, 용매를 감압하에 제거하여 표제 화합물을 무색 오일 (1440 g, 90%)로서 수득하였다. MS (m/z): 322 (M+1).
제조예
12
(6S)-4-벤질-6-(4-플루오로페닐) 모르폴린-3-온
N-벤질-2-클로로-N-[(2S)-2-(4-플루오로페닐)-2-히드록시에틸]아세트아미드 (1440 g, 4.48 mol)를 tert-부틸 알콜 (14.5 L)에 첨가하고, 혼합물을 22℃에서 유지하면서 포타슘 tert-부톡시드 (753 g, 6.73 mol)를 조금씩 첨가하였다. 혼합물을 22℃에서 유지하고, 1.5시간 동안 교반하였다. 염화암모늄의 포화 수용액 (1306 g)을 첨가하여 반응을 켄칭하였다. 추가의 1시간 동안 교반한 다음, H2O (2 L)를 첨가하였다. EtOAc (2 x 10 L)로 추출하고, 추출물을 합하고, 추출물을 감압하에 농축하여 잔류물을 수득하였다. 잔류물을 EtOAc (20 L)에 재용해시키고, H2O (10 L)로 세척하였다. EtOAc 용액을 Na2SO4 상에서 건조시키고, 여과하였다. 여과물을 수집하고, 용매를 감압하에 제거하여 표제 화합물을 무색 오일 (1250 g, 98%)로서 수득하였다. MS (m/z): 286 (M+1).
제조예
13
(2S)-4-벤질-2-(4-플루오로페닐)모르폴린
질소 분위기하에, THF (22 L) 중 (6S)-4-벤질-6-(4-플루오로페닐) 모르폴린-3-온 (625 g, 2.19 mol)의 용액을, 온도를 20℃에서 유지하면서 THF 중 수소화알루미늄리튬 (THF 중 1M, 5.0 L, 5 mol)에 적가하였다. 혼합물을 70℃로 가열하고, 1.5시간 동안 교반하였다. 혼합물을 0℃로 냉각하고, H2O (200 mL)를 첨가하여 반응을 켄칭한 후, 수성 NaOH (4 M, 1.25 L), 이어서 H2O (600 mL)를 더 첨가하였다. 생성 혼합물을 30분 동안 교반하고, 여과하고, 고체를 EtOAc (10 L)로 세정하였다. 여과물을 수집하고, 이를 감압하에 농축하여 표제 화합물 (561 g, 94%)을 수득하였다. MS (m/z): 272 (M+1).
제조예
14
(2S)-2-(4-플루오로페닐)모르폴린 히드로클로라이드
(2S)-4-벤질-2-(4-플루오로페닐)모르폴린 (948 g, 3.5 mol)을 1,2-디클로로에탄 (17 L)에 용해시켰다. 혼합물을 70℃로 가열하고, 1-클로로에틸 클로로포르메이트 (1500 g, 10.5 mol)를 가열하면서 적가하였다. 혼합물을 3시간 동안 70℃에서 교반한 다음, 혼합물을 농축하여 잔류물을 수득하였다. 잔류물을 MeOH (10 L)에 용해시키고, 1시간 동안 교반하면서 70℃로 가열하였다. 용액을 감압하에 농축하여 잔류물을 수득하였다. 잔류물을 EtOAc (5 L)와 슬러리화하고, 여과하고, 고체를 EtOAc (1 L)로 세척하여 회백색 고체를 수득하였다. 고체를 10:1 EtOAc/MeOH (10:1; 3 L)와 슬러리화하고, 여과하고, 고체를 수집하여 표제 화합물을 백색 고체 (300 g)로서 수득하였다. 모액을 농축하여 추가 물질을 수득하였다. 이러한 물질을 EtOAc/MeOH (2:1; 1 L)의 혼합물과 슬러리화하고, 여과하여 추가로 105 g의 표제 화합물을 백색 고체로서 수득하였다. 생성물 배치(batch)를 혼합하여 표제 화합물 (405 g, 53%)을 수득하였다. MS (m/z): 182 (M-Cl). ee 값 100% (1.0 mL/min의 유량으로 25℃에서 90:10 헥산 (0.02% DEA 함유):에틸 알콜을 사용하는 AD-H 250 mm x 4.6 mm x 5 um 칼럼).
제조예
15
2-브로모-1-(2-이소프로폭시페닐)에탄온
1-(2-이소프로폭시페닐)에탄온 (1.0 g, 6 mmol)을 Et2O (25 mL)에 용해시키고, 혼합물을 주위 온도에서 어두운 곳에서 교반하면서 브로민 (0.3 mL, 6 mmol)을 적가하였다. 반응 혼합물을 포화 Na2CO3 수용액으로 세척하였다. 이를 MgSO4 상에서 건조시키고, 여과하고, 여과물을 수집하고, 휘발성 물질을 감압하에 제거하여 표제 화합물 (1.5 g, 83%)을 수득하였다. MS (m/z): 258 (M+1).
제조예
16
4-벤질-2-(2-클로로-4-플루오로-페닐)모르폴린
포름산 (98-100%; 0.30 mL, 8 mmol) 및 2-벤질아미노에탄올 (1.21 g, 8 mmol)을 합하고, 생성 혼합물을 빙조에서 냉각하였다. 2-브로모-1-(2-클로로-4-플루오로-페닐)에탄온 (1.0 g, 4 mmol)을 첨가하고, 혼합물을 환류 가열하고, 그 온도에서 20시간 동안 교반하였다. 혼합물을 DCM으로 희석하고, 포화 Na2CO3 수용액으로 세척하였다. 유기 상을 MgSO4 상에서 건조시키고, 여과하고, 여과물을 수집하고, 감압하에 농축하였다. 헥산 중 0-20% 메틸 3급-부틸 에테르의 구배로 용리시키는 플래시 칼럼 크로마토그래피를 통해 정제하였다. 생성물 분획을 합하고, 용매를 감압하에 제거하여 표제 화합물을 황색 오일 (1.22 g, 43%)로서 수득하였다. MS (m/z): 306 (M+1).
제조예
17
4-벤질-2-(2-이소프로폭시페닐)모르폴린
본질적으로 제조예 16의 방법에 의해 4-벤질-2-(2-이소프로폭시페닐)모르폴린을 제조하였다. MS m/z 312 (M+1)
제조예
18
2-(6-클로로-4-플루오로-시클로헥사-2,4-디엔-1-일)모르폴린
4-벤질-2-(2-클로로-4-플루오로-페닐)모르폴린 (529 mg, 1.73 mmol)을 DCM (2.5 mL)에 용해시켰다. 1-클로로에틸 클로로포르메이트 (1.25 g, 8.65 mmol)를 첨가하고, 80℃로 가열하고, 밤새 교반하였다. MeOH (2.5 mL)를 첨가하고, 3시간 동안 65℃에서 교반하였다. 감압하에 농축하고, MeOH 중 (2N NH3/MeOH)의 0-100% 구배로 용리시키는 SCX 크로마토그래피를 통해 정제하였다. 생성물 분획을 합하고, 용매를 감압하에 제거하여 표제 화합물을 백색 고체 (345 mg, 92%)로서 수득하였다. MS (m/z): 216 (M+1).
제조예
19
2-(2-이소프로폭시페닐)모르폴린
질소 분위기하에 4-벤질-2-(2-이소프로폭시페닐)모르폴린 (0.51 g, 2 mmol), 10% PdOH/탄소 (0.51 g, 10 mol%) 및 무수 암모늄 포르메이트 (0.53 g, 10 mmol)를 합하였다. 생성 혼합물을 환류 가열하고, 교반하였다. 박층 크로마토그래피를 통해 반응의 진행을 모니터링하였다. 완료 후, 반응 혼합물을 셀라이트®의 패드를 통해 여과하고, 여과물을 수집하고, 용매를 감압하에 제거하여 표제 화합물을 오일 (0.25 g, 63%)로서 수득하였다. MS (m/z): 433 (M+1).
제조예
20
N-[2-[2-브로모-1-(3-메톡시페닐)에톡시]에틸]-4-니트로-벤젠술폰아미드
에틸렌 옥시드 (11 mL, 220 mmol)를 0℃로 냉각된 DCM에 일시에 가한 다음, 1-메톡시-3-비닐벤젠 (7.09 g, 52.82 mmol)을 시린지를 통해 첨가하였다. 혼합물을 0℃에서 유지하면서 교반하였다. N-브로모숙신이미드 (9.4 g, 52.82 mmol) 및 4-니트로벤젠술폰아미드 (8.9 g, 44.02 mmol)를 첨가하였다. 플라스크를 호일로 싸고, 반응 혼합물을 주위 온도에서 유지하면서 20시간 동안 교반하였다. 감압하에 농축하고, 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하였다. 잔류물을 헥산 중 EtOAc의 5-40% 구배로 용리시키는 플래시 칼럼 크로마토그래피를 통해 정제하였다. 생성물 분획을 합하고, 용매를 감압하에 제거하여 표제 화합물을 암황색 오일 (14.22 g, 70.3%)로서 수득하였다. MS (m/z): 459 (M+1).
제조예
21
2-(3-메톡시페닐)-4-(4-니트로페닐)술포닐-모르폴린
N-[2-[2-브로모-1-(3-메톡시페닐)에톡시]에틸]-4-니트로-벤젠술폰아미드 (14.22 g, 30.96 moles)를 ACN (200 mL)에 용해시키고; 탄산칼륨 (6.42 g, 46.44 mmol)을 첨가하고, 혼합물을 환류 가열하였다. 혼합물을 환류하면서 3시간 동안 교반하였다. 생성 혼합물을 주위 온도로 냉각하고, 이를 EtOAc로 희석하였다. 셀라이트®를 통해 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하였다. 잔류물을 헥산 중 EtOAc의 50-80% 구배로 용리시키는 플래시 칼럼 크로마토그래피를 통해 정제하였다. 생성물 분획을 합하고, 용매를 감압하에 제거하여 표제 화합물을 오렌지색 고체 (11.2 g, 95.6%)로서 수득하였다. MS (m/z): 379 (M+1).
제조예
22
2-(3-메톡시페닐)모르폴린
2-(3-메톡시페닐)-4-(4-니트로페닐)술포닐-모르폴린 (11.2 g, 29.6 mmol)을 ACN (150 mL) 및 물 (2.67 mL)에 용해시켰다. LiOH (6.21 g, 147.99 mmol)를, 혼합물을 교반하면서 첨가한 후, 1-프로판티올 (13.42 mL, 147.99 mmol)을 첨가하였다. 혼합물을 주위 온도에서 25시간 동안 교반하였다. 혼합물을 EtOAc로 희석하고, 염수를 첨가하였다. EtOAc로 2회 추출하였다. 추출물을 수집하고, 감압하에 ~ 200 mL로 농축한 다음, 1N HCl로 3회 세척하였다. 수성 산 추출물을 합하고, 혼합물이 염기성이 될 때까지 Na2CO3를 첨가하였다. 염기성 용액을 EtOAc로 3회 추출하고, 추출물을 합하고, 추출물을 염수로 세척하고, Na2SO4 상에서 건조시켰다. 여과하고, 여과물을 수집하고, 용매를 감압하에 제거하여 잔류물을 수득하였다. 잔류물을 EtOAc, 이어서 (10%의 MeOH 중 2M NH3)/DCM의 5-100% 구배로 용리시키는 플래시 칼럼 크로마토그래피를 통해 정제하였다. 생성물 분획을 합하고, 용매를 감압하에 제거하여 표제 화합물을 황색 오일 (3.09 g, 15.99 mmol)로서 수득하였다. MS (m/z): 194 (M+1).
제조예
23
N-[(1R)-1-(4-아세틸페닐)에틸]메탄술폰아미드
시험관(tube)을 N-[(1R)-1-(4-브로모페닐)에틸]메탄술폰아미드 (29 g, 104 mmol), 부틸 비닐 에테르 (34.23 mL, 261 mmol), 팔라듐(II) 아세테이트 (14.04 g, 63 mmol), 비스-(1,3-디페닐포스피노)프로판 (52.7 g, 125 mmol) 및 탄산칼륨 (17.3 g, 125 mmol)으로 충전하였다. 시험관을 2분 동안 질소로 탈기한 다음, H2O (69.5 mL) 및 DMF (69.5 mL)를 첨가하였다. 시험관을 밀봉하고, 20시간 동안 110℃에서 교반하였다. 반응 혼합물을 주위 온도로 냉각하고, HCl (2N, 60 mL)을 첨가하였다. 혼합물을 10분 동안 주위 온도에서 교반하였다. 혼합물의 pH를 NaOH 펠릿을 사용하여 pH 7로 조정하고, DCM (220 mL)으로 희석하고, 셀라이트® 패드를 통해 여과하고, 여과물을 수성 K2CO3 (2 x 120 mL), 염수 (2 x 100 mL), 및 H2O (100 mL)로 순차적으로 세척하였다. 혼합물을 MgSO4 상에서 건조시키고, 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하였다. 잔류물을 헥산 중 EtOAc (0, 5, 10, 20, 30 및 최종적으로 40% EtOAc의 단계 구배)로 용리시키는 플래시 칼럼 크로마토그래피를 통해 정제하였다. 생성물 분획을 합하고, 용매를 감압하에 제거하여 표제 화합물 (17.6 g, 70.0%)을 황색 오일로서 수득하였다. MS (m/z): 242 (M+1).
제조예
24
N-[(1R)-1-[4-(1-히드록시에틸)페닐]에틸]메탄술폰아미드, 이성질체 2
N-[(1R)-1-(4-아세틸페닐)에틸]메탄술폰아미드 (15 g, 62 mmol)를 EtOH (155.4 mL)에 용해시키고, 빙조로 냉각하였다. 수소화붕소나트륨 (1.2 g, 31.1 mmol)을 첨가하고, 생성 혼합물을 2시간 동안 빙조에서 교반하였다. H2O (20 mL)로 반응을 켄칭하고, 감압하에 농축하였다. 잔류물을 EtOAc (90 mL) 및 H2O (50 mL)로 희석하였다. 층을 분리하고, 유기 층을 염수 (2 x 50 mL)로 세척하고, MgSO4 상에서 건조시키고, 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하였다. 크로마토그래피 조건 K (하기 참조)를 사용하여 이성질체를 정제하고 분리하여 제2 용리 이성질체를 표제 화합물 (2.01 g, 13%)로서 수집하였다. MS (m/z): 261 (M+18).
실시예
1
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드
질소 분위기하에, 22℃에서 (2S)-2-(4-플루오로페닐)모르폴린 히드로클로라이드 (29.5 g, 128.8 mmol)를 DCM (17 L)에 현탁시키고, 트리에틸아민 (35.89 mL, 257.5 mmol)을 첨가하였다. N-[(1R)-1-(4-포르밀페닐)에틸]메탄술폰아미드 (29.26 g, 128.8 mmol)를 첨가하고, 생성 용액을 30분 동안 교반하였다. 아세트산 (8.85 mL, 154.5 mmol), 이어서 소듐 트리아세톡시보로히드라이드 (86.17 g, 386.3 mmol)를 3개의 배치로 조금씩 첨가하였다. 3시간 동안 교반하고, 반응을 완료까지 LCMS를 통해 모니터링하였다. 중탄산나트륨의 포화 수용액 (259.31 mL)을 서서히 첨가함으로써 반응을 켄칭하여 pH 8을 갖는 용액을 수득하였다. 층을 분리하고, 수성층을 200 mL DCM으로 추출하였다. 유기 층을 합하고, 포화 중탄산나트륨, 물, 염수로 세척한 다음, MgSO4 상에서 건조시켰다. 여과하고, 여과물을 수집하고, 농축하여 잔류물을 수득하였다. 잔류물을 100% DCM 내지 DCM:MeOH (95:5)의 구배를 사용하는 실리카겔 플래시 칼럼 크로마토그래피를 통해 정제하였다. 생성물 분획을 합하고, 농축하여 표제 생성물을 농후한 황색 오일 (41 g, 81.13%)로서 수득하였다. MS (m/z): 393 (M+1)
실시예
2
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 말레에이트
방법 1:
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 (250.47 mg)를 EtOAc (10 mL)에 용해시켰다. 60℃에서 EtOAc (2 mL)에 용해된 말레산 (85 mg)을 첨가하였다. 주위 온도로 냉각하고, 혼합물을 30분 동안 교반하였다. 슬러리를 여과하고, EtOAc (5 mL)로 세정하였다. 여과 케이크를 수집하고 감압하에 건조시켜 표제 화합물을 고체 (280 mg, 97.7%)로서 수득하였다. MS (m/z): 393 (M-말레산+1).
방법 2:
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 (270 g)를 EtOAc (10 L)에 용해시켰다. 혼합물을 60℃로 가열하고, EtOAc (2.8 L) 중 말레산 (96 g, 1.1 eq)을 첨가하였다. 혼합물을 주위 온도로 냉각하고, 생성된 혼합물을 14시간 동안 교반하였다. 슬러리를 여과하고, 고체를 EtOAc (5 L)로 세정하고, 여과 케이크를 감압하에 건조시켰다. 고체를 5 부피의 EtOH (1.4 L)에 용해시키고, 90℃에서 가열하고, 물 (280 mL)을 첨가하였다. 혼합물을 1시간 동안 90℃에서 가열한 다음, 이를 밤새 주위 온도로 냉각하였다. 침전물을 여과하고, 40℃에서 진공 오븐에서 건조시켜 표제 화합물을 백색 고체 (256 g, 70%)로서 수득하였다. MS (m/z): 393 (M-말레산+1).
실시예
3
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 히드로클로라이드
N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 (50 g, 127.39 mmol)를 이소프로필 알콜 (200 mL)에 용해시켰다. HCl (디옥산 중 4M; 63.70 mL, 254.78 mmol)을 용액에 적가하고, 50분 동안 주위 온도에서 교반하였다. 휘발성 물질을 감압하에 제거하고, H2O (200 mL)를 첨가한 다음, 물을 증발시켰다. H2O (200 mL) 및 이소프로필 알콜 (100 mL)을 첨가하고, 총 부피 80 mL로 농축하였다. 생성된 농후한 슬러리를 여과하고, 고체를 H2O로 세척하고, 여과에 의해 수집하고, 여과 케이크를 55℃에서 감압하에 건조시켜 표제 화합물을 백색 고체 (40.6 g, 75%)로서 수득하였다. MS (m/z): 393 (M-Cl).
실시예
4
N-[(1R)-1-(4-{1-[(2S)2-(4-플루오로페닐)모르폴린-4-일]에틸}페닐)에틸]메탄술폰아미드 히드로클로라이드, 이성질체 1
본질적으로 실시예 3의 방법에 의해 N-[(1R)-1-(4-{1-[2-(4-플루오로페닐)모르폴린-4-일]에틸}페닐)에틸]메탄술폰아미드 히드로클로라이드, 이성질체 1을 제조하였다. MS (m/z) 407 (M-Cl)
실시예
5
N-[(1S)-1-(4-{[2-(2-클로로페닐)모르폴린-4-일]메틸}페닐)-2,2,2-트리플루오로에틸]메탄술폰아미드 히드로클로라이드, 이성질체 2
2-(2-클로로페닐)모르폴린, 옥살산 염 (200 mg, 0.696 mmol), 트리에틸아민 (193 μL, 1.39 mmol), N-[(1S)-2,2,2-트리플루오로-1-(4-포르밀페닐)-에틸]-메탄술폰아미드 (205.3 mg, 0.73 mmol) 및 DCM (15 mL)을 합하였다. 아세트산 (47.8 μL, 0.83 mmol) 및 소듐 트리아세톡시보로히드라이드 (465 mg, 2.09 mmol)를 첨가하고, 주위 온도에서 5시간 동안 교반하였다. 혼합물의 pH를 포화 NaHCO3 수용액을 사용하여 10으로 조정하였다. 가스 발생이 중단될 때까지 교반하고, 층을 분리하고, 수성 층을 DCM으로 2회 추출하였다. 유기 추출물을 합하고, 이를 염수로 세척하고, MgSO4 상에서 건조시켰다. 혼합물을 여과하고, 여과물을 수집하고, 이를 감압하에 농축하여 잔류물을 수득하였다. 잔류물을 10 g SCX 카트리지 상에서 정제하고, 카트리지를 DCM, 50% MeOH/DCM, 100% MeOH로 세척한 다음, MeOH 중 NH3 (2N)로 용리시켰다. 생성물 분획을 감압하에 농축하여 조 생성물을 오일로서 제공하였다. 오일을 조건 E (하기 참조)를 사용하는 키랄 HPLC를 통해 정제하여 유리 염기 (104 mg, 32.3%)를 제2 용리 이성질체로서 수득하였다. 1 mL DCM 중 유리 염기 (104 mg, 0.224 mmol)를 용해시키고, Et2O 중 HCl (2 M, 561.6 μL, 1.12 mmol)을 적가하였다. 5분 동안 주위 온도에서 교반한 다음, 용매를 감압하에 제거하여 표제 화합물 (99 mg, 88.2%)을 수득하였다. MS (m/z): 463 (M-Cl).
본질적으로 실시예 5의 방법에 의해 하기 화합물을 제조하였다. 표 1에서의 모든 하기 실시예는 키랄 출발 물질로부터 출발하고/거나 하기에 명시된 크로마토그래피 칼럼 및 조건을 사용하여 단일 이성질체로서 단리되었다. 분리는 유리 염기 또는 그의 염 형태를 사용하여 수행할 수 있었다.
실시예
17
N-[(1R)-1-[4-[1-[(2S) 2-(4-플루오로페닐)모르폴린-4-일]에틸]페닐]에틸]메탄술폰아미드, 이성질체 1
N-[(1R)-1-[4-(1-히드록시에틸)페닐]에틸]-메탄술폰아미드 이성질체 2 (420 mg, 1.73 mmol) 및 DCM (5 mL)을 합하였다. 혼합물을 0℃로 냉각하고, 이를 질소로 퍼징하였다. 아세틸 브로마이드 (295.8 μL, 3.45 mmol)를 첨가하고, 반응물을 0℃에서 유지하면서 10분 동안 교반하였다. 추가량의 아세틸 브로마이드 (519.5 μL, 6.90 mmol)를 첨가하고, 추가의 10분 동안 교반하였다. 반응물을 DCM으로 희석하고, 용매를 감압하에 증발시켜 잔류물을 수득하였다. 잔류물을 DMF (2 mL)에 용해시키고, (2S)-2-(4-플루오로페닐)모르폴린 히드로클로라이드 (71.1 mg, 0.327 mmol), K2CO3 (135.4 mg, 0.980 mmol)를 첨가하고, 밤새 주위 온도에서 교반하였다. 반응물을 여과하고, 여과물을 DCM, DCM/MeOH (1:1), MeOH, 및 최종적으로 2M NH3/MeOH의 용리 순서로 SCX 크로마토그래피를 사용하여 정제하였다. 생성물 분획을 합하고, 용매를 감압하에 제거하여 잔류물을 수득하였다. 잔류물을 역상 HPLC (엑스테라(XTerra) MS C18 칼럼, pH 8)를 통해 정제하여 제1 용리 이성질체 (이성질체 1)를 표제 화합물 (9.6 mg, 7.2%)로서 수집하였다. MS (m/z): 407 (M+1).
MOGAT
-2 억제 검정
인간 MOGAT-2에 대한 화합물의 시험관내 억제 활성을 본 검정에서 평가하였다. MOGAT-2는 장내 트리글리세리드 재합성 경로에서 올레오일 기를 올레오일-CoA로부터 모노올레오일-글리세롤 ("MAG")에 이동시켜 디올레오일-글리세롤 ("DAG")을 형성시킨다. 본 검정은 친수성 분자에 비해 소수성 분자를 선택적으로 추출하는 마이크로신트(Microscint) E 추출을 이용하여 14C-DAG로부터 14C-올레오일-CoA를 분리하였다.
유전자 조작된 곤충 SF9 세포는 인간 MOGAT-2를 발현한다. 프로테아제 억제제 (로슈(Roche) 카탈로그 번호 11873580001)와 함께 20 mM의 NaCl에서 세포 용해물을 제조하였다. 인간 MOGAT-2를 발현하는 SF9 세포를 20 x 2초 동안 15,000 rpm에서 균질화시켰다 (PT-3100 폴리트론). 균질액을 4℃에서 10분 동안 1000 g에서 원심분리하였다. 단백질 정량화 및 활성 시험을 위해 상청액을 분리관에 수집하였다. 글리세롤 모노올레에이트 기질 (스펙트럼 케미칼(Spectrum Chemical), CAS#25496-72-4)을 크로마토그래피로 정제하였다. 모노아실글리세롤 (MAG) 기질을 인지질 소포 (디올레오일 포스파티딜콜린 "DOPC")에서 제조하였다. MAG/DOPC 소포를 20 mM 농도의 총 지질 (MAG 및 DOPC)로 제조하였다. 총 지질에 대한 MAG의 상이한 몰비를 화합물 스크리닝 (8.9%)이나 화합물 동역학 연구 (2.6-40%)를 위해 제조하였다. 유리관에서 클로로포름 중 적절한 양의 정제된 MAG 및 DOPC (아반티 폴라 리피즈(Avanti Polar Lipids) # 850375C)를 혼합하였다. 후속적으로, N2 가스 스트림 하에 클로로포름을 증발시킨 다음, 30분 동안 감압하에 건조시켰다. 목적하는 총 지질 농도를 위해 적절한 양의 완충제 (트리스(Tris)-Cl pH 7.4, 250 mM 수크로스, 1 mM EDTA)를 건조된 MAG/DOPC 혼합물에 첨가하였다. MAG/DOPC 용액을 용액이 투명해질 때까지 초음파처리하였다. 동적 광 산란을 사용하여 소포 크기를 측정하여 균일성을 확인하였다.
검정 완충제는 100 mM 트리스, pH 7.5 (인비트로젠(Invitrogen) 15567-022), 11% DMSO, 250 mM 수크로스 (시그마(Sigma) S-0389), 1 mM EDTA, 및 완전 프로테아제 억제제 칵테일 (로슈 다이아그노스틱(Roche Diagnostic) 12454800)로 이루어졌다. 시험 화합물을 완충제에 기질 및 효소와 함께 첨가하였다. 반응에 관한 최종 농도는 0.016 mg/mL SF9 세포 추출물, 20 μM 올레오일-CoA (3.5 μM 14C-올레오일-CoA), 8.9:91.1 (몰비) MAG:DOPC로 구성된, 초음파처리된 소포 형태의 1.26 mM 총 지질이다. AESSM (12.5%의 100% 변성 EtOH; 11% DI H2O; 2.5% 1.0N NaOH; 59% 이소프로판올 (말린크로트(Mallinckrodt) 3031-08); 15% 헵탄 (옴니 솔브(Omni Solv) HX0078)) (부피 기준)을 첨가함으로써 실온에서 90분의 인큐베이션 후 반응을 중지하였다. 마이크로신트 E를 첨가한 다음, 플레이트를 밀봉하고, 실온에서 적어도 4시간의 평형 후 섬광 계수기 상에서 계수하였다. 농도 대 상대 MOGAT-2 활성을 플로팅함으로써 엑셀 피트(Excel Fit) 소프트웨어 (버전 4; 4-파라미터 비선형 로지스틱(4-parameter nonlinear logistic) 방정식 (어베이스 이퀘이션(ABase Equation) 205)을 사용하여 분석하는 데이터)를 사용하여 IC50 (최대 억제 절반에 이르는 농도)을 계산하였다.
본원에서 예시된 모든 화합물은 이러한 MOGAT-2 시험관내 검정에서 100 nM 미만의 IC50을 갖고, 실시예 2는 12 nM의 IC50을 나타냈다.
MOGAT
-2 세포 검정에서 억제 활성
세포 환경에서 인간 MOGAT-2에 대한 화합물의 억제 활성을 본 검정에서 평가하였다. 카코(Caco)-2는 인간 결장 암종 세포주이고 흔히 장 상피 세포를 위한 모델로서 사용된다. 카코-2는 MOGAT-2를 발현하지 않고, 따라서, 인간 MOGAT-2를 안정한 형질감염을 통해 세포주로 유전자 조작하였다. MAG 유사체, 2-O-헥사데실글리세롤 (HDG)은 가수분해되지 않기 때문이 이를 이용하여 세포의 MOGAT-2 활성을 검출하였고, 생성된 생성물을 질량 분광분석법으로 용이하게 모니터링하였다. 기질을 초음파처리된 소포 형태의 DOPC와의 혼합물로서 사용하여 세포에 전달하였다.
카코2 세포를 100 mm 접시에 시딩하여 24시간 후 완전 배지 (3/1 DMEM: F12 + 10% FBS + 20 mM HEPES + 겐타마이신) 중에서 80% 전면생장률이 되도록 하였다. 리포펙타민 2000 (인비트로젠)을 사용하여 세포를 hMOGAT-2 플라스미드 (MOGAT-2-pCDNA3.1-Hygro)로 형질감염시켰다. 형질감염 혼합물에 6시간 노출 후, 세포를 PBS 중에서 3회 세척한 다음, 배지를 첨가하였다. 세포를 추가의 18시간 인큐베이션 동안 인큐베이션하고, 세포를 트립신화하고, 이를 100 mm 접시 내로 연속하여 희석하였다. 완전 배지 + 400 ㎍/ml 히그로마이신을 첨가하고, 클론이 보일 때까지 인큐베이션하였다. 클론을 단리하고, 24개의 웰 접시에 옮기고, 전면생장으로 성장시켰다. 퀴아젠 RNA이지(Qiagen RNAeasy) 키트를 사용하여 이들 클론으로부터 RNA를 제조하였다. 7900 시퀀스 검출 시스템 (ABI) 상에서 ABI 목록화 검정 (HS00228262)을 사용하여 택맨(Taqman) 분석을 수행하였다. 염소 폴리클로날 항체 (산타 크루즈(Santa Cruz), SC-32392)를 사용하여 웨스턴 블롯 분석에 의해 이들 클론으로부터 용해물을 분석하여 MOGAT-2에 상응하는 38 kD 단백질의 인간 MOGAT-2 발현을 확인하였다.
2-O-헥사데실글리세롤 ("HDG", 바이오신스 케미스트리 앤드 바이올로지 (Biosynth Chemistry & Biology), # H-1806, 20 mg/ml의 562.7 μl) 및 DOPC (20 mg/ml의 14.3 ml)를 유리관에서 클로로포름 중에서 혼합하고, 먼저 N2 가스 하에 및 이어서 추가의 30분 동안 감압하에 건조시켰다. 20 ml의 완충제 (150 mM 트리스-Cl pH 7.4, 250 mM 수크로스, 1 mM EDTA)를 건조된 HDG/DOPC 혼합물에 용액이 투명해질 때까지 초음파처리하면서 첨가하였다. 카코2 세포를 밤새 37℃, 5% CO2에서 폴리-D-리신 코팅된 96-웰 플레이트 ("셀 플레이트")에 도말하였다. 성장 배지를 제거하고, 세포를 30분 동안 2% BSA (시그마)를 함유하는 DMEMF12 (3:1) 배지 (GIBCO(깁코) 93-0152DK)에서 시험 화합물로 전처리하였다. 세포를 4시간 동안 40 μM의 올레산 및 800 μM의 8.9:91.9 (몰비) HDG/DOPC를 함유하는 2% BSA DMEMF12 (3:1) 배지 중에서 한 시험 화합물로 처리하였다. 세포를 50 μl의 트립신 용액으로 트립신화하고, 50 μl의 PBS를 첨가하였다. 드라이 아이스 상에서 세포를 즉시 동결시키고, LC-MS 분석을 위해 -20℃에서 보관하였다. 세포를 클로로포름/메탄올로 다음과 같이 추출하였다: 세포를 2 ml 플레이트에 옮기고, 세포 플레이트를 200 μL 메탄올로 세척한 다음, 메탄올 세척액을 2 ml 플레이트에 옮기고, 세포 플레이트를 200 μL PBS로 다시 세척하고, PBS 세척액을 2 ml 플레이트에 옮겼다. 클로로포름 (400 μL)과 내부 표준 (19.52 ng/mL) DAG (15:0,15:0 (시그마)), D5-TAG (39.03 ng/mL) CDN (16,16,16)을 2 mL 플레이트에 첨가하였다. 밀봉된 2 mL 플레이트를 위 아래로 돌린 다음 (10x), 볼텍싱하고, 스피닝하였다. 2 mL 플레이트로부터 400 μL의 하부 층을 제거하고, 또 다른 플레이트 "최종 플레이트"의 웰에 첨가하였다. CHCl3:MeOH (400 μL 2:1)를 2 mL 플레이트에 첨가하였다. 밀봉된 2 mL 플레이트를 다시 위 아래로 돌린 다음 (10x), 볼텍싱하고, 스피닝하였다. 2 mL 플레이트로부터 220 μL의 하부 층을 제거하고, 최종 플레이트에 첨가하였다. 최종 플레이트를 건조시키고, 500 mL의 IPA로 재구성하였다. 최종 플레이트를 밀봉하고, 5분 동안 진탕시켰다. 최종 플레이트로부터 10 μl의 샘플을 시마드주(Shimadzu) 용매 전달 시스템에 인터페이스로 접속된, 10 μL 루프를 갖는 립(Leap) 오토 샘플러를 사용하여 60℃에서 유지시킨 할로 C8 칼럼 (2.1 x 50, 2.7 uL 입자 크기) 상으로 주입하였다. 채널을 모니터링하여 D5 C16 TAG 내부 표준뿐만 아니라 에테르 TAG, 및 C52 및 C54 천연 TAG에 대한 데이터를 수집하였다. 용매 A는 80/20 H2O/메탄올과 20 μM 아세트산암모늄이었다. 용매 B는 50/50 IPA/THF와 20 μM 아세트산암모늄이었다. 유량은 0.4 mL/분이었다. 세척 용매는 H2O/MeOH 및 DCM이었다. 엑스칼리버(Xcalibur) 소프트웨어를 사용하여 관심 피크의 영역을 추출하고, 데이터를 다음 식을 사용하는 엑셀로 이출하였다: (에테르 TAG의 면적/C54 천연 TAG의 면적) / IS의 면적. 이러한 비는 각각의 웰에서 세포 수의 변화량을 효과적으로 설명하는 것이다. 이러한 MOGAT-2 세포 기반 검정에 관한 결과를 하기 표 3에 제공하였다. MOGAT-2 세포 기반 검정의 결과는 표 3에 열거된 실시예가 세포 환경에서 인간 MOGAT-2를 억제함을 입증하는 것이다.
개의 오일
볼루스
모델에서의 약리학적 효과
소장에서 발견되는 MOGAT-2를 억제하는 것은 과도한 지방 섭취에 의해 유발된 고트리글리세리드혈증을 치료하는데 유용할 수 있다. TAG 흡수를 억제하는 예시된 화합물의 능력을 평가하기 위해, 21 마리의 수컷 비글개 (처리군당 n=7)를 각각의 연구를 위해 등록시키고, 각각의 개는 9 - 13 kg의 체중을 갖는 것으로 선택하였다. 개를 표준 광 주기 (12시간 명 및 12시간 암)로; 실온: 72 ± 8℉에서; 및 30% - 70% 상대 습도에서 케이지에 수용하였다. 연구 개시 이전에 16시간 동안 개를 금식시킨 다음, 금식된 개에게 비히클 (1% HEC, 0.25%, 트윈 80, 소포제) 또는 그 비히클 중 시험 화합물 중 하나를 투여하였다. 투여 후 1시간에 시간 0 샘플용으로 개를 채혈하였다 (경정맥으로부터 0.5 ml). 개에게 시간 0 샘플의 수집 직후 올리브 오일 (시그마 카탈로그 번호: O-1514, 5 ml/kg)을 투여하였다. 화합물 / 비히클 투여 후 1.5, 2, 3, 5, 7, 및 9시간에서 샘플을 얼음 위에 EDTA 관내로 수집하였다. 샘플을 15분 동안 9000 cpm에서 원심분리하고, 로슈 히타치(Roche Hitachi) 917을 사용하여 혈장의 총 트리글리세리드에 대해 분석하였다 (로슈 카탈로그 번호 1877771). 혈장 TAG18.1_18.1_18.1 측정을 위해, 샘플을 추출하고, 10 μL의 혈장을 사용하여 MOGAT-2 세포 검정에서 상기한 것과 유사하게 LC/MS/MS 분석을 수행하였다.
분석물은 TAG 18:1 18:1 18:1의 [M+NH4]+ 이온이었고, 이는 902.8 m/z의 질량을 갖고; 내부 표준은 D5 TAG 16:0 16:0 16:0이었고, 이는 829.8 m/z의 질량을 가졌다. TAG 18:1 18:1 18:1 상대량에서 902.8 m/z (TAG 18:1 18:1 18:1)의 603.5 m/z 딸 이온과 829.8 m/z (D5 TAG 16:0 16:0 16:0 내부 표준)의 556.5 m/z 딸 이온의 비의 변화를 보고하였다. 그래프패드 프리즘(Graphpad Prism)4를 사용하여 총 TAG AUC에서 기준선 TAG AUC를 감하여 순 혈장 TAG AUC를 계산하였다: (순 AUCTAG = 오일 볼루스 후 AUCTAG - 0시간에서 AUCTAG). 혈장 트리글리세리드의 퍼센트 억제를 다음과 같이 계산하였다: (순 TAG AUC의 오일 볼루스 군 평균 - 화합물 처리된 순 TAG AUC의 오일 볼루스 군 평균 / 순 TAG AUC의 오일 볼루스 군 평균) * 100. 최종 통계 분석은 대조군과의 비교를 위해 일원 아노바(One way Anova)의 던넷(Dunnett) 방법을 사용하였다. 모든 순 TAG AUC 값을 연구 내에 가변성을 제한하기 위해 비교용으로 순위가 매겨진 평균된 AUC로 변환시켰다. 생체내에서 MOGAT-2 활성을 억제하고 TAG 흡수를 감소시키는 본 발명의 예시된 화합물의 능력은 본 검정에 따라 추가로 평가될 수 있었다.
실시예 2를 30 mg/kg 용량에서 3개의 연구로 및 75 mg/kg 용량에서 2개의 연구로 이 모델에서 평가하였다. 그러한 연구로부터의 결과의 조합은 식후 트리글리세리드의 변동(excursion)에서 통계학상 유의한 (p< 0.05) 감소를 나타냈다. 결과는 다음과 같았다: 30 mg/kg PO에서 TAG 흡수의 43% 억제 (18.1 TAG의 45%) 및 75 mg/kg PO에서 TAG 흡수의 64% 억제 (18.1 TAG의 63%).
본 발명의 예시된 화합물은, 예컨대 문헌 [Remington's Pharmaceutical Sciences, Gennaro, Ed., Mack Publishing Co. Easton Pa. 1990]에 수록된 관례에 따라 제약 조성물로 용이하게 제제화될 수 있다. 담당의 또는 다른 의료인은 필요로 하는 개인의 치료를 위한, 특히 고트리글리세리드혈증의 치료를 위한 화합물의 유효량을 결정할 수 있을 것이다. 바람직한 제약 조성물은 경구 투여를 위해 정제 또는 캡슐로 제제화될 수 있다. 정제 또는 캡슐은 본 발명의 화합물을 치료를 필요로 하는 환자를 치료하기 위한 유효량으로 포함할 수 있다.
Claims (19)
- 제1항에 있어서, R1이 -CH3인 화합물.
- 제1항에 있어서, R1이 -CF3인 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R2가 H인 화합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, R3이 H인 화합물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, R4가 H 및 할로겐으로부터 선택되는 것인 화합물.
- 제1항 내지 제6항 중 어느 한 항에 있어서, R5가 H, -CF3, F 및 Cl로부터 선택되는 것인 화합물.
- 제1항 내지 제6항 중 어느 한 항에 있어서, R5가 H인 화합물.
- 제1항 내지 제8항 중 어느 한 항에 있어서, R6이 F인 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 제약상 허용되는 염이 클로라이드 염 및 말레에이트 염으로부터 선택되는 것인 화합물.
- 제11항에 있어서, 제약상 허용되는 염이 말레에이트 염인 화합물.
- N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 히드로클로라이드인 화합물.
- N-[(1R)-1-(4-{[(2S)-2-(4-플루오로페닐)모르폴린-4-일]메틸}페닐)에틸]메탄술폰아미드 말레산인 화합물.
- 제1항 내지 제14항 중 어느 한 항에 따른 화합물 및 1종 이상의 제약상 허용되는 담체, 희석제 또는 부형제를 포함하는 제약 조성물.
- 고트리글리세리드혈증의 치료를 필요로 하는 환자에게 유효량의 제1항 내지 제14항 중 어느 한 항에 따른 화합물을 투여하는 것을 포함하는, 상기 환자를 치료하는 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 요법에서 사용하기 위한 화합물.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 고트리글리세리드혈증의 치료에서 사용하기 위한 화합물.
- 고트리글리세리드혈증을 치료하는 의약의 제조에 있어서 제1항 내지 제14항 중 어느 한 항에 따른 화합물의 용도.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12382037.5 | 2012-01-31 | ||
| EP12382037 | 2012-01-31 | ||
| US201261617093P | 2012-03-29 | 2012-03-29 | |
| US61/617,093 | 2012-03-29 | ||
| EP12382433.6 | 2012-11-06 | ||
| EP12382433 | 2012-11-06 | ||
| PCT/US2013/022828 WO2013116065A1 (en) | 2012-01-31 | 2013-01-24 | Novel morpholinyl derivatives useful as mogat-2 inhibitors |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140107641A true KR20140107641A (ko) | 2014-09-04 |
Family
ID=48905712
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147021129A KR20140107641A (ko) | 2012-01-31 | 2013-01-24 | Mogat-2 억제제로서 유용한 신규 모르폴리닐 유도체 |
Country Status (24)
| Country | Link |
|---|---|
| US (1) | US8993568B2 (ko) |
| EP (1) | EP2809661B1 (ko) |
| JP (1) | JP5852269B2 (ko) |
| KR (1) | KR20140107641A (ko) |
| CN (1) | CN104080777B (ko) |
| AP (1) | AP2014007793A0 (ko) |
| AU (1) | AU2013215549B2 (ko) |
| BR (1) | BR112014018712A8 (ko) |
| CA (1) | CA2859992A1 (ko) |
| CL (1) | CL2014001862A1 (ko) |
| CO (1) | CO7020914A2 (ko) |
| CR (1) | CR20140325A (ko) |
| DO (1) | DOP2014000177A (ko) |
| EA (1) | EA024182B1 (ko) |
| ES (1) | ES2571577T3 (ko) |
| GT (1) | GT201400169A (ko) |
| HK (1) | HK1199024A1 (ko) |
| IL (1) | IL233542A0 (ko) |
| MX (1) | MX2014008604A (ko) |
| PE (1) | PE20141789A1 (ko) |
| PH (1) | PH12014501712A1 (ko) |
| SG (1) | SG11201404508XA (ko) |
| WO (1) | WO2013116065A1 (ko) |
| ZA (1) | ZA201405227B (ko) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2807147A1 (en) | 2012-01-23 | 2014-12-03 | Eli Lilly and Company | Phenyl methanesulfonamide derivatives useful as mgat - 2 inhibitors |
| PE20141789A1 (es) | 2012-01-31 | 2014-11-19 | Lilly Co Eli | Nuevos derivados de morofolinilo utiles como inhibidores de mogat-2 |
| TW201343629A (zh) | 2012-01-31 | 2013-11-01 | Lilly Co Eli | 可作為mogat-2抑制劑之新穎芐磺醯胺衍生物 |
| AU2013341584A1 (en) | 2012-11-06 | 2015-04-30 | Eli Lilly And Company | Novel benzyl sulfonamide compounds useful as MoGAT-2 inhibitors |
| EP3395798A4 (en) | 2015-12-21 | 2019-07-17 | Shionogi & Co., Ltd | NON-AROMATIC HETEROCYCLIC DERIVATIVE HAVING MGAT2 INHIBITORY ACTIVITY |
| TWI782056B (zh) | 2017-07-14 | 2022-11-01 | 日商鹽野義製藥股份有限公司 | 具有mgat2抑制活性的縮合環衍生物 |
| WO2020145369A1 (ja) | 2019-01-11 | 2020-07-16 | 塩野義製薬株式会社 | Mgat2阻害活性を有するジヒドロピラゾロピラジノン誘導体 |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5889006A (en) | 1995-02-23 | 1999-03-30 | Schering Corporation | Muscarinic antagonists |
| GB9702194D0 (en) | 1997-02-04 | 1997-03-26 | Lilly Co Eli | Sulphonide derivatives |
| CA2338994A1 (en) | 1998-07-31 | 2000-02-10 | Paul Leslie Ornstein | Sulfonamide derivatives |
| WO2000006539A1 (en) | 1998-07-31 | 2000-02-10 | Eli Lilly And Company | Alkenyl sulphonamide derivatives |
| GB0408777D0 (en) | 2004-04-20 | 2004-05-26 | Glaxo Group Ltd | Compounds |
| EP1655283A1 (en) | 2004-11-08 | 2006-05-10 | Evotec OAI AG | 11beta-HSD1 Inhibitors |
| EP1659113A1 (en) | 2004-11-08 | 2006-05-24 | Evotec AG | Inhibitors of 11beta-hydroxy steroid dehydrogenase type 1 (11beta-HSD1) |
| EP2078719A4 (en) | 2006-09-28 | 2009-11-11 | Dainippon Sumitomo Pharma Co | COMPOUND WITH BICYCLIC PYRIMIDINE STRUCTURE AND THE COMPOUND CONTAINING PHARMACEUTICAL COMPOSITION |
| TW200831092A (en) * | 2006-12-21 | 2008-08-01 | Astrazeneca Ab | Therapeutic agents |
| AU2008333111A1 (en) * | 2007-12-05 | 2009-06-11 | Astrazeneca Ab (Publ) | Morpholine derivates as antiobesity agents |
| CA2709784A1 (en) | 2007-12-21 | 2009-07-09 | University Of Rochester | Method for altering the lifespan of eukaryotic organisms |
| WO2009119726A1 (ja) | 2008-03-28 | 2009-10-01 | 萬有製薬株式会社 | メラニン凝集ホルモン受容体拮抗作用を有するジアリールメチルアミド誘導体 |
| AU2009254547A1 (en) * | 2008-06-04 | 2009-12-10 | Astrazeneca Ab (Publ) | New compounds V |
| JP2012518597A (ja) | 2009-02-23 | 2012-08-16 | Msd株式会社 | ピリミジン−4(3h)−オン誘導体 |
| JP2014051434A (ja) | 2010-12-28 | 2014-03-20 | Dainippon Sumitomo Pharma Co Ltd | 二環性ピリミジン誘導体 |
| EP2807147A1 (en) | 2012-01-23 | 2014-12-03 | Eli Lilly and Company | Phenyl methanesulfonamide derivatives useful as mgat - 2 inhibitors |
| TW201343629A (zh) | 2012-01-31 | 2013-11-01 | Lilly Co Eli | 可作為mogat-2抑制劑之新穎芐磺醯胺衍生物 |
| PE20141789A1 (es) | 2012-01-31 | 2014-11-19 | Lilly Co Eli | Nuevos derivados de morofolinilo utiles como inhibidores de mogat-2 |
| AU2013341584A1 (en) | 2012-11-06 | 2015-04-30 | Eli Lilly And Company | Novel benzyl sulfonamide compounds useful as MoGAT-2 inhibitors |
-
2013
- 2013-01-24 PE PE2014001194A patent/PE20141789A1/es not_active Application Discontinuation
- 2013-01-24 WO PCT/US2013/022828 patent/WO2013116065A1/en active Application Filing
- 2013-01-24 KR KR1020147021129A patent/KR20140107641A/ko active IP Right Grant
- 2013-01-24 CN CN201380007113.8A patent/CN104080777B/zh not_active Expired - Fee Related
- 2013-01-24 EA EA201491227A patent/EA024182B1/ru not_active IP Right Cessation
- 2013-01-24 ES ES13702564T patent/ES2571577T3/es active Active
- 2013-01-24 CA CA2859992A patent/CA2859992A1/en not_active Abandoned
- 2013-01-24 EP EP13702564.9A patent/EP2809661B1/en active Active
- 2013-01-24 US US14/372,833 patent/US8993568B2/en not_active Expired - Fee Related
- 2013-01-24 AP AP2014007793A patent/AP2014007793A0/xx unknown
- 2013-01-24 AU AU2013215549A patent/AU2013215549B2/en not_active Ceased
- 2013-01-24 MX MX2014008604A patent/MX2014008604A/es unknown
- 2013-01-24 JP JP2014554806A patent/JP5852269B2/ja not_active Expired - Fee Related
- 2013-01-24 BR BR112014018712A patent/BR112014018712A8/pt not_active IP Right Cessation
- 2013-01-24 SG SG11201404508XA patent/SG11201404508XA/en unknown
-
2014
- 2014-07-07 IL IL233542A patent/IL233542A0/en unknown
- 2014-07-08 CR CR20140325A patent/CR20140325A/es unknown
- 2014-07-15 CL CL2014001862A patent/CL2014001862A1/es unknown
- 2014-07-16 ZA ZA2014/05227A patent/ZA201405227B/en unknown
- 2014-07-24 CO CO14161421A patent/CO7020914A2/es unknown
- 2014-07-29 GT GT201400169A patent/GT201400169A/es unknown
- 2014-07-30 PH PH12014501712A patent/PH12014501712A1/en unknown
- 2014-07-30 DO DO2014000177A patent/DOP2014000177A/es unknown
- 2014-12-11 HK HK14112464.6A patent/HK1199024A1/zh not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| IL233542A0 (en) | 2014-08-31 |
| US20150005305A1 (en) | 2015-01-01 |
| HK1199024A1 (zh) | 2015-06-19 |
| AU2013215549A1 (en) | 2014-07-17 |
| EP2809661A1 (en) | 2014-12-10 |
| JP2015504917A (ja) | 2015-02-16 |
| EA024182B1 (ru) | 2016-08-31 |
| BR112014018712A2 (ko) | 2017-06-20 |
| SG11201404508XA (en) | 2014-10-30 |
| CO7020914A2 (es) | 2014-08-11 |
| CN104080777A (zh) | 2014-10-01 |
| CN104080777B (zh) | 2015-12-09 |
| EA201491227A1 (ru) | 2015-01-30 |
| ZA201405227B (en) | 2016-05-25 |
| AP2014007793A0 (en) | 2014-07-31 |
| JP5852269B2 (ja) | 2016-02-03 |
| DOP2014000177A (es) | 2014-08-31 |
| CL2014001862A1 (es) | 2014-11-14 |
| GT201400169A (es) | 2015-08-27 |
| EP2809661B1 (en) | 2016-04-06 |
| CR20140325A (es) | 2014-08-25 |
| PH12014501712B1 (en) | 2014-10-13 |
| AU2013215549B2 (en) | 2015-09-03 |
| PE20141789A1 (es) | 2014-11-19 |
| MX2014008604A (es) | 2014-08-22 |
| PH12014501712A1 (en) | 2014-10-13 |
| WO2013116065A1 (en) | 2013-08-08 |
| ES2571577T3 (es) | 2016-05-26 |
| BR112014018712A8 (pt) | 2017-07-11 |
| US8993568B2 (en) | 2015-03-31 |
| CA2859992A1 (en) | 2013-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5852269B2 (ja) | Mogat−2阻害剤として有用な新規モルホリニル誘導体 | |
| JP7085566B2 (ja) | アポトーシス誘発剤 | |
| EP2513114B1 (en) | Pyrrolo[2,3-d]pyrimidine compounds | |
| KR20140106750A (ko) | Mogat-2 억제제로서 유용한 벤질 술폰아미드 유도체 | |
| KR20190026827A (ko) | 방향족 아세틸렌 또는 방향족 에틸렌계 화합물, 그의 중간체, 제조 방법, 약물 조성물 및 용도 | |
| KR101797046B1 (ko) | 중수소화된 페닐 아미노 피리미딘 화합물 및 이 화합물을 함유하는 약물 조성물 | |
| JP7173350B2 (ja) | Lpa1受容体を拮抗するウレア化合物 | |
| JP6407955B2 (ja) | クマリン誘導体、ならびに過剰増殖疾患を治療する際の使用方法 | |
| EP2807147A1 (en) | Phenyl methanesulfonamide derivatives useful as mgat - 2 inhibitors | |
| JP2018536667A (ja) | 重水素化されたBrigatinib誘導体、かかる誘導体を含む薬学的組成物、並びにそれらの使用 | |
| JP5635181B2 (ja) | ニトロイミダゾール系化合物、その製造方法および用途 | |
| EP2917194B1 (en) | Novel benzyl sulfonamide compounds useful as mogat-2 inhibitors | |
| JP2021509399A (ja) | インドールアミン−2,3−ジオキシゲナーゼ阻害剤およびその調製方法と使用 | |
| HUE025731T2 (en) | Chromone derivatives useful in the treatment of diseases mediated by TCR-NCK interaction | |
| WO1996028447A1 (fr) | Derives de pyrrolocarbazole | |
| KR101941794B1 (ko) | 아미노설포닐계 화합물, 이의 제조 방법 및 용도 | |
| CN109422753B (zh) | 一类具有抑制并降解酪氨酸蛋白激酶jak1或jak2活性的化合物 | |
| CN109748914B (zh) | 吡啶并嘧啶类化合物及其应用 | |
| JP2022115836A (ja) | Lpa1受容体を拮抗するウレア化合物を有効成分として含有する医薬 | |
| CN117567392A (zh) | 一种紫檀芪丹皮酚乙酸类化合物、其制备方法及医药用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |