KR20130100125A - 질환의 치료를 위한, IL-1β 및 IL-18에 대한 항체 - Google Patents
질환의 치료를 위한, IL-1β 및 IL-18에 대한 항체 Download PDFInfo
- Publication number
- KR20130100125A KR20130100125A KR1020137006238A KR20137006238A KR20130100125A KR 20130100125 A KR20130100125 A KR 20130100125A KR 1020137006238 A KR1020137006238 A KR 1020137006238A KR 20137006238 A KR20137006238 A KR 20137006238A KR 20130100125 A KR20130100125 A KR 20130100125A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- antibodies
- disease
- cells
- human
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
- C07K16/245—IL-1
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Diabetes (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Emergency Medicine (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Hematology (AREA)
- Endocrinology (AREA)
- Obesity (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 발명은 질환의 치료를 위한 조성물 및 방법에 관한 것이다. 보다 특히, 본 발명은 항-IL-1β 및 항-IL-18 항체 (항-IL-1β 및 항-IL-18 이중특이적 항체 포함), 및 이러한 항체를 사용하여 질환을 치료하는 방법에 관한 것이다.
Description
<관련 출원>
본 정식 출원은 2010년 8월 13일에 출원된 미국 가출원 일련번호 61/373,760을 우선권 주장하며, 그의 전체내용은 참고로 포함된다.
<발명의 분야>
본 발명은 일반적으로 항-IL-1β 및 항-IL-18 항체 (항-IL-1β 및 항-IL-18 이중특이적 항체 및 모노클로날 항체 포함), 및 질환의 치료를 위해 이러한 항체를 사용하는 방법에 관한 것이다.
시토카인의 인터류킨-1 (IL-1) 및 IL-18 패밀리는 기원 메카니즘, 수용체 구조, 및 이용되는 신호 전달 경로에 의해 관련된다. 이러한 시토카인은 전구체 분자로 합성되고, 세포로부터의 방출 이전에 또는 그 동안 효소 카스파제-1에 의해 절단된다. NALP-3 인플라마솜은 활성 카스파제-1을 생성하는데 결정적으로 중요하다 (문헌 [Cassel et al., 2009; Ferrero-Miliani et al., 2007]). IL-1 패밀리는 2가지 효능제, IL-1α 및 IL-1β, 특이적 억제제, IL-1 수용체 길항제 (IL-1Ra), 및 2가지 수용체, 생물학적 활성 유형 IL-1R 및 불활성 유형 II IL-1R을 함유한다 (문헌 [Arend et al., 2008]). IL-1RI 및 IL-33R은 둘 다 동일한 상호작용 보조 단백질 (IL-1RAcP)을 이용한다. IL-1 및 IL-1Ra 사이의 균형은 다양한 기관에서 질환을 예방하는데 중요하고, IL-1의 과잉 생산은 다수의 인간 질환과 관련된다. IL-18 패밀리는 또한 유체 상에서 IL-18에 결합하는 특이적 억제제, IL-18-결합 단백질 (IL-18BP)을 함유한다. IL-18 수용체는 단일 리간드-결합 쇄 및 다양한 상호작용 보조 단백질을 포함하는 IL-1 수용체 복합체와 유사하다. IL-18은 선천성 및 후천성 면역 반응 사이에 중요한 연결을 제공한다.
인플라마솜 활성화 및 IL-1β/IL-18 프로세싱 및 분비는 질환 진행에 관련될 수 있다. 전체 게놈 연관성 연구는 염증성 장 질환 (IBD)에서 인플라마솜에 대한 역할을 나타낸다. 인플라마솜-화합물 NALP-3에서 다형성을 갖는 환자는 보고된 바에 의하면 크론병에 대한 위험이 증가하였다 (문헌 [Ferrero-Miliani et al., 2007; Villani et al., 2009]). 또한, 카스파제-1 활성화 및 IL-1β/IL-18 프로세싱을 제어하는 자가포식 성분 Atg16l1 및 IRGM에서의 다형성은 보고된 바에 의하면 크론병에 연관된다 (문헌 [Baldassano et al., 2007; Cadwell et al., 2008; Kuballa et al., 2008; Saitoh et al., 2008]). 독자적인 연구는 IBD를 갖는 환자에서 IL-1β 및 IL-18의 증가된 혈청 수준을 보고하였다 (문헌 [Ludwiczek et al., 2005; Ludwiczek et al., 2004; Monteleone et al., 1999]). 인간에서의 연구는 추가로 전임상 연구에 의해 뒷받침된다. IL-18 또는 IL-1β의 차단은 보고된 바에 의하면 질환의 전임상 모델에서 임상 스코어의 개선으로 이어진다 (문헌 [Ten Hove et al., 2001]).
또한, 눈에서, 당뇨병성 망막병증을 갖는 환자에서의 IL-1β 수준이 증가한다고 보고되었다 (문헌 [Kowluru and Odenbach, 2004]).
<발명의 개요>
본 발명은 항-IL-1β 및 항-IL-18 항체 (예를 들어, 항-IL-1β 및 항-IL-18 이중특이적 항체 포함), 및 질환의 치료를 위해 이러한 항체를 사용하는 방법을 제공한다. 일부 실시양태에서, 항-IL-1β 및 항-IL-18 항체는 모노클로날 항체이고, 질환의 치료를 위해 환자에게 공동으로 또는 연속적으로 투여된다. 다른 실시양태에서, 항-IL-1β 및 항-IL-18은 이중특이적 항체이고, 질환의 치료를 위해 환자에게 투여된다. 일부 실시양태에서 질환은 인플라마솜-매개 질환, 예를 들어 인플라마솜이 활성화된 질환이다. 질환의 예는 면역 질환 및 자가면역 질환을 포함하고, 염증성 장 질환 (IBD), 연령-관련 황반 변성 (AMD) 및 제2형 당뇨병 (T2D)을 포함한다.
일부 실시양태에서, 본 발명의 항-IL-1β 및 항-IL-18 항체는 IL-1β 및/또는 IL-18의 활성을 차단하거나 중화시키고/거나, IL-1β 및/또는 IL-18에 결합한다. 일부 실시양태에서 이중특이적 항체는 IL-1β 및/또는 IL-18의 활성을 차단하거나 중화시키고/거나, IL-1β 및/또는 IL-18에 결합한다.
한 측면에서,
a. IL-1β/IL-18 이중특이적 항체; 또는
b. IL-1β 및 IL-18에 결합하는 항체; 또는
c. IL-1β에 결합하는 항체 및 IL-18에 결합하는 항체
의 유효량을 환자에게 투여하는 것을 포함하며, 여기서 상기 부분 a, b 또는 c의 항체 또는 항체들은 세포 또는 조직에서 IL-1β 및 IL-18 활성을 중화시키거나 차단할 수 있는 것인, 환자에서 질환을 치료하는 방법이 제공된다.
일부 실시양태에서, 방법에 사용되는 항체/항체들은 인간화된다. 일부 실시양태에서, 항체는 이중 작용 항체이다.
일부 실시양태에서, 방법은 항-IL-1β 항체 및 항-IL-18 항체를 포함하는 조합 치료를 이용한다. 한 실시양태에서, 적어도 하나의 항체는 모노클로날이다. 일부 실시양태에서, 각각의 항체는 모노클로날이다. 일부 실시양태에서, 부분 (c)의 항체들은 동시에 또는 연속적으로 제공된다. 일부 실시양태에서, 항체들은 1시간 내에 투여된다.
일부 실시양태에서, 치료할 질환은 면역 질환 또는 자가면역 질환 또는 염증성 또는 자가염증성 질환이다. 일부 실시양태에서, 질환은 인플라마솜-매개 질환이다. 일부 실시양태에서, 질환은 IL-1β 관련 질환 또는 IL-18 관련 질환 또는 IL-1β/IL-18β 질환이다.
일부 실시양태에서, 질환은 연령-관련 황반 변성 (AMD)이다. 일부 실시양태에서, 질환은 제2형 당뇨병 (T2D)이다. 일부 실시양태에서, 질환은 염증성 장 질환 (IBD)이다. 일부 실시양태에서, 질환은 크론병 (CD)이다. 일부 실시양태에서, 질환은 궤양성 결장염 (UC)이다. 일부 실시양태에서, 질환은 아테롬성동맥경화증이다. 일부 실시양태에서, 질환은 심장-대사 질환이다. 일부 실시양태에서, 질환은 섬유협착성 크론병이다.
일부 실시양태에서, 방법에 의해 치료될 환자는 항-TNF 요법에 반응하지 않은 것이다.
일부 실시양태에서, 환자에서 질환을 치료하는 방법은 IL-1β에 결합하는 모노클로날 항체 및 IL-18에 결합하는 모노클로날 항체의 유효량을 상기 환자에게 투여하는 것을 포함한다.
또 다른 측면에서, 세포 또는 조직을 IL-1β에 결합하는 모노클로날 항체 및 IL-18에 결합하는 모노클로날 항체와 접촉시켜 IL-1β 및/또는 IL-18 활성을 중화시키거나 차단하는 것을 포함하는, 세포 또는 조직에서 IL-1β 및/또는 IL-18 활성을 중화시키거나 차단하는 방법이 제공된다. 일부 실시양태에서, 항체는 공동으로 또는 연속적으로 투여된다. 일부 실시양태에서, 세포는 상기 IL-1β에 결합하는 모노클로날 항체 및 상기 IL-18에 결합하는 모노클로날 항체와 공동으로 또는 연속적으로 접촉한다.
또 다른 측면에서, IL-1β 및 IL-18 활성을 중화시키거나 차단하는 항체가 제공된다. 일부 실시양태에서, 항체는 이중특이적 항체이다. 일부 실시양태에서, 항체는 인간화된다. 일부 실시양태에서, 항체는 IL-1β 및 IL-18에 결합한다.
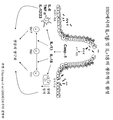
도 1은 IL-1β 및 IL-18에 대한 리간드 및 수용체의 예를 도시한다. 예를 들어, 신호전달은 IL-1β 또는 IL-18에 의한 2가지 수용체 쇄의 참여를 통해 개시될 수 있다. 세포내 톨-인터류킨 수용체-유사 (TIR) 도메인은 전사 인자 NF-kB 및 AP1의 활성화를 유도하며, 이들 인자는 이어서 시토카인 생산을 증가시켜 궁극적으로는 보호 면역, 자가염증성 장애 또는 만성 염증을 일으키는 것으로 생각된다.
도 2는 염증성 장 질환에서 IL-1β/IL-18 관여에 대한 가설 모델의 예를 도시한다. 장 미생물에 의한 고유판 대식세포의 자극은 카스파제-1의 자가촉매 활성화로 이어지고, 이 효소는 이어서 IL-1β 및 IL-18을 프로세싱 및 분비한다. IL-1β 및 IL-18은 다양한 면역 세포 상에서 작용하고, 대식세포에서 전-염증성 시토카인을 유도하고, T-세포를 Th1 및 Th17 병원성 T 세포에 대해 분극화시키고, 상피 장벽을 파괴하여, 보다 많은 병원체가 대식세포를 자극할 수 있도록 한다.
도 3은 유전학이 크론병에서 인플라마솜 활성화에 대한 역할을 어떻게 제안하는지에 대한 예를 도시한다. 자가포식-관련 유전자 ATG16L1 및 IRGM 및 인플라마솜 조절 유전자 NOD2 및 NALP3에서의 다형성은 IL-1β 및 IL-18의 카스파제-1 활성화 및 분비를 증가시킨다.
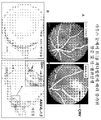
도 4 (A)는 IL-1β 및 IL-18 mRNA의 발현이 크론병 및 UC 환자로부터의 결장 생검에서 증가한다는 것을 보여주는 데이터이다. 값은 애질런트(Agilent) 유전자 플랫폼 상에서 혼성화 신호의 상대적 강도를 기반으로 한다. (B)는 IL-1β 및 IL-18이 크론병 및 UC를 갖는 환자로부터의 혈청에서 증가한다는 것을 보여주는 데이터이다.
도 5는 염증발생 결장에서 IL-1β 및 IL-18의 차등 발현을 보여주는 데이터이다. UC를 갖는 환자로부터의 결장 생검을 통한 단면 상에서의 면역조직화학. 섹션은 인간 IL-1β 및 IL-18에 대한 항체로 염색한다. IL-1β가 주로 경벽성 염증의 부위에 존재하는 대식세포에서 발견되는 반면, IL-18은 림프성 여포에 존재하는 수지상 세포에서 우세하게 발견된다. 둘 다의 경우에, 염색은 단지 염증 영역에서 관찰되었다.
도 6은 5일 동안 임의량의 음용수 중 3.5% DSS를 제공받은 마우스의 결장으로부터 IL-1β 및 IL-18의 증가된 분비를 보여주는 데이터이다.
도 7은 입양 전달된 CD4+CD45RBhi T 세포를 제공받은 마우스의 결장으로부터 IL-1β 및 IL-18의 증가된 분비를 보여주는 데이터이다.
도 8은 피록시캄으로 처리한 IL-10 KO 마우스의 결장으로부터 IL-1β 및 IL-18의 증가된 분비를 보여주는 데이터이다.
도 9는 IL-1R1 및 ASC KO 마우스가 중증도가 유의하게 감소된 DSS-유발 결장염을 나타낸다는 것을 보여주는 데이터이다. IL-1R1, IL-18Ra 및 ASC 결핍 마우스로부터의 결장 스코어.
도 10은 IL-1R1 결핍이 DSS-유발 결장염에서 IL-1β, IL-18, IL-17 및 TNF-알파의 유의한 감소로 이어진다는 것을 보여주는 데이터이다.
도 11은 IL-18R 결핍이 DSS-유발 결장염에서 IL-1β 및 IL-12p40의 수준의 유의한 감소로 이어진다는 것을 보여주는 데이터이다.
도 12는 ASC 결핍이 DSS-유발 결장염에서 IL-1β, IL-18, IL-12p40 및 IL-17의 수준의 유의한 감소로 이어진다는 것을 보여주는 데이터이다.
도 13은 다양한 마우스 IBD 모델로부터 수득한 생체외 결장 배양물에서의 예시적인 시토카인 반응의 개요이다.
도 14는 IL-1β가 AMD 환자의 하위집단의 유리체에서 발현된다는 것을 보여주는 데이터이다. 유리체는 습성 AMD, 지도형 위축 (GA)으로 진단된 환자 또는 황반 주름 또는 황반 원공을 갖는 환자로부터 수집하였다. 시토카인 수준은 ELISA 검정을 이용하여 결정하였다.
도 15는 일정한 광 노출에 따라 눈에서 증가된 IL-1β 및 카스파제-1 발현을 보여주는 데이터이다. (A)에서, 마우스를 10일 동안 일정한 광 (1800 룩스)에 노출시키고, 눈을 제거한 후에; (B)에서, mRNA를 망막으로부터 단리하고, IL-1β mRNA 수준을 실시간 PCR에 의해 결정하고; (C)에서, 전체 눈을 용해 완충제에서 균질화시키고, 세포 추출물을 SDS 겔 상에서 분리하고, 뮤린 카스파제-1에 대한 항체로 블롯팅 및 염색하였다.
도 16은 IL-1β-감염된 눈에서 프로-IL-1β 및 카스파제-1의 발현을 보여주는 데이터이다. 성숙 뮤린 IL-1β를 발현하는 아데노-연관 바이러스 (AAV)를 망막하 주사하였다. 3주 후에, 마우스를 6시간 동안 강한 광 (5000 룩스)에 노출시켰다 (ILE; 강한 광 노출). 눈은 도 15에 기재된 바와 같이 IL-1β 및 카스파제-1의 웨스턴 블롯 분석을 위해 1일 후에 처리하였다.
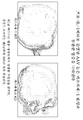
도 17은 마우스 눈에서 IL1β 과다발현에 따라 증가된 염증 및 신-혈관신생을 보여주는 데이터이다. (A)에서, 알비노 마우스에게 빈 AAV 바이러스 또는 IL-1β를 발현하는 바이러스를 망막하 주사하였다. 3주 후에, 마우스에게 FITC 용액을 주사하고, 그의 눈을 플루오레세인 혈관조영에 의해 스캐닝하였다. 화살표는 맥락막 신생혈관형성 (CNV)을 갖는 구역을 가리킨다. (B)에서, 눈을 파라핀 포매 및 구획화를 위해 제핵시키고, 고정시키고, 처리하였다. 섹션을 CD45에 대한 항체로 염색하여 침윤성 면역 세포를 시각화하였다 (삽도 참조). 염증은 빈 AAV 벡터를 망막하 주사한 마우스에는 존재하지 않았다.
도 18은 프로-IL-1β에 감염된 AAV 눈이 카스파제-1 활성과 무관한 염증을 나타낸다는 것을 보여주는 데이터이다. 카스파제-1 wt 또는 ko 마우스에게 도 17에 기재된 바와 같이 AAV-프로-IL-1β를 망막하 주사하였다. 3주 후에, 눈을 기재된 바와 같이 제핵시키고, 처리하였다. 염증은 카스파제-1 활성과 무관하게 진행되었다.
도 19는 AAV-IL1β 및 AAV-IL-18이 둘 다 암순응 ERG 반응을 유의하게 감소시킨다는 것을 보여주는 데이터이다. AAV-IL-1β 및 AAV-IL18로 처리한 마우스의 망막 전위도 (ERG)는 빈 벡터를 주사한 마우스와 비교하여 "a" 및 "b"-파 반응의 유의한 감소를 나타낸다.
도 20은 비인간 동물 (예를 들어, 마우스)에서의 전임상 연구에 사용하기 위한 및 인간 연구를 위한 임상 시약으로서의 항-IL-1β 및 항-IL-18 중화 항체를 개발하기에 유용한, AMD에서의 IL-1β 및 IL-18의 생물학의 개요이다.
도 21은 ELISA-기반 접근법을 이용하여 항-IL-1β 중화 항체를 스크리닝하는 방법의 예를 보여주는 데이터이다.
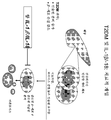
도 22는 햄스터 항-마우스 IL-1β 하이브리도마의 하위세트의 중화 활성을 보여주는 ELISA 검정이다.
도 23은 햄스터 항-마우스 항-IL-1β 항체의 차단 활성에 대한 IC50 값을 설명하는 표이다.
도 24는 인간 및 뮤린 IL-1β/IL-18의 중화 활성을 결정하는데 사용되는 세포주를 보여주는 데이터이다.
도 25는 (A) 증가하는 농도의 뮤린 IL-1β로 처리한 NIH3T3 세포주에서 NF-kB 리포터 활성의 용량-반응; 및 (B) IL-1β-중화 Ab를 함유하는 하이브리도마 상청액의 차단 활성을 보여주는 데이터이다.
도 26은 파지 기술에 의해 유래된 예시적인 항체의 개요이다. 중쇄 가변 영역 (VH) 또는 중쇄 및 경쇄 가변 영역 둘 다 (VHVL)에서 다양성을 갖는 다양한 파지 디스플레이 라이브러리를 스크리닝하였다. 또한, 티로신, 세린 및 글리신이 풍부한 코돈을 사용하여 무작위화 CDR을 생성하는 감소된 유전자 코돈 라이브러리인 합성 라이브러리 (YSGX) (문헌 [Fellouse et al., J Mol Biol, 373, 924-940]) 및 특정 펩티드 서열에 잠재적으로 결합하도록 설계된 항체 라이브러리인 펩티드 라이브러리를 스크리닝하였다.
도 27은 ELISA-기반 중화 검정에서 다양한 파지 항체의 잠금 활성을 보여주는 데이터이다.
도 28은 항-IL-1β/IL-18 중화 항체를 사용한 개입의 췌장 베타 세포 손실 및 잠재적 수준으로 이어지는 사건의 예시적인 순서를 도시하는 그림이다.
도 29는 실시예 4에서 사용되는 실험 프로토콜의 개략도이다.
도 30은 피록시캄 IL-10KO 마우스 IBD 모델에서 항-IL-1β 및/또는 항-IL18 처리의 (A) 조직학적 결장 스코어 결과 및 (B) 시각적 결장 스코어 결과를 보여주는 그래프이다. 또한, TNF-알파 차단의 결과를 보여준다. 항-IL-1β 및 항-IL18 조합 처리는 TNF 차단과 동등하게 효과적이었다.
도 2는 염증성 장 질환에서 IL-1β/IL-18 관여에 대한 가설 모델의 예를 도시한다. 장 미생물에 의한 고유판 대식세포의 자극은 카스파제-1의 자가촉매 활성화로 이어지고, 이 효소는 이어서 IL-1β 및 IL-18을 프로세싱 및 분비한다. IL-1β 및 IL-18은 다양한 면역 세포 상에서 작용하고, 대식세포에서 전-염증성 시토카인을 유도하고, T-세포를 Th1 및 Th17 병원성 T 세포에 대해 분극화시키고, 상피 장벽을 파괴하여, 보다 많은 병원체가 대식세포를 자극할 수 있도록 한다.
도 3은 유전학이 크론병에서 인플라마솜 활성화에 대한 역할을 어떻게 제안하는지에 대한 예를 도시한다. 자가포식-관련 유전자 ATG16L1 및 IRGM 및 인플라마솜 조절 유전자 NOD2 및 NALP3에서의 다형성은 IL-1β 및 IL-18의 카스파제-1 활성화 및 분비를 증가시킨다.
도 4 (A)는 IL-1β 및 IL-18 mRNA의 발현이 크론병 및 UC 환자로부터의 결장 생검에서 증가한다는 것을 보여주는 데이터이다. 값은 애질런트(Agilent) 유전자 플랫폼 상에서 혼성화 신호의 상대적 강도를 기반으로 한다. (B)는 IL-1β 및 IL-18이 크론병 및 UC를 갖는 환자로부터의 혈청에서 증가한다는 것을 보여주는 데이터이다.
도 5는 염증발생 결장에서 IL-1β 및 IL-18의 차등 발현을 보여주는 데이터이다. UC를 갖는 환자로부터의 결장 생검을 통한 단면 상에서의 면역조직화학. 섹션은 인간 IL-1β 및 IL-18에 대한 항체로 염색한다. IL-1β가 주로 경벽성 염증의 부위에 존재하는 대식세포에서 발견되는 반면, IL-18은 림프성 여포에 존재하는 수지상 세포에서 우세하게 발견된다. 둘 다의 경우에, 염색은 단지 염증 영역에서 관찰되었다.
도 6은 5일 동안 임의량의 음용수 중 3.5% DSS를 제공받은 마우스의 결장으로부터 IL-1β 및 IL-18의 증가된 분비를 보여주는 데이터이다.
도 7은 입양 전달된 CD4+CD45RBhi T 세포를 제공받은 마우스의 결장으로부터 IL-1β 및 IL-18의 증가된 분비를 보여주는 데이터이다.
도 8은 피록시캄으로 처리한 IL-10 KO 마우스의 결장으로부터 IL-1β 및 IL-18의 증가된 분비를 보여주는 데이터이다.
도 9는 IL-1R1 및 ASC KO 마우스가 중증도가 유의하게 감소된 DSS-유발 결장염을 나타낸다는 것을 보여주는 데이터이다. IL-1R1, IL-18Ra 및 ASC 결핍 마우스로부터의 결장 스코어.
도 10은 IL-1R1 결핍이 DSS-유발 결장염에서 IL-1β, IL-18, IL-17 및 TNF-알파의 유의한 감소로 이어진다는 것을 보여주는 데이터이다.
도 11은 IL-18R 결핍이 DSS-유발 결장염에서 IL-1β 및 IL-12p40의 수준의 유의한 감소로 이어진다는 것을 보여주는 데이터이다.
도 12는 ASC 결핍이 DSS-유발 결장염에서 IL-1β, IL-18, IL-12p40 및 IL-17의 수준의 유의한 감소로 이어진다는 것을 보여주는 데이터이다.
도 13은 다양한 마우스 IBD 모델로부터 수득한 생체외 결장 배양물에서의 예시적인 시토카인 반응의 개요이다.
도 14는 IL-1β가 AMD 환자의 하위집단의 유리체에서 발현된다는 것을 보여주는 데이터이다. 유리체는 습성 AMD, 지도형 위축 (GA)으로 진단된 환자 또는 황반 주름 또는 황반 원공을 갖는 환자로부터 수집하였다. 시토카인 수준은 ELISA 검정을 이용하여 결정하였다.
도 15는 일정한 광 노출에 따라 눈에서 증가된 IL-1β 및 카스파제-1 발현을 보여주는 데이터이다. (A)에서, 마우스를 10일 동안 일정한 광 (1800 룩스)에 노출시키고, 눈을 제거한 후에; (B)에서, mRNA를 망막으로부터 단리하고, IL-1β mRNA 수준을 실시간 PCR에 의해 결정하고; (C)에서, 전체 눈을 용해 완충제에서 균질화시키고, 세포 추출물을 SDS 겔 상에서 분리하고, 뮤린 카스파제-1에 대한 항체로 블롯팅 및 염색하였다.
도 16은 IL-1β-감염된 눈에서 프로-IL-1β 및 카스파제-1의 발현을 보여주는 데이터이다. 성숙 뮤린 IL-1β를 발현하는 아데노-연관 바이러스 (AAV)를 망막하 주사하였다. 3주 후에, 마우스를 6시간 동안 강한 광 (5000 룩스)에 노출시켰다 (ILE; 강한 광 노출). 눈은 도 15에 기재된 바와 같이 IL-1β 및 카스파제-1의 웨스턴 블롯 분석을 위해 1일 후에 처리하였다.
도 17은 마우스 눈에서 IL1β 과다발현에 따라 증가된 염증 및 신-혈관신생을 보여주는 데이터이다. (A)에서, 알비노 마우스에게 빈 AAV 바이러스 또는 IL-1β를 발현하는 바이러스를 망막하 주사하였다. 3주 후에, 마우스에게 FITC 용액을 주사하고, 그의 눈을 플루오레세인 혈관조영에 의해 스캐닝하였다. 화살표는 맥락막 신생혈관형성 (CNV)을 갖는 구역을 가리킨다. (B)에서, 눈을 파라핀 포매 및 구획화를 위해 제핵시키고, 고정시키고, 처리하였다. 섹션을 CD45에 대한 항체로 염색하여 침윤성 면역 세포를 시각화하였다 (삽도 참조). 염증은 빈 AAV 벡터를 망막하 주사한 마우스에는 존재하지 않았다.
도 18은 프로-IL-1β에 감염된 AAV 눈이 카스파제-1 활성과 무관한 염증을 나타낸다는 것을 보여주는 데이터이다. 카스파제-1 wt 또는 ko 마우스에게 도 17에 기재된 바와 같이 AAV-프로-IL-1β를 망막하 주사하였다. 3주 후에, 눈을 기재된 바와 같이 제핵시키고, 처리하였다. 염증은 카스파제-1 활성과 무관하게 진행되었다.
도 19는 AAV-IL1β 및 AAV-IL-18이 둘 다 암순응 ERG 반응을 유의하게 감소시킨다는 것을 보여주는 데이터이다. AAV-IL-1β 및 AAV-IL18로 처리한 마우스의 망막 전위도 (ERG)는 빈 벡터를 주사한 마우스와 비교하여 "a" 및 "b"-파 반응의 유의한 감소를 나타낸다.
도 20은 비인간 동물 (예를 들어, 마우스)에서의 전임상 연구에 사용하기 위한 및 인간 연구를 위한 임상 시약으로서의 항-IL-1β 및 항-IL-18 중화 항체를 개발하기에 유용한, AMD에서의 IL-1β 및 IL-18의 생물학의 개요이다.
도 21은 ELISA-기반 접근법을 이용하여 항-IL-1β 중화 항체를 스크리닝하는 방법의 예를 보여주는 데이터이다.
도 22는 햄스터 항-마우스 IL-1β 하이브리도마의 하위세트의 중화 활성을 보여주는 ELISA 검정이다.
도 23은 햄스터 항-마우스 항-IL-1β 항체의 차단 활성에 대한 IC50 값을 설명하는 표이다.
도 24는 인간 및 뮤린 IL-1β/IL-18의 중화 활성을 결정하는데 사용되는 세포주를 보여주는 데이터이다.
도 25는 (A) 증가하는 농도의 뮤린 IL-1β로 처리한 NIH3T3 세포주에서 NF-kB 리포터 활성의 용량-반응; 및 (B) IL-1β-중화 Ab를 함유하는 하이브리도마 상청액의 차단 활성을 보여주는 데이터이다.
도 26은 파지 기술에 의해 유래된 예시적인 항체의 개요이다. 중쇄 가변 영역 (VH) 또는 중쇄 및 경쇄 가변 영역 둘 다 (VHVL)에서 다양성을 갖는 다양한 파지 디스플레이 라이브러리를 스크리닝하였다. 또한, 티로신, 세린 및 글리신이 풍부한 코돈을 사용하여 무작위화 CDR을 생성하는 감소된 유전자 코돈 라이브러리인 합성 라이브러리 (YSGX) (문헌 [Fellouse et al., J Mol Biol, 373, 924-940]) 및 특정 펩티드 서열에 잠재적으로 결합하도록 설계된 항체 라이브러리인 펩티드 라이브러리를 스크리닝하였다.
도 27은 ELISA-기반 중화 검정에서 다양한 파지 항체의 잠금 활성을 보여주는 데이터이다.
도 28은 항-IL-1β/IL-18 중화 항체를 사용한 개입의 췌장 베타 세포 손실 및 잠재적 수준으로 이어지는 사건의 예시적인 순서를 도시하는 그림이다.
도 29는 실시예 4에서 사용되는 실험 프로토콜의 개략도이다.
도 30은 피록시캄 IL-10KO 마우스 IBD 모델에서 항-IL-1β 및/또는 항-IL18 처리의 (A) 조직학적 결장 스코어 결과 및 (B) 시각적 결장 스코어 결과를 보여주는 그래프이다. 또한, TNF-알파 차단의 결과를 보여준다. 항-IL-1β 및 항-IL18 조합 처리는 TNF 차단과 동등하게 효과적이었다.
<발명의 상세한 설명>
본 발명은 항-IL-1β 및 항-IL-18 항체 (예를 들어, 항-IL-1β 및 항-IL-18 이중특이적 항체 포함), 및 질환의 치료를 위해 이러한 항체를 사용하는 방법을 제공한다. 일부 실시양태에서, 항-IL-1β 및 항-IL-18 항체는 모노클로날 항체이고, 질환의 치료를 위해 환자에게 공동으로 또는 연속적으로 투여된다. 다른 실시양태에서, 항-IL-1β 및 항-IL-18은 이중특이적 항체이고, 질환의 치료를 위해 환자에게 투여된다. 질환의 예는 면역 질환 및 자가면역 질환을 포함하고, 염증성 장 질환 (IBD), 연령-관련 황반 변성 (AMD) 및 제2형 당뇨병 (T2D)을 포함한다.
일부 실시양태에서, 본 발명의 항-IL-1β 및 항-IL-18 항체는 IL-1β 및/또는 IL-18을 활성을 차단하거나 중화시키고/거나, IL-1β 및/또는 IL-18에 결합한다.
특허, 출원 및 과학 문헌을 비롯하여 본원에서 인용되는 모든 참고문헌은 그 전체내용이 본원에 참고로 포함된다.
<일반적 기술>
본원에 기재되거나 언급된 기술 및 절차는 일반적으로 널리 이해되고 있으며, 당업자에 의해 통상의 방법론, 예컨대 예를 들어 하기 문헌에 기재된 널리 이용되는 방법론을 이용하여 통상적으로 이용된다: 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (F. M. Ausubel, et al. eds., (2003)); the series Methods in Enzymology (Academic Press, Inc.): PCR 2: A Practical Approach (M. J. MacPherson, B. D. Hames and G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory Manual, and Animal Cell Culture (R. I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M. J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R. I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D. M. Weir and C. C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C. A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); 및 Cancer: Principles and Practice of Oncology (V. T. DeVita et al., eds., J.B. Lippincott Company, 1993)].
<정의>
본 명세서를 이해하기 위한 목적으로, 하기 정의가 적용될 것이고, 적절한 경우에는 언제라도 단수형으로 사용된 용어가 또한 복수형을 포함할 것이며, 그 반대의 경우도 마찬가지이다. 하기 열거된 임의의 정의가 본원에 참고로 포함된 임의의 문헌과 모순되는 경우에는 하기 열거된 정의가 우선된다.
본원에 언급된 분자 (예를 들어, 항체, 및 항체가 결합하는 분자)와 관련하여, "활성의" 또는 "활성"은 이러한 분자의 생물학적, 면역학적 및/또는 기능적 활성을 지칭한다. 예를 들어, 일부 실시양태에서, 본 발명의 항-IL-1β 및 항-IL-18 항체는 IL-1β 및 IL-18에 결합하여 결합 활성을 갖는 이중특이적 항체이다. 추가 실시양태에서, 본 발명의 항-IL-1β 및 항-IL-18 항체는 중화 또는 차단 활성을 갖고, 즉 이러한 항체는 IL-1β 및/또는 IL-18의 활성을 중화시키거나 차단할 수 있다.
"아피바디들" 또는 "아피바디"는 Fc 영역에 펩티드 결합에 의해 연결된 단백질의 사용을 지칭하고, 여기서 단백질은 스캐폴드로 이용되어 표적 분자에 대한 결합 표면을 제공한다. 결합 표면은 동일한 표적 분자 상에서 다른 표적 분자 또는 다른 에피토프에 결합할 수 있는 단백질의 라이브러리를 생성하기 위해 돌연변이유발을 통해 변경될 수 있다. 출발 단백질은 종종 자연 발생 단백질, 예컨대 스타필로코쿠스 단백질 A 또는 IgG-결합 B 도메인, 또는 이로부터 유래된 Z 단백질 (문헌 [Nilsson et al. (1987), Prot Eng 1, 107-133], 및 미국 특허 번호 5,143,844) 또는 그의 단편 또는 유도체이다. 예를 들어, 아피바디는 표적 분자(들)에 대해 변경된 결합 친화도를 갖는 Z 단백질 변이체로부터 생성될 수 있으며, 여기서 Z 단백질의 절편은 표적 분자에 결합할 수 있는 변이체의 라이브러리를 생성하기 위해 무작위 돌연변이유발에 의해 돌연변이된다. 아피바디의 예는 미국 특허 번호 6,534,628, 문헌 [Nord K et al., Prot Eng 8:601-608 (1995) 및 Nord K et al., Nat Biotech 15:772-777 (1997). Biotechnol Appl Biochem. 2008 Jun; 50(Pt 2):97-112]을 포함한다.
본원에서 용어 "항체"는 가장 넓은 의미로 사용되고, 자연 발생의 것이든 또는 조작된 것이든 임의의 이뮤노글로불린 (Ig) 분자, 및 원하는 생물학적 활성 (예를 들어, 에피토프 결합 활성)을 나타내는 한 그의 임의의 단편, 돌연변이체, 변이체 또는 유도체를 지칭한다. 항체의 예는 모노클로날 항체, 폴리클로날 항체, 다중특이적 항체, 항체 단편, 단일 도메인 항체, 옥토퍼스 항체 및 DVD 항체를 포함하나 이에 제한되지 않는다. 한 실시양태에서, 본 발명의 항체는 적어도 하나의 가변 도메인을 포함한다. 또 다른 실시양태에서, 본 발명의 항체는 이중특이적 항체이다.
일반적으로, 이뮤노글로불린은 중쇄 불변 도메인의 아미노산 서열에 따라 다양한 클래스로 배정된다. 이뮤노글로불린의 5개의 주요 클래스가 기재되어 있다: IgA, IgD, IgE, IgG 및 IgM. 이들은 서브클래스 (이소형), 예를 들어 IgG-1, IgG-2, IgA-1, IgA-2 등으로 추가로 분류될 수 있다. 각각의 이뮤노글로불린 클래스에 상응하는 중쇄 불변 도메인은 각각 IgA, D, E, G 및 M에 대해 α, δ, ε, γ 및 μ로 지칭된다. 이뮤노글로불린의 다양한 클래스의 서브유닛 구조 및 3차원 배위는 널리 공지되어 있고, 일반적으로 예를 들어 문헌 [Abbas et al., 2000, Cellular and Mol. Immunology, 4th ed]에 기재되어 있다. 항체는 하나 이상의 다른 단백질 또는 펩티드와 항체의 공유 또는 비-공유 회합에 의해 형성된 더 큰 융합 분자의 일부일 수 있다.
한 실시양태에서, 본 발명의 항체는 감소된 (보다 적은) 디술피드 연결부를 갖는다. 한 실시양태에서, 본 발명의 항체는 적어도 1개의 시스테인 잔기가 디술피드 연결부를 형성할 수 없게 된 힌지 영역을 포함하며, 여기서 디술피드 연결부는 바람직하게는 분자간 연결부, 바람직하게는 2개의 중쇄 사이의 연결부이다. 힌지 시스테인은 시스테인 잔기의 결실 또는 시스테인의 또 다른 아미노산으로의 치환을 포함하나 이에 제한되지 않는 당업계에 공지된 임의의 다양한 적합한 방법 (이들 중 일부는 본원에 기재됨)에 의해 디술피드 연결부를 형성할 수 없게 될 수 있다.
어구 "항-IL-1β 항체 및/또는 항-IL-18 항체/항체들"은 문맥에 따라 (1) 항-IL-1β 항체, 또는 (2) 항-IL-18 항체, 또는 (3) 항-IL-1β 항체 및 항-IL-18 항체 (즉, 2개의 항체)의 조합, 또는 (4) IL-1β 및 IL-18 둘 다에 결합하는 항체를 지칭한다.
"친화도 성숙" 항체는 변경(들)을 보유하지 않는 모 항체와 비교하여 항원에 대한 항체의 친화도가 개선된, 그의 하나 이상의 CDR에서 하나 이상의 변경을 갖는 것이다. 바람직한 친화도 성숙 항체는 표적 항원에 대해 나노몰 또는 심지어는 피코몰의 친화도를 가질 것이다. 친화도 성숙 항체는 공지된 절차에 의해 생산된다. 예를 들어, 가변 중쇄 (VH) 및 가변 경쇄 (VL) 도메인 셔플링에 의한 친화도 성숙을 기재한 문헌 [Marks et al., 1992, Biotechnology 10:779-783]을 참조한다. CDR 및/또는 프레임워크 잔기의 무작위 돌연변이유발이 예를 들어 문헌 [Barbas, et al. 1994, Proc. Nat. Acad. Sci, USA 91:3809-3813; Shier et al., 1995, Gene 169:147-155; Yelton et al., 1995, J. Immunol. 155:1994-2004; Jackson et al., 1995, J. Immunol. 154(7):3310-9; 및 Hawkins et al., 1992, J. Mol. Biol. 226:889-896]에 기재되어 있다.
"효능제 항체" 또는 "효능작용 항체"는 항원, 예컨대 수용체에 결합하고 이를 활성화시키는 항체이다. 일반적으로, 효능제 항체의 수용체 활성화 능력은 수용체의 천연 효능제 리간드의 것과 적어도 정성적으로 유사할 것이다 (및 본질적으로 정량적으로 유사할 수 있음).
"항체 단편"은 무손상 항체의 일부, 바람직하게는 무손상 항체의 항원 결합 또는 가변 영역을 포함하는 항체를 지칭한다. 항체 단편의 예는 Fab, Fab', F(ab')2 및 Fv 단편; 디아바디 (Db); 탠덤 디아바디 (taDb), 선형 항체 (미국 특허 번호 5,641,870, 실시예 2; 문헌 [Zapata et al., Protein Eng. 8(10):1057-1062 (1995)] 참조); 1-아암 항체, 미니바디, 단일-쇄 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체 (예를 들어, Db-Fc, taDb-Fc, taDb-CH3 및 (scFV)4-Fc를 포함하나 이에 제한되지 않음)를 포함한다.
일부 실시양태에서, 항체 단편은 오직 무손상 항체의 일부를 포함하며, 여기서 일부는 무손상 항체에 존재하는 경우에 그 일부와 정상적으로 연관된 기능 중 적어도 하나를 유지하고, 이러한 기능의 대부분 또는 전부를 유지할 수 있다. 또 다른 실시양태에서, 본 발명의 항체 단편은 디술피드 연결 능력이 감소된 중쇄, 예를 들어 중쇄간 디술피드 연결에 정상적으로 관련된 힌지 시스테인 중 적어도 1개가 본원에 기재된 바와 같이 변경된 중쇄의 이량체화 (또는 다량체화)를 허용하기에 충분한 불변 영역의 일부를 포함한다. 한 실시양태에서, 항체 단편은 무손상 항체의 항원 결합 부위 또는 가변 도메인을 포함하며, 따라서 항원을 결합하는 능력을 유지한다. 또 다른 실시양태에서, 항체 단편 (예를 들어, Fc 영역을 포함하는 것)은 무손상 항체에 존재하는 경우에 Fc 영역과 정상적으로 연관된 생물학적 기능, 예컨대 FcRn 결합, 항체 반감기 조절, ADCC 기능 및/또는 보체 결합 (예를 들어, 항체가 ADCC 기능 또는 보체 결합에 필요한 글리코실화 프로파일을 갖는 경우) 중 적어도 하나를 유지한다. 항체 단편의 예는 선형 항체; 단일-쇄 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체를 포함하나 이에 제한되지 않는다.
"항체-의존성 세포-매개 세포독성" 및 "ADCC"는 FcR (예컨대, 자연 킬러 (NK) 세포, 호중구 및 대식세포)를 발현하는 비특이적 세포독성 세포가 표적 세포 상에서 결합된 항체를 인식하고, 이후에 표적 세포의 용해를 일으키는 세포-매개 반응을 지칭한다. NK 세포 (ADCC를 매개하기 위한 일차 세포)는 오직 FcγRIII를 발현하는 반면에 단핵구는 FcγRI, FcγRII 및 FcγRIII를 발현한다. 조혈 세포 상에서의 FcR 발현은 문헌 [Ravetch et al., 1991, Annu. Rev. Immunol 9:457-92]의 페이지 464의 표 3에 요약된다. 관심 분자의 ADCC 활성을 평가하기 위해, 미국 특허 번호 5,500,362 또는 5,821,337에 기재된 바와 같은 시험관내 ADCC 검정을 수행할 수 있다. 이러한 검정에 유용한 이펙터 세포는 말초 혈액 단핵 세포 (PBMC) 및 자연 킬러 (NK) 세포를 포함한다. 대안적으로 또는 추가로, 관심 분자의 ADCC 활성은 생체내에서, 예를 들어 문헌 [Clynes et al., 1998, PNAS (USA) 95:652-656]에 개시된 바와 같은 동물 모델에서 평가할 수 있다.
용어 "항-IL-1β 항체" 및 "IL-1β에 결합하는 항체"는 항체가 IL-1β를 표적화하는데 진단제 및/또는 치료제로서 유용하도록 충분한 친화도로 IL-1β에 결합할 수 있는 항체를 지칭한다. 한 실시양태에서, 항-IL-1β 항체의 비관련 비-IL-1β 단백질에 대한 결합의 정도는, 예를 들어 방사성면역검정 (RIA)에 의해 측정된 바와 같이 IL-1β에 대한 항체의 결합의 약 10% 미만이다. 특정 실시양태에서, 항-IL-1β 항체는 다양한 종으로부터의 IL-1β 사이에서 보존된 IL-1β의 에피토프에 결합한다.
용어 "항-IL-18 항체" 및 "IL-18에 결합하는 항체"는 항체가 IL-18을 표적화하는데 진단제 및/또는 치료제로서 유용하도록 충분한 친화도로 IL-18에 결합할 수 있는 항체를 지칭한다. 한 실시양태에서, 항-IL-18 항체의 비관련 비-IL-18 단백질에 대한 결합의 정도는, 예를 들어 방사성면역검정 (RIA)에 의해 측정된 바와 같이 IL-18에 대한 항체의 결합의 약 10% 미만이다. 특정 실시양태에서, 항-IL-18 항체는 다양한 종으로부터의 IL-18 사이에서 보존된 IL-18의 에피토프에 결합한다.
본원에 사용된 "자가면역 질환"은 개체 자신의 조직으로부터 발생하고 이에 대해 지시된 비-악성 질환 또는 장애이다. 본원에 기재된 자가면역 질환은 구체적으로 악성 또는 암성 질환 또는 상태, 특히 B 세포 림프종, 급성 림프모구성 백혈병 (ALL), 만성 림프구성 백혈병 (CLL), 모발상 세포 백혈병 및 만성 골수모구성 백혈병을 제외한다. 자가면역 질환 또는 장애의 예는 연령-관련 황반 변성 (AMD), 염증 반응, 예컨대 염증성 피부 질환 (건선 및 피부염 포함) (예를 들어, 아토피성 피부염); 전신 경피증 및 경화증; 염증성 장 질환과 연관된 반응 (예컨대, 크론병 및 궤양성 결장염); 호흡 곤란 증후군 (성인 호흡 곤란 증후군; ARDS 포함); 피부염; 수막염; 뇌염; 포도막염; 결장염; 사구체신염; 알레르기 상태, 예컨대 습진 및 천식, 및 T 세포의 침윤 및 만성 염증 반응과 관련된 다른 상태; 아테롬성동맥경화증; 백혈구 부착 결핍; 류마티스 관절염; 전신 홍반성 루푸스 (SLE); 루푸스 신염 (LN); 당뇨병 (예를 들어, 제I형 당뇨병 또는 인슐린 의존성 당뇨병); 다발성 경화증; 레이노 증후군; 자가면역 갑상선염; 알레르기성 뇌척수염; 쇼그렌 증후군; 소아 발병 당뇨병; 및 결핵, 사르코이드증, 다발근염, 육아종증 및 혈관염에서 전형적으로 발견되는 시토카인 및 T-림프구에 의해 매개되는 급성 및 지연형 과민증과 연관된 면역 반응; 악성 빈혈 (애디슨병); 백혈구 누출과 관련된 질환; 중추 신경계 (CNS) 염증성 장애; 다발성 기관 손상 증후군; 용혈성 빈혈 (한랭글로불린혈증 또는 쿰스 양성 빈혈을 포함하나 이에 제한되지 않음); 중증 근무력증; 항원-항체 복합체 매개 질환; 항-사구체 기저막 질환; 항인지질 증후군; 알레르기성 신경염; 그레이브스병; 램버트-이튼 근무력 증후군; 수포성 유천포창; 천포창; 자가면역 다발성내분비병증; 라이터병; 강직-인간 증후군; 베체트병; 거대 세포 동맥염; 면역 복합체 신염; IgA 신병증; IgM 다발신경병증; 면역 혈소판감소성 자반증 (ITP) 또는 자가면역 혈소판감소증 등을 포함하나 이에 제한되지 않는다.
AMD는 장년층 사이에서 중증의 비가역적 시각 상실의 주요 원인이다 (예를 들어, 문헌 [Bressler (2004) JAMA 291:1900-01] 참조). 이는 광범위한 임상적 또는 병리학적 소견, 예를 들어 드루젠으로 알려진 연황색 반점, 망막 색소 상피 (RPE)의 파괴, 맥락막 신생혈관형성 (CNV) 및 원반 황반 변성을 특징으로 한다. 질환의 징후는 2가지 형태로 분류된다: 비-삼출성 (건성) 및 삼출성 (습성 또는 신생혈관). 최근에, 습성 AMD의 치료를 위한 여러 요법이 승인되었다 - 베르테포르핀 (비수딘(Visudyne)®)를 이용하는 광역학 요법; VEGF-결합 압타머, 페갑타닙 (마큐젠(Macugen)®); 및 항-VEGF 항체 단편, 라니비주맙 (루센티스(Lucentis)®).
본원에 사용된 "자가염증성 질환"은 유사한 특징, 특히 열을 공유하는 희귀 유전성 면역-매개 장애의 군을 지칭한다. 자가염증성 질환은 높은 역가의 자가항체, 감염 또는 항원-특이적 T 림프구의 부재 하에 재발된 원인불명의 염증을 특징으로 한다. 예시적인 자가염증성 질환은 가족성 지중해열 (FMF); 종양 괴사 인자 (TNF) 수용체-연관 주기열 증후군 (TRAPS); 고이뮤노글로불린혈증 D 및 주기열 증후군 (HIDS); 전신 발병 소아 특발성 관절염 (스틸병); 크리오피린-연관 주기성 증후군 (CAPS); 가족성 한랭 자가염증성 증후군; 머클-웰스 증후군; 인터류킨-1 수용체 길항제의 결핍 (DIRA); 및 신생아 발병 다계통 염증성 질환 (NOMID)/만성 영아 신경 피부 및 관절 (CINCA) 증후군을 포함하나 이에 제한되지 않는다.
자가면역 및 자가염증성 질환은 장애의 군이 둘 다 신체 자신의 조직을 공격하는 면역계로부터 나타나고, 또한 증가된 염증을 나타낸다는 공통적인 특성을 공유한다. 이들 둘 사이에 구별되는 특징은 자가염증성 질환에서의 (높은 역가에서의) 자가항체의 결핍이다.
"생물학적 활성" 또는 "기능적" 이뮤노글로불린은 구조, 조절, 생화학적 또는 생체물리학적 사건에서 그의 천연 활성 중 하나 이상을 발휘할 수 있는 것이다. 예를 들어, 생물학적 활성 항체는 항원에 특이적으로 결합하는 능력을 가질 수 있고, 결합은 세포 또는 분자 사건, 예컨대 신호 전달 또는 효소적 활성을 도출하거나 변경시킬 수 있다. 생물학적 활성 항체는 또한 수용체의 리간드 활성화를 차단할 수 있거나 또는 효능제 항체로 작용할 수 있다. 그의 천연 활성 중 하나 이상을 발휘하는 항체의 능력은 폴리펩티드 쇄의 적절한 폴딩 및 어셈블리를 포함하는 여러 인자에 따라 달라진다.
"결합 친화도"는 일반적으로 분자의 단일 결합 부위 (예를 들어, 항체) 및 그의 결합 파트너 (예를 들어, 항원) 사이의 비공유 상호작용의 총 합계의 강도를 지칭한다. 그의 파트너 Y에 대한 분자 X의 친화도는 일반적으로 해리 상수 (Kd)로 표시될 수 있다. 친화도는 본원에 기재된 것을 포함하여 당업계에 공지된 통상적인 방법에 의해 측정될 수 있다. 저-친화도 항체는 항원에 약하게 결합하고, 용이하게 해리되는 경향이 있는 반면, 고-친화도 항체는 항원에 보다 단단하게 결합하고, 보다 오랫 동안 결합된 상태로 유지된다.
"생물학적 분자"는 핵산, 단백질, 탄수화물, 지질 및 그의 조합을 지칭한다. 한 실시양태에서, 생물학적 분자는 자연에 존재한다.
"차단" 항체 또는 "길항제" 항체는 그가 결합하는 항원의 생물학적 활성을 억제하거나 감소시키는 것이다. 이러한 차단은 임의의 수단에 의해, 예를 들어 수용체에 대한 리간드 결합, 수용체 복합체 형성, 수용체 복합체에서의 티로신 키나제 수용체의 티로신 키나제 활성 및/또는 수용체에서의 또는 수용체에 의한 티로신 키나제 잔기(들)의 인산화를 방해함으로써 일어날 수 있다. 바람직한 차단 항체 또는 길항제 항체는 항원의 생물학적 활성을 실질적으로 또는 완전히 억제한다.
용어 "암" 및 "암성"은 전형적으로 조절되지 않는 세포 성장을 특징으로 하는 포유동물에서의 생리학적 상태를 지칭하거나 기재한다. 암의 예는 암종, 림프종, 모세포종, 육종 및 백혈병을 포함하나 이에 제한되지 않는다. 이러한 암의 보다 특정한 예는 편평세포암, 소세포 폐암, 비소세포 폐암, 폐의 선암종, 폐의 편평세포 암종, 복막암, 간세포성암, 위장암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 간세포암, 유방암, 결장암, 결장직장암, 자궁내막 또는 자궁 암종, 타액선 암종, 신장암, 간암, 전립선암, 외음부암, 갑상선암, 간 암종 및 다양한 유형의 두경부암을 포함한다.
용어 "키메라" 항체는 중쇄 및/또는 경쇄의 일부가 특정한 종으로부터 유래되거나 특정한 항체 클래스 또는 서브클래스에 속하는 항체에서의 상응하는 서열과 동일하거나 또는 이에 상동성인 한편, 쇄(들)의 나머지는 또 다른 종으로부터 유래되거나 또 다른 항체 클래스 또는 서브클래스에 속하는 항체에서의 상응하는 서열과 동일하거나 또는 이에 상동성인 항체, 뿐만 아니라 원하는 생물학적 활성을 나타내는 한 이러한 항체의 단편을 지칭한다 (예를 들어, 미국 특허 번호 4,816,567 및 문헌 [Morrison et al., 1984, Proc. Natl. Acad. Sci. USA 81:6851-6855] 참조).
본원에 사용된 표현 "세포", "세포주" 및 "세포 배양물"은 교환가능하게 사용되고, 모든 이러한 명칭은 자손을 포함한다. 따라서, 단어 "형질전환체" 및 "형질전환된 세포"는 일차 대상 세포 및 전달 횟수와 무관하게 그로부터 유래된 배양물을 포함한다. 의도적인 또는 우연한 돌연변이로 인해, DNA 함량에서 모든 자손이 정확하게 동일하지 않을 수 있음이 또한 이해된다. 본래 형질전환된 세포에서 스크리닝된 것과 동일한 기능 또는 생물학적 활성을 갖는 돌연변이체 자손이 포함된다. 별도의 명칭이 의도되는 경우에, 이는 문맥으로부터 명백할 것이다.
표현 "제어 서열"은 특정한 숙주 유기체에서 작동가능하게 연결된 코딩 서열의 발현에 필요한 DNA 서열을 지칭한다. 원핵생물에 적합한 제어 서열은 예를 들어 프로모터, 임의로는 오퍼레이터 서열 및 리보솜 결합 부위를 포함한다. 진핵 세포는 프로모터, 폴리아데닐화 신호 및 인핸서를 이용하는 것으로 공지되어 있다.
본원에 사용된 "당뇨병"은 동물에서 탄수화물, 지방 및 단백질 대사에 영향을 미치는 만성 장애이다. 당뇨병은 성인에서 실명, 신부전 및 하지 절단의 주요 원인이고, 심혈관 질환 및 졸중에 대한 주요 위험 인자이다. 제I형 당뇨병 (또는 인슐린-의존성 당뇨병 ("IDDM") 또는 소아 발병 당뇨병)은 모든 당뇨병 사례의 대략 10%를 포함한다. 질환은 췌장의 베타 세포에 의한 인슐린 분비 기능의 점진적인 손실을 특징으로 한다. 이러한 특성은 또한 췌장 질환에서 그의 기원을 갖는 비-특발성, 또는 "속발성" 당뇨병이 공유한다. 제I형 당뇨병은 하기 임상적 징후 또는 증상, 예를 들어 지속적으로 상승된 혈장 혈당 농도 또는 고혈당증; 다뇨; 번갈증 및/또는 과식증; 만성 미세혈관 합병증, 예컨대 망막병증, 신병증 및 신경병증; 및 실명, 말기 신질환, 사지 절단 및 심근경색으로 이어질 수 있는 대혈관 합병증, 예컨대 고지혈증 및 고혈압과 연관된다.
제II형 당뇨병 (비-인슐린-의존성 당뇨병 또는 NIDDM)은 글루코스 대사의 조절이상 및 손상된 인슐린 감수성과 관련된 대사 장애이다. 제II형 당뇨병은 통상적으로 성인기에서 발생하고, 신체가 충분한 인슐린을 이용하거나 생성하지 못하는 것과 연관된다. 표적 조직에서 관찰된 인슐린 저항성 뿐만 아니라, 제II형 당뇨병을 앓고 있는 환자는 상대적 인슐린 결핍을 가지며, 즉 환자는 주어진 혈장 혈당 농도에 대해 예측된 인슐린 수준보다 낮은 수준을 갖는다. 제II형 당뇨병은 하기 임상적 징후 또는 증상, 예를 들어 영구적으로 상승되는 혈장 혈당 농도 또는 고혈당증; 다뇨; 번갈증 및/또는 과식증; 만성 미세혈관 합병증, 예컨대 망막병증, 신병증 및 신경병증; 및 실명, 말기 신질환, 사지 절단 및 심근경색으로 이어질 수 있는 대혈관 합병증, 예컨대 고지혈증 및 고혈압을 특징으로 한다. 증후군 X (또한 인슐린 저항성 증후군 (IRS), 대사 증후군 또는 대사 증후군 X로 지칭됨)는 진단상 관상동맥 카테터삽입의 대략 2%에서 인식된다. 이는 종종 손상을 받으면 제II형 당뇨병 및 심혈관 질환 (예를 들어, 내당능 장애 (IGT), 공복 혈당 장애 (IFG), 고인슐린혈증, 인슐린 저항성, 이상지혈증 (예를 들어, 높은 트리글리세리드, 낮은 HDL), 고혈압 및 비만 포함)의 발생에 대한 증상 또는 위험 인자를 나타낸다.
"장애"는 치료 항체 또는 항체들을 사용한 치료로부터 이익을 얻을 임의의 상태이다. 이는 만성 및 급성 장애 또는 질환 (포유동물이 해당 장애에 걸리기 쉬운 병리학적 상태 포함)을 포함한다. 일부 실시양태에서, 장애는 암, 염증성, 면역, 자가염증성 또는 자가면역 질환이다.
"세포외 도메인"은 본원에서 세포의 외부에 있는 막횡단 폴리펩티드의 영역, 예컨대 FcR로 정의된다.
용어 "Fc 수용체" 또는 "FcR"은 항체의 Fc 영역에 결합하는 수용체를 기재하는데 사용된다.
용어 "Fc 영역"은 본원에서 천연 서열 Fc 영역 및 변이체 Fc 영역을 포함하는, 이뮤노글로불린 중쇄의 C-말단 영역을 정의하는데 사용된다. 한 실시양태에서, Fc 영역은 CH2 도메인 및/또는 CH3 도메인을 포함한다. 이뮤노글로불린 중쇄의 Fc 영역의 경계는 달라질 수 있지만, 인간 IgG 중쇄 Fc 영역은 통상적으로 위치 Cys226에서의 아미노산 잔기로부터, 또는 Pro230으로부터 그의 카르복실 말단까지의 스트레치로 정의된다. Fc 영역의 C-말단 리신 (EU 넘버링 시스템에 따른 잔기 447)은 예를 들어 항체의 생산 또는 정제 동안 또는 항체의 중쇄를 코딩하는 핵산의 재조합 조작에 의해 제거될 수 있다. 따라서, 무손상 항체의 조성물은 모든 K447 잔기가 제거된 항체 집단, K447 잔기가 제거되지 않는 항체 집단, 및 K447 잔기가 존재하는 항체와 존재하지 않는 항체의 혼합물을 갖는 항체 집단을 포함할 수 있다. 본원에 사용된 "Fc 복합체"는 2개의 CH2 도메인 및/또는 2개의 CH3 도메인을 지칭하며, 여기서 CH2 도메인 및/또는 CH3 도메인은 펩티드 결합이 아닌 상호작용을 통해 함께 결합된다.
"프레임워크 영역" (FR)은 CDR 잔기가 아닌 가변 도메인 잔기이다. 각각의 IgG 가변 도메인은 전형적으로 FR1, FR2, FR3 및 FR4로 확인되는 4개의 FR을 갖는다. CDR이 카바트에 따라 정의되는 경우에, 경쇄 FR 잔기는 약 잔기 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) 및 98-107 (LCFR4)에 위치하고, 중쇄 FR 잔기는 중쇄 잔기에서 약 잔기 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) 및 103-113 (HCFR4)에 위치한다. CDR이 초가변 루프로부터의 아미노산 잔기를 포함하는 경우에, 경쇄 FR 잔기는 경쇄에서 약 잔기 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) 및 97-107 (LCFR4)에 위치하고, 중쇄 FR 잔기는 중쇄 잔기에서 약 잔기 1-25 (HCFRI), 33-52 (HCFR2), 56-95 (HCFR3) 및 102-113 (HCFR4)에 위치한다. 일부 경우에, CDR이 카바트에 의해 정의된 바와 같은 CDR로부터의 아미노산 및 초가변 루프의 아미노산을 둘 다 포함하는 경우에는 FR 잔기가 그에 따라 조정될 것이다. 예를 들어, CDRH1이 아미노산 H26-H35를 포함하는 경우에, 중쇄 FR1 잔기는 위치 1-25에 존재하고 FR2 잔기는 위치 36-49에 존재한다.
"기능적 Fc 영역"은 천연 서열 Fc 영역의 "이펙터 기능"을 갖는다. 예시적인 "이펙터 기능"은 C1q 결합; 보체 의존성 세포독성; Fc 수용체 결합; 항체-의존성 세포-매개 세포독성 (ADCC); 식세포작용; 세포 표면 수용체 (예를 들어, B 세포 수용체, BCR)의 하향-조절 등을 포함한다. 이러한 이펙터 기능은 일반적으로 Fc 영역이 결합 도메인 (예를 들어, 항체 가변 도메인)과 조합되는 것을 필요로 하고, 예를 들어 본원에 개시된 바와 같은 다양한 검정을 이용하여 평가할 수 있다. "천연 서열 Fc 영역"은 자연에서 발견되는 Fc 영역의 아미노산 서열과 동일한 아미노산 서열을 포함한다. 천연 서열 인간 Fc 영역은 천연 서열 인간 IgG1 Fc 영역 (비-A 및 A 동종이형); 천연 서열 인간 IgG2 Fc 영역; 천연 서열 인간 IgG3 Fc 영역; 및 천연 서열 인간 IgG4 Fc 영역 뿐만 아니라 이들의 자연 발생 변이체를 포함한다. "변이체 Fc 영역"은 본원에 정의된 바와 같은 적어도 하나의 "아미노산 변형"을 통하여 천연 서열 Fc 영역과 상이한 아미노산 서열을 포함한다. 변이체 Fc 영역은 천연 서열 Fc 영역 또는 모 항체의 Fc 영역과 비교하여 적어도 1개의 아미노산 치환을 가질 수 있고, 예를 들어 천연 서열 Fc 영역 또는 모 항체의 Fc 영역 내에 약 1 내지 약 10개의 아미노산 치환 또는 약 1 내지 약 5개의 아미노산 치환을 가질 수 있다. 변이체 Fc 영역은 천연 서열 Fc 영역 및/또는 모 항체의 Fc 영역과 적어도 약 80%의 동일성을 보유할 수 있으며, 이와 적어도 약 90%의 동일성, 또는 이와 적어도 약 95%의 동일성을 가질 수 있다.
용어 "전장 항체", "무손상 항체" 및 "전체 항체"는 본원에서 교환가능하게 사용되고, 하기 정의된 항체 단편이 아닌, 그의 실질적으로 무손상 형태의 항체를 지칭한다. 이 용어는 특히 중쇄 및 Fc 영역을 갖는 항체를 지칭한다. 본 발명의 항체 변이체는 예를 들어 전장 항체일 수 있다. 또한, 전장 항체는 예를 들어 인간, 인간화, 키메라 및/또는 친화도 성숙 항체일 수 있다.
본원에 사용된 "힌지 영역" 및 그의 변이는 당업계에 공지된 의미를 포함하며, 이는 예를 들어 문헌 [Janeway et al., 1999, Immuno Biology: The Immune System in Health and Disease, Elsevier Science Ltd., NY. 4th ed.; Bloom et al., 1997, Protein Science, 6:407-415; Humphreys et al., 1997, J. Immunol. Methods, 209:193-202]에 설명되어 있다.
"상동성"은 서열을 정렬하고, 필요한 경우에는 상동성 퍼센트가 최대가 되도록 갭을 도입한 후에 일치하는, 아미노산 서열 변이체 중의 잔기의 백분율로 정의된다. 정렬 방법 및 정렬을 위한 컴퓨터 프로그램은 당업계에 널리 공지되어 있다. 하나의 이러한 컴퓨터 프로그램은 제넨테크, 인크.(Genentech, Inc.)의 소유로 미국 저작권청 (20559 워싱턴 디.씨.)에 1991년 12월 10일에 사용자 문서로 제출된 "Align 2"이다.
본원에 사용된 용어 "숙주 세포" (또는 "재조합 숙주 세포")는 외인성 폴리뉴클레오티드, 예컨대 재조합 플라스미드 또는 벡터의 도입에 의해 유전자 변경된 또는 유전자 변경될 수 있는 세포를 지칭한다. 이러한 용어는 특정한 대상 세포 뿐만이 아니라 이러한 세포의 자손까지도 지칭하도록 의도된 것으로 이해되어야 한다. 돌연변이 또는 환경적인 영향으로 인해 다음 세대에서 특정의 변형이 일어날 수도 있기 때문에, 이러한 자손은 사실상 모 세포와 동일하지 않을 수 있지만, 여전히 본원에 사용된 용어 "숙주 세포"의 범위 내에 포함된다.
"인간 컨센서스 프레임워크"는 인간 이뮤노글로불린 VL 또는 VH 프레임워크 서열의 선택시에 가장 흔하게 발생하는 아미노산 잔기를 나타내는 프레임워크이다. 일반적으로, 인간 이뮤노글로불린 VL 또는 VH 서열의 선택은 가변 도메인 서열의 하위군으로부터 행한다. 일반적으로, 서열의 하위군은 카바트에서와 같은 하위군이다. 한 실시양태에서, VL의 경우에, 하위군은 카바트에서와 같이 하위군 카파 I이다. 한 실시양태에서, VH의 경우에, 하위군은 카바트에서와 같이 하위군 III이다.
카바트 넘버링 시스템은 일반적으로 가변 도메인 내의 잔기 (대략 경쇄의 잔기 1-107 및 중쇄의 잔기 1-113)를 지칭하는 경우에 이용된다 (예를 들어, 문헌 [Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]). "EU 넘버링 시스템" 또는 "EU 인덱스"는 일반적으로 이뮤노글로불린 중쇄 불변 영역의 잔기를 지칭하는 경우에 이용된다 (예를 들어, 문헌 [Kabat et al., 상기 문헌]에 보고된 EU 인덱스). "카바트에서와 같은 EU 인덱스"는 인간 IgG1 EU 항체의 잔기 넘버링을 지칭한다. 본원에서 달리 언급되지 않는 한, 항체의 가변 도메인 내의 잔기 번호에 대한 언급은 카바트 넘버링 시스템에 의한 잔기 넘버링을 의미한다. 본원에서 달리 언급되지 않는 한, 항체의 불변 도메인 내의 잔기 번호에 대한 언급은 EU 넘버링 시스템에 의한 잔기 넘버링을 의미한다 (예를 들어, 미국 가출원 번호 60/640,323에서 EU 넘버링에 대한 도면 참조).
자연 발생 기본 4-쇄 항체 단위는 2개의 동일한 경쇄 (L) 및 2개의 동일한 중쇄 (H)로 구성된 이종사량체 당단백질이다 (IgM 항체는 J 쇄라 지칭되는 추가의 폴리펩티드와 함께 5개의 기본 이종사량체 단위로 이루어져 있어서 10개의 항원 결합 부위를 함유하고, 분비된 IgA 항체는 중합되어 J 쇄와 함께 기본 4-쇄 단위를 2-5개 포함하는 다가 어셈블리를 형성할 수 있음). IgG의 경우에, 4-쇄 단위는 일반적으로 약 150,000 달톤이다. 각각의 L 쇄는 1개의 공유 디술피드 결합에 의해 H 쇄에 연결되지만, 2개의 H 쇄는 H 쇄 이소형에 따라 1개 이상의 디술피드 결합에 의해 서로 연결된다. 또한, 각각의 H 및 L 쇄에는 일정한 간격을 두고 이격된 쇄내 디술피드 가교가 존재한다. 각각의 H 쇄는 N-말단에 가변 도메인 (VH)을 가지며, 이어서 α 및 γ 쇄 각각의 경우에 3개의 불변 도메인 (CH), μ 및 ε 이소형의 경우에 4개의 CH 도메인을 갖는다. 각각의 L 쇄는 N-말단에 가변 도메인 (VL)을 가지며, 이어서 그의 다른쪽 말단에 불변 도메인 (CL)을 갖는다. VL은 VH와 정렬되고, CL은 중쇄의 제1 불변 도메인 (CH1)과 정렬된다. 특정한 아미노산 잔기는 경쇄 및 중쇄 가변 도메인 사이의 인터페이스를 형성한다고 여겨진다. VH 및 VL의 쌍 형성은 함께 단일 항원-결합 부위를 형성한다. 다양한 클래스의 항체의 구조 및 특성에 대해, 예를 들어 문헌 [Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6]을 참조한다.
임의의 척추동물 종으로부터의 L 쇄는 이들의 불변 도메인의 아미노산 서열을 기반으로 하여 카파 및 람다라고 지칭되는 명백하게 구별되는 2가지 유형 중 하나에 배정될 수 있다. 이뮤노글로불린은 그의 중쇄의 불변 도메인 (CH)의 아미노산 서열에 따라 다양한 클래스 또는 이소형으로 배정될 수 있다. 5가지 클래스의 이뮤노글로불린: IgA, IgD, IgE, IgG 및 IgM이 존재하고, 각각은 α, δ, γ, ε 및 μ로 지칭되는 중쇄를 갖는다. γ 및 α 클래스는 CH 서열 및 기능에 있어서의 상대적으로 작은 차이점을 기반으로 하여 서브클래스로 추가로 분류되는데, 예를 들어 인간은 서브클래스: IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2를 발현한다.
"인간 이펙터 세포"는 하나 이상의 FcR을 발현하고 이펙터 기능을 수행하는 백혈구이다. 일부 실시양태에서, 이러한 세포는 적어도 FcγRIII를 발현하고 ADCC 이펙터 기능을 수행한다. ADCC를 매개하는 인간 백혈구의 예는 말초 혈액 단핵 세포 (PBMC), 자연 킬러 (NK) 세포, 단핵구, 세포독성 T 세포 및 호중구를 포함한다. 이펙터 세포는 천연 공급원, 예를 들어 본원에 기재된 바와 같은 혈액 또는 PBMC (말초 혈액 단핵 세포)로부터 단리할 수 있다.
비인간 (예를 들어, 뮤린) 항체의 "인간화" 형태는 비인간 이뮤노글로불린으로부터 유래된 최소 서열을 함유하는 키메라 항체이다. 대다수의 경우에, 인간화 항체는 수용자의 초가변 영역으로부터의 잔기가 원하는 특이성, 친화도 및 능력을 갖는 마우스, 래트, 토끼 또는 비인간 영장류와 같은 비인간 종 (공여자 항체)의 초가변 영역으로부터의 잔기로 대체된 인간 이뮤노글로불린 (수용자 항체)이다. 일부 경우에, 인간 이뮤노글로불린의 Fv 프레임워크 영역 (FR) 잔기는 상응하는 비인간 잔기로 대체된다. 추가로, 인간화 항체는 수용자 항체 또는 공여자 항체에서는 발견되지 않는 잔기를 포함할 수 있다. 이러한 변형은 항체 성능이 추가로 개선되게 한다. 일반적으로, 인간화 항체는 적어도 1개, 전형적으로는 2개의 가변 도메인을 실질적으로 모두 포함할 것이고, 여기서 모든 또는 실질적으로 모든 초가변 루프는 비인간 이뮤노글로불린의 것에 상응하고 모든 또는 실질적으로 모든 FR 영역은 인간 이뮤노글로불린 서열의 것이다. 임의로, 인간화 항체는 이뮤노글로불린 불변 영역 (Fc)의 적어도 일부, 전형적으로는 인간 이뮤노글로불린의 것을 또한 포함할 것이다. 보다 상세한 내용에 대해 문헌 [Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); 및 Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)]을 참조한다.
"인간 항체"는 인간에 의해 생산된 항체의 것에 상응하는 아미노산 서열을 보유하고/하거나 본원에 개시된 임의의 인간 항체 제조 기술을 이용하여 제조된 항체이다. 이러한 정의는 구체적으로 비인간 항원-결합 잔기를 포함하는 인간화 항체를 배제한다.
본원에 사용된 용어 "고혈당 장애"는 모든 형태의 당뇨병 및 인슐린 저항성으로부터 발생한 장애, 예컨대 제I형 및 제II형 당뇨병 뿐만 아니라 중증 인슐린 저항성, 고인슐린혈증 및 고지혈증, 예를 들어, 비만 대상체 및 인슐린-저항성 당뇨병, 예컨대 멘델홀 증후군, 베르너 증후군, 요정증, 지방위축성 당뇨병 및 다른 지방위축을 지칭한다. 본원에 개시된 특정한 고혈당 장애는 당뇨병, 특히 제1형 및 제II형 당뇨병이다. "당뇨병" 자체는 인슐린의 부적절한 생산 또는 이용과 관련된 탄수화물 대사의 진행성 질환을 지칭하고, 고혈당증 및 당뇨를 특징으로 한다.
본원에 사용된 경우에 용어 "초가변 영역", "HVR", 또는 "HV"는 서열 내에서 초가변적이고/이거나 구조적으로 한정된 루프를 형성하는 항체 가변 도메인의 영역을 지칭한다. 일반적으로, 항체는 6개의 HVR; VH 내에 3개 (H1, H2, H3) 및 VL 내에 3개 (L1, L2, L3)를 포함한다. 천연 항체에서, H3 및 L3은 6개의 HVR 중에서 가장 높은 다양성을 나타내고, 특히 H3은 항체에 정밀한 특이성을 부여하는데 고유한 역할을 수행한다고 여겨진다. 예를 들어, 문헌 [Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003)]을 참조한다. 그러나, 오직 중쇄만을 갖고 경쇄가 결핍된 자연 발생 및 조작된, 기능적 항체의 다수의 예가 존재한다. 예를 들어, 문헌 [Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996)]을 참조한다.
많은 HVR 설명이 사용되고 있고 본원에 포함된다. 카바트 상보성 결정 영역 (CDR)은 서열 가변성을 기반으로 하며, 가장 흔하게 사용된다 (문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)]). 코티아(Chothia)는 대신 구조적 루프의 위치를 지칭한다 (문헌 [Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)]). AbM HVR은 카바트 HVR과 코티아 구조적 루프 사이의 절충안을 나타내고, 옥스포드 몰레큘라(Oxford Molecular)의 AbM 항체 모델링 소프트웨어에 의해 사용된다. "접촉" HVR은 이용가능한 복합체 결정 구조의 분석을 기반으로 한다. 이들 각각의 HVR로부터의 잔기를 하기 나타낸다.
HVR은 일반적으로 초가변 루프로부터의 및/또는 "상보성 결정 영역" (CDR)으로부터의 아미노산 잔기를 포함하며, 후자는 서열 변동성이 가장 높고/거나 항원 인식과 관련된다. 예시적인 초가변 루프는 아미노산 잔기 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) 및 96-101 (H3)에서 발생한다. (문헌 [Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)].) 예시적인 CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 및 CDR-H3)은 L1의 아미노산 잔기 24-34, L2의 50-56, L3의 89-97, H1의 31-35B, H2의 50-65 및 H3의 95-102에서 발생한다. (문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)].) VH 내의 CDR1을 제외하고, CDR은 일반적으로 초가변 루프를 형성하는 아미노산 잔기를 포함한다. CDR은 또한 항원에 접촉하는 잔기인 "특이성 결정 잔기", 또는 "SDR"을 포함한다. SDR은 단축-CDR, 또는 a-CDR로 지칭되는 CDR의 영역 내에 함유된다. 예시적인 a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 및 a-CDR-H3)은 L1의 아미노산 잔기 31-34, L2의 50-55, L3의 89-96, H1의 31-35B, H2의 50-58 및 H3의 95-102에서 발생한다. (문헌 [Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)] 참조.) IgG HVR은 하기 "연장된 HVR"을 포함할 수 있다: VL에서 24-36 또는 24-34 (L1), 46-56 또는 50-56 (L2) 및 89-97 또는 89-96 (L3), 및 VH에서 26-35 (H1), 50-65 또는 49-65 (H2) 및 93-102, 94-102, 또는 95-102 (H3). 달리 나타내지 않는 한, HVR 잔기 및 가변 도메인에서 다른 잔기 (예를 들어, FR 잔기)는 본원에서 문헌 [Kabat et al., 상기 문헌]에 따라 넘버링된다.
2개 이상의 에피토프에 결합할 수 있는 VH/VL 단위를 갖는 항체가 제조될 수 있다 (문헌 [Bostrom et al. (2009) Science 323:1610-1614]; WO 2008/027236 (참고로 포함됨)). 이러한 다중특이적 항체는 항체의 단일 아암 (VH/VL 단위로로 알려짐)이 적어도 동일한 표적 분자 상의 2개의 에피토프 또는 상이한 표적 분자 상의 2개의 에피토프에 결합할 수 있다는 것을 나타내기 위해 "투-인 원" 항체 또는 "이중 작용 Fab" 또는 "DAF"로 본원에서 지칭된다. 한 측면에서, 이들 DAF 항체는 제1 에피토프에 결합하는 항체의 VH/VL 단위의 VL 도메인을 돌연변이시키고, 제1 에피토프 및 제2 에피토프에 결합할 수 있는 돌연변이체 VH/VL 단위를 선택하여 제조될 수 있다. 예를 들어, 한 실시양태에서, 경쇄 CDR의 하나 이상의 용매 접근가능한 아미노산 잔기(들)를 하나 이상의 다른 아미노산 잔기(들)로 무작위적으로 또는 선택적으로 치환한 후에 제2 에피토프에 대한 결합에 대해 돌연변이된 VH/VL 단위를 스크리닝한다.
"인플라마솜-매개 질환"은 IL-1β 및/또는 IL-18이 정상적인, 비-염증발생 조직과 비교하여 상승된 임의의 질환을 지칭한다. 일반적으로, 인플라마솜-매개 질환에서, 카스파제-1 프로세싱 및/또는 활성화는 유도되지 않은 대조 세포와 비교하여 관련/상승된다. 카스파제-1 활성은 상업적으로 입수가능한 검정 키트, 예를 들어 카스파제 1 형광측정 검정 키트 ((Cat. No. ab394120; 아브캄(AbCam), 매사추세츠주 캠브리지), 카스파제-1 비색 검정 (Cat. No. BF14100; R&D 시스템즈(R&D Systems)) 등을 이용하여 측정될 수 있다.
일반적으로, 질환 또는 상태는 이것이 체액 또는 조직에서 IL-1β의 상승된 수준과 연관되거나 또는 신체로부터 채취한 세포 또는 조직이 배양물에서 상승된 수준의 IL-1β를 생산한다면 IL-1β 관련 질환 또는 상태로 여겨질 수 있다. 유사하게, 질환 또는 상태는 이것이 체액 또는 조직에서 IL-18의 상승된 수준과 연관되거나 또는 신체로부터 채취한 세포 또는 조직이 배양물에서 상승된 수준의 IL-18을 생산한다면 IL-18 관련 질환 또는 상태로 여겨질 수 있다. 따라서, IL-1β/IL-18 관련 질환 또는 상태는 체액 또는 조직에서 또는 신체로부터 채취한 세포 또는 조직이 배양물에서 상승된 수준의 두 시토카인을 생산한다면 IL-1β 및 IL-18의 상승된 수준과 연관된다.
면역 및 염증성 질환은 다음을 포함한다: 만성 폐쇄성 폐 질환 (COPD), 류마티스 관절염, 골관절염, 소아 만성 관절염, 척추관절병증, 전신 경화증 (경피증), 특발성 염증성 근병증 (피부근염), 전신 혈관염, 사르코이드증, 자가면역 용혈성 빈혈 (면역 범혈구감소증, 발작성 야간 혈색소뇨), 자가면역 혈소판감소증 (특발성 혈소판감소성 자반증, 면역-매개 혈소판감소증), 갑상선염 (그레이브스병, 하시모토 갑상선염, 소아 림프구성 갑상선염, 위축성 갑상선염) 자가면역 염증성 질환 (예를 들어, 알레르기성 뇌척수염, 다발성 경화증, 인슐린-의존성 당뇨병, 자가면역 포도막망막염, 갑상선중독증, 자가면역 갑상선 질환, 악성-빈혈, 자가이식편 거부, 당뇨병, 및 면역-매개 신질환 (사구체신염, 세뇨관간질 신염)), 중추 및 말초 신경계의 탈수초성 질환, 예컨대 다발성 경화증, 특발성 탈수초성 다발신경병증 또는 길랑-바르 증후군, 및 만성 염증성 탈수초성 다발신경병증; 간담도 질환, 예컨대 감염성 간염 (A, B, C, D, E형 및 다른 비-간친화성 바이러스 간염), 자가면역 만성 활성 간염, 원발성 담즙성 간경변증, 육아종성 간염, 및 경화성 담관염, 글루텐 과민성 장병증, 및 휘플병; 수포성 피부 질환, 다형 홍반 및 접촉성 피부염, 건선을 포함하는 자가면역 또는 면역-매개 피부 질환; 알레르기성 질환, 예컨대 천식, 알레르기성 비염, 아토피성 피부염, 춘계 결막염, 습진, 식품 과민증 및 두드러기; 폐의 면역 질환, 예컨대 호산구성 폐렴, 특발성 폐 섬유증 및 과민성 폐렴; 이식편 거부 및 이식편-대-숙주-질환을 포함하는 이식 연관 질환.
면역 관련 및 염증성 질환은 정상적 생리상태에서 상해 또는 손상에 대해 반응하고, 상해 또는 손상으로부터 복구를 개시하고, 외래 유기체에 대한 선천성 및 후천성 방어를 시작하기에 중요한 상당히 복잡하고, 종종 다중 상호연결된 생물학적 경로의 증상 또는 결과이다. 질환 또는 병리상태는 이들 정상적 생리학적 경로가 반응의 강도에 직접 관련된 것으로서, 비정상적 조절 또는 과도한 자극의 결과로서, 자신에 대한 반응으로서, 또는 그의 조합으로서 추가의 상해 또는 손상을 일으키는 경우에 발생한다.
IL-1β 관련 질환의 예는 급성 췌장염; ALS; 악액질/식욕부진 (AIDS-유발 악액질 포함); 천식 및 다른 폐 질환; 자가면역 혈관염; CIAS1 연관 주기성 증후군 (CAPS); 신생아 발병 다계통 염증성 장애 (NOMID/CINCA), 전신 발병 소아 특발성 관절염, 스틸병, 머클-웰스 증후군, 만성 피로 증후군; 클로스트리디움(Clostridium) 연관 질병 (클로스트리디움-연관 설사 포함); 관상동맥 상태 및 징후 (울혈성 심부전, 관상동맥 재협착, 심근경색, 심근 기능장애 (예를 들어, 패혈증과 관련됨), 및 관상 동맥 우회로 이식 포함); 암, 예컨대 다발성 골수종 및 골수성 (예를 들어, AML 및 CML) 및 다른 백혈병, 뿐만 아니라 종양 전이; 당뇨병 (예를 들어, 인슐린 당뇨병); 자궁내막증; 가족성 한랭 자가염증성 증후군 (FCAS); 가족성 지중해열 (FMF); 열; 섬유근육통; 사구체신염; 이식편 대 숙주 질환/이식 거부; 출혈성 쇼크; 통각과민증; 염증성 장 질환; 관절의 염증성 상태 (건선성 관절염 (뿐만 아니라 골관절염 및 류마티스 관절염) 포함); 염증성 안질환 (예를 들어, 각막 이식과 연관될 수 있음); 허혈 (뇌 허혈 (예를 들어, 각각 신경변성으로 이어질 수 있는 외상, 간질, 출혈 또는 졸중의 결과로서의 뇌 손상) 포함); 가와사키병; 학습 장애; 폐 질환 (예를 들어, ARDS); 근병증 (예를 들어, 근육 단백질 대사, 특히 패혈증에서); 신경독성 (예를 들어, HIV에 의해 유발됨); 골다공증; 통증 (암-관련 통증 포함); 파킨슨병; 치주 질환; 조기 진통; 건선; 재관류 손상; 방사선 요법으로부터의 부작용; 수면 장애; 측두 하악 관절 질환; 종양 괴사 인자 수용체-연관 주기열 증후군 (TRAPS); 포도막염; 또는 좌상, 염좌, 연골 손상, 외상, 정형외과 수술, 감염 또는 다른 질환 과정으로부터 발생하는 염증성 상태이다.
인터류킨 18은 면역 및 염증성 요소와 관련된 다양한 질환과 연관된 병리상태에서 결정적인 역할을 수행한다. 이러한 질환은 류마티스 관절염, 골관절염, 소아 만성 관절염, 라임 관절염, 건선성 관절염, 반응성 관절염, 척추관절병증, 루푸스 (예를 들어, 전신 홍반성 루푸스, 및 루푸스 신염), 크론병, 궤양성 결장염, 염증성 장 질환, 인슐린 의존성 당뇨병, 갑상선염, 천식, 알레르기성 질환, 건선, 제1형 건선, 제2형 건선, 피부염 경피증, 이식편 대 숙주 질환, 기관 이식 거부, 기관 이식과 연관된 급성 또는 만성 면역 질환, 사르코이드증, 아테롬성동맥경화증, 파종성 혈관내 응고, 가와사키병, 그레이브스병, 신증후군, 만성 피로 증후군, 베게너 육아종증, 헤노흐-쉔라인 자반증, 신장의 현미경적 혈관염, 만성 활성 간염, 포도막염, 패혈성 쇼크, 독성 쇼크 증후군, 패혈증 증후군, 악액질, 감염성 질환, 기생충성 질환, 급성 횡단성 척수염, 헌팅톤 무도병, 파킨슨병, 알츠하이머병, 졸중, 원발성 담즙성 간경변증, 용혈성 빈혈, 악성종양, 심부전, 심근경색, 애디슨병, 산발성의 제I형 다선성 결핍 및 제II형 다선성 결핍, 슈미트 증후군, 성인 호흡 곤란 증후군, 탈모증, 원형 탈모증, 혈청음성 관절병증, 관절병증, 라이터병, 건선성 관절병증, 궤양성 결장염성 관절병증, 장병증성 활막염, 클라미디아, 예르시니아 및 살모넬라 연관 관절병증, 척추관절병증, 죽종성 질환, 동맥경화증, 아토피성 알레르기, 자가면역 수포성 질환, 심상성 천포창, 낙엽상 천포창, 유천포창, 선상 IgA 질환, 자가면역 용혈성 빈혈, 쿰스 양성 용혈성 빈혈, 후천성 악성 빈혈, 소아 악성 빈혈, 근통성 뇌염/로얄 프리 질환(Royal Free Disease), 만성 점막피부 칸디다증, 거대 세포 동맥염, 원발성 경화성 간염, 잠재성 자가면역 간염, 후천성 면역결핍 질환 증후군, 후천성 면역결핍 관련 질환, C형 간염, 공통 가변성 면역결핍, 공통 가변성 저감마글로불린혈증, 확장성 심근병증, 여성 불임, 난소 부전, 조기 난소 부전, 섬유화 폐 질환, 잠재성 섬유화 폐포염, 염증후 간질성 폐 질환, 간질성 폐렴, 결합 조직 질환 연관 간질성 폐 질환, 혼합 결합 조직 질환 연관 폐 질환, 전신 경화증 연관 간질성 폐 질환, 류마티스 관절염 연관 간질성 폐 질환, 전신 홍반성 루푸스 연관 폐 질환, 피부근염/다발근염 연관 폐 질환, 쇼그렌병 연관 폐 질환, 강직성 척추염 연관 폐 질환, 혈관염성 미만성 폐 질환, 혈철증 연관 폐 질환, 약물-유발 간질성 폐 질환, 방사선 섬유증, 폐쇄성 세기관지염, 만성 호산구성 폐렴, 림프구성 침윤성 폐 질환, 감염후 간질성 폐 질환, 통풍성 관절염, 자가면역 간염, 제1형 자가면역 간염, 전형적 자가면역 또는 루푸스양 간염, 제2형 자가면역 간염, 항-LKM 항체 간염, 자가면역 매개 저혈당증, 흑색 극세포증을 갖는 B형 인슐린 저항성, 부갑상선기능저하증, 기관 이식과 연관된 급성 면역 질환, 기관 이식과 연관된 만성 면역 질환, 골관절증, 원발성 경화성 담관염, 특발성 백혈구감소증, 자가면역 호중구감소증, 신질환 NOS, 사구체신염, 신장의 현미경적 혈관염, 라임병, 원판상 홍반성 루푸스, 남성 불임증 특발성 또는 NOS, 정자 자가면역, 모든 하위유형의 다발성 경화증, 교감성 안염, 결합 조직 질환에 속발성인 폐 고혈압, 굿패스쳐 증후군, 결절성 다발성동맥염의 폐 징후, 급성 류마티스성 열, 류마티스 척추염, 스틸병, 전신 경화증, 쇼그렌 증후군, 다카야스병/동맥염, 자가면역 혈소판감소증, 특발성 혈소판감소증, 자가면역 갑상선 질환, 갑상선기능항진증, 갑상선종성 자가면역 갑상선기능저하증 또는 하시모토병, 위축성 자가면역 갑상선기능저하증, 원발성 점액수종, 수정체성 포도막염, 원발성 혈관염, 백반증, 급성 간 질환, 만성 간 질환, 알레르기 및 천식, 정신 장애, 우울증, 정신분열증, Th2 유형 및 Thl 유형 매개 질환, 만성 폐쇄성 폐 질환 (COPD), 염증성, 자가면역 및 골 질환을 포함하나 이에 제한되지 않는다.
본 발명의 항체 및 단편은 또한 IL-1β 관련, 또는 IL-18 관련, 또는 자가염증성, 또는 자가면역 또는 염증 또는 면역 질환을 치료하거나 예방하는데 사용될 수 있다.
이러한 질환의 발생은 종종 다단계 경로 및 종종 다수의 다양한 생물학적 시스템/경로를 포함하지만, 하나 이상의 이들 경로 내의 중요한 지점에서 개입은 개선 또는 치료 효과를 가질 수 있다. 치료적 개입은 유해한 과정/경로의 길항작용 또는 유익한 과정/경로의 자극에 의해 일어날 수 있다.
T 림프구 (T 세포)는 포유동물 면역 반응의 중요한 성분이다. T 세포는 주요 조직적합성 복합체 (MHC) 내의 유전자에 의해 코딩된 자기-분자와 회합된 항원을 인식한다. 항원은 항원 제시 세포, 바이러스 감염된 세포, 암 세포, 이식편 등의 표면 상에 MHC 분자와 함께 디스플레이될 수 있다. T 세포 시스템은 숙주 동물에서 건강을 위협하는 이러한 변경된 세포를 제거한다. T 세포는 헬퍼 T 세포 및 세포독성 T 세포를 포함한다. 헬퍼 T 세포는 항원 제시 세포 상의 항원-MHC 복합체를 인식한 후에 광범위하게 증식한다. 헬퍼 T 세포는 또한 다양한 시토카인, 예를 들어 림포카인을 분비하고, 이는 B 세포, 세포독성 T 세포 및 면역 반응에 참여하는 다양한 다른 세포의 활성화에서 중요한 역할을 한다.
다수의 면역 반응에서는 염증 세포가 손상 또는 감염 부위로 침윤한다. 이동하는 세포는 호중구성, 호산구성, 단핵구성 또는 림프구성일 수 있으며, 이는 영향을 받은 조직의 조직학적 검사에 의해 결정될 수 있다. 예를 들어, 문헌 [Current Protocols in Immunology, ed. John E. Coligan, 1994, John Wiley & Sons, Inc.]을 참조한다. 다수의 면역 관련 질환이 공지되어 있고 광범위하게 연구되었다. 이러한 질환은 면역-매개 염증성 질환 (예를 들어, 류마티스 관절염, 면역 매개 신질환, 간담도 질환, 염증성 장 질환 (IBD), 건선 및 천식), 비-면역-매개 염증성 질환, 감염성 질환, 면역결핍 질환, 신생물 및 이식편 거부 등을 포함한다. 면역학 분야에서, 표적은 염증 및 염증성 장애의 치료에 대해 확인되었다. 면역학 분야에서, 표적은 염증 및 염증성 장애의 치료에 대해 본원에서 확인되었다. 면역 관련 질환은 한 경우에 면역 반응을 저해함으로써 치료될 수 있다. 면역 자극 활성을 갖는 분자를 억제하는 중화 항체를 사용하는 것은 면역-매개 및 염증성 질환의 치료에 유익하다. 면역 반응을 억제하는 분자는 면역 반응을 억제하여 면역 관련 질환을 개선시키는데 이용될 수 있다 (단백질을 직접 억제하거나 항체 효능제를 사용함).
본원에 사용된 용어 "이뮤노어드헤신"은 이종 단백질 ("어드헤신")의 결합 특이성을 이뮤노글로불린 불변 도메인의 이펙터 기능과 조합한 분자를 지칭한다. 구조적으로, 이뮤노어드헤신은 아미노산 서열이 항체의 항원 인식 및 결합 부위가 아닌 (즉, "이종성"인) 원하는 결합 특이성을 갖는 아미노산 서열 및 Fc 영역 (예를 들어, IgG의 CH2 및/또는 CH3 서열)의 융합체를 포함한다. 예시적인 어드헤신 서열은 관심 단백질에 결합하는 수용체 (예를 들어, 세포외 도메인) 또는 리간드의 일부를 포함하는 인접한 아미노산 서열을 포함한다. 어드헤신 서열은 또한 관심 단백질에 결합하는 서열일 수 있지만, 수용체 또는 리간드 서열이 아니다 (예를 들어, 펩티바디 내의 어드헤신 서열). 이러한 폴리펩티드 서열은 파지 디스플레이 기술 및 고처리량 분류 방법을 포함하는 다양한 방법에 의해 선택 또는 확인될 수 있다. 이뮤노어드헤신 내의 이뮤노글로불린 불변 도메인 서열은 임의의 이뮤노글로불린, 예컨대 IgG-1, IgG-2, IgG-3 또는 IgG-4 하위유형, IgA (IgA-1 및 IgA-2 포함), IgE, IgD 또는 IgM으로부터 얻을 수 있다. 예시적인 분자는 문헌 [Berg et al., 1991, PNAS (USA) 88:4723- 및 Chamow et al., 1994, J. Immunol. 153:4268]에 기재된 이중특이적 CD4-IgG 분자이다.
"단리된" 항체는 자연 환경의 성분으로부터 확인되고 분리 및/또는 회수된 것이다. 그의 자연 환경의 오염물 성분은 항체에 대한 진단 또는 치료 용도를 방해하는 물질이고, 효소, 호르몬 및 다른 단백질성 또는 비단백질성 용질을 포함할 수 있다. 일부 실시양태에서, 항체는 (1) 로우리 방법에 의해 측정시에 항체의 95 중량%를 초과하는 정도, 가장 바람직하게는 99 중량%를 초과하는 정도로, (2) 스피닝 컵 서열분석기를 이용하여 N-말단 또는 내부 아미노산 서열의 적어도 15개의 잔기를 얻기에 충분한 정도로, 또는 (3) 쿠마시 블루 또는 바람직하게는 은 염색을 이용하여 환원 또는 비환원 조건 하에 SDS-PAGE에 의해 균질한 것으로 나타날 정도로 정제될 것이다. 단리된 항체는 재조합 세포 내의 계내 항체를 포함하는데, 이는 항체 자연 환경의 적어도 하나의 성분이 존재하지 않을 것이기 때문이다. 그러나, 통상적으로, 단리된 항체는 적어도 1회의 정제 단계에 의해 제조될 것이다.
"단리된" 핵산 분자는 항체 핵산의 천연 공급원 내에서 통상적으로 회합되는 적어도 하나의 오염 핵산 분자로부터 확인되어 이로부터 분리된 핵산 분자이다. 단리된 핵산 분자는 자연에서 발견되는 형태 또는 조건 이외의 것이다. 따라서, 단리된 핵산 분자는 천연 세포에 존재하는 것과 같은 핵산 분자와 구별된다. 그러나, 단리된 핵산 분자는, 예를 들어 천연 세포의 경우와 상이한 염색체 위치에 존재하며 통상적으로 항체를 발현하는 세포에 함유된 핵산 분자를 포함한다.
본원에 언급된 바와 같이 용어 "노브-인투-홀(knob-into-hole)" 또는 "KnH"는 돌출부 (노브)를 하나의 폴리펩티드 내로 및 함몰부 (홀)를 다른 폴리펩티드 내로 이들이 상호작용하는 인터페이스에서 도입함으로써 시험관내 또는 생체내에서 함께 2개의 폴리펩티드의 선택적인 쌍 형성을 지시하는 기술을 지칭한다. 예를 들어, KnH는 항체의 Fc:Fc 결합 인터페이스, CL:CH1 인터페이스 또는 VH/VL 인터페이스에 도입되었다 (예를 들어, US20007/0178552, WO 96/027011, WO 98/050431 및 문헌 [Zhu et al. (1997) Protein Science 6:781-788]). 이것은 특히 다중특이적 항체의 제조 동안 함께 2개의 상이한 중쇄의 쌍 형성을 유도하는데 유용하다. 예를 들어, 그의 Fc 영역에 KnH를 갖는 다중특이적 항체는 각각의 Fc 영역에 연결된 단일 가변 도메인을 추가로 포함할 수 있거나, 또는 유사하거나 상이한 경쇄 가변 도메인과 쌍을 형성하는 상이한 중쇄 가변 도메인을 추가로 포함할 수 있다. 실제로, KnH 기술은 2개의 상이한 수용체 세포외 도메인이 함께 쌍을 형성하도록 하거나, 또는 상이한 표적 인식 서열 (예를 들어, 아피바디, 펩티바디 및 다른 Fc 융합체 포함)을 포함하는 임의의 다른 폴리펩티드 서열이 쌍을 형성하도록 하는데 사용될 수 있다.
표현 "선형 항체"는 일반적으로 문헌 [Zapata et al., Protein Eng. 8(10):1057-1062 (1995)]에 기재된 항체를 지칭한다. 간략하게, 이들 항체는 상보적 경쇄 폴리펩티드와 함께 한 쌍의 항원 결합 영역을 형성하는 한 쌍의 탠덤 Fd 절편 (VH-CH1-VH-CH1)을 포함한다. 선형 항체는 이중특이적 또는 단일특이적일 수 있다.
용어 "포유동물"은 인간, 소, 말, 개 및 고양이를 비롯하여, 포유동물로 분류된 임의의 동물을 포함한다. 한 실시양태에서 포유동물은 인간이다.
본원에 사용된 용어 "모노클로날 항체"는 실질적으로 균질한 항체 집단으로부터 수득된 항체를 지칭하고, 즉 이러한 집단을 포함하는 개별 항체는 미량으로 존재할 수 있는 가능한 자연 발생 돌연변이를 제외하고는 동일하다. 모노클로날 항체는 단일 항원 부위에 대해 지시되며 고도로 특이적이다. 또한, 전형적으로 상이한 결정자 (에피토프)에 대해 지시되는 상이한 항체를 포함하는 통상적인 (폴리클로날) 항체 제제와는 대조적으로, 각각의 모노클로날 항체는 항원 상의 단일 결정자에 대해 지시된다. 수식어 "모노클로날"은 항체의 특성을 실질적으로 균질한 항체의 집단으로부터 수득하였다는 것으로 나타내고, 임의의 특정한 방법에 의한 항체 생산이 필요한 것으로 해석되지 않아야 한다. 예를 들어, 본 발명에 따라 사용될 모노클로날 항체는 문헌 [Kohler et al., 1975, Nature 256:495]에 최초로 기재된 하이브리도마 방법에 의해 제조될 수 있거나, 또는 재조합 DNA 방법 (예를 들어, 미국 특허 번호 4,816,567 참조)에 의해 제조될 수 있다. "모노클로날 항체"는 또한, 예를 들어 문헌 [Clackson et al., 1991, Nature 352:624-628 및 Marks et al., 1991, J. Mol. Biol. 222:581-597]에 기술된 기술을 이용하여 파지 항체 라이브러리로부터 단리될 수 있다.
본원에서 모노클로날 항체는 구체적으로 중쇄 및/또는 경쇄의 일부가 특정한 종으로부터 유래되거나 특정한 항체 클래스 또는 서브클래스에 속하는 항체에서의 상응하는 서열과 동일하거나 또는 이에 상동성이고 쇄(들)의 나머지는 다른 종으로부터 유래되거나 다른 항체 클래스 또는 서브클래스에 속하는 항체에서의 상응하는 서열과 동일하거나 또는 이에 상동성인 "키메라" 항체 (이뮤노글로불린) 뿐만 아니라 원하는 생물학적 활성을 나타내는 한 이러한 항체의 단편을 포함한다 (미국 특허 번호 4,816,567; 및 문헌 [Morrison et al., 1984, Proc. Natl. Acad. Sci. USA 81:6851-6855]).
용어 "다중특이적 항체"는 가장 넓은 의미로 사용되고, 다중에피토프 특이성을 갖는 항체를 지칭한다. 이러한 다중특이적 항체는 VHVL 단위가 다중에피토프 특이성을 갖는, 중쇄 가변 도메인 (VH) 및 경쇄 가변 도메인 (VL)을 포함하는 항체, 각각의 VHVL 단위가 상이한 에피토프에 결합하는 2개 이상의 VL 및 VH 도메인을 갖는 항체, 상이한 에피토프에 결합하는 적어도 2개의 단일 가변 도메인과 2개 이상의 단일 가변 도메인을 갖는 항체, 전장 항체, 항체 단편, 예컨대 Fab, Fv, dsFv, scFv, 디아바디, 탠덤 항체, 선형 항체 및 트리아바디, 공유 연결되거나 또는 비-공유 상호작용을 통해 서로 결합하는 항체 단편을 포함하나 이에 제한되지 않는다. 항체 포맷의 다른 예가 이용되거나, 또는 디아바디의 Fc 융합체, 탠덤 항체 및 단일 쇄 항체 (예를 들어, Db-Fc, taDb-Fc, taDb-CH3 및 (scFV)4-Fc), 노브-N-홀 (KnH) 항체, 옥토퍼스 항체 및 DAF 항체를 포함하나 이에 제한되지 않는 다중특이적 항체를 생성하는데 사용될 수 있다.
본원에 사용된 "다중특이적 분자"는 다중에피토프 특이성을 갖는 분자를 지칭한다. "다중에피토프 특이성"은 하나의 표적 분자 또는 상이한 표적 분자 상에서 적어도 2개의 상이한 에피토프에 특이적으로 결합하는 능력을 지칭한다. "단일특이적"은 오직 하나의 에피토프에 결합하는 능력을 지칭한다. 한 실시양태에 따르면 다중특이적 분자는 5μM 내지 0.001pM, 3μM 내지 0.001pM, 1μM 내지 0.001pM, 0.5μM 내지 0.001pM 또는 0.1μM 내지 0.001pM의 친화도로 각각의 에피토프에 결합한다. 본원에 사용된 용어 "이중특이적"은 2개의 에피토프에 결합하는 능력 (예를 들어, 항-IL-1β/IL-18 이중특이적 항체)을 지칭한다. 다중에피토프 특이성을 지지하거나 또는 이를 지지하도록 설계될 수 있는 분자의 예는 항체, 아피바디, 이뮤노어드헤신, 펩티바디 및 다른 Fc 융합체를 포함하나 이에 제한되지 않는다.
본원에 사용된 용어 "옥토퍼스" 항체 또는 항체들은 Fc 영역 및 Fc 영역에 대한 2개 이상의 항원 결합 부위 아미노-말단을 포함하는 다가 항체를 지칭한다 (예를 들어, WO01/77342, 문헌 [Wu et al. (2007) Nature Biotechnology], 및 WO 2007/024715). 한 바람직한 실시양태에서, 항체의 폴리펩티드의 배위는 VD1-(X1)n-VD2-(X2)n-Fc이며, 여기서 VD1은 제1 가변 도메인이고, VD2는 제2 가변 도메인이고, Fc는 Fc 영역의 하나의 폴리펩티드 쇄이고, X1 및 X2는 아미노산 또는 폴리펩티드를 나타내며, n은 0 또는 1이다. 한 실시양태에서, X1 또는 X2는 CH1 도메인, CH1 도메인의 일부, 일부 다른 링커 서열, 예컨대 GS 링커 또는 그의 일부 조합 (예를 들어, WO 2007/024715의 페이지 5)이다.
본원에 사용된 핵산은 또 다른 핵산 서열과 기능적 관계로 배치되는 경우에, "작동가능하게 연결"된다. 예를 들어, 프리서열 또는 분비 리더에 대한 DNA는 항체가 그의 분비에 참여하는 프리단백질로서 발현되는 경우 상기 항체에 대한 DNA에 작동가능하게 연결되거나, 프로모터 또는 인핸서는 코딩 서열이 서열의 전사에 영향을 미치는 경우 상기 코딩 서열에 작동가능하게 연결되거나, 또는 리보솜 결합 부위는 코딩 서열이 번역을 용이하게 하도록 배치되는 경우에 상기 코딩 서열에 작동가능하게 연결된다. 일반적으로, "작동가능하게 연결된"은 연결될 DNA 서열들이 인접하여 위치함을 의미하며, 분비 리더의 경우에는 인접하여 위치하고 리딩 상 내에 존재하는 것을 의미한다. 그러나, 인핸서는 인접하여 위치할 필요가 없다. 연결은 편리한 제한 부위에서의 라이게이션에 의해 달성된다. 이러한 부위가 존재하지 않는 경우에는 합성 올리고뉴클레오티드 어답터 또는 링커를 통상적인 실시에 따라 사용한다.
"펩티바디" 또는 "펩티바디들"은 Fc 도메인을 갖는 펩티드 서열의 융합체를 지칭한다. 2003년 12월 9일에 허여된 미국 특허 번호 6,660,843 (Feige et al.) (그의 전문이 참고로 포함됨)을 참조한다. 이는 N-말단, C-말단, 아미노산 측쇄, 또는 하나 초과의 이들 부위에 연결된 하나 이상의 펩티드 포함한다. 펩티바디 기술을 이용함으로써 하나 이상의 리간드 또는 수용체, 종양-귀소 펩티드, 막-수송 펩티드 등을 표적화하는 펩티드를 포함하는 치료제를 설계할 수 있다. 펩티바디 기술은 선형 및 디술피드-제한된 펩티드, "탠덤 펩티드 다량체" (즉, Fc 도메인의 단일 쇄 상의 1개 초과의 펩티드)를 혼입시킨 다수의 상기 분자의 설계에 유용한 것으로 입증되었다. 예를 들어, 미국 특허 번호 6,660,843; 2003년 10월 16일에 공개된 미국 특허 출원 번호 2003/0195156 (2002년 11월 21일에 공개된 WO 02/092620에 대응함); 2003년 9월 18일에 공개된 미국 특허 출원 번호 2003/0176352 (2003년 4월 17일에 공개된 WO 03/031589에 대응함); 1999년 10월 22일에 출원된 미국 일련번호 09/422,838 (2000년 5월 4일에 공개된 WO 00/24770에 대응함); 2003년 12월 11일에 공개된 미국 특허 출원 번호 2003/0229023; 2003년 7월 17일에 공개된 WO 03/057134; 2003년 12월 25일에 공개된 미국 특허 출원 번호 2003/0236193 (2004년 4월 8일에 출원된 PCT/US04/010989에 대응함); 2003년 9월 18일에 출원된 미국 일련번호 10/666,480 (2004년 4월 1일에 공개된 WO 04/026329에 대응함) (이들 각각은 그 전체내용이 본원에 참고로 포함됨)을 참조한다.
본원에서의 목적을 위해, "제약 조성물"은 포유동물, 특히 인간에 적합하며 이에 투여하기에 적합한 것이다. 따라서, 조성물은 포유동물에서 질환 또는 장애를 치료하는데 사용될 수 있다. 또한, 그의 치료 용도를 방해할 수 있는 오염물(들)이 이로부터 분리되도록 조성물 내의 단백질에 대해 1회 이상의 정제 또는 단리 단계를 수행하였다. 일반적으로, 제약 조성물은 치료 단백질 및 제약상 허용되는 담체 또는 희석제를 포함한다. 조성물은 통상적으로 멸균되고, 동결건조될 수 있다. 제약 제제는 하기에 보다 상세하게 기재된다.
"폴리뉴클레오티드" 또는 "핵산"은 본원에서 교환가능하게 사용되며, 임의의 길이의 뉴클레오티드의 중합체를 지칭하고, DNA 및 RNA를 포함한다. 뉴클레오티드는 데옥시리보뉴클레오티드, 리보뉴클레오티드, 변형된 뉴클레오티드 또는 염기 및/또는 그의 유사체, 또는 DNA 또는 RNA 폴리머라제에 의해 또는 합성 반응에 의해 중합체 내로 혼입될 수 있는 임의의 기질일 수 있다. 폴리뉴클레오티드는 변형된 뉴클레오티드, 예컨대 메틸화 뉴클레오티드 및 그의 유사체를 포함할 수 있다. 뉴클레오티드 구조에 대한 변형은 존재하는 경우에 중합체의 어셈블리 이전 또는 이후에 부여될 수 있다. 뉴클레오티드의 서열에 비-뉴클레오티드 성분이 개재될 수 있다. 폴리뉴클레오티드는 합성 후에, 예컨대 표지와의 접합에 의해 추가로 변형될 수 있다. 다른 유형의 변형은 예를 들어 하나 이상의 자연 발생 뉴클레오티드의 유사체로의 "캡" 치환, 뉴클레오티드간 변형, 예컨대 예를 들어 하전되지 않은 연결부 (예를 들어, 메틸 포스포네이트, 포스포트리에스테르, 포스포아미데이트, 카르바메이트 등) 및 하전된 연결부 (예를 들어, 포스포로티오에이트, 포스포로디티오에이트 등)를 갖는 것, 펜던트 모이어티, 예컨대 예를 들어 단백질 (예를 들어, 뉴클레아제, 독소, 항체, 신호 펩티드, 폴리-L-리신 등)을 함유하는 것, 삽입제 (예를 들어, 아크리딘, 프소랄렌 등)을 갖는 것, 킬레이터 (예를 들어, 금속, 방사성 금속, 붕소, 산화 금속 등)을 함유하는 것, 알킬레이터를 함유하는 것, 변형 연결부 (예를 들어, 알파 아노머 핵산 등)를 갖는 것 뿐만 아니라, 폴리뉴클레오티드(들)의 비변형된 형태를 포함한다. 추가로, 당 내에 통상적으로 존재하는 임의의 히드록실 기가 예를 들어 포스포네이트 기, 포스페이트 기로 대체되거나, 표준 보호기로 보호되거나, 추가의 뉴클레오티드에 대한 추가의 연결이 만들어지도록 활성화되거나, 또는 고체 또는 반고체 지지체에 접합될 수 있다. 5' 및 3' 말단 OH가 인산화되거나 또는 아민 또는 1 내지 20개 탄소 원자의 유기 캡핑 기 모이어티로 치환될 수 있다. 다른 히드록실이 또한 표준 보호기로 유도체화될 수 있다. 폴리뉴클레오티드는 또한 예를 들어 2'-O-메틸-, 2'-O-알릴, 2'-플루오로- 또는 2'-아지도-리보스, 카르보시클릭 당 유사체, α-아노머 당, 에피머 당, 예컨대 아라비노스, 크실로스 또는 릭소스, 피라노스 당, 푸라노스 당, 세도헵툴로스, 비-시클릭 유사체 및 무염기성 뉴클레오시드 유사체, 예를 들어 메틸 리보시드를 포함하여, 일반적으로 당업계에 공지되어 있는 유사한 형태의 리보스 또는 데옥시리보스 당을 함유할 수 있다. 하나 이상의 포스포디에스테르 연결부가 대안적 연결 기로 대체될 수 있다. 이들 대안적 연결 기는 포스페이트가 P(O)S ("티오에이트"), P(S)S ("디티오에이트"), (O)NR2 ("아미데이트"), P(O)R, P(O)OR', CO 또는 CH2 ("포름아세탈") (여기서, 각각의 R 또는 R'는 독립적으로 H이거나 또는 임의로 에테르 (-O-) 연결부를 함유하는 치환 또는 비치환 알킬 (1-20 C), 아릴, 알케닐, 시클로알킬, 시클로알케닐 또는 아르알딜임)로 대체되는 실시양태를 포함하나 이에 제한되지 않는다. 폴리뉴클레오티드 내의 모든 연결이 동일할 필요는 없다. 상기 기재는 RNA 및 DNA를 비롯하여 본원에서 언급되는 모든 폴리뉴클레오티드에 적용된다.
본원에 사용된 "올리고뉴클레오티드"는 일반적으로, 반드시는 아니지만, 일반적으로 길이가 뉴클레오티드 약 200개 미만으로 짧은, 일반적으로 단일 가닥의, 일반적으로 합성 폴리뉴클레오티드를 지칭한다. 용어 "올리고뉴클레오티드" 및 "폴리뉴클레오티드"는 상호 배타적이지 않다. 폴리뉴클레오티드에 대한 상기 기재는 올리고뉴클레오티드에 동일하고 완전하게 적용가능하다.
용어 "수용체 결합 도메인"은 세포 부착 분자를 포함하는, 수용체에 대한 임의의 천연 리간드, 또는 적어도 상응하는 천연 리간드의 정성적 수용체 결합 능력을 유지하는 이러한 천연 리간드의 임의의 영역 또는 유도체를 지칭하는데 사용된다. 이러한 정의는 특히 구체적으로 상기 언급된 수용체에 대한 리간드로부터의 결합 서열을 포함한다.
"분비 신호 서열" 또는 "신호 서열"은 관심있는 새로 합성된 단백질을 원핵생물의 세포 막, 통상적으로 내막 또는 내막과 외막 둘 다를 통해 유도하는데 사용될 수 있는 짧은 신호 펩티드를 코딩하는 핵산 서열을 지칭한다. 이와 같이, 관심 단백질, 예컨대 이뮤노글로불린 경쇄 또는 중쇄 폴리펩티드는 원핵 숙주 세포의 주변세포질 또는 배양 배지로 분비된다. 분비 신호 서열에 의해 코딩되는 신호 펩티드는 숙주 세포에 내인성일 수 있거나, 또는 이들이 외인성일 수 있으며, 발현될 폴리펩티드에 대해 천연 신호 펩티드를 포함한다. 분비 신호 서열은 전형적으로 발현될 폴리펩티드의 아미노 말단에 존재하고, 전형적으로 생합성과 세포질로부터의 폴리펩티드의 분비 사이에 효소에 의해 제거된다. 따라서, 신호 펩티드는 통상적으로 성숙 단백질 생성물에 존재하지 않는다.
표현 "단일 도메인 항체" (sdAb) 또는 "단일 가변 도메인 (SVD) 항체"는 일반적으로 단일 가변 도메인 (VH 또는 VL)이 항원 결합을 부여할 수 있는 항체를 지칭한다. 즉, 단일 가변 도메인은 표적 항원에 결합하기 위해 또 다른 가변 도메인과의 상호작용을 필요로 하지 않는다. 단일 도메인 항체의 예는 자연, 예컨대 낙타류 (라마 및 낙타) 및 연골어류 (예를 들어, 너스 상어)로부터 유래된 것 및 인간 및 마우스 항체로부터 재조합 방법으로부터 유래된 것을 포함하나 이에 제한되지 않는다 (문헌 [Nature (1989) 341:544-546; Dev Comp Immunol (2006) 30:43-56; Trend Biochem Sci (2001) 26:230-235; Trends Biotechnol (2003):21:484-490]; WO 2005/035572; WO 03/035694; [Febs Lett (1994) 339:285-290]; WO00/29004; WO 02/051870).
본원에 사용된 "치료 항체"는 질환 또는 장애에 걸리거나 또는 이에 걸리기 쉬운 포유동물에서 질환 또는 장애를 치료하는데 유효한 항체이다. 예시적인 치료 항체는 본 발명의 항-IL-1β 및 항-IL-18 항체, 예를 들어 본 발명의 항-IL-1β 및 항-IL-18 이중특이적 항체 뿐만 아니라 항체, 예를 들어 rhuMAb 4D5 (헤르셉틴(HERCEPTIN)®) (문헌 [Carter et al., 1992, Proc. Natl. Acad. Sci. USA, 89:4285-4289], 미국 특허 번호 5,725,856); 항-CD20 항체, 예컨대 미국 특허 번호 5,736,137에서와 같은 키메라 항-CD20 "C2B8" (리툭산(RITUXAN)®), 미국 특허 번호 5,721,108, B1에서와 같은 2H7 항체의 키메라 또는 인간화 변이체 또는 토시투모맙 (벡사르(BEXXAR)®); 항-IL-8 (문헌 [St John et al., 1993, Chest, 103:932], 및 국제 공보 번호 WO 95/23865); 항-VEGF 항체, 예를 들어 인간화 및/또는 친화도 성숙 항-VEGF 항체, 예컨대 인간화 항-VEGF 항체 huA4.6.1 아바스틴(AVASTIN)TM (문헌 [Kim et al., 1992, Growth Factors, 7:53-64], 국제 공보 번호 WO 96/30046, 및 WO 98/45331, 1998년 10월 15일에 공개됨); 항-PSCA 항체 (WO01/40309); 항-CD40 항체, 예를 들어 S2C6 및 그의 인간화 변이체 (WO00/75348); 항-CD11a (미국 특허 번호 5,622,700, WO 98/23761, 문헌 [Steppe et al., 1991, Transplant Intl. 4:3-7, 및 Hourmant et al., 1994, Transplantation 58:377-380]); 항-IgE (문헌 [Presta et al., 1993, J. Immunol. 151:2623-2632], 및 국제 공보 번호 WO 95/19181); 항-CD18 (미국 특허 번호 5,622,700, 1997년 4월 22일에 허여됨, 또는 WO 97/26912에서와 같음, 1997년 7월 31일에 공개됨); 항-IgE (미국 특허 번호 5,714,338, 1998년 2월 3일에 허여됨, 또는 미국 특허 번호 5,091,313, 1992년 2월 25일에 허여됨, WO 93/04173, 1993년 3월 4일에 공개됨, 또는 국제 출원 번호 PCT/US98/13410, 1998년 6월 30일에 출원됨, 미국 특허 번호 5,714,338); 항-Apo-2 수용체 항체 (WO 98/51793, 1998년 11월 19일에 공개됨); 항-TNF-α 항체, 예를 들어 cA2 (레미케이드(REMICADE)®), CDP571 및 MAK-195 (미국 특허 번호 5,672,347, 1997년 9월 30일에 허여됨, 문헌 [Lorenz et al. 1996, J. Immunol. 156(4):1646-1653, 및 Dhainaut et al. 1995, Crit. Care Med. 23(9):1461-1469] 참조); 항-조직 인자 (TF) (유럽 특허 번호 0 420 937 B1, 1994년 11월 9일에 등록됨); 항-인간 γ4-β7 인테그린 (WO 98/06248, 1998년 2월 19일에 공개됨); 항-EGFR (WO 96/40210 (1996년 12월 19일에 공개됨)에서와 같은 키메라 또는 인간화 225 항체); 항-CD3 항체, 예컨대 OKT3 (미국 특허 번호 4,515,893, 1985년 5월 7일에 허여됨); 항-CD25 또는 항-tac 항체, 예컨대 CHI-621 (시뮬렉트(SIMULECT)®) 및 (제나팍스(ZENAPAX)®) (미국 특허 번호 5,693,762 참조, 1997년 12월 2일에 허여됨); 항-CD4 항체, 예컨대 cM-7412 항체 (문헌 [Choy et al. 1996, Arthritis Rheum 39(1):52-56]); 항-CD52 항체, 예컨대 CAMPATH-1H (문헌 [Riechmann et al. 1988, Nature 332:323-337]; 항-Fc 수용체 항체, 예컨대 FcγRI에 대해 지시된 M22 항체 (문헌 [Graziano et al. 1995, J. Immunol. 155(10):4996-5002]에서와 같음); 항암배아성 항원 (CEA) 항체, 예컨대 hMN-14 (문헌 [Sharkey et al. 1995, Cancer Res. 55(23 Suppl): 5935s-5945s]); 유방 상피 세포에 대해 지시된 항체, 예를 들어 huBrE-3, hu-Mc 3 및 CHL6 (문헌 [Ceriani et al. 1995, Cancer Res. 55(23): 5852s-5856s; 및 Richman et al. 1995, Cancer Res. 55(23 Supp): 5916s-5920s]); 결장 암종 세포에 결합하는 항체, 예컨대 C242 (문헌 [Litton et al. 1996, Eur J. Immunol. 26(1): 1-9]); 항-CD38 항체, 예를 들어 AT 13/5 (문헌 [Ellis et al. 1995, J. Immunol. 155(2):925-937]); 항-CD33 항체, 예컨대 Hu M195 (문헌 [Jurcic et al. 1995, Cancer Res 55(23 Suppl):5908s-5910s]) 및 CMA-676 또는 CDP771; 항-CD22 항체, 예컨대 LL2 또는 림포사이드(LymphoCide) (문헌 [Juweid et al. 1995, Cancer Res 55(23 Suppl):5899s-5907s]); 항-EpCAM 항체, 예컨대 17-1A (파노렉스(PANOREX)®); 항-GpIIb/IIIa 항체, 예컨대 압식시맙 또는 c7E3 Fab (레오프로(REOPRO)®); 항-RSV 항체, 예컨대 MEDI-493 (시나기스(SYNAGIS)®); 항-CMV 항체, 예컨대 프로토비르(PROTOVIR)®; 항-HIV 항체, 예컨대 PRO542; 항-간염 항체, 예컨대 항-Hep B 항체 오스타비르(OSTAVIR)®; 항-CA 125 항체 오바렉스(OvaRex); 항-이디오타입 GD3 에피토프 항체 BEC2; 항-αvβ3 항체 비탁신(VITAXIN)®; 항-인간 신세포 암종 항체, 예컨대 ch-G250; ING-1; 항-인간 17-IA 항체 (3622W94); 항-인간 결장직장 종양 항체 (A33); GD3 강글리오시드에 대해 지시된 항-인간 흑색종 항체 R24; 항-인간 편평세포 암종 (SF-25); 및 항-인간 백혈구 항원 (HLA) 항체, 예컨대 스마트(Smart) ID10 및 항-HLA DR 항체 온콜림(Oncolym) (Lym-1)을 포함한다.
"표적 분자"는 표적 인식 부위에 결합할 수 있는 분자를 지칭한다. 표적 분자:표적 인식 부위 상호작용의 예는 항원:항체 가변 도메인 상호작용, 수용체:리간드 상호작용, 리간드:수용체 상호작용, 어드헤신:어드헤신 상호작용, 비오틴:스트렙아비딘 상호작용 등을 포함한다. 한 실시양태에서, 표적 분자는 생물학적 분자이다.
용어 "치료 유효량"은 대상체 또는 포유동물에서 질환 또는 장애를 "완화" 또는 "치료"하는데 유효한 본 발명의 조성물의 양을 지칭한다. 한 실시양태에서, "치료 유효량"은 그를 필요로 하는 대상체에서 IL-1β 및 IL-18의 그의 수용체에 대한 결합을 억제 또는 감소시키는데 유효하거나 또는 염증성 장애를 치료 또는 예방하는데 유효한, 단독 또는 다른 활성 성분과 조합된 본원에 기재된 항체의 양을 포함하도록 의도된다.
"치료" (및 그의 문법적 변형, 예컨대 "치료하다" 또는 "치료하는")는 치료될 대상체의 자연적 과정을 변경시키기 위한 임상적 개입을 지칭하고, 임상 병리상태의 예방을 위해 또는 그 과정 동안 수행될 수 있다. 바람직한 치료 효과는 질환의 발생 또는 재발 예방, 증상의 완화, 질환의 임의의 직접 또는 간접적인 병리학적 결과의 축소, 전이의 예방, 질환 질행 속도의 감소, 질환 병태의 개선 또는 호전, 및 차도 또는 개선된 예후를 포함하나 이에 제한되지 않는다. 일부 실시양태에서, 본 발명의 항체는 질환의 발생을 지연시키거나 또는 질환의 진행을 느리게 하기 위해 사용된다. 일반적으로, 질환 또는 장애의 치료는 질환 또는 장애와 연관된 하나 이상의 증상 또는 의학적 문제를 줄이는 것을 포함한다. 일부 실시양태에서, 본 발명의 항체 및 조성물을 사용하여 대상체 또는 포유동물에서 질환 또는 장애의 발생 또는 재발을 예방할 수 있다. 예를 들어, 자가면역 질환을 갖는 대상체에서, 본 발명의 항체는 갑작스런 재발을 예방 또는 치료하는데 사용될 수 있다. 연속 치료 또는 투여는 1일 이상의 치료가 중단되지 않으면서 적어도 매일 치료하는 것을 지칭한다. 간헐적 치료 또는 투여, 또는 간헐적 방식의 치료 또는 투여는 연속적이지 않고, 오히려 사실상 주기적인 치료를 지칭한다. 본원에서 치료 처방은 연속적 또는 간헐적일 수 있다.
용어 "가변"은 가변 도메인의 특정 절편의 서열이 항체마다 광범위하게 상이하다는 사실을 지칭한다. V 도메인은 항원 결합을 매개하고, 특정한 항체마다 그의 특정한 항원에 대한 특이성을 정의한다. 그러나, 가변성이 가변 도메인의 아미노산 범위에 걸쳐 고르게 분포되어 있는 것은 아니다. 대신에, V 영역은 "초가변 영역"이라 지칭되는 가변성이 극도로 높은 보다 짧은 영역에 의해 분리된, 프레임워크 영역 (FR)이라 지칭되는 비교적 불변성인 스트레치로 이루어진다. 한 가변 도메인 내의 초가변 영역은 항체의 유형에 따라 항체 상의 항원-결합 부위 형성에 기여하기 위해 또 다른 쇄로부터의 초가변 영역과 협력할 수 있다 (문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)] 참조). 불변 도메인은 전형적으로 항원에 대한 항체 결합에 직접 관련되지 않지만, 다양한 이펙터 기능, 예컨대 항체 의존성 세포 세포독성 (ADCC)에서의 항체의 참여를 나타낸다.
본원에 사용된 "변이체" 또는 "변경된" 중쇄는 일반적으로, 예를 들어 적어도 1개의 시스테인 잔기가 디술피드 연결부를 형성할 수 없게 된, 감소된 디술피드 연결 능력을 갖는 중쇄를 지칭한다. 바람직하게는, 상기 적어도 1개의 시스테인은 중쇄의 힌지 영역에 있다.
본원에 사용된 용어 "벡터"는 그가 연결된 또 다른 핵산을 수송할 수 있는 핵산 분자를 지칭하도록 의도된다. 벡터의 한 가지 유형은 추가의 DNA 절편이 그 내부에 라이게이션될 수 있는 원형 이중 가닥 DNA 루프인 "플라스미드"이다. 또 다른 유형의 벡터는 파지 벡터이다. 또 다른 유형의 벡터는 추가의 DNA 절편이 바이러스 게놈 내로 라이게이션될 수 있는 바이러스 벡터이다. 특정 벡터는 그것이 도입된 숙주 세포 내에서 자율 복제가 가능하다 (예를 들어, 박테리아 복제 기점을 갖는 박테리아 벡터 및 에피솜 포유동물 벡터). 다른 벡터 (예를 들어, 비-에피솜 포유동물 벡터)는 숙주 세포 내로 도입시에 숙주 세포의 게놈 내로 통합될 수 있고, 이에 의해 숙주 게놈과 함께 복제된다. 또한, 특정 벡터는 벡터가 작동가능하게 연결된 유전자의 발현을 지시할 수 있다. 이러한 벡터가 본원에서 "재조합 발현 벡터" (또는 간단히, "재조합 벡터")로서 지칭된다. 일반적으로, 재조합 DNA 기술에 유용한 발현 벡터는 종종 플라스미드의 형태로 존재한다. 본 명세서에서, "플라스미드" 및 "벡터"는 교환가능하게 사용될 수 있는데, 이는 플라스미드가 가장 흔하게 사용되는 형태의 벡터이기 때문이다.
항체는 이것이 표적 분자가 아닌 다른 분자에 결합하는 것 보다 유의하게 우수한 친화도로 표적 분자에 "선택적으로 결합한다". 상대적 결합 및/또는 결합 친화도는 당업계에 수용된 다양한 방법 (효소 결합 면역흡착 검정 (ELISA) 및 형광 활성화 세포 분류 (FACS)를 포함하나 이에 제한되지 않음)에 의해 입증될 수 있다. 일부 실시양태에서, ELISA에 의해 결정된 바와 같이, 본 발명의 항체는 이것이 비-표적 분자에 결합하는 것보다 적어도 약 1 log 더 높은 농도 반응성으로 표적 분자에 결합한다.
I. 예시적인 항체
가용성 인간 IL-1β 또는 인간 IL-18 또는 그의 단편 (다른 분자에 임의로 접합됨)이 항체를 생성하기 위한 면역원으로 사용될 수 있다. 대안적으로 또는 추가로, 인간 IL-1β 또는 인간 IL-18을 발현하는 세포를 면역원으로 사용할 수 있다. 이러한 세포는 천연 공급원으로부터 유래될 수 있거나, 인간 IL-1β 또는 인간 IL-18을 발현하기 위한 재조합 기술에 의해 형질전환된 세포일 수 있다. 항체를 제조하기에 유용한 인간 IL-1β 또는 인간 IL-18의 다른 형태가 당업자에게 명백할 것이다.
A. 폴리클로날 항체
폴리클로날 항체는 바람직하게는 관련 항원 및 아주반트의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 생성시킬 수 있다. 이관능성 또는 유도체화제, 예를 들어 말레이미도벤조일 술포숙신이미드 에스테르 (시스테인 잔기를 통한 접합), N-히드록시숙신이미드 (리신 잔기를 통한 접합), 글루타르알데히드, 숙신산 무수물, SOCl2, 또는 R1N=C=NR (여기서, R 및 R1은 상이한 알킬 기임)을 사용하여, 면역화될 종에서 면역원성인 단백질, 예를 들어 키홀 림펫 헤모시아닌, 혈청 알부민, 소 티로글로불린 또는 대두 트립신 억제제에 관련 항원을 접합시키는 것이 유용할 수 있다.
예를 들어 단백질 또는 접합체 100 μg 또는 5 μg (각각, 토끼 또는 마우스의 경우)을 3 부피의 프로인트 완전 아주반트와 합하고, 이 용액을 다중 부위에 피내 주사함으로써, 동물을 항원, 면역원성 접합체 또는 유도체에 대해 면역화시킨다. 대략 1개월 후에, 프로인트 완전 아주반트에 포함된 펩티드 또는 접합체의 본래 양의 1/5 내지 1/10을 다중 부위에 피하 주사함으로써 상기 동물을 부스팅시킨다. 7 내지 14일 후, 동물에서 채혈하여, 혈청을 항체 역가에 대해 검정한다. 역가가 정체기에 도달할 때까지 동물을 부스팅시킨다. 바람직하게는, 상이한 단백질에 및/또는 상이한 가교 시약을 통해 접합되었으나 동일한 항원의 접합체로 동물을 부스팅시킨다. 접합체는 또한 재조합 세포 배양에서 단백질 융합체로서 제조될 수 있다. 또한, 명반과 같은 응집제를 적절하게 사용하여 면역 반응을 증진시킨다.
B. 모노클로날 항체
모노클로날 항체를 문헌 [Kohler et al., 1975, Nature, 256:495]에 최초로 기재된 하이브리도마 방법을 이용하여 제조할 수 있거나, 또는 재조합 DNA 방법 (예를 들어, 미국 특허 번호 4,816,567 참조)에 의해 제조할 수 있다.
하이브리도마 방법에서는, 마우스 또는 다른 적절한 숙주 동물, 예컨대 햄스터 또는 마카크 원숭이를 상기 기재된 바와 같이 면역화시켜, 면역화에 사용된 단백질에 특이적으로 결합할 항체를 생산하거나 생산할 수 있는 림프구를 도출한다. 대안적으로, 림프구를 시험관내에서 면역화시킬 수 있다. 이어서, 적합한 융제, 예컨대 폴리에틸렌 글리콜을 사용하여 림프구를 골수종 세포와 융합시켜 하이브리도마 세포를 형성한다 (문헌 [Goding, 1986, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press)]).
이와 같이 제조된 하이브리도마 세포를, 바람직하게는 융합되지 않은 모 골수종 세포의 성장 또는 생존을 억제하는 하나 이상의 물질을 함유하는 적합한 배양 배지에 시딩하여 성장시킨다. 예를 들어, 모 골수종 세포에 하이포크산틴 구아닌 포스포리보실 트랜스퍼라제 (HGPRT 또는 HPRT) 효소가 결핍된 경우에, 하이브리도마용 배양 배지는 전형적으로 하이포크산틴, 아미노프테린 및 티미딘을 포함할 것이며 (HAT 배지), 이러한 물질들은 HGPRT-결핍 세포의 성장을 방지한다.
바람직한 골수종 세포는 효율적으로 융합되고, 선택된 항체-생산 세포에 의한 항체의 안정한 고수준 생산을 지지하고, 배지, 예컨대 HAT 배지에 감수성인 것이다. 이들 중에, 바람직한 골수종 세포주는 뮤린 골수종 세포주, 예컨대 솔크 인스티튜트 셀 디스트리뷰션 센터(Salk Institute Cell Distribution Center, 미국 캘리포니아주 샌디에고)로부터 입수가능한 MOPC-21 및 MPC-11 마우스 종양으로부터 유래된 것, 및 아메리칸 타입 컬쳐 콜렉션(American Type Culture Collection, 미국 메릴랜드주 록빌)으로부터 입수가능한 SP-2 또는 X63-Ag8-653 세포이다. 인간 골수종 및 마우스-인간 이종골수종 세포주는 또한 인간 모노클로날 항체의 생산을 위해 기재되어 있다 (문헌 [Kozbor, 1984, J. Immunol., 133:3001; Brodeur et al., 1987, Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York)]).
하이브리도마 세포가 성장하는 배양 배지를 항원에 대해 지시된 모노클로날 항체의 생산에 대해 검정한다. 바람직하게는, 하이브리도마 세포에 의해 생산되는 모노클로날 항체의 결합 특이성을 면역침전 또는 시험관내 결합 검정, 예컨대 방사성면역검정 (RIA) 또는 효소-연결된 면역흡착 검정 (ELISA)에 의해 결정한다.
원하는 특이성, 친화도 및/또는 활성의 항체를 생산하는 하이브리도마 세포가 확인된 후에, 클론은 제한 희석 절차에 의해 서브클로닝하고 표준 방법 (문헌 [Goding, 상기 문헌])에 의해 성장시킬 수 있다. 이러한 목적에 적합한 배양 배지는 예를 들어 D-MEM 또는 RPMI-1640 배지를 포함한다. 또한, 하이브리도마 세포가 동물에서 복수 종양으로서 생체내에서 성장될 수 있다.
서브클론에 의해 분비된 모노클로날 항체는 통상적인 이뮤노글로불린 정제 절차, 예컨대 예를 들어, 단백질 A-세파로스, 히드록시아파타이트 크로마토그래피, 겔 전기영동, 투석, 또는 친화성 크로마토그래피에 의해 배양 배지, 복수액 또는 혈청으로부터 적합하게 분리된다.
통상적인 절차를 이용하여 (예를 들어, 모노클로날 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브를 사용하여) 모노클로날 항체를 코딩하는 DNA가 용이하게 단리되고 서열분석된다. 하이브리도마 세포는 이러한 DNA의 바람직한 공급원으로 제공된다. 일단 단리되면, DNA를 발현 백터 내로 넣을 수 있고, 이어서 이를 달리 이뮤노글로불린 단백질을 생산하지 않는 숙주 세포, 예컨대 이. 콜라이(E. coli) 세포, 원숭이 COS 세포, 차이니즈 햄스터 난소 (CHO) 세포 또는 골수종 세포 내로 형질감염시켜, 재조합 숙주 세포에서의 모노클로날 항체의 합성을 달성한다. 항체의 재조합 생산은 하기에 더욱 상세하게 기재될 것이다.
추가 실시양태에서, 항체 또는 항체 단편은 문헌 [McCafferty et al., 1990, Nature, 348:552-554]에 기재된 기술을 이용하여 생성된 항체 파지 라이브러리로부터 단리될 수 있다. 문헌 [Clackson et al., 1991, Nature, 352:624-628, 및 Marks et al., 1991, J. Mol. Biol., 222:581-597]은 파지 라이브러리를 사용하여 뮤린 및 인간 항체를 각각 단리하는 방법을 기재한다. 후속 문헌은 쇄 셔플링에 의한 고친화도 (nM 범위) 인간 항체의 생산 (문헌 [Marks et al., 1992, Bio/Technology, 10:779-783]) 뿐만 아니라 매우 큰 파지 라이브러리 구축을 위한 전략으로서 조합 감염 및 생체내 재조합 (문헌 [Waterhouse et al., 1993, Nuc. Acids. Res., 21:2265-2266])을 기재한다. 따라서, 이러한 기술은 모노클로날 항체의 단리를 위한 전통적인 모노클로날 항체 하이브리도마 기술에 대한 실행가능한 대안이다.
DNA는 또한, 예를 들어 상동성 뮤린 서열 대신에 인간 중쇄 및 경쇄 불변 도메인에 대한 코딩 서열을 치환시키거나 (미국 특허 번호 4,816,567; 문헌 [Morrison, et al., 1984, Proc. Natl. Acad. Sci. USA, 81:6851]), 이뮤노글로불린 코딩 서열에 비-이뮤노글로불린 물질 (예를 들어, 단백질 도메인)에 대한 코딩 서열의 전부 또는 일부를 공유 연결시켜 변형될 수 있다.
전형적으로, 이러한 비-이뮤노글로불린 물질은 항체의 불변 도메인에 대해 치환되거나 항체의 하나의 항원-결합 부위의 가변 도메인에 대해 치환되어, 항원에 대한 특이성을 갖는 하나의 항원-결합 부위 및 상이한 항원에 대한 특이성을 갖는 또 다른 항원-결합 부위를 포함하는 키메라 2가 항체를 생성한다.
C. 인간화 및 인간 항체
인간화 항체는 비인간 공급원으로부터의 1개 이상의 아미노산 잔기를 갖는다. 비인간 아미노산 잔기는 종종 "유입" 잔기라고 지칭되고, 전형적으로 "유입" 가변 도메인으로부터의 것이다. 인간화는 일반적으로 설치류 CDR 또는 CDR 서열을 인간 항체의 상응하는 서열에 대해 치환함으로써, 윈터(Winter) 및 동료의 방법 (문헌 [Jones et al., 1986, Nature, 321:522-525; Riechmann et al., 1988, Nature, 332:323-327; Verhoeyen et al., 1988, Science, 239:1534-1536])에 따라 수행할 수 있다. 따라서, 이러한 "인간화" 항체는 무손상 인간 가변 도메인보다 실질적으로 더 적은 부분이 비인간 종으로부터의 상응하는 서열로 치환된 키메라 항체이다 (미국 특허 번호 4,816,567). 실제로, 인간화 항체는 전형적으로 일부 CDR 잔기 및 아마도 일부 FR 잔기가 비인간, 예를 들어 설치류 항체의 유사한 부위로부터의 잔기로 치환된 인간 항체이다.
인간화 항체의 제조에 사용될 인간 가변 도메인 경쇄 및 중쇄 둘 다의 선택은 항원성 감소에 매우 중요하다. 소위 "최적-적합" 방법에 따라, 설치류 항체의 가변 도메인 서열을 공지의 인간 가변-도메인 서열의 전체 라이브러리에 대해 스크리닝한다. 이어서, 설치류의 서열에 가장 근접한 인간 서열이 인간화 항체에 대한 인간 프레임워크 (FR)로서 수용된다 (문헌 [Sims et al., 1987, J. Immunol., 151:2296; Chothia et al., 1987, J. Mol. Biol., 196:901]). 또 다른 방법은 경쇄 또는 중쇄의 특정한 하위군의 모든 인간 항체의 컨센서스 서열로부터 유래된 특정한 프레임워크를 이용한다. 여러 상이한 인간화 항체에 대해 동일한 프레임워크를 사용할 수 있다 (문헌 [Carter et al., 1992, Proc. Natl. Acad. Sci. USA, 89:4285; Presta et al., 1993, J. Immunol., 151:2623]).
또한, 항체가 항원에 대해 높은 친화도를 보유하고 다른 유리한 생물학적 특성을 보유하도록 인간화하는 것이 중요하다. 이 목적을 달성하기 위해서, 바람직한 방법에 따르면, 인간화 항체는 모 서열 및 인간화 서열의 3차원 모델을 이용하는 모 서열 및 다양한 개념적 인간화 생성물의 분석 과정에 의해 제조된다. 3차원 이뮤노글로불린 모델은 통상적으로 이용가능하고, 당업자에게 익숙하다. 선택된 후보 이뮤노글로불린 서열의 가능한 3차원 입체형태적 구조를 예시하고 디스플레이하는 컴퓨터 프로그램이 이용가능하다. 이러한 디스플레이를 조사하면 후보 이뮤노글로불린 서열의 기능에 있어서 잔기의 가능한 역할의 분석, 즉 후보 이뮤노글로불린이 그의 항원에 결합하는 능력에 영향을 미치는 잔기의 분석이 가능하다. 이러한 방식으로, FR 잔기는 수용자 서열 및 유입 서열로부터 선택 및 조합되어 원하는 항체 특성, 예컨대 표적 항원(들)에 대한 친화도 증가를 달성할 수 있다. 일반적으로, CDR 잔기가 항원 결합에 영향을 미치는데 직접적으로, 및 가장 실질적으로 관련된다.
대안적으로, 면역화시에 내인성 이뮤노글로불린 생산의 부재 하에 인간 항체의 전체 레퍼토리를 생산할 수 있는 트랜스제닉 동물 (예를 들어, 마우스)을 생산하는 것이 현재 가능하다. 예를 들어, 키메라 및 배선 돌연변이체 마우스에서 항체 중쇄 연결 영역 (JH) 유전자를 동형접합 결실시키면 내인성 항체 생산이 완전히 억제된다는 것이 기재되어 있다. 인간 배선 이뮤노글로불린 유전자 어레이를 이같은 배선 돌연변이체 마우스에게 전달하면, 항원 접종시에 인간 항체가 생산될 것이다. 예를 들어, 문헌 [Jakobovits et al., 1993, Proc. Natl. Acad. Sci. USA, 90:2551; Jakobovits et al., 1993, Nature, 362:255-258; Bruggermann et al., 1993, Year in Immuno., 7:33; 및 Duchosal et al., 1992, Nature 355:258]을 참조한다. 인간 항체는 또한 파지-디스플레이 라이브러리로부터 유래될 수 있다 (문헌 [Hoogenboom et al., 1991, J. Mol. Biol., 227:381; Marks et al., J. Mol. Biol., 1991, 222:581-597; Vaughan et al., 1996, Nature Biotech 14:309]).
i. 키메라 및 인간화 항체
특정 실시양태에서, 본원에 제공된 항체는 키메라 항체이다. 특정 키메라 항체는 예를 들어 미국 특허 번호 4,816,567; 및 문헌 [Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)]에 기재되어 있다. 한 예에서, 키메라 항체는 비인간 가변 영역 (예를 들어, 마우스, 래트, 햄스터, 토끼 또는 비인간 영장류, 예컨대 원숭이로부터 유래된 가변 영역) 및 인간 불변 영역을 포함한다. 추가의 예에서, 키메라 항체는 클래스 또는 서브클래스가 모 항체의 것으로부터 변화된 "클래스 스위칭" 항체이다. 키메라 항체는 그의 항원-결합 단편을 포함한다.
특정 실시양태에서, 키메라 항체는 인간화 항체이다. 전형적으로, 비인간 항체는 모 비인간 항체의 특이성 및 친화도를 유지하면서 인간에 대한 면역원성이 감소하도록 인간화된다. 일반적으로, 인간화 항체는 HVR, 예를 들어 CDR (또는 그의 일부)이 비인간 항체로부터 유래되고, FR (또는 그의 일부)이 인간 항체 서열로부터 유래된 하나 이상의 가변 도메인을 포함한다. 인간화 항체는 또한 임의로 인간 불변 영역의 적어도 일부를 포함할 것이다. 일부 실시양태에서, 인간화 항체의 일부 FR 잔기는, 예를 들어 항체 특이성 또는 친화도를 복원하거나 또는 개선시키기 위해, 비인간 항체 (예를 들어, HVR 잔기가 유래된 항체)로부터의 상응하는 잔기로 치환된다.
인간화 항체 및 그의 제조 방법은 예를 들어 문헌 [Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)]에서 검토되고, 예를 들어 문헌 [Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989)]; 미국 특허 번호 5,821,337, 7,527,791, 6,982,321, 및 7,087,409; [Kashmiri et al., Methods 36:25-34 (2005)] (SDR (a-CDR) 그라프팅 기재); [Padlan, Mol. Immunol. 28:489-498 (1991)] ("리서페이싱" 기재); [Dall'Acqua et al., Methods 36:43-60 (2005)] ("FR 셔플링" 기재); 및 [Osbourn et al., Methods 36:61-68 (2005) 및 Klimka et al., Br. J. Cancer, 83:252-260 (2000)] (FR 셔플링에 대한 "안내 선택" 접근법 기재)에 추가로 기재되어 있다.
인간화에 사용될 수 있는 인간 프레임워크 영역은 "최적-적합" 방법을 이용하여 선택된 프레임워크 영역 (예를 들어, 문헌 [Sims et al. J. Immunol. 151:2296 (1993)] 참조); 경쇄 또는 중쇄 가변 영역의 특정한 하위군의 인간 항체의 컨센서스 서열로부터 유래된 프레임워크 영역 (예를 들어, 문헌 [Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); 및 Presta et al. J. Immunol., 151:2623 (1993)] 참조); 인간 성숙 (체세포 성숙) 프레임워크 영역 또는 인간 배선 프레임워크 영역 (예를 들어, 문헌 [Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)] 참조); 및 스크리닝 FR 라이브러리로부터 유래된 프레임워크 영역 (예를 들어, 문헌 [Baca et al., J. Biol. Chem. 272:10678-10684 (1997) 및 Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)] 참조)을 포함하나 이에 제한되지 않는다.
ii. 인간 항체
특정 실시양태에서, 본원에 제공된 항체는 인간 항체이다. 인간 항체는 당업계에 공지된 다양한 기술을 이용하여 생산될 수 있다. 인간 항체는 일반적으로 문헌 [van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) 및 Lonberg, Curr. Opin. Immunol. 20:450-459 (2008)]에 기재되어 있다.
인간 항체는 항원 접종에 반응하여 인간 가변 영역을 갖는 무손상 인간 항체 또는 무손상 항체를 생산하도록 변형된 트랜스제닉 동물에게 면역원을 투여하여 제조할 수 있다. 이러한 동물은 전형적으로 내인성 이뮤노글로불린 로커스를 대체하거나 또는 염색체외에 존재하거나 또는 동물의 염색체로 무작위적으로 통합된 인간 이뮤노글로불린 로커스의 전부 또는 일부를 함유한다. 이러한 트랜스제닉 마우스에서, 내인성 이뮤노글로불린 로커스는 일반적으로 불활성화된다. 트랜스제닉 동물로부터 인간 항체를 수득하는 방법의 검토를 위해, 문헌 [Lonberg, Nat. Biotech. 23:1117-1125 (2005)]을 참조한다. 또한, 예를 들어 미국 특허 번호 6,075,181 및 6,150,584 (제노마우스(XENOMOUSE)TM 기술 기재); 미국 특허 번호 5,770,429 (휴맵(HuMab)® 기술 기재); 미국 특허 번호 7,041,870 (K-M 마우스(K-M MOUSE)® 기술 기재), 및 미국 특허 출원 공보 번호 US 2007/0061900 (벨로시마우스(VelociMouse)® 기술 기재)을 참조한다. 이러한 동물에 의해 생성된 무손상 항체로부터의 인간 가변 영역은 예를 들어 상이한 인간 불변 영역과 조합시켜 추가로 변형될 수 있다.
인간 항체는 또한 하이브리도마-기반 방법에 의해 제조될 수 있다. 인간 모노클로날 항체의 생산을 위한 인간 골수종 및 마우스-인간 이종골수종 세포주가 기재되어 있다. (예를 들어, 문헌 [Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); 및 Boerner et al., J. Immunol., 147: 86 (1991)] 참조.) 인간 B-세포 하이브리도마 기술을 통해 생성된 인간 항체는 또한 문헌 [Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006)]에 기재되어 있다. 추가의 방법은, 예를 들어 미국 특허 번호 7,189,826 (하이브리도마 세포주로부터의 모노클로날 인간 IgM 항체의 생산 기재) 및 문헌 [Ni, Xiandai Mianyixue, 26(4):265-268 (2006)] (인간-인간 하이브리도마 기재)에 기재된 것을 포함한다. 인간 하이브리도마 기술 (트리오마(Trioma) 기술)은 또한 문헌 [Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) 및 Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005)]에 기재되어 있다.
인간 항체는 또한 인간-유래 파지 디스플레이 라이브러리로부터 선택된 Fv 클론 가변 도메인 서열을 단리하여 생성될 수 있다. 이어서, 이러한 가변 도메인 서열은 원하는 인간 불변 도메인과 조합될 수 있다. 항체 라이브러리로부터 인간 항체를 선택하기 위한 기술은 하기 기재된다.
D. 다중특이적 항체
다중특이적 항체는 적어도 2가지 상이한 항원에 대한 결합 특이성을 갖는다. 이러한 분자는 통상적으로 오직 2가지 항원에만 결합할 것이지만 (즉, 이중특이적 항체, BsAb), 추가의 특이성을 갖는 항체, 예컨대 삼중특이적 항체가 본원에서 사용되는 경우에는 이러한 표현에 포함된다. BsAb의 예는 IL-1β에 대해 지시된 하나의 항원 결합 부위 및 IL-18에 대해 지시된 또 다른 항원 결합 부위를 갖는 것을 포함한다. 일부 실시양태에서, BsAb는 IL-1β 또는 IL-18에 대한 제1 결합 특이성 및 세포질 ITAM 모티프를 갖는 활성화 수용체에 대한 제2 결합 특이성을 포함한다. ITAM 모티프 구조는 9-11개 아미노산 스페이서에 의해 분리된 2개의 티로신을 보유한다. 일반적 컨센서스 서열은 YxxL/I(x)6-8YxxL이다 (문헌 [Isakov, N., 1997, J. Leukoc. Biol., 61:6-16]). 예시적인 활성화 수용체는 FcεRI, FcγRIII, FcγRI, FcγRIIA 및 FcγRIIC를 포함한다. 다른 활성화 수용체는 예를 들어 CD3, CD2, CD10, CD161, DAP-12, KAR, KARAP, FcεRII, Trem-1, Trem-2, CD28, p44, p46, B 세포 수용체, LMP2A, STAM, STAM-2, GPVI 및 CD40을 포함한다 (예를 들어, 문헌 [Azzoni, et al., 1998, J. Immunol. 161:3493; Kita, et al., 1999, J. Immunol. 162:6901; Merchant, et al., 2000, J. Biol. Chem. 74:9115; Pandey, et al., 2000, J. Biol. Chem. 275:38633; Zheng, et al., 2001, J. Biol. Chem. 276:12999; Propst, et al., 2000, J. Immunol. 165:2214] 참조).
한 실시양태에서, BsAb는 IL-1β에 대한 제1 결합 특이성 및 IL-18에 대한 제2 결합 특이성을 포함한다. 이중특이적 항체는 전장 항체 또는 항체 단편으로 제조될 수 있다 (예를 들어, F(ab')2 이중특이적 항체). 이중특이적 항체는 추가로 노브-인-홀 또는 힌지부재 항체로 제조될 수 있다. 이중특이적 항체는 문헌 [Segal et al., 2001, J. Immunol. Methods 248:1-6]에서 검토된다.
이중특이적 항체의 제조 방법이 당업계에 공지되어 있다. 전장 이중특이적 항체의 전통적인 생산은 2개의 이뮤노글로불린 중쇄-경쇄 쌍의 공발현을 기반으로 하며, 여기서 2개의 쇄는 상이한 특이성을 갖는다 (문헌 [Millstein et al., 1983, Nature, 305:537-539]). 이뮤노글로불린 중쇄 및 경쇄의 무작위 분류로 인해, 이들 하이브리도마 (쿼드로마)는 10가지 상이한 항체 분자들의 잠재적인 혼합물을 생산하며, 이 중에서 오직 하나만이 정확한 이중특이적 구조를 갖는다. 통상적으로 친화성 크로마토그래피 단계에 의해 이루어지는 정확한 분자의 정제는 다소 번거롭고, 생성물 수율이 낮다. 유사한 절차가 WO 93/08829 및 문헌 [Traunecker et al., 1991, EMBO J., 10:3655-3659]에 개시되어 있다.
다른 접근법에 따르면, 원하는 결합 특이성 (항체-항원 결합 부위)을 갖는 항체 가변 도메인이 이뮤노글로불린 불변 도메인 서열에 융합된다. 융합은 힌지, CH2 및 CH3 영역의 적어도 일부를 포함하는 이뮤노글로불린 중쇄 불변 도메인과의 융합일 수 있다. 융합체 중 적어도 하나에 존재하는, 경쇄 결합에 필요한 부위를 함유하는 제1 중쇄 불변 영역 (CH1)을 갖는 것이 바람직하다. 이뮤노글로불린 중쇄 융합체 및 원하는 경우에 이뮤노글로불린 경쇄를 코딩하는 DNA를 별도의 발현 벡터 내로 삽입하고, 적합한 숙주 유기체 내로 공동-형질감염시킨다. 이는 구축에 사용된 3가지 항체 쇄의 동일하지 않은 비가 최적의 수율을 제공하는 실시양태에서 상기 3가지 항체 단편의 상호 비를 조정하는데 큰 유연성을 제공한다. 그러나, 동일한 비의 적어도 2가지 항체 쇄의 발현으로 높은 수율이 수득되는 경우에, 또는 비가 특정한 유의성을 갖지 않는 경우에, 2가지 또는 모든 3가지 항체 쇄에 대한 코딩 서열을 1개의 발현 벡터에 삽입할 수 있다.
이러한 접근법의 또 다른 실시양태에서, 이중특이적 항체는 한쪽 아암에 제1 결합 특이성을 갖는 하이브리드 이뮤노글로불린 중쇄, 및 다른쪽 아암에 하이브리드 이뮤노글로불린 중쇄-경쇄 쌍 (제2 결합 특이성 제공)으로 구성된다. 이중특이적 분자의 절반에만 이뮤노글로불린 경쇄가 존재하는 것이 용이한 분리 방법을 제공하기 때문에, 이러한 비대칭 구조는 원치않는 이뮤노글로불린 쇄 조합물로부터 원하는 이중특이적 화합물의 분리를 용이하게 하는 것으로 밝혀졌다. 이러한 접근법은 WO 94/04690에 개시되어 있다. 이중특이적 항체를 생성하는 방법에 대한 추가의 상세한 내용에 대해, 예를 들어 문헌 [Suresh et al., 1986, Methods in Enzymology, 121:210]을 참조한다.
WO96/27011에 기재된 또 다른 접근법에 따르면, 한 쌍의 항체 분자 사이의 인터페이스를 조작하여 재조합 세포 배양물로부터 회수되는 이종이량체의 백분율을 최대화할 수 있다. 바람직한 인터페이스는 항체 불변 도메인의 CH3 도메인의 적어도 일부를 포함한다. 이러한 방법에서, 제1 항체 분자의 인터페이스로부터의 1개 이상의 소형 아미노산 측쇄가 보다 큰 측쇄 (예를 들어, 티로신 또는 트립토판)로 대체된다. 큰 아미노산 측쇄를 보다 작은 것 (예를 들어, 알라닌 또는 트레오닌)으로 대체함으로써 큰 측쇄(들)에 대해 동일하거나 유사한 크기의 보상 "함몰부"가 제2 항체 분자의 인터페이스 상에 생성된다. 이는 동종이량체와 같은 다른 원치않는 최종-생성물에 비해 이종이량체의 수율을 증가시키는 메카니즘을 제공한다.
이중특이적 항체는 가교된 또는 "이종접합체" 항체를 포함한다. 예를 들어, 이종접합체 내의 항체 중 하나는 아비딘에 커플링되고, 다른 하나는 비오틴에 커플링될 수 있다. 이러한 항체는 예를 들어 면역계 세포의 원치않는 세포로의 표적화 (미국 특허 번호 4,676,980) 및 HIV 감염의 치료 (WO 91/00360, WO 92/200373 및 EP 03089)를 위해 제안된 바 있다. 이종접합체 항체는 임의의 편리한 가교 방법을 이용하여 제조될 수 있다. 적합한 가교제가 당업계에 널리 공지되어 있고, 다수의 가교 기술과 함께 예를 들어 미국 특허 번호 4,676,980에 개시되어 있다.
2가 초과의 원자가를 갖는 항체가 또한 고려된다. 예를 들어, 삼중특이적 항체는 문헌 [Tutt et al., 1991, J. Immunol. 147: 60]에 따라 제조될 수 있다.
"옥토퍼스 항체"를 포함하여, 3개 이상의 기능적 항원 결합 부위를 갖는 조작된 항체가 또한 본원에 포함된다 (예를 들어, US 2006/0025576A1 참조).
본원의 항체 또는 단편은 또한 IL-1β 뿐만 아니라 IL-18에 결합하는 항원 결합 부위를 포함하는 "이중 작용 FAb" 또는 "DAF"를 포함한다 (예를 들어, US 2008/0069820 참조).
E. 변이체 힌지 영역을 갖는 항체
본 발명의 항체는 또한 예를 들어 2003년 10월 30일에 출원된 출원 일련번호 10/697,995에 기재된 바와 같은 변이체 중쇄를 포함할 수 있다. 변이체 중쇄를 포함하는 항체는 시스테인 잔기가 디술피드 연결부를 형성할 수 없도록 하는 적어도 1개의 디술피드-형성 시스테인 잔기의 변경을 포함한다. 한 측면에서, 상기 시스테인(들)은 중쇄의 힌지 영역의 것이다 (따라서, 이러한 힌지 영역은 본원에서 "변이체 힌지 영역"으로 지칭되고, 추가로 "힌지부재"로 지칭될 수 있음).
일부 측면에서, 이러한 이뮤노글로불린은 분자 사이에서 (예컨대, 2개의 중쇄 사이) 또는 분자내에서 (예컨대, 단일 폴리펩티드 쇄 내의 2개의 시스테인 잔기 사이) 디술피드 연결부를 정상적으로 형성할 수 있는 중쇄 시스테인 잔기의 완전한 레퍼토리가 결여되어 있다. 일반적으로 및 바람직하게는, 변경된 (즉, 디술피드 연결부를 형성할 수 없게 된) 시스테인 잔기(들)에 의해 형성된 디술피드 연결부는, 항체에 존재하지 않는 경우에 이뮤노글로불린의 정상적인 물리화학적 및/또는 생물학적 특성의 실질적인 손실을 초래하지 않는 것이다. 바람직하게는, 디술피드 연결부를 형성할 수 없게 된 시스테인 잔기는 중쇄의 힌지 영역의 시스테인이지만 반드시 그러한 것은 아니다.
변이체 중쇄 또는 변이체 힌지 영역을 갖는 항체는 일반적으로 적어도 1개, 적어도 2개, 적어도 3개, 적어도 4개, 또는 2 내지 11개의 중쇄간 디술피드 연결부가 제거된 항체를 숙주 세포에서 발현시키고, 상기 항체를 숙주 세포로부터 회수함으로써 생산된다. 항체를 코딩하는 폴리뉴클레오티드로부터 상기 항체를 발현시킬 수 있고 (상기 항체는 감소된 디술피드 연결 능력을 갖는 변이체 중쇄를 포함함), 이후에 상기 항체를 폴리뉴클레오티드를 포함하는 숙주 세포로부터 회수한다. 바람직하게는, 상기 중쇄는 이뮤노글로불린 중쇄의 변이체 힌지 영역을 포함하며, 여기서 상기 변이체 힌지 영역의 적어도 1개의 시스테인이 디술피드 연결부를 형성할 수 없게 된다.
이뮤노글로불린 중쇄 내의 임의의 시스테인이 본원에 기재된 힌지 시스테인과 유사하게 디술피드 연결부를 형성할 수 없게 될 수 있다는 것이 추가로 예상되며, 단 이러한 변경은 이뮤노글로불린의 생물학적 기능을 실질적으로 감소시키지 않는다. 예를 들어, IgM 및 IgE는 힌지 영역이 결여되어 있으나, 각각은 여분의 중쇄 도메인을 함유하고; 중쇄의 적어도 1개의 (일부 실시양태에서, 모든) 시스테인은 중쇄 및/또는 중쇄를 포함하는 항체의 생물학적 기능을 실질적으로 감소시키지 않는 한 본 발명의 방법으로 디술피드 연결부를 형성할 수 없게 만들 수 있다.
중쇄 힌지 시스테인은 당업계에 널리 공지되어 있다 (예를 들어, 문헌 [Kabat, 1991, "Sequences of proteins of immunological interest," 상기 문헌]에 기재된 바와 같음). 당업계에 공지된 바와 같이, 힌지 시스테인의 수는 이뮤노글로불린의 클래스 또는 서브클래스에 따라 달라진다. 예를 들어, 문헌 [Janeway, 1999, Immunobiology, 4th Ed., (Garland Publishing, NY)]을 참조한다. 예를 들어, 인간 IgGI에서, 2개의 힌지 시스테인이 2개의 프롤린에 의해 분리되고, 이들은 분자간 디술피드 연결부에서 인접한 중쇄 상에서 그의 상대와 정상적으로 쌍을 형성한다. 다른 예는 4개의 힌지 시스테인을 함유하는 인간 IgG2, 11개의 힌지 시스테인을 함유하는 IgG3, 및 2개의 힌지 시스테인을 함유하는 IgG4를 포함한다.
따라서, 본 발명의 방법은 숙주 세포에서 변이체 힌지 영역을 포함하는 이뮤노글로불린 중쇄를 발현시키는 것 (여기서, 변이체 힌지 영역의 적어도 1개의 시스테인이 디술피드 연결부를 형성할 수 없게 되어, 중쇄가 경쇄와 복합체를 형성하여 생물학적 활성 항체를 형성하도록 함), 및 항체를 숙주 세포로부터 회수하는 것을 포함한다.
대안적 실시양태는 적어도 2, 3 또는 4개의 시스테인이 디술피드 연결부를 형성할 수 없게 된 것; 약 2 내지 약 11개의 시스테인이 디술피드 연결부를 형성할 수 없게 된 것; 및 변이체 힌지 영역의 모든 시스테인이 디술피드 연결부를 형성할 수 없게 된 것을 포함한다.
본 발명의 방법에 따라 생산된 바와 같은 본 발명의 항체를 구성하는 경쇄 및 중쇄는 단일 폴리뉴클레오티드에 의해 또는 별도의 폴리뉴클레오티드에 의해 코딩될 수 있다.
디술피드 연결부 형성에 정상적으로 관련된 시스테인은 당업계에 공지된 임의의 다양한 방법, 또는 본원에 기재된 기준을 고려하여 당업자에게 명백하게 될 방법에 의해 디술피드 연결부를 형성할 수 없게 될 수 있다. 예를 들어, 힌지 시스테인은 또 다른 아미노산, 예컨대 디술피드 결합을 할 수 없는 세린으로 치환될 수 있다. 아미노산 치환은 표준 분자 생물학 기술, 예컨대 변형될 힌지 영역을 코딩하는 핵산 서열의 부위 지정 돌연변이유발에 의해 달성될 수 있다. 적합한 기술은 문헌 [Sambrook et al., 1989, Molecular Cloning: A Laboratory Manual, 2nd Ed.]에 기재된 것을 포함한다. 변이체 힌지 영역을 갖는 이뮤노글로불린을 생성하기 위한 다른 기술은 힌지 영역을 코딩하는 올리고뉴클레오티드를 합성하는 것을 포함하고, 여기서 치환될 시스테인에 대한 코돈은 치환 아미노산에 대한 코돈으로 대체된다. 이어서, 이 올리고뉴클레오티드는 다른 적절한 항체 서열, 예컨대 적절한 경우에 가변 영역 및 Fc 서열을 포함하는 벡터 백본에 라이게이션될 수 있다.
또 다른 실시양태에서, 힌지 시스테인은 결실될 수 있다. 아미노산 결실은 표준 분자 생물학 기술, 예컨대 변형될 힌지 영역을 코딩하는 핵산 서열의 부위 지정 돌연변이유발에 의해 달성될 수 있다. 적합한 기술은 문헌 [Sambrook et al., 상기 문헌]에 기재된 것을 포함한다. 변이체 힌지 영역을 갖는 이뮤노글로불린을 생성하기 위한 다른 기술은 변형될 시스테인에 대한 코돈이 결실된 힌지 영역을 코딩하는 서열을 포함하는 올리고뉴클레오티드를 합성하는 것을 포함한다. 이어서, 이 올리고뉴클레오티드는 다른 적절한 항체 서열, 예컨대 적절한 경우에 가변 영역 및 Fc 서열을 포함하는 벡터 백본에 라이게이션될 수 있다.
F. "돌출부-대-함몰부(protuberance-into-cavity)" 전략을 이용하여 형성된 이중특이적 항체
일부 실시양태에서, 본 발명의 이중특이적 항체는 헤테로-올리고머화를 위해 제1 및 제2 폴리펩티드 사이의 인터페이스를 조작하는 "돌출부-대-함몰부" 전략 (또한 "노브 인투 홀"로 지칭됨)을 이용하여 형성된다. 바람직한 인터페이스는 항체 불변 도메인의 CH3 도메인의 적어도 일부를 포함한다. Fc 서열의 CH3 도메인에서 "노브 인투 홀" 돌연변이는 동종이량체의 형성을 크게 감소시키는 것으로 보고되었다 (예를 들어, 문헌 [Merchant et al., 1998, Nature Biotechnology, 16:677-681] 참조). "돌출부"는 제1 폴리펩티드의 인터페이스로부터 소형 아미노산 측쇄를 보다 큰 측쇄 (예를 들어, 티로신 및 트립토판)로 대체하여 구축된다. 돌출부에 대해 동일한 또는 보다 작은 크기의 보상적 "함몰부"는 임의로 큰 아미노산 측쇄를 보다 작은 것 (예를 들어, 알라닌 또는 트레오닌)으로 대체하여 제2 폴리펩티드의 인터페이스 상에서 생성될 수 있다. 적합하게 위치하고 한정된 돌출부 또는 함몰부가 제1 또는 제2 폴리펩티드의 인터페이스에 존재하는 경우에, 오직 인접한 인터페이스에서 각각 상응하는 함몰부 또는 돌출부를 조작할 필요가 있다. 돌출부 및 함몰부는 폴리펩티드를 코딩하는 핵산을 변경시키는 것과 같은 합성 수단 또는 펩티드 합성에 의해 만들어질 수 있다. 노브 인투 홀의 추가의 설명에 대해, 미국 특허 번호 5,731,168; 5,807,706; 5,821,333을 참조한다.
일부 실시양태에서 "노브 인투 홀" 기술을 이용하여 이종이량체화를 촉진함으로써 전장 이중특이적 항-FcγRIIB 및 항-"활성화 수용체" (예를 들어, IgER) 항체를 생성한다. 한 실시양태에서, 구축물은 항-FcγIIB 성분 (예를 들어, p5A6.11.Knob)의 경우에 "노브" 돌연변이 (T366W)를 Fc 영역에 도입하여 제조하고, 항-IgER 성분 (예를 들어, p22E7.11.Hole)의 경우에 "홀" 돌연변이 (T366S, L368A, Y407V)를 도입하여 제조한다. 또 다른 실시양태에서, 구축물은 항-FcγIIB 성분 (예를 들어, p5A6.11.Hole)의 경우에 "홀" 돌연변이를 그의 Fc 영역에 도입하여 제조하고, 항-IgER 성분 (예를 들어, p22E7.11.Knob)의 경우에 "노브" 돌연변이를 그의 Fc 영역에 도입하여 제조한다 (예컨대 본원에 개시된 절차 또는 문헌 [Merchant et al., (1998), 상기 문헌], 또는 미국 특허 번호 5,731,168; 5,807,706; 5,821,333에 개시된 절차에 의함).
"돌출부-대-함몰부" 전략을 이용하여 이종다량체를 제조하는 일반적 방법은 하나의 또는 별도의 숙주 세포에서 돌출부를 코딩하도록 본래 폴리뉴클레오티드로부터 변경된 제1 폴리펩티드를 코딩하는 폴리뉴클레오티드 및 함몰부를 코딩하도록 본래 폴리뉴클레오티드로부터 변경된 제2 폴리펩티드를 코딩하는 제2 폴리뉴클레오티드를 발현시키는 것을 포함한다. 폴리펩티드를 공통 숙주 세포에서 발현시켜 숙주 세포 배양물로부터 이종다량체를 회수하거나 또는 폴리펩티드를 별도의 숙주 세포에서 발현시켜 회수 및 정제한 후에 이종다량체가 형성된다. 일부 실시양태에서, 형성된 이종다량체는 다량체 항체, 예를 들어 이중특이적 항체이다. 또한, 미국 특허 출원 일련번호 13/092,708 (2011년 4월 22일에 출원됨)을 참조한다.
일부 실시양태에서, 본 발명의 항체는 노브 인투 홀 전략을 변이체 힌지 영역 구축물과 조합하여 힌지부재 이중특이적 항체를 생산한다.
G. 면역접합체
본 발명은 또한 하나 이상의 세포독성제, 예컨대 화학요법제 또는 약물, 성장 억제제, 독소 (예를 들어, 단백질 독소, 박테리아, 진균, 식물 또는 동물 기원의 효소 활성 독소 또는 그의 단편) 또는 방사성 동위원소에 접합된 본원의 항-IL-1β 항체 및/또는 항-IL-18 항체/항체들을 포함하는 면역접합체를 제공한다.
한 실시양태에서, 면역접합체는 메이탄시노이드 (미국 특허 번호 5,208,020, 5,416,064 및 유럽 특허 EP 0 425 235 B1 참조); 아우리스타틴, 예컨대 모노메틸아우리스타틴 약물 모이어티 DE 및 DF (MMAE 및 MMAF) (미국 특허 번호 5,635,483 및 5,780,588, 및 7,498,298 참조); 돌라스타틴; 칼리케아미신 또는 그의 유도체 (미국 특허 번호 5,712,374, 5,714,586, 5,739,116, 5,767,285, 5,770,701, 5,770,710, 5,773,001, 및 5,877,296; 문헌 [Hinman et al., Cancer Res. 53:3336-3342 (1993); 및 Lode et al., Cancer Res. 58:2925-2928 (1998)] 참조); 안트라시클린, 예컨대 다우노마이신 또는 독소루비신 (문헌 [Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002)]; 및 미국 특허 번호 6,630,579 참조); 메토트렉세이트; 빈데신; 탁산, 예컨대 도세탁셀, 파클리탁셀, 라로탁셀, 테세탁셀 및 오르타탁셀; 트리코테센; 및 CC1065를 포함하나 이에 제한되지 않는, 하나 이상의 약물에 항체가 접합된 항체-약물 접합체 (ADC)이다.
또 다른 실시양태에서, 면역접합체는 효소 활성 독소 또는 그의 단편 (디프테리아 A 쇄, 디프테리아 독소의 비결합 활성 단편, 외독소 A 쇄 (슈도모나스 아에루기노사(Pseudomonas aeruginosa)로부터 유래됨), 리신 A 쇄, 아브린 A 쇄, 모데신 A 쇄, 알파-사르신, 알레우리테스 포르디이(Aleurites fordii) 단백질, 디안틴 단백질, 피토라카 아메리카나(Phytolaca americana) 단백질 (PAPI, PAPII 및 PAP-S), 모모르디카 카란티아(momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스(sapaonaria officinalis) 억제제, 겔로닌, 미토겔린, 레스트릭토신, 페노마이신, 에노마이신 및 트리코테센을 포함하나 이에 제한되지 않음)에 접합된 본원에 기재된 항체를 포함한다.
또 다른 실시양태에서, 면역접합체는 방사성접합체를 형성하기 위해 방사성 원자에 접합된 본원에 기재된 바와 같은 항체를 포함한다. 다양한 방사성 동위원소가 방사성접합체의 생산을 위해 이용가능하다. 그 예는 At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212, 및 Lu의 방사성 동위원소를 포함한다. 방사성접합체는 검출용으로 사용되는 경우에 신티그래피 연구를 위한 방사성 원자, 예를 들어 tc99m 또는 I123을 포함하거나, 핵 자기 공명 (NMR) 영상화 (자기 공명 영상화, mri로도 공지됨)용 스핀 표지, 예컨대 다시 아이오딘-123, 아이오딘-131, 인듐-111, 플루오린-19, 탄소-13, 질소-15, 산소-17, 가돌리늄, 망가니즈 또는 철을 포함할 수 있다.
항체 및 세포독성제의 접합체는 다양한 이관능성 단백질 커플링제, 예컨대 N-숙신이미딜-3-(2-피리딜디티오) 프로피오네이트 (SPDP), 숙신이미딜-4-(N-말레이미도메틸) 시클로헥산-1-카르복실레이트 (SMCC), 이미노티올란 (IT), 이미도에스테르의 이관능성 유도체 (예컨대, 디메틸 아디프이미데이트 HCl), 활성 에스테르 (예컨대, 디숙신이미딜 수베레이트), 알데히드 (예컨대, 글루타르알데히드), 비스-아지도 화합물 (예컨대, 비스 (p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체 (예컨대, 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트 (예컨대, 톨루엔 2,6-디이소시아네이트) 및 비스-활성 플루오린 화합물 (예컨대, 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조할 수 있다. 예를 들어, 리신 면역독소는 문헌 [Vitetta et al., Science 238:1098 (1987)]에 기재된 바와 같이 제조될 수 있다. 탄소-14-표지된 1-이소티오시아네이토벤질-3-메틸디에틸렌 트리아민펜타아세트산 (MX-DTPA)은 항체에 방사성뉴클레오티드를 접합시키기 위한 예시적인 킬레이트화제이다. WO94/11026을 참조한다. 링커는 세포에서 세포독성 약물의 방출을 용이하게 하는 "절단가능한 링커"일 수 있다. 예를 들어, 산-불안정성 링커, 펩티다제-감수성 링커, 광분해성 링커, 디메틸 링커 또는 디술피드-함유 링커 (문헌 [Chari et al., Cancer Res. 52:127-131 (1992)]; 미국 특허 번호 5,208,020)가 사용될 수 있다.
본원의 면역접합체 또는 ADC는 상업적으로 입수가능한 (예를 들어, 피어스 바이오테크놀로지, 인크.(Pierce Biotechnology, Inc.; 미국 일리노이주 록포드)로부터의) 가교-링커 시약 (BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, 술포-EMCS, 술포-GMBS, 술포-KMUS, 술포-MBS, 술포-SIAB, 술포-SMCC 및 술포-SMPB, 및 SVSB (숙신이미딜-(4-비닐술폰)벤조에이트)를 포함하나 이에 제한되지 않음)으로 제조된 이러한 접합체를 명백하게 고려하나 이에 제한되지 않는다.
II. 벡터, 숙주 세포 및 재조합 방법
본 발명은 또한 본원에 개시된 바와 같은 항체를 코딩하는 단리된 폴리뉴클레오티드, 이러한 폴리뉴클레오티드를 포함하는 벡터 및 숙주 세포, 및 항체의 생산을 위한 재조합 기술을 제공한다.
항체의 재조합 생산을 위해, 항체를 코딩하는 폴리뉴클레오티드를 단리하여, 추가의 클로닝 (DNA의 증폭) 또는 발현을 위한 복제가능한 벡터 내로 삽입한다. 항체를 코딩하는 DNA는 용이하게 단리되고, 통상적인 절차를 이용하여 (예를 들어, 항체를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브를 사용하여) 서열분석된다. 다수의 벡터가 이용가능하다. 벡터 성분은 일반적으로 다음 중 하나 이상을 포함하지만, 이에 제한되지 않는다: 신호 서열, 복제 기점, 하나 이상의 마커 유전자, 인핸서 요소, 프로모터, 및 전사 종결 서열.
(i) 신호 서열 성분
본 발명의 항체는 직접적으로 뿐만 아니라 이종 항체와의 융합 항체로서 재조합적으로 생산될 수 있다. 한 실시양태에서, 이종 항체는 성숙 단백질 또는 항체의 N-말단에 특정 절단 부위를 갖는 신호 서열 또는 다른 항체이다. 바람직하게는 선택된 이종 신호 서열은 숙주 세포에 의해 인식 및 처리 (즉, 신호 펩티다제에 의해 절단)되는 것이다. 천연 항체 신호 서열을 인식 및 처리하지 못하는 원핵 숙주 세포의 경우에는, 신호 서열을, 예를 들어 알칼리성 포스파타제, 페니실리나제, lpp 또는 열-안정한 장독소 II 리더로 이루어진 군 중에서 선택된 원핵 신호 서열로 대체한다. 효모 분비의 경우에는, 천연 신호 서열을 예를 들어 효모 인버타제 리더, α 인자 리더 (사카로미세스(Saccharomyces) 및 클루이베로미세스(Kluyveromyces) α-인자 리더 포함), 또는 산 포스파타제 리더, 씨. 알비칸스(C. albicans) 글루코아밀라제 리더, 또는 WO 90/13646에 기재된 신호로 대체할 수 있다. 포유동물 세포 발현시에, 포유동물 신호 서열 뿐만 아니라 바이러스 분비 리더, 예를 들어 단순 헤르페스 gD 신호가 이용가능하다. 이러한 전구체 영역을 위한 DNA는 항체를 코딩하는 DNA에 리딩 프레임으로 라이게이션된다.
또 다른 실시양태에서, 항체의 생산은 숙주 세포의 세포질에서 일어날 수 있고, 이에 따라 각각의 시스트론 내에 분비 신호 서열의 존재를 필요로 하지 않는다. 이와 관련하여, 이뮤노글로불린 경쇄 및 중쇄는 발현되고, 폴딩되고, 어셈블리되어 세포질 내에 기능적 이뮤노글로불린을 형성한다. 특정 숙주 균주 (예를 들어, 이. 콜라이 trxB 균주)는 디술피드 결합 형성에 유리한 세포질 조건을 제공하며, 이로 인해 발현된 단백질 서브유닛의 적절한 폴딩 및 어셈블리를 허용한다 (문헌 [Proba and Plukthun, 1995, Gene, 159:203]).
(ii) 복제 기점 성분
발현 벡터 및 클로닝 벡터는 둘 다 벡터가 하나 이상의 선택된 숙주 세포 내에서 복제될 수 있게 하는 핵산 서열을 함유한다. 일반적으로, 클로닝 벡터에서 상기 서열이 숙주 염색체 DNA와 무관하게 벡터를 복제할 수 있는 것이고, 복제 기점 또는 자율 복제 서열을 포함한다. 이러한 서열은 다양한 박테리아, 효모 및 바이러스에 대해 널리 공지되어 있다. 플라스미드 pBR322로부터의 복제 기점은 대부분의 그람-음성 박테리아에 적합하고, 2μ 플라스미드 기점은 효모에 적합하며, 다양한 바이러스 기점 (SV40, 폴리오마, 아데노바이러스, VSV 또는 BPV)은 포유동물 세포에서의 클로닝 벡터에 유용하다. 일반적으로, 복제 기점 성분은 포유동물 발현 벡터에서는 필요하지 않다 (전형적으로, SV40 기점은 단지 초기 프로모터를 함유하기 때문에 사용될 수 있음).
(iii) 선택 유전자 성분
발현 및 클로닝 벡터는 선택 마커라고도 지칭되는 선택 유전자를 함유할 수 있다. 전형적인 선택 유전자는 (a) 항생제 또는 다른 독소, 예를 들어 암피실린, 네오마이신, 메토트렉세이트 또는 테트라시클린에 대한 내성을 부여하거나, (b) 영양요구성 결핍을 보완하거나, 또는 (c) 복합 배지로부터 이용할 수 없는 중요 영양분을 공급하는 단백질을 코딩하고, 예를 들어 바실루스의 경우에는 D-알라닌 라세마제를 코딩하는 유전자이다.
선택 계획의 한 예는 숙주 세포의 성장을 정지시키는 약물을 이용한다. 이종 유전자로 성공적으로 형질전환된 세포는 약물 내성을 부여하는 단백질을 생산하고, 따라서 선택 요법에서 생존한다. 이러한 우성 선택의 예는 약물 네오마이신, 미코페놀산 및 히그로마이신을 사용한다.
포유동물 세포에 적합한 선택 마커의 또 다른 예는 항체 핵산을 취하는 세포 성분의 확인을 가능하게 하는 것, 예컨대 DHFR, 티미딘 키나제, 메탈로티오네인-I 및 -II, 바람직하게는 영장류 메탈로티오네인 유전자, 아데노신 데아미나제, 오르니틴 데카르복실라제 등이다.
예를 들어, DHFR 선택 유전자로 형질전환된 세포는 우선 DHFR의 경쟁적 길항제인 메토트렉세이트 (Mtx)를 함유하는 배양 배지에서 모든 형질전환체를 배양함으로써 확인한다. 야생형 DHFR의 사용시에 적절한 숙주 세포는 DHFR 활성이 결핍된 차이니즈 햄스터 난소 (CHO) 세포주이다.
대안적으로, 항체, 야생형 DHFR 단백질 및 또 다른 선택 마커, 예컨대 아미노글리코시드 3'-포스포트랜스퍼라제 (APH)를 코딩하는 DNA 서열로 형질감염되거나 또는 공동-형질감염된 숙주 세포 (특히 내인성 DHFR을 함유하는 야생형 숙주)는 선택 마커, 예컨대 아미노글루코시드계 항생제, 예를 들어 카나마이신, 네오마이신 또는 G418에 대한 선택 작용제를 함유하는 배지에서의 세포 성장에 의해 선택될 수 있다. 미국 특허 번호 4,965,199를 참조한다.
효모에 사용하기 적합한 선택 유전자는 효모 플라스미드 YRp7에 존재하는 trp1 유전자이다 (문헌 [Stinchcomb et al., 1979, Nature, 282:39]). trp1 유전자는 트립토판, 예를 들어 ATCC 번호 44076 또는 PEP4-1에서 성장하는 능력이 결핍된 효모의 돌연변이체 균주에 대한 선택 마커를 제공한다. 문헌 [Jones, 1977, Genetics, 85:12]. 이어서, 효모 숙주 세포 게놈 내의 trp1 병변의 존재는 트립토판의 부재 하의 성장에 의해 형질전환을 검출하기에 유효한 환경을 제공한다. 유사하게, Leu2-결핍 효모 균주 (예를 들어, ATCC 등록 번호 20,622 또는 38,626을 갖는 균주)는 Leu2 유전자를 보유하는 공지된 플라스미드에 의해 보완된다.
또한, 1.6 μm 원형 플라스미드 pKD1로부터 유래된 벡터는 클루이베로미세스 효모의 형질전환에 사용될 수 있다. 대안적으로, 재조합 송아지 키모신의 대규모 생산을 위한 발현 시스템이 케이. 락티스(K. lactis)에 대해 보고되어 있다. 문헌 [Van den Berg, 1990, Bio/Technology, 8:135]을 참조한다. 클루이베로미세스의 산업적 균주에 의한 성숙 재조합 인간 혈청 알부민의 분비를 위한 안정한 다중-카피 발현 벡터가 또한 개시되어 있다. 문헌 [Fleer et al., 1991, Bio/Technology, 9:968-975]을 참조한다.
(iv) 프로모터 성분
발현 및 클로닝 벡터는 통상적으로, 숙주 유기체에 의해 인식되고 항체 핵산에 작동가능하게 연결된 프로모터를 함유한다. 원핵 숙주와 사용하기에 적합한 프로모터는 phoA 프로모터, β-락타마제 및 락토스 프로모터 시스템, 알칼리성 포스파타제, 트립토판 (trp) 프로모터 시스템, 및 하이브리드 프로모터, 예컨대 tac 프로모터를 포함한다. 그러나, 다른 공지의 박테리아 프로모터도 적합하다. 박테리아 시스템에 사용하기 위한 프로모터는 또한 항체를 코딩하는 DNA에 작동가능하게 연결된 샤인-달가노(Shine-Dalgarno, S.D.) 서열을 함유할 것이다.
프로모터 서열은 진핵생물에 대해 공지되어 있다. 실질적으로 모든 진핵 유전자는 전사가 개시되는 부위로부터 대략 25 내지 30개 염기 상류에 위치하는 AT-풍부 영역을 갖는다. 다수의 유전자의 전사 출발점으로부터 70 내지 80개 염기 상류에서 발견되는 또 다른 서열은 CNCAAT 영역 (여기서, N은 임의의 뉴클레오티드일 수 있음)이다. 대부분의 진핵 유전자의 3' 말단에는 코딩 서열의 3' 말단에 폴리 A 꼬리의 부가를 위한 신호일 수 있는 AATAAA 서열이 존재한다. 모든 이러한 서열들이 진핵 발현 벡터 내로 적합하게 삽입된다.
효모 숙주와 사용하기에 적합한 프로모터 서열의 예는 3-포스포글리세레이트 키나제 또는 다른 글리콜분해 효소, 예컨대 에놀라제, 글리세르알데히드-3-포스페이트 데히드로게나제, 헥소키나제, 피루베이트 데카르복실라제, 포스포프룩토키나제, 글루코스-6-포스페이트 이소머라제, 3-포스포글리세레이트 뮤타제, 피루베이트 키나제, 트리오스포스페이트 이소머라제, 포스포글루코스 이소머라제 및 글루코키나제에 대한 프로모터를 포함한다.
성장 조건에 의해 제어되는 전사의 추가의 이점을 갖는 유도성 프로모터인 다른 효모 프로모터는 알콜 데히드로게나제 2, 이소시토크롬 C, 산 포스파타제, 질소 대사와 연관된 분해 효소, 메탈로티오네인, 글리세르알데히드-3-포스페이트 데히드로게나제, 및 말토스 및 갈락토스 이용을 담당하는 효소에 대한 프로모터 영역이다. 효모 발현에 사용하기에 적합한 벡터 및 프로모터는 EP 73,657에 추가로 기재되어 있다. 또한, 효모 인핸서는 효모 프로모터와 함께 유리하게 사용된다.
포유동물 숙주 세포에서 벡터로부터의 항체 전사는, 예를 들어 바이러스, 예컨대 폴리오마 바이러스, 계두 바이러스, 아데노바이러스 (예컨대, 아데노바이러스 2), 소 유두종 바이러스, 조류 육종 바이러스, 시토메갈로바이러스, 레트로바이러스, B형 간염 바이러스, 가장 바람직하게는 원숭이 바이러스 40 (SV40)의 게놈으로부터 수득된 프로모터, 이종 포유동물 프로모터, 예를 들어 액틴 프로모터 또는 이뮤노글로불린 프로모터, 열 충격 프로모터에 의해 제어되며, 단 이러한 프로모터는 숙주 세포 시스템과 상용성이어야 한다.
SV40 바이러스의 초기 및 후기 프로모터는 SV40 바이러스 복제 기점을 또한 함유하는 SV40 제한 단편으로서 편리하게 수득된다. 인간 시토메갈로바이러스의 극초기 프로모터가 HindIII E 제한 단편으로 편리하게 수득된다. 소 유두종 바이러스를 벡터로 사용하는 포유동물 숙주에서 DNA를 발현하기 위한 시스템은 미국 특허 번호 4,419,446에 개시되어 있다. 이 시스템의 변형은 미국 특허 번호 4,601,978에 기재되어 있다. 또한, 단순 헤르페스 바이러스로부터의 티미딘 키나제 프로모터의 제어 하에 마우스 세포에서의 인간 β-인터페론 cDNA의 발현에 대해 또한 문헌 [Reyes et al., 1982, Nature 297:598-601]을 참조한다. 대안적으로, 라우스 육종 바이러스의 긴 말단 반복체를 프로모터로 사용할 수 있다.
(v) 인핸서 요소 성분
고등 진핵생물에 의한 본 발명의 항체를 코딩하는 DNA의 전사는 종종 인핸서 서열의 벡터로의 삽입에 의해 증가한다. 다수의 인핸서 서열이 현재 포유동물 유전자 (글로빈, 엘라스타제, 알부민, α-태아단백질 및 인슐린)로부터 공지되어 있다. 그러나, 전형적으로는 진핵 세포 바이러스로부터의 인핸서를 사용할 것이다. 그의 예는 복제 기점의 후측 (bp 100-270) 상의 SV40 인핸서, 시토메갈로바이러스 초기 프로모터 인핸서, 복제 기점 후측 상의 폴리오마 인핸서 및 아데노바이러스 인핸서를 포함한다. 또한, 진핵 프로모터의 활성화를 위한 인핸서 요소에 대해 문헌 [Yaniv, 1982, Nature 297:17-18]을 참조한다. 인핸서는 항체-코딩 서열의 위치 5' 또는 3'에서 벡터 내로 스플라이싱될 수 있지만, 바람직하게는 프로모터로부터 부위 5'에 위치한다.
(vi) 전사 종결 성분
진핵 숙주 세포 (효모, 진균, 곤충, 식물, 동물, 인간, 또는 다른 다세포 유기체로부터의 유핵 세포)에 사용되는 발현 벡터는 또한 전사의 종결 및 mRNA의 안정화에 필요한 서열을 함유할 것이다. 상기 서열은 통상적으로 진핵 또는 바이러스 DNA 또는 cDNA의 5' 및 때때로 3' 비번역 영역으로부터 통상적으로 이용가능하다. 이들 영역은 항체를 코딩하는 mRNA의 비번역 부분에서 폴리아데닐화 단편으로서 전사된 뉴클레오티드 절편을 함유한다. 하나의 유용한 전사 종결 성분은 소 성장 호르몬 폴리아데닐화 영역이다. WO94/11026 및 이에 개시된 발현 벡터를 참조한다.
(vii) 번역 강도의 조절
본 발명의 이뮤노글로불린은 또한 발현된 경쇄 및 중쇄의 정량적 비가 분비되고 적절하게 어셈블리된 전장 항체의 수율을 최대화하기 위해 조절될 수 있는 발현 시스템으로부터 발현될 수 있다. 이러한 조절은 경쇄 및 중쇄를 위한 번역 강도를 동시에 조절함으로써 달성된다.
번역 강도를 조절하기 위한 한 가지 기술은 미국 특허 번호 5,840,523 (Simmons et al.) 및 문헌 [Simmons et al., 2002, J. Immunol. Methods, 263: 133-147]에 개시되어 있다. 이는 시스트론 내의 번역 개시 영역 (TIR)의 변이체를 이용한다. 주어진 TIR에 대해, 일련의 아미노산 또는 핵산 서열 변이체는 소정 범위의 번역 강도로 생성되고, 이에 의해 상기 인자를 특정 쇄의 원하는 발현 수준을 위해 조정하는 편리한 수단을 제공할 수 있다. TIR 변이체는 아미노산 서열을 변경시킬 수 있는 코돈 변화를 초래하는 통상적인 돌연변이유발 기술에 의해 생성될 수 있지만, 뉴클레오티드 서열의 침묵 변화가 바람직하다. TIR에서의 변경은, 예를 들어 신호 서열에서의 변경과 함께 샤인-달가노 서열의 수 또는 스페이싱의 변경을 포함할 수 있다. 돌연변이체 신호 서열을 생성하는 한 가지 바람직한 방법은 신호 서열의 아미노산 서열이 변화하지 않는 (즉, 변화가 침묵임) 코딩 서열의 도입부에서의 "코돈 뱅크"의 생성이다. 이는 각각의 코돈의 제3 뉴클레오티드 위치를 변화시킴으로써 수행될 수 있고; 추가로 일부 아미노산, 예컨대 류신, 세린 및 아르기닌은 뱅크 제조에 복합성을 추가할 수 있는 다수의 제1 및 제2 위치를 갖는다. 이러한 돌연변이유발 방법은 문헌 [Yansura et al., 1992, METHODS: A Companion to Methods in Enzymol., 4:151-158]에 상세하게 기재되어 있다.
바람직하게는, 그 안의 각각의 시스트론에 대한 소정 범위의 TIR 강도를 갖는 벡터의 세트가 생성된다. 이 제한된 세트는 각각의 쇄의 발현 수준의 비교 뿐만 아니라 다양한 TIR 강도 조합 하에 전장 생성물의 수율을 제공한다. TIR 강도는 미국 특허 번호 5,840,523 (Simmons et al.) 및 문헌 [Simmons et al., 2002, J. Immunol. Methods, 263: 133-147]에 상세하게 기재된 바와 같이 리포터 유전자의 발현 수준을 정량화하여 결정될 수 있다. 본 발명의 목적을 위해, 벡터 내의 TIR의 특정한 쌍에 대한 번역 강도 조합을 (N-경쇄, M-중쇄)로 표시하고, 여기서 N은 경쇄의 상대적 TIR 강도이고, M은 중쇄의 상대적 TIR 강도이다. 예를 들어, (3-경쇄, 7-중쇄)는 벡터가 경쇄 발현의 경우 약 3의 상대적 TIR 강도를 제공하고, 중쇄 발현의 경우 약 7의 상대적 TIR 강도를 제공한다는 것을 의미한다. 번역 강도 비교를 기반으로 하여, 원하는 개별 TIR이 본 발명의 발현 벡터 구축물에서 조합되도록 선택된다.
(viii) 숙주 세포의 선택 및 형질전환
본원에서 벡터에 DNA를 클로닝하거나 여기서 발현시키기에 적합한 숙주 세포는 상기 기재된 원핵생물, 효모 또는 고등 진핵생물 세포이다. 이 목적을 위한 적절한 원핵생물은 아카에박테리아(Archaebacteria) 및 유박테리아(Eubacteria), 예컨대 그람-음성 또는 그람-양성 유기체, 예를 들어 엔테로박테리아세아에(Enterobacteriaceae), 예컨대 에스케리키아(Escherichia), 예를 들어 이. 콜라이, 엔테로박터(Enterobacter), 에르위니아(Erwinia), 클레브시엘라(Klebsiella), 프로테우스(Proteus), 살모넬라(Salmonella), 예를 들어 살모넬라 티피뮤리움(Salmonella typhimurium), 세라티아(Serratia), 예를 들어 세라티아 마르세스칸스(Serratia marcescans) 및 시겔라(Shigella) 뿐만 아니라 바실루스, 예컨대 비. 서브틸리스(B. subtilis) 및 비. 리케니포르미스(B. licheniformis) (예를 들어, 1989년 4월 12일에 공개된 DD 266,710에 개시된 비. 리케니포르미스 41P), 슈도모나스(Pseudomonas), 예컨대 피. 아에루기노사(P. aeruginosa) 및 스트렙토미세스(Streptomyces)를 포함한다. 다른 균주, 예컨대 이. 콜라이 B, 이. 콜라이 X1776 (ATCC 31,537) 및 이. 콜라이 W3110 (ATCC 27,325)가 적합하더라도, 한 바람직한 이. 콜라이 클로닝 숙주는 이. 콜라이 294 (ATCC 31,446)이다. 이러한 예는 제한적이기보다는 예시적이다. 또한 숙주 세포가 최소량의 단백질분해 효소를 분비하는 것이 바람직하고, 추가의 프로테아제 억제제는 바람직하게는 세포 배양물에 혼입될 수 있다. 원핵 숙주 세포는 또한 티오레독신 및/또는 글루타티온 경로에서 돌연변이(들)를 포함할 수 있다.
원핵생물 뿐만 아니라, 진핵 미생물, 예컨대 사상 진균 또는 효모는 항체-코딩 벡터에 적합한 클로닝 또는 발현 숙주이다. 사카로미세스 세레비지아에(Saccharomyces cerevisiae) 또는 통상적인 제빵 효모는 하등 진핵 숙주 미생물 중에서 가장 흔하게 사용된다. 그러나, 다수의 다른 속, 종 및 균주, 예컨대 스키조사카로미세스 폼베(Schizosaccharomyces pombe); 클루이베로미세스 숙주, 예컨대, 예를 들어 케이. 락티스, 케이. 프라길리스(K. fragilis) (ATCC 12,424), 케이. 불가리쿠스(K. bulgaricus) (ATCC 16,045), 케이. 위케라미이(K. wickeramii) (ATCC 24,178), 케이. 왈티이(K. waltii) (ATCC 56,500), 케이. 드로소필라룸(K. drosophilarum) (ATCC 36,906), 케이. 써모톨레란스(K. thermotolerans) 및 케이. 마르시아누스(K. marxianus); 야로위아(yarrowia) (EP 402,226); 피키아 파스토리스(Pichia pastoris) (EP 183,070); 칸디다(Candida); 트리코더마 레에시아(Trichoderma reesia) (EP 244,234); 뉴로스포라 크라사(Neurospora crassa); 슈와니오미세스(Schwanniomyces), 예컨대 슈와니오미세스 옥시덴탈리스(Schwanniomyces occidentalis); 및 사상 진균, 예컨대 예를 들어, 뉴로스포라(Neurospora), 페니실리움(Penicillium), 톨리포클라디움(Tolypocladium) 및 아스페르길루스(Aspergillus) 숙주, 예컨대 에이. 니둘란스(A. nidulans) 및 에이. 니거(A. niger)가 통상적으로 이용가능하고 본원에서 유용하다.
글리코실화 항체의 발현에 적합한 숙주 세포는 다세포 유기체로부터 유래된다. 무척추동물 세포의 예는 식물 및 곤충 세포를 포함한다. 스포도프테라 프루기페르다(Spodoptera frugiperda) (모충), 아에데스 아에집티(Aedes aegypti) (모기), 아에데스 알보픽투스(Aedes albopictus) (모기), 드로소필라 멜라노가스터(Drosophila melanogaster) (과실파리) 및 봄빅스 모리(Bombyx mori)와 같은 숙주로부터의 다수의 바큘로바이러스 균주 및 변이체, 및 상응하는 허용 곤충 숙주 세포가 확인되어 있다. 다양한 형질감염용 바이러스 균주, 예를 들어 아우토그라파 칼리포르니카(Autographa californica) NPV의 L-1 변이체 및 봄빅스 모리 NPV의 Bm-5 균주가 공개적으로 이용가능하고, 이러한 바이러스들은, 특히 스포도프테라 프루기페르다 세포의 형질감염을 위해, 본 발명에 따라 본원에서 바이러스로 사용될 수 있다. 목화, 옥수수, 감자, 대두, 페튜니아, 토마토 및 담배의 식물 세포 배양물이 또한 숙주로서 사용될 수 있다.
척추동물 숙주 세포는 널리 이용되고, 배양물 (조직 배양물)에서의 척추동물 세포의 증식은 통상적인 절차가 되었다. 유용한 포유동물 숙주 세포주의 예는 SV40에 의해 형질전환된 원숭이 신장 CV1 세포주 (COS-7, ATCC CRL 1651); 인간 배아 신장 세포주 (293 또는 현탁액 배양물에서의 성장을 위해 서브클로닝된 293 세포, 문헌 [Graham et al., J. Gen Virol. 36:59 (1977)]); 새끼 햄스터 신장 세포 (BHK, ATCC CCL 10); 차이니즈 햄스터 난소 세포/-DHFR (CHO, 문헌 [Urlaub et al., 1980, Proc. Natl. Acad. Sci. USA 77:4216]); 마우스 세르톨리 세포 (TM4, 문헌 [Mather, 1980, Biol. Reprod. 23:243-251]); 원숭이 신장 세포 (CV1 ATCC CCL 70); 아프리카 녹색 원숭이 신장 세포 (VERO-76, ATCC CRL-1587); 인간 자궁경부 암종 세포 (HELA, ATCC CCL 2); 개 신장 세포 (MDCK, ATCC CCL 34); 버팔로 래트 간 세포 (BRL 3A, ATCC CRL 1442); 인간 폐 세포 (W138, ATCC CCL 75); 인간 간 세포 (Hep G2, HB 8065); 마우스 유방 종양 (MMT 060562, ATCC CCL51); TRI 세포 (문헌 [Mather et al., 1982, Annals N.Y. Acad. Sci. 383:44-68]); MRC 5 세포; FS4 세포; 마우스 골수종 세포, 예컨대 NSO (예를 들어, RCB0213, 문헌 [1992, Bio/Technology 10:169]) 및 SP2/0 세포 (예를 들어, SP2/0-Ag14 세포, ATCC CRL 1581); 래트 골수종 세포, 예컨대 YB2/0 세포 (예를 들어, YB2/3HL.P2.G11.16Ag.20 세포, ATCC CRL 1662); 및 인간 간세포암 세포주 (Hep G2)이다. CHO 세포는 CHO-K1, DUK-B11, CHO-DP12, CHO-DG44 (문헌 [Somatic Cell and Molecular Genetics 12:555 (1986)]) 및 예시적인 숙주 세포주인 Lec13과 함께, 본 발명을 실시하기에 바람직한 세포주이다. CHO-K1, DUK-B11, DG44 또는 CHO-DP12 숙주 세포의 경우에, 이들은 이들에서 발현된 단백질을 푸코실화하는 능력이 결핍되도록 변경될 수 있다.
본 발명은 또한 하이브리도마 세포에 적용가능하다. 용어 "하이브리도마"는 면역학적 기원의 불멸 세포주 및 항체 생산 세포의 융합에 의해 생산된 하이브리드 세포주를 지칭한다. 용어는 헤테로하이브리드 골수종 융합체 (인간 세포 및 뮤린 골수종 세포주의 융합의 결과로, 이는 이후에 형질 세포와 융합되며, 통상적으로 트리오마 세포로 공지되어 있음)의 자손을 포함한다. 또한, 용어는 항체를 생산하는 임의의 불멸화된 하이브리드 세포주, 예컨대 예를 들어 쿼드로마를 포함함을 의미한다 (예를 들어, 문헌 [Milstein et al., 1983, Nature, 537:3053] 참조). 하이브리드 세포주는 인간 및 마우스를 포함하여, 임의의 종의 것일 수 있다.
가장 바람직한 실시양태에서, 포유동물 세포는 비-하이브리도마 포유동물 세포이고, 이는 관심 항체를 코딩하는 외인성 단리된 핵산으로 형질전환된다. "외인성 핵산" 또는 "이종 핵산"은 세포 외래의 핵산 서열 또는 세포와 동종이나 핵산이 통상적으로 발견되지 않는 숙주 세포 핵산 내의 위치에 있는 핵산 서열을 의미한다.
(ix) 숙주 세포 배양
숙주 세포는 항체 생산을 위해 상기 기재된 발현 또는 클로닝 벡터로 형질전환되고, 프로모터를 유도하거나, 형질전환체를 선택하거나, 또는 원하는 서열을 코딩하는 유전자를 증폭시키기에 적절하게 변형된 종래의 영양 배지에서 배양된다.
본 발명의 항체를 생산하는데 사용되는 숙주 세포는 다양한 배지 중에서 배양될 수 있다. 상업적으로 입수가능한 배지, 예컨대 햄 F10 (시그마(Sigma)), 최소 필수 배지 ((MEM), (시그마), RPMI-1640 (시그마)), 및 둘베코 변형 이글 배지 ((DMEM), 시그마)가 숙주 세포의 배양에 적합하다. 또한, 문헌 [Ham et al., 1979, Meth. Enz. 58:44, Barnes et al., 1980, Anal. Biochem. 102:255], 미국 특허 번호 4,767,704; 4,657,866; 4,927,762; 4,560,655; 또는 5,122,469; WO 90/03430; WO 87/00195; 또는 미국 특허 Re. 30,985에 기재된 임의의 배지가 숙주 세포용 배양 배지로 사용될 수 있다. 임의의 이들 배지에는 필요에 따라 호르몬 및/또는 다른 성장 인자 (예컨대, 인슐린, 트랜스페린 또는 표피 성장 인자), 염 (예컨대, 염화나트륨, 칼슘, 마그네슘 및 포스페이트), 완충제 (예컨대, HEPES), 뉴클레오티드 (예컨대, 아데노신 및 티미딘), 항생제 (예컨대, 겐타마이신(GENTAMYCIN)TM 약물), 미량 원소 (통상적으로 마이크로몰 범위의 최종 농도로 존재하는 무기 화합물로서 정의됨) 및 글루코스 또는 등가의 에너지원이 보충될 수 있다. 또한, 임의의 다른 필요한 보충물을 당업자에게 공지된 적절한 농도로 포함시킬 수 있다. 배양 조건, 예컨대 온도, pH 등은 발현을 위해 선택된 숙주 세포와 함께 이전에 이용된 것이고, 당업자에게 명백할 것이다.
모든 배양 배지는 전형적으로 하기 카테고리 중 하나 이상으로부터 적어도 하나의 성분을 제공한다:
1) 통상적으로 탄수화물, 예컨대 글루코스의 형태의, 에너지원;
2) 모든 필수 아미노산, 및 통상적으로 20개의 아미노산의 기본 세트와 시스틴;
3) 비타민 및/또는 저농도로 요구되는 다른 유기 화합물;
4) 유리 지방산; 및
5) 미량 원소 (여기서 미량 원소는 전형적으로 매우 낮은 농도, 통상적으로 마이크로몰 범위로 요구되는 무기 화합물 또는 자연 발생 요소로 정의됨).
배양 배지는 바람직하게는 혈청이 없고 (예를 들어 약 5% 미만, 바람직하게는 1% 미만, 보다 바람직하게는 0% 내지 0.1%의 혈청), 다른 동물-유래의 단백질이 없다. 그러나, 이들은 원하는 경우에 사용될 수 있다. 본 발명의 바람직한 실시양태에서 세포 배양 배지는 과량의 아미노산을 포함한다. 과량으로 제공된 아미노산은 예를 들어 Asn, Asp, Gly, Ile, Leu, Lys, Met, Ser, Thr, Trp, Tyr 및 Val로부터 선택될 수 있다. 바람직하게는, Asn, Asp, Lys, Met, Ser 및 Trp가 과량으로 제공된다. 예를 들어, 유럽 특허 EP 307,247 또는 미국 특허 번호 6,180,401에 특정된 범위의 1 또는 2배 범위의 아미노산, 비타민, 미량 원소 및 다른 배지 성분이 사용될 수 있다. 상기 두 문헌은 본원에 참고로 포함된다.
원하는 단백질을 발현하고 특정 위치에 원하는 탄수화물을 첨가할 수 있는 포유동물 세포의 배양을 위해, 다수의 배양 조건이 배양될 숙주 세포에 특정한 주의를 기울이며 이용될 수 있다. 포유동물 세포에 적합한 배양 조건은 당업계에 널리 공지되어 있거나 (문헌 [W. Louis Cleveland et al., 1983, J. Immunol. Methods 56:221-234]), 당업자에 의해 용이하게 결정될 수 있고 (예를 들어, 문헌 [Animal Cell Culture: A Practical Approach 2nd Ed., Rickwood, D. and Hames, B. D., eds. Oxford University Press, New York (1992)] 참조), 선택된 특정한 숙주 세포에 따라 달라진다.
(x) 항체 정제
재조합 기술을 이용하는 경우에, 항체는 세포 내에서 생산되거나, 주변세포질 공간 내에서 생산되거나, 또는 배지 내로 직접 분비될 수 있다. 항체가 세포 내에서 생산되는 경우에, 제1 단계로서 입자형 잔해인 숙주 세포 또는 용해된 단편을 예를 들어 원심분리 또는 한외여과에 의해 제거한다. 문헌 [Carter et al., 1992, Bio/Technology 10: 163-167]은 이. 콜라이의 주변세포질 공간으로 분비된 항체를 단리하기 위한 절차를 기재한다. 간략하게, 세포 페이스트를 아세트산나트륨 (pH 3.5), EDTA 및 페닐메틸술포닐플루오라이드 (PMSF)의 존재 하에 약 30분에 걸쳐 해동시킨다. 세포 잔해물은 원심분리로 제거할 수 있다. 항체가 배지 내로 분비되는 경우에, 일반적으로 이러한 발현 시스템으로부터의 상청액을 상업적으로 입수가능한 단백질 농축 필터, 예를 들어 아미콘(Amicon) 또는 밀리포어 펠리콘(Millipore Pellicon) 한외여과 장치를 사용하여 먼저 농축시킨다. 단백질분해를 억제하기 위해 프로테아제 억제제, 예컨대 PMSF를 임의의 이전 단계에 포함시킬 수 있고, 우발적인 오염물의 성장을 방지하기 위해 항생제를 포함시킬 수 있다.
세포로부터 제조된 항체 조성물은, 예를 들어 히드록시아파타이트 크로마토그래피, 겔 전기영동, 투석, 및 친화성 크로마토그래피를 이용하여 정제할 수 있으며, 친화성 크로마토그래피가 바람직한 정제 기술이다. 친화성 리간드로서의 단백질 A의 적합성은 항체 내에 존재하는 임의의 이뮤노글로불린 Fc 도메인의 종 및 이소형에 따라 달라진다. 단백질 A를 사용하여 인간 γ1, γ2 또는 γ4 중쇄 기재의 항체를 정제할 수 있다 (문헌 [Lindmark et al., 1983, J. Immunol. Meth. 62:1-13]). 단백질 G는 모든 마우스 이소형 및 인간 γ3에 대해 권장된다 (문헌 [Guss et al., 1986, EMBO J. 5:15671575]). 친화성 리간드가 부착되는 매트릭스는 가장 흔하게는 아가로스이지만, 다른 매트릭스도 이용가능하다. 기계적으로 안정한 매트릭스, 예컨대 제어된 공극 유리 또는 폴리(스티렌디비닐)벤젠은 아가로스로 달성할 수 있는 것보다 더 빠른 유량 및 더 짧은 가공 시간을 가능하게 한다. 항체가 CH3 도메인을 포함하는 경우에, 베이커본드(Bakerbond) ABXTM 수지 (제이. 티. 베이커(J. T. Baker), 뉴저지주 필립스버그)가 정제에 유용하다. 회수될 항체에 따라, 이온-교환 칼럼 상에서의 분획화, 에탄올 침전, 역상 HPLC, 실리카 상 크로마토그래피, 헤파린 세파로스(SEPHAROSE)TM 상 크로마토그래피, 음이온 또는 양이온 교환 수지 (예컨대, 폴리아스파르트산 칼럼) 상 크로마토그래피, 크로마토포커싱, SDS-PAGE 및 황산암모늄 침전과 같은 다른 단백질 정제 기술을 또한 이용할 수 있다.
한 실시양태에서, 당단백질을 렉틴 기질 (예를 들어, 렉틴 친화성 칼럼) 상으로의 흡착을 이용하여 정제하여, 제제로부터 푸코스-함유 당단백질을 제거함으로써 푸코스-무함유 당단백질을 풍부하게 할 수 있다.
(xi) 항체 활성 검정
본 발명의 이뮤노글로불린은 당업계에 공지된 다양한 검정에 의해 그의 물리적/화학적 특성 및 생물학적 기능에 대해 특성화될 수 있다. 본 발명의 한 측면에서, 면역원에 결합하는 본 발명의 항체의 선택성을 다른 결합 표적에 대해 비교하는 것이 중요하다.
본 발명의 특정 실시양태에서, 본원에서 생산된 이뮤노글로불린은 그의 생물학적 활성에 대해 분석된다. 일부 실시양태에서, 본 발명의 이뮤노글로불린은 그의 항원 결합 활성에 대해 시험된다. 당업계에 공지되고 본원에 사용될 수 있는 항원 결합 검정은 웨스턴 블롯, 방사성면역검정, ELISA (효소 결합 면역흡착 검정), "샌드위치" 면역검정, 면역침전 검정, 형광 면역검정 및 단백질 A 면역검정과 같은 기술을 이용하는 임의의 직접적 또는 경쟁적 결합 검정을 비제한적으로 포함한다. 예시적인 항원 결합 검정은 하기 실시예 섹션에서 제공된다.
정제된 이뮤노글로불린은 N-말단 서열분석, 아미노산 분석, 비-변성 크기 배제 고압 액체 크로마토그래피 (HPLC), 질량 분광측정법, 이온 교환 크로마토그래피 및 파파인 소화를 포함하나 이에 제한되지 않는 일련의 검정에 의해 추가로 특성화될 수 있다. 단백질 정량화를 위한 방법은 당업계에 널리 공지되어 있다. 예를 들어, 발현된 단백질의 샘플은 쿠마시-염색 SDS-PAGE 상에서 그의 정량적 강도에 대해 비교될 수 있다. 대안적으로, 관심 특정 밴드(들) (예를 들어, 전장 밴드)는 예를 들어 웨스턴 블롯 겔 분석 및/또는 AME5-RP 검정에 의해 검출될 수 있다.
III. 제약 제제
항체/항체들의 치료 제제는 동결건조 제제 또는 수용액 형태로, 임의의 생리학상 허용되는 담체, 부형제 또는 안정화제와 원하는 정도의 순도를 갖는 항체를 혼합함으로써 제조될 수 있다 (문헌 [Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)]). 허용되는 담체, 부형제 또는 안정화제는 사용된 투여량 및 농도에서 수용자에 비독성이고, 완충제, 예컨대 포스페이트, 시트레이트 및 다른 유기 산; 항산화제 (아스코르브산 및 메티오닌 포함); 보존제 (예컨대, 옥타데실디메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤즈알코늄 클로라이드, 벤제토늄 클로라이드; 페놀, 부틸 또는 벤질 알콜; 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 시클로헥산올; 3-펜탄올 및 m-크레졸); 저분자량 (약 10개 미만의 잔기) 항체; 단백질, 예컨대 혈청 알부민, 젤라틴 또는 이뮤노글로불린; 친수성 중합체, 예컨대 폴리비닐피롤리돈; 아미노산, 예컨대 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌 또는 리신; 모노사카라이드, 디사카라이드, 및 다른 탄수화물 (글루코스, 만노스 또는 덱스트린 포함); 킬레이트화제, 예컨대 EDTA; 당, 예컨대 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염-형성 반대-이온, 예컨대 나트륨; 금속 착체 (예를 들어, Zn-단백질 복합체); 및/또는 비-이온성 계면활성제, 예컨대 트윈(TWEEN)TM, 플루로닉스(PLURONICS)TM 또는 폴리에틸렌 글리콜 (PEG)을 포함한다. 본원에서 예시적인 제약상 허용되는 담체는 간질성 약물 분산액 작용제, 예컨대 가용성 중성-활성 히알루로니다제 당단백질 (sHASEGP), 예를 들어 인간 가용성 PH-20 히알루로니다제 당단백질, 예컨대 rHuPH20 (힐레넥스(HYLENEX)®, 백스터 인터내셔널, 인크.(Baxter International, Inc.))을 추가로 포함한다. rHuPH20을 포함하는, 특정 예시적인 sHASEGP 및 사용 방법은 미국 특허 공보 번호 2005/0260186 및 2006/0104968에 기재되어 있다. 한 측면에서, sHASEGP는 하나 이상의 추가의 글리코사미노글리카나제, 예컨대 콘드로이티나제와 조합된다.
예시적인 동결건조 항체 제제는 미국 특허 번호 6,267,958에 기재되어 있다. 수성 항체 제제는 미국 특허 번호 6,171,586 및 WO2006/044908에 기재된 것을 포함하고, 후자의 제제는 히스티딘-아세테이트 완충제를 포함한다.
본원의 제제는 또한 치료될 특정한 적응증에 필요한 경우에는 하나 초과의 활성 화합물, 바람직하게는 서로 유해한 영향을 미치지 않는 보완적 활성을 갖는 화합물을 함유할 수 있다. 예를 들면, 제제는 추가로 또 다른 항체 또는 화학요법제를 포함할 수 있다. 이러한 분자는 의도된 목적에 유효한 양으로 조합되어 적합하게 존재한다.
활성 성분은 또한, 예를 들어 코아세르베이션 기술에 의해 또는 계면 중합에 의해 제조된 마이크로캡슐, 예를 들어, 각각 히드록시메틸셀룰로스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메타크릴레이트) 마이크로캡슐 내에, 콜로이드성 약물 전달 시스템 (예를 들어, 리포솜, 알부민 마이크로구체, 마이크로에멀젼, 나노입자 및 나노캡슐) 내에, 또는 마크로에멀젼 내에 포획될 수 있다. 이러한 기술은 문헌 [Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)]에 개시되어 있다.
생체내 투여에 사용될 제제는 멸균되어야 한다. 이는 멸균 여과 막을 통한 여과에 의해 용이하게 달성된다.
지속-방출 제제를 제조할 수 있다. 지속-방출 제제의 적합한 예는 항체를 함유하는 고체 소수성 중합체의 반투과성 매트릭스를 포함하고, 이 매트릭스는 성형품, 예를 들어 필름 또는 마이크로캡슐의 형태이다. 지속 방출 매트릭스의 예는 폴리에스테르, 히드로겔 (예를 들어, 폴리(2-히드록시에틸-메타크릴레이트) 또는 폴리(비닐알콜)), 폴리락티드 (미국 특허 번호 3,773,919), L-글루탐산 및 γ 에틸-L-글루타메이트의 공중합체, 비분해성 에틸렌-비닐 아세테이트, 분해성 락트산-글리콜산 공중합체, 예컨대 루프론 데포(LUPRON DEPOT)TM (락트산-글리콜산 공중합체 및 류프롤리드 아세테이트로 구성된 주사가능한 마이크로구체) 및 폴리-D-(-)-3-히드록시부티르산을 포함한다. 중합체, 예컨대 에틸렌-비닐 아세테이트 및 락트산-글리콜산은 100일을 초과하여 분자를 방출할 수 있는 반면, 특정 히드로겔은 단백질을 보다 짧은 기간 동안 방출한다. 캡슐화된 항체가 신체 내에 장기간 동안 유지되는 경우에, 37℃에서 수분에 노출된 결과로 이들이 변성되거나 응집될 수 있어, 생물학적 활성의 손실, 및 가능하게는 면역원성의 변화를 초래한다. 관련 메카니즘에 따라 안정화를 위한 합리적인 전략이 고안될 수 있다. 예를 들어, 응집 메카니즘이 티오-디술피드 상호교환을 통한 분자간 S-S 결합 형성인 것으로 발견되면, 안정화는 술프히드릴 잔기의 변형, 산성 용액으로부터의 동결건조, 수분 함량의 제어, 적절한 첨가제의 사용 및 특정 중합체 매트릭스 조성물의 개발에 의해 달성될 수 있다.
IV. 항체의 비-치료 용도
본 발명의 항체는 친화도 정제 작용제로 사용될 수 있다. 이러한 과정에서, 항체는 당업계에 널리 공지된 방법을 이용하여, 세파덱스(Sephadex)TM 수지 또는 여과지와 같은 고체 상 위에 고정화된다. 고정화된 항체를 정제될 항원을 함유하는 샘플과 접촉시킨 후에 지지체를 적합한 용매로 세척하며, 이러한 용매는 고정화된 항체에 결합된 정제될 항원을 제외하고는 샘플 내의 실질적으로 모든 물질을 제거할 것이다. 최종적으로, 지지체를 또 다른 적합한 용매, 예컨대 글리신 완충제 (pH 5.0)로 세척하며, 이에 의해 항원이 항체로부터 방출될 것이다.
항체는 또한, 예를 들어 특정 세포, 조직 또는 혈청에서 관심 항원의 발현을 검출하기 위한 진단 검정에 유용할 수 있다. 진단 용도를 위해, 항체는 전형적으로 검출가능한 모이어티로 표지될 것이다. 다수의 표지가 이용가능하고, 이들은 일반적으로 하기 카테고리로 분류될 수 있다:
(a) 방사성동위원소, 예컨대 35S, 14C, 125I, 3H 및 131I. 항체는 예를 들어 문헌 [Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, N.Y., Pubs. (1991)]에 기재된 기술을 이용하여 방사성동위원소로 표지될 수 있고, 방사능은 섬광 계수를 이용하여 측정될 수 있다.
(b) 형광 표지, 예컨대 희토류 킬레이트 (유로퓸 킬레이트) 또는 플루오레세인 및 그의 유도체, 로다민 및 그의 유도체, 단실, 리사민(Lissamine), 피코에리트린 및 텍사스 레드(Texas Red)가 이용가능하다. 형광 표지는 예를 들어 문헌 [Current Protocols in Immunology, 상기 문헌]에 개시된 기술을 이용하여 항체에 접합될 수 있다. 형광은 형광계를 이용하여 정량화할 수 있다.
(c) 다양한 효소-기질 표지가 이용가능하고, 미국 특허 번호 4,275,149는 이들 중 일부에 대한 개관을 제공한다. 효소는 일반적으로 발색 기질의 화학적 변경을 촉매하며, 이는 다양한 기술을 이용하여 측정할 수 있다. 예를 들어, 효소는 기질에서의 색 변화를 촉매할 수 있고, 이는 분광학적으로 측정할 수 있다. 대안적으로, 효소는 기질의 형광 또는 화학발광을 변경시킬 수 있다. 형광의 변화를 정량화하는 기술은 상기 기재되어 있다. 화학발광 기질은 화학 반응에 의해 전기적으로 여기된 후에, 측정 (예를 들어, 화학발광측정기를 사용하여 측정)할 수 있는 빛을 방출할 수 있거나 또는 형광 수용자에 에너지를 공여한다. 효소 표지의 예는 루시페라제 (예를 들어, 반딧불이 루시페라제 및 박테리아 루시페라제; 미국 특허 번호 4,737,456), 루시페린, 2,3-디히드로프탈라진디온, 말레이트 데히드로게나제, 우레아제, 퍼옥시다제, 예컨대 양고추냉이 퍼옥시다제 (HRPO), 알칼리성 포스파타제, β-갈락토시다제, 글루코아밀라제, 리소자임, 사카라이드 옥시다제 (예를 들어, 글루코스 옥시다제, 갈락토스 옥시다제, 및 글루코스-6-포스페이트 데히드로게나제), 헤테로시클릭 옥시다제 (예컨대, 우리카제 및 크산틴 옥시타제), 락토퍼옥시다제, 마이크로퍼옥시다제 등을 포함한다. 효소를 항체에 접합시키는 기술은 문헌 [O'Sullivan et al., Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay, in Methods in Enzym. (ed J. Langone and H. Van Vunakis), Academic press, New York, 73:147-166 (1981)]에 기재되어 있다.
효소-기질 조합의 예는 예를 들어 다음을 포함한다:
1) 양고추냉이 퍼옥시다제 (HRPO)는 과산화수소를 이용하여 염료 전구체 (예를 들어, 오르토페닐렌 디아민 (OPD) 또는 3,3',5,5'-테트라메틸 벤지딘 히드로클로라이드 (TMB))를 산화시킴;
2) 알칼리성 포스파타제 (AP)와 발색 기질로서의 파라-니트로페닐 포스페이트; 및
3) β-D-갈락토시다제 (β-D-Gal)와 발색 기질 (예를 들어, p-니트로페닐-β-D-갈락토시다제) 또는 형광 기질 4-메틸움벨리페릴-β-D-갈락토시다제.
다수의 다른 효소-기질 조합이 당업자에게 이용가능하다. 이들의 일반적 검토를 위해서, 미국 특허 번호 4,275,149 및 4,318,980을 참조한다.
때때로, 표지는 항체와 간접적으로 접합된다. 당업자는 이를 달성하기 위한 다양한 기술을 알 것이다. 예를 들어, 항체는 비오틴과 접합될 수 있고, 상기 언급된 표지의 광범위한 3가지 카테고리 중 임의의 것이 아비딘에 접합될 수 있거나, 또는 반대로 접합될 수 있다. 비오틴은 아비딘에 선택적으로 결합하며, 이에 따라 표지는 이러한 간접 방식으로 항체와 접합될 수 있다. 대안적으로, 표지와 항체의 간접 접합을 달성하기 위해서, 항체가 소형 합텐 (예를 들어, 디곡신)과 접합되고, 상기 언급된 다양한 유형의 표지 중 하나가 항-합텐 항체 (예를 들어, 항-디곡신 항체)와 접합된다. 이에 따라, 표지와 항체의 간접 접합이 달성될 수 있다.
본 발명의 또 다른 실시양태에서, 항체는 표지될 필요가 없고, 그의 존재를 이러한 항체에 결합하는 표지된 항체를 사용하여 검출할 수 있다.
본 발명의 항체는 임의의 공지된 검정 방법, 예컨대 경쟁적 결합 검정, 직접 및 간접 샌드위치 검정, 및 면역침전 검정에서 사용될 수 있다. 문헌 [Zola, Monoclonal Antibodies: A Manual of Techniques, pp. 47-158 (CRC Press, Inc. 1987)].
항체는 또한 생체내 진단 검정에 사용될 수 있다. 일반적으로, 항체는 항원 또는 이를 발현하는 세포가 면역섬광조영을 사용하여 국재화될 수 있도록 방사성핵종 (예컨대, 111In, 99Tc, 14C, 131I, 125I, 3H, 32P 또는 35S)으로 표지된다.
V. 항체의 생체내 용도
또 다른 실시양태에서, 본 발명의 항-IL-1β 및/또는 항-IL-18 항체/항체들은 치료제의 기능을 증진시키기 위한 치료제와 공동-투여된다. 예를 들어, 항-FcγRIIB는 FcγRIIB에 대한 IgG 결합을 차단하기 위해 포유동물에 투여되며, 이로 인해 면역 반응의 FcγRIIB-매개 억제를 방지한다. 이는 IgG 치료 항체의 증진된 세포독성을 나타낸다. 예를 들어, 치료 항체가 종양 항원에 특이적인 경우에, 본 발명의 항-FcγRIIB의 항-종양 항원 항체와의 공동-투여는 항-종양 항원 항체의 세포독성을 증진시킨다.
치료 항체 (이들 중 다수는 상기 기재됨)는 암을 포함하여 다양한 질환의 치료를 위해 개발 및 승인되었다. 예를 들어, 리툭산® (리툭시맙) (IDEC 팜(IDEC Pharm)/제넨테크, 인크.)은 B 세포 림프종을 치료하는데 사용되고, 아바스틴TM (베바시주맙) (제넨테크, 인크.)은 전이성 결장직장암을 치료하는데 사용되고, 헤르셉틴® (트라스투맙) (제넨테크, 인크.)은 전이성 유방암을 치료하는데 사용되는 인간화 항-HER2 모노클로날 항체이다. 이러한 치료를 위해 개발된 모든 모노클로날 항체에 의한 암의 치료를 위한 메카니즘을 완전히 이해할 수 없다고 하더라도, 적어도 일부 경우에서, 항체 요법의 유효성의 일부가 면역 이펙터 기능의 동원에 기인할 수 있다 (문헌 [Houghton et al., 2000, Nature Medicine, 6:373-374; Clynes et al., 2000, Nature Medicine, 6:433-446]). 졸레어(XOLAIR)® (오말리주맙) (제넨테크, 인크.)는 알레르기를 치료하는데 사용되는 항-IgE 항체이다.
이러한 이작용성 항체에 대한 치료 잠재력은 염증 및/또는 알레르기에 관련된 신호의 감쇠를 포함할 것이다. 예를 들어, (FcFR을 통해) IgE 및 알레르겐에 의해 활성화되는 경우에, 비만 세포 및 호염기구는 혈관 및 근육 세포에 작용하고 염증 세포를 동원하는 염증 매개물 및 시토카인을 분비한다. 이후에 염증 세포는 장기-지속 염증을 일으키는 계속되는 과정에서, 염증 매개물을 분비하고 염증 세포를 동원한다. 결과적으로, IgE 유발 비만 세포 활성화를 제어하는 수단은 염증 반응의 개시를 중단시킴으로써 알레르기성 질환을 치료하기 위한 치료 접근법을 제공한다. 상기 기재된 바와 같이, 이작용성 항체는 IL-1β에 선택적으로 결합하는 항체 또는 그의 단편을 포함하고 IL-18에 선택적으로 결합하는 항체 또는 그의 단편을 포함한다.
추가의 이작용성 항체의 예 (예를 들어, 이중특이적 항체)는 IL-1β에 선택적으로 결합하는 항체 또는 그의 단편 및 IL-18에 선택적으로 결합하는 제2 항체 또는 그의 단편의 조합을 포함한다. 일부 실시양태에서, 본 발명의 항체는 수용체 활성화에 의해 매개되는 전염증성 신호 및/또는 B 세포 활성화가 억제되도록 항체로 치료된 포유동물에서 억제성 FcγRIIB 수용체를 활성화시키는데 사용된다. 따라서, 항체는 상기 확인된 것과 같은 염증성 장애 및/또는 자가면역 질환을 치료하는데 사용된다.
질환의 예방 또는 치료를 위해, 항체의 적절한 투여량은 치료할 질환의 유형, 질환의 중증도 및 경과, 항체가 예방 목적으로 투여되는지 치료 목적으로 투여되는지의 여부, 선행 요법, 환자의 임상 병력 및 항체에 대한 반응, 및 담당의의 판단에 따라 달라질 것이다. 항체는 한번에 또는 일련의 치료에 걸쳐 환자에게 적합하게 투여된다.
질환의 유형 및 중증도에 따라, 예를 들어 1회 이상의 개별 투여에 의해서든 연속 주입에 의해서든, 항체의 약 1 μg/kg 내지 15 mg/kg (예를 들어, 0.1-20 mg/kg)이 환자에게 투여하기 위한 초기 후보 투여량이다. 전형적인 1일 투여량은 상기 언급된 요인에 따라 약 1 μg/kg 내지 100 mg/kg 또는 그 초과의 범위일 수 있다. 수일 이상에 걸친 반복 투여의 경우에, 상태에 따라 질환 증상의 원하는 억제가 일어날 때까지 치료를 지속한다. 그러나, 다른 투여 요법이 유용할 수 있다. 이러한 요법의 진행은 통상의 기술 및 검정에 의해 용이하게 모니터링된다.
항체 조성물은 우수한 의료 행위에 일관되는 방식으로 제제화, 투약 및 투여될 것이다. 이와 관련하여 고려할 요인은 치료할 특정한 장애, 치료할 특정한 포유동물, 개별 환자의 임상적 상태, 장애의 원인, 작용제의 전달 부위, 투여 방법, 투여 스케줄링, 및 진료의에게 공지된 다른 요인을 포함한다. 투여될 항체의 "치료 유효량"은 이러한 고려사항에 의해 좌우될 것이고, 질환 또는 장애를 예방하거나, 개선시키거나 또는 치료하는데 필요한 최소량이다. 항체는 반드시 그럴 필요는 없지만, 임의로 해당 장애를 예방 또는 치료하는데 현재 사용되는 하나 이상의 작용제와 함께 제제화된다. 이러한 다른 작용제의 유효량은 제제 내에 존재하는 항체의 양, 장애 또는 치료의 유형, 및 상기 논의된 다른 요인에 따라 달라진다. 일반적으로, 이들은 이전에 사용되던 것과 동일한 투여량 및 투여 경로로 사용되거나, 이전에 사용되던 투여량의 약 1 내지 99%로 사용된다.
예를 들어, 염증 세포 (예를 들어, 백혈구) 부착, 이동 및 활성화와 관련된 자가면역 질환, 예컨대 류마티스 관절염 및 루푸스를 치료하기 위해, 본원의 항체는 예를 들어 항-LFA-1 항체 (예컨대, 항-CD11a 또는 항-CD18 항체) 또는 항-ICAM 항체, 예컨대 ICAM-1, -2 또는 -3과 공동-투여될 수 있다. 본원의 항체와 조합하여 류마티스 관절염을 치료하기 위한 추가의 작용제는 엔브렐(Enbrel)TM, DMARDS, 예를 들어 메토트렉세이트, 및 NSAID (비-스테로이드성 항염증 약물)를 포함한다. 또한 본원의 항체보다 하나 초과의 이러한 다른 활성제가 사용될 수 있다. 추가로, 인슐린은 당뇨병 치료를 위해, 항-IgE는 천식 치료를 위해, 항-CD11a는 건선 치료를 위해, 항-알파4베타7 및 성장 호르몬 (GH)은 염증성 장 질환 치료를 위해 사용될 수 있다.
또한, 제제는 유효량의 혈당강하제와 함께 적합하게 투여된다. 본원의 목적을 위해, 용어 "혈당강하제"는 글루코스 대사를 조절하기에 유용한 화합물, 바람직하게는 경구 작용제를 지칭한다. 본원에서 인간에게 사용하기에 보다 바람직한 것을 인슐린 및 술포닐우레아 클래스의 경구 혈당강하제이며, 이는 췌장에 의한 인슐린 분비를 일으킨다. 그 예는 글리부리드, 글리피지드 및 글리클라지드를 포함한다. 또한, 인슐린 감수성을 증진시키거나, 인슐린 감작화제, 예컨대 비구아니드 (메트포르민 및 펜포르민 포함) 및 티아졸리덴디온, 예컨대 레줄린(REZULIN)TM (트로글리타존) 상표명 인슐린-감작화제, 및 PPAR-감마 핵 수용체에 결합하는 다른 화합물이 이 정의 내에 포함되고, 또한 바람직하다.
혈당강하제는 비경구, 비강내, 경구를 비롯한 임의의 적합한 기술, 또는 임의의 다른 유효한 경로에 의해 포유동물에 투여된다. 가장 바람직하게는, 투여는 경구 경로에 의한 것이다. 예를 들어, 1.25, 2.5 및 5 mg 정제 농도에서 업존(Upjohn)에 의해 판매되는 마이크로나제(MICRONASE)TM 정제 (글리부리드)가 경구 투여에 적합하다. 이 요법 상에서 제공되는 제II형 당뇨병을 위한 일반적인 유지 용량은 일반적으로 하루에 약 1.25 내지 20 mg의 범위이며, 이는 단일 용량으로 제공되거나 또는 적절한 것으로 간주된다면 하루 전반에 걸쳐 분할될 수 있다. 문헌 [Physician's Desk Reference, 2563-2565 (1995)]. 처방에 이용가능한 글리부리드-기재 정제의 다른 예는 글리나제(GLYNASE)TM 상표명 약물 (업존) 및 디아베타(DIABETA)TM 상표명 약물 (훽스트-루셀(Hoechst-Roussel))을 포함한다. 글루코트롤(GLUCOTROL)TM (프라트(Pratt))은 글리피지드 (1-시클로헥실-3-(p-(2-(5-메틸피라진 카르복스아미드)에틸)페닐)술포닐)우레아) 정제에 대한 상표명으로, 5- 및 10-mg 강도로 이용가능하며, 또한 식사 제어 후에 저혈당 요법이 요구되는 제II형 당뇨병을 위해 또는 다른 술포닐우레아에 반응하는 것이 중지된 환자에서 처방된다. 문헌 [Physician's Desk Reference, 1902-1903 (1995)]. 술포닐우레아 이외의 혈당강하제, 예컨대 비구아니드 (예를 들어, 메트포르민 및 펜포르민) 또는 티아졸리딘디온 (예를 들어, 트로글리토존) 또는 인슐린 작용에 영향을 미치는 다른 약물이 또한 사용될 수 있다. 티아졸리딘디온이 펩티드와 사용되는 경우에, 이는 현재 이용되는 것과 동일한 수준 또는 다소 보다 낮은 수준에서 사용되며, 펩티드를 단독으로 사용하거나 또는 디온에 함께 사용하여 나타난 효과에 대해 조정될 수 있다. 그 자체로 사용된 트로글리타존 (레줄린TM)의 전형적인 용량은 하루에 약 100-1000 mg, 보다 바람직하게는 200-800 mg/일이고, 이 범위는 본원에 적용가능하다. 예를 들어, 문헌 [Ghazzi et al., Diabetes, 46: 433-439 (1997)]을 참조한다. 트로글리타존보다 강한 인슐린-감작화제인 다른 티아졸리딘디온은 보다 낮은 용량으로 사용될 것이다.
VI. 제조품
본 발명의 또 다른 측면에서, 상기 기재된 장애의 치료, 예방 및/또는 진단에 유용한 물질을 함유하는 제조품이 제공된다. 제조품은 용기, 및 용기 상에 있거나 용기와 결합된 라벨 또는 포장 삽입물을 포함한다. 적합한 용기는 예를 들어 병, 바이알, 시린지, IV 용액 백 등을 포함한다. 용기는 다양한 물질, 예컨대 유리 또는 플라스틱으로부터 형성될 수 있다. 용기는 조성물 자체를 수용하거나 또는 상기 조성물을 상태의 치료, 예방 및/또는 진단에 유효한 또 다른 조성물과 조합하여 수용하며, 멸균 접근 포트를 가질 수 있다 (예를 들어, 용기는 정맥 주사액 백 또는 피하 주사 바늘로 뚫을 수 있는 마개를 갖는 바이알일 수 있음). 조성물 내의 적어도 하나의 활성제는 본 발명의 항체이다. 라벨 또는 포장 삽입물은 조성물이 선택된 상태를 치료하는데 사용된다는 것을 나타낸다. 또한, 제조품은 (a) 그 내부에 조성물을 함유하는 제1 용기 (이 조성물은 본 발명의 항체를 포함함); 및 (b) 그 내부에 조성물을 함유하는 제2 용기 (이 조성물은 추가의 세포독성제 또는 다른 치료제를 포함함)를 포함할 수 있다. 본 발명의 이러한 실시양태에서의 제조품은, 조성물이 특정한 상태를 치료하기 위해 사용될 수 있음을 나타내는 포장 삽입물을 추가로 포함할 수 있다. 대안적으로 또는 추가로, 제조품은 제약상 허용되는 완충제, 예컨대 정균 주사용수 (BWFI), 포스페이트-완충 염수, 링거액 및 덱스트로스 용액을 포함하는 제2 (또는 제3) 용기를 추가로 포함할 수 있다. 이는 다른 완충제, 희석제, 필터, 바늘 및 시린지를 포함하여, 상업적 및 사용자 관점에서 바람직한 다른 물질을 추가로 포함할 수 있다.
치료 항체 조성물은 일반적으로 멸균 접근 포트를 갖는 용기, 예를 들어 정맥 주사액 백 또는 피하 주사 바늘로 뚫을 수 있는 마개를 갖는 바이알에 넣는다.
본 발명은 예를 들어 암 또는 질환의 치료에 유용한 물질을 함유하는 제조품 및 키트를 추가로 제공한다. 제조품은 라벨을 갖는 용기를 포함한다. 적합한 용기는 예를 들어 병, 바이알 및 시험 튜브를 포함한다. 용기는 다양한 물질, 예컨대 유리 또는 플라스틱으로부터 형성될 수 있다. 용기는 본원에 기재된 항체를 포함하는 조성물을 수용한다. 조성물 내의 활성제는 특정한 항체이다. 용기 상의 라벨은 조성물이 특정한 질환 또는 장애의 치료 또는 예방에 사용된다는 것을 나타내고, 또한 상기 기재된 바와 같은 생체내 지침을 나타낼 수 있다.
본 발명의 키트는 상기 기재된 용기 및 완충제를 포함하는 제2 용기를 포함한다. 이는 다른 완충제, 희석제, 필터, 바늘, 시린지, 및 사용 지침서를 갖는 포장 삽입물을 포함하여, 상업적 및 사용자 관점에서 바람직한 다른 물질을 추가로 포함할 수 있다.
임의의 상기 제조품은 IL-1β 및/또는 IL-18 항체/항체들을 대신하여 또는 이에 더하여 본 발명의 면역접합체를 포함할 수 있는 것으로 이해된다.
<실시예>
다음은 본 발명의 방법 및 조성물의 예이고, 예시 목적으로 본원에 제공되며, 본 발명의 범위를 제한하려는 의도가 아니다. 본원에 제공된 일반적 설명을 고려하여 다양한 다른 실시양태가 실시될 수 있는 것으로 이해된다. 본원에 인용된 모든 특허 및 과학 문헌의 개시내용은 그 전체내용이 명백하게 참고로 포함된다.
달리 나타내지 않는 한, 본 실시예에서 언급되는 상업적으로 입수가능한 시약은 제조업체의 지침에 따라 사용하였다. ATCC 등록 번호에 의해, 하기 실시예 및 명세서 전반에 걸쳐 확인되는 세포의 공급원은 아메리칸 타입 컬쳐 콜렉션(버지니아주 마나사스)이다.
방법
덱스트란 황산나트륨 (DSS)-유발 결장염
체중이 19-25 그램인 연령 및 성별-매치된 야생형 및 녹아웃 마우스는 처리하지 않고 두거나 또는 5일 동안 임의량의 음용수 중 3.5% DSS를 제공받을 것이다. 마우스는 제4일에 시작하여 체중 감소에 대해 매일 스코어링하고, 제8일에 희생시킬 것이다. 이어서, 결장을 수집하고, 스코어링하고, 기관 배양 또는 조직병리학에 사용할 것이다. 염증의 정도에 대한 결장의 스코어링을 하기와 같이 수행하였다: 광범위한 플러싱에 의한 분변의 제거 후에, 결장을 벽의 비후화의 정도에 기초하여 스코어링한다. 스코어는 0 내지 4의 범위로, 정상 결장은 0으로 스코어링하고, 전체 길이를 포함하는 비후화된 벽을 갖는 결장은 4로 스코어링한다.
시토카인 프로파일링을 위한 결장 배양
마우스로부터의 결장을 세정하고, 세로로 개방하고, 1% 페니실린/스트렙토마이신 용액을 함유하는 RPMI 배지에 넣었다. 37℃에서 밤새 인큐베이션한 후에, 배양 배지를 수집하고 정화한 후에 바이오라드 바이오-플렉스(BioRad Bio-Plex) 단일 또는 23-플렉스 검정을 이용하여 xMAP-기반 기술 (루미넥스(Luminex))에 의해 시토카인 분석을 수행하였다.
AAV2/5 망막하 주사
동물을 케타민/크실라진 (80mg/kg:15 mg/kg)의 복강내 주사에 의해 마취시켰다. 해부 현미경 아래에서, 30g 인슐린 바늘을 이용하여 공막을 통해 구멍을 만들어, 33-게이지 해밀턴 바늘 및 마이크로-자동-주사기 (월드 프리시젼 인스트루먼츠(World Precision Instruments), 플로리다주 사라소타)를 이용하여 1 μl의 1 x 1012개 AAV2/5 게놈 입자/ml (진디텍트(Genedetect), 플로리다주 브레이든턴)을 망막하 주사하였다. 망막하 기포의 형성은 성공적인 주사를 나타내었다.
웨스턴 블롯
10주령 Balbc 마우스에게 1 μl의 1x109개 AAV2/5-IL1β 또는 AAV2/5 빈 대조군 바이러스 (진디텍트)를 망막하 주사하였다. 4개월 감염 후에, 일부 마우스에게 3.5시간 동안 강한 광 노출 (ILE, 8000 룩스)을 적용한 후에 48시간 동안 암실에 두었다. 눈을 해부하고, 안배 (각막 및 수정체를 제거한 눈)를 프로테아제 억제제 (프로테아제 억제제 칵테일 세트 I, 칼바이오켐(Calbiochem), 뉴저지주 깁스타운)를 함유하는 세포 용해 완충제 (셀 시그널링 테크놀로지스(Cell Signaling Technologies), 매사추세츠주 댄버스)에서 1시간 동안 분쇄하고, -80℃에 냉동시켰다. BCA 검정 (써모/피어스(Thermo/Pierce), 일리노이주 록포드)은 샘플 중의 단백질을 정량화하였다. 레인당 10-20% 트리스-글리신 겔 (인비트로젠(Invitrogen), 캘리포니아주 칼스배드)에, b-메르캅토에탄올이 첨가된 라멜리(Lammeli) 완충제에서 3분 동안 비등시킨 단백질 10 ug을 로딩하고, 1.5시간 동안 125 mW에서 전개시켰다. 단백질을 전달 완충제 (인비트로젠) 중에서 0.2 um 기공 니트로셀룰로스 막으로 25 mW에서 1시간 동안 전달하였다. 블롯을 PBS/0.1% 트윈-20 (PBST) 중 5% 유액으로 1시간 동안 및 1% 유액/PBST에 첨가된 0.2 ug/ml 염소-항-IL-1β (R&D cat# AF-401-NA) 또는 0.5 ug/ml 래트-항-카스파제-1 (제넨테크, 클론 4B4.2)로 1시간 동안 차단하였다. 블롯을 PBST에서 4x5분 세척하였다. 항-염소-HRP (1:5000 R&D) 또는 항-래트-HRP (써모/피어스)를 45분 동안 첨가하고, PBST에서 5x5분 세척하였다. 블롯을 ECL 플러스 및 하이퍼필름 (지이 헬쓰케어(GE Healthcare), 영국 버킹엄셔)으로 발현시켰다.
면역조직화학
10주령 Balbc 마우스에게 1 μl의 1x109개 AAV2/5-IL1β 또는 AAV2/5 빈 대조군 바이러스 (진디텍트)를 망막하 주사하였다. 7주 감염 후에, 전체 눈을 분리하고, 실온에서 밤새 10% 중성 완충 포르말린에 고정시켰다. 섹션을 처리하고, 파라핀에 포매시킨 후에 항-CD45로 염색하고, DAB로 시각화하였다.
형광 혈관조영 (FA)
동물을 케타민/크실라진 (80mg/kg:15 mg/kg)의 복강내 주사에 의해 마취시키고, 눈을 1% 트로픽아미드 (바슈 앤 롬(Bausch and Lomb), 뉴욕주 로체스터)로 팽창시켰다. 인공 누액으로 눈을 촉촉하게 유지시켰다. 마우스에게 100 μl 10% AK-플루오르 주사가능한 플루오레세인 (아콘(Akorn), 일리노이주 버팔로 그로브)을 복강내 주사하였다. 영상은 하이델베르크 스펙트랄리스(Heidelberg Spectralis) HRA/OCT 카메라 (하이델베르크 엔지니어링(Heidelberg Engineering), 캘리포니아주 비스타)로 획득하였다.
광 간섭 단층촬영 (OCT)
동물을 케타민/크실라진 (80mg/kg:15 mg/kg)의 복강내 주사에 의해 마취시키고, 1% 트로픽아미드 (바슈 앤 롬, 뉴욕주 로체스터)로 팽창시켰다. 인공 누액으로 눈을 촉촉하게 유지시켰다. 영상은 하이델베르크 스펙트랄리스 HRA/OCT 카메라 (하이델베르크 엔지니어링, 캘리포니아주 비스타)로 획득하였다. 측정값은 15.2 mm2 넓이의 망막 위의 19개 섹션의 평균 두께이다. 두께는 망막 및 맥락막을 포함한다.
망막전위도 (ERG) 기록
마우스를 ERG 이전에 24시간 동안 암실에 적응시켜 망막 반응을 평형화시켰다. 암실에 적응하면, 모든 후속 절차는 조명을 위해 오직 적색 광을 사용하여 암실에서 수행할 것이다. 동물을 케타민 및 크실라진 (75-80 mg/kg:7.5-15 mg/kg)의 복강내 주사로 마취시켰다. 마우스 체온을 그의 제어 장치에 연결된 항온 가열 플레이트를 이용하여 37℃에서 유지시켰다. 동공을 1% 아트로핀으로 팽창시키고, 각막 표면을 0.5% 프로파라카인 HCl 한 방울로 마취시켰다. 양쪽 눈으로부터의 ERG를 에스피온 E2(Espion E2) (디아그노시스 엘엘씨(Diagnosys LLC), 매사추세츠주 로웰) 시각 전기생리학 시스템을 이용하여 동시에 기록하였다. 마우스를 플랫폼 상에 두고, 기준 전극을 이마에서 피하로 삽입하고, 접지 전극을 꼬리의 기저부에 삽입하였다. 고낙 하이퍼멜로스 용액을 각막 상에 올려 각막과 백금 전극 사이의 전기적 접촉을 확립하고, 눈은 실험 동안 건조되지 않도록 보호하였다. 마우스를 컬러돔(ColorDome) 전시야 데스크탑 간츠펠트(Ganzfeld) 자극장치에 넣고, 기준선 반응을 재확립하기 위해 플래쉬 사이에 2분을 허용하면서 백색 광: 1x10-5-5 cd/m2 범위의 3 플래쉬 강도로 자극하였다. 신호를 0.15-1000 Hz에서 대역-여과하고, 2 kHz에서 샘플링하였다.
파지 패닝 IL-1β에 대한 방법
여러 파지 디스플레이 합성 항체 라이브러리를 고정화된 인간 IL-1β에 대해 패닝하였다. IL-1β에 특이적인 항체 디스플레이 파지 풀의 풍부도를 소 혈청 알부민에의 결합에 특이적인 파지 클론의 회수된 풀에 대한 IL-1β에 특이적인 파지 클론의 회수된 풀의 비를 측정함으로써 3 라운드 및 후속 라운드에서 결정하였다. 합성 나이브 항체 파지 디스플레이 라이브러리의 구축은 다른 곳에도 기재되어 있다 (문헌 [Sidhu et al., 2004]). 여러 라운드의 패닝 후에, IL-1β에 특이적인 항체 가변 중쇄 및 경쇄 도메인을 디스플레이하는 파지 클론을 확인하였다. 가변 중쇄 및 쇄의 DNA 서열을 결정하고, 포유동물 세포에서 일시적 항체 발현이 허용되도록 인간 IgG1 발현 벡터에 재구성하였다. 세포 배양 성장 배지로부터의 항체를 가용성 단백질 결합 친화도 결정 검정, 수용체-리간드 억제 검정 및 기능적 세포 기반 검정에서 후속 시험을 위해 단백질 A를 이용하여 정제하였다.
인간 IL-1RI 또는 IL-1RII에 대한 인간 IL-1β 결합의 경쟁적 억제
뉴트라비딘(NeutrAvidin) (피어스, 일리노이주 록포드)을 포스페이트 완충 염수 (PBS)에서 2 μg/mL로 희석하고, 4℃에서 밤새 인큐베이션하는 동안 ELISA 플레이트 (384-웰 고-결합 플레이트, 눈크(Nunc), 뉴저지주 넵튠) 상에 코팅하였다. 세척 완충제 (PBS/0.05% 트윈-20)로 3회 세척한 후에, 플레이트를 1 내지 2시간 동안 PBS/0.5% 소 혈청 알부민 (BSA)으로 차단하였다. 본 인큐베이션 및 모든 후속 인큐베이션을 궤도 진탕기 상에서 실온에서 수행하였다. 제조업체의 지시에 따라 말레이미드-PEG-비오틴 (피어스)을 이용하여 비오티닐화된 인간 IL-1β (R&D 시스템즈, 미네소타주 미네아폴리스)를 검정 완충제 (PBS/0.5% BSA/0.05% 트윈-20)에서 400 ng/ml로 희석하였다. 차단된 뉴트라비딘 플레이트를 세척하고, 비오티닐화된 인간 IL-1β를 1-2시간 인큐베이션 동안 플레이트 상에 포획하였다. 인간 IL-1RI 및 IL-1RII (R&D 시스템즈)를 제조업체의 지시에 따라 3-아미노-3-데옥시디곡시게닌 헤미숙신아미드 숙신이미딜 에스테르 (인비트로젠, 오리곤주 유진)를 이용하여 디곡시게닌 (DIG)으로 표지하였다. IL-1β에 대한 IL-1RI 및 IL-1RII의 결합을 차단하는 항체의 능력은 넓은 범위에 걸쳐 항체를 희석하고, 이들을 동일한 부피의 DIG-표지된 인간 IL-1RI 또는 IL-1RII (각각 1 μg/ml 또는 60 ng/ml의 최종 농도)와 혼합함으로써 평가하였다. 혼합물을 세척된 플레이트에 첨가하고, 1-2시간 동안 인큐베이션하였다. 이어서, 플레이트-결합된 IL-1RI 또는 IL-1RII를 양고추냉이 퍼옥시다제 (HRP)-접합된 모노클로날 항-DIG 항체 (잭슨 이뮤노리서치(Jackson ImmunoResearch), 펜실베니아주 웨스트 그로브)를 이용하여 검출하였다. 1시간 인큐베이션 및 추가의 세척 단계 후에, 테트라메틸 벤지딘 (TMB, 키르케가드 & 페리 래보러토리즈, 인크.(Kirkegaard & Perry Laboratories, Inc.), 메릴랜드주 게이더스버그)을 첨가하고, 색을 대략 10분 동안 발현시켰다. 반응을 1 M 인산을 첨가하여 중단시켰다. 광학 밀도를 마이크로플레이트 판독기 (450 nm, 650 nm 참조)를 이용하여 판독하고, 결합의 절반 최대 억제를 나타내는 항체 농도를 곡선의 4-파라미터 핏 (칼레이다그래프(Kaleidagraph), 시너지 소프트웨어(Synergy Software), 펜실베니아주 리딩)을 이용하여 결정하였다. 도 21을 참조한다.
마우스 IL-1RI 또는 IL-1RII에 대한 마우스 IL-1β 결합의 경쟁적 억제
마우스 IL-1RI 및 IL-1RII에 대한 마우스 IL-1β의 결합을 차단하는 항체의 능력을 유사한 방법을 이용하여 평가하였다. 마우스 IL-1β (R&D 시스템즈)를 제조업체의 지시에 따라 술포-NHS-LC-비오틴 (피어스)을 이용하여 비오티닐화하고, 400 ng/ml의 농도에서 뉴트라비딘 플레이트 상에 포획하였다. 항체를 넓은 범위에 걸쳐 희석하고, 동일한 부피의 마우스 IL-1RI- 또는 IL-1RII-인간 IgG1 Fc 융합 단백질 (R&D 시스템즈; 각각 1 μg/ml 또는 60 ng/ml의 최종 농도)과 혼합하고, 준비된 플레이트 상에서 1-2시간 동안 인큐베이션하였다. 결합된 수용체를 HRP-접합된 염소 폴리클로날 항-인간 IgG Fc 항체 (잭슨 이뮤노리서치)를 이용하여 검출하였다. 발색 및 데이터 분석을 상기 기재된 바와 같이 수행하였다. 도 21을 참조한다.
인간 IL-18Ra에 대한 인간 IL-18 결합의 경쟁적 억제
전반적인 검정 방법은 인간 IL-1β/IL-1R 결합의 억제를 평가하기 위해 기재된 바와 본질적으로 동일하였다. ELISA 플레이트를 뉴트라비딘 (피어스)으로 코팅하고, 술포-NHS-LC-비오틴 (피어스)을 이용하여 비오티닐화된 인간 IL-18 (R&D 시스템즈)을 400 ng/ml로 희석하고, 플레이트 상에 포획하였다. 인간 IL-18Ra-인간 IgG1 Fc (R&D 시스템즈)를 3-아미노-3-데옥시디곡시게닌 헤미숙신아미드 숙신이미딜 에스테르 (인비트로젠, 오리곤주 유진)를 이용하여 디곡시게닌 (DIG)으로 표지하였다. 희석된 항체를 동일한 부피의 DIG-IL-18Ra-Fc (1 μg/ml의 최종 농도)와 혼합하였다. 결합된 수용체를 항-DIG 항체 (잭슨 이뮤노리서치)를 이용하여 검출하였다. 발색 및 데이터 분석은 상기 기재된 바와 같이 수행하였다.
실시예 1
: 염증성 장 질환에서 조합된 IL-1β 및 IL-18 차단
임상 연구에서, 본 발명자들은 크론병에서 IL-1β 및 IL-18-발현 세포의 유의한 증가 뿐만 아니라 크론병에서 혈청 IL-18 수준의 유의한 증가를 발견하였다 (도 4 참조). IBD의 전임상 마우스 모델에서, 생체외 결장 배양물 중에서 결장으로부터 IL-1β 및 IL-18의 분비가 증가함이 밝혀졌다 (도 5 참조). IL-1β의 경우에, 양성 세포는 활성 염증의 부위에 있었으며, 활성 염증의 증거가 없는 영역에는 소수의 양성 세포가 있거나 양성 세포가 존재하지 않았다 (도 5, 상부 사진). IL-18의 경우에, 양성 세포는 림프성 여포의 변연부 (화살촉)에서의 여포성 수지상 세포 (화살표) 및 골수 수지상 세포와 형태적으로 상용성이다 (도 5, 하부 사진). IL-18 양성 세포는 또한 결장 상피 세포이다. 이러한 결과는 평가된 21명의 크론병 환자 샘플을 대표한다.
연구된 마우스 모델은 DSS-유발 결장염 (WT B6 암컷 마우스에서), T-세포 입양 전달 및 피록시캄-IL-10 KO를 포함하였다 (도 6, 7 및 8 참조). 본 발명자들은 IL-1β, IL-18 또는 둘 다의 차단 (ASC KO 연구의 경우)이 결장염의 DSS 모델에서 염증 반응 (IL-1β, IL-18, TNFα, IL-17, IL-6) 및 결장 스코어를 감소시킨다는 것을 입증하였다 (도 9-13 참조).
실시예 2: 연령-관련 황반 변성에서의 조합된 IL-1β 및 IL-18 차단
이전 연구는 IL-1β가 당뇨병성 망막병증 및 포도막염을 갖는 환자의 유리체액에서 증가한다는 것을 보고하였다. 그러나, 어떠한 연구도 습성 또는 건성 AMD에서 IL-1β 및 IL-18의 존재에 대해 보고하지 않았다. 본 연구는 IL-1β 수준이 AMD 환자의 하위집단의 유리체에서 증가한다는 것을 보여준다 (도 14 참조). 전임상 마우스 연구에서, 본 발명자들은 마우스 눈에서 IL-1β의 과다발현이 망막 염증을 유발하는 반면에 IL-18 과다발현은 그렇지 않다는 것을 보여준다 (도 15-18 참조). 또한, 본 발명자들은 IL-1β 및 IL-18이 둘 다 ERG 기록에 의해 측정된 바와 같이 망막 기능에 영향을 미친다는 것을 보여준다 (도 19 참조). 이러한 연구를 기반으로, 본 발명자들은 단일 및 조합된 IL-1β 및 IL-18 차단이 광수용체 기능 및 CNV/부종을 개선시킬 것으로 예상된다고 결론내렸다 (도 20 참조).
실시예 3
: 제2형 당뇨병에서의 조합된 IL-1β 및 IL-18 차단
본 발명자들은 IL-1β의 표적화가 제2형 당뇨병을 갖는 환자에서 β-세포 기능을 보존시킬 수 있다는 가설을 세웠다. IL-1β는 보고된 바에 의하면 시험관내에서 췌장 β 세포에 의한 인슐린 분비를 감소시키고, 다양한 β-세포 기능을 변경시킨다. 또한, IL-1Ra로의 처리는 보고된 바에 의하면 당뇨병의 동물 모델을 예방 또는 개선시킬 수 있으며, IL-1Ra는 보고된 바에 의하면 제2형 당뇨병을 갖는 환자로부터 수득한 β 세포에서 감소한다. 도 28을 참조한다.
IL-1β/IL-18 경로에서의 유전자 다형성은 보고된 바에 의하면 중심 비만 및 대사 증후군과 연관된다 (문헌 [Carter et al., 2008]). 또한, IL-1β는 보고된 바에 의하면 시험관내에서 췌장 β 세포에 의한 인슐린 분비를 감소시키고 (문헌 [Lewis and Dinarello, 2006]), 아나킨라(Anakinra) (IL-1Ra)는 보고된 바에 의하면 환자에서 혈당증 및 베타 세포 분비 기능을 개선시킨다 (문헌 [Larsen et al., 2007]). 추가로, IL-1 및 IL-18의 증가된 혈청 수준은 보고된 바에 의하면 T2DM 환자에서 IL-1Ra 및 IL-18BP에 대한 비를 감소시켰으며, IL-1Ra 및 IL-18BP는 전임상 모델에서 STZ 또는 고지방 유발된 고혈당증을 방지한다 (문헌 [Sandberg et al., 1994]).
또한, 라르센(Larsen) 등은 아나킨라를 13주 동안 매일 1회 투여함으로써 제2형 당뇨병을 갖는 환자에서 이중-맹검 임상 시험을 수행하였다 (문헌 [Larsen et al., 2007]). 이러한 처리는 혈당증 및 β-세포 인슐린 분비 능력을 개선시켰을 뿐만 아니라 전신 염증의 마커를 감소시켰다. 그러나, 제2형 당뇨병을 갖는 환자에서 보다 연장된 반감기를 보유하며 보다 긴 기간 동안에 걸쳐 투여된 항-IL-1 요법의 β-세포 질량 및 기능의 복구에 대한 가능한 유익한 효과를 결정할 필요가 남아있었다.
실시예 4
: 피록시캄 IL-10KO IBD 모델에서의 항-IL-1b 및/또는 항-IL18
IL-10-/- 마우스에서 자발성 결장염이 발생하였다. 그러나, 발생률 및 중증도가 일관적이지 않았으며, 이로 인해 본 발명자들의 치료제를 시험하기 위한 IBD에 대한 모델로 사용하기가 더 어려워졌다. IL-10-/- 마우스에게 피록시캄을 공급하면, 피록시캄은 이들 마우스에서 만성 장 염증을 악화시킬 것이며, 문헌 [Berg et al. (2002)]에 나타난 바와 같이 결장염 개시를 동시발생시킬 수 있을 것이다. 따라서, 이것은 IBD의 급성 DSS 모델과 대조적으로 IBD의 만성 염증 모델이다.
6-주령 암컷 IL-10KO (제넨테크) 마우스를 하기 처리군으로 분류하였다:
피록시캄 분말을 기하학적 희석을 이용하여 200 ppm의 농도에서 분말로 된 설치류 식이와 혼합하였다. 간략하게, 동등량의 마우스 식이를 피록시캄에 첨가한 후에 완전하게 혼합하였다. 전량의 마우스 식이가 혼입될 때까지, 연속적 동등량의 마우스 식이를 각각의 희석 후에 잘 혼합하면서 첨가하였다. 밤새 금식시킨 후에, 마우스에게 11일 동안 피록시캄 함유 식이를 제공하고, 일상적 식이를 제12일에 다시 제공하였다. 모든 처리는 6주 동안 일주일에 3회 400 μl PBS 중 상기 지시된 양으로 i.p. 주사하여 수행하였다. 동물의 체중을 매일 측정하고, 분석을 위해 연구 종말점에 희생시켰다. 피록시캄 처리의 시작 전에, FACS 및 혈청의 경우에 꼬리 닉에 의해 꼬리 정맥을 통해 100 μl의 혈액을 수집하였다. 이어서, 100 μl의 혈액을 시험 시작 5주 후에 수집할 것이다. 이러한 연구에서, 시각적 결장 스코어, 결장 조직학적 및 혈청 PK에 대한 치료 효과를 분석하였다. 도 29를 참조한다.
다양한 시토카인의 수준을 피록시캄 처리의 존재 및 부재 하의 IL-10 KO 마우스에서 측정하였다. 도 13을 참조한다. 언급된 바와 같이, 피록시캄 처리군에서 (WT 동물에 비해) IL-1β 및 IL-18이 상승한 반면, TNFα, IL-12 및 IL-17은 군 사이에서 대등하였다.
조직병리학적 분석의 경우에, 조직을 10% 포르말린에 고정시킨 후에 구획화 및 헤마톡실린 및 에오신 염색을 위해 파라핀에 포매시켰다. 조직병리학적 스코어는 근위, 중앙 및 말단 결장 뿐만 아니라 직장에서 평가하고, 1 내지 3의 스케일로 스코어링하였다. 개별 결장 절편에 대한 스코어를 합하여 동물당 총 스코어를 산출하였다. 동일한 개체에서 모든 조직학적 특성을 스코어링하였으며, 실험군에 대한 지식은 전혀 없었다.
시각적 결장 스코어 뿐만 아니라 조직학적 스코어에 대한 결과가 도 30에 제시된다. 혈청 수준은 IL-1β 및 IL-18의 경우에 상승하였다. 항-IL-1β 및 항-IL-18 항체의 조합을 사용한 치료는 결장에 대한 손상을 통계적으로 유의하게 감소시켰다. 조합 치료는 TNFRII-Fc 치료만큼 효과적이었다. 이러한 결과는 IL-1β 및 IL-18의 조합된 차단이 IBD에 대해 유효한 요법일 수 있음을 입증한다. IL-1β 및 IL-18의 조합된 차단은 또한 TNF-알파 차단보다 더 안전한 치료를 제공할 수 있다.
참고문헌
Claims (26)
- a. IL-1β/IL-18 이중특이적 항체; 또는
b. IL-1β 및 IL-18에 결합하는 항체; 또는
c. IL-1β에 결합하는 항체 및 IL-18에 결합하는 항체
의 유효량을 환자에게 투여하는 것을 포함하며, 여기서 상기 부분 a, b 또는 c의 항체 또는 항체들은 세포 또는 조직에서 IL-1β 및 IL-18 활성을 중화시키거나 차단할 수 있는 것인, 환자에서 질환을 치료하는 방법. - 제1항에 있어서, 항체/항체들이 인간화된 것인 방법.
- 제1항에 있어서, 부분 (b)의 항체가 이중 작용 항체인 방법.
- 제1항에 있어서, 부분 (c)의 적어도 하나의 항체가 모노클로날인 방법.
- 제1항에 있어서, 부분 (c)의 각 항체가 모노클로날인 방법.
- 제1항에 있어서, 부분 (c)의 항체들이 동시에 또는 연속적으로 제공되는 것인 방법.
- 제6항에 있어서, 항체들을 1시간 내에 투여하는 방법.
- 제1항에 있어서, 질환이 면역 질환 또는 자가면역 질환 또는 염증성 또는 자가염증성 질환인 방법.
- 제1항에 있어서, 질환이 인플라마솜-매개 질환인 방법.
- 제1항에 있어서, 질환이 IL-1β 관련 질환인 방법.
- 제1항에 있어서, 질환이 IL-18 관련 질환인 방법.
- 제1항에 있어서, 질환이 IL-1β/IL-18 관련 질환인 방법.
- 제8항에 있어서, 상기 질환이 연령-관련 황반 변성 (AMD)인 방법.
- 제8항에 있어서, 상기 질환이 제2형 당뇨병 (T2D)인 방법.
- 제8항에 있어서, 상기 질환이 염증성 장 질환 (IBD)인 방법.
- 제15항에 있어서, 상기 IBD가 크론병 (CD)인 방법.
- 제15항에 있어서, 상기 IBD가 궤양성 결장염 (UC)인 방법.
- 제1항에 있어서, 환자가 항-TNF 요법에 반응하지 않은 것인 방법.
- IL-1β에 결합하는 모노클로날 항체 및 IL-18에 결합하는 모노클로날 항체의 유효량을 환자에게 투여하는 것을 포함하는, 환자에서 질환을 치료하는 방법.
- 세포 또는 조직을 IL-1β에 결합하는 모노클로날 항체 및 IL-18에 결합하는 모노클로날 항체와 접촉시켜 IL-1β 및/또는 IL-18 활성을 중화시키거나 차단하는 것을 포함하는, 세포 또는 조직에서 IL-1β 및/또는 IL-18 활성을 중화시키거나 차단하는 방법.
- 제19항에 있어서, 상기 IL-1β에 결합하는 모노클로날 항체 및 상기 IL-18에 결합하는 모노클로날 항체를 공동으로 또는 연속적으로 투여하는 방법.
- 제20항에 있어서, 상기 세포를 상기 IL-1β에 결합하는 모노클로날 항체 및 상기 IL-18에 결합하는 모노클로날 항체와 공동으로 또는 연속적으로 접촉시키는 방법.
- IL-1β 및 IL-18 활성을 중화시키거나 차단하는 항체.
- 제1항에 있어서, 이중특이적 항체인 항체.
- 제1항에 있어서, 인간화된 항체.
- 제1항에 있어서, IL-1β 및 IL-18에 결합하는 항체.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US37376010P | 2010-08-13 | 2010-08-13 | |
| US61/373,760 | 2010-08-13 | ||
| PCT/US2011/047532 WO2012021773A1 (en) | 2010-08-13 | 2011-08-12 | Antibodies to il-1beta and il-18, for treatment of disease |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130100125A true KR20130100125A (ko) | 2013-09-09 |
Family
ID=44511598
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137006238A KR20130100125A (ko) | 2010-08-13 | 2011-08-12 | 질환의 치료를 위한, IL-1β 및 IL-18에 대한 항체 |
Country Status (9)
| Country | Link |
|---|---|
| EP (1) | EP2603525A1 (ko) |
| JP (1) | JP2013537539A (ko) |
| KR (1) | KR20130100125A (ko) |
| CN (2) | CN104474546A (ko) |
| BR (1) | BR112013003279A2 (ko) |
| CA (1) | CA2808185A1 (ko) |
| MX (1) | MX2013001267A (ko) |
| RU (1) | RU2013110844A (ko) |
| WO (1) | WO2012021773A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9707235B1 (en) | 2012-01-13 | 2017-07-18 | University Of Kentucky Research Foundation | Protection of cells from degeneration and treatment of geographic atrophy |
| DK2956056T3 (da) | 2013-03-14 | 2019-09-16 | Univ Laval | Elektroretinografisystem (erg) til vurdering af psykiatriske lidelser |
| RU2015149032A (ru) * | 2013-05-17 | 2017-06-22 | Дженентек, Инк. | Способы диагностирования и лечения воспалительного заболевания кишечника |
| CN103554264B (zh) * | 2013-11-05 | 2015-08-12 | 哈尔滨博翱生物医药技术开发有限公司 | 针对IL-1β和IL-17A的双特异性抗体及其应用 |
| CN107074942A (zh) * | 2014-11-10 | 2017-08-18 | 豪夫迈·罗氏有限公司 | 抗‑IL‑1β抗体和使用方法 |
| KR20170082594A (ko) | 2014-11-10 | 2017-07-14 | 에프. 호프만-라 로슈 아게 | 항-ang2 항체 및 사용 방법 |
| SG11201703428SA (en) | 2014-11-10 | 2017-05-30 | Hoffmann La Roche | Bispecific antibodies and methods of use in ophthalmology |
| CN110251657B (zh) * | 2019-06-14 | 2020-11-17 | 中山大学 | Ebv brlf1及其功能性小肽在抑制炎症小体活性中的应用 |
| KR20230110291A (ko) * | 2020-11-18 | 2023-07-21 | 노파르티스 아게 | Nlrc4-gof 염증복합체병증의 치료에 사용하기 위한 이중특이적 항체 |
| IL308134A (en) * | 2021-06-22 | 2023-12-01 | Novartis Ag | BISPECIFIC ANTIBODIES FOR USE IN THE TREATMENT OF HIDRADENITIS SUPPURATIVA |
Family Cites Families (107)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US577300A (en) | 1897-02-16 | Printing-press | ||
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US4010989A (en) | 1975-10-14 | 1977-03-08 | American Hospital Supply Corporation | Lockable drawer compartment |
| USRE30985E (en) | 1978-01-01 | 1982-06-29 | Serum-free cell culture media | |
| FR2413974A1 (fr) | 1978-01-06 | 1979-08-03 | David Bernard | Sechoir pour feuilles imprimees par serigraphie |
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4318980A (en) | 1978-04-10 | 1982-03-09 | Miles Laboratories, Inc. | Heterogenous specific binding assay employing a cycling reactant as label |
| US4515893A (en) | 1979-04-26 | 1985-05-07 | Ortho Pharmaceutical Corporation | Hybrid cell line for producing complement-fixing monoclonal antibody to human T cells |
| US4419446A (en) | 1980-12-31 | 1983-12-06 | The United States Of America As Represented By The Department Of Health And Human Services | Recombinant DNA process utilizing a papilloma virus DNA as a vector |
| NZ201705A (en) | 1981-08-31 | 1986-03-14 | Genentech Inc | Recombinant dna method for production of hepatitis b surface antigen in yeast |
| US4601978A (en) | 1982-11-24 | 1986-07-22 | The Regents Of The University Of California | Mammalian metallothionein promoter system |
| US4560655A (en) | 1982-12-16 | 1985-12-24 | Immunex Corporation | Serum-free cell culture medium and process for making same |
| US4657866A (en) | 1982-12-21 | 1987-04-14 | Sudhir Kumar | Serum-free, synthetic, completely chemically defined tissue culture media |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| DD266710A3 (de) | 1983-06-06 | 1989-04-12 | Ve Forschungszentrum Biotechnologie | Verfahren zur biotechnischen Herstellung van alkalischer Phosphatase |
| US4767704A (en) | 1983-10-07 | 1988-08-30 | Columbia University In The City Of New York | Protein-free culture medium |
| US4965199A (en) | 1984-04-20 | 1990-10-23 | Genentech, Inc. | Preparation of functional human factor VIII in mammalian cells using methotrexate based selection |
| US5672347A (en) | 1984-07-05 | 1997-09-30 | Genentech, Inc. | Tumor necrosis factor antagonists and their use |
| US4879231A (en) | 1984-10-30 | 1989-11-07 | Phillips Petroleum Company | Transformation of yeasts of the genus pichia |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| GB8516415D0 (en) | 1985-06-28 | 1985-07-31 | Celltech Ltd | Culture of animal cells |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| SE8505922D0 (sv) | 1985-12-13 | 1985-12-13 | Kabigen Ab | Construction of an igg binding protein to facilitate downstream processing using protein engineering |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| US4927762A (en) | 1986-04-01 | 1990-05-22 | Cell Enterprises, Inc. | Cell culture medium with antioxidant |
| GB8610600D0 (en) | 1986-04-30 | 1986-06-04 | Novo Industri As | Transformation of trichoderma |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| IL87737A (en) | 1987-09-11 | 1993-08-18 | Genentech Inc | Method for culturing polypeptide factor dependent vertebrate recombinant cells |
| US5770701A (en) | 1987-10-30 | 1998-06-23 | American Cyanamid Company | Process for preparing targeted forms of methyltrithio antitumor agents |
| US5606040A (en) | 1987-10-30 | 1997-02-25 | American Cyanamid Company | Antitumor and antibacterial substituted disulfide derivatives prepared from compounds possessing a methyl-trithio group |
| US5091313A (en) | 1988-08-05 | 1992-02-25 | Tanox Biosystems, Inc. | Antigenic epitopes of IgE present on B cell but not basophil surface |
| US5720937A (en) | 1988-01-12 | 1998-02-24 | Genentech, Inc. | In vivo tumor detection assay |
| DE68919361T2 (de) | 1988-06-21 | 1995-05-24 | Genentech Inc | Therapeutische zusammensetzungen für die behandlung von myocard-infarkten. |
| AU632065B2 (en) | 1988-09-23 | 1992-12-17 | Novartis Vaccines And Diagnostics, Inc. | Cell culture medium for enhanced cell growth, culture longevity and product expression |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| FR2646437B1 (fr) | 1989-04-28 | 1991-08-30 | Transgene Sa | Nouvelles sequences d'adn, leur application en tant que sequence codant pour un peptide signal pour la secretion de proteines matures par des levures recombinantes, cassettes d'expression, levures transformees et procede de preparation de proteines correspondant |
| EP0402226A1 (en) | 1989-06-06 | 1990-12-12 | Institut National De La Recherche Agronomique | Transformation vectors for yeast yarrowia |
| EP0479909B1 (en) | 1989-06-29 | 1996-10-30 | Medarex, Inc. | Bispecific reagents for aids therapy |
| CA2026147C (en) | 1989-10-25 | 2006-02-07 | Ravi J. Chari | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| CA2086417C (en) | 1990-06-29 | 1999-07-06 | Biosource Technologies, Inc. | Melanin production by transformed organisms |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5122469A (en) | 1990-10-03 | 1992-06-16 | Genentech, Inc. | Method for culturing Chinese hamster ovary cells to improve production of recombinant proteins |
| LU91067I2 (fr) | 1991-06-14 | 2004-04-02 | Genentech Inc | Trastuzumab et ses variantes et dérivés immuno chimiques y compris les immotoxines |
| JP3457962B2 (ja) | 1991-08-14 | 2003-10-20 | ジェネンテク,インコーポレイテッド | 特定Fcεレセプターのための免疫グロブリン変異体 |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| CA2140280A1 (en) | 1992-08-17 | 1994-03-03 | Avi J. Ashkenazi | Bispecific immunoadhesins |
| ATE161192T1 (de) | 1992-08-21 | 1998-01-15 | Genentech Inc | Verfahren zur behandlung einer durch lfa-1 vermittelten störung |
| WO1994011026A2 (en) | 1992-11-13 | 1994-05-26 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human b lymphocyte restricted differentiation antigen for treatment of b cell lymphoma |
| US5736137A (en) | 1992-11-13 | 1998-04-07 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| US5780588A (en) | 1993-01-26 | 1998-07-14 | Arizona Board Of Regents | Elucidation and synthesis of selected pentapeptides |
| ATE157455T1 (de) | 1993-12-10 | 1997-09-15 | Genentech Inc | Methoden zur diagnose von allergie und prüfung anti-allergischer therapeutika |
| SE9400088D0 (sv) | 1994-01-14 | 1994-01-14 | Kabi Pharmacia Ab | Bacterial receptor structures |
| ATE164079T1 (de) | 1994-01-18 | 1998-04-15 | Genentech Inc | Verfahren zur behandlung von parasitären infektionen unter verwendung von ige-antagonisten |
| WO1995023865A1 (en) | 1994-03-03 | 1995-09-08 | Genentech, Inc. | Anti-il-8 monoclonal antibodies for treatment of inflammatory disorders |
| US5856179A (en) | 1994-03-10 | 1999-01-05 | Genentech, Inc. | Polypeptide production in animal cell culture |
| US5773001A (en) | 1994-06-03 | 1998-06-30 | American Cyanamid Company | Conjugates of methyltrithio antitumor agents and intermediates for their synthesis |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| IL117645A (en) | 1995-03-30 | 2005-08-31 | Genentech Inc | Vascular endothelial cell growth factor antagonists for use as medicaments in the treatment of age-related macular degeneration |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US5712374A (en) | 1995-06-07 | 1998-01-27 | American Cyanamid Company | Method for the preparation of substantiallly monomeric calicheamicin derivative/carrier conjugates |
| US5714586A (en) | 1995-06-07 | 1998-02-03 | American Cyanamid Company | Methods for the preparation of monomeric calicheamicin derivative/carrier conjugates |
| JPH11507535A (ja) | 1995-06-07 | 1999-07-06 | イムクローン システムズ インコーポレイテッド | 腫瘍の成長を抑制する抗体および抗体フラグメント類 |
| US6267958B1 (en) | 1995-07-27 | 2001-07-31 | Genentech, Inc. | Protein formulation |
| ATE222774T1 (de) | 1996-01-23 | 2002-09-15 | Genentech Inc | Antikörper gegen cd 18 zur verwendung gegen gehirnschlag |
| US7147851B1 (en) | 1996-08-15 | 2006-12-12 | Millennium Pharmaceuticals, Inc. | Humanized immunoglobulin reactive with α4β7 integrin |
| EP1516629B1 (en) | 1996-11-27 | 2013-04-03 | Genentech, Inc. | Humanized anti CD-11a antibodies |
| TR199903123T2 (xx) | 1997-04-07 | 2000-05-22 | Genentech, Inc. | Anti-Vegf antikorlar�. |
| JP4213224B2 (ja) | 1997-05-02 | 2009-01-21 | ジェネンテック,インコーポレーテッド | ヘテロマルチマー及び共通成分を有する多重特異性抗体の製造方法 |
| DK0981618T4 (da) | 1997-05-15 | 2011-11-21 | Genentech Inc | Anti-Apo-2-antistof |
| US6171586B1 (en) | 1997-06-13 | 2001-01-09 | Genentech, Inc. | Antibody formulation |
| US6610833B1 (en) | 1997-11-24 | 2003-08-26 | The Institute For Human Genetics And Biochemistry | Monoclonal human natural antibodies |
| DK1034298T3 (da) | 1997-12-05 | 2012-01-30 | Scripps Research Inst | Humanisering af murint antistof |
| KR100719202B1 (ko) | 1998-10-23 | 2007-05-16 | 키린-암젠 인코포레이티드 | MPl 수용체에 결합하는 화합물 및 이를 함유하는 제약학적 조성물 |
| US6660843B1 (en) | 1998-10-23 | 2003-12-09 | Amgen Inc. | Modified peptides as therapeutic agents |
| IL127127A0 (en) | 1998-11-18 | 1999-09-22 | Peptor Ltd | Small functional units of antibody heavy chain variable regions |
| JP4028237B2 (ja) | 1999-10-29 | 2007-12-26 | ジェネンテック・インコーポレーテッド | 抗前立腺幹細胞抗原(psca)抗体組成物及び使用方法 |
| DK1242438T3 (da) | 1999-12-29 | 2007-02-12 | Immunogen Inc | Cytotoksiske midler omfattende modificerede doxorubiciner og daunorubiciner og deres terapeutiske anvendelse |
| CN101062415A (zh) * | 2000-02-21 | 2007-10-31 | 应用研究系统Ars股份公司 | Il-18抑制剂的应用 |
| LT2857516T (lt) | 2000-04-11 | 2017-09-11 | Genentech, Inc. | Multivalentiniai antikūnai ir jų panaudojimas |
| CN101525384A (zh) * | 2000-06-29 | 2009-09-09 | 艾博特公司 | 双特异性抗体及其制备方法和用途 |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US7041870B2 (en) | 2000-11-30 | 2006-05-09 | Medarex, Inc. | Transgenic transchromosomal rodents for making human antibodies |
| WO2002051870A2 (en) | 2000-12-22 | 2002-07-04 | GRAD, Carole Legal Representative of KAPLAN, Howard | Phage display libraries of human vh fragments |
| BR0209546A (pt) | 2001-05-11 | 2004-06-29 | Amgen Inc | Composição de matéria, dna, vetor de expressão, célula hospedeira, e, métodos para tratar uma doença autoimune mediada pelas células b, lúpus, um câncer mediado pelas células b, e linfoma de células b |
| US7205275B2 (en) | 2001-10-11 | 2007-04-17 | Amgen Inc. | Methods of treatment using specific binding agents of human angiopoietin-2 |
| US7138370B2 (en) | 2001-10-11 | 2006-11-21 | Amgen Inc. | Specific binding agents of human angiopoietin-2 |
| US7332474B2 (en) | 2001-10-11 | 2008-02-19 | Amgen Inc. | Peptides and related compounds having thrombopoietic activity |
| JP2005289809A (ja) | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| US6919426B2 (en) | 2002-09-19 | 2005-07-19 | Amgen Inc. | Peptides and related molecules that modulate nerve growth factor activity |
| US20060104968A1 (en) | 2003-03-05 | 2006-05-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminogly ycanases |
| US7871607B2 (en) | 2003-03-05 | 2011-01-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminoglycanases |
| EP2221317A3 (en) | 2003-06-30 | 2011-07-27 | Domantis Limited | PEGylated single domain antibodies (dAb) |
| ZA200603619B (en) | 2003-11-06 | 2008-10-29 | Seattle Genetics Inc | Monomethylvaline compounds capable of conjugation to ligands |
| ZA200608130B (en) | 2004-03-31 | 2008-12-31 | Genentech Inc | Humanized anti-TGF-beta antibodies |
| JO3000B1 (ar) | 2004-10-20 | 2016-09-05 | Genentech Inc | مركبات أجسام مضادة . |
| CN101370525B (zh) | 2005-08-19 | 2013-09-18 | Abbvie公司 | 双重可变结构域免疫球蛋白及其用途 |
| US20090298764A1 (en) * | 2006-03-15 | 2009-12-03 | Regents Of The University Of Colorado | Gene and pathway and their use in methods and compositions for predicting onset or progression of autoimmune and/or autoinflammatory diseases |
| CA2648223A1 (en) * | 2006-04-14 | 2007-10-25 | Novartis Ag | Use of il-i antibodies for treating ophthalmic disorders |
| US10118970B2 (en) | 2006-08-30 | 2018-11-06 | Genentech, Inc. | Multispecific antibodies |
| CA2947947C (en) * | 2007-05-29 | 2018-03-06 | Novartis Ag | New indications for anti-il-1-beta therapy |
| EP2247310A4 (en) * | 2008-01-30 | 2012-06-27 | Abbott Lab | COMPOSITIONS AND METHODS FOR CRYSTALLIZING ANTIBODY FRAGMENTS |
| CA2735940A1 (en) * | 2008-09-05 | 2010-03-11 | Xoma Technology Ltd. | Methods for treating or preventing il-1.beta. related diseases |
-
2011
- 2011-08-12 CN CN201410753624.0A patent/CN104474546A/zh active Pending
- 2011-08-12 KR KR1020137006238A patent/KR20130100125A/ko not_active Application Discontinuation
- 2011-08-12 JP JP2013524239A patent/JP2013537539A/ja active Pending
- 2011-08-12 CN CN2011800493677A patent/CN103154032A/zh active Pending
- 2011-08-12 CA CA2808185A patent/CA2808185A1/en not_active Abandoned
- 2011-08-12 WO PCT/US2011/047532 patent/WO2012021773A1/en active Application Filing
- 2011-08-12 BR BR112013003279A patent/BR112013003279A2/pt not_active IP Right Cessation
- 2011-08-12 MX MX2013001267A patent/MX2013001267A/es not_active Application Discontinuation
- 2011-08-12 RU RU2013110844/10A patent/RU2013110844A/ru not_active Application Discontinuation
- 2011-08-12 EP EP11748847.8A patent/EP2603525A1/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| CN104474546A (zh) | 2015-04-01 |
| WO2012021773A1 (en) | 2012-02-16 |
| EP2603525A1 (en) | 2013-06-19 |
| MX2013001267A (es) | 2013-04-10 |
| RU2013110844A (ru) | 2014-09-20 |
| BR112013003279A2 (pt) | 2016-06-14 |
| CA2808185A1 (en) | 2012-02-16 |
| CN103154032A (zh) | 2013-06-12 |
| JP2013537539A (ja) | 2013-10-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20130100125A (ko) | 질환의 치료를 위한, IL-1β 및 IL-18에 대한 항체 | |
| CN109862915B (zh) | 针对信号调控蛋白α的抗体和使用方法 | |
| JP6966991B2 (ja) | Cd45に結合する抗体分子 | |
| JP5729826B2 (ja) | 抗FcγRIIBレセプター抗体およびその使用 | |
| US7655229B2 (en) | Anti-FC-gamma RIIB receptor antibody and uses therefor | |
| US7662926B2 (en) | Anti-Fc-gamma receptor antibodies, bispecific variants and uses therefor | |
| TWI713480B (zh) | 抗CD79b抗體及其使用方法 | |
| CN106661122B (zh) | 具有针对cd79和cd22的特异性的分子 | |
| RU2747980C2 (ru) | Молекулы со специфичностью к cd45 и cd79 | |
| JP2021153590A (ja) | Cd22に結合する抗体分子 | |
| US20170247454A1 (en) | Anti-pd1 antibodies and methods of use | |
| JP6998857B2 (ja) | Cd79に結合する抗体分子 | |
| CN113956358A (zh) | 抗tigit抗体和使用方法 | |
| JP2002530081A (ja) | 親抗体より高度な結合親和性を持つ抗体変異体 | |
| JP2006506943A (ja) | 抗原結合速度の大きい抗体変異体 | |
| JP2022554374A (ja) | 抗tigit抗体及びその使用 | |
| JP2020513761A (ja) | 抗il−5抗体 | |
| US20130149308A1 (en) | Antibodies to il-1beta and il-18, for treatment of disease | |
| CN114026119A (zh) | 结合pdgf-b和pdgf-d的抗原结合分子及其用途 | |
| JP2023542639A (ja) | ヒトモノカルボン酸トランスポーター1抗体及びその使用 | |
| MX2007002571A (en) | Anti-fc-gamma riib receptor antibody and uses therefor |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |