KR20130081300A - 안정한 조효소를 사용하는 탈수소효소의 안정화 - Google Patents
안정한 조효소를 사용하는 탈수소효소의 안정화 Download PDFInfo
- Publication number
- KR20130081300A KR20130081300A KR1020137013118A KR20137013118A KR20130081300A KR 20130081300 A KR20130081300 A KR 20130081300A KR 1020137013118 A KR1020137013118 A KR 1020137013118A KR 20137013118 A KR20137013118 A KR 20137013118A KR 20130081300 A KR20130081300 A KR 20130081300A
- Authority
- KR
- South Korea
- Prior art keywords
- enzyme
- dehydrogenase
- nad
- stabilized
- weeks
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0006—Oxidoreductases (1.) acting on CH-OH groups as donors (1.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0012—Oxidoreductases (1.) acting on nitrogen containing compounds as donors (1.4, 1.5, 1.6, 1.7)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0012—Oxidoreductases (1.) acting on nitrogen containing compounds as donors (1.4, 1.5, 1.6, 1.7)
- C12N9/0014—Oxidoreductases (1.) acting on nitrogen containing compounds as donors (1.4, 1.5, 1.6, 1.7) acting on the CH-NH2 group of donors (1.4)
- C12N9/0016—Oxidoreductases (1.) acting on nitrogen containing compounds as donors (1.4, 1.5, 1.6, 1.7) acting on the CH-NH2 group of donors (1.4) with NAD or NADP as acceptor (1.4.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/96—Stabilising an enzyme by forming an adduct or a composition; Forming enzyme conjugates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/26—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving oxidoreductase
- C12Q1/32—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving oxidoreductase involving dehydrogenase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
- C12Y101/01—Oxidoreductases acting on the CH-OH group of donors (1.1) with NAD+ or NADP+ as acceptor (1.1.1)
- C12Y101/01001—Alcohol dehydrogenase (1.1.1.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
- C12Y101/01—Oxidoreductases acting on the CH-OH group of donors (1.1) with NAD+ or NADP+ as acceptor (1.1.1)
- C12Y101/01006—Glycerol dehydrogenase (1.1.1.6)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
- C12Y101/01—Oxidoreductases acting on the CH-OH group of donors (1.1) with NAD+ or NADP+ as acceptor (1.1.1)
- C12Y101/01027—L-Lactate dehydrogenase (1.1.1.27)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
- C12Y101/01—Oxidoreductases acting on the CH-OH group of donors (1.1) with NAD+ or NADP+ as acceptor (1.1.1)
- C12Y101/01028—D-Lactate dehydrogenase (1.1.1.28)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
- C12Y101/01—Oxidoreductases acting on the CH-OH group of donors (1.1) with NAD+ or NADP+ as acceptor (1.1.1)
- C12Y101/01037—Malate dehydrogenase (1.1.1.37)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
- C12Y101/01—Oxidoreductases acting on the CH-OH group of donors (1.1) with NAD+ or NADP+ as acceptor (1.1.1)
- C12Y101/01047—Glucose 1-dehydrogenase (1.1.1.47)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y104/00—Oxidoreductases acting on the CH-NH2 group of donors (1.4)
- C12Y104/01—Oxidoreductases acting on the CH-NH2 group of donors (1.4) with NAD+ or NADP+ as acceptor (1.4.1)
- C12Y104/01005—L-Amino-acid dehydrogenase (1.4.1.5)
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Enzymes And Modification Thereof (AREA)
Abstract
본 발명은 안정한 조효소의 존재 하에서 효소를 보관함으로써 효소를 안정화시키는 방법에 관한 것이다. 본 발명은 또한 안정한 조효소를 사용하여 안정화된 효소, 및 분석물 검출용 시험 요소에서의 이의 용도에 관한 것이다.
Description
본 발명은 안정한 조효소의 존재 하에서 효소를 보관함으로써 효소를 안정화시키는 방법에 관한 것이다. 본 발명은 또한 안정한 조효소로 안정화된 효소, 및 분석물 검출용 시험 요소에서의 이의 용도에 관한 것이다.
생화학적 측정 시스템은 분석의 임상적 관련 방법의 중요한 구성물이다. 여기서 우선 사항은 효소의 도움으로 직접 또는 간접적으로 측정되는 분석물, 예를 들어 대사산물 또는 기질을 측정하는 것이다. 이러한 경우 분석물은 효소-조효소 복합체의 도움으로 전환된 후 정량화된다. 이는 측정될 분석물이 적합한 효소 및 조효소와 접촉되는 것을 수반하며, 상기 효소는 통상적으로 촉매량으로 사용된다. 조효소는 효소 반응에 의해 변화된다 (예를 들어 산화 또는 환원됨). 상기 방법은 매개체를 통해 전기화학적 또는 광측정적으로, 또는 직접적으로 검출될 수 있다. 교정으로, 측정될 분석물의 농도와 측정 사이의 직접적 관계가 제공된다.
조효소는 효소에 공유결합 또는 비-공유결합적으로 결합하며 분석물의 전환에 의해 변화되는 유기 물질이다. 조효소의 중요한 예는 니코틴아미드 아데닌 디뉴클레오티드 (NAD) 및 니코틴아미드 아데닌 디뉴클레오티드 포스페이트 (NADP) 이며, 이로부터 각각, 환원에 의해 NADH 및 NADPH 가 제조된다.
선행 기술에서 알려져 있는 측정 시스템은 안정성을 달성하기 위한, 제한된 기간 및 냉각 또는 건조 보관과 같은 환경 상 특정 요구사항에 대해서 안정한 것으로서 주목할만하다. 그러므로, 예를 들어 혈중 글루코오스의 자체-모니터링에서의 최종 사용자 스스로에 의해 실행되는 시험과 같은 특정 적용에 대해서, 틀린, 눈에 띄지 않는 잘못된 보관을 통해 옳지 않은 결과가 발생할 수 있다. 특히, 지나치게 길게 개방되는 1차 포장을 통한 건조제 배출은 사용자에 의해 가까스로 확인될 수 있는 일부 시스템으로의 잘못된 측정을 일으킬 수 있다.
생화학적 측정 시스템의 안정성을 증가시키기 위해 사용된 한 공지된 측정법은 안정한 효소의 사용, 예를 들어 호열성 생물체로부터의 효소의 사용이다. 추가적인 가능성은 화학적 개질, 예를 들어 가교, 또는 돌연변이 유발에 의해 효소를 안정화시키는 것이다. 추가적으로, 효소 안정화제 예를 들어 트래할로오스, 폴리비닐피롤리돈 및 혈청 알부민이 또한 첨가될 수 있거나, 예를 들어 중합체 네트워크 내의 광중합에 의해 상기 효소를 둘러쌀 수 있다.
안정한 매개체의 사용에 의해 생화학적 측정 시스템의 안정성을 향상시키기 위한 시도가 또한 있어왔다. 따라서, 가능한 한 낮은 산화환원 전위를 갖는 매개체의 사용을 통해 시험의 특이성이 증가되며, 반응 동안의 간섭이 제거된다. 그러나, 효소/조효소 복합체의 산화환원 전위는 매개체의 산화환원 전위에 대한 낮은 한계를 형성한다. 이들 전위 미만에서는, 매개체를 사용한 반응이 느려지거나 심지어 중단된다.
대안적인 가능성은 또한 매개체 없이 생화학적 측정 시스템을 사용하는 것이다 (예를 들어, 조효소 NADH 와 같은 조효소의 직접적 검출). 그러나 이러한 측정의 한 불리한 점은 NAD 및 NADP 와 같은 조효소가 불안정하다는 것이다.
NAD 및 NADP 는, 이의 분해 통로가 문헌 [N.J. Oppenheimer in The Pyridine Nucleotide Coenzymes, Academic Press New York, London 1982, editors J. Everese, B. Anderson, K. You, Chapter 3, 페이지 56-65] 에 기재되어 있는 염기-적응성 분자이다. 본질적으로 NAD 및 NADP 의 분해는 각각, 리보오스와 피리딘 단위 사이의 글리코실 결합의 절단을 통해 ADP-리보오스를 생성시킨다. 환원된 형태 NADH 및 NADPH 는 다른 한편으로 산-적응성이다 (예를 들어 에피머화는 알려져 있는 한 분해 통로임). 두 경우 모두에서, NAD/NADP 및 NADH/NADPH 의 불안정성은 리보오스 단위와 피리딘 단위 사이의 글리코실 결합의 적응성에서 유래한다. 그러나, 예를 들어 수용액에서와 같은 강하지 않은 조건 하에서도 상기 조효소 NAD 및 NADP 는 각각 주변 습도를 통해 단독으로 가수분해된다. 이러한 불안정성은 분석물의 측정에 있어서의 부정확함을 일으킬 수 있다.
예를 들어, 많은 NAD/NADP 유도체가 [B.M. Anderson in The Pyridine Nucleotide Coenzymes, Academic Press New York, London 1982, editors J. Everese, B. Anderson, K. You, Chapter 4] 에 기재되어 있다. 그러나 이들 유도체 중 대부분은 효소에 의해 잘 허용되지 않는다. 그러므로, 지금까지 진단 시험에서 사용되어 온 유일한 유도체는, 1956 년에 [N.O. Kaplan, J. Biol. Chem. (1956), 221, 823] 에서 최초로 기재된 3-아세틸피리딘 아데닌 디뉴클레오티드 (아세틸 NAD) 이다. 또한 상기 조효소는 산화환원 전위에 있어서의 변화 및 효소에 의한 불량한 허용성을 나타낸다.
WO 01/94370 은 개질된 피리딘기를 갖는 추가적인 NAD 유도체의 사용을 기재한다. 그러나 니코틴아미드기의 개질은, 일반적으로 촉매 반응에 대해 직접적인 영향을 갖는다. 대부분의 경우, 이러한 영향은 부정적이다.
안정화에 대한 추가적인 견해에서는, 리보오스 단위가 변경됨으로써 글리코실 결합의 안정성에 영향을 미친다. 상기 방법은 니코틴아미드기의 촉매 반응을 직접적으로 간섭하지 않는다. 그러나, 효소가 리보오스 단위에 강하고 특이적인 결합을 나타내는 한 간접적인 영향이 존재할 수 있다. [Kaufmann et al.] 은 WO 98/33936 및 US 5,801,006, 및 WO 01/49247 에서 관련되어, 각각 많은 티오리보오스-NAD 유도체를 개시한다. 그러나 니코틴아미드-리보오스 단위의 개질과 효소 반응에서의 유도체의 활성 사이의 관련성은 지금까지 나타난 바 없다.
글리코실 결합을 갖지 않는 유도체인 CarbaNAD 는 1988 년에 최초로 기재되었다 (J.T. Slama, Biochemistry 1989, 27, 183 및 Biochemistry 1989, 28, 7688). 여기에서 리보오스는 카르보시클릭 당 단위에 의해 대체된다. carbaNAD 가 탈수소효소의 기질로서 기재되었지만, 지금까지 이의 활성은 생화학적 검출 방법에서 임상적으로 입증된 바 없다.
자연적 피로포스페이트 대신에 메틸렌비스포스포네이트 화합물로 carbaNAD 를 제조하기 위한 유사한 접근법이 이후 [G.M. Blackburn, Chem. Comm., 1996, 2765] 에 기재되었다. 메틸렌비스포스포네이트는 포스파타아제에 대한 증가된 안정성을 나타내며, ADP-리보실 시클라아제의 저해제로서 사용되었다. 가수분해 안정성에 있어서의 증가는 목표가 아니었다 (J.T. Slama, G.M. Blackburn).
WO 2007/012494 및 US 11/460,366 은 각각 안정한 NAD/NADH 및 NADP/NADPH 유도체, 이들 유도체의 효소 복합체, 및 생화학적 검출 방법 및 시약 키트에서의 이의 용도를 개시한다.
본 발명의 목적은 효소 안정화, 특히 효소의 장기간 안정화를 위한 방법을 제공하는 것을 기초로 하였다.
상기 목적은 효소를 안정화시키는 방법에 의해 달성되며, 상기 효소는 안정한 조효소의 존재 하에 보관된다. 놀랍게도 높은 상대 습도, 또는 심지어 액체 상에서, 및 승온에서 수 주 또는 수 개월의 장기간 안정화가, 안정한 조효소의 도움으로 가능하다는 것이 발견되었다. 효소가 자연적 조효소의 존재 하에 일부 시간 동안 증가된 단기간 안정성을 가짐 [Bertoldi et al., Biochem. J. 389, (2005), 885-898; van den Heuvel et al., J. Biol. Chem. 280 (2005), 32115-32121; 및 Pan et al., J. Chin. Biochem. Soc. Vol. 3 (1974), pp. 1-8] 에도 불구하고, 이들이 장기간에 걸쳐 낮은 안정성을 나타내기 때문에 (Nutrition Reviews 36 (1978), 251-254), 이러한 지각은 놀라운 것이다.
선행 기술에 관한 이러한 지각과 비교하여, 특히, 안정한 조효소가 자연적 조효소에서보다 낮은, 효소와의 결합 상수를 갖기 때문에, 효소가 자연적 조효소의 존재 하에서보다 안정한 조효소의 존재 하에서 증가된 장기간 안정성을 명백히 갖는다는 것은 놀라운 것이다.
본 발명의 방법으로 안정화된 효소는 조효소-의존적 효소이다. 적합한 효소의 예는 글루코오스 탈수소효소 (E.C.1.1.1.47), 락테이트 탈수소효소 (E.C.1.1.1.27, 1.1.1.28), 말레이트 탈수소효소 (E.C.1.1.1.37), 글리세롤 탈수소효소 (E.C.1.1.1.6), 알코올 탈수소효소 (E.C.1.1.1.1), 알파-하이드록시부티레이트 탈수소효소, 소르비톨 탈수소효소 또는 아미노산 탈수소효소, 예를 들어 L-아미노산 탈수소효소 (E.C.1.4.1.5) 에서 선택되는 탈수소효소이다. 추가적으로 적합한 효소는 산화효소, 예를 들어 글루코오스 산화효소 (E.C.1.1.3.4) 또는 콜레스테롤 산화효소 (E.C.1.1.3.6) 및 아미노 트랜스퍼라아제, 각각, 예를 들어 아스파르테이트 또는 알라닌 아미노 트랜스퍼라아제, 5'-뉴클레오티다아제 또는 크레아틴 키나아제이다. 상기 효소는 바람직하게는 글루코오스 탈수소효소이다.
본 발명의 방법의 문맥에서, 돌연변이된 글루코오스 탈수소효소를 사용하는 것이 특히 바람직하다는 것이 증명되었다. 본 출원의 문맥에서 사용되는 바와 같은 용어 "돌연변이체" 는 아미노산의 수는 동일하지만 야생형 효소와 비교하여 개질된 아미노산 서열을 갖는 (즉, 야생형 효소로부터의 하나 이상의 아미노산에 있어서 상이함), 자연적 효소의 유전학적으로 개질된 변이체를 나타낸다. 돌연변이(들)의 도입은 위치-특이적 또는 비-위치-특이적으로, 바람직하게는 당업계에 알려져 있는 재조합 방법을 사용함으로써 위치-특이적으로 발생할 수 있는 한편, 특정 요구사항 및 조건에 대해 적절한, 자연적 효소의 아미노산 서열 내의 하나 이상의 아미노산 교환이 일어난다. 돌연변이체는 특히 바람직하게는 야생형 효소와 비교하여 증가된 열 또는 가수분해 안정성을 갖는다.
돌연변이화된 글루코오스 탈수소효소는 기본적으로는, 이의 아미노산 서열에서의 임의의 위치에서 상응하는 야생형 글루코오스 탈수소효소와 비교하여 개질된 아미노산(들)을 포함할 수 있다. 돌연변이화된 글루코오스 탈수소효소는 바람직하게는 야생형 글루코오스 탈수소효소의 아미노산 서열의 위치 96, 170 및 252 중 하나 이상에서의 돌연변이, 특히 바람직하게는 위치 96 및 위치 170 에서의 돌연변이, 및 위치 170 및 위치 252 에서의 돌연변이를 포함한다. 돌연변이화된 글루코오스 탈수소효소가 이들 돌연변이 외에 추가적인 돌연변이를 포함하지 않는 것이 유리하다는 것이 증명되었다.
위치 96, 170 및 252 에서의 돌연변이는 기본적으로는 야생형 효소의 안정화 (예를 들어 열 또는 가수분해 안정성에서의 증가) 를 일으키는 임의의 아미노산 교환을 포함할 수 있다. 위치 96 에서의 돌연변이는 바람직하게는 글리신에 대한 글루탐산의 아미노산 교환을 포함하는 한편, 위치 170 에 관해서는 아르기닌 또는 라이신에 대한 글루탐산의 아미노산 교환, 특히 라이신에 대한 글루탐산의 아미노산 교환이 바람직하다. 위치 252 에서의 돌연변이에 대해서, 이는 바람직하게는 류신에 대한 라이신의 아미노산 교환을 포함한다.
돌연변이화된 글루코오스 탈수소효소는 임의의 생물학적 공급원에서 유래되는 야생형 글루코오스 탈수소효소의 돌연변이에 의해 수득될 수 있으며, 상기 용어 "생물학적 공급원" 은 본 발명의 문맥에 있어서 세균과 같은 원핵생물, 및 포유류 및 기타 동물과 같은 진핵생물을 모두 포함한다. 야생형 글루코오스 탈수소효소는 바람직하게는 세균, 특히 바람직하게는 바실러스 메가테리움 (Bacillus megaterium), 바실러스 서브틸리스 (Bacillus subtilis) 또는 바실러스 투린기엔시스 (Bacillus thuringiensis), 특히 바실러스 서브틸리스로부터 유래되는 글루코오스 탈수소효소이다.
본 발명의 특히 바람직한 구현예에서는, 돌연변이화된 글루코오스 탈수소효소는 바실러스 서브틸리스로부터의 야생형 글루코오스 탈수소효소의 돌연변이에 의해 수득된 글루코오스 탈수소효소이며, 이는 SEQ ID No.: 1 (GlucDH_E96G_E170K) 에 나타내거나 SEQ ID No.: 2 (GlucDH_E170K_K252L) 에 나타내는 아미노산 서열을 갖는다.
안정한 조효소는 자연적 조효소와 비교하여 화학적으로 개질되며, 자연적 조효소보다 더 높은 안정성 (예를 들어 가수분해 안정성) 을 갖는 조효소이다. 안정한 조효소는 바람직하게는 시험 조건 하에서 가수분해에 대해 안정하다. 자연적 조효소와 비교하여, 안정한 조효소는 효소에 대해 감소된 결합 상수 (예를 들어 2 이상의 인자로 감소된 결합 상수) 를 가질 수 있다.
안정한 조효소의 바람직한 예는 니코틴아미드 아데닌 디뉴클레오티드 (NAD/NADH) 또는 니코틴아미드 아데닌 디뉴클레오티드 포스페이트 (NADP/NADPH) 의 안정한 유도체, 또는 절단형 NAD 유도체, 예를 들어 AMP 잔기를 갖지 않거나 비-뉴클레오시드 잔기 예를 들어 소수성 잔기를 갖는 유도체이다. 마찬가지로, 본 발명의 문맥에서 바람직한 안정한 조효소는 하기 화학식 (I) 의 화합물이다:
NAD/NADH 및 NADP/NADPH 의 바람직한 안정한 유도체는 상술한 참고문헌에 기재되어 있으며, 이의 개시물은 참고문헌으로 명백히 본원에 포함된다. 특히 바람직한 안정화된 조효소는 WO 2007/012494 및 US 11/460366 에 기재되어 있으며, 각각 이의 개시물은 참고문헌으로 명백히 본원에 포함된다. 안정한 조효소는 특히 바람직하게는 하기 일반식 (II) 를 갖는 화합물, 또는 염, 또는 적절한 경우 이의 환원된 형태에서 선택된다:
[식 중,
A = 아데닌 또는 이의 유사체이고,
T = 각각의 경우 독립적으로 O, S 이고,
U = 각각의 경우 독립적으로 OH, SH, BH3 -, BCNH2 - 이고,
V = 각각의 경우 독립적으로 OH 또는 포스페이트기이거나, 두 개의 기가 시클릭 포스페이트기를 형성하고;
W = COOR, CON(R)2, COR, CSN(R)2 이고, R = 각각의 경우 독립적으로 H 또는 C1-C2-알킬이고,
X1, X2 = 각각의 경우 독립적으로 O, CH2, CHCH3, C(CH3)2, NH, NCH3 이고,
Y = NH, S, O, CH2 이고,
Z = 선형 또는 시클릭 유기 라디칼임 (단, Z 및 피리딘 잔기는 글리코시드 결합에 의해 연결되지 않음)].
화학식 (II) 의 화합물에서의 Z 는 바람직하게는 탄소수 4-6, 바람직하게는 탄소수 4 의 선형 라디칼이거나 (1 또는 2개의 탄소 원자는 O, S 및 N 에서 선택되는 하나 이상의 헤테로원자에 의해 임의 대체됨), 탄소수 5 또는 6 이고 O, S 및 N 에서 선택되는 헤테로원자, 및 임의로는 하나 이상의 치환기를 임의로 포함하는 시클릭기를 포함하는 라디칼이며, 라디칼 CR4 2 (식 중, CR4 2 는 시클릭기 및 X2 에 결합하며, R4 = 각각의 경우 독립적으로 H, F, Cl, CH3 임) 이다.
Z 는 특히 바람직하게는 포화 또는 불포화 카르보시클릭 또는 헤테로시클릭 5-원 고리이며, 특히 하기 일반식 (III) 의 화합물 (R5' 와 R5 " 사이에 단일 또는 이중 결합이 존재할 수 있음)이다:
[식 중,
R4 = 각각의 경우 독립적으로 H, F, Cl, CH3 이고,
R5 = CR4 2 이고,
R5' = O, S, NH, NC1-C2-알킬, CR4 2, CHOH, CHOCH3 이고,
R5 " = R5' 와 R5 " 사이에 단일 결합이 존재하는 경우 CR4 2, CHOH, CHOCH3 이고,
R5' 와 R5 " 사이에 이중 결합이 존재하는 경우 R5' = R5 " = CR4 이고,
R6, R6' = 각각의 경우 독립적으로 CH 또는 CCH3 임].
바람직한 구현예에서는, 본 발명의 화합물은 아데닌 또는 아데닌 유사체 예컨대 C8- 및 N6-치환된 아데닌, 데아자 변이체 예컨대 7-데아자, 아자 변이체 예컨대 8-아자 또는 조합물 예컨대 7-데아자 또는 8-아자 또는 카르보시클릭 유사체 예컨대 포르마이신을 포함하는 반면, 7-데아자 변이체는 할로겐, C1-C6-알키닐, -알케닐 또는 -알킬에 의해 위치 7 에서 치환될 수 있다.
추가적으로 바람직한 구현예에서는, 화합물은 리보오스 대신 예를 들어 2-메톡시데옥시리보오스, 2'-플루오로데옥시리보오스, 헥시톨, 알트리톨 및 폴리시클릭 유사체, 각각 예컨대 바이시클로-, LNA- 및 트리시클로-당을 포함하는 아데노신 유사체를 포함한다.
특히, 화학식 (II) 의 화합물에서, (디)포스페이트 산소가 또한 등장성으로, 예를 들어 각각 S- 및 BH3 - 에 의해 O-, 각각 NH, NCH3 및 CH2 에 의해 O, 및 =S 에 의해 =O 가 대체될 수 있다.
본 발명의 화학식 (II) 의 화합물에서의 W 는 바람직하게는 CONH2 또는 COCH3 이다.
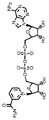
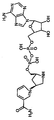
화학식 (III) 의 기에서의 R5 는 바람직하게는 CH2 이다. R5' 가 CH2, CHOH 및 NH 에서 선택되는 것이 또한 바람직하다. 특히 바람직한 구현예에서는, R5' 및 R5 " 는 각각 CHOH 이다. 추가적인 바람직한 구현예에서는, R5' 는 NH 이고 R5 " 는 CH2 이다. 바람직한 안정화된 조효소의 구체적 예를 도 1A 및 B 에 나타낸다.
가장 바람직한 구현예에서는, 안정한 조효소는 carbaNAD 이다.
본 발명의 방법은 특히 효소의 장기간 안정화에 적합하다. 이는 안정한 조효소로 안정화된 상기 효소가 예를 들어 건조 물질로서, 예를 들어 2주 이상, 바람직하게는 4주 이상, 특히 바람직하게는 8주 이상 보관되는 경우, 초기 효소 활성에 대해 바람직하게는 50% 미만, 특히 바람직하게는 30% 미만, 가장 바람직하게는 20% 미만의 감소를 나타낸다는 것을 의미한다.
본 발명의 방법은 또한, 승온, 예를 들어 20℃ 이상, 바람직하게는 25℃ 이상, 특히 바람직하게는 30℃ 이상의 온도에서 안정한 조효소로 안정화된 효소의 보관을 포함한다. 이러한 경우 효소 활성은 초기 수준에 대해 바람직하게는 50% 미만, 특히 바람직하게는 30% 미만, 가장 바람직하게는 20% 미만으로 감소된다.
본 발명에 따른 안정화에 의해, 상기 나타낸 바와 같이 장기간 동안, 및/또는 상기 나타낸 바와 같이 고온에서 건조 시약 없이도 안정한 조효소로 안정화된 효소를 보관할 수 있다. 또한 높은 상대 습도 (예를 들어 50% 이상의 상대 습도) 에서, 안정화된 효소를 보관할 수 있으며, 이 경우 효소 활성은 초기 수준에 대해 바람직하게는 50% 미만, 특히 바람직하게는 30% 미만, 가장 바람직하게는 20% 미만으로 감소된다.
한편 안정한 조효소로 안정화된 효소의 보관은 건조 물질로서, 다른 한편 액체 상으로 실행될 수 있다. 안정화된 효소의 보관은 바람직하게는 분석물을 측정하기에 적합한 시험 요소 상에서, 또는 요소 내에서 일어난다. 이러한 경우, 안정한 조효소로 안정화된 효소는 바람직하게는 검출 시약의 구성물이며, 적절하다면, 염, 완충액 등과 같은 추가적인 구성물을 또한 포함할 수 있다. 이러한 경우, 검출 시약은 바람직하게는 매개체가 없다.
안정한 조효소로 안정화된 효소는 분석물, 예를 들어 혈액, 혈청, 혈장 또는 소변과 같은 체액, 및 하수 샘플 또는 식제품에서의 매개변수를 각각 검출하기 위해 사용될 수 있다.
측정될 수 있는 분석물은 산화환원 반응에 의해 검출될 수 있는 임의의 생물학적 또는 화학적 물질, 예를 들어 조효소-의존적 효소의 기질이거나 자체적으로 조효소-의존적 효소인 물질이다. 분석물의 바람직한 예는 글루코오스, 락트산, 말산, 글리세롤, 알코올, 콜레스테롤, 트리글리세라이드, 아스코르브산, 시스테인, 글루타티온, 펩티드, 우레아, 암모늄, 살리실레이트, 피루베이트, 5'-뉴클레오티다아제, 크레아틴 키나아제 (CK), 락테이트 탈수소효소 (LDH), 이산화탄소 등이다. 분석물은 바람직하게는 글루코오스이다.
본 발명의 또 다른 구현예는 효소 반응에 의해 샘플 내의 분석물을 검출하기 위한 본 발명에 따른 안정한 조효소로 안정화된 효소 또는 본 발명의 화합물의 용도에 관한 것이다. 글루코오스 탈수소효소 (GlucDH) 를 이용한 글루코오스의 검출이 이러한 관계에서 특히 바람직하다.
분석물과의 반응에 의한 안정한 조효소에서의 변경은 기본적으로 임의의 방식으로 검출될 수 있다. 효소 반응을 검출하기 위한 당업계에 알려진 모든 방법을 기본적으로 여기서 사용할 수 있다. 그러나, 조효소에서의 변경은 바람직하게는 광학적 방법에 의해 검출된다. 광학적 검출 방법은 예를 들어 흡광, 형광, 원편광 이색성 (CD), 광학 회전 분산 (ORD), 굴절계 등의 측정을 포함한다.
본 발명의 문맥에서 바람직하게 사용되는 광학적 검출 방법은 광도 측정법이다. 그러나 분석물과의 반응의 결과로서의 조효소에서의 변경의 광도 측정에는, 환원된 조효소의 반응성을 증가시키고 전자가 적합한 광학 표시제 또는 광학 표시제 시스템에 전달될 수 있게 하는 하나 이상의 매개체의 추가적인 존재가 필요하다.
그 중에서도 본 발명의 목적에 적합한 매개체는 니트로소아닐린, 예를 들어 [(4-니트로소페닐)이미노]디메탄올 하이드로클로라이드, 퀴논, 예를 들어 페난트렌퀴논, 페난트롤린퀴논 또는 벤조[h]퀴놀린퀴논, 페나진, 예를 들어 1-(3-카르복시프로폭시)-5-에틸페나지늄 트리플루오로메탄설포네이트, 및/또는 디아포라아제 (EC 1.6.99.2) 이다. 페난트롤린퀴논의 바람직한 예는 1,10-페난트롤린-5,6-퀴논, 1,7-페난트롤린-5,6-퀴논, 4,7-페난트롤린-5,6-퀴논, 및 이의 N-알킬화 및 N,N'-디알킬화된 염 (바람직하게는 N-알킬화 및 N,N'-디알킬화된 염의 경우 반대 이온으로서, 각각, 할라이드, 트리플루오로메탄설포네이트 또는 가용성을 증가시키는 다른 음이온) 을 포함한다.
광학 표시제 또는 광학 표시제 시스템으로서, 환원가능한, 및 환원 상에서 이의 광학 특성 (예를 들어 색, 형광, 반사율, 전파, 편광 및/또는 굴절 지수) 에서의 검출가능한 변화를 겪는 임의의 물질을 사용할 수 있다. 샘플 중 분석물의 존재 및/또는 양의 측정은 육안으로 및/또는 당업자에게 적합한 것으로 보이는 광도 측정법을 사용하는 검출 장치를 사용하여 일어날 수 있다.
헤테로폴리산 및 특히 2,18-포스포몰리브딘산이 광학 표시제로서 바람직하게 사용되며, 상응하는 헤테로폴리 블루로 환원된다.
조효소에서의 변경은 특히 바람직하게는 형광 측정에 의해 검출된다. 형광 측정은 고도로 민감하며, 소형화 시스템에서의 저농도의 분석물도 검출해낼 수 있다.
대안적인 가능성은 또한, 전기화학적 시험 스트립과 같은 적합한 시험 요소를 사용하여 전기화학적으로 조효소에서의 변경을 검출하는 것이다. 다시금, 이의 선결조건은 전자의 이동에 의해, 환원된 조효소에 의해 환원된 형태로 전환될 수 있는 적합한 매개체의 사용이다. 분석물은 환원된 매개체를 산화환원하는데 필요하며 샘플 내의 분석물 농도와 관계되는 전류 측정에 의해 측정된다.
전기화학적 측정에 사용될 수 있는 매개체의 예는 특히, 광도 측정법에서 사용되는 상술한 매개체를 포함한다.
분석물을 검출하기 위해 액체 시험을 사용할 수 있으며, 이러한 경우 시약은 예를 들어 수성액 또는 비수성액 중 현탁액 또는 용액의 형태이거나, 분말 또는 동결건조물의 형태이다. 그러나, 건조 시험을 또한 사용할 수 있으며, 이러한 경우 시약을 지지체, 시험 스트립에 적용한다. 상기 지지체는 예를 들어, 조사할 샘플 액체에 의해 습윤되는 흡수제 및/또는 팽윤 물질 포함 시험 스트립을 포함할 수 있다.
특히 바람직한 시험 형식은 글루코오스 검출을 위해 안정한 NAD 유도체와 함께 효소 글루코오스 탈수소효소를 사용하는 것을 포함하며, 이러한 경우 환원된 조효소 NADH 의 유도체가 형성된다. NADH 는 광학적 방법, 예를 들어 UV 여기 후 광도 측정 또는 형광 측정에 의해 검출된다. 특히 바람직한 시험 시스템은 본원에 참고문헌으로 표현되는 US 2005/0214891 에서 기재된다.
본 발명은 또한 안정한 조효소로 안정화된 효소에 관한 것이며, 상기 안정화된 효소는 적절하게는 높은 습도로, 및 건조제 없이, 바람직하게는 20℃ 이상, 특히 바람직하게는 25℃ 이상, 가장 바람직하게는 30℃ 이상의 온도에서 바람직하게는 2주 이상, 특히 바람직하게는 4주 이상, 가장 바람직하게는 8주 이상 동안 보관시 초기 수준과 비교하여 50% 미만, 바람직하게는 30% 미만, 가장 바람직하게는 20% 미만의 효소 활성 감소를 나타낸다.
본 발명은 또한 상기 나타낸 바와 같은 안정한 조효소로 안정화된 효소를 포함하는, 분석물을 측정하기 위한 검출 시약에 관한 것이다. 본 발명은 추가적으로, 각각 본 발명에 따른 안정화된 효소 및 본 발명에 따른 검출 시약을 포함하는 시험 요소에 관한 것이다. 검출 시약 및 시험 요소는 각각 건조 또는 액체 시험을 실행하기에 적합할 수 있다. 시험 요소는 바람직하게는 분석물의 형광 측정 또는 광도 측정 검출을 위한 시험 스트립이다. 이러한 시험 스트립은 안정한 조효소로 안정화된 효소를 포함하며, 예를 들어 셀룰로오스, 플라스틱 등과 같은 흡수제 및/또는 팽윤 물질 상에서 고정된다.
본 발명을 하기 도면 및 실시예에 의해 보다 상세히 설명할 것이다.
도 1A: 안정한 조효소 carba-NAD (cNAD) 를 나타냄.
도 1B: 안정한 조효소 피롤리디닐-NAD 를 나타냄.
도 2: NAD 및 cNAD 의 존재 하에서의, 각각 보관 이전 및 이후의 글루코오스 탈수소효소 효소 운동학의 결과를 나타냄.
2A: 1일 후 NAD 의 존재 하에서의 GlucDH 의 운동학.
2B: 1일 후 cNAD 의 존재 하에서의 GlucDH 의 운동학.
2C: 5주 동안 32℃, 85% 상대 습도에서 보관 후 NAD 의 존재 하에서의 GlucDH 의 운동학.
2D: 5주 동안 32℃, 85% 상대 습도에서 보관 후 cNAD 의 존재 하에서의 GlucDH 의 운동학.
도 3: 32℃ 및 85% 습도에서 5주 이하의 기간에 걸친, 각각 NAD 의 존재 하에서의 글루코오스 탈수소효소, 및 cNAD 의 존재 하에서의 GlucDH 에 대한 블랭크 값의 비교.
도 4: 32℃ 및 85% 습도에서 NAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 글루코오스 탈수소효소의 다양한 함수 플롯을 나타냄. 보관 기간은 1일 내지 5주로 변화됨.
도 5: 32℃ 및 85% 습도에서 cNAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 글루코오스 탈수소효소의 다양한 함수 플롯을 나타냄. 보관 기간은 각각 1일 내지 5주 (도 5A) 및 1일 내지 24주 (도 5B) 로 변화됨.
도 6: 24주 동안 32℃ 및 85% 습도에서 각각 NAD 및 cNAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 NAD 및 cNAD 의 잔류 함량을 나타냄.
도 7: 각각 5주 (도 7A) 및 24주 (도 7B) 동안 32℃ 및 85% 습도에서 각각 NAD 및 cNAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 GlucDH 활성을 나타냄.
도 8: 25주의 기간에 걸쳐 32℃ 및 83% 상대 습도에서 각각 NAD 및 cNAD 의 존재 하에서 이중 돌연변이체 GlucDH_E96G_E170K (GlucDH-Mut1) 및 이중 돌연변이체 GlucDH_E170K_K252L (GlucDH-Mut2) 을 보관한 후 GlucDH 활성을 나타냄.
도 9: 각각 NAD 및 cNAD 의 존재 하에서 보관한 후 겔 전기영동에 의한 글루코오스 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: GlucDH/NAD, 6℃ 에서 5주; 2: GlucDH/NAD, 32℃/85% 상대 습도에서 5주; 3: GlucDH/cNAD, 6℃ 에서 5주; 4: GlucDH/cNAD, 32℃/85% 상대 습도에서 5주.
도 10: 각각 NAD 및 cNAD 의 존재 하에서 50℃ 에서 보관한 후 겔 전기영동에 의한 글루코오스 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: GlucDH 8.5 mg/㎖, NAD, 0시간; 2: GlucDH 8.5 mg/㎖, NAD, 22시간; 3: GlucDH 8.5 mg/㎖, NAD, 96시간; 4: GlucDH 8.5 mg/㎖, NAD, 118시간; 5: GlucDH 8.5 mg/㎖, NAD, 140시간; 6: GlucDH 8.5 mg/㎖, NAD, 188시간; 7: GlucDH 8.5 mg/㎖, NAD, 476시간; 8: GlucDH 8.5 mg/㎖, cNAD, 0시간; 9: GlucDH 8.5 mg/㎖, cNAD, 188시간; 10: GlucDH 8.5 mg/㎖, cNAD, 476시간.
도 11: 4일 (도 11A) 및 14일 (도 11B) 의 기간에 걸쳐 50℃ 에서 액체 상에서 각각 NAD 및 cNAD 의 존재 하에서의 글루코오스 탈수소효소의 안정성을 나타냄. 시험 조건: GlucDH 10 mg/㎖; NAD 및 cNAD 각각 12 mg/㎖; 완충액: 0.1 M Tris, 1.2 M NaCl, pH 8.5; 온도 50℃.
도 12: 각각 NAD 및 cNAD 의 존재 하에서 보관한 후 겔 전기영동에 의한 효모로부터의 알코올 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: ADH, 6℃ 에서 65시간; 2: ADH/cNAD, 6℃ 에서 65시간; 3: ADH/NAD, 6℃ 에서 65시간; 4: ADH, 35℃ 에서 65시간; 5: ADH/cNAD, 35℃ 에서 65시간; 6: ADH/NAD, 35℃ 에서 65시간.
도 13: 각각 NAD 및 cNAD 의 존재 하에서 35℃ 에서 보관한 후 겔 전기영동에 의한 효모로부터의 알코올 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: ADH/NAD, 0일; 2: ADH/NAD, 1일; 3: ADH/NAD, 2일; 4: ADH/NAD, 3일; 5: ADH/NAD, 5일; 6: ADH/cNAD, 0일; 7: ADH/cNAD, 1일; 8: ADH/cNAD, 2일; 9: ADH/cNAD, 3일; 10: ADH/cNAD, 6일.
도 14: 65시간의 기간에 걸쳐 35℃ 에서 액체 상에서 각각 NAD 및 cNAD 의 존재 하에서 효모로부터의 알코올 탈수소효소의 안정성을 나타냄. 시험 조건: ADH 5 mg/㎖; NAD 및 cNAD 각각 50 mg/㎖; 완충액: 75 mM Na4P2O7, 글리신, pH 9.0; 온도 35℃.
도 15: 11주 동안 실온에서 NAD 및 다양한 매개체의 존재 하에 보관한 후 글루코오스 탈수소효소의 다양한 함수 플롯을 나타냄.
도 16: 다양한 글루코오스 농도에서 NAD 및 1-(3-카르복시프로폭시)-5-에틸페나지늄 트리플루오로-메탄설포네이트의 존재 하에서의 글루코오스 탈수소효소 효소 운동학의 결과를 나타냄.
도 17: 효소로서 GlucDH, 및 매개체로서 디아포라아제를 사용하는 글루코오스 검출을 개략적으로 나타냄.
도 18: 각각, 매개체로서 피롤로퀴놀린퀴논 (PQQ) 및 [(4-니트로소-페닐)이미노]디메탄올 하이드로클로라이드의 존재 하에서의 글루코오스 염료 산화환원효소 (GlucDOR), 및 매개체로서 NAD 및 디아포라아제/[(4-니트로소페닐)이미노]디메탄올 하이드로클로라이드의 존재 하에서의 글루코오스 탈수소효소의 함수 플롯을 나타냄.
도 19: 다양한 글루코오스 농도에서 NAD 및 디아포라아제의 존재 하에서의 글루코오스 탈수소효소 효소 운동학의 결과를 나타냄.
도 20: 각각 NAD 및 cNAD 의 존재 하에서 글루코오스 탈수소효소를 사용하는 글루코오스의 전기화학적 측정에서 글루코오스 농도의 함수로서 측정된 전류를 나타냄. 시험 조건: 25 mM NAD 및 cNAD 각각; 2.5초 지연; 5초 측정 시간.
도 21: 글루코오스 탈수소효소 이중 돌연변이체 GlucDH_E96G_E170K 및 GlucDH_E170K_K252L 의 아미노산 서열을 나타냄.
도 1B: 안정한 조효소 피롤리디닐-NAD 를 나타냄.
도 2: NAD 및 cNAD 의 존재 하에서의, 각각 보관 이전 및 이후의 글루코오스 탈수소효소 효소 운동학의 결과를 나타냄.
2A: 1일 후 NAD 의 존재 하에서의 GlucDH 의 운동학.
2B: 1일 후 cNAD 의 존재 하에서의 GlucDH 의 운동학.
2C: 5주 동안 32℃, 85% 상대 습도에서 보관 후 NAD 의 존재 하에서의 GlucDH 의 운동학.
2D: 5주 동안 32℃, 85% 상대 습도에서 보관 후 cNAD 의 존재 하에서의 GlucDH 의 운동학.
도 3: 32℃ 및 85% 습도에서 5주 이하의 기간에 걸친, 각각 NAD 의 존재 하에서의 글루코오스 탈수소효소, 및 cNAD 의 존재 하에서의 GlucDH 에 대한 블랭크 값의 비교.
도 4: 32℃ 및 85% 습도에서 NAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 글루코오스 탈수소효소의 다양한 함수 플롯을 나타냄. 보관 기간은 1일 내지 5주로 변화됨.
도 5: 32℃ 및 85% 습도에서 cNAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 글루코오스 탈수소효소의 다양한 함수 플롯을 나타냄. 보관 기간은 각각 1일 내지 5주 (도 5A) 및 1일 내지 24주 (도 5B) 로 변화됨.
도 6: 24주 동안 32℃ 및 85% 습도에서 각각 NAD 및 cNAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 NAD 및 cNAD 의 잔류 함량을 나타냄.
도 7: 각각 5주 (도 7A) 및 24주 (도 7B) 동안 32℃ 및 85% 습도에서 각각 NAD 및 cNAD 의 존재 하에서 글루코오스 탈수소효소를 보관한 후 GlucDH 활성을 나타냄.
도 8: 25주의 기간에 걸쳐 32℃ 및 83% 상대 습도에서 각각 NAD 및 cNAD 의 존재 하에서 이중 돌연변이체 GlucDH_E96G_E170K (GlucDH-Mut1) 및 이중 돌연변이체 GlucDH_E170K_K252L (GlucDH-Mut2) 을 보관한 후 GlucDH 활성을 나타냄.
도 9: 각각 NAD 및 cNAD 의 존재 하에서 보관한 후 겔 전기영동에 의한 글루코오스 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: GlucDH/NAD, 6℃ 에서 5주; 2: GlucDH/NAD, 32℃/85% 상대 습도에서 5주; 3: GlucDH/cNAD, 6℃ 에서 5주; 4: GlucDH/cNAD, 32℃/85% 상대 습도에서 5주.
도 10: 각각 NAD 및 cNAD 의 존재 하에서 50℃ 에서 보관한 후 겔 전기영동에 의한 글루코오스 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: GlucDH 8.5 mg/㎖, NAD, 0시간; 2: GlucDH 8.5 mg/㎖, NAD, 22시간; 3: GlucDH 8.5 mg/㎖, NAD, 96시간; 4: GlucDH 8.5 mg/㎖, NAD, 118시간; 5: GlucDH 8.5 mg/㎖, NAD, 140시간; 6: GlucDH 8.5 mg/㎖, NAD, 188시간; 7: GlucDH 8.5 mg/㎖, NAD, 476시간; 8: GlucDH 8.5 mg/㎖, cNAD, 0시간; 9: GlucDH 8.5 mg/㎖, cNAD, 188시간; 10: GlucDH 8.5 mg/㎖, cNAD, 476시간.
도 11: 4일 (도 11A) 및 14일 (도 11B) 의 기간에 걸쳐 50℃ 에서 액체 상에서 각각 NAD 및 cNAD 의 존재 하에서의 글루코오스 탈수소효소의 안정성을 나타냄. 시험 조건: GlucDH 10 mg/㎖; NAD 및 cNAD 각각 12 mg/㎖; 완충액: 0.1 M Tris, 1.2 M NaCl, pH 8.5; 온도 50℃.
도 12: 각각 NAD 및 cNAD 의 존재 하에서 보관한 후 겔 전기영동에 의한 효모로부터의 알코올 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: ADH, 6℃ 에서 65시간; 2: ADH/cNAD, 6℃ 에서 65시간; 3: ADH/NAD, 6℃ 에서 65시간; 4: ADH, 35℃ 에서 65시간; 5: ADH/cNAD, 35℃ 에서 65시간; 6: ADH/NAD, 35℃ 에서 65시간.
도 13: 각각 NAD 및 cNAD 의 존재 하에서 35℃ 에서 보관한 후 겔 전기영동에 의한 효모로부터의 알코올 탈수소효소의 분석. 시험 조건: MW, 10-220 kDa 마커; 1: ADH/NAD, 0일; 2: ADH/NAD, 1일; 3: ADH/NAD, 2일; 4: ADH/NAD, 3일; 5: ADH/NAD, 5일; 6: ADH/cNAD, 0일; 7: ADH/cNAD, 1일; 8: ADH/cNAD, 2일; 9: ADH/cNAD, 3일; 10: ADH/cNAD, 6일.
도 14: 65시간의 기간에 걸쳐 35℃ 에서 액체 상에서 각각 NAD 및 cNAD 의 존재 하에서 효모로부터의 알코올 탈수소효소의 안정성을 나타냄. 시험 조건: ADH 5 mg/㎖; NAD 및 cNAD 각각 50 mg/㎖; 완충액: 75 mM Na4P2O7, 글리신, pH 9.0; 온도 35℃.
도 15: 11주 동안 실온에서 NAD 및 다양한 매개체의 존재 하에 보관한 후 글루코오스 탈수소효소의 다양한 함수 플롯을 나타냄.
도 16: 다양한 글루코오스 농도에서 NAD 및 1-(3-카르복시프로폭시)-5-에틸페나지늄 트리플루오로-메탄설포네이트의 존재 하에서의 글루코오스 탈수소효소 효소 운동학의 결과를 나타냄.
도 17: 효소로서 GlucDH, 및 매개체로서 디아포라아제를 사용하는 글루코오스 검출을 개략적으로 나타냄.
도 18: 각각, 매개체로서 피롤로퀴놀린퀴논 (PQQ) 및 [(4-니트로소-페닐)이미노]디메탄올 하이드로클로라이드의 존재 하에서의 글루코오스 염료 산화환원효소 (GlucDOR), 및 매개체로서 NAD 및 디아포라아제/[(4-니트로소페닐)이미노]디메탄올 하이드로클로라이드의 존재 하에서의 글루코오스 탈수소효소의 함수 플롯을 나타냄.
도 19: 다양한 글루코오스 농도에서 NAD 및 디아포라아제의 존재 하에서의 글루코오스 탈수소효소 효소 운동학의 결과를 나타냄.
도 20: 각각 NAD 및 cNAD 의 존재 하에서 글루코오스 탈수소효소를 사용하는 글루코오스의 전기화학적 측정에서 글루코오스 농도의 함수로서 측정된 전류를 나타냄. 시험 조건: 25 mM NAD 및 cNAD 각각; 2.5초 지연; 5초 측정 시간.
도 21: 글루코오스 탈수소효소 이중 돌연변이체 GlucDH_E96G_E170K 및 GlucDH_E170K_K252L 의 아미노산 서열을 나타냄.
실시예
1
Carba-NAD (도 1A) 또는 NAD 를 글루코오스-특이적 GlucDH 에 첨가하였다. 이들 제형을 각각의 경우 Pokalon film (Lonza) 에 적용하고, 건조 후, 따뜻하고 습한 조건 하에 보관하였다 (32℃, 85% 상대 습도). 이후 반응 운동학 및 함수 플롯을 일정한 간격으로 측정하였다. 동시에, 측정의 각각의 시간에 cNAD/NAD 분석 및 효소의 잔류 활성 측정을 실행하였다.
제 1 일에 측정된 NAD (도 2A) 및 cNAD (도 2B) 에 대한 운동학 플롯은 비교할만 하였고, 또한 글루코오스 의존성에 있어서 유사한 증가를 가졌다. 그러나, 운동학 플롯에서의 뚜렷한 차이는 5주 후 명백하였다. NAD 에 대한 운동학 (도 2C) 이 이의 동력학에 있어서 크게 감소한 반면, cNAD 로 안정화된 촉매의 운동학은 실질적으로 변하지 않고 남아 있었다 (도 2D).
도 3 에서 명백한 바와 같이, 블랭크 값 (혈액 샘플 적용 전의 건조 블랭크 값) 에서도 또한 뚜렷한 차이가 존재하였다. NAD 에 대한 건조 블랭크 값에서의 증가는 형광 입자의 형성으로 인한 것이었다 (상기 Oppenheimer (1982)). 놀랍게도, 이는 cNAD 로는 발생하지 않았다.
각각 NAD 및 cNAD 의 존재 하에서의 글루코오스 탈수소효소의 상이한 안정성은, 도 4 및 5 의 비교로부터 또한 명백하였다. 5주 후, cNAD 로 안정화된 효소에 대한 함수 플롯은 여전히 이전 측정값 내에 존재한 반면 (도 5A), NAD 로 처리된 효소에 대한 플롯 (도 4) 은 높은 농도에서 감소하였으며, 이는 효소/조효소의 양이 지나치게 낮다는 전형적인 표시이다. 도 5B 는 24주의 기간에 걸쳐 cNAD 로 안정화된 글루코오스 탈수소효소의 다양한 함수 플롯을 나타내었다. 이것은 효소의 기능이 기간에 걸쳐 글루코오스 고농도에서 단지 약간 변화하는 이러한 관계에서 명백하며, 24주 후의 값은 5주 후 수득되는 값에 대해 대략적으로 상응하였다.
조효소의 구조와 이의 선결 기간에 걸친 안정성 사이의 관계는 도 6 에서 명백하였다. 이에 따르면, 24주 동안 보관 후 (32℃ 및 85% 상대 습도에서) 글루코오스 검출 시약 내의 cNAD 의 잔류 함량은 여전히 초기 수준의 약 80% 인 반면, NAD 로 안정화된 글루코오스 검출 시약 내의 NAD 의 함량은 단지 5주 후에 초기 수준의 약 35% 로 감소하였고, 외삽법에 의해, 약 17주 후에는 0 으로 감소되었다.
32℃ 및 85% 상대 습도에서 5주 후, 활성 GlucDH 효소의 잔류 활성의 측정 결과 (도 7A) 는 완전히 놀라운 것이었다. NAD 로 안정화된 효소가 다만 극히 낮은 효소 활성을 나타내는 반면 (0.5%), cNAD 로 안정화된 효소는 여전히 70% 의 잔류 활성을 갖는다 (각각의 경우 건조제와 함께 냉장고에서 보관된 샘플과의 비교에 의함). 32℃ 및 85% 상대 습도에서 24주 후 (도 7B), cNAD 로의 안정화에 대한 효소의 잔류 활성은 여전히 약 25% 였다.
야생형 효소 (바실러스 서브틸리스로부터의) 대신 돌연변이체가 사용되는 경우, 잔류 GlucDH 활성을 보다 더 증가시킬 수 있다. 24주 동안 cNAD 의 존재 하에 32℃ 및 85% 상대 습도에서 보관 후, 야생형 효소의 위치 96 에서 글루탐산 → 글리신, 및 위치 170 에서 글루탐산 → 라이신의 아미노산 대체 (GlucDH-Mut1) 를 갖는 GlucDH_E96G_E170K 돌연변이체의 잔류 활성은 약 70% 인 반면, 위치 170 에서 글루탐산 → 라이신, 및 위치 252 에서 라이신 → 류신의 아미노산 대체 (GlucDH-Mut2) 를 갖는 GlucDH_E170K_K252L 돌연변이체의 잔류 활성은 약 50% 였다 (도 8).
SDS 겔에서의 겔 전기영동에 의한 글루코오스 탈수소효소의 분석 (도 9 및 10) 은 또한, 각각 NAD 및 cNAD 의 존재 하의 보관 사이의 차이를 명백히 나타내었다. 효소가 cNAD 의 존재 하에 32℃ 및 85% 상대 습도에서 5주 동안 보관한 후 예측된 이동성을 갖는 밴드로서 여전히 확인가능한 반면, NAD 의 존재 하에 보관된 효소는 완전히 사라졌다 (도 9). 동시에 도 10 으로부터, NAD 에 의해 안정화되고 50℃ 에서 보관된 효소의 밴드는 보관 시간이 증가함에 따라 점점 약해졌고 476시간 후 사실상 사라진 반면, cNAD 의 존재 하에 보관된 효소의 상응하는 밴드는 실험 시작시 검출된 밴드와 비교하여 단지 약간의 변화만을 나타내는 것이 명백하였다.
이러한 결과는 또한 액체 상에서의 보관에 의해 확증될 수 있다 (도 11A 및 11B). 50℃ 에서 95시간 후, 자연적 조효소 NAD 의 존재 하에서의 글루코오스 탈수소효소의 잔류 활성은 약 5% 인 반면, 인공적 조효소 cNAD 의 존재 하에서의 GlucDH 의 잔류 활성은 75% 였다 (도 11A). 50℃ 에서 336시간 동안 보관 후, NAD 로 안정화된 효소의 잔류 활성은 이제 단지 약 1% 였고; cNAD 의 존재 하에 보관된 효소의 잔류 활성은 여전히 약 70% 인 것으로 관찰되었다. 상응하는 SDS 겔은 마찬가지로 자연적 조효소 NAD 의 존재 하의 GlucDH 밴드에서의 변화를 나타내었으며; 높은 분자량에서 새로운 밴드가 나타났고 30 kDa 밴드에서 변화가 있었다.
전체적으로 이는, 공동인자의 안정화가 동시에 효소의 안정화를 야기하며, 이것이 효소의 더 양호한 부착의 협력 효과를 통한 것만은 아니라는 매우 놀라운 결과이다. 공동인자 NAD 의 분해는 효소 GlucDH 의 안정성에 대해 부정적 효과를 가지며, 실제로 이의 불활성화를 가속시킨다. 자연적 NAD 의 인공적 유사체로의 대체는, GlucDH 가 심지어 공동인자의 존재 하의 스트레스 조건 (예를 들어 승온) 하에서 보관될 수 있게 한다.
이러한 시스템으로, 상당히 향상된 안정성을 갖는 혈중 글루코오스 시험 스트립을 제조할 수 있으며, 건조제 없이 이를 제시할 수 있다.
실시예
2
cNAD 또는 NAD 를 알코올 검출 용액에 첨가하였다. 이들 혼합물을 35℃ 에서 보관하였다. 이후 효소의 안정성을 일정한 간격으로 확인하고, 효소의 잔류 활성을 측정하였다.
다시금, SDS 겔에서의 겔 전기영동에 의한 분석 (도 12 및 13) 은 NAD 및 cNAD 의 존재 하에서의 보관 사이의 차이를 나타내었다. 따라서, cNAD 로 안정화된 알코올 탈수소효소의 밴드는 65시간 동안 각각 6℃ 및 35℃ 에서 보관한 후 단지 약간 상이하였다 (인공적 조효소에 의한 효소의 안정화를 나타냄). 반대로, 35℃ 에서 NAD 의 존재 하에 보관된 효소의 밴드는 완전히 사라졌다 (도 12).
도 13 으로부터, NAD 로 안정화되고 35℃ 에서 보관된 효소의 밴드가 보관 시간이 증가함에 따라 점점 약해지고, 5일 후 거의 완전히 사라졌다는 것이 또한 명백하였다. 6일 동안 35℃ 에서 보관 후 검출된, cNAD 로 안정화된 효소의 밴드는 효소가 뚜렷이 덜 분해되었고, 이에 따라 안정성이 증가되었음을 나타내었다.
이러한 결과는 또한 액체 상에서의 보관에서 확증될 수 있다 (도 14). 35℃ 에서 65시간 후, 자연적 조효소 NAD 의 존재 하의 알코올 탈수소효소의 잔류 활성은 약 6% 인 반면, 인공적 조효소 cNAD 의 존재 하의 효소의 잔류 활성은 여전히 약 60% 였다.
실시예
3
글루코오스를 측정하기 위해서, 각각의 경우 글루코오스 탈수소효소, NAD, 매개체, 및 적절한 경우 광학 표시제가 포함되는 다양한 시험 시스템으로 광도적 및 전기화학적으로 측정하였다.
광도적 측정을 위해서, 처음에 각각의 경우 11주 동안 실온에서 보관되고 2,18-포스포몰리브딘산, 그외에 글루코오스 탈수소효소, NAD 및 매개체를 포함하는 네 가지 시험 요소를, 다양한 글루코오스 농도로 조사하였다.
도 15 로부터 명백한 바와 같이, 사용된 모든 네 가지 매개체, 즉 [(4-니트로소페닐)이미노]디메탄올 하이드로클로라이드 (Med A), 1-메틸-5,6-디옥소-5,6-디하이드로-1,10-페난트롤리늄 트리플루오로메탄설포네이트 (Med B), 7-메틸-5,6-디옥소-5,6-디하이드로-1,7-페난트롤리늄 트리플루오로메탄-설포네이트 (Med F) 및 1-(3-카르복시프로폭시)-5-에틸페나지늄 트리플루오로메탄설포네이트 (Med G) 에 대해 글루코오스 농도를 증가시킴에 따라 반사율에서의 감소가 관찰되었으며, 따라서 상술한 매개체는 기본적으로 광도 측정에 의한 글루코오스 측정에 적합하였다.
800 mg/dl 의 부위에서의 높은 글루코오스 농도에서, 각각 [(4-니트로소페닐)이미노]디메탄올 하이드로클로라이드 및 1-(3-카르복시프로폭시)-5-에틸페나지늄 트리플루오로-메탄설포네이트의 사용시 측정된 샘플의 반사율은 여전히 약 20% 였고, 이는 이들 두 매개체가 글루코오스 탈수소효소/NAD 시스템, 및 따라서 글루코오스 탈수소효소/cNAD 시스템을 또한 사용하는 광도 측정법에 특히 적합하다는 것을 제시한다. 0 내지 800 mg/dl 범위의 글루코오스 농도에서 글루코오스 탈수소효소, NAD, 1-(3-카르복시프로폭시)-5-에틸페나지늄 트리플루오로-메탄설포네이트 및 2,18-포스포몰리브딘산 시스템을 사용하는 글루코오스 전환의 운동학을 도 16 에 나타내었다.
도 17 의 개략적 표현에서 명백한 바와 같이, 글루코오스의 광도 측정은 또한 중간 매개체로서 디아포라아제의 (추가적) 사용으로 일어날 수 있다. 도 18 은 글루코오스 탈수소효소, NAD, 디아포라아제, [(4-니트로소페닐)이미노]디메탄올 하이드로클로라이드 및 2,18-포스포몰리브딘산 시스템 (시스템 1) 에 대한 반사율에서의 농도-의존적 감소를 나타낸다. 비교로서 역할하는 시스템은 글루코오스 염료 산화환원효소, 피롤로퀴놀린퀴논, [(4-니트로소페닐)이미노]디메탄올 하이드로클로라이드 및 2,18-포스포몰리브딘산 (시스템 2) 이며, 이는 마찬가지로 반사율에서 농도-의존적 감소를 일으키지만, 글루코오스 염료 산화환원효소의 낮은 특이성으로 인해 불리한 점을 갖는다. 0 내지 800 mg/dl 범위의 글루코오스 농도에서 시스템 1을 사용하는 글루코오스 전환의 운동학을 도 19 에 나타내었다.
광도 측정의 대안으로서, 분석물 측정을 위해 전기화학적 측정법을 또한 사용할 수 있다. 따라서, 환원된 매개체를 재산화하는데 필요한 전류는 시험 요소 (글루코오스 탈수소효소 외에, 조효소로서 NAD, 및 매개체로서 1-(3-카르복시프로폭시)-5-에틸페나지늄 트리플루오로메탄-설포네이트를 포함함) 및 NAD 대신에 안정화된 조효소 cNAD 를 포함하는 상응하는 시스템으로 모두, 글루코오스 농도에 선형 의존적인 것으로 발견되었다 (도 20).
따라서, 탈수소효소/안정한 조효소 시스템을 사용하는 분석물의 측정이 조효소에 비의존적인 또 다른 파장으로의 평가 및 전기화학적 검출에 의해 또한 가능한 것으로 나타났다. 전체 제형은 또한 안정한 효소/조효소 쌍의 사용을 통해 보다 안정화되어야 한다.
<110> F. Hoffmann - La Roche
<120> Stabilisierung von Dehydrogenasen mit stabilen Coenzymen
<130> 40444P WO
<150> EP 08 003 054.7
<151> 2008-02-19
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 261
<212> PRT
<213> Artificial Sequence
<220>
<223> Mutant of glucose dehydrogenase from Bacillus subtilis
<220>
<221> MUTAGEN
<222> (96)
<220>
<221> MUTAGEN
<222> (170)
<400> 1
Met Tyr Pro Asp Leu Lys Gly Lys Val Val Ala Ile Thr Gly Ala Ala
1 5 10 15
Ser Gly Leu Gly Lys Ala Met Ala Ile Arg Phe Gly Lys Glu Gln Ala
20 25 30
Lys Val Val Ile Asn Tyr Tyr Ser Asn Lys Gln Asp Pro Asn Glu Val
35 40 45
Lys Glu Glu Val Ile Lys Ala Gly Gly Glu Ala Val Val Val Gln Gly
50 55 60
Asp Val Thr Lys Glu Glu Asp Val Lys Asn Ile Val Gln Thr Ala Ile
65 70 75 80
Lys Glu Phe Gly Thr Leu Asp Ile Met Ile Asn Asn Ala Gly Leu Gly
85 90 95
Asn Pro Val Pro Ser His Glu Met Pro Leu Lys Asp Trp Asp Lys Val
100 105 110
Ile Gly Thr Asn Leu Thr Gly Ala Phe Leu Gly Ser Arg Glu Ala Ile
115 120 125
Lys Tyr Phe Val Glu Asn Asp Ile Lys Gly Asn Val Ile Asn Met Ser
130 135 140
Ser Val His Glu Val Ile Pro Trp Pro Leu Phe Val His Tyr Ala Ala
145 150 155 160
Ser Lys Gly Gly Ile Lys Leu Met Thr Lys Thr Leu Ala Leu Glu Tyr
165 170 175
Ala Pro Lys Gly Ile Arg Val Asn Asn Ile Gly Pro Gly Ala Ile Asn
180 185 190
Thr Pro Ile Asn Ala Glu Lys Phe Ala Asp Pro Lys Gln Lys Ala Asp
195 200 205
Val Glu Ser Met Ile Pro Met Gly Tyr Ile Gly Glu Pro Glu Glu Ile
210 215 220
Ala Ala Val Ala Val Trp Leu Ala Ser Lys Glu Ser Ser Tyr Val Thr
225 230 235 240
Gly Ile Thr Leu Phe Ala Asp Gly Gly Met Thr Lys Tyr Pro Ser Phe
245 250 255
Gln Ala Gly Arg Gly
260
<210> 2
<211> 261
<212> PRT
<213> Artificial Sequence
<220>
<223> Mutant of glucose dehydrogenase from Bacillus subtilis
<220>
<221> MUTAGEN
<222> (170)
<220>
<221> MUTAGEN
<222> (252)
<400> 2
Met Tyr Pro Asp Leu Lys Gly Lys Val Val Ala Ile Thr Gly Ala Ala
1 5 10 15
Ser Gly Leu Gly Lys Ala Met Ala Ile Arg Phe Gly Lys Glu Gln Ala
20 25 30
Lys Val Val Ile Asn Tyr Tyr Ser Asn Lys Gln Asp Pro Asn Glu Val
35 40 45
Lys Glu Glu Val Ile Lys Ala Gly Gly Glu Ala Val Val Val Gln Gly
50 55 60
Asp Val Thr Lys Glu Glu Asp Val Lys Asn Ile Val Gln Thr Ala Ile
65 70 75 80
Lys Glu Phe Gly Thr Leu Asp Ile Met Ile Asn Asn Ala Gly Leu Glu
85 90 95
Asn Pro Val Pro Ser His Glu Met Pro Leu Lys Asp Trp Asp Lys Val
100 105 110
Ile Gly Thr Asn Leu Thr Gly Ala Phe Leu Gly Ser Arg Glu Ala Ile
115 120 125
Lys Tyr Phe Val Glu Asn Asp Ile Lys Gly Asn Val Ile Asn Met Ser
130 135 140
Ser Val His Glu Val Ile Pro Trp Pro Leu Phe Val His Tyr Ala Ala
145 150 155 160
Ser Lys Gly Gly Ile Lys Leu Met Thr Lys Thr Leu Ala Leu Glu Tyr
165 170 175
Ala Pro Lys Gly Ile Arg Val Asn Asn Ile Gly Pro Gly Ala Ile Asn
180 185 190
Thr Pro Ile Asn Ala Glu Lys Phe Ala Asp Pro Lys Gln Lys Ala Asp
195 200 205
Val Glu Ser Met Ile Pro Met Gly Tyr Ile Gly Glu Pro Glu Glu Ile
210 215 220
Ala Ala Val Ala Val Trp Leu Ala Ser Lys Glu Ser Ser Tyr Val Thr
225 230 235 240
Gly Ile Thr Leu Phe Ala Asp Gly Gly Met Thr Leu Tyr Pro Ser Phe
245 250 255
Gln Ala Gly Arg Gly
260
Claims (24)
- 효소가 안정한 조효소의 존재 하에 보관되는 것을 특징으로 하는, 효소의 안정화 방법.
- 제 1 항에 있어서, 효소가 탈수소효소에서 선택되는 것을 특징으로 하는 방법.
- 제 2 항에 있어서, 효소가 글루코오스 탈수소효소 (E.C.1.1.1.47), 락테이트 탈수소효소 (E.C.1.1.1.27, 1.1.1.28), 말레이트 탈수소효소 (E.C.1.1.1.37), 글리세롤 탈수소효소 (E.C.1.1.1.6), 알코올 탈수소효소 (E.C.1.1.1.1), 알파-하이드록시부티레이트 탈수소효소, 소르비톨 탈수소효소 또는 L-아미노산 탈수소효소 (E.C.1.4.1.5) 와 같은 아미노산 탈수소효소에서 선택되는 탈수소효소인 것을 특징으로 하는 방법.
- 제 1 항 내지 제 3 항 중 어느 한 항에 있어서, 글루코오스 탈수소효소가 효소로서 사용되는 것을 특징으로 하는 방법.
- 제 5 항에 있어서, 안정한 조효소가 하기 일반식 (II) 를 갖는 화합물, 또는 염, 또는 적절한 경우 이의 환원된 형태에서 선택되는 것을 특징으로 하는 방법:
[식 중,
A = 아데닌 또는 이의 유사체이고,
T = 각각의 경우 독립적으로 O, S 이고,
U = 각각의 경우 독립적으로 OH, SH, BH3 -, BCNH2 - 이고,
V = 각각의 경우 독립적으로 OH 또는 포스페이트기이거나, 두 개의 기가 시클릭 포스페이트기를 형성하고;
W = COOR, CON(R)2, COR, CSN(R)2 이고, R = 각각의 경우 독립적으로 H 또는 C1-C2-알킬이고,
X1, X2 = 각각의 경우 독립적으로 O, CH2, CHCH3, C(CH3)2, NH, NCH3 이고,
Y = NH, S, O, CH2 이고,
Z = 선형 또는 시클릭 유기 라디칼임 (단, Z 및 피리딘 잔기는 글리코시드 결합에 의해 연결되지 않음)]. - 제 6 항에 있어서, Z 가 하기에서 선택되는 방법:
(i) 1 또는 2개의 탄소 원자가 O, S 및 N 에서 선택되는 하나 이상의 헤테로원자에 의해 임의 대체되는, 탄소수 4-6, 바람직하게는 탄소수 4 의 선형 라디칼,
(ii) O, S 및 N 에서 선택되는 헤테로원자, 및 임의로는 하나 이상의 치환기를 임의로 포함하는 탄소수 5 또는 6 의 시클릭기를 포함하는 라디칼, CR4 2 가 시클릭기 및 X2 에 결합하고, R4 = 각각의 경우 독립적으로 H, F, Cl, CH3 인 라디칼 CR4 2. - 제 7 항에 있어서, Z 가 포화 또는 불포화 카르보시클릭 또는 헤테로시클릭 5-원 고리, 특히, R5' 와 R5 " 사이에 단일 또는 이중 결합이 존재할 수 있는 하기 일반식 (III) 의 화합물인 방법:
[식 중,
R4 = 각각의 경우 독립적으로 H, F, Cl, CH3 이고,
R5 = CR4 2 이고,
R5' = O, S, NH, NC1-C2-알킬, CR4 2, CHOH, CHOCH3 이고,
R5 " = R5' 와 R5 " 사이에 단일 결합이 존재하는 경우 CR4 2, CHOH, CHOCH3 이고,
R5' 와 R5 " 사이에 이중 결합이 존재하는 경우 R5' = R5 " = CR4 이고,
R6, R6' = 각각의 경우 독립적으로 CH 또는 CCH3 임]. - 제 6 항 내지 제 8 항 중 어느 한 항에 있어서, W = CONH2 또는 COCH3 인 방법.
- 제 8 항 또는 제 9 항에 있어서, R5 가 CH2 인 방법.
- 제 8 항 내지 제 10 항 중 어느 한 항에 있어서, R5' 가 CH2, CHOH 및 NH 에서 선택되는 방법.
- 제 8 항 내지 제 11 항 중 어느 한 항에 있어서, R5' 및 R5 " 가 각각 CHOH 인 방법.
- 제 8 항 내지 제 11 항 중 어느 한 항에 있어서, R5' 가 NH 이고 R5 " 가 CH2 인 방법.
- 제 1 항 내지 제 13 항 중 어느 한 항에 있어서, 안정한 조효소가 carbaNAD 인 것을 특징으로 하는 방법.
- 제 1 항 내지 제 14 항 중 어느 한 항에 있어서, 안정한 조효소로 안정화된 효소가 2주 이상, 바람직하게는 4주 이상, 특히 바람직하게는 8주 이상 보관되는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 15 항 중 어느 한 항에 있어서, 안정한 조효소로 안정화된 효소가 20℃ 이상, 바람직하게는 25℃ 이상, 특히 바람직하게는 30℃ 이상의 온도에서 보관되는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 16 항 중 어느 한 항에 있어서, 안정한 조효소로 안정화된 효소가 건조 시약 없이 보관되는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 17 항 중 어느 한 항에 있어서, 안정한 조효소로 안정화된 효소가 50% 이상의 상대 습도에서 보관되는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 18 항 중 어느 한 항에 있어서, 안정한 조효소로 안정화된 효소의 보관이 건조 물질로서 실행되는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 18 항 중 어느 한 항에 있어서, 안정한 조효소로 안정화된 효소의 보관이 액체 상으로 실행되는 것을 특징으로 하는 방법.
- 제 1 항 내지 제 20 항 중 어느 한 항에 있어서, 안정한 조효소로 안정화된 효소의 보관이 시험 요소 상에서 실행되는 것을 특징으로 하는 방법.
- 안정한 조효소로 안정화된 효소로서, 적절하게는 높은 습도로, 및 건조제 없이, 바람직하게는 20℃ 이상, 특히 바람직하게는 25℃ 이상, 가장 바람직하게는 30℃ 이상의 온도에서 바람직하게는 2주 이상, 특히 바람직하게는 4주 이상, 가장 바람직하게는 8주 이상 동안 보관시 초기 수준과 비교하여 50% 미만, 바람직하게는 30% 미만, 가장 바람직하게는 20% 미만의 효소 활성 감소를 나타내는 것을 특징으로 하는 효소.
- 제 22 항에 따른 안정화된 효소를 포함하는, 분석물 측정용 검출 시약.
- 제 22 항에 따른 안정화된 효소 또는 제 23 항에 따른 검출 시약을 포함하는 것을 특징으로 하는 시험 요소.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08003054A EP2093284A1 (de) | 2008-02-19 | 2008-02-19 | Stabilisierung von Dehydrogenasen mit stabilen Coenzymen |
| EP08003054.7 | 2008-02-19 | ||
| PCT/EP2009/001206 WO2009103540A1 (de) | 2008-02-19 | 2009-02-19 | Stabilisierung von dehydrogenasen mit stabilen coenzymen |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107020894A Division KR101381004B1 (ko) | 2008-02-19 | 2009-02-19 | 안정한 조효소를 사용하는 탈수소효소의 안정화 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130081300A true KR20130081300A (ko) | 2013-07-16 |
Family
ID=39768713
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127027270A KR20120134142A (ko) | 2008-02-19 | 2009-02-19 | 안정한 조효소를 사용하는 탈수소효소의 안정화 |
| KR1020107020894A KR101381004B1 (ko) | 2008-02-19 | 2009-02-19 | 안정한 조효소를 사용하는 탈수소효소의 안정화 |
| KR1020137013118A KR20130081300A (ko) | 2008-02-19 | 2009-02-19 | 안정한 조효소를 사용하는 탈수소효소의 안정화 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127027270A KR20120134142A (ko) | 2008-02-19 | 2009-02-19 | 안정한 조효소를 사용하는 탈수소효소의 안정화 |
| KR1020107020894A KR101381004B1 (ko) | 2008-02-19 | 2009-02-19 | 안정한 조효소를 사용하는 탈수소효소의 안정화 |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US9896666B2 (ko) |
| EP (2) | EP2093284A1 (ko) |
| JP (2) | JP5758128B2 (ko) |
| KR (3) | KR20120134142A (ko) |
| CN (3) | CN101945999B (ko) |
| AR (1) | AR070436A1 (ko) |
| AU (1) | AU2009216908B9 (ko) |
| BR (1) | BRPI0907839A2 (ko) |
| CA (1) | CA2721718C (ko) |
| HK (1) | HK1208703A1 (ko) |
| MX (1) | MX2010008920A (ko) |
| RU (1) | RU2499834C2 (ko) |
| TW (1) | TWI482860B (ko) |
| WO (1) | WO2009103540A1 (ko) |
| ZA (1) | ZA201006638B (ko) |
Families Citing this family (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4786451B2 (ja) * | 2005-07-28 | 2011-10-05 | エフ ホフマン−ラ ロッシュ アクチェン ゲゼルシャフト | Nad/nadhの安定化 |
| WO2010094632A1 (de) * | 2009-02-19 | 2010-08-26 | F. Hoffmann-La Roche Ag | Schnelle reaktionskinetik von enzymen mit niedriger aktivität in trockenen chemieschichten |
| EP2093284A1 (de) | 2008-02-19 | 2009-08-26 | F.Hoffmann-La Roche Ag | Stabilisierung von Dehydrogenasen mit stabilen Coenzymen |
| EP2398909B1 (de) | 2009-02-19 | 2015-07-22 | F. Hoffmann-La Roche AG | Schnelle reaktionskinetik von enzymen mit niedriger aktivität in trockenen chemieschichten |
| EP2226007A1 (de) | 2009-02-19 | 2010-09-08 | Roche Diagnostics GmbH | Testelementmagazin mit abgedeckten Testfeldern |
| EP2226008A1 (de) | 2009-02-19 | 2010-09-08 | Roche Diagnostics GmbH | Verfahren zur Herstellung eines analytischen Magazins |
| CN102325496B (zh) | 2009-02-19 | 2015-10-07 | 霍夫曼-拉罗奇有限公司 | 分析辅助工具的节省空间的储存 |
| EP2292751A1 (de) * | 2009-08-20 | 2011-03-09 | Roche Diagnostics GmbH | Stabilisierung von Enzymen mit stabilen Coenzymen |
| CA2782943C (en) * | 2009-12-16 | 2014-09-09 | F. Hoffmann-La Roche Ag | Detecting the decomposition of enzymes in a test element by means of controlled release of a protected analyte |
| EP2636750A1 (en) * | 2012-03-06 | 2013-09-11 | Roche Diagniostics GmbH | Compatible solute ectoine as well as derivatives thereof for enzyme stabilization |
| PL2864765T3 (pl) | 2012-06-22 | 2021-10-11 | F.Hoffmann-La Roche Ag | Sposób i urządzenie do wykrywania analitu w płynie ustrojowym |
| US8920628B2 (en) | 2012-11-02 | 2014-12-30 | Roche Diagnostics Operations, Inc. | Systems and methods for multiple analyte analysis |
| US8921061B2 (en) | 2012-11-02 | 2014-12-30 | Roche Diagnostics Operations, Inc. | Reagent materials and associated test elements |
| WO2014096184A1 (en) | 2012-12-20 | 2014-06-26 | Roche Diagnostics Gmbh | Method for analyzing a sample of a body fluid |
| PL2936124T3 (pl) | 2012-12-20 | 2017-08-31 | F.Hoffmann-La Roche Ag | Sposoby oceniania medycznych krzywych pomiarowych |
| EP2781919A1 (en) | 2013-03-19 | 2014-09-24 | Roche Diagniostics GmbH | Method / device for generating a corrected value of an analyte concentration in a sample of a body fluid |
| EP2994536B1 (en) | 2013-05-08 | 2017-06-14 | Roche Diabetes Care GmbH | Stabilization of enzymes by nicotinic acid |
| CN105247069A (zh) * | 2013-06-04 | 2016-01-13 | 豪夫迈·罗氏有限公司 | 用于fret的新化合物及与其相关的方法 |
| EP3063169B1 (en) | 2013-10-29 | 2018-10-10 | F. Hoffmann-La Roche AG | Nano-enzyme containers for test elements |
| EP3074524B1 (en) | 2013-11-27 | 2019-11-06 | Roche Diabetes Care GmbH | Composition comprising up-converting phosphors for detecting an analyte |
| EP2927319A1 (en) | 2014-03-31 | 2015-10-07 | Roche Diagnostics GmbH | High load enzyme immobilization by crosslinking |
| KR101896820B1 (ko) | 2014-04-14 | 2018-09-07 | 에프. 호프만-라 로슈 아게 | 페나지늄 매개체 |
| EP3183246B1 (en) | 2014-08-22 | 2020-09-23 | Roche Diagnostics GmbH | Redoxindicators |
| CN107779459B (zh) * | 2016-08-31 | 2021-06-08 | 安琪酵母股份有限公司 | 葡萄糖脱氢酶dna分子、载体和菌株及应用 |
| EP3523639A4 (en) | 2016-10-05 | 2020-06-03 | H. Hoffnabb-La Roche Ag | DETECTION REAGENTS AND ELECTRODE ARRANGEMENTS FOR DIAGNOSTIC MULTIANALYTE TEST ELEMENTS AND METHOD FOR USE THEREOF |
| EP3339431A1 (en) | 2016-12-22 | 2018-06-27 | Roche Diabetes Care GmbH | Glucose dehydrogenase variants with improved properties |
| EP3759231B1 (en) | 2018-02-28 | 2023-10-18 | F. Hoffmann-La Roche AG | Biocompatibility coating for continuous analyte measurement |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU1043568A1 (ru) * | 1981-06-11 | 1983-09-23 | Московский Ордена Ленина,Ордена Октябрьской Революции И Ордена Трудового Красного Знамени Государственный Университет Им.М.В.Ломоносова | Способ определени активности дегидрогеназ крови |
| DE19543493A1 (de) * | 1995-11-22 | 1997-05-28 | Boehringer Mannheim Gmbh | Stabilisierte Coenzym-Lösungen und deren Verwendung zur Bestimmung von Dehydrogenasen bzw. deren Substrate im alkalischen Milieu |
| US5801006A (en) | 1997-02-04 | 1998-09-01 | Specialty Assays, Inc. | Use of NADPH and NADH analogs in the measurement of enzyme activities and metabolites |
| US6380380B1 (en) | 1999-01-04 | 2002-04-30 | Specialty Assays, Inc. | Use of nicotinamide adenine dinucleotide (NAD) and nicotinamide adenine dinucliotide phosphate (NADP) analogs to measure enzyme activities metabolites and substrates |
| AU2001262702A1 (en) | 2000-06-07 | 2001-12-17 | Asahi Kasei Kabushiki Kaisha | Coenzyme derivatives and enzymes appropriate therefor |
| AU1099102A (en) * | 2000-10-31 | 2002-05-15 | Koji Sode | Novel glucose dehydrogenase and process for producing the dehydrogenase |
| JP2003310274A (ja) * | 2002-04-30 | 2003-11-05 | Amano Enzyme Inc | グルコース脱水素酵素およびそれをコードする遺伝子 |
| AU2003240260B2 (en) | 2002-05-16 | 2008-05-22 | F. Hoffmann-La Roche Ag | Method and reagent system having a non-regenerative enzyme-coenzyme complex |
| EP1660648B1 (en) * | 2003-08-11 | 2013-10-09 | Codexis, Inc. | Improved glucose dehydrogenase polypeptides and related polynucleotides |
| AU2005220022B2 (en) | 2004-03-06 | 2010-10-07 | F. Hoffmann-La Roche Ag | Body fluid sampling device |
| US7172890B2 (en) * | 2004-10-28 | 2007-02-06 | Roche Diagnostics Gmbh | Inactivated enzyme variants and associated process and reagent system |
| JP4786451B2 (ja) | 2005-07-28 | 2011-10-05 | エフ ホフマン−ラ ロッシュ アクチェン ゲゼルシャフト | Nad/nadhの安定化 |
| DE102005035461A1 (de) | 2005-07-28 | 2007-02-15 | Roche Diagnostics Gmbh | Stabile NAD/NADH-Derivate |
| EP2093284A1 (de) * | 2008-02-19 | 2009-08-26 | F.Hoffmann-La Roche Ag | Stabilisierung von Dehydrogenasen mit stabilen Coenzymen |
| WO2010009432A1 (en) | 2008-07-17 | 2010-01-21 | Horizon Therapeutics, Inc. | Nsaid dose unit formulations with h2-receptor antagonists and methods of use |
| EP2398909B1 (de) | 2009-02-19 | 2015-07-22 | F. Hoffmann-La Roche AG | Schnelle reaktionskinetik von enzymen mit niedriger aktivität in trockenen chemieschichten |
-
2008
- 2008-02-19 EP EP08003054A patent/EP2093284A1/de not_active Ceased
-
2009
- 2009-02-18 TW TW098105120A patent/TWI482860B/zh active
- 2009-02-19 JP JP2010547110A patent/JP5758128B2/ja not_active Expired - Fee Related
- 2009-02-19 KR KR1020127027270A patent/KR20120134142A/ko not_active Application Discontinuation
- 2009-02-19 CN CN200980105640.6A patent/CN101945999B/zh not_active Expired - Fee Related
- 2009-02-19 CN CN201410680334.8A patent/CN104450659A/zh active Pending
- 2009-02-19 KR KR1020107020894A patent/KR101381004B1/ko active IP Right Grant
- 2009-02-19 CA CA2721718A patent/CA2721718C/en not_active Expired - Fee Related
- 2009-02-19 WO PCT/EP2009/001206 patent/WO2009103540A1/de active Application Filing
- 2009-02-19 RU RU2010138610/10A patent/RU2499834C2/ru not_active IP Right Cessation
- 2009-02-19 EP EP09712033.1A patent/EP2245152B1/de active Active
- 2009-02-19 BR BRPI0907839-8A patent/BRPI0907839A2/pt not_active Application Discontinuation
- 2009-02-19 AU AU2009216908A patent/AU2009216908B9/en not_active Revoked
- 2009-02-19 MX MX2010008920A patent/MX2010008920A/es active IP Right Grant
- 2009-02-19 AR ARP090100571A patent/AR070436A1/es not_active Application Discontinuation
- 2009-02-19 KR KR1020137013118A patent/KR20130081300A/ko not_active Application Discontinuation
-
2010
- 2010-02-12 CN CN2010800085457A patent/CN102325896A/zh active Pending
- 2010-02-12 JP JP2011550531A patent/JP6113405B2/ja not_active Expired - Fee Related
- 2010-08-19 US US12/859,654 patent/US9896666B2/en active Active
- 2010-09-16 ZA ZA2010/06638A patent/ZA201006638B/en unknown
-
2015
- 2015-09-23 HK HK15109305.4A patent/HK1208703A1/xx unknown
-
2018
- 2018-01-11 US US15/868,055 patent/US11220674B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11220674B2 (en) | Stabilization of dehydrogenases with stable coenzymes | |
| US20170073661A1 (en) | Compositions of enzymes stabilized with stable coenzymes | |
| KR101604624B1 (ko) | 건식 화학 층에서 낮은 활성을 갖는 효소의 고속 반응 속도 | |
| US9359634B2 (en) | Fast reaction kinetics of enzymes having low activity in dry chemistry layers | |
| AU2012203453B2 (en) | Stabilization of dehydrogenases using stable coenzymes | |
| JP3775561B2 (ja) | 安定なpqq依存性グルコースデヒドロゲナーゼ組成物 | |
| NZ587397A (en) | Stabilization of dehydrogenases using stable chemically modified coenzymes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |