KR20130036290A - 추가 이황화 결합을 함유하는 인슐린 유도체 - Google Patents
추가 이황화 결합을 함유하는 인슐린 유도체 Download PDFInfo
- Publication number
- KR20130036290A KR20130036290A KR1020137001441A KR20137001441A KR20130036290A KR 20130036290 A KR20130036290 A KR 20130036290A KR 1020137001441 A KR1020137001441 A KR 1020137001441A KR 20137001441 A KR20137001441 A KR 20137001441A KR 20130036290 A KR20130036290 A KR 20130036290A
- Authority
- KR
- South Korea
- Prior art keywords
- insulin
- human insulin
- desb30 human
- ethoxy
- iupac
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/62—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Diabetes (AREA)
- Medicinal Chemistry (AREA)
- Endocrinology (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Toxicology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Emergency Medicine (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Abstract
본 발명은 추가 이황화 결합을 함유하는 인슐린 유도체 및 이것의 제조 방법에 관한 것이다.
Description
본 발명은 추가 이황화 결합을 함유하는 인슐린 유도체 및 이것의 제조 방법에 관한 것이다.
진성 당뇨병은 글루코스를 이용하는 능력이 부분적으로 또는 완전히 상실되는 대사 장애이다. 진성 당뇨병의 치료에서, 인슐린 제제의 많은 다양성이 속효성 인슐린, 이소판 인슐린(지칭된 NPH), 인슐린 아연 현탁액(예컨대, Semilente®, Lente®, 및 Ultralente®), 및 이상성 이소판 인슐린과 같이 제안되고 사용되었다.
사람 인슐린은 2개의 폴리펩티드 쇄로, 각각 21개 및 30개의 아미노산 잔기를 함유하는 A 및 B 쇄로 구성된다. A와 B 쇄는 2개의 이황화 다리에 의해 상호연결된다. 대부분 다른 종으로부터의 인슐린은 유사하지만, 일부 위치에서 아미노산 치환을 함유할 수 있다. 지난 10년간 수많은 사람 인슐린 유사체가 개발되었다. 그것들은 작용의 특정 프로파일, 즉 빠른 작용 또는 지연된 작용을 위해 설계된다. 이러한 인슐린 유사체를 포함하는 상업적으로 구매가능한 제품은 Levemir®, NovoRapid®, Humalog®, Apidra® 및 Lantus®를 포함한다.
사람 인슐린은 그것의 순환으로의 흡수를 제한하는 다수의 프로테아제의 작용에 의해 위장관의 루멘에서 빠르게 분해된다. 친수성이며 단백질 분해에 대해 안정화된 인슐린 유사체는 본래의 인슐린과 비교할 때 동물 모델에서 더 높은 생체이용률을 나타낸다.
이황화 결합의 단백질로의 혼합은 단백질 안정성을 개선하는 본래 방식 중 하나이며; 고온성 유기체 중에서 이황화 결합의 풍도와 최대 성장 온도 사이의 연관성이 발견되었고, 고온 환경의 단백질 안정화에서 이황화 결합의 중요성을 보여주었다(Mallick P, et al, 2002, Proc. Natl. Acad. Sci. USA, 99, 9679-9684.; Ladenstein R, et al, 2006, FEBS J., 273, 4170-4185). 또한 안정성의 증가가 수반되는 단백질로 성공적으로 가공처리되는 이황화 결합의 많은 예가 있다. 가장 큰 안정화 중 하나는 RNAse 바르나제에 대해 달성되었다(Clarke J., Fersht A., 1993, Biochem., 32, 4322-4329). 이러한 안정화는 접힘풀림에 대한 필요한 활성화 에너지를 증가시킴으로써 또는 단백질의 접힘풀림 구조를 제한함으로써 초래되고, 이로써 그것의 구조 엔트로피를 감소시킨다(Pace C.N., 1990, Trends Biol . Sci .,14-17). 그러나, 연구의 이러한 신생 영역에 조예가 훨씬 더 깊을 필요가 있다. 이제까지, 인슐린에서 공학처리된 이황화 결합의 보고가 없었다.
안정한 신규 인슐린 유도체가 여전히 필요하다.
본 발명은 사람 인슐린의 3개의 이황화 결합이 보유되고, 시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식으로 선택되는 인슐린에 부착된 2개 이상의 시스테인 치환 및 측쇄를 갖는 인슐린 유도체에 관한 것이다.
본 발명의 인슐린 유도체가 얻어진 한 양태에서, 시스테인 치환의 부위는 (1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고, (2) 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하는 방식으로 선택된다.
본 발명의 인슐린 유도체가 얻어진 한 양태에서, 시스테인 치환의 부위는 (1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고, (2) 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하고, (3) 인슐린 유도체는 하나 이상의 추가 이황화 결합 없이 사람 인슐린 및/또는 인슐린 유도체에 비해 증가된 물리적 안정성을 가지는 방식으로 선택된다.
본 발명의 인슐린 유도체가 얻어진 한 양태에서, 시스테인 치환의 부위는 (1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고, (2) 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하고, (3) 인슐린 유도체는 단백질 분해에 대해 안정화되는 방식으로 선택된다.
또한 인슐린의 2개 이상의 아미노산을 시스테인 잔기로 치환하는 단계 및 측쇄를 인슐린에 부착하는 단계를 포함하는 인슐린 유도체의 안정화 방법으로서,
a. 사람 인슐린의 3개의 이황화 결합이 보유되고
b. 시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식으로 선택되어,
이로써 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합을 포함하는 인슐린 유도체의 제조 방법이 본원에 설명된다.
도 1: 래트에서 추가 이황화 결합 없는 유사한 유도체와 실시예 1의 유도체의 정맥주사 PK 프로파일의 비교.
도 2: 개에서 추가 이황화 결합 없는 유사한 유도체와 실시예 1의 유도체의 정맥주사 PK 프로파일의 비교.
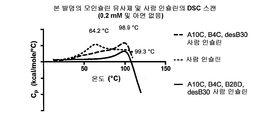
도 3: 본 발명의 인슐린 유도체의 시차 주사 열량측정법(DSC) 데이터.
도 4: 모인슐린 유사체의 시차 주사 열량측정법(DSC) 데이터.
도 2: 개에서 추가 이황화 결합 없는 유사한 유도체와 실시예 1의 유도체의 정맥주사 PK 프로파일의 비교.
도 3: 본 발명의 인슐린 유도체의 시차 주사 열량측정법(DSC) 데이터.
도 4: 모인슐린 유사체의 시차 주사 열량측정법(DSC) 데이터.
본 발명에서 이황화 결합이 인슐린 유도체에 공학처리된 신규 인슐린 유도체가 제공된다.
한 양태에서 본 발명에 따른 인슐린 유도체는 2개 이상의 시스테인 치환을 갖고, 사람 인슐린의 3개의 이황화 결합을 보유한다.
한 양태에서 본 발명의 인슐린 유도체는 측쇄를 가진다. 한 양태에서 측쇄는 리신 잔기의 엡실론 아미노기에 부착된다. 한 양태에서 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착된다.
한 양태에서 본 발명에 따른 인슐린 유도체는 2개 이상의 시스테인 치환, 보유된 사람 인슐린의 3개의 이황화 결합, 그리고 B-쇄에서와 같은 리신 잔기의 엡실론 아미노기에 부착된 측쇄를 가진다.
본 발명의 한 양태에서, 시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식으로 선택된다.
본 발명자들에 의해 본 발명에 따른 인슐린 유도체는 개선된 물리적 안정성을 갖는 것을 알아냈다. 따라서, 인슐린 유사체의 생물학적으로 비활성 및/또는 비가용성 응집체를 형성하기 위해, 본 발명에 따른 인슐린 유도체의 경향은 예를 들어 유사체의 열-기계적 응력으로의 노출 및/또는 소수성 표면 및 계면과 같이 탈안정화하고 있는 계면 및 표면과의 상호작용의 결과로서 감소된다.
본 발명에 따른 사람 인슐린 유도체는 인슐린 수용체와 결합한다. 따라서 본 발명자들에 의해 본 발명에 따른 사람 인슐린 유도체가 개선된 물리적 안정성과, 인슐린 수용체와의 결합 보유를 둘 다 갖는 것이 놀랍게도 발견되었다.
한 양태에서, 본 발명에 따른 인슐린 유도체, 즉 하나 이상의 추가 이황화 결합을 함유하는 인슐린 유도체는 하나 이상의 추가 이황화 결합이 없는 유사한 인슐린 유도체보다 더 지연성이다. 본원에서 "더 지연성"은 그것이 더 긴 제거 반감기 또는 즉 연장된 기간에 대한 인슐린 효과, 즉 작용의 더 긴 기간을 가지는 것으로 의미된다. 따라서 본 발명자들에 의해 하나 이상의 이황화 결합을 포함하는 인슐린 유도체는 하나 이상의 추가 이황화 결합이 없는 유사한 인슐린 유도체와 비교하여 긴 제거 반감기 또는 즉 연장된 기간 동안 인슐린 효과, 또는 작용의 연장된 기간을 가질 수 있다는 것이 놀랍게도 발견되었다.
한 양태에서 본 발명의 인슐린 유도체는 단백질 분해에 대해, 즉 신체의 위장(GI)관 또는 다른 곳에서 빠른 분해에 대해 안정화된다. 한 양태에서 본 발명의 인슐린 유도체는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체와 관련된 단백질 분해에 대해 안정화된다.
단백질 분해에 대해 안정화되는 인슐린 유도체는 본원에서 사람 인슐린에 대해 하나 이상의 프로테아제에 의한 더 느린 분해를 받는 인슐린 유도체로서 이해된다. 한 구체예에서 본 발명에 따른 인슐린 유도체는 사람 인슐린에 대해 하나 이상의 프로테아제에 의한 더 느린 분해를 받는다. 본 발명의 추가 구체예에서 본 발명에 따른 인슐린 유도체는 펩신(예를 들어, 펩신 A, 펩신 B, 펩신 C 및/또는 펩신 F의 이소형과 같음), 키모트립신(예를 들어, 키모트립신 A, 키모트립신 B 및/또는 키모트립신 C의 이소형과 같음), 트립신, 인슐린-분해 효소(IDE), 엘라스타제(예를 들어, 췌장 엘라스타제 I 및/또는 II의 이소형과 같음), 카르복시펩티다제(예를 들어, 카르복시펩티다제 A, 카르복시펩티다제 A2 및/또는 카르복시펩티다제 B의 이소형), 아미노펩티다제, 카텝신 D, 그리고 래트, 돼지 또는 사람으로부터 유도된 장의 추출물에 존재하는 다른 효소로 구성된 군으로부터 선택된 하나 이상의 효소에 의한 분해에 대해 안정화된다.
한 구체예에서 본 발명에 따른 인슐린 유도체는 키모트립신, 트립신, 인슐린-분해 효소(IDE), 엘라스타제, 카르복시펩티다제, 아미노펩티다제 및 카텝신 D로 구성된 군으로부터 선택된 하나 이상의 효소에 의한 분해에 대해 안정화된다. 추가 구체예에서 본 발명에 따른 인슐린 유도체는 키모트립신, 카르복시펩티다제 및 IDE로 구성된 군으로부터 선택된 하나 이상의 효소에 의한 분해에 대해 안정화된다. 추가 구체예에서 본 발명에 따른 인슐린 유도체는 키모트립신 및 IDE로 선택된 하나 이상의 효소에 의한 분해에 대해 안정화된다. 추가 구체예에서 본 발명에 따른 인슐린 유도체는 키모트립신 및 카르복시펩티다제로 선택된 하나 이상의 효소에 의한 분해에 대해 안정화된다.
"프로테아제" 또는 "프로테아제 효소"는 단백질 및 펩티드를 분해하고, 예를 들어 위(펩신), 장의 루멘(키모트립신, 트립신, 엘라스타제, 카르복시펩티다제, 등) 또는 GI관의 점막 표면(아미노펩티다제, 카르복시펩티다제, 엔트로펩티다제, 디펩티딜 펩티다제, 엔도펩티다제, 등), 간(인슐린 분해 효소, 카텝신 D, 등)과 같은 인체의 다양한 조직, 및 다른 조직에서 발견되는 소화 효소이다.
T½은 프로테아제 효소, 예컨대 키모트립신, 펩신 및/또는 카르복시펩티다제 A에 대한 또는 효소의 혼합물, 예컨대 조직 추출물(간, 신장, 십이지장, 공장, 회장, 결장, 위, 등으로부터)에 대한 본 발명에 따른 인슐린 유도체의 단백질분해 안정성의 평가로서 실시예 102에서 기술된 바와 같이 측정될 수 있다. 본 발명의 한 구체예에서 T½은 사람 인슐린에 대해 증가된다. 추가 구체예에서 T½은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 증가된다. 추가 구체예에서 T½은 사람 인슐린에 대해 적어도 2배 증가된다. 추가 구체예에서 T½은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 적어도 2배 증가된다. 추가 구체예에서 T½은 사람 인슐린에 대해 적어도 3배 증가된다. 추가 구체예에서 T½은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 적어도 3배 증가된다. 추가 구체예에서 T½은 사람 인슐린에 대해 적어도 4배 증가된다. 추가 구체예에서 T½은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 적어도 4배 증가된다. 추가 구체예에서 T½은 사람 인슐린에 대해 적어도 5배 증가된다. 추가 구체예에서 T½은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 적어도 5배 증가된다. 추가 구체예에서 T½은 사람 인슐린에 대해 적어도 10배 증가된다. 추가 구체예에서 T½은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 적어도 10배 증가된다.
한 양태에서, 본 발명에 따른 인슐린 유도체는 개선된 화학 안정성을 가진다. 한 양태에서, 본 발명에 따른 인슐린 유도체는 개선된 물리적 안정성을 가진다. 한 양태에서, 본 발명에 따른 인슐린 유도체는 개선된 화학 및 물리적 안정성을 가진다.
한 양태에서, 본 발명에 따른 인슐린 유도체는 사람 인슐린에 대해 개선된 화학 및/또는 물리적 안정성을 가진다. 한 양태에서, 본 발명에 따른 인슐린 유도체는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 개선된 화학 및/또는 물리적 안정성을 가진다.
본원에 사용된 바와 같이 용어 "물리적 안정성"은 열-기계적 응력으로의 노출 및/또는 소수성 표면 및 계면과 같이 탈안정화하는 계면 및 표면과의 상호작용의 결과로서 단백질의 생물학적으로 비활성 및/또는 비가용성 응집체를 형성하기 위한 인슐린 유도체의 경향을 의미한다. 따라서 물리적 불안정성은 표면에 더 높은 순서 구조, 응집, 피브릴화, 침전 및/또는 흡착의 손실을 포함하는 사람 인슐린에 대해 구조 변화를 포함한다. 인슐린과 같은 펩티드는 예를 들어 피브릴화로 인하여 불안정하기 쉬운 것으로 알려져 있다. 인슐린 유도체를 포함하는 용액의 물리적 안정성은 예를 들어 적합한 용기(예를 들어, 카트리지 또는 바이알)에 채워진 용액을 다양한 시간 기간 동안 다른 온도에서 기계적/물리적 응력(예를 들어, 교반)에 노출한 후 육안 검사, 비탁법 및/또는 혼탁도 측정의 종래의 수단에 의해 평가될 수 있다. 용액의 육안 검사는 어두운 배경에서 날카롭고 집중된 불빛으로 수행된다. 용액의 혼탁도는 혼탁도의 정도를 순위, 예를 들어 0 내지 3의 규모로 나타내는 시각적 스코어(혼탁도를 나타내지 않는 용액은 시각적 스코어 0에 대응하고, 시각적 혼탁도가 일광을 나타내는 용액은 시각적 스코어 3에 대응)를 특징으로 한다. 용액은 그것이 일광에서 시각적 혼탁도를 나타낼 때 단백질 응집에 대하여 물리적 불안정으로 분류된다. 대안으로, 용액의 혼탁도는 당업자에게 잘 알려진 간단한 혼탁도 측정에 의해 평가될 수 있다. 또한 인슐린 유도체의 물리적 안정성은 분광 물질 또는 인슐린 유도체의 구조 상태의 프로브를 사용함으로써 평가될 수 있다. 프로브는 바람직하게 단백질의 비자연 형태 이성질체에 우선적으로 결합하는 저분자이다. 단백질 구조의 저분자 분광 프로브의 한 예는 티오플라빈 T이다. 티오플라빈 T는 아밀로이드 피브릴의 검출에 광범위하게 사용되는 형광 염료이다. 아마도 다른 단백질 배열뿐만 아니라 피브릴의 존재하에서, 티오플라빈 T는 피브릴 단백질형과 결합될 때 약 450 nm에서의 새로운 최대 자극 및 약 482 nm에서의 높은 방출을 일으킨다. 비결합 티오플라빈 T는 이들 파장에서 본질적으로 비형광이다. 본 발명의 인슐린 유도체의 물리적 안정성을 예를 들어 실시예 109에 기술된 바와 같이 측정할 수 있다.
다른 저분자는 자연에서 비자연 상태로의 단백질 구조에서 변화의 프로브로서 사용될 수 있다. 예를 들어, "소수성 패치" 프로브는 단백질의 노출된 소수성 패치에 우선적으로 결합한다. 소수성 패치는 일반적으로 그것의 본래 상태에서 단백질의 3차원 구조 내에 매몰되지만, 노출되면 단백질이 접힘풀림되거나 변질되기 시작한다. 이들 저분자인, 분광 프로브의 예는 안트라센, 아크리딘, 페난트롤린 등과 같은 방향족, 소수성 염료이다. 다른 분광 프로브는 금속-아미노산 복합체, 예컨대 페닐알라닌, 류신, 이소류신, 메티오닌, 및 발린 등과 같은 소수성 아미노산의 코발트 금속 복합체이다.
본원에 사용된 바와 같이 인슐린 유도체의 용어 "화학적 안정성"은 본래의 단백질 구조와 비교하여 생물학적 효능이 감소된 가능성 및/또는 면역성 성질이 증가된 가능성이 있는 화학적 분해 생성물의 형성을 이끄는 단백질 구조에서의 화학 공유 변화를 의미하고, 공유 결합의 분해, 예컨대 수분해, 라세미화, 산화 또는 가교의 방지를 포함한다. 다양한 화학적 분해 생성물은 본래 단백질의 타입 및 특성과 인슐린 유도체가 노출되는 환경에 따라 형성될 수 있다. 화학적 분해의 제거는 아마도 대부분 완전히 방지되지 못할 수 있고, 화학적 분해 생성물의 증가량은 당업자에 의해 잘 알려진 단백질 제제의 보관 및 사용 동안에 종종 나타난다. 대부분의 단백질은 글루타민 또는 아스파라긴 잔기에서의 측쇄 아미드기가 가수분해되어 유리 카르복시산을 형성하는 방법으로 탈아미드화하기 쉽다. 아스파라긴 및 아스파르트산 잔기는 isoAsp 분해 생성물을 더 형성할 수 있다. 다른 분해 경로는 고분자량 형질전환 생성물의 형성을 포함하며, 여기서 2개 이상의 단백질 분자는 아미드기전이 및/또는 이황화 상호작용을 통해 서로 공유적으로 결합되어, 공유적으로 결합된 이합체, 올리고머 및 중합체 분해 생성물을 이끈다(Stability of Protein Pharmaceuticals , Ahern. T.J.& Manning M.C., Plenum Press , New York 1992). (예를 들어, 메티오닌 잔기의) 산화 및 라세미화는 화학적 분해의 다른 변종으로서 언급될 수 있다. 인슐린 유도체의 화학 안정성은 다른 환경 상태의 노출(분해 생성물의 형성은, 예를 들어 온도를 증가시킴으로써 종종 가속화될 수 있음) 후 다양한 시점에서 화학적 분해 생성물의 양을 측정함으로써 평가될 수 있다. 개체 분해 생성물은, 예를 들어 때때로 화학/효소 분열과 조합하여 크로마토그래피(예를 들어, SEC-HPLC, RP-HPLC 또는 IE-HPLC)와 분광 방법(다양한 질량 분석 방법)의 조합을 사용하여 분자 크기 및/또는 전하에 따른 분해 생성물의 분리에 의해 종종 측정된다.
한 구체예에서, 본 발명의 인슐린 유도체는 실시예에 기술된 바와 같이 시험될 때 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 화학 안정성에 대해 개선점을 가진다.
한 구체예에서, 본 발명의 인슐린 유도체는, 당업자에 의해 알려지고 예를 들어 실시예 101에 기술된 바와 같이 소수성에 대해 시험될 때 사람 인슐린 및/또는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 친수성에 대해 증가된다.
한 구체예에서, 본 발명의 인슐린 유도체는 응집하는 경향이 거의 없거나 전혀 없다. 응집 경향은, 티오플라빈 어세이에서 시험될 때 하나 이상의 추가 이황화 결합이 없는 사람 인슐린 및/또는 인슐린 유도체의 응집 경향에 비해 바람직하게는 상당히 개선된다.
한 양태에서, 본 발명에 따른 인슐린 유도체는 예를 들어 접힘 안정성, 구조 안정성 및/또는 더 높은 용융 온도와 같은 개선된 열역학적 안정성을 가진다.
본원에 사용할 때 인슐린 유도체는 상기 유도체의 변성이 하나 이상의 추가 이황화 결합이 없는 사람 인슐린 또는 인슐린 유도체와 비교하여 더 높은 응력 수준, 예컨대 변성 물질의 더 높은 온도 및/또는 더 높은 농도를 필요로 한다면, 개선된 "열역학적 안정성"을 갖는다고 한다.
구조 안정성은, 예를 들어 Hudson 및 Andersen, Peptide Science, vol 76 (4), pp. 298-308 (2004)에 의해 기술된 바와 같이 원편광 이색성 및 NMR에 의해 평가될 수 있다. 용융 온도는 인슐린 구조가 가역적으로 또는 비가역적으로 변화되는 온도로서 이해된다. 더 높은 용융 온도는 더 안정한 구조와 대응한다. 용융 온도는, 예를 들어 원편광 이색성 및/또는 NMR에 의해서 구조 안정성을 온도의 함수로서 평가함으로써 또는 시차 주사 열량측정법에 의해 결정될 수 있다. 또한 열역학적 안정성은, 예를 들어 구아니디늄 염산염과 같은 변성 물질이 증가하는 농도의 존재하에서 CD 분광법 및/또는 NMR에 의해 결정될 수 있다. 이전에 기술된 바와 같이(Kaarsholm, N.C., et al, 1993, Biochemistry, 32, 10773-8) 접힘풀림의 자유 에너지는 이러한 실험으로부터 결정될 수 있다. 단백질 변성에 따라, 원 UV 범위(240-218 nm)에서의 음성 CD는 단백질 접힘풀림을 수반하는 정렬된 2차원 구조의 손실과 일관되어 서서히 줄어든다(Holladay et al., 1977, Biochim . Biophys . Acta, 494, 245-254; Melberg and Johnson, 1990, Biochim . Biophys . Acta, 494, 245-254). 근 UV 범위(330-250 nm)에서의 인슐린 CD 스펙트럼은 이황화 결합의 기여로 티로신 발색단의 환경을 반영한다(Morris et al., 1968, Biochim . Biophys . Acta., 160, 145-155; Wood et al., 1975, Biochim . Biophys . Acta, 160, 145-155; Strickland & Mercola, 1976, Biochemistry, 15, 3875-3884). 인슐린의 접힘풀림의 자유 에너지는 이전에 이러한 연구로부터 4.5 kcal/mol로 계산되었다(Kaarsholm, N.C., et al, 1993, Biochemistry, 32, 10773-8).
근 UV 범위(330-250 nm)에서의 인슐린 CD 스펙트럼은 이황화 결합의 기여로 티로신 발색단의 환경을 반영한다. 티로신 잔기가 인슐린의 이합체 표면의 부분이기 때문에, 이 영역에서(특히 276 nm에서) 몰타원율의 변화는 인슐린의 회합 상태를 반영한다. 인슐린의 회합 상태를 측정하는 다른 방식은 본 분야에 알려지고 실시예에 기술된 바와 같이 비해리 조건하에 크기-배제 크로마토그래피의 적용에 의한다.
본 발명에 따른 인슐린 유도체는 실질적으로는 모인슐린에 대해 동일하거나 증가된 생체 내 효능을 가질 수 있다. 한 양태에서 본 발명의 인슐린 유도체는 실질적으로는 모인슐린에 대해 동일한 생체 내 효능을 가진다. 한 양태에서 본 발명의 인슐린 유도체는 모인슐린에 비해 증가된 생체 내 효능을 가진다.
인슐린 생체 내 효능을 측정하기 위한 표준 어세이는 당업자에게 알려져 있고, 실시예에서 기술되는 어세이, 예컨대; 사람 인슐린에 대해 본 발명의 인슐린 유도체의 효능, 정맥주사 일정-상태 클램프 어세이, 예컨대 장내 주사 후 래트 약동학 및 래트 PK, 혈액 글루코스 낮추는 효과 및 정맥주사 래트 PK 어세이를 포함한다.
본 발명에 따른 인슐린 유도체는 실질적으로는 모인슐린에 대해 동일하거나 증가된 시험관 내 효능을 가질 수 있다. 한 양태에서 본 발명의 인슐린 유도체는 실질적으로는 동일한 시험관 내 효능을 가진다. 한 양태에서 본 발명의 인슐린 유도체는 모인슐린에 비해 증가된 시험관 내 효능을 가진다.
인슐린 시험관 내 효능을 측정하기 위한 표준 어세이들은 당업자에게 알려져 있고, 그 중에서도 하기 시험관 내 어세이를 포함한다:
(1) 인슐린의 비교 효능이 세포막, 예를 들어 래트 간 혈장막 분획에 존재하는 인슐린 수용체에 특이적으로 결합되는 125I-인슐린의 50%를 치환하는데 필요한 인슐린 유도체에 대한 인슐린의 비율로서 정의되는, 인슐린 방사수용체 어세이;
(2) 비교 인슐린 효능이 [3-3H] 글루코스의 유기-추출가능 재료(즉, 지질)로의 최대 전환의 50%를 달성하는데 필요한 인슐린 유도체에 대한 인슐린의 비율로서 정의되는, 예를 들어 래트 지방세포로 수행되는 지질생성 어세이; 및
(3) 인슐린 유도체의 비교 효능이 글루코스-1-[14C]의 [14CO2]로의 최대 전환의 50%를 달성하는 인슐린 유도체에 대한 인슐린의 비율로서 정의되는, 분리된 지방 세포에서의 글루코스 산화 어세이.
이황화 결합은 2개의 티올기의 커플링에 의해 유도되고, 본원에서 2개의 황 원자 사이의 연결, 즉 전체 연결성 R-S-S-R을 갖는 구조로서 이해될 것이다. 또한 이황화 결합은 이황화 결합, SS-결합 또는 이황화 다리를 연결하는 것으로 불려질 수 있다. 이황화 결합은 2개의 시스테인 아미노산 잔기를 펩티드에 도입하고, 2개의 티올기를 이황화 결합으로 후속 산화시킴으로써 만들어진다. 이러한 산화는 화학적으로 수행(당업자에 의해 알려짐)되거나, 또는, 예를 들어 효모에서 인슐린 발현 동안에 일어날 수 있다.
시스테인 잔기를 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 도입할 때, 시스테인 잔기는 접혀진 인슐린 유사체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용한다. 예를 들어, 2개의 새로운 시스테인 잔기를 위치시키면, 3차원 구조에서 새로운 시스테인 잔기의 근접은 이황화 결합이 2개의 새로운 시스테인 잔기 사이에 형성될 수 있도록 한다.
단백질(예컨대, 인슐린)에서 이황화 결합의 수는, 예를 들어 실시예에서 기술된 바와 같이 정확한 무손상 질량 측정에 의해 쉽게 측정될 수 있다. 이황화 결합 연결성은 본 분야에 알려진 표준 기술, 예컨대 펩티드 맵핑에 의해 확인될 수 있다(측정됨). 인슐린 펩티드에서 이황화 결합 맵핑을 위한 일반적인 전략은 하기 단계를 포함한다: 1) 가능하면, 펩티드당 단지 단일 이황화 결합을 함유하는 이황화 결합 펩티드로의 비환원된 인슐린의 분열. 선택한 조건은 또한 이황화 결합의 재배열이 방지되도록 한다. 2) 서로로부터 이황화 결합 펩티드의 분리. 3) 개체 이황화 결합에 포함된 시스테인 잔기의 동일화.
사람 인슐린은 전형적으로 2개의 이황화 결합(A6-A11 및 A7- B7)을 함유하는 펩티드 I, 및 단일 이황화 결합(A20-B19)을 함유하는 펩티드 II를 생성하는 Glu-C 프로테아제에 의해 소화된다. 명료하게 펩티드 I에서 이황화 결합을 양도하기 위해, 추가 분열이 필요하다. 산 가수분해(Ryle at al., 1955 Biochem J. 60, 541-56), 수동 Edman 분해(Kumazaki T, Ishii, S. 1990 J. Biochem(Tokyo) 17, 414-9), 또는 서몰리신의 지연된 소화(Ota M, Ariyoshi, Y., 1995, Biosci. Biotech. Biochem. 59, 1956-7)는 이전에 단백질에서의 CysCys 결합을 가수분해하도록 사용되었다. 펩티드 I에서 이황화 결합을 양도하는 대안 방식은 트리스카르복시에틸 포스핀으로의 부분적인 환원(A7-B7 이황화 결합의 환원), 환원된 시스테인 잔기의 알킬화 이어서 완전한 환원 및 다른 알킬기를 사용한 시스테인 알킬화(Yen, T.-Y., Yan, H., Macher, B., 2001 J Mass Spectrom. 37, 15-30)이다. 여분의 이황화 결합을 함유하는 인슐린의 이황화 맵핑을 위한 전략은 원칙적으로 새로운 이황화 결합을 수용하는 방식에서 각 유사체를 위해 조정된 사람 인슐린에 대해 상기 개요한 바와 같이 동일하다. NMR 또는 X-선 결정학에 의한 인슐린 구조의 결정은 이황화 결합 연결성을 확인하기 위한 대안 접근 방법이다. 인슐린의 NMR 및/또는 X-선 구조를 해결하기 위한 조건은 이전에 기술되었고 본 분야에 알려져 있다.
본 발명의 한 양태에서, 사람 인슐린의 3개의 이황화 결합이 보유된 측쇄 및 적어도 2개의 시스테인 치환을 갖는 인슐린 유도체가 제공된다.
본원에서 용어 "시스테인 치환"은 사람 인슐린에 존재하는 아미노산을 시스테인으로 치환하는 것을 의미한다. 예를 들어, A 쇄(IleA10)의 10 위치에서 이소류신 및 사람 인슐린(GlnB4)의 B 쇄의 4 위치에서 글루타민은 각각 시스테인 잔기에 의해 치환될 수 있다. 본원에서 용어 "다른 아미노산 잔기 치환"은 사람 인슐린에 존재하는 아미노산을 시스테인이 아닌 아미노산으로 치환하는 것을 의미한다.
본원에 사용된 바와 같이 용어 "사람 인슐린"은 그것의 2차원 및 3차원 구조와 성질이 잘 알려진 사람 인슐린 호르몬을 의미한다. 사람 인슐린의 3차원 구조는, 예를 들어 많은 다른 조건하에서 NMR 및 X-선 결정학에 의해 측정되었고, 많은 이들 구조가 단백질 데이터 은행(http://www.rcsb.org)에 저장된다. 사람 인슐린 구조의 비제한 예는 T6 구조(http://www.rcsb.org/pdb/explore.do?structureId=1MSO) 및 R6 구조(http://www.rcsb.org/pdb/explore.do?structureId=1EV3)이다. 사람 인슐린은 A-쇄 및 B-쇄로 지칭된 2개의 폴리펩티드 쇄를 가진다. A-쇄는 21개의 아미노산 펩티드이고, B-쇄는 30개의 아미노산 펩티드이며, 2개의 쇄는 이황화 결합에 의해 연결된다: A-쇄의 7 위치에서 시스테인과 B-쇄의 7 위치에서 시스테인 사이의 제 1의 다리, 및 A-쇄의 20 위치에서 시스테인과 B-쇄의 19 위치에서 시스테인 사이의 제 2의 다리. 제 3의 다리는 A-쇄의 6 및 11 위치에서 시스테인들 사이에 존재한다. 따라서 본원에서 "사람 인슐린의 3개의 이황화 결합이 보유되는 인슐린 유도체"는 사람 인슐린의 3개의 이황화 결합, 즉 A-쇄의 7 위치에서 시스테인과 B-쇄의 7 위치에서 시스테인 사이, A-쇄의 20 위치에서 시스테인과 B-쇄의 19 위치에서 시스테인 사이, 그리고 A-쇄의 6 및 11 위치에서 시스테인들 사이의 이황화 결합을 포함하는 인슐린 유도체로서 이해된다.
인체에서, 인슐린 호르몬은 배열에서 24개의 아미노산의 프리펩티드 이어서 86개의 아미노산을 함유하는 프로인슐린: 프리펩티드-B-Arg Arg-C-Lys Arg-A로 구성된 단일-쇄 전구 프로인슐린(인슐린 전구물질)로서 합성되고, 여기서 C는 31개의 아미노산의 연결 펩티드이다. Arg-Arg 및 Lys-Arg는 A 및 B 쇄로부터 연결 펩티드의 분할을 위한 분할 부위이다.
본 발명의 한 양태에서, 사람 인슐린의 3개의 이황화 결합이 보유되며, A-쇄의 A9, A10 및 A12로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B1, B2, B3, B4, B5 및 B6으로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인으로 치환되고, 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되고, 선택적으로 B30 위치에서 아미노산은 삭제된 2개 이상의 시스테인 치환을 갖는 인슐린 유도체가 제공된다. 본 발명의 한 양태에서 A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B1, B2, B3, 및 B4로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인으로 치환되고, 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되고, 선택적으로 B30 위치에서 아미노산은 삭제된다. 본 발명의 한 양태에서 A-쇄의 A9, A10 및 A12로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B1, B2, B3, B4, B5 및 B6으로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인으로 치환되고, A14, A21, B1, B3, B10, B16, B22, B25, B26, B27, B28, B29, B30, B31, B32로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인이 아닌 아미노산으로 치환되고, 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되고, 선택적으로 B30 위치에서 아미노산은 삭제된다. B1 또는 B3가 시스테인일 때, 동일한 아미노산은 시스테인이 아닌 아미노산일 수 있는 반면, 예를 들어 B1이 시스테인이면, B3는 본 발명의 양태에 따라 시스테인이 아닌 아미노산으로 치환되며 그 역도 성립될 수 있다고 이해된다. 본 발명의 한 양태에서, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B1, B2, B3, 및 B4로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 적어도 하나의 아미노산 잔기는 시스테인이 아닌 아미노산으로 치환되고, 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되고, 선택적으로 B30 위치에서 아미노산은 삭제된다. 본 발명의 한 양태에서, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B3 및 B4로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 적어도 하나의 아미노산 잔기는 시스테인이 아닌 아미노산으로 치환되고, 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되고, 선택적으로 B30 위치에서 아미노산은 삭제된다. 본 발명의 한 양태에서, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B3 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 적어도 하나의 아미노산 잔기는 시스테인이 아닌 아미노산으로 치환되고, 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되고, 선택적으로 B30 위치에서 아미노산은 삭제된다. 본 발명의 한 양태에서, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B4에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 적어도 하나의 아미노산 잔기는 시스테인이 아닌 아미노산으로 치환되고, 측쇄는 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되고, 선택적으로 B30 위치에서 아미노산은 삭제된다.
한 양태에서, 본 발명에 따라 B30 위치가 삭제된 인슐린 유도체가 얻어진다.
본 발명에 의해 얻어진 추가 이황화 결합은 동일한 쇄의 2개의 시스테인, 즉 인슐린의 A-쇄에서 2개의 시스테인 또는 B-쇄에서 2개의 시스테인을 연결할 수 있거나, 또는 인슐린의 A-쇄의 시스테인을 B-쇄의 시스테인에 연결할 수 있다. 본 발명에 따른 인슐린 유도체가 얻어진 한 양태에서, 적어도 하나의 추가 이황화 결합은 A-쇄에서 2개의 시스테인을 연결하거나, 또는 B-쇄에서 2개의 시스테인을 연결한다. 본 발명에 따른 인슐린 유도체가 얻어진 한 양태에서, 적어도 하나의 추가 이황화 결합은 A-쇄에서의 시스테인을 B-쇄에서의 시스테인과 연결한다.
본원에서 용어 "추가 이황화 결합"은 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합을 의미할 때 사용된다.
본 발명의 한 양태에서, 위치가 하기로 구성된 군으로부터 선택된 시스테인은 인슐린 유도체의 2개의 위치로 치환된다:
A10C, B1C;
A10C, B2C;
A10C, B3C;
A10C, B4C;
A10C, B5C; 및
B1C, B4C.
본 발명의 한 양태에서, 위치가 하기로 구성된 군으로부터 선택된 시스테인은 인슐린 유사체의 2개의 위치로 치환된다:
A10C, B1C;
A10C, B2C;
A10C, B3C;
A10C, B4C; 및
B1C, B4C.
본 발명의 한 양태에서, 위치가 하기로 구성된 군으로부터 선택된 시스테인은 인슐린 유도체의 2개의 위치로 치환된다:
A10C, B1C;
A10C, B2C;
A10C, B3C; 및
A10C, B4C.
본 발명의 한 양태에서, 위치가 하기로 구성된 군으로부터 선택된 시스테인은 인슐린 유사체의 2개의 위치로 치환된다:
A10C, B3C; and
A10C, B4C.
본 발명의 한 양태에서, 위치가 A10C 및 B3C인 시스테인은 인슐린 유사체의 2개의 위치로 치환된다.
본 발명의 한 양태에서, 위치가 A10C 및 B4C인 시스테인이 인슐린 유사체의 2개의 위치로 치환된다.
본 발명의 한 양태에서, 본 발명의 인슐린 유도체는 시스테인 치환에 더하여 A8H, A14E, A14H, A18L, A21G, B1G, B3Q, B3E, B3T, B3V, B3K, B3L, B16H, B16E, B22E, B24G, B25A, B25H, B25N, B27E, B27D, B27P, B28D, B28E, B28K, desB1, desB24, desB25, desB27 및 desB30으로 구성된 군으로부터 선택된 하나 이상의 아미노산을 포함한다. 본 발명의 한 양태에서, 본 발명의 인슐린 유도체는 시스테인 치환에 더하여 A8H, A14E, A21G, desB1, B1G, B3Q, B3E, B10E, B16H, B16E, B24G, B25H, B25A, B25N, B25G, desB27, B27E, B28E, B28D, 및 desB30으로 구성된 군으로부터 선택된 하나 이상의 아미노산을 포함한다.
본 발명의 한 양태에서, 본 발명의 인슐린 유도체 시스테인 치환에 더하여 A21G, desB1, B1G, B3Q, B3S, B3T 및 B3E로 구성된 군으로부터 선택된 하나 이상의 아미노산을 포함한다.
본 발명의 한 양태에서, 본 발명의 인슐린 유도체는 시스테인 치환에 더하여 A8H, A14E, A14H, B16H, B10E, B16E, B25H, B25A, B25N, B27E, B27P, desB27 및 B28E로 구성된 군으로부터 선택된 하나 이상의 아미노산을 포함한다.
본 발명의 한 양태에서, 본 발명의 인슐린 유도체는 시스테인 치환에 더하여 B28E, B28D, desB27, 및 A14E로 구성된 군으로부터 선택된 하나 이상의 아미노산을 포함한다.
본 발명의 한 양태에서, 본 발명의 인슐린 유도체는 시스테인 치환에 더하여 B3K, B29E, B27E, B27D, desB27, B28E, B28D, B28K 및 B29P로 구성된 군으로부터 선택된 하나 이상의 아미노산을 포함한다.
본 발명의 한 양태에서, 본 발명의 인슐린 유도체는 시스테인 치환에 더하여 B-쇄의 C-말단을 A-쇄의 N-말단에 연결(소위 단일-쇄 인슐린 유도체를 형성)하는 C-펩티드를 포함한다. 본 발명의 한 구체예에서, 모인슐린은 단일 쇄 인슐린 유사체로 구성된 군으로부터 선택된다. 본 발명의 한 구체예에서, 모인슐린은 참조로 본원에 구체적으로 포함되는 WO2007096332호, WO2005054291호 또는 WO2008043033호로 열거된 단일 쇄 인슐린 유사체로 구성된 군으로부터 선택된다.
인슐린 유도체가 얻어진 본 발명의 한 양태에서, 사람 인슐린에 대해 하나의 추가 이황화 결합을 가져오는 2개의 시스테인 치환을 포함한다.
본 발명에 따르면 "인슐린"은 본원에서 사람 인슐린, desB30 사람 인슐린 또는 인슐린 유사체로서 이해될 것이다.
본원에 사용된 바와 같이 용어 "인슐린 펩티드"는 사람 인슐린, desB30 사람 인슐린 또는 인슐린 활성을 갖는 그것의 유사체 또는 유도체 중 하나의 펩티드를 의미한다.
본원에 사용된 바와 같이 용어 "인슐린 유사체"는 인슐린의 하나 이상의 아미노산 잔기가 다른 아미노산 잔기에 의해 치환되거나 및/또는 하나 이상의 아미노산 잔기가 인슐린으로부터 삭제되거나 및/또는 하나 이상의 아미노산 잔기가 인슐린에 첨가 및/또는 삽입된 변형된 인슐린을 의미한다.
한 양태에서 본 발명에 따른 인슐린 유도체는 사람 인슐린에 대해 하나 이상의 추가 이황화 결합(들)을 함유하고 분자의 B-쇄에 존재하는 리신 잔기의 엡실론 아미노기에 부착된 측쇄를 함유하는 인슐린 유사체(상기 정의된 바와 같음)이다.
용어 "인슐린 유도체"는 화학적으로 유도체화된 인슐린(상기 정의된 바와 같음)을 의미하는 것으로 의도된다. 이것은 측쇄(본원에 정의된 바와 같음)가 인슐린과 커플링되는 것을 의미한다. 가장 광범위한 의미에서, 측쇄는 PEG와 같은 어떤 종류일 수 있지만, 더 바람직하게는, 측쇄는 지방산 또는 지방이산 부분을 함유한다.
본원에 사용된 바와 같이 용어 "모인슐린"은 측쇄로 유도체화되기 전에, 하나 이상의 추가 이황화 결합을 갖는 인슐린, 즉 하나 이상의 추가 이황화 결합을 갖는 사람 인슐린, desB30 사람 인슐린 또는 인슐린 유사체를 의미하는 것으로 의도된다.
본원에 사용된 바와 같이 용어 "하나 이상의 추가 이황화 결합이 없는 인슐린 유도체"는 사람 인슐린에 자연적으로 존재하는 3개의 이황화 결합, 즉 A-쇄의 7 위치에서 시스테인과 B-쇄의 7 위치에서 시스테인 사이의 제 1의 다리, A-쇄의 20 위치에서 시스테인과 B-쇄의 19 위치에서 시스테인 사이의 제 2의 다리, 및 A-쇄의 6 및 11 위치에서 시스테인들 사이의 제 3의 다리, 그리고 인슐린에 부착된 측쇄를 갖지만, 추가 이황화 결합/다리가 없는 인슐린 유도체를 의미하는 것으로 의도된다.
본원에 사용된 용어 "측쇄"는 본 발명의 모인슐린에, 예컨대 모인슐린의 B-쇄에 존재하는 리신의 엡실론 아미노기로 커플링된 지방산 또는 지방이산(선택적으로 하나 이상의 링커를 통함)을 의미하는 것으로 의도된다. 측쇄의 지방산 또는 지방이산 부분은 혈청 알부민에 대한 친화도를 수반하고, 링커는 알부민에 대한 친화도를 변형시키거나(예를 들어, 증가), 인슐린 유도체의 용해도를 변형시키거나, 및/또는 인슐린 수용체를 위한 인슐린 유도체의 친화도를 조절하는(증가/감소) 것 중 하나로 작용한다.
한 양태에서, 인슐린 유사체가 인슐린 펩티드의 하나 이상의 아미노산에서 아실화된 본 발명에 따른 인슐린 유도체는 적어도 2개의 시스테인 치환을 포함하는 인슐린 유사체이다.
본원에서, 용어 "아실화 인슐린"은 링커를 통해 하나 이상의 아실 부분의 인슐린과의 부착에 의한 사람 인슐린 또는 인슐린 유사체의 변형을 망라한다.
본 발명에 따른 시스테인 치환에 의해 변형될 수 있는 아실화 인슐린 유사체 형태의 인슐린 유도체의 비제한 실시예는 예를 들어 WO 2009/115469 A1호에서 발견될 수 있다.
본 발명에 따른 인슐린 유도체가 변형된 인슐린인 한 구체예에서, 2개의 아미노산 잔기는 시스테인 잔기에 의해 치환되고, 측쇄가 도입되고, 선택적으로 B30 위치에서 아미노산은 사람 인슐린의 아미노산 서열에 대해 삭제되었다.
한 구체예에서, 본 발명에 따른 인슐린 유도체는 적어도 2개의 치환이 시스테인 잔기에 있는 사람 인슐린에 대해 측쇄 및 2 내지 9개의 돌연변이를 포함하고, 대안으로 본 발명에 따른 인슐린 유도체는 적어도 2개의 치환이 시스테인 잔기에 있는 사람 인슐린에 대해 측쇄 및 2 내지 8개의 돌연변이, 대안으로 적어도 2개의 치환이 시스테인 잔기에 있는 사람 인슐린에 대해 측쇄 및 2 내지 7개의 돌연변이, 대안으로 적어도 2개의 치환이 시스테인 잔기에 있는 사람 인슐린에 대해 측쇄 및 2 내지 6개의 돌연변이, 대안으로 적어도 2개의 치환이 시스테인 잔기에 있는 사람 인슐린에 대해 측쇄 및 2 내지 5개의 돌연변이, 대안으로 적어도 2개의 치환이 시스테인 잔기에 있는 사람 인슐린에 대해 측쇄 및 2 내지 4개의 돌연변이, 대안으로 적어도 2개의 치환이 시스테인 잔기에 있는 사람 인슐린에 대해 측쇄 및 2 내지 3개의 돌연변이, 또는 대안으로 사람 인슐린에 대해 측쇄 및 2개의 시스테인 치환을 포함한다.
인슐린 분자에서의 변형은 쇄(A 또는 B), 위치, 및 본래의 아미노산 잔기를 치환하는 아미노산 잔기에 대한 1개 또는 3개 글자의 코드를 언급하여 표시한다.
본원에서 "A1", "A2" 및 "A3" 등 같은 용어는 인슐린의 A 쇄에서 각각 1, 2 및 3 등의 위치 아미노산을 표시한다(N-말단 단부로부터 셈). 유사하게, B1, B2 및 B3 등 같은 용어는 인슐린의 B 쇄에서 각각 1, 2 및 3 등의 위치 아미노산을 표시한다(N-말단 단부로부터 셈). 아미노산에 대한 한 글자 코드를 사용하면, A10C 같은 용어는 A10 위치에서의 아미노산이 시스테인인 것을 지칭한다. 아미노산에 대한 3개 글자 코드를 사용하면, 대응하는 표현은 A10Cys이다.
"desB30", "B(1-29)" 또는 "desThrB30"은 B30(트레오닌, Thr) 아미노산을 결핍하는 자연 인슐린 B쇄 또는 그것의 유사체를 의미하고, "A(1-21)"은 자연 인슐린 A 쇄를 의미한다. 따라서, 예를 들어, A10C, B1C, desB30 사람 인슐린 또는 대안으로 A10Cys, B1Cys, desB30 사람 인슐린(또는 대안으로 CysA10, CysB1, desThrB30 사람 인슐린)은 A 쇄에서의 10 위치에서 아미노산이 시스테인으로 치환되고, B 쇄에서의 1 위치에서 아미노산이 시스테인으로 치환되고, B 쇄에서의 30 위치(트레오닌, Thr)에서 아미노산이 삭제된 사람 인슐린의 유사체이다.
본원에서, 펩티드 또는 단백질의 명명은 하기 원칙에 따라 수행된다: 이름은 모펩티드 또는 단백질, 예컨대 사람 인슐린에 대해 돌연변이 및 변형(예컨대 아실화)으로서 주어진다. 아실 부분의 명명을 위해, 명명은 IUPAC 명명법에 따라서, 그리고 다른 경우에서는 펩티드 명명법으로서 수행된다. 예를 들어, 아실 부분의 명명은:
예를 들어, 옥타데칸디오일-γGlu-OEG-OEG, 옥타데칸디오일-gGlu-OEG-OEG, 옥타데칸디오일-gGlu-2xOEG, 또는 17-카르복시헵타데카노일-γGlu-OEG-OEG일 수 있고, 여기서
OEG는 아미노산 잔기 8-아미노-3,6-디옥사옥탄산, -NH(CH2)2O(CH2)2OCH2CO-에 대한 속기 표기법이고, γGlu(또는 gGlu)는 아미노산 감마 L-글루탐산 부분에 대한 속기 표기법이다.
예를 들어, 실시예 1의 인슐린(아래 주어진 서열/구조와 함께)은 "A10C, A14E, B4C, B25H, B29K(N ε옥타데칸디오일-gGlu-OEG-OEG), desB30 사람 인슐린"으로 칭하여 A10 위치에서 아미노산, 사람 인슐린에서 I가 C로 돌연변이되고; 사람 인슐린에서 A14, Y는 E로 돌연변이되고; 사람 인슐린에서 B4, Q 위치에서 아미노산은 C로 돌연변이되고; 사람 인슐린에서 B25, F 위치에서 아미노산은 H로 돌연변이되고, 사람 인슐린에서 B29, K 위치에서 아미노산은 B29의 리신 잔기에서 엡실론 질소의 아실화에 의해 변형되고, 잔기 옥타데칸디오일-γGlu-OEG-OEG에 의해 N ε을 나타내고, 사람 인슐린에서 B30, T 위치에서 아미노산은 삭제된 것을 표시한다. 하기 식에서의 별표는 문제에서 잔기가 사람 인슐린과 비교하여 다른(즉 돌연변이됨) 것을 표시한다. 사람 인슐린에서 발견된 이황화 결합은 황 원자로 나타내고, 본 발명의 추가 이황화 결합은 선으로 나타낸다.
게다가, 본 발명의 인슐린은 또한 IUPAC 명명법(OpenEye, IUPAC식)에 따라서 칭할 수 있다. 이 명명법에 따르면, 추가 이황화 다리를 갖는 상기 아실화 인슐린은 하기 이름으로 정한다:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람).
본원에서, 용어 "아미노산 잔기"는 히드록시기가 카르복시기로부터 제거되거나 및/또는 수소 원자가 아미노기로부터 제거된 아미노산이다.
본 발명의 한 양태에서, 본 발명에 따른 인슐린 유도체는 예를 들어 인슐린 아미노산 서열의 Lys 잔기의 ε-아미노기에서 아실기를 포함한다. 한 양태에서 인슐린 유도체는 알부민 결합 잔기, 즉 펩티드 또는 단백질에 부착될 때 생체 내 조건하에서 알부민과 결합하는 잔기를 포함한다.
한 양태에서, 알부민 결합 잔기는 친유성 잔기이다. 추가 양태에서, 친유성 잔기는 링커를 통해 인슐린 아미노산 서열에 부착된다.
본 발명의 추가 양태에서, 알부민 결합 잔기는 생리적 pH에서 음하전된다. 본 발명의 다른 양태에서, 알부민 결합 잔기는 음하전된 기를 포함한다. 음하전될 수 있는 한 바람직한 기는 카르복시산기이다.
한 양태에서, 알부민 결합 잔기는 α,ω-지방이산 잔기이다.
본 발명의 추가 양태에서, 친유성 잔기의 α,ω-지방이산 잔기는 6 내지 40개의 탄소 원자, 8 내지 26개의 탄소 원자 또는 8 내지 22개의 탄소 원자, 또는 14 내지 22개의 탄소 원자, 또는 16 내지 22개의 탄소 원자, 또는 16 내지 20개의 탄소 원자, 또는 16 내지 18개의 탄소 원자, 또는 16개의 탄소 원자, 또는 18개의 탄소 원자, 또는 20개의 탄소 원자, 또는 22개의 탄소 원자를 가진다.
본 발명의 다른 양태에서, 알부민 결합 잔기는 곧은-쇄 또는 분기된 알칸 α,ω-디카르복시산의 아실기이다. 추가 양태에서 알부민 결합 잔기는 예를 들어 감마-Glu 부분과 같은 아미노산 부분을 포함하는, 곧은-쇄 또는 분기된 알칸 α,ω-디카르복시산의 아실기이다. 추가 양태에서 알부민 결합 잔기는, 예를 들어 감마-Glu 부분 및 8-아미노-3,6-디옥사옥탄산(OEG) 부분과 같은 2개의 아미노산 부분을 포함하는, 곧은-쇄 또는 분기된 알칸 α,ω-디카르복시산의 아실기이다. 추가 양태에서 알부민 결합 잔기는 예를 들어 하나의 감마-Glu 부분 및 연이은 8-아미노-3,6-디옥사옥탄산(OEG) 부분들과 같은 더 많은 아미노산 부분들을 포함하는 곧은-쇄 또는 분기된 알칸 α,ω-디카르복시산의 아실기이다.
한 구체예에서, 모인슐린 유사체에 부착된 아실 부분은 하기 화학식을 가진다:
여기서 n은 0 또는 1 내지 3 범위의 정수이고; m은 0 또는 1 내지 10 범위의 정수이고; p는 0 또는 1 내지 10 범위의 정수이고; Acy는 약 8 내지 약 24개의 탄소 원자를 포함하는 지방산 또는 지방이산이고; AA1은 중성 선형 또는 환형 아미노산 잔기이고; AA2는 산성 아미노산 잔기이고; AA3는 중성, 알킬렌글리콜-함유 아미노산 잔기이고; AA1, AA2 및 AA3이 식에 나타난 순서는 독립적으로 호환될 수 있고; AA2는 식을 따라 몇 번 일어날 수 있고(예를 들어, Acy-AA2-AA32-AA2-); AA2는 식을 따라 독립적으로(=다름) 몇 번 일어날 수 있고(예를 들어, Acy-AA2-AA32-AA2-); Acy, AA1, AA2 및/또는 AA3 사이의 연결은, 정식으로, Acy, AA1, AA2 및 AA3의 각각으로부터 수소 원자 또는 수산기(물)의 제거에 의해 얻어질 수 있는 아미드(펩티드)결합이고; 프로테아제 안정화 인슐린에 부착은 식 (I)의 아실 부분에서 AA1, AA2, 또는 AA3 잔기의 C-말단 단부로부터 또는 식 (I)의 모이어티에 존재하는 AA2 잔기의 측쇄(들) 중 하나로부터 일 수 있다.
다른 구체예에서, 모인슐린 유사체에 부착된 아실 부분은 화학식 Acy-AA1n-AA2m-AA3p-(I)을 가지며, 여기서 AA1은 Gly, D- 또는 L-Ala, βAla, 4-아미노부티르산, 5-아미노발레르산, 6-아미노헥산산, D- 또는 L-Glu-α-아미드, D- 또는 L-Glu-γ-아미드, D- 또는 L-Asp-α-아미드, D- 또는 L-Asp-β-아미드, 또는 하기 식 중 하나의 기로부터 선택된다:
여기로부터 수소 원자 및/또는 수산기는 제거되었고, q는 0, 1, 2, 3 또는 4이고, 이 구체예에서, AA1은, 대안으로, 7-아미노헵탄산 또는 8-아미노옥탄산일 수 있다.
다른 구체예에서, 모인슐린 유사체에 부착된 아실 부분은 화학식 Acy-AA1n-AA2m-AA3p-(I)을 가지며, 여기서 AA1은 상기 정의된 바와 같고, AA2는 L- 또는 D-Glu, L- 또는 D-Asp, L- 또는 D-homoGlu 또는 하기 중 어떤 것으로부터 선택된다:
여기로부터 수소 원자 및/또는 수산기는 제거되었고, 화살표는 AA1, AA2, AA3의 아미노기, 또는 프로테아제 안정화 인슐린의 아미노기에 부착 지점을 표시한다.
한 양태에서, 중성 환형 아미노산 잔기 지칭된 AA1은 포화된 6-구성원 탄소환상화합물을 함유하고 선택적으로는 질소 헤테로 원자를 함유하는 아미노산이고, 바람직하게는, 고리는 시클로헥산 고리 또는 피페리딘 고리이다. 바람직하게는, 이러한 중성 환형 아미노산의 분자량은 약 100 내지 약 200 Da의 범위이다.
산성 아미노산 잔기 지칭된 AA2는 2개의 카르복시산기 및 1개의 1차 또는 2차 아미노기를 포함하는 약 200 Da 이하의 분자량을 갖는 아미노산이다. 대안으로, 산성 아미노산 잔기 지칭된 AA2는 1개의 카르복시산기 및 1개의 1차 또는 2차 술폰아미드기를 포함하는 약 250 Da 이하의 분자량을 갖는 아미노산이다.
중성, 알킬렌글리콜-함유 아미노산 잔기 지칭된 AA3은 한 단부에서의 카르복시산 관능성 및 다른 단부에서의 아미노기 관능성을 함유하는 알킬렌글리콜 부분, 선택적으로 올리고- 또는 폴리알킬렌글리콜 부분이다.
본원에서, 용어 알킬렌글리콜 부분은 모노-알킬렌글리콜 부분 그뿐만 아니라 올리고-알킬렌글리콜 부분을 망라한다. 모노- 및 올리고알킬렌글리콜은 모노- 및 올리고에틸렌글리콜 기반, 모노- 및 올리고프로필렌글리콜 기반 및 모노- 및 올리고부틸렌글리콜 기반 쇄, 즉, -CH2CH2O-, -CH2CH2CH2O- 또는 -CH2CH2CH2CH2O- 반복 단위를 기반한 쇄를 포함한다. 알킬렌글리콜 부분은 단분산이다(잘 정의된 길이/분자량을 가짐). 모노알킬렌글리콜 부분은 각 단부에서 다른 기를 함유하는 -OCH2CH2O-, -OCH2CH2CH2O- 또는 OCH2CH2CH2CH2O-를 포함한다.
본원에 언급된 바와 같이, AA1, AA2 및 AA3가 식 (I)(Acy-AA1n-AA2m-AA3p-)을 갖는 아실 부분에 나타난 순서는 독립적으로 호환될 수 있다. 결과적으로, Acy-AA1n-AA2m-AA3p- 식은 또한, 예를 들어 Acy-AA2m-AA1n-AA3p- 식, Acy-AA2-AA3n-AA2- 식, 및 Acy-AA3p-AA2m-AA1n- 식 같은 모이어티를 망라하며, 여기서 Acy, AA1, AA2, AA3, n, m 및 p는 본원에 정의된 바와 같다.
본원에 언급된 바와 같이, Acy, AA1, AA2 및/또는 AA3 부분들 사이의 연결은 그것들이 정식으로 만들어지는 모화합물로부터 물을 제거함으로써 아미드 결합(펩티드 결합) 형성(-CONH-)에 의해 정식으로 얻어진다. 이것은 식 (I)(Acy-AA1n-AA2m-AA3p-, 여기서 Acy, AA1, AA2, AA3, n, m 및 p는 본원에 정의된 바와 같음)을 갖는 아실 부분을 위한 완전한 식을 얻기 위해, 하나는 정식으로 용어 Acy, AA1, AA2 및 AA3를 위해 주어진 화합물들을 취해야하고, 그것들로부터 수소 및/또는 히드록실을 제거하여, 정식으로, 그렇게 얻어진 유리 단부에서 그렇게 얻어진 빌딩 블록을 연결시키는 것을 의미한다
본 발명의 아실화 인슐린 유사체에 존재할 수 있는 Acy-AA1n-AA2m-AA3p- 식의 아실 부분의 비제한, 특정 예는 WO2009/115469 A1호, pp. 27 - 43에 열거된다:
Acy-AA1n-AA2m-AA3p- 식의 아실 부분의 상기 비제한 특정 예의 어떤 것은 모인슐린 유사체의 상기 비제한 특정 예의 어떤 것에 존재하는 리신 잔기의 엡실론 아미노기에 부착될 수 있고, 이로써 본 발명의 아실화 인슐린 유사체의 추가 특정예가 주어질 수 있다.
모인슐린 유사체는 리신 잔기에서 Acy-AA1n-AA2m-AA3p- 식 중 원하는 기를 도입함으로써 본 발명의 추가 이황화 결합을 함유하는 아실화 인슐린으로 전환될 수 있다. Acy-AA1n-AA2m-AA3p- 식의 원하는 기가 어떤 편리한 방법에 의해 도입될 수 있고, 많은 방법이 이러한 반응들을 위해 종래에 기술된다. 보다 세부 사항은 본원의 실시예로부터 나타난다.
본 발명의 한 양태에서, 시스테인 치환의 부위는 사람 인슐린 유도체가 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하는 방식으로 선택된다. 원하는 생물학적 활성은 당업자에게 알려져 있고, 예를 들어 인슐린 수용체에 결합하는 단계, IGF-1(인슐린 성장 인자 1) 수용체에 결합하는 단계, 예를 들어 실시예 106 및 107에 기술된 바와 같은 시험관 내 효능, 생체 내 효능을 포함한다.
본 발명에 따른 인슐린 유도체가 얻어진 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 1%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 3%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 5%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 10%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 15%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 20%이다.
본 발명에 따른 인슐린 유도체가 얻어진 한 양태에서, 인슐린 수용체와의 수용체 결합이 증가된다. 본 발명에 따른 인슐린 유도체가 얻어진 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 110%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 120%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 130%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 140%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 150%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 적어도 160%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 110 내지 200%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 120 내지 180%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 140 내지 180%이다. 한 양태에서, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 인슐린 수용체와의 수용체 결합의 150 내지 170%이다.
폴리펩티드, 예를 들어, 인슐린의 제조는 본 분야에 잘 알려져 있다. 본 발명에 따른 인슐린 유도체를 제조하기 위해 사용되는 인슐린 유사체는 예를 들어 고전 펩티드 합성, 예를 들어 t-Boc 또는 Fmoc 화학을 사용한 고체상 펩티드 합성 또는 다른 잘 설정된 기술, 예를 들어 Greene 및 Wuts, "Protective Groups in Organic Synthesis", John Wiley & Sons, 1999를 참조하여 제조될 수 있다. 또한 인슐린 유사체는 유사체를 코드화하는 DNA 서열을 함유하고, 인슐린 유사체의 발현을 허용하는 조건하에서 인슐린 유사체를 적합한 영양 배지에서 발현할 수 있는 호스트 세포를 배양하는 단계를 포함하는 방법에 의해 제조될 수 있다. 여러 재조합 방법이 사람 인슐린 및 사람 인슐린 유사체의 제조에 사용될 수 있다. 예를 들어, 에스케리키아 콜라이(Escherichia coli) 및 사카로미세스 세레비시아(Saccharomyces cerevisiae)와 같은 미생물에서 인슐린의 제조에 사용될 수 있는 방법의 3가지 비제한 예가 예를 들어 WO2008034881에 개시된다.
전형적으로, 예를 들어 참조로 본원에 구체적으로 포함되는 유럽 1,246,845호 또는 WO2008034881호 둘 다에 기술된 바와 같이, 인슐린 유사체는 잘 알려진 기술에 의해 문제에서 인슐린 유사체 또는 적합한 호스트 세포에서 그것의 전구체를 코드화하는 DNA 서열을 발현함으로써 제조된다.
인슐린 유사체는 유럽 1,246,845호에 기술된 바와 같이 N-말단 연장으로 발현될 수 있다. 배양 배지로의 분비 및 회수 후, 인슐린 전구체는 가능한 N-말단 연장 서열 및 연결 펩티드를 제거하는 다양한 시험관 내 과정을 받아 인슐린 유사체를 제공할 것이다. 이러한 방법은 미국 특허 명세서 4,343,898호 또는 4,916,212호에 기술된 바와 같이 L-트레오닌 에스테르의 존재하에 트립신 또는 아크롬박터 리티쿠스(Achromobacter lyticus) 프로테아제에 의해 효소 전환 이어서 염기 또는 산 가수분해에 의해 인슐린 유사체의 트레오닌 에스테르의 인슐린 유사체로의 전환을 포함한다.
본 발명에 적합한 타입의 N-말단 연장의 예는 그 특허가 참조로 본원에 구체적으로 포함되는 미국 특허 5,395,922호 및 유럽 특허 765,395호 둘 다에서 기술된다.
비자연 아미노산 잔기를 포함하는 인슐린 유사체에 대해, 재조합 세포는 비자연 아미노산이, 예를 들어 tRNA 돌연변이체의 사용에 의해 유사체에 포함되도록 변형되어야 한다. 이와 같이, 간단하게는, 본 발명에 따른 인슐린 유사체는 알려진 인슐린 유사체의 제조와 유사하게 제조된다.
추가 구체예에서, 본 발명은 하기를 포함하는 인슐린 유도체의 제조 방법에 관한 것이다:
(i) 인슐린 전구체를 코드화하는 핵산 서열을 포함하는 호스트 세포를 배양하는 단계;
(ii) 배양 배지로부터 인슐린 전구체를 분리시키는 단계;
(iii) 시험관 내 효소 전환에 의해 인슐린 전구체를 인슐린 유사체로 전환하는 단계; 및
(iv) 인슐린 유사체를 측쇄로 아실화하는 단계.
추가 구체예에서, 본 발명은 하기를 포함하는 인슐린 유도체의 제조 방법에 관한 것이다:
(i) 인슐린 전구체를 코드화하는 핵산 서열을 포함하는 호스트 세포를 배양하는 단계;
(ii) 배양 배지로부터 인슐린 전구체를 분리시키는 단계;
(iii) 인슐린 전구체를 인슐린 유사체로 전환하는 단계; 및
(iv) 인슐린 유사체를 측쇄로 아실화하는 단계.
본 발명의 한 구체예에서 호스트 세포는 효모 호스트 세포이고, 추가 구체예에서 효모 호스트 세포는 사카로미세스(Saccharomyces) 속으로부터 선택된다. 추가 구체예에서 효모 호스트 세포는 사카로미세스 세레비시아(Saccharomyces cerevisiae) 종으로부터 선택된다.
인슐린 유사체는 예를 들어 참조로 포함되는 WO 2010/029159호, WO 00/55119호, WO 04/029077호 및 WO 2006/008238호에서 기술된 바와 같이 당업자에게 알려진 방법에 따라 변형된, 예컨대 아실화될 수 있다.
인슐린 유도체의 안정화 방법이 얻어진 본 발명의 한 양태에서, 인슐린 유도체의 2개 이상의 아미노산을 시스테인 잔기로 치환하는 단계를 포함하는 방법으로서,
a. 사람 인슐린의 3개의 이황화 결합이 보유되고
b. 시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유사체의 3차원 구조에 위치되는 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 위해 허용하는 방식으로 선택되어,
이로써 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합을 포함하는 사람 인슐린 유도체를 만든다.
이것은 본 발명에 따른 인슐린 유도체를 얻는 방법을 설명함으로써 명백하다. 따라서 당업자는 도입된 시스테인 잔기가 접혀진 인슐린 유사체의 3차원 구조에 위치되는 사람 인슐린의 3개의 이황화 결합에 더하여 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식에서 인슐린 유도체를 변형하는 설명 방법을 읽으면 안다.
약학적 조성물
본 발명의 다른 목적은 본 발명에 따른 인슐린 유도체가 0.1 mg/mL 내지 500 mg/mL의 농도를 포함하는 약학적 제제를 제공하는 것이며, 상기 제제는 2.0 내지 10.0의 pH를 가진다. 제제는 프로테아제 억제제(들), 완충용액 시스템, 보존제(들), 긴장제(들), 킬레이트제(들), 안정화제 및 계면활성제를 더 포함할 수 있다. 본 발명의 한 구체예에서 약학적 제제는 수성 제제, 즉 물을 포함하는 제제이다.
다른 구체예에서 약학적 제제는 어떤 사전의 분해 없이 사용할 준비된 건조 제제(예를 들어, 동결-건조 또는 분무-건조)이다.
본 발명에 따른 인슐린 유도체를 함유하는 약학적 조성물은 여러 부위에서, 예를 들어, 국소 부위, 예를 들어, 피부 및 점막 부위에서, 흡수를 우회하는 부위, 예를 들어, 동맥, 정맥, 심장으로의 투여에서, 그리고 흡수를 포함하는 부위, 예를 들어, 피내, 피하, 근육내 또는 복부 내의 투여로 이러한 치료가 필요한 환자에게 투여될 수 있다.
본 발명에 따른 약학적 조성물의 투여는 투여의 여러 경로를 통해, 예를 들어, 혀, 혀 밑, 볼 내, 입 안, 경구, 위 및 장, 코, 폐를 통해, 예를 들어, 세기관지 및 폐포 또는 그것들의 조합을 통해, 상피, 표피, 경피, 질, 직장, 눈, 예를 들어 결막을 통해, 요관, 및 비경구를 통해 이러한 치료가 필요한 환자에게 투여될 수 있다.
본 발명의 조성물은 여러 개의 투여량 형태로, 예를 들어, 용액, 현탁액, 에멀션, 마이크로에멀션, 다중 에멀션, 발포제, 연고, 페이스트, 반창고, 연고, 정제, 코팅된 정제, 헹굼액, 캡슐로서, 예를 들어, 경질 젤라틴 캡슐 및 연질 젤라틴 캡슐, 좌약, 직장 캡슐, 적제, 겔, 분무제, 분말, 에어로졸, 흡입제, 점안액, 안 연고, 안 헹굼액, 질좌약, 질내고리, 질 연고, 주사 용액, 현장 형질전환 용액, 예를 들어 현장 겔링, 현장 설정, 현장 침전, 현장 결정화, 주입 용액, 및 삽입물로 투여될 수 있다.
비경구 투여를 위해, 본 발명의 인슐린 유도체는 알려진 인슐린의 제제로 유사하게 제조된다. 더욱이, 비경구 투여를 위해, 본 발명의 인슐린 유도체는 알려진 인슐린의 투여와 유사하게 투여되고, 의사들은 이 과정에 익숙하다.
비경구 투여는 주사기, 선택적으로 펜-유사 주사기에 의해 수행될 수 있다. 대안으로, 비경구 투여는 주입 펌프에 의해 수행될 수 있다.
본 발명의 인슐린 유도체를 함유하는 주사가능 조성물은 적당한 성분을 용해시키고 혼합하는 단계를 포함하여 원하는 단부 생성물을 제공하는 약학 산업의 종래의 기술을 사용하여 제조될 수 있다. 따라서, 한 과정에 따르면, 본 발명의 인슐린 유도체를 제조되는 조성물의 최종 부피보다 약간 적은 양의 물로 용해시킨다. 등장제, 보존제 및 완충용액을 필요한 만큼 첨가하고, 용액의 pH 값을 필요하다면 산, 예를 들어, 염산, 또는 염기, 예를 들어, 수성 수산화나트륨을 필요한 만큼 사용하여 조정한다. 최종으로, 용액의 부피를 물로 조정하여 성분의 원하는 농도를 제공한다.
보다 더 정확하게는, 본 발명 인슐린 유도체 제조, 예를 들어 용액 또는 현탁액은 본 발명의 화합물을 약간 산성 조건의 수성 배지에서 예를 들어, 약 240 내지 약 2400 nmole/mL 범위의 농도로 용해시킴으로써 제조될 수 있다. 수성 배지를, 예를 들어 염화나트륨 또는 글리세롤로 등장성으로 만든다. 더욱이, 수성 배지는 아세테이트 또는 시트레이트와 같은 완충용액, m-크레졸 또는 페놀과 같은 보존제 및 아연 이온, 예를 들어, 인슐린 활성의 단위당 약 20 ㎍ 이하의 농도로 Zn++을 함유할 수 있다. 용액의 pH 값을, 침전을 피하기 위해 본 발명의 화합물의 등전점에 너무 가깝지는 않도록 중성을 향해 조정한다. 최종 인슐린 제제의 pH 값은 본 발명의 화합물이 사용되는, 아연 이온의 농도 및 본 발명의 화합물의 농도에 의존한다. 인슐린 유도체 제제를 멸균, 예를 들어, 멸균 여과에 의해 만든다.
구강 사용을 위해 의도된 제제는 어떤 알려진 방법에 따라 제조될 수 있고, 이러한 제제는 약학적으로 세련되고 맛있는 제제를 제공하기 위해 감미제, 향미제, 착색제, 및 보존제로 구성된 군으로부터 선택된 하나 이상의 물질을 함유할 수 있다. 정제는 혼합물에서 정제의 제조에 적합한 비독성 약학적으로-허용가능한 부형제로 활성 성분을 함유할 수 있다. 이들 부형제는 예를 들어, 비활성 희석제, 예컨대 만니톨, 말토덱스트린, 카올린, 탄산칼슘, 탄산나트륨, 락토스, 인산칼슘 또는 인산나트륨; 과립화 및 붕해제, 예를 들어 옥수수 녹말; 결합제, 예를 들어, 녹말, 젤라틴, 중합체 또는 아카시아; 및 윤활제, 예를 들어 스테아르산마그네슘, 스테아르산 또는 탈크일 수 있다. 정제는 비코팅될 수 있거나, 또는 그것은 치료적 활성 폴리펩티드의 분해 또는 방출을 지연시키기 위해 알려진 기술에 의해 코팅될 수 있다.
본 발명의 경구로 투여가능한 제제는 제조되고 약학적 화학에서 잘 알려진 방법에 따라 투여될 수 있다. Remington's Pharmaceutical Sciences, 17thed.(A. Osoled., 1985) 참조.
본 발명의 인슐린 유도체 제제는 알려진 인슐린 제제의 사용과 유사하게 사용된다.
투여되는 본 발명의 화합물의 양, 본 발명의 화합물을 투여하는 빈도의 결정, 및 선택적으로 다른 항당뇨병 화합물과 함께 투여할 본 발명의 화합물 또는 화합물들의 결정은 당뇨병의 치료에 익숙한 의사와 협의하여 결정된다.
한 양태에서, 본 발명에 따른 인슐린 유도체는 경구로 투여된다. 한 양태에서, 본 발명에 따른 인슐린 유도체는 비경구로 투여된다.
다른 구체예에서, 본 발명은 약제로서 사용하기 위한 본 발명에 따른 인슐린 유도체에 관한 것이다.
한 구체예에서, 본 발명에 따른 인슐린 유도체는 고혈당증, 타입 2 당뇨병, 손상된 글루코스 내성 및 타입 1 당뇨병의 치료 또는 예방을 위한 약제의 제조에 사용된다.
다른 구체예에서, 본 발명에 따른 인슐린 유도체는 타입 2 당뇨병의 질병 진행을 지연시키거나 예방하기 위한 약제로서 사용된다.
본 발명의 한 구체예에서, 본 발명에 따른 인슐린 유도체는 고혈당증, 타입 2 당뇨병, 손상된 글루코스 내성, 타입 1 당뇨병의 치료 또는 예방을 위해서 또는 타입 2 당뇨병의 질병 진행을 지연시키기 위한 약제로서 사용하기 위함이다.
본 발명의 추가 구체예에서, 고혈당증, 타입 2 당뇨병, 손상된 글루코스 내성, 타입 1 당뇨병을 치료 또는 예방하기 위한 방법 혹은 타입 2 당뇨병의 질병 진행을 지연시키거나 예방하는 방법으로서, 본 발명에 따른 인슐린 유도체의 이러한 치료에 효과적인 양을 이러한 치료를 필요로 하는 환자에게 투여하는 단계를 포함하는 방법이 제공된다.
용어 "당뇨병"은 타입 1 당뇨병, 타입 2 당뇨병 및 고혈당증을 야기하는 다른 상태를 포함한다.
용어 질병의 "치료"는 질병의 치료, 예방 또는 완화를 포함한다.
하기는 본 발명을 추가로 설명하는 양태의 목록이다:
1. 사람 인슐린의 3개의 이황화 결합이 보유되고, 시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식으로 선택되는, 인슐린에 부착된 2개 이상의 시스테인 치환 및 측쇄를 갖는 인슐린 유도체.
2. 양태 1에 있어서, 시스테인 치환의 부위는,
(1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고,
(2) 사람 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하는 방식으로 선택되는 것을 특징으로 하는 인슐린 유도체.
3. 양태 1 또는 양태 2에 있어서, 시스테인 치환의 부위는,
(1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고,
(2) 사람 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하고,
(3) 사람 인슐린 유도체는 사람 인슐린 및/또는 모인슐린에 비해 증가된 물리적 안정성을 갖는 방식으로 선택되는 것을 특징으로 하는 인슐린 유도체.
4. 상기 양태들 중 어느 한 양태에 있어서, 시스테인 치환의 부위는,
(1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고,
(2) 사람 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하고,
(3) 사람 인슐린 유도체는 단백질 분해에 대해 안정화되는 방식으로 선택되는 것을 특징으로 하는 인슐린 유도체.
5. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A9, A10, A11 및 A12로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기가 시스테인으로 치환되고, B-쇄의 B1, B2, B3, B4, B5 및 B6로 구성된 군으로부터 선택된 위치에서 적어도 하나의 아미노산 잔기가 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
6. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B1, B2, B3 및 B4로 구성된 군으로부터 선택된 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
7. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B3 및 B4로 구성된 군으로부터 선택된 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
8. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B3 위치에서 아미노산은 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
9. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B4 위치에서 아미노산은 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
10. 상기 양태들 중 어느 한 양태에 있어서, A-쇄의 A21 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B25 및 B26으로 구성된 군으로부터 선택된 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
11. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B1, B2, B3 및 B4로 구성된 군으로부터 선택된 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되며,
인슐린 유도체의 제거 반감기는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 연장되는 것을 특징으로 하는 인슐린 유도체.
12. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B3 및 B4로 구성된 군으로부터 선택된 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되며,
인슐린 유도체의 제거 반감기는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 연장되는 것을 특징으로 하는 인슐린 유도체.
13. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B3 위치에서 아미노산은 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되며,
인슐린 유도체의 제거 반감기는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 연장되는 것을 특징으로 하는 인슐린 유도체.
14. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B4 위치에서 아미노산은 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되며,
인슐린 유도체의 제거 반감기는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 연장되는 것을 특징으로 하는 인슐린 유도체.
15. 상기 양태들 중 어느 한 양태에 있어서, A-쇄의 A21 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B25 및 B26으로 구성된 군으로부터 선택된 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되며,
인슐린 유도체의 제거 반감기는 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 연장되는 것을 특징으로 하는 인슐린 유도체.
16. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 하나 이상의 추가 이황화 결합은 A-쇄와 B-쇄 사이에서 얻어지는 것을 특징으로 하는 인슐린 유도체.
17. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 하나 이상의 추가 이황화 결합은 A-쇄와 B-쇄 사이에서 얻어지는 것을 특징으로 하는 인슐린 유도체.
18. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 적어도 하나의 추가 이황화 결합은 A-쇄에서 2개의 시스테인을 연결하거나, 또는 B-쇄에서 2개의 시스테인을 연결하는 것을 특징으로 하는 인슐린 유도체.
19. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 수용체 결합의 적어도 1%인 것을 특징으로 하는 인슐린 유도체.
20. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 수용체 결합의 적어도 25%인 것을 특징으로 하는 인슐린 유도체.
21. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 수용체 결합의 적어도 50%인 것을 특징으로 하는 인슐린 유도체.
22. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 수용체 결합의 적어도 75%인 것을 특징으로 하는 인슐린 유도체.
23. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린 수용체와의 수용체 결합은 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체의 수용체 결합의 적어도 90%인 것을 특징으로 하는 인슐린 유도체.
24. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 모인슐린에 대해 개선된 물리적 안정성을 갖는 것을 특징으로 하는 인슐린 유도체.
25. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체보다 신장된 프로파일을 갖는 것을 특징으로 하는 인슐린 유도체.
26. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체에 대해 연장된 제거 반감기를 갖는 것을 특징으로 하는 인슐린 유도체.
27. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
28. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 적어도 하나의 추가 이황화 결합은 A-쇄에서 2개의 시스테인을 연결하거나, 또는 B-쇄에서 시스테인들을 연결하는 것을 특징으로 하는 인슐린 유도체.
29. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 2개의 시스테인 치환을 갖는 것을 특징으로 하는 인슐린 유도체.
30. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린은:
A10C, A14E, B1C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B1C, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B25A, desB30 사람 인슐린,
A10C, A14E, B2C, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B25H, desB27, desB30 사람 인슐린,
A10C, A14E, B3C, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, desB27, desB30 사람 인슐린,
A10C, A14E, B4C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B25A, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, B28E, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, desB27, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B25N, B27E, desB30 사람 인슐린,
A10C, A14E, B4C, B25N, desB27, desB30 사람 인슐린,
A10C, A14E, desB1, B4C, B25H, desB30 사람 인슐린,
A10C, A14H, B4C, B25H, desB30 사람 인슐린,
A10C, B3C, B25H, desB27, desB30 사람 인슐린,
A10C, B3C, B25H, desB30 사람 인슐린,
A10C, B4C, B25H, desB27, desB30 사람 인슐린,
A10C, B4C, B25H, desB30 사람 인슐린,
A10C, A14E, B1C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B16H, B25H, desB30 사람 인슐린으로 구성된 군으로부터 선택되고,
측쇄는 인슐린의 N-말단 또는 인슐린에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체.
31. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린은:
A10C, A14E, B1C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B1C, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B25A, desB30 사람 인슐린,
A10C, A14E, B2C, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B25H, desB27, desB30 사람 인슐린,
A10C, A14E, B3C, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, desB27, desB30 사람 인슐린,
A10C, A14E, B4C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B25A, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, B28E, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, desB27, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B25N, B27E, desB30 사람 인슐린,
A10C, A14E, B4C, B25N, desB27, desB30 사람 인슐린,
A10C, A14E, desB1, B4C, B25H, desB30 사람 인슐린,
A10C, A14H, B4C, B25H, desB30 사람 인슐린,
A10C, B3C, B25H, desB27, desB30 사람 인슐린,
A10C, B3C, B25H, desB30 사람 인슐린,
A10C, B4C, B25H, desB27, desB30 사람 인슐린,
A10C, B4C, B25H, desB30 사람 인슐린,
A10C, A14E, B1C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B16H, B25H, desB30 사람 인슐린으로 구성된 군으로부터 선택되고,
측쇄는 인슐린의 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체.
32. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린은:
A10C, A21G, B1G, B3C, B27E, desB30 사람 인슐린
A10C, A21G, B1G, B3E, B4C, B27E, desB30 사람 인슐린
A10C, A21G, B2C, B3E, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, B2C, B3E, B28E, desB30 사람 인슐린
A10C, A21G, B3C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, B3C, B28E, desB30 사람 인슐린
A10C, A21G, B3E, B4C, B22E, B28E, desB30 사람 인슐린
A10C, A21G, B3E, B4C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, B3E, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B3E, B4C, desB24, B28E, desB30 사람 인슐린
A10C, A21G, B3K, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B3Q, B4C, B28D, desB30 사람 인슐린
A10C, A21G, B3Q, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B4C, desB30 사람 인슐린
A10C, A21G, desB1, B2C, B3E, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, desB1, B2C, B3E, B28E, desB30 사람 인슐린
A10C, A21G, desB1, B3C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, desB1, B3C, B27E, desB30 사람 인슐린
A10C, A21G, desB1, B3C, B28E, desB30 사람 인슐린
A10C, A21G, desB1, B3E, B4C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, desB1, B3E, B4C, B28E, desB30 사람 인슐린
A10C, A21G, desB1, B3Q, B4C, B28E, desB30 사람 인슐린
A10C, A22K, B3C, desB27, desB30 사람 인슐린
A10C, B1C, B28D, desB30 사람 인슐린
A10C, B2C, B28D, desB30 사람 인슐린
A10C, B2C, B3A, desB30 사람 인슐린
A10C, B2C, B3D, desB30 사람 인슐린
A10C, B2C, B3E, desB30 사람 인슐린
A10C, B2C, B3F, desB30 사람 인슐린
A10C, B4C, B28D 사람 인슐린
A10C, B4C, B28D, desB30 사람 인슐린으로 구성된 군으로부터 선택되고,
측쇄는 인슐린의 N-말단 또는 인슐린에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체.
33. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 인슐린은:
A10C, A21G, B1G, B3C, B27E, desB30 사람 인슐린
A10C, A21G, B1G, B3E, B4C, B27E, desB30 사람 인슐린
A10C, A21G, B2C, B3E, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, B2C, B3E, B28E, desB30 사람 인슐린
A10C, A21G, B3C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, B3C, B28E, desB30 사람 인슐린
A10C, A21G, B3E, B4C, B22E, B28E, desB30 사람 인슐린
A10C, A21G, B3E, B4C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, B3E, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B3E, B4C, desB24, B28E, desB30 사람 인슐린
A10C, A21G, B3K, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B3Q, B4C, B28D, desB30 사람 인슐린
A10C, A21G, B3Q, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B4C, B28E, desB30 사람 인슐린
A10C, A21G, B4C, desB30 사람 인슐린
A10C, A21G, desB1, B2C, B3E, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, desB1, B2C, B3E, B28E, desB30 사람 인슐린
A10C, A21G, desB1, B3C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, desB1, B3C, B27E, desB30 사람 인슐린
A10C, A21G, desB1, B3C, B28E, desB30 사람 인슐린
A10C, A21G, desB1, B3E, B4C, B27E, B28K, desB29, desB30 사람 인슐린
A10C, A21G, desB1, B3E, B4C, B28E, desB30 사람 인슐린
A10C, A21G, desB1, B3Q, B4C, B28E, desB30 사람 인슐린
A10C, A22K, B3C, desB27, desB30 사람 인슐린
A10C, B1C, B28D, desB30 사람 인슐린
A10C, B2C, B28D, desB30 사람 인슐린
A10C, B2C, B3A, desB30 사람 인슐린
A10C, B2C, B3D, desB30 사람 인슐린
A10C, B2C, B3E, desB30 사람 인슐린
A10C, B2C, B3F, desB30 사람 인슐린
A10C, B4C, B28D 사람 인슐린
A10C, B4C, B28D, desB30 사람 인슐린으로 구성된 군으로부터 선택되고,
측쇄는 인슐린의 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체.
34. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 측쇄는 인슐린의 N-말단 또는 인슐린에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체.
35. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 측쇄는 인슐린의 B-쇄에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체.
36. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 측쇄는 Acy-AA1n-AA2m-AA3p- 화학식의 아실 부분인 것을 특징으로 하는 인슐린 유도체.
37. 상기 양태들 중 어느 한 양태에 있어서, 가능한 연장으로, 실시예에서 언급된 인슐린 유도체로 구성된 군으로부터 선택되는 것을 특징으로 하는 인슐린 유도체.
38. 인슐린의 2개 이상의 아미노산을 시스테인 잔기로 치환하는 단계 및 측쇄를 인슐린에 부착하는 단계를 포함하는 인슐린의 안정화 방법으로서,
a. 사람 인슐린의 3개의 이황화 결합이 보유되고
b. 시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식으로 선택되어,
이로써 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합을 포함하는 인슐린 유도체의 제조 방법.
39. 양태 1 내지 양태 37 중 어느 한 양태에 따른 인슐린 유도체의 생물학적으로 활성인 양 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물.
40. 양태 39에 있어서, 약학적 허용가능한 담체 및/또는 부형제, 및 선택적으로 보조제를 더 포함하는 것을 특징으로 하는 약학적 조성물.
41. 양태 1 내지 양태 37 중 어느 한 양태에 따른 인슐린 유도체 또는 양태 39 내지 양태 40 중 어느 한 양태에 따른 약학적 조성물을 대상에 투여하는 단계를 포함하는 대상에서 진성 당뇨병의 치료 방법.
42. 양태 1 내지 양태 37 중 어느 한 양태에 따른 인슐린 유도체 또는 양태 39 내지 양태 40 중 어느 한 양태에 따른 약학적 조성물의 치료적 활성 투여량을 이러한 치료를 필요로 하는 환자에게 투여함으로써 포유동물에서 혈액 글루코스 수준을 감소시키는 방법.
43. 고혈당증, 타입 2 당뇨병, 손상된 글루코스 내성 및 타입 1 당뇨병을 치료 또는 예방하는 약학적 조성물로서 사용하기 위한 양태 1 내지 양태 37 중 어느 한 양태에 따른 인슐린 유도체.
44. 타입 2 당뇨병의 질병 진행을 지연시키거나 예방하는 약학적 조성물로서 사용하기 위한 양태 1 내지 양태 37 중 어느 한 양태에 따른 인슐린 유도체.
45. 양태 1 내지 양태 37 중 어느 한 양태에 따른 인슐린 유도체를 약학적으로 허용가능한 물질 및/또는 부형제와 혼합하는 단계를 포함하는 양태 39 내지 양태 40 중 어느 한 양태에 따른 약학적 조성물의 제조 방법.
46. 양태 45에 따른 방법에 의해 얻을 수 있는 약학적 조성물.
본원에서 인용된 공보, 특허 출원, 및 특허를 포함하는 모든 참고는 각 참고가 참조로 포함되도록 개별적으로 그리고 구체적으로 나타낸 것처럼 그것들의 전체 및 동일한 정도로 참조로 본원에 포함되며, 그것들의 전체가 본원에(법에 의해 허용되는 최대 정도로) 제시된다.
모든 주제 및 부제는 본원에서 단지 편의를 위해 사용되며 본 발명을 어떤 방식으로 제한하는 것으로 해석되어선 안 된다.
본원에 제공된 어떤 예 및 모든 예들, 또는 예시적인 언어(예를 들어, "같은")의 사용은 단지 본 발명을 더욱더 잘 설명하도록 의도되고, 달리 청구되지 않는 한 본 발명의 범위에 제한을 제기하지 않는다. 명세서에서의 어떤 언어도 본 발명의 실시에 본질적인 어떤
비청구
요소를 나타내는 것으로 해석되지 않는다.
본원에서 특허 문서의 인용 및 혼합은 단지 편의를 위해 수행되고, 이러한 특허 문서의 타당성, 특허 가능성, 시행 가능성의 어떤 관점으로도 반영하지 않는다.
본 발명은 본원에 적용가능한 법에 의해 허용되는 첨부된 청구 범위에서 열거된 대상 문제의 모든 변형 및 등가물을 포함한다.
실시예
하기 실시예들은 제한이 아닌 설명으로써 제공된다.
본원에 사용된 약어는 하기와 같다: bAla는 베타-알라닐이고, Aoc는 8-아미노옥탄산이고, tBu는 tert-부틸이고, DCM은 디클로로메탄이고, DIC는 디이소프로필카르보디이미드이고, DIPEA = DIEA는 N,N-디이소프로필에틸아민이고, DMF는 N,N-디메틸포름아미드이고, DMSO는 디메틸 술폭시드이고, EtOAc는 에틸 아세테이트이고, Fmoc는 9-플루오렌일메틸옥시카르보닐이고, γGlu는 감마 L-글루타밀이고, HCl은 염산이고, HOBt는 1-히드록시벤조트리아졸이고, NMP는 N-메틸피롤리돈이고, MeCN은 아세토니트릴이고, OEG는 [2-(2-아미노에톡시)에톡시]에틸카르보닐이고, Su는 숙신이미딜-1-일 = 2,5-디옥소-피롤리딘-1-일이고, OSu는 숙신이미딜-1-일옥시 = 2,5-디옥소-피롤리딘-1-일옥시이고, RPC는 역상 크로마토그래피이고, RT는 실온이고 TFA는 트리플루오로아세트산이고, THF는 테트라히드로푸란이고, TNBS는 2,4,6-트리니트로벤젠술폰산이고, TRIS는 트리스(히드록시메틸)아미노메탄이고, TSTU는 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트이다.
하기 실시예 및 일반적인 과정은 명세서에서 그리고 합성 도식에서 동일화된 중간 화합물 및 최종 생성물을 의미한다. 본 발명의 화합물의 제조는 하기 실시예를 사용하여 상세히 기술되지만, 기술된 화학 반응은 본 발명의 화합물의 제조에 대한 그것의 일반적인 적용에 관하여 기술된다. 때때로, 반응은 본 발명의 개시된 범위 내에 포함된 각 화학물에 기술된 바와 같이 적용될 수 없다. 이것이 일어나는 화합물은 당업자에 의해 쉽게 인식될 것이다. 이 경우에서 반응은, 당업자에게 알려진 종래의 변형에 의해, 즉, 방해 군의 적당한 보호에 의해, 다른 종래의 시약으로의 변화에 의해, 또는 반응 조건의 일상적인 변형에 의해, 성공적으로 수행될 수 있다. 대안으로, 본원에 또는 달리 종래에 개시된 다른 반응은 본 발명의 화합물을 대응하는 제조에 적용가능할 것이다. 모든 예비 방법에서, 모든 시작 재료는 알려져 있거나 알려진 시작 재료로부터 쉽게 제조될 수 있다. 모든 온도는 달리 나타내지 않는 한 섭씨 온도로 제시되고, 수득률을 언급할 때 모든 부분 및 백분율은 중량으로 나타내며, 용매 및 용리액을 언급할 때 모든 부분은 부피로 나타낸다.
본 발명의 화합물은 종래에 전형적인 하기 과정 중 한가지 이상을 사용함으로써 정제될 수 있다. 이들 과정은, 필요하면, 구배, pH, 염, 농도, 유속, 컬럼 등에 관해 변형될 수 있다. 문제 등에서 불순물 프로파일, 인슐린의 용해도와 같은 인자에 따라서, 이들 변형은 당업자에 의해 쉽게 인식되고 실행될 수 있다.
산성 HPLC 또는 탈염 후, 화합물은 순수 분획의 동결건조에 의해 분리된다.
중성 HPLC 또는 음이온 교환 크로마토그래피 후, 화합물은, 예를 들어 크기 배제 크로마토그래피에 의해 탈염되거나, 등전위 pH에서 침전되거나, 또는 산성 HPLC에 의해 탈염된다.
전형적인 정제 과정:
HPLC 시스템은 Model 215 Liquid 핸들러, Model 322-H2 Pump 및 Model 155 UV Dector로 구성된 Gilson 시스템이다. 검출은 전형적으로 210 nm 및 280 nm에서 수행한다.
Akta Purifier FPLC 시스템(Amersham Biosciences)은 Model P-900 Pump, Model UV-900 UV 검출기, Model pH/C-900 pH 및 전도도 검출기, Model Frac-950 Frction 수집기로 구성된다. UV 검출은 전형적으로 214 nm, 254 nm 및 276 nm에서 수행한다.
산성
HPLC
:
컬럼: Macherey-Nagel SP 250/21 Nucleusil 300-7 C4
유속: 8 mL/분
완충용액 A: 아세토니트릴 중의 0.1% TFA
완충용액 B: 물 중의 0.1% TFA
구배: 0.0 - 5.0분: 10% A
5.00 - 30.0분: 10% A 내지 90% A
30.0 - 35.0분: 90% A
35.0 - 40.0분: 100% A
중성
HPLC
:
컬럼: Phenomenex, Jupiter, C4, 5 ㎛ 250 × 10.00 mm, 300 Å
유속: 6 mL/분
완충용액 A: 5 mM TRIS, 7.5 mM (NH4)2SO4, pH=7.3, 20% CH3CN
완충용액 B: 60% CH3CN, 40% 물
구배: 0 - 5분: 10% B
5 - 35분: 10 - 60% B
35 - 39분: 60% B
39 - 40분: 70% B
40 - 43.5분: 70% B
음이온 교환 크로마토그래피:
컬럼: RessourceQ, 1 mL
유속: 6 mL/분
완충용액 A: 0.09% NH4HCO3, 0.25% NH4OAc, 42.5% 에탄올 pH 8.4
완충용액 B: 0.09% NH4HCO3, 2.5% NH4OAc, 42.5% 에탄올 pH 8.4
구배: 30 컬럼 부피 동안에 100% A 내지 100% B
탈염
:
컬럼: HiPrep 26/10
유속: 10 mL/분, 6 컬럼 부피
완충용액: 10 mM NH4HCO3
화학식 (
II)
의
아실화
시약의 고체상 합성을 위한 일반적인 과정:
(II): Acy-AA1n-AA2m-AA3p-Act,
여기서 Acy, AA1, AA2, AA3, n, m, 및 p는 상기 정의된 바와 같고, Act는 활성 에스테르, 예컨대 N-히드록시숙신이미드(OSu), 또는 1-히드록시벤조트리아졸의 이탈기이고,
아실 부분의 Acy 및 AA2 부분 내의 카르복시산은 tert-부틸 에스테르로서 보호된다.
본 발명에 따른 화학식 (II)의 화합물은 고체상 펩티드 합성의 당업자에게 잘 알려진 과정을 사용하여 고체 지지체에서 합성될 수 있다. 이 과정은 Fmoc 보호 아미노산의 폴리스티렌 2-클로로트리틸클로라이드 수지에 부착을 포함한다. 부착은, 예를 들어 트리에틸 아민 또는 N,N-디이소프로필에틸아민 같이 3차 아민의 존재하에 유리 N-보호 아미노산을 사용하여 달성될 수 있다(아래 참고들 참조). 이러한 아미노산의 C-말단 단부(수지에 부착됨)는 본 발명의 모인슐린과 커플링되는 합성 서열의 단부이다. Fmoc 아미노산을 수지에 부착한 후, Fmoc기는, 예를 들어 피페리딘 또는 디에틸 아민 같이 2차 아민을 사용하여, 이어서 다른(또는 동일한) Fmoc 보호 아미노산과 탈보호를 커플링하여 탈보호된다. 합성 서열은 헥사데칸2산, 헵타데칸2산, 옥타데칸2산 또는 에이코산2산 모노-tert-부틸 에스테르 같이 모노-tert-부틸 보호된 지방(α, ω)2산의 커플링에 의해 종료된다. 수지로부터 화합물의 분할은 0.5-5% TFA/DCM(디클로로메탄 중의 트리플루오로아세트산), 아세트산(예를 들어, DCM 중의 10%, 또는 HOAc/트리플루오로에탄올/DCM 1:1:8), 또는 DCM 중의 헥사플루오로이소프로판올(예를 들어, "Organic Synthesis on Solid Phase", F.Z. Dorwald, Wiley-VCH, 2000. ISBN 3-527-29950-5, "Peptides: Chemistry 및 Biology", N. Sewald & H.-D. Jakubke, Wiley-VCH, 2002, ISBN 3-527-30405-3 또는 "The Combinatorial Cheemistry Catalog" 1999, Novabiochem AG, 및 거기에 인용된 참고들 참조) 같은 희석된 산을 사용하여 달성된다. 이것은 카르복시산 보호기로서 화합물에 존재하는 tert-부틸 에스테르가 탈보호되지 않은 것을 보증한다. 최종으로, C-말단 카르복시기(수지로부터 자유로움)는, 예를 들어 N-히드록시숙신이미드 에스테르(OSu)로서 활성화되고, 본 발명의 모인슐린에 부착에 커플링 시약으로서 직접적으로 또는 정제 후에 사용된다.
대안으로, 상기의 화학식 (II)의 아실화 시약은 아래 기술된 바와 같이 용액상 합성에 의해 제조될 수 있다.
모노-tert-부틸 보호 지방이산, 예컨대 헥사데칸2산, 헵타데칸2산, 옥타데칸2산 또는 에이코산2산 모노-tert-부틸 에스테르는, 예를 들어 아래 기술된 바와 같은 OSu-에스테르로서, 또는 당업자에게 알려진 어떤 다른 활성화된 에스테르, 예컨대 HOBt- 또는 HOAt-에스테르로서 활성화된다. 이 활성 에스테르는 DIPEA 또는 트리에틸아민과 같은 적합한 염기의 존재하에 THF, DMF, NMP(또는 용매 혼합물)와 같은 적합한 용매에서 아미노산 AA1, 모노-tert-부틸 보호 AA2, 또는 AA3 중 하나와 커플링된다. 중간체는, 예를 들어 추출 과정 또는 크로마토그래피 과정에 의해 분리된다. 결과된 중간체는 다시 활성화(상기 기술된 바와 같음), 그리고 상기 기술된 바와 같이 아미노산 AA1, 모노-tert-부틸 보호 AA2, 또는 AA3 중 하나와 커플링을 받는다. 이 과정은 원하는 보호된 중간체 Acy-AA1n-AA2m-AA3p-OH를 얻을 때까지 반복된다. 이것은 차례로 활성화되어 화학식 (II) Acy-AA1n-AA2m-AA3p-Act의 아실화 시약을 얻는다.
상기 방법 중 어떤 것에 의해 제조된 아실화 시약은 OSu 에스테르로서 활성화 후에 탈보호(tert-부틸)될 수 있다. 이것은 OSu-활성화 tert-부틸 보호 아실화 시약의 TFA 처리에 의해 수행될 수 있다. 어떤 프로테아제 안정화 인슐린의 아실화 후, 본 발명의 결과된 비보호 아실화 프로테아제 안정화 인슐린이 얻어진다.
상기 방법 중 어떤 것에 의해 제조된 시약이 OSu 에스테르로서 활성화 후 탈보호(tert-부틸)되지 않으면, 어떤 프로테아제 안정화 인슐린의 아실화는 대응하는 본 발명의 tert-부틸 보호 아실화 프로테아제 안정화 인슐린을 얻는다. 본 발명의 비보호 아실화 프로테아제 안정화 인슐린을 얻기 위해, 보호 인슐린은 탈보호된다. 이것은 TFA 처리에 의해 수행되어 본 발명의 비보호 아실화 프로테아제 안정화 인슐린을 얻을 수 있다.
사람 인슐린 또는 인슐린 유사체의 리신 잔기(엡실론 위치에서)의 아실화는 알칼리 pH에서(예를 들어, pH 10, 10.5, 11, 11.5, 또는 12에서) 수행된다.
일반 절차 A는 제 1의 실시예에서 예시된다.
실시예
1, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
A10C, B4C, A14E, B25H,desB30 사람 인슐린(2 g)을 100 mM 수성 Na2CO3(50 mL)에 용해시키고, NMP(3 mL)를 첨가하였다. pH를 1N NaOH로 11.2로 조정하였다. NMP(6 mL)에 용해된 옥타데칸디오일-gGlu-OEG-OEG-OSu(0.8 g, 1.4 당량)를 pH 약 11에서 유지하는 1N NaOH와 함께 동시에 첨가하였다. 5분 후, 물(40 mL)을 첨가하고, pH를 1 N HCl을 첨가함으로써 5.5로 낮추었다. 침전물을 원심분리에 의해 분리하였다. 잔류물을 아세토니트릴(30 mL) 및 1% TFA(30 mL)를 함유하는 물에 용해시키고, HPLC에 의해 4회 가동으로 정제하였다:
컬럼: Phenomenex, Gemini, 5μ, C18, 110 Å, 250×30 cm
유속: 20 mL/분
용리액: A: 물 중의 0.1% TFA; B: 아세토니트릴 중의 0.1% TFA
구배:
0 - 7.5분: 10% B,
7.5 - 87.5분: 10% B 내지 60% B,
87.5 - 92.5분: 60% B
92.5 - 97.5분: 60% B 내지 100% B
97.5 - 100분: 100% B
100 - 103분: 10% B
순수 분획들을 모으고 동결건조하였다. 건조 재료를 물(200 mL)에 용해시키고, 0.1 N NaOH를 첨가하여 pH = 8.1로 조정하고 동결건조하여 1 g의 제목 인슐린 유도체를 얻었다.
MALDI-MS: m/z: 6340; 계산값: 6341.
LC-MS(전기분무): m/z = 1586.04(M+4)/4(6340)
실시예
2, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N(
eps
)옥타데칸디오일-
gGlu
),
desB30
사람 인슐린
IUPAC
(
OpenEye
,
IUPAC
식)명:
N{엡실론-B29}-[(4S)-4-
카르복시
-4-(17-
카르복시헵타데카노일아미노
)
부타노일
]-[
CysA10
,
GluA14
,
CysB3
,
HisB25
],
des
-
ThrB30
-인슐린(사람)
LCMS
(전기분무): m/z = 1517.0(M+4)/4(6064)
실시예
3, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
옥타데칸디오일
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-17-카르복시헵타데카노일-[CysA10,CysB3,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1485.0(5935.9). 계산값: 1484.8
실시예
4, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,CysB3,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1525.8(6099.1). 계산값: 1525.8
실시예
5, 일반 절차 A:
A10C, A14E,
desB1
, B4C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-2
xOEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-PheB1,ThrB30-인슐린(사람)-(A)-펩티드,(B2-B29)-펩티드
MS(전기분무) m/4: m/z = 1549.4(6193.6). 계산값: 1549.3
하기 유도체를 유사하게 제조하였다:
실시예
6, 일반 절차 A:
A10C, A14H, B4C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,HisA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
하기 유사체를 유사하게 제조하였다:
실시예
7, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
에이코산디오일
-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1597.6(6386.4). 계산값: 1597.5
실시예
8, 일반 절차 A:
A10C, A14E, B1C, B25H, B29K(N
ε
에이코산디오일
-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB1,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1588.9(6351.6). 계산값: 1588.8
실시예
9, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1514.1(6351.6). 계산값: 1513.8
실시예
10, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1589.6(6355.4). 계산값: 1589.9
실시예
11, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]부타노일]-[CysA10,GluA14,CysB3,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1549.2(6194.2). 계산값: 1549.6
실시예
12, 일반 절차 A:
A10C, A14E, B4C, B25H,
desB27
, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB27,ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1488(5948). 계산값: 1488
실시예
13, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
옥타데칸디오일
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-17-카르복시헵타데카노일-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1481.9(5921.9). 계산값: 1481.5
실시예
14, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1546.1(6180.2). 계산값: 1545
실시예
15, 일반 절차 A:
A10C, A14E, B2C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB2,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1593.6(6370.4). 계산값: 1593.6
실시예
16, 일반 절차 A:
A10C, A14E, B1C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB1,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1581.5(6322.1). 계산값: 1581.5
실시예
17, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1590.5(6357.8). 계산값: 1590.5
실시예
18, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
미리스틸
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-테트라데카노일-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1460.0(5835.8). 계산값: 1460.0
실시예
19, 일반 절차 A:
A10C, B4C, B29K(N
ε
미리스틸
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-테트라데카노일-[CysA10,CysB4],des-ThrB30-인슐린(사람)
MS(전기분무) m/3: m/z = 1961.4(5881.2). 계산값: 1961.4
실시예
20, 일반 절차 A:
A10C, A14E, B3C, B25H,
desB27
, B29K(N(
eps
)옥타데칸디오일-
gGlu
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB25],des-ThrB27,ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1492.2(5964.0). 계산값: 1492.0
실시예
21, 일반 절차 A:
A10C, A14E, B3C, B25H,
desB27
, B29K(N(
eps
)옥타데칸디오일-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB25],des-ThrB27,ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1564.7(6254.3). 계산값: 1564.6
실시예
22, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
에이코산디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1524.4(6093.1). 계산값: 1524.3
실시예
23, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N(
eps
)에이코산디오일-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1593.2(6369.4). 계산값: 1593.4
실시예
24, 일반 절차 A:
A10C, A14E, B3C, B25H,
desB27
, B29K(N(
eps
)에이코산디오일-
gGlu
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB25],des-ThrB27,ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1499.1(5992.0). 계산값: 1499.0
실시예
25, 일반 절차 A:
A10C, A14E, B3C, B25H,
desB27
, B29K(N(
eps
)에이코산디오일-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB25],des-ThrB27,ThrB30-인슐린(사람)
MS(전기분무) m/4: m/z = 1571.8(6282.3). 계산값: 1571.6
유사하게, 하기 유사체를 제조할 수 있다:
실시예
26, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
실시예
27, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
실시예
28, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
헥사데칸디오일
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-15-카르복시펜타데카노일-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
실시예
29, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
실시예
30, 일반 절차 A:
A10C, A14E, B4C, B25H,
desB27
, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
31, 일반 절차 A:
A10C, A14E, B4C, B25H,
desB27
, B29K(N
ε
옥타데칸디오일
-
gGlu
-
gGlu
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
32, 일반 절차 A:
A10C, A14E, B4C, B25H,
desB27
, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
33, 일반 절차 A:
A10C, A14E, B4C, B25H,
desB27
, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
34, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB25],des-ThrB30-인슐린(사람)
실시예
35, 일반 절차 A:
A10C, A14E, B3C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB25],des-ThrB30-인슐린(사람)
실시예
36, 일반 절차 A:
A10C, A14E, B2C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB2,HisB25],des-ThrB30-인슐린(사람)
실시예
37, 일반 절차 A:
A10C, A14E, B2C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB2,HisB25],des-ThrB30-인슐린(사람)
실시예
38, 일반 절차 A:
A10C, A14E, B2C, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB2,HisB25],des-ThrB30-인슐린(사람)
실시예
39, 일반 절차 A:
A10C, A14E, B1C, B25H, B29K(
N
e
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB1,HisB25],des-ThrB30-인슐린(사람)
실시예
40, 일반 절차 A:
A10C, A14E, B1C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB1,HisB25],des-ThrB30-인슐린(사람)
실시예
41, 일반 절차 A:
A10C, A14E, B1C, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB1,HisB25],des-ThrB30-인슐린(사람)
실시예
42, 일반 절차 A:
A10C, B1C, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB1],des-ThrB30-인슐린(사람)
실시예
43, 일반 절차 A:
A10C, B1C, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,CysB1],des-ThrB30-인슐린(사람)
실시예
44, 일반 절차 A:
A10C, B1C, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB1],des-ThrB30-인슐린(사람)
실시예
45, 일반 절차 A:
A10C, B1C, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,CysB1],des-ThrB30-인슐린(사람)
실시예
46, 일반 절차 A:
A10C, B2C, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB2],des-ThrB30-인슐린(사람)
실시예
47, 일반 절차 A:
A10C, B2C, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,CysB2],des-ThrB30-인슐린(사람)
실시예
48, 일반 절차 A:
A10C, B2C, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB2],des-ThrB30-인슐린(사람)
실시예
49, 일반 절차 A:
A10C, B2C, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,CysB2],des-ThrB30-인슐린(사람)
실시예
50, 일반 절차 A:
A10C, B3C, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,CysB3],des-ThrB30-인슐린(사람)
실시예
51, 일반 절차 A:
A10C, B3C, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB3],des-ThrB30-인슐린(사람)
실시예
52, 일반 절차 A:
A10C, B3C, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB3],des-ThrB30-인슐린(사람)
실시예
53, 일반 절차 A:
A10C, B3C, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,CysB3],des-ThrB30-인슐린(사람)
실시예
54, 일반 절차 A:
A10C, B4C, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,CysB4],des-ThrB30-인슐린(사람)
실시예
55, 일반 절차 A:
A10C, B4C, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB4],des-ThrB30-인슐린(사람)
실시예
56, 일반 절차 A:
A10C, B4C, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,CysB4],des-ThrB30-인슐린(사람)
실시예
57, 일반 절차 A:
A10C, B4C, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,CysB4],des-ThrB30-인슐린(사람)
실시예
58, 일반 절차 A:
A10C, A14E, B1C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
-2
xOEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB1,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
59, 일반 절차 A:
A10C, A14E, B1C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB1,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
60, 일반 절차 A:
A10C, A14E, B1C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB1,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
61, 일반 절차 A:
A10C, A14E, B1C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB1,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
62, 일반 절차 A:
A10C, A14E, B1C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB1,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
63, 일반 절차 A:
A10C, A14E, B1C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB1,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
64, 일반 절차 A:
A10C, A14E, B2C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB2,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
65, 일반 절차 A:
A10C, A14E, B2C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB2,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
66, 일반 절차 A:
A10C, A14E, B2C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB2,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
67, 일반 절차 A:
A10C, A14E, B2C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB2,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
68, 일반 절차 A:
A10C, A14E, B2C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB2,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
69, 일반 절차 A:
A10C, A14E, B2C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB2,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
70, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
71, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
72, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
73, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
74, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
75, 일반 절차 A:
A10C, A14E, B4C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
76, 일반 절차 A:
A10C, A14E, B4C, B16H, B25H, B29K(N
ε
헥사데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
77, 일반 절차 A:
A10C, A14E, B4C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
78, 일반 절차 A:
A10C, A14E, B4C, B16H, B25H, B29K(N
ε
옥타데칸디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
79, 일반 절차 A:
A10C, A14E, B4C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
-
OEG
-
OEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
80, 일반 절차 A:
A10C, A14E, B4C, B16H, B25H, B29K(N
ε
에이코산디오일
-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
81, 일반 절차 A:
A10C, A14E, B1C, B25H, B29K(N(
eps
)에이코산디오일-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB1,HisB25],des-ThrB30-인슐린(사람)
실시예
82, 일반 절차 A:
A10C, A14E, B2C, B25H, B29K(N(
eps
)에이코산디오일-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB2,HisB25],des-ThrB30-인슐린(사람)
실시예
83, 일반 절차 A:
A10C, A14E, B2C, B25H, B29K(N(
eps
)에이코산디오일-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB2,HisB25],des-ThrB30-인슐린(사람)
실시예
84, 일반 절차 A:
A10C, A14E, B4C, B25H,
desB27
, B29K(N(
eps
)에이코산디오일-
gGlu
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
85, 일반 절차 A:
A10C, A14E, B4C, B25H,
desB27
, B29K(N(
eps
)에이코산디오일-
gGlu
-2
xOEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
86, 일반 절차 A:
A10C, A14E, B4C, B25H, B29K(N(
eps
)에이코산디오일-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB4,HisB25],des-ThrB30-인슐린(사람)
실시예
87, 일반 절차 A:
A10C, A14E, B3C, B25H,
desB27
, B29K(N(
eps
)헥사데칸디오일-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB3,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
88, 일반 절차 A:
A10C, A14E, B3C, B25H,
desB27
, B29K(N(
eps
)헥사데칸디오일-
gGlu
-2
xOEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,HisB25],des-ThrB27,ThrB30-인슐린(사람)
실시예
89, 일반 절차 A:
A10C, A14E, B3C,
desB27
, B29K(N(
eps
)헥사데칸디오일-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]-[CysA10,GluA14,CysB3],des-ThrB27,ThrB30-인슐린(사람)
실시예
90, 일반 절차 A:
A10C, A14E, B3C,
desB27
, B29K(N(
eps
)헥사데칸디오일-
gGlu
-2
xOEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(15-카르복시펜타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3],des-ThrB27,ThrB30-인슐린(사람)
실시예
91, 일반 절차 A:
A10C, A14E, B3C,
desB27
, B29K(N(
eps
)옥타데칸디오일-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]-[CysA10,GluA14,CysB3],des-ThrB27,ThrB30-인슐린(사람)
실시예
92, 일반 절차 A:
A10C, A14E, B3C,
desB27
, B29K(N(
eps
)옥타데칸디오일-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(17-카르복시헵타데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3],des-ThrB27,ThrB30-인슐린(사람)
실시예
93, 일반 절차 A:
A10C, A14E, B3C,
desB27
, B29K(N(
eps
)에이코산디오일-
gGlu
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]-[CysA10,GluA14,CysB3],des-ThrB27,ThrB30-인슐린(사람)
실시예
94, 일반 절차 A:
A10C, A14E, B3C,
desB27
, B29K(N(
eps
)에이코산디오일-
gGlu
-2
xOEG
),
desB30
사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3],des-ThrB27,ThrB30-인슐린(사람)
실시예
95, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N(
eps
)에이코산디오일-2
xgGlu
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]부타노일]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
96, 일반 절차 A:
A10C, A14E, B3C, B16E, B25H, B29K(N(
eps
)에이코산디오일-
gGlu
-2
xOEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB3,GluB16,HisB25],des-ThrB30-인슐린(사람)
실시예
97, 일반 절차 A:
A10C, A14E, B4C, B16E, B25H, B29K(N(
eps
)에이코산디오일-
gGlu
-2
xOEG
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]에톡시]에톡시]아세틸]아미노]에톡시]에톡시]아세틸]-[CysA10,GluA14,CysB4,GluB16,HisB25],des-ThrB30-인슐린(사람)
실시예
98, 일반 절차 A:
A10C, A14E, B3C, B16H, B25H, B29K(N(
eps
)에이코산디오일-2
xgGlu
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]부타노일]-[CysA10,GluA14,CysB3,HisB16,HisB25],des-ThrB30-인슐린(사람)
실시예
99, 일반 절차 A:
A10C, A14E, B4C, B16E, B25H, B29K(N(
eps
)에이코산디오일-2
xgGlu
), desB30 사람 인슐린
IUPAC(OpenEye, IUPAC식)명:
N{엡실론-B29}-[(4S)-4-카르복시-4-[[(4S)-4-카르복시-4-(19-카르복시노나데카노일아미노)부타노일]아미노]부타노일]-[CysA10,GluA14,CysB4,GluB16,HisB25],des-ThrB30-인슐린(사람)
실시예
100,
인슐린 수용체 결합:
인슐린 수용체 결합
어세이
(
가용화
인슐린 수용체에서)
사람 인슐린 수용체를 위한 본 발명의 인슐린 유도체의 친화도를 Scintillation Proximity Assay(SPA)(Glendorf et al . (2008), Biochemistry, 47, 4743-4751에 따름)에 의해 측정하였다. 경쟁 결합 실험을 사람 IR-A 또는 IR-B 삽입물을 함유하는 pZem 벡터로 안정하게 형질전환된 아기 햄스터 신장(BHK) 세포로부터 밀 배아 응집소 정제에 의해 반정제된 가용화 사람 IR(완전수용체)을 사용하여 Eppendorf epMotion 5075 로봇에서 96-웰 플레이트(폴리스티렌 Optiplate-96, PerkinElmer)에서 수행하였다. 인슐린 유도체 및 사람 인슐린 표준을 함유하는 효모 상층액의 희석 시리즈(8개의 희석, 각 5배, 제 1의 희석 43배)를 만듦으로써 어세이를 초기화하였다. 결합 완충용액에 재부유된 SPA 비드(SPA PVT 항체-결합 비드, 항-마우스 시약 Cat. No. RPNQ0017, GE Healthcare), 항-IR 단일클론성 마우스 항체(83-7), 가용화 사람 IR(hIR-A 또는 hIR-B), 및 [125I]A14Tyr-라벨 인슐린으로 구성된 시약 혼합을 적당한 샘플의 희석 시리즈에 첨가하였다. [125I]A14Tyr-라벨 인슐린의 최종 농도는 7.5 pM이고, 완충용액은 100 mM HEPES(pH7.8), 100 mM NaCl, 10 mM MgSO4, 및 0.025%(v/v) Tween 20으로 구성되었다. 플레이트를 실온에서 24시간 동안 부드럽게 교반하며 배양시키고, 2000 rpm에서 2분 동안 원심분리하고, 3 분/웰 동안 TopCount NXT에서 셌다. SPA로부터의 데이터를 4-파라미터 로지스틱 모델(Volund, A., (1978), Biometrics, 34, 357-365)에 따라 분석하고, 인슐린 유도체의 친화도를 사람 인슐린의 그것에 대해 표현하였다.
또한 이 어세이를 생리적 조건을 모방하기 위해 어세이 완충용액에서 1.5% HSA로 구동하였다.
단일클론성 mIR 항체의 제조
특이적 항체(F12 또는 83-7)를 단일클론성 기술에 의해 제조하였다: RBF 마우스를 피하로 FCA 중의 50 g의 정제된 mIR을 주사, 이어서 FIA 중의 20 g의 mIR로 2회 주사에 의해 면역화시켰다. 높은 반응자 마우스를 정맥주사로 25 g의 mIR로 촉진시키고, 비장을 3일 후에 수확하였다. 비장 세포를 골수종 폭스 세포주로 융합시켰다(Kohler, G & Milstein C. (1976), European J. Immunology, 6:511-19; Taggart RT et al (1983), Science 219:1228-30). 상층액을 mIR 특이적 ELISA에서 항체 생성에 대해 검사하였다. 양성 웰을 복제하고 웨스턴 블롯으로 시험하였다.
인슐린 수용체 결합
어세이
(막-관련 인슐린 수용체에서)
[125I]-사람 인슐린의 막-관련 재조합 사람 인슐린 수용체 이소형 A(hIR-A)에 결합
막-관련 인슐린 수용체의 추출: 10층 세포 공장으로부터 사람 인슐린 수용체 이소형 A를 발현하는 BHK 세포(tk-ts13)를 수확하고, 25 mL의 얼음-냉각 완충용액(25 mM HEPES pH 7.4, 2.5 mM CaCl2, 1 mM MgCl2, 250 mg/L 바시트라신, 0.1 mM Pefablock(Roche))에서 균질화한다. 균질물을 41%의 수크로스 쿠션에 주의하여 층을 쌓고, 초원심분리기, Beckman SW28 회전자에서 4℃에서 95,000 x g으로 75분 동안 원심분리하였다. 혈장막을 수크로스 쿠션 상부로부터 수집하고, 완충용액과 1:4로 희석하고, Beckman SW28 회전자에서 40,000 x g으로 45분 동안 원심분리하였다. 펠릿을 완충용액(25 mM HEPES pH 7.4, 2.5 mM CaCl2, 1 mM MgCl2, 250 mg/L 바시트라신, 0.1 mM Pefablock)에서 부유시키고 -80℃에서 저장하였다.
막-관련 인슐린 수용체에 방사리간드 결합을 96-웰 OptiPlates(Perkin Elmer)에서 복제에서 수행하였다. 막 단백질을 200 mL의 전체 부피의 어세이 완충용액(50 mM HEPES, 150 mM NaCl, 5 mM MgSO4, 0.01% Triton X-100, 0.1% HSA(지방산 없음), Complete™ EDTA-없는 프로테아제 억제제)에서 50 pM [125I-TyrA14]-사람 인슐린과 25℃에서 150분 동안 배양시키고, 사람 인슐린 또는 인슐린 유도체(전형적으로 0.01 내지 300 nM), 및 1 mg의 WGA-코팅 PVT 미소구체(GE Healthcare)의 농도를 증가시켰다. 어세이를 2000 RPM에서 2분 동안 플레이트의 원심분리에 의해 종료시키고, 결합 방사활성을 60분의 지연 후 Packard TopCount NXT에서 셈으로써 정량하였다.
결합 데이터를 GraphPad Prism 5.02(GraphPad Software, San Diego, CA)에서 4-파라미터 S자형 회귀 알고리즘을 사용하여 맞추었다. 결과는 사람 인슐린에 대한 IC50로서 %로 주어진다.
인슐린 수용체 친화도:
본 발명의 인슐린 유도체에서 추가 이황화 다리의 영향은 놀랍게도 작았다. 지방산 측쇄의 효과가 가장 큰 영향을 만들고 있고, 모인슐린에서 논-시스테인 돌연변이의 영향이 두 번째이다. 이것은 하기 표에 예시되며 일반적인 발견이다. 본 발명의 지방산 유도체화 인슐린의 낮은 인슐린 수용체 친화도를 길고 신장된 생체 내 프로파일을 얻기 위해 원하게 된다.
실시예 101, 본 발명의 인슐린 유도체의 소수성:
인슐린 유도체의 소수성은 등용매 조건하에서 가동되는 역상 HPLC에 의해 발견된다. 인슐린 유도체의 용리 시간은 동일한 조건하에서 사람 인슐린(본원에 지칭된 HI)의 그것 또는 알려진 소수성을 갖는 다른 유도체와 비교된다. 소수성, k'rel은 k'relderiv = ((tderiv-t0)/(tref-t0))*k'relref로서 계산된다. 기준으로서 HI를 사용한다: k'relref = k'relHI = 1. HPLC 시스템의 보이드 시간, t0를 5 ㎕의 0.1 mM NaNO3를 주입함으로써 측정한다. 가동 조건:
컬럼: Lichrosorb RP-C18, 5 ㎛, 4 × 250 mm
완충용액 A: 0.1 M 인산나트륨 pH 7.3, 10 부피% CH3CN
완충용액 B: 50 부피% CH3CN
주사 부피: 5 ㎕
가동 시간: 최대 60분
초기 구배를 가동한 후, 유도체 및 기준(예를 들어, HI)을 가동하는 등용매 수준이 선택되고, 등용매 조건하에서 유도체 및 기준의 용리 시간은 k'relderiv를 계산하기 위해 상기 방정식에 사용된다.
실시예
102,
십이지장 루멘 효소를 이용한 인슐린 유도체의 분해:
SPD 래트로부터 십이지장 루멘 효소(십이지장 루멘 함유물의 여과에 의해 제조됨)를 사용한 인슐린 유도체의 분해.
인슐린 유도체 및 표준을 위해 가용한 16 웰을 갖는 96 웰 플레이트(2 mL)에서 로봇에 의해 어세이를 수행하였다. 인슐린 유도체 약 15 μM을 37℃ 100 mM Hepes, pH=7.4에서 십이지장 효소와 함께 배양하고, 샘플을 1, 15, 30, 60, 120 및 240분 후에 취하고, TFA의 첨가에 의해 반응을 퀀칭하였다. 각 지점에서 무손상 인슐린 유도체를 RP-HPLC에 의해 측정하였다. 분해 반감 시간을 데이터의 지수 맞춤에 의해 결정하였고, 각 어세이에서 기준 인슐린, A14E, B25H, desB30 사람 인슐린 또는 사람 인슐린을 위해 측정된 반감 시간에 대해 표준화하였다. 분해를 위해 첨가된 효소의 양은 기준 인슐린의 분해를 위한 반감 시간이 60분 내지 180분이 되도록 하였다. 결과는 래트 십이지장에서 인슐린 유도체를 위한 분해 반감 시간을 동일한 실험으로부터 기준 인슐린의 분해 반감 시간으로 나눈 값(비교 분해 속도)으로서 주어진다.
실시예
103,
래트
약동학, 정맥주사
래트
PK
:
마취된 래트에 다양한 투여량의 인슐린 유도체로 정맥주사로(i.v.) 투여하고, 사용된 화합물의 혈장 농도를 4시간 동안의 지정 간격에서 또는 추가의 투여 후에 면역분석 또는 질량 분석을 사용하여 측정하였다. 약동학 파라미터를 후속으로 WinNonLin Professional(Pharsight Inc., MountainView, CA, USA)을 사용하여 계산하였다.
약 200그램의 무게의 비-단식 수컷 Wistar 래트(Taconic)를 사용하였다.
체중을 측정하고 후속으로 래트를 Hypnorm/Dormicum(각 화합물을 별도로 멸균 주사용수에 1:1로 희석한 다음 혼합; 실험 당일에 신선하게 제조)으로 마취하였다. 마취는 2 mL/kg의 Hypnorm/Doricum 혼합물을 피하로 이어서 30분 간격으로 1 mL/kg을 피하로 2회 유지 투여, 그리고 45분 간격으로 1 mL/kg을 피하로 2회 유지 투여에 의해 개시하였다. 래트를 약간 마취되게 유지하기 위해 필요하면 1-2 mL/kg을 피하로 추가 투여(들)를 통해 공급하였다. 무게 재기 및 초기 마취는 동물들이 이 방에서 저 방으로 옮겨다님으로써 스트레스를 받는 것을 피하기 위해 래트 수용실에서 수행하였다.
PK 프로파일을 도 1에 나타낸다.
실시예
104,
개 약동학, 정맥주사 개
PK
:
수컷 비글견들(약 12 kg)은 인슐린 인슐린 유사체의 단일 투여(2 nmol/kg)를 정맥주사로 받았다. 투여 후 -0.17, 0, 0.083, 0.25, 0.5, 0.75, 1, 1.25, 1.5, 2, 2.5, 3, 3.5, 4, 5, 8, 10, 12, 16, 24, 32, 48, 72, 96, 120, 144 및 168시간 시점에서 혈액을 취하고 혈장을 수집한다. 혈장 샘플을 샌드위치 면역분석 또는 LCMS에 의해 분석하였다. 혈장 농도-시간 프로파일을 WinNonlin Professional 5.2(Pharsight Inc., MountainView, CA, USA)를 사용하여 비구획 약동학 분석에 의해 분석하였다.
실시예
105,
래트
약동학, 장내 주사 후
래트
PK
:
마취된 래트의 장내로(공장으로) 인슐린 유도체를 투여한다. 사용된 화합물의 혈장 농도 그뿐만 아니라 혈액 글루코스의 변화를 4시간 동안의 지정 간격 또는 추가의 투여 후에 측정하였다. 약동학 파라미터를 후속으로 WinNonLin Professional(Pharsight Inc., MountainView, CA, USA)을 사용하여 계산한다.
약 18시간 동안 단식시킨 250-300 g 무게의 수컷 Sprague-Dawley 래트(Taconic)를 피하로 Hypnorm-Dormicum(0.079 mg/mL 펜타닐 시트레이트, 2.5 mg/mL 플루아니손 및 1.25 mg/mL 미다졸람)을 사용하여 초회량(시험 물질 투여에 앞서 -60분의 시간지점에서)으로서 2 mL/kg, 20분 후 1 mL/kg 이어서 40분마다 1 mL/kg으로 마취하였다.
장내 주사 모델로 시험되는 인슐린을 하기 조성물(중량%로)에 따라 제조한다:
45% 프로필렌 글리콜(Merck)
33% Capmul MCM C10(Abitec)
11% 폴록사머 407(BASF)
11% 폴리에틸렌글리콜 3350 Ultra(Fluka).
45%에서 약물 로딩 함량에 독립된 프로필렌 글리콜의 양을 유지하기 위해, 첨가된 인슐린의 양을 프로필렌 글리콜이 아닌 Capmul MCM C10, 폴록사머 407 및 PEG 3350으로부터 동등하게 감한다.
마취된 래트를 37℃에서 안정화된 온도 조절 담요에 위치한다. 1-mL 주사기가 장착된 20 cm의 폴리에틸렌 카테터를 인슐린 제제 또는 부형제로 채운다. 4-5 cm의 정중선 절개를 복벽에 만든다. 카테터를 장벽에 관통하여 맹장으로부터 약 50 cm인 중간-공장으로 부드럽게 삽입한다. 장의 내용물이 존재하면, 적용 부위를 ± 10 cm 옮긴다. 카테터 팁을 장의 부분의 루맨 내부로 약 2 cm에 위치시키고, 결찰의 사용 없이 고정한다. 장을 주의하여 복강으로 교체하고, 복벽 및 피부를 각 층에서 오토클립으로 폐쇄한다. 시간 0에서, 래트에게 0.4 mL/kg의 시험 화합물 또는 부형제를 카테터를 통해 투여한다.
전체 혈액 글루코스 농도를 측정하기 위해 혈액 샘플을 꼬리 팁에서 모세 혈관의 상처에 의해 헤파린처리 10 ㎕ 모세관 튜브로 수집한다. 혈액 글루코스 농도를 500 ㎕ 분석 완충용액에 희석한 후 Biosen 자동분석기(EKF Diagnostic Gmbh, Germany)를 사용하여 글루코스 산화효소 방법에 의해 측정한다. 평균 혈액 글루코스 농도 과정(평균 ± SEM)을 각 화합물에 대해 만든다.
샘플을 혈장 인슐린 농도의 측정을 위해 수집한다. 100 ㎕ 혈액 샘플을 EDTA를 함유하는 냉각한 튜브로 취한다. 샘플을 원심분리(7000 rpm, 4℃, 5분)할 때까지 얼음에 보관하고, 혈장을 Micronic 튜브로 피펫팅한 다음, 어세이할 때까지 -20℃에서 동결시킨다. 인슐린 유도체의 혈장 농도를 개체 유도체에 대해 적당하거나 입증된 면역분석에서 측정한다.
혈액 샘플을 t=-10(혈액 글루코스만을 위함), t=-1(투여 바로 전) 및 4시간 동안의 지정 간격 또는 추가의 투여 후에 취한다.
실시예
106,
사람 인슐린에 대해 본 발명의
아실화
인슐린 유도체의 효능, 정맥주사 일정-상태 클램프.
실험 당일에 238-383 g 무게의 Sprague Dawley 수컷 래트를 클램프 실험에 사용한다. 래트는 제어된 주위 조건하에서 먹이를 자유롭게 먹고, 클램프 실험에 앞서 밤새도록 단식한다(오후 3시부터).
실험 프로토콜:
래트를 수술 과정에 앞서 적어도 1주일 동안 동물 시설에 적응시킨다. 클램프 실험에 앞서 약 1주일 전에, Tygon 카테터를 할로탄 마취하에서 경정맥(투입을 위해) 및 경동맥(혈액 샘플링을 위해)으로 삽입하고, 목 뒤에서 그것을 밖으로 내고 고정한다. 래트에게 수술 후 Streptocilin vet.(Boehringer Ingelheim; 0.15 mL/래트, 근육주사)를 주고, 회복 기간 동안 동물 치료실(25℃)에 위치시킨다. 무통증을 얻기위해, Anorphin(0.06 mg/래트, 피하로)을 마취 동안에 투여하고, Rimadyl(1.5 mg/kg, 피하로)을 마취(2-3시간)로부터 완전히 회복한 후 투여하고 다시 2일 동안 매일 투여한다.
실험 당일 오전 7시에 밤새 단식한(이전 날 오후 3시부터) 래트의 무게를 재고, 샘플링 주사기와 투입 시스템(Harvard 22 Basic 펍프, Harvard, 및 Perfectum Hypodermic 유리 주사기, Aldrich)을 연결한 다음 그것들을 개별 클램프 우리에 위치시켜 실험 시작 전 약 45분 동안 휴식을 취하게 한다. 래트는 전체 실험 동안 그것들의 평소 잠자리에서 자유롭게 움직일 수 있고, 마실 물에 자유로운 접근을 가진다. 혈장 글루코스 수준을 10분 간격으로 측정했던 30분 기초 기간 후, 시험되는 인슐린 유도체 및 사람 인슐린(래트당 1 투여량 수준, 투여량 수준당 n = 6-7)을 300분 동안 일정 속도로 주입한다(i.v.). 선택적으로, 혈장에서 일정 상태 수준에 즉시 달성하기 위해, 시험되는 인슐린 유도체의 프라이밍 볼러스 투입을 투여한다. 프라이밍 볼러스 투입의 투여량은 본 분야의 약동학자에 의해 i.v. 볼러스 약동학으로부터 얻어진 통관 데이터를 기초로 하여 계산할 수 있다. 혈장 글루코스 수준을 10분 간격에서 계속 측정하고, 따라서 정상혈당을 유지하기 위해 20% 수성 글루코스의 투입을 조정한다. 재부유 적혈구의 샘플을 각 래트로부터 모으고, 경동맥 카테터를 통해 약 ½ mL 부피로 되돌려준다.
각 실험 당일에, 시험되는 개체 인슐린 유도체의 용액 및 사람 인슐린 용액의 샘플을 클램프 실험 전과 종반에 취하고, 펩티드의 농도를 HPLC에 의해 확인한다. 래트 인슐린 및 C-펩티드 그뿐만 아니라 시험되는 인슐린 유도체 및 사람 인슐린의 혈장 농도를 연구 전과 종반의 관련 시점에서 측정한다. 래트를 펜토바르비탈 과량투여를 사용하여 실험의 종반에 희생시켰다.
실시예
107,
제어 인슐린 유도체에 대해 본 발명의
아실화
인슐린 유도체의 효능,
래트에
피하 투여
Male Sprague-Dawley 래트(군당 n= 6)는 피하로 부형제 또는 인슐린 인슐린 유사체의 단일 투여량(각각 작용의 중간 기간 또는 작용의 긴 기간을 갖는 유사체에 대해 50 또는 200 nmol/동물)을 받는다. 혈액(혀 밑)을 취하고 혈장을 투여후 각각 작용의 중간 기간 또는 작용의 긴 기간을 갖는 유사체에 대해 0, 1, 2, 4, 8, 24 및 48 또는 0, 2, 4, 8, 24, 48, 72, 96시간 시점에서 수집한다. 혈장을 글루코스에 대해 어세이한다. 글루코스 낮추는 효과를 시간의 함수로서 -델타 혈장 글루코스의 곡선하의 영역으로서 계산하고, 제어 인슐린 유도체와 비교한다.
실시예
108,
용융 온도 결정
시차 주사 열량측정법(DSC).
데이터 수집을 VP-DSC 시차 주사 미세열량측정법(MicroCal, LLC, Northampton, MA)을 사용하여 수행하였다. 모단 단백질 스캔(약 200 μM 인슐린 유도체)을 1℃/분의 스캔 속도 및 0.21 MPa의 초과 압력에서 15℃ 내지 120℃ 기준 세포에서 2 mM 인산 완충용액으로 수행하였다. 모든 샘플 및 기준을 사용 전 즉시 탈가스하였다. 완충용액-완충용액 기준 스캔을 농도 표준화에 앞서 각 샘플 스캔으로부터 감하였다.
DSC 데이터를 도 3 및 도 4에 나타낸다.
실시예
109,
피브릴화의
경향의 결정
티오플라빈
T(
ThT
) 피브릴화
어세이를
위한 일반적인 과정:
원리
펩티드의 낮은 물리적 안정성은 샘플에서 잘-정렬된 실-유사 거대분자 구조로서 관찰되는 아밀로이드 피브릴 형성을 이끌어서 결국 겔 형성을 가져올 수 있다. 이것은 전통적으로 샘플의 육안 검사에 의해 측정되었다. 그러나, 그런 종류의 측정은 매우 주관적이고 관찰자에 의존한다. 그러므로, 저분자 지표 프로브의 적용이 매우 바람직하다. 티오플라빈 T(ThT)는 이러한 프로브이고, 피브릴과 결합할 때 분명한 형광 특징을 가진다(Naiki et al. Anal. Biochem. 177, 244-249, 1989; Le-Vine, Methods Enzymol. 309, 274-284, 1999). 피브릴 형성을 위한 시간 과정은 하기 표현을 갖는 S자형 곡선에 의해 기술될 수 있다(Nielsen at al. Biochemistry 40, 6036-6046, 2001):
여기서, F는 시간 t에서의 ThT 형광이다. 상수 t0는 최대 형광의 50%에 도달하는데 필요한 시간이다. 피브릴 형성을 설명하는 2개의 중요한 파라미터는 [t0 - 2τ]에 의해 계산된 지연-시간 및 겉보기 속도 상수 kapp=1/τ이다.
펩티드의 부분적으로 접혀진 중간체의 형성은 피브릴화를 위한 일반적인 개시 메커니즘으로서 제안된다. 이들 중간체는 더이상의 중간체가 회합할 수 있고 피브릴화가 진행하는 템플레이트를 형성하기 위해 거의 응집하지 않는다. 지연 시간은 핵의 임계 질량이 만들어지는 간격에 대응하고, 겉보기 속도 상수는 피브릴 자체가 형성되는 속도이다.
샘플 제조
샘플을 각 어세이 전에 신선하게 제조하였다. 각 유사체를 7 mM 인산나트륨, pH=7.4에 용해하였다. 티오플라빈 T를 물 중의 저장액으로부터 1 μM의 최종 농도로 샘플에 첨가하였다. 200 ㎕의 샘플 분취량을 96 웰 마이크로타이터 플레이트(Packard Optiplate-96, 흰색 폴리스티렌)에 위치시켰다. 보통, (1개의 시험 조건에 대응하여) 각 샘플당 4개의 복제를 웰의 한 열에 위치시켰다. 플레이트를 Scotch Pad(Qiagen)로 밀봉하였다.
배양 및 형광 측정
ThT 형광 방출의 해당 온도에서의 배양, 교반 및 측정을 Fluoroskan Ascent FL 또는 Varioskan 형광 플레이트 리더(Thermo Labsystems)에서 수행하였다. 온도를 37℃로 조정하였다. 궤도 교반을 모든 제공된 데이터에서 1 mm의 진폭을 갖는 960 rpm으로 조정하였다. 형광 측정을 444 nm 필터를 통해 자극하고 485 nm 필터를 통한 방출을 사용하여 수행하였다.
각 가동은 플레이트를 어세이 온도에서 10분 동안 배양함으로써 초기화되었다. 플레이트를 전형적으로 45시간 동안 매 20분 마다 측정하였다. 각 측정 사이에는, 플레이트를 상기 기술된 바와 같이 교반하고 가열하였다.
데이터 처리
측정 데이터 지점을 추가 가공처리를 위해 Microsoft Excel 서식에서 저장하고, 곡선 도시 및 맞춤을 GraphPad Prism을 사용하여 수행하였다. 피브릴의 부재하에서 ThT로부터의 배경 방출은 무시해도 될 정도였다. 데이터 지점은 전형적으로 4개의 샘플의 평균이다. 단지 동일한 실험에서 얻어진 데이터(즉, 동일한 플레이트 상의 샘플들)만을 다른 어세이들 사이의 비교보다는 한 어세이의 개체 샘플들 사이에서 피브릴화의 비교적인 측정을 보장하는 동일한 그래프에 나타냈다.
데이터 세트는 방정식 (1)과 맞춰질 수 있다. 그러나 완전 S자형 곡선이 보통 측정 시간 동안 달성되지 않기 때문에, 피브릴화의 정도는 4개의 샘플의 평균 및 표준편차로서 계산된 다양한 시점에서의 ThT 형광으로서 표현된다.
ThT 어세이에서 피브릴화에 대해 시험된 본 발명에 따른 어떤 인슐린도 시간의 함수로서 증가된 형광(의 부재)으로 나타낸 바와 같이 피브릴화의 어떤 신호도 나타내지 않는다는 것이 분명하다. 이것은 매우 이상하고, 이것은 본 발명의 유사체의 유용성을 축소해서 말한다.
실시예
110,
래트
지방세포에서의 지질생성
본 발명의 인슐린의 시험관 내 효능의 측정으로서, 지질생성을 사용할 수 있다.
1차 래트 지방세포를 정소상체 지방 패드로부터 분리하고, 예를 들어 1% 지방 없는 HSA와 본 발명의 표준(사람 인슐린, HI) 또는 인슐린 중의 하나를 함유하는 완충용액 중의 3H-글루코스와 배양시킨다. 표식 글루코스를 전체 투여량 반응 곡선을 가져오는 투여량 의존 방식에서 추출가능한 지질로 전환한다. 결과는 표준(HI)과 비교하여 본 발명의 인슐린의 95% 신뢰 한계를 갖는 비교 효능(%)으로서 표현된다.
본 발명의 인슐린에 대한 지질생성 데이터:
본 발명에 따른 유사체의 다수를 위해, 얻어진 지질생성 데이터(0.1% HSA의 존재하에)와 1.5% HSA의 존재하에 얻어진 인슐린 수용체 데이터 사이에 아주 양호한 일치가 있고, 따라서 수용체 결합이 수용체 활성화로 옮겨진다는 것을 확인한다.
실시예
111,
본 발명의 인슐린 유사체의 화학 안정성:
인슐린 유사체의 화학 안정성은 인슐린 유사체를 2 mM 인산, pH=7.5 37℃에서 8주일까지 배양한 후 평가한다. 고분자량 생성물(HMWP)의 형성은 0, 2, 4 및 선택적으로 8주일 후 SEC HPLC 분석에 의해 측정한다. SEC 방법의 결과는 215 nm에서 전체 흡광도의 백분율로서 37℃와 5℃ 시작 샘플에서 HMWP 형성 사이의 차이로서 주어진다. 화학적 분해 생성물을 0, 2, 4 및 선택적으로 8주일 후 RP HPLC 분석에 의해 측정하였다. RP 방법의 결과는 215 nm에서 전체 흡광도의 백분율로서 37℃와 5℃ 시작 샘플에서 관찰된 화학적 분해 사이의 차이로서 주어진다.
SEC-HPLC 방법:
용매: 500 mM NaCl, 10 mM NaH2PO4, 5 mM H3PO4, 50%(v/v) 2-프로판올
유속: 0.5 mL/분
가동 시간: 30분
UV 검출: 215 nm
컬럼: Waters로부터 인슐린 HMWP 컬럼 7.8×300 mm
온도: 50℃
RP-HPLC 방법:
용매 A: 0.09M 인산 완충용액 pH 3.6(인산수소2암모늄), 10% MeCN(v/v)
용매 B: 80% MeCN(v/v%)
유속: 0.3 mL/분
실행 시간: 33분
UV 검출: 215 nm
컬럼: Waters Acquity BEH130 C18 컬럼 1.7 ㎛, 150×2.1 mm
온도: 50℃
구배:
B3에 이황화를 갖는 유사체가 일반적으로 B4에 이황화를 갖는 유사체보다 안정하고, B2 또는 B1에 이황화를 갖는 유사체는 덜 안정하다는 것이 결론이다.
실시예
112,
X-선 구조 결정:
결정화 조건의 실시예가 아래에 주어지지만, 그러나, 정확한 조건은 다른 유사체들과 다를 수 있고, 최적 조건은 많은 다른 조건들을 검사함으로써 알아낸다. 결정은, 예를 들어 0.8 M K/Na 타르트레이트, 0.1 M Tris pH 8.5, 0.5% PEG MME 5000을 함유하는 리저버 용액으로부터 시팅 드롭(sitting drop) 증기 확산 방법에 의해 얻어진다. 데이터를 MarCCD 검출기가 장착된 회전 에노드(anode)(Rigaku, MicroMax-007HF)로 수집하고, XDS(J Appl Crystallogr 26: 795800)에 의해 가공처리한다. 구조는 연구 모델로서 하우스 구조를 갖는 Molrep(J Appl Crystallogr 30: 10221025)을 사용한 분자 치환에 의해 해결된다. 데이터 정제 및 모델 빌딩을 Refmac(Acta Crystallogr D 53: 240255) 및 Coot(Acta Crystallogr D 60: 21262132) 프로그램을 사용하여 만든다.
실시예
113,
구아니디늄
염산염 변성:
여분의 이황화 결합을 함유하는 선택된 인슐린 유도체의 구아니디늄 염산염 변성은 접힘풀림의 자유 에너지를 측정하기 위해 원편광 이색성(CD) 분광법에 의해 수행될 수 있다. 단백질 변성에 따르면, 원 UV 범위(240-218 nm)에서 음성 CD는 단백질 접힘풀림을 동반하는 정렬된 2차원 구조의 손실과 일관되어 서서히 줄어든다. 사람 인슐린의 원-UV CD 스펙트럼은 단백질 접힘풀림 및 자가-회합 둘 다에 민감하다(Holladay et al., 1977 Biochim . Biophys . Acta 494, 245-254.; Melberg & Johnson, 1990, Biochim. Biophys.Acta 494, 245-254). pH 8에서 이들 현상을 분리하기 위해, GuHCl 적정을 다른 단백질 농도, 예를 들어 3, 37, 및 250 μM에서 수행한다. 이들 농도에서, 인슐린 유사체는 주로 단량체, 이합체 및 이합체와 더 높은 응집체의 혼합물로서 존재한다. 근 UV 범위(330-250 nm)에서 인슐린 CD 스펙트럼은 이황화 연결로부터의 기여로 티로신 발색단의 환경을 반영한다(Morris et al., 1968, Biochim.Biophys. Acta . 160, 145-155.; Wood et al., 1975, Biochim. Biophys. Acta. 160, 145-155.; Strickland & Mercola, 1976, Biochemistry 15,3875-3884). 변성제 농도의 함수로서 근 UV 및 원 UV 영역 둘 다에서 몰타원율에서 변화의 플롯이 발생된다. 접힘풀림의 자유 에너지는 2개의 상태 모델에 맞춘 이러한 인슐린 변성 곡선으로부터 이전에 계산하였다(Kaarsholm, N.C. et al 1993 Biochemistry, 32, 10773-8).
단백질 농도를 UV 흡광도 및/또는 RP-HPLC 및/또는 SEC-HPLC의 의해 측정하였다. 변성 샘플을 10 mM Tris/C104- 완충용액, pH 8.0을 갖는 GuHCl 저장액 및 단백질의 다른 비율을 조합함으로써 제조하였다. 단백질 저장액은 전형적으로 10 mM Tris/C104-, pH 8.0에서 1.5 mM이다. GuHCl 저장액은 10 mM Tris/C104-, pH 8.0에서 8.25 M(굴절법에 의해 측정됨)이다. 모든 CD 스펙트럼을 25℃에서 기록한다. 원-UV CD 변성 샘플을 250 내지 218 nm에서 스캔한다. 전형적인 세포 경로 길이 및 단백질 농도는 각각 0.2 cm 및 37 pM이다. 근-UV CD 변성 샘플을 1-cm 경로 길이 및 전형적으로 75 pM 단백질을 사용하여 330 내지 250 nm에서 스캔한다. 모든 스펙트럼을 적당한 용매 바탕을 감하기 전에 Fourier 변환 알고리즘에 의해 매끄럽게 한다. 원-UV 범위에서, Δε는 펩티드 결합의 몰농도에 기초한 반면, 근-UV에서 Δε는 인슐린 단량체의 몰농도로 표준화된다.
GuHCl 변성 곡선을, 접힘/접힘풀림 전이가 2개-상태인 것을 추정함으로써 분석하며, 그런 경우에서, 평형 상수는 K= (ΔεN- Δε)/(Δε - ΔεU)를 사용하여 각 변성제 농도에서 얻어질 수 있는데, 여기서 Δε은 CD의 관측 값이고, ΔεN 및 ΔεU는 주어진 GuHCl 농도에서 각각 자연 및 접힘풀림 형태에 대한 CD 값을 나타낸다(Pace, C. N. (1975) CRC Crit . Rev . Biochem . 3, 1-43). 전이 영역의 GuHCl 농도에서 ΔεN 및 ΔεU에 대한 값은 전이 영역으로의 전이 전 및 후의 베이스라인의 선형 외삽법, 즉, ΔεN = Δεo N + mN[GuHCl] 및 ΔεU = Δεo U + mU[GuHCl]에 의해 얻어졌고, 여기서 Δεo N 및 Δεo U는 절편이고, mN 및 mU는 각각 전이 전 및 후의 베이스라인의 기울기이다. 전이 구역의 주어진 변성제 농도에서 접힘풀림의 자유 에너지는 ΔG = -RT In K에 의해 주어진다. 본 발명자들은 변성제 농도에서 ΔG의 선형 의존을 추정한다: ΔG = ΔGH2O - m[GuHCl], 여기서 ΔGH2O는 변성제의 부재에서 ΔG의 값이고, m은 변성제 농도에서 ΔG의 의존의 정도이다. 이와 같이, 전이 구역에서의 K로부터 유도된 ΔG 값은 다시 ΔGH2O를 제공하는 0 M 변성제로 외삽될 수 있다. 완전한 접힘풀림 곡선에 대한 Δε과 [GuHCl] 사이의 관계를 하기 방정식 (1)에 나타낸다(Santoro, M. M., & Bolen, D. W. (1988) Biochemistry 27,8063-8068):
Δε = (Δεo N + mN[GuHCl]) + (Δεo U + mU[GuHCl]) exp[-(ΔGH2O - m[GuHCl]) / RT) / (I + exp[-(ΔGH2O - m[GuHCl]) / RT]
반응으로서 Δε 그리고 독립 변수로서 [GuHCl]을 갖는, 이 방정식은, 예를 들어 PC SAS의 NLIN 과정(SAS Inc., Cary, NC)을 사용하여 비선형 최소 자승 분석을 받는다. 그 다음 6개의 파라미터는 변성 곡선: Δεo N, Δεo U, mN, mU, m, 및 ΔGH 2O를 설명한다. 게다가, 변성 곡선의 중앙 지점에서의 GuHCl 농도, Cmid는 ΔGH 2O/m에 의해 주어진다. 그 다음 사람과 돌연변이 인슐린 사이의 접힘풀림의 자유 에너지의 차이는 ΔΔGH2O = ΔGH2O(돌연변이체) - ΔGH2O(야생형)으로부터 계산될 수 있다.
실시예
114,
정확한
무손상
질량 결정:
LC-MS 기기 장치는 Acquity UPLC 시스템(Waters, Milford, MA) 및 Synapt G2 질량 분석기(Waters, Milford, MA)로 구성된다. 인슐린 유사체를 C18 역상 HPLC 컬럼에 적용하고, 0.05% 트리플루오로아세트산 중의 아세토니트릴의 선형 구배를 사용하여 분석한다. HPLC로부터의 유속은 2500 V 모세관 전위, 110℃ 공급원 온도, 250℃ 탈용매화 온도 및 50 L/시간의 원뿔 가스 흐름(N2)으로 양성 MS 만의 모드에서 작동하는 Synapt G2의 전기분무 계면으로 직접적으로 적용된다. m/z=100 내지 m/z=3000의 MS 스펙트럼이 초당 2회 얻어진다. 기기를 분석에 앞서 NaI의 표준 혼합물에 의해 보정하고, 류신 엔케팔린의 락(lock) 분무를 LC-MS 분석 동안에 적용한다. 무손상 인슐린 질량을 MaxEnt3 알고리즘을 사용하여 BioPharmaLynx 1.2(Waters, Milford, MA)에 의해 재구성한다. Orbitrap XL 질량 분석기(Thermo Fisher)를 Synapt G2 대신에 사용할 수 있다. Orbitrap 기기를 4 kV의 공급원 전압, 100 μΑ의 공급원 전류, 40의 시스(sheath) 가스 흐름, 10의 보조 가스 흐름, 5의 스위프 가스 흐름, 20 V의 모세관 전압으로 양성 MS 모드에서 작동시킨다. 모든 MS 파라미터를 최적 성능을 위해 기기의 튜닝 동안에 조정하며, 상기 주어진 값에서 약간 이탈할 수 있다. 이 방법에 의해 얻어진 질량 정확도는 10 ppm보다 더 양호하다.
컬럼: Acquity BEH C18 1×150 mm, 1.7 ㎛(Waters)
유속: 0.1 mL/분
완충용액 A: 0.02%(v/v) 또는 0.05%(v/v) TFA
완충용액 B: 아세토니트릴 중의 0.02%(v/v) 또는 0.04%(v/v)의 TFA
구배: 2분 동안 5% B; 12분에서 5% B 내지 50% B, 1분에서 50% B 내지 90% B
UV 검출: 215 nm
SEQUENCE LISTING
<110> NOVO NORDISK A/S
<120> INSULIN DERIVATIVES CONTAINING ADDITIONAL DISULFIDE BONDS
<130> 8198.504-WO
<150> EP 10167046.1
<151> 2010-06-23
<150> EP 10167033.9
<151> 2010-06-23
<150> US 61/359,150
<151> 2010-06-28
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Modified Insulin A chain
<220>
<221> DISULFID
<222> (6)..(6)
<220>
<221> DISULFID
<222> (7)..(7)
<220>
<221> DISULFID
<222> (10)..(10)
<220>
<221> DISULFID
<222> (11)..(11)
<220>
<221> DISULFID
<222> (20)..(20)
<400> 1
Gly Ile Val Glu Gln Cys Cys Thr Ser Cys Cys Ser Leu Glu Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 2
<211> 29
<212> PRT
<213> Artificial
<220>
<223> Modified Insulin B chain
<220>
<221> DISULFID
<222> (4)..(4)
<220>
<221> DISULFID
<222> (7)..(7)
<220>
<221> DISULFID
<222> (19)..(19)
<220>
<221> MOD_RES
<222> (29)..(29)
<223> Xaa is Lys-(N(epsilon)-Octadecanedioyl-gGlu-OEG-OEG)
<400> 2
Phe Val Asn Cys His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe His Tyr Thr Pro Xaa
20 25
Claims (14)
- 사람 인슐린의 3개의 이황화 결합이 보유되고,
시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식으로 선택되는, 인슐린에 부착된 2개 이상의 시스테인 치환 및 측쇄를 갖는 인슐린 유도체. - 제 1항에 있어서, 시스테인 치환의 부위는,
(1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고,
(2) 사람 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하는 방식으로 선택되는 것을 특징으로 하는 인슐린 유도체. - 제 1항 또는 제 2항에 있어서, 시스테인 치환의 부위는,
(1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고,
(2) 사람 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하고,
(3) 사람 인슐린 유도체는 사람 인슐린 및/또는 모인슐린에 비해 증가된 물리적 안정성을 갖는 방식으로 선택되는 것을 특징으로 하는 인슐린 유도체. - 제 1항 내지 제 3항 중 어느 한 항에 있어서, 시스테인 치환의 부위는,
(1) 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하고,
(2) 사람 인슐린 유도체는 사람 인슐린과 관련된 원하는 생물학적 활성을 보유하고,
(3) 사람 인슐린 유도체는 단백질 분해에 대해 안정화되는 방식으로 선택되는 것을 특징으로 하는 인슐린 유도체. - 제 1항 내지 제 4항 중 어느 한 항에 있어서, A-쇄의 A10 위치에서 아미노산 잔기는 시스테인으로 치환되고, B-쇄의 B1, B2, B3 및 B4로 구성된 군으로부터 선택된 위치에서 아미노산 잔기는 시스테인으로 치환되고, 선택적으로 B30 위치에서 아미노산은 삭제되는 것을 특징으로 하는 인슐린 유도체.
- 제 1항 내지 제 5항 중 어느 한 항에 있어서, 하나 이상의 추가 이황화 결합은 A-쇄와 B-쇄 사이에서 얻어지는 것을 특징으로 하는 인슐린 유도체.
- 제 1항 내지 제 6항 중 어느 한 항에 있어서, 하나 이상의 추가 이황화 결합이 없는 인슐린 유도체보다 더 신장된 프로파일을 갖는 것을 특징으로 하는 인슐린 유도체.
- 제 1항 내지 제 7항 중 어느 한 항에 있어서, 인슐린은,
A10C, A14E, B1C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B1C, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B25A, desB30 사람 인슐린,
A10C, A14E, B2C, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B25H, desB27, desB30 사람 인슐린,
A10C, A14E, B3C, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, desB27, desB30 사람 인슐린,
A10C, A14E, B4C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B25A, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, B28E, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, desB27, desB30 사람 인슐린,
A10C, A14E, B4C, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B25N, B27E, desB30 사람 인슐린,
A10C, A14E, B4C, B25N, desB27, desB30 사람 인슐린,
A10C, A14E, desB1, B4C, B25H, desB30 사람 인슐린,
A10C, A14H, B4C, B25H, desB30 사람 인슐린,
A10C, B3C, B25H, desB27, desB30 사람 인슐린,
A10C, B3C, B25H, desB30 사람 인슐린,
A10C, B4C, B25H, desB27, desB30 사람 인슐린,
A10C, B4C, B25H, desB30 사람 인슐린,
A10C, A14E, B1C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B2C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B3C, B16H, B25H, desB30 사람 인슐린,
A10C, A14E, B4C, B16H, B25H, desB30 사람 인슐린으로 구성된 군으로부터 선택되고,
측쇄는 인슐린의 N-말단 또는 인슐린에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체. - 제 1항 내지 제 8항 중 어느 한 항에 있어서, 측쇄는 인슐린의 N-말단 또는 인슐린에서 리신 잔기의 엡실론 아미노기에 부착되는 것을 특징으로 하는 인슐린 유도체.
- 인슐린의 2개 이상의 아미노산을 시스테인 잔기로 치환하는 단계 및 측쇄를 인슐린에 부착하는 단계를 포함하는 인슐린의 안정화 방법으로서,
a. 사람 인슐린의 3개의 이황화 결합이 보유되고
b. 시스테인 치환의 부위는 도입된 시스테인 잔기가 접혀진 인슐린 유도체의 3차원 구조에 위치되어 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합의 형성을 허용하는 방식으로 선택되어,
이로써 사람 인슐린에 존재하지 않는 하나 이상의 추가 이황화 결합을 포함하는 인슐린 유도체의 제조 방법. - 제 1항 내지 제 9항 중 어느 한 항에 따른 인슐린 유도체의 생물학적으로 활성인 양 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물.
- 제 1항 내지 제 10항 중 어느 한 항에 따른 인슐린 유도체 또는 제 11항에 따른 약학적 조성물을 대상에게 투여하는 단계를 포함하는 대상에서의 진성 당뇨병의 치료 방법.
- 제 1항 내지 제 9항 중 어느 한 항에 따른 인슐린 유도체를 약학적으로 허용가능한 물질 및/또는 부형제와 혼합하는 단계를 포함하는 제 11항에 따른 약학적 조성물의 제조 방법.
- 제 13항에 따른 방법에 의해 얻을 수 있는 약학적 조성물.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP10167046 | 2010-06-23 | ||
| EP10167046.1 | 2010-06-23 | ||
| EP10167033 | 2010-06-23 | ||
| EP10167033.9 | 2010-06-23 | ||
| US35915010P | 2010-06-28 | 2010-06-28 | |
| US61/359,150 | 2010-06-28 | ||
| US35950010P | 2010-06-29 | 2010-06-29 | |
| US61/359,500 | 2010-06-29 | ||
| PCT/EP2011/060383 WO2011161125A1 (en) | 2010-06-23 | 2011-06-21 | Insulin derivatives containing additional disulfide bonds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130036290A true KR20130036290A (ko) | 2013-04-11 |
Family
ID=44508482
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137001441A KR20130036290A (ko) | 2010-06-23 | 2011-06-21 | 추가 이황화 결합을 함유하는 인슐린 유도체 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US8853155B2 (ko) |
| EP (1) | EP2585485A1 (ko) |
| JP (1) | JP5931857B2 (ko) |
| KR (1) | KR20130036290A (ko) |
| CN (2) | CN102985440B (ko) |
| AU (1) | AU2011269000C1 (ko) |
| BR (1) | BR112012033107A2 (ko) |
| CA (1) | CA2802510A1 (ko) |
| IL (1) | IL223288A0 (ko) |
| MX (1) | MX337549B (ko) |
| RU (1) | RU2598273C2 (ko) |
| WO (1) | WO2011161125A1 (ko) |
| ZA (1) | ZA201209345B (ko) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009115469A1 (en) | 2008-03-18 | 2009-09-24 | Novo Nordisk A/S | Protease stabilized, acylated insulin analogues |
| CN103533952B (zh) * | 2011-03-15 | 2017-02-15 | 诺沃—诺迪斯克有限公司 | 包含半胱氨酸置换的人胰岛素类似物和衍生物 |
| CN104364262A (zh) * | 2011-12-21 | 2015-02-18 | 诺沃—诺迪斯克有限公司 | N末端修饰的胰岛素衍生物 |
| WO2013153000A2 (en) | 2012-04-11 | 2013-10-17 | Novo Nordisk A/S | Insulin formulations |
| US20150111820A1 (en) | 2012-07-09 | 2015-04-23 | Novo Nordisk A/S | Novel use of insulin derivatives |
| US9896496B2 (en) | 2013-10-07 | 2018-02-20 | Novo Nordisk A/S | Derivative of an insulin analogue |
| AR099569A1 (es) * | 2014-02-28 | 2016-08-03 | Novo Nordisk As | Derivados de insulina y los usos médicos de estos |
| US20180000742A1 (en) * | 2015-01-29 | 2018-01-04 | Novo Nordisk A/S | Pharmaceutical Composition for Oral Insulin Administration Comprising a Tablet Core and a Polyvinyl Alcohol Coating |
| US11583572B2 (en) * | 2015-12-23 | 2023-02-21 | Case Western Reserve University | Encapsulation of ultra-stable insulin analogues with polymer melts |
| CN107436311B (zh) * | 2016-05-25 | 2021-11-19 | 正大天晴药业集团股份有限公司 | 一种鉴别胰岛素单体或胰岛素多聚体的方法 |
| AU2017378102B2 (en) | 2016-12-16 | 2022-10-13 | Novo Nordisk A/S | Insulin containing pharmaceutical compositions |
| US11566059B2 (en) | 2018-08-08 | 2023-01-31 | Daewoong Pharmaceutical Co., Ltd. | Long-acting insulin analogues and derivatives thereof |
| CN113121649B (zh) * | 2019-12-26 | 2022-10-04 | 李瑛� | 一种新型两亲性蛋白、其制备方法及用途 |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4343898A (en) | 1980-02-11 | 1982-08-10 | Novo Industri A/S | Process for preparing esters of human insulin |
| DK58285D0 (da) | 1984-05-30 | 1985-02-08 | Novo Industri As | Peptider samt fremstilling og anvendelse deraf |
| PH25772A (en) * | 1985-08-30 | 1991-10-18 | Novo Industri As | Insulin analogues, process for their preparation |
| DK105489D0 (da) | 1989-03-03 | 1989-03-03 | Novo Nordisk As | Polypeptid |
| DK155690D0 (da) * | 1990-06-28 | 1990-06-28 | Novo Nordisk As | Nye peptider |
| IL114160A (en) | 1994-06-17 | 2006-12-31 | Novo Nordisk As | Dna constructs encoding heterologous proteins and processes for the heterologous protein production in yeast |
| DE19726167B4 (de) | 1997-06-20 | 2008-01-24 | Sanofi-Aventis Deutschland Gmbh | Insulin, Verfahren zu seiner Herstellung und es enthaltende pharmazeutische Zubereitung |
| WO1999021578A1 (en) * | 1997-10-24 | 1999-05-06 | Eli Lilly And Company | Insoluble insulin compositions |
| BR0009040A (pt) | 1999-03-17 | 2001-12-18 | Novo Nordisk As | Método para acilar um grupo amino de um peptìdeoou de uma proteìna, e, composto |
| JP4773023B2 (ja) | 1999-12-29 | 2011-09-14 | ノボ ノルディスク アクティーゼルスカブ | インスリン前駆体及びインスリン前駆体類似体の製造方法 |
| BR0314289B8 (pt) | 2002-09-25 | 2021-07-27 | Novo Nordisk As | método para produzir um peptídeo n-acilado |
| AU2003903124A0 (en) * | 2003-06-20 | 2003-07-10 | Mark Del Borgo | Analogues of heteromeric proteins |
| BRPI0413276B8 (pt) * | 2003-08-05 | 2021-05-25 | Novo Nordisk As | derivado de insulina, complexo de zinco do mesmo, e, composição farmacêutica |
| JP5697831B2 (ja) | 2003-12-03 | 2015-04-08 | ノヴォ ノルディスク アー/エス | 単鎖インシュリン |
| WO2006008238A1 (en) | 2004-07-16 | 2006-01-26 | Novo Nordisk A/S | Method for selective acylation |
| WO2007081824A2 (en) * | 2006-01-06 | 2007-07-19 | Case Western Reserve University | Fibrillation resistant proteins |
| WO2007096332A1 (en) | 2006-02-21 | 2007-08-30 | Novo Nordisk A/S | Single-chain insulin analogues and pharmaceutical formulations thereof |
| WO2007135117A2 (en) * | 2006-05-24 | 2007-11-29 | Novo Nordisk A/S | Soluble, stable insulin-containing formulations |
| WO2008034881A1 (en) | 2006-09-22 | 2008-03-27 | Novo Nordisk A/S | Protease resistant insulin analogues |
| ES2554773T3 (es) | 2006-10-04 | 2015-12-23 | Case Western Reserve University | Insulina y análogos de la insulina resistentes a la fibrilación |
| US9150633B2 (en) * | 2007-08-15 | 2015-10-06 | Novo Nordisk A/S | Insulin analogues with an acyl and alkylene glycol moiety |
| RU2524423C2 (ru) | 2008-01-09 | 2014-07-27 | Санофи-Авентис Дойчланд Гмбх | Новые производные инсулина с чрезвычайно замедленным профилем время/действие |
| EP2254905B1 (en) | 2008-03-14 | 2016-12-14 | Novo Nordisk A/S | Protease-stabilized insulin analogues |
| WO2009115469A1 (en) | 2008-03-18 | 2009-09-24 | Novo Nordisk A/S | Protease stabilized, acylated insulin analogues |
| WO2010029159A1 (en) | 2008-09-12 | 2010-03-18 | Novo Nordisk A/S | Method of acylating a peptide or protein |
| JP2012511506A (ja) | 2008-12-09 | 2012-05-24 | ノヴォ・ノルディスク・アー/エス | 新規インスリンアナログ |
| WO2011028813A2 (en) | 2009-09-01 | 2011-03-10 | Case Western Reserve University | Insulin analogues of enhanced receptor-binding specificity |
| US8815798B2 (en) | 2010-06-23 | 2014-08-26 | Novo Nordisk A/S | Insulin analogues containing additional disulfide bonds |
| WO2011161083A1 (en) | 2010-06-23 | 2011-12-29 | Novo Nordisk A/S | Human insulin containing additional disulfide bonds |
-
2011
- 2011-06-21 CA CA2802510A patent/CA2802510A1/en not_active Withdrawn
- 2011-06-21 JP JP2013515874A patent/JP5931857B2/ja not_active Expired - Fee Related
- 2011-06-21 US US13/805,774 patent/US8853155B2/en not_active Expired - Fee Related
- 2011-06-21 AU AU2011269000A patent/AU2011269000C1/en not_active Ceased
- 2011-06-21 BR BR112012033107A patent/BR112012033107A2/pt not_active IP Right Cessation
- 2011-06-21 EP EP11728615.3A patent/EP2585485A1/en not_active Withdrawn
- 2011-06-21 WO PCT/EP2011/060383 patent/WO2011161125A1/en active Application Filing
- 2011-06-21 RU RU2012157683/10A patent/RU2598273C2/ru not_active IP Right Cessation
- 2011-06-21 CN CN201180031021.4A patent/CN102985440B/zh not_active Expired - Fee Related
- 2011-06-21 KR KR1020137001441A patent/KR20130036290A/ko not_active Application Discontinuation
- 2011-06-21 CN CN201510007033.3A patent/CN104693302A/zh active Pending
- 2011-06-21 MX MX2012014641A patent/MX337549B/es active IP Right Grant
-
2012
- 2012-11-27 IL IL223288A patent/IL223288A0/en unknown
- 2012-12-10 ZA ZA2012/09345A patent/ZA201209345B/en unknown
-
2014
- 2014-08-28 US US14/471,258 patent/US9512195B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| US20140371140A1 (en) | 2014-12-18 |
| RU2598273C2 (ru) | 2016-09-20 |
| ZA201209345B (en) | 2013-08-28 |
| AU2011269000C1 (en) | 2015-10-08 |
| MX2012014641A (es) | 2013-02-07 |
| MX337549B (es) | 2016-03-10 |
| RU2012157683A (ru) | 2014-07-27 |
| JP2013530974A (ja) | 2013-08-01 |
| US8853155B2 (en) | 2014-10-07 |
| JP5931857B2 (ja) | 2016-06-08 |
| EP2585485A1 (en) | 2013-05-01 |
| BR112012033107A2 (pt) | 2016-10-11 |
| CN102985440A (zh) | 2013-03-20 |
| CN104693302A (zh) | 2015-06-10 |
| AU2011269000B2 (en) | 2015-04-23 |
| IL223288A0 (en) | 2013-02-03 |
| AU2011269000A1 (en) | 2012-12-13 |
| WO2011161125A1 (en) | 2011-12-29 |
| CA2802510A1 (en) | 2011-12-29 |
| US20130157938A1 (en) | 2013-06-20 |
| US9512195B2 (en) | 2016-12-06 |
| CN102985440B (zh) | 2016-10-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9512195B2 (en) | Insulin derivatives containing additional disulfide bonds | |
| JP5973427B2 (ja) | 追加のジスルフィド結合を含有するインスリン類似体 | |
| KR20110061552A (ko) | 할로겐 안정화된 인슐린 | |
| AU2014333979B2 (en) | Novel derivative of an insulin analogue | |
| EP3448417A1 (en) | Insulin dimer-incretin conjugates | |
| WO2012171994A1 (en) | Multi substituted insulins | |
| JP6013330B2 (ja) | 追加のジスルフィド結合を含有するヒトインスリン | |
| US20140357838A1 (en) | N-Terminally Modified Insulin Derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| WITB | Written withdrawal of application |