KR20120093066A - 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제 - Google Patents
신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제 Download PDFInfo
- Publication number
- KR20120093066A KR20120093066A KR1020117031347A KR20117031347A KR20120093066A KR 20120093066 A KR20120093066 A KR 20120093066A KR 1020117031347 A KR1020117031347 A KR 1020117031347A KR 20117031347 A KR20117031347 A KR 20117031347A KR 20120093066 A KR20120093066 A KR 20120093066A
- Authority
- KR
- South Korea
- Prior art keywords
- group
- substituted
- mmol
- added
- synthesis
- Prior art date
Links
- 0 CC1(*)C=C(C(NC)=*)c([n](*)c(*)c2)c2C=C1 Chemical compound CC1(*)C=C(C(NC)=*)c([n](*)c(*)c2)c2C=C1 0.000 description 18
- ICAFCACATTZJKF-UHFFFAOYSA-N CC(C)(C)OC(NCc1nc(cc(cc2)-c3nc4ccccc4[o]3)c2[n]1C1CCOCC1)=O Chemical compound CC(C)(C)OC(NCc1nc(cc(cc2)-c3nc4ccccc4[o]3)c2[n]1C1CCOCC1)=O ICAFCACATTZJKF-UHFFFAOYSA-N 0.000 description 2
- PDRZGSJKIISCOZ-UHFFFAOYSA-N Nc(cc(cc1)-c2nc3ccccc3[o]2)c1NC1CCOCC1 Chemical compound Nc(cc(cc1)-c2nc3ccccc3[o]2)c1NC1CCOCC1 PDRZGSJKIISCOZ-UHFFFAOYSA-N 0.000 description 2
- UJAQDTKTGZDRPM-UHFFFAOYSA-N C(COCC1)C1[n]1c(-c2ccccc2)nc2c1ccc(-c1nc3ccccc3[o]1)c2 Chemical compound C(COCC1)C1[n]1c(-c2ccccc2)nc2c1ccc(-c1nc3ccccc3[o]1)c2 UJAQDTKTGZDRPM-UHFFFAOYSA-N 0.000 description 1
- WCCYPGLOYDCJTH-UHFFFAOYSA-N C(c1nc(cc(cc2)-c3nc4ccccc4[o]3)c2[n]1C1CCOCC1)c1ccccc1 Chemical compound C(c1nc(cc(cc2)-c3nc4ccccc4[o]3)c2[n]1C1CCOCC1)c1ccccc1 WCCYPGLOYDCJTH-UHFFFAOYSA-N 0.000 description 1
- SCEBJEJOCOEFSF-UHFFFAOYSA-N CC(C)(C)OC(C[n](c(C)nc1c2)c1ccc2-c1nc2ccccc2[o]1)=O Chemical compound CC(C)(C)OC(C[n](c(C)nc1c2)c1ccc2-c1nc2ccccc2[o]1)=O SCEBJEJOCOEFSF-UHFFFAOYSA-N 0.000 description 1
- MWJMUJUSSUUOIM-QFIPXVFZSA-N CCCNC(C1=CC[C@@H]2OC(c(cc3)cc4c3[n](C3CCOCC3)c(C)n4)=NC2=C1)=O Chemical compound CCCNC(C1=CC[C@@H]2OC(c(cc3)cc4c3[n](C3CCOCC3)c(C)n4)=NC2=C1)=O MWJMUJUSSUUOIM-QFIPXVFZSA-N 0.000 description 1
- LREWIUBFCUDQTO-UHFFFAOYSA-N CN(C)CCNC(CCC(c1nc2ccccc2[o]1)=C1)C1[N+]([O-])=O Chemical compound CN(C)CCNC(CCC(c1nc2ccccc2[o]1)=C1)C1[N+]([O-])=O LREWIUBFCUDQTO-UHFFFAOYSA-N 0.000 description 1
- FYMLEJZBGVPPFP-UHFFFAOYSA-N COC1=CCCC(NC2C(N)=CC(c3nc(CCC=C4)c4[o]3)=CC2)=C1 Chemical compound COC1=CCCC(NC2C(N)=CC(c3nc(CCC=C4)c4[o]3)=CC2)=C1 FYMLEJZBGVPPFP-UHFFFAOYSA-N 0.000 description 1
- MBVSKEYWVHMBDY-UHFFFAOYSA-N COCc1nc(cc(C(F)(F)F)cc2)c2[n]1C1CCOCC1 Chemical compound COCc1nc(cc(C(F)(F)F)cc2)c2[n]1C1CCOCC1 MBVSKEYWVHMBDY-UHFFFAOYSA-N 0.000 description 1
- GQXDUVDFIVVCAQ-UHFFFAOYSA-N Cc([n](C1CCCCC1)c1c2)nc1cc(-c1nc(cccc3)c3[o]1)c2O Chemical compound Cc([n](C1CCCCC1)c1c2)nc1cc(-c1nc(cccc3)c3[o]1)c2O GQXDUVDFIVVCAQ-UHFFFAOYSA-N 0.000 description 1
- YLHIMYKHUYXAMY-UHFFFAOYSA-N Cc1c2nc(-c(cc3)cc(N)c3NC3CCOCC3)[o]c2ccc1 Chemical compound Cc1c2nc(-c(cc3)cc(N)c3NC3CCOCC3)[o]c2ccc1 YLHIMYKHUYXAMY-UHFFFAOYSA-N 0.000 description 1
- BCAJFSSBXPGPFJ-UHFFFAOYSA-N Cc1ccc2[o]c(C(CC3)=CC([N+]([O-])=O)=C3[FH+])nc2c1 Chemical compound Cc1ccc2[o]c(C(CC3)=CC([N+]([O-])=O)=C3[FH+])nc2c1 BCAJFSSBXPGPFJ-UHFFFAOYSA-N 0.000 description 1
- LPUWPTBICSUCAA-UHFFFAOYSA-N Cc1ccc2[s]c(-c(cc3)cc4c3[n](C3CCOCC3)c(CN(C)C)n4)nc2c1 Chemical compound Cc1ccc2[s]c(-c(cc3)cc4c3[n](C3CCOCC3)c(CN(C)C)n4)nc2c1 LPUWPTBICSUCAA-UHFFFAOYSA-N 0.000 description 1
- JOLMFPZWERUOOD-UHFFFAOYSA-N Cc1nc(cc(cc2)-c3nc(cc(cc4)Cl)c4[o]3)c2[n]1CCC(F)(F)F Chemical compound Cc1nc(cc(cc2)-c3nc(cc(cc4)Cl)c4[o]3)c2[n]1CCC(F)(F)F JOLMFPZWERUOOD-UHFFFAOYSA-N 0.000 description 1
- PXSDDASHPHKLQA-UHFFFAOYSA-N Cc1nc(cc(cc2)-c3nc4c(C)cccc4[o]3)c2[n]1C1CCOCC1 Chemical compound Cc1nc(cc(cc2)-c3nc4c(C)cccc4[o]3)c2[n]1C1CCOCC1 PXSDDASHPHKLQA-UHFFFAOYSA-N 0.000 description 1
- BLPOMKDYEYVVKV-UHFFFAOYSA-N Cc1nc(cc(cc2)-c3nc4ccccc4[s]3)c2[n]1C1CCOCC1 Chemical compound Cc1nc(cc(cc2)-c3nc4ccccc4[s]3)c2[n]1C1CCOCC1 BLPOMKDYEYVVKV-UHFFFAOYSA-N 0.000 description 1
- NXFINPYYSDBHQF-UHFFFAOYSA-N Cc1nc(cc(cc2)C(O)=O)c2[n]1C1CCOCC1 Chemical compound Cc1nc(cc(cc2)C(O)=O)c2[n]1C1CCOCC1 NXFINPYYSDBHQF-UHFFFAOYSA-N 0.000 description 1
- VGHOAKQTVWZRGI-UHFFFAOYSA-N Cc1nc(cc(cc2)C3=Nc4ccccc4C3)c2[n]1Cc1ccccn1 Chemical compound Cc1nc(cc(cc2)C3=Nc4ccccc4C3)c2[n]1Cc1ccccn1 VGHOAKQTVWZRGI-UHFFFAOYSA-N 0.000 description 1
- XBMGFDBCZHBFLR-UHFFFAOYSA-N Cc1nc2cc(-c3nc(cccc4)c4[o]3)ccc2[n]1CCNC(CCC(O)=O)=O Chemical compound Cc1nc2cc(-c3nc(cccc4)c4[o]3)ccc2[n]1CCNC(CCC(O)=O)=O XBMGFDBCZHBFLR-UHFFFAOYSA-N 0.000 description 1
- WRHMHCULRITUIZ-UHFFFAOYSA-N NCc1nc(cc(cc2)-c3nc4ccccc4[o]3)c2[n]1C1CCOCC1 Chemical compound NCc1nc(cc(cc2)-c3nc4ccccc4[o]3)c2[n]1C1CCOCC1 WRHMHCULRITUIZ-UHFFFAOYSA-N 0.000 description 1
- XLFBVWGZBNQUAO-UHFFFAOYSA-N Nc(cc(cc1)C2=NCc3ccccc3O2)c1NC1CCOCC1 Chemical compound Nc(cc(cc1)C2=NCc3ccccc3O2)c1NC1CCOCC1 XLFBVWGZBNQUAO-UHFFFAOYSA-N 0.000 description 1
- YQEJBGPZBQIPIK-UHFFFAOYSA-N Nc1cc(-c2nc3cc(Cl)ccc3[o]2)ccc1NCCC(F)(F)F Chemical compound Nc1cc(-c2nc3cc(Cl)ccc3[o]2)ccc1NCCC(F)(F)F YQEJBGPZBQIPIK-UHFFFAOYSA-N 0.000 description 1
- LQKHDUSEJGQTNE-UHFFFAOYSA-N OCc1nc(cc(cc2)-c3nc4ccccc4[s]3)c2[n]1C1CCOCC1 Chemical compound OCc1nc(cc(cc2)-c3nc4ccccc4[s]3)c2[n]1C1CCOCC1 LQKHDUSEJGQTNE-UHFFFAOYSA-N 0.000 description 1
- CZQDYAOWWNDSLI-UHFFFAOYSA-N [O-][N+](c1cc(-c2nc3cc(O)ccc3[o]2)ccc1F)=O Chemical compound [O-][N+](c1cc(-c2nc3cc(O)ccc3[o]2)ccc1F)=O CZQDYAOWWNDSLI-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/423—Oxazoles condensed with carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/426—1,3-Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/428—Thiazoles condensed with carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Epidemiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Cardiology (AREA)
- Pain & Pain Management (AREA)
- Diabetes (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Ophthalmology & Optometry (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Psychiatry (AREA)
- Psychology (AREA)
- Endocrinology (AREA)
- Hospice & Palliative Care (AREA)
- Obesity (AREA)
- Vascular Medicine (AREA)
- Emergency Medicine (AREA)
- Gynecology & Obstetrics (AREA)
- Reproductive Health (AREA)
- Immunology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 신경영양인자의 활성을 증강하고, 또한 신경 세포 보호 작용을 갖는 화합물을 제공한다. 본 발명은, 하기 화학식 (Ⅰ)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물에 관한 것이다.
[식 중, Z는 N 또는 C-R2를 나타내고, X는 N-R3, O 또는 S를 나타내고, Y는 C-R4 또는 N을 나타내고, R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R3은 수소 원자 또는 치환기를 나타내고, R4는 수소 원자 또는 치환기를 나타내고, 환 A는 치환될 수도 있는 벤젠환을 나타내고, 환 B는 치환될 수도 있는 벤젠환을 나타냄]
[식 중, Z는 N 또는 C-R2를 나타내고, X는 N-R3, O 또는 S를 나타내고, Y는 C-R4 또는 N을 나타내고, R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R3은 수소 원자 또는 치환기를 나타내고, R4는 수소 원자 또는 치환기를 나타내고, 환 A는 치환될 수도 있는 벤젠환을 나타내고, 환 B는 치환될 수도 있는 벤젠환을 나타냄]
Description
본 발명은 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제에 관한 것이다.
BDNF 및 NGF 등의 신경영양인자는 중추 및 말초신경계 세포의 분화, 기능 유지, 시냅스 형성, 및 손상시의 재생 및 수복 등에 중요한 역할을 하는 단백질이고, 신경변성 질환, 당뇨병성 신경장해, 근위축성 측책 경화증, 다발성 경화증, 뇌허혈성 질환, 알츠하이머병, 파킨슨병, 헌팅턴 무도병, 우울병 및 암 화학 요법 등에 의한 말초신경장해 등의 치료 등에 유효한 것이 알려져 있다(비특허문헌 2, 3, 4 및 5). 그러나 신경영양인자는 분자량 1만 이상의 고분자 단백질이고, 이러한 고분자 단백질을 치료제로서 이용하는 경우, 투여 방법상의 제약이나 안전성의 문제가 있는 것도 알려져 있는(비특허문헌 6 및 7) 점에서 부작용이 적은 신경영양인자의 작용을 증강하는 저분자 화합물의 제공이 요망되고 있다.
한편, 신경영양인자에 의해 어느 종류의 전사조절인자의 발현이 제어되어 있는 것이 알려져 있고(비특허문헌 1 참조), 신경영양인자에 의해 발현이 제어되어 있는 전사조절인자의 하나로서 NXF가 알려져 있다(특허문헌 1 참조).
또한, NXF가 결손한 마우스에서는 신경변성 질환의 원인의 하나로서 생각되고 있는 글루탐산 독성을 야기하였을 때에 신경변성 질환의 증상이 위독하게 나타나는 점에서 NXF가 신경 보호 작용에 중요한 역할을 갖는 것이 알려져 있다(특허문헌 2 참조).
그런데, 특허문헌 3에는 화학식
으로 표시되는 화합물이 개시되어 있다.
또한, 특허문헌 4에는 화학식
으로 표시되는 화합물이 개시되어 있다.
또한, 특허문헌 5에는 화학식
으로 표시되는 화합물이 개시되어 있다.
또한, 특허문헌 6에는 화학식
으로 표시되는 화합물이 개시되어 있다.
Nature, 322, 1986년, p.552-555
The Journal of the American Society for Experimental Neuro Therapeutics, vol.2, 2005년, p.120-128
Annual review of neuroscience, 24, 2001년, p.1217-1281
Brain research reviews, 30, 1999년, p.176-188
Progress in brain research, 146, 2004년, p.387-401
「최신 의학」 제54권, 제7호, 1999년, 88?94페이지
「인터벤션 시대의 뇌졸중학(개정 제2판) 상권-초급성기부터 재발 예방까지」, 2006년, 649?654페이지
전술한 바와 같이 신경영양인자의 활성을 증강하는 저분자 화합물의 개발?제공이 요망되고 있다.
그래서 발명자들은 NXF 발현의 유도능을 지표로 신경영양인자의 활성을 증강하는 화합물을 탐색한 결과, 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물(본 명세서 중 화합물 (Ⅰ)이라고 칭하는 경우가 있음. 또한, 본 명세서 중 본 발명의 화합물이라고 칭하는 경우가 있음)이 신경영양인자의 활성을 증강하고, 또한 신경 세포 보호 작용하는 것을 발견하여 본 발명에 이르렀다.
[식 중, Z는 N 또는 C-R2를 나타내고, X는 N-R3, O 또는 S를 나타내고, Y는 C-R4 또는 N을 나타내고, R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R3은 수소 원자 또는 치환기를 나타내고, R4는 수소 원자 또는 치환기를 나타내고, 환 A는 치환될 수도 있는 벤젠환을 나타내고, 환 B는 치환될 수도 있는 벤젠환을 나타냄]
본 발명은 이하의 [1] 내지 [13] 등을 제공하는 것이다.
[1] 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물.
[식 중, R1은 (1) C3 - 6알킬기, (2) (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-S-, (g) Ra-SO2-, (h) Ra-CO-O-, (i) Ra-CO-NRa-, (j) Ra-NRa-, (k) Ra-NRa-CS-NRa-, (l) 5 내지 6원의 환상기, (m) 카르복시기, (n) 히드록시기, (o) 아미노기, (p) 복소환-카르보닐기, (q) HO-CO-C2H4-CO-NH-(식 중, 각 Ra는 동일 또는 상이하며, 할로겐으로 치환될 수도 있는 C1 -6 알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환된 C1 - 6알킬기, 또는 (3) (a) 옥소기 및 (b) C1 - 4알콕시-카르보닐기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 탄소수 3 내지 10의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (4) 할로겐 원자 및 C1 - 4알콕시기로 이루어지는 군으로부터 선택되는 1개 이상의 기로 치환된 방향족 탄화수소환기를 나타내고, X는 NH, O 또는 S를 나타내고, Y는 CH 또는 N을 나타내고, Z는 N 또는 C-R2를 나타내고, R2는 (1) 수소 원자, (2) (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb-, (e) Rb-S-, (f) Rb-SO2-, (g) Rb-CO-O-, (h) Rb-CO-NRb-, (i) Rb-NRb-, (j) Rb-NRb-Rb-S(O)n-, (k) 페닐기, (l) 5 내지 6원 포화 복소환기, (m) 히드록시기, 및 (n) 아미노기(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 C1 - 6알킬기, C2-6알케닐기 또는 C2 - 6알키닐기, 또는 (3) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 탄소수 5 내지 6의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기를 나타내고, 환 A는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 할로겐 원자로 치환될 수도 있는 알킬기, (i) 니트로기, 및 (j) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환을 나타내고, 환 B는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 아미드기, (i) 에스테르기, (j) 할로겐 원자로 치환될 수도 있는 알킬기, (k) 니트로기, 및 (l) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환을 나타냄]
[2] Z는 C-R2이고, Y는 N인 상기 [1]에 기재된 화합물.
[3] R1은 5 내지 6원 비방향족 복소환기인 상기 [1]에 기재된 화합물.
[4] R2는 C1 - 6알킬기인 상기 [1]에 기재된 화합물.
[5] Z는 C-R2이고, Y는 N이고, R1은 5 내지 6원 비방향족 복소환기이고, R2는 C1 - 6알킬기인 상기 [1]에 기재된 화합물.
[6] 상기 [1]에 기재된 화합물을 함유하는 의약 조성물.
[7] 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제인 상기 [6]에 기재된 의약 조성물.
[8] 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제가, 뇌허혈성 질환 또는 당뇨병성 신경장해의 치료 또는 예방제인 상기 [7]에 기재된 의약 조성물.
[9] 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물을 유효 성분으로서 함유하는 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제.
[식 중, Z는 N 또는 C-R2를 나타내고, X는 N-R3, O 또는 S를 나타내고, Y는 C-R4 또는 N을 나타내고, R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R3은 수소 원자 또는 치환기를 나타내고, R4는 수소 원자 또는 치환기를 나타내고, 환 A는 치환될 수도 있는 벤젠환을 나타내고, 환 B는 치환될 수도 있는 벤젠환을 나타냄]
[10] 환 A는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 할로겐 원자로 치환될 수도 있는 알킬기, (i) 니트로기, 및 (j) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환이고, 환 B는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 아미드기, (i) 에스테르기, (j) 할로겐 원자로 치환될 수도 있는 알킬기, (k) 니트로기, 및 (l) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환이고, Z는 N 또는 C-R2이고, X는 NH, O 또는 S이고, Y는 CH 또는 N이고, R1은 (1) 수소 원자, (2) C1 - 6알킬기, (3) (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-S-, (g) Ra-SO2-, (h) Ra-CO-O-, (i) Ra-CO-NRa-, (j) Ra-NRa-, (k) Ra-NRa-CS-NRa-, (l) 5 내지 6원의 환상기, (m) 카르복시기, (n) 히드록시기, (o) 아미노기, (p) 복소환-카르보닐기, (q) HO-CO-C2H4-CO-NH-(식 중, 각 Ra는 동일 또는 상이하며, 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환된 C1 - 6알킬기, (4) (a) 옥소기, (b) C1 - 4알콕시-카르보닐기 및 (c) 히드록시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 탄소수 3 내지 10의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (5)할로겐 원자 및 C1 - 4알콕시기로 이루어지는 군으로부터 선택되는 1개 이상의 기로 치환될 수도 있는 방향족 탄화수소환기를 나타내고, R2는 (1) 수소 원자, (2) (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb-, (e) Rb-S-, (f) Rb-SO2-, (g) Rb-CO-O-, (h) Rb-CO-NRb-, (i) Rb-NRb-, (j) Rb-NRb-Rb-S(O)n-, (k) 페닐기, (l) 5 내지 6원 포화 복소환기, (m) 히드록시기, 및 (n) 아미노기(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 C1 - 6알킬기, C2 - 6알케닐기 또는 C2 - 6알키닐기, (3) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 탄소수 5 내지 6의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (4) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 페닐기이거나, 또는 R1 및 R2는 이들이 인접하는 N 및 C와 함께 5 내지 8원 질소 함유 비방향족 복소환을 형성할 수도 있고, X1은 O 또는 NH이고, R2Z는 C1 - 6알킬기인 상기 [9]에 기재된 제제.
[11] 뇌허혈성 질환 또는 당뇨병성 신경장해의 치료 또는 예방제인 상기 [9]에 기재된 제제.
[12] 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물의 유효량을 포유동물에게 투여하는 것을 특징으로 하는, 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방 방법, 또는 이학 요법 효과의 촉진 방법.
[식 중, Z는 N 또는 C-R2를 나타내고, X는 N-R3, O 또는 S를 나타내고, Y는 C-R4 또는 N을 나타내고, R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R3은 수소 원자 또는 치환기를 나타내고, R4는 수소 원자 또는 치환기를 나타내고, 환 A는 치환될 수도 있는 벤젠환을 나타내고, 환 B는 치환될 수도 있는 벤젠환을 나타냄]
[13] 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제를 제조하기 위한, 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물의 용도.
[식 중, Z는 N 또는 C-R2를 나타내고, X는 N-R3, O 또는 S를 나타내고, Y는 C-R4 또는 N을 나타내고, R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고, R3은 수소 원자 또는 치환기를 나타내고, R4는 수소 원자 또는 치환기를 나타내고, 환 A는 치환될 수도 있는 벤젠환을 나타내고, 환 B는 치환될 수도 있는 벤젠환을 나타냄]
또한, 본 발명은 이하의 [1'] 내지 [4'] 등을 제공하는 것이다.
[1'] 화학식 (I')로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물.
[식 중, R1은 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고; X는 N-R3(R3은 수소 원자 또는 치환기를 나타냄), O 또는 S를 나타내고; Y는 C-R4(R4는 수소 원자 또는 치환기를 나타냄) 또는 N을 나타내고; Z는 N 또는 C-R2(R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타냄)를 나타내고; 환 A 및 환 B는 독립적으로 치환될 수도 있는 벤젠환을 나타내되,
단, R1은 화학식
(식 중, Ra1은 카르복시기, 시아노기, 1H-테트라졸릴기, 1-트리페닐메틸-테트라졸릴기 또는 알콕시카르보닐기를 나타내고, Ra2는 수소 원자, 불소 원자, 염소 원자 또는 브롬 원자를 나타냄)
또한, 단, R1은 화학식
(단, [2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-1'-(3-페닐프로필)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-1'-(2-푸라닐메틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-1'-시클로펜틸-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-(2-푸라닐메틸)-1-(1-메틸에틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-[(4-메톡시페닐)메틸]-1-(1-메틸에틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-시클로펜틸-1-(2-푸라닐메틸)-2'-페닐-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-시클로펜틸-1-(2-푸라닐메틸)-2'-[4-(메틸티오)페닐]-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 2'-시클로헥실-1'-시클로펜틸-1-(2-푸라닐메틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-시클로펜틸-1-(2-푸라닐메틸)-2'-(3-티에닐)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-시클로펜틸-2'-[4-(메틸티오)페닐]-1-[3-(4-모르폴리닐)프로필]-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 2'-(4-클로로페닐)-1'-시클로펜틸-1-[3-(4-모르폴리닐)프로필]-, 메틸에스테르,
2,5'-비-1H-벤조이미다졸, 6-페닐-1,1'-비스(페닐메틸)-,
2,5':2',5"-Ter-1H-벤조이미다졸, 6-페닐-1,1',1"-트리스(페닐메틸)-,
2,5'-비-1H-벤조이미다졸, 1,1',2'-트리스(페닐메틸)-,
2,5'-비-1H-벤조이미다졸, 2'-(3-클로로페닐)-1'-[(2,5-디플루오로페닐)메틸]-1-(페닐메틸)-,
벤조티아졸, 2-(2-메틸-1-페닐-1H-벤조이미다졸-5-일)-, 4-메틸벤젠술포네이트(1:1),
벤조티아졸, 2-(2-메틸-1-페닐-1H-벤조이미다졸-5-일)-,
벤조옥사졸, 2-(2-메틸-1-페닐-1H-벤조이미다졸-5-일)-,
2,5'-비-1H-벤조이미다졸, 2'-메틸-1'-페닐-,
2,5'-비-1H-벤조이미다졸, 1-에틸-2'-메틸-1'-페닐-,
벤조옥사졸, 2-(2-메틸-1-페닐-1H-벤조이미다졸-5-일)-, 4-메틸벤젠술포네이트(1:1),
[1,1'-비페닐]-2-카르복실산, 4'-[(1,7'-디메틸-2'-프로필[2,5'-비-1H-벤조이미다졸]-1'-일)메틸]-, 1,1-디메틸에틸에스테르,
[1,1'-비페닐]-2-카르복실산, 4'-[(1,7'-디메틸-2'-프로필[2,5'-비-1H-벤조이미다졸]-1'-일)메틸]-,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-시클로펜틸-1'-(1-메틸에틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-(2-메톡시에틸)-1'-(2-메틸프로필)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-(1-메틸에틸)-1-(2-메틸프로필)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1'-부틸-1-(2-메틸프로필)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-(2-메톡시에틸)-1'-(1-메틸에틸)-, 메틸에스테르,
페놀, 4-[1,1'-디메틸-5-(4-메틸-1-피페라지닐)[2,5'-비-1H-벤조이미다졸]-2'-일]-,
[2,5'-비-1H-벤조이미다졸]-4,4',7,7'-테트라올, 2'-(3,4-디히드록시페닐)-1,1'-디메틸-5-(4-메틸-1-피페라지닐)-,
[2,5'-비-1H-벤조이미다졸]-4,4',7,7'-테트라올, 2'-(4-히드록시페닐)-1,1'-디메틸-5-(4-메틸-1-피페라지닐)-,
2,5'-비-1H-벤조이미다졸, 4',7'-디메톡시-2'-(메톡시메틸)-1'-메틸-6-(4-메틸-1-피페라지닐)-,
[2,5'-비-1H-벤조이미다졸]-2'-메탄올, 4',7'-디메톡시-1'-메틸-6-(4-메틸-1-피페라지닐)-,
[2,5'-비-1H-벤조이미다졸]-4',7'-디올, 2'-(히드록시메틸)-1'-메틸-6-(4-메틸-1-피페라지닐)-,
[2,5'-비-1H-벤조이미다졸]-2'-메탄올, 4',7'-디메톡시-1'-메틸-6-(4-메틸-1-피페라지닐)-, 2'-아세테이트,
2,5'-비-1H-벤조이미다졸, 2'-(클로로메틸)-4',7'-디메톡시-1'-메틸-6-(4-메틸-1-피페라지닐)-,
[2,5'-비-1H-벤조이미다졸]-2'-메탄올, 7'-히드록시-4'-메톡시-1'-메틸-6-(4-메틸-1-피페라지닐)-,
[2,5'-비-1H-벤조이미다졸]-4',7'-디올, 2'-(클로로메틸)-1'-메틸-6-(4-메틸-1-피페라지닐)-,
2,5'-비-1H-벤조이미다졸, 2'-메틸-1'-(1-메틸에틸)-1-(페닐메틸)-,
2,5'-비-1H-벤조이미다졸, 2'-(3-클로로페닐)-1-(페닐메틸)-1'-[2-[(페닐메틸)티오]에틸]-,
[2,5'-비-1H-벤조이미다졸]-6-카르복시미드아미드, 2'-(4-플루오로페닐)-1'-메틸-N-(1-메틸에틸)-,
1H-벤조이미다졸-6-카르복시미드아미드, 2-[4-[1'-부틸-6-[이미노[(1-메틸에틸)아미노]메틸][2,5'-비-1H-벤조이미다졸]-2'-일]페닐]-N-(1-메틸에틸)-,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-2'-(2-플루오로페닐)-1'-(1-메틸에틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-2'-시클로헥실-1'-(1-메틸에틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-1'-(1-메틸에틸)-2'-(3-티에닐)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-1'-(1-메틸에틸)-2'-(4-니트로페닐)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-1'-(1-메틸에틸)-2'-페닐-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 2'-(2-브로모페닐)-1-부틸-1'-(1-메틸에틸)-, 메틸에스테르,
[2,5'-비-1H-벤조이미다졸]-5-카르복실산, 1-부틸-1'-(1-메틸에틸)-, 메틸에스테르,
벤조옥사졸, 2-(1,2-디메틸-1H-벤조이미다졸-5-일)-,
벤조옥사졸, 2-(1-에틸-2-메틸-1H-벤조이미다졸-5-일)-,
벤조티아졸, 2-(1-에틸-2-메틸-1H-벤조이미다졸-5-일)- 및
벤조티아졸, 2-(1,2-디메틸-1H-벤조이미다졸-5-일)-을 제외함).
[2'] R1은 a) 6원의 환상기로 치환될 수도 있는 탄소수 1 내지 6의 비환상 탄화수소기 또는 b) 할로겐 원자, C1 - 4알콕시기 및 C1 - 4알콕시-카르보닐기로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 6 내지 10원의 환상기이고, X가 N-R3(R3은 수소 원자 또는 Ra-O-CO-(Ra는 C1 - 6알킬기임)), O 또는 S이고, Y가 CH 또는 N이고, Z가 N 또는 C-R2(식 중, R2는 a) 수소 원자, b) (1) 할로겐 원자, (2) Rb-O-, (3) Rb-CO-, (4) Rb-CO-O-및 (5) Rb-NRb-(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자, 1개의 페닐기로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 C1 - 6알킬기, 또는 c) 5 내지 6원의 환상기이고, 환 A가 벤젠환이고, 환 B가 할로겐 원자, 니트로기, C1 - 6알킬기 및 아미노기로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환인 상기 [1']에 기재된 화합물.
[3'] 화학식 (I')로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물(이하, 화합물 (Ⅰ')라고 칭하는 경우가 있음. 화합물 (Ⅰ')에 대해서는 상기 화합물 (Ⅰ)의 설명에 의해 마찬가지로 이해됨)을 유효 성분으로서 함유하는 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제.
[식 중, R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고; X는 N-R3(R3은 수소 원자 또는 치환기를 나타냄), O 또는 S를 나타내고; Y는 C-R4(R4는 수소 원자 또는 치환기를 나타냄) 또는 N을 나타내고; Z는 N 또는 C-R2(R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타냄)를 나타내고; 환 A 및 환 B는 독립적으로 치환될 수도 있는 벤젠환을 나타냄]
[4'] 뇌허혈성 질환 또는 당뇨병성 신경장해의 치료 또는 예방제인 상기 [3']에 기재된 제제.
본 발명에 의해 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방 등에 유효한 저분자 화합물의 제공이 가능해진다.
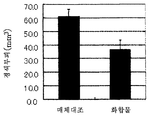
도 1은 경색 부피를 나타내는 그래프(시험예 2).
도 2는 운동신경전달속도(MNCV)의 잠시의 지연을 나타내는 그래프(시험예 3).
도 2는 운동신경전달속도(MNCV)의 잠시의 지연을 나타내는 그래프(시험예 3).
이하, 본 발명을 상세히 설명한다.
이하에 본 명세서 중에서 이용되는 용어를 설명한다.
「아릴(기)」로서는 예를 들면 C6 - 14아릴(기)를 들 수 있다. 「C6 -14아릴(기)」로서는 페닐, 나프틸 및 안트릴을 들 수 있다.
「헤테로아릴(기)」로서는 예를 들면 5 내지 6원의 헤테로아릴(기)를 들 수 있다. 「5 내지 6원의 헤테로아릴(기)」로서는 예를 들면 환 구성 원자로서 산소 원자, 황 원자 및 질소 원자로부터 선택되는 1 내지 3개(바람직하게는 1 내지 2개)의 헤테로 원자를 갖는 5 내지 6원의 헤테로아릴(기)를 들 수 있다.
「환 구성 원자로서 산소 원자, 황 원자 및 질소 원자로부터 선택되는 1 내지 3개(바람직하게는 1 내지 2개)의 헤테로 원자를 갖는 5 내지 6원의 헤테로아릴(기)」로서는, 예를 들면 푸릴(예, 2-푸릴, 3-푸릴), 티에닐(예, 2-티에닐, 3-티에닐), 피리딜(예, 2-피리딜, 3-피리딜, 4-피리딜), 피리미디닐(예, 2-피리미디닐, 4-피리미디닐, 5-피리미디닐, 6-피리미디닐), 피리다지닐(예, 3-피리다지닐, 4-피리다지닐), 피라지닐(예, 2-피라지닐), 피롤릴(예, 1-피롤릴, 2-피롤릴, 3-피롤릴), 이미다졸릴(예, 1-이미다졸릴, 2-이미다졸릴, 4-이미다졸릴, 5-이미다졸릴), 피라졸릴(예, 1-피라졸릴, 3-피라졸릴, 4-피라졸릴), 티아졸릴(예, 2-티아졸릴, 4-티아졸릴, 5-티아졸릴), 이소티아졸릴, 옥사졸릴(예, 2-옥사졸릴, 4-옥사졸릴, 5-옥사졸릴), 이소옥사졸릴, 옥사디아졸릴(예, 1,2,4-옥사디아졸-5-일, 1,3,4-옥사디아졸-2-일), 티아디아졸릴(예, 1,3,4-티아디아졸-2-일), 트리아졸릴(예, 1,2,4-트리아졸-1-일, 1,2,4-트리아졸-3-일, 1,2,3-트리아졸-1-일, 1,2,3-트리아졸-2-일, 1,2,3-트리아졸-4-일), 테트라졸릴 및 트리아지닐 등을 들 수 있다.
「시클로알킬(기)」로서는 예를 들면 C3 - 10시클로알킬(기)를 들 수 있다.
「C3 -10시클로알킬(기)」로서는 예를 들면 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실, 시클로헵틸, 시클로옥틸, 시클로노닐, 시클로데실 및 아다만틸을 들 수 있다.
「시클로알케닐(기)」로서는 예를 들면 C3 - 10시클로알케닐(기)를 들 수 있다.
「C3 -10시클로알케닐(기)」로서는 예를 들면 시클로프로페닐, 시클로부테닐, 시클로펜테닐, 시클로헥세닐, 시클로헵테닐, 시클로옥테닐, 시클로노네닐 및 시클로데세닐을 들 수 있다.
「시클로알카디에닐(기)」로서는 예를 들면 C4 - 10시클로알카디에닐기를 들 수 있다.
「C4 - 10시클로알카디에닐기」로서는 예를 들면 시클로부타디에닐, 시클로펜타디에닐, 시클로헥사디에닐, 시클로헵타디에닐, 시클로옥타디에닐, 시클로노나디에닐 및 시클로데카디에닐을 들 수 있다.
「비방향족 복소환기」로서는 5 내지 6원의 비방향족 복소환기를 들 수 있다. 「5 내지 6원의 비방향족 복소환기」로서는 예를 들면 환 구성 원자로서 산소 원자, 산화될 수도 있는 황 원자 및 질소 원자로부터 선택되는 1 내지 3개(바람직하게는 1 내지 2개)의 헤테로 원자를 갖는 5 내지 6원의 비방향족 복소환기를 들 수 있다.
「환 구성 원자로서 산소 원자, 산화될 수도 있는 황 원자 및 질소 원자로부터 선택되는 1 내지 3개(바람직하게는 1 내지 2개)의 헤테로 원자를 갖는 5 내지 6원의 비방향족 복소환기」로서는 예를 들면 피롤리디닐(예, 1-피롤리디닐, 2-피롤리디닐), 피페리디닐(예, 피페리디노, 2-피페리디닐, 3-피페리디닐, 4-피페리디닐), 모르폴리닐(예, 모르폴리노), 티오모르폴리닐(예, 티오모르폴리노), 피페라지닐(예, 1-피페라지닐, 2-피페라지닐, 3-피페라지닐), 헥사메틸렌이미닐(예, 헥사메틸렌이민-1-일), 옥사졸리디닐(예, 옥사졸리딘-2-일), 티아졸리디닐(예, 티아졸리딘-2-일), 이미다졸리디닐(예, 이미다졸리딘-2-일, 이미다졸리딘-3-일), 옥사졸리닐(예, 옥사졸린-2-일), 티아졸리닐(예, 티아졸린-2-일), 이미다졸리닐(예, 이미다졸린-2-일, 이미다졸린-3-일), 디옥솔릴(예, 1,3-디옥솔-4-일), 디옥솔라닐(예, 1,3-디옥솔란-4-일), 디히드로옥사디아졸릴(예, 4,5-디히드로-1,2,4-옥사디아졸-3-일), 피라닐(예, 4-피라닐), 테트라히드로피라닐(예, 2-테트라히드로피라닐, 3-테트라히드로피라닐, 4-테트라히드로피라닐), 티오피라닐(예, 4-티오피라닐), 테트라히드로티오피라닐(예, 2-테트라히드로티오피라닐, 3-테트라히드로티오피라닐, 4-테트라히드로티오피라닐), 1-옥시드테트라히드로티오피라닐(예, 1-옥시드테트라히드로티오피란-4-일), 1,1-디옥시드테트라히드로티오피라닐(예, 1,1-디옥시드테트라히드로티오피란-4-일), 테트라히드로푸릴(예, 테트라히드로푸란-3-일, 테트라히드로푸란-2-일), 피라졸리디닐(예, 피라졸리딘-1-일, 피라졸리딘-3-일), 피라졸리닐(예, 피라졸린-1-일), 테트라히드로피리미디닐(예, 테트라히드로피리미딘-1-일), 디히드로트리아졸릴(예, 2,3-디히드로-1H-1,2,3-트리아졸-1-일) 및 테트라히드로트리아졸릴(예, 2,3,4,5-테트라히드로-1H-1,2,3-트리아졸-1-일), 디히드로옥사제피닐 등을 들 수 있다.
「알킬(기)」로서는 예를 들면 C1 - 6알킬(기)를 들 수 있다. 「C1 -6알킬(기)」로서는 예를 들면 메틸, 에틸, n-프로필, 이소프로필, n-부틸, sec-부틸, tert-부틸, 펜틸 및 헥실을 들 수 있다.
「알케닐(기)」로서는 예를 들면 C2 - 6알케닐(기)를 들 수 있다. 「C2 -6알케닐(기)」로서는 예를 들면 비닐, 2-프로페닐, 3-메틸-2-부테닐, 1,3-부타디에닐을 들 수 있다.
「알키닐(기)」로서는 예를 들면 C2 - 6알키닐(기)를 들 수 있다. 「C2 -6알키닐(기)」로서는 예를 들면 에티닐, 2-프로피닐 및 2-펜텐-4-이닐을 들 수 있다.
「알킬렌(쇄)」로서는 예를 들면 C1 - 3알킬렌(쇄)를 들 수 있다. C1 - 3알킬렌(쇄)로서는 예를 들면 메틸렌, 에틸렌 및 트리메틸렌을 들 수 있다.
「할로겐(원자)」로서는 예를 들면 불소, 염소, 브롬 및 요오드를 들 수 있다.
「알콕시(기)」로서는 예를 들면 C1 - 6알콕시(기)를 들 수 있다.
「C1 -6알콕시(기)」로서는 예를 들면 메톡시, 에톡시, n-프로필옥시, 이소프로필옥시, n-부틸옥시, sec-부틸옥시, tert-부틸옥시, n-펜틸옥시 및 n-헥실옥시기 등을 들 수 있다.
C1 - 6알콕시(기)는, 즉 Ra-O-(Ra는 C1 - 6알킬(기))이다.
「알콕시-카르보닐(기)」로서는 예를 들면 C1 - 6알콕시-카르보닐(기)를 들 수 있다.
「C1 - 6알콕시-카르보닐(기)」로서는 예를 들면 메톡시카르보닐, 에톡시카르보닐, n-프로필옥시카르보닐, 이소프로필옥시카르보닐, n-부틸옥시카르보닐, sec-부틸옥시카르보닐, tert-부틸옥시카르보닐, n-펜틸옥시카르보닐 및 n-헥실옥시카르보닐기 등을 들 수 있다.
C1 - 6알콕시-카르보닐(기)는, 즉 Ra-O-CO-(Ra는 C1 - 6알킬(기))이다.
특별히 기재가 없는 한 이들 용어가 단어의 일부로서 이용되는 경우에도 이들 예시는 마찬가지로 이용된다.
이하에 화학식 (Ⅰ) 중에서 이용되는 기호를 설명한다.
R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타낸다.
R1로 표시되는 「치환될 수도 있는 비환상 탄화수소기」의 「비환상 탄화수소기」로서는 예를 들면 알킬기, 알케닐기 및 알키닐기를 들 수 있다.
해당 「알킬기」로서는 상기에서 예시한 것을 들 수 있다.
해당 「알케닐기」로서는 상기에서 예시한 것을 들 수 있다.
해당 「알키닐기」로서는 상기에서 예시한 것을 들 수 있다.
그 중에서도 알킬기가 바람직하고, C1 - 6알킬기가 보다 바람직하다.
R1로 표시되는 「치환될 수도 있는 비환상 탄화수소기」의 「비환상 탄화수소기」는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있다.
해당 치환기로서는 예를 들면 (1) 할로겐 원자, (2) 니트로기, (3) 시아노기, (4) Ra-CO-, (5) Ra-CO-O-, (6) Ra-CO-NRa-, (7) Ra-O-, (8) Ra-O-CO-, (9) Ra-O-CO-NRa-, (10) Ra-S-, (11) Ra-SO-, (12) Ra-SO2-, (13) Ra-NRa-, (14) Ra-S-NRa-, (15) Ra-SO-NRa-, (16) Ra-SO2-NRa-, (17) Ra-NRa-, (18) Ra-NRa-CO-, (19) Ra-NRa-CO-NRa-, (20) Ra-NRa-S-, (21) Ra-NRa-SO-, (22) Ra-NRa-SO2-, (23) Ra-NRa-S-NRa-, (24) Ra-NRa-SO-NRa-, (25) Ra-NRa-SO2-NRa-, (26) 치환될 수도 있는 환상기, (27) Ra-O-CO-C2H4-CO-NH- 및 (28) Ra-NRa-CS-NRa-L-(이들 식 중, 각 Ra는 동일 또는 상이하며, 수소 원자, 할로겐 원자 및 페닐기로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 C1 - 6알킬기를 나타냄)을 들 수 있다.
해당 「할로겐 원자」로서는 상기에서 예시한 것을 들 수 있다.
해당 「C1 - 6알킬기」로서는 상기에서 예시한 것을 들 수 있다.
해당 「치환될 수도 있는 환상기」로서는 후술에서 예시하는 R1로 표시되는 「치환될 수도 있는 환상기」와 마찬가지의 것을 들 수 있다.
상기 치환기로서는 그 중에서도 (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-S-, (g) Ra-SO2-, (h) Ra-CO-O-, (i) Ra-CO-NRa-, (j) Ra-NRa-, (k) Ra-NRa-CS-NRa-, (l) 5 내지 6원의 환상기, (m) 카르복시기, (n) 히드록시기, (o) 아미노기, (p) 복소환-카르보닐기, (q) HO-CO-C2H4-CO-NH-(이들 식 중, 각 Ra는 동일 또는 상이하며, 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타냄)가 바람직하고,
(a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-CO-O-, (g) Ra-CO-NRa-, (h) Ra-NRa-, (i) Ra-NRa-CS-NRa-, (j) 5 내지 6원의 환상기(식 중, 각 Ra는 동일 또는 상이하며, 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타냄)가 보다 바람직하다.
또한, R1로 표시되는 「치환될 수도 있는 비환상 탄화수소기」의 「비환상 탄화수소기」는 비치환인 것도 또한 바람직하다.
R1로 표시되는 「치환될 수도 있는 환상기」의 「환상기」로서는 예를 들면 아릴기(방향족 탄소환기) 및 비방향족 환상 탄화수소기(지환식 탄화수소기) 등의 탄소환기; 헤테로아릴기(방향족 복소환기) 및 비방향족 복소환기 등의 복소환기; 및 이들의 축합환기 등을 들 수 있다.
해당 「아릴기」로서는 상기에서 예시한 것을 들 수 있다.
해당 「헤테로아릴기」로서는 상기에서 예시한 것을 들 수 있다.
해당 「비방향족 환상 탄화수소기」로서는 예를 들면 시클로알킬기, 시클로알케닐기 및 시클로알카디에닐기를 들 수 있다.
해당 「시클로알킬기」, 「시클로알케닐기」 및 「시클로알카디에닐기」로서는 각각 상기에서 예시한 것을 들 수 있다.
해당 「비방향족 복소환기」로서는 상기에서 예시한 것을 들 수 있다.
상기 환상기로서는 C3 - 10시클로알킬, C3 - 10시클로알케닐, C4 - 10시클로알카디에닐 등의 탄소수 3 내지 10의 지환식 탄화수소기, 또는 5 내지 6원 비방향족 복소환기가 바람직하다.
R1로 표시되는 「치환될 수도 있는 환상기」의 「환상기」는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있다.
해당 치환기로서는 예를 들면 (1) 할로겐 원자, (2) 니트로기, (3) 시아노기, (4) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기, (5) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알케닐기, (6) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알키닐기, (7) Ra-CO-L-, (8) Ra-CO-O-L-, (9) Ra-CO-NRa-L-, (10) Ra-O-L-, (11) Ra-O-CO-L-, (12) Ra-O-CO-NRa-L-, (13) Ra-S-L-, (14) Ra-SO-L-, (15) Ra-SO2-L-, (16) Ra-NRa-L-, (17) Ra-S-NRa-L-, (18) Ra-SO-NRa-L-, (19) Ra-SO2-NRa-L-, (20) Ra-NRa-L-, (21) Ra-NRa-CO-L-, (22) Ra-NRa-CO-NRa-L-, (23) Ra-NRa-S-L-, (24) Ra-NRa-SO-L-, (25) Ra-NRa-SO2-L-, (26) Ra-NRa-S-NRa-L-, (27) Ra-NRa-SO-NRa-L-, (28) Ra-NRa-SO2-NRa-L-, (29) Ra-O-CO-C2H4-CO-NH- 및 (30) Ra-NRa-CS-NRa-L-(이들 식 중, 각 Ra는 동일 또는 상이하며, 수소 원자 또는 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기를 나타내고, L은 결합손 또는 알킬렌쇄를 나타냄)를 들 수 있다.
해당 「할로겐 원자」, 「C1 - 6알킬기」, 「C1 - 6알케닐기」, 「C1 - 6알키닐기」 및 「알킬렌쇄」로서는 각각 상기에서 예시한 것을 들 수 있다.
상기 비방향족 환상 탄화수소기(특히, 탄소수 3 내지 10의 지환식 탄화수소기) 및 상기 비방향족 복소환기(특히, 5 내지 6원 비방향족 복소환기)의 치환기로서는 그 중에서도 (a) 옥소기, (b) C1 - 4알콕시-카르보닐기, (c) 히드록시기가 바람직하고, (a) 옥소기, (b) C1 - 4알콕시-카르보닐기가 보다 바람직하다.
또한, 상기 아릴기(특히, 페닐기)의 치환기로서는 그 중에서도 (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO-, (d) Rc-CO-NRc-(이들 식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)가 바람직하다.
R1은 바람직하게는 예를 들면 (1) 수소 원자, (2) C1 - 6알킬기, (3) (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-S-, (g) Ra-SO2-, (h) Ra-CO-O-, (i) Ra-CO-NRa-, (j) Ra-NRa-, (k) Ra-NRa-CS-NRa-, (l) 5 내지 6원의 환상기, (m) 카르복시기, (n) 히드록시기, (o) 아미노기, (p) 복소환-카르보닐기, (q) HO-CO-C2H4-CO-NH-(식 중, 각 Ra는 동일 또는 상이하며, 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 C1 - 6알킬기, (4) (a) 옥소기, (b) C1 - 4알콕시-카르보닐기 및 (c) 히드록시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 탄소수 3 내지 10의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (5) 할로겐 원자 및 C1 - 4알콕시기로 이루어지는 군으로부터 선택되는 1개 이상의 기로 치환될 수도 있는 방향족 탄화수소환기이고,
보다 바람직하게는 예를 들면 (1) C3 - 6알킬기, (2) (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-CO-O-, (g) Ra-CO-NRa-, (h) Ra-NRa-, (i) Ra-NRa-CS-NRa- 및 (j) 탄소수 5 내지 6의 탄소환기(식 중, 각 Ra는 동일 또는 상이하며, 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환된 C1 - 6알킬기, 또는 (3) (a) 옥소기 및 (b) C1 - 4알콕시-카르보닐기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 탄소수 3 내지 10의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, (4) 할로겐 원자 및 C1 - 4알콕시기로 이루어지는 군으로부터 선택되는 1개 이상의 기로 치환된 방향족 탄화수소환기이고,
더욱 바람직하게는 예를 들면 5 내지 6원 비방향족 복소환기이다.
또한, 본 발명의 별도의 양태에 있어서는 R1은 바람직하게는 예를 들면 a) 6원의 환상기로 치환될 수도 있는 탄소수 1 내지 6의 비환상 탄화수소기, 또는 b) (1) 할로겐 원자, (2) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알콕시기 및 (3) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알콕시-카르보닐기로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 3 내지 10원의 환상기이고,
보다 바람직하게는 예를 들면 a) 6원의 환상기로 치환될 수도 있는 탄소수 1 내지 6의 비환상 탄화수소기, 또는 b) 할로겐 원자, C1 - 4알콕시기 및 C1 -4알콕시-카르보닐기로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 6 내지 10원의 환상기이고, 더욱 바람직하게는 예를 들면 a) 6원의 환상기로 치환될 수도 있는 C1 - 4알킬기, 또는 b) 1개 이상(바람직하게는 1 내지 3개)의 C1 - 4알콕시기로 치환될 수도 있는 6원의 환상기이다.
X는 N-R3(R3은 수소 원자 또는 치환기를 나타냄), O 또는 S를 나타낸다.
R3으로 표시되는 치환기로서는 예를 들면 (1) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기, (2) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알케닐기, (3) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알키닐기, (4) Ra-CO-L-, (5) Ra-CO-O-L-, (6) Ra-CO-NRa-L-, (7) Ra-O-L-, (8) Ra-O-CO-L-, (9) Ra-O-CO-NRa-L-, (10) Ra-S-L-, (11) Ra-SO-L-, (12) Ra-SO2-L-, (13) Ra-NRa-L-, (14) Ra-S-NRa-L-, (15) Ra-SO-NRa-L-, (16) Ra-SO2-NRa-L-, (17) Ra-NRa-L-, (18) Ra-NRa-CO-L-, (19) Ra-NRa-CO-NRa-L-, (20) Ra-NRa-S-L-, (21) Ra-NRa-SO-L-, (22) Ra-NRa-SO2-L-, (23) Ra-NRa-S-NRa-L-, (24) Ra-NRa-SO-NRa-L- 및 (25) Ra-NRa-SO2-NRa-L-(식 중, 각 Ra는 동일 또는 상이하며, 수소 원자 또는 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기를 나타내고, L은 결합손 또는 알킬렌쇄를 나타냄)를 들 수 있다.
해당 「할로겐 원자」, 「C1 - 6알킬기」, 「C1 - 6알케닐기」, 「C1 - 6알키닐기」 및 「알킬렌쇄」로서는 각각 상기에서 예시한 것을 들 수 있다.
X는 보다 바람직하게는 예를 들면 N-R3(R3은 수소 원자 또는 Ra-O-CO-(Ra는 C1-6알킬기임)임), O 또는 S 이다.
X는 더욱 바람직하게는 NH, O 또는 S이다.
Y는 C-R4(R4는 수소 원자 또는 치환기를 나타냄) 또는 N을 나타낸다.
R4로 표시되는 치환기로서는 예를 들면 (1) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기, (2) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알케닐기, (3) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알키닐기, (4) Ra-CO-L-, (5) Ra-CO-O-L-, (6) Ra-CO-NRa-L-, (7) Ra-O-L-, (8) Ra-O-CO-L-, (9) Ra-O-CO-NRa-L-, (10) Ra-S-L-, (11) Ra-SO-L-, (12) Ra-SO2-L-, (13) Ra-NRa-L-, (14) Ra-S-NRa-L-, (15) Ra-SO-NRa-L-, (16) Ra-SO2-NRa-L-, (17) Ra-NRa-L-, (18) Ra-NRa-CO-L-, (19) Ra-NRa-CO-NRa-L-, (20) Ra-NRa-S-L-, (21) Ra-NRa-SO-L-, (22) Ra-NRa-SO2-L-, (23) Ra-NRa-S-NRa-L-, (24) Ra-NRa-SO-NRa-L- 및 (25) Ra-NRa-SO2-NRa-L-(식 중, 각 Ra는 동일 또는 상이하며, 수소 원자 또는 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기를 나타내고, L은 결합손 또는 알킬렌쇄를 나타냄)를 들 수 있다.
해당 「할로겐 원자」, 「C1 - 6알킬기」, 「C1 - 6알케닐기」, 「C1 - 6알키닐기」 및 「알킬렌쇄」로서는 각각 상기에서 예시한 것을 들 수 있다.
Y는 보다 바람직하게는 예를 들면 CH 또는 N이다.
Y는 더욱 바람직하게는 N이다.
Z는 N 또는 C-R2를 나타낸다.
R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타낸다.
본 발명의 화합물에 있어서 바람직하게는 Z는 C-R2이다.
R2로 표시되는 「치환될 수도 있는 비환상 탄화수소기」의 「비환상 탄화수소기」로서는 예를 들면 알킬기, 알케닐기 및 알키닐기를 들 수 있다.
해당 「알킬기」로서는 상기에서 예시한 것을 들 수 있다.
해당 「알케닐기」로서는 상기에서 예시한 것을 들 수 있다.
해당 「알키닐기」로서는 상기에서 예시한 것을 들 수 있다.
R2로 표시되는 「치환될 수도 있는 비환상 탄화수소기」의 「비환상 탄화수소기」는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있다.
해당 치환기로서는 예를 들면 (1) 할로겐 원자, (2) 니트로기, (3) 시아노기, (4) Rb-CO-, (5) Rb-CO-O-, (6) Rb-CO-NRb-, (7) Rb-O-, (8) Rb-O-CO-, (9) Rb-O-CO-NRb-, (10) Rb-S-, (11) Rb-SO-, (12) Rb-SO2-, (13) Rb-NRb-, (14) Rb-S-NRb-, (15) Rb-SO-NRb-, (16) Rb-SO2-NRb-, (17) Rb-NRb-, (18) Rb-NRb-CO-, (19) Rb-NRb-CO-NRb-, (20) Rb-NRb-S-, (21) Rb-NRb-SO-, (22) Rb-NRb-SO2-, (23) Rb-NRb-S-NRb-, (24) Rb-NRb-SO-NRb- 및 (25) Rb-NRb-SO2-NRb-(이들 식 중, 각 Rb는 동일 또는 상이하며, 수소 원자, 할로겐 원자 및 페닐기로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 C1 - 6알킬기를 나타냄)를 들 수 있다.
해당 「할로겐 원자」로서는 상기에서 예시한 것을 들 수 있다.
해당 「C1 - 6알킬기」로서는 상기에서 예시한 것을 들 수 있다.
상기 치환기로서는 그 중에서도 예를 들면 (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb-, (e) Rb-CO-O-, (f) Rb-CO-NRb-, (g) Rb-NRb-, (h) Rb-NRb-Rb-S(O)n-, (i) 페닐, (j) 5 내지 6원 포화 복소환기 및 (k) 히드록시, (l) 아미노(이들 식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)가 바람직하고, (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb- 및 (e) Rb-CO-NRb-, (f) Rb-NRb-Rb-S(O)n-(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)가 보다 바람직하다.
R2로 표시되는 「치환될 수도 있는 환상기」로서는 R1로 표시되는 「치환될 수도 있는 환상기」와 마찬가지의 것을 들 수 있다.
R2는 바람직하게는 예를 들면 (1) 수소 원자, (2) (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb-, (e) Rb-S-, (f) Rb-SO2-, (g) Rb-CO-O-, (h) Rb-CO-NRb-, (i) Rb-NRb-, (j) Rb-NRb-Rb-S(O)n-, (k) 페닐기, (l) 5 내지 6원 포화 복소환기, (m) 히드록시기, 및 (n) 아미노기(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 C1 - 6알킬기, C2 - 6알케닐기 또는 C2 - 6알키닐기, (3) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 탄소수 5 내지 6의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (4) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 페닐기이고,
보다 바람직하게는 (1) 수소 원자, (2) (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb- 및 (e) Rb-CO-NRb-, (f) Rb-NRb-Rb-S(O)n-(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 C1 - 6알킬기, 또는 (3) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 탄소수 5 내지 6의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기이다.
또한, 본 발명의 별도의 양태에 있어서는 Z는 바람직하게는 예를 들면 N 또는 C-R2(R2는 a) 수소 원자, b) (1) 할로겐 원자, (2) Rb-O-, (3) Rb-O-CO-, (4) Rb-O-CO-NRb-, (5) Rb-CO-, (6) Rb-CO-O- 및 (7) Rb-NRb-(이들 식 중, 각 Rb는 동일 또는 상이하며, 수소 원자, 할로겐 원자 및 페닐기로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 C1-6알킬기, 또는 c) (1) 할로겐 원자, (2) Ra-O-(식 중, Ra는 C1 - 4알킬기를 나타냄), (3) Ra-S-L-(식 중, Ra는 수소 원자 또는 C1 - 3알킬기를 나타내고, L은 결합손 또는 C1-2알킬렌쇄임) 및 선택되는 1개 이상(바람직하게는 1개)의 치환기로 치환될 수도 있는 5 내지 6원의 환상기임)이고,
보다 바람직하게는 예를 들면 N 또는 C-R2(R2는 a) 수소 원자, b) (1) 할로겐 원자, (2) Rb-O-, (3) Rb-CO-, (4) Rb-CO-O- 및 (5) Rb-NRb-(이들 식 중, 각 Rb는 동일 또는 상이하며, 수소 원자, 1개의 페닐기로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 C1 - 6알킬기, 또는 c) 5 내지 6원의 환상기임)이다.
환 A는 치환될 수도 있는 벤젠환을 나타낸다.
환 A로 표시되는 「치환될 수도 있는 벤젠환」의 「벤젠환」은 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있다.
해당 치환기로서는 R1로 표시되는 「치환될 수도 있는 환상기」에 대하여 예시한 치환기와 마찬가지의 것을 들 수 있다.
그 중에서도 예를 들면 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 할로겐 원자로 치환될 수도 있는, (i) 니트로기, (j) 아릴옥시기가 바람직하다.
환 A는 바람직하게는 예를 들면 비치환의(즉,
이외에 치환기를 갖지 않음)의 벤젠환이다.
환 B는 치환될 수도 있는 벤젠환을 나타낸다.
환 B로 표시되는 「치환될 수도 있는 벤젠환」의 「벤젠환」은 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있다.
해당 치환기로서는 R1로 표시되는 「치환될 수도 있는 환상기」에 대하여 예시한 치환기와 마찬가지의 것을 들 수 있다.
그 중에서도 예를 들면 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 아미드기, (i) 알콕시카르보닐기, (j) 할로겐 원자로 치환될 수도 있는 알킬기, (k) 니트로기, (l) 아릴옥시기가 바람직하다.
환 B는 바람직하게는 비치환의 벤젠환이다.
본 발명의 별도의 양태에 있어서, 환 B는 바람직하게는 예를 들면 (1) 할로겐 원자, (2) 니트로기, (3) 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기, (4) Ra-O-CO-L-, (5) Ra-SO2-NRa-L- 및 (6) Ra-NRa-L-(식 중, 각 Ra는 동일 또는 상이하며, 수소 원자 또는 1개 이상(바람직하게는 1 내지 3개)의 할로겐 원자로 치환될 수도 있는 C1 - 6알킬기이고, L은 결합손임)로부터 선택된 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 벤젠환이다.
환 B는 보다 바람직하게는 예를 들면 (1) 할로겐 원자(바람직하게는 염소), (2) 니트로기, (3) C1 - 6알킬기(바람직하게는 메틸) 및 (4) 아미노기로부터 선택된 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 벤젠환이다.
또한, 바람직하게는 화합물 (Ⅰ)로부터, 화학식
(식 중, R1은 치환될 수도 있는 알킬기를 나타냄)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물이 제외된다.
화합물 (Ⅰ)로서는 상기한 바람직한 각 부분 구조, 보다 바람직한 각 부분 구조, 및 더욱 바람직한 각 부분 구조의 예로부터 선택되는 2 이상을 조합하여 이용되고 있는 것이 보다 바람직하다.
화합물 (Ⅰ)은 바람직하게는 예를 들면 이하의 화합물 A이다.
또한, 화합물 A는 신규 화합물이다.
(화합물 A)
화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물.
[식 중, R1은 (1) C3 - 6알킬기, (2) (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-S-, (g) Ra-SO2-, (h) Ra-CO-O-, (i) Ra-CO-NRa-, (j) Ra-NRa-, (k) Ra-NRa-CS-NRa-, (l) 5 내지 6원의 환상기, (m) 카르복시기, (n) 히드록시기, (o) 아미노기, (p) 복소환-카르보닐기, (q) HO-CO-C2H4-CO-NH-(식 중, 각 Ra는 동일 또는 상이하며, 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환된 C1 - 6알킬기, (3) (a) 옥소기 및 (b) C1 - 4알콕시-카르보닐기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 탄소수 3 내지 10의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (4) 할로겐 원자 및 C1 - 4알콕시기로 이루어지는 군으로부터 선택되는 1개 이상의 기로 치환된 방향족 탄화수소환기를 나타내고, X는 NH, O 또는 S를 나타내고, Y는 CH 또는 N을 나타내고, Z는 N 또는 C-R2를 나타내고, R2는 (1) 수소 원자, (2) (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb-, (e) Rb-S-, (f) Rb-SO2-, (g) Rb-CO-O-, (h) Rb-CO-NRb-, (i) Rb-NRb-, (j) Rb-NRb-Rb-S(O)n-, (k) 페닐기, (l) 5 내지 6원 포화 복소환기, (m) 히드록시기, 및 (n) 아미노기(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 -6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 C1 - 6알킬기, C2 - 6알케닐기 또는 C2 - 6알키닐기, 또는 (3) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 탄소수 5 내지 6의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기를 나타내고, 환 A는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 할로겐 원자로 치환될 수도 있는 알킬기, (i) 니트로기 및 (j) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환을 나타내고, 환 B는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 아미드기, (i) 알콕시카르보닐기, (j) 할로겐 원자로 치환될 수도 있는 알킬기, (k) 니트로기 및 (l) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환을 나타냄]
화합물 A에 있어서, 바람직하게는 Z는 C-R2이고, Y는 N이다.
화합물 A에 있어서, 바람직하게는 R1은 5 내지 6원 비방향족 복소환기이다.
화합물 A에 있어서, 바람직하게는 R2는 C1 - 6알킬기이다.
화합물 A에 있어서, 바람직하게는 Z는 C-R2이고, Y는 N이고, R1은 5 내지 6원 비방향족 복소환기이고, R2는 C1 - 6알킬기이다.
또한, 화합물 (Ⅰ')로서 바람직하게는 R1은 a) 6원의 환상기로 치환될 수도 있는 탄소수 1 내지 6의 비환상 탄화수소기, 또는 b) 할로겐 원자, 1개 이상의 C1 - 4알콕시기 및 C1 - 4알콕시-카르보닐기로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 6 내지 10원의 환상기이고, X가 N-R3(R3은 수소 원자 또는 Ra-O-CO-(Ra는 C1 - 6알킬기임)), O 또는 S이고, Y가 CH 또는 N이고, Z가 N 또는 C-R2(식 중, R2는 a) 수소 원자, b) (1) 할로겐 원자, (2) Rb-O-, (3) Rb-CO-, (4) Rb-CO-O- 및 (5) Rb-NRb-(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자, 1개의 페닐기로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 C1 - 6알킬기, 또는 c) 5 내지 6원의 환상기이고, 환 A가 (비치환의) 벤젠환이고, 환 B가 할로겐 원자, C1 - 6알킬기, 니트로기 및 아미노기로부터 선택되는 1개 이상(바람직하게는 1 내지 3개)의 치환기로 치환될 수도 있는 벤젠환인 화합물이다.
화합물 (Ⅰ)은 약학적으로 허용되는 염일 수도 있다. 이러한 염으로서는 예를 들면 금속염, 암모늄염, 유기염기와의 염, 무기산과의 염, 유기산과의 염, 염기성 또는 산성 아미노산과의 염 등을 들 수 있다. 금속염의 바람직한 예로서는 예를 들면 나트륨염, 칼륨염 등의 알칼리금속염; 칼슘염, 마그네슘염, 바륨염 등의 알칼리토류금속염; 알루미늄염 등을 들 수 있다. 유기염기와의 염의 바람직한 예로서는 예를 들면 트리메틸아민, 트리에틸아민, 피리딘, 피콜린, 2,6-루티딘, 에탄올아민, 디에탄올아민, 트리에탄올아민, 시클로헥실아민, 디시클로헥실아민, N,N'-디벤질에틸렌디아민 등과의 염을 들 수 있다. 무기산과의 염의 바람직한 예로서는 예를 들면 염산, 브롬화수소산, 질산, 황산, 인산 등과의 염을 들 수 있다. 유기산과의 염의 바람직한 예로서는 예를 들면 포름산, 아세트산, 트리플루오로아세트산, 프탈산, 푸마르산, 옥살산, 타르타르산, 말레산, 시트르산, 숙신산, 말산, 메탄술폰산, 벤젠술폰산, p-톨루엔술폰산 등과의 염을 들 수 있다. 염기성 아미노산과의 염의 바람직한 예로서는 예를 들면 아르기닌, 리신, 오르니틴 등과의 염을 들 수 있고, 산성 아미노산과의 염의 바람직한 예로서는 예를 들면 아스파라긴산, 글루탐산 등과의 염을 들 수 있다. 이 중, 약학적으로 허용되는 염이 바람직하다. 예를 들면 화합물 내에 산성 관능기를 갖는 경우에는 알칼리금속염(예, 리튬염, 나트륨염, 칼륨염 등), 알칼리토류금속염(예, 마그네슘염, 칼슘염, 바륨염 등) 등의 무기염, 암모늄염 등, 또한 화합물 내에 염기성 관능기를 갖는 경우에는 예를 들면 염산, 브롬화수소산, 질산, 황산, 인산 등 무기산과의 염, 또는 아세트산, 프탈산, 푸마르산, 옥살산, 타르타르산, 말레산, 시트르산, 숙신산, 메탄술폰산, p-톨루엔술폰산 등의 유기산과의 염을 들 수 있다.
화합물 (Ⅰ)은 호변 이성체를 갖는 경우, 안정 구조를 취하는 이성체가 바람직하지만, 본 발명은 이것에 한정되는 것이 아니고, 다른 이성체를 배제하는 것이 아니고, 모두 본 발명의 범위 내이다.
또한, 화합물 (Ⅰ)이 광학 이성체, 입체 이성체, 위치 이성체, 회전 이성체 등의 이성체를 갖는 경우에는 어느 한쪽의 이성체나 혼합물도 본 발명의 범위 내이다. 본 발명의 화합물에 포함된다. 또한, 화합물 (Ⅰ)에 광학 이성체가 존재하는 경우에는 라세미체로부터 분할된 광학 이성체도 본 발명의 범위 내이다.
화합물 (Ⅰ)은 결정일 수도 비결정일 수도 있고, 모두 본 발명의 범위 내이다.
동위 원소(예, 2H, 3H, 14C, 35S, 125I 등) 등으로 표지 또는 치환된 화합물 (Ⅰ)도 본 발명의 범위 내이다.
화합물 (Ⅰ)은 용매화물(예를 들면, 수화물 등)일 수도 무용매화물일 수도 있다.
이하에 화합물 (Ⅰ)의 제조 방법을 설명한다.
특별히 기재가 없는 한, 반응식 중의 화합물의 각 기호는 상기와 마찬가지의 의미를 나타낸다. 또한, 화학식 중의 화합물은 염을 형성하고 있는 경우도 포함하고, 이러한 염으로서는 예를 들면 화합물 (Ⅰ)의 염와 마찬가지의 것을 들 수 있다. 또한, 각 공정에서 얻어진 화합물은 반응액 그대로이거나 조제물로서 다음 반응에 이용할 수도 있지만, 통상법에 따라 반응 혼합물로부터 단리할 수도 있고, 그 자체가 공지된 수단 예를 들면 추출, 농축, 중화, 여과, 증류, 재결정, 증류, 크로마토그래피 등의 분리 수단에 의해 용이하게 정제할 수 있다. 또는 화학식 중의 화합물이 시판되고 있는 경우에는 시판품을 그대로 이용할 수도 있다.
특별히 기재가 없는 한, 본 명세서 중 실온은 약 10℃ 내지 약 35℃이다.
화합물 (Ⅰ)은 예를 들면 이하의 반응식에 나타내는 방법 또는 그에 준한 방법에 의해 제조할 수 있다.
상기한 반응식 중의 공정의 반응을 하기에 상세히 설명한다. 이들 반응을 조합함으로써 본 발명에 있어서의 화학식 (Ⅰ)로 표시되는 화합물 또는 그의 염을 제조할 수 있다.
[아미노화]
화학식
(R3'는 카르복실기, 할로겐 원자, 트리할로메틸기, 또는 화학식
으로 표시되는 기를 나타내고, Xa는 이탈기를 나타내고, X, Y, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-1)과, 화학식
H2N-R1
(R1은 상기와 같음)로 표시되는 화합물 (S-1') 및 그의 염을 반응시킴으로써,
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-2)를 제조할 수 있다.
Xa로 표시되는 이탈기로서는 예를 들면 할로겐 원자; 치환될 수도 있는 알킬술포닐옥시기(예, 메탄술포닐옥시기, 에탄술포닐옥시기 및 트리플루오로메탄술포닐옥시 등의 할로겐 원자로 치환될 수도 있는 알킬술포닐옥시기); 및 치환될 수도 있는 아릴술포닐옥시기(예, 벤젠술포닐옥시, p-톨루엔술포닐옥시기 및 2-니트로벤젠술포닐옥시기) 등을 들 수 있고, 특히 할로겐 원자가 바람직하다.
본 반응에 있어서, 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
화합물 (S-1')의 사용량은 화합물 (S-1) 1몰에 대하여 통상 1 내지 2몰, 바람직하게는 1 내지 1.5몰이다.
이용되는 염기로서는 예를 들면 탄산나트륨, 탄산수소나트륨, 탄산칼륨, 탄산세슘, 인산칼륨 등의 탄산염류; 수산화나트륨, 수산화칼륨 등의 수산화물류; 모르폴린, 피페리딘, 피리딘, 트리메틸아민, 트리에틸아민, 디이소프로필에틸아민, 4-디메틸아미노피리딘과 같은 유기 아민 등을 들 수 있다. 그 사용량은 화합물 (S-1) 1몰에 대하여 통상 1 내지 2몰, 바람직하게는 1 내지 1.5몰이다.
용매로서는 예를 들면 물; 메탄올 및 에탄올 등의 알코올계 용매; 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 아세토니트릴, 디메틸포름아미드, 디메틸술폭시드 및 N-메틸피롤리돈 등의 비양성자성 용매; 클로로포름 등의 할로겐화 탄화수소류, 또는 이들의 혼합 용매 등이 이용되고, 앞에 기재된 유기 아민류나 화합물 (S-1')를 용매와 사용할 수도 있다.
[환원]
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-2)를 접촉 환원법 또는 금속 환원 시약을 이용함으로써,
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-3)을 제조할 수 있다.
접촉 환원법은 1 내지 5기압의 수소 분위기하 또는 경우에 따라 수소 대신에 포름산암모늄을 이용하고, 금속 촉매의 존재하, 약 0℃ 내지 이용한 용매의 비점까지의 범위 내의 온도에서 10분간 내지 48시간 반응시킴으로써 행할 수 있다.
금속 촉매로서는 예를 들면 팔라듐-탄소, 수산화팔라듐-탄소, 로듐-탄소, 라니-니켈, 산화백금 등을 들 수 있고, 그 사용량은 화합물 (S-2)에 대하여 통상 0.01% 내지 100%중량, 바람직하게는 0.1 내지 50%중량이다.
용매로서는 예를 들면 메탄올, 에탄올, 2-프로판올과 같은 알코올계 용매; 테트라히드로푸란 등의 에테르계 용매; 아세트산에틸 등의 에스테르계 용매; N,N-디메틸포름아미드 등의 비양성자성 극성 용매 또는 이들의 혼합 용매 등을 들 수 있다.
금속 환원 시제를 이용하는 경우, 약 0℃ 내지 이용한 용매의 비점까지의 범위 내의 온도에서 10분간 내지 48시간 반응시킴으로써 행할 수 있다.
금속 환원 시제로서는 예를 들면 염화주석(Ⅱ), 환원철 또는 삼염화티탄(Ⅲ) 등을 들 수 있고, 그 사용량은 화합물 (S-2) 1몰에 대하여 통상 1 내지 20몰, 바람직하게는 1 내지 5몰이다.
용매로서는 예를 들면 물; 희염산; 아세트산; 메탄올, 에탄올 및 2-프로판올 등의 알코올계 용매, 테트라히드로푸란, 1,2-디메톡시에탄 등의 에테르계 용매, 아세트산에틸 등의 에스테르계 용매, 아세톤, 아세토니트릴 및 N,N-디메틸포름아미드 등의 비양성자성 극성 용매, 또는 이들의 혼합 용매 등을 들 수 있다.
[환화 1]
환화 1은 산클로라이드 화합물을 이용한 방법, 카르복실산 화합물을 이용한 방법, 알데히드 화합물을 이용한 방법, 트리아세탈 화합물을 이용한 방법 등의 당업자에게 주지의 방법으로 행할 수 있다.
산클로라이드 화합물을 이용한 경우, 예를 들면 문헌[Zhurnal Obshchei Khimii 1962, 32(5), 1581-86(Engl. Transl. Ver.: pp1565-1569)]에 기재된 방법에 준하여 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-3)과,
화학식
R2-COCl
(R2는 상기와 같음)로 표시되는 산클로라이드 화합물을 반응시킴으로써,
화학식
(R1, R2, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-4)를 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
산클로라이드 화합물의 사용량은 화합물 (S-3) 1몰에 대하여 통상 1 내지 5몰, 바람직하게는 1 내지 2몰이다.
용매로서는 예를 들면 테트라히드로푸란, 1,2-디메톡시에탄 등의 에테르계 용매, 아세트산에틸 등의 에스테르계 용매, 아세톤, 아세토니트릴 및 N,N-디메틸포름아미드 등의 비양성자성 극성 용매, 또는 이들의 혼합 용매 등을 들 수 있다.
한편, 카르복실산 화합물을 이용한 경우, 예를 들면 문헌[Zhurnal Obshchei Khimii 1962, 32(5), 1581-86(Engl. Transl. Ver.:pp1565-1569)]에 기재된 방법에 준하여 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-3)과,
화학식
R2-COOH
(R2는 상기와 같음)로 표시되는 카르복실산 화합물을 반응시킴으로써,
화학식
(R1, R2, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-4)를 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
카르복실산 화합물의 사용량은 화합물 (S-3) 1몰에 대하여 통상 1 내지 5몰, 바람직하게는 1 내지 2몰이다.
탈수축합제로서 무수아세트산, 무수프로피온산 등의 저급 지방산 무수물; 메탄술폰산, 파라톨루엔술폰산 등의 유기술폰산; 옥시염화인, 삼염화인, 오산화이인, 황산, 폴리인산, 붕산 등의 무기산을 이용할 수도 있다.
용매로서는 예를 들면 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 또는 이들의 혼합 용매 등이 이용되고, 앞에 기재된 카르복실산을 용매와 사용할 수도 있다.
또한, 알데히드 화합물을 이용한 경우, 예를 들면 문헌[Synthesis 2003, No11, 1683-1692]에 기재된 방법에 준하여 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-3)과,
화학식
R2-CHO
(R2는 상기한 바와 같고, R2'는 알킬쇄를 나타냄)로 표시되는 알데히드 화합물을 반응시킴으로써,
화학식
(R1, R2, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-4)를 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
알데히드 화합물의 사용량은 화합물 (S-3) 1몰에 대하여 통상 1 내지 5몰, 바람직하게는 1 내지 2몰이다.
산화제로서는 예를 들면 m-클로로과벤조산, 2,3-디클로로-5,6-디시아노-1,4-벤조퀴논(DDQ), 옥손, 벤조푸록산, 과망간산칼륨, 과산화수소, 과아세트산, tert-부틸히드로퍼옥시드 등을 들 수 있고, 화합물 (S-3) 1몰에 대하여 통상 0.1 내지 5몰, 바람직하게는 0.5 내지 2몰이다.
용매로서는 예를 들면 물; 메탄올 및 에탄올 등의 알코올계 용매; 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 아세토니트릴, 디메틸포름아미드, 디메틸술폭시드 및 N-메틸피롤리돈 등의 비양성자성 용매; 클로로포름 등의 할로겐화 탄화수소류, 또는 이들의 혼합 용매 등이 이용된다.
또한, 트리아세탈 화합물을 이용한 경우, 예를 들면 문헌[Synthesis, 2008, (3), 387-394]에 기재된 방법에 준하여 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-3)과,
화학식
R2-C(OR2')3
(R2는 상기한 바와 같고, R2'는 알킬쇄를 나타냄)으로 표시되는 트리아세탈 화합물을 반응시킴으로써,
화학식
(R1, R2, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-4)를 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
트리아세탈 화합물의 사용량은 화합물 (S-3) 1몰에 대하여 통상 1 내지 10몰, 바람직하게는 1 내지 5몰이다.
반응계 중에 촉매량의 산을 첨가할 수도 있다. 이용되는 산의 종류로서는 염산, 브롬화수소산, 질산산, 황산 등의 무기산류나, 아세트산, 트리플루오로아세트산, 메탄술폰산, p-톨루엔술폰산 등의 유기산류를 들 수 있다.
용매로서는 예를 들면 메탄올 및 에탄올 등의 알코올계 용매; 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 아세토니트릴, 디메틸포름아미드, 디메틸술폭시드 및 N-메틸피롤리돈 등의 비양성자성 용매; 클로로포름 등의 할로겐화 탄화수소류, 또는 이들의 혼합 용매 등이 이용된다. 앞에 기재된 트리아세탈 화합물을 용매와 사용할 수도 있다.
또한, 이미데이트 화합물을 이용한 경우, 예를 들면 일본 특허 공개 평4-308580호 공보에 기재된 방법에 준하여 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-3)과
화학식
R2-C(=NH)OR2'
(R2 및 R2'는 상기와 같음)로 표시되는 이미데이트 화합물과 반응시킴으로써,
화학식
(R1, R2, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-4)를 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
이미데이트 화합물의 사용량은 화합물 (S-3) 1몰에 대하여 통상 1 내지 5몰, 바람직하게는 1 내지 2몰이다.
용매로서는 예를 들면 메탄올 및 에탄올 등의 알코올계 용매; 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 아세토니트릴, 디메틸포름아미드, 디메틸술폭시드 및 N-메틸피롤리돈 등의 비양성자성 용매; 클로로포름 등의 할로겐화 탄화수소류, 또는 이들의 혼합 용매 등이 이용된다.
[환화 2]
환화 2(즉, 직접 환화 또는 2단계 환화)는 당업자에게 주지의 방법으로 행할 수 있다.
직접 환화는 예를 들면 문헌[Zhurnal Obshchei Khimii 1962, 32(5), 1581-86(Engl. Transl. Ver.: pp1565-1569]에 기재된 방법에 준하여 상기한 카르복실산을 이용한 경우의 환화 1과 마찬가지의 방법으로 제조할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R2 및 환 A는 상기와 같음)으로 표시되는 산화합물 (S-5)와
화학식
(X 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-5')를 반응시킴으로써,
화학식
(R1, R2, X, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-6)을 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
화합물 (S-5')의 사용량은 화합물 (S-5) 1몰에 대하여 통상 1 내지 5몰, 바람직하게는 1 내지 2몰이다.
탈수축합제로서, 무수아세트산, 무수프로피온산 등의 저급 지방산 무수물; 메탄술폰산, 파라톨루엔술폰산 등의 유기술폰산; 옥시염화인, 삼염화인, 오산화이인, 황산, 폴리인산, 붕산 등의 무기산을 이용할 수도 있다.
용매로서는 예를 들면 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 또는 이들의 혼합 용매 등이 이용되고, 앞에 기재된 탈수축합제를 용매와 사용할 수도 있다.
2단계 환화는 예를 들면 문헌[Journal of Medicinal Chemistry 1988, 31(9), 1778-85] 또는 [Bioorganic & Medicinal Chemistry 2004, 12(1), 17-21]에 기재된 방법에 준하여 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R2 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-5)와
화학식
(X 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-5')로부터
화학식
(R1, R2, X, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-6')를 합성하고, 이것을 변환함으로써,
화학식
(R1, R2, X, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-6)을 제조할 수 있다.
1공정째는 축합제 또는 산할로겐화제를 이용한 반응이다.
축합제를 이용하는 경우, 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
화합물 (S-5')의 사용량은 화합물 (S-5) 1몰에 대하여 통상 1 내지 2몰, 바람직하게는 1 내지 1.5몰이다.
축합제로서는 예를 들면 Bop(1H-1,2,3-벤조트리아졸-1-일옥시(트리(디메틸아미노))포스포늄헥사플루오로포스페이트), WSC(1-에틸-3-(3-디메틸아미노프로필)카르보디이미드?염산염), DCC(N,N-디시클로헥실카르보디이미드), CDI(카르보닐디이미다졸), 디에틸포스포릴시아니드 등을 들 수 있다. 축합제의 사용량은 화합물 (S-5) 1몰에 대하여 통상 1 내지 2몰, 바람직하게는 1 내지 1.5몰이다.
또한, 필요에 따라 화합물 (S-5)에 대하여 1당량 내지 과잉량의 유기염기, 예를 들면 트리에틸아민 등을 첨가할 수도 있다.
용매로서 예를 들면 디클로로메탄, 클로로포름 등의 할로겐화 탄화수소류, 예를 들면 디메틸술폭시드 등의 술폭시드류, 예를 들면 아세트산에틸 등의 에스테르류, 예를 들면 테트라히드로푸란, 1,4-디옥산 등의 에테르류, 예를 들면 N,N-디메틸포름아미드, N,N-디메틸아세트아미드 등의 아미드류 등을 들 수 있다.
산할로겐화제를 이용하는 경우, 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
화합물 (S-5')의 사용량은 화합물 (S-5) 1몰에 대하여 통상 1 내지 2몰, 바람직하게는 1 내지 1.5몰이다.
산할로겐화제로서는 예를 들면 티오닐클로라이드, 옥살릴클로라이드, 삼염화인, 오염화인 등을 들 수 있다. 산할로겐화제의 사용량은 화합물 (S-5) 1몰에 대하여 통상 1 내지 10몰, 바람직하게는 1 내지 1.5몰이다.
반응계 중에 촉매량의 N,N-디메틸포름아미드를 첨가할 수도 있다.
용매로서 예를 들면 디클로로메탄, 클로로포름 등의 할로겐화 탄화수소류; 예를 들면, 디메틸술폭시드 등의 술폭시드류; 예를 들면, 아세트산에틸 등의 에스테르류, 예를 들면 테트라히드로푸란, 1,4-디옥산 등의 에테르류; 예를 들면, N,N-디메틸포름아미드, N,N-디메틸아세트아미드 등의 아미드류; 벤젠, 톨루엔 등의 방향족 탄화수소류 등을 들 수 있다.
2공정째는 탈수축합제를 이용한 반응이다.
반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상순간 내지 약 48시간이다.
탈수축합제로서 무수아세트산, 무수프로피온산 등의 저급 지방산 무수물; 메탄술폰산, 파라톨루엔술폰산 등의 유기술폰산; 옥시염화인, 삼염화인, 오산화이인, 황산, 폴리인산, 붕산 등의 무기산을 이용할 수도 있다.
용매로서는 예를 들면 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 또는 이들의 혼합 용매 등이 이용되고, 앞에 기재된 탈수축합제를 용매와 사용할 수도 있다.
[환화 3]
환화 3은 당업자에게 주지의 방법(예를 들면, WO2005/82901에 기재된 방법)으로 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-3)을 니트로소화제를 반응시킴으로써,
화학식
(R1, R3' 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-7)을 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
니트로소화제로서는 아질산나트륨과 같은 알칼리금속 아질산염류, 아질산메틸에스테르 또는 아질산이소아밀과 같은 유기아질산 화합물류를 들 수 있고, 그 사용량은 화합물 (S-3) 1몰에 대하여 통상 1 내지 5몰, 바람직하게는 1 내지 2몰이다.
용매로서는 물과 산의 조합이 이용된다. 산으로서는 염산이나 황산과 같은 무기산류나 아세트산과 같은 유기산류를 들 수 있다.
[환화 4]
환화 4는 당업자에게 주지의 방법(예를 들면, 문헌[Synthetic Communications 1998, 28(22), 4123-4135]에 기재된 방법)으로 행할 수 있다.
구체적으로는 예를 들면
화학식
(Ya는 할로겐 원자를 나타내고, R1, R2 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-8)과
화학식
(X 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-5')를 반응시킴으로써,
화학식
(R1, R2, X, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-6)을 제조할 수 있다.
본 반응에 있어서 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
화합물 (S-5')의 사용량은 화합물 (S-8) 1몰에 대하여 통상 1 내지 2몰, 바람직하게는 1 내지 1.5몰이다.
탈수축합제로서 무수아세트산, 무수프로피온산 등의 저급 지방산 무수물; 메탄술폰산, 파라톨루엔술폰산 등의 유기술폰산; 옥시염화인, 삼염화인, 오산화이인, 황산, 폴리인산, 붕산 등의 무기산을 이용할 수도 있다.
용매로서는 예를 들면 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 또는 이들의 혼합 용매 등이 이용되고, 앞에 기재된 탈수축합제를 용매와 사용할 수도 있다.
[커플링]
커플링은 당업자에게 주지의 방법(예를 들면, 토미오카 키요시 감역, 「인명 반응에게 배우는 유기합성전략」, 가부시키가이샤가가쿠도진, 2006년 8월 15일 p258-259:쿠마타 크로스커플링 반응, p310-311:네기시 크로스커플링 반응 p440-441:스틸-켈리 커플링 반응, p.448-449:스즈끼-미야우라 커플링 반응에 기재된 방법)으로 행할 수 있다.
구체적으로는 예를 들면
화학식
(R1, R2, Xa 및 환 A는 상기와 같음)으로 표시되는 화합물 (S-9)와
화학식
(Yb는 붕소산(B(OH)2) 또는 그 에스테르, 유기주석(예를 들면 SnBu4(테트라부틸주석) 등), 또는 그 밖의 적절한 유기 금속 화합물을 형성하는 금속(예를 들면 마그네슘, 아연 등)을 나타내고, X 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-10)을 반응시킴으로써,
화학식
(R1, R2, X, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-11)을 제조할 수 있다.
반응은 전이 금속 촉매의 존재하, 또한 경우에 따라 배위자, 염기, 첨가제 등의 존재하, 약 20℃ 내지 이용한 용매의 비점까지의 범위 내의 온도에서 10분간 내지 48시간 반응시킴으로써 행할 수 있다.
화합물 (S-10)의 사용량은 화합물 (S-9) 1몰에 대하여 통상 1 내지 20몰, 바람직하게는 1 내지 5몰이다.
전이 금속 촉매로서는 예를 들면 아세트산팔라듐(Ⅱ), 염화팔라듐(Ⅱ), 테트라키스(트리페닐포스핀)팔라듐(0), 비스(트리페닐포스핀)팔라듐클로라이드(Ⅱ), 트리스(디벤질리덴아세톤)디팔라듐(0), 또는 [1,1'-비스(디페닐포스피노)페로센]디클로로팔라듐(Ⅱ) 등을 들 수 있다. 전이 금속 촉매의 사용량은 화합물 (S-10) 1몰에 대하여 통상 0.0001 내지 1몰, 바람직하게는 0.001 내지 1몰이다.
배위자로서는 예를 들면 트리페닐포스핀, 트리-o-톨릴포스핀, 트리-tert-부틸포스핀, 트리-2-푸릴포스핀, 트리-시클로헥실포스핀, 트리페닐아르신, 1,1'-비스(디페닐포스피노)페로센(dppf) 등을 들 수 있다. 배위자의 사용량은 화합물 (S-9) 1몰에 대하여 통상 0.0001 내지 4몰, 바람직하게는 0.001 내지 4몰이다.
염기로서는 예를 들면 트리에틸아민, 디이소프로필에틸아민 등의 유기염기, 탄산나트륨, 탄산수소나트륨, 탄산칼륨, 탄산세슘, 인산칼륨 등의 무기염기 등을 들 수 있다. 염기의 사용량은 화합물 (S-9) 1몰에 대하여 통상 1 내지 10몰, 바람직하게는 1 내지 4몰이다.
첨가제로서는 예를 들면 염화리튬, 플루오르화세슘, 요오드화구리(Ⅰ), 브롬화구리(Ⅰ) 등의 무기염을 들 수 있다.
용매로서는 예를 들면 물, 아세토니트릴이나, 클로로포름 또는 디클로로메탄 등의 용매로서는 예를 들면 물; 메탄올 및 에탄올 등의 알코올계 용매; 테트라히드로푸란 및 디옥산 등의 에테르계 용매; 벤젠, 톨루엔, 크실렌 등의 방향족 탄화수소계 용매; 아세토니트릴; 디메틸포름아미드; 디메틸술폭시드 또는 N-메틸피롤리돈 등의 비양성자성 용매; 클로로포름 등의 할로겐화 탄화수소류, 또는 이들의 혼합 용매 등을 들 수 있다.
(그 밖의 합성법)
당업자에게 주지의 방법(예를 들면, WO03/053344에 기재된 방법)에 의해,
화학식
(R2a는 알킬카르보닐옥시메틸기 또는 벤질옥시메틸기를 나타내고, R1, R2, X, Y, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-12)로부터,
화학식
(R1, X, Y, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-12')를 얻어, 다시 이것을 변환함으로써
화학식
(R2b 및 R2c는 수소 원자 또는 치환될 수도 있는 탄소 원자를 나타내고, R1, X, Y, 환 A 및 환 B는 상기와 같음)으로 표시되는 화합물 (S-12")를 제조할 수 있다.
1공정째는 R2a가 알킬카르보닐옥시메틸기인 경우에는 가수분해, R2a가 벤질옥시메틸기인 경우에는 접촉 환원법에 의해 제조하는 방법이다.
R2a가 알킬카르보닐옥시메틸기인 경우, 반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 24시간이다.
이용되는 알칼리의 종류는 수산화리튬, 수산화나트륨 등의 수산화물을 들 수 있고, 그 사용량은 화합물 (S-12) 1몰에 대하여 통상 1 내지 10몰, 바람직하게는 1 내지 3몰이다.
용매로서 예를 들면 물과, 메탄올, 에탄올과 같은 알코올 용매류; 예를 들면, 디메틸술폭시드 등의 술폭시드류; 예를 들면, 테트라히드로푸란, 1,4-디옥산 등의 에테르류, 예를 들면 N,N-디메틸포름아미드, N,N-디메틸아세트아미드 등의 아미드류 등의 혼합 용매 등이 이용된다.
R2a가 벤질옥시메틸기인 경우, 1 내지 5기압의 수소 분위기하, 또는 경우에 따라 수소 대신에 포름산암모늄을 이용하고, 금속 촉매의 존재하, 약 0℃ 내지 이용한 용매의 비점까지의 범위 내의 온도에서 10분간 내지 48시간 반응시킴으로써 행할 수 있다.
금속 촉매로서는 예를 들면 팔라듐-탄소, 수산화팔라듐-탄소, 로듐-탄소, 라니-니켈, 산화백금 등을 들 수 있고, 그 사용량은 화합물 (S-12)에 대하여 통상 0.01% 내지 100%중량, 바람직하게는 0.1 내지 10%중량이다.
용매로서는 예를 들면 메탄올, 에탄올, 2-프로판올과 같은 알코올계 용매; 테트라히드로푸란 등의 에테르계 용매; 아세트산에틸 등의 에스테르계 용매; N,N-디메틸포름아미드 등의 비양성자성 극성 용매 또는 이들의 혼합 용매 등을 들 수 있다.
2공정째는 산할로겐화제를 이용한 반응이다.
반응 온도의 범위는 통상 실온 내지 환류 온도이고, 반응 시간의 범위는 통상 순간 내지 약 48시간이다.
화합물 (S-12')의 사용량은 카르복실산 화합물 1몰에 대하여 통상 1 내지 2몰, 바람직하게는 1 내지 1.5몰이다.
산할로겐화제로서는 예를 들면 티오닐클로라이드, 옥살릴클로라이드, 삼염화인, 오염화인 등을 들 수 있다. 산할로겐화제의 사용량은 화합물 (S-12') 1몰에 대하여 통상 1 내지 10몰, 바람직하게는 1 내지 1.5몰이다.
반응계 중에 촉매량의 N,N-디메틸포름아미드를 첨가할 수도 있다.
용매로서 예를 들면 디클로로메탄, 클로로포름 등의 할로겐화 탄화수소류; 예를 들면, 디메틸술폭시드 등의 술폭시드류; 예를 들면, 아세트산에틸 등의 에스테르류, 예를 들면 테트라히드로푸란, 1,4-디옥산 등의 에테르류; 예를 들면, N,N-디메틸포름아미드, N,N-디메틸아세트아미드 등의 아미드류; 벤젠, 톨루엔 등의 방향족 탄화수소류 등을 들 수 있다.
이상, 화합물 (Ⅰ)의 제조법에 대하여 설명하였지만, 이들 제조법에 따라 합성되는 화합물 (Ⅰ)은 전용, 농축, 용매 추출, 분류, 정출, 재결정 및 컬럼 크로마토그래피 등의 공지된 수법에 의해 반응 혼합물 중으로부터 분취 및 정제할 수 있다.
또한, 화합물 (Ⅰ)이 유리체로서 얻어진 경우에는 자체 공지된 방법 또는 그에 준하는 방법에 의해 목적으로 하는 상기한 바와 같은 염에 변환할 수 있고, 반대로 화합물 (Ⅰ)의 염으로서 얻어진 경우에는 자체 공지된 방법 또는 그에 준하는 방법에 의해 유리체 또는 목적으로 하는 다른 염에 변환할 수 있다.
예를 들면, 정제된 화합물 (Ⅰ)을 예를 들면 염산, 브롬화수소산, 인산, 황산 등의 무기산류나, 아세트산, 시트르산, 숙신산, 타르타르산, 푸마르산, 말레산, 메탄술폰산, p-톨루엔술폰산 등의 유기산류와 반응시킴으로써, 약제로서 허용할 수 있는 산부가염을 용이하게 얻을 수 있다.
또한, 정제된 화합물 (Ⅰ)을 예를 들면 수산화리튬, 리튬메틸레이트, 수소화나트륨, 탄산나트륨, 수산화나트륨, 나트륨메틸레이트, 수산화칼륨, 탄산칼륨, 수산화칼륨, 칼륨-t-부티레이트와 같은 무기?유기 금속염을 반응시킴으로써, 약제로서 허용할 수 있는 금속염을 용이하게 얻을 수 있다.
본 발명의 화합물을 의도되는 투여에 알맞은 모든 형태로 제공할 수 있다. 알맞은 형태는 약학적으로(즉 생리학적으로) 허용되는 염 및 본 발명의 화합물의 프리드러그 형태 및 프로드러그 형태를 포함한다. 이들 프리드러그 형태 및 프로드러그 형태도 또한 본 발명의 범위 내이다.
본 발명의 화합물은 신경영양인자의 활성을 증강하는 작용을 갖고, 특히 이에 따라 신경의 보호에 중요한 역할을 갖는 NXF 유전자 발현을 유도하는 작용을 갖는다.
따라서, 본 발명의 화합물은 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제로서 사용할 수 있다.
또한, 본 발명의 화합물은 신체 기능의 회복을 위한 이학 요법 효과의 촉진제로서 사용할 수 있다.
본 명세서 중 질환은 장해 및 그 증상을 포함하는 의미로 이용된다.
또한, 본 명세서 중 치료는 증상의 완화를 포함하는 의미로 이용된다.
신경영양인자의 활성이 관여하는 질환으로서는 이하의 뇌신경변성 질환, 척수변성 질환, 망막변성 질환, 말초신경변성 질환 및 그 밖의 질환을 들 수 있다.
뇌신경변성 질환으로서는 예를 들면 신경변성 질환(예, 알츠하이머병, 파킨슨병, 헌팅턴 무도병, 다운증후군 등), 뇌허혈성 질환(뇌졸중, 뇌경색, 일과성 뇌허혈 발작, 지주막하출혈, 허혈성 뇌증, 뇌경색(라크나 경색, 아테롬 혈전성 뇌경색, 심원성 뇌경색증, 출혈성 뇌경색, 그 밖의 경색) 등), 외상성 뇌손상, 백질뇌증 및 다발성 경화증을 들 수 있다.
척수변성 질환으로서는 예를 들면 근위축성측색경화증(ALS), 척수손상, 여러 가지 원인에 의한 척수 장해, 척수성 진행성 근위축증 및 척수성 뇌변성증(SCD)을 들 수 있다.
망막변성 질환으로서는 예를 들면 가령황반변성증(AMD), 당뇨병성 망막증, 망막색소변성증, 고혈압성 망막증 및 녹내증을 들 수 있다.
말초신경변성 질환으로서는 예를 들면 당뇨병성 신경장해, 말초신경손상, 외상성 말초신경장해, 중독, 다른 독성 물질에 의한 말초신경장해, 암화학치료법에 의한 말초신경장해, 길랑-바레(Guillain-Barre) 증후군, 비타민 등의 결핍에 의한 말초신경장해, 아밀로이드 말초신경장해, 허혈성 말초신경장해, 악성 종양에 따른 말초신경장해, 요독증성 말초신경장해, 물리적 원인에 의한 말초신경장해, 샤르코-마리-투스(Charcot-Marie-Tooth)병, 알코올성 말초신경장해, 자율신경이상(무자각성 저혈당, 위부전마비, 신경인성설사 및 변비, 발기부전, 기립성저혈압, 부정맥, 심부전, 무통성심근경색, 발한이상, 신경인성방광 등), 방광기능장해(예, 무억제방광, 반사성방광, 자율성방광, 지각마비성방광, 운동마비성방광 등)를 들 수 있다.
그 밖의 질환으로서는 예를 들면 우울병, 통합실조증, 간질, 자폐증, 치주병, 당뇨병, 당뇨병성 심근증, 당뇨병성 발병변, 염증성 장질환(예, 궤양성 대장염, 크론병 등), 인지증에 따른 문제 행동(예, 배회, 공격적 행위 등), 불안증, 동통, 청각장해, 골 질환(예, 골다공증 등), 관절 질환(예, 샤르코 관절, 변형성 관절증, 류머티즘 등), 히르슈슈프룽병을 들 수 있다.
그 중에서도 본 발명의 화합물은 뇌허혈성 질환 또는 당뇨병성 신경장해에 대하여 바람직하게 적용된다.
본 발명의 화합물은 독성이 낮기 때문에 그대로 또는 약학적으로 허용되는 담체 등과 혼합하여 제제되는 조성물(예, 의약 조성물)로서, 신경영양인자의 활성이 관여하는 질환의 예방 또는 치료를 위해서 인간 등의 포유동물에게 경구적 또는 비경구적으로 안전하게 투여할 수 있다. 「비경구」에는 정맥내, 근육내, 피하, 장기내, 비강내, 피내, 점안, 뇌내, 직장내, 질내 및 복강내 등에 대한 투여를 포함한다.
본 발명의 조성물은 예를 들면 본 발명의 화합물의 1종 이상과 약학적으로 허용되는 담체, 부형제 및/또는 첨가제 등을 함유한다.
본 발명의 조성물은 그 형태에 따라 공지된 방법에 의해 본 발명의 화합물과 약학적으로 허용되는 담체, 부형제 및/또는 첨가제(예, 의약 첨가제, 식품 첨가제, 화장품 첨가제) 등을 혼합함으로써 제조할 수 있다.
본 발명의 조성물에 이용되는 약학적으로 허용되는 담체, 부형제 및/또는 첨가제 등은 상기 조성물의 구체적 용도에 따라 적절하게 선택할 수 있다. 또한, 해당 조성물의 형태도 구체적 용도에 따라 예를 들면 여러 가지 고체, 액체 등의 형태로 할 수 있다.
예를 들면, 본 발명의 의약 조성물 또는 본 발명의 화합물을 의약품으로서 이용하는 경우에는 구체적인 형태로서 예를 들면 산제, 세립제, 과립제, 정제, 시럽제, 캡슐제, 현탁화제, 에멀전제, 엑기스제 및 환제 등의 경구제, 주사제, 외용액제, 연고제 등의 경피흡수제(피부 외용제), 좌제 및 국소 등에 대한 비경구제 등을 들 수 있다.
경구제는 예를 들면 젤라틴, 알긴산나트륨, 전분, 옥수수 전분, 백당, 젖당, 포도당, 만니트, 카르복시메틸셀룰로오스, 덱스트린, 폴리비닐피롤리돈, 결정셀룰로오스, 대두레시틴, 자당, 지방산에스테르, 탈크, 스테아르산마그네슘, 폴리에틸렌글리콜, 규산마그네슘, 무수규산 등의 담체나 부형제, 결합제, 붕괴제, 계면활성제, 활택제, 유동성 촉진제, 희석제, 보존제, 착색제, 향료, 안정화제, 보습제, 방부제, 산화 방지제 등의 의약품 첨가제를 이용하여 통상의 방법에 따라 제조할 수 있다.
투여량은 투여되는 포유동물의 연령, 성별, 체중, 질환의 정도, 본 발명의 화합물의 종류, 투여 형태 등에 따라 다르지만, 통상은 경구의 경우에는 인간 성인으로 1일당 유효 성분량으로서 약 1mg 내지 약 2g, 바람직하게는 유효 성분량으로서 약 5mg 내지 약 1g을 투여하면 된다. 또한, 상기 1일의 투여량을 1회 또는 수회에 나눠 투여할 수 있다.
비경구제 중 주사제는 생리식염수, 멸균수 링거액 등의 수용성 용제, 식물유, 지방산에스테르 등의 비수용성 용제, 포도당, 염화나트륨 등의 등장화제, 용해 보조제, 안정화제, 방부제, 현탁화제, 유화제 등의 의약품 첨가제를 이용하여 통상의 방법에 따라 제조할 수 있다. 외용액제, 겔상 연고 등의 경피 흡수제, 직장내 투여를 위한 좌제 등도 통상의 방법에 따라 제조할 수 있다. 이와 같은 비경구제를 투여하기 위해서는 주사(피하, 정맥내 등), 경피 투여, 직장 투여하면 된다. 국소제는 예를 들면 본 발명의 화합물을 에틸렌비닐아세트산 중합체 등의 서방성 중합체의 펠릿에 넣어 제조할 수 있다. 이 펠릿을 치료할 조직 중에 외과적으로 이식하면 된다.
투여량은 투여되는 포유동물의 연령, 성별, 체중, 질환의 정도, 본 발명의 조성물 또는 본 발명의 화합물의 종류, 투여 형태 등에 따라 다르지만, 통상은 주사의 경우에는 인간 성인으로 유효 성분량으로서 약 0.1mg 내지 약 500mg을 투여하면 된다. 또한, 상기 1일의 투여량을 1회 또는 수회에 나눠 투여할 수 있다.
<실시예>
이하, 본 발명을 합성예, 실시예, 제제예 및 시험예 등에 의해 더욱 자세히 설명하지만, 본 발명은 이들 예에만 한정되는 것이 아니다.
합성예 1
5-(벤조티아졸-2-일)-2-메틸-1-페닐벤조이미다졸의 합성
합성예 1-1
3-니트로-4-페닐아미노벤조산의 합성
가지 플라스크에 4-플루오로-3-니트로벤조산(2.51g, 13.56mmol), 아닐린(2.52g, 27.12mmol) 및 에탄올(9.5mL)을 넣고, 환류 조건하에서 16시간 가열 교반시켰다. 실온까지 냉각후, 희염산(1M, 50mL)에 혼합물을 붓고, 증류수(100mL)로 희석, 그대로 실온에서 30분 교반하였다. 석출한 결정을 여과 취출, 희염산(1M, 약 3mL×3회), 증류수(약 5mL×2회)에 이어서 디에틸에테르(약 3mL)로 세정하였다. 얻어진 결정을 감압 가열 건조함으로써 표제 화합물(3.39g, 정량적)을 적등색 고체로서 얻었다.
합성예 1-2
3-아미노-4-페닐아미노벤조산의 합성
삼구 플라스크에 3-니트로-4-페닐아미노벤조산(합성예 1-1 참조)(1.67g, 6.70mmol), 팔라듐/탄소(Pd:10%, 0.170g) 및 테트라히드로푸란(34mL)을 넣고, 감압/수소 가스 치환을 3회 반복하여 수소 치환하고, 실온에서 2.5시간 교반하였다. 질소 치환후, 증류수(20mL)를 첨가하여 10분 교반, 셀라이트층(20mm 두께)으로 불용물을 여과 분별, 또한 동층을 테트라히드로푸란(20mL×3회)으로 세정하였다. 여과액과 세정액을 합하여 용매를 감압 증류 제거하였다. 아세트산에틸(약 50mL×4회) 추출, 증류수(30mL) 세정, 무수황산나트륨 건조에 이어서 용매를 감압 증류 제거, 또한 감압 건조함으로써 표제 화합물(1.45g, 수율 95.3%)을 담황색 고체로서 얻었다.
합성예 1-3
2-메틸-1-페닐벤조이미다졸-5-카르복실산의 합성
이구 플라스크에 3-아미노-4-페닐아미노벤조산(합성예 1-2 참조)(1.40g, 6.35mmol) 및 탈수 톨루엔(15mL)을 넣어 환류시켰다. 여기에 염화아세틸(1.00g, 12.70mmol)/톨루엔 용액(약 2.5mL)을 약 15분으로 적하후, 동 조건하 2.5시간 교반하였다. 실온까지 방랭, 희수산화나트륨 수용액(10%, 200mL)으로 추출하였다. 암등색 수층을 분액한 후, 빙랭(5 내지 10℃), 액성을 농염산(12M)으로 약 pH 4로 하였다. 석출한 결정을 여과 취출, 증류수로 세정, 감압 가열 건조함으로써 표제 화합물(1.34g, 수율 83.5%)을 담자색 고체로서 얻었다.
합성예 1-4
5-(벤조티아졸-2-일)-2-메틸-1-페닐벤조이미다졸의 합성
이구 플라스크에 2-메틸-1-페닐벤조이미다졸-5-카르복실산(합성예 1-3 참조)(1.33g, 5.28mmol) 및 탈수 테트라히드로푸란(30mL)을 넣고, 실온에서 염화옥살릴(0.70g, 5.30mmol)을 적하하였다. 계속해서 반응 혼합물을 50℃에서 3시간 교반하였다. 실온까지 방랭후, 용매를 감압 증류 제거하여 얻어지는 담황색 잔사에 탈수 테트라히드로푸란(10mL), 2-아미노벤젠티올(0.66g, 5.27mmol)을 더 첨가하여 50℃에서 16시간 교반하였다. 실온까지 방랭후, 클로로포름(50mL×3회)으로 추출, 포화 탄산수소나트륨 수용액(약 50mL), 이어서 포화식염수(약 50mL)으로 세정, 무수 황산마그네슘 건조에 이어서 용매를 감압 증류 제거하여 얻어지는 암황색 유상 잔사(1.84g)를 실리카 겔 칼럼 크로마토그래피(실리카 겔:90g, EtOAc/CHCl3=1/5→1/4)로 정제함으로써 표제 화합물(0.46g, 수율 25.5%)을 오렌지색 분말로서 얻었다.
합성예 2
5-(벤조이미다졸-2-일)-2-메틸-1-페닐벤조이미다졸의 합성
환류 냉각관 부착 이구 플라스크(20mL)에 2-메틸-1-페닐벤조이미다졸-5-카르복실산(합성예 1-3 참조)(0.15g, 0.59mmol) 및 폴리인산(약 2g)을 넣고, 120℃에 가열하였다. 여기에 1,2-디아미노벤젠(0.09g, 0.83mmol)을 첨가하고, 160℃에 가열, 동 조건하에서 20시간 교반하였다. 실온까지 방랭후, 얼음을 첨가하고, 액성을 농암모니아수(28%)로 약 pH 9로 하였다. 석출한 결정을 여과 취출, 증류수 세정(약 3mL×2회), 또한 건조함으로써 표제 화합물(0.25g, 정량적)을 녹색을 띤 담황색 결정으로서 얻었다.
합성예 3
5-(벤조옥사졸-2-일)-2-메틸-1-페닐벤조이미다졸의 합성
환류 냉각관 부착 이구 플라스크(20mL)에 2-메틸-1-페닐벤조이미다졸-5-카르복실산(합성예 1-3 참조)(0.15g, 0.59mmol), 2-아미노페놀(0.09g, 0.82mmol) 및 폴리인산(약 2g)을 넣고, 160℃에 가열, 동 조건하에서 20시간 교반하였다. 실온까지 방랭후, 얼음을 첨가하고, 액성을 농암모니아수(28%)로 약 pH 9로 하였다. 석출한 결정을 여과 취출, 증류수 세정(약 3mL×2회), 또한 건조함으로써 표제 화합물(0.13g, 수율 68%)을 녹색을 띤 담황색 결정으로서 얻었다.
합성예 4
2-아미노-1-(테트라히드로피란-4-일)아미노-4-트리플루오로메틸벤젠의 합성
합성예 4-1
1-(테트라히드로피란-4-일)아미노-2-니트로-4-트리플루오로메틸벤젠의 합성
삼구 플라스크(200mL)에 1-플루오로-2-니트로-4-트리플루오로메틸벤젠(1.59g, 7.61mmol), 4-아미노테트라히드로피란(1.00g, 9.89mmol) 및 피리딘(16mL)을 넣고, 98℃에서 23시간 교반하였다. 생성한 황색 유상물을 실온까지 방랭하고, 증류수(약 20mL)를 교반하면서 첨가하고, 석출한 결정을 여과 취출, 증류수로 세정, 감압 가열 건조함으로써 표제 화합물(2.00g, 수율 90.5%)을 황색 결정으로서 얻었다.
합성예 4-2
2-아미노-1-(테트라히드로피란-4-일)아미노-4-트리플루오로메틸벤젠의 합성
삼구 플라스크(200mL)에 1-(테트라히드로피란-4-일)아미노-2-니트로-4-트리플루오로메틸벤젠(합성예 4-1 참조)(1.00g, 3.45mmol) 및 테트라히드로푸란(17mL)을 넣고, 진탕하여 균일 용액으로 하였다. 여기에 팔라듐/탄소(Pd:10%, 0.09g)를 첨가하여 재차 진탕시켰다. 계속해서 감압/수소 가스 치환을 3회 반복하여 수소 분위기로 하고, 동 조건하 실온에서 4시간 심하게 진탕시킨 후, 질소 치환하고, 증류수(40mL)를 첨가하여 10분 진탕, 셀라이트층(20mm 두께)으로 불용물을 여과 분별, 동층을 아세트산에틸로 더욱 세정하였다. 여과액과 세정액을 합하여 용매를 감압 증류 제거하여 표제 화합물(0.66g, 수율 73.6%)을 백색 분체로서 얻었다.
합성예 5
5-(벤조옥사졸-2-일)-1,2-디메틸벤조이미다졸의 합성
합성예 5-1
(2-메틸아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.2mmol)을 탄산칼륨(50mg, 3.5mmol), 40% 모노메틸아민 수용액(270mg, 3.5mmol)을 포함하는 에탄올(5mL) 용액에 첨가하고, 환류 조건하에서 2시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하여 석출한 결정을 여과하고, 결정을 물로 세정후, 감압 가열 건조함으로써 얻어진 결정을 10% 팔라듐탄소(50mg)를 포함하는 메탄올:테트라히드로푸란-=1:1 혼합 용액(20mL) 용액을 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 8시간 교반하였다. 반응 종료후, 셀라이트 여과하여 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(80mg, 수율 53%)을 담적색 결정으로서 얻었다.
합성예 5-2
5-(벤조옥사졸-2-일)-1,2-디메틸벤조이미다졸의 합성
(2-메틸아미노아닐린-5-일)벤조옥사졸(합성예 5-2 참조)(75mg, 0.31mmol)을 DMF(2mL)에 용해하고, 90% 아세트알데히드 수용액(46mg, 0.94mmol) 이어서 옥손(192mg, 0.31mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.10g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(50.3mg, 수율 61%)을 담갈색 결정으로서 얻었다.
합성예 6
5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸메탄술폰산염의 합성
2-메틸벤조이미다졸-5-카르복실산(1.00g, 5.7mmol), 2-아미노페놀(0.68g, 6.2mmol), 클로로포름(20mL), 트리에틸아민(0.69g, 6.8mmol) 및 WSC(1.20g, 6.2mmol)를 실온에서 철야 교반하였다. 반응 종료후, 농축한 잔사에 물(50mL)을 첨가하고, 아세트산에틸로 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하여 얻어진 결정을 디옥산(30mL)에 용해하고, 메탄술폰산(0.48mL)을 첨가하여 10시간 환류?교반하였다. 냉각후, 석출한 고체를 여과 취출하고, THF로 세정한 후에 50℃에서 감압 건조함으로써 표제 화합물(0.82g, 수율 42%)을 백색 고체로서 얻었다.
합성예 7
5-(벤조옥사졸-2-일)-1-에틸-2-메틸벤조이미다졸의 합성
합성예 7-1
2-(4-에틸아미노-3-니트로페닐)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(321mg, 2.32mmol), 에틸아민 수용액(ca. 70%, 149mg, 2.32mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하여 표제 화합물(310mg, 수율 94.3%)을 얻었다.
합성예 7-2
2-(2-에틸아미노아닐린-5-일)벤조옥사졸
니트로(300mg, 1.06mmol)의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 15시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(246mg, 수율 92%)을 얻었다.
5-(벤조옥사졸-2-일)-1-에틸-2-메틸벤조이미다졸
아민(248mg, 0.979mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(161mg, 1.47mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(230mg, 수율 83%)을 분홍색 결정으로서 얻었다.
실시예 1
5-(벤조티아졸-2-일)-1-페닐-2-(페닐메톡시)메틸벤조이미다졸의 합성
실시예 1-1
1-페닐-2-(페닐메톡시)메틸벤조이미다졸-5-카르복실산의 합성
환류 냉각관 부착 사구 플라스크(300mL)에 3-아미노-4-페닐아미노벤조산(합성예 1-1 참조)(3.09g, 13.54mmol) 및 탈수 톨루엔(45mL)을 넣어 환류시켰다. 여기에 염화벤질옥시아세틸(5g, 27.08mmol)/톨루엔 용액(약 3mL)을 약 10분으로 적하하였다. 동 조건하 15시간 교반하였다. 실온까지 방랭, 희수산화나트륨 수용액(10%, 100mL)으로 추출하였다. 톨루엔(80mL)으로 세정, 암등색 수층을 분액한 후, 냉각(5 내지 10℃), 액성을 농염산(12M)으로 pH 4로 하였다. 석출한 결정을 여과 취출, 증류수 세정, 감압 가열 건조함으로써 표제 화합물(4.21g, 수율 86.8%)을 담자색 분말로서 얻었다.
실시예 1-2
5-(벤조티아졸-2-일)-1-페닐-2-(페닐메톡시)메틸벤조이미다졸의 합성
환류 냉각관 부착 사구 플라스크(500mL)에 1-페닐-2-(페닐메톡시)메틸벤조이미다졸-5-카르복실산(실시예 1-1 참조)(4.00g, 11.16mmol) 및 탈수 테트라히드로푸란(63mL)을 넣고, 염화옥살릴(1.65g, 13.0mmol)을 첨가한 후, 50℃에 가온, 3시간 교반하였다. 실온까지 방랭, 용매를 감압 증류 제거하였다. 잔사의 녹색을 띤 유백색 반고체에 탈수 테트라히드로푸란(30mL)을 재차 첨가하고, 2-아미노벤젠티올(1.40g, 11.22mmol)을 서서히 첨가한 후, 50℃에 가온, 16시간 교반하였다. 실온까지 방랭, 석출한 결정을 여과 취출, 포화 탄산수소나트륨 수용액(약 20mL)으로 세정, 석출 고체를 여과 취출하여 원료와 표제 화합물의 혼합물(원료/표제 화합물=약 1/1(1H-NMR에 기초함), 2.43g)을 얻었다. 여과액을 실온에서 16시간 더 방치하여 석출하는 결정을 여과 취출, 포화 탄산칼륨 수용액으로 리펄프 세정, 증류수 세정, 이어서 감압 가열 건조함으로써 표제 화합물(0.82g, 수율 16%)을 백색 분말로서 얻었다.
실시예 2
5-(벤조티아졸-2-일)-2-히드록시메틸-1-페닐벤조이미다졸의 합성
환류 냉각관 부착 가지 플라스크(50mL)에 5-(벤조티아졸-2-일)-1-페닐-2-(페닐메톡시)메틸벤조이미다졸(실시예 1-2 참조)(0.40g, 0.89mmol) 및 희염산(6M, 5mL)을 넣고, 2시간 환류하였다. 얻어진 담황색 투명 용액을 빙랭한 결과 유백색 현탁액이 되었다. 석출 결정을 여과 취출, 증류수, 이어서 t-부틸메틸에테르로 세정후, 감압 건조함으로써 표제 화합물(0.30g, 수율 94%)을 백색 분말로서 얻었다.
실시예 3
5-(벤조티아졸-2-일)-2-(N,N-디메틸아미노)메틸-1-페닐벤조이미다졸의 합성
이구 플라스크(20mL)에 5-(벤조티아졸-2-일)-2-히드록시메틸-1-페닐벤조이미다졸(실시예 2 참조)(0.24g, 0.67mmol) 및 탈수 디클로로메탄(3mL)을 넣고, 냉각(5 내지 10℃)하였다. 여기에 염화티오닐(0.114g, 0.96mmol)을 적하하였다. 실온에서 10분 교반후, 탈수 N,N-디메틸포름아미드(3방울)를 첨가, 계속해서 1시간 환류시켰다. 실온까지 방랭, 용매를 감압 증류 제거함으로써 대응하는 염화물을 녹색을 띤 유백색 고체로서 제조하고, 여기에 및 탈수 테트라히드로푸란(3mL)을 넣고, 디메틸아민/테트라히드로푸란 용액(2.0M, 1.1mL)을 적하하였다. 40℃까지 가온, 2시간 교반하였다. 실온까지 방랭, 용매를 감압 증류 제거, 잔사를 아세트산에틸(50mL×2회)로 추출, 포화 탄산수소나트륨 수용액(약 30mL×2회), 이어서 증류수(약 30mL)로 세정, 무수황산나트륨으로 건조, 용매를 감압 증류 제거하여 얻어지는 담황색 잔사(0.25g)를 클로로포름과 실리카 겔(0.5g)로부터 흡착 분말을 제조하고, 실리카 겔 칼럼 크로마토그래피(실리카 겔:10g, CHCl3/MeOH=20/1)로 정제, 또한 PTLC로 단리함으로써 표제 화합물(0.008g, 2.9%)을 담황색 결정으로서 얻었다.
실시예 4
5-(벤조티아졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 4-1
4-((테트라히드로피란-4-일)아미노)-3-니트로벤조산의 합성
4-플루오로-3-니트로벤조산(126.4g, 0.68mol)을 에탄올(880mL)에 용해하였다. 트리에틸아민(82.6g, 0.82mol), 4-아미노테트라히드로피란(82.7g, 0.81mol)을 차례로 적하하고, 적하후, 반응액을 가열 환류하였다. 5시간 환류한 후, 트리에틸아민(8.3g, 82mmol), 아미노테트라히드로피란(8.3g, 81mmol)을 첨가하여 다시 9시간 환류하였다. 반응 혼합물을 실온까지 냉각후, 2N HCl(880mL)과 물(880mL)을 첨가하고, 잠시 교반한 후, 얻어진 고체를 여과 취출하였다. 60℃에서 통풍 건조함으로써 표제 화합물(183.3g, 정량적)을 황색 고체로서 얻었다.
실시예 4-2
3-아미노-4-((테트라히드로피란-4-일)아미노)벤조산의 합성
4-((테트라히드로피란-4-일)아미노)-3-니트로벤조산(실시예 4-1 참조)(202g, 0.76mol)을 THF(2.2L)와 메탄올(1.5L)의 혼합 용액에 용해하고, Pd/C(5%, 습윤, 20g)를 첨가하여 5기압에서 수소 첨가 반응을 행하였다. 3시간에 수소의 흡수가 멈추었기 때문에, 계 내를 아르곤 치환후, 촉매를 여과 제거하고, 여과액을 감압 농축함으로써 표제 화합물(180g, 정량적)을 농회색 고체로서 얻었다.
실시예 4-3
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산의 합성
3-아미노-4-((테트라히드로피란-4-일)아미노)벤조산(실시예 4-2 참조)(90g, 0.38mol)을 디옥산(900mL)에 용해하고, 10℃에 냉각후, 염화아세틸(35.0g, 0.45mol)의 디옥산(900mL) 용액을 35분에 걸쳐 적하하였다. 환류 조건하에서 2.5시간 가열 교반한 후, 염화아세틸(15.8g, 0.20mol)의 디옥산(200mL) 용액을 반응액에 추가하고, 또한 환류 조건하에서 3시간 가열 교반하였다. 이어서, 4N HCl 디옥산 용액(100mL)을 첨가하고, 환류 조건하에서 8시간 가열 교반후, 실온까지 냉각하고, 얻어진 고체를 여과 취출, 헥산 세정함으로써 표제 화합물(105g, 정량적)을 담자색 고체로서 얻었다.
실시예 4-4
5-(벤조티아졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
환류 냉각관 부착 사구 플라스크(50mL)에 2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(0.28g, 1.08mmol), 2-아미노벤젠티올(0.14g, 1.08mmol) 및 폴리인산(약11g)을 넣고, 150℃에 가열, 17시간 교반하였다. 실온까지 방랭후, 빙랭(0 내지 5℃), 액성을 농암모니아수(28%)로 약 pH 9로 하였다. 용매의 감압 증류 제거에 이어서 다색 점성 잔사를 아세트산에틸로 추출, 무수 황산마그네슘으로 건조, 재차 용매를 감압 증류 제거하여 얻어지는 잔사를 PTLC로 정제함으로써 표제 화합물(0.007g, 수율 1.8%)을 녹색을 띤 담황색 결정으로서 얻었다.
실시예 5
5-(벤조티아졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸?메탄술폰산염의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(43.0g, 0.17mol), 톨루엔(400mL), 염화티오닐(39.3g, 0.33mol) 및 DMF(1.3g)를 아르곤 기류하 90℃에 승온하였다. 4시간 교반한 후, 용매를 감압 농축하였다. 이것을 톨루엔(250mL)과 THF(150mL)의 혼합 용액에 현탁시키고, 2-아미노티오페놀(20.7g, 0.17mol)의 톨루엔(100mL) 용액에 0℃에서 25분에 걸쳐 적하하였다. 톨루엔(100mL)과 THF(900mL)를 추가하여 실온에서 24시간 교반하였다. 그 후, 2-아미노티오페놀(30.7g, 0.25mol)을 추가하여 16시간 교반하였다. 반응 혼합물을 여과하여 아세트산에틸로 세정하고, 얻어진 고체를 물(1L)에 용해하고, 클로로포름(1L)을 첨가하여 24% NaOH 수용액으로 수층을 알칼리성(pH=10)으로 조정하였다. 클로로포름(1L)을 추가하여 분액하고, 클로로포름층을 물(500mL)로 세정후, Na2SO4로 탈수하였다. 여과후, 용매를 감압 농축하고, 잔사를 실리카 겔 칼럼 크로마토그래피(SiO2, 800g, 클로로포름/메탄올=50/1 내지 30/1)에 의해 정제하고, 얻어진 고체(29.7g)를 메탄올(100mL)과 클로로포름(150mL)의 혼합 용액에 용해하고, 메탄술폰산(24.6g)을 첨가하였다. 잠시 교반한 후, 아세트산에틸(100mL)을 첨가하여 냉각하고, 얻어진 결정을 여과 취출하여 아세트산에틸-메탄올로 세정하고, 40℃에서 감압 건조함으로써 표제 화합물(22.0g, 수율 29.9%)을 미세 녹회색 고체로서 얻었다.
실시예 6
5-(벤조티아졸-2-일)-2-메톡시메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 6-1
2-메톡시메틸-1-(테트라히드로피란-4-일)-5-트리플루오로메틸벤조이미다졸의 합성
환류 냉각관 부착 사구 플라스크(50mL)에 2-아미노-1-(테트라히드로피란-4-일)아미노-4-트리플루오로메틸벤젠(합성예 4 참조)(0.62g, 2.38mmol) 및 탈수 1,4-디옥산(8.5 mL)을 넣어 환류시켰다. 여기에 염화메톡시아세틸(0.57g, 5.25mmol)/1,4-디옥산 용액(약 1.5mL)을 약 10분으로 적하하였다. 동 조건하 2시간 교반하였다. 실온까지 방랭, 증류수를 첨가하고, 용매를 감압 증류 제거하였다. t-부틸메틸에테르 추출, 식염수 세정, 무수황산나트륨 건조에 이어서 용매를 감압 증류 제거함으로써 표제 화합물(0.58g, 수율 77.4%)을 백색 분말로서 얻었다.
실시예 6-2
5-(벤조티아졸-2-일)-2-메톡시메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
가지 플라스크에 2-메톡시메틸-1-(테트라히드로피란-4-일)-5-트리플루오로메틸벤조이미다졸(실시예 6-1 참조)(0.102g, 0.32mmol), 2-아미노벤젠티올(0.041g, 0.33mmol) 및 폴리인산(약 2g)을 넣고, 120℃에 가열, 48시간 교반하였다. 방랭후, 얼음을 첨가하고, 액성을 농암모니아수(28%)로 약 pH 9로 하였다. 클로로포름으로 추출, 무수 황산마그네슘으로 건조, 용매를 증류 제거하여 얻어지는 조생성물(0.21g)을 실리카 겔 칼럼 크로마토그래피(MeOH/CHCl3=1/20)로 정제함으로써 표제 화합물(0.010g, 수율 8.1%)을 담황색 분말로서 얻었다.
실시예 7
2-아세톡시메틸-5-(벤조티아졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 7-1
2-아세톡시메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산의 합성
환류 냉각관 부착 사구 플라스크(1L)에 3-아미노-4-((테트라히드로피란-4-일)아미노)벤조산(14.53g, 45.65mmol) 및 탈수 1,4-디옥산(226mL)을 넣고, 환류시켰다. 여기에 염화아세톡시아세틸(12.57g, 92.07mmol)/1,4-디옥산 용액(100mL)을 약 15분으로 적하하였다. 동 조건하 13시간 교반하였다. 실온까지 방랭, 석출한 결정을 여과 취출, 증류수로 세정후, 감압 가열 건조함으로써 표제 화합물(13.46g, 수율 92.6%)을 백색 분말로서 얻었다.
실시예 7-2
2-아세톡시메틸-5-(벤조티아졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
환류 냉각관 부착 사구 플라스크(500mL)에 2-아세톡시메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(5.98g, 18.79mmol), 탈수 테트라히드로푸란(158mL) 및 염화옥살릴(2.86g, 22.50mmol)을 넣고, 실온에서 탈수 N,N-디메틸포름아미드(1mL)를 적하, 계속해서 반응 혼합물을 50℃에서 5시간 반 교반하였다. 실온까지 방랭후, 용매를 감압 증류 제거하여 얻어지는 담황색 잔사에 테트라히드로푸란(100mL), 또한 2-아미노벤젠티올(2.35g, 18.79mmol)을 첨가하고, 50℃에서 19시간 교반하였다. 실온까지 방랭후, 석출한 결정을 여과 취출, 증류수 세정에 이어서 감압 가열 건조함으로써 표제 화합물(9.00g, 정량적)을 백색 분말로서 얻었다.
실시예 8
5-(벤조티아졸-2-일)-2-히드록시메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
사구 플라스크(1L)에 2-아세톡시메틸-5-(벤조티아졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 7-2 참조)(5.00g, 12.27mmol) 및 메탄올(253mL)을 넣고, 실온에서 수산화리튬 수용액(1.0M, 61mL)을 첨가하였다. 동 조건하, 2시간 교반후, 빙랭(0 내지 10℃)하, 액성을 희염산(1M)으로 약 pH 5로 하였다. 석출한 결정을 여과 취출, 증류수로 세정, 이어서 감압 가열 건조함으로써 표제 화합물(4.28g, 수율 95.4%)을 녹색을 띤 백색 분말로서 얻었다.
실시예 9
5-(벤조티아졸-2-일)-2-(N,N-디메틸아미노메틸)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
가지 플라스크에 5-(벤조티아졸-2-일)-2-히드록시메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 8 참조)(0.431g, 1.179mmol), 염화옥살릴(0.178g, 1.40mmol) 및 탈수 디클로로메탄(22mL)을 넣고, 실온에서 탈수 N,N-디메틸포름아미드(5방울)를 첨가한 후, 3시간 반 환류하였다. 실온까지 방랭, 용매를 감압 증류 제거하였다. 황색 잔사에 탈수 테트라히드로푸란(1mL) 및 무수요오드화나트륨(0.267g, 1.78mmol), 나아가 디메틸아민/테트라히드로푸란 용액(2.0M, 5mL)을 첨가하고, 16시간 환류하였다. 실온까지 방랭후, 용매를 감압 증류 제거하였다. 황색 잔사(0.80g)를 클로로포름(약 30mL)과 실리카 겔(3.2g)로부터 실리카 겔 흡착 분말을 제조, 실리카 겔 칼럼 크로마토그래피(실리카 겔:32g, MeOH/CHCl3=1/20)로 정제함으로써 표제 화합물(0.176g, 수율 38.0%)을 담황색 분말로서 얻었다.
실시예 10
5-(벤조티아졸-2-일)-2-(N,N-디메틸아미노메틸)-1-(테트라히드로피란-4-일)벤조이미다졸염산염의 합성
가지 플라스크에 5-(벤조티아졸-2-일)-2-(N,N-디메틸아미노메틸)-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 9 참조)(0.176g, 0.448mmol), 탈수 디에틸에테르(1mL) 및 탈수 1,4-디옥산(7mL)을 넣고, 0 내지 5℃에서 교반하였다. 여기에 염화수소/디에틸에테르 용액(2.0M, 2mL)을 서서히 첨가한 후, 동 조건에서 30분 교반하였다. 생성한 결정을 여과 취출, 디에틸에테르(약 2mL×3회) 세정에 이어서 감압 건조함으로써 표제 화합물(0.186g, 수율 96.9%)을 담황색 분말로서 얻었다.
실시예 11
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
가지 플라스크(100mL)에 2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(0.64g, 2.46mmol), 2-아미노페놀(0.32g, 2.95mmol) 및 폴리인산(약 18g)을 넣고, 160℃에 가열, 17시간 교반하였다. 방랭후, 얼음을 첨가하고, 액성을 농암모니아수(28%)로 약 pH 9로 하였다. 클로로포름(약 50mL×3회)로 추출, 무수 황산마그네슘으로 건조, 용매를 증류 제거하여 얻어지는 조생성물(0.08g)을 PTLC(CHCl3)로 중전개 정제함으로써 표제 화합물(0.002g, 수율 0.2%)을 황갈색 반고체로서 얻었다.
실시예 12
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸?메탄술폰산염의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(51.2g, 0.19mol), 2-아미노페놀(24.0g, 0.21mol), 탈수 DMF(500mL) 및 WSC(45.0g, 0.23mol)를 아르곤 기류하에서 3시간 교반하였다. 물(2L)을 첨가하고, 얻어진 고체를 여과 취출, 수세하고, 50℃에서 감압 건조하여 얻어진 고체(45.2g, 0.13mol)를 디옥산(500mL)에 용해하고, 메탄술폰산(62.5g, 0.65mol)을 첨가하여 90℃에서 8시간 교반하였다. 용매를 감압 농축하고, 물(1L)을 첨가하고, 1N NaOH로 pH=4로 조정하였다. 클로로포름(2L)을 첨가하여 추출하고, 이어서 수층을 클로로포름(1L)으로 추출하여 합하고, 유기층을 식염수(1L)로 세정하였다. MgSO4 탈수, 여과후, 용매를 감압 농축하였다. 얻어진 잔사를 클로로포름(100mL)과 아세트산에틸(150mL)에 용해하고, 메탄술폰산(25.0g)을 첨가하였다. 냉각하, 잠시 교반한 후, 석출한 고체를 여과 취출하고, 50℃에서 감압 건조함으로써 표제 화합물(23.7g, 수율 28.1%)을 담자색 고체로서 얻었다.
실시예 13
5-(벤조옥사졸-2-일)-2-히드록시메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 13-1
2-아세톡시메틸-5-(2-히드록시아닐리노카르보닐)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
환류 냉각관 부착 사구 플라스크(200mL)에 2-아세톡시메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 7-1 참조)(1.50g, 4.71mmol), 탈수 테트라히드로푸란(40mL) 및 염화옥살릴(0.657g, 5.18mmol)을 넣고, 실온에서 탈수 N,N-디메틸포름아미드(0.4mL)를 적하, 계속해서 반응 혼합물을 50℃에서 14시간 교반하였다. 실온까지 방랭, 용매를 감압 증류 제거하여 얻어지는 담황색 잔사를 0 내지 5℃에 냉각하고, 테트라히드로푸란(40mL), 디이소프로필아민(0.79mL, 5.65mmol), 또한 2-아미노페놀(0.57g, 5.81mmol)을 첨가하고, 실온에서 24시간 교반하였다. 석출한 결정을 여과 취출, 테트라히드로푸란 세정에 이어서 감압 가열 건조함으로써 표제 화합물(2.40g, 정량적)을 백색 분말로서 얻었다.
실시예 13-2
5-(벤조옥사졸-2-일)-2-히드록시메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
가지 플라스크(50mL)에 2-(아세톡시메틸)-5-(2-히드록시아닐리노카르보닐)-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 13-1 참조)(0.50g, 1.22mmol), 톨루엔(6.3mL) 및 p-톨루엔술폰산 수화물(1.60g, 8.41mmol)을 넣고, 1시간 반 환류시켰다. 방랭후, 액성을 포화 탄산수소나트륨 수용액으로 중성으로 하였다. 석출한 결정을 여과 취출, 톨루엔에 이어서 헥산으로 세정, 이어서 감압 가열 건조시키고, 표제 화합물과 5-(벤조옥사졸-5-일)-2-아세톡시메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 혼합물(0.25g:1H-NMR에 의해 각각 0.57mmol 및 0.13mmol 함유한다고 추정)을 백색 분말로서 얻었다. 이 혼합물 및 메탄올 7mL을 가지 플라스크(50mL)에 넣고, 실온에서 수산화리튬 수용액(1M, 0.3mL)을 첨가하여 30분간 교반후, 액성을 희염산(1M)으로 약 pH 6으로 하였다. 석출하는 결정을 여과 취출, 증류수 세정에 이어서, 감압 가열 건조함으로써 표제 화합물(0.07g, 수율 16.4%)을 담도백색 분말로서 얻었다.
실시예 14
5-(벤조옥사졸-2-일)-2-(N,N-디메틸아미노메틸)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
환류 냉각관 부착 가지 플라스크(50mL)에 5-(벤조옥사졸-2-일)-2-히드록시메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 13 참조)(0.055g, 0.16mmol), 염화옥살릴(0.024g, 0.19mmol) 및 탈수 디클로로메탄(3mL)을 넣고, 실온에서 탈수 N,N-디메틸포름아미드(5방울)를 첨가한 후, 3시간 반 환류하였다. 실온까지 방랭, 용매를 감압 증류 제거하였다. 황색 잔사에 탈수 테트라히드로푸란(5mL) 및 무수요오드화나트륨(0.036g, 0.24mmol), 나아가 디메틸아민/테트라히드로푸란 용액(2.0M, 3mL)을 첨가하고, 14시간 환류하였다. 실온까지 방랭후, 용매를 감압 증류 제거하였다. 황색 잔사(0.70g)를 실리카 겔 칼럼 크로마토그래피(실리카 겔:2.6g, MeOH/CHCl3=1/5)로 정제함으로써 표제 화합물(0.026g, 수율 43%)을 담황색 분말로서 얻었다.
실시예 15
5-(벤조옥사졸-2-일)-1-(4-메톡시페닐)-2-메틸벤조이미다졸의 합성
실시예 15-1
4-플루오로-N-(2-히드록시페닐)-3-니트로벤즈아닐리드의 합성
4-플루오로-3-니트로벤조산(2.00g, 10.8mmol)의 클로로포름(40mL) 용액에 2-아미노페놀(1.18g, 10.8mmol), 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드염산염(2.17g, 11.3mmol), 트리에틸아민(1.15g, 11.3mmol)을 첨가하여 실온에서 2.5시간 교반하였다. 반응 종료후, 아세트산에틸을 첨가하여 희석하고, 물, 1N 염산, 포화 탄산수소나트륨 수용액으로 세정하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(2.02g, 수율 68%)을 오렌지색 결정으로서 얻었다.
실시예 15-2
2-(4-플루오로-3-니트로페닐)벤조옥사졸의 합성
4-플루오로-N-(2-히드록시페닐)-3-니트로벤즈아닐리드(실시예 15-1 참조)(2.00g, 7.24mmol)의 톨루엔(50mL) 현탁액에 p-톨루엔술폰산?1수화물(2.07g, 10.9mmol)을 첨가하여 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 용매를 증류 제거한 후, 포화 탄산수소나트륨 수용액을 첨가하여 실온에서 10분간 교반하였다. 석출한 결정을 여과, 물, 톨루엔으로 세정후, 결정을 건조시킴으로써 표제 화합물(1.30g, 수율 70%)을 황색 결정으로서 얻었다.
실시예 15-3
2-(4-(4-메톡시페닐아미노)-3-니트로페닐)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.19mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(295mg, 2.32mmol), p-아니시딘(357mg, 2.90mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 석출한 결정을 여과, 물, 에탄올로 세정후, 결정을 건조시킴으로써 표제 화합물(359mg, 수율 86%)을 오렌지색 결정으로서 얻었다.
실시예 15-4
5-(벤조옥사졸-2-일)-1-(4-메톡시페닐)-2-메틸벤조이미다졸의 합성
2-(4-(4-메톡시페닐아미노)-3-니트로페닐)벤조옥사졸(실시예 15-3 참조)(150mg, 0.415mmol)을 10% 팔라듐탄소(50mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 3시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 유상물의 톨루엔(5mL) 용액에 염화아세틸(70.8mg, 0.902mmol)을 첨가하고, 환류 조건하에서 2.5시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 포화 탄산수소나트륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(47mg, 수율 32%)을 암다색 결정으로서 얻었다.
실시예 16
5-(벤조옥사졸-2-일)-1-시클로헥실-2-메틸벤조이미다졸의 합성
실시예 16-1
2-(4-시클로헥실아미노-3-니트로페닐)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.19mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(295mg, 2.32mmol), 시클로헥실아민(288mg, 2.32mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(191mg, 수율 48%)을 오렌지색 결정으로서 얻었다.
실시예 16-2
5-(벤조옥사졸-2-일)-1-시클로헥실-2-메틸벤조이미다졸의 합성
2-(4-시클로헥실아미노-3-니트로페닐)벤조옥사졸(실시예 16-1 참조)(185mg, 0.548mmol)을 10% 팔라듐탄소(50mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 5시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 유상물의 디메틸포름아미드(1.5mL) 용액에 아세트알데히드-디메틸포름아미드 용액(약 2%, 1.35mL, 0.586mmol), 물(0.1mL), 옥손(117mg, 0.190mmol)을 첨가하고, 실온에서 2.5시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 유상물을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(24.5mg, 수율 14%)을 담다색 유상물로서 얻었다.
실시예 17
5-(벤조옥사졸-2-일)-1-벤질-2-메틸벤조이미다졸의 합성
실시예 17-1
2-(4-벤질아미노-3-니트로페닐)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.19mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(195mg, 2.32mmol), 벤질아민(311mg, 2.90mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하였다. 석출한 결정을 여과, 물, 에탄올로 세정후, 결정을 건조시킴으로써 표제 화합물(347mg, 수율 84%)을 오렌지색 결정으로서 얻었다.
실시예 17-2
2-(2-벤질아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-벤질아미노-3-니트로페닐)벤조옥사졸(실시예 17-1 참조)(340mg, 0.985mmol)에 10% 아세트산 수용액(5mL), 에탄올(8mL), 철분(165mg, 2.95mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 포화 탄산수소나트륨 수용액, 클로로포름을 첨가하고, 셀라이트 여과후, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 유상물을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(87mg, 수율 28%)을 다색 결정으로서 얻었다.
실시예 17-3
5-(벤조옥사졸-2-일)-1-벤질-2-메틸벤조이미다졸의 합성
2-(2-벤질아미노아닐린-5-일)벤조옥사졸(실시예 17-2 참조)(80.0mg, 0.254mmol)의 디메틸포름아미드(2m) 용액에 아세트알데히드 수용액(약 90%, 47.7μl, 0.761mmol), 옥손(102mg, 0.165mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 유상물을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(35.2mg, 수율 41%)을 담다색 결정으로서 얻었다.
실시예 18
5-(벤조티오펜-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 18-1
5-브로모-2-(테트라히드로피란-4-일)니트로벤젠의 합성
가지 플라스크에 5-브로모-2-플루오로니트로벤젠(3.0g, 13.6mmol), 트리에틸아민(1.66g, 16.3mmol), 4-아미노테트라히드로피란(1.52g, 15.0mmol) 및 에탄올(60mL)을 넣고, 환류 조건하에서 2시간 가열 교반시켰다. 반응 혼합물을 감압 농축한 후, 물(60mL)을 첨가하고, 그대로 실온에서 30분 교반하였다. 석출한 결정을 여과 취출, 물로 세정하였다. 얻어진 결정을 감압 가열 건조함으로써 표제 화합물(3.55g, 수율 86%)을 적등색 고체로서 얻었다.
실시예 18-2
5-브로모-2-(테트라히드로피란-4-일)아미노아닐린의 합성
삼구 플라스크에 5-브로모-2-(테트라히드로피란-4-일)니트로벤젠(실시예 18-1 참조)(3.54g, 11.8mmol), 10% 아세트산 수용액 65mL를 넣고, 그 후 전해철(6.56g, 118mmol)을 첨가하여 15분 환류?교반하였다. 실온까지 방랭후, 셀라이트로 불용물을 여과 분별, 또한 동층을 10% 아세트산 수용액 65mL로 세정하였다. 여과액과 세정액을 합하여 아세트산에틸(약 50mL×4회) 추출, 증류수(30mL) 세정, 무수황산나트륨 건조에 이어서 용매를 감압 증류 제거, 또한 감압 건조함으로써 표제 화합물(2.72g, 수율 85.4%)을 담황색 고체로서 얻었다.
실시예 18-3
5-브로모-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-염산염의 합성
이구 플라스크에 5-브로모-2-(테트라히드로피란-4-일)아미노아닐린(실시예 18-2 참조)(2.72g, 10.0mmol) 및 탈수 톨루엔(20mL)을 넣어 환류시켰다. 여기에 염화아세틸(1.57g, 20.0mmol)/톨루엔 용액(약 2.5mL)을 약 15분으로 적하후, 동 조건하 2시간 교반하였다. 실온까지 방랭후, 감압 농축을 행하고, 잔사를 헥산(20mL)으로 리슬러리화하였다. 석출한 결정을 여과 취출, 헥산으로 세정하였다. 얻어진 결정을 감압 가열 건조함으로써 표제 화합물(3.14g, 수율 94.7%)을 담자색 고체로서 얻었다.
실시예 18-4
5-(벤조티오펜-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-브로모-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-염산염(실시예 18-3 참조)(0.38g, 1.15mmol), 2-벤조티오펜보론산(0.25g, 1.40mmol), 에탄올(5mL), 톨루엔(5mL), 2M 탄산나트륨 수용액(2.1mL)을 투입하고, 탈기하였다. 테트라키스(트리페닐포스핀)팔라듐(0.08g, 0.07mmol)을 첨가하고, 3시간 과열 환류하였다. 냉각후, 에탄올, 물을 첨가하여 셀라이트 여과하고, 에탄올, 물로 여상물을 세정하였다. 여세액을 농축하고, 석출한 결정을 여과 취출, 물, 헥산으로 세정, 건조하여 표제 화합물(315mg, 수율 78.9%)을 담갈색 결정으로서 얻었다.
실시예 19
5-(벤조푸란-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-브로모-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 18-3 참조)(0.41g, 1.24mmol), 2-벤조푸란-보론산(0.25g, 1.40mmol), 에탄올(5mL), 톨루엔(5mL), 2M 탄산나트륨 수용액(2.1mL)을 투입하고, 탈기하였다. 테트라키스(트리페닐포스핀)팔라듐(0.08g, 0.07mmol)을 첨가하고, 3시간 과열 환류하였다. 냉각후, 에탄올, 물을 첨가하여 셀라이트 여과하고, 에탄올, 물로 여상물을 세정하였다. 여과액과 세정액을 합하여 아세트산에틸(약 50mL×4회) 추출, 증류수(30mL) 세정, 무수황산나트륨 건조에 이어서 용매를 감압 증류 제거하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(145mg, 수율 35.3%)을 담갈색 결정으로서 얻었다.
실시예 20
5-(벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 20-1
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)니트로벤젠의 합성
5-(벤조옥사졸-2-일)-2-플루오로니트로벤젠(실시예 15-2 참조)(0.55g, 2.13mmol), 트리에틸아민(0.26g, 2.57mmol), 아미노테트라히드로피란(0.24g, 2.34mmol)을 에탄올(10mL)에 첨가하고, 이 반응액을 환류 조건하에서 2시간 가열 교반하였다. 반응 혼합물을 실온까지 냉각하여 감압 농축을 행하고, 얻어진 잔사에 0.1N 염산 수용액(50mL)을 첨가하고, 아세트산에틸(약 50mL×4회) 추출, 증류수(30mL) 세정, 무수황산나트륨 건조에 이어서 용매를 감압 증류 제거하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(440mg, 수율 60.9%)을 담갈색 결정으로서 얻었다.
또한, 본 중간체는 이하와 같이 4-((테트라히드로피란-4-일)아미노)-3-니트로벤조산(실시예 4-1 참조)으로부터 얻을 수도 있다.
4-((테트라히드로피란-4-일)아미노)-3-니트로벤조산(실시예 4-1 참조)(8.0g, 30.0mmol), 2-아미노페놀(3.61g, 33.0mmol), 클로로포름(350mL) 및 WSC 19.7g(100mmol)을 실온에서 3시간 교반하였다. 반응 매스를 감압 농축후, 물(500mL)을 첨가하여 리슬러리를 행하고, 슬러리 매스를 여과 취출한다. 얻어진 고형물을 물 및 에탄올로 세정한 후에 50℃에서 감압 건조를 행하여 얻어진 고체를 디옥산(160mL)에 용해하고, 메탄술폰산(17.0g)을 첨가하고, 환류 조건으로 10시간 교반하였다. 실온까지 방랭한 후에 용매를 감압 농축하고, 얻어진 잔사에 헥산(160mL)을 첨가하여 리슬러리화하고, 고형분을 여과 취출하고, 50℃에서 감압 건조함으로써 표제 화합물(7.70g, 수율 75.5%)을 담황색 고체로서 얻었다.
실시예 20-2
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)니트로벤젠(실시예 20-1 참조)(1.00g, 0.76mol)을 THF 50mL와 메탄올 50mL의 혼합 용액에 용해하고, Pd/C(5%, 습윤, 0.5g)를 첨가하여 수소 첨가 반응을 행하였다. 실온에서 철야 교반후, 촉매를 여과 제거하고, 여과액을 감압 농축함으로써 표제 화합물(812mg, 수율 89.1%)을 회색 고체로서 얻었다.
실시예 20-3
5-(벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.20g, 0.646mmol), 오르토포름산트리에틸(5mL)에 촉매량의 p-톨루엔술폰산일수화물을 첨가하고, 100℃에서 1.5시간 가열하였다. 반응액을 냉각, 아세트산에틸, 물을 첨가하고, 추출하였다. 물로 세정, 황산마그네슘으로 건조, 농축후, 석출한 결정을 여과 취출, 헥산/아세트산에틸 혼합액으로 세정, 건조하여 표제 화합물(65mg, 수율. 31.5%)을 담적갈색 결정으로서 얻었다.
실시예 21
5-(벤조옥사졸-2-일)-2-(2-피리딜)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.15g, 0.484mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 2-피리딘카르복시알데히드(0.06g, 0.561mmol) 이어서 옥손(0.19g, 0.310mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.09g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(135mg, 수율 70.2%)을 백색 결정으로서 얻었다.
실시예 22
5-(벤조옥사졸-2-일)-2-이소프로필-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.15g, 0.484mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 이소프로필알데히드(0.04g, 0.561mmol) 이어서 옥손(0.19g, 0.310mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.09g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(70mg, 수율 43.9%)을 백색 결정으로서 얻었다.
실시예 23
5-(벤조옥사졸-2-일)-2-시클로헥실-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.15g, 0.484mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 시클로헥실알데히드(0.06g, 0.561mmol) 이어서 옥손(0.19g, 0.310mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.09g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(116mg, 수율 59.6%)을 백색 결정으로서 얻었다.
실시예 24
5-(벤조옥사졸-2-일)-2-(3-피리딜)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.15g, 0.484mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 3-피리딘카르복시알데히드(0.06g, 0.561mmol) 이어서 옥손(0.19g, 0.310mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.09g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(95.0mg, 수율 49.5%)을 백색 결정으로서 얻었다.
실시예 25
5-(벤조옥사졸-2-일)-2-페닐-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.15g, 0.484mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 페닐알데히드(0.06g , 0.561mmol) 이어서 옥손(0.19g, 0.310mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.09g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(115mg, 수율 59.9%)을 백색 결정으로서 얻었다.
실시예 26
5-(벤조옥사졸-2-일)-2-(4-피리딜)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.15g, 0.484mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 4-피리딘카르복시알데히드(0.06g, 0.561mmol) 이어서 옥손(0.19g, 0.310mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.09g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(117mg, 수율 60.9%)을 백색 결정으로서 얻었다.
실시예 27
5-(벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)-2-트리플루오로메틸벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.20g, 0.646mmol)을 트리플루오로아세트산(7mL) 중 4시간 반 가열 환류하였다. 반응액을 냉각하고, 물을 첨가, 아세트산에틸로 추출하였다. 유기층을 탄산수소나트륨 수용액, 물로 세정, 황산마그네슘으로 건조, 농축하고, 잔사를 실리카 겔 칼럼 크로마토그래피로 정제하여 표제 화합물(139mg, 수율 55.5%)을 백색 결정으로서 얻었다.
실시예 28
5-(벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)-벤조트리아졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.35g, 1.13mmol)의 농염산(2mL) 용액을 0℃로 냉각한 중에 아질산나트륨 0.09g(1.24mmol)을 포함하는 수용액(0.5mL)을 적하하였다. 실온에서 2시간 교반한 후, 0℃로 냉각, 1N 수산화나트륨 수용액으로 염기성으로 하고, 아세트산에틸로 추출, 수세, 황산마그네슘으로 건조, 농축하였다. 잔사를 실리카 겔 칼럼 크로마토그래피로 정제하여 다갈색 결정(0.17g, 수율 46.9%)을 얻었다.
실시예 29
5-(벤조옥사졸-2-일)-2-메틸-1-tert-부틸벤조이미다졸의 합성
실시예 29-1
2-(2-tert-부틸아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(195mg, 2.32mmol), tert-부틸아민(212mg, 2.90mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 10% 팔라듐탄소(50mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 8시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(50.1mg, 수율 19%)을 적색 결정으로서 얻었다.
실시예 29-2
5-(벤조옥사졸-2-일)-2-메틸-1-tert-부틸벤조이미다졸의 합성
2-(2-tert-부틸아미노아닐린-5-일)벤조옥사졸(실시예 29-1 참조)(45.0mg, 0.160mmol)의 디메틸포름아미드(2mL) 용액에 아세트알데히드 수용액(약 90%, 235μl, 0.480mmol), 옥손(63.9mg, 0.104mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(18.2mg, 수율 38%)을 백색 결정으로서 얻었다.
실시예 30
5-(벤조옥사졸-2-일)-1-(2-메톡시페닐)-2-메틸벤조이미다졸의 합성
실시예 30-1
2-(2-(2-메톡시페닐)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(195mg, 2.32mmol), o-아니시딘(357mg, 2.90mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 10% 팔라듐탄소(50mg)를 포함하는 테트라히드로푸란(5mL) 용액을 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 8시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(51.9mg, 수율 14%)을 적색 결정으로서 얻었다.
실시예 30-2
5-(벤조옥사졸-2-일)-1-(2-메톡시페닐)-2-메틸벤조이미다졸의 합성
2-(2-(2-메톡시페닐)아미노아닐린-5-일)벤조옥사졸(실시예 30-1 참조)(48.0mg, 0.135mmol)의 디메틸포름아미드(2mL) 용액에 아세트알데히드 수용액(약 90%, 20.5μl, 0.405mmol), 옥손(53.9mg, 0.0878mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(18.2mg, 수율 38%)을 백색 결정으로서 얻었다.
실시예 31
5-(벤조옥사졸-2-일)-1-(3-메톡시페닐)-2-메틸벤조이미다졸의 합성
실시예 31-1
2-(2-(3-메톡시페닐)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(195mg, 2.32mmol), m-아니시딘(357mg, 2.90mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 10% 팔라듐탄소(50mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 8시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(58.5mg, 수율 15%)을 담황색 유상물로서 얻었다.
실시예 31-2
5-(벤조옥사졸-2-일)-1-(3-메톡시페닐)-2-메틸벤조이미다졸의 합성
2-(2-(3-메톡시페닐)아미노아닐린-5-일)벤조옥사졸(실시예 31-1 참조)(55.0mg, 0.166mmol)의 디메틸포름아미드(2mL) 용액에 아세트알데히드 수용액(약 90%, 31.2μl, 0.405mmol), 옥손(66.3mg, 0.108mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(17.3mg, 수율 29%)을 담다색 결정으로서 얻었다.
실시예 32
5-(벤조옥사졸-2-일)-2-벤질아미노메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-히드록시메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 13-2 참조)(168mg, 0.481mmol)에 염화티오닐(1.5mL)을 첨가하고, 환류 조건하에서 2시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 농축하였다. 얻어진 결정의 테트라히드로푸란 현탁액에 요오드화나트륨(108mg, 0.722mmol), 벤질아민(258mg, 2.41mmol)을 첨가하고, 환류 조건하에서 1.5시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(182mg, 수율 86%)을 무색 비정질로서 얻었다.
실시예 33
5-(벤조옥사졸-2-일)-1-((1-에톡시카르보닐)피페리딘-4-일)-2-메틸벤조이미다졸의 합성
실시예 33-1
2-(2-(4-(1-에톡시카르보닐)피페리디노아미노)아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(195mg, 2.32mmol), 4-아미노-1-피페리딘카르복실산에틸(499mg, 2.90mmol)을 첨가하고, 환류 조건하에서 3시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 10% 팔라듐탄소(50mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 5시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(162mg, 수율 37%)을 다색 유상물로서 얻었다.
실시예 33-2
5-(벤조옥사졸-2-일)-1-((1-에톡시카르보닐)피페리딘-4-일)-2-메틸벤조이미다졸의 합성
2-(2-(4-(1-에톡시카르보닐)피페리디노아미노)아닐린-5-일)벤조옥사졸(실시예 33-1 참조)(157mg, 0.413mmol)의 디메틸포름아미드(3mL) 용액에 아세트알데히드 수용액(약 90%, 77.7μl, 1.24mmol), 옥손(254mg, 0.413mmol)을 첨가하고, 실온에서 1.5시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(76.7mg, 수율 46%)을 회색 결정으로서 얻었다.
실시예 34
5-(벤조옥사졸-2-일)-1-(4-플루오로페닐)-2-메틸벤조이미다졸의 합성
실시예 34-1
2-(2-(4-플루오로페닐)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(195mg, 2.32mmol), 4-플루오로아닐린(322mg, 2.90mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 10% 팔라듐탄소(50mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 4시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(40.0mg , 수율 11%)을 다색 결정으로서 얻었다.
실시예 34-2
5-(벤조옥사졸-2-일)-1-(4-플루오로페닐)-2-메틸벤조이미다졸의 합성
2-(2-(4-플루오로페닐)아미노아닐린-5-일)벤조옥사졸(실시예 34-1 참조)(38.0mg, 0.119mmol)의 디메틸포름아미드(2mL) 용액에 아세트알데히드 수용액(약 90%, 22.6μl, 0.360mmol), 옥손(73.2mg, 0.119mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(20.0mg, 수율 49%)을 담다색 결정으로서 얻었다.
실시예 35
5-(벤조옥사졸-2-일)-1-(피페리딘-4-일)-2-메틸벤조이미다졸의 합성
실시예 35-1
2-(2-(4-(1-tert-부톡시카르보닐)피페리디노아미노)아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(500mg, 1.94mmol)의 에탄올(10mL) 현탁액에 탄산수소나트륨(329mg, 3.88mmol), 4-아미노-1-tert-부톡시카르보닐피페리딘(970mg, 4.84mmol)을 첨가하고, 환류 조건하에서 2시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 10% 팔라듐탄소(100mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 22시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(353mg, 수율 45%)을 다색 유상물로서 얻었다.
실시예 35-2
5-(벤조옥사졸-2-일)-1-(피페리딘-4-일)-2-메틸벤조이미다졸의 합성
2-(2-(4-(1-tert-부톡시카르보닐)피페리디노아미노)아닐린-5-일)벤조옥사졸(실시예 35-1 참조)(350mg, 0.857mmol)의 디메틸포름아미드(3mL) 용액에 아세트알데히드 수용액(약 90%, 161μl, 2.57mmol), 옥손(527mg, 0.887mmol)을 첨가하고, 실온에서 1시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사의 클로로포름(5mL) 용액에 트리플루오로아세트산을 첨가하고, 실온에서 1시간 교반하였다. 반응 종료후, 물을 첨가하고, 클로로포름으로 2회, 아세트산에틸로 1회, 수층을 세정하였다. 얻어진 수층에 포화 탄산수소나트륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(20.0mg, 수율 7.0%)을 무색의 엿상물로서 얻었다.
실시예 36
1-아다만틸-5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸의 합성
실시예 36-1
2-(2-(1-아다만틸아미노)아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산수소나트륨(195mg, 2.32mmol), 1-아다만탄아민(185mg, 1.22mmol)을 첨가하고, 환류 조건하에서 4시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정을 10% 팔라듐탄소(100mg)를 포함하는 테트라히드로푸란(5mL) 용액에 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 6시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(67.0mg , 수율 16%)을 다색 결정으로서 얻었다.
실시예 36-2
1-아다만틸-5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸의 합성
2-(2-(1-아다만틸아미노)아닐린-5-일)벤조옥사졸(실시예 36-1 참조)(65.0mg, 0.181mmol)의 디메틸포름아미드(2mL) 용액에 아세트알데히드 수용액(약 90%, 34.0μl, 0.542mmol), 옥손(111mg, 0.181mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(33.4mg, 수율 48%)을 담다색 결정으로서 얻었다.
실시예 37
5-(N-t-부톡시카르보닐인돌-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-브로모-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 18-3 참조)(0.40g, 1.21mmol), 2-(N-t-부톡시카르보닐인돌)보론산(0.35g, 0.242mmol), 에탄올(5mL), 톨루엔(5mL), 2M 탄산나트륨 수용액(1.8mL)을 투입하고, 탈기하였다. 테트라키스(트리페닐포스핀)팔라듐(0.07g, 0.07mmol)을 첨가하고, 3시간 과열 환류하였다. 냉각후, 에탄올, 물을 첨가하여 셀라이트 여과하고, 에탄올, 물로 여상물을 세정하였다. 여세액을 농축하고, 석출한 결정을 여과 취출, 물, 헥산으로 세정, 건조하여 표제 화합물(215mg, 수율 41.3%)을 백색 결정으로서 얻었다.
실시예 38
5-(인돌-2-일)-1-(테트라히드로피란-4-일)-2-메틸벤조이미다졸의 합성
5-(N-t-부톡시카르보닐인돌-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 38-1 참조)(200mg, 0.463mmol)을 1N 염산 수용액(10mL)에 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 3일 정치하여 석출한 결정을 여과 취출하고, 이것을 포화 중조수(5mL)에 첨가하여 30분 교반하였다. 석출한 결정을 여과 취출하고, 물로 세정, 건조하여 표제 화합물(155mg, 정량적)을 담갈색 결정으로서 얻었다.
실시예 39
5-(5-메틸벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(0.25g, 0.96mmol), 2-아미노-4-메틸페놀(0.13g, 1.05mmol), 탈수 DMF(10mL) 및 WSC(0.22g, 1.14mmol)를 실온에서 3시간 교반하였다. 반응 종료후, 물(50mL)을 첨가하고, 석출한 결정을 여과하고, 여과 잔사를 물/클로로포름으로 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하여 얻어진 결정을 톨루엔(5mL)에 용해하고, p-톨루엔술폰산 수화물(0.43g, 2.26mmol)을 첨가하여 2시간 환류?교반하였다. 용매를 감압 농축한 후에 물(5mL)을 첨가하여 얻어진 고체를 여과 취출하고, 물로 세정한 후에 50℃에서 감압 건조함으로써 표제 화합물(95mg, 수율 28.5%)을 담갈색 고체로서 얻었다.
실시예 40
5-(5-클로로벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(0.25g, 0.96mmol), 2-아미노-4-클로로페놀(0.15g, 1.05mmol), 탈수 DMF(10mL) 및 WSC(0.22g, 1.14mmol)를 실온에서 철야 교반하였다. 반응 종료후, 물(50mL)을 첨가하고, 석출한 결정을 여과하고, 여과 잔사를 물/클로로포름으로 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하여 얻어진 결정을 톨루엔(5mL)에 용해하고, p-톨루엔술폰산 수화물(0.32g, 1.68mmol)을 첨가하여 2시간 환류?교반하였다. 용매를 감압 농축한 후에 물(5mL)을 첨가하여 얻어진 고체를 여과 취출하고, 물로 세정한 후에 50℃에서 감압 건조함으로써 표제 화합물(54mg, 수율 15.3%)을 담갈색 고체로서 얻었다.
실시예 41
5-(6-클로로벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(0.25g, 0.96mmol), 2-아미노-5-클로로페놀(0.15g, 1.05mmol), 탈수 DMF(10mL) 및 WSC(0.22g, 1.14mmol)를 실온에서 철야 교반하였다. 반응 종료후, 물(50mL)을 첨가하고, 석출한 결정을 여과하고, 여과 잔사를 물/클로로포름으로 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하여 얻어진 결정을 톨루엔(5mL)에 용해하고, p-톨루엔술폰산 수화물(0.38g, 2.00mmol)을 첨가하여 2시간 환류?교반하였다. 용매를 감압 농축한 후에 물(5mL)을 첨가하여 얻어진 고체를 여과 취출하고, 물로 세정한 후에 50℃에서 감압 건조함으로써 표제 화합물(5mg, 수율 1.4%)을 오렌지색 고체로서 얻었다.
실시예 42
5-(6-메틸벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(0.25g, 0.96mmol), 2-아미노-5-메틸페놀(0.13g, 1.05mmol), 탈수 DMF(10mL) 및 WSC(0.22g, 1.14mmol)를 실온에서 철야 교반하였다. 반응 종료후, 물(50mL)을 첨가하고, 석출한 결정을 여과하고, 여과 잔사를 물/클로로포름으로 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하여 얻어진 결정을 톨루엔(5mL)에 용해하고, p-톨루엔술폰산 수화물(0.45g, 2.37mmol)을 첨가하여 2시간 환류?교반하였다. 용매를 감압 농축한 후에 물(5mL)을 첨가하여 얻어진 고체를 여과 취출하고, 물로 세정한 후에 50℃에서 감압 건조함으로써 표제 화합물(16mg, 수율 4.8%)을 오렌지색 고체로서 얻었다.
실시예 43
5-(벤조옥사졸-2-일)-2-에틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.15g, 0.484mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 프로필알데히드(0.03g, 0.561mmol) 이어서 옥손(0.19g, 0.310mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.10g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(44.7mg, 수율 26.6%)을 담갈색 결정으로서 얻었다.
실시예 44
5-(벤조옥사졸-2-일)-2-(이미다졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.10g, 0.32mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 2-이미다졸-카르보알데히드(0.03g, 0.31mmol) 이어서 옥손(0.13g, 0.21mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.10g/15mL)에 첨가하였다. 클로로포름으로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(15mg, 수율 12.1%)을 담갈색 결정으로서 얻었다.
실시예 45
5-(벤조옥사졸-2-일)-2-(티오펜-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(0.13g, 0.42mmol)을 DMF(3mL), 물(0.1mL)에 용해하고, 2-티오펜카르보알데히드(0.05g, 0.45mmol) 이어서 옥손(0.17g, 0.28mmol)을 첨가하고, 실온에서 2시간 반 교반하였다. 반응액을 탄산칼륨 수용액(0.10g/15mL)에 첨가하였다. 아세트산에틸로 추출, 수세하고, 황산마그네슘으로 건조후, 농축, 실리카 겔 칼럼 크로마토그래피로 정제하였다. 얻어진 결정을 헥산과 소량의 아세트산에틸로 세정, 건조하여 표제 화합물(60mg, 수율 36%)을 담갈색 결정으로서 얻었다.
실시예 46
2-메틸-5-(4-메틸벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 46-1
2-플루오로-5-(4-메틸벤조옥사졸-2-일)-니트로벤젠의 합성
3-플루오로-2-니트로벤조산(1.00g, 5.40mmol), DMF 1방울의 톨루엔(10mL)의 현탁액에 염화티오닐(0.78g, 6.56mmol)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 2-히드록시-6-메틸아닐린(0.66g, 5.4mmol), 트리에틸아민(0.66g, 6.5mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 물(50mL)을 첨가하고, 아세트산에틸 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하여 얻어진 결정을 톨루엔(20mL)에 첨가하고, 이어서 p-톨루엔술폰산 수화물(1.14g, 5.99mmol)을 첨가하여 2시간 환류?교반하였다. 용매를 감압 농축한 후, 물(5mL)을 첨가한 후에 아세트산에틸 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(0.50g, 수율 37%)을 담갈색 고체로서 얻었다.
실시예 46-2
2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸의 합성
2-플루오로-5-(4-메틸벤조옥사졸-2-일)-니트로벤젠(실시예 46-1 참조)(0.50g, 1.8 mmmol)의 에탄올(10mL) 현탁액에 트리에틸아민(0.22g, 2.17mmol), 아미노테트라히드로피란(0.20g, 1.9mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각한 후에 희염산(1M, 10mL)에 혼합물을 붓고, 클로로포름(50mL)으로 추출, 포화 탄산수소나트륨 수용액(약 50mL), 이어서 포화식염수(약 50mL)로 세정하였다. 유기층을 무수 황산마그네슘 건조에 이어서 용매를 감압 증류 제거하여 얻어지는 결정을 팔라듐/탄소(Pd:10%, 0.06g) 및 아세트산에틸:메탄올=1:1 혼합 용액(20mL)에 첨가하고, 감압/수소 가스 치환을 3회 반복하여 수소 치환하고, 실온에서 2.5시간 교반하였다. 질소 치환후, 셀라이트층(20mm 두께)으로 불용물을 여과 분별, 또한 동층을 메탄올(20mL×3회)로 세정하였다. 여과액과 세정액을 합하여 용매를 감압 증류 제거함으로써 표제 화합물(0.56g, 수율 94.3%)을 흑갈 고체로서 얻었다.
실시예 46-3
2-메틸-5-(4-메틸벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 46-2 참조)(0.56g, 1.7mmol), 물(0.18mL)을 포함하는 디메틸포름아미드(5mL) 용액에 아세트알데히드 수용액(약 90%, 90mg, 1.8mmol), 옥손(0.69mg, 1.1mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(123mg, 수율 20.4%)을 담다색 결정으로서 얻었다.
실시예 47
2-메틸-5-(6-니트로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 47-1
5-(2-히드록시-4-니트로아닐리노카르보닐)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(0.75g, 2.9mmol), DMF 1방울을 포함하는 톨루엔(10mL)의 현탁액에 염화티오닐(0.41g, 3.4mmol)을 첨가하여 환류 조건으로 7시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 2-히드록시-5-니트로아닐린(0.44g, 2.9mmol), 트리에틸아민(0.32g, 3.2mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 물(30mL)을 첨가하여 석출한 결정을 여과 취출하고, 결정을 물로 세정후, 감압 가열 건조함으로써 표제 화합물(195mg, 수율 17.1%)을 담갈색 고체로서 얻었다.
실시예 47-2
2-메틸-5-(6-니트로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(2-히드록시-4-니트로아닐리노카르보닐)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 47-1 참조)(195mg, 0.492mmol)을 톨루엔(20mL)에 첨가하고, 이어서 p-톨루엔술폰산 수화물(280mg, 1.47mmol)을 첨가하여 4시간 환류?교반하였다. 용매를 감압 농축한 후, 중층물(10mL)을 첨가하여 1시간 실온에서 교반하였다. 석출한 결정을 여과하고, 결정을 물로 세정후, 감압 가열 건조함으로써 표제 화합물(144mg, 수율 77.4%)을 담황색 고체로서 얻었다.
실시예 48
2-메틸-5-(6-아미노벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-5-(6-니트로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 47-2 참조)(135mg, 0.357mmol)을 팔라듐/탄소(Pd:10%, 0.06g)를 포함하는 메탄올(20mL)에 첨가하고, 감압/수소 가스 치환을 3회 반복하여 수소 치환하고, 실온에서 2.5시간 교반하였다. 질소 치환후, 셀라이트층(20mm 두께)으로 불용물을 여과 분별, 또한 동층을 메탄올(20mL×3회)로 세정하였다. 여과액과 세정액을 합하여 용매를 감압 증류 제거하고, 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(50mg, 수율 40.2%)을 갈색 결정으로서 얻었다.
실시예 49
5-(벤조옥사졸-2-일)-1-(4-히드록시시클로헥실)-2-메틸벤조이미다졸의 합성
실시예 49-1
(2-(4-히드록시시클로헥실아미노)니트로벤젠-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(0.60g, 2.3mmol)을 트리에틸아민(0.70g, 7.0mmol), 4-아미노시클로헥산올염산염(0.53g, 2.5mmol)을 포함하는 아세토니트릴(20mL) 용액에 첨가하고, 환류 조건하에서 2시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하여 석출한 결정을 여과하고, 결정을 물로 세정후, 감압 가열 건조함으로써 얻어진 결정을 10% 팔라듐탄소(50mg)를 포함하는 메탄올:테트라히드로푸란=1:1 혼합 용액(20mL) 용액을 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 8시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.50g, 수율 67%)을 담적색 결정으로서 얻었다.
실시예 49-2
5-(벤조옥사졸-2-일)-1-(4-히드록시시클로헥실)-2-메틸벤조이미다졸의 합성
2-(2-(2-메톡시페닐)아미노아닐린-5-일)벤조옥사졸(실시예 49-1 참조)(0.20g, 0.62mmol), 메틸이미데이트염산염(0.07g, 0.68mmol) 및 메탄올을 환류 조건하에서 5시간 가열 교반하였다. 반응 종료후, 실온까지 냉각하고, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(0.14g, 수율 64%)을 담적색 결정으로서 얻었다.
실시예 50
5-(벤조옥사졸-2-일)-2-메틸-1-n-프로필벤조이미다졸의 합성
실시예 50-1
2-(2-n-프로필아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(176mg, 1.28mmol), n-프로필아민(82.4mg, 1.39mmol)을 첨가하고, 2.5시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(7mL) 용액에 10% 팔라듐탄소(100mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 14시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(152mg, 수율 49%)을 얻었다.
실시예 50-2
5-(벤조옥사졸-2-일)-2-메틸-1-n-프로필벤조이미다졸의 합성
2-(2-n-프로필아미노아닐린-5-일)벤조옥사졸(실시예 50-1 참조)(148mg, 0.554mmol)의 디메틸포름아미드(3mL) 용액에 아세트알데히드 수용액(ca. 90%, 104μl, 1.66mmol), 옥손(341mg, 0.554mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(46.6mg, 수율 29%)을 회색 결정으로서 얻었다.
실시예 51
5-(벤조옥사졸-2-일)-1-(2-메톡시에틸)-2-메틸벤조이미다졸의 합성
실시예 51-1
2-(2-(2-메톡시에틸)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(176mg, 1.28mmol), 2-메톡시에틸아민(105mg, 1.39mmol)을 첨가하고, 3.5시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(7mL) 용액에 10% 팔라듐탄소(100mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 6시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(102mg, 수율 31%)을 얻었다.
실시예 51-2
5-(벤조옥사졸-2-일)-1-(2-메톡시에틸)-2-메틸벤조이미다졸의 합성
2-(2-(2-메톡시에틸)아미노아닐린-5-일)벤조옥사졸(실시예 51-1 참조)(98mg, 0.346mmol)의 디메틸포름아미드(2mL) 용액에 아세트알데히드 수용액(ca. 90%, 65.1μl, 1.66mmol), 옥손(213mg, 0.346mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(41.4mg, 수율 39%)을 담다색 결정으로서 얻었다.
실시예 52
5-(벤조옥사졸-2-일)-2-메틸-1-(2-페닐에틸)벤조이미다졸의 합성
실시예 52-1
2-(2-(2-페닐에틸)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(176mg, 1.28mmol), 2-페닐에틸아민(169mg, 1.39mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 14시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(143mg, 수율 37%)을 얻었다.
실시예 52-2
5-(벤조옥사졸-2-일)-2-메틸-1-(2-페닐에틸)벤조이미다졸의 합성
2-(2-(2-페닐에틸)아미노아닐린-5-일)벤조옥사졸(실시예 52-1 참조)(140mg, 0.425mmol)의 메탄올(5mL) 용액에 1,1,1-트리메톡시에탄(61.3mg, 0.510mmol)을 첨가하고, 6시간 가열 환류하였다. 반응 종료후, 농축하고, 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(98.4mg, 수율 66%)을 백색 결정으로서 얻었다.
실시예 53
5-(벤조옥사졸-2-일)-2-메틸-1-cyc-프로필벤조이미다졸의 합성
실시예 53-1
2-(2-cyc-프로필아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(176mg, 1.28mmol), 시클로프로필아민(99.3mg, 1.74mmol)을 첨가하고, 7시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 14시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(141mg, 수율 46%)을 얻었다.
실시예 53-2
5-(벤조옥사졸-2-일)-2-메틸-1-cyc-프로필벤조이미다졸의 합성
2-(2-cyc-프로필아미노아닐린-5-일)벤조옥사졸(실시예 53-1 참조)(140mg, 0.425mmol)의 메탄올(5mL) 용액에 1,1,1-트리메톡시에탄(75mg, 0.624mmol)을 첨가하고, 6시간 가열 환류하였다. 반응 종료후, 농축하고, 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 이미다졸 63.5mg(42%)을 얻었다.
실시예 54
5-(벤조옥사졸-2-일)-2-메틸-1-cyc-프로필메틸벤조이미다졸의 합성
실시예 54-1
2-(2-cyc-프로필메틸아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(176mg, 1.28mmol), 시클로프로필메틸아민(176mg, 1.28mmol)을 첨가하고, 7시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 6시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(142mg, 수율 44%)을 얻었다.
실시예 54-2
5-(벤조옥사졸-2-일)-2-메틸-1-cyc-프로필메틸벤조이미다졸의 합성
2-(2-cyc-프로필메틸아미노아닐린-5-일)벤조옥사졸(실시예 54-1 참조)(140mg, 0.425mmol)의 메탄올(5mL) 용액에 1,1,1-트리메톡시에탄(75mg, 0.624mmol)을 첨가하고, 10시간 가열 환류하였다. 반응 종료후, 농축하고, 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(81.9mg, 수율 54%)을 분홍색 결정으로서 얻었다.
실시예 55
5-(벤조옥사졸-2-일)-1-(2-(tert-부톡시카르보닐아미노)에틸)-2-메틸벤조이미다졸의 합성
실시예 55-1
2-(tert-부톡시카르보닐아미노)에틸아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(600mg, 2.32mmol)을 트리에틸아민(469mg, 4.65mmol)과 2-(tert-부톡시카르보닐아미노)에틸아민(447mg, 2.79mmol)을 포함하는 아세토니트릴(10mL) 용액에 첨가하고, 5시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 6시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(550mg, 수율 64%)을 얻었다.
실시예 55-2
5-(벤조옥사졸-2-일)-1-(2-(tert-부톡시카르보닐아미노)에틸)-2-메틸벤조이미다졸의 합성
2-(tert-부톡시카르보닐아미노)에틸아미노아닐린-5-일)벤조옥사졸(실시예 55-1 참조)(200mg, 0.567mmol)의 메탄올(5mL) 용액에 아세트이미드산메틸염산염(102mg, 0.851mmol)을 첨가하고, 5시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(160mg, 수율 72%)을 백색 결정으로서 얻었다.
실시예 56
1-(2-아미노에틸)-5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸염산염의 합성
5-(벤조옥사졸-2-일)-1-(2-(tert-부톡시카르보닐아미노)에틸)-2-메틸벤조이미다졸(실시예 55-2 참조)(100mg, 0.255mmol)을 4N 염산-디옥산 용액(10mL)에 첨가하고, 5시간 가열 환류하였다. 반응 종료후, 농축 건고함으로써 표제 화합물(95mg, 정량적)을 백색 결정으로서 얻었다.
실시예 57
5-(벤조옥사졸-2-일)-2-메틸-1-(3-페닐프로필)벤조이미다졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(176mg, 1.28mmol), 3-페닐프로필아민(189mg, 1.39mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 6시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사의 메탄올(5mL) 용액에 1,1,1-트리메톡시에탄(108mg, 0.896mmol)을 첨가하고, 6시간 가열 환류하였다. 반응 종료후, 농축하고, 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(58.5mg, 수율 14%)을 백색 결정으로서 얻었다.
실시예 58
5-(벤조옥사졸-2-일)-2-(tert-부톡시카르바미드메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(300mg, 0.97mmol)의 디메틸포름아미드(5mL) 용액에 N-Boc-2-아미노아세트알데히드(232mg, 1.45mmol), 옥손(388mg, 0.631mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(130mg, 30%)을 분홍색 결정으로서 얻었다.
실시예 59
5-(5-tert-부틸벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(250mg, 0.842mmol), 2-아미노-4-tert-부틸페놀(139mg, 0.842mmol), DMF(2mL), 클로로포름(5mL) 및 WSC(178mg, 0.926mmol)를 첨가하고, 22시간 교반하였다. 물을 첨가하고, 얻어진 고체를 여과 취출, 수세하고, 건조하여 얻어진 고체의 디옥산(5mL) 용액에 메탄술폰산(140mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(160mg, 수율 49%)을 백색 결정으로서 얻었다.
실시예 60
5-(5-니트로벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(264mg, 0.888mmol), 염화티오닐(2mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 2-아미노-4-니트로페놀(137mg, 0.888mmol), 트리에틸아민(449mg, 4.44mmol), 테트라히드로푸란(10mL)에 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(140mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(66mg, 수율 20%)을 백색 결정으로서 얻었다.
실시예 61
5-(벤조옥사졸-2-일)-2-벤질-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(200mg, 0.646mmol)의 디메틸포름아미드(3mL) 용액에 페닐아세트알데히드(101mg, 0.840mmol), 옥손(258mg, 0.420mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(110mg, 수율 42%)을 담다색 비정질로서 얻었다.
실시예 62
5-(벤조옥사졸-2-일)-2-트랜스-신남-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(200mg, 0.646mmol)의 디메틸포름아미드(3mL) 용액에 트랜스-신남알데히드(111mg, 0.840mmol), 옥손(258mg, 0.420mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(97mg, 수율 36%)을 담황색 결정으로서 얻었다.
실시예 63
5-(벤조옥사졸-2-일)-2-(푸란-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(200mg, 0.646mmol)의 디메틸포름아미드(2mL) 용액에 푸르푸랄(80.7mg, 0.840mmol), 옥손(258mg, 0.420mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(121mg, 수율 49%)을 담황색 결정으로서 얻었다.
실시예 64
5-(벤조옥사졸-2-일)-2-(푸란-3-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(200mg, 0.646mmol)의 디메틸포름아미드(2mL) 용액에 3-푸르알데히드(80.7mg, 0.840mmol), 옥손(258mg, 0.420mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(171mg, 수율 69%)을 담황색 결정으로서 얻었다.
실시예 65
5-(벤조옥사졸-2-일)-2-(3-메톡시페닐)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(200mg, 0.646mmol)의 메탄올(5mL) 용액에 에틸-3-메톡시벤조이미데이트염산염(153mg, 0.711mmol)을 첨가하고, 8시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(216mg, 수율 79%)을 담다색 비정질로서 얻었다.
실시예 66
5-(5-메톡시벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(250mg, 0.842mmol), 2-아미노-3-메톡시페놀(139mg, 0.842mmol), DMF(5mL) 및 WSC(178mg, 0.926mmol)를 첨가하고, 22시간 교반하였다. 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 고체의 디옥산(5mL) 용액에 메탄술폰산(283mg, 2.95mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(10mg, 수율 3.3%)을 다색 결정으로서 얻었다.
실시예 67
2-아미노메틸-5-(벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸염산염의 합성
5-(벤조옥사졸-2-일)-2-(tert-부톡시카르바미드메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 58 참조)(116mg, 0.259mmol)의 디옥산(3mL) 용액에 4N 염화수소 디옥산 용액(1ml)을 첨가하고, 2시간 가열 환류하였다. 반응 용액을 실온까지 냉각하고, 여과, 얻어진 결정을 THF로 세정하고, 건조하여 표제 화합물(101mg, 수율 93%)을 백색 결정으로서 얻었다.
실시예 68
5-(벤조옥사졸-2-일)-2-(2-페닐에틸)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-트랜스-신남-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 62 참조)(80mg, 0.189mmol)의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(20mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 17시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(61.5mg, 수율 76%)을 백색 결정으로서 얻었다.
실시예 69
5-(벤조옥사졸-2-일)-2-(2-페닐에티닐)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(38.0mg, 0.119mmol)의 디메틸포름아미드(2mL) 용액에 페닐프파르길알데히드(ca. 90%, 22.6μl, 0.360mmol), 옥손(73.2mg, 0.119mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(20.0mg, 수율 49%)을 담황색 결정으로서 얻었다.
실시예 70
5-(5-에틸벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(182mg, 0.612mmol), 염화티오닐(2mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 2-아미노-4-에틸페놀(106mg, 0.612mmol), 트리에틸아민(309mg, 3.06mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(353mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(40mg, 수율 18%)을 담황색 결정으로서 얻었다.
실시예 71
5-(5-트리플루오로메틸벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(182mg, 0.612mmol), 염화티오닐(2mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 4-트리플루오로메틸-2-아미노페놀(132mg, 0.612mmol), 트리에틸아민(309mg, 3.06mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(353mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(28.8mg, 수율 12%)을 백색 결정으로서 얻었다.
실시예 72
5-(5-cyc-헥실벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(182mg, 0.612mmol), 염화티오닐(2mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 4-cyc-헥실-2-아미노페놀(117mg, 0.612mmol), 트리에틸아민(309mg, 3.06mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(353mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(125mg, 수율 49%)을 백색 결정으로서 얻었다.
실시예 73
5-(5-메톡시카르보닐벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(182mg, 0.612mmol), 염화티오닐(2mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 2-아미노-4-메톡시카르보닐페놀(117mg, 0.612mmol), 트리에틸아민(309mg, 3.06mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(353mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(37mg, 수율 15%)을 얻었다.
실시예 74
5-(벤조옥사졸-2-일)-1-n-부틸-2-메틸벤조이미다졸의 합성
실시예 74-1
2-(4-n-부틸아미노-3-니트로페닐)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(321mg, 2.32mmol), 부틸아민(170mg, 2.32mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하여 표제 화합물(358mg, 수율 99.1%)을 얻었다.
실시예 74-2
2-(2-n-부틸아미노아닐린-5-일)벤조옥사졸
2-(4-n-부틸아미노-3-니트로페닐)벤조옥사졸(실시예 74-1 참조)(353mg, 1.13mmol)의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 15시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(305mg, 수율 96%)을 얻었다.
실시예 74-3
5-(벤조옥사졸-2-일)-1-n-부틸-2-메틸벤조이미다졸
2-(2-n-부틸아미노아닐린-5-일)벤조옥사졸(실시예 74-2 참조)(300mg, 1.07mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(175mg, 1.60mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(293mg, 수율 90%)을 백색 결정으로서 얻었다.
실시예 75
5-(5-시아노벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(182mg, 0.612mmol), 염화티오닐(2mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 2-아미노-4-시아노페놀(82.1mg, 0.612mmol), 트리에틸아민(309mg, 3.06mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(353mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(26.1mg, 12%)을 담황색 결정으로서 얻었다.
실시예 76
5-(5-트리플루오로메톡시벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(182mg, 0.612mmol), 염화티오닐(2mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사를 2-아미노-4-트리플루오로메톡시페놀(117mg, 0.612mmol), 트리에틸아민(309mg, 3.06mmol), 테트라히드로푸란(5mL)에 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(353mg, 1.46mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(64mg, 수율 25%)을 분홍색 결정으로서 얻었다.
실시예 77
5-(벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)-2-트리클로로메틸벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(150mg, 0.485mmol)의 아세트산(3mL) 용액에 2,2,2-트리클로로아세토이미드산메틸염산염(94.1mg, 0.533mmol)을 첨가하고, 실온에서 4시간 교반하였다. 반응 종료후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(196mg, 수율 93%)을 회색 결정으로서 얻었다.
실시예 78
5-(벤조옥사졸-2-일)-1-(시클로헥사논-4-일)-2-메틸벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-1-(4-히드록시시클로헥실)-2-메틸벤조이미다졸(실시예 49-2 참조)(50mg, 0.14mmol)의 클로로포름(3mL) 용액에 DDQ(35mg, 0.16mmol)를 첨가하고, 실온에서 철야 교반하였다. 반응 종료후, 농축하여 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(20mg, 수율 40%)을 적갈색 결정으로서 얻었다.
실시예 79
5-(벤조옥사졸-2-일)-2-메틸-1-(2-피코릴)벤조이미다졸의 합성
실시예 79-1
2-(2-(2-피코릴)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(500mg, 1.9mmol)을 2-피코릴아민(520mg, 4.8mmol)을 포함하는 아세토니트릴(5mL) 현탁액에 첨가하고, 2.5시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(7mL) 용액에 10% 팔라듐탄소(100mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 14시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(480mg, 수율 78%)을 백색 고체로서 얻었다.
실시예 79-2
5-(벤조옥사졸-2-일)-2-메틸-1-(2-피코릴)벤조이미다졸의 합성
2-(2-(2-피코릴)아미노아닐린-5-일)벤조옥사졸(실시예 79-1 참조)(250mg, 0.79mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(100mg, 0.87mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(250mg, 수율 93%)을 백색 결정으로서 얻었다.
실시예 80
5-(벤조옥사졸-2-일)-2-메틸-1-이소-프로필벤조이미다졸의 합성
실시예 80-1
2-(4-이소-프로필아미노-3-니트로페닐)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(200mg, 0.774mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(214mg, 1.55mmol), 이소프로필아민(137mg, 2.32mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하여 표제 화합물(227mg, 수율 99%)을 얻었다.
실시예 80-2
2-(2-이소-프로필아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-이소-프로필아미노-3-니트로페닐)벤조옥사졸(실시예 80-1 참조)(224mg, 0.753mmol)의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(40mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 15시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(184mg, 수율 91%)을 얻었다.
실시예 80-3
5-(벤조옥사졸-2-일)-2-메틸-1-이소-프로필벤조이미다졸의 합성
2-(2-이소-프로필아미노아닐린-5-일)벤조옥사졸(실시예 80-2 참조)(180mg, 0.673mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(111mg, 1.01mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(196mg, 정량적)을 백색 결정으로서 얻었다.
실시예 81
5-(벤조옥사졸-2-일)-2-메틸-1-네오-펜틸벤조이미다졸의 합성
실시예 81-1
2-(4-네오-펜틸아미노-3-니트로페닐)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(200mg, 0.774mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(214mg, 1.55mmol), 네오펜틸아민(135mg, 1.55mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하여 표제 화합물(245mg, 수율 97%)을 얻었다.
실시예 81-2
2-(2-네오-펜틸아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-네오-펜틸아미노-3-니트로페닐)벤조옥사졸(실시예 81-1 참조)(242mg, 0.744mmol)의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(40mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 15시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(196mg, 수율 89%)을 얻었다.
실시예 81-3
5-(벤조옥사졸-2-일)-2-메틸-1-네오-펜틸벤조이미다졸의 합성
2-(2-네오-펜틸아미노아닐린-5-일)벤조옥사졸(실시예 81-2 참조)(192mg, 0.650mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(107mg, 0.975mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(155mg, 수율 75%)을 백색 결정으로서 얻었다.
실시예 82
5-(5-아미노벤조옥사졸-2-일)-2-메틸-1-n-프로필벤조이미다졸의 합성
실시예 82-1
3-니트로-4-n-프로필아미노벤조산의 합성
4-트리플루오로-3-니트로벤조산(2.0g, 10.8mmol)의 에탄올(20mL) 현탁액에 탄산칼륨(2.34mg, 16.2mmol), 프로필아민(1.27g, 21.6mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 10% 염산과 아세트산으로 pH 5로 조정하고, 석출한 결정을 여과, 물로 세정후, 건조하여 표제 화합물(1.94g, 수율 80%)을 얻었다.
실시예 82-2
3-아미노-4-n-프로필아미노벤조산
3-니트로-4-n-프로필아미노벤조산(실시예 82-1 참조)(1.94g, 10.8mmol)의 테트라히드로푸란(20mL) 용액에 10% 팔라듐탄소(200mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 6시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축함으로써 표제 화합물(1.68g, 정량적)을 얻었다.
실시예 82-3
2-메틸-1-n-프로필벤조이미다졸-5-카르복실산
3-아미노-4-n-프로필아미노벤조산(실시예 82-2 참조)(1.68g, 8.65mmol)의 메탄올(17mL) 용액에 아세토이미드산메틸염산염(1.14g, 10.4mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 디에틸에테르를 첨가하고, 실온에서 10분 교반하였다. 얻어진 결정을 여과, 디에틸에테르로 세정후, 건조함으로써 표제 화합물(2.20g, 정량적)을 얻었다.
실시예 82-4
5-(5-아미노벤조옥사졸-2-일)-2-메틸-1-n-프로필벤조이미다졸의 합성
2-메틸-1-n-프로필벤조이미다졸-5-카르복실산(실시예 82-3 참조)(1.0g, 3.93mmol), 염화티오닐(8mL)을 첨가하여 환류 조건에서 3시간 교반하였다. 반응 종료후, 감압 농축하여 얻어진 잔사에 2-아미노페놀(456mg, 2.96mmol), 트리에틸아민(899mg, 8.88mmol), 테트라히드로푸란(10mL)을 첨가하고, 실온에서 14시간 교반하였다. 반응 종료후, 농축하고, 얻어진 잔사의 디옥산(10mL) 용액에 메탄술폰산(1.42g, 14.8mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물, 포화 탄산수소나트륨 수용액을 첨가하고, 석출한 결정을 여과, 수세후, 건조시켰다. 얻어진 잔사에 철분(400mg, 7.12mmol), 10% 아세트산 수용액(20mL), 에탄올(20mL)을 첨가하고, 2시간 가열 환류하였다. 반응 용액을 냉각후, 1N 수산화나트륨 수용액, 클로로포름을 첨가하고, 셀라이트 여과하고, 얻어진 여과액을 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제하고, 얻어진 유상물을 테트라히드로푸란(3mL)에 녹이고, 1M 염화수소디에틸에테르 용액(1ml)을 첨가하였다. 석출한 결정을 여과, 테트라히드로푸란으로 세정후, 건조시킴으로써 표제 화합물(168mg, 수율 25%)을 담록색 결정으로서 얻었다.
실시예 83
5-(벤조옥사졸-2-일)-2-메틸-1-(2-(테트라히드로피란-4-일)에틸)벤조이미다졸의 합성
실시예 83-1
2-(2-(테트라히드로피란-4-일)에틸)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(800mg, 3.1mmol)을 2-(테트라히드로피란-4-일)에틸아민(520mg, 3.9mmol) 및 트리에틸아민(500mg, 3.9mmol)을 포함하는 아세토니트릴(5mL) 용액에 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(20mL) 용액에 10% 팔라듐탄소(100mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 철야 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(450mg, 수율 43%)을 시럽상으로서 얻었다.
실시예 83-2
5-(벤조옥사졸-2-일)-2-메틸-1-(2-(테트라히드로피란-4-일)에틸)벤조이미다졸의 합성
2-(2-(테트라히드로피란-4-일)에틸)벤조옥사졸(실시예 83-1 참조)(300mg, 0.89mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(220mg, 1.96mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(190mg, 수율 59%)을 백색 결정으로서 얻었다.
실시예 84
5-(벤조옥사졸-2-일)-2-메틸-1-((테트라히드로피란-4-일)메틸)벤조이미다졸의 합성
실시예 84-1
2-((테트라히드로피란-4-일)메틸)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(900mg, 3.5mmol)을 (테트라히드로피란-4-일)메틸아민(520mg, 3.9mmol) 및 트리에틸아민(500mg, 4.3mmol)을 포함하는 아세토니트릴(5mL) 용액에 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(20mL) 용액에 10% 팔라듐탄소(100mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 철야 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축함으로써 표제 화합물(790mg, 수율 70%)을 백색 고체로서 얻었다.
실시예 84-2
5-(벤조옥사졸-2-일)-2-메틸-1-((테트라히드로피란-4-일)메틸)벤조이미다졸의 합성
2-((테트라히드로피란-4-일)메틸)벤조옥사졸(실시예 84-1 참조)(300mg, 0.93mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(120mg, 1.11mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(290mg, 수율 90%)을 백색 결정으로서 얻었다.
실시예 85
5-(벤조옥사졸-2-일)-2-메틸-1-(3,3,3-트리플루오로프로필)벤조이미다졸의 합성
실시예 85-1
2-(2-(3,3,3-트리플루오로프로필)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(500mg, 3.5mmol)을 (테트라히드로피란-4-일)메틸아민(360mg, 2.4mmol) 및 트리에틸아민(590mg, 7.3mmol)을 포함하는 아세토니트릴(5mL) 용액에 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 테트라히드로푸란(20mL) 용액에 10% 팔라듐탄소(100mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 철야 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하여 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(450mg, 수율 71%)을 비정질상으로서 얻었다.
실시예 85-2
5-(벤조옥사졸-2-일)-2-메틸-1-(3,3,3-트리플루오로프로필)벤조이미다졸의 합성
2-(2-(3,3,3-트리플루오로프로필)아미노아닐린-5-일)벤조옥사졸(실시예 85-1 참조)(300mg, 0.93mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(120mg, 1.11mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축함으로써 표제 화합물(250mg, 수율 93%)을 백색 결정으로서 얻었다.
실시예 86
5-(벤조옥사졸-2-일)-2-(아세트산에틸에스테르-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(200mg, 0.646mmol)의 에탄올(5mL) 용액에 3-에톡시-3-이미노프로피온산에틸염산염(190mg, 0.969mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(249mg, 95%)을 회색 결정으로서 얻었다.
실시예 87
5-(벤조옥사졸-2-일)-2-메틸-1-(1,2,3,4-테트라히드로나프탈렌-1-일)벤조이미다졸의 합성
실시예 87-1
2-(2-(1,2,3,4-테트라히드로나프탈렌-1-일)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(0.50g, 1.9mmol)의 아세토니트릴(10mL) 현탁액에 1-아미노-1,2,3,4-테트라히드로나프탈렌(0.31g, 2.1mmol), 트리에틸아민(0.29g, 3.2mmol)을 첨가하고, 6시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사를 메탄올:테트라히드로푸란=1:1 혼합 용액(50mL)에 용해하고, 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 3시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.40g, 수율 84%)을 무색 비정질로서 얻었다.
실시예 87-2
5-(벤조옥사졸-2-일)-2-메틸-1-(1,2,3,4-테트라히드로나프탈렌-1-일)벤조이미다졸의 합성
2-(2-(1,2,3,4-테트라히드로나프탈렌-1-일)아미노아닐린-5-일)벤조옥사졸(실시예 87-1 참조)(0.30g, 0.8mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(0.10g, 0.9mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.15g, 수율 47%)을 무색 비정질로서 얻었다.
실시예 88
5-(벤조옥사졸-2-일)-1-(2-히드록시에틸)-2-메틸벤조이미다졸의 합성
실시예 88-1
2-(2-(2-히드록시에틸)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(0.50g, 1.9mmol)의 아세토니트릴(10mL) 현탁액에 2-히드록시에틸아민(0.14g, 2.1mmol), 트리에틸아민(0.29g, 2.4mmol)을 첨가하고, 6시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사를 메탄올:테트라히드로푸란=1:1 혼합 용액(50mL)에 용해하고, 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 3시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.36g, 수율 70%)을 박황색 고체로서 얻었다.
실시예 88-2
5-(벤조옥사졸-2-일)-1-(2-히드록시에틸)-2-메틸벤조이미다졸의 합성
2-(2-(2-히드록시에틸)아미노아닐린-5-일)벤조옥사졸(실시예 88-1 참조)(0.10g, 0.4mmol)의 메탄올(2mL) 용액에 아세토이미드산메틸염산염(0.08g, 0.7mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(0.05g, 수율 49%)을 백색 결정으로서 얻었다.
실시예 89
5-(벤조옥사졸-2-일)-1-디페닐메틸-2-메틸벤조이미다졸의 합성
실시예 89-1
2-(2-디페닐메틸아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(0.50g, 1.9mmol)의 아세토니트릴(10mL) 현탁액에 디페닐메틸아민(0.39g, 2.1mmol), 트리에틸아민(0.29g, 2.4mmol)을 첨가하고, 10시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사에 철분(0.33g, 5.8mmol), 아세트산(50mL)을 첨가하고, 2시간 가열 환류하였다. 반응 용액을 냉각후, 셀라이트 여과한 후에 농축하여 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제하고, 얻어진 유상물을 테트라히드로푸란(3mL)에 녹이고, 1M 염화수소디에틸에테르 용액(1ml)을 첨가하였다. 석출한 결정을 여과, 테트라히드로푸란으로 세정후, 건조시킴으로써 표제 화합물(0.15g, 수율 20%)을 박갈색 고체로서 얻었다.
실시예 89-2
5-(벤조옥사졸-2-일)-1-디페닐메틸-2-메틸벤조이미다졸의 합성
2-(2-디페닐메틸아미노아닐린-5-일)벤조옥사졸(실시예 89-1 참조)(0.10g, 0.3mmol)의 메탄올(2mL) 용액에 아세토이미드산메틸염산염(0.06g, 0.5mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.04g, 수율 37%)을 백색 결정으로서 얻었다.
실시예 90
5-(벤조옥사졸-2-일)-2-(테트라히드로푸란-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(푸란-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 63 참조)(90mg, 0.234mmol)의 메탄올:아세트산에틸=1:1(6mL) 용액에 10% 팔라듐탄소(20mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 20시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(31.4mg, 수율 34%)을 무색 비정질로서 얻었다.
실시예 91
5-(벤조옥사졸-2-일)-2-tert-부톡시카르보닐메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 91-1
2-(2-tert-부톡시카르보닐메틸아미노)아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(0.77g, 3.0mmol)의 아세토니트릴(10mL) 현탁액에 글리신tert-부틸에스테르염산염(0.60g, 3.6mmol), 트리에틸아민(0.90g, 9.0mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사를 테트라히드로푸란(50mL)에 용해하고, 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 철야 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.40g, 수율 40%)을 박등색 고체로서 얻었다.
실시예 91-2
5-(벤조옥사졸-2-일)-2-메틸-1-tert-부톡시카르보닐메틸벤조이미다졸의 합성
2-(2-(tert-부톡시카르보닐메틸아미노아닐린-5-일)벤조옥사졸(실시예 91-1 참조)(120mg, 0.353mmol)의 디메틸포름아미드(2mL) 용액에 아세트알데히드(ca. 90%, 66μl, 1.06mmol), 옥손(217mg, 0.353mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(30.7mg, 24%)을 백색 결정으로서 얻었다.
실시예 92
5-(벤조옥사졸-2-일)-1-카르복시메틸-2-메틸벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-메틸-1-tert-부톡시카르보닐메틸벤조이미다졸(실시예 91-2 참조)(100mg, 0.275mmol)의 클로로포름(3mL) 용액에 수산화나트륨 수용액(1M, 0.55mL, 0.55mmol)을 첨가하였다. 이 2층의 용액에 균일해질 때까지 메탄올을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 용액을 농축하고, 아세트산 수용액을 첨가하고, 실온에서 교반하였다. 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(76.9mg, 91%)을 담황색 결정으로서 얻었다.
실시예 93
5-(벤조옥사졸-2-일)-2-메틸-1-(2-(티오모르폴린-1,1-디옥시드-4-일)에틸)벤조이미다졸의 합성
실시예 93-1
2-(N-(2-(티오모르폴린-1,1-디옥시드-4-일)에틸)-2-니트로아닐린-4-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(200mg, 0.774mmol)의 에탄올(5mL) 현탁액에 탄산칼륨(214mg, 1.55mmol), 4-(2-아미노에틸)티오모르폴린-1,1-디옥시드(166mg, 0.930mmol)를 첨가하고, 7시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(296mg, 92%)을 얻었다.
실시예 93-2
5-(벤조옥사졸-2-일)-2-메틸-1-(2-(티오모르폴린-1,1-디옥시드-4-일)에틸)벤조이미다졸의 합성
2-(N-(2-(티오모르폴린-1,1-디옥시드-4-일)에틸)-2-니트로아닐린-4-일)벤조옥사졸(실시예 93-1 참조)(290mg, 0.696mmol)의 테트라히드로푸란(5mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 17시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사의 디메틸포름아미드(2mL) 용액에 아세트알데히드(ca. 90%, 131μl, 2.09mmol), 옥손(429mg, 0.696mmol)을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물, 아세트산에틸로 세정후, 건조함으로써 표제 화합물(125mg, 44%)을 담황색 결정으로서 얻었다.
실시예 94
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)-4-트리플루오로메틸벤조이미다졸의 합성
실시예 94-1
2-(2-플루오로-3-트리플루오로메틸니트로벤젠-5-일)벤조옥사졸의 합성
4-플루오로-3-니트로-5-트리플루오로벤조산(1.00g, 4.0mmol), 2-아미노페놀(0.47g, 4.4mmol), CHCl3(20mL) 및 WSC(0.83g, 4.4mmol)를 첨가하고, 실온에서 1시간 교반하였다. 물을 첨가하고, 클로로포름:아세톤=3:1 용액으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 고체의 디옥산(20mL) 용액에 메탄술폰산(2.28g, 24mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(0.70g, 수율 54%)을 황갈색 결정으로서 얻었다.
실시예 94-2
2-(2-(테트라히드로푸란-2-일)아미노-3-트리플루오로메틸아닐린-5-일)벤조옥사졸의 합성
2-(2-플루오로-3-트리플루오로메틸니트로벤젠-5-일)벤조옥사졸(실시예 94-1 참조)(0.40g, 1.2mmol)의 아세토니트릴(8mL) 현탁액에 4-아미노테트라히드로피란(0.30g, 2.9mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정을 메탄올:테트라히드로푸란=1:1 용액(100mL) 용액에 용해시킨 후에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 2시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.20g, 수율 43%)을 백색 결정으로서 얻었다.
실시예 94-3
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)-4-트리플루오로메틸벤조이미다졸의 합성
2-(2-(테트라히드로푸란-2-일)아미노-3-트리플루오로메틸아닐린-5-일)벤조옥사졸(실시예 94-2 참조)(0.20g, 0.5mmol)의 메탄올(4mL) 용액에 아세토이미드산메틸염산염(0.06g, 0.6mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(0.17g, 수율 79%)을 백색 결정으로서 얻었다.
실시예 95
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로푸란-2-일)메틸벤조이미다졸의 합성
실시예 95-1
2-(2-(테트라히드로푸란-2-일)메틸아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(0.40mg, 1.5mmol)의 아세토니트릴(8mL) 현탁액에 2-아미노메틸테트라히드로푸란(0.36g, 3.6mmol)을 첨가하고, 7시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사를 메탄올:테트라히드로푸란=1:1 혼합 용액(40mL)에 용해하고, 10% 팔라듐탄소(40mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 3시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.40g, 수율 84%)을 갈색 시럽으로서 얻었다.
실시예 95-2
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로푸란-2-일)메틸벤조이미다졸의 합성
2-(테트라히드로피란-2-일)메틸아미노아닐린-5-일)벤조옥사졸(실시예 95-1 참조)(0.15g, 0.4mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(0.05mg, 0.4mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(0.17g, 수율 79%)을 백색 결정으로서 얻었다.
실시예 96
5-(벤조옥사졸-2-일)-2-메틸-1-(3-(모르폴린-4-일)프로필)벤조이미다졸의 합성
실시예 96-1
2-(N-(2-(모르폴린-4-일)-n-프로필)-2-니트로아닐린-4-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(500mg, 1.94mmol)의 에탄올(10mL) 현탁액에 탄산칼륨(535mg, 3.87mmol), N-(3-아미노-n-프로필)모르폴린(336mg, 2.33mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(670mg, 90%)을 얻었다.
실시예 96-2
2-(2-(3-(모르폴린-4-일)-n-프로필)아미노아닐린-4-일)벤조옥사졸의 합성
2-(N-(2-(모르폴린-4-일)-n-프로필)-2-니트로아닐린-4-일)벤조옥사졸(실시예 96-1 참조)(665mg, 1.74mmol)의 테트라히드로푸란(10mL) 용액에 10% 팔라듐탄소(70mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 17시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축함으로써 표제 화합물(605mg, 99%)을 얻었다.
실시예 96-3
5-(벤조옥사졸-2-일)-2-메틸-1-(3-(모르폴린-4-일)-n-프로필)벤조이미다졸의 합성
2-(2-(3-(모르폴린-4-일)-n-프로필)아미노아닐린-4-일)벤조옥사졸(실시예 96-2 참조)(300mg, 0.851mmol)의 메탄올(5mL) 용액에 아세토이미드산메틸염산염(103mg, 0.936mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 결정에 디에틸에테르를 첨가하고, 여과, 디에틸에테르로 세정후, 건조함으로써 표제 화합물(195mg, 61%)을 담다색 결정로서 얻었다.
실시예 97
5-(5-카르복실벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(5-메톡시카르보닐벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 73 참조)(150mg, 0.383mmol)의 클로로포름(3mL) 용액에 수산화나트륨 수용액(1M, 0.5mL, 0.5mmol)을 첨가하였다. 이 2층의 용액에 균일해질 때까지 메탄올을 첨가하고, 실온에서 20시간 교반하였다. 반응 종료후, 용액을 농축하고, 아세트산 수용액을 첨가하고, 실온에서 교반하였다. 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(145mg, 정량적)을 담황색 결정으로서 얻었다.
실시예 98
5-(5-아세틸아미노벤조옥사졸-2-일)-2-메틸-1-n-프로필벤조이미다졸의 합성
5-(5-아미노벤조옥사졸-2-일)-2-메틸-1-n-프로필벤조이미다졸(실시예 82-4 참조)(200mg, 0.653mmol)의 클로로포름(5mL) 용액에 트리에틸아민(132mg, 1.31mmol), 무수아세트산(100mg, 0.979mmol)을 첨가하고, 실온에서 20시간 교반하였다. 반응 종료후, 용액을 농축하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(176mg, 77%)을 담황색 결정으로서 얻었다.
실시예 99
2-메틸-5-(5-n-프로필아미노카르보닐벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(5-카르복실벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 97 참조)(133mg, 0.352mmol)의 클로로포름(5mL) 용액에 프로필아민(25mg, 0.423mmol), WSC(81mg, 0.423mmol)를 첨가하고, 실온에서 22시간 교반하였다. 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 크로마토그래피로 정제함으로써 표제 화합물(57mg, 39%)을 백색 결정으로서 얻었다.
실시예 100
2-(4-아세틸아미노페닐)-5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
실시예 100-1
5-클로로-2-(2-플루오로니트로벤젠-5-일)벤조옥사졸의 합성
4-플루오로-3-니트로벤조산(25.0g, 135mmol), 2-아미노-4-클로로페놀(21.3g, 149mmol), CHCl3(500mL) 및 WSC(28.5g, 149mmol)를 첨가하고, 실온에서 2시간 교반한 반응 매스를 농축한 후에 잔사를 물 및 에탄올로 세정하였다. 얻어진 고체의 디옥산(500mL) 용액에 메탄술폰산(81.9g, 811mmol)을 첨가하고, 18시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(31.0g, 수율 78%)을 적갈색 결정으로서 얻었다.
실시예 100-2
5-클로로-2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸의 합성
5-클로로-2-(2-플루오로니트로벤젠-5-일)벤조옥사졸(실시예 100-1 참조)(5.00g, 17.1mmol)의 아세토니트릴(20mL) 현탁액에 4-아미노테트라히드로피란(3.81g, 38.0mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정을 메탄올:테트라히드로푸란=1:1 용액(100mL) 용액에 용해시킨 후에 10% 팔라듐탄소(500mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 철야 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하여 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(2.86g, 수율 49%)을 황갈색 결정으로서 얻었다.
실시예 100-3
2-(4-아세틸아미노페닐)-5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-클로로-2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 100-2 참조)(250mg, 0.727mmol)의 디메틸포름아미드(3mL) 용액에 4-포르밀아세토아닐리드(142mg, 0.872mmol), 옥손(313mg, 0.509mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물로 세정후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(261mg, 74%)을 백색 결정으로서 얻었다.
실시예 101
5-(5-클로로벤조옥사졸-2-일)-2-(4-메톡시카르보닐페닐)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-클로로-2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 100-2 참조)(250mg, 0.727mmol)의 디메틸포름아미드(3mL) 용액에 4-포르밀벤조산메틸(143mg, 0.872mmol), 옥손(313mg, 0.509mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 물, 아세트산에틸로 세정후, 건조함으로써 표제 화합물(239mg, 67%)을 담황색 결정으로서 얻었다.
실시예 102
2-(4-카르복실페닐)-5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(5-클로로벤조옥사졸-2-일)-2-(4-메톡시카르보닐페닐)-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 101 참조)(220mg, 0.451mmol)의 클로로포름(3mL) 용액에 수산화나트륨 수용액(1M, 1ml, 1mmol)을 첨가하였다. 이 2층의 용액에 균일해질 때까지 메탄올을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 용액을 농축하고, 아세트산 수용액을 첨가하고, 실온에서 교반하였다. 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(205mg, 96%)을 백색 결정으로서 얻었다.
실시예 103
5-(5-클로로벤조옥사졸-2-일)-2-(3-메톡시카르보닐페닐)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-클로로-2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 100-2 참조)(250mg, 0.727mmol)의 디메틸포름아미드(3mL) 용액에 3-포르밀벤조산메틸(143mg, 0.872mmol), 옥손(313mg, 0.509mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(220mg, 62%)을 황색 결정으로서 얻었다.
실시예 104
2-아세틸아미노메틸-5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-클로로-2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 100-2 참조)(250mg, 0.727mmol)의 에탄올(5mL) 용액에 2-아세틸아미노아세토이미드산에틸염산염(263mg, 1.45mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(65.2mg, 21%)을 백색 결정으로서 얻었다.
실시예 105
2-(3-카르복실페닐)-5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-(5-클로로벤조옥사졸-2-일)-2-(3-메톡시카르보닐페닐)-1-(테트라히드로피란-4-일)벤조이미다졸(실시예 103 참조)(280mg, 0.574mmol)의 클로로포름(3mL) 용액에 1M 수산화나트륨 수용액(1ml, 1mmol)을 첨가하였다. 이 2층의 용액에 균일해질 때까지 메탄올을 첨가하고, 실온에서 3시간 교반하였다. 반응 종료후, 용액을 농축하고, 아세트산 수용액을 첨가하고, 실온에서 교반하였다. 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(240mg, 88%)을 백색 결정으로서 얻었다.
실시예 106
2-(3-아세틸아미노페닐)-5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤조이미다졸의 합성
5-클로로-2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 100-2 참조)(250mg, 0.727mmol)의 디메틸포름아미드(5mL) 용액에 3-아세트아미드벤조산(130mg, 0.727mmol), WSC(167mg, 0.872mmol)를 첨가하고, 실온에서 23시간 교반하였다. 포화 탄산수소나트륨 수용액을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(2방울)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(50.5mg, 14%)을 백색 결정으로서 얻었다.
실시예 107
5-(벤조옥사졸-2-일)-2-메틸-1-((4-모르폴리닐)카르보닐메틸)벤조이미다졸의 합성
실시예 107-1
2-(2-((4-모르폴리닐)카르보닐메틸)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(1.20g, 4.6mmol)의 아세토니트릴(24mL) 현탁액에 트리에틸아민(1.17g, 11.6mmol), 아미노아세틸모르폴린(0.73g, 5.1mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사를 메탄올(40mL)에 용해하고, 10% 팔라듐탄소(120mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 3시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(1.50g, 수율 91%)을 담갈색 결정으로서 얻었다.
실시예 107-2
5-(벤조옥사졸-2-일)-2-메틸-1-(4-모르폴리닐)벤조이미다졸의 합성
2-(4-모르폴리닐)아미노아닐린-5-일)벤조옥사졸(실시예 107-1 참조)(0.08g, 0.2mmol)의 메탄올(2mL) 용액에 아세토이미드산메틸염산염(0.03g, 3mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(0.10g, 정량적)을 백색 결정으로서 얻었다.
실시예 108
4-옥소-4-(2-(5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸-1-일)에틸)아미노부티르산의 합성
1-(2-아미노에틸)-5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸염산염(실시예 56참조)(0.20g, 0.6mmol), 무수 숙신산(0.06g, 0.6mmol), 트리에틸아민(0.22g, 2.2mmol), CHCl3(2mL)을 첨가하고, 실온에서 1시간 교반한 후에 환류 온도에서 1시간 과열 교반하였다. 냉각후, 물을 첨가하여 역추출하였다. 얻어진 수층을 농축하고, 잔사를 메탄올로 리슬러리화하였다. 석출한 결정을 여과한 후에 건조함으로써 표제 화합물(0.13g, 수율 69%)을 백색 결정으로서 얻었다.
실시예 109
5-(벤조옥사졸-2-일)-2-메틸-1-(2-트리플루오로아세틸아미노에틸)벤조이미다졸의 합성
1-(2-아미노에틸)-5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸염산염(실시예 56참조)(0.20g, 0.6mmol), 무수트리플루오로아세트산(0.17g, 0.8mmol), 트리에틸아민(0.22g, 2.2mmol), CHCl3(2mL)을 첨가하고, 실온에서 1시간 교반하였다. 냉각후, 클로로포름과 물을 첨가하여 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 고체를 여과 분별?건조함으로써 표제 화합물(0.08g, 수율 34%)을 백색 결정으로서 얻었다.
실시예 110
3-(2-(5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸-1-일)에틸)-1-메틸티오요소의 합성
1-(2-아미노에틸)-5-(벤조옥사졸-2-일)-2-메틸벤조이미다졸염산염(실시예 56참조)(0.20g, 0.6mmol), 이소티오시안산메틸(0.17g, 0.6mmol), 트리에틸아민(0.13g, 13mmol), THF(2mL)를 첨가하고, 실온에서 1시간 교반하였다. 냉각후, 클로로포름과 물을 첨가하여 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 고체를 여과 분별?건조함으로써 표제 화합물(0.08g, 수율 40%)을 백색 결정으로서 얻었다.
실시예 111
5-(벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)-2-(테트라히드로피란-4-일)메틸벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(250mg, 0.808mmol)의 디메틸포름아미드(3mL) 용액에 (4-테트라히드로피라닐)아세트알데히드(114mg, 0.889mmol), 옥손(323mg, 0.525mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(197mg, 58%)을 담다색 결정으로서 얻었다.
실시예 112
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)-6-클로로벤조이미다졸의 합성
실시예 112-1
2-(4-클로로-2-플루오로니트로벤젠-5-일)벤조옥사졸의 합성
2-클로로-4-플루오로-5-니트로벤조산(4.00g, 18.2mmol), 2-아미노페놀(2.09g, 20.1mmol), CHCl3(80mL) 및 WSC(3.84g, 20.0mmol)를 첨가하고, 실온에서 2시간 교반하였다. 물을 첨가하고, 클로로포름:아세톤=3:1 용액으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 고체의 톨루엔(80mL) 용액에 p-톨루엔술폰산일수화물(0.18g, 1.8mmol)을 첨가하고, 40시간 가열 환류하였다. 반응 용액을 농축후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(1.40g, 수율 26%)을 황갈색 결정으로서 얻었다.
실시예 112-2
2-(4-클로로-2-(테트라히드로피란-4-일)아미노니트로벤젠-5-일)벤조옥사졸의 합성
2-(4-클로로-2-플루오로니트로벤젠-5-일)벤조옥사졸(실시예 112-1 참조)(0.38g, 1.3mmol)의 아세토니트릴(8mL) 현탁액에 4-아미노테트라히드로피란(0.30g, 2.9mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과하였다. 얻어진 결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.10g, 수율 21%)을 갈색 결정으로서 얻었다.
실시예 112-3
2-(4-클로로-2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸의 합성
2-(4-클로로-2-(테트라히드로피란-4-일)아미노니트로벤젠-5-일)벤조옥사졸(실시예 112-2 참조)(0.10g, 0.8mmol)에 철분(0.33g, 5.8mmol), 아세트산(50mL)을 첨가하고, 2시간 가열 환류하였다. 반응 용액을 냉각후, 셀라이트 여과한 후에 농축하여 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.06g, 수율 65%)을 적갈색 고체로서 얻었다.
실시예 112-4
5-(벤조옥사졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)-6-클로로벤조이미다졸의 합성
2-(4-클로로-2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 112-3 참조)(0.04g, 0.2mmol)의 메탄올(1.2mL) 용액에 아세토이미드산메틸염산염(0.06g, 0.6mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(0.03g, 수율 79%)을 황갈색 고체로서 얻었다.
실시예 113
5-(벤조옥사졸-2-일)-1-(4-메톡시카르보닐페닐메틸)-2-메틸벤조이미다졸의 합성
실시예 113-1
2-(2-(4-메톡시카르보닐페닐메틸)아미노니트로벤젠-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(250mg, 0.968mmol)의 아세토니트릴(5mL) 현탁액에 트리에틸아민(245mg, 2.42mmol), 4-카르보메톡시벤질아민염산염(215mg, 1.07mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(372mg, 95%)을 얻었다.
실시예 113-2
2-(2-(4-메톡시카르보닐페닐메틸)아미노아닐린-5-일)벤조옥사졸의 합성
2-(2-(4-메톡시카르보닐페닐메틸)아미노니트로벤젠-5-일)벤조옥사졸(실시예 113-2 참조)(367mg, 0.910mmol)에 철분(102mg, 1.82mmol), 10% 아세트산 수용액(5mL), 메탄올(7mL)을 첨가하고, 16시간 가열 환류하였다. 반응 용액을 냉각후, 포화 탄산수소나트륨 수용액, 클로로포름을 첨가하고, 셀라이트 여과하고, 얻어진 여과액을 추출하였다. 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(61.8mg, 18%)을 얻었다.
실시예 113-3
5-(벤조옥사졸-2-일)-1-(4-메톡시카르보닐페닐메틸)-2-메틸벤조이미다졸의 합성
2-(2-(4-메톡시카르보닐페닐메틸)아미노아닐린-5-일)벤조옥사졸(실시예 113-3 참조)아민(59.0mg, 0.159mmol)의 메탄올(3mL) 용액에 아세토이미드산메틸염산염(19mg, 0.174mmol)을 첨가하고, 1.5시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 실온에서 수분 교반하였다. 얻어진 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(62.2mg, 98%)을 황색 결정으로서 얻었다.
실시예 114
5-(벤조옥사졸-2-일)-1-(4-카르복실페닐메틸)-2-메틸벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-1-(4-메톡시카르보닐페닐메틸)-2-메틸벤조이미다졸(실시예 113-4 참조)(55mg, 0.138mmol)의 클로로포름(3mL) 용액에 수산화나트륨 수용액(1M, 0.6mL, 0.6mmol)을 첨가하였다. 이 2층의 용액에 균일해질 때까지 메탄올을 첨가하고, 실온에서 20시간 교반하였다. 반응 종료후, 용액을 농축하고, 아세트산 수용액을 첨가하고, 실온에서 교반하였다. 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(45.9mg, 87%)을 황색 결정으로서 얻었다.
실시예 115
5-(1-벤조옥사졸-2-일)-1-(1-부탄올-2-일)-2-메틸벤조이미다졸의 합성
실시예 115-1
2-(2-(1-n-부탄올-2-일)아미노니트로벤젠-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(250mg, 0.968mmol)의 아세토니트릴(5mL) 현탁액에 탄산칼륨(268mg, 1.94mmol), 2-아미노-1-n-부탄올(95.4mg, 1.07mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(298mg, 94%)을 얻었다.
실시예 115-2
5-(1-벤조옥사졸-2-일)-1-(1-n-부탄올-2-일)-2-메틸벤조이미다졸의 합성
2-(2-(1-n-부탄올-2-일)아미노니트로벤젠-5-일)벤조옥사졸(실시예 115-1 참조)(295mg, 0.901mmol)의 에탄올, 아세트산에틸(1:1, 6mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 19시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사의 에탄올(5mL) 용액에 아세토이미드산에틸염산염(133mg, 1.08mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 실온에서 수분 교반하였다. 얻어진 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(232mg, 72%)을 백색 결정으로서 얻었다.
실시예 116
5-(1-벤조옥사졸-2-일)-1-(2-n-프로판올-1-일)-2-메틸벤조이미다졸의 합성
실시예 116-1
2-(2-(2-n-프로판올-1-일)아미노니트로벤젠-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(250mg, 0.968mmol)의 아세토니트릴(5mL) 현탁액에 탄산칼륨(268mg, 1.94mmol), 1-아미노-2-n-프로판올(80.4mg, 1.07mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(284mg, 94%)을 얻었다.
실시예 116-2
5-(1-벤조옥사졸-2-일)-1-(2-n-프로판올-1-일)-2-메틸벤조이미다졸의 합성
2-(2-(2-n-프로판올-1-일)아미노니트로벤젠-5-일)벤조옥사졸(실시예 116-1)(280mg, 0.894mmol)의 에탄올, 아세트산에틸(1:1, 6mL) 용액에 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 19시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사의 에탄올(5mL) 용액에 아세토이미드산에틸염산염(133mg, 1.08mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 실온에서 수분 교반하였다. 얻어진 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(254mg, 92%)을 백색 결정으로서 얻었다.
실시예 117
5-(벤조옥사졸-2-일)-1-(3-메톡시카르보닐페닐메틸)-2-메틸벤조이미다졸의 합성
실시예 117-1
2-(2-(3-메톡시카르보닐페닐메틸)아미노니트로벤젠-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(250mg, 0.968mmol)의 아세토니트릴(5mL) 현탁액에 트리에틸아민(245mg, 2.42mmol), 3-카르보메톡시벤질아민염산염(215mg, 1.07mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(365mg, 94%)을 얻었다.
실시예 117-2
5-(벤조옥사졸-2-일)-1-(3-메톡시카르보닐페닐메틸)-2-메틸벤조이미다졸의 합성
2-(2-(3-메톡시카르보닐페닐메틸)아미노니트로벤젠-5-일)벤조옥사졸(실시예 117-1)(220mg, 0.545mmol)에 철분(91.4mg, 1.64mmol), 아세트산(5mL)을 첨가하고, 12시간 가열 환류하였다. 반응 용액을 냉각후, 반응 용액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(139mg, 64%)을 백색 결정으로서 얻었다.
실시예 118
5-(1-벤조옥사졸-2-일)-1-(1-아세톡시-2-페닐에탄-2-일)-2-메틸벤조이미다졸의 합성
실시예 118-1
2-(2-(2-페닐-1-에탄올-2-일)아미노니트로벤젠-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(250mg, 0.968mmol)의 아세토니트릴(5mL) 현탁액에 탄산칼륨(268mg, 1.94mmol), 2-페닐글리시놀(146mg, 1.07mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(343mg, 94%)을 얻었다.
실시예 118-2
5-(1-벤조옥사졸-2-일)-1-(1-아세톡시-2-페닐에탄-2-일)-2-메틸벤조이미다졸의 합성
2-(2-(2-페닐-1-에탄올-2-일)아미노니트로벤젠-5-일)벤조옥사졸(실시예 118-1)(340mg, 0.545mmol)에 철분(152mg, 2.72mmol), 아세트산(5mL)을 첨가하고, 12시간 가열 환류하였다. 반응 용액을 냉각후, 반응 용액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(214mg, 57%)을 무색 비정질로서 얻었다.
실시예 119
5-(벤조옥사졸-2-일)-1-(3-카르복실페닐메틸)-2-메틸벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-1-(3-메톡시카르보닐페닐메틸)-2-메틸벤조이미다졸(실시예 117-2 참조)(125mg, 0.315mmol)의 클로로포름(3mL) 용액에 수산화나트륨 수용액(1M, 1ml, 1mmol)을 첨가하였다. 이 2층의 용액에 균일해질 때까지 메탄올을 첨가하고, 실온에서 20시간 교반하였다. 반응 종료후, 용액을 농축하고, 아세트산 수용액을 첨가하고, 실온에서 교반하였다. 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(120mg, 99%)을 백색 결정으로서 얻었다.
실시예 120
5-(1-벤조옥사졸-2-일)-1-(2-페닐에탄올-2-일)-2-메틸벤조이미다졸의 합성
5-(1-벤조옥사졸-2-일)-1-(1-아세톡시-2-페닐에탄-2-일)-2-메틸벤조이미다졸(실시예 118-2 참조)(200mg, 0.486mmol)의 메탄올(5mL) 용액에 수산화나트륨 수용액(1M, 1.5mL, 1.5mmol)을 첨가하고, 실온에서 20시간 교반하였다. 반응 종료후, 용액을 농축하고, 물을 첨가하고, 실온에서 교반하였다. 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(158mg, 88%)을 백색 결정으로서 얻었다.
실시예 121
5-(벤조옥사졸-2-일)-2-메틸-1-(2-tert-부톡시카르보닐-n-프로필)벤조이미다졸의 합성
실시예 121-1
2-(2-tert-부톡시카르보닐-n-프로필아미노)아닐린-5-일)벤조옥사졸의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(0.50g, 1.9mmol)의 아세토니트릴(10mL) 현탁액에 2-tert-부톡시카르보닐-1-프로필아민(0.32g, 2.0mmol), 트리에틸아민(0.22g, 2.2mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 잔사를 테트라히드로푸란(50mL)에 용해하고, 10% 팔라듐탄소(50mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 3시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 표제 화합물(0.62g, 수율 83%)을 박갈색 고체로서 얻었다.
실시예 121-2
5-(벤조옥사졸-2-일)-2-메틸-1-(2-tert-부톡시카르보닐-n-프로필)벤조이미다졸의 합성
2-(2-tert-부톡시카르보닐-n-프로필아미노)아닐린-5-일)벤조옥사졸(실시예 121-1 참조)(0.62g, 1.7mmol)의 THF(20mL) 용액에 아세토이미드산메틸염산염(0.37g, 3.4mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 용액을 냉각후, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 표제 화합물(0.61g, 수율 92%)을 황갈색 고체로서 얻었다.
실시예 122
5-(벤조옥사졸-2-일)-2-메틸-1-(2-카르보닐-n-프로필)벤조이미다졸의 합성
5-(벤조옥사졸-2-일)-2-메틸-1-(2-tert-부톡시카르보닐-n-프로필)벤조이미다졸(실시예 121-2 참조)(0.4g, 1.0mmol) 및 THF-물=2:1 용액(40mL)을 넣고, 실온에서 수산화리튬(0.43g, 1.0mmol)을 첨가하고, 5시간 가열 교반하였다. 보랭후, 액성을 희염산(1M)으로 약 pH 5로 하고, 석출한 결정을 여과 취출, 물로 세정, 이어서 감압 가열 건조함으로써 표제 화합물(0.29g, 수율 83%)을 백색 결정으로서 얻었다.
실시예 123
5-(5-클로로벤조옥사졸-2-일)-2-(4-n-프로필아미노카르보닐페닐)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
2-(4-카르복실페닐)-5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤즈이미다졸(실시예 102 참조)(150mg, 0.317mmol)에 염화티오닐(3mL)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 농축하였다. 얻어진 잔사의 테트라히드로푸란(3mL) 현탁액에 프로필아민(56.2mg, 0.951mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 무색 결정의 표제 화합물 81.3mg(50%)을 얻었다.
실시예 124
5-(벤조옥사졸-2-일)-2-(4-메톡시페닐)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(150mg, 0.485mmol)의 디메틸포름아미드(3mL) 용액에 p-아니스알데히드(79.2mg, 0.582mmol), 옥손(179mg, 0.291mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 건조함으로써 담황색 결정의 표제 화합물 184mg(89%)을 얻었다.
실시예 125
5-(벤조옥사졸-2-일)-2-(2-메톡시페닐)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(150mg, 0.485mmol)의 디메틸포름아미드(3mL) 용액에 o-아니스알데히드(79.2mg, 0.582mmol), 옥손(179mg, 0.291mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 건조함으로써 담황색 결정의 표제 화합물 170mg(82%)을 얻었다.
실시예 126
5-(벤조옥사졸-2-일)-2-(2-클로로페닐)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(150mg, 0.485mmol)의 디메틸포름아미드(3mL) 용액에 o-클로로벤즈알데히드(81.8mg, 0.582mmol), 옥손(179mg, 0.291mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 건조함으로써 무색 결정의 표제 화합물 200mg(96%)을 얻었다.
실시예 127
5-(벤조옥사졸-2-일)-2-(3-클로로페닐)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(150mg, 0.485mmol)의 디메틸포름아미드(3mL) 용액에 m-클로로벤즈알데히드(81.8mg, 0.582mmol), 옥손(179mg, 0.291mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 건조함으로써 무색 결정의 표제 화합물 196mg(94%)을 얻었다.
실시예 128
5-(벤조옥사졸-2-일)-2-(4-클로로페닐)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(150mg, 0.485mmol)의 디메틸포름아미드(3mL) 용액에 p-클로로벤즈알데히드(81.8mg, 0.582mmol), 옥손(179mg, 0.291mmol)을 첨가하고, 실온에서 2시간 교반하였다. 반응 종료후, 탄산칼륨 수용액을 첨가하고, 여과, 수세후, 건조함으로써 무색 결정의 표제 화합물 188mg(90%)을 얻었다.
실시예 129
5-(벤조옥사졸-2-일)-1-(2-(피페리딘-1-일)에틸)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
실시예 129-1
N-(2-(피페리딘-1-일)에틸)-4-(벤조옥사졸-2-일)-2-니트로아닐린의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(200mg, 0.775mmol)의 아세토니트릴(5mL) 현탁액에 탄산칼륨(214mg, 1.55mmol), 1-(2-아미노에틸)피페리딘(119mg, 0.93mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 황색 결정의 표제 화합물 266mg(94%)을 얻었다.
실시예 129-2
5-(벤조옥사졸-2-일)-1-(2-(피페리딘-1-일)에틸)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
N-(2-(피페리딘-1-일)에틸)-4-(벤조옥사졸-2-일)-2-니트로아닐린(263mg, 0.718mmol)의 에탄올-아세트산에틸(1:1, 6mL) 용액에 10% 팔라듐탄소(30mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 16시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사의 에탄올(5mL) 용액에 아세토이미드산에틸염산염(103mg, 0.825mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 실온에서 수분 교반하였다. 얻어진 결정을 여과, 물, 디에틸에테르로 세정후, 건조함으로써 담다색 결정의 표제 화합물 141mg(54%)을 얻었다.
실시예 130
5-(벤조옥사졸-2-일)-1-(2-디메틸아미노에틸)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
실시예 130-1
N-(2-디메틸아미노에틸)-4-(벤조옥사졸-2-일)-2-니트로아닐린의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(200mg, 0.775mmol)의 아세토니트릴(5mL) 현탁액에 탄산칼륨(214mg, 1.55mmol), N,N-디메틸에틸렌디아민(82mg, 0.93mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 오렌지색 결정의 표제 화합물 240mg(95%)을 얻었다.
1G3058451NON_E2_FT.als
실시예 130-2
5-(벤조옥사졸-2-일)-1-(2-디메틸아미노에틸)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
N-(2-디메틸아미노에틸)-4-(벤조옥사졸-2-일)-2-니트로아닐린(236mg, 0.723mmol)의 에탄올, 아세트산에틸(1:1, 6mL) 용액에 10% 팔라듐탄소(30mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 16시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축하였다. 얻어진 잔사의 에탄올(5mL) 용액에 아세토이미드산에틸염산염(103mg, 0.825mmol)을 첨가하고, 2시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 실온에서 수분 교반하였다. 얻어진 결정을 여과, 물, 디에틸에테르로 세정후, 건조함으로써 무색 결정의 표제 화합물 83.4mg(36%)을 얻었다.
실시예 131
5-(벤조옥사졸-2-일)-1-(2-(메틸티오)에틸)-2-메틸벤즈이미다졸의 합성
실시예 131-1
N-(2-(메틸티오)에틸)-4-(벤조옥사졸-2-일)-2-니트로아닐린의 합성
2-(4-플루오로-3-니트로페닐)벤조옥사졸(실시예 15-2 참조)(300mg, 1.16mmol)의 아세토니트릴(5mL) 현탁액에 탄산칼륨(321mg, 1.55mmol), 2-(메틸티오)에틸아민(127mg, 1.39mmol)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조함으로써 적색 결정의 표제 화합물 373mg(98%)을 얻었다.
실시예 131-2
5-(벤조옥사졸-2-일)-1-(2-(메틸티오)에틸)-2-메틸벤즈이미다졸의 합성
N-(2-(메틸티오)에틸)-4-(벤조옥사졸-2-일)-2-니트로아닐린(370mg, 1.12mmol)에 철분(188mg, 3.37mmol), 아세트산(5mL)을 첨가하고, 10시간 가열 환류하였다. 반응 용액을 냉각후, 반응 용액을 농축하였다. 얻어진 잔사를 실리카 겔 칼럼 크로마토그래피로 정제함으로써 분홍색 결정의 표제 화합물 305mg(84%)을 얻었다.
실시예 132
5-(벤조옥사졸-2-일)-1-(2-(메틸술포닐)티오에틸)-2-메틸벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-1-(2-(메틸티오)에틸)-2-메틸벤즈이미다졸(실시예 131 참조)(135mg, 0.417mmol)의 클로로포름(3mL) 용액에 m-클로로과벤조산(166mg, 0.96mmol)을 첨가하고, 실온에서 5시간 교반하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 담도색 결정의 표제 화합물 113mg(76%)을 얻었다.
실시예 133
5-(벤조옥사졸-2-일)-2-(2-(메틸티오)에틸)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(테트라히드로피란-4-일)아미노아닐린(실시예 20-2 참조)(200mg, 0.646mmol)의 테트라히드로푸란(5mL) 용액에 3-(메틸티오)프로피오닐클로라이드(98.5mg, 0.711mmol), 트리에틸아민(131mg, 1.29mmol)을 첨가하고, 실온에서 7시간 교반하였다. 반응 종료후, 물을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(0.5mL)을 첨가하고, 3시간 가열 환류하였다. 반응 종료후, 1M 수산화나트륨 수용액을 첨가하고, 아세트산에틸로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 무색 결정의 표제 화합물 170mg(67%)을 얻었다.
실시예 134
5-(벤조옥사졸-2-일)-2-(2-(메틸술포닐)에틸)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-(벤조옥사졸-2-일)-2-(2-(메틸티오)에틸)-1-(테트라히드로피란-4-일)벤즈이미다졸(실시예 133 참조)(130mg, 0.33mmol)의 클로로포름(3mL) 용액에 m-클로로과벤조산(205mg, 0.83mmol)을 첨가하고, 실온에서 6시간 교반하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 실리카 겔 칼럼 크로마토그래피로 정제함으로써 황색 결정의 표제 화합물 105mg(75%)을 얻었다.
실시예 135
5-(5-클로로벤조옥사졸-2-일)-1-n-프로필벤즈이미다졸의 합성
실시예 135-1
5-(5-클로로벤조옥사졸-2-일)-2-n-프로필아미노아닐린의 합성
5-클로로-2-(2-플루오로-니트로벤젠-5-일)벤조옥사졸(실시예 100-1 참조)(1.5g, 5.13mmol)의 아세토니트릴(10mL) 현탁액에 트리에틸아민(779mg, 7.70mmol), 프로필아민(364mg, 6.16mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 에탄올, 테트라히드로푸란(1:2, 15mL) 용액에 10% 팔라듐탄소(200mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 18시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축함으로써 오렌지색 결정의 표제 화합물 1.5g(97%)을 얻었다.
실시예 135-2
5-(5-클로로벤조옥사졸-2-일)-2-n-프로필아미노아닐린(실시예 135-1 참조)(300mg, 0.994mmol)의 오르토포름산트리에틸(5mL) 용액에 p-톨루엔술폰산(10mg)을 첨가하고, 100℃에서 2시간 교반하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 디에틸에테르로 세정함으로써 담황색 결정의 표제 화합물 146mg(47%)을 얻었다.
실시예 136
5-(5-클로로벤조옥사졸-2-일)-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
5-클로로-2-(2-(테트라히드로피란-4-일)아미노아닐린-5-일)벤조옥사졸(실시예 100-2 참조)(300mg, 0.873mmol)의 오르토포름산트리에틸(5mL) 용액에 p-톨루엔술폰산(10mg)을 첨가하고, 100℃에서 2시간 교반하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 디에틸에테르로 세정후, 아세트산에틸로 세정함으로써 다색 결정의 표제 화합물 200mg(65%)을 얻었다.
실시예 137
5-(5-클로로벤조옥사졸-2-일)-2-메틸-1-n-프로필벤즈이미다졸의 합성
5-(5-클로로벤조옥사졸-2-일)-2-n-프로필아미노아닐린(실시예 143-1 참조)(200mg, 0.663mmol)의 에탄올(5mL) 용액에 아세토이미드산에틸염산염(123mg, 0.995mmol)을 첨가하고, 5시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 디에틸에테르로 세정함으로써 녹색 결정의 표제 화합물 155mg(72%)을 얻었다.
실시예 138
5-(5-클로로벤조옥사졸-2-일)-2-메틸-1-(3,3,3-트리플루오로프로필)벤즈이미다졸의 합성
실시예 138-1
5-클로로-2-(2-(3,3,3-트리플루오로프로필)아미노아닐린-5-일)벤조옥사졸의 합성
5-클로로-2-(2-플루오로니트로벤젠-5-일)벤조옥사졸(실시예 100-1 참조)(815mg, 2.79mmol)의 아세토니트릴(10mL) 현탁액에 트리에틸아민(847mg, 8.37mmol), 3,3,3-트리플루오로프로필아민염산염(500mg, 3.34mmol)을 첨가하고, 4시간 가열 환류하였다. 반응 종료후, 실온까지 냉각하고, 물을 첨가하고, 석출한 결정을 여과, 물로 세정후, 건조하였다. 얻어진 결정의 에탄올, 테트라히드로푸란(1:2, 15mL) 용액에 10% 팔라듐탄소(100mg)를 첨가하고, 플라스크 내를 수소로 치환하고, 실온에서 18시간 교반하였다. 반응 종료후, 셀라이트 여과하고, 여과액을 농축함으로써 오렌지색 결정의 표제 화합물 993mg(100%)을 얻었다.
실시예 138-2
5-(5-클로로벤조옥사졸-2-일)-2-메틸-1-(3,3,3-트리플루오로프로필)벤즈이미다졸의 합성
5-클로로-2-(2-(3,3,3-트리플루오로프로필)아미노아닐린-5-일)벤조옥사졸(실시예 138-1 참조)(200mg, 0.562mmol)의 에탄올(5mL) 용액에 아세토이미드산에틸염산염(104mg, 0.843mmol)을 첨가하고, 5시간 가열 환류하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 디에틸에테르로 세정함으로써 담록색 결정의 표제 화합물 170mg(80%)을 얻었다.
실시예 139
5-(5-클로로벤조옥사졸-2-일)-1-(3,3,3-트리플루오로프로필)벤즈이미다졸의 합성
5-클로로-2-(2-(3,3,3-트리플루오로프로필)아미노아닐린-5-일)벤조옥사졸(실시예 138-1 참조)(200mg, 0.562mmol)의 오르토포름산트리에틸(5mL) 용액에 p-톨루엔술폰산(10mg)을 첨가하고, 100℃에서 4시간 교반하였다. 반응 종료후, 포화 탄산수소나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 디에틸에테르로 세정후, 아세트산에틸로 세정함으로써 담황색 결정의 표제 화합물 127mg(62%)을 얻었다.
실시예 140
5-(벤즈이미다졸-2-일)-2-메틸-1-(테트라히드로피란-4-일)벤즈이미다졸의 합성
2-메틸-1-(테트라히드로피란-4-일)벤조이미다졸-5-카르복실산(실시예 4-3 참조)(500mg, 1.86mmol), 톨루엔(10mL)의 현탁액에 염화티오닐(3mL)을 첨가하여 환류 조건에서 1.5시간 교반한 후에 감압 농축함으로써 얻어진 2-메틸-1-(테트라히드로피란-4-일)벤즈이미다졸-5-카르복실산클로라이드염산염(533mg, 1.69mmol)의 테트라히드로푸란(10mL) 용액에 페닐렌디아민(183mg, 1.69mmol), 트리에틸아민(512mg, 5.07mmol)을 첨가하고, 실온에서 7시간 교반하였다. 반응 종료후, 물을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하였다. 얻어진 잔사의 디옥산(5mL) 용액에 메탄술폰산(0.5mL)을 첨가하고, 24시간 가열 환류하였다. 반응 종료후, 1M 수산화나트륨 수용액을 첨가하고, 클로로포름으로 추출하였다. 얻어진 유기층을 무수황산나트륨으로 건조후, 여과, 농축하고, 얻어진 조결정을 아세트산에틸로 세정함으로써 표제 화합물 300mg(54%)을 얻었다.
시험예 1
(화합물 평가용 세포의 제작)
NXF 유전자의 게놈 서열(등록번호 AB054577 및 NC_000085)의 서열 정보에 따라 PCR 프라이머로서 정방향 프라이머:(5'-tccagtatttgagaaaaggagccaggagtctccat-3'), 역방향 프라이머:(5'-ggaggcttcctcttccttgcttcccggtcttttcg-3')를 제작하고, NXF 유전자 프로모터 부분 번역 영역의 상류 약 5kbp로부터 전사 개시점 근방까지를 PCR법으로 단리하였다. 이때, 마우스 게놈 DNA(다카라사 제조) 1μg을 주형으로 하고, PCR 반응의 변성 조건으로서 95℃에서 1분, 어닐링 및 신장 조건으로서 68℃에서 8분의 2스텝 반응을 35회 반복함으로써 PCR 산물을 얻었다. 얻어진 NXF의 프로모터 부분 단편을 동 프로모터의 하류에 루시페라아제 유전자가 배치되도록 pGL3 베이직 벡터(프로메가(Promega)사 제조)의 SmaI 사이트에 도입하고, NXF의 프로모터의 작용으로 루시페라아제 효소가 발현하는 리포터 플라스미드를 제작하였다.
PC12 세포(ATCC로부터 구입)는 RPMI 배지(GIBCO-BRL사 제조)에 5% FCS(GIBCO-BRL사 제조)와 15% 말 혈청(GIBCO-BRL사 제조) 및 1mM 피루브산나트륨(GIBCO-BRL사 제조)을 첨가한 것을 이용하여 37℃, 5%, CO2 존재하에서 배양하였다. 이 PC12 세포 106개에 대하여 상기한 리포터 플라스미드 12μg 및 1μg의 pRC/RSV 벡터(인비트로겐(Invitrogen)사 제조)를 리포펙타민(Lipofectamine)2000 시약(인비트로겐사 제조)을 이용하여 트랜스펙션하고, 트랜스펙션 2일후에 40mg/L의 제네티신 설페이트(Geneticin sulfate)(GIBCO사 제조)를 포함한 배양액에 교환하여 배양을 계속하였다. 수일마다 40mg/L의 제네티신 설페이트(GIBCO사 제조)를 포함한 배양액으로 배지 교환을 계속하면서 약 1개월간 배양을 계속하여 결과로서 얻어진 세포 콜로니를 복수 픽업하였다. 이 중, 40ng/ml의 NGF(와코쥰야쿠사 제조) 존재하에 루시페라아제 활성이 유도되는 하나의 콜로니를 선택하고, 이하의 화합물 활성 평가용 세포로 하였다.
(화합물의 활성 평가)
96웰 플레이트에 8할 컨플루언트가 된 동 세포를 준비하고, 프로메가사 제조 스테디 글로 루시페라아제(Steady Glo luciferase) 어세이 키트를 이용하여 루시페라아제 리포터 어세이를 실시하였다. 화합물을 포함하는 배양액에 의한 처리는 철야(약 16시간)의 조건으로 실시하고, 화합물을 포함하는 배양액을 전부 제거한 후에 남은 세포에 대하여 PBS로 반으로 희석한 스테디 글로 기질액을 첨가하고, 30분 방치후, 그 각각의 발광량을 루미노미터(퍼킨엘머사 제조 엔비전(Envision))로 측정하였다.
평가 대상 화합물의 활성은 200ng/ml의 NGF의 활성의 증강 활성으로서 측정하였다. 대조 실험구로서는 최종 농도 0.1% DMSO만을 포함하는 배양액을 음성 대조구, 포화 농도의 NGF를 포함하는 배양구를 양성 대조구로 하고, 또한 화합물 농도 0에 상당하는 200ng/ml의 NGF에 첨가하여 0.1% DMSO를 포함하는 실험구를 놓고, 그 루시페라아제 활성을 기준으로 하였을 때의 200ng/ml의 NGF에 첨가하여 화합물 용액(DMSO에 용해시키고, DMSO의 최종 농도가 0.1%가 되도록 제조)을 첨가한 실험구의 상대적 루시페라아제 활성을 산출하고, 그것을 화합물에 의한 200ng/ml의 NGF의 활성의 증강 활성으로 하였다.
NGF의 활성의 증강 활성의 시험 결과를 이하의 표에 기재한다.
+:비교적 약한 증강 활성을 나타낸다(10μM에서만 증강 활성을 나타냄)
++:증강 활성을 나타낸다
+++:특히 강한 증강 활성을 나타낸다(1μM에서 NGF200ng/ml의 활성을 2배 이상 증강함)
시험예 2
웅성 8주령 C57BL/6J계 마우스를 12일간 통상 사육한 후에 미리 좌총경, 외총 동맥을 결찰하고, 중대뇌 동맥을 90분간 폐색한 후에 재개통함으로써 중대뇌 동맥 폐색?재개통 모델을 제조하였다. 동 모델에 화합물을 폐색 3시간 후, 24시간 후, 48시간 후에 30mg/kg으로 꼬리 정맥내 투여하였다. 폐색?재개통 3일후에 단두하고, 두골을 소뇌측으로부터 절단하여 뇌를 적출하였다. 적출한 뇌를 부안액(pH 3.5 내지 4.0)에 넣어 고정하였다. 고정한 뇌로부터 관상단을 잘라내고, 잘라낸 후, 탈수, 투철 후, 파라핀 포매하였다. 박절은 브레그마(Bregma) 1.95mm, 브레그마 1.0mm, 브레그마 -1.40mm 및 브레그마 -3.8mm 부근의 4부위로 하였다. 두께 약 6μm의 세그먼트를 제작하고, HE 염색을 행하였다. 경색 부피의 산출은 이하와 같이 실시하였다.
광학 현미경(대물렌즈×1)에 부착한 카메라(MCD-350, 올림푸스가부시키가이샤)를 이용하여 디지털 화상을 저장하였다. 저장한 디지탈 화상을 어도비 포토샵(Adobe Photoshop) 2.0에 1매의 대지(새로운 레이어)에 붙였다. 대지에 붙인 화상을 기초로 하여 화상 해석 장치(윈 루프(Win ROOF) V 5.6 미타니상사가부시키가이샤)로 경색 면적(S, ㎟), 경색측(좌) 면적(㎟) 및 비경색측(우) 면적(MR, ㎟)을 측정하고, 경색측(좌)의 비경색 면적(ML, ㎟)[경색측(좌) 면적(㎟)-경색 면적(㎟)]을 산출하였다.
이하의 식으로 경색 부피(SV, ㎣), 경색측(좌)의 비경색 부피(MLV, ㎣) 및 비경색측(우) 부피(MRV, ㎣)를 산출하였다.
브레그마 1.95mm 부근의 산출 방법
SV=1/3Σ(S1+S2+S1 1 /2×S2 1 /2)
MLV=1/3Σ(ML1+ML2+ML1 1 /2×ML2 1 /2)
MRV=1/3Σ(MR1+MR2+MR1 1 /2×MR2 1 /2)
브레그마 1.0mm, 브레그마 -1.40mm 및 브레그마 -3.8mm 부근의 산출 방법
SV=2/3Σ(Sn+Sn +1+Sn 1 /2×Sn +1 1/2)
MLV=2/3Σ(MLn+MLn +1+MLn 1 /2×MLn +1 1/2)
MRV=2/3Σ(MRn+MRn +1+MRn 1 /2×MRn +1 1/2)(n=1,2,3,4)
실시예 12의 화합물의 시험 결과(경색 부피)를 도 2에 나타낸다. 이와 같이 화합물 투여군에 있어서 경색 부피의 감소를 확인하였다.
시험예 3
스트렙토조토신(Streptozotocin) 유발 당뇨병 래트에 있어서의 좌골 신경에서의 운동신경전달 속도(MNCV)의 잠시의 지연에 대한 화합물의 예방 효과를 검토하였다.
군 구성은 비당뇨병 대조군, 당뇨병 대조군 및 화합물 투여군으로 하였다. 웅성 8주령 위스타르(Slc:Wistar)계 래트를 7 또는 8일간 통상 사육한 후에, 비당뇨병 대조군에서는 pH 4.5의 0.75mmol/L 시트르산 완충 용액을 2ml/kg으로, 당뇨병 대조군 및 화합물 투여군에서는 0.75mmol/L 시트르산 완충 용액으로 스트렙토조토신(화학명:N-(메틸니트로소카르바모일)-α-D-글루코사민, 제조원:시그마(SIGMA))을 20mg/ml로 제조한 용액을 2ml/kg으로 각각 1회 꼬리 정맥내 투여하였다. 그 후 4주 사육한 후에 비당뇨병 대조군 및 당뇨병 대조군에는 주사용수를 5ml/kg으로, 화합물 투여군에는 주사용수로 10mg/ml로 제조한 화합물 용액을 5ml/kg으로 각 군 모두 1일 1회 경구 투여로 4주간 투여하였다. MNCV의 측정은 각 군 모두 3회 실시하였다. 측정 시기는 1회째를 스트렙토조토신 용액 또는 pH 4.5의 0.75mmol/L 시트르산 완충 용액의 투여 전날, 2회째를 스트렙토조토신 용액 또는 pH 4.5의 0.75mmol/L 시트르산 완충 용액 투여의 4주간 후, 3회째를 4주간의 주사용수 또는 화합물 용액 투여의 마지막 날의 다음날에 측정하였다.
실시예 12의 화합물의 시험 결과(운동신경전달 속도)를 도 2(도면 중, STZ는 스트렙토조토신을 나타냄)에 나타낸다. 이와 같이 화합물 투여군에 있어서 용매 대조 투여군과 비교하여 운동신경전달 속도의 회복이 인정되었다.
시험예 4
시험예 1과 마찬가지로 하여 표 2에 나타내는 화합물의 실시예 NGF 활성의 증강 활성을 평가하였다. 결과를 표 2에 나타낸다.
+:비교적 약한 증강 활성을 나타낸다(10μM에서만 증강 활성을 나타냄)
++:증강 활성을 나타낸다
+++:특히 강한 증강 활성을 나타낸다(1μM에서 NGF200ng/ml의 활성을 2배 이상 증강함)
<산업상 이용가능성>
본 발명의 화합물은 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방 등에 유효하다.
<서열 목록 프리텍스트>
서열 번호 1은 정방향 프라이머이다.
서열 번호 2는 역방향 프라이머이다.
SEQUENCE LISTING
<110> Sumitomo Chemical Company, Limited
<120> A medicament of treating or preventing a disease associated with
activity of a nerve growth factor
<130> S23280WO01
<150> JP2009-131333
<151> 2009-05-29
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 35
<212> DNA
<213> Artificial
<220>
<223> forward primer
<400> 1
tccagtattt gagaaaagga gccaggagtc tccat 35
<210> 2
<211> 35
<212> DNA
<213> Artificial
<220>
<223> reverse primer
<400> 2
ggaggcttcc tcttccttgc ttcccggtct tttcg 35
Claims (13)
- 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물.
[식 중, R1은 (1) C3 - 6알킬기, (2) (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-S-, (g) Ra-SO2-, (h) Ra-CO-O-, (i) Ra-CO-NRa-, (j) Ra-NRa-, (k) Ra-NRa-CS-NRa-, (l) 5 내지 6원의 환상기, (m) 카르복시기, (n) 히드록시기, (o) 아미노기, (p) 복소환-카르보닐기, (q) HO-CO-C2H4-CO-NH-(식 중, 각 Ra는 동일 또는 상이하며, 할로겐으로 치환될 수도 있는 C1 -6 알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환된 C1 - 6알킬기, (3) (a) 옥소기 및 (b) C1 - 4알콕시-카르보닐기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 탄소수 3 내지 10의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (4) 할로겐 원자 및 C1 - 4알콕시기로 이루어지는 군으로부터 선택되는 1개 이상의 기로 치환된 방향족 탄화수소환기를 나타내고,
X는 NH, O 또는 S를 나타내고,
Y는 CH 또는 N을 나타내고,
Z는 N 또는 C-R2를 나타내고,
R2는 (1) 수소 원자, (2) (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb-, (e) Rb-S-, (f) Rb-SO2-, (g) Rb-CO-O-, (h) Rb-CO-NRb-, (i) Rb-NRb-, (j) Rb-NRb-Rb-S(O)n-, (k) 페닐기, (l) 5 내지 6원 포화 복소환기, (m) 히드록시기, 및 (n) 아미노기(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 C1 - 6알킬기, C2-6알케닐기 또는 C2 - 6알키닐기, 또는 (3) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 탄소수 5 내지 6의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기를 나타내고,
환 A는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 할로겐 원자로 치환될 수도 있는 알킬기, (i) 니트로기, 및 (j) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환을 나타내고,
환 B는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 아미드기, (i) 에스테르기, (j) 할로겐 원자로 치환될 수도 있는 알킬기, (k) 니트로기, 및 (l) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환을 나타냄] - 제1항에 있어서, Z는 C-R2이고, Y는 N인 화합물.
- 제1항에 있어서, R1은 5 내지 6원 비방향족 복소환기인 화합물.
- 제1항에 있어서, R2는 C1 - 6알킬기인 화합물.
- 제1항에 있어서, Z는 C-R2이고, Y는 N이고, R1은 5 내지 6원 비방향족 복소환기이고, R2는 C1 - 6알킬기인 화합물.
- 제1항의 화합물을 함유하는 의약 조성물.
- 제6항에 있어서, 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제인 의약 조성물.
- 제7항에 있어서, 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제가, 뇌허혈성 질환 또는 당뇨병성 신경장해의 치료 또는 예방제인 의약 조성물.
- 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물을 유효 성분으로서 함유하는 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제.
[식 중, Z는 N 또는 C-R2를 나타내고,
X는 N-R3, O 또는 S를 나타내고,
Y는 C-R4 또는 N을 나타내고,
R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고,
R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고,
R3은 수소 원자 또는 치환기를 나타내고,
R4는 수소 원자 또는 치환기를 나타내고,
환 A는 치환될 수도 있는 벤젠환을 나타내고,
환 B는 치환될 수도 있는 벤젠환을 나타냄] - 제9항에 있어서, 환 A는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 할로겐 원자로 치환될 수도 있는 알킬기, (i) 니트로기, 및 (j) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환이고,
환 B는 (a) 할로겐 원자, (b) 수산기, (c) 카르복시기, (d) 시아노기, (e) 술파모일기, (f) 모노알킬아미드기, (g) 디알킬아미드기, (h) 아미드기, (i) 에스테르기, (j) 할로겐 원자로 치환될 수도 있는 알킬기, (k) 니트로기, 및 (l) 아릴옥시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 벤젠환이고,
Z는 N 또는 C-R2이고,
X는 NH, O 또는 S이고,
Y는 CH 또는 N이고,
R1은 (1) 수소 원자, (2) C1 - 6알킬기, (3) (a) 할로겐 원자, (b) Ra-O-, (c) Ra-O-CO-, (d) Ra-O-CO-NRa-, (e) Ra-O-CO-C2H4-CO-NH-, (f) Ra-S-, (g) Ra-SO2-, (h) Ra-CO-O-, (i) Ra-CO-NRa-, (j) Ra-NRa-, (k) Ra-NRa-CS-NRa-, (l) 5 내지 6원의 환상기, (m) 카르복시기, (n) 히드록시기, (o) 아미노기, (p) 복소환-카르보닐기, (q) HO-CO-C2H4-CO-NH-(식 중, 각 Ra는 동일 또는 상이하며, 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환된 C1 - 6알킬기, (4) (a) 옥소기, (b) C1 - 4알콕시-카르보닐기 및 (c) 히드록시기로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 탄소수 3 내지 10의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (5)할로겐 원자 및 C1 - 4알콕시기로 이루어지는 군으로부터 선택되는 1개 이상의 기로 치환될 수도 있는 방향족 탄화수소환기를 나타내고,
R2는 (1) 수소 원자, (2) (a) 할로겐 원자, (b) Rb-O-, (c) Rb-O-CO-, (d) Rb-O-CO-NRb-, (e) Rb-S-, (f) Rb-SO2-, (g) Rb-CO-O-, (h) Rb-CO-NRb-, (i) Rb-NRb-, (j) Rb-NRb-Rb-S(O)n-, (k) 페닐기, (l) 5 내지 6원 포화 복소환기, (m) 히드록시기, 및 (n) 아미노기(식 중, 각 Rb는 동일 또는 상이하며, 수소 원자 또는 1개 이상의 할로겐으로 치환될 수도 있는 C1 - 6알킬기를 나타내고, n은 0 내지 2의 정수를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 각각 치환될 수도 있는 C1 - 6알킬기, C2 - 6알케닐기 또는 C2 - 6알키닐기, (3) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 탄소수 5 내지 6의 비방향족 환상 탄화수소기 또는 5 내지 6원 비방향족 복소환기, 또는 (4) (a) 할로겐 원자, (b) Rc-O-, (c) Rc-O-CO- 및 (d) Rc-CO-NRc-(식 중, Rc는 동일 또는 상이하며, 수소 원자 또는 C1 - 6알킬기를 나타냄)로 이루어지는 군으로부터 선택되는 1개 이상의 치환기로 치환될 수도 있는 페닐기이거나, 또는 R1 및 R2는 이들이 인접하는 N 및 C와 함께 5 내지 8원 질소 함유 비방향족 복소환을 형성할 수도 있고,
X1은 O 또는 NH이고,
R2Z는 C1 - 6알킬기인 제제. - 제9항에 있어서, 뇌허혈성 질환 또는 당뇨병성 신경장해의 치료 또는 예방제인 제제.
- 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물, 또는 그의 유효량을 포유동물에게 투여하는 것을 특징으로 하는, 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방 방법, 또는 이학 요법 효과의 촉진 방법.
[식 중, Z는 N 또는 C-R2를 나타내고,
X는 N-R3, O 또는 S를 나타내고,
Y는 C-R4 또는 N을 나타내고,
R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고,
R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고,
R3은 수소 원자 또는 치환기를 나타내고,
R4는 수소 원자 또는 치환기를 나타내고,
환 A는 치환될 수도 있는 벤젠환을 나타내고,
환 B는 치환될 수도 있는 벤젠환을 나타냄] - 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제, 또는 이학 요법 효과의 촉진제를 제조하기 위한, 화학식 (I)로 표시되는 화합물, 그의 약학적으로 허용되는 염, 또는 그의 용매화물의 용도.
[식 중, Z는 N 또는 C-R2를 나타내고,
X는 N-R3, O 또는 S를 나타내고,
Y는 C-R4 또는 N을 나타내고,
R1은 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고,
R2는 수소 원자, 치환될 수도 있는 비환상 탄화수소기 또는 치환될 수도 있는 환상기를 나타내고,
R3은 수소 원자 또는 치환기를 나타내고,
R4는 수소 원자 또는 치환기를 나타내고,
환 A는 치환될 수도 있는 벤젠환을 나타내고,
환 B는 치환될 수도 있는 벤젠환을 나타냄]
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009131333 | 2009-05-29 | ||
| JPJP-P-2009-131333 | 2009-05-29 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120093066A true KR20120093066A (ko) | 2012-08-22 |
Family
ID=43222475
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117031347A KR20120093066A (ko) | 2009-05-29 | 2010-05-28 | 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US8829035B2 (ko) |
| EP (1) | EP2436683B1 (ko) |
| JP (1) | JP2011006409A (ko) |
| KR (1) | KR20120093066A (ko) |
| CN (1) | CN102428080A (ko) |
| AU (1) | AU2010253336A1 (ko) |
| BR (1) | BRPI1011961A2 (ko) |
| CA (1) | CA2762620A1 (ko) |
| ES (1) | ES2484169T3 (ko) |
| MX (1) | MX2011012537A (ko) |
| WO (1) | WO2010137349A1 (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9096549B2 (en) | 2013-02-01 | 2015-08-04 | Acetylon Pharmaceuticals, Inc. | Selective HDAC3 inhibitors |
| US9643920B2 (en) * | 2013-09-05 | 2017-05-09 | Mitsubishi Tanabe Pharma Corporation | Crystalline 4-(3S-(1R-(1-napthyl)ethylamino)pyrrolidin-1-yl)phenylacetic acid |
| JP5829741B2 (ja) * | 2013-09-05 | 2015-12-09 | 田辺三菱製薬株式会社 | 新規な結晶性アリールアルキルアミン化合物およびその製造方法 |
| US10035777B2 (en) * | 2014-08-05 | 2018-07-31 | Bristol-Myers Squibb Company | Heterocyclic kinase inhibitors |
| BR112018006197A2 (pt) | 2015-09-28 | 2018-10-09 | Syngenta Participations Ag | derivados heterocíclicos ativos do ponto de vista pesticida com substituintes contendo enxofre |
| CN108299413A (zh) * | 2018-01-22 | 2018-07-20 | 复旦大学 | 一种无金属催化制备2-(胺基苯基)苯并噁唑及其衍生物的方法 |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1063028B (de) * | 1957-09-10 | 1959-08-06 | Wolfen Filmfab Veb | Verfahren zur Sensibilisierung von Halogensilberemulsionen |
| RU1836357C (ru) | 1990-07-23 | 1993-08-23 | Др.Карл Томэ ГмбХ | Производные бензимидазола, их изомеры, смеси изомеров, гидраты или их физиологически переносимые соли, обладающие антагонистическими в отношении ангиотензина свойствами |
| DE4023369A1 (de) | 1990-07-23 | 1992-01-30 | Thomae Gmbh Dr K | Benzimidazole, diese verbindungen enthaltende arzneimittel und verfahren zu ihrer herstellung |
| JPH04308580A (ja) | 1991-04-05 | 1992-10-30 | Sumitomo Chem Co Ltd | ベンズイミダゾール誘導体、その製造法およびそれを有効成分とする農園芸用殺菌剤 |
| GB9418326D0 (en) | 1994-09-12 | 1994-11-02 | Lilly Industries Ltd | Pharmaceutical compounds |
| DE69531476T2 (de) * | 1994-09-12 | 2004-06-09 | Lilly Industries Ltd., Basingstoke | Serotonergische Modulatoren |
| JP2002543165A (ja) | 1999-05-03 | 2002-12-17 | バテル・メモリアル・インスティテュート | エーロゾル化および吸入のための組成物 |
| DE19920936A1 (de) * | 1999-05-07 | 2000-11-09 | Basf Ag | Heterozyklisch substituierte Benzimidazole, deren Herstellung und Anwendung |
| AU5636900A (en) * | 1999-06-30 | 2001-01-31 | Merck & Co., Inc. | Src kinase inhibitor compounds |
| US6919331B2 (en) | 2001-12-10 | 2005-07-19 | Bristol-Myers Squibb Company | Substituted 2-methyl-benzimidazole respiratory syncytial virus antiviral agents |
| CN1623992A (zh) * | 2003-12-03 | 2005-06-08 | 北京师范大学 | 新型非肽类血管紧张素ⅱ受体拮抗剂类药物、它们的制备及应用 |
| US20070249599A1 (en) | 2004-02-25 | 2007-10-25 | Duffy Kevin J | Novel Chemical Compounds |
| JP2007282502A (ja) | 2006-03-24 | 2007-11-01 | Sumitomo Chemical Co Ltd | 細胞変性制御能力の検定方法 |
| JP2007282501A (ja) | 2006-03-24 | 2007-11-01 | Sumitomo Chemical Co Ltd | アポトーシス制御能力の検定方法 |
| US20080004306A1 (en) * | 2006-04-10 | 2008-01-03 | Painceptor Pharma Corporation | Compositions and methods for modulating gated ion channels |
| WO2008073451A2 (en) * | 2006-12-11 | 2008-06-19 | Sirtris Pharmaceuticals, Inc. | Benzoimidazole derivatives as sirtuin (sir) modulating compounds |
| WO2008153701A1 (en) | 2007-05-24 | 2008-12-18 | Schering Corporation | Compounds for inhibiting ksp kinesin activity |
| US8084466B2 (en) * | 2007-12-18 | 2011-12-27 | Janssen Pharmaceutica Nv | Bicyclic heteroaryl-substituted imidazoles as modulators of the histamine H4 receptor |
| JP2010047517A (ja) * | 2008-08-21 | 2010-03-04 | Sumitomo Chemical Co Ltd | 神経栄養因子の活性が関与する疾患の治療または予防剤、およびその製造方法 |
-
2010
- 2010-05-28 AU AU2010253336A patent/AU2010253336A1/en not_active Abandoned
- 2010-05-28 CN CN2010800218228A patent/CN102428080A/zh active Pending
- 2010-05-28 KR KR1020117031347A patent/KR20120093066A/ko not_active Application Discontinuation
- 2010-05-28 JP JP2010123614A patent/JP2011006409A/ja not_active Ceased
- 2010-05-28 CA CA2762620A patent/CA2762620A1/en not_active Abandoned
- 2010-05-28 ES ES10780309.0T patent/ES2484169T3/es active Active
- 2010-05-28 US US13/322,888 patent/US8829035B2/en not_active Expired - Fee Related
- 2010-05-28 MX MX2011012537A patent/MX2011012537A/es not_active Application Discontinuation
- 2010-05-28 WO PCT/JP2010/003622 patent/WO2010137349A1/ja active Application Filing
- 2010-05-28 EP EP10780309.0A patent/EP2436683B1/en active Active
- 2010-05-28 BR BRPI1011961A patent/BRPI1011961A2/pt not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| MX2011012537A (es) | 2011-12-14 |
| US20120115856A1 (en) | 2012-05-10 |
| EP2436683B1 (en) | 2014-05-14 |
| WO2010137349A1 (ja) | 2010-12-02 |
| EP2436683A4 (en) | 2012-05-16 |
| ES2484169T3 (es) | 2014-08-11 |
| AU2010253336A1 (en) | 2011-12-08 |
| CN102428080A (zh) | 2012-04-25 |
| JP2011006409A (ja) | 2011-01-13 |
| BRPI1011961A2 (pt) | 2016-04-26 |
| US8829035B2 (en) | 2014-09-09 |
| EP2436683A1 (en) | 2012-04-04 |
| CA2762620A1 (en) | 2010-12-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2016323293B2 (en) | Hepatitis B core protein modulators | |
| EP2417127B1 (en) | Kinase inhibitors and method of treating cancer with same | |
| JP5143916B2 (ja) | 新規2環性複素環化合物 | |
| US9907800B2 (en) | Kinase inhibitors and method of treating cancer | |
| US9777005B2 (en) | Bicyclic heterocyclic compound containing a substituted pyrrole ring | |
| CN102695546B (zh) | 作为谷氨酰胺酰环化酶抑制剂的杂环衍生物 | |
| KR20120093066A (ko) | 신경영양인자의 활성이 관여하는 질환의 치료 또는 예방제 | |
| TWI434842B (zh) | Azole compounds | |
| KR20080069208A (ko) | mPGES-1 억제제로서 2-(페닐 또는헤테로사이클릭)-1H-페난트로[9,10-d]이미다졸 | |
| JP5621148B2 (ja) | 5−ht2b受容体拮抗活性を有する新規ピラゾール−3−カルボキサミド誘導体 | |
| WO2010137350A1 (ja) | 神経栄養因子の活性が関与する疾患の治療または予防剤 | |
| JPWO2012020780A1 (ja) | 複素環化合物およびその用途 | |
| JP5722892B2 (ja) | 複素環化合物 | |
| JP5667934B2 (ja) | 新規2環性複素環化合物からなる医薬 | |
| US8383647B2 (en) | Quinoline derivative | |
| TW201307294A (zh) | 雜環化合物及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |