KR20120036304A - 산란 매체에서의 향상된 확산 발광 이미징 또는 단층촬영을 위한 시스템, 방법, 및 발광 마커 - Google Patents
산란 매체에서의 향상된 확산 발광 이미징 또는 단층촬영을 위한 시스템, 방법, 및 발광 마커 Download PDFInfo
- Publication number
- KR20120036304A KR20120036304A KR1020117028821A KR20117028821A KR20120036304A KR 20120036304 A KR20120036304 A KR 20120036304A KR 1020117028821 A KR1020117028821 A KR 1020117028821A KR 20117028821 A KR20117028821 A KR 20117028821A KR 20120036304 A KR20120036304 A KR 20120036304A
- Authority
- KR
- South Korea
- Prior art keywords
- luminescent
- marker
- imaging
- light
- light source
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0062—Arrangements for scanning
- A61B5/0068—Confocal scanning
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0073—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence by tomography, i.e. reconstruction of 3D images from 2D projections
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/05—Detecting, measuring or recording for diagnosis by means of electric currents or magnetic fields; Measuring using microwaves or radio waves
- A61B5/055—Detecting, measuring or recording for diagnosis by means of electric currents or magnetic fields; Measuring using microwaves or radio waves involving electronic [EMR] or nuclear [NMR] magnetic resonance, e.g. magnetic resonance imaging
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
- G01N21/4795—Scattering, i.e. diffuse reflection spatially resolved investigating of object in scattering medium
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Surgery (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Medical Informatics (AREA)
- Molecular Biology (AREA)
- Animal Behavior & Ethology (AREA)
- Radiology & Medical Imaging (AREA)
- Optics & Photonics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- High Energy & Nuclear Physics (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Magnetic Resonance Imaging Apparatus (AREA)
- Analysing Materials By The Use Of Radiation (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
- Endoscopes (AREA)
Abstract
산란 매체에서 관심 영역의 발광 분자 이미징 또는 단층촬영을 위한 방법 및 시스템이 공개된다. 시스템은 산란 매체에 배열된 비선형 발광 마커 물질을 포함한다. 이로써 이미징 또는 단층촬영의 콘트라스트 및 해상도가 향상된다. 비선형 마커는 예를 들어 조명 파장의 들어오는 빛을 업컨버팅하도록 구성된다. 마커의 비선형 파워 의존성은 동시에 둘 이상의 여기 빔으로 얻어진 이미지를 이용함으로써 이미징의 추가적인 향상을 가능하게 한다.
Description
본 발명은 일반적으로 흡수 및 산란 매체의 광발광(photoluminescence) 이미징 또는 광발광 단층촬영(tomography)의 분야와 산란 매체의 광발광 이미징 또는 산란 매체의 단층촬영을 위한 광발광 마커에 관한 것이다.
광발광 이미징(줄여서, 발광 이미징) 또는 광발광 단층촬영(줄여서, 발광 단층촬영)을 위한 관심의 대상인 산란 매체의 예는 생체 조직이다. 조직 광학(tissue optics)은 이러한 조직과 빛의 상호작용을 연구하는데 전념하는 분야이다. 지난 수십 년에 걸쳐서, 이 분야는 급속하게 성장해 왔다. 빛-조직(light-tissue) 상호작용에 대한 지식이 증가함에 따라, 진단 도구로서 조직 광학을 적용하는 것에 대한 관심 또한 나타났고, 기초 연구로부터 그 결실을 거두고 있다.
본 공개가 부분적으로 다루는 조직 광학의 한 분야는 광발광 단층촬영을 포함하는 광발광 이미징인데, 이는 인간 또는 동물의 생체 내(in-vivo) 이미징을 위한 비침습적(non-invasive) 접근법이다. 이러한 이미징 접근법들은 발광 기반이고, 발광 생체 마커의 여기(excitation)를 위해서 외부 광원을 요한다.
광발광은 물질이 광자를 흡수하고 이후 광자를 방출하는 과정이다. 발광의 특정 형태가 형광(fluorescence)인데, 여기서는 전형적으로 방출된 광자가 조명을 위해 사용된 것보다 더 낮은 에너지로 이루어진다. 그래서, 형광에 있어서, 형광 파장은 조명광의 파장을 참조하여 더 긴 파장으로 스토크스 천이(Stokes shifted)된다.
형광 이미징은 알려져 있고, 예를 들어 일정 기간의 시간에 걸쳐 작은 동물들에게서 이들을 희생시킬 필요 없이 약으로부터의 생체 반응을 연구하기 위해서 이용될 수 있다.
Shimomura, Chalfie, 및 Tsien은 매우 중요한 형광 마커가 된 녹색 형광 단백질을 발견하고 개발한 것에 대해서 2008년에 노벨상을 수상하였다.
하지만, 그때까지, 흡수 및 산란 매체에서 확산 발광(diffuse luminescent) 이미징 또는 확산 발광 단층촬영을 위한 형광 분자 이미징 및 단층촬영 시스템은 많은 문제점이 있었다. 예컨대, 이들은 이미징 결과를 기초로 한 진단 업무를 어렵게 하는 낮은 해상도 또는 콘트라스트를 가진다. 그래서, 예컨대 제공된 2차원 또는 3차원 이미지의 향상된 콘트라스트 및/또는 해상도에 의해서 향상된 이미지 품질을 갖는 시스템에 대한 필요가 존재한다.
나아가, 이러한 시스템들은 항상 존재하는 내생적(endogenous) 조직 자가형광(autofluorescence)에 민감해서 측정 결과를 악화시킨다. 형광 생체 마커로부터의 형광 신호와 백그라운드 자가형광은 종종 오버랩(overlap)되기 때문에, 이들을 분리하는 것은 어렵고 종종 신뢰할 수 있게 가능하지는 않다.
자가형광은 스토크스 천이된 형광물질(fluorophore)을 사용할 때 형광 신호를 감추고, 신호-대-백그라운드(signal-to-background) 민감도를 효과적으로 제한한다.
따라서, 특히 향상된 콘트라스트 및/또는 향상된 이미징 해상도에 의해서 증가된 유효성을 허용하는 향상된 확산 발광 이미징 또는 발광 단층촬영 시스템, 방법, 또는 발광 이미징 또는 발광 단층촬영을 위한 발광 마커에 대한 필요가 존재한다.
따라서, 첨부된 특허 청구 범위에 따른 시스템, 방법, 및 이용을 제공함으로써, 본 발명의 실시 예들은 상술한 바와 같은 해당 기술분야에서의 하나 이상의 결함들, 단점들, 또는 문제들을 단일하게 또는 임의의 조합으로 완화, 경감, 또는 제거하는 것을 목적으로 한다.
본 공개에서, 새로운 유형의 발광 마커, 즉 비선형 마커를 가지고 종래의 스토크스 천이된 형광물질을 교체함으로써 상기 목적 및 향상이 달성된다는 것을 보인다.
본 발명의 제1 관점에 따르면, 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법이 제공된다. 영역은 마커 위치에서 산란 매체 내에 배열된 적어도 하나의 발광 마커를 포함하고, 발광 마커는 비선형 발광 마커이다. 방법은, 하나 이상의 광원에 의하여 적어도 하나의 광원 위치로부터 여기 볼륨으로 방출된 여기광에 의해서 발광 마커를 여기시키는 단계; 발광 빛 검출 위치에서 검출기에 의해 여기광에 기인하여 발광 마커로부터 발광을 검출하는 단계; 광원 위치와 마커 위치 사이에서 움직임을 제공하는 단계; 및 마커 위치와 관련하여 광원 위치 및 여기광 강도에서 검출된 발광의 비선형 의존성을 기초로 하여 발광 마커를 이미징하는 단계를 포함한다.
본 발명의 제2 관점에 따르면, 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템이 제공된다. 시스템은 산란 매체의 발광 분자 이미징에서 사용하기 위한 발광 마커를 포함하고, 발광 마커는 산란 매체 내에 배열된 비선형 발광 마커이다. 시스템은 하나 이상의 광원에 의해 여기 볼륨으로 방출된 여기광에 의하여 상기 발광 마커를 여기시키기 위한 적어도 하나의 광원 위치에 의해 배치된 하나 이상의 광원을 포함한다. 시스템은 여기광에 기인하여 발광 마커로부터 발광을 검출하는 발광 빛 검출 위치에서의 검출기를 포함하고, 발광 분자 이미징은 마커 위치와 관련하여 광원 위치 및 여기광 강도에서 검출된 발광의 비선형 의존성을 기초로 한 발광 마커를 이미징하는 것을 포함한다.
실시 예들에서, 발광 마커는 조명 파장의 들어오는 빛을 업컨버팅하도록 구성된 비선형 발광 마커들의 그룹으로 이루어지고, 상기 발광 마커가 상기 들어오는 빛으로 조명될 때 상기 조명 파장보다 더 짧은 발광 파장에서 발광이 발생한다.
발광 마커는 특정 실시 예들에서 생체 발광 마커이다.
본 발명의 다른 관점에 따르면, 본 발명의 제2 관점에 따른 시스템의 이용이 태블릿의 발광 이미징 또는 발광 단층촬영을 위해 제공된다.
본 발명의 다른 관점에 따르면, 본 발명의 제2 관점에 따른 시스템의 이용이 작은 동물의 생체 내 또는 생체 외 발광 이미징 또는 발광 단층촬영을 위해 제공된다.
본 발명의 다른 관점에 따르면, 본 발명의 제2 관점에 따른 시스템의 이용이 상기 발광 이미징 또는 단층촬영에 의해 암 진단과 같은 기능적 진단을 위해 제공된다.
일 실시 예에서, 비선형 마커가 다른 이미징 방식을 위한 이미징 콘트라스트제에 부착된다. 예를 들어, 비선형 마커는 자기 공명 이미징(MRI), 엑스레이(X-Ray) 등과 같은 종래의 이미징 방식을 가진 이미징을 위한 콘트라스트제에 부착된다. 구체적인 실시 예에서, 비선형 마커는 상자성을 갖는, 유기 가돌리늄 복합체 또는 가돌리늄 화합물에 부착된다.
본 발명의 추가적 실시 예들은 종속 청구항에서 정의되고, 본 발명의 제2 및 이어지는 관점들은 제1 관점에 대해서 필요한 부분만 약간 수정한 것이다.
일부 실시 예들은 확산 발광 분자 이미징에서 그리고 형광 분자 단층촬영에서 증가된 해상도를 위해 제공된다.
일부 실시 예들은 태블릿에서 성분의 분포를 결정하기 위해 제공된다. 예를 들어, 비선형 발광 마커 또는 형광물질은 태블릿에서 유효 성분(active ingredient)에 부착될 수 있다. 그래서, 유효 성분의 공간적 분포가 유리하게 결정될 수 있다.
일부 실시 예들은 비선형 마커가 MRI 콘트라스트제로서 사용될 때 의료 자기 공명 이미징에서 강화된 콘트라스트를 제공한다. 동시에, 발광 이미징 또는 단층촬영이 만들어질 수 있고, 생체 내 하나의 동일한 관심 영역의 고해상도 MRI와 결합된 기능적 진단 정보를 제공한다.
본 명세서에서 사용된 용어 "포함한다/포함하는(comprises/comprising)"은 상술한 특징, 정수, 단계, 또는 구성요소의 존재를 특정하기 위해서 취해진 것이며, 하나 이상의 다른 특징, 정수, 단계, 구성요소, 또는 이들의 그룹의 존재 또는 추가를 배제하지 않는다.
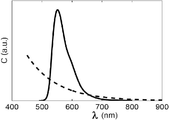
도 1은 자가형광 백그라운드를 가진 전형적인 신호를 도시하는 그래프이고;
도 1a는 자블론스키(Jablonski) 다이어그램이고;
도 1b는 일부 조직 형광물질로부터의 형광 스펙트럼을 도시하는 그래프이고;
도 2의 a) 내지 c)는 a)방사적 및 비방사적 에너지 전달; b)공명 및 비공명 에너지 전달; c)ETU(좌) 및 ESA(우) 업컨버전의 비교의 개략도이고;
도 3의 a) 및 b)는 업컨버전 형광에서 a)단일 여기 형광 및 b) 복수 여기의 개략도이고;
도 4a는 업컨버전 나노결정의 Yb3 +-Tm3 + 이온 쌍에서의 업컨버전 프로세스의 개략도이고;
도 4b는 도 4a의 업컨버전 나노결정에 대한 방출 스펙트럼을 도시하는 그래프이고;
도 5의 (a), (b), 및 (c)는 평면 이미징 구현, 즉 (a)형광물질 이미징을 위해 사용된 셋업(에피-형광); (b)투과조명에서 형광물질 재구성을 위해 사용된 셋업; 및 (c)형광 확산 광학 단층촬영을 위한 다른 셋업이고;
도 6의 (a) 내지 (d)는 다양한 형광 강도 분포를 도시하는 이미지 및 그래프이고;
도 7의 (a) 내지 (c)는 선형 및 비선형 형광물질을 가진 형광 이미징 사이에서 차이의 개략도이고;
도 8은 산란 매체에서 여기광 및 방출광 전파의 개략도이고;
도 9는 선형 및 비선형 형광물질 사이에서 선형 및 비선형 형광물질 사이에서 단층촬영 재구성의 비교를 도시하고;
도 10a 및 10b는 선형(linear)(10a) 및 이차(quadratic)(10b) 파워(power) 의존성에 대한 민감도 프로파일을 도시하고;
도 11은 형광 단층촬영 문제의 개략도이다.
도 12는 단일 빔 여기 및 결합된 단일 빔 여기와 이중 빔 여기에 대한 가중치 행렬 W의 정규화된 특이-값 분포를 도시하는 그래프이다.
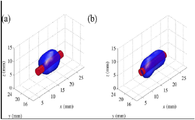
도 13의 (a) 및 (b)는 (a)단일 빔 이미지만을 이용하여, 그리고 (b)단일 빔 및 이중 빔 이미지 둘 다를 이용하여, 업컨버팅 나노입자의 3차원 재구성이다.
도 14의 (a) 내지 (f)는 (14의 (a) 내지 (c))단일 빔 이미지만을 이용하여, 그리고, (14의 (d) 내지 (f))단일 빔 및 이중 빔 이미지 둘 다를 이용하여 재구성하기 위해 재구성된 관련 나노입자들의 단면 슬라이스를 도시한다.
도 15의 (a) 내지 (f)는 (15의 (a) 내지 (c))단일 빔 이미지만을 이용하여, 그리고, (15의 (d) 내지 (f))단일 빔 및 이중 빔 이미지 둘 다를 이용하여 재구성하기 위해 재구성된 관련 로다민(Rhodamine) 6G 분포의 단면 슬라이스를 도시한다.
도 16의 (a) 내지 (c)는 a)선형의 종래 형광 염료, 및 b)업컨버팅 나노입자, 및 c)a)와 b)에서 이미지의 단면을 도시한다.
도 1a는 자블론스키(Jablonski) 다이어그램이고;
도 1b는 일부 조직 형광물질로부터의 형광 스펙트럼을 도시하는 그래프이고;
도 2의 a) 내지 c)는 a)방사적 및 비방사적 에너지 전달; b)공명 및 비공명 에너지 전달; c)ETU(좌) 및 ESA(우) 업컨버전의 비교의 개략도이고;
도 3의 a) 및 b)는 업컨버전 형광에서 a)단일 여기 형광 및 b) 복수 여기의 개략도이고;
도 4a는 업컨버전 나노결정의 Yb3 +-Tm3 + 이온 쌍에서의 업컨버전 프로세스의 개략도이고;
도 4b는 도 4a의 업컨버전 나노결정에 대한 방출 스펙트럼을 도시하는 그래프이고;
도 5의 (a), (b), 및 (c)는 평면 이미징 구현, 즉 (a)형광물질 이미징을 위해 사용된 셋업(에피-형광); (b)투과조명에서 형광물질 재구성을 위해 사용된 셋업; 및 (c)형광 확산 광학 단층촬영을 위한 다른 셋업이고;
도 6의 (a) 내지 (d)는 다양한 형광 강도 분포를 도시하는 이미지 및 그래프이고;
도 7의 (a) 내지 (c)는 선형 및 비선형 형광물질을 가진 형광 이미징 사이에서 차이의 개략도이고;
도 8은 산란 매체에서 여기광 및 방출광 전파의 개략도이고;
도 9는 선형 및 비선형 형광물질 사이에서 선형 및 비선형 형광물질 사이에서 단층촬영 재구성의 비교를 도시하고;
도 10a 및 10b는 선형(linear)(10a) 및 이차(quadratic)(10b) 파워(power) 의존성에 대한 민감도 프로파일을 도시하고;
도 11은 형광 단층촬영 문제의 개략도이다.
도 12는 단일 빔 여기 및 결합된 단일 빔 여기와 이중 빔 여기에 대한 가중치 행렬 W의 정규화된 특이-값 분포를 도시하는 그래프이다.
도 13의 (a) 및 (b)는 (a)단일 빔 이미지만을 이용하여, 그리고 (b)단일 빔 및 이중 빔 이미지 둘 다를 이용하여, 업컨버팅 나노입자의 3차원 재구성이다.
도 14의 (a) 내지 (f)는 (14의 (a) 내지 (c))단일 빔 이미지만을 이용하여, 그리고, (14의 (d) 내지 (f))단일 빔 및 이중 빔 이미지 둘 다를 이용하여 재구성하기 위해 재구성된 관련 나노입자들의 단면 슬라이스를 도시한다.
도 15의 (a) 내지 (f)는 (15의 (a) 내지 (c))단일 빔 이미지만을 이용하여, 그리고, (15의 (d) 내지 (f))단일 빔 및 이중 빔 이미지 둘 다를 이용하여 재구성하기 위해 재구성된 관련 로다민(Rhodamine) 6G 분포의 단면 슬라이스를 도시한다.
도 16의 (a) 내지 (c)는 a)선형의 종래 형광 염료, 및 b)업컨버팅 나노입자, 및 c)a)와 b)에서 이미지의 단면을 도시한다.
본 발명의 실시 예들에서 가능한 이러한 또는 다른 관점, 특징, 및 이점은 첨부 도면을 참조하여 본 발명의 실시 예들에 관한 이하의 설명으로부터 명백하고 분명하게 될 것이다.
본 공개의 일부 실시 예들은 확산 발광 이미징 및 단층촬영을 다루는 상술한 조직 광학 내의 한 영역에 적용된다. 대부분의 가시(visible) 파장에 대해서, 빛은 조직(tissue)안으로 수 밀리미터보다 많이 투과하지 않는다. 하지만, 진단 윈도우( diagnostic window)(파장 600 내지 1600 nm)에서, 빛 투과는 이미징이 수 센티미터까지 통과하는 것을 허용하기에 충분하다. 이것은 조직에서 깊은 이미징 형광 콘트라스트제(contrast agent)의 가능성을 연다. 확산적으로 산란된 빛의 형광 이미지는 바이오메디컬(biomedical) 어플리케이션에서 주목할만한 중요성을 가진다.
형광 단층촬영은 인간 또는 동물 내부에서 콘트라스트제 분포의 3차원 재구성(reconstruction)을 기초로 한다. 3차원 재구성은 형광 이미징 기술을 기초로 한다.
상술한 바와 같이, 확산적으로 산란된 빛의 단층촬영 및 형광 이미징 영역은 오랫동안 내생적 조직 자가형광에 의해서 불리하게 영향을 받아왔고, 좋지 못한 콘트라스트 및 해상도를 겪어왔다. 자가형광은 스토크스 천이된(Stokes shifted) 형광물질을 이용할 때 콘트라스트제로부터 신호를 감추고, 신호-대-백그라운드 민감도를 유효하게 제한한다.
조직 팬텀(phantom) 상에서의 실험은 실제 그대로의 광학 속성들을 가지고 수행되었으며, 자가형광이 없는 신호를 검출하는 것이 가능하다는 것을 보였다. 또한, 3차원 단층촬영 재구성을 위해 나노결정을 이용하는 것이 공개된다.
그래서, 업컨버팅(upconverting) 나노결정과 같은 비선형(non-linear) 마커가 조직 이미징 목적을 위한 중요한 생체 마커로 보인다.
형광 이미징 또는 단층촬영의 바이오메디컬 이미징 내의 여러 어플리케이션들이 이하에서 설명된다. 이것은 산란 매체에 대한 특정한 경우이다.
다른 어플리케이션들이 비생물학적(non-biological) 영역에서 제공된다. 이러한 영역의 예가 물질 테스트를 위한 발광 이미징 또는 단층촬영이고, 비선형 마커를 가진 매체를 흘려서 통과시키는 액체 또는 기체를 위한 필터, 태블릿의 품질 관리 등을 포함한다.
본 발명의 실시 예 및 본 어플리케이션의 내용에서, 형광 이미징은 발광의 이미징의 모든 유형을 나타낸다. 또한, 논의된 임의의 이미징 또는 단층촬영은 고산란(highly scattering) 매체에서, 검출된 빛의 확산성(diffuse character) 때문에 전형적으로 빈약한 해상도를 제공한다. 본 발명의 실시 예들은 발광 단층촬영을 포함하여 이러한 발광 이미징의 콘트라스트 및 해상도를 유리하게 향상시킨다.
본 발명의 구체적인 실시 예가 이제 첨부 도면들을 참조로 설명될 것이다. 하지만, 본 발명은 많은 다른 형태로 구체화될 수 있으며, 본 명세서에서 제시하는 실시 예들에 한정되지 않는 것으로 이해되어야 하며; 오히려 이 실시 예들은 본 공개가 완전하고 철저하게 되도록 하기 위하여 제공되는 것이고, 당업자에게 본 발명의 범위를 충분히 전달할 것이다. 첨부 도면에서 도시된 실시 예들의 상세한 설명에서 사용된 용어는 본 발명을 제한하고자 의도된 것이 아니다. 도면들에서, 동일한 참조번호는 동일한 구성요소를 지칭한다.
이하에서, 형광 이미징 및 조직 광학의 기초에 대한 개요가 제공되고, 업컨버팅 나노결정과 같은 비선형 마커 및 업컨버팅 나노결정을 이용한 형광 광학 단층촬영에 대한 설명이 이어진다. 게다가, 실험 및 시뮬레이션의 결과가 공개된다. 이하의 글에서, 형광 이미징은 발광의 이미징의 모든 유형을 나타낸다. 또한, 논의된 임의의 이미징 또는 단층촬영는 고산란 매체에서, 검출된 빛의 확산성 때문에 빈약한 해상도를 제공한다.
형광 콘트라스트(
Fluorescence
contrast
)
형광 분자(형광물질)로부터의 광방출 프로세스는 자블론스키(Jablonski) 다이어그램에서 설명될 수 있고, 도 1a를 참조한다. 도 1a는 분자의 여기된(excited) 상태로부터 다양한 감쇠 경로를 보이는 자블론스키 다이어그램을 도시한다. 도면의 더 낮은 부분에서, 에탄올의 헤마토포르피린(haematoporphyrin)으로부터의 형광 스펙트럼이 도시된다.
약어는: Sn은 싱글릿(singlet) 상태; Tn은 트리플릿(triplet) 상태; Abs는 흡수; Sc는 산란; IC는 내부 변환(internal conversion); F는 형광; IX는 인터시스템 교차(intersystem crossing); P는 인광(phosphorescence); A는 다른 분자들로의 전달이다. 또한, 일부 프로세스들에 대한 근사적 시간-척도는 도 1a의 오른쪽 아래에서 수명(lifetime)(LT)으로 보이고, τ로도 표시한다.
들어오는 광자가 분자 내에서 두 에너지 밴드들 사이의 갭에 상응하는 에너지를 가진다면, 그것은 흡수될 수 있다. 이렇게 함으로써, 광자 에너지는 더 높은 에너지 밴드로 분자를 여기(excitation)하기 위해서 이용될 수 있다. 여기된 상태는 불안정하고, 분자는 바닥 상태로 돌아갈 것이다. 탈여기(deexcitation)는 도 1a에서 도시된 바와 같이 많은 상이한 경로들을 따라갈 수 있다. 라벨이 붙은 레벨들은 원자들의 에너지 레벨에 대응하는 전자적 레벨들이다. S0, S1 등은 전자 스핀 양자수의 합이 영(zero)인 싱글릿 상태이고, T0, T1 등은 하나의 전자 스핀이 부호를 바꾼 트리플릿 상태이다. 많은 분자들에 대해서 레벨들 사이의 간격은 매우 작고, 이 상태들은 분자 상호작용에 기인하여 오버랩된다. 광자가 분자에 의해서 흡수될 때, 여기된 전자적 레벨에서 가장 낮은 진동 레벨까지 분자를 여기할 필요없이, 더 높은 진동 상태까지 분자를 여기할 것이다. 이것은 빠른(10-15 s) 흡수 프로세스 동안 원자는 진동 운동에서 위치를 바꾸지 않는다고 하는 프랭크-콘돈(Franck-Condon) 원리의 결과이다. 분자가 고에너지(high energy) 레벨로 여기될 때, S1의 가장 낮은 회전-진동 상태로의 빠른 완화(relaxation)가 뒤따를 것이다. 이러한 완화의 짧은 시간 척도(10-12 s)는 회전 진동 레벨의 높은 밀도에 기인한다. S1으로부터 분자는 비복사(radiationless) 운동 상호작용을 통해서 상태 S0로 진행할 수 있다.
이와 달리, 탈여기는 광자의 방출을 초래할 수 있고, 이 프로세스는 형광(fluorescence)이라고 불린다. 전이(transition)는 S0의 회전-진동 상태들 중의 임의의 하나에서 종결될 수 있기 때문에, 상이한 광자들의 에너지는 뚜렷한 값을 가지는 것이 아니라 넓은 분포를 가진다. 그래서, 분자로부터의 형광 스펙트럼은 넓을 것이고, 매우 빈번하게 임의의 두드러지는 구조를 가지지 않을 것이다. 스펙트럼의 형태는 더 낮은 레벨(S0)로의 전이의 가능성을 반영할 것이다. 도 1의 더 낮은 부분에서, 종양 마커 또는 감광제이며 이후에 설명될 헤마토포르피린의 형광 스펙트럼이 도시된다. 일단 경로 흡수-IC-형광(absorption-IC-fluorescence)가 완성되면, 분자는 원래 상태 및 구조로 돌아간다. 그래서, 형광 프로세스는 비파괴적이고 가역적이며, 예컨대 의료 진단에서 이점이 있다.
스핀 금지(spin forbidden)라도, 트리플릿 시스템으로의 전이가 발생할 수 있다. 또한, 트리플릿 시스템에서, 가장 낮은 여기된 상태로의 빠른 내부 변환이 발생할 것이다. S0로의 전이는 스핀 금지이기 때문에, 이것은 전이 S1 S0 보다 훨씬 더 낮은 비율(t 10-6-1 s)로 진행될 것이다. 이 프로세스는 인광(phosphorescence)이라고 불리며, 실온에서는 자주 관찰되는 경우가 적다.
여러 다른 경로들이 다른 분자들로의 에너지 전달, 전자 전달, 엑시머(excimer) 형성, 및 분자 분리를 이끄는 밀어내는 상태로의 여기와 같은 여기된 분자에 대해서 가능하다. 이 프로세스는 도 1a에서 A로 표시된다.
많은 형광 분자들은 공통된 하나의 중요한 특징을 가지는데, 이것은 복합(conjugated) 이중 결합의 깨지지 않는 체인이며, 즉 모든 2차 결합은 이중 결합이다. 헤마토포르피린의 구조가 이것에 대한 예이다(도시되지 않음). 이것은 종양의 광역학 치료 및 형광 진단을 위해서 사용되는 형광 분자이다.
중요한 조직 형광물질들의 형광 속성의 지식에 있어서, 미지 시료의 형광 기록은 각각의 형광물질의 상대적 기여를 산출할 것이다. 만일 형광 특성이 격리된(isolated) 형광물질들에 대해서 동일하다면 형광물질들의 농도가 추정될 수 있다. 하지만, 이것이 항상 그러한 것은 아니다. 오히려, 형광 속성은 극성과 pH 같은 환경적 요소에 의존적이다.
형광의 다른 중요한 관점은 여기된 상태에서 뿐 아니라 바닥 상태에서의 빠른 완화이다. 분자는 완화에 의해서 그 여기 에너지의 일부를 느슨하게 한다. 또한, 수소 결합과 같은 특정 상호작용 및 형광물질 둘레로 용해되는 쌍극자의 재분배는 완화 과정에 기여한다. 그래서, 형광 광자의 에너지는 여기 에너지보다 더 낮고, 또는 다시 말해 형광 파장은 여기 파장보다 길다. 이것은 스토크스 천이라고 불리며 서로 다른 분자환경들에 대해서 상이하다. 그러므로, 분자 환경의 일반적인 지식이 적절한 형광 진단을 위해서 요구된다.
형광 이미징(
Fluorescence
imaging
)
포인트 모니터링 장치들과 대조적으로, 형광 이미징 시스템은 많은 수의 포인트들에서 형광 신호를 검출할 수 있다. 그래서, 관심 영역의 2차원 이미지가 생성된다. 전형적인 시스템은 조절가능한 필터와 함께 카메라를 포함하고, 도 5a를 참조한다. 투과조명(transillumination)에서의 유사한 셋업이 도 5b에서 개략적으로 도시된다. 조절가능한 필터를 가지고, 원하는 검출 파장이 용이하게 선택될 수 있고, 약 20 nm 넓이의 스펙트럼 해상도가 달성될 수 있다.
비선형 형광물질을 가지고 하는 형광
이미징
특히 관심이 있는 형광 이미징의 세부 분야가 본 발명의 실시 예들의 비선형 형광물질을 이용하는 것의 분야이다. 본 어플리케이션의 내용에서, "비선형 마커(non-linear marker)"는 발광 마커이고, 마커의 발광(L)은 여기광(excitation light)(E)의 빛의 흐름에 선형적으로 의존하는 것이 아니다. 그래서, 비선형 마커는: L=k*E^x 에 따른 발광을 가지고, 여기서, x>1이고, k는 양의 상수이다. 비선형 마커는 또한 다음 관계에 따른 발광을 가진다: L=k*E^x + b, L=k(E)*E^x + b, L=k(E)*E^x + b(E), 또는 L=k*E^x + b(E), 여기서, k 및 b는 여기광(E), 즉 k(E) 및 b(E)의 국부적인 장(local field)에 의존하는 또는 일정한 물질 상수이다. 그래서, 종래의 발광 이미징과 비교하여, 비선형 마커(또는 형광물질)는 여기를 위한 하나 이상의 광자를 요할 수 있다. 이것은 여기 볼륨(excitation volume)을 대폭 감소시키고, 더욱 국부적인 여기 포인트를 제공한다. 이러한 방식으로, 발광 이미징의 해상도 및 콘트라스트는 이하에서 보이는 바와 같이 향상된다. 더 상세하게는, 흡수 및 산란 매체의 발광 이미징에서 확산광(diffuse light)의 해상도 및 콘트라스트가 향상된다. 본 발명의 실시 예들은 이러한 효과의 이점을 가진다.
선형 및 비선형 형광물질을 가진 형광 이미징 사이에서의 차이를 도시하기 위해서, 도 7의 (a) 내지 (c)를 참조한다. 도 7의 (a)는 그레이 스케일(gray-scale)로 선형 형광 이미지를 도시한다. 각각의 픽셀(pixel)(705)은 그리드 패턴(grid pattern)(701)에서 하나의 여기 포인트(excitation point)(704)에 대응한다. 도 7의 (b)는 이광자(two-photon) 비선형 형광물질, 즉 비선형 발광 마커(702)를 가지고 획득된 이미지를 도시한다. 도 7의 (c)에서, 형광물질(702)은 (더 큰 원으로) 빨갛게 도시되고(703), 검은 점들(704)은 그리드 패턴(701)에서 여기의 포인트들을 표시한다. 원(703)은 그리드 패턴(701) 상에서 마커(702)의 투사된(projected) 이미지에 대응한다. 여기 포인트(704)는 발광 마커(702)를 스캐닝할 때 광원, 즉 레이저(503)의 위치에 대응한다. 비선형 형광물질을 이용하는 것은 형광 이미지의 해상도 및 콘트라스트를 증가시킨다는 것이 분명하게 보여진다. 이것은 후술하는 도 9와 도 10a 및 10b에 의해서도 뒷받침된다. 특히, 광원이 그리드 패턴(701) 상에서 마커(702) 또는 마커(702)의 대응하는 투사된 이미지(703)에 근접한, 도 7의 (c)에서 706과 같이 표시된 위치에 있는 경우에, 여기 볼륨은 충분히 작고 비선형 마커를 위한 광원 위치(706)로 국부화되어, 어떠한 발광도 도 7의 (b)에서의 해당 픽셀(708)에서 검출되지 않는다. 도 7의 (a)에서의 선형 형광 이미지에 대해서, 해당 픽셀(707)은 산란 매체에서 증가된 여기 볼륨에 기인하여 발광을 받는다. 이광자 비선형 의존성은 여기 볼륨의 좁은(narrow) 광자-밀도를 제공한다. 그래서, 여기광 강도 상에서 검출된 발광의 비선형 의존성을 기초로 하는 마커(702)의 이미징에 의해서 해상도가 증가될 수 있다.
형광 분포 자체의 이미지가 아니라 상이한 여기 위치들에 대한 형광 강도의 이미지를 만듦으로써, 도 16의 (a) 및 (b)에서와 같은 이미지들이 획득될 수 있다. 여기 볼륨이 비선형 형광물질들보다 더 작기 때문에, 형광 마커의 더 작은 부분이 빛나도록 할 것이고, 그래서 종래의 선형 형광물질들과 비교하여 해상도를 증가시킨다.
비선형 형광물질은 선형 형광물질과 비교하여 일반적으로 더 높은 여기 강도를 요하고, 일부 비선형 형광물질은 심지어 코히어런트(coherent) 여기를 요한다. 산란 매체에서, 빛이 집중될 수 없고 모든 방향으로 퍼지기 때문에 높은 강도를 획득하기 어렵다. 이것은 일부 비선형 형광물질이 다른 것들과 비교하여 산란 매체에서 형광 이미징에 대해 더 적절하도록 한다. 형광물질은 특별히 높은 수율을 가질 필요가 있고, 이들은 코히어런트 여기를 요하지 않을 수 있다. 업컨버팅 나노입자는 높은 수율과 넌코히어런트(non-coherent) 여기를 가진 하나의 비선형 형광물질이다.
형광
이미징의
어플리케이션
형광 단층촬영(
Fluorescence
tomography
)
물체의 표면으로부터 방출된 형광의 평면 이미지는 여러 관점에 대한 정보를 포함한다. 분광(spectroscopic) 특징이 형광물질의 유형을 낳고, 강도는 형광물질의 농도와 관련이 있다.
이것은 물체 표면상에 위치된 또는 여기된 형광물질에 대해 유지된다. 깊이 위치한 형광물질을 고려하면, 복잡성은 여러 가지로 증가한다. 이는 분광 특징뿐 아니라 강도가 물체의 벌크 조직, 즉 주변 조직의 광학 속성에 의해 영향을 받고 연관이 있다는 사실에 기인한다. 여러 요소들이 고려되어야 하는데, 즉,
- 여기광 흡수 및 산란. 형광물질은 빛을 방출하도록 여기되어야 하고, 그래서 여기광은 형광물질 위치에 도달해야 한다.
- 여기 광원(light source) 위치. 형광물질에 가깝게 위치된 소스(source)는 동일한 여기광이 주어지면 소스로부터 멀리 위치한 소스에 비하여 더 많은 형광물질을 여기시킬 것이다.
- 형광물질 위치 및 사이즈. 여기서, 형광물질은 내부 구조화된, 즉 균질한(homogeneous) 분포의 형광 마커를 포함하는 잘 정의된 영역으로 다루어진다. 사이즈 및 위치에 따라서 방출된 형광은 경계에서 상이한 모습을 가질 것이다.
- 방출광(emission light) 흡수 및 산란. 방출은 조직을 통하여 전파될 때 감쇠된다. 통상적으로 방출을 위한 광학 속성은 여기광에 대해서와 동일하지 않다.
- 방출광 수집 위치. 수집된 강도는 (경계상에서) 검출된 위치에 의존한다. 이것은 방출 위치(형광물질 위치) 및 수집 위치(경계)로부터 전파(propagation) 경로의 불평등에 기인한다.
이러한 요소들이 항상 변하는 방식으로 관련된다는 사실 때문에, 수집된 신호를 해석하기 위한 도구에 대한 필요는 필연적이다. 그래서, 깊게 위치된 형광 마커의 형광 이미징을 위해 광학 단층촬영 기술을 이용하는 것에서의 근본적인 목표는 흡수 및 산란 물체 내에서 형광물질을 정량화하고 국부화하는 것이다.
용어 "정량화(quantify)"는 형광물질의 진정한 농도가 추구되는 것을 의미하고, 용어 "국부화(localize)"는 물체의 모든 3차원 복셀(voxel)에서 농도가 추구되는 것을 의미한다. 이 두 용어는 또한 물체의 내부의, 형광물질 콘트라스트를 기초로 한, 3차원 이미지를 형성하기 위한 가능성에 이르게 하고, 이것이 단층촬영이라는 명칭의 사용의 동기가 된다.
형광 단층촬영의
어플리케이션
작은 동물
이미징
오늘날, 인도시아닌 그린(Indocyanine green; ICG)만이 의료 진단을 위해서 인간 환자들에게 사용되도록 FDA 승인을 받았지만, 작은 동물 이미징에 대해서는 가능한 형광물질이 많다. 이것은 세포에서 바이오메디컬 현상을 이미징하기 위해 형광을 이용하는 상이한 현미경 기술들의 사용에 의하여 촉발된 지난 수년에 걸친 프로브(probe)의 발전 내에서 가속화된 연구의 결과이다.
형광물질은 활성(active) 프로브와 활성화가능(activateable) 프로브로 분류될 수 있다.
활성 프로브는 타겟에 대한 특정 친화성 리간드에 부착된 불특정 형광물질이다. 이 리간드는 항체, 펩티드, 및 라벨이 붙은 작은 분자일 수 있다. 활성 프로브는 타겟 리간드에 부착되지 않은 경우조차도 여기시에 형광을 방출한다. 이것은 불특정, 즉 이미징될 타겟에 대한 아무런 정보가 없는 백그라운드 형광을 낳는다.
활성화가능 프로브는 단지 "스위치 온(switched on)"될 때에 형광을 방출하기 때문에 더 특정적이다. 형광물질은 켄처(quencher)에 아주 근접하게 배치되고, 그렇지 않으면 여러 형광물질들이 서로 셀프-켄치(self-quench)하도록 함께 배치된다. 이러한 배치는 효소-특정 펩티드 서열 때문에 가능하다. 효소가 있는 경우에, 펩티드 서열이 갈라질 수 있어서, 형광물질은 자유로이 빛을 방출하고 아무런 켄칭(quenching)이 없다. 활성화가능 프로브의 이용은 생체 내 프로테아제(protease)의 식별을 위해 논증되어 왔다. 활성화가능 프로브는 단지 타겟 분자가 존재할 때 여기시에 빛을 방출할 수 있기 때문에 때때로 스마트 프로브 또는 광학 비콘(beacon)이라고도 불린다. 형광 프로브는 특정 분자 또는 특정 생체 이벤트를 타겟으로 하고, 그래서 그 기능이 이미징된다. 이것은 혈관화(vascularization) 및 투과도(permeability)를 가시화하기 위해서 이용된 다른 비-타겟팅(non-targeting) 형광 염료, 예컨대 ICG와는 대조적이다. 콘트라스트를 증가시키는 다른 방법은 유전적으로 인코딩된 프로브를 이용하는 것이다. 이식유전자(transgene)(리포터 유전자; reporter gene)가 세포에 삽입된다. 이식유전자는 전사(transcription)시에 동물 내부에서 고유하게 생성될 형광 단백질(FP)에 대해서 인코딩한다. 프로브는 광학 기술을 이용해서 검출될 수 있고, 이러한 방식은 방출된 형광이 유전자 조절 또는 유전자 발현의 존재를 시각화하기 때문에 간접 형광 이미징이라고 불린다. 세포는 리포터 유전자를 가지고 세포감염될 수 있고, 세포 추적이 이미징될 수 있다. FP를 관심 유전자에 결합시키는 것은 생체 내 임의의 단백질을 대부분 이미징하는 것을 가능하게 한다. 간접 형광 이미징에서의 FP는 FP가 형광을 방출하는 동안 관심 단백질이 영향을 받지 않을 것이라는 사실에 기인하여 흥미로운 이미징 능력, 예컨대 단백질-단백질 상호작용을 제공한다.
여러 유형의 형광 단백질들이 존재하지만, 메인 패밀리는 녹색 형광 단백질(GFP)을 기초로 하는 것이다. 프로브의 발전은 NIR 영역에서 방출하고 흡수하는 GFP를 개발하는 것을 촉진하고 있다. 오늘날 NIR FP는 존재하지 않지만, 황색 및 적색 형광 단백질은 보고된 바 있다(YFP 및 RFP). 콘트라스트는 형광물질 농도 및 형광물질 위치에 의존한다. 콘트라스트는 또한 소위 활성 프로브에 의해 제어된다. 만일 형광물질이 활성이 아니면, 아무런 형광도 방출되지 않을 것이다. 생체 매체에서 형광 진단을 이용함에 있어 항상 존재하는 문제는 자가형광 및 백그라운드 형광이다.
자가형광은 내생적 크로모포어(chromophore)에 의해 방출된 형광이고, 백그라운드 형광은 관심 영역 밖의 형광 프로브로부터 기원한 형광이다. 자가형광 및 백그라운드 형광을 이론적으로 차감하는 방법들이 보고되었다. 불특정 형광의 존재는 콘트라스트를 유효하게 감소시킨다.
임상 암 진단
지금까지 주요 적용은 ICG 또는 그 파생물을 이용한 유방암 진단이다. 형광 단백질은 인간에 대한 적용을 위해서 분명하게 대안이 아니고, 그래서 형광물질 이미징은 불특정 분자 프로브를 기능화함으로써 달성될 것이다.
비선형 형광물질 단층촬영(
Non
-
linear
fluorophore
tomography
)
예컨대, 업컨버팅 나노결정에서 방출된 형광의 이차(quadratic) 의존성 때문에, 형광 단층촬영이 향상된다.
도 9는 선형 형광물질 및 이차(quadratic) 형광물질을 이용하는 것 간의 차이를 도시한다.
도 8은 산란 매체에서의 여기광(801) 및 방출광(802) 전파의 개략도이다.
도 11은 형광 단층촬영 문제의 개략도이다. 여기광(803)을 방출하는 여기 소스는 경계에서 번역되고, 반면에 방출된 형광(804)은 방출 강도가 소스 위치에 따라서 변하는 동안 제자리에 정지하고 있다.
도 10a 및 10b는 선형(10a) 및 이차(10b) 파워 의존성을 갖는 형광물질에 대한 민감도 프로파일을 도시한다. 소스는 도면들에서 왼쪽에 위치하고, 검출기까지의 거리는 L이다. 계산은 무한 균질 매체에 대한 그린 함수(Green's function)를 위한 해석식을 이용하여 수행되었다. 도 10a 및 10b에서 도시된 바와 같이, 이차(quadratic) 민감도 프로파일은 x축 둘레로의 대칭적 회전을 둘러싼 광원 주변에서 매우 샤프(sharp)하다. 이것은 하나의 평면에서 더 높은 민감도(해상도)를 가지고 정보를 추출하는 것이 가능하다는 것을 의미한다.
더 높은 차수의 비선형 형광물질, 예컨대 입방체의 형광물질의 다른 실시 예에서, 콘트라스트 강화는 심지어 추가적으로 향상된다(도시하지 않음).
조직 광학 및 조직의
자가형광
조직 광학의 분야에서, 조직과 빛의 상호작용이 연구된다. 광학적으로, 생체 조직은 물보다 약간 더 높은 굴절률을 가진 비균질(inhomogeneous) 흡수 매체이다. 빛이 조직과 상호작용할 때, 복수의 산란 및 흡수 이벤트가 발생할 것으로 예상되고, 이 이벤트의 가능성은 매우 파장 의존적이다. 조직은 높은 농도의 물을 가지기 때문에, 물로부터의 흡수가 낮은 파장 영역으로부터의 빛을 이용하는 것이 바람직하고, 이것은 사용가능한 파장에 대해 궁극적인 제한을 가할 것이다. 하지만, 경피성(transdermal) 비침습적 어플리케이션에서, 특정 실시 예들에서와 같이, 빛은 사용가능한 파장에 대해서 추가적인 제약을 가하게 될 피부를 투과할 필요가 있다.
피부는 맨 위에 각질층과 그 아래에 표피(epidermis)와 진피(dermis)를 가진 층 구조로 보일 수 있다. 각질층과 표피는 방향성 아미노산, 핵산, 및 유로카닌산으로부터 300 nm보다 작은 파장에 대한 높은 흡수에 주로 기인하여 감쇠하는 빛에서 매우 효과적이다. 350 내지 1200 nm의 더 긴 파장에 대하여, 표피에서의 멜라닌이 주요 흡수체이다. 빛이 진피로 들어가면, 산란이 흡수보다 우세하기 시작한다. 그래서, 진피는 탁한 조직 매트릭스(turbid tissue matrix)로 설명될 수 있다. 진피 밑의 조직 유형들에 대해서, 일반적으로 산란이 흡수보다 우세하다. 대략적 근사에서, 산란은 레일리 산란(Rayleigh scattering)을 이용해서 모델링될 수 있다. 이것은 더 짧은 파장에서의 빛이 더 긴 파장에서의 빛보다 더 많이 산란될 것이라는 것을 의미한다.
조직에서의 산란 및 흡수 둘 다를 고려하면, 경피성 진단 윈도우는 더 긴 파장 영역에서 존재하고, 600 nm에서부터 1600 nm까지의 범위라고 고려될 수 있다.
조직은 여러 내생적 형광물질들을 포함하는데, 이들은 λ < 600 nm에 의해 여기될 때 작은 스토크스 천이를 가진 강한 형광을 가진다. 진단 윈도우에서 더 긴 파장에 대해서, 조직으로부터의 내생적 자가형광은 일반적으로 더 약하다. 하지만, 많은 이미징 및 단층촬영 어플리케이션들에서, 신호 자체 또한 약해서 아티팩트(artifact)를 초래하는 백그라운드 자가형광에 의해서 여전히 제한된다. 자가형광 백그라운드 스펙트럼(파선)을 가진 전형적인 신호(실선)가 도 1에서 도시된다.
상술한 자가형광 또는 조직 자체의 내생적 형광은 여러 상이한 형광물질들에 의해서 초래된다. 공통적인 조직 형광물질들 중의 일부는 결합 섬유(connective fibres)에 존재하는 콜라겐(collagen) 및 엘라스틴(elastin), 대부분의 단백질에 존재하는 트립토판(tryptophan), 및 세포의 소화에서 활성인 NADH(nicotinamid adenine dinucleotide) 및 플라빈(flavin)인데, 콜라겐(101), 엘라스틴(102), NADH(103), 및 카로틴(caroten)(104)의 스펙트럼을 도시하는 도 1b를 참조한다.
스펙트럼은 또한 조직의 광학 속성에 의해 영향을 받는다. 헤모글로빈과 같이 강한 흡수체는 특정 파장에서 형광 빛을 흡수할 수 있고, 그래서 형광 스펙트럼의 모습을 변화시켜서 잘못된 딥(dip) 및 피크(peak)를 생성한다. 헤모글로빈은 또한 여기광을 흡수함으로써 형광 스펙트럼의 전체 강도를 그 형상을 변화시키지 않고 감소시킬 수 있다.
외생적 형광물질(
Exogeneous
fluorophores
)
외생적 형광물질의 일부 예들은 형광 단백질(FP), NIR-염료(ND), 양자점(Quantum dots)(QD), 또는 감광제(photosensitizer)(PS)이다.
양자점은 조직 자가형광보다 더 스토크스 천이된 신호를 방출하는 선형 형광물질이다. 양자점은 자외선(UV) 영역에서 주로 흡수하는 형광물질이다. 짧은 파장에서 조명광을 이용하는 것은 경피성 측정을 위해 이상적이지 않고 UV 광은 얕은 경피성 투과 깊이 및 조명된 조직에서 DNA 손상에 대한 위험에 종속되기 때문에, QD는 많은 어플리케이션들에 대해서 적절하지 않다. 게다가, 양자점은 종종 생명체에 대해서 매우 해가 되는 물질로 제조된다. 게다가, 양자점이 생체 환경에 노출되었을 때 반응하는 경향이 있고 매우 해가 될 수 있다는 연구들이 나오고 있다.
비선형 형광물질(
Non
-
linear
fluorophores
)
비선형 형광물질에 대한 예는 이하에서 더 상세하게 설명된 나노입자들(NP)이다.
업컨버전(
Upconversion
)
업컨버전은 둘 이상의 광자가 흡수될 때 발생하는 비선형 프로세스이고, 들어오는 광자의 에너지보다 더 높은 에너지의 광자가 방출된다.
이 프로세스는 예컨대 긴 시간 동안 하나의 전자를 가둘 수 있는 메타-스테이블(meta-stable) 상태를 포함하는 물질에서 관찰되고, 다른 도달하는 광자와의 상호작용-가능성을 증가시킨다.
일부 실시 예들에서, 상이한 희토류(rare earth) 이온으로 도핑된 고체 형태의 발광 마커가 업컨버전을 획득하기 위해서 이용된다.
고체 상태 업컨버팅 물질은 물질을 예컨대 희토류 이온으로 도핑하여 제조된다. 희토류는 고체 물질에 결속되었을 때조차, 샤프(sharp)한 원자같은 스펙트럼 선들을 제공하고, 내부 껍질 이전에 외부 전자 껍질을 채운다.
업컨버전은, 이온 쌍 및 여기 강도에 따라 상이하게 의존하는 업컨버전 프로세스에 영향을 주는 수많은 프로세스들에 기인해서 발생할 수 있다.
일부 업컨버전 프로세스들이 도 2의 a) 내지 c)에서 도시된다.
프로세스들의 일부는 이온들 간의 에너지 전달을 포함한다. 이 에너지 확산은 방사(radiative) 또는 비방사(non-radiative), 공명(resonant) 또는 비공명(non-resonant)일 수 있으며, 도 2의 a) 및 도 2의 b)를 참조한다. 방사의 경우에 광자는 감광제(sensitizer)로부터 방출되고 활성제(activator)에 의해 흡수되고, 비방사의 경우에 여기 에너지는 정전기 상호작용을 통해서 하나의 이온으로부터 다른 이온으로 점프할 것이다. 두 경우는 실험적으로 구별될 수 있다. 방사적 전달은 샘플의 형상에 의존적이고, 또한 활성제의 수명뿐 아니라 방출 스펙트럼에 영향을 준다. 전이가 비공명인 경우에 포논(phonon)의 도움을 받아야 한다. 비공명 전이는 특히 비방사의 경우에 다른 고체 물질에 비하여 희토류 이온들 사이에서 더 높은 에너지 차이를 만나게 된다.
게다가, 에너지 전달 업컨버전(Energy Transfer Upconversion; ETU) 및 여기된 상태 흡수(Excited-State Absorption; ESA) 프로세스들이 도 2의 c)에서 도면의 왼쪽 및 오른쪽에서 각각 도시된다. 여기된 상태에 있는 이온이 하나 이상의 광자를 흡수할 때 여기된 상태 흡수가 발생한다. 이러한 프로세스를 위한 가능성은 일반적으로 작고, 코히어런트 펌핑(pumping) 하에서만 관찰될 수 있다. 에너지 전달 업컨버전은 이온들 사이에서 에너지 전달을 포함하는 프로세스이다. 여기서, 여기된 상태에서 활성제가 고려된다. 그리고, 에너지는 감광제로부터 비방사적으로 전달될 수 있다. 이것은 에너지 차이만이 에너지를 보존하는데 중요하기 때문에 가능하다.
도 3의 a) 및 b)는 각각 업컨버전 발광에서 형광 및 복수의 여기의 개략도이다. 도 3의 a)에서, 방출 파장(EM)은 여기 파장(EX)보다 더 길다. 도 3의 b)는 단계 1(EX1) 및 단계 2(EX2)에서 발생하는 복수의 여기를 도시하고, 방출 파장(EM)은 여기 파장보다 더 짧다.
나노사이즈의
업컨버팅
결정(
Nanosized
Upconverting
Crystals
)
본 명세서에서는 업컨버팅 나노결정이 근적외선(near-infrared; NIR) 여기(excitation)에서 안티-스토크스 천이된(anti-Stokes shifted) 빛을 효과적으로 방출하기 위한 고유 속성에 기인하여 바이오메디컬 이미징 어플리케이션에서의 형광물질로서 공개된다. 이것은 아무런 자가형광이 존재하지 않는 영역에서 형광 신호를 검출하기 위해 제공된다.
나노사이즈의 업컨버팅 입자들은 예를 들어 란탄계열로 도핑된 산화물(Y2O3)이고, 이것은 제조하기 쉽다.
다른 나노사이즈의 업컨버팅 입자들은 예를 들어 불소이고, 이것은 Y2O3보다 더 높은 효율을 가진다. 더 높은 효율은 불소에서의 낮은 포논 에너지에 의해 설명될 수 있고, 이것은 비방사적 감쇠의 가능성을 더욱 낮춘다.
게다가, 나노사이즈의 업컨버팅 입자들은 예를 들어 Yb3 +/Er3 + 또는 Yb3 +/Tm3 +과 함께 도핑된 나트륨 이트륨 4불소(NaYF4)로 구성된다.
NaYF4는 두 상으로 결정체를 이룰 수 있는데, 각각 α-NaYF4 및 β-NaYF4로 불리는 입방체 또는 6각형이다. β-상 물질로부터 업컨버팅된 발광은 α-상으로부터 업컨버팅된 발광과 비교하여 대략 한 자릿수 더 크다. 현재, 입방체 또는 6각형 상에서 나노사이즈의 입자들을 제조하는 것 또한 가능하다.
효율 차이를 무시하면, 입자들은 또한 다른 사이즈-의존적인 속성을 보인다. 예를 들어, 상이한 방출 선들 사이에서 비율은 나노입자들과 벌크(bulk) 물질에 대해서 상이하다.
이들의 고유한 광학 속성들 때문에, 업컨버팅 나노입자들은 상이한 바이오이미징 어플리케이션을 위한 생체 마커로서 적절하다. 980 nm의 여기 파장에서의 값싼 레이저 다이오드가 존재하는데, 이것은 빛이 조직에서 상대적으로 깊이 투과하기 때문에 바이오이미징 어플리케이션을 위해서 매우 적절하고, 광손상의 위험을 낮춘다.
업컨버팅 나노결정에 있어서, 발광 이미징은 임의의 자가형광을 겪지 않는다. 발광 이미징은 예컨대 스토크스 천이된 형광물질의 생체 마커와 비교하여 더 나은 콘트라스트를 가지고 제공된다.
게다가, 업컨버팅 나노입자들과 같은 비선형 형광물질은 또한 생물학적으로 기능하도록 될(biofunctionalized) 수 있고, 예컨대 암 검색 능력을 준다.
비선형 형광물질은 수용성일 수 있고, 정맥의, 경구의, 또는 장의(enteral) 투여를 위한 용액에서와 같이 특정 어플리케이션에서 용이한 투여를 허용한다.
업컨버팅 나노입자들을 수용성으로 제공하기 위한 방법은 극성(polar) 구조를 갖는 입자들을 코팅하는 것이다. 코팅은 예를 들어 폴리머(polymer) 또는 실리카(silica)로 만들어질 수 있다. 합성 폴리머, 예컨대 PEG(Polyethylene glycol) 및 천연 폴리머 둘 다 코팅을 위해 사용될 수 있다. 이 폴리머들은 생체 환경에서 안정적이고, 임의의 중요한 부정적 방식으로 나노결정의 광학 속성을 간섭하지 않는다.
실리카를 가지고 입자들을 코팅하는 것은 생체 환경에서 특히 이점이 있는 매우 강인한 코팅을 통상적으로 제공한다.
수용성 업컨버팅 나노입자들은 코팅 없이 제공될 수 있다. 수산기(Hydroxyl) 그룹은 화학적 결합 또는 물리적 흡수에 의해서 업컨버팅 나노입자들의 표면에 부착될 수 있다. 수산기 그룹은 공유 결합에 의해 형성된 정의에 의한 것이고, 그 최종 구조는 극성(polar) 속성을 가진다.
게다가, 안정한 보호 코팅이 나노입자에 적용되어 이들이 생체 환경에서의 사용을 위해 적절하게 되도록 할 수 있다.
기능화(
Functionalization
)
업컨버팅 나노입자들의 기능화는, 모든 목적을 위해서 전체적으로 본 문서의 이부분에서 통합된 X. Gao et. al., In vivo cancer targeting and imaging with semiconductor quantum dots, Nature Biotechnology, 22, 8:969-976, 2004에서 설명된 바와 같이 양자점을 기능화하는 것과 유사한 방식으로 만들어질 수 있다. Gao et. al.에서 업컨버팅 희토류 도핑된 나노입자들에 적용할 수 있는 방법들이 설명된다.
이 공개에서의 실시 예에서 사용된 업컨버팅 나노입자들은, Yb3 + 및 Tm3 +의 조합으로 도핑된, G. Yi et. al., Synthesis, characterization, and biological application of size-controlled nanocrystalline NaYF4:Yb,Er infrared-to-visible up-conversion phosphors. Nano Letters, 4, 11:2191-2196, 2004에서 설명된 방법에 따라 준비된 NaYF4-결정이었다. 두 이온들에 대한 에너지 다이어그램이 도 4a에서 도시된다. 도 4a는 Yb3 +/Tm3 + 이온 쌍에서 업컨버전 프로세스들의 개략도이다. 비방사(non-radiative) 업컨버팅 프로세스들은 점선 화살표를 가지고 도시되고, 비방사 감쇠는 명확성을 위해서 생략되었다. 도 4b는 이 업컨버팅 나노입자들에 대한 방출 스펙트럼을 도시하는 그래프이다. 477 nm에서의 푸른 방출 선은 단지 더 높은 펌프 강도에 대해서 가시적이다. x 축 상에서 강도(I)를, 그리고 y 축 상에서 카운트(C)를, 그리고 맞추어진(fitted) 선(401)의 기울기(S)는 2와 같다는 것을 보이는 도 4b의 삽화에서 도시된 바와 같이, 800 nm 선의 펌프-파워 의존성은 낮은 강도를 이용하여 이차(quadratic)로 측정되었다.
실시 예에서, 비선형 마커는 다른 이미징 방식(imaging modality)을 위한 이미징 콘트라스트제에 부착된다. 예를 들어, 비선형 마커는 자기 공명 이미징(Magnetic Resonance Imaging, MRI), 엑스레이(X-Ray) 등과 같이 종래의 이미징 방식을 가지고 이미징을 위한 콘트라스트제에 부착된다. 구체적 실시 예에서, 비선형 마커는 상자성(paramagnetic properties)을 갖는, 유기 가돌리늄(organic gadolinium) 복합체 또는 가돌리늄 화합물에 부착된다. MRI 콘트라스트제로서 사용될 때, 콘트라스트는 의료 자기 공명 이미징에서 강화된다. 동시에 발광 이미징 또는 단층촬영이 만들어질 수 있고, 생체 내 하나의 동일한 관심 영역의 고해상도 MRI와 결합된 기능적인 진단 정보를 제공한다.
다른 어플리케이션들이 비생물학적 영역에서 제공된다. 이러한 영역의 예가 물질 테스트를 위한 발광 이미징 또는 단층촬영이고, 비선형 마커를 가진 매체를 흘려서 통과시키는 액체 또는 기체를 위한 필터, 태블릿의 품질 관리 등을 포함한다.
실험
업컨버팅 나노결정들은 발광 이미징에서 비선형 마커의 적용가능성을 확실시하기 위해서 실험적 셋업(set-up)에서 사용되었다. 생체 내 어플리케이션에서 형광물질로서 사용하기 위한 적절성을 입증하기 위해서, 두 개의 실험이 수행되었다.
첫째, 업컨버팅 나노결정의 형태로 전형적인 다운컨버팅(downconverting) 형광물질 및 이차 형광물질을 이용하여 콘트라스트에서의 차이가 입증되었다.
둘째, 업컨버팅 나노 결정의 형태로 이차 형광물질과 같은 비선형 형광물질을 이용하여 단층촬영 재구성을 위해 수행된 시뮬레이션이 수행되었다.
데이터 수집을 위해 사용된 평면 이미징 시스템들이 도 5의 (a) 및 (b)에서 개략적으로 도시된다. 도 5의 (a)는 형광물질 이미징(에피-형광)을 위한 셋업의 개략도이고; 도 5의 (b)는 투과조명에서 형광물질 재구성을 위한 셋업의 개략도이다.
비행시간법(time-of-flight) 분광학 시스템(500)에 의해 결정된 광학 속성을 가진 인트라라피드(intralipid) 잉크의 용액으로 구성된 조직 팬텀(501)이 사용되었다. 형광물질(502)은 2.4 mm의 내부 직경을 가진 모세관 튜브에 담아졌다. 형광물질의 농도는 나노입자들에 대해서 1 wt%였고, DY-781 유형의 종래의 다운컨버팅 형광물질에 대해서 1 μM였다.
나노입자들의 농도는 양자점을 이용한 연구들과 합당한 관련성을 가지도록 선택되었는데, 즉 1 wt%의 농도가 이용되었다.
CNC 기계로부터 이 단계 모터를 이용하기 때문에, 레이저(503)와 결합된 섬유는 래스터 스캔(raster scan)될 수 있다. 래스터 스캔에서 레이저의 위치는 도 7에서 도시된 바와 같은 그리드 패턴(701)에 의해 설명될 수 있다. 이미지는 800 nm에서 중심인 두 개의 유전체 밴드 패스 필터 뒤에 있는 공랭식 CCD (504) 카메라를 가지고 각각의 스캔 위치에서 획득되었다. 도 5의 (c)는 래스터 스캔 셋업(507)을 도시하는데, 레이저는 아래 위치(505)로부터 조직 팬텀(501)을 스캔한다. CCD(504)는 레이저의 모든 위치(506)에 대해서 하나의 이미지를 캡처할 수 있다. 위치(506)는 도 7에서의 그리드 패턴(701)과 유사한 그리드 패턴(508)을 묘사한다. 레이저의 각각의 위치(506)에 대해서, 팬텀(501)의 모든 면으로부터 방출된 형광, 즉 전체 발광 강도가 측정되어 합해져서 결과 이미지에서 하나의 픽셀을 구성한다. 그래서, 이미지에서 픽셀의 수는 여기 위치(506)의 수에 의해서 주어졌으며, CCD 픽셀의 수에 의한 것이 아니다. 그래서, 해상도는 레이저 광원(505)으로부터 여기광의 광자-밀도에 의해 결정될 수 있으며, 형광 방출광의 광자-밀도에 의한 것이 아니다. 이러한 식으로, 여기 볼륨에서 이-광자(two-photon)의 광자-밀도는 단일-광자(single-photon)의 광자-밀도보다 더 좁기 때문에, 해상도가 증가될 수 있다. 전체 발광 강도를 합할 때, 문턱값이 검출된 발광에 적용될 수 있다. 이러한 식으로 해상도가 증가될 수 있다. 예를 들어, 정의된 문턱 위에 발광 강도가 존재한다면 전체 발광 강도에 더해질 것이다. 문턱은 CCD(504)에서 값으로 정의될 수 있는데, 예를 들어 발광 강도가 피크값의 30% 아래라면 버려질 것이고, 백그라운드 신호로 고려될 수 있다. 게다가, 만일 레이저의 위치(506) 또는 픽셀에 대한 결과적인 전체 발광이 다른 문턱값 아래라면, 백그라운드 신호로 여겨져서 제거될 수 있다. 이와 달리, 발광 신호의 이차 강도는 합해질 수 있다. 이러한 방식으로 해상도가 추가로 증가될 수 있다. 예를 들어, CCD(504)에 의해 검출된 발광 강도는 CCD에서 피크 강도 값의 정의에 의해 0과 1 사이에서 상대적인 값을 가질 수 있고, 현재 픽셀 또는 위치(506)를 위해서 전체 발광 강도에 더해지기 전에 그 자체를 가지고 곱해질 수 있다. 게다가, 전체 발광 강도는 각각의 픽셀 또는 위치(506)에 대해서 그 자체를 가지고 곱해질 수 있다. 도 16의 (a) 내지 (c)는 스캐닝 이미징 기술을 이용한 이미지들을 도시하고, 이미지들에서 각각의 픽셀은 단일한 여기 포인트, 즉 광원 위치(506)에 의해 유도된 형광에 대응한다. 도 16의 (a)는 선형의 종래 형광 염료에 대한 이미지를 도시하고, 도 16의 (b)는 비선형 업컨버팅 나노입자들로부터의 이미지를 도시하고, 각각 10.5 mm 및 8.0 mm로서 FWHM을 도시하는 도 16의 (c)에서 비교 단면 프로파일을 가지고, 1.3의 인자의 향상을 준다.
자가형광
둔감성
(
insensitive
) 형광 분자
이미징
이 실험을 위하여 에피-형광(epi-fluorescence) 셋업이 사용되었다. 팬텀의 광학 속성은 660 nm에서 μ's = 6.5 cm-1 및 μa = 0.44 cm-1 이도록 선택되었고, 작은 동물들에서 발견되는 범위에 속한다.
형광물질 DY-781 및 NaYF4: Yb3 +/Tm3 +을 포함하는 모세관 튜브는 5 mm의 깊이로 잠겼고, 그 깊이는 튜브의 앞 표면으로부터 팬텀의 표면까지의 거리로서 취해졌다. DY-781은 공정한 비교를 얻기 위하여 선택되었는데, 이것이 800 nm에서 방출하고 더 공통적으로 사용된 염료, 예컨대 로다민 클래스(rhodamine class)와 동등한 양자 효율을 가지기 때문이다.
형광물질을 여기시키기 위해서 두 개의 다이오드 레이저들이 사용되었다. DY-781은 780 nm에서 여기되었고, 나노입자들은 980 nm에서 여기되었다.
레이저는 121 위치들로 구성된 4.4×4.4 cm2의 영역에 대해서 래스터 스캔되었다. 그리고, 이미지는 합해졌고, 표면상에서 광자 분포의 표현을 제공한다. 이것은 형광 포함이 검출될 수 있든 없든 제공된다. 카메라상에서 배드 픽셀(bad pixel)의 효과를 억제하기 위하여, 3×3 픽셀의 커널(kernel)을 가진 미디언 필터(median filter)가 합해진 이미지에 적용된다. 자가형광을 시뮬레이션하기 위해서, DY-781은 콘트라스트가 매우 나빠서 데이터가 합당한 방법으로 이용될 수 없는 포인트까지 팬텀에 더해졌다.
사용된 조명 강도는 조직에 해가 없는 것으로 여겨졌다. 마지막 사용된 여기광은 팬텀의 표면상에서 양쪽 레이저들로부터 1cm2의 스폿(spot) 사이즈를 가졌고, 780 nm 레이저에 대해 40 mW/cm2의 강도를 제공했고 980 nm 레이저에 대해 85 mW/cm2의 강도를 제공하였다.
도 6의 (a) 내지 (d)는 실험의 결과로 얻은 다양한 형광 강도 분포를 보이는 이미지 및 그래프이다. 더욱 상세하게는, 각각 수직 방향으로 합을 도시하는 플롯(plot)과 함께, 자가형광을 가지는 것과 자가형광을 가지지 않는 것으로, 도 6의 (a) 및 (c)에 도시된 DY-781 염료와 도 6의 (b) 및 (d)에 도시된 나노입자들의 관점에서 비교 이미지들이 도시된다. 이미지 내에서 흰색 점은 인위적으로 추가되었고, 여기광을 위해 사용된 위치를 나타낸다. 왼쪽 컬럼(column)은 DY-781을 사용한 결과를 도시하고 오른쪽 컬럼은 업컨버팅 나노입자들을 사용한 결과를 도시한다.
도 6의 (a) 및 (c)에 도시된 이미지들은 임의의 추가된 자가형광물질(autofluorophores)을 가지지 않고 얻어지고, 도 6의 (b) 및 (d)에 도시된 이미지들은 40 nM의 백그라운드 자가형광물질 농도를 가지고 얻어진다.
더욱 상세하게는, 도 6의 (a) 내지 (d)는 그들의 단면 프로파일과 함께 자가형광을 가지고 얻어진 이미지와 자가형광을 가지지 않고 얻어진 이미지를 도시한다.
도 6의 (d)로부터 알 수 있는 바와 같이, 도 6의 (c)와 비교하여 감소된 자가형광 백그라운드가 존재하고, 업컨버팅 나노입자들에 대해 신호-대-백그라운드 콘트라스트를 향상시킨다. 이 도면들은 다운컨버팅 형광물질과 업컨버팅 나노결정을 이용한 콘트라스트 차이를 명백하게 입증한다. 추가된 임의의 인위적인 자가형광물질이 없더라도 인트라리피드(intralipid) 그 자체의 자가형광 및 효과가 도 6의 (a)의 단면 프로파일에서 가시적이다는 것은 주목할만한 가치가 있다.
나노입자들을 이용한 최종 결과는 검출기의 신호-대-노이즈 비율에 의해서 주로 제한된다. 이것은 여기 파워(excitation power)를 증가시킴으로써 획득할 수 있는 이미지 질을 향상시키는 것이 가능하다는 것을 의미한다.
DY-781 염료에 대해서는 상황이 다르다. 이 염료는 매우 효율적이고, 신호-대-노이즈 비율에 의해서 일반적으로 제한되지 않는다. 하지만, 신호-대-백그라운드 콘트라스트에 의해 제한된다. 이것은 여기 파워에서의 증가가 더 나은 이미지 품질을 낳지는 않을 것이라는 것을 의미한다.
형광 분자 단층촬영(
Fluorescence
Molecular
Tomography
;
FMT
)
비선형 형광물질 및 종래의 형광물질을 이용한 FMT의 시뮬레이션은 도 5의 (b)에서 도시된 바와 같이 전송-형광(transmission-fluorescence) 셋업에서 수행되었다. 시뮬레이션된 조직 팬텀은 43 mm의 반경을 가진 반무한(semi-infinite) 원기둥(508)으로 모델링되었다. 하나의 기하 평면 둘레로 16개의 균일한 간격의 소스-검출기 포인트들(509)을 가지며, 광학 속성은 λ = 660 nm에서 μ's = 10 cm-1 및 μa = 0.4 cm-1 였다. 형광물질들은 도 5의 (b)에서 도시된 바와 같이 팬텀을 통과하여 뻗어 있는 스틱(stick)처럼 서로 가깝게 배치되었다.
전방향 모델(forward model)은 1785 노드(node)들을 포함하는 균일한 메쉬(mesh)를 사용하였다. 재구성을 위해서, 17 × 17 픽셀의 픽셀 베이시스(pixel basis)가 사용되었다. 재구성 베이스(base)를 선택하기 위한 여러 전략이 존재한다. 두 가지 예가 세컨-메쉬(second-mesh) 베이시스 및 픽셀 베이시스이다. 하지만, 모든 전략들은 문제에서 미지수들의 수를 감소시키는 것을 목표로 한다. 이것이 동기가 되는데, 해가 스무드(smooth)할 것으로 기대되고 더욱 코어스(coarser)한 베이시스가 일-포우즈드니스(ill-posedness)를 향상시키기 때문이다. 이 실험에서, 픽셀 베이시스가 선택되었고, 이것은 규칙적으로 간격을 둔 픽셀들의 세트이다. 이 베이시스는 공간적 선험(a priori) 정보를 가지지 않은 문제들에 대해서 적합하다.
재구성을 위한 입력 데이터는 전방향 시뮬레이션으로부터 획득되었다. 소스는 팬텀 내부에서 하나의 산란 이벤트의 거리에 위치된, 1 W를 가지고 방사하는 등방성 포인트 소스로서 모델링되었다.
재구성을 위한 과정은 다음 단계들을 수행하는 것으로 간략하게 고려될 수 있다; i)여기 위치 각각에 대해서: 정정 파워 인자를 가지고 여기장(excitation field)을 계산; ii)각각의 검출 위치에 대해서: 상술한 여기장을 가지고 방출장(emission field)을 계산, 즉 수반행렬(adjoint)-방법; iii)각각의 여기 및 검출 쌍에 대해서 여기장 및 방출장(수반행렬) 사이의 곱을 계산. 다시 말해, N*M을 계산하고, N은 여기 위치의 수이고, M은 방출 위치의 수이다. 후자는 민감도 프로파일의 계산으로 고려될 수 있다. 결과로 얻은 내부 분포가 저장된다. iv)예컨대, ||Ax - y||를 최소화하여 최소제곱(least-square) 문제를 풂으로써, 검출된 것을 가장 잘 기술하는 내부 형광물질 분포를 찾는데, 여기서 A는 민감도 프로파일을 포함하는 행렬이고, x는 형광물질의 내부 분포이고, y는 측정된 데이터이다.
비선형 마커에 대해서, 빛 전파(방출 및 여기)의 비선형 의존성은 예컨대, 관련 확산 방정식을 풂으로써 모델링될 수 있고, 또는 몬테-카를로(Monte-Carlo) 시뮬레이션을 이용할 수 있다. 이것은 단층촬영을 위한 비선형 마커를 이용하기 위해서 필수적이다. 이것은 여기장을 계산할 때 방출 문제에 대한 입력 데이터로서 이용될 수 있다. 단층촬영 재구성을 위한 상술한 단계들 중의 하나에서, 마커의 파워 의존성이 고려될 수 있다. 예를 들어, 여기광(E) 상에서 발광(L)의 특정한 파워 의존성을 갖는 비선형 마커에 대해서, 여기장의 장 세기(field strength)는 동일한 파워까지 증가하는데, 즉 즉 비선형 마커가 이차(quadratic) 파워 의존성을 가진다면, 여기장의 이차 곱을 계산한다. 이차 여기장 세기는 방출 문제에서 방출장을 계산하기 위해 소스 항으로서 사용된다. 이것은 더욱 좁은 민감도 프로파일을 낳을 수 있고 그로 인해 증가된 해상도를 낳을 수 있다. 좁은 민감도 프로파일은 상술한 좁은 또는 작은 여기 볼륨에 대응한다. 그래서, 발광 마커의 단층촬영 이미지를 재구성하는 것은 비선형 의존성에 따라서 여기장의 곱을 계산하는 것을 포함할 수 있고, 방출장의 계산은 이 곱을 기초로 한다. 그리고, 곱을 계산하는 것은 비선형 관계의 파워 의존성에 대응하는 파워까지 증가된 장 세기의 곱을 형성하기 위해서 여기장의 장 세기를 곱하는 것을 포함할 수 있다.
재구성의 정확도는 광원이 발광 마커에 대해 움직일 때 또는 그 반대의 경우에 각각의 광원 위치에 대해서, 검출된 발광과 같이, 얼마나 많은 정보가 획득되는지에 대해서 의존적이다. 공간적 변화에 의해서 재구성 정보를 획득하는 것뿐 아니라, 이와 달리 스펙트럼 변화에 의해서 재구성 정보를 획득하기 위하여 발광 마커의 복수의 여기 파장 및 방출 파장이 이용될 수 있다. 이 상황에서 CCD는 이미징 및 단층촬영 재구성 양쪽 모두에서 사용하기 위해 여러 파장들의 발광을 검출할 수 있다. 후자의 경우에, 공간적 및 스펙트럼 변화 양쪽 모두는 상술한 민감도 프로파일을 계산하기 위해 이용될 수 있다.
재구성된 결과
도 9는 선형(902) 및 비선형 형광물질(903) 사이에서 단층촬영 재구성의 비교를 도시한다. 도 9에서의 도면은 이차(quadratic) 형광물질의 예로서 제시된다. (이 경우는 이차(quadratic)인 것으로 선택됨)
도 9에서 그라운드 트루스(ground truth)가 입력 이형(Input anomaly)(901)으로서 도시된다. 두 개의 개별적인 하지만 가까운 이형들이 더 큰 원에서 불규칙적인 점들로 도시된다.
도 9로부터 분명하듯이, 선형 형광물질(902)을 이용한 재구성에서, 두 개의 가깝게 위치한 이형들이 구별될 수 없다.
하지만, 이차 형광물질(902)을 이용한 재구성은 두 개의 가깝게 위치한 이형들 사이에서 좋은 간격(separation)을 보인다. 이것은 도 9에서 명백하게 알 수 있다.
이러한 비교는 비선형 형광물질의 이용이 선형 형광물질을 가지고 하는 것보다, 즉 더 높은 콘트라스트 및 해상도를 제공한다는 유리한 효과를 도시한다. 강화는 이하의 수학식 (1)에서 보인 바와 같이 이차 소스 항을 이용하는 동안의 더 좁은 민감도에 기인한 것이다. 이것은 상이한 소스 위치들에 대해 수집된 신호를 고려함으로써 시각화될 수 있다. 이차 형광물질을 이용하기 때문에, 소스 위치가 형광물질 자체의 주변에 존재한다면 신호는 단지 강할 것이다. 그래서, 신호는 선형 형광물질의 경우보다 형광물질의 위치에 대하여 더 많은 정보를 제공할 수 있다. 이것은 또한 도 9에서 도시된 바와 같이 선형 형광물질을 이용해서 해결할 수 없는, 예컨대 두 개의 가깝게 위치한 형광물질을 해결할 가능성을 제공할 수 있다.
업컨버팅
나노입자를 이용한 멀티-빔(multi-beam) 형광 확산 광학 단층촬영
게다가, 본 공개는 동시에 두 개의 빔(beam)을 가진 여기를 포함함으로써 래스터 스캐닝 셋업에서 정보의 양을 추가적으로 증가시키기 위해 업컨버팅 나노입자들의 고유한 비선형 파워 의존성을 활용하기 위한 형광 확산 광학 단층촬영에서의 방법을 입증한다. 증가된 정보는 더욱 정확한 재구성으로 인도한다는 것을 알아냈다.
형광 확산 광학 단층촬영(FDOT)은 탁한 물질 내에서 형광 프로브의 농도의 공간적 분포를 재구성하기 위한 상대적으로 새로운 방식이다. 이미징 도구로서, 이것은 예컨대, 종양, 프로테아제(protease), 및 약 효과를 이미징하기 위해 바이오메디컬 연구에서 좋은 전망을 가진다.
FDOT는 수치적으로 매우 일-포우즈드(ill-posed)한 문제이다. 이 문제에서, 형광 타겟에 대한 재구성의 질은 경계 측정으로부터 획득된 형광 정보의 양과 질에 의해서 직접 결정된다. 계기의 노이즈 및 조직 자가형광은 측정의 주요 교란이고, 좋지 못한 신호 품질을 낳으며, 재구성된 결과에서 심각한 아티팩트를 초래할 수 있다. 이를 극복하기 위하여, 예를 들어 낮은-노이즈 장비를 채용할 수 있고, 백그라운드 차감 또는 스펙트럼 분리(spectral unmixing)를 이용할 수 있다. 하지만, 이러한 방법들이 모든 문제를 해결할 수 없는데, 이들은 필수적으로 재구성을 위한 새로운 제약들을 추가하는 것, 즉 재구성의 질을 향상시키는데 중요한 새로운 독립적인 정보를 더하는 것이 아니라 단지 현재 정보를 더 나은 방식으로 이용하기 때문이다. 비접촉 CCD-기반 FDOT 시스템에서, 더 많은 정보를 얻기 위한 하나의 바람직한 방법은 여기 위치의 수를 증가시킴에 의한 것이다. 하지만, 합당한 레벨 내에서 여기 빔(excitation beam)의 강도를 유지하기 위하여, 여기 빔의 최소 사이즈에 대한 한계가 존재한다. 이것은 가장 높은 여기-위치 밀도까지의 실제적인 상한을 시사하는데, 뚜렷한, 즉 오버랩되지 않는 여기 위치가 재구성을 위해서 바람직하기 때문이다. 선험 구조 정보를 제공하기 위하여 자기-공명 이미징과 같은 해부학적 이미징 방식을 채용하는 것 또한 가능하다. 하지만, 이것은 시스템의 현저하게 증가된 복잡성 및 감소된 유연성을 비용으로 한다.
본 공개에서는, FDOT에서 여기를 위해 동시에 두 개의 빔을 이용함으로써 추가적인 정보를 얻기 위해 업컨버팅 나노입자들의 이차 파워 의존성을 활용하기 위한 접근법을 제시한다. 나노입자 수 밀도 분포 n의 재구성에서 이중 빔(dual-beam) 여기에 의해서 얻어진 이미지(D-유형 이미지라고 함)의 효과가 입증된다. 게다가, 선형 로다민(Rhodamine) 6G와 이차 업컨버팅 나노입자들 간의 재구성된 결과의 비교가 만들어진다.
여기장 및 방출장은 두 개의 결합된 확산 방정식에 의해서 모델링될 수 있다[참조 1]. 이차 형광물질에 대해서 k번째 빔의 여기 하에서 고정된 검출기 위치에서 검출된 형광 신호;
는 전방향 모델 (1)에 의해서 기술될 수 있는데;
여기서, N은 복셀(voxel)의 수를 나타내고,
여기광의 전방향 해는
에 의해서 표시되고;
전방향 형광 문제에 대한 수반행렬 해는
에 의해서 표시된다.
동시에 두 개의 빔을 이용하여 매체를 여기시킬 때, 검출된 신호는 수학식 (2)에 의해서 주어지는데;
이것은 교차항(cross-term)들의 관여를 드러낸다. 래스터 스캐닝 셋업(500, 507)에서, 두 개의 이미지가 두 개의 위치에 대해서 하나의 여기 빔 스캐닝을 가지고 연속적으로 얻어지고(S-유형 이미지라고 함), 세 번째 이미지가 이전의 두 위치 위에서 두 개의 빔 여기를 가지고 얻어진다면(D-유형), 교차항들의 관여는 D-유형 이미지가 기존 S-유형 이미지들로부터 임의의 수학적 처리에 의해서 얻어질 수 없다는 것을 시시하고, 이것은 독립적이며, 추가적인 정보를 포함한다는 것을 나타낸다. 하지만, 선형 형광물질, 예컨대 로다민 6G에 대해서, D-유형 이미지는 단지 기존 S-유형 이미지들의 선형 조합이고, 인버스 문제(inverse problem)에 대해서 더 많은 제약을 추가하지 않을 것이다. 비선형 형광물질에 대해서, 수학식 (2)는 더 많은 동시적인 여기 빔들을 포함하도록 일반화될 수 있다.
재구성에 있어서 이중 빔 여기를 가진 측정의 의의는 수학식 (3)에 의해서 요소들이 주어지는 가중치 행렬 W의 특이-값(singular-value) 분석에 의해서 확정되는데[참조 1];
계산은 유한 요소(finite element) 방법을 구현하는 NIRFAST 패키지를 이용해서 수행되었다. W는 수학식 (4)에 따라서 인자화되었는데;
여기서, U 및 V는 W의 왼쪽 및 오른쪽 특이 벡터(singular vector)를 포함하는 단위 행렬들이고;
는 W의 특이값들을 포함하는 대각 행렬(diagonal matrix)이다. V의 열-공간(column-space)은 이미지-공간 모드에 의해서 스캔된고, U의 열공간은 검출-공간 모드에 의해서 스캔된다. W의 특이값들은 주어진 이미지-공간 모드가 실험적인 셋업에 의해서 얼마나 유효하게 검출될 수 있는지를 나타낸다[참조 2].
도 12는 W의 정규화된 특이-값 분포를 도시한다. x축은 특이값 인덱스(1120)를 도시하고, y축은 정규화된 특이값 강도(1121)를 도시한다. 명확성을 위해서, 모든 두 번째 특이값만이 도시된다. 크로스(1122) 및 플러스(1124) 표시는 선형 형광물질()을 나타내고, 전자는 단일 빔(single-beam) 여기(1122)에 대한 것이고, 후자는 결합된 단일 빔 여기 및 이중 빔 여기(1124)에 대한 것이다. 도시된 바와 같이, 이중 빔 여기(1124)에 기인한 추가적인 특이값의 정규화된 강도는 기계 정밀도까지 떨어졌고, 이것은 이중 빔 여기를 가진 측정이 FDOT의 일-포우즈드니스를 경감시키지 않을 수 있다는 것을 나타낸다. 다시 말해, D-유형 이미지는 기존 S-유형 이미지보다 더 많은 정보를 제공하지 않을 수 있다. 그래서, 재구성의 질을 향상시키지 않을 수 있다. 하지만, 도 12에서 에스터리스크(1123) 및 점(1125)에 표시된 이차 형광물질에 대해서, 추가적인 특이값의 강도(1125)는 여전히 중요하다. 이것은 D-유형 이미지가 재구성의 질에 기여할 것이라는 것을 시사한다.
실험은 660 nm에서 μa= 0.29 cm-1 및 μ's= 10.0 cm-1의 광학 속성을 가진 젤라틴 팬텀에서 수행되었고, 비행시간법 분광학 시스템을 가지고 측정되었다[참조 3]. 로다민 6G(c =0.1μM) 및 NaYF4: Yb3 +/Tm3 + 나노입자들(c = 0.1wt%)의 용액들로 각각 채워진 두 개의 모세관이 형광 병변을 시뮬레이션하기 위해서 사용되었다. 실험적인 셋업 및 대응하는 실행 파라미터들은 앞선 작업에서 사용된 것들과 유사하였다[참조 1]. 조사 중인 팬텀의 제한된 영역 때문에, 본 공개에서는 단지 9개의 여기 위치들(3 x 3 그리드)이 사용되었다. 두 개의 가장 가깝게 이웃하는 위치들의 간격은 3.5 mm였고, 각각의 여기 빔은 약 2.6 mm의 직경을 가졌다. 실험 동안, 단일한 여기 빔이 3 x 3 그리드 위로 스캔하기 위해서 먼저 사용되었고, 하나의 이미지가 CCD 카메라에 의해서 각각의 스캔된 위치에 대해 캡처되었다. 다음 단계에서, 동일한 그리드의 두 개의 가장 가깝게 이웃하는 위치들에 배치된 두 개의 여기 빔은 팬텀을 조명하기 위해서 동시에 채용되었고, 6개의 추가 D-유형 이미지를 제공한다.
도 13의 (a) 및 (b)는 재구성된 업컨버팅 나노입자들의 3차원 렌더링을 도시한다. 각 도면에서 빨간색 원기둥은 동일하고 진정한 형광 병변을 나타낸다. 도 13의 (a)에서는, S-유형 이미지들만 이용되었다. 알 수 있는 바와 같이, 형광 병변의 형상이 과대평가된다. 이러한 과대평가는 인버스 문제의 일-포우즈드니스에 의해 설명될 수 있다. D-유형 이미지들을 추가할 때, 형광 병변 형상의 재구성은 도 13의 (b)에서 도시된 바와 같이 현저하게 향상된다. 두 재구성 간의 차이를 강조하기 위해서, 재구성된 관련 형광물질 분포의 단면 슬라이스들이 도 14의 (a) 내지 (f)에서 도시된다. 깊이가 양쪽 재구성 둘 다에 대해서 (원으로 표시된) 형광 병변의 중심에서 상대적으로 잘 재구성될지라도, 재구성된 형광 병변은 S-유형 및 D-유형 이미지들 양쪽 모두를 이용하는 경우에 대하여 더욱 국한된다. 이 결과는 D-유형의 이미지들이 인버스 문제에 실제로 기여하고 이차 업컨버팅 나노입자들에 대한 더욱 나은 재구성으로 인도한다는 것을 확인해 준다. 선형 로다민 6G에 대한 해당 재구성 또한 수행되었으며, 그 단면 슬라이스들은 도 15의 (a) 내지 (f)에서 도시된다. 나노입자들에 대한 결과와 비교하여, 로다민 6G에 대한 재구성은 D-유형 이미지들을 추가하는 것으로부터 이익이 없으며, 이것은 이론과 일치한다. 형광 병변의 진정한 깊이 또한 빈약하게 재구성된다.
업컨버팅 나노입자들의 비선형 파워 의존성의 추가적인 고유한 이점이 공개된다. 이 이점은 동시에 둘 이상의 여기 빔들을 가지고 얻은 이미지를 이용함으로써 인버스 문제를 위해 추가적인 정보를 획득할 가능성을 허용한다. 이것이 향상된 재구성을 낳는다는 것을 발견하였다. 동일한 이점이 선형 형광물질, 예컨대 로다민 6G를 사용할 때 발견될 수 없다.
본 공개는 비선형 발광 이미징 및 단층촬영의 실시 예들을 나타낸다. 실험에서, 업컨버팅 나노결정을 가진 이미징이 생체 조직과 비슷한 산란 매체에서 가능하다는 것을 보였다. 게다가, 시뮬레이션은 업컨버팅 나노결정과 함께 작용하도록 형광 광학 단층촬영에서 사용된 이론을 채용하는 것이 가능하다는 것을 보였다.
본 공개에서 사용된 업컨버팅 나노결정 입자들은 유기 형광 물질과 비교하여 고유한 광학 속성 덕분에 생체 마커를 위한 것과 같은 다양한 어플리케이션을 가진다.
본 발명은 구체적인 실시 예들을 참조하여 상술되었다. 하지만, 상술된 것이 아닌 다른 실시 예들이 본 발명의 범위 내에서 동등하게 가능하다. 본 발명의 상이한 특징들 및 단계들은 상술한 것이 아닌 다른 조합으로 결합될 수 있다. 본 발명의 범위는 첨부된 특허청구범위에 의해서만 제한된다.
본 방법은 살아있는 인간 또는 동물의 몸의 생체 내에서 수행될 수 있다. 이 경우에 마커는, 혈류로 또는 피하로 또는 종양으로 직접 주사에 의해서 또는 이와 달리 국소(topical) 어플리케이션, 폐 및 다른 비침습적 방법에 의해서와 같이 임의의 방식으로 미리 유입될 수 있다. 이러한 미리 유입은 나머지 방법들과는 별도로 수행될 수 있다. 이러한 미리 유입은 나머지 방법들과 연계하되 바로 그 직전에 수행될 수 있다.
대안적으로 또는 부가적으로, 방법은 방법이 수행된 후에 희생되는 인간 또는 동물 몸에서 수행될 수 있다.
대안적으로 또는 부가적으로, 방법은 살아있지 않은 인간 또는 동물의 몸 또는 몸의 일부, 예컨대 뇌사 상태(brain-dead)의 인간 또는 동물의 몸의 생체 내에서 수행될 수 있다.
대안적으로 또는 부가적으로, 방법은 필터 또는 태블릿과 같은 비의료(non-medical) 분야에서 수행될 수 있다.
다음의 참조들은 모든 목적을 위해서 전부 본 명세서의 이 부분에 참조에 의해서 통합된다:
[참조 1] C. T. Xu, J. Axelsson, and S. Andersson-Engels, Appl. Phys. Lett. 94, 251107 (2009).
[참조 2] J. P. Culver, V. Ntziachristos, M. J. Holboke, and A. G. Yodh, Opt. Lett. 26, 701 (2001).
[참조 3] E. Alerstam, S. Andersson-Engels, and T. Svensson, J. Biomed. Opt. 13, 041304 (2008).
Claims (41)
- 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법으로서,
상기 영역은 마커 위치에서 상기 산란 매체 내에 배열된 적어도 하나의 발광 마커를 포함하고, 상기 발광 마커는 비선형 발광 마커이고;
상기 방법은:
하나 이상의 광원에 의하여 적어도 하나의 광원 위치로부터 여기 볼륨(excitation volume)으로 방출된 여기광(excitation light)에 의해서 상기 발광 마커를 여기시키는 단계; 및
발광 빛 검출 위치에서 검출기에 의해 상기 여기광에 기인하여 상기 발광 마커로부터 발광을 검출하는 단계;
상기 광원 위치와 상기 마커 위치 사이에서 움직임을 제공하는 단계;
상기 마커 위치와 관련하여 상기 광원 위치 및 상기 여기광 강도에서 상기 검출된 발광의 비선형 의존성을 기초로 하여 상기 발광 마커를 이미징하는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 1 항에 있어서,
상기 비선형 의존성은 L=k*E^x 관계에 의해서 주어지고,
E는 상기 여기 볼륨에서 여기광 강도이고,
L은 상기 발광 마커로부터의 발광 빛 강도이고,
k는 양의 상수이고,
x는 1보다 큰 양수인 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 1 항에 있어서,
상기 움직임을 제공하는 단계는 상기 마커 위치와 관련하여 상기 광원 위치를 움직이는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 1 항에 있어서,
상기 움직임을 제공하는 단계는 상기 광원 위치와 관련하여 상기 마커 위치를 움직이는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 3 항에 있어서,
상기 광원 위치가 상기 마커 위치와 관련하여 움직이도록 복수의 상기 광원 위치들 사이에서 상기 하나 이상의 여기 빔을 스캐닝하는 하는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 5 항에 있어서,
상기 복수의 광원 위치들 각각에 대하여 상기 발광 마커의 전체 발광 강도를 갖는 상기 발광을 상기 복수의 광원 위치들 각각에 대해서 검출하는 단계,
상기 복수의 광원 위치들 각각에 대하여 상기 전체 발광 강도의 이미지를 만듦으로써 상기 발광 마커를 이미징하는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 6 항에 있어서,
상기 전체 발광 강도는 상기 발광 마커의 상기 발광을 합함으로써 제공되는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 5 항에 있어서,
상기 복수의 광원 위치들은 그리드 패턴을 형성하고, 상기 발광 마커는 상기 그리드 패턴 상에 투사된 영역을 갖는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 8 항에 있어서,
상기 투사된 영역은 상기 그리드 패턴에 의해 커버된 영역보다 작은 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 8 항에 있어서,
상기 여기 볼륨이 상기 그리드 패턴에서 두 개의 연속적인 광원 위치들 사이에서 실질적으로 오버랩되지 않도록, 상기 하나 이상의 광원은 상기 복수의 광원 위치들 사이에서 스캔되는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 9 항에 있어서,
상기 광원 위치가 상기 투사된 영역과 부분적으로 오버랩된다면 상기 발광 마커가 부분적으로 여기되도록, 상기 여기 볼륨은 상기 복수의 광원 위치들 각각으로 실질적으로 국부화되는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 1 항 내지 제 11 항 중 어느 한 항에 있어서,
동시에 둘 이상의 광원에 의해 상기 발광 마커를 여기시키는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 1 항 내지 제 12 항 중 어느 한 항에 있어서,
제1 광원 위치로부터 제1 파장을 갖는 제1 광원에 의해 상기 발광 마커를 여기시키는 단계,
제2 광원 위치로부터 제2 파장을 갖는 제2 광원에 의해 상기 발광 마커를 여기시키는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 13 항에 있어서,
상기 제1 파장은 상기 제2 파장과 실질적으로 동일한 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 13 항에 있어서,
상기 발광 마커는 동시에 상기 제1 및 제2 광원들에 의해 여기되는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 13 항에 있어서,
상기 제1 및 제2 광원 위치들의 적어도 하나는 상기 마커 위치와 관련하여 움직이는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 1 항 내지 제 16 항 중 어느 한 항에 있어서,
상기 확산 발광 이미징은 확산 발광 단층촬영을 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 17 항에 있어서,
상기 광원 위치가 상기 마커 위치와 관련하여 움직이도록, 복수의 상이한 광원 위치들 사이에서 상기 하나 이상의 광원을 스캐닝하는 단계, 및
상기 복수의 상이한 광원 위치들 각각에 대해서 상기 발광 마커의 발광 이미지들을 제공하기 위하여 상기 발광을 검출하는 단계,
상기 발광 이미지들로부터 상기 발광 마커의 3차원 단층촬영 이미지를 재구성하는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 18 항에 있어서,
상기 3차원 단층촬영 이미지를 재구성하는 단계는,
상기 여기광으로부터 여기장(excitation field)을 계산하는 단계,
상기 발광 마커로부터 방출장(emission field)을 계산하는 단계,
상기 비선형 의존성에 따라 상기 여기장의 곱을 계산하는 단계를 포함하고,
상기 방출장의 상기 계산은 상기 곱을 기초로 하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 19 항에 있어서,
상기 곱을 계산하는 단계는 상기 비선형 관계의 파워 의존성에 대응하는 파워까지 증가된 장 세기(field strength)의 곱을 형성하도록 상기 여기장의 상기 장 세기를 곱하는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 20 항에 있어서,
상기 장 세기의 이차(quadratic) 곱을 계산하는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 제 1 항에 있어서,
상기 움직임을 제공하는 단계는 상기 마커 위치와 관련하여 상기 발광 빛 검출 위치를 움직이는 단계를 포함하는 것을 특징으로 하는 확산 발광 분자 이미징에 의하여 산란 매체에서의 영역을 이미징하는 방법. - 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템으로서,
상기 시스템은 상기 산란 매체의 상기 발광 분자 이미징에서 사용하기 위한 발광 마커를 포함하고, 상기 발광 마커는 상기 산란 매체 내에 배열된 비선형 발광 마커이고,
상기 시스템은,
하나 이상의 광원에 의해 여기 볼륨으로 방출된 여기광에 의하여 상기 발광 마커를 여기시키기 위한 적어도 하나의 광원 위치에 의해 배치된 하나 이상의 광원,
상기 여기광에 기인하여 상기 발광 마커로부터 발광을 검출하는 발광 빛 검출 위치에서의 검출기를 포함하고,
상기 발광 분자 이미징은 상기 마커 위치와 관련하여 상기 광원 위치 및 상기 여기광 강도에서 상기 검출된 발광의 비선형 의존성을 기초로 한 상기 발광 마커를 이미징하는 것을 포함하는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항에 있어서,
상기 발광 마커는 조명 파장의 들어오는 빛을 업컨버팅하도록 구성된 비선형 발광 마커들의 그룹으로 이루어지고,
상기 발광 마커가 상기 들어오는 빛으로 조명될 때 상기 조명 파장보다 더 짧은 발광 파장에서 발광이 발생하는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 또는 제 24 항에 있어서,
상기 발광 마커는 발광 생체 마커이고, 상기 산란 매체는 인간 또는 동물의 조직이고, 상기 발광 생체 마커는 상기 조직 내에 배열될 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제 25 항 중 어느 한 항에 있어서,
상기 발광 마커는 나노사이즈의(nanosized) 업컨버팅 입자들을 포함하는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 26 항에 있어서,
상기 나노사이즈의 업컨버팅 입자들은 Yb3 +/Er3 + 또는 Yb3 +/Tm3 +로 함께 도핑된 나트륨 이트륨 4불소(NaYF4)로 이루어진 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제 26 항 중 어느 한 항에 있어서,
상기 비선형 발광 마커는 수용성인 입자들을 포함하는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 28 항에 있어서,
상기 입자들은 극성인 구조를 가지고 코팅된 나노사이즈의 업컨버팅 입자들인 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 28 항에 있어서,
상기 입자들은 업컨버팅 입자들의 표면에 부착된 수산기 그룹을 갖는 나노사이즈의 업컨버팅 입자들인 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제 30 항 중 어느 한 항에 있어서,
상기 마커는 보호 코팅을 갖는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제 31 항 중 어느 한 항에 있어서,
상기 발광 마커는 생물학적으로 기능하도록 된(biofunctionalized) 생체 마커인 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제 32 항 중 어느 한 항에 있어서,
상기 시스템은 발광 분자 단층촬영을 위하여 마련된 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제 32 항 중 어느 한 항에 있어서,
상기 비선형 마커는 상기 발광 이미징을 위한 방식과 다른 이미징 방식을 위한 이미징 콘트라스트제에 부착된 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 34 항에 있어서,
상기 비선형 마커는, 상자성(paramagnetic properties)을 갖는, 유기 가돌리늄(organic gadolinium) 복합체 또는 가돌리늄 화합물에 부착되고,
상기 시스템은 MRI 및 발광 분자 단층촬영에 의해 상기 관심 영역의 동시 이미징을 위한 자기 공명 이미징(MRI) 장치를 더 포함하는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제 35 항 중 어느 한 항에 있어서,
조명 파장의 상기 들어오는 빛은 둘 이상의 여기 빔들로 동시에 구성되는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 23 항 내지 제36 항 중 어느 한 항에 있어서,
상기 여기광은 제1 광원 위치로부터 제1 파장을 갖는 제1 광원 및 제2 광원 위치로부터 제2 파장을 갖는 제2 광원에 의해서 제공되는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 제 37 항에 있어서,
상기 여기광은 상기 제1 및 제2 광원들에 의하여 동시에 제공되는 것을 특징으로 하는 산란 매체에서 관심 영역의 확산 발광 분자 이미징을 위한 시스템. - 태블릿의 발광 이미징 또는 발광 단층촬영을 위해 제 23 항 내지 제 38 항 중 어느 한 항에 따른 시스템을 이용.
- 작은 동물의 생체 내 또는 생체 외 발광 이미징 또는 발광 단층촬영을 위해 제 23 항 내지 제 38 항 중 어느 한 항에 따른 시스템을 이용.
- 상기 발광 이미징 또는 발광 단층촬영에 의해 암 진단과 같은 기능적 진단을 위해 제 23 항 내지 제 38 항 중 어느 한 항에 따른 시스템을 이용.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE0950313 | 2009-05-05 | ||
| SE0950313-7 | 2009-05-05 | ||
| US21588109P | 2009-05-12 | 2009-05-12 | |
| US61/215,881 | 2009-05-12 | ||
| US25513909P | 2009-10-27 | 2009-10-27 | |
| US61/255,139 | 2009-10-27 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120036304A true KR20120036304A (ko) | 2012-04-17 |
Family
ID=42312993
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117028821A KR20120036304A (ko) | 2009-05-05 | 2010-05-05 | 산란 매체에서의 향상된 확산 발광 이미징 또는 단층촬영을 위한 시스템, 방법, 및 발광 마커 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US9012869B2 (ko) |
| EP (1) | EP2427100B1 (ko) |
| JP (3) | JP2012525883A (ko) |
| KR (1) | KR20120036304A (ko) |
| CN (1) | CN102497803B (ko) |
| AU (1) | AU2010244431B2 (ko) |
| BR (1) | BRPI1011413B1 (ko) |
| CA (1) | CA2760783C (ko) |
| IL (1) | IL216125A (ko) |
| SG (1) | SG175923A1 (ko) |
| WO (1) | WO2010128090A1 (ko) |
| ZA (1) | ZA201108562B (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190080296A (ko) | 2017-12-28 | 2019-07-08 | 주식회사 에스에프에이 | 멀티 트레이 무인 반송대차 시스템 |
| KR20220164911A (ko) * | 2021-06-07 | 2022-12-14 | 전남대학교산학협력단 | 유전자 조작 박테리아를 이용한 소장 내 급성 저산소성 허혈성 조직 진단에 필요한 정보를 제공하는 방법 |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5945226B2 (ja) * | 2009-09-22 | 2016-07-05 | ビセン メディカル, インコーポレイテッド | 拡散媒質の仮想屈折率整合のためのシステムおよび方法 |
| JP6087049B2 (ja) | 2011-11-02 | 2017-03-01 | 浜松ホトニクス株式会社 | 蛍光ファントム装置および蛍光イメージング方法 |
| CN104603600B (zh) * | 2012-07-01 | 2017-09-01 | 卢米托股份有限公司 | 用于散射介质中改进的扩散发光成像或者断层照相的系统和方法 |
| CN103207168A (zh) * | 2012-12-26 | 2013-07-17 | 西安交通大学 | 一种心肌细胞膜电位功能信息光学重构方法 |
| CN104674994A (zh) * | 2015-01-09 | 2015-06-03 | 湘潭市众成宏鑫建筑材料有限公司 | 一种用于现浇空心楼盖的组合芯模及其制作方法 |
| US11971354B2 (en) | 2015-04-08 | 2024-04-30 | Molecular Devices, Llc | Methods and systems for fluorescence detection using infrared dyes |
| US10379046B2 (en) * | 2015-04-08 | 2019-08-13 | Molecular Devices, Llc | Method and system for multiplexed time-resolved fluorescence detection |
| EP3420535B1 (en) | 2016-02-26 | 2022-09-07 | University Of Southern California | Optimized volumetric imaging with selective volume illumination and light field detection |
| US9730649B1 (en) | 2016-09-13 | 2017-08-15 | Open Water Internet Inc. | Optical imaging of diffuse medium |
| DE102016124730A1 (de) * | 2016-12-16 | 2018-06-21 | Olympus Winter & Ibe Gmbh | Endoskopiesystem und Lichtquelle eines Endoskopiesystems |
| EP3809138A1 (en) | 2017-06-08 | 2021-04-21 | Lumito AB | A method of analysing a sample for at least one analyte |
| US10778912B2 (en) | 2018-03-31 | 2020-09-15 | Open Water Internet Inc. | System and device for optical transformation |
| US10778911B2 (en) | 2018-03-31 | 2020-09-15 | Open Water Internet Inc. | Optical transformation device for imaging |
| US10506181B2 (en) | 2018-03-31 | 2019-12-10 | Open Water Internet Inc. | Device for optical imaging |
| US10966612B2 (en) | 2018-06-14 | 2021-04-06 | Open Water Internet Inc. | Expanding beam optical element |
| US10962929B2 (en) | 2018-09-14 | 2021-03-30 | Open Water Internet Inc. | Interference optics for optical imaging device |
| US10874370B2 (en) | 2019-01-28 | 2020-12-29 | Open Water Internet Inc. | Pulse measurement in optical imaging |
| US10955406B2 (en) | 2019-02-05 | 2021-03-23 | Open Water Internet Inc. | Diffuse optical imaging with multiple beams |
| US11320370B2 (en) | 2019-06-26 | 2022-05-03 | Open Water Internet Inc. | Apparatus for directing optical and acoustic signals |
| US11581696B2 (en) | 2019-08-14 | 2023-02-14 | Open Water Internet Inc. | Multi-channel laser |
| US11622686B2 (en) | 2019-11-22 | 2023-04-11 | Open Water Internet, Inc. | Optical imaging with unshifted reference beam |
| US11819318B2 (en) | 2020-04-27 | 2023-11-21 | Open Water Internet Inc. | Optical imaging from light coherence |
| US11259706B2 (en) | 2020-05-19 | 2022-03-01 | Open Water Internet Inc. | Dual wavelength imaging and out of sample optical imaging |
| US11559208B2 (en) | 2020-05-19 | 2023-01-24 | Open Water Internet Inc. | Imaging with scattering layer |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5451785A (en) | 1994-03-18 | 1995-09-19 | Sri International | Upconverting and time-gated two-dimensional infrared transillumination imaging |
| US5832931A (en) * | 1996-10-30 | 1998-11-10 | Photogen, Inc. | Method for improved selectivity in photo-activation and detection of molecular diagnostic agents |
| US20010032053A1 (en) * | 2000-01-24 | 2001-10-18 | Hielscher Andreas H. | Imaging of a scattering medium using the equation of radiative transfer |
| EP1207387A1 (en) * | 2000-11-20 | 2002-05-22 | Institut Curie | Multi-photon imaging installation. |
| US6615063B1 (en) | 2000-11-27 | 2003-09-02 | The General Hospital Corporation | Fluorescence-mediated molecular tomography |
| US6687620B1 (en) * | 2001-08-01 | 2004-02-03 | Sandia Corporation | Augmented classical least squares multivariate spectral analysis |
| JP4804665B2 (ja) * | 2001-08-09 | 2011-11-02 | オリンパス株式会社 | レーザ顕微鏡 |
| EP3252139A1 (en) * | 2001-09-06 | 2017-12-06 | Rapid Micro Biosystems, Inc. | Rapid detection of replicating cells |
| JP2003344285A (ja) * | 2002-05-24 | 2003-12-03 | Japan Science & Technology Corp | 環状断面レーザ光ビーム生成器および多光子顕微鏡 |
| US7303741B2 (en) | 2002-09-23 | 2007-12-04 | General Electric Company | Systems and methods for high-resolution in vivo imaging of biochemical activity in a living organism |
| DE10255013B4 (de) | 2002-11-25 | 2004-12-09 | Siemens Ag | Verfahren und Vorrichtung zur Lokalisierung von Licht emittierenden Bereichen |
| US7510699B2 (en) * | 2003-02-19 | 2009-03-31 | Sicel Technologies, Inc. | In vivo fluorescence sensors, systems, and related methods operating in conjunction with fluorescent analytes |
| EP1727460A2 (en) | 2004-03-11 | 2006-12-06 | The General Hospital Corporation | Method and system for tomographic imaging using fluorescent proteins |
| JP4309787B2 (ja) * | 2004-03-12 | 2009-08-05 | オリンパス株式会社 | 多光子励起型測定装置 |
| US7302348B2 (en) * | 2004-06-02 | 2007-11-27 | Agilent Technologies, Inc. | Method and system for quantifying and removing spatial-intensity trends in microarray data |
| JP2006023382A (ja) | 2004-07-06 | 2006-01-26 | Olympus Corp | 光走査型観察装置 |
| JP4471162B2 (ja) | 2004-07-14 | 2010-06-02 | 富士フイルム株式会社 | 蛍光ct装置 |
| WO2006102395A2 (en) * | 2005-03-22 | 2006-09-28 | Medstar Health Inc | Delivery systems and methods for diagnosing and treating cardiovascular diseases |
| WO2007009812A1 (de) * | 2005-07-22 | 2007-01-25 | Carl Zeiss Microimaging Gmbh | Auflösungsgesteigerte lumineszenz-mikroskopie |
| WO2007054846A2 (en) * | 2005-11-10 | 2007-05-18 | Philips Intellectual Property & Standards Gmbh | Absorption and scattering map reconstruction for optical fluorescence tomography |
| EP2460868A3 (en) | 2006-01-06 | 2013-06-19 | National University of Singapore | Method of preparing nano-structured material(s) and uses thereof |
| US8084753B2 (en) * | 2006-03-20 | 2011-12-27 | Baylor College Of Medicine | Method and system for non-contact fluorescence optical tomography with patterned illumination |
| FR2900043B1 (fr) | 2006-04-24 | 2008-07-04 | Commissariat Energie Atomique | Procede d'imagerie optique par fluorescence de tissus biologiques, notamment pour delimiter des regions d'interet des tissus a analyser par tomographie |
| SG175647A1 (en) | 2006-10-17 | 2011-11-28 | Univ Singapore | Upconversion fluorescent nano-structured material and uses thereof |
| GB0707433D0 (en) * | 2007-04-18 | 2007-05-23 | Stfc Science & Technology | Fluorescence measurement |
| WO2009046392A1 (en) | 2007-10-04 | 2009-04-09 | Trustees Of Princeton University | Synthesis of bio-functionalized rare earth doped upconverting nanophosphors |
| WO2010107720A2 (en) * | 2009-03-18 | 2010-09-23 | Tuan Vo-Dinh | Up and down conversion systems for production of emitted light from various energy sources |
-
2010
- 2010-05-05 BR BRPI1011413-0A patent/BRPI1011413B1/pt active IP Right Grant
- 2010-05-05 US US13/318,403 patent/US9012869B2/en active Active
- 2010-05-05 KR KR1020117028821A patent/KR20120036304A/ko active IP Right Grant
- 2010-05-05 SG SG2011081874A patent/SG175923A1/en unknown
- 2010-05-05 AU AU2010244431A patent/AU2010244431B2/en active Active
- 2010-05-05 WO PCT/EP2010/056127 patent/WO2010128090A1/en active Application Filing
- 2010-05-05 EP EP10720382.0A patent/EP2427100B1/en active Active
- 2010-05-05 CA CA2760783A patent/CA2760783C/en active Active
- 2010-05-05 CN CN201080030265.6A patent/CN102497803B/zh active Active
- 2010-05-05 JP JP2012509034A patent/JP2012525883A/ja active Pending
-
2011
- 2011-11-03 IL IL216125A patent/IL216125A/en active IP Right Grant
- 2011-11-22 ZA ZA2011/08562A patent/ZA201108562B/en unknown
-
2016
- 2016-04-20 JP JP2016084227A patent/JP6650334B2/ja active Active
-
2018
- 2018-05-22 JP JP2018097799A patent/JP2018128470A/ja active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190080296A (ko) | 2017-12-28 | 2019-07-08 | 주식회사 에스에프에이 | 멀티 트레이 무인 반송대차 시스템 |
| KR20220164911A (ko) * | 2021-06-07 | 2022-12-14 | 전남대학교산학협력단 | 유전자 조작 박테리아를 이용한 소장 내 급성 저산소성 허혈성 조직 진단에 필요한 정보를 제공하는 방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| SG175923A1 (en) | 2011-12-29 |
| CA2760783A1 (en) | 2010-11-11 |
| JP2016135316A (ja) | 2016-07-28 |
| CN102497803A (zh) | 2012-06-13 |
| US9012869B2 (en) | 2015-04-21 |
| BRPI1011413B1 (pt) | 2021-09-14 |
| AU2010244431B2 (en) | 2015-05-14 |
| US20120104281A1 (en) | 2012-05-03 |
| EP2427100A1 (en) | 2012-03-14 |
| BRPI1011413A2 (pt) | 2016-03-15 |
| CN102497803B (zh) | 2015-03-25 |
| EP2427100B1 (en) | 2021-08-11 |
| IL216125A (en) | 2014-11-30 |
| JP2012525883A (ja) | 2012-10-25 |
| AU2010244431A1 (en) | 2011-12-01 |
| IL216125A0 (en) | 2012-01-31 |
| WO2010128090A1 (en) | 2010-11-11 |
| CA2760783C (en) | 2018-06-19 |
| JP2018128470A (ja) | 2018-08-16 |
| ZA201108562B (en) | 2015-05-27 |
| JP6650334B2 (ja) | 2020-02-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6650334B2 (ja) | 散乱媒体の拡散ルミネセンスイメージングまたは断層撮影の改善のためのシステム、方法、およびルミネセンスマーカー | |
| Chen et al. | Near-infrared luminescence high-contrast in vivo biomedical imaging | |
| Ntziachristos et al. | Fluorescence imaging with near-infrared light: new technological advances that enable in vivo molecular imaging | |
| Graves et al. | Fluorescence molecular imaging of small animal tumor models | |
| Zacharakis et al. | Fluorescent protein tomography scanner for small animal imaging | |
| JP6443934B2 (ja) | 散乱媒体中の改善された拡散ルミネセンスイメージングまたは断層撮影法のためのシステム | |
| JP2001503748A (ja) | 分子薬の光活性における選択性改善と検出のための方法 | |
| CA2877437A1 (en) | Method and arrangement for the relative position detection of stations by means of radio location | |
| US7809431B2 (en) | Method of optically imaging biological tissues by using fluorescence, in particular for defining regions of interest in tissues to be analyzed by tomography | |
| Mansfield et al. | Distinguished photons: increased contrast with multispectral in vivo fluorescence imaging | |
| Xu | 17 Selected Topics in Biomedical Engineering | |
| Patwardhan et al. | Fluorescence molecular Imaging: Microscopic to macroscopic | |
| Da Silva et al. | In vivo fluorescence molecular optical imaging: from small animal towards clinical applications | |
| Zhou et al. | NIR imaging the delivery of cathepsin B probe to breast tumors | |
| NTZIACHRISTOS et al. | In Vivo Optical Imaging of Molecular Function Using Near-Infrared Fluorescent Probes | |
| Hwang | Improved fluorescence-enhanced optical imaging and tomography by enhanced excitation light rejection | |
| Zacharakis et al. | Three-dimensional optical tomography of fluorescent proteins in the visible | |
| Andersson-Engels et al. | Upconverting nanoparticles as contrast agents for in vivo luminescence imaging and tomography | |
| Terike et al. | Analysis of a fluorescence spectrum for determination of fluorophore depth |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |