BRPI1011413B1 - Sistema, método e marcador luminescente para geração de imagem luminescente difusa melhorada ou tomografia em meio de dispersão - Google Patents
Sistema, método e marcador luminescente para geração de imagem luminescente difusa melhorada ou tomografia em meio de dispersão Download PDFInfo
- Publication number
- BRPI1011413B1 BRPI1011413B1 BRPI1011413-0A BRPI1011413A BRPI1011413B1 BR PI1011413 B1 BRPI1011413 B1 BR PI1011413B1 BR PI1011413 A BRPI1011413 A BR PI1011413A BR PI1011413 B1 BRPI1011413 B1 BR PI1011413B1
- Authority
- BR
- Brazil
- Prior art keywords
- excitation
- marker
- luminescent
- light source
- light
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0062—Arrangements for scanning
- A61B5/0068—Confocal scanning
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0073—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence by tomography, i.e. reconstruction of 3D images from 2D projections
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/05—Detecting, measuring or recording for diagnosis by means of electric currents or magnetic fields; Measuring using microwaves or radio waves
- A61B5/055—Detecting, measuring or recording for diagnosis by means of electric currents or magnetic fields; Measuring using microwaves or radio waves involving electronic [EMR] or nuclear [NMR] magnetic resonance, e.g. magnetic resonance imaging
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
- G01N21/4795—Scattering, i.e. diffuse reflection spatially resolved investigating of object in scattering medium
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Physics & Mathematics (AREA)
- General Health & Medical Sciences (AREA)
- Pathology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- Medical Informatics (AREA)
- Animal Behavior & Ethology (AREA)
- Heart & Thoracic Surgery (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biophysics (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Surgery (AREA)
- Radiology & Medical Imaging (AREA)
- Optics & Photonics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- High Energy & Nuclear Physics (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Magnetic Resonance Imaging Apparatus (AREA)
- Analysing Materials By The Use Of Radiation (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
- Endoscopes (AREA)
Abstract
sistema, método e marcador luminescente para geração de imagem luminescente difusa melhorada ou tomografia em meio de dispersão. um método e um sistema para geração de imagens de luminescência molecular ou tomografia de uma região de interesse em um meio de dispersão é divulgado. o sistema inclui um material marcador luminescente não-linear disposto no meio de dispersão. o contraste e a resolução da imagem ou da tomografia são assim melhorados. 0 marcador não-linear é, por exemplo, configurado para converter a luz recebida de um comprimento de onda de iluminação. a dependência de energia não-linear do marcador permite um maior aperfeiçoamento da imagem usando-se imagens tiradas com dois ou mais feixes de excitação simultaneamente.
Description
A presente invenção pertence, de modo abrangente, ao campo de geração de imagem de fotoluminescência ou tomografia fotoluminescente por absorção de meios de dispersão, bem como a marcadores fotoluminescentes para a referida geração de 10 imagem de fotoluminescência ou tomografia fotoluminescente por absorção de meios de dispersão.
Um exemplo de um meio de dispersão que é de interesse para a geração de imagem de fotoluminescência (em imagem de 15 luminescência curta) ou tomografia de fotoluminescência (em tomografia de luminescência curta) é o tecido biológico. A óptica dos tecidos é um campo dedicado a estudar a interação da luz com os referidos tecidos. Nas últimas décadas este campo tem crescido rapidamente. Com o conhecimento cada vez 20 maior da interação entre luz e tecido, o interesse em se aplicar a óptica de tecidos como ferramenta de diagnóstico fundamental.
Uma área na óptica dos tecidos, e de que a presente invenção trata em parte, é a de imagem de fotoluminescência incluindo tomografia fotoluminescência, que são abordagens 5 não invasivas para a formação in vivo de imagens de seres humanos ou animais. Estas abordagens de imagem são baseadas em luminescência e requerem uma fonte externa de luz para excitação dos marcadores biológicos luminescentes.
A fotoluminescência é um processo no qual uma substância 10 absorve fótons e, em seguida, re-irradia fótons. A forma especifica de luminescência neste caso é a fluorescência, onde os fótons emitidos são normalmente de menor energia do que os utilizados para a iluminação. Assim, em fluorescência, o comprimento de onda fluorescente é deslocado em Stokes para 15 um comprimento de onda com referência ao comprimento de onda da luz de iluminação.
Imagens obtidas por fluorescência são conhecidas e podem, por exemplo, ser usadas para estudar as respostas biológicas de drogas em pequenos animais ao longo de um 20 periodo de tempo, sem a necessidade de sacrificá-los.
Os pesquisadores Shimomura, Chalfie e Tsien foram recompensados com o prêmio Nobel, em 2008, pela descoberta e desenvolvimento da proteína verde fluorescente, que se tornou um marco muito importante na área de fluorescência.
No entanto, até então, imagens de fluorescência molecular e sistemas para geração de imagens de tomografia 5 luminescente difusa ou tomografia luminescente difusa em meio de absorção e dispersão sofriam com uma série de inconvenientes. Elas têm, por exemplo, uma baixa resolução ou contraste, o que torna as tarefas de diagnóstico baseado nos resultados de imagem consideravelmente difícil. Portanto, há 10 uma necessidade de tais sistemas com uma melhor qualidade de imagem, por exemplo, com melhor contraste e/ou resolução das imagens bidimensionais ou tridimensionais fornecidas.
Além disso, estes sistemas são sensíveis à, sempre presente, autofluorescência de tecidos endógenos, que leva a 15 uma deterioração dos resultados de medição. Uma vez que o sinal de fluorescência dos marcadores biológicos fluorescentes e a autofluorescência de fundo muitas vezes sobrepõe-se, a separação dos sinais é difícil e muitas vezes não é possível de forma confiável.
A autofluorescência esconde o sinal de fluorescência quando se utiliza de fluoróforos com deslocamento Stokes, efetivamente limitando a sensibilidade entre sinal e ruído.
Assim, há uma necessidade de imagens difusa luminescentes ou luminescentes melhores. Um sistema de tomografia, com um método ou marcadores luminescentes para imagem luminescente ou tomografia luminescente, em 5 particular, que permitam uma maior eficácia em termos de contraste melhorado e/ou resolução de imagem melhorada se faz necessária.
Assim, as modalidades da presente invenção 10 preferencialmente buscam mitigar, aliviar ou eliminar uma ou mais deficiências, desvantagens ou problemas encontrados no estado da técnica, como os acima identificados, isolados ou em qualquer combinação, fornecendo um sistema, um método, e um uso de acordo com as reivindicações que são apresentadas 15 nesta pedido.
O presente relatório descritivo mostra que, ao se substituir os tradicionais fluoróforos com deslocamento Stokes por um novo tipo de marcador luminescente, ou seja, um marcador não-linear, permite que os objetos e melhorias acima 20 sejam alcançados.
De acordo com um primeiro aspecto da invenção, um método de formar uma imagem de uma região em um meio de dispersão por formação de imagem difusa por luminescência molecular é fornecido. A região compreende pelo menos um marcador luminescente disposto no meio de dispersão em uma posição do marcador, onde o marcador luminescente é um marcador luminescente não-linear. 0 método compreende excitar o marcador luminescente por excitação de emissão por luz por uma ou mais fontes de luz em um volume de excitação de pelo menos uma posição de fonte de luz; a detecção da luminescência do marcador luminescente, devido à luz de excitação, por um detector em uma posição luminescente de detecção de luz; o fornecimento de movimento entre a posição de fonte de luz e a posição do marcador; e a formação de imagens do marcador luminescente com base em uma dependência não-linear da luminescência detectada na intensidade da luz de excitação e a posição da fonte de luz em relação à posição do marcador.
De acordo com um segundo aspecto da invenção, um sistema de imagem molecular por luminescência difusa de uma região de interesse em um meio de dispersão é fornecido. O sistema inclui um marcador luminescente para uso na formação de imagem luminescente molecular do meio de dispersão, onde o marcador luminescente é um marcador não-linear luminescente disposto no meio de dispersão. O sistema compreende uma ou mais fontes de luz posicionadas em pelo menos uma posição de fonte de luz para o marcador luminescente excitado por luz de excitação emitida por uma ou mais fontes de luz em um volume de excitação. O sistema compreende a presença de um detector em uma posição de detecção de luz luminescente; a detecção da luminescência do marcador luminescente, devido à luz de excitação, em que a formação de imagem luminescente molecular compreende o marcador luminescente com base em uma dependência não-linear da luminescência detectada na intensidade da luz de excitação e a posição da fonte de luz em relação à posição do marcador.
Em algumas modalidades, o marcador luminescente é composto de um grupo de marcadores luminescentes não-lineares configurado para converter a luz recebida de um comprimento de onda de iluminação tal que a luminescência ocorre no comprimento de onda de luminescência que é menor do que o referido comprimento de onda de iluminação, quando do referido marcador luminescente é iluminado com a referida luz recebida.
O marcador luminescente é, em certas modalidades, um marcador biológico luminescente. De acordo com um outro aspecto da invenção, a utilização de um sistema de acordo com o segundo aspecto da invenção é fornecida, para a geração de imagem de luminescência ou tomografia de comprimidos. De acordo com outro aspecto da 5 invenção, a utilização de um sistema de acordo com um segundo aspecto da invenção é prevista in vivo ou in vitro para formação de imagem de luminescência ou tomografia de um animal de pequeno porte.
De acordo com outro aspecto da invenção, a utilização de 10 um sistema de acordo com o segundo aspecto da invenção é fornecida para diagnóstico funcional, tal como diagnósticos de câncer por imagem, com a referida luminescência ou tomografia.
Em uma modalidade, os marcadores não-lineares estão 15 ligados a um agente de contraste de imagem para uma outra modalidade de imagem. Por exemplo, um marcador não-linear é ligado a um agente de contraste para imagem de uma modalidade de imagem convencional, como por Ressonância Magnética (MRI), Raios-X e semelhantes. Em uma modalidade especifica, um 20 marcador não-linear é ligado a um composto orgânico de gadolinio ou complexo de gadolinio, que possui propriedades paramagnéticas.
Outras modalidades da presente invenção são definidas nas reivindicações dependentes, onde os recursos para o segundo aspecto e aspectos subsequentes da invenção são aplicados como para o primeiro aspecto, mutatis mutandis.
Algumas modalidades prevêm o aumento na resolução da luminescência molecular difusa de imagem e na tomografia molecular de fluorescência. São também fornecidas algumas modalidades para a determinação da distribuição de ingredientes em comprimidos.
Por exemplo, um marcador não-linear luminescente ou fluoróforo pode ser ligado a um ingrediente ativo em um comprimido. A distribuição espacial do ingrediente ativo pode, assim, vantajosamente ser determinada.
Algumas modalidades provêm um aumento de contraste na 15 ressonância magnética médica, quando marcadores não-lineares são usados como um agente de contraste para MRI. Ao mesmo tempo, a formação de imagem de luminescência ou de tomografia pode ser feita, prevendo informações de diagnóstico funcional combinado com MRI de alta resolução de uma mesma região de interesse e in vivo. Deve-se ressaltar que, de acordo com a presente invenção, o termo "inclui/compreende" é apresentado para especificar a presença de características indicadas, como um todo, em etapas ou em seus componentes, mas não exclui a presença ou adição de uma ou mais outras características, números inteiros, passos, componentes ou grupos dos mesmos.
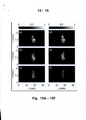
Estes e outros aspectos, características e vantagens de quais modalidades da presente invenção são capazes de apresentar serão elucidados a partir da seguinte descrição de modalidades da presente invenção, sendo feita referência aos desenhos que acompanham o presente relatório descritivo, em que: A figura 1 é um gráfico que mostra um sinal típico com um fundo autofluorescência; A figura IA é um diagrama de Jablonski; A figura 1B é um gráfico que mostra os espectros de fluorescência de alguns tecidos fluoróforos; As figuras 2a a 2c são ilustrações esquemáticas de a) transferência de energia radiativa e não radiativa; b) transferência de energia ressonante e não ressonante; e c) comparação de conversão ETU (esquerda) e ESA (direita); As figuras 3a e 3b são ilustrações esquemáticas de a) fluorescência de excitação única; e b) excitação múltipla em conversão de fluorescência; A figura 4A é uma ilustração esquemática de um processo de conversão no par de ions Yb3+-Tm3+ de uma conversão de nanocristais; A figura 4B é um gráfico que mostra o espectro de emissão para a conversão dos nanocristais da figura 4A; As figuras 5a) , 5b) e 5c) são ilustrações esquemáticas das modalidades de imagens planas, a saber: (a) um setup utilizado para uma imagem com fluoróforo (epi-fluorescência) , (b) uma configuração utilizada para a reconstrução de fluoróforo em transiluminação, e (c) outro setup para tomografia difusa com fluorescência óptica. As figuras de 6a) a 6d) são imagens e gráficos que mostram várias distribuições intensidade de fluorescência; As figuras de 7a) a 7c) são ilustrações esquemáticas da diferença entre imagens de fluorescência com fluoróforos lineares e não lineares; A figura 8 é uma ilustração esquemática de excitação e propagação de emissão de luz em um meio de dispersão; A figura 9 mostra uma comparação das reconstruções tomográficas entre um fluoróforo linear e um não-linear; As figuras 10A e 10B mostram perfis de sensibilidade para fluoróforos com dependência linear de energia (lOA) e dependência quadrática de energia (lOB); e A figura 11 é uma ilustração esquemática do problema da tomografia de fluorescência. A figura 12 é um gráfico que mostra a distribuição singular de um valor normalizado de uma matriz de peso W, de feixe único de excitação e excitação combinada de feixe único e duplo feixe de excitação. As figuras 13A e 13B são reconstruções tridimensionais de conversão de nanoparticulas, usando (10A) apenas imagens de feixe único e usando (10B) imagens de feixe simples e duplo feixe. As figuras de 14A a 14F mostram cortes transversais da distribuição reconstruída de nanoparticulas relativa para reconstruções usando (14A - 14C) apenas imagens de feixe único e usando (14D - 14F) imagens de feixe simples e duplo feixe. As figuras de 15A a 15F mostram cortes transversais da distribuição 6G de Rodamina reconstruída com relação a reconstruções usando (15A - 15C) apenas imagens de feixe único e usando (15D-15F) imagens de feixe único e de duplo feixe. As figuras de 16A a 16C mostram imagens de fluorescência para a) um corante convencional linear de fluorescência e b) as conversões de nanoparticulas e c) seções transversais das imagens em a) e b).
Algumas modalidades da presente invenção pertencem a uma área dentro do campo da óptica do tecido acima, lidando com imagens de luminescência difusa e tomografia. Para a maioria dos comprimentos de onda visiveis, a luz não penetra mais do que alguns milimetros no tecido. Mas na janela de diagnóstico (comprimento de onda entre 600 e 1600 nm) , a penetração de luz é suficiente para permitir imagens por meio de até vários centímetros. Isto abre a possibilidade de se ter agentes de contraste de imagens fluorescentes profundas no tecido. Imagens fluorescentes de luz espalhada difusamente têm uma importância notável em aplicações biomédicas.
A tomografia de fluorescência é baseada em reconstruções tridimensionais de distribuições de contraste no interior de seres humanos ou animais. As reconstruções tridimensionais são baseadas em técnicas de imagens de fluorescência.
Como mencionado acima, a área de imagens de fluorescência e tomografia de luz espalhada difusamente tem sido adversamente afetadas pela autofluorescência de tecidos endógenos, sempre presente, e sofria de baixo contraste e resolução. A autofluorescência esconde o sinal dos agentes de contraste quando se usa fluoróforos com deslocamento Stokes, efetivamente limitando a sensibilidade entre sinal e ruido.
Experiências com tecidos fantasmas, com propriedades ópticas realistas, foram realizadas e foi mostrado que é possivel se detectar um sinal livre de autofluorescência. Além disso, a utilização de nanocristais para reconstrução tomográfica tridimensional é divulgada.
Portanto, marcadores não-lineares, como nanocristais conversores, são mostrados como sendo importantes marcadores biológicos para fins de aplicação em tecidos.
Diversas aplicações, dentro de imagens biomédicas, de imagens de fluorescência ou tomografia são descritas abaixo. Este é um caso especifico para um meio de dispersão.
Outras aplicações são fornecidas em áreas não- biológicas. Exemplos de tais áreas são imagens luminescentes ou tomografia para testes de material, incluindo controle de qualidade de comprimidos, filtros para liquidos ou gases através dos quis flui um meio com marcadores não-lineares, e semelhantes.
No contexto do presente pedido e nas modalidades da invenção, a imagem por fluorescência representa todos os tipos de imagem de luminescência. Além disso, qualquer imagem ou tomografia aqui discutida se encontra em meio altamente disperso, que tradicionalmente proporciona uma resolução pobre devido ao caráter difuso da luz detectada. Modalidades da presente invenção vantajosamente melhoram o contraste e resolução de tais imagens luminescentes, incluindo tomografia luminescente.
Modalidades especificas da invenção serão agora descritas com referência aos desenhos que acompanham o presente relatório descritivo. Esta invenção pode, no entanto, ser incorporada em muitas formas diferentes e não deve ser interpretada como limitada a modalidades aqui estabelecidas, mas sim, deve-se entender que estas modalidades são fornecidas para que esta divulgação seja profunda e completa, e para que este relatório descritivo totalmente transmita o escopo da invenção para aqueles qualificados na técnica. A terminologia usada na descrição detalhada das modalidades ilustradas nos desenhos que acompanham o presente relatório descritivo não se destina a ser um fator limitante da invenção. Nos desenhos, os numerais de referência se referem a elementos. A seguir, uma visão geral dos fundamentos de imagens de fluorescência óptica e de tecidos são dadas, seguido por uma descrição de marcadores não-lineares, como nanocristais conversores e tomografia óptica de fluorescência usando nanocristais conversores. Além 5 disso, resultados de experimentos e de simulações são divulgados. No texto abaixo, uma imagem de fluorescência representa todos os tipos de imagem de luminescência. Além disso, qualquer imagem ou tomografia discutida se encontra em meio altamente espalhado, que proporciona uma resolução mais 10 pobre devido ao caráter difuso da luz detectada.
Contraste de Fluorescência O processo de emissão de luz de uma molécula fluorescente (fluoróforo) pode ser descrito em um diagrama de Jablonski, como pode ser visto na figura IA. A Figura 1 15 mostra um diagrama de Jablonski mostrando os cinco caminhos diferentes decadência de um estado excitado de uma molécula. Na parte inferior da figura, um espectro de fluorescência de hematoporfirina em etanol é mostrado. As abreviaturas são: Sn: estado singleto; Tn: estado tripleto; Abs: Absorção; Sc: dispersão; IC: conversão interna; F: fluorescência; IX: transição inter-sistema; P: fosforescência; A: transferência para outras moléculas. A aproximação de escala de tempo para alguns processos é também mostrada abaixo, na parte direita na figura IA, como tempo de vida (LT) , também indicado como T .
Se um fóton tem uma energia que corresponde ao intervalo entre as duas bandas de energia da molécula, que pode ser absorvido. A energia do fóton estará, assim, sendo usada para a excitação da molécula para a banda de maior energia. Estados excitados são instáveis e a molécula retornará ao estado fundamental. A des-excitação pode seguir uma série de caminhos diferentes, como ilustrado na figura IA. Os niveis são chamados niveis eletrônicos, correspondentes aos niveis de energia dos átomos. As designações SO, Sl, etc, são estados singleto para o qual a soma dos números quânticos de spin do elétron são zero, enquanto TO, Tl, etc, são estados tripleto para os quais o spin de um elétron mudou de sinal. Para moléculas grandes, intervalos entre os niveis são muito pequenos e os estados se sobrepõem devido a interações moleculares. Quando um fóton é absorvido por uma molécula este não necessariamente excita a molécula para o menor nivel de vibração no nivel eletrônico excitado, mas o mais provável para um estado vibracional mais elevado. Este é um resultado do principio de Franck-Condon que afirma que, durante o rápido processo de absorção (de 10'15 segundos), os átomos não mudam sua posição em termos de movimento vibracional. Quando uma molécula é excitada para um alto nivel de energia, um relaxamento rápido para o mais baixo estado rotacional- vibracional de SI se seguirá. A escala de tempo curto (de 10" 12 segundos) desse relaxamento é devida à alta densidade de rotação dos niveis vibracionais. A partir de Sl, as moléculas podem passar para o estado S0 através de interações cinéticas sem radiação. Isso é chamado de conversão interna (Cl).
Alternativamente, a des-excitação pode resultar na emissão de um fóton e este processo é chamado de fluorescência. Considerando que a transição pode ser rescindida em qualquer um dos estados rotacionais- vibracionais de S0, a energia dos fótons diferentes não terá um valor distinto, mas sim uma ampla distribuição. Assim,- um espectro de fluorescência de uma molécula será amplo, na maioria das vezes sem quaisquer estruturas significativas. A forma do espectro irá refletir a probabilidade de transição para os niveis mais baixos (S0). Na parte inferior da figura IA, um espectro de fluorescência da hematoporfirina, que é um marcador tumoral, ou fotossensibilizador, e que será discutido mais tarde, é mostrado. Uma vez que a via de absorção-IC-fluorescência é concluída, a molécula está de volta em seu estado e configuração originais. Assim, o processo de fluorescência é não-destrutivo e reversível, o que é uma vantagem, por exemplo, em diagnósticos médicos.
Embora proibida por spin, uma transição para o sistema triplet© pode ocorrer. Também no sistema tripleto, uma rápida conversão interna para o menor estado excitado irá ocorrer, considerando que a transição para S0 é proibida por spin, esta procederá a uma taxa muito mais baixa (t 10”6 - 1 segundo) do que a transição SI S0. Este processo é chamado de fosforescência e é menos frequentemente observado em temperatura ambiente.
Vários outros caminhos são possíveis para a molécula excitada, como transferir energia para outras moléculas, transferência de elétrons, formação de excímeros e excitação para os estados repulsivos levando a uma dissociação molecular. Estes processos são indicados com um "A" na figura IA.
Muitas moléculas fluorescentes têm uma importante característica em comum, que é uma cadeia ininterrupta de ligações duplas conjugadas, ou seja, a cada segunda ligação é uma ligação dupla. A estrutura da hematoporfirina é um exemplo disto (não mostrado). Esta é uma molécula fluorescente usada para diagnóstico de fluorescência e terapia fotodinâmica de tumores.
Com o conhecimento das propriedades de fluorescência de importantes fluoróforos tecido, uma gravação de fluorescência de uma amostra desconhecida trará a contribuição relativa de cada fluoróforo. Se as características de fluorescência são as mesmas que para os fluoróforos isolados, a concentração de fluoróforos pode ser estimada. Este nem sempre é, porém, o caso. Em vez disso, as propriedades de fluorescência são dependentes de fatores ambientais, tais como polaridade e pH.
Outro aspecto importante da fluorescência é o relaxamento rápido do estado excitado, assim como no estado fundamental. A molécula perde parte de sua energia de excitação por relaxamento. Além disso, a redistribuição dos dipolos do solvente em torno do fluoróforo e interações especificas, tais como pontes de hidrogênio, contribuem para este processo de relaxamento. Assim, a energia dos fótons de fluorescência é menor do que a excitação ou, em outras palavras, o comprimento de onda de fluorescência é maior que o comprimento de onda de excitação. Isso é chamado de deslocamento Stokes e é diferente para diferentes ambientes moleculares. Assim, um conhecimento geral do ambiente molecular é necessário para um diagnóstico adequado de fluorescência. Formação de Imagem por Fluorescência
Em contraste com dispositivos de monitoramento pontual, sistemas de imagem por fluorescência podem detectar um sinal de fluorescência em um grande número de pontos. Assim, uma imagem bidimensional de uma área de interesse é criada. Um sistema atipico compreende uma câmara em conjunto com um filtro sintonizável, como mostrado na figura 5a. A configuração similar, em transiluminação, é esquematicamente ilustrada na figura 5b. Com um filtro sintonizável, os comprimentos de onda de detecção desejados podem ser facilmente selecionados e uma resolução espectral de aproximadamente 20 nm de largura pode ser alcançada. Imagens por Fluorescência com os Fluoróforos Não-Lineares
A subseção particularmente interessante de imagens por fluorescência é aquela que usa fluoróforos não-linear da presente modalidade. No contexto do presente pedido, um "marcador não-linear" é um marcador luminescente, onde uma luminescência (L) do marcador não é linearmente dependente do fluxo luminoso da luz de excitação (E) . Marcadores não- lineares, assim, apresentam uma luminescência de acordo com a expressão : L = k*EAx, onde x > 1, e no qual k é uma constante positiva. Os marcadores não-lineares podem também ter uma luminescência de acordo com as seguintes relações: L
EAx + b(E), onde k e b são constantes do material que ou são constantes ou dependem do campo local de luz de excitação (E) , ou seja, de k (E) e b (E). Em comparação com a imagem de luminescência convencional, marcadores não-lineares (ou fluoróforos) podem, portanto, exigir mais do que um fóton para a excitação. Este fato diminui drasticamente o volume de excitação e fornece um ponto de excitação mais localizado. Desta forma, contraste e resolução de imagem são melhorados com luminescência, como é demonstrado abaixo. Em mais detalhes, o contraste e a resolução de imagem em luz difusa luminescente em meio absorvente e meio disperso é melhorado. Modalidades da presente invenção aproveitam este efeito.
Para ilustrar a diferença entre imagens de fluorescência com fluoróforos lineares e não lineares, é feita referência às figuras de 7a a 7c. A figura 7a ilustra uma imagem linear de fluorescência em tons de cinza. Cada pixel (705) corresponde a um ponto de excitação (704) em um padrão de grade (701) . A figura 7b mostra uma imagem obtida com um de dois fótons, fluoróforo não-linear, ou seja, marcador luminescente não-linear (702). Na figura 7c o fluoróforo (702) é mostrado em vermelho (circulo maior) (703), e os 5 pontos pretos (704) indicam os pontos de excitação no padrão de grade (701). 0 circulo (703) corresponde à imagem projetada do marcador (702) sobre o padrão de grade (701). Os pontos de excitação (704) correspondem à posição da fonte de luz, ou seja, laser (503), ao digitalizar o marcador luminescente (702). Isto permitiu que fosse visto claramente que o uso do fluoróforo não-linear aumenta o contraste e a resolução da imagem fluorescente. Este fato é ainda apoiado pela figura 9 e pelas figuras 10A e 10B descritas abaixo. Em particular, quando a fonte de luz está na posição marcada como (706) na figura 7c, perto do marcador (702) ou da imagem projetada correspondente (703) do marcador (702) sobre o padrão de grade (701), o volume de excitação é suficientemente pequeno e localizado na posição fonte de luz (706) para o marcador não-linear, de tal forma que uma não luminescência é detectada no pixel correspondente (708) na figura 7b. Para a imagem linear de fluorescência da figura 7a, o pixel correspondente (707) recebe luminescência devido ao volume crescente de excitação nos meios de comunicação de dispersão. Os dois fótons com dependência não-linear fornecem uma estreita densidade de fótons do volume de excitação. Assim, a imagem do marcador (702), com base na dependência 5 não-linear da luminescência detectada na intensidade da luz de excitação, a resolução pode ser aumentada.
Ao se fazer não uma imagem da distribuição de fluorescência em si, mas sim da intensidade de fluorescência de excitação para locais diferentes, as imagens como 10 mostradas nas figuras 16a) e 16b) podem ser obtidas. Como o volume de excitação é menor para a fluoróforos não-lineares, que vai propiciar que uma pequena parte do marcador fluorescente brilhe e, assim, aumentar a resolução em relação ao fluoróforo linear convencional.
Fluoróforos não-lineares requerem, em geral, maior intensidade de excitação em comparação com fluoróforos lineares e alguns fluoróforos não-lineares até mesmo exigem excitação coerente. Nos meios de comunicação de dispersão, altas intensidades são dificeis de se alcançar, uma vez que a 20 luz não pode ser focada e se espalha em todas as direções.
Isso faz com que alguns fluoróforos não-lineares mais adequados para imagens de fluorescência em meios de dispersão em comparação com os outros. 0 fluoróforo precisa ter um rendimento excepcionalmente alto, e não pode exigir excitação coerente. As nanoparticulas conversoras são um fluoróforo não-linear, com alto rendimento e excitação não-coerente.
Aplicações de Imagens por Fluorescência Tomografia de Fluorescência Uma imagem planar da fluorescência emitida a partir da superfície de um objeto contém informações sobre vários aspectos. As características espectroscópicas produzem o tipo 10 de fluoróforo e a intensidade está relacionada com a concentração do fluoróforo.
Isto vale tanto para fluoróforos situados ou excitados sobre a superfície do objeto. Considerando fluoróforos profundamente situados, a complexidade aumenta multiplamente.
Isto é devido ao fato de que as características espectroscópicas, bem como a intensidade, estão conectadas e são afetadas pelas propriedades ópticas do tecido grosso que é o objeto, ou seja, o tecido circundante. Vários fatores devem ser considerados, isto é:
Absorção de luz de excitação e dispersão. O fluoróforo deve ser excitado a fim de emitir luz, portanto, a luz de excitação deve chegar ao local do fluoróforo.
Excitação e posição da fonte de luz. Uma fonte posicionada próxima a um fluoróforo vai excitar o fluoróforo mais do que se comparada com uma fonte posicionada longe da fonte, com uma mesma luz de excitação.
Posição e tamanho do fluoróforo. Aqui, o fluoróforo é tratado como uma entidade estruturada interna, ou seja, uma região bem definida que contém uma distribuição homogênea de marcador fluorescente. Dependendo do tamanho e da posição, a fluorescência emitida terá aparência diferente na fronteira.
Absorção de luz de emissão e dispersão. A emissão é atenuada quando se propaga através do tecido. Normalmente, as propriedades ópticas para a emissão não são as mesmas para a luz de excitação.
Emissão e posição de coleta de luz. A intensidade 15 coletada é dependente de onde (na fronteira) esta é detectada. Isto é devido à desigualdade do caminho de propagação a partir do local de emissão (posição do fluoróforo) e do local de coleta (de fronteira).
Devido ao fato de que esses fatores estão ligados em 20 constante mudança de maneiras, a necessidade de ferramentas para interpretar os sinais coletados é inevitável. O objetivo fundamental na utilização de técnicas de tomografia óptica para imagens de fluorescência de marcadores fluorescentes situados profundamente é, então, útil para quantificar e localizar um fluoróforo dentro de um objeto, absorver e dispersar.
O termo "quantificar" significa que a concentração real de um fluoróforo é procurada enquanto o termo "localizar" significa que a concentração em cada voxel tridimensional do objeto é pedida. Os dois termos também levam à possibilidade de se formar uma imagem tridimensional, com base no contraste do fluoróforo, do interior do objeto, motivando, portanto, o uso da tomografia.
Hoje, para formação de imagens de pequenos animais, apenas indocianina verde (ICG) teve sua aprovação concedida pelo FDA para ser usada em pacientes humanos para o diagnóstico médico, mas para imagens de pequenos animais podem ser utilizados vários fluoróforos. Este é um resultado da pesquisa no âmbito do desenvolvimento acelerado da sonda durante os últimos anos, provocado pela utilização de diferentes técnicas de microscopia de fluorescência para os fenômenos utilizando imagens biomédicas nas células. Os fluoróforos podem ser classificados em sondas ativas e sondas ativáveis.
As sondas ativas são fluoróforos não específicos que estão ligados a um ligante de afinidade específica para o destino. Estes ligantes podem ser anticorpos, peptídeos e 5 pequenas moléculas rotuladas. A sonda emite fluorescência ativa após excitação, mesmo que não esteja ligada ao ligante alvo. Isso resulta em fluorescência de fundo que é não- especifica, ou seja, nenhuma há informação sobre o alvo a ser trabalhado.
As sondas ativáveis são mais específicas, uma vez que estas só emitem fluorescência quando "ligadas". O fluoróforos são organizados em estreita proximidade com um supressor e, alternativamente, vários fluoróforos são colocados juntos para auto-extinguir uns aos outros. Este arranjo é possível 15 devido a uma sequência específica entre peptídeo e enzima. Na presença de uma enzima, a sequência peptídeo pode ser clivada e, assim, os fluoróforos estão livres para emitir luz, sem extinção. 0 uso de sondas ativáveis foi demonstrado para a identificação de proteases in vivo. As sondas ativáveis são 20 muitas vezes referidas como sondas inteligentes ou alvos ópticos, já que elas só são capazes de emitir luz sobre excitação quando a molécula-alvo está presente. Sondas fluorescentes estão direcionadas a uma molécula especifica ou a um evento biológico específico, portanto, a sua função é imaginada. Isto contrasta com outras organizações não- direcionadas de corantes fluorescentes, por exemplo, ICG, que 5 são utilizados para visualizar a vascularização e permeabilidade. Outra forma de aumentar o contraste é a utilização de sondas que são geneticamente codificadas. Um transgene (gene repórter) é inserido na célula. 0 transgene codifica para uma proteína fluorescente (FP), que após 10 transcrição será produzida intrinsecamente dentro do animal.
As sondas podem ser detectadas através de técnicas ópticas e esta modalidade é chamada de imagem de fluorescência indireta, já que a fluorescência emitida visualiza a presença de regulação genética ou a expressão do gene. Células podem 15 ser transfectadas com um gene repórter e o rastreamento de células pode ser trabalhado. Fundindo-se os FP a um gene de interesse torna-se possível gerar quase qualquer imagem de proteínas in vivo. A PF em imagens de fluorescência indireta fornece recursos de imagens interessantes, por exemplo 20 interações proteína-proteína, devido ao fato de que a proteína de interesse pode ser afetada enquanto a PF emite fluorescência.
Existem vários tipos de proteinas fluorescentes, mas a familia principal é baseada em proteinas verdes fluorescentes (GFP). O desenvolvimento da sonda está alavancando o desenvolvimento de emissores de GFP que absorvem na região NIR. Hoje nenhum NIR FP está presente, mas proteinas fluorescentes amarelas e vermelhas têm sido relatadas (YFP e RFP) . O contraste é dependente da concentração de fluoróforo e da posição do fluoróforo. O contraste também é controlado através das chamadas sondas ativas. Se o fluoróforo não estiver ativo, não será emitida fluorescência. Um problema sempre presente através do diagnóstico de fluorescência em meios biológicos é autofluorescência e a fluorescência de fundo.
Autofluorescência é a fluorescência emitida por cromóforos endógenos, enquanto que a fluorescência de fundo é a fluorescência proveniente de sondas fluorescentes fora da região de interesse. Formas de, teoricamente, subtrair a autofluorescência e fluorescência de fundo têm sido relatadas. A presença de fluorescência não-especifica efetivamente reduz o contraste. Diagnóstico Clinico do Câncer
A principal aplicação até agora é o diagnóstico do câncer de mama utilizando ICG ou derivados do mesmo. Proteinas fluorescentes, evidentemente, não são uma alternativa para aplicação em seres humanos, portanto, imagens de fluoróforos serão alcançadas mediante a funcionalização de sondas não-moleculares. Tomografia com Fluoróforo Não-Linear
Devido à dependência quadrática da fluorescência emitida, por exemplo até em nanocristais conversores, a tomografia de fluorescência é melhorada. A figura 9 descreve as diferenças entre o uso de um fluoróforo linear e de um fluoróforo quadrático. A figura 8 é uma ilustração esquemática de excitação (801) e emissão (802) da propagação da luz em um meio de dispersão. A figura 11 é uma descrição esquemática do problema da tomografia de fluorescência. Uma fonte de luz de excitação emissora de luz (803) é traduzida na fronteira ao passo que a fluorescência emitida (804) é estática na posição enquanto a intensidade de emissão está mudando de forma dependente do 20 local de origem. As figuras 10A e 10B mostram perfis de sensibilidade de fluoróforos tendo dependência de energia linear (10A) e quadrática (ÍOB) . A fonte se encontra do lado esquerdo nas figuras, e a distância para o detector é L. Os cálculos foram realizados utilizando-se a expressão analitica para a função de Green para um meio infinito homogêneo. Como pode ser visto nas figuras 10A e 10B, o perfil de sensibilidade quadrática é muito acentuado nas proximidades da fonte de luz, em torno de uma revolução simétrica em torno do eixo-x. Isto implica que é possivel se extrair informações com maior sensibilidade (resoluções) em um plano.
Em outras modalidades de fluoróforos não-lineares de ordem superior, por exemplo fluoróforos cúbicos, o realce de contraste é ainda mais melhorado (não mostrado).
Óptica dos Tecidos e Autofluorescência do Tecido Dentro do campo da óptica dos tecidos, a interação da luz com os tecidos é estudada. Opticamente, tecidos biológicos são meios de comunicação e de absorção não- homogêneos, com um indice de refração ligeiramente maior do que o da água. Quando a luz interage com a dispersão de tecidos, se espera que ocorram vários eventos e absorção, onde as possibilidades para estes eventos são altamente dependentes de comprimento de onda. Como o tecido tem uma elevada concentração de água, é uma vantagem se usar a luz de um comprimento de onda na região onde a absorção da água é baixa, já que este irá impor um limite final sobre os comprimentos de onda utilizáveis. No entanto, em aplicações transdérmicas não invasiva, como em certas modalidades, a luz tem de penetrar na pele, o que irá colocar restrições sobre os comprimentos de onda utilizáveis.
A pele pode ser vista como uma estrutura em camadas, com o estrato córneo no topo, seguido da epiderme e da derme inferior. O estrato córneo e a epiderme são muito eficazes em atenuar a luz, principalmente devido à alta absorção para comprimentos de onda < 300 nm a partir de aminoácidos aromáticos, ácidos nucléicos e ácido urocânico. Para comprimentos de onda mais longos, entre 350 e 1200 nm, a melanina na epiderme é a grande absorvedora. Como a luz que entra na derme, a difusão começa a dominar a absorção. A derme, portanto, pode ser descrita como uma matriz de tecido turva. Para os tipos de tecido abaixo da derme, a difusão normalmente domina a absorção. Em uma aproximação grosseira, a dispersão pode ser modelada utilizando-se difusão Rayleigh. Isto implica que a luz em comprimentos de onda mais curtos será muito mais espalhada do que a luz em comprimentos de onda mais longos.
Considerando tanto a difusão e a absorção no tecido, a janela de diagnóstico transdérmico reside nas regiões de comprimento de onda que podem ser consideradas na faixa de 600 nm a 1600 nm.
Tecidos contêm vários fluoróforos endógenos que têm uma forte fluorescência com deslocamento Stokes pequeno quando excitado com X <600 nm. Para comprimentos de onda maiores, na janela de diagnóstico, a autofluorescência endógena do tecido é, em geral, muito mais fraca. No entanto, em muitas imagens 10 e aplicações de tomografia, o sinal em si também é fraco, portanto, ainda limitado pela autofluorescência de fundo que causa artefatos. Um sinal atipico (linha continua), com um espectro de fundo de autofluorescência (linha pontilhada) é mostrado na figura 1.
A referida autofluorescência, ou os tecidos próprios com fluorescência endógena, é causada por vários fluoróforos diferentes. Alguns dos fluoróforos de tecido comuns são o colágeno e a elastina presentes em fibras conjuntivas, o triptofano presente na maioria das proteinas e flavinas e 20 dinucleotideo de adenina nicotinamida (NADH), ativo na digestão de células, por exemplo ver a figura 1B que mostra os espectros de colágeno (101), elastina (102), NADH (103), e caroteno (104).
Os espectros também são influenciados pelas propriedades ópticas do tecido. Absorvedores fortes, como a hemoglobina, podem absorver a luz de fluorescência em certos comprimentos 5 de onda e, portanto, alterar a aparência do espectro de fluorescência, criando falsas depressões e picos.
A hemoglobina também podem diminuir a intensidade geral do espectro de fluorescência, sem alterar a sua forma, pela absorção de luz de excitação. Fluoróforos Exógenos
Alguns exemplos de fluoróforos exógenos são proteinas fluorescentes (FP), NIR-corantes (ND), Quantum dots (QD), ou fotossensibilizadores (PS).
Quantum dots são fluoróforos lineares, que emitem um sinal que é maior do que o deslocamento Stokes de autofluorescência do tecido. Quantum dots são fluoróforos que absorvem principalmente na região ultravioleta (UV) . Considerando que o uso de luz que ilumina em comprimentos de onda curtos não é ideal para medições transdérmicas e a luz. UV está sujeita a profundidade de penetração rasa transdérmica e os riscos de danos de DNA no tecido iluminado, QD não são adequados para muitas aplicações. Além disso, os quantum dots são muitas vezes fabricados com materiais que são altamente tóxicos para os organismos. Além disso, estudos têm mostrado que os quantum dots tendem a reagir quando expostos a ambientes biológicos e podem ser muito 5 prejudiciais. Fluoróforos Não-Lineares Exemplos de fluoróforos não-lineares são nanoparticulas (NP) descritas em mais detalhes abaixo.
A conversão é um processo não-linear que ocorre quando dois ou mais fótons são absorvidos e um fóton de mais alta energia do que aqueles dos fótons de entrada, é lançado.
O processo é, por exemplo, observado em materiais que contenham um estado meta-estàvel, que pode prender um elétron 15 por um longo tempo, aumentando a probabilidade de interação com outro fóton chegando.
Em algumas modalidades, marcadores luminescentes em forma de sólidos dopados com ions de terras raras diferentes são usados para obter conversão.
Materiais conversores em estado sólido são, por exemplo, fabricados por dopagem dos materiais com ions de terras raras. As terras raras enchem sua camada eletrônica externa antes de suas camadas interiores, dando-lhes linhas atômicas agudas como linhas espectrais, mesmo quando ligados em materiais sólidos.
A conversão pode acontecer devido a inúmeros processos, que impactam o processo de conversão de forma diferente, dependendo dos pares de ions e das intensidades de excitação. Alguns processos de conversão são ilustrados nas figuras de 2a) a 2c).
Alguns dos processos envolvem transferência de energia entre ions. Esta difusão de energia, pode ser radiativa ou não-radiativa, ressonante ou não ressonante, como mostrado nas figuras 2a e 2b. No caso radiativo, um fóton é liberado do sensibilizador e absorvido pelo ativador, enquanto que no caso não-radiativo, a energia de excitação vai saltar de um ion para o outro através de uma interação eletrostática. Os dois casos podem ser distinguidos experimentalmente. A transferência radiativa é dependente da forma da amostra e também afeta o espectro de emissão, bem como o tempo de vida do ativador. Quando a transição é não ressonante, ela tem que ser fonon-assistida. As transições não-ressonantes são encontradas para as diferenças de energia mais elevadas entre os ions de terras-raras em comparação com outros materiais sólidos, especialmente nos casos não-radiativos.
Além disso, processos de Conversão com Transferência de Energia (ETU) e Absorção de Estado Excitado (ESA) são ilustrados na figura 2c, respectivamente à esquerda e à direita da figura. Absorções no estado excitado acontecem quando um ion, estando em um estado excitado, absorve mais um fóton. A probabilidade para este processo é normalmente pequena e estes só podem ser observados sob bombeamento coerente. A conversão com transferência de energia é um processo que envolve transferência de energia entre ions. Aqui, um ativador em um estado é considerado excitado. Energia pode, então, ser transferida não-radiativamente de um sensibilizador. Isto é possivel porque as diferenças de energia só são significativas em termos de preservação da energia. As figuras 3a) e 3b) são ilustrações esquemáticas de excitação de fluorescência e luminescência múltiplos em conversão, respectivamente. Na figura 3a), o comprimento de onda de emissão (EM) é maior que o comprimento de onda de excitação (EX). A figura 3b) mostra excitações múltiplas ocorrendo na fase 1 (EX1) e na fase 2 (EX2), onde o comprimento de onda de emissão comprimentos de onda de excitação.
Cristais Nanométricos Conversores Nanocristais conversores são aqui divulgados como fluoróforos em aplicações de imagens biomédicas devido à sua 5 propriedade única de emitir luz anti-Stokes de forma eficiente, passando por cima da excitação do infravermelho próximo (NIR) . Isto propicia a detecção de um sinal fluorescente em uma região onde autofluorescência não está presente.
Partículas nanométricas conversoras são, por exemplo óxidos de lantanídeos dopados (Y2U3) , que são fáceis de se fabricar. Outras partículas nanométricas conversoras são, por exemplo, fluoretos, que têm uma maior eficiência do que Y2O3.
A maior eficiência pode ser explicada pelas energias de fonon baixas em fluoretos, que reduzem a probabilidade de decaimentos não-radiativos.
Outras partículas nanométricas conversoras são, por exemplo, feitas de tetrafluoreto de sódio e ítrio (NaYF4), 20 co-dopado com Yb3+ ou Er3+ ou Yb3+ e ZTM3+. O NaYF4 pode cristalizar em duas fases, cúbica ou hexagonal, chamadas de α-β-NaYF4 e NaYF4, respectivamente. A luminescência convertida a partir do material da fase β- é de aproximadamente uma ordem de magnitude maior em comparação com a luminescência convertida da fase α-. Atualmente, também é possivel fabricar partículas nanométricas em qualquer fase cúbica ou hexagonal.
Desconsiderando as diferenças de eficiência, as partículas também mostram outras propriedades dependentes de tamanho. Por exemplo, a relação entre as linhas de emissão diferentes é diferente para as nanoparticulas e para o material a granel.
Devido às suas propriedades ópticas, as nanoparticulas conversoras são adequadas como marcadores biológicos para aplicações diferentes em formação de imagens biológicas. Existem diodos laser baratos em comprimento de onda de excitação de 98 0 nm, que é um comprimento de onda muito 15 adequado para aplicações em formação de imagens biológicas, já que a luz penetra no tecido de forma relativamente profunda, o que reduz o risco de danos.
Com nanocristais conversores, imagens luminescentes não sofrem de qualquer autofluorescência. Imagens luminescentes 20 são fornecidas com melhor contraste, por exemplo, em comparação com marcadores biológicos de fluoróforos com deslocamento Stokes. Além disso, os fluoróforos não-lineares, como as nanoparticulas, também podem ser conversores biofuncionalizados dando-lhes, por exemplo, habilidades de buscas por tumor.
Os fluoróforos não-lineares podem ser solúveis em água, 5 permitindo a fácil administração em certas aplicações, como em soluções para administração intravenosa, via oral ou enteral.
Uma forma de fornecer nanoparticulas conversoras solúveis em água, é a de revestir as particulas com uma 10 estrutura que é polar. Revestimentos podem, por exemplo, ser feitos de polimeros ou de silica. Tanto os polimeros sintéticos como, por exemplo, polietileno glicol (PEG) quanto os polimeros naturais podem ser utilizados para o . revestimento. Estes polimeros são estáveis em ambientes 15 biológicos e não interferem nas propriedades ópticas dos nanocristais de forma significativamente negativa.
Revestimento das particulas de silica com um revestimento geralmente gera um produto muito robusto, o que é vantajoso, em especial em ambientes biológicos.
Nanoparticulas conversoras solúveis em água podem ser fornecidas sem revestimentos. Grupos hidroxila podem ser ligados às superficies das nanoparticulas conversoras, seja por ligações químicas ou por absorção física. Grupos hidroxila são, por definição, formados por uma ligação covalente e a estrutura final apresenta propriedades polares. Além disso, um revestimento estável de proteção pode ser 5 aplicado nas nanopartículas, para torná-las vantajosamente adequadas para uso em ambientes biológicos. Funcionalização
A funcionalização das nanopartículas conversoras pode ser feita de forma semelhante a uma funcionalização de 10 quantum dots, como descrito por X. Gao et. al., In vivo cancer targeting and imaging with semiconductor quant urn dots, Nature Biotechnology, 22, 8:969-976, 2004, que é incorporado aqui em sua totalidade, para todos os efeitos. Nesta publicação de Gao et. al., métodos que são aplicáveis 15 em nanopartículas conversoras de terras-raras dopadas são descritos.
As nanopartículas conversoras utilizadas em uma modalidade neste relatório descritivo foram NaYF4, com cristais preparados de acordo com o método descrito por G. Yi 20 et. al., Synthesis, characterization, and biological application of size-controlled nanocrystalline NaYF^:Yb,Er infrared-to-visible up-conversion phosphors. Nano Letters, 4, 11:2191-2196, 2004, dopado com uma combinação de Yb3+ e Tm3+.
Os diagramas de energia para os dois ions são mostrados na figura 4A. A figura 4A é uma ilustração esquemática dos processos de conversão com o par iônico Yb3+ e Tm3+. Processos 5 de conversão não radiativa são ilustrados com setas tracejadas e o decaimento não-radiativo foi omitido para maior clareza. A figura 4B é um gráfico que mostra o espectro de emissão para essas nanoparticulas conversoras. A linha de emissão em 477 nm azul só é visivel para intensidades mais elevadas da bomba. A dependência da bomba de alimentação da linha 800 nm foi medida como sendo quadrática usando-se baixa intensidade, como se vê na inserção da figura 4B, mostrando a intensidade (I) sobre o eixo-x e conta (C) sobre o eixo-y e onde o declive (S) da linha equipada (401) é igual a 2.
Em uma modalidade, os marcadores não-lineares estão ligados a um agente de contraste de imagem para uma outra modalidade de imagem. Por exemplo, um marcador não-linear é ligado a um agente de contraste para imagem com uma modalidade de imagem convencional, como por Ressonância
Magnética (MRI), raios-X e semelhantes. Em uma modalidade especifica, um marcador não-linear é ligado a um composto orgânico de gadolinio ou complexo de gadolinio, que possui propriedades paramagnéticas. Quando usado como um agente de contraste para MRI, o contraste é reforçado para ressonância magnética médica. Ao mesmo tempo, a imagem por luminescência ou tomografia podem ser feitas, apresentando informações de 5 diagnóstico funcional combinadas com MRI de alta resolução de uma mesma região de interesse e in vivo.
Outras aplicações são fornecidas em áreas não- biológicas. Exemplos de tais áreas são imagens luminescentes ou tomografia para testes de material, incluindo controle de 10 qualidade de comprimidos, filtros para liquidos ou gases através do qual flui um meio com marcadores não-lineares, entre outras.
Nanocristais conversores foram usados em montagens 15 experimentais, a fim de confirmar a aplicabilidade de marcadores luminescentes não-lineares em imagem. Para demonstrar a adequação para seu uso como fluoróforos em aplicações para vivos, dois experimentos foram realizados.
Em primeiro lugar, as diferenças em contraste usando os 20 tradicionais fluoróforos conversores e fluoróforos quadráticos na forma de nanocristais conversores foram demonstrados.
Em segundo lugar, simulações realizadas para a reconstrução tomográfica usando fluoróforos não-lineares, como fluoróforos quadráticos na forma de nanocristais conversores, foram realizados.
Os sistemas de imagem planar utilizado para coleta de dados são mostrados esquematicamente nas figuras 5a e 5b. A figura 5a é uma ilustração esquemática de uma instalação para imagem por fluoróforo (epi-fluorescência) e a figura 5b é uma configuração para a reconstrução de fluoróforo em 10 transiluminação.
Um tecido fantasma (501) foi utilizado, e este consistiu de uma solução de tinta com propriedades ópticas intralipidica determinada por um sistema de espectroscopia de tempo de vôo (500) . O fluoróforos (502) estavam contidos em 15 tubos capilares com diâmetros internos de 2,4 mm. As concentrações dos fluoróforos foram de 1% em peso para as nanopartículas e 1 M para os fluoróforos conversores tradicionais do tipo DY-781.
A concentração das nanopartículas foi escolhida para ter 20 uma correspondência razoável com estudos usando quantum dots, ou seja, uma concentração de 1% em peso foi usada.
Usando-se dois motores de passo de uma máquina CNC, os lasers de fibra acoplada (503) puderam ser digitalizados por quadro. As posições do laser na digitalização por quadro podem ser descritas por um padrão de grade (701) como mostrado na figura. 7. Uma imagem foi adquirida para cada posição digitalizada com uma câmera CCD refrigerada a ar (504) colocada atrás de dois filtros dielétricos de banda passante centrada em 800 nm. A figura 5c mostra uma configuração de digitalização em quadro (507) onde o laser está digitalizando o tecido fantasma (501) a partir de uma posição abaixo (505). O CCD (504) pode capturar uma imagem para cada posição (506) do laser. As posições (506) descrevem um padrão de grade (508), semelhante ao padrão de grade (701) na figura 7. Para cada posição (506) do laser, a fluorescência emitida por todo o lado do fantasma (501), ou seja, a intensidade da luminescência total, foi medida e somada para formar um pixel da imagem resultante. Portanto, o número de pixels na imagem foi dado pelo número de posições de excitação (506) e não pelo número de pixels CCD. A resolução pode, assim, ser determinada pela densidade de fótons da luz de excitação da fonte de luz laser (505), e não pela densidade da luz fóton de emissão de fluorescência.
Desta forma, porque os dois fótons com densidade de fóton no volume de excitação são mais estreitos do que o de um fóton único com densidade de fóton, a resolução pode ser aumentada. Ao se somar a intensidade de luminescência total, um valor limite pode ser aplicado à luminescência detectada. Desta forma a resolução pode ser aumentada. Por exemplo, somente se a intensidade da luminescência estiver acima de um limite definido, ele será adicionado à intensidade da luminescência total. O limiar pode ser definido como um valor no CCD (504), por exemplo, se a intensidade da luminescência for inferior a 30% de um valor de pico será descartada, pois isso pode ser considerado como um sinal de ruido. Além disso, se a luminescência total resultante de um pixel, ou posição (506) do laser, se encontra abaixo de outro valor limite que pode ser considerado como sinal de ruido esta pode ser removida.
Alternativamente, as intensidades quadráticas do sinal de luminescência podem ser resumidas. Desta forma, a resolução pode ser aumentada. Por exemplo, a intensidade da luminescência detectada pela CCD (504), que pode ter valor relativo entre 0 e 1, por definição, de um valor de pico de intensidade na CCD, pode ser multiplicada com ele mesmo antes de adicionada à intensidade da luminescência total para o pixel atual ou posição (506) . Além disso, a intensidade da luminescência total pode ser multiplicada com ela mesma para cada pixel ou posição (506) . As figuras de 16A a 16C mostra imagens com o uso da técnica de imagem de varredura, onde cada pixel nas imagens corresponde à fluorescência induzida por um único ponto de excitação, ou seja, uma posição de fonte de luz (506) . A figura 16A mostra a imagem de um corante fluorescente convencional linear, e a figura 16B mostra a imagem de nanoparticulas conversoras não-lineares, com um perfil de seção transversal comparativo na figura 16C exibindo o FWHM como 10,5 milimetros e 8,0 mm, respectivamente, dando uma melhoria de um fator de 1,3.
Autofluorescência Insensitiva e Formação de Imagem por Fluorescência Molecular A configuração de epi-fluorescência foi utilizada para este experimento. As propriedades ópticas do fantasma foram escolhidas para ser μ = 6,5 cm-1 e mA = 0,44 cm-1 a 660 nm, que estão dentro da faixa daqueles encontrados em pequenos animais.
Os Tubos Capilares Contendo Os Fluoróforos, Dy-781 E Nayf4:Yb3+/Tm3+ Foram Submersos A Uma Profundidade De 5 Mm, Onde A Profundidade Foi Tomada Como A Distância Entre A Superficie Frontal Dos Tubos Para A Superficie. O Fantasma. dy-781 Foi Escolhido A Fim De Se Obter Uma Comparação Justa, Uma Vez Que Emite Em 800 Nm E Também Tem Uma Eficiência Quântica Que Coincide Com Corantes Mais Comumente Utilizados, Por Exemplo, Da Classe Rodamina.
Dois lasers de diodo foram usados para excitar os fluoróforos. DY-781 estava animado a 780 nm, e as nanopartículas foram excitadas a 980 nm.
Os lasers foram digitalizados por quadro por uma área de 4,4x4,4 cm2 composta por 121 posições. As imagens foram, então, somadas, dando uma representação da distribuição de fótons na superfície. Isso indica, ou não, que uma inclusão fluorescente pode ser detectada. A fim de suprimir os efeitos deletérios de pixels na câmera, um filtro de mediana com um kernel de 3 x 3 pixels foi aplicado às imagens somadas. Para simular autofluorescência, o DY-781 foi adicionado no fantasma até um ponto onde o contraste era tão pobre que os dados não poderiam ser usados de uma maneira razoável.
As intensidades de iluminação que foram usadas foram consideradas não-nocivos ao tecido. A luz de excitação final utilizada tinha um tamanho de mancha de 1 cm4 de ambos os lasers na superfície do fantasma, dando intensidades de 40 mW/cm2 para o laser de 85 nm e 780 mW/cm2 para o laser de 980 nm. As figuras 6a) a 6d) são imagens e gráficos que mostram várias distribuições intensidade de fluorescência resultantes da experiência. Em mais detalhes, imagens comparativas são 5 mostradas em relação ao corante DY-781, visto nas figuras 6a) e 6c), e as nanoparticulas, vistas nas figuras 6b) e 6d), com e sem autofluorescência, juntamente com partes mostrando as somas no sentido vertical, respectivamente. Os pontos brancos nas imagens foram adicionados artificialmente e representam 10 as posições usadas para a luz de excitação. A coluna esquerda mostra os resultados usando-se DY-781, e a coluna da direita mostra os resultados usando nanoparticulas conversoras.
As imagens apresentadas nas figuras 6a) e 6b) são tomadas sem qualquer autofluoróforo acrescido, e as imagens 15 mostradas nas figuras 6c) e 6d) são tomadas com uma concentração de autofluoróforo de fundo de 40 nM.
Em mais detalhes, as figuras 6a) a 6d) mostram as imagens tiradas com e sem autofluorescência juntamente com os seus perfis de seção transversal.
Como pode ser visto na figura 6d) , há uma redução de fundo de autofluorescência em comparação com a figura 6c) , nanopartículas conversoras. Estes números demonstram claramente a diferença de contraste utilizando fluoróforos conversores e nanocristais conversores. Vale a pena notar que, mesmo sem qualquer autofluoróforo artificial adicionado, 5 o meio intralipidico autofluoresce em si e o efeito é visível no perfil de seção transversal na figura 6a).
O resultado final com as nanopartículas é limitado principalmente pela relação sinal-ruído do detector. Isto significa que, ao se aumentar o poder de excitação, é 10 possível melhorar a qualidade da imagem obtida. A situação é diferente para o corante DY-781. O corante é muito eficiente, e não é em geral limitado pela relação sinal-ruído. No entanto, é limitado pelo contraste entre sinal e ruído. Isto significa que um aumento no poder de excitação não irá 15 resultar em uma melhor qualidade de imagem.
Tomografia por Fluorescência Molecular (FMT) Simulações de FMT usando fluoróforos não-lineares e fluoróforos tradicionais foram realizadas em arranjos de transmissão de fluorescência, como mostrado na figura 5b. O 20 tecido fantasma simulado foi modelado como um cilindro semi- infinito (508) com um raio de 43 mm. As propriedades ópticas foram μ = 10 cm-1 e μA = 0,4 a cm-1 em À = 660 nm, com 16 fontes uniformemente espaçadas e pontos de detector (509) em torno de um plano da geometria. Os fluoróforos foram colocados juntos como varas se estendendo por todo o fantasma, como mostrado na figura 5b.
O modelo utilizado para a frente foi uma malha uniforme composta de 1785 nós. Para as reconstruções, uma base de pixel de 17 x 17 pixels foi utilizada. Existem várias estratégias para a escolha de bases de reconstrução. Dois exemplos são a segunda base de malha e a base pixel. Todas as 10 estratégias, no entanto, visam reduzir o número de incógnitas do problema. Isto é motivado já que a solução deverá ser suave e utilizando uma base mais grossa, que melhora um mal posicionamento. Neste experimento, a base de pixel foi escolhida, que é um conjunto de pixels regularmente 15 espaçados. Esta base é adequada para problemas sem nenhuma informação espacial a priori. Os dados de entrada para a reconstrução foram obtidos a partir de uma simulação para a frente.
As fontes foram modeladas como fontes de ponto 20 isotrópico irradiando com 1 W situado a uma distância de um evento de difusão dentro do fantasma.
O procedimento para a reconstrução pode ser brevemente considerado como executando as seguintes etapas: i) Para cada uma das posições de excitação: calcular o campo de excitação com um fator de potência correta; ii) Para cada posição de detecção: calcular a emissão de 5 campo com o campo de excitação acima , ou seja, o método adjunto; iii) calcular o produto entre o campo de excitação e a emissão de campo (adjunto) para cada par de excitação e de detecção. Isto é, calcular N x M, onde N é o número de 10 posições de excitação e M o número de posições de emissão. Este último pode ser considerado como o cálculo dos perfis de sensibilidade. A distribuição interna resultante é armazenada. iv) Encontrar a distribuição interna de fluoróforo que 15 melhor descreve o que é detectado, por exemplo, resolução de problema com minimos quadrados, minimizando ||Ax - y||, onde A é uma matriz que contém os perfis de sensibilidade, x é a distribuição interna de fluoróforos e são y os dados medidos.
Para marcadores não-lineares a dependência não-linear da 20 propagação da luz (de emissão e excitação) pode ser modelada, por exemplo, para se resolver a equação de difusão relacionada ou com o uso de simulações Monte-Carlo. Este aspecto pode ser essencial para utilizar-se os marcadores não-lineares para a tomografia. Ao se ter calculado o campo de excitação, este pode ser usado como dados de entrada para o problema das emissões. Assim, menos um dos passos acima 5 para a reconstrução de tomografia com a dependência de energia do marcador pode ser considerado. Por exemplo, para marcadores não-lineares tendo uma dependência energética especifica da luminescência (L) na luz de excitação (E) , a força do campo de excitação é elevada à mesma potência, ou seja, calculando-se o produto quadrático do campo de excitação se o marcador não-linear tem uma dependência energética quadrática. A intensidade do campo de excitação quadrática é o termo usado como fonte para o cálculo da emissão de campo no problema de emissões. Isso pode resultar em um perfil de sensibilidade mais estreito e permite que a resolução aumente. O perfil de sensibilidade estreita corresponde ao volume de excitação estreito ou pequeno anteriormente abordado. Por isso, reconstruir uma imagem tomográfica do marcador luminescente pode incluir o cálculo de um produto do campo de excitação de acordo com a dependência não-linear, onde o cálculo da emissão de campo é feito com base neste produto. E calcular o produto pode incluir a multiplicação da força de campo do campo de excitação de modo a formar um produto da força de campo elevado à potência correspondente à dependência energética da relação não-linear.
A precisão da reconstrução depende de como muita da informação, tais como a luminescência detectada, é obtida, para cada posição da fonte de luz quando a fonte de luz é movida em relação ao marcador luminescente, ou vice-versa. Além de se obter as informações de reconstrução por variações espaciais, um múltiplo de comprimentos de onda de excitação e emissão de comprimentos de onda do marcador luminescente pode ser utilizado para se obter as informações de reconstrução pela variação de vez espectral. O CCD pode, nesta situação, detectar a luminescência de vários comprimentos de onda para a utilização em ambas as imagens de tomografia e reconstrução. Neste último caso, tanto a variação espacial quanto a espectral podem ser usadas para calcular os perfis de sensibilidade acima mencionados.
Resultados Reconstruídos A figura 9 mostra uma comparação das reconstruções tomográficas entre um fluoróforo linear (902) e um fluoróforo não-linear (903). A ilustração na figura 9 é apresentada como um exemplo de um fluoróforo quadrático. (Neste caso, escolhido para ser quadrático).
A realidade no terreno é mostrada como a anomalia de entrada (901) na figura 9. Duas anomalias distintas, mas 5 próximas, são mostradas como os pontos irregulares no circulo maior.
Na reconstrução usando um fluoróforo linear (902) as duas anomalias situadas perto não podem ser distinguidas, como é evidente na figura 9.
No entanto, uma reconstrução usando um fluoróforo quadrático (902) mostra uma boa separação entre as duas anomalias situadas perto. Isso pode ser claramente visto na figura 9.
Essa comparação ilustra o efeito vantajoso que o uso de 15 recursos fluoróforos não-lineares fornece, ou seja, um maior contraste e resolução, do que com fluoróforos lineares. O aprimoramento é devido à sensibilidade mais estreita durante a utilização do termo da fonte quadrática, como visto na equação (1) abaixo. Isto pode ser visualizado por se 20 considerar o sinal coletado para cargos de origem diferente. Usando um fluoróforo quadrático, o sinal só será forte se a posição de origem estiver nas proximidades do fluoróforo em si. Assim, o sinal pode fornecer mais informações sobre a localização do fluoróforo do que para o caso de um fluoróforo linear. Isso também pode dar a possibilidade de resolver, por exemplo, dois fluoróforos situado perto que não são 5 resolvidos usando-se um fluoróforo linear, como mostrado na figura 9. Fluorescência Tomografia Óptica Difusa de Multi-Feixe, Usando Nanopartículas Conversoras
Além disso, esta invenção demonstra um método de 10 tomografia óptica difusa de fluorescência para explorar a dependência do poder único de nanopartículas conversoras não- lineares para aumentar ainda mais a quantidade de informações em uma configuração de digitalização por quadro incluindo excitação com dois feixes simultaneamente. Verificou-se que o 15 aumento de informações levou a reconstruções mais precisas.
A Tomografia difusa por fluorescência óptica (FDOT) é uma modalidade relativamente nova, que procura reconstituir a distribuição espacial da concentração de sondas fluorescentes de material interno turvo. Como uma ferramenta de imagem, 20 esta tem uma boa perspectiva em estudos biomédicos para a formação de imagem, por exemplo, tumores, proteases, e estudos de efeitos de drogas. A FDOT tem, numericamente, muitos problemas de má-colocação. Nesta edição, a qualidade das reconstruções para o alvo fluorescente é diretamente determinada pela quantidade e qualidade das informações obtidas a partir de medições de fluorescência de fronteira.
Um ruido instrumental e a autofluorescência de tecidos são as principais perturbações das medidas, resultando em má qualidade do sinal, que pode causar graves artefatos nos resultados reconstruídos. Para superar isso, pode-se, por exemplo, empregar equipamento de baixo nivel de ruido, um uso do fundo subtração ou des-mistura espectral. No entanto, tais métodos não podem resolver todos os problemas, uma vez que essencialmente são apenas métodos utilizando as informações presentes de uma forma melhor, ao invés de adicionar novas restrições para a reconstrução, ou seja, a adição de novas informações independentes, o que é fundamental para se melhorar a qualidade das reconstruções. Em um sistema sem contato FDOT com base em CCD, uma forma preferida para obter mais informações é a de se aumentar o número de posições de excitação. No entanto, a fim de manter a intensidade do feixe de excitação dentro de niveis razoáveis, não há um limite para o tamanho minimo do feixe de excitação. Isto implica num limite prático superior para uma densidade mais alta de posição de excitação, uma vez que são distintas, ou seja sem sobreposição de excitação, as posições são as desejadas para as reconstruções. Também é possivel se empregar uma modalidade de imagem anatômica, como ressonância magnética, 5 para fornecer informações estruturais a priori. No entanto, isso impacta o custo da complexidade e aumenta significativamente a flexibilidade reduzida do sistema.
Nesta invenção, apresentamos uma abordagem para explorar a dependência de energia quadrática de nanoparticulas 10 conversoras para se obter informações adicionais, utilizando dois feixes simultaneamente para a excitação em FDOT. O efeito das imagens tiradas com feixe duplo de excitação (chamado tipo D de imagens) sobre as reconstruções da distribuição da densidade de nanoparticulas de número ”n" é 15 demonstrada. Além disso, comparações de resultados entre as reconstruções de Rodamina 6G linear e nanoparticulas quadráticas conversoras são feitas.
Os campos de excitação e emissão podem ser modelados por duas equações de difusão acopladas [Ref. 1]. Para fluoróforos 20 quadráticos, o sinal de fluorescência detectado em uma posição fixa detector sob excitação do feixe k:th; pode ser descrito pelo modelo a seguir (1); onde N denota o número de voxels, denota as coordenadas para a fonte, detector, e voxel, respectivamente, e; ΔVi é o volume de voxel i.
A solução para a excitação de luz é representada por; enquanto a solução para o problema adjunto para fluorescência é representada por
Quando o meio excitante se dá através de dois feixes 10 simultaneamente, o sinal detectado é dado por (2); este revela o envolvimento de termos cruzados. Em uma configuração de digitalização em quadro (500, 507), se duas imagens são tomadas sequencialmente com um feixe de excitação 15 de varredura ao longo de duas posições (chamado tipo S de imagem), e uma terceira imagem é tomada com dois feixes de excitação (tipo D) acima da anterior de duas posições, o envolvimento de termos cruzados implica que a imagem do tipo D não pode ser obtida por qualquer manipulação matemática do tipo S de imagens existente, indicando que ele é independente 5 e contém informações adicionais. No entanto, para fluoróforos lineares, por exemplo, a rodamina 6G, a imagem do tipo D é apenas uma combinação linear do tipo S de imagens existente, e não vai acrescentar mais restrições para o problema inverso. Para fluoróforos não-lineares, deduz-se que a 10 equação (2), que pode ser generalizada para incluir feixes de excitação mais simultânea.
O significado das medições com feixe duplo de excitação nas reconstruções foi confirmado pela análise de valor singular da matriz de peso W, cujos elementos são dados por • 15 (3) [ref. 1] ; com; 5 = 2 para fluoróforos quadráticos; para fluoróforos lineares.
Os cálculos foram realizados utilizando o pacote NIRFAST, com implementação do método de elementos finitos. W foi fatorado de acordo com (4); onde U e V são matrizes unitárias contendo os vetores de esquerda e direita singular de W, e; ∑ é uma matriz diagonal contendo os valores singulares de W.
A coluna de espaço de U é gerada por modos de imagem-espaço, enquanto o espaço de coluna de U é feito atravessado pelos modos de detecção de espaço.
Os valores singulares de W denotam como, efetivamente, um determinado modo de imagem-espaço pode ser detectado por uma configuração experimental [Ref. 2]. A Figura 12 mostra a distribuição de valor singular normalizado de W. O eixo x mostra o indice de valor singular ’ 15 (1120) e o eixo y mostra a intensidade valor normalizado e singular (1121) . Para maior clareza, apenas os valores singulares a cada segundo são mostrados. Os sinais de cruz (1122) e de mais (1124) representam o fluoróforo linear (y = 1), o primeiro para a excitação de feixe único (1122), 20 enquanto o último para a excitação de feixe único combinado e duplo feixe de excitação (1124). Como visto, as intensidades normalizadas dos valores singulares adicionais devido a um feixe duplo de excitação (1124) cairam para a precisão da máquina, o que indica que as medições com feixe duplo de excitação não pode aliviar o mal-posicionamento da FDOT. Em outras palavras, as imagens do tipo D não podem fornecer mais informações do que as já existentes para o tipo S- de imagens. Por isso, não pode se melhorar a qualidade das reconstruções. No entanto, para o fluoróforo quadrático, indicado por sinais de asterisco (1123) e ponto (1125) na figura 12, as intensidades dos valores adicionais singulares (1125) ainda são significativos. Isto implica que as imagens do tipo D vão contribuir para a qualidade das reconstruções.
Os experimentos foram realizados em um fantasma de gelatina com propriedades ópticas de μa = 0,29 cm- 1 e μ’s = 10,0 cm-1 e 660 nm, medidos com um sistema de espectroscopia de tempo de vôo [Ref. 3] . Dois tubos capilares, cheio de soluções de rodamina 6G (c = 0,1 ML) e nanoparticulas NaYF4: Yb3+/Tm3+ (c = 0,1% em peso), respectivamente, foram utilizados para simular as lesões fluorescentes. A configuração experimental e os correspondentes parâmetros de execução foram semelhantes a aqueles utilizados em nosso trabalho anterior [Ref. 1]. Devido à área limitada do fantasma sob investigação, apenas nove posições de excitação (um grid de 3 x 3) foram utilizados na presente invenção. A separação das duas posições de vizinho mais próximo foi de 3,5 mm, e cada feixe de excitação tinha um diâmetro de aproximadamente 2,6 mm. Durante os experimentos, um feixe de 5 excitação simples foi usado pela primeira vez, para fazer a varredura sobre a grade de 3 x 3, e uma imagem foi capturada para cada posição digitalizada por uma câmera CCD. Na próxima etapa, dois feixes de excitação, localizados em dois locais vizinhos mais próximos, da mesma grade, foram simultaneamente 10 empregados para se iluminar o fantasma, dando seis imagens de tipo D extras. As figuras 13A e 13B mostram a renderização tridimensional das nanoparticulas conversoras reconstruídas. Os cilindros vermelhos nas subfiguras são idênticos e .15 representam as lesões verdadeiras fluorescentes. Na reconstrução da figura 13a) , apenas imagens de tipo S foram usadas. Como pode ser visto, a forma da lesão fluorescente é superestimada. Esta superestimação tem de ser explicada pelo mal posicionamento do problema inverso. Ao se adicionar 20 imagens de tipo D, a reconstrução da forma de lesão fluorescentes é melhorada notavelmente, como mostrado na figura 13B. A fim de se enfatizar a diferença entre as duas reconstituições, cortes transversais da distribuição de fluoróforo reconstruídas relativamente são mostrados nas figuras 14A a 14F. Embora a profundidade seja relativamente bem reconstruída e do centro da lesão fluorescente 5 (representado pelos circulos) ser encontrado para ambas as reconstruções, a lesão reconstruida fluorescente é mais confinada para o caso de se usar tanto imagens de tipo-S e D. Este resultado confirma que as imagens do tipo D, de fato, contribuem para o problema inverso e levam a reconstruções 10 melhores para as nanopartículas conversoras quadráticas. As reconstruções correspondentes lineares para a rodamina 6G também foram realizadas, cujos cinco cortes transversais são apresentados nas figuras 15A a 15F. Quando comparados com os resultados para as nanopartículas, as reconstruções de 15 rodamina 6G não se beneficiam da adição das imagens do tipo . D, que está de acordo com a teoria. A verdadeira profundidade da lesão fluorescente também é mal reconstruida.
É divulgada uma vantagem adicional única da dependência de energia não-linear de nanopartículas conversoras. Esta 20 vantagem permite a possibilidade de se obter informações adicionais para o problema inverso, usando imagens tiradas com dois ou mais feixes de excitação simultaneamente.
Determinou-se que isso resultou em reconstruções melhoradas. A mesma vantagem não pôde ser encontrada ao se usar fluoróforos lineares, por exemplo, rodamina 6G.
Esta invenção apresenta modalidades não-lineares de imagem de luminescência e tomografia. Em experimentos, foi demonstrado que a imagem com nanocristais conversores é possível em meio de dispersão parecido com o tecido biológico. Além disso, as simulações mostraram que é possível se adaptar a teoria utilizada na tomografia óptica 10 fluorescente, para trabalhar com os nanocristais conversores.
As partículas de nanocristais conversores utilizados neste relatório descritivo, em comparação com fluoróforos orgânicos, têm uma variedade de aplicações, tais como para marcadores biológicos, graças às suas propriedades ópticas . 15 únicas.
A presente invenção foi descrita acima, com referência às modalidades específicas. No entanto, outras modalidades diferentes das descritas acima são igualmente possíveis no âmbito da invenção. As diferentes características e as etapas 20 da invenção podem ser combinadas em combinações diferentes das descritos. O escopo da invenção é limitado apenas pelas reivindicações desta patente anexadas.
O método pode ser realizado in vivo em um ser humano vivo ou no corpo de um animal. Neste caso, os marcadores podem ser pré-introduzidos no corpo, de qualquer maneira, como por meio de injeção na corrente sanguinea ou por via 5 subcutânea ou diretamente em um tumor, ou, alternativamente, pela aplicação tópica, pulmonar e outros métodos não- invasivos. A pré-introdução pode ser realizada separadamente do restante do método. A pré-introdução pode ser realizada em conexão com o método restante, mas logo antes do mesmo.
Alternativamente ou adicionalmente, o método pode ser realizado em um corpo humano ou animal, que é sacrificado depois que o método é realizado.
Alternativamente ou adicionalmente, o método pode ser realizado in vitro em um ser humano não-vivo ou no corpo do * 15 animal ou parte de um corpo, por exemplo um ser humano com morte cerebral ou no corpo de um animal.
Alternativamente ou adicionalmente, o método pode ser realizado em campos não-médicos, como filtros ou comprimidos.
As referências a seguir são incorporadas por referência 20 neste documento em sua totalidade para todos os efeitos: [Ref. 1] CT Xu, J. Axelsson, e S. Andersson-Engels, Appl. Phys. Lett. 94, 251107 (2009). [Ref. 2] JP Culver, V. Ntziachristos, MJ Holboke, e AG yodh, Opt. Lett. 26, 701 (2001). [Ref. 3] E. Alerstam, S. Andersson-Engels, e T. Svensson, J. Biomed. Opt. 13, 041304 (2008).
Claims (20)
1. Método de formação de imagem de uma região em um meio de dispersão por imagem de luminescência molecular difusa, caracterizado pelo fato de que compreende: fornecer pelo menos um marcador luminescente não linear no referido meio de dispersão em uma posição do marcador na referida região, fornecer o referido marcador luminescente não linear com luz de excitação emitida por uma ou mais fontes de luz em um volume de excitação de pelo menos uma posição de fonte de luz, e detectar luminescência do referido marcador luminescente devido à luz de excitação por um detector em uma posição de detecção de luz luminescente, fornecer movimento entre a referida posição da fonte de luz e a referida posição do marcador, fornecer redução do referido volume de excitação através da imagem do referido marcador luminescente sendo feita com base em uma dependência não linear da referida luminescência detectada em tal intensidade de luz de excitação e em que a posição da fonte de luz é feita em relação à posição do marcador.
2. Método, de acordo com a reivindicação 1, caracterizado pelo fato de que a referida dependência não linear ser dada pela relaçãoem que E é a intensidade da luz de excitação no referido volume de excitação, L é a intensidade da luminescência da luz do marcador luminescente, k é uma constante positiva, e x é um número positivo maior do que um.
3. Método, de acordo com a reivindicação 1, caracterizado pelo fato de que o referido movimento proporcionado compreende: mover a referida posição da fonte de luz em relação à referida posição do marcador.
4. Método, de acordo com a reivindicação 1, caracterizado pelo fato de que o referido movimento proporcionado compreender: mover o referido marcador em relação a referida posição da fonte de luz.
5. Método, de acordo com a reivindicação 3, caracterizado pelo fato de que compreende; escanear um ou mais feixes de excitação entre uma pluralidade de posições da fonte de luz, de modo que a dita posição da fonte de luz seja movida em relação à dita posição do marcador.
6. Método, de acordo com a reivindicação 5, caracterizado pelo fato de que compreende: detectar a referida luminescência para cada uma da referida pluralidade de posições de fonte de luz, a luminescência tendo uma intensidade de luminescência total de marcador luminescente para cada uma da referida pluralidade de posições de fonte de luz do referido marcador luminescente, fazer uma imagem da referida intensidade de luminescência total para cada uma da referida pluralidade de posições da fonte de luz.
7. Método, de acordo com a reivindicação 6, caracterizado pelo fato de que a intensidade de luminescência total é fornecida pela soma da luminescência do dito marcador luminescente.
8. Método, de acordo com a reivindicação 5, caracterizado pelo fato de que a referida pluralidade de posições da fonte de luz forma um padrão de grade, em que o marcador de luminescência tem uma área projetada no referido padrão de grade, em que a referida área projetada é menor do que a área coberta pelo referido padrão de grade, em que o referido volume de excitação está substancialmente localizado em cada uma das várias posições da fonte de luz, de modo que o marcador luminescente seja parcialmente excitado se a posição da fonte de luz se sobrepõe parcialmente à área projetada.
9. Método, de acordo com qualquer uma das reivindicações 1 a 8, caracterizado pelo fato de que compreende excitar o referido marcador luminescente por duas ou mais fontes de luz simultaneamente.
10. Método, de acordo com qualquer uma das reivindicações 1 a 9, caracterizado pelo fato de que compreende: excitar o referido marcador luminescente por uma primeira fonte de luz tendo um primeiro comprimento de onda a partir de uma primeira posição de fonte de luz, excitar o referido marcador luminescente por uma segunda fonte de luz tendo um segundo comprimento de onda de uma segunda posição de fonte de luz.
11. Método, de acordo com a reivindicação 10, caracterizado pelo fato de que o referido primeiro comprimento de onda é substancialmente idêntico ao referido segundo comprimento de onda.
12. Método, de acordo com a reivindicação 10, caracterizado pelo fato de que o referido marcador luminescente é excitado pelas referidas primeira e segunda fontes de luz simultaneamente.
13. Método, de acordo com a reivindicação 10, caracterizado pelo fato de que pelo menos uma das referidas primeira e segunda posições da fonte de luz é movida em relação à referida posição do marcador.
14. Método, de acordo com qualquer uma das reivindicações 1 a 13, caracterizado pelo fato de que a referida imagem luminescente difusa compreende tomografia luminescente difusa.
15. Método, de acordo com a reivindicação 14, caracterizado pelo fato de que compreende: escanear as referidas uma ou mais fontes de luz entre uma pluralidade de diferentes posições de fonte de luz de modo que a referida posição da fonte de luz seja movida em relação à referida posição do marcador, e detectar a referida luminescência para fornecer imagens de luminescência do referido marcador luminescente para cada uma da referida pluralidade de diferentes posições de fonte de luz, reconstruir uma imagem tomográfica tridimensional do referido marcador luminescente a partir das referidas imagens luminescentes.
16. Método, de acordo com a reivindicação 15, caracterizado pelo fato de que reconstruir a referida imagem tomográfica tridimensional compreende: calcular um campo de excitação a partir da referida luz de excitação, calcular um campo de emissão do referido marcador luminescente, calcular um produto do referido campo de excitação de acordo com a referida dependência não linear, e em que o referido cálculo do referido campo de emissão é baseado no referido produto.
17. Método, de acordo com a reivindicação 16, caracterizado pelo fato de que o cálculo do referido produto compreende: multiplicar a intensidade de campo do referido campo de excitação de modo a formar um produto da referida intensidade de campo elevado à potência correspondente à dependência de potência da referida relação não linear.
18. Método, de acordo com a reivindicação 17, caracterizado pelo fato de que compreende o cálculo do produto quadrático da referida intensidade de campo.
19. Sistema para imagem molecular de luminescência difusa de uma região de interesse em um meio de dispersão, o referido sistema compreendendo um marcador luminescente para uso na referida imagem molecular luminescente do referido meio de dispersão, em que o referido marcador luminescente é um marcador luminescente não linear disposto em o referido meio de dispersão, o referido sistema caracterizado pelo fato de compreender: uma ou mais fontes de luz posicionadas por pelo menos uma posição de fonte de luz para excitar o referido marcador luminescente pela luz de excitação emitida pelas referidas uma ou mais fontes de luz em um volume de excitação, um detector em uma posição de detecção de luz luminescente detectando luminescência do referido marcador luminescente devido à referida luz de excitação, em que o sistema é configurado para realizar as etapas do método como definido em qualquer uma das reivindicações 1 a 18.
20. Sistema, de acordo com a reivindicação 19, caracterizado pelo fato da referida luz de entrada de um comprimento de onda de iluminação compreender dois ou mais feixes de excitação simultaneamente, em que a referida luz de excitação é fornecida por uma primeira fonte de luz tendo um primeiro comprimento de onda de uma primeira posição de fonte de luz, e uma segunda fonte de luz tendo um segundo comprimento de onda de uma segunda posição de fonte de luz, e em que a referida luz de excitação é fornecida pelas referidas primeira e segunda fontes de luz simultaneamente.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE0950313 | 2009-05-05 | ||
| SE0950313-7 | 2009-05-05 | ||
| US21588109P | 2009-05-12 | 2009-05-12 | |
| US61/215,881 | 2009-05-12 | ||
| US25513909P | 2009-10-27 | 2009-10-27 | |
| US61/255,139 | 2009-10-27 | ||
| PCT/EP2010/056127 WO2010128090A1 (en) | 2009-05-05 | 2010-05-05 | A system, method, and luminescent marker for improved diffuse luminescent imaging or tomography in scattering media |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BRPI1011413A2 BRPI1011413A2 (pt) | 2016-03-15 |
| BRPI1011413B1 true BRPI1011413B1 (pt) | 2021-09-14 |
Family
ID=42312993
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BRPI1011413-0A BRPI1011413B1 (pt) | 2009-05-05 | 2010-05-05 | Sistema, método e marcador luminescente para geração de imagem luminescente difusa melhorada ou tomografia em meio de dispersão |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US9012869B2 (pt) |
| EP (1) | EP2427100B1 (pt) |
| JP (3) | JP2012525883A (pt) |
| KR (1) | KR20120036304A (pt) |
| CN (1) | CN102497803B (pt) |
| AU (1) | AU2010244431B2 (pt) |
| BR (1) | BRPI1011413B1 (pt) |
| CA (1) | CA2760783C (pt) |
| IL (1) | IL216125A (pt) |
| SG (1) | SG175923A1 (pt) |
| WO (1) | WO2010128090A1 (pt) |
| ZA (1) | ZA201108562B (pt) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5945226B2 (ja) * | 2009-09-22 | 2016-07-05 | ビセン メディカル, インコーポレイテッド | 拡散媒質の仮想屈折率整合のためのシステムおよび方法 |
| JP6087049B2 (ja) | 2011-11-02 | 2017-03-01 | 浜松ホトニクス株式会社 | 蛍光ファントム装置および蛍光イメージング方法 |
| CN104603600B (zh) * | 2012-07-01 | 2017-09-01 | 卢米托股份有限公司 | 用于散射介质中改进的扩散发光成像或者断层照相的系统和方法 |
| CN103207168A (zh) * | 2012-12-26 | 2013-07-17 | 西安交通大学 | 一种心肌细胞膜电位功能信息光学重构方法 |
| CN104674994A (zh) * | 2015-01-09 | 2015-06-03 | 湘潭市众成宏鑫建筑材料有限公司 | 一种用于现浇空心楼盖的组合芯模及其制作方法 |
| US11971354B2 (en) | 2015-04-08 | 2024-04-30 | Molecular Devices, Llc | Methods and systems for fluorescence detection using infrared dyes |
| US10379046B2 (en) * | 2015-04-08 | 2019-08-13 | Molecular Devices, Llc | Method and system for multiplexed time-resolved fluorescence detection |
| EP3420535B1 (en) | 2016-02-26 | 2022-09-07 | University Of Southern California | Optimized volumetric imaging with selective volume illumination and light field detection |
| US9730649B1 (en) | 2016-09-13 | 2017-08-15 | Open Water Internet Inc. | Optical imaging of diffuse medium |
| DE102016124730A1 (de) * | 2016-12-16 | 2018-06-21 | Olympus Winter & Ibe Gmbh | Endoskopiesystem und Lichtquelle eines Endoskopiesystems |
| EP3809138A1 (en) | 2017-06-08 | 2021-04-21 | Lumito AB | A method of analysing a sample for at least one analyte |
| KR101998582B1 (ko) | 2017-12-28 | 2019-07-10 | 주식회사 에스에프에이 | 멀티 트레이 무인 반송대차 시스템 |
| US10778912B2 (en) | 2018-03-31 | 2020-09-15 | Open Water Internet Inc. | System and device for optical transformation |
| US10778911B2 (en) | 2018-03-31 | 2020-09-15 | Open Water Internet Inc. | Optical transformation device for imaging |
| US10506181B2 (en) | 2018-03-31 | 2019-12-10 | Open Water Internet Inc. | Device for optical imaging |
| US10966612B2 (en) | 2018-06-14 | 2021-04-06 | Open Water Internet Inc. | Expanding beam optical element |
| US10962929B2 (en) | 2018-09-14 | 2021-03-30 | Open Water Internet Inc. | Interference optics for optical imaging device |
| US10874370B2 (en) | 2019-01-28 | 2020-12-29 | Open Water Internet Inc. | Pulse measurement in optical imaging |
| US10955406B2 (en) | 2019-02-05 | 2021-03-23 | Open Water Internet Inc. | Diffuse optical imaging with multiple beams |
| US11320370B2 (en) | 2019-06-26 | 2022-05-03 | Open Water Internet Inc. | Apparatus for directing optical and acoustic signals |
| US11581696B2 (en) | 2019-08-14 | 2023-02-14 | Open Water Internet Inc. | Multi-channel laser |
| US11622686B2 (en) | 2019-11-22 | 2023-04-11 | Open Water Internet, Inc. | Optical imaging with unshifted reference beam |
| US11819318B2 (en) | 2020-04-27 | 2023-11-21 | Open Water Internet Inc. | Optical imaging from light coherence |
| US11259706B2 (en) | 2020-05-19 | 2022-03-01 | Open Water Internet Inc. | Dual wavelength imaging and out of sample optical imaging |
| US11559208B2 (en) | 2020-05-19 | 2023-01-24 | Open Water Internet Inc. | Imaging with scattering layer |
| KR102646948B1 (ko) * | 2021-06-07 | 2024-03-13 | 전남대학교산학협력단 | 유전자 조작 박테리아를 이용한 소장 내 급성 저산소성 허혈성 조직 진단에 필요한 정보를 제공하는 방법 |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5451785A (en) | 1994-03-18 | 1995-09-19 | Sri International | Upconverting and time-gated two-dimensional infrared transillumination imaging |
| US5832931A (en) * | 1996-10-30 | 1998-11-10 | Photogen, Inc. | Method for improved selectivity in photo-activation and detection of molecular diagnostic agents |
| US20010032053A1 (en) * | 2000-01-24 | 2001-10-18 | Hielscher Andreas H. | Imaging of a scattering medium using the equation of radiative transfer |
| EP1207387A1 (en) * | 2000-11-20 | 2002-05-22 | Institut Curie | Multi-photon imaging installation. |
| US6615063B1 (en) | 2000-11-27 | 2003-09-02 | The General Hospital Corporation | Fluorescence-mediated molecular tomography |
| US6687620B1 (en) * | 2001-08-01 | 2004-02-03 | Sandia Corporation | Augmented classical least squares multivariate spectral analysis |
| JP4804665B2 (ja) * | 2001-08-09 | 2011-11-02 | オリンパス株式会社 | レーザ顕微鏡 |
| EP3252139A1 (en) * | 2001-09-06 | 2017-12-06 | Rapid Micro Biosystems, Inc. | Rapid detection of replicating cells |
| JP2003344285A (ja) * | 2002-05-24 | 2003-12-03 | Japan Science & Technology Corp | 環状断面レーザ光ビーム生成器および多光子顕微鏡 |
| US7303741B2 (en) | 2002-09-23 | 2007-12-04 | General Electric Company | Systems and methods for high-resolution in vivo imaging of biochemical activity in a living organism |
| DE10255013B4 (de) | 2002-11-25 | 2004-12-09 | Siemens Ag | Verfahren und Vorrichtung zur Lokalisierung von Licht emittierenden Bereichen |
| US7510699B2 (en) * | 2003-02-19 | 2009-03-31 | Sicel Technologies, Inc. | In vivo fluorescence sensors, systems, and related methods operating in conjunction with fluorescent analytes |
| EP1727460A2 (en) | 2004-03-11 | 2006-12-06 | The General Hospital Corporation | Method and system for tomographic imaging using fluorescent proteins |
| JP4309787B2 (ja) * | 2004-03-12 | 2009-08-05 | オリンパス株式会社 | 多光子励起型測定装置 |
| US7302348B2 (en) * | 2004-06-02 | 2007-11-27 | Agilent Technologies, Inc. | Method and system for quantifying and removing spatial-intensity trends in microarray data |
| JP2006023382A (ja) | 2004-07-06 | 2006-01-26 | Olympus Corp | 光走査型観察装置 |
| JP4471162B2 (ja) | 2004-07-14 | 2010-06-02 | 富士フイルム株式会社 | 蛍光ct装置 |
| WO2006102395A2 (en) * | 2005-03-22 | 2006-09-28 | Medstar Health Inc | Delivery systems and methods for diagnosing and treating cardiovascular diseases |
| WO2007009812A1 (de) * | 2005-07-22 | 2007-01-25 | Carl Zeiss Microimaging Gmbh | Auflösungsgesteigerte lumineszenz-mikroskopie |
| WO2007054846A2 (en) * | 2005-11-10 | 2007-05-18 | Philips Intellectual Property & Standards Gmbh | Absorption and scattering map reconstruction for optical fluorescence tomography |
| EP2460868A3 (en) | 2006-01-06 | 2013-06-19 | National University of Singapore | Method of preparing nano-structured material(s) and uses thereof |
| US8084753B2 (en) * | 2006-03-20 | 2011-12-27 | Baylor College Of Medicine | Method and system for non-contact fluorescence optical tomography with patterned illumination |
| FR2900043B1 (fr) | 2006-04-24 | 2008-07-04 | Commissariat Energie Atomique | Procede d'imagerie optique par fluorescence de tissus biologiques, notamment pour delimiter des regions d'interet des tissus a analyser par tomographie |
| SG175647A1 (en) | 2006-10-17 | 2011-11-28 | Univ Singapore | Upconversion fluorescent nano-structured material and uses thereof |
| GB0707433D0 (en) * | 2007-04-18 | 2007-05-23 | Stfc Science & Technology | Fluorescence measurement |
| WO2009046392A1 (en) | 2007-10-04 | 2009-04-09 | Trustees Of Princeton University | Synthesis of bio-functionalized rare earth doped upconverting nanophosphors |
| WO2010107720A2 (en) * | 2009-03-18 | 2010-09-23 | Tuan Vo-Dinh | Up and down conversion systems for production of emitted light from various energy sources |
-
2010
- 2010-05-05 BR BRPI1011413-0A patent/BRPI1011413B1/pt active IP Right Grant
- 2010-05-05 US US13/318,403 patent/US9012869B2/en active Active
- 2010-05-05 KR KR1020117028821A patent/KR20120036304A/ko active IP Right Grant
- 2010-05-05 SG SG2011081874A patent/SG175923A1/en unknown
- 2010-05-05 AU AU2010244431A patent/AU2010244431B2/en active Active
- 2010-05-05 WO PCT/EP2010/056127 patent/WO2010128090A1/en active Application Filing
- 2010-05-05 EP EP10720382.0A patent/EP2427100B1/en active Active
- 2010-05-05 CA CA2760783A patent/CA2760783C/en active Active
- 2010-05-05 CN CN201080030265.6A patent/CN102497803B/zh active Active
- 2010-05-05 JP JP2012509034A patent/JP2012525883A/ja active Pending
-
2011
- 2011-11-03 IL IL216125A patent/IL216125A/en active IP Right Grant
- 2011-11-22 ZA ZA2011/08562A patent/ZA201108562B/en unknown
-
2016
- 2016-04-20 JP JP2016084227A patent/JP6650334B2/ja active Active
-
2018
- 2018-05-22 JP JP2018097799A patent/JP2018128470A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| SG175923A1 (en) | 2011-12-29 |
| CA2760783A1 (en) | 2010-11-11 |
| JP2016135316A (ja) | 2016-07-28 |
| CN102497803A (zh) | 2012-06-13 |
| US9012869B2 (en) | 2015-04-21 |
| AU2010244431B2 (en) | 2015-05-14 |
| US20120104281A1 (en) | 2012-05-03 |
| EP2427100A1 (en) | 2012-03-14 |
| BRPI1011413A2 (pt) | 2016-03-15 |
| CN102497803B (zh) | 2015-03-25 |
| EP2427100B1 (en) | 2021-08-11 |
| IL216125A (en) | 2014-11-30 |
| JP2012525883A (ja) | 2012-10-25 |
| AU2010244431A1 (en) | 2011-12-01 |
| IL216125A0 (en) | 2012-01-31 |
| WO2010128090A1 (en) | 2010-11-11 |
| KR20120036304A (ko) | 2012-04-17 |
| CA2760783C (en) | 2018-06-19 |
| JP2018128470A (ja) | 2018-08-16 |
| ZA201108562B (en) | 2015-05-27 |
| JP6650334B2 (ja) | 2020-02-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6650334B2 (ja) | 散乱媒体の拡散ルミネセンスイメージングまたは断層撮影の改善のためのシステム、方法、およびルミネセンスマーカー | |
| Graves et al. | Fluorescence molecular imaging of small animal tumor models | |
| Kumar et al. | A time domain fluorescence tomography system for small animal imaging | |
| AU2013285996B2 (en) | A system and method for improved diffuse luminescent imaging or tomography in scattering media | |
| Zacharakis et al. | Fluorescent protein tomography scanner for small animal imaging | |
| Stuker et al. | Fluorescence molecular tomography: principles and potential for pharmaceutical research | |
| CA2877437A1 (en) | Method and arrangement for the relative position detection of stations by means of radio location | |
| JP2001503748A (ja) | 分子薬の光活性における選択性改善と検出のための方法 | |
| Mansfield et al. | Distinguished photons: increased contrast with multispectral in vivo fluorescence imaging | |
| Jiang | Fluorescence Molecular Tomography: Principles and Applications | |
| Patwardhan et al. | Fluorescence molecular Imaging: Microscopic to macroscopic | |
| Zacharakis et al. | Three-dimensional optical tomography of fluorescent proteins in the visible | |
| Da Silva et al. | In vivo fluorescence molecular optical imaging: from small animal towards clinical applications | |
| Balalaeva et al. | Diffuse fluorescence tomography of exo-and endogenously labeled tumors | |
| Tan | Quantitative fluorescence molecular tomography: Algorithms, simulations, and phantom/in vivo experiments | |
| Ale et al. | Optical Imaging | |
| Svensson et al. | Upconverting luminescence imaging and tomography for biomedical applications | |
| Terike et al. | Fluorescence Spectroscopy Utilized to Determine the Depth of an Embedded inclusion in Molecular Imaging | |
| Svenmarker | Optical spectroscopy and fluorescence imaging for cancer diagnostics | |
| Terike et al. | Analysis of a fluorescence spectrum for determination of fluorophore depth |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 05/05/2010, OBSERVADAS AS CONDICOES LEGAIS. PATENTE CONCEDIDA CONFORME ADI 5.529/DF, QUE DETERMINA A ALTERACAO DO PRAZO DE CONCESSAO. |