KR20110005783A - 질환 마커 및 그의 용도 - Google Patents
질환 마커 및 그의 용도 Download PDFInfo
- Publication number
- KR20110005783A KR20110005783A KR1020107019933A KR20107019933A KR20110005783A KR 20110005783 A KR20110005783 A KR 20110005783A KR 1020107019933 A KR1020107019933 A KR 1020107019933A KR 20107019933 A KR20107019933 A KR 20107019933A KR 20110005783 A KR20110005783 A KR 20110005783A
- Authority
- KR
- South Korea
- Prior art keywords
- expression
- activity
- oasl
- profile
- patient
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Analytical Chemistry (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Dermatology (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Heart & Thoracic Surgery (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Physical Education & Sports Medicine (AREA)
- Cardiology (AREA)
- Transplantation (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 근염과 같은 염증성 또는 자가면역 장애에서 miRNA 프로파일 및 타입 I IFN/IFNα 유도성 PD 마커 프로파일을 포함한다. 상기 프로파일은 또한 예를 들어 환자의 치료 방법, 환자의 질환 진행의 모니터링 방법, 및 염증성 또는 자가면역 장애를 갖는 환자를 진단하거나 상기 환자에 대한 예측을 제공하는데 사용될 수 있다.
Description
본 발명은 miRNA 마커 및 인터페론 (IFN) 알파/타입 I IFN 유도성 약력학적 (PD) 마커 및 이들을 사용하는 방법에 관한 것이다.
본 발명은 miRNA 마커 및 IFNα/타입 I IFN 유도성 PD 마커를 포함한다. 본 발명은 추가로, 예를 들어, 환자를 치료하고, 질환을 예측 또는 모니터링하는 방법에서 이들 마커를 사용하는 방법을 포함한다.
발명의 요약
본 발명의 한 가지 구체예는 타입 I IFN 또는 IFNα 매개된 질환 또는 장애를 갖는 환자를 치료하는 방법을 포함한다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 환자에게 투여한다. 환자는 차별적 조절된 miRNA 마커 프로파일을 포함한다. 제제는 차별적 조절된 miRNA 마커 프로파일을 중화시킨다.
본 발명의 또 다른 구체예는 필요한 환자에게서 차별적 조절된 miRNA 마커 프로파일을 중화시키는 방법이다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 환자에게 투여한다. 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 중화시킨다.
본 발명의 추가의 구체예는 환자의 자가면역 또는 염증성 질환 진행을 모니터하거나 예측하는 방법이다. 제1 차별적 조절된 miRNA 마커 프로파일은 환자로부터의 제1 샘플에서 수득된다.
본 발명의 또 다른 구체예는 치료제에 의한 치료를 받는 환자의 자가면역 또는 염증성 질환 진행을 모니터하는 방법이다. 제1 miRNA 프로파일은 환자로부터의 제1 샘플에서 수득된다. 치료제를 투여한다. 제2 miRNA 프로파일은 환자로부터의 제2 샘플에서 수득된다. 제1 및 제2 miRNA 프로파일을 비교한다. 제1 및 제2 miRNA 프로파일에서의 편차는 치료제의 효능의 레벨을 나타낸다.
본 발명의 또 다른 구체예에는 근염 환자를 치료하는 방법이다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 환자에게 투여한다. 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 중화시킨다.
본 발명의 추가의 구체예는 환자의 근염 질환 진행을 모니터하거나 예측하는 방법을 포함한다. 제1 IFNα 유도성 PD 마커 발현 프로파일은 환자로부터의 제1 샘플에서 수득된다.
본 발명의 추가의 구체예는 치료제에 의한 치료를 받는 환자의 근염 질환 진행을 모니터하는 방법이다. 제1 IFNα 유도성 PD 마커 발현 프로파일은 환자로부터의 제1 샘플에서 수득된다. 치료제를 환자에게 투여한다. 제2 IFNα 유도성 PD 마커 발현 프로파일은 환자로부터의 제2 샘플로부터 수득된다. 제1 및 제2 IFNα 유도성 PD 마커 발현 프로파일을 비교한다.
도 1a 및 1b: DM 및 PM 환자의 근육 검체에서 최고로 상향조절된 유전자의 대부분은 IFN-α/β 유도성이다. (a) DM 환자 근육 검체에서 상향조절된 유전자를 나타내는 표; (b) DM 및 PM 환자의 근육에서 IFN-α/β 유도성 유전자 표지 (gene signature) 스코어.
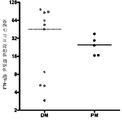
도 2a 및 2b: DM 및 PM 환자에게서 IFN-α/β 유도성 유전자 표지 스코어는 환자 질환 상태가 개선됨에 따라서 감소하며, (a)는 DM 활성 환자 (DMA), DM 개선 환자 (DMI), PM 활성 환자 (PMA), 및 PM 개선 환자 (PMI)의 IFN-α/β 유도성 유전자 표지 스코어를 제공한다. (b)는 IFN-α/β 유도성 유전자 표지 스코어가 DM 환자에게서 이들이 활성 질환으로부터 개선 쪽으로 진행함에 따라 감소하는 것을 보여준다.
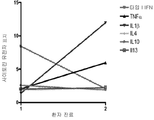
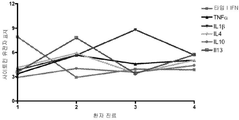
도 3a - 3c: (a) - (c)의 3 명의 환자에 대해서 나타낸 바와 같이, DM 환자 전혈 샘플에서의 IFN-α/β 유도성 유전자 표지 스코어는 임상적 개선과 상관관계가 있지만, 다른 사이토킨 (TNFα, IL lβ, IL4, ILlO, 및 IL 13)의 유전자 표지 스코어는 그렇지 않다.
도 4: DM 환자의 IFN-α/β 유도성 유전자 표지 스코어는 임상적 개선뿐만 아니라 재발을 예보하였다.
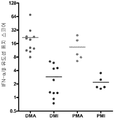
도 5a - 5d: PM 환자에게서 IFN-α/β 유도성 유전자 표지 스코어의 변화는 혈청 CK 레벨과 상관관계가 있으며, (a)는 PM 환자의 IFN-α/β-, TNFa-, ILlβ-, IL4-, ILlO-, IL 13 유도성 유전자 표지 스코어를 나타내고, (b)는 IFN-α/β 유도성 유전자 표지의 곡선에 따르는 환자의 혈청 CK 활성을 제공하며; (c)는 다양한 사이토킨 유전자 표지 스코어와 혈청 CK 레벨 사이의 상관관계를 제공하고; (d)는 건강한 공여체의 경우 (흑색 원)와 대비한 PM 환자의 IFN-α/β 유도성 유전자 표지 스코어의 PCA 플롯 (plot)이다.
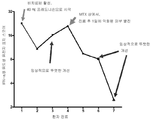
도 6: DM 환자에게서 IFN-α/β 유도성 유전자 표지 스코어의 변화는 혈청 CK 레벨과 상관관계가 있으며, (a)는 의사와의 4 회의 진료 (visit)에 걸친 환자의 혈청 CK 활성을 나타내며; (b)는 동일한 4 회의 진료에 걸친 환자의 IFN-α/β-, TNFa-, ILlβ-, IL4-, ILlO-, IL 13 유도성 유전자 표지 스코어를 나타내고; (c)는 다양한 사이토킨 유전자 표지 스코어와 혈청 CK 레벨 사이의 상관관계를 제공한다. 환자의 전혈에서 상위 25 개의 유도성 유전자의 중화에 의해서 모니터링되는 바와 같은 타입 I IFN 유전자 표지 ((b)에 나타냄)는 임상적 활성을 추적하였다. 진료 1, 치료-전; 진료 2, 리툭시마브 및 스테로이드에 의한 후속 치료 (한계적 개선); 진료 3, 환자는 안정하게 유지되었다; 진료 4, 환자는 크래쉬되었다 (crashed) (혈청 CK 레벨의 빠른 증가).
도 7a 및 7b: 도 6에서 검토한 DM 환자의 IFN-α/β 유도성 유전자 표지는 질환 진행/퇴행을 추적하였으며, (a)는 환자가 진행/퇴행함에 따라 IFN-α/β 유도성 표지에 있어서의 유전자의 중화 및 탈-중화를 나타내는 히트맵 (heatmap)이고; (b)는 건강한 공여체의 경우 (흑색 원)와 대비하여 DM 환자의 IFN-α/β 유도성 유전자 표지 스코어를 추적하는 PCA 플롯.
도 8: IBM 환자의 근육 검체가 IFN-α/β 유도성 유전자 표지 과발현을 나타내는 것을 보여주는 산포 플롯 (scatter plot). 산포 플롯은 두 가지 방법을 사용하여 IBM을 갖는 14 명의 환자로부터의 근육 검체에 대한 IFN-α/β-유전자 표지 스코어의 플롯이다: 25 개 유전자의 동적 (dynamic) 리스트 및 21 개 유전자의 정적 (static) 리스트. 각각의 포인트 (point)는 환자를 나타낸다.
도 9a 및 9b: IBM 환자 혈청 샘플은 뚜렷한 IFN-α/β-유전자 표지 과발현을 나타낸다. (a)는 두 가지 방법을 사용한 9 명의 IBM 환자로부터의 전혈에 대한 IFN-α/β-유전자 표지 스코어: 25 개 유전자의 동적 리스트 및 21 개 유전자의 정적 리스트; (b) 25 개의 유전자의 동적 리스트를 사용한 9 명의 IBM 환자로부터의 전혈에 대한 IFN-α/β-유전자 표지 스코어의 산포 플롯. 각각의 포인트는 환자를 나타낸다.
도 10a 및 10b: JoI 음성 DM 환자는 JoI 양성 DM 환자보다 더 큰 IFN-α/β-유전자 표지 스코어를 가지며, (a)는 DM JoI 양성 및 DM JoI 음성 환자에게서 19 개의 IFN-α/β 유도성 유전자의 과발현; (b)는 19 개의 유전자를 사용한 3 명의 JoI 양성 및 7 명의 JoI 음성 DM 환자로부터의 근육에 대한 IFN-α/β-유전자 표지 스코어의 산포 플롯.
도 11-104: IL4 표지에서 유전자의 주석을 갖는 탐침 리스트.
도 105-158: ILlO 표지에서 유전자의 주석을 갖는 탐침 리스트.
도 159-234: IL13 표지에서 유전자의 주석을 갖는 탐침 리스트.
도 235-381: 807 IFNα 유도성 유전자의 주석을 갖는 탐침 리스트.
도 382-383: 독특한 검출기 ids, miRNA ids, 및 서열에 의한 리스트.
도 384a 및 384b: DM 및 PM 환자에게서 최고로 과발현된 것들 중에서 타입 1 IFN 유도성 유전자의 출현율 (prevalence)을 사용하여 타입 1 IFN 유도성 유전자 표지 스코어-양성 환자를 확인할 수 있으며, (a)는 24 명의 정상적인 건강한 공여체, 20 명의 PM 환자, 및 22 명의 DM 환자, 및 42 명의 DM 및 PM 환자를 24 명의 정상적인 건강한 공여체와 비교하여 타입 1 IFN 유도성이고 상당히 과발현되는 (q-값 < 0.05 및 폴드 (fold) 변화 > 2) 두 가지 모두에 의해서 확인된 136 개의 탐침 세트를 나타내는 히트맵이다. 제1의 흑색 수평 막대는 정상적인 건강한 공여체를 나타내고; 낮음 (low)으로 라벨을 붙인 제2의 수평 막대는 약한 타입 1 IFN 유도성 유전자 표지 스코어를 갖는 환자를 나타내며 (폴드 변화 < 4); 중간 (moderate)으로 라벨을 붙인 세 번째의 수평 막대는 중간 타입 1 IFN 유도성 유전자 표지 스코어 (4 < 폴드 변화 < 10)를 갖는 환자를 나타내고, 높음 (high)으로 라벨을 붙인 네 번째의 수평 막대는 높은 타입 1 IFN 유도성 유전자 표지 스코어를 갖는 환자를 나타내며 (즉, 표지 스코어-양성), (b)는 정상적인 건강한 공여체, 약한 표지 스코어, 중간 표지 스코어 및 높은 표지 스코어로 계층화된 (a)에서의 동일한 대상체에 대한 타입 1 IFN 유도성 유전자 표지 스코어의 산포 플롯이다. IFN=인터페론; DM=피부근염; PM=다발성근염.
도 385a - 385c: 환자 특이적 종방향 타입 1 IFN 유도성 전사 측정은 DM 및 PM 질환 활성을 측정하기 위한 바이오마커 (biomarkers)로서 유용성을 가지며, (a)는 진료 1에서의 21 명의 환자 및 35 명의 정상적인 건강한 공여체에 대한 13-유전자 복합 스코어 (composite score) 및 IFI27, IFI44, IFI44L 및 RSAD2에 대한 개별적인 전사 측정을 사용한 개별적인 유전자 복합 스코어 및 폴드-변화 값이다. 환자는 비교적 낮거나 중등도인 임상적으로 측정된 질환 활성 (MITAX ≤ 6) 및 높은 질환 활성 (MITAX > 6)에 의해서 분류한다. 다중 시험 조정 후에, 4 개의 유전자 중의 어떤 것 또는 13-유전자 복합 스코어에 관해서 정상적인 건강한 공여체와 MITAX ≤ 6인 환자 사이에 유의적인 차이는 없다. 모든 유전자 및 유전자 복합 스코어에 관해서 정상적인 건강한 공여체를 MITAX > 6인 환자와 비교하는 경우, 및 MITAX ≤ 6인 환자를 MITAX > 6인 환자와 비교하는 경우에는 유의적인 차이가 있다 (참조: 표 8). (b)는 MITAX-측정된 질환 활성에서 약간의 변이를 갖는 18 명의 환자에 대한 환자 특이적 분석이고, (c)는 시험에 걸쳐서 MITAX에 변화가 없는 3 명의 환자에 대한 것이다. 18 명의 환자 각각에 대해서 그들의 진료시의 유전자 복합 스코어, 폴드-변화 값 및 원 (raw) p 값이 시험의 과정에 걸친 최저 내지 최고 MITAX 값과 함께 제공된다. MITAX 변이를 갖는 환자는 조정 후에 IFI44를 제외한 모든 유전자/유전자 복합 스코어에 대해서 매우 유의적으로 부합하는 유전자 발현 변화를 나타내었으며; MITAX 변이가 없는 환자는 통계학적 유의성을 부여하기에는 샘플 크기가 너무 작았지만, 본질적으로 유전자 발현 변화를 나타내지 않았다. 모든 유전자 복합 스코어 및 폴드 변화 값은 36 명의 정상적인 건강한 공여체의 중앙값에 대비하여 계산하였다.
도 386a 및 386b: DM 및 PM 환자는 말초혈액으로부터의 타입 1 IFN 13-유전자 복합 스코어와 MITAX 스코어 사이의 상관관계를 입증하였으며, (a)는 적어도 총 4 회의 진료를 한 6명의 환자 (BGE15, BGE99, BGElO, BGE106, BGEl 19, 및 BGE147)에 대한 MITAX 스코어와 13-유전자 복합 스코어 사이의 비교이다. 흑색 실선 및 가장 오른쪽의 y-축은 MITAX 스코어를 나타내는 한편, 흑색 점선 및 가장 왼쪽의 y-축은 13-유전자 복합 스코어를 나타낸다. BGE 15 및 BGE 147에 대한 플롯에서 'H' 표시는 전조 (herald) 진료를 나타내며, (b) 추가의 상관관계는 환자 BGE92에 대해서 13-유전자 복합 스코어와 CK 레벨 사이에서 나타난다. 가장 왼쪽의 플롯에서 흑색 점선과 가장 오른쪽의 y-축은 이 환자에 대한 CK 레벨을 나타낸다. DM=피부근염; PM=다발성 근염; CK=크레아틴 키나제.
도 387a 및 387b: DM 또는 PM이 있는 몇 명의 환자에게서 WB 전조성 질환 재발 시에 타입 1 IFN 유도성 유전자 발현의 강력한 상승. 3 회의 진료가 있었으며, 여기에서 질환은 임상적으로 안정하거나 개선된 것으로 믿어졌지만, 환자는 6-35일 후에 임상적 재발을 발현하였다. 이들 3 회의 진료 각각에서 유의적인 IFN 유도성 유전자 발현 증가는 재발이 곧 일어날 수 있음을 "예보하였으며 (heralded)", (a)는 13-유전자 복합 스코어에 대한 발현 변화를 표로 열거한 것이다. 칼럼은 다음을 나타낸다: 환자 샘플; 전조 (V-전조)와 재발 (V-재발) 진료 사이의 일수; V-전조와 V-재발 사이에서 MITAX 스코어 변화; 선행 진료로부터 V-전조까지에서 유전자 발현의 폴드-증가. (b)는 13-유전자 복합 스코어의 그래프적 표현이다. 중간 진료 (#3)의 각각은 전조 진료이며; MITAX 스코어는 안정하거나, 선행 진료 (#2)에 비해서 개선되었지만, 13-유전자 복합 스코어는 상당히 증가하였으며, 이것은 아마도 다음 진료 (#4)에서 증가된 MITAX 스코어에 의해서 확인되는 재발을 예보할 것이다. IFN=인터페론; DM=피부근염; PM=다발성 근염.
도 388a - 388c: 다른 사이토킨 유도성 표지 스코어는 DM 또는 PM이 있는 중등도 및 중증 환자 사이에서 상이하지 않으며, 질환 활성과 상관관계가 없고, (a)는 진료 1에서 21 명의 환자에 대한 및 36 명의 정상적인 건강한 공여체에 대한 TNF-α, IL-I β, IL-IO, IL-13, 및 GM-CSF에 관한 사이토킨 유도성 유전자 표지가다. 환자는 비교적 낮거나 중등도인 임상적으로 측정된 질환 활성 (MITAX ≤ 6) 및 높은 질환 활성 (MITAX > 6)에 의해서 분류한다. 다중 시험 조정 후에, 정상적인 건강한 공여체와 MITAX ≤ 6인 환자 사이에는 5 개의 사이토킨 유도성 유전자 표지 모두에 대해서 유의적인 차이가 있다. 그러나, 5 개의 사이토킨 유도성 유전자 표지 중의 어떤 것에 관해서도 MITAX ≤ 6 대비 MITAX > 6인 환자 사이에는 유의적인 차이가 없다 (참조: 표 8). (b)는 MITAX-측정된 질환 활성에서 약간의 변이를 갖는 18 명의 환자에 대한 환자 특이적 분석이고, (c)는 시험에 걸쳐서 MITAX에 변화가 없는 3 명의 환자에 대한 것이다. 18 명의 환자 각각에 대해서 그들의 진료시의 사이토킨 유도성 유전자 표지 및 원 p 값이 시험의 과정에 걸친 최저 내지 최고 MITAX 값과 함께 제공된다. MITAX 변이를 갖는 환자는 모든 사이토킨 유도성 유전자 표지에 대해서 유의적으로 부합하는 유전자 발현 변화를 나타내지 않았으며; MITAX 변이가 없는 환자는 통계학적 유의성을 계산하기에는 샘플 크기가 너무 작았지만, 본질적으로 어떤 유전자 발현 변화도 나타내지 않았다. 모든 사이토킨 유도성 유전자 표지는 36 명의 정상적인 건강한 공여체의 중앙값에 대비하여 계산한다. DM=피부근염; PM=다발성 근염.
도 389: 최고 (상부 패널) 및 최저 (하부 패널) MITAX 스코어에 의한, 24 명의 DM 또는 PM 환자에 대한 진료시의 다양한 사이토킨 유도성 유전자 표지의 비교. 각각의 열은 상이한 사이토킨 유도성 유전자 표지의 과발현을 나타낸다. 박스 안에 개략적으로 나타낸 3 명의 환자는 타입 1 IFN 유도성 유전자 표지 스코어-음성이다. 각각의 환자에 대한 상승된 사이토킨-유도된 유전자 표지 레벨은 적색에 가까운 색상으로 표시되는 반면에, 청색에 가까운 색상은 낮은 사이토킨-유도된 유전자 표지 값을 나타낸다. IFN=인터페론; DM=피부근염; PM=다발성 근염.
도 2a 및 2b: DM 및 PM 환자에게서 IFN-α/β 유도성 유전자 표지 스코어는 환자 질환 상태가 개선됨에 따라서 감소하며, (a)는 DM 활성 환자 (DMA), DM 개선 환자 (DMI), PM 활성 환자 (PMA), 및 PM 개선 환자 (PMI)의 IFN-α/β 유도성 유전자 표지 스코어를 제공한다. (b)는 IFN-α/β 유도성 유전자 표지 스코어가 DM 환자에게서 이들이 활성 질환으로부터 개선 쪽으로 진행함에 따라 감소하는 것을 보여준다.
도 3a - 3c: (a) - (c)의 3 명의 환자에 대해서 나타낸 바와 같이, DM 환자 전혈 샘플에서의 IFN-α/β 유도성 유전자 표지 스코어는 임상적 개선과 상관관계가 있지만, 다른 사이토킨 (TNFα, IL lβ, IL4, ILlO, 및 IL 13)의 유전자 표지 스코어는 그렇지 않다.
도 4: DM 환자의 IFN-α/β 유도성 유전자 표지 스코어는 임상적 개선뿐만 아니라 재발을 예보하였다.
도 5a - 5d: PM 환자에게서 IFN-α/β 유도성 유전자 표지 스코어의 변화는 혈청 CK 레벨과 상관관계가 있으며, (a)는 PM 환자의 IFN-α/β-, TNFa-, ILlβ-, IL4-, ILlO-, IL 13 유도성 유전자 표지 스코어를 나타내고, (b)는 IFN-α/β 유도성 유전자 표지의 곡선에 따르는 환자의 혈청 CK 활성을 제공하며; (c)는 다양한 사이토킨 유전자 표지 스코어와 혈청 CK 레벨 사이의 상관관계를 제공하고; (d)는 건강한 공여체의 경우 (흑색 원)와 대비한 PM 환자의 IFN-α/β 유도성 유전자 표지 스코어의 PCA 플롯 (plot)이다.
도 6: DM 환자에게서 IFN-α/β 유도성 유전자 표지 스코어의 변화는 혈청 CK 레벨과 상관관계가 있으며, (a)는 의사와의 4 회의 진료 (visit)에 걸친 환자의 혈청 CK 활성을 나타내며; (b)는 동일한 4 회의 진료에 걸친 환자의 IFN-α/β-, TNFa-, ILlβ-, IL4-, ILlO-, IL 13 유도성 유전자 표지 스코어를 나타내고; (c)는 다양한 사이토킨 유전자 표지 스코어와 혈청 CK 레벨 사이의 상관관계를 제공한다. 환자의 전혈에서 상위 25 개의 유도성 유전자의 중화에 의해서 모니터링되는 바와 같은 타입 I IFN 유전자 표지 ((b)에 나타냄)는 임상적 활성을 추적하였다. 진료 1, 치료-전; 진료 2, 리툭시마브 및 스테로이드에 의한 후속 치료 (한계적 개선); 진료 3, 환자는 안정하게 유지되었다; 진료 4, 환자는 크래쉬되었다 (crashed) (혈청 CK 레벨의 빠른 증가).
도 7a 및 7b: 도 6에서 검토한 DM 환자의 IFN-α/β 유도성 유전자 표지는 질환 진행/퇴행을 추적하였으며, (a)는 환자가 진행/퇴행함에 따라 IFN-α/β 유도성 표지에 있어서의 유전자의 중화 및 탈-중화를 나타내는 히트맵 (heatmap)이고; (b)는 건강한 공여체의 경우 (흑색 원)와 대비하여 DM 환자의 IFN-α/β 유도성 유전자 표지 스코어를 추적하는 PCA 플롯.
도 8: IBM 환자의 근육 검체가 IFN-α/β 유도성 유전자 표지 과발현을 나타내는 것을 보여주는 산포 플롯 (scatter plot). 산포 플롯은 두 가지 방법을 사용하여 IBM을 갖는 14 명의 환자로부터의 근육 검체에 대한 IFN-α/β-유전자 표지 스코어의 플롯이다: 25 개 유전자의 동적 (dynamic) 리스트 및 21 개 유전자의 정적 (static) 리스트. 각각의 포인트 (point)는 환자를 나타낸다.
도 9a 및 9b: IBM 환자 혈청 샘플은 뚜렷한 IFN-α/β-유전자 표지 과발현을 나타낸다. (a)는 두 가지 방법을 사용한 9 명의 IBM 환자로부터의 전혈에 대한 IFN-α/β-유전자 표지 스코어: 25 개 유전자의 동적 리스트 및 21 개 유전자의 정적 리스트; (b) 25 개의 유전자의 동적 리스트를 사용한 9 명의 IBM 환자로부터의 전혈에 대한 IFN-α/β-유전자 표지 스코어의 산포 플롯. 각각의 포인트는 환자를 나타낸다.
도 10a 및 10b: JoI 음성 DM 환자는 JoI 양성 DM 환자보다 더 큰 IFN-α/β-유전자 표지 스코어를 가지며, (a)는 DM JoI 양성 및 DM JoI 음성 환자에게서 19 개의 IFN-α/β 유도성 유전자의 과발현; (b)는 19 개의 유전자를 사용한 3 명의 JoI 양성 및 7 명의 JoI 음성 DM 환자로부터의 근육에 대한 IFN-α/β-유전자 표지 스코어의 산포 플롯.
도 11-104: IL4 표지에서 유전자의 주석을 갖는 탐침 리스트.
도 105-158: ILlO 표지에서 유전자의 주석을 갖는 탐침 리스트.
도 159-234: IL13 표지에서 유전자의 주석을 갖는 탐침 리스트.
도 235-381: 807 IFNα 유도성 유전자의 주석을 갖는 탐침 리스트.
도 382-383: 독특한 검출기 ids, miRNA ids, 및 서열에 의한 리스트.
도 384a 및 384b: DM 및 PM 환자에게서 최고로 과발현된 것들 중에서 타입 1 IFN 유도성 유전자의 출현율 (prevalence)을 사용하여 타입 1 IFN 유도성 유전자 표지 스코어-양성 환자를 확인할 수 있으며, (a)는 24 명의 정상적인 건강한 공여체, 20 명의 PM 환자, 및 22 명의 DM 환자, 및 42 명의 DM 및 PM 환자를 24 명의 정상적인 건강한 공여체와 비교하여 타입 1 IFN 유도성이고 상당히 과발현되는 (q-값 < 0.05 및 폴드 (fold) 변화 > 2) 두 가지 모두에 의해서 확인된 136 개의 탐침 세트를 나타내는 히트맵이다. 제1의 흑색 수평 막대는 정상적인 건강한 공여체를 나타내고; 낮음 (low)으로 라벨을 붙인 제2의 수평 막대는 약한 타입 1 IFN 유도성 유전자 표지 스코어를 갖는 환자를 나타내며 (폴드 변화 < 4); 중간 (moderate)으로 라벨을 붙인 세 번째의 수평 막대는 중간 타입 1 IFN 유도성 유전자 표지 스코어 (4 < 폴드 변화 < 10)를 갖는 환자를 나타내고, 높음 (high)으로 라벨을 붙인 네 번째의 수평 막대는 높은 타입 1 IFN 유도성 유전자 표지 스코어를 갖는 환자를 나타내며 (즉, 표지 스코어-양성), (b)는 정상적인 건강한 공여체, 약한 표지 스코어, 중간 표지 스코어 및 높은 표지 스코어로 계층화된 (a)에서의 동일한 대상체에 대한 타입 1 IFN 유도성 유전자 표지 스코어의 산포 플롯이다. IFN=인터페론; DM=피부근염; PM=다발성근염.
도 385a - 385c: 환자 특이적 종방향 타입 1 IFN 유도성 전사 측정은 DM 및 PM 질환 활성을 측정하기 위한 바이오마커 (biomarkers)로서 유용성을 가지며, (a)는 진료 1에서의 21 명의 환자 및 35 명의 정상적인 건강한 공여체에 대한 13-유전자 복합 스코어 (composite score) 및 IFI27, IFI44, IFI44L 및 RSAD2에 대한 개별적인 전사 측정을 사용한 개별적인 유전자 복합 스코어 및 폴드-변화 값이다. 환자는 비교적 낮거나 중등도인 임상적으로 측정된 질환 활성 (MITAX ≤ 6) 및 높은 질환 활성 (MITAX > 6)에 의해서 분류한다. 다중 시험 조정 후에, 4 개의 유전자 중의 어떤 것 또는 13-유전자 복합 스코어에 관해서 정상적인 건강한 공여체와 MITAX ≤ 6인 환자 사이에 유의적인 차이는 없다. 모든 유전자 및 유전자 복합 스코어에 관해서 정상적인 건강한 공여체를 MITAX > 6인 환자와 비교하는 경우, 및 MITAX ≤ 6인 환자를 MITAX > 6인 환자와 비교하는 경우에는 유의적인 차이가 있다 (참조: 표 8). (b)는 MITAX-측정된 질환 활성에서 약간의 변이를 갖는 18 명의 환자에 대한 환자 특이적 분석이고, (c)는 시험에 걸쳐서 MITAX에 변화가 없는 3 명의 환자에 대한 것이다. 18 명의 환자 각각에 대해서 그들의 진료시의 유전자 복합 스코어, 폴드-변화 값 및 원 (raw) p 값이 시험의 과정에 걸친 최저 내지 최고 MITAX 값과 함께 제공된다. MITAX 변이를 갖는 환자는 조정 후에 IFI44를 제외한 모든 유전자/유전자 복합 스코어에 대해서 매우 유의적으로 부합하는 유전자 발현 변화를 나타내었으며; MITAX 변이가 없는 환자는 통계학적 유의성을 부여하기에는 샘플 크기가 너무 작았지만, 본질적으로 유전자 발현 변화를 나타내지 않았다. 모든 유전자 복합 스코어 및 폴드 변화 값은 36 명의 정상적인 건강한 공여체의 중앙값에 대비하여 계산하였다.
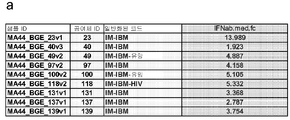
도 386a 및 386b: DM 및 PM 환자는 말초혈액으로부터의 타입 1 IFN 13-유전자 복합 스코어와 MITAX 스코어 사이의 상관관계를 입증하였으며, (a)는 적어도 총 4 회의 진료를 한 6명의 환자 (BGE15, BGE99, BGElO, BGE106, BGEl 19, 및 BGE147)에 대한 MITAX 스코어와 13-유전자 복합 스코어 사이의 비교이다. 흑색 실선 및 가장 오른쪽의 y-축은 MITAX 스코어를 나타내는 한편, 흑색 점선 및 가장 왼쪽의 y-축은 13-유전자 복합 스코어를 나타낸다. BGE 15 및 BGE 147에 대한 플롯에서 'H' 표시는 전조 (herald) 진료를 나타내며, (b) 추가의 상관관계는 환자 BGE92에 대해서 13-유전자 복합 스코어와 CK 레벨 사이에서 나타난다. 가장 왼쪽의 플롯에서 흑색 점선과 가장 오른쪽의 y-축은 이 환자에 대한 CK 레벨을 나타낸다. DM=피부근염; PM=다발성 근염; CK=크레아틴 키나제.
도 387a 및 387b: DM 또는 PM이 있는 몇 명의 환자에게서 WB 전조성 질환 재발 시에 타입 1 IFN 유도성 유전자 발현의 강력한 상승. 3 회의 진료가 있었으며, 여기에서 질환은 임상적으로 안정하거나 개선된 것으로 믿어졌지만, 환자는 6-35일 후에 임상적 재발을 발현하였다. 이들 3 회의 진료 각각에서 유의적인 IFN 유도성 유전자 발현 증가는 재발이 곧 일어날 수 있음을 "예보하였으며 (heralded)", (a)는 13-유전자 복합 스코어에 대한 발현 변화를 표로 열거한 것이다. 칼럼은 다음을 나타낸다: 환자 샘플; 전조 (V-전조)와 재발 (V-재발) 진료 사이의 일수; V-전조와 V-재발 사이에서 MITAX 스코어 변화; 선행 진료로부터 V-전조까지에서 유전자 발현의 폴드-증가. (b)는 13-유전자 복합 스코어의 그래프적 표현이다. 중간 진료 (#3)의 각각은 전조 진료이며; MITAX 스코어는 안정하거나, 선행 진료 (#2)에 비해서 개선되었지만, 13-유전자 복합 스코어는 상당히 증가하였으며, 이것은 아마도 다음 진료 (#4)에서 증가된 MITAX 스코어에 의해서 확인되는 재발을 예보할 것이다. IFN=인터페론; DM=피부근염; PM=다발성 근염.
도 388a - 388c: 다른 사이토킨 유도성 표지 스코어는 DM 또는 PM이 있는 중등도 및 중증 환자 사이에서 상이하지 않으며, 질환 활성과 상관관계가 없고, (a)는 진료 1에서 21 명의 환자에 대한 및 36 명의 정상적인 건강한 공여체에 대한 TNF-α, IL-I β, IL-IO, IL-13, 및 GM-CSF에 관한 사이토킨 유도성 유전자 표지가다. 환자는 비교적 낮거나 중등도인 임상적으로 측정된 질환 활성 (MITAX ≤ 6) 및 높은 질환 활성 (MITAX > 6)에 의해서 분류한다. 다중 시험 조정 후에, 정상적인 건강한 공여체와 MITAX ≤ 6인 환자 사이에는 5 개의 사이토킨 유도성 유전자 표지 모두에 대해서 유의적인 차이가 있다. 그러나, 5 개의 사이토킨 유도성 유전자 표지 중의 어떤 것에 관해서도 MITAX ≤ 6 대비 MITAX > 6인 환자 사이에는 유의적인 차이가 없다 (참조: 표 8). (b)는 MITAX-측정된 질환 활성에서 약간의 변이를 갖는 18 명의 환자에 대한 환자 특이적 분석이고, (c)는 시험에 걸쳐서 MITAX에 변화가 없는 3 명의 환자에 대한 것이다. 18 명의 환자 각각에 대해서 그들의 진료시의 사이토킨 유도성 유전자 표지 및 원 p 값이 시험의 과정에 걸친 최저 내지 최고 MITAX 값과 함께 제공된다. MITAX 변이를 갖는 환자는 모든 사이토킨 유도성 유전자 표지에 대해서 유의적으로 부합하는 유전자 발현 변화를 나타내지 않았으며; MITAX 변이가 없는 환자는 통계학적 유의성을 계산하기에는 샘플 크기가 너무 작았지만, 본질적으로 어떤 유전자 발현 변화도 나타내지 않았다. 모든 사이토킨 유도성 유전자 표지는 36 명의 정상적인 건강한 공여체의 중앙값에 대비하여 계산한다. DM=피부근염; PM=다발성 근염.
도 389: 최고 (상부 패널) 및 최저 (하부 패널) MITAX 스코어에 의한, 24 명의 DM 또는 PM 환자에 대한 진료시의 다양한 사이토킨 유도성 유전자 표지의 비교. 각각의 열은 상이한 사이토킨 유도성 유전자 표지의 과발현을 나타낸다. 박스 안에 개략적으로 나타낸 3 명의 환자는 타입 1 IFN 유도성 유전자 표지 스코어-음성이다. 각각의 환자에 대한 상승된 사이토킨-유도된 유전자 표지 레벨은 적색에 가까운 색상으로 표시되는 반면에, 청색에 가까운 색상은 낮은 사이토킨-유도된 유전자 표지 값을 나타낸다. IFN=인터페론; DM=피부근염; PM=다발성 근염.
상세한 설명
본 발명은 환자에게서 질환 진행을 확인, 진단, 치료 및 모니터하는 방법을 포함한다. 환자는 타입 I IFN 또는 IFNα 유도성 질환, 장애 또는 상태를 갖는 모든 동물; 또는 염증성 또는 자가면역 질환, 장애 또는 상태를 갖는 모든 동물을 포함한다. 환자는 실험적 연구의 결과로 질환, 장애 또는 상태를 가질 수 있으며, 예를 들어, 이것은 질환, 장애 또는 상태에 대해서 개발된 실험적 모델일 수 있다. 대신으로, 환자는 실험적 조작의 부재 하에서 질환, 장애 또는 상태를 가질 수도 있다. 환자는 인간, 마우스, 랫트, 말, 돼지, 고양이, 개, 및 연구를 위해서 사용된 모든 동물을 포함한다.
타입 I IFN 또는 IFNα 유도성 질환, 장애 또는 상태는 타입 I IFN 또는 IFNα PD 마커 발현 프로파일 또는 유전자 표지를 나타내는 어떤 것이라도 된다. PD 마커 발현 프로파일 및 유전자 표지는 동등한 것으로 이해될 것이다. 이들 질환, 장애 또는 상태는 전신 홍반성 루푸스, 인슐린 의존성 당뇨병, 염증성 장 질환 (크론병 (Crohn's disease), 궤양성 대장염 및 셀리악병 (Celiac's disease)을 포함), 다발성 경화증, 건선, 자가면역 갑상선염, 류마티스성 관절염, 사구체신염, 봉입체 근염 또는 피부근염 또는 다발성 근염 또는 비특이성 근염과 같은 특발성 염증성 근염, 또는 괴사성 근육병, 쇼그렌 증후군 (Sjogren's syndrome), 맥관염, 및 유육종증과 같은 자가면역 요소를 갖는 것을 포함한다. 그 밖의 다른 질환, 장애 또는 상태에는 이식편대 숙주 질환 및 이식 거부반응이 포함된다.
환자가 근염 환자라면, 환자는 봉입체 근염 또는 피부근염 또는 다발성 근염을 가질 수 있다. 근염 환자는 높거나 낮은 MITAX (Myositis Intention to Treat scale) 스코어를 가질 수 있다. 당업자는 근염 환자의 MITAX 스코어를 쉽게 결정할 수 있다 [참조: 예를 들어, Walsh RJ, Pinkus JL, et al.]. 혈액 내에는 타입 I 인터페론 유도성 유전자 발현이 존재하고, 피부근염 및 다발성 근염에서의 질환 활성을 반영한다 [참고로 포함된 Arthritis Rheum. 2007; 56(11):3784-92]. 높은 MITAX 스코어는 약 6보다 클 수 있다. 낮은 MITAX 스코어는 약 6 또는 그 미만일 수 있다. 근염 환자는 대신으로, 또는 추가로 중등도 또는 강력한 타입 I IFN- 또는 IFNα 유도성 유전자 표지 스코어를 가질 수도 있다. 타입 I IFN- 또는 IFNα 유도성 유전자 표지 스코어는 약 4 미만의 스코어로 지정된 경우에는 약하고, 대략 4보다 크고 10 미만의 스코어로 지정된 경우에는 중등도이고, 약 10 또는 10보다 큰 스코어로 지정된 경우에는 높은 것일 수 있다. 당업자는 타입 I IFN- 또는 IFNα 유도성 유전자 표지 스코어를 쉽게 이해하고, 결정할 수 있다 [참조: 예를 들어, 참고로 포함된 Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312].
자가면역 질환, 장애 또는 상태는 싸울 외래 물질이 없이 신체의 정상적인 방어적 면역 시스템이 자신을 잘못 공격함으로써 그 자신의 조직에 대한 손상을 야기하는 경우에 면역 시스템이 면역반응을 유발하는 모든 질환, 상태 또는 장애일 수 있다. 이들 질환, 장애 또는 상태에는 다발성 경화증, 크론병, 류마티스성 관절염, 원형탈모증, 강직성 척추염, 항인지질 증후군, 자가면역 아디손 (Addison's disease), 부신의 자가면역 질환, 알레르기성 뇌척수염, 자가면역 용혈성 빈혈, 자가면역 간염, 자가면역 염증성 안 질환, 자가면역 신생아 혈소판감소증, 자가면역 호중구감소증, 자가면역 난소염 및 고환염, 자가면역 혈소판감소증, 자가면역 갑상선염, 베체트병 (Behcet's disease), 수포성 유천포창, 심근증, 심장절개 증후군, 셀리악 스프루 (celiac sprue)-피부염, 만성 활성 간염, 만성 피로 면역 기능부전 증후군 (CFIDS), 만성 염증성 탈수초성 다발신경병증, 척-스트라우스 (Churg-Strauss) 증후군, 반흔성 유천포창, CREST 증후군, 한랭 응집소병, 크론병, 조밀 침착병, 원반형 루푸스, 본태성 혼합 한랭글로불린혈증, 섬유근통-섬유근염, 사구체신염 (예를 들어, IgA 신장병증), 글루텐-민감성 장질환, 굿파스튜어 (Goodpasture) 증후군, 그레이브스 (Graves) 병, 길랑-바레 (Guillain-Barre) 증후군, 갑상선기능항진증 (즉, 하시모토 (Hashimoto) 갑상선염), 특발성 폐섬유증, 특발성 아디손병, 특발성 혈소판감소성 자반병 (ITP), IgA 신경병증, 소아 관절염, 편평태선, 홍반성 루푸스, 메니에르 (Meniere) 병, 혼합 결합조직 질환, 다발성 경화증, 중증 근무력증, 심근염, 타입 1 또는 면역-매개된 당뇨병, 중증 근무력증, 심근염, 신경염, 그 밖의 다른 내분비선 부전, 심상성 천포창, 악성 빈혈, 결절성 다발동맥염, 다연골염, 다내분비질환, 다선 증후군, 류마티스성 다발성 근육통, 다발성 근염 및 피부근염, 후-MI, 원발성 무감마글로불린혈증, 원발성 담즙성 간경변, 건선, 건선성 관절염, 레이놀드 (Raynauld) 현상, 재발성 다연골염, 라이터 (Reiter) 증후군, 류마티스성 심장 질환, 류마티스성 관절염, 유육종증, 공피증, 쇼그렌 증후군, 강직-인간 증후군, 전신 홍반성 루푸스, 홍반성 루푸스, 타카야수 (takayasu) 동맥염, 측두 동맥염/거대세포 동맥염, 궤양성 대장염, 담마진, 포도막염, 포도막 안염, 포진상 피부염 맥관염과 같은 맥관염, 백반증, 및 베제너 (Wegener) 육아종증이 포함된다.
염증성 장애, 질환 또는 상태에는 천식, 알레르기성 장애, 타입-2 매개된 염증을 특징으로 하는 염증성 장애, 폐 섬유증, 만성 폐쇄성 폐질환 (COPD), 뇌염, 염증성 장질환, 패혈성 쇼크, 미분화된 척추관절증, 미분화된 관절증, 관절염, 염증성 골용해, 및 만성 바이러스 또는 박테리아 감염으로 인한 만성 염증이 포함될 수 있다.
환자는 차별적 조절된 miRNA 프로파일을 포함할 수 있다. 차별적 조절된 miRNA 프로파일은, 환자의 조직 샘플이 환자의 대조군 조직 샘플 또는 건강한 대조군 개체에 대해 하나 이상의 miRNA의 증가된 발현을 나타내는 것일 수 있다. 차별적 조절된 miRNA 프로파일은, 환자의 조직 샘플이 환자의 대조군 샘플 또는 건강한 대조군 개체에 대해 하나 이상의 miRNA의 감소된 발현을 나타내는 것일 수 있다. 차별적 조절된 miRNA 프로파일은, 환자의 조직 샘플이 대조군 샘플에 대해 하나 이상의 miRNA의 증가된 발현 및 대조군 샘플에 대해 하나 이상의 miRNA의 감소된 발현 모두를 나타내는 것일 수 있다. 증가된 발현을 나타내는 miRNA의 수는 하기 일 수 있다: 1, 적어도 1, 2, 적어도 2, 3, 적어도 3, 4, 적어도 4, 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 50개. 감소된 발현을 나타내는 miRNA의 수는 하기 일 수 있다: 1, 적어도 1, 2, 적어도 2, 3, 적어도 3, 4, 적어도 4, 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 50개. 발현에서의 차별적 증가 또는 감소는 하기일 수 있다: 대조군 샘플의 대략 10% 내지 500%, 대조군 샘플의 대략 10% 내지 400%, 대조군 샘플의 대략 10% 내지 300%, 대조군 샘플의 대략 10% 내지 250%, 대조군 샘플의 대략 10% 내지 200%, 대조군 샘플의 대략 10% 내지 150%, 대조군 샘플의 대략 10% 내지 100%, 대조군 샘플의 대략 10% 내지 50%, 대조군 샘플의 대략 100% 내지 500%, 대조군 샘플의 대략 200% 내지 500%, 대조군 샘플의 대략 300% 내지 500%, 대조군 샘플의 대략 400% 내지 500%, 대조군 샘플의 대략 50% 내지 100%, 대조군 샘플의 대략 100% 내지 200%, 대조군 샘플의 대략 100% 내지 400%, 대조군 샘플의 대략 200% 내지 400%, 대조군 샘플의 대략 10% 내지 50%, 대조군 샘플의 대략 20% 내지 100%, 대조군 샘플의 대략 25% 내지 75%, 또는 대조군 샘플의 대략 50% 내지 100%. 대조군 샘플의 10, 20, 25, 30, 40, 50, 75, 100, 125, 150, 175, 200, 250, 300, 400, 또는 500 %일 수 있다.
임의의 1, 적어도 1, 2, 적어도 2, 3, 적어도 3, 4, 적어도 4, 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 50개의 차별적으로 발현된 miRNA는 표 2-5 또는 도 382-383 에서 논의된 임의의 miRNA 를 포함할 수 있다. miRNA는 검출기 hsa-miR-34b-4373037 또는 hsa-miR-1-4373161 에 의해 검출될 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제의 투여는 소분자 또는 생물학적 제제의 투여일 수 있다. 치료제가 소분자이면, 천연 공급원으로부터 합성 또는 확인 및 분리될 수 있다.
치료제가 생물학적 제제가면, 타입 I IFN 또는 IFNα의 임의의 서브타입(들)에 대해 특이적인 항체일 수 있다. 예를 들어, 항체는 하기 중의 임의의 하나에 대해 특이적일 수 있다: IFNαl, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNαlO, IFNαl4, IFNα 17, IFNα21, IFNβ, 또는 IFNω. 대안적으로, 항체는 임의의 2, 임의의 3, 임의의 4, 임의의 5, 임의의 6, 임의의 7, 임의의 8, 임의의 9, 임의의 10, 임의의 11, 임의의 12개의 IFNα 서브타입의 타입 I IFN 에 대해 특이적일 수 있다. 항체가 하나 초과의 타입 I IFN 서브타입에 대해 특이적이면, 항체는 IFNαl, IFNα2, IFN α4, IFNα5, IFNα8, IFNαlO, 및 IFNα21 에 대해 특이적일 수 있고; 또는 IFNαl, IFNα2, IFNα4, IFNα5, IFNα8, 및 IFNαlO 에 대해 특이적일 수 있고; 또는 IFNαl, IFNα2, IFNα4, IFNα5, IFNα8, 및 IFNα21 에 대해 특이적일 수 있고; 또는 IFNαl, IFNα2, IFNα4, IFNα5, IFNαlO, 및 IFNα21 에 대해 특이적일 수 있다. 타입 I IFN 또는 IFNα 에 대해 특이적인 항체는 하기를 포함한다: MEDI-545, 임의의 생물제제, 또는 MEDI-545 제외한 항체, U.S. 특허출원 11/009,410 (출원 2004년 12월 10일) 및 11/157,494 (출원 2005년 6월 20일)에 기재된 항체, 9F3 및 U.S. 특허 No. 7,087,726 (실시예 1 및 실시예 2, 표 3 및 표 4 에 개시된 것, 및/또는 라인 25-54, 칼럼 56 상의 표 제목 "Deposit of Material"에 개시된 것)에 기재된 다른 항체, NK-2 및 YOK5/19 (WO 84/03105), LO-22 (U.S. 특허 4,902,618), 144 BS (U.S. 특허 4,885,166), 및 EBI-I, EBI-2, 및 EBI-3 (EP 119476). IFNα 활성을 조절하는 치료제는 IFNα 활성을 중화시킬 수 있다. 당업자는 그와 같은 생물학적 제제의 제조 및 제형 및 그의 투여 방법을 알고 있다.
항체는 합성 항체, 모노클로날 항체, 폴리클로날 항체, 재조합적으로 생산된 항체, 인트라바디 (intrabody), 다중특이성 항체 (이중-특이성 항체 포함), 인간 항체, 인간화된 항체, 키메릭 항체, 단일-쇄 Fv (scFv) (이중-특이성 scFv 포함), BiTE 분자, 단일 쇄 항체, Fab 단편, F(ab') 단편, 디설파이드-연결된 Fv (sdFv), 또는 상기한 것 중의 어떤 것의 에피토프-결합 단편일 수 있다. 항체는 면역글로불린 분자 또는 면역글로불린 분자의 면역학적 활성 부분 중의 어떤 것일 수 있다. 또한, 항체는 어떤 이소타입이라도 될 수 있다. 예를 들어, 이것은 이소타입 IgGl, IgG2, IgG3 또는 IgG4 중의 어떤 것이라도 될 수 있다. 항체는 가변 및 불변 부분을 포함하는 전체-길이 항체, 또는 단일 쇄 항체 또는 Fab 또는 Fab'2 단편과 같은 그의 항원-결합 단편일 수 있다. 항체는 또한, 세포독소 또는 방사성 동위원소와 같은 치료제에 컨쥬게이트되거나 연결될 수 있다.
IFNα 활성을 조정시키도록 결합하는 제제 이외의 제2 제제가 환자에게 투여될 수 있다. 제2 제제에는 이부프로펜, 나프록센, 술린닥, 디클로페낙, 피록시캄, 케토프로펜, 디플루니살, 나부메톤, 에토돌락 및 옥사프로진, 인도메타신과 같은 비-스테로이드성 소염성 약물; 하이드록시클로로퀸과 같은 항-말라리아 약물; 프레드니손, 하이드로코티존, 메틸프레드니솔론 및 덱사메타손과 같은 코르티코스테로이드 호르몬; 메토트렉세이트; 아자티오프린 및 사이클로포스파마이드와 같은 면역억제제; 및, 예를 들어, 알레파셉트 (Alefacept) 및 에팔리주마브 (Efalizumab)와 같이 T 세포를 표적으로 하거나, 엔브렐 (Enbrel), 레미케이드 (Remicade), 및 후미라 (Humira)와 같이 TNFα를 표적으로 하는 생물학적 제제가 포함되나, 이들로 제한되지는 않는다.
제제에 의한 치료는 차별적 조절된 miRNA 프로파일의 중화를 야기할 수 있다. 제제에 의한 치료는 타입 I IFN- 또는 IFNα 매개된 질환 또는 장애의 하나 또는 그 이상의 증상의 감소를 야기할 수 있다. 제제에 의한 치료는 타입 I IFN- 또는 IFNα 매개된 질환 또는 장애와 관련된 더 적은 재발을 야기할 수 있다. 제제에 의한 치료는 타입 I IFN- 또는 IFNα 매개된 질환 또는 장애를 갖는 환자에 대해서 개선된 예후를 제공할 수 있다. 제제에 의한 치료는 환자에 대해서 더 높은 품질의 삶을 제공할 수 있다. 제제에 의한 치료는 제2 제제를 공동-투여할 필요성을 경감시킬 수 있거나, 환자에 대한 제2 제제의 투여의 투약량을 감소시킬 수 있다. 제제에 의한 치료는 타입 I IFN- 또는 IFNα 매개된 질환 또는 장애와 관련된 환자의 입원의 수를 감소시킬 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제는 차별적 조절된 miRNA 프로파일을 중화시킬 수 있다. 차별적 조절된 miRNA 프로파일의 중화는 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 상향조절된 miRNA 에서의 감소일 수 있다. 상향조절된 miRNA는 검출되거나 표 2 또는 표 4 에 포함되거나 도면 시트 382-383 에 보여진 임의의 것들을 포함할 수 있다. 차별적 조절된 miRNA 프로파일의 중화는 임의의 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 임의의 차별적 조절된 miRNA 프로파일에서 상향조적된 유전자의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90%의 감소일 수 있다. 대안적으로, 차별적 조절된 miRNA 프로파일의 중화란, 대조군 샘플에서의 miRNA의 발현 레벨의 겨우 50%, 겨우 45%, 겨우 40%, 겨우 35%, 겨우 30%, 겨우 25%, 겨우 20%, 겨우 15%, 겨우 10%, 겨우 5%, 겨우 4%, 겨우 3%, 겨우 2%, 또는 겨우 1% 내인 상향조절된 miRNA의 발현의 감소를 의미한다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제가 항체와 같은 생물학적 제제가면, 제제는 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 타입 I IFN 또는 IFNα 프로파일을 중화시킬 수 있다.
차별적 조절된 miRNA 프로파일의 중화는 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 miRNA의 하향조절된 발현에서의 증가일 수 있다. 하향조절된 miRNA는 검출되거나 표 3 또는 표 5 에 포함되거나 도면 시트 382-383 에 보여진 임의의 것들을 포함할 수 있다. 차별적 조절된 miRNA 프로파일에서의 하향조절된 유전자의 중화는 임의의 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 또는 적어도 25개의 miRNA (이의 발현은 임의의 miRNA 프로파일에서 하향조절된다)의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90%, 또는 적어도 100%, 또는 적어도 125%, 또는 적어도 130%, 또는 적어도 140%, 또는 적어도 150%, 또는 적어도 175%, 또는 적어도 200%, 또는 적어도 250%, 또는 적어도 300%, 또는 적어도 500%의 증가이다. 대안적으로, 차별적 조절된 miRNA 프로파일의 중화란 대조군 샘플에서의 miRNA의 발현 레벨의 겨우 50%, 겨우 45%, 겨우 40%, 겨우 35%, 겨우 30%, 겨우 25%, 겨우 20%, 겨우 15%, 겨우 10%, 겨우 5%, 겨우 4%, 겨우 3%, 겨우 2%, 또는 겨우 1% 내인 miRNA의 발현에서의 증가를 의미한다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제가 항체와 같은 생물학적 제제가면, 제제는 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 차별적 조절된 miRNA 프로파일을 중화시킬 수 있다.
환자는 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 추가로 포함할 수 있다. 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 강한 프로파일, 중간정도의 프로파일, 또는 약한 프로파일일 수 있다. 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 대조군 샘플(들) 또는 대조군 환자(들)에 대해 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일의 배(fold) 조절장애 (예를 들어, 환자에서의 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 발현에서의 배 증가)를 측정하고 환자의 배 조절장애를 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 갖는 다른 화자와 비교하여 강한, 중간정도, 또는 약한 것으로서 쉽게 지명될 수 있다. 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 참고로 본 명세서에 통합된 PCT/US2007/024947 (2007년 12월 6일 출원)에 개시된 어떤 것일 수 있다.
환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일에 포함될 수 있는 유전자 그룹은 MXl, LY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RASD2, 및 IFI44 일 수 있다. 상기 유전자, 또는 탐침에 의해 검출된 유전자는 IFI44, IFI27, IFI44L, DNAPTP6, LAMP3, LY6E, RSAD2, HERC5, IFI6, ISG15, OAS3, SIGLECl, OAS2, USP18, RTP4, IFITl, MXl, OASl, EPSTIl, PLSCRl, 및 IFRG28 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
유전자는 LAMP3, DNAPTP6, FLJ31033, HERC6, SERPINGl, EPSTIl, RTP4, OASL, FBXO6, IFIT2, IFI44, OAS3, BATF2, ISG15, IRF7, RSAD2, IFI35, OASl, LAP3, IFITl, IFIT5, PLSCRl, IFI44L, MS4A4A, GALM, UBE2L6, TORlB, SAMD9L, HERC5, TDRD7, TREXl, PARP 12, 및 AXUDl 중 임의의 적어도 2, 임의의 적어도 3, 임의의 적어도 4, 임의의 적어도 5, 임의의 적어도 6, 임의의 적어도 7, 임의의 적어도 8, 임의의 적어도 9, 임의의 적어도 10, 또는 임의의 적어도 11, 또는 임의의 적어도 12, 또는 임의의 적어도 13, 또는 임의의 적어도 14, 또는 임의의 적어도 15, 또는 임의의 적어도 16, 또는 임의의 적어도 17, 또는 임의의 적어도 18, 또는 임의의 적어도 19, 또는 적어도 20, 또는 임의의 적어도 21, 또는 임의의 적어도 22, 또는 임의의 적어도 23, 또는 임의의 적어도 24, 또는 임의의 적어도 25, 또는 임의의 적어도 26, 또는 임의의 적어도 27, 또는 임의의 적어도 28, 또는 임의의 적어도 29, 또는 임의의 적어도 30를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI27, SIGLECl, RSAD2, IFI6, IFI44L, IFI44, USPl8, IFIT2, SAMD9L, BIRC4BP, DNAPTP6, OAS3, LY6E, IFITl, LIPA, LOC129607, ISG15, PARP14, MXl, OAS2, OASL, CCL2, HERC5, OASl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFITl, IFIT3, IRF7, IFI6, IL6ST, IRF2, LY6E, MARCKS, MXl, MX2, OASl, EIF2AK2, ISGl5, STAT2, OAS3, IFI44, IFI44L, HERC5, RAB8B, LILRA5, RSAD2, 및 FCHO2 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SERPINGl, IFIT2, IFIT3, IFI6, LY6E, MXl, OASl, ISG15, IFI27, OAS3, IFI44, LAMP3, DNAPTP6, ETV7, HERC5, OAS2, USP18, XAFl, RTP4, SIGLECl, 및 EPSTIl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SERPINGl, IFIT2, IFIT3, IFI6, LY6E, MXl, OASl, ISG15, IFI27, OAS3, IFI44, LAMP3, DNAPTP6, ETV7, HERC5, OAS2, USP18, XAFl, RTP4, SIGLECl, EPSTIl, 및 RSAD2 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 BCL2, BAKl, BAD, BAX, 및 BCL2L1 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 RTP4, RSAD2, HERC5, SIGLECl, USP18, LY6E, ETV7, SERPINGl, IFIT3, OASl, HSXIAPAFl, G1P3, MXl, OAS3, IFI27, DNAPTP6, LAMP3, EPSTIl, IFI44, OAS2, IFIT2, 및 ISGl5 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 LAMP3, SIGLECl, DNAPTP6, IFIT2, ETV7, RTP4, SERPINGl, HERC5, XAFl, MXl, EPSTIl, OAS2, OASl, OAS3, IFIT3, IFI6, USP18, RSAD2, IFI44, LY6E, ISG15, 및 IFI27 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 DNAPTP6, EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, PLSCRl, RSAD2, RTP4, SIGLECl, 및 USP18 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SAMD9L, IFI6, IFI44, IFIT2, ZC3HAV1, ETV6, DAPPl, ILlRN, CEACAMl, OASl, IFI27, OAS3, IFI44L, HERC5, IFITl, EPSTIl, ISGl5, SERPINGl, OASL, GBPl, 및 MXl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, IFITl, ISG15, LAMP3, OAS3, OASl, EPSTIl, IFIT3, OAS2, SIGLECl, 및 USP18 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, IFITl, HERC5, ISG15, LAMP3, OAS3, OASl, EPSTIl, IFIT3, OAS2, LY6E, SIGLECl, 및 USPl8 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, 및 IFITl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SAMD9L, IFI6, IFI44, IFIT2, OASl, IFI27, OAS3, IFI44L, HERC5, IFITl, EPSTIl, ISG15, SERPINGl, OASL, GBPl, 및 MXl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI44L, RSAD2, IFI27, 및 IFI44 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI44L 및 RSAD2 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI444L 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 RSAD2 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
차별적 조절된 miRNA 프로파일을 포함하는 환자는 하향조절된 타입 I IFN 또는 IFNα PD 마커(들)을 추가로 포함할 수 있다. 하향조절된 PD 마커는 유전자 CYPlBl, TGSTl, RRAGD, IRS2, MGSTl, TGFBR3, 및 RGS2 중 임의의 1, 임의의 2, 임의의 3, 임의의 4, 임의의 5, 임의의 6, 또는 임의의 7개를 포함할 수 있다.
차별적 조절된 miRNA 프로파일을 포함하는 환자는 IFNα 또는 타입 I IFN 서브타입의 임의의 수의 발현의 상향조절을 추가로 포함할 수 있다. IFNα 또는 타입 I IFN 서브타입은 임의의 1개 초과, 2개 초과, 3개 초과, 4개 초과, 5개 초과, 6개 초과, 7개 초과, 8개 초과, 9개 초과, 또는 10개 초과의 IFNα 또는 타입 I IFN 서브타입을 포함할 수 있다. 이들 서브타입은 IFNαl, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNαlO, IFNαl4, IFNαl7, IFNα21, IFNβ, 또는 IFNω 를 포함할 수 있다. 환자는 IFN 서브타입 IFNαl, IFNα2, IFNα8, 및 IFNαl4의 발현의 상향조절을 포함할 수 있다.
차별적 조절된 miRNA 프로파일을 포함하는 환자는 IFNα 수용체, IFNARl 또는 IFNAR2, 또는 둘 모두, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 (IFNGRl, IFNGR2, 또는 IFNGRl 및 IFNGR2 둘 모두)의 발현의 상향조절을 추가로 포함할 수 있다. 환자는 IFNα 수용체, IFNARl 또는 IFNAR2, 또는 둘 모두, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 (IFNGRl, IFNGR2, 또는 IFNGRl 및 IFNGR2 둘 모두)의 발현의 상향조절을 포함하는 환자로서 간단히 확인될 수 있다.
환자의 발현 프로파일에서의 타입 I IFN 또는 IFNα 유도성 PD 마커의 상향조절 또는 하향조절은 (환자의 질환 조직이 아닌 샘플 (예를 들어, 건선 환자의 비-질환 피부) 또는 질환 또는 장애에 시달리지 않는 건강한 사람로부터 일 수 있는) 대조군으로부터의 샘플에 대한 임의의 정도까지 일 수 있다. 상향조절 또는 하향조절 정도는 대조군 또는 대조군 샘플의 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 적어도 100%, 적어도 125%, 적어도 150%, 또는 적어도 200%, 또는 적어도 300%, 또는 적어도 400%, 또는 적어도 500% 일 수 있다.
더욱이, 환자는 대조군의 타입 I IFN 서브타입 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 적어도 100%, 적어도 125%, 적어도 150%, 또는 적어도 200%, 또는 적어도 300%, 또는 적어도 400%, 또는 적어도 500% 를 과발현시킬 수 있거나 과발현시키는 조직을 가질 수 있다. 타입 I IFN 서브타입은 IFNαl, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNαlO, IFNαl4, IFNαl 7, IFNα21, IFNβ, 또는 IFNω 중 임의의 하나일 수 있다. 타입 I IFN 서브타입은 IFNαl, IFNα2, IFNα8, 및 IFNαl4 모두를 포함할 수 있다.
환자는 혈청 중의 단백질의 레벨에서의 변화를 추가로 포함할 수 있거나 대안적으로 포함할 수 있다. 환자는 아디포넥틴(adiponectin), 알파-페토프로틴(fetoprotein), 아폴리포프로틴(apolipoprotein) CIII, 베타-2 마이크로글루불린(microglobulin), 암 항원 125, 암 항원 19-9, 에오탁신(eotaxin), FABP, 팩터(factor) VII, 페리틴(ferritin), IL-IO, IL-12p70, IL- 16, IL- 18, IL-lra, IL-3, MCP-I, MMP-3, 미오글로빈(myoglobin), SGOT, 조직 팩터(factor), TIMP-I, TNF RII, TNF-알파, VCAM-I, 또는 vWF 와 같은 단백질의 증가된 혈청 레벨을 가질 수 있다. 환자는 혈청 중 이들 단백질의 임의의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 또는 26의 증가된 혈청 레벨을 가질 수 있다. 증가된 레벨은 대조군, 예를 들어, 건강한 대상체의 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 적어도 100%, 적어도 125%, 적어도 150%, 또는 적어도 200%, 또는 적어도 300%, 또는 적어도 400%, 또는 적어도 500% 일 수 있다. 상기 변화는 BDNK, 보체(complement) 3, CD40 리간드, EGF, ENA-78, EN-RAGE, IGF-I, MDC, 골수세포형과산화효소(myeloperoxidase), RANTES, 또는 트롬보포이에틴(thrombopoietin)과 같은 단백질의 혈정 레벤에서의 감소일 수 있다. 환자는 이들 단백질의 임의의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 또는 11의 감소된 혈청 레벨을 가질 수 있다. 감소된 레벨은 대조군, 예를 들어, 건강한 대상체의 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 또는 적어도 100% 일 수 있다. PD 마커 프로파일은 단백질의 이들 증가 또는 감소된 혈청 레벨의 하나 이상을 포함할 수 있다.
환자는 하기의 자가항원 중 임의의 하나에 결합하는 자가항체를 추가로 포함할 수 있다: (a) 점액세균 (인플루엔자 바이러스) 저항성 1, 인터페론 유도 단백질 p78; (b) 폭식(surfeit) 5, 전사체 변이형 c; (c) 프로테아좀 (포좀(posome), 마크로파인(macropain)) 활성제 서브유닛 3 (PA28 감마; Ki) transc; (d) 레티노산 수용체, 알파; (e) 열충격 10 kDa 단백질 1 (chaperonin 10); (f) 트로포마이신(tropomyosin) 3; (g) 플렉스트린 호몰로지(pleckstrin homology) 유사 도메인, 패밀리 A, 멤버 1; (h) 세포골격 관련 단백질 1; (i) 쇼그렌증후군(Sjogren syndrome) 항원 A2 (60 kDa, 리보뉴클레오(ribonucleo) 단백질 자가항원 SS-A/Ro); (j) NADH 탈수소효소 (유비퀴논) 1, 알파/베타 서브컴플렉스(subcomplex) 1, 8 kDa; (k) NudE 핵 분포 유전자 E 호몰로그(homolog) 1 (A. nidulans); (1) MutL 호몰로그(homolog) 1, 직장암, 비폴립(nonpolyposis) 타입 2 (대장균); (m) 류신 풍분한 반복 (FLII 에서) 상호작용 단백질 2; (n) 트로포마이신(tropomyosin) 1 (alpha); (o) 강직성 대마비 20, 스파르틴(spartin) (트로이 증후군(Troyer syndrome)); (p) 착상전 단백질(preimplantation protein), 전사체 변이형 1; (r) 미토콘드리아 리보솜 단백질 L45; (s) Lin-28 동족체 (C. elegans); (t) 열충격 90 kDa 단백질 1, 알파; (u) dom-3 동족체 Z (C. elegans); (v) 다이네인(dynein), 세포질, 경(light) 중간 폴리펩타이드 2; (w) Ras 관련 C3 부툴리늄 독소(botulinum toxin) 기질 1 (로(rho) 패밀리, 작은 GTP 결합 단백질); (x) 활막 육종, X 파괴점 2, 전사체 변이형 2; (y) moesin; (z) 호머(homer) 호몰로그(homolog) (Drosophila), 전사체 변이형 1; (aa) 아미노산 합성 5 유사 2 (효모)의 GCN5일반 대조군; (bb) 진핵 번역 신장 인자 1 감마; (cc) 진핵 번역 신장 인자 1, 델타; (dd) DNA 손상 유도 전사체 3; (ee) CCAAT/인핸서 결합 단백질 (C/EBP) 감마; 및 명칭 "Auto-antibody markers of autoimmune disease" (2007년 5월 3일 출원)의 가출원 또는 명칭 "Auto-antibody markers of autoimmune disease" (2007년 11월 6일 출원)의 가출원 (예를 들어, 표 2, 4, 5, 및 9 에 기재된 것으로 한정되지 않음)에 기재된 임의의 다른 자가항원. 환자는 이들 자가항원의 임의의 수, 예를 들어, 임의의 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9 적어도 10, 적어도 11, 적어도 12, 적어도 13, 적어도 14, 적어도 15, 적어도 20, 적어도 25 에 결합한 자가항체를 포함할 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제의 투여로 타입 I IFN 또는 IFNα 유도성 프로파일을 대조군 샘플의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90% 내로 추가로 중화시킬 수 있다.
환자의 질환 진행을 모니터 또는 진단하는 방법에서, 환자로부터의 샘플은 제제의 투여 전 및 후에 얻을 수 있다.
샘플은 임의의 생체액 또는 조직, 예컨대 전체 혈액, 혈청, 근육, 타액, 소변, 관절혈액, 골수, 뇌척수액, 코 분비물, 가래, 양수(羊水), 기관지폐세척액, 말초 혈액 단핵세포, 총 백혈구, 림프절 세포, 비장 세포, 편도 세포, 또는 피부를 포함한다. 샘플은 당해 기술에 공지된 임의의 수단으로 얻을 수 있다.
miRNA 프로파일은 (제제 투여 전 및 후) 샘플에서 얻는다. 샘플 중 miRNA 프로파일을 비교한다. 비교는 샘플에 존재하는 miRNA의 수 또는 양, 또는 그의 임의의 조합일 수 있다. 치료제의 효능을 나타내는 편차는, 상향조절된 miRNA의 수 또는 레벨 (또는 그의 임의의 조합)이 치료제의 투여 전에 얻은 샘플에 대해 치료제의 투여 후에 얻은 샘플에서 감소한다면, 나타낼 수 있다. 상향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 감소할 수 있다. 임의의 소정의 상향조절된 miRNA의 레벨은 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 감소할 수 있다. 감소된 레벨을 갖는 상향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 상향조절된 miRNA의 감소된 수 및 감소된 레벨의 임의의 조합은 효능을 나타낼 수 있다. 치료제의 효능을 나타내는 편차는, 하향조절된 miRNA의 수 또는 레벨 (또는 그의 임의의 조합)이 치료제의 투여 전에 얻은 샘플에 대해 치료제의 투여 후에 얻은 샘플에서 감소한다면, 나타낼 수 있다. 하향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 감소할 수 있다. 임의의 소정의 하향조절된 miRNA의 레벨은 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 증가할 수 있다. 증가된 레벨을 갖는 하향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 하향조절된 miRNA의 감소된 수 및 증가된 레벨의 임의의 조합은 효능을 나타낼 수 있다.
환자로부터 얻은 샘플은 제제의 제1 투여 전에 얻을 수 있고, 즉, 환자는 제제가 투여되지 않는다. 대안적으로, 환자로부터 얻은 샘플은 치료 과정에서 체제의 투여 후에 얻을 수 있다. 예를 들어, 제제는 모니터링 프로토콜의 개시 전에 투여되었을지 모른다. 제제의 투여 후에, 추가 샘플은 환자로부터 얻을 수 있고, 샘플에서의 타입 I IFN 또는 IFNα 유도성 PD 마커가 비교된다. 샘플은 동일 또는 상이한 타입일 수 있고, 예를 들어, 얻은 각 샘플 혈액 샘플일 수 있고, 또는 얻은 각 샘플은 혈청 샘플일 수 있다. 각 샘플에서 검출된 타입 I IFN 또는 IFNα 유도성 PD 마커는 동일할 수 있고, 실질적으로 중첩될 수 있고, 또는 유사할 수 있다
샘플은 치료제의 투여 전 및 후의 임의의 시간에서 얻을 수 있다. 치료제의 투여 후에 얻은 샘플은 치료제의 투여 후 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 12, 또는 적어도 14일에 얻을 수 있다. 치료제의 투여 후에 얻은 샘플은 치료제의 투여 후 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 또는 적어도 8주에 얻을 수 있다. . 치료제의 투여 후에 얻은 샘플은 치료제의 투여 후 적어도 2, 적어도 3, 적어도 4, 적어도 5, 또는 적어도 6달에 얻을 수 있다.
추가 샘플은 치료제의 투여 후에 환자로부터 얻을 수 있다. 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25개의 샘플은 경시적으로 질환 또는 장애의 진행 또는 퇴행을 모니터하기 위해 환자로부터 얻을 수 있다. 질환 진행은 적어도 1주, 적어도 2주, 적어도 3주, 적어도 4주, 적어도 5주, 적어도 6주, 적어도 7주, 적어도 2 달, 적어도 3 달, 적어도 4 달, 적어도 5 달, 적어도 6 달, 적어도 1년, 적어도 2년, 적어도 3년, 적어도 4년, 적어도 5년, 적어도 10년, 또는 환자의 일생에 걸쳐 모니터될 수 있다. 추가 샘플은 규칙적인 간격, 예컨대 매달, 2달에 1회, 분기에 1회, 1년에 2회, 또는 매년 간격으로 환자로부터 얻을 수 있다. 샘플은 규칙적인 간격으로 제제의 투여 후에 환자로부터 얻을 수 있다. 예를 들어, 샘플은 각 제제 투여 후 1주, 또는 각 제제 투여 후 2주, 또는 각 제제 투여 후 3주, 또는 각 제제 투여 후 1달, 또는 각 제제 투여 후 2달에 환자로부터 얻을 수 있다. 대안적으로, 다중 샘플은 각 제제 투여 후 환자로부터 얻을 수 있다.
환자에서의 질환 진행은 유사하게 제제의 투여의 부재에서 모니터될 수 있다. 샘플은 질환 또는 장애를 갖는 환자로부터 주기적으로 얻을 수 있다. 질환 진행은, miRNA의 수가 초기에 얻은 샘플에 대해 말기에 얻은 샘플에서 증가한다면, 확인될 수 있다. miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 증가할 수 있다. 질환 진행은, 임의의 소정의 상향조절된 miRNA의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 증가한다면, 확인될 수 있다. 질환 진행은, 임의의 소정의 하향조절된 miRNA의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 감소한다면, 확인될 수 있다. 증가된 레벨을 갖는 상향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 감소된 레벨을 갖는 하향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 상향조절된 miRNA의 증가된 수 및 증가된 레벨의 임의의 조합은 질환 진행을 나타낼 수 있다. 대안적으로, 또는 조합하여, 하향조절된 타입 miRNA의 감소된 수 및 감소된 레벨의 임의의 조합은 질환 진행을 나타낼 수 있다. 질환 퇴행은 또한 제제에 의해 치료되지 않은, 질환 또는 장애를 갖는 환자에서 확인될 수 있다. 이 예에서, 퇴행은, miRNA의 수가 초기에 얻은 샘플에 대해 말기에 얻은 샘플에서 감소한다면 확인될 수 있다. miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 감소할 수 있다. 질환 퇴행은, 임의의 소정의 상향조절된 miRNA의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 감소한다면, 확인될 수 있다. 질환 퇴행은, 임의의 소정의 하향조절된 miRNA의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 증가한다면 확인될 수 있다. 감소된 레벨을 갖는 상향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 증가된 레벨을 갖는 하향조절된 miRNA의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 질환 진행 또는 질환 퇴행은 임의의 기간에 걸쳐 및 임의의 간격으로 샘플을 얻어서 모니터될 수 있다. 질환 진행 또는 질환 퇴행은 적어도 1주, 적어도 2주, 적어도 3주, 적어도 4주, 적어도 5주, 적어도 6주, 적어도 7주, 적어도 2 달, 적어도 3 달, 적어도 4 달, 적어도 5 달, 적어도 6 달, 적어도 1년, 적어도 2년, 적어도 3년, 적어도 4년, 적어도 5년, 적어도 10년, 또는 환자의 일생에 걸쳐 샘플을 얻어서 모니터될 수 있다. 질환 진행 또는 질환 퇴행은 적어도 매달, 2달에 1회, 분기에 1회, 1년에 2회, 또는 매년 샘플을 얻어서 모니터될 수 있다. 샘플을 엄격한 간격으로 얻을 필요는 없다.
샘플에서의 편차는 질환 또는 장애의 치료 전략을 안내할 수 있다. 치료 전략은 특정 치료제의 투약일 수 있고, 또는 환자에 투여된 특정 치료제의 제거 또는 추가 일 수 있다.
본 발명은 또한 근염의 치료, 진단, 예측 및 모니터를 위해 IFNα 유도성 PD 마커를 사용하는 방법을 포함한다. 이들 IFNα 유도성 PD 마커는 또한 근염 환자의 투약 및 치료 또는 근염 질환의 모델을 안내하기 위해 사용될 수 있다.
타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 대조군, 예를 들어 건강한 사람, 환자 또는 환자의 비(non)질환 조직의 샘플에 대한 임의의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일 유전자 또는 유전자 그룹의 상향조절 또는 하향조절을 포함할 수 있다. 유전자 또는 유전자 그룹은 임의의 적어도 2, 임의의 적어도 3, 임의의 적어도 4, 임의의 적어도 5, 임의의 적어도 6, 임의의 적어도 7, 임의의 적어도 8, 임의의 적어도 9, 임의의 적어도 10, 임의의 적어도 11, 임의의 적어도 12, 임의의 적어도 13, 임의의 적어도 14, 임의의 적어도 15, 임의의 적어도 16, 임의의 적어도 17, 임의의 적어도 18, 임의의 적어도 19, 임의의 적어도 20, 임의의 적어도 21, 임의의 적어도 22, 임의의 적어도 23, 임의의 적어도 24, 임의의 적어도 25, 임의의 적어도 26, 임의의 적어도 27, 임의의 적어도 28, 임의의 적어도 29, 임의의 적어도 30, 임의의 적어도 40, 임의의 적어도 50 유전자, 임의의 적어도 75 유전자, 임의의 적어도 100 유전자, 또는 임의의 적어도 150개의 유전자를 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISGl5, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, USP18 을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI27, SIGLECl, RSAD2, IFI6, IFI44L, IFI44, USPl8, IFIT2, SAMD9L, BIRC4BP, DNAPTP6, OAS3, LY6E, IFITl, LIPA, LOC129607, ISG15, PARP14, MXl, OAS2, OASL, CCL2, HERC5, OASl을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFITl, IFIT3, IRF7, IFI6, IL6ST, IRF2, LY6E, MARCKS, MXl, MX2, OASl, EIF2AK2, ISGl5, STAT2, OAS3, IFI44, IFI44L, HERC5, RAB8B, LILRA5, RSAD2, 및 FCHO2을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SERPINGl, IFIT2, IFIT3, IFI6, LY6E, MXl, OASl, ISG15, IFI27, OAS3, IFI44, LAMP3, DNAPTP6, ETV7, HERC5, OAS2, USP18, XAFl, RTP4, SIGLECl, 및 EPSTIl을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SERPINGl, IFIT2, IFIT3, IFI6, LY6E, MXl, OASl, ISG15, IFI27, OAS3, IFI44, LAMP3, DNAPTP6, ETV7, HERC5, OAS2, USP18, XAFl, RTP4, SIGLECl, EPSTIl, 및 RSAD2을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 RTP4, RSAD2, HERC5, SIGLECl, USP18, LY6E, ETV7, SERPINGl, IFIT3, OASl, HSXIAPAFl, G1P3, MXl, OAS3, IFI27, DNAPTP6, LAMP3, EPSTIl, IFI44, OAS2, IFIT2, 및 ISGl5을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 LAMP3, SIGLECl, DNAPTP6, IFIT2, ETV7, RTP4, SERPINGl, HERC5, XAFl, MXl, EPSTIl, OAS2, OASl, OAS3, IFIT3, IFI6, USP18, RSAD2, IFI44, LY6E, ISG15, 및 IFI27을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 DNAPTP6, EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, PLSCRl, RSAD2, RTP4, SIGLECl, 및 USP18 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SAMD9L, IFI6, IFI44, IFIT2, ZC3HAV1, ETV6, DAPPl, ILlRN, CEACAMl, OASl, IFI27, OAS3, IFI44L, HERC5, IFITl, EPSTIl, ISGl5, SERPINGl, OASL, GBPl, 및 MXl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, IFITl, ISG15, LAMP3, OAS3, OASl, EPSTIl, IFIT3, OAS2, SIGLECl, 및 USP18 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, IFITl, HERC5, ISG15, LAMP3, OAS3, OASl, EPSTIl, IFIT3, OAS2, LY6E, SIGLECl, 및 USPl8 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, 및 IFITl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI6, RSAD2, IFI44, IFI44L, 및 IFI27을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 SAMD9L, IFI6, IFI44, IFIT2, OASl, IFI27, OAS3, IFI44L, HERC5, IFITl, EPSTIl, ISG15, SERPINGl, OASL, GBPl, 및 MXl 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI44L, RSAD2, IFI27, 및 IFI44 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI44L 및 RSAD2 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI444L을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 RSAD2을 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 적어도 유전자 IFI27, IL- 12 IR beta2, IL-15R 알파, IL-15, 사이토킨 신호전달 1 (SOCSl)의 억제제, 야누스(janus) 키나아제 2, CXCLI l (T-TAC), TNFSF13B (BAFF), TRAF 타입 도메인 1 (TRAFDl), SERPINGl, CD274 (PDl-L), 인돌아민 2,3-디옥시게나아제 (INDO), 림프구 활성화 유전자 3 (LAG3), 및 캐스페이즈(caspase) 5 를 포함할 수 있다. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
IFNα 유도성 PD 마커 또는 a PD 마커 프로파일은 예를 들어 하기와 같은 임의의 적어도 5개의 유전자를 포함할 수 있다: MXl, LLY6E, IFI27, OASl, IFITl; 또는 MXl, LLY6E, IFI27, OASl, IFI6; 또는 MXl, LLY6E, IFI27, OASl, IFI44L; 또는 MXl, LLY6E, IFI27, OASl, ISG15; 또는 MXl, LLY6E, IFI27, OASl, LAMP3; 또는 MXl, LLY6E, IFI27, OASl, OASL; 또는 MXl, LLY6E, IFI27, OASl, RSAD2; 또는 MXl, LLY6E, IFI27, OASl, IFI44; 또는 MXl, LLY6E, IFI27, OASl, IFIT2; 또는 MXl, LLY6E, IFI27, OASl, 0AS3; 또는 MXl, LLY6E, IFI27, OASl, USP18; 또는 MXl, LLY6E, IFI27, OASl, SIGLECl; 또는 MXl, LLY6E, IFI27, OASl, HERC5; 또는 MXl, LLY6E, IFI27, OASl, DNAPTP6; 또는 MXl, LLY6E, IFI27, OASl, LOC129607; 또는 MXl, LLY6E, IFI27, OASl, EPSTIl; 또는 MXl, LLY6E, IFI27, OASl, BIRC4BP; 또는 MXl, LLY6E, IFI27, OASl, SIGLECl; 또는 MXl, LLY6E, IFI27, OASl, 탐침 229450_at 에 의해 검출된 유전자; 또는 MXl, LLY6E, IFI27, OASl, 탐침 235276_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6; 또는 LLY6E, IFI27, OASl, IFITl, IFI44L; 또는 LLY6E, IFI27, OASl, IFITl, ISGl5; 또는 LLY6E, IFI27, OASl, IFITl, LAMP3; 또는 LLY6E, IFI27, OASl, IFITl, OASL; 또는 LLY6E, IFI27, OASl, IFITl, RSAD2; 또는 LLY6E, IFI27, OASl, IFITl, IFI44; 또는 LLY6E, IFI27, OASl, IFITl, IFIT2; 또는 LLY6E, IFI27, OASl, IFITl, 0AS3; 또는 LLY6E, IFI27, OASl, IFITl, USP18; 또는 LLY6E, IFI27, OASl, IFITl, SIGLECl; 또는 LLY6E, IFI27, OASl, IFITl, HERC5; 또는 LLY6E, IFI27, OASl, IFITl, DNAPTP6; 또는 LLY6E, IFI27, OASl, IFITl, LOC 129607; 또는 LLY6E, IFI27, OASl, IFITl, EPSTIl; 또는 LLY6E, IFI27, OASl, IFITl, BIRC4BP; 또는 LLY6E, IFI27, OASl, IFITl, SIGLECl; 또는 LLY6E, IFI27, OASl, IFITl, 탐침 229450_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5; 또는 IFI27, OASl, IFITl, IFI6, LAMP3; 또는 IFI27, OASl, IFITl, IFI6, OASL; 또는 IFI27, OASl, IFITl, IFI6, RSAD2; 또는 IFI27, OASl, IFITl, IFI6, IFI44; 또는 IFI27, OASl, IFITl, IFI6, IFIT2; 또는 IFI27, OASl, IFITl, IFI6, 0AS3; 또는 IFI27, OASl, IFITl, IFI6, USP18; 또는 IFI27, OASl, IFITl, IFI6, SIGLECl; 또는 IFI27, OASl, IFITl, IFI6, HERC5; 또는 IFI27, OASl, IFITl, IFI6, DNAPTP6; 또는 IFI27, OASl, IFITl, IFI6, LOC 129607; 또는 IFI27, OASl, IFITl, IFI6, EPSTIl; 또는 IFI27, OASl, IFITl, IFI6, BIRC4BP; 또는 IFI27, OASl, IFITl, IFI6, SIGLECl; 또는 IFI27, OASl, IFITl, IFI6, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15; 또는 OASl, IFITl, IFI6, IFI44L, LAMP3; 또는 OASl, IFITl, IFI6, IFI44L, OASL; 또는 OASl, IFITl, IFI6, IFI44L, RSAD2; 또는 OASl, IFITl, IFI6, IFI44L, IFI44; 또는 OASl, IFITl, IFI6, IFI44L, IFIT2; 또는 OASl, IFITl, IFI6, IFI44L, OAS3; 또는 OASl, IFITl, IFI6, IFI44L, USP18; 또는 OASl, IFITl, IFI6, IFI44L, SIGLECl; 또는 OASl, IFITl, IFI6, IFI44L, HERC5; 또는 OASl, IFITl, IFI6, IFI44L, DNAPTP6; 또는 OASl, IFITl, IFI6, IFI44L, LOC 129607; 또는 OASl, IFITl, IFI6, IFI44L, EPSTIl; 또는 OASl, IFITl, IFI6, IFI44L, BIRC4BP; 또는 OASl, IFITl, IFI6, IFI44L, SIGLECl; 또는 OASl, IFITl, IFI6, IFI44L, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3; 또는 IFITl, IFI6, IFI44L, ISG15, OASL; 또는 IFITl, IFI6, IFI44L, ISGl5, RSAD2; 또는 IFITl, IFI6, IFI44L, ISGl5, IFI44; 또는 IFITl, IFI6, IFI44L, ISG 15, IFIT2 또는 IFITl, IFI6, IFI44L, ISG 15, 0AS3; 또는 IFITl, IFI6, IFI44L, ISG15, USP18; 또는 IFITl, IFI6, IFI44L, ISG15, SIGLECl; 또는 IFITl, IFI6, IFI44L, ISG15, HERC5; 또는 IFITl, IFI6, IFI44L, ISG15, DNAPTP6; 또는 IFITl, IFI6, IFI44L, ISGl5, LOC 129607; 또는 IFITl, IFI6, IFI44L, ISGl5, EPSTIl; 또는 IFITl, IFI6, IFI44L, ISG 15, BIRC4BP; 또는 IFITl, IFI6, IFI44L, ISGl5, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISGl5, LAMP3, HERC5; 또는 IFI6, IFI44L, ISGl5, LAMP3, DNAPTP6; 또는 IFI6, IFI44L, ISGl5, LAMP3, LOC 129607; 또는 IFI6, IFI44L, ISGl5, LAMP3, EPSTIl; 또는 IFI6, IFI44L, ISGl5, LAMP3, BIRC4BP; 또는 IFI6, IFI44L, ISGl5, LAMP3, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, SIGLECl; 또는 IFI6, IFI44L, ISG15, LAMP3, USP18; 또는 IFI6, IFI44L, ISG15, LAMP3, OAS3; 또는 IFI6, IFI44L, ISG15, LAMP3, IFIT2; 또는 IFI6, IFI44L, ISGl5, LAMP3, IFI44; 또는 IFI6, IFI44L, ISGl5, LAMP3, RSAD2; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2; 또는 IFI44L, ISGl5, LAMP3, OASL, IFI44; 또는 IFI44L, ISGl5, LAMP3, OASL, IFIT2; 또는 IFI44L, ISGl5, LAMP3, OASL, 0AS3; 또는 IFI44L, ISGl5, LAMP3, OASL, USP18; 또는 IFI44L, ISG15, LAMP3, OASL, SIGLECl; 또는 IFI44L, ISG15, LAMP3, OASL, HERC5; 또는 IFI44L, ISGl5, LAMP3, OASL, DNAPTP6; 또는 IFI44L, ISG 15, LAMP3, OASL, LOC 129607; 또는 IFI44L, ISGl5, LAMP3, OASL, EPSTIl; 또는 IFI44L, ISGl5, LAMP3, OASL, BIRC4BP; 또는 IFI44L, ISGl5, LAMP3, OASL, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, 탐침 235276_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44; 또는 ISG15, LAMP3, OASL, RSAD2, IFIT2; 또는 ISGl5, LAMP3, OASL, RSAD2, OAS3; 또는 ISGl5, LAMP3, OASL, RSAD2, USP18; 또는 ISG15, LAMP3, OASL, RSAD2, SIGLECl; 또는 ISG15, LAMP3, OASL, RSAD2, HERC5; 또는 ISG 15, LAMP3, OASL, RSAD2, DNAPTP6; 또는 ISGl5, LAMP3, OASL, RSAD2, LOC 129607; 또는 ISGl5, LAMP3, OASL, RSAD2, EPSTIl; 또는 ISG 15, LAMP3, OASL, RSAD2, BIRC4BP; 또는 ISG 15, LAMP3, OASL, RSAD2, 탐침 229450_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, 탐침 235276_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2; 또는 LAMP3, OASL, RSAD2, IFI44, OAS3; 또는 LAMP3, OASL, RSAD2, IFI44, USPl8; 또는 LAMP3, OASL, RSAD2, IFI44, SIGLECl; 또는 LAMP3, OASL, RSAD2, IFI44, HERC5; 또는 LAMP3, OASL, RSAD2, IFI44, DNAPTP6; 또는 LAMP3, OASL, RSAD2, IFI44, LOC 129607; 또는 LAMP3, OASL, RSAD2, IFI44, EPSTIl; 또는 LAMP3, OASL, RSAD2, IFI44, BIRC4BP; 또는 LAMP3, OASL, RSAD2, IFI44, 탐침 229450_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3; 또는 OASL, RSAD2, IFI44, IFIT2, USPl8; 또는 OASL, RSAD2, IFI44, IFIT2, SIGLECl; 또는 OASL, RSAD2, IFI44, IFIT2, HERC5; 또는 OASL, RSAD2, IFI44, IFIT2, DNAPTP6; 또는 OASL, RSAD2, IFI44, IFIT2, LOC 129607; 또는 OASL, RSAD2, IFI44, IFIT2, EPSTIl; 또는 OASL, RSAD2, IFI44, IFIT2, BIRC4BP; 또는 OASL, RSAD2, IFI44, IFIT2, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, 탐침 235276_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18; 또는 RSAD2, IFI44, IFIT2, 0AS3, SIGLECl; 또는 RSAD2, IFI44, IFIT2, 0AS3, HERC5; 또는 RSAD2, IFI44, IFIT2, 0AS3, DNAPTP6; 또는 RSAD2, IFI44, IFIT2, 0AS3, LOC 129607; 또는 RSAD2, IFI44, IFIT2, 0AS3, EPSTIl; 또는 RSAD2, IFI44, IFIT2, 0AS3, BIRC4BP; 또는 RSAD2, IFI44, IFIT2, 0AS3, 탐침 229450_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, 0AS3, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl; 또는 IFI44, IFIT2, 0AS3, USP18, HERC5; 또는 IFI44, IFIT2, 0AS3, USP18, DNAPTP6; 또는 IFI44, IFIT2, 0AS3, USP18, LOC129607; 또는 IFI44, IFIT2, 0AS3, USP18, EPSTIl; 또는 IFI44, IFIT2, 0AS3, USP18, BIRC4BP; 또는 IFI44, IFIT2, 0AS3, USP18, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, 0AS3, USP18, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5; 또는 IFIT2, 0AS3, USP18, SIGLECl, DNAPTP6; 또는 IFIT2, OAS3, USP18, SIGLECl, LOC129607; 또는 IFIT2, OAS3, USP18, SIGLECl, EPSTIl; 또는 IFIT2, OAS3, USP18, SIGLECl, BIRC4BP; 또는 IFIT2, OAS3, USP18, SIGLECl, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFIT2, OAS3, USP18, SIGLECl, 탐침 235276_at 에 의해 검출된 유전자; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6; 또는 OAS3, USP18, SIGLECl, HERC5, LOC129607; 또는 OAS3, USP18, SIGLECl, HERC5, EPSTIl; 또는 OAS3, USP18, SIGLECl, HERC5, BIRC4BP; 또는 OAS3, USP18, SIGLECl, HERC5, 탐침 229450_at 에 의해 검출된 유전자; 또는 OAS3, USP18, SIGLECl, HERC5, 탐침 235276_at 에 의해 검출된 유전자; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607; 또는 USP18, SIGLECl, HERC5, DNAPTP6, EPSTIl; 또는 USP18, SIGLECl, HERC5, DNAPTP6, BIRC4BP; 또는 USP18, SIGLECl, HERC5, DNAPTP6, 탐침 229450_at 에 의해 검출된 유전자; 또는 USPl8, SIGLECl, HERC5, DNAPTP6, 탐침 235276_at 에 의해 검출된 유전자; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl; 또는 SIGLECl, HERC5, DNAPTP6, LOC 129607, BIRC4BP; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 229450_at 에 의해 검출된 유전자; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 235276_at 에 의해 검출된 유전자; 또는 HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP; 또는 HERC5, DNAPTP6, LOC 129607, EPSTIl, 탐침 229450_at 에 의해 검출된 유전자; 또는 HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 235276_at 에 의해 검출된 유전자; 또는 DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자; 또는 DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 235276_at 에 의해 검출된 유전자; 또는 LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자, 탐침 235276_at 에 의해 검출된 유전자. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 예를 들어 하기와 같은 임의의 적어도 6개의 유전자를 포함할 수 있다: MXl, LLY6E, IFI27, OASl, IFITl, IFI6; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI44L; 또는 MXl, LLY6E, IFI27, OASl, IFITl, ISG15; 또는 MXl, LLY6E, IFI27, OASl, IFITl, LAMP3; 또는 MXl, LLY6E, IFI27, OASl, IFITl, OASL; 또는 MXl, LLY6E, IFI27, OASl, IFITl, RSAD2; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI44; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFIT2; 또는 MXl, LLY6E, IFI27, OASl, IFITl, OAS3; 또는 MXl, LLY6E, IFI27, OASl, IFITl, USP18; 또는 MXl, LLY6E, IFI27, OASl, IFITl, SIGLECl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, HERC5; 또는 MXl, LLY6E, IFI27, OASl, IFITl, DNAPTP6; 또는 MXl, LLY6E, IFI27, OASl, IFITl, LOC129607; 또는 MXl, LLY6E, IFI27, OASl, IFITl, EPSTIl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, BIRC4BP; 또는 MXl, LLY6E, IFI27, OASl, IFITl, 탐침 229450_at 에 의해 검출된 유전자; 또는 MXl, LLY6E, IFI27, OASl, IFITl, 탐침 235276_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, ISGl5; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, LAMP3; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, OASL; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, RSAD2; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFIT2; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, 0AS3; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, USP18; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, SIGLECl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, HERC5; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, DNAPTP6; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, LOC 129607; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, EPSTIl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, BIRC4BP; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, 탐침 229450_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, LAMP3; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, OASL; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, RSAD2; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, IFI44; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, IFIT2; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, 0AS3; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, USP18; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, SIGLECl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, HERC5; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, DNAPTP6; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, LOC 129607; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, EPSTIl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, BIRC4BP; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, OASL; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, RSAD2; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, IFI44; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, IFIT2; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, 0AS3; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, USP18; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, SIGLECl; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, HERC5; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, DNAPTP6; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LOC 129607; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, EPSTIl; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, BIRC4BP; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, RSAD2; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, IFI44; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, IFIT2; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OAS3; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, USP18; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, SIGLECl; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, HERC5; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, DNAPTP6; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, LOC 129607; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, EPSTIl; 또는 IFITl, IFI6, IFI44L, ISG 15, LAMP3, BIRC4BP; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, IFI44; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, IFIT2; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, OAS3; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, USP18; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, SIGLECl; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, HERC5; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, DNAPTP6; 또는 IFI6, IFI44L, ISG 15, LAMP3, OASL, LOC 129607; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, EPSTIl; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, BIRC4BP; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFIT2; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, OAS3; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, USP18; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, SIGLECl; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, HERC5; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, DNAPTP6; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, LOC 129607; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, EPSTIl; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, BIRC4BP; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, 탐침 235276_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, 0AS3; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, USP18; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, SIGLECl; 또는 ISG 15, LAMP3, OASL, RSAD2, IFI44, HERC5; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, DNAPTP6; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, LOC 129607; 또는 ISG 15, LAMP3, OASL, RSAD2, IFI44, EPSTIl; 또는 ISG 15, LAMP3, OASL, RSAD2, IFI44, BIRC4BP; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, 탐침 229450_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, 탐침 235276_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, USP18; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, SIGLECl; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, HERC5; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, DNAPTP6; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, LOC 129607; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, EPSTIl; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, BIRC4BP; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 229450_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, SIGLECl; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, HERC5; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, DNAPTP6; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, LOC 129607; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, EPSTIl; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, BIRC4BP; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, 탐침 235276_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, HERC5; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, DNAPTP6; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, LOC129607; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, EPSTIl; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, BIRC4BP; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, 탐침 229450_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, DNAPTP6; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, LOC129607; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, EPSTIl; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, BIRC4BP; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, LOC129607; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, EPSTIl; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, BIRC4BP; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 235276_at 에 의해 검출된 유전자; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607; 또는 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, EPSTIl; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, BIRC4BP; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 229450_at 에 의해 검출된 유전자; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 235276_at 에 의해 검출된 유전자; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, BIRC4BP; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 229450_at 에 의해 검출된 유전자; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 235276_at 에 의해 검출된 유전자; 또는 SIGLECl, HERC5, DNAPTP6, LOC 129607, EPSTIl, BIRC4BP; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 229450_at 에 의해 검출된 유전자; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 235276_at 에 의해 검출된 유전자; 또는 HERC5, DNAPTP6, LOC 129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자; 또는 HERC5, DNAPTP6, LOC 129607, EPSTIl, BIRC4BP, 탐침 235276_at 에 의해 검출된 유전자; 또는 DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자, 탐침 235276_at 에 의해 검출된 유전자. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 예를 들어 하기와 같은 임의의 적어도 7개의 유전자를 포함할 수 있다: MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, ISG15; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, LAMP3; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, OASL; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, RSAD2; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFIT2; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, OAS3; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, USP18; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, SIGLECl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, HERC5; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, DNAPTP6; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, LOC129607; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, EPSTIl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, BIRC4BP; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, 탐침 229450_at 에 의해 검출된 유전자; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, 탐침 235276_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, LAMP3; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, OASL; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, RSAD2; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, IFI44; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, IFIT2; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, OAS3; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, USPl8; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, SIGLECl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, HERC5; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, DNAPTP6; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, LOC 129607; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, EPSTIl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, BIRC4BP; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, 탐침 229450_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, OASL; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, RSAD2; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, IFI44; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, IFIT2; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, 0AS3; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, USP18; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, SIGLECl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, HERC5; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, DNAPTP6; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LOC 129607; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, EPSTIl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, BIRC4BP; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, RSAD2; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, IFI44; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, IFIT2; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, 0AS3; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, USP18; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, SIGLECl; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, HERC5; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, DNAPTP6; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, LOC 129607; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, EPSTIl; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, BIRC4BP; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, IFI44; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, IFIT2; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, OAS3; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, USP18; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, SIGLECl; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, HERC5; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, DNAPTP6; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, LOC 129607; 또는 IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, EPSTIl; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, BIRC4BP; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44; 또는 IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFIT2; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, OAS3; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, USP18; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, SIGLECl; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, HERC5; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, DNAPTP6; 또는 IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, LOC 129607; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, EPSTIl; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, BIRC4BP; 또는 IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, 0AS3; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, USP18; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, SIGLECl; 또는 IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, HERC5; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, DNAPTP6; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, LOC 129607; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, EPSTIl; 또는 IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, BIRC4BP; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, 탐침 235276_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, USP18; 또는 ISG 15, LAMP3, OASL, RSAD2, IFI44, IFIT2, SIGLECl; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, HERC5; 또는 ISG 15, LAMP3, OASL, RSAD2, IFI44, IFIT2, DNAPTP6; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, LOC 129607; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, EPSTIl; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, BIRC4BP; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 229450_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 235276_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, SIGLECl; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, HERC5; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, DNAPTP6; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, LOC 129607; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, EPSTIl; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, BIRC4BP; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, 탐침 229450_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USPl8, HERC5; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, DNAPTP6; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, LOC129607; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, EPSTIl; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, BIRC4BP; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, 탐침 235276_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, DNAPTP6; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, LOC129607; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, EPSTIl; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, BIRC4BP; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, 탐침 229450_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, LOC129607; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, EPSTIl; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, BIRC4BP; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, EPSTIl; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, BIRC4BP; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 235276_at 에 의해 검출된 유전자; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, BIRC4BP; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 229450_at 에 의해 검출된 유전자; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 235276_at 에 의해 검출된 유전자; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 229450_at 에 의해 검출된 유전자; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC 129607, EPSTIl, 탐침 235276_at 에 의해 검출된 유전자; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 235276_at 에 의해 검출된 유전자; 또는 HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자, 탐침 235276_at 에 의해 검출된 유전자. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 예를 들어 하기와 같은 임의의 적어도 8개의 유전자를 포함할 수 있다: MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, LAMP3; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, OASL; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, RSAD2; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, IFI44; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, IFIT2; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, OAS3; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, USP18; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, SIGLECl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, HERC5; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, DNAPTP6; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, LOC129607; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, EPSTIl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, BIRC4BP; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, 탐침 229450_at 에 의해 검출된 유전자; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, 탐침 235276_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, OASL; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, RSAD2; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, IFI44; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, IFIT2; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, 0AS3; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, USP18; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, SIGLECl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, HERC5; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, DNAPTP6; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LOC 129607; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, EPSTIl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, BIRC4BP; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, 탐침 229450_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, 탐침 235276_at 에 의해 검출된 유전자; orIFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, RSAD2; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, IFI44; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, IFIT2; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OAS3; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, USP18; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, SIGLECl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, HERC5; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, DNAPTP6; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, LOC 129607; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, EPSTIl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, BIRC4BP; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, IFI44; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, IFIT2; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, 0AS3; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, USP18; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, SIGLECl; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, HERC5; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, DNAPTP6; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, LOC 129607; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, EPSTIl; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, BIRC4BP; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44; 또는 IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFIT2; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, 0AS3; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, USP18; 또는 IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, SIGLECl; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, HERC5; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, DNAPTP6; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, LOC 129607; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, EPSTIl; 또는 IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, BIRC4BP; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, OAS3; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, USP18; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, SIGLECl; 또는 IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, HERC5; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, DNAPTP6; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, LOC 129607; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, EPSTIl; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, BIRC4BP; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, USP18; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, SIGLECl; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, HERC5; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, DNAPTP6; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, LOC 129607; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, EPSTIl; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, BIRC4BP; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 235276_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, SIGLECl; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, HERC5; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, DNAPTP6; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, LOC 129607; 또는 ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, EPSTIl; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, BIRC4BP; 또는 ISG 15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, 탐침 229450_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, 탐침 235276_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USPl8, SIGLECl; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, HERC5; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, DNAPTP6; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, LOC129607; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, EPSTIl; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, BIRC4BP; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, 탐침 229450_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, DNAPTP6; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, LOC129607; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, EPSTIl; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, BIRC4BP; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, 탐침 235276_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, LOC129607; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, EPSTIl; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 229450_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, 0AS3, USPl8, SIGLECl, HERC5, BIRC4BP; 또는 RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, EPSTIl; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, BIRC4BP; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, BIRC4BP; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 235276_at 에 의해 검출된 유전자; 또는 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 229450_at 에 의해 검출된 유전자; 또는 OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 235276_at 에 의해 검출된 유전자; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자; 또는 USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 235276_at 에 의해 검출된 유전자; 또는 SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자, 탐침 235276_at 에 의해 검출된 유전자. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 예를 들어 하기와 같은 임의의 적어도 12개의 유전자를 포함할 수 있다: MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFIT2; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, OAS3; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, USP18; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, SIGLECl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, HERC5; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, DNAPTP6; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, LOC129607; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, EPSTIl; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, BIRC4BP; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, 탐침 229450_at 에 의해 검출된 유전자; 또는 MXl, LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, 탐침 235276_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, 0AS3; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, USP18; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, SIGLECl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, HERC5; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, DNAPTP6; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, LOC 129607; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, EPSTIl; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, BIRC4BP; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, 탐침 229450_at 에 의해 검출된 유전자; 또는 LLY6E, IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, USP18; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, SIGLECl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, HERC5; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, DNAPTP6; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, LOC 129607; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, EPSTIl; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, IFIT2, BIRC4BP; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI27, OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, SIGLECl; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, HERC5; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, DNAPTP6; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, LOC 129607; 또는 OASl, IFITl, IFI6, IFI44L, ISG 15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, EPSTIl; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, BIRC4BP; 또는 OASl, IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASl, IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, HERC5; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, DNAPTP6; 또는 IFITl, IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, LOC129607; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, EPSTIl; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, BIRC4BP; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, DNAPTP6; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, LOC 129607; 또는 IFI6, IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, EPSTIl; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, BIRC4BP; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, 탐침 235276_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, LOC129607; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, EPSTIl; 또는 IFI44L, ISGl5, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, BIRC4BP; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44L, ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, 탐침 235276_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, EPSTIl; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, BIRC4BP; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 229450_at 에 의해 검출된 유전자; 또는 ISG15, LAMP3, OASL, RSAD2, IFI44, IFIT2, 0AS3, USP18, SIGLECl, HERC5, DNAPTP6, 탐침 235276_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USPl8, SIGLECl, HERC5, DNAPTP6, LOC 129607, EPSTIl; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, BIRC4BP; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 229450_at 에 의해 검출된 유전자; 또는 LAMP3, OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, 탐침 235276_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC 129607, EPSTIl, BIRC4BP; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 229450_at 에 의해 검출된 유전자; 또는 OASL, RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, 탐침 235276_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자; 또는 RSAD2, IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC 129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자; 또는 IFI44, IFIT2, OAS3, USP18, SIGLECl, HERC5, DNAPTP6, LOC129607, EPSTIl, BIRC4BP, 탐침 229450_at 에 의해 검출된 유전자 탐침 235276_at 에 의해 검출된 유전자. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 하기의 혈청 단백질 레벨의 하나 이상에서의 변화를 포함할 수 있다: 아디포넥틴, 알파-페토프로틴(fetoprotein), 아폴리포프로틴 CIII, 베타-2 마이크로글루불린(microglobulin), 암 항원 125, 암 항원 19-9, 에오탁신(eotaxin), FABP, 팩터(factor) VII, 페리틴(ferritin), IL-IO, IL-12p70, IL-16, IL-18, IL-lra, IL-3, MCP-I, MMP-3, 미오글로빈(myoglobin), SGOT, 조직 팩터(factor), TIMP-I, TNF RII, TNF-알파, VCAM-I, vWF, BDNK, 보체(complement) 3, CD40 리간드, EGF, ENA-78, EN-RAGE, IGF-I, MDC, 골수세포형과산화효소(myeloperoxidase), RANTES, 또는 트롬보포이에틴(thrombopoietin). 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 하기의 혈청 단백질 레벨의 하나 이상에서의 변화를 포함할 수 있다: 아디포넥틴, 알파-페토프로틴(fetoprotein), 아폴리포프로틴 CIII, 베타-2 마이크로글루불린(microglobulin), 암 항원 125, 암 항원 19-9, 에오탁신(eotaxin), FABP, 팩터(factor) VII, 페리틴(ferritin), IL-IO, IL-12p70, IL-16, IL-18, IL-lra, IL-3, MCP-I, MMP-3, 미오글로빈(myoglobin), SGOT, 조직 팩터(factor), TIMP-I, TNF PJI, TNF-알파, VCAM-I, 또는 vWF. 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
발현 프로파일에서의 IFNα 유도성 PD 마커는 하기의 혈청 단백질 레벨의 하나 이상에서의 변화를 포함할 수 있다: BDNK, 보체(complement) 3, CD40 리간드, EGF, ENA-78, EN-RAGE, IGF-I, MDC, 골수세포형과산화효소(myeloperoxidase), RANTES, 또는 트롬보포이에틴(thrombopoietin). 그와 같은 발현 프로파일에서의 IFNα 유도성 PD 마커는 도면 235-381에 열거된 적어도 하나 이상의 유전자를 추가로 포함할 수 있다.
IFNα 유도성 PD 마커 발현 프로파일은 유전자를 추가로 포함할 수 있고, 그 유전자의 발현 또는 활성은 비(non)기준선 IFNα 레벨에 노출된 세포에서 하향조절된다. 유전자는 하기의 임의의 하나 이상을 포함할 수 있다: SLC4A1, PRSS33, FCERlA, BACH2, KLRBl, D4S234E, T 세포 수용체 알파 로커스(locus)/T 세포 수용체 델타 로커스(locus), FEZl, AFF3, CD160, ABCBl, PTCHl, OR2W3, IGHD, NOG, NR3C2, TNSl, PDZKlIPl, SH2D1B, STRBP, ZMYNDI l, TMODl, FCRLA, DKFZp761P0423, EPB42, NR6A1, LOC341333, MS4A1, IGHM, SIGLECP3, KIR2DS2, PKIA, BLRl, C5orf4, MYLK, LOC283663, MADlLl, CXCL5, D4S234E, FCRLA, KRTl, cl6orf74, ABCB4, 또는 GPRASPl.
PD 마커는 상향조절될 수 있고, 또는 건강한 대상체 또는 비(non)고통의 환자 조직의 마커에 대해 하향조절될 수 있다. 환자의 발현 프로파일에서의 타입 I IFN 또는 IFNα 유도성 PD 마커의 상향조절 또는 하향조절은 (환자의 질환 조직이 아닌 샘플 (예를 들어, 건선 환자의 비-질환 피부) 또는 질환 또는 장애에 시달리지 않는 건강한 사람으로 부터일 수 있는) 대조군으로부터 샘플에 대해 임의의 정도까지 일 수 있다. 상향조절 또는 하향조절 정도는 대조군 또는 대조군 샘플의 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 적어도 100%, 적어도 125%, 적어도 150%, 또는 적어도 200%, 또는 적어도 300%, 또는 적어도 400%, 또는 적어도 500% 일 수 있다.
타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 포함하는 환자는 IFNα 또는 타입 I IFN 서브타입의 임의의 수의 발현의 상향조절을 추가로 포함할 수 있다. IFNα 또는 타입 I IFN 서브타입은 임의의 1개 초과, 2개 초과, 3개 초과, 4개 초과, 5개 초과, 6개 초과, 7개 초과, 8개 초과, 9개 초과, 또는 10개 초과의 IFNα 또는 타입 I IFN 서브타입을 포함할 수 있다. 이들 서브타입은 IFNαl, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNαlO, IFNαl4, IFNαl7, IFNα21, IFNβ, 또는 IFNω 을 포함할 수 있다. 환자는 IFN 서브타입 IFNαl, IFN α2, IFNα8, 및 IFNα 14의 발현의 상향조절을 포함할 수 있다. 발현의 상향조절은 대조군의 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 적어도 100%, 적어도 125%, 적어도 150%, 또는 적어도 200%, 또는 적어도 300%, 또는 적어도 400%, 또는 적어도 500% 일 수 있다.
타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 포함하는 환자는 IFNα 수용체, IFNARl 또는 IFNAR2, 또는 둘 모두, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 (IFNGRl, IFNGR2, 또는 IFNGRl 및 IFNGR2 둘 모두)의 발현의 상향조절을 추가로 포함할 수 있다. 환자는 IFNα 수용체, IFNARl 또는 IFNAR2, 또는 둘 모두, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 (IFNGRl, IFNGR2, 또는 IFNGRl 및 IFNGR2 둘 모두)의 발현의 상향조절을 포함하는 환자로서 간단히 확인될 수 있다.
환자는 혈청 중의 단백질의 레벨의 변화를 추가로 포함하거나 대안적으로 포함할 수 있다. 환자는 하기와 같은 단백질의 증가된 혈청 레벨을 가질 수 있다: 아디포넥틴, 알파-페토프로틴(fetoprotein), 아폴리포프로틴 CIII, 베타-2 마이크로글루불린(microglobulin), 암 항원 125, 암 항원 19-9, 에오탁신(eotaxin), FABP, 팩터(factor) VII, 페리틴(ferritin), IL-10, IL-12p70, IL- 16, IL- 18, IL-lra, IL-3, MCP-I, MMP-3, 미오글로빈(myoglobin), SGOT, 조직 팩터(factor), TIMP-I, TNF RII, TNF-알파, VCAM-I, 또는 vWF. 환자는 혈청에서의 상기 단백질의 임의의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 또는 26개의 증가된 혈청 레벨을 가질 수 있다. 증가된 레벨은 대조군, 예를 들어, 건강한 대상체의 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 적어도 100%, 적어도 125%, 적어도 150%, 또는 적어도 200%, 또는 적어도 300%, 또는 적어도 400%, 또는 적어도 500% 일 수 있다. 상기 변화는 하기와 같은 단백질의 혈청 레벨에서의 감소일 수 있다: BDNK, 보체(complement) 3, CD40 리간드, EGF, ENA-78, EN-RAGE, IGF-I, MDC, 골수세포형과산화효소(myeloperoxidase), RANTES, 또는 트롬보포이에틴(thrombopoietin). 환자는 임의의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 또는 11개의 이들 단백질의 감소된 혈청 레벨을 가질 수 있다. 감소된 레벨은 대조군, 예를 들어, 건강한 대상체의 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 90%, 또는 적어도 100% 일 수 있다. PD 마커 프로파일은 단백질의 이들 증가 또는 감소된 혈청 레벨의 하나 이상을 포함할 수 있다.
환자는 하기의 자가항원 중 임의의 하나에 결합하는 자가항체를 추가로 포함할 수 있다: (a) 점액세균 (인플루엔자 바이러스) 저항성 1, 인터페론 유도 단백질 p78; (b) 폭식(surfeit) 5, 전사체 변이형 c; (c) 프로테아좀 (포좀(posome), 마크로파인(macropain)) 활성제 서브유닛 3 (PA28 감마; Ki) transc; (d) 레티노산 수용체, 알파; (e) 열충격 10 kDa 단백질 1 (chaperonin 10); (f) 트로포마이신(tropomyosin) 3; (g) 플렉스트린 호몰로지(pleckstrin homology) 유사 도메인, 패밀리 A, 멤버 1; (h) 세포골격 관련 단백질 1; (i) 쇼그렌증후군(Sjogren syndrome) 항원 A2 (60 kDa, 리보뉴클레오(ribonucleo) 단백질 자가항원 SS-A/Ro); (j) NADH 탈수소효소 (유비퀴논) 1, 알파/베타 서브컴플렉스(subcomplex) 1, 8 kDa; (k) NudE 핵 분포 유전자 E 호몰로그(homolog) 1 (A. nidulans); (1) MutL 호몰로그(homolog) 1, 직장암, 비폴립(nonpolyposis) 타입 2 (대장균); (m) 류신 풍분한 반복 (FLII 에서) 상호작용 단백질 2; (n) 트로포마이신(tropomyosin) 1 (alpha); (o) 강직성 대마비 20, 스파르틴(spartin) (트로이 증후군(Troyer syndrome)); (p) 착상전 단백질(preimplantation protein), 전사체 변이형 1; (r) 미토콘드리아 리보솜 단백질 L45; (s) Lin-28 동족체 (C. elegans); (t) 열충격 90 kDa 단백질 1, 알파; (u) dom-3 동족체 Z (C. elegans); (v) 다이네인(dynein), 세포질, 경(light) 중간 폴리펩타이드 2; (w) Ras 관련 C3 부툴리늄 독소(botulinum toxin) 기질 1 (로(rho) 패밀리, 작은 GTP 결합 단백질); (x) 활막 육종, X 파괴점 2, 전사체 변이형 2; (y) moesin; (z) 호머(homer) 호몰로그(homolog) (Drosophila), 전사체 변이형 1; (aa) 아미노산 합성 5 유사 2 (효모)의 GCN5일반 대조군; (bb) 진핵 번역 신장 인자 1 감마; (cc) 진핵 번역 신장 인자 1, 델타; (dd) DNA 손상 유도 전사체 3; (ee) CCAAT/인핸서 결합 단백질 (C/EBP) 감마; 및 명칭 "Auto-antibody markers of autoimmune disease" (2007년 5월 3일 출원)의 가출원 또는 명칭 "Auto-antibody markers of autoimmune disease" (2007년 11월 6일 출원)의 가출원 (예를 들어, 표 2, 4, 5, 및 9 에 기재된 것으로 한정되지 않음)에 기재된 임의의 다른 자가항원. 환자는 다수의, 예를 들어, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 11, 적어도 12, 적어도 13, 적어도 14, 적어도 15, 적어도 20, 적어도 25 개의 이들 자가항원에 결합하는 자가항체를 포함할 수 있다.
치료제는 근염 환자에게 투여될 수 있다. 치료제는 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 어떤 분자라도 될 수 있다. 치료제는 소분자 또는 생물학적 제제일 수 있다. 치료제가 소분자인 경우에, 이것은 합성되거나 천연 공급원으로부터 확인 및 분리될 수 있다.
치료제가 생물학적 제제가면, 타입 I IFN 또는 IFNα의 임의의 서브타입(들)에 특이적인 항체일 수 있다. 예를 들어, 항체는 하기 중의 임의의 하나에 대해 특이적일 수 있다: IFNαl, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNαlO, IFNαl4, IFNα 17, IFNα21, IFNβ, 또는 IFNω. 대안적으로, 항체는 임의의 2, 임의의 3, 임의의 4, 임의의 5, 임의의 6, 임의의 7, 임의의 8, 임의의 9, 임의의 10, 임의의 11, 임의의 12개의 IFNα 서브타입의 타입 I IFN 에 특이적일 수 있다. 항체가 하나 초과의 타입 I IFN 서브타입에 대해 특이적이면, 항체는 IFNαl, IFNα2, IFN α4, IFNα5, IFNα8, IFNαlO, 및 IFNα21 에 대해 특이적일 수 있고; 또는 IFNαl, IFNα2, IFNα4, IFNα5, IFNα8, 및 IFNαlO 에 대해 특이적일 수 있고; 또는 for IFNαl, IFNα2, IFNα4, IFNα5, IFNα8, 및 IFNα21 에 대해 특이적일 수 있고; IFNαl, IFNα2, IFNα4, IFNα5, IFNαlO, 및 IFNα21 에 대해 특이적일 수 있다. 타입 I IFN 또는 IFNα 에 대해 특이적인 항체는 MEDI-545, 임의의 생물제제, 또는 MEDI-545 제외한 항체, U.S. 특허출원 11/009,410 (2004년 12월 10일 출원) 및 11/157,494 (2005년 6월 20일 출원)에 기재된 항체, 9F3, 및 U.S. 특허 No. 7,087,726 (실시예 1 및 실시예 2, 표 3 및 표 4 에 기재된 것, 및/또는 칼럼 56의 25-54행의 명칭 "Deposit of Material"의 표에 개시된 것)에 기재된 다른 항체, NK-2 및 YOK5/19 (WO 84/03105), LO-22 (U.S. 특허 4,902,618), 144 BS (U.S. 특허 4,885,166), 및 EBI-I, EBI-2, 및 EBI-3 (EP 119476)에 대해 특이적일 수 있다. IFNα 활성을 조절하는 치료제는 IFNα 활성을 중화시킬 수 있다. 당업자는 그와 같은 생물학적 제제의 제조 및 제형, 및 그의 투여 방법을 알고 있다.
항체는 합성 항체, 모노클로날 항체, 폴리클로날 항체, 재조합으로 생성된 항체, 체내, 다중특이 항체 (양특이 항체 포함), 인간 항체, 인간화 항체, 키메라 항체, 단쇄 Fv (scFv) (양특이 scFv 포함), BiTE 분자, 단쇄 항체, Fab 단편, F(ab') 단편, 디설파이드 결합된 Fv (sdFv), 또는 임의의 상기의 에피토프(epitope) 결합 단편일 수 있다. 항체는 면역글로불린 분자, 또는 면역글로불린 분자의 면역적 활성부의 어떤 것일 수 있다. 더욱이, 항체는 임의의 아이소타입(isotype)일 수 있다. 예를 들어, 임의의 아이소타입(isotype) IgGl, IgG2, IgG3 또는 IgG4 일 수 있다. 항체는 가변 및 일정 부위를 포함하는 전체 길이(full-length) 항체, 또는 그의 항원 결합 단편, 예컨대 단쇄 항체, 또는 Fab 또는 Fab'2 단편일 수 있다. 항체는 또한 치료제, 예컨대 사이톡신 또는 방사성 동위원소에 접합 또는 연결될 수 있다.
IFNα 활성을 조절하기 위해 결합하는 상기 제제 이외의 제2 제제는 근염 환자에 투여될 수 있다. 제2 제제는 비제한적으로 하기를 포함한다: 비스테로이드성 항염증성 약물, 예컨대 이부프로펜(ibuprofen), 나프록센(naproxen), 술린닥(sulindac), 디클로페낙(diclofenac), 피록시캄(piroxicam), 케토프로펜(ketoprofen), 디플루니살(diflunisal), 나부메톤(nabumetone), 에토돌락(etodolac), 및 옥사프로진(oxaprozin), 인도메타신(indomethacin); 항말라리아 약물, 예컨대 히드록시클로로퀸; 코르티코스테로이드(corticosteroid) 호르몬, 예컨대 prednisone, 히드로코르티손(hydrocortisone), 메틸프레드니솔론(methylprednisolone), 및 덱사메타존(dexamethasone); 메토트렉세이트(methotrexate); 면역억제제, 예컨대 아자치오프린(azathioprine) 및 시클로포스파미드(cyclophosphamide); 및 생물학적 제제, 예를 들어, 표적 T 세포, 예컨대 알레파셉트(Alefacept) 및 에팔리주맙(Efalizumab), 또는 표적 TNFα, 예컨대, 엔브렐(Enbrel), 레미케이드(Remicade), 및 휴미라(Humira).
상기 제제에 의한 치료로 타입 I IFN 또는 IFNα 유도성 프로파일이 중화된다. 제제에 의한 치료로 근염 또는 질환 급격한 재발(flare-up)의 하나 이상의 증상이 감소될 수 있다. 증상은 근력 약화, 삼키기 곤란, 호흡 곤란, 열병, 체중 손실, 통증, 근육 압통, 관절염, 및 발진을 포함할 수 있다. 제제에 의한 치료로 예후가 향상된다. 제제에 의한 치료로 환자의 삶의 질이 높아진다. 제제에 의한 치료는 제2 제제를 공통투여할 필요를 줄일 수 있고, 또는 제2 제제의 환자에의 투여의 투약을 적게 할 수 있다. 제제에 의한 치료는 환자의 입원기간을 감소시킬 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제는 타입 I IFN 또는 IFNα 유도성 프로파일을 중화시킬 수 있다. 타입 I IFN 또는 IFNα 유도성 프로파일의 중화는 타입 I IFN 또는 IFNα 에 의해 상향조절된 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 유전자에서의 감소일 수 있다. 타입 I IFN 또는 IFNα 에 의해 상향조절된 유전자는 도 235-381 에서 또는 상기에서 논의된 임의의 유전자 그룹일 수 있다. 타입 I IFN 또는 IFNα 유도성 프로파일의 중화는 임의의 타입 I IFN 또는 IFNα 유도성 프로파일에서 상향조절된 임의의 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 유전자의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90%의 감소이다. 대안적으로, 타입 I IFN 또는 IFNα 유도성 프로파일의 중화는 대조군 샘플 중 타입 I IFN 또는 IFNα 유도성 유전자의 발현 레벨의 겨우 50%, 겨우 45%, 겨우 40%, 겨우 35%, 겨우 30%, 겨우 25%, 겨우 20%, 겨우 15%, 겨우 10%, 겨우 5%, 겨우 4%, 겨우 3%, 겨우 2%, 또는 겨우 1% 내인 상향조절된 타입 I IFN 또는 IFNα 유도성 유전자의 발현의 감소를 의미할 수 있다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제가 항체와 같은 생물학적 제제가면, 제제는 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 타입 I IFN 또는 IFNα 프로파일을 중화시킬 수 있다.
타입 I IFN 또는 IFNα 유도성 프로파일의 중화는 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 또는 적어도 50개의 유전자의 증가된 발현일 수 있고, 그 유전자의 발현은 타입 I IFN 또는 IFNα 에 의해 감소된다. 발현이 타입 I IFN 또는 IFNα 에 의해 감소되는 유전자는 도 235-381 에서 또는 상기에서 논의된 임의의 유전자 그룹일 수 있다. 타입 I IFN 또는 IFNα 유도성 프로파일 중 하향조절된 유전자의 중화는 임의의 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 또는 적어도 25개의 유전자의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90%, 또는 적어도 100%, 또는 적어도 125%, 또는 적어도 130%, 또는 적어도 140%, 또는 적어도 150%, 또는 적어도 175%, 또는 적어도 200%, 또는 적어도 250%, 또는 적어도 300%, 또는 적어도 500%의 증가일 수 있고, 상기 유전자의 발현은 임의의 타입 I IFN 또는 IFNα 유도성 프로파일에서 하향조절된다. 대안적으로, 타입 I IFN 또는 IFNα 유도성 프로파일의 중화란, 대조군 샘플 중 타입 I IFN 또는 IFNα 유도성 (하향조절된) 유전자의 발현 레벨의 겨우 50%, 겨우 45%, 겨우 40%, 겨우 35%, 겨우 30%, 겨우 25%, 겨우 20%, 겨우 15%, 겨우 10%, 겨우 5%, 겨우 4%, 겨우 3%, 겨우 2%, 또는 겨우 1% 내인 타입 I IFN 또는 IFNα 유도성 유전자의 발현의 증가를 의미한다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제가 항체와 같은 생물학적 제제가면, 제제는 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 타입 I IFN 또는 IFNα 프로파일를 중화시킬 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제는 하나 이상의 타입 I IFN 또는 IFNα 서브타입의 발현을 추가로 또는 대안적으로 중화시킬 수 있다. IFNα 또는 타입 I IFN 서브타입은 임의의 1개 초과, 2개 초과, 3개 초과, 4개 초과, 5개 초과, 6개 초과, 7개 초과, 8개 초과, 9개 초과, 또는 10개 초과의 IFNα 또는 타입 I IFN 서브타입을 포함할 수 있다. 이들 서브타입은 IFNαl, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNαlO, IFNαl4, IFNαl7, IFNα21, IFNβ, 또는 IFNω을 포함할 수 있다. 이들 서브타입은 IFNαl, IFNα2, IFNα8, 및 IFNαl4 모두를 포함할 수 있다. 대안적으로, 이들 서브타입은 IFNαl, IFNα2, IFNα4, IFNα5, IFNα8, IFNαlO, IFNα21을 포함할 수 있다. IFNα 또는 타입 I IFN 서브타입의 중화는 임의의 적어도 1, 적어도 2, 적어도 3, 적어도 5, 적어도 7, 적어도 8, 또는 적어도 10개의 서브타입의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90%의 감소일 수 있다. IFNα 또는 타입 I IFN 서브타입의 중화는 대조군 샘플 중 IFNα 또는 타입 I IFN 서브타입의 발현 레벨의 겨우 50%, 겨우 45%, 겨우 40%, 겨우 35%, 겨우 30%, 겨우 25%, 겨우 20%, 겨우 15%, 겨우 10%, 겨우 5%, 겨우 4%, 겨우 3%, 겨우 2%, 또는 겨우 1% 내인 IFNα 또는 타입 I IFN 서브타입 유전자의 발현에서의 감소일 수 있다. IFNα 또는 타입 I IFN 에 결합하고 그 활성을 조절하는 제제가 항체와 같은 생물학적 제제가면, 제제는 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 IFNα 또는 타입 I IFN 서브타입을 중화시킬 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제는 IFNα 수용체, IFNARl 또는 IFNAR2, 또는 둘 모두, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 (IFNGRl, IFNGR2, 또는 IFNGRl 및 IFNGR2 둘 모두)의 발현을 추가로 또는 대안적으로 중화시킬 수 있다. IFNα 수용체, IFNARl 또는 IFNAR2, 또는 둘 모두, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 (IFNGRl, IFNGR2, 또는 IFNGRl 및 IFNGR2 둘 모두)의 발현의 중화는 임의의 적어도 1, 적어도 2, 적어도 3, 적어도 5개, 또는 적어도 6개의 이들 유전자의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90%의 감소일 수 있다. IFNα 수용체, IFNARl 또는 IFNAR2, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 (IFNGRl, IFNGR2, 또는 IFNGRl 및 IFNGR2 둘 모두)의 발현의 중화는 대조군 샘플 중 이들 유전자의 발현 레벨의 겨우 50%, 겨우 45%, 겨우 40%, 겨우 35%, 겨우 30%, 겨우 25%, 겨우 20%, 겨우 15%, 겨우 10%, 겨우 5%, 겨우 4%, 겨우 3%, 겨우 2%, 또는 겨우 1%의 발현의 감소이다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제가 항체와 같은 생물학적 제제가면, 제제는 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 IFNα 수용체 IFNARl 또는 IFNAR2, 또는 TNFα, 또는 IFNγ, 또는 IFNγ 수용체 IFNGRl 또는 IFNGR2의 발현을 중화시킬 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제는 혈청 중의 단백질의 레벨, 예를 들어, 혈청 레벨이 하향조절되는 단백질의 증가 레벨 또는 혈청 레벨이 대조군 대상체의 레벨에 근접한 레벨로 상향조절되는 단백질의 감소 레벨의 변화를 추가로 또는 대안적으로 중화시킬 수 있다. 아디포넥틴, 알파-페토프로틴(fetoprotein), 아폴리포프로틴 CIII, 베타-2 마이크로글루불린(microglobulin), 암 항원 125, 암 항원 19-9, 에오탁신(eotaxin), FABP, 팩터(factor) VII, 페리틴(ferritin), IL-10, IL-12p70, IL-16, IL-18, IL-lra, IL-3, MCP-I, MMP-3, 미오글로빈(myoglobin), SGOT, 조직 팩터(factor), TIMP-I, TNF RII, TNF-알파, VCAM-I, vWF, BDNK, 보체(complement) 3, CD40 리간드, EGF, ENA-78, EN-RAGE, IGF-I, MDC, 골수세포형과산화효소(myeloperoxidase), RANTES, 또는 트롬보포이에틴(thrombopoietin)과 같은 혈청 중 단백질의 발현의 중화는 건강한 대상체의 혈청 중 단백질의 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90% 레벨 내인 단백질의 적어도 1, 적어도 2, 적어도 3, 적어도 5개, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 또는 적어도 25개의 레벨에 의할 수 있다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제가 항체와 같은 생물학적 제제가면, 제제는 혈청 단백질, 예를 들어, 아디포넥틴, 알파- 페토프로틴(fetoprotein), 아폴리포프로틴 CIII, 베타-2 마이크로글루불린(microglobulin), 암 항원 125, 암 항원 19-9, 에오탁신(eotaxin), FABP, 팩터(factor) VII, 페리틴(ferritin), IL-10, IL-12p70, IL-16, IL-18, IL-lra, IL-3, MCP-I, MMP-3, 미오글로빈(myoglobin), SGOT, 조직 팩터(factor), TIMP-I, TNF RII, TNF-알파, VCAM-I, vWF, BDNK, 보체(complement) 3, CD40 리간드, EGF, ENA-78, EN-RAGE, IGF-I, MDC, 골수세포형과산화효소(myeloperoxidase), RANTES, 또는 트롬보포이에틴(thrombopoietin)의 레벨을 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 중화시킬 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제는 임의의 1, 임의의 적어도 2, 임의의 적어도 3, 임의의 적어도 4, 임의의 적어도 5, 임의의 적어도 6, 임의의 적어도 7, 임의의 적어도 8, 임의의 적어도 9, 임의의 적어도 10, 임의의 적어도 15, 또는 임의의 적어도 20개의 하기의 자가항원에 결합하는 자가항체의 수 또는 레벨을 추가로 또는 대안적으로 감소시킬 수 있다: (a) 점액세균 (인플루엔자 바이러스) 저항성 1, 인터페론 유도 단백질 p78; (b) 폭식(surfeit) 5, 전사체 변이형 c; (c) 프로테아좀 (포좀(posome), 마크로파인(macropain)) 활성제 서브유닛 3 (PA28 감마; Ki) transc; (d) 레티노산 수용체, 알파; (e) 열충격 10 kDa 단백질 1 (chaperonin 10); (f) 트로포마이신(tropomyosin) 3; (g) 플렉스트린 호몰로지(pleckstrin homology) 유사 도메인, 패밀리 A, 멤버 1; (h) 세포골격 관련 단백질 1; (i) 쇼그렌증후군(Sjogren syndrome) 항원 A2 (60 kDa, 리보뉴클레오(ribonucleo) 단백질 자가항원 SS-A/Ro); (j) NADH 탈수소효소 (유비퀴논) 1, 알파/베타 서브컴플렉스(subcomplex) 1, 8 kDa; (k) NudE 핵 분포 유전자 E 호몰로그(homolog) 1 (A. nidulans); (1) MutL 호몰로그(homolog) 1, 직장암, 비폴립(nonpolyposis) 타입 2 (대장균); (m) 류신 풍분한 반복 (FLII 에서) 상호작용 단백질 2; (n) 트로포마이신(tropomyosin) 1 (alpha); (o) 강직성 대마비 20, 스파르틴(spartin) (트로이 증후군(Troyer syndrome)); (p) 착상전 단백질(preimplantation protein), 전사체 변이형 1; (r) 미토콘드리아 리보솜 단백질 L45; (s) Lin-28 동족체 (C. elegans); (t) 열충격 90 kDa 단백질 1, 알파; (u) dom-3 동족체 Z (C. elegans); (v) 다이네인(dynein), 세포질, 경(light) 중간 폴리펩타이드 2; (w) Ras 관련 C3 부툴리늄 독소(botulinum toxin) 기질 1 (로(rho) 패밀리, 작은 GTP 결합 단백질); (x) 활막 육종, X 파괴점 2, 전사체 변이형 2; (y) moesin; (z) 호머(homer) 호몰로그(homolog) (Drosophila), 전사체 변이형 1; (aa) 아미노산 합성 5 유사 2 (효모)의 GCN5일반 대조군; (bb) 진핵 번역 신장 인자 1 감마; (cc) 진핵 번역 신장 인자 1, 델타; (dd) DNA 손상 유도 전사체 3; (ee) CCAAT/인핸서 결합 단백질 (C/EBP) 감마; 및 명칭 "Auto-antibody markers of autoimmune disease" (2007년 5월 3일 출원)의 가출원 또는 명칭 "Auto-antibody markers of autoimmune disease" (2007년 11월 6일 출원)의 가출원 (예를 들어, 표 2, 4, 5, 및 9 에 기재된 것으로 한정되지 않음)에 기재된 임의의 다른 자가항원. 자가항체의 레벨에서의 감소는 임의의 자가항체의 존재에서 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 7%, 적어도 8%, 적어도 10%, 적어도 15%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 또는 적어도 90%의 감소일 수 있다. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제가 항체와 같은 생물학적 제제가면, 제제는 자가항체의 수 또는 레벨을 0.3 내지 30 mg/kg, 0.3 내지 10 mg/kg, 0.3 내지 3 mg/kg, 0.3 내지 1 mg/kg, 1 내지 30 mg/kg, 3 내지 30 mg/kg, 5 내지 30 mg/kg, 10 내지 30 mg/kg, 1 내지 10 mg/kg, 3 내지 10 mg/kg, 또는 1 내지 5 mg/kg의 복용량으로 감소시킬 수 있다.
타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제는 인터페론 유도 표지 또는 PD 마커 프로파일에 포함되지 않는 유전자의 발현을 중화시킬 수 없다.
질환 진행의 모니터링은 제제, 예를 들어, 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제, 또는 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조절하지 않는 제제, 또는 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 포함하거나 포함할 수 없는 제제의 조합의 투여 전 및 후에 환자 샘플을 얻어서 수행될 수 있다. 샘플은 임의의 생체액 또는 조직, 예컨대 전체 혈액, 타액, 소변, 관절혈액, 골수, 뇌척수액, 코 분비물, 가래, 양수(羊水), 기관지폐세척액, 말초 혈액 단핵세포, 총 백혈구, 림프절 세포, 비장 세포, 편도 세포, 또는 피부를 포함한다. 샘플은 당해 기술에 공지된 임의의 수단으로 얻을 수 있다.
타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 (제제 투여 전 및 후) 샘플에서 얻는다. 샘플 중 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일이 비교된다. 비교는 샘플에 존재하는 타입 I IFN 또는 IFNα 유도성 PD 마커의 수, 샘플에 존재하는 타입 I IFN 또는 IFNα 유도성 PD 마커의 양, 또는 그의 임의의 조합일 수 있다. 치료제의 효능을 나타내는 편차는, 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 개수 또는 레벨 (또는 그의 임의의 조합)이 치료제의 투여 전에 얻은 샘플에 대해 치료제의 투여 후에 얻은 샘플에서 감소한다면, 나타낼 수 있다. 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 감소할 수 있다. 임의의 소정의 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 레벨은 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 감소할 수 있다. 감소된 레벨을 갖는 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 감소된 수 및 감소된 레벨의 임의의 조합은 효능을 나타낼 수 있다. 치료제의 효능을 나타내는 편차는, 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 개수 또는 레벨 (또는 그의 임의의 조합)이 치료제의 투여 전에 얻은 샘플에 대해 치료제의 투여 후에 얻은 샘플에서 감소한다면, 나타낼 수 있다. 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 감소할 수 있다. 임의의 소정의 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 레벨은 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 증가할 수 있다. 증가된 레벨을 갖는 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 감소된 수 및 증가된 레벨의 임의의 조합은 효능을 나타낼 수 있다.
환자로부터 얻은 샘플은 제제의 제1 투여 전에 얻을 수 있고, 즉, 환자는 제제가 투여되지 않는다. 대안적으로, 환자로부터 얻은 샘플은 치료 과정에서 체제의 투여 후에 얻을 수 있다. 예를 들어, 제제는 모니터링 프로토콜의 개시 전에 투여되었을지 모른다. 제제의 투여 후에, 추가 샘플은 환자로부터 얻을 수 있고, 샘플에서의 타입 I IFN 또는 IFNα 유도성 PD 마커가 비교된다. 샘플은 동일 또는 상이한 타입일 수 있고, 예를 들어, 얻은 각 샘플 혈액 샘플일 수 있고, 또는 얻은 각 샘플은 혈청 샘플일 수 있다. 각 샘플에서 검출된 타입 I IFN 또는 IFNα 유도성 PD 마커는 동일할 수 있고, 실질적으로 중첩될 수 있고, 또는 유사할 수 있다
샘플은 치료제의 투여 전 및 후의 임의의 시간에서 얻을 수 있다. 치료제의 투여 후에 얻은 샘플은 치료제의 투여 후 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 12, 또는 적어도 14일에 얻을 수 있다. 치료제의 투여 후에 얻은 샘플은 치료제의 투여 후 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 또는 적어도 8주에 얻을 수 있다. . 치료제의 투여 후에 얻은 샘플은 치료제의 투여 후 적어도 2, 적어도 3, 적어도 4, 적어도 5, 또는 적어도 6달에 얻을 수 있다.
추가 샘플은 치료제의 투여 후에 환자로부터 얻을 수 있다. 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 12, 적어도 15, 적어도 20, 적어도 25개의 샘플은 경시적으로 질환 또는 장애의 진행 또는 퇴행을 모니터하기 위해 환자로부터 얻을 수 있다. 질환 진행은 적어도 1주, 적어도 2주, 적어도 3주, 적어도 4주, 적어도 5주, 적어도 6주, 적어도 7주, 적어도 2 달, 적어도 3 달, 적어도 4 달, 적어도 5 달, 적어도 6 달, 적어도 1년, 적어도 2년, 적어도 3년, 적어도 4년, 적어도 5년, 적어도 10년, 또는 환자의 일생에 걸쳐 모니터될 수 있다. 추가 샘플은 규칙적인 간격, 예컨대 매달, 2달에 1회, 분기에 1회, 1년에 2회, 또는 매년 간격으로 환자로부터 얻을 수 있다. 샘플은 규칙적인 간격으로 제제의 투여 후에 환자로부터 얻을 수 있다. 예를 들어, 샘플은 각 제제 투여 후 1주, 또는 각 제제 투여 후 2주, 또는 각 제제 투여 후 3주, 또는 각 제제 투여 후 1달, 또는 각 제제 투여 후 2달에 환자로부터 얻을 수 있다. 대안적으로, 다중 샘플은 각 제제 투여 후 환자로부터 얻을 수 있다.
환자에서의 질환 진행은 유사하게 제제의 투여의 부재에서 모니터될 수 있다. 샘플은 질환 또는 장애를 갖는 환자로부터 주기적으로 얻을 수 있다. 질환 진행은, 타입 I IFN 또는 IFNα 유도성 PD 마커의 수가 초기에 얻은 샘플에 대해 말기에 얻은 샘플에서 증가한다면, 확인될 수 있다. 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 증가할 수 있다. 질환 진행은, 임의의 소정의 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 증가한다면, 확인될 수 있다. 질환 진행은, 임의의 소정의 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 감소한다면, 확인될 수 있다. 증가된 레벨을 갖는 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 감소된 레벨을 갖는 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 증가된 수 및 증가된 레벨의 임의의 조합은 질환 진행을 나타낼 수 있다. 대안적으로, 또는 조합하여, 하향조절된 타입 타입 I IFN 또는 IFNα 유도성 PD 마커의 감소된 수 및 감소된 레벨의 임의의 조합은 질환 진행을 나타낼 수 있다. 질환 퇴행은 또한 제제에 의해 치료되지 않은, 질환 또는 장애를 갖는 환자에서 확인될 수 있다. 이 예에서, 퇴행은, 타입 I IFN 또는 IFNα 유도성 PD 마커의 수가 초기에 얻은 샘플에 대해 말기에 얻은 샘플에서 감소한다면 확인될 수 있다. 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 또는 적어도 10까지 감소할 수 있다. 질환 퇴행은, 임의의 소정의 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 감소한다면, 확인될 수 있다. 질환 퇴행은, 임의의 소정의 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 레벨이 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 또는 적어도 95%까지 증가한다면 확인될 수 있다. 감소된 레벨을 갖는 상향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 증가된 레벨을 갖는 하향조절된 타입 I IFN 또는 IFNα 유도성 PD 마커의 수는 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 15, 적어도 20, 적어도 25, 적어도 30, 또는 적어도 35 일 수 있다. 질환 진행 또는 질환 퇴행은 임의의 기간에 걸쳐 및 임의의 간격으로 샘플을 얻어서 모니터될 수 있다. 질환 진행 또는 질환 퇴행은 적어도 1주, 적어도 2주, 적어도 3주, 적어도 4주, 적어도 5주, 적어도 6주, 적어도 7주, 적어도 2 달, 적어도 3 달, 적어도 4 달, 적어도 5 달, 적어도 6 달, 적어도 1년, 적어도 2년, 적어도 3년, 적어도 4년, 적어도 5년, 적어도 10년, 또는 환자의 일생에 걸쳐 샘플을 얻어서 모니터될 수 있다. 질환 진행 또는 질환 퇴행은 적어도 매달, 2달에 1회, 분기에 1회, 1년에 2회, 또는 매년 샘플을 얻어서 모니터될 수 있다. 샘플을 엄격한 간격으로 얻을 필요는 없다.
본 발명은 또한 키트 및 탐침을 포함한다. 탐침은 IFNα 유도성 PD 마커 발현 프로파일에 포함될 수 있는 임의의 유전자의 임의의 발현 또는 활성을 검출하는 임의의 분자일 수 있다.
본 출원인은 본 발명의 측면 중 일부를 기재하기 위해 비제한적인 구체예를 제공한다.
구체예
1. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 투여함을 포함하는 타입 I IFN 또는 IFNα 매개성 질환 또는 장애를 갖는 환자의 치료 방법에 있어서,
상기 환자는 차별적 조절된 miRNA 마커 프로파일을 포함하고,
상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 중화시키는, 방법.
2. 제1 구체예에 있어서, 환자의 차별적 조절된 miRNA 마커 프로파일의 중화를 검출하는 것을 추가로 포함하는, 방법.
3. 제1 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
4. 제3 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
5. 제4 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
6. 제5 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
7. 제6 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
8. 제3 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
9. 제1 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
10. 제9 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
11. 제10 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
12. 제11 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
13. 제12 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
14. 제9 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
15. 제3 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
16. 제15 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
17. 제16 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
18. 제17 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
19. 제18 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
20. 제15 구체예에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
21. 제1 구체예에 있어서, 상기 제제는 생물학적 제제인, 방법.
22. 제21 구체예에 있어서, 상기 제제는 항체인, 방법.
23. 제22 구체예에 있어서, 상기 항체는 MEDI-545 인, 방법.
24. 제22 구체예에 있어서, 상기 항체는 하나 이상의 타입 I IFN 또는 IFNα 서브타입에 대해 특이적이지만, MEDI-545 가 아닌, 방법.
25. 제1 구체예에 있어서, 상기 투여 제제는 질환 또는 장애의 하나 이상의 증상을 경감시키는, 방법.
26. 제22 구체예에 있어서, 상기 항체는 대략 0.03 내지 30 mg/kg의 복용량으로 투여되는, 방법.
27. 제26 구체예에 있어서, 상기 항체는 0.3 내지 3 mg/kg의 복용량으로 투여되는, 방법.
28. 제27 구체예에 있어서, 상기 항체는 0.03 내지 1 mg/kg의 복용량으로 투여되는, 방법.
29. 제21 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 10%까지 중화시키는, 방법.
30. 제29 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 20%까지 중화시키는, 방법.
31. 제30 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 30%까지 중화시키는, 방법.
32. 제31 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 40%까지 중화시키는, 방법.
33. 제32 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 50%까지 중화시키는, 방법.
34. 제1 구체예에 있어서, 상기 질환 또는 장애는 낭창, 건선, 맥관염, 유육종증, 쇼그렌 증후군, 또는 근염 중 하나인, 방법.
35. 제34 구체예에 있어서, 질환 또는 장애는 근염인, 방법.
36. 제1 구체예에 있어서, 상기 환자는 적어도 IFNα 서브타입 1, 2, 8, 및 14의 상향조절된 발현 또는 활성을 추가로 포함하는, 방법.
37. 제2 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 전체 혈액에서 검출되는, 방법.
38. 제2 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 근육 조직에서 검출되는, 방법.
39. 제1 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 강하거나 중간정도인, 방법.
40. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 이를 필요로 하는 환자에 투여함을 포함하는, 필요한 환자의 차별적 조절된 miRNA 마커 프로파일을 중화시키는 방법에 있어서,
상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 중화시키는, 방법.
41. 제40 구체예에 있어서, 환자의 차별적 조절된 miRNA 마커 프로파일의 중화를 검출하는 것을 추가로 포함하는, 방법.
42. 제40 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
43. 제42 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
44. 제43 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
45. 제44 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
46. 제45 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
47. 제42 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
48. 제40 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
49. 제48 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
50. 제49 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
51. 제50 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
52. 제51 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
53. 제48 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
54. 제42 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
55. 제54 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
56. 제55 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
57. 제56 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
58. 제57 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
59. 제54 구체예에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
60. 제40 구체예에 있어서, 상기 제제는 생물학적 제제인, 방법.
61. 제60 구체예에 있어서, 상기 제제는 항체인, 방법.
62. 제61 구체예에 있어서, 상기 항체는 MEDI-545 인, 방법.
63. 제61 구체예에 있어서, 상기 항체는 하나 이상의 타입 I IFN 또는 IFNα 서브타입에 대해 특이적이지만, MEDI-545 가 아닌, 방법.
64. 제40 구체예에 있어서, 상기 투여 제제는 질환 또는 장애의 하나 이상의 증상을 경감시키는, 방법.
65. 제61 구체예에 있어서, 상기 항체는 대략 0.03 내지 30 mg/kg의 복용량으로 투여되는, 방법.
66. 제65 구체예에 있어서, 상기 항체는 0.3 내지 3 mg/kg의 복용량으로 투여되는, 방법.
67. 제66 구체예에 있어서, 상기 항체는 0.03 내지 1 mg/kg의 복용량으로 투여되는, 방법.
68. 제40 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 10%까지 중화시키는, 방법.
69. 제68 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 20%까지 중화시키는, 방법.
70. 제69 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 30%까지 중화시키는, 방법.
71. 제70 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 40%까지 중화시키는, 방법.
72. 제71 구체예에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 50%까지 중화시키는, 방법.
73. 제40 구체예에 있어서, 상기 환자는 낭창, 건선, 맥관염, 유육종증, 쇼그렌 증후군, 또는 근염 중 하나로 진단된, 방법.
74. 제73 구체예에 있어서, 상기 환자는 근염으로 진단된, 방법.
75. 제40 구체예에 있어서, 상기 환자는 적어도 IFNα 서브타입 1, 2, 8, 및 14의 상향조절된 발현 또는 활성을 추가로 포함하는, 방법.
76. 제41 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 전체 혈액에서 검출되는, 방법.
77. 제41 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 근육 조직에서 검출되는, 방법.
78. 제40 구체예에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 강하거나 중간정도인, 방법.
79. 환자로부터의 제1 샘플에서 제1 차별적 조절된 miRNA 마커 프로파일을 얻는 것을 포함하는, 환자의 염증성 질환 진행의 모니터링 또는 예측 방법.
80. 제79 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
81. 제80 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
82. 제81 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
83. 제82 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
84. 제83 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
85. 제80 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
86. 제79 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
87. 제86 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
88. 제87 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
89. 제88 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
90. 제89 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
91. 제86 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
92. 제80 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
93. 제92 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
94. 제93 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
95. 제94 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
96. 제95 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
97. 제92 구체예에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
98. 제79 구체예에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 강한 프로파일이고 환자 예후는 질환 진행인, 방법.
99. 제98 구체예에 있어서, 상기 강한 프로파일은 건강한 개체의 적어도 10배의 miRNA의 차별적 발현을 포함하는, 방법.
100. 제98 구체예에 있어서, 상기 자가면역 질환은 근염인, 방법.
101. 제79 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 약한 프로파일이고 환자 예후는 질환 퇴행인, 방법.
102. 제101 구체예에 있어서, 상기 약한 프로파일은 건강한 개체의 2배 이하의 miRNA의 차별적 발현을 포함하는, 방법.
103. 제98 구체예에 있어서, 상기 강한 프로파일은 의사가 질환 치료를 변경하도록 지시하는, 방법.
104. 제79 구체예에 있어서,
환자로부터의 제2 샘플에서 제2 차별적 조절된 miRNA 마커 프로파일을 얻는 것을 추가로 포함하며;
제1 프로파일에 대한 상기 제2 프로파일에서의 miRNA 마커의 개수 또는 레벨의 증가가 질환 진행을 예측하거나;
제1 프로파일에 대한 상기 제2 프로파일에서의 miRNA 마커의 개수 또는 레벨에서의 감소가 질환 퇴행을 예측하는, 방법.
105. 환자로부터의 제1 샘플에서 제1 miRNA 프로파일을 얻고;
치료제를 투여하고;
환자로부터의 제2 샘플에서 제2 miRNA 프로파일을 얻고;
제1 및 제2 miRNA 프로파일을 비교하는 것을 포함하며,
상기 제1 및 제2 miRNA 프로파일에서의 편차는 치료제의 효능의 레벨을 나타내는, 치료제에 의한 치료를 받는 환자의 자가면역 또는 염증성 질환 진행을 모니터링하는 방법.
106. 제105 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
107. 제106 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
108. 제107 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
109. 제108 구체예에 있어서, 상기 제1 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
110. 제109 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
111. 제106 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
112. 제105 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
113. 제112 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
114. 제113 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
115. 제114 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
116. 제115 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
117. 제112 구체예에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
118. 제106 구체예에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
119. 제118 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
120. 제119 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
121. 제120 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
122. 제121 구체예에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
123. 제118 구체예에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
124. 제105 구체예에 있어서, 상기 자가면역 또는 염증성 질환은 낭창, 특발성 염증성 근염, 쇼그렌 증후군, 맥관염, 유육종증, 또는 건선인, 방법.
125. 제124 구체예에 있어서, 상기 자가면역 질환은 특발성 염증성 근염인, 방법.
126. 제105 구체예에 있어서, 상기 치료제는 소분자 또는 생물학적 제제인, 방법.
127. 제126 구체예에 있어서, 상기 생물학적 제제는 항체인, 방법.
128. 제127 구체예에 있어서, 상기 항체는 MEDI-545 인, 방법.
129. 제105 구체예에 있어서, 상기 제1 miRNA 프로파일은 치료제의 투여 전에 얻는, 방법.
130. 제105 구체예에 있어서, 상기 제1 miRNA 프로파일은 치료제의 투여 시에 얻는, 방법.
131. 제105 구체예에 있어서, 상기 제1 및 제2 샘플은 전체 혈액, 근육, 또는 혈청인, 방법.
132. 제105 구체예에 있어서, 환자로부터의 제3 샘플에서 제3 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
133. 제132 구체예에 있어서, 환자로부터의 제4 샘플에서 제4 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
134. 제133 구체예에 있어서, 환자로부터의 제5 샘플에서 제5 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
135. 제134 구체예에 있어서, 환자로부터의 제6 샘플에서 제6 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
136. 제105 구체예에 있어서, 상기 제2 샘플은 치료제의 투여 후 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
137. 제132 구체예에 있어서, 상기 제3 샘플은 제2 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
138. 제133 구체예에 있어서, 상기 제4 샘플은 제3 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
139. 제134 구체예에 있어서, 상기 제5 샘플은 제4 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
140. 제105 구체예에 있어서, 상기 편차는 건강한 레벨에 대한 환자의 차별적 miRNA 레벨에서의 감소인, 방법.
141. 제105 구체예에 있어서, 상기 편차는 건강한 레벨에 대한 환자의 차별적 miRNA 레벨의 증가인, 방법.
142. 제141 구체예에 있어서, 차별적 miRNA 레벨에서의 상기 증가는 나쁜 질환 예후를 나타내거나, 질환이 돌발하게 되는, 방법.
143. 제141 구체예에 있어서, 환자의 차별적 miRNA 레벨에서의 상기 증가는 환자의 치료에서의 변화를 나타내는, 방법.
144. 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 투여함을 포함하고;
환자는 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 포함하고;
상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 중화시키는, 근염 환자의 치료 방법.
145. 제144 구체예에 있어서, 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일의 중화를 검출하는 것을 추가로 포함하는, 방법.
146. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 MXl, LY6E, IFI27, OASl IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
147. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 LAMP3, SIGLECl, DNAPTP6, IFIT2, ETV7, RTP4, SERPINGl, HERC5, XAFl, MXl, EPSTIl, OAS2, OASl, OAS3, IFIT3, IFI6, USP18, RSAD2, IFI44, LY6E, ISG15, 및 IFI27의 상향조절된 발현 또는 활성을 포함하는, 방법.
148. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, 및 USP18의 상향조절된 발현 또는 활성을 포함하는, 방법.
149. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 DNAPTP6, EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISGl5, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, PLSCRl, RSAD2, RTP4, SIGLECl, 및 USP18의 상향조절된 발현 또는 활성을 포함하는, 방법.
150. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 SAMD9L, IFI6, IFI44, IFIT2, OASl, IFI27, OAS3, IFI44L, HERC5, IFITl, EPSTIl, ISGl5, SERPINGl, OASL, GBPl, 및 MXl의 상향조절된 발현 또는 활성을 포함하는, 방법.
151. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, IFITl, ISG15, LAMP3, OAS3, OASl, EPSTIl, IFIT3, OAS2, SIGLECl, 및 USP18의 상향조절된 발현 또는 활성을 포함하는, 방법.
152. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI6, RSAD2, IFI44, IFI44L, 및 IFI27의 상향조절된 발현 또는 활성을 포함하는, 방법.
153. 제144 구체예에 있어서, 상기 제제는 생물학적 제제인, 방법.
154. 제153 구체예에 있어서, 상기 제제는 항체인, 방법.
155. 제154 구체예에 있어서, 상기 항체는 MEDI-545 인, 방법.
156. 제154 구체예에 있어서, 상기 항체는 하나 이상의 타입 I IFN 또는 IFNα 서브타입에 대해 특이적이지만, MEDI-545 가 아닌, 방법.
157. 제144 구체예에 있어서, 상기 투여 제제는 하나 이상의 근염 증상을 경감시키는, 방법.
158. 제154 구체예에 있어서, 상기 항체는 대략 0.03 내지 30 mg/kg의 복용량으로 투여되는, 방법.
159. 제158 구체예에 있어서, 상기 항체는 0.3 내지 3 mg/kg의 복용량으로 투여되는, 방법.
160. 제159 구체예에 있어서, 상기 항체는 0.03 내지 1 mg/kg의 복용량으로 투여되는, 방법.
161. 제153항 내지 제155항 중 어느 하나의 구체예에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 10%까지 중화시키는, 방법.
162. 제144 구체예에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 20%까지 중화시키는, 방법.
163. 제162 구체예에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 30%까지 중화시키는, 방법.
164. 제163 구체예에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 40%까지 중화시키는, 방법.
165. 제164 구체예에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 50%까지 중화시키는, 방법.
166. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 적어도 IFNα 서브타입 1, 2, 8, 및 14의 상향조절된 발현 또는 활성을 포함하는, 방법.
167. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 PD 마커 유전자의 전사를 포함하는, 방법.
168. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 PD 마커 유전자로부터 발현된 폴리펩타이드를 포함하는, 방법.
169. 환자로부터의 제1 샘플에서 제1 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 포함하는, 환자의 근염 질환 진행의 모니터링 또는 예측 방법.
170. 제169 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 강한 프로파일이고, 환자 예후는 근염 질환 진행인, 방법.
171. 제170 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, 및 USPl8의 과발현 또는 활성을 포함하는, 방법.
172. 제169 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 약한 프로파일이고, 환자 예후는 근염 질환 퇴행인, 방법.
173. 제169 구체예에 있어서,
환자로부터의 제2 샘플에서 제2 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하며;
제1 발현 프로파일에 대한 상기 제2 발현 프로파일에서의 타입 I IFN 또는 IFNα 유도성 PD 마커의 개수 또는 레벨의 증가가 근염 질환 진행을 예측하거나;
제1 발현 프로파일에 대한 상기 제2 발현 프로파일에서의 타입 I IFN 또는 IFNα 유도성 PD 마커의 개수 또는 레벨의 감소가 근염 질환 퇴행을 예측하는, 방법.
174. 환자로부터의 제1 샘플에서 제1 IFNα 유도성 PD 마커 발현 프로파일을 얻고;
치료제를 투여하고;
환자로부터의 제2 샘플에서 제2 IFNα 유도성 PD 마커 발현 프로파일을 얻고;
제1 및 제2 IFNα 유도성 PD 마커 발현 프로파일을 비교하는 것을 포함하며,
상기 제1 및 제2 IFNα 유도성 PD 마커 발현 프로파일에서의 편차는 치료제의 효능의 레벨을 나타내는, 치료제에 의한 치료를 받는 환자의 근염 질환 진행을 모니터링하는 방법.
175. 제174 구체예에 있어서, 상기 제1 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, 및 USPl8의 과발현 또는 활성을 포함하는, 방법.
176. 제174 구체예에 있어서, 상기 편차는 유전자의 활성 레벨의 상향조절된 발현에서의 감소인, 방법.
177. 제174 구체예에 있어서, 상기 치료제는 소분자 또는 생물학적 제제인, 방법.
178. 제177 구체예에 있어서, 상기 치료제는 IFNα 에 결합하고 그 활성을 조정하는 생물학적 제제인, 방법.
179. 제178 구체예에 있어서, 상기 생물학적 제제는 항체인, 방법.
180. 제179 구체예에 있어서, 상기 항체는 MEDI-545 인, 방법.
181. 제179 구체예에 있어서, 상기 항체는 적어도 하나의 IFNα 서브타입에 결합하지만, MEDI-545 가 아닌, 방법.
182. 제174 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 치료제의 투여 전에 얻는, 방법.
183. 제174 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 치료제의 투여 시에 얻는, 방법.
184. 제174 구체예에 있어서, 상기 제1 및 제2 샘플은 전체 혈액, 근육, 또는 혈청인, 방법.
185. 제174 구체예에 있어서, 환자로부터의 제3 샘플에서 제3 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
186. 제185 구체예에 있어서, 환자로부터의 제4 샘플에서 제4 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
187. 제186 구체예에 있어서, 환자로부터의 제5 샘플에서 제5 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
188. 제187 구체예에 있어서, 환자로부터의 제6 샘플에서 제6 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
189. 제174 구체예에 있어서, 상기 제2 샘플은 치료제의 투여 후 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
190. 제185 구체예에 있어서, 상기 제3 샘플은 제2 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
191. 제186 구체예에 있어서, 상기 제4 샘플은 제3 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
192. 제187 구체예에 있어서, 상기 제5 샘플은 제4 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
193. 제174 구체예에 있어서, 상기 편차는 유전자의 상향조절된 발현 또는 활성에서의 감소인, 방법.
194. 제193 구체예에 있어서, 상기 감소는 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 100% 인, 방법.
195. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6의 상향조절된 발현 또는 활성을 포함하는, 방법.
196. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L, RSAD2, IFI27, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
197. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L 및 RSAD2의 상향조절된 발현 또는 활성을 포함하는, 방법.
198. 제169 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6의 상향조절된 발현 또는 활성을 포함하는, 방법.
199. 제169 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L, RSAD2, IFI27, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
200. 제169 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L 및 RSAD2의 상향조절된 발현 또는 활성을 포함하는, 방법.
201. 제174 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6의 상향조절된 발현 또는 활성을 포함하는, 방법.
202. 제174 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L, RSAD2, IFI27, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
203. 제174 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L 및 RSAD2의 상향조절된 발현 또는 활성을 포함하는, 방법.
204. 제1 구체예에 있어서, 상기 환자는 강한 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 갖는, 방법.
205. 제1 구체예에 있어서, 상기 환자는 중간정도의 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 갖는, 방법.
206. 제204 구체예에 있어서, 상기 강한 스코어는 10 이상인, 방법.
207. 제205 구체예에 있어서, 상기 중간정도의 스코어는 4 이상이지만 10 미만인, 방법.
208. 제35 구체예 또는 제74 구체예에 있어서, 상기 근염은 DM 또는 PM 인, 방법.
209. 제144 구체예에 있어서, 상기 근염 환자는 DM 또는 PM 환자인, 방법.
210. 제144 구체예에 있어서, 상기 근염 환자는 6 초과의 MITAX 스코어를 포함하는, 방법.
211. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어는 강한, 방법.
212. 제144 구체예에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어는 중간정도인, 방법.
213. 제211 구체예에 있어서, 상기 스코어는 10 이상인, 방법.
214. 제212 구체예에 있어서, 상기 스코어는 4 이상이지만 10 미만인, 방법.
215. 제174 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 강한 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 포함하는, 방법.
216. 제215 구체예에 있어서, 상기 강한 스코어는 10 이상의 스코어인, 방법.
217. 제174 구체예에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 중간정도의 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 포함하는, 방법.
218. 제217 구체예에 있어서, 상기 중간정도의 스코어는 4 이상이지만 10 미만의 스코어인, 방법.
본 명세서에 언급된 모든 공보, 특허 및 특허출원은, 각 개별 공보, 특허 또는 특허출원이 참고로 본 명세서에 포함되도록 구체적이고 개별적으로 나타내는 것과 동일한 정도로, 참고로 명세서에 통합된다.
본 출원은 다목적으로 참고로 하기를 통합한다: U.S. 가출원 일련 No. 60/873,008(2006년 12월 6일), U.S. 가출원 일련 No. 60/907,762 (2007년 4월 16일), U.S. 가출원 일련 No. 60/924,219(2007년 5월 3일), U.S. 가출원 일련 No. 60/924,584(2007년 5월 21일), 2007, U.S. 가출원 일련 No. 60/960,187(2007년 9월 19일), U.S. 가출원 일련 No. 60/996,176 (2007년 11월 5일) 및 PCT 출원 No. PCT/US2007/024947(2007년 12월 6일). 본 출원은 또한 다목적으로 참고로 하기를 통합한다: U.S. 가출원 일련 No. 61/129,366(2008년 6월 20일) 및 PCT 출원 No. PCT/US2008/062646 (2008년 5월 5일). 본 출원은 또한 다목적으로 참고로 하기를 통합한다: U.S. 가출원 일련 No. 60/924,220(2007년 5월 3일), 가출원 제목 "Auto-Antibody Markers of Autoimmune Disease" (2007년 11월 6일) (일련 번호 60/996,219), U.S. 가출원 entitled "Auto-Antibody Markers of Autoimmune Disease" (2007년 12월 6일) (일련 번호 60/996,820), 및 PCT 출원 No. PCT/US2008/062639 (2008년 5월 5일).
더욱이, 본 출원은 다목적으로 참고로 본 명세서에 통합된 U.S. 가출원 일련 No. 61/006,963 (2008년 2월 8일)에 대한 우선권을 주장한다. 하기의 실시예 세트는 단지 설명하기 위해 제공되고 본 발명은 조금도 이들 실시예로 제한되는 것으로 이해해서는 안 된다.
실시예
실시예
Ia
:
DM
환자 근육 샘플에서 최고의 상향조절된 유전자의 대부분은
IFN
α/β 유도성이다
DM 근육 샘플을 시험하여 어떤 유전자가 DM 환자에게서 최고로 상향조절되었는지를 결정하였다.
전체 RNA 추출 및 마이크로어레이 (microarray) 처리: 전체 RNA는 퀴아겐 알엔이지 피브로우스 티슈 미니 (Qiagen RNeasy Fibrous Tissue Mini, Hilden, Germany)를 사용하여 팍스젠 (PAXgene) 근육 생검으로부터 추출하였다. RNA 순도 및 농도는 분광광도법 (260/280 > 1.9)으로 결정되었다. RNA 품질은 RNA 6000 나노 랩칩 (Nano LabChip®)을 사용하여 애질런트 2100 바이오애날라이저 (Agilent 2100 Bioanalyzer) 상에서 평가하였다.
2 ㎍의 전체 RNA로부터 비오틴-라벨 증폭된 cRNA의 생성은 Affymetrix GenChip® (Affymetrix GeneChip®) One-Cycle cDNA 합성 키트 및 Affymetrix GenChip® (Affymetrix GeneChip®) IVT 라벨링 키트 (Labeling kit)에 의해서 수행되었다. cRNA 생성물의 농도 및 순도는 분광광도법으로 결정되었다. 20 마이크로그램의 각각의 비오틴-라벨 cRNA를 Affymetrix Human Genome U 133 플러스 2.0 GenChip® (GeneChip®) 어레이 상에서 하이브리드화를 위해서 단편화되었다. 단편화된 cRNA는 Affymetrix GenChip® (Affymetrix GeneChip®) 매뉴얼에 개략적으로 기술된 바와 같이 하이브리드화를 위해서 제조되었다. 하이브리드화는 45℃로 설정된 모델 320 회전 하이브리드화 오븐 내에서 밤새 수행되었다. 모든 GenChip® (GeneChip®) 세척 및 염색 절차는 Affymetrix 모델 450 플루이딕스 스테이션 (Fluidics station) 상에서 수행되었다. 어레이는 Affymetrix GenChip® Scanner (Affymetrix GeneChip® Scanner) 3000 상에서 스캐닝되었다. 데이타 수집 및 초기 어레이 품질 평가는 GenChip Operating Software (GeneChip Operating Software; GCOS) 도구를 사용하여 수행되었다.
결과: DM 환자의 근육 검체에서 최고로 상향조절된 유전자의 대부분은 IFNα/β 유도성이다. DM 환자 근육 검체에서 최고로 상향조절된 유전자의 리스트, 및 건강한 대조 근육 샘플에 대비한 DN 환자 근육 샘플에서의 이들 유전자의 폴드-상향조절을 제공하는 도 1a를 참고로 한다. 또한, DM 및 PM 환자의 근육에서 IFN-α/β 유도성 유전자 표지 스코어의 산포 플롯을 제공하는 도 1b를 참고로 한다.
실시예
Ib
: 대부분의
DM
또는
PM
환자 혈액 샘플에서 타입 I
IFN
유도성 유전자의 과발현
DM 및 PM 환자의 혈액 내에서 타입 I IFN 유도성 유전자의 과발현의 출현율 및 크기를 평가하였다.
환자 및 환자 샘플: 두 그룹의 환자가 본 시험에서 사용되었다. 제1 그룹은 말초 WB 샘플 내에서의 전체 유전자 발현과 질환 활성을 포함한 임상적 특징 사이의 연관성의 종단적 탐구시험에 전향적으로 포함된 단일 의료센터로부터의 24 명의 근염 환자 (15 명은 DM이고, 9 명은 PM)를 포함하였다. 총 150 환자-진료로부터의 임상 데이타 및 80 환자-진료로부터의 유전자 발현 데이타를 6 년까지의 기간 (본 시험에서 대한 참여의 평균 기간은 1.6 년이었다)에 걸쳐서 수집하였다. 이들 환자의 임상적 특징은 이하의 표 6에서 요약한다.
[표 6]
24 명의 DM 또는 PM 환자에 대한 임상적 특징
1 또는 2 회의 진료 후의 환자의 일부의 조기 단면 연구는 이미 보고되었으며 [Walsh RJ, Pinkus JL, et al. Type I interferon-inducible gene expression in blood is present and reflects disease activity in dermatomyositis and polymyositis. Arthritis Rheum. 2007; 56(11):3784-92]; 현재의 연구는 참여한 환자의 수를 증가시키고, 환자당 7 회까지의 진료의 종단적 분석을 수행하였다. DM 및 PM에 대한 진단적 기준도 이전에 보고되었다 [Walsh RJ, Pinkus JL, et al. Type I interferon-inducible gene expression in blood is present and reflects disease activity in dermatomyositis and polymyositis. Arthritis Rheum. 2007; 56(11):3784-92]. WB 샘플은 일상적인 임상적 추적 진료에서 수집되었다. 질환 활성은 전술한 바와 같은 MITAX (Myositis Intention to Treat scale) [Walsh RJ, Pinkus JL, et al. Type I interferon-inducible gene expression in blood is present and reflects disease activity in dermatomyositis and polymyositis. Arthritis Rheum. 2007; 56(11):3784-92]를 사용하여 각각의 진료시에 평가되었다. MITAX 스코어 [Rider LG, Miller FW. Idiopathic inflammatory muscle disease: clinical aspects. Baillieres Best Pract Res Clin Rheumatol. 2000; 14(l):37-54]를 포함한 임상적 파라메터는 유전자 발현 데이타에 대해서 모르는 채로 평가하였다. WB 샘플은 어떤 미리 결정된 스케줄에 따라서도 수집되지 않았다. 환자는 참여를 위해서 고지에 입각한 동의를 하였다. 이들 시험은 브리검 앤드 워먼스 병원 (Brigham and Women's Hospital)의 IRB (institutional review board)에 의해서 승인되었다.
근염 환자의 제2 그룹 (18)은 DM 또는 PM을 갖는 환자에게서 임상실험을 위해서 스크리닝 진료시에 수득한 단일 혈액 샘플에 대해서 시험하였다. 이들 혈액 샘플은 다수의 센터에서 다수의 연구자에 의해서 관찰된 환자에 걸친 사이토킨 유도성 유전자 표지의 출혈율의 초기 평가를 위해서 사용하였으며, IRB 승인된 프로토콜 하에서 고지에 입각한 동의에 의해서 수집되었다. 이들 대상체는 적어도 18 세였으며, 보한 (Bohan)과 피터 (Peter) 기준 [Bohan A, Peter JB. Polymyositis and dermatomyositis. N Engl J Med . 1975 Feb 13;292(7):344-7; Bohan A, Peter JB. Polymyositis and dermatomyositis. N Engl J Med. 1975 Feb 20;292(8):403-7]에 따른 추정적이거나 확정적인 DM 또는 PM 및 활성 질환을 가졌다. WB 샘플은 치료 전의 임상적 진료 시에 팍스젠 (PAXgene) RNA 튜브 내에 수집하였다. 모든 대상체는 다음 중의 적어도 2 가지를 가졌다: MMT-8 근육 그룹 시험을 사용한 도수근력시험 (MMT)에서의 강도 > 80/150 내지 < 125/150; 10-㎝ 스케일 상에서의 시각적 상사 스케일 (visual analogue scale)에 의한 환자 포괄적 활성 평가 > 2.0 ㎝; 10-㎝ 스케일 상에서의 시각적 상사 스케일에 의한 의사 포괄적 활성 평가 > 2.0 ㎝; CLINHQA 무능력 지수 (disability index) > 0.25; 및 10 ㎝ 시각적 상사 스케일 상에서의 포괄적 근육외 활성 평가 > 1.0. PM을 갖는 대상체는 PM의 진단과 일치하는 근육 생검 결과의 증거를 갖는 것이 필요하였다. 스크리닝시에, 대상체는 1일에 > 35 ㎎ 프레드니손 또는 등가물, 하이드록시클로로퀸 > 600 ㎎/일, 마이코페놀레이트 모페틸 > 3 g/일, 메토트렉세이트 > 25 ㎎/주일, 아자티오프린 > 3 ㎎/㎏/일, 레플루노마이드 > 20 ㎎/일, 또는 어떤 용량의 사이클로포스파마이드, 사이클로스포린 또는 탈리도마이드도 투여받을 수 없었다.
정상적인 혈액 샘플은 기술된 바와 같이 36 명의 건강한 공여체로부터 유래하였으며 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312; Walsh RJ, Pinkus JL, et al. Type I interferon-inducible gene expression in blood is present and reflects disease activity in dermatomyositis and polymyositis. Arthritis Rheum. 2007; 56(11):3784-92], IRB 승인된 프로토콜 하에서 고지에 입각한 동의에 의해 수집되었다.
전체 RNA 추출, 마이크로어레이 시험, 및 TaqMan QRT-PCR 시험: WB로부터 RNA 분리는 팍스젠 (PAXgene) 튜브 또는 연막 (buffy coat) 샘플을 사용하였으며, Affymetrix (Affymetrix) Ul 33 플러스 2.0 마이크로어레이 시험은 이전에 기술된 바와 같이 수행되었다 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312; Walsh RJ, Pinkus JL, et al. Type I interferon-inducible gene expression in blood is present and reflects disease activity in dermatomyositis and polymyositis. Arthritis Rheum. 2007; 56(l l):3784-92]. RNA는 24 개의 정상적인 건강한 공여체 샘플에 대해 팍스젠 튜브 수집방법을 사용하여 분리하였으며, 반면에 12 개의 정상적인 건강한 공여체 샘플은 연막 방법에 의해서 처리하였다. 이들 정상적인 건강한 공여체 샘플은 샘플 처리 차이에 기인한 어떤 가변성이라도 제거하기 위해서 두 가지 접근방법 중의 하나에 의해서 처리된 환자 샘플에 대한 기준선으로 사용되었다.
플루이다임 바이오마크 (Fluidigm's Biomark) 시스템 동적 어레이 플래트폼 (dynamic array platform) (Fluidigm Corp, South San Francisco, CA, USA)을 사용하여 DM 또는 PM이 있는 15 명의 환자에게서 타입 1 IFN 유도성 유전자, 사이토킨 유도성 유전자의 패널, 및 선택된 면역반응 유전자의 발현 레벨을 측정하였다. 샘플 처리 및 데이타 분석을 위한 일반적인 절차는 이전에 기술된 바와 같았다 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312].
마이크로어레이 데이타 분석: 마이크로어레이 데이타 분석은 바이오컨덕터 (Bioconductor) (http://www.bioconductor.org/) GCRMA 패키지에서 수행된 GCRMA (GC-Content Robust Multichip Analysis)를 사용하여, 이전에 기술된 바와 같이 수행되었다 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312; Yao Y, Jallal J, et al. Type I IFN as a potential therapeutic target for psoriasis. PLoS ONE 2008; 3(7): e2737. doi:10.1371/journal.pone.0002737]. 유전자 표지 스코어를 포함한 2-그룹 비교는 모두 2-샘플 윌콕슨-만-위트니 (Wilcoxon-Mann-Whitney) 시험을 사용하여 계산하였으며, 반면에 짝 비교 (paired comparisons)는 윌콕슨 부호-순위 검정 (Wilcoxon signed-rank test)을 사용하여 계산하였다. 보고된 모든 p 값은 다중 시험에 대해서 조정되지 않지만, 유의성은 본페로니 수정 (Bonferroni correction)을 사용하여 조정된 p 값에 대해서 명시된다. 양성 타입 1 IFN 유도성 유전자 표지 스코어의 확인을 위해서, 본 발명자들은 R (R Development Core Team, University of Auckland, New Zealand)에서의 오류 발견율 (false discovery rate: FDR) 조정에 의해 마이크로어레이의 유의성 분석 (SAM)을 계산하였다.
결과: Affymetrix Human Genome U133 플러스 2.0 GenChip® (GeneChip®)을 이용하여 DM 또는 PM이 있는 42 명의 환자 (22 DM 및 20 PM 환자; 제1 및 2 환자 그룹으로부터)의 말초 WB를 프로파일링하였다. 1,072 및 703 전사물은 건강한 대조군에 비해서 DM 또는 PM이 있는 환자의 혈액 내에서 각각 상향조절 및 하향조절되는 것으로 관찰되었다 (폴드 변화 >2, q<0.05). 1,072 개의 상향조절된 전사물 중에서, 136 개는 기술된 바와 같은 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008;Volume 2009, Article ID 374312, doi:10.4061/2009/374312] 타입 I IFN 패밀리 구성원에 의한 WB의 생체외 자극에 의해서 정의된 바와 같이 타입 1 IFN 유도성이었다. 24 명의 건강한 대조군과 비교하여, DM 또는 PM이 있는 42 명의 환자의 WB 내의 136 개의 전사물의 발현을 가시화하는 히트맵은 도 384a에 나타낸다. 개개 정상적 대조군 및 DM 또는 PM이 잇는 환자의 혈액에서 동적인 25 개의 최고로 과발현된 타입 1 IFN 유도성 유전자 (환자들 사이에서 잠재적으로 상이한 동적 리스트)를 사용하여 계산된 타입 1 IFN 유도성 유전자 표지 스코어는 도 384b에 나타내었다. 시험에서 평가된 환자는 혈액 내에서 타입 1 IFN 유도성 유전자의 과발현의 다양한 정도를 나타내었으며, 이것은 약한 타입 1 IFN 유도성 유전자 표지 (스코어 < 4)를 갖는, DM 또는 PM이 있는 환자의 뚜렷한 집단을 포함하였다. 정상적인 공여체 및 이들 약한 표지 스코어 환자는 도 384b에서 각각 제1 및 제2의 수평 막대로 표시된다. 분류 기준 (여기에서, 타입 1 IFN-유도서 유전자 표지는 4 미만의 스코어로 지정된다면 약한 것이고, 4 이상 내지 10 미만의 스코어로 지정된다면 중등도의 것이고, 10 이상의 스코어로 지정된다면 높은 것이었다)을 기초로 하여, DM 또는 PM이 있는 환자의 17%는 혈액 내에서 타입 1 IFN 유도성 유전자 표지의 과발현이 약하거나 없었다. 환자의 총 45% 및 38%는 각각 중등도이거나 높은 타입 1 IFN 유도성 유전자 표지를 가졌다. 따라서, DM 또는 PM이 있는 환자의 압도적 다수는 혈액 내에서 타입 1 IFN 유도성 유전자 표지의 중등도 내지 높은 과발현을 나타내었다.
실시예
Ic
:
DM
또는
PM
을 갖는 환자에게서 타입 1
IFN
시그날링
경로 활성을 평가하기 위한 13-유전자 패널의 선택
실시예 Ib의 결과를 기초로 하여, DM 및 PM 환자의 혈액에서 타입 1 IFN 시그날링 경로의 활성화를 평가하기 위해서 사용될 수 있는 타입 1 IFN 유도성 유전자의 작은 패널을 선택하였다.
DM 및 PM이 있는 환자의 말초 WB에서 최고로 과발현된 유전자의 순위 결정: 실시예 Ib에 기술된 시험에서 사용된 42 명의 DM 및 PM 환자에 걸쳐서 최고로 과발현된 탐침 세트를 확인하기 위해서, 폴드-변화 값은 Affymetrix Ul 33 플러스 2.0 어레이 상에서 각각의 탐침 세트에 대해 개별적인 각각의 환자와 24 명의 건강한 공여체의 중앙값 사이에서 계산하였다. 각각의 환자의 경우에, 폴드-변화 값은 그 후에 내림 차순으로 순위를 결정하였다. 중앙 순위는 각각의 탐침 세트에 대해서 계산하였으며, 상위 200 개의 종합적인 탐침 세트가 선택되었다. 이전에 타입 1 IFN 유도성인 것으로 확인된 807 개의 탐침 세트 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008;Volume 2009, Article ID 374312, doi: 10.4061/2009/374312]를 이들 200 개의 탐침 세트와 교차시켰으며, 공통적인 이들 탐침 세트를 합하여 DM 또는 PM이 있는 환자의 말초 WB에서 과발현된 타입 1 IFN 유도성 유전자를 확인하였다.
결과: 다수의 유전자의 상대적 발현의 복합 스코어는 이전에 기술된 바와 같이 [Yao, Y, Jallal J, et al. Development of Potential Pharmaco-dynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi:10.4061/2009/374312, Yao, Y, Jallal J, et al. Neutralization of IFN-α/β Inducible Genes and Downstream Effect in a Phase I Trial of an Anti-IFN-α Monoclonal Antibody in SLE. Accepted by Arthritis Rheum.], 경로 활성의 확실한 측정을 제공할 수 있다. DM 또는 PM이 있는 42 명의 환자의 말초 WB에서 100 개의 최고로 과발현된 유전자에 대한 평균 폴드 순위는 이하에 나타낸 표 7에 열거하였다.
[표 7]
DM 또는 PM이 있는 42 명의 환자의 WB에서 100 개의 최고로 과발현된 탐침의 평균 폴드 순위.
복합 유전자 표지 스코어를 계산하기 위해서 사용된 13 개의 타입 1 IFN 유도성 유전자는 적색으로 표시하였다 (RSAD2, IFI27, IFI44L, IFI44, IFITl, OASl, OAS3, HERC5, MXl, EPSTIl, IFIT3, IFI6, 및 ISG15).
DM 및 PM 환자의 혈액 내의 타입 1 IFN 시그날링 경로 활성화를 반영하는 타입 1 IFN 유도성 유전자 표지 스코어를 구성하기 위해서 13 개의 과발현된 타입 1 IFN 유도성 유전자를 이 그룹으로부터 선택하였다. 13 개의 선택된 유전자는 다음과 같았다: DM 및 PM 환자의 혈액 내의 6 개의 최고로 과발현된 타입 1 IFN 유도성 유전자 (IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl)와 DM 근육 검체 내에서 최고로 과발현된 타입 1 IFN 유도성 유전자 중의 하나인 ISGl5 [Greenberg SA, Tawil R, et al. Interferon-alpha/beta-mediated innate immune mechanisms in dermatomyositis. Ann Neural 2005; 57(5):664-78], 및 또한 6 개의 잘 특정화된 타입 1 IFN 유도성 유전자 (OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6). 이러한 13-유전자 패널 (SLE에 대한 21-유전자 패널의 서브세트)에 의한 유전자 표지 스코어는 SLE에서 타입 1 IFN 시그날링 경로 활성화를 특정화하기 위해서 사용된 타입 1 IFN 유도성 유전자에 대한 21-유전자 패널과 매우 확실한 (r=0.98) 상호관련이 있었으며 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312], 또한 개개 환자에게서 동적인 상위 25 개의 최고로 과발현된 타입 1 IFN 유도성 유전자 (r=0.82)를 사용한 대체 유전자 표지 스코어 접근방법과도 상호관련이 있었다 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312, Yao, Y, Jallal J, et al. Neutralization of IFN-α/β-Inducible Genes and Downstream Effect in a Phase I Trial of an Anti-IFN-α Monoclonal Antibody in SLE. Accepted by Arthritis Rheum.].
DM 또는 PM이 있는 환자의 혈액에서 최고로 과발현된 타입 1 IFN 유도성 유전자 이외에도, IFI27, RSAD2, IFI44LL 및 IFI44의 mRNAs의 더 강력한 과발현이 높은 질환 활성을 갖는 DM 및 PM 환자에게서 일반적으로 관찰되었다. 높은 질환 활성을 갖는 12 명의 환자 (MITAX > 6; 참조 상기 표 6)의 경우에, 시험 중의 그들의 피크 MITAX 스코어에서 36 명의 정상적인 대조군의 평균과 비교한 IFI27, RSAD2, IFI44LL 및 IFI44의 mRNAs의 평균 폴드 변화는 각각 89-, 53-, 90- 및 19-배였다. QRT-PCR을 또한 사용하여 이들 4 가지 유전자에 대한 마이크로어레이 결과를 증명하였다. 15 명의 환자 (9 DM, 6 PM)로부터의 WB 샘플을 목적에 따라 선택하였다. 이들 4 개의 개개의 유전자에 대한 QRT-PCR 측정은 마이크로어레이 측정과 높은 상관관계가 있었다 (IFI27 r=0.96; IFI44 r=0.95; IFI44L r=0.98; 및 RSAD2 r=0.98).
실시예
Id
: 근염 질환 활성과 13 개의 유전자
IFN
α/β 유도성 유전자 표지 스코어의 상관관계
24 명의 DM 및 PM 환자에 대해서 수행된 종단적 시험은 13 유전자 타입 I IFN 유도성 표지와 질환 활성 (MITAX)의 연관성을 확인하였다.
종단적 분석을 위한 선형 혼합 모델: 반복된 측정치 분석은 단지 적어도 3 회의 추적 진료를 한 환자들에 대해서 수행되었다 (총 N=53, 12 명의 환자에 대한 추적 진료). MITAX 스코어 (이전에 정의된 바와 같은 낮은 질환 활성 및 높은 질환 활성)가 모두 랜덤 효과에 따라서 모델화된 다음에 대해서 퇴행한 10 개의 상이한 퇴행모델이 적합하였다: 13-유전자 복합 스코어, RSAD2, IFI27, IFI44, 및 IFI44L. 초기 진료 시의 치료 상황은 이진 공변량 (즉, 어떤 것이든 치료/치료 없음)으로 사용되었으며, 유전자 발현 변화에 대한 약물 치료의 영향에 대해 제어하기 위해서 각각의 모델에서 고정화된 효과로 모델화되었다.
결과: 평가된 24 명의 DM 및 PM 환자 중에서, 3 명의 환자 (구체적으로, BGE128, BGE140 및 BGE3)는 항상 < 1인 낮은 IFN 유도성 유전자 표지 스코어를 가졌으며, 그들의 과정 전체에 걸쳐서 정상 대조군의 스코어와 결코 상이하지 않았다. 이것은 MITAX 스코어에 의해서 측정된 것으로서 이들의 질환 활성이 상당히 변화된 경우에도 해당하였다.
종단적 시험에서 나머지 21 명의 환자는 낮고 (MITAX 스코어 < 6; 9 명의 환자) 높은 (MITAX 스코어 > 6; 12 명의 환자) 질환 활성에 의해서 2-그룹 비교로 계층화되었다. 이들 카테고리는 둘 다 타입 1 IFN 유도성 유전자 발현과 연관성을 나타내었다 (13-유전자 스코어 p=0.002, IFI27 p=0.002, 및 RSAD2 p=0.003 - 조정 후에 모두 유의적임; 참조: 표 8 및 도 385a). 36 명의 정상적인 건강한 공여체와 높은 질환 활성을 갖는 환자 사이의 비교시에, 13-유전자 복합 스코어 및 4 개의 개별적인 유전자 둘 다를 사용한 차이는 매우 유의적인 것으로 발견되었다 (표 8; 도 385a). 이들 결과는 타입 1 IFN 유도성 13-유전자 표지 스코어 및 4 개의 개별적인 타입 1 IFN 유도성 유전자의 발현이 둘 다 DM 및 PM 환자의 질환 활성과 강력한 상관관계가 있음을 시사하였다.
[표 8]
4 개의 타입 1 IFN 유도성 유전자, 13-유전자 복합 스코어, 및 5 개의 사이토킨 유도성 유전자 표지 스코어에 대한 진료 1에서의 DM 및 PM 환자에 대한 p 값.
이들 바이오마커는 또한, 종단적 추적 중에 개개 환자 내에서 임상적 질병 활성과 높은 상관관계를 나타내었다. 이들의 진료 중에 질병 활성에서 어떤 변동을 갖는 환자 (N=18)는 MITAX 스코어 변화와 13-유전자 복합 스코어 (p=0.0002) 및 개별적인 유전자 발현 레벨 (IFI27 p=0.0002, RSAD2 p=0.0002, 및 IFI44L p=0.0002 - 모두 조정 후에 유의적임; 도 385b) 둘 다에서의 변화 사이에 강력한 상관관계를 나타내었다. IFI44는 조정 후에 유의적이지 않았다. 또한, 13-유전자 스코어 및 RSAD2 and IFI44L의 mRNAs의 발현은 둘 다 낮은 MITAX 스코어 내지 높은 MITAX 스코어의 18 명의 환자 모두에게서 상승하였다. IFI44 mPvNA의 발현은 낮은 MITAX 스코어 내지 높은 MITAX 스코어의 2 명의 환자에게서 감소하였다. 이들 결과는 복합 스코어가 개별적인 유전자보다 질병 활성과 더 확고하게 상관관계가 있음을 시사한다. 질병 활성에서 변동이 없는 환자 (N=3)는 이들 유전자의 발현 레벨에서 실질적인 변화를 나타내지 않았다 (도 385c).
더구나, 주된 임상적 질병 활성 변화는 13-유전자 복합 표지 스코어에서의 주된 변화와 연관되었다. 80 환자-진료 중에 50 쌍의 연속 진료가 있었다. 이들 50 중에는 질병 활성에 있어서 14 개의 주된 변화가 있었다 (>3의 MITAX 스코어의 변화; 10 개의 개선, 4 개의 악화 현상). 14 개의 변화 모두는 일치된 방향으로 13-유전자 복합 스코어 및 4 개의 개별적인 타입 1 IFN 유도성 유전자의 발현 둘 다에서의 주된 변화와 연관되었다 (13-유전자 복합 스코어, IFI44L 및 IFI27은 최상의 상관관계를 제공한다; 표 9).
[표 9]
질병 활성의 주된 변화는 DM 또는 PM이 있는 환자의 혈액에서 타입 1 IFN 유도성 유전자의 발현에 있어서의 주된 변화와 연관된다.
유전자 발현 변화는 4 개의 전사물 (RSAD2, IFI44L, IFI44, 및 IFI27) 각각 및 13-유전자 복합 스코어에 대한 선행 진료로부터 현재의 진료까지의 폴드 비의 변화율 %로 나타낸다. 개선 (MITAX 스코어의 감소)은 이들 타입 1 IFN 유도성 전사 레벨에서의 뚜렷한 감소와 연관되었으며, 재발은 뚜렷한 증가와 연관되었다 (56 개의 측정치 중에서 1 개의 이상치가 존재한다). 1 회의 진료 (*로 표시됨; 15v4)은 임박한 재발을 나타내는 "전조" 진료에 선행되었으며; 15v3로부터 15v4까지의 MITAX 변화는 31일 간격을 나타내지만, 타입 1 IFN 유도성 유전자 발현은 15v3에서 이미 상승하였다 (15v2로부터 15v3까지에서 나타난 변화).
7 명의 환자는 적어도 4 회의 진료에서 수집된 WB 샘플을 가졌다. 모든 환자는 질병 활성에서의 변화와 13-유전자 복합 스코어 사이의 강력한 상관관계를 나타내었다 (도 386a). 이들 환자 중의 6 명의 경우에, 이것은 질병 활성 척도로서 MITAX 스코어를 사용하여 명백하였으며; 한 명의 무반응성 환자 (BGE92)의 경우에 MITAX 스코어 (이것은 최대 13에 도달하며, 질병 활성에서의 추가의 증가에 따라서 증가할 수 없다)의 제한은 그의 사용을 제한하였지만, 혈청 CK (3,369에서 32,877 IU/L로 상승)는 질병 활성의 변화를 반영하였으며, 13-유전자 복합 스코어의 변화와 강력한 상관관계가 있었다 (도 386b).
모든 환자들에 걸친 임상적 질병 활성과 타입 1 IFN 유도성 유전자 발현 변화 사이의 연관성의 포괄적 요약은 선형 혼합 모델을 사용하여 수행되었다. 선형 혼합 모델 분석의 이점은 환자들에 걸친 정보를 풀링 (pooling)함으로써 추정값을 개선하는 능력이다. 13-유전자 복합 스코어는 임상적 질병 활성과 가장 유의적으로 상관관계가 있는 것으로 밝혀졌으며 (p=0.0007), 여기에서 IFI44L (p=0.001) 및 RSAD2 (p=0.002)는 치료 상황에 대한 제어 후에 적어도 3 회의 추적 측정을 한 12 명의 환자에 대해서 다음으로 우수한-상관관계가 있다 (조정 후에도 여전히 유의적임).
더구나, 3 명의 환자는 "전조" 진료, 또는 MITAX 스코어 질병 활성은 낮지만 13-유전자 복합 스코어는 선행 진료에 비해서 상당히 증가되어 있는 진료를 한 것으로 나타났다 (도 387). 이들 "전조" 진료 (7-35일) 직후에, 3 명의 환자는 각각 질병이 재발하였다.
실시예
2a:
IFN
α/β 유도성 유전자 표지 스코어는 근염 질병 활성을 예측한다
실시예 1b-d 환자와는 별도의 시험으로부터의 DM 및 PM 환자를 마찬가지로 모니터링하여 질병 진행 및/또는 퇴행이 IFNα/β 유도성 유전자 표지의 변화에 의해서 예측될 수 있는지 여부를 결정하였다.
전체 RNA 추출 및 마이크로어레이 처리: 전체 RNA는 팍스젠 혈액 (PAXgene Blood) RNA 키트를 사용하여 팍스젠 혈액으로부터 추출하였다. RNA 순도 및 농도는 분광광도법으로 결정하였다 (260/280 > 1.9). RNA 품질은 RNA 6000 나노 랩칩을 사용하여 애질런트 2100 바이오애날라이저 상에서 평가하였다.
2 ㎍의 전체 RNA로부터 비오틴-라벨 증폭된 cRNA의 생성은 Affymetrix GenChip® One-Cycle cDNA 합성 키트 및 Affymetrix GenChip® IVT 라벨링 키트에 의해서 수행되었다. cRNA 생성물의 농도 및 순도는 분광광도법으로 결정되었다. 20 마이크로그램의 각각의 비오틴-라벨 cRNA를 Affymetrix Human Genome U 133 플러스 2.0 GenChip® 어레이 상에서 하이브리드화를 위해서 단편화되었다. 단편화된 cRNA는 Affymetrix GenChip® 매뉴얼에 개략적으로 기술된 바와 같이 하이브리드화를 위해서 제조되었다. 하이브리드화는 45℃로 설정된 모델 320 회전 하이브리드화 오븐 내에서 밤새 수행되었다. 모든 GenChip® 세척 및 염색 절차는 Affymetrix 모델 450 플루이딕스 스테이션 상에서 수행되었다. 어레이는 Affymetrix GenChip® Scanner 3000 상에서 스캐닝되었다. 데이타 수집 및 초기 어레이 품질 평가는 GenChip Operating Software (GCOS) 도구를 사용하여 수행되었다.
혈청 CK 레벨: 혈청 CK 레벨은 스티븐 그린버그 (Steven Greenberg, Brigham and Women's Hospital, Inc.)로부터 수득하였다.
21 개의 유전자의 정적 리스트를 사용한 IFN 유전자 표지의 계산: 21 개의 유전자는 근염 환자에게서의 그들의 과발현의 출현율 및 크기를 정상적인 대조군의 경우와 비교함으로써 확인되었다. 이것은 각각의 근염 환자에 대한 동일한 21 개의 유전자 (즉, 21 개의 독특한 유전자에 대해서 위치하는 21 개의 탐침)의 표준 리스트를 포함한다. 이들 유전자에는 DNA 폴리머라제-전이활성화된 (transactivated) 단백질 6 - DNAPTP6; 상피 기질 상호작용 1 (유방) - EPSTIl; hect 영역 및 RLD 5 - HERC5; 인터페론, 알파 유도성 단백질 27 - IFI27; 인터페론-유도된 단백질 44 - IFI44; 인터페론-유도된 단백질 44 유사 - IFI44L; 인터페론, 알파 유도성 단백질 6 - IFI6; 테트라트리코펩타이드 반복체를 갖는 인터페론-유도된 단백질 1 - IFITl; 테트라트리코펩타이드 반복체를 갖는 인터페론-유도된 단백질 3 - IFIT3; ISG 15 유비퀴틴 유사 변성제 (modifier); 라이소좀-연관된 막 단백질 3 - LAMP3; 림프구 항원 6 컴플렉스, 유전자좌 (locus) E - LY6E; 믹소바이러스 (인플루엔자 바이러스) 저항성 1, 인터페론 유도성 단백질 p78 - MXl; 2',5'-올리고아데닐레이트 신테타제 1, 40/46 kDa - OASl; 2',5'-올리고아데닐레이트 신테타제 2, 69/71 kDa - OAS2; 2',5'-올리고아데닐레이트 신테타제 3, 10O kDa - OAS3; 인지질 스크램블라제 (scramblase) 1 - PLSCRl; 래디칼 S-아데노실 메티오닌 영역 함유 2 - RSAD2; 수용체 (화학적감각성) 트랜스포터 (transporter)단백질 4 - RTP4; 시알산 결합 Ig 유사 렉틴 1, 시알로어드헤신 - SIGLECl; 유비퀴틴 특이적 펩티다제 18 - USP18이 포함된다. 폴드 변화는 제0일 (투약전)의 근염 환자와 24 명의 정상적인 건강한 대조군의 평균 사이에서 계산된다. 그 후, 이들 21 개의 폴드 변화값의 중앙값을 각각의 근염 환자에 대해서 컴퓨터로 계산하고, 이값을 IFN-α/β 유도성 유전자 표지 스코어로서 사용한다.
TNFα, ILlβ, IL4, ILlO, 및 ILl 3 유전자 표지: TNFα, ILl β, IL4, ILlO, 및 IL 13 유전자 표지는 IFN-α/β 유도성 유전자 표지에 대한 방식과 마찬가지로 계산하였다. 그러나, 확인된 사이토킨 유도성 유전자의 초기 수는 각각의 사이토킨에 대해서 상이하기 때문에, 유전자의 절대 수보다는 백분율이 사용되었다. 예를 들어, 표준으로 IFN-α/β 유도성 유전자 표지를 사용하여 각각의 환자에 대해서 807 유전자 중의 상위 25 개를 선택하였다 (동적 유전자 리스트). 이것은 결정된 IFN-α/β 유도성 유전자의 약 3.5%를 나타낸다. 유전자의 이 백분율은 다른 사이토킨 각각에 대해서 유지되어 각각의 환자에 대한 유전자 표지를 계산하였다. IL 1β 표지가 유도된 IL lβ 유전자에는 다음이 포함된다: 아연 핑거 CCCH-타입 함유 12A - ZC3H12A; 우레이도프로피오나제, 베타 - UPBl; SAM 영역, SH3 영역 및 핵 국재화 시그날, 1 - SAMSNl; B-세포 억제제 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자, 제타 - NFKBIZ; 펜트락신-관련된 유전자, IL-I 베타에 의해서 빠르게 유도됨 - PTX3; 펩티다제 억제제 3, 피부-유도됨 (SKALP) - PB; IBR 영역 함유 2 - IBRDC2; ATG7 오토파지 (autophagy) 관련된 7 동족체 (S. cerevisiae) - ATG7; 아데노신 A2a 수용체 - ADORA2A; B-세포 억제제 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자, 제타 - NFKBIZ; Bcl2 변성 인자 - BMF; 펩티다제 억제제 3, 피부-유도됨 - (SKALP); 다형성 선종 유전자 유사 2 - PLAGL2; 미토겐-활성화된 단백질 키나제 키나제 키나제 8 - MAP3K8; 가설적 단백질 LOC285286 - LOC285286; IBR 영역 함유 2 - IBRDC2; 케모킨 (C-C 모티프) 리간드 4 - CCL4; EH-영역 함유 1 EHDl; B-세포 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자 2 (p49/pl00) - NFKB2; 용질 캐리어 패밀리 39 (아연 트랜스포터), 구성원 8 - SLC39A8; 레티쿨론 2 - RTN2; 니브린 - NBN; 오로소뮤코이드 1 /// 오로소뮤코이드 2 - ORMl /// 0RM2; 용질 캐리어 패밀리 11 (양자-커플링된 2가 금속 이온 트랜스포터), 구성원 2 - SLCl 1A2; RNA 결합 모티프, 단일 스트랜드 상호작용 단백질 1 - RBMSl; 트롬보스폰딘 1 - THBSl; B-세포 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자 2 (p49/pl00) - NFKB2; 가설적 단백질 LOC253842 - LOC253842; 인터류킨-1 수용체-연관된 키나제 3 - IRAK3; 즉각 조기 반응 5 - IER5; EH-영역 함유 1 - EHDl; CDNA 클론 IMAGE:30408657; B-세포 억제제 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자, 알파 - NFKBIA; EH-영역 함유 1 - EHDl; 저산소증 유도성 단백질 2 - HIG2; 프로스타글란딘 E 신타제 - PTGES; 다형성 선종 유전자 유사 2 - PLAGL2; IBR 영역 함유 2 - IBRDC2; CDNA FLJ13601 fis, 클론 PLACE1010069; 트롬보스폰딘 1 - THBSl; 안티자임 (antizyme) 억제제 1 - AZINl; ATPase, H+ 수송, 라이소좀성 42 kDa, Vl 서브유니트 Cl - ATP6V1C1; 스태닌 - SNN; 즉각 조기 반응 3 - IER3; ATG7 오토파지 관련된 7 동족체 (S. cerevisiae) - ATG7; v-rel 세망내피증 바이러스 종양유전자 동족체 B, B-세포 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자 3 (조류) - RELB; G 단백질-커플링된 수용체 157 - GPRl 57; 회돌기교세포 전사인자 1 /// 회돌기교세포 전사인자 1과 유사 /// 회돌기교세포 전사인자 1과 유사 - OLIGl;/// LOC728598 ///; LOC732056 - 6355; 트롬보스폰딘 1 - THBSl.
TNFα 표지가 유도된 TNFα 유전자에는 다음이 포함된다: C-타입 렉틴 영역 패밀리 4, 구성원 D - CLEC4D; DENN/MADD 영역 함유 4A - DENND4A; 포스포이노시타이드-3-키나제 어댑터 (adaptor) 단백질 1 - PIK3AP1; 헬리카제 C 영역 1에 의해서 유도된 인터페론 - IFIHl; SAM 영역, SH3 영역 및 핵 국재화 시그날 1 - SAMSNl; 구아닌 뉴클레오타이드 결합 단백질 (G 단백질), 감마 2 - GNG2; 가설적 단백질 LOC149478 - LOC149478; CDNA FLJ32866 fis, 클론 TESTI2003718; 가설적 단백질 LOC389072 - LOC389072; LIM 영역 키나제 2 - LIMK2; RNA 결합 모티프, 단일 스트랜드 상호작용 단백질 1 - RBMSl; 가설적 단백질 LOC731424 - LOC731424; 세포골격-연관된 단백질 4 - CKAP4; 산성 (로이신-풍부) 핵 인단백질 32 패밀리, 구성원 A - ANP32A; 용질 캐리어 패밀리 7 (양이온성 아미노산 트랜스포터, y+ 시스템), 구성원 5 - SLC7A5; 인플루엔자 바이러스 NSlA 결합 단백질 - IVNSlABP; B-세포 억제제 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자, 알파 - NFKBIA; 클로라이드 세포내 채널 4 - CLIC4; 팍신 (fascin) 동족체 1, 액틴-번들링 (bundling) 단백질 (Strongylo-centrotus purpuratus) - FSCNl; 인터페론 감마 수용체 2 (인터페론 감마 트랜스듀서 (transducer) 1) - IFNGR2; 미리스토일화 알라닌-풍부 단백질 키나제 C 기질 - MARCKS; 조기 성장 반응 1 - EGRl; 안티자임 억제제 1 - AZINl; LIM 영역 키나제 2 - LIMK2; 구아닐레이트 결합 단백질 1, 인터페론 유도성, 67 kDa /// 구아닐레이트 결합 단백질 1, 인터페론 유도성, 67 kDa - GBPl; 종양괴사인자, 알파-유도된 단백질 2 - TNFAIP2; 세포내 어드헤신 분자 1 (CD54), 인간 리노바이러스 수용체 - ICAMl; 종양괴사인자, 알파-유도된 단백질 3 - TNFAIP3; 시그날-조절성 단백질 알파 - SIRPA; 니브린 - NBN; EPM2A (라포린) 상호작용 단백질 1 - EPM2AIP1; 다형성 선종 유전자 유사 2 - PLAGL2; NADH 데하이드로게나제 (유비퀴논) 플라빈단백질 2, 24 kDa - NDUFV2; 닌주린 (ninjurin) 1 - NINJl; 용질 캐리어 패밀리 11 (양자-커플링된 2가 금속 이온 트랜스포터), 구성원 2 - SLCl 1A2; 프리세닐린 1 (알츠하이머병 3) - PSENl; 플렉스트린 - PLEK; 속상수축 및 연장 단백질 제타 1 (자이긴 I) - FEZl; 펩티다제 억제제 3, 피부-유도됨 (SKALP); B-세포 억제제 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자, 입실론 - NFKBIE; 퓨린성 수용체 P2X, 리간드-관문 (ligand-gated) 이온 채널, 4 - P2RX4; 케모킨 (C-C 모티프) 리간드 4 - CCL4; GTP 사이클로하이드롤라제 1 (도파-반응성 근육긴장이상) - GCHl; CD83 분자 - CD83; 인간 면역결핍 바이러스 타입 I 인핸서 결합 단백질 1 - HIVEPl; Nedd4 결합 단백질 1 - N4BP1; 핵 인자 (적혈구-유도된 2) 유사 3 - NFE2L3; 전사인자 유사 5 (기본적인 나선-루프-나선) - TCFL5; 프로스타글란딘 E 수용체 4 (서브타입 EP4) - PTGER4; 폴로 유사 키나제 3 (Drosophila) - PLK3; 아데노신 A2a 수용체 - AD0RA2A; 미토겐-활성화된 단백질 키나제 키나제 키나제 8 - MAP3K8; 오로소뮤코이드 1 - ORMl; 오로소뮤코이드 1 /// 오로소뮤코이드 2 - ORMl /// 0RM2; 케모킨 (C-C 모티프) 리간드 3 /// 케모킨 (C-C 모티프) 리간드 3 유사 1 /// 케모킨; CCL3 /// CCL3L1 /// CCL3L3 /// LOC728830 /// LOC730422; CD40 분자, TNF 수용체 슈퍼패밀리 구성원 5 - CD40; v-rel 세망내피증 바이러스 종양유전자 동족체 B, B-세포 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자 3 (조류) - RELB; 부티로필린, 서브패밀리 2, 구성원 A2 - BTN2A2; 금속-조절성 전사인자 1 - MTFl; 액티빈 A 수용체, 타입 HA -ACVR2A; 플라즈미노겐 활성화제, 유로키나제 - PLAU; TNF 수용체-연관된 인자 1 - TRAFl; 종양괴사인자, 알파-유도된 단백질 6 - TNFAIP6; 인플루엔자 바이러스 NSlA 결합 단백질 - IVNSlABP; 혈소판-활성화 인자 수용체 - PTAFR; 면역글로불린 슈퍼패밀리, 구성원 6 - IGSF6; 가설적 단백질 FLJ23556 - FLJ23556; 전사인자 EC - TFEC; 칼륨 내부-정류 채널, 서브패밀리 J, 구성원 2 - KCNJ2; 퓨린성 수용체 P2X, 리간드-관문 이온 채널, 7 P2RX7 - 6811; egf 유사 모듈 함유, 뮤신 유사, 호르몬 수용체 유사 1 - EMRl; 종양괴사인자 (TNF 슈퍼패밀리, 구성원 2) - TNF; TNFAIP3 상호작용 단백질 1 - TNIPl; LIM 및 노쇠세포 항원 유사 영역 1 - LIMSl; 아실-CoA 신테타제 장쇄 패밀리 구성원 1 - ACSLl; B-세포 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵인자 2 (p49/pl00) - NFKB2; 프리세닐린 1 (알츠하이머병 3) - PSENl; CASP8 및 FADD 유사 세포소멸 조절자 - CFLAR; EH-영역 함유 1 - EHDl; B-세포 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자 1 (pi 05) - NFKBl; 용질 캐리어 패밀리 39 (아연 트랜스포터), 구성원 8 - SLC39A8; CASP8 및 FADD 유사 세포소멸 조절자 /// CASP8 및 FADD 유사 세포소멸 조절자 - CFLAR; 수용체-상호작용 세린-트레오닌 키나제 2 - RIPK2; B-세포 내의 카파 경쇄 폴리펩타이드 유전자 인핸서의 핵 인자 2 (p49/pl00) - NFKB2; 세르핀 펩티다제 억제제, 클레이드 (clade) B (오브알부민), 구성원 9 - SERPINB9; 보체 성분 3a 수용체 1 - C3AR1; CASP8 및 FADD 유사 세포소멸 조절자 - CFLAR; 빌린 유사 - VILL; G 단백질-커플링된 수용체 35 - GPR35; 프로스타글란딘 E 신타제 - PTGES; 바큘로바이러스 IAP 반복체-함유 3 - BIRC3; CASP8 및 FADD 유사 세포소멸 조절자 - CFLAR; LIM 영역 키나제 2 - LIMK2; 백혈구-연관된 면역글로불린 유사 수용체 1 - LAIRl; 팍신 동족체 1, 액틴-번들링 단백질 (Strongylo-centrotus purpuratus) - FSCNl; 키뉴레닌 3-모노옥시게나제 (키뉴레닌 3-하이드록실라제) - KMO; 포스포디에스테라제 4B, cAMP 특이적 (포스포디에스테라제 E4 dunce 동족체, Drosophila) - PDE4B; IgA의 Fc 단편, 수용체 - FCAR; CASP8 및 FADD 유사 세포소멸 조절자 - CFLAR; 케모킨 (C-C 모티프) 수용체 유사 2 /// 케모킨 (C-C 모티프) 수용체 유사 2와 유사함 - CCRL2 /// LOC727811; 혈소판-활성화 인자 수용체 /// 혈소판-활성화 인자 수용체 - PTAFR; 플라즈미노겐 활성화제, 유로키나제 /// 플라즈미노겐 활성화제, 유로키나제 - PLAU; CASP8 및 FADD 유사 세포소멸 조절자 - CFLAR; 안티자임 억제제 1 - AZINl; RAB6 상호작용 단백질 1 - RAB6IP1; 인터류킨 1 수용체 길항제 - ILlRN; 전사인자 7 유사 2 (T-세포 특이적, HMG-박스) - TCF7L2; SEC24 관련된 유전자 패밀리, 구성원 A (S. cerevisiae) - SEC24A; 미리스토일화 알라닌-풍부 단백질 키나제 C 기질 - MARCKS; IBR 영역 함유 3 - IBRDC3; 막-연관된 환 핑거 (C3HC4); GO/Gl스위치 (switch) 2 - G0S2; CDNA FLJ13601 fis, 클론 PLACE1010069; CDC42 효과기 단백질 (Rho GTPase 결합) 2 - CDC42EP2; CASP8 및 FADD 유사 세포소멸 조절자 - CFLAR; 세포내 어드헤신 분자 1 (CD54), 인간 리노바이러스 수용체 - ICAMl; Dmx 유사 2 - DMXL2; 글리세롤 키나제 - GK; NLR 패밀리, 피린 영역 함유 3 - NLRP3; 전사인자 7 유사 2 (T-세포 특이적, HMG-박스) - TCF7L2; CD44 분자 (인디안 혈액 그룹) - CD44; 인터류킨 1 수용체 길항제 - ILlRN; 슈퍼옥사이드 디스뮤타제 2, 미토콘드리아성 - SOD2; CD58 분자 - CD58; 니브린- NBN; 키뉴레니나제 (L-키뉴레닌 하이드롤라제) - KYNU; LIM 영역 키나제 2 - LIMK2; 아연 핑거 영역에 인접한 브로모영역, IA - BAZlA; 스태닌 - SNN; 손상-조절된 오토파지 변성제 - DRAM; 플렉스트린 상동성 영역 함유, 패밀리 F (FYVE 영역을 가짐) 구성원 2 - PLEKHF2; SLAM 패밀리 구성원 7 - SLAMF7; 용질 캐리어 패밀리 15, 구성원 3 - SLC 15 A3; C-타입 렉틴 영역 패밀리 4, 구성원 E - CLEC4E; 용질 캐리어 패밀리 39 (아연 트랜스포터), 구성원 8 - SLC39A8; 프롤린-세린-트레오닌 포스파타제 상호작용 단백질 2 - PSTPIP2; 인터류킨-1 수용체-연관된 키나제 3 - IRAK3; 용질 캐리어 패밀리 2 (촉진된 글루코즈 트랜스포터), 구성원 6 - SLC2A6; SAM 영역, SH3 영역 및 핵 국재화 시그날 1 - SAMSNl; Jun 다이머화 단백질 p2 ISNFT - SNFT; 우레이도프로피오나제, 베타 - UPBl; 아포지단백질 L, 3 - APOL3; FLJ12886; 유리 지방산 수용체 2 - FFAR2; 유리 지방산 수용체 3 /// G 단백질-커플링된 수용체 42 /// 유리 지방산 수용체 3과 유사함 (G-단백질 커플링된 수용체 41) - FFAR3; UDP-Gal :베타G IcNAc 베타 1,4-갈락토실트랜스퍼라제, 폴리펩타이드 5 - B4GALT5; 어듀신 3 (감마) /// 클로라이드; EH-영역 함유 1 - EHDl; 플렉스트린 상동성 영역 함유, 패밀리 F (FYVE 영역 함유) 구성원 2 - PLEKHF2; SLAM 패밀리 구성원 7 - SLAMF7; C-타입 렉틴 영역 패밀리 4, 구성원 E - CLEC4E; 염색체 15 개방 판독 프레임 48 - C15orf48; G 단백질-커플링된 수용체 84 - GPR84; CD274 분자 - CD274 우레이도프로피오나제, 베타 - UPBl; 용질 캐리어 패밀리 35, 구성원 B - SLC35B2; GRAM 영역 함유 IA - GRAMDlA; 종양 단백질 p53 유도성 핵 단백질 2 - TP53INP2; 튜불린 타이로신 리가제 - TTL; 구아닌 뉴클레오타이드 결합 단백질 (G 단백질), 감마 2 - GNG2; 주요 촉진인자 슈퍼패밀리 영역 함유 2 - MFSD2; 호모 사피엔스 (Homo sapiens), 클론 IMAGE:5547644; Cdc42 GTPase-활성화 단백질 - CDGAP; 포크헤드 (forkhead)-연관된 영역을 갖는 TRAF-상호작용 단백질 - TIFA; 데하이드로게나제/리덕타제 (SDR 패밀리) 구성원 13 - DHRS 13; 스플리싱 (splicing) 인자 3a, 서브유니트 2, 66 kDa - SF3A2; ATPase, H+ 수송, 라이소좀성 42 kDa, Vl 서브유니트 Cl - ATP6V1C1; Bcl2 변형인자 BMF; 금속-조절성 전사인자 1 - MTFl; 조기 성장 반응 1 - EGRl; EPM2A (laforin) 상호작용 단백질 1 - EPM2AIP1; 가설적 단백질 MGC7036 - MGC7036; IBR 영역 함유 2 - IBRDC2; 회돌기교세포 전사인자 1 /// 회돌기교세포 전사인자 1과 유사함 /// 회돌기교세포 전사인자 1과 유사함 - OLIGl; 우레이도프로피오나제, 베타 - UPBl; 미토겐-활성화된 단백질 키나제 10 - MAPKlO; 바큘로바이러스성 IAP 반복체-함유 3 - BIRC3; 전체 길이 삽입 cDNA 클론 YX74D05; 포르민 유사 3 - FMNL3; 인터류킨 4 유도된 1 - IL4I1; 구아닐레이트 결합 단백질 1, 인터페론 유도성, 67 kDa - GBPl; 인터류킨-1 수용체-연관된 키나제 2 - IRAK2; 아연 핑거 CCCH-타입 함유 12C - ZC3H12C; 호모 사피엔스, 클론 IMAGE:; 전사인자 7 유사 2 (T-세포 특이적, HMG-박스) - TCF7L2; SLAM 패밀리 구성원 7 - SLAMF7; TNF 수용체-연관된 인자 1 - TRAFl; CDNA 클론 IMAGE:6254031; 미토겐-활성화된 단백질 키나제 키나제 키나제 8 - MAP3K8; 염색체 8 개방 판독 프레임 38 - C8orf38; IBR 영역 함유 2 - IBRDC2; CDNA 클론 IMAGE:5270500; BC008048에 의해서 지지된 가설적 유전자 - LOC440934; IBR 영역 함유 2 - IBRDC2; 세포질 분열의 데디케이터 (dedicator) 4 - DOCK4; Nedd4 결합 단백질 1 - N4BP1; 펩티다제 억제제 3, 피부-유도됨 (SKALP) - PI3.
IL4 표지가 유도된 IL4 유전자에는 다음이 포함되었다: 도 11-104 상에 열거되고 주석을 단 유전자.
ILlO 표지가 유도된 ILlO 유전자에는 다음이 포함되었다: 도 105-158 상에 열거되고 주석을 단 유전자.
IL 13 표지가 유도된 IL 13 유전자에는 다음이 포함되었다: 도 159-234 상에 열거되고 주석을 단 유전자.
결과: 실시예 Id에 기술된 결과와 일치하여, 환자의 이 세트에서 DM 및 PM 환자의 IFN-α/β 유도성 유전자 표지 스코어는 질병 안정성, 개선 및 재발을 예측할 수 있었다. 도 2a는, DM 및 PM 환자의 IFN-α/β 유도성 유전자 표지가 개선되고 있는 경우보다 활성 질병이 있는 경우에 더 큰 것을 나타낸다. 도 2b는 짝을 이룬 샘플 (하나는 활성 질병 중에 수득되고, 하나는 질병 개선 중에 수득된다)에서 개개 DM 환자의 IFN-α/β 유도성 유전자 표지를 제공한다. DM 환자의 IFN-α/β 유도성 유전자 표지는 DM 환자가 질병 개선을 나타냄에 따라서 감소하였다. 도 3은 의사와의 2 회의 진료의 과정에 걸쳐서 임상적 개선을 나타낸 3 명의 다른 DM 환자의 전체 혈액에서의 IFN-α/β 유도성 유전자 표지를 제공한다. 3 명의 환자 ((a), (b), 및 (c)) 각각의 경우에, IFN-α/β 유도성 유전자 표지는 환자가 임상적으로 개선됨에 따라서 감소하였다. 사이토킨 유전자 표지 스코어와 임상적 개선의 이러한 상관관계는 다른 사이토킨 유전자 표지 (TNFα, ILl β, IL4, ILlO, 또는 IL 13)에 대해서는 관찰되지 않았다. 도 4는 DM 환자의 IFN-α/β 유도성 유전자 표지에 있어서의 변화를 제공한다. IFN-α/β 유도성 유전자 표지는 환자의 상태가 임상적으로 악화됨에 따라서 증가하고, 환자의 상태가 임상적으로 개선됨에 따라서 감소한다. 도 5는 또한, PM 환자에게서의 IFN-α/β 유도성 유전자 표지와 혈청 CK 레벨의 상관관계를 나타낸다. 도 6 및 7은 DM 환자에게서의 임상적 질병, 혈청 CK 활성, 및 IFN-α/β 유도성 유전자 표지의 상관관계를 나타낸다. 도 6은 IFN-α/β 유도성 유전자 표지와 혈청 CK 활성 사이의 밀접한 상관관계를 제공한다. 도 7은 또한, IFN-α/β 유도성 유전자 표지와 환자의 임상적 질병 추이의 상관관계를 입증한다.
실시예
2b:
TNF
-α,
IL
-I β,
GM
-
CSF
,
IL
-10 및
IL
-13
시그날링
경로는
DM
및
PM
환자에게서 활성화되지만, 질병 활성과는 상관관계가 없었다
실시예 Id에 기술된 것과 마찬가지로, 전체 게놈 어레이 접근방법을 다시 사용하여 DM 및 PM 병인론에서 역할을 할 수 있는 사이토킨, TNF-α, IL-l β, IL-10, IL-13 및 GM-CSF의 잠재적 효과를 평가하였다. 도 388a는 36 명의 건강한 정상 대조군, 및 낮은 질병 활성 및 높은 질병 활성을 갖는 DM 및 PM 환자 (실시예 Ib-Id에 언급된 환자)의 WB에서 TNF-α, IL-lβ, IL-IO, IL-13 및 GM-CSF 각각에 대한 복합 사이토킨 유도성 유전자 표지 스코어를 나타낸다. 타입 1 IFN, GM-CSF, IL-IO, IL-13, IL-lβ 및 TNF-α의 사이토킨 유도성 유전자 표지 스코어는 문헌 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008;Volume 2009, Article ID 374312, doi: 10.4061/2009/374312; Yao, Y, Jallal J, et al. Neutralization of IFN-α/β-Inducible Genes and Downstream Effect in a Phase I Trial of an Anti-IFN-α Monoclonal Antibody in SLE. Accepted by Arthritis Rheum.]. DM 및 PM 환자는 문헌 [Yao, Y, Jallal J, et al. Development of Potential Pharmacodynamic and Diagnostic Markers for Anti-IFN-α Monoclonal Antibody Trials in Systemic Lupus Erythematosus. Human Genomics and Proteomics. 2008; Volume 2009, Article ID 374312, doi: 10.4061/2009/374312]에 기술된 바와 같이 타입 I IFN 유도성 유전자 표지의 약, 중등도 및 높은 스코어로 분류되었다. 대조군과 낮거나 높은 질병 활성은 갖는 환자 사이에서, WB에서의 TNF-α, IL-lβ, IL-10, IL-13 및 GM-CSF 유도성 유전자 표지 스코어 사이의 모든 차이는 다중 비교를 위한 조정 후에 통계학적으로 유의적이었다 (표 8). 이것은 이들 사이토킨 시그날링 경로 모두가 이들 환자의 혈액에서 활성화되었음을 시사하였다. TaqMan QRT-PCR은 또한, PM, 및 더 적은 정도로는 DM 환자의 근육 생검에서 이들 사이토킨의 mRNAs의 과발현을 입증하였다 (나타내지 않음). 그러나, 이들 사이토킨 유도성 유전자 표지 스코어 중의 어떤 것도 낮은 질병 활성 및 높은 질병 활성을 갖는 환자들 사이에서 통계학적으로 유의적인 차이를 나타내지 않았다 (표 8). 더구나, 시험 중에 질병 활성의 변화를 갖는 18 명의 환자의 경우에 이들 사이토킨 유도성 유전자 표지 스코어의 어떤 것도 일치하는 방향으로 변화하지 않았다 (도 388b). 그의 질병 활성의 레벨이 그들의 치료 전체에 걸쳐서 결코 변화하지 않은 3 명의 환자의 경우에, 이들 사이토킨 유도성 유전자 표지 스코어에서는 어떤 유의적인 변화도 관찰되지 않았다 (도 388c).
도 389는 높은 질병 활성 및 낮은 질병 활성에 의해서 계층화된 모두 24 명의 환자의 사이토킨 유도성 유전자 표지 스코어를 나타낸다. 타입 1 IFN 유도성 유전자의 억제는 질병 활성에서 개선을 나타낸 환자에 대해서 보편적이었지만, 이것은 TNF-α, IL-lβ, IL-IO, IL-13 및 GM-CSF 유도성 유전자 표지의 경우에는 해당하지 않았다.
실시예
3:
IFN
-α/β 유도성 유전자 표지는
IBM
환자 근육 및 전체 혈액 샘플에서 과발현된다
또한, IFN-α/β 유도성 유전자 표지는 IBM 환자 근육 및 전체 혈액 샘플에서 과발현되는 것으로 측정되었다.
전체 RNA 추출 및 마이크로어레이 처리: 전체 RNA는 각각 팍스젠 혈액 RNA 키트 및 퀴아겐 알엔이지 피브로우스 티슈 미니 (Qiagen RNeasy Fibrous Tissue Mini, Hilden, Germany)를 사용하여 팍스젠 혈액 및 근육 생검으로부터 추출하였다. RNA 순도 및 농도는 분광광도법으로 결정하였다 (260/280 > 1.9). RNA 품질은 RNA 6000 나노 랩칩을 사용하여 애질런트 2100 바이오애날라이저 상에서 평가하였다.
2 ㎍의 전체 RNA로부터 비오틴-라벨 증폭된 cRNA의 생성은 Affymetrix GenChip® One-Cycle cDNA 합성 키트 및 Affymetrix GenChip® IVT 라벨링 키트에 의해서 수행되었다. cRNA 생성물의 농도 및 순도는 분광광도법으로 결정되었다. 20 마이크로그램의 각각의 비오틴-라벨 cRNA를 Affymetrix Human Genome U 133 플러스 2.0 GenChip® 어레이 상에서 하이브리드화를 위해서 단편화되었다. 단편화된 cRNA는 Affymetrix GenChip® 매뉴얼에 개략적으로 기술된 바와 같이 하이브리드화를 위해서 제조되었다. 하이브리드화는 45℃로 설정된 모델 320 회전 하이브리드화 오븐 내에서 밤새 수행되었다. 모든 GenChip® 세척 및 염색 절차는 Affymetrix 모델 450 플루이딕스 스테이션 상에서 수행되었다. 어레이는 Affymetrix GenChip® Scanner 3000 상에서 스캐닝되었다. 데이타 수집 및 초기 어레이 품질 평가는 GenChip Operating Software (GCOS) 도구를 사용하여 수행되었다.
21 개의 유전자의 정적 리스트를 사용한 유전자 표지의 계산: 이 리스트 내의 21 개의 유전자는 근염 환자에게서의 그들의 과발현의 출현율 및 크기를 정상적인 대조군의 경우와 비교함으로써 확인되었다. 이것은 각각의 근염 환자에 대한 동일한 21 개의 유전자 (즉, 21 개의 독특한 유전자에 대해서 위치하는 21 개의 탐침)의 표준 리스트를 포함한다. 이들 21 개의 유전자는 DNAPTP6; EPSTIl; HERC5; IFI27; IFI44; IFI44L; IFI6; IFITl; IFIT3; ISG15; LAMP3; LY6E; MXl; OASl; OAS2; OAS3; PLSCRl; RSAD2; RTP4; SIGLECl; 및 USP18이었다. 폴드 변화는 제0일 (투약전)의 근염 환자와 24 명의 정상적인 건강한 대조군의 평균 사이에서 계산된다. 그 후, 이들 21 개의 폴드 변화값의 중앙값을 각각의 근염 환자에 대해서 컴퓨터로 계산하고, 이값을 IFN-α/β 유도성 유전자 표지 스코어로서 사용한다.
25 개 유전자의 동적 리스트를 사용한 유전자 표지의 계산: 각각의 환자에 대해서, 상위 25 개 유전자 (폴드 변화값에 의해서 결정됨)의 동적 리스트는 IFN-α/β 유도성이고, MEDI-545에 의해서 중화되는 것으로 이전에 확인된 807 개의 탐침의 세트로부터 선택된다. 도 235-381을 참고로 한다. 이들 25 개의 유전자는 이들의 폴드 변화 크기에 의해서 선택되고, 모두 독특한 공지의 유전자를 나타낸다 (다수의 탐침에 의해서 표시되는 유전자의 경우에는, 최고의 폴드 변화를 나타내는 것이 목적에 따라서 사용되었다). 폴드 변화는 제0일 (투약전)의 근염 환자와 24 명의 정상적인 건강한 대조군의 평균 사이에서 계산된다. 그 후, 이들 25 개의 폴드 변화값의 중앙값을 각각의 근염 환자에 대해서 컴퓨터로 계산하고, 이값을 IFN-α/β 유도성 유전자 표지 스코어로서 사용한다.
결과: 표 1은, 21 개 유전자의 정적 리스트를 사용하든지, 또는 25 개 유전자의 동적 리스트를 사용하든지 IFN-α/β 유도성 유전자 표지가 IBM 환자 근육에서 과발현되는 것을 나타낸다. 도 8은 표 1에 나타낸 개개 IBM 환자의 근육 조직에서 IFN-α/β 유도성 유전자 표지의 과발현을 나타내는 산포 플롯을 제공한다.
[표 1]
IBM 환자 근육 검체에서 IFN-α/β 유도성 유전자 표지의 과발현
IBM 환자의 전체 혈액을 또한, IFN-α/β 유도성 유전자 표지의 과발현이 검출될 수 있었는지 여부를 결정하기 위해서 시험하였다. 샘플에서 IFN-α/β 유도성 유전자 표지를 검출하기 위해 25 개 유전자의 동적 리스트를 사용하여, IFN-α/β 유도성 유전자 표지의 과발현이 IBM 전체 혈액 내에서 검출될 수 있었다. 9 명의 IBM 환자 전체 혈액 샘플의 IFN-α/β 유도성 유전자 표지 스코어에 대한 도 9a 및 개개 IBM 환자의 IFN-α/β 유도성 유전자 표지 스코어를 설명하는 산포 플롯에 대한 도 9b를 참고로 한다.
실시예
4:
IFN
-α/β 유도성 유전자 표지는
JoI
+
DM
환자에게서 보다
JoI
" 환자의 근육에서 더
상승된다
IFN-α/β 유도성 유전자 표지의 과발현은 JoI+ DM 환자에게서 보다 JoI" 환자의 근육에서 더 크다.
전체 RNA 추출 및 마이크로어레이 처리: 전체 RNA는 퀴아겐 알엔이지 피브로우스 티슈 미니 (Qiagen RNeasy Fibrous Tissue Mini, Hilden, Germany)를 사용하여 팍스젠 근육 생검으로부터 추출하였다. RNA 순도 및 농도는 분광광도법으로 결정하였다 (260/280 > 1.9). RNA 품질은 RNA 6000 나노 랩칩을 사용하여 애질런트 2100 바이오애날라이저 상에서 평가하였다.
2 ㎍의 전체 RNA로부터 비오틴-라벨 증폭된 cRNA의 생성은 Affymetrix GenChip® One-Cycle cDNA 합성 키트 및 Affymetrix GenChip® IVT 라벨링 키트에 의해서 수행되었다. cRNA 생성물의 농도 및 순도는 분광광도법으로 결정되었다. 20 마이크로그램의 각각의 비오틴-라벨 cRNA를 Affymetrix Human Genome U 133 플러스 2.0 GenChip® 어레이 상에서 하이브리드화를 위해서 단편화되었다. 단편화된 cRNA는 Affymetrix GenChip® 매뉴얼에 개략적으로 기술된 바와 같이 하이브리드화를 위해서 제조되었다. 하이브리드화는 45℃로 설정된 모델 320 회전 하이브리드화 오븐 내에서 밤새 수행되었다. 모든 GenChip® 세척 및 염색 절차는 Affymetrix 모델 450 플루이딕스 스테이션 상에서 수행되었다. 어레이는 Affymetrix GenChip® Scanner 3000 상에서 스캐닝되었다. 데이타 수집 및 초기 어레이 품질 평가는 GenChip Operating Software (GCOS) 도구를 사용하여 수행되었다.
19 개의 유전자의 정적 리스트를 사용한 유전자 표지의 계산: 이 리스트 내의 19 개의 유전자는 근염 환자에게서의 그들의 과발현의 출현율 및 크기를 정상적인 대조군의 경우와 비교함으로써 확인되었다. 동일한 19 개의 유전자 (즉, 19 개의 독특한 유전자에 대해서 위치하는 19 개의 탐침)가 각각의 근염 환자에 대해서 사용되었다. 이들 19 개의 유전자는 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISGl5, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, 및 USP18을 포함하였다. 폴드 변화는 제0일 (투약전)의 근염 환자와 24 명의 정상적인 건강한 대조군의 평균 사이에서 계산된다. 그 후, 이들 19 개의 폴드 변화값의 중앙값을 각각에 대해서 컴퓨터로 계산한다.
결과: 도 10a는 IFN-α/β 유도성 유전자 표지에 포함된 19 개 유전자 각각의 중앙-폴드 과발현 및 10 명의 IBM 환자 근육 샘플 각각에 대한 IFN-α/β 유도성 유전자 표지에서의 전반적인 중앙-폴드 변화를 제공한다. 도 10b는 도 10a에 나타낸 각각의 개별적인 IBM 환자의 근육 조직에서 IFN-α/β 유도성 유전자 표지의 과발현을 나타내는 산포 플롯을 제공한다. IFN-α/β 유도성 유전자 표지는 JoI" 및 JoI+ 환자 둘 다의 근육 샘플에서 과발현되었지만, 과발현은 JoI" 환자의 근육 샘플에서 더 컸다.
실시예 5: miRNAs 는 건강한 공여체 근육 조직에 비해서 근염 환자 근육 조직에서 차별적 조절된다
근육 조직에서 miRNA 레벨은 8 명의 건강한 공여체, 11 명의 DM 환자 및 10 명의 IBM 환자로부터 수득된 샘플에서 측정되었다.
샘플 처리: 근육 조직 샘플을 제조자 제안 프로토콜에 따라 mzVVana miRNA 분리 키트 (Ambion, Inc., Austin, TX)를 사용하여 처리하였다. 각각의 샘플의 농도 및 순도 (260/280 ㎚)를 분광광도법으로 측정하였다. 샘플 품질은 애질런트 2100 바이오애날라이저 (Agilent Technologies, Inc., Santa Clara, CA) 분석에 의해서 평가되었다.
TaqMan 어레이 인간 마이크로RNA 패널 (Applied Biosystems, Foster City, CA)에 대한 멀티플렉스 (Multiplex) RT: 처리된 RNA 샘플은 25 ng/㎕의 농도로 표준화되었다. 4 ㎕의 각각의 표준화된 RNA 샘플을 얼음 상에 배치된 8-튜브 마이크로튜브 스트립 (microtube strip) (4 ㎕ × 8)의 개별적인 웰에 전이시켰다. 5 ㎕의 빙냉 RT 마스터 믹스 (master mix)를 4 ㎕의 표준화된 RNA를 함유하는 웰에 첨가하였다. 5 ㎕의 RT 매스터 믹스는 각각 0.2 ㎕의 100 mM dNTPs, 2.0 ㎕의 멀티스크라이브 (MultiScribe) 역전사효소 (50 LVmL), 1.0 ㎕의 1OX 역전사 완충액, 0.125 ㎕의 RNase 억제제 (20 U/㎕), 및 얼음 상에서 제조된 1.675 ㎕의 무-뉴클레아제 물을 함유하였다. 1 ㎕ 용적의 멀티플렉스 RT 인간 프라이머 풀 (프라이머 풀 #1-8 각각의 하나)을 상응하는 마이크로튜브 (마이크로튜브 1-8)에 첨가하여 RNA 샘플당 총 8 개의 독립적인 RT 반응을 제공하였다. 마이크로튜브의 덮개를 씌우고, 부드럽게 혼합하고, 간단하게 원심분리하였다. 그 후, 모든 반응 샘플은 cDNA 합성 프로토콜을 수행하기 전에 얼음 상에서 적어도 5 분 동안 배양하였다.
cDNA 합성 절차는 다음의 프로파일을 사용하여 바이오-래드 (Bio-Rad (Hercules, CA)) 테트라드 써멀 사이클러 (Tetrad thermal cycler) 내에서 수행하였다: 30 분 동안 16℃, 30 분 동안 42℃, 5 분 동안 85℃, 4℃-유지. cDNA 합성반응의 완료 후에, 모든 샘플 용적 (10 ㎕)을 개별적인 1.5 ㎖ 미량원심분리관 (microcentrifuge tubes)에 전이시키고, 615 ㎕의 무-뉴클레아제 물을 첨가함으로써 62.5-배로 희석하였다. 모든 샘플은 추가의 처리시까지 얼음 상에 유지시켰다.
TaqMan 저-밀도 어레이: 인간 마이크로RNA 패널 (Human MicroRNA Panel) TaqMan 저-밀도 어레이 (TLDA) (Applied Biosystems, Foster City, CA) 상에서의 분석을 위한 준비 시에는, 50 마리의 희석된 RT 반응액 및 50 ㎕의 TaqMan 유니버샬 (Universal) PCR 마스터 믹스 (2X) (Applied Biosystems, Foster City, CA)를 개별적인 1.5 ㎖ 미량원심분리관 내에서 조합하였다. 샘플 튜브에 덮개를 씌우고, 부드럽게 혼합시키고, 간단히 원심분리하였다. 어레이를 부하시키는 표준 절차를 수행하였으며, 어레이는 7900HT 고속 실시간 (Fast Real-Time) PCR 시스템 (Applied Biosystems, Foster City, CA) 상에서 작동시켰다. 생성된 Ct 값의 데이타 분석은 SDSv2.2.2 소프트웨어 (Applied Biosystems, Foster City, CA)를 사용하여 수행되었다.
결과: miRNAs는 DM 및 IBM 환자 둘 다의 근육에서 차별적으로 조절되었다. 표 2-5를 참고로 한다. 독특한 검출기 Ids, miRNA ids, 및 순서는 도면 시트에 제시된다.
[표 2]
DM 환자 근육 검체에서 차별적 상향조절된 miRNA
[표 3]
DM 환자 근육 검체에서 차별적 하향조절된 miRNA
[표 4]
IBM 환자 근육 검체에서 차별적 상향조절된 miRNA
[표 5]
IBM 환자 근육 검체에서 차별적 하향조절된 miRNA
차별적 조절 때문에, miRNA는 근염 환자의 진단, 예측, 치료 및/또는 계층화에 유용할 수 있다.
SEQUENCE LISTING
<110> MedImmune LLC
Yao, Yihong
Morehouse, Chris
Higgs, Brandon
Jallal, Bahija
<120> DISEASE MARKERS AND USES THEREOF
<130> IA202PCT
<150> US61/006,963
<151> 2008-02-08
<160> 79
<170> PatentIn version 3.3
<210> 1
<211> 22
<212> RNA
<213> Homo sapiens
<400> 1
uagcuuauca gacugauguu ga 22
<210> 2
<211> 23
<212> RNA
<213> Homo sapiens
<400> 2
uaggcagugu cauuagcuga uug 23
<210> 3
<211> 22
<212> RNA
<213> Homo sapiens
<400> 3
gaaguuguuc gugguggauu cg 22
<210> 4
<211> 21
<212> RNA
<213> Homo sapiens
<400> 4
uggaauguaa agaaguaugu a 21
<210> 5
<211> 22
<212> RNA
<213> Homo sapiens
<400> 5
aacccguaga uccgaacuug ug 22
<210> 6
<211> 22
<212> RNA
<213> Homo sapiens
<400> 6
uacaguacug ugauaacuga ag 22
<210> 7
<211> 22
<212> RNA
<213> Homo sapiens
<400> 7
ucacagugaa ccggucucuu uc 22
<210> 8
<211> 22
<212> RNA
<213> Homo sapiens
<400> 8
uugguccccu ucaaccagcu gu 22
<210> 9
<211> 21
<212> RNA
<213> Homo sapiens
<400> 9
uugguccccu ucaaccagcu a 21
<210> 10
<211> 22
<212> RNA
<213> Homo sapiens
<400> 10
aacauucaac cugucgguga gu 22
<210> 11
<211> 23
<212> RNA
<213> Homo sapiens
<400> 11
caaagaauuc uccuuuuggg cuu 23
<210> 12
<211> 24
<212> RNA
<213> Homo sapiens
<400> 12
aacuggcccu caaagucccg cuuu 24
<210> 13
<211> 22
<212> RNA
<213> Homo sapiens
<400> 13
aagcugccag uugaagaacu gu 22
<210> 14
<211> 21
<212> RNA
<213> Homo sapiens
<400> 14
aucacauugc cagggauuuc c 21
<210> 15
<211> 21
<212> RNA
<213> Homo sapiens
<400> 15
aucacauugc cagggauuac c 21
<210> 16
<211> 22
<212> RNA
<213> Homo sapiens
<400> 16
uucaaguaau ucaggauagg uu 22
<210> 17
<211> 21
<212> RNA
<213> Homo sapiens
<400> 17
uucacagugg cuaaguuccg c 21
<210> 18
<211> 21
<212> RNA
<213> Homo sapiens
<400> 18
uucacagugg cuaaguucug c 21
<210> 19
<211> 21
<212> RNA
<213> Homo sapiens
<400> 19
agggcccccc cucaauccug u 21
<210> 20
<211> 21
<212> RNA
<213> Homo sapiens
<400> 20
uagcaccauc ugaaaucggu u 21
<210> 21
<211> 20
<212> RNA
<213> Homo sapiens
<400> 21
uagcaccauu ugaaaucggu 20
<210> 22
<211> 22
<212> RNA
<213> Homo sapiens
<400> 22
cuuucagucg gauguuugca gc 22
<210> 23
<211> 22
<212> RNA
<213> Homo sapiens
<400> 23
uguaaacauc cucgacugga ag 22
<210> 24
<211> 22
<212> RNA
<213> Homo sapiens
<400> 24
uguaaacauc cuacacucag cu 22
<210> 25
<211> 23
<212> RNA
<213> Homo sapiens
<400> 25
uguaaacauc cuacacucuc agc 23
<210> 26
<211> 22
<212> RNA
<213> Homo sapiens
<400> 26
uguaaacauc cccgacugga ag 22
<210> 27
<211> 22
<212> RNA
<213> Homo sapiens
<400> 27
cuuucagucg gauguuuaca gc 22
<210> 28
<211> 20
<212> RNA
<213> Homo sapiens
<400> 28
uguaaacauc cuugacugga 20
<210> 29
<211> 23
<212> RNA
<213> Homo sapiens
<400> 29
cgcauccccu agggcauugg ugu 23
<210> 30
<211> 22
<212> RNA
<213> Homo sapiens
<400> 30
cuggcccucu cugcccuucc gu 22
<210> 31
<211> 21
<212> RNA
<213> Homo sapiens
<400> 31
gccccugggc cuauccuaga a 21
<210> 32
<211> 23
<212> RNA
<213> Homo sapiens
<400> 32
uccgucucag uuacuuuaua gcc 23
<210> 33
<211> 22
<212> RNA
<213> Homo sapiens
<400> 33
uuaucagaau cuccaggggu ac 22
<210> 34
<211> 22
<212> RNA
<213> Homo sapiens
<400> 34
uaaugccccu aaaaauccuu au 22
<210> 35
<211> 22
<212> RNA
<213> Homo sapiens
<400> 35
cuccugacuc cagguccugu gu 22
<210> 36
<211> 22
<212> RNA
<213> Homo sapiens
<400> 36
cuggacuuag ggucagaagg cc 22
<210> 37
<211> 22
<212> RNA
<213> Homo sapiens
<400> 37
agcucggucu gaggccccuc ag 22
<210> 38
<211> 23
<212> RNA
<213> Homo sapiens
<400> 38
agugacauca cauauacggc agc 23
<210> 39
<211> 23
<212> RNA
<213> Homo sapiens
<400> 39
aguggggaac ccuuccauga gga 23
<210> 40
<211> 21
<212> RNA
<213> Homo sapiens
<400> 40
agacccuggu cugcacucua u 21
<210> 41
<211> 22
<212> RNA
<213> Homo sapiens
<400> 41
aaagcgcuuc ccuucagagu gu 22
<210> 42
<211> 25
<212> RNA
<213> Homo sapiens
<400> 42
cccaucuggg guggccugug acuuu 25
<210> 43
<211> 22
<212> RNA
<213> Homo sapiens
<400> 43
aacccguaga uccgaucuug ug 22
<210> 44
<211> 22
<212> RNA
<213> Homo sapiens
<400> 44
ucggauccgu cugagcuugg cu 22
<210> 45
<211> 22
<212> RNA
<213> Homo sapiens
<400> 45
uaacagucua cagccauggu cg 22
<210> 46
<211> 22
<212> RNA
<213> Homo sapiens
<400> 46
ugagaacuga auuccauggg uu 22
<210> 47
<211> 22
<212> RNA
<213> Homo sapiens
<400> 47
uuaaugcuaa ucgugauagg gg 22
<210> 48
<211> 22
<212> RNA
<213> Homo sapiens
<400> 48
uagcuuauca gacugauguu ga 22
<210> 49
<211> 21
<212> RNA
<213> Homo sapiens
<400> 49
acagcaggca cagacaggca g 21
<210> 50
<211> 23
<212> RNA
<213> Homo sapiens
<400> 50
agcuacauug ucugcugggu uuc 23
<210> 51
<211> 24
<212> RNA
<213> Homo sapiens
<400> 51
agcuacaucu ggcuacuggg ucuc 24
<210> 52
<211> 22
<212> RNA
<213> Homo sapiens
<400> 52
ugguuuaccg ucccacauac au 22
<210> 53
<211> 21
<212> RNA
<213> Homo sapiens
<400> 53
ggcaagaugc uggcauagcu g 21
<210> 54
<211> 22
<212> RNA
<213> Homo sapiens
<400> 54
gcacauuaca cggucgaccu cu 22
<210> 55
<211> 23
<212> RNA
<213> Homo sapiens
<400> 55
uggcaguguc uuagcugguu guu 23
<210> 56
<211> 21
<212> RNA
<213> Homo sapiens
<400> 56
aucauagagg aaaauccacg u 21
<210> 57
<211> 21
<212> RNA
<213> Homo sapiens
<400> 57
uaguagaccg uauagcguac g 21
<210> 58
<211> 23
<212> RNA
<213> Homo sapiens
<400> 58
ucuuggagua ggucauuggg ugg 23
<210> 59
<211> 22
<212> RNA
<213> Homo sapiens
<400> 59
aucaugaugg gcuccucggu gu 22
<210> 60
<211> 21
<212> RNA
<213> Homo sapiens
<400> 60
gugucuuuug cucugcaguc a 21
<210> 61
<211> 22
<212> RNA
<213> Homo sapiens
<400> 61
ugagguagua gguuguauag uu 22
<210> 62
<211> 21
<212> RNA
<213> Homo sapiens
<400> 62
agagguagua gguugcauag u 21
<210> 63
<211> 22
<212> RNA
<213> Homo sapiens
<400> 63
ugagguagua gauuguauag uu 22
<210> 64
<211> 21
<212> RNA
<213> Homo sapiens
<400> 64
ugagguagua guuuguacag u 21
<210> 65
<211> 21
<212> RNA
<213> Homo sapiens
<400> 65
ucguaccgug aguaauaaug c 21
<210> 66
<211> 22
<212> RNA
<213> Homo sapiens
<400> 66
ugauauguuu gauauauuag gu 22
<210> 67
<211> 21
<212> RNA
<213> Homo sapiens
<400> 67
uagguaguuu ccuguuguug g 21
<210> 68
<211> 22
<212> RNA
<213> Homo sapiens
<400> 68
uucaccaccu ucuccaccca gc 22
<210> 69
<211> 23
<212> RNA
<213> Homo sapiens
<400> 69
ugugcaaauc uaugcaaaac uga 23
<210> 70
<211> 23
<212> RNA
<213> Homo sapiens
<400> 70
uaaagugcuu auagugcagg uag 23
<210> 71
<211> 21
<212> RNA
<213> Homo sapiens
<400> 71
uucaaguaau ccaggauagg c 21
<210> 72
<211> 21
<212> RNA
<213> Homo sapiens
<400> 72
uauugcacau uacuaaguug c 21
<210> 73
<211> 21
<212> RNA
<213> Homo sapiens
<400> 73
ugcugacucc uaguccaggg c 21
<210> 74
<211> 22
<212> RNA
<213> Homo sapiens
<400> 74
uuauaauaca accugauaag ug 22
<210> 75
<211> 22
<212> RNA
<213> Homo sapiens
<400> 75
uccuguacug agcugccccg ag 22
<210> 76
<211> 22
<212> RNA
<213> Homo sapiens
<400> 76
acucaaaacc cuucagugac uu 22
<210> 77
<211> 21
<212> RNA
<213> Homo sapiens
<400> 77
uauugcacuu gucccggccu g 21
<210> 78
<211> 22
<212> RNA
<213> Homo sapiens
<400> 78
uucaacgggu auuuauugag ca 22
<210> 79
<211> 22
<212> RNA
<213> Homo sapiens
<400> 79
ugagguagua aguuguauug uu 22
Claims (218)
- 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 투여함을 포함하는 타입 I IFN 또는 IFNα 매개성 질환 또는 장애를 갖는 환자의 치료 방법에 있어서,
상기 환자는 차별적 조절된 miRNA 마커 프로파일을 포함하고,
상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 중화시키는, 방법. - 제1항에 있어서, 환자의 차별적 조절된 miRNA 마커 프로파일의 중화를 검출하는 것을 추가로 포함하는, 방법.
- 제1항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제3항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제4항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제5항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제6항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제3항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
- 제1항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제9항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제10항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제11항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제12항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제9항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
- 제3항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
- 제15항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
- 제16항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
- 제17항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
- 제18항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
- 제15항에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
- 제1항에 있어서, 상기 제제는 생물학적 제제인, 방법.
- 제21항에 있어서, 상기 제제는 항체인, 방법.
- 제22항에 있어서, 상기 항체는 MEDI-545 인, 방법.
- 제22항에 있어서, 상기 항체는 하나 이상의 타입 I IFN 또는 IFNα 서브타입에 대해 특이적이지만, MEDI-545 가 아닌, 방법.
- 제1항에 있어서, 상기 투여 제제는 질환 또는 장애의 하나 이상의 증상을 경감시키는, 방법.
- 제22항에 있어서, 상기 항체는 대략 0.03 내지 30 mg/kg의 복용량으로 투여되는, 방법.
- 제26항에 있어서, 상기 항체는 0.3 내지 3 mg/kg의 복용량으로 투여되는, 방법.
- 제27항에 있어서, 상기 항체는 0.03 내지 1 mg/kg의 복용량으로 투여되는, 방법.
- 제21항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 10%까지 중화시키는, 방법.
- 제29항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 20%까지 중화시키는, 방법.
- 제30항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 30%까지 중화시키는, 방법.
- 제31항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 40%까지 중화시키는, 방법.
- 제32항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 50%까지 중화시키는, 방법.
- 제1항에 있어서, 상기 질환 또는 장애는 낭창, 건선, 맥관염, 유육종증, 쇼그렌 증후군, 또는 근염 중 하나인, 방법.
- 제34항에 있어서, 질환 또는 장애는 근염인, 방법.
- 제1항에 있어서, 상기 환자는 적어도 IFNα 서브타입 1, 2, 8, 및 14의 상향조절된 발현 또는 활성을 추가로 포함하는, 방법.
- 제2항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 전체 혈액에서 검출되는, 방법.
- 제2항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 근육 조직에서 검출되는, 방법.
- 제1항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 강하거나 중간정도인, 방법.
- 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 이를 필요로 하는 환자에 투여함을 포함하는, 필요한 환자의 차별적 조절된 miRNA 마커 프로파일을 중화시키는 방법에 있어서,
상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 중화시키는, 방법. - 제40항에 있어서, 환자의 차별적 조절된 miRNA 마커 프로파일의 중화를 검출하는 것을 추가로 포함하는, 방법.
- 제40항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제42항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제43항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제44항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제45항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제42항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
- 제40항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제48항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제49항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제50항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제51항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제48항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
- 제42항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
- 제54항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
- 제55항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
- 제56항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
- 제57항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
- 제54항에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
- 제40항에 있어서, 상기 제제는 생물학적 제제인, 방법.
- 제60항에 있어서, 상기 제제는 항체인, 방법.
- 제61항에 있어서, 상기 항체는 MEDI-545 인, 방법.
- 제61항에 있어서, 상기 항체는 하나 이상의 타입 I IFN 또는 IFNα 서브타입에 대해 특이적이지만, MEDI-545 가 아닌, 방법.
- 제40항에 있어서, 상기 투여 제제는 질환 또는 장애의 하나 이상의 증상을 경감시키는, 방법.
- 제61항에 있어서, 상기 항체는 대략 0.03 내지 30 mg/kg의 복용량으로 투여되는, 방법.
- 제65항에 있어서, 상기 항체는 0.3 내지 3 mg/kg의 복용량으로 투여되는, 방법.
- 제66항에 있어서, 상기 항체는 0.03 내지 1 mg/kg의 복용량으로 투여되는, 방법.
- 제40항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 10%까지 중화시키는, 방법.
- 제68항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 20%까지 중화시키는, 방법.
- 제69항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 30%까지 중화시키는, 방법.
- 제70항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 40%까지 중화시키는, 방법.
- 제71항에 있어서, 상기 제제는 환자의 차별적 조절된 miRNA 마커 프로파일을 적어도 50%까지 중화시키는, 방법.
- 제40항에 있어서, 상기 환자는 낭창, 건선, 맥관염, 유육종증, 쇼그렌 증후군, 또는 근염 중 하나로 진단된, 방법.
- 제73항에 있어서, 상기 환자는 근염으로 진단된, 방법.
- 제40항에 있어서, 상기 환자는 적어도 IFNα 서브타입 1, 2, 8, 및 14의 상향조절된 발현 또는 활성을 추가로 포함하는, 방법.
- 제41항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 전체 혈액에서 검출되는, 방법.
- 제41항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 환자의 근육 조직에서 검출되는, 방법.
- 제40항에 있어서, 상기 차별적 조절된 miRNA 마커 프로파일은 강하거나 중간정도인, 방법.
- 환자로부터의 제1 샘플에서 제1 차별적 조절된 miRNA 마커 프로파일을 얻는 것을 포함하는, 환자의 염증성 질환 진행의 모니터링 또는 예측 방법.
- 제79항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제80항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제81항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제82항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제83항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제80항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
- 제79항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제86항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제87항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제88항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제89항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제86항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
- 제80항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
- 제92항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
- 제93항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
- 제94항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
- 제95항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
- 제92항에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
- 제79항에 있어서, 상기 제1 차별적 조절된 miRNA 마커 프로파일은 강한 프로파일이고 환자 예후는 질환 진행인, 방법.
- 제98항에 있어서, 상기 강한 프로파일은 건강한 개체의 적어도 10배의 miRNA의 차별적 발현을 포함하는, 방법.
- 제98항에 있어서, 상기 자가면역 질환은 근염인, 방법.
- 제79항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 약한 프로파일이고 환자 예후는 질환 퇴행인, 방법.
- 제101항에 있어서, 상기 약한 프로파일은 건강한 개체의 2배 이하의 miRNA의 차별적 발현을 포함하는, 방법.
- 제98항에 있어서, 상기 강한 프로파일은 의사가 질환 치료를 변경하도록 지시하는, 방법.
- 제79항에 있어서,
환자로부터의 제2 샘플에서 제2 차별적 조절된 miRNA 마커 프로파일을 얻는 것을 추가로 포함하며;
제1 프로파일에 대한 상기 제2 프로파일에서의 miRNA 마커의 개수 또는 레벨의 증가가 질환 진행을 예측하거나;
제1 프로파일에 대한 상기 제2 프로파일에서의 miRNA 마커의 개수 또는 레벨에서의 감소가 질환 퇴행을 예측하는, 방법. - 환자로부터의 제1 샘플에서 제1 miRNA 프로파일을 얻고;
치료제를 투여하고;
환자로부터의 제2 샘플에서 제2 miRNA 프로파일을 얻고;
제1 및 제2 miRNA 프로파일을 비교하는 것을 포함하며,
상기 제1 및 제2 miRNA 프로파일에서의 편차는 치료제의 효능의 레벨을 나타내는, 치료제에 의한 치료를 받는 환자의 자가면역 또는 염증성 질환 진행을 모니터링하는 방법. - 제105항에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 하나 이상의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제106항에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제107항에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제108항에 있어서, 상기 제1 miRNA 마커 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제109항에 있어서, 상기 제1 miRNA 프로파일은 표 2 또는 표 4 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제106항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-34b-4373037 에 의해 검출되는, 방법.
- 제105항에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제112항에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제113항에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제114항에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제115항에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA의 하향조절된 발현 또는 활성을 포함하는, 방법.
- 제112항에 있어서, 상기 적어도 하나의 miRNA는 검출기 hsa-miR-1-4373161 에 의해 검출되는, 방법.
- 제106항에 있어서, 상기 제1 miRNA 프로파일은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 하나의 miRNA의 하향조절된 발현 또는 활성을 추가로 포함하는, 방법.
- 제118항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 2개의 miRNA 인, 방법.
- 제119항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 5개의 miRNA 인, 방법.
- 제120항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 10개의 miRNA 인, 방법.
- 제121항에 있어서, 상기 하향조절된 발현 또는 활성은 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 적어도 15개의 miRNA 인, 방법.
- 제118항에 있어서, 표 3 또는 표 5 에서 확인된 검출기에 의해 검출된 상기 적어도 하나의 miRNA는 hsa-miR-1-4373161 인, 방법.
- 제105항에 있어서, 상기 자가면역 또는 염증성 질환은 낭창, 특발성 염증성 근염, 쇼그렌 증후군, 맥관염, 유육종증, 또는 건선인, 방법.
- 제124항에 있어서, 상기 자가면역 질환은 특발성 염증성 근염인, 방법.
- 제105항에 있어서, 상기 치료제는 소분자 또는 생물학적 제제인, 방법.
- 제126항에 있어서, 상기 생물학적 제제는 항체인, 방법.
- 제127항에 있어서, 상기 항체는 MEDI-545 인, 방법.
- 제105항에 있어서, 상기 제1 miRNA 프로파일은 치료제의 투여 전에 얻는, 방법.
- 제105항에 있어서, 상기 제1 miRNA 프로파일은 치료제의 투여 시에 얻는, 방법.
- 제105항에 있어서, 상기 제1 및 제2 샘플은 전체 혈액, 근육, 또는 혈청인, 방법.
- 제105항에 있어서, 환자로부터의 제3 샘플에서 제3 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제132항에 있어서, 환자로부터의 제4 샘플에서 제4 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제133항에 있어서, 환자로부터의 제5 샘플에서 제5 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제134항에 있어서, 환자로부터의 제6 샘플에서 제6 miRNA 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제105항에 있어서, 상기 제2 샘플은 치료제의 투여 후 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제132항에 있어서, 상기 제3 샘플은 제2 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제133항에 있어서, 상기 제4 샘플은 제3 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제134항에 있어서, 상기 제5 샘플은 제4 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제105항에 있어서, 상기 편차는 건강한 레벨에 대한 환자의 차별적 miRNA 레벨에서의 감소인, 방법.
- 제105항에 있어서, 상기 편차는 건강한 레벨에 대한 환자의 차별적 miRNA 레벨의 증가인, 방법.
- 제141항에 있어서, 차별적 miRNA 레벨에서의 상기 증가는 나쁜 질환 예후를 나타내거나, 질환이 돌발하게 되는, 방법.
- 제141항에 있어서, 환자의 차별적 miRNA 레벨에서의 상기 증가는 환자의 치료에서의 변화를 나타내는, 방법.
- 타입 I IFN 또는 IFNα 에 결합하고 그 활성을 조정하는 제제를 투여함을 포함하고;
환자는 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 포함하고;
상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 중화시키는, 근염 환자의 치료 방법. - 제144항에 있어서, 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일의 중화를 검출하는 것을 추가로 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 MXl, LY6E, IFI27, OASl IFITl, IFI6, IFI44L, ISG15, LAMP3, OASL, RSAD2, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 LAMP3, SIGLECl, DNAPTP6, IFIT2, ETV7, RTP4, SERPINGl, HERC5, XAFl, MXl, EPSTIl, OAS2, OASl, OAS3, IFIT3, IFI6, USP18, RSAD2, IFI44, LY6E, ISG15, 및 IFI27의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, 및 USP18의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 DNAPTP6, EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISGl5, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, PLSCRl, RSAD2, RTP4, SIGLECl, 및 USP18의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 SAMD9L, IFI6, IFI44, IFIT2, OASl, IFI27, OAS3, IFI44L, HERC5, IFITl, EPSTIl, ISGl5, SERPINGl, OASL, GBPl, 및 MXl의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI6, RSAD2, IFI44, IFI44L, IFI27, MXl, IFITl, ISG15, LAMP3, OAS3, OASl, EPSTIl, IFIT3, OAS2, SIGLECl, 및 USP18의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI6, RSAD2, IFI44, IFI44L, 및 IFI27의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 제제는 생물학적 제제인, 방법.
- 제153항에 있어서, 상기 제제는 항체인, 방법.
- 제154항에 있어서, 상기 항체는 MEDI-545 인, 방법.
- 제154항에 있어서, 상기 항체는 하나 이상의 타입 I IFN 또는 IFNα 서브타입에 대해 특이적이지만, MEDI-545 가 아닌, 방법.
- 제144항에 있어서, 상기 투여 제제는 하나 이상의 근염 증상을 경감시키는, 방법.
- 제154항에 있어서, 상기 항체는 대략 0.03 내지 30 mg/kg의 복용량으로 투여되는, 방법.
- 제158항에 있어서, 상기 항체는 0.3 내지 3 mg/kg의 복용량으로 투여되는, 방법.
- 제159항에 있어서, 상기 항체는 0.03 내지 1 mg/kg의 복용량으로 투여되는, 방법.
- 제153항 내지 제155항 중 어느 하나의 항에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 10%까지 중화시키는, 방법.
- 제144항에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 20%까지 중화시키는, 방법.
- 제162항에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 30%까지 중화시키는, 방법.
- 제163항에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 40%까지 중화시키는, 방법.
- 제164항에 있어서, 상기 제제는 환자의 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일을 적어도 50%까지 중화시키는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 적어도 IFNα 서브타입 1, 2, 8, 및 14의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 PD 마커 유전자의 전사를 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 PD 마커 유전자로부터 발현된 폴리펩타이드를 포함하는, 방법.
- 환자로부터의 제1 샘플에서 제1 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 포함하는, 환자의 근염 질환 진행의 모니터링 또는 예측 방법.
- 제169항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 강한 프로파일이고, 환자 예후는 근염 질환 진행인, 방법.
- 제170항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, 및 USPl8의 과발현 또는 활성을 포함하는, 방법.
- 제169항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 약한 프로파일이고, 환자 예후는 근염 질환 퇴행인, 방법.
- 제169항에 있어서,
환자로부터의 제2 샘플에서 제2 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하며;
제1 발현 프로파일에 대한 상기 제2 발현 프로파일에서의 타입 I IFN 또는 IFNα 유도성 PD 마커의 개수 또는 레벨의 증가가 근염 질환 진행을 예측하거나;
제1 발현 프로파일에 대한 상기 제2 발현 프로파일에서의 타입 I IFN 또는 IFNα 유도성 PD 마커의 개수 또는 레벨의 감소가 근염 질환 퇴행을 예측하는, 방법. - 환자로부터의 제1 샘플에서 제1 IFNα 유도성 PD 마커 발현 프로파일을 얻고;
치료제를 투여하고;
환자로부터의 제2 샘플에서 제2 IFNα 유도성 PD 마커 발현 프로파일을 얻고;
제1 및 제2 IFNα 유도성 PD 마커 발현 프로파일을 비교하는 것을 포함하며,
상기 제1 및 제2 IFNα 유도성 PD 마커 발현 프로파일에서의 편차는 치료제의 효능의 레벨을 나타내는, 치료제에 의한 치료를 받는 환자의 근염 질환 진행을 모니터링하는 방법. - 제174항에 있어서, 상기 제1 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 EPSTIl, HERC5, IFI27, IFI44, IFI44L, IFI6, IFITl, IFIT3, ISG15, LAMP3, LY6E, MXl, OASl, OAS2, OAS3, RSAD2, RTP4, SIGLECl, 및 USPl8의 과발현 또는 활성을 포함하는, 방법.
- 제174항에 있어서, 상기 편차는 유전자의 활성 레벨의 상향조절된 발현에서의 감소인, 방법.
- 제174항에 있어서, 상기 치료제는 소분자 또는 생물학적 제제인, 방법.
- 제177항에 있어서, 상기 치료제는 IFNα 에 결합하고 그 활성을 조정하는 생물학적 제제인, 방법.
- 제178항에 있어서, 상기 생물학적 제제는 항체인, 방법.
- 제179항에 있어서, 상기 항체는 MEDI-545 인, 방법.
- 제179항에 있어서, 상기 항체는 적어도 하나의 IFNα 서브타입에 결합하지만, MEDI-545 가 아닌, 방법.
- 제174항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 치료제의 투여 전에 얻는, 방법.
- 제174항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 치료제의 투여 시에 얻는, 방법.
- 제174항에 있어서, 상기 제1 및 제2 샘플은 전체 혈액, 근육, 또는 혈청인, 방법.
- 제174항에 있어서, 환자로부터의 제3 샘플에서 제3 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제185항에 있어서, 환자로부터의 제4 샘플에서 제4 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제186항에 있어서, 환자로부터의 제5 샘플에서 제5 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제187항에 있어서, 환자로부터의 제6 샘플에서 제6 IFNα 유도성 PD 마커 발현 프로파일을 얻는 것을 추가로 포함하는, 방법.
- 제174항에 있어서, 상기 제2 샘플은 치료제의 투여 후 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제185항에 있어서, 상기 제3 샘플은 제2 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제186항에 있어서, 상기 제4 샘플은 제3 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제187항에 있어서, 상기 제5 샘플은 제4 샘플을 얻은 후 적어도 2일, 적어도 5일, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달 또는 적어도 2달에 얻는, 방법.
- 제174항에 있어서, 상기 편차는 유전자의 상향조절된 발현 또는 활성에서의 감소인, 방법.
- 제193항에 있어서, 상기 감소는 적어도 10%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 100% 인, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L, RSAD2, IFI27, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L 및 RSAD2의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제169항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제169항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L, RSAD2, IFI27, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제169항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L 및 RSAD2의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제174항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI27, RSAD2, IFI44L, IFI44, OASl, IFITl, ISG15, OAS3, HERC5, MXl, ESPTIl, IFIT3, 및 IFI6의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제174항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L, RSAD2, IFI27, 및 IFI44의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제174항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 유전자 IFI44L 및 RSAD2의 상향조절된 발현 또는 활성을 포함하는, 방법.
- 제1항에 있어서, 상기 환자는 강한 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 갖는, 방법.
- 제1항에 있어서, 상기 환자는 중간정도의 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 갖는, 방법.
- 제204항에 있어서, 상기 강한 스코어는 10 이상인, 방법.
- 제205항에 있어서, 상기 중간정도의 스코어는 4 이상이지만 10 미만인, 방법.
- 제35항 또는 제74항에 있어서, 상기 근염은 DM 또는 PM 인, 방법.
- 제144항에 있어서, 상기 근염 환자는 DM 또는 PM 환자인, 방법.
- 제144항에 있어서, 상기 근염 환자는 6 초과의 MITAX 스코어를 포함하는, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어는 강한, 방법.
- 제144항에 있어서, 상기 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어는 중간정도인, 방법.
- 제211항에 있어서, 상기 스코어는 10 이상인, 방법.
- 제212항에 있어서, 상기 스코어는 4 이상이지만 10 미만인, 방법.
- 제174항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 강한 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 포함하는, 방법.
- 제215항에 있어서, 상기 강한 스코어는 10 이상의 스코어인, 방법.
- 제174항에 있어서, 상기 제1 IFNα 유도성 PD 마커 발현 프로파일은 중간정도의 타입 I IFN 또는 IFNα 유도성 유전자 표지 스코어를 포함하는, 방법.
- 제217항에 있어서, 상기 중간정도의 스코어는 4 이상이지만 10 미만의 스코어인, 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US696308P | 2008-02-08 | 2008-02-08 | |
| US61/006,963 | 2008-02-08 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110005783A true KR20110005783A (ko) | 2011-01-19 |
Family
ID=40952717
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107019933A KR20110005783A (ko) | 2008-02-08 | 2009-02-06 | 질환 마커 및 그의 용도 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20110262928A1 (ko) |
| EP (2) | EP2252703B1 (ko) |
| JP (1) | JP2011511804A (ko) |
| KR (1) | KR20110005783A (ko) |
| CN (1) | CN101999001B (ko) |
| AU (1) | AU2009212216B2 (ko) |
| BR (1) | BRPI0908065A2 (ko) |
| CA (1) | CA2714410A1 (ko) |
| ES (1) | ES2529593T3 (ko) |
| HK (1) | HK1150063A1 (ko) |
| MX (1) | MX2010008698A (ko) |
| SG (1) | SG188147A1 (ko) |
| WO (1) | WO2009100342A2 (ko) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2567094T3 (es) * | 2007-07-12 | 2016-04-19 | The Brigham And Women's Hospital, Inc. | Composiciones y métodos para diagnosticar y evaluar las miopatías inflamatorias |
| AU2009205956B2 (en) | 2008-01-18 | 2015-07-02 | President And Fellows Of Harvard College | Methods of detecting signatures of disease or conditions in bodily fluids |
| CA2754412A1 (en) * | 2009-03-31 | 2010-10-14 | The United States Of America, As Represented By The Secretary, Departmen T Of Health And Human Services | Differentially expressed micrornas as biomarkers for the diagnosis and treatment of sjogren's syndrome |
| AU2010289383B2 (en) * | 2009-09-03 | 2015-04-16 | Medimmune, Llc | Type 1 interferon diagnostic |
| JPWO2011126105A1 (ja) * | 2010-04-08 | 2013-07-11 | 啓之 吉富 | 免疫系の異常疾患または関節系の異常疾患への罹患またはこれらの病勢を判定するための検査方法 |
| SG10201505724SA (en) | 2010-07-23 | 2015-09-29 | Harvard College | Methods of detecting diseases or conditions using phagocytic cells |
| EP2596353A4 (en) | 2010-07-23 | 2014-01-15 | Harvard College | METHOD FOR DETECTING PRENATAL OR PREGNANT DISEASES OR SUFFERING |
| AU2011280997A1 (en) | 2010-07-23 | 2013-02-28 | President And Fellows Of Harvard College | Methods of detecting autoimmune or immune-related diseases or conditions |
| MX361944B (es) | 2010-07-23 | 2018-12-19 | President And Fellows Of Harvard College Star | Metodos para detectar firmas de enfermedad o condiciones en fluidos corporales. |
| EP2742148B1 (en) * | 2011-08-11 | 2017-06-28 | Hummingbird Diagnostics GmbH | Complex sets of mirnas as non-invasive biomarkers for psoriasis |
| ITRM20110685A1 (it) | 2011-12-23 | 2013-06-24 | Internat Ct For Genetic En Gineering And | Microrna per la rigenerazione cardiaca attraverso l induzione della proliferazione dei miociti cardiaci |
| EP2653554A1 (en) * | 2012-04-17 | 2013-10-23 | Istituto Nazionale Di Genetica Molecolare-INGM | Immune response biomarkers |
| US10494675B2 (en) | 2013-03-09 | 2019-12-03 | Cell Mdx, Llc | Methods of detecting cancer |
| EP2965086A4 (en) | 2013-03-09 | 2017-02-08 | Harry Stylli | Methods of detecting prostate cancer |
| AU2014299322B2 (en) * | 2013-06-28 | 2018-08-09 | Acumen Research Laboratories Pte. Ltd. | Sepsis biomarkers and uses thereof |
| WO2016040843A1 (en) | 2014-09-11 | 2016-03-17 | Harry Stylli | Methods of detecting prostate cancer |
| JP6531306B2 (ja) * | 2015-02-20 | 2019-06-19 | 一三 西野 | 炎症性筋疾患鑑別マーカー及びそれを用いた炎症性筋疾患と非炎症性筋疾患の鑑別方法 |
| CN108379584B (zh) * | 2018-04-12 | 2020-08-11 | 上海交复生物医药科技有限公司 | RSAD2通过wnt通路影响肿瘤细胞替莫唑胺耐药性 |
| WO2019210179A1 (en) * | 2018-04-27 | 2019-10-31 | Stemline Therapeutics, Inc. | Methods of treating an autoimmune disease with a human interleukin-3 (il-3)-diphtheria toxin conjugate (dt-il3) |
| CN110085282A (zh) * | 2019-04-23 | 2019-08-02 | 华中师范大学 | 核酸结构中核苷酸与核苷酸相互作用预测的方法 |
| CN110108880A (zh) * | 2019-05-30 | 2019-08-09 | 四川大学华西医院 | Fez1自身抗体检测试剂在制备肺癌筛查试剂盒中的用途 |
| CN110161235B (zh) * | 2019-06-26 | 2022-04-12 | 江苏省中医院 | 三种血清蛋白联合用于强直性脊柱炎诊断的用途 |
| CA3152279A1 (en) * | 2019-10-04 | 2021-04-08 | The Regents Of The University Of Michigan | Methods for determining responsiveness to anti-tumor necrosis factor therapy in the treatment of psoriasis |
| CN111378742A (zh) * | 2020-04-16 | 2020-07-07 | 嘉兴程瑞医药科技有限公司 | microRNA生物标志物及其在制备自身免疫疾病检测试剂盒中的应用 |
| CN113388677A (zh) * | 2021-06-17 | 2021-09-14 | 河北医科大学第二医院 | 包括ifi44的干燥症诊断标志物组合 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1984003106A1 (en) | 1983-02-04 | 1984-08-16 | Wadley Inst Of Molecular Medic | Production and characterization of hybridoma antibodies directed specifically against common determinant(s) present among closely related, but distinct proteins |
| GB8303165D0 (en) | 1983-02-04 | 1983-03-09 | Secher D S | Monoclonal antibody |
| DE3306060A1 (de) | 1983-02-22 | 1984-08-23 | Boehringer Ingelheim International GmbH, 6507 Ingelheim | Neue immunglobulin-produzierende hybridzellinien, deren verwendung und verfahren zu deren herstellung |
| ATE78262T1 (de) | 1985-06-11 | 1992-08-15 | Ciba Geigy Ag | Hybrid-interferone. |
| US7087726B2 (en) | 2001-02-22 | 2006-08-08 | Genentech, Inc. | Anti-interferon-α antibodies |
| US20070166281A1 (en) * | 2004-08-21 | 2007-07-19 | Kosak Kenneth M | Chloroquine coupled antibodies and other proteins with methods for their synthesis |
| WO2006023966A2 (en) * | 2004-08-24 | 2006-03-02 | The Trustees Of The University Of Pennsylvania Center For Technology Transfer | Assessment of cardiovascular risk |
| US20070065844A1 (en) * | 2005-06-08 | 2007-03-22 | Massachusetts Institute Of Technology | Solution-based methods for RNA expression profiling |
| PT2327792E (pt) * | 2005-08-05 | 2013-11-21 | Genentech Inc | Métodos e composições para a detecção de distúrbios autoimunes |
| US20100143372A1 (en) | 2006-12-06 | 2010-06-10 | Medimmune, Llc | Interferon alpha-induced pharmacodynamic markers |
-
2009
- 2009-02-06 US US12/866,586 patent/US20110262928A1/en not_active Abandoned
- 2009-02-06 KR KR1020107019933A patent/KR20110005783A/ko not_active Application Discontinuation
- 2009-02-06 ES ES09709316.5T patent/ES2529593T3/es active Active
- 2009-02-06 EP EP09709316.5A patent/EP2252703B1/en active Active
- 2009-02-06 BR BRPI0908065-1A patent/BRPI0908065A2/pt not_active IP Right Cessation
- 2009-02-06 JP JP2010546054A patent/JP2011511804A/ja active Pending
- 2009-02-06 AU AU2009212216A patent/AU2009212216B2/en active Active
- 2009-02-06 SG SG2013010608A patent/SG188147A1/en unknown
- 2009-02-06 CA CA2714410A patent/CA2714410A1/en not_active Abandoned
- 2009-02-06 EP EP14191479.6A patent/EP2848702A1/en not_active Withdrawn
- 2009-02-06 MX MX2010008698A patent/MX2010008698A/es active IP Right Grant
- 2009-02-06 CN CN2009801123932A patent/CN101999001B/zh active Active
- 2009-02-06 WO PCT/US2009/033407 patent/WO2009100342A2/en active Application Filing
-
2011
- 2011-04-18 HK HK11103859.1A patent/HK1150063A1/xx unknown
Also Published As
| Publication number | Publication date |
|---|---|
| EP2252703B1 (en) | 2014-11-05 |
| US20110262928A1 (en) | 2011-10-27 |
| WO2009100342A2 (en) | 2009-08-13 |
| CN101999001A (zh) | 2011-03-30 |
| BRPI0908065A2 (pt) | 2015-08-11 |
| CN101999001B (zh) | 2013-11-20 |
| EP2848702A1 (en) | 2015-03-18 |
| MX2010008698A (es) | 2010-12-20 |
| EP2252703A2 (en) | 2010-11-24 |
| CA2714410A1 (en) | 2009-08-13 |
| AU2009212216B2 (en) | 2015-04-09 |
| ES2529593T3 (es) | 2015-02-23 |
| AU2009212216A1 (en) | 2009-08-13 |
| EP2252703A4 (en) | 2011-12-21 |
| SG188147A1 (en) | 2013-03-28 |
| JP2011511804A (ja) | 2011-04-14 |
| HK1150063A1 (en) | 2011-10-28 |
| WO2009100342A3 (en) | 2009-12-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20110005783A (ko) | 질환 마커 및 그의 용도 | |
| AU2007327995B2 (en) | Interferon alpha-induced pharmacodynamic markers | |
| AU2008247398B2 (en) | Interferon alpha-induced pharmacodynamic markers | |
| AU2010289383B2 (en) | Type 1 interferon diagnostic | |
| US20110287022A1 (en) | Interferon alpha-induced pharmacodynamic markers | |
| US20100261172A1 (en) | Interferon alpha-induced pharmacodynamic markers | |
| WO2009155559A1 (en) | Interferon alpha-induced pharmacodynamic markers | |
| AU2015203772A1 (en) | Disease markers and uses thereof | |
| AU2014200127A1 (en) | Interferon alpha-induced pharmacodynamic markers | |
| AU2014200128A1 (en) | Interferon alpha-induced pharmacodynamic markers |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |